KR20190051956A - 단백질용해 절단가능한 키메라 폴리펩타이드 및 이의 사용 방법 - Google Patents
단백질용해 절단가능한 키메라 폴리펩타이드 및 이의 사용 방법 Download PDFInfo
- Publication number
- KR20190051956A KR20190051956A KR1020197005928A KR20197005928A KR20190051956A KR 20190051956 A KR20190051956 A KR 20190051956A KR 1020197005928 A KR1020197005928 A KR 1020197005928A KR 20197005928 A KR20197005928 A KR 20197005928A KR 20190051956 A KR20190051956 A KR 20190051956A
- Authority
- KR
- South Korea
- Prior art keywords
- cell
- polypeptide
- chimeric
- peptide
- cases
- Prior art date
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 531
- 102000004196 processed proteins & peptides Human genes 0.000 title claims abstract description 440
- 229920001184 polypeptide Polymers 0.000 title claims abstract description 432
- 238000000034 method Methods 0.000 title claims abstract description 137
- 108090000623 proteins and genes Proteins 0.000 title claims description 117
- 102000004169 proteins and genes Human genes 0.000 title claims description 109
- 238000010494 dissociation reaction Methods 0.000 title description 2
- 230000005593 dissociations Effects 0.000 title description 2
- 230000027455 binding Effects 0.000 claims abstract description 163
- 230000009870 specific binding Effects 0.000 claims abstract description 118
- 150000007523 nucleic acids Chemical class 0.000 claims abstract description 92
- 102000039446 nucleic acids Human genes 0.000 claims abstract description 87
- 108020004707 nucleic acids Proteins 0.000 claims abstract description 87
- 238000003776 cleavage reaction Methods 0.000 claims abstract description 69
- 230000014509 gene expression Effects 0.000 claims abstract description 64
- 210000004027 cell Anatomy 0.000 claims description 279
- 239000000427 antigen Substances 0.000 claims description 235
- 102000036639 antigens Human genes 0.000 claims description 227
- 108091007433 antigens Proteins 0.000 claims description 227
- 206010028980 Neoplasm Diseases 0.000 claims description 163
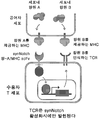
- 102000005650 Notch Receptors Human genes 0.000 claims description 146
- 108010070047 Notch Receptors Proteins 0.000 claims description 146
- 150000001413 amino acids Chemical class 0.000 claims description 124
- 201000011510 cancer Diseases 0.000 claims description 103
- 230000003834 intracellular effect Effects 0.000 claims description 96
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 94
- 230000007017 scission Effects 0.000 claims description 64
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 claims description 62
- 108091008874 T cell receptors Proteins 0.000 claims description 40
- 108700018351 Major Histocompatibility Complex Proteins 0.000 claims description 39
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 claims description 36
- 108700029229 Transcriptional Regulatory Elements Proteins 0.000 claims description 33
- 230000001939 inductive effect Effects 0.000 claims description 31
- 102100022748 Wilms tumor protein Human genes 0.000 claims description 30
- 230000009089 cytolysis Effects 0.000 claims description 30
- 239000012634 fragment Substances 0.000 claims description 30
- 230000001225 therapeutic effect Effects 0.000 claims description 28
- 230000002797 proteolythic effect Effects 0.000 claims description 24
- 206010010356 Congenital anomaly Diseases 0.000 claims description 23
- 210000001519 tissue Anatomy 0.000 claims description 21
- 230000002101 lytic effect Effects 0.000 claims description 19
- 230000001506 immunosuppresive effect Effects 0.000 claims description 18
- 108091006106 transcriptional activators Proteins 0.000 claims description 18
- 239000003795 chemical substances by application Substances 0.000 claims description 16
- 230000028993 immune response Effects 0.000 claims description 16
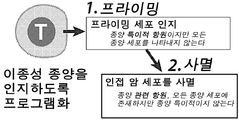
- 230000037452 priming Effects 0.000 claims description 16
- 102000005962 receptors Human genes 0.000 claims description 15
- 108020003175 receptors Proteins 0.000 claims description 15
- 230000004044 response Effects 0.000 claims description 13
- 208000035269 cancer or benign tumor Diseases 0.000 claims description 12
- 210000002865 immune cell Anatomy 0.000 claims description 12
- 102000004127 Cytokines Human genes 0.000 claims description 11
- 108090000695 Cytokines Proteins 0.000 claims description 11
- 230000034994 death Effects 0.000 claims description 11
- 239000003446 ligand Substances 0.000 claims description 11
- 210000004899 c-terminal region Anatomy 0.000 claims description 9
- 210000000056 organ Anatomy 0.000 claims description 9
- 108010074708 B7-H1 Antigen Proteins 0.000 claims description 8
- 230000001640 apoptogenic effect Effects 0.000 claims description 8
- 230000001105 regulatory effect Effects 0.000 claims description 8
- 239000004365 Protease Substances 0.000 claims description 7
- 108700020467 WT1 Proteins 0.000 claims description 7
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 claims description 6
- 102000003814 Interleukin-10 Human genes 0.000 claims description 6
- 108091005804 Peptidases Proteins 0.000 claims description 6
- 230000003213 activating effect Effects 0.000 claims description 6
- 230000002401 inhibitory effect Effects 0.000 claims description 6
- 230000002147 killing effect Effects 0.000 claims description 6
- 102000002659 Amyloid Precursor Protein Secretases Human genes 0.000 claims description 5
- 108010043324 Amyloid Precursor Protein Secretases Proteins 0.000 claims description 5
- 101001028244 Onchocerca volvulus Fatty-acid and retinol-binding protein 1 Proteins 0.000 claims description 5
- 108010003723 Single-Domain Antibodies Proteins 0.000 claims description 5
- 238000004090 dissolution Methods 0.000 claims description 5
- 239000003018 immunosuppressive agent Substances 0.000 claims description 5
- 229940125721 immunosuppressive agent Drugs 0.000 claims description 5
- 239000000411 inducer Substances 0.000 claims description 5
- 230000011664 signaling Effects 0.000 claims description 5
- 238000013518 transcription Methods 0.000 claims description 5
- 230000035897 transcription Effects 0.000 claims description 5
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 claims description 4
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 claims description 4
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 4
- 108020001756 ligand binding domains Proteins 0.000 claims description 4
- 244000045947 parasite Species 0.000 claims description 4
- 230000006337 proteolytic cleavage Effects 0.000 claims description 4
- 208000023275 Autoimmune disease Diseases 0.000 claims description 3
- 239000013604 expression vector Substances 0.000 claims description 3
- 239000003102 growth factor Substances 0.000 claims description 3
- LIWMQSWFLXEGMA-WDSKDSINSA-N Ala-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](C)N LIWMQSWFLXEGMA-WDSKDSINSA-N 0.000 claims description 2
- 108010077805 Bacterial Proteins Proteins 0.000 claims description 2
- 108010058643 Fungal Proteins Proteins 0.000 claims description 2
- 125000002059 L-arginyl group Chemical group O=C([*])[C@](N([H])[H])([H])C([H])([H])C([H])([H])C([H])([H])N([H])C(=N[H])N([H])[H] 0.000 claims description 2
- 108010067390 Viral Proteins Proteins 0.000 claims description 2
- 210000000349 chromosome Anatomy 0.000 claims description 2
- 230000008472 epithelial growth Effects 0.000 claims description 2
- 108010037850 glycylvaline Proteins 0.000 claims description 2
- 244000000011 human parasite Species 0.000 claims description 2
- 238000003259 recombinant expression Methods 0.000 claims description 2
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 claims 2
- 239000012190 activator Substances 0.000 claims 2
- 102000008096 B7-H1 Antigen Human genes 0.000 claims 1
- 108010016626 Dipeptides Proteins 0.000 claims 1
- 101000978703 Escherichia virus Qbeta Maturation protein A2 Proteins 0.000 claims 1
- 108010091748 peptide A Proteins 0.000 claims 1
- 229910052698 phosphorus Inorganic materials 0.000 claims 1
- 239000011574 phosphorus Substances 0.000 claims 1
- 230000017854 proteolysis Effects 0.000 claims 1
- 150000003852 triazoles Chemical class 0.000 claims 1
- 239000013598 vector Substances 0.000 abstract description 12
- 230000003915 cell function Effects 0.000 abstract description 3
- 230000006698 induction Effects 0.000 abstract description 3
- 230000008569 process Effects 0.000 abstract description 2
- 235000001014 amino acid Nutrition 0.000 description 89
- 230000008685 targeting Effects 0.000 description 87
- 235000018102 proteins Nutrition 0.000 description 76
- 210000001744 T-lymphocyte Anatomy 0.000 description 40
- 206010057190 Respiratory tract infections Diseases 0.000 description 37
- 208000015181 infectious disease Diseases 0.000 description 35
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 31
- -1 IL-10-like Proteins 0.000 description 30
- 102000025850 HLA-A2 Antigen Human genes 0.000 description 28
- 108010074032 HLA-A2 Antigen Proteins 0.000 description 28
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 27
- 201000010099 disease Diseases 0.000 description 26
- 230000000694 effects Effects 0.000 description 23
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 20
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 20
- 206010061535 Ovarian neoplasm Diseases 0.000 description 19
- 239000005090 green fluorescent protein Substances 0.000 description 19
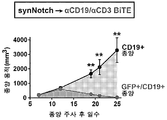
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 16
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 16
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 16
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 16
- 102000001301 EGF receptor Human genes 0.000 description 15
- 241000282414 Homo sapiens Species 0.000 description 15
- 206010033128 Ovarian cancer Diseases 0.000 description 15
- 230000004913 activation Effects 0.000 description 15
- 108060003951 Immunoglobulin Proteins 0.000 description 14
- 102000018358 immunoglobulin Human genes 0.000 description 14
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 13
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 13
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 13
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 13
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 13
- 201000001441 melanoma Diseases 0.000 description 13
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 13
- 101000997835 Homo sapiens Tyrosine-protein kinase JAK1 Proteins 0.000 description 12
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 12
- 102100033438 Tyrosine-protein kinase JAK1 Human genes 0.000 description 12
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 12
- 238000011282 treatment Methods 0.000 description 12
- 206010009944 Colon cancer Diseases 0.000 description 11
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 11
- 238000000338 in vitro Methods 0.000 description 11
- 206010006187 Breast cancer Diseases 0.000 description 10
- 208000026310 Breast neoplasm Diseases 0.000 description 10
- 201000009030 Carcinoma Diseases 0.000 description 10
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 10
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 description 10
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 10
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 10
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 description 10
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 description 10
- 241000700605 Viruses Species 0.000 description 10
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 9
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 9
- 101100067974 Arabidopsis thaliana POP2 gene Proteins 0.000 description 8
- 108091026890 Coding region Proteins 0.000 description 8
- 108010033305 Fanconi Anemia Complementation Group G protein Proteins 0.000 description 8
- 102100034555 Fanconi anemia group G protein Human genes 0.000 description 8
- 101100118549 Homo sapiens EGFR gene Proteins 0.000 description 8
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 description 8
- 101100123851 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) HER1 gene Proteins 0.000 description 8
- 238000004113 cell culture Methods 0.000 description 8
- 230000006870 function Effects 0.000 description 8
- 230000010354 integration Effects 0.000 description 8
- 210000003292 kidney cell Anatomy 0.000 description 8
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 7
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 7
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 7
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 7
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 7
- 101000851181 Homo sapiens Epidermal growth factor receptor Proteins 0.000 description 7
- 101000954986 Homo sapiens Merlin Proteins 0.000 description 7
- 102100037106 Merlin Human genes 0.000 description 7
- 208000034578 Multiple myelomas Diseases 0.000 description 7
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 7
- 206010029260 Neuroblastoma Diseases 0.000 description 7
- 206010035226 Plasma cell myeloma Diseases 0.000 description 7
- 206010060862 Prostate cancer Diseases 0.000 description 7
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 7
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 description 7
- 208000018756 Variant Creutzfeldt-Jakob disease Diseases 0.000 description 7
- 102100033793 ALK tyrosine kinase receptor Human genes 0.000 description 6
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 6
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 6
- 241000282836 Camelus dromedarius Species 0.000 description 6
- 208000017604 Hodgkin disease Diseases 0.000 description 6
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 6
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 6
- 101000779641 Homo sapiens ALK tyrosine kinase receptor Proteins 0.000 description 6
- 101001128135 Homo sapiens NACHT, LRR and PYD domains-containing protein 4 Proteins 0.000 description 6
- 241000124008 Mammalia Species 0.000 description 6
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 6
- 102100031898 NACHT, LRR and PYD domains-containing protein 4 Human genes 0.000 description 6
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 6
- 206010039207 Rocky Mountain Spotted Fever Diseases 0.000 description 6
- 208000009956 adenocarcinoma Diseases 0.000 description 6
- 208000005881 bovine spongiform encephalopathy Diseases 0.000 description 6
- 229940072221 immunoglobulins Drugs 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- 206010022000 influenza Diseases 0.000 description 6
- 102000040430 polynucleotide Human genes 0.000 description 6
- 108091033319 polynucleotide Proteins 0.000 description 6
- 239000002157 polynucleotide Substances 0.000 description 6
- 102200006531 rs121913529 Human genes 0.000 description 6
- 230000028327 secretion Effects 0.000 description 6
- 201000008827 tuberculosis Diseases 0.000 description 6
- 210000004881 tumor cell Anatomy 0.000 description 6
- 206010007134 Candida infections Diseases 0.000 description 5
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 5
- 206010013029 Diphyllobothriasis Diseases 0.000 description 5
- 101000932478 Homo sapiens Receptor-type tyrosine-protein kinase FLT3 Proteins 0.000 description 5
- 101000633784 Homo sapiens SLAM family member 7 Proteins 0.000 description 5
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 5
- 101000823316 Homo sapiens Tyrosine-protein kinase ABL1 Proteins 0.000 description 5
- 206010025323 Lymphomas Diseases 0.000 description 5
- 241000699670 Mus sp. Species 0.000 description 5
- 208000009608 Papillomavirus Infections Diseases 0.000 description 5
- 241000517307 Pediculus humanus Species 0.000 description 5
- 102100026547 Platelet-derived growth factor receptor beta Human genes 0.000 description 5
- 102100020718 Receptor-type tyrosine-protein kinase FLT3 Human genes 0.000 description 5
- 102100029198 SLAM family member 7 Human genes 0.000 description 5
- 206010061372 Streptococcal infection Diseases 0.000 description 5
- 208000024770 Thyroid neoplasm Diseases 0.000 description 5
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 5
- 102100022596 Tyrosine-protein kinase ABL1 Human genes 0.000 description 5
- 201000003984 candidiasis Diseases 0.000 description 5
- 230000001413 cellular effect Effects 0.000 description 5
- 230000033077 cellular process Effects 0.000 description 5
- 206010013023 diphtheria Diseases 0.000 description 5
- 208000032839 leukemia Diseases 0.000 description 5
- 239000002773 nucleotide Substances 0.000 description 5
- 125000003729 nucleotide group Chemical group 0.000 description 5
- 210000003491 skin Anatomy 0.000 description 5
- 201000010740 swine influenza Diseases 0.000 description 5
- 201000002510 thyroid cancer Diseases 0.000 description 5
- 241001480043 Arthrodermataceae Species 0.000 description 4
- 208000004926 Bacterial Vaginosis Diseases 0.000 description 4
- 206010006500 Brucellosis Diseases 0.000 description 4
- 206010073031 Burkholderia infection Diseases 0.000 description 4
- 101100540159 Candida albicans (strain SC5314 / ATCC MYA-2876) TFP1 gene Proteins 0.000 description 4
- 206010008342 Cervix carcinoma Diseases 0.000 description 4
- 206010009344 Clonorchiasis Diseases 0.000 description 4
- 208000008953 Cryptosporidiosis Diseases 0.000 description 4
- 206010011831 Cytomegalovirus infection Diseases 0.000 description 4
- 108020004414 DNA Proteins 0.000 description 4
- 206010018612 Gonorrhoea Diseases 0.000 description 4
- 206010061190 Haemophilus infection Diseases 0.000 description 4
- 108090000353 Histone deacetylase Proteins 0.000 description 4
- 102100038720 Histone deacetylase 9 Human genes 0.000 description 4
- 101000692455 Homo sapiens Platelet-derived growth factor receptor beta Proteins 0.000 description 4
- 101000579425 Homo sapiens Proto-oncogene tyrosine-protein kinase receptor Ret Proteins 0.000 description 4
- 101000857634 Homo sapiens Receptor-transporting protein 1 Proteins 0.000 description 4
- 206010062016 Immunosuppression Diseases 0.000 description 4
- 108090001005 Interleukin-6 Proteins 0.000 description 4
- 102000004889 Interleukin-6 Human genes 0.000 description 4
- 208000008839 Kidney Neoplasms Diseases 0.000 description 4
- 241000282842 Lama glama Species 0.000 description 4
- 206010024238 Leptospirosis Diseases 0.000 description 4
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 4
- 208000016604 Lyme disease Diseases 0.000 description 4
- 206010027406 Mesothelioma Diseases 0.000 description 4
- 102100034256 Mucin-1 Human genes 0.000 description 4
- 241000699666 Mus <mouse, genus> Species 0.000 description 4
- 208000034176 Neoplasms, Germ Cell and Embryonal Diseases 0.000 description 4
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 4
- 102000035195 Peptidases Human genes 0.000 description 4
- 206010035148 Plague Diseases 0.000 description 4
- 208000000474 Poliomyelitis Diseases 0.000 description 4
- 208000024777 Prion disease Diseases 0.000 description 4
- 102100024952 Protein CBFA2T1 Human genes 0.000 description 4
- 102100028286 Proto-oncogene tyrosine-protein kinase receptor Ret Human genes 0.000 description 4
- 102100025426 Receptor-transporting protein 1 Human genes 0.000 description 4
- 206010038389 Renal cancer Diseases 0.000 description 4
- 208000006265 Renal cell carcinoma Diseases 0.000 description 4
- 101100316793 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) VMA1 gene Proteins 0.000 description 4
- 206010039491 Sarcoma Diseases 0.000 description 4
- 241000193998 Streptococcus pneumoniae Species 0.000 description 4
- 206010042971 T-cell lymphoma Diseases 0.000 description 4
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 description 4
- 208000005448 Trichomonas Infections Diseases 0.000 description 4
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 230000030833 cell death Effects 0.000 description 4
- 201000010881 cervical cancer Diseases 0.000 description 4
- 230000001684 chronic effect Effects 0.000 description 4
- 238000011443 conventional therapy Methods 0.000 description 4
- 230000037304 dermatophytes Effects 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 208000001786 gonorrhea Diseases 0.000 description 4
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 4
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 4
- 208000028454 lice infestation Diseases 0.000 description 4
- 201000005202 lung cancer Diseases 0.000 description 4
- 208000020816 lung neoplasm Diseases 0.000 description 4
- 208000018555 lymphatic system disease Diseases 0.000 description 4
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 230000001404 mediated effect Effects 0.000 description 4
- 238000011275 oncology therapy Methods 0.000 description 4
- 201000002528 pancreatic cancer Diseases 0.000 description 4
- 208000008443 pancreatic carcinoma Diseases 0.000 description 4
- 230000029279 positive regulation of transcription, DNA-dependent Effects 0.000 description 4
- 235000019419 proteases Nutrition 0.000 description 4
- 238000011002 quantification Methods 0.000 description 4
- 206010039073 rheumatoid arthritis Diseases 0.000 description 4
- 229940031000 streptococcus pneumoniae Drugs 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- 230000009258 tissue cross reactivity Effects 0.000 description 4
- 102100031585 ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Human genes 0.000 description 3
- 208000030507 AIDS Diseases 0.000 description 3
- 235000002198 Annona diversifolia Nutrition 0.000 description 3
- 208000008715 Ascaridida Infections Diseases 0.000 description 3
- 206010003571 Astrocytoma Diseases 0.000 description 3
- 208000028564 B-cell non-Hodgkin lymphoma Diseases 0.000 description 3
- 206010004146 Basal cell carcinoma Diseases 0.000 description 3
- 208000021130 Bilirubin encephalopathy Diseases 0.000 description 3
- 206010069748 Burkholderia pseudomallei infection Diseases 0.000 description 3
- 208000008889 California Encephalitis Diseases 0.000 description 3
- 206010051226 Campylobacter infection Diseases 0.000 description 3
- 241000222122 Candida albicans Species 0.000 description 3
- 206010007187 Capillariasis Diseases 0.000 description 3
- 241000242722 Cestoda Species 0.000 description 3
- 241000606153 Chlamydia trachomatis Species 0.000 description 3
- 206010008631 Cholera Diseases 0.000 description 3
- 208000037384 Clostridium Infections Diseases 0.000 description 3
- 108010025464 Cyclin-Dependent Kinase 4 Proteins 0.000 description 3
- 108010025468 Cyclin-Dependent Kinase 6 Proteins 0.000 description 3
- 102100036252 Cyclin-dependent kinase 4 Human genes 0.000 description 3
- 102100026804 Cyclin-dependent kinase 6 Human genes 0.000 description 3
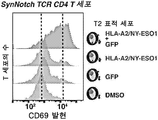
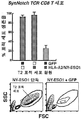
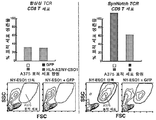
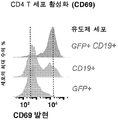
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 3
- 208000000966 Enoplida Infections Diseases 0.000 description 3
- 206010015108 Epstein-Barr virus infection Diseases 0.000 description 3
- 208000007985 Erythema Infectiosum Diseases 0.000 description 3
- 108050001049 Extracellular proteins Proteins 0.000 description 3
- 208000000807 Gnathostomiasis Diseases 0.000 description 3
- 208000009889 Herpes Simplex Diseases 0.000 description 3
- 101000777636 Homo sapiens ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Proteins 0.000 description 3
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 3
- 101000605528 Homo sapiens Kallikrein-2 Proteins 0.000 description 3
- 101000880774 Homo sapiens Protein SSX4 Proteins 0.000 description 3
- 101000997832 Homo sapiens Tyrosine-protein kinase JAK2 Proteins 0.000 description 3
- 102100038356 Kallikrein-2 Human genes 0.000 description 3
- 241000588747 Klebsiella pneumoniae Species 0.000 description 3
- 201000009908 La Crosse encephalitis Diseases 0.000 description 3
- 208000004554 Leishmaniasis Diseases 0.000 description 3
- 206010024641 Listeriosis Diseases 0.000 description 3
- 208000018501 Lymphatic disease Diseases 0.000 description 3
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 3
- 108091005461 Nucleic proteins Proteins 0.000 description 3
- 241000283973 Oryctolagus cuniculus Species 0.000 description 3
- 229920000776 Poly(Adenosine diphosphate-ribose) polymerase Polymers 0.000 description 3
- 102100037727 Protein SSX4 Human genes 0.000 description 3
- 241000589516 Pseudomonas Species 0.000 description 3
- 206010037660 Pyrexia Diseases 0.000 description 3
- 206010037688 Q fever Diseases 0.000 description 3
- 102100033479 RAF proto-oncogene serine/threonine-protein kinase Human genes 0.000 description 3
- 102000014128 RANK Ligand Human genes 0.000 description 3
- 108010025832 RANK Ligand Proteins 0.000 description 3
- 201000000582 Retinoblastoma Diseases 0.000 description 3
- 206010041067 Small cell lung cancer Diseases 0.000 description 3
- 208000000102 Squamous Cell Carcinoma of Head and Neck Diseases 0.000 description 3
- 206010041925 Staphylococcal infections Diseases 0.000 description 3
- 208000005718 Stomach Neoplasms Diseases 0.000 description 3
- 206010043376 Tetanus Diseases 0.000 description 3
- 208000033781 Thyroid carcinoma Diseases 0.000 description 3
- 206010044620 Trichomoniasis Diseases 0.000 description 3
- 208000034784 Tularaemia Diseases 0.000 description 3
- 102100036922 Tumor necrosis factor ligand superfamily member 13B Human genes 0.000 description 3
- 102100033444 Tyrosine-protein kinase JAK2 Human genes 0.000 description 3
- 102100033178 Vascular endothelial growth factor receptor 1 Human genes 0.000 description 3
- 206010003246 arthritis Diseases 0.000 description 3
- 201000008680 babesiosis Diseases 0.000 description 3
- 208000007456 balantidiasis Diseases 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 210000001185 bone marrow Anatomy 0.000 description 3
- 210000003169 central nervous system Anatomy 0.000 description 3
- 201000000652 cercarial dermatitis Diseases 0.000 description 3
- 229940038705 chlamydia trachomatis Drugs 0.000 description 3
- 238000003501 co-culture Methods 0.000 description 3
- 210000001072 colon Anatomy 0.000 description 3
- 238000012258 culturing Methods 0.000 description 3
- 201000002641 cyclosporiasis Diseases 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 208000008576 dracunculiasis Diseases 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 208000000292 ehrlichiosis Diseases 0.000 description 3
- 206010014599 encephalitis Diseases 0.000 description 3
- 206010014881 enterobiasis Diseases 0.000 description 3
- 108020001507 fusion proteins Proteins 0.000 description 3
- 102000037865 fusion proteins Human genes 0.000 description 3
- 206010017758 gastric cancer Diseases 0.000 description 3
- 201000000459 head and neck squamous cell carcinoma Diseases 0.000 description 3
- 208000021145 human papilloma virus infection Diseases 0.000 description 3
- 208000037801 influenza A (H1N1) Diseases 0.000 description 3
- 238000002955 isolation Methods 0.000 description 3
- 208000006663 kernicterus Diseases 0.000 description 3
- 201000010982 kidney cancer Diseases 0.000 description 3
- 210000000265 leukocyte Anatomy 0.000 description 3
- 206010025135 lupus erythematosus Diseases 0.000 description 3
- 210000004698 lymphocyte Anatomy 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- 208000025113 myeloid leukemia Diseases 0.000 description 3
- 201000008482 osteoarthritis Diseases 0.000 description 3
- 206010033794 paragonimiasis Diseases 0.000 description 3
- 102200048928 rs121434568 Human genes 0.000 description 3
- 208000000587 small cell lung carcinoma Diseases 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 206010041823 squamous cell carcinoma Diseases 0.000 description 3
- 201000011549 stomach cancer Diseases 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- 208000006379 syphilis Diseases 0.000 description 3
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 3
- 238000011285 therapeutic regimen Methods 0.000 description 3
- 208000013077 thyroid gland carcinoma Diseases 0.000 description 3
- 230000005909 tumor killing Effects 0.000 description 3
- 230000002485 urinary effect Effects 0.000 description 3
- 206010046885 vaginal cancer Diseases 0.000 description 3
- 208000013139 vaginal neoplasm Diseases 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- 208000024827 Alzheimer disease Diseases 0.000 description 2
- 208000004881 Amebiasis Diseases 0.000 description 2
- 102100021569 Apoptosis regulator Bcl-2 Human genes 0.000 description 2
- 208000036864 Attention deficit/hyperactivity disease Diseases 0.000 description 2
- 208000003950 B-cell lymphoma Diseases 0.000 description 2
- 108091012583 BCL2 Proteins 0.000 description 2
- 102000036365 BRCA1 Human genes 0.000 description 2
- 108700020463 BRCA1 Proteins 0.000 description 2
- 101150072950 BRCA1 gene Proteins 0.000 description 2
- 208000004429 Bacillary Dysentery Diseases 0.000 description 2
- 208000035143 Bacterial infection Diseases 0.000 description 2
- 241000934146 Balamuthia mandrillaris Species 0.000 description 2
- 208000005740 Blastocystis Infections Diseases 0.000 description 2
- 206010069657 Burkholderia cepacia complex infection Diseases 0.000 description 2
- 241000722910 Burkholderia mallei Species 0.000 description 2
- 102100024217 CAMPATH-1 antigen Human genes 0.000 description 2
- 108010065524 CD52 Antigen Proteins 0.000 description 2
- 102100025570 Cancer/testis antigen 1 Human genes 0.000 description 2
- 101710167800 Capsid assembly scaffolding protein Proteins 0.000 description 2
- 102000014914 Carrier Proteins Human genes 0.000 description 2
- 201000009182 Chikungunya Diseases 0.000 description 2
- 208000004293 Chikungunya Fever Diseases 0.000 description 2
- 241000606161 Chlamydia Species 0.000 description 2
- 206010061041 Chlamydial infection Diseases 0.000 description 2
- 206010008874 Chronic Fatigue Syndrome Diseases 0.000 description 2
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 2
- 206010061043 Clostridial infection Diseases 0.000 description 2
- 241000193155 Clostridium botulinum Species 0.000 description 2
- 206010061092 Corynebacterium infection Diseases 0.000 description 2
- 208000020406 Creutzfeldt Jacob disease Diseases 0.000 description 2
- 208000003407 Creutzfeldt-Jakob Syndrome Diseases 0.000 description 2
- 206010011502 Cryptosporidiosis infection Diseases 0.000 description 2
- 206010061802 Cyclosporidium infection Diseases 0.000 description 2
- 201000000077 Cysticercosis Diseases 0.000 description 2
- 208000001490 Dengue Diseases 0.000 description 2
- 206010012310 Dengue fever Diseases 0.000 description 2
- 201000004624 Dermatitis Diseases 0.000 description 2
- 206010012735 Diarrhoea Diseases 0.000 description 2
- 241000255925 Diptera Species 0.000 description 2
- 201000010374 Down Syndrome Diseases 0.000 description 2
- 101150029707 ERBB2 gene Proteins 0.000 description 2
- 102100039247 ETS-related transcription factor Elf-4 Human genes 0.000 description 2
- 208000009366 Echinococcosis Diseases 0.000 description 2
- 206010014733 Endometrial cancer Diseases 0.000 description 2
- 206010014759 Endometrial neoplasm Diseases 0.000 description 2
- 208000010489 Entamoebiasis Diseases 0.000 description 2
- 206010014889 Enterococcal infections Diseases 0.000 description 2
- 206010014909 Enterovirus infection Diseases 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 206010061126 Escherichia infection Diseases 0.000 description 2
- 201000001342 Fallopian tube cancer Diseases 0.000 description 2
- 208000013452 Fallopian tube neoplasm Diseases 0.000 description 2
- 208000001640 Fibromyalgia Diseases 0.000 description 2
- 102100037362 Fibronectin Human genes 0.000 description 2
- 108010067306 Fibronectins Proteins 0.000 description 2
- 201000006353 Filariasis Diseases 0.000 description 2
- 208000021309 Germ cell tumor Diseases 0.000 description 2
- 201000004311 Gilles de la Tourette syndrome Diseases 0.000 description 2
- 208000032612 Glial tumor Diseases 0.000 description 2
- 206010018338 Glioma Diseases 0.000 description 2
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 description 2
- 201000005569 Gout Diseases 0.000 description 2
- 206010069767 H1N1 influenza Diseases 0.000 description 2
- 102100030595 HLA class II histocompatibility antigen gamma chain Human genes 0.000 description 2
- 102000011786 HLA-A Antigens Human genes 0.000 description 2
- 108010075704 HLA-A Antigens Proteins 0.000 description 2
- 108010035452 HLA-A1 Antigen Proteins 0.000 description 2
- 206010019143 Hantavirus pulmonary infection Diseases 0.000 description 2
- 208000018565 Hemochromatosis Diseases 0.000 description 2
- 206010019799 Hepatitis viral Diseases 0.000 description 2
- 208000001688 Herpes Genitalis Diseases 0.000 description 2
- 206010020017 Heterophyiasis Diseases 0.000 description 2
- 102100039236 Histone H3.3 Human genes 0.000 description 2
- 241000228404 Histoplasma capsulatum Species 0.000 description 2
- 101000856237 Homo sapiens Cancer/testis antigen 1 Proteins 0.000 description 2
- 101000813135 Homo sapiens ETS-related transcription factor Elf-4 Proteins 0.000 description 2
- 101000584612 Homo sapiens GTPase KRas Proteins 0.000 description 2
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 description 2
- 101001082627 Homo sapiens HLA class II histocompatibility antigen gamma chain Proteins 0.000 description 2
- 101001005716 Homo sapiens Melanoma-associated antigen 11 Proteins 0.000 description 2
- 101001057156 Homo sapiens Melanoma-associated antigen C2 Proteins 0.000 description 2
- 101001133056 Homo sapiens Mucin-1 Proteins 0.000 description 2
- 101000623901 Homo sapiens Mucin-16 Proteins 0.000 description 2
- 101001122114 Homo sapiens NUT family member 1 Proteins 0.000 description 2
- 101001024605 Homo sapiens Next to BRCA1 gene 1 protein Proteins 0.000 description 2
- 101000880770 Homo sapiens Protein SSX2 Proteins 0.000 description 2
- 101000686031 Homo sapiens Proto-oncogene tyrosine-protein kinase ROS Proteins 0.000 description 2
- 101000729271 Homo sapiens Retinoid isomerohydrolase Proteins 0.000 description 2
- 101000984753 Homo sapiens Serine/threonine-protein kinase B-raf Proteins 0.000 description 2
- 101000749631 Homo sapiens Uromodulin-like 1 Proteins 0.000 description 2
- 101000851018 Homo sapiens Vascular endothelial growth factor receptor 1 Proteins 0.000 description 2
- 241000701085 Human alphaherpesvirus 3 Species 0.000 description 2
- 241000725303 Human immunodeficiency virus Species 0.000 description 2
- 206010020772 Hypertension Diseases 0.000 description 2
- 108010031794 IGF Type 1 Receptor Proteins 0.000 description 2
- 206010061217 Infestation Diseases 0.000 description 2
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 2
- 208000002979 Influenza in Birds Diseases 0.000 description 2
- 102000003816 Interleukin-13 Human genes 0.000 description 2
- 108090000176 Interleukin-13 Proteins 0.000 description 2
- 206010023076 Isosporiasis Diseases 0.000 description 2
- 208000007766 Kaposi sarcoma Diseases 0.000 description 2
- 206010023927 Lassa fever Diseases 0.000 description 2
- 208000007764 Legionnaires' Disease Diseases 0.000 description 2
- 206010024229 Leprosy Diseases 0.000 description 2
- 241000712899 Lymphocytic choriomeningitis mammarenavirus Species 0.000 description 2
- 241000701076 Macacine alphaherpesvirus 1 Species 0.000 description 2
- 208000032271 Malignant tumor of penis Diseases 0.000 description 2
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 description 2
- 201000005505 Measles Diseases 0.000 description 2
- 108050008953 Melanoma-associated antigen Proteins 0.000 description 2
- 102100025083 Melanoma-associated antigen 11 Human genes 0.000 description 2
- 102100027252 Melanoma-associated antigen C2 Human genes 0.000 description 2
- 208000002030 Merkel cell carcinoma Diseases 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 108090000744 Mitogen-Activated Protein Kinase Kinases Proteins 0.000 description 2
- 102000004232 Mitogen-Activated Protein Kinase Kinases Human genes 0.000 description 2
- 208000003445 Mouth Neoplasms Diseases 0.000 description 2
- 108010008707 Mucin-1 Proteins 0.000 description 2
- 102100023123 Mucin-16 Human genes 0.000 description 2
- 208000005647 Mumps Diseases 0.000 description 2
- 206010064789 Mycobacterium abscessus infection Diseases 0.000 description 2
- 241000202934 Mycoplasma pneumoniae Species 0.000 description 2
- 201000003793 Myelodysplastic syndrome Diseases 0.000 description 2
- 201000007224 Myeloproliferative neoplasm Diseases 0.000 description 2
- 206010029266 Neuroendocrine carcinoma of the skin Diseases 0.000 description 2
- 208000031986 Nontuberculous Mycobacterium Infections Diseases 0.000 description 2
- 241000369774 Norwalk-like virus Species 0.000 description 2
- 241000243985 Onchocerca volvulus Species 0.000 description 2
- 102000043276 Oncogene Human genes 0.000 description 2
- 208000007027 Oral Candidiasis Diseases 0.000 description 2
- 241000700635 Orf virus Species 0.000 description 2
- 208000009620 Orthomyxoviridae Infections Diseases 0.000 description 2
- 206010033078 Otitis media Diseases 0.000 description 2
- 208000029082 Pelvic Inflammatory Disease Diseases 0.000 description 2
- 208000002471 Penile Neoplasms Diseases 0.000 description 2
- 206010034299 Penile cancer Diseases 0.000 description 2
- 208000027190 Peripheral T-cell lymphomas Diseases 0.000 description 2
- 101710130420 Probable capsid assembly scaffolding protein Proteins 0.000 description 2
- 108010029485 Protein Isoforms Proteins 0.000 description 2
- 102000001708 Protein Isoforms Human genes 0.000 description 2
- 102100037686 Protein SSX2 Human genes 0.000 description 2
- 102100024601 Protein tyrosine phosphatase type IVA 3 Human genes 0.000 description 2
- 102100023347 Proto-oncogene tyrosine-protein kinase ROS Human genes 0.000 description 2
- 201000004360 Pthirus pubis infestation Diseases 0.000 description 2
- 102000003890 RNA-binding protein FUS Human genes 0.000 description 2
- 108090000292 RNA-binding protein FUS Proteins 0.000 description 2
- 206010037742 Rabies Diseases 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 206010061603 Respiratory syncytial virus infection Diseases 0.000 description 2
- 102100031176 Retinoid isomerohydrolase Human genes 0.000 description 2
- 208000000705 Rift Valley Fever Diseases 0.000 description 2
- 206010039438 Salmonella Infections Diseases 0.000 description 2
- 101710204410 Scaffold protein Proteins 0.000 description 2
- 206010040070 Septic Shock Diseases 0.000 description 2
- 102100027103 Serine/threonine-protein kinase B-raf Human genes 0.000 description 2
- 208000019802 Sexually transmitted disease Diseases 0.000 description 2
- 206010040550 Shigella infections Diseases 0.000 description 2
- 208000021712 Soft tissue sarcoma Diseases 0.000 description 2
- 241000191967 Staphylococcus aureus Species 0.000 description 2
- 208000034972 Sudden Infant Death Diseases 0.000 description 2
- 206010042440 Sudden infant death syndrome Diseases 0.000 description 2
- 230000006044 T cell activation Effects 0.000 description 2
- 208000031672 T-Cell Peripheral Lymphoma Diseases 0.000 description 2
- 208000024313 Testicular Neoplasms Diseases 0.000 description 2
- 206010057644 Testis cancer Diseases 0.000 description 2
- 208000002474 Tinea Diseases 0.000 description 2
- 208000000323 Tourette Syndrome Diseases 0.000 description 2
- 208000016620 Tourette disease Diseases 0.000 description 2
- 206010044248 Toxic shock syndrome Diseases 0.000 description 2
- 231100000650 Toxic shock syndrome Toxicity 0.000 description 2
- 206010044269 Toxocariasis Diseases 0.000 description 2
- 208000030886 Traumatic Brain injury Diseases 0.000 description 2
- 241000893966 Trichophyton verrucosum Species 0.000 description 2
- 101710181056 Tumor necrosis factor ligand superfamily member 13B Proteins 0.000 description 2
- 102100040616 Uromodulin-like 1 Human genes 0.000 description 2
- 208000002495 Uterine Neoplasms Diseases 0.000 description 2
- 108091008605 VEGF receptors Proteins 0.000 description 2
- 102100039037 Vascular endothelial growth factor A Human genes 0.000 description 2
- 201000007096 Vulvovaginal Candidiasis Diseases 0.000 description 2
- 102000040856 WT1 Human genes 0.000 description 2
- 208000008383 Wilms tumor Diseases 0.000 description 2
- 206010048249 Yersinia infections Diseases 0.000 description 2
- 241000607479 Yersinia pestis Species 0.000 description 2
- 102100026497 Zinc finger protein 654 Human genes 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- 208000006730 anaplasmosis Diseases 0.000 description 2
- 230000000890 antigenic effect Effects 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 206010064097 avian influenza Diseases 0.000 description 2
- 210000003719 b-lymphocyte Anatomy 0.000 description 2
- 208000022362 bacterial infectious disease Diseases 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- 210000000988 bone and bone Anatomy 0.000 description 2
- 229940074375 burkholderia mallei Drugs 0.000 description 2
- HFCFMRYTXDINDK-WNQIDUERSA-N cabozantinib malate Chemical compound OC(=O)[C@@H](O)CC(O)=O.C=12C=C(OC)C(OC)=CC2=NC=CC=1OC(C=C1)=CC=C1NC(=O)C1(C(=O)NC=2C=CC(F)=CC=2)CC1 HFCFMRYTXDINDK-WNQIDUERSA-N 0.000 description 2
- 201000004927 campylobacteriosis Diseases 0.000 description 2
- YZBQHRLRFGPBSL-RXMQYKEDSA-N carbapenem Chemical compound C1C=CN2C(=O)C[C@H]21 YZBQHRLRFGPBSL-RXMQYKEDSA-N 0.000 description 2
- 208000019065 cervical carcinoma Diseases 0.000 description 2
- 239000003245 coal Substances 0.000 description 2
- 230000001149 cognitive effect Effects 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- ZYGHJZDHTFUPRJ-UHFFFAOYSA-N coumarin Chemical compound C1=CC=C2OC(=O)C=CC2=C1 ZYGHJZDHTFUPRJ-UHFFFAOYSA-N 0.000 description 2
- 208000017763 cutaneous neuroendocrine carcinoma Diseases 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- 208000025729 dengue disease Diseases 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 108010087914 epidermal growth factor receptor VIII Proteins 0.000 description 2
- 208000020612 escherichia coli infection Diseases 0.000 description 2
- 208000006275 fascioliasis Diseases 0.000 description 2
- 210000004700 fetal blood Anatomy 0.000 description 2
- 201000003444 follicular lymphoma Diseases 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 230000002496 gastric effect Effects 0.000 description 2
- 201000011243 gastrointestinal stromal tumor Diseases 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- 201000004946 genital herpes Diseases 0.000 description 2
- 201000006592 giardiasis Diseases 0.000 description 2
- 201000005648 hantavirus pulmonary syndrome Diseases 0.000 description 2
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 2
- 208000006454 hepatitis Diseases 0.000 description 2
- 231100000283 hepatitis Toxicity 0.000 description 2
- 208000007188 hymenolepiasis Diseases 0.000 description 2
- 201000006747 infectious mononucleosis Diseases 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 230000004068 intracellular signaling Effects 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 208000012987 lip and oral cavity carcinoma Diseases 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 230000003211 malignant effect Effects 0.000 description 2
- 208000020968 mature T-cell and NK-cell non-Hodgkin lymphoma Diseases 0.000 description 2
- 201000004015 melioidosis Diseases 0.000 description 2
- 208000037941 meningococcal disease Diseases 0.000 description 2
- 208000010805 mumps infectious disease Diseases 0.000 description 2
- 208000029766 myalgic encephalomeyelitis/chronic fatigue syndrome Diseases 0.000 description 2
- 230000009826 neoplastic cell growth Effects 0.000 description 2
- 210000000440 neutrophil Anatomy 0.000 description 2
- 210000004882 non-tumor cell Anatomy 0.000 description 2
- 229960002450 ofatumumab Drugs 0.000 description 2
- 208000002042 onchocerciasis Diseases 0.000 description 2
- 201000008968 osteosarcoma Diseases 0.000 description 2
- 208000021010 pancreatic neuroendocrine tumor Diseases 0.000 description 2
- 208000030613 peripheral artery disease Diseases 0.000 description 2
- 210000005259 peripheral blood Anatomy 0.000 description 2
- 239000011886 peripheral blood Substances 0.000 description 2
- 201000002628 peritoneum cancer Diseases 0.000 description 2
- 238000002823 phage display Methods 0.000 description 2
- 206010035653 pneumoconiosis Diseases 0.000 description 2
- 230000023603 positive regulation of transcription initiation, DNA-dependent Effects 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 208000030925 respiratory syncytial virus infectious disease Diseases 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 208000007442 rickets Diseases 0.000 description 2
- 229960004641 rituximab Drugs 0.000 description 2
- 206010039447 salmonellosis Diseases 0.000 description 2
- 201000004409 schistosomiasis Diseases 0.000 description 2
- 230000001932 seasonal effect Effects 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 208000015339 staphylococcus aureus infection Diseases 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- 208000004441 taeniasis Diseases 0.000 description 2
- 201000003120 testicular cancer Diseases 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 208000008732 thymoma Diseases 0.000 description 2
- 229960005267 tositumomab Drugs 0.000 description 2
- 206010044412 transitional cell carcinoma Diseases 0.000 description 2
- 230000009529 traumatic brain injury Effects 0.000 description 2
- 208000009920 trichuriasis Diseases 0.000 description 2
- 201000007423 tubular adenocarcinoma Diseases 0.000 description 2
- 201000008297 typhoid fever Diseases 0.000 description 2
- 241001529453 unidentified herpesvirus Species 0.000 description 2
- 206010046766 uterine cancer Diseases 0.000 description 2
- 229910052720 vanadium Inorganic materials 0.000 description 2
- 201000001862 viral hepatitis Diseases 0.000 description 2
- UJCHIZDEQZMODR-BYPYZUCNSA-N (2r)-2-acetamido-3-sulfanylpropanamide Chemical compound CC(=O)N[C@@H](CS)C(N)=O UJCHIZDEQZMODR-BYPYZUCNSA-N 0.000 description 1
- NEHKZPHIKKEMAZ-ZFVKSOIMSA-N (2s)-2-[[(2s,3r)-2-[[(2s)-2-[[(2s,3s)-2-[[2-[[(2s,3s)-2-[[2-[[(2s)-2-[[(2s)-2-azaniumylpropanoyl]amino]propanoyl]amino]acetyl]amino]-3-methylpentanoyl]amino]acetyl]amino]-3-methylpentanoyl]amino]-4-methylpentanoyl]amino]-3-hydroxybutanoyl]amino]-3-methylb Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O NEHKZPHIKKEMAZ-ZFVKSOIMSA-N 0.000 description 1
- KUBDPRSHRVANQQ-NSOVKSMOSA-N (2s,6s)-6-(4-tert-butylphenyl)-2-(4-methylphenyl)-1-(4-methylphenyl)sulfonyl-3,6-dihydro-2h-pyridine-5-carboxylic acid Chemical compound C1=CC(C)=CC=C1[C@H]1N(S(=O)(=O)C=2C=CC(C)=CC=2)[C@@H](C=2C=CC(=CC=2)C(C)(C)C)C(C(O)=O)=CC1 KUBDPRSHRVANQQ-NSOVKSMOSA-N 0.000 description 1
- QYAPHLRPFNSDNH-MRFRVZCGSA-N (4s,4as,5as,6s,12ar)-7-chloro-4-(dimethylamino)-1,6,10,11,12a-pentahydroxy-6-methyl-3,12-dioxo-4,4a,5,5a-tetrahydrotetracene-2-carboxamide;hydrochloride Chemical compound Cl.C1=CC(Cl)=C2[C@](O)(C)[C@H]3C[C@H]4[C@H](N(C)C)C(=O)C(C(N)=O)=C(O)[C@@]4(O)C(=O)C3=C(O)C2=C1O QYAPHLRPFNSDNH-MRFRVZCGSA-N 0.000 description 1
- HXNBAOLVPAWYLT-NVNXTCNLSA-N (5z)-5-[[5-bromo-2-[(2-bromophenyl)methoxy]phenyl]methylidene]-2-sulfanylidene-1,3-thiazolidin-4-one Chemical compound S\1C(=S)NC(=O)C/1=C/C1=CC(Br)=CC=C1OCC1=CC=CC=C1Br HXNBAOLVPAWYLT-NVNXTCNLSA-N 0.000 description 1
- VXZCUHNJXSIJIM-MEBGWEOYSA-N (z)-but-2-enedioic acid;(e)-n-[4-[3-chloro-4-(pyridin-2-ylmethoxy)anilino]-3-cyano-7-ethoxyquinolin-6-yl]-4-(dimethylamino)but-2-enamide Chemical compound OC(=O)\C=C/C(O)=O.C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1OCC1=CC=CC=N1 VXZCUHNJXSIJIM-MEBGWEOYSA-N 0.000 description 1
- 102100026205 1-phosphatidylinositol 4,5-bisphosphate phosphodiesterase gamma-1 Human genes 0.000 description 1
- 102000010400 1-phosphatidylinositol-3-kinase activity proteins Human genes 0.000 description 1
- 102100025007 14-3-3 protein epsilon Human genes 0.000 description 1
- RTQWWZBSTRGEAV-PKHIMPSTSA-N 2-[[(2s)-2-[bis(carboxymethyl)amino]-3-[4-(methylcarbamoylamino)phenyl]propyl]-[2-[bis(carboxymethyl)amino]propyl]amino]acetic acid Chemical compound CNC(=O)NC1=CC=C(C[C@@H](CN(CC(C)N(CC(O)=O)CC(O)=O)CC(O)=O)N(CC(O)=O)CC(O)=O)C=C1 RTQWWZBSTRGEAV-PKHIMPSTSA-N 0.000 description 1
- DIDGPCDGNMIUNX-UUOKFMHZSA-N 2-amino-9-[(2r,3r,4s,5r)-5-(dihydroxyphosphinothioyloxymethyl)-3,4-dihydroxyoxolan-2-yl]-3h-purin-6-one Chemical compound C1=2NC(N)=NC(=O)C=2N=CN1[C@@H]1O[C@H](COP(O)(O)=S)[C@@H](O)[C@H]1O DIDGPCDGNMIUNX-UUOKFMHZSA-N 0.000 description 1
- 102100023340 3-ketodihydrosphingosine reductase Human genes 0.000 description 1
- 108010082808 4-1BB Ligand Proteins 0.000 description 1
- ACNPUCQQZDAPJH-FMOMHUKBSA-N 4-methylbenzenesulfonic acid;2-[4-[(3s)-piperidin-3-yl]phenyl]indazole-7-carboxamide;hydrate Chemical compound O.CC1=CC=C(S([O-])(=O)=O)C=C1.N1=C2C(C(=O)N)=CC=CC2=CN1C(C=C1)=CC=C1[C@@H]1CCC[NH2+]C1 ACNPUCQQZDAPJH-FMOMHUKBSA-N 0.000 description 1
- 102100030310 5,6-dihydroxyindole-2-carboxylic acid oxidase Human genes 0.000 description 1
- AILRADAXUVEEIR-UHFFFAOYSA-N 5-chloro-4-n-(2-dimethylphosphorylphenyl)-2-n-[2-methoxy-4-[4-(4-methylpiperazin-1-yl)piperidin-1-yl]phenyl]pyrimidine-2,4-diamine Chemical compound COC1=CC(N2CCC(CC2)N2CCN(C)CC2)=CC=C1NC(N=1)=NC=C(Cl)C=1NC1=CC=CC=C1P(C)(C)=O AILRADAXUVEEIR-UHFFFAOYSA-N 0.000 description 1
- 102100021546 60S ribosomal protein L10 Human genes 0.000 description 1
- 102100037685 60S ribosomal protein L22 Human genes 0.000 description 1
- 102100026750 60S ribosomal protein L5 Human genes 0.000 description 1
- RHXHGRAEPCAFML-UHFFFAOYSA-N 7-cyclopentyl-n,n-dimethyl-2-[(5-piperazin-1-ylpyridin-2-yl)amino]pyrrolo[2,3-d]pyrimidine-6-carboxamide Chemical compound N1=C2N(C3CCCC3)C(C(=O)N(C)C)=CC2=CN=C1NC(N=C1)=CC=C1N1CCNCC1 RHXHGRAEPCAFML-UHFFFAOYSA-N 0.000 description 1
- 102100040084 A-kinase anchor protein 9 Human genes 0.000 description 1
- 108091022885 ADAM Proteins 0.000 description 1
- 102000029791 ADAM Human genes 0.000 description 1
- 102100024379 AF4/FMR2 family member 1 Human genes 0.000 description 1
- 102100024387 AF4/FMR2 family member 3 Human genes 0.000 description 1
- 102100024381 AF4/FMR2 family member 4 Human genes 0.000 description 1
- 102100025684 APC membrane recruitment protein 1 Human genes 0.000 description 1
- 101710146195 APC membrane recruitment protein 1 Proteins 0.000 description 1
- 102100034580 AT-rich interactive domain-containing protein 1A Human genes 0.000 description 1
- 102100027452 ATP-dependent DNA helicase Q4 Human genes 0.000 description 1
- 101150020330 ATRX gene Proteins 0.000 description 1
- 102100028247 Abl interactor 1 Human genes 0.000 description 1
- 206010061618 Acanthamoeba infection Diseases 0.000 description 1
- 208000020222 Acanthamoeba infectious disease Diseases 0.000 description 1
- 206010063409 Acarodermatitis Diseases 0.000 description 1
- 208000034950 Acinetobacter Infections Diseases 0.000 description 1
- ORILYTVJVMAKLC-UHFFFAOYSA-N Adamantane Natural products C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 description 1
- 102100035886 Adenine DNA glycosylase Human genes 0.000 description 1
- 102100034540 Adenomatous polyposis coli protein Human genes 0.000 description 1
- 208000010370 Adenoviridae Infections Diseases 0.000 description 1
- 206010060931 Adenovirus infection Diseases 0.000 description 1
- 102100036775 Afadin Human genes 0.000 description 1
- ULXXDDBFHOBEHA-ONEGZZNKSA-N Afatinib Chemical compound N1=CN=C2C=C(OC3COCC3)C(NC(=O)/C=C/CN(C)C)=CC2=C1NC1=CC=C(F)C(Cl)=C1 ULXXDDBFHOBEHA-ONEGZZNKSA-N 0.000 description 1
- 102100033816 Aldehyde dehydrogenase, mitochondrial Human genes 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 101710119858 Alpha-1-acid glycoprotein Proteins 0.000 description 1
- 102100023635 Alpha-fetoprotein Human genes 0.000 description 1
- 206010001980 Amoebiasis Diseases 0.000 description 1
- 206010061424 Anal cancer Diseases 0.000 description 1
- 206010002199 Anaphylactic shock Diseases 0.000 description 1
- 241001465677 Ancylostomatoidea Species 0.000 description 1
- 206010002329 Aneurysm Diseases 0.000 description 1
- 108010049777 Ankyrins Proteins 0.000 description 1
- 102000008102 Ankyrins Human genes 0.000 description 1
- 208000007860 Anus Neoplasms Diseases 0.000 description 1
- 206010073360 Appendix cancer Diseases 0.000 description 1
- 208000005989 Arenaviridae Infections Diseases 0.000 description 1
- 102100026376 Artemin Human genes 0.000 description 1
- 108010031480 Artificial Receptors Proteins 0.000 description 1
- 208000006740 Aseptic Meningitis Diseases 0.000 description 1
- 201000002909 Aspergillosis Diseases 0.000 description 1
- 208000036641 Aspergillus infections Diseases 0.000 description 1
- 208000006096 Attention Deficit Disorder with Hyperactivity Diseases 0.000 description 1
- 102100022716 Atypical chemokine receptor 3 Human genes 0.000 description 1
- 206010003805 Autism Diseases 0.000 description 1
- 208000020706 Autistic disease Diseases 0.000 description 1
- 102100035682 Axin-1 Human genes 0.000 description 1
- 108010028006 B-Cell Activating Factor Proteins 0.000 description 1
- 108700024832 B-Cell CLL-Lymphoma 10 Proteins 0.000 description 1
- 102000052666 B-Cell Lymphoma 3 Human genes 0.000 description 1
- 108700009171 B-Cell Lymphoma 3 Proteins 0.000 description 1
- 102100021630 B-cell CLL/lymphoma 7 protein family member A Human genes 0.000 description 1
- 102100032481 B-cell CLL/lymphoma 9 protein Human genes 0.000 description 1
- 102100027205 B-cell antigen receptor complex-associated protein alpha chain Human genes 0.000 description 1
- 102100027203 B-cell antigen receptor complex-associated protein beta chain Human genes 0.000 description 1
- 102100021631 B-cell lymphoma 6 protein Human genes 0.000 description 1
- 102100037598 B-cell lymphoma/leukemia 10 Human genes 0.000 description 1
- 102100022976 B-cell lymphoma/leukemia 11A Human genes 0.000 description 1
- 102100022983 B-cell lymphoma/leukemia 11B Human genes 0.000 description 1
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 1
- 102100021247 BCL-6 corepressor Human genes 0.000 description 1
- 101150074953 BCL10 gene Proteins 0.000 description 1
- 108700020462 BRCA2 Proteins 0.000 description 1
- 102000052609 BRCA2 Human genes 0.000 description 1
- 108091005625 BRD4 Proteins 0.000 description 1
- 241000193738 Bacillus anthracis Species 0.000 description 1
- 108700003785 Baculoviral IAP Repeat-Containing 3 Proteins 0.000 description 1
- 102100021662 Baculoviral IAP repeat-containing protein 3 Human genes 0.000 description 1
- 101150072667 Bcl3 gene Proteins 0.000 description 1
- 102100031505 Beta-1,4 N-acetylgalactosaminyltransferase 1 Human genes 0.000 description 1
- 206010004593 Bile duct cancer Diseases 0.000 description 1
- 101150104237 Birc3 gene Proteins 0.000 description 1
- 102100037674 Bis(5'-adenosyl)-triphosphatase Human genes 0.000 description 1
- 208000024952 Blastocystis infectious disease Diseases 0.000 description 1
- 206010005098 Blastomycosis Diseases 0.000 description 1
- 208000019838 Blood disease Diseases 0.000 description 1
- 102100035631 Bloom syndrome protein Human genes 0.000 description 1
- 108091009167 Bloom syndrome protein Proteins 0.000 description 1
- 102100025423 Bone morphogenetic protein receptor type-1A Human genes 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 208000003508 Botulism Diseases 0.000 description 1
- 208000014644 Brain disease Diseases 0.000 description 1
- 101150008921 Brca2 gene Proteins 0.000 description 1
- 102100026008 Breakpoint cluster region protein Human genes 0.000 description 1
- 102100033642 Bromodomain-containing protein 3 Human genes 0.000 description 1
- 102100029895 Bromodomain-containing protein 4 Human genes 0.000 description 1
- 206010006448 Bronchiolitis Diseases 0.000 description 1
- 206010069747 Burkholderia mallei infection Diseases 0.000 description 1
- 101710098191 C-4 methylsterol oxidase ERG25 Proteins 0.000 description 1
- 102000007269 CA-125 Antigen Human genes 0.000 description 1
- 108010008629 CA-125 Antigen Proteins 0.000 description 1
- 102000014816 CACNA1D Human genes 0.000 description 1
- 102100034808 CCAAT/enhancer-binding protein alpha Human genes 0.000 description 1
- 102100033849 CCHC-type zinc finger nucleic acid binding protein Human genes 0.000 description 1
- 101710116319 CCHC-type zinc finger nucleic acid binding protein Proteins 0.000 description 1
- 102100031033 CCR4-NOT transcription complex subunit 3 Human genes 0.000 description 1
- 101150013553 CD40 gene Proteins 0.000 description 1
- 102100032937 CD40 ligand Human genes 0.000 description 1
- 102100032912 CD44 antigen Human genes 0.000 description 1
- 102100025221 CD70 antigen Human genes 0.000 description 1
- 108010083123 CDX2 Transcription Factor Proteins 0.000 description 1
- 102000006277 CDX2 Transcription Factor Human genes 0.000 description 1
- 102100021975 CREB-binding protein Human genes 0.000 description 1
- 102100040775 CREB-regulated transcription coactivator 1 Human genes 0.000 description 1
- 102100040755 CREB-regulated transcription coactivator 3 Human genes 0.000 description 1
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 1
- 229940045513 CTLA4 antagonist Drugs 0.000 description 1
- 102100024155 Cadherin-11 Human genes 0.000 description 1
- 101100074828 Caenorhabditis elegans lin-12 gene Proteins 0.000 description 1
- 102100038700 Calcium-responsive transactivator Human genes 0.000 description 1
- 208000006339 Caliciviridae Infections Diseases 0.000 description 1
- 102100033561 Calmodulin-binding transcription activator 1 Human genes 0.000 description 1
- 102100029968 Calreticulin Human genes 0.000 description 1
- 241000282828 Camelus bactrianus Species 0.000 description 1
- 241000589876 Campylobacter Species 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 108010078791 Carrier Proteins Proteins 0.000 description 1
- 102100024965 Caspase recruitment domain-containing protein 11 Human genes 0.000 description 1
- 102100026548 Caspase-8 Human genes 0.000 description 1
- 208000005024 Castleman disease Diseases 0.000 description 1
- 102100028914 Catenin beta-1 Human genes 0.000 description 1
- ZEOWTGPWHLSLOG-UHFFFAOYSA-N Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F Chemical compound Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F ZEOWTGPWHLSLOG-UHFFFAOYSA-N 0.000 description 1
- 108091007854 Cdh1/Fizzy-related Proteins 0.000 description 1
- 102000038594 Cdh1/Fizzy-related Human genes 0.000 description 1
- 208000009846 Central Nervous System Protozoal Infections Diseases 0.000 description 1
- 208000037138 Central nervous system embryonal tumor Diseases 0.000 description 1
- 102100031456 Centriolin Human genes 0.000 description 1
- 102100031203 Centrosomal protein 43 Human genes 0.000 description 1
- 102100034794 Centrosomal protein of 89 kDa Human genes 0.000 description 1
- 101710192994 Centrosomal protein of 89 kDa Proteins 0.000 description 1
- 208000026368 Cestode infections Diseases 0.000 description 1
- 101710098119 Chaperonin GroEL 2 Proteins 0.000 description 1
- 201000006082 Chickenpox Diseases 0.000 description 1
- 208000035086 Chlamydophila Infections Diseases 0.000 description 1
- 241000251730 Chondrichthyes Species 0.000 description 1
- 208000008853 Ciguatera Poisoning Diseases 0.000 description 1
- 101710149695 Clampless protein 1 Proteins 0.000 description 1
- 102100026127 Clathrin heavy chain 1 Human genes 0.000 description 1
- 102100034665 Clathrin heavy chain 2 Human genes 0.000 description 1
- 206010009657 Clostridium difficile colitis Diseases 0.000 description 1
- 206010054236 Clostridium difficile infection Diseases 0.000 description 1
- 206010053567 Coagulopathies Diseases 0.000 description 1
- 241000223205 Coccidioides immitis Species 0.000 description 1
- 102100031048 Coiled-coil domain-containing protein 6 Human genes 0.000 description 1
- 102100023689 Coiled-coil-helix-coiled-coil-helix domain-containing protein 7 Human genes 0.000 description 1
- 102100033601 Collagen alpha-1(I) chain Human genes 0.000 description 1
- 102100029136 Collagen alpha-1(II) chain Human genes 0.000 description 1
- 102100024330 Collectin-12 Human genes 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 206010010741 Conjunctivitis Diseases 0.000 description 1
- 208000031973 Conjunctivitis infective Diseases 0.000 description 1
- 108010043471 Core Binding Factor Alpha 2 Subunit Proteins 0.000 description 1
- 108010060313 Core Binding Factor beta Subunit Proteins 0.000 description 1
- 102000008147 Core Binding Factor beta Subunit Human genes 0.000 description 1
- 241000186216 Corynebacterium Species 0.000 description 1
- 206010011224 Cough Diseases 0.000 description 1
- 208000009798 Craniopharyngioma Diseases 0.000 description 1
- 208000010859 Creutzfeldt-Jakob disease Diseases 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 201000007336 Cryptococcosis Diseases 0.000 description 1
- 241000221204 Cryptococcus neoformans Species 0.000 description 1
- 241001490774 Cryptosporidiidae Species 0.000 description 1
- 241000490513 Ctenocephalides canis Species 0.000 description 1
- 241000258924 Ctenocephalides felis Species 0.000 description 1
- 102100026359 Cyclic AMP-responsive element-binding protein 1 Human genes 0.000 description 1
- 102100039297 Cyclic AMP-responsive element-binding protein 3-like protein 1 Human genes 0.000 description 1
- 102100039299 Cyclic AMP-responsive element-binding protein 3-like protein 2 Human genes 0.000 description 1
- 108010009392 Cyclin-Dependent Kinase Inhibitor p16 Proteins 0.000 description 1
- 108010009367 Cyclin-Dependent Kinase Inhibitor p18 Proteins 0.000 description 1
- 102000009503 Cyclin-Dependent Kinase Inhibitor p18 Human genes 0.000 description 1
- 102100038111 Cyclin-dependent kinase 12 Human genes 0.000 description 1
- 102100024458 Cyclin-dependent kinase inhibitor 2A Human genes 0.000 description 1
- 108010076010 Cystathionine beta-lyase Proteins 0.000 description 1
- 102100030299 Cysteine-rich hydrophobic domain-containing protein 2 Human genes 0.000 description 1
- 102100030115 Cysteine-tRNA ligase, cytoplasmic Human genes 0.000 description 1
- 241000987822 Cystoisospora Species 0.000 description 1
- 102100028202 Cytochrome c oxidase subunit 6C Human genes 0.000 description 1
- 102100025628 Cytochrome c oxidase subunit 7B2, mitochondrial Human genes 0.000 description 1
- 102100038497 Cytokine receptor-like factor 2 Human genes 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- 102100028712 Cytosolic purine 5'-nucleotidase Human genes 0.000 description 1
- 102100038284 Cytospin-B Human genes 0.000 description 1
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 1
- 101150077031 DAXX gene Proteins 0.000 description 1
- 102100021122 DNA damage-binding protein 2 Human genes 0.000 description 1
- 102100028843 DNA mismatch repair protein Mlh1 Human genes 0.000 description 1
- 102100034157 DNA mismatch repair protein Msh2 Human genes 0.000 description 1
- 102100021147 DNA mismatch repair protein Msh6 Human genes 0.000 description 1
- 102100033934 DNA repair protein RAD51 homolog 2 Human genes 0.000 description 1
- 102100022474 DNA repair protein complementing XP-A cells Human genes 0.000 description 1
- 102100022477 DNA repair protein complementing XP-C cells Human genes 0.000 description 1
- 102100024607 DNA topoisomerase 1 Human genes 0.000 description 1
- 101100107081 Danio rerio zbtb16a gene Proteins 0.000 description 1
- 102100028559 Death domain-associated protein 6 Human genes 0.000 description 1
- 108010086291 Deubiquitinating Enzyme CYLD Proteins 0.000 description 1
- 101100166522 Dictyostelium discoideum cycB gene Proteins 0.000 description 1
- 241000935794 Dipylidium Species 0.000 description 1
- 208000002251 Dissecting Aneurysm Diseases 0.000 description 1
- SNRUBQQJIBEYMU-UHFFFAOYSA-N Dodecane Natural products CCCCCCCCCCCC SNRUBQQJIBEYMU-UHFFFAOYSA-N 0.000 description 1
- 102100034583 Dolichyl-diphosphooligosaccharide-protein glycosyltransferase subunit 1 Human genes 0.000 description 1
- 241001669680 Dormitator maculatus Species 0.000 description 1
- 102100029952 Double-strand-break repair protein rad21 homolog Human genes 0.000 description 1
- 101100421450 Drosophila melanogaster Shark gene Proteins 0.000 description 1
- 102100031480 Dual specificity mitogen-activated protein kinase kinase 1 Human genes 0.000 description 1
- 102100023266 Dual specificity mitogen-activated protein kinase kinase 2 Human genes 0.000 description 1
- 102100023274 Dual specificity mitogen-activated protein kinase kinase 4 Human genes 0.000 description 1
- 208000006402 Ductal Carcinoma Diseases 0.000 description 1
- 102100036654 Dynactin subunit 1 Human genes 0.000 description 1
- 102100035813 E3 ubiquitin-protein ligase CBL Human genes 0.000 description 1
- 102100035273 E3 ubiquitin-protein ligase CBL-B Human genes 0.000 description 1
- 102100035275 E3 ubiquitin-protein ligase CBL-C Human genes 0.000 description 1
- 102100037038 E3 ubiquitin-protein ligase CCNB1IP1 Human genes 0.000 description 1
- 102000012199 E3 ubiquitin-protein ligase Mdm2 Human genes 0.000 description 1
- 108050002772 E3 ubiquitin-protein ligase Mdm2 Proteins 0.000 description 1
- 102100027418 E3 ubiquitin-protein ligase RNF213 Human genes 0.000 description 1
- 102100026245 E3 ubiquitin-protein ligase RNF43 Human genes 0.000 description 1
- 102100024816 E3 ubiquitin-protein ligase TRAF7 Human genes 0.000 description 1
- 102100029505 E3 ubiquitin-protein ligase TRIM33 Human genes 0.000 description 1
- 102100040341 E3 ubiquitin-protein ligase UBR5 Human genes 0.000 description 1
- 101150039757 EIF3E gene Proteins 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 102100023792 ETS domain-containing protein Elk-4 Human genes 0.000 description 1
- 208000006825 Eastern Equine Encephalomyelitis Diseases 0.000 description 1
- 201000005804 Eastern equine encephalitis Diseases 0.000 description 1
- 201000011001 Ebola Hemorrhagic Fever Diseases 0.000 description 1
- 208000030820 Ebola disease Diseases 0.000 description 1
- 206010014096 Echinococciasis Diseases 0.000 description 1
- 102100027100 Echinoderm microtubule-associated protein-like 4 Human genes 0.000 description 1
- 206010014596 Encephalitis Japanese B Diseases 0.000 description 1
- 206010014587 Encephalitis eastern equine Diseases 0.000 description 1
- 208000032274 Encephalopathy Diseases 0.000 description 1
- 208000001976 Endocrine Gland Neoplasms Diseases 0.000 description 1
- 102100028401 Endophilin-A2 Human genes 0.000 description 1
- 102100036448 Endothelial PAS domain-containing protein 1 Human genes 0.000 description 1
- 102100031785 Endothelial transcription factor GATA-2 Human genes 0.000 description 1
- 241000588921 Enterobacteriaceae Species 0.000 description 1
- 241000498256 Enterobius Species 0.000 description 1
- 206010014979 Epidemic typhus Diseases 0.000 description 1
- 108010066687 Epithelial Cell Adhesion Molecule Proteins 0.000 description 1
- 102000018651 Epithelial Cell Adhesion Molecule Human genes 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 208000000832 Equine Encephalomyelitis Diseases 0.000 description 1
- 102100031690 Erythroid transcription factor Human genes 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 1
- 102100022462 Eukaryotic initiation factor 4A-II Human genes 0.000 description 1
- 102100033132 Eukaryotic translation initiation factor 3 subunit E Human genes 0.000 description 1
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 1
- 208000010201 Exanthema Diseases 0.000 description 1
- 102100029095 Exportin-1 Human genes 0.000 description 1
- 102100038578 F-box only protein 11 Human genes 0.000 description 1
- 102100026353 F-box-like/WD repeat-containing protein TBL1XR1 Human genes 0.000 description 1
- 101710105178 F-box/WD repeat-containing protein 7 Proteins 0.000 description 1
- 102100028138 F-box/WD repeat-containing protein 7 Human genes 0.000 description 1
- 108010022012 Fanconi Anemia Complementation Group F protein Proteins 0.000 description 1
- 108010067741 Fanconi Anemia Complementation Group N protein Proteins 0.000 description 1
- 102100027281 Fanconi anemia group F protein Human genes 0.000 description 1
- 102100034553 Fanconi anemia group J protein Human genes 0.000 description 1
- 241001126309 Fasciolopsis Species 0.000 description 1
- 102100034334 Fatty acid CoA ligase Acsl3 Human genes 0.000 description 1
- 102100031513 Fc receptor-like protein 4 Human genes 0.000 description 1
- 108010008177 Fd immunoglobulins Proteins 0.000 description 1
- 102100023593 Fibroblast growth factor receptor 1 Human genes 0.000 description 1
- 101710182386 Fibroblast growth factor receptor 1 Proteins 0.000 description 1
- 102100023600 Fibroblast growth factor receptor 2 Human genes 0.000 description 1
- 101710182389 Fibroblast growth factor receptor 2 Proteins 0.000 description 1
- 102100027842 Fibroblast growth factor receptor 3 Human genes 0.000 description 1
- 101710182396 Fibroblast growth factor receptor 3 Proteins 0.000 description 1
- 206010053717 Fibrous histiocytoma Diseases 0.000 description 1
- 206010016675 Filariasis lymphatic Diseases 0.000 description 1
- 102000010451 Folate receptor alpha Human genes 0.000 description 1
- 108050001931 Folate receptor alpha Proteins 0.000 description 1
- 102100027909 Folliculin Human genes 0.000 description 1
- 206010016936 Folliculitis Diseases 0.000 description 1
- 102100029379 Follistatin-related protein 3 Human genes 0.000 description 1
- 208000007212 Foot-and-Mouth Disease Diseases 0.000 description 1
- 241000710198 Foot-and-mouth disease virus Species 0.000 description 1
- 108010010285 Forkhead Box Protein L2 Proteins 0.000 description 1
- 108010009306 Forkhead Box Protein O1 Proteins 0.000 description 1
- 108010009307 Forkhead Box Protein O3 Proteins 0.000 description 1
- 102100035137 Forkhead box protein L2 Human genes 0.000 description 1
- 102100035427 Forkhead box protein O1 Human genes 0.000 description 1
- 102100035421 Forkhead box protein O3 Human genes 0.000 description 1
- 102100035416 Forkhead box protein O4 Human genes 0.000 description 1
- 102100028122 Forkhead box protein P1 Human genes 0.000 description 1
- 102100040680 Formin-binding protein 1 Human genes 0.000 description 1
- 208000001914 Fragile X syndrome Diseases 0.000 description 1
- 102100030334 Friend leukemia integration 1 transcription factor Human genes 0.000 description 1
- 102100024165 G1/S-specific cyclin-D1 Human genes 0.000 description 1
- 102100024185 G1/S-specific cyclin-D2 Human genes 0.000 description 1
- 102100037859 G1/S-specific cyclin-D3 Human genes 0.000 description 1
- 102100037858 G1/S-specific cyclin-E1 Human genes 0.000 description 1
- 102100033452 GMP synthase [glutamine-hydrolyzing] Human genes 0.000 description 1
- 101710071060 GMPS Proteins 0.000 description 1
- 102100030708 GTPase KRas Human genes 0.000 description 1
- 102100039788 GTPase NRas Human genes 0.000 description 1
- 208000022072 Gallbladder Neoplasms Diseases 0.000 description 1
- 208000005577 Gastroenteritis Diseases 0.000 description 1
- 201000003741 Gastrointestinal carcinoma Diseases 0.000 description 1
- 206010051066 Gastrointestinal stromal tumour Diseases 0.000 description 1
- 206010018143 Genital candidiasis Diseases 0.000 description 1
- 208000002966 Giant Cell Tumor of Bone Diseases 0.000 description 1
- 201000003641 Glanders Diseases 0.000 description 1
- 101710088083 Glomulin Proteins 0.000 description 1
- 102100032530 Glypican-3 Human genes 0.000 description 1
- 102100036675 Golgi-associated PDZ and coiled-coil motif-containing protein Human genes 0.000 description 1
- 102100041032 Golgin subfamily A member 5 Human genes 0.000 description 1
- 208000017263 Gonadal germ cell tumor Diseases 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 102100039619 Granulocyte colony-stimulating factor Human genes 0.000 description 1
- 102100039622 Granulocyte colony-stimulating factor receptor Human genes 0.000 description 1
- 102100031493 Growth arrest-specific protein 7 Human genes 0.000 description 1
- 102100025334 Guanine nucleotide-binding protein G(q) subunit alpha Human genes 0.000 description 1
- 102100032610 Guanine nucleotide-binding protein G(s) subunit alpha isoforms XLas Human genes 0.000 description 1
- 102100036738 Guanine nucleotide-binding protein subunit alpha-11 Human genes 0.000 description 1
- 108091059596 H3F3A Proteins 0.000 description 1
- 102100028976 HLA class I histocompatibility antigen, B alpha chain Human genes 0.000 description 1
- 102100028971 HLA class I histocompatibility antigen, C alpha chain Human genes 0.000 description 1
- 102100029966 HLA class II histocompatibility antigen, DP alpha 1 chain Human genes 0.000 description 1
- 102100036242 HLA class II histocompatibility antigen, DQ alpha 2 chain Human genes 0.000 description 1
- 102100036241 HLA class II histocompatibility antigen, DQ beta 1 chain Human genes 0.000 description 1
- 102100040485 HLA class II histocompatibility antigen, DRB1 beta chain Human genes 0.000 description 1
- 108010013476 HLA-A24 Antigen Proteins 0.000 description 1
- 108010058607 HLA-B Antigens Proteins 0.000 description 1
- 108010052199 HLA-C Antigens Proteins 0.000 description 1
- 108010093061 HLA-DPA1 antigen Proteins 0.000 description 1
- 108010086786 HLA-DQA1 antigen Proteins 0.000 description 1
- 108010065026 HLA-DQB1 antigen Proteins 0.000 description 1
- 108010039343 HLA-DRB1 Chains Proteins 0.000 description 1
- 108700039143 HMGA2 Proteins 0.000 description 1
- 108010081348 HRT1 protein Hairy Proteins 0.000 description 1
- 102100021881 Hairy/enhancer-of-split related with YRPW motif protein 1 Human genes 0.000 description 1
- 102100031561 Hamartin Human genes 0.000 description 1
- 208000031220 Hemophilia Diseases 0.000 description 1
- 208000009292 Hemophilia A Diseases 0.000 description 1
- 208000025164 Hendra virus infection Diseases 0.000 description 1
- 208000000464 Henipavirus Infections Diseases 0.000 description 1
- 102100021866 Hepatocyte growth factor Human genes 0.000 description 1
- 102100022057 Hepatocyte nuclear factor 1-alpha Human genes 0.000 description 1
- 102100029283 Hepatocyte nuclear factor 3-alpha Human genes 0.000 description 1
- 208000007514 Herpes zoster Diseases 0.000 description 1
- 208000029433 Herpesviridae infectious disease Diseases 0.000 description 1
- 102100035108 High affinity nerve growth factor receptor Human genes 0.000 description 1
- 102100029009 High mobility group protein HMG-I/HMG-Y Human genes 0.000 description 1
- 102100028999 High mobility group protein HMGI-C Human genes 0.000 description 1
- 102000008949 Histocompatibility Antigens Class I Human genes 0.000 description 1
- 108010088652 Histocompatibility Antigens Class I Proteins 0.000 description 1
- 102100034523 Histone H4 Human genes 0.000 description 1
- 102100022103 Histone-lysine N-methyltransferase 2A Human genes 0.000 description 1
- 102100027755 Histone-lysine N-methyltransferase 2C Human genes 0.000 description 1
- 102100027768 Histone-lysine N-methyltransferase 2D Human genes 0.000 description 1
- 102100029234 Histone-lysine N-methyltransferase NSD2 Human genes 0.000 description 1
- 102100029235 Histone-lysine N-methyltransferase NSD3 Human genes 0.000 description 1
- 102100024594 Histone-lysine N-methyltransferase PRDM16 Human genes 0.000 description 1
- 102100029239 Histone-lysine N-methyltransferase, H3 lysine-36 specific Human genes 0.000 description 1
- 201000002563 Histoplasmosis Diseases 0.000 description 1
- 101150073387 Hmga2 gene Proteins 0.000 description 1
- 101100118545 Holotrichia diomphalia EGF-like gene Proteins 0.000 description 1
- 102100027893 Homeobox protein Nkx-2.1 Human genes 0.000 description 1
- 102100030234 Homeobox protein cut-like 1 Human genes 0.000 description 1
- 101000691599 Homo sapiens 1-phosphatidylinositol 4,5-bisphosphate phosphodiesterase gamma-1 Proteins 0.000 description 1
- 101000760079 Homo sapiens 14-3-3 protein epsilon Proteins 0.000 description 1
- 101000590272 Homo sapiens 26S proteasome non-ATPase regulatory subunit 2 Proteins 0.000 description 1
- 101001050680 Homo sapiens 3-ketodihydrosphingosine reductase Proteins 0.000 description 1
- 101000773083 Homo sapiens 5,6-dihydroxyindole-2-carboxylic acid oxidase Proteins 0.000 description 1
- 101001108634 Homo sapiens 60S ribosomal protein L10 Proteins 0.000 description 1
- 101001117935 Homo sapiens 60S ribosomal protein L15 Proteins 0.000 description 1
- 101001097555 Homo sapiens 60S ribosomal protein L22 Proteins 0.000 description 1
- 101000691083 Homo sapiens 60S ribosomal protein L5 Proteins 0.000 description 1
- 101000890598 Homo sapiens A-kinase anchor protein 9 Proteins 0.000 description 1
- 101000833180 Homo sapiens AF4/FMR2 family member 1 Proteins 0.000 description 1
- 101000833166 Homo sapiens AF4/FMR2 family member 3 Proteins 0.000 description 1
- 101000833170 Homo sapiens AF4/FMR2 family member 4 Proteins 0.000 description 1
- 101000924266 Homo sapiens AT-rich interactive domain-containing protein 1A Proteins 0.000 description 1
- 101000580577 Homo sapiens ATP-dependent DNA helicase Q4 Proteins 0.000 description 1
- 101000724225 Homo sapiens Abl interactor 1 Proteins 0.000 description 1
- 101001000351 Homo sapiens Adenine DNA glycosylase Proteins 0.000 description 1
- 101000924577 Homo sapiens Adenomatous polyposis coli protein Proteins 0.000 description 1
- 101000928246 Homo sapiens Afadin Proteins 0.000 description 1
- 101000785776 Homo sapiens Artemin Proteins 0.000 description 1
- 101000678890 Homo sapiens Atypical chemokine receptor 3 Proteins 0.000 description 1
- 101000874566 Homo sapiens Axin-1 Proteins 0.000 description 1
- 101000971230 Homo sapiens B-cell CLL/lymphoma 7 protein family member A Proteins 0.000 description 1
- 101000798495 Homo sapiens B-cell CLL/lymphoma 9 protein Proteins 0.000 description 1
- 101000914489 Homo sapiens B-cell antigen receptor complex-associated protein alpha chain Proteins 0.000 description 1
- 101000914491 Homo sapiens B-cell antigen receptor complex-associated protein beta chain Proteins 0.000 description 1
- 101000971234 Homo sapiens B-cell lymphoma 6 protein Proteins 0.000 description 1
- 101000903703 Homo sapiens B-cell lymphoma/leukemia 11A Proteins 0.000 description 1
- 101000903697 Homo sapiens B-cell lymphoma/leukemia 11B Proteins 0.000 description 1
- 101100165236 Homo sapiens BCOR gene Proteins 0.000 description 1
- 101000729811 Homo sapiens Beta-1,4 N-acetylgalactosaminyltransferase 1 Proteins 0.000 description 1
- 101000934638 Homo sapiens Bone morphogenetic protein receptor type-1A Proteins 0.000 description 1
- 101000933320 Homo sapiens Breakpoint cluster region protein Proteins 0.000 description 1
- 101000871851 Homo sapiens Bromodomain-containing protein 3 Proteins 0.000 description 1
- 101000945515 Homo sapiens CCAAT/enhancer-binding protein alpha Proteins 0.000 description 1
- 101000919663 Homo sapiens CCR4-NOT transcription complex subunit 3 Proteins 0.000 description 1
- 101000868273 Homo sapiens CD44 antigen Proteins 0.000 description 1
- 101000934356 Homo sapiens CD70 antigen Proteins 0.000 description 1
- 101000896987 Homo sapiens CREB-binding protein Proteins 0.000 description 1
- 101000891939 Homo sapiens CREB-regulated transcription coactivator 1 Proteins 0.000 description 1
- 101000891906 Homo sapiens CREB-regulated transcription coactivator 3 Proteins 0.000 description 1
- 101000762236 Homo sapiens Cadherin-11 Proteins 0.000 description 1
- 101000957728 Homo sapiens Calcium-responsive transactivator Proteins 0.000 description 1
- 101000945309 Homo sapiens Calmodulin-binding transcription activator 1 Proteins 0.000 description 1
- 101000793651 Homo sapiens Calreticulin Proteins 0.000 description 1
- 101000761179 Homo sapiens Caspase recruitment domain-containing protein 11 Proteins 0.000 description 1
- 101000983528 Homo sapiens Caspase-8 Proteins 0.000 description 1
- 101000916173 Homo sapiens Catenin beta-1 Proteins 0.000 description 1
- 101000941711 Homo sapiens Centriolin Proteins 0.000 description 1
- 101000776477 Homo sapiens Centrosomal protein 43 Proteins 0.000 description 1
- 101000912851 Homo sapiens Clathrin heavy chain 1 Proteins 0.000 description 1
- 101000946482 Homo sapiens Clathrin heavy chain 2 Proteins 0.000 description 1
- 101000777370 Homo sapiens Coiled-coil domain-containing protein 6 Proteins 0.000 description 1
- 101000906984 Homo sapiens Coiled-coil-helix-coiled-coil-helix domain-containing protein 7 Proteins 0.000 description 1
- 101000771163 Homo sapiens Collagen alpha-1(II) chain Proteins 0.000 description 1
- 101000711004 Homo sapiens Cx9C motif-containing protein 4 Proteins 0.000 description 1
- 101000855516 Homo sapiens Cyclic AMP-responsive element-binding protein 1 Proteins 0.000 description 1
- 101000745631 Homo sapiens Cyclic AMP-responsive element-binding protein 3-like protein 1 Proteins 0.000 description 1
- 101000745624 Homo sapiens Cyclic AMP-responsive element-binding protein 3-like protein 2 Proteins 0.000 description 1
- 101000884345 Homo sapiens Cyclin-dependent kinase 12 Proteins 0.000 description 1
- 101000991100 Homo sapiens Cysteine-rich hydrophobic domain-containing protein 2 Proteins 0.000 description 1
- 101000586290 Homo sapiens Cysteine-tRNA ligase, cytoplasmic Proteins 0.000 description 1
- 101000861049 Homo sapiens Cytochrome c oxidase subunit 6C Proteins 0.000 description 1
- 101000856671 Homo sapiens Cytochrome c oxidase subunit 7B2, mitochondrial Proteins 0.000 description 1
- 101000956427 Homo sapiens Cytokine receptor-like factor 2 Proteins 0.000 description 1
- 101000915162 Homo sapiens Cytosolic purine 5'-nucleotidase Proteins 0.000 description 1
- 101000884817 Homo sapiens Cytospin-B Proteins 0.000 description 1
- 101001041466 Homo sapiens DNA damage-binding protein 2 Proteins 0.000 description 1
- 101001134036 Homo sapiens DNA mismatch repair protein Msh2 Proteins 0.000 description 1
- 101000968658 Homo sapiens DNA mismatch repair protein Msh6 Proteins 0.000 description 1
- 101000618531 Homo sapiens DNA repair protein complementing XP-A cells Proteins 0.000 description 1
- 101000618535 Homo sapiens DNA repair protein complementing XP-C cells Proteins 0.000 description 1
- 101000830681 Homo sapiens DNA topoisomerase 1 Proteins 0.000 description 1
- 101000848781 Homo sapiens Dolichyl-diphosphooligosaccharide-protein glycosyltransferase subunit 1 Proteins 0.000 description 1
- 101000584942 Homo sapiens Double-strand-break repair protein rad21 homolog Proteins 0.000 description 1
- 101001115395 Homo sapiens Dual specificity mitogen-activated protein kinase kinase 4 Proteins 0.000 description 1
- 101000929626 Homo sapiens Dynactin subunit 1 Proteins 0.000 description 1
- 101000737265 Homo sapiens E3 ubiquitin-protein ligase CBL-B Proteins 0.000 description 1
- 101000737269 Homo sapiens E3 ubiquitin-protein ligase CBL-C Proteins 0.000 description 1
- 101000737896 Homo sapiens E3 ubiquitin-protein ligase CCNB1IP1 Proteins 0.000 description 1
- 101001095815 Homo sapiens E3 ubiquitin-protein ligase RING2 Proteins 0.000 description 1
- 101000650316 Homo sapiens E3 ubiquitin-protein ligase RNF213 Proteins 0.000 description 1
- 101000692702 Homo sapiens E3 ubiquitin-protein ligase RNF43 Proteins 0.000 description 1
- 101000830899 Homo sapiens E3 ubiquitin-protein ligase TRAF7 Proteins 0.000 description 1
- 101000634991 Homo sapiens E3 ubiquitin-protein ligase TRIM33 Proteins 0.000 description 1
- 101000671838 Homo sapiens E3 ubiquitin-protein ligase UBR5 Proteins 0.000 description 1
- 101001048716 Homo sapiens ETS domain-containing protein Elk-4 Proteins 0.000 description 1
- 101001057929 Homo sapiens Echinoderm microtubule-associated protein-like 4 Proteins 0.000 description 1
- 101000851054 Homo sapiens Elastin Proteins 0.000 description 1
- 101000632553 Homo sapiens Endophilin-A2 Proteins 0.000 description 1
- 101001066265 Homo sapiens Endothelial transcription factor GATA-2 Proteins 0.000 description 1
- 101000967216 Homo sapiens Eosinophil cationic protein Proteins 0.000 description 1
- 101001066268 Homo sapiens Erythroid transcription factor Proteins 0.000 description 1
- 101001044475 Homo sapiens Eukaryotic initiation factor 4A-II Proteins 0.000 description 1
- 101001030683 Homo sapiens F-box only protein 11 Proteins 0.000 description 1
- 101000835675 Homo sapiens F-box-like/WD repeat-containing protein TBL1XR1 Proteins 0.000 description 1
- 101000848171 Homo sapiens Fanconi anemia group J protein Proteins 0.000 description 1
- 101000780194 Homo sapiens Fatty acid CoA ligase Acsl3 Proteins 0.000 description 1
- 101000846909 Homo sapiens Fc receptor-like protein 4 Proteins 0.000 description 1
- 101001060703 Homo sapiens Folliculin Proteins 0.000 description 1
- 101001062529 Homo sapiens Follistatin-related protein 3 Proteins 0.000 description 1
- 101000877683 Homo sapiens Forkhead box protein O4 Proteins 0.000 description 1
- 101001059893 Homo sapiens Forkhead box protein P1 Proteins 0.000 description 1
- 101000892722 Homo sapiens Formin-binding protein 1 Proteins 0.000 description 1
- 101001062996 Homo sapiens Friend leukemia integration 1 transcription factor Proteins 0.000 description 1
- 101000980756 Homo sapiens G1/S-specific cyclin-D1 Proteins 0.000 description 1
- 101000980741 Homo sapiens G1/S-specific cyclin-D2 Proteins 0.000 description 1
- 101000738559 Homo sapiens G1/S-specific cyclin-D3 Proteins 0.000 description 1
- 101000738568 Homo sapiens G1/S-specific cyclin-E1 Proteins 0.000 description 1
- 101000744505 Homo sapiens GTPase NRas Proteins 0.000 description 1
- 101001014668 Homo sapiens Glypican-3 Proteins 0.000 description 1
- 101001072499 Homo sapiens Golgi-associated PDZ and coiled-coil motif-containing protein Proteins 0.000 description 1
- 101001039330 Homo sapiens Golgin subfamily A member 5 Proteins 0.000 description 1
- 101000746364 Homo sapiens Granulocyte colony-stimulating factor receptor Proteins 0.000 description 1
- 101000923044 Homo sapiens Growth arrest-specific protein 7 Proteins 0.000 description 1
- 101000857888 Homo sapiens Guanine nucleotide-binding protein G(q) subunit alpha Proteins 0.000 description 1
- 101001014590 Homo sapiens Guanine nucleotide-binding protein G(s) subunit alpha isoforms XLas Proteins 0.000 description 1
- 101001014594 Homo sapiens Guanine nucleotide-binding protein G(s) subunit alpha isoforms short Proteins 0.000 description 1
- 101001072407 Homo sapiens Guanine nucleotide-binding protein subunit alpha-11 Proteins 0.000 description 1
- 101000795643 Homo sapiens Hamartin Proteins 0.000 description 1
- 101000898034 Homo sapiens Hepatocyte growth factor Proteins 0.000 description 1
- 101001045751 Homo sapiens Hepatocyte nuclear factor 1-alpha Proteins 0.000 description 1
- 101001062353 Homo sapiens Hepatocyte nuclear factor 3-alpha Proteins 0.000 description 1
- 101000596894 Homo sapiens High affinity nerve growth factor receptor Proteins 0.000 description 1
- 101000986380 Homo sapiens High mobility group protein HMG-I/HMG-Y Proteins 0.000 description 1
- 101001035966 Homo sapiens Histone H3.3 Proteins 0.000 description 1
- 101001067880 Homo sapiens Histone H4 Proteins 0.000 description 1
- 101001045846 Homo sapiens Histone-lysine N-methyltransferase 2A Proteins 0.000 description 1
- 101001008892 Homo sapiens Histone-lysine N-methyltransferase 2C Proteins 0.000 description 1
- 101001008894 Homo sapiens Histone-lysine N-methyltransferase 2D Proteins 0.000 description 1
- 101000634048 Homo sapiens Histone-lysine N-methyltransferase NSD2 Proteins 0.000 description 1
- 101000634046 Homo sapiens Histone-lysine N-methyltransferase NSD3 Proteins 0.000 description 1
- 101000686942 Homo sapiens Histone-lysine N-methyltransferase PRDM16 Proteins 0.000 description 1
- 101000634050 Homo sapiens Histone-lysine N-methyltransferase, H3 lysine-36 specific Proteins 0.000 description 1
- 101000632178 Homo sapiens Homeobox protein Nkx-2.1 Proteins 0.000 description 1
- 101000726740 Homo sapiens Homeobox protein cut-like 1 Proteins 0.000 description 1
- 101001035137 Homo sapiens Homocysteine-responsive endoplasmic reticulum-resident ubiquitin-like domain member 1 protein Proteins 0.000 description 1
- 101001021527 Homo sapiens Huntingtin-interacting protein 1 Proteins 0.000 description 1
- 101001103039 Homo sapiens Inactive tyrosine-protein kinase transmembrane receptor ROR1 Proteins 0.000 description 1
- 101001046677 Homo sapiens Integrin alpha-V Proteins 0.000 description 1
- 101001076408 Homo sapiens Interleukin-6 Proteins 0.000 description 1
- 101000599886 Homo sapiens Isocitrate dehydrogenase [NADP], mitochondrial Proteins 0.000 description 1
- 101001090172 Homo sapiens Kinectin Proteins 0.000 description 1
- 101001050559 Homo sapiens Kinesin-1 heavy chain Proteins 0.000 description 1
- 101000971521 Homo sapiens Kinetochore scaffold 1 Proteins 0.000 description 1
- 101001139134 Homo sapiens Krueppel-like factor 4 Proteins 0.000 description 1
- 101001139126 Homo sapiens Krueppel-like factor 6 Proteins 0.000 description 1
- 101000981546 Homo sapiens LHFPL tetraspan subfamily member 6 protein Proteins 0.000 description 1
- 101001023330 Homo sapiens LIM and SH3 domain protein 1 Proteins 0.000 description 1
- 101001017855 Homo sapiens Leucine-rich repeats and immunoglobulin-like domains protein 3 Proteins 0.000 description 1
- 101001003687 Homo sapiens Lipoma-preferred partner Proteins 0.000 description 1
- 101001064542 Homo sapiens Liprin-beta-1 Proteins 0.000 description 1
- 101001064870 Homo sapiens Lon protease homolog, mitochondrial Proteins 0.000 description 1
- 101000780202 Homo sapiens Long-chain-fatty-acid-CoA ligase 6 Proteins 0.000 description 1
- 101000878605 Homo sapiens Low affinity immunoglobulin epsilon Fc receptor Proteins 0.000 description 1
- 101000917824 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor II-b Proteins 0.000 description 1
- 101001088892 Homo sapiens Lysine-specific demethylase 5A Proteins 0.000 description 1
- 101001088887 Homo sapiens Lysine-specific demethylase 5C Proteins 0.000 description 1
- 101001025967 Homo sapiens Lysine-specific demethylase 6A Proteins 0.000 description 1
- 101100076418 Homo sapiens MECOM gene Proteins 0.000 description 1
- 101001106413 Homo sapiens Macrophage-stimulating protein receptor Proteins 0.000 description 1
- 101001005667 Homo sapiens Mastermind-like protein 2 Proteins 0.000 description 1
- 101000614988 Homo sapiens Mediator of RNA polymerase II transcription subunit 12 Proteins 0.000 description 1
- 101001057193 Homo sapiens Membrane-associated guanylate kinase, WW and PDZ domain-containing protein 1 Proteins 0.000 description 1
- 101000582631 Homo sapiens Menin Proteins 0.000 description 1
- 101000581507 Homo sapiens Methyl-CpG-binding domain protein 1 Proteins 0.000 description 1
- 101000653360 Homo sapiens Methylcytosine dioxygenase TET1 Proteins 0.000 description 1
- 101000653374 Homo sapiens Methylcytosine dioxygenase TET2 Proteins 0.000 description 1
- 101000794228 Homo sapiens Mitotic checkpoint serine/threonine-protein kinase BUB1 beta Proteins 0.000 description 1
- 101000987094 Homo sapiens Moesin Proteins 0.000 description 1
- 101001074975 Homo sapiens Molybdopterin molybdenumtransferase Proteins 0.000 description 1
- 101000576323 Homo sapiens Motor neuron and pancreas homeobox protein 1 Proteins 0.000 description 1
- 101001030211 Homo sapiens Myc proto-oncogene protein Proteins 0.000 description 1
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 1
- 101001000104 Homo sapiens Myosin-11 Proteins 0.000 description 1
- 101001030232 Homo sapiens Myosin-9 Proteins 0.000 description 1
- 101000906927 Homo sapiens N-chimaerin Proteins 0.000 description 1
- 101000651236 Homo sapiens NCK-interacting protein with SH3 domain Proteins 0.000 description 1
- 101000604452 Homo sapiens NUT family member 2A Proteins 0.000 description 1
- 101000604453 Homo sapiens NUT family member 2B Proteins 0.000 description 1
- 101000588247 Homo sapiens Nascent polypeptide-associated complex subunit alpha Proteins 0.000 description 1
- 101000981973 Homo sapiens Nascent polypeptide-associated complex subunit alpha, muscle-specific form Proteins 0.000 description 1
- 101000581981 Homo sapiens Neural cell adhesion molecule 1 Proteins 0.000 description 1
- 101001014610 Homo sapiens Neuroendocrine secretory protein 55 Proteins 0.000 description 1
- 101000978766 Homo sapiens Neurogenic locus notch homolog protein 1 Proteins 0.000 description 1
- 101000577199 Homo sapiens Neurogenic locus notch homolog protein 2 Proteins 0.000 description 1
- 101000577202 Homo sapiens Neurogenic locus notch homolog protein 3 Proteins 0.000 description 1
- 101000577163 Homo sapiens Neurogenic locus notch homolog protein 4 Proteins 0.000 description 1
- 101000981336 Homo sapiens Nibrin Proteins 0.000 description 1
- 101000979497 Homo sapiens Ninein Proteins 0.000 description 1
- 101000578287 Homo sapiens Non-POU domain-containing octamer-binding protein Proteins 0.000 description 1
- 101000598160 Homo sapiens Nuclear mitotic apparatus protein 1 Proteins 0.000 description 1
- 101000996563 Homo sapiens Nuclear pore complex protein Nup214 Proteins 0.000 description 1
- 101001103036 Homo sapiens Nuclear receptor ROR-alpha Proteins 0.000 description 1
- 101000602926 Homo sapiens Nuclear receptor coactivator 1 Proteins 0.000 description 1
- 101000602930 Homo sapiens Nuclear receptor coactivator 2 Proteins 0.000 description 1
- 101000974343 Homo sapiens Nuclear receptor coactivator 4 Proteins 0.000 description 1
- 101001109689 Homo sapiens Nuclear receptor subfamily 4 group A member 3 Proteins 0.000 description 1
- 101001109719 Homo sapiens Nucleophosmin Proteins 0.000 description 1
- 101000801664 Homo sapiens Nucleoprotein TPR Proteins 0.000 description 1
- 101000986810 Homo sapiens P2Y purinoceptor 8 Proteins 0.000 description 1
- 101000692980 Homo sapiens PHD finger protein 6 Proteins 0.000 description 1
- 101000738901 Homo sapiens PMS1 protein homolog 1 Proteins 0.000 description 1
- 101001094700 Homo sapiens POU domain, class 5, transcription factor 1 Proteins 0.000 description 1
- 101001072590 Homo sapiens POZ-, AT hook-, and zinc finger-containing protein 1 Proteins 0.000 description 1
- 101000613490 Homo sapiens Paired box protein Pax-3 Proteins 0.000 description 1
- 101000601724 Homo sapiens Paired box protein Pax-5 Proteins 0.000 description 1
- 101000601661 Homo sapiens Paired box protein Pax-7 Proteins 0.000 description 1
- 101000601664 Homo sapiens Paired box protein Pax-8 Proteins 0.000 description 1
- 101000692768 Homo sapiens Paired mesoderm homeobox protein 2B Proteins 0.000 description 1
- 101000945735 Homo sapiens Parafibromin Proteins 0.000 description 1
- 101000987581 Homo sapiens Perforin-1 Proteins 0.000 description 1
- 101001134861 Homo sapiens Pericentriolar material 1 protein Proteins 0.000 description 1
- 101000579484 Homo sapiens Period circadian protein homolog 1 Proteins 0.000 description 1
- 101000741790 Homo sapiens Peroxisome proliferator-activated receptor gamma Proteins 0.000 description 1
- 101001120056 Homo sapiens Phosphatidylinositol 3-kinase regulatory subunit alpha Proteins 0.000 description 1
- 101000605639 Homo sapiens Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit alpha isoform Proteins 0.000 description 1
- 101000583474 Homo sapiens Phosphatidylinositol-binding clathrin assembly protein Proteins 0.000 description 1
- 101001001487 Homo sapiens Phosphatidylinositol-glycan biosynthesis class F protein Proteins 0.000 description 1
- 101000595923 Homo sapiens Placenta growth factor Proteins 0.000 description 1
- 101000728115 Homo sapiens Plasma membrane calcium-transporting ATPase 3 Proteins 0.000 description 1
- 101000596046 Homo sapiens Plastin-2 Proteins 0.000 description 1
- 101000609360 Homo sapiens Platelet-activating factor acetylhydrolase IB subunit alpha2 Proteins 0.000 description 1
- 101001126417 Homo sapiens Platelet-derived growth factor receptor alpha Proteins 0.000 description 1
- 101000584499 Homo sapiens Polycomb protein SUZ12 Proteins 0.000 description 1
- 101001126582 Homo sapiens Post-GPI attachment to proteins factor 3 Proteins 0.000 description 1
- 101000610107 Homo sapiens Pre-B-cell leukemia transcription factor 1 Proteins 0.000 description 1
- 101000846284 Homo sapiens Pre-mRNA 3'-end-processing factor FIP1 Proteins 0.000 description 1
- 101001003584 Homo sapiens Prelamin-A/C Proteins 0.000 description 1
- 101001117317 Homo sapiens Programmed cell death 1 ligand 1 Proteins 0.000 description 1
- 101001117312 Homo sapiens Programmed cell death 1 ligand 2 Proteins 0.000 description 1
- 101000611614 Homo sapiens Proline-rich protein PRCC Proteins 0.000 description 1
- 101001098872 Homo sapiens Proprotein convertase subtilisin/kexin type 7 Proteins 0.000 description 1
- 101001117517 Homo sapiens Prostaglandin E2 receptor EP3 subtype Proteins 0.000 description 1
- 101000741885 Homo sapiens Protection of telomeres protein 1 Proteins 0.000 description 1
- 101000718497 Homo sapiens Protein AF-10 Proteins 0.000 description 1
- 101000892360 Homo sapiens Protein AF-17 Proteins 0.000 description 1
- 101000959489 Homo sapiens Protein AF-9 Proteins 0.000 description 1
- 101000892338 Homo sapiens Protein AF1q Proteins 0.000 description 1
- 101000797903 Homo sapiens Protein ALEX Proteins 0.000 description 1
- 101000933601 Homo sapiens Protein BTG1 Proteins 0.000 description 1
- 101000761460 Homo sapiens Protein CASP Proteins 0.000 description 1
- 101000925651 Homo sapiens Protein ENL Proteins 0.000 description 1
- 101000585703 Homo sapiens Protein L-Myc Proteins 0.000 description 1
- 101000579580 Homo sapiens Protein LSM14 homolog A Proteins 0.000 description 1
- 101000979748 Homo sapiens Protein NDRG1 Proteins 0.000 description 1
- 101000573199 Homo sapiens Protein PML Proteins 0.000 description 1
- 101000880769 Homo sapiens Protein SSX1 Proteins 0.000 description 1
- 101000642815 Homo sapiens Protein SSXT Proteins 0.000 description 1
- 101000893493 Homo sapiens Protein flightless-1 homolog Proteins 0.000 description 1
- 101000958299 Homo sapiens Protein lyl-1 Proteins 0.000 description 1
- 101001014035 Homo sapiens Protein p13 MTCP-1 Proteins 0.000 description 1
- 101000695187 Homo sapiens Protein patched homolog 1 Proteins 0.000 description 1
- 101000601770 Homo sapiens Protein polybromo-1 Proteins 0.000 description 1
- 101000830689 Homo sapiens Protein tyrosine phosphatase type IVA 3 Proteins 0.000 description 1
- 101000825949 Homo sapiens R-spondin-2 Proteins 0.000 description 1
- 101000825960 Homo sapiens R-spondin-3 Proteins 0.000 description 1
- 101000779418 Homo sapiens RAC-alpha serine/threonine-protein kinase Proteins 0.000 description 1
- 101000798015 Homo sapiens RAC-beta serine/threonine-protein kinase Proteins 0.000 description 1
- 101000712530 Homo sapiens RAF proto-oncogene serine/threonine-protein kinase Proteins 0.000 description 1
- 101001048695 Homo sapiens RNA polymerase II elongation factor ELL Proteins 0.000 description 1
- 101001062093 Homo sapiens RNA-binding protein 15 Proteins 0.000 description 1
- 101000591128 Homo sapiens RNA-binding protein Musashi homolog 2 Proteins 0.000 description 1
- 101100078258 Homo sapiens RUNX1T1 gene Proteins 0.000 description 1
- 101001111814 Homo sapiens Ran-binding protein 17 Proteins 0.000 description 1
- 101000926086 Homo sapiens Rap1 GTPase-GDP dissociation stimulator 1 Proteins 0.000 description 1
- 101000670549 Homo sapiens RecQ-mediated genome instability protein 2 Proteins 0.000 description 1
- 101000635752 Homo sapiens Receptor-transporting protein 2 Proteins 0.000 description 1
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 1
- 101000738772 Homo sapiens Receptor-type tyrosine-protein phosphatase beta Proteins 0.000 description 1
- 101000591201 Homo sapiens Receptor-type tyrosine-protein phosphatase kappa Proteins 0.000 description 1
- 101000742859 Homo sapiens Retinoblastoma-associated protein Proteins 0.000 description 1
- 101001112293 Homo sapiens Retinoic acid receptor alpha Proteins 0.000 description 1
- 101001091984 Homo sapiens Rho GTPase-activating protein 26 Proteins 0.000 description 1
- 101000927774 Homo sapiens Rho guanine nucleotide exchange factor 12 Proteins 0.000 description 1
- 101000666634 Homo sapiens Rho-related GTP-binding protein RhoH Proteins 0.000 description 1
- 101000687474 Homo sapiens Rhombotin-1 Proteins 0.000 description 1
- 101001111742 Homo sapiens Rhombotin-2 Proteins 0.000 description 1
- 101000631899 Homo sapiens Ribosome maturation protein SBDS Proteins 0.000 description 1
- 101000654718 Homo sapiens SET-binding protein Proteins 0.000 description 1
- 101000650863 Homo sapiens SH2 domain-containing protein 1A Proteins 0.000 description 1
- 101000616523 Homo sapiens SH2B adapter protein 3 Proteins 0.000 description 1
- 101000702542 Homo sapiens SWI/SNF-related matrix-associated actin-dependent regulator of chromatin subfamily E member 1 Proteins 0.000 description 1
- 101000654740 Homo sapiens Septin-5 Proteins 0.000 description 1
- 101000632314 Homo sapiens Septin-6 Proteins 0.000 description 1
- 101000632056 Homo sapiens Septin-9 Proteins 0.000 description 1
- 101000587430 Homo sapiens Serine/arginine-rich splicing factor 2 Proteins 0.000 description 1
- 101000587434 Homo sapiens Serine/arginine-rich splicing factor 3 Proteins 0.000 description 1
- 101000777277 Homo sapiens Serine/threonine-protein kinase Chk2 Proteins 0.000 description 1
- 101000628562 Homo sapiens Serine/threonine-protein kinase STK11 Proteins 0.000 description 1
- 101000595531 Homo sapiens Serine/threonine-protein kinase pim-1 Proteins 0.000 description 1
- 101000783404 Homo sapiens Serine/threonine-protein phosphatase 2A 65 kDa regulatory subunit A alpha isoform Proteins 0.000 description 1
- 101000703745 Homo sapiens Shootin-1 Proteins 0.000 description 1
- 101000687673 Homo sapiens Small integral membrane protein 6 Proteins 0.000 description 1
- 101000701334 Homo sapiens Sodium/potassium-transporting ATPase subunit alpha-1 Proteins 0.000 description 1
- 101000910249 Homo sapiens Soluble calcium-activated nucleotidase 1 Proteins 0.000 description 1
- 101000868152 Homo sapiens Son of sevenless homolog 1 Proteins 0.000 description 1
- 101000808799 Homo sapiens Splicing factor U2AF 35 kDa subunit Proteins 0.000 description 1
- 101000951145 Homo sapiens Succinate dehydrogenase [ubiquinone] cytochrome b small subunit, mitochondrial Proteins 0.000 description 1
- 101000874160 Homo sapiens Succinate dehydrogenase [ubiquinone] iron-sulfur subunit, mitochondrial Proteins 0.000 description 1
- 101000934888 Homo sapiens Succinate dehydrogenase cytochrome b560 subunit, mitochondrial Proteins 0.000 description 1
- 101000628885 Homo sapiens Suppressor of fused homolog Proteins 0.000 description 1
- 101000874179 Homo sapiens Syndecan-1 Proteins 0.000 description 1
- 101000740519 Homo sapiens Syndecan-4 Proteins 0.000 description 1
- 101000891113 Homo sapiens T-cell acute lymphocytic leukemia protein 1 Proteins 0.000 description 1
- 101000625330 Homo sapiens T-cell acute lymphocytic leukemia protein 2 Proteins 0.000 description 1
- 101000800488 Homo sapiens T-cell leukemia homeobox protein 1 Proteins 0.000 description 1
- 101000655119 Homo sapiens T-cell leukemia homeobox protein 3 Proteins 0.000 description 1
- 101000837401 Homo sapiens T-cell leukemia/lymphoma protein 1A Proteins 0.000 description 1
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 1
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 1
- 101001099181 Homo sapiens TATA-binding protein-associated factor 2N Proteins 0.000 description 1
- 101100369992 Homo sapiens TNFSF10 gene Proteins 0.000 description 1
- 101000762938 Homo sapiens TOX high mobility group box family member 4 Proteins 0.000 description 1
- 101000799466 Homo sapiens Thrombopoietin receptor Proteins 0.000 description 1
- 101000795185 Homo sapiens Thyroid hormone receptor-associated protein 3 Proteins 0.000 description 1
- 101000649022 Homo sapiens Thyroid receptor-interacting protein 11 Proteins 0.000 description 1
- 101000772267 Homo sapiens Thyrotropin receptor Proteins 0.000 description 1
- 101000819111 Homo sapiens Trans-acting T-cell-specific transcription factor GATA-3 Proteins 0.000 description 1
- 101000702545 Homo sapiens Transcription activator BRG1 Proteins 0.000 description 1
- 101000835720 Homo sapiens Transcription elongation factor A protein 1 Proteins 0.000 description 1
- 101001041525 Homo sapiens Transcription factor 12 Proteins 0.000 description 1
- 101000596772 Homo sapiens Transcription factor 7-like 1 Proteins 0.000 description 1
- 101000596771 Homo sapiens Transcription factor 7-like 2 Proteins 0.000 description 1
- 101000666382 Homo sapiens Transcription factor E2-alpha Proteins 0.000 description 1
- 101000837845 Homo sapiens Transcription factor E3 Proteins 0.000 description 1
- 101000962461 Homo sapiens Transcription factor Maf Proteins 0.000 description 1
- 101000979190 Homo sapiens Transcription factor MafB Proteins 0.000 description 1
- 101000687905 Homo sapiens Transcription factor SOX-2 Proteins 0.000 description 1
- 101001051166 Homo sapiens Transcriptional activator MN1 Proteins 0.000 description 1
- 101000636213 Homo sapiens Transcriptional activator Myb Proteins 0.000 description 1
- 101000835093 Homo sapiens Transferrin receptor protein 1 Proteins 0.000 description 1
- 101000796673 Homo sapiens Transformation/transcription domain-associated protein Proteins 0.000 description 1
- 101000904724 Homo sapiens Transmembrane glycoprotein NMB Proteins 0.000 description 1
- 101000638154 Homo sapiens Transmembrane protease serine 2 Proteins 0.000 description 1
- 101000795338 Homo sapiens Tripartite motif-containing protein 51 Proteins 0.000 description 1
- 101000850794 Homo sapiens Tropomyosin alpha-3 chain Proteins 0.000 description 1
- 101000830781 Homo sapiens Tropomyosin alpha-4 chain Proteins 0.000 description 1
- 101000795659 Homo sapiens Tuberin Proteins 0.000 description 1
- 101000611183 Homo sapiens Tumor necrosis factor Proteins 0.000 description 1
- 101000638161 Homo sapiens Tumor necrosis factor ligand superfamily member 6 Proteins 0.000 description 1
- 101000638255 Homo sapiens Tumor necrosis factor ligand superfamily member 8 Proteins 0.000 description 1
- 101000610605 Homo sapiens Tumor necrosis factor receptor superfamily member 10A Proteins 0.000 description 1
- 101000610604 Homo sapiens Tumor necrosis factor receptor superfamily member 10B Proteins 0.000 description 1
- 101000648507 Homo sapiens Tumor necrosis factor receptor superfamily member 14 Proteins 0.000 description 1
- 101000801255 Homo sapiens Tumor necrosis factor receptor superfamily member 17 Proteins 0.000 description 1
- 101000823271 Homo sapiens Tyrosine-protein kinase ABL2 Proteins 0.000 description 1
- 101001047681 Homo sapiens Tyrosine-protein kinase Lck Proteins 0.000 description 1
- 101000604583 Homo sapiens Tyrosine-protein kinase SYK Proteins 0.000 description 1
- 101000658084 Homo sapiens U2 small nuclear ribonucleoprotein auxiliary factor 35 kDa subunit-related protein 2 Proteins 0.000 description 1
- 101000643895 Homo sapiens Ubiquitin carboxyl-terminal hydrolase 6 Proteins 0.000 description 1
- 101000740048 Homo sapiens Ubiquitin carboxyl-terminal hydrolase BAP1 Proteins 0.000 description 1
- 101000710907 Homo sapiens Uncharacterized protein C15orf65 Proteins 0.000 description 1
- 101000583031 Homo sapiens Unconventional myosin-Va Proteins 0.000 description 1
- 101000808011 Homo sapiens Vascular endothelial growth factor A Proteins 0.000 description 1
- 101000621459 Homo sapiens Vesicle transport through interaction with t-SNAREs homolog 1A Proteins 0.000 description 1
- 101000867817 Homo sapiens Voltage-dependent L-type calcium channel subunit alpha-1D Proteins 0.000 description 1
- 101000771640 Homo sapiens WD repeat and coiled-coil-containing protein Proteins 0.000 description 1
- 101000650162 Homo sapiens WW domain-containing transcription regulator protein 1 Proteins 0.000 description 1
- 101000804798 Homo sapiens Werner syndrome ATP-dependent helicase Proteins 0.000 description 1
- 101000665937 Homo sapiens Wnt inhibitory factor 1 Proteins 0.000 description 1
- 101100377226 Homo sapiens ZBTB16 gene Proteins 0.000 description 1
- 101000788847 Homo sapiens Zinc finger CCHC domain-containing protein 8 Proteins 0.000 description 1
- 101000788669 Homo sapiens Zinc finger MYM-type protein 2 Proteins 0.000 description 1
- 101000760207 Homo sapiens Zinc finger protein 331 Proteins 0.000 description 1
- 101000964718 Homo sapiens Zinc finger protein 384 Proteins 0.000 description 1
- 101000785690 Homo sapiens Zinc finger protein 521 Proteins 0.000 description 1
- 101000691578 Homo sapiens Zinc finger protein PLAG1 Proteins 0.000 description 1
- 101000634977 Homo sapiens Zinc finger protein RFP Proteins 0.000 description 1
- 101001026573 Homo sapiens cAMP-dependent protein kinase type I-alpha regulatory subunit Proteins 0.000 description 1
- 102100039923 Homocysteine-responsive endoplasmic reticulum-resident ubiquitin-like domain member 1 protein Human genes 0.000 description 1
- 206010020429 Human ehrlichiosis Diseases 0.000 description 1
- 102100035957 Huntingtin-interacting protein 1 Human genes 0.000 description 1
- 108010003272 Hyaluronate lyase Proteins 0.000 description 1
- 102000001974 Hyaluronidases Human genes 0.000 description 1
- 206010020843 Hyperthermia Diseases 0.000 description 1
- 206010021113 Hypothermia Diseases 0.000 description 1
- 102000038455 IGF Type 1 Receptor Human genes 0.000 description 1
- 108010073816 IgE Receptors Proteins 0.000 description 1
- 102000009438 IgE Receptors Human genes 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000012745 Immunoglobulin Subunits Human genes 0.000 description 1
- 108010079585 Immunoglobulin Subunits Proteins 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- 206010021531 Impetigo Diseases 0.000 description 1
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 1
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 description 1
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 description 1
- 102100022337 Integrin alpha-V Human genes 0.000 description 1
- 108010047852 Integrin alphaVbeta3 Proteins 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010002352 Interleukin-1 Proteins 0.000 description 1
- 102000000589 Interleukin-1 Human genes 0.000 description 1
- 108090000177 Interleukin-11 Proteins 0.000 description 1
- 102000003815 Interleukin-11 Human genes 0.000 description 1
- 108010065805 Interleukin-12 Proteins 0.000 description 1
- 102100020793 Interleukin-13 receptor subunit alpha-2 Human genes 0.000 description 1
- 108090000171 Interleukin-18 Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- 108010002586 Interleukin-7 Proteins 0.000 description 1
- 108010002335 Interleukin-9 Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- 206010022678 Intestinal infections Diseases 0.000 description 1
- 208000037396 Intraductal Noninfiltrating Carcinoma Diseases 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- 206010065973 Iron Overload Diseases 0.000 description 1
- 208000009164 Islet Cell Adenoma Diseases 0.000 description 1
- 102100037845 Isocitrate dehydrogenase [NADP], mitochondrial Human genes 0.000 description 1
- 201000005807 Japanese encephalitis Diseases 0.000 description 1
- 241000710842 Japanese encephalitis virus Species 0.000 description 1
- 206010023126 Jaundice Diseases 0.000 description 1
- 206010023138 Jaundice neonatal Diseases 0.000 description 1
- 101710029140 KIAA1549 Proteins 0.000 description 1
- 102100034751 Kinectin Human genes 0.000 description 1
- 102100023422 Kinesin-1 heavy chain Human genes 0.000 description 1
- 102100021464 Kinetochore scaffold 1 Human genes 0.000 description 1
- 201000008225 Klebsiella pneumonia Diseases 0.000 description 1
- 102100020677 Krueppel-like factor 4 Human genes 0.000 description 1
- 102100020679 Krueppel-like factor 6 Human genes 0.000 description 1
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 1
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 1
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 1
- 239000002136 L01XE07 - Lapatinib Substances 0.000 description 1
- 239000005536 L01XE08 - Nilotinib Substances 0.000 description 1
- 239000003798 L01XE11 - Pazopanib Substances 0.000 description 1
- 239000002118 L01XE12 - Vandetanib Substances 0.000 description 1
- 239000002145 L01XE14 - Bosutinib Substances 0.000 description 1
- 239000002146 L01XE16 - Crizotinib Substances 0.000 description 1
- 239000002137 L01XE24 - Ponatinib Substances 0.000 description 1
- 239000002176 L01XE26 - Cabozantinib Substances 0.000 description 1
- 102100024116 LHFPL tetraspan subfamily member 6 protein Human genes 0.000 description 1
- 102100035118 LIM and SH3 domain protein 1 Human genes 0.000 description 1
- 201000005099 Langerhans cell histiocytosis Diseases 0.000 description 1
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 description 1
- 206010023825 Laryngeal cancer Diseases 0.000 description 1
- 208000007811 Latex Hypersensitivity Diseases 0.000 description 1
- 101000740049 Latilactobacillus curvatus Bioactive peptide 1 Proteins 0.000 description 1
- 208000004023 Legionellosis Diseases 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- 102100033284 Leucine-rich repeats and immunoglobulin-like domains protein 3 Human genes 0.000 description 1
- 108090000581 Leukemia inhibitory factor Proteins 0.000 description 1
- 102100026358 Lipoma-preferred partner Human genes 0.000 description 1
- 102100031961 Liprin-beta-1 Human genes 0.000 description 1
- 208000000265 Lobular Carcinoma Diseases 0.000 description 1
- 206010073099 Lobular breast carcinoma in situ Diseases 0.000 description 1
- 208000002041 Loiasis Diseases 0.000 description 1
- 102100034337 Long-chain-fatty-acid-CoA ligase 6 Human genes 0.000 description 1
- 102100038007 Low affinity immunoglobulin epsilon Fc receptor Human genes 0.000 description 1
- 102100029205 Low affinity immunoglobulin gamma Fc region receptor II-b Human genes 0.000 description 1
- 208000019693 Lung disease Diseases 0.000 description 1
- 208000008771 Lymphadenopathy Diseases 0.000 description 1
- 208000037263 Lymphatic filariasis Diseases 0.000 description 1
- 206010025282 Lymphoedema Diseases 0.000 description 1
- 102100033246 Lysine-specific demethylase 5A Human genes 0.000 description 1
- 102100033249 Lysine-specific demethylase 5C Human genes 0.000 description 1
- 102100037462 Lysine-specific demethylase 6A Human genes 0.000 description 1
- 101150113681 MALT1 gene Proteins 0.000 description 1
- 108010068342 MAP Kinase Kinase 1 Proteins 0.000 description 1
- 108010068353 MAP Kinase Kinase 2 Proteins 0.000 description 1
- 102000016200 MART-1 Antigen Human genes 0.000 description 1
- 108010010995 MART-1 Antigen Proteins 0.000 description 1
- 102000017274 MDM4 Human genes 0.000 description 1
- 108050005300 MDM4 Proteins 0.000 description 1
- 102000046015 MDS1 and EVI1 Complex Locus Human genes 0.000 description 1
- 108700024831 MDS1 and EVI1 Complex Locus Proteins 0.000 description 1
- 102000043129 MHC class I family Human genes 0.000 description 1
- 108091054437 MHC class I family Proteins 0.000 description 1
- 102000043131 MHC class II family Human genes 0.000 description 1
- 108091054438 MHC class II family Proteins 0.000 description 1
- 229910015837 MSH2 Inorganic materials 0.000 description 1
- 108700012912 MYCN Proteins 0.000 description 1
- 101150022024 MYCN gene Proteins 0.000 description 1
- 101150053046 MYD88 gene Proteins 0.000 description 1
- 102100021435 Macrophage-stimulating protein receptor Human genes 0.000 description 1
- 208000004059 Male Breast Neoplasms Diseases 0.000 description 1
- 208000006644 Malignant Fibrous Histiocytoma Diseases 0.000 description 1
- 206010025557 Malignant fibrous histiocytoma of bone Diseases 0.000 description 1
- 208000002720 Malnutrition Diseases 0.000 description 1
- PWHULOQIROXLJO-UHFFFAOYSA-N Manganese Chemical compound [Mn] PWHULOQIROXLJO-UHFFFAOYSA-N 0.000 description 1
- 208000000932 Marburg Virus Disease Diseases 0.000 description 1
- 201000011013 Marburg hemorrhagic fever Diseases 0.000 description 1
- 102100025130 Mastermind-like protein 2 Human genes 0.000 description 1
- 102100021070 Mediator of RNA polymerase II transcription subunit 12 Human genes 0.000 description 1
- 102100027240 Membrane-associated guanylate kinase, WW and PDZ domain-containing protein 1 Human genes 0.000 description 1
- 208000024556 Mendelian disease Diseases 0.000 description 1
- 102100030550 Menin Human genes 0.000 description 1
- 201000009906 Meningitis Diseases 0.000 description 1
- 206010027201 Meningitis aseptic Diseases 0.000 description 1
- 206010027202 Meningitis bacterial Diseases 0.000 description 1
- 206010027260 Meningitis viral Diseases 0.000 description 1
- 208000005377 Meningomyelocele Diseases 0.000 description 1
- 206010027439 Metal poisoning Diseases 0.000 description 1
- 206010063569 Metastatic squamous cell carcinoma Diseases 0.000 description 1
- RJQXTJLFIWVMTO-TYNCELHUSA-N Methicillin Chemical compound COC1=CC=CC(OC)=C1C(=O)N[C@@H]1C(=O)N2[C@@H](C(O)=O)C(C)(C)S[C@@H]21 RJQXTJLFIWVMTO-TYNCELHUSA-N 0.000 description 1
- 102100027383 Methyl-CpG-binding domain protein 1 Human genes 0.000 description 1
- 102100030819 Methylcytosine dioxygenase TET1 Human genes 0.000 description 1
- 102100030803 Methylcytosine dioxygenase TET2 Human genes 0.000 description 1
- 108010050345 Microphthalmia-Associated Transcription Factor Proteins 0.000 description 1
- 102100030157 Microphthalmia-associated transcription factor Human genes 0.000 description 1
- 206010053982 Microsporidia infection Diseases 0.000 description 1
- 201000000090 Microsporidiosis Diseases 0.000 description 1
- 108010074346 Mismatch Repair Endonuclease PMS2 Proteins 0.000 description 1
- 102100037480 Mismatch repair endonuclease PMS2 Human genes 0.000 description 1
- 108010009513 Mitochondrial Aldehyde Dehydrogenase Proteins 0.000 description 1
- 102100030144 Mitotic checkpoint serine/threonine-protein kinase BUB1 beta Human genes 0.000 description 1
- 102100027869 Moesin Human genes 0.000 description 1
- 102100035971 Molybdopterin molybdenumtransferase Human genes 0.000 description 1
- 241000700601 Moniliformis Species 0.000 description 1
- 208000005639 Morgellons Disease Diseases 0.000 description 1
- 102100025725 Mothers against decapentaplegic homolog 4 Human genes 0.000 description 1
- 101710143112 Mothers against decapentaplegic homolog 4 Proteins 0.000 description 1
- 102100025170 Motor neuron and pancreas homeobox protein 1 Human genes 0.000 description 1
- 101150097381 Mtor gene Proteins 0.000 description 1
- 108700026676 Mucosa-Associated Lymphoid Tissue Lymphoma Translocation 1 Proteins 0.000 description 1
- 102100038732 Mucosa-associated lymphoid tissue lymphoma translocation protein 1 Human genes 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 101100378170 Mus musculus Actl7a gene Proteins 0.000 description 1
- 101100180399 Mus musculus Izumo1r gene Proteins 0.000 description 1
- 101000978776 Mus musculus Neurogenic locus notch homolog protein 1 Proteins 0.000 description 1
- 101000577200 Mus musculus Neurogenic locus notch homolog protein 2 Proteins 0.000 description 1
- 101000577203 Mus musculus Neurogenic locus notch homolog protein 3 Proteins 0.000 description 1
- 101000577164 Mus musculus Neurogenic locus notch homolog protein 4 Proteins 0.000 description 1
- 101000597780 Mus musculus Tumor necrosis factor ligand superfamily member 18 Proteins 0.000 description 1
- 108010026664 MutL Protein Homolog 1 Proteins 0.000 description 1
- 206010028403 Mutism Diseases 0.000 description 1
- 102100038895 Myc proto-oncogene protein Human genes 0.000 description 1
- 241000186367 Mycobacterium avium Species 0.000 description 1
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 1
- 102100024134 Myeloid differentiation primary response protein MyD88 Human genes 0.000 description 1
- 201000003503 Myelomeningocele Diseases 0.000 description 1
- 102100036639 Myosin-11 Human genes 0.000 description 1
- 102100038938 Myosin-9 Human genes 0.000 description 1
- 108700026495 N-Myc Proto-Oncogene Proteins 0.000 description 1
- 102100023648 N-chimaerin Human genes 0.000 description 1
- 102100030124 N-myc proto-oncogene protein Human genes 0.000 description 1
- 102100027673 NCK-interacting protein with SH3 domain Human genes 0.000 description 1
- 102100029166 NT-3 growth factor receptor Human genes 0.000 description 1
- 102100027086 NUT family member 1 Human genes 0.000 description 1
- 102100038690 NUT family member 2A Human genes 0.000 description 1
- 102100038709 NUT family member 2B Human genes 0.000 description 1
- 206010056970 Naegleria infection Diseases 0.000 description 1
- 102100026779 Nascent polypeptide-associated complex subunit alpha, muscle-specific form Human genes 0.000 description 1
- 206010028885 Necrotising fasciitis Diseases 0.000 description 1
- 201000006346 Neonatal Jaundice Diseases 0.000 description 1
- 102100027347 Neural cell adhesion molecule 1 Human genes 0.000 description 1
- 102000048238 Neuregulin-1 Human genes 0.000 description 1
- 108090000556 Neuregulin-1 Proteins 0.000 description 1
- 208000007316 Neurocysticercosis Diseases 0.000 description 1
- 102000007530 Neurofibromin 1 Human genes 0.000 description 1
- 108010085793 Neurofibromin 1 Proteins 0.000 description 1
- 102100023121 Ninein Human genes 0.000 description 1
- 206010029443 Nocardia Infections Diseases 0.000 description 1
- 206010029444 Nocardiosis Diseases 0.000 description 1
- 102100028102 Non-POU domain-containing octamer-binding protein Human genes 0.000 description 1
- 208000010505 Nose Neoplasms Diseases 0.000 description 1
- 108010029755 Notch1 Receptor Proteins 0.000 description 1
- 102000001759 Notch1 Receptor Human genes 0.000 description 1
- 108010029751 Notch2 Receptor Proteins 0.000 description 1
- 102000001756 Notch2 Receptor Human genes 0.000 description 1
- 102100036961 Nuclear mitotic apparatus protein 1 Human genes 0.000 description 1
- 102100033819 Nuclear pore complex protein Nup214 Human genes 0.000 description 1
- 102100025372 Nuclear pore complex protein Nup98-Nup96 Human genes 0.000 description 1
- 102100039614 Nuclear receptor ROR-alpha Human genes 0.000 description 1
- 102100037223 Nuclear receptor coactivator 1 Human genes 0.000 description 1
- 102100037226 Nuclear receptor coactivator 2 Human genes 0.000 description 1
- 102100022927 Nuclear receptor coactivator 4 Human genes 0.000 description 1
- 102100022673 Nuclear receptor subfamily 4 group A member 3 Human genes 0.000 description 1
- 102100022678 Nucleophosmin Human genes 0.000 description 1
- 102100033615 Nucleoprotein TPR Human genes 0.000 description 1
- 108010042215 OX40 Ligand Proteins 0.000 description 1
- 102000004473 OX40 Ligand Human genes 0.000 description 1
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- 108090000630 Oncostatin M Proteins 0.000 description 1
- 206010031009 Oral pain Diseases 0.000 description 1
- 206010050346 Oropharyngeal candidiasis Diseases 0.000 description 1
- 102100026747 Osteomodulin Human genes 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- 208000005141 Otitis Diseases 0.000 description 1
- 102100028069 P2Y purinoceptor 8 Human genes 0.000 description 1
- 102100026365 PHD finger protein 6 Human genes 0.000 description 1
- 108091007960 PI3Ks Proteins 0.000 description 1
- 102100037482 PMS1 protein homolog 1 Human genes 0.000 description 1
- 102100035423 POU domain, class 5, transcription factor 1 Human genes 0.000 description 1
- 108060006456 POU2AF1 Proteins 0.000 description 1
- 102000036938 POU2AF1 Human genes 0.000 description 1
- 102100036665 POZ-, AT hook-, and zinc finger-containing protein 1 Human genes 0.000 description 1
- 102100024894 PR domain zinc finger protein 1 Human genes 0.000 description 1
- 108010047613 PTB-Associated Splicing Factor Proteins 0.000 description 1
- 102100040891 Paired box protein Pax-3 Human genes 0.000 description 1
- 102100037504 Paired box protein Pax-5 Human genes 0.000 description 1
- 102100037503 Paired box protein Pax-7 Human genes 0.000 description 1
- 102100037502 Paired box protein Pax-8 Human genes 0.000 description 1
- 102100026354 Paired mesoderm homeobox protein 2B Human genes 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 102100034743 Parafibromin Human genes 0.000 description 1
- 208000030852 Parasitic disease Diseases 0.000 description 1
- 102100040884 Partner and localizer of BRCA2 Human genes 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 241000517324 Pediculidae Species 0.000 description 1
- 241000517306 Pediculus humanus corporis Species 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 102000007079 Peptide Fragments Human genes 0.000 description 1
- 108010033276 Peptide Fragments Proteins 0.000 description 1
- 102100028467 Perforin-1 Human genes 0.000 description 1
- 102100028293 Period circadian protein homolog 1 Human genes 0.000 description 1
- 102100038825 Peroxisome proliferator-activated receptor gamma Human genes 0.000 description 1
- 201000005702 Pertussis Diseases 0.000 description 1
- 102100026169 Phosphatidylinositol 3-kinase regulatory subunit alpha Human genes 0.000 description 1
- 102100038332 Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit alpha isoform Human genes 0.000 description 1
- 102100031014 Phosphatidylinositol-binding clathrin assembly protein Human genes 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 241001674048 Phthiraptera Species 0.000 description 1
- 208000007913 Pituitary Neoplasms Diseases 0.000 description 1
- 102100035194 Placenta growth factor Human genes 0.000 description 1
- 102100029744 Plasma membrane calcium-transporting ATPase 3 Human genes 0.000 description 1
- 102000001393 Platelet-Derived Growth Factor alpha Receptor Human genes 0.000 description 1
- 108010068588 Platelet-Derived Growth Factor alpha Receptor Proteins 0.000 description 1
- 108010051742 Platelet-Derived Growth Factor beta Receptor Proteins 0.000 description 1
- 102100039449 Platelet-activating factor acetylhydrolase IB subunit alpha2 Human genes 0.000 description 1
- 102100030485 Platelet-derived growth factor receptor alpha Human genes 0.000 description 1
- 208000005384 Pneumocystis Pneumonia Diseases 0.000 description 1
- 206010073755 Pneumocystis jirovecii pneumonia Diseases 0.000 description 1
- 206010035717 Pneumonia klebsiella Diseases 0.000 description 1
- 102100030702 Polycomb protein SUZ12 Human genes 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 206010054161 Pontiac fever Diseases 0.000 description 1
- 108010009975 Positive Regulatory Domain I-Binding Factor 1 Proteins 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 102100040171 Pre-B-cell leukemia transcription factor 1 Human genes 0.000 description 1
- 102100031755 Pre-mRNA 3'-end-processing factor FIP1 Human genes 0.000 description 1
- 102100026531 Prelamin-A/C Human genes 0.000 description 1
- 102100024213 Programmed cell death 1 ligand 2 Human genes 0.000 description 1
- 102100040829 Proline-rich protein PRCC Human genes 0.000 description 1
- 102100023832 Prolyl endopeptidase FAP Human genes 0.000 description 1
- 108700003766 Promyelocytic Leukemia Zinc Finger Proteins 0.000 description 1
- 102100038950 Proprotein convertase subtilisin/kexin type 7 Human genes 0.000 description 1
- 102100024447 Prostaglandin E2 receptor EP3 subtype Human genes 0.000 description 1
- 108090000708 Proteasome Endopeptidase Complex Proteins 0.000 description 1
- 102000004245 Proteasome Endopeptidase Complex Human genes 0.000 description 1
- 102100038745 Protection of telomeres protein 1 Human genes 0.000 description 1
- 102100026286 Protein AF-10 Human genes 0.000 description 1
- 102100040638 Protein AF-17 Human genes 0.000 description 1
- 102100039686 Protein AF-9 Human genes 0.000 description 1
- 102100040665 Protein AF1q Human genes 0.000 description 1
- 102100026036 Protein BTG1 Human genes 0.000 description 1
- 102100033813 Protein ENL Human genes 0.000 description 1
- 102100030128 Protein L-Myc Human genes 0.000 description 1
- 102100028259 Protein LSM14 homolog A Human genes 0.000 description 1
- 102100024980 Protein NDRG1 Human genes 0.000 description 1
- 102100026375 Protein PML Human genes 0.000 description 1
- 102100037687 Protein SSX1 Human genes 0.000 description 1
- 102100035586 Protein SSXT Human genes 0.000 description 1
- 102100038231 Protein lyl-1 Human genes 0.000 description 1
- 102100031352 Protein p13 MTCP-1 Human genes 0.000 description 1
- 102100028680 Protein patched homolog 1 Human genes 0.000 description 1
- 102100037516 Protein polybromo-1 Human genes 0.000 description 1
- 101710138647 Protein tyrosine phosphatase type IVA 3 Proteins 0.000 description 1
- 208000003251 Pruritus Diseases 0.000 description 1
- 206010037151 Psittacosis Diseases 0.000 description 1
- 241000517305 Pthiridae Species 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 102100022763 R-spondin-2 Human genes 0.000 description 1
- 102100022766 R-spondin-3 Human genes 0.000 description 1
- 102100033810 RAC-alpha serine/threonine-protein kinase Human genes 0.000 description 1
- 102100032315 RAC-beta serine/threonine-protein kinase Human genes 0.000 description 1
- 101710018890 RAD51B Proteins 0.000 description 1
- 102100023449 RNA polymerase II elongation factor ELL Human genes 0.000 description 1
- 102100029244 RNA-binding protein 15 Human genes 0.000 description 1
- 102100034027 RNA-binding protein Musashi homolog 2 Human genes 0.000 description 1
- 108700040655 RUNX1 Translocation Partner 1 Proteins 0.000 description 1
- 102100023320 Ral guanine nucleotide dissociation stimulator Human genes 0.000 description 1
- 101150015043 Ralgds gene Proteins 0.000 description 1
- 102100023857 Ran-binding protein 17 Human genes 0.000 description 1
- 102100034329 Rap1 GTPase-GDP dissociation stimulator 1 Human genes 0.000 description 1
- 101000613608 Rattus norvegicus Monocyte to macrophage differentiation factor Proteins 0.000 description 1
- 102100039613 RecQ-mediated genome instability protein 2 Human genes 0.000 description 1
- 102100030850 Receptor-transporting protein 2 Human genes 0.000 description 1
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 1
- 102100037424 Receptor-type tyrosine-protein phosphatase beta Human genes 0.000 description 1
- 102100034089 Receptor-type tyrosine-protein phosphatase kappa Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 102100038042 Retinoblastoma-associated protein Human genes 0.000 description 1
- 102100023606 Retinoic acid receptor alpha Human genes 0.000 description 1
- 102100035744 Rho GTPase-activating protein 26 Human genes 0.000 description 1
- 102100033193 Rho guanine nucleotide exchange factor 12 Human genes 0.000 description 1
- 102100038338 Rho-related GTP-binding protein RhoH Human genes 0.000 description 1
- 102100024869 Rhombotin-1 Human genes 0.000 description 1
- 102100023876 Rhombotin-2 Human genes 0.000 description 1
- AUNGANRZJHBGPY-SCRDCRAPSA-N Riboflavin Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-SCRDCRAPSA-N 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 102100028750 Ribosome maturation protein SBDS Human genes 0.000 description 1
- 241000606701 Rickettsia Species 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 241000702670 Rotavirus Species 0.000 description 1
- 206010067470 Rotavirus infection Diseases 0.000 description 1
- 241000710799 Rubella virus Species 0.000 description 1
- 102100025373 Runt-related transcription factor 1 Human genes 0.000 description 1
- 102100028029 SCL-interrupting locus protein Human genes 0.000 description 1
- 102100032741 SET-binding protein Human genes 0.000 description 1
- 102100021778 SH2B adapter protein 3 Human genes 0.000 description 1
- 108091006576 SLC34A2 Proteins 0.000 description 1
- 108091007568 SLC45A3 Proteins 0.000 description 1
- 102100037375 SLIT-ROBO Rho GTPase-activating protein 3 Human genes 0.000 description 1
- 108700028341 SMARCB1 Proteins 0.000 description 1
- 101150008214 SMARCB1 gene Proteins 0.000 description 1
- 101150083405 SRGAP3 gene Proteins 0.000 description 1
- 108010017324 STAT3 Transcription Factor Proteins 0.000 description 1
- 101150063267 STAT5B gene Proteins 0.000 description 1
- 108010011005 STAT6 Transcription Factor Proteins 0.000 description 1
- 102100025746 SWI/SNF-related matrix-associated actin-dependent regulator of chromatin subfamily B member 1 Human genes 0.000 description 1
- 102100031029 SWI/SNF-related matrix-associated actin-dependent regulator of chromatin subfamily E member 1 Human genes 0.000 description 1
- 101100379220 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) API2 gene Proteins 0.000 description 1
- 101100439280 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) CLB1 gene Proteins 0.000 description 1
- 101100485284 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) CRM1 gene Proteins 0.000 description 1
- 206010061934 Salivary gland cancer Diseases 0.000 description 1
- 206010039509 Scab Diseases 0.000 description 1
- 241000447727 Scabies Species 0.000 description 1
- 206010039587 Scarlet Fever Diseases 0.000 description 1
- 241000242678 Schistosoma Species 0.000 description 1
- 101000702553 Schistosoma mansoni Antigen Sm21.7 Proteins 0.000 description 1
- 101000714192 Schistosoma mansoni Tegument antigen Proteins 0.000 description 1
- 101100279491 Schizosaccharomyces pombe (strain 972 / ATCC 24843) int6 gene Proteins 0.000 description 1
- 102100032744 Septin-5 Human genes 0.000 description 1
- 102100027982 Septin-6 Human genes 0.000 description 1
- 102100028024 Septin-9 Human genes 0.000 description 1
- 102100029666 Serine/arginine-rich splicing factor 2 Human genes 0.000 description 1
- 102100029665 Serine/arginine-rich splicing factor 3 Human genes 0.000 description 1
- 102100031075 Serine/threonine-protein kinase Chk2 Human genes 0.000 description 1
- 102100026715 Serine/threonine-protein kinase STK11 Human genes 0.000 description 1
- 102100023085 Serine/threonine-protein kinase mTOR Human genes 0.000 description 1
- 102100036077 Serine/threonine-protein kinase pim-1 Human genes 0.000 description 1
- 102100036122 Serine/threonine-protein phosphatase 2A 65 kDa regulatory subunit A alpha isoform Human genes 0.000 description 1
- 201000003176 Severe Acute Respiratory Syndrome Diseases 0.000 description 1
- 102100031975 Shootin-1 Human genes 0.000 description 1
- 102100024040 Signal transducer and activator of transcription 3 Human genes 0.000 description 1
- 102100024474 Signal transducer and activator of transcription 5B Human genes 0.000 description 1
- 102100023980 Signal transducer and activator of transcription 6 Human genes 0.000 description 1
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- 102100024806 Small integral membrane protein 6 Human genes 0.000 description 1
- 208000001203 Smallpox Diseases 0.000 description 1
- 102000013380 Smoothened Receptor Human genes 0.000 description 1
- 101710090597 Smoothened homolog Proteins 0.000 description 1
- 101150045565 Socs1 gene Proteins 0.000 description 1
- 102100038437 Sodium-dependent phosphate transport protein 2B Human genes 0.000 description 1
- 102100030458 Sodium/potassium-transporting ATPase subunit alpha-1 Human genes 0.000 description 1
- 102100024397 Soluble calcium-activated nucleotidase 1 Human genes 0.000 description 1
- 102100037253 Solute carrier family 45 member 3 Human genes 0.000 description 1
- 201000010829 Spina bifida Diseases 0.000 description 1
- 208000006097 Spinal Dysraphism Diseases 0.000 description 1
- 102100038501 Splicing factor U2AF 35 kDa subunit Human genes 0.000 description 1
- 102100027780 Splicing factor, proline- and glutamine-rich Human genes 0.000 description 1
- 206010041736 Sporotrichosis Diseases 0.000 description 1
- 206010041896 St. Louis Encephalitis Diseases 0.000 description 1
- 241000194017 Streptococcus Species 0.000 description 1
- 241000244174 Strongyloides Species 0.000 description 1
- 206010042254 Strongyloidiasis Diseases 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 102100038014 Succinate dehydrogenase [ubiquinone] cytochrome b small subunit, mitochondrial Human genes 0.000 description 1
- 102100035726 Succinate dehydrogenase [ubiquinone] iron-sulfur subunit, mitochondrial Human genes 0.000 description 1
- 102100031715 Succinate dehydrogenase assembly factor 2, mitochondrial Human genes 0.000 description 1
- 108050007461 Succinate dehydrogenase assembly factor 2, mitochondrial Proteins 0.000 description 1
- 102100025393 Succinate dehydrogenase cytochrome b560 subunit, mitochondrial Human genes 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 108700027336 Suppressor of Cytokine Signaling 1 Proteins 0.000 description 1
- 102100024779 Suppressor of cytokine signaling 1 Human genes 0.000 description 1
- 102100026939 Suppressor of fused homolog Human genes 0.000 description 1
- 102100035721 Syndecan-1 Human genes 0.000 description 1
- 102100037220 Syndecan-4 Human genes 0.000 description 1
- 206010042938 Systemic candida Diseases 0.000 description 1
- 230000006052 T cell proliferation Effects 0.000 description 1
- 102100040365 T-cell acute lymphocytic leukemia protein 1 Human genes 0.000 description 1
- 102100025039 T-cell acute lymphocytic leukemia protein 2 Human genes 0.000 description 1
- 102100033111 T-cell leukemia homeobox protein 1 Human genes 0.000 description 1
- 102100032568 T-cell leukemia homeobox protein 3 Human genes 0.000 description 1
- 102100028676 T-cell leukemia/lymphoma protein 1A Human genes 0.000 description 1
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 1
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 1
- 102000046283 TNF-Related Apoptosis-Inducing Ligand Human genes 0.000 description 1
- 108700012411 TNFSF10 Proteins 0.000 description 1
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 description 1
- 102100026749 TOX high mobility group box family member 4 Human genes 0.000 description 1
- 108091007283 TRIM24 Proteins 0.000 description 1
- CBPNZQVSJQDFBE-FUXHJELOSA-N Temsirolimus Chemical compound C1C[C@@H](OC(=O)C(C)(CO)CO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 CBPNZQVSJQDFBE-FUXHJELOSA-N 0.000 description 1
- 102100034196 Thrombopoietin receptor Human genes 0.000 description 1
- 201000009365 Thymic carcinoma Diseases 0.000 description 1
- 102100029689 Thyroid hormone receptor-associated protein 3 Human genes 0.000 description 1
- 102100028094 Thyroid receptor-interacting protein 11 Human genes 0.000 description 1
- 102100029337 Thyrotropin receptor Human genes 0.000 description 1
- 208000035056 Tick-Borne disease Diseases 0.000 description 1
- 206010057179 Toxoplasma infections Diseases 0.000 description 1
- 201000005485 Toxoplasmosis Diseases 0.000 description 1
- 102100021386 Trans-acting T-cell-specific transcription factor GATA-3 Human genes 0.000 description 1
- 102100031027 Transcription activator BRG1 Human genes 0.000 description 1
- 102100026430 Transcription elongation factor A protein 1 Human genes 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102100021123 Transcription factor 12 Human genes 0.000 description 1
- 102100035101 Transcription factor 7-like 2 Human genes 0.000 description 1
- 102100038313 Transcription factor E2-alpha Human genes 0.000 description 1
- 102100028507 Transcription factor E3 Human genes 0.000 description 1
- 102100039189 Transcription factor Maf Human genes 0.000 description 1
- 102100023234 Transcription factor MafB Human genes 0.000 description 1
- 102100024270 Transcription factor SOX-2 Human genes 0.000 description 1
- 102100025171 Transcription initiation factor TFIID subunit 12 Human genes 0.000 description 1
- 102100022011 Transcription intermediary factor 1-alpha Human genes 0.000 description 1
- 102100024592 Transcriptional activator MN1 Human genes 0.000 description 1
- 102100030780 Transcriptional activator Myb Human genes 0.000 description 1
- 102100023931 Transcriptional regulator ATRX Human genes 0.000 description 1
- 102100026144 Transferrin receptor protein 1 Human genes 0.000 description 1
- 102100032762 Transformation/transcription domain-associated protein Human genes 0.000 description 1
- 102100023935 Transmembrane glycoprotein NMB Human genes 0.000 description 1
- 102100031989 Transmembrane protease serine 2 Human genes 0.000 description 1
- 208000004938 Trematode Infections Diseases 0.000 description 1
- 206010044608 Trichiniasis Diseases 0.000 description 1
- 102100029700 Tripartite motif-containing protein 51 Human genes 0.000 description 1
- 206010044684 Trismus Diseases 0.000 description 1
- 206010044688 Trisomy 21 Diseases 0.000 description 1
- 241001504505 Troglodytes troglodytes Species 0.000 description 1
- 102100033080 Tropomyosin alpha-3 chain Human genes 0.000 description 1
- 102100024944 Tropomyosin alpha-4 chain Human genes 0.000 description 1
- 102100031638 Tuberin Human genes 0.000 description 1
- 108010047933 Tumor Necrosis Factor alpha-Induced Protein 3 Proteins 0.000 description 1
- 108010078814 Tumor Suppressor Protein p53 Proteins 0.000 description 1
- 102000015098 Tumor Suppressor Protein p53 Human genes 0.000 description 1
- 102100040247 Tumor necrosis factor Human genes 0.000 description 1
- 102100024596 Tumor necrosis factor alpha-induced protein 3 Human genes 0.000 description 1
- 102100024584 Tumor necrosis factor ligand superfamily member 12 Human genes 0.000 description 1
- 101710097155 Tumor necrosis factor ligand superfamily member 12 Proteins 0.000 description 1
- 102100035283 Tumor necrosis factor ligand superfamily member 18 Human genes 0.000 description 1
- 102100031988 Tumor necrosis factor ligand superfamily member 6 Human genes 0.000 description 1
- 102100032100 Tumor necrosis factor ligand superfamily member 8 Human genes 0.000 description 1
- 102100032101 Tumor necrosis factor ligand superfamily member 9 Human genes 0.000 description 1
- 102100040113 Tumor necrosis factor receptor superfamily member 10A Human genes 0.000 description 1
- 102100040112 Tumor necrosis factor receptor superfamily member 10B Human genes 0.000 description 1
- 102100028785 Tumor necrosis factor receptor superfamily member 14 Human genes 0.000 description 1
- 102100033726 Tumor necrosis factor receptor superfamily member 17 Human genes 0.000 description 1
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 1
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 description 1
- 241000287411 Turdidae Species 0.000 description 1
- 208000037386 Typhoid Diseases 0.000 description 1
- 102100022651 Tyrosine-protein kinase ABL2 Human genes 0.000 description 1
- 102100024036 Tyrosine-protein kinase Lck Human genes 0.000 description 1
- 102100038183 Tyrosine-protein kinase SYK Human genes 0.000 description 1
- 102100035036 U2 small nuclear ribonucleoprotein auxiliary factor 35 kDa subunit-related protein 2 Human genes 0.000 description 1
- 102100022865 UPF0606 protein KIAA1549 Human genes 0.000 description 1
- 102100021015 Ubiquitin carboxyl-terminal hydrolase 6 Human genes 0.000 description 1
- 102100024250 Ubiquitin carboxyl-terminal hydrolase CYLD Human genes 0.000 description 1
- 102100033876 Uncharacterized protein C15orf65 Human genes 0.000 description 1
- 102100030409 Unconventional myosin-Va Human genes 0.000 description 1
- 208000015778 Undifferentiated pleomorphic sarcoma Diseases 0.000 description 1
- 208000037009 Vaginitis bacterial Diseases 0.000 description 1
- 206010046980 Varicella Diseases 0.000 description 1
- 208000005181 Varicella Zoster Virus Infection Diseases 0.000 description 1
- 241000700647 Variola virus Species 0.000 description 1
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 1
- 108010053096 Vascular Endothelial Growth Factor Receptor-1 Proteins 0.000 description 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 1
- 206010047115 Vasculitis Diseases 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 102100023019 Vesicle transport through interaction with t-SNAREs homolog 1A Human genes 0.000 description 1
- 241000607272 Vibrio parahaemolyticus Species 0.000 description 1
- 241001416176 Vicugna Species 0.000 description 1
- 208000028227 Viral hemorrhagic fever Diseases 0.000 description 1
- 206010047505 Visceral leishmaniasis Diseases 0.000 description 1
- 208000027276 Von Willebrand disease Diseases 0.000 description 1
- 206010047741 Vulval cancer Diseases 0.000 description 1
- 208000004354 Vulvar Neoplasms Diseases 0.000 description 1
- 102100029476 WD repeat and coiled-coil-containing protein Human genes 0.000 description 1
- 102100027548 WW domain-containing transcription regulator protein 1 Human genes 0.000 description 1
- 208000033559 Waldenström macroglobulinemia Diseases 0.000 description 1
- 102100035336 Werner syndrome ATP-dependent helicase Human genes 0.000 description 1
- 206010057293 West Nile viral infection Diseases 0.000 description 1
- 101710127857 Wilms tumor protein Proteins 0.000 description 1
- 102100038258 Wnt inhibitory factor 1 Human genes 0.000 description 1
- 241000244005 Wuchereria bancrofti Species 0.000 description 1
- 108700042462 X-linked Nuclear Proteins 0.000 description 1
- 101150094313 XPO1 gene Proteins 0.000 description 1
- 208000003152 Yellow Fever Diseases 0.000 description 1
- 208000025079 Yersinia infectious disease Diseases 0.000 description 1
- 102100025400 Zinc finger CCHC domain-containing protein 8 Human genes 0.000 description 1
- 102100025085 Zinc finger MYM-type protein 2 Human genes 0.000 description 1
- 102100040314 Zinc finger and BTB domain-containing protein 16 Human genes 0.000 description 1
- 102100024661 Zinc finger protein 331 Human genes 0.000 description 1
- 102100040731 Zinc finger protein 384 Human genes 0.000 description 1
- 102100026302 Zinc finger protein 521 Human genes 0.000 description 1
- 102100026200 Zinc finger protein PLAG1 Human genes 0.000 description 1
- 102100029504 Zinc finger protein RFP Human genes 0.000 description 1
- 206010061418 Zygomycosis Diseases 0.000 description 1
- 201000001028 acute contagious conjunctivitis Diseases 0.000 description 1
- 208000011589 adenoviridae infectious disease Diseases 0.000 description 1
- 201000005188 adrenal gland cancer Diseases 0.000 description 1
- 208000024447 adrenal gland neoplasm Diseases 0.000 description 1
- 230000009824 affinity maturation Effects 0.000 description 1
- 229940042992 afinitor Drugs 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 108700025316 aldesleukin Proteins 0.000 description 1
- 229940083773 alecensa Drugs 0.000 description 1
- GYABBVHSRIHYJR-UHFFFAOYSA-N alectinib hydrochloride Chemical compound Cl.CCC1=CC=2C(=O)C(C3=CC=C(C=C3N3)C#N)=C3C(C)(C)C=2C=C1N(CC1)CCC1N1CCOCC1 GYABBVHSRIHYJR-UHFFFAOYSA-N 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 108010029483 alpha 1 Chain Collagen Type I Proteins 0.000 description 1
- 108010026331 alpha-Fetoproteins Proteins 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 229950001537 amatuximab Drugs 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 1
- 208000003455 anaphylaxis Diseases 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 208000010123 anthracosis Diseases 0.000 description 1
- 230000003127 anti-melanomic effect Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 201000011165 anus cancer Diseases 0.000 description 1
- 206010002895 aortic dissection Diseases 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 208000021780 appendiceal neoplasm Diseases 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 208000015802 attention deficit-hyperactivity disease Diseases 0.000 description 1
- 238000013475 authorization Methods 0.000 description 1
- 230000006472 autoimmune response Effects 0.000 description 1
- 229940120638 avastin Drugs 0.000 description 1
- 229950002916 avelumab Drugs 0.000 description 1
- RITAVMQDGBJQJZ-FMIVXFBMSA-N axitinib Chemical compound CNC(=O)C1=CC=CC=C1SC1=CC=C(C(\C=C\C=2N=CC=CC=2)=NN2)C2=C1 RITAVMQDGBJQJZ-FMIVXFBMSA-N 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 201000009904 bacterial meningitis Diseases 0.000 description 1
- 210000003651 basophil Anatomy 0.000 description 1
- 201000010642 baylisascariasis Diseases 0.000 description 1
- 208000001119 benign fibrous histiocytoma Diseases 0.000 description 1
- 229940022836 benlysta Drugs 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 230000008033 biological extinction Effects 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 108010005713 bis(5'-adenosyl)triphosphatase Proteins 0.000 description 1
- 229960003008 blinatumomab Drugs 0.000 description 1
- 229940101815 blincyto Drugs 0.000 description 1
- 108091005948 blue fluorescent proteins Proteins 0.000 description 1
- 201000011143 bone giant cell tumor Diseases 0.000 description 1
- 201000008873 bone osteosarcoma Diseases 0.000 description 1
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 1
- 229940083476 bosulif Drugs 0.000 description 1
- UBPYILGKFZZVDX-UHFFFAOYSA-N bosutinib Chemical compound C1=C(Cl)C(OC)=CC(NC=2C3=CC(OC)=C(OCCCN4CCN(C)CC4)C=C3N=CC=2C#N)=C1Cl UBPYILGKFZZVDX-UHFFFAOYSA-N 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 201000003714 breast lobular carcinoma Diseases 0.000 description 1
- 229950004272 brigatinib Drugs 0.000 description 1
- 206010006451 bronchitis Diseases 0.000 description 1
- 102100037490 cAMP-dependent protein kinase type I-alpha regulatory subunit Human genes 0.000 description 1
- 229940036033 cabometyx Drugs 0.000 description 1
- 229940112129 campath Drugs 0.000 description 1
- 229940056434 caprelsa Drugs 0.000 description 1
- 230000036996 cardiovascular health Effects 0.000 description 1
- 108010021331 carfilzomib Proteins 0.000 description 1
- BLMPQMFVWMYDKT-NZTKNTHTSA-N carfilzomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)[C@]1(C)OC1)NC(=O)CN1CCOCC1)CC1=CC=CC=C1 BLMPQMFVWMYDKT-NZTKNTHTSA-N 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000009087 cell motility Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 201000010353 central nervous system germ cell tumor Diseases 0.000 description 1
- 206010008129 cerebral palsy Diseases 0.000 description 1
- VERWOWGGCGHDQE-UHFFFAOYSA-N ceritinib Chemical compound CC=1C=C(NC=2N=C(NC=3C(=CC=CC=3)S(=O)(=O)C(C)C)C(Cl)=CN=2)C(OC(C)C)=CC=1C1CCNCC1 VERWOWGGCGHDQE-UHFFFAOYSA-N 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 238000012412 chemical coupling Methods 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 230000000973 chemotherapeutic effect Effects 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 208000011654 childhood malignant neoplasm Diseases 0.000 description 1
- 210000003737 chromaffin cell Anatomy 0.000 description 1
- 208000016940 ciguatera fish poisoning Diseases 0.000 description 1
- VYVRIXWNTVOIRD-UHFFFAOYSA-N ciguatoxin Natural products O1C(C(C(C)C2OC3CC(C)CC4OC5(C)C(O)CC6OC7C=CC8OC9CC%10C(C(C%11OC(C=CCC%11O%10)C=CC(O)CO)O)OC9C=CC8OC7CC=CCC6OC5CC4OC3CC2O2)O)C2C(C)C(C)C21CC(O)CO2 VYVRIXWNTVOIRD-UHFFFAOYSA-N 0.000 description 1
- 208000013056 classic Hodgkin lymphoma Diseases 0.000 description 1
- 201000003486 coccidioidomycosis Diseases 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 229940034568 cometriq Drugs 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 229960000956 coumarin Drugs 0.000 description 1
- 235000001671 coumarin Nutrition 0.000 description 1
- KTEIFNKAUNYNJU-GFCCVEGCSA-N crizotinib Chemical compound O([C@H](C)C=1C(=C(F)C=CC=1Cl)Cl)C(C(=NC=1)N)=CC=1C(=C1)C=NN1C1CCNCC1 KTEIFNKAUNYNJU-GFCCVEGCSA-N 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 201000008167 cystoisosporiasis Diseases 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 230000007402 cytotoxic response Effects 0.000 description 1
- BFSMGDJOXZAERB-UHFFFAOYSA-N dabrafenib Chemical compound S1C(C(C)(C)C)=NC(C=2C(=C(NS(=O)(=O)C=3C(=CC=CC=3F)F)C=CC=2)F)=C1C1=CC=NC(N)=N1 BFSMGDJOXZAERB-UHFFFAOYSA-N 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 238000001784 detoxification Methods 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 201000004587 dientamoebiasis Diseases 0.000 description 1
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 208000028715 ductal breast carcinoma in situ Diseases 0.000 description 1
- 229950009791 durvalumab Drugs 0.000 description 1
- 208000019258 ear infection Diseases 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 208000006036 elephantiasis Diseases 0.000 description 1
- 208000014616 embryonal neoplasm Diseases 0.000 description 1
- 201000011523 endocrine gland cancer Diseases 0.000 description 1
- 108010018033 endothelial PAS domain-containing protein 1 Proteins 0.000 description 1
- 210000003979 eosinophil Anatomy 0.000 description 1
- 208000028104 epidemic louse-borne typhus Diseases 0.000 description 1
- 206010015037 epilepsy Diseases 0.000 description 1
- 208000037828 epithelial carcinoma Diseases 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 229940082789 erbitux Drugs 0.000 description 1
- 229940014684 erivedge Drugs 0.000 description 1
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 1
- 201000004101 esophageal cancer Diseases 0.000 description 1
- 201000005884 exanthem Diseases 0.000 description 1
- 108700002148 exportin 1 Proteins 0.000 description 1
- 208000036984 extensively drug-resistant tuberculosis Diseases 0.000 description 1
- 201000008819 extrahepatic bile duct carcinoma Diseases 0.000 description 1
- 206010016235 fasciolopsiasis Diseases 0.000 description 1
- 208000005239 filarial elephantiasis Diseases 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 102000034287 fluorescent proteins Human genes 0.000 description 1
- 108091006047 fluorescent proteins Proteins 0.000 description 1
- 230000003325 follicular Effects 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 210000000232 gallbladder Anatomy 0.000 description 1
- 201000010175 gallbladder cancer Diseases 0.000 description 1
- 208000017211 gastric neuroendocrine tumor G1 Diseases 0.000 description 1
- 208000021302 gastroesophageal reflux disease Diseases 0.000 description 1
- 201000007028 gastrointestinal neuroendocrine tumor Diseases 0.000 description 1
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 1
- 210000004392 genitalia Anatomy 0.000 description 1
- 229940087158 gilotrif Drugs 0.000 description 1
- 210000004907 gland Anatomy 0.000 description 1
- 229940080856 gleevec Drugs 0.000 description 1
- 201000010675 granulomatous amebic encephalitis Diseases 0.000 description 1
- 238000009499 grossing Methods 0.000 description 1
- 210000002768 hair cell Anatomy 0.000 description 1
- 230000035876 healing Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000008642 heat stress Effects 0.000 description 1
- 210000002443 helper t lymphocyte Anatomy 0.000 description 1
- 201000005787 hematologic cancer Diseases 0.000 description 1
- 208000014951 hematologic disease Diseases 0.000 description 1
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 1
- 208000018706 hematopoietic system disease Diseases 0.000 description 1
- 208000031169 hemorrhagic disease Diseases 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- 238000005734 heterodimerization reaction Methods 0.000 description 1
- 230000003284 homeostatic effect Effects 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 102000045609 human NOTCH1 Human genes 0.000 description 1
- 102000046883 human NOTCH2 Human genes 0.000 description 1
- 102000047120 human NOTCH4 Human genes 0.000 description 1
- 229960002773 hyaluronidase Drugs 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 230000036031 hyperthermia Effects 0.000 description 1
- 210000003026 hypopharynx Anatomy 0.000 description 1
- 230000002631 hypothermal effect Effects 0.000 description 1
- 229940061301 ibrance Drugs 0.000 description 1
- 229960001001 ibritumomab tiuxetan Drugs 0.000 description 1
- 229940049235 iclusig Drugs 0.000 description 1
- IFSDAJWBUCMOAH-HNNXBMFYSA-N idelalisib Chemical compound C1([C@@H](NC=2C=3N=CNC=3N=CN=2)CC)=NC2=CC=CC(F)=C2C(=O)N1C1=CC=CC=C1 IFSDAJWBUCMOAH-HNNXBMFYSA-N 0.000 description 1
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 201000001371 inclusion conjunctivitis Diseases 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 229940005319 inlyta Drugs 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 108090000681 interleukin 20 Proteins 0.000 description 1
- 108040003607 interleukin-13 receptor activity proteins Proteins 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 201000002313 intestinal cancer Diseases 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 208000036732 invasive candidiasis Diseases 0.000 description 1
- 206010073096 invasive lobular breast carcinoma Diseases 0.000 description 1
- 229940084651 iressa Drugs 0.000 description 1
- 201000002529 islet cell tumor Diseases 0.000 description 1
- 210000004153 islets of langerhan Anatomy 0.000 description 1
- 229940011083 istodax Drugs 0.000 description 1
- MXAYKZJJDUDWDS-LBPRGKRZSA-N ixazomib Chemical compound CC(C)C[C@@H](B(O)O)NC(=O)CNC(=O)C1=CC(Cl)=CC=C1Cl MXAYKZJJDUDWDS-LBPRGKRZSA-N 0.000 description 1
- 229940000764 kyprolis Drugs 0.000 description 1
- 210000001821 langerhans cell Anatomy 0.000 description 1
- BCFGMOOMADDAQU-UHFFFAOYSA-N lapatinib Chemical compound O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 BCFGMOOMADDAQU-UHFFFAOYSA-N 0.000 description 1
- 206010023841 laryngeal neoplasm Diseases 0.000 description 1
- 208000008127 lead poisoning Diseases 0.000 description 1
- WOSKHXYHFSIKNG-UHFFFAOYSA-N lenvatinib Chemical compound C=12C=C(C(N)=O)C(OC)=CC2=NC=CC=1OC(C=C1Cl)=CC=C1NC(=O)NC1CC1 WOSKHXYHFSIKNG-UHFFFAOYSA-N 0.000 description 1
- 229940064847 lenvima Drugs 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 208000002502 lymphedema Diseases 0.000 description 1
- 230000000527 lymphocytic effect Effects 0.000 description 1
- 208000001581 lymphogranuloma venereum Diseases 0.000 description 1
- 229940100352 lynparza Drugs 0.000 description 1
- 201000000564 macroglobulinemia Diseases 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 201000004792 malaria Diseases 0.000 description 1
- 201000003175 male breast cancer Diseases 0.000 description 1
- 208000010907 male breast carcinoma Diseases 0.000 description 1
- 230000001071 malnutrition Effects 0.000 description 1
- 235000000824 malnutrition Nutrition 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 239000011572 manganese Substances 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- ORZHZQZYWXEDDL-UHFFFAOYSA-N methanesulfonic acid;2-methyl-1-[[4-[6-(trifluoromethyl)pyridin-2-yl]-6-[[2-(trifluoromethyl)pyridin-4-yl]amino]-1,3,5-triazin-2-yl]amino]propan-2-ol Chemical compound CS(O)(=O)=O.N=1C(C=2N=C(C=CC=2)C(F)(F)F)=NC(NCC(C)(O)C)=NC=1NC1=CC=NC(C(F)(F)F)=C1 ORZHZQZYWXEDDL-UHFFFAOYSA-N 0.000 description 1
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 1
- 229960003085 meticillin Drugs 0.000 description 1
- 239000011785 micronutrient Substances 0.000 description 1
- 235000013369 micronutrients Nutrition 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 108091005601 modified peptides Chemical group 0.000 description 1
- 208000008588 molluscum contagiosum Diseases 0.000 description 1
- 208000005871 monkeypox Diseases 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 201000007524 mucormycosis Diseases 0.000 description 1
- 206010051747 multiple endocrine neoplasia Diseases 0.000 description 1
- 208000022155 mycobacterium avium complex disease Diseases 0.000 description 1
- 206010028537 myelofibrosis Diseases 0.000 description 1
- 208000037830 nasal cancer Diseases 0.000 description 1
- 229930014626 natural product Natural products 0.000 description 1
- 201000007970 necrotizing fasciitis Diseases 0.000 description 1
- 208000037971 neglected tropical disease Diseases 0.000 description 1
- 201000008026 nephroblastoma Diseases 0.000 description 1
- 229950008835 neratinib Drugs 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 229940080607 nexavar Drugs 0.000 description 1
- HHZIURLSWUIHRB-UHFFFAOYSA-N nilotinib Chemical compound C1=NC(C)=CN1C1=CC(NC(=O)C=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)=CC(C(F)(F)F)=C1 HHZIURLSWUIHRB-UHFFFAOYSA-N 0.000 description 1
- 229940030115 ninlaro Drugs 0.000 description 1
- 229950011068 niraparib Drugs 0.000 description 1
- 229960003301 nivolumab Drugs 0.000 description 1
- 230000004987 nonapoptotic effect Effects 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 108010054452 nuclear pore complex protein 98 Proteins 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- 208000015380 nutritional deficiency disease Diseases 0.000 description 1
- 229960003347 obinutuzumab Drugs 0.000 description 1
- 229940024847 odomzo Drugs 0.000 description 1
- FDLYAMZZIXQODN-UHFFFAOYSA-N olaparib Chemical compound FC1=CC=C(CC=2C3=CC=CC=C3C(=O)NN=2)C=C1C(=O)N(CC1)CCN1C(=O)C1CC1 FDLYAMZZIXQODN-UHFFFAOYSA-N 0.000 description 1
- 229950008516 olaratumab Drugs 0.000 description 1
- 108091008819 oncoproteins Proteins 0.000 description 1
- 208000003692 opisthorchiasis Diseases 0.000 description 1
- 201000000901 ornithosis Diseases 0.000 description 1
- 229960003278 osimertinib Drugs 0.000 description 1
- DUYJMQONPNNFPI-UHFFFAOYSA-N osimertinib Chemical compound COC1=CC(N(C)CCN(C)C)=C(NC(=O)C=C)C=C1NC1=NC=CC(C=2C3=CC=CC=C3N(C)C=2)=N1 DUYJMQONPNNFPI-UHFFFAOYSA-N 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- AHJRHEGDXFFMBM-UHFFFAOYSA-N palbociclib Chemical compound N1=C2N(C3CCCC3)C(=O)C(C(=O)C)=C(C)C2=CN=C1NC(N=C1)=CC=C1N1CCNCC1 AHJRHEGDXFFMBM-UHFFFAOYSA-N 0.000 description 1
- 208000022102 pancreatic neuroendocrine neoplasm Diseases 0.000 description 1
- 229960001972 panitumumab Drugs 0.000 description 1
- 229960005184 panobinostat Drugs 0.000 description 1
- FWZRWHZDXBDTFK-ZHACJKMWSA-N panobinostat Chemical compound CC1=NC2=CC=C[CH]C2=C1CCNCC1=CC=C(\C=C\C(=O)NO)C=C1 FWZRWHZDXBDTFK-ZHACJKMWSA-N 0.000 description 1
- 229940055729 papain Drugs 0.000 description 1
- 235000019834 papain Nutrition 0.000 description 1
- 208000003154 papilloma Diseases 0.000 description 1
- 208000029211 papillomatosis Diseases 0.000 description 1
- 208000014837 parasitic helminthiasis infectious disease Diseases 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- CUIHSIWYWATEQL-UHFFFAOYSA-N pazopanib Chemical compound C1=CC2=C(C)N(C)N=C2C=C1N(C)C(N=1)=CC=NC=1NC1=CC=C(C)C(S(N)(=O)=O)=C1 CUIHSIWYWATEQL-UHFFFAOYSA-N 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 229960002087 pertuzumab Drugs 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 230000001766 physiological effect Effects 0.000 description 1
- 208000010916 pituitary tumor Diseases 0.000 description 1
- 208000010626 plasma cell neoplasm Diseases 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 201000000317 pneumocystosis Diseases 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- PHXJVRSECIGDHY-UHFFFAOYSA-N ponatinib Chemical compound C1CN(C)CCN1CC(C(=C1)C(F)(F)F)=CC=C1NC(=O)C1=CC=C(C)C(C#CC=2N3N=CC=CC3=NC=2)=C1 PHXJVRSECIGDHY-UHFFFAOYSA-N 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 201000010672 primary amebic meningoencephalitis Diseases 0.000 description 1
- 210000001948 pro-b lymphocyte Anatomy 0.000 description 1
- 229940087463 proleukin Drugs 0.000 description 1
- 230000001902 propagating effect Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 229940034080 provenge Drugs 0.000 description 1
- 208000002815 pulmonary hypertension Diseases 0.000 description 1
- 201000000963 pulmonary neuroendocrine tumor Diseases 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 230000003439 radiotherapeutic effect Effects 0.000 description 1
- 229960002633 ramucirumab Drugs 0.000 description 1
- 206010037844 rash Diseases 0.000 description 1
- 208000010563 rat-bite fever Diseases 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000001172 regenerating effect Effects 0.000 description 1
- 208000007865 relapsing fever Diseases 0.000 description 1
- 201000010174 renal carcinoma Diseases 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 201000006845 reticulosarcoma Diseases 0.000 description 1
- 208000029922 reticulum cell sarcoma Diseases 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 1
- 206010039083 rhinitis Diseases 0.000 description 1
- 229950003687 ribociclib Drugs 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- OHRURASPPZQGQM-UHFFFAOYSA-N romidepsin Natural products O1C(=O)C(C(C)C)NC(=O)C(=CC)NC(=O)C2CSSCCC=CC1CC(=O)NC(C(C)C)C(=O)N2 OHRURASPPZQGQM-UHFFFAOYSA-N 0.000 description 1
- OHRURASPPZQGQM-GCCNXGTGSA-N romidepsin Chemical compound O1C(=O)[C@H](C(C)C)NC(=O)C(=C/C)/NC(=O)[C@H]2CSSCC\C=C\[C@@H]1CC(=O)N[C@H](C(C)C)C(=O)N2 OHRURASPPZQGQM-GCCNXGTGSA-N 0.000 description 1
- 108010091666 romidepsin Proteins 0.000 description 1
- 201000005404 rubella Diseases 0.000 description 1
- 229950004707 rucaparib Drugs 0.000 description 1
- INBJJAFXHQQSRW-STOWLHSFSA-N rucaparib camsylate Chemical compound CC1(C)[C@@H]2CC[C@@]1(CS(O)(=O)=O)C(=O)C2.CNCc1ccc(cc1)-c1[nH]c2cc(F)cc3C(=O)NCCc1c23 INBJJAFXHQQSRW-STOWLHSFSA-N 0.000 description 1
- 201000003804 salivary gland carcinoma Diseases 0.000 description 1
- 208000005687 scabies Diseases 0.000 description 1
- 230000001953 sensory effect Effects 0.000 description 1
- 201000005113 shigellosis Diseases 0.000 description 1
- 208000007056 sickle cell anemia Diseases 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- 208000037968 sinus cancer Diseases 0.000 description 1
- 201000009890 sinusitis Diseases 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- VZZJRYRQSPEMTK-CALCHBBNSA-N sonidegib Chemical compound C1[C@@H](C)O[C@@H](C)CN1C(N=C1)=CC=C1NC(=O)C1=CC=CC(C=2C=CC(OC(F)(F)F)=CC=2)=C1C VZZJRYRQSPEMTK-CALCHBBNSA-N 0.000 description 1
- 238000009987 spinning Methods 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 238000004114 suspension culture Methods 0.000 description 1
- 229940053017 sylvant Drugs 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 229940081616 tafinlar Drugs 0.000 description 1
- 101150047061 tag-72 gene Proteins 0.000 description 1
- 238000002626 targeted therapy Methods 0.000 description 1
- 229940069905 tasigna Drugs 0.000 description 1
- 229940066453 tecentriq Drugs 0.000 description 1
- 210000001550 testis Anatomy 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- 208000016523 tick-borne infectious disease Diseases 0.000 description 1
- 108010078373 tisagenlecleucel Proteins 0.000 description 1
- 229940100411 torisel Drugs 0.000 description 1
- 206010044325 trachoma Diseases 0.000 description 1
- 230000037426 transcriptional repression Effects 0.000 description 1
- 108091006107 transcriptional repressors Proteins 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 229960000575 trastuzumab Drugs 0.000 description 1
- 229960001612 trastuzumab emtansine Drugs 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 208000003982 trichinellosis Diseases 0.000 description 1
- 201000007588 trichinosis Diseases 0.000 description 1
- 108010064892 trkC Receptor Proteins 0.000 description 1
- 201000002311 trypanosomiasis Diseases 0.000 description 1
- 210000005239 tubule Anatomy 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 229940094060 tykerb Drugs 0.000 description 1
- 208000018417 undifferentiated high grade pleomorphic sarcoma of bone Diseases 0.000 description 1
- 229940022919 unituxin Drugs 0.000 description 1
- 208000037965 uterine sarcoma Diseases 0.000 description 1
- UHTHHESEBZOYNR-UHFFFAOYSA-N vandetanib Chemical compound COC1=CC(C(/N=CN2)=N/C=3C(=CC(Br)=CC=3)F)=C2C=C1OCC1CCN(C)CC1 UHTHHESEBZOYNR-UHFFFAOYSA-N 0.000 description 1
- 208000010531 varicella zoster infection Diseases 0.000 description 1
- 201000006266 variola major Diseases 0.000 description 1
- GPXBXXGIAQBQNI-UHFFFAOYSA-N vemurafenib Chemical compound CCCS(=O)(=O)NC1=CC=C(F)C(C(=O)C=2C3=CC(=CN=C3NC=2)C=2C=CC(Cl)=CC=2)=C1F GPXBXXGIAQBQNI-UHFFFAOYSA-N 0.000 description 1
- 229960001183 venetoclax Drugs 0.000 description 1
- LQBVNQSMGBZMKD-UHFFFAOYSA-N venetoclax Chemical compound C=1C=C(Cl)C=CC=1C=1CC(C)(C)CCC=1CN(CC1)CCN1C(C=C1OC=2C=C3C=CNC3=NC=2)=CC=C1C(=O)NS(=O)(=O)C(C=C1[N+]([O-])=O)=CC=C1NCC1CCOCC1 LQBVNQSMGBZMKD-UHFFFAOYSA-N 0.000 description 1
- 230000002861 ventricular Effects 0.000 description 1
- 208000016808 vibrio vulnificus infectious disease Diseases 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 201000010044 viral meningitis Diseases 0.000 description 1
- BPQMGSKTAYIVFO-UHFFFAOYSA-N vismodegib Chemical compound ClC1=CC(S(=O)(=O)C)=CC=C1C(=O)NC1=CC=C(Cl)C(C=2N=CC=CC=2)=C1 BPQMGSKTAYIVFO-UHFFFAOYSA-N 0.000 description 1
- 208000012137 von Willebrand disease (hereditary or acquired) Diseases 0.000 description 1
- WAEXFXRVDQXREF-UHFFFAOYSA-N vorinostat Chemical compound ONC(=O)CCCCCCC(=O)NC1=CC=CC=C1 WAEXFXRVDQXREF-UHFFFAOYSA-N 0.000 description 1
- 229940069559 votrient Drugs 0.000 description 1
- 201000005102 vulva cancer Diseases 0.000 description 1
- 208000012993 vulva sarcoma Diseases 0.000 description 1
- 201000008758 vulvar sarcoma Diseases 0.000 description 1
- 229940049068 xalkori Drugs 0.000 description 1
- 229940055760 yervoy Drugs 0.000 description 1
- 229940034727 zelboraf Drugs 0.000 description 1
- 229940061261 zolinza Drugs 0.000 description 1
- 229940095188 zydelig Drugs 0.000 description 1
- 229940052129 zykadia Drugs 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2833—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against MHC-molecules, e.g. HLA-molecules
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4611—T-cells, e.g. tumor infiltrating lymphocytes [TIL], lymphokine-activated killer cells [LAK] or regulatory T cells [Treg]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/463—Cellular immunotherapy characterised by recombinant expression
- A61K39/4631—Chimeric Antigen Receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/463—Cellular immunotherapy characterised by recombinant expression
- A61K39/4632—T-cell receptors [TCR]; antibody T-cell receptor constructs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464402—Receptors, cell surface antigens or cell surface determinants
- A61K39/464403—Receptors for growth factors
- A61K39/464406—Her-2/neu/ErbB2, Her-3/ErbB3 or Her 4/ ErbB4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464402—Receptors, cell surface antigens or cell surface determinants
- A61K39/464411—Immunoglobulin superfamily
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464402—Receptors, cell surface antigens or cell surface determinants
- A61K39/464411—Immunoglobulin superfamily
- A61K39/464412—CD19 or B4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464452—Transcription factors, e.g. SOX or c-MYC
- A61K39/464453—Wilms tumor 1 [WT1]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464484—Cancer testis antigens, e.g. SSX, BAGE, GAGE or SAGE
- A61K39/464488—NY-ESO
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/46449—Melanoma antigens
- A61K39/464491—Melan-A/MART
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4702—Regulators; Modulating activity
- C07K14/4705—Regulators; Modulating activity stimulating, promoting or activating activity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70539—MHC-molecules, e.g. HLA-molecules
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/27—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterized by targeting or presenting multiple antigens
- A61K2239/28—Expressing multiple CARs, TCRs or antigens
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/10—Immunoglobulins specific features characterized by their source of isolation or production
- C07K2317/14—Specific host cells or culture conditions, e.g. components, pH or temperature
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/32—Immunoglobulins specific features characterized by aspects of specificity or valency specific for a neo-epitope on a complex, e.g. antibody-antigen or ligand-receptor
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/50—Fusion polypeptide containing protease site
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/60—Fusion polypeptide containing spectroscopic/fluorescent detection, e.g. green fluorescent protein [GFP]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/70—Fusion polypeptide containing domain for protein-protein interaction
- C07K2319/71—Fusion polypeptide containing domain for protein-protein interaction containing domain for transcriptional activaation, e.g. VP16
- C07K2319/715—Fusion polypeptide containing domain for protein-protein interaction containing domain for transcriptional activaation, e.g. VP16 containing a domain for ligand dependent transcriptional activation, e.g. containing a steroid receptor domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/80—Fusion polypeptide containing a DNA binding domain, e.g. Lacl or Tet-repressor
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Genetics & Genomics (AREA)
- Cell Biology (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Microbiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Epidemiology (AREA)
- Mycology (AREA)
- Zoology (AREA)
- Engineering & Computer Science (AREA)
- Oncology (AREA)
- Toxicology (AREA)
- Gastroenterology & Hepatology (AREA)
- Biomedical Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biotechnology (AREA)
- Wood Science & Technology (AREA)
- General Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Hematology (AREA)
- Developmental Biology & Embryology (AREA)
- Virology (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
본원의 개시내용은 폴리펩타이드의 특이적 결합 구성원과 이의 결합 파트너와의 결합시 유도되는 절단 반응 후 다양한 세포 공정을 조절하는 키메라 폴리펩타이드를 제공한다. 예를 들어, 유전자 발현의 유도를 포함하는 세포 기능을 조절하기 위해 키메라 폴리펩타이드를 사용하는 방법이 또한 제공된다. 본 발명의 키메라 폴리펩타이드를 암호화하는 핵산 및 관련 발현 카세트 및 벡터 및 상기 핵산 및/또는 발현 카세트 및 벡터를 함유하는 세포가 제공된다. 또한, 기재된 성분 및 방법, 및 본 발명의 방법을 수행하기 위한 키트를 사용하여 대상체를 치료하는 방법이 제공된다.
Description
상호-참조
본 출원은 하기 미국 출원의 우선권을 주장한다: 가특허 출원 번호 제62/378,614호(2016년 8월 23일자로 출원됨), 이 출원은 전문이 본원에 참조로 인용됨.
연방 후원 연구에 관한 진술서
본 발명은 국립보건원에 의해 부여된 승인 번호 R01 CA196277 하의 정부 지원으로 만들어 졌다. 정부는 본 발명에서 특정 권리를 갖는다.
텍스트 파일로서 제공된 서열목록이 참조로 인용됨
이와 함께 서열 목록이 2017년 8월 22일자로 작성되고 365KB의 크기를 갖는, "UCSF- 544WO_SeqList_ST25.txt" 텍스트 파일로서 이에 의해 제공된다. 상기 텍스트 파일의 내용은 이들의 전문이 본원에 참조로 인용된다.
통상적으로, 발현되는 경우 세포 거동 및/또는 활성을 변화시키는 단백질의 발현을 구동하는 유도성 발현 작제물의 사용을 통해 성취되었다. 연구 세팅에서, 유도성 발현 시스템은 세포 생물학, 분자 생물학, 유전학, 생화학 등을 포함하는 생활 과학의 많은 영역에 대한 본 발명자의 이해를 크게 진전시켰다. 잘 연구된 유도성 세포 시스템 (예를 들어, 화학적 유도성, 임의로 유도성 등)은 일반적으로 범용적으로 세포 거동 및 활성에 영향을 미치고/미치거나 활성에서의 변화를 집단의 특정 세포로 제한하거나 상기 시스템을 제어하기 위해, 예를 들어, 시스템을 “가동” 또는 “중단”시키기 위해 사용자-제공된 인풋을 요구한다. 세포 가공은 최근에 예를 들어, 이웃하는 세포에 의해 제공된 바와 같이 이들의 환경에서 신호를 검출하고 자체적으로 상기 신호 전달 인풋을 목적하는 거동 또는 활성 아웃풋으로 전달하기 위해 세포를 재프로그램화 하고자 하는 능력을 제공하였다.
본원의 개시내용은 폴리펩타이드의 특이적 결합 구성원과 이의 결합 파트너와의 결합시 유도되는 절단 반응 후 다양한 세포 공정을 조절하는 키메라 폴리펩타이드를 제공한다. 예를 들어, 유전자 발현의 유도를 포함하는 세포 기능을 조절하기 위해 키메라 폴리펩타이드를 사용하는 방법이 또한 제공된다. 본 발명의 키메라 폴리펩타이드를 암호화하는 핵산 및 관련 발현 카세트 및 벡터 및 상기 핵산 및/또는 발현 카세트 및 벡터를 함유하는 세포가 제공된다. 또한, 기재된 성분 및 방법, 및 본 발명의 방법을 수행하기 위한 키트를 사용하여 대상체를 치료하는 방법이 제공된다.
본원의 개시내용의 양상은 N-말단에서 C-말단으로 및 공유 결합으로 a) 펩타이드-주요 조직적합성 복합체 (펩타이드-MHC)에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인; b) 하나 이상의 단백질용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및 c) 전사 활성화인자 또는 리프레서를 포함하는 세포내 도메인을 포함하는 키메라 폴리펩타이드를 포함하며, 여기서, 펩타이드-MHC로의 특이적 결합 구성원의 결합은 하나 이상의 단백질용해 절단 부위에서 노치 수용체 폴리펩타이드의 절단을 유도함으로써 세포내 도메인을 방출한다.
일부 구현예에서, 특이적 결합 구성원은 항체를 포함한다. 일부 구현예에서, 상기 항체는 나노항체, 디아바디, 트리아바디, 또는 미니바디, F(ab’)2 단편, Fab 단편, 단일쇄 가변 단편 (scFv) 또는 단일 도메인 항체(sdAb)이다.
일부 구현예에서, 특이적 결합 구성원은 세포내 암 항원 펩타이드를 포함하는 펩타이드-MHC에 특이적으로 결합한다. 일부 구현예에서, 상기 세포내 암 항원 펩타이드는 WT1 펩타이드 또는 NY-ESO 펩타이드이다.
일부 구현예에서, 노치 수용체 폴리펩타이드는 이의 N-말단에 하나 이상의 상피 성장 인자 (EGF) 반복체를 포함한다. 일부 구현예에서, 노치 수용체 폴리펩타이드는 이의 N-말단에 2 내지 11개 EGF 반복체를 포함한다. 일부 구현예에서, 노치 수용체 폴리펩타이드는 합성 링커를 포함한다. 일부 구현예에서, 노치 수용체 폴리펩타이드는 하나 이상의 EGF 반복체와 하나 이상의 단백질용해 절단 부위 사이에 합성 링커를 포함한다. 일부 구현예에서, 노치 수용체 폴리펩타이드는 50개 아미노산 내지 1000개 아미노산의 길이를 갖는다. 일부 구현예에서, 노치 수용체 폴리펩타이드는 300개 아미노산 내지 400개 아미노산의 길이를 갖는다. 일부 구현예에서, 하나 이상의 단백질용해 절단 부위는 S2 단백질용해 절단 부위, S3 단백질용해 절단 부위 또는 이의 조합을 포함한다. 일부 구현예에서, 하나 이상의 단백질용해 절단 부위는 예를 들어, Ala-Val 디펩타이드 서열을 포함하는 ADAM-17-형 프로테아제 절단 부위와 같은 ADAM 패밀리형 프로테아제 절단 부위인 S2 단백질용해 절단 부위를 포함한다. 일부 구현예에서, 하나 이상의 단백질용해 절단 부위는 Gly-Val 디펩타이드 서열을 포함하는 감마-세크레타제 (γ-세크레타제) 절단 부위인 S3 단백질용해 절단 부위를 포함한다. 일부 구현예에서, 하나 이상의 단백질용해 절단 부위는 S1 단백질용해 절단 부위를 추가로 포함한다. 일부 구현예에서, S1 단백질용해 절단 부위는 아미노산 서열 Arg-X-(Arg/Lys)-Arg (서열번호: 130) (여기서, X는 임의의 아미노산이다)을 포함하는 푸린형 프로테아제 절단 부위이다. 일부 구현예에서, 노치 수용체 폴리펩타이드는 S1 단백질용해 절단 부위가 부재이다. 일부 구현예에서, 노치 수용체 폴리펩타이드는 도 31a-32b에 제공된 서열과 적어도 85% 아미노산 서열 동일성을 갖는다. 일부 구현예에서, 노치 수용체 폴리펩타이드는 도 31a에 제공된 서열 또는 도 31b에 제공된 서열과 적어도 85% 아미노산 서열 동일성을 갖는다.
본원의 개시내용의 양상은 상기된 임의의 키메라 폴리펩타이드를 암호화하는 핵산을 포함한다.
일부 구현예에서, 핵산은 목적하는 폴리펩타이드 (POI)를 암호화하는 핵산 서열에 작동적으로 연결된 전사 활성화인자 또는 리프레서에 응답하는 전사 조절 요소를 추가로 포함한다. 일부 구현예에서, POI는 리포터 단백질, 키메라 항원 수용체 (CAR), 항체, 키메라 이중특이적 결합 구성원, 가공된 T 세포 수용체 (TCR) 및 선천성-면역 반응 유도제로 이루어진 그룹으로부터 선택되는 이종성 폴리펩타이드이다.
본원의 개시내용의 양상은 상기된 임의의 핵산을 포함하는 재조합 발현 벡터를 포함한다.
본원의 개시내용의 양상은 세포에서 이종성 폴리펩타이드의 발현을 유도하는 방법을 포함하고, 상기 방법은 세포와 펩타이드-주요 조직적합성 복합체 (펩타이드-MHC)와 접촉시키는 단계로서, 여기서, 상기 세포는 상기된 임의의 키메라 폴리펩타이드를 발현하고 상기 키메라 폴리펩타이드의 전사 활성화인자에 응답하는 전사 조절 요소에 작동적으로 연결된 이종성 폴리펩타이드를 암호화하는 서열을 포함하는 단계 및 이로써 상기 키메라 폴리펩타이드의 세포내 도메인을 방출시키는 단계 및 상기 이종성 폴리펩타이드의 발현을 유도하는 단계를 포함한다.
일부 구현예에서, 상기 이종성 폴리펩타이드는 리포터 단백질, 키메라 항원 수용체 (CAR), 항체, 키메라 이중특이적 결합 구성원, 가공된 T 세포 수용체 (TCR) 및 선천성-면역 반응 유도제이다.
본원의 개시내용의 양상은 다음을 포함하는 숙주 세포를 포함한다: a) 제1 펩타이드-주요 조직적합성 복합체 (펩타이드-MHC)에 특이적으로 결합하는 상기된 임의의 키메라 폴리펩타이드를 암호화하는 핵산; 및 b) 목적하는 폴리펩타이드 (POI)를 암호화하는 핵산에 작동적으로 연결된, 키메라 폴리펩타이드의 전사 활성화인자에 응답하는 전사 조절 요소.
일부 구현예에서, 숙주 세포는 유전학적으로 변형되고 핵산 및 전사 조절 요소는 숙주 세포의 게놈 내에 존재한다. 일부 구현예에서, 핵산 및 전사 조절 요소는 숙주 세포 내 염색체 외부에 존재한다. 일부 구현예에서, POI는 이종성 폴리펩타이드이다. 일부 구현예에서, 이종성 폴리펩타이드는 리포터 단백질, 키메라 항원 수용체 (CAR), 항체, 키메라 이중특이적 결합 구성원, 가공된 T 세포 수용체 (TCR) 및 선천성-면역 반응 유도제로 이루어진 그룹으로부터 선택된다. 일부 구현예에서, 이종성 폴리펩타이드는 제2 펩타이드-MHC에 특이적으로 결합하는 CAR이다. 일부 구현예에서, 키메라 폴리펩타이드의 특이적 결합 구성원은 제1 세포내 암 항원 펩타이드를 포함하는 제1 펩타이드-MHC에 특이적으로 결합하고 상기 CAR은 제2 세포내 암 항원 펩타이드를 포함하는 제2 펩타이드-MHC에 특이적으로 결합한다. 일부 구현예에서, 제1 세포내 암 항원 펩타이드는 WT1 펩타이드이고 제2 세포내 암 항원 펩타이드는 NY-ESO 펩타이드이다. 일부 구현예에서, 제1 세포내 암 항원 펩타이드는 NY- ESO 펩타이드이고 제2 세포내 암 항원 펩타이드는 WT1 펩타이드이다. 일부 구현예에서, 이종성 폴리펩타이드는 제2 펩타이드-MHC에 특이적으로 결합하는 가공된 TCR이다. 일부 구현예에서, 키메라 폴리펩타이드의 특이적 결합 구성원은 제1 세포내 암 항원 펩타이드를 포함하는 제1 펩타이드-MHC에 특이적으로 결합하고 상기 가공된 TCR은 제2 세포내 암 항원 펩타이드를 포함하는 제2 펩타이드-MHC에 특이적으로 결합한다. 일부 구현예에서, 제1 세포내 암 항원 펩타이드는 WT1 펩타이드이고 제2 세포내 암 항원 펩타이드는 NY-ESO 펩타이드이다. 일부 구현예에서, 제1 세포내 암 항원 펩타이드는 NY- ESO 펩타이드이고 제2 세포내 암 항원 펩타이드는 WT1 펩타이드이다.
본원의 개시내용의 양상은 a) N-말단에서 C-말단으로 및 공유 결합으로 하기를 포함하는 키메라 폴리펩타이드를 암호화하는 핵산을 포함하는 숙주 세포를 포함한다: i) 암 세포의 표면 상에 존재하는 표적 분자에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인; ii) 하나 이상의 단백질용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및 iii) 전사 활성화인자를 포함하는 세포내 도메인; b) 상기 전사 활성화인자에 응답하는 전사 조절 요소에 작동적으로 연결된 키메라 이중특이적 결합 구성원을 암호화하는 핵산, 여기서, 상기 특이적 결합 구성원의 상기 표적 분자로의 결합은 하나 이상의 단백질용해 절단 부위에서 노치 수용체 폴리펩타이드의 절단을 유도하고 이로써 세포내 도메인을 방출시키고, 상기 전사 조절 요소를 활성화시키고 상기 키메라 이중특이적 결합 구성원이 발현되도록 한다.
일부 구현예에서, 키메라 이중특이적 결합 구성원은 암 항원에 특이적인 결합 도메인 및 면역 세포의 표면 상에서 발현되는 단백질에 특이적인 결합 도메인을 포함한다. 일부 구현예에서, 키메라 이중특이적 결합 구성원은 적어도 하나의 항체 유래된 항원-결합 도메인을 포함한다. 일부 구현예에서, 키메라 이중특이적 결합 구성원은 이중특이적 항체 또는 이의 단편이다. 일부 구현예에서, 키메라 이중특이적 결합 구성원은 리간드-수용체 결합 쌍의 적어도 하나의 수용체, 또는 리간드 결합 도메인을 포함한다. 일부 구현예에서, 키메라 이중특이적 결합 구성원은 적어도 하나의 항체 유래된 항원-결합 도메인 및 리간드-수용체 결합 쌍의 적어도 하나의 수용체 또는 리간드 결합 도메인을 포함한다. 일부 구현예에서, 면역 세포의 표면 상에서 발현된 단백질은 CD3이다. 일부 구현예에서, 면역 세포의 표면 상에서 발현된 단백질은 천연 킬러 그룹 2D (NKG2D) 수용체이다. 일부 구현예에서, 표적 분자는 암 항원이다. 일부 구현예에서, 표적 분자는 조직 특이적 분자이다. 일부 구현예에서, 표적 분자는 기관 특이적 분자이다. 일부 구현예에서, 표적 분자는 세포 유형 특이적 분자이다.
본원의 개시내용의 양상은 상기된 것들 중 어느 하나에 따른 유효량의 숙주 세포를 대상체에게 투여함을 포함하는, 신생물에 대해 대상체를 치료하는 방법을 포함하고, 여기서, 상기 신생물은 표적 분자 및 암 항원을 발현한다.
본원의 개시내용의 양상은 a) N-말단에서 C-말단으로 및 공유 결합으로 하기를 포함하는 키메라 폴리펩타이드를 암호화하는 핵산을 포함하는 숙주 세포를 포함한다: i) 암 세포의 표면 상에 존재하는 표적 분자에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인; ii) 하나 이상의 단백질용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및 iii) 전사 활성화인자를 포함하는 세포내 도메인; b) 상기 전사 활성화인자에 응답하는 전사 조절 요소에 작동적으로 연결된 항-Fc 키메라 항원 수용체 (CAR)를 암호화하는 핵산, 여기서, 상기 특이적 결합 구성원의 상기 표적 분자로의 결합은 하나 이상의 단백질용해 절단 부위에서 노치 수용체 폴리펩타이드의 절단을 유도하고 이로써 세포내 도메인을 방출시키고, 상기 전사 조절 요소를 활성화시키고 상기 항-Fc CAR이 발현되도록 한다.
일부 구현예에서, 표적 분자는 암 항원이다. 일부 구현예에서, 표적 분자는 조직 특이적 분자이다. 일부 구현예에서, 표적 분자는 기관 특이적 분자이다. 일부 구현예에서, 표적 분자는 세포 유형 특이적 분자이다. 일부 구현예에서, 숙주 세포는 추가로 암 세포의 표면 상에 존재하는 암 항원에 특이적이고 항-Fc CAR에 의해 결합된 Fc 영역을 포함하는 항체를 암호화하는 핵산을 포함한다. 일부 구현예에서, 항체를 암호화하는 핵산은 전사 조절 요소에 작동적으로 연결된다.
본원의 개시내용의 양상은 상기된 임의의 숙주 세포의 유효량을 대상체에게 투여함을 포함하는, 신생물에 대해 대상체를 치료하는 방법을 포함하고, 여기서, 상기 신생물은 표적 분자를 발현한다.
일부 구현예에서, 상기 방법은 추가로 암 세포의 표면 상에 존재하는 암 항원에 특이적이고 항-Fc CAR에 의해 결합된 Fc 영역을 포함하는 항체를 대상체에게 투여함을 포함한다.
본원의 개시내용의 양상은 a) N-말단에서 C-말단으로 및 공유 결합으로 하기를 포함하는 키메라 폴리펩타이드를 암호화하는 핵산을 포함하는 숙주 세포를 포함한다: i) 암 세포의 표면 상에 존재하는 표적 분자에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인; ii) 하나 이상의 단백질용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및 iii) 전사 활성화인자를 포함하는 세포내 도메인; b) 상기 전사 활성화인자에 응답하는 전사 조절 요소에 작동적으로 연결된 선천성-면역 반응 유도제를 암호화하는 핵산, 여기서, 상기 특이적 결합 구성원의 상기 표적 분자로의 결합은 하나 이상의 단백질용해 절단 부위에서 노치 수용체 폴리펩타이드의 절단을 유도하고 이로써 세포내 도메인을 방출시키고, 상기 전사 조절 요소를 활성화시키고 상기 선천성 면역 반응 유도제가 발현되도록 한다.
일부 구현예에서, 표적 분자는 조직 특이적 분자이다. 일부 구현예에서, 표적 분자는 기관 특이적 분자이다. 일부 구현예에서, 표적 분자는 세포 유형 특이적 분자이다. 일부 구현예에서, 표적 분자는 암 항원이다. 일부 구현예에서, 선천성-면역 반응 유도제는 세균 단백질 또는 이의 단편이다. 일부 구현예에서, 선천성-면역 반응 유도제는 바이러스 단백질 또는 이의 단편이다. 일부 구현예에서, 선천성-면역 반응 유도제는 진균류 단백질 또는 이의 단편이다. 일부 구현예에서, 선천성-면역 반응 유도제는 포유동물 기생충에 의해 발현되는 단백질 또는 이의 단편이다. 일부 구현예에서, 포유동물 기생충은 사람 기생충이다.
본원의 개시내용의 양상은 상기된 임의의 숙주 세포의 유효량을 대상체에게 투여함을 포함하는, 대상체의 특정 영역에 선천성 면역 반응을 유도하는 방법을 포함하고, 여기서, 상기 영역은 표적 분자를 발현한다. 일부 구현예에서, 상기 대상체의 영역은 신생물을 포함한다.
본원의 개시내용의 양상은 a) N-말단에서 C-말단으로 및 공유 결합으로 i) 암 세포의 표면 상에 존재하는 표적 분자에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인; ii) 하나 이상의 단백질용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및 iii) 전사 활성화인자를 포함하는 세포내 도메인을 포함하는 키메라 폴리펩타이드를 암호화하는 핵산; b) 상기 전사 활성화인자에 응답하는 전사 조절 요소에 작동적으로 연결된 면역 억제 인자를 암호화하는 핵산을 포함하는 숙주 세포를 포함하고, 여기서, 상기 특이적 결합 구성원의 상기 표적 분자로의 결합은 하나 이상의 단백질용해 절단 부위에서 노치 수용체 폴리펩타이드의 절단을 유도하고 이로써 세포내 도메인을 방출시키고, 상기 전사 조절 요소를 활성화시키고 상기 면역 억제 인자가 발현되도록 한다.
일부 구현예에서, 표적 분자는 조직 특이적 분자이다. 일부 구현예에서, 표적 분자는 기관 특이적 분자이다. 일부 구현예에서, 표적 분자는 세포 유형 특이적 분자이다. 일부 구현예에서, 표적 분자는 자가항원이다. 일부 구현예에서, 면역 억제 인자는 면역억제 사이토킨이다. 일부 구현예에서, 면역억제성 사이토킨은 IL-10이다. 일부 구현예에서, 면역 억제 인자는 세포 대 세포 신호전달 면역억제성 리간드이다. 일부 구현예에서, 세포 대 세포 신호전달 면역억제성 리간드는 PD-L1이다.
본원의 개시내용의 양상은 대상체에서 면역 반응을 억제하는 방법을 포함하고, 상기 방법은 상기된 임의의 숙주 세포의 유효량을 대상체에게 투여함을 포함하고, 상기 대상체는 표적 분자를 발현한다. 일부 구현예에서, 상기 대상체는 자가면역 질환을 갖는다.
본원의 개시내용의 양상은 이종성 종양을 사멸시키는 방법을 포함하고, 상기 방법은: 사멸 항원을 발현하는 제1 세포, 및 사멸 항원 및 프라이밍 항원을 발현하는 제2 세포를, 프라이밍 항원에 특이적으로 결합하는 단백질용해 절단가능한 키메라 폴리펩타이드, 사멸 항원에 특이적으로 결합하는 치료학적 폴리펩타이드를 암호화하는 핵산 서열; 및 단백질용해 절단가능한 키메라 폴리펩타이드에 응답하는 핵산에 작동적으로 연결된 전사 조절 요소를 포함하는 가공된 면역 세포와 접촉시키는 단계를 포함하고, 여기서, 상기 단백질용해 절단가능한 키메라 폴리펩타이드의 프라이밍 항원으로의 결합이 전사 조절 요소를 활성화시켜 상기 사멸 항원에 결합되는 경우, 상기 이종성 종양의 제1 및 제2 세포를 사멸시키는 치료학적 폴리펩타이드의 발현을 유도한다.
일부 구현예에서, 치료학적 폴리펩타이드는 키메라 항원 수용체(CAR)이다. 일부 구현예에서, 치료학적 폴리펩타이드는 T 세포 수용체(TCR)이다. 일부 구현예에서, 치료학적 폴리펩타이드는 치료학적 항체이다. 일부 구현예에서, 치료학적 폴리펩타이드는 키메라 이중특이적 결합 구성원이다. 일부 구현예에서, 프라이밍 항원 또는 사멸 항원의 적어도 하나는 MHC와 관련하여 제공되는 세포내 항원이다. 일부 구현예에서, 프라이밍 항원 또는 사멸 항원 둘 다는 MHC와 관련하여 제공되는 세포내 항원이다.
도 1은 수용자 세포에서 유전자 또는 암호화 서열 (“X”)의 발현을 유도하기 위한 공여자 세포의 주요 조직적합성 복합체 (MHC)-제공된 항원과 일 구현예의 수용자 세포 상에 발현된 단백질용해 검출가능한 키메라 폴리펩타이드 (synNotch)의 특이적 결합을 도식적으로 도시한다.
도 2는 MHC-제공된 WT1 항원에 특이적인, 도 1에 일반적으로 도시된 바와 같이 본원에 기재된 하나의 구현예에 따라 단백질용해 절단가능한 키메라 폴리펩타이드를 발현하는 수용자 세포에서 청색 혈광성 단백질 (BFP) 리포터의 특이적 발현을 입증한다. 상기 리포터는 수용자 세포가 MHC-제공된 WT1 항원을 발현하는 공여자 세포와 접촉되는 경우 발현되지만 상기 항원을 발현하지 않는 공여자 세포와 접촉되는 경우에는 발현되지 않는다.
도 3은 단백질용해 절단가능한 키메라 폴리펩타이드의 WT1 세포내 항원 의존성 활성화를 보여주는 도 2와 관련된 정량화를 제공한다.
도 4는 본원에 기재된 하나의 구현예에 따른 항-MHC-제공된 WT1 단백질용해 절단가능한 키메라 폴리펩타이드의 민감성 및 항원 농도 의존성 리포터 활성화를 입증한다.
도 5는 하나의 구현예에 따른, CD8+ T 세포 및 CD4+ T 세포에서 항-MHC-제공된 WT1 단백질용해 절단가능한 키메라 폴리펩타이드의 민감성 및 항원 농도 의존성 리포터 활성화를 입증한다.
도 6은 MHC-제공된 NY-ESO1 항원에 특이적인 T 세포 수용체 (TCR)의 발현을 구동하는 MHC-제공된 WT1 특이적 키메라 폴리펩타이드를 사용한 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 회로를 도식적으로 도시한다. 도시된 구현예에서, T 세포는 WT1과 NY-ESO1 세포내 항원 둘 다를 발현하는 표적 세포와 접촉되는 경우에만 활성화된다.
도 7은 도 6에 도시된 시스템에 따라, WT1 및 NY-ESO1 세포내 항원 둘 다를 발현하는 표적 세포와 접촉하는 경우만의 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 T 세포 활성화 (CD69 활성화 마커 발현에 의해 나타낸 바와 같이)를 도시한다.
도 8은 도 6에 도시된 시스템에 따라, 가공된 T 세포가 WT1 및 NY-ESO1 세포내 항원 둘 다를 발현하는 표적 세포와 접촉하게 되는 경우만의 유의적 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 표적 세포사멸을 도시한다.
도 9는 MHC-제공된 NY-ESO1 항원에 특이적인 T 세포 수용체 (TCR)의 발현을 구동하는 항-GFP 특이적 키메라 폴리펩타이드를 사용한 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 회로를 도식적으로 도시한다.
도 10은 표면-GFP 및 NY-ESO1 세포내 항원 둘 다를 발현하는 표적과 접촉되는 경우의 도 9에 도시된 T 세포의 활성화를 도식적으로 도시한다.
도 11은 도 9에 도시된 시스템에 따라, 표면-GFP 및 NY-ESO1 세포내 항원 둘 다를 발현하는 표적 세포와 접촉하는 경우만의 유의적 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 T 세포 활성화 (CD69 활성화 마커 발현에 의해 나타낸 바와 같이)를 도시한다.
도 12는 도 9에 도시된 시스템에 따라, 표면-GFP 및 NY-ESO1 세포내 항원 둘 다를 발현하는 표적 세포와 접촉하는 경우에만의 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 T 세포 증식을 도시한다.
도 13은 도 9 및 도 10에 도시된 시스템에 따라, 표면-GFP 및 NY-ESO1 세포내 항원 둘 다를 발현하는 표적 세포와 접촉되는 경우만의 유의적 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 T2 표적 세포 사멸을 도시한다.
도 14는 도 9 및 도 10에 도시된 시스템에 따라, 표면-GFP 및 NY-ESO1 세포내 항원 둘 다를 발현하는 표적 세포와 접촉되는 경우만의 유의적 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 A375 표적 세포 사멸을 도시한다. 항-NY-ESO1 TCR을 항상성으로 발현하는 CD8 T 세포에 의한 표적 세포 사멸과의 비교는 게이팅된 TCR 발현과의 증진된 특이성을 입증하는 것으로 나타난다.
도 15는 제2 세포내 항원 (“항원 B”)에 특이적인 TCR의 발현을 구동시키기 위해 제1 세포내 항원 (“항원 A”)에 특이적인 하나의 구현예의 단백질용해 절단가능한 키메라 폴리펩타이드 (synNotch)를 사용하는 이원-세포내-항원 회로의 일반 도식을 제공한다.
도 16은 CD19+ 종양으로 T 세포를 재표적화시키는 α-CD19/CD3 이-특이적 항체인 블리나투모맙의 발현을 조절하는 α-GFP synNotch 수용체로 가공된 CD4+ T 세포를 도시한다.
FIG. 17은 도 16과 관련된 히스토그램 데이터를 제공하고, 이는 표면 GFP+ 단독, CD19+ 단독, 또는 표면 GFP/CD19+ K562과의 동시-배양 후 synNotch T 세포 상에 CD69 (활성화 마커) 발현을 보여준다. T 세포는 표면 GFP/CD19 K562의 존재하에 강하게 활성화하고 T 세포의 작은 퍼센트는 블리나투맙 발현의 낮은 수준의 기본 누출로 인해 CD19+ 단독 K562와 함께 배양되는 경우 활성화한다.
도 18은 각각 좌측 및 우측 옆구리에 CD19-비-표적 K562와 표적 CD19+로 피하 주사된 NSG 마우스를 도시한다. 블리나투모맙 (α-CD19/CD3 BiTE) 발현 조절에서 α-GFP synNotch T 세포는 종양 이식 후 4일째에 마우스로 정맥내 주사하였다. 종양은 25일 동안에 걸쳐 캘리퍼로 측정하였다.
도 19는 블리나투모맙 (α-CD19/CD3 BiTE) 발현 (도 18에 도시된 바와 같이)을 조절하는 α-GFP synNotch 수용체로 가공된 CD4+ 및 CD8+ T 세포로 처리된 마우스에서 양쪽 CD19+ 및 GFP/CD19+ K562 종양 성장 곡선을 제공한다. 이원 항원 GFP/CD19+ 종양은 선택적으로 제거된다(n=5 마우스, 오류 = SEM, 스튜던트의 t-시험 에 의해 결정된 유의성 ** p≤0.01).
도 20은 플라겔린의 발현을 조절하는 α-GFP synNotch 수용체로 가공된 CD4+ T 세포를 도시한다. 리포터 검정에서, 상등액은 표면 GFP+ 또는 GFP- K562와 공동-배양 후 T 세포로부터 수거하고 hTLR5 HEK-블루 분비된 알칼린 포스파타제 (SEAP) 리포터 세포로 첨가하였다. 24시간 후,SEAP 활성을 모니터링하고 상등액 중 플라겔린의 수준을 측정하였다.
도 21은 도 20에 도시된 유도된 선천성 면역 매개체 리포터 검정의 정량화를 제공한다.
도 22는 본원에 기재된 구현예에 따라 이종성 종양을 인지하고 치료하기 위해 T 세포를 프로그래밍함을 도식적으로 도시한다.
도 23은 본원에 기재된 구현예에 따른 GFP “프라이밍” 항원 및 CD19 “사멸” 항원을 발현하는 이종성 종양을 인지하고 치료하기 위한 T 세포 프로그래밍을 입증하기 위해 디자인된 모델 시스템을 도식적으로 도시한다.
도 24는 도 23에 따른 시험관내 모델화된 이원-항원 이종성 종양(“이종성 혼합체”)의 효과적인 표적화 및 사멸을 입증한다.
도 25는 다양한 비율의 프라이밍 항원-발현 세포 및 사멸 항원-발현 세포의 모델 종양을 사용하여 도 23에 도시된 이종성 종양 사멸 모델의 추가의 정량화를 제공한다. “CD19+ 표적” 막대는 상부에 있고 “GFP/CD19+ 표적” 막대는 하부에 있다.
도 26은 1:3 비율의 프라이밍 항원-발현 세포 대 사멸 항원-발현 세포를 갖는 종양에 대해 도 23에 도시된 모델 시스템에 따른 이종성 종양 사멸의 시간 과정을 제공한다.
도 27은 1:19 비율의 프라이밍 항원-발현 세포 대 사멸 항원-발현 세포를 갖는 종양에 대해 도 23에 도시된 모델 시스템에 따른 이종성 종양 사멸의 시간 과정을 제공한다.
도 28은 면역억제성 제제 PD-L1 및 IL-10의 발현을 조절하는 α-CD19 synNotch 수용체로 가공된 CD4+ T 세포를 도식적으로 도시한다.
도 29는 도 28에 도시된 바와 같이 24시간 동안 CD19+ 또는 CD19- K562와의 동시 배양 후 PD-L1 및 세포내 IL-10을 발현하는 synNotch T 세포의 퍼센트의 정량화를 제공한다. 상등액 중에 IL-10의 양은 또한 ELISA로 결정되었다.
도 30a-30g는 본원의 개시내용의 예시적 노치 수용체 폴리펩타이드의 도식을 제공한다.
도 31a-31g는 다양한 종의 노치 수용체 폴리펩타이드의 아미노산 서열(서열번호: 1 내지 7)을 제공한다.
도 32a-32b는 노치 수용체 폴리펩타이드 노치 조절 영역 및 거기에 성분 (서열번호: 16-17)들의 예를 도시한다.
도 33은 야생형 친화성 또는 증진된 친화성 TCR의 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 회로를 도식적으로 도시한다.
도 34는 도 33에 도시된 시스템에 따른 이원-항원 게이팅된 사이토킨 분비를 도시한다.
도 35는 가공된 CD4 T 세포에서 TCR의 발현을 구동하는 단백질용해 절단가능한 키메라 폴리펩타이드 게이팅된 회로를 도식적으로 도시한다.
도 36은 도 35에 도시된 시스템에 따라 표적화된 이원-항원을 발현하는 표적 세포에 응답하는 고수준의 사이토킨 분비를 도시한다.
도 37은 가공된 CD4 또는 CD8 T 세포를 사용하여 임상적 관련 항원 쌍을 표적화하는 단백질용해 절단가능한 키메라 폴리펩타이드 게이팅된 회로를 도식적으로 도시한다.
도 38은 도 37에 도시된 시스템에 따른 가공된 CD8 및 CD4 T 세포 둘 다에 의한 임상적으로 관련된 항원 쌍을 발현하는 표적 세포의 특이적 사멸을 도시한다.
도 39는 HLA-A2/Mart1에 특이적인 TCR의 발현을 구동하는 항-GFP 특이적 키메라 폴리펩타이드를 사용한 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 회로를 도식적으로 도시한다.
도 40은 표면 GFP 및 HLA-A2/Mart1 항원 둘 다를 발현하는 표적 세포의 존재하에서만 도 39에 도식적으로 도시된 회로를 발현하는 T 세포의 특이적 활성화를 도시한다.
도 41은 항-HER2 CAR의 발현을 구동하는 항- HLA-A2/WT1 특이적 키메라 폴리펩타이드를 사용한 내부-외부 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 회로를 도식적으로 도시한다.
도 42는 내부 항원 (HLA-A2/WT1) 및 외부 항원 (HER2) 둘 다를 발현하는 표적 세포의 존재하에서만 도 41에 도식적으로 도시된 회로를 발현하는 T 세포의 특이적 활성화를 도시한다.
도 2는 MHC-제공된 WT1 항원에 특이적인, 도 1에 일반적으로 도시된 바와 같이 본원에 기재된 하나의 구현예에 따라 단백질용해 절단가능한 키메라 폴리펩타이드를 발현하는 수용자 세포에서 청색 혈광성 단백질 (BFP) 리포터의 특이적 발현을 입증한다. 상기 리포터는 수용자 세포가 MHC-제공된 WT1 항원을 발현하는 공여자 세포와 접촉되는 경우 발현되지만 상기 항원을 발현하지 않는 공여자 세포와 접촉되는 경우에는 발현되지 않는다.
도 3은 단백질용해 절단가능한 키메라 폴리펩타이드의 WT1 세포내 항원 의존성 활성화를 보여주는 도 2와 관련된 정량화를 제공한다.
도 4는 본원에 기재된 하나의 구현예에 따른 항-MHC-제공된 WT1 단백질용해 절단가능한 키메라 폴리펩타이드의 민감성 및 항원 농도 의존성 리포터 활성화를 입증한다.
도 5는 하나의 구현예에 따른, CD8+ T 세포 및 CD4+ T 세포에서 항-MHC-제공된 WT1 단백질용해 절단가능한 키메라 폴리펩타이드의 민감성 및 항원 농도 의존성 리포터 활성화를 입증한다.
도 6은 MHC-제공된 NY-ESO1 항원에 특이적인 T 세포 수용체 (TCR)의 발현을 구동하는 MHC-제공된 WT1 특이적 키메라 폴리펩타이드를 사용한 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 회로를 도식적으로 도시한다. 도시된 구현예에서, T 세포는 WT1과 NY-ESO1 세포내 항원 둘 다를 발현하는 표적 세포와 접촉되는 경우에만 활성화된다.
도 7은 도 6에 도시된 시스템에 따라, WT1 및 NY-ESO1 세포내 항원 둘 다를 발현하는 표적 세포와 접촉하는 경우만의 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 T 세포 활성화 (CD69 활성화 마커 발현에 의해 나타낸 바와 같이)를 도시한다.
도 8은 도 6에 도시된 시스템에 따라, 가공된 T 세포가 WT1 및 NY-ESO1 세포내 항원 둘 다를 발현하는 표적 세포와 접촉하게 되는 경우만의 유의적 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 표적 세포사멸을 도시한다.
도 9는 MHC-제공된 NY-ESO1 항원에 특이적인 T 세포 수용체 (TCR)의 발현을 구동하는 항-GFP 특이적 키메라 폴리펩타이드를 사용한 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 회로를 도식적으로 도시한다.
도 10은 표면-GFP 및 NY-ESO1 세포내 항원 둘 다를 발현하는 표적과 접촉되는 경우의 도 9에 도시된 T 세포의 활성화를 도식적으로 도시한다.
도 11은 도 9에 도시된 시스템에 따라, 표면-GFP 및 NY-ESO1 세포내 항원 둘 다를 발현하는 표적 세포와 접촉하는 경우만의 유의적 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 T 세포 활성화 (CD69 활성화 마커 발현에 의해 나타낸 바와 같이)를 도시한다.
도 12는 도 9에 도시된 시스템에 따라, 표면-GFP 및 NY-ESO1 세포내 항원 둘 다를 발현하는 표적 세포와 접촉하는 경우에만의 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 T 세포 증식을 도시한다.
도 13은 도 9 및 도 10에 도시된 시스템에 따라, 표면-GFP 및 NY-ESO1 세포내 항원 둘 다를 발현하는 표적 세포와 접촉되는 경우만의 유의적 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 T2 표적 세포 사멸을 도시한다.
도 14는 도 9 및 도 10에 도시된 시스템에 따라, 표면-GFP 및 NY-ESO1 세포내 항원 둘 다를 발현하는 표적 세포와 접촉되는 경우만의 유의적 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 A375 표적 세포 사멸을 도시한다. 항-NY-ESO1 TCR을 항상성으로 발현하는 CD8 T 세포에 의한 표적 세포 사멸과의 비교는 게이팅된 TCR 발현과의 증진된 특이성을 입증하는 것으로 나타난다.
도 15는 제2 세포내 항원 (“항원 B”)에 특이적인 TCR의 발현을 구동시키기 위해 제1 세포내 항원 (“항원 A”)에 특이적인 하나의 구현예의 단백질용해 절단가능한 키메라 폴리펩타이드 (synNotch)를 사용하는 이원-세포내-항원 회로의 일반 도식을 제공한다.
도 16은 CD19+ 종양으로 T 세포를 재표적화시키는 α-CD19/CD3 이-특이적 항체인 블리나투모맙의 발현을 조절하는 α-GFP synNotch 수용체로 가공된 CD4+ T 세포를 도시한다.
FIG. 17은 도 16과 관련된 히스토그램 데이터를 제공하고, 이는 표면 GFP+ 단독, CD19+ 단독, 또는 표면 GFP/CD19+ K562과의 동시-배양 후 synNotch T 세포 상에 CD69 (활성화 마커) 발현을 보여준다. T 세포는 표면 GFP/CD19 K562의 존재하에 강하게 활성화하고 T 세포의 작은 퍼센트는 블리나투맙 발현의 낮은 수준의 기본 누출로 인해 CD19+ 단독 K562와 함께 배양되는 경우 활성화한다.
도 18은 각각 좌측 및 우측 옆구리에 CD19-비-표적 K562와 표적 CD19+로 피하 주사된 NSG 마우스를 도시한다. 블리나투모맙 (α-CD19/CD3 BiTE) 발현 조절에서 α-GFP synNotch T 세포는 종양 이식 후 4일째에 마우스로 정맥내 주사하였다. 종양은 25일 동안에 걸쳐 캘리퍼로 측정하였다.
도 19는 블리나투모맙 (α-CD19/CD3 BiTE) 발현 (도 18에 도시된 바와 같이)을 조절하는 α-GFP synNotch 수용체로 가공된 CD4+ 및 CD8+ T 세포로 처리된 마우스에서 양쪽 CD19+ 및 GFP/CD19+ K562 종양 성장 곡선을 제공한다. 이원 항원 GFP/CD19+ 종양은 선택적으로 제거된다(n=5 마우스, 오류 = SEM, 스튜던트의 t-시험 에 의해 결정된 유의성 ** p≤0.01).
도 20은 플라겔린의 발현을 조절하는 α-GFP synNotch 수용체로 가공된 CD4+ T 세포를 도시한다. 리포터 검정에서, 상등액은 표면 GFP+ 또는 GFP- K562와 공동-배양 후 T 세포로부터 수거하고 hTLR5 HEK-블루 분비된 알칼린 포스파타제 (SEAP) 리포터 세포로 첨가하였다. 24시간 후,SEAP 활성을 모니터링하고 상등액 중 플라겔린의 수준을 측정하였다.
도 21은 도 20에 도시된 유도된 선천성 면역 매개체 리포터 검정의 정량화를 제공한다.
도 22는 본원에 기재된 구현예에 따라 이종성 종양을 인지하고 치료하기 위해 T 세포를 프로그래밍함을 도식적으로 도시한다.
도 23은 본원에 기재된 구현예에 따른 GFP “프라이밍” 항원 및 CD19 “사멸” 항원을 발현하는 이종성 종양을 인지하고 치료하기 위한 T 세포 프로그래밍을 입증하기 위해 디자인된 모델 시스템을 도식적으로 도시한다.
도 24는 도 23에 따른 시험관내 모델화된 이원-항원 이종성 종양(“이종성 혼합체”)의 효과적인 표적화 및 사멸을 입증한다.
도 25는 다양한 비율의 프라이밍 항원-발현 세포 및 사멸 항원-발현 세포의 모델 종양을 사용하여 도 23에 도시된 이종성 종양 사멸 모델의 추가의 정량화를 제공한다. “CD19+ 표적” 막대는 상부에 있고 “GFP/CD19+ 표적” 막대는 하부에 있다.
도 26은 1:3 비율의 프라이밍 항원-발현 세포 대 사멸 항원-발현 세포를 갖는 종양에 대해 도 23에 도시된 모델 시스템에 따른 이종성 종양 사멸의 시간 과정을 제공한다.
도 27은 1:19 비율의 프라이밍 항원-발현 세포 대 사멸 항원-발현 세포를 갖는 종양에 대해 도 23에 도시된 모델 시스템에 따른 이종성 종양 사멸의 시간 과정을 제공한다.
도 28은 면역억제성 제제 PD-L1 및 IL-10의 발현을 조절하는 α-CD19 synNotch 수용체로 가공된 CD4+ T 세포를 도식적으로 도시한다.
도 29는 도 28에 도시된 바와 같이 24시간 동안 CD19+ 또는 CD19- K562와의 동시 배양 후 PD-L1 및 세포내 IL-10을 발현하는 synNotch T 세포의 퍼센트의 정량화를 제공한다. 상등액 중에 IL-10의 양은 또한 ELISA로 결정되었다.
도 30a-30g는 본원의 개시내용의 예시적 노치 수용체 폴리펩타이드의 도식을 제공한다.
도 31a-31g는 다양한 종의 노치 수용체 폴리펩타이드의 아미노산 서열(서열번호: 1 내지 7)을 제공한다.
도 32a-32b는 노치 수용체 폴리펩타이드 노치 조절 영역 및 거기에 성분 (서열번호: 16-17)들의 예를 도시한다.
도 33은 야생형 친화성 또는 증진된 친화성 TCR의 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 회로를 도식적으로 도시한다.
도 34는 도 33에 도시된 시스템에 따른 이원-항원 게이팅된 사이토킨 분비를 도시한다.
도 35는 가공된 CD4 T 세포에서 TCR의 발현을 구동하는 단백질용해 절단가능한 키메라 폴리펩타이드 게이팅된 회로를 도식적으로 도시한다.
도 36은 도 35에 도시된 시스템에 따라 표적화된 이원-항원을 발현하는 표적 세포에 응답하는 고수준의 사이토킨 분비를 도시한다.
도 37은 가공된 CD4 또는 CD8 T 세포를 사용하여 임상적 관련 항원 쌍을 표적화하는 단백질용해 절단가능한 키메라 폴리펩타이드 게이팅된 회로를 도식적으로 도시한다.
도 38은 도 37에 도시된 시스템에 따른 가공된 CD8 및 CD4 T 세포 둘 다에 의한 임상적으로 관련된 항원 쌍을 발현하는 표적 세포의 특이적 사멸을 도시한다.
도 39는 HLA-A2/Mart1에 특이적인 TCR의 발현을 구동하는 항-GFP 특이적 키메라 폴리펩타이드를 사용한 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 회로를 도식적으로 도시한다.
도 40은 표면 GFP 및 HLA-A2/Mart1 항원 둘 다를 발현하는 표적 세포의 존재하에서만 도 39에 도식적으로 도시된 회로를 발현하는 T 세포의 특이적 활성화를 도시한다.
도 41은 항-HER2 CAR의 발현을 구동하는 항- HLA-A2/WT1 특이적 키메라 폴리펩타이드를 사용한 내부-외부 단백질용해 절단가능한 키메라 폴리펩타이드-게이팅된 회로를 도식적으로 도시한다.
도 42는 내부 항원 (HLA-A2/WT1) 및 외부 항원 (HER2) 둘 다를 발현하는 표적 세포의 존재하에서만 도 41에 도식적으로 도시된 회로를 발현하는 T 세포의 특이적 활성화를 도시한다.
정의
본원에 상호교환적으로 사용되는 용어 “폴리뉴클레오타이드” 및 “핵산”은 임의의 길이의 뉴클레오타이드의 중합체 형태인 리보뉴클레오타이드 또는 데옥시리보뉴클레오타이드를 언급한다. 따라서, 상기 용어는 단일-, 이중-, 또는 다중-가닥 DNA 또는 RNA, 게놈 DNA, cDNA, DNA-RNA 하이브리드, 또는 푸린 및 피리미딘 염기 또는 다른 천연, 화학적으로 또는 생화학적으로 변형된, 비-천연, 또는 유도체화된 뉴클레오타이드 염기를 포함하는 중합체를 포함하지만 이에 제한되지 않는다.
"작동적으로 연결된"은 그와 같이 기재된 성분들이, 이들이 이들의 의도된 방식으로 기능하도록 하는 관계에 있는 병렬을 언급한다. 예를 들어, 프로모터는 상기 프로모터가 이의 전사 또는 발현에 영향을 주는 경우 암호화 서열에 작동적으로 연결되어 있다. 그러나 작동적으로 연결된 핵산 서열은 필연적으로 인접해 있을 필요는 없을 수 있다. 예를 들어, 일부 경우에 프로모터에 작동적으로 연결된 암호화 서열은 프로모터에 인접해 있을 수 있다. 일부 경우에, 프로모터에 작동적으로 연결된 암호화 서열은 암호화 및 비-암호화 서열을 포함하는 하나 이상의 중재 서열에 의해 분리될 수 있다. 또한, 일부 경우에, 2개 초과의 암호화 서열이 작동적으로 연결될 수 있고, 이는 2개 이상의 암호화 서열이 단일 프로모터에 작동적으로 연결되어 있는 경우를 포함하지만 이에 제한되지 않는다.
"벡터" 또는 "발현 벡터"는 또 다른 DNA 분절, 즉, “삽입체”가 세포에서 부착된 분절을 복제하도록 부착될 수 있는 플라스미드, 파아지, 바이러스 또는 코스미드와 같은 레플리콘이다.
본원에 사용된 바와 같은 "이종성"은 각각 천연 (예를 들어, 천연적으로-존재하는) 핵산 또는 단백질에서 발견되지 않는 뉴클레오타이드 또는 폴리뉴클레오타이드 서열을 의미한다. 이종성 핵산 또는 폴리펩타이드는 여기에서 핵산 또는 폴리펩타이드가 존재하거나 발현되는 유기체 또는 세포로서 상이한 종으로부터 유래할 수 있다. 따라서, 이종성 핵산 또는 폴리펩타이드는 일반적으로 이것이 존재하는 세포 또는 유기체와 비교하여 유사하지 않은 진화 기원을 갖는다.
용어 "항체" 및 “면역글로불린”은 임의의 이소형의 항체 또는 면역글로불린, 항원으로의 특이적 결합을 보유하는 항체의 단편을 포함하고, 이는 Fab, Fv, scFv, 및 Fd 단편, 키메라 항체, 인간화된 항체, 단일쇄 항체 (scAb), 단일 도메인 항체(dAb), 단일 도메인 중쇄 항체, 단일 도메인 경쇄 항체, 나노바디, 이중특이적 항체, 다중-특이적 항체, 및 항체 및 비-항체 단백질의 항원-결합 (또한 본원에서 항원 결합으로서 언급됨)을 포함하는 융합 단백질을 포함하지만 이에 제한되지 않는다. 항체는 예를 들어, 방사능동위원소, 검출가능한 생성물을 생성하는 효소, 형광성 단백질 등으로 검출가능하게 표지될 수 있다. 항체는 특이적 결합 쌍의 구성원, 예를 들어, 비오틴(비오틴-아비딘 특이적 결합 쌍의 구성원) 등과 같은 다른 모이어티에 추가로 접합될 수 있다. 항체는 또한 폴리스티렌 플레이트 또는 비드 등을 포함하지만 이에 제한되지 않는 고형 지지체에 결합될 수 있다. 또한 상기 용어에 의해 포함되는 것은 Fab’, Fv, F(ab’)2, 및 또는 항원으로의 특이적 결합을 보유하는 다른 항체 단편 및 모노클로날 항체이다. 본원에 사용된 바와 같은 모노클로날 항체는 동일한 세포 그룹에 의해 생성되는 항체이고, 이 모두는 반복적인 세포 복제에 의해 단일 세포로부터 생성되었다. 즉, 세포 클론만이 단일 항체 종을 생성한다. 모노클로날 항체는 하이브리도마 생성 기술을 사용하여 생성될 수 있지만, 당업자에게 공지된 다른 생성 방법이 또한 사용될 수 있다(예를 들어, 항체는 항체 파아지 디스플레이 라이브러리로부터 유래한다).항체는 1가 또는 2가일 수 있다. 항체는 4개의 폴리펩타이드 쇄: 디설파이드 결합에 의해 연결된 2개의 중쇄 및 2개의 경쇄로 이루어진 “Y-형”인 Ig 단량체일 수 있다.
본원에 사용된 바와 같은 용어 "인간화된 면역글로불린"은 상이한 기원의 면역글로불린 부분을 포함하는 면역글로불린을 언급하고, 여기서, 적어도 하나의 부분은 인간 기원의 아미노산 서열을 포함한다. 예를 들어, 인간화된 항체는 마우스와 같은, 요구되는 특이성을 갖는 비인간 기원의 면역글로불린으로부터, 및 통상적인 기술 (예를 들어, 합성)에 의해 화학적으로 함께 연결되거나 유전학적 가공 기술을 사용하여 연속 폴리펩타이드로서 제조되는 (예를 들어, 키메라 항체의 단백질 부분을 암호화하는 DNA는 연속 폴리펩타이드 쇄를 생성하도록 발현될 수 있다) 인간 기원의 면역글로불린 서열 (예를 들어, 키메라 서열)로부터 유래된 부분을 포함할 수 있다. 인간화된 면역글로불린의 또 다른 예는 비인간 기원의 항체로부터 유래된 상보성-결정 영역 (CDR) 및 인간 기원의 경쇄 및/또는 중쇄로부터 유래된 골격 영역을 포함하는 하나 이상의 면역글로불린 쇄를 함유하는 면역글로불린 (예를 들어, 골격 변화가 있거나 없는 CDR-접목된 항체)이다. 키메라 또는 CDR-접목된 단일쇄 항체는 또한 용어 인간화된 면역글로불린에 의해 포함된다. 예를 들어, 하기 문헌을 참조한다: Cabilly 외, 미국특허 번호 제4,816,567호; Cabilly 외, 유럽 특허 번호 제0,125,023 B1호; Boss 외, 미국특허 번호 제4,816,397호; Cabilly 외, 유럽 특허 번호 제0,120,694 B1호; Neuberger, M.S. 외, WO 86/01533; Neuberger, M.S. 외, 유럽 특허 번호 제0,194,276 B1호; Winter, 미국특허 번호 제5,225,539호; Winter, 유럽 특허 번호 제0,239,400 B1호; Padlan, E.A. 외, 유럽 특허 출원 번호 제0,519,596 A1호.예를 들어 또한 하기 문헌을 참조한다: Ladner 외, 미국특허 번호 제4,946,778호; Huston, 미국특허 번호 제5,476,786호; 및 Bird, R.E. 외, Science, 242:423-426 (1988)), 단일쇄 항체에 관하여.
본원에 사용된 바와 같은 용어 "나노바디" (Nb)는 천연적으로 존재하는 중쇄 항체로부터 유래된 최소 항원 결합 단편 또는 단일 가변 도메인 (VHH)을 언급하고 당업자에게 공지되어 있다. 이들은 낙타과에서 발견되는 중쇄 만의 항체로부터 유래한다(문헌참조: Hamers-Casterman 외, 1993; Desmyter 외, 1996).경쇄 폴리펩타이드가 없는 “낙타과” 면역글로불린 패밀리가 발견된다. "낙타과"는 구시대 낙타과(카멜루스 박트리아누스(Camelus bactrianus) 및 카멜루스 드로메다리우스(Camelus dromedarius)) 및 신시대 낙타과 (예를 들어, 를라마 파코스(Llama paccos), 를라마 글라마(Llama glama), 를라마 구아니코(Llama guanicoe) 및 를라마 비쿠그나(Llama vicugna))를 포함한다. 단일 가변 도메인 중쇄 항체는 본원에서 나노바디 또는 VHH 항체로서 언급된다.
"항체 단편"은 온전한 항체 부분, 예를 들어, 온전한 항체의 항원 결합 또는 가변 영역을 포함한다. 항체 단편의 예는 Fab, Fab', F(ab')2, 및 Fv 단편; 디아바디; 선형구조 항체를 포함한다 (Zapata 외, Protein Eng. 8(10): 1057-1062 (1995)); 도메인 항체(dAb; Holt 외 (2003) Trends Biotechnol.21:484); 단일쇄 항체 분자; 및 항체 단편으로부터 형성된 다중-특이적 항체.항체의 파파인 분해는 소위 “Fab” 단편으로 불리우는 2개의 동일한 항원-결합 단편을 생성하고, 각각은 단일 항원-결합 부위, 및 용이하게 결정화하는 능력을 반영하는 부위로서 나머지 “Fc” 단편을 갖는다. 펩신 처리는 2개의 항원 결합 부위를 갖고 여전히 항원과 가교-결합할 수 있는 F(ab')2 단편을 생성한다.
"Fv"는 완전한 항원-인지 및 -결합 부위를 함유하는 소형 항체 단편이다. 상기 항원은 단단히 비-공유 연합된 하나의 중쇄 및 하나의 경쇄 가변 도메인의 이량체로 이루어진다. 상기 형태에서 각각의 가변 도메인의 3개의 CDR은 VH-VL 이량체의 표면 상에 항원-결합 부위를 한정하기 위해 상호작용한다. 총체적으로, 6개 CDR은 항체에 항원-결합 특이성을 부여한다. 그러나, 단일 가변 도메인 (또는 항원에 특이적인 3개의 CDR만을 포함하는 Fv의 절반)은 항원을 인지하고 결합하는 능력을 갖지만 전체 결합 부위 보다는 낮은 친화성이다.
“Fab” 단편은 또한 경쇄의 불변 도메인 및 중쇄의 제1 불변 도메인(CH1)을 함유한다. Fab 단편은 항체 힌지 영역으로부터의 하나 이상의 시스테인을 포함하는 중쇄 CH1 도메인의 카복시 말단에 수개의 잔기 첨가되어 있어 Fab’ 단편과는 상이하다. Fab'-SH는 본원에서 불변 도메인의 시스테인 잔기(들)이 유리된 티올 그룹을 함유하는 Fab’에 대한 표시이다. F(ab')2 항체 단편은 본래에 이들 사이에 힌지 시스테인을 갖는 Fab’ 단편의 쌍으로서 제조되었다. 항체 단편의 다른 화학적 커플링이 또한 공지되어 있다.
임의의 척추 동물로부터의 항체 (면역글로불린)의 "경쇄"는 이들의 불변 도메인의 아미노산 서열을 기준으로 카파와 람다로 불리는 2개의 명백한 특유의 유형 중 하나에 할당될 수 있다. 이들의 중쇄의 불변 도메인의 아미노산 서열에 의존하여, 면역글로불린은 상이한 부류로 할당될 수 있다. 5개 주요 부류의 면역글로불린이 있다: IgA, IgD, IgE, IgG, 및 IgM, 및 이들 부류 중 여러 개는 추가로 아부류 (이소형), 예를 들어, IgG1, IgG2, IgG3, IgG4, IgA, 및 IgA2로 분류될 수 있다. 상기 아부류는 유형들, 예를 들어, IgG2a 및 IgG2b로 추가로 분류될 수 있다.
"단일쇄 Fv" 또는 "sFv" 또는 “scFv” 항체 단편은 항체의 VH 및 VL 도메인을 포함하고, 여기서, 이들 도메인은 단일 폴리펩타이드 쇄로 존재한다. 일부 구현예에서, Fv 폴리펩타이드는 VH와 VL 도메인 사이에 폴리펩타이드 링커를 추가로 포함하고, 이것은 sFv가 항원 결합을 위해 요구되는 구조를 형성하도록 할 수 있다. sFv의 검토를 위해, 문헌(Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg 및 Moore eds., Springer-Verlag, New York, pp. 269-315 (1994))을 참조한다.
용어 "디아바디"는 2개의 항원-결합 부위를 갖는 작은 항체 단편을 언급하고, 상기 단편은 동일한 폴리펩타이드 쇄 (VH-VL) 중에서 경쇄 가변 도메인(VL)에 연결된 중쇄 가변 도메인(VH)을 포함한다.동일한 쇄 상에서 2개의 도메인 간 쌍 형성을 허용하기에는 너무 짧은 링커를 사용함에 의해, 도메인은 또 다른 쇄의 상보적 도메인과 쌍을 형성하여 2개의 항원-결합 부위를 생성하도록 강제된다. 디아바디는 예를 들어, 하기 문헌에 보다 상세히 기재되어 있다: EP 404,097; WO 93/11161; 및 Hollinger 외 (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448.
본원에 사용된 바와 같은 용어 "친화성"은 2개의 제제 (예를 들어, 항체 및 항원)의 가역적 결합을 위한 평형 상수를 언급하고 해리 상수 (KD)로서 표현된다. 친화성은 관련 없는 아미노산 서열에 대한 항체의 친화성 보다 적어도 1-배 초과, 적어도 2-배 초과, 적어도 3-배 초과, 적어도 4-배 초과, 적어도 5-배 초과, 적어도 6-배 초과, 적어도 7-배 초과, 적어도 8-배 초과, 적어도 9-배 초과, 적어도 10-배 초과, 적어도 20-배 초과, 적어도 30-배 초과, 적어도 40-배 초과, 적어도 50-배 초과, 적어도 60-배 초과, 적어도 70-배 초과, 적어도 80-배 초과, 적어도 90-배 초과, 적어도 100-배 초과, 또는 적어도 1,000-배 초과 또는, 그 이상일 수 있다. 표적 단백질에 대한 항체의 친화성은 예를 들어, 약 100 나노몰 (nM) 내지 약 0.1 nM, 약 100 nM 내지 약 1 피코몰 (pM), 또는 약 100 nM 내지 약 1 펨토몰 (fM) 또는 그 이상일 수 있다. 본원에 사용된 바와 같은 용어 “결합가 (avidity)”는 2개 이상의 제제의 복합체가 희석 후 해리하는 내성을 언급한다. 용어 “면역반응성” 및 “우선적으로 결합한다”는 항체 및/또는 항원-결합 단편과 관련하여 본원에서 상호교환적으로 사용된다.
용어 “결합”은 염 브릿지 및 물 브릿지와 같은 상호작용을 포함하는, 예를 들어 공유, 정전기, 소수성, 및 이온성 및/또는 수소-결합 상호작용으로 인한 2개의 분자 간의 직접적인 연합을 언급한다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드의 세포외 도메인에 존재하는 특이적 결합 구성원은 펩타이드-주요 조직적합성 복합체 (펩타이드-MHC)에 특이적으로 결합한다. “특이적 결합”은 적어도 약 10-7 M 이상, 예를 들어, 5x 10-7 M, 10-8 M, 5 x 10-8 M, 및 그 이상의 친화성으로의 결합을 언급한다. “비-특이적 결합”은 약 10-7 M 미만의 친화성으로의 결합, 예를 들어, 10-6 M, 10-5 M, 10-4 M, 등의 친화성으로의 결합을 언급한다.
본원에 상호교환적으로 사용되는 용어 “폴리펩타이드,” “펩타이드,” 및 “단백질”은 임의의 길이의 아미노산의 중합체 형태를 언급하고 이들은 유전학적으로 암호화되고 비-유전학적으로 암호화된 아미노산, 화학적으로 또는 생화학적으로 변형되거나 유도체화된 아미노산 및 변형된 펩타이드 골격을 갖는 폴리펩타이드를 포함할 수 있다. 상기 용어는 이종성 아미노산 서열을 갖는 융합 단백질, 이종성 및 상동성 리더 서열을 갖는 융합체, N-말단 메티오닌 잔기가 존재하거나 부재인 융합체를 포함하지만 이에 제한되지 않는 융합 단백질; 면역학적으로 태그된 단백질 등을 포함한다.
"단리된" 폴리펩타이드는 이의 천연 환경의 성분으로부터 동정되고 분리되고/되거나 회수된 것이다. 이의 천연 환경의 오염 성분들은 폴리펩타이드에 대해 진단학적 또는 치료학적 사용을 전형적으로 방해하는 물질이고 효소, 호르몬, 및 다른 단백질성 또는 비-단백질성 용질을 포함할 수 있다. 일부 구현예에서, 폴리펩타이드는 (1) 로우리 (Lowry) 방법에 의해 결정된 바와 같이 90중량% 초과, 95중량% 초과, 또는 98 중량% 초과, 예를 들어, 99중량% 초과, (2) 회전 컵 서열결정 장치(spinning cup sequenator)를 사용하여 N-말단 또는 내부 아미노산 서열의 적어도 15개 잔기를 수득하기에 충분한 정도로, 또는 (3) 환원 또는 비환원 조건하에서 쿠마시 블루 또는 실버 염색을 사용한 나트륨 도데실 설페이트-폴리아크릴아미드 겔 전기영동 (SDS-PAGE)에 의한 균질성으로 정제된다. 단리된 폴리펩타이드는 폴리펩타이드의 천연 환경의 적어도 하나의 성분이 존재하지 않기 때문에 재조합 세포내 동일계 폴리펩타이드를 포함한다. 일부 경우에, 단리된 폴리펩타이드는 적어도 하나의 정제 단계에 의해 제조된다.
본원에 상호교환적으로 사용되는 용어 “키메라 항원 수용체” 및 “CAR”은 전적으로는 아니지만 일반적으로 세포외 도메인 (예를 들어, 리간드/항원 결합 도메인), 막관통 도메인 및 하나 이상의 세포내 신호전달 도메인을 포함하는 면역 세포의 활성화를 유발하거나 억제할 수 있는 인공 다중-모듈 분자를 언급한다. 용어 CAR은 구체적으로 CAR 분자에 제한되지 않고 CAR 변이체를 포함한다. CAR 변이체는 스플릿 CAR을 포함하고, 여기서, CAR의 상기 세포외 부분 (예를 들어, 리간드 결합 부분) 및 세포내 부분 (예를 들어, 세포내 신호전달 부분)은 2개의 별도의 분자 상에 존재한다. CAR 변이체는 또한 온-스위치(ON-switch) CAR을 포함하고 이는 조건적으로 활성화될 수 있는 CAR이고, 예를 들어, 스플릿 CAR을 포함하고, 여기서, 스플릿 CAR의 2개 부분의 조건적 헤테로-이량체화는 약리학적으로 조절된다 (예를 들어, 문헌(참조: PCT 공보 번호 WO 2014/127261 A1 및 미국 특허 출원 번호 제2015/0368342 A1호, 이의 내용은 이의 전문이 본원에 참조로 인용된다)에 기재된 바와 같음).CAR 변이체는 또한 이중특이적 CAR을 포함하고, 이는 1차 CAR의 활성을 증폭시키거나 억제할 수 있는 2차 CAR 결합 도메인을 포함한다. CAR 변이체는 또한 저해성 키메라 항원 수용체 (ICRA)를 포함하고 이는 예를 들어, 이중특이적 CAR 시스템의 성분으로서 사용될 수 있고, 여기서, 2차 CAR 결합 도메인의 결합은 1차 CAR 활성화를 억제를 유도한다. CAR 분자 및 이의 유도체 (즉, CAR 변이체)는 예를 들어, 하기 문헌에 기재되어 있다: PCT 출원 번호 US2014/016527; Fedorov 외 Sci Transl Med (2013) ;5(215): 215ra172; Glienke 외 Front Pharmacol (2015) 6:21; Kakarla & Gottschalk 52 Cancer J (2014) 20(2): 151-5; Riddell 외 Cancer J (2014) 20(2): 141-4; Pegram 외 Cancer J (2014) 20(2): 127-33; Cheadle 외 Immunol Rev (2014) 257(1): 91-106; Barrett 외 Annu Rev Med (2014) 65:333-47; Sadelain 외 Cancer Discov (2013) 3(4): 388-98; Cartellieri 외, J Biomed Biotechnol (2010) 956304; 이의 개시내용은 이들의 전문이 본원에 참조로 인용됨.유용한 CAR은 또한 제조원(Novartis (Basel, Switzerland))에 의해 시판되는 바와 같이 렌티바이러스 로딩된 CTL019 (티사겐렉류셀-T) CAR-T 세포에 의해 발현되는 항-CD19―4-1BB―CD3ζ CAR을 포함한다.
본원에 사용된 바와 같은 용어 "치료", "치료하는", “치료한다” 등은 목적하는 약리학적 및/또는 생리학적 효과를 수득함을 언급한다. 상기 효과는 질환 또는 이의 증상을 완전히 또는 부분적으로 예방한다는 측면에서 예방적일 수 있고/있거나 질환 및/또는 상기 질환에 기인한 부작용에 대한 부분적 또는 완전한 치유 측면에서 치료적일 수 있다. 본원에 사용된 바와 같은 "치료"는 포유동물, 특히, 인간에서 임의의 질환 치료를 포함하고 이는 다음 단계를 포함한다: (a) 질환에 걸릴 수 있지만 아직 질환을 갖는 것으로서 진단되지 않은 대상체에서 질환의 발병을 예방하는 단계; (b) 질환을 저해하고, 즉 이의 발병을 억제하는 단계; 및 (c) 질환을 경감시키는, 즉 질환의 퇴행을 유발하는 단계.
“치료학적 유효량” 또는 “유효량”은 질환을 치료하기 위해 포유동물 또는 다른 대상체에게 투여되는 경우, 질환에 대한 상기 치료에 유효하기에 충분한 제제의 양 또는 2개 제제의 조합된 양을 언급한다. “치료학적 유효량”은 제제(들), 질환 및 이의 중증도, 및 치료받을 대상체의 연령, 체중 등에 따라 다양하다.
본원에서 상호교환적으로 사용되는 용어 “개체”, “대상체”, “숙주” 및 “환자”는 뮤린 (예를 들어, 래트, 마우스), 비-인간 영장류, 인간, 개, 고양이, 유제류 (예를 들어, 말, 소, 양, 돼지, 염소), 토끼목 포유동물 등을 포함하지만 이에 제한되지 않는 포유동물을 언급한다. 일부 경우에, 개체는 인간이다. 일부 경우에, 개체는 비-인간 영장류이다. 일부 경우에, 개체는 설치류, 예를 들어, 래트 또는 마우스이다. 일부 경우에, 개체는 토끼목 포유동물, 예를 들어, 토끼이다.
본원에 사용된 바와 같은 용어 “면역 세포”는 일반적으로 골수로에서 생성되는 조혈 줄기 세포 (HSC)로부터 유래된 백혈구 세포 (백혈구)를 포함한다. “면역 세포”는 예를 들어, 림프구(T 세포, B 세포, 천연 킬러 (NK) 세포) 및 골수-유래 세포 (호중구, 호산구, 호염구, 단핵구, 대식세포, 수지상 세포)를 포함한다.
“T 세포”는 T-헬퍼 세포 (CD4+ 세포), 세포독성 T-세포(CD8+ 세포), T-조절 세포 (Treg) 및 감마-델타 T 세포를 포함하는 CD3을 발현하는 모든 유형의 면역 세포를 포함한다.
“세포독성 세포”는 CD8+ T 세포, 천연-킬러 (NK) 세포, 및 호중구를 포함하고, 상기 세포는 세포독성 반응을 매개할 수 있다.
본원에 사용된 바와 같은 용어 “합성”은 일반적으로 천연적으로 존재하지 않는 인공적으로 유래된 폴리펩타이드 또는 폴리펩타이드 암호화 핵산을 언급한다. 상기 합성 폴리펩타이드 및/또는 핵산은 예를 들어, 단일 아미노산, 단일 뉴클레오타이드 등을 포함하는 기본 서브유니트로부터 드 노보 어셈블리될 수 있거나 천연적으로 또는 인공적으로 유래되든 상관없이 예를 들어, 재조합 방법을 통해 기존의 폴리펩타이드 또는 폴리뉴클레오타이드로부터 유래할 수 있다.
본원에 사용된 바와 같은 용어 "재조합체"는 핵산 분자, 예를 들어, 천연적으로 연합된 폴리뉴클레오타이드 서열 모두 또는 일부와 연합되지 않은, 이의 기원 또는 조작에 의한 게놈, cDNA, 바이러스, 반합성, 및/또는 합성 기원의 폴리뉴클레오타이드를 지적한다. 단백질 또는 폴리펩타이드와 관련하여 사용되는 바와 같은 용어 재조합체는 재조합 폴리뉴클레오타이드로부터 발현에 의해 생산되는 폴리펩타이드를 의미한다. 숙주 세포 또는 바이러스와 관련하여 사용되는 바와 같은 용어 재조합체는 재조합 폴리뉴클레오타이드가 도입된 숙주 세포 또는 바이러스를 의미한다. 재조합체는 또한 본원에서 물질 (예를 들어, 세포, 핵산, 단백질 또는 벡터)와 관련하여 물질이 이종성 물질 (예를 들어, 세포, 핵산, 단백질 또는 벡터)의 도입에 의해 변형되었음을 언급하기 위해 사용된다.
본 발명을 추가로 기재하기 전에, 본 발명은 이와 같이 기재된 특정 구현예에 제한되지 않고 물론 다양할 수 있는 것으로 이해되어야만 한다. 또한, 본원에 사용된 용어는 단지 특정 구현예를 기재할 목적을 위한 것이고 본 발명의 범위가 첨부된 청구항에 의해 제한되기 때문에, 제한하는 것으로 의도되지 않는 것으로 이해되어야 한다.
값의 범위가 제공되는 경우, 다르게 명백히 진술되지 않는 경우 상기 범위의 상한치와 하한치 사이에서 하한치 단위의 10분 1로 각각의 사이 값 및 상기 진술된 범위에서 임의의 다른 진술된 값 또는 사이 값이 본 발명에 포함되는 것으로 이해된다. 이들 보다 작은 범위의 상한치 및 하한치는 독립적으로 보다 작은 범위에 포함될 수 있고, 또한 상기 진술된 범위에서 임의의 구체적으로 배제된 치수에 적용되는 본 발명 내에 포함된다. 상기된 범위가 한계치 중 하나 또는 둘 다를 포함하는 경우, 이들 포함된 한계치 중 하나 또는 둘 다를 배제하는 범위가 또한 본 발명에 포함된다.
달리 정의되지 않는 경우, 본원에서 사용된 모든 기술적 및 과학적 용어는 본 발명이 속하는 기술 분야의 통상의 기술자에 의해 통상적으로 이해되는 바와 동일한 의미를 갖는다. 본원에 기재된 것들과 유사하거나 동등한 임의의 방법 및 물질은 본 발명의 수행 또는 시험에서 사용될 수 있지만, 바람직한 방법 및 물질이 지금 기재된다. 본원에 언급된 모든 공보는 공보가 인용하는 것과 관련된 방법 및/또는 물질을 개시하고 기재하기 위해 본원에 참조로 인용된다.
본원 및 첨부된 청구항에서 사용되는 바와 같은 단수 형태 "a", "an” 및 "the"는 문맥이 명백히 달리 지시하지 않는다면, 복수형 지시대상을 포함하는 것으로 주지되어야 한다. 따라서, 예를 들어, “세포”에 대한 언급은 복수의 그러한 세포를 포함하고 “세포”에 대한 언급은 하나 이상의 세포 및 당업자에게 공지된 이의 등가물 등에 대한 언급을 포함한다. 추가로, 청구항은 임의의 선택적 요소를 배제하기 위해 드래프트될 수 있는 것으로 주지된다. 이와 같이, 상기 진술은 청구항 요소의 인용 또는 ”음성” 제한의 사용과 연계하여 “유일하게”, “단지” 등과 같은 그러한 배타적 용어의 사용을 위한 선행 기초로서 작용하는 것으로 의도된다.
명료하게 하기 위해 별도의 구현예와 관련하여 기재된, 본 발명의 특정 구성은 또한 단일 구현예에서 조합으로 제공될 수 있는 것으로 이해된다. 역으로, 간략하게 하기 위해 단일 구현예와 관련하여 기재된, 본 발명의 다양한 특성은 또한 별도로 또는 임의의 적합한-서브-조합으로 제공될 수 있다. 본 발명에 속하는 구현예의 모든 조합은 구체적으로 본 발명에 의해 포함되고 각각 및 모든 조합이 개별적으로 및 명백하게 기재된 바와 같이 본원에 기재된다. 추가로, 다양한 구현예 및 이의 요소의 모든 서브-조합은 또한 구체적으로 본 발명에 의해 포함되고 각각 및 모든 그러한 서브-조합이 본원에 개별적으로 및 명시적으로 기재된 바와 같이 본원에 기재된다.
본원에서 논의된 공보는 본원의 출원일 전 이들의 개시내용을 위해서만 제공된다. 본원에서 어떠한 것도 본 발명이 선행 발명으로 상기 공보 보다 선행하지 않음을 인정하는 것으로서 해석되지 말아야 한다. 추가로, 제공된 공보의 날짜는 독립적으로 확인될 필요가 있을 수 있는 실제 공보 날짜와는 상이할 수 있다.
발명의 상세한 설명
본원의 개시내용은 키메라 폴리펩타이드의 특이적 결합 구성원과 이의 결합 파트너와의 결합시 유도되는 절단 반응 후 다양한 세포 공정을 조절하는 키메라 폴리펩타이드를 제공한다. 예를 들어, 유전자 발현의 유도를 포함하는 세포 기능을 조절하기 위해 키메라 폴리펩타이드를 사용하는 방법이 또한 제공된다. 본 발명의 키메라 폴리펩타이드를 암호화하는 핵산 및 관련 발현 카세트 및 벡터 및 상기 핵산 및/또는 발현 카세트 및 벡터를 함유하는 세포가 제공된다. 또한, 기재된 성분 및 방법, 및 본 발명의 방법을 수행하기 위한 키트를 사용하여 대상체를 치료하는 방법이 제공된다.
방법
방법은 키메라 폴리펩타이드로부터 세포내 도메인을 방출하기 위해 결합-유도된 절단 반응을 진행하는 키메라 폴리펩타이드를 사용한 하나 이상의 세포 공정 및/또는 활성 및/또는 기능을 조절하기 위해 제공된다. 하기에서 보다 상세하게 기재된 바와 같이, 본원의 개시내용의 키메라 폴리펩타이드는 일반적으로 다음을 포함할 수 있다: a) 특이적 결합 구성원을 포함하는 세포외 도메인; b) 하나 이상의 단백질용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및 c) 세포내 도메인.본원의 개시내용의 방법은 특이적 결합 구성원의 이의 결합 파트너로의 결합 시 하나 이상의 세포 공정 및/또는 활성 및/또는 기능을 조절하기 위해 상기 키메라 폴리펩타이드를 사용함을 포함한다.
본원에 기재된 방법에 따라, 일부 경우에, 키메라 폴리펩타이드는 세포내에 있거나 세포내로 도입된 키메라 폴리펩타이드를 암호화하는 핵산으로부터 발현된다. 이와 같이, 일부 경우에, 본 발명의 방법은 세포를 키메라 폴리펩타이드를 암호화하는 핵산과 접촉시킴을 포함할 수 있고, 이때, 상기 접촉은 핵산을 세포로 도입하기에 충분하다. 핵산을 세포로 도입하기 위한 임의의 간편한 방법은 본원에서 유용할 수 있고, 이는 바이러스 형질감염, 전기천공, 지질감염, 충격 (bombardment), 화학적 형질전환, 형질도입될 수 있는 캐리어의 사용 (예를 들어, 형질도입될 수 있는 캐리어 단백질) 등을 포함하지만 이에 제한되지 않는다.
도입된 핵산은 세포 내에 유지될 수 있거나 일시적으로 존재할 수 있다. 이와 같이, 일부 경우에, 도입된 핵산은 세포내에 유지될 수 있고, 예를 들어, 게놈에 통합될 수 있다. 임의의 간편한 핵산 통합 방법은 본원의 방법에서 유용할 수 있고, 이는 예를 들어, 바이러스-기반 통합, 트랜스포존-기반 통합, 상동성 재조합-기반 통합 등을 포함하지만 이에 제한되지 않는다. 일부 경우에, 도입된 핵산은 일시적으로 존재할 수 있고, 예를 들어, 세포내에서 염색체외적으로 존재할 수 있다. 일시적으로 존재하는 핵산은 예를 들어, 임의의 간편한 일시적으로 형질감염된 벡터의 일부로서 지속할 수 있다.
본원의 개시내용의 키메라 폴리펩타이드를 암호화하는 도입된 핵산은 키메라 폴리펩타이드의 발현을 구동하는 프로모터에 작동적으로 연결되는 방식으로 도입될 수 있다. 상기 프로모터의 공급원은 다양할 수 있고, 예를 들어, 상기 프로모터가 예를 들어, 발현 작제물의 일부로서 핵산과 함께 도입되는 경우 또는 상기 프로모터가 핵산을 도입하기 전 세포에 존재하거나 상기 핵산 후 도입되는 경우를 포함할 수 있다. 본원에서 보다 상세히 기재된 바와 같이, 유용한 프로모터는 내인성 프로모터 및 이종성 프로모터를 포함할 수 있다. 예를 들어, 일부 경우에, 핵산은 핵산에 작동적으로 연결된 이종성 프로모터를 함유하는 발현 작제물의 일부로서 도입될 수 있다. 일부 경우에, 핵산은 핵산이 도입되는 세포에 내인성인 프로모터 카피를 함유하는 발현 작제물의 일부로서 도입될 수 있다. 일부 경우에, 핵산은 프로모터 없이 도입될 수 있고 세포의 게놈으로 통합시 핵산은 세포에 이미 존재하는 내인성 프로모터에 작동적으로 연결될 수 있다. 사용되는 형태 및/또는 프로모터에 의존하여, 핵산으로부터 키메라 폴리펩타이드의 발현은 이의 조합을 포함하는 항상성, 유도성, 조직-특이적, 세포-유형 특이적 등인 것으로 구성될 수 있다.
도입 방법과는 상관없이 세포내 본원의 개시내용의 키메라 폴리펩타이드는 일반적으로 혈장막에 잔존하고 상기 키메라 폴리펩타이드의 특이적 결합 구성원이 이의 결합 파트너에 결합되지 않는 경우 불활성인 상태로 남아있다. 본원에 사용된 바와 같이, 본원의 개시내용의 키메라 폴리펩타이드와 관련하여, “불활성”이란 키메라 폴리펩타이드의 세포내 도메인이 절단가능한 폴리펩타이드 (예를 들어, 절단가능한 노치 폴리펩타이드)에 연결된 상태로 남아 있어 세포내 도메인이 격리되어 있고 세포내 기능 및/또는 세포 활성을 조절할 수 없도록 함을 의미한다. 특이적 결합 구성원의 이의 결합 파트너로의 결합시, 키메라 폴리펩타이드는 활성이 되는 것으로 일컬어지고, 여기서, 용어 “활성”은 일반적으로 결합에 의해 유발되는 절단 반응에 의해 키메라 폴리펩타이드로부터 세포내 도메인이 방출되어 세포내 도메인이 유리되고 세포내 기능 및/또는 세포 활성에 영향을 미칠 수 있음을 언급한다.
본원의 방법에 따라 조절될 수 있는 세포 공정 및/또는 활성 및/또는 기능은 다양할 수 있고 유전자 또는 다른 암호화 서열의 발현을 조절하고, 예를 들어, 유전자 또는 암호화 서열의 발현을 유도하고, 유전자 또는 암호화 서열 등의 발현을 억제함을 포함할 수 있지만 이에 제한되지 않는다. 따라서, 일부 경우에, 본원의 방법에 사용되는 키메라 폴리펩타이드의 세포내 도메인은 예를 들어, 전사 활성화인자 또는 전사 억제인자를 포함하는 전사 조절인자를 포함할 수 있다.
일부 경우에, 조절될 수 있는 세포 공정 및/또는 활성 및/또는 기능은 예를 들어, 세포의 유전자 생성물의 발현, 세포의 증식, 세포의 아폽토시스, 세포의 비-아폽토시스 사멸, 세포의 분화, 세포의 탈분화, 세포의 이동, 세포로부터 분자의 분비 (예를 들어, 치료학적 폴리펩타이드의 분비, 사이토킨의 분비 등), 세포의 세포 접착, 면역 세포 활성화 (예를 들어, T 세포 활성화 등), 이펙터 분자의 제조 (예를 들어, 사이토킨, 항체, 성장 인자 등), 표적 핵산의 전사, 표적 mRNA의 해독, 기관 활성, 세포내 트래픽킹 등을 포함하지만 이에 제한되지 않는다.
일부 경우에, 사이토킨의 발현 및/또는 분비는 조절될 수 있다. 이의 발현/분비가 조절될 수 있는 사이토킨의 비제한적인 예는 예를 들어, 다음을포함하지만 이에 제한되지 않는 다음을 포함한다: 인터류킨 및 관련된 것 (예를 들어, IL-1-유사, IL-1α, IL-1β, IL-1RA, IL-18, IL-2, IL-4, IL-7, IL-9, IL-13, IL-15, IL-3, IL-5, GM-CSF, IL-6-유사, IL-6, IL-11, G-CSF, IL-12, LIF, OSM, IL-10-유사, IL-10, IL-20, IL-14, IL-16, IL-17, 등),인터페론(예를 들어, IFN-α, IFN-β, IFN-γ, 등),TNF 패밀리 (예를 들어, CD154, LT-β, TNF-α, TNF-β, 4-1BBL, APRIL, CD70, CD153, CD178, GITRL, LIGHT, OX40L, TALL-1, TRAIL, TWEAK, TRANCE, 등),TGF-β 패밀리 (예를 들어, TGF-β1, TGF-β2, TGF-β3, 등) 등.일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드 또는 이의 복수의 폴리펩타이드를 통한 세포의 활성화는 키메라 폴리펩타이드가 존재하지 않거나 달리 불활성인 경우 상응하는 세포의 것과 상대적으로 사이토킨 발현 및/또는 분비에서의 증가를 유도할 수 있다. 증가 양은 다양할 수 있고 10% 이상의 증가 범위일 수 있고, 예를 들어, 10% 이상, 25% 이상, 50% 이상, 75% 이상, 100% 이상, 150% 이상, 200% 이상, 250% 이상, 300% 이상, 350% 이상, 400% 이상 등을 포함하지만 이에 제한되지 않는다.
일부 경우에, 하기에 보다 상세하게 기재된, 이원-항원 인지가 사용되는 경우, 표적 세포의 항원 둘 다의 결합에 의해 활성화되는 세포는 단지 하나의 항원에 결합된 상응하는 세포와 비교하여 사이토킨의 세포 활성화 또는 발현/분비에서의 증가를 나타낼 수 있다. 일부 경우에, 상기 증가는 10% 이상의 증가 범위일 수 있고, 예를 들어, 10% 이상, 25% 이상, 50% 이상, 75% 이상, 100% 이상, 150% 이상, 200% 이상, 250% 이상, 300% 이상, 350% 이상, 400% 이상 등을 포함하지만 이에 제한되지 않는다.
일부 경우에, 본원에 기재된 방법은 세포를 키메라 폴리펩타이드의 특이적 결합 구성원의 결합 파트너와 접촉시킴에 의해 본원의 개시내용의 키메라 폴리펩타이드를 발현하는 세포에서 폴리펩타이드의 발현을 유도하는 방법을 포함한다. 특정 구성에 의존하여, 상기 방법은 내인성 유전자 또는 암호화 서열 또는 이종성 유전자 또는 암호화 서열의 발현을 유도함을 포함할 수 있다. 일부 경우에, 특이적 결합 구성원의 결합 파트너는 세포의 표면 상에 존재할 수 있다. 일부 경우에, 특이적 결합 구성원의 결합 파트너는 세포의 표면 상에 존재할 수 없고 예를 들어, 기질 (예를 들어, 플레이트 또는 비드의 표면과 같은 고형 지지체)에 결합될 수 있거나 미결합되거나 자유롭게 확산되는 등일 수 있다. 따라서, 본원에 기재된 방법이 세포를 키메라 폴리펩타이드의 특이적 결합 구성원과 접촉시킴을 포함하는 경우, 그러한 접촉은 예를 들어, 자유롭게 확산될 수 있는 결합 파트너와의 접촉, 이들의 표면 상에서 결합 파트너를 발현하는 세포와의 접촉, 접착된 결팝 파트너를 갖는 기질과의 접촉 등을 포함할 수 있지만 이에 제한되지 않는다. 미결합되거나 자유롭게 확산가능한 특이적 결합 구성원은 일부 경우에, 가용성 어댑터 분자로서 기능하고, 예를 들어, 앵커 세포와 수용자 세포 간의 결합을 촉진시켜 본원의 절단 가능한 키메라 폴리펩타이드를 활성화시키고 이는 예를 들어, 하기 문헌에 기재되어 있다: PCT 출원 번호 제US2016/019188호 (공개번호 제 WO 2016/138034호), 이의 개시내용은 이의 전문이 본원에 참조로 인용됨.일부 경우에, 미결합되거나 자유롭게 확산가능한 결합 파트너는 후속적으로 임의의 다른 간편한 수단에 의해 포획되거나 고정될 수 있고, 이는 예를 들어, 미결합되거나 자유롭게 확산가능한 결합 파트너에 특이적으로 결합하고 기질 또는 세포의 표면에 결합되거나 이와 연합되는 추가의 결합 파트너의 도입을 포함하지만 이에 제한되지 않는다.
본원의 방법에서, 특이적 결합 구성원과 결합 파트너의 임의의 간편한 쌍이 사용될 수 있고, 단, 상기 쌍은 키메라 폴리펩타이드를 활성화시키기에 충분히 서로 특이적으로 결합한다. 일부 경우에, 특이적 결합 구성원과 결합 파트너의 유용한 쌍은 항원-항체 쌍을 포함할 수 있고, 여기서, 예를 들어, 상기 항체는 특이적 결합 구성원으로서 사용되고 이의 결합 파트너로서는 항원이거나 상기 항원은 특이적 결합 구성원으로서 사용되고 결합 파트너로서 항체이다.
일부 경우에, 본원에 기재된 방법은 펩타이드-MHC가 키메라 폴리펩타이드의 특이적 결합 구성원과 결합하기에 충분한 조건하에서 세포를 펩타이드-주요 조직적합성 복합체 (펩타이드-MHC)와 접촉시킴에 의해 키메라 폴리펩타이드를 발현하는 세포의 세포 활성을 조절하는 방법을 포함한다. 일부 경우에, 펩타이드-MHC의 키메라 폴리펩타이드로의 결합은 세포내 도메인을 방출시키고 세포내에서 폴리펩타이드의 발현을 유도하는 키메라 폴리펩타이드를 활성화시킨다.
본원의 개시내용의 방법이 키메라 폴리펩타이드를 발현하는 세포와 결합 파트너를 접촉시켜 유전자 또는 암호화 서열의 발현을 유도함을 포함하는 경우, 필수적으로 임의의 폴리펩타이드, 천연물 또는 재조합체가 발현되도록 유도될 수 있다. 일부 경우에, 발현된 폴리펩타이드는 목적하는 폴리펩타이드 (POI)로서 언급될 수 있다. POI는 필수적으로 임의의 폴리펩타이드일 수 있고, 연구 목적의 폴리펩타이드(예를 들어, 리포터 폴리펩타이드, 돌연변이된 폴리펩타이드, 신규한 합성 폴리펩타이드 등), 치료학적 목적의 폴리펩타이드(예를 들어, 천연적으로 존재하는 치료학적 단백질, 재조합 치료학적 폴리펩타이드 등), 산업 목적의 폴리펩타이드(예를 들어, 제조와 같은 산업적 응용에 사용되는 폴리펩타이드) 등을 포함할 수 있지만 이에 제한되지 않는다.
일부 경우에, 발현되도록 유도된 폴리펩타이드는 예를 들어, 리포터 단백질, 키메라 항원 수용체 (CAR), 항체, 키메라 이중특이적 결합 구성원, 가공된 T 세포 수용체 (TCR), 선천성 면역 반응 유도제 등을 포함할 수 있지만 이에 제한되지 않는다.
본원 방법의 “접촉”은 내용에 따라 다양할 수 있고 시험관내 접촉, 생체외 접촉 및 생체내 접촉을 포함할 수 있다. 예를 들어, 일부 경우에, 예를 들어, 키메라 폴리펩타이드를 발현하는 세포가 시험관내 배양되는 경우, 상기 접촉은 결합 파트너 또는 결합 파트너 또는 결합 파트너가 접착된 기질을 발현하는 세포를 시험관내 배양물에 첨가함을 포함할 수 있다. 일부 경우에, 예를 들어, 생체내 개체에 존재하는 세포 상에 존재함을 포함하여, 예를 들어, 결합 파트너가 생체내 개체에 존재하는 경우, 접촉은 키메라 폴리펩타이드를 발현하는 세포를 개체에 투여함을 포함할 수 있다. 일부 경우에, 예를 들어, 키메라 폴리펩타이드를 발현하는 세포가 생체내 개체에 존재하는 경우, 상기 접촉은 결합 파트너를 개체에 투여하고, 개체로부터 세포를 제거하고 세포를 생체외에서 결합 파트너와 접촉시키고, 키메라 폴리펩타이드와 결합 파트너 둘 다가 생체내에서 동시에 발현되도록 유발하거나 가능하게 하는 등을 포함할 수 있다.
세포의 활성을 조절하기 위한 본원의 개시내용의 방법은 단일 세포에서 또는 다세포 환경 (예를 들어, 천연적으로 존재하는 조직; 인공 조직 등)에서 수행될 수 있다. 세포의 활성을 조절하기 위한 본원의 개시내용의 방법은 병행하여 또는 연속으로 수행될 수 있다.
본원의 개시내용의 방법은 추가로 본원의 개시내용의 키메라 폴리펩타이드를 발현하는 세포를 배양함을 포함하고, 이는 예를 들어, 세포와 결합 파트너를 접촉시키기 전에 세포를 배양하고, 세포와 결합 파트너를 접촉시키면서 세포를 배양하고, 세포를 결합 파트너와 접촉시킨 후 세포를 배양함을 포함하지만 이에 제한되지 않는다. 세포 배양의 임의의 간편한 방법이 사용될 수 있는 반면, 상기 방법은 예를 들어, 배양되는 세포 유형, 세포의 의도된 용도 (예를 들어, 세포가 연구 또는 치료학적 목적을 위해 배양되는지의 여부) 등을 포함하지만 이에 제한되지 않는 다양한 인자를 기준으로 다양하다. 일부 경우에, 본원의 개시내용의 방법은 추가로 예를 들어, 세포 배양물을 씨딩하고, 세포 배양물을 공급하고, 세포 배양물을 계대하고, 세포 배양물을 스플릿팅하고, 세포 배양물을 분석하고, 세포 배양물을 약물로 처리하고, 세포 배양물을 수거하는 것 등을 포함하지만 이에 제한되지 않는 세포 배양물의 통상의 공정을 포함할 수 있다.
본원의 개시내용의 방법은 일부 경우에 본원의 방법에 사용되는 세포를 수용하고/하거나 수거함을 추가로 포함한다. 일부 경우에, 세포는 대상체로부터 수거된다. 대상체로부터 세포의 수거는 대상체로부터 조직 샘플을 수득하고, 조직 샘플 기원의 세포를 농축, 단리 및/또는 증식시킴을 포함할 수 있다. 세포의 단리 및/또는 집적은 예를 들어, 배양에 의한 단리/집적 (예를 들어, 부착 배양, 부유 배양 등), 세포 분류 (예를 들어, FACS) 등을 포함하는 임의의 간편한 방법을 사용하여 수행될 수 있다. 세포는 예를 들어, 혈액 (예를 들어, 말초 혈액, 제대혈 등), 골수, 생검, 피부 샘플, 볼 표본 등을 포함하지만 이에 제한되지 않는 임의의 간편한 세포 조직 샘플로부터 수거될 수 있다. 일부 경우에, 세포는 예를 들어, 혈액 은행, 조직 은행 등을 포함하는 공급원으로부터 수용된다. 수용된 세포는 이전에 단리될 수 있거나 조직 샘플의 일부로서 수용될 수 있고 따라서, 단리/집적은 세포를 수용한 후 및 사용 전에 수행될 수 있다. 특정 경우에, 수용된 세포는 예를 들어, 배양된 세포주의 세포를 포함하는 비-주요 세포일 수 있다. 본원에 기재된 방법에 사용하기 위해 적합한 세포는 본원에서 추가로 상세히 기재된다.
치료 방법
본원의 개시내용의 방법은 대상체를 본원에 기재된 바와 같이 하나 이상의 단백질용해 절단가능한 키메라 폴리펩타이드를 사용하여 대상체를 치료하는 방법을 포함한다. 키메라 폴리펩타이드를 전달하는 임의의 간편한 방법은 본원의 방법에 유용할 수 있다. 일부 경우에, 본원의 키메라 폴리펩타이드는 대상체에 키메라 폴리펩타이드를 발현하는 세포를 투여함에 의해 전달될 수 있다. 일부 경우에, 본원의 키메라 폴리펩타이드는 대상체에 키메라 폴리펩타이드를 암호화하는 뉴클레오타이드 서열을 포함하는 핵산을 투여함에 의해 전달될 수 있다. 키메라 폴리펩타이드를 암호화하는 핵산의 대상체로의 투여는 핵산을 함유하는 세포를 대상체에 투여함을 포함할 수 있고, 여기서, 상기 핵산은 발현되거나 아직 발현되지 않을 수 있다. 일부 경우에, 키메라 폴리펩타이드를 암호화하는 핵산의 대상체로의 투여는 핵산을 세포에 전달하도록 디자인된 벡터를 대상체에 투여함을 포함할 수 있다.
따라서, 본원의 치료 방법에서, 키메라 폴리펩타이드를 암호화하는 핵산이 시험관내, 생체외또는 생체내 투여될 수 있다. 일부 경우에, 세포는 대상체로부터 수거될 수 있고 핵산으로 형질감염될 수 있고 형질감염된 세포는 예를 들어, 시험관내 확장을 포함하지만 이에 제한되지 않는 추가 조작의 존재 또는 부재하에 대상체에 투여될 수 있다. 일부 경우에, 예를 들어, 전달 벡터의 존재 또는 부재하의 핵산은 대상체에 직접 투여될 수 있다.
세포 활성의 다양성이 본원의 단백질용해 절단가능한 키메라 폴리펩타이드의 사용을 통해 조절될 수 있다면, 본원의 치료 방법은 다양한 응용을 위해 사용될 수 있다. 비제한적인 예로서, 본원의 방법은 예를 들어, 아칸타모에바(Acanthamoeba) 감염, 악시네노박터(Acinetobacter) 감염, 아데노바이러스(Adenovirus) 감염, ADHD (주의력 결핍/과민성 장애), AIDS (후천성 면역 결핍 증후군), ALS (근위축성 축삭 경화증), 알츠하이머 질환, 아메바증, 장 감염 (아메바 이질 감염(Entamoeba histolytica infection)), 아나플라스마증(Anaplasmosis), 인간, 빈혈증, 안지오스트롱길러스(Angiostrongylus) 감염, 동물-관련 질환, 아니사키스 감염 (아니사키아시스), 탄저병, 대동맥류, 대동맥 박리, 아레나바이러스 감염(Arenavirus Infection), 관절염(예를 들어, 소아 관절염, 섬유근육통, 통풍, 루푸스 (SLE) (전신 홍반성 루푸스), 골관절염, 류마티스 관절염 등)를 포함하지만 이에 제한되지 않는 다양한 질환에 대한 치료에 유용할 수 있다: 아스카리스 감염 (아스카리아시스), 아스퍼질러스(Aspergillus) 감염 (아스퍼질로시스), 천식, 주의력 결핍/과잉행동 장애, 자폐증, 조류 독감, B형 바이러스 감염 (B형 헤르페스 바이러스), 비. 세파시아 감염 (B. cepacia infection) (부르콜데리아 카파시아 감염(Burkholderia cepacia Infection)), 바베시오시스(Babesiosis) (바베시아 감염(Babesia Infection)), 세균성 수막염, 세균성 질염(BV), 발라무티아 감염(Balamuthia infection) (발라무티아 만드릴라리스 감염(Balamuthia mandrillaris infection)), 발라무티아 만트릴라리스 감염(Balamuthia mandrillaris infection), 발란티디아시스(Balantidiasis), 발란티디움 감염(Balantidium Infection) (발란티디아시스(Balantidiasis)), 바일리사스카리스 감염(Baylisascaris Infection), 빌하르지아(Bilharzia), 선천성 결손, 검은 폐 (석탄 근로자의 진폐증), 불라스토시스티스 호미니스 감염(Blastocystis hominis Infection), 블라스토시스티스 감염(Blastocystis Infection), 블라스토마이코시스(Blastomycosis), 출혈 장애, 혈액 장애, 몸니(Body Lice) (페디쿨루스 후마누스 코포리스(Pediculus humanus corporis)), 보렐리아 부르그도르페리 감염(Borrelia burgdorferi Infection), 보툴리눔 중독(Botulism) (클로스트리디움 보툴리님(Clostridium botulinim)), 소의 해면성뇌증(Bovine Spongiform Encephalopathy) (BSE), 브레이너드 설사(Brainerd Diarrhea), 유방암, 모세기관지염(Bronchiolitis), 기관지염, 브루셀라 감염(Brucella Infection) (브루셀로시스(Brucellosis)), 브루셀로시스(Brucellosis), 부르콜데리아 세파시아 감염(Burkholderia cepacia Infection) (비. 카파시아 감염(B. cepacia infection)), 부르콜데리아 말레이(Burkholderia mallei), 부르콜데리아 슈도말레이 감염(Burkholderia pseudomallei Infection), 캄필로박터 감염(Campylobacter Infection) (캄필로박테리오시스(Campylobacteriosis)), 캄필로박테리오시스(Campylobacteriosis), 암 (예를 들어, 결장직장 (결장) 암, 부인과함, 폐암, 전립선암, 피부암 등),캔디다 감염(Candida Infection) (캔디디아시스(Candidiasis)), 캔디디아시스(Candidiasis), 개 독감(Canine Flu), 카필라리아 감염(Capillaria Infection) (카필라리아시스(Capillariasis)), 카필라리아시스(Capillariasis), 카바페넴 내성 크렙시엘라 뉴모니아(Carbapenem resistant Klebsiella pneumonia) (CRKP), 고양이벼룩 촌충(Cat Flea Tapeworm), 세르카리아 피부염(Cercarial Dermatitis), 뇌성마비(Cerebral Palsy), 자궁경부암, 샤가스병(트리파노소마 크루지 감염(Trypanosoma cruzi Infection), 수두(Chickenpox) (바리셀라 질환(Varicella Disease)), 치쿤구니아 열(Chikungunya Fever) (CHIKV), 소아 관절염, 독일 홍역(German Measles) (루벨라 바이러스(Rubella Virus)), 홍역, 볼거리(Mumps), 로타바이러스 감염(Rotavirus Infection), 클라미디아(Chlamydia) (클라미디아 트라코마티스 질환(Chlamydia trachomatis Disease)), 클라미디아 뉴모니아 감염(Chlamydia pneumoniae Infection), 클라미디아 트라코마티스 질환(Chlamydia trachomatis Disease), 콜레라 (비브리오 콜레라 감염(Vibrio cholerae Infection)), 만성 피로 증후군(CFS), 만성 폐색성 폐 질환(COPD), 시구아테라 어류 중독(Ciguatera Fish Poisoning), 시구아톡신(Ciguatoxin), 전형적 크루츠펠트-자콥 질환(Classic Creutzfeldt-Jakob Disease), 클로노르키아시스(Clonorchiasis), 클로노르키스 감염(Clonorchis Infection) (클로노르키아시스(Clonorchiasis)), 클로스트리디움 보툴리님(Clostridium botulinim), 클로스트리디움 디피실 감염(Clostridium difficile Infection), 클로스트리디움 퍼프린겐스 감염(Clostridium perfringens infection), 클로스트리디움 테타니 감염(Clostridium tetani Infection), 응고 장애(Clotting Disorders), CMV (사이토메갈로바이러스 감염(Cytomegalovirus Infection)), 석탄 로자 진폐증(Coal Workers' Pneumoconioses), 코씨디오이도마이코시스(Coccidioidomycosis), 결장직장 (결장) 암, 일반 감기, 결막염, 쿨리 빈혈증(Cooleys Anemia), COPD (만성 폐색성 폐 질환), 코리네박테리움 디프테리아 감염(Corynebacterium diphtheriae Infection), 콕시엘라 부르네티 감염(Coxiella burnetii Infection), 크루츠펠트-자콥 질환(Creutzfeldt-Jakob Disease), CRKP (카바페넴 내성 클렙시엘라 뉴모니아(Carbapenem resistant Klebsiella pneumonia)), 크론 질환, 크립토코코시스(Cryptococcosis), 크립토스포리디오시스(Cryptosporidiosis), 크립토스포리디움 감염(Cryptosporidium Infection) (크립토스포리디오시스(Cryptosporidiosis)), 사이클로스포라 감염(Cyclospora Infection) (사이클로스포리아시스(Cyclosporiasis)), 사이클로스포리아시스(Cyclosporiasis), 시스티세르코시스(Cysticercosis), 시스토이소스포라 감염(Cystoisospora Infection) (시스토이소스포라이아시스(Cystoisosporaiasis)), 시스토이소스포라이아시스(Cystoisosporaiasis), 시토메갈로바이러스 감염(Cytomegalovirus Infection) (CMV), 뎅기열(Dengue Fever) (DF), 뎅기-출혈열 (DHF), 더마토피테스(Dermatophytes), 피부병증, 당뇨병, 다이아몬드 블랙팬 빈혈증(DBA), 디엔타모에바 플라길리스 감염(Dientamoeba fragilis Infection), 디프테리아(Diphtheria) (코리네박테리움 디프테리아 감염(Corynebacterium diphtheriae Infection)), 디필로보트리아시스(Diphyllobothriasis), 디필로보트리움 감염(Diphyllobothrium Infection) (디필로보트리아시스(Diphyllobothriasis)), 디필리디움 감염(Dipylidium Infection), 개 벼룩 촌충(Dog Flea Tapeworm), 다운 증후군(Down Syndrome) (삼중염색체(Trisomy) 21), 드라쿤쿨리아시스(Dracunculiasis), 소형조충(Dwarf Tapeworm) (히메노레피스 감염(Hymenolepis Infection)), 이. 콜라이 감염(E. coli Infection) (에스케리치아 콜라이 감염(Escherichia coli Infection)), 귀 감염 (중이염(Otitis Media)), 동부 말 뇌염(Eastern Equine Encephalitis) (EEE), 에볼라 출혈 열, 에키노코코시스(Echinococcosis), 에를리키오시스(Ehrlichiosis), 엘레판티아시스(Elephantiasis), 뇌염(모기 매개 및 진드기 매개), 엔타모에바 히스톨리티카 감염(Entamoeba histolytica infection), 엔테로비우스 베르미쿨라리스 감염(Enterobius vermicularis Infection), 엔테로바이러스 감염(Enterovirus Infection) (비=폴리오(Non-Polio)), 발진 티푸스(Epidemic Typhus), 뇌전증(Epilepsy), 엡슈타인-바르 바이러스 감염(Epstein-Barr Virus Infection) (EBV 감염), 에스케리치아 콜라이 감염(Escherichia coli Infection), 광범위 약물-내성 TB (XDR TB), 파스시올라 감염(Fasciola Infection) (파시올리아시스(Fascioliasis)), 파스시올로프시스 감염(Fasciolopsis Infection) (파스시올로프시아시스(Fasciolopsiasis)), 피브로마알기아(Fibromyalgia), 피프쓰 질환(Fifth Disease) (파르보바이러스 B 19 감염(Parvovirus B19 Infection)), 플라보링스 관련 폐 질환(Flavorings-Related Lung Disease), 폴리쿨리티스(Folliculitis), 식품-관련 질환, 클로스트리디움 퍼프린겐스(Clostridium perfringens infection), 취약 X 증후군(Fragile X Syndrome), 프란시스셀라 툴라렌시스 감염(Francisella tularensis Infection), 생식기 캔디디아시스(Genital Candidiasis) (벌보바기날 캔디디아시스(Vulvovaginal Candidiasis) (VVC)), 생식기 헤르페스(Genital Herpes) (헤르페스 심플렉스 바이러스 감염(Herpes Simplex Virus Infection)), 생식기 무사마귀, 독열 홍역(루벨라 바이러스), 기아르디아 감염(Giardia Infection) (기아르디아시스(Giardiasis)), 글란더(Glanders) (부르콜데리아 말레이(Burkholderia mallei)), 그나토스토마 감염(Gnathostoma Infection), 그나토스토미아시스(Gnathostomiasis) (그나토스토마 감염(Gnathostoma Infection)), 고노레아(Gonorrhea) (나이세리아 고노로에아 감염(Neisseria gonorrhoeae Infection)), 통풍, 육아종 아메바성 뇌염(Granulomatous amebic encephalitis) (GAE), 그룹 A 스트렙 감염(Group A Strep Infection) (GAS) (그룹 A 스트렙토코커스성 감염(Group A Streptococcal Infection)), 그룹 B 스트레프 감염(Strep Infection) (GBS) (그룹 B 스트렙토코커스성 감염(Streptococcal Infection)), 기니아 충 질환(Guinea Worm Disease) (드라쿤쿨리아시스(Dracunculiasis)), 부인과암(예를 들어, 자궁경부암, 난소암, 자궁암, 질 및 음경암 등),H1N1 Flu, 해모필러스 인플루엔자 감염(Haemophilus influenzae Infection) (Hib 감염), 수족구 질환(H및, Foot, 및 Mouth Disease)(HFMD), 한센 질환(Hansen's Disease), 한타바이러스 폐 증후군(Hantavirus Pulmonary Syndrome) (HPS), 머릿니(Head Lice)(페디쿨러스 후마누스 카피티스(Pediculus humanus capitis)), 심장 질환 (심혈관 건강(Cardiovascular Health)), 열 스트레스(Heat Stress), 헤모크로마토시스(Hemochromatosis), 혈우병, 헨드라 바이러스 감염(Hendra Virus Infection), B형 헤르페스 바이러스(Herpes B virus), 헤르페스 심플렉스 바이러스 감염(Herpes Simplex Virus Infection), 헤테로피에스 감염(Heterophyes Infection) (헤테로피아시스(Heterophyiasis)), Hib 감염 (해모필러스 인플루엔자 감염(Haemophilus influenzae Infection)), 고혈압, 히스토플라스마 카프술라툼 질환(Histoplasma capsulatum Disease), 히스토플라스모시스(Histoplasmosis) (히스토플라스마 카프술라툼 질환(Histoplasma capsulatum Disease)), 핫 터브 래쉬(Hot Tub Rash) (슈도모나스 피부염 감염(Pseudomonas dermatitis Infection)), HPV 감염 (사람 파필로마바이러스 감염(Human Papillomavirus Infection)), 사람 에를리키오시스(Human Ehrlichiosis), 사람 면역결핍 바이러스, 사람 파필로마바이러스 감염(HPV 감염), 히메노레피스 감염(Hymenolepis Infection), 고혈압, 열사병(Hyperthermia), 저체온증(Hypothermia), 농가진(Impetigo), 감염성 모노누클레오시스(Infectious Mononucleosis), 염증성 장 질환(IBD), 인플루엔자, 조류 독감(Avian Influenza), H1N1 Flu, 유행성(Pandemic Flu), 계절성 (Seasonal Flu), 돼지 인플루엔자(Swine Influenza), 공격적 캔디디아시스(Invasive Candidiasis), 철 과부하(Iron Overload) (헤모크로마토시스(Hemochromatosis)), 이소스포라 감염(Isospora Infection) (이소스포리아시스(Isosporiasis)), 일본 뇌염, 황달, 케이. 뉴모니아(K. pneumoniae) (클렙시엘라 뉴모니아(Klebsiella pneumoniae)), 칼라-아자르(Kala-Azar), 가와사키 증후군(Kawasaki Syndrome) (KS), 케르니크테루스(Kernicterus), 클렙시엘라 뉴모니아(Klebsiella pneumoniae) (케이. 뉴모니아(K. pneumoniae)), 라 크로스 뇌염(La Crosse Encephalitis) (LAC), 라 크로스 뇌염 바이러스(La Crosse Encephalitis virus) (LACV), 라사 열(Lassa Fever), 라텍스 알레르기(Latex Allergies), 납 중독(Lead Poisoning), 레지오나이레 질환(Legionnaires' Disease) (레지오넬로시스(Legionellosis)), 레이슈마니아 감염(Leishmania Infection) (레이슈마니아시스(Leishmaniasis)), 나병(Leprosy), 렙토스피라 감염(Leptospira Infection) (렙토스피로시스(Leptospirosis)), 렙토스피로시스(Leptospirosis), 백혈병, 라이스(Lice), 리스테리아 감염(Listeria Infection) (리스테리오시스(Listeriosis)), 리스테리오시스(Listeriosis), 간 질환 및 간염(Liver Disease 및 Hepatitis), 로아 로아 감염(Loa loa Infection), 파상풍(Lockjaw), 로우 게리그 질환(Lou Gehrig's Disease), 폐암, 루프스(Lupus) (SLE) (전신 홍반성 루프스(Systemic lupus erythematosus)), 라임 질환(Lyme Disease) (보렐리아 부르그도페리 감염(Borrelia burgdorferi Infection)), 림프사상충증(Lymphatic Filariasis), 림페데마(Lymphedema), 림프구 맥락수막염 (LCMV), 성병성림프육아종 감염(Lymphogranuloma venereum Infection) (LGV), 말라리아, 마르부르크 출혈혈(Marburg Hemorrhagic Fever), 홍역, 멜리오이도시스(Melioidosis) (부르콜데리아 슈도말레이 감염(Burkholderia pseudomallei Infection)), 수막염(Meningitis) (메닌고코커스성 질환(Meningococcal Disease)), 메닌고코커스성 질환(Meningococcal Disease), 메티실린 내성 스타필로코커스 아우레우스(Methicillin Resistant Staphylococcus aureus) (MRSA), 미세영양물 영양실조(Micronutrient Malnutrition), 마이크로스포리디아 감염(Microsporidia Infection), 몰루스쿰 콘타지오섬(Molluscum Contagiosum), 몽키 B 바이러스(Monkey B virus), 몽키폭스(Monkeypox), 모르겔론(Morgellons), 모기 매개 질환, 무코르마이코시스(Mucormycosis), 다중약물-내성 TB (MDR TB), 멈프(Mump), 마이코박테리움 아브세서스 감염(Mycobacterium abscessus Infection), 마이코박테리움 아비움(Mycobacterium avium) 합병증 (MAC), 마이코플라스마 뉴모니아 감염, 구더기증(Myiasis), 나에글레리아 감염(Naegleria Infection) (주요 아메바 수막내염(Primary Amebic Meningoencephalitis) (PAM)), 괴사성 근막염(Necrotizing Fasciitis), 방치된 열대병(Neglected Tropical Diseases) (NTD), 나이세리아 고노로에아 감염(Neisseria gonorrhoeae Infection), 신경낭미충증(Neurocysticercosis), 새로운 변이체 크루츠펠트-자콥 질환(New Variant Creutzfeldt-Jakob Disease), 신생아 황달 (케르니크테루스(Kernicterus)), 니파 바이러스 뇌염(Nipah Virus Encephalitis), 노카디오시스(Nocardiosis), 비-폴리오 엔테로바이러스 감염(Non-Polio Enterovirus Infection), 비병원성 (무해) 장 원생동물, 노로바이러스 감염(Norovirus Infection), 노르워크 유사 바이러스(Norwalk-like Viruses) (NLV), 신규 H1N1 Flu, 온코세르시아시스(Onchocerciasis), 오피스토르키스 감염(Opisthorchis Infection), 경구암(Oral Cancer), 오르프 바이러스( Orf Virus), 구강인두 캔디디아시스(Oropharyngeal Candidiasis) (OPC), 골관절염(Osteoarthritis) (OA), 골다공증, 중이염(Otitis Media), 난소암, 유행성 Flu, 파라고니미아시스(Paragonimiasis), 파라고니무스 감염(Paragonimus Infection) (파라고니미아시스(Paragonimiasis)), 기생충 질환, 파르보바이러스 B19 감염, 페디쿨러스 후마누스 카피티스(Pediculus humanus capitis), 페디쿨러스 후마누스 코르포리스(Pediculus humanus corporis), 골반 염증 질환(Pelvic Inflammatory Disease) (PID), 말초 동맥 질환(PAD), 백일해(Pertussis), 프티리아시스(Phthiriasis), 핑크 아이(Pink Eye) (결막염(Conjunctivitis)), 요충 감염(Pinworm Infection) (엔테로비우스 베르미쿨라리스 감염(Enterobius vermicularis Infection)), 플라그(Plague) (예르시니아 페스티스 감염(Yersinia pestis Infection)), 뉴모시스티스 지로베시 뉴모니아(Pneumocystis jirovecii Pneumonia), 뉴모니아(Pneumonia), 폴리오 감염(Polio Infection) (폴리오미엘리티스 감염(Poliomyelitis Infection)), 폰티악 열(Pontiac Fever), 프리온 질환(Prion Diseases) (전염성 해면뇌병증(spongiform encephalopathie) (TSE)), 전립선암, 슈도모나스 피부염 감염, 프시타코시스(Psittacosis), 사면발니(Pubic Lice) (프티리아시스(Phthiriasis)), 폐 고혈압, Q 열 (콕시엘라 부르네티 감염(Coxiella burnetii Infection)), 광견병(Rabie), 래쿤 회충 감염(Raccoon Roundworm Infection) (바일리사스카리스 감염(Baylisascaris Infection)), 래트-물림 열 (RBF) (스트렙토바이러스 모닐리포르미스 감염(Streptobacillus moniliformis Infection)), 물놀이병(Recreational Water Illness) (RWI), 재귀열(Relapsing Fever), 호흡기 신시티알 바이러스 감염 (Respiratory Syncytial Virus Infection) (RSV), 류마티스 관절염(RA), 리케치아 리케치 감염(Rickettsia rickettsii Infection), 리프트 발리 열(Rift Valley Fever) (RVF), 백선 (피부사상균(Dermatophytes)), 동물 내 백선, 사상충증(River Blindness) (온코세르시아시스(Onchocerciasis)), 록키산 반점 열(Rocky Mountain Spotted Fever) (RMSF) (리케치아 리케치 감염(Rickettsia rickettsii Infection)), 로타바이러스 감염(Rotavirus Infection), RVF (리프트 발리 열(Rift Valley Fever)), RWI (물놀이병), 살모넬라 감염(살모넬로시스(Salmonellosis)), 스카비에스(Scabies), 스카렛 열(Scarlet Fever), 주혈흡충증(Schistosomiasis) (쉬스토소마 감염(Schistosoma Infection)), 계절 Flu, 중증 급성 호흡기 증후군, 성 전염 질환(STD) (예를 들어, 세균성 질염 (BV), 클라미디아(Chlamydia), 생식기 헤르페스(Genital Herpes), 고노레아(Gonorrhea), 사람 파필로마바이러스 감염(Human Papillomavirus Infection), 골반 염증 질환, 매독, 트리코모니아시스(Trichomoniasis), HIV/AIDS, 등),쉬겔라 감염(Shigella Infection) (쉬겔로시스(Shigellosis)), 쉰글스(Shingles) (바리셀라 조스터 바이러스(Varicella Zoster Virus) (VZV)), 겸상 세포 질환(Sickle Cell Disease), 단일 유전자 장애(Single Gene Disorders), 시누스 감염(Sinus Infection) (시누시투스Sinusitus)), 피부암, 수면병(아프리카 트리파노소미아시스(Trypanosomiasis)), 천연두(Smallpox) (바리올라 메이져 및 바리올라 마이너(Variola Major 및 Variola Minor)), 전염성 농창(Sore Mouth Infection) (오르프 바이러스(Orf Virus)), 남부 진드기-관련 발진 병(Southern Tick-Associated Rash Illness) (STARI), 스피나 비피다(Spina Bifida) (마이엘로메닌고셀레(Myelomeningocele)), 스포로트리코시스(Sporotrichosis), 반점 열 그룹 리케차(Spotted Fever Group Rickettsia) (SFGR), 세인트 루이스 뇌염(St. Louis Encephalitis), 스타필로코커스 아우레우스 감염(Staphylococcus aureus Infection), 스트렙토바실러스 모닐리포르미스 감염(Streptobacillus moniliformis Infection), 스트렙토코커스성 질환(Streptococcal Diseases), 스트렙토코커스 뉴모니아 감염(Streptococcus pneumoniae Infection), 뇌졸중, 스트론길로이데스 감염(Strongyloides Infection) (스트론길로이디아시스(Strongyloidiasis)), 급성 어린이 사망 증후군(Sudden Infant Death Syndrome) (SIDS), 유충형주혈흡충(Swimmer's Itch) (세르카리알 피부염(Cercarial Dermatitis)), 돼지 인플루엔자, 매독(Syphilis) (트레포네마 팔리둠 감염(Treponema pallidum Infection)), 전신 홍반성 루프스(Systemic lupus erythematosus), 촌충 감염(Tapeworm Infection) (타에니아 감염(Taenia Infection)), 고환암(Testicular Cancer), 파상풍 질환(Tetanus Disease) (클로스트리디움 테타니 감염(Clostridium tetani Infection)), 아구창(Thrush) (구강인두 캔디디아시스(Oropharyngeal Candidiasis) (OPC)), 진드기 매개 재귀열, 진드기 매개 질환(예를 들어, 아나플라스모시스(Anaplasmosis), 바베시오시스(Babesiosis), 에를리키오시스(Ehrlichiosis), 라임 질환(Lyme Disease), 투렛 증후군(Tourette Syndrome) (TS), 독성 쇼크 증후군(Toxic Shock Syndrome) (TSS), 톡소카리아시스(Toxocariasis) (톡소카라 감염(Toxocara Infection)), 톡소플라스모시스(Toxoplasmosis) (톡소플라스마 감염(Toxoplasma Infection)), 트라코마 감염(Trachoma Infection), 전염성 해면 뇌병증(Transmissible spongiform encephalopathies) (TSE), 외상 뇌 손상(Traumatic Brain Injury) (TBI), 선모충증 (트리키노시스(Trichinosis)), 트리코모니아시스(Trichomoniasis) (트리코모나스 감염(Trichomonas Infection)), 결핵 (TB) (마이코박테리움 튜버쿨로시스 감염(Mycobacterium tuberculosis Infection)), 야토병(Tularemia) (프란시셀라 툴라렌시스 감염(Francisella tularensis Infection)), 장티푸스(Typhoid Fever) (살모넬라 티피 감염(Salmonella typhi Infection)), 자궁암, 질 및 음경 암(Vaginal 및 Vulvar Cancers), 반코마이신-중간체/내성 스타필로코커스 아우레우스 감염(Resistant Staphylococcus aureus Infections) (VISA/VRSA), 반코마이신-내성 엔테로코시 감염(VRE), 변이체 크루츠펠트-자콥 질환 (vCJD), 바리셀라-조스터 바이러스 감염(Varicella-Zoster Virus Infection), 바리올라 메이져 및 바리올라 마이너(Variola Major 및 Variola Minor), 비브리오 콜레라 감염(Vibrio cholerae Infection), 비브리오 파라해모리티쿠스 감염(Vibrio parahaemolyticus Infection), 비브리오 불니피쿠스 감염(Vibrio vulnificus Infection), 바이러스 위장염(Viral Gastroenteritis), 바이러스 출혈열 (VHF), 바이러스 간염, 바이러스 수막염(무균성 수막염), 본 빌레브란트 질환, 음경질 캔디디아시스(Vulvovaginal Candidiasis) (VVC), 웨스트 나일 바이러스 감염(West Nile Virus Infection), 서부 말 뇌염 감염, 편충 감염(Whipworm Infection) (트리쿠리아시스(Trichuriasis)), 휘트모어 질환(Whitmore's Disease), 백일해(Whooping Cough), 제노트로픽 쥐과 백혈병 바이러스-관련 바이러스 감염, 황열, 예르시니아 페스티스 감염(Yersinia pestis Infection), 예르시니오시스(Yersiniosis) (예르시니아 엔테로콜리티카 감염(Yersinia enterocolitica Infection)), 주노틱 후크웜(Zoonotic Hookworm), 자이고마이코시스(Zygomycosis) 등.
일부 경우에, 본원의 개시내용의 하나 이상의 단백질용해 절단가능한 폴리펩타이드를 사용하는 치료 방법은 암을 치료하는데 유용할 수 있다. 이의 치료가 본원의 개시내용의 하나 이상의 단백질용해 절단가능한 폴리펩타이드의 용도를 포함할 수 있는 암은 다양할 수 있고 예를 들어, 급성 림프아구성 백혈병 (ALL), 급성 골수 백혈병 (AML), 부신피질 암종, AIDS-관련 암 (예를 들어, 카포시 육종, 림프종 등)을 포함할 수 있지만 이에 제한되지 않는다: 항문 암, 맹장 암, 성상 세포종, 비전형적 기형/횡문양 종양, 기저 세포 암종, 담관암 (간외), 방광암, 골암 (예를 들어, 어윙 육종, 골육종 및 악성 섬유 조직구종 등),뇌 줄기 신경교종, 뇌 종양 (예를 들어, 성상 세포종, 중추 신경계 배아 종양, 중추 신경계 생식 세포 종양, 두개인두종, 뇌실막세포종 등),유방암 (예를 들어, 여성 유방암, 남성 유방암, 어린이 유방암 등),기관지 종양, 버킷 림프종, 카르시노이드 종양 (예를 들어, 어린이, 위장 등),비공지된 주요 암종, 심장 (심장) 종양(Cardiac (Heart) Tumors), 중추 신경계 (예를 들어, 비전형적 기형/횡문양 종양, 배아 종양, 생식 세포 종양, 림프종 등),자궁경부암, 어린이암, 척색종, 만성 림프구 백혈병(CLL), 만성 골수 백혈병(CML), 만성 골수증식성 신생물, 결장암, 결장직장암, 두개인두종, 피부 T-세포 림프종, 관암 (예를 들어, 담관암, 간외 등),동일계 관암종(DCIS), 배아 종양, 자궁내막암, 뇌실막세포종, 식도암, 감각신경모세포종, 어윙 육종, 두개내외 생식 세포 종양, 성선외 생식 세포 종양, 간외 담관암, 눈 암 (예를 들어, 안내 흑색종, 망막모세포종 등),골의 섬유성 조직구종 (예를 들어, 악성 종양, 골육종 등),담낭암, 위(위장) 암, 위장 카르시노이드 종양, 위장 위장관 기질 종양(GIST), 생식 세포 종양 (예를 들어, 두개내외, 담낭외, 난소, 고환 등),임신융모질환(Gestational Trophoblastic Disease), 신경교종, 모발 세포 백혈병, 두경부암, 심장암, 간세포 (간) 암, 조직구증(예를 들어, 랑게르한스 세포 등),호지킨 림프종, 하인두암, 안내 흑색종, 섬 세포 종양 (예를 들어, 췌장 신경내분비 종양 등),카포시 육종, 신장암 (예를 들어, 신장 세포, 빌름스 종양, 어린이 신장 종양 등),랑게르한스 세포 조직구증, 후두암, 백혈병 (예를 들어, 급성 림프모구성 (ALL), 급성 골수(AML), 만성 림프구 (CLL), 만성 골수성 (CML), 모발 세포 등),입술 및 구강암, 간암(주요), 동일계 소엽 암종 (LCIS), 폐암 (예를 들어, 비-소 세포, 소세포 등),림프종 (예를 들어, AIDS-관련, 버킷, 피부 T-세포, 호지킨, 비-호지킨, 주요 중추 신경계(CNS) 등),마크로글로불린혈증(예를 들어, 발덴스트롬 등),남성 유방암, 골의 악성 섬유성 조직구종 및 골육종, 흑색종, 메르켈 세포 암종, 중피종, 주요 잠재성을 갖는 전이성 편평상피 목암, NUT 유전자를 포함하는 중앙 관 암종, 입암, 다발성 내분비 신생물 증후군, 다발성 골수종/혈장 세포 신생물, 균상식육종, 골수이형성 증후군, 골수이형성/골수증식성 신생물, 골수성 백혈병 (예를 들어, 만성 (CML), 등),골수성 백혈병(예를 들어, 급성 (AML) 등),골수증식성 신생물(예를 들어, 만성 등),비강 및 부비동암, 비인두암, 신경모세포종, 비-호지킨 림프종, 비-소세포 폐암, 경구암, 구강암(예를 들어, 입술 등),구인두암, 골육종 및 골의 악성 섬유성 조직구종, 난소암 (예를 들어, 상피, 생식 세포 종양, 낮은 악성 잠재적 종양 등),췌장암, 췌장 신경내분비 종양 (섬 세포 종양), 유두종증, 부신결정종, 부비동 및 비강암, 부갑상선암, 음경암, 인두암, 크롬친화성세포종, 뇌하수체 종양, 흉막과 폐의 모세포종, 주요 중추신경계(CNS) 림프종, 전립선암, 직장암, 신장 세포(콩팥) 암, 신우뇨관, 이행 세포 암, 망막모세포종, 횡문근육종, 침샘암, 육종 (예를 들어, 어윙, 카포시, 골육종, 횡문근육종, 연질 조직, 자궁 등),세자리 증후군, 피부암 (예를 들어, 어린이, 흑색종, 메르켈 세포 암종, 비흑색종 등),소세포 폐암, 소장암, 연질 조직 육종, 편평상피 세포 암종, 편평상피 목암 (예를 들어, 주요 잠재력을 갖는, 전이성 등),위(위장) 암, T-세포 림프종, 고환암, 인후암, 흉선종 및 흉선 암종, 갑상선암, 신우뇨관의 이행 세포 암, 신우 뇨관암, 요도암 (예를 들어, 자궁내막 등),자궁 육종, 질암, 음경암, 발덴스트롬 매크로글로불린혈증, 빌름스 종양 등.
일부 경우에, 본원의 개시내용의 방법은 신생물을 갖는 대상체에 본원의 개시내용의 키메라 폴리펩타이드를 발현하는 세포 또는 본원의 개시내용의 키메라 폴리펩타이드를 암호화하는 핵산을 대상체에 투여함에 의해 신생물을 치료함을 포함한다. 일부 경우에, 상기 방법은 추가로 키메라 폴리펩타이드의 세포내 도메인에 의해 조절되는 전사 조절 요소에 작동적으로 연결된 핵산을 대상체에게 투여함을 포함할 수 있다. 본원에 사용된 바와 같은 용어 “신생물”은 일반적으로 조직의 비정상적 성장 또는 비정상적으로 증식하는 세포 또는 세포 집단을 언급하고, 이는 고형 종양, 혈액암 등을 포함하지만 이에 제한되지 않고, 예를 들어, 본원에 열거된 암을 포함하는 예를 들어 임의의 암을 포함한다. 신생물은 양성 또는 악성일 수 있다.
일부 경우에, 본원의 방법은 이종성 종양의 치료에 적용될 수 있다. 본원에 사용된 바와 같은 용어 “이종성 종양”은 일반적으로 적어도 하나의 항원을 차등적으로 발현하는 적어도 2개의 상이한 유형의 종양 세포를 갖는 종양을 언급한다. 예를 들어, 이종성 종양은 제1 항원을 발현하는 종양 세포의 하나의 유형 및 항원을 발현하지 않는 종양 세포의 제2 유형을 포함할 수 있다. 일부 경우에, 이종성 종양은 제1 항원을 고도로 발현하는 종양 세포의 하나의 유형 및 항원의 낮은 발현을 갖는 종양 세포의 제2 유형을 포함할 수 있다. “낮은 발현”이란 항원이 치료 불가능한 항원을 직접적으로 표적화하는 수준으로 발현되는 것을 의미한다. 본원에 기재된 바와 같은 이종성 종양을 표적화하는 방법은 일반적으로 예를 들어, 항원을 차등적으로 발현하는 2개의 세포 유형을 포함하는 종양의 적어도 2개의 상이한 세포 유형을 치료학적으로 표적화함을 포함한다. 따라서, 이종성 종양을 표적화하는 본원에 기재된 방법은 상기 방법에서 표적화된 세포 유형의 항원을 발현하지 않거나 이의 낮은 발현을 보여주는 종양의 세포 유형에 대해 치료학적 효과를 가능하게 할 수 있다.
이종성 종양을 치료하는 방법에 유용한 차등적으로 발현된 항원은 필수적으로 본원에 기재된 바와 같은 특이적 결합 구성원으로 표적화될 수 있는 임의의 항원을 포함할 수 있고, 이는 예를 들어, 암 세포 항원(예를 들어, 표면 발현된 암 항원, 세포내 암 항원 등), 조직 특이적 항원, 세포 유형 특이적 항원 등을 포함하지만 이에 제한되지 않는다. 일부 경우에, 항원은 세포에 대해 내인성으로 발현된다. 일부 경우에, 항원은 이로부터 발현되는 세포에 이종성일 수 있고, 예를 들어, 발현된 이종성 단백질이 항원으로서 작용하는 경우를 포함한다.
일부 경우에, 이종성 종양을 치료하는 방법은 상기 종양을, 프라이밍 항원에 대해 특이적인 단백질용해 절단가능한 키메라 폴리펩타이드를 발현하도록 가공된 면역 세포와 접촉시킴을 포함할 수 있다. 본원에 사용된 바와 같은 용어 “프라이머 항원”은 일반적으로 이종성 종양에 인접해 있는 키메라 폴리펩타이드를 활성화시키기에 충분한 항원을 언급한다. 일부 경우에, 프라이밍 항원은 예를 들어, 이종성 종양의 일부 세포 상에 존재하지만 이종성 종양의 모든 세포에 존재하지 않는, 이종성 종양의 세포의 서브세트에 존재하는 항원일 수 있다. 일부 경우에, 프라이밍 항원에 의한 키메라 폴리펩타이드의 활성화 시, 키메라 폴리펩타이드의 유리된 세포내 도메인은 제2 항원-특이적 폴리펩타이드의 발현을 포함할 수 있다. 일부 경우에, 제2 항원-특이적 폴리펩타이드의 항원은 본원에서 “치료학적 항원” 또는 “사멸 항원”으로서 언급될 수 있다. 본원에 사용된 바와 같은 용어 “치료학적 항원”은 일반적으로 치료학적 작제물이 지시되는 항원, 예를 들어, 항체, CAR, TCR, 키메라 이중특이적 결합 구성원 등을 포함하지만 이에 제한되지 않는 치료학적 작제물에 의해 직접적으로 표적화된 항원을 언급할 수 있다. 본원에 사용된 바와 같은 용어 “사멸 항원”은 일반적으로 사멸을 위해 세포를 표적화하도록 디자인된 작제물이 지시되는 항원, 예를 들어, 항체, CAR, TCR, 키메라 이중특이적 결합 구성원 등을 포함하지만 이에 제한되지 않는, 면역 세포에 의한 사멸 항원을 발현하는 세포의 사멸을 유도하는 작제물에 의해 표적화된 항원을 언급할 수 있다. 일부 경우에, 제2 항원-특이적 폴리펩타이드는 이종성 종양의 모든 또는 거의 모든 또는 대부분의 세포에 존재하는 치료학적 항원으로 지시될 수 있다.
일부 경우에, 본원에 기재된 방법은 대상체에서 선천성 면역 반응을 유도함을 포함한다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드는 발현되는 경우 대상체에서 선천성 면역 반응을 유도하는 폴리펩타이드의 발현을 유도할 수 있다. 본원의 개시내용의 키메라 폴리펩타이드의 특이적 결합 구성원은 특이적 항원의 결합에 반응하여 키메라 폴리펩타이드를 활성화시키도록 가공될 수 있기 때문에, 일부 경우에, 선천성 면역 반응은 특정 항원의 존재에 응답하여 유도될 수 있다. 키메라 폴리펩타이드는 예를 들어, 암 항원, 세포 유형 특이적 항원, 조직 특이적 항원, 감염성 질환 항원 (예를 들어, 세균 항원, 바이러스 항원, 진균류 항원, 병원성 항원 등) 등을 포함하지만 이에 제한되지 않는 임의의 간편하고 적당한 항원에 의해 활성화되도록 가공될 수 있다. 일부 경우에, 선천성 면역 반응은 예를 들어, 항원, 예를 들어, 종양에 국소적으로 존재하는 항원, 종양 미세환경에 국소적으로 존재하는 항원, 감염된 영역 또는 조직에 국소적으로 존재하는 항원 등의 국소적 존재를 기준으로 국소적으로 활성화될 수 있다
일부 경우에, 본원에 기재된 방법은 대상체에서 하나 이상의 면역 억제 인자의 발현을 조절함을 포함한다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드는 발현되는 경우 대상체에서 면역 억제를 유도하는 폴리펩타이드의 발현을 유도할 수 있다. 본원의 개시내용의 키메라 폴리펩타이드의 특이적 결합 구성원은 특이적 항원의 결합에 반응하여 키메라 폴리펩타이드를 활성화시키도록 가공될 수 있기 때문에, 일부 경우에, 면역억제 반응은 특정 항원의 존재에 응답하여 유도될 수 있다. 키메라 폴리펩타이드는 예를 들어, 자가항원(예를 들어, 자가면역 반응을 유도하는 자가-항원), 세포 유형 특이적 항원, 조직 특이적 항원 등을 포함하지만 이에 제한되지 않는 임의의 간편하고 적당한 항원에 의해 활성화되도록 가공될 수 있다. 일부 경우에, 면역억제는 항원, 예를 들어, 조직에 국소적으로 존재하는 항원, 기관에 국소적으로 존재하는 항원 등의 국소적 존재를 기준으로 국소적으로 활성화될 수 있다. 일부 경우에, 면역억제는 예를 들어 본원 개시내용의 키메라 폴리펩타이드를 활성화시키기 위해 범용적으로 존재하는 항원을 사용함으로써 범용적으로 수행될 수 있다. 일부 경우에, 본원에 기재된 방법에 따라 면역억제를 필요로 하는 대상체는 자가면역 질환을 갖는 대상체일 수 있다.
용이하게 이해되는 바와 같이, 본원에 기재된 것을 치료하는 방법은 일부 경우에 하나 이상의 통상적 치료와 조합될 수 있다. 예를 들어, 암학의 경우에, 본원에 기재된 방법은 일부 경우에 통상적인 암 치료요법과 조합될 수 있고, 이는 일부 경우에 예를 들어, 통상적인 화학치료요법, 통상적인 방사선 치료요법, 통상적인 면역치료요법, 수술 등을 포함하지만 이에 제한되지 않는다. 일부 경우에, 본원에 기재된 방법은 통상적인 치료요법 전 또는 후에 사용될 수 있다. 예를 들어, 본원에 기재된 방법은 예를 들어, 대상체가 통상적인 치료요법으로부터의 개선을 나타낸 후 보조 치료요법으로서 사용될 수 있거나, 대상체가 통상적인 치료요법에 응답하지 않는 경우 사용될 수 있다. 일부 경우에, 본원에 기재된 방법은 예를 들어, 추가의 치료요법, 예를 들어, 본원에 기재된 바와 같은 통상의 치료요법을 위한 대상을 준비하기 위해 추가의 치료요법 전에 사용될 수 있다.
통상적인 암 치료요법은 또한 다음을 포함하지만 이에 제한되지 않는 암을 위한 표적화된 치료요법을 포함한다: 예를 들어, HER2 (ERBB2/neu)를 표적화하는 아도-트라스투주맙 엠탄신 (Kadcyla) (유방암에 사용하기 위해 승인된); EGFR (HER1/ERBB1), HER2 (ERBB2/neu)를 표적화하는 아파티닙 (Gilotrif) (비-소세포 폐암에 사용하기 위해 승인된); 표적화하는 알데슬레우킨 (Proleukin) (신장 세포 암종, 흑색종에 사용하기 위해 승인된); ALK를 표적화하는 알레크티닙 (Alecensa) (비-소세포 폐암에 사용하기 위해 승인된); CD52를 표적화하는 알렘투주맙 (Campath) (B-세포 만성 림프성 백혈병에 사용하기 위해 승인됨); PD-L1을 표적화하는 아테졸리주맙 (Tecentriq) (요로상피 세포암종, 비-소세포 폐암에 사용하기 위해 승인된); PD-L1을 표적화하는 아벨루맙 (Bavencio) (메르켈 세포 암종에 사용하기 위해 승인된); KIT, PDGFRβ, VEGFR1/2/3을 표적화하는 악시티닙 (Inlyta) (신장 세포 암종에 사용하기 위해 승인된); BAFF를 표적화하는 벨리무맙 (Benlysta) (홍반성 루푸스에 사용하기 위해 승인된); HDAC를 표적화하는 벨리노스타트 (Beleodaq) (말초 T-세포 림프종에 사용하기 위해 승인된); VEGF 리간드를 표적화하는 베바시주맙 (Avastin) (자궁경부암, 결장직장암, 난관암, 신경모세포종, 비-소세포 폐암, 난소암, 복막암, 신장 세포 암종에 사용하기 위해 승인된); CD19/CD3을 표적화하는 블리나투모맙 (Blincyto) (급성 림프아구성 백혈병 (전구체 B-세포)에 사용하기 위해 승인된); 프로테아좀을 표적화하는 보르테조밉 (Velcade) (다발성 골수종, 맨틀 세포 림프종에 사용하기 위해 승인된); ABL을 표적화하는 보수티닙 (Bosulif) (만성 골수 백혈병에 사용하기 위해 승인된); CD30을 표적화하는 브렌툭시맙 베도틴 (Adcetris) (호지킨 림프종, 역형성 대세포 림프종에 사용하기 위해 승인된); ALK를 표적화하는 브리가티닙 (Alunbrig) (비-소세포 폐암 (ALK+)에 사용하기 위해 승인된); FLT3, KIT, MET, RET, VEGFR2를 표적화하는 카보잔티닙 (Cabometyx, Cometriq) (갑상선 수질암, 신장 세포 암종에 사용하기 위해 승인된); 프로테아좀을 표적화하는 카르필조밉 (Kyprolis) (다발성 골수종에 사용하기 위해 승인된); ALK를 표적화하는 세리티닙 (Zykadia) (비-소세포 폐암에 사용하기 위해 승인된); EGFR (HER1/ERBB1)을 표적화하는 세툭시맙 (Erbitux) (결장직장암, 두경부의 편평상피 세포 암에 사용하기 위해 승인된); MEK를 표적화하는 코비메티닙 (Cotellic) (흑색종에 사용하기 위해 승인된); ALK, MET, ROS1을 표적화하는 크리조티닙 (Xalkori) (비-소세포 폐암에 사용하기 위해 승인된); BRAF를 표적화하는 다브라페닙 (Tafinlar) (흑색종, 비-소세포 폐암에 사용하기 위해 승인된); CD38을 표적화하는 다라투무맙 (Darzalex) (다발성 골수종에 사용하기 위해 승인된); ABL을 표적화하는 다사티닙 (Sprycel) (만성 골수 백혈병, 급성 림프아구성 백혈병에 사용하기 위해 승인된); RANKL을 표적화하는 데노수맙 (Xgeva) (골의 거대 세포 종양에 사용하기 위해 승인된); B4GALNT1 (GD2)을 표적화하는 디누툭시맙 (Unituxin) (소아 신경모세포종에 사용하기 위해 승인된); PD-L1을 표적화하는 두르발루맙 (Imfinzi) (요로상피 암종에 사용하기 위해 승인된); SLAMF7을 표적화하는 엘로투주맙 (Empliciti) (CS1/CD319/CRACC) (다발성 골수종에 사용하기 위해 승인된); IDH2를 표적화하는 에나시데닙 (Idhifa) (급성 골수성 백혈병에 사용하기 위해 승인된); EGFR (HER1/ERBB1)을 표적화하는 에를로티닙 (Tarceva) (비-소세포 폐암, 췌장암에 사용하기 위해 승인된); mTOR을 표적화하는 에베롤리무스 (Afinitor (췌장, 위장관 또는 폐 기원 신경내분비 종양, 신장 세포 암종, 절제 불가능한 뇌실막하 거대 세포 성상세포종, 유방암에 사용하기 위해 승인된); EGFR (HER1/ERBB1)을 표적화하는 게피티닙 (Iressa) (비-소세포 폐암에 사용하기 위해 승인된); CD20을 표적화하는 이브리투모맙 티욱세탄 (Zevalin) (비-호지킨 림프종에 사용하기 위해 승인된); BTK를 표적화하는 이브루티닙 (Imbruvica) (맨틀 세포 림프종, 만성 림프구 백혈병, 발덴스트롬 마크로불린혈증 에 사용하기 위해 승인된); PI3Kδ를 표적화하는 이델라리시브 (Zydelig) (만성 림프구 백혈병, 소포성 B-세포 비-호지킨 림프종, 소 림프구 림프종에 사용하기 위해 승인된); KIT, PDGFR, ABL을 표적화하는 이마티닙 (Gleevec) (GI 기질 종양 (KIT+), 융기성 피부섬유육종, 다중 혈액 종양에 사용하기 위해 승인된); CTLA-4를 표적화하는 이필리무맙 (Yervoy) (흑색종에 사용하기 위해 승인된); 프로테아좀을 표적화하는 익사조밉 (Ninlaro) (다발성 골수종에 사용하기 위해 승인된); HER2 (ERBB2/neu), EGFR (HER1/ERBB1)을 표적화하는 라파티닙 (Tykerb) (유방암 (HER2+)에 사용하기 위해 승인된); VEGFR2를 표적화하는 렌바티닙 (Lenvima) (신장 세포 암종, 갑상선암에 사용하기 위해 승인된); FLT3을 표적화하는 미도스타우린 (Rydapt) (급성 골수성 백혈병 (FLT3+)에 사용하기 위해 승인된); EGFR (HER1/ERBB1)을 표적화하는 넥시투무맙 (Portrazza) (편평상피 비-소세포 폐암에 사용하기 위해 승인된); HER2 (ERBB2/neu)를 표적화하는 네라티닙 (Nerlynx) (유방암에 사용하기 위해 승인된); ABL을 표적화하는 닐로티닙 (Tasigna) (만성 골수 백혈병에 사용하기 위해 승인된); PARP를 표적화하는 니라파립 (Zejula) (난소암, 난관암, 복막암에 사용하기 위해 승인된); PD-1을 표적화는 니볼루맙 (Opdivo) (결장직장암, 두경부 편평상피 세포 암종, 호지킨 림프종, 흑색종 비-소세포 폐암, 신장 세포 암종, 요로상피 암종에 사용하기 위해 승인된); CD20을 표적화하는 오비누투주맙 (Gazyva) (만성 림프구 백혈병, 소포성 림프종에 사용하기 위해 승인된); CD20을 표적화하는 오파투무맙 (Arzerra, HuMax-CD20) (만성 림프구 백혈병에 사용하기 위해 승인된); PARP를 표적화하는 올라파립 (Lynparza) (난소암에 사용하기 위해 승인된); PDGFRα를 표적화하는 올라라투맙 (Lartruvo) (연조직 육종에 사용하기 위해 승인된); EGFR을 표적화하는 오시메르티닙 (Tagrisso) (비-소세포 폐암에 사용하기 위해 승인된); CDK4, CDK6을 표적화하는 팔보시클립 (Ibrance) (유방암에 사용하기 위해 승인된); EGFR (HER1/ERBB1)을 표적화하는 파니투무맙 (Vectibix) (결장직장암에 사용하기 위해 승인된); HDAC를 표적화하는 파노비노스타트 (Farydak) (다발성 골수종에 사용하기 위해 승인된); VEGFR, PDGFR, KIT를 표적화하는 파조파닙 (Votrient) (신장 세포 암종에 사용하기 위해 승인된); PD-1을 표적화하는 펨브롤리주맙 (Keytruda) (고전적인 호지킨 림프종, 흑색종, 비-소세포 폐암 (PD-L1+), 두경부 편평상피 세포 암종, 고형 종양 (MSI-H)에 사용하기 위해 승인된); HER2 (ERBB2/neu)를 표적화하는 페르투주맙 (Perjeta) (유방암 (HER2+)에 사용하기 위해 승인된); ABL, FGFR1-3, FLT3, VEGFR2를 표적화하는 포나티닙 (Iclusig) (만성 골수 백혈병, 급성 림프아구성 백혈병에 사용하기 위해 승인된); VEGFR2를 표적화하는 라무시루맙 (Cyramza) (결장직장암, 위암 또는 위식도 역류 (GEJ) 선암종, 비-소세포 폐암에 사용하기 위해 승인된); KIT, PDGFRβ, RAF, RET, VEGFR1/2/3을 표적화하는 레고라페닙 (Stivarga) (결장직장암, 위장관 기질 종양, 간세포 암종에 사용하기 위해 승인된); CDK4, CDK6을 표적화하는 리보시클립 (Kisqali) (유방암 (HR+, HER2-)에 사용하기 위해 승인된); CD20을 표적화하는 리툭시맙 (Rituxan, Mabthera) (비-호지킨 림프종, 만성 림프구 백혈병, 류마티스 관절염, 다발혈관염 이있는 육아종증에 사용하기 위해 승인된); CD20을 표적화하는 리툭시맙/히알루로니다제 인간 (만성 림프구 백혈병, 확산성 대형 B-세포 림프종, 소포성 림프종에 사용하기 위해 승인된); HDAC를 표적화하는 리미뎁신 (Istodax) (피부 T-세포 림프종, 말초 T-세포 림프종에 사용하기 위해 승인된); PARP를 표적화하는 루카파립 (Rubraca) (난소암에 사용하기 위해 승인된); JAK1/2를 표적화하는 룩솔리티닙 (Jakafi) (골수섬유증에 사용하기 위해 승인된); IL-6을 표적화하는 실툭시맙 (Sylvant) (다중심 캐슬만씨병에 사용하기 위해 승인된); 표적화하는 시푸류셀-T (Provenge) (전립선암에 사용하기 위해 승인된); 평활화를 표적화하는 소니데깁 (Odomzo) (기저 세포암에 사용하기 위해 승인된); VEGFR, PDGFR, KIT, RAF를 표적화하는 소라페닙 (Nexavar) (간세포 암종, 신장 세포 암종, 갑상선 암종에 사용하기 위해 승인된); mTOR을 표적화하는 템시롤리무스 (Torisel) (신장 세포 암종에 사용하기 위해 승인된); CD20을 표적화하는 토시투모맙 (Bexxar) (비-호지킨 림프종에 사용하기 위해 승인된); MEK를 표적화하는 트라메티닙 (Mekinist) (흑색종, 비-소세포 폐암에 사용하기 위해 승인된); HER2 (ERBB2/neu)를 표적화하는 트라스투주맙 (Herceptin) (유방암 (HER2+), 위암 (HER2+)에 사용하기 위해 승인된); EGFR (HER1/ERBB1), RET, VEGFR2를 표적화하는 반데타닙 (Caprelsa) (갑상선 수질암에 사용하기 위해 승인된); BRAF를 표적화하는 베무라페닙 (Zelboraf) (흑색종에 사용하기 위해 승인된); BCL2를 표적화하는 베네토클락 (Venclexta) (만성 림프구 백혈병에 사용하기 위해 승인된); 평활화된 PTCH를 표적화한 비스모데깁 (Erivedge) (기저 세포암에 사용하기 위해 승인된); HDAC를 표적화하는 보리노스타트 (Zolinza) (피부 T-세포 림프종에 사용하기 위해 승인된); PIGF, VEGFA/B를 표적화하는 지브-아플리베르셉트 (Zaltrap) (결장직장암에 사용하기 위해 승인된); 등.
일부 경우에, 예를 들어, 본원에 기재된 방법이 대상체를 치료하기 위해 사용되는 유일한 방법인 경우를 포함하는 본원의 개시내용의 방법은, 임의의 추가의 통상적인 치료요법 없이 사용될 수 있다. 예를 들어, 암학의 경우에, 본원에 기재된 방법은 일부 경우에 암에 대해 대상체를 치료하기 위해 사용되는 유일한 방법일 수 있다.
키메라 폴리펩타이드
본원의 개시내용은 단백질용해 절단가능한 키메라 폴리펩타이드를 제공한다. 본원의 개시내용의 키메라 폴리펩타이드는 일반적으로 다음을 포함할 수 있다: a) 특이적 결합 구성원을 포함하는 세포외 도메인; b) 하나 이상의 단백질용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및 c) 세포내 도메인.이의 결합 파트너에 의한 특이적 결합 구성원의 결합은 일반적으로 하나 이상의 단백질용해 절단 부위에서 단백질용해 절단가능한 노치 수용체의 절단을 유도하여, 세포내 도메인을 방출한다. 세포내 도메인의 방출은 세포의 활성을 조절할 수 있거나 일반적으로 세포내 함유되거나, 세포 표면 상에 발현되거나 분비되는 페이로드의 생성을 유발할 수 있다. 본원의 개시내용의 키메라 폴리펩타이드는 일반적으로 노치 수용체 폴리펩타이드에 이종성인 (즉, 노치 수용체로부터 유래되지 않은) 적어도 하나의 서열을 포함하고, 예를 들어, 이는 세포외 도메인이 노치 수용체 폴리펩타이드에 이종성인 경우, 상기 세포내 도메인이 노치 수용체 폴리펩타이드에 이종성인 경우, 세포외 도메인 및 세포내 도메인 둘 다가 노치 수용체 폴리펩타이드에 이종성인 경우 등을 포함한다.
도메인, 예를 들어, 세포외 도메인, 노치 수용체 폴리펩타이드 조절 도메인, 세포내 도메인 등은 직접적으로, 즉, 어떠한 중재 아미노산 잔기없이 연결될 수 있거나 2개의 도메인을 연결하는 펩타이드 링커를 포함할 수 있다. 펩타이드 링커는 합성일 수 있거나 천연적으로 유래될 수 있고, 이는 예를 들어, 천연적으로 존재하는 폴리펩타이드의 단편을 포함한다.
펩타이드 링커는 약 3개 아미노산(aa) 이하 내지 약 200개 aa 이상의 길이로 다양할 수 있고, 이는 예를 들어, 3개 aa 내지 10개 aa, 5개 aa 내지 15개 aa, 10개 aa 내지 25개 aa, 25개 aa 내지 50개 aa, 50개 aa 내지 75개 aa, 75개 aa 내지 100개 aa, 100개 aa 내지 125개 aa, 125개 aa 내지 150개 aa, 150개 aa 내지 175개 aa, 또는 175개 aa 내지 200개 aa를 포함하지만 이에 제한되지 않는다. 펩타이드 링커는 3개 aa 내지 30개 aa, 예를 들어, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 또는 30개 aa의 길이를 가질 수 있다. 펩타이드 링커는 5개 aa 내지 50개 aa, 예를 들어, 5개 aa 내지 40개 aa, 5개 aa 내지 35개 aa, 5개 aa 내지 30개 aa, 5개 aa 내지 25개 aa, 5개 aa 내지 20개 aa, 5개 aa 내지 15개 aa 또는 5개 aa 내지 10개 aa의 길이를 가질 수 있다.
세포외 도메인
본원의 개시내용의 단백질용해 절단가능한 키메라 폴리펩타이드는 일반적으로 특이적 결합 파트너에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인을 포함한다. 특이적 결합 구성원의 이의 특이적 결합 파트너의 결합은 노치 수용체 폴리펩타이드의 단백질용해 절단을 유발하여 키메라 폴리펩타이드를 발현하는 세포의 활성을 조절하는 세포내 도메인을 방출시킨다.
세포외 도메인의 특이적 결합 구성원은 일반적으로 키메라 폴리펩타이드의 특이성을 결정한다. 일부 경우에, 이의 특이적 결합 구성원을 기준으로 결정된 바와 같은 특이성에 따라 키메라 폴리펩타이드가 언급될 수 있다. 예를 들어, 결합 파트너 “X”를 갖는 특이적 결합 구성원은 X 키메라 폴리펩타이드 또는 항-X 키메라 폴리펩타이드로서 언급될 수 있다.
임의의 간편한 특이적 결합 쌍, 즉, 특이적 결합 구성원 및 특이적 결합 파트너 쌍은 본원의 개시내용의 키메라 폴리펩타이드에 유용할 수 있고, 예를 들어, 항원-항체 쌍, 리간드 수용체 쌍, 스캐폴드 단백질 쌍 등을 포함하지만 이에 제한되지 않는다. 일부 경우에, 특이적 결합 구성원은 항체일 수 있고 이의 결합 파트너는 항체가 특이적으로 결합하는 항원일 수 있다. 일부 경우에, 특이적 결합 구성원은 수용체일 수 있고 이의 결합 파트너는 수용체가 특이적으로 결합하는 리간드일 수 있다. 일부 경우에, 특이적 결합 구성원은 스캐폴드 단백질일 수 있고 이의 결합 파트너는 상기 스캐폴드 단백질이 특이적으로 결합하는 단백질일 수 있다.
일부 경우에, 키메라 폴리펩타이드의 특이적 결합 구성원은 항체이다. 항체는 임의의 항원-결합 항체-기반 폴리펩타이드일 수 있고, 이의 다양한 폴리펩타이드는 당업계에 공지되어 있다. 일부 경우에, 특이적 결합 구성원은 모노클로날 항체, 단일쇄 Fv (scFv), Fab 등이거나 이를 포함한다. 다른 항체 기반 인지 도메인(cAb VHH (낙타과 항체 가변 도메인) 및 인간화된 버젼, IgNAR VH (상어 항체 가변 도메인) 및 인간화된 버젼, sdAb VH (단일 도메인 항체 가변 도메인) 및 “낙타화된” 항체 가변 도메인이 사용을 위해 적합하다. 일부 경우에, T-세포 수용체(TCR) 기반 인지 도메인, 예를 들어, 단일쇄 TCR (scTv, VαVβ를 포함하는 단일쇄 2개-도메인 TCR)은 또한 사용을 위해 적합하다.
본원의 개시내용의 키메라 폴리펩타이드의 특이적 결합 구성원이 항체-기반 결합 구성원인 경우, 키메라 폴리펩타이드는 예를 들어, 항체-기반 결합 구성원에 의해 특이적으로 결합된 항원을 포함하는, 항체-기반 결합 구성원에 대한 결합 파트너의 존재하에 활성화될 수 있다. 일부 경우에, 항체-기반 결합 구성원은 예를 들어, 항체-기반 결합 구성원이 “항-” 항원 항체, 예를 들어, 항-CD19 항체로서 기재되는 경우를 포함하는, 항체-기반 결합 구성원에 의해 결합된 항원을 기준으로 관련 기술 분야에서 통상적으로 수행되는 바와 같이 한정될 수 있다. 따라서, 본원의 개시내용의 키메라 폴리펩타이드에 포함시키기 위해 적합한 항체-기반 결합 구성원은 다양한 항원-결합 특이성을 가질 수 있다.
일부 경우에, 항원-결합 도메인은 암 항원, 즉, 신생물 또는 암 세포에 의해 발현되는 (이에 의해 합성되는) 항원, 즉, 암 세포 연합된 항원 또는 암 (또는 종양) 특이적 항원에 특이적이다.
암 세포 관련 항원은 예를 들어, 유방암 세포, B 세포 림프종, 췌장암, 호지킨 림프종 세포, 난소암 세포, 전립선 암 세포, 중피종, 폐암 세포(예를 들어, 소세포 폐암 세포), 비-호지킨 B-세포 림프종(B-NHL) 세포, 난소암 세포, 전립선 암 세포, 중피종 세포, 폐암 세포(예를 들어, 소세포 폐암 세포), 흑색종 세포, 만성 림프구 백혈병 세포, 급성 림프구 백혈병 세포, 신경모세포종 세포, 신경교종, 신경모세포종, 수모세포종, 결장직장 암 세포 등과 관련된 항원일 수 있다. 암 세포 관련 항원은 또한 비-암성 세포에 의해 발현될 수 있다.
암 세포 특이적 항원은 암에 특이적인 항원 및/또는 특정 유형의 암 또는 예를 들어, 유방암 세포, B 세포 림프종, 췌장암, 호지킨 림프종 세포, 난소암 세포, 전립선 암 세포, 중피종, 폐암 세포(예를 들어, 소세포 폐암 세포), 비-호지킨 B-세포 림프종(B-NHL) 세포, 난소암 세포, 전립선 암 세포, 중피종 세포, 폐암 세포(예를 들어, 소세포 폐암 세포), 흑색종 세포, 만성 림프구 백혈병 세포, 급성 림프구 백혈병 세포, 신경모세포종 세포, 신경교종, 신경모세포종, 수모세포종, 결장직장 암 세포 등을 포함하는 암 세포에 특이적인 항원일 수 있다. 암 (또는 종양) 특이적 항원은 일반적으로 비-암성 세포(또는 비-종양 세포)에 의해 발현되지 않는다. 일부 경우에, 암 (또는 종양) 특이적 항원은 하나 이상의 비-암성 세포 유형 (또는 비-종양 세포 유형)에 의해 최소로 발현될 수 있다. “최소로 발현되는”이란 세포당 발현 수준 또는 최소로, 비유의적으로 또는 비검출가능하게 발현하는 세포의 수의 측면에서 발현 수준이 상기 항원을 발현하는 비-암성 세포로의 특이적 결합 구성원의 결합을 유도함을 의미한다.
일부 경우에, 키메라 폴리펩타이드의 특이적 결합 구성원은 주요 조직적합성 복합체 (MHC) 분자와 결합된 단백질의 단편 (예를 들어, 펩타이드)을 포함하는 표적에 특이적으로 결합할 수 있다. MHC 분자가 세포내 발현되고 세포외 발현되는 단백질 둘 다의 펩타이드 단편을 제공하기 때문에, MHC-펩타이드 복합체에 지시된 특이적 결합 구성원은 세포외 발현된 항원뿐만 아니라 세포내 항원의 표적화를 가능하게 한다.
세포내 발현된 표적 단백질 (예를 들어, 세포질적으로 발현된 (즉, 세포질 단백질), 핵적으로 발현되는 (즉, 핵 단백질) 등)은 세포내 항원 (예를 들어, 세포질 항원, 핵 항원 등)으로서 언급될 수 있다. 따라서, 본원의 개시내용의 특이적 결합 구성원은 또한 일부 경우에 인간 백혈구 항원 (HLA)-펩타이드 복합체로서 기재된, MHC와 복합체화된, 예를 들어, 펩타이드-MHC 복합체의 세포내 항원 단편에 특이적일 수 있다.
모든 내인성 세포성 단백질(숙주 또는 병원체)은 HLA 분자와 연합된 세포 표면에 디스플레이하기 위해 짧은 펩타이드로 가공된다. 세포 표면 상에 디스플레이된 펩타이드-HLA 부류 I 복합체는 T-세포 매개 면역 반응에서 중요한 역할을 수행한다. 대략적으로 9-잔기 길이의 펩타이드는 세포 내부에서 프로테아좀에 의해 분해된 단백질로부터 기원한다. T-세포 수용체가 자가로서 비-자가로서 펩타이드를 인지하는지에 의존하여, 면역 반응이 개시될 수 있다. 암 세포의 표면 상에 특이적으로 디스플레이된 펩타이드-HLA 복합체는 가공된 T-세포 또는 “TCR-유사” 항체를 포함하는, 표적화된 암 치료제를 개발하기 위해 우수한 기회를 제공한다. 예를 들어, MHC 기반 사량체 기술을 포함하는 다양한 기술의 도래는 TCR-유사 항-HLA/펩타이드 특이적 항체를 개발할 능력을 향상시켰다.
일부 경우에, 본원의 키메라 폴리펩타이드의 특이적 결합 구성원의 결합 파트너는 펩타이드-MHC 또는 HLA/펩타이드 복합체를 포함할 수 있다. 일부 경우에, 본원의 키메라 폴리펩타이드의 특이적 결합 구성원은 예를 들어, HLA-A/펩타이드 복합체, HLA-B/펩타이드 복합체 또는 HLA-C/펩타이드 복합체를 포함하는 MHC 부류 I MHC-펩타이드 복합체에 특이적이다. 일부 경우에, 본원의 키메라 폴리펩타이드의 특이적 결합 구성원은 예를 들어, HLA-DPA1/펩타이드 복합체, HLA-DPB1/펩타이드 복합체, HLA-DQA1/펩타이드 복합체, HLA-DQB1/펩타이드 복합체, HLA-DRA/펩타이드 복합체 또는 HLA-DRB1/펩타이드 복합체를 포함하는 MHC 부류 II MHC-펩타이드 복합체에 특이적이다. 일부 경우에, 본원의 키메라 폴리펩타이드의 특이적 결합 구성원은 MHC 부류 III MHC-펩타이드 복합체에 특이적이다.
펩타이드-MHC 결합 파트너는 일반적으로 MHC와 관련하여 제공되는 표적 단백질 단편 펩타이드를 포함한다. 상기 펩타이드는 예를 들어, 이들이 결합된 MHC 분자의 부류를 포함하는 다수의 인자들에 의존하여 크기가 다양하다. 예를 들어, 부류 I MHC 관련된 펩타이드는 일반적으로 9개 aa 길이이지만 크기가 다양할 수 있고 이는 약 9개 aa 미만 또는 약 9개 aa 초과를 포함하고 예를 들어, 8개 aa 또는 10개 aa를 포함하지만 이에 제한되지 않는다. 반면, 부류 II MHC 관련된 펩타이드는 또한 약 13개 aa 내지 약 25개 aa의 크기로 다양할 수 있고, 이는 예를 들어, 13개 aa, 14개 aa, 15개 aa, 16개 aa, 17개 aa, 18개 aa, 19개 aa, 20개 aa, 21개 aa, 22개 aa, 23개 aa, 24개 aa 또는 25개 aa를 포함하지만 이에 제한되지 않는다.
펩타이드-MHC 복합체를 표적화하는 특이적 결합 구성원이 지시될 수 있는 예시적 단백질 표적, 및 각각의 단백질 표적에 대해 MHC와 관련된 예시적 펩타이드는 하기 표 1에 제공된다.
일부 경우에, 본원의 개시내용의 단백질용해 절단가능한 키메라 폴리펩타이드의 특이적 결합 구성원은 표 1의 세포내 암 항원 펩타이드를 갖는 펩타이드-MHC에 특이적으로 결합한다. 일부 경우에, 본원의 개시내용의 단백질용해 절단가능한 키메라 폴리펩타이드의 특이적 결합 구성원은 WT1 펩타이드-MHC에 특이적으로 결합한다. 일부 경우에, 본원의 개시내용의 단백질용해 절단가능한 키메라 폴리펩타이드의 특이적 결합 구성원은 NY-ESO-1 펩타이드-MHC에 특이적으로 결합한다.
일부 경우에, 본원의 개시내용의 단백질용해 절단가능한 키메라 폴리펩타이드의 특이적 결합 구성원은 표 1의 세포내 암 항원 펩타이드를 갖는 펩타이드-MHC에 특이적으로 결합하는 항체 (예를 들어, scFv)이다. 일부 경우에, 본원의 개시내용의 단백질용해 절단가능한 키메라 폴리펩타이드의 특이적 결합 구성원은 WT1 펩타이드-MHC에 특이적으로 결합하는 항체 (예를 들어, scFv)이다.
일부 경우에서, WT1 펩타이드-MHC에 특이적으로 결합하는 항체는 하기의 중쇄 (VH) CDR 서열 중 하나 이상 또는 전부를 포함한다: SYAMS (서열번호: 61), QIDPWGQETLYADSVKG (서열번호: 62) 및 LTGRFDY (서열번호: 63).
일부 경우에서, WT1 펩타이드-MHC에 특이적으로 결합하는 항체는 하기의 경쇄 (VL) CDR 서열 중 하나 이상 또는 전부를 포함한다: RASQSISSYLN (서열번호: 64), SASQLQS (서열번호: 65) 및 QQGPGTPNT (서열번호: 66).
일부 경우에서, WT1 펩타이드-MHC에 특이적으로 결합하는 항체는 하기의 아미노산 서열을 갖는 scFv이다:
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSQIDPWGQETLYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKLTGRFDYWGQGTLVTVSSGGGGSGGGGSGGGGSTDIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYSASQLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGPGTPNTFGQGTKVEIKRA (서열번호: 67).
일부 경우에, 본원의 개시내용의 단백질용해 절단가능한 키메라 폴리펩타이드의 특이적 결합 구성원은 NY-ESO-1 펩타이드-MHC에 특이적으로 결합하는 항체 (예를 들어, scFv)이다.
일부 경우에, 본원의 개시내용의 단백질용해 절단가능한 키메라 폴리펩타이드의 특이적 결합 구성원은 KRAS-G12V 펩타이드-MHC에 특이적으로 결합하는 항체 (예를 들어, scFv) (예를 들어, 항-HLA-A2/KRAS-G12V scFv)이다.
일부 경우에서, KRAS-G12V 펩타이드-MHC에 특이적으로 결합하는 항체는 하기의 아미노산 서열을 갖는 scFv이다:
DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQYYYYPPTFGQGTKVEIKRTGGGSGGGGSGGGASEVQLVESGGGLVQPGGSLRLSCAASGFNINGSYIHWVRQAPGKGLEWVAYIDPETGYSRYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRDSASDAMD VWGQGTLVTVSS (서열번호: 68).
일부 경우에, 본원의 개시내용의 단백질용해 절단가능한 키메라 폴리펩타이드의 특이적 결합 구성원은 KRAS-G12V/C 펩타이드-MHC에 특이적으로 결합하는 항체 (예를 들어, scFv) (예를 들어, 항-HLA-A2/KRAS-G12V/C scFv)이다.
일부 경우에서, KRAS-G12V/C 펩타이드-MHC에 특이적으로 결합하는 항체는 하기의 아미노산 서열을 갖는 scFv이다:
DIQMTQSPSSLSASVGDRVTIACRASQDVNTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQYYYYPPTFGQGTKVEIKRTGGGSGGGGSGGGASEVQLVESGGGLVQPGGSLRLSCAASGFHINGSYIHWVRQAPGKGLKWVAYIDPETGYSRYADSVKGRFAISADMSKNTAYLQMNSLRAEDTAVYYCSRDSASDAM DVWGQGTLVTVSS (서열번호: 69).
일부 경우에, 본원의 개시내용의 단백질용해 절단가능한 키메라 폴리펩타이드의 특이적 결합 구성원은 EGFR-L858R 펩타이드-MHC에 특이적으로 결합하는 항체(예를 들어, scFv) (예를 들어, 항-HLA-A3/EGFR-L858R/C scFv)이다.
일부 경우에서, EGFR-L858R 펩타이드-MHC에 특이적으로 결합하는 항체는 하기의 아미노산 서열을 갖는 scFv이다:
DIQMTQSPSSLSASVGDRVTITCRASQDVNTAVAWYQQKPGKAPKLLIYSASFLYSGVPSRFSGSRSGTDFTLTISSLQPEDFATYYCQQYYSYPPTFGQGTKVEIKRTGGGSGGGGSGGGASEVQLVESGGGLVQPGGSLRLSCAASGFNITSSYIHWVRQAPGKGLEWVAYISPEDGYARHADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCSRDDTYYYSA MDVWGQGTLVTVSS (서열번호: 70).
일부 경우에, 본원의 개시내용의 단백질용해 절단가능한 키메라 폴리펩타이드의 특이적 결합 구성원 (예를 들어, 항체, scFv 등)은 전문이 본원에 참조로 인용되는 문헌(참조: Dhanik 외 BMC Bioinformatics (2016) 17:286)에 기재된 펩타이드-MHC에 특이적으로 결합하고, 이는 다음을 포함하지만 이에 제한되지 않는다: 예를 들어, NLRP4 펩타이드 (예를 들어, HLSPIDCEV (서열번호: 71))-MHC 복합체, UMODL1 펩타이드 (예를 들어, LTSMWSPAV (서열번호: 72))-MHC 복합체, NLRP4 펩타이드 (예를 들어, HLDHPHPAV (서열번호: 73))-MHC 복합체, MAGEC2 펩타이드 (예를 들어, SLSVMSSNV (서열번호: 74))-MHC 복합체, NLRP4 펩타이드 (예를 들어, MMAWSDNKI (서열번호: 75))-MHC 복합체, COX7B2 펩타이드 (예를 들어, TQIGIEWNL (서열번호: 76))-MHC 복합체, NLRP4 펩타이드 (예를 들어, CLFEMQDPA (서열번호: 77))-MHC 복합체, UMODL1 펩타이드 (예를 들어, YLSHPSCNV (서열번호: 78))-MHC 복합체, COX7B2 펩타이드 (예를 들어, GIEWNLSPV (서열번호: 79))-MHC 복합체, MAGEA11 펩타이드 (예를 들어, GLGCSPASI (서열번호: 80))-MHC 복합체, RPE65 펩타이드 (예를 들어, RQAFEFPQI (서열번호: 81))-MHC 복합체, NLRP4 펩타이드 (예를 들어, GMWTDTFEF (서열번호: 82))-MHC 복합체, TRIM51 펩타이드 (예를 들어, YLNWQDTAV (서열번호: 83))-MHC 복합체, MAGEA11 펩타이드 (예를 들어, VLWGPITQI (서열번호: 84))-MHC 복합체, NLRP4 펩타이드 (예를 들어, TLDHTGVVV (서열번호: 85))-MHC 복합체, RPE65 펩타이드 (예를 들어, TMGVWLHIA (서열번호: 86))-MHC 복합체, MAGEC2 펩타이드 (예를 들어, KVWVQGHYL (서열번호: 87))-MHC 복합체, UMODL1 펩타이드 (예를 들어, KINCNNFRL (서열번호: 88))-MHC 복합체 등
임의의 적합한 항-펩타이드-MHC 특이적 결합 구성원(예를 들어, 항-펩타이드-MHC 항체)은 본원에 기재된 바와 같은 본원의 키메라 폴리펩타이드의 세포외 도메인의 특이적 결합 구성원으로서 유용할 수 있고, 예를 들어, 이는 예를 들어, 하기에 기재된 이들 적합한 에피토프에 대한 항체뿐만 아니라 이들 적합한 항-펩타이드-MHC 결합 구성원 및 항체를 포함하지만 이에 제한되지 않는다: 미국특허 번호:6,042,831; 6,252,052; 6,291,430; 6,602,510; 7,157,091; 7,622,569; 7,632,923; 7,638,124; 7,718,777; 8,119,139; 8,647,629; 8,815,528; 8,961,985; 9,023,348; 9,040,669; 9,074,000; 9,095,533; 9,334,317; 미국특허 출원 공개번호:20070092530; 20090042285; 20090226474; 20090304679; 20100062001; 20100111957; 20100158927; 20100158931; 20110020357; 20110033473; 20110293623; 20110318369; 20120141517; 20120294874; 20130101594; 20140024809; 20140065708; 20140271644; 20140294841; 20140296492; 20140363440; 20150125477; 20150125478; 20150259436; 20150320848; 20150322154; 20150368298; 20160017031; 20160168200; PCT 공개번호:WO2002014870; WO2003068201; WO2005120166; WO2007030451; WO2007143104; WO2008120202; WO2008120203; WO2009108372; WO2009125394; WO2009125395; WO2009138236; WO2010037514; WO2010106431; WO2011062560; WO2012007950; WO2012007951; WO2012017003; WO2012109659; WO2012135854; WO2014011489; WO2014143835; WO2015018805; WO2015063302; WO2015070061; WO2015070078; WO2015090229; WO2015130766; WO2015142675; WO2015169945; WO2015193359; WO2015199617; WO2016102272; 등, 이들은 전문이 본원에 참조로 인용된다.
일부 경우에, 항-펩타이드-MHC 특이적 결합 구성원 (예를 들어, 항-펩타이드-MHC 항체)은 본원에 기재된 바와 같은 본원의 키메라 폴리펩타이드의 세포외 도메인의 특이적 결합 구성원으로서 유용할 수 있고, 예를 들어, 이는 예를 들어, 하기 문헌에 기재된 저들 적합한 에피토프에 대한 항체뿐만 아니라 이들 적합한 항-펩타이드-MHC 결합 구성원 및 항체를 포함할 수 있지만 이에 제한되지 않는다: T Cells Expressing Cars Directed Against HLA-0201 eRmf WT-1 Peptide Complex Can Effectively Eradicate WT1+ A0201+ Tumor Cells in-Vitro. (2014) Biol Blood Marrow Transplant; A novel TCR-like CAR with specificity for PR1/HLA-A2 effectively targets myeloid leukemia in vitro when expressed in human adult peripheral blood 및 cord blood T cells. (2016) Cytotherapy; Functional Comparison of Engineered T Cells Carrying a Native TCR versus TCR-like AntibodyBased Chimeric Antigen Receptors Indicates Affinity/Avidity Thresholds. (2014) Journal of Immunology; Affinity maturation of T-cell receptor-like antibodies for Wilms tumor 1 peptide greatly enhances therapeutic potential. (2015) Leukemia; Construction 및 molecular characterization of a T-cell receptor-like antibody 및 CAR-T cells specific for minor histocompatibility antigen HA-1H. (2014) Gene Therapy; Targeting the Intracellular WT1 Oncogene Product with a Therapeutic Human Antibody. (2013) Science Translational Medicine; A phage display selected Fab fragment with MHC class I-restricted specificity for MAGE-A1 allows for retargeting of primary human T lymphocytes. (2001) Gene Therapy; Therapeutic bispecific T-cell engager antibody targeting the intracellular oncoprotein WT1. (2015) Nature Biotechnology; Generation of MANAbodies specific to HLA-restricted epitopes encoded by somatically mutated genes. (2015) PNAS; Antitumor Activity of a Monoclonal Antibody targeting Major Histocompatibility complex class i-Her2 Peptide complexes. (2013) Journal of the National Cancer Institute; Anti-melanoma activity of T cells redirected with a TCR-like chimeric antigen receptor. (2014) Scientific Reports 등.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드의 특이적 결합 구성원은 예를 들어, 하기 문헌에 기재된 것들을 포함하지만 이에 제한되지 않는 T-세포 수용체-유사 항-펩타이드-MHC 항체를 포함할 수 있다: Dahan & Reiter.Expert Rev Mol Med. (2012) 14:e6 및/또는 Cohen & Reiter.Antibodies (2013), 2:517-534, 이는 이들의 전문이 본원에 참조로 인용됨, 이들은 예를 들어, 다음을 포함하지만 이에 제한되지 않는다: HLA-A2/gp100-154를 표적화하는 클론 G2D12; HLA-A2/gp100-209를 표적화하는 클론 1A7; HLA-A2/gp100-209를 표적화하는 클론 G1; HLA-A2/gp100-280을 표적화하는 클론 2F1; HLA-A2/티로시나제-369를 표적화하는 클론 TA2 ; HLA-A2/MART-1-26을 표적화하는 클론 CAG10, CLA12; HLA-A1/MAGE-A1을 표적화하는 클론 Fab-G8; HLA-A1/MAGE-A1을 표적화하는 클론 Fab-Hyb3; HLA-A2/MAGE3-271을 표적화하는 클론 7D4 ; HLA-A2/p68 RNA 헬리카제-128을 표적화하는 클론 RL6A; HLA-A2/NYESO-1-157을 표적화하는 클론 3M4E5, 3M4F4; HLA-A2/NYESO-1-157을 표적화하는 클론 T1; HLA-A2/TARP-29를 표적화하는 클론 D2; HLA-A2/hCGβ-47을 표적화하는 클론 RL4B, 1B10; HLA-A2/hCGβ-40을 표적화하는 클론 3F9 ; HLA-A2/Her2-369를 표적화하는 클론 1B8 ; HLA-A2/PR1을 표적화하는 클론 8F4; HLA-A2/WT1-db126을 표적화하는 클론 F2; HLA-A2/MUC-1-D6-13을 표적화하는 클론 M3A1, M3B8; HLA-A2/텔로머라제-540을 표적화하는 클론 4A9, 4G9; HLA-A2/텔로머라제-865를 표적화하는 클론 3G3, 3H2; HLA-A2/TAX-11을 표적화하는 클론 T3A4, T3D4, T3E3, T3F2, T3D3, T2H9; HLA-A2/M1-58을 표적화하는 클론 M1-D1, M1-G8, M1-D12, M1-A2; HLA-A2/ENV-183을 표적화하는 클론; HLA-C7/Nef-105를 표적화하는 클론 C3; HLA-A2/eIF4G-720을 표적화하는 클론 4F7; HLA-A24/Nef-138을 표적화하는 클론 scFv#3, scFv#27; HLA-A2/pp65-495를 표적화하는 클론 H9 등.
본원에 기재된 펩타이드-MHC 결합 파트너에 추가로 또는 이를 대신하여, 본원의 개시내용의 키메라 폴리펩타이드는 일부 경우에 표면 발현된 항원을 표적화할 수 있다. 본원에 사용된 바와 같은 용어 “표면 발현된 항원”은 일반적으로 적어도 부분적으로 세포외로 발현되어 단백질의 적어도 일부가 세포외부에 노출되도록 하고 결합 파트너와의 결합을 위해 가용한 항원성 단백질을 언급한다. 필수적으로 임의의 표면 발현된 단백질은 본원의 개시내용의 키메라 폴리펩타이드의 표적으로 유용할 수 있다. 표면 발현된 항원의 비제한적인 예는 예를 들어, CD19, CD20, CD30, CD38, Her2/neu, ERBB2, CA125, MUC-1, 전립선-특이적 막 항원 (PSMA), CD44 표면 접착 분자, 메소텔린, 카르시노배아 항원 (CEA), 상피 성장 인자 수용체 (EGFR), EGFRvIII, 혈관 내피 성장 인자 수용체-2 (VEGFR2), 고분자량 흑색종 관련 항원(HMW-MAA), IL-13R-a2, GD2 등을 포함하지만 이에 제한되지 않는다. 표적화될 수 있는 표면 발현된 항원은 또한 예를 들어, 본원에 기재된 표적화된 암 치료제의 이들 표적을 포함하는 통상적인 암 치료요법에서 특이적으로 표적화된 것들을 포함하지만 이에 제한되지 않는다.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드의 특이적 결합 구성원은 암-관련 항원을 표적화할 수 있다. 일부 경우에, 본원의 개시내용의 특이적 결합 구성원은 암 관련 항원에 특이적인 항체를 포함할 수 있다. 암 관련 항원의 비제한적인 예는 예를 들어, CD19, CD20, CD38, CD30, Her2/neu, ERBB2, CA125, MUC-1, 전립선-특이적 막 항원 (PSMA), CD44 표면 접착 분자, 메소텔린, 카르시노배아 항원 (CEA), 상피 성장 인자 수용체 (EGFR), EGFRvIII, 혈관 내피 성장 인자 수용체-2 (VEGFR2), 고분자량의 흑색종 관련 항원 (HMW-MAA), MAGE-A1, IL-13R-a2, GD2 등을 포함하지만 이에 제한되지 않는다. 암-관련 항원은 또한 예를 들어, 4-1BB, 5T4, 선암종 항원, 알파-페토단백질, BAFF, B-림프종 세포, C242 항원, CA-125, 카보닉 언하이드라제 9 (CA-IX), C-MET, CCR4, CD152, CD19, CD20, CD200, CD22, CD221, CD23 (IgE 수용체), CD28, CD30 (TNFRSF8), CD33, CD4, CD40, CD44 v6, CD51, CD52, CD56, CD74, CD80, CEA, CNTO888, CTLA-4, DRS, EGFR, EpCAM, CD3, FAP, 피브로넥틴 추가 도메인-B, 폴레이트 수용체 1, GD2, GD3 강글리오사이드, 당단백질 75, GPNMB, HER2/neu, HGF, 인간 산란 인자수용체 키나제, IGF-1 수용체, IGF-I, IgG1, L1-CAM, IL-13, IL-6, 인슐린-유사 성장 인자 I 수용체, 인테그린 α5β1, 인테그린 αvβ3, MORAb-009, MS4A1, MUC1, 뮤신 CanAg, N-글리콜릴뉴라민산, NPC-1C, PDGF-R α, PDL192, 포스파티딜세린, 전립선 암종 세포, RANKL, RON, ROR1, SCH 900105, SDC1, SLAMF7, TAG-72, 테나신 C, TGF 베타 2, TGF-β, TRAIL-R1, TRAIL-R2, 종양 항원 CTAA16.88, VEGF-A, VEGFR-1, VEGFR2, 및 비멘틴을 포함한다.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드의 특이적 결합 구성원은 재생 간 3의 포스파타제 (PRL-3, 또한 PTP4A3으로서 공지된)를 표적화하는 항체, 예를 들어, 하기에 기재된 바와 같은 PRL3-주맙의 전부 또는 일부를 표적화할 수 있거나 포함할 수 있다: Thura 외 (JCI Insight.2016; 1(9): e87607); 이는 전문이 본원에 참조로 인용된다.
일부 경우에, 키메라 폴리펩타이드의 세포외 도메인은 단지 하나의 특이적 결합 구성원을 포함할 수 있다. 일부 경우에, 키메라 폴리펩타이드의 세포외 도메인은 단일-특이적일 수 있다.
일부 경우에, 키메라 폴리펩타이드의 세포외 도메인은 예를 들어, 이중특이적을 포함하는 다중-특이적일 수 있다. 일부 경우에, 키메라 폴리펩타이드의 이중특이적 세포외 도메인은 예를 들어, 이중특이적 항체를 포함하지만 이에 제한되지 않는, 예를 들어, 본원에 기재된 것들을 포함하는 이중특이적 키메라 결합 구성원 또는 이의 일부를 포함할 수 있다. 일부 경우에, 이중특이적 세포외 도메인은 예를 들어, 서로 직접 연결되거나 링커를 통해 연결됨을 포함하는, 연결된 2개의 특이적 결합 도메인을 포함할 수 있다.
일부 경우에, 키메라 폴리펩타이드의 세포외 도메인은 하나 초과의 특이적 결합 구성원을 포함할 수 있고, 이는 2개의 이상의 특이적 결합 구성원을 포함하고, 여기서, 2개 이상의 특이적 결합 구성원은 서로 (직접적으로 또는 간접적으로 예를 들어, 링커의 사용을 통해) 연결될 수 있거나 이들은 각각 키메라 폴리펩타이드의 또 다른 성분에 (직접적으로 또는 간접적으로, 예를 들어, 링커의 사용을 통해) 연결될 수 있다.
다중-특이적 세포외 도메인은 임의의 조합의 결합 파트너를 인지하거나 이에 결합할 수 있고 따라서 예를 들어, 본원에 기재된 이들 결합 파트너 및 표적을 포함하지만 이에 제한되지 않는 임의의 조합의 표적을 표적화할 수 있다. 따라서, 예를 들어, 이중특이적 세포외 도메인은 2개의 상이한 항원을 표적화할 수 있고, 이는 예를 들어, 2개의 상이한 세포내 항원, 2개의 상이한 세포외(예를 들어, 표면 발현된) 항원 또는 세포내 항원 및 세포외 (예를 들어, 표면 발현된) 항원을 포함하지만 이에 제한되지 않는다. 일부 경우에, 이중특이적 세포외 도메인은 2개의 특이적 결합 구성원을 포함할 수 있고, 이는 예를 들어, 본원에 기재된 항원을 포함하는 항원에 각각 결합하는 본원에 기재된 2개의 특이적 결합 구성원을 포함하는 2개의 특이적 결합 구성원을 포함할 수 있다.
다중 특이적 세포외 도메인의 특이적 결합 도메인은 각각 이들이 이의 일부인 키메라 폴리펩타이드를 활성화시킬 수 있다. 이중특이적 세포외 도메인의 특이적 결합 도메인은 각각 이들이 이의 일부인 키메라 폴리펩타이드를 활성화시킬 수 있다. 일부 경우에, 다중 특이적 또는 이중특이적 결합 도메인은 예를 들어, 본원에 기재된 회로의 OR-게이트로서 포함하는 본원에 기재된 바와 같은 분자 회로의 일부로서 유용할 수 있다.
일부 경우에, 특이적 결합 도메인에 의해 결합된 결합 파트너는 야생형 결합 파트너와 비교하여 돌연변이될 수 있다. 일부 경우에, 돌연변이된 결합 파트너를 인지하는 특이적 결합 도메인은 야생형 결합 파트너에 특이적으로 결합할 수 없다. 일부 경우에, 돌연변이된 결합 파트너를 인지하는 특이적 결합 도메인은 돌연변이된 결합 파트너와의 이의 결합 친화성과 비교하여, 보다 낮은 친화성으로 야생형 결합 파트너에 결합할 수 있다.
예를 들어, 본원에 기재된 것들을 포함하는 임의의 결합 파트너는 돌연변이될 수 있거나 돌연변이된 결합 파트너일 수 있다. 따라서, 본원의 개시내용의 키메라 폴리펩타이드는 돌연변이된 (즉, 비-야생형) 결팝 파트너에 특이적으로 결합하는 특이적 결합 구성원을 포함할 수 있다. 돌연변이된 결합 파트너의 비제한적인 예는 예를 들어, 돌연변이된 항원, 돌연변이된 암 항원, 돌연변이된 자가-항원, 돌연변이된 세포외 항원, 돌연변이된 세포외 암 항원, 돌연변이된 세포외 자가-항원, 돌연변이된 표면 항원, 돌연변이된 표면 암 항원, 돌연변이된 표면 자가-항원, 돌연변이된 항원 펩타이드를 제공하는 펩타이드-MHC 복합체, 돌연변이된 암 항원 펩타이드를 제공하는 펩타이드-MHC 복합체, 돌연변이된 자가-항원 펩타이드를 제공하는 펩타이드-MHC 복합체 등을 포함하지만 이에 제한되지 않는다.
암은 통상적으로 질환과 관련된 돌연변이된 단백질을 포함한다. 암에서 통상적으로 돌연변이된 유전자는 예를 들어, ABI1, ABL1, ABL2, ACKR3, ACSL3, ACSL6, AFF1, AFF3, AFF4, AKAP9, AKT1, AKT2, ALDH2, ALK, AMER1, APC, ARHGAP26, ARHGEF12, ARID1A, ARID2, ARNT, ASPSCR1, ASXL1, ATF1, ATIC, ATM, ATP1A1, ATP2B3, ATRX, AXIN1, BAP1, BCL10, BCL11A, BCL11B, BCL2, BCL3, BCL6, BCL7A, BCL9, BCOR, BCR, BIRC3, BLM, BMPR1A, BRAF, BRCA1, BRCA2, BRD3, BRD4, BRIP1, BTG1, BUB1B, C15orf65, C2orf44, CACNA1D, CALR, CAMTA1, CANT1, CARD11, CARS, CASC5, CASP8, CBFA2T3, CBFB, CBL, CBLB, CBLC, CCDC6, CCNB1IP1, CCND1, CCND2, CCND3, CCNE1, CD274, CD74, CD79A, CD79B, CDC73, CDH1, CDH11, CDK12, CDK4, CDK6, CDKN2A, CDKN2C, CDX2, CEBPA, CEP89, CHCHD7, CHEK2, CHIC2, CHN1, CIC, CIITA, CLIP1, CLP1, CLTC, CLTCL1, CNBP, CNOT3, CNTRL, COL1A1, COL2A1, COX6C, CREB1, CREB3L1, CREB3L2, CREBBP, CRLF2, CRTC1, CRTC3, CSF3R, CTNNB1, CUX1, CYLD, DAXX, DCTN1, DDB2, DDIT3, DDX10, DDX5, DDX6, DEK, DICER1, DNM2, DNMT3A, EBF1, ECT2L, EGFR, EIF3E, EIF4A2, ELF4, ELK4, ELL, ELN, EML4, EP300, EPS15, ERBB2, ERC1, ERCC2, ERCC3, ERCC4, ERCC5, ERG, ETV1, ETV4, ETV5, ETV6, EWSR1, EXT1, EXT2, EZH2, EZR, FAM46C, FANCA, FANCC, FANCD2, FANCE, FANCF, FANCG, FAS, FBXO11, FBXW7, FCGR2B, FCRL4, FEV, FGFR1, FGFR1OP, FGFR2, FGFR3, FH, FHIT, FIP1L1, FLCN, FLI1, FLT3, FNBP1, FOXA1, FOXL2, FOXO1, FOXO3, FOXO4, FOXP1, FSTL3, FUBP1, FUS, GAS7, GATA1, GATA2, GATA3, GMPS, GNA11, GNAQ, GNAS, GOLGA5, GOPC, GPC3, GPHN, H3F3A, H3F3B, HERPUD1, HEY1, HIP1, HIST1H4I, HLA-A, HLF, HMGA1, HMGA2, HNF1A, HNRNPA2B1, HOOK3, HOXA11, HOXA13, HOXA9, HOXC11, HOXC13, HOXD11, HOXD13, HRAS, HSP90AA1, HSP90AB1, IDH1, IDH2, IKZF1, IL2, IL21R, IL6ST, IL7R, IRF4, ITK, JAK1, JAK2, JAK3, JAZF1, JUN, KAT6A, KAT6B, KCNJ5, KDM5A, KDM5C, KDM6A, KDR, KDSR, KIAA1549, KIAA1598, KIF5B, KIT, KLF4, KLF6, KLK2, KMT2A, KMT2C, KMT2D, KRAS, KTN1, LASP1, LCK, LCP1, LHFP, LIFR, LMNA, LMO1, LMO2, LPP, LRIG3, LSM14A, LYL1, MAF, MAFB, MALT1, MAML2, MAP2K1, MAP2K2, MAP2K4, MAX, MDM2, MDM4, MECOM, MED12, MEN1, MET, MITF, MKL1, MLF1, MLH1, MLLT1, MLLT10, MLLT11, MLLT3, MLLT4, MLLT6, MN1, MNX1, MPL, MSH2, MSH6, MSI2, MSN, MTCP1, MUC1, MUTYH, MYB, MYC, MYCL, MYCN, MYD88, MYH11, MYH9, MYO5A, NAB2, NACA, NBN, NCKIPSD, NCOA1, NCOA2, NCOA4, NDRG1, NF1, NF2, NFATC2, NFE2L2, NFIB, NFKB2, NIN, NKX2-1, NONO, NOTCH1, NOTCH2, NPM1, NR4A3, NRAS, NRG1, NSD1, NT5C2, NTRK1, NTRK3, NUMA1, NUP214, NUP98, NUTM1, NUTM2A, NUTM2B, OLIG2, OMD, P2RY8, PAFAH1B2, PALB2, PATZ1, PAX3, PAX5, PAX7, PAX8, PBRM1, PBX1, PCM1, PCSK7, PDCD1LG2, PDE4DIP, PDGFB, PDGFRA, PDGFRB, PER1, PHF6, PHOX2B, PICALM, PIK3CA, PIK3R1, PIM1, PLAG1, PLCG1, PML, PMS1, PMS2, POT1, POU2AF1, POU5F1, PPARG, PPFIBP1, PPP2R1A, PRCC, PRDM1, PRDM16, PRF1, PRKAR1A, PRRX1, PSIP1, PTCH1, PTEN, PTPN11, PTPRB, PTPRC, PTPRK, PWWP2A, RABEP1, RAC1, RAD21, RAD51B, RAF1, RALGDS, RANBP17, RAP1GDS1, RARA, RB1, RBM15, RECQL4, REL, RET, RHOH, RMI2, RNF213, RNF43, ROS1, RPL10, RPL22, RPL5, RPN1, RSPO2, RSPO3, RUNX1, RUNX1T1, SBDS, SDC4, SDHAF2, SDHB, SDHC, SDHD, SEPT5, SEPT6, SEPT9, SET, SETBP1, SETD2, SF3B1, SFPQ, SH2B3, SH3GL1, SLC34A2, SLC45A3, SMAD4, SMARCA4, SMARCB1, SMARCE1, SMO, SOCS1, SOX2, SPECC1, SRGAP3, SRSF2, SRSF3, SS18, SS18L1, SSX1, SSX2, SSX2B, SSX4, SSX4B, STAG2, STAT3, STAT5B, STAT6, STIL, STK11, SUFU, SUZ12, SYK, TAF15, TAL1, TAL2, TBL1XR1, TCEA1, TCF12, TCF3, TCF7L2, TCL1A, TERT, TET1, TET2, TFE3, TFEB, TFG, TFPT, TFRC, THRAP3, TLX1, TLX3, TMPRSS2, TNFAIP3, TNFRSF14, TNFRSF17, TOP1, TP53, TPM3, TPM4, TPR, TRAF7, TRIM24, TRIM27, TRIM33, TRIP11, TRRAP, TSC1, TSC2, TSHR, TTL, U2AF1, UBR5, USP6, VHL, VTI1A, WAS, WHSC1, WHSC1L1, WIF1, WRN, WT1, WWTR1, XPA, XPC, XPO1, YWHAE, ZBTB16, ZCCHC8, ZMYM2, ZNF331, ZNF384, ZNF521 및 ZRSR2를 포함한다. 일부 경우에, 특이적 결합 구성원은 예를 들어 상기된 것들을 포함하지만 이에 제한되지 않는, 암에서 통상적으로 돌연변이된 유전자의 돌연변이된 버전에 결합한다. 일부 경우에, 특이적 결합 구성원은 예를 들어 상기된 것들을 포함하지만 이에 제한되지 않는, 암에서 통상적으로 돌연변이된 유전자의 돌연변이된 버전으로부터 유래하는 돌연변이된 암 항원 펩타이드를 제공하는 펩타이드-MHC 복합체에 결합한다. 일부 경우에, 특이적 결합 구성원은 돌연변이체 KRAS 펩타이드를 제공하는 펩타이드-MHC 복합체에 결합한다.
일부 경우에, 결합 파트너/특이적 결합 구성원 쌍은 직교화될 수 있다. 본원에 사용된 바와 같은, “직교화된”이란 이들의 본래의 또는 야생형으로부터 변형되어 상기 직교 쌍이 서로 특이적으로 결합하지만 상기 쌍의 비-변형된 또는 야생형 성분들에 특이적으로 또는 실질적으로 결합하지 않도록 하는 것을 의미한다. 임의의 결합 파트너/특이적 결합 쌍은 직교화될 수 있고, 이는 예를 들어, 본원에 기재된 이들 결합 파트너/특이적 결합 쌍을 포함하지만 이에 제한되지 않는다.
본원에 기재된 키메라 폴리펩타이드 및 방법 및 회로에 사용하기 위해 채택될 수 있는 특정 세포외 도메인 및 이의 성분은 예를 들어, PCT 출원 번호 US2016/019188에 기재된 것들을 포함하지만 이에 제한되지 않는다(공개번호 제 WO 2016/138034호), 이의 개시내용은 이의 전문이 본원에 참조로 인용됨.
노치 수용체 폴리펩타이드
상기된 바와 같이, 본원의 개시내용의 키메라 폴리펩타이드는 노치 수용체 폴리펩타이드를 포함한다. 본원의 키메라 폴리펩타이드의 노치 수용체 폴리펩타이드는 다양하고 약 50개 아미노산 이하 내지 약 1000개 이상의 아미노산 길이의 범위이고 일반적으로 하나 이상의 리간드-유도성 단백질용해 절단 부위를 포함한다. 노치 수용체 폴리펩타이드는 노치 조절 영역 또는 이의 변형된 형태를 함유하는 합성 수용체를 포함한다.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 50개 아미노산 (aa) 내지 1000개 aa, 예를 들어, 50개 aa 내지 75개 aa, 75개 aa 내지 100개 aa, 100개 aa 내지 150개 aa, 150개 aa 내지 200개 aa, 200개 aa 내지 250개 aa, 250개 aa 내지 300개 aa, 300개 aa 내지 350개 aa, 350개 aa 내지 400개 aa, 400개 aa 내지 450개 aa, 450개 aa 내지 500개 aa, 500개 aa 내지 550개 aa, 550개 aa 내지 600개 aa, 600개 aa 내지 650개 aa, 650개 aa 내지 700개 aa, 700개 aa 내지 750개 aa, 750개 aa 내지 800개 aa, 800개 aa 내지 850개 aa, 850개 aa 내지 900개 aa 또는 950개 aa 내지 1000개 aa의 길이를 갖는다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 300개 aa 내지 400개 aa의 길이를 갖는다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 300개 aa 내지 350개 aa의 길이를 갖는다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 300개 aa 내지 325개 aa의 길이를 갖는다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 350개 aa 내지 400개 aa의 길이를 갖는다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 750개 aa 내지 850개 aa의 길이를 갖는다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 50개 aa 내지 75개 aa의 길이를 갖는다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 310개 aa 내지 320개 aa, 예를 들어, 310개 aa, 311개 aa, 312개 aa, 313개 aa, 314개 aa, 315개 aa, 316개 aa, 317개 aa, 318개 aa, 319개 aa, 또는 320개 aa의 길이를 갖는다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 315개 aa의 길이를 갖는다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 360개 aa 내지 370개 aa, 예를 들어, 360개 aa, 361개 aa, 362개 aa, 363개 aa, 364개 aa, 365개 aa, 366개 aa, 367개 aa, 368개 aa, 369개 aa, 또는 370개 aa의 길이를 갖는다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 367개 aa의 길이를 갖는다.
일부 경우에, 노치 수용체 폴리펩타이드는 예를 들어, 하기의 서열번호: 중 하나를 포함하는 노치 수용체의 아미노산 서열과 적어도 50%, 적어도 55%, 적어도 60%, 적어도 65%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열을 포함한다: 1, 2 및 5-15.일부 경우에, 노치 수용체 폴리펩타이드의 노치 조절 영역은 포유동물 노치 조절 영역이고, 이는 예를 들어, 마우스 노치 (예를 들어, 마우스 노치1, 마우스 노치2, 마우스 노치3 또는 마우스 노치4) 조절 영역, 래트 노치 조절 영역 (예를 들어, 래트 노치1, 래트 노치2 또는 래트 노치3), 인간 노치 조절 영역 (예를 들어, 인간 노치1, 인간 노치2, 인간 노치3 또는 인간 노치4) 등 또는 포유동물 노치 조절 영역으로부터 유래되고, 예를 들어, 하기 서열번호: 중 하나를 포함하는 포유동물 노치 수용체 아미노산 서열의 포유동물 노치 조절 영역의 아미노산 서열과 적어도 50%, 적어도 55%, 적어도 60%, 적어도 65%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 노치 조절 영역을 포함하지만 이에 제한되지 않는다: 1, 2 및 5-15.
본원의 노치 조절 영역은 이의 다양한 성분들 (예를 들어, 도메인. 절단 부위 등)을 포함할 수 있거나 배제할 수 있다. 적절하게 전체 또는 부분적으로 존재할 수 있거나 부재일 수 있는 노치 조절 영역의 상기 성분들의 예는 예를 들어, 하나 이상의 EGF-유사 반복 도메인, 하나 이상의 Lin12/노치 반복 도메인, 하나 이상의 헤테로이량체화 도메인 (예를 들어, HD-N 또는 HD-C), 막관통 도메인, 하나 이상의 단백질용해 절단 부위 (예를 들어, 푸린 유사 프로테아제 부위 (예를 들어, S1 부위), ADAM-패밀리 프로테아제 부위 (예를 들어, S2 부위) 및/또는 감마-세크레타제 부위 (예를 들어, S3 부위) 등을 포함한다. 노치 수용체 폴리펩타이드는 일부 경우에 예를 들어, 델타-결합 도메인과 같은 노치-리간드 결합 도메인을 포함하는, 하나 이상의 노치 세포외 도메인 전부 또는 일부를 배제할 수 있다. 노치 수용체 폴리펩타이드는 일부 경우에 예를 들어, 델타-결합 도메인과 같은 노치-리간드 결합 도메인을 포함하는, 하나 이상의 노치 세포외 도메인의 하나 이상의 비기능성 버전을 포함할 수 있다. 노치 수용체 폴리펩타이드는 일부 경우에 하나 이상의 노치 세포내 도메인의 전부 또는 일부를 배제할 수 있고, 이는 예를 들어, 노치 Rbp-관련 분자 도메인(즉, RAM 도메인), 노치 앙키린 반복 도메인, 노치 트랜스활성화 도메인, 노치 PEST 도메인 등을 포함한다. 노치 수용체 폴리펩타이드는 일부 경우에 하나 이상의 노치 세포내 도메인의 하나 이상의 비기능성 버전을 포함하고 이는 예를 들어, 비기능성 노치 Rbp-관련 분자 도메인 (즉, RAM 도메인), 비기능성 노치 앙키린 반복 도메인, 비기능성 노치 트랜스활성화 도메인, 비기능성 노치 PEST 도메인 등을 포함한다.
TM 도메인을 포함하는 노치 수용체 폴리펩타이드
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 하기의 아미노산 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함한다: IPYKIEAVKSEPVEPPLPSQLHLMYVAAAAFVLLFFVGCGVLLSRKRRRQLCIQKL (서열번호: 89); 여기서, 상기 TM 도메인은 밑줄쳐져 있고; 여기서, 상기 노치 수용체 폴리펩타이드는 S2 단백질용해 절단 부위 및 S3 단백질용해 절단 부위를 포함하고; 여기서, 상기 노치 수용체 폴리펩타이드는 50개 아미노산 (aa) 내지 65개 aa, 예를 들어, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 또는 65개 aa의 길이를 갖는다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 하기의 아미노산 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함한다: IPYKIEAVKSEPVEPPLPSQLHLMYVAAAAFVLLFFVGCGVLLSRKRRRQLCIQKL (서열번호: 89); 여기서, 상기 TM 도메인은 밑줄쳐져 있고; 여기서, 상기 노치 수용체 폴리펩타이드는 S2 단백질용해 절단 부위 및 S3 단백질용해 절단 부위를 포함하고; 여기서, 상기 노치 수용체 폴리펩타이드는 56개 아미노산의 길이를 갖는다.
LNR 분절, HD-N 분절, HD-C 분절 및 TM 도메인을 포함하는 노치 수용체 폴리펩타이드
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 다음을 포함한다: i) LNR-A 분절; ii) LNR-B 분절; iii) LNR-C 분절; iv) HD-N 분절, v) HD-C 분절; 및 vi) TM 도메인.LNR-A 분절, LNR-B 분절, 및 LNR-C 분절은 총체적으로 “LNR 분절”로서 언급될 수 있다. 상기 노치 수용체 폴리펩타이드는 도 30a에 도식적으로 도시한다.
LNR 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1442-1562와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 90개 아미노산 내지 150개 아미노산, 예를 들어, 90개 아미노산 (aa) 내지 100개 aa, 100개 aa 내지 110개 aa, 110개 aa 내지 120개 aa, 120개 aa 내지 130개 aa, 130개 aa 내지 140개 aa, 또는 140개 aa 내지 150개 aa의 길이를 가질 수 있다. 일부 경우에, LNR 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1442-1562와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 115개 aa 내지 125개 aa, 예를 들어, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 또는 125개 aa의 길이를 갖는다.
LNR 분절은 하기의 아미노산 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함할 수 있다: PPQIEEACELPECQVDAGNKVCNLQCNNHACGWDGGDCSLNFNDPWKNCTQSLQCWKYFSDGHCDSQCNSAGCLFDGFDCQLTEGQCNPLYDQYCKDHFSDGHCDQGCNSAECEWDGLDC (서열번호: 90); 및 118 내지 122개 아미노산 (예를 들어, 118, 119, 120, 121, 또는 122개 아미노산)의 길이를 가질 수 있다.
HD-N 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1563-1664와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 90개 아미노산(aa) 내지 110개 aa, 예를 들어, 90개 aa 내지 95개 aa, 95개 aa 내지 100개 aa, 100개 aa 내지 105개 aa, 또는 105개 aa 내지 110개 aa의 길이를 가질 수 있다. 일부 경우에, HD-N 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1563-1664와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 95개 aa 내지 105개 aa, 예를 들어, 95, 96, 98, 98, 99, 100, 101, 102, 103, 104, 또는 105개 aa의 길이를 갖는다.
HD-C 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1665-1733과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 60개 아미노산(aa) 내지 80개 aa, 예를 들어, 60개 aa 내지 65개 aa, 65개 aa 내지 70개 aa, 70개 aa 내지 75개 aa, 또는 75개 aa 내지 80개 aa의 길이를 가질 수 있다. 일부 경우에, HD-C 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1665-1733과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 65개 아미노산 내지 75개 아미노산, 예를 들어, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 또는 75개 아미노산의 길이를 갖는다.
HD 분절 (HD-N + HD-C)은 하기의 아미노산 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함할 수 있다: AAGTLVLVVLLPPDQLRNNSFHFLRELSHVLHTNVVFKRDAQGQQMIFPYYGHEEELRKHPIKRSTVGWATSSLLPGTSGGRQRRELDPMDIRGSIVYLEIDNRQCVQSSSQCFQSATDVAAFLGALASLGSLNIPYKIEAVKSEPVEPPLP (서열번호: 91); 및 150, 151, 152, 153, 또는 154개 아미노산의 길이를 가질 수 있다.
막관통 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1736 내지 1756과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 15개 아미노산(aa) 내지 25개 아미노산, 예를 들어, 15, 16, 17, 18, 29, 20, 21, 22, 23, 24, 또는 25개 아미노산의 길이를 가질 수 있다.
막관통 분절은 하기의 아미노산 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함할 수 있다: HLMYVAAAAFVLLFFVGCGVLLS (서열번호: 92); 및 21, 22, 23, 24, 또는 25개 아미노산 길이를 가질 수 있다.
일부 경우에, 노치 수용체 폴리펩타이드는 약 310개 아미노산 (aa) 내지 약 320개 aa (예를 들어, 310개 aa, 311개 aa, 312개 aa, 313개 aa, 314개 aa, 315개 aa, 316개 aa, 317개 aa, 318개 aa, 319개 aa, 또는 320개 aa)의 길이를 갖고, 도 31a에 도시된 아미노산 서열의 아미노산 1442-1756과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상응하는 분절의 예는 도 31b-31g에 도시한다)을 포함한다.
일부 경우에, 노치 수용체 폴리펩타이드는 하기의 아미노산 서열과 적어도 50%, 적어도 55%, 적어도 60%, 적어도 65%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열을 포함한다: PPQIEEACELPECQVDAGNKVCNLQCNNHACGWDGGDCSLNFNDPWKNCTQSLQCWKYFSDGHCDSQCNSAGCLFDGFDCQLTEGQCNPLYDQYCKDHFSDGHCDQGCNSAECEWDGLDCAEHVPERLAAGTLVLVVLLPPDQLRNNSFHFLRELSHVLHTNVVFKRDAQGQQMIFPYYGHEEELRKHPIKRSTVGWATSSLLPGTSGGRQRRELDPMDIRGSIVYLEIDNRQCVQSSSQCFQSATDVAAFLGALASLGSLNIPYKIEAVKSEPVEPPLPSQLHLMYVAAAAFVLLFFVGCGVLLS (서열번호: 93); 및 300개 아미노산 내지 310개 아미노산(예를 들어, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 또는 310개 아미노산)의 길이를 갖는다.
일부 경우에, 노치 수용체 폴리펩타이드는 하기의 아미노산 서열과 적어도 50%, 적어도 55%, 적어도 60%, 적어도 65%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열을 포함한다: PCVGSNPCYNQGTCEPTSENPFYRCLCPAKFNGLLCHILDYSFTGGAGRDIPPPQIEEACELPECQVDAGNKVCNLQCNNHACGWDGGDCSLNFNDPWKNCTQSLQCWKYFSDGHCDSQCNSAGCLFDGFDCQLTEGQCNPLYDQYCKDHFSDGHCDQGCNSAECEWDGLDCAEHVPERLAAGTLVLVVLLPPDQLRNNSFHFLRELSHVLHTNVVFKRDAQGQQMIFPYYGHEEELRKHPIKRSTVGWATSSLLPGTSGGRQRRELDPMDIRGSIVYLEIDNRQCVQSSSQCFQSATDVAAFLGALASLGSLNIPYKIEAVKSEPVEPPLPSQLHLMYVAAAAFVLLFFVGCGVLLS (서열번호: 94); 및 350개 아미노산 내지 370개 아미노산(예를 들어, 350 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 또는 370개 아미노산)의 길이를 갖는다.
단일 EGF 반복체, LNR 분절, HD-N 분절, HD-C 분절 및 TM 도메인을 포함하는 노치 수용체 폴리펩타이드
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 다음을 포함한다: i) 단일 EGF 반복체; ii) LNR 분절; iii) HD-N 분절; iv) HD-C 분절, 및 v) TM 도메인을 포함한다. 상기 노치 수용체 폴리펩타이드는 도 30b에 도식적으로 도시한다.
EGF 반복체는 도 31a에 도시된 아미노산 서열의 아미노산 1390 내지 1430과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 35개 아미노산(aa) 내지 45개 aa(예를 들어, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 또는 45개 aa)의 길이를 가질 수 있다.
EGF 반복체는 하기의 아미노산 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함할 수 있다: PCVGSNPCYNQGTCEPTSENPFYRCLCPAKFNGLLCH (서열번호: 95); 및 35개 아미노산 내지 40개 아미노산 (예를 들어, 35, 36, 37, 38, 39, 또는 40개 아미노산)의 길이를 가질 수 있다.
LNR 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1442-1562와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 90개 아미노산 내지 150개 아미노산, 예를 들어, 90개 아미노산 (aa) 내지 100개 aa, 100개 aa 내지 110개 aa, 110개 aa 내지 120개 aa, 120개 aa 내지 130개 aa, 130개 aa 내지 140개 aa, 또는 140개 aa 내지 150개 aa의 길이를 가질 수 있다. 일부 경우에, LNR 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1442-1562와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 115개 aa 내지 125개 aa, 예를 들어, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 또는 125개 aa의 길이를 갖는다.
LNR 분절은 하기의 아미노산 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함할 수 있다: PPQIEEACELPECQVDAGNKVCNLQCNNHACGWDGGDCSLNFNDPWKNCTQSLQCWKYFSDGHCDSQCNSAGCLFDGFDCQLTEGQCNPLYDQYCKDHFSDGHCDQGCNSAECEWDGLDC (서열번호: 90); 및 118 내지 122개 아미노산 (예를 들어, 118, 119, 120, 121, 또는 122개 아미노산)의 길이를 가질 수 있다.
HD-N 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1563-1664와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 90개 아미노산(aa) 내지 110개 aa, 예를 들어, 90개 aa 내지 95개 aa, 95개 aa 내지 100개 aa, 100개 aa 내지 105개 aa, 또는 105개 aa 내지 110개 aa의 길이를 가질 수 있다. 일부 경우에, HD-N 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1563-1664와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 95개 aa 내지 105개 aa, 예를 들어, 95, 96, 98, 98, 99, 100, 101, 102, 103, 104, 또는 105개 aa의 길이를 갖는다.
HD-C 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1665-1733과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 60개 아미노산(aa) 내지 80개 aa, 예를 들어, 60개 aa 내지 65개 aa, 65개 aa 내지 70개 aa, 70개 aa 내지 75개 aa, 또는 75개 aa 내지 80개 aa의 길이를 가질 수 있다. 일부 경우에, HD-C 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1665-1733과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 65개 아미노산 내지 75개 아미노산, 예를 들어, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 또는 75개 아미노산의 길이를 갖는다.
HD 분절 (HD-N + HD-C)은 하기의 아미노산 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함할 수 있다: AAGTLVLVVLLPPDQLRNNSFHFLRELSHVLHTNVVFKRDAQGQQMIFPYYGHEEELRKHPIKRSTVGWATSSLLPGTSGGRQRRELDPMDIRGSIVYLEIDNRQCVQSSSQCFQSATDVAAFLGALASLGSLNIPYKIEAVKSEPVEPPLP (서열번호: 91); 및 150, 151, 152, 153, 또는 154개 아미노산의 길이를 가질 수 있다.
막관통 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1736 내지 1756과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 15개 아미노산(aa) 내지 25개 아미노산, 예를 들어, 15, 16, 17, 18, 29, 20, 21, 22, 23, 24, 또는 25개 아미노산의 길이를 가질 수 있다.
막관통 분절은 하기의 아미노산 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함할 수 있다: HLMYVAAAAFVLLFFVGCGVLLS (서열번호: 92); 및 21, 22, 23, 24, 또는 25개 아미노산 길이를 가질 수 있다.
일부 경우에, 노치 수용체 폴리펩타이드는 약 360개 아미노산 (aa) 내지 약 375개 aa (예를 들어, 360개 aa, 361개 aa, 362개 aa, 363개 aa, 364개 aa, 365개 aa, 366개 aa, 367개 aa, 368개 aa, 369개 aa, 또는 370개 aa, 371개 aa, 372개 aa, 373개 aa, 374개 aa 또는 375개 aa)의 길이를 갖고, 도 31a에 도시된 아미노산 서열의 아미노산 1390-1756과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상응하는 분절의 예는 도 31b-31g에 도시한다)을 포함한다.
일부 경우에서, 노치 수용체 폴리펩타이드는 합성 링커를 포함한다. 예를 들어, 일부 경우에, 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 다음을 포함한다: i) 합성 링커; ii) EGF 반복체; iii) LNR 분절; iv) HD-N 분절, v) HD-C 분절; 및 vi) TM 도메인.상기 노치 수용체 폴리펩타이드는 도 30c에 도식적으로 도시한다.
합성 링커는 약 10개 아미노산 (aa) 내지 약 200개 aa, 예를 들어, 10개 aa 내지 25개 aa, 25개 aa 내지 50개 aa, 50개 aa 내지 75개 aa, 75개 aa 내지 100개 aa, 100개 aa 내지 125개 aa, 125개 aa 내지 150개 aa, 150개 aa 내지 175개 aa 또는 175개 aa 내지 200개 aa의 길이를 가질 수 있다. 합성 링커는 10개 aa 내지 30개 aa, 예를 들어, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 또는 30개 aa의 길이를 가질 수 있다. 합성 링커는 30개 aa 내지 50개 aa, 예를 들어, 30개 aa 내지 35개 aa, 35개 aa 내지 40개 aa, 40개 aa 내지 45개 aa, 또는 45개 aa 내지 50개 aa의 길이를 가질 수 있다.
일부 경우에, 본원에 기재된 바와 같은 합성 링커는 세포외 단백질 구조적 도메인 또는 이의 일부를 포함할 수 있다. 합성 링커로서 사용하기 위해 적합한 세포외 단백질 구조적 도메인은 예를 들어, Ig-유사 세포외 구조적 도메인, Fc 세포외 구조적 도메인, 피브로넥틴 세포외 구조적 도메인 등을 포함하지만 이에 제한되지 않는다. 일부 경우에, 합성 링커는 다수의 세포외 단백질 구조적 도메인을 포함할 수 있고, 여기서, 상기 다수의 도메인은 다수의 동일한 도메인 또는 다수의 상이한 도메인을 포함할 수 있다.
2-11 EGF 반복체, LNR 분절, HD-N 분절, HD-C 분절 및 TM 도메인을 포함하는 노치 수용체 폴리펩타이드
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 다음을 포함한다: i) 2 내지 11개 EGF 반복체; ii) LNR 분절; iii) HD-N 분절; iv) HD-C 분절, 및 v) TM 도메인을 포함한다. 상기 노치 수용체 폴리펩타이드는 도 30d에 도식적으로 도시한다.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 다음을 포함한다: i) 2개의 EGF 반복체; ii) LNR 분절; iii) HD-N 분절; iv) HD-C 분절, 및 v) TM 도메인을 포함한다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 다음을 포함한다: i) 3개의 EGF 반복체; ii) LNR 분절; iii) HD-N 분절; iv) HD-C 분절, 및 v) TM 도메인을 포함한다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 다음을 포함한다: i) 4개의 EGF 반복체; ii) LNR 분절; iii) HD-N 분절; iv) HD-C 분절, 및 v) TM 도메인을 포함한다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 다음을 포함한다: i) 5개의 EGF 반복체; ii) LNR 분절; iii) HD-N 분절; iv) HD-C 분절, 및 v) TM 도메인을 포함한다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 다음을 포함한다: i) 6개의 EGF 반복체; ii) LNR 분절; iii) HD-N 분절; iv) HD-C 분절, 및 v) TM 도메인을 포함한다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 다음을 포함한다: i) 7개의 EGF 반복체; ii) LNR 분절; iii) HD-N 분절; iv) HD-C 분절, 및 v) TM 도메인을 포함한다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 다음을 포함한다: i) 8개의 EGF 반복체; ii) LNR 분절; iii) HD-N 분절; iv) HD-C 분절, 및 v) TM 도메인을 포함한다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 다음을 포함한다: i) 9개의 EGF 반복체; ii) LNR 분절; iii) HD-N 분절; iv) HD-C 분절, 및 v) TM 도메인을 포함한다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 다음을 포함한다: i) 10개의 EGF 반복체; ii) LNR 분절; iii) HD-N 분절; iv) HD-C 분절, 및 v) TM 도메인을 포함한다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 존재하는 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 다음을 포함한다: i) 11개의 EGF 반복체; ii) LNR 분절; iii) HD-N 분절; iv) HD-C 분절, 및 v) TM 도메인을 포함한다.
EGF 반복체는 도 31a에 도시된 아미노산 서열의 아미노산 1390 내지 1430과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 35개 아미노산(aa) 내지 45개 aa(예를 들어, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 또는 45개 aa)의 길이를 가질 수 있다.
EGF 반복체는 도 31a에 도시된 아미노산 서열의 아미노산 869-905(dinecvlspcrhgascqnthggyrchcqagysgrnce; 서열번호: 96)와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 35개 아미노산 내지 약 40개 아미노산(aa)(예를 들어, 35, 36, 37, 38, 39, 또는 40개 aa)의 길이를 가질 수 있다.
EGF 반복체는 도 31a에 도시된 아미노산 서열의 아미노산 907-943(diddcrpnpchnggsctdgintafcdclpgfrgtfce; 서열번호: 97)과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 35개 아미노산 내지 약 40개 아미노산(aa)(예를 들어, 35, 36, 37, 38, 39, 또는 40개 aa)의 길이를 가질 수 있다.
EGF 반복체는 도 31a에 도시된 아미노산 서열의 아미노산 945-981(dinecasdpcrnganctdcvdsytctcpagfsgihce; 서열번호: 98)과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 35개 아미노산 내지 약 40개 아미노산(aa)(예를 들어, 35, 36, 37, 38, 39, 또는 40개 aa)의 길이를 가질 수 있다.
EGF 반복체는 도 31a에 도시된 아미노산 서열의 아미노산 988-1019(tesscfnggtcvdginsftclcppgftgsycq; 서열번호: 99)와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 30개 아미노산 내지 약 35개 아미노산(aa)(예를 들어, 30, 31, 32, 33, 34, 또는 35개 aa)의 길이를 가질 수 있다.
EGF 반복체는 도 31a에 도시된 아미노산 서열의 아미노산 1021-1057(dvnecdsqpclhggtcqdgcgsyrctcpqgytgpncq; 서열번호: 100)과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 35개 아미노산 내지 약 40개 아미노산(aa)(예를 들어, 35, 36, 37, 38, 39, 또는 40개 aa)의 길이를 가질 수 있다.
EGF 반복체는 도 31a에 도시된 아미노산 서열의 아미노산 1064-1090(dsspcknggkcwqthtqyrcecpsgwt; 서열번호: 101)과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 25개 아미노산 내지 약 30개 아미노산(aa)(예를 들어, 25, 26, 27, 28, 29, 또는 30개 aa)의 길이를 가질 수 있다.
EGF 반복체는 도 31a에 도시된 아미노산 서열의 아미노산 1146-1180(lvdecspspcqngatctdylggysckcvagyhgvnc; 서열번호: 102)과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 35개 아미노산 내지 약 40개 아미노산(aa)(예를 들어, 35, 36, 37, 38, 39, 또는 40개 aa)의 길이를 가질 수 있다.
EGF 반복체는 도 31a에 도시된 아미노산 서열의 아미노산 1184-1219(ideclshpcqnggtcldlpntykcscprgtqgvhce; 서열번호: 103)와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 35개 아미노산 내지 약 40개 아미노산(aa)(예를 들어, 35, 36, 37, 38, 39, 또는 40개 aa)의 길이를 가질 수 있다.
EGF 반복체는 도 31a에 도시된 아미노산 서열의 아미노산 1238-1265(cfnngtcvdqvggysctcppgfvgerce; 서열번호: 104)와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 25개 아미노산 내지 약 30개 아미노산(aa)(예를 들어, 25, 26, 27, 28, 29, 또는 30개 aa)의 길이를 가질 수 있다.
EGF 반복체는 아미노산 서열 1267-1305 (dvneclsnpcdargtqncvqrvndfhcecraghtgrrce; (서열번호: 와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함할 수 있다: 도 31a아미노산 서열의 105), 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절(여기서, 상응하는 분절의 예는 도 31b-31g에 도시되어 있다); 및 35개 아미노산 내지 약 40개 아미노산 (aa) (예를 들어, 35, 36, 37, 38, 39, 또는 40개 aa)의 길이를 가질 수 있다.
EGF 반복체는 하기의 아미노산 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함할 수 있다: PCVGSNPCYNQGTCEPTSENPFYRCLCPAKFNGLLCH (서열번호: 95); 및 35개 아미노산 내지 40개 아미노산 (예를 들어, 35, 36, 37, 38, 39, 또는 40개 아미노산)의 길이를 가질 수 있다.
LNR 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1442-1562와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 90개 아미노산 내지 150개 아미노산, 예를 들어, 90개 아미노산 (aa) 내지 100개 aa, 100개 aa 내지 110개 aa, 110개 aa 내지 120개 aa, 120개 aa 내지 130개 aa, 130개 aa 내지 140개 aa, 또는 140개 aa 내지 150개 aa의 길이를 가질 수 있다. 일부 경우에, LNR 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1442-1562와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 115개 aa 내지 125개 aa, 예를 들어, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 또는 125개 aa의 길이를 갖는다.
LNR 분절은 하기의 아미노산 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함할 수 있다: PPQIEEACELPECQVDAGNKVCNLQCNNHACGWDGGDCSLNFNDPWKNCTQSLQCWKYFSDGHCDSQCNSAGCLFDGFDCQLTEGQCNPLYDQYCKDHFSDGHCDQGCNSAECEWDGLDC (서열번호: 90); 및 118 내지 122개 아미노산 (예를 들어, 118, 119, 120, 121, 또는 122개 아미노산)의 길이를 가질 수 있다.
HD-N 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1563-1664와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 90개 아미노산(aa) 내지 110개 aa, 예를 들어, 90개 aa 내지 95개 aa, 95개 aa 내지 100개 aa, 100개 aa 내지 105개 aa, 또는 105개 aa 내지 110개 aa의 길이를 가질 수 있다. 일부 경우에, HD-N 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1563-1664와 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 95개 aa 내지 105개 aa, 예를 들어, 95, 96, 98, 98, 99, 100, 101, 102, 103, 104, 또는 105개 aa의 길이를 갖는다.
HD-C 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1665-1733과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 60개 아미노산(aa) 내지 80개 aa, 예를 들어, 60개 aa 내지 65개 aa, 65개 aa 내지 70개 aa, 70개 aa 내지 75개 aa, 또는 75개 aa 내지 80개 aa의 길이를 가질 수 있다. 일부 경우에, HD-C 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1665-1733과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 65개 아미노산 내지 75개 아미노산, 예를 들어, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 또는 75개 아미노산의 길이를 갖는다.
HD 분절 (HD-N + HD-C)은 하기의 아미노산 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함할 수 있다: AAGTLVLVVLLPPDQLRNNSFHFLRELSHVLHTNVVFKRDAQGQQMIFPYYGHEEELRKHPIKRSTVGWATSSLLPGTSGGRQRRELDPMDIRGSIVYLEIDNRQCVQSSSQCFQSATDVAAFLGALASLGSLNIPYKIEAVKSEPVEPPLP (서열번호: 91); 및 150, 151, 152, 153, 또는 154개 아미노산의 길이를 가질 수 있다.
막관통 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1736 내지 1756과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 15개 아미노산(aa) 내지 25개 아미노산, 예를 들어, 15, 16, 17, 18, 29, 20, 21, 22, 23, 24, 또는 25개 아미노산의 길이를 가질 수 있다.
막관통 분절은 하기의 아미노산 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함할 수 있다: HLMYVAAAAFVLLFFVGCGVLLS (서열번호: 92); 및 21, 22, 23, 24, 또는 25개 아미노산 길이를 가질 수 있다.
일부 경우에, 노치 수용체 폴리펩타이드는 약 490개 아미노산 (aa) 내지 약 900개 aa의 길이를 갖고 도 31a에 도시된 아미노산 서열의 i) 아미노산 1267-1756; ii) 1238-1756; iii) 1184-1756; iv) 1146-1756; v) 1064-1756; vi) 1021-1756; vii) 988-1756; viii) 945-1756; ix) 907-1756; 또는 x) 869-1756과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절을 포함하고, 여기서, 상응하는 분절의 예는 도 31b-31g에 도시되어 있다.
일부 경우에서, 노치 수용체 폴리펩타이드는 합성 링커를 포함한다. 예를 들어, 일부 경우에, 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 다음을 포함한다: i) 2 내지 11개 EGF 합성 링커; ii) 합성 링커; iii) LNR 분절; iv) HD-N 분절, v) HD-C 분절; 및 vi) TM 도메인.상기 노치 수용체 폴리펩타이드는 도 30e에 도식적으로 도시한다.
합성 링커는 약 10개 아미노산 (aa) 내지 약 200개 aa, 예를 들어, 10개 aa 내지 25개 aa, 25개 aa 내지 50개 aa, 50개 aa 내지 75개 aa, 75개 aa 내지 100개 aa, 100개 aa 내지 125개 aa, 125개 aa 내지 150개 aa, 150개 aa 내지 175개 aa 또는 175개 aa 내지 200개 aa의 길이를 가질 수 있다. 합성 링커는 10개 aa 내지 30개 aa, 예를 들어, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 또는 30개 aa의 길이를 가질 수 있다. 합성 링커는 30개 aa 내지 50개 aa, 예를 들어, 30개 aa 내지 35개 aa, 35개 aa 내지 40개 aa, 40개 aa 내지 45개 aa, 또는 45개 aa 내지 50개 aa의 길이를 가질 수 있다.
HD-C 분절 및 TM 도메인을 포함하는 노치 수용체 폴리펩타이드
일부 경우에, 노치 수용체 폴리펩타이드는 N-말단에서 C-말단으로의 순서로 i) HD-C 분절; 및 ii) TM 도메인을 포함하고, 여기서, 상기 노치 수용체 폴리펩타이드는 LNR 분절을 포함하지 않는다. 일부 경우에, LNR 분절은 이종성 폴리펩타이드로 대체된다. 상기 노치 수용체 폴리펩타이드는 도 30f에 도식적으로 도시한다.
HD-C 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1665-1733과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 60개 아미노산(aa) 내지 80개 aa, 예를 들어, 60개 aa 내지 65개 aa, 65개 aa 내지 70개 aa, 70개 aa 내지 75개 aa, 또는 75개 aa 내지 80개 aa의 길이를 가질 수 있다. 일부 경우에, HD-C 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1665-1733과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 65개 아미노산 내지 75개 아미노산, 예를 들어, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 또는 75개 아미노산의 길이를 갖는다.
막관통 분절은 도 31a에 도시된 아미노산 서열의 아미노산 1736 내지 1756과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 15개 아미노산(aa) 내지 25개 아미노산, 예를 들어, 15, 16, 17, 18, 29, 20, 21, 22, 23, 24, 또는 25개 아미노산의 길이를 가질 수 있다.
막관통 분절은 하기의 아미노산 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함할 수 있다: HLMYVAAAAFVLLFFVGCGVLLS (서열번호: 92); 및 21, 22, 23, 24, 또는 25개 아미노산 길이를 가질 수 있다.
일부 경우에, 노치 수용체 폴리펩타이드는 도 31a에 도시된 아미노산 서열의 아미노산 1665 내지 1756과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함할 수 있고; 85개 아미노산 aa 내지 95개 aa(예를 들어, 85, 86, 98, 98, 89, 90, 91, 92, 93, 94, 또는 95개 aa)의 길이를 갖는다.
일부 경우에, 노치 수용체 폴리펩타이드는 도 31a에 도시된 아미노산 서열의 아미노산 1665 내지 1756과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100% 아미노산 서열 동일성을 갖는 아미노산 서열, 또는 또 다른 노치 수용체 폴리펩타이드의 상응하는 분절 (여기서, 상기 상응하는 분절의 예는 도 31b-31g에 도시되어 있다)을 포함하고; 노치 수용체 폴리펩타이드의 N-말단에서 인-프레임으로 융합된 이종성 폴리펩타이드를 포함한다.
단백질용해 절단 부위
상기 주지된 바와 같이, 본원의 개시내용의 키메라 폴리펩타이드는 예를 들어, 50개 아미노산 내지 1000개 아미노산의 길이를 갖고 하나 이상의 단백질용해 절단 부위를 갖는, 노치 수용체 폴리펩타이드를 포함한다.
일부 경우에서, 노치 수용체 폴리펩타이드는 단지 하나의 단백질용해 절단 부위를 포함한다. 일부 경우에서, 노치 수용체 폴리펩타이드는 2개의 단백질용해 절단 부위를 포함한다. 일부 경우에서, 노치 수용체 폴리펩타이드는 3개의 단백질용해 절단 부위를 포함한다. 단순하게 하기 위해, 절단 부위는 본원에서 “S1,” “S2,” 및 “S3” 단백질용해 절단 부위로서 언급될 것이다.
일부 경우에서, 노치 수용체 폴리펩타이드는 S1 단백질용해 절단 부위를 포함한다. S1 단백질용해 절단 부위는 HD-N 분절과 HD-C 분절 사이에 위치할 수 있다. 일부 경우에, S1 단백질용해 절단 부위는 푸린-유사 프로테아제 절단 부위이다. 푸린-유사 프로테아제 절단 부위는 캐노니컬 서열 Arg-X-(Arg/Lys)-Arg (서열번호: 130)을 가질 수 있고, 여기서, X는 임의의 아미노산이고; 상기 프로테아제는 캐노니컬 서열에 바로 인접한 C-말단을 절단한다. 예를 들어, 일부 경우에, S1 단백질용해 절단 부위를 포함하는 아미노산 서열은 아미노산 서열 GRRRRELDPM (서열번호: 106)을 가질 수 있고, 여기서, 절단은 “RE” 서열 사이에서 일어난다. 또 다른 예로서, S1 단백질용해 절단 부위를 포함하는 아미노산 서열은 아미노산 서열 RQRRELDPM(서열번호: 107)을 가질 수 있고, 여기서, 절단은 “RE” 서열 사이에서 일어난다.
일부 경우에서, 노치 수용체 폴리펩타이드는 S2 단백질용해 절단 부위를 포함한다. S2 단백질용해 절단 부위는 HD-C 분절 내에 위치할 수 있다. 일부 경우에, S2 단백질용해 절단 부위는 예를 들어, ADAM-17-유형 프로테아제 절단 부위와 같은 ADAM 패밀리 유형 프로테아제 절단 부위이다. ADAM-17-유형의 프로테아제 절단 부위는 Ala-Val 디펩타이드 서열을 포함할 수 있고, 여기서, 상기 효소는 Ala와 Val 사이를 절단한다. 예를 들어, 일부 경우에, S2 단백질용해 절단 부위를 포함하는 아미노산 서열은 아미노산 서열 KIEAVKSE (서열번호: 108)를 가질 수 있고, 여기서, 절단은 “AV” 서열 사이에서 일어난다. 또 다른 예로서, S2 단백질용해 절단 부위를 포함하는 아미노산 서열은 아미노산 서열 KIEAVQSE(서열번호: 109)를 가질 수 있고, 여기서, 절단은 “AV” 서열 사이에서 일어난다.
일부 경우에서, 노치 수용체 폴리펩타이드는 S3 단백질용해 절단 부위를 포함한다. S3 단백질용해 절단 부위는 TM 도메인 내에 위치할 수 있다. 일부 경우에, S3 단백질용해 절단 부위는 감마-세크레타제 (γ-세크레타제) 절단 부위이다. γ -세크레타제 절단 부위는 Gly-Val 디펩타이드 서열을 포함할 수 있고, 여기서, 상기 효소는 Gly와 Val 사이를 절단한다. 예를 들어, 일부 경우에, S3 단백질용해 절단 부위는 아미노산 서열은 아미노산 서열 VGCGVLLS (서열번호: 110)를 갖고, 여기서, 절단은 “GV” 서열 사이에서 일어난다. 일부 경우에서, S3 단백질용해 절단 부위는 아미노산 서열 GCGVLLS (서열번호: 111)를 포함한다.
일부 경우에서, 노치 수용체 폴리펩타이드는 S1 단백질용해 절단 부위가 없다. 일부 경우에서, 노치 수용체 폴리펩타이드는 S2 단백질용해 절단 부위가 없다. 일부 경우에서, 노치 수용체 폴리펩타이드는 S3 단백질용해 절단 부위가 없다. 일부 경우에서, 노치 수용체 폴리펩타이드는 S1 단백질용해 절단 부위와 S2 단백질용해 절단 부위 둘 다가 없다. 일부 경우에서, 노치 수용체 폴리펩타이드는 S3 단백질용해 절단 부위를 포함하고; S1 단백질용해 절단 부위와 S2 단백질용해 절단 부위 둘 다가 없다. 이의 예는 도 30g에 도식적으로 도시한다.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드의 노치 수용체 폴리펩타이드는 도 32a-32b의 노치 수용체 폴리펩타이드일 수 있거나 도 32a-32b에 존재하는 노치 수용체 폴리펩타이드의 전부를 포함하거나 전혀 포함하지 않거나 보다 많은 부분을 포함할 수 있다.
본원에 기재된 키메라 폴리펩타이드 및 방법 및 회로에 사용하기 위해 채택될 수 있는 특정 노치 수용체 폴리펩타이드 및 이의 성분은 예를 들어, PCT 출원 번호 US2016/019188에 기재된 것들을 포함하지만 이에 제한되지 않는다(공개번호 제 WO 2016/138034호), 이의 개시내용은 이의 전문이 본원에 참조로 인용됨.
세포내 도메인
상기 주지된 바와 같이, 본원의 개시내용의 키메라 폴리펩타이드는 키메라 폴리펩타이드의 세포외 특이적 결합 구성원의 결합 파트너로의 결합 후 방출되는 세포내 도메인을 포함하고, 여기서, 그러한 결합은 상기 언급된 단백질용해 절단 부위의 절단을 유도한다.
세포내 도메인은 노치 수용체 폴리펩타이드에 이종성인 아미노산 서열을 포함한다. 다른 말로, 세포내 도메인은 노치 수용체 폴리펩타이드에 천연적으로 존재하지 않는 아미노산 서열을 포함한다.
일부 경우에서, 키메라 폴리펩타이드로부터 방출되는 경우 세포내 도메인은 세포내에서 전사 반응을 유도하거나 다르게는 전사를 조절한다. 예를 들어, 일부 경우에서, 세포내 도메인은 세포 내 전사를 활성화시키고 따라서 전사 활성화인자로서 작용하고 전사 활성화 도메인을 함유할 수 있다.
세포내 도메인은 필수적으로 발현된 펩타이드 또는 단백질에 기인할 수 있는 임의의 이펙터 기능을 제공할 수 있고, 여기서, 그러한 이펙터 기능은 예를 들어, 세포에 의한 하나 이상의 사이토킨의 증가된 생성; 세포에 의한 호르몬의 증가되거나 감소된 생성; 세포에 의한 항체의 생성; 기관 활성에서의 변화; 세포 내 폴리펩타이드의 트래픽킹에서의 변화; 표적 유전자의 전사에서의 변화; 단백질 활성에서의 변화; 세포 활성, 예를 들어, 세포 사멸에서의 변화; 세포 증식; 세포 분화에 대한 효과; 세포 생존에 대한 효과; 세포 신호전달 반응의 조절 등을 포함할 수 있지만 이에 제한되지 않는다. 일부 경우에, 세포내 도메인은 키메라 폴리펩타이드로부터 방출되는 경우 표적 유전자의 전사에서의 변화를 제공한다. 일부 경우에서, 키메라 폴리펩타이드로부터 방출되는 경우 세포내 도메인은 표적 유전자의 전사에서의 증가를 제공한다. 일부 경우에서, 키메라 폴리펩타이드로부터 방출되는 경우 세포내 도메인은 표적 유전자의 발현에서의 감소를 제공한다.
일부 경우에, 본원의 개시내용의 단백질용해 절단가능한 키메라 폴리펩타이드의 세포내 도메인은 전사 활성화 인자를 포함한다. 임의의 간편한 전사 활성화인자는 본원의 개시내용의 키메라 폴리펩타이드의 세포내 도메인에 유용할 수 있다. 세포 또는 시스템내에서, 전사 활성화인자는 전사 활성화인자에 응답하는 전사 조절 요소와 쌍을 이루어, 예를 들어, 상기 전사 조절 요소에 작동적으로 연결된 목적하는 폴리펩타이드를 암호화하는 핵산의 발현을 구동시킨다. 유용한 전사 활성화인자, 전사 조절 요소, 활성화인자/조절 요소 쌍 및 상기 시스템의 성분들은 예를 들어, 하기 문헌에 기재된 것들을 포함하지만 이에 제한되지 않는 유도성 발현 시스템에 사용되는 것들을 포함할 수 있지만 이에 제한되지 않는다: Goverdhana 외 Mol Ther. (2005) 12(2): 189-211; 미국특허 출원 공개번호 20160152701, 20150376627, 20130212722, 20070077642, 20050164237, 20050066376, 20040235169, 20040038249, 20030220286, 20030199022, 20020106720; 이의 개시내용은 이들의 전문이 본원에 참조로 인용됨.
일부 경우에, 유용한 전사 활성화인자는 포유동물 전사 인자 또는 이의 가공되거나 돌연변이된 형태를 포함할 수 있다. 일부 경우에, 유용한 전사 활성화인자는 인간 전사 인자 또는 이의 가공되거나 돌연변이된 형태를 포함할 수 있다. 일부 경우에, 유용한 전사 활성화인자는 마우스 전사 인자 또는 이의 가공되거나 돌연변이된 형태를 포함할 수 있다. 일부 경우에, 유용한 전사 활성화인자는 래트 전사 인자 또는 이의 가공되거나 돌연변이된 형태를 포함할 수 있다. 일부 경우에, 유용한 전사 활성화인자는 소 전사 인자 또는 이의 가공되거나 돌연변이된 형태를 포함할 수 있다. 일부 경우에, 유용한 전사 활성화인자는 돼지 전사 인자 또는 이의 가공되거나 돌연변이된 형태를 포함할 수 있다.
일부 경우에, 포유동물 전사 인자의 사용은 상기 전사 인자가 포유동물에서 면역 반응을 유도할 기회를 감소시킬 수 있다. 일부 경우에, 예를 들어, 돌연변이되거나 가공된 포유동물 전사 인자를 포함하는 가공되거나 돌연변이된 전사의 사용은 상기 전사 인자가 포유동물에서 면역 반응을 유도할 기회를 감소시킬 수 있다. 유용한 포유동물 전사 인자는 예를 들어, 아연 핑거 (ZnF) 단백질을 포함하지만 이에 제한되지 않는다.
일부 경우에, 세포내 도메인은 전사 활성화인자이다. 일부 경우에, 세포내 도메인은 하기의 테트라사이클린-조절된 전사 활성화인자 (tTA) 아미노산 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함한다: MSRLDKSKVINSALELLNEVGIEGLTTRKLAQKLGVEQPTLYWHVKNKRALLDALAIEMLDRHHTHFCPLEGESWQDFLRNNAKSFRCALLSHRDGAKVHLGTRPTEKQYETLENQLAFLCQQGFSLENALYALSAVGHFTLGCVLEDQEHQVAKEERETPTTDSMPPLLRQAIELFDHQGAEPAFLFGLELIICGLEKQLKCESGGPADALDDFDLDMLPADALDDFDLDMLPADALDDFDLDMLPG (서열번호: 112); 및 약 245개 아미노산 내지 252개 아미노산 (예를 들어, 248, 249, 250, 251, 또는 252개 아미노산)의 길이를 갖는다.
일부 구현예에서, 세포내 도메인은 전사 활성화인자를 포함한다. 일부 경우에, 전사 활성화인자는 GAL4-VP16이다. 일부 경우에, 전사 활성화인자는 VP64 Zip(+)이다. 일부 경우에, 전사 활성화인자는 가공된 단백질, 예를 들어, VP64와 같은 이펙터 도메인에 융합된 아연 핑거 또는 TALE 기반 DNA 결합 도메인이다. 당업계에 공지된 다양한 다른 전사 활성화인자가 사용에 적합하다.
일부 경우에, 세포내 도메인은 하기의 GAL4-VP64 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함한다: MKLLSSIEQACDICRLKKLKCSKEKPKCAKCLKNNWECRYSPKTKRSPLTRAHLTEVESRLERLEQLFLLIFPREDLDMILKMDSLQDIKALLTGLFVQDNVNKDAVTDRLASVETDMPLTLRQHRISATSSSEESSNKGQRQLTVSAAAGGSGGSGGSDALDDFDLDMLGSDALDDFDLDMLGSDALDDFDLDMLGSDALDDFDLDMLGS (서열번호: 113); 및 208 내지 214개 아미노산(예를 들어, 208, 209, 210, 211, 212, 213, 또는 214개 아미노산)의 길이를 갖는다.
일부 경우에, 세포내 도메인은 하기의 VP64 Zip(+) 전사 활성화인자 서열과 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 98%, 적어도 99%, 또는 100%의 아미노산 서열 동일성을 갖는 아미노산 서열을 포함한다: PKKKRKVDALDDFDLDMLGSDALDDFDLDMLGSDALDDFDLDMLGSDALDDFDLDMLGSGGSGGSGGSLEIEAAFLERENTALETRVAELRQRVQRLRNRVSQYRTRYGPLGGGK (서열번호: 114); 및 105 내지 115개 아미노산(예를 들어, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114 또는 115개 아미노산)의 길이를 갖는다.
일부 경우에, 본원의 개시내용의 단백질용해 절단가능한 키메라 폴리펩타이드의 세포내 도메인은 키메라 폴리펩타이드의 활성화 시, POI의 발현을 유도한다. POI는 필수적으로 임의의 폴리펩타이드일 수 있고, 연구 목적의 폴리펩타이드(예를 들어, 리포터 폴리펩타이드, 돌연변이된 폴리펩타이드, 신규한 합성 폴리펩타이드 등), 치료학적 목적의 폴리펩타이드(예를 들어, 천연적으로 존재하는 치료학적 단백질, 재조합 치료학적 폴리펩타이드 등), 산업 목적의 폴리펩타이드(예를 들어, 제조와 같은 산업적 응용에 사용되는 폴리펩타이드) 등을 포함할 수 있지만 이에 제한되지 않는다.
일부 경우에, POI는 예를 들어, 종양, 암 등과 같은 신생물을 치료하기 위한 치료학적 폴리펩타이드를 포함하지만 이에 제한되지 않는 치료학적 폴리펩타이드일 수 있다. 일부 경우에, 신생물을 치료하기 위한 치료학적 POI는 암에 대한 면역치료요법에 사용되는 POI일 수 있다. 일부 경우에서, 치료학적 POI는 CAR일 수 있다. 일부 경우에서, 치료학적 POI는 TCR일 수 있다. 일부 경우에서, 치료학적 POI는 항체일 수 있다. 일부 경우에서, 치료학적 POI는 키메라 이중특이적 결합 구성원일 수 있다. 일부 경우에서, 치료학적 POI는 선천적 면역 반응 유도제일 수 있다. 일부 경우에서, 치료학적 POI는 면역 억제 인자일 수 있다.
본원의 개시내용의 POI는 직교화된 POI를 포함한다. 직교화된 POI는 이들의 본래 또는 야생형 형태로부터 변형되어 상기 직교 POI가 특이적 직교화된 파트너와 상호작용하거나 결합하지만 비변형되거나 야생형 파트너와 특이적으로 또는 실질적으로 반응하지 않는 상기 POI를 포함한다. 임의의 POI는 직교화될 수 있고 예를 들어, 본원에 기재된 상기 POI를 포함하지만 이에 제한되지 않는다.
일부 경우에서, 치료학적 POI는 항-Fc CAR일 수 있다. 항-Fc CAR은 일반적으로 Fc 수용체의 세포외 도메인, 세포내 신호전달 도메인 및 임의로 동시-자극 도메인을 포함한다. 치료학적 내용에 의존하여, 항-Fc CAR은 예를 들어, Fc-감마 수용체 (예를 들어, FcγRI (CD64), FcγRIIA (CD32), FcγRIIB (CD32), FcγRIIIA (CD16a), FcγRIIIB (CD16b)), Fc-알파 수용체 (예를 들어, FcαRI (CD89)) 또는 Fc-엡실론 수용체(예를 들어, FcεRI, FcεRII (Cd23))를 포함하는 임의의 Fc 수용체의 세포외 도메인을 포함할 수 있다. 예를 들어, 일부 경우에서, 항-Fc CAR은 CD16 Fc 수용체의 세포외 도메인을 포함할 수 있다. 일부 경우에, 항-Fc CAR은 CD16Fc 수용체의 세포외 도메인, CD3-제타 세포내 신호전달 도메인 및 4-1BB 동시-자극 도메인을 포함할 수 있다. 일부 경우에, 항-Fc CAR은 항체-커플링된 T-세포 수용체 (ACTR)일 수 있고, 예를 들어, 하기 제조원으로부터 시판되는 것들이다(제조원: Unum Therapeutics Inc.;Cambridge, MA).
일부 경우에, 항-Fc CAR의 하나 이상의 도메인은 상기 도메인이 예를 들어, 세포 내 신호전달 성질을 조절하기 위해(예를 들어, 신호전달을 증가시키거나 신호전달을 감소시키기 위해), 결합 파트너에 대한 친화성을 조절하도록 (예를 들어, 친화성을 증가시키거나 친화성을 감소시키기 위해) 돌연변이된 경우 등을 포함하는 돌연변이된 도메인일 수 있다.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드는 세포 상에서 발현되어, 키메라 폴리펩타이드의 특이적 결합 파트너에 결합 시, 키메라 폴리펩타이드의 세포내 도메인은 세포 내 핵산 서열로부터 항-Fc CAR의 전사를 유도할 수 있다. 일부 경우에, 항-Fc CAR 및 종양 항원에 결합하는 항체는 상기 대상체에 투여될 수 있고, 또한 상기 세포가 투여된다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드는 세포 상에서 발현되어, 키메라 폴리펩타이드의 특이적 결합 파트너에 결합 시, 키메라 폴리펩타이드의 세포내 도메인은 항-FcCAR, 및 항-Fc CAR 및 세포 내 하나 이상의 핵산 서열로부터 종양 항원을 결합하는 항체의 전사를 유도할 수 있다.
일부 경우에서, 치료학적 POI는 키메라 이중특이적 결합 구성원일 수 있다. 본원에 사용된 바와 같이, “키메라 이중특이적 결합 구성원”이란 2개의 상이한 결합 파트너 (예를 들어, 2개의 상이한 항원)에 대해 이원 특이성을 갖는 키메라 폴리펩타이드를 의미한다. 키메라 이중특이적 결합 구성원의 비제한적인 예는 이중특이적 항체, 이중특이적 접합된 모노클로날 항체(mab)2, 이중특이적 항체 단편(예를 들어, F(ab)2, 이중특이적 scFv, 이중특이적 디아바디, 단일쇄 이중특이적 디아바디, 등), 이중특이적 T 세포 인게이져 (BiTE), 이중특이적 접합된 단일 도메인 항체, 미카바디 및 이의 돌연변이체 등을 포함한다. 키메라 이중특이적 결합 구성원의 비제한적인 예는 또한 하기 문헌에 기재된 상기 키메라 이중특이적 제제를 포함한다. MAbs. (2012) 4(2): 182-197; Stamova 외 Antibodies 2012, 1(2), 172-198; Farhadfar 외 Leuk Res. (2016) 49:13-21; Benjamin 외 Ther Adv Hematol. (2016) 7(3): 142-56; Kiefer 외 Immunol Rev. (2016) 270(1): 178-92; Fan 외 J Hematol Oncol. (2015) 8:130; May 외 Am J Health Syst Pharm. (2016) 73(1): e6-e13; 이의 개시내용은 이들의 전문이 본원에 참조로 인용됨.
일부 경우에, 키메라 이중특이적 결합 구성원은 이중특이적 항체일 수 있다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드의 활성에 응답하여 발현될 수 있는 이중특이적 항체는 예를 들어, 본원에 기재된 적어도 하나(예를 들어, 2개를 포함하는)의 암 항원을 포함하지만 이에 제한되지 않는 적어도 하나의 암 항원 (예를 들어, 2개의 암 항원을 포함하는)을 표적화하는 이중특이적 항체일 수 있다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드의 활성화에 응답하여 발현될 수 있는 이중특이적 항체는 예를 들어 본원에 기재된 암 항원 및 본원에 기재된 면역 항원을 포함하지만 이에 제한되지 않는 하나의 암 항원 및 하나의 면역 세포 항원을 표적화하는 이중특이적 항체일 수 있다.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드의 활성화에 응답하여 발현될 수 있는 이중특이적 항체는 예를 들어, bsAb MDX-210 (Her2 및 CD64를 표적화하는), MDX-H210 (Her2 및 CD64를 표적화하는), MDX-447 (EGFR 및 CD64를 표적화하는), HRS-3/A9 (CD30 항원 및 수용체 FcγRIII (CD16)를 표적화하는 이중특이적 F(ab')2 항체), 항-CD3 × 항-EpCAM TriomAb/bsAb, 카투막소맙, 에르투막소맙, Bi20 (림포문(Lymphomun) 또는 fBTA05), 항-CD19 × CD3 디아바디, 항-CD19 × CD16 디아바디, 항-EGFR × CD3 디아바디, 항-PSMA × CD3 디아바디, rM28 및 NG2를 표적화하는 디아바디, 항-CD28 × CD20 이중특이적 탠덤 scFv 등일 수 있다.
일부 경우에, 키메라 이중특이적 결합 구성원은 이중특이적 T 세포 인게이져(BiTE)일 수 있다. BiTE는 일반적으로 면역 세포 항원과 결합하는 특이적 결합 구성원 (예를 들어, scFv)을 암 항원 (예를 들어, 종양 관련 항원, 종양 특이적 항원 등)에 결합하는 특이적 결합 구성원 (예를 들어, scFv)에 융합시킴에 의해 제조된다. 예를 들어, 예시적 BiTE는 짭은 펩타이드 링커 (예를 들어, 5개 아미노산 링커, 예를 들어, GGGGS (서열번호: 115))를 통해 항-종양 관련 항원 (예를 들어, EpCAM, CD19 등)에 융합된 항-CD3 scFv를 포함한다.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드의 활성화에 응답하여 발현될 수 있는 BiTE는 예를 들어 본원에 기재된 암 항원을 포함하지만 이에 제한되지 않는 적어도 하나의 암 항원을 표적화하는 BiTE일 수 있다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드의 활성화에 응답하여 발현될 수 있는 BiTE는 예를 들어 본원에 기재된 암 항원 및 본원에 기재된 면역 항원을 포함하지만 이에 제한되지 않는 하나의 암 항원 및 하나의 면역 세포 항원을 표적화하는 BiTE일 수 있다.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드는 세포 상에서 발현되어, 키메라 폴리펩타이드의 특이적 결합 파트너에 결합 시, 키메라 폴리펩타이드의 세포내 도메인은 세포 내 핵산 서열로부터 BiTE의 전사를 유도할 수 있다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드는 세포 상에서 발현되어, 펩타이드-MHC 특이적 결합 파트너에 결합 시, 키메라 폴리펩타이드의 세포내 도메인은 BiTE의 전사를 유도할 수 있다. 일부 경우에, 본원에 기재된 바와 같이 사용하기에 적합한 BiTE는 예를 들어, 항-CD3 × 항-CD19 BiTE (예를 들어, 블리나투모맙), 항-EpCAM × 항i-CD3 BiTE (예를 들어, MT110), 항-CEA × 항-CD3 BiTE (예를 들어, MT111/MEDI-565), 항-CD33 × 항-CD3 BiTE, 항-HER2 BiTE, 항-EGFR BiTE, 항-IgE BiTE 등을 포함한다.
일부 경우에, 키메라 이중특이적 결합 구성원은 미카바디(Micabody) 또는 이의 돌연변이체일 수 있다. 미카바디는 일반적으로 NKG2D 수용체에 특이적으로 결합하는 적어도 하나의 도메인에 연결된 항원-특이적 결합 부분을 포함한다. 일부 경우에, 미카바디 또는 이의 돌연변이체는 NKG2D 수용체에 특이적으로 결합하는 가공된 MICA α1-α2 도메인을 포함한다.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드의 활성화에 응답하여 발현될 수 있는 미카바디 또는 이의 돌연변이체는 예를 들어 본원에 기재된 암 항원을 포함하지만 이에 제한되지 않는 적어도 하나의 암 항원을 표적화하는 미카바디 또는 이의 돌연변이체일 수 있다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드의 활성화에 응답하여 발현될 수 있는 미카바디 또는 이의 돌연변이체는 HER2를 표적화하는 미카바디 또는 이의 돌연변이체(예를 들어, 항-HER2 미카바디 또는 이의 돌연변이체)일 수 있다. 미카바디 및 관련 성분들 및 작동 원리의 비제한적인 예는 예를 들어, 다음 문헌에 기재되어 있다: Cho 외, Cancer Res. (2010) 70(24): 10121-30; Bauer 외 Science. (1999) 285(5428): 727-9; Morvan 외 Nat Rev Cancer. (2016) 16(1): 7-19; 이의 개시내용은 이의 전문이 본원에 참조로 인용됨.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드는 세포 상에서 발현되어, 키메라 폴리펩타이드의 특이적 결합 파트너에 결합 시, 키메라 폴리펩타이드의 세포내 도메인은 세포 내 핵산 서열로부터 미카바디 또는 이의 돌연변이체의 전사를 유도할 수 있다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드는 세포 상에서 발현되어, 펩타이드-MHC 특이적 결합 파트너에 결합 시, 키메라 폴리펩타이드의 세포내 도메인은 미카바디 또는 이의 돌연변이체의 전사를 유도할 수 있다. 미카바디 및 이의 돌연변이체는 제조원 (AvidBiotics (South San Francisco, CA))에 의해 개발된 것들 및 온라인(avidbiotics(dot)com)에 기재된 것들을 포함한다.
일부 경우에, 키메라 이중특이적 결합 구성원은 CAR T 세포 어댑터 일 수 있다. 본원에 기재된 바와 같이, “CAR T 세포 어댑터”는 CAR의 항원 인지 도메인에 결합하고 상기 CAR을 제2 항원으로 재지시하는 발현된 이중특이적 폴리펩타이드를 의미한다. 일반적으로, CAR T 세포 어댑터는 결합 영역을 갖고, 하나는 이것이 지시되는 CAR 상의 에피토프 및 결합되는 경우, CAR을 활성화하는 결합 신호를 전달하는 결합 파트너에 지시된 제2 에피토프에 특이적이다. 유용한 CAR T 세포 어댑터는 예를 들어, 하기 문헌에 기재된 것들을 포함하지만 이에 제한되지 않는다: Kim 외 J Am Chem Soc. (2015) 137(8): 2832-5; Ma 외 Proc Natl Acad Sci U S A. (2016) 113(4): E450-8 및 Cao 외 Angew Chem Int Ed Engl. (2016) 55(26): 7520-4; 이의 개시내용은 이의 전문이 본원에 참조로 인용됨.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 의해 유도된 치료학적 POI는 항체이다. 적합한 항체는, 예를 들어, α4β1 및 α4β7 인테그린의 α4 서브유니트를 표적화하는 나탈리주맙 (Tysabri; Biogen Idec/Elan) (MS 및 크론 질환의 치료에 사용된 바와 같이); α4β7 인테그린을 표적화하는 베돌리주맙 (MLN2; Millennium Pharmaceuticals/Takeda) (UC 및 크론 질환의 치료에 사용된 바와 같이); BAFF를 표적화하는 벨리무맙 (Benlysta; Human Genome Sciences/ GlaxoSmithKline) (SLE의 치료에 사용된 바와 같이); BAFF 및 APRIL을 표적화하는 아탁시셉트 (TACI-Ig; Merck/Serono) (SLE의 치료에 사용된 바와 같이); CD2를 표적화하는 알레파셉트 (Amevive; Astellas) (판상형 건선증, GVHD의 치료에 사용된 바와 같이); CD3을 표적화하는 오텔릭시주맙 (TRX4; Tolerx/GlaxoSmithKline) (T1D의 치료에 사용된 바와 같이); CD3을 표적화하는 테플리주맙 (MGA031; MacroGenics/Eli Lilly) (T1D의 치료에 사용된 바와 같이); CD20을 표적화하는 리툭시맙 (Rituxan/Mabthera; Genentech/Roche/Biogen Idec) (비-호지킨 림프종, RA (TNF 차단에 대한 부적절한 반응을 보이는 환자) 및 CLL의 치료에 사용된 바와 같이); CD20을 표적화하는 오파투무맙 (Arzerra; Genmab/GlaxoSmithKline) (CLL, RA의 치료에 사용된 바와 같이); CD20을 표적화하는 오크렐리주맙 (2H7; Genentech/Roche/Biogen Idec) (RA 및 SLE의 치료에 사용된 바와 같이); CD22를 표적화하는 에프라투주맙 (hLL2; Immunomedics/UCB) (SLE 및 비-호지킨 림프종의 치료에 사용된 바와 같이); CD52를 표적화하는 알렘투주맙 (Campath/MabCampath; Genzyme/Bayer) (CLL, MS의 치료에 사용된 바와 같이); CD80 및 CD86을 표적화하는 아바타셉트 (Orencia; Bristol-Myers Squibb) (RA 및 JIA, UC 및 크론 질환, SLE의 치료에 사용된 바와 같이); C5 보체 단백질을 표적화하는 에쿨리주맙 (Soliris; Alexion pharmaceuticals) (발작성 야행성 혈색소증의 치료에 사용된 바와 같이); IgE를 표적화하는 오말리주맙 (Xolair; Genentech/Roche/Novartis) (중등도-중증 지속성 알레르기성 천식 치료에 사용된 바와 같이); IL-1β를 표적화하는 카나키누맙 (Ilaris; Novartis) (크리오피린-관련된 주기적 증후군, 전신 JIA, 신생아-발현 다발성 염증 질환 및 급성 통풍의 치료에 사용된 바와 같이); IL-5를 표적화하는 메폴리주맙 (Bosatria; GlaxoSmithKline) (과다호산구 증후군의 치료에 사용된 바와 같이); IL-5를 표적화하는 레슬리주맙 (SCH55700; Ception Therapeutics) (호산구 식도염의 치료에 사용된 바와 같이); IL-6R을 표적화하는 토실리주맙 (Actemra/RoActemra; Chugai/Roche) (RA, JIA의 치료에 사용된 바와 같이); IL-12 및 IL-23을 표적화하는 우스테키누맙 (Stelara; Centocor) (판상형 건선증, 건선 관절염, 크론 질환의 치료에 사용된 바와 같이); IL-12 및 IL-23을 표적화하는 브리아키누맙 (ABT-874; Abbott) (건선증 및 판상형 건선증의 치료에 사용된 바와 같이); TNF를 표적화하는 에타네르셉트 (Enbrel; Amgen/Pfizer) (RA, JIA, 건선 관절염, AS 및 판상형 건선증의 치료에 사용된 바와 같이); TNF를 표적화하는 인플릭시맙 (Remicade; Centocor/Merck) (크론 질환, RA, 건선 관절염, UC, AS 및 판상형 건선증의 치료에 사용된 바와 같이); TNF를 표적화하는 아달리무맙 (Humira/Trudexa; Abbott) (RA, JIA, 건선 관절염, 크론 질환, AS 및 판상형 건선증의 치료에 사용된 바와 같이); TNF를 표적화하는 세르톨리주맙 페골(Cimzia; UCB) (크론 질환 및 RA의 치료에 사용된 바와 같이); TNF를 표적화하는 골리무맙 (Simponi; Centocor) (RA, 건선 관절염 및 AS의 치료에 사용된 바와 같이); 등을 포함한다.
일부 경우에, 이의 생산이 유도되는 항체는 암의 치료를 위한 치료학적 항체이다. 그러한 항체는, 예를 들어 CTLA-4를 표적화하는 이필리무맙 (흑색종, 전립선암, RCC의 치료에 사용된 바와 같이); CTLA-4를 표적화하는 트레멜리무맙 (CRC, 위, 흑색종, NSCLC의 치료에 사용된 바와 같이); PD-1을 표적화하는 니볼루맙 (흑색종, NSCLC, RCC의 치료에 사용된 바와 같이); PD-1을 표적화하는 MK-3475 (흑색종의 치료에 사용된 바와 같이); PD-1을 표적화하는 피딜리주맙 (혈액학 악성종양의 치료에 사용된 바와 같이); PD-L1을 표적화하는 BMS-936559 (흑색종, NSCLC, 난소, RCC의 치료에 사용된 바와 같이); PD-L1을 표적화하는 MEDI4736; PD-L1을 표적화하는 MPDL33280A (흑색종의 치료에 사용된 바와 같이); CD20을 표적화하는 리툭시맙 (비-호지킨 림프종의 치료에 사용된 바와 같이); 이브리투모맙 티욱세탄 및 토시투모맙 (림프종의 치료에 사용된 바와 같이); 브렌툭시맙 베도틴 타르게팅 CD30 (호지킨 림프종의 치료에 사용된 바와 같이); CD33을 표적화하는 겜투주맙 오조가미신 (급성 골수 백혈병의 치료에 사용된 바와 같이); CD52를 표적화하는 알렘투주맙 (만성 림프구 백혈병의 치료에 사용된 바와 같이); EpCAM을 표적화하는 IGN101 및 아데카투무맙 (상피 종양 (유방, 결장 및 폐)의 치료에 사용된 바와 같이); CEA를 표적화하는 라베투주맙 (유방, 결장 및 폐 종양의 치료에 사용된 바와 같이); gpA33을 표적화하는 huA33 (결장직장 암종의 치료에 사용된 바와 같이); 뮤신을 표적화하는 펨투모맙 및 오레고보맙 (유방, 결장, 폐 및 난소암의 치료에 사용된 바와 같이); TAG-72를 표적화하는 CC49 (민레투모맙) (유방, 결장 및 폐 종양의 치료에 사용된 바와 같이); CAIX를 표적화하는 cG250 (신장 세포 암종의 치료에 사용된 바와 같이); PSMA를 표적화하는 J591 (전립선 암종의 치료에 사용된 바와 같이); 엽산-결합 단백질을 표적화하는 MOv18 및 MORAb-003 (farletuzumab) (난소암의 치료에 사용된 바와 같이); 강글리오시드를 표적화하는 3F8, ch14.18 및 KW-2871 (예를 들어, GD2, GD3 및 GM2) (신경외배엽 종양 및 일부 상피 종양의 치료에 사용된 바와 같이); Le y를 표적화하는 hu3S193 및 IgN311 (유방, 결장, 폐 및 전립선 종양의 치료에 사용된 바와 같이); VEGF를 표적화하는 베바시주맙 (종양 혈관계의 치료에 사용된 바와 같이); VEGFR을 표적화하는 IM-2C6 및 CDP791 (상피-유래 고형 종양의 치료에 사용된 바와 같이); 인테그린 _V_3을 표적화하는 에타라시주맙 (혈관계의 치료에 사용된 바와 같이); 인테그린 _5_1을 표적화하는 볼복시맙 (종양 혈관계의 치료에 사용된 바와 같이); EGFR을 표적화하는 세툭시맙, 파니투무맙, 니모투주맙 및 806 (신경교종, 폐, 유방, 결장, 및 두경부 종양의 치료에 사용된 바와 같이); ERBB2를 표적화하는 트라스투주맙 및 페르투주맙 (유방, 결장, 폐, 난소 및 전립선 종양의 치료에 사용된 바와 같이); ERBB3을 표적화하는 MM-121 (유방, 결장, 폐, 난소 및 전립선 종양의 치료에 사용된 바와 같이); MET를 표적화하는 AMG 102, METMAB 및 SCH 900105 (유방, 난소 및 폐 종양의 치료에 사용된 바와 같이); IGF1R을 표적화하는 AVE1642, IMC-A12, MK-0646, R1507 및 CP 751871 (신경교종, 폐, 유방, 두경부, 전립성 및 갑상선암의 치료에 사용된 바와 같이); EPHA3을 표적화하는 KB004 및 IIIA4 (폐, 신장 및 결장 종양, 흑색종, 신경교종 및 혈액학적 악성 종양의 치료에 사용된 바와 같이); TRAILR1을 표적화하는 마파투무맙 (HGS-ETR1) (결장, 폐 및 췌장 종양 및 혈액학적 악성종양의 치료에 사용된 바와 같이); TRAILR2를 표적화하는 HGS-ETR2 및 CS-1008; RANKL을 표적화하는 데노수맙 (전립선암 및 골 전이의 치료에 사용된 바와 같이); FAP를 표적화하는 시브로투주맙 및 F19 (결장, 유방, 폐, 췌장, 및 두경부 종양의 치료에 사용된 바와 같이); 테나신을 표적화하는 81C6 (신경교종, 유방 및 전립선 종양의 치료에 사용된 바와 같은); CD3을 표적화하는 블리나투모맙 (Blincyto; Amgen) (ALL의 치료에 사용된 바와 같은); 암 면역요법에 사용된 바와 같이 PD-1을 표적화하는 펨브롤리주맙; c-Myc를 표적화하는 9E10 항체; 등을 포함한다.
일부 경우에, 발현이 본 발명의 키메라 폴리펩타이드에 의해 유도될 수 있는 유용한 항체는 8H9, 아바고보맙, 압식시맙, 아비투주맙, 아브릴루맙, 악톡주맙, 아두카누맙, 아펠리모맙, 아푸투주맙, 알라시주맙 페골, ALD518, 알리로쿠맙, 알투모맙 펜테테이트, 아마툭시맙, 아나투모맙 마페나톡스, 아네투맙 라브탄신, 아니프롤루맙, 안루킨주맙, 아폴리주맙, 아르시투모맙, 아스크린바쿠맙, 아셀리주맙, 아테졸리주맙, 아티누맙, 아틀리주맙/토실리주맙, 아조롤리무맙, 바피네우주맙, 바실릭시맙, 바비툭시맙, 벡투모맙, 베겔로맙, 벤랄리주맙, 베르틸리무맙, 베실레소맙, 베바시주맙/라니비주맙, 베즐로톡수맙, 비시로맙, 비마그루맙, 비메키주맙, 비바투주맙 메르탄신, 블로소주맙, 보코시주맙, 브렌툭시맙베도틴, 브로달루맙, 브롤루시주맙, 브론틱투주맙, 칸투주맙 메르탄신, 칸투주맙 라브탄신, 카플라시주맙, 카프로맙 펜데티드, 카를루맙, 카투막소맙, cBR96-독소루비신 임무노콘주게이트, 세델리주맙, Ch.14.18, 시타투주맙 보가톡스, 식수투무맙, 클라자키주맙, 클레놀릭시맙, 클리바투주맙 테트락세탄, 코드리투주맙, 콜툭시맙 라브탄신, 코나투무맙, 콘시주맙, CR6261, 크레네주맙, 다세투주맙, 다클리주맙, 달로투주맙, 다피롤리주맙 페골, 다라투무맙, 덱트레쿠맙, 뎀시주맙, 데닌투주맙 마포도틴, 데를로툭시맙 비오틴, 데투모맙, 디누툭시맙, 디리다부맙, 도를리모맙 아리톡스, 드로지투맙, 둘리고투맙, 두필루맙, 두르발루맙, 두시기투맙, 에크로멥시맙, 에도바코맙, 에드레콜로맙, 에팔리주맙, 에푼구맙, 엘델루맙, 엘겜투맙, 엘로투주맙, 엘시리리모맙, 에막투주맙, 에미베주투맙, 에나바투주맙, 엔포르투맙 베도틴, 엔리모맙 페골, 에노블리투주맙, 에노키주맙, 에노티쿠맙, 엔시툭시맙, 에피투모맙 시툭세탄, 에르리주맙, 에르투막소맙, 에트롤리주맙, 에비나쿠맙, 에볼로쿠맙, 엑비비르맙, 파놀레소맙, 파랄리모맙, 파를레투주맙, 피시누맙, FBTA05, 펠비주맙, 페자키누맙, 피클라투주맙, 피기투무맙, 피리부맙, 플란모투맙, 플레티쿠맙, 폰톨리주맙, 포랄루맙, 포라비루맙, 프레솔리무맙, 풀라누맙, 푸툭시맙, 갈릭시맙, 가니투맙, 간테네루맙, 가빌리모맙, 게보키주맙, 기렌툭시맙, 글렘바투무맙 베도틴, 고밀릭시맙, 구셀쿠맙, 이발리주맙, 이발리주맙, 이크루쿠맙, 이다루시주맙, 이고보맙, IMAB362, 이말루맙, 임시로맙, 임가투주맙, 인클라쿠맙, 인다툭시맙 라브탄신, 인두사투맙 베도틴, 이놀리모맙, 이노투주맙 오조가미신, 인테투무맙, 이라투무맙, 이사툭시맙, 이톨리주맙, 익세키주맙, 켈릭시맙, 람브롤리주맙, 람팔리주맙, 레브리키주맙, 레말레소맙, 렌질루맙, 레르델리무맙, 렉사투무맙, 리비리루맙, 리파스투주맙 베도틴, 리겔리주맙, 릴로토맙 사테트락세탄, 린투주맙, 리릴루맙, 로델시주맙, 로키베트맙, 로르보투주맙 메르탄신, 루카투무맙, 룰리주맙 페골, 루밀릭시맙, 룸레투주맙, 마르게툭시맙, 마슬리모맙, 마투주맙, 마브릴리무맙, 메텔리무맙, 밀라투주맙, 민레투모맙, 미르베툭시맙 소라브탄신, 미투모맙, 모가물리주맙, 모롤리무맙, 모롤리무맙 면역, 모타비주맙, 목세투모맙 파수도톡스, 무로모납-CD3, 나콜로맙 타페나톡스, 나밀루맙, 나프투모맙 에스타페나톡스, 나르나투맙, 네바쿠맙, 넥시투무맙, 네몰리주맙, 네렐리모맙, 네스바쿠맙, 노페투모맙 메르펜탄, 오빌톡삭시맙, 오비누투주맙, 오카라투주맙, 오둘리모맙, 오랄라투맙, 올로키주맙, 오나르투주맙, 온툭시주맙, 오피시누맙, 오포르투주맙 모나톡스, 오르티쿠맙, 오틀레르투주맙, 옥셀루맙, 오자네주맙, 오조랄리주맙, 파기박시맙, 팔리비주맙, 판코맙, 파노바쿠맙, 파르사주투맙, 파스콜리주맙, 파소툭시맙, 파텔리주맙, 파트리투맙, 페라키주맙, 펙셀리주맙, 피나투주맙 베도틴, 핀투모맙, 플라쿨루맙, 폴라주투맙 베도틴, 포네주맙, 플릭시맙, 프리톡삭시맙, 프리투무맙, PRO 140, 퀼리주맙, 라코투모맙, 라드레투맙, 라피비루맙, 랄판시주맙, 라무시루맙, 라니비주맙, 락시바쿠맙, 레파네주맙, 레게비루맙, 릴로투무맙, 리누쿠맙, 로바투무맙, 롤레두맙, 로모소주맙, 론탈리주맙, 로벨리주맙, 루플리주맙, 사시투주맙 고비테칸, 사말리주맙, 사릴루맙, 사무모맙 펜데타이드, 세쿠키누맙, 세리반투맙, 세톡삭시맙, 세비루맙, SGN-CD19A, SGN-CD33A, 시팔리무맙, 실툭시맙, 심투주맙, 시플리주맙, 시루쿠맙, 소피투주맙 베도틴, 솔란주맙, 솔리토맙, 소넵시주맙, 손투주맙, 스타물루맙, 술레소맙, 수비주맙, 타발루맙, 타카투주맙 ?락세탄, 타도시주맙, 탈리주맙, 타네주맙, 타플리투모맙 팝톡스, 타렉투맙, 테피바주맙, 텔리모맙 아리톡스, 테나투모맙, 테넬릭시맙, 테프로투무맙, 테시돌루맙, 테툴로맙, TGN1412, 티실리무맙/트레멜리무맙, 티가투주맙, 틸드라키주맙, TNX-650, 토랄리주맙, 토사톡수맙, 토베투맙, 트랄로키누맙, TRBS07, 트레갈리주맙, 트레보그루맙, 투코투주맙 셀몰류킨, 투미루맙, 우블리툭시맙, 울로쿠플루맙, 우렐루맙, 우르톡사주맙, 반도르투주맙 베도틴, 반틱투맙, 바누시주맙, 바팔릭시맙, 바를리루맙, 바텔리주맙, 벨투주맙, 베팔리모맙, 베센쿠맙, 비실리주맙, 보르세투주맙 마포도틴, 보투무맙, 잘루투무맙, 자놀리무맙, 자툭시맙, 지랄리무맙, 졸리모맙 아리톡스 등을 포함하지만 이에 제한되지 않는다.
일부 경우에, 본원의 기재내용의 단백질용해 절단가능한 키메라 폴리펩타이드는 세포 내 T-세포 수용체 (TCR)의 발현을 유도할 수 있다. 임의의 TCR은 본원의 개시내용의 방법을 사용하여 키메라 폴리펩타이드에 의해 유도될 수 있고, 이는 예를 들어, 암 세포의 표면 상에 발현된 에피토프, 암 세포의 표면 상의 펩타이드-MHC 복합체 등을 포함하는 임의의 다양한 에피토프에 특이적인 TCR을 포함한다. TCR은 일반적으로 알파쇄 및 베타쇄를 포함하고 주요 조직적합성 복합체에 의해 제공되는 경우 항원을 인지한다. 일부 경우에, TCR은 가공된 TCR이다.
면역 세포 활성화 기능을 갖는 임의의 가공된 TCR은 본원의 개시내용의 방법을 사용하여 유도될 수 있다. 상기 TCR은 예를 들어, 항원-특이적 TCR, 모노클로날 TCR (MTCR), 단일쇄 MTCR, 고친화성 CDR2 돌연변이체 TCR, CD1-결합 MTCR, 고친화성 NY-ESO TCR, VYG HLA-A24 텔로머라제 TCR을 포함하고, 예를 들어, 하기 문헌에 기재된 것들을 포함한다: PCT Pub Nos. WO 2003/020763, WO 2004/033685, WO 2004/044004, WO 2005/114215, WO 2006/000830, WO 2008/038002, WO 2008/039818, WO 2004/074322, WO 2005/113595, WO 2006/125962; Strommes 외 Immunol Rev.2014; 257(1): 145-64; Schmitt 외 Blood.2013; 122(3): 348-56; Chapuls 외 Sci Transl Med. 2013; 5(174): 174ra27; Thaxton 외 Hum Vaccin Immunother.2014; 10(11): 3313-21 (PMID:25483644); Gschweng 외 Immunol Rev.2014; 257(1): 237-49 (PMID:24329801); Hinrichs 외 Immunol Rev.2014; 257(1): 56-71 (PMID:24329789); Zoete 외 Front Immunol. 2013; 4:268 (PMID:24062738); Marr 외 Clin Exp Immunol. 2012; 167(2): 216-25 (PMID:22235997); Zhang 외 Adv Drug Deliv Rev.2012; 64(8): 756-62 (PMID:22178904); Chhabra 외 Scientific World Journal.2011; 11:121-9 (PMID:21218269); Boulter 외 Clin Exp Immunol. 2005; 142(3): 454-60 (PMID:16297157); Sami 외 Protein Eng Des Sel.2007; 20(8): 397-403; Boulter 외 Protein Eng. 2003; 16(9): 707-11; Ashfield 외 IDrugs.2006; 9(8): 554-9; Li 외 Nat Biotechnol.2005; 23(3): 349-54; Dunn 외 Protein Sci. 2006; 15(4): 710-21; Liddy 외 Mol Biotechnol.2010; 45(2); Liddy 외 Nat Med. 2012; 18(6): 980-7; Oates, 외 Oncoimmunology.2013; 2(2): e22891; McCormack, 외 Cancer Immunol Immunother.2013 Apr;62(4): 773-85; Bossi 외 Cancer Immunol Immunother.2014; 63(5): 437-48 및 Oates, 외 Mol Immunol. 2015 Oct;67(2 Pt A): 67-74; 이의개시내용은 이들의 전문이 본원에 참조로 인용됨.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드는 예를 들어, 세포내 암 항원을 포함하는 암 항원을 표적화하는 가공된 TCR의 발현을 유도한다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드에 의해 발현되도록 유도된 가공된 TCR은 하기 표 2에 열거된 항원 표적을 표적화하는 가공된 TCR이다.
일부 경우에, 특정 항원을 표적화하는 발현된 TCR은 항-[항원] TCR로서 기재될 수 있다. 따라서, 일부 경우에, 본원의 키메라 폴리펩타이드에 의해 발현되도록 유도될 수 있는 예시적 TCR은 다음을 포함하지만 이에 제한되지 않는다: 예를 들어, 항-NY-ESO-1 TCR; 항-MART-1 TCR; 항-MAGE-A3 TCR; 항-MAGE-A3 TCR; 항-CEA TCR; 항-gp100 TCR; 항-WT1 TCR; 항-HBV TCR; 항-gag (WT 및/또는r α/6) TCR; 항-P53 TCR; DR4 TCR에 결합된 항-TRAIL; 항-HPV-16 (E6 및/또는 E7) TCR; 항-서바이빈 TCR; 항-KRAS 돌연변이체 TCR; 항-SSX2 TCR; 항-MAGE-A10 TCR; 항-MAGE-A4 TCR; 항-AFP TCR; 등.
일부 경우에, TCR은 항-NY-ESO1 TCR (예를 들어, 항i-HLA-A2/NY-ESO1 scTv)이다. 일부 경우에, 항-NY-ESO1 TCR은 하기의 서열을 갖는다:
METLLGLLILWLQLQWVSSKQEVTQIPAALSVPEGENLVLNCSFTDSAIYNLQWFRQDPGKGLTSLLLIQSSQREQTSGRLNASLDKSSGRSTLYIAASQPGDSATYLCAVRPLLDGTYIPTFGRGTSLIVHPGSADDAKKDAAKKDGKSMSIGLLCCAALSLLWAGPVNAGVTQTPKFQVLKTGQSMTLQCAQDMNHEYMSWYRQDPGMGLRLIHYSVGAGTTDRGEVPNGYNVSRSTIEDFPLRLLSAAPSQTSVYFCASSYVGDTGELFFGEGSRLTVL (서열번호: 116).
유용한 TCR은 이들 각각의 항원에 대해 증진된 친화성을 갖는 것들뿐만 아니라 이들 각각의 항원에 대해 야생형 친화성을 갖는 것들을 포함한다. 이들 각각의 항원에 대해 증진된 친화성을 갖는 TCR은 “친화성 증진된” 또는 “증진된 친화성” TCR로서 언급될 수 있다. TCR의 친화성은 결합-부위 가공 (즉, 이상적 디자인), 스크리닝 (예를 들어, TCR 디스플레이) 등을 포함하지만 이에 제한되지 않는 임의의 간편한 수단에 의해 증진될 수 있다. 친화성 증진된 TCR 및 증진된 친화성 TCR을 생성시키는 방법의 비제한적인 예는 예를 들어 하기 문헌에 기재된 것들을 포함하지만 이에 제한되지 않는다: PCT 공개번호 20150118208, 2013256159, 20160083449; 20140349855, 20100113300, 20140371085, 20060127377, 20080292549, 20160280756, 20140065111, 20130058908, 20110038842, 20110014169, 2003276403 등; 이의 개시내용은 이들의 전문이 본원에 참조로 인용된다.
유용한 TCR은 일부 경우에 또한 하나 이상의 시스테인 변형을 포함하는 변형된 TCR 쇄를 포함한다. 상기 시스테인 변형은 2개의 변형된 TCR 쇄 사이에서 쌍을 형성할 수 있다. 2개의 TCR 쇄 사이에서 쌍을 형성하는 경우, 상응하는 변형은 쌍을 형성한 쇄 간에 재조합 디설파이드 결합을 유도할 수 있다.
일부 구현예에서, TCR은 알파 쇄에서 제1 시스테인 변형 및 베타 쇄에서 제2 시스테인 변형을 포함할 수 있고, 여기서, 상기 제1 및 제2 시스테인 변형은 쇄 둘 다가 세포 내 존재하는 경우, 상기 알파 쇄와 상기 베타 쇄 간에 재조합 디설파이드 결합을 형성한다. 재조합 디설파이드 결합을 형성하는 상기 시스테인 변형은 “상응하는 시스테인 변형”으로서 언급될 수 있다.
일부 경우에, 변형된 TCR 알파 쇄는 잔기의 시스테인으로의 치환을 포함할 수 있고 이는 재조합 디설파이드 결합을 생성하기에 충분한 시스테인 변형을 유도한다. 시스테인으로 돌연변이되는 경우 재조합 디설파이드 결합을 유도하는 TCR 베타 쇄에 상응하는 잔기를 갖는 TCR 알파 쇄의 임의의 적당한 잔기는 시스테인 변형된 알파 쇄를 생성하는데 사용될 수 있다. 일부 경우에, 치환된 잔기는 TCR 알파 불변 쇄에 존재하는 잔기이다. 일부 경우에, 상기 치환은 티로신의 시스테인으로의 치환이다. 일부 경우에, 상기 치환은 T48C 치환 또는 하기의 인간 TCR 알파 쇄 불변 영역 서열에 존재하는 T48C 치환과 같은 상응하는 돌연변이이다: PNIQNPDPAVYQLRDSKSSDKSVCLFTDFDSQTNVSQSKDSDVYITDKCVLDMRSMDFKSNSAVAWSNKSDFACANAFNNSIIPEDTFFPSPESSCDVKLVEKSFETDTNLNFQNLSVIGFRILLLKVAGFNLLMTLRLWSS (서열번호: 131).일부 경우에, 상기 치환은 T84C 치환 또는 하기의 마우스 TCR 알파 쇄 불변 영역 서열에 존재하는 T84C 치환과 같은 상응하는 돌연변이이다: PYIQNPEPAVYQLKDPRSQDSTLCLFTDFDSQINVPKTMESGTFITDKTVLDMKAMDSKSNGAIAWSNQTSFTCQDIFKETNACYPSSDVPCDATLTEKSFETDMNLNFQNLSVMGLRILLLKVAGFNLLMTLRLWSS (서열번호: 132).
일부 경우에, 본원의 TCR 알파 쇄 또는 이의 상응하는 도메인 (예를 들어, 알파 가변 도메인, 알파 불변 도메인, 알파 막관통 도메인, 알파 연결 펩타이드 도메인 등)은 예를 들어, T48C 또는 T84C 함유 TCR 알파 서열과 같은 시스테인 변형된 알파 쇄와 적어도 약 75%, 적어도 약 80%, 적어도 약 85%, 적어도 약 90%, 적어도 약 95%, 적어도 약 98%, 또는 100% 아미노산 서열 동일성을 가질 수 있다.
일부 경우에, 변형된 TCR 베타 쇄는 잔기의 시스테인으로의 치환을 포함할 수 있고 이는 재조합 디설파이드 결합을 생성하기에 충분한 시스테인 변형을 유도한다. 시스테인으로 돌연변이되는 경우 재조합 디설파이드 결합을 유도하는 TCR 베타 쇄에 상응하는 잔기를 갖는 TCR 베타 쇄의 임의의 적당한 잔기는 시스테인 변형된 베타 쇄를 생성하는데 사용될 수 있다. 일부 경우에, 치환된 잔기는 TCR 베타 불변 쇄에 존재하는 잔기이다. 일부 경우에, 상기 치환은 세린의 시스테인으로의 치환이다. 일부 경우에, 상기 치환은 S58C 치환 또는 하기의 인간 TCR 베타 쇄 불변 영역 서열에 존재하는 S58C 치환과 같은 상응하는 돌연변이이다: EDLNKVFPPEVAVFEPSEAEISHTQKATLVCLATGFFPDHVELSWWVNGKEVHSGVCTDPQPLKEQPALNDSRYCLSSRLRVSATFWQNPRNHFRCQVQFYGLSENDEWTQDRAKPVTQIVSAEAWGRADCGFTSVSYQQGVLSATILYEILLGKATLYAVLVSALVLMAMVKRKDF (서열번호: 133).일부 경우에, 상기 치환은 S79C 치환 또는 하기의 마우스 TCR 베타 쇄 불변 영역 서열에 존재하는 S79C 치환과 같은 상응하는 돌연변이이다: EDLRNVTPPKVSLFEPSKAEIANKQKATLVCLARGFFPDHVELSWWVNGKEVHSGVSTDPQAYKESNYSYCLSSRLRVCATFWHNPRNHFRCQVQFHGLSEEDKWPEGSPKPVTQNISAEAWGRADCGITSASYQQGVLSATILYEILLGKATLYAVLVSTLVVMAMVKRKNS (서열번호: 134).
일부 경우에, 본원의 TCR 베타 쇄 또는 이의 상응하는 도메인 (예를 들어, 베타 가변 도메인, 베타 불변 도메인, 베타 막관통 도메인, 베타 연결 펩타이드 도메인 등)은 예를 들어, 상기 제공된 S58C 또는 S79C 함유 TCR 베타 서열과 같은 시스테인 변형된 베타 쇄와 적어도 약 75%, 적어도 약 80%, 적어도 약 85%, 적어도 약 90%, 적어도 약 95%, 적어도 약 98%, 또는 100% 아미노산 서열 동일성을 가질 수 있다.
일부 경우에서, 치료학적 POI는 선천적 면역 반응 유도제일 수 있다. 본원에 사용된 바와 같은, “천연적-면역 반응 유도제”는 포유동물 내 발현되는 경우 선천성 면역 반응을 유도하는 임의의 단백질을 의미한다. 선천성 면역 유도제는 예를 들어, 세균으로부터 유래된 단백질 또는 이의 단편, 바이러스로부터 유래된 단백질 또는 이의 단편, 진균류로부터 유래된 단백질 또는 이의 단편, 예를 들어, 인간 기생충을 포함하는 포유동물 기생충으로부터 유래된 단백질 또는 이의 단편을 포함하지만 이에 제한되지 않는다. 포유동물 세포에 의해 발현되는 경우 선천성 면역 반응을 유도하는 임의의 단백질은 본원의 개시내용의 선천성-면역 유도제로서 유용할 수 있다. 일부 경우에, 선천성 면역 반응 유도제는 플라겔린 단백질일 수 있다.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드는 세포 상에서 발현되어, 키메라 폴리펩타이드의 특이적 결합 파트너에 결합 시, 키메라 폴리펩타이드의 세포내 도메인은 세포 내 핵산 서열로부터 항-면역 반응 유도제의 전사를 유도할 수 있다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드는 세포 상에서 발현되어, 펩타이드-MHC 특이적 결합 파트너에 결합 시, 키메라 폴리펩타이드의 세포내 도메인은 선천성-면역 반응 유도제의 전사를 유도할 수 있다.
일부 경우에서, 치료학적 POI는 면역 억제 인자일 수 있다. 본원에 사용된 바와 같은, “면역 억제 인자”는 포유동물 내 발현되는 경우 면역 반응을 억제하는 임의의 단백질을 의미한다. 면역 억제 인자는 예를 들어, 면역억제 사이토킨(예를 들어, IL-10), 면역억제 세포-대-세포 신호전달 리간드(예를 들어, PD-L1), 면역억제 분비된 단백질(예를 들어, TGF-베타), 면역억제 항체(예를 들어, 항-CD3 항체(예를 들어, 오르토클론 OKT3 (또한 무로모납-CD3) 등), 항-CD25 항체, (예를 들어, 바실릭시맙, 다클리주맙 등) 항-CD52 항체(예를 들어, 캄파트-1H (또한 알렘투주맙으로서 공지된) 등) 등을 포함하지만 이에 제한되지 않는다. 포유동물 세포에 의해 발현되는 경우 면역 반응을 억제하는 임의의 단백질은 본원의 개시내용의 면역 억제 인자로서 유용할 수 있다. 일부 경우에, 면역 억제 인자는 IL-10일 수 있다. 일부 경우에, 면역 억제 인자는 PD-L1일 수 있다. 일부 경우에, 면역 억제 인자는 TGF-베타일 수 있다. 일부 경우에, 면역 억제 인자는 면역억제 항체(예를 들어, (예를 들어, 항-CD3 항체 (예를 들어, 오르토클론 OKT3 (또한 무로모납-CD3) 등으로서 공지된), 항-CD25 항체, (예를 들어, 바실릭시맙, 다클리주맙 등), 항-CD52 항체(예를 들어, 캄파트-1H (또한 알렘투주맙으로서 공지된) 등)일 수 있다.
일부 경우에, 키메라 폴리펩타이드는 예를 들어, 면역억제 사이토킨 및 면역억제 세포-대-세포 신호전달 리간드, 2개 이상의 면역억제 사이토킨, 2개 이상의 면역억제 세포-대-세포 신호전달 리간드 등을 포함하는 2개 이상의 면역 억제 인자의 발현을 구동할 수 있다. 일부 경우에, 키메라 폴리펩타이드는 IL-10 및 PD-L1의 발현을 구동할 수 있다. 일부 경우에, 키메라 폴리펩타이드는 3개 이상의 면역 억제 인자의 발현을 구동할 수 있다.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드는 세포 상에서 발현되어, 키메라 폴리펩타이드의 특이적 결합 파트너에 결합 시, 키메라 폴리펩타이드의 세포내 도메인은 세포 내 핵산 서열로부터 면역 억제 인자의 전사를 유도할 수 있다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드는 세포 상에서 발현되어, 펩타이드-MHC 특이적 결합 파트너에 결합 시, 키메라 폴리펩타이드의 세포내 도메인은 면역 억제 인자의 전사를 유도할 수 있다.
일부 경우에, 치료학적 POI는 케모킨일 수 있다. 발현된 케모킨은 세포 이동을 포함하지만 이에 제한되지 않는 하나 이상의 세포 거동에 영향을 미칠 수 있다. 일부 경우에, 본원의 개시내용의 키메라 수용체 폴리펩타이드의 세포내 도메인은 케모킨의 발현을 유도할 수 있다. 적합한 케모킨의 예는 예를 들어, MIP-1, MIP-1β, MCP-1, RANTES, IP10 등을 포함한다. 적합한 케모킨의 추가의 예는 케모킨 (C-C 모티프) 리간드-2 (CCL2; 또한 단핵구 화학주성 단백질-1 또는 MCP1로서 언급됨); 케모킨 (C-C 모티프) 리간드-3 (CCL3; 또한 대식세포 염증 단백질-1A 또는 MIP1A로서 공지된); 케모킨 (C-C 모티프) 리간드-5 (CCL5; 또한 RANTES로서 공지된); 케모킨 (C-C 모티프) 리간드-17 (CCL17; 또한 흉선 및 활성화 조절된 케모킨 또는 TARC로서 공지된); 케모킨 (C-C 모티프) 리간드-19 (CCL19; 또한, EBI1 리간드 케모킨 또는 ELC로서 공지된); 케모킨 (C-C 모티프) 리간드-21 (CCL21; 또한 6Ckine으로서 공지된); C-C 케모킨 수용체 7형 (CCR7); 케모킨 (C-X-C 모티프) 리간드 9 (CXCL9; 또한 감마 인터페론 또는 MIG에 의해 유도된 모노킨으로서 공지된); 케모킨 (C-X-C 모티프) 리간드 10 (CXCL10; 또한 인터페론 감마-유도된 단백질 10 또는 IP-10으로서 공지된); 케모킨 (C-X-C 모티프) 리간드 11 (CXCL11; 또한 인터페론-유도성 T-세포 알파 화학유인제 또는 I-TAC); 케모킨 (C-X-C 모티프) 리간드 16 (CXCL16; 케모킨 (C 모티프) 리간드 (XCL1; 또한 림포택틴으로서 공지된); 및 대식세포 콜로니-자극 인자 (MCSF)를 포함하지만 이에 제한되지 않는다.
본원에 기재된 키메라 폴리펩타이드 및 방법 및 회로에 사용하기 위해 채택될 수 있는 특정 세포내 도메인 및 이의 성분은 예를 들어, PCT 출원 번호 US2016/019188에 기재된 것들을 포함하지만 이에 제한되지 않는다(공개번호 제 WO 2016/138034호), 이의 개시내용은 이의 전문이 본원에 참조로 인용됨.
추가의 폴리펩타이드
본원의 개시내용의 키메라 폴리펩타이드는 하나 이상의 추가의 폴리펩타이드를 추가로 포함할 수 있고, 여기서, 적합한 추가의 폴리펩타이드는 신호 서열; 에피토프 태그; 친화성 도메인; 핵 국소화 신호 (NLS); 및 검출가능한 신호를 생성하는 폴리펩타이드를 포함하지만 이에 제한되지 않는다. 하나 이상의 추가의 서열은 적당한 경우, 예를 들어, N-말단에서, C-말단에서, 2개의 도메인 사이에서 (예를 들어, 세포외 도메인과 막관통 도메인 사이에서, 세포외 도메인과 노치 수용체 폴리펩타이드 사이에서, 노치 수용체 폴리펩타이드와 세포내 신호전달 서열 사이에서 등)을 포함하는, 필수적으로 임의의 위치에서 키메라 폴리펩타이드에 부착될 수 있다. 추가의 서열은 독립적으로 다른 도메인의 키메라 폴리펩타이드와 기능할 수 있거나 키메라 폴리펩타이드의 임의의 도메인과 연합될 수 있고 함께 기능할 수 있다.
본원의 개시내용의 키메라 폴리펩타이드에 사용하기에 적합한 신호 서열은 천연적으로 존재하는 신호 서열, 합성 (예를 들어, 인조) 신호 서열 등을 포함하는, 임의의 진핵 세포 신호 서열을 포함한다.
적합한 에피토프 태그는 헤마글루티닌 (HA; 예를 들어, YPYDVPDYA (서열번호: 117); FLAG (예를 들어, DYKDDDDK (서열번호: 118); c-myc (예를 들어, EQKLISEEDL; 서열번호: 119) 등을 포함하지만 이에 제한되지 않는다.
친화성 도메인은 예를 들어, 동정 또는 정제를 위해 유용한, 고체 지지체 상에 고정화된 것과 같은 결합 파트너와 상호작용할 수 있는 펩타이드 서열을 포함한다. 본원의 개시내용의 키메라 폴리펩타이드와 융합되는 경우 다중 연속 단일 아미노산, 예를 들어, 히스티딘은 니켈 세파로스와 같은 수지 칼럼으로의 고친화성 결합에 의해 재조합 키메라 폴리펩타이드의 1-단계 정제를 위해 사용될 수 있다. 예시적 친화성 도메인은 His5 (HHHHH) (서열번호: 120), HisX6 (HHHHHH) (서열번호: 121), C-myc (EQKLISEEDL) (서열번호: 119), Flag (DYKDDDDK) (서열번호: 118), Strep 태그 (WSHPQFEK) (서열번호: 122), 헤마글리티닌, 예를 들어, HA 태그(YPYDVPDYA) (서열번호: 117), GST, 티오레독신, 셀룰로스 결합 도메인, RYIRS (서열번호: 123), Phe-His-His-Thr (서열번호124), 키틴 결합 도메인, S-펩타이드, T7 펩타이드, SH2 도메인, C-말단 RNA 태그, WEAAAREACCRECCARA (서열번호: 125), 금속 결합 도메인, 예를 들어, 아연 결합 도메인 또는 칼슘 결합 도메인, 예를 들어, 칼슘-결합 단백질로부터의 것들, 예를 들어, 칼모듈린, 트로포닌 C, 칼시뉴린 B, 미오신 경쇄, 레코베린, S-모듈린, 비시닌, VILIP, 뉴로칼신, 히포칼신, 프레쿠에닌, 칼트락틴, 칼파인 대형-서브유니트, S100 단백질, 파르브알부민, 칼빈딘 D9K, 칼빈딘 D28K, 및 칼레티닌, 인테인, 비오틴, 스트렙타비딘, MyoD, Id, 류신 지퍼 서열, 및 말토스 결합 단백질을 포함한다.
적합한 핵 국소화 신호 (“NLS”; 또한 본원에서 “핵 국소화 서열”로서 언급됨) 예를 들어, PKKKRKV (서열번호: 126); KRPAATKKAGQAKKKK (서열번호: 127); MVPKKKRK (서열번호: 128); MAPKKKRKVGIHGVPAA (서열번호: 129) 등을 포함한다. NLS는 본원의 키메라 폴리펩타이드의 N-말단에; 본원의 개시내용의 키메라 폴리펩타이드의 N-말단 근처에 (예를 들어, N-말단의 5개 아미노산 내, 10개 아미노산 내, 또는 20개 아미노산 내); 본원의 개시내용의 키메라 폴리펩타이드의 C-말단에; 본원의 개시내용의 키메라 폴리펩타이드의 C-말단 근처에 (예를 들어, C-말단의 5개 아미노산 내, 10개 아미노산 내, 또는 20개 아미노산 내); 또는 내부적으로 본원의 개시내용의 키메라 폴리펩타이드 내에 존재할 수 있다.
적합한 검출가능한 신호-생성 단백질은 예를 들어, 형광성 단백질; 생성물로서 검출가능한 신호를 생성하는 반응을 촉매하는 효소 등을 포함한다.
적합한 형광성 단백질은 녹색 형광성 단백질 (GFP) 또는 이의 변이체, GFP의 청색 형광성 변이체(BFP), GFP의 시안 형광성 변이체(CFP), GFP의 황색 형광성 변이체(YFP), 증진된 GFP (EGFP), 증진된 CFP (ECFP), 증진된 YFP (EYFP), GFPS65T, 에메랄드, Topaz (TYFP), 비너스(Venus), 시트린(Citrine), m시트린, GFPuv, 탈안정화된 EGFP (dEGFP), 탈안정화된 ECFP (dECFP), 탈안정화된 EYFP (dEYFP), mCFPm, 세룰레안, T-사피르, CyPet, YPet, mKO, HcRed, t-HcRed, DsRed, DsRed2, DsRed-단량체, J-Red, 이량체2, t-이량체2(12), mRFP1, 포실로포린, 레닐라 GFP, 몬스터 GFP, paGFP, 카에데(Kaede) 단백질 및 킨들링(kindling) 단백질, 피코빌리단백질 및 B-피코에리트린, R-피코에리트린 및 알로피코시아닌을 포함하는 피코빌리단백질 접합체를 포함하지만 이에 제한되지 않는다. 형광성 단백질의 다른 예는 mHoneydew, mBanana, mOrange, dTomato, tdTomato, mTangerine, mStrawberry, mCherry, mGrape1, mRaspberry, mGrape2, mPlum (Shaner 외 (2005) Nat. Methods 2:905-909) 등을 포함한다. 다음 문헌에 기재된 바와 같이 안토조안 종 (Anthozoan species)으로부터 임의의 다양한 형광성 및 착색된 단백질(문헌참조: 예를 들어, Matz 외 (1999) Nature Biotechnol.17:969-973)은 사용에 적합하다.
적합한 효소는 말 서양고추냉이 퍼옥시다제 (HRP), 알칼린 포스파타제 (AP), 베타-갈락토시다제 (GAL), 글루코스-6-포스페이트 데하이드로게나제, 베타-N-아세틸글루코사미니다제, β-글루쿠로니다제, 인버타제, 크산틴 옥시다제, 반딧불이 루시퍼라제, 글루코스 옥시다제 (GO) 등을 포함하지만 이에 제한되지 않는다.
본원에 기재된 키메라 폴리펩타이드 및 방법 및 회로에 사용하기 위해 채택될 수 있는 특정 추가의 수용체 폴리펩타이드 및 이의 성분은 예를 들어, PCT 출원 번호 US2016/019188에 기재된 것들을 포함하지만 이에 제한되지 않는다(공개번호 제 WO 2016/138034호), 이의 개시내용은 이의 전문이 본원에 참조로 인용됨.
핵산
본원의 개시내용은 본원의 개시내용의 단백질용해 절단가능한 키메라 폴리펩타이드를 암호화하는 뉴클레오타이드 서열을 포함하는 핵산을 제공한다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드를 암호화하는 뉴클레오타이드 서열을 포함하는 핵산은 발현 벡터 내에 함유된다. 따라서, 본원의 개시내용은 본원의 개시내용의 키메라 폴리펩타이드를 암호화하는 뉴클레오타이드 서열을 포함하는 핵산을 포함하는 재조합 발현 벡터를 제공한다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드를 암호화하는 뉴클레오타이드 서열은 전사 조절 요소 (예를 들어, 프로모터, 인핸서 등)에 작동적으로 연결된다).일부 경우에, 전사 조절 요소는 유도성이다. 일부 경우에, 전사 조절 요소는 항상성이다. 일부 경우에, 프로모터는 진핵 세포에서 기능성이다. 일부 경우에, 프로모터는 세포 유형-특이적 프로모터이다. 일부 경우에, 프로모터는 조직-특이적 프로모터이다.
사용되는 숙주/벡터 시스템에 의존하여, 항상성 및 유도성 프로모터, 전사 인핸서 요소, 전사 종결인자 등을 포함하는, 임의의 다수의 적합한 전사 및 해독 조절 요소들은 발현 벡터에 사용될 수 있다(문헌참조: 예를 들어, Bitter 외 (1987) Methods in Enzymology, 153:516-544).
프로모터는 항상성 활성 프로모터 (즉, 활성/”ON” 상태에서 항상성인 프로모터)일 수 있고, 이것은 유도성 프로모터(즉, 이의 상태로서 활성/”ON” 또는 불활성/”OFF” 상태가 외부 자극에 의해, 예를 들어, 특정 온도, 화합물 또는 단백질의 존재에 의해 조절되는 프로모터)일 수 있고, 이것은 공간적으로 제한된 프로모터 (즉, 전사 조절 요소, 인핸서 등) (예를 들어, 조직 특이적 프로모터, 세포 유형 특이적 프로모터 등)일 수 있고, 이것은 일시적으로 제한된 프로모터 (즉, 배아 발육의 특이적 단계 동안에 또는 생물학적 공정, 예를 들어, 마우스에서 모발 모낭 사이클의 특이적 단계 동안에 “ON” 상태 또는 “OFF” 상태인 프로모터)일 수 있다.
적합한 프로모터 및 증진제 요소들은 당업계에 공지되어 있다. 세균 세포에서 발현을 위해, 적합한 프로모터는 lacI, lacZ, T3, T7, gpt, 람다 P 및 trc를 포함하지만 이에 제한되지 않는다. 진핵 세포에서 발현하기 위해, 적합한 프로모터는 경쇄 및/또는 중쇄 면역글로불린 유전자 프로모터 및 인핸서 요소; 사이토메갈로바이러스 이메디에이트 어얼리 프로모터; 헤르페스 심플렉스 바이러스 티미딘 키나제 프로모터; 어얼리 및 레이트 SV40 프로모터; 레트로바이러스 기원의 긴 말단 반복체에 존재하는 프로모터; 마우스 메탈로티오네인-I 프로모터; 및 다양한 당업계 공지된 조직 특이적 프로모터를 포함하지만 이에 제한되지 않는다.
일부 경우에, 본원에 기재된 핵산의 전사 조절 요소는 시스-작용 조절 서열을 포함할 수 있다. 임의의 적합한 시스-작용 조절 서열은 본원에 기재된 핵산에 유용할 수 있다. 예를 들어, 일부 경우에, 시스-작용 조절 서열은 업스트림 활성화 서열 또는 업스트림 활성화 서열 (UAS)일 수 있거나 이를 포함할 수 있다. 일부 경우에, 본원에 기재된 핵산의 UAS는 Gal4 반응성 UAS일 수 있다.
가역적 유도성 프로모터를 포함하는 적합한 가역적 프로모터는 당업계에 공지되어 있다. 상기 가역적 프로모터는 많은 유기체, 예를 들어, 진핵 세포 및 원핵 세포로부터 단리될 수 있고 이로부터 유래될 수 있다. 제2 유기체에 사용하기 위한 제1 유기체, 예를 들어 제1 진핵 세포 및 제2 진핵 세포, 제1 진핵 세포 및 제2 원핵 세포 등으로부터 유래된 가역적 프로모터의 변형은 당업계에 널리 공지되어 있다. 상기 가역적 프로모터, 및 상기 가역적 프로모터를 기반으로 하지만 또한 추가의 조절 단백질을 포함하는 시스템은 알콜 조절된 프로모터 (예를 들어, 알콜 데하이드로게나제 I (alcA) 유전자 프로모터, 알콜 트랜스활성화 단백질 (AIcR)에 반응하는 프로모터 등)), 테트라사이클린 조절된 프로모터, (예를 들어, Tet활성화인자, TetON, TetOFF 등을 포함하는 프로모터 시스템), 스테로이드 조절된 프로모터 (예를 들어, 래트 글루코코르티코이드 수용체 프로모터 시스템, 인간 에스트로겐 수용체 프로모터 시스템, 레티노이드 프로모터 시스템, 갑상선 프로모터 시스템, 엑디손(ecdysone) 프로모터 시스템, 미페프리스톤(mifepristone) 프로모터 시스템등), 금속 조절된 프로모터 (예를 들어, 메탈로티오네인 프로모터 시스템 등), 발병-관련된 조절된 프로모터 (예를 들어, 살리실산 조절된 프로모터, 에틸렌 조절된 프로모터, 벤조티아디아졸 조절된 프로모터 등), 온도 조절된 프로모터 (예를 들어, 열 쇼크 유도성 프로모터(예를 들어, HSP-70, HSP-90, 대두 열 쇼크 프로모터 등), 경쇄 조절된 프로모터, 합성 유도성 프로모터 등을 포함하지만 이에 제한되지 않는다.
사용에 적합한 유도성 프로모터는 본원에 기재되거나 당업자에게 공지된 임의의 유도성 프로모터를 포함한다. 유도성 프로모터의 예는 제한 없이 화학적/생화학적 조절되고 물리적으로 조절된 프로모터, 예를 들어, 알콜-조절된 프로모터, 테트라사이클린-조절된 프로모터(예를 들어, 언하이드로테트라사이클린 (aTc)-반응성 프로모터 및 다른 테트라사이클린-반응성 프로모터 시스템을 포함하고, 이는 테트라사이클린 리프레서 단백질 (tetR), 테트라사이클린 작동인자 서열(tetO) 및 테트라사이클린 트랜스활성화인자 융합 단백질 (tTA)), 스테로이드-조절된 프로모터(예를 들어, 래트 글루코코르티코이드 수용체, 인간 에스트로겐 수용체, 모트엑디손 수용체 기반이 되는 프로모터, 및 스테로이드/레티노이드/티로이드 수용체 슈퍼패밀리로부터의 프로모터), 금속-조절된 프로모터(예를 들어, 호모, 마우스 및 인간으로부터 메탈로티오네인 (금속 이온을 결합하고 격리시키는 단백질) 유전자 로부터 유래하는 프로모터), 발병-조절된 프로모터 (예를 들어, 살리실산, 에틸렌 또는 벤조티아디아졸(BTH)에 의해 유도된), 온도/열-유도성 프로모터(예를 들어, 열 쇼크 프로모터), 및 광-조절된 프로모터(예를 들어, 식물 세포로부터 광 반응성 프로모터)를 포함한다.
일부 경우에, 프로모터는 CD8 세포-특이적 프로모터, CD4 세포-특이적 프로모터, 호중구-특이적 프로모터, 또는 NK-특이적 프로모터이다. 예를 들어, CD4 유전자 프로모터가 사용될 수 있고 예를 들어, 하기 문헌을 참조한다: Salmon 외 (1993) Proc. Natl. Acad. Sci. USA 90:7739; 및 Marodon 외 (2003) Blood 101:3416.또 다른 예로서, CD8 유전자 프로모터가 사용될 수 있다. NK 세포-특이적 발현은 Ncr1 (p46) 프로모터를 사용함에 의해 성취될 수 있고; 예를 들어, 하기 문헌을 참조한다: Eckelhart 외 (2011) Blood 117:1565.
일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드를 암호화하는 뉴클레오타이드 서열을 포함하는 핵산은 재조합 발현 벡터이거나 재조합 발현 벡터 내에 포함된다. 일부 구현예에서, 재조합 발현 벡터는 바이러스 작제물, 예를 들어, 재조합 아데노-관련 바이러스(AAV) 작제물, 재조합 아데노바이러스 작제물, 재조합 렌티바이러스 작제물, 재조합 레트로바이러스 작제물 등이다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드를 암호화하는 뉴클레오타이드 서열을 포함하는 핵산은 재조합 렌티바이러스 벡터이다. 일부 경우에, 본원의 개시내용의 키메라 폴리펩타이드를 암호화하는 뉴클레오타이드 서열을 포함하는 핵산은 재조합 AAV 벡터이다.
적합한 발현 벡터는 바이러스 벡터 (예를 들어. 백시니아 바이러스 기반의 바이러스 벡터; 폴리오바이러스; 아데노바이러스(문헌참조: 예를 들어, Li 외, Invest Opthalmol Vis Sci 35:2543 2549, 1994; Borras 외, Gene Ther 6:515 524, 1999; Li 및 Davidson, PNAS 92:7700 7704, 1995; Sakamoto 외, Hum Gene Ther 5:1088 1097, 1999; WO 94/12649, WO 93/03769; WO 93/19191; WO 94/28938; WO 95/11984 및 WO 95/00655); 아데노-관련 바이러스(문헌참조: 예를 들어, Ali 외, Hum Gene Ther 9:81 86, 1998, Flannery 외, PNAS 94:6916 6921, 1997; Bennett 외, Invest Opthalmol Vis Sci 38:2857 2863, 1997; Jomary 외, Gene Ther 4:683 690, 1997, Rolling 외, Hum Gene Ther 10:641 648, 1999; Ali 외, Hum Mol Genet 5:591 594, 1996; Srivastava in WO 93/09239, Samulski 외, J. Vir. (1989) 63:3822-3828; Mendelson 외, Virol. (1988) 166:154-165; 및 Flotte 외, PNAS (1993) 90:10613-10617); SV40; 헤르페스 심플렉스 바이러스; 사람 면역결핍 바이러스 (문헌참조: 예를 들어, Miyoshi 외, PNAS 94:10319 23, 1997; Takahashi 외, J Virol 73:7812 7816, 1999); 레트로바이러스 벡터(예를 들어, 뮤린 백혈병 바이러스, 비장 괴사 바이러스, 및 라우스 사코마 바이러스(Rous Sarcoma Virus), 하베이 사코마 바이러스, 아비안 류코시스 바이러스(avian leukosis virus), 렌티바이러스, 인간 면역결핍 바이러스, 골수증식성 사코마 바이러스(myeloproliferative sarcoma virus), 및 포유동물 종양 바이러스)와 같은 레트로바이러스로부터 유래된 벡터 등을 포함하지만 이에 제한되지 않는다. 일부 경우에, 상기 벡터는 렌티바이러스 벡터이다. 또한, 트랜스포존-매개된 벡터, 예를 들어, 피기백 (piggyback) 및 슬리핑 뷰티 벡터가 적합하다.
본원의 개시내용의 핵산은 목적하는 폴리펩타이드 (POI)를 암호화하는 핵산 서열을 포함할 수 있다. POI는 필수적으로 임의의 폴리펩타이드일 수 있고, 연구 목적의 폴리펩타이드(예를 들어, 리포터 폴리펩타이드, 돌연변이된 폴리펩타이드, 신규한 합성 폴리펩타이드 등), 치료학적 목적의 폴리펩타이드(예를 들어, 천연적으로 존재하는 치료학적 단백질, 재조합 치료학적 폴리펩타이드 등), 산업 목적의 폴리펩타이드(예를 들어, 제조와 같은 산업적 응용에 사용되는 폴리펩타이드) 등을 포함할 수 있지만 이에 제한되지 않는다.
일부 경우에서, POI는 전사 활성화인자일 수 있다. 일부 경우에서, POI는 CAR일 수 있다. 일부 경우에서, POI는 TCR일 수 있다. 일부 경우에서, POI는 항체일 수 있다. 일부 경우에서, POI는 키메라 이중특이적 결합 구성원일 수 있다. 일부 경우에서, POI는 선천성-면역 반응 유도제일 수 있다. 일부 경우에서, POI는 면역 억제 인자일 수 있다. 일부 경우에서, POI는 본원에 기재된 바와 같은, 예를 들어, 본원에 기재된 바와 같은 다중-성분 회로에 사용된 바와 같은 단백질용해 절단가능한 키메라 폴리펩타이드일 수 있다.
본원에 기재된 키메라 폴리펩타이드 및 방법 및 회로에 사용하기 위해 채택될 수 있는 특정 핵산 및 성분은 예를 들어, PCT 출원 번호 US2016/019188에 기재된 것들을 포함하지만 이에 제한되지 않는다(공개번호 제 WO 2016/138034호), 이의 개시내용은 이의 전문이 본원에 참조로 인용됨.
세포
본원의 개시내용은 본원에 기재된 바와 같은 키메라 폴리펩타이드를 발현하도록 가공된 세포를 포함한다. 일부 경우에, 본원의 개시내용의 세포는 본원에 기재된 바와 같은 키메라 폴리펩타이드를 암호화하는 핵산을 포함한다. 일부 경우에, 본원의 개시내용의 세포는 전사 조절 요소, 예를 들어, 본원의 개시내용의 키메라 폴리펩타이드의 유리된 세포내 도메인에 반응하여 키메라 폴리펩타이드의 활성화시 핵산의 발현을 유도하는 전사 활성화인자에 작동적으로 연결된 핵산을 포함한다. 목적하는 임의의 폴리펩타이드는 본원의 개시내용의 키메라 폴리펩타이드에 반응하는 전사 조절 요소에 작동적으로 연결된 세포 내 핵산으로부터 암호화될 수 있다.
본원의 개시내용의 방법은 임의의 진핵 세포의 활성을 조절하기 위해 사용될 수 있다. 일부 경우에, 상기 세포는 생체내이다. 일부 경우에, 상기 세포는 생체외이다. 일부 경우에, 상기 세포는 시험관내이다. 일부 경우에, 상기 세포는 포유동물 세포이다. 일부 경우에, 세포는 인간 세포이다. 일부 경우에, 세포는 비-인간 영장류 세포이다. 일부 경우에, 상기 세포는 설치류 세포이다. 일부 경우에, 상기 세포는 마우스 세포이다. 일부 경우에, 상기 세포는 래트 세포이다.
적합한 세포는 신경 세포; 간 세포; 신장 세포; 면역 세포; 심장 세포; 골격근 세포; 평활근 세포; 폐 세포 등을 포함한다.
적합한 세포는 줄기 세포(예를 들어. 배아성 줄기(ES) 세포, 유도된 다능성 시스템(iPS) 세포; 생식 세포 (예를 들어, 난모세포, 정자, 난원세포, 정원 세포 등); 체세포, 예를 들어. 섬유아세포, 희소돌기신경교, 신경교세포, 조혈 세포, 뉴런, 근육 세포, 골 세포, 간세포, 췌장 세포 등을 포함한다.
적합한 세포는 인간 배아 줄기 세포, 태아 심근세포, 근섬유아세포, 간엽 줄기 세포, 자가이식된 확장된 심근세포, 지방세포, 전능 세포, 다능성 세포, 혈액 줄기 세포, 근원세포, 성인 줄기 세포, 골수 세포, 간엽 세포, 배아성 줄기 세포, 조직질실 세포, 상피 세포, 내피 세포, 중피 세포, 섬유아세포, 골아세포, 연골세포, 외인성 세포, 내인성 세포, 줄기 세포, 조혈 줄기 세포, 골수 유래된 선조체 세포, 심근 세포, 골격 세포, 태아 세포, 미분화 세포, 다분화능 선조체 세포, 단일분화능 선조체 세포, 단핵구, 심장 근아세포 근원세포, 골격 근원세포, 대식세포, 모세관 내피 세포, 이종 세포, 동종 세포, 및 생후 줄기 세포를 포함한다.
일부 경우에, 세포는 면역 세포, 뉴런, 상피 세포 및 내피 세포 또는 줄기 세포이다. 일부 경우에, 면역 세포는 T 세포, B 세포, 단핵구, 천연 킬러 세포, 수지상 세포,또는 대식세포이다. 일부 경우에, 상기 면역 세포는 세포독성 T 세포이다. 일부 경우에, 상기 면역 세포는 헬퍼 T 세포이다. 일부 경우에, 상기 면역 세포는 조절 T 세포(Treg)이다.
일부 경우에, 상기 세포는 줄기 세포이다. 일부 경우에, 상기 세포는 유도된 다능성 줄기 세포이다. 일부 경우에, 상기 세포는 간엽 줄기 세포이다. 일부 경우에, 상기 세포는 조혈 줄기 세포이다. 일부 경우에, 상기 세포는 성인 줄기 세포이다.
적합한 세포는 기관지폐포 줄기 세포 (BASCs), 벌즈 (bulge) 상피 줄기 세포(bESC), 각막 상피 줄기 세포(CESC), 심장 줄기 세포 (CSC), 상피 신경관 줄기 세포 (eNCSC), 배아성 줄기 세포(ESC), 내피 선조체 세포 (EPC), 간 난원형 세포 (HOC), 조혈 줄기 세포 (HSC), 케라티노사이트 줄기 세포 (keratinocyte stem cell) (KSC), 간엽 줄기 세포 (MSC), 신경 줄기 세포 (NSC), 췌장 줄기 세포 (PSC), 망막 줄기 세포 (RSC), 및 피부-유래된 전구체 (SKP)를 포함한다.
일부 경우에, 줄기 세포는 조혈 줄기 세포 (HSC)이고, 전사 인자는 HSC를 적혈구 세포, 혈소판, 림프구, 단핵구, 호중구, 호염구 또는 호산구로 분화시키기 위한 분화를 유도한다. 일부 경우에, 줄기 세포는 간엽 줄기 세포(MSC)이고, 전사 인자는 MSC의 연결 조직 세포, 예를 들어, 골 세포, 연골, 평활근, 건, 인대, 간질, 골수, 피부 또는 지방으로의 분화를 유도한다.
본원의 개시내용의 세포는 유전학적으로 변형된, 예를 들어, 본원의 개시내용의 핵산으로 변형된 숙주 세포, 즉, 본원의 개시내용의 키메라 폴리펩타이드를 암호화하는 뉴클레오타이드 서열을 포함하는 핵산으로 유전학적으로 변형된 숙주 세포일 수 있다. 하나의 구현예에서, 본원의 개시내용은 세포, 예를 들어, 본원의 개시내용의 핵산을 함유하도록 유전학적으로 변형된 숙주 세포에서 이종성 폴리펩타이드의 발현을 유도하는 방법을 제공한다. 방법은 일반적으로 세포를 본원의 개시내용의 키메라 폴리펩타이드의 특이적 결합 구성원의 결합 파트너와 접촉시킴을 포함한다. 상기 결합은 하나 이상의 단백질용해 절단 부위에서 노치 수용체 폴리펩타이드의 절단을 유도함으로써 세포내 도메인을 방출시킨다. 세포내 도메인의 방출은 세포의 활성을 조절할 수 있고, 예를 들어, 이종성 유전자 또는 암호화서열의 발현을 유도할 수 있다.
하나의 구현예에서, 본원의 개시내용의 방법은 일반적으로 세포를, 본원의 개시내용의 키메라 폴리펩타이드의 특이적 결합 구성원과 결합하는 펩타이드-MHC와 접촉시킴을 포함한다. 상기 결합은 하나 이상의 단백질용해 절단 부위에서 노치 수용체 폴리펩타이드의 절단을 유도함으로써 세포내 도메인을 방출시킨다. 세포내 도메인의 방출은 세포의 활성을 조절할 수 있고, 예를 들어, 이종성 유전자 또는 암호화서열의 발현을 유도할 수 있다.
일부 경우에, 세포는 진핵 세포이다. 일부 경우에, 세포는 포유동물 세포, 양서류 세포, 파충류 세포, 조류 세포 또는 식물 세포이다. 일부 경우에, 상기 세포는 식물 세포이다.
일부 경우에, 상기 세포는 포유동물 세포이다. 일부 경우에, 세포는 인간 세포이다. 일부 경우에, 상기 세포는 마우스 세포이다. 일부 경우에, 상기 세포는 래트 세포이다. 일부 경우에, 세포는 비-인간 영장류 세포이다. 일부 경우에, 상기 세포는 토끼목 포유동물 세포이다. 일부 경우에, 상기 세포는 유제류 세포이다.
일부 경우에, 상기 세포는 면역 세포, 예를 들어, T 세포, B 세포, 대식세포, 수지상 세포l, 천연 킬러 세포, 단핵구 등이다. 일부 경우에, 상기 세포는 T 세포이다. 일부 경우에, 상기 세포는 세포독성 T 세포 (예를 들어, CD8+ T 세포)이다. 일부 경우에, 상기 세포는 헬퍼 T 세포 (예를 들어, CD4+ T 세포)이다. 일부 경우에, 상기 세포는 조절 T 세포(“Treg”)이다. 일부 경우에, 상기 세포는 B 세포이다. 일부 경우에, 상기 세포는 대식세포이다. 일부 경우에, 상기 세포는 수지상 세포이다. 일부 경우에, 상기 세포는 말초 혈액 단핵 세포이다. 일부 경우에, 상기 세포는 단핵구이다. 일부 경우에, 세포는 천연 킬러 (NK) 세포이다. 일부 경우에, 상기 세포는 CD4+, FOXP3+ Treg 세포이다. 일부 경우에, 상기 세포는 CD4+, FOXP3- Treg 세포이다.
일부 경우에, 상기 세포는 개체로부터 수득된다. 예를 들어, 일부 경우에, 상기 세포는 1차 세포이다. 또 다른 예로서, 상기 세포는 개체로부터 수득된 줄기 세포 또는 선조체 세포이다.
하나의 비제한적인 예로서, 일부 경우에, 상기 세포는 개체로부터 수득된 면역 세포이다. 하나의 예로서, 상기 세포는 개체로부터 수득된 T 림프구일 수 있다. 또 다른 예로서, 상기 세포는 개체로부터 수득된 세포독성 세포 (예를 들어, 세포독성 T 세포, 헬퍼 T 세포 등)이다. 또 다른 예로서, 상기 세포는 개체로부터 수득된 헬퍼 T 세포일 수 있다. 또 다른 예로서, 상기 세포는 개체로부터 수득된 조절 T 세포일 수 있다. 또 다른 예로서, 상기 세포는 개체로부터 수득된 NK 세포일 수 있다. 또 다른 예로서, 상기 세포는 개체로부터 수득된 대식세포일 수 있다. 또 다른 예로서, 상기 세포는 개체로부터 수득된 수지상 세포일 수 있다. 또 다른 예로서, 상기 세포는 개체로부터 수득된 B 세포일 수 있다. 또 다른 예로서, 상기 세포는 개체로부터 수득된 말초 혈액 단핵 세포일 수 있다.
일부 경우에, 숙주 세포는 체세포, 예를 들어, 섬유아세포, 조혈 세포, 뉴런, 췌장 세포, 근육 세포, 골 세포, 간 세포, 췌장 세포, 상피 세포, 내피 세포, 심근세포, T 세포, B 세포, 골 세포 등이다.
일부 경우에, 세포는 예를 들어, 본원의 개시내용의 2개의 상이한 키메라 폴리펩타이드, 본원의 개시내용의 3개의 상이한 키메라 폴리펩타이드, 본원의 개시내용의 4개의 상이한 키메라 폴리펩타이드, 본원의 개시내용의 5개의 상이한 키메라 폴리펩타이드를 포함하지만 이에 제한되지 않는 본원의 개시내용의 2개 이상의 상이한 키메라 폴리펩타이드를 발현하도록 유전학적으로 변형된다.
본원에 기재된 키메라 폴리펩타이드에 사용하기 위해 채택될 수 있고/있거나 방법 및 회로에 조절될 수 있는 특정 세포 및 성분들 및 이의 활성은 예를 들어, 하기 문헌에 기재된 것들을 포함하지만 이에 제한되지 않는다: PCT 출원 번호 US2016/019188(공개에 기재된 것들을 포함하지만 이에 제한되지 않는다. 번호 제 WO 2016/138034호), 이의 개시내용은 이의 전문이 본원에 참조로 인용됨.
회로
본원의 개시내용의 키메라 폴리펩타이드의 세포내 도메인은 세포외 도메인의 특이적 결합 구성원으로의 결합 파트너의 결합 시 방출되는 경우 본원에 기재된 바와 같은 다양한 폴리펩타이드의 발현을 유도할 수 있다. 일부 경우에, 2개 이상의 폴리펩타이드의 유도된 발현은 논리적 게이트된 회로를 생성할 수 있다. 상기 논리적 게이트된 회로는 예를 들어, “및 게이트”, “OR 게이트”, “NOT 게이트” 및 이의 조합을 포함할 수 있지만 이에 제한되지 않고, 이는 예를 들어, 보다 높은 정도의 게이트를 포함하고, 이는 예를 들어, 보다 높은 정도의 및 게이트, 보다 높은 정도의 OR 게이트, 보다 높은 정도의 NOT 게이트, 보다 높은 정도의 조합된 게이트(즉, 및, OR 및/또는 NOT 게이트의 일부 조합을 사용한 게이트)를 포함한다.
본원의 개시내용의 “및” 게이트는 2개 이상의 인풋이 신호의 전파를 위해 요구되는 경우를 포함한다. 예를 들어, 일부 경우에, 및 게이트는 본원의 개시내용의 키메라 폴리펩타이드 및 2차 결합-의존성 분자를 통한 신호전달을 허용한다. 및 게이트에서, 2개의 인풋, 예를 들어, 2개의 항원은 회로를 통한 신호 전달을 위해 요구된다.
본원의 개시내용의 “OR” 게이트는 2개 이상의 인풋 중 어느 하나가 신호의 전파를 허용할 수 있는 경우를 포함한다. 예를 들어, 일부 경우에, OR 게이트는 본원의 개시내용의 2개의 상이한 키메라 폴리펩타이드 중 어느 하나를 통한 신호전달을 허용한다. OR 게이트에서, 임의의 하나의 인풋, 예를 들어, 2개의 항원 중 어느 하나는 회로의 신호전달 아웃풋을 유도할 수 있다. 하나의 구현예에서, OR 게이트는 2개의 별도의 분자 또는 작제물의 사용을 통해 성취될 수 있다. 또 다른 구현예에서, OR 게이트는 예를 들어, 각각 상이한 결합 파트너에 결합하지만 이중 하나가 키메라 폴리펩타이드를 활성화시킬 수 있는 2개의 상이한 특이적 결합 구성원을 갖는 단백질용해 절단가능한 키메라 폴리펩타이드를 포함하는, 2개의 항원을 인지하는 단일 작제물의 사용을 통해 성취될 수 있다. 일부 경우에, OR 게이트는 예를 들어, 각각 상이한 항원에 결합하지만 이중 하나의 항원이 키메라 폴리펩타이드를 활성화시킬 수 있는 2개의 상이한 특이적 결합 구성원을 갖는 단백질용해 절단가능한 키메라 폴리펩타이드를 포함하는, 2개의 항원을 인지하는 단일 작제물의 사용을 통해 성취될 수 있다.
본원의 개시내용의 “NOT” 게이트는 인풋이 신호의 전파를 차단할 수 있는 경우를 포함한다. 예를 들어, 일부 경우에, NOT 게이트는 본원의 개시내용의 키메라 폴리펩타이드를 통한 신호 전달을 저해한다. 하나의 구현예에서, NOT 게이트는 결합 상호작용의 저해를 포함할 수 있다. 예를 들어, 본원의 개시내용의 스플릿 키메라 폴리펩타이드의 일부의 결합을 차단하는 경쟁적 저해제는 회로를 통한 신호전달을 차단하는 NOT 게이트로서 작용할 수 있다. 또 다른 구현예에서, NOT 게이트는 회로의 요소의 기능적 저해를 포함할 수 있다. 예를 들어, 본원의 개시내용의 키메라 폴리펩타이드를 통한 신호전달 또는 회로를 통한 신호전달 결과를 기능적으로 차단하는 저해제는 NOT 게이트로서 작용할 수 있다.
일부 경우에, 면역억제제 (예를 들어, 면역 억제 인자)의 생성은 본원에 기재된 다중-인풋 회로에서 NOT 게이트 기능성을 제공할 수 있다.
다중-인풋 게이트는 NOT 게이트를 활성화시키는 신호 (예를 들어, 특정 음성 항원)이 존재할 때 및/또는 존재하는 경우에 회로의 일부 다른 성분을 통한 신호전달을 차단하거나 세포 반응을 중단시키기 위해 다양한 상이한 방식으로 NOT 게이트를 사용할 수 있다. 예를 들어, 및+NOT 게이트는 제1 항원의 존재에서 특정 세포 활성에 양성으로 영향을 미치는 본원의 개시내용의 키메라 폴리펩타이드 및 제2 항원의 존재에서 세포 활성에 음성으로 영향을 미치는 본원의 개시내용의 키메라 폴리펩타이드를 포함할 수 있다.
일부 경우에, 본원의 개시내용의 회로는 세포내 항원의 펩타이드를 나타내는 펩타이드-MHC 복합체에 특이적인 특이적 결합 구성원에 의해 제공되는 세포내 항원의 인지를 사용할 수 있다. 세포내 항원 인지를 사용하는 회로는 일부 경우에 세포내 항원 인지와 제2 항원의 인지를 커플링시킬 수 있고, 여기서, 상기 제2 항원은 또한 세포내 항원일 수 있거나 세포외 (예를 들어, 표면 발현된) 항원일 수 있다. 따라서, 일부 경우에, 회로는 “내부-내부(inside-inside)” 회로일 수 있고 여기서, 상기 회로는 2개의 세포내 항원의 인지에 의존한다. 일부 경우에, 회로는 “내부-외부(inside-outside)” 회로일 수 있고, 여기서, 상기 회로는 세포내 항원의 제1 인지 및 세포외 항원의 제2 인지에 의존한다. 일부 경우에, 회로는 “외부-내부(outside-inside)” 회로일 수 있고, 여기서, 상기 회로는 세포외 항원의 제1 인지 및 세포내 항원의 제2 인지에 의존한다. 일부 경우에, 회로는 “외부-외부(outside-outside)” 회로일 수 있고 여기서, 상기 회로는 2개의 세포외 항원의 인지에 의존한다. 상기 회로는 2개의 항원으로 제한되지 않고, 일부 경우에, 예를 들어, 내부-내부-내부 항원 회로, 내부-내부-외부 항원 회로, 내부-외부-내부 항원 회로, 외부-내부-내부 항원 회로, 내부-외부-외부 항원 회로 등을 포함할 수 있다.
하나의 구현예에서, “내부-내부” 회로는 펩타이드-MHC와 관련하여 제1 세포내 항원과 결합시 예를 들어, TCR, CAR, 항체, 키메라 이중특이적 결합 구성원 등을 포함하는, 펩타이드-MHC와 관련하여 제2 세포내 항원을 인지하는 치료제의 발현을 유도하는 제1 키메라 폴리펩타이드를 포함할 수 있다. 하나의 구현예에서, “내부-내부” 회로는 MHC와 관련하여 WT1 세포내 항원과 결합시 예를 들어, TCR, CAR, 항체, 키메라 이중특이적 결합 구성원 등을 포함하는, 펩타이드-MHC와 관련하여 제2 세포내 항원을 인지하는 치료제의 발현을 유도하는 제1 키메라 폴리펩타이드를 포함할 수 있다. 하나의 구현예에서, “내부-내부” 회로는 MHC와 관련하여 NY-ESO1 세포내 항원과 결합시 예를 들어, TCR, CAR, 항체, 키메라 이중특이적 결합 구성원 등을 포함하는, 펩타이드-MHC와 관련하여 제2 세포내 항원을 인지하는 치료제의 발현을 유도하는 제1 키메라 폴리펩타이드를 포함할 수 있다.
하나의 구현예에서, “내부-외부” 회로는 펩타이드-MHC와 관련하여 세포내 항원과 결합시 예를 들어, TCR, CAR, 항체, 키메라 이중특이적 결합 구성원 등을 포함하는, 세포외 항원을 인지하는 치료제의 발현을 유도하는 키메라 폴리펩타이드를 포함할 수 있다. 하나의 구현예에서, “내부-외부” 회로는 MHC와 관련하여 WT1 세포내 항원과 결합시 예를 들어, TCR, CAR, 항체, 키메라 이중특이적 결합 구성원 등을 포함하는, 세포외 항원을 인지하는 치료제의 발현을 유도하는 키메라 폴리펩타이드를 포함할 수 있다. 하나의 구현예에서, “내부-외부” 회로는 MHC와 관련하여 NY-ESO1 세포내 항원과 결합시 예를 들어, TCR, CAR, 항체, 키메라 이중특이적 결합 구성원 등을 포함하는, 세포외 항원 인지하는 치료제의 발현을 유도하는 키메라 폴리펩타이드를 포함할 수 있다.
본원의 개시내용의 다중-인풋 회로 및 논리적 게이트된 시스템이 구체적으로 기재된 것들에 제한되지 않고 기재된 것들과 비교하여 또 다른 형태 및/또는 보다 높은 정도의 게이트를 포함할 수 있다. 예를 들어, 일부 경우에, 본원의 개시내용의 논리적 게이트된 시스템은 2개 인풋 게이트, 3개 인풋 게이트, 4개 인풋 게이트, 5개 인풋 게이트, 6개 인풋 게이트, 7개 인풋 게이트, 8개 인풋 게이트, 9개 인풋 게이트, 10개 인풋 게이트 이상일 수 있다. 예를 들어, 키메라 폴리펩타이드, CAR, TCR, 키메라 이중특이적 결합 구성원을 포함하는 본원에 기재된 임의의 작제물은 예를 들어, 키메라 폴리펩타이드, CAR, TCR, 키메라 이중특이적 결합 구성원, 제2 키메라 폴리펩타이드, 제2 CAR, 제2 TCR, 제2 키메라 이중특이적 결합 구성원 등을 포함하는 본원에 기재된 임의의 다른 작제물과 연계된 회로에 유용할 수 있다.
본원에 기재된 키메라 폴리펩타이드 및 방법과 함께 사용하도록 조정될 수 있는 특정 회로 및 그 구성요소는 예를 들어, PCT 출원 번호 US2016/019188에 기재된 것들을 포함하지만 이에 제한되지 않는다(공개번호 제 WO 2016/138034호), 이의 개시내용은 이의 전문이 본원에 참조로 인용됨.
키트
본원의 개시내용은 본원에 기재된 방법을 수행하고/하거나 하나 이상의 키메라 폴리펩타이드, 키메라 폴리펩타이드를 암호화하는 핵산, 이의 성분 등을 작제하기 위한 키트를 제공한다.
일부 경우에, 본원의 키트는 본원의 개시내용의 키메라 폴리펩타이드를 암호화하는 뉴클레오타이드 서열 또는 이의 하나 이상의 부분을 포함하는 발현 벡터를 포함한다. 일부 경우에, 본원의 키트는 본원의 개시내용의 키메라 폴리펩타이드를 포함한다.
일부 경우에, 본원의 키트는 본원의 개시내용의 키메라 폴리펩타이드를 암호화하는 뉴클레오타이드 서열을 포함하는 핵산으로 유전학적으로 변형되거나 변형되어야만 하는 세포, 예를 들어, 숙주 세포 또는 숙주 세포주를 포함한다. 일부 경우에, 본원의 키트는 본원의 개시내용의 키메라 폴리펩타이드를 암호화하는 뉴클레오타이드 서열을 포함하는 재조합 발현 벡터로 유전학적으로 변형되거나 변형되어야만 하는 세포, 예를 들어, 숙주 세포를 포함한다. 키트 성분들은 동일한 컨테이너 또는 별도의 컨테이너에 있을 수 있다.
상기된 임의의 키트는 추가로 하나 이상의 추가의 시약을 포함할 수 있고, 여기서, 상기 추가의 시약은 하기로부터 선택될 수 있다: 희석 완충액; 재구성 용액; 세척 완충액; 조절 시약; 조절 발현 벡터; 음성 조절 폴리펩타이드 (예를 들어, 하나 이상의 단백질용해 절단 부위가 부재여서, 결합시, 세포내 도메인이 방출되지 않는 키메라 폴리펩타이드); 양성 조절 폴리펩타이드; 키메라 폴리펩타이드의 시험관내 생산을 위한 시약 등.
상기 언급된 성분들에 추가로, 본원의 키트는 본원의 방법을 수행하기 위해 키트의 성분들을 사용하기 위한 지침서를 추가로 포함할 수 있다. 본원의 방법을 수행하기 위한 지침서는 일반적으로 적합한 판독 매체 상에 기록한다. 예를 들어, 지침서는 기재, 예를 들어, 종이 또는 플라스틱 등 상에 인쇄될 수 있다. 이와 같이, 상기 지침서는 키트 또는 이의 성분 등의 컨테이너의 라벨링 (즉, 팩키징 또는 서브팩키징과 관련된)에서 팩키지 삽입물로서 키트에 존재할 수 있다. 다른 구현예에서, 상기 지침서는 적합한 컴퓨터 판독 저장 매체, 예를 들어, CD-ROM, 디스켓, 플래시 드라이브 등 상에 존재하는 전자 저장 데이터 파일로서 존재한다. 여전히 다른 구현예에서, 실제 지침서는 키트에 존재하지 않지만, 예를 들어, 인터넷을 통한 원거리 공급원으로부터의 지침서를 수득하기 위한 수단이 제공된다. 구현예의 하나의 예는 지침서가 검토될 수 있고/있거나 지침서가 다운로드될 수 있는 웹 주소를 포함하는 키트이다. 지침서에 관하여, 지침서를 수득하기 위한 상기 수단은 적합한 기재 상에 기록한다.
개시내용의 비제한적인 양상의 예
상기된 본원의 주요 요지의 구현예를 포함하는 양상은 단독으로 또는 하나 이상의 다른 양상 또는 구현예와 조합하여 이로울 수 있다. 이전의 기재를 제한하는 것 없이, 하기 번호의 개시내용의 특정 비제한적인 양상이 제공된다. 본 개시내용 판독시에 당업자에게 자명해지는 바와 같이, 개별적으로 번호를 매긴 양상의 각각이 사용될 수 있거나 이전에 또는 하기의 개별적으로 번호를 매긴 임의의 양상과 조합될 수 있다. 이것은 모든 상기 양상의 조합을 위한 지지를 제공하는 것으로 의도되고 하기에 명백하게 제공된 양상의 조합으로 제한되지 않는다:
1. N-말단에서 C-말단으로 및 공유 결합으로 하기를 포함하는 키메라 폴리펩타이드:
a) 펩타이드-주요 조직적합성 복합체 (펩타이드-MHC)에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인;
b) 하나 이상의 단백질 용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및
c) 전사 활성화인자를 포함하는 세포내 도메인을 포함하고, 여기서 상기 특이적 결합 구성원의 펩타이드-MHC로의 결합이 상기 하나 이상의 단백질용해 절단 부위에서 노치 수용체 폴리펩타이드의 절단을 유도하여 세포내 도메인을 방출시킨다.
2. 양상 1에 있어서, 상기 특이적 결합 구성원이 항체를 포함하는, 키메라 폴리펩타이드.
3. 양상 2에 있어서, 상기 항체가 나노항체, 디아바디, 트리아바디, 또는 미니바디, F(ab’)2 단편, Fab 단편, 단일쇄 가변 단편 (scFv) 또는 단일 도메인 항체(sdAb)인, 키메라 폴리펩타이드.
4. 양상 1 내지 3 중 어느 한 양상에 있어서, 상기 특이적 결합 구성원이 세포내 암 항원 펩타이드를 포함하는 펩타이드-MHC에 특이적으로 결합하는, 키메라 폴리펩타이드.
5. 양상 4에 있어서, 상기 세포내 암 항원 펩타이드가 WT1 펩타이드 또는 NY-ESO 펩타이드인, 키메라 폴리펩타이드.
6. 양상 1 내지 5 중 어느 한 양상에 있어서, 상기 노치 수용체 폴리펩타이드가 이의 N-말단에 하나 이상의 상피 성장 인자 (EGF) 반복체를 포함하는, 키메라 폴리펩타이드.
7. 양상 6에 있어서, 상기 노치 수용체 폴리펩타이드가 이의 N-말단에 2 내지 11개 EGF 반복체를 포함하는, 키메라 폴리펩타이드.
8. 양상 1 내지 7 중 어느 한 양상에 있어서, 상기 노치 수용체 폴리펩타이드가 합성 링커를 포함하는, 키메라 폴리펩타이드.
9. 양상 8에 있어서, 상기 노치 수용체 폴리펩타이드가 상기 하나 이상의 EGF 반복체와 상기 하나 이상의 단백질용해 절단 부위 사이에 합성 링커를 포함하는, 키메라 폴리펩타이드.
10. 양상 1 내지 9 중 어느 한 양상에 있어서, 상기 노치 수용체 폴리펩타이드가 50개 아미노산 내지 1000개 아미노산의 길이를 갖는, 키메라 폴리펩타이드.
11 양상 10에 있어서, 상기 노치 수용체 폴리펩타이드가 300개 아미노산 내지 400개 아미노산의 길이를 갖는, 키메라 폴리펩타이드.
12. 양상 1 내지 11 중 어느 한 양상에 있어서, 상기 하나 이상의 단백질용해 절단 부위가 S2 단백질용해 절단 부위, S3 단백질용해 절단 부위 또는 이의 조합을 포함하는, 키메라 폴리펩타이드.
13. 양상 12에 있어서, 상기 하나 이상의 단백질용해 절단 부위가 Ala-Val 디펩타이드 서열을 포함하는 ADAM-17-유형의 프로테아제 절단 부위인 S2 단백질용해 절단 부위를 포함하는, 키메라 폴리펩타이드.
14. 양상 1 내지 13 중 어느 한 양상에 있어서, 상기 하나 이상의 단백질용해 절단 부위가 Gly-Val 디펩타이드 서열을 포함하는 감마-세크레타제 (γ-세크레타제) 절단 부위인 S3 단백질용해 절단 부위를 포함하는, 키메라 폴리펩타이드.
15. 양상 1 내지 14 중 어느 한 양상에 있어서, 상기 하나 이상의 단백질용해 절단 부위가 S1 단백질용해 절단 부위를 추가로 포함하는, 키메라 폴리펩타이드.
16. 양상 15에 있어서, 상기 S1 단백질용해 절단 부위가 아미노산 서열 Arg-X-(Arg/Lys)-Arg (서열번호: 130) (여기서, X는 임의의 아미노산이다)을 포함하는 푸린형 프로테아제 절단 부위인, 키메라 폴리펩타이드.
17. 양상 1 내지 16 중 어느 한 양상에 있어서, 상기 노치 수용체 폴리펩타이드가 S1 단백질용해 절단 부위가 부재인, 키메라 폴리펩타이드.
18. 양상 1 내지 17 중 어느 한 양상에 있어서, 상기 노치 수용체 폴리펩타이드가 도 31a-32b에 제공된 서열과 적어도 85% 아미노산 서열 동일성을 갖는, 키메라 폴리펩타이드.
19. 양상 18에 있어서, 상기 노치 수용체 폴리펩타이드가 도 31a에 제공된 서열 또는 도 31b에 제공된 서열과 적어도 85% 아미노산 서열 동일성을 갖는, 키메라 폴리펩타이드.
20. 양상 1 내지 19 중 어느 한 양상에 따른 키메라 폴리펩타이드를 암호화하는 핵산.
21. 양상 20에 있어서, 상기 핵산이 목적하는 폴리펩타이드 (POI)를 암호화하는 핵산 서열에 작동적으로 연결된 전사 활성화인자에 응답하는 전사 조절 요소를 추가로 포함하는, 핵산.
22. 양상 21에 있어서, 상기 POI가 리포터 단백질, 키메라 항원 수용체 (CAR), 항체, 키메라 이중특이적 결합 구성원, 가공된 T 세포 수용체 (TCR) 및 선천성-면역 반응 유도제로 이루어진 그룹으로부터 선택되는 이종성 폴리펩타이드인, 핵산.
23. 양상 20 내지 22 중 어느 한 양상에 따른 핵산을 포함하는 재조합 발현 벡터.
24.세포에서 이종성 폴리펩타이드의 발현을 유도하는 방법으로서, 상기 방법이:
세포와 펩타이드-주요 조직적합성 복합체 (펩타이드-MHC)를 접촉시키는 단계로서, 여기서, 상기 세포는 양상 1 내지 19 중 어느 한 양상에 따른 키메라 폴리펩타이드를 발현하고 상기 키메라 폴리펩타이드의 전사 활성화인자에 응답하는 전사 조절 요소에 작동적으로 연결된 이종성 폴리펩타이드를 암호화하는 서열을 포함하여 상기 키메라 폴리펩타이드의 세포내 도메인을 방출시키고 상기 이종성 폴리펩타이드의 발현을 유도하는 단계를 포함하는, 방법.
25. 양상 24에 있어서, 상기 이종성 폴리펩타이드가 리포터 단백질, 키메라 항원 수용체 (CAR), 항체, 키메라 이중특이적 결합 구성원, 가공된 T 세포 수용체 (TCR) 및 선천성-면역 반응 유도제인, 방법.
26. 다음을 포함하는 숙주 세포:
a) 제1 펩타이드-주요 조직적합성 복합체 (펩타이드-MHC)에 특이적으로 결합하는 양상 20 내지 22 중 어느 한 양상에 따른 키메라 폴리펩타이드를 암호화하는 핵산; 및
b) 목적하는 폴리펩타이드 (POI)를 암호화하는 핵산에 작동적으로 연결된 키메라 폴리펩타이드의 전사 활성화인자에 응답하는 전사 조절 요소.
27. 양상 26에 있어서, 상기 숙주 세포가 유전학적으로 변형되고 상기 핵산 및 상기 전사 조절 요소가 상기 숙주 세포의 게놈 내에 존재하는, 숙주 세포.
28. 양상 26에 있어서, 상기 핵산 및 상기 전사 조절 요소가 상기 숙주 세포 내 염색체 외부에 존재하는, 숙주 세포.
29. 양상 26 내지 28 중 어느 한 양상에 있어서, 상기 POI가 이종성 폴리펩타이드인, 숙주 세포.
30. 양상 29에 있어서, 상기 이종성 폴리펩타이드가 리포터 단백질, 키메라 항원 수용체 (CAR), 항체, 키메라 이중특이적 결합 구성원, 가공된 T 세포 수용체 (TCR) 및 선천성-면역 반응 유도제로 이루어진 그룹으로부터 선택되는, 숙주 세포.
31. 양상 30에 있어서, 상기 이종성 폴리펩타이드가 제2 펩타이드-MHC에 특이적으로 결합하는 CAR인, 숙주 세포.
32. 양상 31에 있어서, 상기 키메라 폴리펩타이드의 상기 특이적 결합 구성원이 제1 세포내 암 항원 펩타이드를 포함하는 제1 펩타이드-MHC에 특이적으로 결합하고 상기 CAR이 제2 세포내 암 항원 펩타이드를 포함하는 제2 펩타이드-MHC에 특이적으로 결합하는, 숙주 세포.
33. 양상 32에 있어서, 상기 제1 세포내 암 항원 펩타이드가 WT1 펩타이드이고 상기 제2 세포내 암 항원 펩타이드가 NY-ESO 펩타이드인, 숙주 세포.
34. 양상 32에 있어서, 상기 제1 세포내 암 항원 펩타이드가 NY- ESO 펩타이드이고 상기 제2 세포내 암 항원 펩타이드가 WT1 펩타이드인, 숙주 세포.
35. 양상 30에 있어서, 상기 이종성 폴리펩타이드가 제2 펩타이드-MHC에 특이적으로 결합하는 가공된 TCR인, 숙주 세포.
36. 양상 35에 있어서, 상기 키메라 폴리펩타이드의 상기 특이적 결합 구성원이 제1 세포내 암 항원 펩타이드를 포함하는 제1 펩타이드-MHC에 특이적으로 결합하고 상기 가공된 TCR이 제2 세포내 암 항원 펩타이드를 포함하는 제2 펩타이드-MHC에 특이적으로 결합하는, 숙주 세포.
37. 양상 36에 있어서, 상기 제1 세포내 암 항원 펩타이드가 WT1 펩타이드이고 상기 제2 세포내 암 항원 펩타이드가 NY-ESO 펩타이드인, 숙주 세포.
38. 양상 36에 있어서, 상기 제1 세포내 암 항원 펩타이드가 NY- ESO 펩타이드이고 상기 제2 세포내 암 항원 펩타이드가 WT1 펩타이드인, 숙주 세포.
39. 다음을 포함하는 숙주 세포:
a) N-말단에서 C-말단으로 및 공유 결합으로 하기를 포함하는 키메라 폴리펩타이드를 암호화하는 핵산:
i) 암 세포의 표면 상에 존재하는 표적 분자에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인;
ii) 하나 이상의 단백질용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및
iii) 전사 활성화인자를 포함하는 세포내 도메인;
b) 상기 전사 활성화인자에 응답하는 전사 조절 요소에 작동적으로 연결된 키메라 이중특이적 결합 구성원을 암호화하는 핵산으로서, 상기 표적 분자로의 특이적 결합 구성원의 결합이 상기 하나 이상의 단백질용해 절단 부위에서 상기 노치 수용체 폴리펩타이드의 절단을 유도하여 세포내 도메인을 방출시키고, 상기 전사 조절 요소를 활성화시키고 상기 키메라 이중특이적 결합 구성원이 발현되도록 하는, 핵산.
40. 양상 39에 있어서, 상기 키메라 이중특이적 결합 구성원이 암 항원에 특이적인 결합 도메인 및 면역 세포의 표면상에서 발현되는 단백질에 특이적인 결합 도메인을 포함하는, 숙주 세포.
41. 양상 39 또는 40에 있어서, 상기 키메라 이중특이적 결합 구성원이 적어도 하나의 항체 유래된 항원-결합 도메인을 포함하는, 숙주 세포.
42. 양상 41에 있어서, 상기 키메라 이중특이적 결합 구성원이 이중특이적 항체 또는 이의 단편인, 숙주 세포.
43. 양상 39 내지 41 중 어느 한 양상에 있어서, 상기 키메라 이중특이적 결합 구성원이 리간드-수용체 결합 쌍의 적어도 하나의 수용체 또는 리간드 결합 도메인을 포함하는, 숙주 세포.
44. 양상 39 내지 43 중 어느 한 양상에 있어서, 상기 키메라 이중특이적 결합 구성원이 적어도 하나의 항체 유래된 항원-결합 도메인 및 리간드-수용체 결합 쌍의 적어도 하나의 수용체 또는 리간드 결합 도메인을 포함하는, 숙주 세포.
45. 양상 40 내지 44 중 어느 한 양상에 있어서, 면역 세포의 표면 상에 발현되는 상기 단백질이 CD3인, 숙주 세포.
46. 양상 40 내지 44 중 어느 한 양상에 있어서, 면역 세포의 표면 상에서 발현된 상기 단백질이 천연 킬러 그룹 2D (NKG2D) 수용체인, 숙주 세포.
47. 양상 39 내지 46 중 어느 한 양상에 있어서, 상기 표적 분자가 암 항원인, 숙주 세포.
48. 양상 39 내지 46 중 어느 한 양상에 있어서, 상기 표적 분자가 조직 특이적 분자인, 숙주 세포.
49 양상 39 내지 46 중 어느 한 양상에 있어서, 상기 표적 분자가 기관 특이적 분자인, 숙주 세포.
50. 양상 39 내지 46 중 어느 한 양상에 있어서, 상기 표적 분자가 세포 유형 특이적 분자인, 숙주 세포.
51. 양상 39 내지 50 중 어느 한 양상에 따른 유효량의 숙주 세포를 대상체에게 투여함을 포함하는, 신생물에 대해 대상체를 치료하는 방법으로서, 여기서, 상기 신생물은 표적 분자 및 암 항원을 발현하는, 방법.
52. 다음을 포함하는 숙주 세포:
a) N-말단에서 C-말단으로 및 공유 결합으로 하기를 포함하는 키메라 폴리펩타이드를 암호화하는 핵산:
i) 암 세포의 표면 상에 존재하는 표적 분자에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인;
ii) 하나 이상의 단백질용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및
iii) 전사 활성화인자를 포함하는 세포내 도메인;
b) 상기 전사 활성화인자에 응답하는 전사 조절 요소에 작동적으로 연결된 항-Fc 키메라 항원 수용체 (CAR)를 암호화하는 핵산으로서, 상기 표적 분자로의 특이적 결합 구성원의 결합이 상기 하나 이상의 단백질용해 절단 부위에서 상기 노치 수용체 폴리펩타이드의 절단을 유도하여 세포내 도메인을 방출시키고, 상기 전사 조절 요소를 활성화시키고 상기 항-Fc CAR이 발현되도록 하는, 핵산.
53. 양상 52에 있어서, 상기 표적 분자가 암 항원인, 숙주 세포.
54. 양상 52에 있어서, 상기 표적 분자가 조직 특이적 분자인, 숙주 세포.
55. 양상 52에 있어서, 상기 표적 분자가 기관 특이적 분자인, 숙주 세포.
56. 양상 52에 있어서, 상기 표적 분자가 세포 특이적 분자인, 숙주 세포.
57. 양상 52 내지 56 중 어느 한 양상에 있어서, 상기 숙주 세포가 추가로 암 세포의 표면 상에 존재하는 암 항원에 특이적이고 항-Fc CAR에 의해 결합된 Fc 영역을 포함하는 항체를 암호화하는 핵산을 포함하는, 숙주 세포.
58. 양상 57에 있어서, 상기 항체를 암호화하는 핵산이 상기 전사 조절 요소에 작동적으로 연결된, 숙주 세포.
59. 양상 52 내지 58 중 어느 한 양상에 따른 유효량의 숙주 세포를 대상체에게 투여함을 포함하는, 신생물에 대해 대상체를 치료하는 방법으로서, 여기서, 상기 신생물은 상기 표적 분자를 발현하는, 방법.
60. 양상 59에 있어서, 상기 방법이 추가로 암 세포의 표면 상에 존재하는 암 항원에 특이적이고 항-Fc CAR에 의해 결합된 Fc 영역을 포함하는 항체를 대상체에게 투여함을 포함하는, 방법.
61. 다음을 포함하는 숙주 세포:
a) N-말단에서 C-말단으로 및 공유 결합으로 하기를 포함하는 키메라 폴리펩타이드를 암호화하는 핵산:
i) 암 세포의 표면 상에 존재하는 표적 분자에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인;
ii) 하나 이상의 단백질용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및
iii) 전사 활성화인자를 포함하는 세포내 도메인;
b) 상기 전사 활성화인자에 응답하는 전사 조절 요소에 작동적으로 연결된 선천성 면역 반응 유도제를 암호화하는 핵산으로서, 상기 표적 분자로의 상기 특이적 결합 구성원의 결합이 상기 하나 이상의 단백질용해 절단 부위에서 상기 노치 수용체 폴리펩타이드의 절단을 유도하여 세포내 도메인을 방출시키고, 상기 전사 조절 요소를 활성화시키고 상기 선천성 면역 반응 유도제가 발현되도록 하는, 핵산.
62. 양상 61에 있어서, 상기 표적 분자가 조직 특이적 분자인, 방법.
63. 양상 61에 있어서, 상기 표적 분자가 기관 특이적 분자인 방법.
64. 양상 61에 있어서, 상기 표적 분자가 세포 유형 특이적 분자인, 방법.
65. 양상 61에 있어서, 상기 표적 분자가 암 항원인 방법.
66. 양상 61 내지 65 중 어느 한 양상에 있어서, 상기 선천성 면역 반응 유도제가 세균 단백질 또는 이의 단편인, 방법.
67. 양상 61 내지 65 중 어느 한 양상에 있어서, 상기 선천성 면역 반응 유도제가 바이러스 단백질 또는 이의 단편인, 방법.
68. 양상 61 내지 65 중 어느 한 양상에 있어서, 상기 선천성 면역 반응 유도제가 진균류 단백질 또는 이의 단편인, 방법.
69. 양상 61 내지 68 중 어느 한 양상에 있어서, 상기 선천성 면역 반응 유도제가 포유동물 기생충에 의해 발현되는 단백질 또는 이의 단편인, 방법.
70. 양상 69에 있어서, 상기 포유동물 기생충이 인간 기생충인, 방법.
71. 양상 61 내지 70 중 어느 한 양상에 따른 유효량의 숙주 세포를 대상체에게 투여함을 포함하는, 상기 대상체 영역에서 국소 선천성 면역 반응을 유도하는 방법으로서, 상기 영역이 상기 표적 분자를 발현하는, 방법.
72. 양상 71에 있어서, 상기 대상체의 영역이 신생물을 포함하는, 방법.
73. 다음을 포함하는 숙주 세포:
a) N-말단에서 C-말단으로 및 공유 결합으로 하기를 포함하는 키메라 폴리펩타이드를 암호화하는 핵산:
i) 암 세포의 표면 상에 존재하는 표적 분자에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인;
ii) 하나 이상의 단백질용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및
iii) 전사 활성화인자를 포함하는 세포내 도메인;
b) 상기 전사 활성화인자에 응답하는 전사 조절 요소에 작동적으로 연결된 면역 억제 인자를 암호화하는 핵산으로서, 상기 표적 분자로의 특이적 결합 구성원의 결합이 상기 하나 이상의 단백질용해 절단 부위에서 상기 노치 수용체 폴리펩타이드의 절단을 유도하여 세포내 도메인을 방출시키고, 상기 전사 조절 요소를 활성화시키고 상기 면역 억제 인자가 발현되도록 하는, 핵산.
74. 양상 73에 있어서, 상기 표적 분자가 조직 특이적 분자인, 방법.
75. 양상 73에 있어서, 상기 표적 분자가 기관 특이적 분자인, 방법.
76. 양상 73에 있어서, 상기 표적 분자가 세포 유형 특이적 분자인, 방법.
77. 양상 73에 있어서, 상기 표적 분자가 자가항원인, 방법.
78. 양상 73 내지 77 중 어느 한 양상에 있어서, 상기 면역 억제 인자가 면역억제성 사이토킨인, 방법.
79. 양상 78에 있어서, 상기 면역억제성 사이토킨이 IL-10인 방법.
80. 양상 73 내지 77 중 어느 한 양상에 있어서, 상기 면역 억제 인자가 세포-대-세포 신호전달 면역억제성 리간드인, 방법.
81. 양상 80에 있어서, 상기 세포-대-세포 신호전달 면역억제성 리간드가 PD-L1인 방법.
82. 양상 73 내지 81 중 어느 한 양상에 따른 유효량의 숙주 세포를 대상체에게 투여함을 포함하는, 상기 대상체에서 면역 반응을 억제하는 방법으로서, 상기 대상체가 상기 표적 분자를 발현하는, 방법.
83. 양상 82에 있어서, 상기 대상체가 자가면역 질환을 갖는, 방법.
84.이종성 종양을 사멸시키는 방법으로서, 상기 방법이:
사멸 항원을 발현하는 제1 세포 및 상기 사멸 항원 및 프라이밍 항원을 발현하는 제2 세포를 포함하는 이종성 종양을:
상기 프라이밍 항원에 특이적으로 결합하는 단백질용해 절단가능한 키메라 폴리펩타이드;
상기 사멸 항원에 특이적으로 결합하는 치료학적 폴리펩타이드를 암호화하는 핵산 서열; 및
단백질용해 절단가능한 키메라 폴리펩타이드에 응답하는 상기 핵산에 작동적으로 연결된 전사 조절 요소를 포함하는 가공된 면역 세포와 접촉시키는 단계를 포함하며,
여기서, 상기 단백질용해 절단가능한 키메라 폴리펩타이드의 상기 프라이밍 항원으로의 결합이 상기 전사 조절 요소를 활성화시켜 상기 사멸 항원에 결합되는 경우, 상기 이종성 종양의 제1 및 제2 세포를 사멸시키는 치료학적 폴리펩타이드의 발현을 유도하는, 방법.
85. 양상 84에 있어서, 상기 치료학적 폴리펩타이드가 키메라 항원 수용체 (CAR)인, 방법.
86. 양상 84에 있어서, 상기 치료학적 폴리펩타이드가 조직 T 세포 수용체 (TCR)인, 방법.
87. 양상 84에 있어서, 상기 치료학적 폴리펩타이드가 치료학적 항체인, 방법.
88. 양상 84에 있어서, 상기 치료학적 폴리펩타이드가 키메라 이중특이적 결합 구성원인, 방법.
89. 양상 84 내지 88 중 어느 한 양상에 있어서, 상기 프라이밍 항원 또는 상기 사멸 항원 중 적어도 하나가 MHC와 관련하여 제공되는 세포내 항원인, 방법.
90. 양상 84 내지 89 중 어느 한 양상에 있어서, 상기 프라이밍 항원 및 상기 사멸 항원 둘 다가 MHC와 관련하여 제공되는 세포내 항원인, 방법.
실시예
하기의 실시예는 본 발명을 수행하고 사용하는 방법에 대한 완전한 개시 및 기재를 당업자에게 제공하기 위해 제시되고 본원 발명자가 이들의 발명으로서 간주하는 것의 범위를 제한하는 것으로 의도되지 않고 이들은 하기 실험이 모두 또는 수행된 실험 만을 나타내는 것으로 의도되지 않는다. 사용된 수치 (예를 들어, 양, 온도 등)와 관련된 정확도를 확실히 하기 위해 노력했지만 일부 실험 오류 및 편차가 고려되어야만 한다. 달리 지시되지 않는 경우, 부는 중량부이고, 분자량은 중량 평균 분자량이고, 온도는 섭씨 온도이고 압력은 대기압 또는 이의 주변 기압이다. 표준 약어가 하기와 같이 사용될 수 있다: 예를 들어, bp, 염기쌍(들); kb, 킬로베이스(들); pl, 피코리터(들)(picoliter(s)); s 또는 sec, 초(들); min, 분(들); h 또는 hr, 시간(들); aa, 아미노산(들); kb, 킬로베이스(들); bp, 염기쌍(들); nt, 뉴클레오타이드(들); i.m., 근육내(로); i.p., 복막내(로); s.c., 피하(로) 등.
실시예
1:
펩타이드
-주요 조직적합성 복합체 (
펩타이드
-
MHC
) 유도된 신호전달.
절단가능한 키메라 노치 폴리펩타이드에 의한 펩타이드-MHC의 인지를 통해 세포 신호전달에 영향을 미치는 능력을 연구하였다. 도 1에 다이아그램된 바와 같이, “공여자(sender) 세포”의 세포내 항원의 펩타이드-MHC에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인에 연결된 절단가능한 노치 폴리펩타이드를 포함하는 키메라 폴리펩타이드를 디자인하였다. “수용자 세포”에 의해 발현되는 키메라 폴리펩타이드의 세포외 도메인은 “공여자 세포”의 펩타이드-MHC에 결합한다. 상기 결합 시, 상기 절단가능한 노치 폴리펩타이드는 절단되어 예를 들어, 유리된 세포내 도메인에 응답하는 프로모터에 작동적으로 연결된 전이유전자(예를 들어, 도 1에서 “X”)의 발현을 포함하는 세포내 공정에 영향을 미칠 수 있는 세포내 부분을 방출시킨다.
대표적인 예로서, 키메라 폴리펩타이드는 빌름스 종양 단백질(Wilms Tumor Protein) 1 (WT1) 펩타이드-MHC에 결합하는 세포외 도메인 및 유리된 경우, 청색 형광성 단백질 (BFP)에 작동적으로 연결된 업스트림 활성화 서열 (UAS)에 결합하여 상기 시스템이 CD8 수용자 세포로 가공된 경우 활성화 리포터로서 작용하는 GAL4 전사 활성화인자 세포내 도메인을 사용하여 디자인하였다. 도 2는 펩타이드-MHC 음성(WT1) 또는 양성 (WT1+) T2 공여자 세포와 접촉되는 경우 BFP 리포터를 발현하는 수용자 세포의 상대적 수준을 입증한다. 도 3은 표적 WT1 세포내 항원 발현의 존재 또는 부재와 함께 HLA-A2를 발현하는 T2 세포의 존재하에 검정된 수용자 CD8 T 세포 반응의 정량화를 제공한다. 도 2 및 도 3에서 알 수 있는 바와 같이, T 세포 반응은 제공된 세포내 항원에 고도로 특이적이고 이의 존재에 의존한다.
도 4에서 입증된 바와 같이, 수용자 세포 반응은 또한 제공된 세포내 항원의 양에 의존한다. T2 공여자 세포는 WT1 펩타이드-MHC의 상이한 양 (10 μM, 1 μM 및 100 nM)을 발현하도록 가공되고 수용자 세포 반응은 각각의 집단과 함께 검정하였다. 리포터 발현은 WT1 펩타이드-MHC 발현 수준과 상호관련이 있는 것으로 나타났고 이는 용량 의존성 활성화를 지적한다.
추가로, 관련 없는 세포내 항원 펩타이드-MHC (NY-ESO1 펩타이드) 발현 T2 세포의 존재하에 검정되는 경우, 리포터 활성화는 음성 대조군 (DMSO)과 유사하였고, 이는 추가로 활성화가 항원-특이적임을 지적한다. 표적 세포내 항원 WT1 펩타이드-MHC 또는 관련 없는 세포내 항원 NY-ESO1 펩타이드-MHC의 3개의 상이한 농도에 걸쳐, 항원 농도 의존성 리포터 활성화는 수용자 세포에서 WT1에 응답하는 것으로 나타나지만 CD8+ T 세포 및 CD4+ T 세포 둘 다에서 NY-ESO1에는 응답하지 않는 것으로 나타났다(도 5).
실시예
2: 이원
세포내
항원 의존성 T 세포 활성화.
이원 세포내 항원 및-게이트는 가공된 T 세포 활성화가 표적 세포 상의 2개의 세포내 항원의 제공에 의존하도록 디자인하였다. 구체적으로, 도 6에 제공된 바와 같은 대표적인 예로서, 시스템은 T 세포로 디자인되고 가공되고, 여기서, 항-HLA-A2/NY-ESO1 TCR의 발현은 항-HLA-A2/WT1 scFv synNotch의 유리된 세포내 도메인에 의해 유도된다. 단지 NY-ESO1을 발현하는 T2 표적 세포와 함께 제공되는 경우, 항-HLA-A2/NY-ESO1 TCR의 발현은 유도되지 않고 어떠한 T 세포 활성화도 일어나지 않는다. 그러나, NY-ESO1 및 WT1 둘 다를 발현하는 T2 표적 세포와 함께 제공되는 경우, WT1 펩타이드-MHC의 항-HLA-A2/WT1 scFV synNotch로의 결합은 노치 폴리펩타이드의 절단을 유도하여, 항-HLA-A2/NY-ESO1 TCR의 발현을 구동하는 UAS에 결합하는 GAL4 전사 활성화인자를 방출한다. 발현된 항-HLA-A2/NY-ESO1 TCR의 표적 세포 상의 NY-ESO1 펩타이드-MHC로의 결합은 예를 들어, CD69 및/또는 세포독성 검정을 사용하여 검출되는 바와 같이 T 세포의 활성화를 유도한다.
상기 시스템에서 T 세포 활성화는 항원 또는 둘 다를 발현하는 T2 표적 세포를 사용하여 시험하였다. 도 7에서 알 수 있는 바와 같이, CD69 발현을 사용한 측정시 강한 활성화는 가공된 T 세포가 이원 항원(HLA-A2/NY-ESO1 및 HLA-A2/WT1) T2 표적 세포와 접촉되는 경우 나타났다. 그러나, 음성 대조군(DMSO)과 유사한 활성화의 부재는 가공된 T 세포가 2개의 세포내 항원 (HLA-A2/NY-ESO1 또는 HLA-A2/WT1) 중 단지 하나를 발현하는 T2 세포와 접촉되는 경우 나타났다. T2 세포 사멸에 대한 상응하는 결과는 가공된 T 세포가 이원- 또는 단일-항원 발현 T2 표적 세포와 함께 제공되는 경우 나타났다(도 8).이들 결과는 이원-세포내 항원 및-게이트의 기능성 및 표적 세포내 항원 둘 다를 발현하는 표적 세포에만 응답하는 가공된 T 세포를 활성화시키는데 있어서의 상기 특이성을 입증한다.
상기 접근법의 다능성을 추가로 입증하기 위해, 표면 표적 항원 및 세포내 표적 항원 둘 다를 발현하는 세포를 표적화하는 추가의 이원-항원 및-게이트를 디자인하고 시험하였다. 구체적으로, 도 9 및 FIG. 10에 제공된 바와 같은 대표적인 예로서, 시스템은 T 세포로 디자인되고 가공되고, 여기서, 항-HLA-A2/NY-ESO1 TCR의 발현은 항-표면-발현된- GFP synNotch의 유리된 세포내 도메인에 의해 유도된다. 단지 NY-ESO1을 발현하는 T2 표적 세포와 함께 제공되는 경우, 항-HLA-A2/NY-ESO1 TCR의 발현은 유도되지 않고 어떠한 T 세포 활성화도 일어나지 않는다. 그러나, NY-ESO1 및 GFP 둘 다를 발현하는 T2 표적 세포와 함께 제공되는 경우, 항-GFP synNotch로의 표면-발현된 GFP의 결합은 노치 폴리펩타이드의 절단을 유도하여, 항-HLA-A2/NY-ESO1 TCR의 발현을 구동하는 UAS에 결합하는 GAL4 전사 활성화인자를 방출한다. 발현된 항-HLA-A2/NY-ESO1 TCR의 표적 세포 상의 NY-ESO1 펩타이드-MHC로의 결합은 T 세포의 활성화를 유발한다.
이원-항원 회로를 발현하는 가공된 CD4+ 및 CD8+ T 세포의 활성화는 CD69 발현 (도 11), T 세포 증식(도 12), T2 표적 세포 사멸(도 13) 및 A375 표적 세포 사멸(도 14)을 사용하여 검정하였다. 각각의 검정에서, T 세포 활성화 및 다운스트림 효과, 예를 들어, 표적 세포 사멸은 표적 세포에 의한 표적 항원 둘 다의 발현에 의존하였고, 이는 세포내 항원의 조합이 사용되든 (예를 들어, 일반적으로 도 15에 다이아그램된 바와 같이) 또는 표면 발현된 항원 반응성 성분이 하나 이상의 세포내 항원 인지 요소와 조합되든 상관 없이 이원-항원 synNotch 및-게이트의 강한 특이성을 입증한다.
상기 접근법의 다능성을 추가로 입증하기 위해, 표면 표적 항원 및 NY-ESO1 이외의 다른 세포내 표적 항원 둘 다를 발현하는 세포를 표적화하는 추가의 이원-항원 및-게이트를 디자인하고 시험하였다. 구체적으로, 도 39에 도식적으로 도시된 바와 같이, 시스템은 T 세포로 디자인되고 가공되고, 여기서, 항-HLA-A2/Mart1의 발현은 항-표면-발현된 GFP synNotch의 유리된 세포내 도메인에 의해 유도된다. 단지 Mart1 단독을 발현하는 T2 표적 세포와 함께 제공되는 경우, 항-HLA-A2/Mart1 TCR의 발현은 유도되지 않고 어떠한 T 세포 활성화도 일어나지 않는다. 그러나, Mart1과 GFP 둘 다를 발현하는 T2 표적 세포와 함께 제공되는 경우, 항-GFP synNotch로의 표면-발현된 GFP의 결합은 노치 폴리펩타이드의 절단을 유도하여, 항-HLA-A2/Mart1 TCR의 발현을 구동하는 UAS에 결합하는 GAL4 전사 활성화인자를 방출한다. 발현된 항-HLA-A2/Mart1 TCR의 표적 세포 상의 Mart1 펩타이드-MHC로의 결합은 T 세포의 활성화를 유발한다. 주르캣(Jurkat) T 세포주는 상기 이원-항원 회로를 발현하도록 가공하였고, T 세포의 활성화는 CD69 발현을 사용하여 검정하였다. 도 40에 제공된 바와 같이, 상기 검정 결과는 CD69 상향조절에 의한 측정시 T 세포 활성화가 표적 세포에 의한 표적 항원 둘 다의 발현에 의존함에 따라서 pMHC 항원을 표적화하는 이원-항원 synNotch 및-게이트의 강한 특이성을 추가로 입증함을 보여주었다.
실시예
3:
키메라
이중특이적
결합 구성원의 특이적 국소 전달.
키메라 이중특이적 결합 구성원의 특이적 국소 발현을 유도하기 위한 synNotch의 용도는 대표적인 2개의 성분 시스템을 사용하여 검정하였다. 구체적으로, 도 16에 도시된 바와 같이, 항-GFP synNotch를 사용하여 가공된 T 세포에서 항-CD19/항-CD3 이중특이적 T-세포 인게이져 (BiTE)(블리나투모맙)의 발현을 구동하였다. 유도제 표적 세포의 표면 상에 발현된 GFP에 결합시, 항-GFP synNotch는 항-CD19/항-CD3 BiTE를 암호화하는 서열에 작동적으로 연결된 UAS에 결합하는 GAL4 전사 활성화인자를 방출한다. BiTE의 발현은 표적 세포 발현된 CD19 및 T 세포 발현된 CD3의 이원-결합 및 T 세포 활성화를 유도한다.
CD4+ T 세포 활성화는 CD69 발현을 사용하여 검정하였다. 항-GFP-GAL4 synNotch를 발현하고 GAL4 반응성 UAS에 작동적으로 연결된 항-CD19/항-CD3 BiTE를 암호화하는 서열을 갖는 CD4+ T 세포는 CD19 단독, GFP 단독 또는 CD19 및 GFP 둘 다를 발현하는 유도제 세포와 접촉시켰다. 유의적 T 세포 활성화는 단지 CD19 및 GFP 둘 다를 발현하는 유도제 세포가 사용된 경우에 나타났다(도 17).이들 시험관내 결과는 키메라 이중특이적 결합 구성원 페이로드가 synNotch 게이트된 회로를 사용하여 효과적으로 및 특이적으로 발현될 수 있고, 예를 들어, T 세포 활성화와 같은 세포 반응을 조절하기 위해 사용될 수 있음을 입증한다.
키메라 이중특이적 결합 구성원의 synNotch 게이트된 발현의 사용은 대표적인 예로서 종양-국소화된 α-CD19/α-CD3 BiTE 생산 모델을 사용하여 생체내에서 추가로 연구하였다(도18).마우스에, 좌측 옆구리에 프라이밍 항원 음성(GFP) 표적 항원 양성(CD19+) 종양 세포 및 우측 옆구리에 이원 양성(GFP+/CD19+) 종양 세포를 피하 주사하였다. α-CD19/α-CD3 이중특이적 T 세포 인게이져 (BiTE) 발현의 조절에서 α-GFP synNotch T 세포 (CD4+ 및 CD8+)는 종양이 확립된 후 마우스에 주사하였다. 종양은 캘리퍼 측정에 의한 종양 부하를 분석하기 위해 지정된 시점에서 수거하였다.
α-CD19/α-CD3의 상기된 모델 종양-국소화된 생산에서, BiTE는 프라이밍 항원-의존성 방식에서 종양 부하를 효과적으로 감소시키는 것으로 나타났다(도 19).종양 용적은 도 18과 관련하여 상기된 바와 같은 좌측 옆구리와 우측 옆구리에 대해 측정하였다. 치료 과정 동안에, 종양 용적은 프라이밍 항원 (GFP) 및 BiTE 표적화된 항원 (CD19) 둘 다를 발현하는 종양(GFP+/CD19+ 종양)에서 감소하였다. 대조적으로, 종양 용적은 BiTE 표적화된 항원을 발현하지만 프라이밍 항원은 발현하지 않는 우측 옆구리 종양(CD19+ 종양)에서 감소하지 않았다. 이들 결과는 생체내 종양 용적을 효과적으로 감소시키는 BiTE 페이로드의 공간적 특이적 표적화를 구동하기 위한 2개의 항원 T 세포 및-게이트의 효과적인 용도를 입증한다. α-GFP synNotch는 조직 특이적, 기관 특이적 또는 세포 유형 특이적 T 세포 프라이밍을 위해, 내인성으로 또는 이종성으로 발현되는 임의의 다른 항원을 효과적으로 표적화하는 임의의 다른 SynNotch로 대체될 수 있다.
실시예
4: 선천성 면역 반응의 특이적 유도
선천성 면역 반응을 특이적으로 및/또는 국소적으로 유도하기 위한 synNotch의 용도는 대표적인 모델 시스템을 사용하여 연구하였다. 구체적으로, 도 20에 도시된 바와 같이, 시스템은 가공된 T 세포에서 플라겔린 (FliC)을 암호화하는 핵산 서열에 작동적으로 연결된 리포터의 발현을 구동시키기 위해 표면 발현된 GFP에 특이적인 synNotch를 사용하여 고안하였다. T 세포로부터 플라겔린 페이로드의 분비는 유도제 세포의 표면 상에 존재하는 synNotch 결합 GFP에 의존한다. 선천성 면역 반응 유도를 검출하고 측정하기 위해, 분비된 알칼린 포스파타제(SEAP) 리포터를 사용하였고, 여기서, 플라겔린의 TLR5 리포터 세포 상의 톨형 수용체 5 (TLR5)로의 결합은 선천성 면역 반응 활성의 정량화를 가능하게 하는 SEAP의 발현을 구동한다.
상기된 시스템으로 가공된 T 세포는 TLR5 리포터 세포의 존재하에 배양하였다. TLR 리포터 세포 SEAP 활성은 표면-발현 GFP+ 유도제 세포를 사용한 GFP의 자극의 존재 또는 부재하에 650 nm에서의 흡광도로 측정하였다. 도 21에 제공된 상기 검정 결과는 상기 선천성 면역 반응이 GFP 의존성 방식으로 특이적으로 활성화됨을 보여주었다. 상기 예는 항원 의존성 synNotch 폴리펩타이드를 사용하여 폴리펩타이드를 유동하는 선천성 면역 반응 유도 폴리펩타이드의 발현을 구동시킴에 의해 선천성 면역 반응을 특이적으로 및/또는 국소적으로 유도하기 위해 synNotch가 사용될 수 있음을 입증한다.
실시예
5:
이종성
종양의 치료.
다중-성분 전략은 이종성 종양을 인지하도록 T 세포를 프로그램화하기 위해 도 22에 도시된 바와 같이 개발하였다. T 세포는 (1) 종양에 특이적이지만 모든 종양 세포에 존재하지 않는 종양 특이적항원을 사용하여 이종성 종양에 존재하는 프라이밍 세포를 인지하고, (2) 모든 종양 세포에 존재하지만 종양 특이적이지 않은 종양 관련 항원을 사용하여 이종성 종양의 인접 세포를 사멸시키도록 프로그램화된다.
이종성 종양을 치료하기 위한 synNotch 시스템의 용도는 대표적인 모델 시스템을 사용하여 연구하였다. 구체적으로, 도 23에 도시된 바와 같이, T 세포는 GFP 프라이밍 항원에 특이적인 “프라이밍” synNotch 수용체 및 CD19에 특이적인 “사멸” CAR을 생성하도록 가공하였다. 상기 시스템은 상기 synNotch 프라이밍 수용체가 GFP 프라이밍 항원에 결합하는 경우, synNotch의 유리된 세포내 도메인이 CD19가 존재하는 경우, 세포 사멸을 유도하는 CD19-특이적 사멸 CAR의 발현을 구동하도록 디자인하였다.
도 24에 도시된 바와 같이, CD19를 발현하지만 GFP 프라이밍 항원을 발현하는 표적 세포의 집단이 가공된 T 세포로 처리되는 경우, 표적 세포의 어떠한 사멸도 관찰되지 않았다. CD19+/GFP- 표적 세포뿐만 아니라 이원-발현 CD19+/GFP+ 표적 세포를 포함하는 이종성 세포 집단이 가공된 T 세포로 처리된 경우, CD19+/GFP+ 표적 세포 및 CD19+/GFP- 표적 세포 둘 다의 사멸이 관찰되었다. 상기 결과는 이종성 집단에서 GFP 항원의 존재가 일반적으로 CD19-특이적 사멸을 위해 가공된 T 세포를 프라이밍하고 가공된 T 세포에 의한 세포 사멸이 상기 프라이밍 항원을 발현하는 상기 세포에 제한되지 않음을 입증하였다.
이종성 종양 세포 사멸의 상기 효과는 GFP/CD19+ 표적 세포 대 CD19+ 단독 표적 세포의 다양한 비율을 갖는 집단을 사용하여 추가로 정량하였다. 상기 이종성 집단은 항-GFP synNotch → 항-CD19 CAR T 세포 또는 형질도입되지 않은 음성 조절 T 세포로 처리하고 시점은 24시간 및 72시간에 취하였다(도 25).어떠한 세포 사멸도 형질도입되지 않은 세포로 처리되는 경우 임의의 집단에서 관찰되지 않았다. 그러나, 24시간에, 실질적 세포 사멸은 항-GFP synNotch → 항-CD19 CAR T 세포로 처리 후 모든 집단에서 관찰되었고 72시간까지 모든 표적 세포는 제거되었다.
이들 결과는 종양 이종성의 정도 또는 프라이밍 항원의 상대적 풍부함/결핍에 상관없이, 이종성 종양의 특이적이고 효과적인 종양 세포 사멸이 상기 프라이밍 → 사멸 synNotch 게이트된 시스템을 사용하여 성취됨을 입증한다. 다른 말로 하면, 기재된 시스템은 이종성 종양이 높거나 낮은 퍼센트의 프라이밍 항원 발현 세포를 함유하는지를 판단하는데 효과적이고 특이적이다.
1:3의 프라이밍 대 표적 이종성 혼합물 중 프라이밍 및 비-프라이밍 (“표적”) 집단에 대한 시스템의 사멸 효과의 보다 높은 일시적 해상도가 도 26에 제공된다. 상기된 바와 같이, 집단 둘 다의 모든 세포는 처리 후 72시간까지 제거된다.
도 27에서 알 수 있는 바와 같이, 프라이밍 세포 대 비-프라이밍 표적 세포가 1:19의 비율로 낮은 경우라도, CD19+ 비-프라이밍 항원 표적 세포는 도 26에서의 것과 유사한 일시적 역학으로 효과적으로 사멸된다. 72시간까지 표적 세포의 본래의 집단의 10% 미만이 잔류한다. 총체적으로, 이들 결과는 synNotch 게이트된 종양 세포 사멸 시스템이 종양 내에 synNotch 프라이밍 항원을 발현하는 세포의 상대적 제공과는 상관없이 이종성 종양을 특이적으로 치료하는데 효과적임을 입증한다.
실시예
6: 면역 억제제의 조절된 발현.
암 면역치료요법에서 면역 반응을 유도하는 것에 추가로, 단백질용해 절단가능한 키메라 폴리펩타이드는 또한 암 치료요법에 외에 유용한 기능에 대해 연구되었다. 예시적 synNotch를 사용하여 연구된 하나의 적용은 예를 들어, 자가면역 세팅에서 면역 억제였다. 세포-대-접촉 억제를 구동하는, 사이토킨, IL-10 및 T 세포 저해 리간드, PD-L1과 같은 근거리분비 저해 신호의 자발적 생성을 구동하는 SynNotch T 세포가 가공되었다(도 28).
CD19 자극을 사용하여 검정된 바와 같이, 항-CD19 synNotch 수용체는 CD19+ K562s를 사용한 자극에 응답하여 억제제 (PD-L1 및 IL-10) 둘 다를 구동시킬 수 있었다(도 29).비-천연 합성 T 세포 반응을 조절하는 synNotch 수용체 T 세포의 다른 예뿐만 아닐 상기 예는 치료학적 세포의 효과를 증진시킬 수 있거나, 항상성 및 천연 기능을 복구하기 위해 조직 또는 질환 환경을 재프로그램할 수 있는 광범위한 치료학적 제제를 생성하기 위한 synNotch 가공된 세포의 광범위하게 다양한 적용을 강조한다.
실시예
7: 야생형 친화성 및 증진된 친화성
TCR을
사용한 이원-항원
게이트된
사이
토킨 분비.
추가의 이원-항원 및-게이트는 표적 표면 항원(표면-발현된 GFP) 및 세포내 표적 항원(NY-ESO) 둘 다를 발현하는 표적화 세포에 응답하는 CD8 T 세포 사이토킨 분비를 시험하기 위해 표면 항원 게이트된 TCR 발현용으로 디자인하였다. 구체적으로, 도 33에 도식적으로 제공된 바와 같이, CD8 T 세포는 항-HLA-A2/NY-ESO1 TCR의 발현을 조절하는 항-GFP synNotch로 가공하여 사이토킨 인터페론의 방출이 표면-발현된-GFP 및 HLA-A2/NY-ESO1 둘 다를 발현하는 T2 표적 세포에 응답하여 일어나도록 한다. 상기 시스템은 야생형 친화성 및 친화성 증진된 항-HLA-A2/NY-ESO1 TCR 둘 다와 함께 시험하였다.
도 34에 나타낸 바와 같이, TCR 중 어느 하나의 항-GFP synNotch 게이트된 발현을 갖는 CD8 T 세포를 활성화시키고 이원-항원 GFP+/HLA-A2/NY-ESO1+ T2 표적 세포의 존재하에서만 IFNγ을 분비하였다. 추가로, CD8 T 세포 활성화의 수준 (IFNγ 방출에 의한 측정시)은 친화성이 표적 세포 관여 시, 야생형 친화성 TCR 세포와 비교하여, 많은 IFNγ의 거의 2배로 생성된 TCR 세포를 증진시킴으로서 이의 표적 항원에 대한 TCR의 친화성에 의존하였다.
이들 결과는 야생형 친화성 및 증진된 친화성 TCR을 사용한 이원-항원(표면 항원 및 세포내 항원) 게이트된 사이토킨 분비를 입증한다. 상기 데이터는 또한 T 세포 활성화 및 사이토킨 분비의 수준이 이들의 표적 항원에 대해 상이한 친화성을 갖는 TCR의 게이트된 발현을 통해 조절될 수 있음을 보여준다.
실시예
8: 이원-항원
게이트된
CD4 T 세포
사이토킨
분비.
CD4 T 세포 활성화 및 사이토킨 분비는 항-HLA-A2/NY-ESO1 TCR을 조절하는 항-HLA-A2/WT1 synNotch로 가공된 CD4 T 세포에서 시험하였다(도 35에 도시된 바와 같이).도 36에 제공된 데이터에 의해 나타낸 바와 같이, 항-HLA-A2/WT1 synNotch 및 항-HLA-A2/NY-ESO1 TCR 발현 세포는 HLA-A2/WT1 및 HLA-A2/NY-ESO1 항원 둘 다를 발현하는 T2 표적 세포에 특이적으로 응답하여 고수준의 IFNγ 항원을 방출한다. 사이토킨 분비의 일부 낮은 수준은 항-HLA-A2/WT1 synNotch에 의한 HLA-A2 단독의 부분적 인지로 인해 HLA-A2/NY-ESO1만을 발현하는 T2 표적 세포에 응답하여 나타났다. synNotch 수용체에서 다중 상이한 항-HLA-A2/WT1 scFv의 시험은 표적화된 특이적 WT1 펩타이드에 상관없이 단독의 항-HLA-A2의 낮은 수준의 측정가능한 인지를 밝혔다. 그러나, 항원 둘 다를 발현하는 표적 세포에 응답하여 세포 활성화 및 사이토킨 방출의 고수준의 증가는 상기 배경 HLA-A2 부분적 인지가 적당히 이원-항원 표적화 및 특이성을 영향을 주지 않음을 지적한다.
실시예
9: 임상적 관련 이원-항원
표적화
.
임상적으로 관련된 항원 쌍을 사용한 기재된 표면 항원/pMHC 항원 및-게이팅 전략의 다능성을 추가로 입증하기 위해, CD8 및 CD4 T 세포 둘 다는 항-HLA-A2/NY-ESO1 TCR을 조절하는 항-HER2 synNotch로 가공하였다. Her2 및 HLA-A2/NY-ESO1은 유방암 및 신경교종을 포함하는 다양한 암에서 동시 발현되는 것으로 밝혀졌다. 상기 게이팅/표적화 전략을 도시하는 도식은 도 37에 제공된다.
도 38에 제공된 결과에서 보여지는 바와 같이, 가공된 CD8 및 CD4 T 세포 둘 다는 표적 항원 둘 다(HER2 및 HLA-A2/NY-ESO1)를 발현하는 표적 T2 세포를 특이적으로 사멸시켰다. 2개의 항원 중 하나만을 발현하는 대조군 세포는 영향받지 않았다. 주지할 만하게, 가공된 CD4 세포에 의한 이원-항원 표적 세포의 특이적 사멸은 표면 항원/pMHC 항원 인지 회로가 CD8-독립적 방식으로 표적 사멸을 유도할 수 있음을 입증하였다.
총체적으로, 상기 실시예의 결과는 적어도 하나의 세포내 항원을 표적화하는 것들을 포함하는, 임상적으로 관련된 항원 쌍을 발현하는 세포가 가공된 이원-항원 게이트된 CD8 T 세포 및/또는 이원-항원 게이트된 CD4 T 세포를 사용하여 효과적으로 표적화되고 사멸될 수 있음을 입증한다.
실시예
10: CAR 발현을 조절하는
pMHC
-감지
synNotch를
사용한 이원-항원
표적화
.
상기 접근법의 다능성을 추가로 입증하기 위해, 표면 표적 항원 및 세포내 표적 항원 둘 다를 발현하는 세포를 표적화하는 CAR을 함유하는 추가의 이원-항원 및-게이트를 디자인하고 시험하였다. 예시적 시스템은 도 41에 도시하고, 여기서, T 세포로 디자인되고 가공된 바와 같이, 항-Her2 CAR의 발현은 항-HLA-A2/WT1 synNotch의 유리된 세포내 도메인에 의해 유도된다. 상기 회로는 표면 항원-특이적 CAR의 발현을 조절하는 pMHC-특이적 synNotch 수용체의 예로서 작용한다. 단지 Her2를 발현하는 T2 표적 세포와 함께 제공되는 경우, 항-Her2 CAR의 발현은 유도되지 않고 어떠한 T 세포 활성화도 일어나지 않는다. 그러나, WT1 및 Her2 둘 다를 발현하는 T2 표적 세포와 함께 제공되는 경우, 항-HLA-A2/WT1 synNotch로의 표면-HLA-A2/WT1의 결합은 노치 폴리펩타이드의 절단을 유도하여, 항-Her2 CAR의 발현을 구동하는 UAS에 결합하는 GAL4 전사 활성화인자를 방출한다. 발현된 항-Her2 CAR의 표적 세포 상의 Her2로의 결합은 T 세포의 활성화를 유발한다. 상기 이원-항원 회로를 발현하도록 가공된 주르캣 T 세포주의 CD69 발현을 사용하여 측정된 바와 같은 수득한 활성화는 도 42에 제공된다. 상기 검정 결과는 T 세포 활성화(즉, CD69 상향조절)가 표적 세포에 의한 표적 항원 둘 다의 발현에 의존하였고, 이는 다시 이원-항원 synNotch 및-게이트의 강한 특이성을 추가로 입증함을 보여주었다. 본 실시예는 또한 표면 항원-특이적 CAR의 발현을 조절하는 pMHC-특이적 synNotch 수용체와 함께 이원-항원 synNotch 및-게이트에 사용될 수 있는 광범위한 항원 조합을 보여준다.
본 발명은 이의 특이적 구현예를 참조로 기재되었지만, 이것은 다양한 변화가 만들어질 수 있고 등가물이 본 발명의 취지 및 범위를 벗어나는 것 없이 대체될 수 있는 것으로 이해되어야만 한다. 추가로, 많은 변형은 특정 상황, 재료, 물질의 조성, 공정 단계 또는 단계들이 본 발명의 목적, 취지 및 범위에 적응되도록 만들어질 수 있다. 상기 변형은 첨부된 청구항의 범위내에 있는 것으로 의도된다.
<110> Lim, Wendell A.
Roybal, Kole T.
Williams, Jasper Z.
<120> Proteolytically Cleavable Chimeric Polypeptides and Methods of
Use Thereof
<130> UCSF-544WO
<150> US 62/378,614
<151> 2016-08-23
<160> 134
<170> KoPatentIn version 3.0
<210> 1
<211> 2555
<212> PRT
<213> Homo sapiens
<400> 1
Met Pro Pro Leu Leu Ala Pro Leu Leu Cys Leu Ala Leu Leu Pro Ala
1 5 10 15
Leu Ala Ala Arg Gly Pro Arg Cys Ser Gln Pro Gly Glu Thr Cys Leu
20 25 30
Asn Gly Gly Lys Cys Glu Ala Ala Asn Gly Thr Glu Ala Cys Val Cys
35 40 45
Gly Gly Ala Phe Val Gly Pro Arg Cys Gln Asp Pro Asn Pro Cys Leu
50 55 60
Ser Thr Pro Cys Lys Asn Ala Gly Thr Cys His Val Val Asp Arg Arg
65 70 75 80
Gly Val Ala Asp Tyr Ala Cys Ser Cys Ala Leu Gly Phe Ser Gly Pro
85 90 95
Leu Cys Leu Thr Pro Leu Asp Asn Ala Cys Leu Thr Asn Pro Cys Arg
100 105 110
Asn Gly Gly Thr Cys Asp Leu Leu Thr Leu Thr Glu Tyr Lys Cys Arg
115 120 125
Cys Pro Pro Gly Trp Ser Gly Lys Ser Cys Gln Gln Ala Asp Pro Cys
130 135 140
Ala Ser Asn Pro Cys Ala Asn Gly Gly Gln Cys Leu Pro Phe Glu Ala
145 150 155 160
Ser Tyr Ile Cys His Cys Pro Pro Ser Phe His Gly Pro Thr Cys Arg
165 170 175
Gln Asp Val Asn Glu Cys Gly Gln Lys Pro Gly Leu Cys Arg His Gly
180 185 190
Gly Thr Cys His Asn Glu Val Gly Ser Tyr Arg Cys Val Cys Arg Ala
195 200 205
Thr His Thr Gly Pro Asn Cys Glu Arg Pro Tyr Val Pro Cys Ser Pro
210 215 220
Ser Pro Cys Gln Asn Gly Gly Thr Cys Arg Pro Thr Gly Asp Val Thr
225 230 235 240
His Glu Cys Ala Cys Leu Pro Gly Phe Thr Gly Gln Asn Cys Glu Glu
245 250 255
Asn Ile Asp Asp Cys Pro Gly Asn Asn Cys Lys Asn Gly Gly Ala Cys
260 265 270
Val Asp Gly Val Asn Thr Tyr Asn Cys Arg Cys Pro Pro Glu Trp Thr
275 280 285
Gly Gln Tyr Cys Thr Glu Asp Val Asp Glu Cys Gln Leu Met Pro Asn
290 295 300
Ala Cys Gln Asn Gly Gly Thr Cys His Asn Thr His Gly Gly Tyr Asn
305 310 315 320
Cys Val Cys Val Asn Gly Trp Thr Gly Glu Asp Cys Ser Glu Asn Ile
325 330 335
Asp Asp Cys Ala Ser Ala Ala Cys Phe His Gly Ala Thr Cys His Asp
340 345 350
Arg Val Ala Ser Phe Tyr Cys Glu Cys Pro His Gly Arg Thr Gly Leu
355 360 365
Leu Cys His Leu Asn Asp Ala Cys Ile Ser Asn Pro Cys Asn Glu Gly
370 375 380
Ser Asn Cys Asp Thr Asn Pro Val Asn Gly Lys Ala Ile Cys Thr Cys
385 390 395 400
Pro Ser Gly Tyr Thr Gly Pro Ala Cys Ser Gln Asp Val Asp Glu Cys
405 410 415
Ser Leu Gly Ala Asn Pro Cys Glu His Ala Gly Lys Cys Ile Asn Thr
420 425 430
Leu Gly Ser Phe Glu Cys Gln Cys Leu Gln Gly Tyr Thr Gly Pro Arg
435 440 445
Cys Glu Ile Asp Val Asn Glu Cys Val Ser Asn Pro Cys Gln Asn Asp
450 455 460
Ala Thr Cys Leu Asp Gln Ile Gly Glu Phe Gln Cys Ile Cys Met Pro
465 470 475 480
Gly Tyr Glu Gly Val His Cys Glu Val Asn Thr Asp Glu Cys Ala Ser
485 490 495
Ser Pro Cys Leu His Asn Gly Arg Cys Leu Asp Lys Ile Asn Glu Phe
500 505 510
Gln Cys Glu Cys Pro Thr Gly Phe Thr Gly His Leu Cys Gln Tyr Asp
515 520 525
Val Asp Glu Cys Ala Ser Thr Pro Cys Lys Asn Gly Ala Lys Cys Leu
530 535 540
Asp Gly Pro Asn Thr Tyr Thr Cys Val Cys Thr Glu Gly Tyr Thr Gly
545 550 555 560
Thr His Cys Glu Val Asp Ile Asp Glu Cys Asp Pro Asp Pro Cys His
565 570 575
Tyr Gly Ser Cys Lys Asp Gly Val Ala Thr Phe Thr Cys Leu Cys Arg
580 585 590
Pro Gly Tyr Thr Gly His His Cys Glu Thr Asn Ile Asn Glu Cys Ser
595 600 605
Ser Gln Pro Cys Arg His Gly Gly Thr Cys Gln Asp Arg Asp Asn Ala
610 615 620
Tyr Leu Cys Phe Cys Leu Lys Gly Thr Thr Gly Pro Asn Cys Glu Ile
625 630 635 640
Asn Leu Asp Asp Cys Ala Ser Ser Pro Cys Asp Ser Gly Thr Cys Leu
645 650 655
Asp Lys Ile Asp Gly Tyr Glu Cys Ala Cys Glu Pro Gly Tyr Thr Gly
660 665 670
Ser Met Cys Asn Ile Asn Ile Asp Glu Cys Ala Gly Asn Pro Cys His
675 680 685
Asn Gly Gly Thr Cys Glu Asp Gly Ile Asn Gly Phe Thr Cys Arg Cys
690 695 700
Pro Glu Gly Tyr His Asp Pro Thr Cys Leu Ser Glu Val Asn Glu Cys
705 710 715 720
Asn Ser Asn Pro Cys Val His Gly Ala Cys Arg Asp Ser Leu Asn Gly
725 730 735
Tyr Lys Cys Asp Cys Asp Pro Gly Trp Ser Gly Thr Asn Cys Asp Ile
740 745 750
Asn Asn Asn Glu Cys Glu Ser Asn Pro Cys Val Asn Gly Gly Thr Cys
755 760 765
Lys Asp Met Thr Ser Gly Tyr Val Cys Thr Cys Arg Glu Gly Phe Ser
770 775 780
Gly Pro Asn Cys Gln Thr Asn Ile Asn Glu Cys Ala Ser Asn Pro Cys
785 790 795 800
Leu Asn Gln Gly Thr Cys Ile Asp Asp Val Ala Gly Tyr Lys Cys Asn
805 810 815
Cys Leu Leu Pro Tyr Thr Gly Ala Thr Cys Glu Val Val Leu Ala Pro
820 825 830
Cys Ala Pro Ser Pro Cys Arg Asn Gly Gly Glu Cys Arg Gln Ser Glu
835 840 845
Asp Tyr Glu Ser Phe Ser Cys Val Cys Pro Thr Gly Trp Gln Gly Gln
850 855 860
Thr Cys Glu Val Asp Ile Asn Glu Cys Val Leu Ser Pro Cys Arg His
865 870 875 880
Gly Ala Ser Cys Gln Asn Thr His Gly Gly Tyr Arg Cys His Cys Gln
885 890 895
Ala Gly Tyr Ser Gly Arg Asn Cys Glu Thr Asp Ile Asp Asp Cys Arg
900 905 910
Pro Asn Pro Cys His Asn Gly Gly Ser Cys Thr Asp Gly Ile Asn Thr
915 920 925
Ala Phe Cys Asp Cys Leu Pro Gly Phe Arg Gly Thr Phe Cys Glu Glu
930 935 940
Asp Ile Asn Glu Cys Ala Ser Asp Pro Cys Arg Asn Gly Ala Asn Cys
945 950 955 960
Thr Asp Cys Val Asp Ser Tyr Thr Cys Thr Cys Pro Ala Gly Phe Ser
965 970 975
Gly Ile His Cys Glu Asn Asn Thr Pro Asp Cys Thr Glu Ser Ser Cys
980 985 990
Phe Asn Gly Gly Thr Cys Val Asp Gly Ile Asn Ser Phe Thr Cys Leu
995 1000 1005
Cys Pro Pro Gly Phe Thr Gly Ser Tyr Cys Gln His Asp Val Asn Glu
1010 1015 1020
Cys Asp Ser Gln Pro Cys Leu His Gly Gly Thr Cys Gln Asp Gly Cys
1025 1030 1035 1040
Gly Ser Tyr Arg Cys Thr Cys Pro Gln Gly Tyr Thr Gly Pro Asn Cys
1045 1050 1055
Gln Asn Leu Val His Trp Cys Asp Ser Ser Pro Cys Lys Asn Gly Gly
1060 1065 1070
Lys Cys Trp Gln Thr His Thr Gln Tyr Arg Cys Glu Cys Pro Ser Gly
1075 1080 1085
Trp Thr Gly Leu Tyr Cys Asp Val Pro Ser Val Ser Cys Glu Val Ala
1090 1095 1100
Ala Gln Arg Gln Gly Val Asp Val Ala Arg Leu Cys Gln His Gly Gly
1105 1110 1115 1120
Leu Cys Val Asp Ala Gly Asn Thr His His Cys Arg Cys Gln Ala Gly
1125 1130 1135
Tyr Thr Gly Ser Tyr Cys Glu Asp Leu Val Asp Glu Cys Ser Pro Ser
1140 1145 1150
Pro Cys Gln Asn Gly Ala Thr Cys Thr Asp Tyr Leu Gly Gly Tyr Ser
1155 1160 1165
Cys Lys Cys Val Ala Gly Tyr His Gly Val Asn Cys Ser Glu Glu Ile
1170 1175 1180
Asp Glu Cys Leu Ser His Pro Cys Gln Asn Gly Gly Thr Cys Leu Asp
1185 1190 1195 1200
Leu Pro Asn Thr Tyr Lys Cys Ser Cys Pro Arg Gly Thr Gln Gly Val
1205 1210 1215
His Cys Glu Ile Asn Val Asp Asp Cys Asn Pro Pro Val Asp Pro Val
1220 1225 1230
Ser Arg Ser Pro Lys Cys Phe Asn Asn Gly Thr Cys Val Asp Gln Val
1235 1240 1245
Gly Gly Tyr Ser Cys Thr Cys Pro Pro Gly Phe Val Gly Glu Arg Cys
1250 1255 1260
Glu Gly Asp Val Asn Glu Cys Leu Ser Asn Pro Cys Asp Ala Arg Gly
1265 1270 1275 1280
Thr Gln Asn Cys Val Gln Arg Val Asn Asp Phe His Cys Glu Cys Arg
1285 1290 1295
Ala Gly His Thr Gly Arg Arg Cys Glu Ser Val Ile Asn Gly Cys Lys
1300 1305 1310
Gly Lys Pro Cys Lys Asn Gly Gly Thr Cys Ala Val Ala Ser Asn Thr
1315 1320 1325
Ala Arg Gly Phe Ile Cys Lys Cys Pro Ala Gly Phe Glu Gly Ala Thr
1330 1335 1340
Cys Glu Asn Asp Ala Arg Thr Cys Gly Ser Leu Arg Cys Leu Asn Gly
1345 1350 1355 1360
Gly Thr Cys Ile Ser Gly Pro Arg Ser Pro Thr Cys Leu Cys Leu Gly
1365 1370 1375
Pro Phe Thr Gly Pro Glu Cys Gln Phe Pro Ala Ser Ser Pro Cys Leu
1380 1385 1390
Gly Gly Asn Pro Cys Tyr Asn Gln Gly Thr Cys Glu Pro Thr Ser Glu
1395 1400 1405
Ser Pro Phe Tyr Arg Cys Leu Cys Pro Ala Lys Phe Asn Gly Leu Leu
1410 1415 1420
Cys His Ile Leu Asp Tyr Ser Phe Gly Gly Gly Ala Gly Arg Asp Ile
1425 1430 1435 1440
Pro Pro Pro Leu Ile Glu Glu Ala Cys Glu Leu Pro Glu Cys Gln Glu
1445 1450 1455
Asp Ala Gly Asn Lys Val Cys Ser Leu Gln Cys Asn Asn His Ala Cys
1460 1465 1470
Gly Trp Asp Gly Gly Asp Cys Ser Leu Asn Phe Asn Asp Pro Trp Lys
1475 1480 1485
Asn Cys Thr Gln Ser Leu Gln Cys Trp Lys Tyr Phe Ser Asp Gly His
1490 1495 1500
Cys Asp Ser Gln Cys Asn Ser Ala Gly Cys Leu Phe Asp Gly Phe Asp
1505 1510 1515 1520
Cys Gln Arg Ala Glu Gly Gln Cys Asn Pro Leu Tyr Asp Gln Tyr Cys
1525 1530 1535
Lys Asp His Phe Ser Asp Gly His Cys Asp Gln Gly Cys Asn Ser Ala
1540 1545 1550
Glu Cys Glu Trp Asp Gly Leu Asp Cys Ala Glu His Val Pro Glu Arg
1555 1560 1565
Leu Ala Ala Gly Thr Leu Val Val Val Val Leu Met Pro Pro Glu Gln
1570 1575 1580
Leu Arg Asn Ser Ser Phe His Phe Leu Arg Glu Leu Ser Arg Val Leu
1585 1590 1595 1600
His Thr Asn Val Val Phe Lys Arg Asp Ala His Gly Gln Gln Met Ile
1605 1610 1615
Phe Pro Tyr Tyr Gly Arg Glu Glu Glu Leu Arg Lys His Pro Ile Lys
1620 1625 1630
Arg Ala Ala Glu Gly Trp Ala Ala Pro Asp Ala Leu Leu Gly Gln Val
1635 1640 1645
Lys Ala Ser Leu Leu Pro Gly Gly Ser Glu Gly Gly Arg Arg Arg Arg
1650 1655 1660
Glu Leu Asp Pro Met Asp Val Arg Gly Ser Ile Val Tyr Leu Glu Ile
1665 1670 1675 1680
Asp Asn Arg Gln Cys Val Gln Ala Ser Ser Gln Cys Phe Gln Ser Ala
1685 1690 1695
Thr Asp Val Ala Ala Phe Leu Gly Ala Leu Ala Ser Leu Gly Ser Leu
1700 1705 1710
Asn Ile Pro Tyr Lys Ile Glu Ala Val Gln Ser Glu Thr Val Glu Pro
1715 1720 1725
Pro Pro Pro Ala Gln Leu His Phe Met Tyr Val Ala Ala Ala Ala Phe
1730 1735 1740
Val Leu Leu Phe Phe Val Gly Cys Gly Val Leu Leu Ser Arg Lys Arg
1745 1750 1755 1760
Arg Arg Gln His Gly Gln Leu Trp Phe Pro Glu Gly Phe Lys Val Ser
1765 1770 1775
Glu Ala Ser Lys Lys Lys Arg Arg Glu Pro Leu Gly Glu Asp Ser Val
1780 1785 1790
Gly Leu Lys Pro Leu Lys Asn Ala Ser Asp Gly Ala Leu Met Asp Asp
1795 1800 1805
Asn Gln Asn Glu Trp Gly Asp Glu Asp Leu Glu Thr Lys Lys Phe Arg
1810 1815 1820
Phe Glu Glu Pro Val Val Leu Pro Asp Leu Asp Asp Gln Thr Asp His
1825 1830 1835 1840
Arg Gln Trp Thr Gln Gln His Leu Asp Ala Ala Asp Leu Arg Met Ser
1845 1850 1855
Ala Met Ala Pro Thr Pro Pro Gln Gly Glu Val Asp Ala Asp Cys Met
1860 1865 1870
Asp Val Asn Val Arg Gly Pro Asp Gly Phe Thr Pro Leu Met Ile Ala
1875 1880 1885
Ser Cys Ser Gly Gly Gly Leu Glu Thr Gly Asn Ser Glu Glu Glu Glu
1890 1895 1900
Asp Ala Pro Ala Val Ile Ser Asp Phe Ile Tyr Gln Gly Ala Ser Leu
1905 1910 1915 1920
His Asn Gln Thr Asp Arg Thr Gly Glu Thr Ala Leu His Leu Ala Ala
1925 1930 1935
Arg Tyr Ser Arg Ser Asp Ala Ala Lys Arg Leu Leu Glu Ala Ser Ala
1940 1945 1950
Asp Ala Asn Ile Gln Asp Asn Met Gly Arg Thr Pro Leu His Ala Ala
1955 1960 1965
Val Ser Ala Asp Ala Gln Gly Val Phe Gln Ile Leu Ile Arg Asn Arg
1970 1975 1980
Ala Thr Asp Leu Asp Ala Arg Met His Asp Gly Thr Thr Pro Leu Ile
1985 1990 1995 2000
Leu Ala Ala Arg Leu Ala Val Glu Gly Met Leu Glu Asp Leu Ile Asn
2005 2010 2015
Ser His Ala Asp Val Asn Ala Val Asp Asp Leu Gly Lys Ser Ala Leu
2020 2025 2030
His Trp Ala Ala Ala Val Asn Asn Val Asp Ala Ala Val Val Leu Leu
2035 2040 2045
Lys Asn Gly Ala Asn Lys Asp Met Gln Asn Asn Arg Glu Glu Thr Pro
2050 2055 2060
Leu Phe Leu Ala Ala Arg Glu Gly Ser Tyr Glu Thr Ala Lys Val Leu
2065 2070 2075 2080
Leu Asp His Phe Ala Asn Arg Asp Ile Thr Asp His Met Asp Arg Leu
2085 2090 2095
Pro Arg Asp Ile Ala Gln Glu Arg Met His His Asp Ile Val Arg Leu
2100 2105 2110
Leu Asp Glu Tyr Asn Leu Val Arg Ser Pro Gln Leu His Gly Ala Pro
2115 2120 2125
Leu Gly Gly Thr Pro Thr Leu Ser Pro Pro Leu Cys Ser Pro Asn Gly
2130 2135 2140
Tyr Leu Gly Ser Leu Lys Pro Gly Val Gln Gly Lys Lys Val Arg Lys
2145 2150 2155 2160
Pro Ser Ser Lys Gly Leu Ala Cys Gly Ser Lys Glu Ala Lys Asp Leu
2165 2170 2175
Lys Ala Arg Arg Lys Lys Ser Gln Asp Gly Lys Gly Cys Leu Leu Asp
2180 2185 2190
Ser Ser Gly Met Leu Ser Pro Val Asp Ser Leu Glu Ser Pro His Gly
2195 2200 2205
Tyr Leu Ser Asp Val Ala Ser Pro Pro Leu Leu Pro Ser Pro Phe Gln
2210 2215 2220
Gln Ser Pro Ser Val Pro Leu Asn His Leu Pro Gly Met Pro Asp Thr
2225 2230 2235 2240
His Leu Gly Ile Gly His Leu Asn Val Ala Ala Lys Pro Glu Met Ala
2245 2250 2255
Ala Leu Gly Gly Gly Gly Arg Leu Ala Phe Glu Thr Gly Pro Pro Arg
2260 2265 2270
Leu Ser His Leu Pro Val Ala Ser Gly Thr Ser Thr Val Leu Gly Ser
2275 2280 2285
Ser Ser Gly Gly Ala Leu Asn Phe Thr Val Gly Gly Ser Thr Ser Leu
2290 2295 2300
Asn Gly Gln Cys Glu Trp Leu Ser Arg Leu Gln Ser Gly Met Val Pro
2305 2310 2315 2320
Asn Gln Tyr Asn Pro Leu Arg Gly Ser Val Ala Pro Gly Pro Leu Ser
2325 2330 2335
Thr Gln Ala Pro Ser Leu Gln His Gly Met Val Gly Pro Leu His Ser
2340 2345 2350
Ser Leu Ala Ala Ser Ala Leu Ser Gln Met Met Ser Tyr Gln Gly Leu
2355 2360 2365
Pro Ser Thr Arg Leu Ala Thr Gln Pro His Leu Val Gln Thr Gln Gln
2370 2375 2380
Val Gln Pro Gln Asn Leu Gln Met Gln Gln Gln Asn Leu Gln Pro Ala
2385 2390 2395 2400
Asn Ile Gln Gln Gln Gln Ser Leu Gln Pro Pro Pro Pro Pro Pro Gln
2405 2410 2415
Pro His Leu Gly Val Ser Ser Ala Ala Ser Gly His Leu Gly Arg Ser
2420 2425 2430
Phe Leu Ser Gly Glu Pro Ser Gln Ala Asp Val Gln Pro Leu Gly Pro
2435 2440 2445
Ser Ser Leu Ala Val His Thr Ile Leu Pro Gln Glu Ser Pro Ala Leu
2450 2455 2460
Pro Thr Ser Leu Pro Ser Ser Leu Val Pro Pro Val Thr Ala Ala Gln
2465 2470 2475 2480
Phe Leu Thr Pro Pro Ser Gln His Ser Tyr Ser Ser Pro Val Asp Asn
2485 2490 2495
Thr Pro Ser His Gln Leu Gln Val Pro Glu His Pro Phe Leu Thr Pro
2500 2505 2510
Ser Pro Glu Ser Pro Asp Gln Trp Ser Ser Ser Ser Pro His Ser Asn
2515 2520 2525
Val Ser Asp Trp Ser Glu Gly Val Ser Ser Pro Pro Thr Ser Met Gln
2530 2535 2540
Ser Gln Ile Ala Arg Ile Pro Glu Ala Phe Lys
2545 2550 2555
<210> 2
<211> 2531
<212> PRT
<213> Mus musculus
<400> 2
Met Pro Arg Leu Leu Thr Pro Leu Leu Cys Leu Thr Leu Leu Pro Ala
1 5 10 15
Leu Ala Ala Arg Gly Leu Arg Cys Ser Gln Pro Ser Gly Thr Cys Leu
20 25 30
Asn Gly Gly Arg Cys Glu Val Ala Asn Gly Thr Glu Ala Cys Val Cys
35 40 45
Ser Gly Ala Phe Val Gly Gln Arg Cys Gln Asp Ser Asn Pro Cys Leu
50 55 60
Ser Thr Pro Cys Lys Asn Ala Gly Thr Cys His Val Val Asp His Gly
65 70 75 80
Gly Thr Val Asp Tyr Ala Cys Ser Cys Pro Leu Gly Phe Ser Gly Pro
85 90 95
Leu Cys Leu Thr Pro Leu Asp Asn Ala Cys Leu Ala Asn Pro Cys Arg
100 105 110
Asn Gly Gly Thr Cys Asp Leu Leu Thr Leu Thr Glu Tyr Lys Cys Arg
115 120 125
Cys Pro Pro Gly Trp Ser Gly Lys Ser Cys Gln Gln Ala Asp Pro Cys
130 135 140
Ala Ser Asn Pro Cys Ala Asn Gly Gly Gln Cys Leu Pro Phe Glu Ser
145 150 155 160
Ser Tyr Ile Cys Arg Cys Pro Pro Gly Phe His Gly Pro Thr Cys Arg
165 170 175
Gln Asp Val Asn Glu Cys Ser Gln Asn Pro Gly Leu Cys Arg His Gly
180 185 190
Gly Thr Cys His Asn Glu Ile Gly Ser Tyr Arg Cys Ala Cys Arg Ala
195 200 205
Thr His Thr Gly Pro His Cys Glu Leu Pro Tyr Val Pro Cys Ser Pro
210 215 220
Ser Pro Cys Gln Asn Gly Gly Thr Cys Arg Pro Thr Gly Asp Thr Thr
225 230 235 240
His Glu Cys Ala Cys Leu Pro Gly Phe Ala Gly Gln Asn Cys Glu Glu
245 250 255
Asn Val Asp Asp Cys Pro Gly Asn Asn Cys Lys Asn Gly Gly Ala Cys
260 265 270
Val Asp Gly Val Asn Thr Tyr Asn Cys Arg Cys Pro Pro Glu Trp Thr
275 280 285
Gly Gln Tyr Cys Thr Glu Asp Val Asp Glu Cys Gln Leu Met Pro Asn
290 295 300
Ala Cys Gln Asn Gly Gly Thr Cys His Asn Thr His Gly Gly Tyr Asn
305 310 315 320
Cys Val Cys Val Asn Gly Trp Thr Gly Glu Asp Cys Ser Glu Asn Ile
325 330 335
Asp Asp Cys Ala Ser Ala Ala Cys Phe Gln Gly Ala Thr Cys His Asp
340 345 350
Arg Val Ala Ser Phe Tyr Cys Glu Cys Pro His Gly Arg Thr Gly Leu
355 360 365
Leu Cys His Leu Asn Asp Ala Cys Ile Ser Asn Pro Cys Asn Glu Gly
370 375 380
Ser Asn Cys Asp Thr Asn Pro Val Asn Gly Lys Ala Ile Cys Thr Cys
385 390 395 400
Pro Ser Gly Tyr Thr Gly Pro Ala Cys Ser Gln Asp Val Asp Glu Cys
405 410 415
Ala Leu Gly Ala Asn Pro Cys Glu His Ala Gly Lys Cys Leu Asn Thr
420 425 430
Leu Gly Ser Phe Glu Cys Gln Cys Leu Gln Gly Tyr Thr Gly Pro Arg
435 440 445
Cys Glu Ile Asp Val Asn Glu Cys Ile Ser Asn Pro Cys Gln Asn Asp
450 455 460
Ala Thr Cys Leu Asp Gln Ile Gly Glu Phe Gln Cys Ile Cys Met Pro
465 470 475 480
Gly Tyr Glu Gly Val Tyr Cys Glu Ile Asn Thr Asp Glu Cys Ala Ser
485 490 495
Ser Pro Cys Leu His Asn Gly His Cys Met Asp Lys Ile Asn Glu Phe
500 505 510
Gln Cys Gln Cys Pro Lys Gly Phe Asn Gly His Leu Cys Gln Tyr Asp
515 520 525
Val Asp Glu Cys Ala Ser Thr Pro Cys Lys Asn Gly Ala Lys Cys Leu
530 535 540
Asp Gly Pro Asn Thr Tyr Thr Cys Val Cys Thr Glu Gly Tyr Thr Gly
545 550 555 560
Thr His Cys Glu Val Asp Ile Asp Glu Cys Asp Pro Asp Pro Cys His
565 570 575
Tyr Gly Ser Cys Lys Asp Gly Val Ala Thr Phe Thr Cys Leu Cys Gln
580 585 590
Pro Gly Tyr Thr Gly His His Cys Glu Thr Asn Ile Asn Glu Cys His
595 600 605
Ser Gln Pro Cys Arg His Gly Gly Thr Cys Gln Asp Arg Asp Asn Ser
610 615 620
Tyr Leu Cys Leu Cys Leu Lys Gly Thr Thr Gly Pro Asn Cys Glu Ile
625 630 635 640
Asn Leu Asp Asp Cys Ala Ser Asn Pro Cys Asp Ser Gly Thr Cys Leu
645 650 655
Asp Lys Ile Asp Gly Tyr Glu Cys Ala Cys Glu Pro Gly Tyr Thr Gly
660 665 670
Ser Met Cys Asn Val Asn Ile Asp Glu Cys Ala Gly Ser Pro Cys His
675 680 685
Asn Gly Gly Thr Cys Glu Asp Gly Ile Ala Gly Phe Thr Cys Arg Cys
690 695 700
Pro Glu Gly Tyr His Asp Pro Thr Cys Leu Ser Glu Val Asn Glu Cys
705 710 715 720
Asn Ser Asn Pro Cys Ile His Gly Ala Cys Arg Asp Gly Leu Asn Gly
725 730 735
Tyr Lys Cys Asp Cys Ala Pro Gly Trp Ser Gly Thr Asn Cys Asp Ile
740 745 750
Asn Asn Asn Glu Cys Glu Ser Asn Pro Cys Val Asn Gly Gly Thr Cys
755 760 765
Lys Asp Met Thr Ser Gly Tyr Val Cys Thr Cys Arg Glu Gly Phe Ser
770 775 780
Gly Pro Asn Cys Gln Thr Asn Ile Asn Glu Cys Ala Ser Asn Pro Cys
785 790 795 800
Leu Asn Gln Gly Thr Cys Ile Asp Asp Val Ala Gly Tyr Lys Cys Asn
805 810 815
Cys Pro Leu Pro Tyr Thr Gly Ala Thr Cys Glu Val Val Leu Ala Pro
820 825 830
Cys Ala Thr Ser Pro Cys Lys Asn Ser Gly Val Cys Lys Glu Ser Glu
835 840 845
Asp Tyr Glu Ser Phe Ser Cys Val Cys Pro Thr Gly Trp Gln Gly Gln
850 855 860
Thr Cys Glu Val Asp Ile Asn Glu Cys Val Lys Ser Pro Cys Arg His
865 870 875 880
Gly Ala Ser Cys Gln Asn Thr Asn Gly Ser Tyr Arg Cys Leu Cys Gln
885 890 895
Ala Gly Tyr Thr Gly Arg Asn Cys Glu Ser Asp Ile Asp Asp Cys Arg
900 905 910
Pro Asn Pro Cys His Asn Gly Gly Ser Cys Thr Asp Gly Ile Asn Thr
915 920 925
Ala Phe Cys Asp Cys Leu Pro Gly Phe Gln Gly Ala Phe Cys Glu Glu
930 935 940
Asp Ile Asn Glu Cys Ala Ser Asn Pro Cys Gln Asn Gly Ala Asn Cys
945 950 955 960
Thr Asp Cys Val Asp Ser Tyr Thr Cys Thr Cys Pro Val Gly Phe Asn
965 970 975
Gly Ile His Cys Glu Asn Asn Thr Pro Asp Cys Thr Glu Ser Ser Cys
980 985 990
Phe Asn Gly Gly Thr Cys Val Asp Gly Ile Asn Ser Phe Thr Cys Leu
995 1000 1005
Cys Pro Pro Gly Phe Thr Gly Ser Tyr Cys Gln Tyr Asp Val Asn Glu
1010 1015 1020
Cys Asp Ser Arg Pro Cys Leu His Gly Gly Thr Cys Gln Asp Ser Tyr
1025 1030 1035 1040
Gly Thr Tyr Lys Cys Thr Cys Pro Gln Gly Tyr Thr Gly Leu Asn Cys
1045 1050 1055
Gln Asn Leu Val Arg Trp Cys Asp Ser Ala Pro Cys Lys Asn Gly Gly
1060 1065 1070
Arg Cys Trp Gln Thr Asn Thr Gln Tyr His Cys Glu Cys Arg Ser Gly
1075 1080 1085
Trp Thr Gly Val Asn Cys Asp Val Leu Ser Val Ser Cys Glu Val Ala
1090 1095 1100
Ala Gln Lys Arg Gly Ile Asp Val Thr Leu Leu Cys Gln His Gly Gly
1105 1110 1115 1120
Leu Cys Val Asp Glu Gly Asp Lys His Tyr Cys His Cys Gln Ala Gly
1125 1130 1135
Tyr Thr Gly Ser Tyr Cys Glu Asp Glu Val Asp Glu Cys Ser Pro Asn
1140 1145 1150
Pro Cys Gln Asn Gly Ala Thr Cys Thr Asp Tyr Leu Gly Gly Phe Ser
1155 1160 1165
Cys Lys Cys Val Ala Gly Tyr His Gly Ser Asn Cys Ser Glu Glu Ile
1170 1175 1180
Asn Glu Cys Leu Ser Gln Pro Cys Gln Asn Gly Gly Thr Cys Ile Asp
1185 1190 1195 1200
Leu Thr Asn Ser Tyr Lys Cys Ser Cys Pro Arg Gly Thr Gln Gly Val
1205 1210 1215
His Cys Glu Ile Asn Val Asp Asp Cys His Pro Pro Leu Asp Pro Ala
1220 1225 1230
Ser Arg Ser Pro Lys Cys Phe Asn Asn Gly Thr Cys Val Asp Gln Val
1235 1240 1245
Gly Gly Tyr Thr Cys Thr Cys Pro Pro Gly Phe Val Gly Glu Arg Cys
1250 1255 1260
Glu Gly Asp Val Asn Glu Cys Leu Ser Asn Pro Cys Asp Pro Arg Gly
1265 1270 1275 1280
Thr Gln Asn Cys Val Gln Arg Val Asn Asp Phe His Cys Glu Cys Arg
1285 1290 1295
Ala Gly His Thr Gly Arg Arg Cys Glu Ser Val Ile Asn Gly Cys Arg
1300 1305 1310
Gly Lys Pro Cys Lys Asn Gly Gly Val Cys Ala Val Ala Ser Asn Thr
1315 1320 1325
Ala Arg Gly Phe Ile Cys Arg Cys Pro Ala Gly Phe Glu Gly Ala Thr
1330 1335 1340
Cys Glu Asn Asp Ala Arg Thr Cys Gly Ser Leu Arg Cys Leu Asn Gly
1345 1350 1355 1360
Gly Thr Cys Ile Ser Gly Pro Arg Ser Pro Thr Cys Leu Cys Leu Gly
1365 1370 1375
Ser Phe Thr Gly Pro Glu Cys Gln Phe Pro Ala Ser Ser Pro Cys Val
1380 1385 1390
Gly Ser Asn Pro Cys Tyr Asn Gln Gly Thr Cys Glu Pro Thr Ser Glu
1395 1400 1405
Asn Pro Phe Tyr Arg Cys Leu Cys Pro Ala Lys Phe Asn Gly Leu Leu
1410 1415 1420
Cys His Ile Leu Asp Tyr Ser Phe Thr Gly Gly Ala Gly Arg Asp Ile
1425 1430 1435 1440
Pro Pro Pro Gln Ile Glu Glu Ala Cys Glu Leu Pro Glu Cys Gln Val
1445 1450 1455
Asp Ala Gly Asn Lys Val Cys Asn Leu Gln Cys Asn Asn His Ala Cys
1460 1465 1470
Gly Trp Asp Gly Gly Asp Cys Ser Leu Asn Phe Asn Asp Pro Trp Lys
1475 1480 1485
Asn Cys Thr Gln Ser Leu Gln Cys Trp Lys Tyr Phe Ser Asp Gly His
1490 1495 1500
Cys Asp Ser Gln Cys Asn Ser Ala Gly Cys Leu Phe Asp Gly Phe Asp
1505 1510 1515 1520
Cys Gln Leu Thr Glu Gly Gln Cys Asn Pro Leu Tyr Asp Gln Tyr Cys
1525 1530 1535
Lys Asp His Phe Ser Asp Gly His Cys Asp Gln Gly Cys Asn Ser Ala
1540 1545 1550
Glu Cys Glu Trp Asp Gly Leu Asp Cys Ala Glu His Val Pro Glu Arg
1555 1560 1565
Leu Ala Ala Gly Thr Leu Val Leu Val Val Leu Leu Pro Pro Asp Gln
1570 1575 1580
Leu Arg Asn Asn Ser Phe His Phe Leu Arg Glu Leu Ser His Val Leu
1585 1590 1595 1600
His Thr Asn Val Val Phe Lys Arg Asp Ala Gln Gly Gln Gln Met Ile
1605 1610 1615
Phe Pro Tyr Tyr Gly His Glu Glu Glu Leu Arg Lys His Pro Ile Lys
1620 1625 1630
Arg Ser Thr Val Gly Trp Ala Thr Ser Ser Leu Leu Pro Gly Thr Ser
1635 1640 1645
Gly Gly Arg Gln Arg Arg Glu Leu Asp Pro Met Asp Ile Arg Gly Ser
1650 1655 1660
Ile Val Tyr Leu Glu Ile Asp Asn Arg Gln Cys Val Gln Ser Ser Ser
1665 1670 1675 1680
Gln Cys Phe Gln Ser Ala Thr Asp Val Ala Ala Phe Leu Gly Ala Leu
1685 1690 1695
Ala Ser Leu Gly Ser Leu Asn Ile Pro Tyr Lys Ile Glu Ala Val Lys
1700 1705 1710
Ser Glu Pro Val Glu Pro Pro Leu Pro Ser Gln Leu His Leu Met Tyr
1715 1720 1725
Val Ala Ala Ala Ala Phe Val Leu Leu Phe Phe Val Gly Cys Gly Val
1730 1735 1740
Leu Leu Ser Arg Lys Arg Arg Arg Gln His Gly Gln Leu Trp Phe Pro
1745 1750 1755 1760
Glu Gly Phe Lys Val Ser Glu Ala Ser Lys Lys Lys Arg Arg Glu Pro
1765 1770 1775
Leu Gly Glu Asp Ser Val Gly Leu Lys Pro Leu Lys Asn Ala Ser Asp
1780 1785 1790
Gly Ala Leu Met Asp Asp Asn Gln Asn Glu Trp Gly Asp Glu Asp Leu
1795 1800 1805
Glu Thr Lys Lys Phe Arg Phe Glu Glu Pro Val Val Leu Pro Asp Leu
1810 1815 1820
Ser Asp Gln Thr Asp His Arg Gln Trp Thr Gln Gln His Leu Asp Ala
1825 1830 1835 1840
Ala Asp Leu Arg Met Ser Ala Met Ala Pro Thr Pro Pro Gln Gly Glu
1845 1850 1855
Val Asp Ala Asp Cys Met Asp Val Asn Val Arg Gly Pro Asp Gly Phe
1860 1865 1870
Thr Pro Leu Met Ile Ala Ser Cys Ser Gly Gly Gly Leu Glu Thr Gly
1875 1880 1885
Asn Ser Glu Glu Glu Glu Asp Ala Pro Ala Val Ile Ser Asp Phe Ile
1890 1895 1900
Tyr Gln Gly Ala Ser Leu His Asn Gln Thr Asp Arg Thr Gly Glu Thr
1905 1910 1915 1920
Ala Leu His Leu Ala Ala Arg Tyr Ser Arg Ser Asp Ala Ala Lys Arg
1925 1930 1935
Leu Leu Glu Ala Ser Ala Asp Ala Asn Ile Gln Asp Asn Met Gly Arg
1940 1945 1950
Thr Pro Leu His Ala Ala Val Ser Ala Asp Ala Gln Gly Val Phe Gln
1955 1960 1965
Ile Leu Leu Arg Asn Arg Ala Thr Asp Leu Asp Ala Arg Met His Asp
1970 1975 1980
Gly Thr Thr Pro Leu Ile Leu Ala Ala Arg Leu Ala Val Glu Gly Met
1985 1990 1995 2000
Leu Glu Asp Leu Ile Asn Ser His Ala Asp Val Asn Ala Val Asp Asp
2005 2010 2015
Leu Gly Lys Ser Ala Leu His Trp Ala Ala Ala Val Asn Asn Val Asp
2020 2025 2030
Ala Ala Val Val Leu Leu Lys Asn Gly Ala Asn Lys Asp Met Gln Asn
2035 2040 2045
Asn Lys Glu Glu Thr Pro Leu Phe Leu Ala Ala Arg Glu Gly Ser Tyr
2050 2055 2060
Glu Thr Ala Lys Val Leu Leu Asp His Phe Ala Asn Arg Asp Ile Thr
2065 2070 2075 2080
Asp His Met Asp Arg Leu Pro Arg Asp Ile Ala Gln Glu Arg Met His
2085 2090 2095
His Asp Ile Val Arg Leu Leu Asp Glu Tyr Asn Leu Val Arg Ser Pro
2100 2105 2110
Gln Leu His Gly Thr Ala Leu Gly Gly Thr Pro Thr Leu Ser Pro Thr
2115 2120 2125
Leu Cys Ser Pro Asn Gly Tyr Leu Gly Asn Leu Lys Ser Ala Thr Gln
2130 2135 2140
Gly Lys Lys Ala Arg Lys Pro Ser Thr Lys Gly Leu Ala Cys Gly Ser
2145 2150 2155 2160
Lys Glu Ala Lys Asp Leu Lys Ala Arg Arg Lys Lys Ser Gln Asp Gly
2165 2170 2175
Lys Gly Cys Leu Leu Asp Ser Ser Ser Met Leu Ser Pro Val Asp Ser
2180 2185 2190
Leu Glu Ser Pro His Gly Tyr Leu Ser Asp Val Ala Ser Pro Pro Leu
2195 2200 2205
Leu Pro Ser Pro Phe Gln Gln Ser Pro Ser Met Pro Leu Ser His Leu
2210 2215 2220
Pro Gly Met Pro Asp Thr His Leu Gly Ile Ser His Leu Asn Val Ala
2225 2230 2235 2240
Ala Lys Pro Glu Met Ala Ala Leu Ala Gly Gly Ser Arg Leu Ala Phe
2245 2250 2255
Glu Pro Pro Pro Pro Arg Leu Ser His Leu Pro Val Ala Ser Ser Ala
2260 2265 2270
Ser Thr Val Leu Ser Thr Asn Gly Thr Gly Ala Met Asn Phe Thr Val
2275 2280 2285
Gly Ala Pro Ala Ser Leu Asn Gly Gln Cys Glu Trp Leu Pro Arg Leu
2290 2295 2300
Gln Asn Gly Met Val Pro Ser Gln Tyr Asn Pro Leu Arg Pro Gly Val
2305 2310 2315 2320
Thr Pro Gly Thr Leu Ser Thr Gln Ala Ala Gly Leu Gln His Ser Met
2325 2330 2335
Met Gly Pro Leu His Ser Ser Leu Ser Thr Asn Thr Leu Ser Pro Ile
2340 2345 2350
Ile Tyr Gln Gly Leu Pro Asn Thr Arg Leu Ala Thr Gln Pro His Leu
2355 2360 2365
Val Gln Thr Gln Gln Val Gln Pro Gln Asn Leu Gln Leu Gln Pro Gln
2370 2375 2380
Asn Leu Gln Pro Pro Ser Gln Pro His Leu Ser Val Ser Ser Ala Ala
2385 2390 2395 2400
Asn Gly His Leu Gly Arg Ser Phe Leu Ser Gly Glu Pro Ser Gln Ala
2405 2410 2415
Asp Val Gln Pro Leu Gly Pro Ser Ser Leu Pro Val His Thr Ile Leu
2420 2425 2430
Pro Gln Glu Ser Gln Ala Leu Pro Thr Ser Leu Pro Ser Ser Met Val
2435 2440 2445
Pro Pro Met Thr Thr Thr Gln Phe Leu Thr Pro Pro Ser Gln His Ser
2450 2455 2460
Tyr Ser Ser Ser Pro Val Asp Asn Thr Pro Ser His Gln Leu Gln Val
2465 2470 2475 2480
Pro Glu His Pro Phe Leu Thr Pro Ser Pro Glu Ser Pro Asp Gln Trp
2485 2490 2495
Ser Ser Ser Ser Pro His Ser Asn Ile Ser Asp Trp Ser Glu Gly Ile
2500 2505 2510
Ser Ser Pro Pro Thr Thr Met Pro Ser Gln Ile Thr His Ile Pro Glu
2515 2520 2525
Ala Phe Lys
2530
<210> 3
<211> 1429
<212> PRT
<213> Caenorhabditis elegans
<400> 3
Met Arg Ile Pro Thr Ile Cys Phe Leu Phe Leu Leu Ile Ser Leu Ser
1 5 10 15
Lys Ser Leu His Ile Gly Ser Cys Leu Gly Leu Ile Cys Gly Arg Asn
20 25 30
Gly His Cys His Ala Gly Pro Val Asn Gly Thr Gln Thr Ser Tyr Trp
35 40 45
Cys Arg Cys Asp Glu Gly Phe Gly Gly Glu Tyr Cys Glu Gln Gln Cys
50 55 60
Asp Val Ser Lys Cys Gly Ala Asp Glu Lys Cys Val Phe Asp Lys Asp
65 70 75 80
Tyr Arg Met Glu Thr Cys Val Cys Lys Asp Cys Asp Ile Asn Gly Asn
85 90 95
Ser Leu Leu Lys Pro Ser Cys Pro Ser Gly Tyr Gly Gly Asp Asp Cys
100 105 110
Lys Thr Gln Gly Trp Cys Tyr Pro Ser Val Cys Met Asn Gly Gly Gln
115 120 125
Cys Ile Gly Ala Gly Asn Arg Ala Lys Cys Ala Cys Pro Asp Gly Phe
130 135 140
Lys Gly Glu Arg Cys Glu Leu Asp Val Asn Glu Cys Glu Glu Asn Lys
145 150 155 160
Asn Ala Cys Gly Asn Arg Ser Thr Cys Met Asn Thr Leu Gly Thr Tyr
165 170 175
Ile Cys Val Cys Pro Gln Gly Phe Leu Pro Pro Asp Cys Leu Lys Pro
180 185 190
Gly Asn Thr Ser Thr Val Glu Phe Lys Gln Pro Val Cys Phe Leu Glu
195 200 205
Ile Ser Ala Asp His Pro Asp Gly Arg Ser Met Tyr Cys Gln Asn Gly
210 215 220
Gly Phe Cys Asp Lys Ala Ser Ser Lys Cys Gln Cys Pro Pro Gly Tyr
225 230 235 240
His Gly Ser Thr Cys Glu Leu Leu Glu Lys Glu Asp Ser Cys Ala Ser
245 250 255
Asn Pro Cys Ser His Gly Val Cys Ile Ser Phe Ser Gly Gly Phe Gln
260 265 270
Cys Ile Cys Asp Asp Gly Tyr Ser Gly Ser Tyr Cys Gln Glu Gly Lys
275 280 285
Asp Asn Cys Val Asn Asn Lys Cys Glu Ala Gly Ser Lys Cys Ile Asn
290 295 300
Gly Val Asn Ser Tyr Phe Cys Asp Cys Pro Pro Glu Arg Thr Gly Pro
305 310 315 320
Tyr Cys Glu Lys Met Asp Cys Ser Ala Ile Pro Asp Ile Cys Asn His
325 330 335
Gly Thr Cys Ile Asp Ser Pro Leu Ser Glu Lys Ala Phe Glu Cys Gln
340 345 350
Cys Glu Pro Gly Tyr Glu Gly Ile Leu Cys Glu Gln Asp Lys Asn Glu
355 360 365
Cys Leu Ser Glu Asn Met Cys Leu Asn Asn Gly Thr Cys Val Asn Leu
370 375 380
Pro Gly Ser Phe Arg Cys Asp Cys Ala Arg Gly Phe Gly Gly Lys Trp
385 390 395 400
Cys Asp Glu Pro Leu Asn Met Cys Gln Asp Phe His Cys Glu Asn Asp
405 410 415
Gly Thr Cys Met His Thr Ser Asp His Ser Pro Val Cys Gln Cys Lys
420 425 430
Asn Gly Phe Ile Gly Lys Arg Cys Glu Lys Glu Cys Pro Ile Gly Phe
435 440 445
Gly Gly Val Arg Cys Asp Leu Arg Leu Glu Ile Gly Ile Cys Ser Arg
450 455 460
Gln Gly Gly Lys Cys Phe Asn Gly Gly Lys Cys Leu Ser Gly Phe Cys
465 470 475 480
Val Cys Pro Pro Asp Phe Thr Gly Asn Gln Cys Glu Val Asn Arg Lys
485 490 495
Asn Gly Lys Ser Ser Leu Ser Glu Asn Leu Cys Leu Ser Asp Pro Cys
500 505 510
Met Asn Asn Ala Thr Cys Ile Asp Val Asp Ala His Ile Gly Tyr Ala
515 520 525
Cys Ile Cys Lys Gln Gly Phe Glu Gly Asp Ile Cys Glu Arg His Lys
530 535 540
Asp Leu Cys Leu Glu Asn Pro Cys Ser Asn Gly Gly Val Cys His Gln
545 550 555 560
His Arg Glu Ser Phe Ser Cys Asp Cys Pro Pro Gly Phe Tyr Gly Asn
565 570 575
Gly Cys Glu Gln Glu Lys Met Phe Arg Cys Leu Lys Ser Thr Cys Gln
580 585 590
Asn Gly Gly Val Cys Ile Asn Glu Glu Glu Lys Gly Arg Lys Cys Glu
595 600 605
Cys Ser Tyr Gly Phe Ser Gly Ala Arg Cys Glu Glu Lys Ile Asn Leu
610 615 620
Thr Gly Phe Thr Glu Lys Asp Ser Leu Leu Arg Ser Val Cys Glu Lys
625 630 635 640
Arg Lys Cys Ser Glu Arg Ala Asn Asp Gly Asn Cys Asp Ala Asp Cys
645 650 655
Asn Tyr Ala Ala Cys Lys Phe Asp Gly Gly Asp Cys Ser Gly Lys Arg
660 665 670
Glu Pro Phe Ser Lys Cys Arg Tyr Gly Asn Met Cys Ala Asp Phe Phe
675 680 685
Ala Asn Gly Val Cys Asn Gln Ala Cys Asn Asn Glu Glu Cys Leu Tyr
690 695 700
Asp Gly Met Asp Cys Leu Pro Ala Val Val Arg Cys Pro Val Lys Ile
705 710 715 720
Arg Glu His Cys Ala Ser Arg Phe Ala Asn Gly Ile Cys Asp Pro Glu
725 730 735
Cys Asn Thr Asn Gly Cys Gly Phe Asp Gly Gly Asp Cys Asp Asn Glu
740 745 750
Thr Asn Ala Thr Ile Ile Thr Asn Ile Arg Ile Thr Val Gln Met Asp
755 760 765
Pro Lys Glu Phe Gln Val Thr Gly Gly Gln Ser Leu Met Glu Ile Ser
770 775 780
Ser Ala Leu Arg Val Thr Val Arg Ile Gln Arg Asp Glu Glu Gly Pro
785 790 795 800
Leu Val Phe Gln Trp Asn Gly Glu Ser Glu Met Asp Arg Val Lys Met
805 810 815
Asn Glu Arg Gln Leu Thr Glu Gln His Val Leu Ser Thr Ser Ile Ser
820 825 830
Arg Lys Ile Lys Arg Ser Ala Thr Asn Ile Gly Val Val Val Tyr Leu
835 840 845
Glu Val Gln Glu Asn Cys Asp Thr Gly Lys Cys Leu Tyr Lys Asp Ala
850 855 860
Gln Ser Val Val Asp Ser Ile Ser Ala Arg Leu Ala Lys Lys Gly Ile
865 870 875 880
Asp Ser Phe Gly Ile Pro Ile Ser Glu Ala Leu Val Ala Glu Pro Arg
885 890 895
Lys Ser Gly Asn Asn Thr Gly Phe Leu Ser Trp Asn Ala Leu Leu Leu
900 905 910
Ile Gly Ala Gly Cys Leu Ile Val Met Val Val Leu Met Leu Gly Ala
915 920 925
Leu Pro Gly Asn Arg Thr Arg Lys Arg Arg Met Ile Asn Ala Ser Val
930 935 940
Trp Met Pro Pro Met Glu Asn Glu Glu Lys Asn Arg Lys Asn His Gln
945 950 955 960
Ser Ile Thr Ser Ser Gln His Ser Leu Leu Glu Ala Ser Tyr Asp Gly
965 970 975
Tyr Ile Lys Arg Gln Arg Asn Glu Leu Gln His Tyr Ser Leu Tyr Pro
980 985 990
Asn Pro Gln Gly Tyr Gly Asn Gly Asn Asp Phe Leu Gly Asp Phe Asn
995 1000 1005
His Thr Asn Leu Gln Ile Pro Thr Glu Pro Glu Pro Glu Ser Pro Ile
1010 1015 1020
Lys Leu His Thr Glu Ala Ala Gly Ser Tyr Ala Ile Thr Glu Pro Ile
1025 1030 1035 1040
Thr Arg Glu Ser Val Asn Ile Ile Asp Pro Arg His Asn Arg Thr Val
1045 1050 1055
Leu His Trp Ile Ala Ser Asn Ser Ser Ala Glu Lys Ser Glu Asp Leu
1060 1065 1070
Ile Val His Glu Ala Lys Glu Cys Ile Ala Ala Gly Ala Asp Val Asn
1075 1080 1085
Ala Met Asp Cys Asp Glu Asn Thr Pro Leu Met Leu Ala Val Leu Ala
1090 1095 1100
Arg Arg Arg Arg Leu Val Ala Tyr Leu Met Lys Ala Gly Ala Asp Pro
1105 1110 1115 1120
Thr Ile Tyr Asn Lys Ser Glu Arg Ser Ala Leu His Gln Ala Ala Ala
1125 1130 1135
Asn Arg Asp Phe Gly Met Met Val Tyr Met Leu Asn Ser Thr Lys Leu
1140 1145 1150
Lys Gly Asp Ile Glu Glu Leu Asp Arg Asn Gly Met Thr Ala Leu Met
1155 1160 1165
Ile Val Ala His Asn Glu Gly Arg Asp Gln Val Ala Ser Ala Lys Leu
1170 1175 1180
Leu Val Glu Lys Gly Ala Lys Val Asp Tyr Asp Gly Ala Ala Arg Lys
1185 1190 1195 1200
Asp Ser Glu Lys Tyr Lys Gly Arg Thr Ala Leu His Tyr Ala Ala Gln
1205 1210 1215
Val Ser Asn Met Pro Ile Val Lys Tyr Leu Val Gly Glu Lys Gly Ser
1220 1225 1230
Asn Lys Asp Lys Gln Asp Glu Asp Gly Lys Thr Pro Ile Met Leu Ala
1235 1240 1245
Ala Gln Glu Gly Arg Ile Glu Val Val Met Tyr Leu Ile Gln Gln Gly
1250 1255 1260
Ala Ser Val Glu Ala Val Asp Ala Thr Asp His Thr Ala Arg Gln Leu
1265 1270 1275 1280
Ala Gln Ala Asn Asn His His Asn Ile Val Asp Ile Phe Asp Arg Cys
1285 1290 1295
Arg Pro Glu Arg Glu Tyr Ser Met Asp Leu His Ile Gln His Thr His
1300 1305 1310
Gln Pro Gln Pro Ser Arg Lys Val Thr Arg Ala Pro Lys Lys Gln Thr
1315 1320 1325
Ser Arg Ser Lys Lys Glu Ser Ala Ser Asn Ser Arg Asp Ser Thr His
1330 1335 1340
Leu Thr Pro Pro Pro Ser Asp Gly Ser Thr Ser Thr Pro Ser Pro Gln
1345 1350 1355 1360
His Phe Met Asn Thr Thr His Thr Thr Pro Thr Ser Leu Asn Tyr Leu
1365 1370 1375
Ser Pro Glu Tyr Gln Thr Glu Ala Gly Ser Ser Glu Ala Phe Gln Pro
1380 1385 1390
Gln Cys Gly Ala Phe Gly Asn Gly Glu Met Trp Tyr Thr Arg Ala Ser
1395 1400 1405
Thr Ser Tyr Thr Gln Met Gln Asn Glu Pro Met Thr Arg Tyr Ser Glu
1410 1415 1420
Pro Ala His Tyr Phe
1425
<210> 4
<211> 2703
<212> PRT
<213> Drosophila melanogaster
<400> 4
Met Gln Ser Gln Arg Ser Arg Arg Arg Ser Arg Ala Pro Asn Thr Trp
1 5 10 15
Ile Cys Phe Trp Ile Asn Lys Met His Ala Val Ala Ser Leu Pro Ala
20 25 30
Ser Leu Pro Leu Leu Leu Leu Thr Leu Ala Phe Ala Asn Leu Pro Asn
35 40 45
Thr Val Arg Gly Thr Asp Thr Ala Leu Val Ala Ala Ser Cys Thr Ser
50 55 60
Val Gly Cys Gln Asn Gly Gly Thr Cys Val Thr Gln Leu Asn Gly Lys
65 70 75 80
Thr Tyr Cys Ala Cys Asp Ser His Tyr Val Gly Asp Tyr Cys Glu His
85 90 95
Arg Asn Pro Cys Asn Ser Met Arg Cys Gln Asn Gly Gly Thr Cys Gln
100 105 110
Val Thr Phe Arg Asn Gly Arg Pro Gly Ile Ser Cys Lys Cys Pro Leu
115 120 125
Gly Phe Asp Glu Ser Leu Cys Glu Ile Ala Val Pro Asn Ala Cys Asp
130 135 140
His Val Thr Cys Leu Asn Gly Gly Thr Cys Gln Leu Lys Thr Leu Glu
145 150 155 160
Glu Tyr Thr Cys Ala Cys Ala Asn Gly Tyr Thr Gly Glu Arg Cys Glu
165 170 175
Thr Lys Asn Leu Cys Ala Ser Ser Pro Cys Arg Asn Gly Ala Thr Cys
180 185 190
Thr Ala Leu Ala Gly Ser Ser Ser Phe Thr Cys Ser Cys Pro Pro Gly
195 200 205
Phe Thr Gly Asp Thr Cys Ser Tyr Asp Ile Glu Glu Cys Gln Ser Asn
210 215 220
Pro Cys Lys Tyr Gly Gly Thr Cys Val Asn Thr His Gly Ser Tyr Gln
225 230 235 240
Cys Met Cys Pro Thr Gly Tyr Thr Gly Lys Asp Cys Asp Thr Lys Tyr
245 250 255
Lys Pro Cys Ser Pro Ser Pro Cys Gln Asn Gly Gly Ile Cys Arg Ser
260 265 270
Asn Gly Leu Ser Tyr Glu Cys Lys Cys Pro Lys Gly Phe Glu Gly Lys
275 280 285
Asn Cys Glu Gln Asn Tyr Asp Asp Cys Leu Gly His Leu Cys Gln Asn
290 295 300
Gly Gly Thr Cys Ile Asp Gly Ile Ser Asp Tyr Thr Cys Arg Cys Pro
305 310 315 320
Pro Asn Phe Thr Gly Arg Phe Cys Gln Asp Asp Val Asp Glu Cys Ala
325 330 335
Gln Arg Asp His Pro Val Cys Gln Asn Gly Ala Thr Cys Thr Asn Thr
340 345 350
His Gly Ser Tyr Ser Cys Ile Cys Val Asn Gly Trp Ala Gly Leu Asp
355 360 365
Cys Ser Asn Asn Thr Asp Asp Cys Lys Gln Ala Ala Cys Phe Tyr Gly
370 375 380
Ala Thr Cys Ile Asp Gly Val Gly Ser Phe Tyr Cys Gln Cys Thr Lys
385 390 395 400
Gly Lys Thr Gly Leu Leu Cys His Leu Asp Asp Ala Cys Thr Ser Asn
405 410 415
Pro Cys His Ala Asp Ala Ile Cys Asp Thr Ser Pro Ile Asn Gly Ser
420 425 430
Tyr Ala Cys Ser Cys Ala Thr Gly Tyr Lys Gly Val Asp Cys Ser Glu
435 440 445
Asp Ile Asp Glu Cys Asp Gln Gly Ser Pro Cys Glu His Asn Gly Ile
450 455 460
Cys Val Asn Thr Pro Gly Ser Tyr Arg Cys Asn Cys Ser Gln Gly Phe
465 470 475 480
Thr Gly Pro Arg Cys Glu Thr Asn Ile Asn Glu Cys Glu Ser His Pro
485 490 495
Cys Gln Asn Glu Gly Ser Cys Leu Asp Asp Pro Gly Thr Phe Arg Cys
500 505 510
Val Cys Met Pro Gly Phe Thr Gly Thr Gln Cys Glu Ile Asp Ile Asp
515 520 525
Glu Cys Gln Ser Asn Pro Cys Leu Asn Asp Gly Thr Cys His Asp Lys
530 535 540
Ile Asn Gly Phe Lys Cys Ser Cys Ala Leu Gly Phe Thr Gly Ala Arg
545 550 555 560
Cys Gln Ile Asn Ile Asp Asp Cys Gln Ser Gln Pro Cys Arg Asn Arg
565 570 575
Gly Ile Cys His Asp Ser Ile Ala Gly Tyr Ser Cys Glu Cys Pro Pro
580 585 590
Gly Tyr Thr Gly Thr Ser Cys Glu Ile Asn Ile Asn Asp Cys Asp Ser
595 600 605
Asn Pro Cys His Arg Gly Lys Cys Ile Asp Asp Val Asn Ser Phe Lys
610 615 620
Cys Leu Cys Asp Pro Gly Tyr Thr Gly Tyr Ile Cys Gln Lys Gln Ile
625 630 635 640
Asn Glu Cys Glu Ser Asn Pro Cys Gln Phe Asp Gly His Cys Gln Asp
645 650 655
Arg Val Gly Ser Tyr Tyr Cys Gln Cys Gln Ala Gly Thr Ser Gly Lys
660 665 670
Asn Cys Glu Val Asn Val Asn Glu Cys His Ser Asn Pro Cys Asn Asn
675 680 685
Gly Ala Thr Cys Ile Asp Gly Ile Asn Ser Tyr Lys Cys Gln Cys Val
690 695 700
Pro Gly Phe Thr Gly Gln His Cys Glu Lys Asn Val Asp Glu Cys Ile
705 710 715 720
Ser Ser Pro Cys Ala Asn Asn Gly Val Cys Ile Asp Gln Val Asn Gly
725 730 735
Tyr Lys Cys Glu Cys Pro Arg Gly Phe Tyr Asp Ala His Cys Leu Ser
740 745 750
Asp Val Asp Glu Cys Ala Ser Asn Pro Cys Val Asn Glu Gly Arg Cys
755 760 765
Glu Asp Gly Ile Asn Glu Phe Ile Cys His Cys Pro Pro Gly Tyr Thr
770 775 780
Gly Lys Arg Cys Glu Leu Asp Ile Asp Glu Cys Ser Ser Asn Pro Cys
785 790 795 800
Gln His Gly Gly Thr Cys Tyr Asp Lys Leu Asn Ala Phe Ser Cys Gln
805 810 815
Cys Met Pro Gly Tyr Thr Gly Gln Lys Cys Glu Thr Asn Ile Asp Asp
820 825 830
Cys Val Thr Asn Pro Cys Gly Asn Gly Gly Thr Cys Ile Asp Lys Val
835 840 845
Asn Gly Tyr Lys Cys Val Cys Lys Val Pro Phe Thr Gly Arg Asp Cys
850 855 860
Glu Ser Lys Met Asp Pro Cys Ala Ser Asn Arg Cys Lys Asn Glu Ala
865 870 875 880
Lys Cys Thr Pro Ser Ser Asn Phe Leu Asp Phe Ser Cys Thr Cys Lys
885 890 895
Leu Gly Tyr Thr Gly Arg Tyr Cys Asp Glu Asp Ile Asp Glu Cys Ser
900 905 910
Leu Ser Ser Pro Cys Arg Asn Gly Ala Ser Cys Leu Asn Val Pro Gly
915 920 925
Ser Tyr Arg Cys Leu Cys Thr Lys Gly Tyr Glu Gly Arg Asp Cys Ala
930 935 940
Ile Asn Thr Asp Asp Cys Ala Ser Phe Pro Cys Gln Asn Gly Gly Thr
945 950 955 960
Cys Leu Asp Gly Ile Gly Asp Tyr Ser Cys Leu Cys Val Asp Gly Phe
965 970 975
Asp Gly Lys His Cys Glu Thr Asp Ile Asn Glu Cys Leu Ser Gln Pro
980 985 990
Cys Gln Asn Gly Ala Thr Cys Ser Gln Tyr Val Asn Ser Tyr Thr Cys
995 1000 1005
Thr Cys Pro Leu Gly Phe Ser Gly Ile Asn Cys Gln Thr Asn Asp Glu
1010 1015 1020
Asp Cys Thr Glu Ser Ser Cys Leu Asn Gly Gly Ser Cys Ile Asp Gly
1025 1030 1035 1040
Ile Asn Gly Tyr Asn Cys Ser Cys Leu Ala Gly Tyr Ser Gly Ala Asn
1045 1050 1055
Cys Gln Tyr Lys Leu Asn Lys Cys Asp Ser Asn Pro Cys Leu Asn Gly
1060 1065 1070
Ala Thr Cys His Glu Gln Asn Asn Glu Tyr Thr Cys His Cys Pro Ser
1075 1080 1085
Gly Phe Thr Gly Lys Gln Cys Ser Glu Tyr Val Asp Trp Cys Gly Gln
1090 1095 1100
Ser Pro Cys Glu Asn Gly Ala Thr Cys Ser Gln Met Lys His Gln Phe
1105 1110 1115 1120
Ser Cys Lys Cys Ser Ala Gly Trp Thr Gly Lys Leu Cys Asp Val Gln
1125 1130 1135
Thr Ile Ser Cys Gln Asp Ala Ala Asp Arg Lys Gly Leu Ser Leu Arg
1140 1145 1150
Gln Leu Cys Asn Asn Gly Thr Cys Lys Asp Tyr Gly Asn Ser His Val
1155 1160 1165
Cys Tyr Cys Ser Gln Gly Tyr Ala Gly Ser Tyr Cys Gln Lys Glu Ile
1170 1175 1180
Asp Glu Cys Gln Ser Gln Pro Cys Gln Asn Gly Gly Thr Cys Arg Asp
1185 1190 1195 1200
Leu Ile Gly Ala Tyr Glu Cys Gln Cys Arg Gln Gly Phe Gln Gly Gln
1205 1210 1215
Asn Cys Glu Leu Asn Ile Asp Asp Cys Ala Pro Asn Pro Cys Gln Asn
1220 1225 1230
Gly Gly Thr Cys His Asp Arg Val Met Asn Phe Ser Cys Ser Cys Pro
1235 1240 1245
Pro Gly Thr Met Gly Ile Ile Cys Glu Ile Asn Lys Asp Asp Cys Lys
1250 1255 1260
Pro Gly Ala Cys His Asn Asn Gly Ser Cys Ile Asp Arg Val Gly Gly
1265 1270 1275 1280
Phe Glu Cys Val Cys Gln Pro Gly Phe Val Gly Ala Arg Cys Glu Gly
1285 1290 1295
Asp Ile Asn Glu Cys Leu Ser Asn Pro Cys Ser Asn Ala Gly Thr Leu
1300 1305 1310
Asp Cys Val Gln Leu Val Asn Asn Tyr His Cys Asn Cys Arg Pro Gly
1315 1320 1325
His Met Gly Arg His Cys Glu His Lys Val Asp Phe Cys Ala Gln Ser
1330 1335 1340
Pro Cys Gln Asn Gly Gly Asn Cys Asn Ile Arg Gln Ser Gly His His
1345 1350 1355 1360
Cys Ile Cys Asn Asn Gly Phe Tyr Gly Lys Asn Cys Glu Leu Ser Gly
1365 1370 1375
Gln Asp Cys Asp Ser Asn Pro Cys Arg Val Gly Asn Cys Val Val Ala
1380 1385 1390
Asp Glu Gly Phe Gly Tyr Arg Cys Glu Cys Pro Arg Gly Thr Leu Gly
1395 1400 1405
Glu His Cys Glu Ile Asp Thr Leu Asp Glu Cys Ser Pro Asn Pro Cys
1410 1415 1420
Ala Gln Gly Ala Ala Cys Glu Asp Leu Leu Gly Asp Tyr Glu Cys Leu
1425 1430 1435 1440
Cys Pro Ser Lys Trp Lys Gly Lys Arg Cys Asp Ile Tyr Asp Ala Asn
1445 1450 1455
Tyr Pro Gly Trp Asn Gly Gly Ser Gly Ser Gly Asn Asp Arg Tyr Ala
1460 1465 1470
Ala Asp Leu Glu Gln Gln Arg Ala Met Cys Asp Lys Arg Gly Cys Thr
1475 1480 1485
Glu Lys Gln Gly Asn Gly Ile Cys Asp Ser Asp Cys Asn Thr Tyr Ala
1490 1495 1500
Cys Asn Phe Asp Gly Asn Asp Cys Ser Leu Gly Ile Asn Pro Trp Ala
1505 1510 1515 1520
Asn Cys Thr Ala Asn Glu Cys Trp Asn Lys Phe Lys Asn Gly Lys Cys
1525 1530 1535
Asn Glu Glu Cys Asn Asn Ala Ala Cys His Tyr Asp Gly His Asp Cys
1540 1545 1550
Glu Arg Lys Leu Lys Ser Cys Asp Ser Leu Phe Asp Ala Tyr Cys Gln
1555 1560 1565
Lys His Tyr Gly Asp Gly Phe Cys Asp Tyr Gly Cys Asn Asn Ala Glu
1570 1575 1580
Cys Ser Trp Asp Gly Leu Asp Cys Glu Asn Lys Thr Gln Ser Pro Val
1585 1590 1595 1600
Leu Ala Glu Gly Ala Met Ser Val Val Met Leu Met Asn Val Glu Ala
1605 1610 1615
Phe Arg Glu Ile Gln Ala Gln Phe Leu Arg Asn Met Ser His Met Leu
1620 1625 1630
Arg Thr Thr Val Arg Leu Lys Lys Asp Ala Leu Gly His Asp Ile Ile
1635 1640 1645
Ile Asn Trp Lys Asp Asn Val Arg Val Pro Glu Ile Glu Asp Thr Asp
1650 1655 1660
Phe Ala Arg Lys Asn Lys Ile Leu Tyr Thr Gln Gln Val His Gln Thr
1665 1670 1675 1680
Gly Ile Gln Ile Tyr Leu Glu Ile Asp Asn Arg Lys Cys Thr Glu Cys
1685 1690 1695
Phe Thr His Ala Val Glu Ala Ala Glu Phe Leu Ala Ala Thr Ala Ala
1700 1705 1710
Lys His Gln Leu Arg Asn Asp Phe Gln Ile His Ser Val Arg Gly Ile
1715 1720 1725
Lys Asn Pro Gly Asp Glu Asp Asn Gly Glu Pro Pro Ala Asn Val Lys
1730 1735 1740
Tyr Val Ile Thr Gly Ile Ile Leu Val Ile Ile Ala Leu Ala Phe Phe
1745 1750 1755 1760
Gly Met Val Leu Ser Thr Gln Arg Lys Arg Ala His Gly Val Thr Trp
1765 1770 1775
Phe Pro Glu Gly Phe Arg Ala Pro Ala Ala Val Met Ser Arg Arg Arg
1780 1785 1790
Arg Asp Pro His Gly Gln Glu Met Arg Asn Leu Asn Lys Gln Val Ala
1795 1800 1805
Met Gln Ser Gln Gly Val Gly Gln Pro Gly Ala His Trp Ser Asp Asp
1810 1815 1820
Glu Ser Asp Met Pro Leu Pro Lys Arg Gln Arg Ser Asp Pro Val Ser
1825 1830 1835 1840
Gly Val Gly Leu Gly Asn Asn Gly Gly Tyr Ala Ser Asp His Thr Met
1845 1850 1855
Val Ser Glu Tyr Glu Glu Ala Asp Gln Arg Val Trp Ser Gln Ala His
1860 1865 1870
Leu Asp Val Val Asp Val Arg Ala Ile Met Thr Pro Pro Ala His Gln
1875 1880 1885
Asp Gly Gly Lys His Asp Val Asp Ala Arg Gly Pro Cys Gly Leu Thr
1890 1895 1900
Pro Leu Met Ile Ala Ala Val Arg Gly Gly Gly Leu Asp Thr Gly Glu
1905 1910 1915 1920
Asp Ile Glu Asn Asn Glu Asp Ser Thr Ala Gln Val Ile Ser Asp Leu
1925 1930 1935
Leu Ala Gln Gly Ala Glu Leu Asn Ala Thr Met Asp Lys Thr Gly Glu
1940 1945 1950
Thr Ser Leu His Leu Ala Ala Arg Phe Ala Arg Ala Asp Ala Ala Lys
1955 1960 1965
Arg Leu Leu Asp Ala Gly Ala Asp Ala Asn Cys Gln Asp Asn Thr Gly
1970 1975 1980
Arg Thr Pro Leu His Ala Ala Val Ala Ala Asp Ala Met Gly Val Phe
1985 1990 1995 2000
Gln Ile Leu Leu Arg Asn Arg Ala Thr Asn Leu Asn Ala Arg Met His
2005 2010 2015
Asp Gly Thr Thr Pro Leu Ile Leu Ala Ala Arg Leu Ala Ile Glu Gly
2020 2025 2030
Met Val Glu Asp Leu Ile Thr Ala Asp Ala Asp Ile Asn Ala Ala Asp
2035 2040 2045
Asn Ser Gly Lys Thr Ala Leu His Trp Ala Ala Ala Val Asn Asn Thr
2050 2055 2060
Glu Ala Val Asn Ile Leu Leu Met His His Ala Asn Arg Asp Ala Gln
2065 2070 2075 2080
Asp Asp Lys Asp Glu Thr Pro Leu Phe Leu Ala Ala Arg Glu Gly Ser
2085 2090 2095
Tyr Glu Ala Cys Lys Ala Leu Leu Asp Asn Phe Ala Asn Arg Glu Ile
2100 2105 2110
Thr Asp His Met Asp Arg Leu Pro Arg Asp Val Ala Ser Glu Arg Leu
2115 2120 2125
His His Asp Ile Val Arg Leu Leu Asp Glu His Val Pro Arg Ser Pro
2130 2135 2140
Gln Met Leu Ser Met Thr Pro Gln Ala Met Ile Gly Ser Pro Pro Pro
2145 2150 2155 2160
Gly Gln Gln Gln Pro Gln Leu Ile Thr Gln Pro Thr Val Ile Ser Ala
2165 2170 2175
Gly Asn Gly Gly Asn Asn Gly Asn Gly Asn Ala Ser Gly Lys Gln Ser
2180 2185 2190
Asn Gln Thr Ala Lys Gln Lys Ala Ala Lys Lys Ala Lys Leu Ile Glu
2195 2200 2205
Gly Ser Pro Asp Asn Gly Leu Asp Ala Thr Gly Ser Leu Arg Arg Lys
2210 2215 2220
Ala Ser Ser Lys Lys Thr Ser Ala Ala Ser Lys Lys Ala Ala Asn Leu
2225 2230 2235 2240
Asn Gly Leu Asn Pro Gly Gln Leu Thr Gly Gly Val Ser Gly Val Pro
2245 2250 2255
Gly Val Pro Pro Thr Asn Ser Ala Ala Gln Ala Ala Ala Ala Ala Ala
2260 2265 2270
Ala Ala Val Ala Ala Met Ser His Glu Leu Glu Gly Ser Pro Val Gly
2275 2280 2285
Val Gly Met Gly Gly Asn Leu Pro Ser Pro Tyr Asp Thr Ser Ser Met
2290 2295 2300
Tyr Ser Asn Ala Met Ala Ala Pro Leu Ala Asn Gly Asn Pro Asn Thr
2305 2310 2315 2320
Gly Ala Lys Gln Pro Pro Ser Tyr Glu Asp Cys Ile Lys Asn Ala Gln
2325 2330 2335
Ser Met Gln Ser Leu Gln Gly Asn Gly Leu Asp Met Ile Lys Leu Asp
2340 2345 2350
Asn Tyr Ala Tyr Ser Met Gly Ser Pro Phe Gln Gln Glu Leu Leu Asn
2355 2360 2365
Gly Gln Gly Leu Gly Met Asn Gly Asn Gly Gln Arg Asn Gly Val Gly
2370 2375 2380
Pro Gly Val Leu Pro Gly Gly Leu Cys Gly Met Gly Gly Leu Ser Gly
2385 2390 2395 2400
Ala Gly Asn Gly Asn Ser His Glu Gln Gly Leu Ser Pro Pro Tyr Ser
2405 2410 2415
Asn Gln Ser Pro Pro His Ser Val Gln Ser Ser Leu Ala Leu Ser Pro
2420 2425 2430
His Ala Tyr Leu Gly Ser Pro Ser Pro Ala Lys Ser Arg Pro Ser Leu
2435 2440 2445
Pro Thr Ser Pro Thr His Ile Gln Ala Met Arg His Ala Thr Gln Gln
2450 2455 2460
Lys Gln Phe Gly Gly Ser Asn Leu Asn Ser Leu Leu Gly Gly Ala Asn
2465 2470 2475 2480
Gly Gly Gly Val Val Gly Gly Gly Gly Gly Gly Gly Gly Gly Val Gly
2485 2490 2495
Gln Gly Pro Gln Asn Ser Pro Val Ser Leu Gly Ile Ile Ser Pro Thr
2500 2505 2510
Gly Ser Asp Met Gly Ile Met Leu Ala Pro Pro Gln Ser Ser Lys Asn
2515 2520 2525
Ser Ala Ile Met Gln Thr Ile Ser Pro Gln Gln Gln Gln Gln Gln Gln
2530 2535 2540
Gln Gln Gln Gln Gln Gln His Gln Gln Gln Gln Gln Gln Gln Gln Gln
2545 2550 2555 2560
Gln Gln Gln Gln Gln Gln Gln Gln Leu Gly Gly Leu Glu Phe Gly Ser
2565 2570 2575
Ala Gly Leu Asp Leu Asn Gly Phe Cys Gly Ser Pro Asp Ser Phe His
2580 2585 2590
Ser Gly Gln Met Asn Pro Pro Ser Ile Gln Ser Ser Met Ser Gly Ser
2595 2600 2605
Ser Pro Ser Thr Asn Met Leu Ser Pro Ser Ser Gln His Asn Gln Gln
2610 2615 2620
Ala Phe Tyr Gln Tyr Leu Thr Pro Ser Ser Gln His Ser Gly Gly His
2625 2630 2635 2640
Thr Pro Gln His Leu Val Gln Thr Leu Asp Ser Tyr Pro Thr Pro Ser
2645 2650 2655
Pro Glu Ser Pro Gly His Trp Ser Ser Ser Ser Pro Arg Ser Asn Ser
2660 2665 2670
Asp Trp Ser Glu Gly Val Gln Ser Pro Ala Ala Asn Asn Leu Tyr Ile
2675 2680 2685
Ser Gly Gly His Gln Ala Asn Lys Gly Ser Glu Ala Ile Tyr Ile
2690 2695 2700
<210> 5
<211> 2900
<212> PRT
<213> Bos taurus
<400> 5
Met Thr Pro Val Cys Thr Pro Thr Arg Pro Gly Pro Cys Ala His Pro
1 5 10 15
Ala Leu Pro Arg Ser Thr Pro His Ser Ile Thr Asp Ser Ser Arg Ala
20 25 30
Glu Pro Ile Glu Ser Phe Leu Val Leu Ser Pro Ala Leu Glu Leu Arg
35 40 45
Leu Leu Leu Ala Val Val Gly Gln Asp Thr Pro Leu Gly Asp Val Trp
50 55 60
Ala Gly Gly Lys Ala Ser Gly Gly Gly Asp Thr Glu Gly Pro Leu Ser
65 70 75 80
Glu Gly Ser Lys Glu Gly Glu Ala Ala Thr Gly Pro Gln Ala Pro Gly
85 90 95
Ala Glu Trp His Ala Pro Pro Arg Ser Thr Cys Leu Ser Ser Thr Pro
100 105 110
Arg Pro Glu Ala Val Pro Pro Ser Leu Pro Cys Arg Ser Pro Gly Trp
115 120 125
Gly Ala Cys Gly Gly Arg Arg Pro Gly Pro Ala Leu Glu Pro Ala His
130 135 140
Met Gly Ser Val Pro Ser Gln Gln Arg Pro Pro Gly Leu Asp Arg Ser
145 150 155 160
Arg Glu Asp Asn Gly Pro Pro Gln Pro Leu Pro Ser Pro His Gly Gly
165 170 175
Ala Ser Leu Ala Pro Ala Pro Pro Pro Ala Cys Arg Gly Trp Gln Pro
180 185 190
Pro Leu Arg Trp Pro Gly Ala Ala Ala Ala Arg Val Pro Gly His Arg
195 200 205
Arg Thr Cys Ser Pro Ala Ala Leu Cys Pro Cys Cys Arg Cys Leu Ile
210 215 220
Tyr Trp Ala Arg Phe Ser Ser His Cys Asn Ser Arg Ser Leu Pro Gly
225 230 235 240
Gln Asp Ala Leu Gly Pro Gly Leu Trp Val Pro Ser Ala Thr Gln Ala
245 250 255
Gly Thr Arg Gln Pro Val Thr Gly Ser Thr Leu Ser Gly Gly His Ala
260 265 270
Thr Phe Pro Arg Leu Gln Gly Met Ala Leu Pro Glu Pro Glu Gly Glu
275 280 285
Gly Pro Pro Thr Thr Ser Ala Gln Gly Cys Gly Pro Ser Val Arg Ala
290 295 300
Ala Phe Pro Gly Arg Cys Gln Leu Gly Ala Val Gly Ala Phe His Pro
305 310 315 320
Arg Gly Ser Ala Ala Gly Lys Arg Glu Ala Trp Leu Val Pro Glu Pro
325 330 335
Leu Leu Gly Phe Pro Ser Ser Ser Arg Leu Arg Gly Asp Pro Gly Gly
340 345 350
His Val Pro Pro Arg Leu Lys Lys Pro Arg Gln Gln Val Ala Lys Gly
355 360 365
Gly Pro Gly Ala Gly Val Ala Gly Ala Glu Pro Phe Pro Val Gly Ser
370 375 380
Ala Gly Asp Gln Ala Trp Gly Trp Ala Gly Gly Lys Ala Pro Pro Thr
385 390 395 400
Pro Gly Ser Pro Ala Thr Val Ala Ala Arg Glu Pro Ala Gln Gly Leu
405 410 415
Pro Asp Cys Gly Gly Ala Phe Ala Gly Gln Gln Cys Gln Ala Pro Asn
420 425 430
Pro Cys Leu Ser Ala Pro Cys Lys Asn Gly Gly Thr Cys His Thr Thr
435 440 445
Glu Arg Glu Gly Leu Val Asp Tyr Val Cys Gly Cys Arg Leu Gly Phe
450 455 460
Ser Gly Pro Leu Cys Leu Thr Pro Arg Asp His Ala Cys Leu Ala Ser
465 470 475 480
Pro Cys Leu Asn Gly Gly Thr Cys Asp Leu Leu Thr Leu Thr Glu Tyr
485 490 495
Lys Cys Leu Cys Thr Pro Gly Trp Ser Gly Lys Thr Cys Gln Gln Ala
500 505 510
Asp Pro Cys Ala Ser Asn Pro Cys Ala Asn Gly Gly Gln Cys Leu Pro
515 520 525
Phe Glu Ala Ser Tyr Ile Cys His Cys Pro Pro Gly Phe His Gly Pro
530 535 540
Thr Cys Arg Gln Asp Val Asn Glu Cys Ser Gln Ser Pro Gly Leu Cys
545 550 555 560
His His Gly Gly Thr Cys Leu Asn Glu Val Gly Ser Tyr Arg Cys Val
565 570 575
Cys Arg Pro Thr His Thr Gly Pro His Cys Glu Leu Pro Tyr Val Pro
580 585 590
Cys Ser Pro Ser Pro Cys Gln Asn Gly Gly Thr Cys Arg Pro Thr Gly
595 600 605
Asp Thr Thr His Glu Cys Ala Cys Leu Pro Gly Phe Thr Gly Gln Asn
610 615 620
Cys Glu Glu Asn Ile Asp Asp Cys Pro Gly Asn Ser Cys Lys Asn Gly
625 630 635 640
Gly Ala Cys Val Asp Gly Val Asn Thr Tyr Asn Cys Arg Cys Pro Pro
645 650 655
Glu Trp Thr Gly Gln Tyr Cys Thr Glu Asp Val Asp Glu Cys Gln Leu
660 665 670
Met Pro Asn Ala Cys Gln Asn Gly Gly Thr Cys His Asn Thr His Gly
675 680 685
Gly Tyr Asn Cys Val Cys Val Asn Gly Trp Thr Gly Glu Asp Cys Ser
690 695 700
Glu Asn Ile Asp Asp Cys Ala Ser Ala Ser Cys Phe Gln Gly Ala Thr
705 710 715 720
Cys His Asp Arg Val Ala Ser Phe Tyr Cys Glu Cys Pro His Gly Arg
725 730 735
Thr Gly Leu Leu Cys His Leu Asn Asp Ala Cys Ile Ser Asn Pro Cys
740 745 750
Asn Glu Gly Ser Asn Cys Asp Thr Asn Pro Val Asn Gly Lys Ala Ile
755 760 765
Cys Thr Cys Pro Ser Gly Tyr Thr Gly Pro Ala Cys Ser Gln Asp Val
770 775 780
Asp Glu Cys Ser Leu Gly Ala Asn Pro Cys Glu His Ala Gly Lys Cys
785 790 795 800
Ile Asn Thr Leu Gly Ser Phe Glu Cys Gln Cys Leu Gln Gly Tyr Thr
805 810 815
Gly Pro Arg Cys Glu Ile Asp Val Asn Glu Cys Val Ser Asn Pro Cys
820 825 830
Gln Asn Asp Ala Thr Cys Leu Asp Gln Ile Gly Glu Phe Gln Cys Ile
835 840 845
Cys Met Pro Gly Tyr Glu Gly Leu His Cys Glu Val Asn Thr Asp Glu
850 855 860
Cys Ala Ser Ser Pro Cys Leu Gln Asn Gly Arg Cys Leu Asp Lys Ile
865 870 875 880
Asn Glu Phe Val Cys Glu Cys Pro Thr Gly Phe Thr Gly His Leu Cys
885 890 895
Gln Tyr Asp Val Asp Glu Cys Ala Ser Thr Pro Cys Lys Asn Gly Ala
900 905 910
Lys Cys Leu Asp Gly Pro Asn Thr Tyr Thr Cys Val Cys Thr Glu Gly
915 920 925
Tyr Thr Gly Pro His Cys Glu Val Asp Ile Asp Glu Cys Asp Pro Asp
930 935 940
Pro Cys His Tyr Gly Ser Cys Lys Asp Gly Val Ala Thr Phe Thr Cys
945 950 955 960
Leu Cys Gln Pro Gly Tyr Thr Gly His His Cys Glu Ser Asn Ile Asn
965 970 975
Glu Cys His Ser Gln Pro Cys Arg His Gly Gly Thr Cys Gln Asp Arg
980 985 990
Asp Asn Ala Tyr Leu Cys Phe Cys Leu Lys Gly Thr Thr Gly Pro Asn
995 1000 1005
Cys Glu Ile Asn Leu Asp Asp Cys Ala Ser Asn Pro Cys Asp Ser Gly
1010 1015 1020
Thr Cys Leu Asp Lys Ile Asp Gly Tyr Glu Cys Ala Cys Glu Pro Gly
1025 1030 1035 1040
Tyr Thr Gly Ser Met Cys Asn Ile Asn Ile Asp Glu Cys Ala Asp Ser
1045 1050 1055
Pro Cys His Asn Gly Gly Thr Cys Glu Asp Gly Ile Asn Gly Phe Thr
1060 1065 1070
Cys Arg Cys Pro Glu Gly Tyr His Asp Pro Thr Cys Leu Ser Glu Val
1075 1080 1085
Asn Glu Cys Ser Ser Asn Pro Cys Ile His Gly Ala Cys Arg Asp Ser
1090 1095 1100
Leu Asn Gly Tyr Lys Cys Asp Cys Asp Pro Gly Trp Ser Gly Ala Asn
1105 1110 1115 1120
Cys Asp Val Asn Asn Asp Glu Cys Glu Ser Asn Pro Cys Ile Asn Gly
1125 1130 1135
Gly Thr Cys Lys Asp Met Thr Ser Gly Tyr Val Cys Ala Cys Arg Glu
1140 1145 1150
Gly Phe Ser Gly Pro Asn Cys Gln Thr Asn Ile Asn Glu Cys Ala Ser
1155 1160 1165
Asn Pro Cys Leu Asn Gln Gly Thr Cys Ile Asp Asp Val Ala Gly Tyr
1170 1175 1180
Lys Cys Asn Cys Leu Leu Pro Tyr Thr Gly Ala Thr Cys Glu Val Val
1185 1190 1195 1200
Leu Ala Pro Cys Ala Pro Gly Pro Cys Arg Asn Gly Gly Glu Cys Arg
1205 1210 1215
Glu Ser Glu Asp Tyr Glu Ser Phe Ser Cys Ala Cys Pro Ala Gly Trp
1220 1225 1230
Gln Gly Gln Thr Cys Glu Ile Asp Ile Asn Glu Cys Val Lys Ser Pro
1235 1240 1245
Cys Arg Ala Gly Ala Ser Cys Gln Asn Thr Asn Gly Ser Tyr Arg Cys
1250 1255 1260
His Cys Gln Ala Gly Tyr Thr Gly Arg Asn Cys Glu Thr Asp Ile Asp
1265 1270 1275 1280
Asp Cys Arg Pro Asn Pro Cys His Asn Gly Gly Ser Cys Thr Asp Gly
1285 1290 1295
Ile Asn Thr Ala Phe Cys Asp Cys Leu Pro Gly Phe Gln Gly Ala Phe
1300 1305 1310
Cys Glu Glu Asp Ile Asn Glu Cys Ala Ser Ser Pro Cys Arg Asn Gly
1315 1320 1325
Ala Asn Cys Thr Asp Cys Val Asp Ser Tyr Thr Cys Thr Cys Pro Thr
1330 1335 1340
Gly Phe Ser Gly Ile His Cys Glu Asn Asn Thr Pro Asp Cys Thr Glu
1345 1350 1355 1360
Ser Ser Cys Phe Asn Gly Gly Thr Cys Val Asp Gly Ile Asn Ser Phe
1365 1370 1375
Thr Cys Leu Cys Pro Pro Gly Phe Thr Gly Ser Tyr Cys Gln His Asp
1380 1385 1390
Val Asn Glu Cys Asp Ser Arg Pro Cys Leu His Gly Gly Thr Cys His
1395 1400 1405
Asp Ser Tyr Gly Thr Tyr Thr Cys Thr Cys Pro Gln Gly Tyr Thr Gly
1410 1415 1420
Leu Asn Cys Gln Thr Leu Val Arg Trp Cys Asp Ser Ser Pro Cys Lys
1425 1430 1435 1440
Asn Asp Gly Arg Cys Trp Gln Thr Asn Ala Leu Tyr Arg Cys Glu Cys
1445 1450 1455
His Ser Gly Trp Thr Gly Leu Tyr Cys Asp Val Pro Ser Val Ser Cys
1460 1465 1470
Glu Val Ala Ala Arg Gln Gln Gly Val Asn Val Thr His Leu Cys Arg
1475 1480 1485
Asn Gly Gly Leu Cys Met Asn Ala Gly Asn Thr His Arg Cys His Cys
1490 1495 1500
Gln Ala Gly Tyr Thr Gly Ser Tyr Cys Glu Glu Gln Val Asp Glu Cys
1505 1510 1515 1520
Ser Pro Ser Pro Cys Gln Asn Gly Ala Thr Cys Thr Asp Tyr Pro Gly
1525 1530 1535
Gly Tyr Ser Cys Glu Cys Val Ala Gly Tyr His Gly Val Asn Cys Ser
1540 1545 1550
Glu Glu Val Asn Glu Cys Leu Ser Gln Pro Cys Arg Asn Gly Gly Thr
1555 1560 1565
Cys Ile Asp Leu Thr Asn Thr Tyr Lys Cys Ser Cys Pro Arg Gly Thr
1570 1575 1580
Gln Gly Val His Cys Glu Ile Asn Val Asp Asp Cys Asn Pro Pro Ile
1585 1590 1595 1600
Asp Pro Val Ser Arg Gly Pro Lys Cys Phe Asn Asn Gly Thr Cys Val
1605 1610 1615
Asp Gln Val Gly Gly Tyr Ser Cys Ser Cys Pro Pro Gly Phe Val Gly
1620 1625 1630
Glu Arg Cys Glu Gly Asp Val Asn Glu Cys Leu Ser Asn Pro Cys Asp
1635 1640 1645
Ala Arg Gly Thr Gln Asn Cys Val Gln His Val Asn Ala Phe His Cys
1650 1655 1660
Glu Cys Arg Ala Gly His Thr Gly Arg Arg Cys Glu Ser Val Ile Asn
1665 1670 1675 1680
Gly Cys Lys Asp Arg Pro Cys Lys Asn Gly Gly Ser Cys Ala Val Ala
1685 1690 1695
Ser Asn Thr Ala Arg Gly Phe Ile Cys Lys Cys Pro Ala Gly Phe Glu
1700 1705 1710
Gly Ala Thr Cys Glu Asn Asp Ala Arg Ser Cys Gly Ser Leu Arg Cys
1715 1720 1725
Leu Asn Gly Gly Thr Cys Ile Ala Gly Pro Arg Ser Pro Thr Cys Leu
1730 1735 1740
Cys Leu Gly Pro Phe Thr Gly Pro Glu Cys Gln Phe Pro Ala Ser Ser
1745 1750 1755 1760
Pro Cys Val Gly Gly Asn Pro Cys Tyr Asn Gln Gly Val Cys Glu Pro
1765 1770 1775
Thr Ala Glu Ser Pro Phe Tyr Arg Cys Arg Cys Pro Ala Lys Phe Asn
1780 1785 1790
Gly Leu Leu Cys His Ile Leu Asp Tyr Ser Phe Gly Gly Gly Val Gly
1795 1800 1805
Leu Asp Ile Pro Pro Pro Gln Ile Glu Glu Thr Cys Glu Leu Pro Gly
1810 1815 1820
Cys Arg Glu Glu Ala Gly Asn Lys Val Cys Ser Leu Gln Cys Asn Ser
1825 1830 1835 1840
His Ala Cys Gly Trp Asp Gly Gly Asp Cys Ser Leu Asp Phe Asp Asp
1845 1850 1855
Pro Trp Gln Asn Cys Thr Gln Ser Leu Gln Cys Trp Lys Tyr Phe Ser
1860 1865 1870
Asn Gly Arg Cys Asp Ser Gln Cys Asn Ser Ala Gly Cys Leu Phe Asp
1875 1880 1885
Gly Phe Asp Cys Gln Arg Ala Glu Gly Gln Cys Asn Pro Leu Tyr Asp
1890 1895 1900
Gln Tyr Cys Lys Asp His Phe Arg Asp Gly His Cys Asp Gln Gly Cys
1905 1910 1915 1920
Asn Ser Ala Glu Cys Glu Trp Asp Gly Leu Asp Cys Ala Glu His Val
1925 1930 1935
Pro Glu Arg Leu Ala Ala Gly Thr Leu Val Leu Val Val Leu Met Pro
1940 1945 1950
Pro Glu Gln Leu Arg Asn Arg Ser Leu His Phe Leu Arg Glu Leu Ser
1955 1960 1965
Arg Leu Leu His Thr Asn Val Val Phe Lys Arg Asp Ala Ser Gly Gln
1970 1975 1980
Gln Met Ile Phe Pro Tyr Tyr Gly Arg Ala Pro Leu Pro Ala Gly Glu
1985 1990 1995 2000
Arg Ser Glu Glu Cys Arg Cys Glu His His Ala Cys Pro Ala Gly Ala
2005 2010 2015
Gly Gln Gly Glu Pro Ser Gly Pro Leu Cys Thr Ser Arg Ser Ile Val
2020 2025 2030
Tyr Leu Glu Ile Asp Asn Arg Gln Cys Val Gln Ser Ser Ser Gln Cys
2035 2040 2045
Phe Gln Ser Ala Thr Asp Val Ala Ala Phe Leu Gly Ala Leu Ala Ser
2050 2055 2060
Leu Gly Ser Leu Asn Ile Pro Tyr Lys Ile Glu Ala Val Gln Ser Glu
2065 2070 2075 2080
Thr Val Glu Pro Pro Pro Pro Pro Pro Leu His Phe Met Tyr Val Ala
2085 2090 2095
Val Val Ala Phe Val Leu Leu Phe Phe Val Gly Cys Gly Val Leu Leu
2100 2105 2110
Ser Arg Lys Arg Arg Arg Gln His Gly Gln Leu Trp Phe Pro Glu Gly
2115 2120 2125
Phe Lys Val Ser Glu Ala Ser Lys Lys Lys Arg Arg Glu Pro Leu Gly
2130 2135 2140
Glu Asp Ser Val Gly Leu Lys Pro Leu Lys Asn Ser Ser Asp Gly Ala
2145 2150 2155 2160
Leu Met Asp Asp Asn Gln Asn Glu Trp Gly Asp Glu Gly Leu Glu Ala
2165 2170 2175
Lys Lys Phe Arg Phe Glu Glu Pro Val Val Leu Pro Asp Leu Asp Asp
2180 2185 2190
Gln Thr Asp His Arg Gln Trp Thr Gln Gln His Leu Asp Ala Ala Asp
2195 2200 2205
Leu Arg Val Ser Ala Met Ala Pro Thr Pro Pro Gln Gly Glu Ala Asp
2210 2215 2220
Ala Asp Cys Met Asp Val Asn Val Arg Gly Pro Asp Gly Phe Thr Pro
2225 2230 2235 2240
Leu Met Ile Ala Ser Cys Ser Gly Gly Gly Leu Glu Thr Gly Asn Ser
2245 2250 2255
Glu Glu Glu Glu Asp Ala Pro Ala Val Ile Ser Asp Phe Ile Tyr Gln
2260 2265 2270
Gly Ala Ser Leu His Asn Gln Thr Asp Arg Thr Gly Glu Thr Ala Leu
2275 2280 2285
His Leu Ala Ala Arg Tyr Ser Arg Ser Asp Ala Ala Lys Arg Leu Leu
2290 2295 2300
Glu Ala Ser Ala Asp Ala Asn Ile Gln Asp Asn Met Gly Arg Thr Pro
2305 2310 2315 2320
Leu His Ala Ala Val Ser Ala Asp Ala Gln Gly Val Phe Gln Ile Leu
2325 2330 2335
Ile Arg Asn Arg Ala Thr Asp Leu Asp Ala Arg Met His Asp Gly Thr
2340 2345 2350
Thr Pro Leu Ile Leu Ala Ala Arg Leu Ala Val Glu Gly Met Leu Glu
2355 2360 2365
Asp Leu Ile Asn Ser His Ala Asp Val Asn Ala Val Asp Asp Leu Gly
2370 2375 2380
Lys Ser Ala Leu His Trp Ala Ala Ala Val Asn Asn Val Glu Ala Ala
2385 2390 2395 2400
Val Val Leu Leu Lys Asn Gly Ala Asn Lys Asp Met Gln Asn Asn Lys
2405 2410 2415
Glu Glu Thr Pro Leu Phe Leu Ala Ala Arg Glu Gly Ser Tyr Glu Thr
2420 2425 2430
Ala Lys Val Leu Leu Asp His Phe Ala Asn Arg Asp Ile Thr Asp His
2435 2440 2445
Met Asp Arg Leu Pro Arg Asp Ile Ala Gln Glu Arg Met His His Asp
2450 2455 2460
Ile Val Arg Leu Leu Asp Glu Tyr Ser Leu Val Arg Ser Pro Pro Leu
2465 2470 2475 2480
His Gly Ala Thr Leu Gly Gly Thr Pro Thr Leu Ser Pro Pro Leu Cys
2485 2490 2495
Ser Pro Asn Gly Tyr Leu Gly Asn Leu Lys Pro Pro Met Gln Gly Lys
2500 2505 2510
Lys Ala Arg Lys Pro Ser Thr Lys Gly Leu Ala Cys Gly Gly Lys Glu
2515 2520 2525
Pro Lys Asp Leu Lys Ala Arg Arg Lys Lys Ser Gln Asp Gly Lys Gly
2530 2535 2540
Cys Leu Leu Asp Ser Gly Ser Val Met Ser Pro Val Asp Ser Leu Glu
2545 2550 2555 2560
Ser Pro His Gly Tyr Leu Ser Asp Val Ala Ser Pro Pro Leu Leu Pro
2565 2570 2575
Ser Pro Phe Gln Pro Ser Pro Ser Val Pro Leu Asn His Leu Pro Gly
2580 2585 2590
Met Pro Glu Thr His Leu Gly Val Ser His Leu Ser Val Ala Ala Lys
2595 2600 2605
Pro Glu Met Ala Val Leu Ser Gly Gly Ser Arg Leu Ala Phe Glu Ala
2610 2615 2620
Gly Pro Pro Arg Leu Ser His Leu Pro Val Ala Ser Ser Thr Ser Thr
2625 2630 2635 2640
Ile Leu Gly Ser Gly Gly Ser Gly Gly Ser Gly Ala Val Asn Phe Thr
2645 2650 2655
Val Gly Gly Ala Ala Gly Leu Asn Gly Gln Cys Glu Trp Leu Ser Arg
2660 2665 2670
Leu Gln Asn Gly Leu Val Pro Asn Gln Tyr Asn Pro Leu Arg Gly Gly
2675 2680 2685
Val Thr Pro Gly Thr Leu Ser Thr Gln Ala Ala Gly Leu Gln His Gly
2690 2695 2700
Thr Val Gly Pro Leu His Ala Pro Ala Leu Ser Gln Val Met Thr Tyr
2705 2710 2715 2720
Gln Ala Leu Pro Ser Thr Arg Leu Ala Ser Gln Pro His Leu Val Gln
2725 2730 2735
Pro Gln Gln Asn Leu Gln Met Gln Pro Pro Ser Met Pro Pro Gln Pro
2740 2745 2750
Asn Leu Gln Pro His Leu Gly Val Ser Ser Ala Ala Ser Gly His Leu
2755 2760 2765
Gly Arg Ser Phe Leu Gly Gly Glu Leu Ser Gln Ala Asp Met Gln Pro
2770 2775 2780
Leu Gly Pro Gly Asn Leu Ala Ala His Thr Val Leu Pro Gln Asp Gly
2785 2790 2795 2800
Gln Val Leu Pro Thr Ser Leu Pro Ser Thr Leu Ala Pro Pro Thr Met
2805 2810 2815
Ala Pro Pro Met Thr Thr Ala Gln Phe Leu Thr Pro Pro Ser Gln His
2820 2825 2830
Ser Tyr Ser Ser Ser Pro Val Asp Asn Thr Pro Ser His Gln Leu Gln
2835 2840 2845
Val Pro Glu His Pro Phe Leu Thr Pro Ser Pro Glu Ser Pro Asp Gln
2850 2855 2860
Trp Ser Ser Ser Ser Pro His Ser Asn Ile Ser Asp Trp Ser Glu Gly
2865 2870 2875 2880
Ile Ser Ser Pro Pro Thr Ser Val Pro Ser Gln Ile Ala His Val Pro
2885 2890 2895
Glu Ala Phe Lys
2900
<210> 6
<211> 2561
<212> PRT
<213> Gallus gallus
<400> 6
Met Gly Arg Cys Ser Ala Ala His Pro Arg Gly Gly Val His Cys Pro
1 5 10 15
Gly Leu Cys Ala Val Pro Asp Ala Leu Leu Leu Phe Pro Gly Val Arg
20 25 30
Cys Thr Gln Leu Ala Glu Ser Cys Leu Asn Gly Gly Lys Cys Glu Thr
35 40 45
Phe Leu Asn Gly Thr Glu Val Cys Gln Cys Ser Ser Ala His Met Gly
50 55 60
Glu Arg Cys Gln Leu Pro Asn Pro Cys Leu Ser Ser Pro Cys Lys Asn
65 70 75 80
Ala Gly Thr Cys Ile Pro Leu Leu Arg Gly Ser Thr Ala Asp Tyr Thr
85 90 95
Cys Val Cys Arg Leu Gly Phe Thr Asp Glu Leu Cys Leu Thr Pro Leu
100 105 110
Asp Asn Ala Cys Leu Asn Asn Pro Cys Arg Asn Gly Gly Thr Cys Asp
115 120 125
Leu Val Thr Leu Ser Glu Tyr Lys Cys Arg Cys Pro Pro Gly Trp Ser
130 135 140
Gly Lys Thr Cys Gln Gln Ala Asp Pro Cys Ala Ser Asn Pro Cys Ala
145 150 155 160
Asn Gly Gly Gln Cys Val Pro Phe Glu Ala His Tyr Ile Cys Arg Cys
165 170 175
Thr Ala Gly Phe His Gly Ala Asn Cys Lys Gln Asp Val Asn Glu Cys
180 185 190
Asn Ile Ser Pro Pro Val Cys Lys Asn Gly Gly Ser Cys Thr Asn Glu
195 200 205
Val Gly Thr Tyr Gln Cys Ser Cys Lys Pro Ala Tyr Thr Gly Gln Asn
210 215 220
Cys Glu His Leu Tyr Val Pro Cys Asn Pro Ser Pro Cys Gln Asn Gly
225 230 235 240
Gly Thr Cys Arg Gln Thr Gly Asp Thr Thr Tyr Asp Cys Thr Cys Leu
245 250 255
Pro Gly Phe Thr Gly Gln Asn Cys Glu Glu Asn Ile Asp Asp Cys Pro
260 265 270
Gly Asn Asn Cys Arg Asn Gly Gly Thr Cys Val Asp Gly Val Asn Thr
275 280 285
Tyr Asn Cys Gln Cys Pro Pro Glu Trp Thr Gly Gln Tyr Cys Thr Glu
290 295 300
Asp Val Asp Glu Cys Gln Leu Met Pro Asn Ala Cys Gln Asn Gly Gly
305 310 315 320
Thr Cys His Asn Asn His Gly Gly Tyr Asn Cys Val Cys Val Asn Gly
325 330 335
Trp Thr Gly Glu Asp Cys Ser Glu Asn Ile Asp Asp Cys Ala Met Ala
340 345 350
Ala Cys Phe Gln Gly Ala Thr Cys His Asp Arg Val Ala Ser Phe Tyr
355 360 365
Cys Glu Cys Pro His Gly Arg Thr Gly Leu Leu Cys His Leu Asp Asp
370 375 380
Ala Cys Ile Ser Asn Pro Cys Asn Glu Gly Ser Asn Cys Asp Thr Asn
385 390 395 400
Pro Val Asn Gly Lys Ala Ile Cys Thr Cys Pro Ser Gly Tyr Met Gly
405 410 415
Pro Ala Cys Asn Gln Asp Val Asp Glu Cys Ser Leu Gly Ala Asn Pro
420 425 430
Cys Glu His Ala Gly Lys Cys Ile Asn Thr Gln Gly Ser Phe Gln Cys
435 440 445
Gln Cys Leu Gln Gly Tyr Ser Gly Pro Arg Cys Glu Ile Asp Val Asn
450 455 460
Glu Cys Leu Ser Asn Pro Cys Gln Asn Asp Ala Thr Cys Leu Asp Gln
465 470 475 480
Ile Gly Glu Phe Gln Cys Ile Cys Met Pro Gly Tyr Glu Gly Val Tyr
485 490 495
Cys Glu Ile Asn Thr Asp Glu Cys Ala Ser Ser Pro Cys Leu His Asn
500 505 510
Gly Asn Cys Leu Asp Lys Ile Asn Glu Phe His Cys Glu Cys Pro Thr
515 520 525
Gly Phe Asn Gly His Leu Cys Gln Phe Asp Ile Asp Glu Cys Ala Ser
530 535 540
Thr Pro Cys Lys Asn Gly Ala Lys Cys Val Asp Gly Pro Asn Thr Tyr
545 550 555 560
Ser Cys Glu Cys Thr Glu Gly Phe Ser Gly Val His Cys Glu Ile Asp
565 570 575
Ile Asp Glu Cys Asn Pro Asp Pro Cys His Tyr Gly Thr Cys Lys Asp
580 585 590
Ser Ile Ala Ala Phe Thr Cys Leu Cys Gln Pro Gly Tyr Thr Gly His
595 600 605
Arg Cys Asp Ile Asn Ile Asn Glu Cys Gln Ser Gln Pro Cys Arg Asn
610 615 620
Gly Gly Thr Cys Gln Asp Arg Asp Asn Ala Tyr Asn Cys Leu Cys Leu
625 630 635 640
Lys Gly Thr Thr Gly Pro Asn Cys Glu Ile Asn Leu Asp Asp Cys Ala
645 650 655
Ser Asn Pro Cys Asp Tyr Gly Lys Cys Ile Asp Lys Ile Asn Gly Tyr
660 665 670
Glu Cys Thr Cys Glu Pro Gly Tyr Thr Gly Arg Met Cys Asn Ile Asn
675 680 685
Ile Asp Glu Cys Ala Ser Asn Pro Cys His Asn Gly Gly Thr Cys Lys
690 695 700
Asp Gly Ile Asn Gly Phe Thr Cys Leu Cys Pro Glu Gly Phe His Asp
705 710 715 720
Pro Lys Cys Leu Ser Glu Val Asn Glu Cys Asn Ser Asn Pro Cys Ile
725 730 735
His Gly Arg Cys His Asp Gly Leu Asn Gly Tyr Arg Cys Asp Cys Asp
740 745 750
Pro Gly Trp Ser Gly Thr Asn Cys Asp Ile Asn Asn Asn Glu Cys Glu
755 760 765
Ser Asn Pro Cys Met Asn Gly Gly Thr Cys Lys Asp Met Thr Ser Gly
770 775 780
Tyr Ile Cys Thr Cys Arg Glu Gly Phe Ser Gly Pro Asn Cys Gln Thr
785 790 795 800
Asn Ile Asn Glu Cys Ala Ser Asn Pro Cys Leu Asn Gln Gly Thr Cys
805 810 815
Ile Asp Asp Val Ala Gly Tyr Thr Cys Asn Cys Leu Leu Pro Tyr Thr
820 825 830
Gly Ala Thr Cys Glu Asp Val Leu Ala Pro Cys Ala Gly Gly Pro Cys
835 840 845
Lys Asn Gly Gly Glu Cys Arg Glu Ser Glu Asp Tyr Lys Arg Phe Ser
850 855 860
Cys Ser Cys Pro Pro Gly Trp Gln Gly Gln Thr Cys Glu Ile Asp Ile
865 870 875 880
Asn Glu Cys Val Lys Ser Pro Cys Arg Asn Gly Ala Thr Cys Gln Asn
885 890 895
Thr Asn Gly Ser Tyr Arg Cys Leu Cys Arg Val Gly Phe Ala Gly Arg
900 905 910
Asn Cys Asp Thr Asp Ile Asp Asp Cys Gln Pro Asn Pro Cys His Asn
915 920 925
Gly Gly Ser Cys Ser Asp Gly Ile Gly Thr Phe Phe Cys Glu Cys Leu
930 935 940
Ala Gly Phe Arg Gly Leu Lys Cys Glu Glu Asp Ile Asn Glu Cys Ala
945 950 955 960
Ser Asn Pro Cys Lys Asn Gly Ala Asn Cys Thr Asp Cys Val Asn Ser
965 970 975
Tyr Thr Cys Thr Cys Pro Ser Gly Phe Ser Gly Ile His Cys Glu Asn
980 985 990
Asn Thr Pro Asp Cys Thr Glu Ser Ser Cys Phe Asn Gly Gly Thr Cys
995 1000 1005
Val Asp Gly Ile Asn Thr Phe Thr Cys Leu Cys Pro Ser Gly Phe Thr
1010 1015 1020
Gly Ser Tyr Cys Glu His Asn Ile Asn Glu Cys Asp Ser Lys Pro Cys
1025 1030 1035 1040
Leu Asn Gly Gly Thr Cys Gln Asp Ser Tyr Gly Thr Tyr Lys Cys Thr
1045 1050 1055
Cys Pro Gln Gly Tyr Thr Gly Leu Asn Cys Gln Asn Leu Val Arg Trp
1060 1065 1070
Cys Asp Ser Ser Pro Cys Lys Asn Gly Gly Lys Cys Trp Gln Thr Asn
1075 1080 1085
Asn Leu Tyr Arg Cys Glu Cys Asn Ser Gly Trp Thr Gly Leu Tyr Cys
1090 1095 1100
Asp Val Pro Ser Val Ser Cys Glu Val Ala Ala Lys Gln Gln Gly Ile
1105 1110 1115 1120
Asp Val Ala His Leu Cys Arg Asn Ser Gly Leu Cys Val Asp Ser Gly
1125 1130 1135
Asn Thr His Phe Cys Arg Cys Gln Ala Gly Tyr Thr Gly Ser Tyr Cys
1140 1145 1150
Glu Glu Gln Val Asp Glu Cys Ser Pro Asn Pro Cys Gln Asn Gly Ala
1155 1160 1165
Thr Cys Thr Asp Tyr Leu Gly Gly Tyr Ser Cys Glu Cys Val Ala Gly
1170 1175 1180
Tyr His Gly Val Asn Cys Ser Glu Glu Ile Asn Glu Cys Leu Ser His
1185 1190 1195 1200
Pro Cys Gln Asn Gly Gly Thr Cys Ile Asp Leu Ile Asn Thr Tyr Lys
1205 1210 1215
Cys Ser Cys Pro Arg Gly Thr Gln Gly Val His Cys Glu Ile Asn Val
1220 1225 1230
Asp Asp Cys Ser Pro Phe Phe Asp Pro Val Thr Leu Gly Pro Lys Cys
1235 1240 1245
Phe Asn Asn Gly Lys Cys Thr Asp Arg Val Gly Gly Tyr Ser Cys Ile
1250 1255 1260
Cys Pro Pro Gly Phe Val Gly Glu Arg Cys Glu Gly Asp Val Asn Glu
1265 1270 1275 1280
Cys Leu Ser Asn Pro Cys Asp Ala Arg Gly Thr Gln Asn Cys Val Gln
1285 1290 1295
Arg Val Asn Asp Tyr Lys Cys Glu Cys Arg Pro Gly Tyr Ala Gly Arg
1300 1305 1310
Arg Cys Asp Thr Val Val Asp Gly Cys Lys Gly Lys Pro Cys Arg Asn
1315 1320 1325
Gly Gly Thr Cys Ala Val Ala Ser Asn Thr Gly Arg Gly Phe Ile Cys
1330 1335 1340
Lys Cys Pro Pro Gly Phe Val Gly Ala Thr Cys Glu Asn Asp Ser His
1345 1350 1355 1360
Thr Cys Gly Thr Leu His Cys Leu Asn Gly Gly Thr Cys Ile Ser Met
1365 1370 1375
His Lys Ser Ser Lys Cys Val Cys Ala Ala Ala Phe Thr Gly Pro Glu
1380 1385 1390
Cys Gln Tyr Pro Ala Ser Ser Pro Cys Ile Ser Asn Pro Cys Tyr Asn
1395 1400 1405
Gly Gly Thr Cys Glu Phe Leu Ser Asp Ala Ser Pro Tyr Tyr His Cys
1410 1415 1420
Asn Cys Pro Ala Asn Phe Asn Gly Leu Asn Cys His Ile Leu Asp Phe
1425 1430 1435 1440
Asp Phe Gln Gly Gly Phe Gly Gln Asp Ile Ile Pro Pro Lys Ile Glu
1445 1450 1455
Glu Lys Cys Glu Ile Ala Val Cys Ala Ser Tyr Ala Gly Asn Lys Ile
1460 1465 1470
Cys Asp Gly Lys Cys Asn Asn His Ala Cys Gly Trp Asp Gly Gly Asp
1475 1480 1485
Cys Ser Leu Asn Phe Asn Asp Pro Trp Lys Asn Cys Ser Gln Ser Leu
1490 1495 1500
Gln Cys Trp Lys Tyr Phe Asn Asp Gly Lys Cys Asp Ser Gln Cys Asn
1505 1510 1515 1520
Asn Ala Gly Cys Leu Tyr Asp Gly Phe Asp Cys Gln Lys Tyr Glu Gly
1525 1530 1535
Gln Cys Asn Pro Leu Tyr Asp Gln Tyr Cys Lys Asp His Phe Ser Asp
1540 1545 1550
Gly His Cys Asp Gln Gly Cys Asn Asn Phe Glu Cys Glu Trp Asp Gly
1555 1560 1565
Leu Asp Cys Ala Asn Asn Met Pro Glu Lys Leu Ala Asp Gly Thr Leu
1570 1575 1580
Val Val Val Val Leu Ile Thr Pro Glu Asn Leu Lys Asn Asn Ser Phe
1585 1590 1595 1600
Asn Phe Leu Arg Glu Leu Ser Arg Val Leu His Thr Asn Val Val Phe
1605 1610 1615
Lys Lys Asn Ala Lys Gly Glu Tyr Met Ile Phe Pro Tyr Tyr Gly Asn
1620 1625 1630
Glu Glu Glu Leu Lys Lys His Tyr Ile Lys Arg Ser Thr Glu Asp Trp
1635 1640 1645
Ala Asp Met Ser Ser Ala Val Ile Asn Lys Val Lys Ser Ser Leu Tyr
1650 1655 1660
Ser Arg Ala Gly Arg Arg Gln Lys Arg Glu Leu Asp Gln Met Asp Ile
1665 1670 1675 1680
Arg Gly Ser Ile Val Tyr Leu Glu Ile Asp Asn Arg Gln Cys Ile Gln
1685 1690 1695
Ser Ser Ser Gln Cys Phe Gln Ser Ala Thr Asp Val Ala Ala Phe Leu
1700 1705 1710
Gly Ala Leu Ala Ser Leu Gly Asn Leu Asn Ile Pro Tyr Lys Ile Glu
1715 1720 1725
Ala Val Lys Ser Glu Thr Ala Glu Pro Ala Arg Asn Ser Gln Leu Tyr
1730 1735 1740
Pro Met Tyr Val Val Val Ala Ala Leu Val Leu Leu Ala Phe Ile Gly
1745 1750 1755 1760
Val Gly Val Leu Val Ser Arg Lys Arg Arg Arg Glu His Gly Gln Leu
1765 1770 1775
Trp Phe Pro Glu Gly Phe Lys Val Thr Glu Ser Ser Lys Lys Lys Arg
1780 1785 1790
Arg Glu Pro Leu Gly Glu Asp Ser Val Gly Leu Lys Pro Leu Lys Asn
1795 1800 1805
Ala Ser Asp Gly Thr Leu Met Asp Asp Asn Gln Asn Glu Trp Gly Asp
1810 1815 1820
Glu Glu Thr Leu Asp Thr Lys Lys Phe Arg Phe Glu Glu Gln Ala Met
1825 1830 1835 1840
Leu Pro Asp Thr Asp Asp Gln Thr Asp His Arg Gln Trp Thr Gln Gln
1845 1850 1855
His Leu Asp Ala Ala Asp Leu Arg Ile Ser Ser Met Ala Pro Thr Pro
1860 1865 1870
Pro Gln Gly Glu Ile Asp Ala Asp Cys Met Asp Val Asn Val Arg Gly
1875 1880 1885
Pro Asp Gly Phe Thr Pro Leu Met Ile Ala Ser Cys Ser Gly Gly Gly
1890 1895 1900
Leu Glu Thr Gly Asn Ser Glu Glu Glu Asp Asp Ala Pro Ala Val Ile
1905 1910 1915 1920
Ser Asp Phe Ile Tyr Gln Gly Ala Ser Leu His Asn Gln Thr Asp Arg
1925 1930 1935
Thr Gly Glu Thr Ala Leu His Leu Ala Ala Arg Tyr Ser Arg Ser Asp
1940 1945 1950
Ala Ala Lys Arg Leu Leu Glu Ala Ser Ala Asp Ala Asn Ile Gln Asp
1955 1960 1965
Asn Met Gly Arg Thr Pro Leu His Ala Ala Val Ser Ala Asp Ala Gln
1970 1975 1980
Gly Val Phe Gln Ile Leu Ile Arg Asn Arg Ala Thr Asp Leu Asp Ala
1985 1990 1995 2000
Arg Met His Asp Gly Thr Thr Pro Leu Ile Leu Ala Ala Arg Leu Ala
2005 2010 2015
Val Glu Gly Met Leu Glu Asp Leu Ile Asn Cys His Ala Asp Val Asn
2020 2025 2030
Ala Val Asp Asp Leu Gly Lys Ser Ala Leu His Trp Ala Ala Ala Val
2035 2040 2045
Asn Asn Val Glu Ala Ala Val Val Leu Leu Lys Asn Gly Ala Asn Lys
2050 2055 2060
Asp Met Gln Asn Asn Lys Glu Glu Thr Pro Leu Phe Leu Ala Ala Arg
2065 2070 2075 2080
Glu Gly Ser Tyr Glu Thr Ala Lys Val Leu Leu Asp His Phe Ala Asn
2085 2090 2095
Arg Asp Ile Thr Asp His Met Asp Arg Leu Pro Arg Asp Ile Ala Gln
2100 2105 2110
Glu Arg Met His His Asp Ile Val Arg Leu Leu Asp Glu Tyr Asn Leu
2115 2120 2125
Val Arg Ser Pro Pro Leu His Ser Gly Pro Leu Gly Ala Pro Thr Leu
2130 2135 2140
Ser Pro Pro Leu Cys Ser Pro Ser Ser Tyr Ile Gly Asn Leu Lys Pro
2145 2150 2155 2160
Ala Val Gln Gly Lys Lys Ala Arg Lys Pro Ser Thr Lys Gly Leu Ser
2165 2170 2175
Cys Asn Gly Lys Asp Ser Lys Asp Leu Lys Ala Arg Arg Lys Lys Ser
2180 2185 2190
Gln Asp Gly Lys Gly Cys Leu Leu Asp Asn Ser Ser Val Leu Ser Pro
2195 2200 2205
Val Asp Ser Leu Glu Ser Pro His Gly Tyr Leu Ser Asp Val Ala Ser
2210 2215 2220
Pro Pro Leu Met Thr Ser Pro Phe Gln Gln Ser Pro Ser Met Pro Leu
2225 2230 2235 2240
Asn His Leu Pro Gly Met Pro Asp Ala His Met Ser Ile Asn His Leu
2245 2250 2255
Asn Met Ala Gly Lys Gln Glu Met Ala Leu Gly Gly Ser Gly Arg Met
2260 2265 2270
Ala Phe Glu Ala Val Pro Pro Arg Leu Ser His Leu Pro Val Ser Ser
2275 2280 2285
Pro Ser Thr Ala Met Ser Asn Ala Pro Met Asn Phe Ser Val Gly Gly
2290 2295 2300
Ala Ala Gly Leu Ser Gly Gln Cys Asp Trp Leu Ser Arg Leu Gln Ser
2305 2310 2315 2320
Gly Met Val Gln Asn Gln Tyr Gly Ala Met Arg Gly Gly Met Gln Pro
2325 2330 2335
Gly Thr His Gln Gln Ala Gln Asn Leu Gln His Gly Met Met Ser Ser
2340 2345 2350
Leu His Asn Gly Leu Pro Ser Thr Ser Leu Ser Gln Met Met Ser Tyr
2355 2360 2365
Gln Ala Met Pro Ser Thr Arg Leu Ala Ser Gln Pro His Leu Leu Gln
2370 2375 2380
Asn Gln Gln Met Gln Gln Met Gln Gln Pro Gly Met Gln Pro Gln Pro
2385 2390 2395 2400
Gly Met Gln Pro Gln Pro Gly Met Gln Gln Pro Gln Gln Gln Pro Gln
2405 2410 2415
Gln Gln Pro Gln Pro Gln Gln His His Asn Pro Gly Ser Asn Ala Ser
2420 2425 2430
Gly His Met Gly Gln Asn Phe Leu Gly Thr Glu Leu Ser Gln Pro Asp
2435 2440 2445
Met Gln Pro Val Ser Ser Ser Ala Met Ala Val His Thr Ile Leu Pro
2450 2455 2460
Gln Asp Ser Gln Leu Leu Pro Thr Ser Leu Pro Ser Ser Leu Ala Gln
2465 2470 2475 2480
Pro Met Thr Thr Thr Gln Phe Leu Thr Pro Pro Ser Gln His Ser Tyr
2485 2490 2495
Ser Ser Pro Leu Asp Asn Thr Pro Ser His Gln Leu Gln Val Pro Asp
2500 2505 2510
His Pro Phe Leu Thr Pro Ser Pro Glu Ser Pro Asp Gln Trp Ser Ser
2515 2520 2525
Ser Ser Pro His Ser Asn Val Ser Asp Trp Ser Glu Gly Ile Ser Ser
2530 2535 2540
Pro Pro Thr Ser Met Gln Ser Gln Met Gly His Ile Pro Glu Ala Phe
2545 2550 2555 2560
Lys
<210> 7
<211> 2531
<212> PRT
<213> Rattus rattus
<400> 7
Met Pro Arg Leu Leu Ala Pro Leu Leu Cys Leu Thr Leu Leu Pro Ala
1 5 10 15
Leu Ala Ala Arg Gly Leu Arg Cys Ser Gln Pro Ser Gly Thr Cys Leu
20 25 30
Asn Gly Gly Arg Cys Glu Val Ala Asn Gly Thr Glu Ala Cys Val Cys
35 40 45
Ser Gly Ala Phe Val Gly Gln Arg Cys Gln Asp Pro Ser Pro Cys Leu
50 55 60
Ser Thr Pro Cys Lys Asn Ala Gly Thr Cys Tyr Val Val Asp His Gly
65 70 75 80
Gly Ile Val Asp Tyr Ala Cys Ser Cys Pro Leu Gly Phe Ser Gly Pro
85 90 95
Leu Cys Leu Thr Pro Leu Ala Asn Ala Cys Leu Ala Asn Pro Cys Arg
100 105 110
Asn Gly Gly Thr Cys Asp Leu Leu Thr Leu Thr Glu Tyr Lys Cys Arg
115 120 125
Cys Pro Pro Gly Trp Ser Gly Lys Ser Cys Gln Gln Ala Asp Pro Cys
130 135 140
Ala Ser Asn Pro Cys Ala Asn Gly Gly Gln Cys Leu Pro Phe Glu Ser
145 150 155 160
Ser Tyr Ile Cys Gly Cys Pro Pro Gly Phe His Gly Pro Thr Cys Arg
165 170 175
Gln Asp Val Asn Glu Cys Ser Gln Asn Pro Gly Leu Cys Arg His Gly
180 185 190
Gly Thr Cys His Asn Glu Ile Gly Ser Tyr Arg Cys Ala Cys Arg Ala
195 200 205
Thr His Thr Gly Pro His Cys Glu Leu Pro Tyr Val Pro Cys Ser Pro
210 215 220
Ser Pro Cys Gln Asn Gly Gly Thr Cys Arg Pro Thr Gly Asp Thr Thr
225 230 235 240
His Glu Cys Ala Cys Leu Pro Gly Phe Ala Gly Gln Asn Cys Glu Glu
245 250 255
Asn Val Asp Asp Cys Pro Gly Asn Asn Cys Lys Asn Gly Gly Ala Cys
260 265 270
Val Asp Gly Val Asn Thr Tyr Asn Cys Arg Cys Pro Pro Glu Trp Thr
275 280 285
Gly Gln Tyr Cys Thr Glu Asp Val Asp Glu Cys Gln Leu Met Pro Asn
290 295 300
Ala Cys Gln Asn Ala Gly Thr Cys His Asn Ser His Gly Gly Tyr Asn
305 310 315 320
Cys Val Cys Val Asn Gly Trp Thr Gly Glu Asp Cys Ser Asp Asn Ile
325 330 335
Asp Asp Cys Ala Ser Ala Ala Cys Phe Gln Gly Ala Thr Cys His Asp
340 345 350
Arg Val Ala Ser Phe Tyr Cys Glu Cys Pro His Gly Arg Thr Gly Leu
355 360 365
Leu Cys His Leu Asn Asp Ala Cys Ile Ser Asn Pro Cys Asn Glu Gly
370 375 380
Ser Asn Cys Asp Thr Asn Pro Val Asn Gly Lys Ala Ile Cys Thr Cys
385 390 395 400
Pro Arg Gly Tyr Thr Gly Pro Ala Cys Ser Gln Asp Val Asp Glu Cys
405 410 415
Ala Leu Gly Ala Asn Pro Cys Glu His Ala Gly Lys Cys Leu Asn Thr
420 425 430
Leu Gly Ser Phe Glu Cys Gln Cys Leu Gln Gly Tyr Thr Gly Pro Arg
435 440 445
Cys Glu Ile Asp Val Asn Glu Cys Ile Ser Asn Pro Cys Gln Asn Asp
450 455 460
Ala Thr Cys Leu Asp Gln Ile Gly Glu Phe Gln Cys Ile Cys Met Pro
465 470 475 480
Gly Tyr Glu Gly Val Tyr Cys Glu Ile Asn Thr Asp Glu Cys Ala Ser
485 490 495
Ser Pro Cys Leu His Asn Gly Arg Cys Val Asp Lys Ile Asn Glu Phe
500 505 510
Leu Cys Gln Cys Pro Lys Gly Phe Ser Gly His Leu Cys Gln Tyr Asp
515 520 525
Val Asp Glu Cys Ala Ser Thr Pro Cys Lys Asn Gly Ala Lys Cys Leu
530 535 540
Asp Gly Pro Asn Thr Tyr Thr Cys Val Cys Thr Glu Gly Tyr Thr Gly
545 550 555 560
Thr His Cys Glu Val Asp Ile Asp Glu Cys Asp Pro Asp Pro Cys His
565 570 575
Ile Gly Leu Cys Lys Asp Gly Val Ala Thr Phe Thr Cys Leu Cys Gln
580 585 590
Pro Gly Tyr Thr Gly His His Cys Glu Thr Asn Ile Asn Glu Cys His
595 600 605
Ser Gln Pro Cys Arg His Gly Gly Thr Cys Gln Asp Arg Asp Asn Tyr
610 615 620
Tyr Leu Cys Leu Cys Leu Lys Gly Thr Thr Gly Pro Asn Cys Glu Ile
625 630 635 640
Asn Leu Asp Asp Cys Ala Ser Asn Pro Cys Asp Ser Gly Thr Cys Leu
645 650 655
Asp Lys Ile Asp Gly Tyr Glu Cys Ala Cys Glu Pro Gly Tyr Thr Gly
660 665 670
Ser Met Cys Asn Val Asn Ile Asp Glu Cys Ala Gly Ser Pro Cys His
675 680 685
Asn Gly Gly Thr Cys Glu Asp Gly Ile Ala Gly Phe Thr Cys Arg Cys
690 695 700
Pro Glu Gly Tyr His Asp Pro Thr Cys Leu Ser Glu Val Asn Glu Cys
705 710 715 720
Asn Ser Asn Pro Cys Ile His Gly Ala Cys Arg Asp Gly Leu Asn Gly
725 730 735
Tyr Lys Cys Asp Cys Ala Pro Gly Trp Ser Gly Thr Asn Cys Asp Ile
740 745 750
Asn Asn Asn Glu Cys Glu Ser Asn Pro Cys Val Asn Gly Gly Thr Cys
755 760 765
Lys Asp Met Thr Ser Gly Tyr Val Cys Thr Cys Arg Glu Gly Phe Ser
770 775 780
Gly Pro Asn Cys Gln Thr Asn Ile Asn Glu Cys Ala Ser Asn Pro Cys
785 790 795 800
Leu Asn Gln Gly Thr Cys Ile Asp Asp Val Ala Gly Tyr Lys Cys Asn
805 810 815
Cys Pro Leu Pro Tyr Thr Gly Ala Thr Cys Glu Val Val Leu Ala Pro
820 825 830
Cys Ala Thr Ser Pro Cys Lys Asn Ser Gly Val Cys Lys Glu Ser Glu
835 840 845
Asp Tyr Glu Ser Phe Ser Cys Val Cys Pro Thr Gly Trp Gln Gly Gln
850 855 860
Thr Cys Glu Ile Asp Ile Asn Glu Cys Val Lys Ser Pro Cys Arg His
865 870 875 880
Gly Ala Ser Cys Gln Asn Thr Asn Gly Ser Tyr Arg Cys Leu Cys Gln
885 890 895
Ala Gly Tyr Thr Gly Arg Asn Cys Glu Ser Asp Ile Asp Asp Cys Arg
900 905 910
Pro Asn Pro Cys His Asn Gly Gly Ser Cys Thr Asp Gly Val Asn Ala
915 920 925
Ala Phe Cys Asp Cys Leu Pro Gly Phe Gln Gly Ala Phe Cys Glu Glu
930 935 940
Asp Ile Asn Glu Cys Ala Thr Asn Pro Cys Gln Asn Gly Ala Asn Cys
945 950 955 960
Thr Asp Cys Val Asp Ser Tyr Thr Cys Thr Cys Pro Thr Gly Phe Asn
965 970 975
Gly Ile His Cys Glu Asn Asn Thr Pro Asp Cys Thr Glu Ser Ser Cys
980 985 990
Phe Asn Gly Gly Thr Cys Val Asp Gly Ile Asn Ser Phe Thr Cys Leu
995 1000 1005
Cys Pro Pro Gly Phe Thr Gly Ser Tyr Cys Gln Tyr Asp Val Asn Glu
1010 1015 1020
Cys Asp Ser Arg Pro Cys Leu His Gly Gly Thr Cys Gln Asp Ser Tyr
1025 1030 1035 1040
Gly Thr Tyr Lys Cys Thr Cys Pro Gln Gly Tyr Thr Gly Leu Asn Cys
1045 1050 1055
Gln Asn Leu Val Arg Trp Cys Asp Ser Ala Pro Cys Lys Asn Gly Gly
1060 1065 1070
Lys Cys Trp Gln Thr Asn Thr Gln Tyr His Cys Glu Cys Arg Ser Gly
1075 1080 1085
Trp Thr Gly Phe Asn Cys Asp Val Leu Ser Val Ser Cys Glu Val Ala
1090 1095 1100
Ala Gln Lys Arg Gly Ile Asp Val Thr Leu Leu Cys Gln His Gly Gly
1105 1110 1115 1120
Leu Cys Val Asp Glu Glu Asp Lys His Tyr Cys His Cys Gln Ala Gly
1125 1130 1135
Tyr Thr Gly Ser Tyr Cys Glu Asp Glu Val Asp Glu Cys Ser Pro Asn
1140 1145 1150
Pro Cys Gln Asn Gly Ala Thr Cys Thr Asp Tyr Leu Gly Gly Phe Ser
1155 1160 1165
Cys Lys Cys Val Ala Gly Tyr His Gly Ser Asn Cys Ser Glu Glu Ile
1170 1175 1180
Asn Glu Cys Leu Ser Gln Pro Cys Gln Asn Gly Gly Thr Cys Ile Asp
1185 1190 1195 1200
Leu Thr Asn Thr Tyr Lys Cys Ser Cys Pro Arg Gly Thr Gln Gly Val
1205 1210 1215
His Cys Glu Ile Asn Val Asp Asp Cys His Pro Pro Leu Asp Pro Ala
1220 1225 1230
Ser Arg Ser Pro Lys Cys Phe Asn Asn Gly Thr Cys Val Asp Gln Val
1235 1240 1245
Gly Gly Tyr Thr Cys Thr Cys Pro Pro Gly Phe Val Gly Glu Arg Cys
1250 1255 1260
Glu Gly Asp Val Asn Glu Cys Leu Ser Asn Pro Cys Asp Pro Arg Gly
1265 1270 1275 1280
Thr Gln Asn Cys Val Gln Arg Val Asn Asp Phe His Cys Glu Cys Arg
1285 1290 1295
Ala Gly His Thr Gly Arg Arg Cys Glu Ser Val Ile Asn Gly Cys Arg
1300 1305 1310
Gly Lys Pro Cys Arg Asn Gly Gly Val Cys Ala Val Ala Ser Asn Thr
1315 1320 1325
Ala Arg Gly Phe Ile Cys Arg Cys Pro Ala Arg Phe Glu Gly Ala Thr
1330 1335 1340
Cys Glu Asn Asp Ala Arg Thr Cys Gly Ser Leu Arg Cys Leu Asn Gly
1345 1350 1355 1360
Gly Thr Cys Ile Ser Gly Pro Arg Ser Pro Thr Cys Leu Cys Leu Gly
1365 1370 1375
Ser Phe Thr Gly Pro Glu Cys Gln Phe Pro Ala Ser Ser Pro Cys Val
1380 1385 1390
Gly Ser Asn Pro Cys Tyr Asn Gln Gly Thr Cys Glu Pro Thr Ser Glu
1395 1400 1405
Ser Pro Phe Tyr Arg Cys Leu Cys Pro Ala Lys Phe Asn Gly Leu Leu
1410 1415 1420
Cys His Ile Leu Asp Tyr Ser Phe Thr Gly Ala Ala Gly Arg Asp Ile
1425 1430 1435 1440
Pro Pro Pro Gln Ile Glu Glu Ala Cys Glu Leu Pro Glu Cys Gln Glu
1445 1450 1455
Asp Ala Gly Asn Lys Val Cys Asn Leu Gln Cys Asn Asn His Ala Cys
1460 1465 1470
Gly Trp Asp Gly Gly Asp Cys Ser Leu Asn Phe Asn Asp Pro Trp Lys
1475 1480 1485
Asn Cys Thr Gln Ser Leu Gln Cys Trp Lys Tyr Phe Ser Asp Gly His
1490 1495 1500
Cys Asp Ser Gln Cys Asn Ser Ala Gly Cys Leu Phe Asp Gly Phe Asp
1505 1510 1515 1520
Cys Gln Leu Thr Glu Gly Gln Cys Asn Pro Leu Tyr Asp Gln Tyr Cys
1525 1530 1535
Lys Asp His Phe Ser Asp Gly His Cys Asp Gln Gly Cys Asn Ser Ala
1540 1545 1550
Glu Cys Glu Trp Asp Gly Leu Asp Cys Ala Glu His Val Pro Glu Arg
1555 1560 1565
Leu Ala Ala Gly Thr Leu Val Leu Val Val Leu Leu Pro Pro Asp Gln
1570 1575 1580
Leu Arg Asn Asn Ser Phe His Phe Leu Arg Asp Val Ser His Val Leu
1585 1590 1595 1600
His Thr Asn Val Val Phe Lys Arg Asp Ala Gln Gly Gln Gln Met Ile
1605 1610 1615
Phe Pro Tyr Tyr Gly Arg Glu Glu Glu Leu Arg Lys His Pro Ile Lys
1620 1625 1630
Arg Ser Ala Val Gly Trp Ala Thr Thr Ser Leu Leu Pro Gly Thr Asn
1635 1640 1645
Gly Gly Arg Gln Arg Arg Glu Leu Asp Pro Met Asp Ile His Gly Ser
1650 1655 1660
Ile Val Tyr Leu Glu Ile Asp Asn Arg Gln Cys Val Gln Ser Ser Ser
1665 1670 1675 1680
Gln Cys Phe Gln Ser Ala Thr Asp Val Ala Ala Phe Leu Gly Ala Leu
1685 1690 1695
Ala Ser Leu Gly Ser Leu Asn Ile Pro Tyr Lys Ile Glu Ala Val Lys
1700 1705 1710
Ser Glu Thr Val Glu Pro Pro Leu Pro Ser Gln Leu His Leu Met Tyr
1715 1720 1725
Val Ala Ala Ala Ala Phe Val Leu Leu Phe Phe Val Gly Cys Gly Val
1730 1735 1740
Leu Leu Ser Arg Lys Arg Arg Arg Gln His Gly Gln Leu Trp Phe Pro
1745 1750 1755 1760
Glu Gly Phe Lys Val Ser Glu Ala Ser Lys Lys Lys Arg Arg Glu Pro
1765 1770 1775
Leu Gly Glu Asp Ser Val Gly Leu Lys Pro Leu Lys Asn Ala Ser Asp
1780 1785 1790
Gly Ala Leu Met Asp Asp Asn Gln Asn Glu Trp Gly Asp Glu Asp Leu
1795 1800 1805
Glu Thr Lys Lys Phe Arg Phe Glu Glu Pro Val Val Leu Pro Asp Leu
1810 1815 1820
Asp Asp Gln Thr Asp His Arg Gln Trp Thr Gln Gln His Leu Asp Ala
1825 1830 1835 1840
Ala Asp Leu Arg Val Ser Ala Met Ala Pro Thr Pro Pro Gln Gly Glu
1845 1850 1855
Val Asp Ala Asp Cys Met Asp Val Asn Val Arg Gly Pro Asp Gly Phe
1860 1865 1870
Thr Pro Leu Met Ile Ala Ser Cys Ser Gly Gly Gly Leu Glu Thr Gly
1875 1880 1885
Asn Ser Glu Glu Glu Glu Asp Ala Pro Ala Val Ile Ser Asp Phe Ile
1890 1895 1900
Tyr Gln Gly Ala Ser Leu His Asn Gln Thr Asp Arg Thr Gly Glu Thr
1905 1910 1915 1920
Ala Leu His Leu Ala Ala Arg Tyr Ser Arg Ser Asp Ala Ala Lys Arg
1925 1930 1935
Leu Leu Glu Ala Ser Ala Asp Ala Asn Ile Gln Asp Asn Met Gly Arg
1940 1945 1950
Thr Pro Leu His Ala Ala Val Ser Ala Asp Ala Gln Gly Val Phe Gln
1955 1960 1965
Ile Leu Leu Arg Asn Arg Ala Thr Asp Leu Asp Ala Arg Met His Asp
1970 1975 1980
Gly Thr Thr Pro Leu Ile Leu Ala Ala Arg Leu Ala Val Glu Gly Met
1985 1990 1995 2000
Leu Glu Asp Leu Ile Asn Ser His Ala Asp Val Asn Ala Val Asp Asp
2005 2010 2015
Leu Gly Lys Ser Ala Leu His Trp Ala Ala Ala Val Asn Asn Val Asp
2020 2025 2030
Ala Ala Val Val Leu Leu Lys Asn Gly Ala Asn Lys Asp Met Gln Asn
2035 2040 2045
Asn Lys Glu Glu Thr Pro Leu Phe Leu Ala Ala Arg Glu Gly Ser Tyr
2050 2055 2060
Glu Thr Ala Lys Val Leu Leu Asp His Phe Ala Asn Arg Asp Ile Thr
2065 2070 2075 2080
Asp His Met Asp Arg Leu Pro Arg Asp Ile Ala Gln Glu Arg Met His
2085 2090 2095
His Asp Ile Val Arg Leu Leu Asp Glu Tyr Asn Leu Val Arg Ser Pro
2100 2105 2110
Gln Leu His Gly Thr Ala Leu Gly Gly Thr Pro Thr Leu Ser Pro Thr
2115 2120 2125
Leu Cys Ser Pro Asn Gly Tyr Leu Gly Asn Leu Lys Ser Ala Thr Gln
2130 2135 2140
Gly Lys Lys Ala Arg Lys Pro Ser Thr Lys Gly Leu Ala Cys Ser Ser
2145 2150 2155 2160
Lys Glu Ala Lys Asp Leu Lys Ala Arg Arg Lys Lys Ser Gln Asp Gly
2165 2170 2175
Lys Gly Cys Leu Leu Asp Ser Ser Ser Met Leu Ser Pro Val Asp Ser
2180 2185 2190
Leu Glu Ser Pro His Gly Tyr Leu Ser Asp Val Ala Ser Pro Pro Leu
2195 2200 2205
Leu Pro Ser Pro Phe Gln Gln Ser Pro Ser Met Pro Leu Ser His Leu
2210 2215 2220
Pro Gly Met Pro Asp Thr His Leu Gly Ile Ser His Leu Asn Val Ala
2225 2230 2235 2240
Ala Lys Pro Glu Met Ala Ala Leu Ala Gly Gly Ser Arg Leu Ala Phe
2245 2250 2255
Glu Pro Pro Pro Pro Arg Leu Ser His Leu Pro Val Ala Ser Ser Ala
2260 2265 2270
Ser Thr Val Leu Ser Thr Asn Gly Thr Gly Ala Met Asn Phe Thr Val
2275 2280 2285
Gly Ala Pro Ala Ser Leu Asn Gly Gln Cys Glu Trp Leu Pro Arg Leu
2290 2295 2300
Gln Asn Gly Met Val Pro Ser Gln Tyr Asn Pro Leu Arg Pro Gly Val
2305 2310 2315 2320
Thr Pro Gly Thr Leu Ser Thr Gln Ala Ala Gly Leu Gln His Gly Met
2325 2330 2335
Met Gly Pro Ile His Ser Ser Leu Ser Thr Asn Thr Leu Ser Pro Ile
2340 2345 2350
Ile Tyr Gln Gly Leu Pro Asn Thr Arg Leu Ala Thr Gln Pro His Leu
2355 2360 2365
Val Gln Thr Gln Gln Val Gln Pro Gln Asn Leu Gln Ile Gln Pro Gln
2370 2375 2380
Asn Leu Gln Pro Pro Ser Gln Pro His Leu Ser Val Ser Ser Ala Ala
2385 2390 2395 2400
Asn Gly His Leu Gly Arg Ser Phe Leu Ser Gly Glu Pro Ser Gln Ala
2405 2410 2415
Asp Val Gln Pro Leu Gly Pro Ser Ser Leu Pro Val His Thr Ile Leu
2420 2425 2430
Pro Gln Glu Ser Gln Ala Leu Pro Thr Ser Leu Pro Ser Ser Met Val
2435 2440 2445
Pro Pro Met Thr Thr Thr Gln Phe Leu Thr Pro Pro Ser Gln His Ser
2450 2455 2460
Tyr Ser Ser Ser Pro Val Asp Asn Thr Pro Ser His Gln Leu Gln Val
2465 2470 2475 2480
Pro Glu His Pro Phe Leu Thr Pro Ser Pro Glu Ser Pro Asp Gln Trp
2485 2490 2495
Ser Ser Ser Ser Arg His Ser Asn Ile Ser Asp Trp Ser Glu Gly Ile
2500 2505 2510
Ser Ser Pro Pro Thr Ser Met Pro Ser Gln Ile Thr His Ile Pro Glu
2515 2520 2525
Ala Phe Lys
2530
<210> 8
<211> 2471
<212> PRT
<213> Homo sapiens
<400> 8
Met Pro Ala Leu Arg Pro Ala Leu Leu Trp Ala Leu Leu Ala Leu Trp
1 5 10 15
Leu Cys Cys Ala Ala Pro Ala His Ala Leu Gln Cys Arg Asp Gly Tyr
20 25 30
Glu Pro Cys Val Asn Glu Gly Met Cys Val Thr Tyr His Asn Gly Thr
35 40 45
Gly Tyr Cys Lys Cys Pro Glu Gly Phe Leu Gly Glu Tyr Cys Gln His
50 55 60
Arg Asp Pro Cys Glu Lys Asn Arg Cys Gln Asn Gly Gly Thr Cys Val
65 70 75 80
Ala Gln Ala Met Leu Gly Lys Ala Thr Cys Arg Cys Ala Ser Gly Phe
85 90 95
Thr Gly Glu Asp Cys Gln Tyr Ser Thr Ser His Pro Cys Phe Val Ser
100 105 110
Arg Pro Cys Leu Asn Gly Gly Thr Cys His Met Leu Ser Arg Asp Thr
115 120 125
Tyr Glu Cys Thr Cys Gln Val Gly Phe Thr Gly Lys Glu Cys Gln Trp
130 135 140
Thr Asp Ala Cys Leu Ser His Pro Cys Ala Asn Gly Ser Thr Cys Thr
145 150 155 160
Thr Val Ala Asn Gln Phe Ser Cys Lys Cys Leu Thr Gly Phe Thr Gly
165 170 175
Gln Lys Cys Glu Thr Asp Val Asn Glu Cys Asp Ile Pro Gly His Cys
180 185 190
Gln His Gly Gly Thr Cys Leu Asn Leu Pro Gly Ser Tyr Gln Cys Gln
195 200 205
Cys Pro Gln Gly Phe Thr Gly Gln Tyr Cys Asp Ser Leu Tyr Val Pro
210 215 220
Cys Ala Pro Ser Pro Cys Val Asn Gly Gly Thr Cys Arg Gln Thr Gly
225 230 235 240
Asp Phe Thr Phe Glu Cys Asn Cys Leu Pro Gly Phe Glu Gly Ser Thr
245 250 255
Cys Glu Arg Asn Ile Asp Asp Cys Pro Asn His Arg Cys Gln Asn Gly
260 265 270
Gly Val Cys Val Asp Gly Val Asn Thr Tyr Asn Cys Arg Cys Pro Pro
275 280 285
Gln Trp Thr Gly Gln Phe Cys Thr Glu Asp Val Asp Glu Cys Leu Leu
290 295 300
Gln Pro Asn Ala Cys Gln Asn Gly Gly Thr Cys Ala Asn Arg Asn Gly
305 310 315 320
Gly Tyr Gly Cys Val Cys Val Asn Gly Trp Ser Gly Asp Asp Cys Ser
325 330 335
Glu Asn Ile Asp Asp Cys Ala Phe Ala Ser Cys Thr Pro Gly Ser Thr
340 345 350
Cys Ile Asp Arg Val Ala Ser Phe Ser Cys Met Cys Pro Glu Gly Lys
355 360 365
Ala Gly Leu Leu Cys His Leu Asp Asp Ala Cys Ile Ser Asn Pro Cys
370 375 380
His Lys Gly Ala Leu Cys Asp Thr Asn Pro Leu Asn Gly Gln Tyr Ile
385 390 395 400
Cys Thr Cys Pro Gln Gly Tyr Lys Gly Ala Asp Cys Thr Glu Asp Val
405 410 415
Asp Glu Cys Ala Met Ala Asn Ser Asn Pro Cys Glu His Ala Gly Lys
420 425 430
Cys Val Asn Thr Asp Gly Ala Phe His Cys Glu Cys Leu Lys Gly Tyr
435 440 445
Ala Gly Pro Arg Cys Glu Met Asp Ile Asn Glu Cys His Ser Asp Pro
450 455 460
Cys Gln Asn Asp Ala Thr Cys Leu Asp Lys Ile Gly Gly Phe Thr Cys
465 470 475 480
Leu Cys Met Pro Gly Phe Lys Gly Val His Cys Glu Leu Glu Ile Asn
485 490 495
Glu Cys Gln Ser Asn Pro Cys Val Asn Asn Gly Gln Cys Val Asp Lys
500 505 510
Val Asn Arg Phe Gln Cys Leu Cys Pro Pro Gly Phe Thr Gly Pro Val
515 520 525
Cys Gln Ile Asp Ile Asp Asp Cys Ser Ser Thr Pro Cys Leu Asn Gly
530 535 540
Ala Lys Cys Ile Asp His Pro Asn Gly Tyr Glu Cys Gln Cys Ala Thr
545 550 555 560
Gly Phe Thr Gly Val Leu Cys Glu Glu Asn Ile Asp Asn Cys Asp Pro
565 570 575
Asp Pro Cys His His Gly Gln Cys Gln Asp Gly Ile Asp Ser Tyr Thr
580 585 590
Cys Ile Cys Asn Pro Gly Tyr Met Gly Ala Ile Cys Ser Asp Gln Ile
595 600 605
Asp Glu Cys Tyr Ser Ser Pro Cys Leu Asn Asp Gly Arg Cys Ile Asp
610 615 620
Leu Val Asn Gly Tyr Gln Cys Asn Cys Gln Pro Gly Thr Ser Gly Val
625 630 635 640
Asn Cys Glu Ile Asn Phe Asp Asp Cys Ala Ser Asn Pro Cys Ile His
645 650 655
Gly Ile Cys Met Asp Gly Ile Asn Arg Tyr Ser Cys Val Cys Ser Pro
660 665 670
Gly Phe Thr Gly Gln Arg Cys Asn Ile Asp Ile Asp Glu Cys Ala Ser
675 680 685
Asn Pro Cys Arg Lys Gly Ala Thr Cys Ile Asn Gly Val Asn Gly Phe
690 695 700
Arg Cys Ile Cys Pro Glu Gly Pro His His Pro Ser Cys Tyr Ser Gln
705 710 715 720
Val Asn Glu Cys Leu Ser Asn Pro Cys Ile His Gly Asn Cys Thr Gly
725 730 735
Gly Leu Ser Gly Tyr Lys Cys Leu Cys Asp Ala Gly Trp Val Gly Ile
740 745 750
Asn Cys Glu Val Asp Lys Asn Glu Cys Leu Ser Asn Pro Cys Gln Asn
755 760 765
Gly Gly Thr Cys Asp Asn Leu Val Asn Gly Tyr Arg Cys Thr Cys Lys
770 775 780
Lys Gly Phe Lys Gly Tyr Asn Cys Gln Val Asn Ile Asp Glu Cys Ala
785 790 795 800
Ser Asn Pro Cys Leu Asn Gln Gly Thr Cys Phe Asp Asp Ile Ser Gly
805 810 815
Tyr Thr Cys His Cys Val Leu Pro Tyr Thr Gly Lys Asn Cys Gln Thr
820 825 830
Val Leu Ala Pro Cys Ser Pro Asn Pro Cys Glu Asn Ala Ala Val Cys
835 840 845
Lys Glu Ser Pro Asn Phe Glu Ser Tyr Thr Cys Leu Cys Ala Pro Gly
850 855 860
Trp Gln Gly Gln Arg Cys Thr Ile Asp Ile Asp Glu Cys Ile Ser Lys
865 870 875 880
Pro Cys Met Asn His Gly Leu Cys His Asn Thr Gln Gly Ser Tyr Met
885 890 895
Cys Glu Cys Pro Pro Gly Phe Ser Gly Met Asp Cys Glu Glu Asp Ile
900 905 910
Asp Asp Cys Leu Ala Asn Pro Cys Gln Asn Gly Gly Ser Cys Met Asp
915 920 925
Gly Val Asn Thr Phe Ser Cys Leu Cys Leu Pro Gly Phe Thr Gly Asp
930 935 940
Lys Cys Gln Thr Asp Met Asn Glu Cys Leu Ser Glu Pro Cys Lys Asn
945 950 955 960
Gly Gly Thr Cys Ser Asp Tyr Val Asn Ser Tyr Thr Cys Lys Cys Gln
965 970 975
Ala Gly Phe Asp Gly Val His Cys Glu Asn Asn Ile Asn Glu Cys Thr
980 985 990
Glu Ser Ser Cys Phe Asn Gly Gly Thr Cys Val Asp Gly Ile Asn Ser
995 1000 1005
Phe Ser Cys Leu Cys Pro Val Gly Phe Thr Gly Ser Phe Cys Leu His
1010 1015 1020
Glu Ile Asn Glu Cys Ser Ser His Pro Cys Leu Asn Glu Gly Thr Cys
1025 1030 1035 1040
Val Asp Gly Leu Gly Thr Tyr Arg Cys Ser Cys Pro Leu Gly Tyr Thr
1045 1050 1055
Gly Lys Asn Cys Gln Thr Leu Val Asn Leu Cys Ser Arg Ser Pro Cys
1060 1065 1070
Lys Asn Lys Gly Thr Cys Val Gln Lys Lys Ala Glu Ser Gln Cys Leu
1075 1080 1085
Cys Pro Ser Gly Trp Ala Gly Ala Tyr Cys Asp Val Pro Asn Val Ser
1090 1095 1100
Cys Asp Ile Ala Ala Ser Arg Arg Gly Val Leu Val Glu His Leu Cys
1105 1110 1115 1120
Gln His Ser Gly Val Cys Ile Asn Ala Gly Asn Thr His Tyr Cys Gln
1125 1130 1135
Cys Pro Leu Gly Tyr Thr Gly Ser Tyr Cys Glu Glu Gln Leu Asp Glu
1140 1145 1150
Cys Ala Ser Asn Pro Cys Gln His Gly Ala Thr Cys Ser Asp Phe Ile
1155 1160 1165
Gly Gly Tyr Arg Cys Glu Cys Val Pro Gly Tyr Gln Gly Val Asn Cys
1170 1175 1180
Glu Tyr Glu Val Asp Glu Cys Gln Asn Gln Pro Cys Gln Asn Gly Gly
1185 1190 1195 1200
Thr Cys Ile Asp Leu Val Asn His Phe Lys Cys Ser Cys Pro Pro Gly
1205 1210 1215
Thr Arg Gly Leu Leu Cys Glu Glu Asn Ile Asp Asp Cys Ala Arg Gly
1220 1225 1230
Pro His Cys Leu Asn Gly Gly Gln Cys Met Asp Arg Ile Gly Gly Tyr
1235 1240 1245
Ser Cys Arg Cys Leu Pro Gly Phe Ala Gly Glu Arg Cys Glu Gly Asp
1250 1255 1260
Ile Asn Glu Cys Leu Ser Asn Pro Cys Ser Ser Glu Gly Ser Leu Asp
1265 1270 1275 1280
Cys Ile Gln Leu Thr Asn Asp Tyr Leu Cys Val Cys Arg Ser Ala Phe
1285 1290 1295
Thr Gly Arg His Cys Glu Thr Phe Val Asp Val Cys Pro Gln Met Pro
1300 1305 1310
Cys Leu Asn Gly Gly Thr Cys Ala Val Ala Ser Asn Met Pro Asp Gly
1315 1320 1325
Phe Ile Cys Arg Cys Pro Pro Gly Phe Ser Gly Ala Arg Cys Gln Ser
1330 1335 1340
Ser Cys Gly Gln Val Lys Cys Arg Lys Gly Glu Gln Cys Val His Thr
1345 1350 1355 1360
Ala Ser Gly Pro Arg Cys Phe Cys Pro Ser Pro Arg Asp Cys Glu Ser
1365 1370 1375
Gly Cys Ala Ser Ser Pro Cys Gln His Gly Gly Ser Cys His Pro Gln
1380 1385 1390
Arg Gln Pro Pro Tyr Tyr Ser Cys Gln Cys Ala Pro Pro Phe Ser Gly
1395 1400 1405
Ser Arg Cys Glu Leu Tyr Thr Ala Pro Pro Ser Thr Pro Pro Ala Thr
1410 1415 1420
Cys Leu Ser Gln Tyr Cys Ala Asp Lys Ala Arg Asp Gly Val Cys Asp
1425 1430 1435 1440
Glu Ala Cys Asn Ser His Ala Cys Gln Trp Asp Gly Gly Asp Cys Ser
1445 1450 1455
Leu Thr Met Glu Asn Pro Trp Ala Asn Cys Ser Ser Pro Leu Pro Cys
1460 1465 1470
Trp Asp Tyr Ile Asn Asn Gln Cys Asp Glu Leu Cys Asn Thr Val Glu
1475 1480 1485
Cys Leu Phe Asp Asn Phe Glu Cys Gln Gly Asn Ser Lys Thr Cys Lys
1490 1495 1500
Tyr Asp Lys Tyr Cys Ala Asp His Phe Lys Asp Asn His Cys Asp Gln
1505 1510 1515 1520
Gly Cys Asn Ser Glu Glu Cys Gly Trp Asp Gly Leu Asp Cys Ala Ala
1525 1530 1535
Asp Gln Pro Glu Asn Leu Ala Glu Gly Thr Leu Val Ile Val Val Leu
1540 1545 1550
Met Pro Pro Glu Gln Leu Leu Gln Asp Ala Arg Ser Phe Leu Arg Ala
1555 1560 1565
Leu Gly Thr Leu Leu His Thr Asn Leu Arg Ile Lys Arg Asp Ser Gln
1570 1575 1580
Gly Glu Leu Met Val Tyr Pro Tyr Tyr Gly Glu Lys Ser Ala Ala Met
1585 1590 1595 1600
Lys Lys Gln Arg Met Thr Arg Arg Ser Leu Pro Gly Glu Gln Glu Gln
1605 1610 1615
Glu Val Ala Gly Ser Lys Val Phe Leu Glu Ile Asp Asn Arg Gln Cys
1620 1625 1630
Val Gln Asp Ser Asp His Cys Phe Lys Asn Thr Asp Ala Ala Ala Ala
1635 1640 1645
Leu Leu Ala Ser His Ala Ile Gln Gly Thr Leu Ser Tyr Pro Leu Val
1650 1655 1660
Ser Val Val Ser Glu Ser Leu Thr Pro Glu Arg Thr Gln Leu Leu Tyr
1665 1670 1675 1680
Leu Leu Ala Val Ala Val Val Ile Ile Leu Phe Ile Ile Leu Leu Gly
1685 1690 1695
Val Ile Met Ala Lys Arg Lys Arg Lys His Gly Ser Leu Trp Leu Pro
1700 1705 1710
Glu Gly Phe Thr Leu Arg Arg Asp Ala Ser Asn His Lys Arg Arg Glu
1715 1720 1725
Pro Val Gly Gln Asp Ala Val Gly Leu Lys Asn Leu Ser Val Gln Val
1730 1735 1740
Ser Glu Ala Asn Leu Ile Gly Thr Gly Thr Ser Glu His Trp Val Asp
1745 1750 1755 1760
Asp Glu Gly Pro Gln Pro Lys Lys Val Lys Ala Glu Asp Glu Ala Leu
1765 1770 1775
Leu Ser Glu Glu Asp Asp Pro Ile Asp Arg Arg Pro Trp Thr Gln Gln
1780 1785 1790
His Leu Glu Ala Ala Asp Ile Arg Arg Thr Pro Ser Leu Ala Leu Thr
1795 1800 1805
Pro Pro Gln Ala Glu Gln Glu Val Asp Val Leu Asp Val Asn Val Arg
1810 1815 1820
Gly Pro Asp Gly Cys Thr Pro Leu Met Leu Ala Ser Leu Arg Gly Gly
1825 1830 1835 1840
Ser Ser Asp Leu Ser Asp Glu Asp Glu Asp Ala Glu Asp Ser Ser Ala
1845 1850 1855
Asn Ile Ile Thr Asp Leu Val Tyr Gln Gly Ala Ser Leu Gln Ala Gln
1860 1865 1870
Thr Asp Arg Thr Gly Glu Met Ala Leu His Leu Ala Ala Arg Tyr Ser
1875 1880 1885
Arg Ala Asp Ala Ala Lys Arg Leu Leu Asp Ala Gly Ala Asp Ala Asn
1890 1895 1900
Ala Gln Asp Asn Met Gly Arg Cys Pro Leu His Ala Ala Val Ala Ala
1905 1910 1915 1920
Asp Ala Gln Gly Val Phe Gln Ile Leu Ile Arg Asn Arg Val Thr Asp
1925 1930 1935
Leu Asp Ala Arg Met Asn Asp Gly Thr Thr Pro Leu Ile Leu Ala Ala
1940 1945 1950
Arg Leu Ala Val Glu Gly Met Val Ala Glu Leu Ile Asn Cys Gln Ala
1955 1960 1965
Asp Val Asn Ala Val Asp Asp His Gly Lys Ser Ala Leu His Trp Ala
1970 1975 1980
Ala Ala Val Asn Asn Val Glu Ala Thr Leu Leu Leu Leu Lys Asn Gly
1985 1990 1995 2000
Ala Asn Arg Asp Met Gln Asp Asn Lys Glu Glu Thr Pro Leu Phe Leu
2005 2010 2015
Ala Ala Arg Glu Gly Ser Tyr Glu Ala Ala Lys Ile Leu Leu Asp His
2020 2025 2030
Phe Ala Asn Arg Asp Ile Thr Asp His Met Asp Arg Leu Pro Arg Asp
2035 2040 2045
Val Ala Arg Asp Arg Met His His Asp Ile Val Arg Leu Leu Asp Glu
2050 2055 2060
Tyr Asn Val Thr Pro Ser Pro Pro Gly Thr Val Leu Thr Ser Ala Leu
2065 2070 2075 2080
Ser Pro Val Ile Cys Gly Pro Asn Arg Ser Phe Leu Ser Leu Lys His
2085 2090 2095
Thr Pro Met Gly Lys Lys Ser Arg Arg Pro Ser Ala Lys Ser Thr Met
2100 2105 2110
Pro Thr Ser Leu Pro Asn Leu Ala Lys Glu Ala Lys Asp Ala Lys Gly
2115 2120 2125
Ser Arg Arg Lys Lys Ser Leu Ser Glu Lys Val Gln Leu Ser Glu Ser
2130 2135 2140
Ser Val Thr Leu Ser Pro Val Asp Ser Leu Glu Ser Pro His Thr Tyr
2145 2150 2155 2160
Val Ser Asp Thr Thr Ser Ser Pro Met Ile Thr Ser Pro Gly Ile Leu
2165 2170 2175
Gln Ala Ser Pro Asn Pro Met Leu Ala Thr Ala Ala Pro Pro Ala Pro
2180 2185 2190
Val His Ala Gln His Ala Leu Ser Phe Ser Asn Leu His Glu Met Gln
2195 2200 2205
Pro Leu Ala His Gly Ala Ser Thr Val Leu Pro Ser Val Ser Gln Leu
2210 2215 2220
Leu Ser His His His Ile Val Ser Pro Gly Ser Gly Ser Ala Gly Ser
2225 2230 2235 2240
Leu Ser Arg Leu His Pro Val Pro Val Pro Ala Asp Trp Met Asn Arg
2245 2250 2255
Met Glu Val Asn Glu Thr Gln Tyr Asn Glu Met Phe Gly Met Val Leu
2260 2265 2270
Ala Pro Ala Glu Gly Thr His Pro Gly Ile Ala Pro Gln Ser Arg Pro
2275 2280 2285
Pro Glu Gly Lys His Ile Thr Thr Pro Arg Glu Pro Leu Pro Pro Ile
2290 2295 2300
Val Thr Phe Gln Leu Ile Pro Lys Gly Ser Ile Ala Gln Pro Ala Gly
2305 2310 2315 2320
Ala Pro Gln Pro Gln Ser Thr Cys Pro Pro Ala Val Ala Gly Pro Leu
2325 2330 2335
Pro Thr Met Tyr Gln Ile Pro Glu Met Ala Arg Leu Pro Ser Val Ala
2340 2345 2350
Phe Pro Thr Ala Met Met Pro Gln Gln Asp Gly Gln Val Ala Gln Thr
2355 2360 2365
Ile Leu Pro Ala Tyr His Pro Phe Pro Ala Ser Val Gly Lys Tyr Pro
2370 2375 2380
Thr Pro Pro Ser Gln His Ser Tyr Ala Ser Ser Asn Ala Ala Glu Arg
2385 2390 2395 2400
Thr Pro Ser His Ser Gly His Leu Gln Gly Glu His Pro Tyr Leu Thr
2405 2410 2415
Pro Ser Pro Glu Ser Pro Asp Gln Trp Ser Ser Ser Ser Pro His Ser
2420 2425 2430
Ala Ser Asp Trp Ser Asp Val Thr Thr Ser Pro Thr Pro Gly Gly Ala
2435 2440 2445
Gly Gly Gly Gln Arg Gly Pro Gly Thr His Met Ser Glu Pro Pro His
2450 2455 2460
Asn Asn Met Gln Val Tyr Ala
2465 2470
<210> 9
<211> 2321
<212> PRT
<213> Homo sapiens
<400> 9
Met Gly Pro Gly Ala Arg Gly Arg Arg Arg Arg Arg Arg Pro Met Ser
1 5 10 15
Pro Pro Pro Pro Pro Pro Pro Val Arg Ala Leu Pro Leu Leu Leu Leu
20 25 30
Leu Ala Gly Pro Gly Ala Ala Ala Pro Pro Cys Leu Asp Gly Ser Pro
35 40 45
Cys Ala Asn Gly Gly Arg Cys Thr Gln Leu Pro Ser Arg Glu Ala Ala
50 55 60
Cys Leu Cys Pro Pro Gly Trp Val Gly Glu Arg Cys Gln Leu Glu Asp
65 70 75 80
Pro Cys His Ser Gly Pro Cys Ala Gly Arg Gly Val Cys Gln Ser Ser
85 90 95
Val Val Ala Gly Thr Ala Arg Phe Ser Cys Arg Cys Pro Arg Gly Phe
100 105 110
Arg Gly Pro Asp Cys Ser Leu Pro Asp Pro Cys Leu Ser Ser Pro Cys
115 120 125
Ala His Gly Ala Arg Cys Ser Val Gly Pro Asp Gly Arg Phe Leu Cys
130 135 140
Ser Cys Pro Pro Gly Tyr Gln Gly Arg Ser Cys Arg Ser Asp Val Asp
145 150 155 160
Glu Cys Arg Val Gly Glu Pro Cys Arg His Gly Gly Thr Cys Leu Asn
165 170 175
Thr Pro Gly Ser Phe Arg Cys Gln Cys Pro Ala Gly Tyr Thr Gly Pro
180 185 190
Leu Cys Glu Asn Pro Ala Val Pro Cys Ala Pro Ser Pro Cys Arg Asn
195 200 205
Gly Gly Thr Cys Arg Gln Ser Gly Asp Leu Thr Tyr Asp Cys Ala Cys
210 215 220
Leu Pro Gly Phe Glu Gly Gln Asn Cys Glu Val Asn Val Asp Asp Cys
225 230 235 240
Pro Gly His Arg Cys Leu Asn Gly Gly Thr Cys Val Asp Gly Val Asn
245 250 255
Thr Tyr Asn Cys Gln Cys Pro Pro Glu Trp Thr Gly Gln Phe Cys Thr
260 265 270
Glu Asp Val Asp Glu Cys Gln Leu Gln Pro Asn Ala Cys His Asn Gly
275 280 285
Gly Thr Cys Phe Asn Thr Leu Gly Gly His Ser Cys Val Cys Val Asn
290 295 300
Gly Trp Thr Gly Glu Ser Cys Ser Gln Asn Ile Asp Asp Cys Ala Thr
305 310 315 320
Ala Val Cys Phe His Gly Ala Thr Cys His Asp Arg Val Ala Ser Phe
325 330 335
Tyr Cys Ala Cys Pro Met Gly Lys Thr Gly Leu Leu Cys His Leu Asp
340 345 350
Asp Ala Cys Val Ser Asn Pro Cys His Glu Asp Ala Ile Cys Asp Thr
355 360 365
Asn Pro Val Asn Gly Arg Ala Ile Cys Thr Cys Pro Pro Gly Phe Thr
370 375 380
Gly Gly Ala Cys Asp Gln Asp Val Asp Glu Cys Ser Ile Gly Ala Asn
385 390 395 400
Pro Cys Glu His Leu Gly Arg Cys Val Asn Thr Gln Gly Ser Phe Leu
405 410 415
Cys Gln Cys Gly Arg Gly Tyr Thr Gly Pro Arg Cys Glu Thr Asp Val
420 425 430
Asn Glu Cys Leu Ser Gly Pro Cys Arg Asn Gln Ala Thr Cys Leu Asp
435 440 445
Arg Ile Gly Gln Phe Thr Cys Ile Cys Met Ala Gly Phe Thr Gly Thr
450 455 460
Tyr Cys Glu Val Asp Ile Asp Glu Cys Gln Ser Ser Pro Cys Val Asn
465 470 475 480
Gly Gly Val Cys Lys Asp Arg Val Asn Gly Phe Ser Cys Thr Cys Pro
485 490 495
Ser Gly Phe Ser Gly Ser Thr Cys Gln Leu Asp Val Asp Glu Cys Ala
500 505 510
Ser Thr Pro Cys Arg Asn Gly Ala Lys Cys Val Asp Gln Pro Asp Gly
515 520 525
Tyr Glu Cys Arg Cys Ala Glu Gly Phe Glu Gly Thr Leu Cys Asp Arg
530 535 540
Asn Val Asp Asp Cys Ser Pro Asp Pro Cys His His Gly Arg Cys Val
545 550 555 560
Asp Gly Ile Ala Ser Phe Ser Cys Ala Cys Ala Pro Gly Tyr Thr Gly
565 570 575
Thr Arg Cys Glu Ser Gln Val Asp Glu Cys Arg Ser Gln Pro Cys Arg
580 585 590
His Gly Gly Lys Cys Leu Asp Leu Val Asp Lys Tyr Leu Cys Arg Cys
595 600 605
Pro Ser Gly Thr Thr Gly Val Asn Cys Glu Val Asn Ile Asp Asp Cys
610 615 620
Ala Ser Asn Pro Cys Thr Phe Gly Val Cys Arg Asp Gly Ile Asn Arg
625 630 635 640
Tyr Asp Cys Val Cys Gln Pro Gly Phe Thr Gly Pro Leu Cys Asn Val
645 650 655
Glu Ile Asn Glu Cys Ala Ser Ser Pro Cys Gly Glu Gly Gly Ser Cys
660 665 670
Val Asp Gly Glu Asn Gly Phe Arg Cys Leu Cys Pro Pro Gly Ser Leu
675 680 685
Pro Pro Leu Cys Leu Pro Pro Ser His Pro Cys Ala His Glu Pro Cys
690 695 700
Ser His Gly Ile Cys Tyr Asp Ala Pro Gly Gly Phe Arg Cys Val Cys
705 710 715 720
Glu Pro Gly Trp Ser Gly Pro Arg Cys Ser Gln Ser Leu Ala Arg Asp
725 730 735
Ala Cys Glu Ser Gln Pro Cys Arg Ala Gly Gly Thr Cys Ser Ser Asp
740 745 750
Gly Met Gly Phe His Cys Thr Cys Pro Pro Gly Val Gln Gly Arg Gln
755 760 765
Cys Glu Leu Leu Ser Pro Cys Thr Pro Asn Pro Cys Glu His Gly Gly
770 775 780
Arg Cys Glu Ser Ala Pro Gly Gln Leu Pro Val Cys Ser Cys Pro Gln
785 790 795 800
Gly Trp Gln Gly Pro Arg Cys Gln Gln Asp Val Asp Glu Cys Ala Gly
805 810 815
Pro Ala Pro Cys Gly Pro His Gly Ile Cys Thr Asn Leu Ala Gly Ser
820 825 830
Phe Ser Cys Thr Cys His Gly Gly Tyr Thr Gly Pro Ser Cys Asp Gln
835 840 845
Asp Ile Asn Asp Cys Asp Pro Asn Pro Cys Leu Asn Gly Gly Ser Cys
850 855 860
Gln Asp Gly Val Gly Ser Phe Ser Cys Ser Cys Leu Pro Gly Phe Ala
865 870 875 880
Gly Pro Arg Cys Ala Arg Asp Val Asp Glu Cys Leu Ser Asn Pro Cys
885 890 895
Gly Pro Gly Thr Cys Thr Asp His Val Ala Ser Phe Thr Cys Thr Cys
900 905 910
Pro Pro Gly Tyr Gly Gly Phe His Cys Glu Gln Asp Leu Pro Asp Cys
915 920 925
Ser Pro Ser Ser Cys Phe Asn Gly Gly Thr Cys Val Asp Gly Val Asn
930 935 940
Ser Phe Ser Cys Leu Cys Arg Pro Gly Tyr Thr Gly Ala His Cys Gln
945 950 955 960
His Glu Ala Asp Pro Cys Leu Ser Arg Pro Cys Leu His Gly Gly Val
965 970 975
Cys Ser Ala Ala His Pro Gly Phe Arg Cys Thr Cys Leu Glu Ser Phe
980 985 990
Thr Gly Pro Gln Cys Gln Thr Leu Val Asp Trp Cys Ser Arg Gln Pro
995 1000 1005
Cys Gln Asn Gly Gly Arg Cys Val Gln Thr Gly Ala Tyr Cys Leu Cys
1010 1015 1020
Pro Pro Gly Trp Ser Gly Arg Leu Cys Asp Ile Arg Ser Leu Pro Cys
1025 1030 1035 1040
Arg Glu Ala Ala Ala Gln Ile Gly Val Arg Leu Glu Gln Leu Cys Gln
1045 1050 1055
Ala Gly Gly Gln Cys Val Asp Glu Asp Ser Ser His Tyr Cys Val Cys
1060 1065 1070
Pro Glu Gly Arg Thr Gly Ser His Cys Glu Gln Glu Val Asp Pro Cys
1075 1080 1085
Leu Ala Gln Pro Cys Gln His Gly Gly Thr Cys Arg Gly Tyr Met Gly
1090 1095 1100
Gly Tyr Met Cys Glu Cys Leu Pro Gly Tyr Asn Gly Asp Asn Cys Glu
1105 1110 1115 1120
Asp Asp Val Asp Glu Cys Ala Ser Gln Pro Cys Gln His Gly Gly Ser
1125 1130 1135
Cys Ile Asp Leu Val Ala Arg Tyr Leu Cys Ser Cys Pro Pro Gly Thr
1140 1145 1150
Leu Gly Val Leu Cys Glu Ile Asn Glu Asp Asp Cys Gly Pro Gly Pro
1155 1160 1165
Pro Leu Asp Ser Gly Pro Arg Cys Leu His Asn Gly Thr Cys Val Asp
1170 1175 1180
Leu Val Gly Gly Phe Arg Cys Thr Cys Pro Pro Gly Tyr Thr Gly Leu
1185 1190 1195 1200
Arg Cys Glu Ala Asp Ile Asn Glu Cys Arg Ser Gly Ala Cys His Ala
1205 1210 1215
Ala His Thr Arg Asp Cys Leu Gln Asp Pro Gly Gly Gly Phe Arg Cys
1220 1225 1230
Leu Cys His Ala Gly Phe Ser Gly Pro Arg Cys Gln Thr Val Leu Ser
1235 1240 1245
Pro Cys Glu Ser Gln Pro Cys Gln His Gly Gly Gln Cys Arg Pro Ser
1250 1255 1260
Pro Gly Pro Gly Gly Gly Leu Thr Phe Thr Cys His Cys Ala Gln Pro
1265 1270 1275 1280
Phe Trp Gly Pro Arg Cys Glu Arg Val Ala Arg Ser Cys Arg Glu Leu
1285 1290 1295
Gln Cys Pro Val Gly Val Pro Cys Gln Gln Thr Pro Arg Gly Pro Arg
1300 1305 1310
Cys Ala Cys Pro Pro Gly Leu Ser Gly Pro Ser Cys Arg Ser Phe Pro
1315 1320 1325
Gly Ser Pro Pro Gly Ala Ser Asn Ala Ser Cys Ala Ala Ala Pro Cys
1330 1335 1340
Leu His Gly Gly Ser Cys Arg Pro Ala Pro Leu Ala Pro Phe Phe Arg
1345 1350 1355 1360
Cys Ala Cys Ala Gln Gly Trp Thr Gly Pro Arg Cys Glu Ala Pro Ala
1365 1370 1375
Ala Ala Pro Glu Val Ser Glu Glu Pro Arg Cys Pro Arg Ala Ala Cys
1380 1385 1390
Gln Ala Lys Arg Gly Asp Gln Arg Cys Asp Arg Glu Cys Asn Ser Pro
1395 1400 1405
Gly Cys Gly Trp Asp Gly Gly Asp Cys Ser Leu Ser Val Gly Asp Pro
1410 1415 1420
Trp Arg Gln Cys Glu Ala Leu Gln Cys Trp Arg Leu Phe Asn Asn Ser
1425 1430 1435 1440
Arg Cys Asp Pro Ala Cys Ser Ser Pro Ala Cys Leu Tyr Asp Asn Phe
1445 1450 1455
Asp Cys His Ala Gly Gly Arg Glu Arg Thr Cys Asn Pro Val Tyr Glu
1460 1465 1470
Lys Tyr Cys Ala Asp His Phe Ala Asp Gly Arg Cys Asp Gln Gly Cys
1475 1480 1485
Asn Thr Glu Glu Cys Gly Trp Asp Gly Leu Asp Cys Ala Ser Glu Val
1490 1495 1500
Pro Ala Leu Leu Ala Arg Gly Val Leu Val Leu Thr Val Leu Leu Pro
1505 1510 1515 1520
Pro Glu Glu Leu Leu Arg Ser Ser Ala Asp Phe Leu Gln Arg Leu Ser
1525 1530 1535
Ala Ile Leu Arg Thr Ser Leu Arg Phe Arg Leu Asp Ala His Gly Gln
1540 1545 1550
Ala Met Val Phe Pro Tyr His Arg Pro Ser Pro Gly Ser Glu Pro Arg
1555 1560 1565
Ala Arg Arg Glu Leu Ala Pro Glu Val Ile Gly Ser Val Val Met Leu
1570 1575 1580
Glu Ile Asp Asn Arg Leu Cys Leu Gln Ser Pro Glu Asn Asp His Cys
1585 1590 1595 1600
Phe Pro Asp Ala Gln Ser Ala Ala Asp Tyr Leu Gly Ala Leu Ser Ala
1605 1610 1615
Val Glu Arg Leu Asp Phe Pro Tyr Pro Leu Arg Asp Val Arg Gly Glu
1620 1625 1630
Pro Leu Glu Pro Pro Glu Pro Ser Val Pro Leu Leu Pro Leu Leu Val
1635 1640 1645
Ala Gly Ala Val Leu Leu Leu Val Ile Leu Val Leu Gly Val Met Val
1650 1655 1660
Ala Arg Arg Lys Arg Glu His Ser Thr Leu Trp Phe Pro Glu Gly Phe
1665 1670 1675 1680
Ser Leu His Lys Asp Val Ala Ser Gly His Lys Gly Arg Arg Glu Pro
1685 1690 1695
Val Gly Gln Asp Ala Leu Gly Met Lys Asn Met Ala Lys Gly Glu Ser
1700 1705 1710
Leu Met Gly Glu Val Ala Thr Asp Trp Met Asp Thr Glu Cys Pro Glu
1715 1720 1725
Ala Lys Arg Leu Lys Val Glu Glu Pro Gly Met Gly Ala Glu Glu Ala
1730 1735 1740
Val Asp Cys Arg Gln Trp Thr Gln His His Leu Val Ala Ala Asp Ile
1745 1750 1755 1760
Arg Val Ala Pro Ala Met Ala Leu Thr Pro Pro Gln Gly Asp Ala Asp
1765 1770 1775
Ala Asp Gly Met Asp Val Asn Val Arg Gly Pro Asp Gly Phe Thr Pro
1780 1785 1790
Leu Met Leu Ala Ser Phe Cys Gly Gly Ala Leu Glu Pro Met Pro Thr
1795 1800 1805
Glu Glu Asp Glu Ala Asp Asp Thr Ser Ala Ser Ile Ile Ser Asp Leu
1810 1815 1820
Ile Cys Gln Gly Ala Gln Leu Gly Ala Arg Thr Asp Arg Thr Gly Glu
1825 1830 1835 1840
Thr Ala Leu His Leu Ala Ala Arg Tyr Ala Arg Ala Asp Ala Ala Lys
1845 1850 1855
Arg Leu Leu Asp Ala Gly Ala Asp Thr Asn Ala Gln Asp His Ser Gly
1860 1865 1870
Arg Thr Pro Leu His Thr Ala Val Thr Ala Asp Ala Gln Gly Val Phe
1875 1880 1885
Gln Ile Leu Ile Arg Asn Arg Ser Thr Asp Leu Asp Ala Arg Met Ala
1890 1895 1900
Asp Gly Ser Thr Ala Leu Ile Leu Ala Ala Arg Leu Ala Val Glu Gly
1905 1910 1915 1920
Met Val Glu Glu Leu Ile Ala Ser His Ala Asp Val Asn Ala Val Asp
1925 1930 1935
Glu Leu Gly Lys Ser Ala Leu His Trp Ala Ala Ala Val Asn Asn Val
1940 1945 1950
Glu Ala Thr Leu Ala Leu Leu Lys Asn Gly Ala Asn Lys Asp Met Gln
1955 1960 1965
Asp Ser Lys Glu Glu Thr Pro Leu Phe Leu Ala Ala Arg Glu Gly Ser
1970 1975 1980
Tyr Glu Ala Ala Lys Leu Leu Leu Asp His Phe Ala Asn Arg Glu Ile
1985 1990 1995 2000
Thr Asp His Leu Asp Arg Leu Pro Arg Asp Val Ala Gln Glu Arg Leu
2005 2010 2015
His Gln Asp Ile Val Arg Leu Leu Asp Gln Pro Ser Gly Pro Arg Ser
2020 2025 2030
Pro Pro Gly Pro His Gly Leu Gly Pro Leu Leu Cys Pro Pro Gly Ala
2035 2040 2045
Phe Leu Pro Gly Leu Lys Ala Ala Gln Ser Gly Ser Lys Lys Ser Arg
2050 2055 2060
Arg Pro Pro Gly Lys Ala Gly Leu Gly Pro Gln Gly Pro Arg Gly Arg
2065 2070 2075 2080
Gly Lys Lys Leu Thr Leu Ala Cys Pro Gly Pro Leu Ala Asp Ser Ser
2085 2090 2095
Val Thr Leu Ser Pro Val Asp Ser Leu Asp Ser Pro Arg Pro Phe Gly
2100 2105 2110
Gly Pro Pro Ala Ser Pro Gly Gly Phe Pro Leu Glu Gly Pro Tyr Ala
2115 2120 2125
Ala Ala Thr Ala Thr Ala Val Ser Leu Ala Gln Leu Gly Gly Pro Gly
2130 2135 2140
Arg Ala Gly Leu Gly Arg Gln Pro Pro Gly Gly Cys Val Leu Ser Leu
2145 2150 2155 2160
Gly Leu Leu Asn Pro Val Ala Val Pro Leu Asp Trp Ala Arg Leu Pro
2165 2170 2175
Pro Pro Ala Pro Pro Gly Pro Ser Phe Leu Leu Pro Leu Ala Pro Gly
2180 2185 2190
Pro Gln Leu Leu Asn Pro Gly Thr Pro Val Ser Pro Gln Glu Arg Pro
2195 2200 2205
Pro Pro Tyr Leu Ala Val Pro Gly His Gly Glu Glu Tyr Pro Ala Ala
2210 2215 2220
Gly Ala His Ser Ser Pro Pro Lys Ala Arg Phe Leu Arg Val Pro Ser
2225 2230 2235 2240
Glu His Pro Tyr Leu Thr Pro Ser Pro Glu Ser Pro Glu His Trp Ala
2245 2250 2255
Ser Pro Ser Pro Pro Ser Leu Ser Asp Trp Ser Glu Ser Thr Pro Ser
2260 2265 2270
Pro Ala Thr Ala Thr Gly Ala Met Ala Thr Thr Thr Gly Ala Leu Pro
2275 2280 2285
Ala Gln Pro Leu Pro Leu Ser Val Pro Ser Ser Leu Ala Gln Ala Gln
2290 2295 2300
Thr Gln Leu Gly Pro Gln Pro Glu Val Thr Pro Lys Arg Gln Val Leu
2305 2310 2315 2320
Ala
<210> 10
<211> 2003
<212> PRT
<213> Homo sapiens
<400> 10
Met Gln Pro Pro Ser Leu Leu Leu Leu Leu Leu Leu Leu Leu Leu Leu
1 5 10 15
Cys Val Ser Val Val Arg Pro Arg Gly Leu Leu Cys Gly Ser Phe Pro
20 25 30
Glu Pro Cys Ala Asn Gly Gly Thr Cys Leu Ser Leu Ser Leu Gly Gln
35 40 45
Gly Thr Cys Gln Cys Ala Pro Gly Phe Leu Gly Glu Thr Cys Gln Phe
50 55 60
Pro Asp Pro Cys Gln Asn Ala Gln Leu Cys Gln Asn Gly Gly Ser Cys
65 70 75 80
Gln Ala Leu Leu Pro Ala Pro Leu Gly Leu Pro Ser Ser Pro Ser Pro
85 90 95
Leu Thr Pro Ser Phe Leu Cys Thr Cys Leu Pro Gly Phe Thr Gly Glu
100 105 110
Arg Cys Gln Ala Lys Leu Glu Asp Pro Cys Pro Pro Ser Phe Cys Ser
115 120 125
Lys Arg Gly Arg Cys His Ile Gln Ala Ser Gly Arg Pro Gln Cys Ser
130 135 140
Cys Met Pro Gly Trp Thr Gly Glu Gln Cys Gln Leu Arg Asp Phe Cys
145 150 155 160
Ser Ala Asn Pro Cys Val Asn Gly Gly Val Cys Leu Ala Thr Tyr Pro
165 170 175
Gln Ile Gln Cys His Cys Pro Pro Gly Phe Glu Gly His Ala Cys Glu
180 185 190
Arg Asp Val Asn Glu Cys Phe Gln Asp Pro Gly Pro Cys Pro Lys Gly
195 200 205
Thr Ser Cys His Asn Thr Leu Gly Ser Phe Gln Cys Leu Cys Pro Val
210 215 220
Gly Gln Glu Gly Pro Arg Cys Glu Leu Arg Ala Gly Pro Cys Pro Pro
225 230 235 240
Arg Gly Cys Ser Asn Gly Gly Thr Cys Gln Leu Met Pro Glu Lys Asp
245 250 255
Ser Thr Phe His Leu Cys Leu Cys Pro Pro Gly Phe Ile Gly Pro Asp
260 265 270
Cys Glu Val Asn Pro Asp Asn Cys Val Ser His Gln Cys Gln Asn Gly
275 280 285
Gly Thr Cys Gln Asp Gly Leu Asp Thr Tyr Thr Cys Leu Cys Pro Glu
290 295 300
Thr Trp Thr Gly Trp Asp Cys Ser Glu Asp Val Asp Glu Cys Glu Thr
305 310 315 320
Gln Gly Pro Pro His Cys Arg Asn Gly Gly Thr Cys Gln Asn Ser Ala
325 330 335
Gly Ser Phe His Cys Val Cys Val Ser Gly Trp Gly Gly Thr Ser Cys
340 345 350
Glu Glu Asn Leu Asp Asp Cys Ile Ala Ala Thr Cys Ala Pro Gly Ser
355 360 365
Thr Cys Ile Asp Arg Val Gly Ser Phe Ser Cys Leu Cys Pro Pro Gly
370 375 380
Arg Thr Gly Leu Leu Cys His Leu Glu Asp Met Cys Leu Ser Gln Pro
385 390 395 400
Cys His Gly Asp Ala Gln Cys Ser Thr Asn Pro Leu Thr Gly Ser Thr
405 410 415
Leu Cys Leu Cys Gln Pro Gly Tyr Ser Gly Pro Thr Cys His Gln Asp
420 425 430
Leu Asp Glu Cys Leu Met Ala Gln Gln Gly Pro Ser Pro Cys Glu His
435 440 445
Gly Gly Ser Cys Leu Asn Thr Pro Gly Ser Phe Asn Cys Leu Cys Pro
450 455 460
Pro Gly Tyr Thr Gly Ser Arg Cys Glu Ala Asp His Asn Glu Cys Leu
465 470 475 480
Ser Gln Pro Cys His Pro Gly Ser Thr Cys Leu Asp Leu Leu Ala Thr
485 490 495
Phe His Cys Leu Cys Pro Pro Gly Leu Glu Gly Gln Leu Cys Glu Val
500 505 510
Glu Thr Asn Glu Cys Ala Ser Ala Pro Cys Leu Asn His Ala Asp Cys
515 520 525
His Asp Leu Leu Asn Gly Phe Gln Cys Ile Cys Leu Pro Gly Phe Ser
530 535 540
Gly Thr Arg Cys Glu Glu Asp Ile Asp Glu Cys Arg Ser Ser Pro Cys
545 550 555 560
Ala Asn Gly Gly Gln Cys Gln Asp Gln Pro Gly Ala Phe His Cys Lys
565 570 575
Cys Leu Pro Gly Phe Glu Gly Pro Arg Cys Gln Thr Glu Val Asp Glu
580 585 590
Cys Leu Ser Asp Pro Cys Pro Val Gly Ala Ser Cys Leu Asp Leu Pro
595 600 605
Gly Ala Phe Phe Cys Leu Cys Pro Ser Gly Phe Thr Gly Gln Leu Cys
610 615 620
Glu Val Pro Leu Cys Ala Pro Asn Leu Cys Gln Pro Lys Gln Ile Cys
625 630 635 640
Lys Asp Gln Lys Asp Lys Ala Asn Cys Leu Cys Pro Asp Gly Ser Pro
645 650 655
Gly Cys Ala Pro Pro Glu Asp Asn Cys Thr Cys His His Gly His Cys
660 665 670
Gln Arg Ser Ser Cys Val Cys Asp Val Gly Trp Thr Gly Pro Glu Cys
675 680 685
Glu Ala Glu Leu Gly Gly Cys Ile Ser Ala Pro Cys Ala His Gly Gly
690 695 700
Thr Cys Tyr Pro Gln Pro Ser Gly Tyr Asn Cys Thr Cys Pro Thr Gly
705 710 715 720
Tyr Thr Gly Pro Thr Cys Ser Glu Glu Met Thr Ala Cys His Ser Gly
725 730 735
Pro Cys Leu Asn Gly Gly Ser Cys Asn Pro Ser Pro Gly Gly Tyr Tyr
740 745 750
Cys Thr Cys Pro Pro Ser His Thr Gly Pro Gln Cys Gln Thr Ser Thr
755 760 765
Asp Tyr Cys Val Ser Ala Pro Cys Phe Asn Gly Gly Thr Cys Val Asn
770 775 780
Arg Pro Gly Thr Phe Ser Cys Leu Cys Ala Met Gly Phe Gln Gly Pro
785 790 795 800
Arg Cys Glu Gly Lys Leu Arg Pro Ser Cys Ala Asp Ser Pro Cys Arg
805 810 815
Asn Arg Ala Thr Cys Gln Asp Ser Pro Gln Gly Pro Arg Cys Leu Cys
820 825 830
Pro Thr Gly Tyr Thr Gly Gly Ser Cys Gln Thr Leu Met Asp Leu Cys
835 840 845
Ala Gln Lys Pro Cys Pro Arg Asn Ser His Cys Leu Gln Thr Gly Pro
850 855 860
Ser Phe His Cys Leu Cys Leu Gln Gly Trp Thr Gly Pro Leu Cys Asn
865 870 875 880
Leu Pro Leu Ser Ser Cys Gln Lys Ala Ala Leu Ser Gln Gly Ile Asp
885 890 895
Val Ser Ser Leu Cys His Asn Gly Gly Leu Cys Val Asp Ser Gly Pro
900 905 910
Ser Tyr Phe Cys His Cys Pro Pro Gly Phe Gln Gly Ser Leu Cys Gln
915 920 925
Asp His Val Asn Pro Cys Glu Ser Arg Pro Cys Gln Asn Gly Ala Thr
930 935 940
Cys Met Ala Gln Pro Ser Gly Tyr Leu Cys Gln Cys Ala Pro Gly Tyr
945 950 955 960
Asp Gly Gln Asn Cys Ser Lys Glu Leu Asp Ala Cys Gln Ser Gln Pro
965 970 975
Cys His Asn His Gly Thr Cys Thr Pro Lys Pro Gly Gly Phe His Cys
980 985 990
Ala Cys Pro Pro Gly Phe Val Gly Leu Arg Cys Glu Gly Asp Val Asp
995 1000 1005
Glu Cys Leu Asp Gln Pro Cys His Pro Thr Gly Thr Ala Ala Cys His
1010 1015 1020
Ser Leu Ala Asn Ala Phe Tyr Cys Gln Cys Leu Pro Gly His Thr Gly
1025 1030 1035 1040
Gln Trp Cys Glu Val Glu Ile Asp Pro Cys His Ser Gln Pro Cys Phe
1045 1050 1055
His Gly Gly Thr Cys Glu Ala Thr Ala Gly Ser Pro Leu Gly Phe Ile
1060 1065 1070
Cys His Cys Pro Lys Gly Phe Glu Gly Pro Thr Cys Ser His Arg Ala
1075 1080 1085
Pro Ser Cys Gly Phe His His Cys His His Gly Gly Leu Cys Leu Pro
1090 1095 1100
Ser Pro Lys Pro Gly Phe Pro Pro Arg Cys Ala Cys Leu Ser Gly Tyr
1105 1110 1115 1120
Gly Gly Pro Asp Cys Leu Thr Pro Pro Ala Pro Lys Gly Cys Gly Pro
1125 1130 1135
Pro Ser Pro Cys Leu Tyr Asn Gly Ser Cys Ser Glu Thr Thr Gly Leu
1140 1145 1150
Gly Gly Pro Gly Phe Arg Cys Ser Cys Pro His Ser Ser Pro Gly Pro
1155 1160 1165
Arg Cys Gln Lys Pro Gly Ala Lys Gly Cys Glu Gly Arg Ser Gly Asp
1170 1175 1180
Gly Ala Cys Asp Ala Gly Cys Ser Gly Pro Gly Gly Asn Trp Asp Gly
1185 1190 1195 1200
Gly Asp Cys Ser Leu Gly Val Pro Asp Pro Trp Lys Gly Cys Pro Ser
1205 1210 1215
His Ser Arg Cys Trp Leu Leu Phe Arg Asp Gly Gln Cys His Pro Gln
1220 1225 1230
Cys Asp Ser Glu Glu Cys Leu Phe Asp Gly Tyr Asp Cys Glu Thr Pro
1235 1240 1245
Pro Ala Cys Thr Pro Ala Tyr Asp Gln Tyr Cys His Asp His Phe His
1250 1255 1260
Asn Gly His Cys Glu Lys Gly Cys Asn Thr Ala Glu Cys Gly Trp Asp
1265 1270 1275 1280
Gly Gly Asp Cys Arg Pro Glu Asp Gly Asp Pro Glu Trp Gly Pro Ser
1285 1290 1295
Leu Ala Leu Leu Val Val Leu Ser Pro Pro Ala Leu Asp Gln Gln Leu
1300 1305 1310
Phe Ala Leu Ala Arg Val Leu Ser Leu Thr Leu Arg Val Gly Leu Trp
1315 1320 1325
Val Arg Lys Asp Arg Asp Gly Arg Asp Met Val Tyr Pro Tyr Pro Gly
1330 1335 1340
Ala Arg Ala Glu Glu Lys Leu Gly Gly Thr Arg Asp Pro Thr Tyr Gln
1345 1350 1355 1360
Glu Arg Ala Ala Pro Gln Thr Gln Pro Leu Gly Lys Glu Thr Asp Ser
1365 1370 1375
Leu Ser Ala Gly Phe Val Val Val Met Gly Val Asp Leu Ser Arg Cys
1380 1385 1390
Gly Pro Asp His Pro Ala Ser Arg Cys Pro Trp Asp Pro Gly Leu Leu
1395 1400 1405
Leu Arg Phe Leu Ala Ala Met Ala Ala Val Gly Ala Leu Glu Pro Leu
1410 1415 1420
Leu Pro Gly Pro Leu Leu Ala Val His Pro His Ala Gly Thr Ala Pro
1425 1430 1435 1440
Pro Ala Asn Gln Leu Pro Trp Pro Val Leu Cys Ser Pro Val Ala Gly
1445 1450 1455
Val Ile Leu Leu Ala Leu Gly Ala Leu Leu Val Leu Gln Leu Ile Arg
1460 1465 1470
Arg Arg Arg Arg Glu His Gly Ala Leu Trp Leu Pro Pro Gly Phe Thr
1475 1480 1485
Arg Arg Pro Arg Thr Gln Ser Ala Pro His Arg Arg Arg Pro Pro Leu
1490 1495 1500
Gly Glu Asp Ser Ile Gly Leu Lys Ala Leu Lys Pro Lys Ala Glu Val
1505 1510 1515 1520
Asp Glu Asp Gly Val Val Met Cys Ser Gly Pro Glu Glu Gly Glu Glu
1525 1530 1535
Val Gly Gln Ala Glu Glu Thr Gly Pro Pro Ser Thr Cys Gln Leu Trp
1540 1545 1550
Ser Leu Ser Gly Gly Cys Gly Ala Leu Pro Gln Ala Ala Met Leu Thr
1555 1560 1565
Pro Pro Gln Glu Ser Glu Met Glu Ala Pro Asp Leu Asp Thr Arg Gly
1570 1575 1580
Pro Asp Gly Val Thr Pro Leu Met Ser Ala Val Cys Cys Gly Glu Val
1585 1590 1595 1600
Gln Ser Gly Thr Phe Gln Gly Ala Trp Leu Gly Cys Pro Glu Pro Trp
1605 1610 1615
Glu Pro Leu Leu Asp Gly Gly Ala Cys Pro Gln Ala His Thr Val Gly
1620 1625 1630
Thr Gly Glu Thr Pro Leu His Leu Ala Ala Arg Phe Ser Arg Pro Thr
1635 1640 1645
Ala Ala Arg Arg Leu Leu Glu Ala Gly Ala Asn Pro Asn Gln Pro Asp
1650 1655 1660
Arg Ala Gly Arg Thr Pro Leu His Ala Ala Val Ala Ala Asp Ala Arg
1665 1670 1675 1680
Glu Val Cys Gln Leu Leu Leu Arg Ser Arg Gln Thr Ala Val Asp Ala
1685 1690 1695
Arg Thr Glu Asp Gly Thr Thr Pro Leu Met Leu Ala Ala Arg Leu Ala
1700 1705 1710
Val Glu Asp Leu Val Glu Glu Leu Ile Ala Ala Gln Ala Asp Val Gly
1715 1720 1725
Ala Arg Asp Lys Trp Gly Lys Thr Ala Leu His Trp Ala Ala Ala Val
1730 1735 1740
Asn Asn Ala Arg Ala Ala Arg Ser Leu Leu Gln Ala Gly Ala Asp Lys
1745 1750 1755 1760
Asp Ala Gln Asp Asn Arg Glu Gln Thr Pro Leu Phe Leu Ala Ala Arg
1765 1770 1775
Glu Gly Ala Val Glu Val Ala Gln Leu Leu Leu Gly Leu Gly Ala Ala
1780 1785 1790
Arg Glu Leu Arg Asp Gln Ala Gly Leu Ala Pro Ala Asp Val Ala His
1795 1800 1805
Gln Arg Asn His Trp Asp Leu Leu Thr Leu Leu Glu Gly Ala Gly Pro
1810 1815 1820
Pro Glu Ala Arg His Lys Ala Thr Pro Gly Arg Glu Ala Gly Pro Phe
1825 1830 1835 1840
Pro Arg Ala Arg Thr Val Ser Val Ser Val Pro Pro His Gly Gly Gly
1845 1850 1855
Ala Leu Pro Arg Cys Arg Thr Leu Ser Ala Gly Ala Gly Pro Arg Gly
1860 1865 1870
Gly Gly Ala Cys Leu Gln Ala Arg Thr Trp Ser Val Asp Leu Ala Ala
1875 1880 1885
Arg Gly Gly Gly Ala Tyr Ser His Cys Arg Ser Leu Ser Gly Val Gly
1890 1895 1900
Ala Gly Gly Gly Pro Thr Pro Arg Gly Arg Arg Phe Ser Ala Gly Met
1905 1910 1915 1920
Arg Gly Pro Arg Pro Asn Pro Ala Ile Met Arg Gly Arg Tyr Gly Val
1925 1930 1935
Ala Ala Gly Arg Gly Gly Arg Val Ser Thr Asp Asp Trp Pro Cys Asp
1940 1945 1950
Trp Val Ala Leu Gly Ala Cys Gly Ser Ala Ser Asn Ile Pro Ile Pro
1955 1960 1965
Pro Pro Cys Leu Thr Pro Ser Pro Glu Arg Gly Ser Pro Gln Leu Asp
1970 1975 1980
Cys Gly Pro Pro Ala Leu Gln Glu Met Pro Ile Asn Gln Gly Gly Glu
1985 1990 1995 2000
Gly Lys Lys
<210> 11
<211> 2470
<212> PRT
<213> Mus musculus
<400> 11
Met Pro Asp Leu Arg Pro Ala Ala Leu Arg Ala Leu Leu Trp Leu Trp
1 5 10 15
Leu Cys Gly Ala Gly Pro Ala His Ala Leu Gln Cys Arg Gly Gly Gln
20 25 30
Glu Pro Cys Val Asn Glu Gly Thr Cys Val Thr Tyr His Asn Gly Thr
35 40 45
Gly Phe Cys Arg Cys Pro Glu Gly Phe Leu Gly Glu Tyr Cys Gln His
50 55 60
Arg Asp Pro Cys Glu Lys Asn Arg Cys Gln Asn Gly Gly Thr Cys Val
65 70 75 80
Pro Gln Gly Met Leu Gly Lys Ala Thr Cys Arg Cys Ala Pro Gly Phe
85 90 95
Thr Gly Glu Asp Cys Gln Tyr Ser Thr Ser His Pro Cys Phe Val Ser
100 105 110
Arg Pro Cys Gln Asn Gly Gly Thr Cys His Met Leu Ser Arg Asp Thr
115 120 125
Tyr Glu Cys Thr Cys Gln Val Gly Phe Thr Gly Lys Gln Cys Gln Trp
130 135 140
Thr Asp Ala Cys Leu Ser His Pro Cys Glu Asn Gly Ser Thr Cys Thr
145 150 155 160
Ser Val Ala Ser Gln Phe Ser Cys Lys Cys Pro Ala Gly Leu Thr Gly
165 170 175
Gln Lys Cys Glu Ala Asp Ile Asn Glu Cys Asp Ile Pro Gly Arg Cys
180 185 190
Gln His Gly Gly Thr Cys Leu Asn Leu Pro Gly Ser Tyr Arg Cys Gln
195 200 205
Cys Gly Gln Gly Phe Thr Gly Gln His Cys Asp Ser Pro Tyr Val Arg
210 215 220
Gly Leu Pro Cys Val Asn Gly Gly Thr Cys Arg Gln Thr Gly Asp Phe
225 230 235 240
Thr Leu Glu Cys Asn Cys Leu Pro Gly Phe Glu Gly Ser Thr Cys Glu
245 250 255
Arg Asn Ile Asp Asp Cys Pro Asn His Lys Cys Gln Asn Gly Gly Val
260 265 270
Cys Val Asp Gly Val Asn Thr Tyr Asn Cys Arg Cys Pro Pro Gln Trp
275 280 285
Thr Gly Gln Phe Cys Thr Glu Asp Val Asp Glu Cys Leu Leu Gln Pro
290 295 300
Asn Ala Cys Gln Asn Gly Gly Thr Cys Thr Asn Arg Asn Gly Gly Tyr
305 310 315 320
Gly Cys Val Cys Val Asn Gly Trp Ser Gly Asp Asp Cys Ser Glu Asn
325 330 335
Ile Asp Asp Cys Ala Tyr Ala Ser Cys Thr Pro Gly Ser Thr Cys Ile
340 345 350
Asp Arg Val Ala Ser Phe Ser Cys Leu Cys Pro Glu Gly Lys Ala Gly
355 360 365
Leu Leu Cys His Leu Asp Asp Ala Cys Ile Ser Asn Pro Cys His Lys
370 375 380
Gly Ala Leu Cys Asp Thr Asn Pro Leu Asn Gly Gln Tyr Ile Cys Thr
385 390 395 400
Cys Pro Gln Gly Tyr Lys Gly Ala Asp Cys Thr Glu Asp Val Asp Glu
405 410 415
Cys Ala Met Ala Asn Ser Asn Pro Cys Glu His Ala Gly Lys Cys Val
420 425 430
Asn Thr Asp Gly Ala Phe His Cys Glu Cys Leu Lys Gly Tyr Ala Gly
435 440 445
Pro Arg Cys Glu Met Asp Ile Asn Glu Cys His Ser Asp Pro Cys Gln
450 455 460
Asn Asp Ala Thr Cys Leu Asp Lys Ile Gly Gly Phe Thr Cys Leu Cys
465 470 475 480
Met Pro Gly Phe Lys Gly Val His Cys Glu Leu Glu Val Asn Glu Cys
485 490 495
Gln Ser Asn Pro Cys Val Asn Asn Gly Gln Cys Val Asp Lys Val Asn
500 505 510
Arg Phe Gln Cys Leu Cys Pro Pro Gly Phe Thr Gly Pro Val Cys Gln
515 520 525
Ile Asp Ile Asp Asp Cys Ser Ser Thr Pro Cys Leu Asn Gly Ala Lys
530 535 540
Cys Ile Asp His Pro Asn Gly Tyr Glu Cys Gln Cys Ala Thr Gly Phe
545 550 555 560
Thr Gly Ile Leu Cys Asp Glu Asn Ile Asp Asn Cys Asp Pro Asp Pro
565 570 575
Cys His His Gly Gln Cys Gln Asp Gly Ile Asp Ser Tyr Thr Cys Ile
580 585 590
Cys Asn Pro Gly Tyr Met Gly Ala Ile Cys Ser Asp Gln Ile Asp Glu
595 600 605
Cys Tyr Ser Ser Pro Cys Leu Asn Asp Gly Arg Cys Ile Asp Leu Val
610 615 620
Asn Gly Tyr Gln Cys Asn Cys Gln Pro Gly Thr Ser Gly Leu Asn Cys
625 630 635 640
Glu Ile Asn Phe Asp Asp Cys Ala Ser Asn Pro Cys Met His Gly Val
645 650 655
Cys Val Asp Gly Ile Asn Arg Tyr Ser Cys Val Cys Ser Pro Gly Phe
660 665 670
Thr Gly Gln Arg Cys Asn Ile Asp Ile Asp Glu Cys Ala Ser Asn Pro
675 680 685
Cys Arg Lys Gly Ala Thr Cys Ile Asn Asp Val Asn Gly Phe Arg Cys
690 695 700
Ile Cys Pro Glu Gly Pro His His Pro Ser Cys Tyr Ser Gln Val Asn
705 710 715 720
Glu Cys Leu Ser Asn Pro Cys Ile His Gly Asn Cys Thr Gly Gly Leu
725 730 735
Ser Gly Tyr Lys Cys Leu Cys Asp Ala Gly Trp Val Gly Val Asn Cys
740 745 750
Glu Val Asp Lys Asn Glu Cys Leu Ser Asn Pro Cys Gln Asn Gly Gly
755 760 765
Thr Cys Asn Asn Leu Val Asn Gly Tyr Arg Cys Thr Cys Lys Lys Gly
770 775 780
Phe Lys Gly Tyr Asn Cys Gln Val Asn Ile Asp Glu Cys Ala Ser Asn
785 790 795 800
Pro Cys Leu Asn Gln Gly Thr Cys Phe Asp Asp Val Ser Gly Tyr Thr
805 810 815
Cys His Cys Met Leu Pro Tyr Thr Gly Lys Asn Cys Gln Thr Val Leu
820 825 830
Ala Pro Cys Ser Pro Asn Pro Cys Glu Asn Ala Ala Val Cys Lys Glu
835 840 845
Ala Pro Asn Phe Glu Ser Phe Ser Cys Leu Cys Ala Pro Gly Trp Gln
850 855 860
Gly Lys Arg Cys Thr Val Asp Val Asp Glu Cys Ile Ser Lys Pro Cys
865 870 875 880
Met Asn Asn Gly Val Cys His Asn Thr Gln Gly Ser Tyr Val Cys Glu
885 890 895
Cys Pro Pro Gly Phe Ser Gly Met Asp Cys Glu Glu Asp Ile Asn Asp
900 905 910
Cys Leu Ala Asn Pro Cys Gln Asn Gly Gly Ser Cys Val Asp His Val
915 920 925
Asn Thr Phe Ser Cys Gln Cys His Pro Gly Phe Ile Gly Asp Lys Cys
930 935 940
Gln Thr Asp Met Asn Glu Cys Leu Ser Glu Pro Cys Lys Asn Gly Gly
945 950 955 960
Thr Cys Ser Asp Tyr Val Asn Ser Tyr Thr Cys Thr Cys Pro Ala Gly
965 970 975
Phe His Gly Val His Cys Glu Asn Asn Ile Asp Glu Cys Thr Glu Ser
980 985 990
Ser Cys Phe Asn Gly Gly Thr Cys Val Asp Gly Ile Asn Ser Phe Ser
995 1000 1005
Cys Leu Cys Pro Val Gly Phe Thr Gly Pro Phe Cys Leu His Asp Ile
1010 1015 1020
Asn Glu Cys Ser Ser Asn Pro Cys Leu Asn Ala Gly Thr Cys Val Asp
1025 1030 1035 1040
Gly Leu Gly Thr Tyr Arg Cys Ile Cys Pro Leu Gly Tyr Thr Gly Lys
1045 1050 1055
Asn Cys Gln Thr Leu Val Asn Leu Cys Ser Arg Ser Pro Cys Lys Asn
1060 1065 1070
Lys Gly Thr Cys Val Gln Glu Lys Ala Arg Pro His Cys Leu Cys Pro
1075 1080 1085
Pro Gly Trp Asp Gly Ala Tyr Cys Asp Val Leu Asn Val Ser Cys Lys
1090 1095 1100
Ala Ala Ala Leu Gln Lys Gly Val Pro Val Glu His Leu Cys Gln His
1105 1110 1115 1120
Ser Gly Ile Cys Ile Asn Ala Gly Asn Thr His His Cys Gln Cys Pro
1125 1130 1135
Leu Gly Tyr Thr Gly Ser Tyr Cys Glu Glu Gln Leu Asp Glu Cys Ala
1140 1145 1150
Ser Asn Pro Cys Gln His Gly Ala Thr Cys Asn Asp Phe Ile Gly Gly
1155 1160 1165
Tyr Arg Cys Glu Cys Val Pro Gly Tyr Gln Gly Val Asn Cys Glu Tyr
1170 1175 1180
Glu Val Asp Glu Cys Gln Asn Gln Pro Cys Gln Asn Gly Gly Thr Cys
1185 1190 1195 1200
Ile Asp Leu Val Asn His Phe Lys Cys Ser Cys Pro Pro Gly Thr Arg
1205 1210 1215
Gly Leu Leu Cys Glu Glu Asn Ile Asp Glu Cys Ala Gly Gly Pro His
1220 1225 1230
Cys Leu Asn Gly Gly Gln Cys Val Asp Arg Ile Gly Gly Tyr Thr Cys
1235 1240 1245
Arg Cys Leu Pro Gly Phe Ala Gly Glu Arg Cys Glu Gly Asp Ile Asn
1250 1255 1260
Glu Cys Leu Ser Asn Pro Cys Ser Ser Glu Gly Ser Leu Asp Cys Val
1265 1270 1275 1280
Gln Leu Lys Asn Asn Tyr Asn Cys Ile Cys Arg Ser Ala Phe Thr Gly
1285 1290 1295
Arg His Cys Glu Thr Phe Leu Asp Val Cys Pro Gln Lys Pro Cys Leu
1300 1305 1310
Asn Gly Gly Thr Cys Ala Val Ala Ser Asn Met Pro Asp Gly Phe Ile
1315 1320 1325
Cys Arg Cys Pro Pro Gly Phe Ser Gly Ala Arg Leu Gln Ser Ser Cys
1330 1335 1340
Gly Gln Val Lys Cys Arg Arg Gly Glu Gln Cys Ile His Thr Asp Ser
1345 1350 1355 1360
Gly Pro Arg Cys Phe Cys Leu Asn Pro Lys Asp Cys Glu Ser Gly Cys
1365 1370 1375
Ala Ser Asn Pro Cys Gln His Gly Gly Thr Cys Tyr Pro Gln Arg Gln
1380 1385 1390
Pro Pro His Tyr Ser Cys Arg Cys Pro Pro Ser Phe Gly Gly Ser His
1395 1400 1405
Cys Glu Leu Tyr Thr Ala Pro Thr Ser Thr Pro Pro Ala Thr Cys Gln
1410 1415 1420
Ser Gln Tyr Cys Ala Asp Lys Ala Arg Asp Gly Ile Cys Asp Glu Ala
1425 1430 1435 1440
Cys Asn Ser His Ala Cys Gln Trp Asp Gly Gly Asp Cys Ser Leu Thr
1445 1450 1455
Met Glu Asp Pro Trp Ala Asn Cys Thr Ser Thr Leu Arg Cys Trp Glu
1460 1465 1470
Tyr Ile Asn Asn Gln Cys Asp Glu Gln Cys Asn Thr Ala Glu Cys Leu
1475 1480 1485
Phe Asp Asn Phe Glu Cys Gln Arg Asn Ser Lys Thr Cys Lys Tyr Asp
1490 1495 1500
Lys Tyr Cys Ala Asp His Phe Lys Asp Asn His Cys Asp Gln Gly Cys
1505 1510 1515 1520
Asn Ser Glu Glu Cys Gly Trp Asp Gly Leu Asp Cys Ala Ser Asp Gln
1525 1530 1535
Pro Glu Asn Leu Ala Glu Gly Thr Leu Ile Ile Val Val Leu Leu Pro
1540 1545 1550
Pro Glu Gln Leu Leu Gln Asp Ser Arg Ser Phe Leu Arg Ala Leu Gly
1555 1560 1565
Thr Leu Leu His Thr Asn Leu Arg Ile Lys Gln Asp Ser Gln Gly Ala
1570 1575 1580
Leu Met Val Tyr Pro Tyr Phe Gly Glu Lys Ser Ala Ala Met Lys Lys
1585 1590 1595 1600
Gln Lys Met Thr Arg Arg Ser Leu Pro Glu Glu Gln Glu Gln Glu Gln
1605 1610 1615
Glu Val Ile Gly Ser Lys Ile Phe Leu Glu Ile Asp Asn Arg Gln Cys
1620 1625 1630
Val Gln Asp Ser Asp Gln Cys Phe Lys Asn Thr Asp Ala Ala Ala Ala
1635 1640 1645
Leu Leu Ala Ser His Ala Ile Gln Gly Thr Leu Ser Tyr Pro Leu Val
1650 1655 1660
Ser Val Phe Ser Glu Leu Glu Ser Pro Arg Asn Ala Gln Leu Leu Tyr
1665 1670 1675 1680
Leu Leu Ala Val Ala Val Val Ile Ile Leu Phe Phe Ile Leu Leu Gly
1685 1690 1695
Val Ile Met Ala Lys Arg Lys Gln Ala Trp Leu Pro Leu Ala Ala Gly
1700 1705 1710
Arg Phe Thr Leu Arg Arg Asp Ser Ser Asn His Lys Arg Arg Glu Pro
1715 1720 1725
Val Gly Gln Asp Ala Val Gly Leu Lys Asn Leu Ser Val Gln Val Ser
1730 1735 1740
Glu Ala Asn Leu Ile Gly Ser Gly Thr Ser Glu His Trp Val Asp Asp
1745 1750 1755 1760
Glu Gly Pro Gln Pro Lys Lys Ala Lys Ala Glu Asp Glu Ala Leu Leu
1765 1770 1775
Ser Glu Asp Asp Pro Ile Asp Arg Arg Pro Trp Thr Gln Gln His Leu
1780 1785 1790
Glu Ala Ala Asp Ile Ser His Thr Pro Ser Leu Ala Leu Thr Pro Pro
1795 1800 1805
Gln Ala Glu Gln Glu Val Asp Val Leu Asp Val Asn Val Arg Gly Pro
1810 1815 1820
Asp Gly Cys Thr Pro Leu Met Leu Ala Ser Leu Arg Gly Gly Ser Ser
1825 1830 1835 1840
Asp Leu Ser Asp Glu Asp Glu Asp Ala Glu Asp Ser Ser Ala Asn Ile
1845 1850 1855
Ile Thr Asp Leu Val Tyr Gln Gly Ala Ser Leu Gln Ala Gln Thr Asp
1860 1865 1870
Arg Thr Gly Glu Met Ala Leu His Leu Ala Ala Arg Tyr Ser Arg Ala
1875 1880 1885
Asp Ala Ala Lys Arg Leu Leu Asp Ala Gly Ala Asp Arg Asn Ala Gln
1890 1895 1900
Asp Asn Met Gly Arg Cys Pro Leu His Ala Ala Val Ala Gly Asp Ala
1905 1910 1915 1920
Gln Gly Val Phe Gln Ile Leu Ile Arg Asn Arg Val Thr Asp Leu Asp
1925 1930 1935
Ala Arg Met Asn Asp Gly Thr Thr Pro Leu Ile Leu Ala Ala Arg Leu
1940 1945 1950
Ala Val Glu Gly Met Val Ala Glu Leu Ile Asn Cys Gln Ala Asp Val
1955 1960 1965
Asn Ala Val Asp Asp His Gly Lys Ser Ala Leu His Trp Ala Ala Ala
1970 1975 1980
Val Asn Asn Val Glu Ala Thr Leu Leu Leu Leu Lys Asn Gly Ala Asn
1985 1990 1995 2000
Arg Asp Met Gln Asp Asn Lys Glu Glu Thr Pro Leu Phe Leu Ala Ala
2005 2010 2015
Arg Glu Gly Ser Tyr Glu Ala Ala Lys Ile Leu Leu Asp His Phe Ala
2020 2025 2030
Asn Arg Asp Ile Thr Asp His Met Asp Arg Leu Pro Arg Asp Val Ala
2035 2040 2045
Arg Asp Arg Met His His Asp Ile Val Arg Leu Leu Asp Glu Tyr Asn
2050 2055 2060
Val Thr Pro Ser Pro Pro Gly Thr Val Leu Thr Ser Ala Leu Ser Pro
2065 2070 2075 2080
Val Leu Cys Gly Pro Asn Arg Ser Phe Leu Ser Leu Lys His Thr Pro
2085 2090 2095
Met Gly Lys Lys Ala Arg Arg Pro Asn Thr Lys Ser Thr Met Pro Thr
2100 2105 2110
Ser Leu Pro Asn Leu Ala Lys Glu Ala Lys Asp Ala Lys Gly Ser Arg
2115 2120 2125
Arg Lys Lys Cys Leu Asn Glu Lys Val Gln Leu Ser Glu Ser Ser Val
2130 2135 2140
Thr Leu Ser Pro Val Asp Ser Leu Glu Ser Pro His Thr Tyr Val Ser
2145 2150 2155 2160
Asp Ala Thr Ser Ser Pro Met Ile Thr Ser Pro Gly Ile Leu Gln Ala
2165 2170 2175
Ser Pro Thr Pro Leu Leu Ala Ala Ala Ala Pro Ala Ala Pro Val His
2180 2185 2190
Thr Gln His Ala Leu Ser Phe Ser Asn Leu His Asp Met Gln Pro Leu
2195 2200 2205
Ala Pro Gly Ala Ser Thr Val Leu Pro Ser Val Ser Gln Leu Leu Ser
2210 2215 2220
His His His Ile Ala Pro Pro Gly Ser Ser Ser Ala Gly Ser Leu Gly
2225 2230 2235 2240
Arg Leu His Pro Val Pro Val Pro Ala Asp Trp Met Asn Arg Val Glu
2245 2250 2255
Met Asn Glu Thr Gln Tyr Ser Glu Met Phe Gly Met Val Leu Ala Pro
2260 2265 2270
Ala Glu Gly Ala His Pro Gly Ile Ala Ala Pro Gln Ser Arg Pro Pro
2275 2280 2285
Glu Gly Lys His Met Ser Thr Gln Arg Glu Pro Leu Pro Pro Ile Val
2290 2295 2300
Thr Phe Gln Leu Ile Pro Lys Arg Ser Ile Ala Gln Ala Ala Gly Ala
2305 2310 2315 2320
Pro Gln Thr Gln Ser Ser Cys Pro Pro Ala Val Ala Gly Pro Leu Pro
2325 2330 2335
Ser Met Tyr Gln Ile Pro Glu Met Pro Arg Leu Pro Ser Val Ala Phe
2340 2345 2350
Pro Pro Thr Met Met Pro Gln Gln Glu Gly Gln Val Ala Gln Thr Ile
2355 2360 2365
Val Pro Thr Tyr His Pro Phe Pro Ala Ser Val Gly Lys Tyr Pro Thr
2370 2375 2380
Pro Pro Ser Gln His Ser Tyr Ala Ser Ser Asn Ala Ala Glu Arg Thr
2385 2390 2395 2400
Pro Ser His Gly Gly His Leu Gln Gly Glu His Pro Tyr Leu Thr Pro
2405 2410 2415
Ser Pro Glu Ser Pro Asp Gln Trp Ser Ser Ser Ser Pro His Ser Ala
2420 2425 2430
Ser Asp Trp Ser Asp Val Thr Thr Ser Pro Thr Pro Gly Gly Gly Gly
2435 2440 2445
Gly Gly Gln Arg Gly Pro Gly Thr His Met Ser Glu Pro Pro His Ser
2450 2455 2460
Asn Met Gln Val Tyr Ala
2465 2470
<210> 12
<211> 1964
<212> PRT
<213> Mus musculus
<400> 12
Met Gln Pro Gln Leu Leu Leu Leu Leu Leu Leu Pro Leu Asn Phe Pro
1 5 10 15
Val Ile Leu Thr Arg Glu Leu Leu Cys Gly Gly Ser Pro Glu Pro Cys
20 25 30
Ala Asn Gly Gly Thr Cys Leu Arg Leu Ser Gln Gly Gln Gly Ile Cys
35 40 45
Gln Cys Ala Pro Gly Phe Leu Gly Glu Thr Cys Gln Phe Pro Asp Pro
50 55 60
Cys Arg Asp Thr Gln Leu Cys Lys Asn Gly Gly Ser Cys Gln Ala Leu
65 70 75 80
Leu Pro Thr Pro Pro Ser Ser Arg Ser Pro Thr Ser Pro Leu Thr Pro
85 90 95
His Phe Ser Cys Thr Cys Pro Ser Gly Phe Thr Gly Asp Arg Cys Gln
100 105 110
Thr His Leu Glu Glu Leu Cys Pro Pro Ser Phe Cys Ser Asn Gly Gly
115 120 125
His Cys Tyr Val Gln Ala Ser Gly Arg Pro Gln Cys Ser Cys Glu Pro
130 135 140
Gly Trp Thr Gly Glu Gln Cys Gln Leu Arg Asp Phe Cys Ser Ala Asn
145 150 155 160
Pro Cys Ala Asn Gly Gly Val Cys Leu Ala Thr Tyr Pro Gln Ile Gln
165 170 175
Cys Arg Cys Pro Pro Gly Phe Glu Gly His Thr Cys Glu Arg Asp Ile
180 185 190
Asn Glu Cys Phe Leu Glu Pro Gly Pro Cys Pro Gln Gly Thr Ser Cys
195 200 205
His Asn Thr Leu Gly Ser Tyr Gln Cys Leu Cys Pro Val Gly Gln Glu
210 215 220
Gly Pro Gln Cys Lys Leu Arg Lys Gly Ala Cys Pro Pro Gly Ser Cys
225 230 235 240
Leu Asn Gly Gly Thr Cys Gln Leu Val Pro Glu Gly His Ser Thr Phe
245 250 255
His Leu Cys Leu Cys Pro Pro Gly Phe Thr Gly Leu Asp Cys Glu Met
260 265 270
Asn Pro Asp Asp Cys Val Arg His Gln Cys Gln Asn Gly Ala Thr Cys
275 280 285
Leu Asp Gly Leu Asp Thr Tyr Thr Cys Leu Cys Pro Lys Thr Trp Lys
290 295 300
Gly Trp Asp Cys Ser Glu Asp Ile Asp Glu Cys Glu Ala Arg Gly Pro
305 310 315 320
Pro Arg Cys Arg Asn Gly Gly Thr Cys Gln Asn Thr Ala Gly Ser Phe
325 330 335
His Cys Val Cys Val Ser Gly Trp Gly Gly Ala Gly Cys Glu Glu Asn
340 345 350
Leu Asp Asp Cys Ala Ala Ala Thr Cys Ala Pro Gly Ser Thr Cys Ile
355 360 365
Asp Arg Val Gly Ser Phe Ser Cys Leu Cys Pro Pro Gly Arg Thr Gly
370 375 380
Leu Leu Cys His Leu Glu Asp Met Cys Leu Ser Gln Pro Cys His Val
385 390 395 400
Asn Ala Gln Cys Ser Thr Asn Pro Leu Thr Gly Ser Thr Leu Cys Ile
405 410 415
Cys Gln Pro Gly Tyr Ser Gly Ser Thr Cys His Gln Asp Leu Asp Glu
420 425 430
Cys Gln Met Ala Gln Gln Gly Pro Ser Pro Cys Glu His Gly Gly Ser
435 440 445
Cys Ile Asn Thr Pro Gly Ser Phe Asn Cys Leu Cys Leu Pro Gly Tyr
450 455 460
Thr Gly Ser Arg Cys Glu Ala Asp His Asn Glu Cys Leu Ser Gln Pro
465 470 475 480
Cys His Pro Gly Ser Thr Cys Leu Asp Leu Leu Ala Thr Phe His Cys
485 490 495
Leu Cys Pro Pro Gly Leu Glu Gly Arg Leu Cys Glu Val Glu Val Asn
500 505 510
Glu Cys Thr Ser Asn Pro Cys Leu Asn Gln Ala Ala Cys His Asp Leu
515 520 525
Leu Asn Gly Phe Gln Cys Leu Cys Leu Pro Gly Phe Thr Gly Ala Arg
530 535 540
Cys Glu Lys Asp Met Asp Glu Cys Ser Ser Thr Pro Cys Ala Asn Gly
545 550 555 560
Gly Arg Cys Arg Asp Gln Pro Gly Ala Phe Tyr Cys Glu Cys Leu Pro
565 570 575
Gly Phe Glu Gly Pro His Cys Glu Lys Glu Val Asp Glu Cys Leu Ser
580 585 590
Asp Pro Cys Pro Val Gly Ala Ser Cys Leu Asp Leu Pro Gly Ala Phe
595 600 605
Phe Cys Leu Cys Arg Pro Gly Phe Thr Gly Gln Leu Cys Glu Val Pro
610 615 620
Leu Cys Thr Pro Asn Met Cys Gln Pro Gly Gln Gln Cys Gln Gly Gln
625 630 635 640
Glu His Arg Ala Pro Cys Leu Cys Pro Asp Gly Ser Pro Gly Cys Val
645 650 655
Pro Ala Glu Asp Asn Cys Pro Cys His His Gly His Cys Gln Arg Ser
660 665 670
Leu Cys Val Cys Asp Glu Gly Trp Thr Gly Pro Glu Cys Glu Thr Glu
675 680 685
Leu Gly Gly Cys Ile Ser Thr Pro Cys Ala His Gly Gly Thr Cys His
690 695 700
Pro Gln Pro Ser Gly Tyr Asn Cys Thr Cys Pro Ala Gly Tyr Met Gly
705 710 715 720
Leu Thr Cys Ser Glu Glu Val Thr Ala Cys His Ser Gly Pro Cys Leu
725 730 735
Asn Gly Gly Ser Cys Ser Ile Arg Pro Glu Gly Tyr Ser Cys Thr Cys
740 745 750
Leu Pro Ser His Thr Gly Arg His Cys Gln Thr Ala Val Asp His Cys
755 760 765
Val Ser Ala Ser Cys Leu Asn Gly Gly Thr Cys Val Asn Lys Pro Gly
770 775 780
Thr Phe Phe Cys Leu Cys Ala Thr Gly Phe Gln Gly Leu His Cys Glu
785 790 795 800
Glu Lys Thr Asn Pro Ser Cys Ala Asp Ser Pro Cys Arg Asn Lys Ala
805 810 815
Thr Cys Gln Asp Thr Pro Arg Gly Ala Arg Cys Leu Cys Ser Pro Gly
820 825 830
Tyr Thr Gly Ser Ser Cys Gln Thr Leu Ile Asp Leu Cys Ala Arg Lys
835 840 845
Pro Cys Pro His Thr Ala Arg Cys Leu Gln Ser Gly Pro Ser Phe Gln
850 855 860
Cys Leu Cys Leu Gln Gly Trp Thr Gly Ala Leu Cys Asp Phe Pro Leu
865 870 875 880
Ser Cys Gln Met Ala Ala Met Ser Gln Gly Ile Glu Ile Ser Gly Leu
885 890 895
Cys Gln Asn Gly Gly Leu Cys Ile Asp Thr Gly Ser Ser Tyr Phe Cys
900 905 910
Arg Cys Pro Pro Gly Phe Gln Gly Lys Leu Cys Gln Asp Asn Met Asn
915 920 925
Pro Cys Glu Pro Asn Pro Cys His His Gly Ser Thr Cys Val Pro Gln
930 935 940
Pro Ser Gly Tyr Val Cys Gln Cys Ala Pro Gly Tyr Glu Gly Gln Asn
945 950 955 960
Cys Ser Lys Val Leu Glu Ala Cys Gln Ser Gln Pro Cys His Asn His
965 970 975
Gly Thr Cys Thr Ser Arg Pro Gly Gly Phe His Cys Ala Cys Pro Pro
980 985 990
Gly Phe Val Gly Leu Arg Cys Glu Gly Asp Val Asp Glu Cys Leu Asp
995 1000 1005
Arg Pro Cys His Pro Ser Gly Thr Ala Ala Cys His Ser Leu Ala Asn
1010 1015 1020
Ala Phe Tyr Cys Gln Cys Leu Pro Gly His Thr Gly Gln Arg Cys Glu
1025 1030 1035 1040
Val Glu Met Asp Leu Cys Gln Ser Gln Pro Cys Ser Asn Gly Gly Ser
1045 1050 1055
Cys Glu Ile Thr Thr Gly Pro Pro Pro Gly Phe Thr Cys His Cys Pro
1060 1065 1070
Lys Gly Phe Glu Gly Pro Thr Cys Ser His Lys Ala Leu Ser Cys Gly
1075 1080 1085
Ile His His Cys His Asn Gly Gly Leu Cys Leu Pro Ser Pro Lys Pro
1090 1095 1100
Gly Ser Pro Pro Leu Cys Ala Cys Leu Ser Gly Phe Gly Gly Pro Asp
1105 1110 1115 1120
Cys Leu Thr Pro Pro Ala Pro Pro Gly Cys Gly Pro Pro Ser Pro Cys
1125 1130 1135
Leu His Asn Gly Thr Cys Thr Glu Thr Pro Gly Leu Gly Asn Pro Gly
1140 1145 1150
Phe Gln Cys Thr Cys Pro Pro Asp Ser Pro Gly Pro Arg Cys Gln Arg
1155 1160 1165
Pro Gly Ala Ser Gly Cys Glu Gly Arg Gly Gly Asp Gly Thr Cys Asp
1170 1175 1180
Ala Gly Cys Ser Gly Pro Gly Gly Asp Trp Asp Gly Gly Asp Cys Ser
1185 1190 1195 1200
Leu Gly Val Pro Asp Pro Trp Lys Gly Cys Pro Pro His Ser Gln Cys
1205 1210 1215
Trp Leu Leu Phe Arg Asp Gly Arg Cys His Pro Gln Cys Asp Ser Glu
1220 1225 1230
Glu Cys Leu Phe Asp Gly Tyr Asp Cys Glu Ile Pro Leu Thr Cys Ile
1235 1240 1245
Pro Ala Tyr Asp Gln Tyr Cys Arg Asp His Phe His Asn Gly His Cys
1250 1255 1260
Glu Lys Gly Cys Asn Asn Ala Glu Cys Gly Trp Asp Gly Gly Asp Cys
1265 1270 1275 1280
Arg Pro Glu Gly Glu Asp Ser Glu Gly Arg Pro Ser Leu Ala Leu Leu
1285 1290 1295
Val Val Leu Arg Pro Pro Ala Leu Asp Gln Gln Leu Leu Ala Leu Ala
1300 1305 1310
Arg Val Leu Ser Leu Thr Leu Arg Val Gly Leu Trp Val Arg Lys Asp
1315 1320 1325
Ser Glu Gly Arg Asn Met Val Phe Pro Tyr Pro Gly Thr Arg Ala Lys
1330 1335 1340
Glu Glu Leu Ser Gly Ala Arg Asp Ser Ser Ser Trp Glu Arg Gln Ala
1345 1350 1355 1360
Pro Pro Thr Gln Pro Leu Gly Lys Glu Thr Glu Ser Leu Gly Ala Gly
1365 1370 1375
Phe Val Val Val Met Gly Val Asp Leu Ser Arg Cys Gly Pro Glu His
1380 1385 1390
Pro Ala Ser Arg Cys Pro Trp Asp Ser Gly Leu Leu Leu Arg Phe Leu
1395 1400 1405
Ala Ala Met Ala Ala Val Gly Ala Leu Glu Pro Leu Leu Pro Gly Pro
1410 1415 1420
Leu Leu Ala Ala His Pro Gln Ala Gly Thr Arg Pro Pro Ala Asn Gln
1425 1430 1435 1440
Leu Pro Trp Pro Ile Leu Cys Ser Pro Val Val Gly Val Leu Leu Leu
1445 1450 1455
Ala Leu Gly Ala Leu Leu Val Leu Gln Leu Ile Arg Arg Arg Arg Arg
1460 1465 1470
Glu His Gly Ala Leu Trp Leu Pro Pro Gly Phe Ile Arg Arg Pro Gln
1475 1480 1485
Ala Gln Gln Ala Pro His Arg Arg Arg Pro Pro Leu Gly Glu Asp Asn
1490 1495 1500
Ile Gly Leu Lys Ala Leu Lys Pro Glu Ala Glu Val Asp Glu Asp Gly
1505 1510 1515 1520
Val Ala Met Cys Ser Gly Pro Glu Glu Gly Glu Ala Glu Glu Thr Ala
1525 1530 1535
Ser Ala Ser Arg Cys Gln Leu Trp Pro Leu Asn Ser Ser Cys Gly Glu
1540 1545 1550
Leu Pro Gln Ala Ala Met Leu Thr Pro Pro Gln Glu Cys Glu Ser Glu
1555 1560 1565
Val Leu Asp Val Asp Thr Cys Gly Pro Asp Gly Val Thr Pro Leu Met
1570 1575 1580
Ser Ala Val Phe Cys Gly Gly Val Gln Ser Thr Thr Gly Ala Ser Pro
1585 1590 1595 1600
Gln Arg Leu Gly Leu Gly Asn Leu Glu Pro Trp Glu Pro Leu Leu Asp
1605 1610 1615
Arg Gly Ala Cys Pro Gln Ala His Thr Val Gly Thr Gly Glu Thr Pro
1620 1625 1630
Leu His Leu Ala Ala Arg Phe Ser Arg Pro Thr Ala Ala Arg Arg Leu
1635 1640 1645
Leu Glu Ala Gly Ala Asn Pro Asn Gln Pro Asp Arg Ala Gly Arg Thr
1650 1655 1660
Pro Leu His Thr Ala Val Ala Ala Asp Ala Arg Glu Val Cys Gln Leu
1665 1670 1675 1680
Leu Leu Ala Ser Arg Gln Thr Ser Val Asp Ala Arg Thr Glu Asp Gly
1685 1690 1695
Thr Thr Pro Leu Met Leu Ala Ala Arg Leu Ala Val Glu Asp Leu Val
1700 1705 1710
Glu Glu Leu Ile Ala Ala Arg Ala Asp Val Gly Ala Arg Asp Lys Arg
1715 1720 1725
Gly Lys Thr Ala Leu His Trp Ala Ala Ala Val Asn Asn Ala Arg Ala
1730 1735 1740
Ala Arg Ser Leu Leu Gln Ala Gly Ala Asp Lys Asp Ala Gln Asp Ser
1745 1750 1755 1760
Arg Glu Gln Thr Pro Leu Phe Leu Ala Ala Arg Glu Gly Ala Val Glu
1765 1770 1775
Val Ala Gln Leu Leu Leu Glu Leu Gly Ala Ala Arg Gly Leu Arg Asp
1780 1785 1790
Gln Ala Gly Leu Ala Pro Gly Asp Val Ala Arg Gln Arg Ser His Trp
1795 1800 1805
Asp Leu Leu Thr Leu Leu Glu Gly Ala Gly Pro Thr Thr Gln Glu Ala
1810 1815 1820
Arg Ala His Ala Arg Thr Thr Pro Gly Gly Gly Ala Ala Ala Arg Cys
1825 1830 1835 1840
Arg Thr Leu Ser Ala Gly Ala Arg Pro Arg Gly Gly Gly Ala Cys Leu
1845 1850 1855
Gln Ala Arg Thr Trp Ser Val Asp Leu Gly Ala Arg Gly Gly Lys Val
1860 1865 1870
Tyr Ala Arg Cys Arg Ser Arg Ser Gly Ser Cys Gly Gly Pro Thr Thr
1875 1880 1885
Arg Gly Arg Arg Phe Ser Ala Gly Ser Arg Gly Arg Arg Gly Ala Arg
1890 1895 1900
Ala Ser Gln Asp Asp Trp Pro Arg Asp Trp Val Ala Leu Glu Ala Cys
1905 1910 1915 1920
Gly Ser Ala Cys Ser Ala Pro Ile Pro Pro Pro Ser Leu Thr Pro Ser
1925 1930 1935
Pro Glu Arg Gly Ser Pro Gln Val Ala Trp Gly Leu Pro Val His Gln
1940 1945 1950
Glu Ile Pro Leu Asn Ser Val Val Arg Asn Leu Asn
1955 1960
<210> 13
<211> 2318
<212> PRT
<213> Mus musculus
<400> 13
Met Gly Leu Gly Ala Arg Gly Arg Arg Arg Arg Arg Arg Leu Met Ala
1 5 10 15
Leu Pro Pro Pro Pro Pro Pro Met Arg Ala Leu Pro Leu Leu Leu Leu
20 25 30
Leu Ala Gly Leu Gly Ala Ala Ala Pro Pro Cys Leu Asp Gly Ser Pro
35 40 45
Cys Ala Asn Gly Gly Arg Cys Thr His Gln Gln Pro Ser Leu Glu Ala
50 55 60
Ala Cys Leu Cys Leu Pro Gly Trp Val Gly Glu Arg Cys Gln Leu Glu
65 70 75 80
Asp Pro Cys His Ser Gly Pro Cys Ala Gly Arg Gly Val Cys Gln Ser
85 90 95
Ser Val Val Ala Gly Thr Ala Arg Phe Ser Cys Arg Cys Leu Arg Gly
100 105 110
Phe Gln Gly Pro Asp Cys Ser Gln Pro Asp Pro Cys Val Ser Arg Pro
115 120 125
Cys Val His Gly Ala Pro Cys Ser Val Gly Pro Asp Gly Arg Phe Ala
130 135 140
Cys Ala Cys Pro Pro Gly Tyr Gln Gly Gln Ser Cys Gln Ser Asp Ile
145 150 155 160
Asp Glu Cys Arg Ser Gly Thr Thr Cys Arg His Gly Gly Thr Cys Leu
165 170 175
Asn Thr Pro Gly Ser Phe Arg Cys Gln Cys Pro Leu Gly Tyr Thr Gly
180 185 190
Leu Leu Cys Glu Asn Pro Val Val Pro Cys Ala Pro Ser Pro Cys Arg
195 200 205
Asn Gly Gly Thr Cys Arg Gln Ser Ser Asp Val Thr Tyr Asp Cys Ala
210 215 220
Cys Leu Pro Gly Phe Glu Gly Gln Asn Cys Glu Val Asn Val Asp Asp
225 230 235 240
Cys Pro Gly His Arg Cys Leu Asn Gly Gly Thr Cys Val Asp Gly Val
245 250 255
Asn Thr Tyr Asn Cys Gln Cys Pro Pro Glu Trp Thr Gly Gln Phe Cys
260 265 270
Thr Glu Asp Val Asp Glu Cys Gln Leu Gln Pro Asn Ala Cys His Asn
275 280 285
Gly Gly Thr Cys Phe Asn Leu Leu Gly Gly His Ser Cys Val Cys Val
290 295 300
Asn Gly Trp Thr Gly Glu Ser Cys Ser Gln Asn Ile Asp Asp Cys Ala
305 310 315 320
Thr Ala Val Cys Phe His Gly Ala Thr Cys His Asp Arg Val Ala Ser
325 330 335
Phe Tyr Cys Ala Cys Pro Met Gly Lys Thr Gly Leu Leu Cys His Leu
340 345 350
Asp Asp Ala Cys Val Ser Asn Pro Cys His Glu Asp Ala Ile Cys Asp
355 360 365
Thr Asn Pro Val Ser Gly Arg Ala Ile Cys Thr Cys Pro Pro Gly Phe
370 375 380
Thr Gly Gly Ala Cys Asp Gln Asp Val Asp Glu Cys Ser Ile Gly Ala
385 390 395 400
Asn Pro Cys Glu His Leu Gly Arg Cys Val Asn Thr Gln Gly Ser Phe
405 410 415
Leu Cys Gln Cys Gly Arg Gly Tyr Thr Gly Pro Arg Cys Glu Thr Asp
420 425 430
Val Asn Glu Cys Leu Ser Gly Pro Cys Arg Asn Gln Ala Thr Cys Leu
435 440 445
Asp Arg Ile Gly Gln Phe Thr Cys Ile Cys Met Ala Gly Phe Thr Gly
450 455 460
Thr Tyr Cys Glu Val Asp Ile Asp Glu Cys Gln Ser Ser Pro Cys Val
465 470 475 480
Asn Gly Gly Val Cys Lys Asp Arg Val Asn Gly Phe Ser Cys Thr Cys
485 490 495
Pro Ser Gly Phe Ser Gly Ser Met Cys Gln Leu Asp Val Asp Glu Cys
500 505 510
Ala Ser Thr Pro Cys Arg Asn Gly Ala Lys Cys Val Asp Gln Pro Asp
515 520 525
Gly Tyr Glu Cys Arg Cys Ala Glu Gly Phe Glu Gly Thr Leu Cys Glu
530 535 540
Arg Asn Val Asp Asp Cys Ser Pro Asp Pro Cys His His Gly Arg Cys
545 550 555 560
Val Asp Gly Ile Ala Ser Phe Ser Cys Ala Cys Ala Pro Gly Tyr Thr
565 570 575
Gly Ile Arg Cys Glu Ser Gln Val Asp Glu Cys Arg Ser Gln Pro Cys
580 585 590
Arg Tyr Gly Gly Lys Cys Leu Asp Leu Val Asp Lys Tyr Leu Cys Arg
595 600 605
Cys Pro Pro Gly Thr Thr Gly Val Asn Cys Glu Val Asn Ile Asp Asp
610 615 620
Cys Ala Ser Asn Pro Cys Thr Phe Gly Val Cys Arg Asp Gly Ile Asn
625 630 635 640
Arg Tyr Asp Cys Val Cys Gln Pro Gly Phe Thr Gly Pro Leu Cys Asn
645 650 655
Val Glu Ile Asn Glu Cys Ala Ser Ser Pro Cys Gly Glu Gly Gly Ser
660 665 670
Cys Val Asp Gly Glu Asn Gly Phe His Cys Leu Cys Pro Pro Gly Ser
675 680 685
Leu Pro Pro Leu Cys Leu Pro Ala Asn His Pro Cys Ala His Lys Pro
690 695 700
Cys Ser His Gly Val Cys His Asp Ala Pro Gly Gly Phe Arg Cys Val
705 710 715 720
Cys Glu Pro Gly Trp Ser Gly Pro Arg Cys Ser Gln Ser Leu Ala Pro
725 730 735
Asp Ala Cys Glu Ser Gln Pro Cys Gln Ala Gly Gly Thr Cys Thr Ser
740 745 750
Asp Gly Ile Gly Phe Arg Cys Thr Cys Ala Pro Gly Phe Gln Gly His
755 760 765
Gln Cys Glu Val Leu Ser Pro Cys Thr Pro Ser Leu Cys Glu His Gly
770 775 780
Gly His Cys Glu Ser Asp Pro Asp Arg Leu Thr Val Cys Ser Cys Pro
785 790 795 800
Pro Gly Trp Gln Gly Pro Arg Cys Gln Gln Asp Val Asp Glu Cys Ala
805 810 815
Gly Ala Ser Pro Cys Gly Pro His Gly Thr Cys Thr Asn Leu Pro Gly
820 825 830
Asn Phe Arg Cys Ile Cys His Arg Gly Tyr Thr Gly Pro Phe Cys Asp
835 840 845
Gln Asp Ile Asp Asp Cys Asp Pro Asn Pro Cys Leu His Gly Gly Ser
850 855 860
Cys Gln Asp Gly Val Gly Ser Phe Ser Cys Ser Cys Leu Asp Gly Phe
865 870 875 880
Ala Gly Pro Arg Cys Ala Arg Asp Val Asp Glu Cys Leu Ser Ser Pro
885 890 895
Cys Gly Pro Gly Thr Cys Thr Asp His Val Ala Ser Phe Thr Cys Ala
900 905 910
Cys Pro Pro Gly Tyr Gly Gly Phe His Cys Glu Ile Asp Leu Pro Asp
915 920 925
Cys Ser Pro Ser Ser Cys Phe Asn Gly Gly Thr Cys Val Asp Gly Val
930 935 940
Ser Ser Phe Ser Cys Leu Cys Arg Pro Gly Tyr Thr Gly Thr His Cys
945 950 955 960
Gln Tyr Glu Ala Asp Pro Cys Phe Ser Arg Pro Cys Leu His Gly Gly
965 970 975
Ile Cys Asn Pro Thr His Pro Gly Phe Glu Cys Thr Cys Arg Glu Gly
980 985 990
Phe Thr Gly Ser Gln Cys Gln Asn Pro Val Asp Trp Cys Ser Gln Ala
995 1000 1005
Pro Cys Gln Asn Gly Gly Arg Cys Val Gln Thr Gly Ala Tyr Cys Ile
1010 1015 1020
Cys Pro Pro Gly Trp Ser Gly Arg Leu Cys Asp Ile Gln Ser Leu Pro
1025 1030 1035 1040
Cys Thr Glu Ala Ala Ala Gln Met Gly Val Arg Leu Glu Gln Leu Cys
1045 1050 1055
Gln Glu Gly Gly Lys Cys Ile Asp Lys Gly Arg Ser His Tyr Cys Val
1060 1065 1070
Cys Pro Glu Gly Arg Thr Gly Ser His Cys Glu His Glu Val Asp Pro
1075 1080 1085
Cys Thr Ala Gln Pro Cys Gln His Gly Gly Thr Cys Arg Gly Tyr Met
1090 1095 1100
Gly Gly Tyr Val Cys Glu Cys Pro Ala Gly Tyr Ala Gly Asp Ser Cys
1105 1110 1115 1120
Glu Asp Asn Ile Asp Glu Cys Ala Ser Gln Pro Cys Gln Asn Gly Gly
1125 1130 1135
Ser Cys Ile Asp Leu Val Ala Arg Tyr Leu Cys Ser Cys Pro Pro Gly
1140 1145 1150
Thr Leu Gly Val Leu Cys Glu Ile Asn Glu Asp Asp Cys Asp Leu Gly
1155 1160 1165
Pro Ser Leu Asp Ser Gly Val Gln Cys Leu His Asn Gly Thr Cys Val
1170 1175 1180
Asp Leu Val Gly Gly Phe Arg Cys Asn Cys Pro Pro Gly Tyr Thr Gly
1185 1190 1195 1200
Leu His Cys Glu Ala Asp Ile Asn Glu Cys Arg Pro Gly Ala Cys His
1205 1210 1215
Ala Ala His Thr Arg Asp Cys Leu Gln Asp Pro Gly Gly His Phe Arg
1220 1225 1230
Cys Val Cys His Pro Gly Phe Thr Gly Pro Arg Cys Gln Ile Ala Leu
1235 1240 1245
Ser Pro Cys Glu Ser Gln Pro Cys Gln His Gly Gly Gln Cys Arg His
1250 1255 1260
Ser Leu Gly Arg Gly Gly Gly Leu Thr Phe Thr Cys His Cys Val Pro
1265 1270 1275 1280
Pro Phe Trp Gly Leu Arg Cys Glu Arg Val Ala Arg Ser Cys Arg Glu
1285 1290 1295
Leu Gln Cys Pro Val Gly Ile Pro Cys Gln Gln Thr Ala Arg Gly Pro
1300 1305 1310
Arg Cys Ala Cys Pro Pro Gly Leu Ser Gly Pro Ser Cys Arg Val Ser
1315 1320 1325
Arg Ala Ser Pro Ser Gly Ala Thr Asn Ala Ser Cys Ala Ser Ala Pro
1330 1335 1340
Cys Leu His Gly Gly Ser Cys Leu Pro Val Gln Ser Val Pro Phe Phe
1345 1350 1355 1360
Arg Cys Val Cys Ala Pro Gly Trp Gly Gly Pro Arg Cys Glu Thr Pro
1365 1370 1375
Ser Ala Ala Pro Glu Val Pro Glu Glu Pro Arg Cys Pro Arg Ala Ala
1380 1385 1390
Cys Gln Ala Lys Arg Gly Asp Gln Asn Cys Asp Arg Glu Cys Asn Thr
1395 1400 1405
Pro Gly Cys Gly Trp Asp Gly Gly Asp Cys Ser Leu Asn Val Asp Asp
1410 1415 1420
Pro Trp Arg Gln Cys Glu Ala Leu Gln Cys Trp Arg Leu Phe Asn Asn
1425 1430 1435 1440
Ser Arg Cys Asp Pro Ala Cys Ser Ser Pro Ala Cys Leu Tyr Asp Asn
1445 1450 1455
Phe Asp Cys Tyr Ser Gly Gly Arg Asp Arg Thr Cys Asn Pro Val Tyr
1460 1465 1470
Glu Lys Tyr Cys Ala Asp His Phe Ala Asp Gly Arg Cys Asp Gln Gly
1475 1480 1485
Cys Asn Thr Glu Glu Cys Gly Trp Asp Gly Leu Asp Cys Ala Ser Glu
1490 1495 1500
Val Pro Ala Leu Leu Ala Arg Gly Val Leu Val Leu Thr Val Leu Leu
1505 1510 1515 1520
Pro Pro Glu Glu Leu Leu Arg Ser Ser Ala Asp Phe Leu Gln Arg Leu
1525 1530 1535
Ser Ala Ile Leu Arg Thr Ser Leu Arg Phe Arg Leu Asp Ala Arg Gly
1540 1545 1550
Gln Ala Met Val Phe Pro Tyr His Arg Pro Ser Pro Gly Ser Glu Ser
1555 1560 1565
Arg Val Arg Arg Glu Leu Gly Pro Glu Val Ile Gly Ser Val Val Met
1570 1575 1580
Leu Glu Ile Asp Asn Arg Leu Cys Leu Gln Ser Ala Glu Asn Asp His
1585 1590 1595 1600
Cys Phe Pro Asp Ala Gln Ser Ala Ala Asp Tyr Leu Gly Ala Leu Ser
1605 1610 1615
Ala Val Glu Arg Leu Asp Phe Pro Tyr Pro Leu Arg Asp Val Arg Gly
1620 1625 1630
Glu Pro Leu Glu Ala Pro Glu Gln Ser Val Pro Leu Leu Pro Leu Leu
1635 1640 1645
Val Ala Gly Ala Val Phe Leu Leu Ile Ile Phe Ile Leu Gly Val Met
1650 1655 1660
Val Ala Arg Arg Lys Arg Glu His Ser Thr Leu Trp Phe Pro Glu Gly
1665 1670 1675 1680
Phe Ala Leu His Lys Asp Ile Ala Ala Gly His Lys Gly Arg Arg Glu
1685 1690 1695
Pro Val Gly Gln Asp Ala Leu Gly Met Lys Asn Met Ala Lys Gly Glu
1700 1705 1710
Ser Leu Met Gly Glu Val Val Thr Asp Leu Asn Asp Ser Glu Cys Pro
1715 1720 1725
Glu Ala Lys Arg Leu Lys Val Glu Glu Pro Gly Met Gly Ala Glu Glu
1730 1735 1740
Pro Glu Asp Cys Arg Gln Trp Thr Gln His His Leu Val Ala Ala Asp
1745 1750 1755 1760
Ile Arg Val Ala Pro Ala Thr Ala Leu Thr Pro Pro Gln Gly Asp Ala
1765 1770 1775
Asp Ala Asp Gly Val Asp Val Asn Val Arg Gly Pro Asp Gly Phe Thr
1780 1785 1790
Pro Leu Met Leu Ala Ser Phe Cys Gly Gly Ala Leu Glu Pro Met Pro
1795 1800 1805
Ala Glu Glu Asp Glu Ala Asp Asp Thr Ser Ala Ser Ile Ile Ser Asp
1810 1815 1820
Leu Ile Cys Gln Gly Ala Gln Leu Gly Ala Arg Thr Asp Arg Thr Gly
1825 1830 1835 1840
Glu Thr Ala Leu His Leu Ala Ala Arg Tyr Ala Arg Ala Asp Ala Ala
1845 1850 1855
Lys Arg Leu Leu Asp Ala Gly Ala Asp Thr Asn Ala Gln Asp His Ser
1860 1865 1870
Gly Arg Thr Pro Leu His Thr Ala Val Thr Ala Asp Ala Gln Gly Val
1875 1880 1885
Phe Gln Ile Leu Ile Arg Asn Arg Ser Thr Asp Leu Asp Ala Arg Met
1890 1895 1900
Ala Asp Gly Ser Thr Ala Leu Ile Leu Ala Ala Arg Leu Ala Val Glu
1905 1910 1915 1920
Gly Met Val Glu Glu Leu Ile Ala Ser His Ala Asp Val Asn Ala Val
1925 1930 1935
Asp Glu Leu Gly Lys Ser Ala Leu His Trp Ala Ala Ala Val Asn Asn
1940 1945 1950
Val Glu Ala Thr Leu Ala Leu Leu Lys Asn Gly Ala Asn Lys Asp Met
1955 1960 1965
Gln Asp Ser Lys Glu Glu Thr Pro Leu Phe Leu Ala Ala Arg Glu Gly
1970 1975 1980
Ser Tyr Glu Ala Ala Lys Leu Leu Leu Asp His Leu Ala Asn Arg Glu
1985 1990 1995 2000
Ile Thr Asp His Leu Asp Arg Leu Pro Arg Asp Val Ala Gln Glu Arg
2005 2010 2015
Leu His Gln Asp Ile Val Arg Leu Leu Asp Gln Pro Ser Gly Pro Arg
2020 2025 2030
Ser Pro Ser Gly Pro His Gly Leu Gly Pro Leu Leu Cys Pro Pro Gly
2035 2040 2045
Ala Phe Leu Pro Gly Leu Lys Ala Val Gln Ser Gly Thr Lys Lys Ser
2050 2055 2060
Arg Arg Pro Pro Gly Lys Thr Gly Leu Gly Pro Gln Gly Thr Arg Gly
2065 2070 2075 2080
Arg Gly Lys Lys Leu Thr Leu Ala Cys Pro Gly Pro Leu Ala Asp Ser
2085 2090 2095
Ser Val Thr Leu Ser Pro Val Asp Ser Leu Asp Ser Pro Arg Pro Phe
2100 2105 2110
Ser Gly Pro Pro Ala Ser Pro Gly Gly Phe Pro Leu Glu Gly Pro Tyr
2115 2120 2125
Ala Thr Thr Ala Thr Ala Val Ser Leu Ala Gln Leu Gly Ala Ser Arg
2130 2135 2140
Ala Gly Pro Leu Gly Arg Gln Pro Pro Gly Gly Cys Val Leu Ser Phe
2145 2150 2155 2160
Gly Leu Leu Asn Pro Val Ala Val Pro Leu Asp Trp Ala Arg Leu Pro
2165 2170 2175
Pro Pro Ala Pro Pro Gly Pro Ser Phe Leu Leu Pro Leu Ala Pro Gly
2180 2185 2190
Pro Gln Leu Leu Asn Pro Gly Ala Pro Val Ser Pro Gln Glu Arg Pro
2195 2200 2205
Pro Pro Tyr Leu Ala Ala Pro Gly His Gly Glu Glu Tyr Pro Ala Ala
2210 2215 2220
Gly Thr Arg Ser Ser Pro Thr Lys Ala Arg Phe Leu Arg Val Pro Ser
2225 2230 2235 2240
Glu His Pro Tyr Leu Thr Pro Ser Pro Glu Ser Pro Glu His Trp Ala
2245 2250 2255
Ser Pro Ser Pro Pro Ser Leu Ser Asp Trp Ser Asp Ser Thr Pro Ser
2260 2265 2270
Pro Ala Thr Ala Thr Asn Ala Thr Ala Ser Gly Ala Leu Pro Ala Gln
2275 2280 2285
Pro His Pro Ile Ser Val Pro Ser Leu Pro Gln Ser Gln Thr Gln Leu
2290 2295 2300
Gly Pro Gln Pro Glu Val Thr Pro Lys Arg Gln Val Met Ala
2305 2310 2315
<210> 14
<211> 2471
<212> PRT
<213> Rattus norvegicus
<400> 14
Met Pro Ala Leu Arg Pro Ala Ala Leu Arg Ala Leu Leu Trp Leu Trp
1 5 10 15
Leu Cys Gly Ala Gly Pro Ala His Ala Leu Gln Cys Arg Gly Gly Gln
20 25 30
Glu Pro Cys Val Asn Glu Gly Thr Cys Val Thr Tyr His Asn Gly Thr
35 40 45
Gly Tyr Cys Arg Cys Pro Glu Gly Phe Leu Gly Glu Tyr Cys Gln His
50 55 60
Arg Asp Pro Cys Glu Lys Asn Arg Cys Gln Asn Gly Gly Thr Cys Val
65 70 75 80
Thr Gln Ala Met Leu Gly Lys Ala Thr Cys Arg Cys Ala Pro Gly Phe
85 90 95
Thr Gly Glu Asp Cys Gln Tyr Ser Thr Ser His Pro Cys Phe Val Ser
100 105 110
Arg Pro Cys Gln Asn Gly Gly Thr Cys His Met Leu Ser Trp Asp Thr
115 120 125
Tyr Glu Cys Thr Cys Gln Val Gly Phe Thr Gly Lys Gln Cys Gln Trp
130 135 140
Thr Asp Val Cys Leu Ser His Pro Cys Glu Asn Gly Ser Thr Cys Ser
145 150 155 160
Ser Val Ala Asn Gln Phe Ser Cys Arg Cys Pro Ala Gly Ile Thr Gly
165 170 175
Gln Lys Cys Asp Ala Asp Ile Asn Glu Cys Asp Ile Pro Gly Arg Cys
180 185 190
Gln His Gly Gly Thr Cys Leu Asn Leu Pro Gly Ser Tyr Arg Cys Gln
195 200 205
Cys Pro Gln Arg Phe Thr Gly Gln His Cys Asp Ser Pro Tyr Val Pro
210 215 220
Cys Ala Pro Ser Pro Cys Val Asn Gly Gly Thr Cys Arg Gln Thr Gly
225 230 235 240
Asp Phe Thr Ser Glu Cys His Cys Leu Pro Gly Phe Glu Gly Ser Asn
245 250 255
Cys Glu Arg Asn Ile Asp Asp Cys Pro Asn His Lys Cys Gln Asn Gly
260 265 270
Gly Val Cys Val Asp Gly Val Asn Thr Tyr Asn Cys Arg Cys Pro Pro
275 280 285
Gln Trp Thr Gly Gln Phe Cys Thr Glu Asp Val Asp Glu Cys Leu Leu
290 295 300
Gln Pro Asn Ala Cys Gln Asn Gly Gly Thr Cys Thr Asn Arg Asn Gly
305 310 315 320
Gly Tyr Gly Cys Val Cys Val Asn Gly Trp Ser Gly Asp Asp Cys Ser
325 330 335
Glu Asn Ile Asp Asp Cys Ala Phe Ala Ser Cys Thr Pro Gly Ser Thr
340 345 350
Cys Ile Asp Arg Val Ala Ser Phe Ser Cys Leu Cys Pro Glu Gly Lys
355 360 365
Ala Gly Leu Leu Cys His Leu Asp Asp Ala Cys Ile Ser Asn Pro Cys
370 375 380
His Lys Gly Ala Leu Cys Asp Thr Asn Pro Leu Asn Gly Gln Tyr Ile
385 390 395 400
Cys Thr Cys Pro Gln Ala Tyr Lys Gly Ala Asp Cys Thr Glu Asp Val
405 410 415
Asp Glu Cys Ala Met Ala Asn Ser Asn Pro Cys Glu His Ala Gly Lys
420 425 430
Cys Val Asn Thr Asp Gly Ala Phe His Cys Glu Cys Leu Lys Gly Tyr
435 440 445
Ala Gly Pro Arg Cys Glu Met Asp Ile Asn Glu Cys His Ser Asp Pro
450 455 460
Cys Gln Asn Asp Ala Thr Cys Leu Asp Lys Ile Gly Gly Phe Thr Cys
465 470 475 480
Leu Cys Met Pro Gly Phe Lys Gly Val His Cys Glu Leu Glu Val Asn
485 490 495
Glu Cys Gln Ser Asn Pro Cys Val Asn Asn Gly Gln Cys Val Asp Lys
500 505 510
Val Asn Arg Phe Gln Cys Leu Cys Pro Pro Gly Phe Thr Gly Pro Val
515 520 525
Cys Gln Ile Asp Ile Asp Asp Cys Ser Ser Thr Pro Cys Leu Asn Gly
530 535 540
Ala Lys Cys Ile Asp His Pro Asn Gly Tyr Glu Cys Gln Cys Ala Thr
545 550 555 560
Gly Phe Thr Gly Thr Leu Cys Asp Glu Asn Ile Asp Asn Cys Asp Pro
565 570 575
Asp Pro Cys His His Gly Gln Cys Gln Asp Gly Ile Asp Ser Tyr Thr
580 585 590
Cys Ile Cys Asn Pro Gly Tyr Met Gly Ala Ile Cys Ser Asp Gln Ile
595 600 605
Asp Glu Cys Tyr Ser Ser Pro Cys Leu Asn Asp Gly Arg Cys Ile Asp
610 615 620
Leu Val Asn Gly Tyr Gln Cys Asn Cys Gln Pro Gly Thr Ser Gly Leu
625 630 635 640
Asn Cys Glu Ile Asn Phe Asp Asp Cys Ala Ser Asn Pro Cys Leu His
645 650 655
Gly Ala Cys Val Asp Gly Ile Asn Arg Tyr Ser Cys Val Cys Ser Pro
660 665 670
Gly Phe Thr Gly Gln Arg Cys Asn Ile Asp Ile Asp Glu Cys Ala Ser
675 680 685
Asn Pro Cys Arg Lys Asp Ala Thr Cys Ile Asn Asp Val Asn Gly Phe
690 695 700
Arg Cys Met Cys Pro Glu Gly Pro His His Pro Ser Cys Tyr Ser Gln
705 710 715 720
Val Asn Glu Cys Leu Ser Ser Pro Cys Ile His Gly Asn Cys Thr Gly
725 730 735
Gly Leu Ser Gly Tyr Lys Cys Leu Cys Asp Ala Gly Trp Val Gly Ile
740 745 750
Asn Cys Glu Val Asp Lys Asn Glu Cys Leu Ser Asn Pro Cys Gln Asn
755 760 765
Gly Gly Thr Cys Asn Asn Leu Val Asn Gly Tyr Arg Cys Thr Cys Lys
770 775 780
Lys Gly Phe Lys Gly Tyr Asn Cys Gln Val Asn Ile Asp Glu Cys Ala
785 790 795 800
Ser Asn Pro Cys Leu Asn Gln Gly Thr Cys Leu Asp Asp Val Ser Gly
805 810 815
Tyr Thr Cys His Cys Met Leu Pro Tyr Thr Gly Lys Asn Cys Gln Thr
820 825 830
Val Leu Ala Pro Cys Ser Pro Asn Pro Cys Glu Asn Ala Ala Val Cys
835 840 845
Lys Glu Ala Pro Asn Phe Glu Ser Phe Thr Cys Leu Cys Ala Pro Gly
850 855 860
Trp Gln Gly Gln Arg Cys Thr Val Asp Val Asp Glu Cys Val Ser Lys
865 870 875 880
Pro Cys Met Asn Asn Gly Ile Cys His Asn Thr Gln Gly Ser Tyr Met
885 890 895
Cys Glu Cys Pro Pro Gly Phe Ser Gly Met Asp Cys Glu Glu Asp Ile
900 905 910
Asn Asp Cys Leu Ala Asn Pro Cys Gln Asn Gly Gly Ser Cys Val Asp
915 920 925
Lys Val Asn Thr Phe Ser Cys Leu Cys Leu Pro Gly Phe Val Gly Asp
930 935 940
Lys Cys Gln Thr Asp Met Asn Glu Cys Leu Ser Glu Pro Cys Lys Asn
945 950 955 960
Gly Gly Thr Cys Ser Asp Tyr Val Asn Ser Tyr Thr Cys Thr Cys Pro
965 970 975
Ala Gly Phe His Gly Val His Cys Glu Asn Asn Ile Asp Glu Cys Thr
980 985 990
Glu Ser Ser Cys Phe Asn Gly Gly Thr Cys Val Asp Gly Ile Asn Ser
995 1000 1005
Phe Ser Cys Leu Cys Pro Val Gly Phe Thr Gly Pro Phe Cys Leu His
1010 1015 1020
Asp Ile Asn Glu Cys Ser Ser Asn Pro Cys Leu Asn Ser Gly Thr Cys
1025 1030 1035 1040
Val Asp Gly Leu Gly Thr Tyr Arg Cys Thr Cys Pro Leu Gly Tyr Thr
1045 1050 1055
Gly Lys Asn Cys Gln Thr Leu Val Asn Leu Cys Ser Pro Ser Pro Cys
1060 1065 1070
Lys Asn Lys Gly Thr Cys Ala Gln Glu Lys Ala Arg Pro Arg Cys Leu
1075 1080 1085
Cys Pro Pro Gly Trp Asp Gly Ala Tyr Cys Asp Val Leu Asn Val Ser
1090 1095 1100
Cys Lys Ala Ala Ala Leu Gln Lys Gly Val Pro Val Glu His Leu Cys
1105 1110 1115 1120
Gln His Ser Gly Ile Cys Ile Asn Ala Gly Asn Thr His His Cys Gln
1125 1130 1135
Cys Pro Leu Gly Tyr Thr Gly Ser Tyr Cys Glu Glu Gln Leu Asp Glu
1140 1145 1150
Cys Ala Ser Asn Pro Cys Gln His Gly Ala Thr Cys Ser Asp Phe Ile
1155 1160 1165
Gly Gly Tyr Arg Cys Glu Cys Val Pro Gly Tyr Gln Gly Val Asn Cys
1170 1175 1180
Glu Tyr Glu Val Asp Glu Cys Gln Asn Gln Pro Cys Gln Asn Gly Gly
1185 1190 1195 1200
Thr Cys Ile Asp Leu Val Asn His Phe Lys Cys Ser Cys Pro Pro Gly
1205 1210 1215
Thr Arg Gly Leu Leu Cys Glu Glu Asn Ile Asp Asp Cys Ala Gly Ala
1220 1225 1230
Pro His Cys Leu Asn Gly Gly Gln Cys Val Asp Arg Ile Gly Gly Tyr
1235 1240 1245
Ser Cys Arg Cys Leu Pro Gly Phe Ala Gly Glu Arg Cys Glu Gly Asp
1250 1255 1260
Ile Asn Glu Cys Leu Ser Asn Pro Cys Ser Ser Glu Gly Ser Leu Asp
1265 1270 1275 1280
Cys Ile Gln Leu Lys Asn Asn Tyr Gln Cys Val Cys Arg Ser Ala Phe
1285 1290 1295
Thr Gly Arg His Cys Glu Thr Phe Leu Asp Val Cys Pro Gln Lys Pro
1300 1305 1310
Cys Leu Asn Gly Gly Thr Cys Ala Val Ala Ser Asn Val Pro Asp Gly
1315 1320 1325
Phe Ile Cys Arg Cys Pro Pro Gly Phe Ser Gly Ala Arg Cys Gln Ser
1330 1335 1340
Ser Cys Gly Gln Val Lys Cys Arg Arg Gly Glu Gln Cys Val His Thr
1345 1350 1355 1360
Ala Ser Gly Pro His Cys Phe Cys Pro Asn His Lys Asp Cys Glu Ser
1365 1370 1375
Gly Cys Ala Ser Asn Pro Cys Gln His Gly Gly Thr Cys Tyr Pro Gln
1380 1385 1390
Arg Gln Pro Pro Tyr Tyr Ser Cys Arg Cys Ser Pro Pro Phe Trp Gly
1395 1400 1405
Ser His Cys Glu Ser Tyr Thr Ala Pro Thr Ser Thr Pro Pro Ala Thr
1410 1415 1420
Cys Leu Ser Gln Tyr Cys Ala Asp Lys Ala Arg Asp Gly Ile Cys Asp
1425 1430 1435 1440
Glu Ala Cys Asn Ser His Ala Cys Gln Trp Asp Gly Gly Asp Cys Ser
1445 1450 1455
Leu Thr Met Glu Asp Pro Trp Ala Asn Cys Thr Ser Ser Leu Arg Cys
1460 1465 1470
Trp Glu Tyr Ile Asn Asn Gln Cys Asp Glu Leu Cys Asn Thr Ala Glu
1475 1480 1485
Cys Leu Phe Asp Asn Phe Glu Cys Gln Arg Asn Ser Lys Thr Cys Lys
1490 1495 1500
Tyr Asp Lys Tyr Cys Ala Asp His Phe Lys Asp Asn His Cys Asp Lys
1505 1510 1515 1520
Gly Cys Asn Asn Glu Glu Cys Gly Trp Asp Gly Leu Asp Cys Ala Ala
1525 1530 1535
Asp Gln Pro Glu Asn Leu Ala Glu Gly Ile Leu Val Ile Val Val Leu
1540 1545 1550
Leu Pro Pro Glu Gln Leu Leu Gln Asp Ser Arg Ser Phe Leu Arg Ala
1555 1560 1565
Leu Gly Thr Leu Leu His Thr Asn Leu Arg Ile Lys Gln Asp Ser Gln
1570 1575 1580
Gly Ala Leu Met Val Tyr Pro Tyr Tyr Gly Glu Lys Ser Ala Ala Met
1585 1590 1595 1600
Lys Lys Gln Lys Val Ala Arg Arg Ser Leu Pro Asp Glu Gln Glu Gln
1605 1610 1615
Glu Ile Ile Gly Ser Lys Val Phe Leu Glu Ile Asp Asn Arg Gln Cys
1620 1625 1630
Val Gln Asp Ser Asp Gln Cys Phe Lys Asn Thr Asp Ala Ala Ala Ala
1635 1640 1645
Leu Leu Ala Ser His Ala Ile Gln Gly Thr Leu Ser Tyr Pro Leu Val
1650 1655 1660
Ser Val Val Ser Glu Ser Glu Asp Pro Arg Asn Thr Pro Leu Leu Tyr
1665 1670 1675 1680
Leu Leu Ala Val Ala Val Val Ile Ile Leu Phe Leu Ile Leu Leu Gly
1685 1690 1695
Val Ile Met Ala Lys Arg Lys Arg Lys His Gly Phe Leu Trp Leu Pro
1700 1705 1710
Glu Gly Phe Thr Leu Arg Arg Asp Ser Ser Asn His Lys Arg Arg Glu
1715 1720 1725
Pro Val Gly Gln Asp Ala Val Gly Leu Lys Asn Leu Ser Val Gln Val
1730 1735 1740
Ser Glu Ala Asn Leu Ile Gly Ser Thr Thr Ser Glu His Trp Gly Asp
1745 1750 1755 1760
Asp Glu Gly Pro Gln Pro Lys Lys Ala Lys Ala Glu Asp Asp Glu Ala
1765 1770 1775
Leu Leu Ser Glu Asp Asp Pro Val Asp Arg Arg Pro Trp Thr Gln Gln
1780 1785 1790
His Leu Glu Ala Ala Asp Ile Arg Arg Thr Pro Ser Leu Ala Leu Thr
1795 1800 1805
Pro Pro Gln Ala Glu Gln Glu Val Asp Val Leu Asp Val Asn Val Arg
1810 1815 1820
Gly Pro Asp Gly Cys Thr Pro Leu Met Leu Ala Ser Leu Arg Gly Gly
1825 1830 1835 1840
Ser Ser Asp Leu Ser Asp Glu Asp Glu Asp Ala Glu Asp Ser Ser Ala
1845 1850 1855
Asn Ile Ile Thr Asp Leu Val Tyr Gln Gly Ala Ser Leu Gln Ala Gln
1860 1865 1870
Thr Asp Arg Thr Gly Glu Met Ala Leu His Leu Ala Ala Arg Tyr Ser
1875 1880 1885
Arg Ala Asp Ala Ala Lys Arg Leu Leu Asp Ala Gly Ala Asp Ala Asn
1890 1895 1900
Ala Gln Asp Asn Met Gly Arg Cys Pro Leu His Ala Ala Val Ala Ala
1905 1910 1915 1920
Asp Ala Gln Gly Val Phe Gln Ile Leu Ile Arg Asn Arg Val Thr Asp
1925 1930 1935
Leu Asp Ala Arg Met Asn Asp Gly Thr Thr Pro Leu Ile Leu Ala Ala
1940 1945 1950
Arg Leu Ala Val Glu Gly Met Val Ala Glu Leu Ile Asn Cys Gln Ala
1955 1960 1965
Asp Val Asn Ala Val Asp Asp His Gly Lys Ser Ala Leu His Trp Ala
1970 1975 1980
Ala Ala Val Asn Asn Val Glu Ala Thr Leu Leu Leu Leu Lys Asn Gly
1985 1990 1995 2000
Ala Asn Arg Asp Met Gln Asp Asn Lys Glu Glu Thr Pro Leu Phe Leu
2005 2010 2015
Ala Ala Arg Glu Gly Ser Tyr Glu Ala Ala Lys Ile Leu Leu Asp His
2020 2025 2030
Phe Ala Asn Arg Asp Ile Thr Asp His Met Asp Arg Leu Pro Arg Asp
2035 2040 2045
Val Ala Arg Asp Arg Met His His Asp Ile Val Arg Leu Leu Asp Glu
2050 2055 2060
Tyr Asn Val Thr Pro Ser Pro Pro Gly Thr Val Leu Thr Ser Ala Leu
2065 2070 2075 2080
Ser Pro Val Leu Cys Gly Pro Asn Arg Ser Phe Leu Ser Leu Lys His
2085 2090 2095
Thr Pro Met Gly Lys Lys Ala Arg Arg Pro Asn Thr Lys Ser Thr Met
2100 2105 2110
Pro Thr Ser Leu Pro Asn Leu Ala Lys Glu Ala Lys Asp Val Lys Gly
2115 2120 2125
Ser Arg Arg Lys Lys Cys Leu Asn Glu Lys Val Gln Leu Ser Glu Ser
2130 2135 2140
Ser Val Thr Leu Ser Pro Val Asp Ser Leu Glu Ser Pro His Thr Tyr
2145 2150 2155 2160
Val Ser Asp Ala Thr Ser Ser Pro Met Ile Thr Ser Pro Gly Ile Leu
2165 2170 2175
Gln Ala Ser Pro Thr Pro Leu Leu Ala Ala Ala Pro Ala Ala Pro Val
2180 2185 2190
His Ala Gln His Ala Leu Ser Phe Ser Asn Leu His Glu Met Gln Pro
2195 2200 2205
Leu Arg Pro Gly Ala Ser Thr Val Leu Pro Ser Val Ser Gln Leu Leu
2210 2215 2220
Ser His His His Ile Val Pro Pro Gly Ser Gly Ser Ala Gly Ser Leu
2225 2230 2235 2240
Gly Arg Leu His Ser Val Pro Val Pro Ser Asp Trp Met Asn Arg Val
2245 2250 2255
Glu Met Ser Glu Thr Gln Tyr Ser Glu Met Phe Gly Met Val Leu Ala
2260 2265 2270
Pro Ala Glu Gly Thr His Pro Gly Met Ala Ala Pro Gln Ser Arg Ala
2275 2280 2285
Pro Glu Gly Lys Pro Ile Pro Thr Gln Arg Glu Pro Leu Pro Pro Ile
2290 2295 2300
Val Thr Phe Gln Leu Ile Pro Lys Gly Ser Leu Ala Gln Ala Ala Gly
2305 2310 2315 2320
Ala Pro Gln Thr Gln Ser Gly Cys Pro Pro Ala Val Ala Gly Pro Leu
2325 2330 2335
Pro Ser Met Tyr Gln Ile Pro Glu Met Ala Arg Leu Pro Ser Val Ala
2340 2345 2350
Phe Pro Pro Thr Met Met Pro Gln Gln Glu Gly Gln Val Ala Gln Thr
2355 2360 2365
Ile Val Pro Thr Tyr His Pro Phe Pro Ala Ser Val Gly Lys Tyr Pro
2370 2375 2380
Thr Pro Pro Ser Gln His Ser Tyr Ala Ser Ser Asn Ala Ala Glu Arg
2385 2390 2395 2400
Thr Pro Asn His Gly Gly His Leu Gln Gly Glu His Pro Tyr Leu Thr
2405 2410 2415
Pro Ser Pro Glu Ser Pro Asp Gln Trp Ser Ser Ser Ser Pro His Ser
2420 2425 2430
Ala Ser Asp Trp Ser Asp Val Thr Thr Ser Pro Thr Pro Gly Gly Gly
2435 2440 2445
Gly Gly Gly Gln Arg Gly Pro Gly Thr His Met Ser Glu Pro Pro His
2450 2455 2460
Ser Asn Met Gln Val Tyr Ala
2465 2470
<210> 15
<211> 2319
<212> PRT
<213> Rattus norvegicus
<400> 15
Met Gly Pro Gly Ala Arg Gly Arg Arg Arg Arg Arg Arg Leu Met Ala
1 5 10 15
Leu Pro Pro Pro Pro Pro Pro Met Arg Ala Leu Pro Leu Leu Leu Leu
20 25 30
Leu Leu Ala Gly Leu Gly Ala Ala Ala Pro Pro Cys Leu Asp Gly Ser
35 40 45
Pro Cys Ala Asn Gly Gly Arg Cys Thr His Gln Gln Pro Ser Arg Glu
50 55 60
Ala Ala Cys Leu Cys Leu Pro Gly Trp Val Gly Glu Arg Cys Gln Leu
65 70 75 80
Glu Asp Pro Cys His Ser Gly Pro Cys Ala Gly Arg Gly Val Cys Gln
85 90 95
Ser Ser Val Val Ala Gly Val Ala Arg Phe Ser Cys Arg Cys Leu Arg
100 105 110
Gly Phe Arg Gly Pro Asp Cys Ser Leu Pro Asp Pro Cys Phe Ser Ser
115 120 125
Pro Cys Ala His Gly Ala Pro Cys Ser Val Gly Ser Asp Gly Arg Tyr
130 135 140
Ala Cys Ala Cys Pro Pro Gly Tyr Gln Gly Arg Asn Cys Arg Ser Asp
145 150 155 160
Ile Asp Glu Cys Arg Ala Gly Ala Ser Cys Arg His Gly Gly Thr Cys
165 170 175
Ile Asn Thr Pro Gly Ser Phe His Cys Leu Cys Pro Leu Gly Tyr Thr
180 185 190
Gly Leu Leu Cys Glu Asn Pro Ile Val Pro Cys Ala Pro Ser Pro Cys
195 200 205
Arg Asn Gly Gly Thr Cys Arg Gln Ser Ser Asp Val Thr Tyr Asp Cys
210 215 220
Ala Cys Leu Pro Gly Phe Glu Gly Gln Asn Cys Glu Val Asn Val Asp
225 230 235 240
Asp Cys Pro Gly His Arg Cys Leu Asn Gly Gly Thr Cys Val Asp Gly
245 250 255
Val Asn Thr Tyr Asn Cys Gln Cys Pro Pro Glu Trp Thr Gly Gln Phe
260 265 270
Cys Thr Glu Asp Val Asp Glu Cys Gln Leu Gln Pro Asn Ala Cys His
275 280 285
Asn Gly Gly Thr Cys Phe Asn Leu Leu Gly Gly His Ser Cys Val Cys
290 295 300
Val Asn Gly Trp Thr Gly Glu Ser Cys Ser Gln Asn Ile Asp Asp Cys
305 310 315 320
Ala Thr Ala Val Cys Phe His Gly Ala Thr Cys His Asp Arg Val Ala
325 330 335
Ser Phe Tyr Cys Ala Cys Pro Met Gly Lys Thr Gly Leu Leu Cys His
340 345 350
Leu Asp Asp Ala Cys Val Ser Asn Pro Cys His Glu Asp Ala Ile Cys
355 360 365
Asp Thr Asn Pro Val Ser Gly Arg Ala Ile Cys Thr Cys Pro Pro Gly
370 375 380
Phe Thr Gly Gly Ala Cys Asp Gln Asp Val Asp Glu Cys Ser Ile Gly
385 390 395 400
Ala Asn Pro Cys Glu His Leu Gly Arg Cys Val Asn Thr Gln Gly Ser
405 410 415
Phe Leu Cys Gln Cys Gly Arg Gly Tyr Thr Gly Pro Arg Cys Glu Thr
420 425 430
Asp Val Asn Glu Cys Leu Ser Gly Pro Cys Arg Asn Gln Ala Thr Cys
435 440 445
Leu Asp Arg Ile Gly Gln Phe Thr Cys Ile Cys Met Ala Gly Phe Thr
450 455 460
Gly Thr Phe Cys Glu Val Asp Ile Asp Glu Cys Gln Ser Ser Pro Cys
465 470 475 480
Val Asn Gly Gly Val Cys Lys Asp Arg Val Asn Gly Phe Ser Cys Thr
485 490 495
Cys Pro Ser Gly Phe Ser Gly Ser Thr Cys Gln Leu Asp Val Asp Glu
500 505 510
Cys Ala Ser Thr Pro Cys Arg Asn Gly Ala Lys Cys Val Asp Gln Pro
515 520 525
Asp Gly Tyr Glu Cys Arg Cys Ala Glu Gly Phe Glu Gly Thr Leu Cys
530 535 540
Glu Arg Asn Val Asp Asp Cys Ser Pro Asp Pro Cys His His Gly Arg
545 550 555 560
Cys Val Asp Gly Ile Ala Ser Phe Ser Cys Ala Cys Ala Pro Gly Tyr
565 570 575
Thr Gly Ile Arg Cys Glu Ser Gln Val Asp Glu Cys Arg Ser Gln Pro
580 585 590
Cys Arg Tyr Gly Gly Lys Cys Leu Asp Leu Val Asp Lys Tyr Leu Cys
595 600 605
Arg Cys Pro Pro Gly Thr Thr Gly Val Asn Cys Glu Val Asn Ile Asp
610 615 620
Asp Cys Ala Ser Asn Pro Cys Thr Phe Gly Val Cys Arg Asp Gly Ile
625 630 635 640
Asn Arg Tyr Asp Cys Val Cys Gln Pro Gly Phe Thr Gly Pro Leu Cys
645 650 655
Asn Val Glu Ile Asn Glu Cys Ala Ser Ser Pro Cys Gly Glu Gly Gly
660 665 670
Ser Cys Val Asp Gly Glu Asn Gly Phe His Cys Leu Cys Pro Pro Gly
675 680 685
Ser Leu Pro Pro Leu Cys Leu Pro Ala Asn His Pro Cys Ala His Lys
690 695 700
Pro Cys Ser His Gly Val Cys His Asp Ala Pro Gly Gly Phe Gln Cys
705 710 715 720
Val Cys Asp Pro Gly Trp Ser Gly Pro Arg Cys Ser Gln Ser Leu Ala
725 730 735
Pro Asp Ala Cys Glu Ser Gln Pro Cys Gln Ala Gly Gly Thr Cys Thr
740 745 750
Ser Asp Gly Ile Gly Phe His Cys Thr Cys Ala Pro Gly Phe Gln Gly
755 760 765
His Gln Cys Glu Val Leu Ser Pro Cys Thr Pro Ser Leu Cys Glu His
770 775 780
Gly Gly His Cys Glu Ser Asp Pro Asp Gln Leu Thr Val Cys Ser Cys
785 790 795 800
Pro Pro Gly Trp Gln Gly Pro Arg Cys Gln Gln Asp Val Asp Glu Cys
805 810 815
Ala Gly Ala Ser Pro Cys Gly Pro His Gly Thr Cys Thr Asn Leu Pro
820 825 830
Gly Ser Phe Arg Cys Ile Cys His Gly Gly Tyr Thr Gly Pro Phe Cys
835 840 845
Asp Gln Asp Ile Asp Asp Cys Asp Pro Asn Pro Cys Leu Asn Gly Gly
850 855 860
Ser Cys Gln Asp Gly Val Gly Ser Phe Ser Cys Ser Cys Leu Ser Gly
865 870 875 880
Phe Ala Gly Pro Arg Cys Ala Arg Asp Val Asp Glu Cys Leu Ser Ser
885 890 895
Pro Cys Gly Pro Gly Thr Cys Thr Asp His Val Ala Ser Phe Thr Cys
900 905 910
Thr Cys Pro Pro Gly Tyr Gly Gly Phe His Cys Glu Thr Asp Leu Leu
915 920 925
Asp Cys Ser Pro Ser Ser Cys Phe Asn Gly Gly Thr Cys Val Asp Gly
930 935 940
Val Asn Ser Phe Ser Cys Leu Cys Arg Pro Gly Tyr Thr Gly Thr His
945 950 955 960
Cys Gln Tyr Lys Val Asp Pro Cys Phe Ser Arg Pro Cys Leu His Gly
965 970 975
Gly Ile Cys Asn Pro Thr His Ser Gly Phe Glu Cys Thr Cys Arg Glu
980 985 990
Gly Phe Thr Gly Asn Gln Cys Gln Asn Pro Val Asp Trp Cys Ser Gln
995 1000 1005
Ala Pro Cys Gln Asn Gly Gly Arg Cys Val Gln Thr Gly Ala Tyr Cys
1010 1015 1020
Ile Cys Pro Pro Glu Trp Ser Gly Pro Leu Cys Asp Ile Pro Ser Leu
1025 1030 1035 1040
Pro Cys Thr Glu Ala Ala Ala His Met Gly Val Arg Leu Glu Gln Leu
1045 1050 1055
Cys Gln Ala Gly Gly Gln Cys Ile Asp Lys Asp His Ser His Tyr Cys
1060 1065 1070
Val Cys Pro Glu Gly Arg Met Gly Ser His Cys Glu Gln Glu Val Asp
1075 1080 1085
Pro Cys Thr Ala Gln Pro Cys Gln His Gly Gly Thr Cys Arg Gly Tyr
1090 1095 1100
Met Gly Gly Tyr Val Cys Glu Cys Pro Thr Gly Tyr Ser Gly Asp Ser
1105 1110 1115 1120
Cys Glu Asp Asp Val Asp Glu Cys Ala Ser Gln Pro Cys Gln Asn Gly
1125 1130 1135
Gly Ser Cys Ile Asp Leu Val Ala His Tyr Leu Cys Ser Cys Pro Pro
1140 1145 1150
Gly Thr Leu Gly Val Leu Cys Glu Ile Asn Glu Asp Asp Cys Gly Pro
1155 1160 1165
Gly Pro Ser Leu Asp Ser Gly Leu Arg Cys Leu His Asn Gly Thr Cys
1170 1175 1180
Val Asp Leu Val Gly Gly Phe Arg Cys Asn Cys Pro Pro Gly Tyr Thr
1185 1190 1195 1200
Gly Leu His Cys Glu Ala Asp Ile Asn Glu Cys Arg Pro Gly Thr Cys
1205 1210 1215
His Ala Ala His Thr Arg Asp Cys Leu Gln Asp Pro Gly Gly His Phe
1220 1225 1230
Arg Cys Ile Cys Leu Pro Gly Phe Thr Gly Pro Arg Cys Gln Thr Ala
1235 1240 1245
Leu Phe Pro Cys Glu Ser Gln Pro Cys Gln His Gly Gly Gln Cys Arg
1250 1255 1260
Pro Ser Leu Gly Arg Gly Gly Gly Leu Thr Phe Thr Cys His Cys Val
1265 1270 1275 1280
Gln Pro Phe Trp Gly Leu Arg Cys Glu Arg Val Ala Arg Ser Cys Arg
1285 1290 1295
Glu Leu Gln Cys Pro Val Gly Ile Pro Cys Gln Gln Thr Ala Arg Gly
1300 1305 1310
Pro Arg Cys Ala Cys Pro Pro Gly Leu Ser Gly Pro Ser Cys Arg Val
1315 1320 1325
Ser Arg Ala Ser Pro Ser Gly Ala Thr Asn Thr Ser Cys Ala Ala Thr
1330 1335 1340
Pro Cys Leu His Gly Gly Ser Cys Leu Pro Val Gln Ser Val Pro Phe
1345 1350 1355 1360
Phe Arg Cys Val Cys Ala Pro Gly Trp Gly Gly Pro Arg Cys Glu Thr
1365 1370 1375
Pro Ser Ala Ala Pro Glu Val Pro Glu Glu Pro Arg Cys Pro Arg Ala
1380 1385 1390
Ala Cys Gln Ala Lys Arg Gly Asp Gln Asn Cys Asp Arg Glu Cys Asn
1395 1400 1405
Ser Pro Gly Cys Gly Trp Asp Gly Gly Asp Cys Ser Leu Asn Val Asp
1410 1415 1420
Asp Pro Trp Arg Gln Cys Glu Ala Leu Gln Cys Trp Arg Leu Phe Asn
1425 1430 1435 1440
Asn Ser Arg Cys Asp Pro Ala Cys Ser Ser Pro Ala Cys Leu Tyr Asp
1445 1450 1455
Asn Phe Asp Cys Tyr Ser Gly Gly Arg Asp Arg Thr Cys Asn Pro Val
1460 1465 1470
Tyr Lys Lys Tyr Cys Ala Asp His Phe Ala Asp Gly Arg Cys Asp Gln
1475 1480 1485
Gly Cys Asn Thr Glu Glu Cys Gly Trp Asp Gly Leu Asp Cys Ala Ser
1490 1495 1500
Glu Val Pro Ala Leu Leu Ala Arg Gly Val Leu Val Leu Thr Val Leu
1505 1510 1515 1520
Leu Pro Pro Glu Glu Leu Leu Arg Ser Ser Ala Asp Phe Leu Gln Arg
1525 1530 1535
Leu Ser Ala Ile Leu Arg Thr Ser Leu Arg Phe Arg Leu Asp Ala Arg
1540 1545 1550
Gly Gln Ala Met Val Phe Pro Tyr His Arg Pro Ser Pro Gly Ser Glu
1555 1560 1565
Ser Arg Val Arg Arg Glu Leu Gly Pro Glu Val Ile Gly Ser Val Val
1570 1575 1580
Met Leu Glu Ile Asp Asn Arg Leu Cys Leu Lys Ser Ala Glu Asn Asp
1585 1590 1595 1600
His Cys Phe Pro Asp Ala Gln Ser Ala Ala Asp Tyr Leu Gly Ala Leu
1605 1610 1615
Ser Ala Val Glu Arg Leu Asp Phe Pro Tyr Pro Leu Arg Asp Val Arg
1620 1625 1630
Gly Glu Pro Leu Glu Pro Pro Glu Gln Ser Val Pro Leu Leu Pro Leu
1635 1640 1645
Leu Val Ala Gly Ala Val Phe Leu Leu Val Ile Phe Val Leu Gly Val
1650 1655 1660
Met Val Ala Arg Arg Lys Arg Glu His Ser Thr Leu Trp Phe Pro Glu
1665 1670 1675 1680
Gly Phe Ala Leu His Lys Asp Ile Ala Ala Gly His Lys Gly Arg Arg
1685 1690 1695
Glu Pro Val Gly Gln Asp Ala Leu Gly Met Lys Asn Met Thr Lys Gly
1700 1705 1710
Glu Ser Leu Met Gly Glu Val Ala Thr Asp Trp Asn Asp Ser Glu Cys
1715 1720 1725
Pro Glu Ala Lys Arg Leu Lys Val Glu Glu Pro Gly Met Gly Ala Glu
1730 1735 1740
Glu Pro Val Asp Cys Arg Gln Trp Thr Gln His His Leu Val Ala Ala
1745 1750 1755 1760
Asp Ile Arg Val Ala Pro Ala Met Ala Leu Thr Pro Pro Gln Gly Asp
1765 1770 1775
Ala Asp Ala Asp Gly Met Asp Val Asn Val Arg Gly Pro Asp Gly Phe
1780 1785 1790
Thr Pro Leu Met Leu Ala Ser Phe Cys Gly Gly Ala Leu Glu Pro Met
1795 1800 1805
Pro Ala Glu Glu Asp Glu Ala Asp Asp Thr Ser Ala Ser Ile Ile Ser
1810 1815 1820
Asp Leu Ile Cys Gln Gly Ala Gln Leu Gly Ala Arg Thr Asp Arg Thr
1825 1830 1835 1840
Gly Glu Thr Ala Leu His Leu Ala Ala Arg Tyr Ala Arg Ala Asp Ala
1845 1850 1855
Ala Lys Arg Leu Leu Asp Ala Gly Ala Asp Thr Asn Ala Gln Asp His
1860 1865 1870
Ser Gly Arg Thr Pro Leu His Thr Ala Val Thr Ala Asp Ala Gln Gly
1875 1880 1885
Val Phe Gln Ile Leu Ile Arg Asn Arg Ser Thr Asp Leu Asp Ala Arg
1890 1895 1900
Met Ala Asp Gly Ser Thr Ala Leu Ile Leu Ala Ala Arg Leu Ala Val
1905 1910 1915 1920
Glu Gly Met Val Glu Glu Leu Ile Ala Ser His Ala Asp Val Asn Ala
1925 1930 1935
Val Asp Glu Leu Gly Lys Ser Ala Leu His Trp Ala Ala Ala Val Asn
1940 1945 1950
Asn Val Glu Ala Thr Leu Ala Leu Leu Lys Asn Gly Ala Asn Lys Asp
1955 1960 1965
Met Gln Asp Ser Lys Glu Glu Thr Pro Leu Phe Leu Ala Ala Arg Glu
1970 1975 1980
Gly Ser Tyr Glu Ala Ala Lys Leu Leu Leu Asp His Phe Ala Asn Arg
1985 1990 1995 2000
Glu Ile Thr Asp His Leu Asp Arg Leu Pro Arg Asp Val Ala Gln Glu
2005 2010 2015
Arg Leu His Gln Asp Ile Val Arg Leu Leu Asp Gln Pro Ser Gly Pro
2020 2025 2030
Arg Ser Pro Ser Gly Pro His Gly Leu Gly Pro Leu Leu Cys Pro Pro
2035 2040 2045
Gly Ala Phe Leu Pro Gly Leu Lys Ala Val Gln Ser Gly Thr Lys Lys
2050 2055 2060
Ser Arg Arg Pro Pro Gly Lys Thr Gly Leu Gly Pro Gln Gly Thr Arg
2065 2070 2075 2080
Gly Arg Gly Lys Lys Leu Thr Leu Ala Cys Pro Gly Pro Leu Ala Asp
2085 2090 2095
Ser Ser Val Thr Leu Ser Pro Val Asp Ser Leu Asp Ser Pro Arg Pro
2100 2105 2110
Phe Gly Gly Pro Pro Ala Ser Pro Gly Gly Phe Pro Leu Glu Gly Pro
2115 2120 2125
Tyr Ala Thr Thr Ala Thr Thr Val Ser Leu Ala Gln Leu Gly Ala Ser
2130 2135 2140
Arg Ala Gly Pro Leu Gly Arg Gln Pro Pro Gly Gly Cys Val Leu Ser
2145 2150 2155 2160
Leu Gly Leu Leu Asn Pro Val Ala Val Pro Leu Asp Trp Ala Arg Leu
2165 2170 2175
Pro Pro Pro Ala Pro Pro Gly Pro Ser Phe Leu Leu Pro Leu Ala Pro
2180 2185 2190
Gly Ser Gln Leu Leu Asn Pro Ala Thr Pro Val Ser Pro His Glu Arg
2195 2200 2205
Pro Pro Pro Tyr Leu Ala Ala Pro Gly His Gly Glu Glu Tyr Pro Ala
2210 2215 2220
Ala Gly Thr His Ser Ser Pro Thr Lys Ala Arg Phe Leu Arg Val Pro
2225 2230 2235 2240
Ser Glu His Pro Tyr Leu Thr Pro Ser Pro Glu Ser Pro Glu His Trp
2245 2250 2255
Ala Ser Pro Ser Pro Pro Ser Leu Ser Asp Trp Ser Asp Ser Thr Pro
2260 2265 2270
Ser Pro Ala Thr Ala Thr Ser Ala Thr Ala Ala Gly Ala Leu Pro Ala
2275 2280 2285
Gln Pro His Pro Ile Ser Val Pro Ser Leu Pro Gln Ser Gln Thr Gln
2290 2295 2300
Leu Gly Pro Gln Pro Glu Val Thr Pro Lys Arg Gln Val Met Ala
2305 2310 2315
<210> 16
<211> 333
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 16
Ile Leu Asp Tyr Ser Phe Thr Gly Gly Ala Gly Arg Asp Ile Pro Pro
1 5 10 15
Pro Gln Ile Glu Glu Ala Cys Glu Leu Pro Glu Cys Gln Val Asp Ala
20 25 30
Gly Asn Lys Val Cys Asn Leu Gln Cys Asn Asn His Ala Cys Gly Trp
35 40 45
Asp Gly Gly Asp Cys Ser Leu Asn Phe Asn Asp Pro Trp Lys Asn Cys
50 55 60
Thr Gln Ser Leu Gln Cys Trp Lys Tyr Phe Ser Asp Gly His Cys Asp
65 70 75 80
Ser Gln Cys Asn Ser Ala Gly Cys Leu Phe Asp Gly Phe Asp Cys Gln
85 90 95
Leu Thr Glu Gly Gln Cys Asn Pro Leu Tyr Asp Gln Tyr Cys Lys Asp
100 105 110
His Phe Ser Asp Gly His Cys Asp Gln Gly Cys Asn Ser Ala Glu Cys
115 120 125
Glu Trp Asp Gly Leu Asp Cys Ala Glu His Val Pro Glu Arg Leu Ala
130 135 140
Ala Gly Thr Leu Val Leu Val Val Leu Leu Pro Pro Asp Gln Leu Arg
145 150 155 160
Asn Asn Ser Phe His Phe Leu Arg Glu Leu Ser His Val Leu His Thr
165 170 175
Asn Val Val Phe Lys Arg Asp Ala Gln Gly Gln Gln Met Ile Phe Pro
180 185 190
Tyr Tyr Gly His Glu Glu Glu Leu Arg Lys His Pro Ile Lys Arg Ser
195 200 205
Thr Val Gly Trp Ala Thr Ser Ser Leu Leu Pro Gly Thr Ser Gly Gly
210 215 220
Arg Gln Arg Arg Glu Leu Asp Pro Met Asp Ile Arg Gly Ser Ile Val
225 230 235 240
Tyr Leu Glu Ile Asp Asn Arg Gln Cys Val Gln Ser Ser Ser Gln Cys
245 250 255
Phe Gln Ser Ala Thr Asp Val Ala Ala Phe Leu Gly Ala Leu Ala Ser
260 265 270
Leu Gly Ser Leu Asn Ile Pro Tyr Lys Ile Glu Ala Val Lys Ser Glu
275 280 285
Pro Val Glu Pro Pro Leu Pro Ser Gln Leu His Leu Met Tyr Val Ala
290 295 300
Ala Ala Ala Phe Val Leu Leu Phe Phe Val Gly Cys Gly Val Leu Leu
305 310 315 320
Ser Arg Lys Arg Arg Arg Gln Leu Cys Ile Gln Lys Leu
325 330
<210> 17
<211> 370
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 17
Pro Cys Val Gly Ser Asn Pro Cys Tyr Asn Gln Gly Thr Cys Glu Pro
1 5 10 15
Thr Ser Glu Asn Pro Phe Tyr Arg Cys Leu Cys Pro Ala Lys Phe Asn
20 25 30
Gly Leu Leu Cys His Ile Leu Asp Tyr Ser Phe Thr Gly Gly Ala Gly
35 40 45
Arg Asp Ile Pro Pro Pro Gln Ile Glu Glu Ala Cys Glu Leu Pro Glu
50 55 60
Cys Gln Val Asp Ala Gly Asn Lys Val Cys Asn Leu Gln Cys Asn Asn
65 70 75 80
His Ala Cys Gly Trp Asp Gly Gly Asp Cys Ser Leu Asn Phe Asn Asp
85 90 95
Pro Trp Lys Asn Cys Thr Gln Ser Leu Gln Cys Trp Lys Tyr Phe Ser
100 105 110
Asp Gly His Cys Asp Ser Gln Cys Asn Ser Ala Gly Cys Leu Phe Asp
115 120 125
Gly Phe Asp Cys Gln Leu Thr Glu Gly Gln Cys Asn Pro Leu Tyr Asp
130 135 140
Gln Tyr Cys Lys Asp His Phe Ser Asp Gly His Cys Asp Gln Gly Cys
145 150 155 160
Asn Ser Ala Glu Cys Glu Trp Asp Gly Leu Asp Cys Ala Glu His Val
165 170 175
Pro Glu Arg Leu Ala Ala Gly Thr Leu Val Leu Val Val Leu Leu Pro
180 185 190
Pro Asp Gln Leu Arg Asn Asn Ser Phe His Phe Leu Arg Glu Leu Ser
195 200 205
His Val Leu His Thr Asn Val Val Phe Lys Arg Asp Ala Gln Gly Gln
210 215 220
Gln Met Ile Phe Pro Tyr Tyr Gly His Glu Glu Glu Leu Arg Lys His
225 230 235 240
Pro Ile Lys Arg Ser Thr Val Gly Trp Ala Thr Ser Ser Leu Leu Pro
245 250 255
Gly Thr Ser Gly Gly Arg Gln Arg Arg Glu Leu Asp Pro Met Asp Ile
260 265 270
Arg Gly Ser Ile Val Tyr Leu Glu Ile Asp Asn Arg Gln Cys Val Gln
275 280 285
Ser Ser Ser Gln Cys Phe Gln Ser Ala Thr Asp Val Ala Ala Phe Leu
290 295 300
Gly Ala Leu Ala Ser Leu Gly Ser Leu Asn Ile Pro Tyr Lys Ile Glu
305 310 315 320
Ala Val Lys Ser Glu Pro Val Glu Pro Pro Leu Pro Ser Gln Leu His
325 330 335
Leu Met Tyr Val Ala Ala Ala Ala Phe Val Leu Leu Phe Phe Val Gly
340 345 350
Cys Gly Val Leu Leu Ser Arg Lys Arg Arg Arg Gln Leu Cys Ile Gln
355 360 365
Lys Leu
370
<210> 18
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 18
Arg Met Phe Pro Asn Ala Pro Tyr Leu
1 5
<210> 19
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 19
Lys Leu Val Val Val Gly Ala Gly Gly Val
1 5 10
<210> 20
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 20
Lys Leu Val Val Val Gly Ala Val Gly Val
1 5 10
<210> 21
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 21
Lys Leu Val Val Val Gly Ala Cys Gly Val
1 5 10
<210> 22
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 22
Lys Leu Val Val Val Gly Ala Asp Gly Val
1 5 10
<210> 23
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 23
Val Val Gly Ala Val Gly Val Gly Lys
1 5
<210> 24
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 24
Val Val Gly Ala Cys Gly Val Gly Lys
1 5
<210> 25
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 25
Val Val Gly Ala Gly Gly Val Gly Lys
1 5
<210> 26
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 26
Lys Ile Thr Asp Phe Gly Leu Ala Lys
1 5
<210> 27
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 27
Lys Ile Thr Asp Phe Gly Arg Ala Lys
1 5
<210> 28
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 28
Val Leu Gln Glu Leu Asn Val Thr Val
1 5
<210> 29
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 29
Glu Ala Asp Pro Thr Gly His Ser Tyr
1 5
<210> 30
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 30
Phe Leu Trp Gly Pro Arg Ala Leu Val
1 5
<210> 31
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 31
Leu Leu Gly Arg Asn Ser Phe Glu Val
1 5
<210> 32
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 32
Ser Thr Thr Pro Pro Pro Gly Thr Arg Val
1 5 10
<210> 33
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 33
Arg Met Pro Glu Ala Ala Pro Pro Val
1 5
<210> 34
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 34
Gly Leu Ala Pro Pro Gln His Leu Ile Arg Val
1 5 10
<210> 35
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 35
Glu Leu Ala Gly Ile Gly Ile Leu Thr Val
1 5 10
<210> 36
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 36
Glu Ala Ala Gly Ile Gly Ile Leu Thr Val
1 5 10
<210> 37
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 37
Ile Met Asp Gln Val Pro Phe Ser Val
1 5
<210> 38
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 38
Lys Thr Trp Gly Gln Tyr Trp Gln Val
1 5
<210> 39
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 39
Tyr Leu Glu Pro Gly Pro Val Thr Val
1 5
<210> 40
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 40
Tyr Leu Glu Pro Gly Pro Val Thr Ala
1 5
<210> 41
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 41
Ile Thr Asp Gln Val Pro Phe Ser Val
1 5
<210> 42
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 42
Asn Leu Val Pro Met Val Ala Thr Val
1 5
<210> 43
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 43
Ala Ile Ile Arg Ile Leu Gln Gln Leu
1 5
<210> 44
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 44
Val Leu His Asp Asp Leu Leu Glu Ala
1 5
<210> 45
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 45
Val Leu Arg Asp Asp Leu Leu Glu Ala
1 5
<210> 46
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 46
Ser Leu Leu Met Trp Ile Thr Gln Val
1 5
<210> 47
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 47
Leu Leu Asp Phe Val Arg Phe Met Gly Val
1 5 10
<210> 48
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 48
Phe Met Asn Lys Phe Ile Tyr Glu Ile
1 5
<210> 49
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 49
Lys Ile Phe Gly Ser Leu Ala Phe Leu
1 5
<210> 50
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 50
Gly Val Leu Pro Ala Leu Pro Gln Val
1 5
<210> 51
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 51
Thr Met Thr Arg Val Leu Gln Gly Val
1 5
<210> 52
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 52
Phe Leu Leu Thr Arg Ile Leu Thr Ile
1 5
<210> 53
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 53
Ile Leu Ala Lys Phe Leu His Trp Leu
1 5
<210> 54
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 54
Arg Leu Val Asp Asp Phe Leu Leu Val
1 5
<210> 55
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 55
Leu Leu Leu Thr Val Leu Thr Val Val
1 5
<210> 56
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 56
Phe Leu Arg Asn Phe Ser Leu Met Leu
1 5
<210> 57
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 57
Tyr Met Asp Gly Thr Met Ser Gln Val
1 5
<210> 58
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 58
Tyr Leu Leu Pro Ala Ile Val His Ile
1 5
<210> 59
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 59
Phe Leu Ser Glu Leu Thr Gln Gln Leu
1 5
<210> 60
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 60
Ala Leu Tyr Val Asp Ser Leu Phe Phe Leu
1 5 10
<210> 61
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 61
Ser Tyr Ala Met Ser
1 5
<210> 62
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 62
Gln Ile Asp Pro Trp Gly Gln Glu Thr Leu Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 63
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 63
Leu Thr Gly Arg Phe Asp Tyr
1 5
<210> 64
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 64
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 65
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 65
Ser Ala Ser Gln Leu Gln Ser
1 5
<210> 66
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 66
Gln Gln Gly Pro Gly Thr Pro Asn Thr
1 5
<210> 67
<211> 241
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 67
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gln Ile Asp Pro Trp Gly Gln Glu Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Leu Thr Gly Arg Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Thr Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
130 135 140
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser
145 150 155 160
Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
165 170 175
Lys Leu Leu Ile Tyr Ser Ala Ser Gln Leu Gln Ser Gly Val Pro Ser
180 185 190
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
195 200 205
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Pro
210 215 220
Gly Thr Pro Asn Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
225 230 235 240
Ala
<210> 68
<211> 241
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 68
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Tyr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Gly Gly Gly
100 105 110
Ser Gly Gly Gly Gly Ser Gly Gly Gly Ala Ser Glu Val Gln Leu Val
115 120 125
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
130 135 140
Cys Ala Ala Ser Gly Phe Asn Ile Asn Gly Ser Tyr Ile His Trp Val
145 150 155 160
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Tyr Ile Asp Pro
165 170 175
Glu Thr Gly Tyr Ser Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr
180 185 190
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
195 200 205
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Asp Ser Ala
210 215 220
Ser Asp Ala Met Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser
225 230 235 240
Ser
<210> 69
<211> 241
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 69
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Ala Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Tyr Tyr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Gly Gly Gly
100 105 110
Ser Gly Gly Gly Gly Ser Gly Gly Gly Ala Ser Glu Val Gln Leu Val
115 120 125
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
130 135 140
Cys Ala Ala Ser Gly Phe His Ile Asn Gly Ser Tyr Ile His Trp Val
145 150 155 160
Arg Gln Ala Pro Gly Lys Gly Leu Lys Trp Val Ala Tyr Ile Asp Pro
165 170 175
Glu Thr Gly Tyr Ser Arg Tyr Ala Asp Ser Val Lys Gly Arg Phe Ala
180 185 190
Ile Ser Ala Asp Met Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
195 200 205
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Asp Ser Ala
210 215 220
Ser Asp Ala Met Asp Val Trp Gly Gln Gly Thr Leu Val Thr Val Ser
225 230 235 240
Ser
<210> 70
<211> 243
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 70
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ser Tyr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Gly Gly Gly
100 105 110
Ser Gly Gly Gly Gly Ser Gly Gly Gly Ala Ser Glu Val Gln Leu Val
115 120 125
Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser
130 135 140
Cys Ala Ala Ser Gly Phe Asn Ile Thr Ser Ser Tyr Ile His Trp Val
145 150 155 160
Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Tyr Ile Ser Pro
165 170 175
Glu Asp Gly Tyr Ala Arg His Ala Asp Ser Val Lys Gly Arg Phe Thr
180 185 190
Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln Met Asn Ser
195 200 205
Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ser Arg Asp Asp Thr
210 215 220
Tyr Tyr Tyr Ser Ala Met Asp Val Trp Gly Gln Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser
<210> 71
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 71
His Leu Ser Pro Ile Asp Cys Glu Val
1 5
<210> 72
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 72
Leu Thr Ser Met Trp Ser Pro Ala Val
1 5
<210> 73
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 73
His Leu Asp His Pro His Pro Ala Val
1 5
<210> 74
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 74
Ser Leu Ser Val Met Ser Ser Asn Val
1 5
<210> 75
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 75
Met Met Ala Trp Ser Asp Asn Lys Ile
1 5
<210> 76
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 76
Thr Gln Ile Gly Ile Glu Trp Asn Leu
1 5
<210> 77
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 77
Cys Leu Phe Glu Met Gln Asp Pro Ala
1 5
<210> 78
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 78
Tyr Leu Ser His Pro Ser Cys Asn Val
1 5
<210> 79
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 79
Gly Ile Glu Trp Asn Leu Ser Pro Val
1 5
<210> 80
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 80
Gly Leu Gly Cys Ser Pro Ala Ser Ile
1 5
<210> 81
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 81
Arg Gln Ala Phe Glu Phe Pro Gln Ile
1 5
<210> 82
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 82
Gly Met Trp Thr Asp Thr Phe Glu Phe
1 5
<210> 83
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 83
Tyr Leu Asn Trp Gln Asp Thr Ala Val
1 5
<210> 84
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 84
Val Leu Trp Gly Pro Ile Thr Gln Ile
1 5
<210> 85
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 85
Thr Leu Asp His Thr Gly Val Val Val
1 5
<210> 86
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 86
Thr Met Gly Val Trp Leu His Ile Ala
1 5
<210> 87
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 87
Lys Val Trp Val Gln Gly His Tyr Leu
1 5
<210> 88
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 88
Lys Ile Asn Cys Asn Asn Phe Arg Leu
1 5
<210> 89
<211> 56
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 89
Ile Pro Tyr Lys Ile Glu Ala Val Lys Ser Glu Pro Val Glu Pro Pro
1 5 10 15
Leu Pro Ser Gln Leu His Leu Met Tyr Val Ala Ala Ala Ala Phe Val
20 25 30
Leu Leu Phe Phe Val Gly Cys Gly Val Leu Leu Ser Arg Lys Arg Arg
35 40 45
Arg Gln Leu Cys Ile Gln Lys Leu
50 55
<210> 90
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 90
Pro Pro Gln Ile Glu Glu Ala Cys Glu Leu Pro Glu Cys Gln Val Asp
1 5 10 15
Ala Gly Asn Lys Val Cys Asn Leu Gln Cys Asn Asn His Ala Cys Gly
20 25 30
Trp Asp Gly Gly Asp Cys Ser Leu Asn Phe Asn Asp Pro Trp Lys Asn
35 40 45
Cys Thr Gln Ser Leu Gln Cys Trp Lys Tyr Phe Ser Asp Gly His Cys
50 55 60
Asp Ser Gln Cys Asn Ser Ala Gly Cys Leu Phe Asp Gly Phe Asp Cys
65 70 75 80
Gln Leu Thr Glu Gly Gln Cys Asn Pro Leu Tyr Asp Gln Tyr Cys Lys
85 90 95
Asp His Phe Ser Asp Gly His Cys Asp Gln Gly Cys Asn Ser Ala Glu
100 105 110
Cys Glu Trp Asp Gly Leu Asp Cys
115 120
<210> 91
<211> 152
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 91
Ala Ala Gly Thr Leu Val Leu Val Val Leu Leu Pro Pro Asp Gln Leu
1 5 10 15
Arg Asn Asn Ser Phe His Phe Leu Arg Glu Leu Ser His Val Leu His
20 25 30
Thr Asn Val Val Phe Lys Arg Asp Ala Gln Gly Gln Gln Met Ile Phe
35 40 45
Pro Tyr Tyr Gly His Glu Glu Glu Leu Arg Lys His Pro Ile Lys Arg
50 55 60
Ser Thr Val Gly Trp Ala Thr Ser Ser Leu Leu Pro Gly Thr Ser Gly
65 70 75 80
Gly Arg Gln Arg Arg Glu Leu Asp Pro Met Asp Ile Arg Gly Ser Ile
85 90 95
Val Tyr Leu Glu Ile Asp Asn Arg Gln Cys Val Gln Ser Ser Ser Gln
100 105 110
Cys Phe Gln Ser Ala Thr Asp Val Ala Ala Phe Leu Gly Ala Leu Ala
115 120 125
Ser Leu Gly Ser Leu Asn Ile Pro Tyr Lys Ile Glu Ala Val Lys Ser
130 135 140
Glu Pro Val Glu Pro Pro Leu Pro
145 150
<210> 92
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 92
His Leu Met Tyr Val Ala Ala Ala Ala Phe Val Leu Leu Phe Phe Val
1 5 10 15
Gly Cys Gly Val Leu Leu Ser
20
<210> 93
<211> 306
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 93
Pro Pro Gln Ile Glu Glu Ala Cys Glu Leu Pro Glu Cys Gln Val Asp
1 5 10 15
Ala Gly Asn Lys Val Cys Asn Leu Gln Cys Asn Asn His Ala Cys Gly
20 25 30
Trp Asp Gly Gly Asp Cys Ser Leu Asn Phe Asn Asp Pro Trp Lys Asn
35 40 45
Cys Thr Gln Ser Leu Gln Cys Trp Lys Tyr Phe Ser Asp Gly His Cys
50 55 60
Asp Ser Gln Cys Asn Ser Ala Gly Cys Leu Phe Asp Gly Phe Asp Cys
65 70 75 80
Gln Leu Thr Glu Gly Gln Cys Asn Pro Leu Tyr Asp Gln Tyr Cys Lys
85 90 95
Asp His Phe Ser Asp Gly His Cys Asp Gln Gly Cys Asn Ser Ala Glu
100 105 110
Cys Glu Trp Asp Gly Leu Asp Cys Ala Glu His Val Pro Glu Arg Leu
115 120 125
Ala Ala Gly Thr Leu Val Leu Val Val Leu Leu Pro Pro Asp Gln Leu
130 135 140
Arg Asn Asn Ser Phe His Phe Leu Arg Glu Leu Ser His Val Leu His
145 150 155 160
Thr Asn Val Val Phe Lys Arg Asp Ala Gln Gly Gln Gln Met Ile Phe
165 170 175
Pro Tyr Tyr Gly His Glu Glu Glu Leu Arg Lys His Pro Ile Lys Arg
180 185 190
Ser Thr Val Gly Trp Ala Thr Ser Ser Leu Leu Pro Gly Thr Ser Gly
195 200 205
Gly Arg Gln Arg Arg Glu Leu Asp Pro Met Asp Ile Arg Gly Ser Ile
210 215 220
Val Tyr Leu Glu Ile Asp Asn Arg Gln Cys Val Gln Ser Ser Ser Gln
225 230 235 240
Cys Phe Gln Ser Ala Thr Asp Val Ala Ala Phe Leu Gly Ala Leu Ala
245 250 255
Ser Leu Gly Ser Leu Asn Ile Pro Tyr Lys Ile Glu Ala Val Lys Ser
260 265 270
Glu Pro Val Glu Pro Pro Leu Pro Ser Gln Leu His Leu Met Tyr Val
275 280 285
Ala Ala Ala Ala Phe Val Leu Leu Phe Phe Val Gly Cys Gly Val Leu
290 295 300
Leu Ser
305
<210> 94
<211> 358
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 94
Pro Cys Val Gly Ser Asn Pro Cys Tyr Asn Gln Gly Thr Cys Glu Pro
1 5 10 15
Thr Ser Glu Asn Pro Phe Tyr Arg Cys Leu Cys Pro Ala Lys Phe Asn
20 25 30
Gly Leu Leu Cys His Ile Leu Asp Tyr Ser Phe Thr Gly Gly Ala Gly
35 40 45
Arg Asp Ile Pro Pro Pro Gln Ile Glu Glu Ala Cys Glu Leu Pro Glu
50 55 60
Cys Gln Val Asp Ala Gly Asn Lys Val Cys Asn Leu Gln Cys Asn Asn
65 70 75 80
His Ala Cys Gly Trp Asp Gly Gly Asp Cys Ser Leu Asn Phe Asn Asp
85 90 95
Pro Trp Lys Asn Cys Thr Gln Ser Leu Gln Cys Trp Lys Tyr Phe Ser
100 105 110
Asp Gly His Cys Asp Ser Gln Cys Asn Ser Ala Gly Cys Leu Phe Asp
115 120 125
Gly Phe Asp Cys Gln Leu Thr Glu Gly Gln Cys Asn Pro Leu Tyr Asp
130 135 140
Gln Tyr Cys Lys Asp His Phe Ser Asp Gly His Cys Asp Gln Gly Cys
145 150 155 160
Asn Ser Ala Glu Cys Glu Trp Asp Gly Leu Asp Cys Ala Glu His Val
165 170 175
Pro Glu Arg Leu Ala Ala Gly Thr Leu Val Leu Val Val Leu Leu Pro
180 185 190
Pro Asp Gln Leu Arg Asn Asn Ser Phe His Phe Leu Arg Glu Leu Ser
195 200 205
His Val Leu His Thr Asn Val Val Phe Lys Arg Asp Ala Gln Gly Gln
210 215 220
Gln Met Ile Phe Pro Tyr Tyr Gly His Glu Glu Glu Leu Arg Lys His
225 230 235 240
Pro Ile Lys Arg Ser Thr Val Gly Trp Ala Thr Ser Ser Leu Leu Pro
245 250 255
Gly Thr Ser Gly Gly Arg Gln Arg Arg Glu Leu Asp Pro Met Asp Ile
260 265 270
Arg Gly Ser Ile Val Tyr Leu Glu Ile Asp Asn Arg Gln Cys Val Gln
275 280 285
Ser Ser Ser Gln Cys Phe Gln Ser Ala Thr Asp Val Ala Ala Phe Leu
290 295 300
Gly Ala Leu Ala Ser Leu Gly Ser Leu Asn Ile Pro Tyr Lys Ile Glu
305 310 315 320
Ala Val Lys Ser Glu Pro Val Glu Pro Pro Leu Pro Ser Gln Leu His
325 330 335
Leu Met Tyr Val Ala Ala Ala Ala Phe Val Leu Leu Phe Phe Val Gly
340 345 350
Cys Gly Val Leu Leu Ser
355
<210> 95
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 95
Pro Cys Val Gly Ser Asn Pro Cys Tyr Asn Gln Gly Thr Cys Glu Pro
1 5 10 15
Thr Ser Glu Asn Pro Phe Tyr Arg Cys Leu Cys Pro Ala Lys Phe Asn
20 25 30
Gly Leu Leu Cys His
35
<210> 96
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 96
Asp Ile Asn Glu Cys Val Leu Ser Pro Cys Arg His Gly Ala Ser Cys
1 5 10 15
Gln Asn Thr His Gly Gly Tyr Arg Cys His Cys Gln Ala Gly Tyr Ser
20 25 30
Gly Arg Asn Cys Glu
35
<210> 97
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 97
Asp Ile Asp Asp Cys Arg Pro Asn Pro Cys His Asn Gly Gly Ser Cys
1 5 10 15
Thr Asp Gly Ile Asn Thr Ala Phe Cys Asp Cys Leu Pro Gly Phe Arg
20 25 30
Gly Thr Phe Cys Glu
35
<210> 98
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 98
Asp Ile Asn Glu Cys Ala Ser Asp Pro Cys Arg Asn Gly Ala Asn Cys
1 5 10 15
Thr Asp Cys Val Asp Ser Tyr Thr Cys Thr Cys Pro Ala Gly Phe Ser
20 25 30
Gly Ile His Cys Glu
35
<210> 99
<211> 32
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 99
Thr Glu Ser Ser Cys Phe Asn Gly Gly Thr Cys Val Asp Gly Ile Asn
1 5 10 15
Ser Phe Thr Cys Leu Cys Pro Pro Gly Phe Thr Gly Ser Tyr Cys Gln
20 25 30
<210> 100
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 100
Asp Val Asn Glu Cys Asp Ser Gln Pro Cys Leu His Gly Gly Thr Cys
1 5 10 15
Gln Asp Gly Cys Gly Ser Tyr Arg Cys Thr Cys Pro Gln Gly Tyr Thr
20 25 30
Gly Pro Asn Cys Gln
35
<210> 101
<211> 27
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 101
Asp Ser Ser Pro Cys Lys Asn Gly Gly Lys Cys Trp Gln Thr His Thr
1 5 10 15
Gln Tyr Arg Cys Glu Cys Pro Ser Gly Trp Thr
20 25
<210> 102
<211> 36
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 102
Leu Val Asp Glu Cys Ser Pro Ser Pro Cys Gln Asn Gly Ala Thr Cys
1 5 10 15
Thr Asp Tyr Leu Gly Gly Tyr Ser Cys Lys Cys Val Ala Gly Tyr His
20 25 30
Gly Val Asn Cys
35
<210> 103
<211> 36
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 103
Ile Asp Glu Cys Leu Ser His Pro Cys Gln Asn Gly Gly Thr Cys Leu
1 5 10 15
Asp Leu Pro Asn Thr Tyr Lys Cys Ser Cys Pro Arg Gly Thr Gln Gly
20 25 30
Val His Cys Glu
35
<210> 104
<211> 28
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 104
Cys Phe Asn Asn Gly Thr Cys Val Asp Gln Val Gly Gly Tyr Ser Cys
1 5 10 15
Thr Cys Pro Pro Gly Phe Val Gly Glu Arg Cys Glu
20 25
<210> 105
<211> 39
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 105
Asp Val Asn Glu Cys Leu Ser Asn Pro Cys Asp Ala Arg Gly Thr Gln
1 5 10 15
Asn Cys Val Gln Arg Val Asn Asp Phe His Cys Glu Cys Arg Ala Gly
20 25 30
His Thr Gly Arg Arg Cys Glu
35
<210> 106
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 106
Gly Arg Arg Arg Arg Glu Leu Asp Pro Met
1 5 10
<210> 107
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 107
Arg Gln Arg Arg Glu Leu Asp Pro Met
1 5
<210> 108
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 108
Lys Ile Glu Ala Val Lys Ser Glu
1 5
<210> 109
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 109
Lys Ile Glu Ala Val Gln Ser Glu
1 5
<210> 110
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 110
Val Gly Cys Gly Val Leu Leu Ser
1 5
<210> 111
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 111
Gly Cys Gly Val Leu Leu Ser
1 5
<210> 112
<211> 248
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 112
Met Ser Arg Leu Asp Lys Ser Lys Val Ile Asn Ser Ala Leu Glu Leu
1 5 10 15
Leu Asn Glu Val Gly Ile Glu Gly Leu Thr Thr Arg Lys Leu Ala Gln
20 25 30
Lys Leu Gly Val Glu Gln Pro Thr Leu Tyr Trp His Val Lys Asn Lys
35 40 45
Arg Ala Leu Leu Asp Ala Leu Ala Ile Glu Met Leu Asp Arg His His
50 55 60
Thr His Phe Cys Pro Leu Glu Gly Glu Ser Trp Gln Asp Phe Leu Arg
65 70 75 80
Asn Asn Ala Lys Ser Phe Arg Cys Ala Leu Leu Ser His Arg Asp Gly
85 90 95
Ala Lys Val His Leu Gly Thr Arg Pro Thr Glu Lys Gln Tyr Glu Thr
100 105 110
Leu Glu Asn Gln Leu Ala Phe Leu Cys Gln Gln Gly Phe Ser Leu Glu
115 120 125
Asn Ala Leu Tyr Ala Leu Ser Ala Val Gly His Phe Thr Leu Gly Cys
130 135 140
Val Leu Glu Asp Gln Glu His Gln Val Ala Lys Glu Glu Arg Glu Thr
145 150 155 160
Pro Thr Thr Asp Ser Met Pro Pro Leu Leu Arg Gln Ala Ile Glu Leu
165 170 175
Phe Asp His Gln Gly Ala Glu Pro Ala Phe Leu Phe Gly Leu Glu Leu
180 185 190
Ile Ile Cys Gly Leu Glu Lys Gln Leu Lys Cys Glu Ser Gly Gly Pro
195 200 205
Ala Asp Ala Leu Asp Asp Phe Asp Leu Asp Met Leu Pro Ala Asp Ala
210 215 220
Leu Asp Asp Phe Asp Leu Asp Met Leu Pro Ala Asp Ala Leu Asp Asp
225 230 235 240
Phe Asp Leu Asp Met Leu Pro Gly
245
<210> 113
<211> 211
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 113
Met Lys Leu Leu Ser Ser Ile Glu Gln Ala Cys Asp Ile Cys Arg Leu
1 5 10 15
Lys Lys Leu Lys Cys Ser Lys Glu Lys Pro Lys Cys Ala Lys Cys Leu
20 25 30
Lys Asn Asn Trp Glu Cys Arg Tyr Ser Pro Lys Thr Lys Arg Ser Pro
35 40 45
Leu Thr Arg Ala His Leu Thr Glu Val Glu Ser Arg Leu Glu Arg Leu
50 55 60
Glu Gln Leu Phe Leu Leu Ile Phe Pro Arg Glu Asp Leu Asp Met Ile
65 70 75 80
Leu Lys Met Asp Ser Leu Gln Asp Ile Lys Ala Leu Leu Thr Gly Leu
85 90 95
Phe Val Gln Asp Asn Val Asn Lys Asp Ala Val Thr Asp Arg Leu Ala
100 105 110
Ser Val Glu Thr Asp Met Pro Leu Thr Leu Arg Gln His Arg Ile Ser
115 120 125
Ala Thr Ser Ser Ser Glu Glu Ser Ser Asn Lys Gly Gln Arg Gln Leu
130 135 140
Thr Val Ser Ala Ala Ala Gly Gly Ser Gly Gly Ser Gly Gly Ser Asp
145 150 155 160
Ala Leu Asp Asp Phe Asp Leu Asp Met Leu Gly Ser Asp Ala Leu Asp
165 170 175
Asp Phe Asp Leu Asp Met Leu Gly Ser Asp Ala Leu Asp Asp Phe Asp
180 185 190
Leu Asp Met Leu Gly Ser Asp Ala Leu Asp Asp Phe Asp Leu Asp Met
195 200 205
Leu Gly Ser
210
<210> 114
<211> 115
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 114
Pro Lys Lys Lys Arg Lys Val Asp Ala Leu Asp Asp Phe Asp Leu Asp
1 5 10 15
Met Leu Gly Ser Asp Ala Leu Asp Asp Phe Asp Leu Asp Met Leu Gly
20 25 30
Ser Asp Ala Leu Asp Asp Phe Asp Leu Asp Met Leu Gly Ser Asp Ala
35 40 45
Leu Asp Asp Phe Asp Leu Asp Met Leu Gly Ser Gly Gly Ser Gly Gly
50 55 60
Ser Gly Gly Ser Leu Glu Ile Glu Ala Ala Phe Leu Glu Arg Glu Asn
65 70 75 80
Thr Ala Leu Glu Thr Arg Val Ala Glu Leu Arg Gln Arg Val Gln Arg
85 90 95
Leu Arg Asn Arg Val Ser Gln Tyr Arg Thr Arg Tyr Gly Pro Leu Gly
100 105 110
Gly Gly Lys
115
<210> 115
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 115
Gly Gly Gly Gly Ser
1 5
<210> 116
<211> 282
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 116
Met Glu Thr Leu Leu Gly Leu Leu Ile Leu Trp Leu Gln Leu Gln Trp
1 5 10 15
Val Ser Ser Lys Gln Glu Val Thr Gln Ile Pro Ala Ala Leu Ser Val
20 25 30
Pro Glu Gly Glu Asn Leu Val Leu Asn Cys Ser Phe Thr Asp Ser Ala
35 40 45
Ile Tyr Asn Leu Gln Trp Phe Arg Gln Asp Pro Gly Lys Gly Leu Thr
50 55 60
Ser Leu Leu Leu Ile Gln Ser Ser Gln Arg Glu Gln Thr Ser Gly Arg
65 70 75 80
Leu Asn Ala Ser Leu Asp Lys Ser Ser Gly Arg Ser Thr Leu Tyr Ile
85 90 95
Ala Ala Ser Gln Pro Gly Asp Ser Ala Thr Tyr Leu Cys Ala Val Arg
100 105 110
Pro Leu Leu Asp Gly Thr Tyr Ile Pro Thr Phe Gly Arg Gly Thr Ser
115 120 125
Leu Ile Val His Pro Gly Ser Ala Asp Asp Ala Lys Lys Asp Ala Ala
130 135 140
Lys Lys Asp Gly Lys Ser Met Ser Ile Gly Leu Leu Cys Cys Ala Ala
145 150 155 160
Leu Ser Leu Leu Trp Ala Gly Pro Val Asn Ala Gly Val Thr Gln Thr
165 170 175
Pro Lys Phe Gln Val Leu Lys Thr Gly Gln Ser Met Thr Leu Gln Cys
180 185 190
Ala Gln Asp Met Asn His Glu Tyr Met Ser Trp Tyr Arg Gln Asp Pro
195 200 205
Gly Met Gly Leu Arg Leu Ile His Tyr Ser Val Gly Ala Gly Thr Thr
210 215 220
Asp Arg Gly Glu Val Pro Asn Gly Tyr Asn Val Ser Arg Ser Thr Ile
225 230 235 240
Glu Asp Phe Pro Leu Arg Leu Leu Ser Ala Ala Pro Ser Gln Thr Ser
245 250 255
Val Tyr Phe Cys Ala Ser Ser Tyr Val Gly Asp Thr Gly Glu Leu Phe
260 265 270
Phe Gly Glu Gly Ser Arg Leu Thr Val Leu
275 280
<210> 117
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 117
Tyr Pro Tyr Asp Val Pro Asp Tyr Ala
1 5
<210> 118
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 118
Asp Tyr Lys Asp Asp Asp Asp Lys
1 5
<210> 119
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 119
Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu
1 5 10
<210> 120
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 120
His His His His His
1 5
<210> 121
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 121
His His His His His His
1 5
<210> 122
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 122
Trp Ser His Pro Gln Phe Glu Lys
1 5
<210> 123
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 123
Arg Tyr Ile Arg Ser
1 5
<210> 124
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 124
Phe His His Thr
1
<210> 125
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 125
Trp Glu Ala Ala Ala Arg Glu Ala Cys Cys Arg Glu Cys Cys Ala Arg
1 5 10 15
Ala
<210> 126
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 126
Pro Lys Lys Lys Arg Lys Val
1 5
<210> 127
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 127
Lys Arg Pro Ala Ala Thr Lys Lys Ala Gly Gln Ala Lys Lys Lys Lys
1 5 10 15
<210> 128
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 128
Met Val Pro Lys Lys Lys Arg Lys
1 5
<210> 129
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 129
Met Ala Pro Lys Lys Lys Arg Lys Val Gly Ile His Gly Val Pro Ala
1 5 10 15
Ala
<210> 130
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<220>
<221> MISC_FEATURE
<222> (2)
<223> The residue at this position may be any amino acid.
<220>
<221> MISC_FEATURE
<222> (3)
<223> The residue at this position may be an Arg or Lys.
<400> 130
Arg Xaa Xaa Arg
1
<210> 131
<211> 142
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 131
Pro Asn Ile Gln Asn Pro Asp Pro Ala Val Tyr Gln Leu Arg Asp Ser
1 5 10 15
Lys Ser Ser Asp Lys Ser Val Cys Leu Phe Thr Asp Phe Asp Ser Gln
20 25 30
Thr Asn Val Ser Gln Ser Lys Asp Ser Asp Val Tyr Ile Thr Asp Lys
35 40 45
Cys Val Leu Asp Met Arg Ser Met Asp Phe Lys Ser Asn Ser Ala Val
50 55 60
Ala Trp Ser Asn Lys Ser Asp Phe Ala Cys Ala Asn Ala Phe Asn Asn
65 70 75 80
Ser Ile Ile Pro Glu Asp Thr Phe Phe Pro Ser Pro Glu Ser Ser Cys
85 90 95
Asp Val Lys Leu Val Glu Lys Ser Phe Glu Thr Asp Thr Asn Leu Asn
100 105 110
Phe Gln Asn Leu Ser Val Ile Gly Phe Arg Ile Leu Leu Leu Lys Val
115 120 125
Ala Gly Phe Asn Leu Leu Met Thr Leu Arg Leu Trp Ser Ser
130 135 140
<210> 132
<211> 138
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 132
Pro Tyr Ile Gln Asn Pro Glu Pro Ala Val Tyr Gln Leu Lys Asp Pro
1 5 10 15
Arg Ser Gln Asp Ser Thr Leu Cys Leu Phe Thr Asp Phe Asp Ser Gln
20 25 30
Ile Asn Val Pro Lys Thr Met Glu Ser Gly Thr Phe Ile Thr Asp Lys
35 40 45
Thr Val Leu Asp Met Lys Ala Met Asp Ser Lys Ser Asn Gly Ala Ile
50 55 60
Ala Trp Ser Asn Gln Thr Ser Phe Thr Cys Gln Asp Ile Phe Lys Glu
65 70 75 80
Thr Asn Ala Cys Tyr Pro Ser Ser Asp Val Pro Cys Asp Ala Thr Leu
85 90 95
Thr Glu Lys Ser Phe Glu Thr Asp Met Asn Leu Asn Phe Gln Asn Leu
100 105 110
Ser Val Met Gly Leu Arg Ile Leu Leu Leu Lys Val Ala Gly Phe Asn
115 120 125
Leu Leu Met Thr Leu Arg Leu Trp Ser Ser
130 135
<210> 133
<211> 177
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 133
Glu Asp Leu Asn Lys Val Phe Pro Pro Glu Val Ala Val Phe Glu Pro
1 5 10 15
Ser Glu Ala Glu Ile Ser His Thr Gln Lys Ala Thr Leu Val Cys Leu
20 25 30
Ala Thr Gly Phe Phe Pro Asp His Val Glu Leu Ser Trp Trp Val Asn
35 40 45
Gly Lys Glu Val His Ser Gly Val Cys Thr Asp Pro Gln Pro Leu Lys
50 55 60
Glu Gln Pro Ala Leu Asn Asp Ser Arg Tyr Cys Leu Ser Ser Arg Leu
65 70 75 80
Arg Val Ser Ala Thr Phe Trp Gln Asn Pro Arg Asn His Phe Arg Cys
85 90 95
Gln Val Gln Phe Tyr Gly Leu Ser Glu Asn Asp Glu Trp Thr Gln Asp
100 105 110
Arg Ala Lys Pro Val Thr Gln Ile Val Ser Ala Glu Ala Trp Gly Arg
115 120 125
Ala Asp Cys Gly Phe Thr Ser Val Ser Tyr Gln Gln Gly Val Leu Ser
130 135 140
Ala Thr Ile Leu Tyr Glu Ile Leu Leu Gly Lys Ala Thr Leu Tyr Ala
145 150 155 160
Val Leu Val Ser Ala Leu Val Leu Met Ala Met Val Lys Arg Lys Asp
165 170 175
Phe
<210> 134
<211> 173
<212> PRT
<213> Artificial Sequence
<220>
<223> synthetic amino acid sequence
<400> 134
Glu Asp Leu Arg Asn Val Thr Pro Pro Lys Val Ser Leu Phe Glu Pro
1 5 10 15
Ser Lys Ala Glu Ile Ala Asn Lys Gln Lys Ala Thr Leu Val Cys Leu
20 25 30
Ala Arg Gly Phe Phe Pro Asp His Val Glu Leu Ser Trp Trp Val Asn
35 40 45
Gly Lys Glu Val His Ser Gly Val Ser Thr Asp Pro Gln Ala Tyr Lys
50 55 60
Glu Ser Asn Tyr Ser Tyr Cys Leu Ser Ser Arg Leu Arg Val Cys Ala
65 70 75 80
Thr Phe Trp His Asn Pro Arg Asn His Phe Arg Cys Gln Val Gln Phe
85 90 95
His Gly Leu Ser Glu Glu Asp Lys Trp Pro Glu Gly Ser Pro Lys Pro
100 105 110
Val Thr Gln Asn Ile Ser Ala Glu Ala Trp Gly Arg Ala Asp Cys Gly
115 120 125
Ile Thr Ser Ala Ser Tyr Gln Gln Gly Val Leu Ser Ala Thr Ile Leu
130 135 140
Tyr Glu Ile Leu Leu Gly Lys Ala Thr Leu Tyr Ala Val Leu Val Ser
145 150 155 160
Thr Leu Val Val Met Ala Met Val Lys Arg Lys Asn Ser
165 170
Claims (90)
- N-말단에서 C-말단으로 및 공유 결합으로 하기를 포함하는 키메라 폴리펩타이드:
a) 펩타이드-주요 조직적합성 복합체 (펩타이드-MHC)에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인;
b) 하나 이상의 단백질 용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및
c) 전사 활성화인자를 포함하는 세포내 도메인을 포함하고, 여기서 상기 특이적 결합 구성원의 펩타이드-MHC로의 결합이 상기 하나 이상의 단백질용해 절단 부위에서 노치 수용체 폴리펩타이드의 절단을 유도하여 세포내 도메인을 방출시킨다. - 청구항 1에 있어서, 상기 특이적 결합 구성원이 항체를 포함하는, 키메라 폴리펩타이드.
- 청구항 2에 있어서, 상기 항체가 나노항체, 디아바디, 트리아바디, 또는 미니바디, F(ab')2 단편, Fab 단편, 단일쇄 가변 단편 (scFv) 또는 단일 도메인 항체(sdAb)인, 키메라 폴리펩타이드.
- 청구항 1 내지 3 중 어느 한 항에 있어서, 상기 특이적 결합 구성원이 세포내 암 항원 펩타이드를 포함하는 펩타이드-MHC에 특이적으로 결합하는, 키메라 폴리펩타이드.
- 청구항 4에 있어서, 상기 세포내 암 항원 펩타이드가 WT1 펩타이드 또는 NY-ESO 펩타이드인, 키메라 폴리펩타이드.
- 청구항 1 내지 5 중 어느 한 항에 있어서, 상기 노치 수용체 폴리펩타이드가 이의 N-말단에 하나 이상의 상피 성장 인자 (EGF) 반복체를 포함하는, 키메라 폴리펩타이드.
- 청구항 6에 있어서, 상기 노치 수용체 폴리펩타이드가 이의 N-말단에 2 내지 11개 EGF 반복체를 포함하는, 키메라 폴리펩타이드.
- 청구항 1 내지 7 중 어느 한 항에 있어서, 상기 노치 수용체 폴리펩타이드가 합성 링커를 포함하는, 키메라 폴리펩타이드.
- 청구항 8에 있어서, 상기 노치 수용체 폴리펩타이드가 상기 하나 이상의 EGF 반복체와 상기 하나 이상의 단백질용해 절단 부위 사이에 합성 링커를 포함하는, 키메라 폴리펩타이드.
- 청구항 1 내지 9 중 어느 한 항에 있어서, 상기 노치 수용체 폴리펩타이드가 50개 아미노산 내지 1000개 아미노산의 길이를 갖는, 키메라 폴리펩타이드.
- 청구항 10에 있어서, 상기 노치 수용체 폴리펩타이드가 300개 아미노산 내지 400개 아미노산의 길이를 갖는, 키메라 폴리펩타이드.
- 청구항 1 내지 11 중 어느 한 항에 있어서, 상기 하나 이상의 단백질용해 절단 부위가 S2 단백질용해 절단 부위, S3 단백질용해 절단 부위 또는 이의 조합을 포함하는, 키메라 폴리펩타이드.
- 청구항 12에 있어서, 상기 하나 이상의 단백질용해 절단 부위가 Ala-Val 디펩타이드 서열을 포함하는 ADAM-17-유형의 프로테아제 절단 부위인 S2 단백질용해 절단 부위를 포함하는, 키메라 폴리펩타이드.
- 청구항 1 내지 13 중 어느 한 항에 있어서, 상기 하나 이상의 단백질용해 절단 부위가 Gly-Val 디펩타이드 서열을 포함하는 감마-세크레타제 (γ-세크레타제) 절단 부위인 S3 단백질용해 절단 부위를 포함하는, 키메라 폴리펩타이드.
- 청구항 1 내지 14 중 어느 한 항에 있어서, 상기 하나 이상의 단백질용해 절단 부위가 S1 단백질용해 절단 부위를 추가로 포함하는, 키메라 폴리펩타이드.
- 청구항 15에 있어서, 상기 S1 단백질용해 절단 부위가 아미노산 서열 Arg-X-(Arg/Lys)-Arg (서열번호 130)(여기서, X는 임의의 아미노산이다)을 포함하는 푸린형 프로테아제 절단 부위인, 키메라 폴리펩타이드.
- 청구항 1 내지 16 중 어느 한 항에 있어서, 상기 노치 수용체 폴리펩타이드가 S1 단백질용해 절단 부위가 부재인, 키메라 폴리펩타이드.
- 청구항 1 내지 17 중 어느 한 항에 있어서, 상기 노치 수용체 폴리펩타이드가 도 31a-32b에 제공된 서열과 적어도 85% 아미노산 서열 동일성을 갖는, 키메라 폴리펩타이드.
- 청구항 18에 있어서, 상기 노치 수용체 폴리펩타이드가 도 31a에 제공된 서열 또는 도 31b에 제공된 서열과 적어도 85% 아미노산 서열 동일성을 갖는, 키메라 폴리펩타이드.
- 청구항 1 내지 19 중 어느 한 항에 따른 키메라 폴리펩타이드를 암호화하는 핵산.
- 청구항 20에 있어서, 상기 핵산이 목적하는 폴리펩타이드 (POI)를 암호화하는 핵산 서열에 작동적으로 연결된 전사 활성화인자에 응답하는 전사 조절 요소를 추가로 포함하는, 핵산.
- 청구항 21에 있어서, 상기 POI가 리포터 단백질, 키메라 항원 수용체 (CAR), 항체, 키메라 이중특이적 결합 구성원, 가공된 T 세포 수용체 (TCR) 및 선천성-면역 반응 유도제로 이루어진 그룹으로부터 선택되는 이종성 폴리펩타이드인, 핵산.
- 청구항 20 내지 22 중 어느 한 항에 따른 핵산을 포함하는 재조합 발현 벡터.
- 세포에서 이종성 폴리펩타이드의 발현을 유도하는 방법으로서, 상기 방법이:
세포와 펩타이드-주요 조직적합성 복합체 (펩타이드-MHC)를 접촉시키는 단계로서, 상기 세포는 청구항 1 내지 19 중 어느 한 항에 따른 키메라 폴리펩타이드를 발현하고 상기 키메라 폴리펩타이드의 전사 활성화인자에 응답하는 전사 조절 요소에 작동적으로 연결된 이종성 폴리펩타이드를 암호화하는 서열을 포함하여 상기 키메라 폴리펩타이드의 세포내 도메인을 방출시키고 상기 이종성 폴리펩타이드의 발현을 유도하는 단계를 포함하는, 방법. - 청구항 24에 있어서, 상기 이종성 폴리펩타이드가 리포터 단백질, 키메라 항원 수용체 (CAR), 항체, 키메라 이중특이적 결합 구성원, 가공된 T 세포 수용체 (TCR) 및 선천성-면역 반응 유도제인, 방법.
- 다음을 포함하는 숙주 세포:
a) 제1 펩타이드-주요 조직적합성 복합체 (펩타이드-MHC)에 특이적으로 결합하는 청구항 20 내지 22 중 어느 한 항에 따른 키메라 폴리펩타이드를 암호화하는 핵산; 및
b) 목적하는 폴리펩타이드 (POI)를 암호화하는 핵산에 작동적으로 연결된 키메라 폴리펩타이드의 전사 활성화인자에 응답하는 전사 조절 요소. - 청구항 26에 있어서, 상기 숙주 세포가 유전학적으로 변형되고 상기 핵산 및 상기 전사 조절 요소가 상기 숙주 세포의 게놈 내에 존재하는, 숙주 세포.
- 청구항 26에 있어서, 상기 핵산 및 상기 전사 조절 요소가 상기 숙주 세포 내 염색체 외부에 존재하는, 숙주 세포.
- 청구항 26 내지 28 중 어느 한 항에 있어서, 상기 POI가 이종성 폴리펩타이드인, 숙주 세포.
- 청구항 29에 있어서, 상기 이종성 폴리펩타이드가 리포터 단백질, 키메라 항원 수용체 (CAR), 항체, 키메라 이중특이적 결합 구성원, 가공된 T 세포 수용체 (TCR) 및 선천성-면역 반응 유도제로 이루어진 그룹으로부터 선택되는, 숙주 세포.
- 청구항 30에 있어서, 상기 이종성 폴리펩타이드가 제2 펩타이드-MHC에 특이적으로 결합하는 CAR인, 숙주 세포.
- 청구항 31에 있어서, 상기 키메라 폴리펩타이드의 상기 특이적 결합 구성원이 제1 세포내 암 항원 펩타이드를 포함하는 제1 펩타이드-MHC에 특이적으로 결합하고 상기 CAR이 제2 세포내 암 항원 펩타이드를 포함하는 제2 펩타이드-MHC에 특이적으로 결합하는, 숙주 세포.
- 청구항 32에 있어서, 상기 제1 세포내 암 항원 펩타이드가 WT1 펩타이드이고 상기 제2 세포내 암 항원 펩타이드가 NY-ESO 펩타이드인, 숙주 세포.
- 청구항 32에 있어서, 상기 제1 세포내 암 항원 펩타이드가 NY- ESO 펩타이드이고 상기 제2 세포내 암 항원 펩타이드가 WT1 펩타이드인, 숙주 세포.
- 청구항 30에 있어서, 상기 이종성 폴리펩타이드가 제2 펩타이드-MHC에 특이적으로 결합하는 가공된 TCR인, 숙주 세포.
- 청구항 35에 있어서, 상기 키메라 폴리펩타이드의 상기 특이적 결합 구성원이 제1 세포내 암 항원 펩타이드를 포함하는 제1 펩타이드-MHC에 특이적으로 결합하고 상기 가공된 TCR이 제2 세포내 암 항원 펩타이드를 포함하는 제2 펩타이드-MHC에 특이적으로 결합하는, 숙주 세포.
- 청구항 36에 있어서, 상기 제1 세포내 암 항원 펩타이드가 WT1 펩타이드이고 상기 제2 세포내 암 항원 펩타이드가 NY-ESO 펩타이드인, 숙주 세포.
- 청구항 36에 있어서, 상기 제1 세포내 암 항원 펩타이드가 NY- ESO 펩타이드이고 상기 제2 세포내 암 항원 펩타이드가 WT1 펩타이드인, 숙주 세포.
- 다음을 포함하는 숙주 세포:
a) N-말단에서 C-말단으로 및 공유 결합으로 하기를 포함하는 키메라 폴리펩타이드를 암호화하는 핵산:
i) 암 세포의 표면 상에 존재하는 표적 분자에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인;
ii) 하나 이상의 단백질용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및
iii) 전사 활성화인자를 포함하는 세포내 도메인;
b) 상기 전사 활성화인자에 응답하는 전사 조절 요소에 작동적으로 연결된 키메라 이중특이적 결합 구성원을 암호화하는 핵산으로서, 상기 표적 분자로의 특이적 결합 구성원의 결합이 상기 하나 이상의 단백질용해 절단 부위에서 상기 노치 수용체 폴리펩타이드의 절단을 유도하여 세포내 도메인을 방출시키고, 상기 전사 조절 요소를 활성화시키고 상기 키메라 이중특이적 결합 구성원이 발현되도록 하는, 핵산. - 청구항 39에 있어서, 상기 키메라 이중특이적 결합 구성원이 암 항원에 특이적인 결합 도메인 및 면역 세포의 표면상에서 발현되는 단백질에 특이적인 결합 도메인을 포함하는, 숙주 세포.
- 청구항 39 또는 40에 있어서, 상기 키메라 이중특이적 결합 구성원이 적어도 하나의 항체 유래된 항원-결합 도메인을 포함하는, 숙주 세포.
- 청구항 41에 있어서, 상기 키메라 이중특이적 결합 구성원이 이중특이적 항체 또는 이의 단편인, 숙주 세포.
- 청구항 39 내지 41 중 어느 한 항에 있어서, 상기 키메라 이중특이적 결합 구성원이 리간드-수용체 결합 쌍의 적어도 하나의 수용체 또는 리간드 결합 도메인을 포함하는, 숙주 세포.
- 청구항 39 내지 43 중 어느 한 항에 있어서, 상기 키메라 이중특이적 결합 구성원이 적어도 하나의 항체 유래된 항원-결합 도메인 및 리간드-수용체 결합 쌍의 적어도 하나의 수용체 또는 리간드 결합 도메인을 포함하는, 숙주 세포.
- 청구항 40 내지 44 중 어느 한 항에 있어서, 면역 세포의 표면 상에 발현되는 상기 단백질이 CD3인, 숙주 세포.
- 청구항 40 내지 44 중 어느 한 항에 있어서, 면역 세포의 표면 상에서 발현된 상기 단백질이 천연 킬러 그룹 2D (NKG2D) 수용체인, 숙주 세포.
- 청구항 39 내지 46 중 어느 한 항에 있어서, 상기 표적 분자가 암 항원인, 숙주 세포.
- 청구항 39 내지 46 중 어느 한 항에 있어서, 상기 표적 분자가 조직 특이적 분자인, 숙주 세포.
- 청구항 39 내지 46 중 어느 한 항에 있어서, 상기 표적 분자가 기관 특이적 분자인, 숙주 세포.
- 청구항 39 내지 46 중 어느 한 항에 있어서, 상기 표적 분자가 세포 유형 특이적 분자인, 숙주 세포.
- 청구항 39 내지 50 중 어느 한 항에 따른 유효량의 숙주 세포를 대상체에게 투여함을 포함하는, 신생물에 대해 대상체를 치료하는 방법으로서, 상기 신생물은 표적 분자 및 암 항원을 발현하는, 방법.
- 다음을 포함하는 숙주 세포:
a) N-말단에서 C-말단으로 및 공유 결합으로 하기를 포함하는 키메라 폴리펩타이드를 암호화하는 핵산:
i) 암 세포의 표면 상에 존재하는 표적 분자에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인;
ii) 하나 이상의 단백질용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및
iii) 전사 활성화인자를 포함하는 세포내 도메인;
b) 상기 전사 활성화인자에 응답하는 전사 조절 요소에 작동적으로 연결된 항-Fc 키메라 항원 수용체 (CAR)를 암호화하는 핵산으로서, 상기 표적 분자로의 특이적 결합 구성원의 결합이 상기 하나 이상의 단백질용해 절단 부위에서 상기 노치 수용체 폴리펩타이드의 절단을 유도하여 세포내 도메인을 방출시키고, 상기 전사 조절 요소를 활성화시키고 상기 항-Fc CAR이 발현되도록 하는, 핵산. - 청구항 52에 있어서, 상기 표적 분자가 암 항원인, 숙주 세포.
- 청구항 52에 있어서, 상기 표적 분자가 조직 특이적 분자인, 숙주 세포.
- 청구항 52에 있어서, 상기 표적 분자가 기관 특이적 분자인, 숙주 세포.
- 청구항 52에 있어서, 상기 표적 분자가 세포 유형 특이적 분자인, 숙주 세포.
- 청구항 52 내지 56 중 어느 한 항에 있어서, 상기 숙주 세포가 추가로 암 세포의 표면 상에 존재하는 암 항원에 특이적이고 항-Fc CAR에 의해 결합된 Fc 영역을 포함하는 항체를 암호화하는 핵산을 포함하는, 숙주 세포.
- 청구항 57에 있어서, 상기 항체를 암호화하는 핵산이 상기 전사 조절 요소에 작동적으로 연결된, 숙주 세포.
- 청구항 52 내지 58 중 어느 한 항에 따른 유효량의 숙주 세포를 대상체에게 투여함을 포함하는, 신생물에 대해 대상체를 치료하는 방법으로서, 상기 신생물은 상기 표적 분자를 발현하는, 방법.
- 청구항 59에 있어서, 상기 방법이 추가로 암 세포의 표면 상에 존재하는 암 항원에 특이적이고 항-Fc CAR에 의해 결합된 Fc 영역을 포함하는 항체를 대상체에게 투여함을 포함하는, 방법.
- 다음을 포함하는 숙주 세포:
a) N-말단에서 C-말단으로 및 공유 결합으로 하기를 포함하는 키메라 폴리펩타이드를 암호화하는 핵산:
i) 암 세포의 표면 상에 존재하는 표적 분자에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인;
ii) 하나 이상의 단백질용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및
iii) 전사 활성화인자를 포함하는 세포내 도메인;
b) 상기 전사 활성화인자에 응답하는 전사 조절 요소에 작동적으로 연결된 선천성 면역 반응 유도제를 암호화하는 핵산으로서, 상기 표적 분자로의 상기 특이적 결합 구성원의 결합이 상기 하나 이상의 단백질용해 절단 부위에서 상기 노치 수용체 폴리펩타이드의 절단을 유도하여 세포내 도메인을 방출시키고, 상기 전사 조절 요소를 활성화시키고 상기 선천성 면역 반응 유도제가 발현되도록 하는, 핵산. - 청구항 61에 있어서, 상기 표적 분자가 조직 특이적 분자인, 방법.
- 청구항 61에 있어서, 상기 표적 분자가 기관 특이적 분자인, 방법.
- 청구항 61에 있어서, 상기 표적 분자가 세포 유형 특이적 분자인, 방법.
- 청구항 61에 있어서, 상기 표적 분자가 암 항원인, 방법.
- 청구항 61 내지 65 중 어느 한 항에 있어서, 상기 선천성 면역 반응 유도제가 세균 단백질 또는 이의 단편인, 방법.
- 청구항 61 내지 65 중 어느 한 항에 있어서, 상기 선천성 면역 반응 유도제가 바이러스 단백질 또는 이의 단편인, 방법.
- 청구항 61 내지 65 중 어느 한 항에 있어서, 상기 선천성 면역 반응 유도제가 진균류 단백질 또는 이의 단편인, 방법.
- 청구항 61 내지 68 중 어느 한 항에 있어서, 상기 선천성 면역 반응 유도제가 포유동물 기생충에 의해 발현되는 단백질 또는 이의 단편인, 방법.
- 청구항 69에 있어서, 상기 포유동물 기생충이 인간 기생충인, 방법.
- 청구항 61 내지 70 중 어느 한 항에 따른 유효량의 숙주 세포를 대상체에게 투여함을 포함하는, 상기 대상체 영역에서 국소 선천성 면역 반응을 유도하는 방법으로서, 상기 영역이 상기 표적 분자를 발현하는, 방법.
- 청구항 71에 있어서, 상기 대상체의 영역이 신생물을 포함하는, 방법.
- 다음을 포함하는 숙주 세포:
a) N-말단에서 C-말단으로 및 공유 결합으로 하기를 포함하는 키메라 폴리펩타이드를 암호화하는 핵산:
i) 암 세포의 표면 상에 존재하는 표적 분자에 특이적으로 결합하는 특이적 결합 구성원을 포함하는 세포외 도메인;
ii) 하나 이상의 단백질용해 절단 부위를 포함하는 단백질용해 절단가능한 노치 수용체 폴리펩타이드; 및
iii) 전사 활성화인자를 포함하는 세포내 도메인;
b) 상기 전사 활성화인자에 응답하는 전사 조절 요소에 작동적으로 연결된 면역 억제 인자를 암호화하는 핵산으로서, 상기 표적 분자로의 특이적 결합 구성원의 결합이 상기 하나 이상의 단백질용해 절단 부위에서 상기 노치 수용체 폴리펩타이드의 절단을 유도하여 세포내 도메인을 방출시키고, 상기 전사 조절 요소를 활성화시키고 상기 면역 억제 인자가 발현되도록 하는, 핵산. - 청구항 73에 있어서, 상기 표적 분자가 조직 특이적 분자인, 방법.
- 청구항 73에 있어서, 상기 표적 분자가 기관 특이적 분자인, 방법.
- 청구항 73에 있어서, 상기 표적 분자가 세포 유형 특이적 분자인, 방법.
- 청구항 73에 있어서, 상기 표적 분자가 자가항원인, 방법.
- 청구항 73 내지 77 중 어느 한 항에 있어서, 상기 면역 억제 인자가 면역억제성 사이토킨인, 방법.
- 청구항 78에 있어서, 상기 면역억제성 사이토킨이 IL-10인, 방법.
- 청구항 73 내지 77 중 어느 한 항에 있어서, 상기 면역 억제 인자가 세포-대-세포 신호전달 면역억제성 리간드인, 방법.
- 청구항 80에 있어서, 상기 세포-대-세포 신호전달 면역억제성 리간드가 PD-L1인, 방법.
- 청구항 73 내지 81 중 어느 한 항에 따른 유효량의 숙주 세포를 대상체에게 투여함을 포함하는, 상기 대상체에서 면역 반응을 억제하는 방법으로서, 상기 대상체가 상기 표적 분자를 발현하는, 방법.
- 청구항 82에 있어서, 상기 대상체가 자가면역 질환을 갖는, 방법.
- 이종성 종양을 사멸시키는 방법으로서, 상기 방법이:
사멸 항원을 발현하는 제1 세포 및 상기 사멸 항원 및 프라이밍 항원을 발현하는 제2 세포를 포함하는 이종성 종양을:
상기 프라이밍 항원에 특이적으로 결합하는 단백질용해 절단가능한 키메라 폴리펩타이드;
상기 사멸 항원에 특이적으로 결합하는 치료학적 폴리펩타이드를 암호화하는 핵산 서열; 및
단백질용해 절단가능한 키메라 폴리펩타이드에 응답하는 상기 핵산에 작동적으로 연결된 전사 조절 요소를 포함하는 가공된 면역 세포와 접촉시키는 단계를 포함하며,
상기 단백질용해 절단가능한 키메라 폴리펩타이드의 상기 프라이밍 항원으로의 결합이 상기 전사 조절 요소를 활성화시켜 상기 사멸 항원에 결합되는 경우, 상기 이종성 종양의 제1 및 제2 세포를 사멸시키는 치료학적 폴리펩타이드의 발현을 유도하는, 방법. - 청구항 84에 있어서, 상기 치료학적 폴리펩타이드가 키메라 항원 수용체(CAR)인, 방법.
- 청구항 84에 있어서, 상기 치료학적 폴리펩타이드가 T 세포 수용체(TCR)인, 방법.
- 청구항 84에 있어서, 상기 치료학적 폴리펩타이드가 치료학적 항체인, 방법.
- 청구항 84에 있어서, 상기 치료학적 폴리펩타이드가 키메라 이중특이적 결합 구성원인, 방법.
- 청구항 84 내지 88 중 어느 한 항에 있어서, 상기 프라이밍 항원 또는 상기 사멸 항원 중 적어도 하나가 MHC와 관련하여 제공되는 세포내 항원인, 방법.
- 청구항 84 내지 89 중 어느 한 항에 있어서, 상기 프라이밍 항원 및 상기 사멸 항원 둘 다가 MHC와 관련하여 제공되는 세포내 항원인, 방법.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020237006942A KR102637610B1 (ko) | 2016-08-23 | 2017-08-22 | 단백질용해 절단가능한 키메라 폴리펩타이드 및 이의 사용 방법 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662378614P | 2016-08-23 | 2016-08-23 | |
| US62/378,614 | 2016-08-23 | ||
| PCT/US2017/048040 WO2018039247A1 (en) | 2016-08-23 | 2017-08-22 | Proteolytically cleavable chimeric polypeptides and methods of use thereof |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020237006942A Division KR102637610B1 (ko) | 2016-08-23 | 2017-08-22 | 단백질용해 절단가능한 키메라 폴리펩타이드 및 이의 사용 방법 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190051956A true KR20190051956A (ko) | 2019-05-15 |
Family
ID=61245300
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020237006942A KR102637610B1 (ko) | 2016-08-23 | 2017-08-22 | 단백질용해 절단가능한 키메라 폴리펩타이드 및 이의 사용 방법 |
| KR1020197005928A KR20190051956A (ko) | 2016-08-23 | 2017-08-22 | 단백질용해 절단가능한 키메라 폴리펩타이드 및 이의 사용 방법 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020237006942A KR102637610B1 (ko) | 2016-08-23 | 2017-08-22 | 단백질용해 절단가능한 키메라 폴리펩타이드 및 이의 사용 방법 |
Country Status (9)
| Country | Link |
|---|---|
| US (2) | US11401332B2 (ko) |
| EP (1) | EP3504245A4 (ko) |
| JP (2) | JP2019528077A (ko) |
| KR (2) | KR102637610B1 (ko) |
| CN (1) | CN109843929A (ko) |
| AU (1) | AU2017316649A1 (ko) |
| CA (1) | CA3034093A1 (ko) |
| SG (2) | SG10201913583QA (ko) |
| WO (1) | WO2018039247A1 (ko) |
Families Citing this family (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP4079292A1 (en) | 2010-09-24 | 2022-10-26 | The Brigham and Women's Hospital, Inc. | Nanostructured gels capable of controlled release of encapsulated agents |
| JP2018510623A (ja) | 2015-02-20 | 2018-04-19 | オハイオ・ステイト・イノベーション・ファウンデーション | Nkg2d及び腫瘍関連抗原に対する二価抗体 |
| EP3280437A4 (en) | 2015-04-06 | 2018-09-12 | Jianhua Yu | Egfr-directed car therapy for glioblastoma |
| WO2018050225A1 (en) * | 2016-09-15 | 2018-03-22 | Yu Di | T-cell immunotherapy |
| US11020410B2 (en) | 2017-02-03 | 2021-06-01 | The Brigham And Women's Hospital, Inc. | Self-assembled gels formed with anti-retroviral drugs, prodrugs thereof, and pharmaceutical uses thereof |
| US11325957B2 (en) * | 2017-06-19 | 2022-05-10 | Cell Design Labs, Inc. | Methods and compositions for reducing the immunogenicity of chimeric notch receptors |
| GB201804291D0 (en) * | 2018-03-16 | 2018-05-02 | Evox Therapeutics Ltd | Cell-mediated exosome delivery |
| CN112118850A (zh) * | 2018-03-16 | 2020-12-22 | 赛通免疫治疗公司 | 双特异性抗体car细胞免疫疗法 |
| JP2021520352A (ja) | 2018-04-04 | 2021-08-19 | アリヴィオ セラピューティクス, インコーポレイテッド | 生物製剤の制御送達用の自己組織化ゲルおよびその製造方法 |
| WO2019195576A1 (en) * | 2018-04-06 | 2019-10-10 | The Regents Of The University Of California | Trans-antigen targeting in heterogeneous cancers and methods of use thereof |
| CA3096812A1 (en) * | 2018-04-10 | 2019-10-17 | Stichting Sanquin Bloedvoorziening | Chimeric notch receptors |
| EP3847650A1 (en) | 2018-09-06 | 2021-07-14 | The Broad Institute, Inc. | Nucleic acid assemblies for use in targeted delivery |
| EP3891286A4 (en) * | 2018-12-06 | 2022-10-19 | The Board of Trustees of the Leland Stanford Junior University | REGULABLE CELL SURFACE RECEPTORS AND RELATED COMPOSITIONS AND METHODS |
| CN113164578B (zh) * | 2019-01-03 | 2024-04-30 | 南京传奇生物科技有限公司 | 表达鞭毛蛋白多肽的经修饰的免疫细胞 |
| CN114585645A (zh) * | 2019-08-09 | 2022-06-03 | A2生物治疗公司 | 对杂合性丧失作出响应的细胞表面受体 |
| JP2022548796A (ja) * | 2019-09-24 | 2022-11-21 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | ヒンジドメインを有するノッチ受容体 |
| US20220348677A1 (en) * | 2019-09-24 | 2022-11-03 | The Regents Of The University Of California | Receptors with heterologous transmembrane domain |
| CN114729025A (zh) * | 2019-09-24 | 2022-07-08 | 加利福尼亚大学董事会 | 用于配体依赖性转录调控的新型受体 |
| WO2021061791A1 (en) * | 2019-09-24 | 2021-04-01 | The Regents Of The University Of California | Notch receptors with zinc finger-containing transcriptional effector |
| CN110716044B (zh) * | 2019-10-23 | 2023-04-18 | 郑州大学 | 一种用于食管鳞癌早期筛查和诊断的血清蛋白标志物、试剂盒及检测方法 |
| CN110970090B (zh) * | 2019-11-18 | 2021-06-29 | 华中科技大学 | 一种用于判断待处理多肽与阳性数据集肽段相似度的方法 |
| WO2021131944A1 (ja) * | 2019-12-27 | 2021-07-01 | 国立大学法人神戸大学 | 癌遺伝子治療薬 |
| WO2021257989A2 (en) * | 2020-06-18 | 2021-12-23 | Flagship Pioneering, Inc. | Methods and compositions for modulating cells and cellular membranes |
| AU2021329375A1 (en) | 2020-08-20 | 2023-04-20 | A2 Biotherapeutics, Inc. | Compositions and methods for treating ceacam positive cancers |
| JP2023538114A (ja) | 2020-08-20 | 2023-09-06 | エー2 バイオセラピューティクス, インコーポレイテッド | メソテリン陽性がんを治療するための組成物及び方法 |
| US11661459B2 (en) | 2020-12-03 | 2023-05-30 | Century Therapeutics, Inc. | Artificial cell death polypeptide for chimeric antigen receptor and uses thereof |
| EP4263600A1 (en) | 2020-12-18 | 2023-10-25 | Century Therapeutics, Inc. | Chimeric antigen receptor systems with adaptable receptor specificity |
| WO2022183056A1 (en) * | 2021-02-26 | 2022-09-01 | Salk Institute For Biological Studies | Modulating regulatory t cell function in autoimmune disease and cancer |
| CA3213044A1 (en) * | 2021-03-23 | 2022-09-29 | Kole T. ROYBAL | Synthetic intermembrane proteolysis receptors for custom antigen-induced transcriptional regulation |
| WO2022204326A1 (en) * | 2021-03-24 | 2022-09-29 | The Regents Of The University Of California | Humanized synthetic notch receptors with augmented transactivation domains and uses thereof |
| CN114736308B (zh) * | 2022-03-15 | 2022-12-27 | 四川宜美康科技有限公司 | 球虫抗原肽/il5的融合蛋白基因工程菌的制备及用途 |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5780300A (en) | 1995-09-29 | 1998-07-14 | Yale University | Manipulation of non-terminally differentiated cells using the notch pathway |
| GB0112818D0 (en) * | 2001-05-25 | 2001-07-18 | Lorantis Ltd | Conjugate |
| GB0220658D0 (en) | 2002-09-05 | 2002-10-16 | Lorantis Ltd | Immunotherapy |
| CA2664738C (en) | 2006-09-29 | 2017-03-07 | Oncomed Pharmaceuticals, Inc. | Compositions and methods for diagnosing and treating cancer |
| WO2009040782A2 (en) | 2007-09-28 | 2009-04-02 | Royal College Of Surgeons In Ireland | A method of assessing colorectal cancer status in an individual |
| NZ590131A (en) | 2008-07-08 | 2012-10-26 | Oncomed Pharm Inc | Notch-binding agents and antagonists and methods of use thereof |
| WO2011130624A2 (en) | 2010-04-16 | 2011-10-20 | Immune Disease Institute, Inc. | Sustained polypeptide expression from synthetic, modified rnas and uses thereof |
| WO2014055668A1 (en) | 2012-10-02 | 2014-04-10 | Memorial Sloan-Kettering Cancer Center | Compositions and methods for immunotherapy |
| US10117896B2 (en) | 2012-10-05 | 2018-11-06 | The Trustees Of The University Of Pennsylvania | Use of a trans-signaling approach in chimeric antigen receptors |
| GB201306536D0 (en) | 2013-04-10 | 2013-05-22 | Gt Biolog Ltd | Polypeptide and immune modulation |
| MX2016005689A (es) | 2013-10-31 | 2016-08-08 | Hutchinson Fred Cancer Res | Celulas no t efectoras y madre/progenitoras hematopoyeticas modificadas y usos de estas. |
| US9730935B2 (en) | 2013-12-13 | 2017-08-15 | The Board Of Trustees Of The Leland Stanford Junior University | Targeting a non-canonical notch signaling pathway for cancer treatment |
| CN106456748A (zh) | 2014-01-08 | 2017-02-22 | 小利兰·斯坦福大学托管委员会 | 小细胞肺癌的靶向疗法 |
| DK3105335T3 (da) | 2014-02-14 | 2020-01-13 | Univ Texas | Kimære antigenreceptorer og fremgangsmåder til fremstilling heraf |
| JP6665102B2 (ja) | 2014-02-21 | 2020-03-13 | セレクティスCellectis | 制御性t細胞をインサイチューで阻害するための方法 |
| EP3174546B1 (en) * | 2014-07-31 | 2019-10-30 | Novartis AG | Subset-optimized chimeric antigen receptor-containing t-cells |
| EP3186284B1 (en) | 2014-08-28 | 2022-04-06 | BioAtla, Inc. | Conditionally active chimeric antigen receptors for modified t-cells |
| US20160081314A1 (en) * | 2014-09-19 | 2016-03-24 | Regeneron Pharmaceuticals, Inc. | Chimeric Antigen Receptors |
| WO2016093243A1 (ja) | 2014-12-09 | 2016-06-16 | 北海道公立大学法人札幌医科大学 | 腫瘍抗原ペプチド |
| MX2017010721A (es) | 2015-02-24 | 2018-08-28 | Univ California | Interruptores transcripcionales activados mediante unión y métodos para su uso. |
-
2017
- 2017-08-22 SG SG10201913583QA patent/SG10201913583QA/en unknown
- 2017-08-22 CN CN201780063755.8A patent/CN109843929A/zh active Pending
- 2017-08-22 US US16/325,657 patent/US11401332B2/en active Active
- 2017-08-22 KR KR1020237006942A patent/KR102637610B1/ko active IP Right Grant
- 2017-08-22 WO PCT/US2017/048040 patent/WO2018039247A1/en unknown
- 2017-08-22 AU AU2017316649A patent/AU2017316649A1/en active Pending
- 2017-08-22 KR KR1020197005928A patent/KR20190051956A/ko not_active Application Discontinuation
- 2017-08-22 JP JP2019510951A patent/JP2019528077A/ja active Pending
- 2017-08-22 EP EP17844296.8A patent/EP3504245A4/en active Pending
- 2017-08-22 SG SG11201901528RA patent/SG11201901528RA/en unknown
- 2017-08-22 CA CA3034093A patent/CA3034093A1/en active Pending
-
2022
- 2022-03-30 JP JP2022057245A patent/JP2022106714A/ja active Pending
- 2022-06-15 US US17/841,595 patent/US20220324982A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| SG10201913583QA (en) | 2020-02-27 |
| JP2022106714A (ja) | 2022-07-20 |
| KR102637610B1 (ko) | 2024-02-19 |
| SG11201901528RA (en) | 2019-03-28 |
| JP2019528077A (ja) | 2019-10-10 |
| US11401332B2 (en) | 2022-08-02 |
| WO2018039247A1 (en) | 2018-03-01 |
| EP3504245A4 (en) | 2020-04-22 |
| US20190202918A1 (en) | 2019-07-04 |
| CN109843929A (zh) | 2019-06-04 |
| KR20230038295A (ko) | 2023-03-17 |
| US20220324982A1 (en) | 2022-10-13 |
| CA3034093A1 (en) | 2018-03-01 |
| AU2017316649A1 (en) | 2019-03-07 |
| EP3504245A1 (en) | 2019-07-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102637610B1 (ko) | 단백질용해 절단가능한 키메라 폴리펩타이드 및 이의 사용 방법 | |
| US20200331985A1 (en) | Force sensor cleavage domain containing chimeric polypeptides and methods of use thereof | |
| US20200345845A1 (en) | Compositions and methods related to cell systems for penetrating solid tumors | |
| JP6905163B2 (ja) | サイトカイン放出症候群を予測するバイオマーカー | |
| US20190359678A1 (en) | Chimeric t cell antigen receptors and methods of use thereof | |
| JP2017145258A (ja) | Aprilバリアント | |
| CA3125529A1 (en) | Polypeptides comprising modified il-2 polypeptides and uses thereof | |
| JP2024037966A (ja) | 単鎖キメラポリペプチドおよびその使用 | |
| JP2019513400A (ja) | エクスビボのbite活性化t細胞 | |
| IL295077A (en) | Methods for treating age-related and inflammatory diseases | |
| CA3091138A1 (en) | Compositions and methods for cellular immunotherapy | |
| US20210023136A1 (en) | Trans-antigen targeting in heterogeneous cancers and methods of use thereof | |
| JP2023519107A (ja) | 制御性t細胞を活性化する方法 | |
| JP2023532904A (ja) | 修飾il-2ポリペプチドを含むポリペプチド及びその使用 | |
| JP2024016134A (ja) | 細胞療法に関連する毒性に関する製造物品および方法 | |
| JP2024508207A (ja) | がんに対する組み合わせ治療におけるltbrアゴニスト | |
| JP2024500065A (ja) | Tigitベースのキメラタンパク質及びlightベースのキメラタンパク質を使用してがんを処置する方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application | ||
| E801 | Decision on dismissal of amendment | ||
| E601 | Decision to refuse application |