KR20190049732A - 5-ht2c 수용체 효능제 및 조성물 및 사용 방법 - Google Patents
5-ht2c 수용체 효능제 및 조성물 및 사용 방법 Download PDFInfo
- Publication number
- KR20190049732A KR20190049732A KR1020197007503A KR20197007503A KR20190049732A KR 20190049732 A KR20190049732 A KR 20190049732A KR 1020197007503 A KR1020197007503 A KR 1020197007503A KR 20197007503 A KR20197007503 A KR 20197007503A KR 20190049732 A KR20190049732 A KR 20190049732A
- Authority
- KR
- South Korea
- Prior art keywords
- pyrazino
- hexahydro
- naphthyridine
- halogen
- optionally substituted
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/4375—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a six-membered ring having nitrogen as a ring heteroatom, e.g. quinolizines, naphthyridines, berberine, vincamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/4985—Pyrazines or piperazines ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/32—Alcohol-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/34—Tobacco-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains three hetero rings
- C07D471/14—Ortho-condensed systems
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Addiction (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Psychiatry (AREA)
- Epidemiology (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
- Child & Adolescent Psychology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
본 발명은 화학식 A의 화합물 및 5-HT2C수용체의 활성을 조절하는 이의 약학 조성물에 관한 것이다.
화학식 A
본 발명의 화합물 및 이의 약학 조성물은 5-HT2C 수용체-매개 장애의 치료, 예컨대, 체중 관리, 포만감 유도, 및 식품 섭취 감소, 비만, 항정신병제-유발 체중 증가, 제2형 당뇨병, 프레더-윌리 증후군, 담배/니코틴 의존, 약물 중독, 알콜 중독 등의 예방 및 치료, 강박 스펙트럼 장애 및 충동 조절 장애(손톱 물어뜯기 및 교조증 포함), 수면 장애, 요실금, 정신 장애(정신분열증, 신경성 식욕부진 및 신경성 폭식증 포함), 알츠하이머병, 성 기능 장애, 발기 부전, 간질, 운동 장애(파킨슨병 및 항정신병제-유발 운동 장애 포함), 고혈압, 이상지혈증, 비알콜성 지방간 질환, 비만-관련 신장 질환, 및 수면 무호흡의 치료에 유용한 방법에 관한 것이다. 또한 선택적으로 보충제와 조합되어 사용되는, 본원에서 제공된 화합물을 포함하는 조성물이 제공된다.
화학식 A
본 발명의 화합물 및 이의 약학 조성물은 5-HT2C 수용체-매개 장애의 치료, 예컨대, 체중 관리, 포만감 유도, 및 식품 섭취 감소, 비만, 항정신병제-유발 체중 증가, 제2형 당뇨병, 프레더-윌리 증후군, 담배/니코틴 의존, 약물 중독, 알콜 중독 등의 예방 및 치료, 강박 스펙트럼 장애 및 충동 조절 장애(손톱 물어뜯기 및 교조증 포함), 수면 장애, 요실금, 정신 장애(정신분열증, 신경성 식욕부진 및 신경성 폭식증 포함), 알츠하이머병, 성 기능 장애, 발기 부전, 간질, 운동 장애(파킨슨병 및 항정신병제-유발 운동 장애 포함), 고혈압, 이상지혈증, 비알콜성 지방간 질환, 비만-관련 신장 질환, 및 수면 무호흡의 치료에 유용한 방법에 관한 것이다. 또한 선택적으로 보충제와 조합되어 사용되는, 본원에서 제공된 화합물을 포함하는 조성물이 제공된다.
Description
본 발명은 화학식 A의 화합물 및 5-HT2C수용체의 활성을 조절하는 이의 약학 조성물에 관한 것이다. 본 발명의 화합물 및 이의 약학 조성물은 5-HT2C 수용체-매개 장애의 치료, 예컨대, 체중 관리, 포만감 유도, 및 식품 섭취 감소 방법, 및 비만의 예방 및 치료, 항정신병제-유발 체중 증가, 제2형 당뇨병, 프레더-윌리 증후군, 담배/니코틴 의존, 약물 중독, 알콜 중독, 병적 도박, 보상 결핍 증후군 및 성 중독, 강박 스펙트럼 장애 및 충동 조절 장애(손톱 물어뜯기 및 교조증 포함), 수면 장애(불면증, 분절 수면 구조, 및 서파 수면 장애 포함), 요실금, 정신 장애(정신분열증, 신경성 식욕부진 및 신경성 폭식증 포함), 알츠하이머병, 성 기능 장애, 발기 부전, 간질, 운동 장애(파킨슨병 및 항정신병제-유발 운동 장애 포함), 고혈압, 이상지혈증, 비알콜성 지방간 질환, 비만-관련 신장 질환, 및 수면 무호흡의 예방 및 치료에 유용한 방법에 관한 것이다. 또한, 일부 구현예에서, 선택적으로 보충제와 병용하여, 본원의 화합물을 포함하는 조성물, 및 선택적으로 보충제와 병용하여, 본원의 화합물을 투여하는 단계를 포함하는, 담배 흡연의 빈도를 감소시키려고 시도하는 개체에서 담배 흡연의 빈도를 감소시키거나; 담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조하거나; 흡연 중단 및 연관된 체중 증가 예방을 보조하거나; 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 제어하거나; 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 감소시키거나; 니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에서 니코틴 의존, 중독 및/또는 금단을 치료하거나; 니코틴 사용을 중단하려고 시도하는 개체에 의한 니코틴 재발 사용의 가능성을 감소시키는 방법이 제공된다.
비만은 제2형 당뇨병, 고혈압, 뇌졸중, 암, 및 담낭 질환과 같은 부수적인 질병으로 인한 이환율과 사망률의 위험이 증가하는 생명을 위협하는 질환이다.
비만은 이제 서구 세계에서 주요 건강관리 문제가 되고 있으며 일부 제3세계 국가에서 증가하고 있다. 비만인 수의 증가는 주로 고지방 식품에 대한 선호도 증가와 대부분의 사람들의 생활에서의 활동 감소에도 기인한다. 현재 미국 인구의 약 30%가 비만인 것으로 간주된다.
과체중 또는 비만으로 분류되는지 여부는 일반적으로 체중(kg)을 신장의 제곱값(m2)으로 나눈 체질량 지수(BMI)를 기준으로 결정된다. 따라서 BMI의 단위는 kg/m2이며, 각각의 10년 시기에서 최소 사망률과 관련된 BMI 범위를 계산할 수 있다. 과체중은 25 내지 30 kg/m2 BMI 범위로 정의되고, 비만은 30 kg/m2 초과의 BMI로 정의된다(아래 표 참조).
체질량 지수 (BMI) 별 체중 분류
BMI가 증가함에 따라 다른 위험 요소와 독립적인 다양한 원인으로 사망 위험이 증가한다. 비만과 관련된 가장 흔한 질병은 심혈관 질환(특히 고혈압), 당뇨병(비만은 당뇨병 발병을 악화시킴), 담낭 질환(특히 암) 및 생식계 질환이다. 비만과 특정 병태 사이의 연관성의 세기는 다양하다. 가장 강력한 것 중 하나는 제2형 당뇨병과의 연관성이다. 과도한 체지방은 남성의 경우 당뇨병의 64%와 여성의 경우의 77%의 원인이 된다(Seidell, Semin Vasc Med 5:3-14(2005)). 연구에 따르면 체중이 완만하게 감소하더라도 관상동맥 심장 질환이 발생할 위험이 크게 감소될 수 있다.
그러나, 지방(지방 조직)과 관련된 근육인 체질량의 비율을 고려하지 않는다는 점에서 BMI 정의에 문제가 있다. 이를 고려하여, 비만은 또한 체지방 함량을 기준으로 남성의 경우에 25% 초과, 여성의 경우에 30% 초과인 것으로 정의될 수 있다.
비만은 심혈관 질환의 발병 위험을 상당히 증가시킨다. 관상동맥 부전, 죽상경화, 및 심부전이 비만에 의해 유도되는 심혈관 합병증의 선두 자리에 있다. 전체 인구가 이상적인 체중을 가진다면 관상동맥 부전의 위험은 25% 감소되고, 심부전의 위험 및 뇌혈관 사고의 위험은 35% 감소될 것으로 추정된다. 관상동맥 질환의 발병률은 30% 과체중인 50세 미만인 대상체에서 2배가 된다. 당뇨병 환자는 수명이 30% 감소할 위험성이 있다. 45세 이후, 당뇨병이 있는 사람은 당뇨병이 없는 사람보다 유의한 심장 질환을 앓게 될 가능성이 약 3배 더 높고, 뇌졸중을 앓게 될 가능성이 최대 5배까지 더 높다. 이러한 조사 결과들은 당뇨병 및 관상동맥 심장 질환에 대한 위험 인자와, 비만 예방에 기초하여 상기 병태들을 예방하기 위한 통합 접근법의 잠재적인 가치 사이의 상호 관계를 강조한다(Perry, I. J. , et al. , BMJ 310, 560-564(1995)).
당뇨병은 또한 신장 질환, 안구 질환 및 신경계 문제의 발병과 관련되어 있다. 신장병증(nephropathy)이라고도 하는 신장 질환은 신장의 "여과기 기전"이 손상되어 단백질의 과도한 양이 소변으로 누출되어 결국 신장이 파괴될 때 발생한다. 당뇨병은 또한 안구 뒤쪽의 망막 손 상에 주요 원인이 되며 백내장 및 녹내장의 위험을 증가시킨다. 마지막으로, 당뇨병은 특히 다리와 발의 신경 손상과 관련이 있으며, 이는 통증을 감지하는 능력을 방해하고 심각한 감염의 원인이 된다. 종합하면, 당뇨병 합병증은 국민의 주요 사망 원인 중 하나이다.
치료법의 제1선은 환자의 식사에서 지방 함량을 감소시키고, 이의 신체 활동을 증가시키는 것과 같이, 식이 및 생활 방식에 관한 충고를 환자에게 제공하는 것이다. 그러나, 많은 환자들은 이것이 어렵다는 것을 알며, 이러한 노력으로부터의 결과를 유지하기 위해 약물 요법으로부터 추가적인 도움이 필요하다.
현재 시판되는 대부분의 제품들은 효능 부족 또는 허용되지 않는 부작용 프로파일로 인해 비만 치료법으로서 성공하지 못했다. 지금까지 가장 성공적인 약물은 간접적으로 작용하는 5-하이드록시트립타민(5-HT) 작용제인 d-펜플루라민(리덕스(Redux)TM)이지만, 환자의 최대 1/3에서 심장 판막 결손증이 보고되어 1998년 FDA에 의해 상기 작용제의 사용이 중지되었다.
게다가, 췌장 리파제 억제에 의해 지방의 흡수를 막는 약물인 오를리스타트(제니칼(Xenical)TM), 및 5-HT/노르아드레날린 재흡수 억제제인 시부트라민(리덕틸(Reductil)TM)인 2종의 약물이 미국 및 유럽에서 출시되었다. 그러나 이러한 제품과 관련된 부작용은 장기적인 유용성을 제한할 수 있다. 제니칼을 사용하는 치료는 일부 환자에서 위장 불쾌감을 유도하는 것으로 보고되어 있으며, 한편 시부트라민은 일부 환자에서 혈압 상승과 연관이 있었다.
세로토닌(5-HT) 신경전달은 신체 장애 및 정신 장애 둘 다에서 수많은 생리학적 과정에서 중요한 역할을 한다. 5-HT는 섭식 거동의 조절과 관련되어 있다. 5-HT는 포만감을 유도함으로써 작용하는 것으로 여겨지며, 이로써 5-HT가 증진된 대상체는 섭식을 보다 이른 시점에 중단하고 더 적은 칼로리를 섭취하게 된다. 5-HT2C 수용체에 대한 5-HT의 자극 작용은 섭식 조절에서 및 d-펜플루라민의 항-비만 효과에서 중요한 역할을 하는 것으로 나타났다. 5-HT2C 수용체는 뇌에서(특히, 변연 구조, 추체외로 경로, 시상 및 시상하부, 즉, 시상하부 뇌실곁핵 및 등쪽안쪽 시상하부핵, 및 주로 맥락총에서) 고밀도로 발현되고, 말초 조직에서 저밀도로 발현되거나, 말초 조직에 존재하지 않기 때문에, 본원에 제공된 화합물은 더욱 효과적이고, 안전한 항비만제일 수 있다. 또한, 5-HT2C 녹아웃 마우스는 인지 장애가 있고 발작이 일어나기 쉬운 과체중이다.
5-HT2C 수용체는 강박 장애, 일부 형태의 우울증, 및 간질에서 역할을 할 수 있는 것으로 여겨진다. 따라서, 작용제는 항-공황장애 특성, 및 성 기능 장애의 치료에서 유용한 특성을 가질 수 있다.
요약하면, 5-HT2C 수용체는 비만 및 정신 장애 치료를 위한 수용체 표적이며, 식품 섭취 및 체중을 안전하게 감소시키는 5-HT2C 작용제에 대한 필요성이 있음을 알 수 있다.
5-HT2C 수용체는 14개의 별개의 세로토닌 수용체 아형 중 하나이다. 5-HT2C 수용체와 밀접하게 관련된 2종의 수용체는 상당한 서열 상동성을 공유하는 5-HT2A 및 5-HT2B 수용체이다. 중심 5-HT2A 수용체의 활성화는 지각 및 환각의 변화를 포함하는 비선택적 세로토닌성 약물의 다수의 불리한 중추 신경계 영향에 대한 원인이라고 여겨진다. 심혈관계에 위치한 5-HT2B 수용체의 활성화는 세로토닌 기전을 통해 작용하는 다수의 다른 약물과 펜플루라민의 사용과 연관이 있는 심장 판막 질환 및 폐 고혈압을 초래하는 것으로 가정된다.
로카세린(PCT 특허 공보 WO2003/086303에 개시)은 5-HT2C 수용체의 작용제이고, 동물 모델 및 인간에서 비만을 감소시키는 데 효능을 보인다. 2009년 12월에, 아레나 파마슈티칼스(Arena Pharmaceuticals)는 로카세린에 대한 신약 승인 신청서(New Drug Application) 또는 NDA를 미국 식품 의약품국(FDA)에 제출하였다. NDA 제출은 총 8,576명의 환자에 대한 18회의 임상 시험을 포함하는 로카세린의 임상 개발 프로그램으로부터의 광범위한 데이터 패키지에 기초한다. 주요 3상 임상 시험 프로그램에서는 최대 2년 동안 치료된 거의 7,200명 환자를 평가하였고, 그 결과, 로카세린은 탁월한 내약성과 함께, 일관되게 유의한 체중 감소를 초래하는 것으로 나타났다. 환자의 약 2/3는 적어도 5%의 체중 감소를 달성하였고, 1/3을 넘는 환자들이 적어도 10%의 체중 감소를 달성하였다. 평균적으로, 환자들은 17 내지 18 파운드, 또는 이의 체중의 약 8%를 감량하였다. 신체 조성, 지질, 심혈관 위험 인자 및 혈당 파라미터를 포함한, 2차 종점은 위약과 비교하여 개선되었다. 또한 심박수 및 혈압은 강하되었다. 로카세린은 심장 판막증의 위험을 증가시키지 않았다. 로카세린은 삶의 질을 개선시켰고, 우울증 또는 자살 관념에 대한 어떠한 신호도 없었다. 위약 비율보다 5% 초과한 유일의 유해 사례는 일반적으로 경미하거나, 중간 정도의 일시적 두통이었다. 정상 BMI가 25인 것에 기초하였을 때, 1차 3상 시험에서 환자는 이의 과다한 체중의 약 1/3을 감량하였다. 2차 3상 시험에서 상위 사분위수의 환자에 대한 평균 체중의 감량은 35 파운드 또는 체중의 16%였다.
3상 임상 시험 프로그램의 일환으로서, 로카세린은 경구용 고혈당제("BLOOM-DM")로 치료된 저조하게 제어된 제2형 당뇨병을 가진 604명의 성인을 대상으로 무작위, 위약 대조, 다중 장소, 이중 맹검 시험으로 평가되었다. 전체 연구 결과의 분석에 의하면 로카세린은 1년째 = 5% 또는 = 10% 체중 감소를 달성한 환자의 비율로서 또는 평균 체중 변화로서 측정했을 때 유의한 체중 감소를 보였다(Diabetes 60, Suppl 1, 2011). 로카세린은 전체 환자 집단에서 혈당 조절을 유의하게 개선하였다. 따라서 로카세린은 체중 관리에 유용할 뿐만 아니라, 제2형 당뇨병 치료에도 유용하다.
2012년 6월 27일에, FDA는 적어도 하나의 체중 관련 동반이환 병태(예를 들어, 고혈압, 이상지혈증, 제2형 당뇨병)의 존재 하에 최초 체질량 지수(BMI) 30 kg/m2 이상(비만) 또는 27 kg/m2 이상(과체중)의 성인 환자에서 만성 체중 관리를 위한 신체 활동 증가 및 저칼로리 식이 보조제로서, 로카세린(벨빅(BELVIQ)®)을 미국 마약 단속국(Drug Enforcement Administration)(DEA)에 의한 최종 스케줄링 결정에 따라, 임시로 승인했다. 2012년 12월 19일에 DEA는 로카세린을 남용 위험이 낮은, 스케줄 4 약물로서 분류하도록 권장하였다. 연방 관보 사무국(Office of the Federal Register)은 벨빅을 관리대상 의약품법(Controlled Substances Act)의 스케줄 4로 평가하는 DEA의 최종 규칙을 공람시켰다. 스케줄링 지정이 발효되었고 DEA 최종 규칙이 연방 관보에 게시된 지 30일 후인 2013년 6월 7일에 벨빅이 미국에서 출시되었다.
담배 사용은 예방가능한 질병과 전세계의 조기 사망의 주요 원인이다. 세계 보건기구 개황 보고서(World Health Organization Fact Sheet)(2013년 7월)에 따르면, 모든 담배 사용자 중 50%는 담배-관련 질병으로 사망하며 - 이는 매년 대략 6백만명이 된다. 직접 담배 사용으로 인한 사망자는 연간 5백만명을 넘는 것으로 추정되며, 나머지 사망은 간접 흡연에 노출로 인한 것이다(World Health Organization website. Fact Sheet No 339: Tobacco. www. who. int/mediacentre/factsheets/fs339/en/index. html. Updated July 2013. Accessed September 10, 2013). 미국 질병 통제 예방 센터(Centers for Disease Control 및 Prevention)(CDC)에 따르면, 미국의 대략 4380만명의 성인이 담배 흡연자(cigarette smoker)이다. 미국에서, 담배 사용이 매년 5명 중 1명 사망의 원인이 된다(World Health Organization website. Fact Sheet No 339: Tobacco. www. who. int/mediacentre/factsheets/fs339/en/index. html. Updated July 2013. Accessed September 10, 2013). 담배 사용은 심혈관 질환, 폐 및 다른 암, 및 만성 하부 호흡기 질환(만성 기관지염, 폐기종, 천식, 및 다른 만성 하부 호흡기 질환)과 직접 관련된다(Health Effects of Cigarette Smoking. Centers for Disease Prevention website. www. cdc. gov/tobacco/data_statistics/fact_sheets/health_effects/effects_cig_smoking/ Accessed September 10, 2013). 이들은 만성 하부 호흡기 질환이 뇌혈관 질환을 대체한 2008년 이후 미국에서 사망의 상위 3대 원인으로 자리 매김했으며, 뇌혈관 질환 또한 담배 사용과 직접 연관이 있다(Molgaard CA, Bartok A, Peddecord KM, Rothrock J. The association between cerebrovascular disease 및 smoking: a case-control study. Neuroepidemiology. 1986;5(2):88-94).
2002년부터 8년에 걸쳐 2138명의 미국 흡연자의 흡연 거동을 조사한 연구에 따르면, 대략 1/3의 대상체가 전년도에 금연 시도를 한 것으로 보고하였으며, 원래 코호트의 대략 85%가 설문 기간에 걸쳐 적어도 1회 금연 시도를 하였으며, 평균 금연율은 유지된 코호트의 경우에 3. 8%인 것으로 밝혀졌다. 대다수의 흡연자들은 금연 시도를 하지만, 지속된 금연은 여전히 성취하기가 어렵다(Cummings KM, Cornelius ME, Carpenter MJ, et al. Abstract: How Many Smokers Have Tried to Quit? Society for Research on Nicotine 및 Tobacco. Poster Session 2. March 2013. POS2-65).
기존의 흡연 중단 치료는 챈틱스(CHANTIX)(바레니클린) 및 지반(ZYBAN)(부프로피온 SR)을 포함한다. 그러나, 챈틱스 및 지반 둘 다의 처방 정보는 블랙 박스 경고를 포함한다. 챈틱스 처방 정보는 환자의 전형적이지 않은 초조, 적대감, 우울한 기분 변화, 거동 또는 사고의 증상, 및 자살 관념 또는 자살 거동을 포함하는 심각한 신경정신병적 사건에 대한 경고를 전한다(CHANTIX(varenicline)(package insert), New York, NY: Pfizer Labs, Division of Pfizer, Inc. ; 2012). 또한, 경고는 메타-분석에서 심혈관계 사건을 발견한 경우는 드물었으나, 일부는 챈틱스로 치료한 개체에서 더 빈번히 보고되었으며; 그 차이는 통계적으로 유의하지 않았다고 알린다(CHANTIX(varenicline)(package insert), New York, NY: Pfizer Labs, Division of Pfizer, Inc. ; 2012). 지반 처방 정보는 치료 동안 뿐만 아니라 치료 중단 후에 심각한 신경정신병적 사건에 대한 유사한 블랙 박스 경고를 포함한다(ZYBAN(bupropion hydrochloride)(package insert), Research Triangle Park, NC: GlaxoSmithKline; 2012). 추가 경고는 어린이, 청소년 및 청년에서 자살 사고 및 거동, 및 정신 장애의 위험이 증가하므로 항우울제를 사용하는 개체의 모니터링을 포함한다(ZYBAN(bupropion hydrochloride)(package insert), Research Triangle Park, NC: GlaxoSmithKline; 2012).
추가로, 체중 증가는 금연의 널리 인식된 부작용이다. 흡연 중단은 약 80%의 흡연자에게서 체중 증가를 야기한다. 금연 후 첫해의 평균 체중 증가는 4-5 kg이며, 이 중 대부분은 첫 3개월 동안 증가된다. 이러한 체중은 흡연 중단의 건강상 이점과 비교하여 약간의 불편으로 전형적으로 여겨지나, 금연자의 10-20%는 10 kg 넘게 증가된다. 또한 모든 대상체의 1/3은 이들이 흡연을 다시 시작한 후에 초과 체중을 감량할 수 없었다고 말했는데, 이는 여러번 금연 시도가 누적 체중 증가를 야기한다는 가설에 신빙성을 더해 준다(Veldheer S, Yingst J, Foulds G, Hrabovsky S, Berg A, Sciamanna C, Foulds J. Once bitten, twice shy: concern about gaining weight after smoking cessation 및 its association with seeking treatment. Int J Clin Pract. (2014) 68:388-395).
이러한 통계 자료를 고려해 볼 때, 여성 흡연자의 50%와 남성 흡연자의 25%가 금연 후 체중 증가(post-cessation weight gain)(PCWG)에 대한 두려움을 금연에 대한 가장 큰 장벽으로서 언급하고, 거의 같은 비율이 이전의 금연 시도에서 재발의 원인으로 체중 증가를 언급한 것은 아마 놀랄 일이 아니다(Meyers AW, Klesges RC, Winders SE, Ward KD, Peterson BA, Eck LH. Are weight concerns predictive of smoking cessation? A prospective analysis. J Consult Clin Psychol. (1997) 65: 448-452; Clark MM, Decker PA, Offord KP, Patten CA, Vickers KS, Croghan IT, Hays JT, Hurt RD, Dale LC. Weight concerns among male smokers. Addict Behav. (2004) 29:1637- 1641; Clark MM, Hurt RD, Croghan IT, Patten CA, Novotny P, Sloan JA, Dakhil SR, Croghan GA, Wos EJ, Rowland KM, Bernath A, Morton RF, Thomas SP, Tschetter LK, Garneau S, Stella PJ, Ebbert LP, Wender DB, Loprinzi CL. The prevalence of weight concerns in a smoking abstinence clinical trial. Addict Behav. (2006) 31:1144-1152. ; Pomerleau CS, Kurth CL. Willingness of female smokers to tolerate postcessation weight gain. J Subst Abuse. (1996) 8:371-378; Pomerleau CS, Zucker AN, Stewart AJ. Characterizing concerns about post cessation weight gain: results from a national survey of women smokers. Nicotine Tob Res. (2001) 3:51-60). 특히, 여성들은 금연하는 동안 체중이 증가하는 것을 꺼리며; 약 40%는 그들이 어쨋든 체중이 증가한다면 흡연을 다시 시작할 것이라고 말한다(Veldheer S, Yingst J, Foulds G, Hrabovsky S, Berg A, Sciamanna C, Foulds J. Once bitten, twice shy: concern about gaining weight after smoking cessation 및 its association with seeking treatment. Int J Clin Pract. (2014) 68:388-395; Pomerleau CS, Kurth CL. Willingness of female smokers to tolerate postcessation weight gain. J Subst Abuse(1996) 8:371-378; Pomerleau CS, Zucker AN, Stewart AJ. Characterizing concerns about post-cessation weight gain: results from a national survey of women smokers. Nicotine Tob Res. (2001) 3:51-60; Tønnesen P, Paoletti P, Gustavsson G, Russell MA, Saracci R, Gulsvik A, Rijcken B, Sawe U. Higher dosage nicotine patches increase one-year smoking cessation rates: results from the European CEASE trial. Collaborative European Anti-Smoking Evaluation. European Respiratory Society. Eur Respir J. (1999) 13:238-246).
경미한 흡연자와 중간 정도의 흡연자는 일반적으로 심한 흡연자보다 더 많은 동기 부여가 될 것이므로, 금연할 가능성이 적은 '하드-코어' 흡연자의 비율이 점점 높아지고 있는 것으로 간주된다(Hughes JR. The hardening hypothesis: is the ability to quit decreasing due to increasing nicotine dependence? A review 및 commentary. Drug Alcohol Depend. (2011) 117:111-117). 일반적으로 체중 증가 우려(weight-gain concern)(WGC)와 연관된 인자 중 하나는 높은 니코틴 의존이며; 따라서 매우 니코틴 의존적이면서 또한 체중이 우려되는 흡연자에게 금연의 전망은 훨씬 어려울 수 있다. 또한, 다소 역설적으로, 심한 흡연자는 경미한 흡연자보다 체중이 더 많이 나가고 비만의 가능성이 높은데, 이는 체중과 흡연 사이에 더 복잡한 관계를 시사한다(Chiolero A, Jacot-Sadowski I, Faeh D, Paccaud F, Cornuz J. Association of cigarettes smoked daily with obesity in a general adult population. Obesity(Silver Spring)(2007) 15:1311-1318; John U, Hanke M, Rumpf HJ, Thyrian JR. Smoking status, cigarettes per day, 및 their relationship to overweight 및 obesity among former 및 current smokers in a national adult general population sample. Int J Obes(Lond). (2005) 29:1289-1294). 몇몇 연구는 과체중 흡연자와 비만 흡연자가 정상 체중 흡연자보다 더 높은 수준의 흡연-관련 체중 증가 우려를 나타냄을 밝혔다(Aubin H-J, Berlin I, Smadja E, West R. Factors associated with higher body mass index, weight concern, 및 weight gain in a multinational cohort study of smokers intending to quit. Int. J. Environ. Res. Public Health. (2009). 6:943-957; Levine MD, Bush T, Magnusson B, Cheng, Y, Chen X. Smoking-related weight concerns 및 obesity: differences among normal weight, overweight, 및 obese smokers using a telephone tobacco quitline. Nicotine Tob Res. (2013) 15:1136-1140). 비만 흡연자에서 높은 체중 증가 우려와 높은 니코틴 의존을 고려해 볼 때, 금연 후 체중 증가를 해결하는 흡연 중단 개입이 이 집단에 특히 유익할 수 있을 것이다.
흡연 중단을 위한 몇몇 요법의 존재에도 불구하고, 장기간의 성공률은 낮고 금연에 대한 주요 장벽이 남아 있다. 이들 장벽을 해결하는 안전하고 효과적인 요법에 대한 상당한 충족되지 않은 필요성이 있다. 또한 5-HT2C 수용체와 관련된 질환 및 장애의 치료를 위한 대안적인 화합물이 여전히 필요하다.
일 구현예에서, 화학식 A 및 이의 약학적으로 허용되는 염, 용매화물, 및 수화물로부터 선택된 화합물이 본원에서 제공된다:
화학식 A
여기서,
n은 1 또는 2이고;
각각의 R6, R7, 및 R8은 수소 및 C1-C6 알킬로부터 독립적으로 선택되고;
R9는 수소 또는 C1-C6 알킬이고;
X2는 N 또는 CR2이고;
X3은 N 또는 CR3이고;
X4는 N 또는 CR4이고;
여기서, 각각의 R1, R2, R3, 및 R4는 각각 독립적으로 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로 알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴;
할로겐;
c)
C2-C6 알케닐;
d)
C3-C8 사이클로알킬;
e)
할로겐으로 선택적으로 치환된 5- 내지 10-원 헤테로아릴;
f)
할로겐, 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴,
여기서, C6-C10 아릴은 헤테로사이클 고리와 선택적으로 융합됨;
g)
할로겐으로 선택적으로 치환된 CONHC1-C6 알킬;
h)
NH(CO)R5, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택됨;
i)
할로겐; 및
j)
C1-C6 알킬티오;
여기서, X2, X3 및 X4 중 2개를 초과하지 않고 적어도 하나는 N이고,
(i) X2, X3 및 X4 중 오직 하나만이 N이고 R1, R2, R3, 및 R4 중 적어도 하나가 수소이거나;
(ii) 오직 X2 및 X4만이 N이다.
또한, 본원에 제공된 화합물 및 약학적으로 허용되는 담체를 포함하는 조성물이 제공된다.
또한, 본원에 제공된 화합물 및 약학적으로 허용되는 담체를 혼합하는 것을 포함하는, 조성물을 제조하는 방법이 제공된다.
또한, 본원에 제공된 화합물 및 약학적으로 허용되는 담체를 포함하는 약학 조성물이 제공된다.
또한, 본원에 제공된 화합물 및 약학적으로 허용되는 담체를 혼합하는 것을 포함하는, 약학 조성물을 제조하는 방법이 제공된다.
또한, 식품 섭취의 감소를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 식품 섭취를 감소시키는 방법이 제공된다.
또한, 포만감 유도를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 포만감을 유도하는 방법이 제공된다.
또한, 비만 치료 또는 예방을 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 비만을 치료 또는 예방하는 방법이 제공된다.
또한, 비만 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 비만을 치료하는 방법이 제공된다.
또한, 비만 예방을 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 비만을 예방하는 방법이 제공된다.
또한, 체중 관리를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 체중을 관리하는 방법이 제공된다.
또한, 제2형 당뇨병, 약물 및 알콜 중독 또는 발작 장애의 치료 또는 예방을 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 2형 당뇨병, 약물 및 알콜 중독 또는 발작 장애를 치료 또는 예방하는 방법이 제공된다.
또한, 식품 섭취를 감소시키기 위한 약제의 제조를 위한 본원에 제공된 화합물의 용도가 제공된다.
또한, 포만감을 유도하기 위한 약제의 제조를 위한 본원에 제공된 화합물의 용도가 제공된다.
또한, 비만 치료를 위한 약제의 제조를 위한 본원에 제공된 화합물의 용도가 제공된다.
또한, 비만 예방 위한 약제의 제조를 위한 본원에 제공된 화합물의 용도가 제공된다.
또한, 체중 관리를 위한 약제의 제조를 위한 본원에 제공된 화합물의 용도가 제공된다.
또한, 치료에 의해 인간 또는 동물의 신체를 치료하는 방법에 사용하기 위한 화합물이 제공된다.
또한, 식품 섭취를 감소시키는 방법에 사용하기 위한 화합물이 제공된다.
또한, 포만감을 유도하는 방법에 사용하기 위한 화합물이 제공된다.
또한, 비만 치료 또는 예방 방법에 사용하기 위한 화합물이 제공된다.
또한, 비만 치료 방법에 사용하기 위한 화합물이 제공된다.
또한, 비만 예방 방법에 사용하기 위한 화합물이 제공된다.
또한, 체중 관리에 사용하기 위한 화합물이 제공된다.
담배 흡연의 빈도를 감소시키려고 시도하는 개체에게 유효량의 본원에 제공된 화합물을 처방 및/또는 투여하는 단계를 포함하는, 상기 개체에서 담배 흡연의 빈도를 감소시키는 방법이 제공된다.
또한, 담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에게 유효량의 본원에 제공된 화합물을 처방 및/또는투여하는 단계를 포함하는, 상기 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조하는 방법이 제공된다.
또한, 흡연을 중단하고 체중 증가를 예방하려고 시도하는 개체에게 유효량의 본원에 제공된 화합물을 처방 및/또는 투여하는 단계를 포함하는, 상기 개체에서 흡연 중단 및 연관된 체중 증가 예방을 보조하는 방법이 제공된다.
담배 흡연을 중단하려고 시도하는 개체에게 유효량의 본원에 제공된 화합물을 처방 및/또는 투여하는 단계를 포함하는, 상기 개체에 의한 흡연 중단과 연관된 체중 증가를 제어하는 방법이 또한 제공된다.
니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에게 유효량의 본원에 제공된 화합물을 처방 및/또는 투여하는 단계를 포함하는, 상기 개체에서 니코틴 의존, 중독 및/또는 금단을 치료하는 방법이 또한 제공된다.
또한, 니코틴 사용을 중단하려고 시도하는 개체에게 유효량의 본원에 제공된 화합물을 처방 및/또는 투여하는 단계를 포함하는, 상기 개체에 의한 니코틴의 재발 사용의 가능성을 감소시키는 방법이 제공된다.
담배 흡연을 중단하려고 시도하는 개체에게 유효량의 본원에 제공된 화합물을 처방 및/또는 투여하는 단계를 포함하는, 상기 개체에 의한 흡연 중단과 연관된 체중 증가를 감소시키는 방법이 또한 제공된다.
또한, 다음의 단계를 포함하는, 담배 흡연의 빈도를 감소시키려고 시도하는 개체에서 담배 흡연의 빈도를 감소시키거나, 담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조하거나, 흡연 중단 및 연관된 체중 증가 예방을 보조하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 제어하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 감소시키거나, 니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에서 니코틴 의존, 중독 및/또는 금단을 치료하거나, 니코틴 사용을 중단하려고 시도하는 개체에 의한 니코틴의 재발 사용의 가능성을 감소시키는 방법이 또한 제공된다:
초기 BMI가 27 kg/m2 이상인 개체를 선택하는 단계; 및
상기 개체에게 유효량의 본원에 제공된 화합물을 처방 및/또는 투여하는 단계.
또한, 다음의 단계를 포함하는, 담배 흡연의 빈도를 감소시키려고 시도하는 개체에서 담배 흡연의 빈도를 감소시키거나, 담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조하거나, 흡연 중단 및 연관된 체중 증가 예방을 보조하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 제어하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 감소시키거나, 니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에서 니코틴 의존, 중독 및/또는 금단을 치료하거나, 니코틴 사용을 중단하려고 시도하는 개체에 의한 니코틴의 재발 사용의 가능성을 감소시키는 방법이 또한 제공된다:
본원에 제공된 화합물을 투여하는 단계;
상기 투여 동안 BMI에 대해 개체를 모니터링하는 단계; 및
상기 투여 동안 개체의 BMI가 18. 5 kg/m2 미만이 되는 경우에 상기 투여를 중단하는 단계.
또한, 본원에 제공된 화합물로부터 선택된 화합물을 초기 BMI가 25 kg/m2 이하인 개체에게 투여하는 단계;
상기 투여 동안 체중에 대해 상기 개체를 모니터링하는 단계; 및
상기 투여 동안 상기 개체의 체중이 약 1% 초과 감소하는 경우에 상기 투여를 중단하는 단계를 포함하는, 담배 흡연의 빈도를 감소시키려고 시도하는 개체에서 담배 흡연의 빈도를 감소시키거나, 담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조하거나, 흡연 중단 및 연관된 체중 증가 예방을 보조하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 제어하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 감소시키거나, 니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에서 니코틴 의존, 중독 및/또는 금단을 치료하거나, 니코틴 사용을 중단하려고 시도하는 개체에 의한 니코틴의 재발 사용의 가능성을 감소시키는 방법이 또한 제공된다
또한, 본원에 제공된 화합물을 개체에게 투여하는 단계;
상기 투여 동안 체중에 대해 상기 개체를 모니터링하는 단계; 및
상기 투여 동안 상기 개체의 체중이 약 1 kg 초과 감소하는 경우에 상기 투여를 중단하는 단계를 포함하는, 담배 흡연의 빈도를 감소시키려고 시도하는 개체에서 담배 흡연의 빈도를 감소시키거나, 담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조하거나, 흡연 중단 및 연관된 체중 증가 예방을 보조하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 제어하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 감소시키거나, 니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에서 니코틴 의존, 중독 및/또는 금단을 치료하거나, 니코틴 사용을 중단하려고 시도하는 개체에 의한 니코틴의 재발 사용의 가능성을 감소시키는 방법이 또한 제공된다
또한, 본원에서 제공된 화합물 및 적어도 하나의 보충제를 포함하는 조성물이 제공된다.
또한, 보충제와 조합되어 사용하기 위한 본원에서 제공된 화합물이 제공된다.
본원에 제공된 화합물과 조합하여 사용하기 위한, 니코틴 대체 요법으로부터 선택된 보충제가 또한 제공된다.
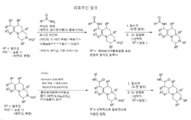
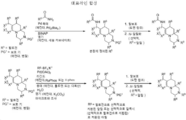
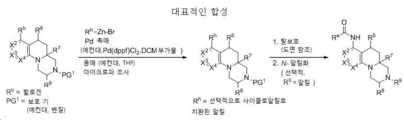
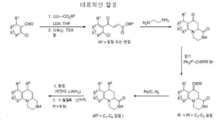
도 1 내지 8: 본 발명의 화합물에 대한 대표적인 합성.
표 9: 본원의 실시예 6에 따라 비히클("VEH"); 1 mg/kg의 화합물 152; 2 mg/kg의 화합물 152; 및 5 mg/kg의 화합물 152의 투여 1시간 후 식품 섭취.
표 9: 본원의 실시예 6에 따라 비히클("VEH"); 1 mg/kg의 화합물 152; 2 mg/kg의 화합물 152; 및 5 mg/kg의 화합물 152의 투여 1시간 후 식품 섭취.
본 명세서에서 사용되는 바와 같이, 하기 단어 및 어구는 그들이 사용되는 문맥이 달리 나타내는 경우를 제외하고는, 아래에 설명된 바와 같은 의미를 일반적으로 갖도록 의도된다.
본원에 사용된 용어 "작용제"는 수용체, 예컨대, 5-HT2C 세로토닌 수용체와 상호작용하여 이를 활성화시키고 상기 수용체의 생리학적 또는 약리학적 반응 특징을 개시하는 모이어티를 지칭한다.
용어 "조성물"은 적어도 하나의 추가 성분과 조합된, 본원에 제공된 화합물의 염, 용매화물, 및 수화물을 포함하나 이에 제한되지는 않는 화합물을 지칭한다.
용어 "약학 조성물"은 적어도 하나의 활성 성분, 예컨대, 본원에 제공된 화합물의 염, 용매화물, 및 수화물을 포함하나 이에 제한되지는 않는 본원에 제공된 화합물을 포함하는 조성물을 지칭하며, 이에 따라 조성물은 포유동물(예를 들어, 제한없이 인간)에서 특정되고 효과적인 결과에 대한 조사를 받을 수 있다. 당업자는 활성 성분이 통상의 기술자의 필요에 기초하여 원하는 효과적인 결과를 갖는지 여부를 결정하기에 적절한 기술을 알고 있거나 주지하고 있을 것이다.
용어 "개체"는 인간을 지칭한다. 개체는 성인 또는 사춘기 이전(아동)일 수 있고 임의의 성별의 개체일 수 있다. 개체는 환자 또는 치료를 받고자 하는 다른 개체일 수 있다. 본원에 개시된 방법은 비인간 포유동물, 예컨대, 가축 또는 애완동물에게 또한 적용될 수 있다.
본원에 사용된 바와 같이, "복수의 개체"는 한 명 초과의 개체를 의미한다.
본원에서 사용된 바와 같이 "투여하는"은 화합물 또는 다른 요법, 치료 또는 치료법을 제공하는 것을 의미한다. 예를 들어, 건강관리 전문 종사자는 화합물을 샘플 형태로 개체에게 직접 제공할 수 있거나, 화합물에 대한 구두 또는 서면 처방을 제공함으로써 화합물을 개체에게 간접적으로 제공할 수 있다. 또한, 예를 들어, 개체는 건강관리 전문 종사자의 관여 없이 그 스스로 화합물을 얻을 수 있다. 화합물 투여는 개체가 실제로 화합물을 내재화하는 것을 포함할 수 있거나 포함하지 않을 수 있다. 개체가 화합물을 내재화하는 경우, 신체는 화합물에 의해 일부 방식으로 변환된다.
본원에 사용된 바와 같이, "처방하는"은 약물 또는 다른 요법, 치료 또는 치료법의 사용을 지시하거나, 허가하거나, 권장한다는 것을 의미한다. 일부 구현예에서, 건강관리 전문 종사자는 개체에게 화합물, 투여 요법 또는 다른 치료법을 사용하는 것을 구두로 조언하거나, 권장하거나, 허가할 수 있다. 이 경우에, 건강관리 전문 종사자는 화합물, 투여 요법 또는 치료법에 대한 처방전을 제공하거나 제공하지 않을 수 있다. 또한, 건강관리 전문 종사자는 권장되는 화합물 또는 치료법을 제공하거나, 제공하지 않을 수 있다. 예를 들어, 건강관리 전문 종사자는 개체에게 화합물을 제공하지 않으면서 화합물 입수처에 대해 조언할 수 있다. 일부 구현예에서, 건강관리 전문 종사자는 개체에게 화합물, 투여 요법 또는 치료법에 대한 처방전을 제공할 수 있다. 예를 들어, 건강관리 전문 종사자는 개체에게 서면 또는 구두 처방을 제공할 수 있다. 처방전은 종이 상에, 또는 전자 매체, 예컨대, 컴퓨터 파일 상에, 예를 들어, 휴대용 컴퓨터 장치 상에 작성될 수 있다. 예를 들어, 건강관리 전문 종사자는 종이 또는 전자 매체를 화합물, 투여 요법 또는 치료법에 대한 처방전으로 변환시킬 수 있다. 또한 약국 또는 조제실에 전화하거나(구두) 또는 팩스로(서면) 처방전을 보낼 수 있다. 일부 구현에서, 화합물 또는 치료법의 샘플을 개체에게 제공할 수 있다. 본원에 사용된 바와 같이, 화합물의 샘플을 제공하는 것이 화합물에 대한 묵시의 처방이 된다. 전 세계의 상이한 건강관리 시스템은 화합물 또는 치료법을 처방하고 투여하기 위한 상이한 방법을 사용하며, 이들 방법들은 본 개시내용에 포함된다.
처방전은 예를 들어, 개체의 이름 및/또는 예컨대, 생년월일과 같은 식별 정보를 포함할 수 있다. 또한, 예를 들어, 처방전은 의약명, 의약 강도, 용량, 투여 빈도, 투여 경로, 조제 개수 또는 조제량, 리필 수, 의사 이름, 및/또는 의사 서명을 포함할 수 있다. 또한, 예를 들어, 처방전은 DEA 번호 또는 주 번호를 포함할 수 있다.
건강관리 전문 종사자는 예를 들어, 의사, 간호사, 임상 간호사, 보조 의사, 임상의, 또는 체중 관리, 식품 섭취 감소, 포만감 유도, 및 비만 치료 또는 예방을 위해 화합물(약물)을 처방하거나 투여할 수 있는 다른 관련된 건강관리 전문가를 포함할 수 있다. 또한, 건강관리 전문 종사자는 개체에게 화합물 또는 약물을 권장, 처방, 투여하거나, 개체가 화합물 또는 약물을 받지 못하도록 할 수 있는 어느 누구든지, 예를 들어, 보험 제공자를 포함할 수 있다.
용어 "예방하다", "예방하는", 또는 "예방", 예컨대, 비만 예방은 특정 장애와 연관된 하나 이상의 증상의 발생 또는 발병을 예방하는 것을 지칭하며, 반드시 장애의 완전한 예방을 의미하는 것은 아니다. 예를 들어, 비록 개체가 어느 정도 체중이 증가하더라도 체중 증가가 예방될 수 있다. 예를 들어, 용어 "예방하다", "예방하는", 또는 "예방"은, 궁극적으로 질환 또는 병태의 적어도 하나의 증상을 보일 수 있지만, 아직까지는 그렇지 않은 개체에게 예방학적 또는 예방적 기준으로 요법을 투여하는 것을 지칭한다. 이러한 개체는 질환의 후속 발생과 관련이 있는 것으로 공지된 위험 인자에 기초하여 확인될 수 있다. 대안적으로, 예방학적 조치로서 예방 요법은 위험 인자에 대한 사전 확인 없이 투여될 수 있다. 적어도 하나 이상의 증상의 발병을 지연시키는 것이 예방 또는 예방법으로서 또한 간주될 수 있다.
예를 들어, 용어 "예방하다", "예방하는" 또는 "예방"은 흡연 중단과 연관된 체중 증가의 예방을 지칭할 수 있다.
어구 "약학적으로 허용되는 염, 용매화물, 및 수화물" 또는 어구 "약학적으로 허용되는 염, 수화물, 또는 용매화물"이 본원에 기재된 화합물의 언급 시 사용되는 경우, 이는 화합물의 약학적으로 허용되는 용매화물 및/또는 수화물, 화합물의 약학적으로 허용되는 염, 뿐만 아니라 화합물의 약학적으로 허용되는 염의 용매화물 및/또는 수화물을 포괄한다는 것을 알 수 있다. 어구 "약학적으로 허용되는 수화물 및 용매화물" 또는 어구 "약학적으로 허용되는 수화물 또는 용매화물"이 염인 본원에 기재된 화합물의 언급시 사용되는 경우, 이는 이러한 염의 약학적으로 허용되는 용매화물 및/또는 수화물을 포괄한다는 것을 또한 알 수 있다. 또한, 당업자는 수화물이 용매화물의 아속임을 알 수 있다.
용어 "전구약물"은 대사 산물 또는 모 약물이 원하는 약리학적 반응을 후속적으로 나타낼 수 있도록 투여 후 활성 또는 모 약물에 화학적 또는 효소적 변환을 일으켜야 하는 제제를 지칭한다.
용어 "치료하다", "치료하는", 또는 "치료"는 질환 또는 병태의 적어도 하나의 증상을 이미 나타내고 있거나, 질환 또는 병태의 적어도 하나의 증상을 이전에 나타냈던 개체에게 요법을 투여하는 것을 포함한다. 예를 들어, "치료하는"은 질환 또는 병태 증상을 완화, 약화 또는 호전시키거나, 추가 증상을 예방하거나, 증상의 근본적인 대사상의 원인을 호전 또는 예방하거나, 질환 또는 병태를 억제시키거나, 예컨대, 질환 또는 병태의 진행을 정지시키거나, 질환 또는 병태를 경감시키거나, 질환 또는 병태를 퇴행을 유발시키거나, 질환 또는 병태에 의해 유발된 병태를 경감시키거나, 질환 또는 병태의 증상을 예방학적으로 및/또는 치료학적으로 중단시키는 것을 포함할 수 있다. 예를 들어, 장애와 관련하여 용어 "치료하는"은 특정 장애와 관련된 하나 이상의 증상의 중증도 감소를 의미할 수 있다. 따라서, 장애를 치료한다는 것이 반드시 장애와 연관된 모든 증상의 중증도를 감소시킨다는 것을 의미하는 것은 아니며, 반드시 장애와 연관된 하나 이상의 증상의 중증도를 완전히 감소시킨다는 것을 의미하는 것은 아니다. 예를 들어, 비만 치료 방법으로 체중이 감소될 수 있지만; 체중 감소가, 개체가 더 이상 비만이 아닐 정도로 충분할 필요는 없다. 체중 또는 관련 파라미터, 예컨대, BMI, 허리 둘레 및 체지방률의 약간의 감소조차도 건강을 개선시킬 수 있으며, 예를 들어, 혈압을 강하시키거나, 혈중 지질 프로파일을 개선시키거나, 수면 무호흡을 감소시킬 수 있는 것으로 나타났다. 또 다른 예로서, 중독의 치료 방법은 갈망의 수, 빈도 또는 중증도, 행동 추구, 재발의 감소를 초래할 수 있거나, 이는 자제를 초래할 수 있다.
본원에 사용된 바와 같이, 용어 "치료하다", "치료하는", 또는 "치료"는 질환, 장애, 병태, 의존, 또는 거동의 적어도 하나의 증상, 예컨대, 질환 또는 병태의 적어도 하나의 증상을 이미 나타내고 있거나, 이전에 나타냈던 개체에게 요법을 투여하는 것을 지칭한다. 예를 들어, "치료하는"은 질환, 장애, 병태, 의존 또는 거동과 관련하여 다음 중 어느 것이든 포함할 수 있다: 완화, 약화 또는 호전, 억제(예를 들어, 진행 정지), 경감, 또는 퇴행 유발. "치료하는"은 질환, 장애, 병태, 의존, 또는 거동의 증상, 예컨대, 질환 또는 병태의 증상을 치료하거나, 추가 증상을 예방하거나, 상기 증상의 근본적인 생리학상 원인을 예방하거나, 상기 증상을(예방학적으로 및/또는 치료학적으로) 중단시키는 것을 또한 포함할 수 있다.
용어 "체중 관리"는 체중을 조절하는 것을 지칭하며, 본 개시내용의 맥락에서 체중 감소 및 체중 감소의 유지(이는 본원에서 체중 유지라고도 칭해짐)에 관한 것이다. 체중을 조절하는 것 이외에도, 체중 관리는 체중과 관련된 파라미터, 예를 들어, BMI, 체지방률 및 허리 둘레를 조절하는 것을 포함한다. 예를 들어, 과체중이거나 비만인 개체에 대한 체중 관리는 체중을 더욱 건강한 범위로 유지하고자 하는 목적으로 체중을 감소시키는 것을 의미할 수 있다. 또한, 예를 들어, 과체중이거나 비만인 개체에 대한 체중 관리는 체중 감소를 수반하거나 수반하지 않으면서 체지방 또는 허리 주위의 둘레를 감소시키는 것을 포함할 수 있다. 체중 감소의 유지(체중 유지)는 체중 감소 후 체중 증가를 예방하거나, 감소시키거나 또는 제어하는 것을 포함한다. 체중 감소 후 체중 증가는 흔히 일어나는 것으로 널리 공지되어 있다. 체중 감소는, 예를 들어 다이어트, 운동, 질병, 약물 치료, 수술 또는 이들 방법의 임의의 조합으로 인해 일어날 수 있지만, 종종 체중이 감소한 개체는 감소한 체중의 일부 또는 전부를 회복할 것이다. 따라서, 체중이 감소한 개체에서의 체중 유지는 체중 감소 후 체중 증가를 예방하거나, 체중 감소 후 체중 증가량을 감소시키거나, 체중 감소 후 체중 증가를 제어하거나, 체중 감소 후 체중 증가 속도를 둔화하는 것을 포함할 수 있다. 본원에 사용된 바와 같이, "체중 관리를 필요로 하는 개체에서의 체중 관리"는 개체가 체중 관리 처치를 필요로 하거나, 그로부터 이익을 얻게 될 것이라는 건강관리 전문 종사자의 판단을 지칭한다. 이러한 판단은 건강관리 전문 종사자의 전문 지식 범위 내에 있는 여러 가지의 인자에 기초하여 이루어지나, 본원에 개시된 방법에 의해 치료될 수 있는 병태를 개체가 앓고 있다는 지식을 포함한다.
"체중 관리"는 또한 체중 증가 예방, 체중 증가 제어, 체중 증가 감소, 체중 유지 또는 체중 감소 유도를 포함한다. 체중 관리는 체중 조절(체중 조절로도 칭해짐) 및/또는 체중과 관련된 파라미터, 예를 들어, BMI, 체지방률 및/또는 허리 둘레를 조절하는 것을 지칭한다. 또한, 체중 관리는 BMI의 증가를 예방하거나, BMI의 증가를 감소시키거나, BMI를 유지하거나, BMI의 증가를 감소시키거나; 체지방률 증가를 예방하거나, 체지방률 증가를 감소시키거나, 체지방률을 유지하거나, 체지방률을 감소시키거나; 허리 둘레 증가를 예방하거나, 허리 둘레 증가를 감소시키거나, 허리 둘레를 유지하거나, 허리 둘레를 감소시키는 것을 또한 포함한다.
용어 "식품 섭취의 감소를 필요로 하는 개체에서 식품 섭취를 감소시키는"은 개체가 식품 섭취의 감소를 필요로 하거나, 그로부터 이익을 얻게 될 것이라는 건강관리 전문 종사자의 판단을 지칭한다. 이러한 판단은 건강관리 전문 종사자의 전문 지식 범위 내에 포함되어 있는 여러 가지의 인자에 기초하여 이루어지나, 본원에 개시된 방법에 의해 치료될 수 있는 병태, 예를 들어, 비만을 개체가 앓고 있다는 지식을 포함한다. 일부 구현예에서, 식품 섭취의 감소를 필요로 하는 개체는 과체중인 개체이다. 일부 구현예에서, 식품 섭취의 감소를 필요로 하는 개체는 비만인 개체이다.
용어 "포만감"은 용량까지 또는 용량을 초과하여 먹거나 만족하는 수준 또는 상태를 지칭한다. 포만감은 개체가 가지는 느낌이므로 이는 개체가 식사 중 정해진 시간 간격에 충만감을 느꼈는지, 실컷 먹었는지 또는 만족하였는지를 구두로 또는 서면으로 개체에게 질문함으로써 종종 결정된다. 실컷 먹었다고 느낀 개체는 충만감, 허기 감소 또는 소멸, 식욕 감소 또는 소멸, 또는 먹고자 하는 충동의 결여를 보고할 것이다. 충만감은 물리적인 감각이지만, 포만감은 정신적인 느낌이다. 충만감을 느끼거나, 실컷 먹었거나 또는 만족하는 개체는 먹는 것을 중단할 가능성이 많고, 따라서 포만감을 유도하여 개체에서 식품 섭취를 감소시킬 수 있다. 본원에 사용된 바와 같*, "포만감 유도를 필요로 하는 개체에서 포만감을 유도하는"은 개체가 포만감 유도를 필요로 하거나, 그로부터 이익을 얻게 될 것이라는 건강관리 전문 종사자의 판단을 지칭한다. 이러한 판단은 건강관리 전문 종사자의 전문 지식 범위 내에 포함되어 있는 여러 가지의 인자에 기초하여 이루어지나, 본 개시내용의 방법에 의해 치료될 수 있는 병태, 예컨대, 비만을 개체가 앓고 있다는 지식을 포함한다.
용어 "비만 치료를 필요로 하는 개체에서 비만을 치료하는"는 개체가 비만 치료를 필요로 하거나, 그로부터 이익을 얻게 될 것이라는 건강관리 전문 종사자의 판단을 지칭한다. 이러한 판단은 건강관리 전문 종사자의 전문 지식 범위 내에 포함되어 있는 여러 가지의 인자에 기초하여 이루어지나, 본 개시내용의 방법에 의해 치료될 수 있는 병태를 개체가 앓고 있다는 지식을 포함한다. 개체의 비만 여부를 결정하기 위해, 개체의 체중, 체질량 지수(BMI), 허리 둘레 또는 체지방률을 측정함으로써 개체가 체중 역치, BMI 역치, 허리 둘레 역치 또는 체지방률 역치를 충족시키는지를 결정할 수 있다.
용어 "비만 예방을 필요로 하는 개체에서 비만을 예방하는"은 개체가 비만 예방을 필요로 하거나, 그로부터 이익을 얻게 될 것이라는 건강관리 전문 종사자의 판단을 지칭한다. 이러한 판단은 건강관리 전문 종사자의 전문 지식 범위 내에 있는 여러 가지의 인자에 기초하여 이루어지나, 본원에 개시된 방법에 의해 치료될 수 있는 병태를 개체가 앓고 있다는 지식을 포함한다. 일부 구현예에서, 비만 예방을 필요로 하는 개체는 과체중(비만 전단계로도 칭해짐)인 개체이다. 일부 구현예에서, 비만 예방을 필요로 하는 개체는 비만 가족력이 있는 개체이다. 개체의 과체중 여부를 결정하기 위해, 개체의 체중, 체질량 지수(BMI), 허리 둘레 또는 체지방률을 측정함으로써 개체가 체중 역치, BMI 역치, 허리 둘레 역치 또는 체지방률 역치를 충족시키는지를 결정할 수 있다.
본원에 사용된 바와 같이, 본원에서 사용된 "유해 사례" 또는 "독성 사례"는 치료 동안 그 자체가 나타날 수 있는 임의의 부적당한 의학적 사건이다. 치료와 연관된 유해 사례는 예를 들어, 두통, 메스꺼움, 흐린 시력, 감각 이상, 변비, 피로, 구강 건조증, 현기증, 비정상적인 꿈, 불면증, 비인두염, 치통, 부비동염, 허리 통증, 졸림, 바이러스성 위장염, 계절성 알레르기, 또는 팔다리에 통증을 포함할 수 있다. 추가의 가능한 유해 효과는, 예를 들어, 위장 장애(변비, 복부 팽만, 설사), 무력증, 흉통, 피로, 약물 과민증, 섬유 근육통, 악관절 관절 증후군, 두통, 현기증, 편두통, 불안, 우울한 기분, 과민성, 자살 관념, 양극성 장애, 우울증, 약물 남용 및 호흡 곤란을 포함한다. 본원에 개시된 방법에서, 용어 "유해 사례"는 보다 일반적인 다른 용어, 예컨대, "독성"으로 대체될 수 있다. 유해 사례의 용어 "위험 감소"는 유해 사례 또는 독성 사례가 발생할 수 있는 확률을 감소시키는 것을 의미한다.
본원에 사용된 용어 "작용제"는 수용체, 예컨대, 5-HT2C 세로토닌 수용체와 상호작용하여 이를 활성화시키고, 상기 수용체의 생리학적 또는 약리학적 반응 특징을 개시하는 모이어티를 지칭한다.
용어 "즉시-방출형 투여 형태"는 제제로부터 활성 약학 성분(API)을 방출하는 인간 또는 다른 동물에게 경구 투여시 급속히 붕괴되는 제형을 지칭한다. 일부 구현예에서, 즉시-방출형 투여 형태의 T80%는 3시간 미만이다. 일부 구현예에서, 즉시-방출형 투여 형태의 T80%는 1시간 미만이다. 일부 구현예에서, 즉시-방출형 투여 형태의 T80%는 30분 미만이다. 일부 구현예에서, 즉시-방출형 투여 형태의 T80%는 10분 미만이다.
용어 "T80%"는 API를 포함하는 특정 제형으로부터 API의 80% 누적 방출을 달성하는 데 필요한 시간을 지칭한다.
용어 "변형-방출형 투여 형태"는 인간 또는 다른 동물에게 경구 투여시, 즉시-방출형 투여 형태의 API와 비교할 때 연장된 기간에 걸쳐 더 느린 속도로(예를 들어, 지속 방출), 주어진 시간 후에(즉, 지연된 방출) 또는 연장된 기간 동안(연장된 방출) API를 방출하는 임의의 제형을 지칭한다.
본원에 사용된 바와 같이, "니코틴 대체 요법"(일반적으로 "NRT"로 약칭함)은 담배 제품 이외의 방식으로 인체에 니코틴의 치료상 투여를 지칭한다. 니코틴 대체 요법은 관련 기술분야, 예를 들어,미국 특허 번호 4,597,961, 5,004,610, 4,946,853, 및 4,920,989에 기재된 패치 및 다른 시스템을 포함하는, 경피 니코틴 전달 시스템을 포함할 수 있다. 흡입형 니코틴(예를 들어, 폐 경로를 통한 니코틴의 전달)이 또한 공지되어 있다. 경점막 투여(예를 들어, 경구 약물 투여 형태를 통한 전신 순환계로의 니코틴의 전달)이 또한 공지되어 있다. 경구 약물 투여 형태(예를 들어, 로젠지, 캡슐, 검, 정제, 좌약, 연고, 겔, 페서리, 막, 및 분말)는 전형적으로 점막과 접촉하여 유지되어 급속히 붕괴 및/또는 용해되어 즉각적으로 전신 흡수된다. 당업자는 수많은 상이한 치료법 및 투여 방식이 단일 개체를 치료하는 데 사용될 수 있음을 이해할 것이다. 예를 들어, 개체는 경피 투여에 의한 니코틴 및 점막에 투여되는 니코틴으로 동시에 치료될 수 있다. 일부 구현예에서, 니코틴 대체 요법은 니코틴 검(예를 들어, 니코레테(NICORETTE)), 니코틴 경피 시스템, 예컨대, 니코틴 패치(예를 들어, 하비트롤(HABITROL) 및 니코덤(NICODERM)), 니코틴 로젠지(예를 들어, 코미트(COMMIT)), 니코틴 마이크로탭(예를 들어, 니코레테(NICORETTE) 마이크로탭), 니코틴 스프레이 또는 흡입제(예를 들어, 니코트롤(NICOTROL)), 및 당업계에 공지된 다른 니코틴 대체 요법으로부터 선택된다. 일부 구현예에서, 니코틴 대체 요법은 전자 담배, 개인 기화기 및 전자 니코틴 전달 시스템을 포함한다.
본원에 사용된 바와 같이, 약물 조합물 및/또는 선택적 5-HT2C 작용제와 적어도 1종의 보충제의 조합물과 관련하여 사용된 바와 같은 "조합물"은 (1) 물리적, 화학적, 또는 다른 방법으로 조합되거나 혼합되어 단일 독립체로서 생산되는, 2개 이상의 구성 요소, 즉 약물/장치, 생물제제/장치, 약물/생물제제, 또는 약물/장치/생물제제로 구성된 제품; (2) 단일 패키지로 또는 유닛으로서 함께 포장되고 약물 및 장치 제품, 장치 및 생물학적 제품, 또는 생물학적 및 약물 제품으로 구성된 두 개 이상의 개별 제품; (3) 개별적으로 포장된 약물, 장치, 또는 생물학적 제품으로서, 이의 조사 계획 또는 제안된 라벨링에 따라 단지 승인된 개별적으로 특정된 약물, 장치, 또는 생물학적 제품과 사용되도록 의도되며 여기서 둘 다는 의도된 용도, 적응증 또는 효과를 달성하기 위해 요구되는 경우이며 여기서 제안된 제품의 승인시 승인된 제품의 라벨링을, 예를 들어, 의도된 용도, 투여 형태, 강도, 투여 경로, 또는 용량의 유의한 변화를 반영하기 위해, 변경시킬 필요가 있을 경우인, 상기 약물, 장치, 또는 생물학적 제품; 또는 (4) 개별적으로 포장된 임의의 시험용 약물, 장치, 또는 생물학적 제품으로서, 이의 제안된 라벨링에 따라 단지 또 다른 개별적으로 특정된 시험용 약물, 장치, 또는 생물학적 제품과 함께 사용하기 위한 것이며 여기서 둘 다는 의도된 용도, 적응증 또는 효과를 달성하기 위해 요구되는 경우인, 상기 시험용 약물, 장치, 또는 생물학적 제품을 지칭한다. 조합물은, 2종 이상의 별개의 약물 성분이 단일 투여 형태로 조합되어 있는 고정-용량 조합 제품(FDC); 조합 사용을 지원하기 위해 적절한 라벨링과 함께 포장된, 2종 이상의 별도의 약물 제품을 이의 최종 투여 형태로 포함하는 공동-포장된 제품; 비록 상대 용량이 고정되어 있지 않고, 약물 또는 생물제제가 반드시 동시에 제공될 필요는 없지만, 환자가 1차 치료와 함께(즉, 1차 치료에 보조로) 사용되는 2차 약물 제품으로 유지 관리되는 보조 요법을 제한없이 포함한다. 보조 요법 제품은 공동-포장될 수 있으며, 부수적인 사용을 위해 라벨이 붙어 있거나 그렇지 않을 수 있다.
본원에 사용된 바와 같이, "반응자"는 선택적 5-HT2C 수용체 작용제의 투여의 특정된 기간 동안 담배 사용으로부터의 금연 지속을 경험한 개체를 지칭한다. 일부 구현예에서, "반응자"는 선택적 5-HT2C 수용체 작용제의 투여의 제9주 내지 제12주 흡연 또는 다른 니코틴 사용을 보고하지 않고,
10 ppm 이하의 호기말 호기 일산화탄소-확인 측정치를 나타내는 개체를 지칭한다.
본원에 사용된 바와 같이, "담배 제품"은 담배, 즉 니코티아나(Nicotiana) 속의 식물의 잎의 농산물을 포함하는 제품을 지칭한다. 담배 제품은 일반적으로 2가지 유형으로 나눌 수 있다: 파이프 담배, 시가렛(전자 담배 포함) 및 시가, 뿐만 아니라 무아셀, 독하, 시샤 담배, 후카 담배, 또는 단순히 시샤를 제한없이 포함한 피는 담배; 및 츄잉 담배, 디핑 담배(딥, 습식 스너프 (또는 스너프)로도 알려짐), 미국식 습식 스너프, 스누스, 이크믹, 나스워, 구트카, 툼박, 샴마, 담배 워터, 스핏 담배, 크리미 스너프 또는 담배 페이스트, 용해 가능한 담배 및 담배 검을 제한없이 포함한 무연 담배.
본원에 사용된 바와 같이, "파거스트롬 시험"은 니코틴 중독의 세기를 평가하는 시험인 니코틴 의존에 대한 표준 시험을 지칭한다. Heatherton, T. F. , Kozlowski, L. T. , Frecker, R. C. , Fagerstrφm, K. O. The Fagerstrφm test for Nicotine Dependence: A revision of the Fagerstrφm Tolerance Questionnaire. Br J Addict 1991; 86:1119-27을 참조한다. 시험은 니코틴 의존을 0-10의 척도로 측정하는 간략한 자기-보고 설문으로 이루어지며, 10은 최고 수준의 의존이다. 0-2점은 매우 낮은 의존에 해당한다. 3-4점은 낮은 의존에 해당한다. 5점은 보통 의존성에 해당한다. 6-7점은 높은 의존성에 해당한다. 8-10점은 매우 높은 의존성에 해당한다.
정신 장애의 진단 및 통계 매뉴얼 제3 개정판(Diagnostic 및 Statistical Manual of Mental Disorders, Revised Third Edition)(DSM-III-R)에 특정된 니코틴 갈망 시험을 포함하나 이에 제한되지는 않는 다른 방법을 이용하여 니코틴에 대한 갈망을 평가할 수 있다.
본원에 사용될 때, "기분 및 신체적 증상의 척도(Mood 및 Physical Symptoms Scale)"(MPSS)는 담배 금단 증상을 평가하는 척도를 지칭한다(West R, Hajek P: Evaluation of the mood 및 physical symptoms scale(MPSS) to assess cigarette withdrawal. Psychopharmacology 2004, 177(1-2):195-199). MPSS의 핵심 요소는 우울한 기분, 과민성, 차분하지 못함, 집중하기 어려움 및 배고픔의 5-포인트 등급 및 흡연에 대한 충동 강도 및 이러한 충동으로 보내는 시간의 6-포인트 등급을 포함한다.
본원에 사용될 때, 로카세린은 (R)-8-클로로-1-메틸-2,3,4,5-테트라하이드로-1H-3-벤즈아제핀을 지칭한다. 유사하게, 로카세린 하이드로클로라이드는 (R)-8-클로로-1-메틸-2,3,4,5-테트라하이드로-1H-3-벤즈아제핀의 염산 염을 지칭한다(Statement on Nonproprietary Name Adopted by the USAN Council for Lorcaserin Hydrochloride 참조).
용어 "펜테르민"은,
클로르펜테르민(2-(4-클로로-페닐)-1,1-디메틸-에틸아민) 등과 같은, 그러나 이에 제한되지는 않는, 펜테르민 유도체 및 이의 제약상 허용되는 염을 포함하는, 1,1-디메틸-2-페닐-에틸아민을 지칭한다. 일 구현예에서, 펜테르민은 1,1-디메틸-2-페닐-에틸아민의 HCl 염 형태이다.
용어 "암페타민"은 1-페닐프로판-2-아민 및 이의 염, 용매화물, 및 수화물을 지칭한다.
용어 "치환된 암페타민"은 추가 치환을 가진 암페타민을 기반으로 하는 화학물질을 지칭한다. 치환된 암페타민의 예는 다음을 포함하나, 이에 제한되지는 않는다: 메타암페타민(N-메틸-1-페닐프로판-2-아민); 에페드린(2-(메틸아미노)-1-페닐프로판-1-올); 카티논(2-아미노-1-페닐-1-프로파논); MDMA(3,4-메틸렌디옥시-N-메틸암페타민); 및 DOM(2,5-디메톡시-4-메틸암페타민); 및 이의 염, 용매화물, 및 수화물.
용어 "벤조디아제핀"은 알프라졸람, 브레타제닐, 브로마제팜, 브로티졸람, 클로르디아제폭시드, 시놀라제팜, 클로나제팜, 클로라제페이트, 클로티아제팜, 클록사졸람, 사이클로벤자프린, 데로라제팜, 디아제팜, 에스타졸람, 에티졸람, 에틸, 로플라제페이트 플루니트라제팜, 5-(2-브로모페닐)-7-플루오로-1H-벤조[e][1,4]디아제핀-2(3H)-온, 플루라제팜, 플루토프라제팜, 할라제팜, 케타졸람, 로프라졸람, 로라제팜, 로르메타제팜, 메다제팜, 미다졸람, 니메타제팜, 니트라제팜, 노르다제팜, 옥사제팜, 페나제팜, 피나제팜, 프라제팜, 프레마제팜, 피라졸람, 쿠아제팜, 테마제팜, 테트라제팜, 및 트리아졸람 및 이의 염, 용매화물, 및 수화물을 포함하나 이에 제한되지는 않는다.
용어 "비정형 벤조디아제핀 수용체 리간드"는 클로바잠, DMCM, 플루마제닐, 에스조피클론, 잘레플론, 졸피뎀, 및 조피클론 및 이의 염, 용매화물, 및 수화물을 포함하나 이에 제한되지는 않는다.
용어 "마리화나"는 테트라하이드로카나비놀, 카나디올, 카나비놀, 및 테트라하이드로카나비바린 및 이의 염, 용매화물, 및 수화물로부터 선택된 1종 이상의 화합물을 포함하는 조성물을 지칭한다.
용어 "코카인"은 벤조일메틸엑고닌 및 이의 염, 용매화물, 및 수화물을 지칭한다.
용어 "덱스트로메토르판"은 (4bS,8aR,9S)-3-메톡시-11-메틸-6,7,8,8a,9,10-헥사하이드로-5H-9,4b-(에피미노에탄)페난트렌 및 이의 염, 용매화물, 및 수화물을 지칭한다.
용어 "에스조피클론"은 (S)-6-(5-클로로피리딘-2-일)-7-옥소-6,7-디하이드로-5H-피롤로[3,4-b]피라진-5-일 4-메틸피페라진-1-카르복실레이트 및 이의 염, 용매화물, 및 수화물을 지칭한다.
용어 "GHB"는 4-하이드록시부탄산 및 이의 염, 용매화물, 및 수화물을 지칭한다.
용어 "LSD"는 리세르그산 디에틸아미드 및 이의 염, 용매화물, 및 수화물을 지칭한다.
용어 "케타민"은 2-(2-클로로페닐)-2-(메틸아미노)사이클로헥사논 및 이의 염, 용매화물, 및 수화물을 지칭한다.
용어 "모노아민 재흡수 억제제"는 각각의 모노아민 수송체 중 하나 이상의 작용을 차단함으로써 3가지 주요 모노아민 신경 전달 물질인 세로토닌, 노르에피네프린, 및 도파민 중 하나 이상의 재흡수 억제제로서 작용하는 약물을 지칭한다. 노아민 재흡수 억제제의 예는 알라프로클레이트, 시탈로프람, 다폭세틴, 에스시탈로프람, 페목세틴, 플루옥세틴, 플루복사민, 이폭세틴, 인달핀, 오밀록세틴, 파누라민, 파록세틴, 피란다민, RTI-353, 세르틀란린, 지멜리딘, 데스메틸시탈로프람, 데스메틸세르트랄린, 디데스메틸시탈로프람, 세프록세틴, 시아노프라민, 리톡세틴, 루바조돈, SB-649,915, 트라조돈, 빌라조돈, 보르티옥세틴, 덱스트로메토르판, 디멘하이드리네이트, 디펜하이드라민, 메피라민, 피릴라민, 메타돈, 프로폭시펜, 메셈브린, 메셈프린, 록스인돌, 아메달린, 토목세틴, CP-39,332, 달레달린, 에디복세틴, 에스레복세틴, 로르탈라민, 마진돌, 니속세틴, 레복세틴, 탈로프람, 탈수프람, 탄다민, 빌록사진, 마프로틸린, 부프로피온, 시클라진돌, 마니팍신, 라다팍신, 타펜타돌, 테닐록사진, 징코 빌로바, 알트로판, 암포넬산, 벤조티오페닐사이클로헥실피페리딘, DBL-583, 디플루오로핀, 1-(2-(디페닐메톡시)에틸)-4-(3-페닐프로필)피페라진, 4-13-메틸-4,6-디옥사-11,12-디아자트리사이클로[7. 5. 0. 0]테트라데카-1,3(7),8,10-테트라엔-10-일}아닐린, 이오메토판, [(1R,2S,3S,5S)-3-(4-아이오도페닐)-8-메틸-8-아자비사이클로[3. 2. 1]옥탄-2-일]-피롤리딘-1-일메탄온, 바녹세린, 메디폭사민, 카에노멜레스 스페시오사(Chaenomeles speciosa), 히퍼포린, 아드히퍼포린, 부프로피온, 프라미펙솔, 카베르골린, 벤라팍신, 데스벤라팍신, 둘록세틴, 밀나시프란, 레보밀나시프란, 비시파딘, 4-인돌릴아릴알킬아민, 1-나프틸아릴알킬아민, 아미넵틴, 데속시피프라드롤, 덱스메틸페니데이트, 디페메토렉스, 디페닐프롤리놀, 에틸페니데이트, 펜캄파민, 펜카민, 레페타민, 메소카르브, 메틸렌디옥시피로발레론, 메틸페니데이트, 노미펜신, 메틸 2-사이클로펜틸-2-(3,4-디클로로페닐)아세테이트, 옥솔린산, 피프라드롤, 프롤린탄, 피로발레론, 타메트랄린, 1-[1-(3-클로로페닐)-2-(4-메틸피페라진-1-일)에틸]사이클로헥산-1-올, 네포팜, 아미티파딘, EB-1020, 테소펜신, NSD-788, 테다티옥세틴, RG7166, Lu-AA37096, Lu-AA34893, NS-2360, 비시파딘, SEP-227162, SEP-225289, DOV-216,303, 브라소펜신, NS-2359, 디클로펜신, EXP-561, 탁실, 나피론, 5-APB, 6-APB, 및 히퍼포린, 및 이의 염, 용매화물, 및 수화물을 포함한다.
용어 "니코틴"은 3-(1-메틸피롤리딘-2-일)피리딘을 지칭한다.
용어 "아편제"는 하기 화합물 및 이의 염, 용매화물, 및 수화물을 포함하나 이에 제한되지는 않는다: 알펜타닐, 알파프로딘, 아닐레리딘, 벤지트라미드, 부프레노르핀, 부토르파놀, 덱스트로프로폭시펜, 카르펜타닐, 코데인, 디아모르핀, 덱스트로모라미드, 데조신, 양귀비 짚, 디하이드로코데인, 디하이드로에토르핀, 디페녹실레이트, 에틸모르핀, 에토르핀, 하이드로클로라이드, 펜타닐, 하이드로코돈, 하이드로모르폰, 이소메타돈, 레보-알파세틸메타돌, 레보메토르판, 레보르파놀, 멥타지놀, 메타조신, 메타돈, 메토폰, 모르핀, 날부핀, 아편, 오리파빈, 옥시코돈, 옥시모르폰, 펜타조신, 페티딘, 페나조신, 피미노딘, 프로폭시펜, 라세메토르판, 라세모르판, 레미펜타닐, 수펜타닐, 타펜타돌, 및 테바인.
예를 들어, 상기 용어는 하기 화합물 및 이의 염, 용매화물, 및 수화물: 알펜타닐, 알파프로딘, 아닐레리딘, 벤지트라미드, 덱스트로프로폭시펜, 카르펜타닐, 코데인, 디아모르핀, 양귀비 짚, 디하이드로코데인, 디하이드로에토르핀, 디페녹실레이트, 에틸모르핀, 에토르핀, 하이드로클로라이드, 펜타닐, 하이드로코돈, 하이드로모르폰, 이소메타돈, 레보-알파세틸메타돌, 레보메토르판, 레보르파놀, 메타조신, 메타돈, 메토폰, 모르핀, 아편, 오리파빈, 옥시코돈, 옥시모르폰, 페티딘, 페나조신, 피미노딘, 라세메토르판, 라세모르판, 레미펜타닐, 수펜타닐, 타펜타돌, 및 테바인.
용어 "PCP"는 1-(1-페닐사이클로헥실)피페리딘 및 이의 염, 용매화물, 및 수화물을 지칭한다.
용어 "치환된 펜에틸아민"은 하기 화합물 및 이의 염, 용매화물, 및 수화물을 포함하나 이에 제한되지는 않는다: 2-(4-브로모-2,5-디메톡시페닐)-N-[(2-메톡시페닐)메틸]에탄아민, 2-(4-클로로-2,5-디메톡시페닐)-N-[(2-메톡시페닐)메틸]에탄아민, 2-(4-아이오도-2,5-디메톡시페닐)-N-[(2-메톡시페닐)메틸]에탄아민, 4-브로모-2,5-디메톡시펜에틸아민, 1-(4-클로로-2,5-디메톡시페닐)-2-아미노에탄, 1-(2,5-디메톡시-4-메틸페닐)-2-아미노에탄, 1-(2,5-디메톡시-4-에틸페닐)-2-아미노에탄, 4-플루오로-2,5-디메톡시펜에틸아민, 2,5-디메톡시-4-아이오도펜에틸아민, 2,5-디메톡시-4-니트로펜에틸아민, 2-(2,5-디메톡시-4-프로필페닐)에탄아민, 2,5-디메톡시-4-에틸티오펜에틸아민, 2-[2,5-디메톡시-4-(2-플루오로에틸티오)페닐]에탄아민, 2,5-디메톡시-4-이소프로필티오펜에틸아민, 2,5-디메톡시-4-n-프로필티오펜에틸아민, 2-[4-[(사이클로프로필메틸)티오]-2,5-디메톡시페닐]에탄아민, 2-[4-(부틸티오)-2,5-디메톡시페닐]에탄아민, 6-하이드록시도파민, 도파민, 에피네프린, 메스칼린, 메타-옥토파민, 메타-티라민, 메틸페니데이트, n-메틸펜에틸아민, 노르에피네프린, 파라-옥토파민, 파라-티라민, 펜테르민, 페닐에프린, 살부타몰, 및 β-메틸펜에틸아민, 및 이의 염, 용매화물, 및 수화물.
용어 "실로시빈"은 [3-(2-디메틸아미노에틸)-1H-인돌-4-일] 디하이드로겐 포스페이트, 및 이의 염, 용매화물, 및 수화물을 지칭한다.
용어 "합성 스테로이드"는 하기 화합물 및 이의 염, 용매화물, 및 수화물을 포함하나 이에 제한되지는 않는다: 1-안드로스텐디올, 안드로스텐디올, 1-안드로스텐디온, 안드로스텐디온, 볼란디올, 볼라스테론, 볼데논, 볼디온, 칼루스테론, 클로스테볼, 다나졸, 데하이드로클로르메틸테스토스테론, 데속시메틸테스토스테론, 디하이드로테스토스테론, 드로스타놀론, 에틸에스트레놀, 플루옥시메스테론, 포르메볼론, 푸라자볼, 게스트리논, 4-하이드록시테스토스테론, 메스타놀론, 메스테롤론, 메테놀론, 메탄디에논, 메탄드리올, 메타스테론, 메틸디에놀론, 메틸-1-테스토스테론, 메틸노르테스토스테론, 메틸테스토스테론, 메트리볼론, 미볼레론, 난드롤론, 19-노르안드로스텐디온, 노르볼레톤, 노르클로스테볼, 노르에탄드롤론, 옥사볼론, 옥산드롤론, 옥시메스테론, 옥시메톨론, 프라스테론, 프로스타노졸, 퀸볼론, 스타노졸롤, 스텐볼론, 1-테스토스테론, 테스토스테론, 테트라하이드로게스트리논, 및 트렌볼론.
본원에 사용될 때, 용어 "초과"는 용어는 기호 >와 상호교환적으로 사용되고, 용어 "미만"은 기호 <와 상호교환적으로 사용된다. 마찬가지로, 용어 이하는 기호 =와 상호교환적으로 사용되며 용어 이상은 기호 =와 상호교환적으로 사용된다.
정수가 본원에 개시된 방법에서 사용될 때, 용어 "약"은 정수 앞에 삽입될 수 있다. 예를 들어, 용어 "29 kg/m2 초과"는 "약 29 kg/m2 초과"로 치환될 수 있다.
본 명세서에서 사용되는 바와 같이, 하기 약어는 이들이 사용되는 문맥이 달리 나타내는 경우를 제외하고는, 아래에 설명된 바와 같은 의미를 일반적으로 갖는 것으로 의도된다.
본 명세서 전반에 걸쳐, 문맥상 달리 요구되지 않는 한, 단어 "포함하다", 또는 파생어, 예컨대, "포함한다" 또는 "포함하는"은 언급된 단계 또는 요소 또는 정수, 또는 단계들 또는 요소들 또는 정수들의 군을 포함한다는 것을 암시하지만, 임의의 다른 단계 또는 요소 또는 정수, 또는 요소들 또는 정수들의 군을 배제시킨다는 것을 암시하는 것은 아니라는 점을 이해할 것이다.
본 명세서 전반에 걸쳐, 구체적으로 달리 언급되지 않는 한, 또는 문맥상 달리 요구되지 않는 한, 단일의 단계, 물질의 조성물, 단계들의 군 또는 물질의 조성물들의 군에 대해 언급하는 것은 하나 및 복수(즉, 하나 이상)의 상기 단계들, 물질의 조성물들, 단계들의 군 또는 물질의 조성물들의 군을 포함하는 것으로 이해되어야 한다.
본원에 기재된 각각의 구현예는 구체적으로 달리 언급되지 않는 한, 각각의 모든 다른 구현예에 준용되는 것으로 한다.
당업자는 본원에 기재된 본 발명이 구체적으로 기재된 것 이외의 것으로 쉽게 변형 및 수정될 수 있다는 것을 알 수 있을 것이다. 본 발명은 상기의 변형 및 수정 모두를 포함하는 것으로 이해하여야 한다. 본 발명은 본 명세서에서 개별적으로 또는 집합적으로 언급되거나 명시된 단계들, 특징들, 조성물들, 및 화합물들 모두, 및 달리 구체적으로 언급되지 않는 한, 상기 단계들, 또는 특징들의 임의의 및 모든 조합, 또는 임의의 2가지 이상을 또한 포함한다.
본 발명은 단지 예시 목적으로 의도된 것인, 본원에 기재된 구체적 구현예에 의해 범주가 한정되지 않아야 한다. 기능적으로 등가인 생성물, 조성물 및 방법은 본원에 기재된 바와 같이, 본 발명의 범주 내에 명확하게 포함된다.
명확하게 하기 위해 문맥상 별개의 구현예로 기재된 본 발명의 특정 특징은 단일 구현예로 조합하여 또한 제공될 수 있다는 것을 알 수 있다. 반대로, 간략하게 하기 위해 문맥상 단일 구현예로 기재된 본 발명의 다양한 특징은 별개로 또는 임의의 적합한 하위조합으로 또한 제공될 수 있다. 예를 들어, 본원에 제공된 화합물을 처방하거나 투여하는 것을 열거하는 방법은 2가지 방법으로 분리될 수 있다; 하나는 본원에 제공된 화합물을 처방하는 것을 열거하는 방법이고, 나머지는 본원에 제공된 화합물을 투여하는 것을 열거하는 방법이다. 또한, 예를 들어, 본원에 제공된 화합물을 처방하는 것을 열거하는 방법, 및 본원에 제공된 화합물을 투여하는 것을 열거하는 별개의 방법은 본원에 제공된 화합물을 처방하고/거나 투여하는 것을 열거하는 단일의 방법으로 조합될 수 있다. 또한, 예를 들어, 본원에 제공된 화합물을 처방하거나 투여하는 것을 열거하는 방법은 2가지 방법으로 분리될 수 있다-하나는 본원에 제공된 화합물을 처방하는 것을 열거하는 방법이고, 나머지는 본원에 제공된 화합물을 투여하는 것을 열거하는 방법이다. 또한, 예를 들어, 본원에 제공된 화합물을 처방하는 것을 열거하는 방법, 및 본원에 제공된 화합물을 투여하는 것을 열거하는 본 발명의 별개의 방법은 본원에 제공된 화합물을 처방하고/거나 투여하는 것을 열거하는 단일의 방법으로 조합될 수 있다.
화학적 기, 모이어티 또는 라디칼
용어 "C1-C6 알콕시"는 산소 원자에 부착되어 있는 C1-C6 알킬기를 포함하는 라디칼을 지칭하며, 여기서 C1-C6 알킬은 본원에서 확인된 동일한 정의를 갖는다. 일부 구현예는 1 내지 5개의 탄소를 함유한다. 일부 구현예는 1 내지 4 개의 탄소를 함유한다. 일부 구현예는 1 내지 3 개의 탄소를 함유한다. 일부 구현예는 1 내지 2 개의 탄소를 함유한다. 예로는 메톡시, 에톡시, n-프로폭시, 이소프로폭시, n-부톡시, 터트-부톡시, 이소부톡시, 및 sec-부톡시를 포함하나 이로 제한되는 것은 아니다.
용어 "C1-C6 알킬티오"는 황 원자에 부착되어 있는 C1-C6 알킬기를 포함하는 라디칼을 지칭하며, 여기서 C1-C6 알킬은 본원에서 확인된 동일한 정의를 갖는다. 일부 구현예는 1 내지 5개의 탄소를 함유한다. 일부 구현예는 1 내지 4 개의 탄소를 함유한다. 일부 구현예는 1 내지 3 개의 탄소를 함유한다. 일부 구현예는 1 내지 2 개의 탄소를 함유한다. 예로는, 메틸티오, 에틸티오, n-프로필티오, 이소프로필티오, n-부틸티오, 터트-부틸티오, 이소부틸티오, 및 sec-부틸티오를 포함하나 이로 제한되는 것은 아니다.
용어 "C1-C6 알킬"은 1 내지 6개의 탄소를 함유하는 직쇄형 또는 분지형 탄소 라디칼을 지칭한다. 일부 구현예는 1 내지 5개의 탄소를 함유한다. 일부 구현예는 1 내지 4 개의 탄소를 함유한다. 일부 구현예는 1 내지 3 개의 탄소를 함유한다. 일부 구현예는 1 내지 2 개의 탄소를 함유한다. 알킬기는 메틸, 에틸, n-프로필, 이소프로필, n-부틸, sec-부틸, 이소부틸, 터트-부틸, 펜틸, 이소펜틸, t-펜틸, 네오펜틸, 1-메틸부틸 [즉, -CH(CH3)CH2CH2CH3], 2-메틸부틸 [즉, -CH2CH(CH3)CH2CH3], 및 n-헥실을 포함하나 이로 제한되는 것은 아니다.
용어 "C2-C6 알케닐"은 2 내지 6 개의 탄소 및 탄소-탄소 이중 결합을 함유하는 직쇄형 또는 분지형 탄소 라디칼을 지칭한다. 일부 구현예는 2 내지 5개의 탄소를 함유한다. 일부 구현예는 2 내지 4개의 탄소를 함유한다. 일부 구현예는 2 내지 3개의 탄소를 함유한다. 일부 구현예는 2개의 탄소를 함유한다. 알케닐기의 예는 비닐, 프로프-1-엔-1-일, 프로프-1-엔-2-일, 알릴, 부트-2-엔-1-일, 및 부트-1-엔-1-일을 포함하나 이로 제한되는 것은 아니다. 적용가능한 경우, 달리 명시하지 않는 한, 알케닐기는 (E) 이성질체, (Z) 이성질체 및 이들의 혼합물로 확장되어 포함한다.
용어 "C3-C8 사이클로알킬"은 3 내지 7개의 탄소를 함유하는 포화 고리 라디칼을 지칭한다. 일부 구현예는 3개의 탄소를 함유한다. 일부 구현예는 5개의 탄소를 함유한다. 일부 구현예는 4개의 탄소를 함유한다. 일부 구현예는 6개의 탄소를 함유한다. 예는 사이클로프로필, 사이클로부틸, 사이클로펜틸, 및 사이클로헥실을 포함한다.
용어 "C6-C10 아릴"은 6 내지 10 개의 고리 탄소를 함유하는 방향족 고리 라디칼을 의미한다. 예로는, 페닐 및 나프틸을 포함하나 이로 제한되는 것은 아니다.
용어 "3- 내지 8-원 헤테로사이클로알킬"은 하나 이상의 원자가 헤테로원자인 3 내지 8개의 원자를 함유하는 포화 고리 라디칼을 지칭한다. 일부 구현예에서, 고리 원자 중 하나, 둘 또는 세개는 헤테로원자이다. 일부 구현예에서, 고리 원자 중 하나, 둘 또는 세 개는 각각 독립적으로 O, N 또는 S인 헤테로원자이다. 예는 아지리디닐, 아제타닐, 피롤리디닐, 피페리디닐, 테트라하이드로퓨라닐, 테트라하이드로피라닐, 피페라지닐, 및 모폴리닐을 포함한다.
용어 "5- 내지 10-원 헤테로아릴"은 단일 고리 또는 2개의 융합된 고리를 함유할 수 있는, 5 내지 10개의 고리 시스템을 지칭하며, 여기서, 적어도 하나의 고리는 방향족이고, 방향족 고리의 적어도 하나의 고리 원자는 예컨대, O, S 및 N으로부터 선택되는 헤테로원자이고, 여기서, N은 H, C1-C4 아실, C1-C4 알킬, 또는 O(즉, N-옥시드를 형성함)으로 선택적으로 치환되고 S는 하나 또는 2개의 산소로 선택적으로 치환된다. 일부 구현예에서, 방향족 고리는 하나의 헤테로원자를 함유한다. 일부 구현예에서, 방향족 고리는 2개의 헤테로원자를 함유한다. 일부 구현예에서, 방향족 고리는 3개의 헤테로원자를 함유한다. 일부 구현예는 5-원 헤테로아릴 고리에 관한 것이다. 5-원 헤테로아릴 고리의 예는 퓨라닐, 티에닐, 피롤릴, 이미다졸릴, 옥사졸릴, 티아졸릴, 이족사졸릴, 피라졸릴, 이소티아졸릴, 옥사디아졸릴, 트리아졸릴, 테트라졸릴, 및 티아디아졸릴을 포함하나 이로 제한되는 것은 아니다. 일부 구현예는 6-원 헤테로아릴 고리에 관한 것이다. 6-원 헤테로아릴 고리의 예는 피리디닐, 피라지닐, 피리미디닐, 피리다지닐, 및 트리아지닐을 포함하나 이로 제한되는 것은 아니다.
용어 "카보사이클릭 고리"는 3 내지 7개의 탄소를 함유하는 포화 고리를 지칭한다. 일부 구현예는 3개의 탄소를 함유한다. 일부 구현예는 5개의 탄소를 함유한다. 일부 구현예는 4개의 탄소를 함유한다. 일부 구현예는 6개의 탄소를 함유한다.
용어 "헤테로사이클릭 고리"는 3 내지 7개의 원자를 함유하는 포화 고리를 지칭하고, 이의 1개 이상은 헤테로원자이다. 일부 구현예에서, 고리 원자 중 하나, 둘 또는 세개는 헤테로원자이다. 일부 구현예에서, 고리 원자 중 하나, 둘 또는 세 개는 각각 독립적으로 O, N 또는 S인 헤테로원자이다.
용어 "할로겐"은 플루오로, 클로로, 브로모 또는 아이오도기를 지칭한다. 기를 언급하는 경우, "플루오로" 및 "플루오린"은 상호교환가능하게 사용될 수 있고; "클로로" 및 "염소"는 상호교환가능하게 사용될 수 있고; "브로모" 및 "브로민"은 상호교환가능하게 사용될 수 있고; "아이오도" 및 "아이오딘"은 상호교환가능하게 사용될 수 있다.
화합물에서 주어진 치환기의 출현 수는 아래첨자(예컨대 "n" 등)에 의해 명시될 수 있다. 달리 명시되지 않는 한, 아래첨자는 양의 정수이거나 0일 수 있다. 아래첨자의 0의 값은 치환기가 부재임을 나타내는 것으로 의도된다.
화합물
일 구현예에서, 화학식 A 및 이의 약학적으로 허용되는 염, 용매화물, 및 수화물로부터 선택된 화합물이 본원에서 제공된다:
화학식 A
여기서,
n은 1 또는 2이고;
각각의 R6, R7, 및 R8은 수소 및 C1-C6 알킬로부터 독립적으로 선택되고;
R9는 수소 또는 C1-C6 알킬이고;
X2는 N 또는 CR2이고;
X3은 N 또는 CR3이고;
X4는 N 또는 CR4이고;
여기서, 각각의 R1, R2, R3, 및 R4는 각각 독립적으로 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c)
C2-C6 알케닐;
d)
C3-C8 사이클로알킬;
e)
할로겐으로 선택적으로 치환된 5- 내지 10-원 헤테로아릴;
f)
할로겐, 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴,
여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합됨;
g)
할로겐으로 선택적으로 치환된 CONHC1-C6 알킬;
h)
NH(CO)R5, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택됨;
i)
할로겐; 및
j)
C1-C6 알킬티오;
여기서, X2, X3 및 X4 중 2개를 초과하지 않는 적어도 하나는 N이고,
(i) X2, X3 및 X4 중 오직 하나만이 N이고 R1, R2, R3, 및 R4 중 적어도 하나가 수소이거나;
(ii) 오직 X2 및 X4만이 N이다.
본원에 기술된 일반 화학식, 예컨대, 화학식 A, Ia 등 본원 내에 포함된 가변기(예컨대, X, R1, 등)로 표현되는 화학기에 관한 구현예의 모든 조합은, 각각의 조합 및 모든 조합이 개별적으로 그리고 명시적으로 인용되는 것처럼 본 발명에 의해 구체적으로 포함되어 이러한 조합이 안정한 화합물(즉, 분리되고, 특성분석되며 생물학적 활성에 대해 시험될 수 있는 화합물)을 생성하는 화합물을 포함하도록 확장된다. 또한, 본원에 기재된 용도 및 의학적 징후의 모든 하위 조합뿐만 아니라 이러한 가변기를 기술하는 실시 양태에 열거된 화학적 그룹의 모든 하위 조합은 마치 화학적 그룹 및 하위 결합의 각각의 및 모든 서브 결합 사용 및 의학적 징후의 개별적 및 명시적으로 인용되었다.
또한, 일부 구현예는 본원에 개시된 가변기 및 또한, 일부 구현예는 본원에 개시된 가변기 및 일반 화학식으로 나타내어지는 화학적 기에 관한 1개 이상의 구현예의 모든 조합 또는 본원에 개시된 1종 이상의 화합물의 모든 조합을 본원에 구체적으로 개시되거나 또는 마치 각각의 및 모든 조합이 개별적으로 및 명시적으로 열거된 것처럼 본원에 열거된 임의의 참고문헌에 구체적으로 개시된, 소듐/글루코스 공동수송체-2(SGLT2) 억제제, 리파제 억제제, 모노아민 재흡수 억제제, 항경련제, 글루코스 민감제, 인크레틴 모방체, 아밀린 유사체, GLP-1 유사체, Y 수용체 펩티드, 5-HT2C 수용체 작용제, 오피오이드 수용체 길항제, 식욕 억제제, 식욕 감퇴제, 및 호르몬 등으로부터 선택된 1종 이상의 체중 감량 약물의 모든 조합과 함께 또는 조합하여 포함한다. 일부 구현예에서, 체중 감량 약물은 다파글리플로진, 카나글리플로진, 이프라글리플로진, 토포글리플로진, 엠파글리플로진, 레모글리플로진 에타보네이트, 오를리스타트, 세틸리스타트, 알라프로클레이트, 시탈로프람, 다폭세틴, 에스시탈로프람, 페목세틴, 플루옥세틴, 플루복사민, 이폭세틴, 인달핀, 오밀록세틴, 파누라민, 파록세틴, 피란다민, 세르틀란린, 지멜리딘, 데스메틸시탈로프람, 데스메틸세르트랄린, 디데스메틸시탈로프람, 세프록세틴, 시아노프라민, 리톡세틴, 루바조돈, 트라조돈, 빌라조돈, 보르티옥세틴, 덱스트로메토르판, 디멘하이드리네이트, 디펜하이드라민, 메피라민, 피릴라민, 메타돈, 프로폭시펜, 메셈브린, 록스인돌, 아메달린, 토목세틴, 달레달린, 에디복세틴, 에스레복세틴, 로르탈라민, 마진돌, 니속세틴, 레복세틴, 탈로프람, 탈수프람, 탄다민, 빌록사진, 마프로틸린, 부프로피온, 시클라진돌, 마니팍신, 라다팍신, 타펜타돌, 테닐록사진, 징코 빌로바, 알트로판, 디플루오로핀, 이오메토판, 바녹세린, 메디폭사민, 카에노멜레스 스페시오사, 히퍼포린, 아드히퍼포린, 부프로피온, 프라미펙솔, 카베르골린, 벤라팍신, 데스벤라팍신, 둘록세틴, 밀나시프란, 레보밀나시프란, 비시파딘, 아미넵틴, 데속시피프라드롤, 덱스메틸페니데이트, 디페메토렉스, 디페닐프롤리놀, 에틸페니데이트, 펜캄파민, 펜카민, 레페타민, 메소카르브, 메틸렌디옥시피로발레론, 메틸페니데이트, 노미펜신, 옥솔린산, 피프라드롤, 프롤린탄, 피로발레론, 타메트랄린, 네포팜, 아미티파딘, 테소펜신, 테다티옥세틴, 비시파딘, 브라소펜신, 디클로펜신, 탁실, 나피론, 히퍼포린, 토피라메이트, 조니사미드, 메트포르민, 아카르보스, 로지글리타존, 피오글리타존, 트로글리타존, 엑세나티드, 리라글루티드, 타스포글루티드, 오비네피티드, 프람린티드, 펩티드 YY, 바비카세린, 날트렉손, 날록손, 펜테르민, 디에틸프로피온, 옥시메타졸린, 벤플루오렉스, 옥시메타졸린, 벤플루오렉스, 부테놀리드, 카틴, 펜메트라진, 페닐프로판올아민, 피로글루타밀-히스티딜-글리신, 암페타민, 벤즈페타민, 덱스메틸페니데이트, 덱스트로암페타민, 메틸렌디옥시피로발레론, 글루카곤, 리스덱스암페타민, 메타암페타민, 메틸페니데이트, 펜디메트라진, 펜에틸아민, 카페인, 브로모크립틴, 에페드린, 슈도에페드린, 리모나반트, 수리나반트, 미르타자핀, 다이어트엑스(Dietex)®, MG 플러스 프로테인(Plus Protein)?, 인슐린, 및 렙틴 및 이의 제약상 허용되는 염 및 조합물로부터 선택된다.
본원에 사용된 "치환된"은 화학적 기의 적어도 1개의 수소 원자가 1가 또는 2가일 수 있는 비-수소 치환기 또는 기에 의해 대체되는 것을 나타낸다. 상기 치환기 또는 기가 2가인 경우, 상기 기가 또 다른 치환기 또는 기로 추가 치환된다는 것을 이해한다. 본원에서 화학적 기가 "치환된" 경우에, 이는 완전한 원자가의 치환까지 가질 수 있고; 예를 들어 메틸 기는 1, 2 또는 3개의 치환기에 의해 치환될 수 있고, 메틸렌기는 1 또는 4개의 치환기에 의해 치환될 수 있고, 페닐기는 1, 2, 3, 4 또는 5개의 치환기에 의해 치환될 수 있고, 나프틸기는 1, 2, 3, 4, 5, 6 또는 7개의 치환기에 의해 치환될 수 있고, 기타 이와 같다. 마찬가지로, "1개 이상의 치환기로 치환된"은 상기 기가 1개의 치환기 내지 상기 기에 의해 물리적으로 허용된 총 개수의 치환기로 치환된 것을 지칭한다. 또한, 기가 1개 초과의 기들로 치환된 경우에, 이들은 동일할 수 있거나 또는 이들은 상이할 수 있다.
본원에 제공된 화합물은 호변이성질체 형태, 예컨대, 케토-에놀 호변이성질체 등을 또한 포함할 수 있다. 호변이성질체 형태는 적절한 치환에 의해 하나의 형태로 평형 상태 또는 입체적으로 고정될 수 있다. 다양한 호변이성질체 형태가 본원에 제공된 화합물의 범주 내에 포함되는 것으로 이해된다.
화학식 A, Ia 또는 본 개시내용의 전반에 걸쳐 사용된 다른 화학식의 화합물이 1개 이상의 키랄 중심을 가질 수 있으며, 따라서 거울상 이성질체 및/또는 부분입체 이성질체로 존재할 수 있는 것으로 이해되고 인식된다. 본 발명은 이러한 모든 거울상 이성질체, 부분입체 이성질체 및 이의 혼합물, 예컨대, 비제한적으로 라세미체까지 확장되며 이들을 포함하는 것으로 이해된다. 화학식 A, Ia 또는 본 개시내용의 전반에 걸쳐 사용된 다른 화학식의 화합물은, 달리 언급되거나 나타내지 않는 한, 모든 개별 거울상 이성질체 및 이의 혼합물을 나타내는 것으로 이해된다.
정수 n
일부 구현예에서, n은 1 또는 2이다.
일부 구현예에서, n은 1이다.
일부 구현예에서, n은 2이다.
기 X
2
, X
3
및 X
4
일부 구현예에서,
X2는 N 또는 CR2이고;
X3은 N 또는 CR3이고;
X4는 N 또는 CR4이고;
여기서, X2, X3 및 X4 중 2개를 초과하지 않는 적어도 하나는 N이고,
(i) X2, X3 및 X4 중 오직 하나만이 N이고 R1, R2, R3, 및 R4 중 적어도 하나가 수소이거나;
(ii) 오직 X2 및 X4만이 N이다.
일부 구현예에서,
X2는 N 또는 CR2이고;
X3은 N 또는 CR3이고;
X4는 N 또는 CR4이고;
여기서, X2, X3 및 X4 중 2개를 초과하지 않는 적어도 하나는 N이다.
일부 구현예에서,
X2는 N이고;
X3은 CR3이고;
X4는 N이다.
기 R
1
일부 구현예에서, R1은 다음으로부터 선택된다:
a)
수소;일부 구현예에서, R1은 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c)
C2-C6 알케닐;
d)
C3-C8 사이클로알킬;
e)
할로겐으로 선택적으로 치환된 5- 내지 10-원 헤테로아릴;
f)
할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴,
여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합됨;
g)
할로겐으로 선택적으로 치환된 CONHC1-C6 알킬;
h)
NH(CO)R5, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택됨;
i)
할로겐; 및
j)
C1-C6 알킬티오;
일부 구현예에서, R1은 수소이다.
일부 구현예에서, R1은 C1-C6 알킬이다.
일부 구현예에서, R1은 C6-C10 아릴로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 할로겐으로 치환된 C6-C10 아릴로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 C1-C6 알콕시로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알콕시로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 C3-C8 사이클로알킬로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 OH로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 CN으로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 5- 내지 10-원 헤테로아릴로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 할로겐으로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 C6-C10 아릴, 할로겐으로 치환된 C6-C10 아릴, C1-C6 알콕시, 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알콕시, C3-C8 사이클로알킬¸ OH, CN, 3- 내지 8-원 헤테로사이클로알킬, 5- 내지 10-원 헤테로아릴, 또는 할로겐이다.
일부 구현예에서, R1은 n-펜틸이다.
일부 구현예에서, R1은 펜탄-2-일이다.
일부 구현예에서, R1은 에틸이다.
일부 구현예에서, R1은 i-프로필이다.
일부 구현예에서, R1은 n-부틸이다.
일부 구현예에서, R1은 n-프로필이다.
일부 구현예에서, R1은 i-부틸이다.
일부 구현예에서, R1은 메틸이다.
일부 구현예에서, R1은 이소펜틸이다.
일부 구현예에서, R1은 t-부틸이다.
일부 구현예에서, R1은 네오펜틸이다.
일부 구현예에서, R1은 벤질이다.
일부 구현예에서, R1은 할로겐으로 치환된 벤질이다.
일부 구현예에서, R1은 불소로 치환된 벤질이다.
일부 구현예에서, R1은 2-플루오로벤질이다.
일부 구현예에서, R1은 3-플루오로벤질이다.
일부 구현예에서, R1은 4- 플루오로벤질이다.
일부 구현예에서, R1은 펜에틸이다.
일부 구현예에서, R1은 메톡시에틸이다.
일부 구현예에서, R1은 메톡시메틸이다.
일부 구현예에서, R1은 이소프로폭시메틸이다.
일부 구현예에서, R1은((테트라하이드로-2H-피란-4-일)메톡시)메틸이다.
일부 구현예에서, R1은 사이클로헥실메틸이다.
일부 구현예에서, R1은 사이클로부틸메틸이다.
일부 구현예에서, R1은 사이클로부틸(하이드록시)메틸이다.
일부 구현예에서, R1은 하이드록시메틸이다.
일부 구현예에서, R1은 3-하이드록시프로필이다.
일부 구현예에서, R1은 2-시아노에틸이다.
일부 구현예에서, R1은(테트라하이드로-2H-피란-2-일)메틸이다.
일부 구현예에서, R1은 피리딘-2-일메틸이다.
일부 구현예에서, R1은 3,3,3-트리플루오로프로필이다.
일부 구현예에서, R1은 C2-C6 알케닐이다.
일부 구현예에서, R1은 (E)-부트-2-엔-1-일이다.
일부 구현예에서, R1은 C3-C8 사이클로알킬이다.
일부 구현예에서, R1은 사이클로헥실이다.
일부 구현예에서, R1은 사이클로펜틸이다.
일부 구현예에서, R1은 사이클로부틸이다.
일부 구현예에서, R1은 사이클로프로필이다.
일부 구현예에서, R1은 5- 내지 10-원 헤테로아릴이다.
일부 구현예에서, R1은 할로겐으로 치환된 5- 내지 10-원 헤테로아릴이다.
일부 구현예에서, R1은 티오펜-2-일(예컨대 화합물 126의 R1 참조)이다.
일부 구현예에서, R1은 피리딘-2-일이다.
일부 구현예에서, R1은 5-클로로피리딘-2-일이다.
일부 구현예에서, R1은 할로겐, 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴이고, 여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합된다.
일부 구현예에서, R1은 페닐이다.
일부 구현예에서, R1은 4-메톡시페닐이다.
일부 구현예에서, R1은 3-트리플루오로메톡시페닐이다.
일부 구현예에서, R1은 2-트리플루오로메틸페닐이다.
일부 구현예에서, R1은 2-클로로페닐이다.
일부 구현예에서, R1은 2-플루오로페닐이다.
일부 구현예에서, R1은 3-플루오로페닐이다.
일부 구현예에서, R1은 2,3-디플루오로페닐이다.
일부 구현예에서, R1은 벤조[d][1,3]디옥솔-5-일이다.
일부 구현예에서, R1은 CONHC1-C6 알킬이다.
일부 구현예에서, R1은 할로겐으로 치환된 CONHC1-C6 알킬이다.
일부 구현예에서, R1은 CONHCH3이다.
일부 구현예에서, R1은 CONHCH2CHF2이다.
일부 구현예에서, R1은 NH(CO)R5이고, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택된다.
일부 구현예에서, R1은 할로겐이다.
일부 구현예에서, R1은 염소이다.
일부 구현예에서, R1은 브로민이다.
일부 구현예에서, R1은 C1-C6 알킬티오이다.
일부 구현예에서, R1은 메틸티오이다.
일부 구현예에서, R1은 CONHC1-C6 알킬, 할로겐으로 치환된 CONHC1-C6 알킬, 할로겐, 또는 C1-C6 알킬티오이다.
일부 구현예에서, R1은 NH(CO)R5이고, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로 이루어진 군으로부터 선택된다.
일부 구현예에서, R1은 벤조[d][1,3]디옥솔-5-일, 메틸카바모일, 수소, 2-클로로벤즈아미도, 3-(트리플루오로메톡시)페닐, 벤질, 2-메톡시에틸, 펜틸, 펜탄-2-일, 에틸, 이소프로필, 부틸, 프로필, 이소부틸, 3-플루오로벤질, 2-플루오로벤질, 메틸, 이소펜틸, 메톡시메틸, 사이클로헥실메틸, 네오펜틸, 사이클로부틸(하이드록시)메틸, (에톡시카보닐)아미노, 2-페닐아세트아미도, 부티르아미도, 티오펜-2-일, 사이클로헥실, 4-플루오로벤질, 피롤리딘-1-카복스아미도, (테트라하이드로-2H-피란-2-일)메틸, ((테트라하이드로-2H-피란-4-일)메톡시)메틸, 2-(트리플루오로메틸)페닐, 4-메톡시페닐, 브로모, 사이클로부틸메틸, 2,3-디플루오로벤즈아미도, 벤즈아미도, (2,2-디플루오로에틸)카바모일, 사이클로프로판카복스아미도, 2-시아노에틸, 피리딘-2-일메틸, 부트-2-엔-1-일, 이소프로폭시메틸, 5-클로로피리딘-2-일, 사이클로펜틸, 사이클로부틸, 클로로, 사이클로프로필, 3,3,3-트리플루오로프로필, 펜에틸, 및 사이클로펜틸메틸로 이루어진 군으로부터 선택된다.
기 X
2
일부 구현예에서, X2는 N 또는 CR2이다.
일부 구현예에서, X2는 N이다.
일부 구현예에서, X2는 CR2이다.
기 R
2
일부 구현예에서, R2는 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로 알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c)
C2-C6 알케닐;
d)
C3-C8 사이클로알킬;
e)
할로겐으로 선택적으로 치환된 5- 내지 10-원 헤테로아릴;
f)
할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴,
여기서, C6-C10 아릴은 헤테로환 고리와 선택적으로 융합됨;
g)
할로겐으로 선여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합됨;
g)
할로겐으로 선택적으로 치환된 CONHC1-C6 알킬;
h)
NH(CO)R5이고, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택됨;
i)
할로겐; 및
j)
C1-C6 알킬티오.
일부 구현예에서, R2는 수소, C1-C6 알킬, C6-C10 아릴로 치환된 C1-C6 알킬, C1-C6 알콕시로 치환된 C1-C6 알킬, C3-C8 사이클로알킬로 치환된 C1-C6 알킬, 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알킬, C3-C8 사이클로알킬, 할로겐, 또는 C1-C6 알킬티오로 이루어진 군으로부터 선택된다.
일부 구현예에서, R2는 수소, 프로필, 벤질, 2-시아노에틸, 이소프로폭시메틸, 사이클로헥실메틸, (테트라하이드로-2H-피란-2-일)메틸, 사이클로부틸, 클로로, 및 사이클로펜틸메틸로 이루어진 군으로부터 선택된다.
일부 구현예에서, R2는 수소이다.
일부 구현예에서, R2는 C1-C6 알킬이다.
일부 구현예에서, R2는 C6-C10 아릴로 치환된 C1-C6 알킬이다.
일부 구현예에서, R2는 n-프로필이다.
일부 구현예에서, R2는 벤질이다.
일부 구현예에서, R2는 CN으로 치환된 C1-C6 알킬이다.
일부 구현예에서, R2는 C1-C6 알콕시로 치환된 C1-C6 알킬이다.
일부 구현예에서, R2는 이소프로폭시메틸이다.
일부 구현예에서, R2는 C3-C8 사이클로알킬로 치환된 C1-C6 알킬이다.
일부 구현예에서, R2는 사이클로헥실이다.
일부 구현예에서, R2는 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알킬이다.
일부 구현예에서, R2는 (테트라하이드로-2H-피란-2-일)메틸이다.
일부 구현예에서, R2는 C3-C8 사이클로알킬이다.
일부 구현예에서, R2는 사이클로부틸이다.
일부 구현예에서, R2는 할로겐이다.
일부 구현예에서, R2는 염소이다.
일부 구현예에서, R2는 C1-C6 알킬티오이다.
일부 구현예에서, R2는 메틸티오이다.
기 X
3
일부 구현예에서, X3은 N 또는 CR3이다.
일부 구현예에서, X3은 N이다.
일부 구현예에서, X3은 CR3이다.
기 R
3
일부 구현예에서, R3은 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c)
C2-C6 알케닐;
d)
C3-C8 사이클로알킬;
e)
할로겐으로 선택적으로 치환된 5- 내지 10-원 헤테로아릴;
f)
할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴,
여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합됨;
g)
할로겐으로 선택적으로 치환된 CONHC1-C6 알킬;
h)
NH(CO)R5, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택됨;
i)
할로겐; 및
j)
C1-C6 알킬티오.
일부 구현예에서, R3은 수소 또는 C1-C6 알킬티오이다.
일부 구현예에서, R3은 수소및 메틸티오로 이루어진 군으로부터 선택된다.
일부 구현예에서, R3은 수소이다.
일부 구현예에서, R3은 C1-C6 알킬이다.
일부 구현예에서, R3은 C6-C10 아릴로 치환된 C1-C6 알킬이다.
일부 구현예에서, R3은 n-프로필이다.
일부 구현예에서, R3은 벤질이다.
일부 구현예에서, R3은 C1-C6 알킬티오이다.
일부 구현예에서, R3은 메틸티오이다.
기 X
4
일부 구현예에서, X4는 N 또는 CR4이다.
일부 구현예에서, X4는 N이다.
일부 구현예에서, X4는 CR4이다.
기 R
4
일부 구현예에서, R4는 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c)
C2-C6 알케닐;
d)
C3-C8 사이클로알킬;
e)
할로겐으로 선택적으로 치환된 5- 내지 10-원 헤테로아릴;
f)
할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴,
여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합됨;
g)
할로겐으로 선택적으로 치환된 CONHC1-C6 알킬;
h)
NH(CO)R5, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택됨;
i)
할로겐; 및
j)
C1-C6 알킬티오.
일부 구현예에서, R4는 수소이다.
일부 구현예에서, R4는 C1-C6 알킬이다.
일부 구현예에서, R4는 C6-C10 아릴로 치환된 C1-C6 알킬이다.
일부 구현예에서, R4는 n-프로필이다.
일부 구현예에서, R4는 벤질이다.
일부 구현예에서, R4는 C1-C6 알킬티오이다.
일부 구현예에서, R4는 티오메틸이다.
기 R
5
일부 구체 예에서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 일부 구체예에서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택된다.
일부 구체예에서, R5는 C1-C6 알콕시이다.
일부 구체예에서, R5는 C1-C6 알킬이다.
일부 구체예에서, R5는 C6-C10 아릴로 치환된 C1-C6 알킬이다.
일부 구체예에서, R5는 C6-C10 아릴이다.
일부 구체예에서, R5는 할로겐으로 치환된 C6-C10 아릴이다.
일부 구체예에서, R5는 3- 내지 8-원 헤테로사이클로알킬이다.
일부 구체예에서, R5는C3-C8 사이클로알킬이다.
일부 구체예에서, R5는 에톡시이다.
일부 구체예에서, R5는 n-프로필이다.
일부 구체예에서, R5는 벤질이다.
일부 구체예에서, R5는 페닐이다.
일부 구체예에서, R5는 2-클로로페닐이다.
일부 구체예에서, R5는 2,3-디플루오로페닐이다.
일부 구체예에서, R5는 피롤리디닐이다.
일부 구체예에서, R5는 사이클로프로필이다.
기 R
6
일부 구현예에서, R6은 수소 및 C1-C6 알킬로부터 선택된다.
일부 구현예에서, R6은 수소 및 메틸로 이루어진 군으로부터 선택된다.
일부 구현예에서, R6은 수소이다.
일부 구현예에서, R6은 C1-C6 알킬이다.
일부 구현예에서, R6은 메틸이다.
기 R
7
일부 구현예에서, R7은 수소, 및 C1-C6 알킬로부터 선택된다.
일부 구현예에서, R7은 수소이다.
일부 구현예에서, R7은 C1-C6 알킬이다.
일부 구현예에서, R7은 메틸이다.
기 R
8
일부 구현예에서, R8은 수소 및 C1-C6 알킬로부터 선택된다.
일부 구현예에서, R8은 수소이다.
일부 구현예에서, R8은 C1-C6 알킬이다.
일부 구현예에서, R8은 메틸이다.
기 R
9
일부 구현예에서, R9는 수소이다.
일부 구현예에서, R9는 C1-C6 알킬이다.
일부 구현예에서, R9는 수소 및 메틸로 이루어진 군으로부터 선택된다.
일부 구현예에서, R9는 메틸이다.
화학식 A의 구현예
일부 구현예에서, R1은 벤조[d][1,3]디옥솔-5-일, 메틸카바모일, 수소, 2-클로로벤즈아미도, 3-(일부 구현예에서, R1은 벤조[d][1,3]디옥솔-5-일, 메틸카바모일, 수소, 2-클로로벤즈아미도, 3-(트리플루오로메톡시)페닐, 벤질, 2-메톡시에틸, 펜틸, 펜탄-2-일, 에틸, 이소프로필, 부틸, 프로필, 이소부틸, 3-플루오로벤질, 2-플루오로벤질, 메틸, 이소펜틸, 메톡시메틸, 사이클로헥실메틸, 네오펜틸, 사이클로부틸(하이드록시)메틸, (에톡시카보닐)아미노, 2-페닐아세트아미도, 부티르아미도, 티오펜-2-일, 사이클로헥실, 4-플루오로벤질, 피롤리딘-1-카복스아미도, (테트라하이드로-2H-피란-2-일)메틸, ((테트라하이드로-2H-피란-4-일)메톡시)메틸, 2-(트리플루오로메틸)페닐, 4-메톡시페닐, 브로모, 사이클로부틸메틸, 2,3-디플루오로벤즈아미도, 벤즈아미도, (2,2-디플루오로에틸)카바모일, 사이클로프로판카복스아미도, 2-시아노에틸, 피리딘-2-일메틸, 부트-2-엔-1-일, 이소프로폭시메틸, 5-클로로피리딘-2-일, 사이클로펜틸, 사이클로부틸, 클로로, 사이클로프로필, 3,3,3-트리플루오로프로필, 펜에틸, 및 사이클로펜틸메틸로 이루어진 군으로부터 선택되며;
X2는 N이거나, X2는 CR2이고 R2는 수소, 프로필, 벤질, 2-시아노에틸, 이소프로폭시메틸, 사이클로헥실메틸, (테트라하이드로-2H-피란-2-일)메틸, 사이클로부틸, 클로로, 및 사이클로펜틸메틸로 이루어진 군으로부터 선택되고;
X3은 N이거나, X3은 CR3이고 R3은 수소및 메틸티오로 이루어진 군으로부터 선택되고;
X4는 N이거나, X4는 CR4이고 R4는 수소이고;
R6은수소 및 메틸로 이루어진 군으로부터 선택되고;
R9는수소 및 메틸로 이루어진 군으로부터 선택된다.
일부 구현예에서, 화학식 A의 화합물은 화학식 Ia의 화합물 및 이의 약학적으로 허용되는 염, 용매화물 및 수화물로부터 선택된다:
화학식 Ia
여기서
n은 1 또는 2이고;
R1은 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c)
C2-C6 알케닐;
d)
C3-C8 사이클로알킬;
e)
할로겐으로 선택적으로 치환된 5- 내지 10-원 헤테로아릴;
f)
할로겐, 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴,
여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합됨;
g)
할로겐으로 선택적으로 치환된 CONHC1-C6 알킬;
h)
NH(CO)R5, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택됨;
i)
할로겐; 및
j)
C1-C6 알킬티오;
여기서, X2, X3 및 X4 중 2개를 초과하지 않는 적어도 하나는 N이고,
(i) X2, X3 및 X4 중 오직 하나만이 N이고 R1, R2, R3, 및 R4 중 적어도 하나가 수소이거나;
(ii) 오직 X2 및 X4만이 N이다.
본원에 기술된 일반 화학식, 예컨대, 화학식 A, Ia 등 본원 내에 포함된 변수(예컨대, X, R1, 등)로 표현되는 화학기에 관한 구현예의 모든 조합은, 각각의 조합 및 모든 조합이 개별적으로 그리고 명시적으로 인용되는 것처럼 본 발명에 의해 명확하게 포함되어, 이러한 조합이 안정한 화합물(즉, 분리되고, 특성 분석되며 생물학적 활성에 대해 시험될 수 있는 화합물)을 생성하는 화합물을 포함하도록 확장된다. 또한, 본원에 기재된 용도 및 의학적 징후의 모든 하위 조합뿐만 아니라 이러한 변수를 기술하는 구현예에 열거된 화학적 그룹의 모든 하위 조합은 마치 화학적 그룹 및 하위 결합의 각각의 및 모든 서브 결합 사용 및 의학적 징후의 개별적 및 명시적으로 인용된 것처럼, 본 발명(들)에 명확하게 포함된다.
또한, 일부 구현예는 본원에 개시된 변수 및 또한, 일부 구현예는 본원에 개시된 변수 및 일반 화학식으로 나타내어지는 화학적 기에 관한 1개 이상의 구현예의 모든 조합 또는 본원에 개시된 1종 이상의 화합물의 모든 조합을 본원에 구체적으로 개시되거나 또는 마치 각각의 및 모든 조합이 개별적으로 및 명시적으로 열거된 것처럼 본원에 열거된 임의의 참고문헌에 구체적으로 개시된, 소듐/글루코스 공동수송체-2(SGLT2) 억제제, 리파제 억제제, 모노아민 재흡수 억제제, 항경련제, 글루코스 민감제, 인크레틴 모방체, 아밀린 유사체, GLP-1 유사체, Y 수용체 펩티드, 5-HT2C 수용체 작용제, 오피오이드 수용체 길항제, 식욕 억제제, 식욕 감퇴제, 및 호르몬 등으로부터 선택된 1종 이상의 체중 감량 약물의 모든 조합과 함께 또는 조합하여 포함한다. 일부 구현예에서, 체중 감량 약물은 다파글리플로진, 카나글리플로진, 이프라글리플로진, 토포글리플로진, 엠파글리플로진, 레모글리플로진 에타보네이트, 오를리스타트, 세틸리스타트, 알라프로클레이트, 시탈로프람, 다폭세틴, 에스시탈로프람, 페목세틴, 플루옥세틴, 플루복사민, 이폭세틴, 인달핀, 오밀록세틴, 파누라민, 파록세틴, 피란다민, 세르틀란린, 지멜리딘, 데스메틸시탈로프람, 데스메틸세르트랄린, 디데스메틸시탈로프람, 세프록세틴, 시아노프라민, 리톡세틴, 루바조돈, 트라조돈, 빌라조돈, 보르티옥세틴, 덱스트로메토르판, 디멘하이드리네이트, 디펜하이드라민, 메피라민, 피릴라민, 메타돈, 프로폭시펜, 메셈브린, 록스인돌, 아메달린, 토목세틴, 달레달린, 에디복세틴, 에스레복세틴, 로르탈라민, 마진돌, 니속세틴, 레복세틴, 탈로프람, 탈수프람, 탄다민, 빌록사진, 마프로틸린, 부프로피온, 시클라진돌, 마니팍신, 라다팍신, 타펜타돌, 테닐록사진, 징코 빌로바, 알트로판, 디플루오로핀, 이오메토판, 바녹세린, 메디폭사민, 카에노멜레스 스페시오사, 히퍼포린, 아드히퍼포린, 부프로피온, 프라미펙솔, 카베르골린, 벤라팍신, 데스벤라팍신, 둘록세틴, 밀나시프란, 레보밀나시프란, 비시파딘, 아미넵틴, 데속시피프라드롤, 덱스메틸페니데이트, 디페메토렉스, 디페닐프롤리놀, 에틸페니데이트, 펜캄파민, 펜카민, 레페타민, 메소카르브, 메틸렌디옥시피로발레론, 메틸페니데이트, 노미펜신, 옥솔린산, 피프라드롤, 프롤린탄, 피로발레론, 타메트랄린, 네포팜, 아미티파딘, 테소펜신, 테다티옥세틴, 비시파딘, 브라소펜신, 디클로펜신, 탁실, 나피론, 히퍼포린, 토피라메이트, 조니사미드, 메트포르민, 아카르보스, 로지글리타존, 피오글리타존, 트로글리타존, 엑세나티드, 리라글루티드, 타스포글루티드, 오비네피티드, 프람린티드, 펩티드 YY, 바비카세린, 날트렉손, 날록손, 펜테르민, 디에틸프로피온, 옥시메타졸린, 벤플루오렉스, 옥시메타졸린, 벤플루오렉스, 부테놀리드, 카틴, 펜메트라진, 페닐프로판올아민, 피로글루타밀-히스티딜-글리신, 암페타민, 벤즈페타민, 덱스메틸페니데이트, 덱스트로암페타민, 메틸렌디옥시피로발레론, 글루카곤, 리스덱스암페타민, 메타암페타민, 메틸페니데이트, 펜디메트라진, 펜에틸아민, 카페인, 브로모크립틴, 에페드린, 슈도에페드린, 리모나반트, 수리나반트, 미르타자핀, 다이어트엑스(Dietex)®, MG 플러스 프로테인(Plus Protein)™, 인슐린, 및 렙틴 및 이의 제약상 허용되는 염 및 조합물로부터 선택된다.
본원에 사용된 "치환된"은 화학적 기의 적어도 1개의 수소 원자가 1가 또는 2가일 수 있는 비-수소 치환기 또는 기에 의해 대체되는 것을 나타낸다. 상기 치환기 또는 기가 2가인 경우, 상기 기가 또 다른 치환기 또는 기로 추가 치환된다는 것을 알 수 있다. 본원에서 화학적 기가 "치환된" 경우에, 이는 완전한 원자가의 치환까지 가질 수 있고; 예를 들어 메틸 기는 1, 2 또는 3개의 치환기에 의해 치환될 수 있고, 메틸렌기는 1 또는 4개의 치환기에 의해 치환될 수 있고, 페닐기는 1, 2, 3, 4 또는 5개의 치환기에 의해 치환될 수 있고, 나프틸기는 1, 2, 3, 4, 5, 6 또는 7개의 치환기에 의해 치환될 수 있고, 기타 등등과 같다. 마찬가지로, "1개 이상의 치환기로 치환된"은 상기 기가 1개의 치환기 내지 상기 기에 의해 물리적으로 허용된 총 개수의 치환기로 치환된 것을 지칭한다. 또한, 기가 1개 초과의 기들로 치환된 경우에, 이들은 동일할 수 있거나 또는 이들은 상이할 수 있다.
본원에 제공된 화합물은 호변이성질체 형태, 예컨대, 케토-에놀 호변이성질체 등을 또한 포함할 수 있다. 호변이성질체 형태는 적절한 치환에 의해 하나의 형태로 평형 상태 또는 입체적으로 고정될 수 있다. 다양한 호변이성질체 형태가 본원에 제공된 화합물의 범주 내에 포함됨을 알 수 있다.
화학식 A, Ia 또는 본 개시내용의 전반에 걸쳐 사용된 다른 화학식의 화합물이 1개 이상의 키랄 중심을 가질 수 있으며, 따라서 거울상 이성질체 및/또는 부분입체 이성질체로 존재할 수 있음을 알 수 있으며 주지되어 있다. 본 발명은 이러한 모든 거울상 이성질체, 부분입체 이성질체 및 이의 혼합물, 예컨대, 비제한적으로 라세미체까지 확장되며 이들을 포함함을 알 수 있다. 화학식 A, Ia 또는 본 개시내용의 전반에 걸쳐 사용된 다른 화학식의 화합물은, 달리 언급되거나 나타내지 않는 한, 모든 개별 거울상 이성질체 및 이의 혼합물을 나타내는 것으로 이해된다.
정수 n
일부 구현예에서, n은 1 또는 2이다.
일부 구현예에서, n은 1이다.
일부 구현예에서, n은 2이다.
기 X
2
, X
3
및 X
4
일부 구현예에서,
X2는 N 또는 CR2이고;
X3은 N 또는 CR3이고;
X4는 N 또는 CR4이고;
여기서, X2, X3 및 X4 중 2개를 초과하지 않는 적어도 하나는 N이고,
(i) X2, X3 및 X4 중 오직 하나만이 N이고 R1, R2, R3, 및 R4 중 적어도 하나가 수소이거나;
(ii) 오직 X2 및 X4만이 N이다.
일부 구현예에서,
X2는 N 또는 CR2이고;
X3은 N 또는 CR3이고;
X4는 N 또는 CR4이고;
여기서, X2, X3 및 X4 중 2개를 초과하지 않는 적어도 하나는 N이다.
일부 구현예에서,
X2는 N이고;
X3은 CR3이고;
X4는 N이다.
기 R
1
일부 구현예에서, R1은 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c)
C2-C6 알케닐;
d)
C3-C8 사이클로알킬;
e)
할로겐으로 선택적으로 치환된 5- 내지 10-원 헤테로아릴;
f)
할로겐, 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴,
여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합됨;
g)
할로겐으로 선택적으로 치환된 CONHC1-C6 알킬;
h)
NH(CO)R5, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택됨;
i)
할로겐; 및
j)
C1-C6 알킬티오.
일부 구현예에서, R1은 수소이다.
일부 구현예에서, R1은 C1-C6 알킬이다.
일부 구현예에서, R1은 C6-C10 아릴로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 할로겐으로 치환된 C6-C10 아릴로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 C1-C6 알콕시로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알콕시로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 C3-C8 사이클로알킬로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 OH로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 CN으로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 5- 내지 10-원 헤테로아릴로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 할로겐으로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 C6-C10 아릴, 할로겐으로 치환된 C6-C10 아릴, C1-C6 알콕시, 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알콕시, C3-C8 사이클로알킬¸ OH, CN, 3- 내지 8-원 헤테로사이클로알킬, 5- 내지 10-원 헤테로아릴, 또는 할로겐으로 치환된 C1-C6 알킬이다.
일부 구현예에서, R1은 n-펜틸이다.
일부 구현예에서, R1은 펜탄-2-일이다.
일부 구현예에서, R1은 에틸이다.
일부 구현예에서, R1은 i-프로필이다.
일부 구현예에서, R1은 n-부틸이다.
일부 구현예에서, R1은 n-프로필이다.
일부 구현예에서, R1은 i-부틸이다.
일부 구현예에서, R1은 메틸이다.
일부 구현예에서, R1은 이소펜틸이다.
일부 구현예에서, R1은 t-부틸이다.
일부 구현예에서, R1은 네오펜틸이다.
일부 구현예에서, R1은 벤질이다.
일부 구현예에서, R1은 할로겐으로 치환된 벤질이다.
일부 구현예에서, R1은 불소로 치환된 벤질이다.
일부 구현예에서, R1은 2-플루오로벤질이다.
일부 구현예에서, R1은 3-플루오로벤질이다.
일부 구현예에서, R1은 4- 플루오로벤질이다.
일부 구현예에서, R1은 펜에틸이다.
일부 구현예에서, R1은 메톡시에틸이다.
일부 구현예에서, R1은 메톡시메틸이다.
일부 구현예에서, R1은 이소프로폭시메틸이다.
일부 구현예에서, R1은 ((테트라하이드로-2H-피란-4-일)메톡시)메틸이다.
일부 구현예에서, R1은 사이클로헥실메틸이다.
일부 구현예에서, R1은 사이클로부틸메틸이다.
일부 구현예에서, R1은 사이클로부틸(하이드록시)메틸이다.
일부 구현예에서, R1은 하이드록시메틸이다.
일부 구현예에서, R1은 3-하이드록시프로필이다.
일부 구현예에서, R1은 2-시아노에틸이다.
일부 구현예에서, R1은 (테트라하이드로-2H-피란-2-일)메틸이다.
일부 구현예에서, R1은 피리딘-2-일메틸이다.
일부 구현예에서, R1은 3,3,3-트리플루오로프로필이다.
일부 구현예에서, R1은 C2-C6 알케닐이다.
일부 구현예에서, R1은 (E)-부트-2-엔-1-일이다.
일부 구현예에서, R1은 C3-C8 사이클로알킬이다.
일부 구현예에서, R1은 사이클로헥실이다.
일부 구현예에서, R1은 사이클로펜틸이다.
일부 구현예에서, R1은 사이클로부틸이다.
일부 구현예에서, R1은 사이클로프로필이다.
일부 구현예에서, R1은 5- 내지 10-원 헤테로아릴이다.
일부 구현예에서, R1은 할로겐으로 치환된 5- 내지 10-원 헤테로아릴이다.
일부 구현예에서, R1은 티오펜-2-일(예컨대, 화합물 126의 R1 참조)이다.
일부 구현예에서, R1은 피리딘-2-일이다.
일부 구현예에서, R1은 5-클로로피리딘-2-일이다.
일부 구현예에서, R1은 할로겐, 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴이고, 여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합된다.
일부 구현예에서, R1은 페닐이다.
일부 구현예에서, R1은 4-메톡시페닐이다.
일부 구현예에서, R1은 3-트리플루오로메톡시페닐이다.
일부 구현예에서, R1은 2-트리플루오로메틸페닐이다.
일부 구현예에서, R1은 2-클로로페닐이다.
일부 구현예에서, R1은 2-플루오로페닐이다.
일부 구현예에서, R1은 3-플루오로페닐이다.
일부 구현예에서, R1은 2,3-디플루오로페닐이다.
일부 구현예에서, R1은 벤조[d][1,3]디옥솔-5-일이다.
일부 구현예에서, R1은 CONHC1-C6 알킬이다.
일부 구현예에서, R1은 할로겐으로 치환된 CONHC1-C6 알킬이다.
일부 구현예에서, R1은 CONHCH3이다.
일부 구현예에서, R1은 CONHCH2CHF2이다.
일부 구현예에서, R1은 NH(CO)R5이고, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택된다.
일부 구현예에서, R1은 할로겐이다.
일부 구현예에서, R1은 염소이다.
일부 구현예에서, R1은 브로민이다.
일부 구현예에서, R1은 C1-C6 알킬티오이다.
일부 구현예에서, R1은 메틸티오이다.
일부 구현예에서, R1은 CONHC1-C6 알킬, 할로겐으로 치환된 CONHC1-C6 알킬, 할로겐, 또는 C1-C6 알킬티오이다.
일부 구현예에서, R1은 NH(CO)R5이고, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로 이루어진 군으로부터 선택된다.
일부 구현예에서, R1은 벤조[d][1,3]디옥솔-5-일, 메틸카바모일, 수소, 2-클로로벤즈아미도, 3-(트리플루오로메톡시)페닐, 벤질, 2-메톡시에틸, 펜틸, 펜탄-2-일, 에틸, 이소프로필, 부틸, 프로필, 이소부틸, 3-플루오로벤질, 2-플루오로벤질, 메틸, 이소펜틸, 메톡시메틸, 사이클로헥실메틸, 네오펜틸, 사이클로부틸(하이드록시)메틸, (에톡시카보닐)아미노, 2-페닐아세트아미도, 부티르아미도, 티오펜-2-일, 사이클로헥실, 4-플루오로벤질, 피롤리딘-1-카복스아미도, (테트라하이드로-2H-피란-2-일)메틸, ((테트라하이드로-2H-피란-4-일)메톡시)메틸, 2-(트리플루오로메틸)페닐, 4-메톡시페닐, 브로모, 사이클로부틸메틸, 2,3-디플루오로벤즈아미도, 벤즈아미도, (2,2-디플루오로에틸)카바모일, 사이클로프로판카복스아미도, 2-시아노에틸, 피리딘-2-일메틸, 부트-2-엔-1-일, 이소프로폭시메틸, 5-클로로피리딘-2-일, 사이클로펜틸, 사이클로부틸, 클로로, 사이클로프로필, 3,3,3-트리플루오로프로필, 펜에틸, 및 사이클로펜틸메틸로 이루어진 군으로부터 선택된다.
기 X
2
일부 구현예에서, X2는 N 또는 CR2이다.
일부 구현예에서, X2는 N이다.
일부 구현예에서, X2는 CR2이다.
기 R
2
일부 구현예에서, R2는 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로 알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c)
C2-C6 알케닐;
d)
C3-C8 사이클로알킬;
e)
할로겐으로 선택적으로 치환된 5- 내지 10-원 헤테로아릴;
f)
할로겐, 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴,
여기서, C6-C10 아릴은 헤테로환 고리와 선택적으로 융합됨;
g)
할로겐으로 선택적으로 치환된 CONHC1-C6 알킬;
h)
NH(CO)R5이고, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택됨;
i)
할로겐; 및
j)
C1-C6 알킬티오.
일부 구현예에서, R2는 수소, C1-C6 알킬, C6-C10 아릴로 치환된 C1-C6 알킬, C1-C6 알콕시로 치환된 C1-C6 알킬, C3-C8 사이클로알킬로 치환된 C1-C6 알킬, 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알킬, C3-C8 사이클로알킬, 할로겐, 또는 C1-C6 알킬티오로 이루어진 군으로부터 선택된다.
일부 구현예에서, R2는 수소, 프로필, 벤질, 2-시아노에틸, 이소프로폭시메틸, 사이클로헥실메틸, (테트라하이드로-2H-피란-2-일)메틸, 사이클로부틸, 클로로, 및 사이클로펜틸메틸로 이루어진 군으로부터 선택된다.
일부 구현예에서, R2는 수소이다.
일부 구현예에서, R2는 C1-C6 알킬이다.
일부 구현예에서, R2는 C6-C10 아릴로 치환된 C1-C6 알킬이다.
일부 구현예에서, R2는 n-프로필이다.
일부 구현예에서, R2는 벤질이다.
일부 구현예에서, R2는 CN으로 치환된 C1-C6 알킬이다.
일부 구현예에서, R2는 C1-C6 알콕시로 치환된 C1-C6 알킬이다.
일부 구현예에서, R2는 이소프로폭시메틸이다.
일부 구현예에서, R2는 C3-C8 사이클로알킬로 치환된 C1-C6 알킬이다.
일부 구현예에서, R2는 사이클로헥실이다.
일부 구현예에서, R2는 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알킬이다.
일부 구현예에서, R2는 (테트라하이드로-2H-피란-2-일)메틸이다.
일부 구현예에서, R2는 C3-C8 사이클로알킬이다.
일부 구현예에서, R2는 사이클로부틸이다.
일부 구현예에서, R2는 할로겐이다.
일부 구현예에서, R2는 염소이다.
일부 구현예에서, R2는 C1-C6 알킬티오이다.
일부 구현예에서, R2는 메틸티오이다.
기 X
3
일부 구현예에서, X3은 N 또는 CR3이다.
일부 구현예에서, X3은 N이다.
일부 구현예에서, X3은 CR3이다.
기 R
3
일부 구현예에서, R3은 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c)
C2-C6 알케닐;
d)
C3-C8 사이클로알킬;
e)
할로겐으로 선택적으로 치환된 5- 내지 10-원 헤테로아릴;
f)
할로겐, 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴,
여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합됨;
g)
할로겐으로 선택적으로 치환된 CONHC1-C6 알킬;
h)
NH(CO)R5, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택됨;
i)
할로겐; 및
j)
C1-C6 알킬티오.
일부 구현예에서, R3은 수소 또는 C1-C6 알킬티오이다.
일부 구현예에서, R3은 수소 및 메틸티오로 이루어진 군으로부터 선택된다.
일부 구현예에서, R3은 수소이다.
일부 구현예에서, R3은 C1-C6 알킬이다.
일부 구현예에서, R3은 C6-C10 아릴로 치환된 C1-C6 알킬이다.
일부 구현예에서, R3은 n-프로필이다.
일부 구현예에서, R3은 벤질이다.
일부 구현예에서, R3은 C1-C6 알킬티오이다.
일부 구현예에서, R3은 메틸티오이다.
기 X
4
일부 구현예에서, X4는 N 또는 CR4이다.
일부 구현예에서, X4는 N이다.
일부 구현예에서, X4는 CR4이다.
기 R
4
일부 구현예에서, R4는 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c)
C2-C6 알케닐;
d)
C3-C8 사이클로알킬;
e)
할로겐으로 선택적으로 치환된 5- 내지 10-원 헤테로아릴;
f)
할로겐, 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴,
여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합됨;
g)
할로겐으로 선택적으로 치환된 CONHC1-C6 알킬;
h)
NH(CO)R5, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택됨;
i)
할로겐; 및
j)
C1-C6 알킬티오.
일부 구현예에서, R4는 수소이다.
일부 구현예에서, R4는 C1-C6 알킬이다.
일부 구현예에서, R4는 C6-C10 아릴로 치환된 C1-C6 알킬이다.
일부 구현예에서, R4는 n-프로필이다.
일부 구현예에서, R4는 벤질이다.
일부 구현예에서, R4는 C1-C6 알킬티오이다.
일부 구현예에서, R4는 티오메틸이다.
기 R
5
일부 구체예에서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택된다.
일부 구체예에서, R5는 C1-C6 알콕시이다.
일부 구체예에서, R5는 C1-C6 알킬이다.
일부 구체예에서, R5는 C6-C10 아릴로 치환된 C1-C6 알킬이다.
일부 구체예에서, R5는 C6-C10 아릴이다.
일부 구체예에서, R5는 할로겐으로 치환된 C6-C10 아릴이다.
일부 구체예에서, R5는 3- 내지 8-원 헤테로사이클로알킬이다.
일부 구체예에서, R5는C3-C8 사이클로알킬이다.
일부 구체예에서, R5는 에톡시이다.
일부 구체예에서, R5는 n-프로필이다.
일부 구체예에서, R5는 벤질이다.
일부 구체예에서, R5는 페닐이다.
일부 구체예에서, R5는 2-클로로페닐이다.
일부 구체예에서, R5는 2,3-디플루오로페닐이다.
일부 구체예에서, R5는 피롤리디닐이다.
일부 구체예에서, R5는 사이클로프로필이다.
기 R
6
일부 구현예에서, R6은 수소 및 C1-C6 알킬로부터 선택된다.
일부 구현예에서, R6은 수소 및 메틸로 이루어진 군으로부터 선택된다.
일부 구현예에서, R6은 수소이다.
일부 구현예에서, R6은 C1-C6 알킬이다.
일부 구현예에서, R6은 메틸이다.
기 R
7
일부 구현예에서, R7은 수소, 및 C1-C6 알킬로부터 선택된다.
일부 구현예에서, R7은 수소이다.
일부 구현예에서, R7은 C1-C6 알킬이다.
일부 구현예에서, R7은 메틸이다.
기 R
8
일부 구현예에서, R8은 수소 및 C1-C6 알킬로부터 선택된다.
일부 구현예에서, R8은 수소이다.
일부 구현예에서, R8은 C1-C6 알킬이다.
일부 구현예에서, R8은 메틸이다.
기 R
9
일부 구현예에서, R9는 수소이다.
일부 구현예에서, R9는 C1-C6 알킬이다.
일부 구현예에서, R9는 수소 및 메틸로 이루어진 군으로부터 선택된다.
일부 구현예에서, R9는 메틸이다.
화학식 A의 구현예
일부 구현예에서, R1은 벤조[d][1,3]디옥솔-5-일, 메틸카바모일, 수소, 2-클로로벤즈아미도, 3-(트리플루오로메톡시)페닐, 벤질, 2-메톡시에틸, 펜틸, 펜탄-2-일, 에틸, 이소프로필, 부틸, 프로필, 이소부틸, 3-플루오로벤질, 2-플루오로벤질, 메틸, 이소펜틸, 메톡시메틸, 사이클로헥실메틸, 네오펜틸, 사이클로부틸(하이드록시)메틸, (에톡시카보닐)아미노, 2-페닐아세트아미도, 부티르아미도, 티오펜-2-일, 사이클로헥실, 4-플루오로벤질, 피롤리딘-1-카복스아미도, (테트라하이드로-2H-피란-2-일)메틸, ((테트라하이드로-2H-피란-4-일)메톡시)메틸, 2-(트리플루오로메틸)페닐, 4-메톡시페닐, 브로모, 사이클로부틸메틸, 2,3-디플루오로벤즈아미도, 벤즈아미도, (2,2-디플루오로에틸)카바모일, 사이클로프로판카복스아미도, 2-시아노에틸, 피리딘-2-일메틸, 부트-2-엔-1-일, 이소프로폭시메틸, 5-클로로피리딘-2-일, 사이클로펜틸, 사이클로부틸, 클로로, 사이클로프로필, 3,3,3-트리플루오로프로필, 펜에틸, 및 사이클로펜틸메틸로 이루어진 군으로부터 선택되며;
X2는 N이거나, X2는 CR2이고 R2는 수소, 프로필, 벤질, 2-시아노에틸, 이소프로폭시메틸, 사이클로헥실메틸, (테트라하이드로-2H-피란-2-일)메틸, 사이클로부틸, 클로로, 및 사이클로펜틸메틸로 이루어진 군으로부터 선택되고;
X3은 N이거나, X3은 CR3이고 R3은 수소 및 메틸티오로 이루어진 군으로부터 선택되고;
X4는 N이거나, X4는 CR4이고 R4는 수소이고;
R6은 수소 및 메틸로 이루어진 군으로부터 선택되고;
R9는 수소 및 메틸로 이루어진 군으로부터 선택된다.
일부 구현예에서, 화학식 A의 화합물은 화학식 Ia의 화합물 및 이의 약학적으로 허용되는 염, 용매화물 및 수화물로부터 선택된다:
화학식 Ia
여기서
n은 1 또는 2이고;
R1은 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c)
C2-C6 알케닐;
d)
C3-C8 사이클로알킬;
e)
할로겐으로 선택적으로 치환된 5- 내지 10-원 헤테로아릴;
f)
할로겐, 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴,
여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합됨;
g)
할로겐으로 선택적으로 치환된 CONHC1-C6 알킬;
h)
NH(CO)R5, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택됨;
i)
할로겐; 및
j)
C1-C6 알킬티오;
그리고,
R2는 수소 및 선택적으로 C6-C10 아릴로 치환된 C1-C6 알킬로부터 선택된다.
화학식 Ia의 일부 구현예에서, n은 1이다.
화학식 Ia의 일부 구현예에서, n은 2이다.
화학식 Ia의 일부 구현예에서, R1은 수소이다.
화학식 Ia의 일부 구현예에서, R1은 C1-C6 알킬이다.
화학식 Ia의 일부 구현예에서, R1은 C6-C10 아릴로 치환된 C1-C6 알킬이다.
화학식 Ia의 일부 구현예에서, R1은 할로겐으로 치환된 C6-C10아릴로 치환된 C1-C6 알킬이다.
화학식 Ia의 일부 구현예에서, R1은 C1-C6 알콕시로 치환된 C1-C6 알킬이다.
화학식 Ia의 일부 구현예에서, R1은 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알콕시로 치환된 C1-C6 알킬이다.
화학식 Ia의 일부 구현예에서, R1은 C3-C8 사이클로알킬로 치환된 C1-C6 알킬이다.
화학식 Ia의 일부 구현예에서, R1은 OH로 치환된 C1-C6 알킬이다.
화학식 Ia의 일부 구현예에서, R1은 CN로 치환된 C1-C6 알킬이다.
화학식 Ia의 일부 구현예에서, R1은 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알킬이다.
화학식 Ia의 일부 구현예에서, R1은 5- 내지 10-원 헤테로아릴로로 치환된 C1-C6 알킬이다.
화학식 Ia의 일부 구현예에서, R1은 할로겐으로 치환된 C1-C6 알킬이다.
화학식 Ia의 일부 구현예에서, R1은 n-펜틸이다.
화학식 Ia의 일부 구현예에서, R1은 펜탄-2-일이다.
화학식 Ia의 일부 구현예에서, R1은 에틸이다.
화학식 Ia의 일부 구현예에서, R1은 i-프로필이다.
화학식 Ia의 일부 구현예에서, R1은 n-부틸이다.
화학식 Ia의 일부 구현예에서, R1은 n-프로필이다.
화학식 Ia의 일부 구현예에서, R1은 i-부틸이다.
화학식 Ia의 일부 구현예에서, R1은 메틸이다.
화학식 Ia의 일부 구현예에서, R1은 이소펜틸이다.
화학식 Ia의 일부 구현예에서, R1은 t-부틸이다.
화학식 Ia의 일부 구현예에서, R1은 네오펜틸이다.
화학식 Ia의 일부 구현예에서, R1은 벤질이다.
화학식 Ia의 일부 구현예에서, R1은 할로겐으로 치환된 벤질이다.
화학식 Ia의 일부 구현예에서, R1은 불소로 치환된 벤질이다.
화학식 Ia의 일부 구현예에서, R1은 2-플루오로벤질이다.
화학식 Ia의 일부 구현예에서, R1은 3-플루오로벤질이다.
화학식 Ia의 일부 구현예에서, R1은 4-플루오로벤질이다.
화학식 Ia의 일부 구현예에서, R1은 펜에틸이다.
화학식 Ia의 일부 구현예에서, R1은 메톡시에틸이다.
화학식 Ia의 일부 구현예에서, R1은 메톡시메틸이다.
화학식 Ia의 일부 구현예에서, R1은 이소프로폭시메틸이다.
화학식 Ia의 일부 구현예에서, R1은((테트라하이드로-2H-피란-4-일)메톡시)메틸이다.
화학식 Ia의 일부 구현예에서, R1은 사이클로헥실메틸이다.
화학식 Ia의 일부 구현예에서, R1은 사이클로부틸메틸이다.
화학식 Ia의 일부 구현예에서, R1은 사이클로부틸(하이드록시)메틸이다.
화학식 Ia의 일부 구현예에서, R1은 하이드록시메틸이다.
화학식 Ia의 일부 구현예에서, R1은 3-하이드록시프로필이다.
화학식 Ia의 일부 구현예에서, R1은 2-시아노에틸이다.
화학식 Ia의 일부 구현예에서, R1은(테트라하이드로-2H-피란-2-일)메틸이다.
화학식 Ia의 일부 구현예에서, R1은 피리딘-2-일메틸이다.
화학식 Ia의 일부 구현예에서, R1은 3,3,3-트리플루오로프로필이다.
화학식 Ia의 일부 구현예에서, R1은 C2-C6 알케닐이다.
화학식 Ia의 일부 구현예에서, R1은 (E)-부트-2-엔-1-일이다.
화학식 Ia의 일부 구현예에서, R1은 C3-C8 사이클로알킬이다.
화학식 Ia의 일부 구현예에서, R1은 사이클로헥실이다.
화학식 Ia의 일부 구현예에서, R1은 사이클로펜틸이다.
화학식 Ia의 일부 구현예에서, R1은 사이클로부틸이다.
화학식 Ia의 일부 구현예에서, R1은 사이클로프로필이다.
화학식 Ia의 일부 구현예에서, R1은 5- 내지 10-원 헤테로아릴이다.
화학식 Ia의 일부 구현예에서, R1은 할로겐으로 치환된 5- 내지 10-원 헤테로아릴이다.
화학식 Ia의 일부 구현예에서, R1은 티오펜-2-일이다.
화학식 Ia의 일부 구현예에서, R1은 피리딘-2-일이다.
화학식 Ia의 일부 구현예에서, R1은 5-클로로피리딘-2-일이다.
화학식 Ia의 일부 구현예에서, R1은 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴이고, 여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합된다.
화학식 Ia의 일부 구현예에서, R1은 페닐이다.
화학식 Ia의 일부 구현예에서, R1은 4-메톡시페닐이다.
화학식 Ia의 일부 구현예에서, R1은 3-트리플루오로메톡시페닐이다.
화학식 Ia의 일부 구현예에서, R1은 2-트리플루오로메톡실페닐이다.
화학식 Ia의 일부 구현예에서, R1은 2-클로로페닐이다.
화학식 Ia의 일부 구현예에서, R1은 2-플루오로페닐이다.
화학식 Ia의 일부 구현예에서, R1은 3-플루오로페닐이다.
화학식 Ia의 일부 구현예에서, R1은 2,3-디플루오로페닐이다.
화학식 Ia의 일부 구현예에서, R1은 벤조[d][1,3]디옥솔-5-일이다.
화학식 Ia의 일부 구현예에서, R1은 CONHC1-C6 알킬이다.
화학식 Ia의 일부 구현예에서, R1은 할로겐으로 치환된 CONHC1-C6 알킬이다.
화학식 Ia의 일부 구현예에서, R1은 CONHCH3이다.
화학식 Ia의 일부 구현예에서, R1은 CONHCH2CHF2이다.
화학식 Ia의 일부 구현예에서, R1은 NH(CO)R5이고, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택된다.
화학식 Ia의 일부 구현예에서, R1은 할로겐이다.
화학식 Ia의 일부 구현예에서, R1은 염소이다.
화학식 Ia의 일부 구현예에서, R1은 브로민이다.
화학식 Ia의 일부 구현예에서, R1은 C1-C6 알킬티오이다.
화학식 Ia의 일부 구현예에서, R1은 메틸티오이다.
화학식 Ia의 일부 구현예에서, R5는 에톡시이다.
화학식 Ia의 일부 구현예에서, R5는 n-프로필이다.
화학식 Ia의 일부 구현예에서, R5는 벤질이다.
화학식 Ia의 일부 구현예에서, R5는 페닐이다.
화학식 Ia의 일부 구현예에서, R5는 2-클로로페닐이다.
화학식 Ia의 일부 구현예에서, R5는 2,3-디플루오로페닐이다.
화학식 Ia의 일부 구현예에서, R5는 피롤리디닐이다.
화학식 Ia의 일부 구현예에서, R5는 사이클로프로필이다.
화학식 Ia의 일부 구현예에서, R2는 수소이다.
화학식 Ia의 일부 구현예에서, R2는 n-프로필이다.
화학식 Ia의 일부 구현예에서, R2는 벤질이다.
일부 구현예에서, 화학식 Ia의 화합물은 화학식 Ia-i의 화합물 및 이의 약학적으로 허용되는 염, 용매화물 및 수화물로부터 선택된다:
화학식 Ia-i
일부 구현예에서, 화학식 Ia의 화합물은 화학식 Ia-ii의 화합물 및 이의 약학적으로 허용되는 염, 용매화물 및 수화물로부터 선택된다:
화학식 Ia-ii
화학식 Ia, Ia-i 또는 Ia-ii의 일부 구현예에서, R1은 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴;
및
할로겐;
c)
C3-C8 사이클로알킬; 및
d)
할로겐;
그리고,
R2는 수소이다.
일부 구현예에서, 화학식 A의 화합물은 화학식 IIa의 화합물 및 이의 약학적으로 허용되는 염, 용매화물 및 수화물로부터 선택된다:
화학식 IIa
여기서,
n은 1 또는 2이고;
R1은 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c)
C2-C6 알케닐;
d)
C3-C8 사이클로알킬;
e)
할로겐으로 선택적으로 치환된 5- 내지 10-원 헤테로아릴;
f)
할로겐, 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴,
여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합됨;
g)
할로겐으로 선택적으로 치환된 CONHC1-C6 알킬;
h)
NH(CO)R5, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택됨;
i)
할로겐; 및
j)
C1-C6 알킬티오.
화학식 IIa의 일부 구현예에서, n은 1이다.
화학식 IIa의 일부 구현예에서, n은 2이다.
화학식 IIa의 일부 구현예에서, R1은 수소이다.
화학식 IIa의 일부 구현예에서, R1은 C1-C6 알킬이다.
화학식 IIa의 일부 구현예에서, R1은 C6-C10 아릴로 치환된 C1-C6 알킬이다.
화학식 IIa의 일부 구현예에서, R1은 할로겐으로 치환된 C6-C10아릴로 치환된 C1-C6 알킬이다.
화학식 IIa의 일부 구현예에서, R1은 C1-C6 알콕시로 치환된 C1-C6 알킬이다.
화학식 IIa의 일부 구현예에서, R1은 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알콕시로 치환된 C1-C6 알킬이다.
화학식 IIa의 일부 구현예에서, R1은 C3-C8 사이클로알킬로 치환된 C1-C6 알킬이다.
화학식 IIa의 일부 구현예에서, R1은 OH로 치환된 C1-C6 알킬이다.
화학식 IIa의 일부 구현예에서, R1은 CN으로 치환된 C1-C6 알킬이다.
화학식 IIa의 일부 구현예에서, R1은 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알킬이다.
화학식 IIa의 일부 구현예에서, R1은 5- 내지 10-원 헤테로아릴로로 치환된 C1-C6 알킬이다.
화학식 IIa의 일부 구현예에서, R1은 할로겐으로 치환된 C1-C6 알킬이다.
화학식 IIa의 일부 구현예에서, R1은 n-펜틸이다.
화학식 IIa의 일부 구현예에서, R1은 펜탄-2-일이다.
화학식 IIa의 일부 구현예에서, R1은 에틸이다.
화학식 IIa의 일부 구현예에서, R1은 i-프로필이다.
화학식 IIa의 일부 구현예에서, R1은 n-부틸이다.
화학식 IIa의 일부 구현예에서, R1은 n-프로필이다.
화학식 IIa의 일부 구현예에서, R1은 i-부틸이다.
화학식 IIa의 일부 구현예에서, R1은 메틸이다.
화학식 IIa의 일부 구현예에서, R1은 이소펜틸이다.
화학식 IIa의 일부 구현예에서, R1은 t-부틸이다.
화학식 IIa의 일부 구현예에서, R1은 네오펜틸이다.
화학식 IIa의 일부 구현예에서, R1은 벤질이다.
화학식 IIa의 일부 구현예에서, R1은 할로겐으로 치환된 벤질이다.
화학식 IIa의 일부 구현예에서, R1은 불소로 치환된 벤질이다.
화학식 IIa의 일부 구현예에서, R1은 2-플루오로벤질이다.
화학식 IIa의 일부 구현예에서, R1은 3-플루오로벤질이다.
화학식 IIa의 일부 구현예에서, R1은 4-플루오로벤질이다.
화학식 IIa의 일부 구현예에서, R1은 펜에틸이다.
화학식 IIa의 일부 구현예에서, R1은 메톡시에틸이다.
화학식 IIa의 일부 구현예에서, R1은 메톡시메틸이다.
화학식 IIa의 일부 구현예에서, R1은 이소프로폭시메틸이다.
화학식 IIa의 일부 구현예에서, R1은 ((테트라하이드로-2H-피란-4-일)메톡시)메틸이다.
화학식 IIa의 일부 구현예에서, R1은 사이클로헥실메틸이다.
화학식 IIa의 일부 구현예에서, R1은 사이클로부틸메틸이다.
화학식 IIa의 일부 구현예에서, R1은 사이클로부틸(하이드록시)메틸이다.
화학식 IIa의 일부 구현예에서, R1은 하이드록시메틸이다.
화학식 IIa의 일부 구현예에서, R1은 3-하이드록시프로필이다.
화학식 IIa의 일부 구현예에서, R1은 2-시아노에틸이다.
화학식 IIa의 일부 구현예에서, R1은 R1은 (테트라하이드로-2H-피란-2-일)메틸이다.
화학식 IIa의 일부 구현예에서, R1은 피리딘-2-일메틸이다.
화학식 IIa의 일부 구현예에서, R1은 3,3,3-트리플루오로프로필이다.
화학식 IIa의 일부 구현예에서, R1은 C2-C6 알케닐이다.
화학식 IIa의 일부 구현예에서, R1은 (E)-부트-2-엔-1-일이다.
화학식 IIa의 일부 구현예에서, R1은 C3-C8 사이클로알킬이다.
화학식 IIa의 일부 구현예에서, R1은 사이클로헥실이다.
화학식 IIa의 일부 구현예에서, R1은 사이클로펜틸이다.
화학식 IIa의 일부 구현예에서, R1은 사이클로부틸이다.
화학식 IIa의 일부 구현예에서, R1은 사이클로프로필이다.
화학식 IIa의 일부 구현예에서, R1은 5- 내지 10-원 헤테로아릴이다.
화학식 IIa의 일부 구현예에서, R1은 할로겐으로 치환된 5- 내지 10-원 헤테로아릴이다.
화학식 IIa의 일부 구현예에서, R1은 티오펜-2-일이다.
화학식 IIa의 일부 구현예에서, R1은 피리딘-2-일이다.
화학식 IIa의 일부 구현예에서, R1은 5-클로로피리딘-2-일이다.
화학식 IIa의 일부 구현예에서, R1은 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴이고, 여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합된다.
화학식 IIa의 일부 구현예에서, R1은 페닐이다.
화학식 IIa의 일부 구현예에서, R1은 4-메톡시페닐이다.
화학식 IIa의 일부 구현예에서, R1은 3-트리플루오로메톡시페닐이다.
화학식 IIa의 일부 구현예에서, R1은 2-트리플루오로메틸페닐이다.
화학식 IIa의 일부 구현예에서, R1은 2-클로로페닐이다.
화학식 IIa의 일부 구현예에서, R1은 2-플루오로페닐이다.
화학식 IIa의 일부 구현예에서, R1은 3-플루오로페닐이다.
화학식 IIa의 일부 구현예에서, R1은 2,3-디플루오로페닐이다.
화학식 IIa의 일부 구현예에서, R1은 벤조[d][1,3]디옥솔-5-일이다.
화학식 IIa의 일부 구현예에서, R1은 CONHC1-C6 알킬이다.
화학식 IIa의 일부 구현예에서, R1은 할로겐으로 치환된 CONHC1-C6 알킬이다.
화학식 IIa의 일부 구현예에서, R1은 CONHCH3이다.
화학식 IIa의 일부 구현예에서, R1은 CONHCH2CHF2이다.
화학식 IIa의 일부 구현예에서, R1은 NH(CO)R5이고, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택된다.
화학식 IIa의 일부 구현예에서, R1은 할로겐이다.
화학식 IIa의 일부 구현예에서, R1은 염소이다.
화학식 IIa의 일부 구현예에서, R1은 브로민이다.
화학식 IIa의 일부 구현예에서, R1은 C1-C6 알킬티오이다.
화학식 IIa의 일부 구현예에서, R1은 메틸티오이다.
화학식 IIa의 일부 구현예에서, R5는 에톡시이다.
화학식 IIa의 일부 구현예에서, R5는 n-프로필이다.
화학식 IIa의 일부 구현예에서, R5는 벤질이다.
화학식 IIa의 일부 구현예에서, R5는 페닐이다.
화학식 IIa의 일부 구현예에서, R5는 2-클로로페닐이다.
화학식 IIa의 일부 구현예에서, R5는 2,3-디플루오로페닐이다.
화학식 IIa의 일부 구현예에서, R5는 피롤리디닐이다.
화학식 IIa의 일부 구현예에서, R5는 사이클로프로필이다.
일부 구현예에서, 화학식 IIa의 화합물은 화학식 IIa-i의 화합물 및 이의 약학적으로 허용되는 염, 용매화물 및 수화물로부터 선택된다:
화학식 IIa-i
일부 구현예에서, 화학식 IIa의 화합물은 화학식 IIa-ii의 화합물 및 이의 약학적으로 허용되는 염, 용매화물 및 수화물로부터 선택된다:
화학식 IIa-ii
화학식 Ia, IIa-i 또는 IIa-ii의 일부 구현예에서, R1은 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴;
및
할로겐;
c)
C3-C8 사이클로알킬; 및
d)
할로겐.
일부 구현예에서, 화학식 A의 화합물은 화학식 IIIa의 화합물 및 이의 약학적으로 허용되는 염, 용매화물 및 수화물로부터 선택된다:
화학식 IIIa
여기서,
n은 1 또는 2이고;
R1은 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c)
C2-C6 알케닐;
d)
C3-C8 사이클로알킬;
e)
할로겐으로 선택적으로 치환된 5- 내지 10-원 헤테로아릴;
f)
할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴,
여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합됨;
g)
할로겐으로 선택적으로 치환된 CONHC1-C6 알킬;
h)
NH(CO)R5, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택됨;
i)
할로겐; 및
j)
C1-C6 알킬티오.
화학식 IIIa의 일부 구현예에서, n은 1이다.
화학식 IIIa의 일부 구현예에서, n은 2이다.
화학식 IIIa의 일부 구현예에서, R1은 수소이다.
화학식 IIIa의 일부 구현예에서, R1은 C1-C6 알킬이다.
화학식 IIIa의 일부 구현예에서, R1은 C6-C10 아릴로 치환된 C1-C6 알킬이다.
화학식 IIIa의 일부 구현예에서, R1은 할로겐으로 치환된 C6-C10아릴로 치환된 C1-C6 알킬이다.
화학식 IIIa의 일부 구현예에서, R1은 C1-C6 아릴로 치환된 C1-C6 알킬이다.
화학식 IIIa의 일부 구현예에서, R1은 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알콕시로 치환된 C1-C6 알킬이다.
화학식 IIIa의 일부 구현예에서, R1은 C3-C8 사이클로알킬로 치환된 C1-C6 알킬이다.
화학식 IIIa의 일부 구현예에서, R1은 OH로 치환된 C1-C6 알킬이다.
화학식 IIIa의 일부 구현예에서, R1은 CN으로 치환된 C1-C6 알킬이다.
화학식 IIIa의 일부 구현예에서, R1은 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알킬이다.
화학식 IIIa의 일부 구현예에서, R1은 5- 내지 10-원 헤테로아릴로로 치환된 C1-C6 알킬이다.
화학식 IIIa의 일부 구현예에서, R1은 할로겐으로 치환된 C1-C6 알킬이다.
화학식 IIIa의 일부 구현예에서, R1은 n-펜틸이다.
화학식 IIIa의 일부 구현예에서, R1은 펜탄-2-일이다.
화학식 IIIa의 일부 구현예에서, R1은 에틸이다.
화학식 IIIa의 일부 구현예에서, R1은 i-프로필이다.
화학식 IIIa의 일부 구현예에서, R1은 n-부틸이다.
화학식 IIIa의 일부 구현예에서, R1은 n-프로필이다.
화학식 IIIa의 일부 구현예에서, R1은 i-부틸이다.
화학식 IIIa의 일부 구현예에서, R1은 메틸이다.
화학식 IIIa의 일부 구현예에서, R1은 이소펜틸이다.
화학식 IIIa의 일부 구현예에서, R1은 t-부틸이다.
화학식 IIIa의 일부 구현예에서, R1은 네오펜틸이다.
화학식 IIIa의 일부 구현예에서, R1은 벤질이다.
화학식 IIIa의 일부 구현예에서, R1은 할로겐으로 치환된 벤질이다.
화학식 IIIa의 일부 구현예에서, R1은 불소로 치환된 벤질이다.
화학식 IIIa의 일부 구현예에서, R1은 2-플루오로벤질이다.
화학식 IIIa의 일부 구현예에서, R1은 3-플루오로벤질이다.
화학식 IIIa의 일부 구현예에서, R1은 4-플루오로벤질이다.
화학식 IIIa의 일부 구현예에서, R1은 펜에틸이다.
화학식 IIIa의 일부 구현예에서, R1은 메톡시에틸이다.
화학식 IIIa의 일부 구현예에서, R1은 메톡시메틸이다.
화학식 IIIa의 일부 구현예에서, R1은 이소프로폭시메틸이다.
화학식 IIIa의 일부 구현예에서, R1은((테트라하이드로-2H-피란-4-일)메톡시)메틸이다.
화학식 IIIa의 일부 구현예에서, R1은 사이클로헥실메틸이다.
화학식 IIIa의 일부 구현예에서, R1은 사이클로부틸메틸이다.
화학식 IIIa의 일부 구현예에서, R1은 사이클로부틸(하이드록시)메틸이다.
화학식 IIIa의 일부 구현예에서, R1은 하이드록시메틸이다.
화학식 IIIa의 일부 구현예에서, R1은 3-하이드록시프로필이다.
화학식 IIIa의 일부 구현예에서, R1은 2-시아노에틸이다.
화학식 IIIa의 일부 구현예에서, R1은(테트라하이드로-2H-피란-2-일)메틸이다.
화학식 IIIa의 일부 구현예에서, R1은 피리딘-2-일메틸이다.
화학식 IIIa의 일부 구현예에서, R1은 3,3,3-트리플루오로프로필이다.
화학식 IIIa의 일부 구현예에서, R1은 C2-C6 알케닐이다.
화학식 IIIa의 일부 구현예에서, R1은 (E)-부트-2-엔-1-일이다.
화학식 IIIa의 일부 구현예에서, R1은 C3-C8 사이클로알킬이다.
화학식 IIIa의 일부 구현예에서, R1은 사이클로헥실이다.
화학식 IIIa의 일부 구현예에서, R1은 사이클로펜틸이다.
화학식 IIIa의 일부 구현예에서, R1은 사이클로부틸이다.
화학식 IIIa의 일부 구현예에서, R1은 사이클로프로필이다.
화학식 IIIa의 일부 구현예에서, R1은 5- 내지 10-원 헤테로아릴이다.
화학식 IIIa의 일부 구현예에서, R1은 할로겐으로 치환된 5- 내지 10-원 헤테로아릴이다.
화학식 IIIa의 일부 구현예에서, R1은 티오펜-2-일이다.
화학식 IIIa의 일부 구현예에서, R1은 피리딘-2-일이다.
화학식 IIIa의 일부 구현예에서, R1은 5-클로로피리딘-2-일이다.
화학식 IIIa의 일부 구현예에서, R1은 할로겐, 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴이고, 여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합된다.
화학식 IIIa의 일부 구현예에서, R1은 페닐이다.
화학식 IIIa의 일부 구현예에서, R1은 4-메톡시페닐이다.
화학식 IIIa의 일부 구현예에서, R1은 3-트리플루오로메톡시페닐이다.
화학식 IIIa의 일부 구현예에서, R1은 2-트리플루오로메틸페닐이다.
화학식 IIIa의 일부 구현예에서, R1은 2-클로로페닐이다.
화학식 IIIa의 일부 구현예에서, R1은 2-플루오로페닐이다.
화학식 IIIa의 일부 구현예에서, R1은 3-플루오로페닐이다.
화학식 IIIa의 일부 구현예에서, R1은 2,3-디플루오로페닐이다.
화학식 IIIa의 일부 구현예에서, R1은 벤조[d][1,3]디옥솔-5-일이다.
화학식 IIIa의 일부 구현예에서, R1은 CONHC1-C6 알킬이다.
화학식 IIIa의 일부 구현예에서, R1은 할로겐으로 치환된 CONHC1-C6 알킬이다.
화학식 IIIa의 일부 구현예에서, R1은 CONHCH3이다.
화학식 IIIa의 일부 구현예에서, R1은 CONHCH2CHF2이다.
화학식 IIIa의 일부 구현예에서, R1은 NH(CO)R5이고, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택된다.
화학식 IIIa의 일부 구현예에서, R1은 할로겐이다.
화학식 IIIa의 일부 구현예에서, R1은 염소이다.
화학식 IIIa의 일부 구현예에서, R1은 브로민이다.
화학식 IIIa의 일부 구현예에서, R1은 C1-C6 알킬티오이다.
화학식 IIIa의 일부 구현예에서, R1은 메틸티오이다.
화학식 IIIa의 일부 구현예에서, R5는 에톡시이다.
화학식 IIIa의 일부 구현예에서, R5는 n-프로필이다.
화학식 IIIa의 일부 구현예에서, R5는 벤질이다.
화학식 IIIa의 일부 구현예에서, R5는 페닐이다.
화학식 IIIa의 일부 구현예에서, R5는 2-클로로페닐이다.
화학식 IIIa의 일부 구현예에서, R5는 2,3-디플루오로페닐이다.
화학식 IIIa의 일부 구현예에서, R5는 피롤리디닐이다.
화학식 IIIa의 일부 구현예에서, R5는 사이클로프로필이다.
일부 구현예에서, 화학식 IIIa의 화합물은 화학식 IIIa-i의 화합물 및 이의 약학적으로 허용되는 염, 용매화물 및 수화물로부터 선택된다:
화학식 IIIa-i
일부 구현예에서, 화학식 IIIa의 화합물은 화학식 IIIa-ii의 화합물 및 이의 약학적으로 허용되는 염, 용매화물 및 수화물로부터 선택된다:
화학식 IIIa-ii
화학식 IIIa, IIIa-i 또는 IIIa-ii의 일부 구현예에서, R1은 다음으로부터 선택된다:
a)
수소;
b)
각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴;
및
할로겐;
c)
C3-C8 사이클로알킬; 및
d)
할로겐.
화학식 A의 일부 구현예는 표 A에 나타낸 하기 군으로부터 선택되는 하나 이상의 화합물 및 이의 약학적으로 허용되는 염, 용매화물, 및 수화물의 모든 조합물을 포함한다.
표
A
일부 구현예에서, 도 1 내지 8에 개시된 중간체가 제공되며, 여기서 도면의 변수는 본원에 기술된 것과 동일한 정의를 갖는다.
본원의 전반에 걸쳐 사용된 화학식 A, Ia, 또는 다른 화학식의 화합물은 예컨대, 본원의 도 1 내지 8의 합성 반응식에 기재된 바와 같이 제조될 수 있다. 이러한 방식은 예시적인 것으로서 제한하려는 것은 아니다. 통상의 기술자는 반응식이 관련 기술분야에 공지된 방법에서 변형되어 화학식 A 또는 I의 동일 또는 상이한 화합물에 도달할 수 있음을 용이하게 이해하고 인지할 수 있다.
추가적으로, 이의 이성질체, 부분입체 이성질체 및 거울상 이성질체를 포함한, 본원에 제공된 개별 화합물 및 화학 속은 이의 약학적으로 허용되는 염, 용매화물, 및 수화물을 포함한다. 또한, 본원에 제공된 개별 화합물 및 화학 속은 이의 모든 약학적으로 허용되는 염, 용매화물, 특히 수화물을 포함한다.
본원에 제공된 화합물은 관련 기술분야의 통상의 기술자에 의해 사용되는 관련된 공개 문헌의 절차에 따라 제조될 수 있다. 이들 반응에 대한 예시적인 시약 및 절차는 이후 작업 실시예에 나타나 있다. 보호 및 탈보호는 관련 기술분야에 일반적으로 공지된 절차에 의해 수행할 수 있다(예컨대, Greene, T. W. 및 Wuts, P. G. M. , Protecting Groups in Organic Synthesis, 3rd Edition, 1999 [Wiley] 참조).
본 발명은 마치 각각 개별적으로 각각의 키랄 탄소에 대한 구체적인 입체화학 표시로 개시되는 것처럼, 본원에 개시된 각각의 화합물 및 일반 화학식의 각각의 이성질체, 각각의 부분입체 이성질체, 각각의 거울상 이성질체 및 이의 혼합물을 포괄한다는 것을 알 수 있다. 개별 이성질체 및 거울상 이성질체의 분리(예컨대, 키랄 HPLC, 부분입체 이성질체 혼합물의 재결정질화 등에 의해) 또는 개별 이성질체의 선택적 합성(예컨대, 거울상 이성질체 선택적 합성 등에 의해)을 관련 기술분야의 통상의 기술자에게 널리 공지되어 있는 다양한 방법의 적용에 의해 완수할 수 있다. 일부 구현예에서, 본원에 개시된 화합물은 다른 입체이성질체가 실질적으로 없는 입체이성질체로서 존재할 수 있다. 본원에서 사용된 바와 같은 용어 "다른 입체이성질체가 실질적으로 없는"은 10% 미만의 다른 입체이성질체, 예컨대, 5% 미만의 다른 입체이성질체, 예컨대, 2% 미만의 다른 입체이성질체, 예컨대, 2% 미만의 다른 입체이성질체가 존재함을 의미한다.
또한, 요법에 의한 인간 또는 동물 신체의 치료 방법에서 사용하기 위한 화합물이 제공된다.
또한, 식품 섭취를 감소시키기 위한 방법에서 사용하기 위한 화합물이 제공된다.
또한, 포만감을 유도하기 위한 방법에서 사용하기 위한 화합물이 제공된다.
또한, 비만의 치료 또는 예방 방법에서 사용하기 위한 화합물이 또한 제공된다.
또한, 비만 치료 방법에 사용하기 위한 화합물이 제공된다.
또한, 비만 예방 방법에 사용하기 위한 화합물이 제공된다.
또한, 체중 관리에 사용하기 위한 화합물이 제공된다.
일부 구현예에서, 체중 관리는 외과적 체중 감소 절차를 추가로 포함한다.
일부 구현예에서, 체중 관리는 체중 감소를 포함한다.
일부 구현예에서, 체중 관리는 체중 감소의 유지를 포함한다.
일부 구현예에서, 체중 관리는 저칼로리 식이를 추가로 포함한다.
일부 구현예에서, 체중 관리는 규칙적인 운동 프로그램을 추가로 포함한다.
일부 구현예에서, 체중 관리는 저칼로리 식이 및 규칙적인 운동 프로그램 둘 다를 추가로 포함한다.
일부 구현예에서, 체중 관리를 필요로 하는 개체는 30 kg/m2 이상의 초기 체질량 지수를 가진 비만 환자이다.
일부 구현예에서, 체중 관리를 필요로 하는 개체는 적어도 하나의 체중 관련 동반이환 병태의 존재 하에 27 kg/m2 이상의 초기 체질량 지수를 가진 과체중 환자이다.
일부 구현예에서, 체중 관련 동반이환 병태는 고혈압, 이상지혈증, 심혈관 질환, 글루코스 불내성, 및 수면 무호흡으로부터 선택된다.
항정신병제-유발 체중 증가의 치료에서 사용하기 위한 화합물이 또한 제공된다.
제2형 당뇨병의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
1종 이상의 제2형 당뇨병 의약과 조합하여 제2형 당뇨병의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
일부 구현예에서, 1종 이상의 제2형 당뇨병 치료의 필요성이 감소된다.
일부 구현예에서, 1종 이상의 제2형 당뇨병 치료의 필요성이 제거된다.
제2형 당뇨병의 예방 방법에서 사용하기 위한 화합물이 또한 제공된다.
일부 구현예에서 다른 제2형 당뇨병 치료의 필요성이 감소된다.
일부 구현예에서 다른 제2형 당뇨병 치료의 필요성이 제거된다.
프레더-윌리 증후군의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
중독의 치료를 위한 화합물이 또한 제공된다.
약물 및 알콜 중독의 치료를 위한 화합물이 또한 제공된다.
알콜 중독의 치료를 위한 화합물이 또한 제공된다.
약물 중독의 치료를 위한 화합물이 또한 제공된다.
일부 구현예에서, 약물은 암페타민, 치환된 암페타민, 벤조디아제핀, 비정형 벤조디아제핀 수용체 리간드, 마리화나, 코카인, 덱스트로메토르판, GHB, LSD, 케타민, 모노아민 재흡수 억제제, 니코틴, 아편제, PCP, 치환된 펜에틸아민, 실로시빈, 및 합성 스테로이드로부터 선택된다.
일부 구현예에서, 약물은 니코틴이다.
일부 구현예에서, 약물은 암페타민이다.
일부 구현예에서, 약물은 치환된 암페타민이다.
일부 구현예에서, 약물은 메타암페타민이다.
일부 구현예에서, 약물은 벤조디아제핀이다.
일부 구현예에서, 약물은 비정형 벤조디아제핀 수용체 리간드이다.
일부 구현예에서, 약물은 마리화나이다.
일부 구현예에서, 약물은 코카인이다.
일부 구현예에서, 약물은 덱스트로메토르판이다.
일부 구현예에서, 약물은 GHB이다.
일부 구현예에서, 약물은 LSD이다.
일부 구현예에서, 약물은 케타민이다.
일부 구현예에서, 약물은 모노아민 재흡수 억제제이다.
일부 구현예에서, 약물은 아편제이다.
일부 구현예에서, 약물은 PCP이다.
일부 구현예에서, 약물은 치환된 펜에틸아민이다.
일부 구현예에서, 약물은 실로시빈이다.
일부 구현예에서, 약물은 합성 스테로이드이다.
흡연 중단을 보조하기 위한 화합물이 또한 제공된다.
담배 의존의 치료를 위한 화합물이 또한 제공된다.
니코틴 의존의 치료를 위한 화합물이 또한 제공된다.
알콜중독의 치료를 위한 화합물이 또한 제공된다.
병적 도박의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
보상 결핍 증후군의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
성 중독의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
강박 스펙트럼 장애의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
충동 조절 장애의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
손톱 물어뜯기의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
교조증의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
수면 장애의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
불면증의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
분절 수면 구조의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
서파 수면의 장애의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
요실금의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
정신 장애의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
정신분열증의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
신경성 식욕부진의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
신경성 폭식증의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
알츠하이머병의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
성 기능 장애의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
발기 부전의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
간질의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
운동 장애의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
파킨슨증의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
항정신병제-유발 운동 장애의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
고혈압의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
이상지혈증의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
비알콜성 지방간 질환의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
비만-관련 신장 질환의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
수면 무호흡의 치료 방법에서 사용하기 위한 화합물이 또한 제공된다.
적응증
체중 관리
FDA는 체중 감소를 위해, 적어도 하나의 체중-관련 의학적 상태(예를 들어, 고혈압, 높은 콜레스테롤, 또는 제2형 당뇨병)를 가진 비만(30 kg/m2 이상의 BMI), 또는 과체중(27 kg/m2 이상의 BMI)인 성인에서 만성 체중 관리를 위한 신체 활동 증가 및 저칼로리 식이와 함께 벨빅을 사용하는 것을 승인하였다(www. belviq. com).
일부 구현예에서, 체중 관리를 필요로 하는 개체는 과체중인 개체이다. 일부 구현예에서, 체중 관리를 필요로 하는 개체는 과도한 내장 지방을 갖는 개체이다. 일부 구현예에서, 체중 관리를 필요로 하는 개체는 비만인 개체이다. 개체의 과체중 또는 비만 여부를 결정하기 위해, 개체의 체중, 체질량 지수(BMI), 허리 둘레 또는 체지방률을 측정함으로써 개체가 체중 역치, BMI 역치, 허리 둘레 역치 또는 체지방률 역치를 충족시키는지를 결정할 수 있다.
체중의 측정은 체중의 시각적 추정, 체중 측정 장치의 사용, 예컨대, 전자 체중계 또는 기계적 대저울의 사용을 통해 이루어질 수 있다. 일부 구현예에서, 체중 관리를 필요로 하는 개체는 체중이 약 90 kg 초과, 약 100 kg 초과, 또는 약 110 kg 초과인 성인 남성이다. 일부 구현예에서, 체중 관리를 필요로 하는 개체는 체중이 약 80 kg 초과, 약 90 kg 초과, 또는 약 100 kg 초과인 성인 여성이다. 일부 구현예에서, 개체는 사춘기 전이고 체중이 약 30 kg 초과, 약 40 kg 초과, 또는 약 50 kg 초과이다.
개체가 과체중 또는 비만인지 여부는 체중(kg)을 키의 제곱값(m2)으로 나눔으로써 계산되는, 이의 체질량 지수(BMI)에 기초하여 결정될 수 있다. 따라서, BMI의 단위는 kg/m2이며, 각각의 10년 시기에서 최소 사망률과 연관된 BMI 범위를 계산할 수 있다. 세계 보건기구(World Health Organization)(W. H. O. )의 분류에 따르면, 과체중은 BMI가 25-30 kg/m2 범위인 것으로 정의되고, 비만은 BMI가 30 kg/m2 초과인 것으로 정의된다(상세한 W. H. O. BMI 분류에 대해서는 하기 표 참조).
BMI (세계 보건기구)에 따른 성인 저체중, 과체중 및 비만의 국제 분류
BMI의 건강한 범위, 및 과체중 또는 비만 여부의 다른 척도는 유전적 또는 인종적 차이에 따라 또한 달라질 수 있다. 예를 들어, 아시아인 집단은 백인보다 더 낮은 BMI에서 부정적인 건강 결과를 발생시키기 때문에, 일부 국가는 자국민에 대해 비만을 다시 정의하였다. 예를 들어, 일본에서는 25 초과의 임의의 BMI는 비만으로서 정의되고 중국에서는 28 초과의 임의의 BMI가 비만으로서 정의된다. 유사하게, 체중, 허리 둘레 또는 체지방률에 대한 상이한 역치값을 상이한 집단의 개체에 대해 사용될 수 있다. 위의 표에 포함된 추가 컷-오프 포인트(예를 들어, 23, 27. 5, 32. 5 및 37. 5)는 공중 보건 조치를 위한 포인트로서 추가되었다. WHO는 국가들의 국제 비교를 용이하게 할 목적으로 보고 목적을 위해 모든 범주를 사용하여야 한다고 권장한다.
BMI의 측정은 BMI의 시각적 추정, 키 측정 장치, 예컨대, 스타디오미터 또는 신장계(height rod)의 사용 및 체중 측정 장치, 예컨대, 전자 체중계 또는 기계적 대저울의 사용을 통해 이루어질 수 있다. 일부 구현예에서, 체중 관리를 필요로 하는 개체는 BMI가 약 25 kg/m2 초과, 약 26 kg/m2 초과, 약 27 kg/m2 초과, 약 28 kg/m2 초과, 약 29 kg/m2 초과, 약 30 kg/m2 초과, 약 31 kg/m2 초과, 약 32 kg/m2 초과, 약 33 kg/m2 초과, 약 34 kg/m2 초과, 약 35 kg/m2 초과, 약 36 kg/m2 초과, 약 37 kg/m2 초과, 약 38 kg/m2 초과, 약 39 kg/m2 초과, 또는 40 kg/m2 초과인 성인이다. 일부 구현예에서, 개체는 BMI가 약 20 kg/m2 초과, 약 21 kg/m2 초과, 약 22 kg/m2 초과, 약 23 kg/m2 초과, 약 24 kg/m2 초과, 약 25 kg/m2 초과, 약 26 kg/m2 초과, 약 27 kg/m2 초과, 약 28 kg/m2 초과, 약 29 kg/m2 초과, 약 30 kg/m2 초과, 약 31 kg/m2 초과, 약 32 kg/m2 초과, 약 33 kg/m2 초과, 약 34 kg/m2 초과, 또는 약 35 kg/m2 초과인 사춘기 전이다.
허리 둘레의 측정은 허리 둘레의 시각적 추정의 사용 또는 허리 둘레 측정 장치, 예컨대, 테이프 측정의 사용을 통해 이루어질 수 있다.
개체의 허리 둘레와 체지방률의 건강한 범위의 결정은 성별에 따라 다르다. 예를 들어, 여성은 전형적으로 남성보다 작은 허리 둘레를 가지고 있으므로 과체중 또는 비만에 대한 허리 둘레 역치는 여성에게 더 낮다. 또한 여성은 전형적으로 남성보다 체지방률이 더 높기 때문에 여성의 과체중 또는 비만에 대한 체지방률 역치는 남성보다 더 높다. 또한 BMI의 건강한 범위, 및 과체중 또는 비만 여부의 다른 척도는 연령에 따라 달라질 수 있다. 예를 들어, 성인보다 아동(사춘기 전 개체)에 대해 과체중 또는 비만 여부를 고려하기 위한 체중 역치는 더 낮다.
일부 구현예에서, 체중 관리를 필요로 하는 개체는 허리 둘레가 약 100 cm 초과, 약 110 cm 초과, 약 120 cm 초과, 약 110 cm 초과인 성인 남성 또는 허리 둘레가 약 80 cm 초과, 약 90 cm 초과, 또는 약 100 cm 초과인 성인 여성이다. 일부 구현예에서, 개체는 허리 둘레가 약 60 cm 초과, 약 70 cm 초과, 또는 약 80 cm 초과인 사춘기 전이다.
체지방률의 결정은 체지방률의 시각적 추정의 사용 또는 체지방률 측정 장치, 예컨대, 생체 전기 임피던스, 컴퓨터 단층 촬영, 자기 공명 영상화, 근적외선 이용법, 이중 에너지 X 선 흡광도 측정의 사용, 초음파의 사용, 신체 평균 밀도 측정의 사용, 스킨폴드 방법의 사용, 또는 신장 및 둘레 방법의 사용을 통해 이루어질 수 있다. 일부 구현예에서, 체중 관리를 필요로 하는 개체는 체지방률이 약 25% 초과, 약 30% 초과, 또는 약 35% 초과인 성인 남성이거나 체지방률이 약 30% 초과, 약 35% 초과, 또는 약 40% 초과인 성인 여성이다. 일부 구현예에서, 개체는 체지방률이 약 30% 초과, 약 35% 초과, 또는 약 40% 초과인 사춘기 전이다.
일부 구현예에서, 본원에 제공된 화합물의 투여를 변형시키는 것은 본원에 제공된 화합물과 조합하여 사용되는 개체에게 체중 감량 약물 또는 절차를 처방하거나 투여하는 것을 포함한다.
항정신병제-유발 체중 증가
항정신병제-유발 체중 증가는 항정신병 의약의 심각한 부작용으로서 환자의 이환율, 사망률, 및 불순응을 증가시킬 수 있다. 비록 5-HT2C 수용체의 길항 작용이 기여할 가능성이 있긴 하지만, 항정신병 약물로 인한 체중 증가의 기저를 이루는 기전은 완전히 이해되지는 않는다. 동물 연구는 체중 증가를 일으킬 가능성이 가장 큰 약물인 클로자핀 및 올란자핀은 시상 하부의 신경펩티드 Y-함유 뉴런에 직접적인 영향을 미치며; 이들 뉴런은 식품 섭취를 조절에 대한 순환 식욕감퇴 호르몬 렙틴의 효과를 매개함을 나타낸다(Association Between Early 및 Rapid Weight Gain 및 Change in Weight Over One Year of Olanzapine Therapy in Patients with Schizophrenia 및 Related Disorders; Kinon, B. J. et al. , Journal of Clinical Psychopharmacology(2005), 25(3), 255-258). 또한, 5-HT2C-수용체 길항제인 올란자핀으로 치료받는 정신 분열병 또는 관련 장애 환자에서 유의한 전체 체중 증가가 밝혀졌다(The 5-HT 2C Receptor 및 Antipsychotic-Induced Weight Gain - Mechanisms 및 Genetics; Reynolds G. P. et al. ; Journal of Psychopharmacology(2006), 20(4 Suppl), 15-8). 따라서, 5-HT2C-수용체 작용제, 예컨대, 본원에 제공된 화합물은 항정신병제-유발 체중 증가를 치료하는데 유용하다.
당뇨병
5-HT2C-수용체 작용5-HT2C-수용체 작용제는 섭취 거동, 에너지 소비, 운동 활성, 체중, 또는 지방량에 어떠한 영향도 미치지 않는 작용제의 농도에서 비만 및 제2형 당뇨병의 뮤린 모델에서 글루코스 내성을 상당히 개선시키고 혈장 인슐린을 감소시키는 것으로 공지되어 있다(Serotonin 2C Receptor Agonists Improve Type 2 Diabetes via Melanocortin-4 Receptor Signaling Pathways; Ligang, Z. et al. , Cell Metab. 2007 November 7; 6(5): 398-405).
3상 임상 시험 프로그램의 일환으로서, 벨빅은 경구용 고혈당제로 치료된 저조하게 제어된 제2형 당뇨병을 가진 604명의 성인을 대상으로 무작위, 위약 대조, 다중 장소, 이중 맹검 시험("BLOOM-DM")으로 평가되었다. 혈당(glycemic), 지질 및 혈압 계열 내에, 벨빅군의 환자는 HbA1c에서의 위약 및 공복 혈당에 비해 통계적으로 유의한 개선을 달성하였다. 벨빅(10 mg BID) 환자는 위약군의 경우에 0. 4% 감소와 비교하여 HbA1c에서 0. 9% 감소를 달성하였으며(p < 0. 0001), 위약군의 경우에 11. 9% 감소와 비교하여 공복 혈당에서 27. 4% 감소를 달성하였다(p < 0. 001). 제2형 당뇨병을 가진 환자 중에서, 당뇨병을 치료하는 의약의 사용은 혈당 조절의 평균 개선과 공동으로 벨빅을 복용한 환자에서 감소하였다. 특히, 술포닐우레아 및 티아졸리딘디온의 평균 1일 용량이 벨빅군에서 16-24% 감소하였으며, 위약군에서는 증가하였다(Effect of Lorcaserin on the Use of Concomitant Medications for Dyslipidemia, Hypertension 및 Type 2 Diabetes during Phase 3 Clinical Trials Assessing Weight Loss in Patients with Type 2 Diabetes; Vargas, E. et al. ; Abstracts of Papers, Obesity Society 30th Annual Scientic Meeting, San Antonio, Texas, Sept. 20-24 2012, (2012), 471-P). 당뇨병을 가진 환자를 배제한 연구에서 집단은 1. 5 초과의 기준선 항상성 평가 모델-인슐린 저항성(HOMA-IR) 값에 의해 나타난 바와 같이, 인슐린 저항적이었다. 평균 공복 혈당은 위약(+0. 6 mg/dL)과 비교하여 벨빅(-0. 2 mg/dL)에 의해 통계적으로 유의하게 감소되었고, 벨빅은 HbA1c가 작지만 통계적으로 유의한 감소를 유발하였다. 한 연구에서, 공복 인슐린은 위약(-1. 3 μIU/mL)에 비해 벨빅군(-3. 3 μIU/mL)에서 유의하게 감소하여, 위약(-0. 2)과 비교하여 벨빅군(-0. 4)에서 인슐린 저항성(HOMA-IR에 의해 나타냄)이 상당히 개선되었다. 따라서 본원에 제공된 화합물은 제2형 당뇨병의 예방 및 치료에 유용하다.
프레더-윌리 증후군
프레더-윌리 증후군(PWS)은 인지 결손, 영아 저긴장증 및 성장 장애, 저신장, 성선 기능 저하증 및 병적 비만을 야기할 수 있는 과식증을 포함한 복잡한 표현형을 특징으로 하는 염색체 15q11-13 상의 부계 유전자 발현의 상실로 인한 모계 각인 인간 장애이다(Goldstone, 2004; Nicholls 및 Knepper, 2001). PWS를 치료하기 위해 5-HT2C-수용체 작용제, 예컨대, 본원에 제공된 화합물을 사용하는 것에 대해 문헌에 근거가 있다(Mice with altered serotonin 2C receptor RNA editing display characteristics of Prader-Willi syndrome. Morabito, M. V. et al. , Neurobiology of Disease 39 2010) 169-180; 및 Self-injurious behavior 및 serotonin in Prader-Willi syndrome. Hellings, J. A. 및 Warnock, J. K. Psychopharmacology bulletin(1994), 30(2), 245-50).
물질 남용 및 다른 중독
중독은 뇌 보상, 동기 부여, 기억, 및 관련 회로망의 주요 만성 질환이다. 이들 회로의 기능 장애는 생물학적, 심리적, 사회적, 및 정신적 징후를 야기한다. 이것은 물질 사용 및 다른 거동에 의한 보상 및/또는 구제를 병적으로 추구하는 개체에 반영된다. 중독은 지속적인 자제 불능, 거동 제어 장애, 갈망, 이의 거동 및 대인 관계의 상당한 문제에 대한 인식 감소, 및 기능장애성 감정 반응을 특징으로 한다. 다른 만성 질환과 마찬가지로, 중독은 종종 재발 및 완화의 순환을 수반한다. 회복 활동에서 치료 또는 개입이 없으면, 중독은 진행성이며 장애 또는 조기 사망을 초래할 수 있다.
갈망과 약물 사용을 촉발시킬 뿐만 아니라, 잠재적으로 다른 중독성 거동의 진입 빈도를 증가시키는 외부 단서(external cues)의 힘은, 또한 중독의 특징이며, 해마는 이전의 쾌감의 또는 불쾌한 경험을 기억하는 데 중요하며, 편도체는 동기 부여가 이들 과거 경험과 연관된 거동을 선택하는 데 집중하는 데 중요하다. 비록 일부 사람들은 중독을 가진 사람들과 그렇지 않은 사람들의 차이가 알콜/약물 사용의 양 또는 빈도, 중독성 거동(도박 또는 지출)의 진입, 또는 다른 외부 보 상에 대한 노출(예컨대 음식 또는 섹스)로 여기긴 하지만, 중독의 특징적인 측면은 개체가 그러한 노출, 스트레스 요인 및 환경 단서에 반응하는 질적인 방식이다. 중독을 가진 사람들이 물질 사용이나 외부 보상을 추구하는 방식의 특히 병리학적인 측면은 유해 결과의 축적에도 불구하고 보상에 대한 선입관, 강박사고 및/또는 추구(예를 들어, 알콜 및 다른 약물 사용)가 지속된다는 것이다. 이들 징후는 손상된 제어의 반영으로서, 강박적으로 또는 충동적으로 발생할 수 있다.
5-HT2C 수용체, 예컨대, 본원에 제공된 화합물의 작용제는 물질 남용, 중독 및 재발의 설치류 모델에서 활성이 있으며, 이러한 작용제는 도파민 기능의 조정을 통해 작용한다는 문헌에 강한 근거가 있다.
1.
흡연 & 담배 사용
담배 사용은 담배/니코틴 의존 및 심각한 건강 문제를 야기할 수 있다. 금연은 흡연-관련 질환을 앓게될 위험을 상당히 감소시킬 수 있다. 담배/니코틴 의존은 종종 반복적인 개입을 필요로 하는 만성적인 병태이다.
2.
약물 중독
약물 중독을 치료하기 위해 5-HT2C-수용체 작용제, 예컨대, 본원에 제공된 화합물을 사용하는 것에 대해 문헌에 근거가 있다(Novel Pharmacotherapeutic Approaches for the Treatment of Drug Addiction 및 Craving; Heidbreder et al, Current Opinion in Pharmacology(2005), 5(1), 107-118).
3.
알콜중독
알콜중독을 치료하기 위해 5-HT2C-수용체 작용제, 예컨대, 본원에 제공된 화합물을 사용하는 것에 대해 문헌에 근거가 있다(An Investigation of the Role of 5-HT 2C Receptors in Modifying Ethanol Self-Administration Behaviour; Tomkins et al. Pharmacology, biochemistry, 및 behavior(2002), 71(4), 735-44).
4.
병적 도박
병적 도박을 치료하기 위해 5-HT2C-수용체 작용제, 예컨대, 본원에 제공된 화합물을 사용하는 것에 대해 문헌에 근거가 있다. 마라치티, 디(Marazziti, D. ) 등은 혈소판 5-HT 수송체 병적 도박 환자의 최대 결합 능력은 건강한 대상체의 것보다 상당히 더 낮다는 것을 발견하였다. 병적 도박 환자는 혈소판 5-HT 수송체의 수준에서 이 병태의 5-HT 시스템의 관여를 시사하는 기능 장애를 보였다. (Decreased Density of the Platelet Serotonin Transporter in Pathological Gamblers; Marazziti, D. et al. , Neuropsychobiology(2008), 57(1-2), 38-43. )
5.
보상 결핍 증후군; 성 중독
도파민계, 특히 도파민 D2 수용체는 보상 기전에 관련되어 있다. 중변연 뇌 영역에서 신경 전달 물질 상호 작용의 순 효과는 도파민(DA)이 중격의지핵에서 뉴런으로부터 방출되고 도파민 D2 수용체와 상호 작용할 때 "보상"을 유도한다. "보상 캐스케이드"는 세로토닌의 방출을 수반하며, 이는 결국 시상하부에서 엔케팔린을 자극하며, 이는 결국 흑질에서 GABA를 억제하며, 이는 결국 중격의지핵 또는 "보상 부위"에서 방출되는 DA의 양을 미세 조정한다. 정상 조건 하에 보상 부위에서 DA가 정상 욕동을 유지하는 것으로 널리 공지되어 있다. 실제로, DA는 "쾌락 분자" 및/또는 "항스트레스 분자"로서 공지되게 되었다. DA가 시냅스로 방출될 때, 이는 다수의 DA 수용체(D1-D5)를 자극하여 웰빙과 스트레스 감소에 대한 느낌을 증가시킨다. 문헌의 의견 일치는 특정 유전적 변이체(다유전자의)에 의해 유발될 수 있는, 뇌 보상 캐스케이드에 기능 장애가 있는 경우, 특히 저도파민 형질을 유발하는 DA 시스템에서, 그 사람의 뇌는 기분을 좋게 하기 위해 DA 고정을 필요로 한다. 이 형질은 여러 약물-추구 거동을 야기한다. 이는 알콜, 코카인, 헤로인, 마리화나, 니코틴, 및 글루코스 모두가 비정상적인 갈망을 치유할 수 있는, 뇌 DA의 활성화와 신경 전달을 유발하기 때문이다. 확실히 10년의 연구 후 우리는 DAD2 수용체 A1 대립 유전자의 담체가 D2 수용체를 손상시켰다는 것을 확신을 갖고 말할 수 있다. 따라서, D2 수용체의 부족으로 인해 개체는 다중 중독성, 충동적 및 강박적 거동 성향, 예컨대, 심각한 알콜중독, 코카인, 헤로인, 마리화나 및 니코틴 사용, 글루코스 폭식, 병적 도박, 성 중독, ADHD, 투렛 증후군, 자폐증, 만성 폭력, 외상 후 스트레스 장애, 분열성/회피성 클러스터, 행동 장애 및 반사회적 행동을 나타낼 위험성이 높아진다. 블룸(Blum)은 다중 유전자 및 환경 자극(다면 발현) 및 그 결과로 생기는 이상 행동 둘 다로 인한 보상 캐스케이드의 붕괴를 설명하기 위해, 이 저도파민 형질을 보상 결핍 증후군의 지시문 하에 통합하였다. (Reward Deficiency Syndrome: a Biogenetic Model for the Diagnosis 및 Treatment of Impulsive, Addictive, 및 Compulsive Behaviors; Blum K. et al. ; Journal of psychoactive drugs(2000), 32 Suppl, i-iv, 1-112). 따라서, 본원에 제공된 화합물은 보상 결핍 증후군, 다중 중독성, 충동적 및 강박적 거동 성향, 예컨대, 심각한 알콜중독, 코카인, 헤로인, 마리화나 및 니코틴 사용, 글루코스 폭식, 병적 도박, 성 중독, ADHD, 투렛 증후군, 자폐증, 만성 폭력, 외상 후 스트레스 장애, 분열성/회피성 클러스터, 행동 장애 및 반사회적 행동의 치료에 유용하다. 일부 구현예에서, 본원에 제공된 화합물은 성 중독의 치료에 유용하다.
강박 스펙트럼 장애; 충동 조절 장애; 교조증
현상적 및 병인학적 유사성에 의한 강박 장애(OCD)와 관련된 일군의 병태인 강박 스펙트럼 장애(OCSD)의 이환율이 점점 더 인식되고 있다. 세로토닌 재흡수 억제제(SRI)는 신체 추형 장애, 건강 염려증, 교조증, 및 심인성 찰과상에 대한 제1선의, 단기 치료제법으로서의 이점을 보여주었으며, 발모벽, 병적 도박 및 충동 구매에서 일부 이점을 가진다. (Obsessive-Compulsive Spectrum Disorders: a Review of the Evidence-Based Treatments. Ravindran A. V. , et al. , Canadian journal of psychiatry, (2009), 54(5), 331-43). 충돌 조절 장애, 예컨대, 발모벽(털 뽑기), 병적 도박, 방화벽, 병적 도벽, 및 간헐적인 폭발 장애, 뿐만 아니라 교조증(손톱 물어뜯기)은, 세로토닌 재흡수 억제제, 예컨대, 클로미프라민, 플루복사민, 플루복세틴, 지멜리딘, 및 세르트랄린 또는 이의 염을 투여함으로써 치료된다. 5주 시험에서 클로미프라민을 사용하여 상당한 개선이 주목되었다(Method of Treating Trichotillomania 및 Onychophagia, Swedo, S. E. et al. , PCT Int. Appl. (1992), WO 9218005 A1 19921029). 따라서, 본원에 제공된 화합물은 신체 추형 장애, 건강 염려증, 교조증, 심인성 찰상, 발모벽, 병적 도박, 충동 구매, 병적 도벽, 및 간헐적인 폭발 장애의 치료에 유용하다. 일부 구현예에서, 본원에 제공된 화합물은 교조증의 치료에 유용하다.
수면
불면증을 치료하기 위해, 서파 수면을 증가시키기 위해, 수면 강화를 위해, 및 분절 수면 구조를 치료하기 위해 5-HT2C-수용체 작용제, 예컨대, 본원에 제공된 화합물을 사용하는 것에 대해 문헌에 근거가 있다. (The Role of Dorsal Raphe Nucleus Serotonergic 및 Non-Serotonergic Neurons, 및 of their Receptors, in Regulating Waking 및 Rapid Eye Movement(REM) Sleep; Monti, J. M. ; Sleep medicine reviews(2010), 14(5), 319-27). 또한, 5-HT2C-수용체 녹아웃 마우스는 야생형보다 각성상태를 더 많이 나타내며 서파 수면은 덜 나타낸다(Serotonin 1B 및 2C Receptor Interactions in the Modulation of Feeding Behaviour in the Mouse; Dalton, G. L. et al. , Psychopharmacology(2006), 185(1), 45-57). 그러나, 5-HT2C-수용체 작용제, m-클로로페닐피페라진(mCPP)은 인간에서 서파 수면을 감소시키는 것으로 나타났다(Decreased Tryptophan Availability but Normal Post-Synaptic 5-HT2C Receptor Sensitivity in Chronic Fatigue Syndrome; Vassallo, C. M. et al. , Psychological medicine(2001), 31(4), 585-91).
요실금
세로토닌성 시스템은 방광 기능 조절에 널리 관련되어 왔다. 5-HT3 및 5-HT4 수용체를 발현하는 신경절 이전 섬유 및 신경절 세로토닌성 뉴런, 및 5-HT1 및 5-HT2 수용체를 발현하는 이펙터 평활근 세포가 토끼에서 방광 수축 활성의 조절에 적극적으로 관여한다는 것이 입증되었다(Role of Serotonin Receptors in Regulation of Contractile Activity of Urinary Bladder in Rabbits; Lychkova, A. E. 및 Pavone, L. M. , Urology 2013 Mar;81(3):696). 또한, 요실금을 치료하기 위해 5-HT2C-수용체 작용제, 예컨대, 본원에 제공된 화합물을 사용하는 것에 대해 문헌에 근거가 있다(Discovery of a Novel Azepine Series of Potent 및 Selective 5-HT 2C Agonists as Potential Treatments for Urinary Incontinence; Brennan et al. ; Bioorganic & medicinal chemistry letters(2009), 19(17), 4999-5003).
정신 질환
정신 장애를 치료하기 위해 5-HT2C-수용체 작용제, 예컨대, 본원에 제공된 화합물 및 이의 전구약물을 사용하는 것에 대해 문헌에 근거가 있다(5-HT 2C Receptor Agonists as an Innovative Approach for Psychiatric Disorders; Rosenzweig-Lipson et al. , Drug news & perspectives(2007), 20(9), 565-71; 및 Naughton et al. , Human Psychopharmacology(2000), 15(6), 397-415).
1.
정신분열증
5-HT2C 수용체는 뇌 전체에 널리 분포되어 있는 매우 복잡하고, 고도로 조절된 수용체이다. 5-HT2C 수용체는 여러 신호 전달 경로에 결합하여 다수의 세포 내 신호전달 분자의 개입을 유도한다. 또한, 5-HT2C 수용체의 다수의 대립 유전자 변이체가 존재하며, 수용체는 코딩 영역에서 RNA 편집된다. 이 수용체의 복잡성은 정신분열증의 치료에서 작용제 또는 길항제의 유용성을 시사하는 연구에 의해 추가로 강조된다. 신경화학적, 전기생리학적 및 거동적 관점으로부터의 5-HT2C 작용제의 전임상 프로파일은 추체외로 증상 또는 체중 증가 없이 항정신병제-유사 효능을 나타내는 것이다. 최근, 선택적 5-HT2C 작용제인 바비카세린은 체중 증가가 없고 추체외로 부작용의 불리함 없이 정신 분열병 환자의 II상 임상 시험에서 임상 효능을 입증했다. 이들 자료는 매우 고무적이며, 본원에 제공된 화합물이 정신 장애, 예컨대, 정신분열증의 치료에 유용하다는 것을 시사한다(5-HT 2C Agonists as Therapeutics for the Treatment of Schizophrenia. Rosenzweig-Lipson, S. et al. , Handbook of Experimental Pharmacology(2012), 213(Novel Antischizophrenia Treatments), 147-165).
2.
섭식 장애
5-HT2C 수용체 작용제, 예컨대, 본원에 제공된 화합물은 신경성 식욕부진 및 신경성 폭식증과 같은, 그러나 이에 제한되지는 않는 섭식 장애를 가진 개체에서의 정신병적 증상 및 거동의 치료에 유용하다. 신경성 식욕부진을 가진 개체는 종종 사회적 고립을 나타낸다. 식욕부진증 개체는 종종 우울, 불안, 강박사고, 완벽주의 형질, 및 경직된 인지 스타일의 증상 뿐만 아니라 성적 무관심도 나타낸다. 다른 섭식 장애는, 신경성 식욕부진, 신경성 폭식증, 폭식 섭식 장애(강박적 섭식) 및 ED-NOS(즉, 달리 규정되지 않은 섭식 장애 - 공식적 진단)를 포함한다. ED-NOS로 진단된 개체는 개체가 특정 진단을 위한 소수의 기준을 제외하고는 모두 충족시키는 상황을 포함하여 비정형 섭식 장애를 가지고 있다. 음식과 체중과 관련하여 개체가 하는 일은 정상적이지도 건강하지도 않다.
알츠하이머병
5-HT2C 수용체는 알츠하이머병(AD)에서 역할을 한다. 현재 AD로 처방되는 치료제는 효소인 아세틸콜린에스테라제를 억제함으로써 작용하는 콜린유사제제이다. 생성된 결과는 아세틸콜린의 증가된 수준이며, 이는 AD를 가진 환자에서 신경 기능 및 인지를 약간 개선시킨다. 비록, 콜린성 뇌 신경 세포의 기능 부전은 AD의 초기 징후이긴 하지만, 이들 작용제로 질환의 진행을 늦추려는 시도는 단지 약간의 성공만이 있었는데, 아마도 투여될 수 있는 용량이 말초 콜린성 부작용, 예컨대, 진전, 메스꺼움, 및 구강 건조증에 의해 제한되기 때문이다. 또한, AD가 진행됨에 따라, 이들 작용제는 지속적인 콜린성 신경 세포의 손실로 인해 이의 효과를 잃는 경향이 있다.
그러므로, AD에서 유익한 효과를 갖는 작용제, 특히 현재 요법으로 관찰되는 부작용 없이, 인지 개선 및 질환 진행을 둔화시키거나 억제함으로써 증상을 경감시키는 작용제에 대한 필요성이 있다. 따라서, 두뇌에서 독점적으로 발현되는 세로토닌 5-HT2C 수용체는 AD의 치료에 유용한 5-HT2C 수용체, 예컨대, 본원에 제공된 화합물의 매력적인 표적 및 작용제이다.
성기능 장애;
발기 부전
5-HT2C 수용체의 기능과 연관될 수 있는 또 다른 질환, 장애 또는 병태는 발기 부전(ED)이다. 발기 부전은 성교, 사정, 또는 둘 다에 대해 충분히 단단한 발기를 달성 또는 유지할 수 없는 것이다. 미국에서 2천만-3천만명으로 추정되는 남성이 그들의 삶에서 어느 때에 이 병태를 갖는다. 이 병태의 유병률은 연령에 따라 증가한다. 40세 남성의 5%가 ED를 보고한다. 이 비율은 65세까지 15% 내지 25%로, 75세가 넘어서는 55%까지 증가한다.
발기 부전은 다수의 구별되는 문제로 인해 생길 수 있다. 이는 욕망이나 성욕 상실, 발기 유지 불가능, 조루, 발산 부족, 및 오르가즘 달성 불가능을 포함한다. 빈번히, 이들 문제 중 하나 초과 자체가 동시에 나타난다. 병태는 다른 질환 상태(전형적으로 만성 병태)의 이차적, 비뇨생식기계 또는 내분비계의 특정 장애의 결과, 약제(예를 들어, 항고혈압 약물, 항우울 약물, 항정신병 약물 등) 치료에 이차적 또는 정신적 문제의 결과일 수 있다. 발기 부전은, 기질성인 경우, 주로 죽상동맥경화증, 당뇨병 및 고혈압과 연관된 혈관 불규칙성으로 인한 것이다.
남성과 여성의 성 기능 장애의 치료를 위해 세로토닌 5-HT2C 작용제의 사용에 대한 증거가 있다. 세로토닌 5-HT2C 수용체는 감각 정보의 처리 및 통합, 중추 모노아민성 계의 조절, 및 신경 내분비 반응, 불안, 섭식 거동 및 뇌척수액 생성의 조정과 관련되어 있다(Tecott, L. H. , et al. Nature 374: 542-546(1995)). 또한, 세로토닌 5-HT2C 수용체는 래트, 원숭이 및 인간에서 음경 발기의 중재에 관련되어 왔다. 따라서, 본원에 제공된 화합물은 성 기능 장애 및 발기 부전의 치료에 유용하다.
발작 장애
증거는 발작 장애의 병태생리학에서 모노아민, 노르에피네프린 및 세로토닌의 역할을 시사한다(Electrophysiological Assessment of Monoamine Synaptic Function in Neuronal Circuits of Seizure Susceptible Brains; Waterhouse, B. D. ; Life Sciences(1986), 39(9), 807-18). 따라서, 5-HT2C 수용체 작용제, 예컨대, 본원에 제공된 화합물은 발작 장애의 치료에 유용하다.
간질은 재발하는 예측 불가능한 자발적인 발작을 특징으로 하는 가끔씩 발생하는 뇌 기능 장애의 증후군이다. 소뇌 기능 장애는 측두엽 간질의 인식된 합병증이며 발작 발생, 운동 결핍 및 기억 손상과 연관되어 있다. 세로토닌은 5-HT2C 수용체를 통해 소뇌 기능에 조정 작용을 발휘하는 것으로 공지되어 있다. (Down-regulation of Cerebellar 5-HT 2C Receptors in Pilocarpine-Induced Epilepsy in Rats: Therapeutic Role of Bacopa monnieri Extract; Krishnakumar, A. et al. , Journal of the Neurological Sciences(2009), 284(1-2), 124-128). 기능적 5-HT2C-수용체가 결핍된 돌연변이 마우스는 또한 발작으로 인해 자발적으로 사망하기 쉽다(Eating Disorder 및 Epilepsy in Mice Lacking 5-HT 2C Serotonin Receptors; Tecott, L. H. et al. , Nature. 1995 Apr 6;374(6522):542-6). 제대로 제어되지 않은 간질을 가진, 우울증이 없는 환자에서 추가 치료로서 선택적 세로토닌 재흡수 억제제인 시알로프람의 예비 시험에서, 중앙 발작 빈도는 55. 6% 하락했다(The Anticonvulsant Effect of Citalopram as an Indirect Evidence of Serotonergic Impairment in Human Epileptogenesis; Favale, E. et al. , Seizure. 2003 Jul;12(5):316-8). 따라서, 5-HT2C 수용체 작용제, 예컨대, 본원에 제공된 화합물은 간길의 치료에 유용하다. 예를 들어, 5-HT2C 수용체 작용제, 예컨대, 본원에 제공된 화합물은 전신 비경련성 간질, 전신 경련성 간질, 소발작 간질 지속 상태, 대발작 간질 지속 상태, 의식 손상이 있거나 없는 부분 간질, 영아 연축, 또는 부분 간질 지속증의 치료에 유용하다.
영아기의 중증 근간대 간질(SMEI)로도 공지된 드라베 증후군은, 아이들이 표준 항간질 약물에 반응이 없는 소아기 간질의 파국적 형태이다. 평균 사망 연령은 4-6 세이다. 환자가 이 나이를 넘어 살아남으면 정신적으로 지체될 가능성이 있다. 20년에 걸친 사례 연구의 데이터는 간접적으로 작용하는 세로토닌 작용제 펜플루라민의 저용량 투여가 드라베 증후군 피팅을 가진 환자를 중단시킨다는 것을 입증한다. 따라서, 5-HT2C 수용체 작용제, 예컨대, 본원에 제공된 화합물은 드라베 증후군의 치료에 유용하다.
운동 장애
기저 신경절은 운동의 통제에서뿐만 아니라 일부 인지 기능 및 거동 기능에서도 중대한 역할을 하는, 척추동물의 뇌에서 피질하 핵의 고도로 상호 연결된 군이다. 최근의 몇몇 연구는 중추 신경계(CNS)에서의 세로토닌 경로가 기저 신경절의 조정과 인간의 비자발적 운동 장애의 병태생리학에 밀접하게 관여되는 것으로 강조하였다. 이러한 관찰은 기저 신경절의 큰 세로토닌성 신경분포를 보여주는 해부학적 증거에 의해 뒷받침된다. 실제로, 세로토닌성 말단은 선조체, 담창구, 시상하부 및 흑질에서 도파민(DA)-함유 뉴런 및 γ-아미노부티르산(GABA)-함유 뉴런과 시냅스 접촉을 하는 것으로 보고되어 있다. 이들 두뇌 영역은 세로토닌(5-HT)의 최고 농도를 함유하며, 흑질 망상부가 가장 큰 투입을 수용한다. 또한, 이들 구조에서 5-HT 상이한 수용체 아형의 높은 발현이 밝혀졌다(Serotonin Involvement in the Basal Ganglia Pathophysiology: Could the 5-HT 2C Receptor be a New Target for Therapeutic Strategies? Di Giovanni, G. et al. , Current medicinal Chemistry(2006), 13(25), 3069-81). 따라서, 5-HT2C 수용체 작용제, 예컨대, 본원에 제공된 화합물은 운동 장애의 치료에 유용하다. 일부 구현예에서, 본원에 제공된 화합물은 파킨슨증의 치료에 유용하다. 일부 구현예에서, 본원에 제공된 화합물은 항정신병 약물 사용과 연관된 운동 장애의 치료에 유용하다.
고혈압
제2형 당뇨병이 없는 환자의 임상 시험에서, 벨빅 복용 환자의 2. 2%와 위약 복용 환자의 1. 7%는 항고혈압 의약의 총 1일 용량을 감소시켰으며, 한편 2. 2% 및 3. 0% 각각은 총 1일 용량을 증가시켰다. 제2형 당뇨병이 없는 환자에서, 벨빅 치료군과 비교하여 위약으로 치료된 수치적으로 더 많은 환자가 이상지혈증 및 고혈압 요법을 시작했다. 제2형 당뇨병을 가진 환자에서, 벨빅 복용 환자의 8. 2% 및 위약 복용 환자의 6. 0%는 항고혈압 의약의 총 1일 용량을 감소시켰으며, 한편 6. 6% 및 6. 3% 각각은 총 1일 용량을 증가시켰다 (Effect of Lorcaserin on the Use of Concomitant Medications for Dyslipidemia, Hypertension 및 Type 2 Diabetes during Phase 3 Clinical Trials Assessing Weight Loss in Patients with Type 2 Diabetes; Vargas, E. et al. ; Abstracts of Papers, Obesity Society 30th Annual Scientic Meeting, San Antonio, Texas, Sept. 20-24 2012, (2012), 471-P). 따라서, 5-HT2C 수용체 작용제, 예컨대, 본원에 제공된 화합물은 고혈압의 치료에 유용하다.
이상지혈증
제2형 당뇨병이 없는 환자의 임상 시험에서, 벨빅 복용 환자의 1. 3%와 위약 복용 환자의 0. 7%는 이상지혈증의 치료에 사용되는 의약의 총 1일 용량을 감소시켰으며; 2. 6% 및 3. 4% 각각은 시험 동안 이들 의약의 사용을 증가시켰다. 제2형 당뇨병이 없는 환자에서, 벨빅 치료군과 비교하여 위약으로 치료된 수치적으로 더 많은 환자가 이상지혈증 및 고혈압 요법을 시작했다. 제2형 당뇨병을 가진 환자에서, 벨빅 BID 복용 환자의 5. 5% 및 위약 복용 환자의 2. 4%는 이상지혈증의 치료에 사용되는 의약의 총 1일 용량을 감소시켰으며; 3. 1% 및 6. 7% 각각은 시험 동안 이들 의약의 사용을 증가시켰다. (Effect of Lorcaserin on the Use of Concomitant Medications for Dyslipidemia, Hypertension 및 Type 2 Diabetes during Phase 3 Clinical Trials Assessing Weight Loss in Patients with Type 2 Diabetes; Vargas, E. et al. ; Abstracts of Papers, Obesity Society 30th Annual Scientic Meeting, San Antonio, Texas, Sept. 20-24 2012, (2012), 471-P). 따라서, 5-HT2C 수용체 작용제, 예컨대, 본원에 제공된 화합물은 이상지혈증의 치료에 유용하다.
비알콜성 지방간 질환
비알콜성 지방간 질환은 다양한 간 질환을 포함한다. 단순 지방증 또는 지방 간은 이제 성인의 31%와 어린이의 16%에서 발견된다. 지방증이 있는 사람들 중, 대략 5%는 비알콜성 지방 간염(NASH)을 일으킬 것이며, 여기서 지방증은 염증과 섬유화를 동반한다. NASH 환자의 25%까지 간경화로 진행될 것이다. NASH는 미국에서 간 이식의 세 번째 선두 적응증이며, 현재의 추세가 지속된다면 가장 일반적이 될 것이다. 따라서, 이의 발병기전과 치료법을 이해하는 것이 가장 중요하다. 저칼로리 섭취와 신체 활동 증가를 통한 체중의 전반적인 감소는 NASH 치료의 현재 중심이다(Dietary Treatment of Nonalcoholic Steatohepatitis; Perito, E. R. , et al. ; Disclosures Curr Opin Gastroenterol, 2013; 29(2):170-176). 따라서, 5-HT2C 수용체 작용제, 예컨대, 본원에 제공된 화합물은, 식품 섭취를 감소시키고 포만감을 유도하는 이의 능력 때문에, 비알콜성 지방간 질환의 치료에 유용하다.
비만-관련 신장 질환
비만은 증가된 당뇨병, 고혈압, 및 심혈관 질환의 중요한 원인으로서 확립되어 있고, 이들 모두 만성 신장 질환을 촉진시킬 수 있다. 최근에, 이들 위험이 없더라도, 비만 자체가 만성 신장 질환을 유의하게 증가시키고 이의 진행을 가속화한다는 인식이 커지고 있다 (Scope 및 mechanisms of obesity-related renal disease; Hunley, T. E. et al. ; Current Opinion in Nephrology & Hypertension(2010), 19(3), 227-234). 따라서, 5-HT2C 수용체 작용제, 예컨대, 본원에 제공된 화합물은, 이의 비만 치료 능력 때문에, 비만-관련 신장 질환의 치료에 유용하다.
카테콜아민 억제
본원에 제공된 화합물을 개체에 투여하면 체중 감소과 관계없이 개체의 노르 에피네프린 수준이 감소한다. 5-HT2C 수용체 작용제, 예컨대, 본원에 제공된 화합물은 개체의 노르에피네프린 수준의 감소에 의해 개선되는 장애의 치료에 유용하며, 여기서 상기 장애는 고노르에피네프린혈증, 심근병증, 심장 비대, 심근경색 후 재형성에서의 심근 세포 비대, 심박수 상승, 혈관 수축, 급성 폐 혈관 수축, 고혈압, 심부전, 뇌졸증 후 심장 기능 장애, 심장 부정맥, 대사 증후군, 비정상적인 지질 대사, 고열, 쿠싱 증후군, 갈색세포종, 간질, 폐쇄성 수면 무호흡, 불면증, 녹내장, 골관절염, 류마티스 관절염, 및 천식을 포함하나 이에 제한되지는 않는다.
담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에게 유효량의 본원에 제공된 화합물을 처방 및/또는 투여하는 단계를 포함하는, 상기 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조하는 방법이 또한 제공된다. 일부 구현예에서, 담배 제품의 사용의 중단을 보조하는 것은 흡연 중단을 보조하는 것이고, 담배 제품의 사용을 중단하려고 시도하는 개체는 흡연을 중단하려고 시도하는 개체이다.
담배 제품의 사용을 중단하려고 시도하는 개체에게 유효량의 본원에 제공된 화합물을 처방 및/또는 투여하는 단계를 포함하는, 담배 제품의 사용 중단 및 연관된 체중 증가 예방을 보조하는 방법이 또한 제공된다. 일부 구현예에서, 담배 제품의 사용의 중단을 보조하는 것은 흡연 중단을 보조하는 것이고, 담배 제품의 사용을 중단하려고 시도하는 개체는 흡연을 중단하려고 시도하는 개체이다.
담배 흡연의 빈도를 감소시키려고 시도하는 개체에게 유효량의 본원에 제공된 화합물을 처방 및/또는 투여하는 단계를 포함하는, 상기 개체에서 담배 흡연의 빈도를 감소시키는 방법이 또한 제공된다.
담배 흡연을 중단하려고 시도하는 개체에게 유효량의 본원에 제공된 화합물을 처방 및/또는 투여하는 단계를 포함하는, 상기 개체에 의한 흡연 중단과 연관된 체중 증가를 제어하는 방법이 또한 제공된다.
담배 흡연을 중단하려고 시도하는 개체에게 유효량의 본원에 제공된 화합물을 처방 및/또는 투여하는 단계를 포함하는, 상기 개체에 의한 흡연 중단과 연관된 체중 증가를 감소시키는 방법이 또한 제공된다.
니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에게 유효량의 본원에 제공된 화합물을 처방 및/또는 투여하는 단계를 포함하는, 상기 개체 에서 니코틴 의존, 중독 및/또는 금단을 치료하는 방법이 또한 제공된다.
니코틴 사용을 중단하려고 시도하는 개체에게 유효량의 본원에 제공된 화합물을 처방 및/또는 투여하는 단계를 포함하는, 상기 개체에 의한 니코틴의 재발 사용의 가능성을 감소시키는 방법이 또한 제공된다.
니코틴 중독 및 흡연 중단과 관련된 방법
또한, 다음의 단계를 포함하는, 담배 흡연의 빈도를 감소시키려고 시도하는 개체에서 담배 흡연의 빈도를 감소시키거나, 담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조하거나, 흡연 중단 및 연관된 체중 증가 예방을 보조하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 제어하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 감소시키거나, 니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에서 니코틴 의존, 중독 및/또는 금단을 치료하거나, 니코틴 사용을 중단하려고 시도하는 개체에 의한 니코틴의 재발 사용의 가능성을 감소시키는 방법이 또한 제공된다:
초기 BMI가 27 kg/m2 이상인 개체를 선택하는 단계; 및
상기 개체에게 유효량의 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물을 적어도 1년 동안 처방 및/또는 투여하는 단계.
또한, 다음의 단계를 포함하는, 담배 흡연의 빈도를 감소시키려고 시도하는 개체에서 담배 흡연의 빈도를 감소시키거나, 담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조하거나, 흡연 중단 및 연관된 체중 증가 예방을 보조하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 제어하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 감소시키거나, 니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에서 니코틴 의존, 중독 및/또는 금단을 치료하거나, 니코틴 사용을 중단하려고 시도하는 개체에 의한 니코틴의 재발 사용의 가능성을 감소시키는 방법이 또한 제공된다:
본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물을 개체에게 투여하는 단계;
상기 투여 동안 BMI에 대해 개체를 모니터링하는 단계; 및
상기 투여 동안 개체의 BMI가 18. 5 kg/m2 미만이 되는 경우에 상기 투여를 중단하는 단계.
또한, 다음의 단계를 포함하는, 담배 흡연의 빈도를 감소시키려고 시도하는 개체에서 담배 흡연의 빈도를 감소시키거나, 담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조하거나, 흡연 중단 및 연관된 체중 증가 예방을 보조하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 제어하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 감소시키거나, 니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에서 니코틴 의존, 중독 및/또는 금단을 치료하거나, 니코틴 사용을 중단하려고 시도하는 개체에 의한 니코틴의 재발 사용의 가능성을 감소시키는 방법이 또한 제공된다:
본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물을 초기 BMI가 25 kg/m2인 개체에게 투여하는 단계;
상기 투여 동안 체중에 대해 상기 개체를 모니터링하는 단계; 및
상기 투여 동안 상기 개체의 체중이 약 1% 초과 감소하는 경우에 상기 투여를 중단하는 단계.
일부 구현예에서, 상기 투여 동안 개체의 체중이 약 2% 초과 감소하면 투여를 중단한다. 일부 구현예에서, 상기 투여 동안 개체의 체중이 약 3% 초과 감소하면 투여를 중단한다. 일부 구현예에서, 상기 투여 동안 개체의 체중이 약 4% 초과 감소하면 투여를 중단한다. 일부 구현예에서, 상기 투여 동안 개체의 체중이 약 5% 초과 감소하면 투여를 중단한다.
또한, 다음의 단계를 포함하는, 담배 흡연의 빈도를 감소시키려고 시도하는 개체에서 담배 흡연의 빈도를 감소시키거나, 담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조하거나, 흡연 중단 및 연관된 체중 증가 예방을 보조하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 제어하거나, 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 감소시키거나, 니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에서 니코틴 의존, 중독 및/또는 금단을 치료하거나, 니코틴 사용을 중단하려고 시도하는 개체에 의한 니코틴의 재발 사용의 가능성을 감소시키는 방법이 또한 제공된다:
본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물을 개체에게 투여하는 단계;
상기 투여 동안 체중에 대해 상기 개체를 모니터링하는 단계; 및
상기 투여 동안 상기 개체의 체중이 약 1 kg 초과 감소하는 경우에 상기 투여를 중단하는 단계.
일부 구현예에서, 화합물은 흡연 중단 치료에 대한 보조제로서 사용하기 위한 것이다. 일부 구현예에서, 화합물은 담배 흡연의 중단을 위한 보조제로서 사용하기 위한 것이다. 일부 구현예에서, 화합물은 흡연 중단 치료 및 연관된 체중 증가의 예방에 대한 보조제로서 사용하기 위한 것이다. 일부 구현예에서, 화합물은 흡연 중단을 위한 체중-중립적 개입으로서 사용하기 위한 것이다. 일부 구현예에서, 체중 증가가 흡연 중단 동안 발생한다. 일부 구현예에서, 체중 증가가 흡연 중단 후 발생한다.
흡연 중단 또는 담배 제품의 사용의 중단 또는 줄임에 관한 본 발명의 임의의 구현예는 담배 제품(또는 이의 구체적 예), 담배 대체 요법(또는 이의 구체적 예), 및/또는 임의의 전자 니코틴 전달 시스템(예를 들어, 전자 담배 또는 개인 기화기)를 포함하는, 임의의 및 모든 공급원 또는 임의의 개별 공급원으로부터 니코틴 투여의 사용의 중단 또는 줄임에 적당할 수 있다. 본 발명은 모든 이러한 구현예를 구체적으로 포괄한다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물의 투여 전에, 개체는 1일에 10 개비 이상의 담배를 핀다. 일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물의 투여 전에, 개체는 1일에 11-20 개비의 담배를 핀다. 일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물의 투여 전에, 개체는 1일에 21-30 개비의 담배를 핀다. 일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물의 투여 전에, 개체는 1일에 31 개비 이상의 담배를 핀다.
일부 구현예에서, 개체는 다음 중 하나로부터 선택되는 초기 BMI를 갖는다: 24 kg/m2 이상, 23 kg/m2 이상, 22. 5 kg/m2 이상, 22 kg/m2 이상, 21 kg/m2 이상, 20 kg/m2 이상, 19 kg/m2 이상, 또는 18. 5 kg/m2 이상. 일부 구현예에서, 투여 전에, 개체는 23 kg/m2 이상의 초기 BMI를 갖는다. 일부 구현예에서, 투여 전에, 개체는 22. 5 kg/m2 이상의 초기 BMI를 갖는다. 일부 구현예에서, 투여 전에, 개체는 22 kg/m2 이상의 초기 BMI를 갖는다. 일부 구현예에서, 투여 전에, 개체는 18. 5 kg/m2 이상의 초기 BMI를 갖는다. 일부 구현예에서, 투여 전에, 개체는 18 kg/m2 이상의 초기 BMI를 갖는다. 일부 구현예에서, 투여 전에, 개체는 17. 5 kg/m2 이상의 초기 BMI를 갖는다. 일부 구현예에서, 투여 전에, 개체는 25 kg/m2 이상의 초기 체질량 지수 및 적어도 하나의 체중-관련 동반이환 병태를 갖는다.
일부 구현예에서, 투여 전에, 개체는 27 kg/m2 이상의 초기 체질량 지수를 갖는다. 일부 구현예에서, 투여 전에, 개체는 27 kg/m2 이상의 초기 체질량 지수 및 적어도 하나의 체중-관련 동반이환 병태를 갖는다.
일부 구현예에서, 체중 관련 동반이환 병태는 고혈압, 이상지혈증, 심혈관 질환, 글루코스 불내성 및 수면 무호흡으로부터 선택된다. 일부 구현예에서, 체중 관련 동반이환 병태는 고혈압, 이상지혈증, 및 제2형 당뇨병으로부터 선택된다.
일부 구현예에서, 투여 전에, 개체는 30 kg/m2 이상의 초기 체질량 지수를 갖는다.
일부 구현예에서, 투여 전에, 개체는 18. 5 내지 25 kg/m2의 초기 BMI를 갖는다.
일부 구현예에서, 개체는 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물을 투여하기 전에 우울증을 앓고 있다.
일부 구현예에서, 개체는 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물을 투여하기 전에 기존의 정신 질환을 앓고 있다.
일부 구현예에서, 기존의 정신 질환은 정신분열증, 양극성 장애, 또는 주요 우울 장애로부터 선택된다.
일부 구현예에서, 개체는 파거스트롬 점수를 기반으로 하여 니코틴 의존에 대해 평가된다. 일부 구현예에서, 개체는 0, 1, 또는 2의 점수를 갖는다. 일부 구현예에서, 개체는 3 또는 4의 점수를 갖는다. 일부 구현예에서, 개체는 5의 점수를 갖는다. 일부 구현예에서, 개체는 6 또는 7의 점수를 갖는다. 일부 구현예에서, 개체는 8, 9, 또는 10의 점수를 갖는다. 일부 구현예에서, 개체는 3 이상의 점수를 갖는다. 일부 구현예에서, 개체는 5 이상의 점수를 갖는다. 일부 구현예에서, 개체는 6 이상의 점수를 갖는다. 일부 구현예에서, 개체는 8 이상의 점수를 갖는다.
일부 구현예에서, 개체는 0, 1 또는 2의 파거스트롬 점수 및 25 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 0, 1 또는 2의 파거스트롬 점수 및 25 kg/m2 이상 및 30 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 0, 1 또는 2의 파거스트롬 점수 및 30 kg/m2 이상의 BMI를 갖는다.
일부 구현예에서, 개체는 3 또는 4의 파거스트롬 점수 및 25 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 3 또는 4의 파거스트롬 점수 및 25 kg/m2 이상 및 30 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 3, 또는 4의 파거스트롬 점수 및 30 kg/m2 이상의 BMI를 갖는다.
일부 구현예에서, 개체는 5의 파거스트롬 점수 및 25 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 5의 파거스트롬 점수 및 25 kg/m2 이상 및 30 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 5의 파거스트롬 점수 및 30 kg/m2 이상의 BMI를 갖는다.
일부 구현예에서, 개체는 6 또는 7의 파거스트롬 점수 및 25 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 6 또는 7의 파거스트롬 점수 및 25 kg/m2 이상 및 30 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 6, 또는 7의 파거스트롬 점수 및 30 kg/m2 이상의 BMI를 갖는다.
일부 구현예에서, 개체는 8, 9 또는 10의 파거스트롬 점수 및 25 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 8, 9 또는 10의 파거스트롬 점수 및 25 kg/m2 이상 및 30 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 8, 9 또는 10의 파거스트롬 점수 및 30 kg/m2 이상의 BMI를 갖는다.
일부 구현예에서, 개체는 3 이상의 파거스트롬 점수 및 25 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 3 이상의 파거스트롬 점수 및 25 kg/m2 이상 및 30 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 3 이상의 파거스트롬 점수 및 30 kg/m2 이상의 BMI를 갖는다.
일부 구현예에서, 개체는 5 이상의 파거스트롬 점수 및 25 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 5 이상의 파거스트롬 점수 및 25 kg/m2 이상 및 30 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 5 이상의 파거스트롬 점수 및 30 kg/m2 이상의 BMI를 갖는다.
일부 구현예에서, 개체는 6 이상의 파거스트롬 점수 및 25 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 6 이상의 파거스트롬 점수 및 25 kg/m2 이상 및 30 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 6 이상의 파거스트롬 점수 및 30 kg/m2 이상의 BMI를 갖는다.
일부 구현예에서, 개체는 8 이상의 파거스트롬 점수 및 25 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 8 이상의 파거스트롬 점수 및 25 kg/m2 이상 및 30 kg/m2 미만의 BMI를 갖는다. 일부 구현예에서, 개체는 8 이상의 파거스트롬 점수 및 30 kg/m2 이상의 BMI를 갖는다.
일부 구현예에서, 설문지를 사용하여 금연 동안 경험한 증상, 예컨대, 흡연 욕구, 금단, 또는 강화 효과를 평가한다. 일부 실시양태에서, 설문지를 다음으로부터 선택한다: 미네소타 니코틴 금단 점수(Minnesota Nicotine Withdrawal Score)(MNWS), 흡연 욕구에 대한 약식 설문지(Brief Questionnaire of Smoking Urges)(QSU-Brief), 맥네트 대처 효과 설문지(McNett Coping Effectiveness Questionnaire)(mCEQ), 3-인자 섭식 설문지(Three-Factor Eating Questionnaire)(TFEQ), 및 음식 갈망 인벤토리(Food Craving Inventory)(FCI).
일부 구현예에서, 니코틴 의존, 중독 및/또는 금단은 담배 제품의 사용으로부터 생긴다. 일부 구현예에서, 니코틴 의존, 중독 및/또는 금단은 니코틴 대체 요법의 사용으로부터 생긴다.
일부 구현예에서, 니코틴 의존, 중독 및/또는 금단은 니코틴 대체 요법의 사용으로부터 생긴다.
일부 구현예에서, 개체에게 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물을 금연 목표일에 먼저 투여한다. 일부 구현예에서, 개체에게 화합물을 금연 목표일의 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 또는 35일 전에 투여한다. 일부 구현예에서, 개체에게 화합물을 금연 목표일의 적어도 7일 전에 투여한다. 일부 구현예에서, 개체에게 화합물을 금연 목표일의 약 7 내지 약 35일 전에 투여한다. 일부 구현예에서, 개체에게 화합물을 금연 목표일의 적어도 14일 전에 투여한다. 일부 구현예에서, 개체에게 화합물을 금연 목표일의 약 14 내지 약 35일 전에 투여한다.
일부 구현예에서, 개체는 치료의 제8일과 제35일 사이에 금연한다. 일부 구현예에서, 개체는 치료의 제15일과 제35일 사이에 금연한다. 일부 구현예에서, 개체는 치료의 제22일과 제35일 사이에 금연한다. 일부 구현예에서, 개체는 치료의 제8일에 금연한다. 일부 구현예에서, 개체는 치료의 제15일에 금연한다. 일부 구현예에서, 개체는 치료의 제22일에 금연한다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물을 투여하기 전에, 방법은 개체에게 담배 흡연을 중단할 날짜를 정하도록 지시하는 단계를 추가로 포함한다. 일부 구현예에서, 화합물의 투여는 담배 흡연을 중단하려고 정해진 날짜의 약 7일 전에 시작한다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물을 투여한 후, 방법은 개체에게 담배 흡연을 중단할 날짜를 정하도록 지시하는 단계를 추가로 포함한다. 일부 구현예에서, 담배 흡연을 중단하려고 정해진 날짜는 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물의 투여의 적어도 7일 후에 발생한다. 일부 구현예에서, 담배 흡연을 중단하려고 정해진 날짜는 화합물의 투여의 35일 전에 발생한다.
일부 구현예에서, 개체는 이전에 담배 흡연을 중단하려고 시도하였으나 담배 흡연 중단에 성공하지 못했다. 일부 구현예에서, 개체는 이전에 담배 흡연을 중단하려고 시도하였으나 그 후 재발하여 담배 흡연을 다시 시작하였다.
일부 구현예에서, 투여로 인해 MPSS 테스트로부터의 데이터 분석으로 측정된 바와 같이 흡연 중단을 견디는 능력이 통계적으로 유의하게 개선된다.
일부 구현예에서, 개체는 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물의 처방 및/또는 투여 전 12주 동안 니코틴 사용을 삼가하였다.
일부 구현예에서, 개체는 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물의 처방 및/또는 투여 전 24주 동안 니코틴 사용을 삼가하였다.
일부 구현예에서, 개체는 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물의 처방 및/또는 투여 전 9개월 동안 니코틴 사용을 삼가하였다.
일부 구현예에서, 개체는 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물의 처방 및/또는 투여 전 52주 동안 니코틴 사용을 삼가하였다.
일부 구현예에서, 금연은 자기-보고된다. 일부 구현예에서, 자기-보고는 설문지에 대한 응답을 기준으로 한다. 일부 구현예에서, 설문지는 니코틴 사용 인벤토리(Nicotine Use Inventory)이다. 일부 구현예에서, 개체는 어떠한 담배(심지어 한 모금)도 피우지 않은 것으로 자기-보고한다. 일부 구현예에서, 개체는 어떠한 다른 니코틴-함유 제품도 사용하지 않는 것으로 자기-보고한다. 일부 구현예에서, 개체는 어떠한 담배(심지어 한 모금)도 피우지 않았고 어떠한 다른 니코틴-함유 제품도 사용하지 않는 것으로 자기-보고한다.
일부 구현예에서, 치료 지속기간은 12주, 6개월, 9개월, 1년, 18개월, 2년, 3년, 4년, 및 5년으로부터 선택된다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물은 적어도 약 2주 동안 투여된다. 일부 구현예에서, 화합물은 적어도 약 4주 동안 투여된다. 일부 구현예에서, 화합물은 적어도 약 8주 동안 투여된다. 일부 구현예에서, 화합물은 적어도 약 12주 동안 투여된다. 일부 구현예에서, 화합물은 적어도 약 6개월 동안 투여된다. 일부 구현예에서, 화합물은 적어도 약 1년 동안 투여된다. 일부 구현예에서, 화합물은 적어도 약 2년 동안 투여된다. 일부 구현예에서, 화합물은 약 7주 내지 약 12주 동안 투여된다. 일부 구현예에서, 화합물은 약 12주 내지 약 52주 동안 투여된다. 일부 구현예에서, 화합물은 약 6개월 내지 약 1년 동안 투여된다.
일부 구현예에서, 개체는 1차 치료 기간 동안 치료를 받는다. 일부 구현예에서, 개체는, 예를 들어, 장기간의 금연의 가능성을 증가시키기 위해, 추가 치료 기간 동안 치료를 받는다. 일부 구현예에서, 1차 치료 기간에 실패하는 개체에게 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물을 임의로 2차 치료 기간 동안 보충제와 조합하여 투여한다. 일부 구현예에서, 1차 치료 동안 재발하는 개체에게 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물을 임의로 2차 치료 기간 동안 보충제와 조합하여 투여한다. 일부 구현예에서, 1차 치료 후에 재발하는 개체에게 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물을 임의로 2차 치료 기간 동안 보충제와 조합하여 투여한다. 일부 구현예에서, 1차 치료 기간은 12주이다. 일부 구현예에서, 2차 치료 기간은 12주 이하이다. 일부 구현예에서, 2차 치료 기간은 12주이다. 일부 구현예에서, 2차 치료 기간은 12주 초과이다. 일부 구현예에서, 1차 치료 기간은 1년이다. 일부 구현예에서, 2차 치료 기간은 1년 이하이다. 일부 구현예에서, 2차 치료 기간은 1년이다. 일부 구현예에서, 1차 치료 기간은 2차 치료 기간보다 길다. 일부 구현예에서, 1차 치료 기간은 2차 치료 기간보다 짧다. 일부 구현예에서, 1차 치료 기간 및 2차 치료 기간은 동일한 시간 길이다.
일부 구현예에서, 체중 증가의 예방 또는 감소, 또는 체중 감소의 유도는 개체가 흡연 중단을 시도할 때 전형적으로 경험하는 체중 증가 또는 감소의 양에 관하여 측정하였다. 일부 구현예에서, 체중 증가의 예방 또는 감소, 또는 체중 감소의 유도는 개체가 또 다른 약물과 함께 흡연 중단을 시도할 때 전형적으로 경험하는 체중 증가 또는 감소의 양에 관하여 측정하였다.
일부 구현예에서, 체중 증가를 제어하는 것은 체중 증가를 예방하는 것을 포함한다. 일부 구현예에서, 체중 증가를 제어하는 것은 체중 감소를 유도하는 것을 포함한다. 일부 구현예에서, 체중 증가를 제어하는 것은 적어도 약 0. 5%, 1%, 1. 5%, 2%, 2. 5%, 3%, 3. 5%, 4%, 4. 5%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 또는 20%의 체중 감소를 유도하는 것을 포함한다. 일부 구현예에서, 체중 감소는 적어도 1%이다. 일부 구현예에서, 체중 감소는 적어도 1. 5%이다. 일부 구현예에서, 체중 감소는 적어도 약 2%이다. 일부 구현예에서, 체중 감소는 적어도 3%이다. 일부 구현예에서, 체중 감소는 적어도 4%이다. 일부 구현예에서, 체중 감소는 적어도 5%이다. 일부 구현예에서, 체중 증가를 제어하는 것은 BMI를 감소시키는 것을 포함한다. 일부 구현예에서, 체중 증가를 제어하는 것은 체지방률을 감소시키는 것을 포함한다. 일부 구현예에서, 체중 증가를 제어하는 것은 허리 둘레를 감소시키는 것을 포함한다. 일부 구현예에서, 체중 증가를 제어하는 것은 BMI를 적어도 약 0. 25, 0. 5, 1, 1. 5, 2, 2. 5, 3, 3. 5, 4, 4. 5, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20 kg/m2 감소시키는 것을 포함한다. 일부 구현예에서, BMI 적어도 1 kg/m2 감소된다. 일부 구현예에서, BMI 적어도 1. 5 kg/m2 감소된다. 일부 구현예에서, BMI 적어도 2 kg/m2 감소된다. 일부 구현예에서, BMI 적어도 2. 5 kg/m2 감소된다. 일부 구현예에서, BMI 적어도 5 kg/m2 감소된다. 일부 구현예에서, BMI 적어도 10 kg/m2 감소된다. 일부 구현예에서, 체중 증가를 제어하는 것은 체지방률을 적어도 약 0. 5%, 1%, 1. 5%, 2%, 2. 5%, 3%, 3. 5%, 4%, 4. 5%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 또는 20% 감소시키는 것을 포함한다. 일부 구현예에서, 체지방률의 감소는 적어도 1%이다. 일부 구현예에서, 체지방률의 감소는 적어도 2. 5%이다. 일부 구현예에서, 체지방률의 감소는 적어도 5%이다. 일부 구현예에서, 체중 증가를 제어하는 것은 허리 둘레를 적어도 약 0. 5, 1, 1. 5, 2, 2. 5, 3, 3. 5, 4, 4. 5, 5, 6, 7, 8, 9, 또는 10 cm 감소시키는 것을 포함한다. 일부 구현예에서, 허리 둘레의 감소는 적어도 1 cm이다. 일부 구현예에서, 허리 둘레의 감소는 적어도 2. 5 cm이다. 일부 구현예에서, 허리 둘레의 감소는 적어도 5 cm이다. 일부 구현예에서, 체중 증가를 제어하는 것은 체중을 적어도 약 0. 5, 1, 1. 5, 2, 2. 5, 3, 3. 5, 4, 4. 5, 5, 6, 7, 8, 9, 또는 10 kg 감소시키는 것을 포함한다. 일부 구현예에서, 체중의 감소는 적어도 1 kg이다. 일부 구현예에서, 체중의 감소는 적어도 2. 5 kg이다. 일부 구현예에서, 체중의 감소는 적어도 5 kg이다.
일부 구현예에서, 개체의 BMI는 다음 중 하나로부터 선택된 BMI가 된다: 18 kg/m2 이상, 17. 5 kg/m2 이상, 17 kg/m2 이상, 16 kg/m2 이상, 및 15 kg/m2 이상.
일부 구현예에서, 체중의 감소는 다음 중 하나로부터 선택된다: 약 1. 5% 초과, 약 2% 초과, 약 2. 5% 초과, 약 3% 초과, 약 3. 5% 초과, 약 4% 초과, 약 4. 5% 초과, 및 약 5% 초과.
일부 구현예에서, 체중의 감소는 다음 중 하나로부터 선택된다: 약 1. 5 kg 초과, 약 2 kg 초과, 약 2. 5 kg 초과, 약 3 kg 초과, 약 3. 5 kg 초과, 약 4 kg 초과, 약 4. 5 kg 초과, 및 약 5 kg 초과.
일부 구현예에서, 치료를 필요로 하는 개체는 25 kg/m2 이상, 24 kg/m2 이상, 23 kg/m2 이상, 22 kg/m2 이상, 21 kg/m2 이상, 20 kg/m2 이상, 19 kg/m2 이상, 및 18. 5 kg/m2 이상으로부터 선택되는 BMI를 갖는다. 일부 구현예에서, BMI는 약 0. 25, 0. 5, 1, 1. 5, 2, 2. 5, 3, 3. 5, 4, 4. 5, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14,15, 16, 17, 18, 19, 또는 20 kg/m2 초과로 감소되지 않는다. 일부 구현예에서, BMI는 1 kg/m2 초과로 감소되지 않는다. 일부 구현예에서, BMI는 1. 5 kg/m2 초과로 감소되지 않는다. 일부 구현예에서, BMI는 2 kg/m2 초과로 감소되지 않는다. 일부 구현예에서, BMI는 2. 5 kg/m2 초과로 감소되지 않는다. 일부 구현예에서, BMI는 5 kg/m2 초과로 감소되지 않는다. 일부 구현예에서, BMI는 10 kg/m2 초과로 감소되지 않는다. 일부 구현예에서, 체지방률은 약 0. 5%, 1%, 1. 5%, 2%, 2. 5%, 3%, 3. 5%, 4%, 4. 5%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 또는 20% 초과로 감소되지 않는다. 일부 구현예에서, 체지방률은 1% 초과로 감소되지 않는다. 일부 구현예에서, 체지방률은 2. 5% 초과로 감소되지 않는다. 일부 구현예에서, 체지방률은 5% 초과로 감소되지 않는다. 일부 구현예에서, 허리 둘레는 약 0. 5, 1, 1. 5, 2, 2. 5, 3, 3. 5, 4, 4. 5, 5, 6, 7, 8, 9, 또는 10 cm 초과로 감소되지 않는다. 일부 구현예에서, 허리 둘레는 1 cm 초과로 감소되지 않는다. 일부 구현예에서, 허리 둘레는 2. 5 cm 초과로 감소되지 않는다. 일부 구현예에서, 허리 둘레는 5 cm 초과로 감소되지 않는다. 일부 구현예에서, 체중은 약 0. 5, 1, 1. 5, 2, 2. 5, 3, 3. 5, 4, 4. 5, 5, 6, 7, 8, 9, 또는 10 kg 초과로 감소되지 않는다. 일부 구현예에서, 체중 감소는 1 kg 이하이다. 일부 구현예에서, 체중 감소는 2.5 kg 이하이다. 일부 구현예에서, 체중 감소는 5 kg 이하이다.
일부 구현예에서, 체중 증가를 제어하는 것은 적어도 약 12주, 적어도 약 6개월, 적어도 약 9개월, 적어도 약 1년, 적어도 약 18개월, 또는 적어도 약 2년 동안 적어도 약간의 체중 감소를 유지하는 것을 포함한다. 예를 들어, 일부 구현예에서, 개체는 1차 치료 동안 5 kg를 감량하고 2차 치료 동안 상기 체중 감소의 적어도 1 kg을 유지한다. 일부 구현예에서, 개체는 치료의 최초 12주 동안 3 kg을 감량하고, 치료의 1년 후 총 5 kg을 감량한다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물의 사용을 중단한다. 예를 들어, 일부 구현예에서, 개체의 BMI가 약 15 kg/m2 이하, 약 15. 5 kg/m2 이하, 약 16 kg/m2 이하, 약 16. 5 kg/m2 이하, 약 17 kg/m2 이하, 약 17. 5 kg/m2 이하, 약 18 kg/m2 이하, 약 18. 5 kg/m2 이하, 약 19 kg/m2 이하, 약 19. 5 kg/m2 이하, 약 20 kg/m2 이하, 약 20. 5 kg/m2 이하, 약 21 kg/m2 이하, 약 21. 5 kg/m2 이하, 약 22 kg/m2 이하, 약 22. 5 kg/m2 이하, 또는 약 23 kg/m2 이하가 되면, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물의 사용을 중단한다.
일부 구현예에서, 개체는 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물을, 본원에 기재된 바와 같이, 임의로 적어도 1종의 보충제와 조합하여 투여한 결과로서 하나 이상의 추가적인 유익한 효과를 경험한다.
일부 구현예에서, 하나 이상의 추가적인 유익한 효과는 체중 평가에서의 감소, 심혈관 적응증에서의 개선, 및/또는 개선된 혈당증으로부터 선택된다. 일부 구현예에서, 하나 이상의 추가적인 유익한 효과는 체중 평가에서의 감소, 심혈관 적응증에서의 개선, 및/또는 개선된 지혈증로부터 선택된다.
일부 구현예에서, 하나 이상의 추가적인 유익한 효과는 체중 평가에서의 감소를 포함한다. 일부 구현예에서, 체중 평가에서의 감소는 체중 감소를 포함한다. 일부 구현예에서, 하나 이상의 유익한 효과는 허기의 감소, 음식 갈망의 감소, 또는 식간 간격의 증가를 포함한다.
일부 구현예에서, 하나 이상의 추가적인 유익한 효과는 하나 이상의 심혈관 적응증에서의 개선을 포함한다. 일부 구현예에서, 하나 이상의 심혈관 적응증에서의 개선은 수축기 및 확장기 혈압(각각 SBP 및 DBP)의 감소, 심박수의 감소, 총 콜레스테롤의 감소, LDL 콜레스테롤의 감소, HDL 콜레스테롤의 감소 및/또는 트리글리세리드 수준의 감소 중 하나 이상을 포함한다.
일부 구현예에서, 하나 이상의 추가적인 유익한 효과는 SBP의 감소를 포함한다. 일부 구현예에서, 제2형 당뇨병을 갖지 않은 개체에서의 SBP의 감소는 적어도 약 2 mmHg이다. 일부 구현예에서, 제2형 당뇨병을 갖지 않은 개체에서의 SBP의 감소는 적어도 약 2 내지 5 mmHg이다. 일부 구현예에서, 제2형 당뇨병을 가진 개체에서의 SBP의 감소는 적어도 약 2 mmHg이다. 일부 구현예에서, 제2형 당뇨병을 가진 개체에서의 SBP의 감소는 적어도 약 2 내지 5 mmHg이다. 일부 구현예에서, 기준 공복 글루코스 장애를 가진 개체에서의 SBP의 감소는 적어도 약 1 mmHg이다. 일부 구현예에서, 기준 공복 글루코스 장애를 가진 개체에서의 SBP의 감소는 약 1 내지 5 mmHg이다.
일부 구현예에서, 하나 이상의 추가적인 유익한 효과는 DBP의 감소를 포함한다. 일부 구현예에서, 제2형 당뇨병을 갖지 않은 개체에서의 DBP의 감소는 적어도 약 1 mmHg이다. 일부 구현예에서, 제2형 당뇨병을 갖지 않은 개체에서의 DBP의 감소는 적어도 약 1 내지 5 mmHg이다. 일부 구현예에서, 제2형 당뇨병을 가진 개체에서의 DBP의 감소는 적어도 약 1 mmHg이다. 일부 구현예에서, 제2형 당뇨병을 가진 개체에서의 DBP의 감소는 적어도 약 1 내지 5 mmHg이다. 일부 구현예에서, 기준 공복 글루코스 장애를 가진 개체에서의 DBP의 감소는 적어도 약 1 mmHg이다. 일부 구현예에서, 기준 공복 글루코스 장애를 가진 개체에서의 DBP의 감소는 약 1 내지 5 mmHg이다.
일부 구현예에서, 하나 이상의 추가적인 유익한 효과는 심박수의 감소를 포함한다. 일부 구현예에서, 제2형 당뇨병을 갖지 않은 개체에서의 심박수의 감소는 적어도 약 2 BPM이다. 일부 구현예에서, 제2형 당뇨병을 갖지 않은 개체에서의 심박수의 감소는 적어도 약 2 내지 5 BPM이다. 일부 구현예에서, 제2형 당뇨병을 가진 개체에서의 심박수의 감소는 적어도 약 2 BPM이다. 일부 구현예에서, 제2형 당뇨병을 가진 개체에서의 심박수의 감소는 적어도 약 2 내지 5 BPM이다. 일부 구현예에서, 기준 공복 글루코스 장애를 가진 개체에서의 심박수의 감소는 적어도 약 2 mmHg이다. 일부 구현예에서, 기준 공복 글루코스 장애를 가진 개체에서의 심박수의 감소는 약 2 내지 5 mmHg이다.
일부 구현예에서, 지혈증에서의 개선은 총 콜레스테롤 수준의 감소를 포함한다. 일부 구현예에서, 제2형 당뇨병을 갖지 않은 개체에서의 총 콜레스테롤 수준의 감소는 적어도 약 1 mg/dL이다. 일부 구현예에서, 제2형 당뇨병을 갖지 않은 개체에서의 총 콜레스테롤 수준의 감소는 1. 5 내지 약 2 mg/dL이다. 일부 구현예에서, 제2형 당뇨병을 갖지 않은 개체에서의 총 콜레스테롤 수준의 감소는 적어도 약 0. 5 mg/dL이다. 일부 구현예에서, 제2형 당뇨병을 가진 개체에서의 총 콜레스테롤 수준의 감소는 0. 5 내지 약 1 mg/dL이다. 일부 구현예에서, 기준 공복 글루코스 장애를 가진 개체에서의 총 콜레스테롤 수준의 감소는 적어도 약 2 mmHg이다. 일부 구현예에서, 기준 공복 글루코스 장애를 가진 개체에서의 총 콜레스테롤 수준의 감소는 적어도 약 2 내지 3 mmHg이다.
일부 구현예에서, 지혈증에서의 개선은 LDL 콜레스테롤 수준의 감소를 포함한다. 일부 구현예에서, 제2형 당뇨병을 갖지 않은 개체에서의 LDL 콜레스테롤 수준의 감소는 적어도 약 1 mg/dL이다. 일부 구현예에서, 제2형 당뇨병을 갖지 않은 개체에서의 LDL 콜레스테롤 수준의 감소는 약 1 내지 2 mg/dL이다. 일부 구현예에서, 제2형 당뇨병을 가진 개체에서의 LDL 콜레스테롤 수준의 감소는 적어도 약 1 mg/dL이다. 일부 구현예에서, 제2형 당뇨병을 가진 개체에서의 LDL 콜레스테롤 수준의 감소는 약 1 내지 1. 5 mg/dL이다. 일부 구현예에서, 기준 공복 글루코스 장애를 가진 개체에서의 LDL 콜레스테롤 수준의 감소는 적어도 약 2 mg/dL이다. 일부 구현예에서, 기준 공복 글루코스 장애를 가진 개체에서의 LDL 콜레스테롤 수준의 감소는 적어도 약 2 내지 3 mg/dL이다.
일부 구현예에서, 지혈증에서의 개선은 HDL 콜레스테롤 수준의 감소를 포함한다. 일부 구현예에서, 제2형 당뇨병을 갖지 않은 개체에서의 HDL 콜레스테롤 수준의 감소는 적어도 약 4 mg/dL이다. 일부 구현예에서, 제2형 당뇨병을 갖지 않은 개체에서의 HDL 콜레스테롤 수준의 감소는 약 3 내지 6 mg/dL이다. 일부 구현예에서, 제2형 당뇨병을 가진 개체에서의 HDL 콜레스테롤 수준의 감소는 적어도 약 5 mg/dL이다. 일부 구현예에서, 제2형 당뇨병을 가진 개체에서의 HDL 콜레스테롤 수준의 감소는 약 7 내지 10 mg/dL이다. 일부 구현예에서, 기준 공복 글루코스 장애를 가진 개체에서의 HDL 콜레스테롤 수준의 감소는 적어도 약 2 mg/dL이다. 일부 구현예에서, 기준 공복 글루코스 장애를 가진 개체에서의 HDL 콜레스테롤 수준의 감소는 적어도 약 2 내지 3 mg/dL이다.
일부 구현예에서, 하나 이상의 추가적인 유익한 효과는 혈당증에서의 개선을 포함한다. 일부 구현예에서, 혈당증에서의 개선은 공복 혈장 글루코스의 감소 및/또는 당화 헤모글로빈(A1C) 수준의 감소를 포함한다. 일부 구현예에서, 혈당증에서의 개선은 공복 혈장 글루코스의 감소를 포함한다. 일부 구현에서, 혈당증에서의 개선은 당화 헤모글로빈(A1C) 수준의 감소를 포함한다. 일부 구현예에서, 혈당증에서의 개선은 트리글리세리드 수준의 감소를 포함한다.
본원에 제공된 화합물은 다종다양한 투여 형태로 투여될 수 있다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물은 경구 투여에 적합한 정제로 투여된다.
일부 구현예에서, 활성 성분은, 예를 들어, 관련 기술분야에 공지된 기술을 사용하여, 즉시-방출형 투여 형태로서 제제화된다. 일부 구현예에서, 활성 성분은, 예를 들어, 관련 기술분야에 공지된 기술을 사용하여, 변형-방출형 투여 형태로서 제제화된다. 일부 구현예에서, 활성 성분은, 예를 들어, 관련 기술분야에 공지된 기술을 사용하여, 지속-방출형 투여 형태로서 제제화된다. 일부 구현예에서, 활성 성분은, 예를 들어, 관련 기술분야에 공지된 기술을 사용하여, 지연-방출형 투여 형태로서 제제화된다.
일부 구현예에서, 방법은 임의의 두 개의 순차적 투여 사이의 평균 간격이 다음과 같은 빈도로, 변형-방출형 투여 형태의 복수의 투여를 포함한다: 적어도 약 24시간; 또는 약 24시간.
일부 구현예에서, 방법은 변형-방출형 투여 형태의 복수의 투여를 포함하고, 변형-방출형 투여 형태는 1일 1회 투여된다.
일부 구현예에서, 복수의 투여는 다음과 같다: 적어도 약 30; 적어도 약 180; 적어도 약 365; 또는 적어도 약 730.
병용 요법
화합물 또는 이의 약학적으로 허용되는 염, 수화물 또는 용매화물은 단독 활성 약제(즉, 단일 요법)로서 투여될 수 있거나, 함께 또는 개별적으로 투여되는 하나 이상의 체중 감량 약물과 조합하여 사용될 수 있다. 체중 관리, 포만감 유도, 식품 섭취 감소, 흡연 중단 보조, 및 비만, 항정신병제-유발 체중 증가, 제2형 당뇨병, 프레더-윌리 증후군, 담배 의존, 니코틴 의존, 약물 중독, 알콜 중독, 병적 도박, 보상 결핍 증후군, 성 중독, 강박 스펙트럼 장애, 충동 조절 장애, 손톱 물어뜯기, 교조증, 수면 장애, 불면증, 분절 수면 구조, 서파 수면의 장애, 요실금, 정신 장애, 정신분열증, 신경성 식욕부진, 신경성 폭식증, 알츠하이머병, 성 기능 장애, 발기 부전, 간질, 운동 장애, 파킨슨증, 항정신병제-유발 운동 장애, 고혈압, 이상지혈증, 비알콜성 지방간 질환, 비만-관련 신장 질환, 및 수면 무호흡의 예방 및 치료를 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을, 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 체중 관리, 포만감 유도, 식품 섭취 감소, 흡연 중단 보조, 및 상기 언급된 질환의 예방 및 치료 방법이 제공된다.
식품 섭취의 감소를 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 상기 개체에서 식품 섭취를 감소시키는 방법이 또한 제공된다.
포만감의 유도를 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 상기 개체에서 포만감을 유도하는 방법이 또한 제공된다.
비만의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 상기 개체에서 비만을 치료하는 방법이 또한 제공된다.
비만의 예방을 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 상기 개체에서 비만을 치료하는 방법이 또한 제공된다.
체중 관리를 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 상기 개체에서 비만을 치료하는 방법이 또한 제공된다.
제2형 당뇨병의 예방을 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 상기 개체에서 제2형 당뇨병을 예방하는 방법이 또한 제공된다.
본원에 개시된 화합물을 체중 감량 약물과의 조합 요법으로서 투여하는 경우, 화합물 및 체중 감량 약물은 동시에 또는 상이한시간에 주어진 별도의 약학 조성물로서 제제화될 수 있거나; 본원에 개시된 화합물 및 약제는 단일 단위 투여로서 함께 제제화될 수 있다.
요법에 의한 인간 또는 동물 신체의 치료 방법에서 사용하기 위한 체중 감량 약물과 조합하여 사용하기 위한 본원에 기재된 화합물이 제공된다.
체중 관리, 포만감 유도, 식품 섭취 감소, 흡연 중단 보조, 및 비만, 항정신병제-유발 체중 증가, 제2형 당뇨병, 프레더-윌리 증후군, 중독, 담배 의존, 니코틴 의존, 약물 중독, 알콜 중독, 병적 도박, 보상 결핍 증후군, 성 중독, 강박 스펙트럼 장애, 충동 조절 장애, 손톱 물어뜯기, 교조증, 수면 장애, 불면증, 분절 수면 구조, 서파 수면의 장애, 요실금, 정신 장애, 정신분열증, 신경성 식욕부진, 신경성 폭식증, 알츠하이머병, 성 기능 장애, 발기 부전, 간질, 운동 장애, 파킨슨증, 항정신병제-유발 운동 장애, 고혈압, 이상지혈증, 비알콜성 지방간 질환, 비만-관련 신장 질환, 및 수면 무호흡의 예방 및 치료를 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을, 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 체중 관리, 포만감 유도, 식품 섭취 감소, 흡연 중단 보조, 및 상기 언급된 질환의 예방 및 치료를 위한, 체중 감량 약물과 조합하여 사용하기 위한 본원에 기재된 화합물이 또한 제공된다.
식품의 섭취 감소를 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 상기 개체에서 식품 섭취를 감소시키기 위한, 체중 감량 약물과 조합하여 사용하기 위한 본원에 기재된 화합물이 또한 제공된다.
포만감의 유도를 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 상기 개체에서 포만감을 유도하기 위한, 체중 감량 약물과 조합하여 사용하기 위한 본원에 기재된 화합물이 또한 제공된다.
비만의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 상기 개체에서 비만을 치료하기 위한, 체중 감량 약물과 조합하여 사용하기 위한 본원에 기재된 화합물이 또한 제공된다.
비만의 예방을 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 상기 개체에서 비만을 예방하기 위한, 체중 감량 약물과 조합하여 사용하기 위한 본원에 기재된 화합물이 또한 제공된다.
체중 관리를 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 상기 개체에서 체중 관리하기 위한, 체중 감량 약물과 조합하여 사용하기 위한 본원에 기재된 화합물이 또한 제공된다.
제2형 당뇨병의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 상기 개체에서 제2형 당뇨병을 치료하기 위한, 체중 감량 약물과 조합하여 사용하기 위한 본원에 기재된 화합물이 또한 제공된다.
제2형 당뇨병의 예방을 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 상기 개체에서 제2형 당뇨병을 예방하기 위한, 체중 감량 약물과 조합하여 사용하기 위한 본원에 기재된 화합물이 또한 제공된다.
일부 구현예에서, 본원에 기재된 화합물 및 체중 감량 약물은 동시에 투여된다.
일부 구현예에서, 본원에 기재된 화합물 및 체중 감량 약물은 별도로 투여된다.
일부 구현예에서, 본원에 기재된 화합물 및 체중 감량 약물은 순차적으로 투여된다.
일부 구현예에서, 체중 감량 약물은 본원에 구체적으로 개시되거나 또는 마치 각각의 및 모든 조합이 개별적으로 및 명시적으로 열거된 것처럼 본원에 열거된 임의의 참고문헌에 구체적으로 개시된, 소듐/글루코스 공동수송체-2(SGLT2) 억제제, 리파제 억제제, 모노아민 재흡수 억제제, 항경련제, 글루코스 민감제, 인크레틴 모방체, 아밀린 유사체, GLP-1 유사체, Y 수용체 펩티드, 5-HT2C 수용체 작용제, 오피오이드 수용체 길항제, 식욕 억제제, 식욕 감퇴제, 및 호르몬 등으로부터 선택된다. 일부 구현예에서, 체중 감량 약물은 다파글리플로진, 카나글리플로진, 이프라글리플로진, 토포글리플로진, 엠파글리플로진, 레모글리플로진 에타보네이트, 오를리스타트, 세틸리스타트, 알라프로클레이트, 시탈로프람, 다폭세틴, 에스시탈로프람, 페목세틴, 플루옥세틴, 플루복사민, 이폭세틴, 인달핀, 오밀록세틴, 파누라민, 파록세틴, 피란다민, 세르틀란린, 지멜리딘, 데스메틸시탈로프람, 데스메틸세르트랄린, 디데스메틸시탈로프람, 세프록세틴, 시아노프라민, 리톡세틴, 루바조돈, 트라조돈, 빌라조돈, 보르티옥세틴, 덱스트로메토르판, 디멘하이드리네이트, 디펜하이드라민, 메피라민, 피릴라민, 메타돈, 프로폭시펜, 메셈브린, 록스인돌, 아메달린, 토목세틴, 달레달린, 에디복세틴, 에스레복세틴, 로르탈라민, 마진돌, 니속세틴, 레복세틴, 탈로프람, 탈수프람, 탄다민, 빌록사진, 마프로틸린, 부프로피온, 시클라진돌, 마니팍신, 라다팍신, 타펜타돌, 테닐록사진, 징코 빌로바, 알트로판, 디플루오로핀, 이오메토판, 바녹세린, 메디폭사민, 카에노멜레스 스페시오사, 히퍼포린, 아드히퍼포린, 부프로피온, 프라미펙솔, 카베르골린, 벤라팍신, 데스벤라팍신, 둘록세틴, 밀나시프란, 레보밀나시프란, 비시파딘, 아미넵틴, 데속시피프라드롤, 덱스메틸페니데이트, 디페메토렉스, 디페닐프롤리놀, 에틸페니데이트, 펜캄파민, 펜카민, 레페타민, 메소카르브, 메틸렌디옥시피로발레론, 메틸페니데이트, 노미펜신, 옥솔린산, 피프라드롤, 프롤린탄, 피로발레론, 타메트랄린, 네포팜, 아미티파딘, 테소펜신, 테다티옥세틴, 비시파딘, 브라소펜신, 디클로펜신, 탁실, 나피론, 히퍼포린, 토피라메이트, 조니사미드, 메트포르민, 로지글리타존, 피오글리타존, 트로글리타존, 엑세나티드, 리라글루티드, 타스포글루티드, 오비네피티드, 프람린티드, 펩티드 YY, 바비카세린, 날트렉손, 날록손, 펜테르민, 디에틸프로피온, 옥시메타졸린, 벤플루오렉스, 부테놀리드, 카틴, 펜메트라진, 페닐프로판올아민, 피로글루타밀-히스티딜-글리신, 암페타민, 벤즈페타민, 덱스메틸페니데이트, 덱스트로암페타민, 메틸렌디옥시피로발레론, 글루카곤, 리스덱스암페타민, 메타암페타민, 메틸페니데이트, 펜디메트라진, 펜에틸아민, 카페인, 브로모크립틴, 에페드린, 슈도에페드린, 리모나반트, 수리나반트, 미르타자핀, 다이어트엑스®, MG 플러스 프로테인™, 인슐린, 및 렙틴 및 이의 약학적으로 허용되는 염 및 조합물로부터 선택된다. 일부 구현예에서, 체중 감량 약물은 펜테르민이다.
일부 구현예에서, 체중 관리는 외과적 체중 감소 절차를 추가로 포함한다.
일부 구현예에서, 체중 관리는 저칼로리 식이를 추가로 포함한다.
일부 구현예에서, 체중 관리는 규칙적인 운동 프로그램을 추가로 포함한다.
일부 구현예에서, 개체는 25 kg/m2 이상의 초기 체질량 지수를 갖는다.
일부 구현예에서, 개체는 27 kg/m2 이상의 초기 체질량 지수를 갖는다.
일부 구현예에서, 개체는 적어도 하나의 체중 관련 동반이환 병태를 갖는다.
일부 구현예에서, 체중 관련 동반이환 병태는 고혈압, 이상지혈증, 심혈관 질환, 글루코스 불내성 및 수면 무호흡으로부터 선택된다.
일부 구현예에서, 체중 관련 동반이환 병태는 고혈압, 이상지혈증, 및 제2형 당뇨병으로부터 선택된다.
일부 구현예에서, 개체는 30 kg/m2 이상의 초기 체질량 지수를 갖는다.
제2형 당뇨병의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 기재된 화합물을 본원에 기재된 바와 같은 하나 이상의 체중 감량 약물과 조합하여 투여하는 것을 포함하는, 상기 개체에서 제2형 당뇨병을 치료하는 방법이 또한 제공된다.
대표적인 방법
식품 섭취의 감소를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 식품 섭취를 감소시키는 방법이 제공된다.
또한, 포만감 유도를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 포만감을 유도하는 방법이 제공된다.
또한, 비만 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 비만을 치료하는 방법이 제공된다.
또한, 비만 예방을 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 비만을 예방하는 방법이 제공된다.
또한, 체중 관리를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 체중을 관리하는 방법이 제공된다.
일부 구현예에서, 체중 관리는 외과적 체중 감소 절차를 추가로 포함한다.
일부 구현예에서, 체중 관리는 외과적 체중 감소 절차를 추가로 포함한다.
일부 구현예에서, 체중 관리는 체중 감소를 포함한다.
일부 구현예에서, 체중 관리는 체중 감소의 유지를 포함한다.
일부 구현예에서, 체중 관리는 저칼로리 식이를 추가로 포함한다.
일부 구현예에서, 체중 관리는 규칙적인 운동 프로그램을 추가로 포함한다.
일부 구현예에서, 체중 관리는 저칼로리 식이 및 규칙적인 운동 프로그램 둘 다를 추가로 포함한다.
일부 구현예에서, 체중 관리를 필요로 하는 개체는 30 kg/m2 이상의 초기 체질량 지수를 가진 비만 환자이다.
일부 구현예에서, 체중 관리를 필요로 하는 개체는 적어도 하나의 체중 관련 동반이환 병태의 존재 하에 27 kg/m2 이상의 초기 체질량 지수를 가진 과체중 환자이다.
일부 구현예에서, 체중 관련 동반이환 병태는 고혈압, 이상지혈증, 심혈관 질환, 글루코스 불내성, 및 수면 무호흡으로부터 선택된다.
항정신병제-유발 체중 증가의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 항정신병제-유발 체중 증가를 치료하는 방법이 또한 제공된다.
제2형 당뇨병의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 제2형 당뇨병을 치료하는 방법이 또한 제공된다.
제2형 당뇨병의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 1종 이상의 제2형 당뇨병 의약과 조합하여 투여하는 것을 포함하는, 상기 개체에서 제2형 당뇨병을 치료하는 방법이 또한 제공된다.
일부 구현예에서, 1종 이상의 제2형 당뇨병 치료의 필요성이 감소된다.
일부 구체예에서, 하나 이상의 제2형 당뇨병 치료에 대한 필요성이 제거된다.
제2형 당뇨병의 예방을 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 제2형 당뇨병을 예방하는 방법이 또한 제공된다.
프레더-윌리 증후군의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 프레더-윌리 증후군을 치료하는 방법이 또한 제공된다.
중독의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 중독을 치료하는 방법이 또한 제공된다.
약물 및 알콜 중독의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 약물 및 알콜 중독을 치료하는 방법이 또한 제공된다.
알콜 중독의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 알콜 중독을 치료하는 방법이 또한 제공된다.
약물 중독의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 약물 중독을 치료하는 방법이 또한 제공된다.
일부 구현예에서, 약물은 암페타민, 치환된 암페타민, 벤조디아제핀, 비정형 벤조디아제핀 수용체 리간드, 마리화나, 코카인, 덱스트로메토르판, GHB, LSD, 케타민, 모노아민 재흡수 억제제, 니코틴, 아편제, PCP, 치환된 펜에틸아민, 실로시빈, 및 합성 스테로이드로부터 선택된다.
일부 구현예에서, 약물은 니코틴이다.
일부 구현예에서, 약물은 암페타민이다.
일부 구현예에서, 약물은 치환된 암페타민이다.
일부 구현예에서, 약물은 메타암페타민이다.
일부 구현예에서, 약물은 벤조디아제핀이다.
일부 구현예에서, 약물은 비정형 벤조디아제핀 수용체 리간드이다.
일부 구현예에서, 약물은 마리화나이다.
일부 구현예에서, 약물은 코카인이다.
일부 구현예에서, 약물은 덱스트로메토르판이다.
일부 구현예에서, 약물은 에스조피클론이다.
일부 구현예에서, 약물은 GHB이다.
일부 구현예에서, 약물은 LSD이다.
일부 구현예에서, 약물은 케타민이다.
일부 구현예에서, 약물은 모노아민 재흡수 억제제이다.
일부 구현예에서, 약물은 아편제이다.
일부 구현예에서, 약물은 PCP이다.
일부 구현예에서, 약물은 치환된 펜에틸아민이다.
일부 구현예에서, 약물은 실로시빈이다.
일부 구현예에서, 약물은 합성 스테로이드이다.
일부 구현예에서, 약물은 졸피뎀이다.
흡연 중단 보조를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 흡연 중단을 보조하는 방법이 또한 제공된다.
담배 의존의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 담배 의존을 치료하는 방법이 또한 제공된다.
니코틴 의존의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 니코틴 의존을 치료하는 방법이 또한 제공된다.
알콜중독의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 알콜중독을 치료하는 방법이 또한 제공된다.
병적 도박의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 병적 도박을 치료하는 방법이 또한 제공된다.
보상 결핍 증후군의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 보상 결핍 증후군을 치료하는 방법이 또한 제공된다.
성 중독의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 성 중독을 치료하는 방법이 또한 제공된다.
강박 스펙트럼 장애의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 강박 스펙트럼 장애를 치료하는 방법이 또한 제공된다.
충동 조절 장애의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 충동 조절 장애를 치료하는 방법이 또한 제공된다.
손톱 물어뜯기의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 손톱 물어뜯기를 치료하는 방법이 또한 제공된다.
교조증의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 교조증을 치료하는 방법이 또한 제공된다.
수면 장애의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 수면 장애를 치료하는 방법이 또한 제공된다.
불면증의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 불면증을 치료하는 방법이 또한 제공된다.
분절 수면 구조의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 분절 수면 구조를 치료하는 방법이 또한 제공된다.
서파 수면 장애의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 서파 수면 장애를 치료하는 방법이 또한 제공된다.
요실금의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 요실금을 치료하는 방법이 또한 제공된다.
정신 장애의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 정신 장애를 치료하는 방법이 또한 제공된다.
정신분열증의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 정신분열증을 치료하는 방법이 또한 제공된다.
신경성 식욕부진의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 신경성 식욕부진을 치료하는 방법이 또한 제공된다.
신경성 폭식증의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 신경성 폭식증을 치료하는 방법이 또한 제공된다.
알츠하이머병의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 알츠하이머병을 치료하는 방법이 또한 제공된다.
성 기능 장애의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 성 기능 장애를 치료하는 방법이 또한 제공된다.
발기 부전의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 발기 부전을 치료하는 방법이 또한 제공된다.
발작 장애의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 발작 장애를 치료하는 방법이 또한 제공된다.
간질의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 간질을 치료하는 방법이 또한 제공된다.
드라베 증후군의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 드라베 증후군을 치료하는 방법이 또한 제공된다.
운동 장애의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 운동 장애를 치료하는 방법이 또한 제공된다.
파킨슨병의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 파킨슨병을 치료하는 방법이 또한 제공된다.
항정신병-유발 운동 장애의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 항정신병-유발 운동 장애를 치료하는 방법이 또한 제공된다.
고혈압의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 고혈압을 치료하는 방법이 또한 제공된다.
이상지혈증의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 이상지혈증을 치료하는 방법이 또한 제공된다.
비알콜성 지방간의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 비알콜성 지방간을 치료하는 방법이 또한 제공된다.
비만-관련 신장 질환을 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 비만-관련 신장 질환을 치료하는 방법이 또한 제공된다.
수면 무호흡의 치료를 필요로 하는 개체에게 치료 유효량의 본원에 제공된 화합물을 투여하는 것을 포함하는, 상기 개체에서 수면 무호흡을 치료하는 방법이 또한 제공된다.
식품 섭취를 감소시키기 위한 약제의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
포만감을 유도하기 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
비만의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
비만의 예방을 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
또한, 체중 관리를 위한 약제의 제조를 위한 본원에 제공된 화합물의 용도가 제공된다.
일부 구현예에서, 체중 관리는 외과적 체중 감소 절차를 추가로 포함한다.
일부 구현예에서, 체중 관리는 체중 감소를 포함한다.
일부 구현예에서, 체중 관리는 체중 감소의 유지를 포함한다.
일부 구현예에서, 체중 관리는 저칼로리 식이를 추가로 포함한다.
일부 구현예에서, 체중 관리는 규칙적인 운동 프로그램을 추가로 포함한다.
일부 구현예에서, 체중 관리는 저칼로리 식이 및 규칙적인 운동 프로그램 둘 다를 추가로 포함한다.
일부 구현예에서, 체중 관리를 필요로 하는 개체는 30 kg/m2 이상의 초기 체질량 지수를 가진 비만 환자이다.
일부 구현예에서, 체중 관리를 필요로 하는 개체는 적어도 하나의 체중 관련 동반이환 병태의 존재 하에 27 kg/m2 이상의 초기 체질량 지수를 가진 과체중 환자이다.
일부 구현예에서, 체중 관련 동반이환 병태는 고혈압, 이상지혈증, 심혈관 질환, 글루코스 불내성, 및 수면 무호흡으로부터 선택된다.
항정신병제-유발 체중 증가의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
제2형 당뇨병의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
1종 이상의 제2형 당뇨병 의약과 조합하여 제2형 당뇨병의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
일부 구현예에서, 1종 이상의 제2형 당뇨병 치료의 필요성이 감소된다.
일부 구체예에서, 1종 이상의 제2형 당뇨병 치료에 대한 필요성이 제거된다.
제2형 당뇨병의 예방을 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
프레더-윌리 증후군의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
중독의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
약물 및 알콜 중독의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
알콜 중독의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
약물 중독의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
일부 구현예에서, 약물은 암페타민, 치환된 암페타민, 벤조디아제핀, 비정형 벤조디아제핀 수용체 리간드, 마리화나, 코카인, 덱스트로메토르판, GHB, LSD, 케타민, 모노아민 재흡수 억제제, 니코틴, 아편제, PCP, 치환된 펜에틸아민, 실로시빈, 및 합성 스테로이드로부터 선택된다.
일부 구현예에서, 약물은 니코틴이다.
일부 구현예에서, 약물은 암페타민이다.
일부 구현예에서, 약물은 치환된 암페타민이다.
일부 구현예에서, 약물은 메타암페타민이다.
일부 구현예에서, 약물은 치환된 벤조디아제핀이다.
일부 구현예에서, 약물은 비정형 벤조디아제핀 수용체 리간드이다.
일부 구현예에서, 약물은 마리화나이다.
일부 구현예에서, 약물은 코카인이다.
일부 구현예에서, 약물은 덱스트로메토르판이다.
일부 구현예에서, 약물은 에스조피클론이다.
일부 구현예에서, 약물은 GHB이다.
일부 구현예에서, 약물은 LSD이다.
일부 구현예에서, 약물은 케타민이다.
일부 구현예에서, 약물은 모노아민 재흡수 억제제이다.
일부 구현예에서, 약물은 아편제이다.
일부 구현예에서, 약물은 PCP이다.
일부 구현예에서, 약물은 치환된 펜에틸아민이다.
일부 구현예에서, 약물은 실로시빈이다.
일부 구현예에서, 약물은 합성 스테로이드이다.
일부 구현예에서, 약물은 졸피뎀이다.
흡연 중단을 보조하기 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
담배 의존의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
니코틴 의존의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
알콜중독의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
병적 도박의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
보상 결핍 증후군의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
성 중독의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
강박 스펙트럼 장애의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
충동 조절 장애의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
손톱 물어뜯기의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
교조증의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
수면 장애의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
불면증의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
분절 수면 구조의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
서파 수면 장애의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
요실금의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
정신 장애의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
정신분열증의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
신경성 식욕부진의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
신경성 폭식증의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
알츠하이머병의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
성 기능 장애의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
발기 부전의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
발작 장애의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
간질의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
드라베 증후군의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
운동 장애의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
파킨슨병의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
항정신병제-유발 운동 장애의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
고혈압의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
이상지혈증의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
비알콜성 지방간 질환의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
비만-관련 신장 질환의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
수면 무호흡의 치료를 위한 의약의 제조를 위한 본원에 제공된 화합물의 용도가 또한 제공된다.
일부 구현예에서, 개체는 또한 보충제를 처방 및/또는 투여받고 있다.
본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 적어도 1종의 보충제를 포함하는 조성물이 또한 제공된다.
본원에 사용된 바와 같이, "보충제"는 본원에 기재된 5-HT2C 작용제의 활성을 보완하는 추가의 치료제를 지칭하며 그 이유는 보충제가 담배 흡연의 빈도를 감소시키려고 시도하는 개체에서 담배 흡연의 빈도를 감소시키거나; 담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조하거나; 흡연 중단 및 연관된 체중 증가 예방을 보조하거나; 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 제어하거나; 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 감소시키거나; 니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에서 니코틴 의존, 중독 및/또는 금단을 치료하거나; 니코틴 사용을 중단하려고 시도하는 개체에 의한 니코틴의 재발 사용의 가능성을 감소시키는 방법과 관련되기 때문이다. 일부 구현예에서, "보충제"는 펜테르민이 아니다.
보충제는 니코틴 대체 요법, 항우울제 및 항불안제, 예컨대, 선택적 세로토닌 재흡수 억제제, 예를 들어, 시탈로프람, 에스시탈로프람, 플루옥세틴, 파록세틴, 세르트랄린 등을 포함한다. 세로토닌 및 노르에피네프린 재흡수 억제제, 예컨대, 둘록세틴, 벤라팍신, 등이 또한 사용될 수 있다. 노르에피네프린 및 도파민 재흡수 억제제, 예컨대, 부프로피온이 또한 사용될 수 있다. 테트라사이클릭 항우울제, 예컨대, 미르타자핀; 조합된 재흡수 억제제 및 수용체 차단제, 예컨대, 트라조돈, 네파조돈, 마프로틸린; 트리사이클릭 항우울제, 예컨대, 아미트립틸린, 아목사핀, 데시프라민, 독세핀, 이미프라민, 노르트립틸린, 프로트립틸린 및 트리미프라민; 모노아민 옥시다제 억제제, 예컨대, 페넬진, 트라닐시프로민, 이소카르복사지드, 세레길린; 벤조디아제핀, 예컨대, 로라제팜, 클로나제팜, 알프라졸람, 및 디아제팜; 세로토닌 1A 수용체 작용제, 예컨대, 부스피론, 아리피라졸, 쿠에티아핀, 탄도스피론 및 비페프루녹스; 및 베타-아드레날린성 수용체 차단제, 예컨대, 프로프라놀롤이 또한 사용될 수 있다. 다른 보충제는 다른 약리학상 작용제, 예컨대, UTP, 아밀로리드, 항생제, 기관지 확장제, 항염증제 및 점액 용해제(예를 들어, n-아세틸-시스테인)을 포함한다.
일부 구현예에서, 보충제는 니코틴 대체 요법로부터 선택된다. 일부 구현예에서, 니코틴 대체 요법은 니코틴 검, 니코틴 경피 시스템, 니코틴 로젠지, 니코틴 마이크로탭, 및 니코틴 스프레이 또는 흡입제로부터 선택된다. 일부 구현예에서, 보충제는 전자 담배이다.
일부 구현예에서, 보충제는 니코틴 검이고, 조성물은 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 니코틴 경피 시스템을 포함하는 조성물이다.
일부 구현예에서, 보충제는 니코틴 경피 시스템이고, 조성물은 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 니코틴 검을 포함하는 조성물이다.
일부 구현예에서, 보충제는 니코틴 로젠지이고, 조성물은 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 니코틴 로젠지를 포함하는 조성물이다.
일부 구현예에서, 보충제는 니코틴 마이크로탭이고, 조성물은 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 니코틴 마이크로탭을 포함하는 조성물이다.
일부 구현예에서, 보충제는 니코틴 스프레이 또는 흡입제이고 조성물은 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 니코틴 스프레이 또는 흡입제를 포함하는 조성물이다.
일부 구현예에서, 보충제는 전자 담배이고, 조성물은 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 전자 담배를 포함하는 조성물이다.
일부 구현예에서, 보충제는 항우울제로부터 선택되고, 조성물은 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 항우울제로부터 선택된 보충제를 포함하는 조성물이다.
일부 구현예에서, 보충제는 항우울제이고, 조성물은 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 항우울제를 포함하는 조성물이다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 항우울제는 고정 용량 조합 제품으로서 제제화된다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 항우울제는 공동-포장 제품으로서 제제화된다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 항우울제는 보조 요법을 위해 제제화된다.
일부 구현예에서, 보충제는 노르트립틸린이고, 조성물은 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 노르트립틸린을 포함하는 조성물이다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 노르트립틸린은 고정 용량 조합 제품으로서 제제화된다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 노르트립틸린은 공동-포장 제품으로서 제제화된다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 노르트립틸린은 보조 요법을 위해 제제화된다.
일부 구현예에서, 보충제는 노르트립틸린이고, 조성물은 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 부프로피온을 포함하는 조성물이다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 부프로피온은 고정 용량 조합 제품으로서 제제화된다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 부프로피온 공동-포장 제품으로서 제제화된다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 부프로피온은 보조 요법을 위해 제제화된다.
일부 구현예에서, 보충제는 노르트립틸린이며, 조성물은 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 클로니딘을 포함하는 조성물이다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 클로니딘은 고정 용량 조합 제품으로서 제제화된다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 클로니딘은 공동-포장 제품으로서 제제화된다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 클로니딘은 보조 요법을 위해 제제화된다.
일부 구현예에서, 보충제는 노르트립틸린이며, 조성물은 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 바레니클린을 포함하는 조성물이다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 바레니클린은 고정 용량 조합 제품으로서 제제화된다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 바레니클린은 공동-포장 제품으로서 제제화된다.
일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 바레니클린은 보조 요법을 위해 제제화된다.
일부 구현예에서, 개체는 보충제로 이전에 치료를 받았다. 일부 구현예에서, 개체는 보충제를 사용한 이전 치료에 난치성이었다.
일부 구현예에서, 개체는 니코틴 대체 요법으로 이전에 치료를 받았다. 일부 구현예에서, 개체는 니코틴 대체 요법을 사용한 이전 치료에 불응하였다.
다음을 위한 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 적어도 1종의 보충제를 포함하는 조성물이 또한 제공된다:
담배 흡연의 빈도를 감소시키려고 시도하는 개체에서 담배 흡연의 빈도를 감소;
담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조;
흡연 중단 보조 및 연관된 체중 증가 예방;
담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 제어;
담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 감소;
니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에서 니코틴 의존, 중독 및/또는 금단을 치료; 또는
니코틴 사용을 중단하려고 시도하는 개체에 의한 니코틴의 재발 사용의 가능성을 감소.
다음을 위한 약제로서 사용하기 위한 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 적어도 1종의 보충제를 포함하는 조성물이 또한 제공된다:
담배 흡연의 빈도를 감소시키려고 시도하는 개체에서 담배 흡연의 빈도를 감소;
담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조;;
흡연 중단 보조 및 연관된 체중 증가 예방;
담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 제어;
담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 감소;
니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에서 니코틴 의존, 중독 및/또는 금단을 치료; 또는
니코틴 사용을 중단하려고 시도하는 개체에 의한 니코틴의 재발 사용의 가능성을 감소.
담배 흡연의 빈도를 감소시키려고 시도하는 개체에서 담배 흡연의 빈도를 감소시키거나; 담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조하거나; 흡연 중단 및 연관된 체중 증가 예방을 보조하거나; 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 제어하거나; 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 감소시키거나; 니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에서 니코틴 의존, 중독 및/또는 금단을 치료하거나; 니코틴 사용을 중단하려고 시도하는 개체에 의한 니코틴의 재발 사용의 가능성을 감소시키기 위한 의약의 제조에서의 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 적어도 1종의 보충제를 포함하는 조성물이 또한 제공된다.
본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물 및 적어도 1종의 보충제를 포함하는 조성물의 단위 투여 형태가 또한 제공된다.
담배 흡연의 빈도를 감소시키려고 시도하는 개체에서 담배 흡연의 빈도를 감소시키거나; 담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조하거나; 흡연 중단 및 연관된 체중 증가 예방을 보조하거나; 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 제어하거나; 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 감소시키거나; 니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에서 니코틴 의존, 중독 및/또는 금단을 치료하거나; 니코틴 사용을 중단하려고 시도하는 개체에 의한 니코틴의 재발 사용의 가능성을 감소시키기 위한, 보충제와 조합하여 사용하기 위한, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물이 또한 제공된다.
본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물과 조합하여 사용하기 위한, 니코틴 대체 요법으로부터 선택된 보충제가 또한 제공된다.
담배 흡연의 빈도를 감소시키려고 시도하는 개체에서 담배 흡연의 빈도를 감소시키거나; 담배 제품의 사용을 중단하거나 줄이려고 시도하는 개체에서 담배 제품의 사용의 중단 또는 줄임을 보조하거나; 흡연 중단 및 연관된 체중 증가 예방을 보조하거나; 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 제어하거나; 담배 흡연을 중단하려고 시도하는 개체에 의한 흡연 중단과 연관된 체중 증가를 감소시키거나; 니코틴 의존, 중독 및/또는 금단을 치료하려고 시도하는 개체에서 니코틴 의존, 중독 및/또는 금단을 치료하거나; 니코틴 사용을 중단하려고 시도하는 개체에 의한 니코틴의 재발 사용의 가능성을 감소시키기 위한, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물과 조합하여 사용하기 위한 보충제가 또한 제공된다.
일부 구현예에서, 화합물은 즉시-방출형 투여 형태로서 제제화되고 보충제는 즉시-방출형 투여 형태로서 또한 제제화된다. 일부 구현예에서, 5-HTC 작용제는 즉시-방출형 투여 형태로서 제제화되고 보충제는 변형-방출형 투여 형태로서 제제화된다. 일부 구현예에서, 화합물은 변형-방출형 투여 형태로서 제제화되고 보충제는 즉시-방출형 투여 형태로서 제제화된다. 일부 구현예에서, 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물은 변형-방출형 투여 형태로서 제제화되고 보충제는 변형-방출형 투여 형태로서 또한 제제화된다.
본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물은 본원에서 확인된 1종 이상의 다른 보충제와 순차적으로 또는 공동으로 투여될 수 있다. 제제 및 약리학상 제제의 양은, 예를 들어, 사용되는 약리학상 제제의 유형, 및 투여 일정 및 경로에 따라 달라진다.
보충제는 본원에 제공된 화합물, 및 이의 염, 용매화물, 및 수화물로부터 선택된 화합물과 함께 부수적으로 전달될 수 있거나, 독립적으로 투여될 수 있다. 보충제 전달은 경구, 흡입, 주사 등을 포함한 관련 기술분야에 공지된 임의의 적합한 방법을 통할 수 있다.
일부 구현예에서, 본원에 기재된 방법은 개체에게 교육 자료 및/또는 상담을 제공하는 단계를 추가로 포함한다. 일부 구현예에서, 상담은 흡연 중단에 관한 것이다. 일부 구현예에서, 상담은 식이 요법 및 운동과 관련된 상담을 제한없이 포함한, 체중 관리에 관한 것이다. 일부 구현예에서, 식이 요법 및 운동과 관련된 상담을 제한없이 포함한, 흡연 중단 및 체중 관리 둘 다에 관한 것이다.
일부 구현예에서, 본원에 기재된 방법은 상기 개체에게 생화학적 피드백; 침 요법; 최면; 거동 중재; 지원 서비스; 및/또는 정신사회적 치료를 제공하는 단계를 추가로 포함한다.
본원에 기재된 투여 형태가 본원에 기재된 화합물, 본원에 기재된 화합물의 약학적으로 허용되는 염, 본원에 기재된 화합물의 용매화물 또는 수화물, 또는 본원에 기재된 화합물의 약학적으로 허용되는 염의 용매화물 또는 수화물을 활성 성분으로서 포함할 수 있다는 것은 관련 기술분야의 통상의 기술자에게 명백할 것이다. 또한, 본원에 기재된 화합물 및 이의 염의 다양한 수화물 및 용매화물은 제약 조성물의 제조에 있어서 중간체로서의 용도를 가질 것이다. 본원에 언급된 것들 이외에 적합한 수화물 및 용매화물을 제조하고 확인하기 위한 통상의 절차는 관련 기술분야의 통상의 기술자에게 널리 공지되어 있다; 예를 들어 pages 202-209 of K. J. Guillory, "Generation of Polymorphs, Hydrates, Solvates, 및 Amorphous Solids," in: Polymorphism in Pharmaceutical Solids, ed. Harry G. Britain, Vol. 95, Marcel Dekker, Inc. , New York, 1999를 참조한다. 따라서, 본 개시내용의 한 측면은 본원에 기재된 화합물 및/또는 이의 제약상 허용되는 염(이는 관련 기술분야에 공지된 방법, 예컨대, 열중량측정 분석(TGA), TGA-질량 분광학, TGA-적외선 분광학, 분말 X-선 회절(XRPD), 칼 피셔 적정, 고해상도 X-선 회절 등에 의해 단리하고 특성화할 수 있음)의 수화물 및 용매화물의 투여 방법에 관한 것이다. 통상의 기준으로 용매화물 및 수화물을 확인하기 위한 신속하고 효율적인 서비스를 제공하는 다수의 기업이 존재한다. 이러한 서비스를 제공하는 회사의 예는 윌밍턴 파마테크(Wilmington PharmaTech)(미국 델라웨어주 윌밍턴), 아반티움 테크놀로지즈(Avantium Technologies)(암스테르담) 및 앱투이트(Aptuit)(코네티컷트주 그린위치)를 포함한다.
유사다형성
다형성은 결정 격자에서 분자의 상이한 배열 및/또는 형태를 갖는 둘 이상의 결정질상으로서 존재하는 물질의 능력이다. 다형체는 액체 상태 또는 기체 상태에서 동일한 특성을 나타내지만, 이들은 고체 상태에서 상이하게 거동할 수 있다.
단일-성분 다형체 이외에도, 약물은 염 및 다른 다성분 결정질상으로서 또한 존재할 수 있다. 예를 들어, 용매화물 및 수화물은 API 호스트, 및 게스트로서의 용매 또는 물 분자 중 하나를 각각 함유할 수 있다. 유사하게, 게스트 화합물이 실온에서 고체인 경우, 생성된 형태는 종종 공결정으로 칭해진다. 염, 용매화물, 수화물 및 공결정은 또한 다형성을 나타낼 수 있다. 동일한 API 호스트를 공유하지만 이의 게스트에 대해 상이한 결정질상은, 서로의 유사다형체로서 지칭될 수 있다.
용매화물은 분명한 결정 격자에서 결정화된 용매 분자를 함유한다. 결정화된 용매가 물인 용매화물은 수화물로 지칭된다. 물은 대기 중의 구성성분이기 때문에, 약물의 수화물은 오히려 쉽게 형성될 수 있다.
최근에, 245개의 화합물의 다형체 스크리닝은 그들 중 약 90%가 다수의 고체 형태를 나타내는 것을 밝혀냈다. 전반적으로, 화합물의 대략 절반은 다형성이었으며, 이들은 종종 1개 내지 3개의 형태를 가졌다. 화합물 중 약 1/3은 수화물을 형성하였고, 약 1/3은 용매화물을 형성하였다. 64개의 화합물의 공결정 스크리닝으로부터의 데이터는 수화물 또는 용매화물 이외에 60%가 공결정을 형성함을 나타냈다. (G. P. Stahly, Crystal Growth & Design(2007), 7(6), 1007-1026. )
동위원소
본 개시내용은 본 발명의 염 및 이의 결정질 형태에 존재하는 원자의 모든 동위원소를 포함한다. 동위원소는 원자 번호는 동일하지만, 질량수는 상이한 원자들을 포함한다. 본 발명의 한 측면은 원자 번호는 동일하지만, 질량수는 상이한 원자로 대체된, 본 발명의 염 및 이의 결정질 형태에 존재하는 하나 이상의 원자의 모든 조합을 포함한다. 이의 일례로는 본 발명의 염 및 이의 결정질 형태 중 하나에서 발견되는 천연적으로 가장 풍부한 동위원소, 예컨대, 1H 또는 12C인 원자를 천연적으로 가장 풍부한 것이 아닌 동위원소, 예컨대, 2H 또는 3H(1H를 대체), 또는 11C, 13C, 또는 14C(12C를 대체)인 상이한 원자로 대체하는 것이다. 이러한 대체가 일어난 염은 동위원소-표지된 것으로서 일반적으로 지칭된다. 본 발명의 염 및 이의 결정질 형태의 동위원소-표지화는 관련 기술분야의 통상의 기술자에게 공지된 여러 가지의 상이한 합성 방법 중 어느 하나를 사용하여 완수될 수 있고, 이는 이러한 동위원소-표지화 수행에 필요한 합성 방법 및 이용가능한 시약에 대한 이해로 쉽게 확인된다. 일반적인 예로서, 그리고 제한없이, 수소의 동위원소는 2H(중수소) 및 3H(삼수소)를 포함한다. 탄소 동위원소는 11C, 13C, 및 14C를 포함한다. 질소 동위원소 13N 및 15N을 포함한다. 산소 동위원소는 15O, 17O, 및 18C를 포함한다. 불소 동위원소는 18F를 포함한다. 황 동위원소는 35S를 포함한다. 염소 동위원소는 36Cl을 포함한다. 브로민 동위 원소는 75Br, 76Br, 77Br, 및 82Br을 포함한다. 요오드 동위원소는 123I, 124I, 125I, 및 131I를 포함한다. 본 발명의 또 다른 측면은 본 발명의 염 및 이의 결정질 형태 중 하나 이상을 포함하는, 예컨대, 합성, 사전 제제화 등 동안 제조된 것과 같은 조성물, 및 예컨대, 포유동물에서 본원에 기재된 장애 중 하나 이상을 치료하는데 사용하기 위한 의도로 제조된 것과 같은 제약 조성물을 포함하며, 여기서, 조성물 중 동위원소의 천연적으로 발생된 분포는 교란된다. 본 발명의 또 다른 측면은 염이 하나 이상의 위치에서 천연적으로 가장 풍부한 동위원소 이외의 동위원소로 대체된, 본원에 기재된 바와 같은 염 및 이의 결정질 형태를 포함하는 조성물 및 약학 조성물을 포함한다. 이러한 동위원소의 교란 또는 농축을 측정하는 방법, 예컨대, 질량 분광측정법은 쉽게 이용가능하고, 방사성-동위원소인 동위원소의 경우는 추가의 방법, 예컨대, HPLC 또는 GC와 관련되어 사용되는 무선 검파기가 이용가능하다.
원하는 약리학적 프로파일을 유지하면서 흡수, 분포, 대사, 배설 및 독성(ADMET) 특성을 개선시키는 것이 약물 개발의 주요 도전 과제이다. ADMET 특성을 개선시키기 위한 구조적 변화는 종종 납 화합물의 약리학을 변경시킨다. 중수소 치환이 ADMET 특성에 미치는 영향은 예측할 수 없지만, 선택적 경우에 중수소는 이의 약리학의 섭동을 최소화하면서 화합물의 ADMET 특성을 개선시킬 수 있다. 중수소가 치료 실체에서의 개선을 가능하게 하는 2가지 예는, CTP-347 및 CTP-354이다. CTP-347은 파록세틴의 임상적으로 관찰되는 CYP2D6의 메커니즘-기반 불활성화에 대한 감소된 원인을 가진 파록세틴의 중수소화된 버전이다. CTP-354는 저조한 약물동태학(PK) 특성으로 인해 개발되지 않은 유망한 전임상 감마-아미노부티르산 A 수용체(GABAA) 조정제(L-838417)의 중수소화된 버전이다. 둘 다의 경우에, 중수소 치환은 모든 수소 화합물에 비해 생화학적 효력 및 선택성을 상당히 변경시키지 않으면서 안전성, 효능, 및/또는 내약성을 개선시키는 잠재력을 제공하는 개선된 ADMET 프로파일을 발생시켰다. 상응하는 모든 수소 화합물에 비해 개선된 ADMET 프로파일 및 실질적으로 유사한 생화학적 효력 및 선택성을 가진 본 발명의 중수소 치환된 화합물이 제공된다.
다른 유용성
인간을 포함한 조직 샘플에서 5-HT2C 수용체를 편재화하고 정량화하기 위해, 그리고 5-HT2C 수용체 리간드를 방사능 표지된 화합물의 억제 결합에 의해 확인하기 위해, 방사능 영상화에서 뿐만 아니라 시험관내 및 생체내 검정 둘 다에서도 유용한 방사능 표지된 본원에 제공된 화합물이 제공된다. 이러한 방사능 표지된 화합물을 포함하는 신규 5-HT2C 수용체 검정이 또한 제공된다.
특정 동위원소-표지된 본원에 제공된 화합물은 화합물 및/또는 기질 조직 분포 검정에서 유용하다. 일부 구현예에서, 방사성핵종 3H 및/또는 14C 동위원소가 이러한 연구에서 유용하다. 또한, 보다 무거운 동위원소, 예컨대, 중수소(즉, 2H)로의 치환은 더 큰 대사 안정성으로부터 생긴 특정의 치료 이점(예를 들어, 생체내 반감기 증가 또는 투여 요건의 감소)을 제공할 수 있고, 따라서 일부 상황에서 바람직할 수 있다. 동위원소 표지된 본원에 제공된 화합물은 비-동위원소 표지된 시약에 대해 동위원소 표지된 시약을 치환함으로써 도면 및 실시예에 개시된 절차와 유사한 하기 절차에 의해 일반적으로 제조될 수 있다. 유용한 다른 합성 방법은 하기에 논의된다.
방사성-동위원소를 유기 화합물 내로 혼입하는 합성 방법은 본원에 제공된 화합물에 적용가능하고 관련 기술분야에 널리 공지되어 있다. 이들 합성 방법, 예를 들어, 활성 수준의 삼중수소를 표적 분자 내로 혼입하는 합성 방법은 하기와 같다:
A. 삼중수소 기체를 사용한 촉매적 환원: 이 절차는 보통 높은 특이적 활성 생성물을 수득하고, 할로겐화 또는 불포화 전구체를 필요로 한다.
B. 수소화붕소소듐 [3H]를 사용한 환원: 이 절차는 다소 저렴하고, 알데하이드, 케톤, 락톤, 에스테르 등과 같은 환원성 관능기를 함유하는 전구체를 필요로 한다.
C. 수소화알루미늄리튬 [3H]을 사용한 환원: 이 절차는 거의 이론상의 특이적 활성으로 생성물을 제공한다. 이는 알데하이드, 케톤, 락톤, 에스테르 등과 같은 환원성 관능기를 함유하는 전구체를 또한 필요로 한다.
D. 삼중수소 기체 노출 표지화: 이 절차는 적합한 촉매의 존재 하에 삼중수소 기체에 대해 교환가능한 양성자를 함유하는 전구체를 노출시키는 것을 포함한다.
E. 메틸 아이오다이드 [3H]을 사용한 N-메틸화: 이 절차는 보통 적절한 전구체를 높은 특이적 활성의 메틸 아이오다이드(3H)로 처리함으로써 O-메틸 또는 N-메틸(3H) 생성물을 제조하기 위해 사용된다. 이 방법은 일반적으로 더 높은 특이적 활성, 예컨대, 예를 들어, 약 70 내지 90 Ci/mmol를 허용한다.
활성 수준의 125I를 표적 분자에 혼입하는 합성 방법은 다음을 포함한다:
A. 샌드마이어 및 유사 반응: 이 절차는 아릴 아민 또는 헤테로아릴 아민을 디아조늄 염, 예컨대, 디아조늄 테트라플루오로보레이트 염으로 변형시키고, 후속적으로 Na125I를 사용하여 125I 표지된 화합물로 변환시킨다. 대표적인 절차는 Zhu, G-D. 및 co-workers in J. Org. Chem. , 2002, 67, 943-948에 보고되어 있다.
B. 페놀의 오르토 125아이오딘화: 이 절차는 Collier, T. L. 및 co-workers in J. Labelled Compd. Radiopharm. , 1999, 42, S264-S266에 보고된 바와 같이 페놀의 오르토 위치에 125I의 혼입을 허용한다.
C. 125I를 사용한 아릴 및 헤테로아릴 브로마이드 교환: 이 방법은 일반적으로 2 단계 공정이다. 제1 단계는, 트리-알킬틴할라이드 또는 헥사알킬디틴 [예를 들어, (CH3)3SnSn(CH3)3]의 존재 하에, 예를 들어, Pd 촉매화 반응 [예를 들어, Pd(Ph3P)4]을 이용하여 또는 아릴 또는 헤테로아릴 리튬을 통해 아릴 또는 헤테로아릴 브로마이드를 상응하는 트리-알킬틴 중간체로 전환시키는 것이다. 대표적인 절차는 Le Bas, M. -D. 및 co-workers in J. Labelled Compd. Radiopharm. 2001, 44, S280-S282에 보고되어 있다.
본원에 개시된 방사능표지된 화합물은 화합물을 확인/평가하기 위한 스크리닝 검정에서 사용될 수 있다. 일반적인 용어에서, 새로 합성된 또는 확인된 화합물(즉, 시험 화합물)은 방사능-표지된 화합물의 5-HT2C 수용체로의 결합을 감소시키는 이의 능력으로 평가될 수 있다. 따라서, 5-HT2C 수용체에 결합하는 본원에 개시된 방사능표지된 화합물과 경쟁하는 시험 화합물의 능력은 이의 결합 친화성과 직접 관련된다.
본원에 제공된 특정 표지된 화합물은 특정 5-HT2C 수용체에 결합한다. 일 구현예에서, 표지된 화합물의 IC50은 약 500 μM 미만이다. 일 구현예에서, 표지된 화합물의 IC50은 약 100 μM 미만이다. 일 구현예에서, 표지된 화합물의 IC50은 약 10 μM 미만이다. 일 구현예에서, 표지된 화합물의 IC50은 약 1 μM 미만이다. 일 구현예에서, 표지된 화합물의 IC50은 약 0. 1 μM 미만이다. 일 구현예에서, 표지된 화합물의 IC50은 약 0. 01 μM 미만이다. 일 구현예에서, 표지된 화합물의 IC50은 약 0. 005 μM 미만이다.
개시된 수용체 및 방법의 다른 용도는 그 중에서도 본 개시내용의 검토에 기초하여 관련 기술분야의 통상의 기술자에게 자명할 것이다.
조성물 및 제제
제제는 임의의 적합한 방법, 전형적으로 활성 화합물을 액체 또는 미세하게 분할된 고체 담체 또는 둘 다와 요구되는 비율로 균일하게 혼합한 후, 필요한 경우, 생성된 혼합물을 원하는 형상으로 형성시킴으로써 제조될 수 있다.
종래 부형제, 예컨대, 결합화제, 충전제, 허용되는 습윤화제, 정제화 윤활제 및 붕해제가 경구 투여용 정제 및 캡슐제에 사용될 수 있다. 경구 투여용 액체 제제는 용액제, 에멀젼, 수성 또는 오일성 현탁제, 및 시럽제 형태일 수 있다. 대안적으로, 경구용 제제는 사용 전 물 또는 또 다른 적합한 액체 비히클로 재구성될 수 있는 건식 산제 형태일 수 있다. 추가의 첨가제, 예컨대, 현탁화제 또는 유화제, 비수성 비히클(식용유 포함), 보존제 및 향미제 및 착색제가 액체 제제에 첨가될 수 있다. 비경구 투여 형태는, 본원에 제공된 화합물을 적합한 액체 비히클에 용해시키고, 충전시키기 전, 용액을 필터 멸균시키고, 적절한 바이알 또는 앰플을 실링하여 제조될 수 있다. 이는 단지 관련 기술분야에 널리 공지된, 투여 형태를 제조하는 다수의 적절한 방법의 일부 일례일 뿐이다.
본원에 제공된 화합물은 관련 기술분야의 통상의 기술자에게 널리 공지된 기술을 사용하여 약학 조성물로 제제화될 수 있다. 본원에서 언급된 것 이외의, 적합한 약학적으로 허용되는 담체는 관련 기술분야에 공지되어 있다; 예를 들어, Remington, The Science 및 Practice of Pharmacy, 20th Edition, 2000, Lippincott Williams & Wilkins, (Editors: Gennaro et al. )를 참조한다.
예방 또는 치료에 사용하기 위해, 본원에 제공된 화합물은, 대안적 사용에서, 원료 또는 순수한 화학물질로서 투여될 수 있다는 것도 가능하지만, 화합물 또는 활성 성분을, 약학적으로 허용되는 담체를 추가로 포함하는 약학 제제 또는 조성물로서 제공하는 것이 바람직하다.
약학 제제는 경구, 직장, 비강, 국소(협측 및 설하 포함), 질 또는 비경구(근육내, 피하 및 정맥내) 투여용으로 적합한 것 또는 흡입, 통기에 의한, 또는 경피용 패치에 의한 투여에 적합한 형태의 것을 포함한다. 경피용 패치는 약물을 최소로 분해시키면서 효율적인 방식으로 흡수될 수 있도록 약물을 제공함으로써 제어된 속도로 약물을 분배한다. 전형적으로, 경피용 패치는 불투과성 지지층, 단일 감압 접착제 및 이형 라이너가 있는 제거 가능한 보호층을 포함한다. 관련 기술분야의 통상의 기술자는 통상의 기술자의 필요에 기초하여 원하는 효과적인 경피용 패치를 제작하는데 적절한 기법을 이해하고, 인식할 것이다.
따라서, 종래 보조제, 담체, 또는 희석제와 함께, 본원에 제공된 화합물은 제약 제제 및 이의 단위 투여의 형태 내로 배치될 수 있고, 상기 형태로 고체, 예컨대, 이 모두 경구용으로서, 정제 또는 충전된 캡슐제, 또는 액체, 예컨대, 용액제, 현탁제, 에멀젼, 엘릭시르, 겔제 또는 이들로 충전된 캡슐제로서, 직장 투여용으로 좌제 형태로; 또는 비경구용(피하 포함)으로 멸균 주사액의 형태로 사용될 수 있다. 이러한 약학 조성물 및 이의 단위 투여 형태는 추가의 활성 화합물 또는 주성분과 함께 또는 없이, 종래 비율로 종래 성분들을 포함할 수 있으며, 이러한 단위 투여 형태는 사용되는 의도하는 1일 투여량 범위에 비례하는 임의의 적합한 유효량의 활성 성분을 함유할 수 있다.
경구 투여의 경우, 약학 조성물은 예를 들어, 정제, 캡슐제, 현탁제 또는 액체제의 형태일 수 있다. 약학 조성물은 바람직하게는 특정 양의 활성 성분을 함유하는 투여 단위 형태로 제조된다. 이러한 투여 단위의 예는 종래 첨가제, 예컨대, 락토스, 만니톨, 옥수수 전분 또는 감자 전분과 함께; 결합제, 예컨대, 결정질 셀룰로스, 셀룰로스 유도체, 아카시아, 옥수수 전분 또는 젤라틴과 함께; 붕해제, 예컨대, 옥수수 전분, 감자 전분 또는 소듐 카르복시메틸-셀룰로스와 함께; 및 윤활제, 예컨대, 탈크 또는 스테아린산 마그네슘과 함께 포함하는, 캡슐제, 정제, 산제, 과립제 또는 현탁제가 있다. 활성 성분은, 예를 들어, 염수, 덱스트로스 또는 물이 적합한 제약상 허용되는 담체로서 사용될 수 있는 조성물로서 주사에 의해 또한 투여될 수 있다.
본원에 제공된 화합물은 제약 조성물, 특히 5-HT2C 수용체 조정제로서 활성 성분으로서 사용될 수있다. "약학 조성물"의 맥락에서 정의된, 용어 "활성 성분"은 일반적으로 어떤 약학적 효과를 제공하지 않는 것으로 알려진, "불활성 성분"과는 대조적으로, 주요 약리 효과를 제공하는 약학 조성물의 성분을 지칭한다.
본원에 제공된 화합물이 사용될 때, 용량은 광범위한 제한 범위 내에서 달라질 수 있으며, 관례상 및 의사에게 알려져 있는 바와 같이, 각각의 개별 사례별로 개체의 상태에 맞게 적합화되어야 한다. 예를 들어, 이는 치료하고자 하는 질병의 성질 및 중증도, 개체, 예컨대, 환자의 상태, 사용되는 화합물, 급성 또는 만성 질환 상태가 치료 또는 예방적으로 수행되는지 여부, 또는 본원에 제공된 화합물 이외에 추가의 활성 화합물이 투여되는지 여부에 따라 달라진다. 대표적인 용량은 약 0. 001 mg 내지 약 5000 mg, 약 0. 001 mg 내지 약 2500 mg, 약 0. 001 mg 내지 약 1000 mg, 약 0. 001 mg 내지 약 500 mg, 약 0. 001 mg 내지 약 250 mg, 약 0. 001 mg to 100 mg, 약 0. 001 mg 내지 약 50 mg 및 약 0. 001 mg 내지 약 25 mg를 포함하나, 이에 제한되지는 않는다. 하루 동안 다중 용량이 투여될 수 있으며, 특히 상대적으로 대량이 필요한 것으로 간주될 때, 예를 들어, 2, 3, 또는 4회분 용량으로 투여될 수 있다. 개체에 따라, 그리고 건강관리 제공자로부터 적절한 것으로 간주되는 바에 따라, 본원에 기재된 용량으로부터 더 많은 양으로 또는 더 적은 양으로 이탈뒬 필요가 있을 수 있다.
본원에 개시된 모든 투여 양은 활성 모이어티, 즉 의도된 약리학적 또는 생리학적 작용을 제공하는 분자 또는 이온에 대해 계산된다.
치료에 사용하는데 필요한 활성 성분, 또는 이의 활성 염 또는 유도체의 양은 선택된 특정 염 뿐만 아니라, 투여 경로, 치료되는 병태의 성질 및 개체의 연령 및 병태에 따라 달라질 것이며, 궁극적으로는 주치의 또는 임상의의 재량에 따라 달라지게 될 것이다. 일반적으로, 관련 기술분야의 통상의 기술자는 모델 시스템, 전형적으로 동물 모델에서 수득된 생체내 데이터를 또 다른, 예컨대, 인간의 것으로 외삽하는 방법을 이해한다. 일부 환경에서, 이들 외삽은 단지 또 다른, 예컨대, 포유동물, 바람직하게는 인간과의 비교로 동물 모델의 체중에 기초할 수 있지만, 더 빈번하게는 이들 외삽은 간단하게 체중에 기초한다기보다는 여러 가지의 인자를 포함한다. 대표적인 인자는 개체의 유형, 연령, 체중, 성별, 식이 및 의학적 상태, 질환의 중증도, 투여 경로, 약리학상 고려 사항, 예컨대, 사용되는 특정 화합물의 활성, 효능, 약물동태학적 성질 및 독성 프로파일, 약물 전달 시스템 사용 여부, 급성 또는 만성 질환 상태가 치료 또는 예방적으로 수행되는지 여부, 또는 본원에 제공된 화합물 이외에 추가의 활성 화합물, 예컨대, 약물 조합의 일부가 투여되는지 여부를 포함한다. 본원에 제공된 화합물 및/또는 조성물을 이용하여 질환 상태를 치료하기 위한 투여 요법은 상기 언급된 바와 같이 여러 가지의 인자에 따라 선택된다. 따라서, 사용되는 실제 투여 요법은 광범위하게 달라질 수 있으므로, 바람직한 투여 요법으로부터 벗어날 수 있으며, 관련 기술분야의 통상의 기술자는 이들 전형적인 범위 밖의 투여량 및 투여 요법을 시험할 수 있고, 적절할 경우, 본원에 개시된 방법에서 사용할 수 있다는 것을 인식할 것이다.
바람직한 용량은 편의상 단일 용량으로, 또는 적절한 간격을 두고 투여되는 분할된 용량으로, 예를 들어, 1일에 2, 3, 4회 또는 그 초과의 하위용량으로 제공될 수 있다. 하위용량 그 자체도 예컨대, 다수회에 걸친 이산형으로 느슨하게 이격된 투여로 추가로 분할될 수 있다. 1일 용량은 특히 적절한 것으로 간주되는 바에 따라 상대적으로 대량이 투여되는 경우에는 수회, 예를 들어, 2, 3 또는 4회부 투여로 분할될 수 있다. 적절할 경우, 개체 거동에 따라, 지시된 1일 용량으로부터 더 많은 양으로 또는 더 적은 양으로 이탈될 필요가 있을 수 있다.
본원에 제공된 화합물은 다종다양한 경구용 및 비경구용 투여 형태로 투여될 수 있다.
본원에 제공된 화합물로부터 약학 조성물을 제조하기 위해, 적합한 약학적으로 허용되는 담체의 선택은 고체, 액체, 또는 둘 다의 혼합물일 수 있다. 고체 형태 제제는 분말, 정제, 환제, 캡슐제, 카쉐제, 좌제 및 분산성 과립제를 포함한다. 고체 담체는 하나 이상의 성분일 수 있고, 이것은 또한 희석제, 향미제, 가용화제, 윤활제, 현탁화제, 결합제, 보존제, 정제 붕해제 또는 캡슐화 물질로서 작용할 수 있다.
분말에서, 담체는 미분된 활성 성분과의 혼합물 중에 있는 미분된 고체이다.
정제에서, 활성 성분은 필요한 결합능을 갖는 담체와 적합한 비율로 혼합되고, 목적하는 형상 및 크기로 압축된다.
분말 및 정제는 다양한 백분율 양의 활성 화합물을 함유할 수 있다. 분말 또는 정제 중의 대표적인 양은 활성 화합물의 0. 5 내지 약 90%일 수 있으나; 통상의 기술자는 이들 범위 이외의 양이 필요한 경우를 알 것이다. 분말 및 정제를 위한 적합한 담체는 탄산마그네슘, 스테아르산 마그네슘, 활석, 당, 락토스, 펙틴, 덱스트린, 전분, 젤라틴, 트라가칸스, 메틸셀룰로스, 소듐 카르복시메틸셀룰로스, 저융점 왁스, 코코아 버터 등을 포함한다. 용어 "제제"는 캡슐제를 제공하는 담체로서의 캡슐화 물질과 활성 화합물의 제제를 지칭하며, 여기서 담체를 함유한 또는 함유하지 않은 활성 성분은 담체에 의해 둘러싸여 있고, 따라서 담체와 회합되어 있다. 유사하게, 카쉐제 및 로젠지제가 포함된다. 정제, 분말, 캡슐제, 환제, 카쉐제 및 로젠지제는 경구 투여에 적합한 고체 형태로서 사용될 수 있다.
좌제를 제조하기 위해, 저융점 왁스, 예컨대, 지방산 글리세리드 또는 코코아 버터와의 혼합물을 먼저 용융시키고, 활성 성분을 그 안에서, 교반에 의해서와 같이, 균질하게 분산시킨다. 그 다음에, 용융된 균질 혼합물을 통상의 크기의 주형에 붓고, 냉각시킴으로써 고체화시킨다.
질 투여에 적합한 제제는 활성 성분 이외에도 관련 기술분야에 적절한 것으로 공지된 바와 같은 담체를 함유한 페사리, 탐폰, 크림제, 겔제, 페이스트, 발포제 또는 분무제로서 존재할 수 있다.
액체 형태 제제는 용액제, 현탁액제 및 에멀젼제, 예를 들어, 물 또는 물-프로필렌 글리콜 용액제를 포함한다. 예를 들어, 비경구 주사 액체 제제는 수성 폴리에틸렌 글리콜 용액 중의 용액제로서 제제화될 수 있다. 주사가능한 제제, 예를 들어, 주사가능한 멸균 수성 또는 유성 현탁액제는 적합한 분산제 또는 습윤제 및 현탁화제를 사용하여, 공지된 기술에 따라 제제화될 수 있다. 주사가능한 멸균 제제는 또한 비경구로 허용되는 비독성 희석제 또는 용매, 예를 들어, 1,3-부탄디올 중 용액으로서의 주사가능한 멸균 용액제 또는 현탁액제일 수 있다. 사용될 수 있는 허용되는 비히클 및 용매 중에, 물, 링거액 및 등장성 소듐 클로라이드 용액이 있다. 또한, 멸균 고정유가 통상적으로 용매 또는 현탁화 매질로서 사용된다. 이러한 목적을 위해, 합성 모노- 또는 디글리세리드를 포함한 임의의 배합 고정유가 사용될 수 있다. 또한, 지방산, 예컨대, 올레산이 주사제의 제조에서의 용도가 밝혀져 있다.
따라서, 본원에 제공된 화합물은 (예를 들어, 주사, 예를 들어 볼루스 주사 또는 연속 주입에 의한) 비경구 투여를 위해 제제화될 수 있고, 앰플, 미리 채워진 시린지, 적은 부피 주입에서의 단위 투여 형태, 또는 첨가된 보존제를 함유한 다중-용량 용기로 존재할 수 있다. 약학 조성물은 유성 또는 수성 비히클 중 현탁액제, 용액제 또는 에멀젼제와 같은 형태를 취할 수 있고, 현탁화제, 안정화제 및/또는 분산제와 같은 제제화제를 함유할 수 있다. 대안적으로, 활성 성분은 사용 전에, 적합한 비히클, 예를 들어 멸균 발열원-무함유 물과 함께 구성하기 위한, 멸균 고체의 무균 단리에 의해 또는 용액으로부터의 동결건조에 의해 얻어진 산제 형태일 수 있다.
경구 사용에 적합한 수성 제제는 물에 활성 성분을 용해시키거나 현탁시키고 필요에 따라 적합한 착색제, 향미제, 안정화제 및 증점제를 첨가함으로써 제조될 수 있다.
경구 사용에 적합한 수성 현탁액제는 미분된 활성 성분을 점성 물질, 예컨대, 천연 또는 합성 검, 수지, 메틸셀룰로스, 소듐 카르복시메틸셀룰로스, 또는 다른 널리 공지된 현탁화제와 함께 물에 분산시킴으로써 제조될 수 있다.
또한, 사용 직전에 경구 투여를 위한 액체 형태 제제로 전환되는 것으로 의도되는 고체 형태 제제가 포함된다. 이러한 액체 형태는, 용액제, 현탁액제 및 에멀젼제를 포함한다. 이들 제제는 활성 성분 이외에도 착색제, 향미제, 안정화제, 완충제, 인공 및 천연 감미제, 분산제, 증점제, 가용화제 등을 함유할 수 있다.
표피로의 국소 투여를 위해, 본원에 제공된 화합물은 연고제, 크림제 또는 로션제로서, 또는 경피 패치로서 제제화될 수 있다.
연고제 및 크림제는, 예를 들어, 적합한 증점제 및/또는 겔화제가 첨가된 수성 또는 유성 기재와 함께 제제화될 수 있다. 로션제는 수성 또는 유성 기재와 함께 제제화될 수 있고, 일반적으로 하나 이상의 유화제, 안정화제, 분산제, 현탁화제, 증점제 또는 착색제를 함유할 것이다.
구강으로의 국소 투여에 적합한 제제는 향미 기재, 통상적으로 수크로스 및 아카시아 또는 트라가칸트 중에 활성제를 포함하는 로젠지제; 불활성 기재, 예컨대, 젤라틴 및 글리세린 또는 수크로스 및 아카시아 중에 활성 성분을 포함하는 파스틸; 및 적합한 액체 담체 중에 활성 성분을 포함한 구강세척제를 포함한다.
용액제 또는 현탁액제는 통상의 수단, 예를 들어 점적기, 피펫 또는 분무기를 사용하여 비강에 직접 도포된다. 제제는 단일 또는 다중-용량 형태로 제공될 수 있다. 점적기 또는 피펫의 다중-용량 형태에서, 이것은 용액제 또는 현탁액제의 적절한 미리 결정된 부피를 환자에게 투여함으로써 달성될 수 있다. 분무기의 경우에, 이것은 예를 들어 계량 원자화 분무 펌프에 의해 달성될 수 있다.
기도로의 투여는 또한 에어로졸 제제에 의해 달성될 수 있고, 여기서 활성 성분은 적합한 추진체를 함유한 가압 팩으로 제공된다. 본원에 제공된 화합물 또는 이들을 포함하는 약학 조성물이 에어로졸(예를 들어, 흡입에 의한 비내 에어로졸)로서 투여되는 경우, 이것은 분무기, 네뷸라이저, 펌프 네뷸라이저, 흡입기, 계량 흡입기 또는 건조 분말 흡입기를 이용하여 수행될 수 있다. 에어로졸로서의 본원에 제공된 화합물의 투여를 위한 제약 형태는 관련 기술분야의 통상의 기술자에게 널리 공지된 공정에 의해 제조될 수 있다. 이의 제조를 위해, 예를 들어, 본원에 제공된 화합물의 용액제 또는 분산액제는 물, 물/알콜 혼합물 또는 적합한 염수 용액 중에서, 예를 들어 통상의 첨가제(예를 들어 벤질 알콜 또는 다른 적합한 보존제), 생체이용률을 증가시키기 위한 흡수 증진제, 가용화제, 분산제 등을 이용하여 사용될 수 있고, 적절한 경우, 통상의 추진체, 예를 들어, 이산화탄소, CFC, 예컨대, 디클로로디플루오로메탄, 트리클로로플루오로메탄, 디클로로테트라플루오로에탄 등을 이용하여 사용될 수 있다. 에어로졸은 편의상 계면활성제, 예컨대, 레시틴을 함유할 수 있다. 약물의 용량은 계량 밸브의 제공에 의해 제어될 수 있다.
비내 제제를 포함한, 기도로의 투여를 위해 의도된 제제에서, 화합물은 일반적으로 예를 들어 대략 10 ㎛ 이하의 작은 입자 크기를 가질 것이다. 이러한 입자 크기는 관련 기술분야에 공지된 수단, 예를 들어 미세화에 의해 얻어질 수 있다. 원하는 경우, 활성 성분의 지속 방출을 제공하기 위해 적합한 제제가 사용될 수 있다.
대안적으로, 활성 성분은 건조 분말, 예를 들어, 적합한 분말 기재, 예컨대, 락토스, 전분, 전분 유도체, 예컨대, 하이드록시프로필메틸 셀룰로스 및 폴리비닐피롤리돈(PVP) 중의 화합물의 분말 믹스의 형태로 제공될 수 있다. 편리하게는 분말 담체는 비강에서 겔을 형성할 것이다. 분말 조성물은, 예를 들어, 흡입기에 의해 분말이 투여될 수 있는 젤라틴 또는 블리스터 팩의 단위 투여 형태(예를 들어, 캡슐 또는 카트리지)로 존재할 수 있다.
약학 제제는 바람직하게는 단위 투여 형태이다. 이러한 형태에서, 제제는 적절한 양의 활성 성분을 함유한 단위 용량으로 하위분할된다. 단위 투여 형태는 패키징된 제제일 수 있고, 상기 패키지는 분리된 양의 제제, 예컨대, 패킷된 정제, 캡슐제, 및 바이알 또는 앰플 중의 산제를 함유한다. 또한, 단위 투여 형태는 캡슐제, 정제, 카쉐제 또는 로젠지제 자체일 수 있거나, 이것은 적절한 수의 이들 중 어느 하나의 포장된 형태일 수 있다.
경구 투여용 정제 또는 캡슐 및 정맥내 투여용 액체가 바람직한 조성물이다.
본원에 제공된 화합물은 선택적으로, 무기 및 유기 산을 포함한 약학적으로 허용되는 비독성 산으로부터 제조된 약학적으로 허용되는 산 부가염을 포함한 제약상 허용되는 염으로서 존재할 수 있다. 대표적인 산은 아세트산, 벤젠술폰산, 벤조산, 캄포르술폰산, 시트르산, 에텐술폰산, 디클로로아세트산, 포름산, 푸마르산, 글루콘산, 글루탐산, 히푸르산, 브로민화수소산, 염산, 이세티온산, 락트산, 말레산, 말산, 만델산, 메탄술폰산, 뮤신산, 질산, 옥살산, 파모산, 판토텐산, 인산, 숙신산, 황산, 타르타르산, 옥살산, p-톨루엔술폰산 등을 포함하나, 이에 제한되지는 않는다. 카르복실산 관능기를 함유하는 본원에 제공된 특정 화합물은 선택적으로, 비독성, 제약상 허용되는 금속 양이온 및 유기 염기로부터 유래된 양이온을 함유하는 제약상 허용되는 염으로서 존재할 수 있다. 대표적인 금속은 알루미늄, 칼슘, 리튬, 마그네슘, 칼륨, 소듐, 아연 등을 포함하나, 이에 제한되지는 않는다. 일부 구현예에서 제약상 허용되는 금속은 소듐이다. 대표적인 유기 염기는 벤자틴(N 1,N 2-디벤질에탄-1,2-디아민), 클로로프로카인(2-(디에틸아민)에틸 4-(클로로아미노)벤조에이트), 콜린, 디에탄올아민, 에틸렌디아민, 메글루민((2R,3R,4R,5S)-6-(메틸아미노)헥산-1,2,3,4,5-펜탄올), 프로카인(2-(디에틸아미노아미노)에틸 4-아미노벤조에이트) 등을 포함하나, 이에 제한되지는 않는다. 특정 약학적으로 허용되는 염은 Berge, et al. , Journal of Pharmaceutical Sciences, 66:1-19(1977)에 열거되어 있다.
산 부가염은 화합물 합성의 직접적인 생성물로서 수득될 수 있다. 대안으로, 유리 염기는 용매를 증발시키거나 또는 달리 염 및 용매를 분리함으로써 단리되는 염 및 적절한 산을 함유한 적합한 용매에 용해될 수 있다. 본원에 제공된 화합물은 관련 기술분야의 통상의 기술자에게 공지된 방법을 이용하여 표준 저분자량 용매와의 용매화물을 형성할 수 있다.
본원에 제공된 화합물은 "전구약물"로 전환될 수 있다. 용어 "전구약물"은 관련 기술분야에 공지된 특정 화학적 기를 갖도록 개질된 화합물을 지칭하며, 개체에 투여되는 경우에 생체내변환되어 모 화합물을 제공한다. 따라서, 전구약물은 일시적인 방식으로 사용되는 하나 이상의 특수화된 비독성 보호 기를 함유하여 화합물의 성질을 변경시키거나 제거하는 본원에 제공된 화합물로서 여겨질 수 있다. 하나의 일반적인 측면에서, "전구약물" 접근법은 경구 흡수를 용이하게 하기 위해 활용된다. 철저한 논의가 T. Higuchi 및 V. Stella, Pro-drugs as Novel Delivery Systems Vol. 14 of the A. C. S. Symposium Series; 및 in Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association 및 Pergamon Press, 1987에 제공되어 있다.
본 발명의 일부 구현예는 본원에 개시된 화합물 구현예 중 어느 한 구현예에 따른 적어도 1종의 화합물을 본원에 기재된 바와 같은 적어도 1종의 약제 및 제약상 허용되는 담체와 함께 혼합하는 것을 포함하는 "병용-요법"을 위한 약학 조성물의 제조 방법을 포함한다.
5-HT2C 수용체 조정제를 약학 조성물 중 활성 성분으로서 활용하는 경우, 인간에서 뿐만 아니라 다른 비-인간 포유동물에서의 사용을 의도함을 주의한다. 동물 건강관리 영역에서의 최근 진보는 반려 동물(예를 들어, 고양이, 개 등) 및 가축(예를 들어, 소, 닭, 어류 등)에서의 5-HT2C 수용체-연관 질환 또는 장애의 치료를 위한 활성제, 예컨대, 5-HT2C 수용체 조정제의 사용을 위해 제공된 고려사항을 요구한다. 관련 기술분야의 통상의 기술자는 이러한 환경에서 이러한 화합물의 유용성의 이해로 쉽게 확인된다.
인식되는 바와 같이, 본원에 제공된 방법의 단계는 임의의 특정 횟수 또는 임의의 특정 순서로 수행될 필요는 없다. 본 발명의 추가적인 목적, 이점 및 신규한 특징은 이의 하기 실시예의 실험에 따라 관련 기술분야의 통상의 기술자에게 명백해질 것이고, 이는 예시적인 것으로 의도되며 제한하려는 것은 아니다.
실시예
실시예 1: 표 A의 화합물의 합성.
본원에 개시된 화합물 및 이의 합성은 하기 실시예에 의해 추가로 설명된다. 하기 실시예는 본 발명을 추가 정의하기 위해 제공되지만, 본 발명은 이들 실시예의 세부 사항에 제한되지는 않는다. 상기 및 하기에 본원에 기재된 화합물은 표 A에서 101, 105, 108, 113, 114, 116, 129, 130, 133, 및 134의 화합물을 제외하고 ChemBioDraw Ultra에 따라 명명되며, ChemBioDraw Ultra 12. 0. 2. 1076이 화학 명칭을 생성하지 않았다. 특정 경우에 일반명이 사용되고, 이들 일반명이 관련 기술분야의 통상의 기술자에 의해 인지될 것으로 이해된다.
화학: 양성자 핵 자기 공명(1H NMR) 스펙트럼은 5 mm BBFO 프로브가 장착된 브루커 어밴스 III-400 상에서 기록하였다. 화학적 이동은 기준으로서 사용된 잔존 용매 신호에 대해 백만분율(ppm)로 나타냈다. NMR 약어는 다음과 같이 사용된다: s = 단일선, d = 이중선, dd = 이중선의 이중선, t = 삼중선, q = 사중선, m = 다중선, bs = 넓은 단일선, sxt = 육중선. 마이크로파 조사는 Smith SynthesizerTM 또는 엠리스 Emrys OptimizerTM(Biotage)를 이용하여 수행하였다. 박층 크로마토그래피(TLC)는 실리카겔 60 F254(Merck) 상에서 수행하고, 정제용 박층 크로마토그래피(정제용 TLC)는 PK6F 실리카겔 60 플레이트(Whatman) 상에서 수행하고, 칼럼 크로마토그래피는 키젤겔 60, 0. 063-0. 200 mm(Merck)를 사용하여 실리카겔 칼럼 상에서 수행하였다. 증발을 감압 하에 부치(Buechi) 회전 증발기 상에서 행하였다. Celite® 545는 팔라듐의 여과에 사용하였다.
LCMS 스펙: HPLC- Agilent 1200; 펌프: G1312A; DAD:G1315B; 오토샘플러: G1367B; 질량분석계-Agilent G1956A; 이온화 공급원: ESI; 건조 기체 유량:10 L/분; 네뷸라이저 압력: 40 psig; 건조 기체 온도: 350 °C; 모세관 전압: 2500 V; 소프트웨어: Agilent Chemstation Rev. B. 04. 03.
실시예 1. 1: (
R)-N
-(6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)피롤리딘-1-카복사미드(화합물 131)의 제조. .
단계 A: (
R)
-벤질 4-(벤질(2-에톡시-2-옥소에틸)아미노)-3-((
터트
-부톡시카보닐)아미노)-4-옥소부타노에이트의 제조.
DCM(120 mL) 중의 (R)-4-(벤질옥시)-2-((터트-부톡시카보닐)아미노)-4-옥소부타논산(15 g, 46. 39 mmol) 및 DCC(9. 575 g, 46. 39 mmol)의 냉각된(빙조) 용액에 에틸 2-(벤질아미노)아세테이트(8. 965 g, 46. 39 mmol)를 첨가하였다. 반응물을 실온으로 서서히 가온하고 밤새 교반 하였다. 혼합물을 여과하고 DMC로 세척하였다. 여액을 농축시켰다. 잔류물을 MTBE에 용해시키고 실온에서 1시간 동안 정치시켰다. 형성된 추가 침전물을 여과에 의해 제거하고, 여액을 진공에서 농축시켜 담황색 점성 오일로서 표제 화합물(23. 13 g, 100%)을 수득하였다. LCMS m/z = 499. 4 [M+H]+.
단계 B: (
R)
-벤질 2-(4-벤질-3,6-디옥소피페라진-2-일)아세테이트의 제조.
DCM(80 mL) 중의 (R)-벤질 4-(벤질(2-에톡시-2-옥소에틸)아미노)-3-((터트-부톡시카보닐)아미노)-4-옥소부타노에이트(23. 13 g, 46. 39 mmol) 용액에 TFA(30 mL)를 첨가하였다. 반응물을 실온에서 밤새 교반 하였다. 혼합물을 농축시켰다. 잔류물을 IPA(100 mL)에 용해시키고 80 °C에서 1시간 동안 가열하여 농축하였다. 포화 소듐 바이카보네이트 및 물을 첨가하였다. 회백색 고체를 수집하고 물로 세척하여 표제 화합물(15. 838 g, 96. 9%)을 수득하였다. LCMS m/z = 353. 4 [M+H]+; 1H NMR(400 MHz, CDCl3) δ ppm 2. 86(dd, J = 17. 5 및 9. 0 Hz, 1H), 3. 16(dd, J = 17. 6 및 3. 2 Hz, 1H), 3. 84(dd, J = 3. 6 및 1. 0 Hz, 2H), 4. 40-4. 46(m, 1H), 4. 57(AB, J = 27. 6 및 14. 5 Hz, 2H), 5. 10(d, J = 2. 2 Hz, 2H), 6. 48(s, 1H), 7. 22-7. 42(m, 10H).
단계 C: (
R
)
-터트-
부틸 4-벤질-2-(2-하이드록시에틸)피페라진-1- 카복실레이트의 제조.
빙수조에서 N2 하에 THF(150 mL) 중의 (R)-벤질 2-(4-벤질-3,6-디옥소피페라진-2-일)아세테이트(25. 935 g, 73. 60 mmol) 용액에 2 M의 THF(96. 00 mL, 192. 0 mmol) 중의 LiAlH4 용액을 천천히 첨가하였다. 반응물을 60 ℃에서 밤새 가열 하였다. 빙수조에서 냉각시킨 후, 물(7. 28 mL), 15 % NaOH(7. 28 mL) 및 물(3 x 7. 28 mL)로 조심스럽게 반응물을 급랭시켰다. 혼합물을 30 분 동안 교반한 다음 셀라이트를 통해 여과하고 THF-MeOH로 세척하였다. 여액을 농축시켰다. 잔류물을 THF(80 mL)에 용해시키고, 포화 소듐 바이카보네이트(50 mL)를 첨가하고, 이어서 디-터트-부틸디카보네이트(19. 28 g, 88. 32 mmol)를 첨가하였다. 반응물을 실온에서 밤새 교반하고, 물로 희석하고, 에틸 아세테이트로 추출하였다. 합한 유기물을 농축시켰다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(17. 22 g, 73. 0 %)을 수득하였다. LCMS m/z = 321. 2 [M+H]+; 1H NMR(400 MHz, CDCl3) δ ppm 1. 48(s, 9H), 2. 00-2. 08(m, 1H), 2. 20-2. 30(m, 2H), 2. 70-2. 80(m, 2H), 2. 98-3. 08(m, 1H), 3. 34-3. 54(m, 3H), 3. 60-3. 68(m, 1H), 3. 78-4. 05(m, 2H), 4. 22-4. 36(m, 1H), 7. 24-7. 40(m, 5H).
단계 D: (
R)
-6-벤질헥사하이드로-3
H
-피라지노[1,2-c][1,2,3]옥사티아진 1,1-다이옥시드의 제조.
DCM(100 mL)/TFA(25 mL) 중의 (R)-터트-부틸 4-벤질-2-(2-하이드록시에틸)피페라진-1-카복실레이트(17. 22 g, 53. 74 mmol)의 용액을 실온에서 밤새 교반하고, 진공에서 농축하였다. 잔류물을 DCM(200 mL)에 용해시키고, 빙수조에서 냉각시키고, 이미다졸(14. 63 g, 215. 0 mmol) 및 트리에틸아민(22. 47 mL, 161. 2 mmol)을 첨가하였다. 10분 후, 혼합물을 N2 하에 티오닐 클로라이드(5. 866 mL, 80. 61 mmol)로 처리하였다. 반응물을 실온으로 가온하고 밤새 교반하였다. 혼합물을 물로 희석시키고 DCM으로 추출하였다. 합한 유기물을 건조시키고 농축시켰다. 잔류물을 CH3CN-H2O(200 mL, 1:1) 용매 혼합물 중에 용해시키고 빙수조에서 냉각시켰다. 루테늄(III) 클로라이드 수화물(0. 111 g, 0. 537 mmol)을 첨가하고, 이어서 소듐 퍼리오데이트(20. 69 g, 96. 73 mmol)를 첨가하였다. 반응물을 서서히 실온으로 가온시키고 2시간 동안 교반하였다. 혼합물을 물로 희석시키고 에틸 아세테이트로 추출하였다. 합한 유기물을 농축시켰다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(3. 207 g, 21. 1 %)을 수득하였다. LCMS m/z = 283. 2 [M+H]+; 1H NMR(400 MHz, CDCl3) δ ppm 1. 38-1. 45(m, 1H), 2. 42-2. 60(m, 4H), 2. 65-2. 72(m, 1H), 3. 22-3. 28(m, 1H), 3. 39-3. 46(m, 1H), 3. 50 및 3. 56(AB, J = 13. 1 Hz, 2H), 3. 84-3. 92(m, 1H), 4. 48-4. 54(m, 1H), 4. 70-4. 78(m, 1H), 7. 27-7. 38(m, 5H).
단계 E: (
R)
-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘의 제조.
N2 하에 -78 °C에서 THF(80 mL) 중의 2,2,6,6-테트라메틸피페리딘(3. 07 ml, 18. 17 mmol) 용액에 2. 5 M의 헥산(7. 27 mL, 18. 17 mmol) 중의 n-부틸리튬 용액을 첨가하였다. 30분 동안 교반한 후, HMPA(헥사메틸 포스포르아미드)(9. 88 mL, 56. 79 mmol)를 함유하는 THF(10 mL) 중의 4-브로모-2-플루오로피리딘(3. 198 g, 18. 17 mmol) 용액을 첨가하였다. 반응물을 1시간 동안 교반하였다. THF(10 mL) 중의 (R)-6-벤질헥사하이드로-3H-피라지노[1,2-c][1,2,3]옥사티아진 1,1-디옥시드(3. 207 g, 11. 36 mmol)를 첨가하였다. 냉각조를 빙수조로 전환하였다. 반응물을 서서히 실온으로 가온하고 밤새 교반하였다. 혼합물을 MeOH(20 mL) 중의 1. 25 M HCl 용액으로 급랭시켰다. 혼합물을 10분 동안 교반하고 진공에서 농축시켰다. 잔류물을 MeOH(50 mL) 중에 용해시키고 1N 수성 HCl(40 mL)로 처리하였다. 반응물을 60 ℃에서 2시간 동안 가열한 후 농축시켰다. 잔류물을 EtOAc와 포화 NaHCO3 사이에 분배시켰다. 합한 유기물을 농축시켰다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 회백색 고체로서 표제 화합물(2. 33 g, 57. 3 %)을 수득하였다. LCMS m/z = 359. 2 [M+H]+; 1H NMR(400 MHz, CDCl3) δ ppm 1. 63-1. 74(m, 1H), 1. 84-1. 95(m, 2H), 2. 13-2. 21(m, 1H), 2. 58- 2. 68(m, 1H), 2. 84-2. 97(m, 4H), 3. 25-3. 32(m, 1H), 3. 48 및 3. 58(AB, J = 13. 0 Hz, 2H), 4. 65-4. 72(m, 1H), 6. 76(d, J = 5. 3 Hz, 1H), 7. 26-7. 37(m, 5H), 7. 76(d, J = 5. 4 Hz, 1H).
단계 F: (
R
)-
N
-(8-벤질-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)피롤리딘-1-카복사미드의 제조.
2 중량% TPGS-750M/H2O(0. 25 mL) 중의 (R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(30 mg, 83. 73 μmol), 피롤리딘-1-카복사미드(10. 51 mg, 92. 11 μmol), 알릴팔라듐(II) 클로라이드 이량체(306. 4 μg, 0. 837 μmol), 및 디-터트-부틸(1-메틸-2,2-디페닐사이클로프로필)포스핀(1. 181 mg, 3. 3 μmol)의 탈기된 혼합물에 칼륨 터트-부톡시드(14. 09 mg, 0. 126 mmol)를 첨가하였다. 반응물을 50 ℃에서 24시간 동안 교반하였다. 혼합물을 H2O로 희석시키고 EtOAc로 추출하였다. 유기 추출물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(7. 7 mg, 24%)을 수득하였다. LC/MS m/z = 392. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 58-1. 72(m, 1H), 1. 88-2. 00(m, 6H), 2. 12-2. 23(m, 1H), 2. 56-2. 73(m, 2H), 2. 78-2. 88(m, 1H), 2. 89-3. 00(m, 2H), 3. 18-3. 28(m, 1H), 3. 41-3. 50(m, 4H), 3. 52-3. 62(m, 2H), 4. 47-4. 56(m, 1H), 6. 92(d, J = 5. 7 Hz, 1H), 7. 23-7. 40(m, 5H), 7. 80(d, J = 5. 7 Hz, 1H).
단계 G: (
R
)-
N
-(6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)피롤리딘-1-카복사미드(화합물 131)의 제조.
실온에서 CH2Cl2(0. 2 mL) 중의 (R)-N-(8-벤질-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-일)피롤리딘-1-카복사미드(6. 5 mg, 16. 60 μmol)의 교반된 용액에 트리에틸아민(6. 942 μl, 49. 81 μmol)을 첨가한 다음 1-클로로에틸 카보노클로리데이트(5. 395 μl, 49. 81 μmol)를 서서히 첨가하였다. 반응물을 40 ℃에서 2시간 동안 교반하였다. 혼합물을 DCM으로 희석시키고 포화 NaHCO3을 첨가하였다. 합한 유기 추출물을 무수 Na2SO4로 건조시키고, 여과하고, 농축하였다. 잔류물을 메탄올(1 mL)에 용해시키고 환류에서 1시간 동안 가열하였다. 혼합물을 농축시켰다. 잔류물을 HPLC로 정제하여 표제 화합물(5. 2 mg, 59%)을 수득하였다. LC/MS m/z = 302. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 73-1. 86(m, 1H), 2. 00(bs, 4H), 2. 19-2. 29(m, 1H), 2. 64-2. 75(m, 1H), 2. 75-2. 86(m, 1H), 3. 04-3. 12(m, 1H), 3. 25-3. 36(m, 1H), 3. 44-3. 65(m, 7H), 3. 73-3. 83(m, 1H), 4. 36-4. 45(m, 1H), 7. 54(d, J = 7 Hz, 1H), 7. 82(d, J = 7 Hz, 1H).
실시예 1. 2: (
R)
-에틸(6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)카바메이트(화합물 123)의 제조.
단계 A: (
R)
-에틸(8-벤질-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)카바메이트의 제조.
2 중량% TPGS-750M/H2O(0. 6 mL) 중의 (R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(68 mg, 0. 190 mmol), 에틸 카바메이트(18. 60 mg, 0. 209 mmol), 알릴팔라듐(II) 클로라이드 이량체(1. 389 mg, 3. 8 μmol), 및 디-터트-부틸(1-메틸-2,2-디페닐클로로프로필)포스핀(5. 352 mg, 15. 18 μmol)의 탈기된 혼합물에 포타슘 터트-부톡시드(31. 95 mg, 0. 285 mmol)를 첨가하였다. 반응물을 50 ℃에서 24시간 동안 교반하였다. 반응물을 H2O로 희석시키고 EtOAc로 추출하였다. 유기 추출물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(14. 2 mg, 20%)을 수득하였다. LC/MS m/z = 367. 4 [M+H]+.
단계 B: (
R)
-에틸(6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)카바메이트(화합물 123)의 제조.
실온에서 CH2Cl2(0. 5 mL) 중의 (R)-에틸(8-벤질-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-일)카바메이트(14 mg, 38. 20 μmol)의 교반된 용액에 트리에틸아민(15. 97 μl, 0. 115 mmol)을 첨가한 다음 1-클로로에틸 카보노클로리데이트(12. 41 μl, 0. 115 mmol)를 천천히 첨가하였다. 반응물을 40 ℃에서 2시간 동안 교반하였다. 혼합물을 DCM으로 희석시키고 포화 NaHCO3을 첨가하였다. 합한 유기 추출물을 무수 Na2SO4로 건조시키고, 여과하고, 농축하였다. 잔류물을 메탄올(1 mL)에 용해시키고 환류에서 1시간 동안 가열하였다. 혼합물을 농축시켰다. 잔류물을 HPLC로 정제하여 표제 화합물(15. 6 mg, 81%)을 수득하였다. LC/MS m/z = 277. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 34(t, J = 7 Hz, 3H), 1. 72-1. 85(m, 1H), 2. 18-2. 29(m, 1H), 2. 60-2. 73(m, 1H), 2. 79-2. 90(m, 1H), 3. 03-3. 14(m, 1H), 3. 26-3. 37(m, 1H), 3. 48-3. 66(m, 3H), 3. 75-3. 85(m, 1H), 4. 28(q, J = 7 Hz, 2H), 4. 34-4. 42(m, 1H), 7. 83-7. 90(m, 2H).
실시예 1. 3: (
R)-N-
(2,2-디플루오로에틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-카복사미드(화합물 140)의 제조..
단계 A: (
R)
-8-벤질-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-카복실산의 제조.
H2O(1 mL) 중의 (R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(0. 050 g, 0. 140 mmol), 2,2-디플루오로에탄아민(33. 94 mg, 0. 419 mmol), 및 소듐 카보네이트(29. 58 mg, 0. 279 mmol)의 혼합물에 Herrmann-Beller 촉매(7. 868 mg, 8. 4 μmol), 트리-터트-부틸포스포늄 테트라플루오로보레이트(4. 842 mg, 16. 75 μmol), 및 몰리브데늄헥사카보닐(36. 85 mg, 0. 140 mmol)을 첨가하였다. 반응물을 마이크로파 조사 하에 170 ℃에서 20분 동안 가열하였다. 혼합물을 2M HCl로 산성화시키고, MeOH로 희석하고 여과하였다. 여액을 HPLC로 정제하여 표제 화합물(29. 7 mg, 38. 6%) 및 (R)-8-벤질-N-(2,2-디플루오로에틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-카복사미드(1. 5 mg, 1. 7%)를 수득하였다. LC/MS m/z = 324. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 67-1. 81(m, 1H), 2. 09-2. 19(m, 1H), 2. 91-3. 01(m, 1H), 3. 05(t, J = 12Hz, 1H), 3. 20-3. 27(m, 2H), 3. 27-3. 31(m, 2H), 3. 52-3. 80(m, 3H), 4. 37-4. 47(m, 2H), 7. 12(d, J = 5. 5 Hz, 1H), 7. 48-7. 59(m, 5H), 8. 04(d, J = 5. 6 Hz, 1H).
단계 B: (
R)
-8-벤질-
N
-(2,2-디플루오로에틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-카복사미드의 제조.
MeCN(0. 6 mL) 중의 (R)-8-벤질-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-카복실산(29. 7 mg, 53. 86 μmol), HATU(26. 62 mg, 70. 02 μmol), 및 트리에틸아민(22. 52 μl, 0. 162 mmol)의 혼합물에 2,2-디플루오로에탄아민(5. 676 mg, 70. 02 μmol)을 첨가하였다. 반응물을 23 ℃에서 1시간 동안 교반하였다. 혼합물을 농축시켰다. 잔류물을 HPLC로 정제하여 표제 화합물의 TFA 염을 수득하였다. 상기 TFA 염을 DCM에 용해시키고 트리에틸아민 10 μL를 첨가하고 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물의 유리 염기(9. 3 mg, 44. 7 %)를 수득하였다. LC/MS m/z = 387. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 66-1. 80(m, 1H), 2. 06-2. 16(m, 1H), 2. 76-2. 94(m, 2H), 2. 95-3. 23(m, 3H), 3. 50-3. 66(m, 3H), 3. 66-3. 79(m, 2H), 4. 41(s, 2H), 5. 50(d, J = 14 Hz, 1H), 5. 83-6. 18(m, 1H), 6. 72(d, J = 5. 2 Hz, 1H), 7. 50-7. 60(m, 5H), 8. 05(d, J = 5. 1 Hz, 1H).
단계 C: (
R)
-
N
-(2,2-디플루오로에틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-카복사미드(화합물 140)의 제조.
실온에서 CH2Cl2(0. 4 mL) 중의 (R)-8-벤질-N-(2,2-디플루오로에틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-카복사미드(9. 3 mg, 24. 07 μmol)의 교반된 용액에 트리에틸아민(10. 06 μl, 72. 20 μmol)을 첨가한 다음 1-클로로에틸 카보노클로리데이트(7. 820 μL, 72. 20 μmol)를 천천히 첨가하였다. 반응물을 40 ℃에서 2시간 동안 교반하였다. 혼합물을 DCM으로 희석시키고 포화 NaHCO3을 첨가하였다. 합한 유기 추출물을 무수 Na2SO4로 건조시키고, 여과하고, 농축하였다. 잔류물을 메탄올(1 mL)에 용해시키고 환류에서 1시간 동안 가열하였다. 혼합물을 농축시켰다. 잔류물에 DCM(0. 2 mL), 트리에틸아민(7. 333 μl, 52. 61 μmol) 및 (BOC)2O(5. 741 mg, 26. 31 μmol)를 첨가하였다. 반응물을 실온에서 1시간 동안 교반하였다. 혼합물을 실리카겔 칼럼 크로마토그래피로 정제하여 (R)-터트-부틸 4-((2,2-디플루오로에틸)카바모일)-6a,7,9,10-테트라하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-8(6H)-카복실레이트(7. 7 mg, 80. 7%)를 수득하였다. LC/MS m/z = 397. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 48(s, 9H), 1. 60-1. 73(m, 1H), 2. 00-2. 09(m, 1H), 2. 61-2. 88(m, 4H), 2. 88-3. 06(m, 1H), 3. 22-3. 30(m, 1H), 3. 61-3. 80(m, 2H), 4. 02-4. 15(m, 2H), 4. 63-4. 73(m, 1H), 5. 84-6. 18(m, 1H), 6. 58(d, J = 5. 1 Hz, 1H), 7. 98(d, J = 5. 1 Hz, 1H).
상기 물질에 MeOH(2 mL) 중의 1. 25 M HCl을 첨가하였다. 반응물을 55 ℃에서 1시간 동안 가열하여 표제 화합물(2. 8 mg, 22. 2%)을 수득하였다. LC/MS m/z = 297. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 75-1. 89(m, 1H), 2. 20-2. 32(m, 1H), 2. 80-3. 02(m, 2H), 3. 17(t, J = 12 Hz, 1H), 3. 35-3. 44(m, 1H), 3. 54-3. 85(m, 5H), 3. 95-4. 07(m, 1H), 4. 49-4. 58(m, 1H), 5. 90-6. 23(m, 1H), 7. 01(d, J = 6. 4 Hz, 1H), 7. 99(d, J = 6. 4 Hz, 1H).
실시예 1. 4: (
R)-N
-메틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-카복사미드(화합물 102)의 제조.
단계 A: (
R)
-8-벤질-
N
-메틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-카복사미드의 제조.
H2O(1 mL) 중의, (R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(0. 050 g, 0. 140 mmol), 에탄올 중의 메탄아민(0.434 mL, 3.489 mmol), 및 소듐 카보네이트(29. 58 mg, 0. 279 mmol)의 혼합물에 Herrmann-Beller 촉매(7. 868 mg, 8. 4 μmol), 트리-터트-부틸포스포늄 테트라플루오로보레이트(4. 842 mg, 16. 75 μmol), 및 몰리브데늄헥사카보닐(25. 79 mg, 97. 69 μmol)을 첨가하였다. 반응물을 마이크로파 조사 하에 170 ℃에서 20분 동안 가열하였다. 혼합물을 여과하였다. 여액을 2M HCl로 희석시키고 HPLC로 정제하여 표제 화합물(5. 9 mg, 12. 6%)을 수득하였다. LC/MS m/z = 337. 4 [M+H]+.
단계 B: (
R)-N
-메틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-카복사미드(화합물 102)의 제조.
실온에서 CH2Cl2(0. 2 mL) 중의 (R)-8-벤질-N-메틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-카복사미드(5. 9 mg, 17. 54 μmol)의 교반된 용액에 트리에틸아민(7. 333 μL, 52. 61 μmol)을 첨가한 후 1-클로로에틸 카보노클로리데이트(5. 698 μl, 52. 61 μmol)를 천천히 첨가하였다. 반응물을 40 ℃에서 2시간 동안 교반하였다. 혼합물을 DCM으로 희석시키고 포화 NaHCO3을 첨가하였다. 합한 유기 추출물을 무수 Na2SO4로 건조시키고, 여과하고, 농축하였다. 잔류물을 메탄올(1 mL)에 용해시키고 환류에서 1시간 동안 가열하였다. 혼합물을 농축시켰다. 잔류물을 HPLC로 정제하였다. 수득된 물질에 DCM(0. 2 mL), 트리에틸아민(7. 333 μl, 52. 61 μmol) 및 (BOC)2O(5. 741 mg, 26. 31 μmol)을 첨가하였다. 반응물을 실온에서 1시간 동안 교반하였다. 혼합물을 실리카겔 칼럼 크로마토그래피로 정제한 다음 HPLC로 정제하여 (R)-터트-부틸 4-(메틸카바모일)-6a,7,9,10-테트라하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-8(6H)-카복실레이트(4. 1 mg)를 수득하였다. LC/MS m/z = 347. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 49(s, 9H), 1. 61-1. 77(m, 1H), 2. 13-2. 24(m, 1H), 2. 73-2. 85(m, 1H), 2. 85-3. 04(m, 4H), 3. 31-3. 43(m, 2H), 3. 68-3. 80(m, 1H), 4. 02-4. 18(m, 3H), 6. 85(d, J = 6. 4 Hz, 1H), 7. 86(d, J = 6. 4 Hz, 1H).
상기 물질에 MeOH(2 mL) 중의 1. 25 M HCl을 첨가하였다. 반응물을 55 ℃에서 1시간 동안 가열하고 농축하여 표제 화합물(2. 4 mg, 42. 9%)을 수득하였다. LC/MS m/z = 247. 0 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 74-1. 88(m, 1H), 2. 19-2. 31(m, 1H), 2. 78-3. 00(m, 5H), 3. 17(t, J = 12. 5 Hz, 1H), 3. 33-3. 44(m, 1H), 3. 54-3. 74(m, 3H), 3. 95-4. 06(m, 1H), 4. 49-4. 58(m, 1H), 6. 99(d, J = 6. 4 Hz, 1H), 7. 97(d, J = 6. 4 Hz, 1H).
실시예 1. 5: (
R)
-4-사이클로헥실-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 127)의 제조.
단계 A: (
R)
-8-벤질-4-사이클로헥실-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘의 제조.
4% BrijTM 30(2. 397 mL, 0. 251 mmol) 중의 디클로로비스(p-디메틸아미노페닐디-터트-부틸포스핀)팔라듐(2. 973 mg, 4. 2 μmol) 및 아연 분진(27. 37 mg, 0. 419 mmol)에 N,N,N',N'-테트라메틸에틸렌디아민(44. 23 μl, 0. 293 mmol), 브로모사이클헥산(34. 13 mg, 0. 209 mmol), 및 (R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(30 mg, 83. 73 μmol)을 첨가하였다. 반응물을 23 ℃에서 96시간 동안 교반하였다. 혼합물을 시린지 필터를 통해 여과하고 ACN으로 세척하였다. 여액을 HPLC로 정제하여 표제 화합물(6. 1 mg, 12. 4%)을 수득하였다. LC/MS m/z = 362. 6 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 26-1. 56(m, 5H), 1. 68-1. 83(m, 4H), 1. 83-1. 95(m, 2H), 2. 15-2. 25(m, 1H), 2. 72-2. 92(m, 2H), 2. 95-3. 06(m, 2H), 3. 15-3. 25(m, 1H), 3. 40-3. 51(m, 1H), 3. 51-3. 66(m, 2H), 3. 72-3. 83(m, 1H), 4. 36(s, 2H), 4. 45-4. 55(m, 1H), 6. 99(d, J = 6. 4 Hz, 1H), 7. 48-7. 57(m, 5H), 7. 86(d, J = 6. 4 Hz, 1H).
단계 B: (
R)
-4-사이클로헥실-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 127)의 제조.
실온에서 CH2Cl2(0. 2 mL) 중의 (R)-8-벤질-4-사이클로헥실-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(2. 6 mg, 7. 2 μmol)의 교반된 용액에 트리에틸아민(3. 007 μl, 21. 58 μmol)을 첨가한 후에 1-클로로에틸 카보노클로리데이트(2. 337 μl, 21. 58 μmol)를 천천히 첨가하였다. 반응물을 40 ℃에서 2시간 동안 교반하였다. 혼합물을 DCM으로 희석시키고 포화 NaHCO3을 첨가하였다. 합한 유기 추출물을 무수 Na2SO4로 건조시키고, 여과하고, 농축하였다. 잔류물을 메탄올(1 mL)에 용해시키고 환류에서 1시간 동안 가열하였다. 혼합물을 농축시켰다. 잔류물을 HPLC로 정제하여 표제 화합물(2. 2 mg, 61. 2%)을 수득하였다. LC/MS m/z = 272. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 27-1. 40(m, 1H), 1. 40-1. 57(m, 4H), 1. 69-1. 85(m, 4H), 1. 85-1. 96(m, 2H), 2. 18-2. 28(m, 1H), 2. 73-2. 92(m, 2H), 2. 95-3. 11(m, 2H), 3. 23-3. 32(m, 1H), 3. 38-3. 48(m, 1H), 3. 50-3. 62(m, 2H), 3. 71-3. 81(m, 2H), 4. 47-4. 56(m, 1H), 6. 98(d, J = 6. 3 Hz, 1H), 7. 88(d, J = 6. 3 Hz, 1H).
실시예 1. 6: 5-메틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 158)의 제조.
단계 A: 에틸 4-(2-클로로피리딘-3-일)-4-옥소부트-2-에노에이트의 제조.
디이소프로필아민(2. 178 mL, 15. 54 mmol)을 THF(15mL)에 용해시키고 빙조에서 냉각시켰다. n-부틸리튬(6. 217 mL, 15. 54 mmol)을 조심스럽게 첨가하고 반응물을 30분 동안 교반하여 LDA를 형성하였다. THF(50mL) 중의 에틸 프로피오레이트(1. 525 g, 15. 54 mmol)의 용액을 -77°C(드라이아이스/IPA)로 냉각시키고 LDA 용액을 캐뉼라를 통해 첨가하였다. 30분 동안 교반한 후, THF(15 mL) 중의 2-클로로니코틴알데하이드(2. 0 g, 14. 13 mmol) 용액을 첨가하였다. 반응 혼합물을 -77°C에서 1시간 동안 교반하였다. 드라이아이스 조를 제거하고 반응물을 포화 NH4Cl로 급랭시켰다. 실온으로 가온시킨 후, 혼합물을 EtOAc(2X)로 추출하였다. 합한 유기물을 염수로 세척하고 MgSO4에서 건조시키고 농축하였다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 에틸 4-(2-클로로피리딘-3-일)-4-하이드록시부트-2-이노에이트(2. 6 g, 10. 85 mmol, 76. 8 %)를 수득하였다. LCMS m/z = 240. 0 [M+H]+; 1H NMR(400 MHz, CDCl3) δ ppm 1. 32(t, J = 7. 2 Hz, 3H), 2. 78(d, J = 5. 3 Hz, 1H), 4. 26(q, J = 7. 1 Hz, 2H), 5. 89(d, J = 5. 1 Hz, 1H), 7. 34(dd, J = 7. 6, 4. 8 Hz, 1H), 8. 07(dd, J = 7. 5, 2. 0 Hz, 1H), 8. 41(dd, J = 4. 7, 1. 9 Hz, 1H).
상기로부터 수득한 에틸 4-(2-클로로피리딘-3-일)-4-하이드록시부트-2-이노에이트를 디옥산(30 mL) 중에 용해시키고 트리에틸아민(3. 151 mL, 22. 61 mmol)을 첨가하였다. 반응물을 60 ℃에서 밤새 가열하고 농축 건조시켜 표제 화합물(2. 6 g, 10. 85 mmol, 76. 8 %)을 수득하였다. LCMS m/z = 240. 0 [M+H]+; 1H NMR(400 MHz, CDCl3) δ ppm 1. 34(t, J = 7. 1 Hz, 3H), 4. 29(q, J = 7. 2 Hz, 2H), 6. 70(d, J = 15. 7 Hz, 1H), 7. 39(dd, J = 7. 6, 4. 8 Hz, 1H), 7. 56(d, J = 15. 7 Hz, 1H), 7. 85(dd, J = 7. 6, 1. 8 Hz, 1H), 8. 56(dd, J = 4. 8, 2. 0 Hz, 1H).
단계 B. 6,6a,9,10-테트라하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-5,7(8
H
)-디온의 제조.
DMF 중의 에틸 4-(2-클로로피리딘-3-일)-4-옥소부트-2-에노에이트(2. 6 g, 10. 85 mmol)의 용액에 에탄-1,2-디아민(0. 717 g, 11. 93 mmol)을 첨가하였다. 반응물을 60 ℃에서 4시간 동안 가열하였다. 혼합물을 실온으로 냉각시키고 농축시켰다. 잔류물을 HPLC로 정제하였다. 분획을 농축하고 포화 NaHCO3으로 중화시켰다. 혼합물을 EtOAc(3X)로 추출하고, 건조 및 농축시켜 표제 화합물(0. 4 g, 1. 841 mmol, 17. 0 %)을 고체로서 수득하였다. LCMS m/z = 218. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 8. 39(dd, J = 4. 7, 2. 0 Hz, 1H), 8. 12(dd, J = 7. 7, 2. 0 Hz, 1H), 6. 84(dd, J = 7. 6, 4. 7 Hz, 1H), 4. 93(ddd, J = 13. 4, 4. 3, 2. 2 Hz, 1H), 4. 23(dd, J = 13. 9, 4. 0 Hz, 1H), 3. 53(m, 1H), 3. 45(m, 1H), 3. 16-3. 08(m, 2H), 2. 85(dd, J = 16. 8, 13. 9 Hz, 1H).
단계 C: 5-메틸-6,6a,9,10-테트라하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-7(8H)-온의 제조.
THF(1 mL) 중의 메틸트리페닐포스포늄 브로미드(0. 329 g, 0. 921 mmol)의 용액에 포타슘 터트-부톡시드(0. 145 g, 1. 289 mmol)를 첨가하고, 혼합물을 실온에서 30분 동안 교반하였다. THF(1 mL) 중의 6,6a,9,10-테트라하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-5,7(8H)-디온(80 mg, 0. 368 mmol)의 용액을 첨가하고, 반응을 40분 동안 계속하였다. 물을 첨가하고 수성 층을 EtOAc(3X)로 추출하였다. 합한 유기층을 염수로 세척하고 무수 소듐 설페이트로 건조시키고, 여과하였다. 여액을 진공에서 증발시키고, 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 5-메틸렌-6,6a,9,10-테트라하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-7(8H)-온(30 mg, 0. 139 mmol, 37. 8 %)을 수득하였다. LCMS m/z = 216. 2 [M+H]+.
메탄올(3 mL) 중의 5-메틸렌-6,6a,9,10-테트라하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-7(8H)-온의 용액에 팔라듐/C(3. 919 mg, 36. 83 μmol)를 첨가하였다. 반응물을 수소 대기 하에 두고 2시간 동안 교반하였다. 혼합물을 셀라이트를 통해 여과하였다. 여액을 농축시켜 표제 화합물을 부분입체 이성질체의 9:1 혼합물로서 수득하였다. LCMS m/z = 218. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 35(d, J = 6. 6 Hz, 3H), 1. 61(m, 1H), 2. 55(ddd, J = 13. 1, 4. 8, 3. 8 Hz, 1H), 2. 97(m, 1H), 3. 08(ddd, J = 13. 4, 10. 9, 3. 8 Hz, 1H), 3. 34(m, 1H), 3. 44(m, 1H), 4. 08(dd, J = 11. 6, 3. 8 Hz, 1H), 4. 78(ddd, J = 13. 4, 4. 23, 2. 5 Hz, 1H), 6. 63(dd, J = 7. 4, 5. 0 Hz, 1H), 7. 42(dt, J = 7. 4, 1. 6 Hz, 1H), 7. 89(ddd, J = 5. 0, 1. 7, 0. 9 Hz, 1H).
단계 D: 5-메틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 158)의 제조.
THF 중의 5-메틸-6,6a,9,10-테트라하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-7(8H)-온(30 mg, 0. 138 mmol)의 용액에 리튬 알루미늄 하이드리드(0. 207 mL, 0. 414 mmol)를 첨가하였다. 반응물을 실온에서 2시간 동안 교반한 후 Rochelle 염으로 조심스럽게 급랭시켰다. 고체를 여과하고 여액을 농축시켰다. 잔류물을 1N HCl로 산성화시키고 HPLC로 정제하여 표제 화합물(10 mg, 31. 52 μmol, 22. 8 %)을 고체로서 수득하였다. LCMS m/z = 204. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 42(d, J = 6. 6 Hz, 3H), 1. 50(m, 1H), 2. 23(dt, J = 13. 3, 4. 3 Hz, 1H), 2. 96(m, 1 H), 2. 99(dd, J = 12. 6, 11. 6 Hz, 1H), 3. 29(m, 1H), 3. 46(ddd, J = 14. 7, 12. 4, 2. 8 Hz, 1H), 3. 60(m, 2 H), 3. 90(m, 1H), 4. 56(dt, J = 14. 7, 2. 9 Hz, 1H), 6. 99(dd, J = 7. 5, 5. 9 Hz, 1H), 7. 85(dt, J = 7. 5, 1. 6 Hz, 1H), 7. 92(dt, J = 5. 8, 1. 5 Hz, 1H).
실시예 1. 7: (
R)
-4-클로로-2-(메틸티오)-5,6,6a,7,8,9,10,11-옥타하이드로피리미도[5',4':5,6]피리도[1,2-a][1,4]디아제핀(화합물 159)의 제조.
단계 A: (
R)-터트
-부틸 4-벤질-2-(2-옥소에틸)-1,4-디아제판-1-카복실레이트의 제조.
N2 하에 -78 °C에서 추가로 희석된 w/DCM(15 mL)의 옥살릴 클로라이드(DCM 중의 2. 0M)(5. 980 mL, 11. 96 mmol)의 용액에 디메틸 설폭시드(1. 487 mL, 20. 93 mmol)를 적하 방식으로 첨가하였다. 30분 동안 교반한 후, DCM(12 mL) 중의 (R)-터트-부틸 4-벤질-2-(2-하이드록시에틸)-1,4-디아제판-1-카복실레이트(2. 0 g, 5. 980 mmol)의 용액을 첨가하고 반응물을 -78 °C에서 1. 5시간 동안 교반하였다. 트리에틸아민(6. 251 mL, 44. 85 mmol)을 첨가하고 15분 후에 혼합물을 0 ℃로 가온하고 45분 동안 교반하였다. 포화 NH4Cl 용액을 첨가하고 상을 분리하였다. 유기물을 물 및 염수로 세척하고, MgSO4로 건조시키고, 여과하고, 농축하였다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(1. 2 g, 3. 610 mmol, 60. 4 %)을 투명 오일로서 수득하였다. LCMS m/z = 333. 4 [M+H]+; 1H NMR(400 MHz, CDCl3) δ ppm 9. 64(m, 1H), 7. 34-7. 29(m, 4H), 7. 26(m, 1H), 4. 71(m, 0. 51H), 4. 49(m, 0. 49H), 3. 83(m, 0. 49H), 3. 74-3. 63(m, 2. 51H), 3. 03-2. 92(m, 2H), 2. 87(dt, J = 8. 2, 4. 2 Hz, 1H), 2. 65-2. 49(m, 2H), 2. 45-2. 34(m, 2H), 1. 89(m, 1H), 1. 56(m, 1H), 1. 49(s, 4. 41H), 1. 48(s, 4. 59H).
단계 B: (6aR)-8-벤질-4-클로로-2-(메틸티오)-5,6,6a,7,8,9,10,11-옥타하이드로피리미도[5',4':5,6]피리도[1,2-a][1,4]디아제핀-5-올의 제조.
실온에서 질소 하에 THF(5. 0 mL) 중의 4,6-디클로로-2-(메틸티오)피리미딘(0. 50 g, 2. 563 mmol) 용액에 TMPMgCl-LiCl(THF/PhMe 중의 1. 0 M)(3. 076 mL, 3. 076 mmol)을 첨가하였다. 30분 후, (R)-터트-부틸 4-벤질-2-(2-옥소에틸)-1,4-디아제판-1-카복실레이트(0. 852 g, 2. 563 mmol)를 첨가하였다. 반응물을 실온에서 1시간 동안 교반한 후 NH4Cl로 급랭시켰다. 혼합물을 EtOAc로 추출하고, MgSO4로 건조시켜 추가 정제 없이 (7S)-터트-부틸 4-벤질-7-(2-(4,6-디클로로-2-(메틸티오)피리미딘-5-일)-2-하이드록시에틸)-1,4-디아제판-1-카복실레이트를 수득하였다. LCMS m/z = 527. 4 [M+H]+.
(7S)-터트-부틸 4-벤질-7-(2-(4,6-디클로로-2-(메틸티오)피리미딘-5-일)-2-하이드록시에틸)-1,4-디아제판-1-카복실레이트를 4N HCl/디옥산 중에 용해시키고 1시간 동안 교반하였다. 반응 혼합물을 농축시키고 DCM(10 mL)에서 취하였다. DIEA(2. 232 mL, 12. 82 mmol)를 첨가하고 반응물을 실온에서 30분 동안 교반하였다. 혼합물을 농축시켰다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(325 mg, 0. 831 mmol, 32. 4 %)을 부분입체 이성질체의 혼합물로서 수득하였다. LCMS m/z = 391. 6 [M+H]+.
단계 C: (
R)
-8-벤질-4-클로로-2-(메틸티오)-5,6,6a,7,8,9,10,11-옥타하이드로피리미도[5',4':5,6]피리도[1,2-a][1,4]디아제핀의 제조.
(6aR)-8-벤질-4-클로로-2-(메틸티오)-5,6,6a,7,8,9,10,11-옥타하이드로피리미도[5',4':5,6]피리도[1,2-a][1,4]디아제핀-5-올(325 mg, 0. 831 mmol)에 트리에틸실란(2. 656 mL, 16. 63 mmol) 및 TFA(2. 546 mL, 33. 25 mmol)를 첨가하였다. 반응 혼합물을 45 ℃에서 밤새 가열하였다. 혼합물을 농축시켰다. 잔류물을 EtOAc 중에서 취하여 1M Na2CO3 및 염수로 세척하였다. 유기층을 건조 및 농축시켜 표제 화합물(0. 31 g, 0. 827 mmol, 99. 5 %)을 수득하였다. LCMS m/z = 374. 6 [M+H]+.
단계 D: (
R)
-4-클로로-2-(메틸티오)-5,6,6a,7,8,9,10,11-옥타하이드로피리미도[5',4':5,6]피리도[1,2-a][1,4]디아제핀(화합물 159)의 제조.
(R)-8-벤질-4-클로로-2-(메틸티오)-5,6,6a,7,8,9,10,11-옥타하이드로피리미도[5',4':5,6]피리도[1,2-a][1,4]디아제핀으로부터, 실시예 1. 1, 단계 G에 기술된 것과 유사한 방법을 사용하여 표제 화합물을 제조하였다. LCMS m/z = 285. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 2. 08-2. 01(m, 2H), 2. 12(m, 1H), 2. 20(m, 1H), 2. 67(m, 1H), 2. 86(dt, J = 9. 2, 4. 4 Hz, 1H), 2. 97(s, 3H), 3. 25-3. 15(m, 3H), 3. 46-3. 40(m, 2H), 4. 08(m, 1H), 4. 85(m, 1H).
실시예 1. 8: (
R
)-4-클로로-5,6,6a,7,8,9,10,11- 옥타하이드로피리미도[5',4': 5,6]피리도[1,2-a][1,4] 디아제핀(화합물 160)의 제조.
단계 A: (
R)
-8-벤질-4-클로로-5,6,6a,7,8,9,10,11-옥타하이드로피리미도[5',4':5,6]피리도[1,2-a][1,4]디아제핀의 제조.
THF 중의 (R)-8-벤질-4-클로로-2-(메틸티오)-5,6,6a,7,8,9,10,11-옥타하이드로피리미도[5',4':5,6]피리도[1,2-a][1,4]디아제핀(50 mg, 0. 133 mmol) 용액에 팔라듐/C(14. 19 mg, 0. 133 mmol) 및 트리에틸실란(0. 426 mL, 2. 667 mmol)을 첨가하였다. 반응물을 실온에서 밤새 교반하였다. 혼합물을 셀라이트를 통해 여과하고 농축시켜 표제 화합물을 수득하였다. LCMS m/z = 329. 4 [M+H]+.
단계 B: (
R)
-4-클로로-5,6,6a,7,8,9,10,11-옥타하이드로피리미도[5',4':5,6]피리도[1,2-a][1,4]디아제핀(화합물 160)의 제조.
(R)-8-벤질-4-클로로-5,6,6a,7,8,9,10,11-옥타하이드로피리미도[5',4':5,6]피리도[1,2-a][1,4]디아제핀으로부터, 실시예 1. 1의 단계 G에 기술된 것과 유사한 방법을 사용하여 표제 화합물을 제조하였다. LCMS m/z = 239. 0 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 98-2. 06(m, 2H), 2. 10(m, 1H), 2. 18(m, 1H), 2. 74(m, 1H), 2. 93(dt, J = 9. 4, 4. 7 Hz, 1H), 3. 15-3. 27(m, 3H), 3. 38-3. 48(m, 2H), 4. 11(m, 1H), 4. 83(m, 1H), 8. 21(s, 1H).
실시예 1. 9: (
R)
-4-클로로-2-(메틸티오)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1',2':1,6]피리도[2,3-d]피리미딘(화합물 169)의 제조.
단계 A: (6aR)-8-벤질-4-클로로-2-(메틸티오)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1',2':1,6]피리도[2,3-d]피리미딘-5-올의 제조.
4,6-디클로로-2-(메틸티오)피리미딘 및 (R)-터트-부틸 4-벤질-2-(2-옥소에틸)피페라진-1-카복실레이트로부터, 실시예 1. 7의 단계 B에 기술된 것과 유사한 방법을 사용하여 표제 화합물을 제조하였다. LCMS m/z = 277. 2 [M+H]+.
단계 B: (
R)
-4-클로로-2-(메틸티오)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1',2':1,6]피리도[2,3-d]피리미딘(화합물 169)의 제조.
(6aR)-8-벤질-4-클로로-2-(메틸티오)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1',2':1,6]피리도[2,3-d]피리미딘-5-올로부터, 실시예 1. 1, 단계 G에 기술된 것과 유사한 방법을 사용하여 표제 화합물을 제조하였다. LCMS m/z = 271. 2 [M+H]+; 1H NMR (400 MHz, CD3OD) δ ppm 1. 76 (m, 1H), 2. 18 (m, 1H), 2. 47 (s, 3H), 2. 66 (ddd, J = 16. 7, 11. 4, 5. 4 Hz, 1H), 2. 88 (dt, J = 16. 9, 4. 7Hz, 1 H), 2. 97 (dd, J = 12. 5, 11. 8 Hz, 1 H), 3. 05-3. 20 (m, 2 H), 3. 45-3. 56 (m, 2 H), 3. 65 (m, 1H), 5. 08 (m, 1H).
실시예 1. 10: (
R)
-3-클로로-4-(3,3,3-트리플루오로프로필)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 167)의 제조.
DCM 중의 (R)-4-(3,3,3-트리플루오로프로필)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(15 mg, 52. 57 μmol) 용액에 NCS(8. 425 mg, 63. 09 μmol)를 첨가하였다. 반응물을 실온에서 1시간 동안 교반하였다. 반응물을 물로 급랭시키고 농축하였다. 잔류물을 HPLC로 정제하여 표제 화합물(3. 1 mg, 7. 1 μmol, 13. 6 %)을 수득하였다. LCMS m/z = 320. 0 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 81(m, 1H), 2. 16(m, 1H), 2. 29-2. 46(m, 2H), 2. 83(ddd, J = 16. 5, 11. 4, 5. 1 Hz, 1H), 2. 87-3. 02(m, 5H), 3. 13(td, J = 12. 7, 3. 6 Hz, 1H), 3. 41 - 3. 53(m, 3H), 4. 97(ddd, J = 14. 3, 3. 5, 1. 9 Hz, 1H), 8. 00(s, 1H).
실시예 1. 11: (
R)
-8-메틸-4-(3,3,3-트리플루오로프로필)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 168)의 제조.
에탄올 중의 (R)-4-(3,3,3-트리플루오로프로필)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(15 mg, 52. 57 μmol) 용액에 파라포름알데하이드(9. 472 mg, 0. 315 mmol)를 첨가하였다. 이어서, 소듐 보로하이드리드(5. 967 mg, 0. 158 mmol)를 첨가하고 혼합물을 60 °C에서 밤새 교반하였다. 반응물을 물로 급랭시키고 농축하였다. 잔류물을 HPLC로 정제하여 표제 화합물(2. 7 mg, 6. 5 μmol, 12. 4 %)을 수득하였다. LCMS m/z = 300. 0 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 05-1. 90(br. s. , 3H), 1. 68(m, 1H), 2. 20(m, 1H), 2. 44-2. 60(m, 3H) 2. 66-2. 81(m, 2H), 2. 90-2. 99(m, 3H), 3. 22-3. 29(m, 2H), 3. 33-3. 39(m, 1 H), 3. 63(m, 1H) 4. 21(m, 1H) 6. 14(br. s. , 1 H) 6. 93(d, J = 6. 6 Hz, 1 H), 7. 79(d, J = 6. 3 Hz, 1H).
실시예 1. 12: (
R)
-4-(3-(트리플루오로메톡시)페닐)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘(화합물 105)의 제조.
단계 A: (
R)
-8-벤질-4-클로로-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘(중간체 1) 및 (
R)
-3-벤질-7-브로모-2,3,4,4a,5,6-헥사하이드로-1
H
-피라지노[1,2-
a
][1,6]나프티리딘(중간체 2)의 제조.
N2 하에 -78 °C에서 THF(5. 0 mL) 중의 2,2,6,6-테트라메틸피페리딘(0. 132 ml, 0. 781 mmol) 용액에 n-부틸리튬(헥산 중의 2. 5 M, 0. 312 mL, 0. 781 mmol)을 첨가하였다. 30분 동안 교반한 후에, THF(2. 5 mL) 중의 2-브로모-4-클로로피리딘(141 mg, 0. 732 mmol) 용액을 첨가하였다. 혼합물을 -78 °C에서 30분 동안 교반하였으며, 이때 THF(2. 5 mL) 중의 (R)-6-벤질헥사하이드로-3H-피라지노[1,2-c][1,2,3]옥사티아진 1,1-디옥시드(145 mg, 0. 488 mmol)를 첨가하였다. 반응을 즉시 빙수조로 전환시켜 0 ℃로 가열하였다. 1시간 동안 교반한 후, MeOH(6 mL) 중의 1. 25M HCl을 첨가하여 반응물을 급랭시켰다. 혼합물을 실온으로 가온하고, 밤새 교반하고, 진공에서 농축하였다. 잔류물을 MeOH(5 mL) 중에 용해시키고 1N 수성 HCl(5 mL)로 처리하였다. 이어서, 반응물을 마이크로파 조사를 통해 60 ℃에서 2시간 동안 가열하였다. 혼합물을 농축시키고, EtOAc와 포화 수성 NaHCO3 사이에 분배하였다. 상을 분리시키고 유기물을 포화 수성 NaHCO3으로 세척하고, MgSO4 상에서 건조하고 여과하고, 농축하였다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 다음을 수득하였다:
중간체 1; 백색 고체로서 (R)-8-벤질-4-클로로-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(58 mg, 0. 19 mmol, 39% 수율). LCMS m/z = 314. 0 [M+H]+; 1H NMR(400 MHz, CDCl3): δ ppm 1. 69(m, 1H), 1. 96-1. 84(m, 2H), 2. 18(td, J = 11. 5, 3. 3 Hz, 1H), 2. 63(ddd, J = 17. 1, 12. 3, 5. 1 Hz, 1H), 2. 98-2. 84(m, 4H), 3. 28(tt, J = 10. 4, 3. 1 Hz, 1H), 3. 49(d, J = 13. 0 Hz, 1H), 3. 59(d, J = 13. 0 Hz, 1H), 4. 68(ddd, J = 12. 8, 2. 9, 1. 8 Hz, 1H), 6. 59(d, J = 5. 6 Hz, 1H), 7. 28(m, 1H), 7. 37-7. 31(m, 4H), 7. 87(d, J = 5. 3 Hz, 1H).
이어서,
중간체 2; (R)-3-벤질-7-브로모-2,3,4,4a,5,6-헥사하이드로-1H-피라지노[1,2-a][1,6]나프티리딘(45 mg, 0. 126 mmol, 26% 수율). LCMS m/z = 360. 4 [M+H]+; 1H NMR(400 MHz, CDCl3): δ ppm 1. 69(m, 1H), 1. 97-1. 86(m, 2H), 2. 19(m, 1H), 2. 63(ddd, J = 17. 2, 11. 7, 5. 9 Hz, 1H), 3. 01-2. 80(m, 4H), 3. 18(tt, J = 10. 4, 3. 1 Hz, 1H), 3. 51(d, J = 13. 0 Hz, 1H), 3. 56(d, J = 13. 0 Hz, 1H), 3. 72(m, 1H), 6. 52(d, J = 6. 1 Hz, 1H), 7. 29(m, 1H), 7. 36-7. 31(m, 4H), 7. 86(d, J = 5. 8 Hz, 1H).
단계 B: (
R)
-8-벤질-4-(3-(트리플루오로메톡시)페닐)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘의 제조.
디옥산/물(9 : 1, 1 mL) 중의 (R)-8-벤질-4-클로로-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(29 mg, 0. 092 mmol), (3-(트리플루오로메톡시)페닐)보론산(38 mg, 0. 19 mmol), X-Phos(6. 6 mg, 0. 014 mmol), Pd(OAc)2(1. 6 mg, 0. 007 mmol), 및 K3PO4(49 mg, 0. 23 mmoL) 혼합물을 100 °C의 마이크로파에서 10시간 동안 가열하였다. 혼합물을 EtOAc로 희석하고, MgSO4 상에서 건조시키고, 여과하고, 농축하였다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(31 mg, 0. 073 mmol, 79% 수율)을 수득하였다. LCMS m/z = 440. 4 [M+H]+; 1H NMR(400 MHz, CDCl3): δ ppm 1. 60(m, 1H), 1. 91-1. 79(m, 2H), 2. 20(m, 1H), 2. 54(ddd, J = 16. 2, 4. 8, 3. 9 Hz, 1H), 2. 63(dd, J = 11. 9, 4. 8 Hz, 1H), 3. 00-2. 84(m, 3H), 3. 37(tt, J = 10. 2, 3. 3 Hz, 1H), 3. 50(d, J = 13. 1 Hz, 1H), 3. 60(d, J = 13. 1 Hz, 1H), 4. 82(m, 1H), 6. 45(d, J = 5. 1 Hz, 1H), 7. 13(m, 1H), 7. 22-7. 18(m, 2H), 7. 27(m, 1H), 7. 39-7. 29(m, 4H), 7. 43(t, J = 8. 0 Hz, 1H), 8. 03(d, J = 5. 3 Hz, 1H).
단계 C: (
R)
-4-(3-(트리플루오로메톡시)페닐)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘(화합물 105)의 제조.
MeOH(1. 0 mL) 중의 (R)-8-벤질-4-(3-(트리플루오로메톡시)페닐)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(31 mg, 0. 073 mmol) 용액에 암모늄 포르메이트(92. 2 mg, 1. 46 mmol) 및 10% Pd/C(40 mg)를 첨가하였다. 반응물을 마이크로파 조사를 통해 65 ℃에서 10시간 동안 가열하였다. 혼합물을 셀라이트를 통해 여과하고(81. 2 μl, 0. 583 mmol) 및 (BOC)2O(79. 5 mg, 0. 364 mmol)를 첨가하였다. 혼합물을 실온에서 밤새 교반하고 진공에서 농축하였다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 (R)-터트-부틸 4-(3-(트리플루오로메톡시)페닐)-6a,7,9,10-테트라하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-8(6H)-카복실레이트를 수득하였다. LCMS m/z = 450. 4 [M+H]+.
상기 (R)-터트-부틸 4-(3-(트리플루오로메톡시)페닐)-6a,7,9,10-테트라하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-8(6H)-카복실레이트를 디옥산(2. 5 mL) 중의 4N HCl로 처리하고 실온에서 2시간 동안 교반하였다. 진공에서 농축시킨 후, 생성된 잔류물을 물에 용해시키고, 냉동시키고 동결건조하여 표제 화합물을 수득하였다. LCMS m/z = 350. 2 [M+H]+; 1H NMR(400 MHz, CD3OD): δ ppm 1. 78(m, 1H), 2. 21(m, 1H), 2. 90-2. 73(m, 2H), 3. 20(m, 1H), 3. 43(m, 1H), 3. 77-3. 52(m, 3H), 4. 07(m, 1H), 4. 55(d, J = 10. 9 Hz, 1H), 7. 03(d, J = 4. 3 Hz, 1H), 7. 50-7. 34(m, 3H), 7. 67(t, J = 6. 8 Hz, 1H), 7. 98(d, J = 4. 3 Hz, 1H).
실시예 1. 13: (
R)
-4-(3,3,3-트리플루오로프로필)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 152)의 제조.
단계 A: (
R)
-8-벤질-4-(3,3,3-트리플루오로프로필)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘의 제조.
PhMe/물(9:1,3 mL) 중의 (R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(300 mg, 0. 837 mmol), 포타슘 3,3,3-트리플루오로프로판-1-트리플루오로보레이트(342 mg, 1. 68 mmol), RuPhos(58. 6 mg, 0. 126 mmol), Pd(OAc)2(14. 1 mg, 0. 0628 mmol), 및 K2CO3(347 mg, 2. 51 mmol) 혼합물을 115 °C의 마이크로파에서 10시간 동안 가열하였다. 혼합물을 EtOAc로 희석하고, MgSO4 상에서 건조시키고, 여과하고, 농축하였다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(272 mg, 0. 725 mmol, 87% 수율)을 수득하였다. LCMS m/z = 376. 2 [M+H]+; 1H NMR(400 MHz, CDCl3): δ ppm 1. 69(m, 1H), 1. 97-1. 84(m, 2H), 2. 18(td, J = 11. 6, 3. 4 Hz, 1H), 2. 37- 2. 23(m, 2H), 2. 62(ddd, J = 17. 3, 12. 1, 5. 6, Hz, 1H), 2. 78-2. 68(m, 3H), 2. 91-2. 83(m, 2H), 2. 96(m, 1H), 3. 28(tt, J = 10. 4, 3. 0 Hz, 1H), 3. 49(d, J = 13. 0 Hz, 1H), 3. 61(d, J = 13. 0 Hz, 1H), 4. 70(ddd, J = 12. 5, 3. 0, 2. 7 Hz, 1H), 6. 38(d, J = 5. 1 Hz, 1H), 7. 28(m, 1H), 7. 38-7. 31(m, 4H), 7. 95(d, J = 5. 1 Hz, 1H).
단계 B: (
R)
-4-(3,3,3-트리플루오로프로필)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘(화합물 152)의 제조.
DCM(5 mL) 중의 (R)-8-벤질-4-(3,3,3-트리플루오로프로필)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(272 mg, 0. 725 mmol) 용액에 1-클로로에틸 카보노클로리데이트(0. 235 ml, 2. 169 mmol) 및 DIEA(0. 378 mL, 2. 169 mmol)를 첨가하였다. 혼합물을 실온에서 밤새 교반하고 진공에서 농축하였다. 농축액을 MeOH(1. 5 mL)에 용해시키고 60 ℃의 마이크로파에서 2시간 동안 가열하였다. 재료를 Strata® SCX(5 g) 카트리지에 로딩하였다. MeOH(약 15 mL)를 칼럼에 통과시켜 결합하지 않은 불순물을 제거하였다. 이어서 생성물을 칼럼을 통해 MeOH(15 mL) 중의 2N NH3 용액에 통과시켜 용리하였다. 용리액을 농축시키고 생성된 유리 염기를 물(5 mL) 및 AcOH(2. 0 당량)로 처리하였다. 2분 동안 교반하고 휘저은(agitating) 후, 혼합물을 여과하고 여액을 냉동시키고 동결건조시켜 표제 화합물(210 mg, 0. 608 mmol, 84 % 수율)을 백색 고체로서 수득하였다. LCMS m/z = 286. 2 [M+H]+; 1H NMR(400 MHz, CDCl3): δ ppm 1. 72(m, 1H), 1. 99(s, 3H), 2. 03(m, 1H), 2. 39-2. 23(m, 2H), 2. 82-2. 57(m, 5H), 2. 97-2. 83(m, 2H), 3. 31-319(m, 2H), 3. 38(tt, J = 10. 5, 3. 2 Hz, 1H), 4. 86(m, 1H), 6. 44(d, J = 5. 1 Hz, 1H), 7. 96(d, J = 5. 3 Hz, 1H).
실시예 1.14: (R)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 (화합물 148)의 제조.
MeOH (1.5 mL) 중의 (R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 (14.0 mg, 15.6 μmol)의 용액에, 10% Pd/C (25 mg) 및 암모늄 포르메이트 (14.8 mg, 0.234 mmol) 를 첨가하였다. 그 혼합물을 마이크로파 조사를 통해서 5 시간 동안 60 °C 로 가열하였다. 그 혼합물을 셀라이트를 통해 여과하였으며 그 여액에 트리에틸아민 (21.8 μl, 0.156 mmol) 및 (BOC)2O (17.1 mg, 78.2 μmol) 을 첨가하였다. 그 용액을 실온에서 2 시간 동안 교반하여 농축하였다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여, (R)-터트-부틸 6a,7,9,10-테트라하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-8(6H)-카르복실레이트를 수득하였다. LCMS m/z = 290.4 [M+H]+.
위에서 수득된 (R)-터트-부틸 6a,7,9,10-테트라하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-8(6H)-카르복실레이트를 4N HCl/디옥산 (2.5 mL)으로 처리하여 실온에서 45분간 교반하였다. 진공에서 농축한 후, 그 물질을 물에 용해시켜 동결건조하여 표제 화합물 (2.0 mg, 6.5 μmol, 42% 수율)을 수득하였다. LCMS m/z = 190.2 [M+H]+; 1H NMR (400 MHz, CD3OD): δ ppm 1.87 (m, 1H), 2.26 (m, 1H), 2.93 (m, 1H), 3.24-3.09 (m, 1H), 3.77-3.54 (m, 4H), 3.98 (m, 1H), 4.45 (m, 1H), 7.04 (m, 1H), 7.94-7.81 (m, 2H).
실시예 1. 15: (
R)
-2,3,4,4a,5,6-헥사하이드로-1
H
-피라지노[1,2-
a
][1,6]나프티리딘(화합물 155)의 제조.
단계 A: (
R)
-3-벤질-2,3,4,4a,5,6-헥사하이드로-1
H
-피라지노[1,2-
a
][1,6]나프티리딘의 제조.
THF(0. 75 mL) 중의 (R)-3-벤질-7-브로모-2,3,4,4a,5,6-헥사하이드로-1H-피라지노[1,2-a][1,6]나프티리딘(23 mg, 64. 2 μmol) 용액에(사이클로부틸메틸)아연(II) 브로미드(0. 77 mL의 THF 중의 0. 5M 용액, 0. 385 mmol)를 첨가한 후에 Pd(dppf)Cl2 DCM 부가물(7. 9 mg, 9. 6 μmol)을 첨가하였다. 반응물을 100 ℃의 마이크로파에서 10시간 동안 가열하였다. 포화 수성 NaHCO3을 첨가하고 혼합물을 10분 동안 교반하였다. 혼합물을 EtOAc로 추출하고 유기물을 포화 수성 NaHCO3으로 세척하고, MgSO4 상에서 건조시키고, 여과하고, 농축하여 표제 화합물을 수득하였다. LCMS m/z = 280. 2 [M+H]+.
단계 B: (
R)
-2,3,4,4a,5,6-헥사하이드로-1
H
-피라지노[1,2-
a
][1,6]나프티리딘(화합물 155)의 제조.
(R)-3-벤질-2,3,4,4a,5,6-헥사하이드로-1H-피라지노[1,2-a][1,6]나프티리딘으로부터, 실시예 1. 12의 단계 C에 기술된 것과 유사한 방법을 사용하여 표제 화합물을 제조하였다. LCMS m/z = 190. 2 [M+H]+; 1H NMR(400 MHz, CD3OD): δ ppm 1. 84(m, 1H), 2. 27(m, 1H), 2. 93-2. 78(m, 2H), 3. 13(t, J = 12. 3 Hz, 1H), 3. 76-3. 49(m, 4H), 3. 94(m, 1H), 4. 50(d, J = 14. 9 Hz, 1H), 7. 22(d, J = 7. 1 Hz, 1H), 8. 07(s, 1H), 8. 16(d, J = 7. 1 Hz, 1H).
실시예 1. 16: (
R)
-7-(사이클로부틸메틸)-2,3,4,4a,5,6-헥사하이드로-1
H
-피라지노[1,2-
a
][1,6]나프티리딘(화합물 154)의 제조.
단계 A: (
R)
-3-벤질-7-(사이클로부틸메틸)-2,3,4,4a,5,6-헥사하이드로-1
H
-피라지노[1,2-a][1,6]나프티리딘의 제조.
THF(0. 75 mL) 중의 (R)-3-벤질-7-브로모-2,3,4,4a,5,6-헥사하이드로-1H-피라지노[1,2-a][1,6]나프티리딘 용액에 (사이클로부틸메틸)아연(II) 브로미드(0. 770 mL의 THF 중의 0. 5M 용액, 0. 385 mmol)를 신선하게 첨가한 후 Pd(dppf)Cl2. DCM 부가물(7. 9 mg, 9. 6 μmol)을 첨가하였다. 반응물을 100 ℃의 마이크로파에서 10시간 동안 가열하였다. 포화 수성 NaHCO3을 첨가하고 혼합물을 10분 동안 교반하였다. 혼합물을 EtOAc로 추출하고 유기물을 포화 수성 NaHCO3으로 세척하고, MgSO4 상에서 건조시키고, 여과하고, 농축하였다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(6. 0 mg, 17 μmol, 27% 수율)을 수득하였다. LCMS m/z = 348. 2 [M+H]+; 1H NMR(400 MHz, CDCl3): δ ppm 1. 95-1. 48(m, 7H), 2. 19(m, 1H), 2. 63(ddd, J = 17. 3, 12. 1, 5. 6, Hz, 1H), 2. 80-2. 69(m, 4H), 2. 97-2. 83(m, 3H), 3. 14(tt, J = 10. 4, 3. 0 Hz, 1H), 3. 50(d, J = 13. 0 Hz, 1H), 3. 56(d, J = 13. 0 Hz, 1H), 3. 73(m, 1H), 6. 45(d, J = 6. 1 Hz, 1H), 7. 27(m, 1H), 7. 36-7. 29(m, 4H), 8. 06(d, J = 6. 1 Hz, 1H).
단계 B: (
R)
-7-(사이클로부틸메틸)-2,3,4,4a,5,6-헥사하이드로-1
H
-피라지노[1,2-
a
][1,6]나프티리딘(화합물 154)의 제조.
(R)-3-벤질-7-(사이클로부틸메틸)-2,3,4,4a,5,6-헥사하이드로-1H-피라지노[1,2-a][1,6]나프티리딘으로부터, 실시예 1. 12의 단계 C에 기술된 것과 유사한 방법을 사용하여 표제 화합물을 제조하였다. LCMS m/z = 258. 4 [M+H]+; 1H NMR(400 MHz, CD3OD): δ ppm 1. 97-1. 75(m, 4H), 2. 11-2. 00(m, 2H), 2. 26(m, 1H), 2. 68(m, 1H), 2. 78(ddd, J = 20. 8, 10. 7, 6. 6 Hz, 1H), 2. 97-2. 87(m, 2H), 3. 11(m, 1H), 3. 26(m, 1H), 3. 78-3. 46(m, 5H), 3. 88(m, 1H), 4. 48(m, 1H), 7. 14(d, J = 7. 3 Hz, 1H), 8. 04(d, J = 7. 3 Hz, 1H).
실시예 1. 17: (
R)
-4-브로모-5,6,6a,7,8,9,10,11-옥타하이드로-[1,4]디아제피노[1,2-
a
][1,8]나프티리딘(화합물 156)의 제조.
단계 A: (
R)-터트
-부틸 3-(2-하이드록시에틸)-1,4-디아제판-1-카복실레이트의 제조.
디옥산(20 mL) 중의 (R)-터트-부틸 4-벤질-2-(2-하이드록시에틸)-1,4-디아제판-1-카복실레이트(7. 61 g, 22. 8 mmol)용액에 디옥산(56. 9 ml, 228 mmol) 중의 4N HCl을 첨가하였다. 혼합물을 실온에서 2. 5시간 동안 교반하고 진공에서 농축시켰다. 잔류물을 EtOAc와 수성 NaOH 사이에 분배하였다. 상을 분리시키고 유기물을 염수로 세척하고, MgSO4 상에서 건조하고, 여과하고, 농축하여 (R)-2-(4-벤질-1,4-디아제판-2-일)에탄올(5. 33 g, 22. 7 mmol, 100% 수율)을 수득하였다. LCMS m/z = 235. 4 [M+H]+; 1H NMR(400 MHz, CDCl3): δ ppm 1. 33(m, 1H), 1. 57(m, 1H), 1. 77- 1. 66(m, 2H), 2. 33(dd, J = 13. 4, 9. 3 Hz, 1H), 2. 49(ddd, J = 12. 9, 8. 1, 5. 1 Hz, 1H), 2. 89-2. 76(m, 3H), 2. 94(ddd, J = 14. 3, 7. 2, 5. 2 Hz, 1H), 3. 07(m, 1H), 3. 63(d, J = 13. 4 Hz, 1H), 3. 69(d, J = 13. 4 Hz, 1H), 3. 85-3. 72(m, 2H), 7. 25(m, 1H),7. 36-7. 28(m, 4H).
MeOH(50 mL) 중의 (R)-2-(4-벤질-1,4-디아제판-2-일)에탄올(5. 33 g, 22. 7 mmol) 용액에 10% Pd/C(1. 5 g)를 첨가하였다. 혼합물을 75 psi H2에서 Parr 진탕기 상에 18시간 동안 두었다. 혼합물을 셀라이트를 통해 여과하고 농축시켜 (R)-2-(1,4-디아제판-2-일)에탄올(2. 84 g, 19. 7 mmol, 87% 수율)을 투명 오일로서 수득하였다. 1H NMR(400 MHz, d 6 -DMSO): δ ppm 1. 42-1. 28(m, 2H), 1. 63-1. 51(m, 2H), 2. 26(dd, J = 13. 4, 9. 1 Hz, 1H), 2. 70-2. 59(m, 3H), 2. 90-2. 77(m, 3H), 3. 28-3. 00(br s, 3H), 3. 49(t, J = 6. 3 Hz, 2H). LCMS m/z = 145. 4 [M+H]+.
(R)-2-(1,4-디아제판-2-일)에탄올(2. 84 g, 19. 7 mmol)을 MeOH(25 mL)에 용해시키고, 0 °C로 냉각시키고 MeOH(25 mL) 중의 (BOC)2O(4. 221 g, 19. 34 mmol)를 시린지 펌프를 통해 1시간 동안 적하 방식으로 첨가하였다. 혼합물을 서서히 실온으로 가온하고 밤새 교반하였다. 혼합물을 진공에서 농축시키고 EtOAc와 포화 수성 NH4Cl 사이에 분배하였다. 소량의 수성 1N HCl을 첨가하여 수성 상이 산성이 되도록 하였다. 상을 분리하고 EtOAc 층을 포화 수성 NH4Cl로 추출하였다. 유기 상을 폐기하였다. 수성 상을 10% 수성 NaOH로 염기성으로 만들고 DCM(3x)으로 추출하였다. 유기물을 MgSO4 상에서 건조시키고, 여과하고, 농축하여 투명 오일로서 표제 화합물(3. 756 g, 15. 37 mmol, (R)-터트-부틸 4-벤질-2-(2-하이드록시에틸)-1,4-디아제판-1-카복실레이트로부터 68% 수율)을 수득하였다. LCMS m/z = 245. 4 [M+H]+; 1H NMR(400 MHz, CDCl3): δ ppm 1. 46(s, 9H), 1. 65-1. 48(m, 2H), 1. 88-1. 64(m, 1H), 2. 72(m, 1H), 2. 86(m, 1H), 3. 22-2. 94(m, 3H), 3. 68(m, 1H), 3. 89-3. 74(m, 3H).
단계 B: (
R)-터트
-부틸 헥사하이드로-[1,2,3]옥사티아지노[3,4-
a
][1,4]디아제핀-6(7
H
)-카복실레이트 1,1-디옥시드의 제조.
DCM(150 mL) 중의 이미다졸(7. 82 g, 115 mmol) 빙냉 용액에 DCM(40 mL) 중의 티오닐 클로라이드(2. 794 ml, 38. 31 mmol)를 적하 방식으로 첨가하였다. 빙조를 제거하고 혼합물을 실온에서 1시간 동안 교반하였다. 혼합물을 -78 ℃로 냉각시키고 DCM(50 mL) 중의 (R)-터트-부틸 3-(2-하이드록시에틸)-1,4-디아제판-1-카복실레이트(3. 74 g, 15. 3 mmol)를 적하 방식으로 첨가하였다. 혼합물을 실온으로 가온시키고 밤새 교반하였다. 포화 수성 NH4Cl을 첨가하고 층을 분리하였다. 수성 상을 DCM으로 역추출하고 합한 유기물을 포화 수성 NH4Cl(2Х) 및 염수로 세척하였다. 유기물을 MgSO4 상에서 건조시키고, 여과하고, 농축하여 투명 오일로서 (4aR)-터트-부틸 헥사하이드로-[1,2,3]옥사티아지노[3,4-a][1,4]디아제핀-6(7H)-카복실레이트 1-옥시드(3. 506 g, 13. 32 mmol, 87% 수율)를 부분입체 이성질체의 혼합물(1. 12:1)로서 수득하였다. LCMS m/z = 291. 4 [M+H]+; 1H NMR(400 MHz, CDCl3): δ ppm 1. 45(m, 9H), 1. 55(m, 1H), 2. 05-1. 69(m, 3H), 2. 79(m, 0. 47H), 3. 29-2. 32(m, 3H), 4. 29-3. 51(m, 4. 53H), 4. 37(dt, J = 12. 1, 4. 2 Hz, 0. 47H), 4. 87(m, 0. 53H).
RuCl3-수화물(7. 5 mg, 33 μmol)을 물(7. 0 mL)에 용해시켰다. 소량의 소듐 퍼리오데이트를 첨가하였다(물 용액에 완전히 용해된 약 1. 00 g의 소듐 퍼리오데이트를 첨가하였음). 수용액 및 잔류의 소듐 퍼리오데이트를 교반 막대가 들어있는 500 mL RB 플라스크에서 실리카겔(15 g)에 첨가하였다. 5분 후, EtOAc(60 mL)를 첨가하고 혼합물을 빙조에서 냉각시켰다. EtOAc(60 mL) 중의 (4aR)-터트-부틸 헥사하이드로-[1,2,3]옥사티아지노[3,4-a][1,4]디아제핀-6(7H)-카복실레이트 1-옥시드(상기로부터 3. 506 g, 13. 29 mmol) 용액을 실리카겔/옥시던트 슬러리에 적하 방식으로 첨가하였다. 혼합물을 실온으로 천천히 가온하면서 3시간 동안 교반하였다. 슬러리를 실리카겔 패드를 통해 여과하였다. 여액을 MgSO4 상에서 건조시키고, 여과시키고, 농축하여 백색 고체로서 표제 화합물(2. 396 g, 7. 820 mmol, 59% 수율)을 수득하였다. LCMS m/z = 307. 6 [M+H]+; 1H NMR(Boc-rotamers의 1 : 1 혼합물, 400 MHz, CDCl3): δ ppm 1. 46(s, 4. 5H), 1. 47(s, 4. 5H), 1. 56(m, 1H), 2. 02-1. 74(m, J = 3H), 2. 93(m, 0. 5H), 3. 29-2. 99(m, 2. 5H), 3. 80-3. 62(m, 1. 5H), 3. 98-3. 81(m, 1. 5H), 4. 49-432(m, 2H), 4. 70(m, 1H).
단계 C: (
R)-터트
-부틸 4-브로모-5,6,6a,7,10,11-헥사하이드로-[1,4]디아제피노[1,2-
a
][1,8]나프티리딘-8(9
H
)-카복실레이트의 제조.
N2 하에 -78 °C에서 THF(6. 0 mL) 중의 2,2,6,6-테트라메틸피페리딘(0. 397 mL, 2. 350 mmol) 용액에 n-부틸리튬(0. 940 mL의 헥산 중의 2. 5 M 용액, 2. 350 mmol)을 첨가하였다. 30분 동안 교반한 후 HMPA(1. 29 mL, 7. 34 mmol)를 함유하는 THF(3 mL) 중의 4-브로모-2-플루오로피리딘(414 mg, 2. 35 mmol) 용액을 첨가하였다. 혼합물을 1시간 동안 추가로 교반하였으며 이때 THF(3 mL) 중의 (R)-터트-부틸 헥사하이드로-[1,2,3]옥사티아지노[3,4-a][1,4]디아제핀-6(7H)-카복실레이트 1,1-디옥시드(450 mg, 1. 47 mmol)를 첨가하였다. 혼합물을 즉시 빙수조로 전환시켜 0 ℃로 가열하였다. 혼합물을 서서히 실온으로 가온하고 밤새 교반하며 아세트산(1. 5 mL) 및 물(1. 5 mL)을 첨가하였다. 반응 혼합물을 밀봉된 바이알로 옮기고 80 ℃에서 18시간 동안 가열하였다. 혼합물을 진공에서 농축시키고 EtOAc와 10% 수성 NaOH 사이에 분배하였다. 상을 분리시키고 유기물을 염수로 세척하고, MgSO4 상에서 건조시키고, 여과하고, 농축하였다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(88 mg, 0. 230 mmol, 16% 수율)을 수득하였다. LCMS m/z = 384. 2 [M+H]+; 1H NMR(Boc-rotamers의 1.8:1 혼합물, 400 MHz, CDCl3): δ ppm 1. 41(s, 3. 24H), 1. 46(s, 5. 76H), 2. 05-1. 79(m, 3H), 2. 17(m, 1H), 3. 10(m, 0. 64H), 3. 21-2. 55(m, 5H), 3. 72-3. 53(m, 2. 36H), 3. 95(dd, J = 13. 5, 3. 7 Hz, 0. 64H), 4. 61(m, 1H), 6. 70(d, J = 5. 6 Hz, 1H), 7. 75(d, J = 5. 3 Hz, 1H).
단계 D: (
R)
-4-브로모-5,6,6a,7,8,9,10,11-옥타하이드로-[1,4]디아제피노[1,2-
a
][1,8]나프티리딘(화합물 156)의 제조.
DCM/TFA(1:1, 1. 0 mL) 중의 (R)-터트-부틸 4-브로모-5,6,6a,7,10,11-헥사하이드로-[1,4]디아제피노[1,2-a][1,8]나프티리딘-8(9H)-카복실레이트(9. 6 mg, 0. 025 mmol) 용액을 실온에서 밤새 교반하였다. 혼합물을 진공에서 농축하고 동결건조한 후 HPLC로 정제하여 표제 화합물(6. 8 mg, 17 μmol, 68% 수율)을 수득하였다. LCMS m/z = 282. 4 [M+H]+; 1H NMR(400 MHz, CD3OD): δ ppm 2. 14-2. 01(m, 2H), 2. 38-2. 15(m, 2H), 2. 80(m, 1H), 3. 05(m, 1H), 3. 30-3. 20(m, 2H), 3. 55-3. 41(m, 3H), 4. 24(m, 1H), 4. 34(m, 1H), 7. 09(d, J = 5. 6 Hz, 1H), 7. 77(d, J = 6. 2 Hz, 1H).
실시예 1. 18: (
R)
-4-(3,3,3-트리플루오로프로필)-5,6,6a,7,8,9,10,11-옥타하이드로-[1,4]디아제피노[1,2-
a
][1,8]나프티리딘(화합물 157)의 제조.
단계 A: (
R)-터트
-부틸 4-(3,3,3-트리플루오로프로필)-5,6,6a,7,10,11-헥사하이드로-[1,4]디아제피노[1,2-
a
][1,8]나프티리딘-8(9
H
)-카복실레이트의 제조.
(R)-터트-부틸 4-브로모-5,6,6a,7,10,11-헥사하이드로-[1,4]디아제피노[1,2-a][1,8]나프티리딘-8(9H)-카복실레이트로부터, 실시예 1. 13의 단계 A에 기술된 것과 유사한 방법을 사용하여 표제 화합물을 제조하였다. LCMS m/z = 400. 2 [M+H]+; 1H NMR(Boc-rotamers의 2:1 혼합물, 400 MHz, CDCl3): δ ppm 1. 44(s, 9H), 2. 05-1. 78(m, 3H), 2. 18(m, 1H), 2. 42-2. 25(m, 2H), 2. 80-2. 56(m, 4H), 3. 14-2. 80(m, 3H), 3. 79-3. 56(m, 2. 33H), 3. 90(dd, J = 13. 5, 3. 9 Hz, 0. 66H), 4. 65(ddd, J = 14. 3, 6. 3, 1. 4 Hz, 1H), 6. 33(d, J = 5. 1 Hz, 1H), 7. 93(d, J = 5. 3 Hz, 1H).
단계 B: (
R)
-4-(3,3,3-트리플루오로프로필)-5,6,6a,7,8,9,10,11-옥타하이드로-[1,4]디아제피노[1,2-a][1,8]나프티리딘(화합물 157)의 제조.
(R)-터트-부틸 4-(3,3,3-트리플루오로프로필)-5,6,6a,7,10,11-헥사하이드로-[1,4]디아제피노[1,2-a][1,8]나프티리딘-8(9H)-카복실레이트로부터, 실시예 1. 17의 단계 D에 기술된 것과 유사한 방법을 사용하여 표제 화합물을 제조하였다. LCMS m/z = 300. 4 [M+H]+; 1H NMR(400 MHz, CD3OD): δ ppm 2. 19-2. 02(m, 2H), 2. 41-2. 25(m, 2H), 2. 62-2. 48(m, 2H), 2. 82(ddd, J = 17. 4, 11. 8, 5. 6 Hz, 1H), 3. 03-2. 94(m, 3H), 3. 42-3. 32(m, 2H), 3. 51(dd, J = 14. 0, 3. 8 Hz, 1H), 3. 55(ddd, J = 13. 8, 7. 8, 3. 4 Hz, 1H), 3. 66(ddd, J = 14. 5, 8. 0, 4. 8 Hz, 1H), 4. 06(ddd, J = 14. 5, 6. 1, 5. 2 Hz, 1H), 4. 35(m, 1H), 6. 96(d, J = 6. 6 Hz, 1H), 7. 81(d, J = 6. 6 Hz, 1H).
실시예 1. 19: (
R)
-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,7]나프티리딘(화합물 153)의 제조.
단계 A: (
R)
-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,7]나프티리딘의 제조.
N2 하에 -78 °C에서 THF(4. 0 mL) 중의 2,2,6,6-테트라메틸피페리딘(0. 136 ml, 0. 807 mmol) 용액에 n-부틸리튬(0. 323 ml의 헥산 중의 2. 5 M 용액, 0. 807 mmol)을 첨가하였다. 30분 동안 교반한 후에, THF(1. 5 mL) 중의 3-브로모-5-플루오로피리딘(133 mg, 0. 757 mmol) 용액을 첨가하였다. 혼합물을 45분 동안 교반하였으며 THF(1. 5 mL) 중의 (R)-6-벤질헥사하이드로-3H-피라지노[1,2-c][1,2,3]옥사티아진 1,1-디옥시드(142 mg, 0. 505 mmol)를 첨가하였다. 혼합물을 즉시 빙수조로 전환시켜 0 ℃로 가열하였다. 2시간 동안 교반한 후, MeOH(5 mL) 중의 1. 25M HCl을 첨가하여 급랭시켰다. 혼합물을 10분 동안 교반하고 진공에서 농축시켰다. 잔류물을 MeOH(4 mL) 중에 용해시키고 1N 수성 HCl(2 mL)로 처리하고 마이크로파 조사를 통해 60 °C에서 2시간 동안 가열하였다. 혼합물을 HPLC로 정제하였다. 합한 분획을 농축시키고 DCM과 포화 수성 NaHCO3 사이에 분배하였다. 상을 분리시키고 수성 상을 DCM으로 역추출하였다. 합한 유기물을 MgSO4 상에서 건조시키고, 여과하고, 농축하여 (R)-1-벤질-3-(2-(3-브로모-5-플루오로피리딘-4-일)에틸)피페라진을 수득하였다. LCMS m/z = 380. 2 [M+H]+.
DMF(2. 0 mL) 중의 (R)-1-벤질-3-(2-(3-브로모-5-플루오로피리딘-4-일)에틸)피페라진 용액에 K2CO3(31 mg, 0. 275 mmol)을 첨가하였다. 마이크로파 조사를 통해 반응물을 120 ℃로 가열하고 6시간 동안 교반하였다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(9. 4 mg, 26 μmol, 5% 수율)을 수득하였다. LCMS m/z = 360. 4 [M+H]+; 1H NMR(400 MHz, CDCl3): δ ppm 1. 72(m, 1H), 1. 97-1. 86(m, 2H), 2. 26(m, 1H), 2. 66(ddd, J = 17. 9, 11. 7, 6. 7 Hz, 1H), 3. 00-2. 81(m, 4H), 3. 05(tt, J = 10. 4, 2. 9 Hz, 1H), 3. 51(d, J = 13. 0 Hz, 1H), 3. 57(d, J = 13. 0 Hz, 1H), 3. 76(m, 1H), 7. 28(m, 1H), 7. 60-7. 30(m, 4H), 8. 03(s, 1H), 8. 07(s, 1H).
단계 B: (
R)
-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,7]나프티리딘(화합물 153)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,7]나프티리딘으로부터, 실시예 1. 12의 단계 C에 기술된 방법과 유사한 방법을 사용하여 표제 화합물을 제조하였다. LCMS m/z = 190. 2 [M+H]+; 1H NMR(400 MHz, CD3OD): δ ppm 1. 86(m, 1H), 2. 21(m, 1H), 3. 17-2. 98(m, 3H), 3. 39(m, 1H), 3. 60-3. 49(m, 2H), 3. 72-3. 63(m, 2H), 4. 23(d, J = 13. 6 Hz, 1H), 7. 65(d, J = 5. 6 Hz, 1H), 8. 08(d, J = 5. 8 Hz, 1H), 8. 35(s, 1H).
실시예 1. 20: 4-브로모-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘(화합물 136)의 제조.
단계 A: 에틸 4-(4-브로모-2-플루오로피리딘-3-일)-4-하이드록시부트-2-이노에이트의 제조.
N2 하에 -78 °C에서 THF(100 mL) 중의 에틸프로프-2-이노에이트(2. 92 g, 29. 8 mmol) 용액에 LDA(14. 9 mL의 THF/헵탄/에틸벤젠 중의 2M 용액, 29. 8 mmol)을 적하 방식으로 첨가하였다. 혼합물을 -78 ℃에서 20분 동안 교반하고 THF 중의 4-브로모-2-플루오로-피리딘-3-카브알데하이드(5. 79 g, 28. 38 mmol) 용액을 첨가하였다. 혼합물을 -78 ℃에서 1시간 동안 교반하고 포화 수성 NH4Cl(100 mL)을 첨가하여 반응물을 급랭시켰다. 혼합물을 EtOAc(3 Х 100 mL)로 추출하고 합한 유기물을 Na2SO4 상에서 건조시기고,여과하고 농축하였다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(1. 47 g, 4. 87 mmol, 17% 수율)을 적색 오일로서 수득하였다. LCMS m/z = 302. 0 [M+H]+; 1H NMR(400 MHz, CDCl3): δ ppm 1. 32(t, J = 7. 2 Hz, 3 H), 3. 08(dd, J = 9. 2, 2. 8 Hz, 1H), 4. 26(q, J = 7. 2 Hz, 2H), 6. 04(dd, J = 9. 1, 1. 9 Hz, 1H), 7. 49-7. 44(m, 1H), 8. 05(dd, J = 5. 3, 0. 8 Hz, 1H).
단계 B: (
E)
-에틸 4-(4-브로모-2-플루오로피리딘-3-일)-4-옥소부트-2-에노에이트의 제조.
15 °C에서 디옥산(40 mL) 중의 에틸 4-(4-브로모-2-플루오로피리딘-3-일)-4-하이드록시부트-2-이노에이트(1. 30 g, 4. 30 mmol) 용액에 Et3N(653 mg, 6. 45 mmol)을 첨가하였다. 이어서 반응물을 60 ℃로 가열하고 16시간 동안 교반하였다. 혼합물을 진공에서 농축시켰다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물 (903 mg, 2. 99 mmol, 69% 수율)을 황색 오일로서 수득하였다. 1H NMR(400 MHz, CDCl3): δ ppm 1. 34(t, J = 7. 2 Hz, 3H), 4. 30(q, J = 7. 1 Hz, 2H), 6. 58(d, J = 16. 1 Hz, 1H), 7. 31(d, J = 16. 1 Hz, 1H), 7. 52(d, J = 5. 4 Hz, 1H), 8. 17(d, J = 5. 3 Hz, 1H).
단계 C: 4-브로모-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘(화합물 136)의 제조.
실온에서 THF(10 mL) 중의 에틸(E)-4-(4-브로모-2-플루오로-3-피리딜)-4-옥소-부트-2-에노에이트(200 mg, 0. 662 mmol) 용액에 에탄-1,2-디아민(35. 8 mg, 0. 596 mmol) 및 K2CO3(183 mg, 1. 32 mmol)을 첨가하였다. 반응 혼합물을 실온에서 15시간 동안 교반하고 혼합물을 여과하고 여액을 농축하여 4-브로모-6,6a,9,10-테트라하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-5,7(8H)-디온을 수득하였다. LCMS m/z = 296. 0 [M+H]+.
THF(10 mL) 중의 (상기로부터의) 4-브로모-6,6a,9,10-테트라하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-5,7(8H)-디온 용액에 하나의 부분의 BH3-Me2S(0. 338 mL의 10 M 용액, 3. 38 mmol)를 15 °C에서 첨가하였다. 혼합물을 15 내지 20 ℃에서 15시간 동안 교반하였다. 이어서 반응물을 60 내지 80 ℃로 가열하고 16시간 동안 교반하였다. 반응물을 0 °C로 냉각시키고 0 ℃에서 MeOH(20 mL)를 첨가하여 급랭시켰다. 혼합물을 진공에서 농축시켰다. 잔류물을 HPLC로 정제하여 표제 화합물(19 mg, 0. 071 mmol, 11% 수율)을 황색 고체로서 수득하였다. LCMS m/z = 268. 1 [M+H]+; 1H NMR(400 MHz, CD3OD): δ ppm 1. 69(m, 1H), 2. 07(m, 1H), 2. 35(m, 1H), 2. 59(td, J = 12. 0, 6. 0 Hz, 1H), 2. 70(ddd, J = 17. 6, 12. 0, 5. 6 Hz, 1H), 2. 82(td, J = 13. 2, 3. 2 Hz, 1H), 2. 97(m, 1H), 3. 25-3. 12(m, 2H), 3. 30(m, 1H), 4. 73(ddd, J = 14. 0, 3. 6, 1. 6 Hz, 1H), 6. 90(d, J = 5. 6 Hz, 1H),7. 78(d, J = 5. 6 Hz, 1H).
실시예 1. 21: 4-(사이클로부틸메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘(화합물 137)의 제조.
단계 A:
터트
-부틸 4-브로모-6a,7,9,10-테트라하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘-8(6
H
)-카복실레이트의 제조.
실온에서 THF(0. 5 mL) 중의 4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(17 mg, 0. 063 mmol), 및 Et3N(13 μL, 0. 095 mmol)의 용액에 Boc2O(21 mg, 0. 095 mmol)를 첨가하였다. 혼합물을 실온에서 밤새 교반하고 추가의 Boc2O(28 mg, 0. 126 mmol) 및 Et3N(13 μL, 0. 095 mmol)을 첨가하였다. 혼합물을 추가로 66시간 동안 교반하였다. 혼합물을 MeOH(0. 5 mL)로 추가로 희석하고 추가의 BOC2O(21 mg, 0. 095 mmol) 및 Et3N(26 μL, 0. 126 mmol)을 첨가하였다. 혼합물을 마이크로파 조사를 통해 60 °C에서 10시간 동안 가열하였다. 혼합물을 농축하고 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(16 mg, 40 μmol, 63% 수율)을 수득하였다. LCMS m/z = 370. 2 [M+H]+; 1H NMR(400 MHz, CDCl3): δ ppm 1. 48(s, 9H), 1. 70(m, 1H), 2. 03(m, 1H), 2. 72-2. 57(m, 2H), 2. 79(td, J = 12. 8, 3. 2 Hz, 1H), 3. 00-2. 88(m, 2H), 3. 20(tt, J = 10. 5, 3. 3 Hz, 1H), 4. 22-3. 96(m, 1H), 4. 72(d, J = 12. 9 Hz, 1H), 6. 79(d, J = 5. 6 Hz, 1H),7. 78(d, J = 5. 3 Hz, 1H).
단계 B: 4-(사이클로부틸메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘(화합물 137)의 제조.
터트-부틸 4-브로모-6a,7,9,10-테트라하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-8(6H)-카복실레이트(16. 2 mg, 39. 6 μmol)를 THF(0. 396 mL의 0. 5 M 용액, 0. 198 mmol) 중의 (사이클로부틸메틸)아연(II) 브로미드 용액에 용해하였다. Pd(dppf)Cl2. DCM 부가물(3. 2 mg, 4. 0 μmol)을 첨가하고 혼합물을 마이크로파 조사를 통해 90 °C에서 2시간 동안 가열하였다. 추가의 Pd(dppf)Cl2. DCM 부가물(6. 4 mg, 8. 0 μmol) 및 신선한 THF(0. 396 mL의 0. 5 M 용액, 0. 198 mmol) 중의 (사이클로부틸메틸)아연(II) 브로미드를 첨가하였다. 반응물을 100 ℃에서 10시간 동안 가열하였다. 혼합물을 HPLC로 정제하여 터트-부틸 4-브로모-6a,7,9,10-테트라하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-8(6H)-카복실레이트를 수득하였다. LCMS m/z = 358. 4 [M+H]+.
터트-부틸 4-브로모-6a,7,9,10-테트라하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-8(6H)-카복실레이트를 4N HCl/디옥산(2. 5 mL) 중에서 실온에서 2. 5시간 동안 교반하고 진공에서 농축하였다. 잔류물을 물에 용해시키고, 냉동시킨 후 동결건조시켜 표제 화합물(2. 0 mg, 5. 3 μmol, 13% 수율)을 수득하였다. LCMS m/z = 258. 4 [M+H]+.
실시예 1. 22: (
R)
-4-클로로-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘(화합물 150)의 제조.
실온에서 DCM(1. 5 mL) 중의 (R)-8-벤질-4-클로로-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(20 mg, 63. 7 μmol)의 교반된 용액에 DIEA(33. 3 μL, 0. 191 mmol)를 첨가한 후 1-클로로에틸 카보노클로리데이트(20. 7 μL, 0. 191 mmol)를 천천히 첨가하였다. 반응물을 40 ℃에서 1시간 동안 교반하였다. 혼합물을 농축시켰다. 잔류물을 메탄올(1. 5 mL)에 용해시켰다. 반응물을 환류에서 1시간 동안 가열하였다. 혼합물을 농축시켰다. 잔류물을 세미 분취용(semi preparative) HPLC로 정제하였다. 합한 분획을 동결건조시켜 표제 화합물(12 mg, 41. 7 %)을 수득하였다. LCMS m/z = 224. 0 [M+H+]; 1H NMR(400 MHz, CD3OD) δ ppm 1. 72-1. 84(m, 1H), 2. 14-2. 21(m, 1H), 2. 71-2. 81(m, 1H), 2. 96(dd, J = 12. 4 및 11. 7 Hz, 1H), 3. 00-3. 22(m, 3H), 3. 45-3. 62(m, 3H), 4. 88-4. 94(m, 1H), 6. 83(d, J = 5. 6 Hz, 1H), 7. 90(d, J = 5. 6 Hz, 1H).
실시예 1. 23: (
R)
-4-사이클로프로필-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘(화합물 151)의 제조.
단계 A: (
R)
-8-벤질-4-사이클로프로필-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘의 제조.
실온에서 N2 하에 THF(1. 5 mL) 중의 (R)-8-벤질-4-클로로-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(26 mg, 82. 85 μmol) 용액에 비스(트리-터트-부틸포스핀)팔라듐(8. 5 mg, 16. 57 μmol) 및 THF(0. 331 mL, 0. 166 mmol) 중의 0. 5 M 용액의 사이클로프로필아연 브로미드를 첨가하였다. 반응물을 환류에서 밤새 교반하였다. 반응물에 2 당량의 추가의 비스(트리-터트-부틸포스핀)팔라듐 및 2 당량의 추가의 THF 중의 0. 5 M 용액의 사이클로프로필아연 브로미드를 첨가하였다. 반응물을 마이크로파 조사 하에 100 ℃에서 4시간 동안 가열하였다. 반응물을 포화 NH4Cl로 급랭시켰다. 혼합물을 에틸 아세테이트로 추출하였다. 합한 유기물을 농축시켰다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(19 mg, 71. 8 %)을 수득하였다. LCMS m/z = 320. 0 [M+H]+.
단계 B: (
R)
-4-사이클로프로필-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘(화합물 151)의 제조.
실온에서 DCM(1. 5 mL) 중의 (R)-8-벤질-4-사이클로프로필-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(19 mg, 59. 48 μmol) 용액에 DIEA(32. 7 μL, 0. 188 mmol)를 첨가한 후 1-클로로에틸 카보노클로리데이트(20. 3 μL, 0. 188 mmol)를 천천히 첨가하였다. 반응물을 40 ℃에서 1시간 동안 교반하였다. 혼합물을 농축시켰다. 잔류물을 메탄올(1. 5 mL)에 용해시키고 1시간 동안 환류에서 가열하였다. 혼합물을 농축시켰다. 잔류물을 세미 분취용 HPLC로 정제하였다. 합한 분획을 동결건조시켜 표제 화합물(13 mg, 45. 4 %)을 수득하였다. LCMS m/z = 230. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 0. 88-0. 98(m, 2H), 1. 22-1. 28(m, 2H), 1. 78-1. 90(m, 1H), 2. 11-2. 17(m, 1H), 2. 24-2. 32(m, 1H), 2. 84-2. 94(m, 1H), 3. 10(dd, J = 12. 5 및 11. 8 Hz, 1H), 3. 16(dt, J = 16. 4 및 4. 9 Hz, 1H), 3. 25-3. 35(m, 1H), 3. 50-3. 65(m, 3H), 3. 80-3. 88(m, 1H), 4. 36-4. 43(m, 1H), 6. 57(d, J = 6. 7 Hz, 1H), 7. 78(d, J = 6. 7 Hz, 1H).
실시예 1. 24 : (
R)
-4-사이클로부틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘(화합물 149)의 제조.
(R)-8-벤질-4-클로로-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 사이클로부틸아연 브로미드를 사용하여 실시예 1. 23에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 244. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 72-1. 82(m, 1H), 1. 86-1. 94(m, 1H), 2. 08-2. 27(m, 4H), 2. 38-2. 46(m, 2H), 2. 64-2. 74(m, 1H), 2. 87(dt, J = 16. 4 및 4. 9 Hz, 1H), 3. 07(dd, J = 12. 4 및 11. 7 Hz, 1H), 3. 25-3. 35(m, 1H), 3. 45-3. 63(m, 3H), 3. 73-3. 83(m, 2H), 4. 42-4. 48(m, 1H), 7. 04(d, J = 6. 4 Hz, 1H), 7. 90(d, J = 6. 4 Hz, 1H).
실시예 1. 25: (
R)
-4-벤질-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 106)의 제조.
단계 A: (
R)
-4,8-디벤질-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘의 제조.
실온에서 N2 하에 THF(10 mL) 중의 (R)-8-벤질-4-클로로-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(424 mg, 1. 351 mmol) 용액에 비스(트리-터트-부틸포스핀)팔라듐(138 mg, 0. 270 mmol) 및 THF(5. 404 mL, 2. 702 mmol) 중의 0. 5 M 용액의 벤질아연 브로미드를 첨가하였다. 반응물을 62 ℃에서 밤새 교반하였다. 반응물을 NH4Cl로 급랭시키고 에틸 아세테이트로 추출하였다. 합한 유기물을 농축시켰다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(422 mg, 84. 5 %)을 수득하였다. LCMS m/z = 370. 2 [M+H]+; 1H NMR(400 MHz, CDCl3) δ ppm 1. 62-1. 73(m, 1H), 1. 83-1. 95(m, 2H), 2. 20-2. 29(m, 1H), 2. 50-2. 62(m, 1H), 2. 71-2. 78(m, 1H), 2. 87-3. 04(m, 3H), 3. 24-3. 32(m, 1H), 3. 53 및 3. 63(AB, J = 13. 1 Hz, 2H), 3. 87(d, J = 2. 5 Hz, 2H), 4. 71-4. 78(m, 1H), 6. 40(d, J = 5. 1 Hz, 1H), 7. 08-7. 12(m, 2H), 7. 17-7. 22(m, 1H), 7. 25-7. 38(m, 7H), 7. 98(d, J = 5. 1 Hz, 1H).
단계 B: (
R)
-4-벤질-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 106)의 제조.
실온에서 DCM(10 mL) 중의 (R)-4,8-디벤질-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(470 mg, 1. 272 mmol)의 교반된 용액에 DIEA(0. 665 mL, 3. 816 mmol)를 첨가한 후 1-클로로에틸 카보노클로리데이트(0. 413 mL, 3. 816 mmol)를 천천히 첨가하였다. 반응물을 40 ℃에서 2시간 동안 교반하고 농축하였다. 잔류물을 메탄올(10 mL)에 용해시키고 1시간 동안 환류에서 가열하였다. 혼합물을 농축시켰다. 잔류물을 분취용 HPLC로 정제하였다. 합한 분획을 동결건조시켜 TFA 염으로서 표제 화합물을 수득하고, 이를 메탄올(5 mL) 중의 1. 25 M 용액 중에 용해시킨 다음, 농축하였다. 이 과정을 3회 반복하여 표제 화합물을 HCl 염(388 mg, 86. 6 %)으로서 수득하였다. LCMS m/z = 280. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 72-1. 84(m, 1H), 2. 21-2. 28(m, 1H), 2. 71-2. 81(m, 1H), 3. 00(dt, J = 16. 5 및 4. 8 Hz, 1H), 3. 13(dd, J = 12. 5 및 11. 8 Hz, 1H), 3. 30-3. 40(m, 1H), 3. 53-3. 71(m, 3H), 3. 89-3. 98(m, 1H), 4. 13(s, 2H), 4. 40-4. 48(m, 1H), 6. 92(d, J = 6. 5 Hz, 1H), 7. 18-7. 27(m, 3H), 7. 30-7. 35(m, 2H), 7. 84(d, J = 6. 5 Hz, 1H).
실시예 1. 26: (
R)
-4-에틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 110)의 제조.
단계 A:
(R)
-8-벤질-4-에틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘의 제조.
실온에서 N2 하에 THF(2 mL) 중의 (R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(25 mg, 69. 78 μmol) 용액에 비스(트리-터트-부틸포스핀) 팔라듐(7. 2 mg, 13. 96 μmol) 및 헥산(0. 14 mL, 0. 140 mmol) 중의 1 M 용액의 디에틸아연을 첨가하였다. 반응물을 62 ℃에서 밤새 교반하였다. 혼합물을 여과하였다. 여액을 농축시켰다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(18 mg, 83 %)을 수득하였다. LCMS m/z = 308. 2 [M+H]+.
단계 B: (
R)
-4-에틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 110)의 제조.
실온에서 상기에서 수득한 DCM(1. 5 mL) 중의 (R)-8-벤질-4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 용액에 DIEA(36. 4 μL, 0. 209 mmol)를 첨가한 후 1-클로로에틸 카보노클로리데이트(22. 6 μL, 0. 209 mmol)를 천천히 첨가하였다. 반응물을 40 ℃에서 1시간 동안 교반하였다. 혼합물을 농축시켰다. 잔류물을 메탄올(1. 5 mL)에 용해시키고 30분 동안 환류에서 가열하였다. 혼합물을 농축하였다. 잔류물을 세미 분취용 HPLC로 정제하였다. 합한 분획을 동결건조시켜 표제 화합물(26 mg, 83. 7 %)을 수득하였다. LCMS m/z = 218. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 26(t, J = 7. 6 Hz, 3H), 1. 77-1. 87(m, 1H), 2. 23-2. 31(m, 1H), 2. 72-2. 82(m, 1H), 2. 77(q, J = 7. 6 Hz, 2H), 2. 98(dt, J = 16. 5 및 4. 9 Hz, 1H), 3. 13(dd, J = 12. 6 및 11. 8 Hz, 1H), 3. 32-3. 39(m, 1H), 3. 55-3. 66(m, 3H), 3. 85-3. 94(m, 1H), 4. 42-4. 48(m, 1H), 7. 00(d, J = 6. 5 Hz, 1H), 7. 87(d, J = 6. 5 Hz, 1H).
실시예 1. 27: (
R)
-4-(2-플루오로벤질)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 116)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 (2-플루오로벤질)아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 298. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 75-1. 85(m, 1H), 2. 19-2. 28(m, 1H), 2. 72-2. 82(m, 1H), 3. 02(dt, J = 16. 7 및 4. 8 Hz, 1H), 3. 16(dd, J = 12. 6 및 11. 8 Hz, 1H), 3. 25-3. 35(m, 1H), 3. 38-3. 47(m, 1H), 3. 50-3. 62(m, 2H), 3. 72-3. 80(m, 1H), 4. 08(s, 2H), 4. 52-4. 58(m, 1H), 6. 73(d, J = 6. 2 Hz, 1H), 7. 08-7. 24(m, 3H), 7. 28-7. 35(m, 1H), 7. 85(d, J = 6. 2 Hz, 1H).
실시예 1. 28: (
R)
-4-(3-플루오로벤질)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 115)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 (3-플루오로벤질)아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 298. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 70-1. 80(m, 1H), 2. 14-2. 22(m, 1H), 2. 63-2. 75(m, 1H), 2. 90-3. 08(m, 2H), 3. 22-3. 30(m, 1H), 3. 30-3. 45(m, 1H), 3. 47-3. 62(m, 2H), 3. 65-3. 76(m, 1H), 4. 08(s, 2H), 4. 54-4. 65(m, 1H), 6. 78-6. 82(m, 1H), 6. 88-6. 93(m, 1H), 6. 94-7. 03(m, 2H), 7. 30-7. 36(m, 1H), 7. 89(d, J = 5. 9 Hz, 1H).
실시예 1. 29: ( R) -4-(4-플루오로벤질)-6,6a,7,8,9,10-헥사하이드로-5 H -피라지노[1,2-a][1,8]나프티리딘(화합물 128)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 (4-플루오로벤질)아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 298. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 70-1. 80(m, 1H), 2. 15-2. 23(m, 1H), 2. 65-2. 75(m, 1H), 2. 95(dt, J = 16. 6 및 4. 8 Hz, 1H), 3. 03(dd, J = 12. 6 및 11. 8 Hz, 1H), 3. 22-3. 30(m, 1H), 3. 32-3. 42(m, 1H), 3. 48-3. 62(m, 2H), 3. 68-3. 75(m, 1H), 4. 04(s, 2H), 4. 55-4. 62(m, 1H), 6. 78(d, J = 6. 0 Hz, 1H), 7. 02-7. 07(m, 3H), 7. 16-7. 22(m, 1H), 7. 88(d, J = 6. 0 Hz, 1H).
실시예 1. 30: (
R)
-4-(사이클로헥실메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 120)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 (사이클로헥실메틸)아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 286. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 00-1. 15(m, 2H), 1. 15-1. 30(m, 3H), 1. 55-1. 83(m, 7H), 2. 19-2. 27(m, 1H), 2. 55-2. 65(m, 2H), 2. 72-2. 80(m, 1H), 2. 96(dt, J = 16. 4 및 4. 9 Hz, 1H), 3. 08(dd, J = 12. 4 및 11. 9 Hz, 1H), 3. 27-3. 35(m, 1H), 3. 45-3. 62(m, 3H), 3. 77-3. 85(m, 1H), 4. 45-4. 52(m, 1H), 6. 86(dd, J = 6. 3 Hz, 1H), 7. 81(d, J = 6. 3 Hz, 1H).
실시예 1. 31: (
R)
-4-네오펜틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 121)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 네오페닐아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 260. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 01(s, 9H), 1. 68-1. 78(m, 1H), 2. 18-2. 26(m, 1H), 2. 68(s, 2H), 2. 72-2. 80(m, 1H), 2. 98-3. 12(m, 2H), 3. 20-3. 30(m, 1H), 3. 49-3. 62(m, 3H), 3. 72-3. 80(m, 1H), 4. 45-4. 52(m, 1H), 6. 86(dd, J = 6. 3 Hz, 1H), 7. 81(d, J = 6. 3 Hz, 1H).
실시예 1. 32: (
R)
-4-프로필-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 113)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 n-프로필아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 232. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 02(t, J = 7. 3 Hz, 3H), 1. 61-1. 71(m, 2H), 1. 75-1. 85(m, 1H), 2. 22-2. 28(m, 1H), 2. 68-2. 82(m, 3H), 2. 98(dt, J = 16. 5 및 4. 9 Hz, 1H), 3. 10(dd, J = 12. 4 및 11. 8 Hz, 1H), 3. 28-3. 35(m, 1H), 3. 54-3. 64(m, 3H), 3. 85-3. 91(m, 1H), 4. 40-4. 46(m, 1H), 6. 95(d, J = 6. 4 Hz, 1H), 7. 83(d, J = 6. 4 Hz, 1H).
실시예 1. 33: (
R)
-4-이소부틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 114)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 이소부틸아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 246. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 0. 98(t, J = 6. 7 Hz, 2 x 3H), 1. 73-1. 83(m, 1H), 1. 90-2. 00(m, 1H), 2. 20-2. 28(m, 1H), 2. 55-2. 65(m, 2H), 2. 72-2. 81(m, 1H), 2. 98(dt, J = 16. 4 및 4. 9 Hz, 1H), 3. 09(t, J = 12. 6 및 11. 8 Hz, 1H), 3. 28-3. 35(m, 1H), 3. 52-3. 63(m, 3H), 3. 80-3. 88(m, 1H), 4. 45-4. 49(m, 1H), 6. 90(d, J = 6. 3 Hz, 1H), 7. 82(d, J = 6. 3 Hz, 1H).
실시예 1. 34: (
R)
-4-이소프로필-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 111)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 이소프로필아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 232. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 24(d, J = 6. 8 Hz, 3H), 1. 27(d, J = 6. 8 Hz, 3H), 1. 75-1. 85(m, 1H), 2. 22-2. 30(m, 1H), 2. 76-2. 84(m, 1H), 3. 04(dt, J = 16. 4 및 4. 9 Hz, 1H), 3. 11(dd, J = 12. 6 및 11. 8 Hz, 1H), 3. 26-3. 37(m, 2H), 3. 52-3. 64(m, 3H), 3. 83-3. 91(m, 1H), 4. 39-4. 45(m, 1H), 7. 07(d, J = 6. 5 Hz, 1H), 7. 88(d, J = 6. 4 Hz, 1H).
실시예 1. 35: (
R)
-4-부틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 112)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 부틸아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다.
LCMS m/z = 246. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 0. 97(t, J = 7. 3 Hz, 3H), 1. 40-1. 48(m, 2H), 1. 55-1. 65(m, 2H), 1. 75-1. 85(m, 1H), 2. 21-2. 28(m, 1H), 2. 72(t, J = 6. 9 Hz, 2H), 2. 74-2. 82(m, 1H), 2. 97(dt, J = 16. 5 및 4. 9 Hz, 1H), 3. 10(dd, J = 12. 6 및 11. 8 Hz, 1H), 3. 28-3. 35(m, 1H), 3. 52-3. 64(m, 3H), 3. 82-3. 90(m, 1H), 4. 41-4. 47(m, 1H), 6. 95(d, J = 6. 4 Hz, 1H), 7. 83(d, J = 6. 4 Hz, 1H).
실시예 1. 36: (
R)
-4-사이클로펜틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 147)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 사이클로펜틸아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 258. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 28-1. 33(m, 2H), 1. 53-1. 68(m, 2H), 1. 72-1. 93(m, 5H), 1. 99-2. 12(m, 1H), 2. 20-2. 28(m, 1H), 2. 75-2. 85(m, 1H), 3. 00-3. 10(m, 2H), 3. 26-3. 35(m, 1H), 3. 44-3. 64(m, 3H), 3. 75-3. 85(m, 1H), 4. 44-4. 51(m, 1H), 7. 00(d, J = 6. 4 Hz, 1H), 7. 86(d, J = 6. 4 Hz, 1H).
실시예 1. 37: (
R)
-4-메틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 117)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 메틸아연 클로라이드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다.
LCMS m/z = 204. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 77-1. 87(m, 1H), 2. 23-2. 31(m, 1H), 2. 42(s, 3H), 2. 72-2. 82(m, 1H), 2. 95(dt, J = 16. 7 및 4. 8 Hz, 1H), 3. 13(dd, J = 12. 7 및 11. 8 Hz, 1H), 3. 32-3. 39(m, 1H), 3. 55-3. 66(m, 3H), 3. 87-3. 94(m, 1H), 4. 40-4. 47(m, 1H), 6. 98(d, J = 6. 4 Hz, 1H), 7. 80(d, J = 6. 4 Hz, 1H).
실시예 1. 38: (
R)
-3-(6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)프로판나이트릴(화합물 142)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 (2-시아노에틸)아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 243. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 75-1. 85(m, 1H), 2. 20-2. 28(m, 1H), 2. 76-2. 85(m, 3H), 2. 95-3. 08(m, 4H), 3. 24-3. 30(m, 1H), 3. 35-3. 44(m, 1H), 3. 51-3. 61(m, 2H), 3. 74-3. 81(m, 1H), 4. 60-4. 65(m, 1H), 6. 91(d, J = 6. 0 Hz, 1H), 7. 93(d, J = 6. 0 Hz, 1H).
실시예 1. 39: (
R)
-4-(피리딘-2-일메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 143)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 2-피리디닐메틸아연 클로라이드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 281. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 75-1. 85(m, 1H), 2. 16-2. 23(m, 1H), 2. 68-2. 78(m, 1H), 2. 96(dt, J = 16. 5 및 4. 8 Hz, 1H), 3. 05(dd, J = 12. 5 및 11. 8 Hz, 1H), 3. 23-3. 30(m, 1H), 3. 32-3. 42(m, 1H), 3. 50-3. 62(m, 2H), 3. 70-3. 80(m, 1H), 4. 36(s, 2H), 4. 62-4. 68(m, 1H), 6. 75(d, J = 6. 0 Hz, 1H), 7. 56(d, J = 7. 9 Hz, 1H), 7. 58-7. 63(m, 1H), 7. 91(d, J = 6. 0 Hz, 1H), 8. 13(td, J = 7. 8 및 1. 5 Hz, 1H), 8. 62(dd, J = 5. 3 및 0. 8 Hz, 1H).
실시예 1. 40: (
R,E)
-4-(부트-2-엔-1-일)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 144)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 3-부테닐아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 244. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 69(dd, J = 5. 9 및 1. 1 Hz, 3H), 1. 72-1. 83(m, 1H), 2. 19-2. 27(m, 1H), 2. 72-2. 82(m, 1H), 2. 95(dt, J = 16. 5 및 4. 8 Hz, 1H), 3. 09(dd, J = 12. 6 및 11. 8 Hz, 1H), 3. 27-3. 35(m, 1H), 3. 38-3. 42(m, 2H), 3. 48-3. 64(m, 3H), 3. 79-3. 88(m, 1H), 4. 42-4. 50(m, 1H), 5. 48-5. 64(m, 2H), 6. 92(d, J = 6. 4 Hz, 1H), 7. 85(d, J = 6. 4 Hz, 1H).
실시예 1. 41: (
R)
-4-이소펜틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 118)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 이소페닐아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 260. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 0. 99(d, J = 7. 6 Hz, 2 x 3H), 1. 44-1. 50(m, 2H), 1. 62-1. 72(m, 1H), 1. 75-1. 85(m, 1H), 2. 22-2. 28(m, 1H), 2. 68-2. 82(m, 3H), 2. 95(dt, J = 16. 4 및 4. 9 Hz, 1H), 3. 08(dd, J = 12. 6 및 11. 8 Hz, 1H), 3. 28-3. 35(m, 1H), 3. 55-3. 66(m, 3H), 3. 85-3. 94(m, 1H), 4. 42-4. 48(m, 1H), 6. 94(d, J = 6. 4 Hz, 1H), 7. 83(d, J = 6. 4 Hz, 1H).
실시예 1. 42: (
R)
-4-(티오펜-2-일)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 126)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 2-티에닐아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 272. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 70-1. 80(m, 1H), 2. 15-2. 22(m, 1H), 2. 92-3. 11(m, 3H), 3. 25-3. 35(m, 1H), 3. 38-3. 46(m, 1H), 3. 50-3. 62(m, 2H), 3. 77-3. 85(m, 1H), 4. 68-4. 75(m, 1H), 7. 01(d, J = 6. 0 Hz, 1H), 7. 22(dd, J = 5. 1 및 3. 7 Hz, 1H), 7. 37(dd, J = 3. 6 및 1. 1Hz, 1H), 7. 68(dd, J = 5. 1 및 1. 1 Hz, 1H), 7. 95(d, J = 6. 0 Hz, 1H).
실시예 1. 43 및 44: (6aR)-4-(펜탄-2-일)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 109) 및 (
R)
-4-펜틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 108)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 펜탄-2-일아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다.
(6aR)-4-(펜탄-2-일)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 109).
LCMS m/z = 260. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 0. 88-0. 95(m, 3H), 1. 22(dd, J = 7. 8 및 6. 8 Hz, 3H), 1. 18-1. 38(m, 2H), 1. 57-1. 65(m, 2H), 1. 74-1. 84(m, 1H), 2. 21-2. 29(m, 1H), 2. 73-2. 84(m, 1H), 2. 98- 3. 19(m, 3H), 3. 28-3. 35(m, 1H), 3. 50-3. 63(m, 3H), 3. 81-3. 89(m, 1H), 4. 42-4. 48(m, 1H), 7. 02(d, J = 6. 4 Hz, 1H), 7. 87(d, J = 6. 4 Hz, 1H).
(R)
-4-펜틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 108).
LCMS m/z = 260. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 0. 90-0. 95(m, 3H), 1. 35-1. 45(m, 4H), 1. 55-1. 65(m, 2H), 1. 72-1. 82(m, 1H), 2. 21-2. 28(m, 1H), 2. 65-2. 82(m, 3H), 2. 92- 3. 10(m, 2H), 3. 28-3. 35(m, 1H), 3. 40-3. 63(m, 3H), 3. 75-3. 83(m, 1H), 4. 47-4. 54(m, 1H), 6. 90(d, J = 6. 3 Hz, 1H), 7. 83(d, J = 6. 3 Hz, 1H).
실시예 1. 45: (
R)
-4-(이소프로폭시메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 145)의 제조.
실온에서 N2 하에 THF(1. 5 mL)-H2O(0. 15 mL)의 혼합된 용매 중의 (R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(25 mg, 69. 78 μmol) 용액에 포타슘 트리플루오로(이소프로폭시메틸)보레이트(25. 2 mg, 0. 14 mmol), 세슘 카보네이트(45. 5 mg, 0. 140 mmol) 및 Pd(dppf)Cl2. DCM 부가물(11. 4 mg, 13. 96 μmol)을 첨가하였다. 반응물을 80 ℃에서 밤새 교반하였다. 혼합물을 여과하였다. 여액을 농축시켰다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 (R)-8-벤질-4-(이소프로폭시메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘을 수득하고, 이를 DCM(1. 5 mL) 중에 용해하였다. 실온에서 DIEA(36. 4 μL, 0. 209 mmol)를 첨가한 후, 1-클로로에틸 카보노클로리데이트(22. 7 μL, 0. 209 mmol)를 첨가하였다. 반응물을 40 ℃에서 1시간 동안 교반하였다. 혼합물을 농축시켰다. 잔류물을 메탄올(1. 5 mL)에 용해시키고 30분 동안 환류에서 가열하였다. 혼합물을 농축하였다. 잔류물을 세미 분취용 HPLC로 정제하였다. 합한 분획을 동결건조시켜 표제 화합물(15 mg, 43. 9 %)을 수득하였다. LCMS m/z = 262. 0 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 24(d, J = 6. 2 Hz, 2 x 3H), 1. 76-1. 85(m, 1H), 2. 20-2. 27(m, 1H), 2. 68-2. 78(m, 1H), 2. 87(dt, J = 16. 7 및 4. 9 Hz, 1H), 3. 08(dd, J = 12. 6 및 11. 8 Hz, 1H), 3. 25-3. 35(m, 1H), 3. 47-3. 64(m, 3H), 3. 72-3. 87(m, 2H), 4. 47-4. 53(m, 1H), 4. 54 및 4. 61(AB, J = 14. 9 Hz, 2H), 7. 18(d, J = 6. 3 Hz, 1H), 7. 92(d, J = 6. 3 Hz, 1H).
실시예 1. 46: (
R)
-4-(메톡시메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 119)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 포타슘 트리플루오로(메톡시메틸)보레이트를 사용하여 실시예 1. 45에 기술된 것과 동일한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 234. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 77-1. 87(m, 1H), 2. 22-2. 30(m, 1H), 2. 70-2. 78(m, 1H), 2. 87(dt, J = 16. 7 및 4. 9 Hz, 1H), 3. 13(dd, J = 12. 6 및 11. 8 Hz, 1H), 3. 32-3. 40(m, 1H), 3. 50(s, 3H), 3. 55-3. 68(m, 3H), 3. 88-3. 94(m, 1H), 4. 42-4. 48(m, 1H), 4. 52 및 4. 59(AB, J = 15. 2 Hz, 2H), 7. 22(d, J = 6. 5 Hz, 1H), 7. 91(d, J = 6. 5 Hz, 1H).
실시예 1. 47: (
R)
-4-(2-메톡시에틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 107)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 포타슘 트리플루오로(2-메톡시에틸)보레이트를 사용하여 실시예 1. 45에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 248. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 72-1. 82(m, 1H), 2. 20-2. 27(m, 1H), 2. 73-2. 82(m, 1H), 2. 94-3. 12(m, 4H), 3. 25-3. 35(m, 1H), 3. 30(s, 3H), 3. 45-3. 62(m, 3H), 3. 66(t, J = 6. 3 Hz, 2H), 3. 77-3. 84(m, 1H), 4. 45-4. 52(m, 1H), 6. 96(d, J = 6. 3 Hz, 1H), 7. 84(d, J = 6. 3 Hz, 1H).
실시예 1. 48: (6aR)-4-((테트라하이드로-2
H
-피란-2-일)메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 132)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 포타슘 트리플루오로((테트라하이드로-2H-피란-2-일)메톡시)메틸)보레이트를 사용하여 실시예 1. 45에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 288. 0 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 33-1. 58(m, 4H), 1. 67-1. 88(m, 3H), 2. 18-2. 27(m, 1H), 2. 70-3. 15(m, 5H), 3. 28-3. 37(m, 2H), 3. 52-3. 64(m, 4H), 3. 80-3. 88(m, 2H), 4. 40-4. 48(m, 1H), 6. 98(d, J = 6. 4 Hz, 1H), 7. 81(d, J = 6. 4 Hz, 1H).
실시예 1. 49: (
R)
-4-(((테트라하이드로-2
H
-피란-4-일)메톡시)메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 133)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 포타슘 트리플루오로((테트라하이드로-2H-피란-4-일)메톡시)메틸)보레이트를 사용하여 실시예 1. 45에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 318. 0 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 32-1. 44(m, 2H), 1. 65-1. 73(m, 2H), 1. 75-1. 85(m, 1H), 1. 90-2. 00(m, 1H), 2. 20-2. 27(m, 1H), 2. 68-2. 78(m, 1H), 2. 87(dt, J = 16. 6 및 4. 8 Hz, 1H), 3. 10(dd, J = 12. 6 및 11. 8 Hz, 1H), 3. 28-3. 37(m, 1H), 3. 40-3. 48(m, 4H), 3. 50-3. 65(m, 3H), 3. 82-3. 88(m, 1H), 3. 92-3. 98(m, 2H), 4. 46-4. 52(m, 1H), 4. 55 및 4. 61(AB, J = 14. 9 Hz, 2H), 7. 17(d, J = 6. 3 Hz, 1H), 7. 93(d, J = 6. 3 Hz, 1H).
실시예 1. 50: (
R)
-4-펜에틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 161)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 포타슘 트리플루오로(펜에틸)보레이트를 사용하여 실시예 1. 45에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 294. 0 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 56-1. 66(m, 1H), 2. 06-2. 14(m, 1H), 2. 55-2. 65(m, 1H), 2. 78(dt, J = 16. 6 및 4. 9 Hz, 1H), 2. 90-3. 00(m, 2H), 3. 00-3. 08(m, 1H), 3. 04(t, J = 6. 2 Hz, 2H), 3. 25-3. 35(m, 1H), 3. 50-3. 62(m, 3H), 3. 78-3. 86(m, 1H), 4. 40-4. 47(m, 1H), 6. 92(d, J = 6. 3 Hz, 1H), 7. 14-7. 20(m, 3H), 7. 20-7. 28(m, 2H), 7. 81(d, J = 6. 3 Hz, 1H).
실시예 1. 51: (
R)
-4-(사이클로펜틸메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 170)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 포타슘(사이클로펜틸메틸)트리플루오로보레이트를 사용하여 실시예 1. 45에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 272. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 22-1. 33(m, 2H), 1. 54-1. 65(m, 2H), 1. 67-1. 85(m, 5H), 2. 08-2. 18(m, 1H), 2. 23-2. 31(m, 1H), 2. 73-2. 85(m, 3H), 3. 01(dt, J = 16. 6 및 4. 9 Hz, 1H), 3. 12(dd, J = 12. 6 및 11. 8 Hz, 1H), 3. 30-3. 38(m, 1H), 3. 55-3. 66(m, 3H), 3. 86-3. 93(m, 1H), 4. 42-4. 48(m, 1H), 6. 98(d, J = 6. 4 Hz, 1H), 7. 83(d, J = 6. 4 Hz, 1H).
실시예 1. 52: (
R)
-4-에틸-3-프로필-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 129)의 제조.
단계 A: (
R)
-8-벤질-3-브로모-4-에틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘의 제조.
아세토나이트릴(10 mL) 중의 (R)-8-벤질-4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(262 mg, 0. 852 mmol) 용액에 NBS(0. 167 g, 0. 937 mmol)를 첨가하였다. 반응물을 실온에서 밤새 교반하였다. 포화 수성 NaHCO3을 첨가하였다. 혼합물을 에틸 아세테이트로 추출하였다. 합한 유기물을 농축시켰다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(289 mg, 87. 8 %)을 수득하였다. LCMS m/z = 387. 4 [M+H]+; 1H NMR(400 MHz, CDCl3) δ ppm 1. 10(t, J = 7. 6 Hz, 3H), 1. 62-1. 72(m, 1H), 1. 84-1. 95(m, 2H), 2. 14-2. 22(m, 1H), 2. 62-2. 72(m, 1H), 2. 68(q, J = 7. 6 Hz, 2H), 2. 78-2. 97(m, 4H), 3. 20-3. 28(m, 1H), 3. 48 및 3. 58(AB, J = 13. 1 Hz, 2H), 4. 60-4. 68(m, 1H), 7. 25-7. 34(m, 5H), 8. 08(s, 1H).
단계 B: (
R)
-4-에틸-3-프로필-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 129)의 제조.
(R)-8-벤질-3-브로모-4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 프로필아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 260. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 01(t, J = 7. 3 Hz, 3H), 1. 16(t, J = 7. 6 Hz, 3H), 1. 58-1. 66(m, 2H), 1. 73-1. 84(m, 1H), 2. 20-2. 28(m, 1H), 2. 58-2. 63(m, 2H), 2. 74-2. 85(m, 3H), 2. 95-3. 10(m, 2H), 3. 23-3. 35(m, 1H), 3. 40-3. 62(m, 3H), 3. 70-3. 80(m, 1H), 4. 40-4. 47(m, 1H), 7. 71(s, 1H).
실시예 1. 53: (
R)
-3-벤질-4-에틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 130)의 제조.
(R)-8-벤질-3-브로모-4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 벤질아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 308. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 0. 96(t, J = 7. 6 Hz, 3H), 1. 73-1. 84(m, 1H), 2. 20-2. 28(m, 1H), 2. 71(q, J = 7. 6 Hz, 2H), 2. 74-2. 85(m, 1H), 2. 97(dt, J = 16. 4 및 4. 9 Hz, 1H), 3. 08(dd, J = 12. 5 및 11. 8 Hz, 1H), 3. 27-3. 35(m, 1H), 3. 47-3. 62(m, 3H), 3. 78-3. 85(m, 1H), 4. 02(s, 2H), 4. 42-4. 48(m, 1H), 7. 16-7. 25(m, 3H), 7. 28-7. 33(m, 2H), 7. 68(s, 1H).
실시예 1. 54: (
R)
-3-(4-에틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-3-일)프로판나이트릴(화합물 162)의
제조.
(R)-8-벤질-3-브로모-4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 (2-시아노에틸)아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 271. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 18(t, J = 7. 6 Hz, 3H), 1. 73-1. 85(m, 1H), 2. 20-2. 28(m, 1H), 2. 74-2. 87(m, 5H), 2. 97-3. 10(m, 4H), 3. 25-3. 32(m, 1H), 3. 45-3. 62(m, 3H), 3. 76-3. 85(m, 1H), 4. 46-4. 52(m, 1H), 7. 87(s, 1H).
실시예 1. 55: (
R)
-4-에틸-3-(이소프로폭시메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 163)의 제조.
(R)-8-벤질-3-브로모-4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 포타슘 트리플루오로(이소프로폭시메틸)보레이트를 사용하여 실시예 1. 45에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 290. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 20(t, J = 7. 6 Hz, 3H), 1. 21(d, J = 6. 2 Hz, 2 x 3H), 1. 73-1. 84(m, 1H), 2. 21-2. 29(m, 1H), 2. 74-2. 85(m, 3H), 3. 01(dt, J = 16. 4 및 4. 9 Hz, 1H), 3. 09(dd, J = 12. 5 및 11. 8 Hz, 1H), 3. 27-3. 35(m, 1H), 3. 47-3. 62(m, 3H), 3. 73-3. 80(m, 1H), 3. 78-3. 85(m, 1H), 4. 45-4. 50(m, 1H), 4. 49(s, 2H), 7. 86(s, 1H).
실시예 1. 56: (
R)
-3-(사이클로헥실메틸)-4-에틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 164)의 제조.
(R)-8-벤질-3-브로모-4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 사이클로헥실메틸아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 314. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 0. 97-1. 10(m, 2H), 1. 17(t, J = 7. 6 Hz, 3H), 1. 15-1. 26(m, 3H), 1. 42-1. 52(m, 1H), 1. 65-1. 85(m, 6H), 2. 21-2. 29(m, 1H), 2. 51(d, J = 7. 2 Hz, 2H), 2. 76-2. 86(m, 3H), 3. 01(dt, J = 16. 4 및 4. 9 Hz, 1H), 3. 10(dd, J = 12. 5 및 11. 8 Hz, 1H), 3. 27-3. 35(m, 1H), 3. 52-3. 65(m, 3H), 3. 81-3. 90(m, 1H), 4. 37-4. 42(m, 1H), 7. 65(s, 1H).
실시예 1. 57: (6aR)-4-에틸-3-((테트라하이드로-2
H
-피란-2-일)메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 165)의 제조.
(R)-8-벤질-3-브로모-4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 포타슘 트리플루오로((테트라하이드로-2H-피란-2-일)메틸)보레이트를 사용하여 실시예 1. 45에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 316. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 14(t, J = 7. 6 Hz, 3H), 1. 30-1. 40(m, 1H), 1. 48-1. 58(m, 3H), 1. 67-1. 87(m, 3H), 2. 19-2. 27(m, 1H), 2. 72-2. 85(m, 5H), 2. 97(dt, J = 16. 4 및 4. 9 Hz, 1H), 3. 05(dd, J = 12. 5 및 11. 8 Hz, 1H), 3. 24-3. 30(m, 1H), 3. 32-3. 38(m, 1H), 3. 40-3. 48(m, 2H), 3. 50-3. 62(m, 2H), 3. 68-3. 77(m, 1H), 3. 85-3. 91(m, 1H), 4. 44-4. 50(m, 1H), 7. 76(s, 1H).
실시예 1. 58: (
R)
-3-사이클로부틸-4-에틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 166)의 제조.
(R)-8-벤질-3-브로모-4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 사이클로부틸아연 브로미드를 사용하여 실시예 1. 26에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 272. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 15(t, J = 7. 6 Hz, 3H), 1. 72-1. 91(m, 2H), 2. 08-2. 20(m, 3H), 2. 20-2. 28(m, 1H), 2. 35-2. 42(m, 2H), 2. 74(q, J = 7. 6 Hz, 2H), 2. 78-2. 85(m, 1H), 3. 00(dt, J = 16. 4 및 4. 9 Hz, 1H), 3. 08(dd, J = 12. 5 및 11. 8 Hz, 1H), 3. 27-3. 35(m, 1H), 3. 50-3. 68(m, 4H), 3. 78-3. 88(m, 1H), 4. 38-4. 45(m, 1H), 7. 68(s, 1H).
실시예 1. 59: (
R)
-3-(사이클로펜틸메틸)-4-에틸-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 171)의 제조.
(R)-8-벤질-3-브로모-4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 포타슘(사이클로펜틸메틸)트리플루오로보레이트를 사용하여 실시예 1. 45에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 300. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 60(t, J = 7. 6 Hz, 3H), 1. 20-1. 29(m, 2H), 1. 53-1. 64(m, 2H), 1. 64-1. 84(m, 5H), 2. 05-2. 13(m, 1H), 2. 20-2. 28(m, 1H), 2. 64(d, J = 7. 4 Hz, 2H), 2. 76-2. 86(m, 3H), 3. 00(dt, J = 16. 6 및 4. 9 Hz, 1H), 3. 07(dd, J = 12. 6 및 11. 8 Hz, 1H), 3. 26-3. 34(m, 1H), 3. 46-3. 63(m, 3H), 3. 76-3. 84(m, 1H), 4. 38-4. 44(m, 1H), 7. 70(s, 1H).
실시예 1. 60: (
R)
-N-(6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)부티르아미드(화합물 125)의 제조.
디옥산(1. 5 mL) 중의 8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(20 mg, 55. 82 μmol), 부티르아미드(7. 3 mg, 83. 73 μmol), Pd2dba3(8 mg, 8. 7 μmol), 및 세슘 카보네이트(27. 3 mg, 83. 73 μmol)의 혼합물에 BINAP(11 mg, 17. 67 μmol)를 첨가하였다. 반응물을 85 ℃에서 밤새 가열하였다. 혼합물을 여과하고 에틸 아세테이트로 세척하였다. 여액을 농축시켰다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 N-(8-벤질-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-일)부티르아미드를 수득하고, 이를 DCM(1. 5 mL) 중에 용해하였다. 실온에서 DIEA(21. 5 μL, 0. 123 mmol)를 첨가한 후, 1-클로로에틸 카보노클로리데이트(13. 4 μL, 0. 123 mmol)를 천천히 첨가하였다. 반응물을 40 ℃에서 1시간 동안 교반하였다. 혼합물을 농축시켰다. 잔류물을 메탄올(1. 5 mL)에 용해시키고 30분 동안 환류에서 가열하였다. 혼합물을 농축하였다. 잔류물을 세미 분취용 HPLC로 정제하였다. 합한 분획을 동결건조시켜 표제 화합물(9. 1 mg, 44. 0 %)을 수득하였다. LCMS m/z = 275. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 00(t, J = 7. 4 Hz, 3H), 1. 68-1. 84(m, 3H), 2. 18-2. 25(m, 1H), 2. 48(t, J = 7. 4 Hz, 2H), 2. 65-2. 74(m, 1H), 2. 84(dt, J = 16. 5 및 4. 8 Hz, 1H), 3. 05(dd, J = 12. 5 및 11. 8 Hz, 1H), 3. 22-3. 35(m, 1H), 3. 36-3. 44(m, 1H), 3. 50-3. 61(m, 2H), 3. 70-3. 78(m, 1H), 4. 51-4. 58(m, 1H), 7. 54(d, J = 6. 7 Hz, 1H), 7. 84(d, J = 6. 6 Hz, 1H).
실시예 1. 61: (
R)-N
-(6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)-2-페닐아세트아미드(화합물 124)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 2-페닐아세트아미드를 사용하여 실시예 1. 60에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다.
LCMS m/z = 323. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 68-1. 80(m, 1H), 2. 14-2. 20(m, 1H), 2. 59-2. 69(m, 1H), 2. 75(dt, J = 16. 5 및 4. 8 Hz, 1H), 3. 02(dd, J = 12. 5 및 11. 8 Hz, 1H), 3. 20-3. 28(m, 1H), 3. 35-3. 38(m, 1H), 3. 48-3. 59(m, 2H), 3. 65-3. 73(m, 1H), 3. 81(s, 2H), 4. 55-4. 62(m, 1H), 7. 25-7. 37(m, 5H), 7. 43(d, J = 6. 5 Hz, 1H), 7. 88(d, J = 6. 5 Hz, 1H).
실시예 1. 62: (
R)-N
-(6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)사이클로프로판카복사미드(화합물 141)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 사이클로프로판카복사미드를 사용하여 실시예 1. 60에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 273. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 0. 92-1. 03(m, 4H), 1. 73-1. 84(m, 1H), 1. 95-2. 02(m, 1H), 2. 19-2. 26(m, 1H), 2. 67-2. 77(m, 1H), 2. 89(dt, J = 16. 5 및 4. 8 Hz, 1H), 3. 05(dd, J = 12. 5 및 11. 8 Hz, 1H), 3. 22-3. 35(m, 1H), 3. 35-3. 43(m, 1H), 3. 50-3. 62(m, 2H), 3. 70-3. 77(m, 1H), 4. 51-4. 57(m, 1H), 7. 58(d, J = 6. 6 Hz, 1H), 7. 87(d, J = 6. 7 Hz, 1H).
실시예 1. 63: (
R)-N
-(6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)벤즈아미드(화합물 139)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 벤즈아미드를 사용하여 실시예 1. 60에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 309. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 75-1. 85(m, 1H), 2. 21-2. 28(m, 1H), 2. 74-2. 84(m, 1H), 2. 89(dt, J = 16. 5 및 4. 8 Hz, 1H), 3. 10(dd, J = 12. 5 및 11. 8 Hz, 1H), 3. 29-3. 36(m, 1H), 3. 50-3. 65(m, 3H), 3. 81-3. 89(m, 1H), 4. 50-4. 56(m, 1H), 7. 50(d, J = 6. 8 Hz, 1H), 7. 53-7. 57(m, 2H), 7. 62-7. 67(m, 1H), 7. 94(d, J = 6. 8 Hz, 1H), 7. 95-7. 99(m, 2H).
실시예 1. 64: (
R)
-2,3-디플루오로-
N
-(6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)벤즈아미드(화합물 138)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 2,3-디플루오로벤즈아미드를 사용하여 실시예 1. 60에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 345. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 77-1. 87(m, 1H), 2. 23-2. 30(m, 1H), 2. 74-2. 84(m, 1H), 2. 92(dt, J = 16. 5 및 4. 8 Hz, 1H), 3. 10(dd, J = 12. 5 및 11. 8 Hz, 1H), 3. 28-3. 35(m, 1H), 3. 49-3. 65(m, 3H), 3. 81-3. 88(m, 1H), 4. 50-4. 56(m, 1H), 7. 31-7. 36(m, 1H), 7. 49-7. 57(m, 1H), 7. 59-7. 64(m, 1H), 7. 73(d, J = 6. 8 Hz, 1H), 7. 96(d, J = 6. 8 Hz, 1H).
실시예 1. 65: (
R)
-2-클로로-
N
-(6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)벤즈아미드(화합물 104)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 2-클로로벤즈아미드를 사용하여 실시예 1. 60에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다.
LCMS m/z = 343. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 60-1. 70(m, 1H), 1. 97-2. 04(m, 1H), 2. 54(dd, J = 12. 5 및 11. 8 Hz, 1H), 2. 64-2. 74(m, 1H), 2. 76-2. 87(m, 3H), 3. 03-3. 13(m, 2H), 3. 19-3. 26(m, 1H), 4. 61-4. 66(m, 1H), 6. 96(m, 1H), 7. 40-7. 54(m, 3H), 7. 58-7. 62(m, 1H), 7. 91(d, J = 5. 4 Hz, 1H).
실시예 1. 66: (
R)
-4-(5-클로로피리딘-2-일)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 146)의 제조.
디옥산(1. 5 mL) 및 물(100 μL) 중의 (R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(25 mg, 69. 78 μmol), Pd(dppf)Cl2 DCM 부가물(11. 4 mg, 13. 96 μmol), (5-클로로피리딘-2-일)보론산(22 mg, 0. 14 mmol), 및 포타슘 카보네이트(19. 3 mg, 0. 14 mmol)혼합물을 N2 하에서 90 °C에서 밤새 교반하였다. 혼합물을 시린지 필터로 여과하였다. 여액을 농축시켰다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 (R)-8-벤질-4-(5-클로로피리딘-2-일)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘을 수득하고, 이를 DCM(1. 5 mL) 중에 용해하였다. DIEA(36. 4 μL, 0. 209 mmol)를 첨가한 후 1-클로로에틸 카보노클로리데이트(22. 7 μL, 0. 209 mmol)를 천천히 첨가하였다. 반응물을 40 ℃에서 1시간 동안 교반하였다. 혼합물을 농축시켰다. 잔류물을 메탄올(1. 5 mL)에 용해시키고 30분 동안 환류에서 가열하였다. 혼합물을 농축하였다. 잔류물을 세미 분취용 HPLC로 정제하였다. 합한 분획을 동결건조시켜 표제 화합물(8 mg, 21. 7 %)을 수득하였다. LCMS m/z = 301. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 67-1. 77(m, 1H), 2. 08-2. 16(m, 1H), 2. 72-2. 88(m, 2H), 3. 03(dd, J = 12. 6 및 11. 8 Hz, 1H), 3. 21-3. 45(m, 2H), 3. 46-3. 52(m, 1H), 3. 55-3. 60(m, 1H), 3. 70-3. 78(m, 1H), 4. 85-4. 90(m, 1H), 6. 88(d, J = 5. 6 Hz, 1H), 7. 56(dd, J = 5. 4 및 2. 0 Hz, 1H), 7. 66(dd, J = 2. 0 및 0. 4 Hz, 1H), 8. 06(d, J = 5. 6 Hz, 1H), 8. 62(dd, J = 5. 5 및 0. 4 Hz, 1H).
실시예 1. 67: (
R)
-4-(2-(트리플루오로메틸)페닐)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 134)의제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 2-(트리플루오로메틸)페닐보론산을 사용하여 실시예 1. 66에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 334. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 58-1. 82(m, 1H), 2. 02-2. 16(m, 1H), 2. 28-2. 60(m, 2H), 2. 98-3. 14(m, 1H), 3. 25-3. 35(m, 1H), 3. 40-3. 55(m, 2H), 3. 57-3. 64(m, 1H), 3. 74-3. 86(m, 1H), 4. 68-4. 77(m, 1H), 6. 77-6. 81(m, 1H), 7. 31(d, J = 7. 6 Hz, 1H), 7. 64-7. 70(m, 1H), 7. 71-7. 77(m, 1H), 7. 85-7. 89(m, 1H), 7. 98(d, J = 5. 9 Hz, 1H).
실시예 1. 68: (
R)
-4-(4-메톡시페닐)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 135)의제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 (4-메톡시페닐)보론산을 사용하여 실시예 1. 66에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 296. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 66-1. 76(m, 1H), 2. 13-2. 20(m, 1H), 2. 83-2. 88(m, 2H), 3. 11(dd, J = 12. 6 및 11. 8 Hz, 1H), 3. 35-3. 39(m, 1H), 3. 53-3. 58(m, 1H), 3. 59-3. 67(m, 2H), 3. 86(s, 3H), 3. 86-3. 96(m, 1H), 4. 51-4. 56(m, 1H), 6. 97(d, J = 6. 4 Hz, 1H), 7. 06-7. 09(m, 2H), 7. 36-7. 38(m, 2H), 7. 93(d, J = 6. 4 Hz, 1H).
실시예 1. 69: (
R)
-4-(벤조[d][1,3]디옥소-5-일)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 101)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘 및 벤조[d][1,3]디옥소-5-일보론산을 사용하여 실시예 1. 66에 기술된 것과 유사한 방법으로 표제 화합물을 제조하였다. LCMS m/z = 310. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 66-1. 76(m, 1H), 2. 13-2. 20(m, 1H), 2. 83-2. 88(m, 2H), 3. 12(dd, J = 12. 6 및 11. 8 Hz, 1H), 3. 35-3. 39(m, 1H), 3. 53-3. 58(m, 1H), 3. 60-3. 68(m, 2H), 3. 90-3. 96(m, 1H), 4. 48-4. 55(m, 1H), 6. 05(s, 2H), 6. 89-6. 93(m, 2H), 6. 96-6. 99(m, 2H), 7. 92(d, J = 6. 4 Hz, 1H).
실시예 1. 70: 사이클로부틸(
(R)
-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)메탄올(화합물 122)의 제조.
단계 A: 8-벤질-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘 및 (8-벤질-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)(사이클로부틸)메탄올의 제조.
N2 하에 -78 °C에서 THF(4 mL) 중의 8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(100 mg, 0. 279 mmol) 용액에 헥산(0. 123 mL, 0. 307 mmol) 중의 2. 5 M 용액의 n-부틸리튬을 첨가하였다. 5분 후, 사이클로부탄카브알데하이드(25. 8 mg, 0. 307 mmol)를 첨가하였다. 반응물을 1시간 동안 교반하며 실온으로 가온하였다. 반응물을 물로 급랭하였다. 생성된 혼합물을 에틸 아세테이트로 추출하였다. 합한 유기물을 농축시켰다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 8-벤질-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(44 mg, 56. 4 %) 및 (8-벤질-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-일)(사이클로부틸)메탄올(15 mg, 14. 8 %)을 2개의 부분입체 이성질체(13 mg 및 2 mg)로서 수득하였다.
8-벤질-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘.
LCMS m/z = 280. 2 [M+H]+; 1H NMR(400 MHz, CDCl3) δ ppm 1. 65-1. 75(m, 1H), 1. 85-2. 05(m, 2H), 2. 15-2. 22(m, 1H), 2. 62-2. 69(m, 1H), 2. 73-2. 83(m, 1H), 2. 86-2. 99(m, 3H), 3. 28-3. 36(m, 1H), 3. 49 및 3. 59(AB, J = 13. 0 Hz, 2H), 4. 68-4. 73(m, 1H), 6. 50(dd, J = 7. 1 및 5. 0 Hz, 1H), 7. 10-7. 13(m, 1H), 7. 25-7. 29(m, 1H), 7. 30-7. 37(m, 4H), 7. 97-8. 00(m, 1H).
(8-벤질-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)(사이클로부틸)메탄올.
주요 이성질체: LCMS m/z = 364. 4 [M+H]+; 1H NMR(400 MHz, CDCl3) δ ppm 1. 60-1. 70(m, 1H), 1. 80-2. 05(m, 7H), 2. 17-2. 24(m, 1H), 2. 56-2. 66(m, 2H), 2. 86-2. 99(m, 5H), 3. 26-3. 33(m, 1H), 3. 51 및 3. 61(AB, J = 13. 0 Hz, 2H), 4. 69-4. 77(m, 2H), 6. 63(d, J = 5. 3 Hz, 1H), 7. 26-7. 40(m, 5H), 7. 98(d, J = 5. 3 Hz, 1H). 미미한 이성질체: LCMS m/z = 364. 4 [M+H]+; 1H NMR(400 MHz, CDCl3) δ ppm 1. 63-1. 73(m, 1H), 1. 80-2. 05(m, 7H), 2. 17-2. 24(m, 1H), 2. 63-2. 75(m, 2H), 2. 80-3. 00(m, 5H), 3. 22-3. 30(m, 1H), 3. 50 및 3. 60(AB, J = 13. 0 Hz, 2H), 4. 66-4. 72(m, 1H), 4. 74(d, J = 6. 8 Hz, 1H), 6. 62(d, J = 5. 3 Hz, 1H), 7. 26-7. 40(m, 5H), 7. 98(d, J = 5. 3 Hz, 1H).
단계 B: 사이클로부틸((
R
)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘-4-일)메탄올(화합물 122)의 제조.
실온에서 DCM(1. 5 mL) 중의 상기 수득된 주요 이성질체(13 mg, 35. 76 μmol)의 교반된 용액에 DIEA(18. 7 μL, 0. 107 mmol)를 첨가한 후 1-클로로에틸 카보노클로리데이트(11. 6 μL, 0. 107 mmol)를 천천히 첨가하였다. 반응물을 40 ℃에서 1시간 동안 교반하였다. 혼합물을 농축시켰다. 잔류물을 메탄올(1. 5 mL)에 용해시키고 30분 동안 환류에서 가열하였다. 혼합물을 농축하였다. 잔류물을 세미 분취용 HPLC로 정제하였다. 합한 분획을 동결건조시켜 TFA 염으로서 표제 화합물(7. 6 mg, 42. 4 %)을 수득하였다. LCMS m/z = 274. 4 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 1. 70-1. 90(m, 5H), 1. 90-2. 00(m, 1H), 2. 04-2. 13(m, 1H), 2. 22-2. 29(m, 1H), 2. 56-2. 65(m, 1H), 2. 70-2. 80(m, 1H), 3. 03-3. 12(m, 2H), 3. 27-3. 35(m, 1H), 3. 52-3. 64(m, 3H), 3. 83-3. 91(m, 1H), 4. 43-4. 49(m, 1H), 4. 80-4. 90(물 피크 중에 묻힘, 1H), 7. 15(d, J = 6. 5 Hz, 1H), 7. 88(d, J = 6. 5 Hz, 1H).
실시예 1. 71: (
R)
-3-프로필-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 103)의 제조.
단계 A: (
R)
-8-벤질-3-브로모-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘의 제조.
아세토나이트릴(2 mL) 중의 (R)-8-벤질-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(44 mg, 0. 157 mmol) 용액에 N-브로모숙신이미드(30. 8 mg, 0. 173 mmol)를 첨가하였다. 반응물을 실온에서 밤새 교반하였다. 포화 NaHCO3을 첨가하였다. 혼합물을 에틸 아세테이트로 추출하였다. 합한 유기물을 농축시켰다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 표제 화합물(34 mg, 60. 3 %)을 수득하였다. LCMS m/z = 259. 2 [M+H]+; 1H NMR(400 MHz, CDCl3) δ ppm 1. 55-1. 65(m, 1H), 1. 75-1. 82(m, 2H), 2. 04-2. 11(m, 1H), 2. 52-2. 59(m, 1H), 2. 63-2. 73(m, 1H), 2. 76-2. 89(m, 3H), 3. 18-3. 26(m, 1H), 3. 41 및 3. 51(AB, J = 13. 0 Hz, 2H), 4. 52-4. 57(m, 1H), 7. 12-7. 13(m, 1H), 7. 16-7. 28(m, 5H), 7. 90-7. 92(m, 1H).
단계 B: (
R)
-3-프로필-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,8]나프티리딘(화합물 103)의 제조.
N2 하에 실온에서 THF(1. 5 mL) 중의 (R)-8-벤질-3-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(30 mg, 83. 73 μmol), 비스(트리-터트-부틸포스핀)팔라듐(8. 6 mg, 16. 75 μmol)의 혼합물에 프로필아연(II) 브로미드(0. 335 mL, 0. 167 mmol)을 첨가하였다. 반응물을 60 ℃에서 밤새 교반하였다. 혼합물을 여과하였다. 여액을 농축시켰다. 잔류물을 실리카겔 칼럼 크로마토그래피로 정제하여 (R)-8-벤질-3-프로필-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘을 수득하고, 이를 실온에서 DCM(1. 5 mL) 중에 용해하였다. DIEA(32. 5 μL, 0. 187 mmol)를 첨가한 후 1-클로로에틸 카보노클로리데이트(20 μL, 0. 187 mmol)를 첨가하였다. 반응물을 40 ℃에서 1시간 동안 교반하였다. 혼합물을 농축시켰다. 잔류물을 메탄올(1. 5 mL)에 용해시키고 30분 동안 환류에서 가열하였다. 혼합물을 농축하였다. 잔류물을 세미 분취용 HPLC로 정제하였다. 합한 분획을 동결건조시켜 표제 화합물(16 mg, 56. 0 %)을 수득하였다. LCMS m/z = 232. 2 [M+H]+; 1H NMR(400 MHz, CD3OD) δ ppm 0. 95(t, J = 7. 3 Hz, 3H), 1. 58-1. 66(m, 2H), 1. 76-1. 86(m, 1H), 2. 18-2. 25(m, 1H), 2. 55(t, J = 7. 5 Hz, 2H), 2. 85-2. 93(m, 2H), 3. 05(dd, J = 12. 5 및 11. 8 Hz, 1H), 3. 23-3. 35(m, 1H), 3. 40-3. 62(m, 3H), 3. 75-3. 85(m, 1H), 4. 46-4. 54(m, 1H), 7. 66(s, 1H), 7. 73(s, 1H).
실시예 1. 72: (
R)
-4-브로모-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,7]나프티리딘(화합물 172)의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,7]나프티리딘으로부터, 생성물이 HPLC로 정제된 것을 제외하고 실시예 1. 13의 단계 B에 기술된 것과 유사한 방법을 사용하여 표제 화합물을 제조하였다. LCMS m/z = 268. 0 [M+H]+; 1H NMR(400 MHz, CD3OD): δ ppm 1. 68(m, 1H), 2. 03(m, 1H), 2. 55(dd, J = 12. 2, 10. 7 Hz, 1H), 3. 19-2. 67(m, 8H), 3. 88(m, 1H), 7. 99(s, 1H),8. 05(s, 1H).
실시예 1. 73: (
R)
-4-프로필-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,7]나프티리딘(화합물 173)의 제조.
단계 A: (
R)
-8-벤질-4-프로필-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,7]나프티리딘의 제조.
N2 대기 하에 15 °C에서 톨루엔(5 mL) 및 H2O(1 mL) 중의 (R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,7]나프티리딘(139 mg, 0. 387 mmol) 및 프로필보론산(170 mg, 1. 93 mmol)용액에 [2-(2-아미노페닐)페닐]-클로로-팔라듐;디사이클로헥실-[2-(2,6-디메톡시페닐)페닐]포스판(Sphos 바이페닐 Pd-예비촉매)(27. 9 mg, 0. 0387 mmol) 및 Cs2CO3(379 mg, 1. 16 mmol)을 첨가하였다. 반응물을 16시간 동안 90 ℃로 가열하였다. 혼합물을 실온으로 냉각시키고, EtOAc(20 mL)로 희석하고 염수로 세척하였다. 유기물을 Na2SO4 상에서 건조시키고, 여과하고 농축하였다. 잔류물을 제조용 TLC로 정제하여 표제 화합물(105 mg, 0. 325 mmol, 84% 수율)을 황색 오일로서 수득하였다. LCMS m/z = 322. 2 [M+H]+.
단계 B: (
R)
-4-프로필-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,7]나프티리딘(화합물 173)의 제조.
(R)-8-벤질-4-프로필-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,7]나프티리딘으로부터, 생성물이 HPLC로 정제된 것을 제외하고 실시예 1. 13의 단계 B에 기술된 것과 유사한 방법을 사용하여 표제 화합물을 제조하였다. LCMS m/z = 232. 0 [M+H]+; 1H NMR(400 MHz, CD3OD): δ ppm 0. 98(t, J = 7. 3 Hz, 3H), 1. 74-1. 53(m, 3H), 2. 02-1. 93(m, 1H), 2. 61-2. 5-(m, 3H), 2. 96-2. 88(m, 4H), 3. 14-2. 99(m, 2H), 3. 83(m, 1H), 7. 70(s, 1H),7. 93(s, 1H).
실시예 1. 74: (
R)
-4-(사이클로헥실메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,7]나프티리딘(화합물 174)의 제조.
단계 A: (
R)
-8-벤질-4-(사이클로헥실메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,7]나프티리딘의 제조.
(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,7]나프티리딘으로부터, 실시예 1. 73의 단계 A에 기술된 것과 유사한 방법을 사용하여 표제 화합물을 제조하였다. LCMS m/z = 376. 4 [M+H]+.
단계 B: (
R)
-4-(사이클로헥실메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,7]나프티리딘(화합물 174)의 제조.
(R)-8-벤질-4-(사이클로헥실메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,7]나프티리딘으로부터, 생성물이 HPLC로 정제된 것을 제외하고 실시예 1. 13의 단계 B에 기술된 것과 유사한 방법을 사용하여 표제 화합물을 제조하였다. LCMS m/z = 286. 1 [M+H]+; 1H NMR(400 MHz, CD3OD): δ ppm 1. 08-0. 94(m, 2H), 1. 22(br s, 3H), 1. 49(m, 1H), 1. 77-1. 59(m, 6H), 1. 96(dd, J = 7. 5, 3. 5 Hz, 1H), 2. 50-2. 36(m, 2H), 2. 54(t, J = 11. 4 Hz, 1H), 2. 66-2. 80(m, 3H), 2. 94-2. 84(m, 2H), 2. 99(d, J = 12. 2 Hz, 1H), 3. 09(d, J = 12. 0 Hz, 1H), 3. 82(d, J = 11. 5 Hz, 1H), 7. 64(s, 1H),7. 91(s, 1H).
실시예 1. 75: (
R)
-4-벤질-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,7]나프티리딘(화합물 175)의 제조.
단계 A: (
R)
-4,8-디벤질-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-a][1,7]나프티리딘의 제조.
N2 대기 하에서 15 °C에서 디옥산(5 mL) 및 H2O(1 mL) 중의 (R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,7]나프티리딘(139 mg, 0. 387 mmol) 및 포타슘 벤질(트리플루오로)보라뉴이드(BnBF3K, 307 mg, 1. 55 mmol) 용액에 Pd(dppf)Cl2. CH2Cl2(63. 2 mg, 0. 0774 mmol) 및 Cs2CO3(378 mg, 1. 16 mmol)을 첨가하였다. 반응물을 16시간 동안 90 ℃로 가열하였다. 실온으로 냉각시킨 후, 혼합물을 염수(10 mL)로 희석하고 EtOAc(3 Х 5 mL)로 추출하였다. 유기층을 Na2SO4 상에서 건조시키고, 여과하고 농축하였다. 잔류물을 제조용 TLC로 정제하여 표제 화합물(53 mg, 0. 143 mmol, 37% 수율)을 황색 오일로서 수득하였다. LCMS m/z = 370. 1 [M+H]+.
단계 B: (
R)
-4-벤질-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,7]나프티리딘(화합물 175)의 제조.
(R)-4,8-디벤질-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,7]나프티리딘으로부터, 생성물이 HPLC로 정제된 것을 제외하고 실시예 1. 13의 단계 B에 기술된 것과 유사한 방법을 사용하여 표제 화합물을 제조하였다. LCMS m/z = 280. 0 [M+H]+; 1H NMR(400 MHz, CD3OD): δ ppm 1. 60(m, 1H), 1. 86(m, 1H), 2. 60-2. 47(m, 2H), 2. 78-2. 66(m, 2H), 2. 91-2. 80(m, 2H), 2. 97(m, 1H), 3. 10(m, 1H), 3. 84(m, 1H), 3. 93(s, 2H), 7. 11(m, 2H), 7. 19(m, 1H), 7. 29-7. 23(m, 2H), 7. 73(s, 1H), 8. 01(s, 1H).
실시예 1. 76: (
R)
-4-(사이클로부틸메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘(화합물 176)의 제조.
단계 A: (
R)
-8-벤질-4-(사이클로부틸메틸)-6,6a,7,8,9,10-헥사하이드로-5
H
-피라지노[1,2-
a
][1,8]나프티리딘의 제조.
니트(neat) (R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(40 mg, 0. 11 mmol)의 용액에 (사이클로부틸메틸)아연(II) 브로미드(1. 12 mL의 THF 중의 0. 5M 용액, 0. 558 mmol)를 신선하게 첨가한 후 Pd(dppf)Cl2. DCM 부가물(9. 1 mg, 11 μmol)을 첨가하였다. 혼합물을 100 ℃의 마이크로파에서 5시간 동안 가열하였다. 포화 수성 NaHCO3을 첨가하고 혼합물을 EtOAc로 추출하였다. 유기물을 포화 수성 NaHCO3 및 염수로 세척하였다. 합한 유기물을 MgSO4 상에서 건조시키고, 여과하고, 농축하였다. 농축물은 상당한 양(1H NMR에 의해 3 중량% 초과)의 출발 물질 [(R)-8-벤질-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘]을 함유하였으므로 상기 물질을(사이클로부틸메틸)아연(II) 브로미드(1. 12 mL의 THF 중의 0. 5M 용액, 0. 558 mmol)에 재용해하고 Pd(dppf)Cl2. DCM 부가물(9. 1 mg, 11 μmol)을 첨가하였다. 혼합물을 110 ℃의 마이크로파에서 12시간 동안 가열하였다. 후처리를 전술한 바와 같이 수행하였다. 혼합물을 95% H2O, 20 mL/분, λ = 214 nm]에 대해 H2O(1% v/v TFA 함유) 구배 중의 역상 HPLC [Phenomenex® Luna C18 칼럼(10μ, 250 Х 21. 2 mm), 5%(v/v) CH3CN으로 정제하였다. 원하는 중간체를 함유하는 분획을 농축시키고 EtOAc와 포화 수성 NaHCO3 사이에 분배하였다. 상을 분리하고 유기물을 MgSO4 상에서 건조시키고, 여과하고, 농축하였다. 실리카겔 크로마토그래피(Et3N 첨가물을 갖는 헥산 중의 35% EtOAc에 대해 0. 5% Et3N을 함유하는 헥산 중의 0. 5% Et3N을 함유하는 2% EtOAc 구배)로 정제하여 (R)-8-벤질-4-(사이클로부틸메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘(6. 8 mg, 20 μmol, 18% 수율)을 수득하였다. LCMS m/z = 348. 6 [M + H]+; 1H NMR(400 MHz, CDCl3) δ ppm 7. 89(d, J = 5. 2 Hz, 1H), 7. 37-7. 29(m, 4H), 7. 27(m, 1H), 6. 37(d, J = 5. 2 Hz, 1H), 4. 69(m, 1H), 3. 59(d, J = 13. 0 Hz, 1H), 3. 49(d, J = 13. 0 Hz, 1H), 3. 25(tt, J = 10. 4, 3. 0 Hz, 1H), 2. 97(m, 1H), 2. 91-2. 82(m, 2H), 2. 74(ddd, J = 16. 2, 5. 2, 3. 2 Hz, 1H), 2. 63-2. 43(m, 4H), 2. 19(td, J = 11. 6, 3. 2 Hz, 1H), 2. 09-1. 98(m, 2H), 1. 92-1. 78(m, 3H), 1. 74-1. 62(m, 3H).
단계 B: (
R)
-4-(사이클로부틸메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-
a
][1,8]나프티리딘(화합물 176)의 제조.
(R)-8-벤질-4-(사이클로부틸메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘으로부터, 생성물이 HPLC로 정제된 것을 제외하고 실시예 1. 13의 단계 B에 기술된 것과 유사한 방법을 사용하여 표제 화합물을 제조하였다. LCMS m/z = 258. 4 [M + H]+; 1H NMR(400 MHz, CD3OD) δ ppm 7. 85(d, J = 5. 2 Hz, 1H), 6. 54(d, J = 5. 2 Hz, 1H), 4. 82(m, 1H), 3. 44-3. 25(m, 3H), 3. 06(td, J = 12. 6, 3. 5 Hz, 1H), 2. 95-2. 78(m, 3H), 2. 74-2. 51(m, 4H), 2. 11-2. 00(m, 3H), 1. 92-1. 82(m, 2H), 1. 79-1. 66(m, 3H).
실시예 2 - 안정한 세포주의 생성
관심 수용체를 코딩하는 플라스미드 DNA는 표준 분자 생물학 툴을 사용하여 생산된다. 플라스미드는 전형적으로 관심 수용체에 대한 코딩 서열이 삽입되는 다중 클로닝 부위, 숙주 세포 내로 도입될 때 수용체의 발현을 유도하는 프로모터 및 숙주 세포가 항생제 내성을 부여하는 단백질을 생성하도록 하는 저항성 유전자 서열을 함유한다. 일반적으로 사용되는 프로모터는 거대세포바이러스 프로모터(CMV)이며, 일반적으로 사용되는 저항성 유전자는 네오마이신에 대한 저항성을 부여하는 neo 유전자이다. 플라스미드 DNA는 리포펙션 또는 전기천공법과 같은 방법을 사용하여 모 세포(일반적으로 사용되는 세포주는 CHO-K1 및 HEK293을 포함한다)에 도입된다. 그 다음에 세포를 1-2 일 동안 배양물 중에서 회수한다. 이 시점에서, 선택 작용제(예를 들어, 발현 플라스미드가 neo 유전자를 함유하는 경우에 네오마이신)를 플라스미드 DNA를 흡수하지 못하여 네오마이신 내성을 갖지 않게 된 임의의 세포를 사멸시키기에 충분한 농도로 세포 배양 배지에 첨가한다.
일시적인 형질 감염은 플라스미드 DNA를 세포에 도입하는 효율적인 방법이기 때문에, 배양물 중의 많은 세포는 초기에 네오마이신 내성을 나타낼 것이다. 몇 가지 세포 분열 과정에서, 플라스미드에 의해 코딩되는 단백질의 발현은 전형적으로 없어지고 결국 대부분의 세포는 항생제에 의해 사멸하게 된다. 그러나, 소수의 세포에서, 플라스미드 DNA가 염색체 DNA에 무작위로 통합될 수 있다. 플라스미드 DNA가 neo 유전자의 지속적인 발현을 허용하는 방식으로 통합되면, 이들 세포는 네오마이신에 영구적으로 내성이 된다. 전형적으로, 2주 동안 형질감염된 세포를 배양한 후, 나머지 세포의 대부분은 이러한 방식으로 플라스미드를 통합한 것들이다.
세포의 생성된 안정된 풀은 매우 이질적이며, 엄청나게 상이한 수준의 수용체를 발현할 수 있다(또는 어떠한 수용체도 전혀 발현하지 않을 수 있다). 이러한 유형의 세포 집단은 관심 수용체에 대한 적절한 작용제로 자극될 때 기능적 반응을 제공할 수 있지만, 상기 집단은 높은 발현 수준에 의해 유발되는 수용체 예비 효과를 고려하여 신중한 약리학적 연구에는 전형적으로 적합하지 않다.
따라서, 클론 세포주가 이 세포 집단에서 유래된다. 세포를 웰당 하나의 세포 밀도로 다중-웰 플레이트에 플레이팅하였다. 세포를 플레이팅한 후, 플레이트를 검사하고 하나 초과의 세포를 포함하는 웰을 폐기한다. 그 다음에, 세포를 일정 기간 동안 배양하고 네오마이신 존재 하에 분열을 계속하는 세포는 평가에 충분한 세포가 생길 때까지 결국 더 큰 배양 용기로 확대된다.
세포의 평가
수많은 방법이 세포를 평가하는데 사용될 수 있다. 기능 검정에서의 특성 규명은 일부 세포가 작용제의 효력 및 효과를 과장함을 밝힐 수 있는데, 이는 아마도 수용체 예비의 존재를 나타내는 것이다. 방사성 리간드 결합 검정에서의 평가를 위한 세포막의 준비는 막 수용체 밀도의 정량적 결정을 할 수 있게 한다. 세포 표면 수용체 밀도의 평가는, 전형적으로 GPCR에 대한 N-말단에서, 수용체 내로 조작될 수 있는 에피토프 태그 또는 수용체에 대한 항체를 사용하는 유동 세포측정에 의해 또한 수행될 수 있다. 동 세포측정 방법은 클로날 세포 집단이 균질한 방식으로 수용체를 발현하는지(예상되는지)를 결정할 수 있으며 각각의 클로날 세포 집단 사이의 상대적 발현 수준을 정량할 수 있게 한다. 그러나, 상기 계수법이 절대 수용체 발현 수준을 제공하지는 않는다.
세포주에 수용체 예비 효과가 없도록 하려는 경우, 수용체 발현은 낮아야 하며 (평가된 다른 클론에 비해) 균질하여야 한다(유동 세포측정 평가가 가능한 경우). 기능 검정에서, 적합한 클론은 다른 클론보다 더 낮은(즉, 더 높은 EC50 값) 작용제 효력을 초래할 것이다. 부분 작용제가 이용 가능한 경우, 수용체 예비의 부재는 완전한 작용제에 비해 낮은 효능에서 반영되며, 한편 수용체 발현 수준이 높은 세포는 부분 작용제 효력을 과장할 것이다. 높은 수용체 수준을 나타내는 세포에서, 부분 작용제는 더 이상 완전한 작용제보다 낮은 효능을 나타내지 않을 수 있다.
관심 수용체와 비가역적으로 결합하거나 공유적으로 상호 작용하는 작용제가 이용 가능한 경우, 어떤 수용체 예비도 함유하지 않은 세포주의 처리는 방사성 리간드 결합에 의해 측정된 이용 가능한 수용체 밀도를 감소시켜야 하므로 작용제에 대한 기능적 반응의 크기를 감소시킬 수 있다. 그러나, 수용체 밀도의 감소는 작용제 효력 또는 부분 작용제 효력의 감소를 초래하지 않고 발생하여야 한다.
실시예 3: 방사성 리간드 결합 검증을 위한 막 준비.
표 A의 화합물에 대해, 준비 절차를 사용하였다. 재조합 5-HT2 수용체를 안정적으로 발현하는 HEK293 세포를 수확하고, 빙냉 인산염 완충 식염수, pH 7. 4(PBS)에 현탁시키고, 4℃에서 20분 동안 48,000 g에서 원심분리하였다. 이어서 생성된 세포 펠렛을 20 mM HEPES, pH 7. 4 및 0. 1 mM EDTA를 함유하는 세척 완충제에 재현탁시키고 브링크만 폴리트론을 사용하여 얼음 위에서 균질화한 후, 원심분리하였다(4℃에서 20분 동안 48,000 g). 그 다음에 펠렛을 20 mM HEPES, pH 7. 4에 재현탁시키고 얼음 위에서 균질화한 후, 원심분리하였다(4℃에서 20분 동안 48,000 g). 조 막 펠렛을 방사성 리간드 결합 검정에 사용할 때까지 -80℃에서 보관하였다.
실시예 4: 방사성 리간드 결합 검정.
표 A의 화합물에 대해, 하기 절차를 사용하였다. 방사성 리간드 결합 검정을 시판되는 5-HT2 수용체 작용제 [125I]DOI를 방사성 리간드로서 사용하여 수행하고 비특이적 결합을 비표지된 DOI의 존재 하에 10 μM의 포화 농도에서 결정하였다. 경쟁 실험은 0. 4 내지 0. 6 nM의 최종 검정 농도에서 방사성 리간드 및 실시예 3에 기재된 바와 같이 수득된 5-HT2 수용체 발현 HEK293 세포막(15-25 ㎍ 막 단백질/웰)을 이용하였다. 실험은 95 μL의 검정 완충제(20 mM HEPES, pH 7. 4, 10 mM MgCl2), 50 μL의 막, 50 μL의 방사성 리간드 스톡, 및 검정 완충제에 희석된 5 μL의 시험 화합물을 96-웰 마이크로티터 플레이트에 첨가한 다음에, 1시간 동안 실온에서 인큐베이션하는 것을 포함하였다. 96-웰 팩커드 여과 장치를 사용하여 감압 하에 PerkinElmer F/C 여과 플레이트 통한 급속 여과에 의해, 이어서 빙냉 검정 완충제로 3회 세척하여 검정 인큐베이션을 종결하였다. 그 다음에 플레이트를 45℃에서 최소 2시간 동안 건조시켰다. 마지막으로, 25 μL의 BetaScintTM 섬광 칵테일을 각각의 웰에 첨가하고 플레이트를 Packard TopCount® 섬광 계수기에서 계수하였다. 각각의 경쟁 연구에서, 시험 화합물을 각각의 시험 농도에서 삼중 결정으로 10가지 농도로 투여하였다.
5-HT2C, 5-HT2B, 및 5-HT2A 수용체에서 표 A의 일부 화합물에 대해 시험된 관찰된 DOI 결합 K i 값을 표 B에 열거하였다.
표 B
실시예 5 : IP 축적 검정.
재조합 5-HT2 수용체를 발현하는 HEK293 세포를 멸균 폴리-D-리신 코팅된 96-웰 마이크로티터 플레이트(35,000개 세포/웰)에 첨가하고 18시간 동안 미오이노시톨-무함유 DMEM에서 [3H]이노시톨의 0. 6 μCi/웰로 표지하였다. 혼입되지 않은 [3H] 이노시톨을 흡인에 의해 제거하고 LiCl(최종 10 mM) 및 파르길린(최종 10 μM)으로 보충된 새로운 미오이노시톨-무함유 DMEM으로 대체하였다. 그 다음에, 연속 희석된 시험 화합물을 첨가하고 37℃(5-HT2B, 및 5-HT2A) 및 실온(5-HT2C)에서 2시간 동안 인큐베이션을 수행하였다. 그 다음에 빙냉 0. 1 M 포름산을 첨가하여 세포를 용해시킨 후 -80℃에서 동결시켜 인큐베이션을 종결시켰다. 해동 후, AG1-X8 이온 교환 수지(Bio-Rad)를 사용하여 총 [3H] 이노시톨 포스페이트를 [3H]이노시톨로부터 분해하고, [3H]이노시톨 포스페이트를 Perkin Elmer TopCount® 섬광 계수기를 사용하여 섬광 계수에 의해 측정하였다. 모든 EC50 결정은 10개의 상이한 농도를 사용하여 수행하였고 각각의 시험 농도에서 3중으로 결정하였다. 5-HT2C, 5-HT2B, 및 5-HT2A 수용체에서 시험된 표 A의 화합물에 대해 관찰된 IP 축적 EC50 값을 표 C에 열거하였다.
표 C
실시예 6: 수컷 스프라그 돌리 래트에서 식품 섭취에 대한 화합물의 효과.
수컷 스프라그 돌리 래트(225-300 g)를 온도 및 습도 제어 환경(12 시간:12 시간 명:암 주기, 0600 시간에 점등)에서 케이지당 3마리씩 수용하였다. 시험 전날 1600 시간에, 래트를 새로운 케이지에 넣고 음식물을 제거하였다. 시험 당일에, 래트를 음식물에 접근할 수 없는 1000 시간에 그리드 바닥이 있는 개별 케이지에 넣었다. 1130 시간에, 음식을 제시하기 30분 전에 래트(n = 8)에게 경구 위관영양법을 통해 시험 화합물(PO, 1 mL/kg, 시험 화합물의 2 mg/kg 또는 10 mg/kg의 양으로) 또는 비히클(20% 하이드록시프로필-β-사이클로덱스트린)을 투여하였다. 약물 투여 후 60분(식품 제시 후 30분)에 식품 섭취를 측정하였다.
도 9에 나타난 바와 같이, 누적 식품 섭취는 위약에 비해 화합물 152의 투여 1시간 후에 현저하게 감소하였다.
개시된 방법의 다른 용도는 특히 본 특허 문헌의 검토에 기초하여 관련 기술분야의 통상의 기술자에게 명백해질 것이다.
Claims (50)
- 화학식 A의 화합물, 및 이의 약학적으로 허용되는 염, 용매화물, 및 수화물로부터 선택되는 화합물:
화학식 A
여기서,
n은 1 또는 2이고;
각각의 R6, R7, 및 R8은 수소 및 C1-C6 알킬로부터 독립적으로 선택되고;
R9는 수소 또는 C1-C6 알킬이고;
X2는 N 또는 CR2이고;
X3은 N 또는 CR3이고;
X4는 N 또는 CR4이고;
여기서, 각각의 R1, R2, R3, 및 R4는 각각 독립적으로 다음으로부터 선택된다:
a) 수소;
b) 각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c) C2-C6 알케닐;
d) C3-C8 사이클로알킬;
e) 할로겐으로 선택적으로 치환된 5- 내지 10-원 헤테로아릴;
f) 할로겐, 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴,
여기서, C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합됨;
g) 할로겐으로 선택적으로 치환된 CONHC1-C6 알킬;
h) NH(CO)R5, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로부터 선택됨;
i) 할로겐; 및
j) C1-C6 알킬티오;
여기서, X2, X3 및 X4 중 2개를 초과하지 않는 적어도 하나는 N이고,
(i) X2, X3 및 X4 중 오직 하나만이 N이고 R1, R2, R3, 및 R4 중 적어도 하나가 수소이거나;
(ii) 오직 X2 및 X4만이 N이다. - 제1항에 있어서, n이 1인 화합물.
- 제1항에 있어서, n이 2인 화합물.
- 제1항 내지 제3항 중 어느 한 항에 있어서, R1이 수소인 화합물.
- 제1항 내지 제3항 중 어느 한 항에 있어서, R1이 C1-C6 알킬인 화합물.
- 제1항 내지 제3항 중 어느 한 항에 있어서, R1이 C6-C10 아릴로 치환된 C1-C6 알킬, 할로겐으로 치환된 C6-C10 아릴, C1-C6 알콕시, 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알콕시, C3-C8 사이클로알킬¸ OH, CN, 3- 내지 8-원 헤테로사이클로알킬, 5- 내지 10-원 헤테로아릴, 또는 할로겐인 화합물.
- 제1항 내지 제3항 중 어느 한 항에 있어서, R1이 할로겐, 할로겐으로 선택적으로 치환된 C1-C6 알콕시, 및 할로겐으로 선택적으로 치환된 C1-C6 알킬로부터 각각 독립적으로 선택된 하나 이상의 기로 선택적으로 치환된 C6-C10 아릴이고, 상기 C6-C10 아릴은 헤테로사이클릭 고리와 선택적으로 융합되는 화합물.
- 제1항 내지 제3항 중 어느 한 항에 있어서, R1이 CONHC1-C6 알킬, 할로겐으로 치환된 CONHC1-C6 알킬, 할로겐, 또는 C1-C6 알킬티오인 화합물.
- 제1항 내지 제3항 중 어느 한 항에 있어서, R1이 NH(CO)R5이고, 여기서, R5는 C1-C6 알콕시, C6-C10 아릴로 선택적으로 치환된 C1-C6 알킬, 할로겐으로 선택적으로 치환된 C6-C10 아릴, 3- 내지 8-원 헤테로사이클로알킬, 및 C3-C8 사이클로알킬로 이루어진 군으로부터 선택되는 화합물.
- 제1항 내지 제3항 중 어느 한 항에 있어서, R1이 벤조[d][1,3]디옥솔-5-일, 메틸카바모일, 수소, 2-클로로벤즈아미도, 3-(트리플루오로메톡시)페닐, 벤질, 2-메톡시에틸, 펜틸, 펜탄-2-일, 에틸, 이소프로필, 부틸, 프로필, 이소부틸, 3-플루오로벤질, 2-플루오로벤질, 메틸, 이소펜틸, 메톡시메틸, 사이클로헥실메틸, 네오펜틸, 사이클로부틸(하이드록시)메틸, (에톡시카보닐)아미노, 2-페닐아세트아미도, 부티르아미도, 티오펜-2-일, 사이클로헥실, 4-플루오로벤질, 피롤리딘-1-카복스아미도, (테트라하이드로-2H-피란-2-일)메틸, ((테트라하이드로-2H-피란-4-일)메톡시)메틸, 2-(트리플루오로메틸)페닐, 4-메톡시페닐, 브로모, 사이클로부틸메틸, 2,3-디플루오로벤즈아미도, 벤즈아미도, (2,2-디플루오로에틸)카바모일, 사이클로프로판카복스아미도, 2-시아노에틸, 피리딘-2-일메틸, 부트-2-엔-1-일, 이소프로폭시메틸, 5-클로로피리딘-2-일, 사이클로펜틸, 사이클로부틸, 클로로, 사이클로프로필, 3,3,3-트리플루오로프로필, 펜에틸, 및 사이클로펜틸메틸로 이루어진 군으로부터 선택되는 화합물.
- 제1항 내지 제10항 중 어느 한 항에 있어서, X2가 CR2인 화합물.
- 제1항 내지 제10항 중 어느 한 항에 있어서, X2가 CR2이고, R2는 수소, C1-C6 알킬, C6-C10 아릴로 치환된 C1-C6 알킬, C1-C6 알콕시로 치환된 C1-C6 알킬, C3-C8 사이클로알킬로 치환된 C1-C6 알킬, 3- 내지 8-원 헤테로사이클로알킬로 치환된 C1-C6 알킬, C3-C8 사이클로알킬, 할로겐, 또는 C1-C6 알킬티오로 이루어진 군으로부터 선택되는 화합물.
- 제1항 내지 제10항 중 어느 한 항에 있어서, X2가 CR2이고, R2는 수소, 프로필, 벤질, 2-시아노에틸, 이소프로폭시메틸, 사이클로헥실메틸, (테트라하이드로-2H-피란-2-일)메틸, 사이클로부틸, 클로로, 및 사이클로펜틸메틸로 이루어진 군으로부터 선택되는 화합물.
- 제1항 내지 제13항 중 어느 한 항에 있어서, X3이 CR3인 화합물.
- 제1항 내지 제13항 중 어느 한 항에 있어서, X3이 CR3이고, R3이 수소 또는 C1-C6 알킬티오인 화합물.
- 제1항 내지 제13항 중 어느 한 항에 있어서, X3이 CR3이고 R3은 수소 및 메틸티오로 이루어진 군으로부터 선택되는 화합물.
- 제1항 내지 제16항 중 어느 한 항에 있어서, X4가 CR4인 화합물.
- 제1항 내지 제16항 중 어느 한 항에 있어서, X4가 CR4이고 R4가 수소인 화합물.
- 제1항 내지 제18항 중 어느 한 항에 있어서, R6이 수소인 화합물.
- 제1항 내지 제18항 중 어느 한 항에 있어서, R6이 C1-C6 알킬인 화합물.
- 제1항 내지 제18항 중 어느 한 항에 있어서, X6이 수소 및 메틸로 이루어진 군으로부터 선택되는 화합물.
- 제1항 내지 제21항 중 어느 한 항에 있어서, R7이 수소인 화합물.
- 제1항 내지 제21항 중 어느 한 항에 있어서, R8이 수소인 화합물.
- 제1항 내지 제23항 중 어느 한 항에 있어서, R9가 수소인 화합물.
- 제1항 내지 제23항 중 어느 한 항에 있어서, R9가 C1-C6 알킬인 화합물.
- 제1항 내지 제23항 중 어느 한 항에 있어서, X9가 수소 및 메틸로 이루어진 군으로부터 선택되는 화합물.
- 제1항에 있어서,
R1이 벤조[d][1,3]디옥솔-5-일, 메틸카바모일, 수소, 2-클로로벤즈아미도, 3-(트리플루오로메톡시)페닐, 벤질, 2-메톡시에틸, 펜틸, 펜탄-2-일, 에틸, 이소프로필, 부틸, 프로필, 이소부틸, 3-플루오로벤질, 2-플루오로벤질, 메틸, 이소펜틸, 메톡시메틸, 사이클로헥실메틸, 네오펜틸, 사이클로부틸(하이드록시)메틸, (에톡시카보닐)아미노, 2-페닐아세트아미도, 부티르아미도, 티오펜-2-일, 사이클로헥실, 4-플루오로벤질, 피롤리딘-1-카복스아미도, (테트라하이드로-2H-피란-2-일)메틸, ((테트라하이드로-2H-피란-4-일)메톡시)메틸, 2-(트리플루오로메틸)페닐, 4-메톡시페닐, 브로모, 사이클로부틸메틸, 2,3-디플루오로벤즈아미도, 벤즈아미도, (2,2-디플루오로에틸)카바모일, 사이클로프로판카복스아미도, 2-시아노에틸, 피리딘-2-일메틸, 부트-2-엔-1-일, 이소프로폭시메틸, 5-클로로피리딘-2-일, 사이클로펜틸, 사이클로부틸, 클로로, 사이클로프로필, 3,3,3-트리플루오로프로필, 펜에틸, 및 사이클로펜틸메틸로 이루어진 군으로부터 선택되고;
X2는 N이거나, X2는 CR2이고 R2는 수소, 프로필, 벤질, 2-시아노에틸, 이소프로폭시메틸, 사이클로헥실메틸, (테트라하이드로-2H-피란-2-일)메틸, 사이클로부틸, 클로로, 및 사이클로펜틸메틸로 이루어진 군으로부터 선택되고;
X3은 N이거나 X3은 CR3이고, R3은 수소 및 메틸티오로 이루어진 군으로부터 선택되고;
X4는 N이거나 X4는 CR4이고, R4는 수소이고;
R6은 수소 및 메틸로 이루어진 군으로부터 선택되고;
R9는 수소 및 메틸로 이루어진 군으로부터 선택되는, 화합물. - 제1항에 있어서, 화학식 A의 화합물은 화학식 Ia-i의 화합물 및 이의 약학적으로 허용되는 염, 용매화물, 및 수화물로부터 선택되는 화합물:
화학식 Ia-i.
여기서,
R1은 다음으로부터 선택된다:
a) 수소;
b) 각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c) C3-C8 사이클로알킬; 및
i) 할로겐;
그리고
R2는 수소이다. - 제1항에 있어서, 화학식 A의 화합물은 화학식 IIa-i의 화합물 및 이의 약학적으로 허용되는 염, 용매화물, 및 수화물로부터 선택되는 화합물:
화학식 IIa-i.
여기서,
R1은 다음으로부터 선택된다:
a) 수소;
b) 각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8-원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c) C3-C8 사이클로알킬; 및
d) 할로겐. - 제1항에 있어서, 화학식 A의 화합물은 화학식 IIIa-i의 화합물 및 이의 약학적으로 허용되는 염, 용매화물, 및 수화물로부터 선택되는 화합물:
화학식 IIIa-i.
여기서,
R1은 다음으로부터 선택된다:
a) 수소;
b) 각각 독립적으로 다음으로부터 선택된 하나 이상의 기로 선택적으로 치환된 C1-C6 알킬:
할로겐으로 선택적으로 치환된 C6-C10 아릴;
3- 내지 8-원 헤테로사이클로알킬로 선택적으로 치환된 C1-C6 알콕시;
C3-C8 사이클로알킬;
OH;
CN;
3- 내지 8- 원 헤테로사이클로알킬;
5- 내지 10-원 헤테로아릴; 및
할로겐;
c) C3-C8 사이클로알킬; 및
d) 할로겐. - 제1항에 있어서, 하기 화합물 및 이의 약학적으로 허용되는 염, 용매화물, 및 수화물로부터 선택되는 화합물:
(R)-4-(벤조[d][1,3]디옥솔-5-일)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-N-메틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-카복사미드;
(R)-3-프로필-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-2-클로로-N-(6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-일)벤즈아미드;
(R)-4-(3-(트리플루오로메톡시)페닐)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-벤질-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-(2-메톡시에틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-펜틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(6aR)-4-(펜탄-2-일)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-이소프로필-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-부틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-프로필-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-이소부틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-(3-플루오로벤질)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-(2-플루오로벤질)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-메틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-이소펜틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-(메톡시메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-(사이클로헥실메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-네오펜틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
사이클로부틸((R)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-일)메탄올;
(R)-에틸(6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-일)카바메이트;
(R)-N-(6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-일)-2-페닐아세트아미드;
(R)-N-(6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-일)부티르아미드;
(R)-4-(티오펜-2-일)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-사이클로헥실-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-(4-플루오로벤질)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-에틸-3-프로필-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-3-벤질-4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-N-(6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-일)피롤리딘-1-카복사미드;
(6aR)-4-((테트라하이드로-2H-피란-2-일)메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-(((테트라하이드로-2H-피란-4-일)메톡시)메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-(2-(트리플루오로메틸)페닐)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-(4-메톡시페닐)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
4-(사이클로부틸메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-2,3-디플루오로-N-(6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-일)벤즈아미드;
(R)-N-(6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-일)벤즈아미드;
(R)-N-(2,2-디플루오로에틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-카복사미드;
(R)-N-(6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-일)사이클로프로판카복사미드;
(R)-3-(6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-4-일)프로판나이트릴;
(R)-4-(피리딘-2-일메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R,E)-4-(부트-2-엔-1-일)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-(이소프로폭시메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-(5-클로로피리딘-2-일)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-사이클로펜틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-사이클로부틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-클로로-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-사이클로프로필-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-(3,3,3-트리플루오로프로필)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,7]나프티리딘;
(R)-7-(사이클로부틸메틸)-2,3,4,4a,5,6-헥사하이드로-1H-피라지노[1,2-a][1,6]나프티리딘;
(R)-2,3,4,4a,5,6-헥사하이드로-1H-피라지노[1,2-a][1,6]나프티리딘;
(R)-4-브로모-5,6,6a,7,8,9,10,11-옥타하이드로-[1,4]디아제피노[1,2-a][1,8]나프티리딘;
(R)-4-(3,3,3-트리플루오로프로필)-5,6,6a,7,8,9,10,11-옥타하이드로-[1,4]디아제피노[1,2-a][1,8]나프티리딘;
5-메틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-클로로-2-(메틸티오)-5,6,6a,7,8,9,10,11-옥타하이드로피리미도[5',4':5,6]피리도[1,2-a][1,4]디아제핀;
(R)-4-클로로-5,6,6a,7,8,9,10,11-옥타하이드로피리미도[5',4':5,6]피리도[1,2-a][1,4]디아제핀;
(R)-4-펜에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-3-(4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘-3-일)프로판나이트릴;
(R)-4-에틸-3-(이소프로폭시메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-3-(사이클로헥실메틸)-4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(6aR)-4-에틸-3-((테트라하이드로-2H-피란-2-일)메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-3-사이클로부틸-4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-3-클로로-4-(3,3,3-트리플루오로프로필)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-8-메틸-4-(3,3,3-트리플루오로프로필)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-클로로-2-(메틸티오)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1',2':1,6]피리도[2,3-d]피리미딘;
(R)-4-(사이클로펜틸메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-3-(사이클로펜틸메틸)-4-에틸-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘;
(R)-4-브로모-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,7]나프티리딘;
(R)-4-프로필-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,7]나프티리딘;
(R)-4-(사이클로헥실메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,7]나프티리딘;
(R)-4-벤질-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,7]나프티리딘; 및
(R)-4-(사이클로부틸메틸)-6,6a,7,8,9,10-헥사하이드로-5H-피라지노[1,2-a][1,8]나프티리딘. - 제1항 내지 제31항 중 어느 한 항에 따른 화합물 및 약학적으로 허용되는 담체를 포함하는 약학 조성물.
- 식품 섭취의 감소를 필요로 하는 개체에게 치료 유효량의 제1항 내지 제31항 중 어느 한 항의 화합물 또는 제32항의 조성물을 투여하는 것을 포함하는, 상기 개체에서 식품 섭취를 감소시키는 방법이다.
- 포만감의 유도를 필요로 하는 개체에게 치료 유효량의 제1항 내지 제31항 중 어느 한 항의 화합물 또는 제32항의 조성물을 투여하는 것을 포함하는, 상기 개체에서 포만감을 유도하는 방법이다.
- 비만 치료 또는 예방을 필요로 하는 개체에게 치료 유효량의 제1항 내지 제31항 중 어느 한 항의 화합물 또는 제32항의 조성물을 투여하는 것을 포함하는, 상기 개체에서 비만 치료 또는 예방하는 방법이다.
- 체중 관리를 필요로 하는 개체에게 치료 유효량의 제1항 내지 제31항 중 어느 한 항의 화합물 또는 제32항의 조성물을 투여하는 것을 포함하는, 상기 개체에서 체중을 관리하는 방법이다.
- 제2형 당뇨병, 약물 및 알콜 중독 또는 발작 장애의 치료 또는 예방을 필요로 하는 개체에게 치료 유효량의 제1항 내지 제31항 중 어느 한 항의 화합물 또는 제32항의 조성물을 투여하는 것을 포함하는, 상기 개체에서 제2형 당뇨병, 약물 및 알콜 중독 또는 발작 장애를 치료 또는 예방하는 방법이다.
- 식품 섭취를 감소시키기 위한 약제의 제조를 위한 제1항 내지 제31항 중 어느 한 항에 따른 화합물의 용도.
- 포만감 유도를 위한 약제의 제조를 위한 제1항 내지 제31항 중 어느 한 항에 따른 화합물의 용도.
- 비만 치료 또는 예방을 위한 약제의 제조를 위한 제1항 내지 제31항 중 어느 한 항에 따른 화합물의 용도.
- 체중 관리를 위한 약제의 제조를 위한 제1항 내지 제31항 중 어느 한 항에 따른 화합물의 용도.
- 제2형 당뇨병, 약물 및 알콜 중독 또는 발작 장애의 치료 또는 예방을 위한 약제의 제조를 위한 제1항 내지 제31항 중 어느 한 항에 따른 화합물의 용도.
- 요법에 의한 인간 또는 동물의 치료를 위한 방법에서 사용하기 위한 제1항 내지 제31항 중 어느 한 항의 화합물 또는 제32항의 조성물.
- 식품 섭취를 감소시키기 위한 방법에서 사용하기 위한 제1항 내지 제31항 중 어느 한 항의 화합물 또는 제32항의 조성물.
- 포만감을 유도하기 위한 방법에서 사용하기 위한 제1항 내지 제31항 중 어느 한 항의 화합물 또는 제32항의 조성물.
- 비만의 치료 또는 예방을 위한 방법에서 사용하기 위한 제1항 내지 제31항 중 어느 한 항의 화합물 또는 제32항의 조성물.
- 체중 관리에서 사용하기 위한 제1항 내지 제31항 중 어느 한 항의 화합물 또는 제32항의 조성물.
- 제2형 당뇨병, 약물 및 알콜 중독 또는 발작 장애의 치료 또는 예방을 위한 방법에서 사용하기 위한 제1항 내지 제31항 중 어느 한 항의 화합물 또는 제32항의 조성물.
- 제37항, 제42항, 또는 제48항 중 어느 한 항에 있어서, 발작 장애가 간질 또는 드라베 증후군인, 방법, 용도, 또는 화합물.
- 제1항 내지 제31항 중 어느 한 항의 화합물 및 약학적으로 허용되는 담체를 혼합하는 것을 포함하는, 약학 조성물의 제조 방법이다.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662377119P | 2016-08-19 | 2016-08-19 | |
| US62/377,119 | 2016-08-19 | ||
| PCT/US2017/047644 WO2018035477A1 (en) | 2016-08-19 | 2017-08-18 | 5-ht2c receptor agonists and compositions and methods of use |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190049732A true KR20190049732A (ko) | 2019-05-09 |
Family
ID=59799461
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197007503A KR20190049732A (ko) | 2016-08-19 | 2017-08-18 | 5-ht2c 수용체 효능제 및 조성물 및 사용 방법 |
Country Status (14)
| Country | Link |
|---|---|
| US (2) | US10836764B2 (ko) |
| EP (1) | EP3500570B1 (ko) |
| JP (1) | JP6977024B2 (ko) |
| KR (1) | KR20190049732A (ko) |
| CN (1) | CN109952301B (ko) |
| AU (1) | AU2017313908C1 (ko) |
| BR (1) | BR112019003142A2 (ko) |
| CA (1) | CA3033142A1 (ko) |
| EA (1) | EA038219B1 (ko) |
| IL (1) | IL264682B (ko) |
| MA (1) | MA45987A (ko) |
| MX (1) | MX2019002020A (ko) |
| NZ (1) | NZ750469A (ko) |
| WO (1) | WO2018035477A1 (ko) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190049732A (ko) * | 2016-08-19 | 2019-05-09 | 아레나 파마슈티칼스, 인크. | 5-ht2c 수용체 효능제 및 조성물 및 사용 방법 |
| GB2571696B (en) | 2017-10-09 | 2020-05-27 | Compass Pathways Ltd | Large scale method for the preparation of Psilocybin and formulations of Psilocybin so produced |
| JPWO2019131902A1 (ja) | 2017-12-27 | 2020-12-10 | 武田薬品工業株式会社 | 腹圧性尿失禁および便失禁の治療薬 |
| WO2020072675A1 (en) | 2018-10-02 | 2020-04-09 | Northwestern University | Beta-carbolines as positive allosteric modulators of the human serotonin receptor 2c (5-ht2c) |
| CA3138094A1 (en) | 2019-04-17 | 2020-10-22 | Compass Pathfinder Limited | Methods for treating anxiety disorders, headache disorders, and eating disorders with psilocybin |
| WO2022011350A1 (en) * | 2020-07-10 | 2022-01-13 | Eleusis Therapeutics Us, Inc. | Method of treatment for psilocybin or psilocin infusion |
| US11312684B1 (en) | 2021-02-10 | 2022-04-26 | Eleusis Therapeutics Us, Inc. | Pharmaceutically acceptable salts of psilocin and uses thereof |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4597961A (en) | 1985-01-23 | 1986-07-01 | Etscorn Frank T | Transcutaneous application of nicotine |
| US4920989A (en) | 1985-04-25 | 1990-05-01 | Regents Of The University Of California | Method and apparatus for aiding in the reduction of incidence of tobacco smoking |
| IL86170A (en) | 1987-05-01 | 1992-12-01 | Elan Transdermal Ltd | Preparations and compositions comprising nicotine for percutaneous administration |
| US5004610A (en) | 1988-06-14 | 1991-04-02 | Alza Corporation | Subsaturated nicotine transdermal therapeutic system |
| WO1992001029A1 (en) | 1990-07-03 | 1992-01-23 | Quaker Chemical Corporation | Aqueous coolant |
| AU1919592A (en) | 1991-04-16 | 1992-11-17 | National Institutes Of Health | Method of treating trichotillomania and onychophagia |
| CA2482195A1 (en) | 2002-04-12 | 2003-10-23 | The University Of Chicago | Farnesoid x-activated receptor agonists |
| JP5520051B2 (ja) * | 2007-11-15 | 2014-06-11 | 武田薬品工業株式会社 | 縮合ピリジン誘導体およびその用途 |
| US8518933B2 (en) * | 2009-04-23 | 2013-08-27 | Abbvie Inc. | Modulators of 5-HT receptors and methods of use thereof |
| CN103189053A (zh) * | 2010-09-01 | 2013-07-03 | 艾尼纳制药公司 | 用于体重控制的5-ht2c激动剂的调节释放剂型 |
| WO2015066344A1 (en) * | 2013-11-01 | 2015-05-07 | Arena Pharmaceuticals, Inc. | 5-ht2c receptor agonists and compositions and methods of use |
| WO2015161287A1 (en) * | 2014-04-17 | 2015-10-22 | G1 Therapeutics, Inc. | Tricyclic lactams for use in the protection of normal cells during chemotherapy |
| KR20190049732A (ko) * | 2016-08-19 | 2019-05-09 | 아레나 파마슈티칼스, 인크. | 5-ht2c 수용체 효능제 및 조성물 및 사용 방법 |
-
2017
- 2017-08-18 KR KR1020197007503A patent/KR20190049732A/ko not_active Application Discontinuation
- 2017-08-18 JP JP2019509528A patent/JP6977024B2/ja active Active
- 2017-08-18 WO PCT/US2017/047644 patent/WO2018035477A1/en unknown
- 2017-08-18 AU AU2017313908A patent/AU2017313908C1/en not_active Ceased
- 2017-08-18 EA EA201990527A patent/EA038219B1/ru not_active IP Right Cessation
- 2017-08-18 CA CA3033142A patent/CA3033142A1/en active Pending
- 2017-08-18 US US16/326,522 patent/US10836764B2/en active Active
- 2017-08-18 EP EP17762266.9A patent/EP3500570B1/en active Active
- 2017-08-18 NZ NZ750469A patent/NZ750469A/en not_active IP Right Cessation
- 2017-08-18 CN CN201780062933.5A patent/CN109952301B/zh not_active Expired - Fee Related
- 2017-08-18 BR BR112019003142-1A patent/BR112019003142A2/pt not_active IP Right Cessation
- 2017-08-18 MA MA045987A patent/MA45987A/fr unknown
- 2017-08-18 MX MX2019002020A patent/MX2019002020A/es unknown
-
2019
- 2019-02-06 IL IL264682A patent/IL264682B/en unknown
-
2020
- 2020-10-19 US US17/073,458 patent/US11608339B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| MA45987A (fr) | 2019-06-26 |
| EP3500570B1 (en) | 2022-10-05 |
| EA038219B1 (ru) | 2021-07-26 |
| EA201990527A1 (ru) | 2019-07-31 |
| US11608339B2 (en) | 2023-03-21 |
| AU2017313908C1 (en) | 2022-06-09 |
| CA3033142A1 (en) | 2018-02-22 |
| JP2019524844A (ja) | 2019-09-05 |
| US10836764B2 (en) | 2020-11-17 |
| NZ750469A (en) | 2023-03-31 |
| US20210214355A1 (en) | 2021-07-15 |
| JP6977024B2 (ja) | 2021-12-08 |
| IL264682B (en) | 2021-08-31 |
| CN109952301B (zh) | 2022-03-25 |
| CN109952301A (zh) | 2019-06-28 |
| EP3500570A1 (en) | 2019-06-26 |
| BR112019003142A2 (pt) | 2019-05-21 |
| AU2017313908A1 (en) | 2019-02-28 |
| AU2017313908B2 (en) | 2021-10-21 |
| US20190225612A1 (en) | 2019-07-25 |
| WO2018035477A1 (en) | 2018-02-22 |
| MX2019002020A (es) | 2019-11-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11608339B2 (en) | 5-HT2C receptor agonists and compositions and methods of use | |
| KR102275505B1 (ko) | 5-ht2c 수용체 효능제 및 조성물 및 사용 방법 | |
| US11395824B2 (en) | 5-HT2C receptor agonists and compositions and methods of use | |
| JP2018519251A5 (ko) | ||
| TW201605856A (zh) | 5-HTc受體促效劑 | |
| NZ739883B2 (en) | 5-ht2c receptor agonists and compositions and methods of use | |
| NZ737412B2 (en) | 5-ht2c receptor agonists and compositions and methods of use |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| WITB | Written withdrawal of application |