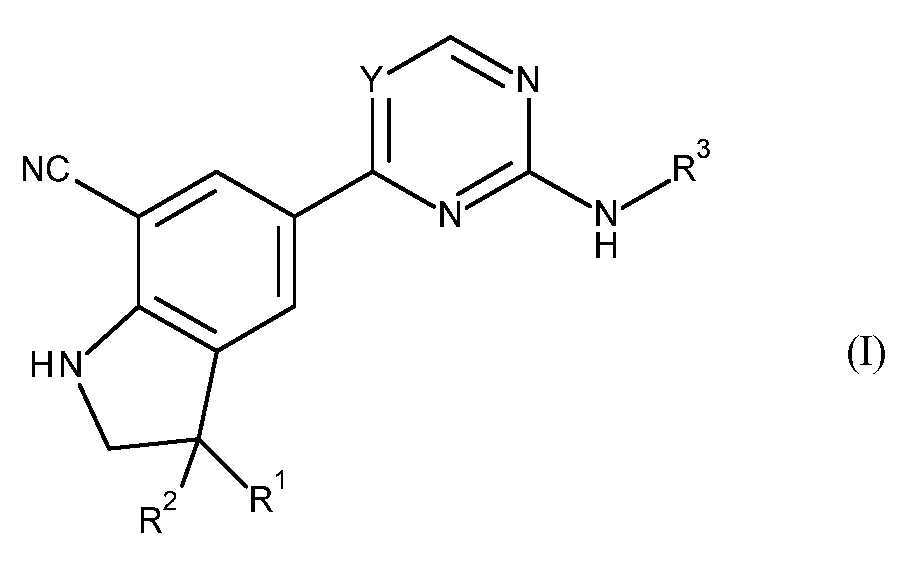
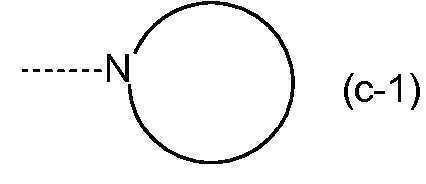
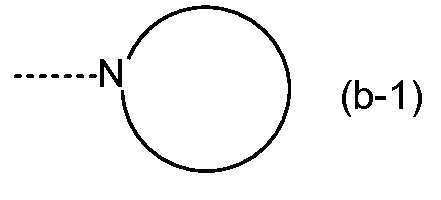
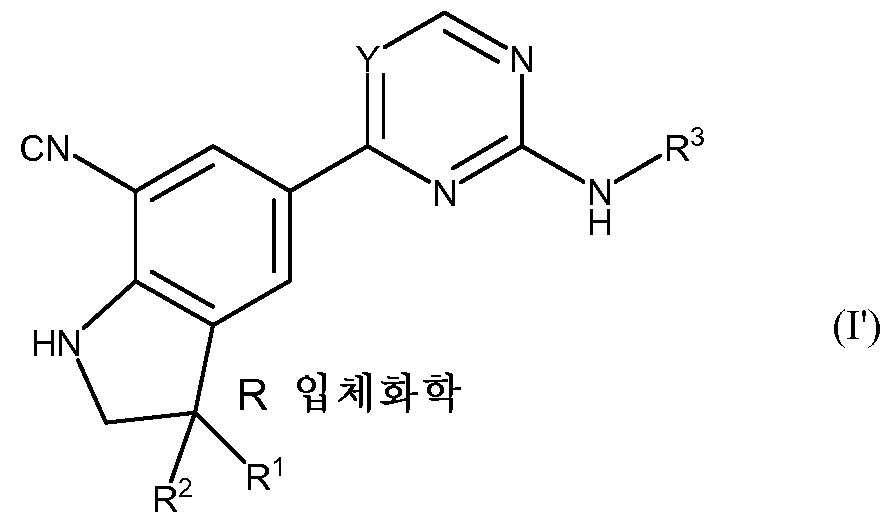
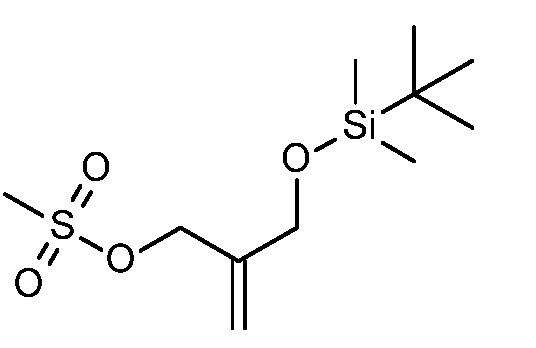
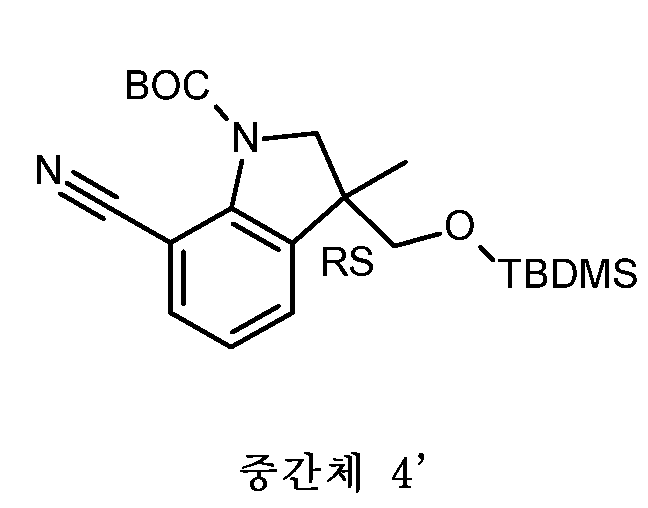
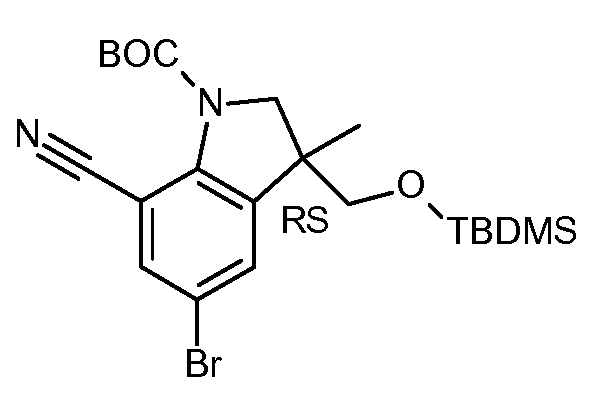
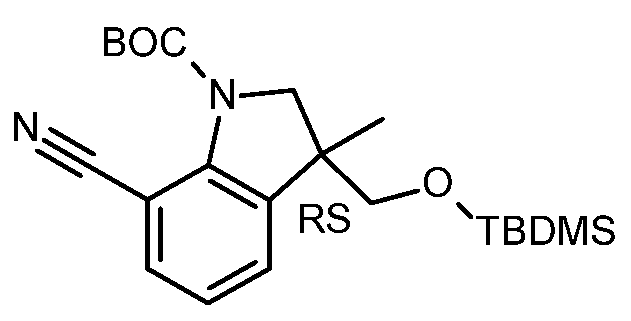
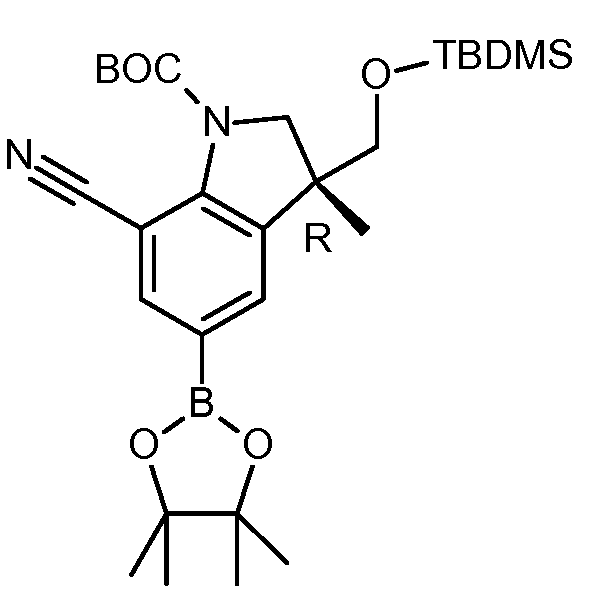
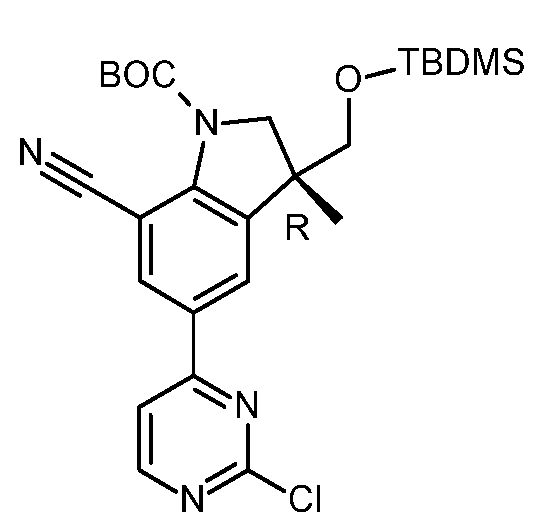
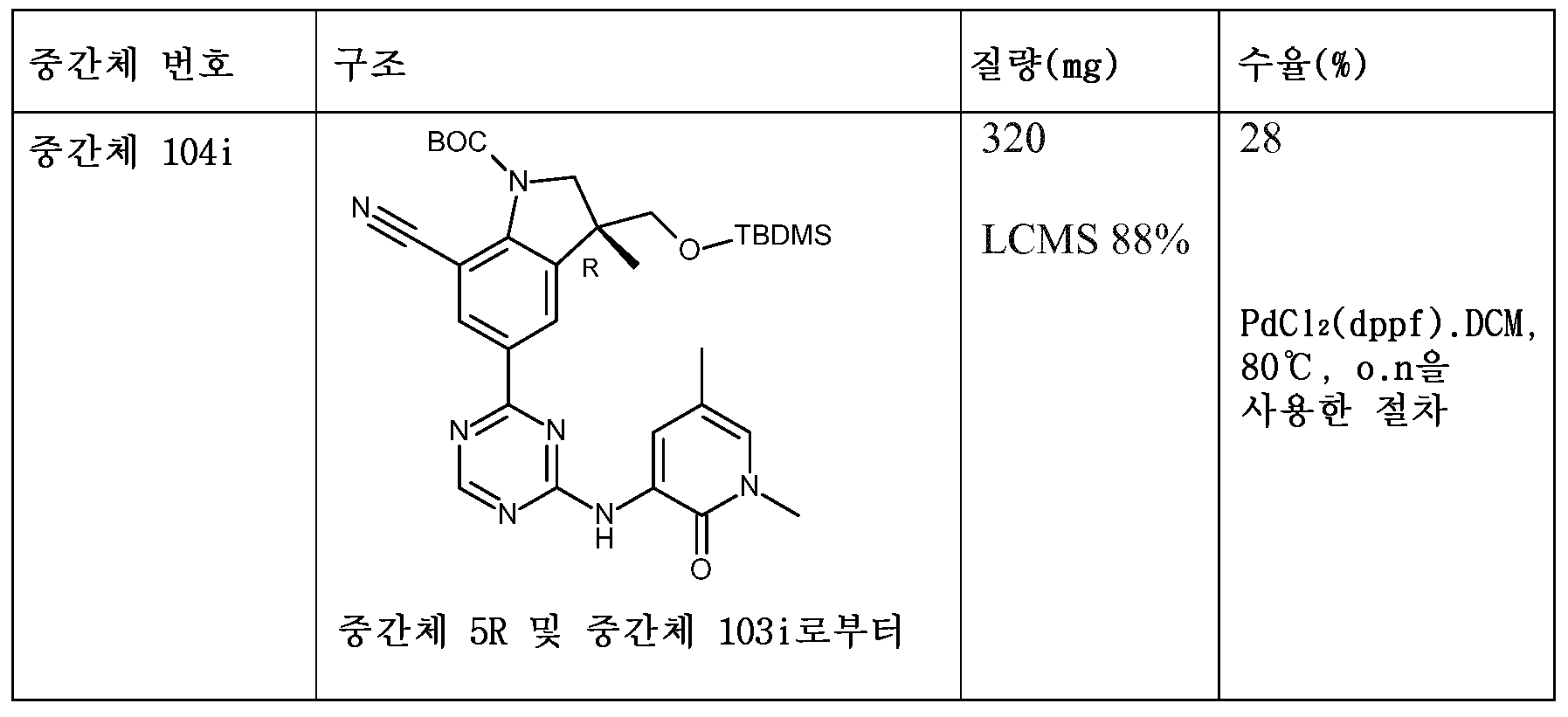
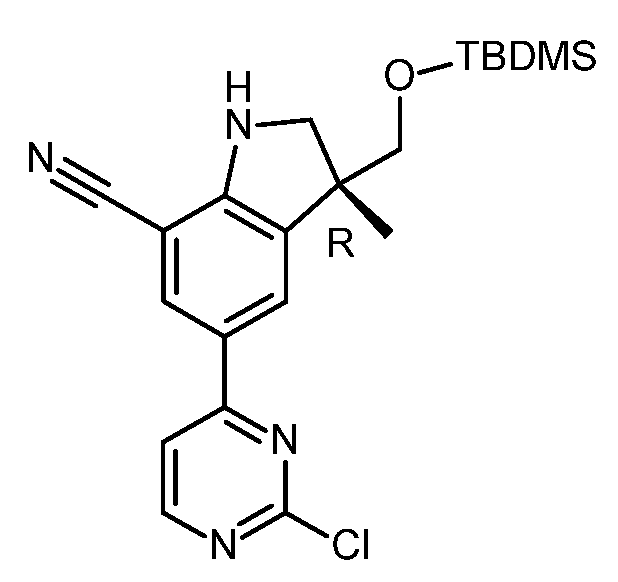
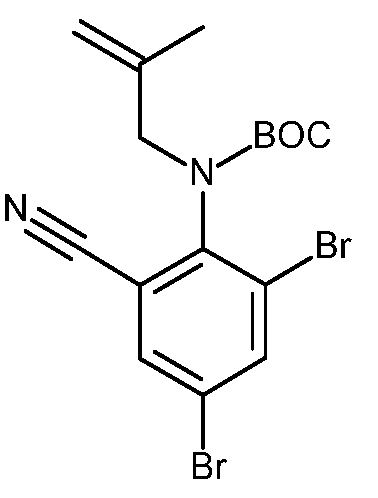
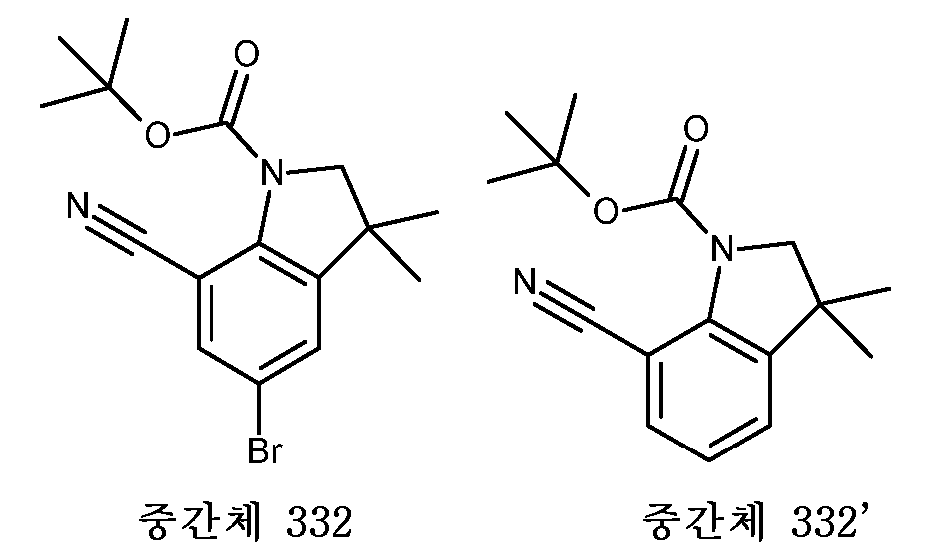
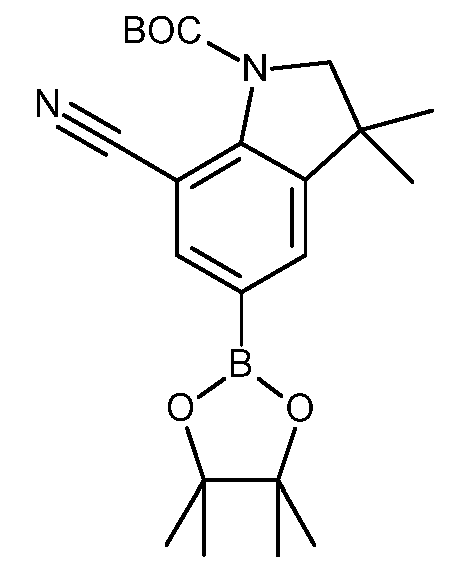
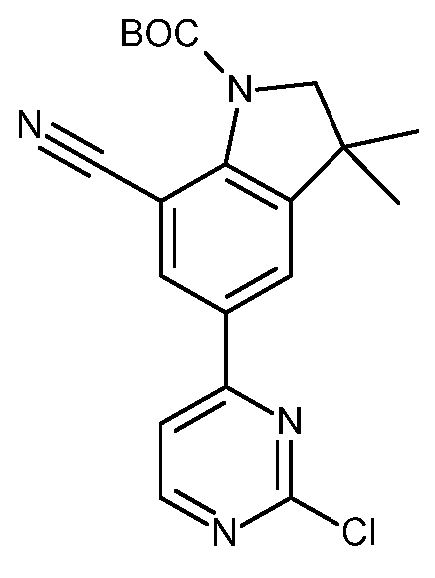
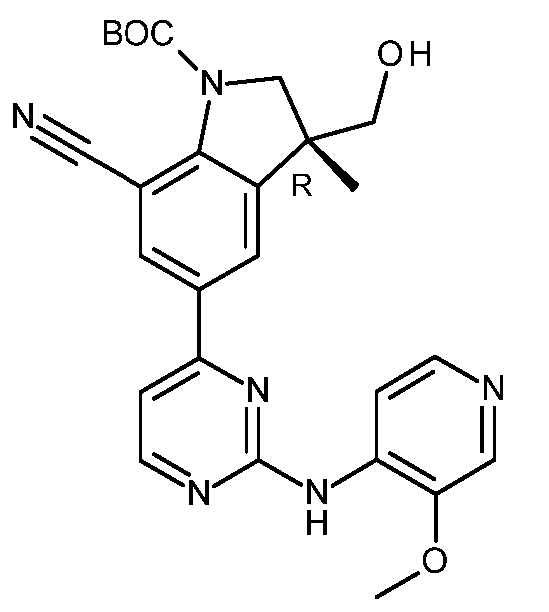
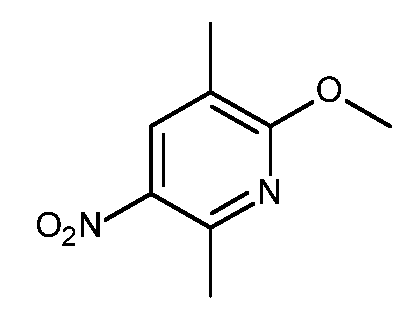
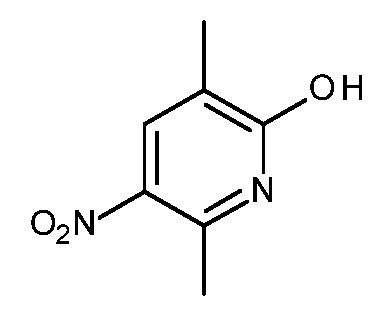
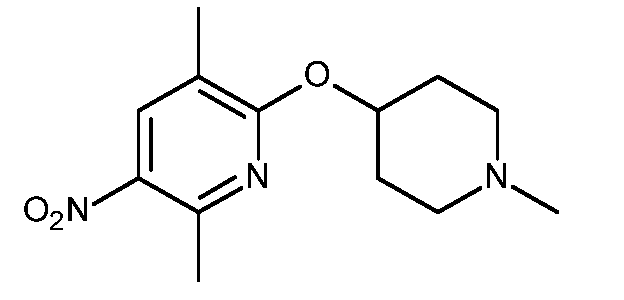
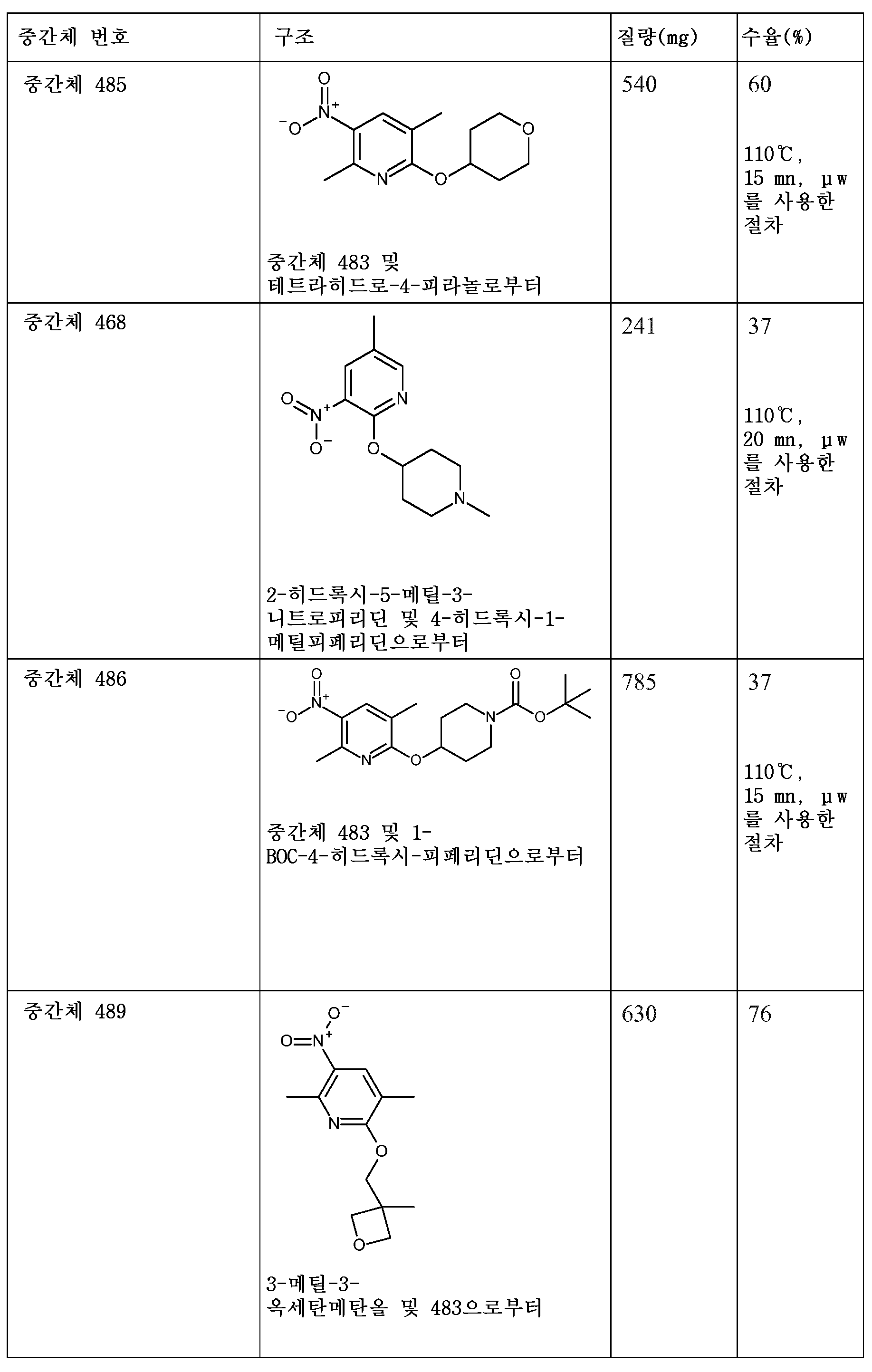
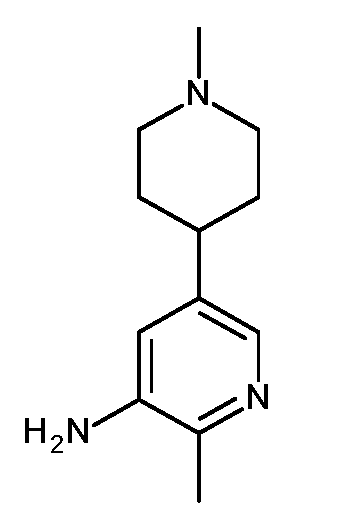
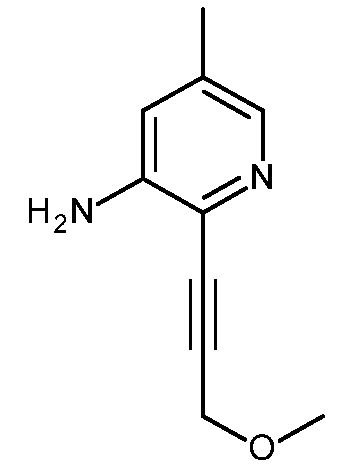
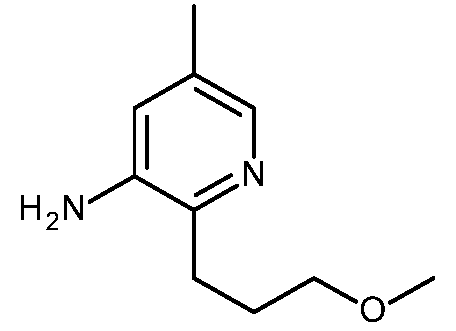
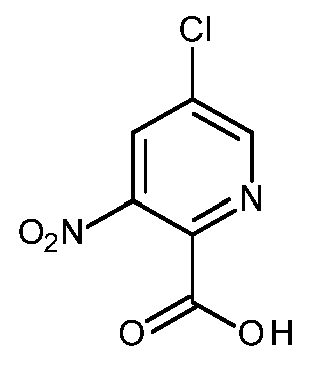
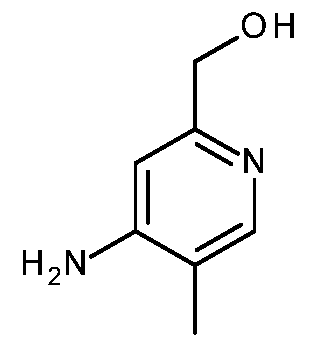
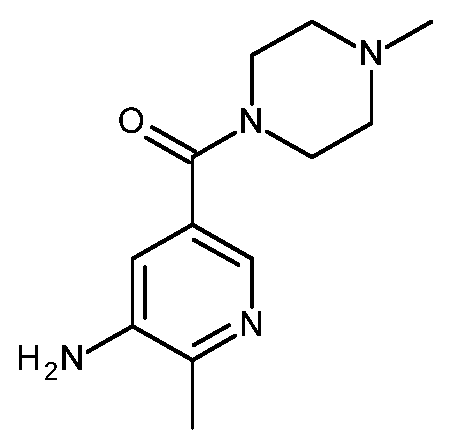
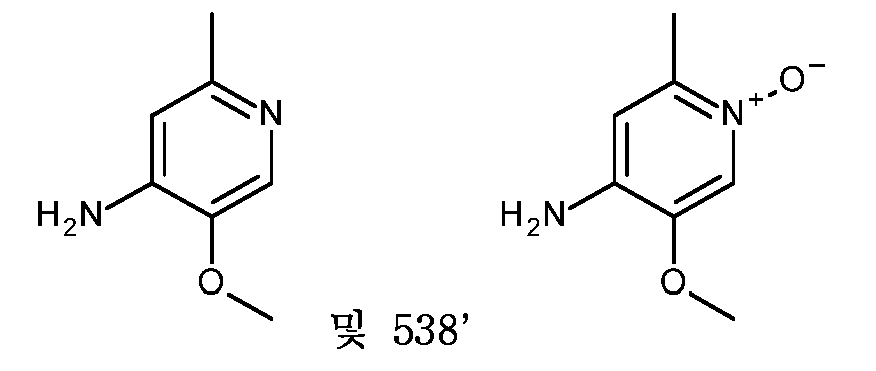
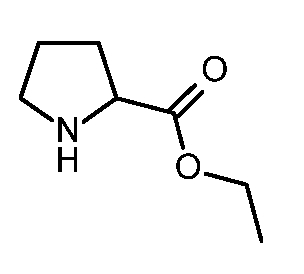
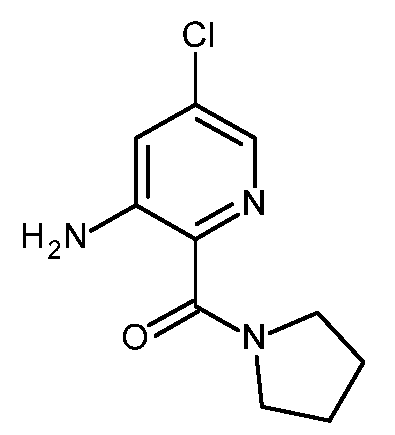
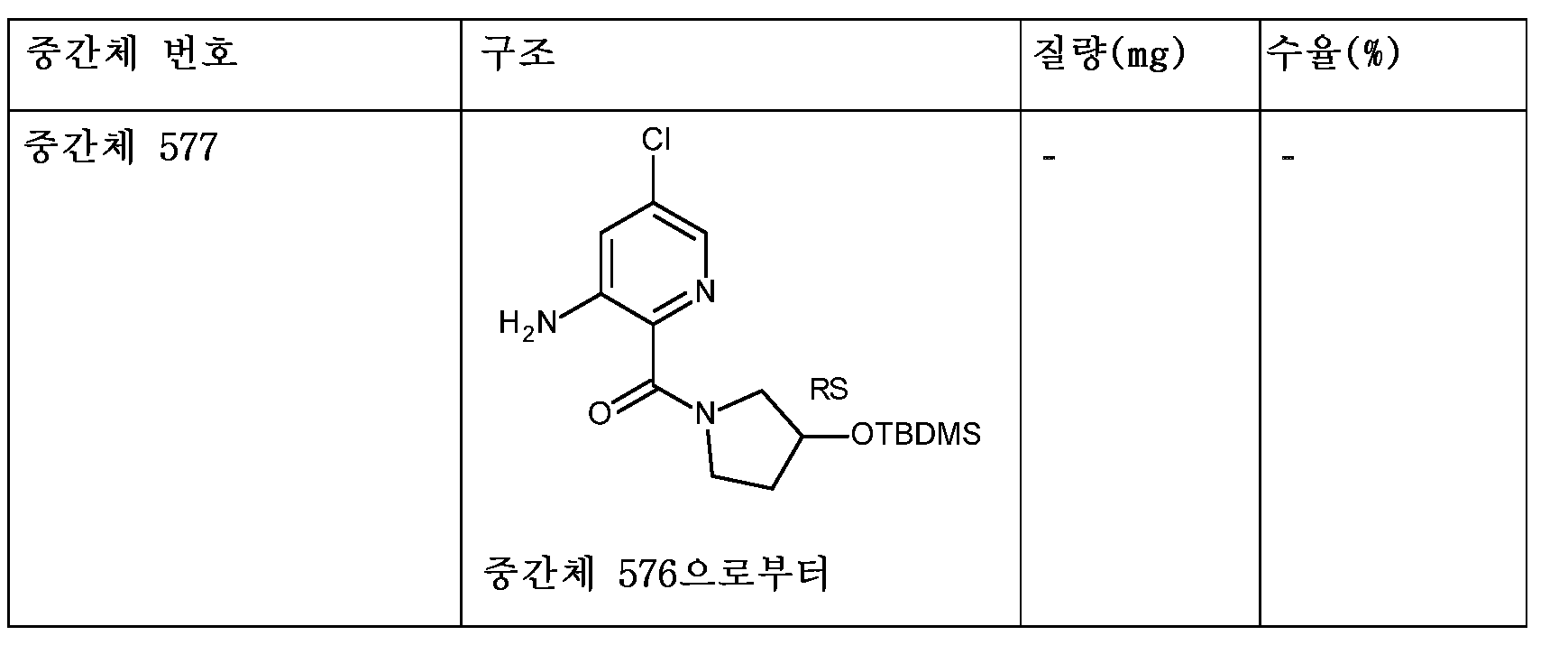
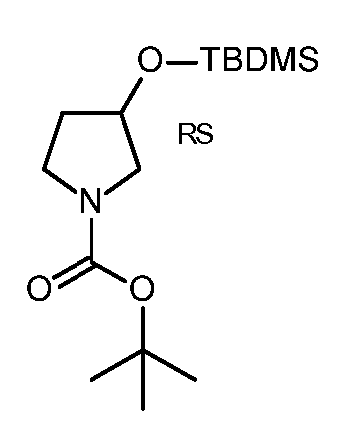
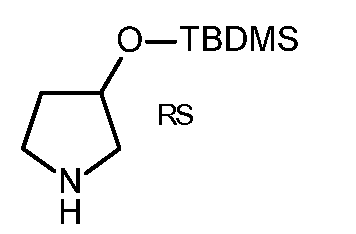
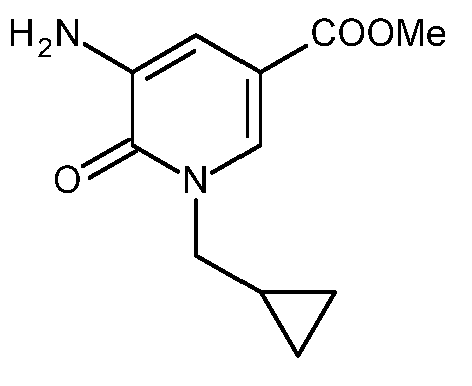
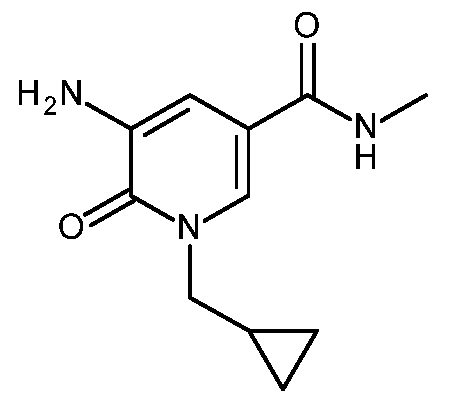
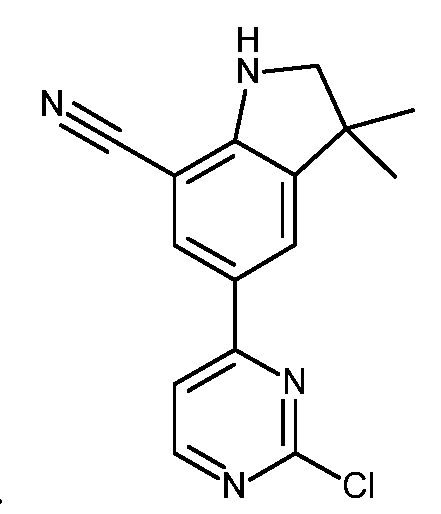
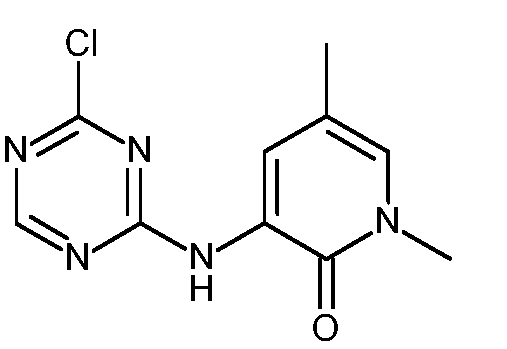
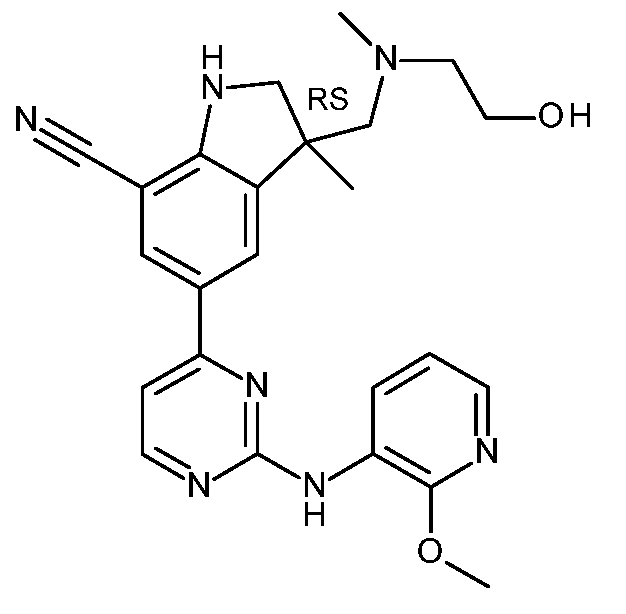
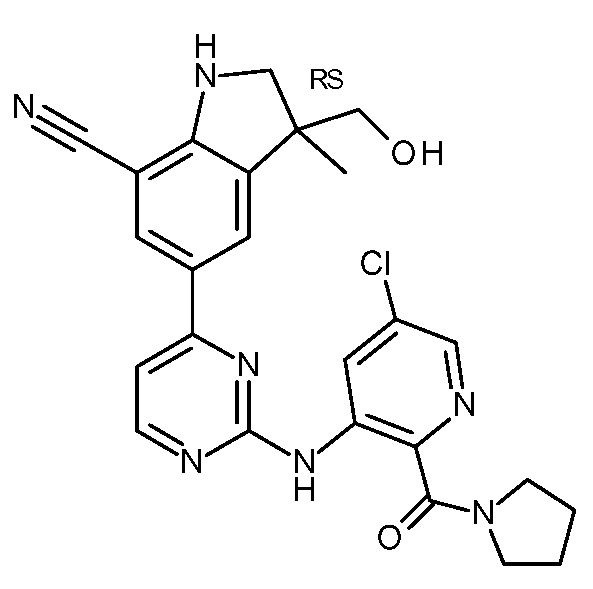
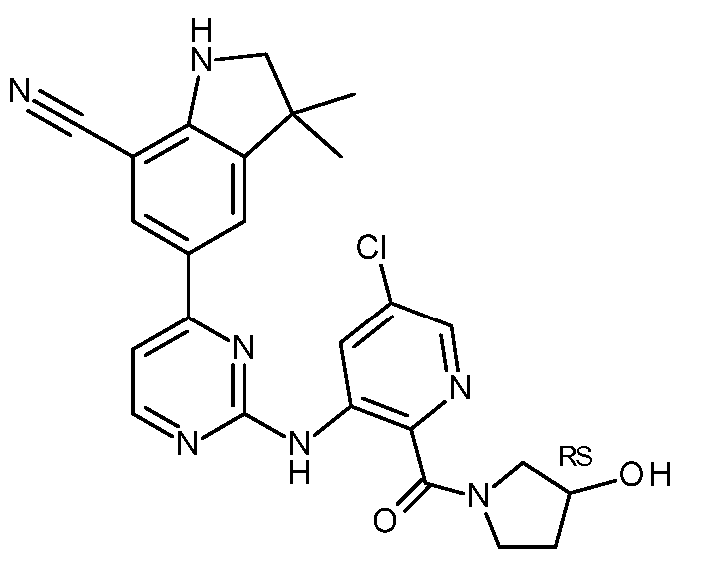
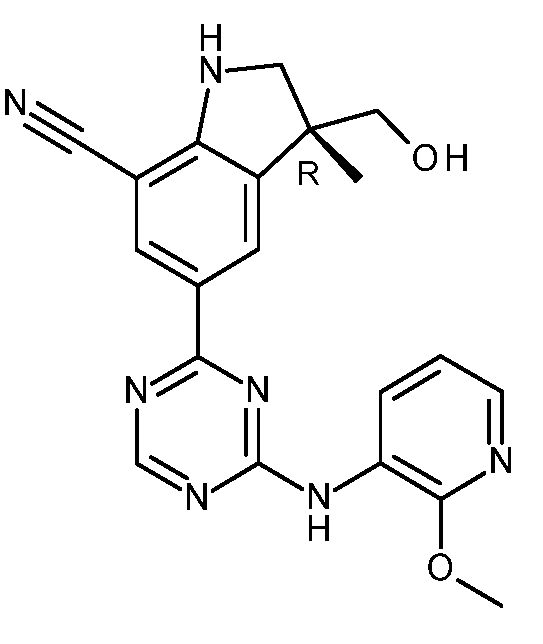
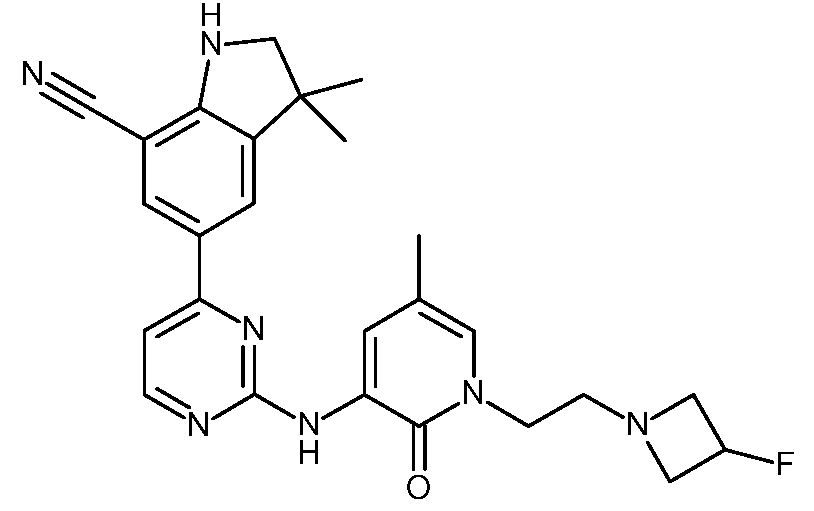
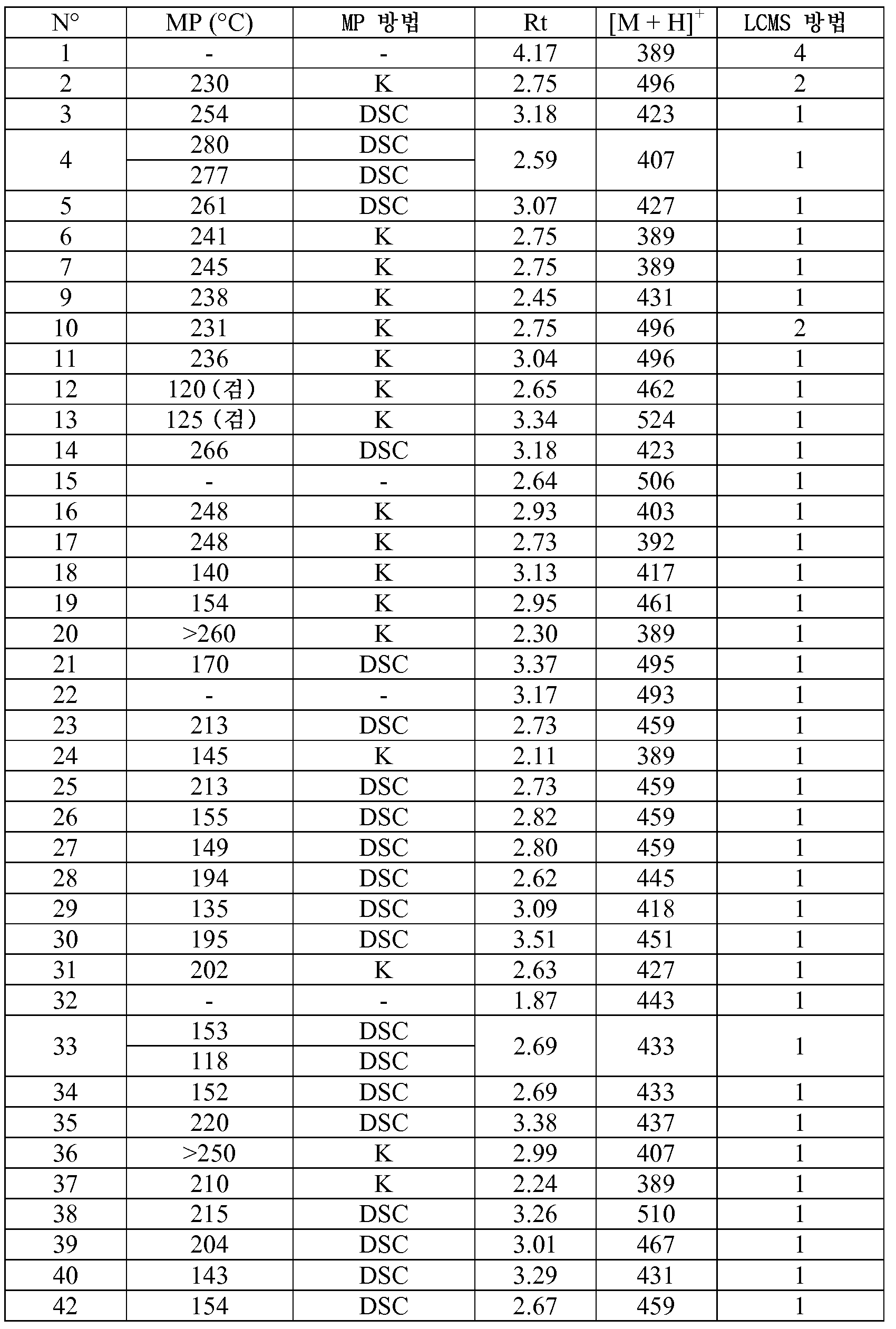
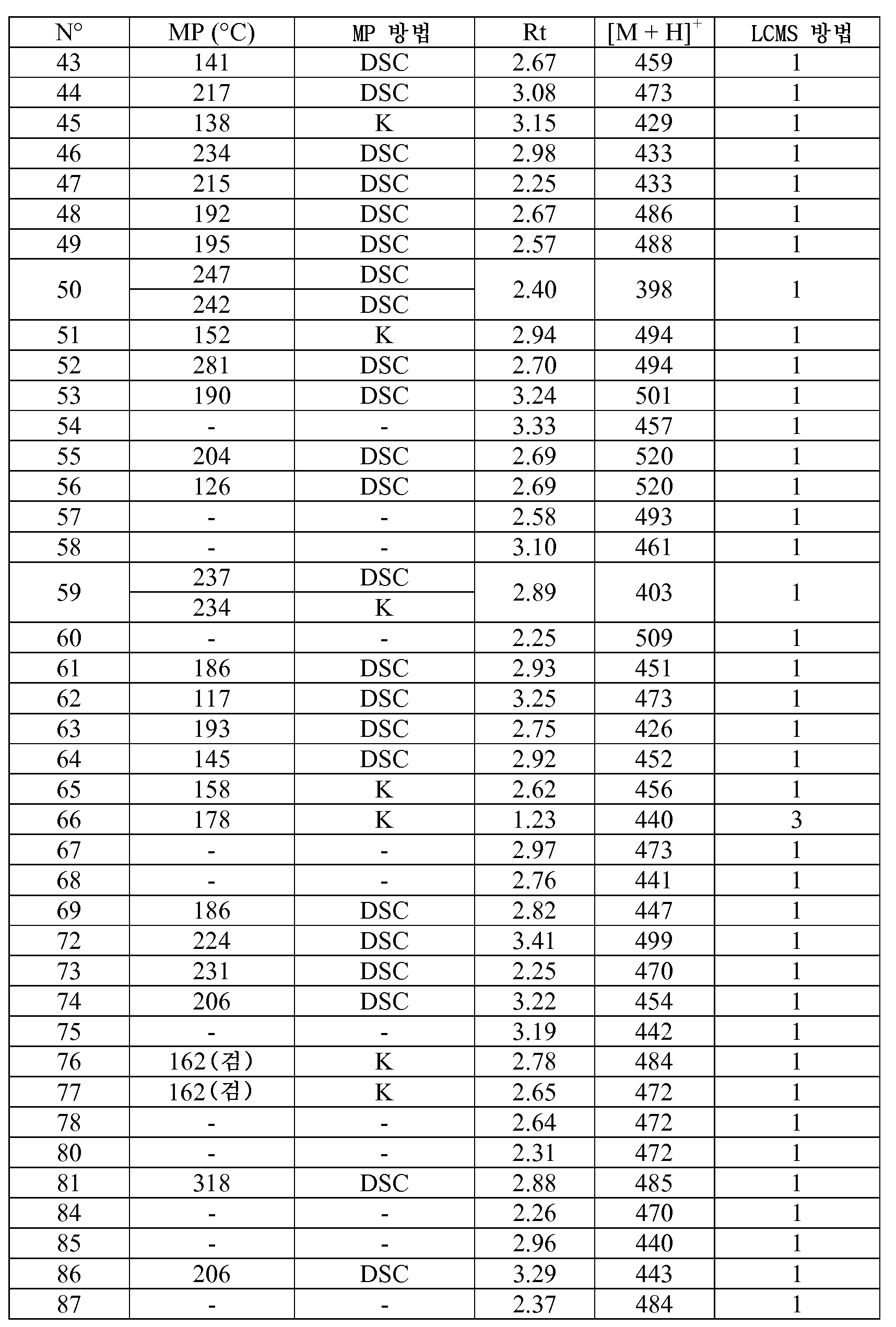
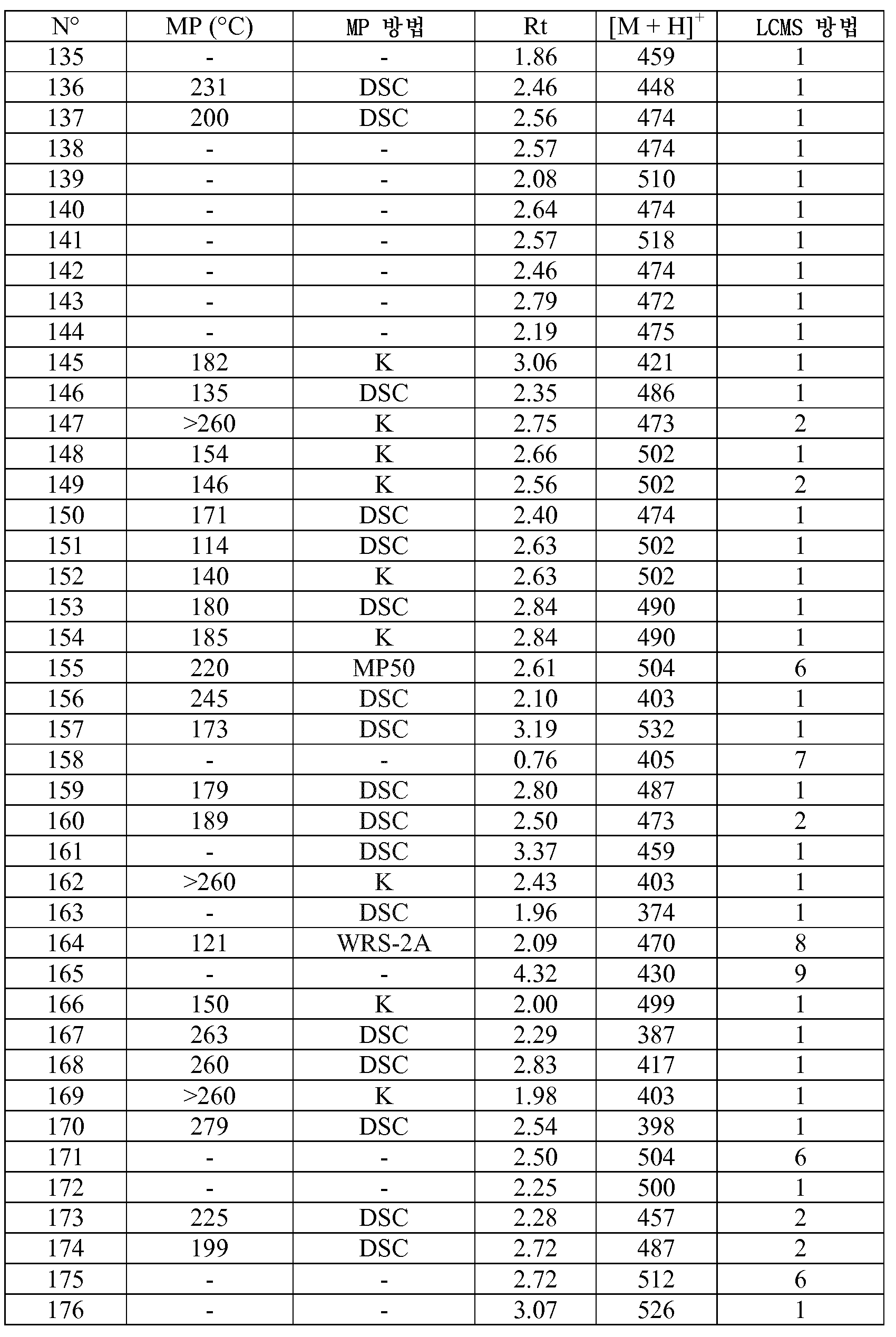KR20180098679A - Nik 억제제로서의 신규 6원 헤테로방향족 치환된 시아노인돌린 유도체 - Google Patents
Nik 억제제로서의 신규 6원 헤테로방향족 치환된 시아노인돌린 유도체 Download PDFInfo
- Publication number
- KR20180098679A KR20180098679A KR1020187024027A KR20187024027A KR20180098679A KR 20180098679 A KR20180098679 A KR 20180098679A KR 1020187024027 A KR1020187024027 A KR 1020187024027A KR 20187024027 A KR20187024027 A KR 20187024027A KR 20180098679 A KR20180098679 A KR 20180098679A
- Authority
- KR
- South Korea
- Prior art keywords
- alkyl
- substituted
- het
- cycloalkyl
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
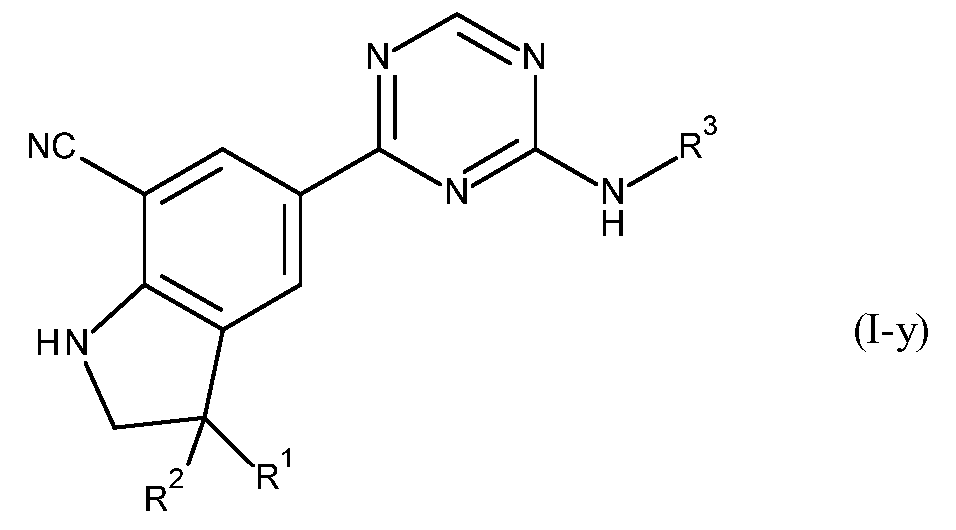
- 125000001072 heteroaryl group Chemical group 0.000 title claims description 46
- 239000003112 inhibitor Substances 0.000 title description 10
- JXAAHLCOCLPRHW-UHFFFAOYSA-N 2,3-dihydroindole-1-carbonitrile Chemical class C1=CC=C2N(C#N)CCC2=C1 JXAAHLCOCLPRHW-UHFFFAOYSA-N 0.000 title 1
- 150000001875 compounds Chemical class 0.000 claims abstract description 238
- 238000011282 treatment Methods 0.000 claims abstract description 54
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 31
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 30
- 201000011510 cancer Diseases 0.000 claims abstract description 28
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 22
- 201000010099 disease Diseases 0.000 claims abstract description 21
- 125000000217 alkyl group Chemical group 0.000 claims description 1754
- 125000001424 substituent group Chemical group 0.000 claims description 394
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 309
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims description 281
- -1 or -NH 2 Chemical group 0.000 claims description 279
- 229910052739 hydrogen Inorganic materials 0.000 claims description 256
- 239000001257 hydrogen Substances 0.000 claims description 255
- 125000005843 halogen group Chemical group 0.000 claims description 234
- 229910052717 sulfur Inorganic materials 0.000 claims description 166
- 229910052799 carbon Inorganic materials 0.000 claims description 137
- 150000003839 salts Chemical class 0.000 claims description 135
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 123
- 239000012453 solvate Substances 0.000 claims description 119
- 125000005842 heteroatom Chemical group 0.000 claims description 118
- 229910052760 oxygen Inorganic materials 0.000 claims description 110
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 82
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 72
- 125000004432 carbon atom Chemical group C* 0.000 claims description 69
- 229910052757 nitrogen Inorganic materials 0.000 claims description 65
- 125000003118 aryl group Chemical group 0.000 claims description 55
- 150000002431 hydrogen Chemical class 0.000 claims description 55
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 52
- 125000000623 heterocyclic group Chemical group 0.000 claims description 51
- 238000000034 method Methods 0.000 claims description 40
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 30
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 claims description 27
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 claims description 27
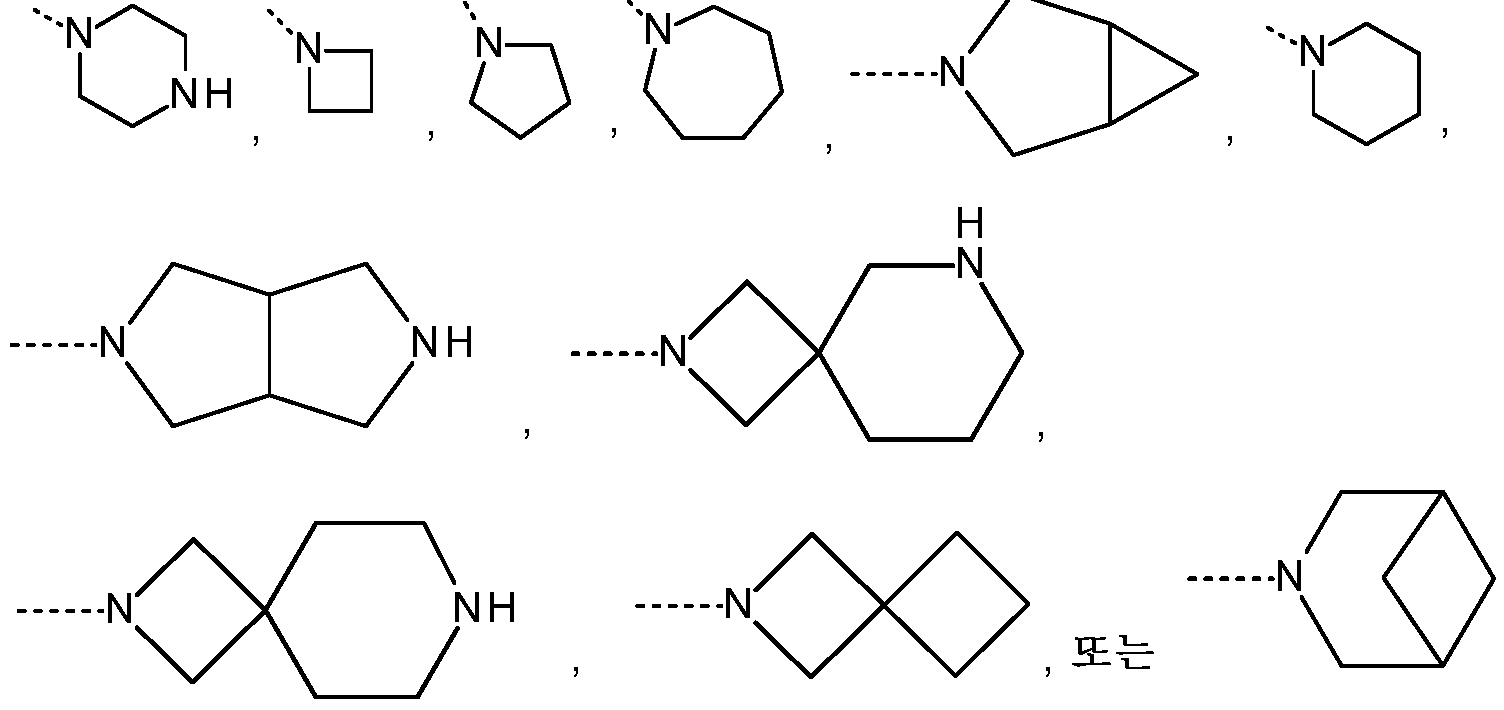
- 125000003003 spiro group Chemical group 0.000 claims description 25
- 239000003814 drug Substances 0.000 claims description 20
- 125000004429 atom Chemical group 0.000 claims description 17
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 17
- 125000006413 ring segment Chemical group 0.000 claims description 14
- 125000003342 alkenyl group Chemical group 0.000 claims description 10
- 241001465754 Metazoa Species 0.000 claims description 8
- 239000003937 drug carrier Substances 0.000 claims description 8
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims description 6
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 6
- 238000011321 prophylaxis Methods 0.000 claims description 6
- 125000000304 alkynyl group Chemical group 0.000 claims description 5
- 239000003085 diluting agent Substances 0.000 claims description 4
- 230000002062 proliferating effect Effects 0.000 claims description 4
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims 1
- 108040008091 NF-kappaB-inducing kinase activity proteins Proteins 0.000 abstract description 52
- 102000019148 NF-kappaB-inducing kinase activity proteins Human genes 0.000 abstract description 52
- 230000002265 prevention Effects 0.000 abstract description 14
- 206010012601 diabetes mellitus Diseases 0.000 abstract description 10
- 208000027866 inflammatory disease Diseases 0.000 abstract description 10
- 108091000080 Phosphotransferase Proteins 0.000 abstract description 9
- 102000020233 phosphotransferase Human genes 0.000 abstract description 9
- 208000023275 Autoimmune disease Diseases 0.000 abstract description 8
- 208000008589 Obesity Diseases 0.000 abstract description 8
- 208000030159 metabolic disease Diseases 0.000 abstract description 8
- 235000020824 obesity Nutrition 0.000 abstract description 8
- 241000124008 Mammalia Species 0.000 abstract description 7
- 101001005550 Homo sapiens Mitogen-activated protein kinase kinase kinase 14 Proteins 0.000 abstract description 3
- 102100025211 Mitogen-activated protein kinase kinase kinase 14 Human genes 0.000 abstract description 3
- 230000006806 disease prevention Effects 0.000 abstract description 2
- 206010057190 Respiratory tract infections Diseases 0.000 description 197
- 239000002904 solvent Substances 0.000 description 101
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 98
- 150000001721 carbon Chemical group 0.000 description 51
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 48
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 47
- 238000006243 chemical reaction Methods 0.000 description 46
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 42
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 42
- 239000002585 base Substances 0.000 description 42
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 38
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 36
- 239000000203 mixture Substances 0.000 description 35
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 33
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 32
- 125000006239 protecting group Chemical group 0.000 description 30
- 108010057466 NF-kappa B Proteins 0.000 description 28
- 102000003945 NF-kappa B Human genes 0.000 description 28
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 28
- 239000003054 catalyst Substances 0.000 description 26
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 25
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 23
- 239000002253 acid Substances 0.000 description 22
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 22
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 21
- 210000004027 cell Anatomy 0.000 description 20
- 239000000460 chlorine Substances 0.000 description 20
- 125000004744 butyloxycarbonyl group Chemical group 0.000 description 19
- 229910052801 chlorine Inorganic materials 0.000 description 19
- 229910052794 bromium Inorganic materials 0.000 description 18
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 17
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 17
- ZDZHCHYQNPQSGG-UHFFFAOYSA-N binaphthyl group Chemical group C1(=CC=CC2=CC=CC=C12)C1=CC=CC2=CC=CC=C12 ZDZHCHYQNPQSGG-UHFFFAOYSA-N 0.000 description 15
- 235000019439 ethyl acetate Nutrition 0.000 description 14
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 14
- 239000003446 ligand Substances 0.000 description 14
- 230000004913 activation Effects 0.000 description 13
- 238000010992 reflux Methods 0.000 description 13
- 230000001225 therapeutic effect Effects 0.000 description 13
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 12
- 230000037361 pathway Effects 0.000 description 12
- 238000002360 preparation method Methods 0.000 description 12
- 108010014632 NF-kappa B kinase Proteins 0.000 description 11
- 125000004122 cyclic group Chemical group 0.000 description 11
- 230000014509 gene expression Effects 0.000 description 11
- 239000000377 silicon dioxide Substances 0.000 description 11
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 description 10
- 206010025323 Lymphomas Diseases 0.000 description 10
- 125000002619 bicyclic group Chemical group 0.000 description 10
- 239000003153 chemical reaction reagent Substances 0.000 description 10
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 10
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 description 10
- 208000035475 disorder Diseases 0.000 description 10
- 229910052740 iodine Inorganic materials 0.000 description 10
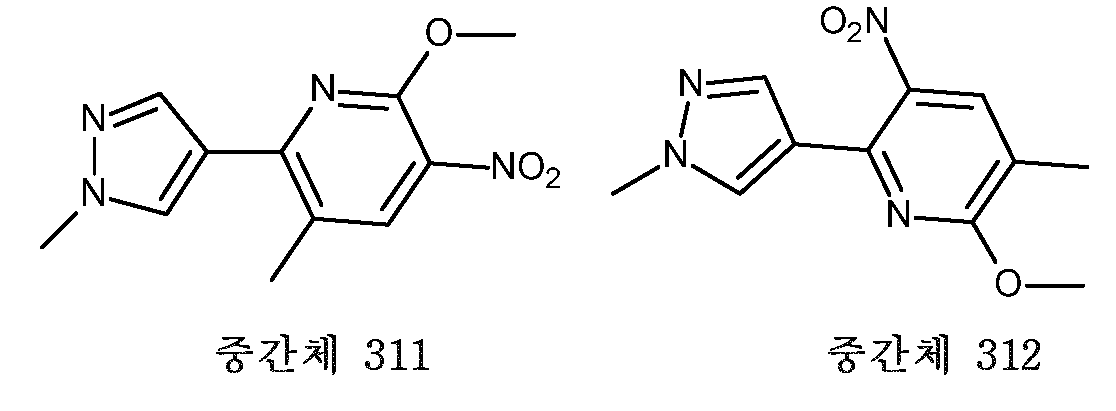
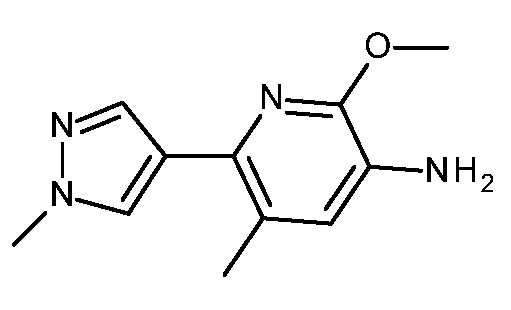
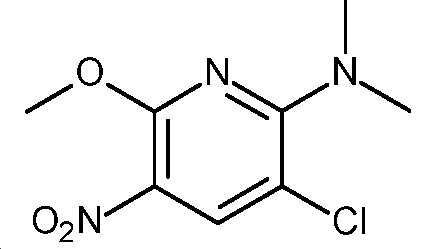
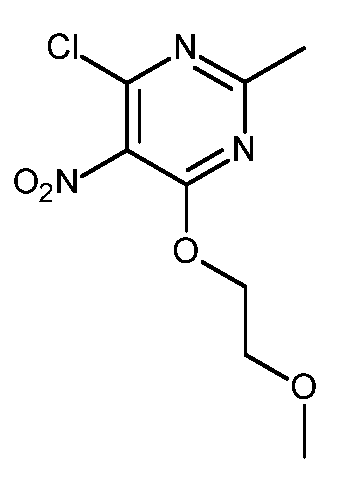
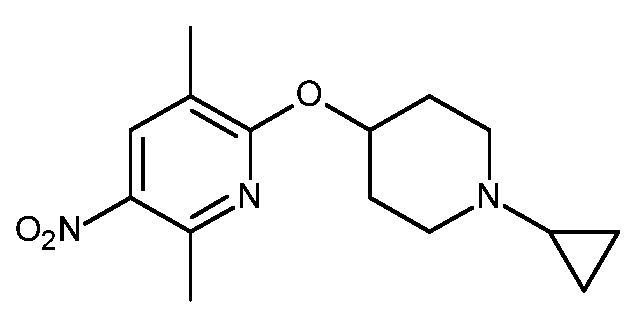
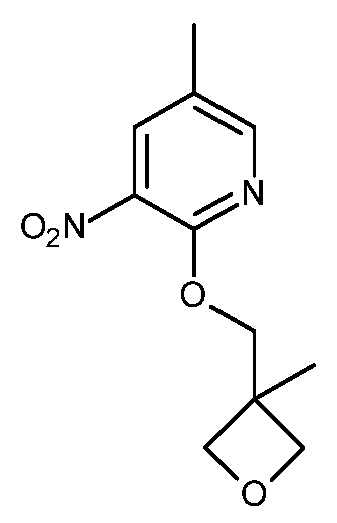
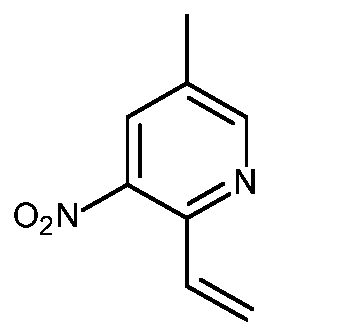
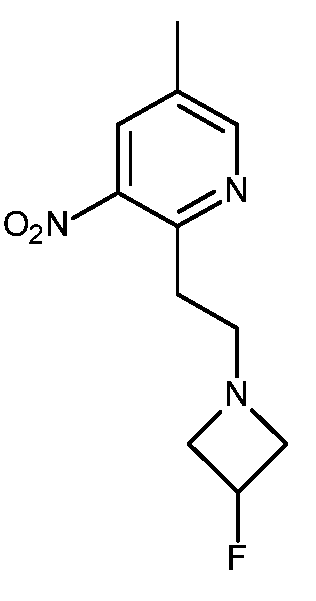
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 9
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 9
- 239000004480 active ingredient Substances 0.000 description 9
- 230000037396 body weight Effects 0.000 description 9
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 9
- 206010061218 Inflammation Diseases 0.000 description 8
- 241000699670 Mus sp. Species 0.000 description 8
- 206010035226 Plasma cell myeloma Diseases 0.000 description 8
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 8
- 239000003795 chemical substances by application Substances 0.000 description 8
- 230000004054 inflammatory process Effects 0.000 description 8
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 8
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 8
- 230000000259 anti-tumor effect Effects 0.000 description 7
- 230000006907 apoptotic process Effects 0.000 description 7
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 7
- 229910000024 caesium carbonate Inorganic materials 0.000 description 7
- 125000003386 piperidinyl group Chemical group 0.000 description 7
- 108090000623 proteins and genes Proteins 0.000 description 7
- 230000004044 response Effects 0.000 description 7
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 7
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 6
- 208000017604 Hodgkin disease Diseases 0.000 description 6
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 6
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 6
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 6
- 230000002757 inflammatory effect Effects 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 6
- 230000008569 process Effects 0.000 description 6
- 150000003254 radicals Chemical class 0.000 description 6
- 230000019491 signal transduction Effects 0.000 description 6
- FVAUCKIRQBBSSJ-UHFFFAOYSA-M sodium iodide Chemical compound [Na+].[I-] FVAUCKIRQBBSSJ-UHFFFAOYSA-M 0.000 description 6
- 229940124597 therapeutic agent Drugs 0.000 description 6
- 210000001519 tissue Anatomy 0.000 description 6
- 125000006590 (C2-C6) alkenylene group Chemical group 0.000 description 5
- 239000007821 HATU Substances 0.000 description 5
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 description 5
- 208000034578 Multiple myelomas Diseases 0.000 description 5
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 5
- 108091027967 Small hairpin RNA Proteins 0.000 description 5
- 102000004399 TNF receptor-associated factor 3 Human genes 0.000 description 5
- 108090000922 TNF receptor-associated factor 3 Proteins 0.000 description 5
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 5
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 5
- 102100036922 Tumor necrosis factor ligand superfamily member 13B Human genes 0.000 description 5
- 206010003246 arthritis Diseases 0.000 description 5
- 210000004369 blood Anatomy 0.000 description 5
- 239000008280 blood Substances 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 238000009472 formulation Methods 0.000 description 5
- 229910052736 halogen Inorganic materials 0.000 description 5
- 150000002367 halogens Chemical class 0.000 description 5
- 230000002489 hematologic effect Effects 0.000 description 5
- 239000004615 ingredient Substances 0.000 description 5
- 239000000543 intermediate Substances 0.000 description 5
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 5
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 5
- 201000002528 pancreatic cancer Diseases 0.000 description 5
- 208000008443 pancreatic carcinoma Diseases 0.000 description 5
- 230000035755 proliferation Effects 0.000 description 5
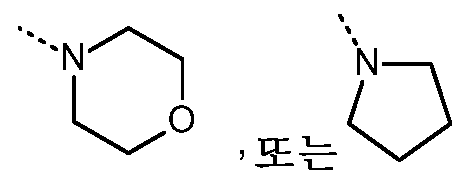
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 5
- 229920006395 saturated elastomer Polymers 0.000 description 5
- 239000007858 starting material Substances 0.000 description 5
- 239000003826 tablet Substances 0.000 description 5
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 description 4
- LBLYYCQCTBFVLH-UHFFFAOYSA-M 2-methylbenzenesulfonate Chemical compound CC1=CC=CC=C1S([O-])(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-M 0.000 description 4
- BKOOMYPCSUNDGP-UHFFFAOYSA-N 2-methylbut-2-ene Chemical compound CC=C(C)C BKOOMYPCSUNDGP-UHFFFAOYSA-N 0.000 description 4
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 4
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 4
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 4
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 4
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 4
- 239000004280 Sodium formate Substances 0.000 description 4
- 210000001744 T-lymphocyte Anatomy 0.000 description 4
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 4
- 239000000654 additive Substances 0.000 description 4
- 125000002393 azetidinyl group Chemical group 0.000 description 4
- 210000003719 b-lymphocyte Anatomy 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 4
- 239000002775 capsule Substances 0.000 description 4
- 239000003638 chemical reducing agent Substances 0.000 description 4
- 230000008878 coupling Effects 0.000 description 4
- 238000010168 coupling process Methods 0.000 description 4
- 238000005859 coupling reaction Methods 0.000 description 4
- 230000002950 deficient Effects 0.000 description 4
- 238000001727 in vivo Methods 0.000 description 4
- 208000032839 leukemia Diseases 0.000 description 4
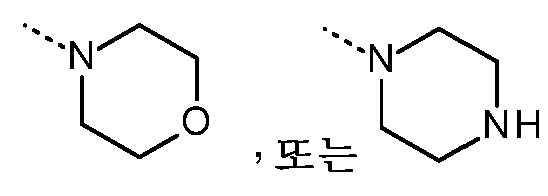
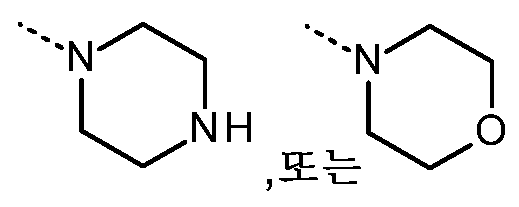
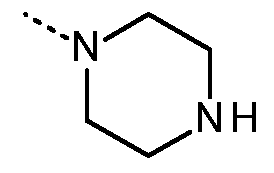
- 125000002757 morpholinyl group Chemical group 0.000 description 4
- 230000035772 mutation Effects 0.000 description 4
- 125000003566 oxetanyl group Chemical group 0.000 description 4
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 4
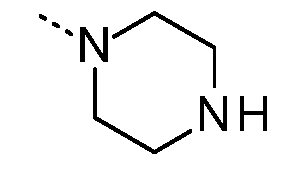
- 125000004193 piperazinyl group Chemical group 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 235000011056 potassium acetate Nutrition 0.000 description 4
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 125000000714 pyrimidinyl group Chemical group 0.000 description 4
- 239000011541 reaction mixture Substances 0.000 description 4
- 206010039073 rheumatoid arthritis Diseases 0.000 description 4
- 230000011664 signaling Effects 0.000 description 4
- 229910000029 sodium carbonate Inorganic materials 0.000 description 4
- HLBBKKJFGFRGMU-UHFFFAOYSA-M sodium formate Chemical compound [Na+].[O-]C=O HLBBKKJFGFRGMU-UHFFFAOYSA-M 0.000 description 4
- 235000019254 sodium formate Nutrition 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 238000006467 substitution reaction Methods 0.000 description 4
- KDYFGRWQOYBRFD-UHFFFAOYSA-N succinic acid Chemical compound OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 4
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 4
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 4
- YMBCJWGVCUEGHA-UHFFFAOYSA-M tetraethylammonium chloride Chemical compound [Cl-].CC[N+](CC)(CC)CC YMBCJWGVCUEGHA-UHFFFAOYSA-M 0.000 description 4
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 4
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 4
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 3
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 3
- 208000009746 Adult T-Cell Leukemia-Lymphoma Diseases 0.000 description 3
- 208000016683 Adult T-cell leukemia/lymphoma Diseases 0.000 description 3
- 108010028006 B-Cell Activating Factor Proteins 0.000 description 3
- 206010006187 Breast cancer Diseases 0.000 description 3
- 208000026310 Breast neoplasm Diseases 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 3
- 206010009944 Colon cancer Diseases 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- 229930012538 Paclitaxel Natural products 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 208000000389 T-cell leukemia Diseases 0.000 description 3
- 208000028530 T-cell lymphoblastic leukemia/lymphoma Diseases 0.000 description 3
- KPCZJLGGXRGYIE-UHFFFAOYSA-N [C]1=CC=CN=C1 Chemical group [C]1=CC=CN=C1 KPCZJLGGXRGYIE-UHFFFAOYSA-N 0.000 description 3
- PDKXJKWLFFZPPF-UHFFFAOYSA-N [dimethylamino-(3-oxidotriazolo[4,5-b]pyridin-3-ium-1-yl)methylidene]-dimethylazanium Chemical compound C1=CC=C2N(C(N(C)C)=[N+](C)C)N=[N+]([O-])C2=N1 PDKXJKWLFFZPPF-UHFFFAOYSA-N 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 239000002671 adjuvant Substances 0.000 description 3
- 201000006966 adult T-cell leukemia Diseases 0.000 description 3
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 3
- 239000002246 antineoplastic agent Substances 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 230000001684 chronic effect Effects 0.000 description 3
- 206010009887 colitis Diseases 0.000 description 3
- 230000006552 constitutive activation Effects 0.000 description 3
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 3
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical compound CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- DWYMPOCYEZONEA-UHFFFAOYSA-L fluoridophosphate Chemical compound [O-]P([O-])(F)=O DWYMPOCYEZONEA-UHFFFAOYSA-L 0.000 description 3
- 239000012458 free base Substances 0.000 description 3
- 125000000524 functional group Chemical group 0.000 description 3
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 3
- 229960005277 gemcitabine Drugs 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 238000010438 heat treatment Methods 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- 201000001441 melanoma Diseases 0.000 description 3
- 201000000050 myeloid neoplasm Diseases 0.000 description 3
- 210000002997 osteoclast Anatomy 0.000 description 3
- 229940127084 other anti-cancer agent Drugs 0.000 description 3
- 229960001592 paclitaxel Drugs 0.000 description 3
- 229910052763 palladium Inorganic materials 0.000 description 3
- 239000000825 pharmaceutical preparation Substances 0.000 description 3
- 125000004940 pyridazin-4-yl group Chemical group N1=NC=C(C=C1)* 0.000 description 3
- 125000002098 pyridazinyl group Chemical group 0.000 description 3
- 125000004076 pyridyl group Chemical group 0.000 description 3
- 125000004527 pyrimidin-4-yl group Chemical group N1=CN=C(C=C1)* 0.000 description 3
- 125000004528 pyrimidin-5-yl group Chemical group N1=CN=CC(=C1)* 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 229930195734 saturated hydrocarbon Natural products 0.000 description 3
- 210000003491 skin Anatomy 0.000 description 3
- 239000001632 sodium acetate Substances 0.000 description 3
- 235000017281 sodium acetate Nutrition 0.000 description 3
- 239000012321 sodium triacetoxyborohydride Substances 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 210000001685 thyroid gland Anatomy 0.000 description 3
- 229960000303 topotecan Drugs 0.000 description 3
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 3
- 229960001727 tretinoin Drugs 0.000 description 3
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 3
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 3
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 2
- IAKHMKGGTNLKSZ-INIZCTEOSA-N (S)-colchicine Chemical compound C1([C@@H](NC(C)=O)CC2)=CC(=O)C(OC)=CC=C1C1=C2C=C(OC)C(OC)=C1OC IAKHMKGGTNLKSZ-INIZCTEOSA-N 0.000 description 2
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 2
- TXNLQUKVUJITMX-UHFFFAOYSA-N 4-tert-butyl-2-(4-tert-butylpyridin-2-yl)pyridine Chemical group CC(C)(C)C1=CC=NC(C=2N=CC=C(C=2)C(C)(C)C)=C1 TXNLQUKVUJITMX-UHFFFAOYSA-N 0.000 description 2
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- 208000036170 B-Cell Marginal Zone Lymphoma Diseases 0.000 description 2
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 2
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 2
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 2
- 201000009030 Carcinoma Diseases 0.000 description 2
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 2
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- GHVNFZFCNZKVNT-UHFFFAOYSA-N Decanoic acid Natural products CCCCCCCCCC(O)=O GHVNFZFCNZKVNT-UHFFFAOYSA-N 0.000 description 2
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- ZQZFYGIXNQKOAV-OCEACIFDSA-N Droloxifene Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=C(O)C=CC=1)\C1=CC=C(OCCN(C)C)C=C1 ZQZFYGIXNQKOAV-OCEACIFDSA-N 0.000 description 2
- 201000008808 Fibrosarcoma Diseases 0.000 description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 2
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 230000005526 G1 to G0 transition Effects 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 208000009329 Graft vs Host Disease Diseases 0.000 description 2
- 102000003964 Histone deacetylase Human genes 0.000 description 2
- 108090000353 Histone deacetylase Proteins 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 2
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 2
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 2
- 206010022489 Insulin Resistance Diseases 0.000 description 2
- 108010078049 Interferon alpha-2 Proteins 0.000 description 2
- 108010055717 JNK Mitogen-Activated Protein Kinases Proteins 0.000 description 2
- 208000019693 Lung disease Diseases 0.000 description 2
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 2
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 2
- 201000003791 MALT lymphoma Diseases 0.000 description 2
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 2
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 2
- 206010033128 Ovarian cancer Diseases 0.000 description 2
- 206010061535 Ovarian neoplasm Diseases 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- 108020004459 Small interfering RNA Proteins 0.000 description 2
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 102000004393 TNF receptor-associated factor 2 Human genes 0.000 description 2
- 108090000925 TNF receptor-associated factor 2 Proteins 0.000 description 2
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 2
- 235000009754 Vitis X bourquina Nutrition 0.000 description 2
- 235000012333 Vitis X labruscana Nutrition 0.000 description 2
- 240000006365 Vitis vinifera Species 0.000 description 2
- 235000014787 Vitis vinifera Nutrition 0.000 description 2
- JAZCEXBNIYKZDI-UHFFFAOYSA-N [Ir+] Chemical compound [Ir+] JAZCEXBNIYKZDI-UHFFFAOYSA-N 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- 239000003513 alkali Substances 0.000 description 2
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 2
- 229930013930 alkaloid Natural products 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 229960002932 anastrozole Drugs 0.000 description 2
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 2
- 229940045799 anthracyclines and related substance Drugs 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 238000003491 array Methods 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 230000001363 autoimmune Effects 0.000 description 2
- 229960002756 azacitidine Drugs 0.000 description 2
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 210000000988 bone and bone Anatomy 0.000 description 2
- 210000001185 bone marrow Anatomy 0.000 description 2
- 229960001467 bortezomib Drugs 0.000 description 2
- 229960004117 capecitabine Drugs 0.000 description 2
- 229960004562 carboplatin Drugs 0.000 description 2
- 229960005243 carmustine Drugs 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 230000021164 cell adhesion Effects 0.000 description 2
- 230000030833 cell death Effects 0.000 description 2
- 230000010261 cell growth Effects 0.000 description 2
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 2
- 229960004630 chlorambucil Drugs 0.000 description 2
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 2
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 2
- 229960004316 cisplatin Drugs 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 208000029742 colonic neoplasm Diseases 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 229960004397 cyclophosphamide Drugs 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 229960000975 daunorubicin Drugs 0.000 description 2
- VRLDVERQJMEPIF-UHFFFAOYSA-N dbdmh Chemical compound CC1(C)N(Br)C(=O)N(Br)C1=O VRLDVERQJMEPIF-UHFFFAOYSA-N 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 230000002939 deleterious effect Effects 0.000 description 2
- JQVDAXLFBXTEQA-UHFFFAOYSA-N dibutylamine Chemical compound CCCCNCCCC JQVDAXLFBXTEQA-UHFFFAOYSA-N 0.000 description 2
- CSJLBAMHHLJAAS-UHFFFAOYSA-N diethylaminosulfur trifluoride Chemical compound CCN(CC)S(F)(F)F CSJLBAMHHLJAAS-UHFFFAOYSA-N 0.000 description 2
- 239000012153 distilled water Substances 0.000 description 2
- 229960003668 docetaxel Drugs 0.000 description 2
- 229950004203 droloxifene Drugs 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 230000004064 dysfunction Effects 0.000 description 2
- 229960001904 epirubicin Drugs 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000003889 eye drop Substances 0.000 description 2
- 229940012356 eye drops Drugs 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 239000011737 fluorine Substances 0.000 description 2
- 125000001153 fluoro group Chemical group F* 0.000 description 2
- 229960002949 fluorouracil Drugs 0.000 description 2
- 230000003325 follicular Effects 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- QBKSWRVVCFFDOT-UHFFFAOYSA-N gossypol Chemical compound CC(C)C1=C(O)C(O)=C(C=O)C2=C(O)C(C=3C(O)=C4C(C=O)=C(O)C(O)=C(C4=CC=3C)C(C)C)=C(C)C=C21 QBKSWRVVCFFDOT-UHFFFAOYSA-N 0.000 description 2
- 208000024908 graft versus host disease Diseases 0.000 description 2
- 201000005787 hematologic cancer Diseases 0.000 description 2
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 2
- 150000002430 hydrocarbons Chemical group 0.000 description 2
- 229960000908 idarubicin Drugs 0.000 description 2
- 229910052738 indium Inorganic materials 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 206010022000 influenza Diseases 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 229960004768 irinotecan Drugs 0.000 description 2
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 2
- 230000001788 irregular Effects 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 2
- 230000000155 isotopic effect Effects 0.000 description 2
- 229940043355 kinase inhibitor Drugs 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 238000004811 liquid chromatography Methods 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 201000005202 lung cancer Diseases 0.000 description 2
- 208000020816 lung neoplasm Diseases 0.000 description 2
- 210000001165 lymph node Anatomy 0.000 description 2
- 210000003563 lymphoid tissue Anatomy 0.000 description 2
- 201000010893 malignant breast melanoma Diseases 0.000 description 2
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical class ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 2
- 229960004961 mechlorethamine Drugs 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 229910000403 monosodium phosphate Inorganic materials 0.000 description 2
- 235000019799 monosodium phosphate Nutrition 0.000 description 2
- 239000007922 nasal spray Substances 0.000 description 2
- 229940097496 nasal spray Drugs 0.000 description 2
- OSTGTTZJOCZWJG-UHFFFAOYSA-N nitrosourea Chemical compound NC(=O)N=NO OSTGTTZJOCZWJG-UHFFFAOYSA-N 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 150000003833 nucleoside derivatives Chemical class 0.000 description 2
- 150000007530 organic bases Chemical class 0.000 description 2
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 230000008506 pathogenesis Effects 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 239000008177 pharmaceutical agent Substances 0.000 description 2
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 229910000027 potassium carbonate Inorganic materials 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 229940002612 prodrug Drugs 0.000 description 2
- 239000000651 prodrug Substances 0.000 description 2
- WGYKZJWCGVVSQN-UHFFFAOYSA-N propylamine Chemical compound CCCN WGYKZJWCGVVSQN-UHFFFAOYSA-N 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 230000017854 proteolysis Effects 0.000 description 2
- 125000004307 pyrazin-2-yl group Chemical group [H]C1=C([H])N=C(*)C([H])=N1 0.000 description 2
- 125000003373 pyrazinyl group Chemical group 0.000 description 2
- 229960004622 raloxifene Drugs 0.000 description 2
- GZUITABIAKMVPG-UHFFFAOYSA-N raloxifene Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 GZUITABIAKMVPG-UHFFFAOYSA-N 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 229930002330 retinoic acid Natural products 0.000 description 2
- OHRURASPPZQGQM-GCCNXGTGSA-N romidepsin Chemical compound O1C(=O)[C@H](C(C)C)NC(=O)C(=C/C)/NC(=O)[C@H]2CSSCC\C=C\[C@@H]1CC(=O)N[C@H](C(C)C)C(=O)N2 OHRURASPPZQGQM-GCCNXGTGSA-N 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 239000002453 shampoo Substances 0.000 description 2
- 239000004055 small Interfering RNA Substances 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 2
- 239000012312 sodium hydride Substances 0.000 description 2
- 229910000104 sodium hydride Inorganic materials 0.000 description 2
- 235000009518 sodium iodide Nutrition 0.000 description 2
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 229960005137 succinic acid Drugs 0.000 description 2
- 229960002317 succinimide Drugs 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 229960001603 tamoxifen Drugs 0.000 description 2
- UMGDCJDMYOKAJW-UHFFFAOYSA-N thiourea Chemical compound NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 description 2
- 238000011200 topical administration Methods 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 229960000575 trastuzumab Drugs 0.000 description 2
- TUQOTMZNTHZOKS-UHFFFAOYSA-N tributylphosphine Chemical compound CCCCP(CCCC)CCCC TUQOTMZNTHZOKS-UHFFFAOYSA-N 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- 210000004881 tumor cell Anatomy 0.000 description 2
- 229960003048 vinblastine Drugs 0.000 description 2
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 2
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 2
- 229960002066 vinorelbine Drugs 0.000 description 2
- WAEXFXRVDQXREF-UHFFFAOYSA-N vorinostat Chemical compound ONC(=O)CCCCCCC(=O)NC1=CC=CC=C1 WAEXFXRVDQXREF-UHFFFAOYSA-N 0.000 description 2
- 229960000237 vorinostat Drugs 0.000 description 2
- XRASPMIURGNCCH-UHFFFAOYSA-N zoledronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CN1C=CN=C1 XRASPMIURGNCCH-UHFFFAOYSA-N 0.000 description 2
- 229960004276 zoledronic acid Drugs 0.000 description 2
- RRKODOZNUZCUBN-CCAGOZQPSA-N (1z,3z)-cycloocta-1,3-diene Chemical compound C1CC\C=C/C=C\C1 RRKODOZNUZCUBN-CCAGOZQPSA-N 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- BWDQBBCUWLSASG-MDZDMXLPSA-N (e)-n-hydroxy-3-[4-[[2-hydroxyethyl-[2-(1h-indol-3-yl)ethyl]amino]methyl]phenyl]prop-2-enamide Chemical compound C=1NC2=CC=CC=C2C=1CCN(CCO)CC1=CC=C(\C=C\C(=O)NO)C=C1 BWDQBBCUWLSASG-MDZDMXLPSA-N 0.000 description 1
- XGQXULJHBWKUJY-LYIKAWCPSA-N (z)-but-2-enedioic acid;n-[2-(diethylamino)ethyl]-5-[(z)-(5-fluoro-2-oxo-1h-indol-3-ylidene)methyl]-2,4-dimethyl-1h-pyrrole-3-carboxamide Chemical compound OC(=O)\C=C/C(O)=O.CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C XGQXULJHBWKUJY-LYIKAWCPSA-N 0.000 description 1
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 1
- GYSCBCSGKXNZRH-UHFFFAOYSA-N 1-benzothiophene-2-carboxamide Chemical compound C1=CC=C2SC(C(=O)N)=CC2=C1 GYSCBCSGKXNZRH-UHFFFAOYSA-N 0.000 description 1
- 229940122124 17,20 lyase inhibitor Drugs 0.000 description 1
- OZMLUMPWPFZWTP-UHFFFAOYSA-N 2-(tributyl-$l^{5}-phosphanylidene)acetonitrile Chemical compound CCCCP(CCCC)(CCCC)=CC#N OZMLUMPWPFZWTP-UHFFFAOYSA-N 0.000 description 1
- VOXBZHOHGGBLCQ-UHFFFAOYSA-N 2-amino-3,7-dihydropurine-6-thione;hydrate Chemical compound O.N1C(N)=NC(=S)C2=C1N=CN2.N1C(N)=NC(=S)C2=C1N=CN2 VOXBZHOHGGBLCQ-UHFFFAOYSA-N 0.000 description 1
- SXJDCULZDFWMJC-UHFFFAOYSA-N 2-amino-6-bromo-4-(1-cyano-2-ethoxy-2-oxoethyl)-4H-1-benzopyran-3-carboxylic acid ethyl ester Chemical compound C1=C(Br)C=C2C(C(C#N)C(=O)OCC)C(C(=O)OCC)=C(N)OC2=C1 SXJDCULZDFWMJC-UHFFFAOYSA-N 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 1
- TVZGACDUOSZQKY-LBPRGKRZSA-N 4-aminofolic acid Chemical compound C1=NC2=NC(N)=NC(N)=C2N=C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 TVZGACDUOSZQKY-LBPRGKRZSA-N 0.000 description 1
- 150000005007 4-aminopyrimidines Chemical class 0.000 description 1
- WUBBRNOQWQTFEX-UHFFFAOYSA-N 4-aminosalicylic acid Chemical compound NC1=CC=C(C(O)=O)C(O)=C1 WUBBRNOQWQTFEX-UHFFFAOYSA-N 0.000 description 1
- KBIWNQVZKHSHTI-UHFFFAOYSA-N 4-n,4-n-dimethylbenzene-1,4-diamine;oxalic acid Chemical compound OC(=O)C(O)=O.CN(C)C1=CC=C(N)C=C1 KBIWNQVZKHSHTI-UHFFFAOYSA-N 0.000 description 1
- XAUDJQYHKZQPEU-KVQBGUIXSA-N 5-aza-2'-deoxycytidine Chemical compound O=C1N=C(N)N=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 XAUDJQYHKZQPEU-KVQBGUIXSA-N 0.000 description 1
- WYWHKKSPHMUBEB-UHFFFAOYSA-N 6-Mercaptoguanine Natural products N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 1
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 1
- FJHBVJOVLFPMQE-QFIPXVFZSA-N 7-Ethyl-10-Hydroxy-Camptothecin Chemical compound C1=C(O)C=C2C(CC)=C(CN3C(C4=C([C@@](C(=O)OC4)(O)CC)C=C33)=O)C3=NC2=C1 FJHBVJOVLFPMQE-QFIPXVFZSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- SHGAZHPCJJPHSC-ZVCIMWCZSA-N 9-cis-retinoic acid Chemical compound OC(=O)/C=C(\C)/C=C/C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-ZVCIMWCZSA-N 0.000 description 1
- HPLNQCPCUACXLM-PGUFJCEWSA-N ABT-737 Chemical compound C([C@@H](CCN(C)C)NC=1C(=CC(=CC=1)S(=O)(=O)NC(=O)C=1C=CC(=CC=1)N1CCN(CC=2C(=CC=CC=2)C=2C=CC(Cl)=CC=2)CC1)[N+]([O-])=O)SC1=CC=CC=C1 HPLNQCPCUACXLM-PGUFJCEWSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- 208000036762 Acute promyelocytic leukaemia Diseases 0.000 description 1
- 108010012934 Albumin-Bound Paclitaxel Proteins 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 102000015790 Asparaginase Human genes 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- 206010003571 Astrocytoma Diseases 0.000 description 1
- 208000003950 B-cell lymphoma Diseases 0.000 description 1
- 230000003844 B-cell-activation Effects 0.000 description 1
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 1
- 239000012664 BCL-2-inhibitor Substances 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 108700003785 Baculoviral IAP Repeat-Containing 3 Proteins 0.000 description 1
- 102000051819 Baculoviral IAP Repeat-Containing 3 Human genes 0.000 description 1
- 229940123711 Bcl2 inhibitor Drugs 0.000 description 1
- 101150104237 Birc3 gene Proteins 0.000 description 1
- 229940122361 Bisphosphonate Drugs 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 206010051728 Bone erosion Diseases 0.000 description 1
- KAJYHKRSEVHEGX-HCQSHQBASA-N C1[C@@]([N+]([O-])=O)(C)[C@@H](NC(=O)OC)[C@@H](C)O[C@H]1O[C@@H]1C(/C)=C/[C@@H]2[C@@H](O)CC(C=O)=CC2(C2=O)OC(O)=C2C(=O)[C@@]2(C)[C@@H]3[C@@H](C)C[C@H](C)[C@H](O[C@@H]4O[C@@H](C)[C@H](OC(C)=O)[C@H](O[C@@H]5O[C@@H](C)[C@H](O[C@@H]6O[C@@H](C)[C@H](O[C@@H]7O[C@@H](C)[C@H](O)CC7)[C@H](O)C6)CC5)C4)[C@H]3C=C[C@H]2\C(C)=C/C1 Chemical compound C1[C@@]([N+]([O-])=O)(C)[C@@H](NC(=O)OC)[C@@H](C)O[C@H]1O[C@@H]1C(/C)=C/[C@@H]2[C@@H](O)CC(C=O)=CC2(C2=O)OC(O)=C2C(=O)[C@@]2(C)[C@@H]3[C@@H](C)C[C@H](C)[C@H](O[C@@H]4O[C@@H](C)[C@H](OC(C)=O)[C@H](O[C@@H]5O[C@@H](C)[C@H](O[C@@H]6O[C@@H](C)[C@H](O[C@@H]7O[C@@H](C)[C@H](O)CC7)[C@H](O)C6)CC5)C4)[C@H]3C=C[C@H]2\C(C)=C/C1 KAJYHKRSEVHEGX-HCQSHQBASA-N 0.000 description 1
- 108010029697 CD40 Ligand Proteins 0.000 description 1
- 102100032937 CD40 ligand Human genes 0.000 description 1
- KLWPJMFMVPTNCC-UHFFFAOYSA-N Camptothecin Natural products CCC1(O)C(=O)OCC2=C1C=C3C4Nc5ccccc5C=C4CN3C2=O KLWPJMFMVPTNCC-UHFFFAOYSA-N 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- OKTJSMMVPCPJKN-NJFSPNSNSA-N Carbon-14 Chemical compound [14C] OKTJSMMVPCPJKN-NJFSPNSNSA-N 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- JWBOIMRXGHLCPP-UHFFFAOYSA-N Chloditan Chemical compound C=1C=CC=C(Cl)C=1C(C(Cl)Cl)C1=CC=C(Cl)C=C1 JWBOIMRXGHLCPP-UHFFFAOYSA-N 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 1
- 206010048832 Colon adenoma Diseases 0.000 description 1
- 102000007644 Colony-Stimulating Factors Human genes 0.000 description 1
- 108010071942 Colony-Stimulating Factors Proteins 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- 206010052360 Colorectal adenocarcinoma Diseases 0.000 description 1
- 102000002004 Cytochrome P-450 Enzyme System Human genes 0.000 description 1
- 108010015742 Cytochrome P-450 Enzyme System Proteins 0.000 description 1
- 108010037645 Cytokine TWEAK Proteins 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 229940123780 DNA topoisomerase I inhibitor Drugs 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- 101100193633 Danio rerio rag2 gene Proteins 0.000 description 1
- ZBNZXTGUTAYRHI-UHFFFAOYSA-N Dasatinib Chemical compound C=1C(N2CCN(CCO)CC2)=NC(C)=NC=1NC(S1)=NC=C1C(=O)NC1=C(C)C=CC=C1Cl ZBNZXTGUTAYRHI-UHFFFAOYSA-N 0.000 description 1
- WEAHRLBPCANXCN-UHFFFAOYSA-N Daunomycin Natural products CCC1(O)CC(OC2CC(N)C(O)C(C)O2)c3cc4C(=O)c5c(OC)cccc5C(=O)c4c(O)c3C1 WEAHRLBPCANXCN-UHFFFAOYSA-N 0.000 description 1
- 108010002156 Depsipeptides Proteins 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- QXNVGIXVLWOKEQ-UHFFFAOYSA-N Disodium Chemical compound [Na][Na] QXNVGIXVLWOKEQ-UHFFFAOYSA-N 0.000 description 1
- XXPXYPLPSDPERN-UHFFFAOYSA-N Ecteinascidin 743 Natural products COc1cc2C(NCCc2cc1O)C(=O)OCC3N4C(O)C5Cc6cc(C)c(OC)c(O)c6C(C4C(S)c7c(OC(=O)C)c(C)c8OCOc8c37)N5C XXPXYPLPSDPERN-UHFFFAOYSA-N 0.000 description 1
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 1
- 102000003951 Erythropoietin Human genes 0.000 description 1
- 108090000394 Erythropoietin Proteins 0.000 description 1
- 229940102550 Estrogen receptor antagonist Drugs 0.000 description 1
- 208000006168 Ewing Sarcoma Diseases 0.000 description 1
- 206010061850 Extranodal marginal zone B-cell lymphoma (MALT type) Diseases 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- VWUXBMIQPBEWFH-WCCTWKNTSA-N Fulvestrant Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3[C@H](CCCCCCCCCS(=O)CCCC(F)(F)C(F)(F)F)CC2=C1 VWUXBMIQPBEWFH-WCCTWKNTSA-N 0.000 description 1
- 206010051066 Gastrointestinal stromal tumour Diseases 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- 239000000579 Gonadotropin-Releasing Hormone Substances 0.000 description 1
- 108010069236 Goserelin Proteins 0.000 description 1
- 102000009465 Growth Factor Receptors Human genes 0.000 description 1
- 108010009202 Growth Factor Receptors Proteins 0.000 description 1
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 1
- 108010033040 Histones Proteins 0.000 description 1
- 102000006947 Histones Human genes 0.000 description 1
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 1
- 101000962345 Homo sapiens NACHT, LRR and PYD domains-containing protein 12 Proteins 0.000 description 1
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 101001059454 Homo sapiens Serine/threonine-protein kinase MARK2 Proteins 0.000 description 1
- 102000038455 IGF Type 1 Receptor Human genes 0.000 description 1
- 108010031794 IGF Type 1 Receptor Proteins 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000003815 Interleukin-11 Human genes 0.000 description 1
- 108090000177 Interleukin-11 Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- SHGAZHPCJJPHSC-NUEINMDLSA-N Isotretinoin Chemical compound OC(=O)C=C(C)/C=C/C=C(C)C=CC1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-NUEINMDLSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 1
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 1
- 239000002067 L01XE06 - Dasatinib Substances 0.000 description 1
- 239000002136 L01XE07 - Lapatinib Substances 0.000 description 1
- XNRVGTHNYCNCFF-UHFFFAOYSA-N Lapatinib ditosylate monohydrate Chemical compound O.CC1=CC=C(S(O)(=O)=O)C=C1.CC1=CC=C(S(O)(=O)=O)C=C1.O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 XNRVGTHNYCNCFF-UHFFFAOYSA-N 0.000 description 1
- 108010000817 Leuprolide Proteins 0.000 description 1
- HLFSDGLLUJUHTE-SNVBAGLBSA-N Levamisole Chemical compound C1([C@H]2CN3CCSC3=N2)=CC=CC=C1 HLFSDGLLUJUHTE-SNVBAGLBSA-N 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- 208000028018 Lymphocytic leukaemia Diseases 0.000 description 1
- 108010091221 Lymphotoxin beta Receptor Proteins 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 108091054455 MAP kinase family Proteins 0.000 description 1
- 102000043136 MAP kinase family Human genes 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- XOGTZOOQQBDUSI-UHFFFAOYSA-M Mesna Chemical compound [Na+].[O-]S(=O)(=O)CCS XOGTZOOQQBDUSI-UHFFFAOYSA-M 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 101100193635 Mus musculus Rag2 gene Proteins 0.000 description 1
- 201000003793 Myelodysplastic syndrome Diseases 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- 208000014767 Myeloproliferative disease Diseases 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- 102100039240 NACHT, LRR and PYD domains-containing protein 12 Human genes 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 101100030361 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) pph-3 gene Proteins 0.000 description 1
- KYRVNWMVYQXFEU-UHFFFAOYSA-N Nocodazole Chemical compound C1=C2NC(NC(=O)OC)=NC2=CC=C1C(=O)C1=CC=CS1 KYRVNWMVYQXFEU-UHFFFAOYSA-N 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 102000004245 Proteasome Endopeptidase Complex Human genes 0.000 description 1
- 108090000708 Proteasome Endopeptidase Complex Proteins 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 108091030071 RNAI Proteins 0.000 description 1
- 101100226004 Rattus norvegicus Erc2 gene Proteins 0.000 description 1
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 1
- 101100379220 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) API2 gene Proteins 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 206010039710 Scleroderma Diseases 0.000 description 1
- 229940124639 Selective inhibitor Drugs 0.000 description 1
- 206010040047 Sepsis Diseases 0.000 description 1
- 102100028904 Serine/threonine-protein kinase MARK2 Human genes 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- 101000857870 Squalus acanthias Gonadoliberin Proteins 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 102000001854 Steroid 17-alpha-Hydroxylase Human genes 0.000 description 1
- 108010015330 Steroid 17-alpha-Hydroxylase Proteins 0.000 description 1
- 108091008874 T cell receptors Proteins 0.000 description 1
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 1
- 206010042971 T-cell lymphoma Diseases 0.000 description 1
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 description 1
- NAVMQTYZDKMPEU-UHFFFAOYSA-N Targretin Chemical compound CC1=CC(C(CCC2(C)C)(C)C)=C2C=C1C(=C)C1=CC=C(C(O)=O)C=C1 NAVMQTYZDKMPEU-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 229940123237 Taxane Drugs 0.000 description 1
- 108091033399 Telomestatin Proteins 0.000 description 1
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 1
- QHOPXUFELLHKAS-UHFFFAOYSA-N Thespesin Natural products CC(C)c1c(O)c(O)c2C(O)Oc3c(c(C)cc1c23)-c1c2OC(O)c3c(O)c(O)c(C(C)C)c(cc1C)c23 QHOPXUFELLHKAS-UHFFFAOYSA-N 0.000 description 1
- 239000000365 Topoisomerase I Inhibitor Substances 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 206010052779 Transplant rejections Diseases 0.000 description 1
- RTKIYFITIVXBLE-UHFFFAOYSA-N Trichostatin A Natural products ONC(=O)C=CC(C)=CC(C)C(=O)C1=CC=C(N(C)C)C=C1 RTKIYFITIVXBLE-UHFFFAOYSA-N 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 102000004243 Tubulin Human genes 0.000 description 1
- 108090000704 Tubulin Proteins 0.000 description 1
- 108060008683 Tumor Necrosis Factor Receptor Proteins 0.000 description 1
- 102000000160 Tumor Necrosis Factor Receptor-Associated Peptides and Proteins Human genes 0.000 description 1
- 108010080432 Tumor Necrosis Factor Receptor-Associated Peptides and Proteins Proteins 0.000 description 1
- 102100024584 Tumor necrosis factor ligand superfamily member 12 Human genes 0.000 description 1
- 102100022156 Tumor necrosis factor receptor superfamily member 3 Human genes 0.000 description 1
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 1
- 108010083111 Ubiquitin-Protein Ligases Proteins 0.000 description 1
- 102000006275 Ubiquitin-Protein Ligases Human genes 0.000 description 1
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Natural products NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 1
- 229930003316 Vitamin D Natural products 0.000 description 1
- QYSXJUFSXHHAJI-XFEUOLMDSA-N Vitamin D3 Natural products C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C/C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-XFEUOLMDSA-N 0.000 description 1
- FCVHBUFELUXTLR-UHFFFAOYSA-N [Li].[AlH3] Chemical class [Li].[AlH3] FCVHBUFELUXTLR-UHFFFAOYSA-N 0.000 description 1
- BDKZHNJTLHOSDW-UHFFFAOYSA-N [Na].CC(O)=O Chemical compound [Na].CC(O)=O BDKZHNJTLHOSDW-UHFFFAOYSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 229940028652 abraxane Drugs 0.000 description 1
- 230000035508 accumulation Effects 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 208000009956 adenocarcinoma Diseases 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 229960001445 alitretinoin Drugs 0.000 description 1
- 125000004450 alkenylene group Chemical group 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229960000473 altretamine Drugs 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 229940024606 amino acid Drugs 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 229960003896 aminopterin Drugs 0.000 description 1
- 229960004909 aminosalicylic acid Drugs 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000003432 anti-folate effect Effects 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 230000000118 anti-neoplastic effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 229940127074 antifolate Drugs 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 230000030741 antigen processing and presentation Effects 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 210000000709 aorta Anatomy 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 239000003886 aromatase inhibitor Substances 0.000 description 1
- 229940046844 aromatase inhibitors Drugs 0.000 description 1
- 150000004982 aromatic amines Chemical class 0.000 description 1
- GOLCXWYRSKYTSP-UHFFFAOYSA-N arsenic trioxide Inorganic materials O1[As]2O[As]1O2 GOLCXWYRSKYTSP-UHFFFAOYSA-N 0.000 description 1
- 238000006254 arylation reaction Methods 0.000 description 1
- 229960003272 asparaginase Drugs 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 210000004227 basal ganglia Anatomy 0.000 description 1
- JUHORIMYRDESRB-UHFFFAOYSA-N benzathine Chemical compound C=1C=CC=CC=1CNCCNCC1=CC=CC=C1 JUHORIMYRDESRB-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 229960000397 bevacizumab Drugs 0.000 description 1
- 229960002938 bexarotene Drugs 0.000 description 1
- 125000002618 bicyclic heterocycle group Chemical group 0.000 description 1
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical group C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 150000004663 bisphosphonates Chemical class 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- HQABUPZFAYXKJW-UHFFFAOYSA-N butan-1-amine Chemical class CCCCN HQABUPZFAYXKJW-UHFFFAOYSA-N 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- KVUAALJSMIVURS-ZEDZUCNESA-L calcium folinate Chemical compound [Ca+2].C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 KVUAALJSMIVURS-ZEDZUCNESA-L 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 229940127093 camptothecin Drugs 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- XREUEWVEMYWFFA-CSKJXFQVSA-N carminomycin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=C(O)C=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XREUEWVEMYWFFA-CSKJXFQVSA-N 0.000 description 1
- 229930188550 carminomycin Natural products 0.000 description 1
- XREUEWVEMYWFFA-UHFFFAOYSA-N carminomycin I Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=C(O)C=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XREUEWVEMYWFFA-UHFFFAOYSA-N 0.000 description 1
- 229950001725 carubicin Drugs 0.000 description 1
- 230000006369 cell cycle progression Effects 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 210000003679 cervix uteri Anatomy 0.000 description 1
- ZXFCRFYULUUSDW-OWXODZSWSA-N chembl2104970 Chemical compound C([C@H]1C2)C3=CC=CC(O)=C3C(=O)C1=C(O)[C@@]1(O)[C@@H]2CC(O)=C(C(=O)N)C1=O ZXFCRFYULUUSDW-OWXODZSWSA-N 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 230000002759 chromosomal effect Effects 0.000 description 1
- 235000019504 cigarettes Nutrition 0.000 description 1
- 229960002436 cladribine Drugs 0.000 description 1
- 229960000928 clofarabine Drugs 0.000 description 1
- WDDPHFBMKLOVOX-AYQXTPAHSA-N clofarabine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@@H]1F WDDPHFBMKLOVOX-AYQXTPAHSA-N 0.000 description 1
- 229960001338 colchicine Drugs 0.000 description 1
- 210000004922 colonic epithelial cell Anatomy 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 230000004154 complement system Effects 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 238000006482 condensation reaction Methods 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 239000000625 cyclamic acid and its Na and Ca salt Substances 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- HCAJEUSONLESMK-UHFFFAOYSA-N cyclohexylsulfamic acid Chemical compound OS(=O)(=O)NC1CCCCC1 HCAJEUSONLESMK-UHFFFAOYSA-N 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 229960000684 cytarabine Drugs 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- 229960002448 dasatinib Drugs 0.000 description 1
- 229960003603 decitabine Drugs 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 150000001993 dienes Chemical class 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- 229940043279 diisopropylamine Drugs 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 1
- WEHWNAOGRSTTBQ-UHFFFAOYSA-N dipropylamine Chemical compound CCCNCCC WEHWNAOGRSTTBQ-UHFFFAOYSA-N 0.000 description 1
- 208000037765 diseases and disorders Diseases 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 description 1
- 239000003968 dna methyltransferase inhibitor Substances 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 230000002500 effect on skin Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 210000004696 endometrium Anatomy 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 210000002615 epidermis Anatomy 0.000 description 1
- 230000008971 epithelial apoptosis Effects 0.000 description 1
- 230000008472 epithelial growth Effects 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 1
- 229960001433 erlotinib Drugs 0.000 description 1
- 229940105423 erythropoietin Drugs 0.000 description 1
- 210000003238 esophagus Anatomy 0.000 description 1
- 229960001842 estramustine Drugs 0.000 description 1
- FRPJXPJMRWBBIH-RBRWEJTLSA-N estramustine Chemical compound ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 FRPJXPJMRWBBIH-RBRWEJTLSA-N 0.000 description 1
- 229940011871 estrogen Drugs 0.000 description 1
- 239000000262 estrogen Substances 0.000 description 1
- 239000000328 estrogen antagonist Substances 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 229960000752 etoposide phosphate Drugs 0.000 description 1
- LIQODXNTTZAGID-OCBXBXKTSA-N etoposide phosphate Chemical compound COC1=C(OP(O)(O)=O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 LIQODXNTTZAGID-OCBXBXKTSA-N 0.000 description 1
- 230000003090 exacerbative effect Effects 0.000 description 1
- 229960002428 fentanyl Drugs 0.000 description 1
- IVLVTNPOHDFFCJ-UHFFFAOYSA-N fentanyl citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1N(C(=O)CC)C(CC1)CCN1CCC1=CC=CC=C1 IVLVTNPOHDFFCJ-UHFFFAOYSA-N 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- 239000004052 folic acid antagonist Substances 0.000 description 1
- 235000008191 folinic acid Nutrition 0.000 description 1
- 239000011672 folinic acid Substances 0.000 description 1
- 230000022244 formylation Effects 0.000 description 1
- 238000006170 formylation reaction Methods 0.000 description 1
- 238000001640 fractional crystallisation Methods 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 229960002258 fulvestrant Drugs 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 210000000232 gallbladder Anatomy 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 201000011243 gastrointestinal stromal tumor Diseases 0.000 description 1
- 229960000578 gemtuzumab Drugs 0.000 description 1
- 229960003297 gemtuzumab ozogamicin Drugs 0.000 description 1
- 238000003197 gene knockdown Methods 0.000 description 1
- 230000009368 gene silencing by RNA Effects 0.000 description 1
- 239000003862 glucocorticoid Substances 0.000 description 1
- 229960004275 glycolic acid Drugs 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- XLXSAKCOAKORKW-AQJXLSMYSA-N gonadorelin Chemical compound C([C@@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 XLXSAKCOAKORKW-AQJXLSMYSA-N 0.000 description 1
- 229940035638 gonadotropin-releasing hormone Drugs 0.000 description 1
- 229960003690 goserelin acetate Drugs 0.000 description 1
- 229930000755 gossypol Natural products 0.000 description 1
- 229950005277 gossypol Drugs 0.000 description 1
- 230000026030 halogenation Effects 0.000 description 1
- 238000005658 halogenation reaction Methods 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- UUVWYPNAQBNQJQ-UHFFFAOYSA-N hexamethylmelamine Chemical compound CN(C)C1=NC(N(C)C)=NC(N(C)C)=N1 UUVWYPNAQBNQJQ-UHFFFAOYSA-N 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 229960003911 histrelin acetate Drugs 0.000 description 1
- BKEMVGVBBDMHKL-VYFXDUNUSA-N histrelin acetate Chemical compound CC(O)=O.CC(O)=O.CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC(N=C1)=CN1CC1=CC=CC=C1 BKEMVGVBBDMHKL-VYFXDUNUSA-N 0.000 description 1
- XGIHQYAWBCFNPY-AZOCGYLKSA-N hydrabamine Chemical class C([C@@H]12)CC3=CC(C(C)C)=CC=C3[C@@]2(C)CCC[C@@]1(C)CNCCNC[C@@]1(C)[C@@H]2CCC3=CC(C(C)C)=CC=C3[C@@]2(C)CCC1 XGIHQYAWBCFNPY-AZOCGYLKSA-N 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 230000037417 hyperactivation Effects 0.000 description 1
- 229960003685 imatinib mesylate Drugs 0.000 description 1
- YLMAHDNUQAMNNX-UHFFFAOYSA-N imatinib methanesulfonate Chemical compound CS(O)(=O)=O.C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 YLMAHDNUQAMNNX-UHFFFAOYSA-N 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 238000010874 in vitro model Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 229940102223 injectable solution Drugs 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 229960003521 interferon alfa-2a Drugs 0.000 description 1
- 229960003507 interferon alfa-2b Drugs 0.000 description 1
- 229940074383 interleukin-11 Drugs 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 125000002346 iodo group Chemical group I* 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- JJWLVOIRVHMVIS-UHFFFAOYSA-N isopropylamine Chemical compound CC(C)N JJWLVOIRVHMVIS-UHFFFAOYSA-N 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 229960000448 lactic acid Drugs 0.000 description 1
- 229960004891 lapatinib Drugs 0.000 description 1
- 229960001320 lapatinib ditosylate Drugs 0.000 description 1
- 229960003881 letrozole Drugs 0.000 description 1
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 1
- 229960001691 leucovorin Drugs 0.000 description 1
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 1
- 229960004338 leuprorelin Drugs 0.000 description 1
- 229960001614 levamisole Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000004777 loss-of-function mutation Effects 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 208000003747 lymphoid leukemia Diseases 0.000 description 1
- 229940124302 mTOR inhibitor Drugs 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 1
- OCSMOTCMPXTDND-OUAUKWLOSA-N marimastat Chemical compound CNC(=O)[C@H](C(C)(C)C)NC(=O)[C@H](CC(C)C)[C@H](O)C(=O)NO OCSMOTCMPXTDND-OUAUKWLOSA-N 0.000 description 1
- 229950008959 marimastat Drugs 0.000 description 1
- 235000012054 meals Nutrition 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 229940126601 medicinal product Drugs 0.000 description 1
- RQZAXGRLVPAYTJ-GQFGMJRRSA-N megestrol acetate Chemical compound C1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 RQZAXGRLVPAYTJ-GQFGMJRRSA-N 0.000 description 1
- 229960004296 megestrol acetate Drugs 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 201000008806 mesenchymal cell neoplasm Diseases 0.000 description 1
- 229960004635 mesna Drugs 0.000 description 1
- LULAYUGMBFYYEX-UHFFFAOYSA-N metachloroperbenzoic acid Natural products OC(=O)C1=CC=CC(Cl)=C1 LULAYUGMBFYYEX-UHFFFAOYSA-N 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 239000003475 metalloproteinase inhibitor Substances 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 1
- 238000010208 microarray analysis Methods 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 239000002829 mitogen activated protein kinase inhibitor Substances 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 229960000350 mitotane Drugs 0.000 description 1
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- 125000005322 morpholin-1-yl group Chemical group 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 230000002071 myeloproliferative effect Effects 0.000 description 1
- AZBFJBJXUQUQLF-UHFFFAOYSA-N n-(1,5-dimethylpyrrolidin-3-yl)pyrrolidine-1-carboxamide Chemical compound C1N(C)C(C)CC1NC(=O)N1CCCC1 AZBFJBJXUQUQLF-UHFFFAOYSA-N 0.000 description 1
- DUWWHGPELOTTOE-UHFFFAOYSA-N n-(5-chloro-2,4-dimethoxyphenyl)-3-oxobutanamide Chemical compound COC1=CC(OC)=C(NC(=O)CC(C)=O)C=C1Cl DUWWHGPELOTTOE-UHFFFAOYSA-N 0.000 description 1
- BLCLNMBMMGCOAS-UHFFFAOYSA-N n-[1-[[1-[[1-[[1-[[1-[[1-[[1-[2-[(carbamoylamino)carbamoyl]pyrrolidin-1-yl]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-[(2-methylpropan-2-yl)oxy]-1-oxopropan-2-yl]amino]-3-(4-hydroxyphenyl)-1-oxopropan-2-yl]amin Chemical compound C1CCC(C(=O)NNC(N)=O)N1C(=O)C(CCCN=C(N)N)NC(=O)C(CC(C)C)NC(=O)C(COC(C)(C)C)NC(=O)C(NC(=O)C(CO)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C(CC=1NC=NC=1)NC(=O)C1NC(=O)CC1)CC1=CC=C(O)C=C1 BLCLNMBMMGCOAS-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- NPAGDVCDWIYMMC-IZPLOLCNSA-N nandrolone Chemical compound O=C1CC[C@@H]2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 NPAGDVCDWIYMMC-IZPLOLCNSA-N 0.000 description 1
- 229960004719 nandrolone Drugs 0.000 description 1
- 210000003739 neck Anatomy 0.000 description 1
- 208000007538 neurilemmoma Diseases 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 238000006396 nitration reaction Methods 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 230000011164 ossification Effects 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 229940116315 oxalic acid Drugs 0.000 description 1
- 229960001756 oxaliplatin Drugs 0.000 description 1
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000036542 oxidative stress Effects 0.000 description 1
- WRUUGTRCQOWXEG-UHFFFAOYSA-N pamidronate Chemical compound NCCC(O)(P(O)(O)=O)P(O)(O)=O WRUUGTRCQOWXEG-UHFFFAOYSA-N 0.000 description 1
- 229940046231 pamidronate Drugs 0.000 description 1
- WLJNZVDCPSBLRP-UHFFFAOYSA-N pamoic acid Chemical compound C1=CC=C2C(CC=3C4=CC=CC=C4C=C(C=3O)C(=O)O)=C(O)C(C(O)=O)=CC2=C1 WLJNZVDCPSBLRP-UHFFFAOYSA-N 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000013610 patient sample Substances 0.000 description 1
- 229960003931 peginterferon alfa-2b Drugs 0.000 description 1
- 108010092851 peginterferon alfa-2b Proteins 0.000 description 1
- WBXPDJSOTKVWSJ-ZDUSSCGKSA-N pemetrexed Chemical compound C=1NC=2NC(N)=NC(=O)C=2C=1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 WBXPDJSOTKVWSJ-ZDUSSCGKSA-N 0.000 description 1
- 239000003961 penetration enhancing agent Substances 0.000 description 1
- 235000019371 penicillin G benzathine Nutrition 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 229960002340 pentostatin Drugs 0.000 description 1
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 1
- 210000001428 peripheral nervous system Anatomy 0.000 description 1
- 229960002087 pertuzumab Drugs 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 230000034190 positive regulation of NF-kappaB transcription factor activity Effects 0.000 description 1
- 230000029279 positive regulation of transcription, DNA-dependent Effects 0.000 description 1
- 238000002600 positron emission tomography Methods 0.000 description 1
- 230000001323 posttranslational effect Effects 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 1
- 229960004618 prednisone Drugs 0.000 description 1
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- 230000007112 pro inflammatory response Effects 0.000 description 1
- 229960000624 procarbazine Drugs 0.000 description 1
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 229940107700 pyruvic acid Drugs 0.000 description 1
- 150000004053 quinones Chemical class 0.000 description 1
- SBYHFKPVCBCYGV-UHFFFAOYSA-N quinuclidine Chemical compound C1CC2CCN1CC2 SBYHFKPVCBCYGV-UHFFFAOYSA-N 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 108091006084 receptor activators Proteins 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 239000012440 retinoic acid metabolism blocking agent Substances 0.000 description 1
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 1
- 229960004641 rituximab Drugs 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 206010039667 schwannoma Diseases 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 238000010956 selective crystallization Methods 0.000 description 1
- 229940095743 selective estrogen receptor modulator Drugs 0.000 description 1
- 239000000333 selective estrogen receptor modulator Substances 0.000 description 1
- CYOHGALHFOKKQC-UHFFFAOYSA-N selumetinib Chemical compound OCCONC(=O)C=1C=C2N(C)C=NC2=C(F)C=1NC1=CC=C(Br)C=C1Cl CYOHGALHFOKKQC-UHFFFAOYSA-N 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- VGKDLMBJGBXTGI-SJCJKPOMSA-N sertraline Chemical compound C1([C@@H]2CC[C@@H](C3=CC=CC=C32)NC)=CC=C(Cl)C(Cl)=C1 VGKDLMBJGBXTGI-SJCJKPOMSA-N 0.000 description 1
- 229960002073 sertraline Drugs 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 230000007727 signaling mechanism Effects 0.000 description 1
- 229960003323 siltuximab Drugs 0.000 description 1
- 210000002027 skeletal muscle Anatomy 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 239000000779 smoke Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 239000012279 sodium borohydride Substances 0.000 description 1
- 229910000033 sodium borohydride Inorganic materials 0.000 description 1
- MFBOGIVSZKQAPD-UHFFFAOYSA-M sodium butyrate Chemical compound [Na+].CCCC([O-])=O MFBOGIVSZKQAPD-UHFFFAOYSA-M 0.000 description 1
- MIXCUJKCXRNYFM-UHFFFAOYSA-M sodium;diiodomethanesulfonate;n-propyl-n-[2-(2,4,6-trichlorophenoxy)ethyl]imidazole-1-carboxamide Chemical compound [Na+].[O-]S(=O)(=O)C(I)I.C1=CN=CN1C(=O)N(CCC)CCOC1=C(Cl)C=C(Cl)C=C1Cl MIXCUJKCXRNYFM-UHFFFAOYSA-M 0.000 description 1
- 210000004988 splenocyte Anatomy 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 239000004544 spot-on Substances 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 230000000707 stereoselective effect Effects 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 230000003637 steroidlike Effects 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 230000035882 stress Effects 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000001384 succinic acid Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- 230000006103 sulfonylation Effects 0.000 description 1
- 238000005694 sulfonylation reaction Methods 0.000 description 1
- 229960001796 sunitinib Drugs 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 230000008093 supporting effect Effects 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 229940037128 systemic glucocorticoids Drugs 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000003277 telomerase inhibitor Substances 0.000 description 1
- YVSQVYZBDXIXCC-INIZCTEOSA-N telomestatin Chemical compound N=1C2=COC=1C(N=1)=COC=1C(N=1)=COC=1C(N=1)=COC=1C(N=1)=COC=1C(=C(O1)C)N=C1C(=C(O1)C)N=C1[C@@]1([H])N=C2SC1 YVSQVYZBDXIXCC-INIZCTEOSA-N 0.000 description 1
- 229960004964 temozolomide Drugs 0.000 description 1
- MFPWEWYKQYMWRO-UHFFFAOYSA-N tert-butyl carboxy carbonate Chemical compound CC(C)(C)OC(=O)OC(O)=O MFPWEWYKQYMWRO-UHFFFAOYSA-N 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 150000003510 tertiary aliphatic amines Chemical class 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 229960005353 testolactone Drugs 0.000 description 1
- BPEWUONYVDABNZ-DZBHQSCQSA-N testolactone Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(OC(=O)CC4)[C@@H]4[C@@H]3CCC2=C1 BPEWUONYVDABNZ-DZBHQSCQSA-N 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- 229960003433 thalidomide Drugs 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- 238000003354 tissue distribution assay Methods 0.000 description 1
- 229960005026 toremifene Drugs 0.000 description 1
- XFCLJVABOIYOMF-QPLCGJKRSA-N toremifene Chemical compound C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 XFCLJVABOIYOMF-QPLCGJKRSA-N 0.000 description 1
- 229960005267 tositumomab Drugs 0.000 description 1
- 125000002088 tosyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1C([H])([H])[H])S(*)(=O)=O 0.000 description 1
- 239000003558 transferase inhibitor Substances 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- RTKIYFITIVXBLE-QEQCGCAPSA-N trichostatin A Chemical compound ONC(=O)/C=C/C(/C)=C/[C@@H](C)C(=O)C1=CC=C(N(C)C)C=C1 RTKIYFITIVXBLE-QEQCGCAPSA-N 0.000 description 1
- 125000004044 trifluoroacetyl group Chemical group FC(C(=O)*)(F)F 0.000 description 1
- YFTHZRPMJXBUME-UHFFFAOYSA-N tripropylamine Chemical compound CCCN(CCC)CCC YFTHZRPMJXBUME-UHFFFAOYSA-N 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 210000004926 tubular epithelial cell Anatomy 0.000 description 1
- 230000005740 tumor formation Effects 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 102000003298 tumor necrosis factor receptor Human genes 0.000 description 1
- 230000006663 ubiquitin-proteasome pathway Effects 0.000 description 1
- 238000010798 ubiquitination Methods 0.000 description 1
- 230000034512 ubiquitination Effects 0.000 description 1
- 210000002438 upper gastrointestinal tract Anatomy 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 238000009834 vaporization Methods 0.000 description 1
- 230000008016 vaporization Effects 0.000 description 1
- 229940099039 velcade Drugs 0.000 description 1
- LQBVNQSMGBZMKD-UHFFFAOYSA-N venetoclax Chemical compound C=1C=C(Cl)C=CC=1C=1CC(C)(C)CCC=1CN(CC1)CCN1C(C=C1OC=2C=C3C=CNC3=NC=2)=CC=C1C(=O)NS(=O)(=O)C(C=C1[N+]([O-])=O)=CC=C1NCC1CCOCC1 LQBVNQSMGBZMKD-UHFFFAOYSA-N 0.000 description 1
- 229960001183 venetoclax Drugs 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 235000019166 vitamin D Nutrition 0.000 description 1
- 239000011710 vitamin D Substances 0.000 description 1
- 150000003710 vitamin D derivatives Chemical class 0.000 description 1
- 229940046008 vitamin d Drugs 0.000 description 1
- 235000012431 wafers Nutrition 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 238000010626 work up procedure Methods 0.000 description 1
- 238000012447 xenograft mouse model Methods 0.000 description 1
- 229940004212 yondelis Drugs 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Immunology (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Epidemiology (AREA)
Abstract
Description
Claims (20)
- 하기 화학식(I)의 화합물, 이의 호변이성체 또는 입체이성체 형태, 또는 이의 약학적으로 허용가능한 부가 염, 또는 용매화물:
여기에서
R1은 C1- 4알킬을 나타내고;
R2는 C1- 6알킬, 또는 1개의 R5로 치환된 C1- 6알킬을 나타내며;
Y는 CR4 또는 N을 나타내고;
R4는 수소 또는 할로를 나타내며;
R5는 할로, Het3a, -NR6aR6b, 또는 -OR7을 나타내고;
R6a는 수소 또는 C1- 4알킬을 나타내며;
R6b는 수소; C1- 4알킬; C3- 6시클로알킬; -C(=O)-C1- 4알킬; -C(=O)-Het4; -S(=O)2-C1-4알킬; -OH 및 -NR16aR16b로 구성된 군으로부터 선택된 1개의 치환기로 치환된 -C(=O)-C1- 4알킬; 또는 -OH 및 -S(=O)2-C1- 4알킬로 구성된 군으로부터 선택된 1개의 치환기로 치환된 C1- 4알킬을 나타내고;
R7은 수소, C1- 4알킬, -C1- 4알킬-NR8aR8b, -C(=O)-R9, -S(=O)2-OH, -P(=O)2-OH, -(C=O)-CH(NH2)-C1-4알킬-Ar1, 또는 -C1-4알킬-Het3b를 나타내며;
R8a는 수소 또는 C1- 4알킬을 나타내고;
R8b는 수소, C1- 4알킬, 또는 C3- 6시클로알킬을 나타내며;
R9는 C1- 6알킬, 또는 -NH2, -COOH, 및 Het6으로 구성된 군으로부터 선택된 1개의 치환기로 치환된 C1- 6알킬을 나타내고;
R16a 및 R16b는 각기 독립적으로 수소, C1- 4알킬 또는 C3- 6시클로알킬을 나타내며;
R3은 할로; 시아노; C1- 6알킬; -O-C1- 4알킬; -C(=O)-R10; -S(=O)2-C1- 4알킬; -S(=O)(=N-R20a)-C1-4알킬; 1, 2 또는 3개의 할로 원자로 치환된 -O-C1- 4알킬; -O-C1-4알킬-R12; C3- 6시클로알킬; -O-C3- 6시클로알킬; Het1a; -O-Het1b; R18; R21; -P(=O)-(C1- 4알킬)2; -NH-C(=O)-C1- 4알킬; -NH-C(=O)-Het1g; -NR17aR17b; 1, 2 또는 3개의 할로 원자로 치환된 C1- 4알킬; 1, 2 또는 3개의 -OH 치환기로 치환된 C1- 4알킬; 1개의 R13으로 치환된 C1- 4알킬; 1개의 R18로 치환된 C1- 4알킬; C2- 6알케닐; 1개의 R13으로 치환된 C2-6알케닐; C2- 6알키닐; 및 1개의 R13으로 치환된 C2- 6알키닐로 구성된 군으로부터 각기 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환된 1 또는 2개의 N 원자를 함유하는 6원 헤테로방향족 고리를 나타내거나; 또는
R3은 2-옥소-1,2-디히드로피리딘-3-일을 나타내며,
여기에서 상기 2-옥소-1,2-디히드로피리딘-3-일은 N 원자 상에 C1- 6알킬; C3- 6시클로알킬; Het1a; R18; R21; 1, 2 또는 3개의 할로 원자로 치환된 C1- 4알킬; 1, 2 또는 3개의 -OH 치환기로 치환된 C1- 4알킬; 1개의 R13으로 치환된 C1-4알킬; 1개의 R18로 치환된 C1- 4알킬; C2- 6알케닐; 및 1개의 R13으로 치환된 C2-6알케닐로 구성된 군으로부터 선택된 치환기로 임의로 치환될 수 있으며; 단 Het1a 또는 R18이 2-옥소-1,2-디히드로피리딘-3-일의 N 원자에 직접 결합되는 경우, 상기 Het1a 또는 R18은 고리 탄소 원자를 통해 N 원자에 결합되며;
여기에서 상기 2-옥소-1,2-디히드로피리딘-3-일은 고리 탄소 원자상에 할로; 시아노; C1- 6알킬; -O-C1- 4알킬; -C(=O)-R10; -S(=O)2-C1- 4알킬; -S(=O)(=N-R20a)-C1- 4알킬; 1, 2 또는 3개의 할로 원자로 치환된 -O-C1- 4알킬; -O-C1- 4알킬-R12; C3- 6시클로알킬; -O-C3- 6시클로알킬; Het1a; -O-Het1b; R18; R21; -P(=O)-(C1- 4알킬)2; -NH-C(=O)-C1- 4알킬; -NH-C(=O)-Het1g; -NR17aR17b; 1, 2 또는 3개의 할로 원자로 치환된 C1- 4알킬; 1, 2 또는 3개의 -OH 치환기로 치환된 C1- 4알킬; 1개의 R13으로 치환된 C1- 4알킬; 1개의 R18로 치환된 C1- 4알킬; C2-6알케닐; 1개의 R13으로 치환된 C2- 6알케닐; C2- 6알키닐; 및 1개의 R13으로 치환된 C2- 6알키닐로 구성된 군으로부터 각기 독립적으로 선택된 총 1, 2 또는 3개의 치환기로 임의로 치환될 수 있고;
R10은 -OH, -O-C1- 4알킬, -NR11aR11b 또는 Het2를 나타내며;
R18은 1, 2 또는 3개의 N 원자를 함유하는 5원 방향족 고리를 나타내고; 여기에서 상기 5원 방향족 고리는 C1- 4알킬 및 C3- 6시클로알킬로 구성된 군으로부터 선택된 1개의 치환기로 임의로 치환될 수 있으며;
R21은 3,6-디히드로-2H-피란-4-일 또는 1,2,3,6-테트라히드로-4-피리디닐을 나타내며, 여기에서 1,2,3,6-테트라히드로-4-피리디닐은 N 원자상에 C1- 4알킬 또는 C3-6시클로알킬로 임의로 치환될 수 있고;
Het1a, Het1c 및 Het1d는 각기 독립적으로 O, S, S(=O)p 및 N으로부터 각기 독립적으로 선택된 1 또는 2개의 헤테로원자를 함유하는 4 내지 7원 모노시클릭 포화 헤테로시클릴; 또는 O, S, S(=O)p 및 N으로부터 각기 독립적으로 선택된 1, 2 또는 3개의 헤테로원자를 함유하는 융합, 스피로 및 가교된 사이클을 포함하는 6 내지 11원 비시클릭 포화 헤테로시클릴을 나타내며;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴 또는 상기 6 내지 11원 비시클릭 포화 헤테로시클릴은, 가능하다면, 1, 2 또는 3개의 고리 N 원자 상에 C1- 4알킬, C3- 6시클로알킬, 및 -OH 및 -O-C1- 4알킬로 구성된 군으로부터 선택된 1개의 치환기로 치환된 C1- 4알킬로 구성된 군으로부터 각기 독립적으로 선택된 치환기로 임의로 치환될 수 있고;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴 또는 상기 6 내지 11원 비시클릭 포화 헤테로시클릴은 1, 2 또는 3개의 고리 C 원자 상에 -OH, 할로, C1-4알킬, 시아노, -C(=O)-C1- 4알킬, -O-C1- 4알킬, -NH2, -NH(C1- 4알킬), 및 -N(C1-4알킬)2로 구성된 군으로부터 각기 독립적으로 선택된 1 또는 2개의 치환기로 임의로 치환될 수 있으며;
Het1b, Het1e, Het1g, Het4, Het7 및 Het8은 각기 독립적으로 임의의 이용가능한 고리 탄소 원자를 통해 화학식(I)의 분자의 나머지 부분에 결합된 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내고, 1 또는 2개의 헤테로원자를 함유하는 상기 Het1b, Het1e, Het1g, Het4, Het7 및 Het8은 각기 독립적으로 O, S, S(=O)p 및 N으로부터 선택되며;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 가능하다면, 1 또는 2개의 고리 N 원자 상에 C1- 4알킬, C3- 6시클로알킬, 및 -OH 및 -O-C1- 4알킬로 구성된 군으로부터 선택된 1개의 치환기로 치환된 C1- 4알킬로 구성된 군으로부터 각기 독립적으로 선택된 치환기로 임의로 치환될 수 있고;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 1, 2 또는 3개의 고리 C 원자 상에 -OH, 할로, C1- 4알킬, 시아노, -C(=O)-C1- 4알킬, -O-C1- 4알킬, -NH2, -NH(C1-4알킬), 및 -N(C1- 4알킬)2로 구성된 군으로부터 각기 독립적으로 선택된 1 또는 2개의 치환기로 임의로 치환될 수 있으며;
Het2는 하기 화학식(b-1)의 헤테로시클릴을 나타내고:
;
(b-1)은 O, S, S(=O)p 및 N으로부터 선택된 1개의 추가의 헤테로원자를 임의로 함유하는 N-연결된 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내거나, 또는 O, S, S(=O)p 및 N으로부터 각기 독립적으로 선택된 1 또는 2개의 추가의 헤테로원자를 임의로 함유하는 융합, 스피로 및 가교된 사이클을 포함하는 N-연결된 6 내지 11원 비시클릭 포화 헤테로시클릴을 나타내며;
여기에서 (b-1)이 1 또는 2개의 추가의 N 원자를 함유하는 경우, 상기 1 또는 2개의 N 원자는 C1- 4알킬, C3- 6시클로알킬 및 Het7로 구성된 군으로부터 각기 독립적으로 선택된 치환기로 임의로 치환될 수 있고;
여기에서 (b-1)은 1, 2 또는 3개의 고리 C 원자 상에 할로, -OH, 시아노, C1-4알킬, -O-C1- 4알킬, -NH2, -NH(C1- 4알킬), -N(C1- 4알킬)2, 및 C1- 4알킬-OH로 구성된 군으로부터 각기 독립적으로 선택된 1 또는 2개의 치환기로 임의로 치환될 수 있으며;
R11b는 수소; Het1e; C1- 4알킬; -C1- 4알킬-Het5; -C1- 4알킬-Het8; 할로, -OH 및 -O-C1-4알킬로 구성된 군으로부터 각기 독립적으로 선택된 1, 2 또는 3개의 치환기로 치환된 C1- 4알킬; C3- 6시클로알킬; 또는 할로, -OH 및 -O-C1- 4알킬로 구성된 군으로부터 각기 독립적으로 선택된 1, 2 또는 3개의 치환기로 치환된 C3- 6시클로알킬을 나타내고;
R13은 -O-C1- 4알킬, -C(=O)NR15aR15b, -NR19aR19b, C3- 6시클로알킬, Het1d, 또는 -C(=O)-Het1f를 나타내며;
R12는 -OH, -O-C1- 4알킬, -NR14aR14b, -C(=O)NR14cR14d, -S(=O)2-C1- 4알킬, -S(=O)(=N-R20b)-C1-4알킬, C3-6시클로알킬, Ar2, 또는 Het1c를 나타내고;
Ar1은 1개의 히드록시로 임의로 치환된 페닐을 나타내며;
Ar2는 1개의 C1- 4알킬로 임의로 치환된 페닐을 나타내고;
Het3a, Het3b, Het5, Het6 및 Het1f는 각기 독립적으로 하기 화학식(c-1)의 헤테로시클릴을 나타내며:
;
(c-1)은 O, S, S(=O)p 및 N으로부터 선택된 1개의 추가의 헤테로원자를 임의로 함유하는 N-연결된 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내고;
여기에서 (c-1)이 1개의 추가의 N 원자를 함유하는 경우, 상기 추가의 N 원자는 C1- 4알킬 또는 C3- 6시클로알킬로 임의로 치환될 수 있으며;
여기에서 (c-1)은 1 또는 2개의 고리 C-원자 상에 할로, C1- 4알킬, 및 C3- 6시클로알킬로 구성된 군으로부터 각기 독립적으로 선택된 1 또는 2개의 치환기로 임의로 치환될 수 있고;
R11a, R14a, R14c, R15a, R17a 및 R19a는 각기 독립적으로 수소 또는 C1- 4알킬을 나타내며;
R14b, R14d, R15b, R17b 및 R19b는 각기 독립적으로 수소; C1- 4알킬; C3- 6시클로알킬; -C(=O)-C1-4알킬; 할로, -OH 및 -O-C1- 4알킬로 구성된 군으로부터 선택된 1개의 치환기로 치환된 C1- 4알킬; 할로, -OH 및 -O-C1- 4알킬로 구성된 군으로부터 선택된 1개의 치환기로 치환된 -C(=O)-C1- 4알킬; 또는 -S(=O)2-C1- 4알킬을 나타내고;
R20a 및 R20b는 각기 독립적으로 수소; C1- 4알킬; C3- 6시클로알킬; 또는 -OH 및 -O-C1-4알킬로 구성된 군으로부터 선택된 1개의 치환기로 치환된 C1- 4알킬을 나타내며;
p는 1 또는 2를 나타낸다. - 제1항에 있어서,
Y는 CR4를 나타내고;
R5는 Het3a, -NR6aR6b, 또는 -OR7을 나타내며;
R3은 할로; 시아노; C1- 6알킬; -O-C1- 4알킬; -C(=O)-R10; -S(=O)2-C1- 4알킬; -S(=O)(=N-R20a)-C1-4알킬; 1, 2 또는 3개의 할로 원자로 치환된 -O-C1- 4알킬; -O-C1-4알킬-R12; C3- 6시클로알킬; -O-C3- 6시클로알킬; Het1a; -O-Het1b; R18; R21; -P(=O)-(C1-4알킬)2; -NH-C(=O)-C1- 4알킬; -NH-C(=O)-Het1g; -NR17aR17b; 1, 2 또는 3개의 할로 원자로 치환된 C1- 4알킬; 1, 2 또는 3개의 -OH 치환기로 치환된 C1- 4알킬; 1개의 R13으로 치환된 C1- 4알킬; 1개의 R18로 치환된 C1- 4알킬; C2- 6알케닐; 및 1개의 R13으로 치환된 C2-6알케닐로 구성된 군으로부터 각기 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환된 1 또는 2개의 N 원자를 함유하는 6원 헤테로방향족 고리를 나타내거나;
또는 R3은 2-옥소-1,2-디히드로피리딘-3-일을 나타내며,
여기에서 상기 2-옥소-1,2-디히드로피리딘-3-일은 N 원자 상에 C1- 6알킬; C3- 6시클로알킬; Het1a; R18; R21; 1, 2 또는 3개의 할로 원자로 치환된 C1- 4알킬; 1, 2 또는 3개의 -OH 치환기로 치환된 C1- 4알킬; 1개의 R13으로 치환된 C1- 4알킬; 1개의 R18로 치환된 C1- 4알킬; C2- 6알케닐; 및 1개의 R13으로 치환된 C2- 6알케닐로 구성된 군으로부터 선택된 치환기로 임의로 치환될 수 있으며; 단 Het1a 또는 R18이 2-옥소-1,2-디히드로피리딘-3-일의 N 원자에 직접 결합될 때, 상기 Het1a 또는 R18은 고리 탄소 원자를 통해 N 원자에 결합되며;
여기에서 상기 2-옥소-1,2-디히드로피리딘-3-일은 고리 탄소 원자 상에 할로; 시아노; C1- 6알킬; -O-C1- 4알킬; -C(=O)-R10; -S(=O)2-C1- 4알킬; -S(=O)(=N-R20a)-C1- 4알킬; 1, 2 또는 3개의 할로 원자로 치환된 -O-C1- 4알킬; -O-C1- 4알킬-R12; C3- 6시클로알킬; -O-C3- 6시클로알킬; Het1a; -O-Het1b; R18; R21; -P(=O)-(C1- 4알킬)2; -NH-C(=O)-C1- 4알킬; -NH-C(=O)-Het1g; -NR17aR17b; 1, 2 또는 3개의 할로 원자로 치환된 C1- 4알킬; 1, 2 또는 3개의 -OH 치환기로 치환된 C1- 4알킬; 1개의 R13으로 치환된 C1- 4알킬; 1개의 R18로 치환된 C1- 4알킬; C2-6알케닐; 및 1개의 R13으로 치환된 C2- 6알케닐로 구성된 군으로부터 각기 독립적으로 선택된 총 1, 2 또는 3개의 치환기로 임의로 치환될 수 있고;
Het2는 하기 화학식(b-1)의 헤테로시클릴을 나타내며:
;
(b-1)은 O, S, S(=O)p 및 N으로부터 선택된 1개의 추가의 헤테로원자를 임의로 함유하는 N-연결된 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내거나, 또는 O, S, S(=O)p 및 N으로부터 각기 독립적으로 선택된 1 또는 2개의 추가의 헤테로원자를 임의로 함유하는 융합, 스피로 및 가교된 사이클을 포함하는 N-연결된 6 내지 11원 비시클릭 포화 헤테로시클릴을 나타내고;
여기에서 (b-1)이 1 또는 2개의 추가의 N 원자를 함유하는 경우, 상기 1 또는 2개의 N 원자는 C1-4알킬로 임의로 치환될 수 있으며;
여기에서 (b-1)은 1, 2 또는 3개의 고리 C 원자 상에 할로, -OH, 시아노, C1-4알킬, -O-C1- 4알킬, -NH2, -NH(C1- 4알킬), -N(C1- 4알킬)2, 및 C1- 4알킬-OH로 구성된 군으로부터 각기 독립적으로 선택된 1 또는 2개의 치환기로 임의로 치환될 수 있고;
R11b는 수소; Het1e; C1- 4알킬; C1- 4알킬-Het5; 할로, -OH 및 -O-C1- 4알킬로 구성된 군으로부터 각기 독립적으로 선택된 1, 2 또는 3개의 치환기로 치환된 C1- 4알킬; C3- 6시클로알킬; 또는 할로, -OH 및 -O-C1- 4알킬로 구성된 군으로부터 각기 독립적으로 선택된 1, 2 또는 3개의 치환기로 치환된 C3- 6시클로알킬을 나타내며;
R14b, R14d, R15b, R17b 및 R19b는 각기 독립적으로 수소; C1- 4알킬; C3- 6시클로알킬; 또는 할로, -OH 및 -O-C1- 4알킬로 구성된 군으로부터 선택된 1개의 치환기로 치환된 C1-4알킬을 나타내는 화합물. - 제1항에 있어서,
R5는 Het3a, -NR6aR6b, 또는 -OR7을 나타내며;
R6b는 C1- 4알킬; C3- 6시클로알킬; -C(=O)-C1- 4알킬; 또는 -OH 및 -S(=O)2-C1- 4알킬로 구성된 군으로부터 선택된 1개의 치환기로 치환된 C1- 4알킬을 나타내고;
R7은 수소, C1- 4알킬, -C1- 4알킬-NR8aR8b, -C(=O)-R9, 또는 -C1- 4알킬-Het3b를 나타내며;
R8a는 수소를 나타내고;
R8b는 C1- 4알킬, 또는 C3- 6시클로알킬을 나타내며;
R9는 C1- 4알킬, 또는 -NH2로 구성된 군으로부터 선택된 1개의 치환기로 치환된 C1-4알킬을 나타내고;
R3은 할로; 시아노; C1- 6알킬; -O-C1- 4알킬; -C(=O)-R10; -O-C1- 4알킬-R12; C3- 6시클로알킬; -O-C3- 6시클로알킬; Het1a; -O-Het1b; 1, 2 또는 3개의 -OH 치환기로 치환된 C1- 4알킬; R18; R21; -P(=O)-(C1- 4알킬)2; -NR17aR17b; 1, 2 또는 3개의 할로 원자로 치환된 C1- 4알킬; 1개의 R13으로 치환된 C1- 4알킬; C2- 6알케닐; 및 1개의 R13으로 치환된 C2- 6알케닐로 구성된 군으로부터 각기 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환된 1 또는 2개의 N 원자를 함유하는 6원 헤테로방향족 고리를 나타내거나;
또는 R3은 2-옥소-1,2-디히드로피리딘-3-일을 나타내고,
여기에서 상기 2-옥소-1,2-디히드로피리딘-3-일은 N 원자 상에 C1- 6알킬; 1, 2 또는 3개의 -OH 치환기로 치환된 C1- 4알킬; 1개의 R13으로 치환된 C1- 4알킬; 1개의 R18로 치환된 C1- 4알킬로 구성된 군으로부터 선택된 치환기로 임의로 치환될 수 있으며;
여기에서 상기 2-옥소-1,2-디히드로피리딘-3-일은 고리 탄소 원자 상에 할로; C1- 6알킬; -C(=O)-R10; 및 Het1a로 구성된 군으로부터 각기 독립적으로 선택된 총 1, 2 또는 3개의 치환기로 임의로 치환될 수 있고;
R10은 -O-C1- 4알킬, -NR11aR11b 또는 Het2를 나타내며;
R21은 3,6-디히드로-2H-피란-4-일을 나타내고;
Het1a, Het1c 및 Het1d는 각기 독립적으로 O 및 N으로부터 각기 독립적으로 선택된 1 또는 2개의 헤테로원자를 함유하는 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내고;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 가능하다면, 1 또는 2개의 고리 N 원자 상에 C1- 4알킬, C3- 6시클로알킬, 및 1개의 -OH 치환기로 치환된 C1- 4알킬로 구성된 군으로부터 각기 독립적으로 선택된 치환기로 임의로 치환될 수 있으며;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 1, 2 또는 3개의 고리 C 원자 상에 할로 및 C1- 4알킬로 구성된 군으로부터 각기 독립적으로 선택된 1 또는 2개의 치환기로 임의로 치환될 수 있고;
Het1b는 임의의 이용가능한 고리 탄소 원자를 통해 화학식(I)의 분자의 나머지 부분에 결합된 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내며, 상기 1 또는 2개의 헤테로원자를 함유하는 Het1b는 각기 독립적으로 O 및 N으로부터 선택되고; 여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 가능하다면, 1 또는 2개의 고리 N 원자 상에 C1- 4알킬 및 C3- 6시클로알킬로 구성된 군으로부터 각기 독립적으로 선택된 치환기로 임의로 치환될 수 있으며;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 1, 2 또는 3개의 고리 C 원자 상에 1 또는 2개의 할로 치환기로 임의로 치환될 수 있고;
Het2는 하기 화학식(b-1)의 헤테로시클릴을 나타내고:
;
(b-1)은 1개의 추가의 N 원자를 임의로 함유하는 N-연결된 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내며;
여기에서 (b-1)이 1개의 추가의 N 원자를 함유하는 경우, 상기 1개의 N 원자는 C1- 4알킬로 임의로 치환될 수 있고;
여기에서(b-1)은 1, 2 또는 3개의 고리 C 원자 상에 1 또는 2개의 -OH 치환기로 임의로 치환될 수 있으며;
R11b는 C1- 4알킬을 나타내고;
R13은 -O-C1- 4알킬, -C(=O)NR15aR15b, -NR19aR19b, C3- 6시클로알킬, 또는 Het1d를 나타내며;
R12는 -OH, -O-C1- 4알킬, -C(=O)NR14cR14d, C3- 6시클로알킬, 또는 Het1c를 나타내고;
Het3a 및 Het3b는 각기 독립적으로 하기 화학식(c-1)의 헤테로시클릴을 나타내며:
;
(c-1)은 O 및 N으로부터 선택된 1개의 추가의 헤테로원자를 임의로 함유하는 N-연결된 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내고;
R14d, R15b, R17b 및 R19b는 각기 독립적으로 C1- 4알킬; C3- 6시클로알킬; 또는 1개의 -O-C1-4알킬 치환기로 치환된 C1-4알킬을 나타내는 화합물. - 제1항 또는 제2항에 있어서,
R3은 제1항 또는 제2항에서 정의된 바와 같은 1, 2 또는 3개의 치환기로 임의로 치환된, 1 또는 2개의 N 원자를 함유하는 6원 헤테로방향족 고리를 나타내며;
R6b는 C1- 4알킬; C3- 6시클로알킬; -C(=O)-C1- 4알킬; 또는 -OH 및 -S(=O)2-C1- 4알킬로 구성된 군으로부터 선택된 1개의 치환기로 치환된 C1- 4알킬을 나타내고;
R7은 수소, C1- 4알킬, -C1- 4알킬-NR8aR8b, -C(=O)-R9, 또는 -C1- 4알킬-Het3b를 나타내며;
R8a는 수소를 나타내고;
R8b는 C1- 4알킬, 또는 C3- 6시클로알킬을 나타내며;
R9는 C1- 4알킬, 또는 -NH2로 구성된 군으로부터 선택된 1개의 치환기로 치환된 C1-4알킬을 나타내고;
R3은 할로; 시아노; C1- 6알킬; -O-C1- 4알킬; -C(=O)-R10; -O-C1- 4알킬-R12; C3- 6시클로알킬; -O-C3- 6시클로알킬; Het1a; -O-Het1b; R18; R21; -P(=O)-(C1- 4알킬)2; -NR17aR17b; 1, 2 또는 3개의 할로 원자로 치환된 C1- 4알킬; 1개의 R13으로 치환된 C1- 4알킬; C2- 6알케닐; 및 1개의 R13으로 치환된 C2- 6알케닐로 구성된 군으로부터 각기 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환된 1 또는 2개의 N 원자를 함유하는 6원 헤테로방향족 고리를 나타내고;
R10은 -O-C1- 4알킬, -NR11aR11b 또는 Het2를 나타내며;
R18은 1, 2 또는 3개의 N 원자를 함유하는 5원 방향족 고리를 나타내고; 여기에서 상기 5원 방향족 고리는 1개의 C1-4알킬 치환기로 임의로 치환될 수 있으며;
R21은 3,6-디히드로-2H-피란-4-일을 나타내고;
Het1a 및 Het1c는 각기 독립적으로 O 및 N으로부터 각기 독립적으로 선택된 1 또는 2개의 헤테로원자를 함유하는 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내며;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 가능하다면, 1 또는 2개의 고리 N 원자 상에 C1- 4알킬, 및 1개의 -OH 치환기로 치환된 C1- 4알킬로 구성된 군으로부터 각기 독립적으로 선택된 치환기로 임의로 치환될 수 있고;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 1, 2 또는 3개의 고리 C 원자 상에 1 또는 2개의 C1- 4알킬 치환기로 임의로 치환될 수 있으며;
Het1b는 임의의 이용가능한 고리 탄소 원자를 통해 화학식(I)의 분자의 나머지 부분에 결합된 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내고, 상기 1 또는 2개의 헤테로원자를 함유하는 Het1b는 각기 독립적으로 O 및 N으로부터 선택되며;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 가능하다면, 1 또는 2개의 고리 N 원자 상에 C1- 4알킬 치환기로 임의로 치환될 수 있으며;
Het2는 하기 화학식(b-1)의 헤테로시클릴을 나타내고:
;
(b-1)은 1개의 추가의 N 원자를 임의로 함유하는 N-연결된 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내며;
여기에서 (b-1)이 1개의 추가의 N 원자를 함유하는 경우, 상기 1개의 N 원자는 C1- 4알킬로 임의로 치환될 수 있으며;
R11b는 C1- 4알킬을 나타내고;
R13은 -O-C1- 4알킬, -C(=O)NR15aR15b, 또는 C3- 6시클로알킬을 나타내며;
R12는 -OH, -O-C1- 4알킬, -C(=O)NR14cR14d, C3- 6시클로알킬, 또는 Het1c를 나타내고;
Het3a 및 Het3b는 각기 독립적으로 하기 화학식(c-1)의 헤테로시클릴을 나타내며:
;
(c-1)은 O 및 N으로부터 선택된 1개의 추가의 헤테로원자를 임의로 함유하는 N-연결된 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내고;
R11a, R14c, R15a, R17a는 각기 독립적으로 수소 또는 C1- 4알킬을 나타내며;
R14d, R15b, R17b는 각기 독립적으로 C1- 4알킬; 또는 1개의 -O-C1- 4알킬 치환기로 치환된 C1- 4알킬을 나타내는 화합물. - 제1항 또는 제2항에 있어서,
R2는 1개의 R5로 치환된 C1- 6알킬을 나타내며;
R3은 제1항 또는 제2항에서 정의된 바와 같은 1, 2 또는 3개의 치환기로 임의로 치환된 1 또는 2개의 N 원자를 함유하는 6원 헤테로방향족 고리를 나타내고;
R5는 -NR6aR6b, 또는 -OR7을 나타내며;
R6a는 수소를 나타내고;
R6b는 -C(=O)-C1- 4알킬을 나타내며;
R7은 수소를 나타내고;
R3은 할로; 시아노; C1- 6알킬; -O-C1- 4알킬; -C(=O)-R10; -O-C1- 4알킬-R12; Het1a; -NR17aR17b; 1개의 R13으로 치환된 C1- 4알킬로 구성된 군으로부터 각기 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환된 1 또는 2개의 N 원자를 함유하는 6원 헤테로방향족 고리를 나타내며;
R10은 -NR11aR11b를 나타내고;
Het1a는 O 및 N으로부터 각기 독립적으로 선택된 1 또는 2개의 헤테로원자를 함유하는 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내며;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 가능하다면, 1 또는 2개의 고리 N 원자 상에 C1- 4알킬, 및 1개의 -OH 치환기로 치환된 C1- 4알킬로 구성된 군으로부터 각기 독립적으로 선택된 치환기로 임의로 치환될 수 있으며;
R11b는 C1- 4알킬을 나타내고;
R13은 -O-C1- 4알킬을 나타내며;
R12는 -O-C1- 4알킬을 나타내고;
R17a는 수소를 나타내며;
R17b는 1개의 -O-C1- 4알킬 치환기로 치환된 C1- 4알킬을 나타내는 화합물. - 제1항에 있어서,
R2는 1개의 R5로 치환된 C1- 6알킬을 나타내며;
R3은 제1항 또는 제2항에서 정의된 바와 같은 1, 2 또는 3개의 치환기로 임의로 치환된 1 또는 2개의 N 원자를 함유하는 6원 헤테로방향족 고리를 나타내고;
R4는 수소를 나타내며;
R5는 -OR7을 나타내고;
R7은 수소를 나타내며;
R3은 할로; 시아노; C1- 6알킬; -O-C1- 4알킬; -C(=O)-R10; -O-C1- 4알킬-R12; Het1a; -NR17aR17b; 1개의 R13으로 치환된 C1- 4알킬로 구성된 군으로부터 각기 독립적으로 선택된 1, 2 또는 3개의 치환기로 임의로 치환된 1 또는 2개의 N 원자를 함유하는 6원 헤테로방향족 고리를 나타내고;
R10은 -NR11aR11b를 나타내며;
Het1a는 O 및 N으로부터 각기 독립적으로 선택된 1 또는 2개의 헤테로원자를 함유하는 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내고;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 가능하다면, 1 또는 2개의 고리 N 원자 상에 C1- 4알킬, 및 1개의 -OH 치환기로 치환된 C1- 4알킬로 구성된 군으로부터 각기 독립적으로 선택된 치환기로 임의로 치환될 수 있으며;
R11b는 C1- 4알킬을 나타내고;
R13은 -O-C1- 4알킬을 나타내며;
R12는 -O-C1- 4알킬을 나타내고;
R17a는 수소를 나타내며;
R17b는 1개의 -O-C1- 4알킬 치환기로 치환된 C1- 4알킬을 나타내는 화합물. - 제1항 또는 제2항에 있어서,
R2는 1개의 R5로 치환된 C1- 6알킬을 나타내며;
R4는 수소를 나타내고;
R5는 -OR7을 나타내며;
R7은 수소를 나타내고;
R3은 2-옥소-1,2-디히드로피리딘-3-일을 나타내며,
여기에서 상기 2-옥소-1,2-디히드로피리딘-3-일은 N 원자 상에 C1- 6알킬; 1, 2 또는 3개의 -OH 치환기로 치환된 C1- 4알킬; 1개의 R13으로 치환된 C1- 4알킬; 1개의 R18로 치환된 C1- 4알킬로 구성된 군으로부터 선택된 치환기로 임의로 치환될 수 있고;
여기에서 상기 2-옥소-1,2-디히드로피리딘-3-일은 고리 탄소 원자 상에 할로; C1- 6알킬; 및 Het1a로 구성된 군으로부터 각기 독립적으로 선택된 총 1, 2 또는 3개의 치환기로 임의로 치환될 수 있으며;
R18은 1, 2 또는 3개의 N 원자를 함유하는 5원 방향족 고리를 나타내고; 상기 5원 방향족 고리는 C1- 4알킬 및 C3- 6시클로알킬로 구성된 군으로부터 선택된 1개의 치환기로 임의로 치환될 수 있고;
Het1a 및 Het1d는 각기 독립적으로 O 및 N으로부터 각기 독립적으로 선택된 1 또는 2개의 헤테로원자를 함유하는 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내며;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 가능하다면, 1 또는 2개의 고리 N 원자 상에 C1- 4알킬로 임의로 치환될 수 있고;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 1 또는 2개의 고리 C-원자 상에 할로 및 C1- 4알킬로 구성된 군으로부터 각기 독립적으로 선택된 1 또는 2개의 치환기로 임의로 치환될 수 있으며;
R13은 -O-C1- 4알킬, -C(=O)NR15aR15b, C3- 6시클로알킬, 또는 Het1d를 나타내고;
R15a는 C1- 4알킬을 나타내며;
R15b는 C1- 4알킬을 나타내는 화합물. - 제1항 또는 제2항에 있어서,
R2는 1개의 R5로 치환된 C1- 6알킬을 나타내고;
R4는 수소를 나타내며;
R5는 -OR7을 나타내고;
R7은 수소를 나타내며;
R3은 2-옥소-1,2-디히드로피리딘-3-일을 나타내고,
여기에서 상기 2-옥소-1,2-디히드로피리딘-3-일은 N 원자 상에 C1- 6알킬; 1개의 R13으로 치환된 C1- 4알킬; 1개의 R18로 치환된 C1- 4알킬로 구성된 군으로부터 선택된 치환기로 임의로 치환될 수 있으며;
여기에서 상기 2-옥소-1,2-디히드로피리딘-3-일은 고리 탄소 원자 상에 할로 및 C1- 6알킬로 구성된 군으로부터 각기 독립적으로 선택된 총 1, 2 또는 3개의 치환기로 임의로 치환될 수 있고;
R18은 1, 2 또는 3개의 N 원자를 함유하는 5원 방향족 고리를 나타내며; 여기에서 상기 5원 방향족 고리는 1개의 C1- 4알킬 치환기로 임의로 치환될 수 있으며;
Het1d는 O 및 N으로부터 각기 독립적으로 선택된 1 또는 2개의 헤테로원자를 함유하는 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내고;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 1 또는 2개의 고리 C-원자 상에 할로 및 C1- 4알킬로 구성된 군으로부터 각기 독립적으로 선택된 1 또는 2개의 치환기로 임의로 치환될 수 있으며;
R13은 Het1d를 나타내는 화합물. - 제1항 또는 제2항에 있어서,
R5는 -NR6aR6b, 또는 -OR7을 나타내며;
R6b는 수소; C1- 4알킬; C3- 6시클로알킬; -C(=O)-C1- 4알킬; -S(=O)2-C1- 4알킬; -OH 및 -NR16aR16b로 구성된 군으로부터 선택된 1개의 치환기로 치환된 -C(=O)-C1- 4알킬; 또는 -OH 및 -S(=O)2-C1- 4알킬로 구성된 군으로부터 선택된 1개의 치환기로 치환된 C1-4알킬을 나타내고;
R7은 수소, C1- 4알킬, -C1- 4알킬-NR8aR8b, -C(=O)-R9, -S(=O)2-OH, -P(=O)2-OH, 또는 -(C=O)-CH(NH2)-C1-4알킬-Ar1을 나타내는 화합물. - 제1항 내지 제4항 중 어느 한 항에 있어서,
R1은 메틸을 나타내고;
R2는 메틸 또는 -CH2-OH를 나타내는 화합물. - 제1항 내지 제10항 중 어느 한 항에 있어서,
R4는 수소인 화합물. - 제1항 내지 제5항 중 어느 한 항에 있어서,
R5는 -OR7을 나타내고;
R7은 수소를 나타내는 화합물. - 제1항 또는 제2항에 있어서,
Het1a, Het1c 및 Het1d는 각기 독립적으로 O, S, S(=O)p 및 N으로부터 각기 독립적으로 선택된 1 또는 2개의 헤테로원자를 함유하는 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내며;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 가능하다면, 1 또는 2개의 고리 N 원자 상에 C1- 4알킬, C3- 6시클로알킬, 및 -OH 및 -O-C1- 4알킬로 구성된 군으로부터 선택된 1개의 치환기로 치환된 C1- 4알킬로 구성된 군으로부터 각기 독립적으로 선택된 치환기로 임의로 치환될 수 있으며;
여기에서 상기 4 내지 7원 모노시클릭 포화 헤테로시클릴은 1, 2 또는 3개의 고리 C 원자 상에 -OH, 할로, C1- 4알킬, 시아노, -C(=O)-C1- 4알킬, -O-C1- 4알킬, -NH2, -NH(C1-4알킬), 및 -N(C1- 4알킬)2로 구성된 군으로부터 각기 독립적으로 선택된 1 또는 2개의 치환기로 임의로 치환될 수 있는 화합물. - 제1항 또는 제2항에 있어서,
Het2는 하기 화학식(b-1)의 헤테로시클릴을 나타내고:
;
(b-1)은 O, S, S(=O)p 및 N으로부터 선택된 1개의 추가의 헤테로원자를 임의로 함유하는 N-연결된 4 내지 7원 모노시클릭 포화 헤테로시클릴을 나타내며;
여기에서 (b-1)이 1개의 추가의 N 원자를 함유하는 경우, 상기 N 원자는 임의로 C1- 4알킬로 치환될 수 있고;
여기에서(b-1)은 1, 2 또는 3개의 고리 C 원자 상에 할로, -OH, 시아노, C1- 4알킬, -O-C1- 4알킬, -NH2, -NH(C1- 4알킬), -N(C1- 4알킬)2, 및 C1- 4알킬-OH로 구성된 군으로부터 각기 독립적으로 선택된 1 또는 2개의 치환기로 임의로 치환될 수 있는 화합물. - 제1항 내지 제15항 중 어느 한 항의 화합물 및 약학적으로 허용가능한 담체 또는 희석제를 포함하는 약학 조성물.
- 제1항 내지 제15항 중 어느 한 항에 있어서, 의약으로 사용되는 화합물.
- 제1항 내지 제15항 중 어느 한 항에 있어서, 암의 예방 또는 치료에 사용되는 화합물.
- 제18항에 있어서, 암의 예방 또는 치료에 사용되는 약학 조성물.
- 제1항 내지 제15항 중 어느 한 항의 화합물의 유효량을 온혈 동물에게 투여하는 것을 포함하는, 온혈 동물에서 세포 증식성 질환을 치료 또는 예방하는 방법.
Applications Claiming Priority (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP16152415 | 2016-01-22 | ||
| EP16152414 | 2016-01-22 | ||
| EP16152414.5 | 2016-01-22 | ||
| EP16152415.2 | 2016-01-22 | ||
| EP16159659 | 2016-03-10 | ||
| EP16159659.8 | 2016-03-10 | ||
| EP16159658.0 | 2016-03-10 | ||
| EP16159658 | 2016-03-10 | ||
| PCT/EP2017/051160 WO2017125534A1 (en) | 2016-01-22 | 2017-01-20 | New 6-membered heteroaromatic substituted cyanoindoline derivatives as nik inhibitors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20180098679A true KR20180098679A (ko) | 2018-09-04 |
| KR102720461B1 KR102720461B1 (ko) | 2024-10-21 |
Family
ID=57868253
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187024027A Active KR102720461B1 (ko) | 2016-01-22 | 2017-01-20 | Nik 억제제로서의 신규 6원 헤테로방향족 치환된 시아노인돌린 유도체 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US11001569B2 (ko) |
| EP (1) | EP3405464B1 (ko) |
| JP (1) | JP6916796B2 (ko) |
| KR (1) | KR102720461B1 (ko) |
| CN (1) | CN109311846B (ko) |
| AU (1) | AU2017208555B2 (ko) |
| CA (1) | CA3012031C (ko) |
| ES (1) | ES2776658T3 (ko) |
| WO (1) | WO2017125534A1 (ko) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA3012031C (en) | 2016-01-22 | 2024-03-26 | Janssen Pharmaceutica Nv | 6-membered heteroaromatic substituted cyanoindoline derivatives as nik inhibitors |
| ES2775449T3 (es) | 2016-01-22 | 2020-07-27 | Janssen Pharmaceutica Nv | Nuevos derivados de cianoindolina sustituida como inhibidores de nik |
| US20190119299A1 (en) * | 2016-06-30 | 2019-04-25 | Janssen Pharmaceutica Nv | Cyanoindoline derivatives as nik inhibitors |
| CN109641882B (zh) | 2016-06-30 | 2022-10-28 | 杨森制药有限公司 | 作为nik抑制剂的杂芳族衍生物 |
| EP3617195B1 (en) * | 2017-04-27 | 2024-08-28 | Mochida Pharmaceutical Co., Ltd. | Novel tetrahydronaphthyl urea derivatives as inhibitors of tropomyosin receptor kinase a for the treatment of pain |
| EP3702354B1 (en) * | 2017-09-30 | 2024-05-22 | Haihe Biopharma Co., Ltd. | Compound having erk kinase inhibitory activity and use thereof |
| EP4480953B1 (en) | 2018-10-22 | 2026-02-04 | Alumis Inc. | Tyk2 inhibitors and uses thereof |
| CR20210587A (es) | 2019-05-31 | 2022-02-11 | Janssen Pharmaceutica Nv | Inhibidores de molécula pequeña de quinasa inductora de nf-kb |
| CA3242545A1 (en) * | 2021-12-20 | 2023-06-29 | Nimml Institute | Immunoregulatory compounds |
| FI4387730T3 (fi) * | 2022-09-08 | 2025-08-25 | Redx Pharma Ltd | ROCK-inhibiittorin kiinteät muodot |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002079197A1 (en) * | 2001-03-29 | 2002-10-10 | Vertex Pharmaceuticals Incorporated | Inhibitors of c-jun n-terminal kinases (jnk) and other protein kinases |
| WO2003030909A1 (en) * | 2001-09-25 | 2003-04-17 | Bayer Pharmaceuticals Corporation | 2- and 4-aminopyrimidines n-substtituded by a bicyclic ring for use as kinase inhibitors in the treatment of cancer |
| WO2009158011A1 (en) * | 2008-06-26 | 2009-12-30 | Amgen Inc. | Alkynyl alcohols as kinase inhibitors |
| WO2010042337A1 (en) * | 2008-10-07 | 2010-04-15 | Merck Sharp & Dohme Corp. | Novel 6-azaindole aminopyrimidine derivatives having nik inhibitory activity |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030004174A9 (en) | 2000-02-17 | 2003-01-02 | Armistead David M. | Kinase inhibitors |
| AU2001245353A1 (en) | 2000-02-29 | 2001-09-12 | Cor Therapeutics, Inc. | Benzamides and related inhibitors of factor xa |
| EP1397142A4 (en) | 2001-06-19 | 2004-11-03 | Bristol Myers Squibb Co | PYRIMIDINE PHOSPHODIESTERASE (PDE) INHIBITORS 7 |
| DK2361248T3 (en) | 2008-06-27 | 2019-01-14 | Celgene Car Llc | Heteroberl compounds and uses thereof |
| BR112012003637A2 (pt) | 2009-08-17 | 2017-04-25 | Memorial Sloan Kettering Cancer Center | "compostos de ligação de proteína de choque térmico, composições, e métodos para preparar e usar os mesmos" |
| WO2011153553A2 (en) | 2010-06-04 | 2011-12-08 | The Regents Of The University Of California | Methods and compositions for kinase inhibition |
| KR101764952B1 (ko) | 2010-07-29 | 2017-08-03 | 리겔 파마슈티칼스, 인크. | Ampk-활성화 헤테로시클릭 화합물 및 그의 사용 방법 |
| BR112013026202A2 (pt) * | 2011-04-12 | 2017-07-25 | Myrexis Inc | composições e usos terapêuticos de inibidores quinase epsilon relacionado a ikk e quinase i de ligação a tank |
| TWI663166B (zh) | 2013-04-24 | 2019-06-21 | 健生藥品公司 | 新化合物 |
| NZ748260A (en) | 2013-08-30 | 2020-01-31 | Ptc Therapeutics Inc | Substituted pyrimidine bmi-1 inhibitors |
| TWI627173B (zh) | 2013-09-26 | 2018-06-21 | 比利時商健生藥品公司 | 作為NIK抑制劑的新穎3-(1H-吡唑-4-基)-1H-吡咯并[2,3-c]吡啶衍生物 |
| TWI704146B (zh) * | 2013-09-26 | 2020-09-11 | 比利時商健生藥品公司 | 用作NIK抑制劑之新的1-(4-嘧啶基)-1H-吡唑並[3,2-c]吡啶衍生物 |
| HRP20190039T1 (hr) | 2014-04-04 | 2019-03-08 | Syros Pharmaceuticals, Inc. | Inhibitori ciklin-ovisne kinaze 7 (cdk7) |
| KR20170030474A (ko) | 2014-05-22 | 2017-03-17 | 더 유니버시티 오브 시드니 | 오메가―3 유사체 |
| WO2016022645A1 (en) | 2014-08-06 | 2016-02-11 | Merck Sharp & Dohme Corp. | Heterocyclic cgrp receptor antagonists |
| WO2016062791A1 (en) * | 2014-10-23 | 2016-04-28 | Janssen Pharmaceutica Nv | New pyrazole derivatives as nik inhibitors |
| CN106928216A (zh) * | 2015-12-31 | 2017-07-07 | 中国科学院上海药物研究所 | 具有erk激酶抑制活性的化合物、其制备方法和用途 |
| ES2775449T3 (es) | 2016-01-22 | 2020-07-27 | Janssen Pharmaceutica Nv | Nuevos derivados de cianoindolina sustituida como inhibidores de nik |
| CA3012031C (en) | 2016-01-22 | 2024-03-26 | Janssen Pharmaceutica Nv | 6-membered heteroaromatic substituted cyanoindoline derivatives as nik inhibitors |
| SMT202300273T1 (it) | 2016-03-16 | 2023-09-06 | Kura Oncology Inc | Derivati di tieno[2,3–d]pirimidina sostituiti come inibitori di menina–mll e metodi d’uso |
| CN109641882B (zh) | 2016-06-30 | 2022-10-28 | 杨森制药有限公司 | 作为nik抑制剂的杂芳族衍生物 |
| US20190119299A1 (en) | 2016-06-30 | 2019-04-25 | Janssen Pharmaceutica Nv | Cyanoindoline derivatives as nik inhibitors |
-
2017
- 2017-01-20 CA CA3012031A patent/CA3012031C/en active Active
- 2017-01-20 KR KR1020187024027A patent/KR102720461B1/ko active Active
- 2017-01-20 WO PCT/EP2017/051160 patent/WO2017125534A1/en not_active Ceased
- 2017-01-20 CN CN201780019718.7A patent/CN109311846B/zh active Active
- 2017-01-20 AU AU2017208555A patent/AU2017208555B2/en active Active
- 2017-01-20 JP JP2018535877A patent/JP6916796B2/ja active Active
- 2017-01-20 US US16/071,298 patent/US11001569B2/en active Active
- 2017-01-20 EP EP17701111.1A patent/EP3405464B1/en active Active
- 2017-01-20 ES ES17701111T patent/ES2776658T3/es active Active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002079197A1 (en) * | 2001-03-29 | 2002-10-10 | Vertex Pharmaceuticals Incorporated | Inhibitors of c-jun n-terminal kinases (jnk) and other protein kinases |
| WO2003030909A1 (en) * | 2001-09-25 | 2003-04-17 | Bayer Pharmaceuticals Corporation | 2- and 4-aminopyrimidines n-substtituded by a bicyclic ring for use as kinase inhibitors in the treatment of cancer |
| WO2009158011A1 (en) * | 2008-06-26 | 2009-12-30 | Amgen Inc. | Alkynyl alcohols as kinase inhibitors |
| WO2010042337A1 (en) * | 2008-10-07 | 2010-04-15 | Merck Sharp & Dohme Corp. | Novel 6-azaindole aminopyrimidine derivatives having nik inhibitory activity |
Also Published As
| Publication number | Publication date |
|---|---|
| CA3012031C (en) | 2024-03-26 |
| CA3012031A1 (en) | 2017-07-27 |
| CN109311846A (zh) | 2019-02-05 |
| EP3405464B1 (en) | 2019-12-04 |
| JP2019502714A (ja) | 2019-01-31 |
| AU2017208555A1 (en) | 2018-08-02 |
| WO2017125534A1 (en) | 2017-07-27 |
| US11001569B2 (en) | 2021-05-11 |
| AU2017208555B2 (en) | 2021-03-18 |
| EP3405464A1 (en) | 2018-11-28 |
| US20200109129A1 (en) | 2020-04-09 |
| JP6916796B2 (ja) | 2021-08-11 |
| ES2776658T3 (es) | 2020-07-31 |
| KR102720461B1 (ko) | 2024-10-21 |
| CN109311846B (zh) | 2021-03-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102720461B1 (ko) | Nik 억제제로서의 신규 6원 헤테로방향족 치환된 시아노인돌린 유도체 | |
| KR102784966B1 (ko) | Nik 억제제로서 신규 치환된 시아노인돌린 유도체 | |
| KR102517352B1 (ko) | Nik 억제제로서의 헤테로방향족 유도체 | |
| KR102524622B1 (ko) | Nik 억제제로서의 신규 티에노피리미딘 유도체 | |
| KR102523405B1 (ko) | Nik 억제제로서의 신규 피라졸로피리미딘 유도체 | |
| KR102587619B1 (ko) | Nik 억제제로서의 시아노인돌린 유도체 | |
| KR102662373B1 (ko) | Nik 억제제로서의 신규 치환 아자인돌린 유도체 | |
| RU2780577C2 (ru) | Новые замещенные производные азаиндолина в качестве ингибиторов nik | |
| HK1261385A1 (en) | New substituted cyanoindoline derivatives as nik inhibitors | |
| HK1261385B (en) | New substituted cyanoindoline derivatives as nik inhibitors | |
| EA037358B1 (ru) | Новые замещённые производные цианиндолина в качестве nik-ингибиторов |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0105 | International application |
Patent event date: 20180821 Patent event code: PA01051R01D Comment text: International Patent Application |
|
| PG1501 | Laying open of application | ||
| PA0201 | Request for examination |
Patent event code: PA02012R01D Patent event date: 20220113 Comment text: Request for Examination of Application |
|
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection |
Comment text: Notification of reason for refusal Patent event date: 20240312 Patent event code: PE09021S01D |
|
| E701 | Decision to grant or registration of patent right | ||
| PE0701 | Decision of registration |
Patent event code: PE07011S01D Comment text: Decision to Grant Registration Patent event date: 20240815 |
|
| GRNT | Written decision to grant | ||
| PR0701 | Registration of establishment |
Comment text: Registration of Establishment Patent event date: 20241017 Patent event code: PR07011E01D |
|
| PR1002 | Payment of registration fee |
Payment date: 20241017 End annual number: 3 Start annual number: 1 |
|
| PG1601 | Publication of registration |