KR20180098651A - 발광 화합물 - Google Patents
발광 화합물 Download PDFInfo
- Publication number
- KR20180098651A KR20180098651A KR1020187021898A KR20187021898A KR20180098651A KR 20180098651 A KR20180098651 A KR 20180098651A KR 1020187021898 A KR1020187021898 A KR 1020187021898A KR 20187021898 A KR20187021898 A KR 20187021898A KR 20180098651 A KR20180098651 A KR 20180098651A
- Authority
- KR
- South Korea
- Prior art keywords
- ring
- substituted
- tadf
- species
- ring system
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Ceased
Links
- 150000001875 compounds Chemical class 0.000 title claims description 10
- 125000004122 cyclic group Chemical group 0.000 claims abstract description 57
- 125000003118 aryl group Chemical group 0.000 claims abstract description 42
- 125000001072 heteroaryl group Chemical group 0.000 claims abstract description 29
- 230000003111 delayed effect Effects 0.000 claims abstract description 19
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims abstract description 17
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 claims abstract description 12
- 125000000623 heterocyclic group Chemical group 0.000 claims abstract description 10
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 claims description 25
- -1 -CF 3 Chemical group 0.000 claims description 23
- 125000001424 substituent group Chemical group 0.000 claims description 22
- 125000000217 alkyl group Chemical group 0.000 claims description 19
- 150000002148 esters Chemical class 0.000 claims description 12
- 229910000073 phosphorus hydride Inorganic materials 0.000 claims description 12
- 150000003003 phosphines Chemical class 0.000 claims description 11
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 9
- 125000004414 alkyl thio group Chemical group 0.000 claims description 8
- 125000002252 acyl group Chemical group 0.000 claims description 7
- 125000003368 amide group Chemical group 0.000 claims description 7
- 238000000034 method Methods 0.000 claims description 7
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 7
- 125000005420 sulfonamido group Chemical group S(=O)(=O)(N*)* 0.000 claims description 7
- 125000003441 thioacyl group Chemical group 0.000 claims description 7
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 claims description 6
- 150000001408 amides Chemical class 0.000 claims description 6
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 6
- 150000001299 aldehydes Chemical class 0.000 claims description 5
- 125000003545 alkoxy group Chemical group 0.000 claims description 5
- 125000001246 bromo group Chemical group Br* 0.000 claims description 5
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 5
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N fluorene Chemical compound C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 claims description 5
- 125000001153 fluoro group Chemical group F* 0.000 claims description 5
- 229910052739 hydrogen Inorganic materials 0.000 claims description 5
- 125000002346 iodo group Chemical group I* 0.000 claims description 5
- 150000002576 ketones Chemical class 0.000 claims description 5
- 229910052757 nitrogen Inorganic materials 0.000 claims description 5
- 125000000008 (C1-C10) alkyl group Chemical group 0.000 claims description 4
- FKASFBLJDCHBNZ-UHFFFAOYSA-N 1,3,4-oxadiazole Chemical group C1=NN=CO1 FKASFBLJDCHBNZ-UHFFFAOYSA-N 0.000 claims description 4
- XFXPMWWXUTWYJX-UHFFFAOYSA-N Cyanide Chemical compound N#[C-] XFXPMWWXUTWYJX-UHFFFAOYSA-N 0.000 claims description 4
- 125000005843 halogen group Chemical group 0.000 claims description 4
- 239000000463 material Substances 0.000 claims description 4
- 150000003457 sulfones Chemical class 0.000 claims description 4
- 150000003462 sulfoxides Chemical class 0.000 claims description 4
- 229910052760 oxygen Inorganic materials 0.000 claims description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 3
- 229920006395 saturated elastomer Polymers 0.000 claims description 3
- 229910052717 sulfur Inorganic materials 0.000 claims description 3
- 238000007725 thermal activation Methods 0.000 claims description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims 2
- 150000000178 1,2,4-triazoles Chemical class 0.000 claims 1
- JIHQDMXYYFUGFV-UHFFFAOYSA-N 1,3,5-triazine Chemical compound C1=NC=NC=N1 JIHQDMXYYFUGFV-UHFFFAOYSA-N 0.000 claims 1
- 150000004657 carbamic acid derivatives Chemical class 0.000 claims 1
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 claims 1
- 150000003216 pyrazines Chemical class 0.000 claims 1
- 150000003230 pyrimidines Chemical class 0.000 claims 1
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 27
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 17
- 239000000243 solution Substances 0.000 description 16
- 238000006243 chemical reaction Methods 0.000 description 11
- 238000004770 highest occupied molecular orbital Methods 0.000 description 11
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 description 11
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 10
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 10
- 239000000203 mixture Substances 0.000 description 10
- 239000002904 solvent Substances 0.000 description 8
- WJFKNYWRSNBZNX-UHFFFAOYSA-N 10H-phenothiazine Chemical compound C1=CC=C2NC3=CC=CC=C3SC2=C1 WJFKNYWRSNBZNX-UHFFFAOYSA-N 0.000 description 7
- 230000009102 absorption Effects 0.000 description 7
- 238000010521 absorption reaction Methods 0.000 description 7
- 229950000688 phenothiazine Drugs 0.000 description 7
- 239000007787 solid Substances 0.000 description 7
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 6
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- 238000007872 degassing Methods 0.000 description 6
- UJOBWOGCFQCDNV-UHFFFAOYSA-N Carbazole Natural products C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 5
- 238000002484 cyclic voltammetry Methods 0.000 description 5
- 238000000295 emission spectrum Methods 0.000 description 5
- 238000004896 high resolution mass spectrometry Methods 0.000 description 5
- 238000005259 measurement Methods 0.000 description 5
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 5
- 239000000523 sample Substances 0.000 description 5
- 239000010409 thin film Substances 0.000 description 5
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical class CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 4
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- DMBHHRLKUKUOEG-UHFFFAOYSA-N diphenylamine Chemical compound C=1C=CC=CC=1NC1=CC=CC=C1 DMBHHRLKUKUOEG-UHFFFAOYSA-N 0.000 description 4
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 4
- 239000004926 polymethyl methacrylate Substances 0.000 description 4
- 238000006862 quantum yield reaction Methods 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- 239000012925 reference material Substances 0.000 description 4
- 230000002441 reversible effect Effects 0.000 description 4
- 239000000377 silicon dioxide Substances 0.000 description 4
- 125000003363 1,3,5-triazinyl group Chemical class N1=C(N=CN=C1)* 0.000 description 3
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 3
- 238000000862 absorption spectrum Methods 0.000 description 3
- WVAHKIQKDXQWAR-UHFFFAOYSA-N anthracene-1-carbonitrile Chemical group C1=CC=C2C=C3C(C#N)=CC=CC3=CC2=C1 WVAHKIQKDXQWAR-UHFFFAOYSA-N 0.000 description 3
- 238000004440 column chromatography Methods 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 235000019439 ethyl acetate Nutrition 0.000 description 3
- 230000005284 excitation Effects 0.000 description 3
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 3
- 125000004433 nitrogen atom Chemical group N* 0.000 description 3
- 239000012044 organic layer Substances 0.000 description 3
- 238000004809 thin layer chromatography Methods 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- AZQWKYJCGOJGHM-UHFFFAOYSA-N 1,4-benzoquinone Chemical compound O=C1C=CC(=O)C=C1 AZQWKYJCGOJGHM-UHFFFAOYSA-N 0.000 description 2
- HGEQVUZFWUSIOF-UHFFFAOYSA-N 10-fluoroanthracene-9-carbonitrile Chemical compound C1=CC=C2C(F)=C(C=CC=C3)C3=C(C#N)C2=C1 HGEQVUZFWUSIOF-UHFFFAOYSA-N 0.000 description 2
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical class C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- WTDHULULXKLSOZ-UHFFFAOYSA-N Hydroxylamine hydrochloride Chemical compound Cl.ON WTDHULULXKLSOZ-UHFFFAOYSA-N 0.000 description 2
- LOUPRKONTZGTKE-WZBLMQSHSA-N Quinine Chemical compound C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@@H]2[C@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-WZBLMQSHSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 2
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 125000005577 anthracene group Chemical group 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- TXCDCPKCNAJMEE-UHFFFAOYSA-N dibenzofuran Chemical compound C1=CC=C2C3=CC=CC=C3OC2=C1 TXCDCPKCNAJMEE-UHFFFAOYSA-N 0.000 description 2
- IYYZUPMFVPLQIF-UHFFFAOYSA-N dibenzothiophene Chemical compound C1=CC=C2C3=CC=CC=C3SC2=C1 IYYZUPMFVPLQIF-UHFFFAOYSA-N 0.000 description 2
- 239000003480 eluent Substances 0.000 description 2
- 239000010408 film Substances 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 238000005648 named reaction Methods 0.000 description 2
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical compound C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 description 2
- 230000003647 oxidation Effects 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- 230000001590 oxidative effect Effects 0.000 description 2
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical compound C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 2
- 125000001484 phenothiazinyl group Chemical group C1(=CC=CC=2SC3=CC=CC=C3NC12)* 0.000 description 2
- 238000005424 photoluminescence Methods 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 description 2
- 238000005215 recombination Methods 0.000 description 2
- 230000006798 recombination Effects 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 238000004528 spin coating Methods 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 239000003115 supporting electrolyte Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 230000007704 transition Effects 0.000 description 2
- UXJHQQLYKUVLIE-UHFFFAOYSA-N 1,2-dihydroacridine Chemical group C1=CC=C2N=C(C=CCC3)C3=CC2=C1 UXJHQQLYKUVLIE-UHFFFAOYSA-N 0.000 description 1
- VXBUUDWUCCIMRC-UHFFFAOYSA-N 10-carbazol-9-ylanthracene-9-carbonitrile Chemical compound C12=CC=CC=C2C(C#N)=C(C=CC=C2)C2=C1N1C2=CC=CC=C2C2=CC=CC=C21 VXBUUDWUCCIMRC-UHFFFAOYSA-N 0.000 description 1
- KAESVJOAVNADME-UHFFFAOYSA-N 1H-pyrrole Natural products C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 1
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 1
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 1
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 1
- BRUOAURMAFDGLP-UHFFFAOYSA-N 9,10-dibromoanthracene Chemical compound C1=CC=C2C(Br)=C(C=CC=C3)C3=C(Br)C2=C1 BRUOAURMAFDGLP-UHFFFAOYSA-N 0.000 description 1
- NRHBVROZGBJODW-UHFFFAOYSA-N C(#N)C=1C2=CC=CC=C2C(=C2C=CC=CC=12)N(C1=CC=CC=C1)C1=CC=CC=C1 Chemical compound C(#N)C=1C2=CC=CC=C2C(=C2C=CC=CC=12)N(C1=CC=CC=C1)C1=CC=CC=C1 NRHBVROZGBJODW-UHFFFAOYSA-N 0.000 description 1
- JEGDAVOUVOOUFC-UHFFFAOYSA-N C(#N)C=1C2=CC=CC=C2C(=C2C=CC=CC=12)N1C2=CC=CC=C2SC=2C=CC=CC1=2 Chemical compound C(#N)C=1C2=CC=CC=C2C(=C2C=CC=CC=12)N1C2=CC=CC=C2SC=2C=CC=CC1=2 JEGDAVOUVOOUFC-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 235000001258 Cinchona calisaya Nutrition 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 238000004639 Schlenk technique Methods 0.000 description 1
- 238000011000 absolute method Methods 0.000 description 1
- 150000007960 acetonitrile Chemical class 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 238000005273 aeration Methods 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 150000001491 aromatic compounds Chemical class 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 150000001540 azides Chemical class 0.000 description 1
- 125000005605 benzo group Chemical group 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 150000001716 carbazoles Chemical class 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- LOUPRKONTZGTKE-UHFFFAOYSA-N cinchonine Natural products C1C(C(C2)C=C)CCN2C1C(O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-UHFFFAOYSA-N 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 238000006482 condensation reaction Methods 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- BOXSCYUXSBYGRD-UHFFFAOYSA-N cyclopenta-1,3-diene;iron(3+) Chemical compound [Fe+3].C=1C=C[CH-]C=1.C=1C=C[CH-]C=1 BOXSCYUXSBYGRD-UHFFFAOYSA-N 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 238000003113 dilution method Methods 0.000 description 1
- ZOMNIUBKTOKEHS-UHFFFAOYSA-L dimercury dichloride Chemical class Cl[Hg][Hg]Cl ZOMNIUBKTOKEHS-UHFFFAOYSA-L 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 230000005611 electricity Effects 0.000 description 1
- 238000002848 electrochemical method Methods 0.000 description 1
- 230000005518 electrochemistry Effects 0.000 description 1
- 238000000921 elemental analysis Methods 0.000 description 1
- 230000005281 excited state Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- KTWOOEGAPBSYNW-UHFFFAOYSA-N ferrocene Chemical compound [Fe+2].C=1C=C[CH-]C=1.C=1C=C[CH-]C=1 KTWOOEGAPBSYNW-UHFFFAOYSA-N 0.000 description 1
- 238000003818 flash chromatography Methods 0.000 description 1
- 125000003983 fluorenyl group Chemical class C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 230000005283 ground state Effects 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 229910052741 iridium Inorganic materials 0.000 description 1
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 1
- 238000012417 linear regression Methods 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- RLKHFSNWQCZBDC-UHFFFAOYSA-N n-(benzenesulfonyl)-n-fluorobenzenesulfonamide Chemical compound C=1C=CC=CC=1S(=O)(=O)N(F)S(=O)(=O)C1=CC=CC=C1 RLKHFSNWQCZBDC-UHFFFAOYSA-N 0.000 description 1
- UFWIBTONFRDIAS-UHFFFAOYSA-N naphthalene-acid Natural products C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 1
- 150000002790 naphthalenes Chemical class 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 150000002825 nitriles Chemical class 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 238000007339 nucleophilic aromatic substitution reaction Methods 0.000 description 1
- 238000010534 nucleophilic substitution reaction Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 125000002524 organometallic group Chemical group 0.000 description 1
- MPQXHAGKBWFSNV-UHFFFAOYSA-N oxidophosphanium Chemical class [PH3]=O MPQXHAGKBWFSNV-UHFFFAOYSA-N 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 125000005575 polycyclic aromatic hydrocarbon group Chemical group 0.000 description 1
- 125000003367 polycyclic group Chemical group 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 238000010926 purge Methods 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 125000005581 pyrene group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- JUJWROOIHBZHMG-UHFFFAOYSA-N pyridine Substances C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 150000003222 pyridines Chemical class 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 150000003233 pyrroles Chemical class 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- 229960000948 quinine Drugs 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 238000007670 refining Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 239000012488 sample solution Substances 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H01L51/50—
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
- H10K50/135—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers comprising mobile ions
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/633—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising polycyclic condensed aromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
- C09K2211/1033—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom with oxygen
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
- C09K2211/1037—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom with sulfur
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/10—Triplet emission
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/20—Delayed fluorescence emission
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
Landscapes
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Organic Chemistry (AREA)
- Optics & Photonics (AREA)
- Indole Compounds (AREA)
- Electroluminescent Light Sources (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
- Nitrogen- Or Sulfur-Containing Heterocyclic Ring Compounds With Rings Of Six Or More Members (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Description
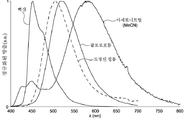
도 2는 TADF 종의 순환 전압곡선(cyclic voltammogram)을 나타내고;
도 3a는 TADF 종의 방출 스펙트럼을 나타내고;
도 3b는 TADF 종의 방출 스펙트럼을 나타낸다.
| 화학식 VII, 화학식 VIII 및 화학식 IX의 흡수 및 전기 화학적 데이터 | ||
| 분자 | λabs a (㎚)[ε(x104M-1㎝-1)] | 전기 화학론 b (eV) |
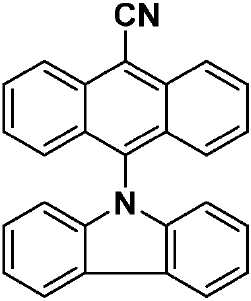
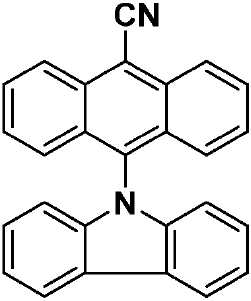
| CzAnCN(화학식 VII) | 310 [0.29], 322 [0.45], 334 [0.63], 352 [0.46], 370 [0.87], 390 [0.91], 408 [0.84], 435(sh) [0.31] | HOMO: -5.99 LUMO: -3.15 △E: 2.84 |
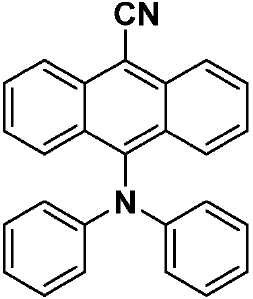
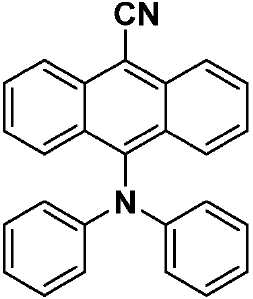
| TPAAnCN(화학식 VIII) | 343(sh) [0.23], 361(sh) [0.47], 373 [0.62], 381 [0.64], 402 [0.58], 472 [0.64] | HOMO: -5.68 LUMO: -3.20 △E: 2.84 |
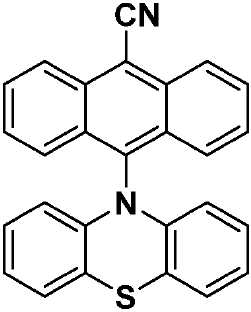
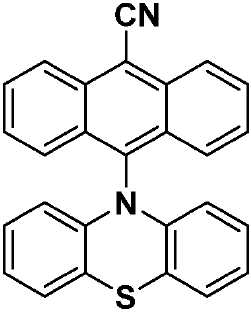
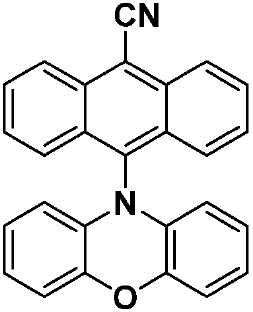
| PTZAnCN(화학식 IX) | 328(br) [0.58], 353 [0.69], 370 [1.24], 388 [1.53], 411 [1.46], 480 [0.04] | HOMO: -5.19 LUMO: -3.15 △E: 2.04 |
| a . 298K에서 DCM 중에서 측정. b . 지지 전해질로서 0.1M [nBu4N]PF6을, 그리고 내부 기준물질(SCE 대비 0.38V)로서 Fc/Fc+를 사용하여 MeCN 중에서 측정. HOMO 및 LUMO 에너지는 하기 식을 이용하여 계산되었다: EHOMO/LUMO = -(Eox pa,1/ERED PC,1 + 4.8)eV17(여기서, Eox pa 및 ERED PC는 각각 양극 및 음극 피크 전위임). ΔΕ = -(EHOMO-ELUMO). | ||
| 화학식 VII, 화학식 VIII 및 화학식 IX의 광 물리학 데이터 | ||||
| CzAnCN(화학식 VII) | TPAAnCN(화학식 VIII) | PTZAnCN(화학식 IX) | ||
| 헥산 | λem a (㎚) | 452(49) | 506(55) | 641(105) |
| ΦPL b (%) | 63.0(27.8) | 69.8(47.2) | n.d. | |
| Te(ns) | 22.3, 760 | 26.3, 858 | 5.3, 1,320 | |
| CHCl3 | λem a (㎚) | 518(83) | 588(98) | N/A |
| ΦPL b (%) | 32.8(14.7) | 43.2(37.5) | N/A | |
| Te(ns) | 38.8, 708 | 30.1 | N/A | |
| MeCN | λem a (㎚) | 581(124) | 638(137) | N/A |
| ΦPL b (%) | 5.7(2.9) | 6.7(6.3) | N/A | |
| Te(ns) | 13.8, 1,050 | 8.3 | N/A | |
| 박막 c | λem a (㎚) | 504(78) | 580(92) | 674(212) |
| ΦPL d (%) | 49.2(47.0) | 63.4(62.6) | 1.4(1.0) | |
| Te(ns) | 21.6, 416 | 29.4, 644 | 8.6, 1,032 | |
| a . 방출 최대치 및 반치전폭(FWHM)은 탈기 용액에서 보고된다. b . H2SO4(수성) 중의 0.5M 황산퀴닌은 기준물질(ΦPL: 54.6%)로서 사용되었다. 인용된 값은 탈기 용액에 대한 것이다. 괄호 한의 값은 통기 용액에 대한 것이다. c . 박막은 PMMA에서 10중량%의 도핑된 샘플을 스핀-코팅함으로써 제조되었다. d. 값은 적분구를 이용하여 결정된다. 탈기는 N2 퍼지(N2 purge)에 의한 것이다. | ||||
Claims (18)
- 제 1 항에 있어서, 상기 고리 시스템(Q)은 적어도 하나의 고도 불포화 고리를 포함하는 것을 특징으로 하는 유기 열 활성화 지연 형광(TADF) 종.
- 제 1 항에 있어서, 상기 고리 시스템(Q)은 적어도 하나의 다른 고리에 융합된 적어도 하나의 벤젠 고리를 포함하는 것을 특징으로 하는 유기 열 활성화 지연 형광(TADF) 종.
- 제 1 항에 있어서, 상기 고리 시스템(Q)에서 함께 융합된 적어도 2개의 고리 둘 모두는 방향족 및/또는 헤테로 방향족 고리인 것을 특징으로 하는 유기 열 활성화 지연 형광(TADF) 종.
- 제 1 항에 있어서, 상기 고리 시스템(Q)은 어닐레이팅(annelating)된 벤젠 또는 어닐레이팅된 헤테로아렌 고리 시스템인 것을 특징으로 하는 유기 열 활성화 지연 형광(TADF) 종.
- 제 1 항 내지 제 5 항 중 어느 한 항에 있어서, 상기 공여체(D) 및 수용체(A) 모이어티는 상기 고리 시스템(Q)의 동일한 고리 상에 위치하는 것을 특징으로 하는 유기 열 활성화 지연 형광(TADF) 종.
- 제 1 항 내지 제 6 항 중 어느 한 항에 있어서, 상기 공여체(D) 및 수용체(A) 모이어티는 벤젠 고리 상에서 서로에 대해 파라(para)-위치에 위치하는 것을 특징으로 하는 유기 열 활성화 지연 형광(TADF) 종.
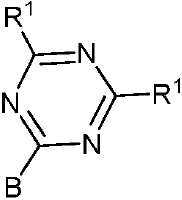
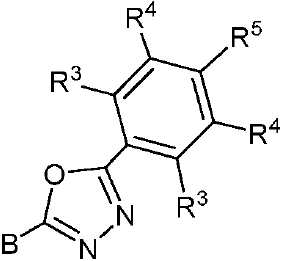
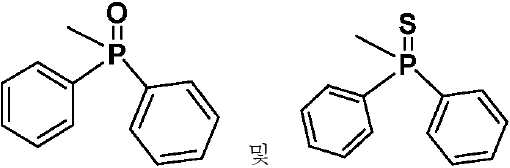
- 제 1 항 내지 제 7 항 중 어느 한 항에 있어서, 상기 수용체(A) 모이어티는 시아노(-CN), 케톤, 에스테르류, 아미드류, 알데히드류, 설폰류, 설폭시드류, 산화포스핀, 케톤류, 에스테르류, 아미드류, 알데히드류, 설폰류, 설폭시드류, 산화포스핀류, 및 치환 및 비치환된 피리미딘, 피라진, 1,2,4-트리아졸, 1,3,5-트리아진 및 1,3,4-옥사디아졸 모이어티로 이루어진 군으로부터 선택되는 것을 특징으로 하는 유기 열 활성화 지연 형광(TADF) 종.
- 제 8 항에 있어서, 상기 적어도 하나의 수용체 모이어티는 화학식 II, 화학식 III 및 화학식 IIIa 중 하나에 따르는 것을 특징으로 하는 유기 열 활성화 지연 형광(TADF) 종:
[화학식 II]
[화학식 III]
[화학식 IIIa]
상기 식에서, -B는 고리 시스템(Q)에 대한 결합 위치를 나타내고;
-R2는 환형일 수 있고 불포화될 수 있는 치환 또는 비치환된 1차, 2차 또는 3차 알킬(예를 들어, C1-C10 또는 심지어는 C1-C4)을 나타내고;
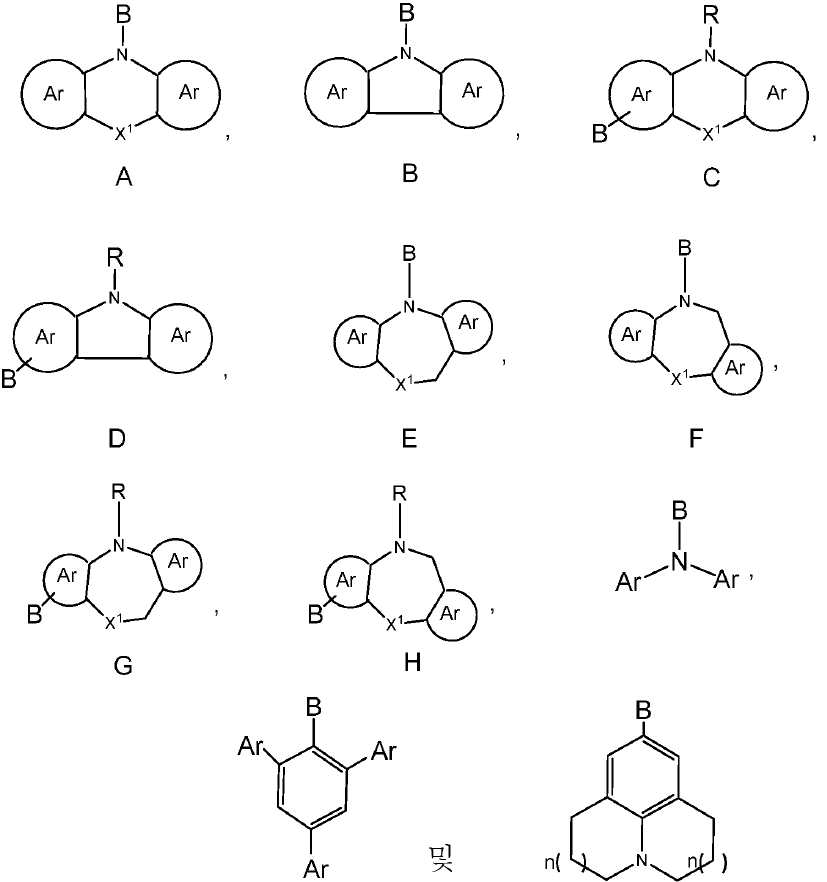
R1, R3, R4 및 R5 기는 각각의 경우에 대해 독립적으로는 -H, 환형일 수 있고 불포화될 수 있는 치환 또는 비치환된 1차, 2차 또는 3차 알킬(예를 들어, C1-C10 또는 심지어는 C1-C4); 치환 또는 비치환된 아릴 또는 헤테로아릴, -CF3, -OMe, -SF5, -NO2, 할로, 아릴 하이드록시, 아미노, 알콕시, 알킬티오, 카르복시, 시아노, 티오, 포르밀, 에스테르, 아실, 티오아실, 아미도, 설폰아미도, 카바메이트, 산화포스핀 및 황화포스핀으로 이루어진 군으로부터 선택된다. - 제 1 항 내지 제 9 항 중 어느 한 항에 있어서, 상기 공여체(D) 모이어티는 하기 화합물로 이루어진 군으로부터 선택되는 것을 특징으로 하는 유기 열 활성화 지연 형광(TADF) 종:
상기 식에서, -B는 고리 시스템(Q)에 대한 결합 위치를 나타내되, 화학식 C, 화학식 D, 화학식 G 및 화학식 H의 구조 내에서는 질소에 대해 파라-위치에 있고;
X1은 O, S, NR, SiR2, PR 및 CR2로 이루어진 군으로부터 선택되고;
R 각각은 -H, 알킬, 아릴 또는 헤테로아릴(예를 들어, 치환 또는 비치환된 C1-C20 또는 심지어는 C1-C10 알킬)로 이루어진 군으로부터 독립적으로 선택되고;
Ar 각각은 각각의 경우에 대해 독립적으로는 치환 또는 비치환된 아릴 또는 헤테로아릴로 이루어진 군으로부터 선택되고;
은 각각의 경우에 대해 독립적으로는 화학식 A, 화학식 B, 화학식 C, 화학식 D, 화학식 E 또는 화학식 F의 구조의 중심 고리에 융합된 치환 또는 비치환된 아릴 또는 헤테로아릴 고리; 예를 들어, 5원 또는 6원의 치환 또는 비치환된 아릴 또는 헤테로아릴 고리를 나타내고;
n( )는 상기 벤젠 고리에 어닐레이팅된 고리 내의 포화된 -CH2- 기의 선택적 존재를 나타내고;
n은 각각의 경우에 대해 독립적으로는 0, 1 또는 2이다. - 제 1 항 내지 제 10 항 중 어느 한 항에 있어서, 상기 공여체(D) 모이어티는 하기 화합물로 이루어진 군으로부터 선택되는 것을 특징으로 하는 유기 열 활성화 지연 형광(TADF) 종:
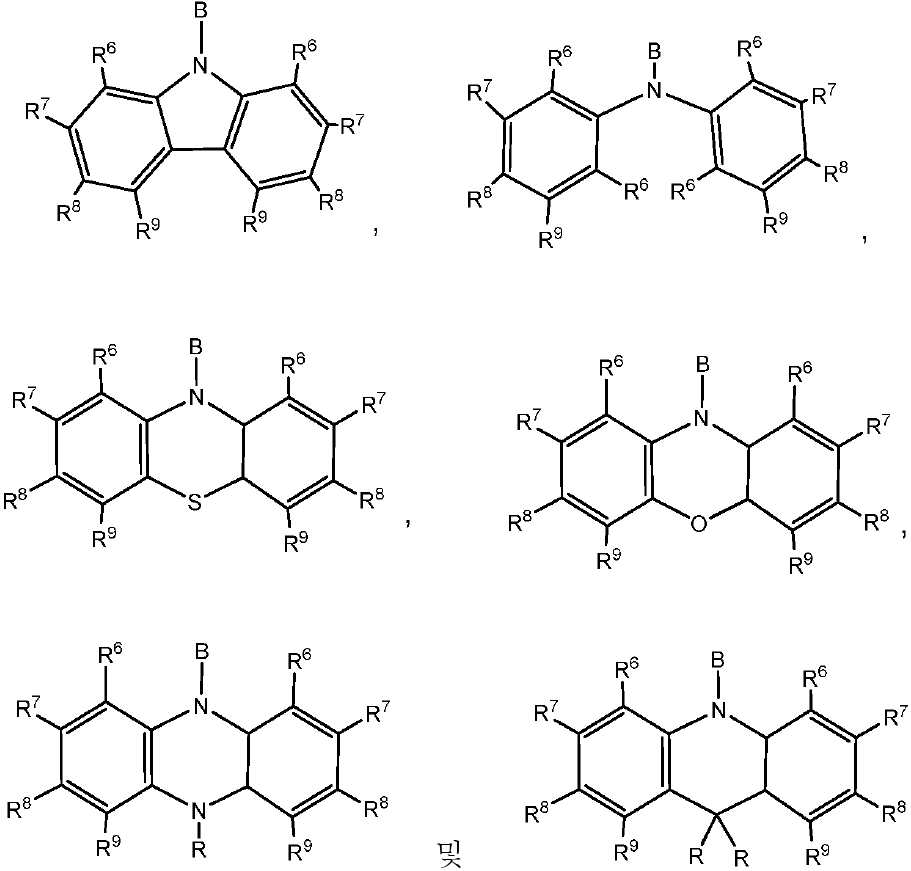
상기 식에서, -B는 고리 시스템(Q)에 대한 결합 위치를 나타내고;
R6, R7, R8 및 R9 기 각각은 각각의 경우에 대해 독립적으로는 -H, 환형일 수 있고 불포화될 수 있는 치환 또는 비치환된 1차, 2차 또는 3차 알킬(예를 들어, C1-C10 또는 심지어는 C1-C4); 치환 또는 비치환된 아릴 또는 헤테로아릴, -CF3, -OMe, -SF5, -NO2, 할로(예를 들어, 플루오로, 클로로, 브로모 및 요오도), 아릴, 아릴 하이드록시, 아미노, 알콕시, 알킬티오, 카르복시, 시아노, 티오, 포르밀, 에스테르, 아실, 티오아실, 아미도, 설폰아미도, 카바메이트, 산화포스핀 및 황화포스핀으로 이루어진 군으로부터 선택되고;
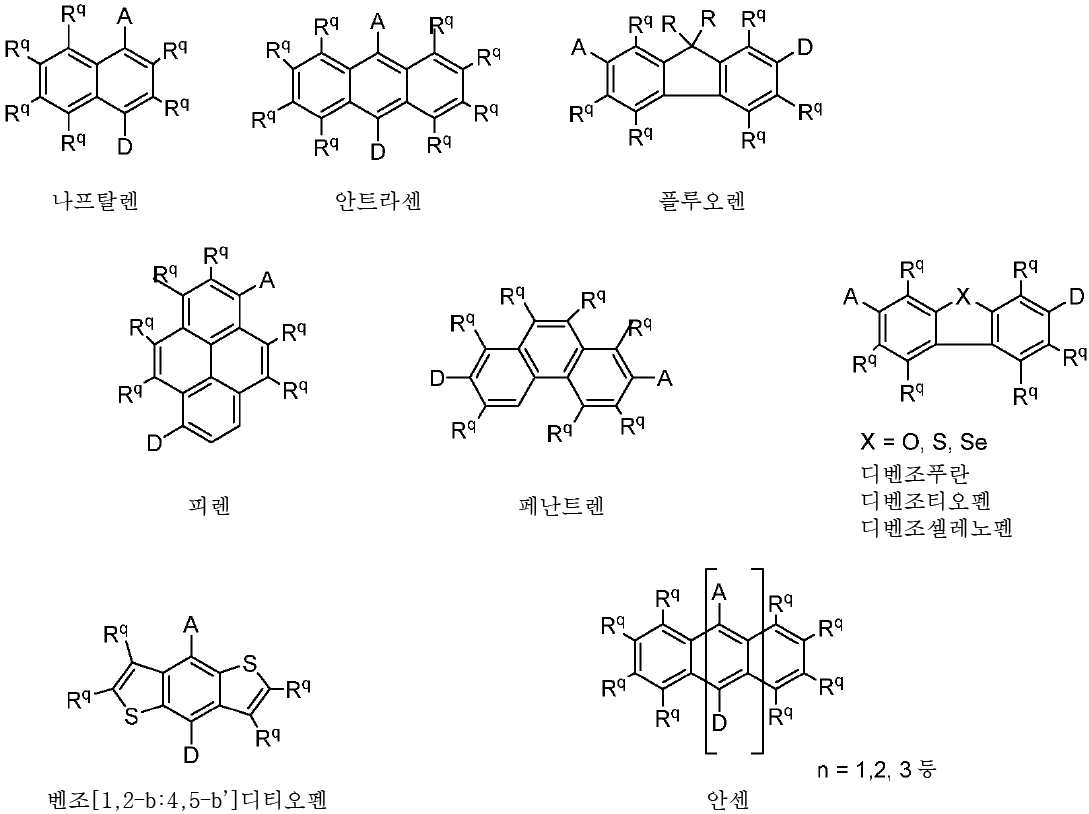
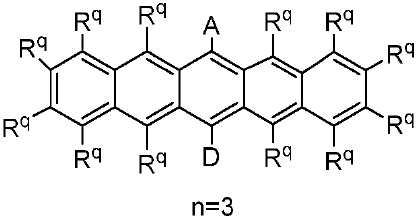
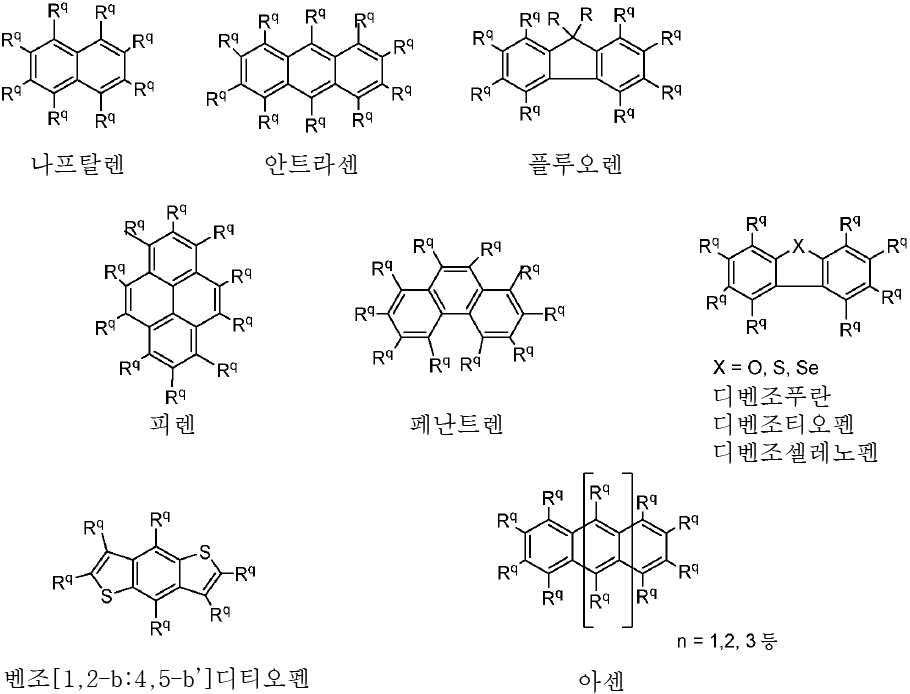
R 각각은 -H, 알킬, 아릴 또는 헤테로아릴(예를 들어, 치환 또는 비치환된 C1-C20 또는 심지어는 C1-C10 알킬)로 이루어진 군으로부터 독립적으로 선택된다. - 제 1 항에 있어서, 상기 고리 시스템(Q)은 하기 화합물로 이루어진 군으로부터 선택되는 것을 특징으로 하는 유기 열 활성화 지연 형광(TADF) 종:
상기 식에서, Rq 치환기들 중 적어도 하나는 공여체(D) 모이어티이고, Rq 치환기들 중 적어도 하나는 수용체(A) 모이어티이고;
나머지 Rq 치환기는 각각의 경우에 대해 독립적으로는 -H, 환형일 수 있고 불포화될 수 있는 치환 또는 비치환된 1차, 2차 또는 3차 알킬(예를 들어, C1-C10 또는 심지어는 C1-C4); 치환 또는 비치환된 아릴 또는 헤테로아릴, -CF3, -OMe, -SF5, -NO2, 할로, 아릴, 아릴 하이드록시, 아미노, 알콕시, 알킬티오, 카르복시, 시아노, 티오, 포르밀, 에스테르, 아실, 티오아실, 아미도, 설폰아미도, 카바메이트, 산화포스핀 및 황화포스핀으로 이루어진 군으로부터 선택되고;
n은 1 이상이다. - 제 12 항에 있어서, 상기 n은 1 내지 10의 범위인 것을 특징으로 하는 유기 열 활성화 지연 형광(TADF) 종.
- 제 12 항에 있어서, 상기 플루오렌 상의 R 치환기는 -H, 알킬, 아릴 또는 헤테로아릴(예를 들어, 치환 또는 비치환된 C1-C20 또는 심지어는 C1-C10)로 이루어진 군으로부터 독립적으로 선택되는 것을 특징으로 하는 유기 열 활성화 지연 형광(TADF) 종.
- 제 1 항 내지 제 15 항 중 어느 한 항에 따른 유기 열 활성화 지연 형광(TADF) 종을 에미터 물질(emitter material)로서 포함하는 발광 장치.
- 제 16 항에 있어서, 상기 발광 장치는 유기 발광 다이오드(OLED)인 것을 특징으로 하는 발광 장치.
- 제 16 항에 있어서, 상기 발광 장치는 발광 전기화학 전지(LEEC)인 것을 특징으로 하는 발광 장치.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GBGB1523037.8A GB201523037D0 (en) | 2015-12-29 | 2015-12-29 | Light emitting compounds |
| GB1523037.8 | 2015-12-29 | ||
| PCT/GB2016/053858 WO2017115068A1 (en) | 2015-12-29 | 2016-12-08 | Light emitting compounds |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180098651A true KR20180098651A (ko) | 2018-09-04 |
Family
ID=55359160
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187021898A Ceased KR20180098651A (ko) | 2015-12-29 | 2016-12-08 | 발광 화합물 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20190027693A1 (ko) |
| EP (1) | EP3398217A1 (ko) |
| JP (1) | JP2019509977A (ko) |
| KR (1) | KR20180098651A (ko) |
| CN (1) | CN108780852B (ko) |
| GB (1) | GB201523037D0 (ko) |
| WO (1) | WO2017115068A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11844274B2 (en) | 2019-04-05 | 2023-12-12 | Samsung Display Co., Ltd. | Organic electroluminescence device and compound for organic electroluminescence device |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10680188B2 (en) | 2016-11-11 | 2020-06-09 | Universal Display Corporation | Organic electroluminescent materials and devices |
| US11910699B2 (en) * | 2017-08-10 | 2024-02-20 | Universal Display Corporation | Organic electroluminescent materials and devices |
| GB201717193D0 (en) * | 2017-10-19 | 2017-12-06 | Univ Durham | Thermally activated delayed fluorescence molecules, materials comprising said molecules, and devices comprising said materials |
| CN108864068B (zh) * | 2018-07-27 | 2021-12-28 | 武汉天马微电子有限公司 | 一种化合物以及有机发光显示装置 |
| CN109456276A (zh) * | 2018-10-22 | 2019-03-12 | 武汉华星光电半导体显示技术有限公司 | 深红光热活化延迟荧光材料及其合成方法、电致发光器件 |
| CN109503508A (zh) * | 2018-11-15 | 2019-03-22 | 武汉华星光电半导体显示技术有限公司 | 绿光热活化延迟荧光材料及其合成方法、电致发光器件 |
| CN111303009B (zh) * | 2018-12-12 | 2022-02-15 | 华中科技大学 | 一种具有高效率、低滚降的蒽基深蓝光有机电致发光材料 |
| CN110054643B (zh) * | 2019-04-25 | 2021-10-15 | 上海天马有机发光显示技术有限公司 | 一种化合物、发光材料、有机发光显示面板及有机发光显示装置 |
| WO2024025871A1 (en) * | 2022-07-26 | 2024-02-01 | Mississippi State University | Methods and systems for integrating-sphere-assisted resonance synchronous (isars) spectroscopy |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3008897B2 (ja) * | 1997-07-14 | 2000-02-14 | 日本電気株式会社 | 有機エレクトロルミネッセンス素子 |
| JPH11111458A (ja) * | 1997-09-29 | 1999-04-23 | Toyo Ink Mfg Co Ltd | 有機エレクトロルミネッセンス素子材料およびそれを使用した有機エレクトロルミネッセンス素子 |
| JP3633236B2 (ja) * | 1997-10-06 | 2005-03-30 | 東洋インキ製造株式会社 | 有機エレクトロルミネッセンス素子材料およびそれを使用した有機エレクトロルミネッセンス素子 |
| JP4404473B2 (ja) * | 2000-12-25 | 2010-01-27 | 富士フイルム株式会社 | 新規含窒素へテロ環化合物、発光素子材料およびそれらを使用した発光素子 |
| US20070141393A1 (en) * | 2005-12-21 | 2007-06-21 | Eastman Kodak Company | Amino anthracene compounds in OLED devices |
| KR100852328B1 (ko) * | 2006-03-15 | 2008-08-14 | 주식회사 엘지화학 | 신규한 안트라센 유도체, 이의 제조방법 및 이를 이용한유기 전기 발광 소자 |
| JP5624270B2 (ja) * | 2007-09-18 | 2014-11-12 | ユー・ディー・シー アイルランド リミテッド | 有機電界発光素子 |
| KR100989815B1 (ko) * | 2008-03-20 | 2010-10-29 | 다우어드밴스드디스플레이머티리얼 유한회사 | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고있는 유기 발광 소자 |
| KR20130020503A (ko) * | 2011-08-17 | 2013-02-27 | (주)씨에스엘쏠라 | 유기발광화합물 및 이를 이용한 유기 광소자 |
| JP2013179198A (ja) * | 2012-02-29 | 2013-09-09 | Toyo Ink Sc Holdings Co Ltd | 有機エレクトロルミネッセンス素子用材料およびその用途 |
| TWI679790B (zh) * | 2012-08-03 | 2019-12-11 | 日商半導體能源研究所股份有限公司 | 發光元件 |
| KR102144606B1 (ko) * | 2013-03-29 | 2020-08-13 | 가부시키가이샤 큐럭스 | 유기 일렉트로 루미네선스 소자 |
| EP2984151B1 (de) * | 2013-04-08 | 2018-04-25 | Merck Patent GmbH | Organische elektrolumineszenzvorrichtung |
| WO2015029964A1 (ja) * | 2013-08-30 | 2015-03-05 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、発光材料、発光性薄膜、表示装置及び照明装置 |
| KR101502316B1 (ko) * | 2014-04-18 | 2015-03-13 | 롬엔드하스전자재료코리아유한회사 | 복수종의 호스트 재료 및 이를 포함하는 유기 전계 발광 소자 |
| KR20150126755A (ko) * | 2014-05-02 | 2015-11-13 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| JPWO2016017514A1 (ja) * | 2014-07-31 | 2017-04-27 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、発光性薄膜、表示装置及び照明装置 |
| KR102096480B1 (ko) * | 2015-07-30 | 2020-04-03 | 쓰추안 날리지 익스프레스 인스티튜트 포 이노베이티브 테크놀로지스 컴퍼니 리미티드 | 공여체와 수용체 사이에 2개의 비공액 브릿지가 있는 유효 열활성화 지연 형광 유기 분자 및 광전 소자에서의 그 응용 |
-
2015
- 2015-12-29 GB GBGB1523037.8A patent/GB201523037D0/en not_active Ceased
-
2016
- 2016-12-08 EP EP16812793.4A patent/EP3398217A1/en not_active Withdrawn
- 2016-12-08 WO PCT/GB2016/053858 patent/WO2017115068A1/en not_active Ceased
- 2016-12-08 CN CN201680077271.4A patent/CN108780852B/zh not_active Expired - Fee Related
- 2016-12-08 JP JP2018534633A patent/JP2019509977A/ja active Pending
- 2016-12-08 US US16/067,390 patent/US20190027693A1/en not_active Abandoned
- 2016-12-08 KR KR1020187021898A patent/KR20180098651A/ko not_active Ceased
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11844274B2 (en) | 2019-04-05 | 2023-12-12 | Samsung Display Co., Ltd. | Organic electroluminescence device and compound for organic electroluminescence device |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2019509977A (ja) | 2019-04-11 |
| CN108780852A (zh) | 2018-11-09 |
| WO2017115068A1 (en) | 2017-07-06 |
| GB201523037D0 (en) | 2016-02-10 |
| CN108780852B (zh) | 2020-12-15 |
| EP3398217A1 (en) | 2018-11-07 |
| US20190027693A1 (en) | 2019-01-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20180098651A (ko) | 발광 화합물 | |
| Cui et al. | Organoboron compounds with an 8-hydroxyquinolato chelate and its derivatives: substituent effects on structures and luminescence | |
| JP6861644B2 (ja) | 発光デバイス及び化合物 | |
| KR102082528B1 (ko) | 유기 발광 소자 그리고 그것에 사용하는 발광 재료 및 화합물 | |
| Zeng et al. | Cationic Bis‐cyclometallated Iridium (iii) Phenanthroline Complexes with Pendant Fluorenyl Substituents: Synthesis, Redox, Photophysical Properties and Light‐Emitting Cells | |
| CN103052644A (zh) | 用于光电器件的铜(i)配合物 | |
| Zhang et al. | New platinum (II) one-armed Schiff base complexes for blue and orange PHOLEDs applications | |
| Slodek et al. | Does the length matter?-Synthesis, photophysical, and theoretical study of novel quinolines based on carbazoles with different length of alkyl chain | |
| Skardziute et al. | Synthesis and optical properties of the isomeric pyrimidine and carbazole derivatives: effects of polar substituents and linking topology | |
| Huang et al. | Thermally activated delayed fluorescence of N-phenylcarbazole and triphenylamine functionalised tris (aryl) triazines | |
| Li et al. | Effects of electron affinity and steric hindrance of the trifluoromethyl group on the π‐bridge in designing blue thermally activated delayed fluorescence emitters | |
| Yang et al. | Charged dinuclear Cu (I) complexes for solution-processed single-emitter warm white organic light-emitting devices | |
| Sun et al. | Multi-substituted dibenzo [a, c] phenazine derivatives as solution-processable thermally activated delayed fluorescence materials for orange–red organic light-emitting diodes | |
| Karthik et al. | Synthesis, characterization and electroluminescence of carbazole-benzimidazole hybrids with thiophene/phenyl linker | |
| Patil et al. | Universal blue emitters for high efficiency thermally activated delayed fluorescence and fluorescent organic light-emitting diodes | |
| Arsenyan et al. | Dual versus normal TADF of pyridines ornamented with multiple donor moieties and their performance in OLEDs | |
| Shan et al. | Manipulating the AIE and low-temperature phosphorescence properties of o-carborane-imidazole derivatives via fine tuning their structural features | |
| Gupta et al. | Deep-red to NIR solution-processed OLEDs of donor-decorated quinoxaline-based TADF aggregates | |
| Zhang et al. | An efficient blue thermally activated delayed fluorescence material based on 4-fluorocyanobenzene derivative for organic light-emitting diodes | |
| Kang et al. | Effective exciplex host for solution-processed narrowband blue TADF-OLEDs using a 9-(dibenzo [b, d] thiophen-2-yl)-9H-carbazole analogue with an adamantane substituent | |
| Zhong et al. | Synthesis and luminescence properties of polymeric complexes of Cu (II), Zn (II) and Al (III) with functionalized polybenzimidazole containing 8-hydroxyquinoline side group | |
| Kumar et al. | Facile color tuning of thermally activated delayed fluorescence by substituted ortho-carbazole-appended triarylboron emitters | |
| Tang et al. | Achieving high efficiency at high luminance in fluorescent organic light‐emitting diodes through triplet–triplet fusion based on phenanthroimidazole‐benzothiadiazole derivatives | |
| Li et al. | Cyano Decoration of π‐Bridge to Boost Photoluminescence and Electroluminescence Quantum Yields of Triazine/Carbazole Based Blue TADF Emitter | |
| Xiao et al. | Synthesis and optoelectronic properties of a series of novel spirobifluorene derivatives starting from the readily available reagent 4, 4′-bisalkylated biphenyl |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0105 | International application |
Patent event date: 20180727 Patent event code: PA01051R01D Comment text: International Patent Application |
|
| PG1501 | Laying open of application | ||
| A201 | Request for examination | ||
| PA0201 | Request for examination |
Patent event code: PA02012R01D Patent event date: 20211116 Comment text: Request for Examination of Application |
|
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection |
Comment text: Notification of reason for refusal Patent event date: 20240408 Patent event code: PE09021S01D |
|
| E601 | Decision to refuse application | ||
| PE0601 | Decision on rejection of patent |
Patent event date: 20240613 Comment text: Decision to Refuse Application Patent event code: PE06012S01D Patent event date: 20240408 Comment text: Notification of reason for refusal Patent event code: PE06011S01I |