KR20180098294A - 뮤코지질증 ii형을 치료하기 위한 아데노-관련 바이러스 벡터 - Google Patents
뮤코지질증 ii형을 치료하기 위한 아데노-관련 바이러스 벡터 Download PDFInfo
- Publication number
- KR20180098294A KR20180098294A KR1020187019970A KR20187019970A KR20180098294A KR 20180098294 A KR20180098294 A KR 20180098294A KR 1020187019970 A KR1020187019970 A KR 1020187019970A KR 20187019970 A KR20187019970 A KR 20187019970A KR 20180098294 A KR20180098294 A KR 20180098294A
- Authority
- KR
- South Korea
- Prior art keywords
- aav
- raav
- gnptab
- mammal
- iii
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New or modified breeds of animals
- A01K67/027—New or modified breeds of vertebrates
- A01K67/0275—Genetically modified vertebrates, e.g. transgenic
- A01K67/0276—Knock-out vertebrates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/005—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'active' part of the composition delivered, i.e. the nucleic acid delivered
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0075—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the delivery route, e.g. oral, subcutaneous
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0083—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the administration regime
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/0004—Screening or testing of compounds for diagnosis of disorders, assessment of conditions, e.g. renal clearance, gastric emptying, testing for diabetes, allergy, rheuma, pancreas functions
- A61K49/0008—Screening agents using (non-human) animal models or transgenic animal models or chimeric hosts, e.g. Alzheimer disease animal model, transgenic model for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/10—Laxatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/12—Antidiarrhoeals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/16—Central respiratory analeptics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/12—Transferases (2.) transferring phosphorus containing groups, e.g. kinases (2.7)
- C12N9/1288—Transferases for other substituted phosphate groups (2.7.8)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y207/00—Transferases transferring phosphorus-containing groups (2.7)
- C12Y207/08—Transferases for other substituted phosphate groups (2.7.8)
- C12Y207/08017—UDP-N-acetylglucosamine--lysosomal-enzyme N-acetylglucosaminephosphotransferase (2.7.8.17)
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/07—Animals genetically altered by homologous recombination
- A01K2217/075—Animals genetically altered by homologous recombination inducing loss of function, i.e. knock out
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/07—Animals genetically altered by homologous recombination
- A01K2217/075—Animals genetically altered by homologous recombination inducing loss of function, i.e. knock out
- A01K2217/077—Animals genetically altered by homologous recombination inducing loss of function, i.e. knock out heterozygous knock out animals displaying phenotype
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/105—Murine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; AVICULTURE; APICULTURE; PISCICULTURE; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2267/00—Animals characterised by purpose
- A01K2267/03—Animal model, e.g. for test or diseases
- A01K2267/0306—Animal model for genetic diseases
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14132—Use of virus as therapeutic agent, other than vaccine, e.g. as cytolytic agent
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
- C12N2750/14142—Use of virus, viral particle or viral elements as a vector virus or viral particle as vehicle, e.g. encapsulating small organic molecule
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
- C12N2750/14143—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14151—Methods of production or purification of viral material
- C12N2750/14152—Methods of production or purification of viral material relating to complementing cells and packaging systems for producing virus or viral particles
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2830/00—Vector systems having a special element relevant for transcription
- C12N2830/15—Vector systems having a special element relevant for transcription chimeric enhancer/promoter combination
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2830/00—Vector systems having a special element relevant for transcription
- C12N2830/50—Vector systems having a special element relevant for transcription regulating RNA stability, not being an intron, e.g. poly A signal
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Genetics & Genomics (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Zoology (AREA)
- Biotechnology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Wood Science & Technology (AREA)
- Biomedical Technology (AREA)
- Molecular Biology (AREA)
- General Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Epidemiology (AREA)
- Microbiology (AREA)
- Environmental Sciences (AREA)
- Neurology (AREA)
- Virology (AREA)
- Physical Education & Sports Medicine (AREA)
- Neurosurgery (AREA)
- Animal Husbandry (AREA)
- Biodiversity & Conservation Biology (AREA)
- Plant Pathology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Diabetes (AREA)
- Pulmonology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Pathology (AREA)
- Immunology (AREA)
Abstract
Description
도 1b는 GNPTAB 녹아웃 마우스를 생성하기 위해 사용된 마우스 ES 클론을 보여주는 서던 블롯이다.
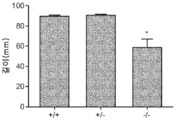
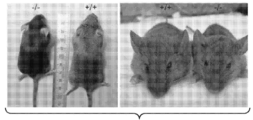
도 2a 내지 도 2c는 GNPTAB 녹아웃 마우스에 존재하는 성장 지체를 보여준다. (도 2a) 6 주령의 야생형(+/+), 이형접합체(+/-) 및 동형접합체(-/-) 마우스의 체중(g)(***; p<0.0001; Bonterroni 다중 비교 테스트). (도 2b) 6 주령의 야생형, 이형접합체 및 동형접합체 마우스의 코-항문 길이(mm)(*; p<0.02; Bonterroni 다중 비교 테스트). (도 2c) 야생형 및 동형접합체 마우스의 육안 형태.
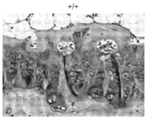
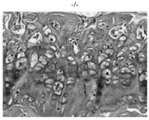
도 3a 및 도 3b는 야생형(도 3a) 및 동형접합체 녹아웃(도 3b) 마우스 유래의 헤마톡실린 및 에오신 염색된 대퇴부 연골의 대표 절편의 광학 현미경 이미지를 보여준다.
도 4a 내지 도 4f는 녹아웃(KO) 마우스의 침샘 내 자가리소좀의 축적을 입증한다. (도 4a 내지 도 4c) 점액성 및 장액성 세포로 구성된 야생형 마우스 침샘 꽈리의 개관을 보여주는 EM. (도 4d) KO 침샘 꽈리의 개관. KO에서는 큰 공포(vacuole)의 대량 축적에 의해 전반적 구조가 파괴되어 있다. (도 4e 내지 도 4f) 단일 막에 의해 둘러싸여 있고 분해되지 않은 물질을 함유하는, (도 4d)로부터의 공포의 더 높은 배율. 확대 영역은 (도 4d)에서 박스로 표시된다. AL, 자가리소좀; Mu, 점액성 세포; N, 핵; SG; 분비성 과립.
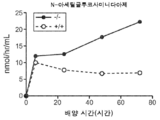
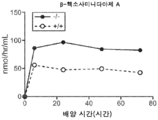
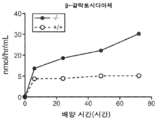
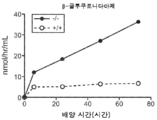
도 5a 내지 도 5d는 야생형(뚫린 원) 및 KO 마우스(채워진 원)의 혈청에서의 리소좀 효소 활성을 표시된 바와 같이 보여준다. N-아세틸글루코사미니다아제(도 5a), β-헥소사미니다아제 A(도 5b), β-갈락토시다아제(도 5c) 및 β-글루쿠로니다아제(도 5d)의 활성이 나타난다.
도 6a 및 도 6b는 주사를 위한 실험 일정의 개관을 제공한다. (도 6a) 6 주령의 바이러스 벡터 주사된 마우스에 대한 연구의 장기간 처리를 위한 일정. (도 6b) 각 처리 그룹에 대해 주사된 마우스의 총 수(n)가 표시되어 있다.
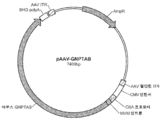
도 7a는 마우스 GNPTAB cDNA를 함유하는 pAAV2/8-GNPTAB 벡터의 개략도이다. 마우스 GNPTAB cDNA 서열은 GenBank 수탁 번호 NM_001004164.2에 기반한다. 뉴클레오티드 서열은 마우스에서의 발현을 위해 코돈 최적화되었다. 아미노산 서열은 변하지 않는다.
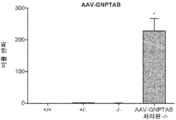
도 7b는 대조군 한 배 새끼에 비하여 AAV-GNPTAB로 주사된 KO 마우스로부터의 간의 정량적 분석을 보여준다.
도 8a 및 도 8b는 대조군 및 AAV-GNPTAB 처리된 KO 마우스에 대한 시간에 따른 시작 중량으로부터의 체중 변화를 나타낸다. (도 8a) 대조군 마우스 및 AAV-GNPTAB 처리된 KO 마우스의 총 체중(* p<0.05 Dunnett 다중 비교 테스트). (도 8b) 시간에 따른 시작 중량으로부터의 중량 변화량으로서 표현된 데이터.
도 9a 및 도 9b는 대조군 및 AAV-GNPTAB 처리된 KO 마우스에 대한 시간에 따른 시작 신장으로부터의 신장 변화를 나타낸다. (도 9a) 신체 길이의 주사 전과 주사 후 6 주를 비교한 비율로 표현된 데이터 (도 9b) 신체 길이의 주사 전과 주사 후 32 주를 비교한 비율로 표현된 데이터.
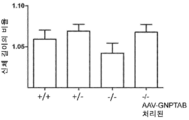
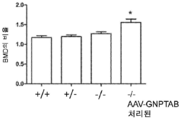
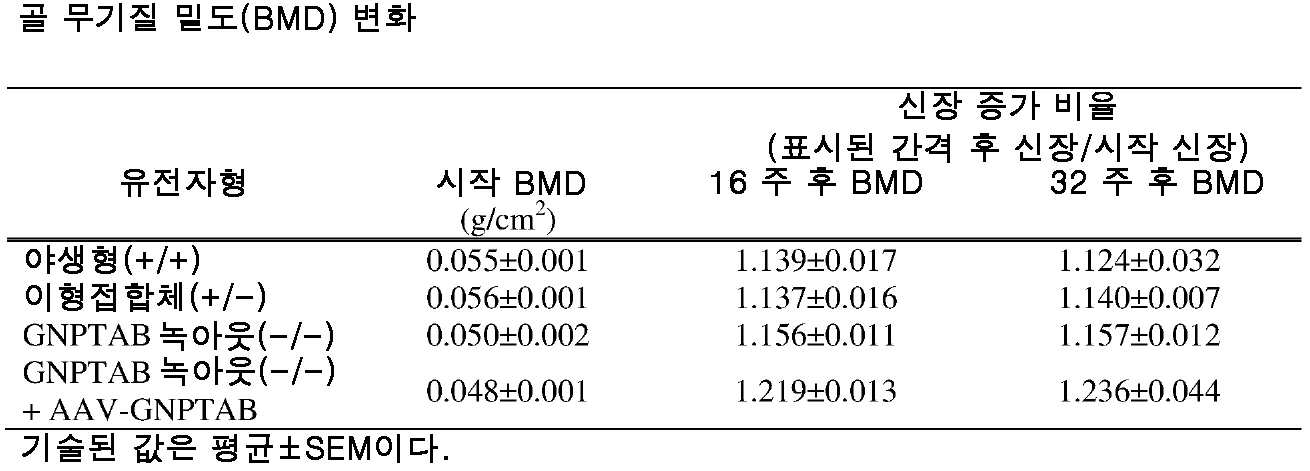
도 10a 내지 도 10c는 주사 전(도 10a), 주사 후 16 주(도 10b) 및 주사 후 32 주(도 10c)에서의 골 무기질 밀도의 수준을 보여주는 히스토그램을 제공한다. (도 10a) 동형접합체 및 AAV-GNPTAB로 처리된 동형접합체로부터의 데이터를 야생형 및 이형접합체의 데이터와 비교하였다(†; p<0.05, ‡; 야생형과 비교하여 p<0.02, *; p<0.02, **; 이형접합체와 비교하여 p<0.002). AAV-GNPTAB 처리는 처리 후 16 주(도 10b) 및 처리 후 32 주(도 10c) 동형접합체 마우스에서 BMD 비율(Tx 후/Tx 전)의 통계적으로 유의미한 증가를 야기하였다. (도 10b) 처리 후 16 주에, AAV-GNPTAB로 처리된 GNPTAB 공백(null) 마우스는 다른 마우스보다 BMD 비율에서의 유의미한 증가를 나타내었다(**; P<0.02). (도 10c) 처리 후 32 주에, GNPTAB 처리 마우스에서 BMD 비율에서의 유의미한 차이가 관찰되었다(#; p<0.05, **; p<0.02). P 값은 양쪽 꼬리 t-검정(two-tailed t-test), 비대응표본 t-검정(unpaired t-test) 분석에 의해 결정되었다. 데이터는 평균±SEM으로 표시된다.
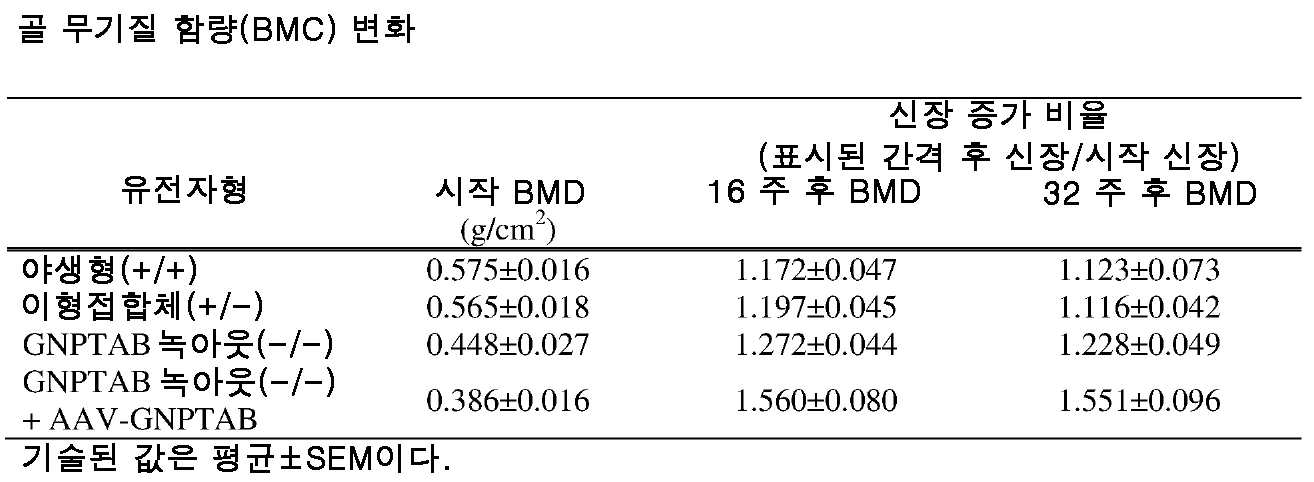
도 11a 내지 도 11c는 주사 전(도 11a), 주사 후 16 주 (도 11b), 및 주사 후 32 주(도 11c)에서의 골 무기질 함량의 수준을 보여주는 히스토그램을 제공한다. (도 11a) 동형접합체 및 AAV-GNPTAB로 처리된 동형접합체로부터의 데이터를 야생형 및 이형접합체의 데이터와 비교하였다(†; p<0.05, ‡; 야생형과 비교하여 p<0.02, *; p<0.02, **; 이형접합체와 비교하여 p<0.002). AAV-GNPTAB 처리는 처리 후 16 주(도 11b) 및 처리 후 32 주(도 11c) 동형접합체 마우스에서 BMD 비율(Tx 후/Tx 전)의 통계적으로 유의미한 증가를 야기하였다. (도 11b) 처리 후 16 주에, AAV-GNPTAB로 처리된 GNPTAB 공백(null) 마우스는 다른 마우스보다 BMD 비율에서의 유의미한 증가를 나타내었다(**; P<0.02). (도 11c) 처리 후 32 주에, GNPTAB 처리 마우스에서 BMD 비율에서의 유의미한 차이가 관찰되었다(#; p<0.05, **; p<0.02). P 값은 양쪽 꼬리 t-검정, 비대응표본 t-검정 분석에 의해 결정되었다. 데이터는 평균±SEM으로 표시된다.
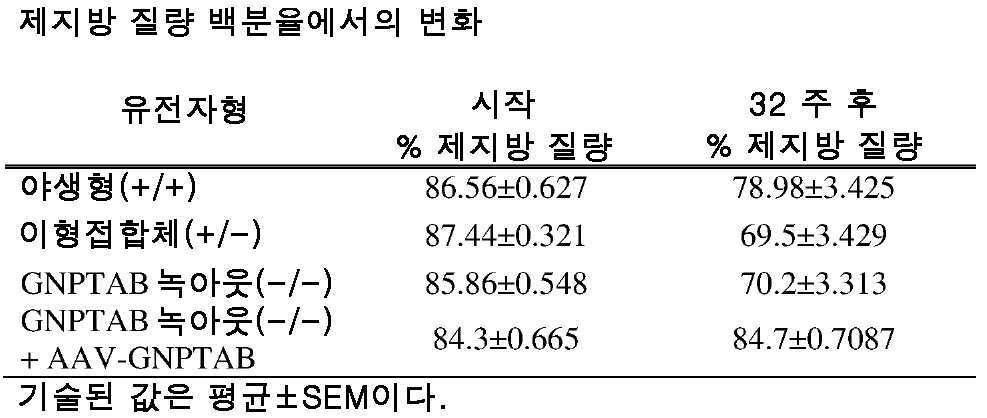
도 12a 및 도 12b는 주사 전의 제지방 질량 백분율의 수준(도 12a) 및 주사 후 32 주의 제지방 질량 백분율의 변화(도 12b)를 보여주는 히스토그램을 제공한다. (도 12a) 동형접합체, 및 AAV-GNPTAB로 처리된 동형접합체로부터의 데이터를 야생형 및 이형접합체의 데이터와 비교하였다(†; 야생형과 비교하여 p<0.02, *; p<0.05, **; 이형접합체와 비교하여 p<0.001). (도 12b) 처리 후 32 주에, AAV-GNPTAB 처리 마우스에서 제지방 질량 %의 변화가 관찰되지 않았다. P 값은 양쪽 꼬리 t-검정, 비대응표본 t-검정 분석에 의해 결정되었다. 데이터는 평균±SEM으로 표시된다.
Claims (121)
- N-아세틸글루코사민-1-포스페이트 트랜스퍼라제(GNPTAB)를 인코딩하는 핵산 및 적어도 하나의 AAV 역위 말단 반복부(ITR)를 포함하는, 재조합 아데노-관련 바이러스(rAAV) 벡터.
- 제1항에 있어서, GNPTAB은 알파 및 베타 서브유닛을 포함하는, rAAV.
- 제1항 또는 제2항에 있어서, GNPTAB은 프로모터에 작동 가능하게 연결된, rAAV 벡터.
- 제1항 내지 제3항 중 어느 한 항에 있어서, GNPTAB은 인간 GNPTAB인, rAAV 벡터.
- 제1항 내지 제4항 중 어느 한 항에 있어서, GNPTAB은 SEQ ID NO:1의 아미노산 서열과 적어도 약 80%, 적어도 약 85%, 적어도 약 90% 또는 적어도 약 95% 동일한 아미노산 서열을 포함하는, rAAV 벡터.
- 제1항 내지 제5항 중 어느 한 항에 있어서, GNPTAB은 SEQ ID NO:1의 아미노산 서열을 포함하는, rAAV 벡터.
- 제1항 내지 제6항 중 어느 한 항에 있어서, 프로모터는 CMV 인핸서/닭 베타-액틴(CBA) 프로모터인, rAAV 벡터.
- 제7항에 있어서, CBA 프로모터는 변형된 CBA 프로모터인, rAAV 벡터.
- 제8항에 있어서, 변형된 CBA 프로모터는 절단된 CBA 프로모터인, rAAV 벡터.
- 제7항 내지 제9항 중 어느 한 항에 있어서, CMV 인핸서는 단축된 CMV 인핸서인, rAAV 벡터.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 벡터는 인트론을 포함하는, rAAV 벡터.
- 제11항에 있어서, 인트론은 MVM 인트론인, rAAV 벡터.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 벡터는 폴리아데닐화 서열을 포함하는, rAAV 벡터.
- 제13항에 있어서, 폴리아데닐화 서열은 소 성장 호르몬 폴리아데닐화 서열인, rAAV 벡터.
- 제1항 내지 제14항 중 어느 한 항에 있어서, AAV 말단 반복부는 AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAVrh8, AAVrh8R, AAV9, AAV10, AAVrh10, AAV11, AAV12, AAV2R471A, AAV DJ, 염소 AAV, 소 AAV, 또는 마우스 AAV 혈청형 ITR인, rAAV 벡터.
- 제15항에 있어서, rAAV 벡터는 2개의 ITR을 포함하는, rAAV 벡터.
- 제1항 내지 제16항 중 어느 한 항의 rAAV 벡터를 포함하는, rAAV 입자.
- 제17항에 있어서, AAV 입자는 AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAVrh8, AAVrh8R, AAV9, AAV10, AAVrh10, AAV11, AAV12, AAV2 R471A, AAV2/2-7m8, AAV DJ, AAV2 N587A, AAV2 E548A, AAV2 N708A, AAV V708K, 염소 AAV, AAV1/AAV2 키메라, 소 AAV, 마우스 AAV, 또는 rAAV2/HBoV1 혈청형 캡시드를 포함하는, rAAV 입자 방법.
- 제17항 또는 제18항에 있어서, rAAV 입자는 동일한 AAV 혈청형에서 유래된 하나 이상의 ITR 및 캡시드를 포함하는, rAAV 입자.
- 제17항 또는 제18항에 있어서, rAAV 입자는 rAAV 바이러스 입자의 캡시드와 상이한 AAV 혈청형에서 유래된 하나 이상의 ITR을 포함하는, rAAV 입자.
- 제20항에 있어서, rAAV 입자는 AAV8 캡시드를 포함하며, 벡터는 AAV2 ITR을 포함하는, rAAV 입자.
- 제17항 내지 제21항 중 어느 한 항에 있어서, rAAV 입자는 rAAV 벡터를 인코딩하는 핵산 및 AAV rep 및 cap 기능을 인코딩하는 핵산으로 숙주 세포를 형질감염시키고, AAV 헬퍼 기능을 인코딩하는 핵산을 제공함으로써 생산되는, rAAV 입자.
- 제22항에 있어서, AAV 헬퍼 기능은 AAV 헬퍼 기능을 인코딩하는 핵산으로 숙주 세포를 형질감염시킴으로써 제공되는, rAAV 입자.
- 제22항에 있어서, AAV 헬퍼 기능은 AAV 헬퍼 기능을 제공하는 AAV 헬퍼 바이러스로 숙주세포를 감염시킴으로써 제공되는, rAAV 입자.
- 제24항에 있어서, AAV 헬퍼 바이러스는 아데노바이러스, 단순 헤르페스 바이러스 또는 배큘로바이러스인, rAAV 입자.
- 제17항 내지 제21항 중 어느 한 항에 있어서, rAAV 입자는 rAAV 벡터를 인코딩하는 핵산 및 AAV rep 및 cap 기능을 인코딩하는 핵산을 포함하며, AAV 헬퍼 기능을 인코딩하는 핵산을 제공하는 AAV 생산체 세포에 의해 생산되는, rAAV 입자.
- 제26항에 있어서, AAV 생산체 세포는 AAV 헬퍼 기능을 인코딩하는 핵산을 포함하는, rAAV 입자.
- 제26항에 있어서, AAV 헬퍼 기능은 AAV 헬퍼 기능을 제공하는 AAV 헬퍼 바이러스로 AAV 생산체 세포를 감염시킴으로써 제공되는, rAAV 입자.
- 제28항에 있어서, AAV 헬퍼 바이러스는 아데노바이러스, 단순 헤르페스 바이러스, 또는 배큘로바이러스인, rAAV 입자.
- 제17항 내지 제29항 중 어느 한 항의 rAAV 입자를 포함하는, 약학적 조성물.
- 제17항 내지 제29항 중 어느 한 항의 rAAV 입자 또는 제30항의 약학적 조성물의 유효량을 포유동물에게 투여하는 것을 포함하는, 포유동물에서 뮤코지질증 II형(ML II) 또는 뮤코지질증 III형(ML III)을 치료하는 방법.
- 유효량의 rAAV 입자를 포유동물에게 투여하는 것을 포함하는, 포유동물에서 뮤코지질증 II형(ML II) 또는 뮤코지질증 III형(ML III)을 치료하는 방법으로서, rAAV 입자는 rAAV 벡터를 포함하며, rAAV 벡터는 N-아세틸글루코사민-1-포스페이트 트랜스퍼라제(GNPTAB)를 인코딩하는 핵산 및 적어도 하나의 AAV ITR을 포함하는, 방법.
- 유효량의 rAAV 입자를 포유동물에게 투여하는 것을 포함하는, 뮤코지질증 II형(ML II) 또는 뮤코지질증 III형(ML III)을 갖는 포유동물에서의 신체 크기를 유지 또는 증가시키는 방법으로서, rAAV 입자는 rAAV 벡터를 포함하며, rAAV 벡터는 N-아세틸글루코사민-1-포스페이트 트랜스퍼라제(GNPTAB)를 인코딩하는 핵산 및 적어도 하나의 AAV ITR을 포함하며, GNPTAB의 발현이 체중 증가 폭의 유지 또는 증가, 및/또는 신장 증가 폭의 유지 또는 증가를 야기하는, 방법.
- 유효량의 rAAV 입자를 포유동물에게 투여하는 것을 포함하는, 뮤코지질증 II형(ML II) 또는 뮤코지질증 III형(ML III)을 갖는 포유동물에서의 신체 크기의 감소를 예방하는 방법으로서, rAAV 입자는 rAAV 벡터를 포함하며, rAAV 벡터는 N-아세틸글루코사민-1-포스페이트 트랜스퍼라제(GNPTAB)를 인코딩하는 핵산 및 적어도 하나의 AAV ITR을 포함하며, GNPTAB의 발현이 체중 감소를 예방하는, 방법.
- 유효량의 rAAV 입자를 포유동물에게 투여하는 것을 포함하는, 뮤코지질증 II형(ML II) 또는 뮤코지질증 III형(ML III)을 갖는 포유동물에서의 골 무기질 함량을 유지 또는 증가시키는 방법으로서, rAAV 입자는 rAAV 벡터를 포함하며, rAAV 벡터는 GNPTAB를 인코딩하는 핵산 및 적어도 하나의 AAV ITR을 포함하며, GNPTAB의 발현이 골 무기질 함량의 유지 또는 증가를 야기하는, 방법.
- 유효량의 rAAV 입자를 포유동물에게 투여하는 것을 포함하는, 뮤코지질증 II형(ML II) 또는 뮤코지질증 III형(ML III)을 갖는 포유동물에서의 골 무기질 함량의 감소를 예방하는 방법으로서, rAAV 입자는 rAAV 벡터를 포함하며, rAAV 벡터는 GNPTAB를 인코딩하는 핵산 및 적어도 하나의 AAV ITR을 포함하며, GNPTAB의 발현이 골 무기질 함량의 감소를 예방하는, 방법.
- 유효량의 rAAV 입자를 포유동물에게 투여하는 것을 포함하는, 뮤코지질증 II형(ML II) 또는 뮤코지질증 III형(ML III)을 갖는 포유동물에서의 골 무기질 밀도를 유지 또는 증가시키는 방법으로서, rAAV 입자는 rAAV 벡터를 포함하며, rAAV 벡터는 GNPTAB를 인코딩하는 핵산 및 적어도 하나의 AAV ITR을 포함하며, GNPTAB의 발현이 골 무기질 밀도의 유지 또는 증가를 야기하는, 방법.
- 유효량의 rAAV 입자를 포유동물에게 투여하는 것을 포함하는, 뮤코지질증 II형(ML II) 또는 뮤코지질증 III형(ML III)을 갖는 포유동물에서의 골 무기질 밀도의 감소를 예방하는 방법으로서, rAAV 입자는 rAAV 벡터를 포함하며, rAAV 벡터는 GNPTAB를 인코딩하는 핵산 및 적어도 하나의 AAV ITR을 포함하며, GNPTAB의 발현이 골 무기질 밀도의 감소를 예방하는, 방법.
- 제31항에 있어서, 치료는 ML II 또는 ML III의 하나 이상의 증상을 완화시키며, ML II 또는 ML III의 하나 이상의 증상은 골격 결함, 인지 결핍, 대근육 및 소근육 운동 기술의 발달 지연, 난청, 근육 긴장 결핍, 팽만된 복부, 배꼽 탈장, 기도의 진행성 점막 비후, 잦은 호흡기 감염, 승모판막 비대 및 기능 부전, 변비 또는 설사인, 방법.
- 제31항에 있어서, 치료는 ML II 또는 ML III의 하나 이상의 증상의 진행을 지연시키며, ML II 또는 ML III의 하나 이상의 증상은 골격 결함, 인지 결핍, 대근육 및 소근육 운동 기술의 발달 지연, 난청, 근육 긴장 결핍, 팽만된 복부, 배꼽 탈장, 기도의 진행성 점막 비후, 잦은 호흡기 감염, 승모판막 비대 및 기능 부전, 변비 또는 설사인, 방법.
- 유효량의 rAAV 입자를 포유동물에게 투여하는 것을 포함하는, 포유동물에서 ML II 또는 ML III의 하나 이상의 증상을 완화하는 방법으로서, rAAV 입자는 rAAV 벡터를 포함하며, rAAV 벡터는 GNPTAB를 인코딩하는 핵산 및 적어도 하나의 AAV ITR을 포함하며; ML II 또는 ML III의 하나 이상의 증상은 골격 결함, 인지 결핍, 대근육 및 소근육 운동 기술의 발달 지연, 난청, 근육 긴장 결핍, 팽만된 복부, 배꼽 탈장, 기도의 진행성 점막 비후, 잦은 호흡기 감염, 승모판막 비대 및 기능 부전, 변비 또는 설사인, 방법.
- 유효량의 rAAV 입자를 포유동물에게 투여하는 것을 포함하는, 포유동물에서 ML II 또는 ML III의 하나 이상의 증상의 진행을 지연하는 방법으로서, rAAV 입자는 rAAV 벡터를 포함하며, rAAV 벡터는 GNPTAB를 인코딩하는 핵산 및 적어도 하나의 AAV ITR을 포함하며; ML II 또는 ML III의 하나 이상의 증상은 골격 결함, 인지 결핍, 대근육 및 소근육 운동 기술의 발달 지연, 난청, 근육 긴장 결핍, 팽만된 복부, 배꼽 탈장, 기도의 진행성 점막 비후, 잦은 호흡기 감염, 승모판막 비대 및 기능 부전, 변비 또는 설사인, 방법.
- 제31항 내지 제42항 중 어느 한 항에 있어서, GNPTAB는 프로모터에 작동 가능하게 연결되는, 방법.
- 제31항 내지 제43항 중 어느 한 항에 있어서, GNPTAB은 인간 GNPTAB인, 방법.
- 제31항 내지 제44항 중 어느 한 항에 있어서, GNPTAB은 SEQ ID NO:1의 아미노산 서열과 적어도 약 80% 동일한 아미노산 서열을 포함하는, 방법.
- 제31항 내지 제45항 중 어느 한 항에 있어서, GNPTAB은 SEQ ID NO:1의 아미노산 서열을 포함하는, 방법.
- 제43항 내지 제46항 중 어느 한 항에 있어서, 프로모터는 CMV 인핸서/닭 베타-액틴(CBA) 프로모터인, 방법.
- 제47항에 있어서, CBA 프로모터는 변형된 CBA 프로모터인, 방법.
- 제47항에 있어서, 변형된 CBA 프로모터는 절단된 CBA 프로모터인, 방법.
- 제47항 내지 제49항 중 어느 한 항에 있어서, CMV 인핸서는 단축된 CMV 인핸서인, 방법.
- 제31항 내지 제50항 중 어느 한 항에 있어서, 벡터는 인트론을 포함하는, 방법.
- 제51항에 있어서, 인트론은 MVM 인트론인, 방법.
- 제31항 내지 제52항 중 어느 한 항에 있어서, 벡터는 폴리아데닐화 서열을 포함하는, 방법.
- 제53항에 있어서, 폴리아데닐화 서열은 소 성장 호르몬 폴리아데닐화 서열인, 방법.
- 제31항 내지 제54항 중 어느 한 항에 있어서, AAV 말단 반복부는 AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAVrh8, AAVrh8R, AAV9, AAV10, AAVrh10, AAV11, AAV12, AAV2R471A, AAV DJ, 염소 AAV, 소 AAV, 또는 마우스 AAV 혈청형 ITR인, 방법.
- 제55항에 있어서, rAAV 벡터는 2개의 ITR을 포함하는, 방법.
- 제31항 내지 제56항 중 어느 한 항에 있어서, AAV 입자는 AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAVrh8, AAVrh8R, AAV9, AAV10, AAVrh10, AAV11, AAV12, AAV2 R471A, AAV2/2-7m8, AAV DJ, AAV2 N587A, AAV2 E548A, AAV2 N708A, AAV V708K, 염소 AAV, AAV1/AAV2 키메라, 소 AAV, 마우스 AAV, 또는 rAAV2/HBoV1 혈청형 캡시드를 포함하는, 방법.
- 제31항 내지 제57항 중 어느 한 항에 있어서, rAAV 입자는 동일한 AAV 혈청형에서 유래된 하나 이상의 ITR 및 캡시드를 포함하는, 방법.
- 제31항 내지 제57항 중 어느 한 항에 있어서, rAAV 입자는 rAAV 바이러스 입자의 캡시드와 상이한 AAV 혈청형에서 유래된 하나 이상의 ITR을 포함하는, 방법.
- 제59항에 있어서, rAAV 입자는 AAV8 캡시드를 포함하며, 벡터는 AAV2 ITR을 포함하는, 방법.
- 제31항 내지 제60항 중 어느 한 항에 있어서, rAAV 입자는 rAAV 벡터를 인코딩하는 핵산 및 AAV rep 및 cap 기능을 인코딩하는 핵산으로 숙주 세포를 형질감염시키고, AAV 헬퍼 기능을 인코딩하는 핵산을 제공함으로써 생산되는 방법.
- 제61항에 있어서, AAV 헬퍼 기능은 AAV 헬퍼 기능을 인코딩하는 핵산으로 숙주 세포를 형질감염시킴으로써 제공되는 방법.
- 제62항에 있어서, AAV 헬퍼 기능은 AAV 헬퍼 기능을 제공하는 AAV 헬퍼 바이러스로 숙주 세포를 감염시킴으로써 제공되는 방법.
- 제63항에 있어서, AAV 헬퍼 바이러스는 아데노바이러스, 단순 헤르페스 바이러스 또는 배큘로바이러스인 방법.
- 제31항 내지 제60항 중 어느 한 항에 있어서, rAAV 입자는 rAAV 벡터를 인코딩하는 핵산 및 AAV rep 및 cap 기능을 인코딩하는 핵산을 포함하며, AAV 헬퍼 기능을 인코딩하는 핵산을 제공하는 AAV 생산체 세포에 의해 생산되는, 방법.
- 제65항에 있어서, AAV 생산체 세포는 AAV 헬퍼 기능을 인코딩하는 핵산을 포함하는, 방법.
- 제66항에 있어서, AAV 헬퍼 기능은 AAV 헬퍼 기능을 제공하는 AAV 헬퍼 바이러스로 AAV 생산체 세포를 감염시킴으로써 제공되는 방법.
- 제67항에 있어서, AAV 헬퍼 바이러스는 아데노바이러스, 단순 헤르페스 바이러스, 또는 배큘로바이러스인 방법.
- 제31항 내지 제68항 중 어느 한 항에 있어서, 포유동물은 인간인 방법.
- 제69항에 있어서, 인간은 소아 대상체인 방법.
- 제69항에 있어서, 인간은 청년인 방법.
- 제31항 내지 제71항 중 어느 한 항에 있어서, rAAV는 정맥내, 복강내, 동맥내, 근육내, 피하, 또는 간내 투여되는, 방법.
- 제72항에 있어서, rAAV는 정맥내 투여되는, 방법.
- 제31항 내지 제73항 중 어느 한 항에 있어서, rAAV는 하나를 초과하는 위치에 투여되는, 방법.
- 제31항 내지 제74항 중 어느 한 항에 있어서, 투여는 반복되는, 방법.
- 제31항 내지 제75항 중 어느 한 항에 있어서, rAAV 바이러스 입자는 약학적 조성물 내에 존재하는, 방법.
- 제76항에 있어서, 약학적 조성물은 약학적으로 허용 가능한 담체를 추가로 포함하는, 방법.
- 포유동물에서 ML II 또는 ML III을 치료하기 위한 약제의 제조에 있어서의 제30항의 약학적 조성물의 용도.
- 제31항 내지 제77항 중 어느 한 항의 방법에 사용하기 위한 약제의 제조에 있어서의 제30항의 약학적 조성물의 용도.
- 포유동물에서 ML II 또는 ML III을 치료하기 위한 약제의 제조에 있어서의 제17항 내지 제29항 중 어느 한 항의 rAAV 입자의 용도.
- 제31항 내지 제77항 중 어느 한 항의 방법에 사용하기 위한 약제의 제조에 있어서의 제17항 내지 제29항 중 어느 한 항의 rAAV 입자의 용도.
- 포유동물에서 ML II 또는 ML III을 치료하기 위한 제30항의 약학적 조성물의 용도.
- 제31항 내지 제77항 중 어느 한 항의 방법에 사용하기 위한 제30항의 약학적 조성물의 용도.
- 포유동물에서 ML II 또는 ML III을 치료하기 위한 제17항 내지 제29항 중 어느 한 항의 재조합 AAV의 용도.
- 제31항 내지 제77항 중 어느 한 항의 방법에 사용하기 위한 제17항 내지 제29항 중 어느 한 항의 재조합 AAV의 용도.
- 포유동물에서 ML II 또는 ML III의 하나 이상의 증상을 완화시키거나 포유동물에서 ML II 또는 ML III의 하나 이상의 증상의 진행을 지연하기 위한 약제의 제조에 있어서의 제30항의 약학적 조성물의 용도.
- 포유동물에서 ML II 또는 ML III의 하나 이상의 증상을 완화시키거나 포유동물에서 ML II 또는 ML III의 하나 이상의 증상의 진행을 지연하기 위한 약제의 제조에 있어서의 제17항 내지 제29항 중 어느 한 항의 rAAV 입자의 용도.
- 포유동물에서 ML II 또는 ML III의 하나 이상의 증상을 완화시키거나 포유동물에서 ML II 또는 ML III의 하나 이상의 증상의 진행을 지연하기 위한 제30항의 약학적 조성물의 용도.
- 포유동물에서 ML II 또는 ML III의 하나 이상의 증상을 완화시키거나 포유동물에서 ML II 또는 ML III의 하나 이상의 증상의 진행을 지연하기 위한 제17항 내지 제29항 중 어느 한 항의 재조합 AAV의 용도.
- 제86항 내지 제89항 중 어느 한 항에 있어서, ML II 또는 ML III의 하나 이상의 증상은 골격 결함, 인지 결핍, 대근육 및 소근육 운동 기술의 발달 지연, 난청, 근육 긴장 결핍, 팽만된 복부, 배꼽 탈장, 기도의 진행성 점막 비후, 잦은 호흡기 감염, 승모판막 비대 및 기능 부전, 변비 또는 설사인, 용도.
- 제78항 내지 제90항 중 어느 한 항에 있어서, 포유동물은 인간인, 용도.
- 제1항 내지 제16항 중 어느 한 항의 rAAV 벡터, 제17항 내지 제29항 중 어느 한 항의 rAAV 입자 또는 제30항의 약학적 조성물을 포함하는, 키트.
- 제31항 내지 제77항 중 어느 한 항의 방법에 따른 ML II 또는 ML III를 치료하기 위한 키트로서, 키트는 제1항 내지 제16항 중 어느 한 항의 rAAV 벡터, 제17항 내지 제29항 중 어느 한 항의 rAAV 입자 또는 제30항의 약학적 조성물을 포함하는, 키트.
- 제92항 또는 제93항에 있어서, 하나 이상의 완충제 또는 약학적으로 허용 가능한 부형제를 추가로 포함하는, 키트.
- 제92항 내지 제94항 중 어느 한 항에 있어서, ML II 및/또는 ML III의 치료에 사용하기 위한 설명서를 추가로 포함하는, 키트.
- 뮤코지질증 II(ML II)의 동물 모델로서, N-아세틸글루코사민-1-포스페이트 트랜스퍼라제(GNPTAB) 유전자의 적어도 하나의 대립유전자는 엑손 12와 엑손 20 사이에 위치한 결실을 포함하는, 동물 모델.
- 제96항에 있어서, GNPTAB 유전자의 적어도 하나의 대립유전자는 엑손 12와 엑손 20에 걸친 결실을 포함하는, 동물 모델.
- 제96항 또는 제97항에 있어서, 동물은 GNPTAB 유전자 내의 결실에 대하여 동형접합인, 동물 모델.
- 제96항 또는 제97항에 있어서, 동물은 GNPTAB 유전자 내의 결실에 대하여 이형접합인, 동물 모델.
- 제96항 내지 제99항 중 어느 한 항에 있어서, GNPTAB 유전자의 일부분이 리포터 및/또는 선택 마커를 인코딩하는 유전자에 의해 대체되는, 동물 모델.
- 제100항에 있어서, 선택 마커는 네오마이신에 대한 내성을 부여하는, 동물 모델.
- 제96항 내지 제101항 중 어느 한 항에 있어서, 동물은 포유동물인, 동물 모델.
- 제102항에 있어서, 포유동물은 설치류인, 동물 모델.
- 제103항에 있어서, 설치류는 마우스인, 동물 모델.
- 제104항에 있어서, 마우스는 129/Sv 및/또는 C57Bl/6에서 유래된 유전적 배경을 가지는, 동물 모델.
- 제96항 내지 제104항 중 어느 한 항에 있어서, 동물은 면역적격 또는 면역결핍인, 동물 모델.
- 동물 상의 GNPTAB 유전자의 적어도 하나의 대립유전자 내에 엑손 12와 엑손 20 사이의 결실을 도입하는 것을 포함하는 뮤코지질증 II(ML II)의 동물모델을 생성하는, 방법.
- 제107항에 있어서, GNPTAB 유전자의 적어도 하나의 대립유전자는 엑손 12와 엑손 20에 걸친 결실을 포함하는, 방법.
- 제107항 또는 제108항에 있어서, 동물은 GNPTAB 유전자 내의 결실에 대하여 동형접합이 되도록 사육되는, 방법.
- 제107항 또는 제108항에 있어서, 동물은 GNPTAB 유전자 내의 결실에 대하여 이형접합이 되도록 사육되는, 방법.
- 제107항 내지 제110항 중 어느 한 항에 있어서, GNPTAB 유전자의 일부분이 리포터 및/또는 선택 마커를 인코딩하는 유전자에 의해 대체되는, 방법.
- 제111항에 있어서, 선택 마커는 네오마이신에 대한 내성을 부여하는, 방법.
- 제107항 내지 제112항 중 어느 한 항에 있어서, 동물은 포유동물인 방법.
- 제113항에 있어서, 포유동물은 설치류인, 방법.
- 제114항에 있어서, 설치류는 마우스인, 방법.
- 제115항에 있어서, 마우스는 129/Sv 및/또는 C57Bl/6에서 유래된 유전적 배경을 가지는, 방법.
- 제96항 내지 제104항 중 어느 한 항에 있어서, 동물은 면역적격 또는 면역결핍인, 방법.
- 제107항 내지 제117항 중 어느 한 항의 방법에 의해 생성되는 뮤코지질증 II의 동물 모델.
- 제96항 내지 제106항 중 어느 한 항의 동물 모델에게 제제를 투여하는 것을 포함하는 뮤코지질증 II(ML II)의 치료를 위한 제제를 평가하는 방법으로서, ML II의 하나 이상의 증상의 완화는 제제가 ML II의 유익한 치료를 제공할 수 있음을 나타내는, 방법.
- 제119항에 있어서, ML II의 증상은 체중 감소, 골 밀도 감소, 골 무기질 함량 감소, 골격 결함, 인지 결핍, 대근육 및 소근육 운동 기술의 발달 지연, 난청, 근육 긴장 결핍, 팽만된 복부, 배꼽 탈장, 기도의 진행성 점막 비후, 잦은 호흡기 감염, 승모판막 비대 및 기능 부전, 변비 및/또는 설사인, 방법.
- 제119항 또는 제120항에 있어서, 제제는 저분자, 폴리펩티드, 항체, 핵산 또는 재조합 바이러스 입자인, 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562267502P | 2015-12-15 | 2015-12-15 | |
| US62/267,502 | 2015-12-15 | ||
| PCT/US2016/066611 WO2017106313A1 (en) | 2015-12-15 | 2016-12-14 | Adeno-associated viral vectors for treating mucolipidosis type ii |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20180098294A true KR20180098294A (ko) | 2018-09-03 |
| KR102833376B1 KR102833376B1 (ko) | 2025-07-11 |
Family
ID=57737987
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187019970A Active KR102833376B1 (ko) | 2015-12-15 | 2016-12-14 | 뮤코지질증 ii형을 치료하기 위한 아데노-관련 바이러스 벡터 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20200261598A1 (ko) |
| EP (1) | EP3390644B1 (ko) |
| JP (3) | JP7347932B2 (ko) |
| KR (1) | KR102833376B1 (ko) |
| CN (1) | CN108603199A (ko) |
| AU (2) | AU2016372035B2 (ko) |
| CA (1) | CA3008268A1 (ko) |
| ES (1) | ES2991277T3 (ko) |
| IL (1) | IL259964B (ko) |
| MX (1) | MX2018007330A (ko) |
| RU (1) | RU2742612C2 (ko) |
| SG (2) | SG11201804994QA (ko) |
| WO (1) | WO2017106313A1 (ko) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BR112020008835A2 (pt) | 2017-11-07 | 2020-10-20 | The University Of North Carolina At Chapel Hill | genes de aga otimizados e cassetes de expressão e seu uso |
| CN113302201A (zh) * | 2018-11-21 | 2021-08-24 | 斯特里迪比奥公司 | 重组病毒载体和用于产生所述重组病毒载体的核酸 |
| AU2020366242A1 (en) * | 2019-10-18 | 2022-05-26 | Research Institute At Nationwide Children's Hospital | Materials and methods for the treatment of disorders associated mutations in the IRF2BPL gene |
| CN116096394A (zh) * | 2020-02-13 | 2023-05-09 | 特纳亚治疗股份有限公司 | 用于治疗心脏病的基因疗法载体 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015060722A1 (en) * | 2013-10-24 | 2015-04-30 | Uniqure Ip B.V. | Aav-5 pseudotyped vector for gene therapy for neurological diseases |
| WO2015168666A2 (en) * | 2014-05-02 | 2015-11-05 | Genzyme Corporation | Aav vectors for retinal and cns gene therapy |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5478745A (en) * | 1992-12-04 | 1995-12-26 | University Of Pittsburgh | Recombinant viral vector system |
| US6566118B1 (en) | 1997-09-05 | 2003-05-20 | Targeted Genetics Corporation | Methods for generating high titer helper-free preparations of released recombinant AAV vectors |
| US6995006B2 (en) | 1997-09-05 | 2006-02-07 | Targeted Genetics Corporation | Methods for generating high titer helper-free preparations of released recombinant AAV vectors |
| WO1999055378A1 (en) * | 1998-04-27 | 1999-11-04 | Temple University - Of The Commonwealth System Of Higher Education | Method of treating endotoxemia |
| US6534300B1 (en) * | 1999-09-14 | 2003-03-18 | Genzyme Glycobiology Research Institute, Inc. | Methods for producing highly phosphorylated lysosomal hydrolases |
| US6723551B2 (en) | 2001-11-09 | 2004-04-20 | The United States Of America As Represented By The Department Of Health And Human Services | Production of adeno-associated virus in insect cells |
| IL161827A0 (en) | 2001-11-13 | 2005-11-20 | Univ Pennsylvania | A method of detecting and/or identifying adeno-associated virus (aav) sequences and isolating novelsequences identified thereby |
| CN100471957C (zh) * | 2002-04-30 | 2009-03-25 | 艾维亚医药/生物技术有限公司 | 用于免疫治疗的腺病毒载体 |
| US7510872B2 (en) | 2003-02-26 | 2009-03-31 | Nationwide Children's Hospital | Recombinant adeno-associated virus production |
| EP2277996B1 (en) | 2003-05-21 | 2014-09-03 | Genzyme Corporation | Methods for producing preparations of recombinant AAV virions substantially free of empty capsids |
| WO2006119432A2 (en) | 2005-04-29 | 2006-11-09 | The Government Of The U.S.A., As Rep. By The Sec., Dept. Of Health & Human Services | Isolation, cloning and characterization of new adeno-associated virus (aav) serotypes |
| WO2007120542A2 (en) | 2006-03-30 | 2007-10-25 | The Board Of Trustees Of The Leland Stanford Junior University | Aav capsid library and aav capsid proteins |
| PT2158322T (pt) * | 2007-06-06 | 2017-08-09 | Genzyme Corp | Terapia genética para doenças do armazenamento lisossomal |
| HUE028341T2 (en) | 2009-06-16 | 2016-12-28 | Genzyme Corp | Improved methods for purification of recombinant aav vectors |
| UA115648C2 (uk) * | 2010-06-25 | 2017-12-11 | Шае Хюмен Дженетік Терапіс, Інк. | Доставка терапевтичних агентів до цнс |
| US8663624B2 (en) | 2010-10-06 | 2014-03-04 | The Regents Of The University Of California | Adeno-associated virus virions with variant capsid and methods of use thereof |
| JP6224459B2 (ja) | 2011-02-17 | 2017-11-01 | ザ・トラステイーズ・オブ・ザ・ユニバーシテイ・オブ・ペンシルベニア | 組織特異性を改変し、aav9媒介遺伝子導入を改善するための組成物および方法 |
| WO2014144486A2 (en) * | 2013-03-15 | 2014-09-18 | The Children's Hospital Of Philadelphia | Vectors comprising stuffer/filler polynucleotide sequences and methods of use |
-
2016
- 2016-12-14 AU AU2016372035A patent/AU2016372035B2/en active Active
- 2016-12-14 RU RU2018124448A patent/RU2742612C2/ru active
- 2016-12-14 KR KR1020187019970A patent/KR102833376B1/ko active Active
- 2016-12-14 SG SG11201804994QA patent/SG11201804994QA/en unknown
- 2016-12-14 WO PCT/US2016/066611 patent/WO2017106313A1/en not_active Ceased
- 2016-12-14 MX MX2018007330A patent/MX2018007330A/es unknown
- 2016-12-14 IL IL259964A patent/IL259964B/en unknown
- 2016-12-14 CA CA3008268A patent/CA3008268A1/en active Pending
- 2016-12-14 EP EP16822578.7A patent/EP3390644B1/en active Active
- 2016-12-14 JP JP2018531240A patent/JP7347932B2/ja active Active
- 2016-12-14 US US16/061,579 patent/US20200261598A1/en active Pending
- 2016-12-14 ES ES16822578T patent/ES2991277T3/es active Active
- 2016-12-14 CN CN201680081705.8A patent/CN108603199A/zh active Pending
- 2016-12-14 SG SG10201912935WA patent/SG10201912935WA/en unknown
-
2021
- 2021-12-24 JP JP2021210071A patent/JP2022046635A/ja active Pending
-
2023
- 2023-06-28 AU AU2023204116A patent/AU2023204116A1/en active Pending
-
2024
- 2024-02-13 JP JP2024019140A patent/JP2024056832A/ja active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015060722A1 (en) * | 2013-10-24 | 2015-04-30 | Uniqure Ip B.V. | Aav-5 pseudotyped vector for gene therapy for neurological diseases |
| WO2015168666A2 (en) * | 2014-05-02 | 2015-11-05 | Genzyme Corporation | Aav vectors for retinal and cns gene therapy |
Non-Patent Citations (1)
| Title |
|---|
| J. Inherit. Metab. Dis., Vol.38, No.S1, pp.S245(2015.08.04.) * |
Also Published As
| Publication number | Publication date |
|---|---|
| IL259964B (en) | 2022-09-01 |
| US20200261598A1 (en) | 2020-08-20 |
| JP2022046635A (ja) | 2022-03-23 |
| JP2024056832A (ja) | 2024-04-23 |
| CN108603199A (zh) | 2018-09-28 |
| RU2742612C2 (ru) | 2021-02-09 |
| SG10201912935WA (en) | 2020-02-27 |
| JP7347932B2 (ja) | 2023-09-20 |
| MX2018007330A (es) | 2019-03-14 |
| RU2018124448A (ru) | 2020-01-17 |
| WO2017106313A1 (en) | 2017-06-22 |
| JP2019500034A (ja) | 2019-01-10 |
| EP3390644A1 (en) | 2018-10-24 |
| SG11201804994QA (en) | 2018-07-30 |
| IL259964A (en) | 2018-07-31 |
| AU2016372035B2 (en) | 2023-03-30 |
| KR102833376B1 (ko) | 2025-07-11 |
| AU2016372035A1 (en) | 2018-08-02 |
| BR112018012015A2 (pt) | 2018-12-04 |
| AU2023204116A1 (en) | 2023-07-13 |
| RU2018124448A3 (ko) | 2020-08-14 |
| EP3390644B1 (en) | 2024-07-31 |
| ES2991277T3 (es) | 2024-12-03 |
| CA3008268A1 (en) | 2017-06-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2015367385B2 (en) | Nucleic acid constructs and gene therapy vectors for use in the treatment of Wilson disease | |
| AU2023204116A1 (en) | Adeno-associated viral vectors for treating mucolipidosis type II | |
| JP2020059737A (ja) | 網膜色素変性症のための遺伝子治療 | |
| JP2018506585A (ja) | 線条体および皮質へのウイルス粒子の強化された送達 | |
| TW202035439A (zh) | 生成經改良的人類pah以藉由肝導向的基因置換療法來治療重度苯丙酮尿症(pku) | |
| JP2018505663A (ja) | ウィルソン病及び他の状態の処置に使用するための核酸構築物及び遺伝子治療ベクター | |
| US20250179522A1 (en) | Human pah expression cassette for treatment of pku by liver-directed gene replacement therapy | |
| US20230398192A1 (en) | Methods of treating metachromatic leukodystrophy | |
| HK1261965B (en) | Adeno-associated viral vectors for treating mucolipidosis type ii | |
| HK1261965A1 (en) | Adeno-associated viral vectors for treating mucolipidosis type ii | |
| BR112018012015B1 (pt) | Partículas compreendendo vetores virais adenoassociados, seu uso para tratar mucolipidose tipo ii ou iii e composição farmacêutica | |
| US20250152744A1 (en) | Methods of treating neurodegenerative disorders | |
| RU2848343C1 (ru) | Кассета экспрессии pah человека для лечения pku с помощью направленной на печень генной заместительной терапии | |
| WO2025160452A1 (en) | Methods for fus-based delivery of viral particles to the brain | |
| CN116648503A (zh) | 通过肝导向基因替代疗法治疗pku的人pah表达盒 | |
| Atlas et al. | Recombinant Adeno-Associated Virus-Mediated Gene Therapy for Treatment of Familial Hypercholesterolemia in Rabbits |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0105 | International application |
St.27 status event code: A-0-1-A10-A15-nap-PA0105 |
|
| P11-X000 | Amendment of application requested |
St.27 status event code: A-2-2-P10-P11-nap-X000 |
|
| P13-X000 | Application amended |
St.27 status event code: A-2-2-P10-P13-nap-X000 |
|
| PG1501 | Laying open of application |
St.27 status event code: A-1-1-Q10-Q12-nap-PG1501 |
|
| R17-X000 | Change to representative recorded |
St.27 status event code: A-3-3-R10-R17-oth-X000 |
|
| E13-X000 | Pre-grant limitation requested |
St.27 status event code: A-2-3-E10-E13-lim-X000 |
|
| P11-X000 | Amendment of application requested |
St.27 status event code: A-2-2-P10-P11-nap-X000 |
|
| P13-X000 | Application amended |
St.27 status event code: A-2-2-P10-P13-nap-X000 |
|
| PA0201 | Request for examination |
St.27 status event code: A-1-2-D10-D11-exm-PA0201 |
|
| R18-X000 | Changes to party contact information recorded |
St.27 status event code: A-3-3-R10-R18-oth-X000 |
|
| PE0902 | Notice of grounds for rejection |
St.27 status event code: A-1-2-D10-D21-exm-PE0902 |
|
| T11-X000 | Administrative time limit extension requested |
St.27 status event code: U-3-3-T10-T11-oth-X000 |
|
| E13-X000 | Pre-grant limitation requested |
St.27 status event code: A-2-3-E10-E13-lim-X000 |
|
| P11-X000 | Amendment of application requested |
St.27 status event code: A-2-2-P10-P11-nap-X000 |
|
| P13-X000 | Application amended |
St.27 status event code: A-2-2-P10-P13-nap-X000 |
|
| E701 | Decision to grant or registration of patent right | ||
| PE0701 | Decision of registration |
St.27 status event code: A-1-2-D10-D22-exm-PE0701 |
|
| F11 | Ip right granted following substantive examination |
Free format text: ST27 STATUS EVENT CODE: A-2-4-F10-F11-EXM-PR0701 (AS PROVIDED BY THE NATIONAL OFFICE) |
|
| PR0701 | Registration of establishment |
St.27 status event code: A-2-4-F10-F11-exm-PR0701 |
|
| PR1002 | Payment of registration fee |
St.27 status event code: A-2-2-U10-U12-oth-PR1002 Fee payment year number: 1 |
|
| U12 | Designation fee paid |
Free format text: ST27 STATUS EVENT CODE: A-2-2-U10-U12-OTH-PR1002 (AS PROVIDED BY THE NATIONAL OFFICE) Year of fee payment: 1 |
|
| PG1601 | Publication of registration |
St.27 status event code: A-4-4-Q10-Q13-nap-PG1601 |
|
| Q13 | Ip right document published |
Free format text: ST27 STATUS EVENT CODE: A-4-4-Q10-Q13-NAP-PG1601 (AS PROVIDED BY THE NATIONAL OFFICE) |
|
| G17 | Pta granted |
Free format text: ST27 STATUS EVENT CODE: A-4-4-G10-G17-TAD-PR1102 (AS PROVIDED BY THE NATIONAL OFFICE) |
|
| PR1102 | Extension of patent period due to registration delay |
St.27 status event code: A-4-4-G10-G17-tad-PR1102 Protection beyond ip right term event data comment text: Claim Total Quantity : 0, Period Limitation Text : 24 |