KR20170137848A - 폐암을 치료하는 방법 - Google Patents
폐암을 치료하는 방법 Download PDFInfo
- Publication number
- KR20170137848A KR20170137848A KR1020177032864A KR20177032864A KR20170137848A KR 20170137848 A KR20170137848 A KR 20170137848A KR 1020177032864 A KR1020177032864 A KR 1020177032864A KR 20177032864 A KR20177032864 A KR 20177032864A KR 20170137848 A KR20170137848 A KR 20170137848A
- Authority
- KR
- South Korea
- Prior art keywords
- fra
- antibody
- seq
- patient
- ser ser
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57407—Specifically defined cancers
- G01N33/57423—Specifically defined cancers of lung
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/82—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving vitamins or their receptors
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Biomedical Technology (AREA)
- Biochemistry (AREA)
- Organic Chemistry (AREA)
- Microbiology (AREA)
- Food Science & Technology (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Biotechnology (AREA)
- Cell Biology (AREA)
- Physics & Mathematics (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Hospice & Palliative Care (AREA)
- Oncology (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Epidemiology (AREA)
- Mycology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
본원에서는 폴레이트 수용체 알파 (FRA)-발현 폐암을 앓는 환자에서 FRA 표적화제를 이용하는 치료에 대한 반응성의 가능성을 예측하는 방법을 제공한다. FRA 표적화제를 이용하여 환자에서 FRA-발현 폐암을 치료하는 방법 또한 제공한다. 본 방법은 생물학적 샘플 중 환자의 FRA 발현 수준을 정량화 또는 결정하는 단계 및 FRA 발현 수준을 정량화하는데 사용되는 참조 표준과 환자의 FRA 발현 수준을 비교하는 단계를 수반하고, 여기서 환자의 FRA 발현 수준이 참조 FRA 발현 수준과 동일하거나 또는 그를 초과한다면, 환자는 FRA 표적화제를 이용하는 치료에 대해 반응할 가능성이 있는 것이다. 확인된 FRA-발현 폐암 환자 집단의 반응 예측용 및 치료용의 관련된 키트를 추가로 제공한다.
Description
관련 출원에 대한 상호 참조
본 출원은 2015년 4월 17일에 출원된 미국 가출원 번호 62/149184의 이익을 주장하고, 상기 가출원의 내용은 그 전문이 본원에서 참조로 포함된다.
서열 목록
본 출원은 ASCII 포맷으로 전자 제출되고, 그의 전문이 본원에서 참조로 포함된 서열 목록을 포함한다. 2016년 4월 13일에 작성된 상기 ASCII 사본의 명칭은 104018.000950_SL.txt이고, 크기는 30,473 바이트이다.
기술 분야
본원에 기술된 주제는 폴레이트 수용체 알파 (FRA)-발현 폐암을 앓는 환자에서 FRA 표적화제를 이용하는 치료에 대한 반응성의 가능성을 예측하는 방법, 및 FRA 표적화제를 이용하여 환자에서 FRA-발현 폐암을 치료하는 방법에 관한 것이다.
미국 암 협회에 따르면, 2015년 미국에서 221,200건의 신규 사례가 폐암 및 기관지암 진단을 받은 것으로 추정되었고, 이는 전체 신규 암 사례의 약 14%를 차지한다. 추가로, 2015년에서 폐암 및 기관지암으로 인한 사망이 158,040건에 달하는 것으로 추정되었고, 이는 전체 암 사망의 약 27%를 차지한다. 전체 폐암 중 대략 84%가 비소세포 폐암 (NSCLC)이고, 5년 생존율은 18%에 불과하다. 문헌 [American Cancer Society. Cancer Facts & Figures 2015. Atlanta: American Cancer Society. 2015].
진행성 NSCLC는 여전히, 지속적인 장기간의 생존은 극히 드문, 치료하기 어려운 암으로 남아있다. 화학요법, 특히, 백금 기반 더블릿 화학요법은 표적화된 요법을 위한 것으로 활성화 돌연변이가 없거나, 또는 비공지된 환자를 위한 것으로 확립된 치료이다. 진행성 NSCLC를 앓는 환자를 위한 화학요법을 선택할 때, 조직학적 성질은 점점 더 중요시되고 있는 인자이다 (Li et al., J Clin Oncol 2013;31:1039-1049.). 진행성 NSCLC에서의 대규모 3상 연구에서, 선암종 또는 대세포 암종을 앓는 대상체에서 시스플라틴 + 페메트렉세드가 시스플라틴 + 젬시타빈과 비교하였을 때 통계학상 우수한 전체 생존 (OS)을 제공한 것으로 나타났다 (Scagliotti, et al., J Clin Oncol 2008;26:3543-3551.). 그러나, 동일한 연구에서, 편평 세포 조직학적 성질을 보이는 상기 대상체는 젬시타빈 + 시스플라틴으로 치료받았을 때 더욱 우수한 결과를 보였다.
최근 다수의 드라이버 돌연변이가 확인되었으며, 이로써 표적화된 요법은 NSCLC에서 더욱 우수한 결과를 얻을 수 있었다. 폐암 돌연변이 컨소시엄은 그들이 평가한 선암종을 앓는 1,007명의 환자 중 64%에서 상기 "작용가능한" 돌연변이를 발견하였으며, 가장 일반적인 것은 KRAS, EGFR, 및 ALK였다. 본 연구에서 표적화된 요법을 사용한 결과, 확인된 돌연변이를 가지고 있지만, 표적화된 요법을 받지 않은 환자에서의 OS는 2.4년 및 발암성 드라이버를 보이지 않은 환자에서의 OS는 2.1년인 것 대비로 표적화된 요법을 받은, 발암성 드라이버를 보인 환자 서브세트에서의 OS 중간값은 3.5년이었다 (P = 0.001). (Kris et al., JAMA 2014;311:1998-2006.).
폴레이트 수용체 알파 (FRA)는 그의 발현 및 생물학적 성질이 다수의 악성 종양 세포 유형과 연관이 있는 세포 표면 GPI-고정된 단백질이다. FRA에 대한 항체가 개발되었고, 이를 임상전 및 임상 연구에서 시험하여 상기 항원을 발현하는 종양을 앓는 환자에서 상기 항체가 암 성장을 억제하는데 미치는 효과를 평가하였다. 최근에는 난소암 및 폐암에 대해 항-FRA 항체가 미치는 효과를 시험하기 위해 상기 질환에서 시험이 수행되었다 (Armstrong et al., Gynecol. Oncol. 2013 Jun;129(3):452-8; Thomas et al., Lung Cancer. 2013; 80(1):15-8). 이들 시험으로부터 얻은 결과는 항-FRA 요법이, 부분적으로는 다양한 수준의 FRA 항원 뿐만 아니라, 항-FRA 항체의 약리학적 활성(들)에 영향을 줄 수 있는 다른 인자를 보이는 암 환자로 이루어진, 광범위한 비강화된 또는 바이오마커-선별된, 이종성 치료 의향 집단에서 통계학상 유의한 임상적 이익을 제공하는 데에는 실패하였다는 것을 입증한다 (Vergote et al., Cancer Metastasis Rev. 2015 Jan 7, DOI 10.1007/s10555-014-9539-8; Thomas et al., Lung Cancer. 2013; 80(1):15-8). 대부분의 항-FRA 항체 임상 연구는 모든 참가자를 포함하여 왔지만, FRA 발현의 임계 수준이 항-FRA 항체 요법에 대한 치료학적 반응과 상관관계가 있을 수 있는지 여부를 결정하기 위해 FRA 발현 수준에 기초하여 환자를 선별한 적은 없었다. 현재, 항-FRA 항체 요법에 대한 치료학적 반응과 FRA의 발현 수준과의 상관관계를 제안하는 데이터는 없다. 실제로, 종양 항원 발현과 항원 표적화된 요법에 대한 반응 사이의 상관 관계의 결과는 다수의 종양 항원에 대해 확인하기가 어려웠다. 가장 잘 연구된 종양 항원 중 하나인 HER2는 발현-임상적 이익의 상관관계가 부족하고, 이로써, 항-HER2 항체 허셉틴(Herceptin) (트라스투주맙)으로 치료받은 환자는 종양 항원이 높거나, 낮음에 상관없이 임상적 이익을 보인 것으로 입증된 다수의 예들 중 하나이다 (Paik et al.; N Engl J Med 2008; 358:1409-1411).
FRA를 표적화하는 치료 요법에 대해 반응할 NSCLC 환자를 확인하는 방법이 절실히 요구되고 있다. 본원에 기술된 방법 및 키트는 이러한 요구를 충족시켜 준다.
본원에서는 폴레이트 수용체 알파 (FRA)-발현 폐암을 앓는 환자에서 폴레이트 수용체 알파 (FRA)-표적화제를 이용하는 치료에 대한 반응성의 가능성을 예측하는 방법을 제공한다. 상기 치료에 대한 반응성의 가능성을 예측하는 방법은 생물학적 샘플 중 환자의 FRA 발현 수준을 결정하는 단계; 및 환자의 FRA 발현 수준을 참조 FRA 발현 수준과 비교하는 단계를 수반한다. 환자의 FRA 발현 수준이 참조 FRA 발현 수준과 동일하거나 또는 그를 초과한다면, 환자는 FRA 표적화제를 이용하는 치료에 대해 반응할 가능성이 있는 것이다.
본원에서는 또한 FRA 표적화제를 이용하여 환자에서 폴레이트 수용체 알파 FRA-발현 폐암을 치료하는 방법을 제공한다. 상기 방법은 생물학적 샘플 중 환자의 FRA 발현 수준을 결정하는 단계; 및 환자의 FRA 발현 수준을 참조 FRA 발현 수준과 비교하는 단계; 및 환자의 FRA 발현 수준이 참조 FRA 발현 수준과 동일하거나 또는 그를 초과한다면, 환자에게 FRA 표적화제를 투여하는 단계를 수반한다. 일부 실시양태에서, 화학요법제 (예컨대, 본원에 기술된 표준 치료 화학요법)를 FRA 표적화제와 함께 또는 그를 사용하지 않고 환자에게 투여한다.
본원에 기술된 폴레이트 수용체 알파 (FRA)-표적화제를 이용하는 치료에 대한 반응성의 가능성을 예측하는 방법, 및 FRA 표적화제를 이용하여 환자에서 폴레이트 수용체 알파 FRA-발현 폐암을 치료하는 방법의 일부 실시양태에서, FRA 표적화제는 FRA에 면역특이적으로 결합하는 항체, 또는 그의 항원 결합 단편을 포함한다. 바람직한 실시양태에서, FRA에 면역특이적으로 결합하는 항체로는 팔레투주맙을 포함한다. 일부 실시양태에서, FRA에 면역특이적으로 결합하는 항체는 독소, 예컨대, 예를 들어, 미세관 억제제, DNA 손상 작용제 (예컨대, 방사성핵종), DNA 복구 억제제, 또는 신호 전달 억제제에 접합된다. 본원에 기술된 방법에 따라 FRA 표적화제로서 사용될 수 있는 예시적인 항체-약물 접합체는 IMGN853이다. 본원에 기술된 방법의 일부 실시양태에서, FRA 표적화제는 빈타폴리드이다.
본원에 기술된 방법의 일부 실시양태에서, FRA-발현 폐암은 FRA 발현 비소세포 폐암 (NSCLC)이다. 일부 실시양태에서, NSCLC는 선암종이다.
상기 언급된 각 방법의 경우, 참조 FRA 발현 수준은, FRA 표적화제를 투여받은 FRA-발현 폐암에 걸린 환자 집단이 위약을 투여받은 FRA-발현 폐암에 걸린 환자 집단에 비해 적어도 하나의 임상적 결과에서의 통계학상 유의한 개선을 입증한 수준 초과의 FRA 발현 수준에 상응한다. 개선된 임상적 결과는 예를 들어, 무진행 생존 및/또는 전체 생존일 수 있다. 일부 실시양태에서, 참조 FRA 발현 수준은 본원에 기술된 바와 같이 42%의 +1 이상의 항-FRA 염색에 상응한다. 일부 실시양태에서, 참조 FRA 발현 수준은 본원에 기술된 바와 같이 21%의 +2 이상의 항-FRA 염색이다. 일부 실시양태에서, 참조 FRA 발현 수준은 본원에 기술된 바와 같이 14%의 +3 이상의 염색이다. 일부 실시양태에서, 참조 FRA 발현 수준은 7의 FRAMSCOR (또는 M-점수)이다. 일부 실시양태에서, 참조 FRA 발현 수준은 0.25의 HBSCOR이다.
일부 실시양태에서, FRA-발현 폐암에 걸린 환자 집단은 화학요법제, 예컨대, 예를 들어, 탁산, 백금-함유 화합물 (예컨대, 시스플라틴, 카르보플라틴), 및 항폴레이트 (예컨대, 페메트렉세드), 또는 그의 임의의 조합을 추가로 투여받는다.
FRA 발현 수준은 본원에 기술된 방법에 의해 단백질 정량화 또는 RNA 정량화에 의해 측정될 수 있다. 세포질 또는 막 FRA 발현이 측정될 수 있다. 바람직한 실시양태에서, FRA 발현 수준은 면역조직화학적 분석에 의해 측정된다. 바람직한 실시양태에서, FRA 발현 수준은 하기 항체 중 적어도 하나를 이용하여 면역검정에 의해 결정된다:
(a) 팔레투주맙과 동일한 에피토프에 결합하는 항체;
(b) CDRH1로서 서열식별번호(SEQ ID NO): 1 (GFTFSGYGLS), CDRH2로서 서열식별번호: 2 (MISSGGSYTYYADSVKG), CDRH3으로서 서열식별번호: 3 (HGDDPAWFAY), CDRL1로서 서열식별번호: 4 (SVSSSISSNNLH), CDRL2로서 서열식별번호: 5 (GTSNLAS) 및 CDRL3으로서 서열식별번호: 6 (QQWSSYPYMYT)을 포함하는 항체;
(c) 서열식별번호: 7의 아미노산 서열을 포함하는 성숙 경쇄 가변 영역 및 아미노산 서열식별번호: 8을 포함하는 성숙 중쇄 가변 영역을 포함하는 항체;
(d) 팔레투주맙;
(e) 548908 항체;
(f) 548908 항체와 동일한 에피토프에 결합하는 항체;
(g) 6D398 항체;
(h) 6D398 항체와 동일한 에피토프에 결합하는 항체;
(i) BN3.2 항체 (레이카 바이오시스템즈(Leica Biosystems));
(j) BN3.2 항체와 동일한 에피토프에 결합하는 항체;
(k) 26B3 항체와 동일한 에피토프에 결합하는 항체;
(l) CDRH1로서 서열식별번호: 14 (GYFMN), CDRH2로서 서열식별번호: 15 (RIFPYNGDTFYNQKFKG), CDRH3으로서 서열식별번호: 16 (GTHYFDY), CDRL1로서 서열식별번호: 17 (RTSENIFSYLA), CDRL2로서 서열식별번호: 18 (NAKTLAE) 및 CDRL3으로서 서열식별번호: 19 (QHHYAFPWT)를 포함하는 항체;
(m) 26B3 항체;
(n) 19D4 항체와 동일한 에피토프에 결합하는 항체;
(o) CDRH1로서 서열식별번호: 20 (HPYMH), CDRH2로서 서열식별번호: 21 (RIDPANGNTKYDPKFQG), CDRH3으로서 서열식별번호: 22 (EEVADYTMDY), CDRL1로서 서열식별번호: 23 (RASESVDTYGNNFIH), CDRL2로서 서열식별번호: 24 (LASNLES) 및CDRL3으로서 서열식별번호: 25 (QQNNGDPWT)를 포함하는 항체;
(p) 19D4 항체;
(q) 9F3 항체와 동일한 에피토프에 결합하는 항체;
(r) CDRH1로서 서열식별번호: 26 (SGYYWN), CDRH2로서 서열식별번호: 27 (YIKSDGSNNYNPSLKN), CDRH3으로서 서열식별번호: 28 (EWKAMDY), CDRL1로서 서열식별번호: 29 (RASSTVSYSYLH), CDRL2로서 서열식별번호: 30 (GTSNLAS) 및 CDRL3으로서 서열식별번호: 31 (QQYSGYPLT)을 포함하는 항체;
(s) 9F3 항체;
(t) 24F12 항체와 동일한 에피토프에 결합하는 항체;
(u) CDRH1로서 서열식별번호: 32 (SYAMS), CDRH2로서 서열식별번호: 33 (EIGSGGSYTYYPDTVTG), CDRH3으로서 서열식별번호: 34 (ETTAGYFDY), CDRL1로서 서열식별번호: 35 (SASQGINNFLN), CDRL2로서 서열식별번호: 36 (YTSSLHS) 및 CDRL3으로서 서열식별번호: 37 (QHFSKLPWT)을 포함하는 항체;
(v) 24F12 항체;
(w) 하기로 이루어진 군으로부터 선택되는 가변 영역 경쇄를 포함하는 항체:
(i) LK26HuVK;
(ii) LK26HuVKY;
(iii) LK26HuVKPW; 및
(iv) LK26HuVKPW,Y;
(x) 하기로 이루어진 군으로부터 선택되는 가변 영역 중쇄를 포함하는 항체:
(i) LK26HuVH;
(ii) LK26HuVH FAIS,N;
(iii) LK26HuVH SLF;
(iv) LK26HuVH I,I;
(v) LK26KOLHuVH;
(y) 중쇄 가변 영역 LK26KOLHuVH (서열식별번호: 46) 및 경쇄 가변 영역 LK26HuVKPW,Y (서열식별번호: 41)를 포함하는 항체;
(z) 중쇄 가변 영역 LK26HuVH SLF (서열식별번호: 44) 및 경쇄 가변 영역 LK26HuVKPW,Y (서열식별번호: 41)를 포함하는 항체;
(aa) 중쇄 가변 영역 LK26HuVH FAIS,N (서열식별번호: 43) 및 경쇄 가변 영역 LK26HuVKPW,Y (서열식별번호: 41)를 포함하는 항체; 및
(bb) 뮤린 모노클로날 LK26 항체.
본원에 기술된 방법에서, FRA 발현 수준은 디지털 영상화 기술 또는 수동 병리상태 정량화에 의해 평가될 수 있다. 일부 실시양태에서, FRA 발현 수준은 FRAMSCOR 또는 HBSCOR에 의해 평가된다.
본원에 기술된 방법에 따라 검정되는 생물학적 샘플은 소변, 혈액, 혈청, 혈장, 타액, 순환 세포, 순환 종양 세포, 또는 종양 조직 (예컨대, 흉막 조직)일 수 있다. 일부 실시양태에서, 생물학적 샘플은 삼출액으로부터 유래된 흉막 세포를 포함한다.
기술된 방법은 환자의 FRA 발현 수준이 참조 FRA 발현 수준과 동일하거나 또는 초과하는지 여부와는 상관 없이 환자에게 화학요법제를 투여하는 단계를 추가로 수반할 수 있다. 바람직한 실시양태에서, 화학요법제로는 백금-함유 화합물, 예컨대, 시스플라틴 또는 카르보플라틴; 탁산 (예를 들어, 파클리탁셀); 항폴레이트 (예컨대, 페메트렉세드); 또는 그의 임의의 조합을 포함한다. 예를 들어, 본원에 기술된 방법에서, 환자는 카르보플라틴 및 파클리탁셀; 카르보플라틴 및 페메트렉세드; 또는 시스플라틴 및 페메트렉세드를 투여받을 수 있다.
요약된 주제에 관한 추가 측면은 상세한 설명 및 제공된 실시예 및 관련 도면에서 더욱 상세하게 제공된다.
상기 발명의 내용란 뿐만 아니라, 하기의 상세한 설명은 첨부된 도면과 함께 읽을 때 추가로 이해된다. 개시된 방법을 예시하기 위한 목적으로 본 방법의 예시적인 실시양태는 도면으로 제시되지만; 본 방법이 개시된 구체적인 실시양태로 제한되는 것은 아니다. 본 도면에서:
도 1은 FRAMSCOR 및 HBSCOR을 통한 FRA 정량화를 위한 흉막 조직 적합성을 보여주는 것이다. 정상 (좌측 상단 패널) 또는 악성 비소세포 폐 선암종 (NSCLC) 조직 샘플 (다른 모든 패널)을 환자로부터 입수하였다. 조직을 포르말린 고정시키고, 유리 슬라이드 상에서 절개하고, 26B3 항-FRA 항체를 사용하여 FRA 발현에 대해 염색하였다. 염색된 슬라이드를 현미경법에 의해 시각화하고, 사진 촬영을 통해 문서로 기록하여 입증하였다. 본 도면은 정량화된 FRA 세포질 또는 막 염색에 적합한 흉막 조직 표본 및 염색을 나타낸다 (맨 윗줄). 조직 보존이 불량하거나, 조직 형태가 불량하거나, 또는 과다 염색을 보이는 표준 뿐만 아니라, 흉막 조직이 아닌, 흉막 삼출액 중의 악성 세포로 구성된 것은 FRA 발현 임상적 결과 상관관계 연구에서 제외된다. 후자의 예는 맨 아랫줄에 제시되어 있다. 삼출액으로부터 유래된 세포는 항-FRA 치료 반응에 필요한 최소 FRA 수준을 측정하는데 사용된다.
도 2는 악성 흉막 조직에서 FRA 발현을 +1 (낮은 발현), +2 (중간 정도 수준) 및 +3 (높은 수준)으로 점수화하는데 사용된 참조 데이터 세트의 대표적인 샘플을 보여주는 것이다.
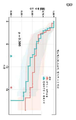
도 3은 HBSCOR 방법을 사용하여 임상적 결과 (전체 생존)에 대한 FRA의 세포질 수준을 결정하는 대표적인 발현 컷포인트 분석을 보여주는 것이다. 반응의 유의한 개선은 그의 FRA 발현 수준이 HBSCOR ~0.29 이상을 초과하는 것인 환자에서 관찰된다. 상기 수준에서, 그의 종양 FRA 발현 수준이 상기 값 미만인 환자와 비교하였을 때, 유의한 임상적 반응 (위험비 < 0.5)이 관찰된다. HBSCOR 0.25 이상인, 팔레투주맙으로 치료받은 환자에서 양성 임상적 결과 (위험비 < 0.7)가 관찰된다.
도 4a 및 4b는 표준 치료 (SOC) 화학요법 +/- 팔레투주맙으로 치료받고, 높은 수준의 막 국재화된 (FRAMSCOR) FRA를 발현하는 환자의 임상적 반응을 도시한 것이다. 패널 A는 각각 18.3 mo vs 10.0 mo (위험비 0.54; p = 0.0266)로, 위약 + SOC로 치료받은 환자 (적색 라인; 동그라미 표시) 대비 팔레투주맙 + SOC로 치료받고 (청색 라인; 삼각형 표시), 7 초과의 FRAMSCOR을 갖는 환자에서 OS의 임상적으로 중요한 개선이 이루어진 것인, FRAMSCOR 방법을 사용하여 높은 수준의 FRA를 보이는 환자에서의 전체 생존 (OS)의 대표적인 측정값을 보여주는 것이다. PFS를 측정하였을 때에도 유사한 임상적 이익이 관찰되었다. 패널 B는 위약 + SOC로 치료받은 환자 (적색 라인; 동그라미 표시) 대비 팔레투주맙 + SOC로 치료받고 (청색 라인; 삼각형 표시), 7 미만의 FRAMSCOR을 갖는 환자에서는 OS의 임상적으로 중요한 개선이 이루어지지 않았다는 것을 보여주는 것이다 (p = 0.386).
도 5a 및 5b는 HBSCOR 방법을 사용하여 결정 시 낮은 수준의 세포질 FRA를 발현하는 환자 (패널 A) vs 높은 수준의 세포질 FRA를 발현하고 (패널 B), 표준 치료 화학요법 +/- 팔레투주맙으로 치료받은 환자의 임상적 반응을 도시한 것이다. 패널 A는 차선의 HBSCOR (HBSCOR < 0.38)을 나타내는 환자는 위약 대조군 (개방형 동그라미 표시)과 비교하였을 때, 팔레투주맙 (폐쇄형 동그라미 표시)으로 치료받은 경우, 어떤 임상적 개선도 보이지 않은 것인 (위험비 1.03; p = 0.5389), FRA 수준이 낮은 환자에서의 전체 생존 (OS)의 대표적인 측정값을 보여주는 것이다. 패널 B는 전체 생존이 8.8개월 개선된 것으로 해석되는, 최적의 HBSCOR을 나타내는 환자에서의 전체 생존의 통계학상 유의한 개선을 보여주는 것이다 (HBSCOR ≥ 0.38; 위험비 0.24; p = 0.0069). PFS를 측정하였을 때에도 유사한 효과가 관찰되었다.
도 1은 FRAMSCOR 및 HBSCOR을 통한 FRA 정량화를 위한 흉막 조직 적합성을 보여주는 것이다. 정상 (좌측 상단 패널) 또는 악성 비소세포 폐 선암종 (NSCLC) 조직 샘플 (다른 모든 패널)을 환자로부터 입수하였다. 조직을 포르말린 고정시키고, 유리 슬라이드 상에서 절개하고, 26B3 항-FRA 항체를 사용하여 FRA 발현에 대해 염색하였다. 염색된 슬라이드를 현미경법에 의해 시각화하고, 사진 촬영을 통해 문서로 기록하여 입증하였다. 본 도면은 정량화된 FRA 세포질 또는 막 염색에 적합한 흉막 조직 표본 및 염색을 나타낸다 (맨 윗줄). 조직 보존이 불량하거나, 조직 형태가 불량하거나, 또는 과다 염색을 보이는 표준 뿐만 아니라, 흉막 조직이 아닌, 흉막 삼출액 중의 악성 세포로 구성된 것은 FRA 발현 임상적 결과 상관관계 연구에서 제외된다. 후자의 예는 맨 아랫줄에 제시되어 있다. 삼출액으로부터 유래된 세포는 항-FRA 치료 반응에 필요한 최소 FRA 수준을 측정하는데 사용된다.
도 2는 악성 흉막 조직에서 FRA 발현을 +1 (낮은 발현), +2 (중간 정도 수준) 및 +3 (높은 수준)으로 점수화하는데 사용된 참조 데이터 세트의 대표적인 샘플을 보여주는 것이다.
도 3은 HBSCOR 방법을 사용하여 임상적 결과 (전체 생존)에 대한 FRA의 세포질 수준을 결정하는 대표적인 발현 컷포인트 분석을 보여주는 것이다. 반응의 유의한 개선은 그의 FRA 발현 수준이 HBSCOR ~0.29 이상을 초과하는 것인 환자에서 관찰된다. 상기 수준에서, 그의 종양 FRA 발현 수준이 상기 값 미만인 환자와 비교하였을 때, 유의한 임상적 반응 (위험비 < 0.5)이 관찰된다. HBSCOR 0.25 이상인, 팔레투주맙으로 치료받은 환자에서 양성 임상적 결과 (위험비 < 0.7)가 관찰된다.
도 4a 및 4b는 표준 치료 (SOC) 화학요법 +/- 팔레투주맙으로 치료받고, 높은 수준의 막 국재화된 (FRAMSCOR) FRA를 발현하는 환자의 임상적 반응을 도시한 것이다. 패널 A는 각각 18.3 mo vs 10.0 mo (위험비 0.54; p = 0.0266)로, 위약 + SOC로 치료받은 환자 (적색 라인; 동그라미 표시) 대비 팔레투주맙 + SOC로 치료받고 (청색 라인; 삼각형 표시), 7 초과의 FRAMSCOR을 갖는 환자에서 OS의 임상적으로 중요한 개선이 이루어진 것인, FRAMSCOR 방법을 사용하여 높은 수준의 FRA를 보이는 환자에서의 전체 생존 (OS)의 대표적인 측정값을 보여주는 것이다. PFS를 측정하였을 때에도 유사한 임상적 이익이 관찰되었다. 패널 B는 위약 + SOC로 치료받은 환자 (적색 라인; 동그라미 표시) 대비 팔레투주맙 + SOC로 치료받고 (청색 라인; 삼각형 표시), 7 미만의 FRAMSCOR을 갖는 환자에서는 OS의 임상적으로 중요한 개선이 이루어지지 않았다는 것을 보여주는 것이다 (p = 0.386).
도 5a 및 5b는 HBSCOR 방법을 사용하여 결정 시 낮은 수준의 세포질 FRA를 발현하는 환자 (패널 A) vs 높은 수준의 세포질 FRA를 발현하고 (패널 B), 표준 치료 화학요법 +/- 팔레투주맙으로 치료받은 환자의 임상적 반응을 도시한 것이다. 패널 A는 차선의 HBSCOR (HBSCOR < 0.38)을 나타내는 환자는 위약 대조군 (개방형 동그라미 표시)과 비교하였을 때, 팔레투주맙 (폐쇄형 동그라미 표시)으로 치료받은 경우, 어떤 임상적 개선도 보이지 않은 것인 (위험비 1.03; p = 0.5389), FRA 수준이 낮은 환자에서의 전체 생존 (OS)의 대표적인 측정값을 보여주는 것이다. 패널 B는 전체 생존이 8.8개월 개선된 것으로 해석되는, 최적의 HBSCOR을 나타내는 환자에서의 전체 생존의 통계학상 유의한 개선을 보여주는 것이다 (HBSCOR ≥ 0.38; 위험비 0.24; p = 0.0069). PFS를 측정하였을 때에도 유사한 효과가 관찰되었다.
개시된 방법은 본 개시내용의 일부를 형성하는 첨부된 도면과 관련하여 취해지는 하기의 상세한 설명을 참조로 하여 더욱 쉽게 이해될 수 있다. 개시된 방법은 본원에 기술되고/거나, 제시된 구체적인 방법으로 제한되는 것이 아니며, 본원에서 사용된 용어는 단지 예로서 특정 실시양태를 기술하고자 하는 것이며, 청구되는 방법을 제한하는 것으로 의도되지 않음을 이해하여야 한다.
유사하게, 달리 구체적으로 언급되지 않는 한, 가능한 작용 기전 또는 모드 또는 개선 이유에 관한 임의의 기술 내용은 단지 예시적인 것을 의미하며, 개시된 방법은 상기 제안된 작용 기전 또는 모드 또는 개선 이유의 정확성 또는 부정확성에 의해 제한되지 않아야 한다.
본원에서 명료함을 위해 별개의 실시양태의 문맥에서 기술된 개시된 방법의 특정 특징은 또한 단일 실시양태에서 조합되어 제공될 수 있다는 것을 이해하여야 한다. 반대로, 간결함을 위해 단일 실시양태의 문맥에서 기술된 개시된 방법의 다양한 특징은 또한 별개로 또는 임의의 하위조합으로 제공될 수 있다.
본원에서 사용되는 바, 단수 형태는 복수 형태의 것도 포함한다.
측정가능한 값, 예컨대, 양, 시간적 지속 기간 등을 언급할 때 본원에서 사용되는 바, "약"이라는 용어는 언급된 값으로부터의 최대 ± 10% 이하의 변동을 포함하는 것으로 의미되는데, 그 이유는 상기 변동은 개시된 방법을 수행하는데 적절하기 때문이다. 달리 명시되지 않는 한, 본 명세서 및 특허청구범위에서 사용되는 성분, 특성의 양을 표시하는 모든 수치, 예컨대, 분자량, 반응 조건 등은 모든 경우에서 "약"이라는 용어로 수식될 수 있는 것으로 이해되어야 한다. 따라서, 달리 반대로 명시되지 않는 한, 하기 명세서 및 첨부된 특허청구범위에 기술된 수치상의 파라미터는 본 발명에 의해 수득하고자 하는 원하는 특성에 따라 달라질 수 있는 근사값이다. 적어도, 및 특허청구범위의 범주에 대한 등가물의 원리의 출원을 제한하고자 하는 시도로서가 아닌, 각 수치상의 파라미터는 적어도 보고된 유효 숫자의 개수에 비추어, 및 통상의 반올림 기술을 적용함으로써 해석되어야 한다.
"항체"라는 용어는 달리 언급되지 않는 한, (a) 모든 면역글로불린 이소타입 (IgG, IgA, IgE, IgM, IgD, 및 IgY), 부류 (예컨대, IgG1, IgG2, IgG3, IgG4, IgA1, IgA2), 서브부류, 및 각 이소타입의 각종 단량체 및 중합체 형태를 비롯한, 면역글로불린 폴리펩티드, 즉, 특이적 항원 (예컨대, 폴레이트 수용체 알파)에 특이적으로 결합하는 항원 결합 부위를 함유하는 면역글로불린 패밀리의 폴리펩티드, 및 (b) 항원 (예컨대, 폴레이트 수용체 알파)에 면역특이적으로 결합하는 상기 면역글로불린 폴리펩티드의 보존적으로 치환된 변이체를 지칭한다. 항체는 일반적으로 예를 들어, 문헌 [Harlow & Lane, Antibodies: A Laboratory Manual (Cold Spring Harbor Laboratory Press, 1988)]에 기술되어 있다. 달리 문맥으로부터 자명해지지 않는 한, 항체에 관한 언급은 하기에서 더욱 상세하게 기술되는 항체 유도체 또한 포함한다.
"항체 단편"은 전장의 항체의 일부분, 일반적으로 그의 항원 결합 영역 또는 가변 영역, 예컨대, Fab, Fab', F(ab')2, 및 Fv 단편; 디아바디; 바이오바디; 선형 항체; 단일 쇄 항체 분자; 및 항체 단편으로부터 형성된 다중특이적 항체를 포함한다. 항체의 단백질 분해 소화 및 숙주 세포에서의 재조합 생산을 비롯한 다양한 기술이 항체 단편 제조를 위해 개발되었지만; 그러나, 항체 단편 제조를 위한 다른 기술도 통상의 기술자에게 자명할 것이다. 일부 실시양태에서, 최상의 항체 단편은 단일 쇄 Fv 단편 (scFv)이다. "단일 쇄 Fv" 또는 "scFv" 항체 단편은 항체의 VH 및 VL 도메인을 포함하며, 여기서 상기 도메인은 단일 폴리펩티드 쇄에 존재한다. 일반적으로, Fv 폴리펩티드는 VH 및 VL 도메인 사이에, scFv가 항원 결합을 위해 바람직한 구조를 형성할 수 있게 하는 폴리펩티드 링커를 추가로 포함한다. scFv 및 다른 항체 단편의 리뷰를 위해, 문헌 [James D. Marks, Antibody Engineering, Chapter 2, Oxford University Press (1995) (Carl K. Borrebaeck, Ed.)]를 참조한다.
"항체 유도체"란, 이종성 분자의 공유 부착에 의해, 예컨대, 이종성 폴리펩티드 (예컨대, 세포독소) 또는 치료제 (예컨대, 화학요법제)의 부착에 의해, 또는 보통은 항체와는 관련이 없는 글리코실화, 데글리코실화, 아세틸화 또는 인산화 등에 의해 변형된, 상기 정의된 바와 같은 항체를 의미한다.
"모노클로날 항체"라는 용어는 그의 제조 방법이 아니고, 임의의 진핵 또는 원핵 세포 클론을 비롯한, 단일 세포 클론, 또는 파지 클론으로부터 유래된 항체를 지칭한다. 따라서, "모노클로날 항체"라는 용어는 하이브리도마 기술을 통해 제조된 항체로 제한되지 않는다.
"항원"은 항체의 특이적인 결합 대상이 되는 엔티티이다. 예를 들어, 폴레이트 수용체 알파는 항-폴레이트 수용체 알파 항체가 특이적으로 결합하게 되는 항원이다.
FRA 표적화제는 FRA를 표적화하거나, 또는 FRA를 통해 그의 효과를 발휘하는 치료제이다. FRA 표적화제로는 FRA 결합 단백질, 예컨대, FRA에 면역특이적으로 결합하는 항체 및 그의 항원 결합 단편, 예컨대, 팔레투주맙; 상기 항체 및 항원 결합 단편의 약물 접합체, 예컨대, IMGN853 (이뮤노겐(Immunogen)); 및 소분자, 예컨대, 빈타폴리드 (EC 145; 엔도사이트(Endocyte))를 포함하나, 이에 제한되지 않는다. 빈타폴리드는, 약물이 FRA 및 세포내이입을 통해 암성 세포의 세포질 내로 유리될 수 있도록 허용하는, 폴레이트-데스아세틸빈블라스틴 모노히드라지드 접합체이다. 바람직한 실시양태에서, FRA 표적화제는 팔레투주맙이다.
"암" 및 "종양"이라는 용어는 관련 기술분야에 널리 공지되어 있고, 예컨대, 대상체에 암 유발 세포에 전형적인 특징, 예컨대, 비조절성 증식, 불멸, 전이성 잠재능, 신속한 성장 및 증식률, 및 특정의 특징적인 형태학적 특징이 있는 세포가 존재함을 지칭한다. 암 세포는 대개 종양 형태로 존재하지만, 상기 세포는 대상체 내에 단독으로 존재할 수 있거나, 또는 비-종양원성 암 세포, 예컨대, 백혈병 세포일 수 있다. 본원에서 사용되는 바, "암"이라는 용어는 악성 암 뿐만 아니라, 전암성 암도 포함한다.
본원에서 사용되는 바, "폴레이트 수용체 알파" (이는 또한 FRA, FR 알파, FOLR-1 또는 FOLR1로도 지칭됨)라는 용어는 폴레이트에 대해 높은 친화성을 갖는 수용체의 알파 이소폼을 지칭한다. 막 결합 FRA는 글리코실 포스파티딜이노시톨 (GPI) 앵커에 의해 세포에 부착되어 있고, 막과 세포내이입 구획 사이를 재순환하고, 폴레이트를 세포 내로 수송할 수 있다. FRA는 여성의 생식관, 태반, 유방, 신장 근위 세뇨관, 맥락막망, 폐 및 타액선의 것을 비롯한, 다양한 상피 조직에서 발현된다. 가용성 형태의 FRA로는 막 상에 고정된 폴레이트 수용체에 대한 프로테아제 또는 포스포리파제의 작용에 의해 유도된 것을 포함하나, 이에 제한되지 않는다.
인간 FRA에 대한 컨센서스 뉴클레오티드 및 아미노산 서열은 각각 서열식별번호: 9 및 10으로 본원에 기술되어 있다.
변이체, 예를 들어, 자연적으로 발생된 대립유전자 변이체 또는 적어도 하나의 아미노산 치환을 포함하는 서열이 본원에서 사용되는 상기 용어에 의해 포함된다.
본원에서 사용되는 바, "세포에 결합되지 않은"이라는 용어는 단백질이 세포, 예컨대, 암성 세포의 세포막에 부착되지 않은 것을 지칭한다. 특정 실시양태에서, 세포에 결합되지 않은 FRA는 어떤 세포에도 결합되지 않은 비결합된 상태이며, 이는 생물학적 유체, 예컨대, 소변, 혈청, 혈장, 또는 흉막 삼출액 중에서 자유롭게 부유하거나, 또는 용해되어 있다. 예를 들어, 세포에 결합되지 않은 단백질은 정상 세포 또는 암성 세포로부터, 예를 들어, 암성 세포의 표면으로부터 생물학적 유체 내로 배출, 분비 또는 외수송될 수 있다.
본원에서 사용되는 바, 명시된 RNA의 "수준" 또는 "발현 수준"이란, RNA 수준의 측정을 위해 관련 기술분야에 공지된 임의의 방법을 사용하여 결정된 바와 같은 RNA의 수준을 지칭한다. 상기 방법으로는 분광광도법 (예컨대, 자외선 흡광도), 형광측정법, 하이브리드화 검정, 및 미세모세관 전기영동을 포함하나, 이에 제한되지 않는다.
본원에서 사용되는 바, 명시된 단백질의 "수준" 또는 "발현 수준"이란, 단백질 수준의 측정을 위해 관련 기술분야에 공지된 임의의 방법을 사용하여 결정된 바와 같은 단백질의 수준을 지칭한다. 상기 방법으로는 예를 들어, 전기영동, 모세관 전기영동, 고성능 액체 크로마토그래피 (HPLC), 박층 크로마토그래피 (TLC), 고확산 크로마토그래피, 유체 또는 겔 침전 반응, 흡수 분광법, 비색 검정, 분광측정 검정, 유세포 분석법, 면역확산 (단일 또는 이중), 용액상 검정, 면역형광측정법, 면역침전, 평형 투석, 면역확산, 용액상 검정, 면역전기영동, 웨스턴 블롯팅, 방사성면역검정 (RIA), 효소 결합된 면역흡착 검정 (ELISA), 면역형광 검정, 및 전기화학발광 면역검정 (하기 예시됨) 등을 포함한다. 바람직한 실시양태에서, 상기 수준은 본원에서 더욱 상세하게 기술되는 바와 같이 항체 기반 기술을 사용하여 결정된다.
명시된 단백질, 예컨대, 예를 들어 FRA의 발현 수준을 결정하기 위해 면역검정에서 사용되는 항체는 검출가능한 표지로 표지될 수 있다. 결합제 또는 항체와 관련하여 "표지된"이라는 용어는 검출가능한 물질을 결합제 또는 항체에 커플링시킴으로써 (즉, 물리적으로 연결시킴으로써) 이루어진 결합제 또는 항체의 직접적인 표지 뿐만 아니라, 직접 표지된 또 다른 시약과의 반응성에 의한 결합제 또는 항체의 간접적인 표지를 포함하는 것으로 의도된다. 간접 표지의 예로는 형광 표지된 2차 항체를 사용하는 1차 항체의 검출을 포함한다. 한 실시양태에서, 항체를 표지하고, 예컨대, 방사성 표지하거나, 발색단 표지하거나, 형광단 표지하거나, 또는 효소 표지한다. 또 다른 실시양태에서, 항체는 항체 유도체 (예컨대, 기질과, 또는 단백질-리간드 쌍의 단백질 또는 리간드 (예컨대, 비오틴-스트렙트아비딘)와 접합된 항체), 또는 항체 단편 (예컨대, 단일 쇄 항체, 단리된 항체 초가변 도메인)이다.
명시된 마커 (예컨대, FRA)의 발현 수준은 관련 기술분야에 공지된 임의의 RNA 또는 단백질 정량화 방법에 의해 결정될 수 있다. 상기 방법으로는 분광광도법 (예컨대, 자외선 흡광도), 형광측정법, 하이브리드화 검정, 전기영동, 모세관 전기영동, 고성능 액체 크로마토그래피 (HPLC), 박층 크로마토그래피 (TLC), 고확산 크로마토그래피, 유체 또는 겔 침전 반응, 흡수 분광법, 비색 검정, 분광측정 검정, 유세포 분석법, 면역확산 (단일 또는 이중), 용액상 검정, 면역형광측정법, 면역침전, 평형 투석, 면역확산, 용액상 검정, 면역전기영동, 웨스턴 블롯팅, 방사성면역검정 (RIA), 효소 결합된 면역흡착 면역흡착 검정 (ELISA), 면역형광 검정, 및 전기화학발광 면역검정 (하기 예시) 등을 포함하나, 이에 제한되지 않는다. 바람직한 실시양태에서, 상기 수준은 본원에서 더욱 상세하게 기술되는 바와 같이 항체 기반 기술을 사용하여 결정된다. 바람직한 실시양태에서, (예컨대, 종양 조직의) 면역조직화학적 분석이 사용된다. 한 실시양태에서, 프로테오믹 방법, 예컨대, 질량 분석법이 사용된다. 질량 분석법은 화학 화합물을 이온화하여 하전된 분자 (또는 그의 단편)을 생성하는 단계, 및 그의 질량-대-전하 비를 측정하는 단계로 이루어진 분석 기술이다. 전형적인 질량 분석법 방법에서, 샘플을 대상체로부터 수득하고, 질량 분석법에 로딩하고, 그의 성분 (예컨대, FRA)을 상이한 방법에 의해 (예컨대, 전자빔을 이용하여 그에 충격을 가함으로써) 이온화시켜 하전된 입자 (이온)을 형성한다. 이어서, 전자기장을 통해 통과함에 따라, 이온 이동으로부터 입자의 질량-대-전하 비를 산출한다.
샘플, 예컨대 소변 또는 혈청을 단백질 결합 칩에 적용하는 것을 수반하는 매트릭스 연합된 레이저 탈착/이온화 비행 시간 질량 분석법 (MALDI-TOF MS) 또는 표면 증강된 레이저 탈착/이온화 비행 시간 질량 분석법 (SELDI-TOF MS) (Wright, G.L., Jr., et al. (2002) Expert Rev Mol Diagn 2:549; Li, J., et al. (2002) Clin Chem 48:1296; Laronga, C., et al. (2003) Dis Markers 19:229; Petricoin, E.F., et al. (2002) 359:572; Adam, B.L., et al. (2002) Cancer Res 62:3609; Tolson, J., et al. (2004) Lab Invest 84:845; Xiao, Z., et al. (2001) Cancer Res 61:6029)이 FRA의 수준을 결정하는데 사용될 수 있다.
추가로, 마커 (예컨대, FRA)의 수준을 결정하기 위한 생체내 기술은, 마커에 결합하여 그를 검출할 수 있는 것인, 마커에 대한 표지된 항체를 대상체 내로 도입하는 것을 포함한다. 대상체 내의 검출가능한 마커의 존재, 수준, 또는 위치는 표준 영상화 기술 (예컨대, PET)을 사용하여 결정될 수 있다.
본원에서 사용되는 바, "폐암에 걸린" 또는 "폐암을 앓는" 대상체는 유자격 임상의에 의해 임상적으로 임의 병기의 폐암 진단을 받은 대상체, 또는 상기 암의 하나 이상의 징후 또는 증상을 보인 후, 이어서, 유자격 임상의에 의해 임상적으로 상기 암 진단을 받은 대상체이다. 폴레이트 수용체 알파-발현 폐암의 동물 모델로서의 역할을 하는 비-인간 대상체 또한 "폴레이트 수용체 알파-발현 폐암에 걸린" 대상체 범주 내에 포함될 수 있다.
본원에서 사용되는 바, "폴레이트 수용체 알파-발현 폐암"은 암 세포가 그의 표면 상에 폴레이트 수용체 알파를 발현하거나, 또는 그를 제시한다는 점을 특징으로 하는 임의 유형의 폐암을 포함한다. 폐암은 본원에서 사용되는 "폴레이트 수용체 알파-발현 폐암"이라는 용어에 의해 포함되는 FRA를 발현하는 것으로 임상적 진단을 받을 수는 있지만, 그러한 진단을 받아야 하는 것을 아니다. "폴레이트 수용체 알파-발현 폐암"이라는 어구는 구체적으로 FRA-발현 비소세포 폐암 (NSCLC) 및 FRA-발현 비소세포 폐 선암종을 포함한다.
본원에서 사용되는 바, "샘플" 또는 "생물학적 샘플"이라는 용어는 대상체로부터 단리된 유사 체액, 세포, 또는 조직의 수집물 뿐만 아니라, 대상체 내에 존재하는 체액, 세포, 또는 조직을 지칭한다. FRA의 발현 수준에 대해 평가되는 샘플은 소변, 혈액, 혈청, 혈장, 흉막 삼출액, 객담, 기관지 세척액, 순환 세포, 순환 종양 세포, 조직 결합되지 않은 세포 (즉, 유리 세포), 조직 (예컨대, 흉막 조직, 외과적으로 절제된 종양 조직, 생검 (세침 흡인물 포함)), 조직학적 시료 등으로부터 유래될 수 있다.
일부 실시양태에서, 마커 수준의 결정을 위해 샘플 중 단지 일부분만이 검정되거나, 또는 마커 수준의 결정을 위해 샘플 중 다양한 부분이 다양하게 검정된다. 또한, 다수의 실시양태에서, 샘플을 검정 이전에 물리적 또는 화학적 수단에 의해 전처리할 수 있다. 예를 들어, 샘플을, 마커에 대한 샘플을 검정하기 이전에 원심분리 희석 및/또는 가용화 물질로 처리 (예컨대, 구아니딘 처리)할 수 있다. 상기 기술은 검정의 정확성, 신뢰도 및 재현가능성을 증진시키는 역할을 한다.
"참조 발현 수준"이라는 용어는 마커 (예컨대, FRA)의 발현 수준을 기술하는데 사용될 때, 대상체로부터 유래된 샘플 중의 마커 수준과 비교하는데 사용되는, 승인받은 또는 미리 결정된 마커 수준을 지칭한다. 한 실시양태에서, FRA의 참조 발현 수준은 FRA 표적화제 대신 위약을 받은, FRA-발현 폐암에 걸린 환자 집단 대비로, FRA 표적화제 (예컨대, FRA에 면역특이적으로 결합하는 항체)로 치료받은, FRA-발현 폐암에 걸린 환자 집단을 사용하여 미리 결정된다. 환자 집단은 항체 또는 위약 이외에도, 상기 FRA-발현 폐암을 위한 표준 치료 요법을 받을 수 있다.
본원에서 사용되는 바, 특정 결합제, 예컨대, 항체와 "샘플을 접촉시킨다"라는 용어는 샘플 또는 그의 임의의 일부분을 작용제에 노출시켜 샘플 중 적어도 일부가 작용제와 접촉하도록 하는 것을 포함한다. 샘플 또는 그의 일부는 그와 작용제를 접촉시키는 조치를 실행하기 이전에 어떤 방식으로든, 예컨대, 물리적 또는 화학적으로 처리함으로써 (예컨대, 희석하거나, 또는 구아니딘으로 처리함으로써) 변경시킬 수 있다.
"억제한다" 또는 "의 억제"라는 용어는 측정가능한 양만큼 감소시키거나, 또는 완전히 방해하는 것을 의미한다.
항-FRA 치료제가 폴레이트 수용체 알파-발현 세포에 미치는 효과와 관련하여 "고갈시킨다"라는 용어는 폴레이트 수용체 알파-발현 세포 수를 감소시키거나, 또는 그를 제거하는 것을 지칭한다.
본원에 기술된 방법에 따라 사용되는 항체와 관련하여 "기능성"이라는 용어는 항체가 (1) 항원에 결합할 수 있고/거나, (2) 항원 발현 세포를 고갈시키거나, 또는 그를 억제한다는 것을 나타낸다.
"치료" 또는 "치료한다" 또는 "양성 치료학적 반응"이라는 용어는 임의의 임상적 병기에서의 폴레이트 수용체 알파-발현 폐암의 임상적 또는 진단학적 증상의 발병 이후에 대상체에게 FRA 표적화제를 투여함으로써, 질환의 임상적 또는 진단학적 증상의 감소 또는 제거로 입증되는 바와 같이, 환자에서 폴레이트 수용체 알파-발현 폐암의 진행을 저속화시키거나, 중단시키거나, 또는 역전시키는 것을 지칭한다. 치료는 예를 들어, 증상의 중증도, 증상 수, 또는 재발 빈도 감소, FRA-발현 폐암 세포 고갈, FRA-발현 폐암 세포의 성장 억제, 또는 특정 임상적 결과 (예컨대, 무진행 생존, 전체 생존)에서의 통계학상 유의하고/거나 임상적으로 관련된 개선을 포함할 수 있다.
"FRA 표적화제를 이용한 치료에 대해 반응성"이라는 어구는 FRA 표적화제 투여 후 후보 대상체 (즉, FRA-발현 폐암을 앓는 개체)가 폐암과 관련하여 양성 치료학적 반응을 보일 것이라는 것을 의미하는 것으로 의도된다.
"제약상 허용되는"이라는 용어는 상기 특성 및/또는 물질이 약리학적/독물학적 관점에서 볼 때, 환자에게 허용가능하고, 조성, 제제화, 안정성, 환자 수용 및 생체이용성에 관한 물리적/화학적 관점에서 볼 때, 제조 약제사에게 허용가능하다는 것을 지칭하고, 이는 동물에서의, 및 더욱 특히, 인간에서의 사용을 위한 것으로, 연방 정부 또는 주 정부의 규제 기관에 의해 승인을 받았거나, 또는 미국 약전 또는 일반적으로 인정되는 다른 약전에 열거된 특성 및/또는 물질을 포함한다. "제약상 화합성인 성분"이라는 용어는 항-폴레이트 수용체 알파 항체와 함께 투여되는 제약상 허용되는 희석제, 애주번트, 부형제, 또는 비히클을 지칭한다. "제약상 허용되는 담체"란, 활성 성분(들)의 생물학적 활성의 효과를 방해하지 않고, 투여 대상이 되는 호스트에 독성을 띠지 않는 매질을 지칭한다.
"유효량" 및 "치료 유효량"이라는 용어는 본원에서 상호교환적으로 사용되고, 제약 작용제의 투여와 관련하여, 환자에서 폴레이트 수용체 알파-발현 폐암의 하나 이상의 임상적 또는 진단학적 증상의 발생을 억제하거나, 또는 그를 호전시키는데 충분한 작용제 (예컨대, FRA 표적화제)의 양을 지칭한다. 작용제의 치료 유효량은 인자, 예컨대, 개체의 질환 상태, 연령, 성별, 및 체중, 및 개체에서 원하는 반응을 유도할 수 있는 작용제의 능력에 따라 달라질 수 있다. 상기 결과로는 관련 기술분야에서 적합한 임의의 수단에 의해 결정되는 바와 같이, 폴레이트 수용체 알파-발현 폐암의 치료를 포함할 수 있지만, 이에 제한되지 않는다. 유효량의 작용제가 "효과적인 요법"으로 본원에 기술된 방법에 따라 투여된다. "효과적인 요법"이라는 용어는 폴레이트 수용체 알파-발현 폐암 치료를 달성하는데 적합한 작용제의 양 및 투여 빈도의 조합을 지칭한다.
"환자" 및 "대상체"라는 용어는 상호교환적으로 사용되며, 이는 진단학적, 예방학적, 또는 치료학적 치료를 받는, 수의학적 대상체를 비롯한, 인간 및 다른 비-인간 동물을 지칭한다. "비-인간 동물"이라는 용어는 모든 척추동물, 예컨대, 포유동물 및 비-포유동물, 예컨대, 비-인간 영장류, 마우스, 토끼, 양, 개, 고양이, 말, 소, 닭, 양서류 및 파충류를 포함한다. 바람직한 실시양태에서, 대상체는 인간이다.
치료제는 전형적으로 원치 않는 오염 물질로부터의 실질적으로 순수한 형태이다. 이는 작용제가 전형적으로 적어도 약 50% w/w (중량/중량) 순수할 뿐만 아니라, 실질적으로는 간섭 단백질 및 오염 물질이 없다는 것을 의미한다. 종종, 작용제는 적어도 약 80% w/w, 및 더욱 바람직하게는 적어도 90 또는 약 95% w/w 순수하다. 그러나, 종래 단백질 정제 기법을 사용할 경우, 적어도 99% 순도 w/w의 균질한 펩티드를 수득할 수 있다.
FRA 표적화제를 이용한 치료에 대한 반응성의 가능성을 예측하는 방법
본원에서는 폴레이트 수용체 알파 (FRA)-발현 폐암을 앓는 환자에서 FRA 표적화제 (예컨대, FRA에 면역특이적으로 결합하는 항체)를 이용한 치료에 대한 반응성의 가능성을 예측하는 방법을 제공한다. 본원에 기술된 FRA 표적화제를 이용한 치료에 대한 반응성의 가능성을 예측하는 방법의 일부 실시양태에서, FRA-발현 폐암은 비소세포 폐암 (NSCLC)이다. 일부 실시양태에서, NSCLC는 선암종이다.
폴레이트 수용체 알파 (FRA)-발현 폐암을 앓는 환자에서 FRA 표적화제를 이용한 치료에 대한 반응성의 가능성을 예측하는 기술된 방법은 환자의 생물학적 샘플 중 환자의 FRA 발현 수준을 결정하는 단계를 수반한다.
환자의 생물학적 샘플 중 FRA 발현 수준의 결정은 진단 시, 외과적 절제 시, 제1선 요법 개시 시, 제1선 요법 완료 시, 암의 증후성 진행, 혈청학적 진행 및/또는 방사선학상 진행을 보일 때, 제2선 요법 또는 그 후속된 요법 개시 시, 및/또는 상기 요법 완료 시에 수행될 수 있다.
폴레이트 수용체 알파 (FRA)-발현 폐암을 앓는 환자에서 FRA 표적화제를 이용한 치료에 대한 반응성의 가능성을 예측하는 개시된 방법에서, FRA 발현 수준은 공지된 RNA 또는 단백질 정량화 방법을 비롯한, 관련 기술분야에 공지된 임의 수단에 의해 결정될 수 있다. 상기 방법은 단백질 발현을 검출하는 항체의 사용, 핵산 하이브리드화, 정량적 RT-PCR, 면역침전, 평형 투석, 면역확산, 면역조직화학법, 형광 활성화 세포 분류 (FACS), 형광측정법, 하이브리드화 검정, 전기영동, 모세관 전기영동, 고성능 액체 크로마토그래피 (HPLC), 박층 크로마토그래피 (TLC), 고확산 크로마토그래피, 유체 또는 겔 침전 반응, 흡수 분광법, 비색 검정, 분광측정 검정, 유세포 분석법, 면역확산 (단일 또는 이중), 용액상 검정, 면역침전, 평형 투석, 면역확산, 용액상 검정, 면역전기영동, 웨스턴 블롯팅, 방사성면역검정 (RIA), 효소 결합된 면역흡착 검정 (ELISA), 면역형광 검정, 및 전기화학발광 면역검정 등을 포함하나, 이에 제한되지 않는다. 바람직한 실시양태에서, 상기 수준은 본원에서 더욱 상세하게 기술되는 바와 같이 항체 기반 기술을 사용하여 결정된다. 바람직한 실시양태에서, (예컨대, 흉막 조직의) 면역조직화학적 분석이 사용된다. FRA의 발현 수준을 결정하는 단계는 생체외 또는 생체내에서 수행될 수 있다.
생체외 평가를 위해, FRA 발현 수준을 결정하는데 사용되는 생물학적 샘플은 소변, 전혈, 혈청, 혈장, 흉막 삼출액, 객담, 기관지 세척액, 순환 세포, 순환 종양 세포, 조직 결합되지 않은 세포 (즉, 유리 세포), 조직 (예컨대, 흉막 조직, 외과적으로 절제된 종양 조직, 생검 (세침 흡인물 포함)), 조직학적 시료 등일 수 있다. 조직학적으로 절개할 수 있도록 허용하기 위해 검정 수행 대상이 되는 조직 샘플을 고정시키거나, 또는 냉동시킬 수 있다. 바람직하게는, 절개된 조직 샘플을 알데히드 고정제, 예컨대, 포름알데히드, 파라포름알데히드, 글루타르알데히드; 또는 중금속 고정제, 예컨대, 염화제2수은 중에서 고정시킨다. 더욱 바람직하게는, 절개된 조직 샘플을 항체와 함께 인큐베이션시키기 이전에 포르말린 중에 고정시키고, 파라핀 왁스 중에 포매시킨다. 임의적으로, 에피토프의 접근성을 증가시키기 위해 FFPE 표본을 시트레이트, EDTA, 효소적 분해 또는 열로 처리할 수 있다. 대안적으로, 공지된 또는 의심되는 폐암으로부터의 세포로부터 단백질 분획을 단리시키고, ELISA, 웨스턴 블롯팅, 면역침전 등에 의해 분석할 수 있다. 또 다른 변형법에서, 세포를 FACS 분석에 의해 폴레이트 수용체 알파의 발현에 대해 분석할 수 있다. 추가의 변형법에서, 공지된 또는 의심되는 폐암으로부터의 세포로부터 mRNA를 추출할 수 있다. 이어서, mRNA 또는 그로부터 유래된 핵산, 예컨대, cDNA를 폴레이트 수용체 알파를 코딩하는 DNA에 결합하는 핵산 프로브에의 하이브리드화에 의해 분석할 수 있다.
예를 들어, FRA 발현 수준을 결정하는 단계는 대상체로부터 수득된 폐암 조직의 생물학적 샘플 중 FRA 발현 수준을 결정하는 것을 수반할 수 있다. FRA 발현 수준은, 암 (예컨대, 폐암)으로부터인 것으로 공지된, 또는 그러한 것으로 의심되는 세포를 함유하는 샘플을 항-FRA 항체 또는 항원 결합 단편과 접촉시키는 면역검정에 의해 결정될 수 있다. 접촉 후, 표본 중 항체 또는 항원 결합 단편의 세포에의 결합 이벤트의 존재 또는 부재를 결정한다. 결합은 상기 표본 중 암성 세포 상에서 발현되는 항원의 존재 또는 부재와 관련이 있다. 일반적으로, 샘플을 검출가능한 신호를 생성할 수 있는 항-FRA 항체 또는 항원 결합 단편의 표지된 특이적 결합 파트너와 접촉시킨다. 대안적으로, 항-FRA 항체 또는 단편 그 자체가 표지될 수 있다. 표지 유형의 예로는 효소 표지, 방사성 동위 원소 표지, 비방사성 표지, 형광 표지, 독소 표지 및 화학발광 표지를 포함한다. 다수의 상기와 같은 표지는 관련 기술분야의 통상의 기술자에게 쉽게 알려져 있다. 예를 들어, 적합한 표지로는 방사성 표지, 형광 표지 (예컨대, 다이라이트(DyLight)® 649), 에피토프 태그, 비오틴, 발색단 표지, ECL 표지, 또는 효소를 포함하나, 이에 제한되는 것으로 간주되지 않는다. 더욱 구체적으로, 기술된 표지는 루테늄, 111In-DOTA, 111In- 디에틸렌트리아민펜타아세트산 (DTPA), 호스래디쉬 퍼옥시다제, 알칼리성 포스파타제 및 베타-갈락토시다제, 폴리-히스티딘 (HIS 태그), 아크리딘 염료, 시아닌 염료, 플루오론 염료, 옥사진 염료, 페난트리딘 염료, 로다민 염료, 알렉사플루오르(Alexafluor)® 염료 등을 포함한다. 표지로부터의 신호 검출이 샘플 중의 폴레이트 수용체 알파에 특이적으로 결합한 항체 또는 단편의 존재를 나타낸다.
상기 언급된 바와 같이, 일부 실시양태에서, FRA 발현 수준은 암 (예컨대, 폐암)으로부터인 것으로 공지된, 또는 그러한 것으로 의심되는 세포를 함유하는 샘플을 항-FRA 항체 또는 항원 결합 단편과 접촉시키는 면역검정에 의해 결정될 수 있다. 일부 실시양태에서, FRA는 샘플 중 세포에 결합되어 있지 않은 것이다. 대상체로부터 유래된 샘플 중 FRA의 발현 수준을 결정하는 방법은 예를 들어, 미국 공개 번호 20130017195 (이는 본원에서 참조로 포함됨)에 개시되어 있다. 대상체로부터 유래된 샘플 중 세포에 결합되어 있지 않은 FRA의 발현 수준을 결정하는 방법은 예를 들어, 미국 공개 번호 20120207771 (이는 본원에서 참조로 포함됨)에 개시되어 있다. FRA의 발현 수준을 결정하는데 사용되는 샘플은 예를 들어, 소변, 혈액, 혈청, 혈장, 흉막 삼출액, 객담, 기관지 세척액, 순환 세포, 순환 종양 세포, 조직 결합되지 않은 세포 (즉, 유리 세포), 조직 (예컨대, 흉막 조직, 외과적으로 절제된 종양 조직, 생검 (세침 흡인물 포함)), 조직학적 시료 등일 수 있다. 바람직한 실시양태에서, 샘플은 조직, 소변, 또는 혈청이다.
다양한 측면에서, FRA의 발현 수준은 샘플을 FRA에 결합하는 항체와 접촉시킴으로써 결정된다. 예를 들어, 항-FRA 항체는 하기 항체들로 이루어진 군으로부터 선택될 수 있다:
(a) MORAb-003 항체와 동일한 에피토프에 결합하는 항체;
(b) CDRH1로서 서열식별번호: 1 (GFTFSGYGLS), CDRH2로서 서열식별번호: 2 (MISSGGSYTYYADSVKG), CDRH3으로서 서열식별번호: 3 (HGDDPAWFAY), CDRL1로서 서열식별번호: 4 (SVSSSISSNNLH), CDRL2로서 서열식별번호: 5 (GTSNLAS) 및 CDRL3으로서 서열식별번호: 6 (QQWSSYPYMYT)을 포함하는 항체;
(c) 하기를 포함하는 항체:
서열식별번호: 7의 아미노산 서열을 포함하는 성숙 경쇄 가변 영역:
서열식별번호: 8의 아미노산 서열을 포함하는 성숙 중쇄 가변 영역:
(CDR 밑줄로 표시);
(d) 미국 공개 번호 20090274697 및 미국 특허 번호 8,124,083 (상기 문헌 각각의 전체 내용이 본원에서 참조로 포함됨)에 기술된 MORAb-003 항체 (USAN 명칭: 팔레투주맙);
(e) 548908 항체 (노부스(Novus); 카탈로그 번호 MAB5646);
(f) 548908 항체와 동일한 에피토프에 결합하는 항체;
(g) 6D398 항체 (유에스바이올로지칼 라이프 사이언시스(USBiological Life Sciences));
(h) 6D398 항체와 동일한 에피토프에 결합하는 항체;
(i) BN3.2 항체 (레이카 바이오시스템즈);
(j) BN3.2 항체와 동일한 에피토프에 결합하는 항체;
(k) 26B3 항체와 동일한 에피토프에 결합하는 항체;
(l) CDRH1로서 서열식별번호: 14 (GYFMN), CDRH2로서 서열식별번호: 15 (RIFPYNGDTFYNQKFKG), CDRH3으로서 서열식별번호: 16 (GTHYFDY), CDRL1로서 서열식별번호: 17 (RTSENIFSYLA), CDRL2로서 서열식별번호: 18 (NAKTLAE) 및 CDRL3으로서 서열식별번호: 19 (QHHYAFPWT)를 포함하는 항체;
(m) 26B3 항체;
(n) 19D4 항체와 동일한 에피토프에 결합하는 항체;
(o) CDRH1로서 서열식별번호: 20 (HPYMH), CDRH2로서 서열식별번호: 21 (RIDPANGNTKYDPKFQG), CDRH3으로서 서열식별번호: 22 (EEVADYTMDY), CDRL1로서 서열식별번호: 23 (RASESVDTYGNNFIH), CDRL2로서 서열식별번호: 24 (LASNLES) 및 CDRL3으로서 서열식별번호: 25 (QQNNGDPWT)를 포함하는 항체;
(p) 19D4 항체 (미국 특허 8,475,795 참조);
(q) 9F3 항체와 동일한 에피토프에 결합하는 항체;
(r) CDRH1로서 서열식별번호: 26 (SGYYWN), CDRH2로서 서열식별번호: 27 (YIKSDGSNNYNPSLKN), CDRH3으로서 서열식별번호: 28 (EWKAMDY), CDRL1로서 서열식별번호: 29 (RASSTVSYSYLH), CDRL2로서 서열식별번호: 30 (GTSNLAS) 및 CDRL3으로서 서열식별번호: 31 (QQYSGYPLT)을 포함하는 항체;
(s) 9F3 항체 (미국 특허 8,475,795 참조);
(t) 24F12 항체와 동일한 에피토프에 결합하는 항체;
(u) CDRH1로서 서열식별번호: 32 (SYAMS), CDRH2로서 서열식별번호: 33 (EIGSGGSYTYYPDTVTG), CDRH3으로서 서열식별번호: 34 (ETTAGYFDY), CDRL1로서 서열식별번호: 35 (SASQGINNFLN), CDRL2로서 서열식별번호: 36 (YTSSLHS) 및 CDRL3으로서 서열식별번호: 37 (QHFSKLPWT)을 포함하는 항체;
(v) 24F12 항체 (미국 특허 8,475,795 참조);
(w) 하기로 이루어진 군으로부터 선택되는 가변 영역 경쇄를 포함하는 항체:
(i) 서열식별번호: 38에 기재된 LK26HuVK:
(ii) 서열식별번호: 39에 기재된 LK26HuVKY:
(iii) 서열식별번호: 40에 기재된 LK26HuVKPW:
및
(iv) 서열식별번호: 41에 기재된 LK26HuVKPW,Y:
(x) 하기로 이루어진 군으로부터 선택되는 가변 영역 중쇄를 포함하는 항체:
(i) 서열식별번호: 42에 기재된 LK26HuVH:
(ii) 서열식별번호: 43에 기재된 LK26HuVH FAIS,N:
(iii) 서열식별번호: 44에 기재된 LK26HuVH SLF:
(iv) 서열식별번호: 45에 기재된 LK26HuVH I,I:
(v) 서열식별번호: 46에 기재된 LK26KOLHuVH:
(y) 중쇄 가변 영역 LK26KOLHuVH (서열식별번호: 46) 및 경쇄 가변 영역 LK26HuVKPW,Y (서열식별번호: 41)를 포함하는 항체;
(z) 중쇄 가변 영역 LK26HuVH SLF (서열식별번호: 44) 및 경쇄 가변 영역 LK26HuVKPW,Y (서열식별번호: 41)를 포함하는 항체;
(aa) 중쇄 가변 영역 LK26HuVH FAIS,N (서열식별번호: 43) 및 경쇄 가변 영역 LK26HuVKPW,Y (서열식별번호: 41)를 포함하는 항체; 및
(bb) 유럽 특허 출원 번호 86104170.5 (레티그(Rettig), 이는 본원에서 참조로 포함됨)에 기술된 바와 같은 뮤린 모노클로날 LK26 항체로서, 그의 중쇄 및 경쇄는 본원에서 각각 서열식별번호: 11 및 12로 제시된 것:
특정 실시양태에서, 항-FRA 항체는 (i) 중쇄 가변 영역 LK26KOLHuVH (서열식별번호: 46) 및 경쇄 가변 영역 LK26HuVKPW,Y (서열식별번호: 41); 중쇄 가변 영역 LK26HuVH SLF (서열식별번호: 44) 및 경쇄 가변 영역 LK26HuVKPW,Y (서열식별번호: 41); 또는 중쇄 가변 영역 LK26HuVH FAIS,N (서열식별번호: 43) 및 경쇄 가변 영역 LK26HuVKPW,Y (서열식별번호: 41)를 포함한다. MORAb-003을 생산하는 차이니즈 햄스터 난소 (CHO) 세포는 2006년 4월 24일자로 ATCC (미국 버지니아주 20110 마나사스 유니버시티 불러바드 10801)에 기탁되었고, 수탁 번호 PTA-7552를 지정받았다.
폴레이트 수용체 알파에 면역특이적으로 결합하는 다른 유용한 항체는 각각 서열식별번호: 7 및 서열식별번호: 8과 적어도 90%, 바람직하게는 적어도 95% 또는 99%의 서열 동일성을 갖는 성숙 경쇄 및 중쇄 가변 영역을 포함한다. 폴레이트 수용체 알파에 면역특이적으로 결합하는 다른 유용한 항체 또는 그의 유도체는 예를 들어, 면역검정에 의해 결정되는 바, 폴레이트 수용체 알파에 대한 팔레투주맙의 결합을 경쟁적으로 억제할 수 있다. 경쟁적 억제란, 적어도 2배, 바람직하게는 5배 초과로 존재할 때, 항체가 폴레이트 수용체 알파에 대한 팔레투주맙의 결합을 적어도 50%, 더욱 전형적으로, 적어도 60%, 추가로 더욱 전형적으로, 적어도 70%, 및 가장 전형적으로, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 또는 적어도 95%만큼 억제한다는 것을 의미한다.
폴레이트 수용체 알파에 면역특이적으로 결합하는 항체는 또한 상기 개시된 항-폴레이트 수용체 알파 항체의 유도체일 수 있다. 전형적인 변형으로는 예컨대, 글리코실화, 탈글리코실화, 아세틸화, 페길화, 인산화, 아미드화, 공지된 보호기/차단기에 의한 유도체화, 단백질 분해 절단, 세포 리간드 또는 다른 단백질에의 연결 등을 포함한다. 추가로, 유도체는 하나 이상의 비고전적 아미노산을 함유할 수 있다.
특정 실시양태에서, 항-FRA 항체는 뮤린 항체, 인간 항체, 인간화 항체, 이중특이적 항체, 키메라 항체, Fab, Fab'2, ScFv, SMIP, 아피바디, 아비머, 버사바디, 나노바디, 바이오바디, 및 도메인 항체로 이루어진 군으로부터 선택된다. 대안적으로, 또는 조합하여, 항-FRA 항체는 예를 들어, 방사성-표지, 비오틴-표지, 발색단-표지, 형광단-표지, 또는 효소-표지로 이루어진 군으로부터 선택되는 표지로 표지된다.
추가 측면에서, 대상체로부터 유래된 샘플 중의 폴레이트 수용체 알파 (FRA) 발현 수준은 2-항체 샌드위치 검정에 의해 평가된다. 샌드위치 검정의 일부 실시양태에서, 샘플을 (a) 고체 지지체에 고정화되고, 24F12 항체로 표지된 9F3 항체, (b) 고체 지지체에 고정화되고, 19D4 항체로 표지된 26B3 항체, 및 (c) 고체 지지체에 고정화되고, 26B3 항체로 표지된 9F3 항체와 접촉시킨다. 예를 들어, 샘플은 소변, 전혈, 혈청, 혈장, 흉막 삼출액, 객담, 기관지 세척액, 순환 세포, 순환 종양 세포, 조직 결합되지 않은 세포 (즉, 유리 세포), 조직 (예컨대, 흉막 조직, 외과적으로 절제된 종양 조직, 생검 (세침 흡인물 포함)), 조직학적 시료 등일 수 있다.
특정 실시양태에서, 샘플을 샘플 중 FRA 발현 수준을 결정하기 이전에 구아니딘으로 처리한다. 대안적으로, 또는 조합하여, 샘플을 샘플 중 FRA 발현 수준을 결정하기 이전에 희석시킨다. 대안적으로, 또는 조합하여, 샘플을 샘플 중 FRA 발현 수준을 결정하기 이전에 원심분리하거나, 와동시키거나, 또는 그 둘 다를 수행한다.
또 다른 변형법에서, 공지된 또는 의심되는 폐암 중의 FRA 발현 수준은 환자에게 표지된 항-FRA 항체 또는 그의 항원 결합 단편을 투여하고, 생체내 영상화에 의해 항체 또는 단편을 검출함으로써 생체내에서 검출될 수 있다. 상기 기술된 항체들 중 임의의 것이 생체내 영상화 분석에서 유사하게 사용될 수 있다.
폐 조직 샘플 중의 FRA 수준은 하나 이상의 표준과 관련하여 결정될 수 있다 (그러나, 그러할 필요는 없음). 표준은 과거 시점에 측정된 것일 수 있거나, 또는 동시에 결정될 수 있다. 표준은 예를 들어, 상이한 대상체로부터의, 암성인 것으로 공지된 FRA-발현 폐 조직 샘플, 상이한 대상체로부터의, 암성이 아닌 것으로 공지된 FRA-발현 폐 조직 샘플, 환자 또는 FRA를 발현하지 않는 것으로 공지된 다른 대상체로부터의 조직, 또는 FRA-발현 폐암 세포주일 수 있다.
(사용될 경우) 표준 대비의, 항-FRA 항체 또는 단편의 FRA에의 결합으로부터의 검출가능한 신호가 존재하는 것은 조직 샘플 중 FRA가 존재한다는 것을 시사하는 것이며, 검출가능한 결합 수준은 FRA 발현 수준을 나타내는 것이다. 조직 절편 상에서 수행된 검정에서, 발현 수준은 FRA의 검출가능한 발현을 보이는 샘플의 표면적 백분율로서 표시될 수 있다. 대안적으로, 또는 추가로, 발현 수준 (강도)은 샘플 중 전체 발현의 척도 또는 샘플 중 FRA를 발현하는 세포의 척도로서 사용될 수 있다. 발현 강도는 예를 들어, 앞서 기술된 바와 같은 방법을 사용하여 조직 절편의 디지털 영상화 또는 수동 현미경 평가를 통해 결정될 수 있다 (Potts, Drug Discov Today, 2009; 14(19-20):935-41; O'Shannessy et al., Oncotarget, 2012; 3(4):414-25; 미국 특허 8,475,795; 제조사의 설명서, 카탈로그 번호 IPI4006K G10 (바이오케어 메디칼(Biocare Medical: 미국 캘리포니아주 콩코드))). FRA 발현 강도를 사용하여 본원에 기술된 바와 같은 FRAMSCOR 또는 HBSCOR을 결정할 수 있다. 특히, FRAMSCOR (M-점수) 은 하기와 같은 0, 1+, 2+, 3+ 점수화 체계 전제 하에 가중 평균으로서 산출된 것이다 (도 2 참조):
x = 1+로 염색된 종양 %
y = 2+로 염색된 종양 %
z = 3+로 염색된 종양 %일 때,
예시 목적으로, 환자의 종양이 +1인 FRA 염색이 20%, +2인 FRA 염색이 10%, 및 +3인 FRA 염색이 20%를 보일 때, M 점수 = 16.6이다. HBSCOR (H-점수) 는 표적 조직 구획 중의 모든 세포로부터 계산된 바이오마커 염색 (본 경우에서는 FRA 염색)에 대한 평균 광학 밀도를 보고한다. 이는 세포 분류 없이 선형 점수 및 H-점수의 연속된 확장을 통해 조직 구획을 결정하기 위해 전용 조직 인식 특징을 이용한다. H-점수는 조직 중 바이오마커 발현을 점수화하기 위해 병리학자 및 관련 기술분야의 통상의 기술자에 의해 보편적으로 사용되는 표준 점수화 방법으로서, 이는 기본적으로 모든 강도 수준에서의 강도 점수의 총합 (1+, + 2 x 2+, + 3x 3+)이다. HBSCOR은 세포 측정값 (광학 밀도) 총합을 세포 총 수로 나눈 값으로부터 도출된다. 결과적으로, HBSCOR은 표적 조직 구획 중의 모든 세포로부터 계산된 바이오마커 염색에 대한 값을 보고한다. 이러한 산출은 하기 공식을 사용하여 정량화된다:
일단 환자의 FRA 발현 수준을 결정하고 나면, 이를 참조 FRA 발현 수준과 비교한다. 바람직한 실시양태에서, 환자의 FRA 발현 수준을 참조 FRA 발현 수준과의 비교를 위해 FRAMSCOR (즉, M-점수) 또는 HBSCOR (즉, H-점수)로 제시한다. 바람직한 실시양태에서, 참조 FRA 발현 수준은 미리 결정된 것이다. 예를 들어, 참조 데이터 세트는 FRA 발현 수준이 낮은, 중간 정도, 및 높은 비관련 환자로부터의 샘플을 사용하여 확립될 수 있다. 상기 데이터 세트는, 그에 의해서 환자들 간의 상대적인 FRA 발현 수준이 비교되고, 수동 및 디지털 분석 FRAMSCOR 및 HBSCOR 방법을 사용하여 정량화되는 것인 표준을 나타낸다. 일부 실시양태에서, 참조 FRA 발현 수준은 위약을 투여받은 FRA-발현 폐암에 걸린 환자 집단과 FRA 표적화제를 투여받은 FRA-발현 폐암에 걸린 환자 집단의 비교에 의해 결정된다. FRA-발현 폐암에 걸린 환자 집단은 또한 표준 치료 화학요법을 받을 수 있다. FRA-발현 폐암에 걸린 각 집단 중의 각 환자에 대한 FRA 발현 수준을 상기 기술된 방법에 따라 결정한다. 환자 집단에 대한 임상적 결과 (예컨대, 무진행 생존 또는 전체 생존)를 모니터링한다. 이어서, FRA 발현 수준 대비 환자 집단에 대한 임상적 결과를 하기 제공되는 실시예에 기술된 바와 같이 비교한다. 참조 FRA 발현 수준은, FRA 표적화제 (예컨대, FRA에 면역특이적으로 결합하는 항체)를 투여받은 FRA-발현 폐암에 걸린 환자 집단이 위약을 투여받은 FRA-발현 폐암에 걸린 환자 집단에 비해 적어도 하나의 임상적 결과에서의 통계학상 유의한 개선을 입증한 수준 초과의 FRA 발현 수준에 상응한다. 환자의 FRA 발현 수준이 참조 FRA 발현 수준과 동일하거나 또는 그를 초과한다는 것은 환자가 FRA 표적화제를 이용하는 치료로부터 이익을 얻게 될 것이라는 것을 나타낸다.
치료 방법
본원에서는 또한 폴레이트 수용체 알파 (FRA)-발현 폐암을 앓는 환자를 치료하는 방법을 제공한다. FRA-발현 폐암을 앓는 환자를 치료하는 방법의 일부 실시양태에서, 암은 NSCLC이다. 일부 실시양태에서, NSCLC는 선암종이다. 환자에서 FRA-발현 폐암을 치료하는 개시된 방법은, 참조 FRA 발현 수준과 동일하거나 또는 그를 초과하는 FRA 발현 수준을 갖는 환자에게 폴레이트 수용체 알파 (FRA)에 면역특이적으로 결합하는 항체를 투여하는 것인 방법을 포함한다.
본원에 기술된 폴레이트 수용체 알파 (FRA)-발현 폐암을 앓는 환자를 치료하는 방법에 따라, 상기 기술된 바와 같이, 환자의 생물학적 샘플 중의 환자의 FRA 발현 수준을 정량화하고, 참조 FRA 발현 수준과 비교한다. 환자의 FRA 발현 수준이 참조 FRA 발현 수준과 동일하거나 또는 그를 초과한다면, 이때 환자에게 FRA 표적화제 (예컨대, FRA에 면역특이적으로 결합하는 항체)를 투여한다.
본원에 기술된 치료 방법의 일부 실시양태에서, FRA 표적화제는 빈타폴리드이다. 일부 실시양태에서, FRA 표적화제는 FRA에 면역특이적으로 결합하는 항체, 예컨대, 제한하는 것은 아니지만, 폐암 세포 상에서 발현된 폴레이트 수용체 알파에 면역특이적으로 결합하는 항체; 상기 항체의 항원 결합 단편; 그의 유도체; 및 변이체이다. 바람직한 실시양태에서, 폴레이트 수용체 알파에 면역특이적으로 결합하는 항체는 하기 항체로 이루어진 군으로부터 선택되는 항체이다:
(a) CDRH1로서 서열식별번호: 1, CDRH2로서 서열식별번호: 2, CDRH3으로서 서열식별번호: 3, CDRL1로서 서열식별번호: 4, CDRL2로서 서열식별번호: 5 및 CDRL3으로서 서열식별번호: 6을 포함하는 항체;
(b) 서열식별번호: 7의 아미노산 서열을 포함하는 성숙 경쇄 가변 영역 및/또는 서열식별번호: 8의 아미노산 서열을 포함하는 성숙 중쇄 가변 영역을 포함하는 항체;
(c) 팔레투주맙;
(d) 각각 서열식별번호: 7 및 서열식별번호: 8과 적어도 90%, 바람직하게는 적어도 95% 또는 99%의 서열 동일성을 갖는 성숙 경쇄 및 중쇄 가변 영역을 포함하는, 폴레이트 수용체 알파에 특이적으로 결합하는 항체;
(e) 예를 들어, 면역검정에 의해 결정 시, 폴레이트 수용체 알파에 대한 팔레투주맙의 결합을 경쟁적으로 억제할 수 있는 항체 또는 그의 유도체.
FRA에 면역특이적으로 결합하는 항체의 유도체 또한 본 발명의 방법을 실시하는데 사용될 수 있다. 전형적인 변형으로는 예컨대, 글리코실화, 탈글리코실화, 아세틸화, 페길화, 인산화, 아미드화, 공지된 보호기/차단기에 의한 유도체화, 단백질 분해 절단, 세포 리간드 또는 다른 단백질에의 연결 등을 포함한다. 추가로, 유도체는 하나 이상의 비고전적 아미노산을 함유할 수 있다. 일부 실시양태에서, FRA에 면역특이적으로 결합하는 상기 항체는 독소, 예컨대, 제한하는 것은 아니지만, 미세관 억제제, DNA 손상 작용제 (예컨대, 방사성핵종), DNA 복구 억제제, 또는 신호 전달 억제제에 접합된다. 항체 접합을 위한 링커 및 항체를 접합시키기 위한 방법은 관련 기술분야에 공지되어 있다. 본원에 기술된 방법에 따라 FRA 표적화제로서 사용될 수 있는 예시적인 항체-약물 접합체는 IMGN853이다.
본 방법은 다른 치료 수단, 예컨대, 수술 (예컨대, 용적축소 수술), 방사선, 표적화된 요법, 화학요법, 면역요법, 성장 인자 억제제의 사용, 또는 항-혈관신생 인자와 함께 조합될 수 있다. FRA 표적화제는 수술, 화학요법 또는 방사선 요법 치료를 받는 환자에게 동시에 투여될 수 있다. 대안적으로는, 환자는 적어도 1시간 내지 최대 수개월만큼 FRA 표적화제 투여 이전 또는 이후에, 예를 들어, 적어도 1시간, 5시간, 12시간, 1일, 1주일, 1개월, 또는 3개월만큼 FRA 표적화제 투여 이전 또는 이후에 수술, 화학요법 또는 방사선 요법을 받을 수 있다. 예를 들어, 본원에서 제공하는 치료 방법의 일부 실시양태는 FRA 표적화제 이외에도 대상체에게 치료 유효량의 백금-함유 화합물, 항폴레이트, 및/또는 탁산을 투여하는 것을 추가로 수반한다. 예시적인 백금-함유 화합물은 시스플라틴 또는 카르보플라틴이다. 치료 방법에서 사용하기 위한 탁산의 예로는 파클리탁셀, 도세탁셀, 및 그의 반합성, 합성 및/또는 변형된 버전 및 제제 (제한하는 것은 아니지만, 냅-파클리탁셀 (아브락산(Abraxane)®), 카바지탁셀 (제브타나(Jevtana)®), DJ-927 (테세탁셀(Tesetaxel)®), 파클리탁셀 폴리글루멕스 (오팍시오(Opaxio)®), XRP9881 (라로탁셀(Larotaxel)®), 엔도TAG(EndoTAG) + 파클리탁셀 (엔도TAG®-1), 폴리머릭-미셀라(Polymeric-micellar) 파클리탁셀 (진솔-PM®(Genexol-PM®)), DHA-파클리탁셀 (탁소프렉신(Taxoprexin)®), BMS-184476 포함)를 포함하나, 이에 제한되지 않는다. 예시적인 항폴레이트는 페메트렉세드이다. 백금-함유 화합물은 1주마다 1회, 2주마다 1회, 3주마다 1회, 또는 4주마다 1회 환자에게 투여될 수 있다. 탁산은 1주마다 1회, 2주마다 1회, 3주마다 1회, 또는 4주마다 1회 환자에게 투여될 수 있다. 항폴레이트는 1주마다 1회, 2주마다 1회, 3주마다 1회, 또는 4주마다 1회 환자에게 투여될 수 있다. 백금-함유 화합물 및 탁산 또는 항폴레이트, 둘 다가 치료 요법의 일부로서 환자에게 투여되는 실시양태에서, 탁산 또는 항폴레이트는 백금-함유 화합물 이전에, 그 이후에, 또는 그와 동시에 투여될 수 있다.
본원에 기술된 치료 방법의 일부 실시양태에서, 환자는 환자의 FRA 발현 수준을 정량화하기 이전에 암 치료를 위해 폐암의 외과적 절제, 사전 백금-기반 요법, 사전 탁산-기반 요법, 및/또는 사전 백금 및 탁산-기반 요법을 받을 수 있다. 환자가 환자의 FRA 발현 수준을 결정하기 이전에 암 치료를 위해 암의 외과적 절제, 사전 백금-기반 요법, 사전 탁산-기반 요법, 및/또는 사전 백금 및 탁산-기반 요법을 받은 것인 본 방법의 일부 실시양태에서, 환자는 환자의 FRA 발현 수준을 결정하는 단계 이전에 암의 증후성 진행, 혈청학적 진행 및/또는 방사선학상 진행을 보일 수 있다.
본원에 기술된 치료 방법에 따라 치료제 (FRA 표적화제, 탁산, 항폴레이트, 및/또는 백금-함유 화합물 포함)를 투여하는 것은 관련 기술분야에 공지된 임의의 수단에 의해 이루어질 수 있다.
치료제 (FRA 표적화제, 탁산, 항폴레이트, 및/또는 백금-함유 화합물 포함)를 투여하는 데, 진피내, 근육내, 복강내, 정맥내, 피하, 비내, 경막외, 및 경구 경로를 비롯한, 다양한 전달 시스템이 사용될 수 있다. 작용제는 예를 들어, 주입 또는 볼루스 주사에 의해, 상피 또는 점막피부 내벽 (예컨대, 구강 점막, 직장, 및 장 점막 등)을 통한 흡수에 의해 투여될 수 있다. 투여는 전신 또는 국소 투여일 수 있다.
치료제는 주사에 의해, 카테터에 의해, 좌제에 의해, 또는 막, 예컨대, 시알라스틱 막, 또는 섬유를 비롯한, 다공성, 비다공성 또는 젤라틴성 물질의 것인 임플란트에 의해 투여될 수 있다. 본원에 기술된 바와 같은 용도의 치료제 및 그의 제약 조성물은 임의의 허용되는 투여 형태, 예컨대, 캡슐제, 정제, 수성 현탁제, 액제 등으로 경구적으로 투여될 수 있다.
치료제의 바람직한 투여 방법으로는 정맥내 주사 및 복강내 투여를 포함하나, 이에 제한되지 않는다.
대안적으로, 치료제는 방출 조절형 시스템으로 전달될 수 있다. 예를 들어, 펌프가 사용될 수 있다 (문헌 [Langer, 1990, Science 249:1527-1533; Sefton, 1989, CRC Crit. Ref Biomed. Eng. 14:201; Buchwald et al., 1980, Surgery 88:507; Saudek et al., 1989, N. Engl. J. Med. 321:574] 참조). 대안적으로, 중합체 물질이 사용될 수 있다 (문헌 [Medical Applications of Controlled Release (Langer & Wise eds., CRC Press, Boca Raton, Fla., 1974); Controlled Drug Bioavailability, Drug Product Design and Performance (Smolen & Ball eds., Wiley, New York, 1984); Ranger & Peppas, 1983, Macromol. Sci. Rev. Macromol. Chem. 23:61] 참조. 또한, 문헌 [Levy et al., 1985, Science 228:190; During et al., 1989, Ann. Neurol. 25:351; Howard et al., 1989, J. Neurosurg. 71:105] 참조). 다른 방출 조절형 시스템은 예를 들어, 문헌 [Langer, 상기 문헌 동일]에 논의되어 있다.
치료제는 치료 또는 예방 유효량의 치료제(들) 및 하나 이상의 제약상 허용되거나, 또는 화합성인 성분을 포함하는 제약 조성물로서 투여될 수 있다. 예를 들어, 제약 조성물은 전형적으로 하나 이상의 제약 담체 (예컨대, 멸균 액체, 예컨대, 물 및 오일, 석유, 동물, 식물 또는 합성 기원의 것, 예컨대, 땅콩유, 대두유, 광유, 참기름 등 포함)를 포함한다. 물은 제약 조성물이 정맥내로 투여될 때 더욱 전형적인 담체이다. 염수 용액 (예컨대, 포스페이트 완충처리된 염수) 및 수성 덱스트로스 및 글리세롤 용액 또한 특히 주사액용 액체 담체로서 사용될 수 있다. 적합한 제약 부형제로는 예를 들어, 전분, 글루코스, 락토스, 수크로스, 젤라틴, 맥아, 쌀, 밀가루, 백악, 실리카 겔, 스테아르산 나트륨, 글리세롤 모노스테아레이트, 탈크, 염화나트륨, 탈지분유, 글리세롤, 프로필렌, 글리콜, 물, 에탄올 등을 포함한다. 원하는 경우, 조성물은 또한 최소량의 습윤화제 또는 유화제, pH 완충화제 (예컨대, 아미노산) 및/또는 가용화제 또는 안정화제 (예컨대, 비이온성 계면활성제, 예컨대, 트윈 또는 당, 예컨대, 수크로스, 트레할로스 등)를 함유할 수 있다. 팔레투주맙의 바람직한 제제는 팔레투주맙, 인산나트륨, 염화나트륨 (NaCl), 및 폴리소르베이트-80 (pH 7.2)을 함유한다. 팔레투주맙의 바람직한 최종의 제제는 5 mg/mL 팔레투주맙, 10 mM 인산나트륨, 150 mM NaCl, 및 0.01% 폴리소르베이트-80 (pH 7.2)을 함유한다.
본원에서 제공하는 제약 조성물은 액제, 현탁제, 에멀젼, 정제, 환제, 캡슐제, 분제, 지속 방출형 제제 등의 형태를 취할 수 있다. 사용 직전 액체 제제로 전환시키고자 하는 고체 형태 제제 또한 포함한다. 조성물은 종래 결합제 및 담체, 예컨대, 트리글리세리드와 함께 좌제로서 제제화될 수 있다. 경구용 제제는 표준 담체, 예컨대, 제약 등급의 만닛톨, 락토스, 전분, 스테아르산 마그네슘, 소듐 사카린, 셀룰로스, 탄산 마그네슘 등을 포함할 수 있다. 적합한 제약 담체의 예는 문헌 [E. W. Martin, "Remington's Pharmaceutical Sciences"]에 기술되어 있다. 상기 조성물은 상기 형태가 환자에게 적절히 투여될 수 있도록 하기 위해, 적합한 양의 담체와 함께 치료 유효량의 핵산 또는 단백질을 전형적으로는 정제된 형태로 함유할 것이다. 제제는 투여 모드에 상응한다.
전형적으로, 정맥내 투여용 조성물은 멸균 등장성 수성 완충제 중의 액제이다. 필요할 경우, 제약은 주사 부위의 통증 완화를 위해 가용화제 및 국부 마취제, 예컨대, 리그노카인 또한 포함할 수 있다. 일반적으로, 성분들은 별개로 공급되거나, 또는 단위 투여 형태로, 예를 들어, 활성제의 정량이 명시된 기밀하게 밀봉된 용기, 예컨대, 앰플 또는 사쉐 중의 동결건조된 분제 또는 농축물로서 함께 혼합된다. 제약 조성물을 주입에 의해 투여하고자 하는 경우, 멸균 제약 등급의 물 또는 염수를 함유하는 주입 병에 분배될 수 있다. 제약 조성물을 주사에 의해 투여하는 경우, 투여 이전에 성분을 혼합할 수 있도록 하기 위해 멸균 주사용수 또는 염수 앰플을 제공할 수 있다.
폐암 치료에 효과적인 치료제의 양은 표준 임상 기술에 의해 결정될 수 있다. 추가로, 최적의 투여량 범위를 확인하는데 도움을 주기 위하여 임의적으로 시험관내 검정이 사용될 수 있다. 제제에서 사용되는 정확한 용량은 또한 투여 경로, 및 암 병기에 의존하고, 의사의 판단 및 각 환자의 상화에 따라 결정되어야 한다. 유효 용량은 시험관내 또는 동물 모델 시험 시스템으로부터 도출된 용량-반응 곡선으로부터 외삽될 수 있다. 세포 배양물에서 결정된 바와 같은 IC50 (즉, 증상의 증상의 반수 최대 억제를 달성하는 시험 화합물의 농도)을 포함하는 순환 혈장 농도 범위를 달성하기 위한 용량이 동물 모델에서 제제화될 수 있다.
예를 들어, 작용제의 독성 및 치료학적 효능은 LD50 (집단 중 50%에게 치명적인 용량) 및 ED50 (집단 중 50%에서 치료상 유효한 용량)을 결정하기 위한 표준 제약 방법에 의해 세포 배양물 또는 실험 동물에서 결정될 수 있다. 독성 효과와 치료학적 효과 사이의 용량비가 치료 지수이고, 이는 LD50/ED50 비로 표시될 수 있다. 치료 지수가 큰 작용제가 바람직하다. 작용제가 독성 부작용을 보일 때에는 비-폴레이트 수용체 알파-발현 세포에의 잠재적인 손상을 최소화시켜 부작용을 감소시키기 위해서 작용제를 이환 조직 부위로 표적화하는 전달 시스템이 사용될 수 있다.
일부 실시양태에서, 대상체는 대상체 중량 1 kg당 약 0.01 ㎍ 내지 약 500 mg인 1일 용량 범위로 본원에 기술된 치료제를 투여받을 수 있다. 전형적으로, 폴레이트 수용체 알파-발현 폐암을 앓는 환자에게 투여되는 치료제 (예컨대, FRA 표적화제, 예컨대 FRA에 면역특이적으로 결합하는 항체, 바람직하게는 팔레투주맙)의 투여량은 약 0.1 mg/kg (대상체의 체중) 내지 약 100 mg/kg (대상체의 체중)이다. 더욱 전형적으로, 대상체에게 투여되는 투여량은 약 1.25 mg/kg (대상체의 체중) 내지 약 12.5 mg/kg (대상체의 체중), 또는 더욱더 전형적으로, 약 2.5 mg/kg (대상체의 체중) 내지 약 10.0 mg/kg (대상체의 체중)이다. 일부 실시양태에서, 폴레이트 수용체 알파-발현 폐암을 앓는 대상체에게 투여되는 FRA 표적화제 (예컨대, FRA에 면역특이적으로 결합하는 항체, 바람직하게는 팔레투주맙)의 투여량은 약 5.0 mg/kg (대상체의 체중) 내지 약 7.5 mg/kg (대상체의 체중)이다. 본원에 기술된 치료 방법의 일부 실시양태에서, 약 7.5 mg/kg 내지 약 12.5 mg/kg, 바람직하게는 약 10 mg/kg인, 용량의 FRA 표적화제 (예컨대, FRA에 면역특이적으로 결합하는 항체)가 부하 용량이 대상체에게 투여된다. 본원에 기술된 치료 방법의 일부 실시양태에서, 매주 약 7.5 mg/kg 내지 약 12.5 mg/kg, 바람직하게는 약 10 mg/kg인 2개 부하 용량의 FRA 표적화제 (예컨대, FRA에 면역특이적으로 결합하는 항체)가 처음 2주간의 치료에서 대상체에게 투여된다. 일부 실시양태에서, 폴레이트 수용체 알파-발현 폐암을 앓는 대상체에게 투여되는 탁산의 투여량은 약 50 mg/㎡ (대상체의 체중) 내지 약 250 mg/㎡ (대상체의 체중), 바람직하게는 약 75 mg/㎡ (대상체의 체중) 내지 약 200 mg/㎡ (대상체의 체중)이다. 일부 실시양태에서, 폴레이트 수용체 알파-발현 폐암을 앓는 대상체에게 투여되는 카르보플라틴의 투여량은 약 AUC 3, 바람직하게는 약 AUC 4, 더욱 바람직하게는 약 AUC 5-6이고, 일부 바람직한 실시양태에서, 약 AUC 6이다. 일부 실시양태에서, 폴레이트 수용체 알파-발현 폐암을 앓는 대상체에게 투여되는 시스플라틴의 투여량은 약 50 mg/㎡ (대상체의 체중) 내지 약 250 mg/㎡ (대상체의 체중), 바람직하게는 약 75 mg/㎡ (대상체의 체중) 내지 약 200 mg/㎡ (대상체의 체중)이다. 일부 실시양태에서, 폴레이트 수용체 알파-발현 폐암을 앓는 대상체에게 투여되는 항폴레이트의 투여량은 약 400 내지 약 600 mg/㎡이다. 바람직한 실시양태에서, FRA 표적화제의 투여와 함께 조합하여 적어도 4 내지 6회 사이클의 화학요법이 환자에게 투여된다.
효과적인 치료를 위해, 관련 기술분야의 통상의 기술자는 치료받는 대상체에 적합한 치료제(들)의 투여 스케줄 및 투여량을 권장할 수 있다. 필요로 하는 한 그 동안에는 1일 1 내지 4회 이상, 주 1회, 2주마다 1회, 3주마다 1회, 또는 4주마다 1회 투약하는 것이 바람직할 수 있다. 전형적으로, FRA 표적화제는 매주 대상체에게 투여된다.
조성물이 지속 전달 비히클로 제제화된다면 덜 빈번하게 투약될 수 있다. 투여 스케줄 또한, 대상체의 필요에 의존할 수 있는 활성 약물 농도에 의존하여 달라질 수 있다.
키트
본원에서는 FRA-발현 폐암을 앓는 환자에서 FRA 표적화제를 이용하는 치료에 대한 반응성의 가능성을 예측하기 위한 키트를 추가로 제공한다. 일부 실시양태에서, 키트는 항-FRA 항체, 비사용 시 항체를 함유하기 위한 용기, 및 대상체의 FRA 발현 수준을 결정하기 위해 항-FRA 항체를 사용하는 것에 대한 설명서를 함유한다. 하나 이상의 추가의 용기는 마커 검정(들)에서 사용하고자 하는 구성 요소, 예컨대, 시약 또는 완충제를 동봉할 수 있다. 상기 키트는 또한 또는 대안적으로 항체 결합을 직접 또는 간접적으로 검출하는데 적합한 리포터 기를 함유하는 검출 시약을 함유할 수 있다.
본원에서는 또한 FRA 표적화제 (예컨대, 빈타폴리드, FRA에 면역특이적으로 결합하는 항체, 예컨대, 팔레투주맙, 또는 항체-약물 접합체, 예컨대, IMGN853), 비사용 시 FRA 표적화제를 함유하기 위한 용기, 및 FRA 표적화제 사용 설명서를 포함하는, 환자에서 FRA-발현 폐암을 치료하기 위한 키트를 제공한다. 팔레투주맙이 키트에서 FRA에 면역특이적으로 결합하는 바람직한 항체이다. 일부 실시양태에서, FRA-발현 폐암을 앓는 대상체를 치료하기 위한 키트는 환자의 생물학적 샘플 중의 FRA 발현 수준을 정량화하는데 사용하기 위한 항-FRA 항체 또한 함유한다. 상기 후자의 항-FRA 항체는 치료학적으로 투여되는, FRA에 면역특이적으로 결합하는 항체와 동일하거나 또는 상이한 것일 수 있다. 일부 실시양태에서, 키트는 또한 비사용 시 항-FRA 항체를 함유하기 위한 용기 및 대상체의 FRA의 발현 수준을 결정하기 위해 항-FRA 항체를 사용하는 것에 대한 설명서를 함유한다.
FRA-발현 폐암을 앓는 대상체를 치료하기 위한 키트는 본원에 기술된 바와 같은 추가 치료제 (예컨대, 백금-함유 화합물, 탁산, 및/또는 항폴레이트)를 함유할 수 있다. 키트에 포함시키고자 하는 백금-함유 화합물의 예로는 시스플라틴 및 카르보플라틴을 포함하나, 이에 제한되지 않는다. 키트에 포함시키고자 하는 탁산의 예로는 파클리탁셀, 도세탁셀, 및 파클리탁셀, 도세탁셀, 및 그의 반합성, 합성 및/또는 변형된 버전 및 제제 (제한하는 것은 아니지만, 냅-파클리탁셀 (아브락산®), 카바지탁셀 (제브타나®), DJ-927 (테세탁셀®), 파클리탁셀 폴리글루멕스 (오팍시오®), XRP9881 (라로탁셀®), 엔도TAG + 파클리탁셀 (엔도TAG®-1), 폴리머릭-미셀라 파클리탁셀 (진솔-PM®), DHA-파클리탁셀 (탁소프렉신®), BMS-184476 포함)를 포함하나, 이에 제한되지 않는다. 키트에 포함시키고자 하는 항폴레이트의 예로는 페메트렉세드가 있다. 치료제는 키트에의 분배에 적합한 다양한 형태 중 임의의 것으로 존재할 수 있다. 키트에의 분배에 적합한 치료제의 형태로는 액제, 분제, 정제, 현탁제, 및 치료제를 제공하기 위한 유사 제제를 포함할 수 있다. 키트는 또한 치료제(들)의 주사, 재구성, 또는 희석을 위해 제약상 허용되는 희석제 (예컨대, 멸균수)를 포함할 수 있다. 하나 이상의 추가의 용기는 마커 검정(들)에서 사용하고자 하는 구성 요소, 예컨대, 시약 또는 완충제를 동봉할 수 있다. 상기 키트는 또한 또는 대안적으로 항체 결합을 직접 또는 간접적으로 검출하는데 적합한 리포터 기를 함유하는 검출 시약을 함유할 수 있다.
키트는 또한 전형적으로 본원에 기술된 방법에서 사용에 관한 라벨 또는 설명서를 함유한다. 라벨 또는 설명서란, 키트를 제조, 수송, 판매 또는 사용하는 동안 언제라도 키트에 부착되거나, 또는 다르게는 그를 수반하는 임의의 서면 작성물 또는 기록물을 지칭한다. 통지서는, 제조, 사용 또는 판매의 정부 기관에 의한 인간 투여용으로서의 승인을 반영하는 것인, 제약 또는 생물학적 제품의 제조, 사용 또는 판매를 규제하는 상기 기관에 의해 규정된 형식의 통지서일 수 있다. 라벨 또는 설명서는 또한 광고 전단 및 책자, 포장재, 설명서, 오디오 또는 비디오카세트, 컴퓨터 디스크 뿐만 아니라, 제약 키트 상에 직접 인쇄된 기입물도 포함할 수 있다.
하기 실시예는 본원에 개시된 실시양태 중 일부의 것을 추가로 기술하기 위해 제공되는 것이다. 본 실시예는 개시된 실시양태를 제한하는 것이 아니라, 예시하는 것으로 의도된다.
실시예 1
환자
유자격 대상체는, 면역조직화학법에 의하면, 종양 세포 중 적어도 5%에서 (1+ 이상의 막 염색으로 정의되는) FRA 발현이 일어나고, 컴퓨터 단층 촬영술 (CT) 또는 자기 공명 영상 (MRI) (ClinicalTrials.gov 식별자 NCT01218516)을 사용하여 고형 종양의 반응 평가 기준(Response Evaluation Criteria in Solid Tumors: RECIST) 버전 1.1에 따라 적어도 하나의 1차원적으로 측정 가능한 병변을 갖는 병기 IV기로 분류되는, 새로 진단받은, 절제 불가능한, 조직학상 또는 세포학상 확인된 폐의 선암종을 앓고 있어야 한다. 최대 항-FRA 항체 약리학적 효과(들)를 위해 이론상 요구될 수 있는 FRA 양성 반응의 정도 및 빈도에 관한 데이터는 존재하지 않는 바, (관련 기술분야의 통상의 기술자에 의해 전형적으로 사용되는 방법을 사용하였을 때) 종양이 +1 강도 막 FRA 발현으로 적어도 5%의 양성 반응을 보이는 환자를 FRA 양성 종양을 앓으며, 연구에 포함될 자격이 있는 것으로 지정하였다. 대상체는 그의 폐암을 치유하고자 하는 의향으로 어떤 사전 화학요법, 방사선 요법, 또는 수술도 받지 않았다.
치료
대상체는 팔레투주맙 또는 위약와 함께 선택된 백금 더블릿 (카르보플라틴 곡선하 면적 (AUC) 약동학적 노출 수준 6 및 파클리탁셀 200 mg/㎡; 카르보플라틴 AUC 5-6 및 페메트렉세드 500 mg/㎡; 또는 시스플라틴 75 mg/㎡ 및 페메트렉세드 500 mg/㎡)을 받는 것으로 1:1 비로 무작위화하였다. 미국 동부 종양학 협력 그룹(Eastern Cooperative Oncology Group: ECOG) 활동 상태 (0 또는 1) 및 선택된 화학요법 요법 유형에 의해 무작위화를 계층화하였다. 무작위화된 모든 대상체를 3개의 허용되는 화학요법 요법 중 하나와 함께 조합하여 팔레투주맙 7.5 mg/kg 또는 위약으로 치료하였는데, 이는 21-일 주기의 제1일에 정맥내로 (IV) 투여되었으며, 단, 예외적으로, 제1 주기의 경우, 팔레투주맙 또는 위약 단일 요법이 제8일에 부하 용량으로서 투여되었다. 2 주기를 시작으로, 모든 추가 주기의 재1일에 팔레투주맙 또는 위약을 화학요법과 함께 조합하여 투여하였다.
모든 프로토콜 허용되는 백금 더블릿을 4 주기 이상이되, 단, 6 주기 이하 동안 3주마다 1회 투여하였다. 화학요법 요법은 일단 개시하고 나면 바꾸지 않았다. 화학요법 투약은 국가별 승인받은 패키지 인서트에 따른 독성에 기인하여 및 대상체가 경험한 독성 정도에 기초하여 감소시키거나, 또는 지연시킬 수 있었다. 화학요법을 제4 주기 이전에 중단하였거나, 또는 화학요법이 6주 초과의 기간 동안 지속된 경우, 대상체를 프로토콜 치료에서 중단시켰다.
조합 요법으로부터의 임상적 이익을 경험한 상기 대상체는 문서화된 방사선 촬영상의 진행 또는 질환 진행에 관한 다른 프로토콜 승인받은 척도가 있을 때까지 계속해서 21-일 주기의 제1일에 팔레투주맙 또는 위약을 받을 수 있었다. 일단 질환이 발생하고 나면, 각 대상체를 생존 상태 및 병기 IV의 폐의 선암종에 대한 추가의 전신 요법 사용에 대해 추적 검사하였다. 본 추적 검사 기간 동안, 처음 9개월 동안에는 매달 대상체와 연락하였고, 그 이후에는 사망할 때까지 2개월마다 연락하였다.
평가
방사선 촬영상의 질환 평가는 조합 요법 동안 2주기마다 및 단일요법 동안에는 3주기마다 이루어졌고, 독립 검토에 따라 국소적으로 판독하였다. RECIST v.1.1을 사용하여 중앙 검토에 의해 독립적으로 CT 스캔 (또는 MRI) 또한 평가하였다. 어느 이유에서든 방사선 촬영상의 진행 이전에 연구 치료를 중단한 대상체는 문서화된 방사선 촬영상의 진행 또는 질환 진행에 관한 다른 프로토콜 승인받은 척도가 있을 때까지 9주마다 방사선 촬영에 의해 추적 검사하였다.
연구 전 기간 동안에 걸쳐 안전성 평가를 수행하였고, 이는 유해 사례 (AE) 검토, 신체 검사, 실험실 평가, 항-약물 항체 (ADA), 및 심전도 검사 (ECG)를 포함하였다.
PFS는 무작위화 수행일부터, RECIST에 의한 방사선 평가에 기초한 진행 또는 연구원에 의해 평가된 최종적 임상 질환 진행 (예컨대, 양성 반응을 보이는 체액 세포학상의 신규 발생)에 대한 최초 관찰일까지의, 또는 진행성 질환 부재 하에서의, 어느 원인에서든 사망일까지의 시간 (개월)으로 정의되었다.
종양 조직 중의 상대적인 FRA 발현 수준 또는 발현의 임계 수준이 표준 치료 화학요법 (카르보플라틴 + 파클리탁셀; 카르보플라틴 + 페메트렉세드; 또는 시스플라틴 + 페메트렉세드)과 조합된 비소세포 폐 선암종 (NSCLC) 환자에서의 개선된 팔레투주맙 매개 임상적 개선에 중요하다는 것을 입증하기 위해, 화학요법을 받은 적이 없는 병기 IV기의 NSCLC 선암종 환자로부터 유래된 종양 병변으로부터 제조된 5 μm 조직 절편 슬라이드를 세포질 또는 막 FRA 발현 수준에 대해 분석하였다.
표준 프로토콜 설명서에 따라 26B3 항-FRA 항체 (O'Shannessy et al., Oncotarget, 2012; 3(4):414-25; 이는 또한 카탈로그 번호 IPI4006K G10 (바이오케어 메디칼: 미국 캘리포니아주 콩코드) 내에 함유; 또한 미국 특허 8,475,795 참조)를 사용하여 본 연구를 위해 면역조직화학적 (IHC) 분석에 의해 FRA 단백질 수준을 결정하였다. FRA 발현을 정량화하기 위해, 두 방법 중 한 방법에 의해 수준을 결정하고, 숙련된 병리학자에 의해 맹검 방식으로 분석하였다. 앞서 기술된 바와 같은 방법을 사용하여 (Potts, Drug Discov Today, 2009; 14(19-20):935-41; O'Shannessy et al., Oncotarget, 2012; 3(4):414-25; 미국 특허 8,475,795; 제조사의 설명서, 카탈로그 번호 IPI4006K G10 (바이오케어 메디칼: 미국 캘리포니아주 콩코드)) 26B3 염색된 조직 절편에 대한 디지털 영상화 또는 수동 현미경 평가를 통해 세포질 또는 막 FRA 발현을 결정하였다.
플래그쉽 바이오사이언시스(Flagship Biosciences: 미국 콜로라도주 웨스트민스터)에 따라 셀 맵(Cell Map) 및/또는 스테인 맵(Stain Map) 알고리즘을 통해 이미지 애널리시스(Image Analysis)를 사용하여 26B3 염색된 절편화된 조직 슬라이드 중의 FRA의 디지털 분석을 수행하였다. 관련 기술분야의 통상의 숙련된 병리학자와 함께 2곳의 독립 실험실에 의한 현미경을 이용한 평가에 의해서 FRA 발현의 수동 분석을 수행하였다.
디지털 영상화 또는 수동 분석에 의해 도출된 막 또는 세포질 FRA 발현 수준을 정량화하기 위해, FRA 염색을 종양 양성률 및 신호 강도 백분율로서 정량화하는 알고리즘을 개발하였다. 수동 병리상태 점수화 방법에서 사용하기 위한 것으로 확인된 상기 값은 막 염색에 대해 FRA M 스코어 (FRAMSCOR)로서 표시된다. 디지털 영상화 분석에서 사용하기 위한 것으로 확인된 값은 세포질 염색에 대해 HBS 스코어 (HBSCOR)로서 표시된다. 바이오마커 발현 수준을 정확하게 정량화하는데 사용된 이전 방법은, 고도로 정확한 점수화를 달성하기 위해서는 종양 절편은 윤곽이 매우 명확하여야 하고, IHC 염색은 균일하여야 한다는 것을 결정하였다. 본 연구에 포함된 환자에 대해 수득된 조직 절편 및 염색의 정질을 평가하기 위해, 관련 기술분야의 통상의 맹검화된 병리학자는 FRA 26B3 염색된 NSCLC 종양 조직 절편의 무결성을 평가하여 흉막 조직 유래 표준을 이용하여 흉막 조직 중의 FRA 발현과 비교하였다. 전체 평가 후, 병리학자는 FRAMSCOR 및 HBSCOR 흉막 조직 분석에 적합한 조직 슬라이드는 130개 중 85개인 것으로 간주하였다. 남은 45개의 슬라이드는 FRA 발현의 "존재"를 검출하는 데에는 적합하지만, 1.) 막 발현을 정확하게 분석할 수 있는 능력을 불가능하게 만든 불량한 조직 보존; 2.) 흉막 조직 (흉막 삼출액 배경 내의 악성 세포만을 오직 함유하는 슬라이드의 서브세트) 중 FRA 발현을 정확하게 결정하지 못하는 무능력; 및/또는 3.) 선형 범위에서 정밀한 염색 분석을 방해한 과다 염색에 기인하여 상세한 발현 분석은 불가능하였다. 도 1은 치료 의향 집단 (ITT) 중 원래의 임상 세트의 일부인, FRAMSCOR 또는 HBSCOR에 의한 FRA 발현 정량화에 적합하지 않은 것의 예 대비의, 조직 무결성/형태 및 염색의 적합성을 보여주는 것이다.
85개의 적합한 흉막 종양 절편에서의 FRA 염색 강도를 결정하기 위해, FRA 발현 수준이 낮은, 중간 정도, 및 높은 비관련 환자로부터의 샘플을 사용하여 흉막 조직 참조 데이터 세트를 먼저 확립하였다. 상기 데이터 세트는, 그에 의해서 환자들 간의 상대적인 FRA 발현 수준이 비교되고, 수동 및 디지털 분석 FRAMSCOR 및 HBSCOR 방법을 사용하여 정량화되는 것인 표준을 나타낸다. 도 2는 관련 기술분야의 통상의 기술자에 의해 공지된 바와 같이, NSCLC 선암종 샘플 중 FRA를 +1 (낮은 발현), +2 (중간 정도 발현) 및 +3 (높은 발현)으로 점수화하는데 사용된 참조 데이터 세트의 예를 보여주는 것이다. 추가로, 종양 양성률 백분율을 또한 하기 공식을 사용하여 각 방법에 대한 알고리즘으로 팩토링하였다 (종양 표면적의 1 내지 100%의 양성률).
FRAMSCOR (M-점수) 은 하기와 같은 0, 1+, 2+, 3+ 점수화 체계 전제 하에 가중 평균으로서 산출된 것이다 (도 2 참조):
x = 1+로 염색된 종양 %
y = 2+로 염색된 종양 %
z = 3+로 염색된 종양 %일 때,
예시 목적으로, 환자의 종양이 +1인 26B3-FRA 염색을 20%, +2인 26B3-FRA 염색을 10%, 및 +3인 26B3-FRA 염색을 20% 보일 때, M 점수 = 16.6이다.
HBSCOR 은 표적 조직 구획 중의 모든 세포로부터 계산된 바이오마커 염색 (본 경우에서는 FRA의 26B3-염색)에 대한 평균 광학 밀도를 보고한다. 이는 세포 분류 없이 선형 점수 및 H-점수의 연속된 확장을 통해 조직 구획을 결정하기 위해 전용 조직 인식 특징을 이용한다. H-점수는 조직 중 바이오마커 발현을 점수화하기 위해 병리학자 및 관련 기술분야의 통상의 기술자에 의해 보편적으로 사용되는 표준 점수화 방법으로서, 이는 기본적으로 모든 강도 수준에서의 강도 점수의 총합 (1+, + 2 x 2+, + 3x 3+)이다. HBSCOR은 세포 측정값 (광학 밀도) 총합을 세포 총 수로 나눈 값으로부터 도출된다. 결과적으로, HBSCOR은 표적 조직 구획 중의 모든 세포로부터 계산된 바이오마커 염색에 대한 값을 보고한다. 이러한 산출은 하기 공식을 사용하여 정량화된다:
26B3 항체를 사용하여 FRA에 대해 염색된 환자 유래의 조직을 함유하는 평가가능한 슬라이드를 맹검 방식의 분석 하에 상기 기술된 FRAMSCOR 및 HBSCOR 방법을 사용하여 분석하고, 정량화하였다. 데이터를 먼저 발현 컷포인트 분석을 사용하여 분석하였다. 높은 또는 낮은 FRA 발현이 위약 대조군 치료받은 환자 대비의 팔레투주맙 치료에 대한 치료학적 반응과 상관관계가 있는지 여부를 결정하기 위해 전체 생존 (OS)과의 폴레이트 수용체 알파 (FRA) 발현의 상관관계를 수행하였다. 도 3은 이에 의해서 환자 표본이 HBSCOR 방법을 통해 FRA 발현에 대해 정량화된 것인 본 분석의 예를 보여주는 것이다. 제시된 바와 같이, 발현이 낮은 환자 대비 더 높은 수준으로 FRA를 발현하는 팔레투주맙으로 치료받은 환자에서 임상적 양의 값의 위험비가 존재하는 바, 환자 OS의 유의한 반응이 관찰된다. 무진행 생존 (PFS) 또는 OS의 함수로서 FRA 발현 및 팔레투주맙 치료가 환자의 임상적 반응에 미치는 전반적인 영향을 결정하기 위해, 카플란 마이어(Kaplan Meier) 분석을 수행하였다. 도 4에 제시된 바와 같이, FRAMSCOR을 사용하였을 때, 높은 FRA 막 발현에 대해 선별된 환자는, 오직 위약 + SOC로만 치료받은 환자 (p = 0.386)와 비교하여 팔레투주맙 + SOC로 치료받았을 때, OS가 통계학상 유의한 임상적 개선을 보인 것으로 나타났다 (8.4개월 개선, HR 0.54; p = 0.0266). 높은 FRA 막 염색 대 낮은 막 염색을 나타낸 환자에서 개선된 PFS 반응 또한 관찰되었다 (제시하지 않음). HBSCOR 방법을 사용하여 최적의 FRA 세포질 발현을 보인 환자를 사용하였을 때, 팔레투주맙으로 치료받은 환자는 최적의 FRA 수준보다 적은 수준으로 발현하며, 팔레투주맙으로 치료받은 환자 (도 5, 패널 A)와 비교하였을 때, PFS 및 OS가 통계학상 유의한 임상적 이익을 보인 것으로 나타난 (도 5, 패널 B), 유사한 효과가 관찰되었다. 이러한 관찰 결과는, 위약 + SOC로 치료받은 환자 대비 팔레투주맙 + SOC로 치료받은 환자에서의 통계학상의 임상적 이익을 입증하는데 실패한 ITT 집단에 대해 수행된 바와 같이 (PFS HR 0.91, p = 0.7045 및 OS HR 0.91, p = 0.6525), 치료학적 이익을 개선시키기 위해서는 단지 임의의 FRA 발현을 보이는 종양을 앓는 환자를 동원하는 것보다는 폐암 환자의 생검 중 FRA 발현을 확인하는 것을 사용하여 FRAMSCOR 또는 HBSCOR 방법 사용 시 최소의 임계 수준을 보이는 환자를 결정하는 것을 교시한다.
SOC 치료에 대한 NSCLC 폐암 환자의 임상적 반응에 영향을 줄 수 있는 표준 인자, 예컨대, 흡연, 연령 또는 ECOG 상태를 사용하여 다변량 분석을 수행하였다. 다변량 분석에서 FRA 수준이 높은 환자에서는 임상적 반응에 미치는 팔레투주맙의 통계학상 긍정적 효과에 영향을 주는 어떤 효과도 관찰되지 않았다.
상기 관찰 결과는 흉막 악성 조직을 함유하고, 항-폴레이트 수용체 알파 항체 요법에 반응할 수 있는 환자를 확인하는데 사용하기 위하여 막으로 또는 세포질에 국재화된 FRA 발현을 정량화 가능하게 분석할 수 있도록 하는 방식으로 염색된 우수한 품질의 조직 생검을 사용하는 것의 용도를 교시한다. 후속 분석에서는 흉막 삼출액 및 세침 흡인물로부터 유래된 환자 샘플 또한 항-FRA 치료학적 효과에 대해 적합한 FRA 발현을 보이는 환자를 확인하기 위해 정량화될 수 있다는 것이 밝혀졌다. 상기 경우에서, 비-흉막 기반 참조 표준이 비교를 위해 개발될 수 있다. 추가로, 상기 결과는 FRAMSCOR 또는 HBSCOR 방법을 통해 결정 시 막 및/또는 세포질에서 더 높은 수준으로 FRA를 발현하는 종양을 앓는 환자가 PFS 및 OS를 비롯한 임상적 결과에서의 유의한 개선을 보인다는 것을 입증한다. 상기 교시는 항-FRA 항체 요법(들)에 반응할 가능성이 가장 큰 NSCLC 환자에서의 항-FRA 항체 요법의 사용을 포지셔닝시켜야 한다. FRA 수준은 SOC와 조합된 항-FRA 항체 요법에 반응할 환자를 정의하는데 중요하다. 추가 시험 및 임상적 유용성은 효능에 대한 최소 컷포인트를 초과하는 FRA의 필요한 임계 수준을 보이는 환자를 치료하는 것을 도입하여야 한다. 본원에서 정의된 상기 수준은 7 이상의 FRAMSCOR 및 0.25 이상의 HBSCOR을 포함한다 (도 3 참조). 평균적으로, 이는 +1 강도인 FRA 발현이 42% 초과, +2 강도인 FRA 발현이 21%인 NSCLC 종양 및/또는 +3 강도인 FRA 발현이 14% 초과인 종양으로 해석된다.
SEQUENCE LISTING
<110> MORPHOTEK, INC.
<120> METHODS FOR TREATING LUNG CANCER
<130> 104018.000950
<140>
<141>
<150> 62/149,184
<151> 2015-04-17
<160> 46
<170> PatentIn version 3.5
<210> 1
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 1
Gly Phe Thr Phe Ser Gly Tyr Gly Leu Ser
1 5 10
<210> 2
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 2
Met Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 3
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 3
His Gly Asp Asp Pro Ala Trp Phe Ala Tyr
1 5 10
<210> 4
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 4
Ser Val Ser Ser Ser Ile Ser Ser Asn Asn Leu His
1 5 10
<210> 5
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 5
Gly Thr Ser Asn Leu Ala Ser
1 5
<210> 6
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 6
Gln Gln Trp Ser Ser Tyr Pro Tyr Met Tyr Thr
1 5 10
<210> 7
<211> 217
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 7
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Val Ser Ser Ser Ile Ser Ser Asn
20 25 30
Asn Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Trp
35 40 45
Ile Tyr Gly Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Phe Thr Ile Ser Ser Leu Gln
65 70 75 80
Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro
85 90 95
Tyr Met Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr
100 105 110
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
115 120 125
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
130 135 140
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
145 150 155 160
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
165 170 175
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
180 185 190
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
195 200 205
Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 8
<211> 449
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 8
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ser Ala Ser Gly Phe Thr Phe Ser Gly Tyr
20 25 30
Gly Leu Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Met Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ala Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly Val Tyr Phe Cys
85 90 95
Ala Arg His Gly Asp Asp Pro Ala Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Pro Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
Lys
<210> 9
<211> 962
<212> DNA
<213> Homo sapiens
<400> 9
tcaaggttaa acgacaagga cagacatggc tcagcggatg acaacacagc tgctgctcct 60
tctagtgtgg gtggctgtag taggggaggc tcagacaagg attgcatggg ccaggactga 120
gcttctcaat gtctgcatga acgccaagca ccacaaggaa aagccaggcc ccgaggacaa 180
gttgcatgag cagtgtcgac cctggaggaa gaatgcctgc tgttctacca acaccagcca 240
ggaagcccat aaggatgttt cctacctata tagattcaac tggaaccact gtggagagat 300
ggcacctgcc tgcaaacggc atttcatcca ggacacctgc ctctacgagt gctcccccaa 360
cttggggccc tggatccagc aggtggatca gagctggcgc aaagagcggg tactgaacgt 420
gcccctgtgc aaagaggact gtgagcaatg gtgggaagat tgtcgcacct cctacacctg 480
caagagcaac tggcacaagg gctggaactg gacttcaggg tttaacaagt gcgcagtggg 540
agctgcctgc caacctttcc atttctactt ccccacaccc actgttctgt gcaatgaaat 600
ctggactcac tcctacaagg tcagcaacta cagccgaggg agtggccgct gcatccagat 660
gtggttcgac ccagcccagg gcaaccccaa tgaggaggtg gcgaggttct atgctgcagc 720
catgagtggg gctgggccct gggcagcctg gcctttcctg cttagcctgg ccctaatgct 780
gctgtggctg ctcagctgac ctccttttac cttctgatac ctggaaatcc ctgccctgtt 840
cagccccaca gctcccaact atttggttcc tgctccatgg tcgggcctct gacagccact 900
ttgaataaac cagacaccgc acatgtgtct tgagaattat ttggaaaaaa aaaaaaaaaa 960
aa 962
<210> 10
<211> 257
<212> PRT
<213> Homo sapiens
<400> 10
Met Ala Gln Arg Met Thr Thr Gln Leu Leu Leu Leu Leu Val Trp Val
1 5 10 15
Ala Val Val Gly Glu Ala Gln Thr Arg Ile Ala Trp Ala Arg Thr Glu
20 25 30
Leu Leu Asn Val Cys Met Asn Ala Lys His His Lys Glu Lys Pro Gly
35 40 45
Pro Glu Asp Lys Leu His Glu Gln Cys Arg Pro Trp Arg Lys Asn Ala
50 55 60
Cys Cys Ser Thr Asn Thr Ser Gln Glu Ala His Lys Asp Val Ser Tyr
65 70 75 80
Leu Tyr Arg Phe Asn Trp Asn His Cys Gly Glu Met Ala Pro Ala Cys
85 90 95
Lys Arg His Phe Ile Gln Asp Thr Cys Leu Tyr Glu Cys Ser Pro Asn
100 105 110
Leu Gly Pro Trp Ile Gln Gln Val Asp Gln Ser Trp Arg Lys Glu Arg
115 120 125
Val Leu Asn Val Pro Leu Cys Lys Glu Asp Cys Glu Gln Trp Trp Glu
130 135 140
Asp Cys Arg Thr Ser Tyr Thr Cys Lys Ser Asn Trp His Lys Gly Trp
145 150 155 160
Asn Trp Thr Ser Gly Phe Asn Lys Cys Ala Val Gly Ala Ala Cys Gln
165 170 175
Pro Phe His Phe Tyr Phe Pro Thr Pro Thr Val Leu Cys Asn Glu Ile
180 185 190
Trp Thr His Ser Tyr Lys Val Ser Asn Tyr Ser Arg Gly Ser Gly Arg
195 200 205
Cys Ile Gln Met Trp Phe Asp Pro Ala Gln Gly Asn Pro Asn Glu Glu
210 215 220
Val Ala Arg Phe Tyr Ala Ala Ala Met Ser Gly Ala Gly Pro Trp Ala
225 230 235 240
Ala Trp Pro Phe Leu Leu Ser Leu Ala Leu Met Leu Leu Trp Leu Leu
245 250 255
Ser
<210> 11
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Any amino acid
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Any amino acid
<400> 11
Gln Val Xaa Leu Gln Xaa Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Gly Tyr
20 25 30
Gly Leu Ser Trp Val Arg Gln Thr Pro Asp Lys Arg Leu Glu Trp Val
35 40 45
Ala Met Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ala Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Phe
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Asp Asp Thr Ala Ile Tyr Ile Cys
85 90 95
Ala Arg His Gly Asp Asp Pro Ala Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala
115
<210> 12
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 12
Asp Ile Glu Leu Thr Gln Ser Pro Ala Leu Met Ala Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Ser Val Ser Ser Ser Ile Ser Ser Asn
20 25 30
Asn Leu His Trp Tyr Gln Gln Lys Ser Glu Thr Ser Pro Lys Pro Trp
35 40 45
Ile Tyr Gly Thr Ser Asn Leu Ala Ser Gly Val Pro Leu Arg Phe Arg
50 55 60
Gly Phe Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu
65 70 75 80
Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro
85 90 95
Tyr Met Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 13
<400> 13
000
<210> 14
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 14
Gly Tyr Phe Met Asn
1 5
<210> 15
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 15
Arg Ile Phe Pro Tyr Asn Gly Asp Thr Phe Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 16
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 16
Gly Thr His Tyr Phe Asp Tyr
1 5
<210> 17
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 17
Arg Thr Ser Glu Asn Ile Phe Ser Tyr Leu Ala
1 5 10
<210> 18
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 18
Asn Ala Lys Thr Leu Ala Glu
1 5
<210> 19
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 19
Gln His His Tyr Ala Phe Pro Trp Thr
1 5
<210> 20
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 20
His Pro Tyr Met His
1 5
<210> 21
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 21
Arg Ile Asp Pro Ala Asn Gly Asn Thr Lys Tyr Asp Pro Lys Phe Gln
1 5 10 15
Gly
<210> 22
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 22
Glu Glu Val Ala Asp Tyr Thr Met Asp Tyr
1 5 10
<210> 23
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 23
Arg Ala Ser Glu Ser Val Asp Thr Tyr Gly Asn Asn Phe Ile His
1 5 10 15
<210> 24
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 24
Leu Ala Ser Asn Leu Glu Ser
1 5
<210> 25
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 25
Gln Gln Asn Asn Gly Asp Pro Trp Thr
1 5
<210> 26
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 26
Ser Gly Tyr Tyr Trp Asn
1 5
<210> 27
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 27
Tyr Ile Lys Ser Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu Lys Asn
1 5 10 15
<210> 28
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 28
Glu Trp Lys Ala Met Asp Tyr
1 5
<210> 29
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 29
Arg Ala Ser Ser Thr Val Ser Tyr Ser Tyr Leu His
1 5 10
<210> 30
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 30
Gly Thr Ser Asn Leu Ala Ser
1 5
<210> 31
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 31
Gln Gln Tyr Ser Gly Tyr Pro Leu Thr
1 5
<210> 32
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 32
Ser Tyr Ala Met Ser
1 5
<210> 33
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 33
Glu Ile Gly Ser Gly Gly Ser Tyr Thr Tyr Tyr Pro Asp Thr Val Thr
1 5 10 15
Gly
<210> 34
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 34
Glu Thr Thr Ala Gly Tyr Phe Asp Tyr
1 5
<210> 35
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 35
Ser Ala Ser Gln Gly Ile Asn Asn Phe Leu Asn
1 5 10
<210> 36
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 36
Tyr Thr Ser Ser Leu His Ser
1 5
<210> 37
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<400> 37
Gln His Phe Ser Lys Leu Pro Trp Thr
1 5
<210> 38
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 38
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Val Ser Ser Ser Ile Ser Ser Asn
20 25 30
Asn Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln
65 70 75 80
Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro
85 90 95
Tyr Met Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 39
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 39
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Val Ser Ser Ser Ile Ser Ser Asn
20 25 30
Asn Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Phe Thr Ile Ser Ser Leu Gln
65 70 75 80
Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro
85 90 95
Tyr Met Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 40
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 40
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Val Ser Ser Ser Ile Ser Ser Asn
20 25 30
Asn Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Trp
35 40 45
Ile Tyr Gly Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln
65 70 75 80
Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro
85 90 95
Tyr Met Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 41
<211> 110
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 41
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Val Ser Ser Ser Ile Ser Ser Asn
20 25 30
Asn Leu His Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Pro Trp
35 40 45
Ile Tyr Gly Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Phe Thr Ile Ser Ser Leu Gln
65 70 75 80
Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Tyr Pro
85 90 95
Tyr Met Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 42
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 42
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Ala Ser Gly Phe Thr Phe Ser Gly Tyr
20 25 30
Gly Leu Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Met Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Gly Asp Asp Pro Ala Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser
115
<210> 43
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 43
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Ala Ser Gly Phe Thr Phe Ser Gly Tyr
20 25 30
Gly Leu Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Met Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ala Ile Ser Arg Asp Asn Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Gly Asp Asp Pro Ala Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser
115
<210> 44
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 44
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Ala Ser Gly Phe Thr Phe Ser Gly Tyr
20 25 30
Gly Leu Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Met Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Ser Leu Phe
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Gly Asp Asp Pro Ala Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 45
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 45
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Ala Ser Gly Phe Thr Phe Ser Gly Tyr
20 25 30
Gly Leu Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp Val
35 40 45
Ala Met Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ile Tyr Ile Cys
85 90 95
Ala Arg His Gly Asp Asp Pro Ala Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser
115
<210> 46
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 46
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ser Ala Ser Gly Phe Thr Phe Ser Gly Tyr
20 25 30
Gly Leu Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Met Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Ala Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly Val Tyr Phe Cys
85 90 95
Ala Arg His Gly Asp Asp Pro Ala Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Pro Val Thr Val Ser Ser
115
Claims (43)
- 폴레이트 수용체 알파 (FRA)에 면역특이적으로 결합하는 항체를 이용하여 환자에서 폴레이트 수용체 알파 (FRA)-발현 폐암을 치료하는 방법이며,
환자의 생물학적 샘플 중 환자의 FRA 발현 수준을 결정하는 단계;
환자의 FRA 발현 수준을 참조 FRA 발현 수준과 비교하는 단계; 및
상기 환자의 FRA 발현 수준이 상기 참조 FRA 발현 수준과 동일하거나 또는 그를 초과한다면, 상기 환자에게 치료 유효량의 상기 항체를 투여하는 단계
를 포함하는 방법. - 환자에서 폴레이트 수용체 알파 (FRA)-발현 폐암을 치료하는 방법이며, 환자에게 폴레이트 수용체 알파 (FRA)에 면역특이적으로 결합하는 항체를 투여하는 단계를 포함하고, 여기서 환자의 FRA 발현 수준은 참조 FRA 발현 수준과 동일하거나 또는 그를 초과하는 것인 방법.
- 폴레이트 수용체 알파 (FRA)-발현 폐암을 앓는 환자에서 폴레이트 수용체 알파 (FRA)에 면역학적으로 결합하는 항체를 이용하는 치료에 대한 반응성의 가능성을 예측하는 방법이며,
환자의 생물학적 샘플 중 환자의 FRA 발현 수준을 결정하는 단계; 및
상기 환자의 FRA 발현 수준을 참조 FRA 발현 수준과 비교하는 단계
를 포함하고,
여기서, 상기 환자의 FRA 발현 수준이 상기 참조 FRA 발현 수준과 동일하거나 또는 그를 초과한다면, 상기 환자는 FRA에 면역특이적으로 결합하는 FRA에 면역학적으로 결합하는 상기 항체를 이용하는 치료에 대해 반응할 가능성이 있는 것인 방법. - 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 참조 FRA 발현 수준이, FRA에 면역특이적으로 결합하는 상기 항체를 투여받은 상기 FRA-발현 폐암에 걸린 환자 집단이 위약을 투여받은 상기 FRA-발현 폐암에 걸린 환자 집단에 비해 적어도 하나의 임상적 결과에서의 통계학상 유의한 개선을 입증한 수준 초과의 FRA 발현 수준에 상응하는 것인 방법.
- 제4항에 있어서, 상기 환자 집단이 화학요법제를 추가로 투여받은 것인 방법.
- 제5항에 있어서, 상기 화학요법제가 탁산, 시스플라틴, 카르보플라틴, 및/또는 페메트렉세드를 포함하는 것인 방법.
- 제1항 내지 제6항 중 어느 한 항에 있어서, 상기 FRA 발현 수준이 단백질 정량화 또는 RNA 정량화에 의해 측정되는 것인 방법.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 상기 FRA 발현 수준이 면역조직화학적 분석에 의해 측정되는 것인 방법.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 상기 FRA 발현 수준이 세포질 FRA 발현인 방법.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 상기 FRA 발현 수준이 막 FRA 발현인 방법.
- 제1항 내지 제10항 중 어느 한 항에 있어서, FRA에 면역특이적으로 결합하는 상기 항체가 독소에 접합되는 것인 방법.
- 제11항에 있어서, 상기 독소가 미세관 억제제, DNA 손상 작용제, DNA 복구 억제제, 또는 신호 전달 억제제를 포함하는 것인 방법.
- 제11항에 있어서, 상기 DNA 손상 작용제가 방사성핵종을 포함하는 것인 방법.
- 제1항 내지 제13항 중 어느 한 항에 있어서, FRA에 면역특이적으로 결합하는 상기 항체가
CDRH1로서 서열식별번호: 1, CDRH2로서 서열식별번호: 2, CDRH3으로서 서열식별번호: 3, CDRL1로서 서열식별번호: 4, CDRL2로서 서열식별번호: 5 및 CDRL3으로서 서열식별번호: 6을 포함하는 항체;
서열식별번호: 7의 아미노산 서열을 포함하는 성숙 경쇄 가변 영역 및/또는 서열식별번호: 8의 아미노산 서열을 포함하는 성숙 중쇄 가변 영역을 포함하는 항체;
팔레투주맙;
각각 서열식별번호: 7 및 서열식별번호: 8과 적어도 90%, 바람직하게는 적어도 95% 또는 99%의 서열 동일성을 갖는 성숙 경쇄 및 중쇄 가변 영역을 포함하는, 폴레이트 수용체 알파에 특이적으로 결합하는 항체; 또는
폴레이트 수용체 알파에 대한 팔레투주맙의 결합을 경쟁적으로 억제할 수 있는 항체 또는 그의 유도체인
방법. - 제1항 내지 제14항 중 어느 한 항에 있어서, 상기 환자에게 치료 유효량의 화학요법제를 투여하는 단계를 추가로 포함하는 방법.
- 제15항에 있어서, 상기 화학요법제가 백금-함유 화합물을 포함하는 것인 방법.
- 제16항에 있어서, 상기 백금-함유 화합물이 시스플라틴 또는 카르보플라틴을 포함하는 것인 방법.
- 제1항 내지 제17항 중 어느 한 항에 있어서, 상기 환자에게 치료 유효량의 탁산을 투여하는 단계를 추가로 포함하는 방법.
- 제18항에 있어서, 상기 탁산이 파클리탁셀인 방법.
- 제15항 내지 제19항 중 어느 한 항에 있어서, 상기 환자에게 치료 유효량의 페메트렉세드를 투여하는 단계를 추가로 포함하는 방법.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 상기 환자에게 카르보플라틴 및 파클리탁셀을 투여하는 단계를 추가로 포함하는 방법.
- 제21항에 있어서, 카르보플라틴이 상기 환자에게 약 6 또는 그 미만의 곡선하 면적 (AUC)을 달성하도록 투여되는 것인 방법.
- 제21항 또는 제22항에 있어서, 파클리탁셀이 상기 환자에게 약 50 mg/㎡ 내지 약 250 mg/㎡의 용량으로 투여되는 것인 방법.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 상기 환자에게 카르보플라틴 및 페메트렉세드를 투여하는 단계를 추가로 포함하는 방법.
- 제24항에 있어서, 상기 카르보플라틴이 상기 환자에게 약 5-6 또는 그 미만의 곡선하 면적을 달성하도록 투여되는 것인 방법.
- 제24항 또는 제25항에 있어서, 상기 페메트렉세드가 상기 환자에게 약 400 내지 약 600 mg/㎡의 용량으로 투여되는 것인 방법.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 상기 환자에게 시스플라틴 및 페메트렉세드를 투여하는 단계를 추가로 포함하는 방법.
- 제27항에 있어서, 시스플라틴이 상기 환자에게 약 50 mg/㎡ 내지 약 250 mg/㎡의 용량으로 투여되는 것인 방법.
- 제27항 또는 제28항에 있어서, 페메트렉세드가 약 400 mg/㎡ 내지 약 600 mg/㎡의 용량으로 투여되는 것인 방법.
- 제1항 내지 제29항 중 어느 한 항에 있어서, 상기 FRA 발현 수준이 하기 항체 중 적어도 하나를 이용하여 면역검정에 의해 결정되는 것인 방법:
(a) 팔레투주맙과 동일한 에피토프에 결합하는 항체;
(b) CDRH1로서 서열식별번호: 1 (GFTFSGYGLS), CDRH2로서 서열식별번호: 2 (MISSGGSYTYYADSVKG), CDRH3으로서 서열식별번호: 3 (HGDDPAWFAY), CDRL1로서 서열식별번호: 4 (SVSSSISSNNLH), CDRL2로서 서열식별번호: 5 (GTSNLAS) 및 CDRL3으로서 서열식별번호: 6 (QQWSSYPYMYT)을 포함하는 항체;
(c) 서열식별번호: 7의 아미노산 서열을 포함하는 성숙 경쇄 가변 영역 및 아미노산 서열식별번호: 8을 포함하는 성숙 중쇄 가변 영역을 포함하는 항체;
(d) 팔레투주맙;
(e) 548908 항체;
(f) 548908 항체와 동일한 에피토프에 결합하는 항체;
(g) 6D398 항체;
(h) 6D398 항체와 동일한 에피토프에 결합하는 항체;
(i) BN3.2 항체;
(j) BN3.2 항체와 동일한 에피토프에 결합하는 항체;
(k) 26B3 항체와 동일한 에피토프에 결합하는 항체;
(l) CDRH1로서 서열식별번호: 14 (GYFMN), CDRH2로서 서열식별번호: 15 (RIFPYNGDTFYNQKFKG), CDRH3으로서 서열식별번호: 16 (GTHYFDY), CDRL1로서 서열식별번호: 17 (RTSENIFSYLA), CDRL2로서 서열식별번호: 18 (NAKTLAE) 및 CDRL3으로서 서열식별번호: 19 (QHHYAFPWT)를 포함하는 항체;
(m) 26B3 항체;
(n) 19D4 항체와 동일한 에피토프에 결합하는 항체;
(o) CDRH1로서 서열식별번호: 20 (HPYMH), CDRH2로서 서열식별번호: 21 (RIDPANGNTKYDPKFQG), CDRH3으로서 서열식별번호: 22 (EEVADYTMDY), CDRL1로서 서열식별번호: 23 (RASESVDTYGNNFIH), CDRL2로서 서열식별번호: 24 (LASNLES) 및CDRL3으로서 서열식별번호: 25 (QQNNGDPWT)를 포함하는 항체;
(p) 19D4 항체;
(q) 9F3 항체와 동일한 에피토프에 결합하는 항체;
(r) CDRH1로서 서열식별번호: 26 (SGYYWN), CDRH2로서 서열식별번호: 27 (YIKSDGSNNYNPSLKN), CDRH3으로서 서열식별번호: 28 (EWKAMDY), CDRL1로서 서열식별번호: 29 (RASSTVSYSYLH), CDRL2로서 서열식별번호: 30 (GTSNLAS) 및 CDRL3으로서 서열식별번호: 31 (QQYSGYPLT)을 포함하는 항체;
(s) 9F3 항체;
(t) 24F12 항체와 동일한 에피토프에 결합하는 항체;
(u) CDRH1로서 서열식별번호: 32 (SYAMS), CDRH2로서 서열식별번호: 33 (EIGSGGSYTYYPDTVTG), CDRH3으로서 서열식별번호: 34 (ETTAGYFDY), CDRL1로서 서열식별번호: 35 (SASQGINNFLN), CDRL2로서 서열식별번호: 36 (YTSSLHS) 및 CDRL3으로서 서열식별번호: 37 (QHFSKLPWT)을 포함하는 항체;
(v) 24F12 항체;
(w) 하기로 이루어진 군으로부터 선택되는 가변 영역 경쇄를 포함하는 항체:
(i) LK26HuVK;
(ii) LK26HuVKY;
(iii) LK26HuVKPW; 및
(iv) LK26HuVKPW,Y;
(x) 하기로 이루어진 군으로부터 선택되는 가변 영역 중쇄를 포함하는 항체:
(i) LK26HuVH;
(ii) LK26HuVH FAIS,N;
(iii) LK26HuVH SLF;
(iv) LK26HuVH I,I;
(v) LK26KOLHuVH;
(y) 중쇄 가변 영역 LK26KOLHuVH (서열식별번호: 46) 및 경쇄 가변 영역 LK26HuVKPW,Y (서열식별번호: 41)를 포함하는 항체;
(z) 중쇄 가변 영역 LK26HuVH SLF (서열식별번호: 44) 및 경쇄 가변 영역 LK26HuVKPW,Y (서열식별번호: 41)를 포함하는 항체;
(aa) 중쇄 가변 영역 LK26HuVH FAIS,N (서열식별번호: 43) 및 경쇄 가변 영역 LK26HuVKPW,Y (서열식별번호: 41)를 포함하는 항체; 및
(bb) 뮤린 모노클로날 LK26 항체. - 제1항 내지 제30항 중 어느 한 항에 있어서, 상기 환자의 FRA 발현 수준이 디지털 영상화 기술 또는 수동 병리상태 정량화에 의해 평가되는 것인 방법.
- 제7항에 있어서, 상기 환자의 FRA 발현 수준이 FRAMSCOR 또는 HBSCOR에 의해 평가되는 것인 방법.
- 제32항에 있어서, 상기 참조 FRA 발현 수준이 42%의 +1 이상의 항-FRA 염색인 방법.
- 제32항에 있어서, 상기 참조 FRA 발현 수준이 21%의 +2 이상의 항-FRA 염색인 방법.
- 제32항에 있어서, 상기 참조 FRA 발현 수준이 14%의 +3 이상의 염색인 방법.
- 제32항에 있어서, 상기 참조 FRA 발현 수준이 7의 FRAMSCOR인 방법.
- 제32항에 있어서, 상기 참조 FRA 발현 수준이 0.25의 HBSCOR인 방법.
- 제1항 내지 제37항 중 어느 한 항에 있어서, 상기 생물학적 샘플이 전혈, 혈청, 혈장, 순환 세포, 순환 종양 세포, 유리 세포, 조직, 흉막 삼출액, 소변, 타액, 객담, 또는 기관지 세척액인 방법.
- 제1항 내지 제38항 중 어느 한 항에 있어서, 상기 생물학적 샘플이 흉막 조직을 포함하는 것인 방법.
- 제1항 내지 제39항 중 어느 한 항에 있어서, 상기 생물학적 샘플이 삼출액으로부터 유래된 흉막 세포를 포함하는 것인 방법.
- 제4항에 있어서, 상기 적어도 하나의 임상적 결과가 무진행 생존 및/또는 전체 생존인 방법.
- 제1항 내지 제41항 중 어느 한 항에 있어서, 상기 FRA-발현 폐암이 FRA-발현 비소세포 폐암 (NSCLC)인 방법.
- 제42항에 있어서, 상기 NSCLC가 선암종인 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562149184P | 2015-04-17 | 2015-04-17 | |
| US62/149,184 | 2015-04-17 | ||
| PCT/US2016/027497 WO2016168440A1 (en) | 2015-04-17 | 2016-04-14 | Methods for treating lung cancer |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170137848A true KR20170137848A (ko) | 2017-12-13 |
Family
ID=55809240
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177032864A KR20170137848A (ko) | 2015-04-17 | 2016-04-14 | 폐암을 치료하는 방법 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20180125970A1 (ko) |
| EP (1) | EP3283886B1 (ko) |
| JP (1) | JP2018516244A (ko) |
| KR (1) | KR20170137848A (ko) |
| CN (1) | CN107624071A (ko) |
| AU (1) | AU2016248222A1 (ko) |
| BR (1) | BR112017022320A2 (ko) |
| CA (1) | CA2983126A1 (ko) |
| IL (1) | IL255079A0 (ko) |
| MX (1) | MX2017013390A (ko) |
| RU (1) | RU2718780C9 (ko) |
| SG (1) | SG11201708546UA (ko) |
| WO (1) | WO2016168440A1 (ko) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009521206A (ja) * | 2005-04-22 | 2009-06-04 | モルフォテック、インク. | 免疫エフェクター活性を有する葉酸受容体アルファ陽性細胞に内部移行する抗体 |
| US20170247449A1 (en) * | 2014-06-06 | 2017-08-31 | Kyowa Hakko Kirin Co., Ltd | Therapeutic method and medicament for cancer patients by folr1-targeting drug and an antagonist for folic acid metabolism |
| EP3544999A1 (en) * | 2016-11-23 | 2019-10-02 | Eisai R&D Management Co., Ltd. | Anti-folate receptor alpha antibodies and uses thereof |
| JP7433236B2 (ja) | 2018-03-13 | 2024-02-19 | フェインズ セラピューティクス,インコーポレーテッド | 抗葉酸受容体1抗体及びその使用 |
| CA3103369A1 (en) * | 2018-06-18 | 2019-12-26 | Medimmune Limited | Combination of lif inhibitors and platinum-based antineoplastic agents for use in treating cancer |
| CN110221052B (zh) * | 2019-06-17 | 2022-09-23 | 昆山德诺瑞尔生物科技有限公司 | Ppfibp1蛋白在制备肝癌术后预后评估试剂盒中的应用 |
| WO2023170216A1 (en) * | 2022-03-11 | 2023-09-14 | Astrazeneca Ab | A SCORING METHOD FOR AN ANTI-FRα ANTIBODY-DRUG CONJUGATE THERAPY |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2316857A1 (en) | 2004-02-12 | 2011-05-04 | Morphotek, Inc. | Monoclonal antibodies that specifically bind to folate receptor alpha |
| JP2009521206A (ja) * | 2005-04-22 | 2009-06-04 | モルフォテック、インク. | 免疫エフェクター活性を有する葉酸受容体アルファ陽性細胞に内部移行する抗体 |
| GB0718167D0 (en) * | 2007-09-18 | 2007-10-31 | Cancer Rec Tech Ltd | Cancer marker and therapeutic target |
| MX343607B (es) | 2010-11-05 | 2016-11-11 | Morphotek Inc | Receptor alfa de folato como marcador de diagnóstico y pronóstico para cánceres que expresan receptor alfa de folato. |
| CA2841725C (en) * | 2011-07-15 | 2021-03-09 | Eisai R&D Management Co., Ltd. | Anti-folate receptor alpha antibodies and uses thereof |
-
2016
- 2016-04-14 MX MX2017013390A patent/MX2017013390A/es unknown
- 2016-04-14 SG SG11201708546UA patent/SG11201708546UA/en unknown
- 2016-04-14 CN CN201680028727.8A patent/CN107624071A/zh active Pending
- 2016-04-14 JP JP2017554475A patent/JP2018516244A/ja active Pending
- 2016-04-14 EP EP16718820.0A patent/EP3283886B1/en active Active
- 2016-04-14 AU AU2016248222A patent/AU2016248222A1/en not_active Abandoned
- 2016-04-14 BR BR112017022320A patent/BR112017022320A2/pt not_active Application Discontinuation
- 2016-04-14 KR KR1020177032864A patent/KR20170137848A/ko unknown
- 2016-04-14 RU RU2017136863A patent/RU2718780C9/ru not_active IP Right Cessation
- 2016-04-14 WO PCT/US2016/027497 patent/WO2016168440A1/en active Application Filing
- 2016-04-14 US US15/566,888 patent/US20180125970A1/en not_active Abandoned
- 2016-04-14 CA CA2983126A patent/CA2983126A1/en not_active Abandoned
-
2017
- 2017-10-17 IL IL255079A patent/IL255079A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| EP3283886B1 (en) | 2020-01-15 |
| US20180125970A1 (en) | 2018-05-10 |
| JP2018516244A (ja) | 2018-06-21 |
| RU2718780C2 (ru) | 2020-04-14 |
| RU2017136863A (ru) | 2019-05-17 |
| SG11201708546UA (en) | 2017-11-29 |
| WO2016168440A1 (en) | 2016-10-20 |
| IL255079A0 (en) | 2017-12-31 |
| CA2983126A1 (en) | 2016-10-20 |
| BR112017022320A2 (pt) | 2018-07-24 |
| RU2017136863A3 (ko) | 2019-08-21 |
| RU2718780C9 (ru) | 2020-07-08 |
| CN107624071A (zh) | 2018-01-23 |
| AU2016248222A1 (en) | 2017-11-09 |
| MX2017013390A (es) | 2018-06-13 |
| EP3283886A1 (en) | 2018-02-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP3283886B1 (en) | Methods for treating lung cancer | |
| US10273308B2 (en) | Methods of producing antibodies specific for p95 | |
| US20190202930A1 (en) | Methods for treatment of ovarian cancer | |
| EP1948213B1 (en) | Methods to predict and prevent resistance to taxoid compounds | |
| US20220365088A1 (en) | Autoantibody biomarkers of ovarian cancer | |
| US10221240B2 (en) | Methods for treatment of gastric cancer | |
| WO2019064073A1 (en) | USE OF CA125 FOR PREDICTING ANTI-MESOTHELIC TREATMENT OF MESOTHELIOMES | |
| US20110195074A1 (en) | Ephrin Type-A Receptor 7 Protein |