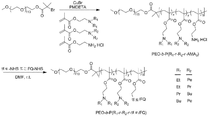
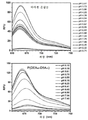
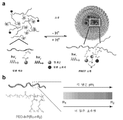
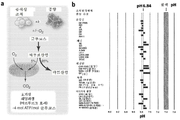
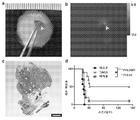
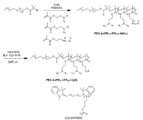
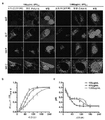
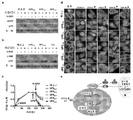
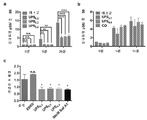
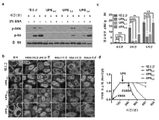
KR20170029430A - Ph 반응성 중합체의 라이브러리 및 이의 나노프로브 - Google Patents
Ph 반응성 중합체의 라이브러리 및 이의 나노프로브 Download PDFInfo
- Publication number
- KR20170029430A KR20170029430A KR1020167035901A KR20167035901A KR20170029430A KR 20170029430 A KR20170029430 A KR 20170029430A KR 1020167035901 A KR1020167035901 A KR 1020167035901A KR 20167035901 A KR20167035901 A KR 20167035901A KR 20170029430 A KR20170029430 A KR 20170029430A
- Authority
- KR
- South Korea
- Prior art keywords
- polymer
- alkyl
- peo
- substituted
- tumor
- Prior art date
Links
- 229920000642 polymer Polymers 0.000 title claims abstract description 220
- 239000000693 micelle Substances 0.000 claims abstract description 193
- 238000000034 method Methods 0.000 claims abstract description 181
- 238000003384 imaging method Methods 0.000 claims abstract description 131
- 206010028980 Neoplasm Diseases 0.000 claims description 329
- 210000004027 cell Anatomy 0.000 claims description 223
- 125000000217 alkyl group Chemical group 0.000 claims description 143
- 229910052739 hydrogen Inorganic materials 0.000 claims description 109
- 239000001257 hydrogen Substances 0.000 claims description 109
- 239000000975 dye Substances 0.000 claims description 104
- 230000007704 transition Effects 0.000 claims description 100
- 150000002431 hydrogen Chemical class 0.000 claims description 87
- 125000000547 substituted alkyl group Chemical group 0.000 claims description 76
- 230000004913 activation Effects 0.000 claims description 70
- 238000006243 chemical reaction Methods 0.000 claims description 67
- 239000000203 mixture Substances 0.000 claims description 65
- 201000011510 cancer Diseases 0.000 claims description 53
- 125000003118 aryl group Chemical group 0.000 claims description 50
- 150000001450 anions Chemical class 0.000 claims description 46
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 44
- 210000001163 endosome Anatomy 0.000 claims description 38
- -1 SHBED Chemical compound 0.000 claims description 37
- 150000001875 compounds Chemical class 0.000 claims description 36
- 229910052751 metal Inorganic materials 0.000 claims description 35
- 239000002184 metal Substances 0.000 claims description 35
- 230000004044 response Effects 0.000 claims description 34
- 238000001356 surgical procedure Methods 0.000 claims description 34
- 230000003287 optical effect Effects 0.000 claims description 33
- 239000007850 fluorescent dye Substances 0.000 claims description 32
- 125000005346 substituted cycloalkyl group Chemical group 0.000 claims description 30
- 230000002132 lysosomal effect Effects 0.000 claims description 29
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 29
- 210000003712 lysosome Anatomy 0.000 claims description 28
- 108090000623 proteins and genes Proteins 0.000 claims description 28
- 238000002603 single-photon emission computed tomography Methods 0.000 claims description 28
- 125000001072 heteroaryl group Chemical group 0.000 claims description 27
- 239000003112 inhibitor Substances 0.000 claims description 27
- 230000001868 lysosomic effect Effects 0.000 claims description 27
- 125000002252 acyl group Chemical group 0.000 claims description 26
- 230000037361 pathway Effects 0.000 claims description 25
- 230000008569 process Effects 0.000 claims description 25
- 238000001514 detection method Methods 0.000 claims description 23
- 150000003384 small molecules Chemical class 0.000 claims description 23
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 22
- 239000010949 copper Substances 0.000 claims description 22
- 210000001165 lymph node Anatomy 0.000 claims description 21
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 20
- 102000004169 proteins and genes Human genes 0.000 claims description 20
- GTACSIONMHMRPD-UHFFFAOYSA-N 2-[4-[2-(benzenesulfonamido)ethylsulfanyl]-2,6-difluorophenoxy]acetamide Chemical compound C1=C(F)C(OCC(=O)N)=C(F)C=C1SCCNS(=O)(=O)C1=CC=CC=C1 GTACSIONMHMRPD-UHFFFAOYSA-N 0.000 claims description 19
- 101710130081 Aspergillopepsin-1 Proteins 0.000 claims description 19
- 102100031007 Cytosolic non-specific dipeptidase Human genes 0.000 claims description 19
- 208000020816 lung neoplasm Diseases 0.000 claims description 19
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 18
- 238000000295 emission spectrum Methods 0.000 claims description 18
- 201000005202 lung cancer Diseases 0.000 claims description 18
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 claims description 18
- 208000010444 Acidosis Diseases 0.000 claims description 17
- 230000003834 intracellular effect Effects 0.000 claims description 17
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 16
- 208000026310 Breast neoplasm Diseases 0.000 claims description 15
- 150000002500 ions Chemical class 0.000 claims description 15
- 208000013824 Acidemia Diseases 0.000 claims description 14
- 238000012879 PET imaging Methods 0.000 claims description 13
- 238000010494 dissociation reaction Methods 0.000 claims description 13
- 230000005593 dissociations Effects 0.000 claims description 13
- 208000002154 non-small cell lung carcinoma Diseases 0.000 claims description 13
- 238000012634 optical imaging Methods 0.000 claims description 13
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 13
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 claims description 13
- 101000584612 Homo sapiens GTPase KRas Proteins 0.000 claims description 12
- 230000008859 change Effects 0.000 claims description 12
- 238000010791 quenching Methods 0.000 claims description 12
- 102100030708 GTPase KRas Human genes 0.000 claims description 11
- 101710181599 Serine/threonine-protein kinase STK11 Proteins 0.000 claims description 11
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 11
- 230000035772 mutation Effects 0.000 claims description 11
- 230000000171 quenching effect Effects 0.000 claims description 11
- 238000002271 resection Methods 0.000 claims description 11
- 239000000126 substance Substances 0.000 claims description 11
- 230000008685 targeting Effects 0.000 claims description 11
- 206010006187 Breast cancer Diseases 0.000 claims description 10
- 206010064571 Gene mutation Diseases 0.000 claims description 10
- 150000001335 aliphatic alkanes Chemical class 0.000 claims description 10
- 239000002738 chelating agent Substances 0.000 claims description 10
- 201000010536 head and neck cancer Diseases 0.000 claims description 10
- 229910021645 metal ion Inorganic materials 0.000 claims description 10
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims description 10
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 10
- 210000000577 adipose tissue Anatomy 0.000 claims description 9
- 231100000590 oncogenic Toxicity 0.000 claims description 9
- 230000002246 oncogenic effect Effects 0.000 claims description 9
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 claims description 9
- 101150105104 Kras gene Proteins 0.000 claims description 8
- 102000017298 Monocarboxylate transporters Human genes 0.000 claims description 8
- 108050005244 Monocarboxylate transporters Proteins 0.000 claims description 8
- 230000008901 benefit Effects 0.000 claims description 8
- 239000003795 chemical substances by application Substances 0.000 claims description 8
- 239000002253 acid Substances 0.000 claims description 7
- 210000000481 breast Anatomy 0.000 claims description 7
- 210000004881 tumor cell Anatomy 0.000 claims description 7
- JPVYNHNXODAKFH-UHFFFAOYSA-N Cu2+ Chemical compound [Cu+2] JPVYNHNXODAKFH-UHFFFAOYSA-N 0.000 claims description 6
- 206010027476 Metastases Diseases 0.000 claims description 6
- 229940079593 drug Drugs 0.000 claims description 6
- 239000003814 drug Substances 0.000 claims description 6
- MOFVSTNWEDAEEK-UHFFFAOYSA-M indocyanine green Chemical compound [Na+].[O-]S(=O)(=O)CCCCN1C2=CC=C3C=CC=CC3=C2C(C)(C)C1=CC=CC=CC=CC1=[N+](CCCCS([O-])(=O)=O)C2=CC=C(C=CC=C3)C3=C2C1(C)C MOFVSTNWEDAEEK-UHFFFAOYSA-M 0.000 claims description 6
- 229960004657 indocyanine green Drugs 0.000 claims description 6
- 230000009401 metastasis Effects 0.000 claims description 6
- 238000012544 monitoring process Methods 0.000 claims description 6
- 208000000102 Squamous Cell Carcinoma of Head and Neck Diseases 0.000 claims description 5
- 201000000459 head and neck squamous cell carcinoma Diseases 0.000 claims description 5
- 230000019491 signal transduction Effects 0.000 claims description 5
- 102000008394 Immunoglobulin Fragments Human genes 0.000 claims description 4
- 108010021625 Immunoglobulin Fragments Proteins 0.000 claims description 4
- 238000010521 absorption reaction Methods 0.000 claims description 4
- 238000001727 in vivo Methods 0.000 claims description 4
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 4
- 102000039446 nucleic acids Human genes 0.000 claims description 4
- 108020004707 nucleic acids Proteins 0.000 claims description 4
- 150000007523 nucleic acids Chemical class 0.000 claims description 4
- JHALWMSZGCVVEM-UHFFFAOYSA-N 2-[4,7-bis(carboxymethyl)-1,4,7-triazonan-1-yl]acetic acid Chemical compound OC(=O)CN1CCN(CC(O)=O)CCN(CC(O)=O)CC1 JHALWMSZGCVVEM-UHFFFAOYSA-N 0.000 claims description 3
- 102000003846 Carbonic anhydrases Human genes 0.000 claims description 3
- 108090000209 Carbonic anhydrases Proteins 0.000 claims description 3
- WDLRUFUQRNWCPK-UHFFFAOYSA-N Tetraxetan Chemical compound OC(=O)CN1CCN(CC(O)=O)CCN(CC(O)=O)CCN(CC(O)=O)CC1 WDLRUFUQRNWCPK-UHFFFAOYSA-N 0.000 claims description 3
- 230000002285 radioactive effect Effects 0.000 claims description 3
- WGTODYJZXSJIAG-UHFFFAOYSA-N tetramethylrhodamine chloride Chemical compound [Cl-].C=12C=CC(N(C)C)=CC2=[O+]C2=CC(N(C)C)=CC=C2C=1C1=CC=CC=C1C(O)=O WGTODYJZXSJIAG-UHFFFAOYSA-N 0.000 claims description 3
- VILCJCGEZXAXTO-UHFFFAOYSA-N 2,2,2-tetramine Chemical compound NCCNCCNCCN VILCJCGEZXAXTO-UHFFFAOYSA-N 0.000 claims description 2
- GRUVVLWKPGIYEG-UHFFFAOYSA-N 2-[2-[carboxymethyl-[(2-hydroxyphenyl)methyl]amino]ethyl-[(2-hydroxyphenyl)methyl]amino]acetic acid Chemical compound C=1C=CC=C(O)C=1CN(CC(=O)O)CCN(CC(O)=O)CC1=CC=CC=C1O GRUVVLWKPGIYEG-UHFFFAOYSA-N 0.000 claims description 2
- GOLORTLGFDVFDW-UHFFFAOYSA-N 3-(1h-benzimidazol-2-yl)-7-(diethylamino)chromen-2-one Chemical group C1=CC=C2NC(C3=CC4=CC=C(C=C4OC3=O)N(CC)CC)=NC2=C1 GOLORTLGFDVFDW-UHFFFAOYSA-N 0.000 claims description 2
- UDGUGZTYGWUUSG-UHFFFAOYSA-N 4-[4-[[2,5-dimethoxy-4-[(4-nitrophenyl)diazenyl]phenyl]diazenyl]-n-methylanilino]butanoic acid Chemical compound COC=1C=C(N=NC=2C=CC(=CC=2)N(C)CCCC(O)=O)C(OC)=CC=1N=NC1=CC=C([N+]([O-])=O)C=C1 UDGUGZTYGWUUSG-UHFFFAOYSA-N 0.000 claims description 2
- KJSJBKBZMGSIPT-UHFFFAOYSA-N 4-oxo-3-phenylmethoxypyran-2-carboxylic acid Chemical compound O1C=CC(=O)C(OCC=2C=CC=CC=2)=C1C(=O)O KJSJBKBZMGSIPT-UHFFFAOYSA-N 0.000 claims description 2
- 239000012099 Alexa Fluor family Substances 0.000 claims description 2
- 229910052765 Lutetium Inorganic materials 0.000 claims description 2
- QPCDCPDFJACHGM-UHFFFAOYSA-N N,N-bis{2-[bis(carboxymethyl)amino]ethyl}glycine Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CC(O)=O QPCDCPDFJACHGM-UHFFFAOYSA-N 0.000 claims description 2
- 241001181114 Neta Species 0.000 claims description 2
- 208000035896 Twin-reversed arterial perfusion sequence Diseases 0.000 claims description 2
- 229910052769 Ytterbium Inorganic materials 0.000 claims description 2
- 229910052767 actinium Inorganic materials 0.000 claims description 2
- 230000006907 apoptotic process Effects 0.000 claims description 2
- 229910001451 bismuth ion Inorganic materials 0.000 claims description 2
- 229910001431 copper ion Inorganic materials 0.000 claims description 2
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 claims description 2
- CKHJYUSOUQDYEN-UHFFFAOYSA-N gallium(3+) Chemical compound [Ga+3] CKHJYUSOUQDYEN-UHFFFAOYSA-N 0.000 claims description 2
- 229910001449 indium ion Inorganic materials 0.000 claims description 2
- 230000002401 inhibitory effect Effects 0.000 claims description 2
- RVPVRDXYQKGNMQ-UHFFFAOYSA-N lead(2+) Chemical compound [Pb+2] RVPVRDXYQKGNMQ-UHFFFAOYSA-N 0.000 claims description 2
- 229910052706 scandium Inorganic materials 0.000 claims description 2
- 229910052713 technetium Inorganic materials 0.000 claims description 2
- 229910052723 transition metal Inorganic materials 0.000 claims description 2
- 229910001428 transition metal ion Inorganic materials 0.000 claims description 2
- 150000003624 transition metals Chemical class 0.000 claims description 2
- 210000005167 vascular cell Anatomy 0.000 claims description 2
- GBNDTYKAOXLLID-UHFFFAOYSA-N zirconium(4+) ion Chemical compound [Zr+4] GBNDTYKAOXLLID-UHFFFAOYSA-N 0.000 claims description 2
- 238000012831 peritoneal equilibrium test Methods 0.000 claims 6
- 238000012636 positron electron tomography Methods 0.000 claims 6
- 238000012877 positron emission topography Methods 0.000 claims 6
- 125000001475 halogen functional group Chemical group 0.000 claims 5
- 125000004356 hydroxy functional group Chemical group O* 0.000 claims 3
- FDSYTWVNUJTPMA-UHFFFAOYSA-N 2-[3,9-bis(carboxymethyl)-3,6,9,15-tetrazabicyclo[9.3.1]pentadeca-1(15),11,13-trien-6-yl]acetic acid Chemical compound C1N(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CC2=CC=CC1=N2 FDSYTWVNUJTPMA-UHFFFAOYSA-N 0.000 claims 1
- UQQQAKFVWNQYTP-UHFFFAOYSA-N 3,6,10,13,16,19-hexazabicyclo[6.6.6]icosane-1,8-diamine Chemical compound C1NCCNCC2(N)CNCCNCC1(N)CNCCNC2 UQQQAKFVWNQYTP-UHFFFAOYSA-N 0.000 claims 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 claims 1
- XFXPMWWXUTWYJX-UHFFFAOYSA-N Cyanide Chemical compound N#[C-] XFXPMWWXUTWYJX-UHFFFAOYSA-N 0.000 claims 1
- ACHQFNGCBWWVRR-UHFFFAOYSA-N NOPO Chemical compound NOPO ACHQFNGCBWWVRR-UHFFFAOYSA-N 0.000 claims 1
- 229960001138 acetylsalicylic acid Drugs 0.000 claims 1
- 108700013553 diamsar chelate Proteins 0.000 claims 1
- RDYMFSUJUZBWLH-UHFFFAOYSA-N endosulfan Chemical compound C12COS(=O)OCC2C2(Cl)C(Cl)=C(Cl)C1(Cl)C2(Cl)Cl RDYMFSUJUZBWLH-UHFFFAOYSA-N 0.000 claims 1
- 208000006575 hypertriglyceridemia Diseases 0.000 claims 1
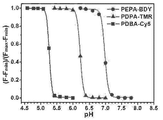
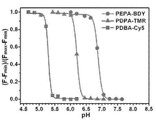
- 230000002209 hydrophobic effect Effects 0.000 abstract description 31
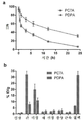
- 208000015778 Undifferentiated pleomorphic sarcoma Diseases 0.000 description 267
- 239000000523 sample Substances 0.000 description 111
- 229920001577 copolymer Polymers 0.000 description 108
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 74
- 238000001994 activation Methods 0.000 description 70
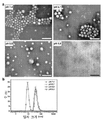
- 239000002105 nanoparticle Substances 0.000 description 68
- 239000000178 monomer Substances 0.000 description 64
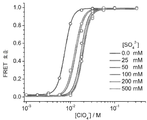
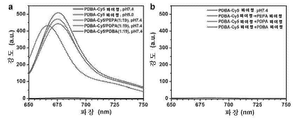
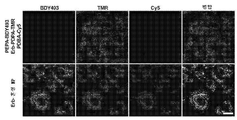
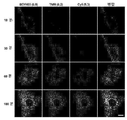
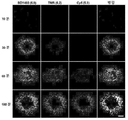
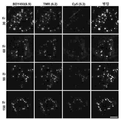
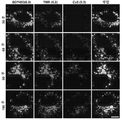
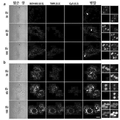
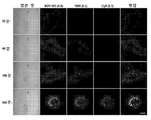
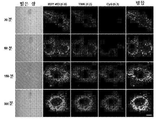
- 238000002866 fluorescence resonance energy transfer Methods 0.000 description 62
- 241000699670 Mus sp. Species 0.000 description 61
- SJIXRGNQPBQWMK-UHFFFAOYSA-N DEAEMA Natural products CCN(CC)CCOC(=O)C(C)=C SJIXRGNQPBQWMK-UHFFFAOYSA-N 0.000 description 52
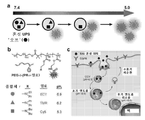
- 230000015572 biosynthetic process Effects 0.000 description 50
- 239000000243 solution Substances 0.000 description 47
- 210000001519 tissue Anatomy 0.000 description 45
- 230000000694 effects Effects 0.000 description 43
- 210000003463 organelle Anatomy 0.000 description 41
- 229920001510 poly[2-(diisopropylamino)ethyl methacrylate] polymer Polymers 0.000 description 36
- 230000006870 function Effects 0.000 description 35
- 229920001400 block copolymer Polymers 0.000 description 32
- 230000000875 corresponding effect Effects 0.000 description 31
- 230000035800 maturation Effects 0.000 description 31
- 238000004458 analytical method Methods 0.000 description 30
- 238000002347 injection Methods 0.000 description 30
- 239000007924 injection Substances 0.000 description 30
- 230000001419 dependent effect Effects 0.000 description 26
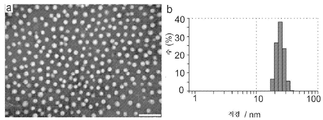
- 238000002296 dynamic light scattering Methods 0.000 description 26
- 238000002474 experimental method Methods 0.000 description 26
- 238000003786 synthesis reaction Methods 0.000 description 25
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 25
- 102000008135 Mechanistic Target of Rapamycin Complex 1 Human genes 0.000 description 24
- 108010035196 Mechanistic Target of Rapamycin Complex 1 Proteins 0.000 description 24
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 24
- 239000002953 phosphate buffered saline Substances 0.000 description 24
- 229910020366 ClO 4 Inorganic materials 0.000 description 23
- 229910052799 carbon Inorganic materials 0.000 description 21
- 241001465754 Metazoa Species 0.000 description 20
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 20
- 230000005764 inhibitory process Effects 0.000 description 20
- 230000007246 mechanism Effects 0.000 description 20
- 239000003607 modifier Substances 0.000 description 20
- 229940024606 amino acid Drugs 0.000 description 19
- 235000001014 amino acid Nutrition 0.000 description 19
- 150000001413 amino acids Chemical class 0.000 description 19
- 230000003196 chaotropic effect Effects 0.000 description 19
- ZCXUVYAZINUVJD-AHXZWLDOSA-N 2-deoxy-2-((18)F)fluoro-alpha-D-glucose Chemical compound OC[C@H]1O[C@H](O)[C@H]([18F])[C@@H](O)[C@@H]1O ZCXUVYAZINUVJD-AHXZWLDOSA-N 0.000 description 18
- 238000002189 fluorescence spectrum Methods 0.000 description 18
- 235000018102 proteins Nutrition 0.000 description 18
- 238000001338 self-assembly Methods 0.000 description 18
- 238000004627 transmission electron microscopy Methods 0.000 description 18
- 238000012512 characterization method Methods 0.000 description 17
- 238000009826 distribution Methods 0.000 description 17
- 230000009977 dual effect Effects 0.000 description 17
- 235000015097 nutrients Nutrition 0.000 description 17
- 210000000056 organ Anatomy 0.000 description 17
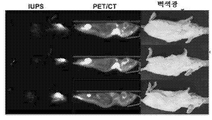
- 238000010176 18-FDG-positron emission tomography Methods 0.000 description 16
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 16
- 125000004432 carbon atom Chemical group C* 0.000 description 16
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 16
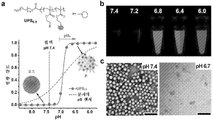
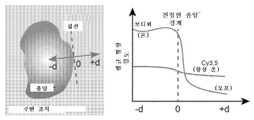
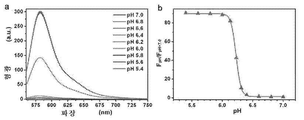
- 230000020477 pH reduction Effects 0.000 description 16
- 230000035945 sensitivity Effects 0.000 description 16
- 108700012439 CA9 Proteins 0.000 description 15
- 102100024423 Carbonic anhydrase 9 Human genes 0.000 description 15
- 210000004369 blood Anatomy 0.000 description 15
- 239000008280 blood Substances 0.000 description 15
- 239000000872 buffer Substances 0.000 description 15
- 238000013461 design Methods 0.000 description 15
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 14
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 14
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 14
- 206010057249 Phagocytosis Diseases 0.000 description 14
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 14
- 239000008103 glucose Substances 0.000 description 14
- 230000000670 limiting effect Effects 0.000 description 14
- 230000008782 phagocytosis Effects 0.000 description 14
- 238000011002 quantification Methods 0.000 description 14
- 230000004083 survival effect Effects 0.000 description 14
- 238000012360 testing method Methods 0.000 description 14
- QLIBJPGWWSHWBF-UHFFFAOYSA-N 2-aminoethyl methacrylate Chemical compound CC(=C)C(=O)OCCN QLIBJPGWWSHWBF-UHFFFAOYSA-N 0.000 description 13
- 230000003139 buffering effect Effects 0.000 description 13
- 230000021615 conjugation Effects 0.000 description 13
- 125000004122 cyclic group Chemical group 0.000 description 13
- 102000005962 receptors Human genes 0.000 description 13
- 108020003175 receptors Proteins 0.000 description 13
- 238000012546 transfer Methods 0.000 description 13
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 12
- 241000699666 Mus <mouse, genus> Species 0.000 description 12
- 230000002378 acidificating effect Effects 0.000 description 12
- 230000001413 cellular effect Effects 0.000 description 12
- 229910052757 nitrogen Inorganic materials 0.000 description 12
- 239000011780 sodium chloride Substances 0.000 description 12
- WHTVZRBIWZFKQO-AWEZNQCLSA-N (S)-chloroquine Chemical compound ClC1=CC=C2C(N[C@@H](C)CCCN(CC)CC)=CC=NC2=C1 WHTVZRBIWZFKQO-AWEZNQCLSA-N 0.000 description 11
- 102000009565 Lysosomal-Associated Membrane Protein 2 Human genes 0.000 description 11
- 108010009491 Lysosomal-Associated Membrane Protein 2 Proteins 0.000 description 11
- 125000004429 atom Chemical group 0.000 description 11
- 229960003677 chloroquine Drugs 0.000 description 11
- WHTVZRBIWZFKQO-UHFFFAOYSA-N chloroquine Natural products ClC1=CC=C2C(NC(C)CCCN(CC)CC)=CC=NC2=C1 WHTVZRBIWZFKQO-UHFFFAOYSA-N 0.000 description 11
- 239000002207 metabolite Substances 0.000 description 11
- 239000002245 particle Substances 0.000 description 11
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 10
- 206010069755 K-ras gene mutation Diseases 0.000 description 10
- 238000010560 atom transfer radical polymerization reaction Methods 0.000 description 10
- 230000015556 catabolic process Effects 0.000 description 10
- 229920000547 conjugated polymer Polymers 0.000 description 10
- 210000003734 kidney Anatomy 0.000 description 10
- 210000002966 serum Anatomy 0.000 description 10
- 239000011550 stock solution Substances 0.000 description 10
- 102000004190 Enzymes Human genes 0.000 description 9
- 108090000790 Enzymes Proteins 0.000 description 9
- 102100034068 Monocarboxylate transporter 1 Human genes 0.000 description 9
- BZKPWHYZMXOIDC-UHFFFAOYSA-N acetazolamide Chemical compound CC(=O)NC1=NN=C(S(N)(=O)=O)S1 BZKPWHYZMXOIDC-UHFFFAOYSA-N 0.000 description 9
- 229960000571 acetazolamide Drugs 0.000 description 9
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 9
- 210000004556 brain Anatomy 0.000 description 9
- 239000002131 composite material Substances 0.000 description 9
- 125000004093 cyano group Chemical group *C#N 0.000 description 9
- 238000011156 evaluation Methods 0.000 description 9
- 229910052760 oxygen Inorganic materials 0.000 description 9
- 239000001301 oxygen Substances 0.000 description 9
- 238000006116 polymerization reaction Methods 0.000 description 9
- 101000937642 Homo sapiens Malonyl-CoA-acyl carrier protein transacylase, mitochondrial Proteins 0.000 description 8
- 101000590830 Homo sapiens Monocarboxylate transporter 1 Proteins 0.000 description 8
- 101000837841 Homo sapiens Transcription factor EB Proteins 0.000 description 8
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 8
- 238000005481 NMR spectroscopy Methods 0.000 description 8
- 102100028502 Transcription factor EB Human genes 0.000 description 8
- 238000009825 accumulation Methods 0.000 description 8
- 125000003277 amino group Chemical group 0.000 description 8
- 239000008367 deionised water Substances 0.000 description 8
- 229910021641 deionized water Inorganic materials 0.000 description 8
- 230000005284 excitation Effects 0.000 description 8
- 125000005843 halogen group Chemical group 0.000 description 8
- 210000004185 liver Anatomy 0.000 description 8
- 238000004519 manufacturing process Methods 0.000 description 8
- 238000005259 measurement Methods 0.000 description 8
- 210000004940 nucleus Anatomy 0.000 description 8
- VLTRZXGMWDSKGL-UHFFFAOYSA-M perchlorate Chemical compound [O-]Cl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-M 0.000 description 8
- 230000002829 reductive effect Effects 0.000 description 8
- SUKJFIGYRHOWBL-UHFFFAOYSA-N sodium hypochlorite Chemical compound [Na+].Cl[O-] SUKJFIGYRHOWBL-UHFFFAOYSA-N 0.000 description 8
- 101000609947 Homo sapiens Rod cGMP-specific 3',5'-cyclic phosphodiesterase subunit alpha Proteins 0.000 description 7
- 102000003855 L-lactate dehydrogenase Human genes 0.000 description 7
- 108700023483 L-lactate dehydrogenases Proteins 0.000 description 7
- 102100039177 Rod cGMP-specific 3',5'-cyclic phosphodiesterase subunit alpha Human genes 0.000 description 7
- 238000011579 SCID mouse model Methods 0.000 description 7
- 102100026715 Serine/threonine-protein kinase STK11 Human genes 0.000 description 7
- 210000003486 adipose tissue brown Anatomy 0.000 description 7
- 125000003545 alkoxy group Chemical group 0.000 description 7
- 229940098773 bovine serum albumin Drugs 0.000 description 7
- 229910001914 chlorine tetroxide Inorganic materials 0.000 description 7
- 150000002148 esters Chemical class 0.000 description 7
- 239000012091 fetal bovine serum Substances 0.000 description 7
- 238000000799 fluorescence microscopy Methods 0.000 description 7
- 230000014509 gene expression Effects 0.000 description 7
- 239000003999 initiator Substances 0.000 description 7
- 230000003902 lesion Effects 0.000 description 7
- 210000003205 muscle Anatomy 0.000 description 7
- JTSLALYXYSRPGW-UHFFFAOYSA-N n-[5-(4-cyanophenyl)-1h-pyrrolo[2,3-b]pyridin-3-yl]pyridine-3-carboxamide Chemical compound C=1C=CN=CC=1C(=O)NC(C1=C2)=CNC1=NC=C2C1=CC=C(C#N)C=C1 JTSLALYXYSRPGW-UHFFFAOYSA-N 0.000 description 7
- 229920001977 poly(N,N-diethylacrylamides) Polymers 0.000 description 7
- 229920001223 polyethylene glycol Polymers 0.000 description 7
- 125000006413 ring segment Chemical group 0.000 description 7
- 102200006531 rs121913529 Human genes 0.000 description 7
- 239000011734 sodium Substances 0.000 description 7
- 238000003860 storage Methods 0.000 description 7
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 7
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 6
- PTLKXMHIRDLHIM-UHFFFAOYSA-N 4-(pyridin-2-yldisulfanyl)butanimidamide Chemical compound NC(=N)CCCSSC1=CC=CC=N1 PTLKXMHIRDLHIM-UHFFFAOYSA-N 0.000 description 6
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- 108091027967 Small hairpin RNA Proteins 0.000 description 6
- 238000003917 TEM image Methods 0.000 description 6
- 125000003710 aryl alkyl group Chemical group 0.000 description 6
- 238000010586 diagram Methods 0.000 description 6
- 229920001109 fluorescent polymer Polymers 0.000 description 6
- 210000002216 heart Anatomy 0.000 description 6
- 125000005842 heteroatom Chemical group 0.000 description 6
- 229920001600 hydrophobic polymer Polymers 0.000 description 6
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 6
- 238000011534 incubation Methods 0.000 description 6
- 230000006698 induction Effects 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 6
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 6
- 239000006174 pH buffer Substances 0.000 description 6
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 6
- 239000004055 small Interfering RNA Substances 0.000 description 6
- 150000003512 tertiary amines Chemical class 0.000 description 6
- 210000003462 vein Anatomy 0.000 description 6
- SYFGLWDDLZQFNI-UHFFFAOYSA-N 2-[4-(carboxymethyl)-1,4,8,11-tetrazabicyclo[6.6.2]hexadecan-11-yl]acetic acid Chemical compound C1CN(CC(O)=O)CCCN2CCN(CC(=O)O)CCCN1CC2 SYFGLWDDLZQFNI-UHFFFAOYSA-N 0.000 description 5
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 5
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 5
- 102000001301 EGF receptor Human genes 0.000 description 5
- 108060006698 EGF receptor Proteins 0.000 description 5
- CERQOIWHTDAKMF-UHFFFAOYSA-M Methacrylate Chemical compound CC(=C)C([O-])=O CERQOIWHTDAKMF-UHFFFAOYSA-M 0.000 description 5
- 206010061309 Neoplasm progression Diseases 0.000 description 5
- 229920002873 Polyethylenimine Polymers 0.000 description 5
- 125000001931 aliphatic group Chemical group 0.000 description 5
- 238000000540 analysis of variance Methods 0.000 description 5
- 230000008499 blood brain barrier function Effects 0.000 description 5
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 5
- 230000001276 controlling effect Effects 0.000 description 5
- 230000001086 cytosolic effect Effects 0.000 description 5
- 238000011161 development Methods 0.000 description 5
- 230000018109 developmental process Effects 0.000 description 5
- 235000003642 hunger Nutrition 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 230000007774 longterm Effects 0.000 description 5
- 229920002521 macromolecule Polymers 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 239000002609 medium Substances 0.000 description 5
- 238000002552 multiple reaction monitoring Methods 0.000 description 5
- UKODFQOELJFMII-UHFFFAOYSA-N pentamethyldiethylenetriamine Chemical compound CN(C)CCN(C)CCN(C)C UKODFQOELJFMII-UHFFFAOYSA-N 0.000 description 5
- 238000004445 quantitative analysis Methods 0.000 description 5
- 239000000700 radioactive tracer Substances 0.000 description 5
- 239000012217 radiopharmaceutical Substances 0.000 description 5
- 229940121896 radiopharmaceutical Drugs 0.000 description 5
- 230000002799 radiopharmaceutical effect Effects 0.000 description 5
- 229920005604 random copolymer Polymers 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- 210000000952 spleen Anatomy 0.000 description 5
- 230000037351 starvation Effects 0.000 description 5
- 238000003756 stirring Methods 0.000 description 5
- 239000000758 substrate Substances 0.000 description 5
- 235000000346 sugar Nutrition 0.000 description 5
- 230000005751 tumor progression Effects 0.000 description 5
- VRYALKFFQXWPIH-PBXRRBTRSA-N (3r,4s,5r)-3,4,5,6-tetrahydroxyhexanal Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)CC=O VRYALKFFQXWPIH-PBXRRBTRSA-N 0.000 description 4
- OBMRSUNAEQGDLK-UHFFFAOYSA-N 2-(dipropylamino)ethyl 2-methylprop-2-enoate Chemical compound CCCN(CCC)CCOC(=O)C(C)=C OBMRSUNAEQGDLK-UHFFFAOYSA-N 0.000 description 4
- 108010088751 Albumins Proteins 0.000 description 4
- 102000009027 Albumins Human genes 0.000 description 4
- 102000004225 Cathepsin B Human genes 0.000 description 4
- 108090000712 Cathepsin B Proteins 0.000 description 4
- 208000032612 Glial tumor Diseases 0.000 description 4
- 206010018338 Glioma Diseases 0.000 description 4
- 206010021143 Hypoxia Diseases 0.000 description 4
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 4
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 4
- 208000007660 Residual Neoplasm Diseases 0.000 description 4
- 238000000692 Student's t-test Methods 0.000 description 4
- 229930006000 Sucrose Natural products 0.000 description 4
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 4
- GYDJEQRTZSCIOI-UHFFFAOYSA-N Tranexamic acid Chemical compound NCC1CCC(C(O)=O)CC1 GYDJEQRTZSCIOI-UHFFFAOYSA-N 0.000 description 4
- 230000003321 amplification Effects 0.000 description 4
- 230000000259 anti-tumor effect Effects 0.000 description 4
- 239000007864 aqueous solution Substances 0.000 description 4
- 230000006399 behavior Effects 0.000 description 4
- 230000002146 bilateral effect Effects 0.000 description 4
- 150000001721 carbon Chemical group 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 230000002860 competitive effect Effects 0.000 description 4
- 230000002596 correlated effect Effects 0.000 description 4
- DDRJAANPRJIHGJ-UHFFFAOYSA-N creatinine Chemical compound CN1CC(=O)NC1=N DDRJAANPRJIHGJ-UHFFFAOYSA-N 0.000 description 4
- 238000002073 fluorescence micrograph Methods 0.000 description 4
- 238000005227 gel permeation chromatography Methods 0.000 description 4
- 230000012010 growth Effects 0.000 description 4
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 4
- 230000004807 localization Effects 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 230000002503 metabolic effect Effects 0.000 description 4
- 230000007935 neutral effect Effects 0.000 description 4
- 238000003199 nucleic acid amplification method Methods 0.000 description 4
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 4
- 238000011084 recovery Methods 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- 238000011160 research Methods 0.000 description 4
- 238000000926 separation method Methods 0.000 description 4
- 238000010186 staining Methods 0.000 description 4
- 239000005720 sucrose Substances 0.000 description 4
- 229910052717 sulfur Inorganic materials 0.000 description 4
- 238000012353 t test Methods 0.000 description 4
- ANRHNWWPFJCPAZ-UHFFFAOYSA-M thionine Chemical compound [Cl-].C1=CC(N)=CC2=[S+]C3=CC(N)=CC=C3N=C21 ANRHNWWPFJCPAZ-UHFFFAOYSA-M 0.000 description 4
- 238000004448 titration Methods 0.000 description 4
- 238000000108 ultra-filtration Methods 0.000 description 4
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 3
- 108010013238 70-kDa Ribosomal Protein S6 Kinases Proteins 0.000 description 3
- 102100036475 Alanine aminotransferase 1 Human genes 0.000 description 3
- 108010082126 Alanine transaminase Proteins 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- 208000003174 Brain Neoplasms Diseases 0.000 description 3
- 102000000844 Cell Surface Receptors Human genes 0.000 description 3
- 108010001857 Cell Surface Receptors Proteins 0.000 description 3
- 102100025064 Cellular tumor antigen p53 Human genes 0.000 description 3
- 102000005853 Clathrin Human genes 0.000 description 3
- 108010019874 Clathrin Proteins 0.000 description 3
- 229910021589 Copper(I) bromide Inorganic materials 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 239000012594 Earle’s Balanced Salt Solution Substances 0.000 description 3
- 102000004157 Hydrolases Human genes 0.000 description 3
- 108090000604 Hydrolases Proteins 0.000 description 3
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 3
- IQPSEEYGBUAQFF-UHFFFAOYSA-N Pantoprazole Chemical compound COC1=CC=NC(CS(=O)C=2NC3=CC=C(OC(F)F)C=C3N=2)=C1OC IQPSEEYGBUAQFF-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 3
- 241000953555 Theama Species 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 230000005856 abnormality Effects 0.000 description 3
- 125000003342 alkenyl group Chemical group 0.000 description 3
- 125000003282 alkyl amino group Chemical group 0.000 description 3
- 125000001118 alkylidene group Chemical group 0.000 description 3
- 229920000469 amphiphilic block copolymer Polymers 0.000 description 3
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 3
- 230000008436 biogenesis Effects 0.000 description 3
- 210000001218 blood-brain barrier Anatomy 0.000 description 3
- 230000037396 body weight Effects 0.000 description 3
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 3
- 239000003054 catalyst Substances 0.000 description 3
- 230000019522 cellular metabolic process Effects 0.000 description 3
- 230000033077 cellular process Effects 0.000 description 3
- 229930193282 clathrin Natural products 0.000 description 3
- 210000001072 colon Anatomy 0.000 description 3
- 238000004624 confocal microscopy Methods 0.000 description 3
- 210000000172 cytosol Anatomy 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 230000000593 degrading effect Effects 0.000 description 3
- 230000003111 delayed effect Effects 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 239000012153 distilled water Substances 0.000 description 3
- 231100000673 dose–response relationship Toxicity 0.000 description 3
- 239000003480 eluent Substances 0.000 description 3
- 208000002854 epidermolysis bullosa simplex superficialis Diseases 0.000 description 3
- 210000002919 epithelial cell Anatomy 0.000 description 3
- SUPCQIBBMFXVTL-UHFFFAOYSA-N ethyl 2-methylprop-2-enoate Chemical compound CCOC(=O)C(C)=C SUPCQIBBMFXVTL-UHFFFAOYSA-N 0.000 description 3
- 238000000684 flow cytometry Methods 0.000 description 3
- 235000019253 formic acid Nutrition 0.000 description 3
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 3
- 229920001519 homopolymer Polymers 0.000 description 3
- 230000007954 hypoxia Effects 0.000 description 3
- 238000011503 in vivo imaging Methods 0.000 description 3
- 238000002372 labelling Methods 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 125000005647 linker group Chemical group 0.000 description 3
- 210000004072 lung Anatomy 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- CWKLZLBVOJRSOM-UHFFFAOYSA-N methyl pyruvate Chemical compound COC(=O)C(C)=O CWKLZLBVOJRSOM-UHFFFAOYSA-N 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 210000004237 neck muscle Anatomy 0.000 description 3
- 239000013642 negative control Substances 0.000 description 3
- 125000004433 nitrogen atom Chemical group N* 0.000 description 3
- 238000005457 optimization Methods 0.000 description 3
- 238000004806 packaging method and process Methods 0.000 description 3
- 230000000242 pagocytic effect Effects 0.000 description 3
- 229960005019 pantoprazole Drugs 0.000 description 3
- 230000026731 phosphorylation Effects 0.000 description 3
- 238000006366 phosphorylation reaction Methods 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 102000004196 processed proteins & peptides Human genes 0.000 description 3
- 230000005588 protonation Effects 0.000 description 3
- 230000002685 pulmonary effect Effects 0.000 description 3
- 238000005086 pumping Methods 0.000 description 3
- 238000002390 rotary evaporation Methods 0.000 description 3
- 229920006395 saturated elastomer Polymers 0.000 description 3
- 230000028327 secretion Effects 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000000527 sonication Methods 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 239000011593 sulfur Substances 0.000 description 3
- 230000009747 swallowing Effects 0.000 description 3
- 238000000954 titration curve Methods 0.000 description 3
- 231100000588 tumorigenic Toxicity 0.000 description 3
- 230000000381 tumorigenic effect Effects 0.000 description 3
- 238000002604 ultrasonography Methods 0.000 description 3
- 230000000007 visual effect Effects 0.000 description 3
- 238000012800 visualization Methods 0.000 description 3
- 230000004580 weight loss Effects 0.000 description 3
- CDUQMGQIHYISOP-RMKNXTFCSA-N (e)-2-cyano-3-phenylprop-2-enoic acid Chemical compound OC(=O)C(\C#N)=C\C1=CC=CC=C1 CDUQMGQIHYISOP-RMKNXTFCSA-N 0.000 description 2
- CYNYIHKIEHGYOZ-UHFFFAOYSA-N 1-bromopropane Chemical compound CCCBr CYNYIHKIEHGYOZ-UHFFFAOYSA-N 0.000 description 2
- SWKPGMVENNYLFK-UHFFFAOYSA-N 2-(dipropylamino)ethanol Chemical compound CCCN(CCC)CCO SWKPGMVENNYLFK-UHFFFAOYSA-N 0.000 description 2
- INZOTETZQBPBCE-NYLDSJSYSA-N 3-sialyl lewis Chemical compound O[C@H]1[C@H](O)[C@H](O)[C@H](C)O[C@H]1O[C@H]([C@H](O)CO)[C@@H]([C@@H](NC(C)=O)C=O)O[C@H]1[C@H](O)[C@@H](O[C@]2(O[C@H]([C@H](NC(C)=O)[C@@H](O)C2)[C@H](O)[C@H](O)CO)C(O)=O)[C@@H](O)[C@@H](CO)O1 INZOTETZQBPBCE-NYLDSJSYSA-N 0.000 description 2
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 2
- 229910018072 Al 2 O 3 Inorganic materials 0.000 description 2
- 238000009020 BCA Protein Assay Kit Methods 0.000 description 2
- 206010010356 Congenital anomaly Diseases 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 102000013446 GTP Phosphohydrolases Human genes 0.000 description 2
- 101710113436 GTPase KRas Proteins 0.000 description 2
- 108091006109 GTPases Proteins 0.000 description 2
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 description 2
- 101001091538 Homo sapiens Pyruvate kinase PKM Proteins 0.000 description 2
- QIGBRXMKCJKVMJ-UHFFFAOYSA-N Hydroquinone Chemical compound OC1=CC=C(O)C=C1 QIGBRXMKCJKVMJ-UHFFFAOYSA-N 0.000 description 2
- 102000014944 Lysosome-Associated Membrane Glycoproteins Human genes 0.000 description 2
- 108010064171 Lysosome-Associated Membrane Glycoproteins Proteins 0.000 description 2
- 239000007987 MES buffer Substances 0.000 description 2
- 241000204031 Mycoplasma Species 0.000 description 2
- 238000011789 NOD SCID mouse Methods 0.000 description 2
- SUHOOTKUPISOBE-UHFFFAOYSA-N O-phosphoethanolamine Chemical compound NCCOP(O)(O)=O SUHOOTKUPISOBE-UHFFFAOYSA-N 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 108010076504 Protein Sorting Signals Proteins 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- 102100034911 Pyruvate kinase PKM Human genes 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- 208000015634 Rectal Neoplasms Diseases 0.000 description 2
- 108091006647 SLC9A1 Proteins 0.000 description 2
- 206010070834 Sensitisation Diseases 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- 102100030980 Sodium/hydrogen exchanger 1 Human genes 0.000 description 2
- 108010078814 Tumor Suppressor Protein p53 Proteins 0.000 description 2
- 238000002679 ablation Methods 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 230000007950 acidosis Effects 0.000 description 2
- 208000026545 acidosis disease Diseases 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 125000002015 acyclic group Chemical group 0.000 description 2
- 230000002776 aggregation Effects 0.000 description 2
- 238000004220 aggregation Methods 0.000 description 2
- 238000013019 agitation Methods 0.000 description 2
- 150000007824 aliphatic compounds Chemical class 0.000 description 2
- 125000003368 amide group Chemical group 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 239000000427 antigen Substances 0.000 description 2
- 108091007433 antigens Proteins 0.000 description 2
- 102000036639 antigens Human genes 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 230000003115 biocidal effect Effects 0.000 description 2
- 230000008033 biological extinction Effects 0.000 description 2
- 239000000090 biomarker Substances 0.000 description 2
- 230000017531 blood circulation Effects 0.000 description 2
- 210000000988 bone and bone Anatomy 0.000 description 2
- 238000009395 breeding Methods 0.000 description 2
- 230000001488 breeding effect Effects 0.000 description 2
- 210000000424 bronchial epithelial cell Anatomy 0.000 description 2
- 238000004422 calculation algorithm Methods 0.000 description 2
- CREMABGTGYGIQB-UHFFFAOYSA-N carbon carbon Chemical compound C.C CREMABGTGYGIQB-UHFFFAOYSA-N 0.000 description 2
- IWXNYAIICFKCTM-UHFFFAOYSA-N cariporide Chemical compound CC(C)C1=CC=C(C(=O)N=C(N)N)C=C1S(C)(=O)=O IWXNYAIICFKCTM-UHFFFAOYSA-N 0.000 description 2
- 229950008393 cariporide Drugs 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000004700 cellular uptake Effects 0.000 description 2
- 230000008045 co-localization Effects 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 238000011109 contamination Methods 0.000 description 2
- 238000007334 copolymerization reaction Methods 0.000 description 2
- 229940109239 creatinine Drugs 0.000 description 2
- 125000000000 cycloalkoxy group Chemical group 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 125000004663 dialkyl amino group Chemical group 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 238000009510 drug design Methods 0.000 description 2
- 230000001516 effect on protein Effects 0.000 description 2
- 238000000132 electrospray ionisation Methods 0.000 description 2
- 238000005421 electrostatic potential Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 229940082789 erbitux Drugs 0.000 description 2
- 239000003797 essential amino acid Substances 0.000 description 2
- 235000020776 essential amino acid Nutrition 0.000 description 2
- 230000001747 exhibiting effect Effects 0.000 description 2
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 2
- 125000003709 fluoroalkyl group Chemical group 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 210000001035 gastrointestinal tract Anatomy 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 230000004190 glucose uptake Effects 0.000 description 2
- 125000001188 haloalkyl group Chemical group 0.000 description 2
- 150000002390 heteroarenes Chemical class 0.000 description 2
- 230000036571 hydration Effects 0.000 description 2
- 238000006703 hydration reaction Methods 0.000 description 2
- JYGXADMDTFJGBT-VWUMJDOOSA-N hydrocortisone Chemical compound O=C1CC[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 JYGXADMDTFJGBT-VWUMJDOOSA-N 0.000 description 2
- 229920001477 hydrophilic polymer Polymers 0.000 description 2
- 238000005286 illumination Methods 0.000 description 2
- 238000010191 image analysis Methods 0.000 description 2
- 125000002883 imidazolyl group Chemical group 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 230000036039 immunity Effects 0.000 description 2
- 238000003119 immunoblot Methods 0.000 description 2
- 238000010166 immunofluorescence Methods 0.000 description 2
- 230000001771 impaired effect Effects 0.000 description 2
- 238000011065 in-situ storage Methods 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 229920000831 ionic polymer Polymers 0.000 description 2
- JMMWKPVZQRWMSS-UHFFFAOYSA-N isopropanol acetate Natural products CC(C)OC(C)=O JMMWKPVZQRWMSS-UHFFFAOYSA-N 0.000 description 2
- 239000004310 lactic acid Substances 0.000 description 2
- 235000014655 lactic acid Nutrition 0.000 description 2
- 238000002357 laparoscopic surgery Methods 0.000 description 2
- 238000002350 laparotomy Methods 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 210000000653 nervous system Anatomy 0.000 description 2
- 239000012299 nitrogen atmosphere Substances 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 230000010627 oxidative phosphorylation Effects 0.000 description 2
- 238000001139 pH measurement Methods 0.000 description 2
- 210000001539 phagocyte Anatomy 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- IYDGMDWEHDFVQI-UHFFFAOYSA-N phosphoric acid;trioxotungsten Chemical compound O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.O=[W](=O)=O.OP(O)(O)=O IYDGMDWEHDFVQI-UHFFFAOYSA-N 0.000 description 2
- 231100000572 poisoning Toxicity 0.000 description 2
- 230000000607 poisoning effect Effects 0.000 description 2
- 229960003712 propranolol Drugs 0.000 description 2
- BBEAQIROQSPTKN-UHFFFAOYSA-N pyrene Chemical compound C1=CC=C2C=CC3=CC=CC4=CC=C1C2=C43 BBEAQIROQSPTKN-UHFFFAOYSA-N 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- 206010038038 rectal cancer Diseases 0.000 description 2
- 201000001275 rectum cancer Diseases 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 230000029219 regulation of pH Effects 0.000 description 2
- 238000007634 remodeling Methods 0.000 description 2
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- DAEPDZWVDSPTHF-UHFFFAOYSA-M sodium pyruvate Chemical compound [Na+].CC(=O)C([O-])=O DAEPDZWVDSPTHF-UHFFFAOYSA-M 0.000 description 2
- 238000000935 solvent evaporation Methods 0.000 description 2
- 230000010473 stable expression Effects 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 238000003419 tautomerization reaction Methods 0.000 description 2
- 230000001052 transient effect Effects 0.000 description 2
- 230000014616 translation Effects 0.000 description 2
- 230000032258 transport Effects 0.000 description 2
- 230000004614 tumor growth Effects 0.000 description 2
- 238000011179 visual inspection Methods 0.000 description 2
- 239000012130 whole-cell lysate Substances 0.000 description 2
- WVWOOAYQYLJEFD-UHFFFAOYSA-N 1-(2-nitroimidazol-1-yl)-3-piperidin-1-ylpropan-2-ol Chemical compound C1=CN=C([N+]([O-])=O)N1CC(O)CN1CCCCC1 WVWOOAYQYLJEFD-UHFFFAOYSA-N 0.000 description 1
- MPPPKRYCTPRNTB-UHFFFAOYSA-N 1-bromobutane Chemical compound CCCCBr MPPPKRYCTPRNTB-UHFFFAOYSA-N 0.000 description 1
- YZWKKMVJZFACSU-UHFFFAOYSA-N 1-bromopentane Chemical compound CCCCCBr YZWKKMVJZFACSU-UHFFFAOYSA-N 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 1
- UATUCIKYJLUTBD-UHFFFAOYSA-N 2-(dibutylamino)ethyl 2-methylprop-2-enoate Chemical compound CCCCN(CCCC)CCOC(=O)C(C)=C UATUCIKYJLUTBD-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- SVYHMICYJHWXIN-UHFFFAOYSA-N 2-[di(propan-2-yl)amino]ethyl 2-methylprop-2-enoate Chemical compound CC(C)N(C(C)C)CCOC(=O)C(C)=C SVYHMICYJHWXIN-UHFFFAOYSA-N 0.000 description 1
- SCVJRXQHFJXZFZ-KVQBGUIXSA-N 2-amino-9-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-3h-purine-6-thione Chemical compound C1=2NC(N)=NC(=S)C=2N=CN1[C@H]1C[C@H](O)[C@@H](CO)O1 SCVJRXQHFJXZFZ-KVQBGUIXSA-N 0.000 description 1
- GHCZTIFQWKKGSB-UHFFFAOYSA-N 2-hydroxypropane-1,2,3-tricarboxylic acid;phosphoric acid Chemical compound OP(O)(O)=O.OC(=O)CC(O)(C(O)=O)CC(O)=O GHCZTIFQWKKGSB-UHFFFAOYSA-N 0.000 description 1
- SSONCJTVDRSLNK-UHFFFAOYSA-N 2-methylprop-2-enoic acid;hydrochloride Chemical compound Cl.CC(=C)C(O)=O SSONCJTVDRSLNK-UHFFFAOYSA-N 0.000 description 1
- KPGXRSRHYNQIFN-UHFFFAOYSA-L 2-oxoglutarate(2-) Chemical compound [O-]C(=O)CCC(=O)C([O-])=O KPGXRSRHYNQIFN-UHFFFAOYSA-L 0.000 description 1
- ZNYVGVMHKCUCAT-UHFFFAOYSA-N 3-[[4,7-bis[[hydroxy(hydroxymethyl)phosphoryl]methyl]-1,4,7-triazonan-1-yl]methyl-hydroxyphosphoryl]propanoic acid Chemical compound OCP(O)(=O)CN1CCN(CP(O)(=O)CO)CCN(CP(O)(=O)CCC(O)=O)CC1 ZNYVGVMHKCUCAT-UHFFFAOYSA-N 0.000 description 1
- 102100036009 5'-AMP-activated protein kinase catalytic subunit alpha-2 Human genes 0.000 description 1
- UNGMOMJDNDFGJG-UHFFFAOYSA-N 5-carboxy-X-rhodamine Chemical compound [O-]C(=O)C1=CC(C(=O)O)=CC=C1C1=C(C=C2C3=C4CCCN3CCC2)C4=[O+]C2=C1C=C1CCCN3CCCC2=C13 UNGMOMJDNDFGJG-UHFFFAOYSA-N 0.000 description 1
- WIYVVIUBKNTNKG-UHFFFAOYSA-N 6,7-dimethoxy-3,4-dihydronaphthalene-2-carboxylic acid Chemical compound C1CC(C(O)=O)=CC2=C1C=C(OC)C(OC)=C2 WIYVVIUBKNTNKG-UHFFFAOYSA-N 0.000 description 1
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 1
- 230000002407 ATP formation Effects 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 1
- 201000004384 Alopecia Diseases 0.000 description 1
- 108091023037 Aptamer Proteins 0.000 description 1
- 241001120493 Arene Species 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- 241000238097 Callinectes sapidus Species 0.000 description 1
- 102000047934 Caspase-3/7 Human genes 0.000 description 1
- 108700037887 Caspase-3/7 Proteins 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 101710164760 Chlorotoxin Proteins 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 206010010144 Completed suicide Diseases 0.000 description 1
- 229910021591 Copper(I) chloride Inorganic materials 0.000 description 1
- TXIXSLPEABAEHP-UHFFFAOYSA-N Dimethyl 2-oxoglutarate Chemical compound COC(=O)CCC(=O)C(=O)OC TXIXSLPEABAEHP-UHFFFAOYSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 101150029707 ERBB2 gene Proteins 0.000 description 1
- 102000009024 Epidermal Growth Factor Human genes 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- BPNZYADGDZPRTK-UDUYQYQQSA-N Exametazime Chemical compound O/N=C(\C)[C@@H](C)NCC(C)(C)CN[C@H](C)C(\C)=N\O BPNZYADGDZPRTK-UDUYQYQQSA-N 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 206010016717 Fistula Diseases 0.000 description 1
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 102000010451 Folate receptor alpha Human genes 0.000 description 1
- 108050001931 Folate receptor alpha Proteins 0.000 description 1
- MPJKWIXIYCLVCU-UHFFFAOYSA-N Folinic acid Natural products NC1=NC2=C(N(C=O)C(CNc3ccc(cc3)C(=O)NC(CCC(=O)O)CC(=O)O)CN2)C(=O)N1 MPJKWIXIYCLVCU-UHFFFAOYSA-N 0.000 description 1
- 206010018341 Gliosis Diseases 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 101000783681 Homo sapiens 5'-AMP-activated protein kinase catalytic subunit alpha-2 Proteins 0.000 description 1
- 101000577126 Homo sapiens Monocarboxylate transporter 4 Proteins 0.000 description 1
- 101000577129 Homo sapiens Monocarboxylate transporter 5 Proteins 0.000 description 1
- 206010053317 Hydrophobia Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical group C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102100023915 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 108010065805 Interleukin-12 Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- 206010023379 Ketoacidosis Diseases 0.000 description 1
- 208000007976 Ketosis Diseases 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 241001424413 Lucia Species 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 208000015439 Lysosomal storage disease Diseases 0.000 description 1
- 208000035346 Margins of Excision Diseases 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 206010027417 Metabolic acidosis Diseases 0.000 description 1
- 229930191564 Monensin Natural products 0.000 description 1
- GAOZTHIDHYLHMS-UHFFFAOYSA-N Monensin A Natural products O1C(CC)(C2C(CC(O2)C2C(CC(C)C(O)(CO)O2)C)C)CCC1C(O1)(C)CCC21CC(O)C(C)C(C(C)C(OC)C(C)C(O)=O)O2 GAOZTHIDHYLHMS-UHFFFAOYSA-N 0.000 description 1
- 108700038057 Monocarboxylate transporter 1 Proteins 0.000 description 1
- 102100025276 Monocarboxylate transporter 4 Human genes 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- JCXJVPUVTGWSNB-UHFFFAOYSA-N Nitrogen dioxide Chemical compound O=[N]=O JCXJVPUVTGWSNB-UHFFFAOYSA-N 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- 229920001244 Poly(D,L-lactide) Polymers 0.000 description 1
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Natural products C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 1
- 101150030875 RAB7A gene Proteins 0.000 description 1
- 206010037742 Rabies Diseases 0.000 description 1
- 206010067362 Radiation necrosis Diseases 0.000 description 1
- 238000001069 Raman spectroscopy Methods 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 208000003826 Respiratory Acidosis Diseases 0.000 description 1
- 102000002278 Ribosomal Proteins Human genes 0.000 description 1
- 108010000605 Ribosomal Proteins Proteins 0.000 description 1
- 101100490193 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) ACL4 gene Proteins 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- 101000662518 Solanum tuberosum Sucrose synthase Proteins 0.000 description 1
- 206010067130 Spastic diplegia Diseases 0.000 description 1
- AUYYCJSJGJYCDS-LBPRGKRZSA-N Thyrolar Chemical compound IC1=CC(C[C@H](N)C(O)=O)=CC(I)=C1OC1=CC=C(O)C(I)=C1 AUYYCJSJGJYCDS-LBPRGKRZSA-N 0.000 description 1
- 108090000340 Transaminases Proteins 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 102000004338 Transferrin Human genes 0.000 description 1
- 108090000901 Transferrin Proteins 0.000 description 1
- 102000044209 Tumor Suppressor Genes Human genes 0.000 description 1
- 108700025716 Tumor Suppressor Genes Proteins 0.000 description 1
- 206010064390 Tumour invasion Diseases 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 1
- 230000006682 Warburg effect Effects 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- PNNCWTXUWKENPE-UHFFFAOYSA-N [N].NC(N)=O Chemical compound [N].NC(N)=O PNNCWTXUWKENPE-UHFFFAOYSA-N 0.000 description 1
- 210000001015 abdomen Anatomy 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- HSANJBZMPJBTRT-UHFFFAOYSA-N acetic acid;1,4,7,10-tetrazacyclododecane Chemical compound CC(O)=O.CC(O)=O.CC(O)=O.CC(O)=O.C1CNCCNCCNCCN1 HSANJBZMPJBTRT-UHFFFAOYSA-N 0.000 description 1
- CYJYKTMBMMYRHR-UHFFFAOYSA-N acetic acid;1,4,7-triazonane Chemical compound CC(O)=O.CC(O)=O.CC(O)=O.C1CNCCNCCN1 CYJYKTMBMMYRHR-UHFFFAOYSA-N 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 125000004442 acylamino group Chemical group 0.000 description 1
- 125000005035 acylthio group Chemical group 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 125000002723 alicyclic group Chemical group 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 125000006323 alkenyl amino group Chemical group 0.000 description 1
- 125000003302 alkenyloxy group Chemical group 0.000 description 1
- 150000001345 alkine derivatives Chemical class 0.000 description 1
- 125000000033 alkoxyamino group Chemical group 0.000 description 1
- 125000005277 alkyl imino group Chemical group 0.000 description 1
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 1
- 125000004656 alkyl sulfonylamino group Chemical group 0.000 description 1
- 125000004414 alkyl thio group Chemical group 0.000 description 1
- 125000006319 alkynyl amino group Chemical group 0.000 description 1
- 125000000304 alkynyl group Chemical group 0.000 description 1
- 125000005133 alkynyloxy group Chemical group 0.000 description 1
- 231100000360 alopecia Toxicity 0.000 description 1
- 230000001195 anabolic effect Effects 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 238000000149 argon plasma sintering Methods 0.000 description 1
- 125000001691 aryl alkyl amino group Chemical group 0.000 description 1
- 125000001769 aryl amino group Chemical group 0.000 description 1
- 125000004421 aryl sulphonamide group Chemical group 0.000 description 1
- 125000004104 aryloxy group Chemical group 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 239000003855 balanced salt solution Substances 0.000 description 1
- 238000007681 bariatric surgery Methods 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 102000012740 beta Adrenergic Receptors Human genes 0.000 description 1
- 108010079452 beta Adrenergic Receptors Proteins 0.000 description 1
- 230000002715 bioenergetic effect Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 230000007177 brain activity Effects 0.000 description 1
- 210000004958 brain cell Anatomy 0.000 description 1
- 210000005013 brain tissue Anatomy 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 239000008366 buffered solution Substances 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 230000009400 cancer invasion Effects 0.000 description 1
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 230000005754 cellular signaling Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000000919 ceramic Substances 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 206010008129 cerebral palsy Diseases 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 239000013522 chelant Substances 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- QPAKKWCQMHUHNI-GQIQPHNSSA-N chlorotoxin Chemical compound C([C@H]1C(=O)NCC(=O)N2CCC[C@H]2C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H]2CSSC[C@H]3C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H]4CSSC[C@@H](C(N[C@@H](CCSC)C(=O)N5CCC[C@H]5C(=O)N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](CCCCN)NC(=O)CNC(=O)[C@H](CCCNC(N)=N)NC(=O)CNC(=O)[C@H](CCCCN)NC(=O)CNC(=O)CNC(=O)[C@H](CSSC[C@H](NC(=O)[C@H](CC(C)C)NC2=O)C(=O)N[C@@H](CCCNC(N)=N)C(N)=O)NC4=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N3)=O)NC(=O)[C@@H](N)CCSC)C1=CC=C(O)C=C1 QPAKKWCQMHUHNI-GQIQPHNSSA-N 0.000 description 1
- 229960005534 chlorotoxin Drugs 0.000 description 1
- 238000002052 colonoscopy Methods 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 230000024203 complement activation Effects 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 238000010226 confocal imaging Methods 0.000 description 1
- 238000001218 confocal laser scanning microscopy Methods 0.000 description 1
- 230000001268 conjugating effect Effects 0.000 description 1
- OXBLHERUFWYNTN-UHFFFAOYSA-M copper(I) chloride Chemical compound [Cu]Cl OXBLHERUFWYNTN-UHFFFAOYSA-M 0.000 description 1
- 239000011258 core-shell material Substances 0.000 description 1
- 208000029078 coronary artery disease Diseases 0.000 description 1
- 230000001054 cortical effect Effects 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- 239000006059 cover glass Substances 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- 150000001924 cycloalkanes Chemical class 0.000 description 1
- 125000000392 cycloalkenyl group Chemical group 0.000 description 1
- 125000004465 cycloalkenyloxy group Chemical group 0.000 description 1
- 125000006310 cycloalkyl amino group Chemical group 0.000 description 1
- 125000005356 cycloalkylalkenyl group Chemical group 0.000 description 1
- 125000005366 cycloalkylthio group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 238000007405 data analysis Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- BVTBRVFYZUCAKH-UHFFFAOYSA-L disodium selenite Chemical compound [Na+].[Na+].[O-][Se]([O-])=O BVTBRVFYZUCAKH-UHFFFAOYSA-L 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 238000001493 electron microscopy Methods 0.000 description 1
- 150000002081 enamines Chemical class 0.000 description 1
- 238000005538 encapsulation Methods 0.000 description 1
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 210000001723 extracellular space Anatomy 0.000 description 1
- 210000002468 fat body Anatomy 0.000 description 1
- 235000013861 fat-free Nutrition 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 230000003890 fistula Effects 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- GVEPBJHOBDJJJI-UHFFFAOYSA-N fluoranthrene Natural products C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=C1 GVEPBJHOBDJJJI-UHFFFAOYSA-N 0.000 description 1
- 238000001917 fluorescence detection Methods 0.000 description 1
- 238000012632 fluorescent imaging Methods 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 229920002313 fluoropolymer Polymers 0.000 description 1
- 239000004811 fluoropolymer Substances 0.000 description 1
- 229940014144 folate Drugs 0.000 description 1
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 1
- 235000019152 folic acid Nutrition 0.000 description 1
- 239000011724 folic acid Substances 0.000 description 1
- VVIAGPKUTFNRDU-ABLWVSNPSA-N folinic acid Chemical compound C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-ABLWVSNPSA-N 0.000 description 1
- 235000008191 folinic acid Nutrition 0.000 description 1
- 239000011672 folinic acid Substances 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 230000009760 functional impairment Effects 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 108091006104 gene-regulatory proteins Proteins 0.000 description 1
- 102000034356 gene-regulatory proteins Human genes 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 208000005017 glioblastoma Diseases 0.000 description 1
- 230000007387 gliosis Effects 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 230000002414 glycolytic effect Effects 0.000 description 1
- 230000001279 glycosylating effect Effects 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 201000003911 head and neck carcinoma Diseases 0.000 description 1
- 230000035876 healing Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000003862 health status Effects 0.000 description 1
- 125000005241 heteroarylamino group Chemical group 0.000 description 1
- 125000005553 heteroaryloxy group Chemical group 0.000 description 1
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000002962 histologic effect Effects 0.000 description 1
- 230000013632 homeostatic process Effects 0.000 description 1
- 229960000890 hydrocortisone Drugs 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 230000003301 hydrolyzing effect Effects 0.000 description 1
- 230000001146 hypoxic effect Effects 0.000 description 1
- 150000002466 imines Chemical class 0.000 description 1
- 238000010185 immunofluorescence analysis Methods 0.000 description 1
- 230000002055 immunohistochemical effect Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- 230000010189 intracellular transport Effects 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- CANPFCFJURGKAX-JTQLQIEISA-N iolopride Chemical compound CCN1CCC[C@H]1CNC(=O)C1=C(O)C(I)=CC=C1OC CANPFCFJURGKAX-JTQLQIEISA-N 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000000644 isotonic solution Substances 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 230000003907 kidney function Effects 0.000 description 1
- 229960001691 leucovorin Drugs 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 1
- 230000003908 liver function Effects 0.000 description 1
- 208000037841 lung tumor Diseases 0.000 description 1
- 230000001926 lymphatic effect Effects 0.000 description 1
- 230000002535 lyotropic effect Effects 0.000 description 1
- 230000007309 lysosomal acidification Effects 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 230000036244 malformation Effects 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 230000037353 metabolic pathway Effects 0.000 description 1
- 238000007884 metabolite profiling Methods 0.000 description 1
- 238000002705 metabolomic analysis Methods 0.000 description 1
- 230000001431 metabolomic effect Effects 0.000 description 1
- 150000002734 metacrylic acid derivatives Chemical class 0.000 description 1
- VHRYZQNGTZXDNX-UHFFFAOYSA-N methacryloyl chloride Chemical compound CC(=C)C(Cl)=O VHRYZQNGTZXDNX-UHFFFAOYSA-N 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 210000003470 mitochondria Anatomy 0.000 description 1
- 230000002438 mitochondrial effect Effects 0.000 description 1
- 230000006705 mitochondrial oxidative phosphorylation Effects 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000003990 molecular pathway Effects 0.000 description 1
- 229960005358 monensin Drugs 0.000 description 1
- GAOZTHIDHYLHMS-KEOBGNEYSA-N monensin A Chemical compound C([C@@](O1)(C)[C@H]2CC[C@@](O2)(CC)[C@H]2[C@H](C[C@@H](O2)[C@@H]2[C@H](C[C@@H](C)[C@](O)(CO)O2)C)C)C[C@@]21C[C@H](O)[C@@H](C)[C@@H]([C@@H](C)[C@@H](OC)[C@H](C)C(O)=O)O2 GAOZTHIDHYLHMS-KEOBGNEYSA-N 0.000 description 1
- 229940126127 monocarboxylate transporter inhibitor Drugs 0.000 description 1
- 238000000491 multivariate analysis Methods 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 238000002610 neuroimaging Methods 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 235000021095 non-nutrients Nutrition 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 235000021232 nutrient availability Nutrition 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 230000000771 oncological effect Effects 0.000 description 1
- 230000000174 oncolytic effect Effects 0.000 description 1
- 102000027450 oncoproteins Human genes 0.000 description 1
- 108091008819 oncoproteins Proteins 0.000 description 1
- 238000010397 one-hybrid screening Methods 0.000 description 1
- 230000002611 ovarian Effects 0.000 description 1
- KHPXUQMNIQBQEV-UHFFFAOYSA-N oxaloacetic acid Chemical compound OC(=O)CC(=O)C(O)=O KHPXUQMNIQBQEV-UHFFFAOYSA-N 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 210000002741 palatine tonsil Anatomy 0.000 description 1
- 239000000123 paper Substances 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 210000002824 peroxisome Anatomy 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 230000002399 phagocytotic effect Effects 0.000 description 1
- 238000009520 phase I clinical trial Methods 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 230000010399 physical interaction Effects 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 229950010456 pimonidazole Drugs 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229920002939 poly(N,N-dimethylacrylamides) Polymers 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 229920001481 poly(stearyl methacrylate) Polymers 0.000 description 1
- 229920001513 poly[2-(diethylamino)ethyl methacrylate] polymer Polymers 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 238000002600 positron emission tomography Methods 0.000 description 1
- 238000007781 pre-processing Methods 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 238000002203 pretreatment Methods 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000006308 propyl amino group Chemical group 0.000 description 1
- 230000004845 protein aggregation Effects 0.000 description 1
- 210000004777 protein coat Anatomy 0.000 description 1
- 230000007925 protein solubilization Effects 0.000 description 1
- 238000001799 protein solubilization Methods 0.000 description 1
- 238000001243 protein synthesis Methods 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 229940126409 proton pump inhibitor Drugs 0.000 description 1
- 239000000612 proton pump inhibitor Substances 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 238000006862 quantum yield reaction Methods 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 238000010526 radical polymerization reaction Methods 0.000 description 1
- 239000012857 radioactive material Substances 0.000 description 1
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 1
- 239000000985 reactive dye Substances 0.000 description 1
- 229920013730 reactive polymer Polymers 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 230000020988 regulation of intracellular pH Effects 0.000 description 1
- 230000008844 regulatory mechanism Effects 0.000 description 1
- 230000027756 respiratory electron transport chain Effects 0.000 description 1
- 230000029054 response to nutrient Effects 0.000 description 1
- 230000035440 response to pH Effects 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 239000001022 rhodamine dye Substances 0.000 description 1
- 238000002432 robotic surgery Methods 0.000 description 1
- 210000003079 salivary gland Anatomy 0.000 description 1
- 239000012898 sample dilution Substances 0.000 description 1
- 238000009738 saturating Methods 0.000 description 1
- 230000002000 scavenging effect Effects 0.000 description 1
- 210000002955 secretory cell Anatomy 0.000 description 1
- 230000011218 segmentation Effects 0.000 description 1
- 230000008313 sensitization Effects 0.000 description 1
- 210000005005 sentinel lymph node Anatomy 0.000 description 1
- 239000012679 serum free medium Substances 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 208000037968 sinus cancer Diseases 0.000 description 1
- 229960002930 sirolimus Drugs 0.000 description 1
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- JHJLBTNAGRQEKS-UHFFFAOYSA-M sodium bromide Chemical class [Na+].[Br-] JHJLBTNAGRQEKS-UHFFFAOYSA-M 0.000 description 1
- 229940054269 sodium pyruvate Drugs 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 229960001471 sodium selenite Drugs 0.000 description 1
- 235000015921 sodium selenite Nutrition 0.000 description 1
- 239000011781 sodium selenite Substances 0.000 description 1
- 238000011895 specific detection Methods 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- PXQLVRUNWNTZOS-UHFFFAOYSA-N sulfanyl Chemical compound [SH] PXQLVRUNWNTZOS-UHFFFAOYSA-N 0.000 description 1
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- 230000009897 systematic effect Effects 0.000 description 1
- 125000004213 tert-butoxy group Chemical group [H]C([H])([H])C(O*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- RKSOPLXZQNSWAS-UHFFFAOYSA-N tert-butyl bromide Chemical compound CC(C)(C)Br RKSOPLXZQNSWAS-UHFFFAOYSA-N 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000001302 tertiary amino group Chemical group 0.000 description 1
- JGVWCANSWKRBCS-UHFFFAOYSA-N tetramethylrhodamine thiocyanate Chemical compound [Cl-].C=12C=CC(N(C)C)=CC2=[O+]C2=CC(N(C)C)=CC=C2C=1C1=CC=C(SC#N)C=C1C(O)=O JGVWCANSWKRBCS-UHFFFAOYSA-N 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 125000003441 thioacyl group Chemical group 0.000 description 1
- 125000002813 thiocarbonyl group Chemical group *C(*)=S 0.000 description 1
- 210000000779 thoracic wall Anatomy 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 125000003944 tolyl group Chemical group 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 102000014898 transaminase activity proteins Human genes 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 239000012581 transferrin Substances 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- ILWRPSCZWQJDMK-UHFFFAOYSA-N triethylazanium;chloride Chemical compound Cl.CCN(CC)CC ILWRPSCZWQJDMK-UHFFFAOYSA-N 0.000 description 1
- 229940035722 triiodothyronine Drugs 0.000 description 1
- 230000005748 tumor development Effects 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 238000002525 ultrasonication Methods 0.000 description 1
- 238000002371 ultraviolet--visible spectrum Methods 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 229940124676 vascular endothelial growth factor receptor Drugs 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 230000028973 vesicle-mediated transport Effects 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- AFVLVVWMAFSXCK-UHFFFAOYSA-N α-cyano-4-hydroxycinnamic acid Chemical compound OC(=O)C(C#N)=CC1=CC=C(O)C=C1 AFVLVVWMAFSXCK-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/001—Preparation for luminescence or biological staining
- A61K49/0013—Luminescence
- A61K49/0017—Fluorescence in vivo
- A61K49/005—Fluorescence in vivo characterised by the carrier molecule carrying the fluorescent agent
- A61K49/0054—Macromolecular compounds, i.e. oligomers, polymers, dendrimers
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G65/00—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/001—Preparation for luminescence or biological staining
- A61K49/0013—Luminescence
- A61K49/0017—Fluorescence in vivo
- A61K49/0019—Fluorescence in vivo characterised by the fluorescent group, e.g. oligomeric, polymeric or dendritic molecules
- A61K49/0021—Fluorescence in vivo characterised by the fluorescent group, e.g. oligomeric, polymeric or dendritic molecules the fluorescent group being a small organic molecule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/001—Preparation for luminescence or biological staining
- A61K49/0013—Luminescence
- A61K49/0017—Fluorescence in vivo
- A61K49/0019—Fluorescence in vivo characterised by the fluorescent group, e.g. oligomeric, polymeric or dendritic molecules
- A61K49/0021—Fluorescence in vivo characterised by the fluorescent group, e.g. oligomeric, polymeric or dendritic molecules the fluorescent group being a small organic molecule
- A61K49/0032—Methine dyes, e.g. cyanine dyes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/001—Preparation for luminescence or biological staining
- A61K49/0013—Luminescence
- A61K49/0017—Fluorescence in vivo
- A61K49/0019—Fluorescence in vivo characterised by the fluorescent group, e.g. oligomeric, polymeric or dendritic molecules
- A61K49/0021—Fluorescence in vivo characterised by the fluorescent group, e.g. oligomeric, polymeric or dendritic molecules the fluorescent group being a small organic molecule
- A61K49/0041—Xanthene dyes, used in vivo, e.g. administered to a mice, e.g. rhodamines, rose Bengal
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F220/00—Copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and only one being terminated by only one carboxyl radical or a salt, anhydride ester, amide, imide or nitrile thereof
- C08F220/02—Monocarboxylic acids having less than ten carbon atoms; Derivatives thereof
- C08F220/10—Esters
- C08F220/34—Esters containing nitrogen, e.g. N,N-dimethylaminoethyl (meth)acrylate
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F8/00—Chemical modification by after-treatment
- C08F8/30—Introducing nitrogen atoms or nitrogen-containing groups
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F8/00—Chemical modification by after-treatment
- C08F8/30—Introducing nitrogen atoms or nitrogen-containing groups
- C08F8/32—Introducing nitrogen atoms or nitrogen-containing groups by reaction with amines
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F8/00—Chemical modification by after-treatment
- C08F8/34—Introducing sulfur atoms or sulfur-containing groups
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F8/00—Chemical modification by after-treatment
- C08F8/42—Introducing metal atoms or metal-containing groups
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B69/00—Dyes not provided for by a single group of this subclass
- C09B69/10—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds
- C09B69/103—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds containing a diaryl- or triarylmethane dye
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B69/00—Dyes not provided for by a single group of this subclass
- C09B69/10—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds
- C09B69/105—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds containing a methine or polymethine dye
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B69/00—Dyes not provided for by a single group of this subclass
- C09B69/10—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds
- C09B69/106—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds containing an azo dye
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B69/00—Dyes not provided for by a single group of this subclass
- C09B69/10—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds
- C09B69/109—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds containing other specific dyes
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
- G01N21/643—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes" non-biological material
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/645—Specially adapted constructive features of fluorimeters
- G01N21/6456—Spatial resolved fluorescence measurements; Imaging
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/58—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances
- G01N33/582—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances with fluorescent label
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/84—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving inorganic compounds or pH
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
- G01N2021/6432—Quenching
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
- G01N2021/6439—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes" with indicators, stains, dyes, tags, labels, marks
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
- G01N2021/6439—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes" with indicators, stains, dyes, tags, labels, marks
- G01N2021/6441—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes" with indicators, stains, dyes, tags, labels, marks with two or more labels
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Physics & Mathematics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Molecular Biology (AREA)
- Polymers & Plastics (AREA)
- General Chemical & Material Sciences (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Optics & Photonics (AREA)
- Biotechnology (AREA)
- Cell Biology (AREA)
- Microbiology (AREA)
- Food Science & Technology (AREA)
- Inorganic Chemistry (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
- Investigating Or Analysing Materials By The Use Of Chemical Reactions (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Graft Or Block Polymers (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Macromonomer-Based Addition Polymer (AREA)
- Processes Of Treating Macromolecular Substances (AREA)
Abstract
본 개시내용은 pH에 민감한 소수성 및 친수성 세그먼트를 함유하는 중합체에 관한 것이다. 일부 양상에서, 중합체는 pH에 대해 민감하며 특정 pH에 기반하여 형광 변화를 초래하는 마이셀을 형성한다. 일부 양상에서, 본 개시내용은 또한 세포 또는 세포외 환경의 이미징 또는 약물의 전달을 위해 중합체를 이용하는 방법을 제공한다.
Description
본 출원은 2014년 6월 6일자로 출원된 미국 가출원 특허 제62/009,019호로부터의 우선권의 유익을 주장하며, 이 기초출원의 전문은 본 명세서에 참고로 포함된다.
본 발명은 미국 국립보건원에 의해 부여되는 등록 번호 R01 EB013149호 하에서 정부 지원에 의해 이루어졌다. 정부는 본 발명에서 특정 권리를 가진다.
기술분야
본 개시내용은 일반적으로 분자 및 세포 생물학, 암 이미징, 나노기법 및 형광 센서 분야에 관한 것이다. 더 구체적으로, 이는 pH 변화의 검출을 위한 나노플랫폼에 관한 것이다.
형광 이미징은 미시적, 메조스코픽 및 거시적 수준에서 공간-시간적 정보를 제공하는 그의 능력 덕분에 살아있는 세포에서의 생물학적 분자, 경로 및 과정의 연구에서 중요한 수단이 되었다(예를 들어, 문헌[Tsien, R. Y. Nat. Rev. Mol . Cell Biol. 2003, 4, SS16; Weissleder, R., Nature 2008, 452, 580; Fernandez-Suarez, M., Nat. Rev. Mol . Cell Biol . 2008, 9, 929] 참조). 최근에, 이온 및 산화환원 전위, 효소 발현 및 pH와 같은 생리적 자극에 반응하는 활성화 가능한 이미징 프로브는 세포 생리 과정을 프로빙하는 것에 상당한 주목을 받았다(예를 들어, 문헌[de Silva, A. P., Chem . Rev. 1997, 97, 1515; Zhang, J., Nat. Rev. Mol . Cell Biol . 2002, 3, 906; Lee, S., Chem . Commun . 2008, 4250; Kobayashi, H.; Chem . Res. 2010, 44, 83; Lovell, J. F., Chem . Rev. 2010, 110, 2839; Ueno, T., Nat. Methods 2011, 8, 642] 참조). 이들 자극 중에서, pH는 세포내(pHi)와 세포외(pHe) 환경 둘 다에서 중요한 역할을 하는 중요한 생리적 매개변수로서 두드러진다(Alberts, B., Molecular Biology of the Cell; 5th ed.; Garland Science: New York, 2008).
다양한 pH-민감성 형광 프로브가 보고되었지만(Kobayashi, H., Chem . Rev. 2010, 110, 2620; Han, J. Y., Chem . Rev. 2010, 110, 2709), 그들의 pH 민감성은 주로 형광단에 대해 pH-의존적 광 유도 전자 전달(PeT) 특성을 지니는 이온화 가능한 잔기로부터 생긴다. 이들 형광제에 대한 하나의 잠재적 결점은 헨더슨-하셀바흐 방정식(Henderson-Hasselbalch equation)에 의해 좌우되는 바와 같은 그들의 광범위한 pH 반응이다(ΔpH 대략 2)(Atkins, P., Physical Chemistry; Oxford University Press, 2009). 급격한 pH 반응의 이러한 결여는 정상 조직 환경(7.4) 이상의 산성 세포내 세포 기관 간의 미묘한 pH 차이(예를 들어, 초기 엔도좀과 리소좀 사이의 1 미만의 pH 차이)(Maxfield, F. R., Nat. Rev. Mol . Cell Biol . 2004, 5, 121; Casey, J. R., Nat. Rev. Mol . Cell Biol . 2010, 11, 50) 또는 고형 종양에서의 pHe(6.5 내지 6.9)(Webb, B. A., Nat. Rev. Cancer 2011, 11, 671; Zhang, X., J. Nucl. Med . 2010, 51, 1167)를 검출하는 것을 어렵게 만든다. 게다가, pH 전이점 및 방출 파장(특히, 근적외선(near IR) 범위에서)의 동시 제어는 소분자 염료에 대해 어렵다. pH-민감성 형광 나노입자를 개발하기 위한 최근의 시도는 소분자 pH-민감성 염료에 컨쥬게이팅된 중합체(Srikun, D., J. Chem . Sci . 2011, 2, 1156; Benjaminsen, R. V., ACS Nano 2011, 5, 5864; Albertazzi, L., J. Am. Chem . Soc . 2010, 132, 18158; Urano, Y., Nat. Med . 2009, 15, 104) 또는 pH-비민감성 염료에 대한 pH-민감성 링커의 사용(Li, C., Adv. Funct. Mater. 2010, 20, 2222; Almutairi, A., J. Am. Chem . Soc . 2007, 130, 444)을 주로 사용한다. 이들 나노프로브 설계는 또한 광범위 pH 반응을 수득하고, pH 전이점을 미세동조하는 능력을 결여한다.
최근에, pH 반응 시스템을 생성하기 위한 중합체의 사용은 WO 2013/152059에 기재되었는데, 이는 사용된 특정 단량체에 기반하여 상대적으로 좁은 범위의 pH 전이점을 생성하지만, pH 전이점을 특이적으로 미세동조하는 것의 유연성을 결여한다.
더 나아가, 종양 세포의 이미징은 종양 경계를 분명히 하며 종양을 절제하는 수술의 효능을 증가시키는 향상된 방법을 제공할 수 있다. 종양 경계의 묘사를 돕기 위한 다양한 방법이 제시되었다. 브레인랩(Brainlab)(상표명)과 같은 이미지 네비게이터(image navigator)를 이용하는 통상적인 이미징 양상, 예컨대 CT, MRI 또는 초음파는 처음에 수술전 이미지를 사용한 다음, 두개저 및 부비강암뿐만 아니라 뇌종양의 절제를 가이드하기 위한 수술 기준 마커를 수술 중에 사용한다. 주된 단점은 확고한 골표적에 대해 부동성인 종양만이 정확하게 이미징될 수 있고, 수술전 이미지는 실시간 피드백을 제공하는 수술 중 조작을 설명하도록 업데이트될 수 없다는 것이다. 수술중 MRI는 뇌 종양을 이미징하기 위해 소수의 센터에서 사용 중이지만, 실시간 이미징을 위한 수술실 내에 값비싼 자기 시설을 필요로 하며, 최근의 검토는 이것이 통상적인 수술 네비게이션 이상으로 중요하지 않은 이점을 가질 수 있다는 것을 시사한다(Kubben et al., 2011). 초음파는 구강 HNSCC에 대한 종양 깊이를 평가하기 위해 사용되었지만, 두경부의 덜 접근성인 주요 부위에서 사용하는 것이 어렵다(Lodder et al., 2011).
이들 해부학 기반 이미징 양상은 큰 해상도를 갖지만, 질병 특이적 정보를 거의 제공하지 않는다. 광학 이미징 전략은 세포 이미징, 천연 자가형광 및 라만 산란에 기반하여 수술 중인 조직을 이미징하기 위해 빠르게 사용되었다(Vahrmeijer et al., 2013; Nguyen & Tsien, 2013; Dacosta et al., 2006; Draga et al., 2010; Haka et al., 2006; Schwarz et al., 2009 및 Mo et al., 2009). 불행하게도, 종양 경계 검출을 위해 조직 자가형광을 사용하는 것은 암조직과 정상 조직 사이의 강한 분광분석 차이의 결여에 기인하는 높은 위양성 및 위음성 결과에 의해 제한된다(Liu et al., 2010; Kanter et al., 2009; Ramanujam et al., 1996 및 Schomacker et al., 1992).
수술중 경계 평가를 위한 다양한 외인성 형광단이 개발되었다. 가장 통상적인 전략은 세포-표면 수용기, 예컨대 엽산 수용기-α(FR-α)(van Dam et al., 2011), 클로로톡신(Veiseh et al., 2007), 표피성장인자 수용기(EGFR)(Ke et al., 2003 및 Urano et al., 2009), Her2/neu(Koyama et al., 2007), 종양 연관 항원(예를 들어, 전립선-특이적 막 항원, PSMA)(Tran Cao et al., 2012, 암성태아성 항원 및 탄수화물 항원 19-9(CA19-9)(Tran Cao et al., 2012; McElroy et al., 2008)에 중점을 두었다. 이들 중에서, 엽산-FITC 및 클로로톡신-Cy5.5 컨쥬게이트는 각각 난소 및 피부암의 수술에서 I상 임상 시험으로 이미 진행되었다. 이들 성공에도 불구하고, 주요 제한 중 하나는 암 환자에서 광범위 종양 적용 가능성을 결여한다. 종양 시각화를 위한 세포-표면 수용기 전략을 위해, 균일한 마커의 결여는 다양한 종양 유전자형 및 해부학적 부위를 지니는 종양을 시각화하기 위해 보편적 플랫폼을 생성하는 것을 어렵게 한다. 추가로, 상대적으로 낮은(f㏖ 내지 n㏖) 그리고 고도로 가변성인 발현 수준(100 내지 300배)은 신호 증폭 없이 통상적인 화학량론적 전략을 위해(예를 들어, 리간드:수용기에 대해 1:1) 도전하게 한다. 이는 특히 상시 접속된 프로브 설계 때문에 혈액 배경을 상승시키는 인간화된 mAb의 긴 순환 시간에 기인하여 mAb-염료 컨쥬게이트(예를 들어, 에르비툭스(Erbitux)-ICG)에 대해 도전한다.
그것으로서, 종양의 이미징을 위한 pH 반응 시스템을 생성할 수 있는 새로운 중합체는 연구 진단 및 이미징 프로토콜에 대한 가치를 가진다.
일부 양상에서, 본 개시내용은 하기 화학식의 중합체를 제공한다:
식 중: R1은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 치환된 사이클로알킬(C≤12), 또는 , 또는 금속 킬레이트기이거나; n은 1 내지 500의 정수이고; R2 및 R2'는 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되며; R3은 하기 화학식의 기이고:
식 중: nx는 1 내지 10이고; X1, X2 및 X3은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되며; 그리고 X4 및 X5는 알킬(C≤12), 사이클로알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4 및 X5는 함께 취해지고 알칸다이일(C≤12), 알콕시다이일(C≤12), 알킬아미노다이일(C≤12), 또는 임의의 이들 기의 치환된 형태이며; x는 1 내지 150의 정수이고; R4는 하기 화학식의 기이다:
식 중: ny는 1 내지 10이고; X1', X2' 및 X3'는 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되며; X4' 및 X5'는 알킬(C≤12), 사이클로알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4'과 X5'는 함께 취해지고 알칸다이일(C≤12), 알콕시다이일(C≤12), 알킬아미노다이일(C≤12), 또는 임의의 이들 기의 치환된 형태이며; y는 1 내지 150의 정수이고; R5는 하기 화학식의 기이다:
식 중: nz는 1 내지 10이고; Y1, Y2 및 Y3은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되며; 그리고 Y4는 수소, 알킬(C≤12), 아실(C≤12), 치환된 알킬(C≤12), 치환된 아실(C≤12), 염료 또는 형광 소광제이고; z는 0 내지 6의 정수이며; 그리고 R6은 수소, 할로, 하이드록시, 알킬(C≤12) 또는 치환된 알킬(C≤12)이되, R3, R4 및 R5는 중합체 내에서 임의의 순서로 생길 수 있고, 단, R3 및 R4는 동일한 기가 아니다. 일부 실시형태에서, 화합물은 화학식에 의해 추가로 나타내며, 식 중: R1은 수소, 알킬(C≤12), 치환된 알킬(C≤12), 또는 , 또는 금속 킬레이트기이고; n은 10 내지 500의 정수이며; R2 및 R2'는 수소, 알킬(C≤12) 또는 치환된 알킬(C≤12)로부터 각각 독립적으로 선택되고; R3은 하기 화학식의 기이다:
식 중: X1, X2 및 X3은 수소, 알킬(C≤12) 또는 치환된 알킬(C≤12)로부터 각각 독립적으로 선택되고; 그리고 X4 및 X5는 알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4 및 X5는 함께 취해지고, 알칸다이일(C≤8), 알콕시다이일(C≤8), 알킬아미노다이일(C≤8), 또는 임의의 이들 기의 치환된 형태이며; x는 1 내지 100의 정수이고; R4는 하기 화학식의 기이다:
식 중: X1', X2' 및 X3'는 수소, 알킬(C≤12), 또는 치환된 알킬(C≤12)로부터 각각 독립적으로 선택되고; 그리고 X4' 및 X5'는 알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4' 및 X5'는 함께 취해지고, 알칸다이일(C≤8), 알콕시다이일(C≤8), 알킬아미노다이일(C≤8), 또는 임의의 이들 기의 치환된 형태이며; y는 1 내지 100의 정수이고; R5는 하기 화학식의 기이다:
식 중: Y1, Y2 및 Y3은 수소, 알킬(C≤12), 치환된 알킬(C≤12)로부터 각각 독립적으로 선택되고; 그리고 Y4는 수소, 아실(C≤12), 치환된 아실(C≤12), 염료, 또는 형광 소광제이며; z는 0 내지 6의 정수이고; 그리고 R6은 수소, 할로, 알킬(C≤12), 또는 치환된 알킬(C≤12)이되, 여기서 R3, R4 및 R5는 중합체 내에서 임의의 순서로 생길 수 있고, 단, R3 및 R4는 동일한 기가 아니다. 일부 실시형태에서, 화합물은 화학식에 의해 추가로 나타내며, 여기서: R1은 수소, 알킬(C≤8), 치환된 알킬(C≤8), 또는 , 또는 금속 킬레이트기이고; n은 10 내지 200의 정수이며; R2 및 R2'는 수소, 알킬(C≤8), 또는 치환된 알킬(C≤8)로부터 각각 독립적으로 선택되고; R3은 하기 화학식의 기이다:
식 중: X1, X2 및 X3은 수소, 알킬(C≤8), 또는 치환된 알킬(C≤8)로부터 각각 독립적으로 선택되고; 그리고 X4 및 X5는 알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4 및 X5는 함께 취해지고 알칸다이일(C≤8) 또는 치환된 알칸다이일(C≤8)이며; x는 1 내지 100의 정수이고; R4는 하기 화학식의 기이다:
식 중: X1', X2' 및 X3'는 수소, 알킬(C≤8), 또는 치환된 알킬(C≤8)로부터 각각 독립적으로 선택되고; 그리고 X4' 및 X5'는 알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4' 및 X5'는 함께 취해지고, 알칸다이일(C≤8) 또는 치환된 알칸다이일(C≤8)이며; y는 1 내지 100의 정수이고; R5는 하기 화학식의 기이다:
식 중: Y1, Y2 및 Y3는 수소, 알킬(C≤8), 치환된 알킬(C≤8)로부터 각각 독립적으로 선택되고; Y4는 수소, 염료, 또는 형광 소광제이고; z는 0 내지 6의 정수이며; 그리고 R6은 수소, 할로, 알킬(C≤6), 또는 치환된 알킬(C≤6)이되, R3, R4 및 R5는 중합체 내에서 임의의 순서로 생길 수 있고, 단, R3과 R4는 동일한 기가 아니다. 일부 실시형태에서, R1은 수소이다. 일부 실시형태에서, R1은 알킬(C≤6)이다. 일부 실시형태에서, R1은 메틸이다. 일부 실시형태에서, R1은 이다. 일부 실시형태에서, R1은 금속 킬레이트기, 예컨대 DOTA, TETA, 다이암사르, NOTA, NETA, TACN-TM, DTPA, TRAP, NOPO, AAZTA, DATA, HBED, SHBED, BPCA, CP256, DFO, PCTA, HEHA, PEPA, 또는 이들의 유도체로부터 선택된 금속 킬레이트기이다. 일부 실시형태에서, 금속 킬레이트기는 질소 함유 거대고리이다. 일부 실시형태에서, 질소 함유 거대고리는 하기 화학식의 화합물이다:
식 중:
R7, R8, R9, R10, R7', R8' 및 R9'는 수소, 알킬(C≤12), 아실(C≤12), -알칸다이일(C≤12)-아실(C≤12), 또는 임의의 이들 기의 치환된 형태; 또는 링커로부터 각각 독립적으로 선택되되, 링커는 알칸다이일(C≤12)-C(O)NH- 또는 치환된 알칸다이일(C≤12)-C(O)NH-이거나; 또는
R7은 R8, R9 또는 R10 중 하나와 함께 취해지고, 알칸다이일(C≤6)이거나; 또는
R8은 R7, R9 또는 R10 중 하나와 함께 취해지고, 알칸다이일(C≤6)이거나; 또는
R9는 R7, R8 또는 R10 중 하나와 함께 취해지고, 알칸다이일(C≤6)이거나; 또는
R10은 R7, R8 또는 R9 중 하나와 함께 취해지고 알칸다이일(C≤6)이거나; 또는
R7'는 R8' 또는 R9' 중 하나와 함께 취해지고, 알칸다이일(C≤6)이거나; 또는
R8'는 R7' 또는 R9' 중 하나와 함께 취해지고, 알칸다이일(C≤6)이거나; 또는
R9'는 R7' 또는 R8' 중 하나와 함께 취해지고, 알칸다이일(C≤6)이고; 그리고
a, b, c, d, a', b', 및 c'는 1, 2, 3 또는 4로부터 각각 독립적으로 선택된다.
일부 실시형태에서, a, b, c, d, a', b', 및 c'는 2 또는 3으로부터 각각 독립적으로 선택된다. 일부 실시형태에서, 금속 킬레이트기는:
일부 실시형태에서, 금속 킬레이팅 착물은 금속 이온에 결합된다. 일부 실시형태에서, 금속 이온은 방사성핵종 또는 방사성금속이다. 일부 실시형태에서, 금속 이온은 PET 또는 SPECT 이미징에 적합하다. 일부 실시형태에서, 금속 킬레이팅 착물은 전이 금속 이온에 결합된다. 일부 실시형태에서, 금속 이온은 구리 이온, 갈륨 이온, 스칸듐 이온, 인듐 이온, 루테튬 이온, 이테르븀 이온, 지르코늄 이온, 비스무트 이온, 납 이온, 악티늄 이온 또는 테크네튬 이온이다. 일부 실시형태에서, 금속 이온은 99 m Tc, 60Cu, 61Cu, 62Cu, 64Cu, 86Y, 90Y, 89Zr, 44Sc, 47Sc, 66Ga, 67Ga, 68Ga, 111In, 177Lu, 225ac, 212Pb, 212bi, 213bi, 111In, 114 m In, 114In, 186Re 또는 188Re로부터 선택된 동위원소이다. 일부 실시형태에서, 전이 금속은 구리(II) 이온이다. 일부 실시형태에서, 구리(II) 이온은 64Cu2 + 이온이다. 일부 실시형태에서, 금속 킬레이팅 착물은:
일부 실시형태에서, R2는 알킬(C≤6)이다. 일부 실시형태에서, R2는 메틸이다. 일부 실시형태에서, R2'는 알킬(C≤6)이다. 일부 실시형태에서, R2'는 메틸이다. 일부 실시형태에서, R3은 하기 화학식에 의해 추가로 나타낸다:
식 중: X1은 수소, 알킬(C≤8), 또는 치환된 알킬(C≤8)로부터 선택되고; 그리고 X4 및 X5는 알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4 및 X5는 함께 취해지고, 알칸다이일(C≤8) 또는 치환된 알칸다이일(C≤8)이고; 일부 실시형태에서, X1은 알킬(C≤6)이다. 일부 실시형태에서, X1은 메틸이다. 일부 실시형태에서, X4는 알킬(C≤8)이다. 일부 실시형태에서, X4는 메틸, 에틸, 프로필, 부틸 또는 펜틸이다. 일부 실시형태에서, X5는 알킬(C≤8)이다. 일부 실시형태에서, X5는 메틸, 에틸, 프로필, 부틸 또는 펜틸이다.
일부 실시형태에서, R4는 추가로 하기 화학식으로 나타낸다:
식 중: X1'는 수소, 알킬(C≤8), 또는 치환된 알킬(C≤8)로부터 선택되고; 그리고 X4' 및 X5'는 알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4' 및 X5'는 함께 취해지고, 알칸다이일(C≤8) 또는 치환된 알칸다이일(C≤8)이다. 일부 실시형태에서, X1'는 알킬(C≤6)이다. 일부 실시형태에서, X1은 메틸이다. 일부 실시형태에서, X4'는 알킬(C≤8)이다. 일부 실시형태에서, X4'는 메틸, 에틸, 프로필, 부틸 또는 펜틸이다. 일부 실시형태에서, X5'는 알킬(C≤8)이다. 일부 실시형태에서, X5'는 메틸, 에틸, 프로필, 부틸 또는 펜틸이다. 일부 실시형태에서, R5는 추가로 하기 화학식에 의해 나타낸다:
식 중: Y1은 수소, 알킬(C≤8), 치환된 알킬(C≤8)로부터 선택되고; Y4는 수소, 염료, 또는 형광 소광제이다. 일부 실시형태에서, Y1은 알킬(C≤6)이다. 일부 실시형태에서, Y1은 메틸이다. 일부 실시형태에서, Y4는 수소이다. 일부 실시형태에서, Y4는 염료이다. 일부 실시형태에서, Y4는 형광 염료이다. 일부 실시형태에서, 형광 염료는 쿠마린, 플루오레세인, 로다민, 잔텐, 보디피(BODIPY)(등록상표), 알렉사 플루오르(Alexa Fluor)(등록상표) 또는 사이아닌 염료이다. 일부 실시형태에서, 형광 염료는 인도사이아닌 그린, AMCA-x, 마리나 블루, PyMPO, 로다민 그린(상표명), 테트라메틸로다민, 5-카복시-X-로다민, 보디피493, 보디피 TMR-x, 보디피630, 사이아닌5, 사이아닌5.5 및 사이아닌7.5이다. 일부 실시형태에서, 형광 염료는 인도사이아닌 그린이다. 일부 실시형태에서, Y4는 형광 소광제이다. 일부 실시형태에서, 형광 소광제는 QSY7, QSY21, QSY35, BHQ1, BHQ2, BHQ3, TQ1, TQ2, TQ3, TQ4, TQ5, TQ6 및 TQ7이다. 일부 실시형태에서, n은 75 내지 150이다. 일부 실시형태에서, n은 100 내지 125이다. 일부 실시형태에서, x는 1 내지 99이다. 일부 실시형태에서, x는 1 내지 5, 5 내지 10, 10 내지 15, 15 내지 20, 20 내지 25, 25 내지 30, 30 내지 35, 35 내지 40, 40 내지 45, 45 내지 50, 50 내지 55, 55 내지 60, 60 내지 65, 65 내지 70, 70 내지 75, 75 내지 80, 80 내지 85, 85 내지 90, 90 내지 95, 95 내지 99 또는 이 안에서 유도될 수 있는 임의의 범위이다. 일부 실시형태에서, y는 1 내지 99이다. 일부 실시형태에서, y는 1 내지 5, 5 내지 10, 10 내지 15, 15 내지 20, 20 내지 25, 25 내지 30, 30 내지 35, 35 내지 40, 40 내지 45, 45 내지 50, 50 내지 55, 55 내지 60, 60 내지 65, 65 내지 70, 70 내지 75, 75 내지 80, 80 내지 85, 85 내지 90, 90 내지 95, 95 내지 99 또는 이 안에서 유도될 수 있는 임의의 범위이다. 일부 실시형태에서, z는 0 내지 6이다. 일부 실시형태에서, z는 1 내지 6이다. 일부 실시형태에서, z는 0 내지 2, 2 내지 4, 4 내지 6, 또는 이 안에서 유도될 수 있는 임의의 범위이다. 일부 실시형태에서, R3, R4 및 R5는 중합체 내에서 임의의 순서로 생길 수 있다. 일부 실시형태에서, R3, R4 및 R5는 화학식 I에서 기재된 순서로 생긴다. 일부 실시형태에서, 상기 중합체는 표적 모이어티를 추가로 포함한다. 일부 실시형태에서, 표적 모이어티는 소분자, 항체, 항체 단편, 또는 신호전달 펩타이드이다. 일부 실시형태에서, R3 및 R4는 하기로부터 선택된다:
일부 실시형태에서, 중합체는 PEO114-P(DEA20-D5a60), PEO114-P(DEA40-D5a40), PEO114-P(DEA60-D5a20), PEO114-P(DPA60-DBA20), PEO114-P(DPA40-DBA40), PEO114-P(DPA20-DBA60), PEO114-P(DEA76-DPA24), PEO114-P(DEA58-DPA42), PEO114-P(DEA39-DPA61), PEO114-P(DEA21-DPA79), PEO114-P(DPA30-DBA50), PEO114-P(DBA28-D5a52), PEO114-P(DBA56-D5a24), PEO114-P(DEA20-D5a60-AMA3), PEO114-P(DEA40-D5a40-AMA3), PEO114-P(DEA60-D5a20-AMA3), PEO114-P(DPA60-DBA20-AMA3), PEO114-P(DPA40-DBA40-AMA3), PEO114-P(DPA20-DBA60-AMA3), PEO114-P(DEA76-DPA24-AMA3), PEO114-P(DEA58-DPA42-AMA3), PEO114-P(DEA39-DPA61-AMA3), PEO114-P(DEA21-DPA79-AMA3), PEO114-P(DPA30-DBA50-AMA3), PEO114-P(DBA28-D5a52-AMA3) 또는 PEO114-P(DBA56-D5a24-AMA3), PEO114-P(DEA11-EPA89), PEO114-P(DEA22-EPA78), PEO114-P(EPA90-DPA10), PEO114-P(EPA79-DPA21)이다.
다른 양상에서, 본 개시내용은 하기 화학식의 중합체를 제공한다:
식 중: R1은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 치환된 사이클로알킬(C≤12), 또는, 또는 금속 킬레이트기이고; n은 1 내지 500의 정수이며; R2 및 R2'는 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고; R3은 하기 화학식의 기이다:
식 중: nx는 1 내지 10이고; X1, X2 및 X3은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고; X4는 펜틸, n-프로필 또는 에틸이며; 그리고 X5는 펜틸 또는 n-프로필이고; x는 1 내지 100의 정수이며; R4는 하기 화학식의 기이고:
식 중: Y1, Y2 및 Y3은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고; 그리고 Y4는 수소, 알킬(C≤12), 아실(C≤12), 치환된 알킬(C≤12), 치환된 아실(C≤12), 염료, 또는 형광 소광제이며; y는 1 내지 6의 정수이고; 그리고 R5는 수소, 할로, 하이드록시, 알킬(C≤12), 또는 치환된 알킬(C≤12)이다. 일부 실시형태에서, Y4는 형광 염료이다. 일부 실시형태에서, 형광 염료는 인도사이아닌 그린이다. 일부 실시형태에서, 중합체는 PEO114-P(D5a80), PEO114-P(D5a100), PEO114-P(DPA80), PEO114-P(DPA100), PEO114-P(EPA80) 및 PEO114-P(EPA100)이다.
또 다른 양상에서, 본 개시내용은 하기 화학식의 화합물을 제공한다:
다른 양상에서, 본 개시내용은 본 개시내용의 중합체의 마이셀을 제공한다.
또 다른 양상에서, 본 개시내용은 본 개시내용의 제1 중합체의 마이셀을 포함하는 pH 반응 시스템을 제공하되, z는 0이 아니고, Y4는 염료이며, 마이셀은 pH 전이점 및 방출 스펙트럼을 가진다. 일부 실시형태에서, 마이셀은 본 개시내용의 제2 중합체를 추가로 포함하되, z는 0이 아니고, Y4는 형광 소광제이다. 일부 실시형태에서, 제2 중합체는 Y4가 형광 소광제라는 것을 제외하고 제1 중합체와 동일한 화학식을 가진다. 일부 실시형태에서, pH 전이점은 3 내지 9이다. 일부 실시형태에서, pH 전이점은 4 내지 8이다. 일부 실시형태에서, pH 전이점은 4 내지 6이다. 일부 실시형태에서, pH 전이점은 6 내지 7.5이다. 일부 실시형태에서, pH 전이점은 4.38, 4.67, 4.96, 5.27, 5.63, 5.91, 6.21, 6.45, 6.76, 7.08 또는 7.44이다. 일부 실시형태에서, 방출 스펙트럼은 400 내지 850㎚이다. 일부 실시형태에서, 시스템은 1 pH 단위 미만의 pH 반응(ΔpH10 -90%)을 가진다. 일부 실시형태에서, pH 반응은 0.25 pH 단위 미만이다. 일부 실시형태에서, pH 반응은 0.15 pH 단위 미만이다. 일부 실시형태에서, 형광 신호는 25 초과의 형광 활성화 비를 가진다. 일부 실시형태에서, 형광 활성화 비는 50 초과이다.
또 다른 양상에서, 본 개시내용은 하기를 포함하는 세포내 또는 세포외 환경의 pH를 이미징하는 방법을 제공한다:
(a)
본 개시내용의 마이셀을 환경과 접촉시키는 단계; 및
(b)
상기 환경으로부터 하나 이상의 광학 신호를 검출하는 단계로서, 광학 신호의 검출은 마이셀이 그의 pH 전이점에 도달되고 해리된다는 것을 나타내는, 상기 광학 신호를 검출하는 단계.
일부 실시형태에서, 광학 신호는 형광 신호이다. 일부 실시형태에서, 세포내 환경이 이미징될 때, 세포는 마이셀의 흡수를 야기하기에 적합한 조건 하에서 마이셀과 접촉된다. 일부 실시형태에서, 세포내 환경은 세포의 부분이다. 일부 실시형태에서, 세포의 부분은 리소좀 또는 엔도좀이다. 일부 실시형태에서, 세포외 환경은 종양 또는 혈관 세포이다. 일부 실시형태에서, 세포외 환경은 혈관내 또는 혈관외이다. 일부 실시형태에서, 종양 환경의 pH를 이미징하는 것은 감시림프절 또는 림프절들을 이미징하는 것을 포함한다. 일부 실시형태에서, 감시림프절 또는 림프절들을 이미징하는 것은 종양의 수술적 절제 및 종양 전이의 병기화를 허용한다. 일부 실시형태에서, 종양 환경의 pH를 이미징하는 것은 종양 크기 및 경계의 결정을 허용한다. 일부 실시형태에서, 종양 환경의 pH를 이미징하는 것은 수술 동안 종양의 더 정확한 제거를 허용한다. 일부 실시형태에서, 감시 림프절 또는 림프절들의 pH를 이미징하는 것은 수술 동안 감시 림프절 또는 림프절들의 더 정확한 제거를 허용한다. 일부 실시형태에서, 상기 방법은 하기 단계들을 추가로 포함한다:
(a)
상기 세포를 관심 대상의 화합물과 접촉시키는 단계;
(b)
환경에서 하나 이상의 광학 신호를 검출하는 단계; 및
(c)
세포를 관심 대상의 화합물과 접촉시킨 후에 광학 신호의 변화가 일어나는지의 여부를 결정하는 단계.
일부 실시형태에서, 관심 대상의 화합물은 약물, 항체, 펩타이드, 단백질, 핵산 또는 소분자이다.
또 다른 양상에서, 본 개시내용은 하기 단계들을 포함하는 표적 세포에 관심 대상의 화합물을 전달하는 방법을 제공한다:
(a)
관심 대상의 화합물을 제1항 내지 제55항의 중합체의 마이셀로 캡슐화하는 단계; 및
(b)
표적 세포의 pH가 마이셀의 해리 및 화합물의 방출을 촉발시키는 조건 하에서 표적 세포를 마이셀과 접촉시킴으로써, 관심 대상의 화합물을 전달하는 단계.
일부 실시형태에서, 관심 대상의 화합물은 세포 내로 전달된다. 일부 실시형태에서, 관심 대상의 화합물은 세포에 전달된다. 일부 실시형태에서, 관심 대상의 화합물은 약물, 항체, 펩타이드, 단백질, 핵산 또는 소분자이다. 일부 실시형태에서, 상기 방법은 마이셀을 환자에게 투여하는 단계를 포함한다.
또 다른 양상에서, 본 개시내용은 하기 단계를 포함하는 환자에서 종양을 절제하는 방법을 제공한다:
(a)
상기 환자에게 본 개시내용의 pH 반응 시스템의 유효량을 투여하는 단계;
(b)
환자에 대해 하나 이상의 광학 신호를 검출하는 단계로서; 상기 광학 신호는 종양의 존재를 나타내는, 상기 광학 신호를 검출하는 단계; 및
(c)
수술을 통해 종양을 절제하는 단계.
일부 실시형태에서, 광학 신호는 종양의 경계를 나타낸다. 일부 실시형태에서, 종양은 90% 절제되거나, 또는 종양은 95% 절제되거나, 또는 종양은 99% 절제된다. 일부 실시형태에서, 종양은 고형 종양이고, 예컨대 고형 종양은 암으로부터 유래된다. 일부 실시형태에서, 암은 유방암 또는 두경부암, 예컨대 두경부 편평세포 암종이다. 일부 실시형태에서, pH 반응 시스템은 하기 화학식의 중합체를 포함한다:
식 중: x는 30 내지 150의 정수이고, y는 1 또는 2의 정수이며; x 및 y는 중합체 전체적으로 무작위 분포되고; 그리고 ICG는 형광 염료 인도사이아닌 그린이다.
또 다른 양상에서, 본 개시내용은 암 치료가 필요한 환자에게 본 개시내용의 pH 반응 시스템을 투여하는 단계를 포함하는, 환자에서 엔도좀/리소좀 pH 저지가 쉬운 암 치료 방법을 제공한다. 일부 실시형태에서, 암은 폐암, 예컨대 비소세포 폐암이다. 일부 실시형태에서, 암은 KRAS 유전자에서의 돌연변이 또는 LKB1 유전자에서의 돌연변이를 포함한다. 다른 실시형태에서, 암은 KRAS와 LKB1 유전자 둘 다에서 돌연변이를 포함한다. 일부 실시형태에서, 방법은 세포자멸사를 유도하기에 충분하다.
또 다른 양상에서, 본 개시내용은 세포에서 유전자 돌연변이의 존재를 동정하는 방법을 제공한다:
(a)
2 이상의 마이셀을 포함하는 pH 반응 시스템을 세포 또는 세포의 환경을 접촉시키는 단계; 및
(b)
환경으로부터 2 이상의 광학 신호를 검출하는 단계로서, 광학 신호의 검출은 마이셀 중 하나가 그의 pH 전이점에 도달되었고 해리되었음을 나타내는, 상기 광학 신호를 검출하는 단계; 및
(c)
2 이상의 광학 신호를 상호 연관지어서 세포 내 유전자 돌연변이의 존재를 결정하는 단계.
일부 실시형태에서, 유전자 돌연변이는 KRAS 유전자 내 돌연변이이다. 일부 실시형태에서, 2 이상의 마이셀은 6.9, 6.2 및 5.3에서의 pH 전이점을 지니는 3개의 마이셀을 포함한다. 일부 실시형태에서, 각각의 3개의 마이셀은 PDPA-TMR, PEPA-BDY493 및 PDBA-Cy5로부터 선택되는 중합체로부터 제조된다. 일부 실시형태에서, 상기 방법은 생체내에서 수행되고, 세포를 접촉시키는 단계는 하나 이상의 마이셀을 환자에게 투여하는 단계를 포함한다.
또 다른 양상에서, 본 개시내용은 하기 단계들을 포함하는 종양 산성혈증 경로를 동정하는 방법을 제공한다:
(a)
하나 이상의 마이셀을 포함하는 본 개시내용의 pH 반응 시스템을 세포 또는 세포의 환경과 접촉시키는 단계;
(b)
상기 세포를 pH 조절 경로의 저해제와 접촉시키는 단계;
(c)
세포 또는 세포의 환경으로부터 2 이상의 광학 신호를 검출하는 단계로서, 상기 광학 신호의 검출은 마이셀 중 하나가 그의 pH 전이점에 도달되고 해리된다는 것을 나타내는, 상기 광학 신호를 검출하는 단계; 및
(d)
2 이상의 광학 신호를 종양 산성혈증 경로에서의 변형과 상호 연관짓는 단계.
일부 실시형태에서, pH 조절 경로의 저해제는 모노카복실레이트 수송체, 탄산 무수화 효소, 음이온 교환체, Na+-중탄산염 교환체, Na+/H+ 교환체 또는 V-ATP 분해효소의 저해제이다. 일부 실시형태에서, 하나 이상의 마이셀은 중합체 백본에 부착된 2 이상의 형광단을 지니는 중합체를 포함한다. 일부 실시형태에서, 상기 방법은 하나의 마이셀을 포함하고, 상기 마이셀은 상이한 형광단 또는 상이한 R3기를 지니는 2 이상의 중합체를 포함한다. 일부 실시형태에서, 마이셀은 상이한 형광단 및 상이한 R3기를 지니는 2 이상의 중합체를 포함한다.
140.
종양의 존재를 결정하기 위해 환자를 이미징하는 방법으로서,
(a)
본 개시내용의 하나 이상의 마이셀을 포함하는 pH 반응 시스템을 종양과 접촉시키는 단계로서, 상기 마이셀은 R1에서 금속 킬레이트기를 추가로 포함하는, 상기 pH 반응 시스템을 종양과 접촉시키는 단계;
(b)
하나 이상의 PET 또는 SPECT 이미징 스캔을 수집하는 단계; 및
(c)
하나 이상의 광학적 이미징 스캔을 수집하는 단계로서, 상기 광학 신호의 검출은 마이셀 중 하나가 그의 pH 전이점에 도달되고 해리되었음을 나타내는, 상기 광학적 이미징 스캔을 수집하는 단계를 포함하되;
하나 이상의 PET 또는 SPECT 이미징 스캔 및 하나 이상의 광학적 이미징 스캔은 종양의 식별을 초래하는, 종양의 존재를 결정하기 위해 환자를 이미징하는 방법.
일부 실시형태에서, 광학적 이미징 스캔은 PET 또는 SPECT 이미징 스캔 전에 수집된다. 다른 실시형태에서, the 광학적 이미징 스캔은 PET 또는 SPECT 이미징 스캔 후에 수집된다. 다른 실시형태에서, 광학적 이미징 스캔은 PET 또는 SPECT 이미징 스캔과 동시에 수집된다. 일부 실시형태에서, 이미징 스캔은 PET 이미징 스캔이다. 다른 실시형태에서, 이미징 스캔은 SPECT 이미징 스캔이다. 일부 실시형태에서, 금속 킬레이트기는 64Cu 이온에 결합된다. 일부 실시형태에서, 금속 킬레이트기는 질소 함유 거대고리이다. 일부 실시형태에서, 질소 함유 거대고리는 하기와 같다:
식 중: R7, R8, R9, R10, R7', R8', R9' a, b, c, d, a', b' 및 c'는 상기 정의한 바와 같다. 일부 실시형태에서, 질소 함유 거대고리는:
또 다른 양상에서, 본 개시내용은 하기 화학식의 중합체를 제공한다:
식 중:
R1은 금속 킬레이트기이고;
n은 1 내지 500의 정수이며;
R2 및 R2'는 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고;
R3은 하기 화학식의 기이다:
식 중:
nx는 1 내지 10이고;
X1, X2 및 X3은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고; 그리고
X4 및 X5는 알킬(C≤12), 사이클로알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4와 X5는 함께 취해지고, 알칸다이일(C≤12), 알콕시다이일(C≤12), 알킬아미노다이일(C≤12), 또는 임의의 이들 기의 치환된 형태이며;
x는 1 내지 150의 정수이고;
R4는 하기 화학식의 기이다:
식 중:
nz는 1 내지 10이고;
Y1, Y2 및 Y3은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되며; 그리고
Y4는 수소, 알킬(C≤12), 아실(C≤12), 치환된 알킬(C≤12), 치환된 아실(C≤12), 염료, 또는 형광 소광제이고;
y는 0 내지 6의 정수이며; 그리고
R4는 수소, 할로, 하이드록시, 알킬(C≤12), 또는 치환된 알킬(C≤12)이고,
R3 및 R4는 중합체 내에서 임의의 순서로 생길 수 있고, 단 R3 및 R4는 동일한 기가 아니다.
일부 실시형태에서, R3은:
식 중: X1, X4 및 X5는 상기 정의한 바와 같다.
일부 실시형태에서, X1은 알킬(C≤12), 예컨대 X1은 메틸이다. 일부 실시형태에서, X4 및 X5는 함께 취해지고, 알칸다이일(C≤12) 또는 치환된 알칸다이일(C≤12)이다. 일부 실시형태에서, X4 및 X5는 함께 취해지고, -CH2CH2CH2CH2CH2CH2-이다. 일부 실시형태에서, R4는 하기와 같다:
식 중: Y1 및 Y4는 상기 정의한 바와 같다. 일부 실시형태에서, Y4는 염료이다. 일부 실시형태에서, Y4는 형광 염료이다. 일부 실시형태에서, Y1은 알킬(C≤12)이고, 예컨대 Y1은 메틸이다. 일부 실시형태에서, x는 40, 60, 80, 100 또는 120이다. 일부 실시형태에서, y는 1, 2 또는 3이고, 예컨대 y는 3이다. 일부 실시형태에서, 중합체는 PEO114-P(C7A40-r-ICG3), PEO114-P(C7A60-r-ICG3), PEO114-P(C7A80-r-ICG3), PEO114-P(C7A100-r-ICG3), 또는 PEO114-P(C7A120-r-ICG3)이되, PEO 기는 금속 킬레이트기로 캡핑된다.
본 명세서에서 사용되는 바와 같은 "pH 반응 시스템," "마이셀," "pH-반응성 마이셀", "pH-민감성 마이셀", "pH-활성화 가능한 마이셀" 및 "pH-활성화 가능한 마이셀의(pHAM) 나노입자"는 pH에 따라서(예를 들어, 특정 pH 초과 또는 미만) 해리되는 하나 이상의 블록 공중합체를 포함하는 마이셀을 나타내기 위해 본 명세서에서 상호호환적으로 사용된다. 비제한적 예로서, 특정 pH에서, 블록 공중합체는 실질적으로 마이셀 형태이다. pH가 변함에 따라(예를 들어, 감소됨에 따라), 마이셀이 해리되기 시작하고, pH가 추가로 변함에 따라(예를 들어, 추가로 감소됨에 따라), 블록 공중합체는 해리된(비-마이셀)형태로 실질적으로 존재한다.
본 명세서에서 사용되는 바와 같은 "pH 전이 범위"는 마이셀이 해리되는 pH 범위를 나타낸다.
본 명세서에서 사용되는 바와 같은 "pH 전이값"(pHt)은 마이셀의 절반이 해리되는 pH를 나타낸다.
본 명세서에 기재된 임의의 방법 또는 조성물은 본 명세서에 기재된 임의의 다른 방법 또는 조성물에 대해 실행될 수 있다는 것이 상정된다.
용어 "포함하다"(comprise)(및 포함하다의 임의의 형태, 예컨대 "포함하다(comprises)" 및 "포함하는"), "가지다"(및 가지다(have)의 임의의 형태, 예컨대 "가지다(has)" 및 "갖는"), "함유하다(contain)"(함유하다의 임의의 형태, 예컨대 "함유하다(contains)" 및 "함유하는"), 및 "포함하다(include)"(및 포함하다의 임의의 형태, 예컨대 "포함하다(includes)" 및 "(including)")는 제약이 없는 연결동사이다. 결과로서, 하나 이상의 인용 단계 또는 구성요소를 "포함하거나", "가지거나", "함유하거나" 또는 "포함하는" 방법, 조성물, 키트 또는 시스템은 해당의 인용된 해당 단계들 또는 구성요소들을 갖지만, 해당 단계들 또는 구성요소들만을 갖는 것으로 제한되지 않으며; 인용되지 않는 구성요소들 또는 단계들을 가질 수 있다(즉, 아우를 수 있다). 마찬가지로, 하나 이상의 인용된 특징을 "포함하거나", "가지거나", "함유하거나" 또는 "포함하는" 방법, 조성물, 키트 또는 시스템의 구성요소는 해당 특징을 갖지만, 이것으로 제한되지 않으며; 인용되지 않는 특징을 가질 수도 있다.
임의의 본 발명의 방법, 조성물, 키트 및 시스템의 임의의 실시형태는 기재된 단계 및/또는 특징을 포함한다/포함한다/함유한다/가진다 보다는 이루어지거나 또는 본질적으로 이루어질 수 있다. 따라서, 임의의 청구범위에서, 용어 "이루어지는" 또는 "본질적으로 이루어지는"은 다르게는 제약이 없는 연결 동사를 이용함으로써 주어진 청구범위를 변화시키기 위해, 상기 열거한 임의의 제약이 없는 연결 동사로 대체할 수 있다.
개시내용이 대안 및 "및/또는"만을 지칭하는 정의를 뒷받침하더라도, 청구범위에서 용어 "또는"의 사용은 대안만을 지칭하는 것으로 명확하게 표시되지 않는 한 또는 대안이 상호 배타적이 아닌 한, "및/또는"을 의미하기 위해 사용된다. 본 명세서 전체적으로, 용어 "약"은 값이 값을 결정하기 위해 사용되는 장치 또는 방법에 대한 오차의 표준 편차를 포함한다는 것을 나타내기 위해 사용된다. 오래된 특허법에 따라, 단수의 단어는 청구범위 또는 명세서에서 "포함하는"이라는 단어와 함께 사용될 때, 달리 구체적으로 언급되지 않는 한 하나 이상을 의미한다.
본 개시내용의 다른 목적, 특징 및 이점은 다음의 상세한 설명으로부터 명확하게 될 것이다. 그러나, 개시내용의 구체적 실시형태를 나타내는 동안 상세한 설명 및 구체적 실시예는 단지 예시의 방법에 의해 주어지는데, 본 개시내용의 정신과 범주 내에서의 다양한 변화 및 변형이 본 상세한 설명으로부터 당업자에게 명확하게 될 것이기 때문인 것으로 이해되어야 한다.
본 특허 또는 출원은 칼라로 수행한 적어도 하나의 도면을 포함한다. 칼라 도면(들)을 지니는 본 특허 또는 특허 출원의 사본은 요청 시 그리고 필요한 수수료의 지불 시 특허청에 의해 제공될 것이다.
다음의 도면은 본 명세서의 부분을 형성하고, 본 개시내용의 특정 양상을 추가로 입증하기 위해 추가로 포함된다. 개시내용은 본 명세서에 제시된 구체적 실시형태의 상세한 설명과 조합하여 이들 도면 중 하나 이상을 참고로 하여 더 잘 이해될 수 있다.
도 1은 염료- 또는 형광 소광제 (FQ)-컨쥬게이팅된 PEO-b-P(R1-r-R2) 공중합체의 합성을 도시한 도면. PR 세그먼트의 소수성은 2개의 단량체의 몰분율을 달리함으로써 연속적으로 제어될 수 있다(R1 또는 R2: Et, 에틸; Pr, 프로필; Bu, 부틸; Pe, 펜틸).
도 2는 무작위 공중합체에서의 상이한 단량체(DEA 및 D5a) 비에서 PEO-P(DEAx-D5ay)(x + y = 80) 공중합체의 1H NMR 스펙트럼을 도시한 도면. 소수성 PR 블록에서의 단량체 조성을 추정하기 위해 0.9ppm 및 1.1ppm에서의 피크를 사용하였다.
도 3은 무작위 공중합체에서의 상이한 단량체(DPA 및 DBA) 비에서 PEO-P(DPAx-DBAy)(x + y = 80) 공중합체의 1H NMR 스펙트럼을 도시한 도면. 소수성 PR 블록에서의 단량체 조성을 추정하기 위해 1.3ppm 및 1.4 ppm에서의 피크를 사용하였다.
도 4는 소수성 PR 블록에서의 단량체(DEA 및 DPA) 비를 조절함으로써 7.8, 7.4, 7.1, 6.8, 6.5 및 6.2에서 pHt 값에 의한 나노프로브 조성물의 1H NMR 스펙트럼을 도시한 도면. 소수성 PR 블록에서 단량체 조성을 추정하기 위해 0.9ppm 및 1.0 내지 1.1 ppm에서의 피크를 사용하였다.
도 5는 소수성 PR 블록에서의 단량체(DPA 및 DBA) 비를 조절함으로써 6.2, 5.9, 5.6 및 5.3에서 pHt 값에 의한 나노프로브 조성물의 1H NMR 스펙트럼을 도시한 도면. 소수성 PR 블록에서 단량체 조성을 추정하기 위해 1.3ppm 및 1.4 ppm에서의 피크를 사용하였다.
도 6은 소수성 PR 블록에서의 단량체(DBA 및 D5a) 비를 조절함으로써 5.3, 5.0, 4.7 및 4.4에서 pHt 값에 의한 나노프로브 조성물의 1H NMR 스펙트럼을 도시한 도면. 소수성 PR 블록에서 단량체 조성을 추정하기 위해 1.3ppm 및 1.4 ppm에서의 피크를 사용하였다.
도 7a 내지 도 7c: (도 7a) pHt의 제어를 위한 PDEA / PD5a 분자 혼합물 대 P(DEA 40 -D5a 40 ) 공중합체 전략의 비교. (도 7b) pH의 함수로서 2개의 단량체의 상이한 비를 이용한 P( DEA x - D5a y ) 나노프로브의 정규화된 형광 강도. (도 7c) 나노프로브 pHt는 PR 세그먼트에서의 DEA-MA 단량체의 몰분율과 선형 상관관계가 있다. 이들 연구에서 중합체 농도는 0.1㎎/㎖였다.
도 8은 PDEA / PD5a 마이셀 배합물 대 P( DEA 40 - D5a 40 ) 공중합체 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. Cy5 염료(λex/λem = 646/662㎚)를 대응하는 공중합체의 PR 블록에 컨쥬게이션하였다. 정규화된 형광 강도 대 pH 관계를 도 7a에서 나타내었다.
도 9는 거친 조정 P( DEA x - D5a y ) 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. Cy5 염료(λex/λem = 646/662㎚)를 공중합체의 PR 블록에 컨쥬게이션시켰다. 정규화된 형광 강도 대 pH 관계를 도 7b에 나타내었다.
도 10a 내지 도 10 d:(도 10a) Cy5-컨쥬게이팅된 P( DPA x - DBA y ) 나노프로브에 대해 pH의 함수로서 정규화된 형광 강도. (도 10b) P( DPA x - DBA y ) 대 P(DEA 40 -D5a 40 ) 나노프로브에 대해 pH의 함수로서 유도체화된 형광 플롯(dF/dpH, 4a로부터의 데이터). 밀접한 소수성을 지니는 메타크릴레이트 단량체(즉, DPA/DBA 대 DEA/D5a)의 사용은 훨씬 더 가파른 pH 전이를 초래하였다. (도 10c) 상이한 공중합체 조성물에 대해 덜 소수성인 단량체의 몰분율의 함수로서 나노프로브 pHt의 선형 관계. 이들 상관관계는 작업자-사전결정 pHt를 달성하기 위해 최적의 공중합체 조성을 선택하기 위한 표준 곡선으로서 작용한다. (도 10d) 0.3 pH 증분으로 전체 생리적 범위의 pH(4 내지 7.4)를 아우르는 UPS 나노프로브의 대표적인 라이브러리. 모든 나노프로브를 Cy5 염료와 컨쥬게이션하였다. 중합체 농도는 0.1㎎/㎖였다.
도 11은 미세동조된 P( DPA x - DBA y ) 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. Cy5 염료(λex/λem = 646/662㎚)를 공중합체의 PR 블록에 컨쥬게이션시켰다. 정규화된 형광 강도 대 pH 관계를 도 10a에서 나타내었다.
도 12는 UPS 라이브러리 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. 각각의 UPS 나노프로브에 대한 조성을 표 3에 나타낸다. Cy5 염료(λex/λem = 646/662㎚)를 공중합체의 PR 블록에 컨쥬게이션시켰다. 정규화된 형광 강도 대 pH 관계를 도 10d에 나타내었다.
도 13은 0.3 pH 증분으로 10개 나노프로브로 이루어진 UPS 라이브러리의 형광 이미징을 도시한 도면. 각각의 UPS 나노프로브에 대한 조성물을 표 3에 나타낸다. Cy5 염료(λex/λem = 646/662㎚)를 공중합체의 PR 블록에 컨쥬게이션시였다. 나노프로브의 이미지를 마에스트로 이미징 시스템(Maestro Imaging system)에서 촬영하였다.
도 14a 내지 도 14f는 (도 14a) PEO-PDPA-염료/FQ 공중합체의 구조를 도시한 도면. (도 14b) 큰 스토크스 이동을 지니는 선택된 형광단의 구조를 도시한 도면. (도 14c) 선택된 로다민 염료의 구조를 도시한 도면. (도 14d) 선택된 보디피 염료의 구조를 도시한 도면. (도 14e) 선택된 사이아닌 염료의 구조를 도시한 도면. 모든 형광단에 대한 여기/방출 파장을 도 14b 내지 e에서 각각 나타낸다. (도 14f) 선택된 형광 소광제의 구조를 도시한 도면. 각각의 소광제의 활성 소광 범위를 괄호에 나타낸다.
도 15a 및 도 15b는 초-pH 민감성(UPS) 마이셀 나노프로브의 개략적 설계를 도시한 도면. (도 15a) 유니머 상태에서(pH < pHt), 중합체 해리는 형광단-소광제 분리 및 강한 형광 방출을 초래하였다. 마이셀 상태에서(pH > pHt), 형광 소광은 형광단의 방출 강도를 극적으로 억제한다. (도 15b) PR 세그먼트의 소수성을 연속적으로 미세동조하는 능력에 의해 나노프로브 pHt의 작업자-사전결정 제어를 달성하기 위해 공중합체 전략을 사용하였다.
도 16a 및 도 16b는 PDPA -염료/PDPA - FQ의 상이한 비로 pH 5.0(ON) 및 pH 7.4(오프)에서 혼합된 나노입자의 형광 강도비를 도시한 도면. (도 16a) 큰 스토크스 이동을 지니는 형광단(AMCA, MB 및 PPO)에 대한 결과. (도 16b) 형광단의 보디피(등록상표) 패밀리에 대한 결과. 형광단 및 FQ의 구조를 도 14a 내지 f에서 나타낸다.
도 17a 내지 도 17f는 형광 소광제가 없는(좌측 열) 또는 형광 소광제가 있는(우측 열)의 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. 큰 스토크스 이동을 지니는 형광단을 이 연구에 제시하였다. 형광단 및 FQ의 구조를 도 14a 내지 f에 나타내었다.
도 18a 내지 도 18 f는 FQ-컨쥬게이팅된 PDPA 공중합체의 도입은 상이한 PDPA -염료 나노프로브의 형광 활성화 비를 상당히 증가시켰음을 도시한 도면. 상이한 pH 대 pH 7.4(FpH/F7. 4)에서 형광 강도비를 공중합체 단독(도 18a, 도 18c 및 도 18e)에 대해 그리고 FQ-컨쥬게이팅된 공중합체의 첨가에 따라(도 18b, 18d 및 18f) 컨쥬게이팅하였다. 형광단 및 FQ의 구조를 도 14a 내지 도 14f에 나타내었다.
도 19a 내지 도 19f는 형광 소광제가 있는(좌측 열) 또는 형광 소광제가 있는(우측 열) 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. 형광단의 보디피(등록상표) 패밀리를 이 연구에 제시하였다. 형광단 및 FQ의 구조를 도 14a 내지 도 14f에 나타내었다.
도 20a 내지 도 20f는 형광 소광제가 있는(좌측 열) 또는 형광 소광제가 있는(우측 열) 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. 형광단의 로다민 패밀리를 이 연구에서 제시하였다. 형광단 및 FQ의 구조를 도 14a 내지 도 14f에 나타내었다.
도 21a 내지 e는 형광 소광제가 있는(좌측 열) 또는 형광 소광제가 있는(우측 열) 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. 형광단의 사이아닌 패밀리를 이 연구에서 제시하였다. 형광단 및 FQ의 구조를 도 14a 내지 f에 나타내었다.
도 22a 내지 도 22d는 상이한 pH 대 pH 7.4(FpH/F7. 4)에서 형광 강도비가 공중합체 단독(도 22a, 도 22c)에 대해 그리고 염료의 로다민 및 사이아닌 패밀리에 대한 FQ-컨쥬게이팅된 공중합체의 첨가에 따라(도 22b, 도 22d) 플롯팅하였다는 것을 도시한 도면. 형광단 및 FQ의 구조를 도 14a 내지 도 14f에 나타내었다.
도 23a 및 도 23b는 종양에서 호기적 해당 및 산성 세포외 pH(pHe)를 도시한 도면. (도 23a) 암 세포는 산소가 존재하는지의 여부와 상관없이 글루코스를 대부분 락트산염으로 전환시킨다(바르부르크 효과(Warburg effect)). 도면은 문헌[Heiden, et al., 2009]으로부터 적합하게 된다. (도 23b) 산성 pHe를 30종의 상이한 인간암 세포주로부터의 269 종양에서 측정하였다. 평균 pHe = 6.84(변화 범위는 6.71 내지 7.01), 이는 혈액 pH(7.4) 미만임. 도면은 문헌[Volk, et al., 1993]으로부터 적합하게 된다.
도 24는 넓은 pH 범위(4 내지 7.4) 및 큰 형광 방출(400 내지 820㎚)을 확장시키는 10개의 나노프로브로 이루어진 예시적인 UPS 라이브러리를 도시한 도면. 각각의 나노프로브는 그의 전이 pH 및 형광단에 의해 암호화된다. 4.4- AMCA 및 4.7-MB의 이미지를 여기광 365㎚에서 카메라에 의해 촬영하였다. 나노프로브 용액의 나머지의 이미지를 마에스트로 이미징 시스템 상에서 촬영하였다.
도 25는 2개의 독립적 메커니즘에 의한 이온성 중합체 마이셀의 자기-조립을 도시한 도면. 좌측 패널은 pH에 의한 마이셀화의 유도가 증가되며, PR 세그먼트가 중화되고 소수성이 되어 마이셀 형성이 구동된다는 것을 나타낸다. 놀랍게도, 낮은 pH에서 카오트로픽 이온(CA, 예컨대 ClO4 -)의 첨가는 암모늄 PR 세그먼트에 의한 마이셀화를 야기한다(우측 패널). 상이한 소수성 측쇄를 지니는 일련의 PEO - b -PR 공중합체(1-5)의 구조를 삽도에 나타낸다.
도 26a 내지 도 26c는 (도 26a) 카오트로픽 음이온이 양성자화된 PR 세그먼트를 지니는 PEO - b -PR 공중합체로부터의 마이셀 자기 조립, 즉, 단백질을 용해하는 그들의 능력(솔트 인(salt-in))으로부터 반전된 "솔트 아웃(salt-out)" 효과를 유도한다는 것을 도시한 도면. (도 26b) CA-유도 마이셀 자기 조립체를 연구하기 위한 FRET 설계의 도시. CA의 첨가는 마이셀 형성 및 공여체로부터 수용체(acceptor)(Cy5) 염료까지의 효율적인 에너지 전달(TMR)을 초래한다. (도 26c) 항-호프마이스터 경향을 나타내는 카오트로픽 음이온-유도 마이셀 자기 조립.
도 27은 상이한 농도의 카오트로픽 음이온에서 PEO - b -P( DPA - r - TMR )/ PEO - b -P(DPA- r -Cy5)의 FRET 중합체 쌍의 형광 스펙트럼을 도시한 도면. 샘플을 λex = 545㎚에서 여기시키고, 방출 스펙트럼을 560 내지 750㎚에서 수집하였다. 모든 실험을 PEO- b -PDPA의 전이 pH(pHt=6.1) 미만인 pH=4에서 수행하였다.
도 28은 상이한 농도의 코스모트로픽 및 경계 음이온에서 PEO - b -P( DPA - r -TMR)/ PEO - b -P( DPA - r - Cy5 )의 FRET 중합체 쌍의 형광 스펙트럼을 도시한 도면. 샘플을 λex = 545㎚에서 여기시키고, 방출 스펙트럼을 560 내지 750㎚에서 수집하였다. 모든 실험을 PEO - b - PDPA의 전이 pH(pHt=6.1) 미만인 pH=4에서 수행하였다.
도 29a 및 b는 Cl-(도 29a) 및 ClO4 - 음이온(도 29b)의 존재에서 공중합체 3의 마이셀 전이의 TEM 및 DLS 분석을 도시한 도면. 음이온 둘 다의 농도를 50mM에서 제어하였다(pH = 5.0). 축척 바는 TEM 이미지에서 100㎚이다.
도 30a 및 도 30b는 pH 7.4에서 Cl-(50mM)의 존재에서 공중합체 3의 마이셀의 마이셀 형태 및 유체역학적 직경의 (도 30a) TEM 및 (도 30b) DLS 분석을 도시한 도면. 축척 바는 TEM 이미지에서 100㎚이다.
도 31a 및 도 31b는 pH 7.4에서 ClO4 -(50mM)의 존재에서 공중합체 3의 마이셀의 마이셀 형태 및 유체역학적 직경의 (도 31a) TEM 및 (도 31B) DLS 분석을 도시한 도면. 축척 바는 TEM 이미지에서 100㎚이다.
도 32a 및 도 32b는 pH 7.4 및 5.0에서 ClO4 -(50mM)의 존재에서 PEO - b - PLA 공중합체의 마이셀 형태 및 유체역학적 직경의 (도 32a) TEM 및 (도 32b) DLS 분석을 도시한 도면. 축척 바는 TEM 이미지에서 100㎚이다.
도 33은 상이한 초기 농도의 Cl-(0 내지 2,000mM)에서 PEO - b -P( DPA - r -TMR)/PEO- b -P(DPA- r -Cy5)의 FRET 중합체 쌍의 형광 스펙트럼을 도시한 도면. 마이셀 형성을 유도하기 위해 상이한 농도의 ClO4 -(M) 음이온을 첨가하였다. 샘플을 λex = 545㎚에서 여기시키고, 방출 스펙트럼을 560 내지 750㎚에서 수집하였다. 모든 실험을 PEO- b -PDPA의 전이 pH(pHt=6.1) 미만의 pH=4에서 수행하였다.
도 34는 상이한 경쟁 Cl- 농도(0 내지 2,000mM)에서 ClO4 - 농도의 함수로서 FRET 전달 효율을 도시한 도면.
도 35는 상이한 초기 농도의 SO4 2-(0 내지 500mM)에서 PEO - b -P( DPA - r -TMR)/PEO- b -P(DPA- r -Cy5)의 FRET 중합체 쌍의 형광 스펙트럼을 도시한 도면. 마이셀 형성을 유도하기 위해 상이한 농도의 ClO4 -(M) 음이온을 첨가하였다. 샘플을 λex = 545㎚에서 여기시키고, 방출 스펙트럼을 560 내지 750㎚로부터 수집하였다. 모든 실험을 PEO- b -PDPA의 전이 pH(pHt=6.1) 미만의 pH=4에서 수행하였다.
도 36은 상이한 경쟁 SO4 2- 농도(0 내지 500mM)에서 ClO4 - 농도의 함수로서 FRET 전달 효율을 도시한 도면.
도 37a 및 도 37b는 상이한 농도의 경쟁 SO4 2- 음이온의 존재에서 공중합체 3의 (도 37a) ClO4 --유도 자기-조립을 도시한 도면. (도 37b) 경쟁 Cl- 및 SO4 2- 음이온의 이온 강도의 함수로서 ClO4 --유도 자기-조립으로부터의 FRET 효율(FC50). 이들 연구에서 용액 pH를 4에서 제어하였다.
도 38a 및 도 38b는 (도 38a) PR 세그먼트의 소수성 강도가 마이셀 유도에서 ClO4 -의 능력에 영향을 미친다는 것을 도시한 도면. 더 많은 소수성 PR 세그먼트(예를 들어, 5에서의 펜틸기)는 ClO4 - 민감성을 증가시켜 마이셀 형성을 유도한다. (도 38b) 이온성 중합체 마이셀의 자기-조립에 대한 2가지 중요한 기여 인자(소수성 알킬쇄 길이 및 카오트로픽 음이온)를 도시하는 경험 모델.
도 39는 상이한 소수성 강도의 PEO - b -P(R- r - TMR )/ PEO - b -P(R- r - Cy5 )의 FRET 중합체 쌍의 형광 스펙트럼을 도시한 도면(PR 세그먼트는 메틸에서 펜틸 측쇄까지 다양함). 마이셀 형성을 유도하기 위해 상이한 농도의 ClO4 -(M) 음이온을 첨가하였다. 샘플을 λex= 545㎚에서 여기시키고, 방출 스펙트럼을 560 내지 750㎚에서 수집하였다. 모든 실험을 PEO-b-PDPA의 전이 pH(pHt=6.1) 미만의 pH=4에서 수행하였다.
도 40a 내지 c는 6.9에서 절묘하게 급격한 pH 전이를 지니는 UPS6 .9 나노프로브를 도시한 도면. (도 40a) 이온화 가능한 블록 공중합체 및 그의 pH-의존적 형광 방출 특성의 구조. 높은 pH(즉, 7.4 또는 7.2)에서, UPS는 침묵으로 남아있다. 6.9 미만의 pH에서, UPS는 마이셀 해리의 결과로서 활성화된다. pH 반응은 가정적 소분자 pH 센서(청색 파선)보다 훨씬 더 급격하다. (도 40b) 상이한 pH 완충제 중의 UPS6 .9 용액의 형광 이미지. (도 40c) 각각 pH 7.4 및 6.7에서 마이셀 및 유니머 단계에서 UPS6.9의 투과 전자 현미경(중합체 농도 = 1㎎/㎖, 축척 바 = 100㎚).
도 41a 및 도 41b는 비슷한 크기를 지니지만 상이한 pH 전이(pHt = 6.3 및 6.9)를 지니는 2개의 UPS 나노프로브의 PK/BD를 도시한 도면.
도 42a 및 도 42b는 (도 42a) 원발성 HNSCC 종양의 제거 후 목 측면에 대한 대표적인 감시림프절의 NIR 이미지를 도시한 도면. (도 42b) 조직학(H&E)은 결절 구조를 입증할 수 있었다. 선택된 결절의 피질 영역에서 HN5 세포(검정색 화살표)의 존재를 나타내었다.
도 43a 내지 도 43i는 PINS 나노프로브의 합성 및 최적화를 도시한 도면. 도 43a ICG-컨쥬게이팅된 PEG-b-P(EPAx-r-ICGy)블록 공중합체의 개략적 합성. 도 43b 내지 도 43d pH-의존적 형광 특성에 대한 PEPA 세그먼트 영향의 연구: (도 43b) 형광 강도, (도 43c) 7.4 이상의 관심 대상의 pH에서 형광 활성화 비, 및 (도 43D) 정규화된 형광 강도. PEPA 세그먼트 길이는 변화된 반면(x= 40, 60, 80, 100, 120), 중합체 쇄 당 ICG의 수는 1에서 유지되었다. 도 43e 내지 도 43g: pH-의존적 형광 특성에 대한 ICG 컨쥬게이션 수의 영향 연구: (도 43e) 형광 강도, (도 43f) 7.4 이상의 관심 대상의 pH에서 형광 활성화 비, 및 (도 43g) 정규화된 형광 강도. 중합체 쇄 당 ICG의 수는 변화된 반면(y= 0.5, 1, 2), PEPA 세그먼트 길이는 100에서 제어되었다. 도 43h 및 도 43i: (도 43h) pH 7.4에서 인간 혈청 및 (도 43i) pH 6.0에서 인간 혈청에서 PEPA100-ICGy(n = 0.5, 1, 2)의 단량체 피크 강도(λ=808㎚)에 대한 정규화에 의한 UV-Vis 흡수 스펙트럼. 이들 데이터에 기반하여, PEG-b-P(EPA100-r-ICG1)는 동물 이미징 연구를 위한 최적의 조성물로서 선택하였다.
도 44a 내지 도 44f는 PINS의 특징을 도시한 도면. 도 44a PINS 농도 및 pH의 함수로서 형광 강도의 3D 플롯. 도 44b pH-민감성 오프/온 활성화를 나타내는 SPY 엘리트(SPY Elite)(등록상표) 수술 카메라에 의한 PINS 용액의 근적외선 이미지. 도 44c는 pH 7.4 및 6.5에서 각각 마이셀 및 유니머 상태로 PINS의 투고 전자 현미경. 중합체 농도 = 1㎎/㎖; 축척 바 = 100㎚. PBS(도 44d) 또는 50% 인간 혈청(도 44e) 중에서 저장 시 pH 6.5(검정색 막대) 및 7.4(흰색 막대)에서 PINS 형광 강도. 도 44f 저장 시 PINS 나노프로브의 수 중량 유체 역학적 반경. (도 44d) 내지 (도 44f)에 대한 저장 조건: -20℃에서 10% w/v 수크로스 용액. 이들 결과는 PINS가 -20℃에서 10% w/v 수크로스 용액 중에서 6개월 이상의 저장에서 안정하였다는 것을 나타낸다.
도 45a 내지 도 45e는 인간 HN5 정위 종양을 보유하는 마우스에서 PINS의 용량 반응을 도시한 도면. 꼬리 정맥을 통해 상이한 용량의 PINS(1.0, 2.5 및 5.0㎎/kg)을 주사한 마우스의 백색광(도 45a) 및 근적외선(도 45b) 이미지. HN5 종양 강도는 PINS 용량이 증가함에 따라 증가되었다. 2.5㎎/kg PINS까지 동등한 염료 용량으로 유리 ICG 대조군은 관찰가능한 종양 콘트라스트를 나타내지 않았다. 도 45c: 선택한 시점에서 상이한 용량의 PINS를 주사한 대표적인 마우스의 NIR 이미지. 정맥 주사 후 시간의 함수로서 종양 형광 강도의 정량화(도 45d) 및 노이즈비에 대한 종양 콘트라스트(도 45e)(n = 3). 5.0㎎/kg에서 더 높은 PINS 용량 근육 조직에서의 더 높은 배경 신호에 기인하여 감소된 CNR을 야기하였다. 도 45e로부터의 결과에 기반하여, 2.5㎎/kg를 종양 산성혈증 이미징에 대한 최적의 PINS 용량으로서 선택하였다.
도 46a 및 도 46b는 PINS에 의한 종양 산성혈증 이미징을 나타낸다. 도 46a FDG를 이용하는 PET에 의한 종양 대사 이미징 또는 PINS에 의한 NIR 형광 이미징의 개략도를 도시한 도면. 도 46b 큰 또는 작은 HN5 정위 종양을 보유하는 SCID 마우스에서 PINS 이미징과 FDG-PET의 비교. PINS 이미징은 FDG-PET에 대한 극적으로 개선된 민감도 및 종양 검출의 특이성을 나타내었다. 추가적인 비교는 도 47a 내지 도 47e에서 이용가능하다(각각의 그룹에 대해 n =3).
도 47a 내지 도 47e는 정위 HN5 종양을 보유하는 마우스에서 PINS 이미징과 FDG-PET의 비교를 도시한 도면. 큰 종양(200㎣, 도 47a) 또는 작은 종양(15㎣, 도 47b)을 지니는 동일한 그룹의 마우스에 대한 백색광, FDG-PET/CT 및 NIR 이미지. PINS 이미징은 모든 크고 작은 종양에 대해 선명한 종양 경계 묘사를 허용하였다. 큰 종양에 대해, FDG-PET는 종양 주변에 대해 더 높은 신호가 PINS 활성화와 일치한다는 것을 나타내었다. 큰 종양(도 47c) 및 작은 종양(도 47d)을 지니는 동일 그룹의 마우스의 시상면도. 도 47e 도 46a 및 도 46b에서 나타낸 큰 종양 및 작은 종양에 대한 스티치드(Stitched) H&E 이미지. 축척 바: 큰 종양에서 2 mm 및 작은 종양 이미지에서 500㎛.
도 48은 PINS 이미징이 광범위 종양 특이성을 달성한 방법을 도시한 도면. PINS 나노프로브(2.5㎎/kg, SPY 엘리트(등록상표) 임상 카메라에 의한 이미징 24시간 전에 i.v. 주사)는 상이한 종양 모델(두경부, 유방, 복막 전이, 신장, 뇌) 및 기관 부위에서 광범위 종양 이미징 효능을 입증한다. 화살촉은 종양 위치를 나타낸다.
도 49a 및 도 49b는 상이한 임상 카메라를 이용하는 PINS 나노프로브의 적합성을 도시한 도면. 도 49a: 임상적으로 사용된 ICG 이미징 시스템: 노바덱(Novadaq) SPY 엘리트(등록상표), 하마마츠(Hamamastu) PDE 및 레이카(Leica) FL-800 모델. 도 49b: 상이한 임상 ICG 이미징 시스템 하에서 동일한 종양 보유 마우스의 백색광 및 NIR 이미지.
도 50a 내지 도 50f는 PINS 주사 후 생체밖 기관 및 종양 형광 이미징을 도시한 도면. (도 50a) HN5, (도 50b) FaDu 및 (도 50c) HCC4034 두경부 종양, (도 50d) MBA-MD-231 및 (도 50e) 4T1 유방 종양, 및 (도 50f) U87 신경교종을 보유하는 마우스에서 나노프로브의 주사 후 24시간에 주요 기관의 NIR 이미지 및 형광 강도의 기관 대 근육비의 정량화. 데이터를 평균 ± s.d.로서 제시한다(n = 3). 신호 포화때문에 간을 계산하지 않았다.
도 51a 및 도 51b는 정위 두경부 종양을 보유하는 마우스에서 종양 산성혈증 가이딩 수술(TAGS)을 도시한 도면. 도 51a는 SPY 엘리트(등록상표) 카메라에 의한 원발성 HN5 종양 및 잔여 종양의 성공적인 검출의 수술 절제. 눈에 의한 종양층의 시각적 검사는 주변 근육 조직으로부터 잔여 종양을 차별화할 수 없었다(상부 좌측). 종양 조직(T) 및 정상 조직(N)을 조직학에 의해 입증하였다. 축척 바 = 1 mm(낮은 배율) 또는 100㎛(고 배율). 도 51b 예상한 바와 같이 감량 수술은 비처리 대조군 이상의 생존 이점을 제공하지 않았다. TAGS는 백색광 및 기타 대조군 이상의 상당히 개선된 장기간 생존을 나타낸다(****P < 0.0001). 대조군 및 감량 그룹에 대해 n = 7; 백색광 그룹에 대해 n = 15; TAGS 그룹에 대해 n = 18.
도 52는 원발성 종양, 종양 경계 및 음성층의 조직 확인을 도시한 도면. 비생존 수술 동안 수집한 각각의 유형의 표본으로부터 5가지 대표적인 H&E 조직학 이미지. 화살촉은 종양 경계 표본에서 암 세포의 존재를 나타낸다. 축척 바 = 1㎜ (상부 행, 저배율) 또는 100㎛(하부 행, 고 배율).
도 53a 내지 도 53d는 작은 잠재성 유방 종양 결절을 보유하는 마우스에서 종양 산성혈증 가이드 수술을 도시한 도면. 종양 병소(1백만개 미만의 세포)는 SPY 카메라 하에서 보았지만(도 53b) 시각적 검출에 의하지 않는다(도 53a). 도 53c: 작은 유방 종양 결절의 대표적인 이력 부문을 TAGS 동안 절제하였다; 축척 바 = 200㎛. 도 53d: 카플란-마이어(Kaplan-Meier) 곡선은 백색광 및 비처리 대조군 그룹에 걸쳐 TAGS에 의한 상당히 개선된 장기간 생존을 입증한다. 대조군에 대해, n = 7; 백색광 및 TAGS 그룹 n = 10; *P < 0.05.
도 54a 내지 도 54c는 PINS에 의한 상이한 종양 산성혈증 경로를 표적화하는 소분자 저해제의 평가를 도시한 도면. 도 54a: 괄호에서 선택된 소분자 저해제 및 그들의 대응하는 표적의 화학적 구조: 아세트아졸아마이드(CAIX), α-사이아노-4-하이드록시신나메이트 또는 CHC(MCT), 카리포라이드(NHE1) 및 판토프라졸(양성자 펌프). 도 54b: PBS 또는 다른 종양 산성혈증 저해제의 주사 후 면역적격 BalB/C 마우스에서 삼중 음성 4T1 유방 종양을 보유하는 마우스의 대표적인 이미지. 도 54c: 도 54b에서 나타낸 NIR 형광 이미지의 정량화. 형광 강도를 PBS 대조군에 대해 정규화하였다. 아세트아졸아마이드에 의한 CAIX 저해는 종양 산성혈증의 가장 효율적인 억제를 초래하였다.
도 55a 내지 도 55e는 건강한 C57bL/6 마우스에서 정맥내로 투여된 PINS의 안전성 평가를 도시한 도면. 도 55a: PBS 대조군에 비해 200 또는 250㎎/kg PINS의 볼루스 주사 후 C57bL/6 면역적격 마우스의 체중의 정규화된 변화. 도 55b 내지 도 55e: 상이한 용량에서 PINS의 볼루스 주사 후 그리고 선택 시점 후 희생시킨 C57bL/6 면역적격 마우스의 간(도 55b 및 도 55c) 및 신장(도 55d 및 도 55e) 기능에 대한 혈청 검사. 모들 그룹에 대해 n = 5. 약어: ALT, 알라닌 아미노트랜스퍼라제; GOT, 글루탐산 옥살로아세트산 트랜스아미나제; BUN, 혈액 요소 질소; CRE, 크레아티닌; 점선은 C57bL/6 마우스에 대한 전형적인 야생형 평균값을 나타낸다.
도 56은 PINS의 안전성 평가를 위한 주요 기관의 조직학 분석을 도시한 도면. PINS의 볼루스 주사(250㎎/kg) 또는 반복 주사(25㎎/kg/주, 5회 주사) 후에 그리고 선택 시점 후 희생시킨 C57bL/6 면역적격 마우스로부터의 주요 기관의 대표적인 H&E 부문(각각의 그룹에 대해 n=5). 250㎎/kg에서, 미세지방증을 더 이른 시점(제1일 및 제7일)에 간에서 관찰하였지만, 제28일에 회복되었다. 비장, 신장 및 심장은 기형을 나타내지 않았다. 반복 주사에 대해, 임의의 주요 기관에서 이상이 관찰되지 않았다.
도 57a 내지 도 57c는 넓은 생리적 pH 범위에 걸쳐 급격하게 한정된 완충 능력을 지니는 UPS 나노입자 라이브러리를 도시한 도면. (도 57a) UPS 나노입자의 완충 효과 및 미세 동조 가능한 소수성 및 pKa를 지니는 PEO-b-P(R1-r-R2) 공중합체의 화학적 구조의 개략적 도시. 각각의 공중합체에 대한 조성물을 표 11에 나타낸다. (도 57b) 0.4M HCl을 이용하는, UPS6 .2, UPS5 .3 및 UPS4 .4 나노입자를 함유하는 용액의 pH 적정. 최대 완충제 pH는 각각의 공중합체의 겉보기 pKa에 대응한다. 클로로퀸(CQ, pKa = 8.3 및 10.4), 소분자 베이스, 및 폴리에틸렌이민(PEI)을 비교를 위해 포함시켰다. (도 57c) UPS 라이브러리의 각각의 구성성분에 대한 완충 능력(β)을 4.0 내지 7.4의 pH 범위에서 pH의 함수로서 플롯팅하였다. 상이한 pH 값에서, UPS 나노입자는 CQ 이상으로 완충제 강도에서 30 내지 300배 더 높았다. L.E. 및 E.E.는 각각 후기 엔도좀 및 초기 엔도좀에 대한 약어이다.
도 58은 염료-컨쥬게이팅된 2블록 공중합체의 합성을 도시한 도면. PR 세그먼트는 상이한 몰분율을 지니는 2개의 단량체로부터의 무작위 블록으로 이루어져서 그의 소수성 및 pH 전이를 미세동조한다(표 10 참조). Cy5 염료의 구조를 또한 나타낸다.
도 59는 UPS 나노프로브 라이브러리의 TEM 이미지를 도시한 도면. 나노프로브를 PBS 완충제(pH 7.4) 중에 용해시키고, TEM 분석 전에 탄소 그리드 상에서 건조시켰다. 음성 염색법을 위해 포스포텅스텐산을 사용하였다. 축척 바 = 모든 이미지에 대해 100㎚.
도 60은 UPS 나노프로브 라이브러리의 각각의 구성성분의 pH 적정을 도시한 도면. HCl(0.4 M)은 모두 10개의 UPS 나노프로브의 마이셀 용액(아민기의 양에 기반하여 2㎎/㎖ 중합체 농도 또는 8mM), 클로로퀸 용액(아민기의 양에 기반하여 2㎎/㎖ 또는 12.5mM) 및 PEI(분지됨, MW 10,000Da, 폴리사이언스 인코포레이티드(Polyscience, Inc.)) 용액(아민기의 양에 기반하여 0.3㎎/㎖ 또는 7.3mM)을 적정하기 위해 증분적으로 첨가하였다. pH/도전율계(메틀러 톨레도(Mettler Toledo))를 사용하여 적정 동안 용액 중의 pH 변화를 모니터링하였다.
도 61a 내지 도 61c는 항상-온/오프-온 UPS(Always-ON/OFF-ON UPS) 나노입자의 합성 및 특성규명을 도시한 도면. (도 61a) 및 (도 61b) 이중 리포터 나노입자의 개략도. 마이셀 상태에서, 항상-온 염료는 온/오프 형광단에 대한 소광제로서 작용한다. 마이셀이 분해될 때, 항상-온 및 온/오프 형광단은 독립적으로 형광을 낸다. 이들 두 염료와 컨쥬게이션된 중합체의 비가 변함에 따라 보디피(도 61a) 및 Cy3.5(도 61b)의 온/오프 비는 변한다. 60% 보디피-컨쥬게이팅된 공중합체와 40% Cy3.5-컨쥬게이팅된 공중합체의 중량 분율을 최종 조합으로서 선택하였다. (도 61c) pH의 함수로서 UPS6 .2 나노프로브의 형광 신호 증폭. 녹색 및 황색 필터를 이용하여 마에스트로 생체내 이미징 시스템(CRI) 상에서 이미지를 캡처하였다.
도 62a 내지 도 62c는 HeLa 세포에서 식균 작용 기관의 pH-민감성 이미징 및 완충작용을 도시한 도면. (도 62a) 저용량(100㎍/㎖) 및 고용량 (1,000㎍/㎖)의 UPS6.2에 대한 5분 노출 후 표시 시점에서 HeLa 세포의 대표적인 공초점 이미지. 핵을 호크스트에 의해 청색으로 염색하였다. 축척 바 = 10㎛. (도 62b) 항상-온/오프-온 UPS6 .2의 활성화 역학의 정량적 분석. 보디피 채널(오프-온)에서 점무늬의 형광 강도를 Cy3.5의 형광 강도에 대해 정규화시켰다(항상-온). (도 62c) 표시 용량의 UPS6 .2로 처리한 HeLa 세포에서 엔도좀/리소좀 pH의 실시간 측정. 인시추 pH 측정을 위해 리소센서 비율계량 이미징 프로브를 사용하였다. 오차 막대는 각각의 시점에 50개 세포기관으로부터의 표준 편차를 나타낸다.
도 63a 내지 도 63c는 UPS5 .3 나노프로브에 의한 HeLa 세포의 완충 식균 작용 세포소기관을 도시한 도면. (도 63a) 저용량(100㎍/㎖) 및 고용량(1,000㎍/㎖)의 항상-온(Cy3.5) /오프-온(보디피) UPS5 .3에 대한 5분 노출 후 표시 시점에서 HeLa 세포의 대표적인 공초점 이미지. 핵을 호크스트에 의해 청색으로 염색하였다. 축척 바 = 10㎛. (도 63b) UPS5 .3의 오프-온 활성화 과정의 정량적 분석. 보디피 채널에서 세포 내 점무늬의 형광 강도를 TMR 채널에서 동일한 점무늬의 형광 강도에 대해 정규화시켰다. (도 63c) 표시 용량의 항상-온(Cy3.5)/오프-온(보디피) UPS5 . 3로 처리한 HeLa 세포에서 엔도좀/리소좀 pH 변동의 실시간 측정. 인시추 pH 측정을 위해 리소센서 황/청 DND160 비율계량 이미징 프로브를 사용하였다. 오차 막대는 각각의 시점에 50개 세포소기관으로부터의 표준 편차를 나타낸다.
도 64a 내지 도 64f는 식균 작용 세포소기관의 pH 완충이 그들의 막 단백질 역학에 영향을 미친다는 것을 도시한 도면. HeLa 세포를 세포 흡수 동안 5분 동안 1,000㎍/㎖ UPS6 .2-Cy5 또는 UPS4 .4-Cy5로 처리하였다. 이어서, 그들은 고정 전 15분(도 64a), 1시간(도 64b) 및 2시간(도 64c) 동안 인큐베이션시켰다. 면역형광(IF) 이미지는 초기 엔도좀(Rab5) 또는 리소좀(LAMP2)에서 UPS 나노프로브의 국소화를 나타낸다. 축척 바 = 10㎛ 및 5㎛(삽도). 이마리스(Imaris) 소프트웨어를 사용하여 z-적층 공초점 이미지의 군집화를 분석하였다. Rab5(도 64d) 및 LAMP2(도 64e)와 함께 공동국소화된 UPS의 분획 및 LAMP2와 함께 공동국소화된 Rab5의 분율(도 64f)을 먼델 계수(Mander's coefficient)로부터 계산하였다, n = 10, α = 0.05, ****p<0.0001. 이원 ANOVA 및 시닥 다중 비교 검정(Sidak's multiple comparison test)을 수행하여 통계학적 유의도를 평가하였다.
도 65a 내지 도 65e는 UPS에 의한 엔도좀-리소좀의 클램핑 내강 pH가 아미노산-의존적 mTORC1 활성화를 선택적으로 저해한다는 것을 도시한 도면. HeLa 세포를 2시간 동안 EBSS에서 기아 상태로 만들었고, 이어서, (도 65a) UPS6 .2/UPS5 .3/UPS5 .0 및 (도 65b) UPS4 .7/UPS4 .4의 존재에서 표시 시간 간격 동안 필수 아미노산(EAA)으로 자극하였다. 물 및 50μM 클로로퀸(CQ)을 대조군으로서 사용하였다. 표시한 인단백질의 축적을 전세포 용해물의 면역블롯에 의해 평가하였다. (도 65c) 표시 처리 후 GFP-TFEB의 핵/사이토졸 분포의 정량적 분석. 오차 막대는 표준 편차를 나타낸다, n = 10. (도 65d) 도 65c에 대한 대표적인 이미지. 축척 바 = 10㎛. (도 65e) mTORC1 신호전달 경로의 알부민-유도 아미노산 의존적 활성화에 대해 유리 아미노산에 필요한 pH 전이의 작업 모델.
도 66a 내지 도 66c는 UPS 노출 시 mTORC1 신호 정량화 및 카텝신 B 활성을 도시한 도면. (도 66a 및 도 66b) 도 64a 및 도 64b에서 총 단백질 수준에 의해 정규화된 인산화된 S6 단백질의 정량적 분석. 각각의 시점에 대조군(물)과 UPS 처리군 사이의 통계적 차이를 이원 ANOVA 및 더넷(Dunnett's) 다중 비교 검정에 의해 검출하였다, α = 0.05, **p<0.01, ****p<0.0001 또는 유의하지 않음(n.s.). 대조군고 UPS 처리군 사이의 통계학적 차이는 도 66b에서 임의의 시점에 유의하지 않았다. 오차 막대는 표준 편차를 나타낸다, n = 3. (도 66c) 카텝신 B 활성을 표시 처리에 응하여 측정하였다(n = 2). '섭식'과 모든 다른 그룹 간의 통계학적 차이를 일원 ANOVA 및 더넷 다중 비교 검정에 의해 검출하였다, α = 0.05, *p<0.05 또는 유의하지 않음(n.s.).
도 67a 내지 도 67d는 알부민-의존적 mTORC1 경로 활성화가 UPS4 .4에 의해 저해된다는 것을 도시한 도면. (도 67a) HeLa 세포는 2시간 동안 영양소가 고갈된 다음 표시된 UPS 나노입자(1,000㎍/㎖)의 존재 또는 부재에서 BSA 흡수(2%)되었다. 표시 인단백질의 축적을 전세포 용해물의 면역블롯에 의해 모니터링하였다. (도 67b) GFP-태그 TFEB의 핵/사이토졸 분포를 표시 조건에 응하여 모니터링하였다. (도 67c) 인산화된 S6 단백질의 정량적 분석을 (도 67a)에서의 총 단백질 수준에 의해 정규화하였다. 오차 막대는 표준 편차를 나타낸다, n = 3. 각각의 시점에 대조군과 UPS 처리군 사이의 통계학적 차이를 이원 ANOVA 및 더넷 다중 비교 검정에 의해 검출하였다, α = 0.05, **p<0.01, ****p<0.0001 또는 유의하지 않음(n.s.). (도 67d)(도 67b)(사이토졸에서 = 0, 핵에서 = 1)에서 나타낸 결과에서 TFEB의 국소화의 정량적 분석. 오차 막대는 표준 편차를 나타낸다. 축척 바 = 10㎛.
도 68a 내지 도 68c는 리소좀 pH의 선택적 완충이 세포 대사 풀을 조절한다는 것을 도시한 도면. (도 68a) 계통도는 총 단백질 함량에 대해 정규화한 바와 같이 영양소가 가득한(섭식) 또는 고갈된(기아) 배지에서 표시한 대사산물의 상대적 존재비를 표시한다. 세포를 표시 용량에서 UPS4 .4로 처리하였다. (도 68b) 영양소가 가득한 조건과 영양소가 고갈된 조건 하에서 선택 아미노산의 정규화된 존재비. 오차 막대는 표준 편차를 나타낸다, n = 6. (도 68c) 세포 대사 풀의 균형에 대한 환경 및 리소좀 pH의 결과를 나타내는 개략도.
도 69a 내지 도 69g는 UPS 나노입자가 리소좀 스트레스에 민감한 NSCLC 세포를 선택적으로 사멸시킨다는 것을 도시한 도면. (도 69a) 사용한 세포 모델의 개략도 및 리소좀 성숙에 대한 그들의 대응하는 취약성. (도 69b) 유효량으로 UPS에 노출과 함께 그리고 노출 없이 HBEC30 KT 및 HCC4017의 상대적 생존능력을 나타내는 DIC 이미지(UPS6 .2 및 UPS5 .3 = 400㎍/㎖, UPS4 .4 = 1,000㎍/㎖). 축척 바 =100㎛. (도 69c 내지 도 69e) HBEC30KT, HBEC30KT KP, HBEC30KT KPL 및 HCC4017 세포에서 카스파제3/7 활성을 표시 용량의 UPS에 노출 후 72시간에 측정하였다. 이원 ANOVA 및 시닥 다중 비교 검정을 수행하여 HBEC30KT와 HCC4017, 및 HBEC30KT KP와 HBEC30KT KPL 사이에서 관찰된 차이의 통계학적 유의도를 평가하였다, α = 0.05, **p<0.01, ****p<0.0001. (도 69f 및 도 69g) 메틸 파이루베이트(MP), 다이메틸-2-옥소글루타레이트(MOG), 또는 물(파선)의 표시 농도와 함께 72시간 동안 1,000㎍/㎖ UPS6 .2에 대한 HCC4017(도 69f) 및 HBEC30 KT KPL(도 69g)의 노출 후 세포의 ATP 수준을 측정하였다. 처리가 없는(UPS가 없음) 대조군에 대해 값을 정규화시켰다. 오차 막대는 표준 편차를 나타낸다, n = 4.
도 70a 내지 도 70d는 I-UPS6 .9 나노프로브를 나타낸다. (도 70a) ICG-컨쥬게이팅된 블록 공중합체, PEG-b-P(C7A-r-ICG)의 개략적 합성. (도 70b) pH-민감성 off/on 활성화를 나타내는 SPY 엘리트(등록상표) 수술 카메라에 의한 I-UPS6 .9 용액의 근적외선 이미지. (도 70c) pH의 함수로서 정규화된 형광 강도는 더 긴 PC7A 세그먼트가 약간 더 낮은 pH 전이 및 더 급격한 반응을 야기한다는 것을 나타낸다. (도 70d) 프로브 농도 및 pH의 함수로서 형광 강도의 3D 플롯. 도 70b 내지 70d로부터의 데이터를 20% 혈청-함유 용액 중에서 얻었다.
도 71은 킬레이터 컨쥬게이팅된 중합체, CB-TE2A-PEG-PC7AX의 제안된 합성 경로를 도시한 도면.
도 72는 FDG-PET 및 I-UPS에 의해 이미징된 정위 HN5 종양을 보유하는 마우스를 도시한 도면. FDG-PET 이미지에서 갈색 지방 또는 목 근육(화살표)로부터의 위양성을 나타내는 시상면 위치에서 마우스를 이미징하였다.
도 73은 다양한 종양 모델(두경부, 유방, 결장직장 복막 전이, 신장, 뇌)에서 광범위 암 특이성을 지니는 I-UPS에 의한 종양 산성혈증 이미징을 도시한 도면. 황색 화살촉은 종양 위치를 나타낸다. I-UPS6 .9(2.5㎎/kg)는 SPY 카메라에 의한 이미징 전 24시간에 i.v. 주사하였다.
도 74a 및 도 74b는 (도 74a) 정위 4T1 유방 종양의 I-UPS6 .9-가이딩된 절제를 도시한 도면. 종양 병소(1백만개 미만의 세포)는 SPY 카메라 하에서 가시적이었지만(우측 패널), 시각적 검출에 의하지 않는다(좌측 패널). (도 74b) 카플란-마이어 곡선은 백색광(P<0.05) 및 비처리 대조군(P<0.01)에 대한 I-UPS6 .9-가이딩된 절제에 의한 개선된 장기간 생존을 입증한다.
도 75는 항상-온/오프-온 이중 리포터 신호를 지니는 UPS 나노프로브를 도시한 도면. UPS6 .9는 예로서 사용되며, FRET 공여체/수용체 쌍으로서 보디피/Cy3.5가 사용된다.
도 76a 내지 도 76c는 미세동조된 pH 전이를 지니는 UPS 나노프로브를 도시한 도면. (도 76a) PR 블록에서 DPA-MA 및 DEA-MA 서브유닛의 몰분율을 달리함에 따른 PEG-b-PR 공중합체의 합성 개략도. (도 76b) 상이한 PR 조성에 대한 UPS 나노프로브의 pH 반응. Cy5.5를 모델 염료로서 사용하였다. (도 76c) DPA의 몰 백분율의 함수로서 전이 pH는 사전결정된 pH 전이를 지니는 UPS의 합리적 설계를 위한 표준 곡선을 확립한다.
도 77은 암 세포에서 pH 조절 기작을 도시한 도면. 양성자 펌핑은 미세환경에서 종양 산성혈증을 초래할 뿐만 아니라 세포 증식 및 이동을 촉진시키기 위해 세포내 pH를 상승시킨다(Neri & Supuran, 2011).
도 78a 내지 도 78e는 UPS6 .9 나노프로브가 A549 폐 종양에서 종양 pHe를 특이적으로 이미징할 수 있다는 것을 도시한 도면. (도 78a) 호기성 해당은 암 세포에서 글루코스를 락트산염으로 전환한다. 2-DG 및 CHC는 각각 글루코스 흡수 및 락트산 분비에 대한 대사 저해제이다. (도 78b) A549 세포에서 락트산 분비 속도에 대한 2-DG 또는 CHC의 효과. (도 78c) 6시간 인큐베이션 후 2-DG 또는 CHC의 존재에서 A549 세포 배양 배지의 산성화. *P < 0.05, **P < 0.01, ***P < 0.001, 비히클과 비교함. (도 78d) UPS6 .9(10㎎/kg)의 주사 후 24시간에 A549 종양-보유 마우스의 오버레이된 형광 이미지. 대조군에서, 2-DG(250㎎/kg) 또는 CHC(250㎎/kg)를 UPS6.9 투여 전 12시간에 주사하였다. Cy5.5(밝은 점) 및 자가형광(밝은 배경)을 복합 이미지에서 나타낸다. (도 78e) UPS6 .9 주사 후 시간의 함수로서 종양과 정상 조직 사이의 NIR 형광 강도비(T/N 비). 데이터를 평균 ± s.d.로서 제시한다(n = 4).
도 79a 내지 도 79c는 정위 4T1 유방 종양의 I-UPS 이미징을 도시한 도면. 종양 병소(1백만개 미만의 세포)는 SPY 카메라 하에 가시적이었지만(열 모드, 도 79b) 시각적 검출에 의해서는 보이지 않았다(도 79a). 종양 존재를 조직학에 의해 입증하였다(도 79c). 축척 바는 도 79c에서 200㎛이다.
도 80은 FDG-PET 및 I-UPS에 의해 이미징되는 정위 HN5 종양을 보유하는 마우스를 도시한 도면. 마우스는 FDG-PET 이미지에서 (3마리 마우스 중 2마리) 목에서 갈색 지방 조직으로부터의 위양성을 나타내기 위해 시상면 위치에서 이미징된다.
도 81은 80명의 인간 비소세포 폐암 세포의 패널로부터의 글루코스 소모 및 락트산염 분비 속도를 도시한 도면. 이들 폐암 세포는 Lacout/Gluin의 비로서 표시하는 바와 같은 다양한 해당과정 속도를 보여준다.
도 82는 보디피 및 Cy3.5 신호를 정량화하고, 조직학에 의해 설명된 진정한 종양 경계를 상호연관 짓는 개략도를 도시한 도면. 종양 접점에 대한 수직선에 따른 형광 강도가 측정될 것이다. 평균 강도 대 거리는 종양 경계를 따라 다중 접점으로부터 결정될 것이다.
도 83은 비슷한 크기이지만 상이한 pH 전이를 지니는 2개의 UPS 나노프로브의 PK/BD의 비교를 도시한 도면.
도 84a 내지 도 84c는 다중 스펙트럼 혼성 UPS 나노프로브의 개략도 및 작업 원리를 도시한 도면. 도 84a: 다중-스펙트럼 혼성 UPS 나노프로브는 상이한 형광 염료에 의해 각각 암호화된 3개의 PEG-b-PR 블록 공중합체에 의해 공학 처리된다. 혼성 UPS 나노프로브는 중성 pH에서 "오프(오프)"로 남아있다. pH가 낮아질 때, PEG-b-(PR-r-염료) 성분은 해리되고, 미묘한 pH 변화와 만날 때 상이한 색을 제공하도록 순차적으로 형광을 낸다. 도 84b: PEG-b-PR 블록 공중합체 및 형광 염료 컨쥬게이팅된 중합체의 화학적 구조. 도 84c: 수용기-매개된 내포작용, 예컨대 혈관내피세포 성장인자 수용기(EGFR)를 통한 살아있는 세포 내 다중-스펙트럼 혼성 UPS 나노프로브의 내재화 및 활성화. 내재화 후에, PEPA-BDY493은 클라트린-코팅 소수포(CCV, pH 대략 6.8)에 의해 온(ON)으로 전환되고, 이어서, PDPA-TMR은 초기 엔도좀에 의해 활성화되며(pH 대략 6.0), 최종적으로 PDBA-Cy5는 후기 엔도좀/리소좀(pH 대략 5.0 내지 5.5)에 의해 온으로 조정된다.
도 85a 및 도 85b는 (도 85a) pH-의존적 형광 방출 스펙트럼 및 (도 85b) 0.1 M PBS 용액 중에서 pH의 함수로서 PEPA-BDY493의 형광 강도 비를 도시한 도면. 샘플을 488㎚에서 여기시키고, 방출 스펙트럼을 500 내지 650㎚에서 수집한다. 중합체 농도를 0.1㎎/㎖에서 제어한다.
도 86a 및 도 86b는 (도 86a) pH-의존적 형광 방출 스펙트럼 및 (도 86b) 0.1 M PBS 용액 중에서 pH의 함수로서 PDPA-TMR의 형광 강도비를 도시한 도면. 샘플을 545㎚에서 여기시키고, 방출 스펙트럼을 560 내지 750㎚에서 수집한다. 중합체 농도를 0.1㎎/㎖에서 제어한다.
도 87a 및 도 87b는 (도 87a) pH-의존적 형광 방출 스펙트럼 및 (도 87b) 0.1 M PBS 용액 중에서 pH의 함수로서 PDBA-Cy5의 형광 강도비를 도시한 도면. 샘플을 640㎚에서 여기시키고, 방출 스펙트럼을 650 내지 750㎚에서 수집한다. 중합체 농도를 0.1㎎/㎖에서 제어한다.
도 88은 PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5 마이셀에 대해 pH의 함수로서 정규화된 형광 강도를 도시한 도면. 중합체 농도는 100㎕/㎖였다.
도 89a 및 도 89b는 분자 혼합된 마이셀 및 마이셀 혼합물의 형광 특징을 도시한 도면. (도 89a) pH 7.4에서 1:19의 몰 비로 PDBA-Cy5 및 PEG-b-(PR-r-AMA3)의 분자 혼합된 마이셀의 형광 강도. (도 89b) pH 7.4에서 1:19의 몰 비로 PDBA-Cy5 마이셀과 PEG-b-(PR-r-AMA3) 마이셀의 마이셀 혼합물의 형광 강도.
도 90a 내지 도 90d는 형광 공명 에너지 전이(FRET) 실험이 다중-스펙트럼 혼성 UPS 나노프로브의 형성을 입증한다는 것을 도시한 도면. PEG-b-PR 블록 공중합체는 상이한 염료에 의해 암호화된다. PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5를 포함하는 3가지 예시적인 PEG-b-(PR-r-염료) 블록 공중합체는 호모FRET 효과를 최소화하기 위해 낮은 염료/중합체 비(1:1)로 합성된다. 도 90a: PEPA-BDY493, PDPA-TMR, PEPA-BDY493/PDPA-TMR(1:1) 마이셀, 및 PEPA-BDY493과 PDPA-TMR의 마이셀 혼합물을 485㎚에서 여기시키고, 이어서, 방출 스펙트럼을 490 내지 720㎚에서 수집한다. PEPA-BDY493 내지 PDPA-TMR의 강한 FRET 효과가 관찰되는데, 이는 PEPA/PDPA 혼성 나노입자의 형성을 나타낸다. 도 90b: PDPA-TMR로부터 PDBA-Cy5까지의 강한 FRET 효과가 관찰되는데, 이는 PDPA/PDBA 혼성 나노입자의 형성을 나타낸다. 도 90c: PEPA-BDY493으로부터 PDBA-Cy5까지의 강한 FRET 효과가 관찰되는데, 이는 PEPA/PDBA 혼성 나노입자의 형성을 나타낸다. 도 90d: BDY493으로부터 TMR까지, 최종적으로 Cy5까지의 강한 순차적 FRET 효과가 관찰되는데, 이는 PEPA/PDPA/PDBA 혼성 나노입자의 형성을 나타낸다.
도 91은 PEPA-BDY493 (1), PDPA-TMR (2), PDBA-Cy5 (3), 및 3위 1체(three-in-one) 혼성 나노프로브(4)를 포함하는 염료-컨쥬게이팅된 중합체 마이셀의 대표적인 이미지를 도시한 도면.
도 92a 내지 도 92f는 혼성 나노프로브의 시험관내 특징을 도시한 도면. (도 92a 내지 도 92d) 상이한 pH 완충제에서 혼성 나노프로브의 형광 스펙트럼. BDY493, TMR 및 Cy5 신호는 각각 485, 545 및 640㎚에서 여기된다. BDY493, TMR 및 Cy5에 대한 방출 스펙트럼은 각각 490 내지 750㎚, 560 내지 750, 및 650 내지 750㎚로부터 수집된다. (도 92e) 시간의 함수로서 혼성 나노프로브의 계수율 및 정규화된 형광 강도를 플롯팅한다. 상이한 pH에서 계수율을 동적 광산란 분석에 의해 결정한다. 다중-스펙트럼 혼성 UPS 나노프로브의 다단계 활성화를 상이한 pH 범위에서 녹색, 적색 및 청색 S자형 곡선에 의해 나타낸다. (도 92f) 상이한 pH에서 다중-스펙트럼 UPS 나노프로브의 대표적인 형광 이미지를 캡처한다. 황색은 녹색과 적색 신호가 병합된 색이다. 백색은 청색, 녹색 및 적색 신호가 병합된 색이다.
도 93a 내지 도 93f는 혼성 나노프로브의 pH-의존적 형광 방출 스펙트럼을 도시한 도면. BDY493, TMR 및 Cy5 신호는 각각 485, 545 및 640㎚에서 여기되었다. 대응되는 방출 스펙트럼을 각각 490 내지 750, 560 내지 750 및 650 내지 750㎚에서 수집하였다.
도 94는 pH의 함수로서 혼성 UPS 나노프로브 내 PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5 성분의 정규화된 형광 강도를 도시한 도면.
도 95a 및 도 95b는 상이한 pH 용액에서 혼성 나노프로브의 형태 및 입자 크기 분포의 (도 95a) TEM 및 (도 95b) DLS 분석을 도시한 도면. 축척 바는 TEM 이미지에서 100㎚이다.
도 96은 A549 세포에서 에르비툭스(Erbitux)-컨쥬게이팅된 PDPA-TMR 나노프로브의 특이적 형광 활성화를 도시한 도면. 세포를 에르비툭스-컨쥬게이팅된 PDPA-TMR 마이셀 (상부) 또는 PDPA-TMR 마이셀(하부)로 1시간 동안 각각 처리하였다. 축척 바는 40㎛이다.
도 97은 A549 인간 폐암 세포의 단일 식균 작용 세포 소기관에서 에르비툭스-암호화된 혼성 UPS 나노프로브의 동시통합화된 흡수를 도시한 도면. 종양 세포를 3시간 동안 나노프로브와 함께 인큐베이션시킨 다음 공초점 이미징하였다. 축척 바는 40㎛이다.
도 98은 폐암 A549 세포에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 99는 두경부암 HN5 세포에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 100은 KRAS 유전자 돌연변이를 갖는 인간 폐암 H460 세포주에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 101은 KRAS 유전자 돌연변이를 갖는 인간 폐암 A549 세포주에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 102는 P53 유전자 돌연변이를 갖는 인간 폐암 H2882 세포주에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 103a 및 도 103b는 폐암 세포주의 패널에서 세포 소기관 성숙을 도시한 도면. 초기 엔도좀(도 103a) 및 후기 엔도좀/리소좀(도 103b)의 성숙 속도의 정량화는 표현형 차이를 초래하는 Kras 돌연변이를 정확히 기술한다. 30분에 초기 엔도좀(EE)에서 PDPA-TMR(I 6.2)의 형광 강도는 PEPA-BDY493 신호(I 6.9)에 의해 정규화된다. 75분에 후기 엔도좀/리소좀(LE/Lys)에서 PDBA-Cy5(I 5.3)의 형광 강도는 PEPA-BDY493 신호(I 6.9)에 의해 정규화된다. Kras 돌연변이 세포주와 Kras 야생형 세포주 사이의 상당한 차이는 KRAS 돌연변이가 후기 엔도좀/리소좀 성숙을 초래한다는 것을 나타낸다. **P<0.01, 짝지은, 양측 t-검정; n = 10.
도 104a 내지 도 104d는 폐암 세포주의 패널에서 세포 소기관 성숙을 도시한 도면. 초기 엔도좀(도 104a) 및 후기 엔도좀/리소좀(도 104b)의 성숙 속도의 정량화는 표현형 차이를 초래하는 Kras 돌연변이를 정확히 기술한다. 도 104c: 30분에 초기 엔도좀(EE)에서 PDPA-TMR의 형광 강도(I 6.2)는 PEPA-BDY493 신호(I 6.9)에 의해 정규화된다. 도 104d: 75분에 후기 엔도좀/리소좀(LE/Lys)에서 PDBA-Cy5(I 5.3)의 형광 강도는 PEPA-BDY493 신호(I 6.9)에 의해 정규화된다. K-ras 돌연변이 세포주와 K-ras 야생형 세포주 사이의 상당한 차이는 KRAS 돌연변이가 후기 엔도좀/리소좀 성숙을 초래한다는 것을 나타낸다. **P<0.01, 짝지은, 양측 t 검정; n = 10.
도 105a 및 도 105b는 살아있는 세포에서 다중-스펙트럼 혼성 UPS 나노프로브를 이용하는 내포작용 동안 세포 소기관 성숙의 다단계 pH 이미징을 도시한 도면. HBEC30 폐 상피세포(도 105a) 및 동질유전자 HCC4017 폐암 세포(도 105b)를 4℃에서 30분 동안 100㎍/㎖ 에르비툭스-컨쥬게이팅된 혼성 UPS 나노프로브와 함께 인큐베이션시키고 나서, 세척하고, 공초점 현미경 하에 37℃에서 실시간으로 이미징하였다. PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5 신호를 각각 488, 543 및 637㎚에서 여기시킨다. FITC(515/30BP), TRITC(590/75bP) 및 Cy5(650LP) 필터를 PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5 이미지 캡처를 위해 사용한다. BDY493, TMR 및 Cy5를 각각 녹색, 적색 및 청색으로 나타낸다. 축척 바는 20㎛이다.
도 106은 HBEC30KT 인간 상피 세포에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 107은 인간 동질유전자 HCC4017 폐암 세포에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 108은 HBEC30KT-shTP53 세포에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 109는 HBEC30KT-shTP53 / KRAS G12V 세포에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 110은 HBEC30KT-shTP53 / KRAS G12V / shLKB1 세포에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 111a 내지 도 111d는 동질유전자 진행 계열의 HBEC30 세포에서 시간-과정 세포 소기관 성숙을 도시한 도면. 초기 엔도좀(도 111a) 및 후기 엔도좀/리소좀(도 111b)의 성숙 속도의 정량화는 표현형 차이를 초래하는 Kras 돌연변이를 정확히 기술한다. 도 111c: 30분에 초기 엔도좀(EE)에서 PDPA-TMR의 형광 강도(I 6.2)는 PEPA-BDY493 신호(I 6.9)에 의해 정규화된다. HBEC30KT-shTP53과 HBEC30KT-shTP53 / KRAS G12V 세포 사이의 상당한 차이는 KRAS 돌연변이가 초기 엔도좀 성숙을 초래한다는 것을 나타낸다. **P<0.01, 짝지은, 양측 t 검정; n = 10. 도 111d: 150분에 후기 엔도좀/리소좀(LE/Lys)에서 PDBA-Cy5의 형광 강도(I 5.3)는 PEPA-BDY493 신호(I 6.9)에 의해 정규화되었다. HBEC30KT-shTP53과 HBEC30KT-shTP53 / KRAS G12V 세포 사이의 상당한 차이는 KRAS 돌연변이가 후기 엔도좀/리소좀 성숙을 초래한다는 것을 나타낸다. **P<0.01, 짝지은, 양측 t 검정; n = 10.
도 112a 내지 도 112c는 항상-온/오프-온 UPS 나노입자의 합성 및 특징을 도시한 도면. (도 112a) 및 (도 112b) 이중-리포터 나노입자의 개략도. 마이셀 상태에서, 항상-온 염료는 온/오프 형광단에 대한 소광제로서 작용한다. 마이셀이 해리될 때, 항상-온 및 온/오프 형광단은 독립적으로 형광을 낼 수 있다. 이들 두 염료와 컨쥬게이팅된 중합체의 비가 변할 때 보디피(도 112a) 및 Cy3.5(도 112b)의 온/오프 비가 변한다. 40% Cy3.5-컨쥬게이팅된 공중합체와 함께 60% 보디피-컨쥬게이팅된 공중합체의 중량 분율은 최종 조합으로서 선택되었다. (도 112c) pH의 함수로서 UPS6 .2 나노프로브의 형광 신호 증폭. 이미지를 녹색 및 황색 필터를 이용하여 마에스트로 생체내 이미징 시스템(CRI) 상에서 캡처하였다.
도 113a 및 도 113b는 삼블록 공중합체 PEO-b-P(DEA -b- D5a), PEO-b-P(D5a40-b-DEA40) 및 무작위 블록 중합체 PEO-b-P(DEA -r- D5a)의 화학 구조를 도시한 도면(도 113a). 3차 아미노기의 몰분율의 함수로서 PEO-b-P(D5a40-b-DEA40), PEO-b-P(DEA 40-b- D5a 40) 및 PEO-b-P(D5a40-r-DEA40) 공중합체에 대한 pH 적정 곡선(도 113b).
도 114a 및 도 114b는 분자 혼합된 마이셀 및 마이셀 혼합물의 형광 특징을 도시한 도면. (도 114a) pH 7.4에서 1:19의 몰비로 PEPA-Cy5 및 PEG-b-(PR-r-AMA3)의 분자 혼합된 마이셀의 형광 강도. (도 114b) pH 7.4에서 1:19의 몰 비로 PEPA-Cy5 마이셀과 PEG-b-(PR-r-AMA3) 마이셀의 마이셀 혼합물의 형광 강도.
다음의 도면은 본 명세서의 부분을 형성하고, 본 개시내용의 특정 양상을 추가로 입증하기 위해 추가로 포함된다. 개시내용은 본 명세서에 제시된 구체적 실시형태의 상세한 설명과 조합하여 이들 도면 중 하나 이상을 참고로 하여 더 잘 이해될 수 있다.
도 1은 염료- 또는 형광 소광제 (FQ)-컨쥬게이팅된 PEO-b-P(R1-r-R2) 공중합체의 합성을 도시한 도면. PR 세그먼트의 소수성은 2개의 단량체의 몰분율을 달리함으로써 연속적으로 제어될 수 있다(R1 또는 R2: Et, 에틸; Pr, 프로필; Bu, 부틸; Pe, 펜틸).
도 2는 무작위 공중합체에서의 상이한 단량체(DEA 및 D5a) 비에서 PEO-P(DEAx-D5ay)(x + y = 80) 공중합체의 1H NMR 스펙트럼을 도시한 도면. 소수성 PR 블록에서의 단량체 조성을 추정하기 위해 0.9ppm 및 1.1ppm에서의 피크를 사용하였다.
도 3은 무작위 공중합체에서의 상이한 단량체(DPA 및 DBA) 비에서 PEO-P(DPAx-DBAy)(x + y = 80) 공중합체의 1H NMR 스펙트럼을 도시한 도면. 소수성 PR 블록에서의 단량체 조성을 추정하기 위해 1.3ppm 및 1.4 ppm에서의 피크를 사용하였다.
도 4는 소수성 PR 블록에서의 단량체(DEA 및 DPA) 비를 조절함으로써 7.8, 7.4, 7.1, 6.8, 6.5 및 6.2에서 pHt 값에 의한 나노프로브 조성물의 1H NMR 스펙트럼을 도시한 도면. 소수성 PR 블록에서 단량체 조성을 추정하기 위해 0.9ppm 및 1.0 내지 1.1 ppm에서의 피크를 사용하였다.
도 5는 소수성 PR 블록에서의 단량체(DPA 및 DBA) 비를 조절함으로써 6.2, 5.9, 5.6 및 5.3에서 pHt 값에 의한 나노프로브 조성물의 1H NMR 스펙트럼을 도시한 도면. 소수성 PR 블록에서 단량체 조성을 추정하기 위해 1.3ppm 및 1.4 ppm에서의 피크를 사용하였다.
도 6은 소수성 PR 블록에서의 단량체(DBA 및 D5a) 비를 조절함으로써 5.3, 5.0, 4.7 및 4.4에서 pHt 값에 의한 나노프로브 조성물의 1H NMR 스펙트럼을 도시한 도면. 소수성 PR 블록에서 단량체 조성을 추정하기 위해 1.3ppm 및 1.4 ppm에서의 피크를 사용하였다.
도 7a 내지 도 7c: (도 7a) pHt의 제어를 위한 PDEA / PD5a 분자 혼합물 대 P(DEA 40 -D5a 40 ) 공중합체 전략의 비교. (도 7b) pH의 함수로서 2개의 단량체의 상이한 비를 이용한 P( DEA x - D5a y ) 나노프로브의 정규화된 형광 강도. (도 7c) 나노프로브 pHt는 PR 세그먼트에서의 DEA-MA 단량체의 몰분율과 선형 상관관계가 있다. 이들 연구에서 중합체 농도는 0.1㎎/㎖였다.
도 8은 PDEA / PD5a 마이셀 배합물 대 P( DEA 40 - D5a 40 ) 공중합체 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. Cy5 염료(λex/λem = 646/662㎚)를 대응하는 공중합체의 PR 블록에 컨쥬게이션하였다. 정규화된 형광 강도 대 pH 관계를 도 7a에서 나타내었다.
도 9는 거친 조정 P( DEA x - D5a y ) 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. Cy5 염료(λex/λem = 646/662㎚)를 공중합체의 PR 블록에 컨쥬게이션시켰다. 정규화된 형광 강도 대 pH 관계를 도 7b에 나타내었다.
도 10a 내지 도 10 d:(도 10a) Cy5-컨쥬게이팅된 P( DPA x - DBA y ) 나노프로브에 대해 pH의 함수로서 정규화된 형광 강도. (도 10b) P( DPA x - DBA y ) 대 P(DEA 40 -D5a 40 ) 나노프로브에 대해 pH의 함수로서 유도체화된 형광 플롯(dF/dpH, 4a로부터의 데이터). 밀접한 소수성을 지니는 메타크릴레이트 단량체(즉, DPA/DBA 대 DEA/D5a)의 사용은 훨씬 더 가파른 pH 전이를 초래하였다. (도 10c) 상이한 공중합체 조성물에 대해 덜 소수성인 단량체의 몰분율의 함수로서 나노프로브 pHt의 선형 관계. 이들 상관관계는 작업자-사전결정 pHt를 달성하기 위해 최적의 공중합체 조성을 선택하기 위한 표준 곡선으로서 작용한다. (도 10d) 0.3 pH 증분으로 전체 생리적 범위의 pH(4 내지 7.4)를 아우르는 UPS 나노프로브의 대표적인 라이브러리. 모든 나노프로브를 Cy5 염료와 컨쥬게이션하였다. 중합체 농도는 0.1㎎/㎖였다.
도 11은 미세동조된 P( DPA x - DBA y ) 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. Cy5 염료(λex/λem = 646/662㎚)를 공중합체의 PR 블록에 컨쥬게이션시켰다. 정규화된 형광 강도 대 pH 관계를 도 10a에서 나타내었다.
도 12는 UPS 라이브러리 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. 각각의 UPS 나노프로브에 대한 조성을 표 3에 나타낸다. Cy5 염료(λex/λem = 646/662㎚)를 공중합체의 PR 블록에 컨쥬게이션시켰다. 정규화된 형광 강도 대 pH 관계를 도 10d에 나타내었다.
도 13은 0.3 pH 증분으로 10개 나노프로브로 이루어진 UPS 라이브러리의 형광 이미징을 도시한 도면. 각각의 UPS 나노프로브에 대한 조성물을 표 3에 나타낸다. Cy5 염료(λex/λem = 646/662㎚)를 공중합체의 PR 블록에 컨쥬게이션시였다. 나노프로브의 이미지를 마에스트로 이미징 시스템(Maestro Imaging system)에서 촬영하였다.
도 14a 내지 도 14f는 (도 14a) PEO-PDPA-염료/FQ 공중합체의 구조를 도시한 도면. (도 14b) 큰 스토크스 이동을 지니는 선택된 형광단의 구조를 도시한 도면. (도 14c) 선택된 로다민 염료의 구조를 도시한 도면. (도 14d) 선택된 보디피 염료의 구조를 도시한 도면. (도 14e) 선택된 사이아닌 염료의 구조를 도시한 도면. 모든 형광단에 대한 여기/방출 파장을 도 14b 내지 e에서 각각 나타낸다. (도 14f) 선택된 형광 소광제의 구조를 도시한 도면. 각각의 소광제의 활성 소광 범위를 괄호에 나타낸다.
도 15a 및 도 15b는 초-pH 민감성(UPS) 마이셀 나노프로브의 개략적 설계를 도시한 도면. (도 15a) 유니머 상태에서(pH < pHt), 중합체 해리는 형광단-소광제 분리 및 강한 형광 방출을 초래하였다. 마이셀 상태에서(pH > pHt), 형광 소광은 형광단의 방출 강도를 극적으로 억제한다. (도 15b) PR 세그먼트의 소수성을 연속적으로 미세동조하는 능력에 의해 나노프로브 pHt의 작업자-사전결정 제어를 달성하기 위해 공중합체 전략을 사용하였다.
도 16a 및 도 16b는 PDPA -염료/PDPA - FQ의 상이한 비로 pH 5.0(ON) 및 pH 7.4(오프)에서 혼합된 나노입자의 형광 강도비를 도시한 도면. (도 16a) 큰 스토크스 이동을 지니는 형광단(AMCA, MB 및 PPO)에 대한 결과. (도 16b) 형광단의 보디피(등록상표) 패밀리에 대한 결과. 형광단 및 FQ의 구조를 도 14a 내지 f에서 나타낸다.
도 17a 내지 도 17f는 형광 소광제가 없는(좌측 열) 또는 형광 소광제가 있는(우측 열)의 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. 큰 스토크스 이동을 지니는 형광단을 이 연구에 제시하였다. 형광단 및 FQ의 구조를 도 14a 내지 f에 나타내었다.
도 18a 내지 도 18 f는 FQ-컨쥬게이팅된 PDPA 공중합체의 도입은 상이한 PDPA -염료 나노프로브의 형광 활성화 비를 상당히 증가시켰음을 도시한 도면. 상이한 pH 대 pH 7.4(FpH/F7. 4)에서 형광 강도비를 공중합체 단독(도 18a, 도 18c 및 도 18e)에 대해 그리고 FQ-컨쥬게이팅된 공중합체의 첨가에 따라(도 18b, 18d 및 18f) 컨쥬게이팅하였다. 형광단 및 FQ의 구조를 도 14a 내지 도 14f에 나타내었다.
도 19a 내지 도 19f는 형광 소광제가 있는(좌측 열) 또는 형광 소광제가 있는(우측 열) 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. 형광단의 보디피(등록상표) 패밀리를 이 연구에 제시하였다. 형광단 및 FQ의 구조를 도 14a 내지 도 14f에 나타내었다.
도 20a 내지 도 20f는 형광 소광제가 있는(좌측 열) 또는 형광 소광제가 있는(우측 열) 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. 형광단의 로다민 패밀리를 이 연구에서 제시하였다. 형광단 및 FQ의 구조를 도 14a 내지 도 14f에 나타내었다.
도 21a 내지 e는 형광 소광제가 있는(좌측 열) 또는 형광 소광제가 있는(우측 열) 나노프로브의 pH-의존적 형광 스펙트럼을 도시한 도면. 형광단의 사이아닌 패밀리를 이 연구에서 제시하였다. 형광단 및 FQ의 구조를 도 14a 내지 f에 나타내었다.
도 22a 내지 도 22d는 상이한 pH 대 pH 7.4(FpH/F7. 4)에서 형광 강도비가 공중합체 단독(도 22a, 도 22c)에 대해 그리고 염료의 로다민 및 사이아닌 패밀리에 대한 FQ-컨쥬게이팅된 공중합체의 첨가에 따라(도 22b, 도 22d) 플롯팅하였다는 것을 도시한 도면. 형광단 및 FQ의 구조를 도 14a 내지 도 14f에 나타내었다.
도 23a 및 도 23b는 종양에서 호기적 해당 및 산성 세포외 pH(pHe)를 도시한 도면. (도 23a) 암 세포는 산소가 존재하는지의 여부와 상관없이 글루코스를 대부분 락트산염으로 전환시킨다(바르부르크 효과(Warburg effect)). 도면은 문헌[Heiden, et al., 2009]으로부터 적합하게 된다. (도 23b) 산성 pHe를 30종의 상이한 인간암 세포주로부터의 269 종양에서 측정하였다. 평균 pHe = 6.84(변화 범위는 6.71 내지 7.01), 이는 혈액 pH(7.4) 미만임. 도면은 문헌[Volk, et al., 1993]으로부터 적합하게 된다.
도 24는 넓은 pH 범위(4 내지 7.4) 및 큰 형광 방출(400 내지 820㎚)을 확장시키는 10개의 나노프로브로 이루어진 예시적인 UPS 라이브러리를 도시한 도면. 각각의 나노프로브는 그의 전이 pH 및 형광단에 의해 암호화된다. 4.4- AMCA 및 4.7-MB의 이미지를 여기광 365㎚에서 카메라에 의해 촬영하였다. 나노프로브 용액의 나머지의 이미지를 마에스트로 이미징 시스템 상에서 촬영하였다.
도 25는 2개의 독립적 메커니즘에 의한 이온성 중합체 마이셀의 자기-조립을 도시한 도면. 좌측 패널은 pH에 의한 마이셀화의 유도가 증가되며, PR 세그먼트가 중화되고 소수성이 되어 마이셀 형성이 구동된다는 것을 나타낸다. 놀랍게도, 낮은 pH에서 카오트로픽 이온(CA, 예컨대 ClO4 -)의 첨가는 암모늄 PR 세그먼트에 의한 마이셀화를 야기한다(우측 패널). 상이한 소수성 측쇄를 지니는 일련의 PEO - b -PR 공중합체(1-5)의 구조를 삽도에 나타낸다.
도 26a 내지 도 26c는 (도 26a) 카오트로픽 음이온이 양성자화된 PR 세그먼트를 지니는 PEO - b -PR 공중합체로부터의 마이셀 자기 조립, 즉, 단백질을 용해하는 그들의 능력(솔트 인(salt-in))으로부터 반전된 "솔트 아웃(salt-out)" 효과를 유도한다는 것을 도시한 도면. (도 26b) CA-유도 마이셀 자기 조립체를 연구하기 위한 FRET 설계의 도시. CA의 첨가는 마이셀 형성 및 공여체로부터 수용체(acceptor)(Cy5) 염료까지의 효율적인 에너지 전달(TMR)을 초래한다. (도 26c) 항-호프마이스터 경향을 나타내는 카오트로픽 음이온-유도 마이셀 자기 조립.
도 27은 상이한 농도의 카오트로픽 음이온에서 PEO - b -P( DPA - r - TMR )/ PEO - b -P(DPA- r -Cy5)의 FRET 중합체 쌍의 형광 스펙트럼을 도시한 도면. 샘플을 λex = 545㎚에서 여기시키고, 방출 스펙트럼을 560 내지 750㎚에서 수집하였다. 모든 실험을 PEO- b -PDPA의 전이 pH(pHt=6.1) 미만인 pH=4에서 수행하였다.
도 28은 상이한 농도의 코스모트로픽 및 경계 음이온에서 PEO - b -P( DPA - r -TMR)/ PEO - b -P( DPA - r - Cy5 )의 FRET 중합체 쌍의 형광 스펙트럼을 도시한 도면. 샘플을 λex = 545㎚에서 여기시키고, 방출 스펙트럼을 560 내지 750㎚에서 수집하였다. 모든 실험을 PEO - b - PDPA의 전이 pH(pHt=6.1) 미만인 pH=4에서 수행하였다.
도 29a 및 b는 Cl-(도 29a) 및 ClO4 - 음이온(도 29b)의 존재에서 공중합체 3의 마이셀 전이의 TEM 및 DLS 분석을 도시한 도면. 음이온 둘 다의 농도를 50mM에서 제어하였다(pH = 5.0). 축척 바는 TEM 이미지에서 100㎚이다.
도 30a 및 도 30b는 pH 7.4에서 Cl-(50mM)의 존재에서 공중합체 3의 마이셀의 마이셀 형태 및 유체역학적 직경의 (도 30a) TEM 및 (도 30b) DLS 분석을 도시한 도면. 축척 바는 TEM 이미지에서 100㎚이다.
도 31a 및 도 31b는 pH 7.4에서 ClO4 -(50mM)의 존재에서 공중합체 3의 마이셀의 마이셀 형태 및 유체역학적 직경의 (도 31a) TEM 및 (도 31B) DLS 분석을 도시한 도면. 축척 바는 TEM 이미지에서 100㎚이다.
도 32a 및 도 32b는 pH 7.4 및 5.0에서 ClO4 -(50mM)의 존재에서 PEO - b - PLA 공중합체의 마이셀 형태 및 유체역학적 직경의 (도 32a) TEM 및 (도 32b) DLS 분석을 도시한 도면. 축척 바는 TEM 이미지에서 100㎚이다.
도 33은 상이한 초기 농도의 Cl-(0 내지 2,000mM)에서 PEO - b -P( DPA - r -TMR)/PEO- b -P(DPA- r -Cy5)의 FRET 중합체 쌍의 형광 스펙트럼을 도시한 도면. 마이셀 형성을 유도하기 위해 상이한 농도의 ClO4 -(M) 음이온을 첨가하였다. 샘플을 λex = 545㎚에서 여기시키고, 방출 스펙트럼을 560 내지 750㎚에서 수집하였다. 모든 실험을 PEO- b -PDPA의 전이 pH(pHt=6.1) 미만의 pH=4에서 수행하였다.
도 34는 상이한 경쟁 Cl- 농도(0 내지 2,000mM)에서 ClO4 - 농도의 함수로서 FRET 전달 효율을 도시한 도면.
도 35는 상이한 초기 농도의 SO4 2-(0 내지 500mM)에서 PEO - b -P( DPA - r -TMR)/PEO- b -P(DPA- r -Cy5)의 FRET 중합체 쌍의 형광 스펙트럼을 도시한 도면. 마이셀 형성을 유도하기 위해 상이한 농도의 ClO4 -(M) 음이온을 첨가하였다. 샘플을 λex = 545㎚에서 여기시키고, 방출 스펙트럼을 560 내지 750㎚로부터 수집하였다. 모든 실험을 PEO- b -PDPA의 전이 pH(pHt=6.1) 미만의 pH=4에서 수행하였다.
도 36은 상이한 경쟁 SO4 2- 농도(0 내지 500mM)에서 ClO4 - 농도의 함수로서 FRET 전달 효율을 도시한 도면.
도 37a 및 도 37b는 상이한 농도의 경쟁 SO4 2- 음이온의 존재에서 공중합체 3의 (도 37a) ClO4 --유도 자기-조립을 도시한 도면. (도 37b) 경쟁 Cl- 및 SO4 2- 음이온의 이온 강도의 함수로서 ClO4 --유도 자기-조립으로부터의 FRET 효율(FC50). 이들 연구에서 용액 pH를 4에서 제어하였다.
도 38a 및 도 38b는 (도 38a) PR 세그먼트의 소수성 강도가 마이셀 유도에서 ClO4 -의 능력에 영향을 미친다는 것을 도시한 도면. 더 많은 소수성 PR 세그먼트(예를 들어, 5에서의 펜틸기)는 ClO4 - 민감성을 증가시켜 마이셀 형성을 유도한다. (도 38b) 이온성 중합체 마이셀의 자기-조립에 대한 2가지 중요한 기여 인자(소수성 알킬쇄 길이 및 카오트로픽 음이온)를 도시하는 경험 모델.
도 39는 상이한 소수성 강도의 PEO - b -P(R- r - TMR )/ PEO - b -P(R- r - Cy5 )의 FRET 중합체 쌍의 형광 스펙트럼을 도시한 도면(PR 세그먼트는 메틸에서 펜틸 측쇄까지 다양함). 마이셀 형성을 유도하기 위해 상이한 농도의 ClO4 -(M) 음이온을 첨가하였다. 샘플을 λex= 545㎚에서 여기시키고, 방출 스펙트럼을 560 내지 750㎚에서 수집하였다. 모든 실험을 PEO-b-PDPA의 전이 pH(pHt=6.1) 미만의 pH=4에서 수행하였다.
도 40a 내지 c는 6.9에서 절묘하게 급격한 pH 전이를 지니는 UPS6 .9 나노프로브를 도시한 도면. (도 40a) 이온화 가능한 블록 공중합체 및 그의 pH-의존적 형광 방출 특성의 구조. 높은 pH(즉, 7.4 또는 7.2)에서, UPS는 침묵으로 남아있다. 6.9 미만의 pH에서, UPS는 마이셀 해리의 결과로서 활성화된다. pH 반응은 가정적 소분자 pH 센서(청색 파선)보다 훨씬 더 급격하다. (도 40b) 상이한 pH 완충제 중의 UPS6 .9 용액의 형광 이미지. (도 40c) 각각 pH 7.4 및 6.7에서 마이셀 및 유니머 단계에서 UPS6.9의 투과 전자 현미경(중합체 농도 = 1㎎/㎖, 축척 바 = 100㎚).
도 41a 및 도 41b는 비슷한 크기를 지니지만 상이한 pH 전이(pHt = 6.3 및 6.9)를 지니는 2개의 UPS 나노프로브의 PK/BD를 도시한 도면.
도 42a 및 도 42b는 (도 42a) 원발성 HNSCC 종양의 제거 후 목 측면에 대한 대표적인 감시림프절의 NIR 이미지를 도시한 도면. (도 42b) 조직학(H&E)은 결절 구조를 입증할 수 있었다. 선택된 결절의 피질 영역에서 HN5 세포(검정색 화살표)의 존재를 나타내었다.
도 43a 내지 도 43i는 PINS 나노프로브의 합성 및 최적화를 도시한 도면. 도 43a ICG-컨쥬게이팅된 PEG-b-P(EPAx-r-ICGy)블록 공중합체의 개략적 합성. 도 43b 내지 도 43d pH-의존적 형광 특성에 대한 PEPA 세그먼트 영향의 연구: (도 43b) 형광 강도, (도 43c) 7.4 이상의 관심 대상의 pH에서 형광 활성화 비, 및 (도 43D) 정규화된 형광 강도. PEPA 세그먼트 길이는 변화된 반면(x= 40, 60, 80, 100, 120), 중합체 쇄 당 ICG의 수는 1에서 유지되었다. 도 43e 내지 도 43g: pH-의존적 형광 특성에 대한 ICG 컨쥬게이션 수의 영향 연구: (도 43e) 형광 강도, (도 43f) 7.4 이상의 관심 대상의 pH에서 형광 활성화 비, 및 (도 43g) 정규화된 형광 강도. 중합체 쇄 당 ICG의 수는 변화된 반면(y= 0.5, 1, 2), PEPA 세그먼트 길이는 100에서 제어되었다. 도 43h 및 도 43i: (도 43h) pH 7.4에서 인간 혈청 및 (도 43i) pH 6.0에서 인간 혈청에서 PEPA100-ICGy(n = 0.5, 1, 2)의 단량체 피크 강도(λ=808㎚)에 대한 정규화에 의한 UV-Vis 흡수 스펙트럼. 이들 데이터에 기반하여, PEG-b-P(EPA100-r-ICG1)는 동물 이미징 연구를 위한 최적의 조성물로서 선택하였다.
도 44a 내지 도 44f는 PINS의 특징을 도시한 도면. 도 44a PINS 농도 및 pH의 함수로서 형광 강도의 3D 플롯. 도 44b pH-민감성 오프/온 활성화를 나타내는 SPY 엘리트(SPY Elite)(등록상표) 수술 카메라에 의한 PINS 용액의 근적외선 이미지. 도 44c는 pH 7.4 및 6.5에서 각각 마이셀 및 유니머 상태로 PINS의 투고 전자 현미경. 중합체 농도 = 1㎎/㎖; 축척 바 = 100㎚. PBS(도 44d) 또는 50% 인간 혈청(도 44e) 중에서 저장 시 pH 6.5(검정색 막대) 및 7.4(흰색 막대)에서 PINS 형광 강도. 도 44f 저장 시 PINS 나노프로브의 수 중량 유체 역학적 반경. (도 44d) 내지 (도 44f)에 대한 저장 조건: -20℃에서 10% w/v 수크로스 용액. 이들 결과는 PINS가 -20℃에서 10% w/v 수크로스 용액 중에서 6개월 이상의 저장에서 안정하였다는 것을 나타낸다.
도 45a 내지 도 45e는 인간 HN5 정위 종양을 보유하는 마우스에서 PINS의 용량 반응을 도시한 도면. 꼬리 정맥을 통해 상이한 용량의 PINS(1.0, 2.5 및 5.0㎎/kg)을 주사한 마우스의 백색광(도 45a) 및 근적외선(도 45b) 이미지. HN5 종양 강도는 PINS 용량이 증가함에 따라 증가되었다. 2.5㎎/kg PINS까지 동등한 염료 용량으로 유리 ICG 대조군은 관찰가능한 종양 콘트라스트를 나타내지 않았다. 도 45c: 선택한 시점에서 상이한 용량의 PINS를 주사한 대표적인 마우스의 NIR 이미지. 정맥 주사 후 시간의 함수로서 종양 형광 강도의 정량화(도 45d) 및 노이즈비에 대한 종양 콘트라스트(도 45e)(n = 3). 5.0㎎/kg에서 더 높은 PINS 용량 근육 조직에서의 더 높은 배경 신호에 기인하여 감소된 CNR을 야기하였다. 도 45e로부터의 결과에 기반하여, 2.5㎎/kg를 종양 산성혈증 이미징에 대한 최적의 PINS 용량으로서 선택하였다.
도 46a 및 도 46b는 PINS에 의한 종양 산성혈증 이미징을 나타낸다. 도 46a FDG를 이용하는 PET에 의한 종양 대사 이미징 또는 PINS에 의한 NIR 형광 이미징의 개략도를 도시한 도면. 도 46b 큰 또는 작은 HN5 정위 종양을 보유하는 SCID 마우스에서 PINS 이미징과 FDG-PET의 비교. PINS 이미징은 FDG-PET에 대한 극적으로 개선된 민감도 및 종양 검출의 특이성을 나타내었다. 추가적인 비교는 도 47a 내지 도 47e에서 이용가능하다(각각의 그룹에 대해 n =3).
도 47a 내지 도 47e는 정위 HN5 종양을 보유하는 마우스에서 PINS 이미징과 FDG-PET의 비교를 도시한 도면. 큰 종양(200㎣, 도 47a) 또는 작은 종양(15㎣, 도 47b)을 지니는 동일한 그룹의 마우스에 대한 백색광, FDG-PET/CT 및 NIR 이미지. PINS 이미징은 모든 크고 작은 종양에 대해 선명한 종양 경계 묘사를 허용하였다. 큰 종양에 대해, FDG-PET는 종양 주변에 대해 더 높은 신호가 PINS 활성화와 일치한다는 것을 나타내었다. 큰 종양(도 47c) 및 작은 종양(도 47d)을 지니는 동일 그룹의 마우스의 시상면도. 도 47e 도 46a 및 도 46b에서 나타낸 큰 종양 및 작은 종양에 대한 스티치드(Stitched) H&E 이미지. 축척 바: 큰 종양에서 2 mm 및 작은 종양 이미지에서 500㎛.
도 48은 PINS 이미징이 광범위 종양 특이성을 달성한 방법을 도시한 도면. PINS 나노프로브(2.5㎎/kg, SPY 엘리트(등록상표) 임상 카메라에 의한 이미징 24시간 전에 i.v. 주사)는 상이한 종양 모델(두경부, 유방, 복막 전이, 신장, 뇌) 및 기관 부위에서 광범위 종양 이미징 효능을 입증한다. 화살촉은 종양 위치를 나타낸다.
도 49a 및 도 49b는 상이한 임상 카메라를 이용하는 PINS 나노프로브의 적합성을 도시한 도면. 도 49a: 임상적으로 사용된 ICG 이미징 시스템: 노바덱(Novadaq) SPY 엘리트(등록상표), 하마마츠(Hamamastu) PDE 및 레이카(Leica) FL-800 모델. 도 49b: 상이한 임상 ICG 이미징 시스템 하에서 동일한 종양 보유 마우스의 백색광 및 NIR 이미지.
도 50a 내지 도 50f는 PINS 주사 후 생체밖 기관 및 종양 형광 이미징을 도시한 도면. (도 50a) HN5, (도 50b) FaDu 및 (도 50c) HCC4034 두경부 종양, (도 50d) MBA-MD-231 및 (도 50e) 4T1 유방 종양, 및 (도 50f) U87 신경교종을 보유하는 마우스에서 나노프로브의 주사 후 24시간에 주요 기관의 NIR 이미지 및 형광 강도의 기관 대 근육비의 정량화. 데이터를 평균 ± s.d.로서 제시한다(n = 3). 신호 포화때문에 간을 계산하지 않았다.
도 51a 및 도 51b는 정위 두경부 종양을 보유하는 마우스에서 종양 산성혈증 가이딩 수술(TAGS)을 도시한 도면. 도 51a는 SPY 엘리트(등록상표) 카메라에 의한 원발성 HN5 종양 및 잔여 종양의 성공적인 검출의 수술 절제. 눈에 의한 종양층의 시각적 검사는 주변 근육 조직으로부터 잔여 종양을 차별화할 수 없었다(상부 좌측). 종양 조직(T) 및 정상 조직(N)을 조직학에 의해 입증하였다. 축척 바 = 1 mm(낮은 배율) 또는 100㎛(고 배율). 도 51b 예상한 바와 같이 감량 수술은 비처리 대조군 이상의 생존 이점을 제공하지 않았다. TAGS는 백색광 및 기타 대조군 이상의 상당히 개선된 장기간 생존을 나타낸다(****P < 0.0001). 대조군 및 감량 그룹에 대해 n = 7; 백색광 그룹에 대해 n = 15; TAGS 그룹에 대해 n = 18.
도 52는 원발성 종양, 종양 경계 및 음성층의 조직 확인을 도시한 도면. 비생존 수술 동안 수집한 각각의 유형의 표본으로부터 5가지 대표적인 H&E 조직학 이미지. 화살촉은 종양 경계 표본에서 암 세포의 존재를 나타낸다. 축척 바 = 1㎜ (상부 행, 저배율) 또는 100㎛(하부 행, 고 배율).
도 53a 내지 도 53d는 작은 잠재성 유방 종양 결절을 보유하는 마우스에서 종양 산성혈증 가이드 수술을 도시한 도면. 종양 병소(1백만개 미만의 세포)는 SPY 카메라 하에서 보았지만(도 53b) 시각적 검출에 의하지 않는다(도 53a). 도 53c: 작은 유방 종양 결절의 대표적인 이력 부문을 TAGS 동안 절제하였다; 축척 바 = 200㎛. 도 53d: 카플란-마이어(Kaplan-Meier) 곡선은 백색광 및 비처리 대조군 그룹에 걸쳐 TAGS에 의한 상당히 개선된 장기간 생존을 입증한다. 대조군에 대해, n = 7; 백색광 및 TAGS 그룹 n = 10; *P < 0.05.
도 54a 내지 도 54c는 PINS에 의한 상이한 종양 산성혈증 경로를 표적화하는 소분자 저해제의 평가를 도시한 도면. 도 54a: 괄호에서 선택된 소분자 저해제 및 그들의 대응하는 표적의 화학적 구조: 아세트아졸아마이드(CAIX), α-사이아노-4-하이드록시신나메이트 또는 CHC(MCT), 카리포라이드(NHE1) 및 판토프라졸(양성자 펌프). 도 54b: PBS 또는 다른 종양 산성혈증 저해제의 주사 후 면역적격 BalB/C 마우스에서 삼중 음성 4T1 유방 종양을 보유하는 마우스의 대표적인 이미지. 도 54c: 도 54b에서 나타낸 NIR 형광 이미지의 정량화. 형광 강도를 PBS 대조군에 대해 정규화하였다. 아세트아졸아마이드에 의한 CAIX 저해는 종양 산성혈증의 가장 효율적인 억제를 초래하였다.
도 55a 내지 도 55e는 건강한 C57bL/6 마우스에서 정맥내로 투여된 PINS의 안전성 평가를 도시한 도면. 도 55a: PBS 대조군에 비해 200 또는 250㎎/kg PINS의 볼루스 주사 후 C57bL/6 면역적격 마우스의 체중의 정규화된 변화. 도 55b 내지 도 55e: 상이한 용량에서 PINS의 볼루스 주사 후 그리고 선택 시점 후 희생시킨 C57bL/6 면역적격 마우스의 간(도 55b 및 도 55c) 및 신장(도 55d 및 도 55e) 기능에 대한 혈청 검사. 모들 그룹에 대해 n = 5. 약어: ALT, 알라닌 아미노트랜스퍼라제; GOT, 글루탐산 옥살로아세트산 트랜스아미나제; BUN, 혈액 요소 질소; CRE, 크레아티닌; 점선은 C57bL/6 마우스에 대한 전형적인 야생형 평균값을 나타낸다.
도 56은 PINS의 안전성 평가를 위한 주요 기관의 조직학 분석을 도시한 도면. PINS의 볼루스 주사(250㎎/kg) 또는 반복 주사(25㎎/kg/주, 5회 주사) 후에 그리고 선택 시점 후 희생시킨 C57bL/6 면역적격 마우스로부터의 주요 기관의 대표적인 H&E 부문(각각의 그룹에 대해 n=5). 250㎎/kg에서, 미세지방증을 더 이른 시점(제1일 및 제7일)에 간에서 관찰하였지만, 제28일에 회복되었다. 비장, 신장 및 심장은 기형을 나타내지 않았다. 반복 주사에 대해, 임의의 주요 기관에서 이상이 관찰되지 않았다.
도 57a 내지 도 57c는 넓은 생리적 pH 범위에 걸쳐 급격하게 한정된 완충 능력을 지니는 UPS 나노입자 라이브러리를 도시한 도면. (도 57a) UPS 나노입자의 완충 효과 및 미세 동조 가능한 소수성 및 pKa를 지니는 PEO-b-P(R1-r-R2) 공중합체의 화학적 구조의 개략적 도시. 각각의 공중합체에 대한 조성물을 표 11에 나타낸다. (도 57b) 0.4M HCl을 이용하는, UPS6 .2, UPS5 .3 및 UPS4 .4 나노입자를 함유하는 용액의 pH 적정. 최대 완충제 pH는 각각의 공중합체의 겉보기 pKa에 대응한다. 클로로퀸(CQ, pKa = 8.3 및 10.4), 소분자 베이스, 및 폴리에틸렌이민(PEI)을 비교를 위해 포함시켰다. (도 57c) UPS 라이브러리의 각각의 구성성분에 대한 완충 능력(β)을 4.0 내지 7.4의 pH 범위에서 pH의 함수로서 플롯팅하였다. 상이한 pH 값에서, UPS 나노입자는 CQ 이상으로 완충제 강도에서 30 내지 300배 더 높았다. L.E. 및 E.E.는 각각 후기 엔도좀 및 초기 엔도좀에 대한 약어이다.
도 58은 염료-컨쥬게이팅된 2블록 공중합체의 합성을 도시한 도면. PR 세그먼트는 상이한 몰분율을 지니는 2개의 단량체로부터의 무작위 블록으로 이루어져서 그의 소수성 및 pH 전이를 미세동조한다(표 10 참조). Cy5 염료의 구조를 또한 나타낸다.
도 59는 UPS 나노프로브 라이브러리의 TEM 이미지를 도시한 도면. 나노프로브를 PBS 완충제(pH 7.4) 중에 용해시키고, TEM 분석 전에 탄소 그리드 상에서 건조시켰다. 음성 염색법을 위해 포스포텅스텐산을 사용하였다. 축척 바 = 모든 이미지에 대해 100㎚.
도 60은 UPS 나노프로브 라이브러리의 각각의 구성성분의 pH 적정을 도시한 도면. HCl(0.4 M)은 모두 10개의 UPS 나노프로브의 마이셀 용액(아민기의 양에 기반하여 2㎎/㎖ 중합체 농도 또는 8mM), 클로로퀸 용액(아민기의 양에 기반하여 2㎎/㎖ 또는 12.5mM) 및 PEI(분지됨, MW 10,000Da, 폴리사이언스 인코포레이티드(Polyscience, Inc.)) 용액(아민기의 양에 기반하여 0.3㎎/㎖ 또는 7.3mM)을 적정하기 위해 증분적으로 첨가하였다. pH/도전율계(메틀러 톨레도(Mettler Toledo))를 사용하여 적정 동안 용액 중의 pH 변화를 모니터링하였다.
도 61a 내지 도 61c는 항상-온/오프-온 UPS(Always-ON/OFF-ON UPS) 나노입자의 합성 및 특성규명을 도시한 도면. (도 61a) 및 (도 61b) 이중 리포터 나노입자의 개략도. 마이셀 상태에서, 항상-온 염료는 온/오프 형광단에 대한 소광제로서 작용한다. 마이셀이 분해될 때, 항상-온 및 온/오프 형광단은 독립적으로 형광을 낸다. 이들 두 염료와 컨쥬게이션된 중합체의 비가 변함에 따라 보디피(도 61a) 및 Cy3.5(도 61b)의 온/오프 비는 변한다. 60% 보디피-컨쥬게이팅된 공중합체와 40% Cy3.5-컨쥬게이팅된 공중합체의 중량 분율을 최종 조합으로서 선택하였다. (도 61c) pH의 함수로서 UPS6 .2 나노프로브의 형광 신호 증폭. 녹색 및 황색 필터를 이용하여 마에스트로 생체내 이미징 시스템(CRI) 상에서 이미지를 캡처하였다.
도 62a 내지 도 62c는 HeLa 세포에서 식균 작용 기관의 pH-민감성 이미징 및 완충작용을 도시한 도면. (도 62a) 저용량(100㎍/㎖) 및 고용량 (1,000㎍/㎖)의 UPS6.2에 대한 5분 노출 후 표시 시점에서 HeLa 세포의 대표적인 공초점 이미지. 핵을 호크스트에 의해 청색으로 염색하였다. 축척 바 = 10㎛. (도 62b) 항상-온/오프-온 UPS6 .2의 활성화 역학의 정량적 분석. 보디피 채널(오프-온)에서 점무늬의 형광 강도를 Cy3.5의 형광 강도에 대해 정규화시켰다(항상-온). (도 62c) 표시 용량의 UPS6 .2로 처리한 HeLa 세포에서 엔도좀/리소좀 pH의 실시간 측정. 인시추 pH 측정을 위해 리소센서 비율계량 이미징 프로브를 사용하였다. 오차 막대는 각각의 시점에 50개 세포기관으로부터의 표준 편차를 나타낸다.
도 63a 내지 도 63c는 UPS5 .3 나노프로브에 의한 HeLa 세포의 완충 식균 작용 세포소기관을 도시한 도면. (도 63a) 저용량(100㎍/㎖) 및 고용량(1,000㎍/㎖)의 항상-온(Cy3.5) /오프-온(보디피) UPS5 .3에 대한 5분 노출 후 표시 시점에서 HeLa 세포의 대표적인 공초점 이미지. 핵을 호크스트에 의해 청색으로 염색하였다. 축척 바 = 10㎛. (도 63b) UPS5 .3의 오프-온 활성화 과정의 정량적 분석. 보디피 채널에서 세포 내 점무늬의 형광 강도를 TMR 채널에서 동일한 점무늬의 형광 강도에 대해 정규화시켰다. (도 63c) 표시 용량의 항상-온(Cy3.5)/오프-온(보디피) UPS5 . 3로 처리한 HeLa 세포에서 엔도좀/리소좀 pH 변동의 실시간 측정. 인시추 pH 측정을 위해 리소센서 황/청 DND160 비율계량 이미징 프로브를 사용하였다. 오차 막대는 각각의 시점에 50개 세포소기관으로부터의 표준 편차를 나타낸다.
도 64a 내지 도 64f는 식균 작용 세포소기관의 pH 완충이 그들의 막 단백질 역학에 영향을 미친다는 것을 도시한 도면. HeLa 세포를 세포 흡수 동안 5분 동안 1,000㎍/㎖ UPS6 .2-Cy5 또는 UPS4 .4-Cy5로 처리하였다. 이어서, 그들은 고정 전 15분(도 64a), 1시간(도 64b) 및 2시간(도 64c) 동안 인큐베이션시켰다. 면역형광(IF) 이미지는 초기 엔도좀(Rab5) 또는 리소좀(LAMP2)에서 UPS 나노프로브의 국소화를 나타낸다. 축척 바 = 10㎛ 및 5㎛(삽도). 이마리스(Imaris) 소프트웨어를 사용하여 z-적층 공초점 이미지의 군집화를 분석하였다. Rab5(도 64d) 및 LAMP2(도 64e)와 함께 공동국소화된 UPS의 분획 및 LAMP2와 함께 공동국소화된 Rab5의 분율(도 64f)을 먼델 계수(Mander's coefficient)로부터 계산하였다, n = 10, α = 0.05, ****p<0.0001. 이원 ANOVA 및 시닥 다중 비교 검정(Sidak's multiple comparison test)을 수행하여 통계학적 유의도를 평가하였다.
도 65a 내지 도 65e는 UPS에 의한 엔도좀-리소좀의 클램핑 내강 pH가 아미노산-의존적 mTORC1 활성화를 선택적으로 저해한다는 것을 도시한 도면. HeLa 세포를 2시간 동안 EBSS에서 기아 상태로 만들었고, 이어서, (도 65a) UPS6 .2/UPS5 .3/UPS5 .0 및 (도 65b) UPS4 .7/UPS4 .4의 존재에서 표시 시간 간격 동안 필수 아미노산(EAA)으로 자극하였다. 물 및 50μM 클로로퀸(CQ)을 대조군으로서 사용하였다. 표시한 인단백질의 축적을 전세포 용해물의 면역블롯에 의해 평가하였다. (도 65c) 표시 처리 후 GFP-TFEB의 핵/사이토졸 분포의 정량적 분석. 오차 막대는 표준 편차를 나타낸다, n = 10. (도 65d) 도 65c에 대한 대표적인 이미지. 축척 바 = 10㎛. (도 65e) mTORC1 신호전달 경로의 알부민-유도 아미노산 의존적 활성화에 대해 유리 아미노산에 필요한 pH 전이의 작업 모델.
도 66a 내지 도 66c는 UPS 노출 시 mTORC1 신호 정량화 및 카텝신 B 활성을 도시한 도면. (도 66a 및 도 66b) 도 64a 및 도 64b에서 총 단백질 수준에 의해 정규화된 인산화된 S6 단백질의 정량적 분석. 각각의 시점에 대조군(물)과 UPS 처리군 사이의 통계적 차이를 이원 ANOVA 및 더넷(Dunnett's) 다중 비교 검정에 의해 검출하였다, α = 0.05, **p<0.01, ****p<0.0001 또는 유의하지 않음(n.s.). 대조군고 UPS 처리군 사이의 통계학적 차이는 도 66b에서 임의의 시점에 유의하지 않았다. 오차 막대는 표준 편차를 나타낸다, n = 3. (도 66c) 카텝신 B 활성을 표시 처리에 응하여 측정하였다(n = 2). '섭식'과 모든 다른 그룹 간의 통계학적 차이를 일원 ANOVA 및 더넷 다중 비교 검정에 의해 검출하였다, α = 0.05, *p<0.05 또는 유의하지 않음(n.s.).
도 67a 내지 도 67d는 알부민-의존적 mTORC1 경로 활성화가 UPS4 .4에 의해 저해된다는 것을 도시한 도면. (도 67a) HeLa 세포는 2시간 동안 영양소가 고갈된 다음 표시된 UPS 나노입자(1,000㎍/㎖)의 존재 또는 부재에서 BSA 흡수(2%)되었다. 표시 인단백질의 축적을 전세포 용해물의 면역블롯에 의해 모니터링하였다. (도 67b) GFP-태그 TFEB의 핵/사이토졸 분포를 표시 조건에 응하여 모니터링하였다. (도 67c) 인산화된 S6 단백질의 정량적 분석을 (도 67a)에서의 총 단백질 수준에 의해 정규화하였다. 오차 막대는 표준 편차를 나타낸다, n = 3. 각각의 시점에 대조군과 UPS 처리군 사이의 통계학적 차이를 이원 ANOVA 및 더넷 다중 비교 검정에 의해 검출하였다, α = 0.05, **p<0.01, ****p<0.0001 또는 유의하지 않음(n.s.). (도 67d)(도 67b)(사이토졸에서 = 0, 핵에서 = 1)에서 나타낸 결과에서 TFEB의 국소화의 정량적 분석. 오차 막대는 표준 편차를 나타낸다. 축척 바 = 10㎛.
도 68a 내지 도 68c는 리소좀 pH의 선택적 완충이 세포 대사 풀을 조절한다는 것을 도시한 도면. (도 68a) 계통도는 총 단백질 함량에 대해 정규화한 바와 같이 영양소가 가득한(섭식) 또는 고갈된(기아) 배지에서 표시한 대사산물의 상대적 존재비를 표시한다. 세포를 표시 용량에서 UPS4 .4로 처리하였다. (도 68b) 영양소가 가득한 조건과 영양소가 고갈된 조건 하에서 선택 아미노산의 정규화된 존재비. 오차 막대는 표준 편차를 나타낸다, n = 6. (도 68c) 세포 대사 풀의 균형에 대한 환경 및 리소좀 pH의 결과를 나타내는 개략도.
도 69a 내지 도 69g는 UPS 나노입자가 리소좀 스트레스에 민감한 NSCLC 세포를 선택적으로 사멸시킨다는 것을 도시한 도면. (도 69a) 사용한 세포 모델의 개략도 및 리소좀 성숙에 대한 그들의 대응하는 취약성. (도 69b) 유효량으로 UPS에 노출과 함께 그리고 노출 없이 HBEC30 KT 및 HCC4017의 상대적 생존능력을 나타내는 DIC 이미지(UPS6 .2 및 UPS5 .3 = 400㎍/㎖, UPS4 .4 = 1,000㎍/㎖). 축척 바 =100㎛. (도 69c 내지 도 69e) HBEC30KT, HBEC30KT KP, HBEC30KT KPL 및 HCC4017 세포에서 카스파제3/7 활성을 표시 용량의 UPS에 노출 후 72시간에 측정하였다. 이원 ANOVA 및 시닥 다중 비교 검정을 수행하여 HBEC30KT와 HCC4017, 및 HBEC30KT KP와 HBEC30KT KPL 사이에서 관찰된 차이의 통계학적 유의도를 평가하였다, α = 0.05, **p<0.01, ****p<0.0001. (도 69f 및 도 69g) 메틸 파이루베이트(MP), 다이메틸-2-옥소글루타레이트(MOG), 또는 물(파선)의 표시 농도와 함께 72시간 동안 1,000㎍/㎖ UPS6 .2에 대한 HCC4017(도 69f) 및 HBEC30 KT KPL(도 69g)의 노출 후 세포의 ATP 수준을 측정하였다. 처리가 없는(UPS가 없음) 대조군에 대해 값을 정규화시켰다. 오차 막대는 표준 편차를 나타낸다, n = 4.
도 70a 내지 도 70d는 I-UPS6 .9 나노프로브를 나타낸다. (도 70a) ICG-컨쥬게이팅된 블록 공중합체, PEG-b-P(C7A-r-ICG)의 개략적 합성. (도 70b) pH-민감성 off/on 활성화를 나타내는 SPY 엘리트(등록상표) 수술 카메라에 의한 I-UPS6 .9 용액의 근적외선 이미지. (도 70c) pH의 함수로서 정규화된 형광 강도는 더 긴 PC7A 세그먼트가 약간 더 낮은 pH 전이 및 더 급격한 반응을 야기한다는 것을 나타낸다. (도 70d) 프로브 농도 및 pH의 함수로서 형광 강도의 3D 플롯. 도 70b 내지 70d로부터의 데이터를 20% 혈청-함유 용액 중에서 얻었다.
도 71은 킬레이터 컨쥬게이팅된 중합체, CB-TE2A-PEG-PC7AX의 제안된 합성 경로를 도시한 도면.
도 72는 FDG-PET 및 I-UPS에 의해 이미징된 정위 HN5 종양을 보유하는 마우스를 도시한 도면. FDG-PET 이미지에서 갈색 지방 또는 목 근육(화살표)로부터의 위양성을 나타내는 시상면 위치에서 마우스를 이미징하였다.
도 73은 다양한 종양 모델(두경부, 유방, 결장직장 복막 전이, 신장, 뇌)에서 광범위 암 특이성을 지니는 I-UPS에 의한 종양 산성혈증 이미징을 도시한 도면. 황색 화살촉은 종양 위치를 나타낸다. I-UPS6 .9(2.5㎎/kg)는 SPY 카메라에 의한 이미징 전 24시간에 i.v. 주사하였다.
도 74a 및 도 74b는 (도 74a) 정위 4T1 유방 종양의 I-UPS6 .9-가이딩된 절제를 도시한 도면. 종양 병소(1백만개 미만의 세포)는 SPY 카메라 하에서 가시적이었지만(우측 패널), 시각적 검출에 의하지 않는다(좌측 패널). (도 74b) 카플란-마이어 곡선은 백색광(P<0.05) 및 비처리 대조군(P<0.01)에 대한 I-UPS6 .9-가이딩된 절제에 의한 개선된 장기간 생존을 입증한다.
도 75는 항상-온/오프-온 이중 리포터 신호를 지니는 UPS 나노프로브를 도시한 도면. UPS6 .9는 예로서 사용되며, FRET 공여체/수용체 쌍으로서 보디피/Cy3.5가 사용된다.
도 76a 내지 도 76c는 미세동조된 pH 전이를 지니는 UPS 나노프로브를 도시한 도면. (도 76a) PR 블록에서 DPA-MA 및 DEA-MA 서브유닛의 몰분율을 달리함에 따른 PEG-b-PR 공중합체의 합성 개략도. (도 76b) 상이한 PR 조성에 대한 UPS 나노프로브의 pH 반응. Cy5.5를 모델 염료로서 사용하였다. (도 76c) DPA의 몰 백분율의 함수로서 전이 pH는 사전결정된 pH 전이를 지니는 UPS의 합리적 설계를 위한 표준 곡선을 확립한다.
도 77은 암 세포에서 pH 조절 기작을 도시한 도면. 양성자 펌핑은 미세환경에서 종양 산성혈증을 초래할 뿐만 아니라 세포 증식 및 이동을 촉진시키기 위해 세포내 pH를 상승시킨다(Neri & Supuran, 2011).
도 78a 내지 도 78e는 UPS6 .9 나노프로브가 A549 폐 종양에서 종양 pHe를 특이적으로 이미징할 수 있다는 것을 도시한 도면. (도 78a) 호기성 해당은 암 세포에서 글루코스를 락트산염으로 전환한다. 2-DG 및 CHC는 각각 글루코스 흡수 및 락트산 분비에 대한 대사 저해제이다. (도 78b) A549 세포에서 락트산 분비 속도에 대한 2-DG 또는 CHC의 효과. (도 78c) 6시간 인큐베이션 후 2-DG 또는 CHC의 존재에서 A549 세포 배양 배지의 산성화. *P < 0.05, **P < 0.01, ***P < 0.001, 비히클과 비교함. (도 78d) UPS6 .9(10㎎/kg)의 주사 후 24시간에 A549 종양-보유 마우스의 오버레이된 형광 이미지. 대조군에서, 2-DG(250㎎/kg) 또는 CHC(250㎎/kg)를 UPS6.9 투여 전 12시간에 주사하였다. Cy5.5(밝은 점) 및 자가형광(밝은 배경)을 복합 이미지에서 나타낸다. (도 78e) UPS6 .9 주사 후 시간의 함수로서 종양과 정상 조직 사이의 NIR 형광 강도비(T/N 비). 데이터를 평균 ± s.d.로서 제시한다(n = 4).
도 79a 내지 도 79c는 정위 4T1 유방 종양의 I-UPS 이미징을 도시한 도면. 종양 병소(1백만개 미만의 세포)는 SPY 카메라 하에 가시적이었지만(열 모드, 도 79b) 시각적 검출에 의해서는 보이지 않았다(도 79a). 종양 존재를 조직학에 의해 입증하였다(도 79c). 축척 바는 도 79c에서 200㎛이다.
도 80은 FDG-PET 및 I-UPS에 의해 이미징되는 정위 HN5 종양을 보유하는 마우스를 도시한 도면. 마우스는 FDG-PET 이미지에서 (3마리 마우스 중 2마리) 목에서 갈색 지방 조직으로부터의 위양성을 나타내기 위해 시상면 위치에서 이미징된다.
도 81은 80명의 인간 비소세포 폐암 세포의 패널로부터의 글루코스 소모 및 락트산염 분비 속도를 도시한 도면. 이들 폐암 세포는 Lacout/Gluin의 비로서 표시하는 바와 같은 다양한 해당과정 속도를 보여준다.
도 82는 보디피 및 Cy3.5 신호를 정량화하고, 조직학에 의해 설명된 진정한 종양 경계를 상호연관 짓는 개략도를 도시한 도면. 종양 접점에 대한 수직선에 따른 형광 강도가 측정될 것이다. 평균 강도 대 거리는 종양 경계를 따라 다중 접점으로부터 결정될 것이다.
도 83은 비슷한 크기이지만 상이한 pH 전이를 지니는 2개의 UPS 나노프로브의 PK/BD의 비교를 도시한 도면.
도 84a 내지 도 84c는 다중 스펙트럼 혼성 UPS 나노프로브의 개략도 및 작업 원리를 도시한 도면. 도 84a: 다중-스펙트럼 혼성 UPS 나노프로브는 상이한 형광 염료에 의해 각각 암호화된 3개의 PEG-b-PR 블록 공중합체에 의해 공학 처리된다. 혼성 UPS 나노프로브는 중성 pH에서 "오프(오프)"로 남아있다. pH가 낮아질 때, PEG-b-(PR-r-염료) 성분은 해리되고, 미묘한 pH 변화와 만날 때 상이한 색을 제공하도록 순차적으로 형광을 낸다. 도 84b: PEG-b-PR 블록 공중합체 및 형광 염료 컨쥬게이팅된 중합체의 화학적 구조. 도 84c: 수용기-매개된 내포작용, 예컨대 혈관내피세포 성장인자 수용기(EGFR)를 통한 살아있는 세포 내 다중-스펙트럼 혼성 UPS 나노프로브의 내재화 및 활성화. 내재화 후에, PEPA-BDY493은 클라트린-코팅 소수포(CCV, pH 대략 6.8)에 의해 온(ON)으로 전환되고, 이어서, PDPA-TMR은 초기 엔도좀에 의해 활성화되며(pH 대략 6.0), 최종적으로 PDBA-Cy5는 후기 엔도좀/리소좀(pH 대략 5.0 내지 5.5)에 의해 온으로 조정된다.
도 85a 및 도 85b는 (도 85a) pH-의존적 형광 방출 스펙트럼 및 (도 85b) 0.1 M PBS 용액 중에서 pH의 함수로서 PEPA-BDY493의 형광 강도 비를 도시한 도면. 샘플을 488㎚에서 여기시키고, 방출 스펙트럼을 500 내지 650㎚에서 수집한다. 중합체 농도를 0.1㎎/㎖에서 제어한다.
도 86a 및 도 86b는 (도 86a) pH-의존적 형광 방출 스펙트럼 및 (도 86b) 0.1 M PBS 용액 중에서 pH의 함수로서 PDPA-TMR의 형광 강도비를 도시한 도면. 샘플을 545㎚에서 여기시키고, 방출 스펙트럼을 560 내지 750㎚에서 수집한다. 중합체 농도를 0.1㎎/㎖에서 제어한다.
도 87a 및 도 87b는 (도 87a) pH-의존적 형광 방출 스펙트럼 및 (도 87b) 0.1 M PBS 용액 중에서 pH의 함수로서 PDBA-Cy5의 형광 강도비를 도시한 도면. 샘플을 640㎚에서 여기시키고, 방출 스펙트럼을 650 내지 750㎚에서 수집한다. 중합체 농도를 0.1㎎/㎖에서 제어한다.
도 88은 PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5 마이셀에 대해 pH의 함수로서 정규화된 형광 강도를 도시한 도면. 중합체 농도는 100㎕/㎖였다.
도 89a 및 도 89b는 분자 혼합된 마이셀 및 마이셀 혼합물의 형광 특징을 도시한 도면. (도 89a) pH 7.4에서 1:19의 몰 비로 PDBA-Cy5 및 PEG-b-(PR-r-AMA3)의 분자 혼합된 마이셀의 형광 강도. (도 89b) pH 7.4에서 1:19의 몰 비로 PDBA-Cy5 마이셀과 PEG-b-(PR-r-AMA3) 마이셀의 마이셀 혼합물의 형광 강도.
도 90a 내지 도 90d는 형광 공명 에너지 전이(FRET) 실험이 다중-스펙트럼 혼성 UPS 나노프로브의 형성을 입증한다는 것을 도시한 도면. PEG-b-PR 블록 공중합체는 상이한 염료에 의해 암호화된다. PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5를 포함하는 3가지 예시적인 PEG-b-(PR-r-염료) 블록 공중합체는 호모FRET 효과를 최소화하기 위해 낮은 염료/중합체 비(1:1)로 합성된다. 도 90a: PEPA-BDY493, PDPA-TMR, PEPA-BDY493/PDPA-TMR(1:1) 마이셀, 및 PEPA-BDY493과 PDPA-TMR의 마이셀 혼합물을 485㎚에서 여기시키고, 이어서, 방출 스펙트럼을 490 내지 720㎚에서 수집한다. PEPA-BDY493 내지 PDPA-TMR의 강한 FRET 효과가 관찰되는데, 이는 PEPA/PDPA 혼성 나노입자의 형성을 나타낸다. 도 90b: PDPA-TMR로부터 PDBA-Cy5까지의 강한 FRET 효과가 관찰되는데, 이는 PDPA/PDBA 혼성 나노입자의 형성을 나타낸다. 도 90c: PEPA-BDY493으로부터 PDBA-Cy5까지의 강한 FRET 효과가 관찰되는데, 이는 PEPA/PDBA 혼성 나노입자의 형성을 나타낸다. 도 90d: BDY493으로부터 TMR까지, 최종적으로 Cy5까지의 강한 순차적 FRET 효과가 관찰되는데, 이는 PEPA/PDPA/PDBA 혼성 나노입자의 형성을 나타낸다.
도 91은 PEPA-BDY493 (1), PDPA-TMR (2), PDBA-Cy5 (3), 및 3위 1체(three-in-one) 혼성 나노프로브(4)를 포함하는 염료-컨쥬게이팅된 중합체 마이셀의 대표적인 이미지를 도시한 도면.
도 92a 내지 도 92f는 혼성 나노프로브의 시험관내 특징을 도시한 도면. (도 92a 내지 도 92d) 상이한 pH 완충제에서 혼성 나노프로브의 형광 스펙트럼. BDY493, TMR 및 Cy5 신호는 각각 485, 545 및 640㎚에서 여기된다. BDY493, TMR 및 Cy5에 대한 방출 스펙트럼은 각각 490 내지 750㎚, 560 내지 750, 및 650 내지 750㎚로부터 수집된다. (도 92e) 시간의 함수로서 혼성 나노프로브의 계수율 및 정규화된 형광 강도를 플롯팅한다. 상이한 pH에서 계수율을 동적 광산란 분석에 의해 결정한다. 다중-스펙트럼 혼성 UPS 나노프로브의 다단계 활성화를 상이한 pH 범위에서 녹색, 적색 및 청색 S자형 곡선에 의해 나타낸다. (도 92f) 상이한 pH에서 다중-스펙트럼 UPS 나노프로브의 대표적인 형광 이미지를 캡처한다. 황색은 녹색과 적색 신호가 병합된 색이다. 백색은 청색, 녹색 및 적색 신호가 병합된 색이다.
도 93a 내지 도 93f는 혼성 나노프로브의 pH-의존적 형광 방출 스펙트럼을 도시한 도면. BDY493, TMR 및 Cy5 신호는 각각 485, 545 및 640㎚에서 여기되었다. 대응되는 방출 스펙트럼을 각각 490 내지 750, 560 내지 750 및 650 내지 750㎚에서 수집하였다.
도 94는 pH의 함수로서 혼성 UPS 나노프로브 내 PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5 성분의 정규화된 형광 강도를 도시한 도면.
도 95a 및 도 95b는 상이한 pH 용액에서 혼성 나노프로브의 형태 및 입자 크기 분포의 (도 95a) TEM 및 (도 95b) DLS 분석을 도시한 도면. 축척 바는 TEM 이미지에서 100㎚이다.
도 96은 A549 세포에서 에르비툭스(Erbitux)-컨쥬게이팅된 PDPA-TMR 나노프로브의 특이적 형광 활성화를 도시한 도면. 세포를 에르비툭스-컨쥬게이팅된 PDPA-TMR 마이셀 (상부) 또는 PDPA-TMR 마이셀(하부)로 1시간 동안 각각 처리하였다. 축척 바는 40㎛이다.
도 97은 A549 인간 폐암 세포의 단일 식균 작용 세포 소기관에서 에르비툭스-암호화된 혼성 UPS 나노프로브의 동시통합화된 흡수를 도시한 도면. 종양 세포를 3시간 동안 나노프로브와 함께 인큐베이션시킨 다음 공초점 이미징하였다. 축척 바는 40㎛이다.
도 98은 폐암 A549 세포에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 99는 두경부암 HN5 세포에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 100은 KRAS 유전자 돌연변이를 갖는 인간 폐암 H460 세포주에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 101은 KRAS 유전자 돌연변이를 갖는 인간 폐암 A549 세포주에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 102는 P53 유전자 돌연변이를 갖는 인간 폐암 H2882 세포주에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 103a 및 도 103b는 폐암 세포주의 패널에서 세포 소기관 성숙을 도시한 도면. 초기 엔도좀(도 103a) 및 후기 엔도좀/리소좀(도 103b)의 성숙 속도의 정량화는 표현형 차이를 초래하는 Kras 돌연변이를 정확히 기술한다. 30분에 초기 엔도좀(EE)에서 PDPA-TMR(I 6.2)의 형광 강도는 PEPA-BDY493 신호(I 6.9)에 의해 정규화된다. 75분에 후기 엔도좀/리소좀(LE/Lys)에서 PDBA-Cy5(I 5.3)의 형광 강도는 PEPA-BDY493 신호(I 6.9)에 의해 정규화된다. Kras 돌연변이 세포주와 Kras 야생형 세포주 사이의 상당한 차이는 KRAS 돌연변이가 후기 엔도좀/리소좀 성숙을 초래한다는 것을 나타낸다. **P<0.01, 짝지은, 양측 t-검정; n = 10.
도 104a 내지 도 104d는 폐암 세포주의 패널에서 세포 소기관 성숙을 도시한 도면. 초기 엔도좀(도 104a) 및 후기 엔도좀/리소좀(도 104b)의 성숙 속도의 정량화는 표현형 차이를 초래하는 Kras 돌연변이를 정확히 기술한다. 도 104c: 30분에 초기 엔도좀(EE)에서 PDPA-TMR의 형광 강도(I 6.2)는 PEPA-BDY493 신호(I 6.9)에 의해 정규화된다. 도 104d: 75분에 후기 엔도좀/리소좀(LE/Lys)에서 PDBA-Cy5(I 5.3)의 형광 강도는 PEPA-BDY493 신호(I 6.9)에 의해 정규화된다. K-ras 돌연변이 세포주와 K-ras 야생형 세포주 사이의 상당한 차이는 KRAS 돌연변이가 후기 엔도좀/리소좀 성숙을 초래한다는 것을 나타낸다. **P<0.01, 짝지은, 양측 t 검정; n = 10.
도 105a 및 도 105b는 살아있는 세포에서 다중-스펙트럼 혼성 UPS 나노프로브를 이용하는 내포작용 동안 세포 소기관 성숙의 다단계 pH 이미징을 도시한 도면. HBEC30 폐 상피세포(도 105a) 및 동질유전자 HCC4017 폐암 세포(도 105b)를 4℃에서 30분 동안 100㎍/㎖ 에르비툭스-컨쥬게이팅된 혼성 UPS 나노프로브와 함께 인큐베이션시키고 나서, 세척하고, 공초점 현미경 하에 37℃에서 실시간으로 이미징하였다. PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5 신호를 각각 488, 543 및 637㎚에서 여기시킨다. FITC(515/30BP), TRITC(590/75bP) 및 Cy5(650LP) 필터를 PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5 이미지 캡처를 위해 사용한다. BDY493, TMR 및 Cy5를 각각 녹색, 적색 및 청색으로 나타낸다. 축척 바는 20㎛이다.
도 106은 HBEC30KT 인간 상피 세포에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 107은 인간 동질유전자 HCC4017 폐암 세포에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 108은 HBEC30KT-shTP53 세포에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 109는 HBEC30KT-shTP53 / KRAS G12V 세포에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 110은 HBEC30KT-shTP53 / KRAS G12V / shLKB1 세포에서 다색 혼성 나노프로브에 의한 엔도좀 성숙의 다중복합 이미징을 도시한 도면. 축척 바는 20㎛이다.
도 111a 내지 도 111d는 동질유전자 진행 계열의 HBEC30 세포에서 시간-과정 세포 소기관 성숙을 도시한 도면. 초기 엔도좀(도 111a) 및 후기 엔도좀/리소좀(도 111b)의 성숙 속도의 정량화는 표현형 차이를 초래하는 Kras 돌연변이를 정확히 기술한다. 도 111c: 30분에 초기 엔도좀(EE)에서 PDPA-TMR의 형광 강도(I 6.2)는 PEPA-BDY493 신호(I 6.9)에 의해 정규화된다. HBEC30KT-shTP53과 HBEC30KT-shTP53 / KRAS G12V 세포 사이의 상당한 차이는 KRAS 돌연변이가 초기 엔도좀 성숙을 초래한다는 것을 나타낸다. **P<0.01, 짝지은, 양측 t 검정; n = 10. 도 111d: 150분에 후기 엔도좀/리소좀(LE/Lys)에서 PDBA-Cy5의 형광 강도(I 5.3)는 PEPA-BDY493 신호(I 6.9)에 의해 정규화되었다. HBEC30KT-shTP53과 HBEC30KT-shTP53 / KRAS G12V 세포 사이의 상당한 차이는 KRAS 돌연변이가 후기 엔도좀/리소좀 성숙을 초래한다는 것을 나타낸다. **P<0.01, 짝지은, 양측 t 검정; n = 10.
도 112a 내지 도 112c는 항상-온/오프-온 UPS 나노입자의 합성 및 특징을 도시한 도면. (도 112a) 및 (도 112b) 이중-리포터 나노입자의 개략도. 마이셀 상태에서, 항상-온 염료는 온/오프 형광단에 대한 소광제로서 작용한다. 마이셀이 해리될 때, 항상-온 및 온/오프 형광단은 독립적으로 형광을 낼 수 있다. 이들 두 염료와 컨쥬게이팅된 중합체의 비가 변할 때 보디피(도 112a) 및 Cy3.5(도 112b)의 온/오프 비가 변한다. 40% Cy3.5-컨쥬게이팅된 공중합체와 함께 60% 보디피-컨쥬게이팅된 공중합체의 중량 분율은 최종 조합으로서 선택되었다. (도 112c) pH의 함수로서 UPS6 .2 나노프로브의 형광 신호 증폭. 이미지를 녹색 및 황색 필터를 이용하여 마에스트로 생체내 이미징 시스템(CRI) 상에서 캡처하였다.
도 113a 및 도 113b는 삼블록 공중합체 PEO-b-P(DEA -b- D5a), PEO-b-P(D5a40-b-DEA40) 및 무작위 블록 중합체 PEO-b-P(DEA -r- D5a)의 화학 구조를 도시한 도면(도 113a). 3차 아미노기의 몰분율의 함수로서 PEO-b-P(D5a40-b-DEA40), PEO-b-P(DEA 40-b- D5a 40) 및 PEO-b-P(D5a40-r-DEA40) 공중합체에 대한 pH 적정 곡선(도 113b).
도 114a 및 도 114b는 분자 혼합된 마이셀 및 마이셀 혼합물의 형광 특징을 도시한 도면. (도 114a) pH 7.4에서 1:19의 몰비로 PEPA-Cy5 및 PEG-b-(PR-r-AMA3)의 분자 혼합된 마이셀의 형광 강도. (도 114b) pH 7.4에서 1:19의 몰 비로 PEPA-Cy5 마이셀과 PEG-b-(PR-r-AMA3) 마이셀의 마이셀 혼합물의 형광 강도.
일부 양상에서, 본 개시내용은 특정 전이 pH 초과에서 해리되는 pH 반응성 나노입자를 형성할 수 있는 중합체를 제공한다. 일부 실시형태에서, 이들 중합체는 0.25 pH 단위 미만의 목적으로 하는 pH 전이점(ΔpH10-90%)의 특정 맞춤을 허용할 뿐만 아니라 약 pH 4 내지 약 pH 8의 pH 전이점 범위에 대해 pH 프로브를 개발하는 상이한 단량체의 혼합물을 포함한다. 넓은 범위의 pH 전이점은 소포 수송, 종양 pHe의 이미징, 특정 조직에 대한 약물 화합물의 전달, 종양 조직을 절제하기 위한 수술 능력을 개선시키기 위한 종양 시각화의 개선, 또는 엔도좀/리소좀의 성숙 또는 발생의 연구를 포함하지만, 이들로 제한되지 않는 넓은 적용범위를 허용한다. 일부 양상에서, 본 개시내용은 상기 기재한 바와 같은 pH 반응 시스템에서 이들 중합체를 이용하는 방법을 제공한다. 본 개시내용의 중합체 및 얻어진 pH 반응 시스템을 이용하는 추가적인 방법은 본 명세서에 참고로 포함된 WO 2013/152059에 기재되어 있다.
A.
화학적 정의
화학적 기와 관련하여 사용될 때: "수소"는 -H를 의미하고; "하이드록시"는 -OH를 의미하며; "카복시"는 -C(=O)OH(또한 -COOH 또는 -CO2H로 기재됨); "할로"는 독립적으로 -F, -Cl, -Br 또는 -I를 의미하고; "아미노"는 -NH2를 의미하며; "나이트로"는 -NO2를 의미하고; "사이아노"는 -CN을 의미하며; 1가 내용에서 "포스페이트"는 -OP(O)(OH)2 또는 이의 탈양성자화된 형태를 의미하고; 2가 내용에서 "포스페이트"는 -OP(O)(OH)O- 또는 이의 탈양성자화된 형태를 의미하고; "머캅토"는 -SH를 의미하며; "티오"는 =S를 의미하고; "설폰일"은 -S(O)2-를 의미하며; "설핀일"은 -S(O)-를 의미한다.
화학식과 관련하여, 기호 "-"는 단일 결합을 의미하고, "="는 이중 결합을 의미하며, "≡"는 삼중결합을 의미한다. 기호 ""는 단일 또는 이중으로 존재한다면, 선택적 결합을 나타낸다. 기호 ""는 단일 결합 또는 이중 결합을 나타낸다. 따라서, 예를 들어, 화학식 는 및 를 포함한다. 그리고, 하나의 이러한 고리 원자가 하나 초과의 이중 결합의 부분을 형성하지 않는다는 것이 이해된다. 더 나아가, 1 또는 2개의 입체 발생 원자를 연결할 때 공유 결합 기호 "-"는 임의의 바람직한 입체화학을 표시하지 않는다는 것이 주목된다. 대신에, 모든 입체이성질체뿐만 아니라 이의 혼합물을 아우른다. 기호 ""는, 결합을 수직으로 가로질러 도시될 때(예를 들어, 메틸에 대해 ) 기의 부착 지점을 나타낸다. 부착 지점은 전형적으로 부착 지점을 분명하게 동정함에 있어서 독자를 돕기 위해 더 큰 기에 대해 이러한 방식으로만 동정된다는 것을 주목한다. 기호 ""는 웨지(wedge)의 두꺼운 말단에 부착된 기가 "페이지 밖"에 있는 단일 결합을 의미한다. 기호 ""는 웨지의 두꺼운 말단에 부착된 기가 "페이지 내에" 있는 단일 결합을 의미한다. 기호 ""는 이중 결합 주위의 기하학(예를 들어, E 또는 Z 중 하나)이 정해지지 않는 단일 결합을 의미한다. 따라서 선택사항 둘 다 뿐만 아니라 이들의 조합이 의도된다. 본 출원에 나타낸 구조의 원자에 대한 임의의 정해지지 않은 원자가는 해당 원자에 결합된 수소 원자를 명확하게 나타낸다. 탄소 원자 상의 볼드체 점은 해당 탄소에 부착된 수소가 종이 면 바깥으로 배향된다는 것을 나타낸다.
"R" 기가 고리계 상에서, 예를 들어 하기 화학식에서 "유동기"로서 도시될 때:
R은 안정한 구조가 형성된다면 도시되거나, 암시되거나 또는 명확하게 나타나는 수소를 포함하는 임의의 고리 원자에 부착된 임의의 수소 원자를 치환할 수 있다. "R"기가 축합된 고리계 상에서, 예를 들어 하기 화학식에서 "유동기"로서 도시될 때,
R은 달리 구체화되지 않는 한 축합 고리 중 하나의 임의의 고리 원자에 부착된 임의의 수소를 치환할 수 있다. 치환 가능한 수소는 안정한 구조가 형성된다면, 도시된 수소(예를 들어, 상기 화학식에서 질소에 부착된 수소), 암시된 수소(예를 들어, 나타내지 않았지만 존재할 것으로 이해되는 상기 화학식의 수소), 명확하게 나타낸 수소, 및 존재가 고리 원자의 정체성에 의존하는 선택적 수소(예를 들어, X가 -CH-일 때 X기에 부착된 수소)를 포함한다. 도시된 예에서, R은 축합 고리계의 5-원 또는 6-원 고리 중 하나에 존재할 수 있다. 상기 화학식에서, 삽입 어구에 포함된 "R" 기 바로 다음의 아래 첨자 "y"는 수치적 변수를 나타낸다. 달리 구체화되지 않는 한, 이 변수는 0, 1, 2, 또는 2 초과의 임의의 정수일 수 있으며, 고리 또는 고리계의 치환 가능한 수소 원자의 최대 수에 의해서만 제한된다.
이하의 그룹 및 부류에 대해, 다음의 삽입 어구 첨자는 다음과 같이 그룹/부류를 추가로 나타낸다: "(Cn)"은 그룹/부류에서 탄소 원자의 정확한 수(n)을 나타낸다. "(C≤n)"은 당해 기에 대해서는 가능한 적은 최소 수로 그룹/부류에 있을 수 있는 탄소 원자의 최대 수(n)를 나타내며, 예를 들어, "알켄일(C≤8)" 또는 부류 "알켄(C≤8)"기에서 탄소 원자의 최소 수는 2인 것으로 이해된다. 예를 들어, "알콕시(C≤10)"는 1 내지 10개의 탄소 원자를 갖는 해당 알콕시기를 표시한다. (Cn-n')는 상기 기에서 탄소 원자의 최소(n)와 최대 수(n')를 둘 다 나타낸다. 유사하게, "알킬(C2-10)"은 2 내지 10개의 탄소 원자를 갖는 해당 알킬기를 표시한다.
본 명세서에 사용된 바와 같은 용어 "포화된"은 이렇게 변형된 화합물 또는 기가 탄소-탄소 이중 결합이 없고 탄소-탄소 삼중 결합이 없다는 것을 의미한다. 포화된 기의 치환된 형태의 경우에, 하나 이상의 탄소 산소 이중 결합 또는 탄소 질소 이중 결합이 존재할 수 있다. 그리고, 이러한 결합이 존재할 때, 케토-엔올 호변 이성질화 또는 이민/엔아민 호변 이성질화의 부분으로서 생길 수 있는 탄소-탄소이중 결합은 불가능하게 되지 않는다.
"치환된"이라는 수식어 없이 사용될 때 용어 "지방족"은 이렇게 변형된 화합물/가가 비환식 또는 환식이지만, 비방향족 탄화수소 화합물 또는 기라는 것을 의미한다. 지방족 화합물/기에서, 탄소 원자는 직쇄, 분지쇄 또는 비방향족 고리(지환식)에서 함께 결합될 수 있다. 지방족 화합물/기는 단일 결합(알칸/알킬)에 의해 결합되는 불포화일 수 있거나 또는 하나 이상의 이중 결합(알켄/알켄일)을 지니는 또는 하나 이상의 삼중 결합(알킨/알킨일)을 지니는 불포화될 수 있다.
"치환된"이라는 수식어 없이 사용될 때 용어 "알킬"은 부착 지점으로서 탄소 원자를 지니며, 선형 또는 분지형 비환식 구조를 지니고 탄소 및 수소 이외의 원자가 없는 1가 포화 지방족기를 지칭한다. -CH3 (Me), -CH2CH3 (Et), -CH2CH2CH3(n-Pr 또는 프로필), -CH(CH3)2(i-Pr, i Pr 또는 아이소프로필), -CH2CH2CH2CH3(n-Bu), -CH(CH3)CH2CH3(sec-부틸), -CH2CH(CH3)2(아이소부틸), -C(CH3)3(tert-부틸, t-부틸, t-Bu 또는 t Bu) 및 -CH2C(CH3)3(neo-펜틸)기는 알킬기의 비제한적 예이다. "치환된"이라는 수식어 없이 사용될 때 용어 "알칸다이일"은 부착 지점(들)으로서 1 또는 2개의 탄소 원자를 지니며, 선형 또는 분지형 비환식 구조를 지니고 탄소-탄소 이중 또는 삼중 결합이 없고, 탄소 및 수소 이외의 원자가 없는 2가 포화 지방족기를 지칭한다. -CH2- (메틸렌), -CH2CH2-, -CH2C(CH3)2CH2- 및 -CH2CH2CH2- 기는 알칸다이일기의 비제한적 예이다. "치환된"이라는 수식어 없이 사용될 때 용어 "알킬리덴"은 2가 기 =CRR'을 지칭하며, 이때 R 및 R'는 독립적으로 수소 또는 알킬이다. 알킬리덴기의 비제한적 예는 =CH2, =CH(CH2CH3) 및 =C(CH3)2를 포함한다. "알칸"은 화합물 H-R을 지칭하되, 여기서 R은 알킬이며, 이 용어는 상기 정의된 바와 같다. 임의의 이들 용어는 "치환된"이라는 수식어와 함께 사용될 때 하나 이상의 수소 원자는 -OH, -F, -Cl, -Br, -I, -NH2, -NO2, -CO2H, -CO2CH3, -CN, -SH, -OCH3, -OCH2CH3, -C(O)CH3, -NHCH3, -NHCH2CH3, -N(CH3)2, -C(O)NH2, -OC(O)CH3 또는 -S(O)2NH2에 의해 독립적으로 대체되었다. 다음의 기는 치환된 알킬 기의 비제한적 예이다: -CH2OH, -CH2Cl, -CF3, -CH2CN, -CH2C(O)OH, -CH2C(O)OCH3, -CH2C(O)NH2, -CH2C(O)CH3, -CH2OCH3, -CH2OC(O)CH3, -CH2NH2, -CH2N(CH3)2 및 -CH2CH2Cl. 용어 "할로알킬"은 치환된 알킬의 서브세트이며, 이때, 하나 이상의 수소 원자는 할로기로 대체되었고, 탄소, 수소 및 할로겐을 제외한 다른 원자는 존재하지 않는다. -CH2Cl 기는 할로알킬의 비제한적 예이다. 용어 "플루오로알킬"은 치환된 알킬의 서브세트이며, 이때 하나 이상의 수소는 플루오로기로 치환되었고, 탄소, 수소 및 플루오린을 제외한 다른 원자는 존재하지 않는다. -CH2F, -CF3 및 -CH2CF3 기는 플루오로알킬기의 비제한적 예이다.
"치환된"이라는 수식어 없이 사용될 때 용어 "사이클로알킬"은 부착 지점으로서 탄소 원자를 지니며, 선형 또는 분지형 사이클로 또는 환식 구조를 지니고 탄소-탄소 이중 또는 삼중 결합이 없으며, 탄소 및 수소 이외의 원자가 없는 1가 포화 지방족기를 지칭한다. 본 명세서에서 사용되는 바와 같은 사이클로알킬기는 부착 지점이 고리계라면, 고리계에 부착된 하나 이상의 분지 알킬기(탄소 수 제한 허용)를 함유할 수 있다. 사이클로알킬기의 비제한적 예는: -CH(CH2)2 (사이클로프로필), 사이클로부틸, 사이클로펜틸, 또는 사이클로헥실을 포함한다. "치환된"이라는 수식어 없이 사용될 때 용어 "사이클로알칸다이일"은 부착 지점(들)으로서 1 또는 2개의 탄소 원자를 지니며, 선형 또는 분지형 사이클로 또는 환식 구조를 지니고, 탄소-탄소 이중 또는 삼중 결합이 없고, 탄소 및 수소 이외의 원자가 없는 2가 포화 지방족기를 지칭한다. 는 사이클로알칸다이일기의 비제한적 예이다. "치환된"이라는 수식어 없이 사용될 때 용어 "사이클로알킬리덴"은 2가 =CRR' 기를 지칭하며, 이때 R 및 R'는 함께 취해져서 적어도 2개의 탄소를 지니는 사이클로알칸다이일기를 형성한다. 알킬리덴기의 비제한적 예는 =C(CH2)2 및 =C(CH2)5를 포함한다. "사이클로알칸"은 화합물 H-R을 지칭하되, R은 사이클로알킬이고, 이 용어는 상기 정의한 바와 같다. 임의의 이들 용어가 "치환된"이라는 수식어와 함께 사용될 때, 하나 이상의 수소 원자는 -OH, -F, -Cl, -Br, -I, -NH2, -NO2, -CO2H, -CO2CH3, -CN, -SH, -OCH3, -OCH2CH3, -C(O)CH3, -NHCH3, -NHCH2CH3, -N(CH3)2, -C(O)NH2, -OC(O)CH3 또는 -S(O)2NH2에 의해 독립적으로 대체되었다. 다음의 기는 치환된 사이클로알킬기의 비제한적 예이다: -C(OH)(CH2)2, .
"치환된"이라는 수식어와 함께 사용될 때 용어 "아릴"은 부착 지점으로서 방향족 탄소 원자를 지니는 1가 불포화 방향족기를 지칭하며, 상기 탄소 원자는 하나 이상의 6원 방향족 고리 구조의 부분을 형성하되, 고리 원자는 모든 탄소이고, 기는 탄소 및 수소 이외의 원소로 이루어지지 않는다. 하나 초과의 고리가 존재한다면, 고리는 축합되거나 비축합될 수 있다. 본 명세서에서 사용되는 바와 같은 용어는 제1 방향족 고리 또는 존재하는 임의의 추가적인 방향족 고리에 부착된 하나 이상의 알킬 또는 아르알킬기(탄소수 제한 허용)의 존재를 불가능하게 하지 않는다. 아릴기의 비제한적 예는 페닐(Ph), 메틸페닐, (다이메틸)페닐, -C6H4CH2CH3(에틸페닐), 나프틸, 및 바이페닐로부터 유도된 1가 기를 포함한다. "치환된"이라는 수식어와 함께 사용될 때 용어 "아렌다이일"은 부착 지점으로서 2개의 방향족 탄소 원자를 지니는 2가 방향족기를 지칭하며, 상기 탄소 원자는 하나 이상의 6월 방향족 고리 구조(들)의 부분을 형성하되, 고리 원자는 모두 탄소이고, 1가 기는 탄소 및 수소 이외의 원자로 이루어지지 않는다. 본 명세서에서 사용되는 바와 같은 용어는 제1 방향족 고리 또는 존재하는 임의의 추가적인 방향족 고리에 부착된 하나 이상의 알킬, 아릴 또는 아르알킬기(탄소수 제한 허용)의 존재를 불가능하게 하지 않는다. 하나 초과의 고리가 존재한다면, 고리는 축합 또는 비축합될 수 있다. 비축합 고리는 다음 중 하나 이상을 통해 연결될 수 있다: 공유 결합, 알칸다이일, 또는 알켄다이일기(탄소수 제한 허용). 아렌다이일기의 비제한적 예는 하기를 포함한다:
"아렌"은 화합물 H-R을 지칭하되, R은 아릴이고, 해당 용어는 상기 정의한 바와 같다. 벤젠 및 톨루엔은 아렌의 비제한적 예이다. 임의의 이들 용어가 "치환된"이라는 수식어와 함께 사용될 때, 하나 이상의 수소 원자는 -OH, -F, -Cl, -Br, -I, -NH2, -NO2, -CO2H, -CO2CH3, -CN, -SH, -OCH3, -OCH2CH3, -C(O)CH3, -NHCH3, -NHCH2CH3, -N(CH3)2, -C(O)NH2, -OC(O)CH3 또는 -S(O)2NH2에 의해 독립적으로 치환되었다.
"치환된"이라는 수식어 없이 사용될 때 용어 "헤테로아릴"은 부착 지점으로서 방향족 탄소 원자 또는 질소 원자와 함께 1가 방향족 기를 지칭하고, 상기 탄소 원자 또는 질소 원자는 하나 이상의 방향족 고리 구조의 부분을 형성하되, 고리 원자 중 적어도 하나는 질소, 산소 또는 황이고, 헤테로아릴기는 탄소, 수소, 방향족 질소, 방향족 산소 및 방향족 황 이외의 원자로 이루어지지 않는다. 하나 초과의 고리가 제공된다면, 고리는 축합 또는 비축합될 수 있다. 본 명세서에서 사용되는 바와 같은 용어는 방향족 고리 또는 방향족 고리계에 부착된 하나 이상의 알킬, 아릴, 및/또는 아르알킬기(탄소수 제한 허용)의 존재를 불가능하게 하지 않는다. 헤테로아릴기의 비제한적 예는 퓨란일, 이미다졸릴, 인돌릴, 인다졸릴(Im), 아이소옥사졸릴, 메틸피리딘일, 옥사졸릴, 페닐피리딘일, 피리딘일, 피롤릴, 피리미딘일, 피라진일, 퀴놀릴, 퀴나졸릴, 퀴녹살린일, 트라이아진일, 테트라졸릴, 티아졸릴, 티엔일 및 트라아졸릴을 포함한다. 용어 "N-헤테로아릴"은 부착지점으로서 질소 원자를 지니는 헤테로아릴 기를 지칭한다. "치환된"이라는 수식어 없이 사용될 때 용어 "헤테로아렌다이일"은 2개의 부착지점으로서 2개의 방향족 탄소 원자, 2개의 방향족 질소 원자 또는 1개의 방향족 탄소 원자 및 1개의 방향족 질소 원자를 지니는 2가 방향족기를 지칭하며, 상기 원자는 하나 이상의 방향족 고리 구조(들)의 부분을 형성하되, 고리 원자 중 적어도 하나는 질소, 산소 또는 황이고, 2가기는 탄소, 수소, 방향족 질소, 방향족 산소 및 방향족 황 이외의 원자로 이루어지지 않는다. 하나 초과의 고리가 존재한다면, 고리는 축합 또는 비축합될 수 있다. 비축합 고리는 다음 중 하나 이상을 통해 연결될 수 있다: 공유 결합, 알칸다이일 또는 알켄다이일기(탄소수 제한 허용). 본 명세서에 사용되는 바와 같은 용어는 방향족 고리 또는 방향족 고리계에 부착된 하나 이상의 알킬, 아릴 및/또는 아르알킬기(탄소수 제한 허용)의 존재를 불가능하게 하지 않는다. 헤테로아렌다이일기의 비제한적 예는 하기를 포함한다:
"헤테로아렌"은 화합물 H-R을 지칭하되, 여기서 R은 헤테로아릴이다. 피리딘 및 퀴놀린은 헤테로아렌의 비제한적 예이다. 이들 용어가 "치환된"이라는 수식어와 함께 사용될 때, 하나 이상의 수소 원자는 -OH, -F, -Cl, -Br, -I, -NH2, -NO2, -CO2H, -CO2CH3, -CN, -SH, -OCH3, -OCH2CH3, -C(O)CH3, -NHCH3, -NHCH2CH3, -N(CH3)2, -C(O)NH2, -OC(O)CH3 또는 -S(O)2NH2에 의해 독립적으로 대체되었다.
"치환된"이라는 수식어와 함께 사용될 때 용어 "아실"은 -C(O)R기를 지칭하며, 이때 R은 수소, 알킬, 사이클로알킬, 아릴, 아르알킬 또는 헤테로아릴이며, 해당 용어는 상기 정의한 바와 같다. -CHO, -C(O)CH3(아세틸, Ac), -C(O)CH2CH3, -C(O)CH2CH2CH3, -C(O)CH(CH3)2, -C(O)CH(CH2)2, -C(O)C6H5, -C(O)C6H4CH3, -C(O)CH2C6H5, -C(O)(이미다졸릴)기는 아실기의 비제한적 예이다. "티오아실"은 -C(O)R 기의 산소 원자가 황 원자로 대체된 것(-C(S)R)을 제외하고, 유사한 방식으로 정의된다. 용어 "알데하이드"는 상기 정의한 바와 같은 알칸에 대응하되, 수소 원자 중 적어도 하나는 -CHO 기로 대체되었다. 임의의 이들 용어가 "치환된"이라는 수식어와 함께 사용될 때, 하나 이상의 수소 원자(만약에 있다면, 카본일 또는 티오카본일기에 직접적으로 부착된 수소 원자를 포함)는 -OH, -F, -Cl, -Br, -I, -NH2, -NO2, -CO2H, -CO2CH3, -CN, -SH, -OCH3, -OCH2CH3, -C(O)CH3, -NHCH3, -NHCH2CH3, -N(CH3)2, -C(O)NH2, -OC(O)CH3 또는 -S(O)2NH2로 독립적으로 대체되었다. -C(O)CH2CF3, -CO2H (카복실), -CO2CH3 (메틸카복실), -CO2CH2CH3, -C(O)NH2 (카바모일) 및 -CON(CH3)2기는 치환된 아실기의 비제한적 예이다.
"치환된"이라는 수식어 없이 사용될 때 용어 "알콕시"는 -OR기를 지칭하며, R은 알킬이며, 해당 용어는 상기 정의된 바와 같다. 알콕시기의 비제한적 예는 -OCH3(메톡시), -OCH2CH3(에톡시), -OCH2CH2CH3, -OCH(CH3)2 (아이소프로폭시) 및 -OC(CH3)3(tert-뷰톡시)을 포함한다. "치환된"이라는 수식어 없이 사용될 때, 용어 "사이클로알콕시", "알켄일옥시", "사이클로알켄일옥시", "알킨일옥시", "아릴옥시", "아르알콕시", "헤테로아릴옥시", "헤테로사이클로알콕시" 및 "아실옥시"는 -로로서 정의된 기를 지칭하며, 이때 R은 각각 사이클로알킬, 알켄일, 사이클로알켄일, 알킨일, 아릴, 아르알킬, 헤테로아릴, 헤테로사이클로알킬 및 아실이다. 용어 "알콕시다이일"은 2가기 -O-알칸다이일-, -O-알칸다이일-O- 또는 -알칸다이일-O-알칸다이일-을 지칭한다. "치환된"이라는 수식어 없이 사용될 때 용어 "알킬티오", "사이클로알킬티오" 및 "아실티오"는 -SR기를 지칭하며, 이때 R은 각각 알킬, 사이클로알킬 및 아실이다. 용어 "알코올"은 상기 정의한 바와 같은 알칸에 대응하되, 수소 원자 중 적어도 하나는 하이드록시기로 대체되었다. 용어 "에터"는 상기 정의한 바와 같은 알칸에 대응하되, 수소 원자 중 적어도 하나는 알콕시 또는 사이클로알콕시기로 치환되었다. 임의의 이들 용어가 "치환된"이라는 수식어와 함께 사용될 때, 하나 이상의 수소 원자는 -OH, -F, -Cl, -Br, -I, -NH2, -NO2, -CO2H, -CO2CH3, -CN, -SH, -OCH3, -OCH2CH3, -C(O)CH3, -NHCH3, -NHCH2CH3, -N(CH3)2, -C(O)NH2, -OC(O)CH3 또는 -S(O)2NH2로 독립적으로 치환되었다.
"치환된"이라는 수식어 없이 사용될 때 용어 "알킬아미노"는 -NHR기를 지칭하며, 이때 R은 알킬이고, 해당 용어는 상기 정의한 바와 같다. 알킬아미노기의 비제한적 예는 -NHCH3 및 -NHCH2CH3을 포함한다. "치환된"이라는 수식어 없이 사용될 때 용어 "다이알킬아미노"는 -NRR'기를 지칭하며, 이때 R 및 R'는 각각 독립적으로 동일 또는 상이한 알킬 기일 수 있거나, 또는 R 및 R'는 알칸다이일을 나타내기 위해 함께 취해질 수 있다. 다이알킬아미노기의 비제한적 예는: -N(CH3)2, -N(CH3)(CH2CH3) 및 N-피롤리딘일을 포함한다. "치환된"이라는 수식어 없이 사용될 때 용어 "알콕시아미노", "사이클로알킬아미노", "알켄일아미노", "사이클로알켄일아미노", "알킨일아미노", "아릴아미노", "아르알킬아미노", "헤테로아릴아미노", "헤테로사이클로알킬아미노" 및 "알킬설폰일아미노"는 -NHR로서 정의되는 기를 지칭하며, 이때 R은 각각 알콕시, 사이클로알킬, 알켄일, 사이클로알켄일, 알킨일, 아릴, 아르알킬, 헤테로아릴, 헤테로사이클로알킬 및 알킬설폰일이다. 아릴아미노기의 비제한적 예는 -NHC6H5. "치환된"이라는 수식어 없이 사용될 때 용어 "아미도"(아실아미노)는 -NHR기를 지칭하며, 이때 R은 아실이고, 해당 용어는 상기 정의한 바와 같다. 아미도기의 비제한적 예는 -NHC(O)CH3이다. "치환된"이라는 수식어 없이 사용될 때 용어 "알킬이미노"는 2가기 =NR을 지칭하며, 이때 R은 알킬이고, 해당 용어는 상기 정의한 바와 같다. 용어 "알킬아미노다이일"은 2가기 -NH-알칸다이일-, -NH-알칸다이일-NH- 또는 -알칸다이일-NH-알칸다이일-을 지칭한다. 임의의 이들 용어가 "치환된"이라는 수식어와 함께 사용될 때, 하나 이상의 수소 원자는 -OH, -F, -Cl, -Br, -I, -NH2, -NO2, -CO2H, -CO2CH3, -CN, -SH, -OCH3, -OCH2CH3, -C(O)CH3, -NHCH3, -NHCH2CH3, -N(CH3)2, -C(O)NH2, -OC(O)CH3 또는 -S(O)2NH2로 독립적으로 치환된다. -NHC(O)OCH3 및 -NHC(O)NHCH3 기는 치환된 아민도기의 비제한적 예이다.
B.
세포외
Ph
e
본 개시내용은 또한 세포 또는 세포 그룹의 세포외 pH(pHe)를 이미징하는 것에 관한 것이다. 특히, 세포외 환경은 종양 세포를 가질 수 있었다. 암 세포가 글루코스를 우선적으로 취하고 그것을 락트산으로 전환시키는 호기성 해당과정(바르부르크 효과라고도 알려짐, 도 23a)은 종양 조직의 존재를 결정하는 방법으로서 종양 세포의 pHe를 이미징함에 있어서 강한 관심을 불러 일으켰다(Heiden et al., 2009). 바르부르크 효과의 임상 관련성은 종양 진단뿐만 아니라 치료 반응을 모니터링하기 위한 2-18F-데옥시글루코스(FDG)의 넓은 임상 용도에 의해 이미 분명해졌다. 종양 미세환경에서, 락트산은 암세포 막에서 상승된 모노카복실레이트 수송체에 기인하여 세포외 공간에서 우선적으로 축적된다(Halestrap & Prince 1999). 종양에서 세포외 pH(pHe)의 얻어진 산성화는 증가된 종양 침습 및 전이를 위한 세포외 기질의 리모델링을 촉진시킨다. 최근에, 바버(Barber) 및 동료는 다른 "암의 특징"으로서 종양에서 하향조절된 pH를 기재하였다(Webb et al., 2011).
다수의 이전 연구는 종양 미세환경에서 pHe를 정량화하는 것이 수행되었다(Gillies et al., 1994; Gillies et al., 2004; van Sluis et al., 1999 및 Volk et al., 1993). 도 23b는 30개의 상이한 인간암 세포주로부터의 268 종양에서 대표적인 pHe 연구이다(Volk et al., 1993). 혈액 pH(7.4)에 비해, 모든 종양 pHe는 6.71 내지 7.01 범위에서 평균 6.84로 산성이다. 종양 pHe의 산성은 지속적이지만, 종양 특이적 이미징을 위해 그것을 연구하는 것은 상대적으로 작은 pH 차이(즉, < 1 pH 단위)에 기인하여 도전적이어서 본 출원을 위한 특정 관심의 매우 좁은 pH 전이 범위를 갖는 프로브를 제조한다.
일부 실시형태에서, 본 개시내용은 감염, 누공, 궤양, 당뇨병 또는 다른 질환으로부터의 케토산증, 저산소증, 대사성산증, 호흡 산성혈증, 독성 섭취, 중독, 골교체, 퇴행성 질환, 화상 방사선 또는 다른 공급원으로부터의 상처 및 조직 손상을 포함하지만, 이들로 제한되지 않는 세포내 또는 세포외 pH에 영향을 미쳤거나 또는 영향을 미치는 생리적 및/또는 병리적 과정에서 사용될 수 있는 중합체 및 마이셀을 제공한다.
C.
종양 경계의 수술
이미징
수술적 절제 가장자리에서 암 세포의 존재에 의해 정해지는 양성 종양 경계는 수술 후 HNSCC 환자의 종양 재발 및 생존의 가장 중요한 지표이다(Woolgar & Triantafyllou 2005; McMahon et al., 2003; Ravasz et al., Atkins et al., 2012 및 Iczkowski & Lucia 2011). 일부 실시형태에서, 환경의 정상 생리적 pH와 상이한 세포외 pH 환경을 나타내는 임의의 암 세포주는 본 명세서에 개시된 pH 반응 시스템에 의해 이미징될 수 있다. 더 나아가, pH 반응성 염료에서 사용되는 염료를 변형함으로써, 다양한 상이한 상업적으로 입수가능한 수술 이미징 시스템은 종양의 경계를 측정하기 위해 사용될 수 있다. 이들 시스템은 개복술(예를 들어, SPY 엘리트(등록상표)), 현미경 수술(칼 자이스(Carl Zeiss), 레이카(Leica)), 복강경 검사(올림푸스(Olympus), 칼 스토츠(Karl Storz)), 및 로봇 수술(다 빈치(da Vinci)(등록상표))에 대한 시스템을 포함하지만, 이들로 제한되지 않는다. 다수의 이들 임상 시스템은 수술 동안 실시간 이미징을 허용하는 빠른 획득 시간을 가진다. 더 나아가, 본 명세서에 개시된 혼합된 중합체뿐만 아니라 혼합된 중합체를 생성하기 위해 사용되는 임의의 개개 단량체의 동종중합체는 수술 동안 종양의 이미징을 위해 pH 반응 시스템에서 사용될 수 있다.
D.
블록 공중합체 및 형광 염료
본 명세서에 개시된 pH-반응성 마이셀 및 나노입자는 블록 공중합체 및 형광 염료를 포함한다. 블록 공중합체는 친수성 중합체 세그먼트 및 소수성 중합체 세그먼트를 포함한다. 소수성 중합체 세그먼트는 pH 민감성이다. 예를 들어, 소수성 중합체 세그먼트는 pH 민감성을 제공하기 위해 이온화 가능한 아민기를 포함할 수 있다. 블록 공중합체는 이들 이온화 가능한 블록 공중합체의 초분자 자기-조립에 기반하여 pH-활성화 가능한 마이셀(pHAM) 나노입자를 형성한다. 더 높은 pH에서, 블록 공중합체는 마이셀로 조립되는 반면, 더 낮은 pH에서, 소수성 중합체 세그먼트에서 아민기의 이온화는 마이셀의 해리를 초래한다. 이온화 가능한 기는 상이한 pH 값에서 조정가능한 친수성/소수성 블록으로서 작용하는데, 이는 마이셀의 역학적 자기 조립에 직접적으로 영향을 미칠 수 있다.
진단 또는 pH 모니터링 적용분야에 대해, 표지 모이어티는 블록 공중합체에 컨쥬게이션될 수 있다. 일부 실시형태에서, 표지(예를 들어, 형광 표지)는 pH가 마이셀 형성을 선호할 때 마이셀 내부에 격리된다. 마이셀 내의 격리는 (예를 들어, 형광 소광을 통해) 표지 신호의 감소를 초래한다. 특이적 pH 조건은 마이셀의 빠른 양성자화 및 유니머로의 해리를 야기함으로써, 표지를 노출시키고, 표지 신호를 증가시킬 수 있다(예를 들어, 형광 방출의 증가). 본 개시내용의 마이셀은 진단 적용분야에서 하기와 같은 하나 이상의 이점을 제공한다: (1) 이전의 마이셀 조성물에 대해 몇 시간 또는 며칠과 대조적으로, 특정 pH 환경(예를 들어, 산성 환경) 하에서 짧은 시간의 양 내의(예를 들어, 몇 분 내의) 마이셀의 해리(및 표지 신호에서 빠른 증가); (2) 증가된 이미징 페이로드; (3) 목적으로 하는 부위(예를 들어, 종양 또는 특정 식균 작용의 구획)에 대한 표지의 선택적 표적화; (4) 연장된 혈액 순환 시간; (5) 특정의 좁은 pH 범위 내의 반응(예를 들어, 특정 세포 소기관의 표적화를 위함); 및 (6) 고 콘트라스트 민감성 및 특이성. 예를 들어, 마이셀은 정상 생리 조건 하에서(예를 들어, 혈액 순환, 세포 배양 조건) 최소 배경 신호에 의해 침묵으로(또는 오프 상태로) 머물러 있을 수 있지만, 이미징 신호는 마이셀이 그들의 의도된 분자 표적(예를 들어, 세포외 종양 환경 또는 세포의 세포 소기관)에 도달될 때 크게 증폭될 수 있다.
수많은 형광 염료는 당업계에 잘 공지되어 있다. 개시내용의 특정 양상에서, 형광 염료는 pH 비민감성 형광 염료이다. 일부 실시형태에서, 형광 염료는 활성화에 대한 증가된 신호 변화를 얻기 위해 형광 소광제와 짝지어진다. 형광 염료는 직접적으로 또는 링커 모이어티를 통해 공중합체에 컨쥬게이팅될 수 있다. 당업계에 공지된 방법은, 예를 들어, 소수성 중합체에 형광 염료를 컨쥬게이팅하기 위해 사용될 수 있다. 일부 실시형태에서, 형광 염료는 아마이드 결합을 통해 소수성 중합체의 아민에 컨쥬게이팅될 수 있다.
블록 공중합체 및 형광 염료에 컨쥬게이팅된 블록 공중합체의 예는 다음을 포함한다:
식 중: R1은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 치환된 사이클로알킬(C≤12), , 또는 금속 킬레이트기이고; n은 1 내지 250의 정수이며; R2 및 R2'는 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고; R3은 하기 화학식의 기이다:
식 중: X1, X2 및 X3은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고; 그리고 X4 및 X5는 알킬(C≤12), 사이클로알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4 및 X5는 함께 취해지고 알칸다이일(C≤12), 알콕시다이일(C≤12), 알킬아미노다이일(C≤12), 또는 임의의 이들 기의 치환된 형태이며; x는 1 내지 100의 정수이고; R4는 하기 화학식의 기이다:
식 중: X1', X2' 및 X3'는 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고; 그리고 X4' 및 X5'는 알킬(C≤12), 사이클로알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4' 및 X5'는 함께 취해지고, 알칸다이일(C≤12), 알콕시다이일(C≤12), 알킬아미노다이일(C≤12), 또는 임의의 이들 기의 치환된 형태이며; y는 1 내지 100의 정수이고; R5는 하기 화학식의 기이다:
식 중: Y1, Y2 및 Y3은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되며; 그리고 Y4는 수소, 알킬(C≤12), 아실(C≤12), 치환된 알킬(C≤12), 치환된 아실(C≤12), 염료, 또는 형광 소광제이며; z는 0 내지 6의 정수이고; 그리고 R6은 수소, 할로, 하이드록시, 알킬(C≤12), 또는 치환된 알킬(C≤12)이되, R3, R4 및 R5는 중합체 내에서 임의의 순서로 생길 수 있고, 단, R3과 R4는 동일한 기가 아니다. 일부 실시형태에서, 더 긴 중합체 내의 R3, R4 및 R5의 각각의 단량체는 중합체 내에서 임의의 순서로 생길 수 있다. 일부 실시형태에서, 중합체의 특정 조성(R3, R4 및 R5 단량체의 몰분율)은 해당 중합체를 이용하여 생성되는 나노입자의 특정 pH 전이점에 관한 것이다.
E.
마이셀
시스템 및 조성물
본 명세서에 개시된 시스템 및 조성물은 단일 마이셀 또는 상이한 pH 수준으로 조정되는 일련의 마이셀 중 하나를 이용한다. 더 나아가, 마이셀은 좁은 pH 전이 범위를 가진다. 일부 실시형태에서, 마이셀은은 약 1 미만의 pH 단위의 pH 전이 범위를 가진다. 다양한 실시형태에서, 마이셀은 약 0.9 미만, 약 0.8 미만, 약 0.7 미만, 약 0.6 미만, 약 0.5 미만, 약 0.4 미만, 약 0.3 미만, 약 0.25 미만, 약 0.2 미만 또는 약 0.1 미만의 pH 단위의 pH 전이 범위를 가진다. 좁은 pH 전이 범위는 유리하게는 pH의 미묘한 변화와 함께 형광단의 완전한 켜짐을 초래할 수 있는 급격한 pH 반응을 제공한다.
따라서, 마이셀 코어에서 형광단의 pH-유도 마이셀화 및 소광을 갖는 단일 또는 일련의 pH-조정 가능한, 다색 형광 나노입자는 (중합체를 통한) pH 전이의 독립적 제어를 위한 메커니즘, 형광 방출 또는 형광 소광제의 용도를 제공한다. 형광 파장은, 예를 들어, 보라색 내지 근적외선 방출 범위(400 내지 820㎚)로부터 미세동조될 수 있다. 그들의 형광 온/오프 활성화는 0.25 이하의 pH 단위 내에서 달성될 수 있는데, 이는 소분자 pH 센서에 비해 훨씬 더 좁다. 일부 실시형태에서, 형광 온/오프 활성화를 위한 더 좁은 범위는 범위가 0.2 이하의 pH 단위가 되도록 달성될 수 있다. 일부 실시형태에서, 범위는 0.15 이하의 pH 단위이다. 더 나아가, 형광 소광제의 용도는 또한 회합 나노입자와 해리 나노입자 사이의 차이가 회합 나노입자의 50배 초과가 되도록 형광 활성화를 증가시킬 수 있다. 일부 실시형태에서, 형광 활성화는 회합된 나노입자보다 75배 초과로 더 크다. 이 다색, pH 조정 가능 및 활성화 가능한 형광 나노플랫폼은 식균 작용의 세포 소기관, 암과 관련된 수용기 사이클링 및 식균 작용의 수송, 리소좀 저장 질환 및 신경 장애에서 pH 조절과 같은 근본적 세포 생리 과정을 연구하기 위한 가치 있는 도구를 제공한다.
마이셀의 크기는 전형적으로 나노미터 규모(즉, 직경이 약 1㎚ 내지 1㎛)일 것이다. 일부 실시형태에서, 마이셀은 크기가 약 10 내지 약 200㎚이다. 일부 실시형태에서, 마이셀은 크기가 약 20 내지 약 100㎚이다. 일부 실시형태에서, 마이셀은 크기가 약 30 내지 약 50㎚이다.
F.
표적화
모이어티
마이셀 및 나노입자는 표적 모이어티를 추가로 포함할 수 있다. 표적 모이어티는, 예를 들어, 특정 세포 표면 수용체, 세포 표면 마커에, 또는 세포 소기관에(예를 들어, 핵, 미토콘드리아, 소포체, 엽록체, 아포플라스트 또는 퍼옥시좀) 나노입자 또는 마이셀을 표적화하기 위해 사용될 수 있다. 이러한 표적화 모이어티는 수용체 재순환, 마커 재순환, 세포내 pH 조절, 식균 작용의 수송의 연구에서 유리하게 될 것이다.
표적 모이어티는, 예를 들어, 항체 또는 항체 단편(예를 들어, Fab' 단편), 단백질, 펩타이드(예를 들어, 신호 펩타이드), 앱타머 또는 소분자(예를 들어, 폴산)일 수 있다. 표적 모이어티는 당업계에 공지된 방법에 의해 블록 공중합체에 컨쥬게이팅될 수 있다(예를 들어, 친수성 중합체 세그먼트에 컨쥬게이팅됨). 표적 모이어티의 선택은 특정 표적에 의존할 것이다. 예를 들어, 항체, 항체 단편, 소분자 또는 결합 상대는 세포 표면 수용기 및 세포 표면 마커를 표적화하는데 더 적절할 수 있는 반면, 펩타이드, 특히 신호 펩타이드는 세포 소기관을 표적화하는데 더 적절할 수 있다.
G.
형광 검출
본 개시내용의 다양한 양상은 형광 신호의 증가를 검출하는 것에 의한 마이셀 해리의 직접적 또는 간접적 검출에 관한 것이다. 형광 염료로부터의 형광 신호를 검출하기 위한 기법은 당업계에 공지되어 있다. 예를 들어, 이하의 실시예에 기재한 바와 같은 형광 공초점 현미경은 하나의 이러한 기법이다.
유세포 분석은, 예를 들어, 형광 신호를 검출하기 위해 사용될 수 있는 다른 기법이다. 유세포 분석은 액체 샘플 중에서 세포 또는 다른 입자, 예컨대 마이크로스피어의 분리를 수반한다. 유세포 분석의 기본 단계는 액체 스트림이 센싱 영역을 통과하도록 장치를 통과하는 유체 샘플의 방향과 관련된다. 입자는 센서에 의해 한 번에 하나씩 통과하여야 하고, 크기, 굴절, 광산란, 불투명도, 거칠기, 형상, 형광 등에 기반하여 범주화될 수 있다.
본 명세서에 기재된 측정은 다중 검출 파장에서 및/또는 다중 시점에서 형광 방출 규모를 나타내는 수치적 값과 같은 세포의 하나 이상의 특징을 결정하기 위해 세포의 하나 이상의 이미지를 분석하기 위한 이미지 처리를 포함할 수 있다.
H.
키트
본 개시내용은 또한 키트를 제공한다. 본 명세서에 개시된 임의의 성분은 키트에서 합쳐질 수 있다. 특정 실시형태에서, 키트는 상기 기재한 바와 같은 pH-반응 시스템 또는 조성물을 포함한다.
키트는 일반적으로 적어도 하나의 바이알, 시험관, 플라스크, 병, 주사기 또는 성분이 배치되고, 바람직하게, 적합하게는 분취될 수 있는 다른 용기를 포함할 것이다. 키트 내에서 하나 초과의 성분이 있는 경우에, 키트는 또한 일반적으로 추가적인 성분이 별도로 배치될 수 있는 제2, 제3 또는 다른 추가적인 용기를 포함할 것이다. 그러나, 성분의 다양한 조합이 용기 내에 포함될 수 있다. 일부 실시형태에서, 일련의 모든 마이셀 집단은 단일 용기 내에서 조합된다. 다른 실시형태에서, 일련의 일부 또는 모든 마이셀 집단은 별개의 용기로 제공된다.
본 개시내용의 키트는 또한 전형적으로 상업적 판매를 위해 완전히 밀봉된 다양한 용기를 수용하기 위한 패키징을 포함할 것이다. 이러한 패키징은 목적으로 하는 용기에서 유지되는 판지 또는 주사 또는 블루우 성형 플라스틱 패키징을 포함할 수 있다. 키트는 또한 키트 성분을 사용하기 위한 설명서를 포함할 수 있다. 설명서는 실행될 수 있는 변화를 포함할 수 있다.
I.
SPECT
및 PET
방사성핵종 이미징 양상(양전자 방출 단층촬영(PET); 단일 광자 방출 컴퓨터 단층촬영(SPECT))은 방사성핵종-표지 방사성 트레이서의 위치 및 농도를 맵핑하는 진단적 횡단 이미징 기법이다. CT 및 MRI는 종양의 위치 및 정도에 관한 상당한 해부학적 정보를 제공하지만, 이들 이미징 양상은 부종, 방사선 괴사, 등급화 또는 신경아교증을 적절하게 차별화할 수 없다. PET 및 SPECT는 국소화를 위해 사용될 수 있고, 대사 활성을 측정함으로써 특성규명될 수 있다.
PET 및 SPECT는 세포 생존도와 같은 세포 수준에서의 정보에 관간 정보를 제공한다. PET에서, 환자는 물질이 신체를 통해 이동함에 따라 모니터링될 수 있는 양전자를 방출하는 약간 방사성인 물질과 함께 흡수되거나 또는 주사된다. 하나의 통상적인 적용분야에서, 예를 들어, 환자는 부착된 양전자 방출핵과 함께 글루코스를 제공하고, 그들의 뇌는 그들이 다양한 작업을 수행함에 따라 모니터링된다. 뇌가 그것이 작동함에 따라 글루코스를 사용하기 때문에, PET 이미지는 뇌 활성이 높은 경우를 보여준다.
PET에 대해 단일-광자 방출 컴퓨터 단층촬영 또는 SPECT가 밀접하게 관련된다. 둘 사이의 주된 차이는 양전자-방출 물질 대신에, SPECT는 저에너지 광자를 방출하는 방사성 트레이서를 사용한다는 점이다. SPECT는 관상동맥 질환을 진단하는데 가치가 있으며, 이미 일부 2백 5십만건의 SPECT 심장 연구가 미국에서 매년 행해진다.
이미징을 위한 PET 방사성 의약품은 11C, 13N, 15O, 18F, 82Rb, 62Cu 및 68Ga과 같은 양전자 방출핵으로 통상적으로 표지된다. SPECT 방사성 의약품은 99m Tc, 201Tl 및 67Ga과 같은 양전자 방출핵으로 통상적으로 표지된다. 뇌 이미징에 관해, PET 및 SPECT 방사성 의약품은 혈액-뇌-장벽 투과율(BBB), 뇌관류 및 대사 수용기-결합 및 항원-항체 결합에 따라 분류된다(Saha et al., 1994). 혈액-뇌-장벽 SPECT 제제, 예컨대 99m TcO4-DTPA, 201Tl 및 [67Ga]시트르산염은 정상 뇌 세포에 의해 제외되지만, 변경된 BBB 때문에 종양 세포 내로 유입된다. SPECT 관류 작용제, 예컨대 [123I]IMP, [ 99m Tc]HMPAO, [ 99m Tc]ECD는 친유성 제제이며, 따라서 정상 뇌 내로 확산된다. 중요한 수용기-결합 SPECT 방사성 의약품은 [123I]QNE, [123I]IBZM 및 [123I]이오마젠일을 포함한다. 이들 트레이서는 특정 수용기에 결합되고, 수용기-관련 질환의 평가에서 중요성을 가진다.
J.
실시예
다음의 실시예는 본 개시내용의 바람직한 실시형태를 입증하기 위해 포함된다. 다음의 실시예에 개시된 기법은 본 개시내용의 실행에서 잘 작용하기 위해 본 발명자에 의해 발견된 기법을 나타내며, 따라서, 그의 실행을 위한 바람직한 방식을 구성하는 것으로 고려될 수 있다는 것이 당업자에 의해 인식되어야 한다. 그러나, 당업자는 본 개시내용에 비추어, 다수의 변화가 개시된 구체적 실시형태에서 이루어질 수 있고, 또한 본 개시내용의 정신과 범주로부터 벗어나는 일 없이 비슷하거나 또는 유사한 결과를 얻을 수 있다는 것을 인식하여야 한다.
실시예
1: pH 반응성
나노프로브의
라이브러리의 제조를 위한 방법 및 물질
1.
물질
상이한 형광단 및 형광 소광제의 N-하이드록실 숙신이미달(NHS) 에스터를 다음과 같이 얻었다: RhoG-NHS, TMR-NHS, ROX-NHS, BDY-NHS, BDY-TMR-NHS, BDY630-NHS, AMCA-x-NHS, MB-NHS, PPO-NHS, QSY35, QSY7 및 QSY21 에스터를 인비트로젠사(Invitrogen Company)로부터 구입하였고; Cy5-NHS, Cy5.5-NHS, Cy7.5-NHS 에스터를 루미프로브 코포레이션(Lumiprobe Corporation)으로부터 구입하였으며; BHQ-1-NHS 에스터를 바이오서치 테크놀로지즈(Biosearch Technologies)로부터 구입하였다. PEO 거대개시제(macroinitiator), MeO-PEO114-Br를 본 명세서에 참고로 포함된 문헌[Bronstein, et al.]에서의 절차에 따라 2-브로모-2-메틸 프로판오일 브로마이드 및 MeO-PEO114-OH로부터 제조하였다. 브로모프로판, 브로모부탄, 브로모펜탄, 에탄올아민, 메타크릴레이트 클로라이드 및 나트륨염을 시그마 알드리치사(Sigma-Aldrich)로부터 구입하였다. 단량체, 예컨대 2-(다이메틸아미노)에틸 메타크릴레이트(DMA-MA), 2-(다이에틸아미노)에틸 메타크릴레이트(DEA-MA) 및 2-아미노에틸 메타크릴레이트(AMA)를 폴리사이언스사(Polyscience Company)로부터 구입하였다. AMA를 아이소프로판올 및 에틸 아세테이트(3:7)를 이용하여 2회 재결정화하였다. 단량체 2-(다이부틸아미노) 에틸 메타크릴레이트(DBA-MA)를 앞서 공개된 절차에 따라 합성하였다.2 2-(다이프로필아미노) 에틸 메타크릴레이트(DPA-MA) 및 2-(다이펜틸아미노) 에틸 메타크릴레이트(D5a-MA)의 합성을 본 명세서에서 보고한다. AMA 단량체를 사용 전 아이소프로판올 및 에틸 아세테이트(3:7)로 2회 재결정화하였다. 다른 용매 및 시약을 시그마 알드리치 또는 피셔 사이언티픽 인코포레이티드(Fisher Scientific Inc)로부터 받은 것으로 사용하였다.
2.
새로운
메타크릴레이트
단량체의 합성
새로운 메타크릴레이트 단량체를 공개된 방법에 따라 합성하였다. [2] 2-(다이프로필아미노) 에틸 메타크릴레이트(DPA-MA)의 합성을 본 명세서에서 실시예로서 기재한다. 처음에, 에탄올아민(12.2g, 0.2㏖) 및 브로모프로판(49.2g, 0.4㏖)을 400㎖ 아세토나이트릴 중에 용해시키고 나서, Na2CO3(53.0g, 0.5㏖)를 용액에 첨가하였다. 밤새 반응시킨 후에, 용액을 여과시켜 침전된 NaBr 염 및 추가 Na2CO3를 제거하였다. CH3CN 용매를 회전증발기에 의해 제거하였다. 얻어진 잔사를 진공에서 증류시켜 (0.05mmHg에서 40 내지 45℃) 무색 액체로서 2-(다이프로필아미노) 에탄올을 얻었다. 이어서, 2-(다이프로필아미노) 에탄올(21.3g, 0.1㏖), 트라이에틸아민(10.1g, 0.1㏖), 및 저해제 하이드로퀴논(0.11g, 0.001㏖)을 100㎖ CH2Cl2 중에 용해시키고, 염화 메타크릴로일(10.4g, 0.1㏖)을 3구 플라스크에 적가하였다. 용액을 밤새 환류시켰다. 반응 후, 용액을 여과시켜 침전시킨 트라이에틸아민-HCl 염을 제거하고, CH2Cl2 용매를 회전증발기에 의해 제거하였다. 얻어진 잔사를 진공에서 (0.05mmHg에서 47 내지 53℃) 무색 액체로서 증류시켰다. 합성 후에, 단량체를 1H-NMR에 의해 특성규명하였다. 모든 NMR 스펙트럼을 배리언(Varian) 500MHz 분광기 상에서 내부 기준으로서 테트라메틸실란(TMS)을 이용하여 CDCl3 중에서 얻었다. 두 새로운 단량체의 특성규명은 다음과 같다:
2-(
다이프로필아미노
) 에틸
메타크릴레이트
(
DPA
-MA)
1 H NMR (TMS, CDCl3, ppm): 6.10 (br, 1H, CHH=C(CH3)-), 5.54 (br, 1H, CHH=C(CH3)-), 4.07 (t, 2H, -OCH 2CH2N-), 3.01 (t, 2H, -OCH2CH 2N-), 2.68 (t, 4H, -N(CH 2CH2CH3)2, 1.94 (s, 3H, CH2=C(CH 3)-), 1.44 (m, 4H, -N(CH2CH 2CH3)2), 1.01(t, 6H, -N(CH2CH2CH 3)2)
2-(
다이펜틸아미노
) 에틸
메타크릴레이트
(
D5a
-MA)
1 H NMR (TMS, CDCl3, ppm): 6.10 (br, 1H, CHH=C(CH3)-), 5.55 (br, 1H, CHH=C(CH3)-), 4.20 (t, 2H, -OCH 2CH2N-), 2.74 (t, 2H, -OCH2CH 2N-), 2.45 (t, 4H, -N(CH 2CH2CH2 CH2CH3)2, 1.94 (s, 3H, CH2=C(CH 3)-), 1.43 (m, 4H, -N(CH2CH 2CH2 CH2CH3)2), 1.30 (m, 4H, -N(CH2CH2CH 2 CH2CH3)2), 1.24 (m, 4H, -N(CH2CH2CH2 CH 2CH3)2), 0.88 (t, 6H, -N(CH2CH2CH2 CH2CH 3)2),
2-(에틸
프로필아미노
) 에틸 메타크릴레이트(EPA-MA)
1 H NMR (TMS, CDCl3, ppm): 6.10 (s, 1H, CHH=C(CH3)-), 5.54 (s, 1H, CHH=C(CH3)-), 4.20 (t, 2H, -OCH 2CH2N-), 2.75 (t, 2H, -OCH2CH 2N-), 2.58 (q, 2H, -N(CH2CH2CH3)(CH 2CH3)), 2.44 (m, 2H, -N(CH 2CH2CH3)(CH2CH3)), 1.94 (s, 3H, CH2=C(CH 3)-), 1.45 (m, 2H, -N(CH2CH 2CH3)(CH2CH3)), 1.02 (t, 3H, -N(CH2CH2CH3)(CH2CH 3)), 0.87 (t, 3H, -N(CH2CH2CH 3)(CH2CH3))
2-(부틸
(아이소프로필)아미노
) 에틸 메타크릴레이트(
ni
D3
.5a-MA)
1 H NMR (TMS, CDCl3, ppm): 6.09 (s, 1H, CHH=C(CH3)-), 5.53 (s, 1H, CHH=C(CH3)-), 4.11 (t, 2H, -OCH 2CH2N-), 2.92 (m, 1H, -N(CH2CH2CH2CH3)(CH(CH3)2), 2.64 (t, 2H, -OCH2CH 2N-), 2.42 (t, 2H, -N(CH 2CH2CH2CH3)(CH(CH3)2), 1.93 (s, 3H, CH2=C(CH 3)-), 1.38 (m, 2H, -N(CH2CH 2CH2CH3)(CH(CH3)2), 1.29 (m, 2H, -N(CH2CH2CH 2CH3)(CH(CH3)2), 0.97 (d, 6H, -N(CH2CH2CH2CH3)(CH(CH 3)2), 0.88 (t, 3H, -N(CH2CH2CH2CH 3)(CH(CH3)2)
3.
PEO
-
b
-PR 블록 공중합체의 합성
PEO-b-PR 공중합체를 본 명세서에 참고로 포함된 문헌[Zhou, et al., 2011]에 기재된 바와 같은 원자 이동 라디칼 중합(원자 이동 라디칼 중합: ATRP)에 의해 합성하였다. 무 염료 공중합체를 중합체 특성규명에서 사용하였다. 표 1 내지 3은 각각의 공중합체의 특성규명을 요약한다. PEO-b-PDPA를 절차를 설명하기 위한 예로서 사용한다. 처음에, DPA-MA(1.70g, 8m㏖), PMDETA(21㎕, 0.1m㏖) 및 MeO-PEO114-Br(0.5g, 0.1m㏖)을 중합 관 내에 채웠다. 이어서, 단량체 및 개시제를 용해하기 위해 2-프로판올(2㎖)과 DMF(2㎖)의 혼합물을 첨가하였다. 산소를 제거하기 위한 냉동-펌프-해동의 3회 주기 후에, CuBr(14㎎, 0.1m㏖)을 질소 분위기 하에 중합관 내에 첨가하고 나서, 관을 진공에서 밀봉시켰다. 중합을 40℃에서 8시간 동안 수행하였다. 중합 후에, 반응 혼합물을 10㎖ THF로 희석시키고 나서, 중성 Al2O3 칼럼을 통과시켜 촉매를 제거하였다. THF 용매를 회전증발기에 의해 제거하였다. 잔사를 증류수 중에서 투석하고 나서, 동결건조시켜 백색 분말을 얻었다.
4.
PEO
-
b
-(PR-
r
-염료/
FQ
) 블록 공중합체의 합성
AMA를 염료 또는 형광 소광제의 컨쥬게이션을 위해 사용하였다. PEO-b-(PR-r-AMA) 공중합체의 합성은 상기 기재한 절차를 따랐다. 3개의 1차 아미노기를 AMA 단량체 대 개시제의 공급비(비 = 3)를 조절함으로써 각각의 중합체 쇄에 도입하였다. 합성 후에, PEO-b-(PR-r-AMA)(10㎎)을 2㎖ DMF 중에 용해시켰다. 이어서, NHS-에스터(염료-NHS 또는 FQ-NHS에 대해 1.5 당량)를 첨가하였다. 밤새 반응시킨 후에, 공중합체를 분취 겔 침투 크로마토그래피(배리언(Varian)에 의한 PLgel Prep 10 m 10E3Å 300×250 칼럼, 용리액으로서 5㎖/분으로 THF)에 의해 정제하여 유리 염료 분자를 제거하였다. 생성된 PEO-b-(PR-r-염료/FQ) 공중합체를 동결건조시키고 나서, 저장 동안 -20℃에서 유지하였다.
5.
마이셀
나노입자의 제조
마이셀을 본 명세서에 참고로 포함된 문헌[Zhou, et al., 2011]에 앞서 기재한 바와 같이 제조하였다. 전형적인 절차에서, 5㎎의 PDPA - Cy5를 0.5㎖ THF 중에 용해시켰다. 이어서, 용액을 초음파 처리 하에 4㎖의 밀리큐(Milli-Q) 탈이온수에 서서히 첨가하였다. 혼합물을 4회 여과시켜, 미세 한외여과 시스템을 이용하여 THF를 제거하였다(MWCO = 100 KD). 이어서, 탈이온수를 첨가하여 저장 용액으로서 중합체 농도를 5㎎/㎖로 조절하였다. 혼합된 마이셀에 대해, PR-염료 및 PR-FQ 공중합체의 상이한 중량비를 0.5㎖ THF 중에 용해시키고 나서, 동일한 절차를 사용하였다.
6.
형광 특성규명
형광 방출 스펙트럼을 히타치(Hitachi) 형광계(F-7500 모델) 상에서 얻었다. 각각의 공중합체에 대해, 샘플을 2㎎/㎖의 농도로 밀리큐 워터 중에서 처음에 제조하였다. 이어서, 저장 용액을 상이한 pH 값을 지니는 0.2 M 시트르산-포스페이트 완충제(0.15M 염화나트륨을 함유) 중에서 희석시켰다. 최종 중합체 농도를 100 내지 200㎍/㎖로 조절하였다.
상이한 pH 값(각각의 샘플에 대해 100㎍/㎖)에서 4.4-7.1- Cy5s, 5.0- BDY, 5.3-RhoG, 5.6- TMR, 5.9- ROX, 6.2- BDY630, 6.5- Cy5, 6.8- Cy5 .5 및 7.1- Cy7 .5 용액의 형광 이미지에 대해, 기기 매뉴얼에 따라 적절한 통과 대역 여기 필터 및 적절한 롱 패스 방출 필터를 선택함으로써 마에스트로 이미징 시스템(매사추세츠주 우번에 소재한 CRI사(CRI, Inc.))을 사용하였다. 4.4- AMCA 및 4.7-MB에 대해, 소형 UV 광(365㎚)의 조사 하에서 카메라에 의해 이미지를 촬영하였다. 모든 측정을 실온에서 수행하였다.
실시예
2: pH 반응성 중합체
마이셀의
라이브러리의 합성 및 특성규명
1.
ATRP
방법에 의한 공중합체 합성.
공중합체 합성을 위한 촉매 및 N,N,N',N',N''-펜타메틸다이에틸렌트라이아민(PMDETA) 리간드로서 CuBr을 이용하는 원자 이동 라디칼 중합(ATRP) 방법(Tsarevsky and Matyjaszewski, 2007; Ma, et al., 2003)(도 1)을 사용하여 연구를 위한 공중합체를 제조하였다. 동종중합체 PR 블록을 지니는 PEO-b-PR 공중합체를 앞서 기재한 바와 같은 단일 메타릴레이트 단량체를 이용하여 합성하였다(Zhou, et al., 2011; Zhou, et al., 2012). PR 세그먼트의 소수성을 연속적으로 미세동조하기 위해, 상이한 소수성을 지니는 2개의 메타크릴레이트 단량체를 이용하여 공중합 전략을 사용하였다(도 1). 2개 단량체-의 몰분율을 중합 전에 정확하게 제어하여 무작위 공중합P(R1-r-R2) 블록을 야기할 수 있다. 상이한 다이알킬쇄 길이(예를 들어, 에틸, 프로필, 부틸 및 펜틸)를 지니는 일련의 메타크릴레이트 단량체를 현재 연구에 사용하였다. 형광단 또는 형광 소광제를 도입하기 위해, 유리 아미노기가 활성화된 N-하이드록실숙신이미딜(NHS) 에스터를 통해 염료 또는 FQ에 컨쥬게이션되는 경우 아미노에틸메타크릴레이트(AMA-MA)(중합체 쇄 당 3개의 반복 단위)를 또한 도입하였다.
합성 후에, 화학적 조성을 입증하는 1H NMR 및 수- 및 중량 평균 분자량 및 다분산성을 측정하는 겔 침투 크로마토그래피를 이용하여 공중합체를 특성규명하였다(표 1 내지 3, 도 2 내지 6).
2.
pH
t
대조군에 대한 공중합 대 분자 혼합물 전략의 비교.
초기에, UPS 나노프로브의 pHt 값을 제어하는 그들의 능력에 대한 2가지 상이한 전략을 비교하였다. 제1 전략은 상이한 pH 전이를 지니는 2개의 상이한 PEO-b-PR 공중합체의 분자 혼합물과 관련된다. 이 예에서, Cy5-컨쥬게이팅된 PEO-b-폴리[2-(다이에틸아미노)에틸 메타크릴레이트](PDEA, 모든 공중합체를 이하에 구체화하지 않는 한, PR 세그먼트에서 Cy5 염료와 컨쥬게이팅함) 및 PEO-b-폴리[2-(다이펜틸아미노)에틸 메타크릴레이트](PD5a)를 사용하였다. PDEA 및 PD5a 나노프로브는 각각 4.4 및 7.8에서 pH 전이를 가졌다. 각각의 마이셀에서 동일한 몰 백분율(즉, 50%)를 이용하는 공중합체 둘 다로 이루어진 마이셀 나노프로브를 생성하기 위해 용매 증발 절차를 사용하였다(이는 헤테로FRET 실험에 의해 입증되었다). 제2 전략에서, PR 세그먼트가 2개 단량체로부터의 무작위 공중합체로 구성된 경우(각각의 단량체에 대해 40개 반복 단위, 표 1), Cy5-컨쥬게이팅된 PEO-b-폴리[2-(다이에틸아미노)에틸 메타크릴레이트-r-2-(다이펜틸아미노)에틸 메타크릴레이트] 공중합체(P(DEA 40 -D5a 40 ))를 합성하였다. 유체 역학적 직경은 PDEA / PD5a(분자 혼합물) 및 P(DEA 40 -D5a 40 )(공중합체) 마이셀 각각에 대해 65 및 22㎚였다.
2개의 마이셀 설계는 형광 방출 대 pH 관계의 극적으로 상이한 패턴을 나타내었다. PDEA / PD5a 나노프로브에 대해, 형광 온/오프 전이가 4.4 및 7.8에 있는 경우 개개 공중합체에 대응하는 pH 전이의 독특한 거동을 관찰하였다(도 7a, 도 8). 이 결과는 마이셀 코어 내에서 PDEA와 PD5a 사이의 사슬 얽힘이 개개의 중합체 해리 거동을 극복하는데 충분하지 않다는 것을 시사한다. 대조적으로, P( DEA 40 - D5a 40 ) 나노프로브는 PDEA와 PD5a 전이 사이의 거의 절반인 6.0에서 단일 pH 전이를 나타내었다.
전이 pH의 제어를 연구하기 위해, 2개 단량체의 몰분율을 달리하면서 일련의 P(DEA x -D5a y ) 공중합체를 합성하였다. 얻어진 공중합체는 상이한 pH 전이를 나타내었다(도 7b, 도 9). DEA 단량체의 몰분율의 함수로서 나노프로브의 pHt의 플롯은 선형 상관관계를 나타내었다(도 7c). 더 적은 소수성 단량체(예를 들어, DEA-MA)의 더 높은 백분율의 포함은 더 높은 pH 전이를 초래하였다. UPS 나노프로브의 전이 pH는 PR 세그먼트의 소수성을 달리함으로써 주로 제어될 수 있다. 이 관찰은 소분자 pH 센서와 대조적이며, 여기서 전자 당김기 또는 전자 공여기는 미세동조에 필수적이다(Urano, et al., 2009).
3.
단량체 적합성은 pH 전이의 급격함에 영향을 미친다.
상이한 단량체 백분율을 지니는 P(DEA x -D5a y ) 나노프로브는 전이 pH의 제어를 허용하였지만(도 7b 내지 C), pH 전이의 급격함은 동종중합체 PR 세그먼트를 지니는 대응하는 나노프로브보다 상당히 더 넓었다. 더 구체적으로, ΔpH10 -90% 값(형광 강도가 10에서 90%로 증가하는 경우의 pH 범위)은 PDEA 및 PD5a 나노프로브 각각에 대한 0.14 및 0.19에 비해 25, 50 및 75%의 DEA-MA 조성물을 지니는 P( DEA x -D5a y ) 공중합체에 대해 0.65, 0.64 및 0.47이었다. P( DEA x - D5a y ) 공중합체로부터의 광범위 pH 반응은 큰 소수성 차이를 지니는 단량체로부터의 이질적 쇄 특성을 나타낸다.
pH 전이의 급격함을 개선시키기 위해, 밀접하게 매칭된 소수성을 지니는 단량체의 사용을 연구하였다. 예로서, 일련의 P( DPA x - DBA y ) 나노프로브를 생성하기 위해 2-(다이프로필아미노)에틸 메타크릴레이트(DPA-MA) 및 2-(다이부틸아미노)에틸 메타크릴레이트(DBA-MA)를 선택하였다. 2개의 단량체는 질소 대체물 상에서 하나의 탄소만큼 상이하다(즉, 프로필 대 부틸). 2개 단량체의 공중합은 급격한 pH 전이를 지니는 더 정제된, 조정가능한 일련의 나노프로브를 야기하였다(도 10a, 도 11). ΔpH10-90% 값은 25, 50 및 75%의 DPA-MA 조성을 지니는 P( DPA x - DBA y ) 나노프로브에 대해 각각 0.19, 0.20 및 0.18이었다. 각각의 공중합체 프로브는 급격한 pH 전이를 유지하였다(0.25 미만의 pH 단위). 도 10b는 pH의 함수로서 형광 유도체 플롯을 나타내는데, 이는 동일한 pH 스팬(span)에서의 단일 P( DEA 40 - D5a 40 ) 나노프로브에 비해 일련의 P(DPA x -DBA y ) 나노프로브의 크게 증가된 급격함을 추가로 도시한다.
DPA-MA 단량체의 몰분율의 함수로서 P( DPA x - DBA y ) 나노프로브의 pHt 값의 플롯은 또한 선형 상관관계를 수득하였다(도 10c). 유사하게, 단량체의 pHt와 몰분율 사이의 선형 관계를 입증하는 P( DBA x - D5a y ) 및 P( DEA x - DPA y ) 시리즈에 대한 표준 곡선을 확립하였다. 이들 표준 곡선은 정확한 PR 조성을 지니는 공중합체를 선택함으로써(즉, 단량체 쌍 및 구체적 몰분율의 선택) 임의의 사전결정된 pH 전이(4.4 내지 7.8)를 지니는 UPS 나노프로브의 합리적 설계를 가능하게 한다. 개념의 증거를 위해, 전체 생리적 범위의 pH(4.4 내지 7.4)를 아우르는 0.3 pH 증분으로 10개 나노프로브로 이루어진 UPS 라이브러리를 생성한 반면, 각각의 나노프로브는 급격한 pH 전이를 유지하였다(온과 오프 상태의 0.25 미만 pH 단위, 도 10d, 도 12 내지 13).
4.
광범위한
형광단
선택에 대한 형광
소광제의
사용.
이전에, 호모-FRET 유도 형광 붕괴는 UPS 나노프로브의 온/오프 활성화 가능한 설계를 달성하기 위한 주요 메커니즘이라는 것이 보고되었다(Zhou, et al., 2012). 이 메커니즘은 단지 작은 스토크스 이동(40㎚ 미만)을 지니는 형광단(예를 들어, 로다민 및 사이아닌 염료)에만 적용된다. 큰 스토크스 이동을 지니는 염료에 대해(예를 들어, 마리나 블루 또는 PPO, Δλ≥100㎚), 형광 활성화 비(RF = Fon/Foff(여기서, Fon 및 Foff는 각각 온 및 오프 상태에서의 형광 강도임)는 5 미만이었다. 게다가, 염료의 보디피(등록상표) 패밀리에 대해, pH 전이는 넓으며(0.5 초과 pH 단위) 광 유도 전자 전달(PeT) 메커니즘의 결과로서 상대적으로 낮은 RF(15 미만)를 지닌다(Petsalakis, et al., 2008; Tal, et al., 2006; Dale and Rebek, 2006).
이들 제한을 극복하기 위해, 형광단 선택을 넓히기 위한 형광 소광제(FQ)의 사용을 연구하였다. 형광 소광제는 활성화 가능한 이미징 프로브의 설계를 위한 다수 기에 의해 널리 사용되었다(Blum, et al., 2005; Lee, et al., 2009; Levi, et al., 2010; Maxwell, et al., 2009). 메커니즘은 목적으로 하는 형광단으로부터 FQ까지의 형광 공명 에너지 전이에 기반하는데, 이는 후속적으로 방사성 에너지를 열로 소실시킨다. 이 설계에서, 상이한 방출 파장에 민감한 일련의 FQ를 제조하고 공중합체 상에 컨쥬게이션시켰다(도 14). 동일한 마이셀 코어 중에서 FQ-컨쥬게이팅된 중합체를 염료-컨쥬게이팅된 중합체와 혼합함으로써 UPS 나노프로브를 생성하였다. 마이셀 상태에서, FQ는 화합물이 형광단 신호를 효과적으로 퀀칭시킬 것으로 기대되며, 마이셀 해리 시, FQ 및 형광단의 분리는 형광 방출에서 상당한 증가를 초래한다(도 15a).
FQ 전략의 유효성을 평가하기 위해, PEO-b-폴리[2-(프로필아미노)에틸 메타크릴레이트](PDPA)를 모델 시스템으로서 사용하였고, 상이한 FQ 및 형광단을 공중합체에 컨쥬게이팅시켰다. PDPA 나노프로브는 6.2에서 pH 전이를 가졌다. 처음에, 큰 스토크스 이동을 지니는 형광단(예를 들어, AMCA: 353/442; 마리나 블루 또는 MB: 362/462; PyMPO 또는 PPO: 415/570에 대한 FQ 전략을 연구하였다. 두 수는 여기 및 방출 파장을 각각 지칭한다). FQ-컨쥬게이팅된 중합체의 도입 없이, PDPA -AMCA 및 PDPA -MB 나노프로브는 pH 5.0 및 7.4 각각에서 온과 오프 상태 사이에서 단지 3배의 형광 활성화를 나타내었다(도 18a). PDPA - QSY35 내지 PDPA - AMCA 또는 PDPA-MB의 도입은 형광 활성화의 상당한 증가를 초래하였는데, PDPA - QSY35의 몰분율이 67%가 될 때 안정기에 도달되었다(도 16a). 이 조성에서, RF 값은 대략 90배에 도달되었는데, 이는 FQ가 없는 것보다 30배 더 높다(도 18b). 유사하게, PDPA - PPO 나노프로브에 대한 PDPA - QSY7(50㏖%)의 도입은 각각 6 내지 130배 초과로 RF 값을 증가시켰다(도 18b).
염료의 보디피(등록상표) 패밀리에 대해, PDPA - BDY493 및 PDPA - TMR 나노프로브는 단지 대략 15배의 형광 활성화를 수득하였는데(도 18C), 이는 생물학적 용도에서 적절하지 않다(예를 들어, 세포 이미징 동안, 배경 신호를 억제하기 위해 30 초과의 RF 값이 필수적임). PDPA - BDY493 및 PDPA - TMR 나노프로브에 대한 PDPA -BHQ1(50㏖%) 및 PDPA - QSY7(50㏖%)의 도입은 극적으로 증가된 RF 값을 야기하였다(둘 다 100배 초과, 도 18D, 도 19). 흥미롭게도, PDPA - BDY630 단독은 40배 RF 값을 달성할 수 있었다. PDPA - QSY21의 첨가는 250배 이상으로 RF 값을 추가로 증가시켰다(도 18D)
이전의 연구는 작은 스토크스 이동(40㎚ 미만)을 지니는 로다민 및 사이아닌 염료가 호모FRET-유도 형광 붕괴 메커니즘을 통한 큰 RF 값을 지니는 UPS 나노프로브를 생성할 수 있다는 것을 나타내었다(Zhou, et al., 2012). 이 연구로부터의 결과는 이전의 보고를 확인하였는데, 여기서 PDPA -염료 공중합체는 단독으로 로다민 및 사이아닌 염료에 대해 각각 50배 초과 및 100배 초과에 도달되었다. FQ-컨쥬게이팅된 공중합체의 첨가는 이들 나노프로브에 대해 RF 값을 추가로 증가시켰다(도 18F, 도 20 내지 22).
도 18e 내지 f는 형광 소광제의 도입과 함께 그리고 도입 없이 PDPA 나노프로브에서 사용되는 모든 형광단에 대한 형광 활성화 비(RF=F5.0/F7.4)를 요약한다. 데이터는 FQ-컨쥬게이팅된 중합체의 첨가에 의해, 모든 형광단(총 12)은 스토크스 이동 또는 PeT 메커니즘과 상관없이 보편적으로 높은 활성화 비(50배 초과)를 나타내었다. 추가로, FQ-컨쥬게이팅된 중합체의 도입은 pH 전이의 급격함에 영향을 미치지 않았다(모든 복합 나노프로브는 온과 오프 상태 사이에서 0.25 미만의 pH 단위를 가진다, 도 18b 및 18D 및 도 22b 내지 22d).
5.
큰 pH 전이 및 형광 방출에 걸쳐있는 UPS 라이브러리.
상기 결과에 기반하여, 상이한 형광단에 의해 각각 암호화된 10개의 나노프로브로 이루어진 대표적인 UPS 라이브러리를 생성하였다. 각각의 나노프로브에 대한 조성물은 도 10d에 따르는데(상세한 설명을 위해 표 3 참조), 이는 4 내지 7.4의 pH 스팬에서 0.3 pH 증분으로 수집을 초래하였다. 각각의 나노프로브에 대해, 동일한 중합체 농도(즉, 0.1㎎/㎖)이지만 상이한 pH 값에서 공중합체의 일련의 수용액을 제조하였다. 4.4- AMCA, 4.7-MB, 5.0- BDY 및 6.2- BDY630 나노프로브에 대해, 대응하는 공중합체를 동일한 당량의 FQ-컨쥬게이팅된 매칭 공중합체와 혼합하여 높은 온/오프 콘트라스트를 달성하였다. 도 24는 각각의 형광단에 대응하는 여기/방출 파장에서 UPS 나노프로브 라이브러리의 방출 이미지를 나타낸다.
도 24로부터의 결과는 전체 생리적 pH 4 내지 7.4에 걸쳐 있는 외부 환경에 대해 UPS 나노프로브의 강한 pH 민감성을 도시한다. 가장 낮은 pH 범위에서, 4.4-AMCA 나노프로브는 pH 4.55에서 오프였지만, pH 4.25에서 온으로 조정될 수 있다. 이 나노프로브는 가수분해효소가 효소 활성을 위한 낮은 pH를 필요로 하는 경우 기능성 리소좀 pH의 검출에서 유용할 수 있다. 나노프로브의 온/오프 특징은 리소좀 기능에 영향을 미치는 분자 경로 또는 소분자 동요를 동정하기 위한 선별 적용을 통해 그들을 특히 크게 유용하게 만든다. 더 높은 pH 범위(예를 들어, 6.5 내지 7.1)를 아우르는 나노프로브를 위해, 나노프로브는 종양의 산성 pHe의 이미징에 유용할 수 있고, 나노프로브 활성화는 암 세포의 해당과정 속도와 상관 관계가 있다(Wang, et al., 2014; Ko, et al. 2010). 중간 범위(예를 들어, 5.0 내지 6.5)에서 나노프로브는 엔도좀/리소좀의 성숙 연구에 유용할 수 있으며, 준세포 이미징 또는 약물 전달 적용을 위한 세포 소기관-특이적 조성물을 확립한다.
실시예
3: 음이온 구동
마이셀
형성 방법
1.
PEO
-
b
-PR 블록 공중합체의 합성
본 명세서에 참고로 포함된 문헌[Zhou, et al., 2011]에 의해 보고된 바와 같은 원자 이동 라디칼 중합(ATRP)에 의해 PEO-b-PR 공중합체(반응식 1)를 합성하였다. 무 염료 공중합체를 중합체 특성규명에서 사용하였다. PEO-b-PDPA(3)은 절차를 도시하기 위한 예로서 사용한다. 처음에, DPA-MA(1.70g, 8m㏖), PMDETA(21㎕, 0.1m㏖) 및 MeO-PEO114-Br(0.5g, 0.1m㏖)를 중합관 내에 채웠다. 이어서, 2-프로판올(2㎖)과 DMF(2㎖)의 혼합물을 첨가하여 단량체 및 개시제를 용해시켰다. 산소를 제거하기 위해 3주기의 냉동-펌프-해동 후에, CuBr(14㎎, 0.1m㏖)를 질소 분위기 하에 중합 관에 첨가하였고, 관을 진공에서 밀봉하였다. 40℃에서 8시간 동안 중합을 수행하였다. 중합 후에, 반응 혼합물을 10㎖ THF로 희석시키고 나서, 중성 Al2O3 칼럼을 통과시켜 Cu 촉매를 제거하였다. THF 용매를 회전증발기에 의해 제거하였다. 잔사를 증류수 중에서 투석시키고 나서, 동결건조시켜 백색 분말을 얻었다. 표 4는 각각의 공중합체의 특성규명을 요약한다.
2.
PEO
-
b
-(PR-
r
-
TMR
/
Cy5
) 블록 공중합체의 합성
AMA 단량체를 염료의 컨쥬게이션을 위해 공중합체에 혼입시켰다(반응식 S1b). PEO - b -(PR-r-AMA) 공중합체의 합성은 상기 기재한 절차에 따랐다. 3개의 1차 아미노기를 AMA 단량체 대 개시제의 공급비(비 = 3)를 조절함으로써 각각의 중합체 쇄에 도입하였다. 대표적인 절차에서, PEO - b -(PR-r-AMA)(50㎎)을 2㎖ DMF 중에 용해시켰다. 이어서, NHS-에스터(TMR-NHS에 대해 2.0 당량 및 Cy5-NHS에 대해 1.0 당량)를 첨가하였다. 밤새 반응시킨 후에, 공중합체를 분취 겔 침투 크로마토그래피(배리언에 의한 PLgel Prep 10 m 10E3 Å 300×250 칼럼, 용리액으로서 5㎖/분으로 THF)에 의해 정제하여 유리 염료 분자를 제거하였다. 생성된 PEO - b -(PR- r -염료) 공중합체를 동결건조시키고 나서, 저장 동안 -20℃에서 유지하였다. 블록 공중합체가 마이셀 내로 자기 조립될 때 염료는 헤테로 FRET 둘 다를 마찬가지로 겪어서 자기 소광된다는 것을 주목하는 것은 중요하다. 따라서 각각의 중합체 쇄에 대한 염료 컨쥬게이션은 FRET 실험에 대해 중요하다. 실험에서, TMR 및 Cy5의 컨쥬게이션 수는 중합체 쇄 당 2 및 1에서 각각 제어되었다.
3.
마이셀
나노입자의 제조
각각의 공중합체에 대해, 마이셀의 저장 용액을 본 명세서에 참고로 포함되는 문헌[Nasongkla, et al. (2006)]에 기재한 바와 같은 용매 증발 방법에 따라 제조하였다. PEO - b -( PDPA -r- TMR ) 마이셀 용액의 예에서, 20㎎의 공중합체를 1.0㎖ THF 중에서 처음 용해시키고 나서, 이어서, 초음파 처리 하에 8㎖ 탈이온수 내로 적가하였다. THF를 5회 동안 (100 KD) 막을 이용하는 한외여과를 통해 제거하였다. 이어서, 저장 용액으로서 5㎎/㎖까지 중합체 농도를 조절하기 위해 탈이온수를 첨가하였다. PEO - b - PDMA 저장 용액은 탈이온수 중에서 공중합체를 직접적으로 용해시킴으로써 제조할 수 있었다.
FRET 실험을 위한 마이셀 용액 샘플을 유사한 방법으로 제조하였다. PEO - b -(PDPA-TMR/Cy5) 샘플의 제조를 대표적인 절차로서 기재하였다. 처음에, 0.1㎖ PDPA-TMR 및 0.1㎖ PDPA - Cy5 저장 용액을 1.8㎖ 탈이온수에 첨가하였다. 이어서, 수불용성 블록 공중합체를 용해시키기 위해 1.8㎕의 1.0M HCl을 첨가하고 나서, 용액 pH를 4로 조절하였다. 출발 샘플에서 HCl로부터의 Cl-는 2mM 미만이었는데, 이는 실험 결과에 따라 마이셀화를 동요하는 그들의 능력을 등한시할 수 있었다.
4.
FRET 실험
형광 방출 스펙트럼을 히타치 형광계(F-7500 모델) 상에서 얻었다. 샘플을 545㎚에서 여기시켰고, 방출 스펙트럼을 560 내지 750㎚에서 수집하였다. 상이한 음이온의 도입에 의한 PEO - b - PDPA 자기-조립 거동을 위한 FRET 실험은 유사한 절차를 따랐다. ClO4 -를 예로서 사용하였다: 0.2㎕의 10 M NaClO4 용액을 pH=4에서 0.5㎎/㎖로 염료-컨쥬게이팅된 PDPA (PDPA - TMR / PDPA - Cy5 = 1:1) 용액에 2.0㎖까지 첨가하고 나서, ClO4 - 농도를 1 mM로 조절하였다. 이어서, 소용적의 10M NaClO4 용액을 증분적으로 첨가하여 ClO4 - 농도를 3.2, 5.6, 10 mM로 증가시켰다. 10mM 후에, 샘플 희석을 피하기 위해 고체 NaClO4를 용액에 첨가하여 ClO4 - 농도를 증가시켰다. 첨가된 NaClO4의 총 용적은 2㎕ 미만인데, 이는 총 용적 2㎖에 비해 무시될 수 있다. NaClO4의 각각의 첨가 후 4분 교반 후에 형광 방출 스펙트럼을 수집하였다.
5.
TEM
및 DLS 특성규명
TEM 및 DLS 분석을 위한 샘플을 상기 기재한 절차에 따라 제조하였다. PEO - b -PDPA의 전이 pH는 6.1이었다. 처음에, 0.1㎖ PDPA - TMR 및 0.1㎖ PDPA - Cy5 저장 용액을 1.6㎖ 탈이온수에 첨가하였다. 이어서, 고체 NaClO4 및 NaCl을 용액에 첨가하고 나서, 교반 후에 용해시켰다. HCl 및 NaOH 용액(1 M)을 사용하여 용액 pH를 5.0 내지 7.4로 조절하였다. 탈이온수를 첨가하여 총 용적을 2mL까지 조절하였다. 나노입자의 형태 및 크기를 투고 전자 현미경(TEM, JEOL 1200EX 모델)에 의해 특성규명하였다. 유체역학 직경(Dh)을 동적 광산란(DLS, 말번 마이크로V 모델(Malvern MicroV Model), He-Ne 레이저, λ=632㎚)에 의해 결정하였다.
6.
음이온 경쟁 실험
마이셀 샘플의 제조는 FRET 실험에서 기재한 것과 동일한 절차를 따랐다. 고체 NaCl 및 Na2SO4 분말을 수용액 중에 용해시켜 초기 음이온 농도를 달성하였다. Cl-의 초기 농도는 0, 50, 100, 200, 500, 1000 및 2000 mM이었다. SO4 2-의 초기 농도는 0, 25, 50, 100, 200 및 500mM이었다. 형광 방출 스펙트럼은 NaClO4의 첨가 후 교반 후 4분에 수집하였다. 결과를 S자형 곡선에 적합화시켰다. 과염소산염의 절반의 최대 FRET 효율 농도는 Cl- 및 SO4 2-의 경쟁 능력을 정량화하기 위한 FC50으로서 정의하였다.
7.
ClO
4
-
유도
마이셀 자기-조립 of
PEO
-b-PR 공중합체
상이한 알킬 측쇄를 지니는 일련의 PEO-b-PR 공중합체(도 25에서 1 내지 5)를 이 연구에서 사용하였다. 마이셀 샘플의 제조는 FRET 실험 부문에서 기재한 것에 따랐다. 이 일련의 실험에서, 용액의 이온 강도는 100 mM의 NaCl 농도를 이용함으로써 완충되었다. 이를 NaClO4로부터의 이온 강도 분포를 최소화하기 위해 사용하였는데, 더 많은 소수성 PEO-b-PR 공중합체(예를 들어, 5)는 마이셀 자기-조립을 유도하는데 더 적은 농도를 필요로 하기 때문이다. 실험 후에, FRET 효율은 FRET 부문에 앞서 기재한 바와 같이 계산하였다.
실시예
4: 음이온 구동
마이셀
형성 결과 및 논의
pHt 미만의 pH에서 양성자화된 PEO -b-PR 공중합체의 놀라운 카오트로픽 음이온-유도 마이셀화의 발견(도 25)을 기재한다. 놀랍게도, 단백질 응집에서의 효과와 대조적으로 카오트로픽 음이온은 마이셀화를 초래하지만, 코스모트로픽 음이온은 단백질 응집에서의 그들의 효과와 대조적으로 그렇지 않은 항-호프마이스터 경향을 발견하였다(Zhang and Cremer, 2006; Parsons, et al., 2011; Kunz, et al., 2004)(도 26a).
처음에, 마이셀 자기-조립 과정을 연구하기 위한 형광 에너지 공명 전달(FRET) 방법을 확립하였다. FRET는 중합체/단백질의 입체배좌 및 상전이를 검출함에 있어서 고도로 민감한데, 에너지 전달 효율이 공여체-수용체 거리의 여섯번째 힘에 반비례하기 때문이다(Jares-Erijman and Jovin, 2003; Sapsford, et al., 2006). 상기 방법에서, 블록 공중합체는 공여체 또는 수용체 염료 중 하나를 이용하여 컨쥬게이팅되었다(도 25에서 1 내지 5, 표 4)(Tsarevsky and Matyjaszewski, 2007; Ma, et al., 2003). PEO -b-폴리(다이프로필아미노에틸 메타크릴레이트)(3, pHt=6.1)을 모델 공중합체로서, 테트라메틸 로다민(TMR, λex/λem = 545/580㎚)/Cy5 (λex/λem = 647/666㎚)을 공여체/수용체로서 각각 선택하였다(Ha, et al., 1999; Grunwell, et al., 2001)
pH 4에서, 3(pHt = 6.1)에서 3차 아민을 양성장화하고 나서, 얻어진 공중합체는 분산된 양이온성 유니머로서 수 중에서 가용성이었다. 용액 중에서 유니머(따라서 TMR 및 Cy5) 사이의 큰 거리에 기인하여 FRET 효과는 관찰되지 않았다. 카오트로픽 음이온(예를 들어, ClO4 -, SCN- 또는 I-)의 첨가는 TMR로부터의 형광 강도의 감소 및 Cy5의 방출 강도의 증가를 초래하였는데(도 27), 이는 중합체 마이셀의 형성을 나타낸다. 마이셀 형성은 마이셀 코어 내에서 TMR 및 Cy5를 매우 근접하게 가져옴으로써, FRET 효율을 극적으로 증가시킨다는 가설을 세웠다(도 26b). 대조적으로, 코스모트로픽 음이온(예를 들어, SO4 2-, H2PO4 -)은 그들의 용해도 제한에 가까운 농도에서 조차 임의의 FRET 전달을 야기하지 않았다(도 28)(표 5).
FRET 효과는 마이셀화를 유도하는 그들의 능력에서 상이한 음이온을 비교하기 위해 정량화되었다(도 26c). FRET 효율을 (FA/FD)/(FA/FD)max로서 정규화하였고, 여기서, FA 및 FD는 각각 상이한 음이온 농도에서 TMR 및 Cy5의 형광 강도이며; (FA/FD)max는 높은 ClO4 - 농도에서 FA/FD (3.3)의 최대값이었다. FRET 효율은 상이한 음이온에 대한 농도의 함수로서 플롯팅하였다. 결과는 항-호프마이스터 경향을 나타내는데, 여기서 카오트로픽 음이온은 유니머 해리(즉, 마이셀화)를 유도할 수 있는 반면, 코스모트로픽 음이온은 그렇지 않았다(도 26c). 이 관찰은 단백질 가용화에서, 코스모트로픽 이온이 수중에서 단백질 응집을 유도하는 것으로 알려져 있지만, 카오트로픽 이온은 그렇지 않은 고전적인 호프마이스터 효과와 대조적이다(Hofmeister, 1888; Collins and Washabaugh, 1985)
공중합체 3은 카오트로픽 음이온에 대해 상이한 검출 감도를 나타내었다. 데이터는 ClO4 - > SCN- > I- > NO3 -의 순서를 따른 FRET 감도를 나타낸다. FC50은 FRET 효율이 50%인 음이온 농도로서 정의한다. FC50의 값은 ClO4 -, SCN- 및 I-에 대해 각각 11, 68 및 304 mM이었다. NO3 -에 대해, 그의 포화 농도(대략 3M)에서 약한 FRET 효과만이 관찰되었다. 더 상세한 시험은 3배 ClO4 - 농도 변화(즉, 6 내지 18 mM, 도 26c)만이 FRET 효율을 10%에서 90%를 증가시키는데 필수적이라는 것을 나타낸다. 이 좁은 농도 의존도는 앞서 보고한 바와 같은 초-pH 반응과 유사한 증가된 협력 반응을 시사한다(Zhou, et al., 2011; Zhou, et al., 2012; Huang, et al., 2013; Wang, et al., 2013).
카오트로픽 음이온-유도 마이셀화를 추가로 확인하기 위해, 투과 전자 현미경(TEM) 및 동적 광산란(DLS)을 사용하여 마이셀 전이 동안 형태 및 유체 역학적 직경 각각에서의 변화를 조사하였다. 클로라이드 음이온(Cl-)을 음성 대조군으로서 사용하였다. 50mM Cl-의 존재에서, 공중합체 3은 pH 5.0에서 유니머로서 남아있었다(6.1에서 그의 pHt 미만, 도 29a). 대조적으로, Cl-가 ClO4 -로 대체되었을 때 공중합체 3은 구체 마이셀로 자기 조립되었다(도 29b). DLS 분석은 음이온이 각각 Cl-로부터 ClO4 -로 변하였을 때 유체 역학적 직경의 7±2로부터 26±3㎚까지의 증가를 나타내었다(도 29). 이 크기 증가는 유니머 상태로부터 마이셀 상태까지 공중합체 3의 전이를 반영하는데, 이는 FRET 및 TEM 데이터와 일치된다. pH 7.4에서, 공중합체 3은 각각 Cl- 및 ClO4 - 음이온의 존재 하에 27±2 및 28±3㎚에서 유체 역학적 직경을 지니는 구체 마이셀로서 존재하였다(도 30 내지 도 31). 비이온화 가능한 양친매성 블록 공중합체, 예컨대 PEO-b-폴리(D,L-락트산)(PEO-b-PLA)에 대해, pH 변화도 ClO4 - 첨가도 마이셀 상태에 대한 임의의 효과를 갖지 않았다(도 32).
이어서, 카오트로픽 음이온-유도 자기-조립은 경쟁 코스모트로픽 또는 경계 음이온의 존재 하에 연구하였다. 공중합체 3은 경쟁 SO4 2- 또는 Cl-의 상이한 초기 농도로 pH 4에서 용해시켰다. 이어서, 마이셀화를 유도하기 위해 카오트로픽 음이온 ClO4 -를 첨가하였다(도 33 내지 도 36). 도 37a는 ClO4 - 농도의 함수로서 FRET 효율의 대표적인 예를 나타낸다. SO4 2- 음이온의 첨가는 마이셀 유도에서 ClO4 -의 감도를 감소시킬 수 있었다. FC50 값을 정량화하여 경쟁 음이온의 효과를 평가하였다(도 37b). 경쟁 음이온의 이온 강도의 함수로서 종 모양 곡선을 관찰하였다. 낮은 이온 강도(<0.1 M)에서, 경쟁 음이온의 첨가는 마이셀 형성을 유도하기 위한 ClO4 -의 능력을 감소시켰는데, 이는 PR 세그먼트의 암모늄기와의 그들의 경쟁과 일치한다. SO4 2- 또는 Cl-의 높은 이온 강도(0.5M 초과)에서, 그러나, ClO4 - 유도 자기-조립의 상승작용이 관찰되었다. 이 효과는 높은 코스모트로픽 이온 농도에서 더 정돈된 벌크 워터 구조에 기인할 수 있는데, 이는 마이셀 자기-조립 동안 소수성 회화ㅂ을 더 바람직하게 만든다.
최종적으로, 카오트로픽 음이온-유도 마이셀화(도 38a)에 대한 PR 세그먼트의 소수성 강도의 효과를 연구하였다. 3차 아민에 대해 메틸로부터 펜틸기까지의 상이한 알킬쇄 길이를 보유하는 일련의 PEO -b-PR 공중합체(도 25에서 1 내지 5)를 합성하였다. 결과는 PR 세그먼트의 소수성에 대한 ClO4 --유도 자기-조립의 명확한 의존도를 나타내었다(도 39). 적어도 소수성 측쇄(즉, 1에서 메틸)에 의해, 마이셀화는 가장 높은 ClO4 - 농도(1M)에서 조차 관찰되지 않았다. 대조적으로, 대부분의 소수성 측쇄(5에서 펜틸)는 ClO4 -에 의한 가장 민감한 마이셀화 유도를 초래하였다. 측쇄가 각각 펜틸, 부틸, 프로필 및 에틸기일 때 FC50 값은 2, 4, 35, 134 mM였다(도 38a).
상기 연구로부터의 결과는 카오트로픽 음이온에 의해 유도되는 3차 암모늄기를 지니는 블록 공중합체로부터의 고도로 흔치 않은 마이셀 자기 조립 과정을 설명한다. 현재의 나노시스템에서 몇몇 독특한 특징이 있다: 첫째로, 카오트로픽 음이온은 소수성 마이셀 코어 환경에서 양으로 하전된 암모늄기를 지니는 안정한 이온쌍을 형성할 수 있다. 대다수의 암모늄기가 이온화된 상태라는 것을 가정하면, 이는 추정된 코어 크기 14㎚로 마이셀 당 대략 60,000개의 이온 쌍(마이셀 당 800개의 중합체 쇄, (Wang, et al., 2013) 중합체 쇄 및 6㎚의 PEO 껍질 크기 당 70 내지 80개의 반복 단위의 아미노기-함유 단량체에 기반한 계산)(Leontidis, 2002)으로 번역된다. 둘째로, 카오트로픽 음이온만이 마이셀을 형성할 수 있는 반면, 코스모트로픽(SO4 2-) 및 경계(Cl-) 음이온은 이 능력을 갖지 않았다. 이 경향은 고전적 단백질 가용화 연구에서 대응하기 위해 나타난다. 셋째로, 마이셀화를 유도하기 위한 카오트로픽 음이온의 능력은 초-pH 민감 반응과 유사한 긍정적 협동성을 나타낸다. 이전의 연구는 형광 활성화(10% 내지 90% 반응)가 0.25 pH 단위([H+]에서 2배 미만) 내에서 일어났다는 것을 나타내었다. 이 연구는 3배[ClO4 -] 변화의 기간에 일어난 FRET 전달을 나타낸다. 마지막으로, 코스모트로픽 및 경계 음이온을 이용한 경쟁 실험은 종 모양 곡선을 설명하였는데, 이는 현재 시스템에서 마이셀 자기-조립 과정의 복잡성 및 미묘한 특성을 나타낸다.
경험 모델(도 38b)은 마이셀 자기-조립 과정에 기여하는 인자를 도시하도록 구성하였다. 이론에 의해 구속되는 일 없이, 증가되는 알킬쇄 길이로부터의 소수성 상호작용은 마이셀 형성을 위한 우세한 구동력을 제공하는 것으로 가설을 세운다. 이는 3차 아민의 측쇄가 메틸기일 때(도 38b의 좌측 아암 상의 파선에 의해 표시한 바와 같음) 마이셀 형성의 결여에 의해 뒷받침된다. 유사하게, 중화된 공중합체 1은 그의 pHt 초과의 pH에서 마이셀을 형성하지 않았다(Zhou, et al., 2011). 한편으로, 음이온은 마이셀화에서 중요한 역할을 한다. 강한 수화 껍질 및 약한 극성 특성규명을 갖는 것으로 알려진 코스모트로픽 음이온은 이온쌍의 형성 및 소수성 코어에서 이온쌍의 안정화에서 활동적으로 덜 바람직하다(Collins, 1997; Underwood and Anacker, 1987). 카오트로픽 음이온은 수화 시스(sheath)를 제거할 때 그들의 강한 분극률 및 낮은 에너지 비용에 의해 소수성 마이셀 코어에서 안정한 이온쌍의 형성을 가능하게 한다(Zhang and Cremer, 2009).
실시예
5: Sentinel 림프절 검출
1. UPS6
.9에 의한 위험
감시림프절에서의
동정
UPS6 .9 나노프로브는 위험 감시림프절에서 동정하는 능력을 입증하였다. 도 42a는 SPY 엘리트(등록상표) 카메라에 의한 원발성 종양 부위 근처의 목 측면 상의 대표적인 감시림프절의 동정을 나타낸다. 8개의 림프절을 원발성 두경부암을 지니는 4마리의 상이한 동물(동물 당 2개)에서 동정하였다. 이들 결절은 마우스에서 원발성 두경부 종양을 탈수시키는 목 분지(cervical basin)에 있으며, 마우스에서 전형적으로 발견되는 목 림프절에 해부학적으로 대응된다. 모두 8개의 결절 구조를 UPS6.9 단독에 의해 동정하였고; 그들은 크기가 백색광을 이용하여 보기에는 너무 작은 밀리미터 이하이고 목 지방 및 침샘과 밀접하게 관련되지만, SPY 카메라에 의해 시각화할 때 밝았다. 임상 병리학자에 의한 H&E 분석은 림프절로서 동정된 구조를 입증하였다. 8개 결절 중 1개는 도 42b 하부 패널에서 검정색 화살표에 의해 표시하는 바와 같이 HN5 암 세포의 존재를 나타내었다. 몇몇 경우에, 그들의 원발성 종양의 완전한 절제가 있었던 마우스에서 종양의 결절 재발이 관찰되었다. 거대 종양은 원발성 종양 부위 대신 목 측면에서 나타났다. 이들 데이터는 종양의 완전한 절제를 달성하기 위한 위험 림프절 동정의 중요성을 시사한다. 종양을 탈수시키는 단일 결절을 동정하고, 대부분이 암세포를 함유하지 않는다는 사실은 이들 결절이 원발성 종양 부위로부터 림프관 내로 탈수되는 SLN 수집 활성화 중합체 프로브를 나타낸다는 것을 시사한다.
실시예
6: pH-활성화된
인도사이아닌
그린-암호화된 나노센서(PINS)의 개발
1.
PINS의 제조 및 나노센서 특성규명
폴리(에틸렌 글리콜)-b-폴리(에틸프로필아미노에틸 메타크릴레이트) 공중합체(PEG-b-(PEPAx-r-ICGy)(여기서, x 및 y는 각각 EPA 단량체 및 ICG 염료의 무작위 반복 단위의 수를 나타냄; 도 43a 내지 도 43i)의 마이셀을 포함하는 pH-활성화 가능한 인도사이아닌 그린-암호화 나노센서(PINS)를 합성하였다. 소수성 마이셀화 및 호모FRET-유도 형광 소광(Zhou et al., 2011 및 Zhou et al., 2012)은 극적으로 뾰족한 pH 반응을 제공하였다. PEPA 세그먼트 길이 및 ICG 컨쥬게이션 수(도 44a 내지 도 44f)의 체계적 최적화는 6.9에서 급격한pH 전이, 높은 형광 활성화 비, 최적의 입자 크기(25㎚), 및 신호 증폭을 위한 나노프로브 당 ICG 평균 800을 지니는 최적의 PINS 조성물을 야기하였다. 보고된 pH-민감성 프로브(예를 들어, 소분자 염료(Urano et al., 2009), 펩타이드(Weerakkody et al., 2013) 또는 2 pH에 걸쳐 10배 신호 변화를 지니는 PeT 나노프로브(Diaz-Fernandez et al., 2006))와 비교하여, PINS 설계는 6.9에서 0.15 pH 스팬에 걸쳐 100배 초과의 신호 증가를 달성하였다. ICG 염료에 연결된 추가적인 중합체를 제조하였고, 표 6에서 특성규명한다.
나노센서를 이용한 초기 용량 반응 연구를 본 명세서에 기재한 다른 pH 반응 시스템에 기인한 것과 유사한 인간 두경부 HN5 정위 종양 이종이식을 보유하는 마우스에서 수행하였다. PINS를 꼬리 정맥을 통해 정맥내로 주사하였고, 임상 SPY 엘리트(등록상표) 카메라를 사용하여 동물을 이미징하였다(도 45a 내지 도 45e). 계속된 시간 창(12 내지 24시간)에 걸쳐 노이즈 비에 대한 거대 종양 콘트라스트(CNR=27)에 기인하여 이미징 용량으로서 사용하기 위한 2.5㎎/kg 양을 선택하였다. 안정한 시간 창은 빠른 신장 클리어런스 때문에 일시적 창(2 내지 3시간)을 이용하는 소분자 트레이서 이상으로 종양 수술에 대해 유리하다(Choi et al., 2013). 2.5㎎/kg PINS에서와 같은 동등한 염료 용량에서 유리 ICG의 주사는 관찰가능한 종양 콘트라스트를 나타내지 않았다(도 45b).
PINS에 의한 종양 산성혈증 이미징은 뇌 및 갈색 지방 조직이 위양성 모방 임상 관찰을 야기한 FDG-PET에 비해 종양 검출의 감도 및 특이성을 개선시켰다(도 46b 및 도 47a 내지 도 47e)(Cook et al., 2004 및 Fukui et al., 2005). FDG-PET는 큰 HN5 종양(대략 200㎣)을 검출하였지만, PET 방법은 작은 종양 결절(대략 15㎣, 표 7)을 검출할 때 성공적이지 않았다. 정상 조직 콘트라스트(CNR>20)에 대해 높은 종양을 지니는 PINS를 이용하여 다수의 상이한 종양 크기를 검출할 수 있었다. 더 나아가, PINS는 서브밀리미터 공간 해상도에서 종양 경계를 묘사할 수 있었다(도 46b 및 도 47a 내지 도 47e).
종양 검출의 폭을 평가하기 위해, 3개의 정위 두경부 종양(HN5, FaDu 및 HCC4034, B.D.S의 환자로부터의 종양 이종이식), 피하 유방 종양(MDA-MB-231), 유방내 정위 유방 종양(삼중 음성 4T1), HCT116 결장직장 암세포로부터의 복막 전이 모델, 신장암의 환자 유래 이종이식 및 U87 신경교종 세포로부터의 정위 뇌 종양을 이미징하였다. 면역적격 BalB/C 마우스에서의 4T1 종양을 제외하고 모든 종양을 NOD-SCID 마우스에서 확립하였다. 모든 종양 유형에 걸쳐 밝은 형광 조명을 관찰하였다(도 48). 생체밖 이미징은 높은 암 특이성을 지니는 근육 이상으로(20 내지 50배) 종양의 높은 콘트라스트 비를 나타내었다(도 49a 및 도 49b). HN5 종양 모델을 이용하여, 다중 임상 카메라를 이용하는 PINS 이미징의 적합성을 입증하였다(도 50a 내지 도 50f).
SPY 카메라를 이용하여, HN5 두경부 또는 4T1 유방암을 보유하는 마우스에서 실시간 종양 산성혈증 가이딩 수술(TAGS)을 수행하였다. PINS(2.5㎎/kg)를 수술 전 12 내지 24시간에 정맥내로 주사하였다. HN5 종양 함유 마우스에서의 대표적인 수술에서, 원발성 종양의 절제 후, 잔여 종양은 SPY 카메라에 의해 명확하게 보였지만(도 51a에서 중간 좌측 패널) 백색광 하에서는 그렇지 않았다(상부 좌측 패널). 경계 묘사의 정확성을 조사하기 위해, HN5 두경부 종양을 보유하는 9마리 마우스에서 이중맹검 프로토콜을 이용하여 비생존 수술을 분석하였다. 수술은 PINS 조명 하에서 종양을 절제하며, 원발성 종양, 종양 경계 또는 형광에 기반한 음성 근육 조직 중 하나로서 조직 표본(2 내지 3㎜ 크기)을 표시하였다. 이어서, 표본을 냉동 분획화하고 나서, H&E로 염색하였다. 조직학적 평가를 임상 병리학자에 의해 독립적으로 수행하였다(도 52). 금 표준으로서 조직학을 이용하면, PINS 형광 평가는 89.5% 내지 100%(n=27)의 검출 정확성의 95% 신뢰도를 가졌다. 장기간 생존 수술 결과는 백색광 수술(WLS), 용적 축소 수술 및 비처리 대조군 이상으로 TAGS에 의해 개선된 국소-국부 제어 및 전반적인 생존을 나타낸다(도 51b). 거시적으로 양성의 경계를 지니는 용적 축소 수술은 전형적으로 두경부암에 대해 생존 이점을 제공하지 않으며, WLS의 적합성을 위한 대조군으로서 작용하였다. WLS는 동등한 생존을 나타낸 용적 축소 및 비처리 대조군(P<0.0001)보다 우수하였는데, 이는 양호한 비편향 기법을 나타낸다. TAGS는 18마리 동물 중 13마리(72%)에서 최선의 결과를 유도하였는데, 이는 수술 후 150일에 치유를 나타내었다(P<0.0001 대 WLS, 도 51b).
잠재성 암성 결절을 동정하는 것이 종양 경계에 걸쳐 우선 순위를 취할 수 있는 임상 시나리오를 모방하기 위해, 작은 정위 유방 종양을 면역적격 암컷 BalB/C 마우스에서 확인하였다. 5×104개 삼중 음성 4T1 유방암 세포를 서혜부 유방 패드에서 주사하였다. 24시간의 추정 배가시간에 의해, 결절 크기는 제4일에 병변에서 1백만개 미만의 4T1 세포를 나타낸다. SPY 카메라 하에서 PINS는 4T1 병변을 동정할 수 있었는데, 이는 조직학에 의해 확인하였다(도 53a 내지 도 53c). 종양은 시각적 검사 또는 촉진을 이용하여 검출할 수 없었다. 백색광 제어를 위해, 종양은 가시적으로 되기 위해 대략 25㎣로 성장하도록 허용되었고, 원발성 종양 및 주변 경계를 조심해서 절제하였다. TAGS는 우수한 시각화를 초래하였는데, 이는 비처리 대조군 및 WLS 이상으로 절제 후 생존을 개선시켰고(P<0.05, 도 53d), 이는 PINS에 의한 최상의 이미징 감도를 입증하였다.
상이한 종양 산성혈증 경로를 표적화하는 소분자 저해제에 대한 종양 반응은 PINS에 의해 평가하였다(도 54a 내지 도 54c). 4종의 저해제를 선택하였다: 탄산 무수화 효소 IX(CAIX),V)에 대해 아세트아졸아마이드(Neri & Supuran, 2011) 모노카복실레이트 수송체(MCT)에 대해 α-사이아노-4-하이드록시신나메이트(CHC) (Sonveaux et al., 2008), 나트륨 양성자 교환기 1(NHE1)에 대해 카리포라이드(Cardone et al., 2005) 및 양성자 펌프 저해제(PPI)로서 판토프라졸(Vishvakarma & Singh, 2011). PINS는 저해제 투여 후 4T1 종양을 보유하는 BalB/C 마우스에 대해 정맥내로 주사하였다. PINS 주사 후 24시간에 NIR 이미징은 PBS 대조군 이상으로 CAIX 저해제 아세트아졸아마이드에 의한 급격한 저해(74.2%)를 나타내었다. MCT 저해제 CHC에 의한 보통의 저해(29.3%)가 또한 관찰되었다. 카리포라이드 또는 판토프라졸에 의한 상당한 저해가는 주목되지 않았다. PINS 반응은 4T1 종양에서 CAIX 저해제의 앞서 보고된 항종양 효능과 일치된다(Lou et al., 2011 및 Pacchiano et al., 2011). 1H/31P19 또는 과분극 13C MRI 방법과 비해(Gallagher et al., 2008), PINS 이미징은 종양 산성혈증의 메커니즘적 조사 및 고형암의 하향조절된 pH를 표적화하는 약물의 발생에 대해 단순하고 편리한 리포터 분석을 제공한다(Neri & Supuran, 2011 및 Parks et al., 2013).
면역적격 C57bL/6 마우스에서 PINS의 안전성 평가는 고용량에서 일시적 체중 감소를 나타내었다(도 55a 및 표 8 및 표 9). 최대 허용 용량은 이미징 용량보다 100배 더 큰 250㎎/kg이다. 마우스를 200 및 250㎎/kg에서 제1일, 제7일 및 제28일에 희생시켰다. 간 및 신장 기능을 측정하였다(도 55b 내지 도 55d). 간 효소 수준(ALT 및 GOT)은 PINS 주사 후 제1일에 증가되었고, 제7일에 정상으로 돌아왔다. 조직 분석(도 56)은 제1일에 250㎎/kg 그룹의 간에서 미세지방증을 나타내었고, 제28일에 정상으로 되돌아왔다. 다른 주요 기관(예를 들어, 신장, 심장, 비장, 뇌)은 정상이다.
2.
물질 및 방법
PINS의 단량체 및 중합체의 특성규명. 2-(에틸프로필아미노)에틸 메타크릴레이트(EPA-MA) 및 폴리(에틸렌 글리콜)-b-폴리(에틸프로필아미노에틸 메타크릴레이트) 공중합체(PEG-b-(PEPA))의 합성을 상기 방법 부문에서 기재하였다. 이하는 단량체 및 공중합체의 화학적 특성규명이다:
2-( 에틸프로필아미노 ) 에틸 메타크릴레이트 (EPA-MA): 1 H NMR (TMS, CDCl3, ppm): 6.10 (s, 1H, CHH=C(CH3)-), 5.54 (s, 1H, CHH=C(CH3)-), 4.20 (t, 2H, -OCH 2CH2N-), 2.75 (t, 2H, -OCH2CH 2N-), 2.58 (q, 2H, -N(CH2CH2CH3)(CH 2CH3)), 2.44 (m, 2H, -N(CH 2CH2CH3)(CH2CH3)), 1.94 (s, 3H, CH2=C(CH 3)-), 1.45 (m, 2H, -N(CH2CH 2CH3)(CH2CH3)), 1.02 (t, 3H, -N(CH2CH2CH3)(CH2CH 3)), 0.87 (t, 3H, -N(CH2CH2CH 3)(CH2CH3)). 13 CNMR (CDCl3, ppm):167.42, 136.36, 125.35, 63.20, 56.31, 51.51, 48.32, 20.54, 18.33, 12.09, 11.82. [M+H]+: 200.2 (계산치 200.3).
폴리 ( 에틸렌 글리콜 )- b - 폴리 ( 에틸프로필아미노에틸 메타크릴레이트 ) ( PEO - b -P(EPA) 100 ): 1 H NMR (TMS, CDCl3, ppm): 3.99 (b, 204H, -COOCH2-), 3.83-3.45 (m, 450H, -CH2CH2O-), 3.38 (s, 3H, CH3O-), 2.68 (b, 204H,-OCH2CH2N), 2.55 (b, 204H, N(CH2CH2CH3)(CH2CH3)), 2.41 (b, 204H, -N(CH 2CH2CH3)(CH2CH3)), 1.78-1.90 (m, 270H, CCH3C & C(CH3)2), 1.45 (m, 204H, -N(CH2CH2CH3)(CH2CH3)), 1.02 (b, 306, -N(CH2CH2CH3)(CH2CH 3)), 0.88 (b, 306H, -N(CH2CH2CH 3)(CH2CH3)). 13 CNMR (CDCl3, ppm): 177.73, 177.33, 176.61, 70.58, 63.26, 63.13, 56.21, 51.09, 45.05, 44.70, 38.69, 31.92, 30.33, 29.69, 29.36, 28.90, 23.72, 22.98, 22.69, 20.62, 16.53, 14.13, 12.18, 11.91.
PINS의 형광 활성화. 상이한 pH 완충제 용액 중의 PINS의 형광 강도를 히타치 형광계(F-7500 모델) 상에서 측정하였다. 각각의 PINS 조성에 대해, 2.5㎎/㎖의 농도로 밀리큐 워터 중의 저장 용액을 제조하였다. 이어서, 저장 용액을 상이한 pH 값을 지니는 80mM 인산염-완충 식염수(PBS) 완충제 또는 상이한 pH 값을 지니는 80mM PBS 완충제 중의 50% 인간 혈청 중 하나를 이용하여 희석시켰다. 최종 마이셀 농도를 PBS 중의 0.05㎎/㎖로 또는 50% 인간 혈청 중의 0.025㎎/㎖로 제어하였다. 나노프로브 용액을 780㎚에서 여기시키고 나서, 방출 스펙트럼을 800㎚ 내지 900㎚에서 수집하였다. PBS 중의 815㎚ 및 50% 인간 혈청 중의 830㎚를 나노프로브의 pH 반응을 정량화하기 위해 사용하였다. 상이한 pH 값에서 시험관내 PINS 용액(0.05㎎/㎖)의 형광 이미지를 SPY 엘리트(등록상표) 이미징 시스템에 의해 촬영하였다.
보관 수명 연구. 새로 제조한 나노프로브 수용액(5㎎/㎖)을 동일한 용적의 20% 수크로스 수용액과 혼합하여 10% 수크로스 중의 2.5㎎/㎖ 저장 용액을 생성하였다. 저장 용액을 나누고 나서, 몇몇 시험관에서 밀봉하고, -20℃ 냉동고에서 냉동시켰다. 샘플을 상기 기재한 바와 같이 PBS 또는 50% 인간 혈청 중의 형광 활성화를 시험하기 위해 표시 시점에 해동시켰다.
세포 배양물. 생체내 종양 모델을 위해 사용한 암 세포주는 HN5, FaDu, HCC4034 인간 두경부암, MDA-MB-231 및 4T1 유방암, U87 신경교종, 및 HCT116 결장직장암 세포를 포함한다. HN5 및 FaDu 세포주를 마이클 스토리 연구실(Michael Story's lab)으로부터 얻었고; HCC4034를 바란 수머 박사(Dr. Baran Sumer)의 두경부 환자의 절제 종양으로부터 존 미나 연구실(John Minna's lab)에 의해 확립하였으며; MD-MBA-231, 4T1 및 HCT116을 데이비드 부트만 연구실(David Boothman lab)로부터 얻었고; U87을 다웬 자오 연구실(Dawen Zhao lab)로부터 얻었다. 모든 세포주를 사용 전 마이코플라스마 오염에 대해 시험하였다. 오염에 대한 음성 상태를 바이오툴사(Biotool)로부터의 마이코플라스마 검출 키트에 의해 입증하였다. 세포를 10% 소 태아 혈청 및 항생제와 함께 DMEM 중에서 배양시켰다.
동물 모델. 본 연구와 관련된 동물 프로토콜을 검토하고 나서, 실험동물운영위원회(Institutional Animal Care and Use Committee)에 의해 승인하였다. 암컷 NOD-SCID 마우스(6 내지 8주)를 UT 사우스웨스턴 메디컬 센터 브리딩 코어(UT Southwestern Medical Center Breeding Core)로부터 구입하였다. 정위 두경부 종양에 대해, HN5, FaDu 또는 HCC4034 세포(마우스 당 2×106개)를 이하삼각 영역 내로 주사하였다. 접종 후 1주에, 종양 크기 100 내지 200㎣를 지니는 동물을 이미징 연구를 위해 사용하였다. 피하 유방 종양 모델을 우측 옆구리 상에 MDA-MB-231(마우스 당 2×106개) 세포를 주사함으로써 확인하였다. HCT-116(마우스 당 2×106개) 세포의 복막내 주사 다음에 복부의 부드러운 마사지에 의해 복막의 전이를 확립하였다. 정위 U87 신경교종 보유 마우스를 U87 세포의 두개내 주사에 의해 확립하였다. XP296 환자 유래 신장 이종이식을 보유하는 마우스는 제임스 브루가롤라스 연구소(James Brugarolas lab)에 의해 제공되었다. 암컷 BalB/C 마우스(6 내지 8주)를 UT 사우스웨스턴 메디컬 센터 브리딩 코어로부터 구입하였다. 정위 유방 종양 모델을 우측 흉곽 유선 내로 4T1(마우스 당 5×104개) 세포의 주사에 의해 BalB/C 마우스에서 확립하였다.
용량-반응 연구. HN5-종양-보유 마우스(각각의 그룹에 대해 3)를 1.0, 2.5 또는 5.0㎎/kg PINS 등장 용액으로 주사하였다. 대조군을 0.08㎎/kg 유리 ICG 염료(2.5㎎/kg PINS 중의 염료 함량과 동등함)로 주사하였다. 표시한 시점에, 마우스를 2.5% 아이소플루오란으로 마취시키고 나서, SPY 엘리트(등록상표)로 이미징하였다. 형광 강도를 이미지 J(Image J)에 의해 측정하였다. 콘트라스트 대 노이즈 비(CNR)를 다음의 식에 의해 계산하였다:
FI (종양) 및 FI (정상 조직)은 각각 종양 및 정상 조직의 형광 강도이다. 배경 노이즈를 정상 조직 형광의 표준 편차로서 측정하였다.
생체내 및 생체밖 형광 이미징 . 나노프로브(U87 및 XP296에 대해 3.0㎎/kg을 제외하고 모든 종양 모델에 대해 2.5㎎/kg)를 종양-보유 마우스의 꼬리 정맥을 통해 정맥내로 투여하였다. 24시간 후에, 동물을 SPY 엘리트(등록상표) 임상 카메라에 의해 이미징하였다. 생체밖 이미징을 위해, 종양 및 주요 기관을 채취하고, 이미징하였다. 종양 및 기관의 형광 강도를 비슷한 크기의 근육 조직에 대해 정규화하였다.
실시예
7: 식균 작용의 세포 소기관을 평가하기 위한
마이셀의
용도 및 신호전달 및 증식에서 그들의 용도
1.
pH 반응 시스템의 제조
세포 소기관의 생리학적 역할을 평가하기 위해, 일련의 양친매성 블록 공중합체 PEO-b-P(R1-r-R2)(여기서, PEO는 폴리(에틸렌 옥사이드) 및 P(R1-r-R2)는 이온화 가능한 무작위 공중합체 블록임)를 합성하였다(도 57a 및 도 58). 각각의 공중합체의 몰 조성물을 표 10에 나타낸다. 높은 pH(예를 들어, 인산염-완충 식염수 중의 7.4)에서, 이들 공중합체는 코어셸 마이셀 구조(직경 30 내지 60㎚, 표면 정전기 퍼텐셜 -2 내지 0 mV, 표 10 및 도 59)로 자기 조립한다. 각각의 공중합체의 겉보기 pKa 미만의 pH에서, 마이셀은 3차 아민의 양성자화에 기인하여 유니머로 해리된다. 이전의 연구는 일련의 조정가능한, 초-pH 민감 형광 센서의 개발을 위해 급격한 pH-의존적 마이셀 전이를 연구하였다(Ma, et al., 2014).
| UPS 나노입자의 화학적 조성 및 물리적 특성. | ||||||
| 조성 a | D h (nm) b | PDI b | ζ(mV) c | pK a d | pH t e | |
| UPS 4 .4 | P(D5a80) | 47.5±3.0 | 0.13±0.01 | -1.1±0.2 | 4.35 | 4.39 |
| UPS 4 .7 | P(DBA28-D5a52) | 62.4±2.9 | 0.08±0.01 | -0.5±0.1 | 4.65 | 4.71 |
| UPS 5 .0 | P(DBA56-D5a24) | 54.6±1.2 | 0.10±0.01 | -1.3±0.4 | 4.93 | 5.02 |
| UPS 5 .3 | P(DBA80) | 42.3±2.6 | 0.12±0.02 | -0.7±0.1 | 5.31 | 5.32 |
| UPS 5 .6 | P(DPA30-DBA50) | 49.8±2.6 | 0.11±0.01 | -2.1±0.4 | 5.58 | 5.61 |
| UPS 5 .9 | P(DPA60-DBA20) | 49.2±1.3 | 0.11±0.01 | -0.9±0.1 | 5.89 | 5.91 |
| UPS 6 .2 | P(DPA80) | 44.3±1.2 | 0.10±0.01 | -1.6±1.8 | 6.19 | 6.22 |
| UPS 6 .5 | P(DEA21-DPA79) | 42.0±1.3 | 0.12±0.02 | -0.9±0.6 | 6.45 | 6.50 |
| UPS 6 .8 | P(DEA39-DPA61) | 35.2±1.3 | 0.11±0.01 | -1.4±0.6 | 6.77 | 6.79 |
| UPS 7 .1 | P(DEA58-DPA42) | 32.7±1.3 | 0.13±0.01 | -0.9±1.1 | 7.05 | 7.08 |
| aPR 세그먼트의 조성물만을 나타낸다. 첨자는 각각의 단량체에 대한 반복 단위의 수를 나타낸다. b유체 역학적 직경(Dh) 및 다분산 지수(PDI)를 동적 광산란 분석에 의해 분석하였다. cUPS 나노입자의 표면 정전기 퍼텐셜(ζ)을 제타 시저(Zeta Sizer)에 의해 분석하였다. dUPS 나노입자에 대한 겉보기 pKa 값을 150mM NaCl의 존재 하에 pH 적정 실험에 의해 측정하였다. e전이 pH(pHt)를 형광 강도에 기반하여 Cy5-컨쥬게이팅된 UPS 나노프로브로부터 측정하였다. | ||||||
본 명세서에서 넓은 범위의 pH 중의 좁은 pH 간격(4.0 내지 7.4)에서 정교한 pH-조정 가능 완충제 능력을 갖는 UPS 나노입자를 기재한다. 도 57b는 150mM NaCl의 존재에서 3가지 예시적인 UPS4 .4, UPS5 .3 및 UPS6 .2 나노입자의 pH 적정 곡선을 나타낸다(각각의 첨자는 대응하는 공중합체의 pKa를 나타낸다, 표 10). 결과는 HCl(0.4M)이 중합체 용액에 첨가될 때, UPS4 .4, UPS5 .3 및 UPS6 .2(2㎎/㎖)가 각각 4.4, 5.3 및 6.2에서 그들의 겉보기 pKa에서 pH를 완충시킬 수 있다는 것을 나타내었다. 대조적으로, 생물학적 연구에서 널리 사용되는 소분자 염기인 클로로퀸(CQ)은 넓은 pH 완충제로서 pH 6 내지 9 범위의 넓은 pH 반응(pKa = 8.3)뿐만 아니라 폴리에틸렌이민을 나타내었다(Suh et al., 1994).
pH 적정 곡선으로부터의 완충 능력의 결정(도 57c 및 도 60)은 pH 4.0 내지 7.4의 범위의 특정 pH에서 정교한 완충제 강도를 나타내었다. 더 구체적으로, UPS4.4, UPS5 .6 및 UPS7 .1 나노입자에 대한 최대값은 40㎎의 나노입자 당 1.4, 1.5 및 1.6 mmol HCl이었는데, 이는 pH 4.4, 5.6 및 7.1에서의 CQ보다 각각 339-, 75- 및 30-배 더 높다(도 57c). UPS 나노입자의 이런 수집은 초기 엔도좀(E.E., 6.0 내지 6.5)(Weisz, 2003)으로부터 후기 엔도좀(L.E., 5.0 내지 5.5)(Weisz, 2003) 내지 리소좀(4.0 내지 4.5)(Casey et al., 2010)까지 세포 소기관 pH의 기능적 범위에 대해 pH-특이적 "양성자 스펀지"의 독특한 세트를 제공한다.
2. pH
완충 능력 및 양성자
펌핑
속도
동시 이미징 및 완충제 연구를 위해, 이중 형광 리포터를 이용하는 새로운 나노입자 설계를 확립하였다: pH 환경과 상관없이 세포내 나노입자를 추적하기 위한 "항상 온" 리포터, 및 pH-활성화 가능한 리포터(세포외 매질 pH 7.4에서 오프 및 내포작용 후 특정 세포 소기관 pH에서 온). PEO의 말단 단부 상에서 염료(예를 들어, Cy3.5)를 컨쥬게이팅할 때의 초기 시도는 항상 온 신호로 이어지지만, 그러나, 얻어진 나노입자는 혈청 단백질에 대한 염료 결합의 결과로서 불안정하였다. 이 제한을 극복하기 위해, 마이셀의 코어에서 도입된 형광단 쌍을 이용하는 헤테로FRET 설계를 사용하였다. 예로서, FRET 쌍(예를 들어, 공여체 및 수용체로서 각각 보디피 및 Cy3.5)을 UPS6.2 공중합체의 PR 세그먼트에 컨쥬게이션시켰다. 동일한 마이셀 코어 내의 두 염료-컨쥬게이팅된 공중합체(공여체/수용체의 최적의 몰비 = 2:1)의 혼합은 낮은 pH에서 마이셀 분해 후 유니머 상태에서 형광 회수를 제외하고, 마이셀 상태(pH > pKa)에서 공여체 염료(예를 들어, 보디피)의 헤테로FRET-유도 형광 소광을 허용하였다(도 61a 상부 패널). "항상 온" 신호를 생성하기 위해, 마이셀에서 Cy3.5-컨쥬게이팅된 공중합체의 중량 분율을 낮게 유지하여(예를 들어, 40%) 마이셀 상태에서 수용체 염료에 대한 호모FRET-유도 형광 소광을 회피하였다(Zhou, et al., 2012)(도 61b). 얻어진 UPS 나노입자는 넓은 pH 범위에 걸쳐 Cy3.5 채널에서 일정한 형광 강도를 나타내었지만, 보디피 신호에 대해 특정 pH에서 초-pH 민감 활성화를 달성하였다(도 61c). 형광단은 둘 다 마이셀 코어 내에 포함되기 때문에, 얻어진 UPS 나노입자는 안정하고, 단백질 결합으로부터 유리되었다.
UPS6 .2 및 UPS5 .3은 이미징 및 완충 연구를 위해 선택하였는데, 그들의 겉보기 pKa가 초기 엔도좀 내지 후기 엔도좀 및 리소좀 전이까지 각각 대응하기 때문이다(Weisz, 2003). HeLa 세포를 5분 동안 37℃에서 증가된 용량(100, 400 및 1,000㎍/㎖)의 UPS6 . 2 UPS5 . 3과 함께 인큐베이션시켜 내포작용을 통해 입자를 흡수시키고(Conner & Schmid, 2003), 이어서, 새로운 배지(DMEM 중의 10% FBS)로 세척하였다. 100㎍/㎖에서, 절반의 최대 UPS6 .2 활성화(보디피 채널)를 30분까지 관찰하였고, 절반의 최대 UPS5 .3 활성화를 60분까지 관찰하였다(UPS6 .2에 대해 도 62a 및 도 62b; UPS5.3에 대해 도 63a 및 도 63b). 대조적으로, 1,000㎍/㎖에서, Cy3.5 신호에 의한 HeLa 세포 내 입자 흡수의 명확한 표시에도 불구하고, 보디피 신호의 활성화 신호는 적어도 60분까지 지연되었다(도 62a 및 도 62b 및 도 63a 및 도 63b). 라이소센서를 이용한 엔도좀 pH의 인시추 정량화는 400 및 1,000㎍/㎖ UPS6 .2(도 62c) 및 UPS5 .3(도 63c)에 대한 세포의 노출 시 각각 pH 6.2 및 5.3에서 용량 의존적인 지속적 pH 안정기를 나타내었다. 나노입자 중 하나에 대해, 100 ㎍/㎖ 용량은 세포 소기관 산성화를 지연시키는 데 불충분하였다.
산성화 속도를 추가로 정량화하기 위해, HeLa 세포 당 마이셀 나노입자의 수를 내재화된 UPS의 형광 강도를 세포수로 나눈 것에 기반하여 측정하였다(이하의 방법 참조). 데이터는 더 고용량 인큐베이션 용량에서 증가된 수의 나노입자를 나타낸다(표 11). 마이셀 당 아미노기의 수(64,000) 및 세포 당 평균 200개 엔도좀/리소좀에 기반하여(Holtzman, 1989), 각각의 세포 소기관에 대해 초당 대략 150 내지 210개 양성자로서 산성화 속도를 계산하였다. 이 결과는 2개 양성자/가수분해된 ATP/V-ATP 분해효소(Deamer et al., 1999), 소모된 3개 ATP 분자/회전(Cross & Muller, 2004), 2.4회 회전/초(Imamura et al., 2003) 및 세포 소기관 당 평균 20 V-ATP 분해효소(Imamura et al., 2003)에 기반한 계산과 일치된다 .
| UPS 나노입자에 의한 식균 작용의 세포 소기관의 산성화 속도의 정량화. | ||||||
| [UPS] med (㎍/㎖) |
D
h
/ζ
(nm/mV) a |
No. UPS/ 세포(×10 2 ) b | 안정기 pH (평균±SD) |
t
p
(분) c |
양성자 속도 (×10 2 /초) d | |
|
UPS 6 .2 |
100 400 1,000 |
42.3±2.6/ -0.7±0.1 |
4.7 17 24 |
n.d. 6.2±0.1 6.2±0.1 |
n.d. 51 84 |
N/A 1.8 1.5 |
|
UPS 5 .3 |
100 400 1,000 |
44.3±1.2/ -1.6±1.8 |
4.6 17 24 |
n.d. 5.4±0.1 5.3±0.1 |
n.d. 43 68 |
N/A 2.1 1.9 |
| a유체역학적 직경(Dh) 및 제타 퍼텐셜(ζ)을 pH 7.4에서 PBS 완충제 중에서 측정하였다. b마이셀 당 800개 공중합체 쇄에 기반하여 계산하였다. ctp는 시간 간격으로서 측정하였으며, 여기서 pH는 안정한 값에서 완충되었다. d각각의 식균 작용의 세포 소기관 내로의 양성자 펌핑 속도. | ||||||
3. mTORC1
활성화의 2가지 상이한 방식에 대한 pH 역치
엔도좀 단백질 외피 성숙 및 엔도좀/리소좀-의존적 신호 형질도입에 대한 내강 pH의 UPS 완충의 결과를 시험하였다. 이 목적을 위해, 별도로 보고되고 pH 6.2, 5.3, 5.0, 4.7 및 4.4에서 완충된 UPS 나노입자를 선택하였다. 이 범위는 초기 엔도좀, 후기 엔도좀 및 리소좀에서 확립된 발광 pH 값을 아우른다. 초기 엔도좀 생물발생의 차별적 특징은 내강 pH 범위 6.0 내지 6.5에 대응하는(Weisz, 2003) Rab5 GTP 분해효소의 동원이다(Huotari, & Helenius, 2011). 완전 성숙 리소좀은 내강 pH 범위 4.0 내지 4.5로 LAMP2 양성이다(Casey et al., 2010). 엔도좀 성숙 마커를 이용하는 UPS 양성 엔도좀의 공동국소화의 정량화를 가능하게 하기 위해, Cy5-암호화된 UPS6 .2 및 UPS4 .4를 마이셀 상태에서 검출 가능한 형광을 허용하는 낮은 염료/중합체 비를 이용하여 개발하였다(Wang et al., 2014)(도 64a). 1,000㎍/㎖의 농도에서 15분 내에, UPS6 .2 및 UPS4 .4 양성 엔도좀의 60% 초과는 또한 Rab5 양성이었다(도 64a 및 도 64d). UPS4 .4 양성 엔도좀은 60분 내에 Rab5 음성/LAMP2 양성 성숙 상태로 추가로 전이되었다(도 64b 및 도 64e 내지 도 64f). 특히, UPS6 .2 양성 엔도좀은 또한 이 전이에서 정상적으로 수반되는 내강 산성화의 저해에도 불구하고 유사한 기간에 LAMP2 양성이 되었다(도 64b 및 도 64d). 그러나, UPS6 .2는 Rab5의 방출을 지연시켜, 60분에 이례적인 Rab5/LAMP2 양성 엔도좀의 일시적 축적을 초래하였다(도 64b 및 도 64f). 이들 관찰은 내강 pH 및 내강 pH-민감성 Rab5 방출 메커니즘의 존재와 독립적인 초기 엔도좀에 대해 LAMP2를 동원하는 조절 메커니즘의 존재를 나타낸다.
엔도솜/리소좀 생물학에 대한 내강 pH 클램핑의 결과를 시험하기 위해, 리소좀 생물발생과 관련되는 것으로 최근에 보고된 중요한 조절 시스템 - 즉, 라파마이신 복합체 1의 포유류 표적(mTORC1)을 통한 세포 성장의 영양소 의존적 활성화를 평가하였다. 포유류 세포에서, mTORC1는 내재화된 유리 아미노산에 반응한 엔도솜/리소좀막에 대해 국소화된다(Sancak et al., 2010). 더 나아가, 엔도솜/리소좀 막 상의 V-ATP 분해효소와 Rag GTP 분해효소 사이의 물리적 상호작용은 영양소 이용가능성에 반응하여 mTORC1 활성화에 필요하다(Zoncu et al ., 2011). 아미노산 유도 mTORC1 활성화를 평가하기 위해, mTORC1 경로 활성화의 두 정량적 리포터를 사용하였다: mTORC1 기질 p70S6 키나제(p70S6K)의 인산화/활성화 및 mTORC1 기질 TFEB의 핵/세포질 분포.
무 영양소 균형 염 용액(EBSS) 중에서 2시간 동안 HeLa 세포의 인큐베이션은 p70S6K과 그의 기질 S6 둘 다에 대해 활성화 부위 인산화의 감소된 축적에 의해 나타내는 바와 같이 mTORC1 활성을 저해하는데 충분하였다. 필수 아미노산의 첨가는 5분 내에 경로 활성화를 유도하기에 충분하였다(도 65a 및 도 66a 및 도 66b). 1,000㎍/㎖의 UPS4 .7, 또는 UPS4 .4에 의한 전처리는 유리 아미노산에 대한 mTORC1 반응에 대해 효과가 거의 없거나 전혀 없었다. 대조적으로, 1,000㎍/㎖ UPS6 .2, UPS5 .3 및 UPS5.0에 의한 전처리는 유리 아미노산에 대한 mTORC1 경로 반응을 지연시키고 상당히 억제하였다(도 65a 및 도 65b 및 도 66a 및 도 66b). mTORC1 경로 반응의 선택적 UPS 저해는 TFEB 핵/세포질 분포에 의해 반영되었다. mTORC1에 의한 이 전사 인자의 인산화는 핵 제외를 초래함으로써, 영양소가 가득한 조건에서 TFEB 전사 프로그램을 저해한다(Pena-Llopis et al., 2011, Settembre et al., 2012 및 Roczniak-Ferguson et al., 2012). Hela 세포에서, GFP-태그 TFEB의 안정한 발현에 의해, UPS6.2, UPS5 .3 및 UPS5 .0에 의한 전처리는 유리 아미노산의 첨가 시 세포질에 대한 TFEB의 재분포를 저해하였다. 대조적으로, UPS4 .7 및 UPS4 .4로 전처리된 세포에서, TFEB는 정상적으로 재분포가 진행되었다(도 65c 및 도 65d).
상기 데이터는 pH 5의 역치 미만의 엔도좀 산성화가 mTORC1의 유리 아미노산-유도 활성화에 필수적이라는 것을 시사한다. 유리 아미노산보다는 오히려 거대분자 영양소 공급원으로서 소 혈청 알부민(BSA)을 이용하여 유사한 실험을 수행하였다. 유리 아미노산과 유사하게, BSA 노출은 영양소 기아상태 후 mTORC1를 재활성화하는데 충분하였다(도 67a 내지 도 67d). 그러나, 유리 아미노산과 대조적으로, UPS4 .4는 BSA에 반응하여 mTORC1 활성화를 지연시켰다(도 67a 및 도 67d). 유리 아미노산에 정상적으로 반응된 UPS4 .4로 처리된 세포를 고려하면, 지연 반응은 리소좀에서 산 가수분해효소에 의해 BSA의 단백질 분해의 저해 결과에서 BSA에 대해 추정된다. 이와 일치되게, UPS4 .4의 존재 하에 카텝신 B 활성의 상당한 저해가 발견되었다(도 66c). 종합하면, 이들 관찰은 별도의 리소좀 pH 역치가 유리 아미노산 센싱에 대해 산 가수분해효소 활성에 필요하다는 것을 나타낸다(도 65e).
4. 리소좀
pH를 완충시키는 것에 의한 세포
대사산물
풀의 조절
리소좀은 세포내 거대분자 및 파편을 다시 이용하여 에너지 생성을 위해 또는 세포 환경의 영양 상태에 반응하여 새로운 세포 성분의 구성을 위해 배치된 대사 중간체를 생성하였다(Settembre et al., 2013). 리소좀에서 지질 및 당단백질을 포함하는 거대 분자의 비정상적 축적은 대사 장애와 관련된다. 리소좀 산성화의 고도로 선택적인 동요와 관련된 변경을 크게 평가하기 위해, 세포 내에서 작은 대사물질의 축적은 영양소 기아 대 영양소가 가득한 성장 조건 하에서 UPS4 .4와 함께 장입에 의해 정량화하였다. 0, 200 및 400㎍/㎖의 UPS4 .4에 대한 12시간 노출 후, HeLa 세포를 용해하고 나서, 액체 크로마토그래피-삼사중극 질량 분광계(LC/MS/MS)를 이용하여 세포내 대사물질을 정량화하였다. 68개의 대사산물을 3×106개 HeLa 세포로부터 정량화가능하며, 이는 리소좀 내 pH 저지 4.4에서 다수의 용량-의존적 및 영양소-의존적 결과를 나타낸다(도 68a). 영양소가 가득한 조건 하에서, UPS4 .4의 용량이 증가됨에 따라, 세포의 단백질 함량에 대해 정규화될 때 대부분의 대사산물의 상대적 존재비는 또한 증가되었다. 이는 대부분의 아미노산(도 68b 상부 패널)을 포함하는데, 이는 아미노산의 리소좀 유출에서 단백질 합성 및/또는 결함에 대해 그들을 사용하는데 필요한 동화작용 신호의 저해와 일치된다. 영양소 고갈 조건에서, UPS4 .4는 뉴클레오타이드 및 그들의 전구체의 상대적 존재비(예를 들어, 도 68a에서 하부 클러스터)를 향상시켰고, cAMP의 제2 전령을 대규모로 억제하였다. 라이신, 발린, 메티오닌 및 알기닌을 포함하는 다수의 필수 아미노산의 상실을 또한 관찰하였으며, 이는 알부민과 같은 거대 분자의 기아-유도 이화작용의 저해와 일치된다(도 68b 하부 패널). 이들 결과는 세포 소기관 산성화와 대사 풀 사이의 메커니즘적 연결을 시사하며, 영양소의 존재 또는 부재 하에 수많은 대사 경로의 항상성을 위해 적절한 리소좀 산도가 필요하다는 가설을 강화하였다(도 68c).
5. 엔도좀
/리소좀 pH 저지에 대한
NSCLC
세포의 효과
본 발명자들은 최근에 비소세포 폐암(NSCLC) 세포에서 선택적 대사 취약성을 기재함으로써, KRAS 암유전자 및 LKB1 종양 억제유전자에서의 동시 발생 돌연변이가 미토콘드리아 건강 상태의 유지를 위한 리소좀 이화작용에 대해 세포 중독을 초래한다는 것을 기재하였다(Kim et al., 2013). V-ATP 분해효소 활성의 유전적 또는 화학적 저해는 이 종양 발생 배경에서 세포예정사를 선택적으로 유도하기에 충분하였다. 이는 ATP 생성을 위한 TCA 순환 기질의 리소좀-의존적 공급 저해의 직접적 결과가 되는 것으로 제안되었다. UPS 라이브러리는 암세포에서 사이토졸 pH 및 mTORC1/AMPK 단백질 복합체에 대한 V-ATP 분해효소의 다면발현 기여와 관련된 교란인자(confounder)의 부재 하에서 이 가설을 직접적으로 시험할 기회를 얻었다(Zoncu et al., 2011 Zhang et al., 2014). 모델 시스템으로서, 동일한 환자로부터의 정상(HBEC30KT) 및 종양-유래(HCC4017) 세포주를 동질유전자 진행 시리즈와 함께 사용하였고, 이때 KRAS 및 LKB1 병변은 정상 세포 배경 내로 인공 도입하였다(도 69a)(Ramirez et al., 2004). UPS6 .2, UPS5 .3 및 UPS4 .4로 고용량에서 처리한 HCC4017와 HBEC30KT 사이의 세포 수 및 형태의 비교는 HCC4017에 대한 이들 UPS 나노입자의 고도로 선택적인 독성을 나타내었다(도 69b). LKB1의 저해와 함께 종양 발생 KRAS의 발현은 UPS-유도 세포예정사에 대한 기관지 상피세포의 민감성을 유도하는데 충분하였다(도 69c 내지 도 69e). 중요하게는, TCA 주기 기질(메틸 파이루베이트 및 α-케토글루타레이트)의 세포 침투성 유사체의 첨가 시 종양-유래 세포(도 69g)와 유전자 공학처리된 세포(도 69g) 둘 다에서 이 표현형을 구하였다. 따라서, 리소좀 기능에 대한 KRAS/LKB1 공동 돌연변이체 NSCLC 세포의 선택적 취약성은 세포외 거대분자의 이화작용의 중독으로부터 일어난다. 게다가, UPS4 .4 이상으로 UPS6.2에 의한 더 높은 세포독성은 이들 세포에서의 치사율에 추가로 기여하는 mTORC1 저해를 나타낸다.
6. 논의
내강 산성화는 상이한 단계에서 수용기 재이용, 세포 소기관 수송 및 단백질/지질 이화작용과 같은 독특한 세포 기능을 부여하는 포유류 세포에서 식균 작용의 세포 소기관의 성숙의 특징이다(Maxfield & McGraw, 2004 및 Yeung et al., 2006). 현재의 도구 또는 시약(예를 들어, 클로로퀸, NH4Cl, 바필로마이신 A1)은 세포 침투성이며, 광범위한 pH 활성을 차단한다. 결과적으로, 이들 제제를 이용하는 엔도좀/리소좀 기능에 대한 생물학적 질문은 혼합된, 비특이적 pH 효과뿐만 아니라 다른 산성 세포 소기관(예컨대, 골지체)의 동요에 기인하여 고통받을 수 있다. 대조적으로, 현재의 UPS 나노입자는 내포작용을 통해 배타적으로 세포를 유입하며; 더 나아가, 그들은 식균 작용 경로를 따라 작업자-사전결정 역치에서 내강 pH의 강한 그리고 미세-규모 완충을 가능하게 한다. 앞서 보고한 초-pH 민감 형광 반응(Zhou et al., 2011 및 Zhou et al., 2012)과 함께 예리한 pH-특이적 완충 효과는, 소수성 마이셀화(상 전이)가 3차 아민의 협동 양성자화를 야기하는 pH 전이를 극적으로 선명하게 한 자기-조립 시스템에서 독특한 나노규모 특성이 있다. 그 결과, UPS 나노입자는 0.3 pH 단위 내에서 고해상도 완충 효과를 수득하였다. UPS 플랫폼의 완충 pH 범위(겉보기 pKa 주위에 집중됨)는 전자 당김/공여 치환체에 의해 대부분 제어되는 소분자 pH 완충제/센서와 달리 PR 세그먼트의 소수성에 의해 미세동조될 수 있다(Urano, et al., 2008). 독특한 pH-특이적, 조정 가능한 "양성자 스펀지" 효과는 다른 분해 다염기 완충제와 별개이다(예를 들어, 폴리에틸렌이민, 도 57c). 동시 이미징 및 완충 능력을 추가로 달성하기 위해, 헤테로FRET 전략을 이용하여 항상-온/오프-온 조성을 구성하였다. 이 나노입자 설계는 HeLa 세포에서 식균 작용의 세포 소기관(150 내지 210개 양성자/초)의 산성화 속도의 제1 측정을 허용하였는데, 이는 문헌 데이터에 기반한 추정(240 내지 310)과 동일한 규모이다.
UPS 라이브러리의 상세한 평가는 엔도좀 생물학 및 바이오-나노 상호작용의 이해에 기여하는, 식균 작용의 세포 소기관의 내강 pH의 동요가 다중 세포 생리 과정에 영향을 미치는 방법을 설명한다. 더 구체적으로, 라이브러리의 "동요 및 보고" 특징은 엔도좀 성숙의 시간-분해 정량화 및 엔도좀 외피 단백질 교환에 대한 내강 pH의 포함되지 않은 앞서 인정되지 않은 결과를 허용한다. 특히, "성숙" 리소좀 마커인 LAMP2의 동원은 내강 산성화와 독립적으로 일어나는 것으로 발견되었다. 반면에, 초기 엔도좀 마커 Rab5의 방출은 내강 알칼리화에 의해 지연되어, Rab5/LAMP2 양성 엔도좀의 드노보 축적을 초래한다. 이는 엔도좀/리소좀 생물발생을 지배하는 현재 기재되지 않았지만, 연구 가능한 pH-민감성 및 pH-비민감성 메커니즘을 나타낸다. UPS 완충 능력을 미세동조하는 능력은 또한 mTORC1 경로의 알부민 의존적 활성화에 대해 유리 아미노산에 필요한 별도의 pH 역치의 차별을 허용하였다. 이론에 의해 구속되는 일 없이, pH 5.0 이하로 산성화는 V-ATP 분해효소 단백질 복합체와의 "내부-외부" 통신을 위해 또는 아미노산 센싱 동안 V-ATP 분해효소에서 입체배좌 변화의 유도를 위해 유리 아미노산을 방출할 것이 필요한 것으로 믿어진다(Zoncu et al., 2011). 유사하게, pH 4.4 이하의 산성화는 mTORC1의 알부민 의존적 활성화에서 사용되는데, 가수분해효소 활성화 및 후속적 단백질 이화작용에 대한 필요에 기인할 가능성이 있다. UPS 합성의 확장성은 세포외 거대분자의 리소좀 소모의 저해 시 세포 대사물질 환경의 광범위 스펙트럼 정량화를 가능하게 한다. 식균 작용의 세포 소기관 내의 UPS의 배타적 흡수는 성장 조절 신호전달 경로 및 세포 대사에서 엔도좀/리소좀 pH의 참여를 구체적으로 평가하기 위한 기회를 얻었다.
7. 방법
1.
화학물질
Cy5-NHS, 보디피-NHS 및 Cy3.5-NHS 에스터는 루미프로브 코포레이션(Lumiprobe Corp.)(미국 플로리다주에 소재)으로부터 구입하였다. 단량체 2-(다이에틸아미노) 에틸 메타크릴레이트(DEA-MA) 및 2-아미노에틸 메타크릴레이트(AMA)를 폴리사이언스사(Polyscience Company)로부터 구입하였다. 단량체 2-(다이부틸아미노) 에틸 메타크릴레이트(DBA-MA)(Zhou et al., 2011), 2-(다이프로필아미노) 에틸 메타크릴레이트(DPA-MA) 및 2-(다이펜틸아미노) 에틸 메타크릴레이트(D5a-MA) (Li et al., 2014)뿐만 아니라 PEO 거대개시제(MeO-PEO114-Br)를 본 발명자들의 이전의 작업에서 기재한 방법에 따라 제조하였다1. N,N,N',N'',N'''-펜타메틸다이에틸렌트라이아민(PMDETA)을 시그마 알드리치사로부터 구입하였다. 아미콘 울트라-15(Amicon ultra-15) 원심분리 필터 관(MWCO = 100 K)을 밀리포어(Millipore)(매사추세츠주에 소재)로부터 얻었다. 다른 시약 및 유기 용매는 시그마 알드리치 또는 피셔 사이언티픽 인코포레이티드로부터의 분석 등급이었다.
2.
세포, 배양 배지 및 생물학적 시약
NSCLC 세포주 HCC4017 및 그의 매칭된 정상 기관지 상피 세포주 HBEC30KT를 동일한 환자로부터 연구하였다. 이들 세포의 발생 및 대응하는 HBEC30KT 종양 발생 진행 시리즈는 앞서 보고한 바와 같았다(Ramirez, et al., 2004). HCC4017 및 모든 HBEC30-유래 세포주를 2% 소 태아 혈청(FBS, 아틀란타 바이올로지컬스(Atlanta Biologicals) 및 1% 항생제(GIBCO)와 함께 ACL4 배지(0.02㎎/㎖ 인슐린, 0.01㎎/㎖ 트랜스페린, 25nM 아셀렌산나트륨, 50 nM 하이드로코르티손, 10mM HEPES, 1 ng/㎖ EGF, 0.01mM 에탄올아민, 0.01mM O-포스포릴에탄올아민, 0.1 nM 트라이요오도티로닌, 2㎎/㎖ BSA, 0.5mM 피루브산나트륨으로 보충한 RPMI 1640) 중에서 배양시켰다. HeLa 및 GFP-TFEB HeLa 세포를 10% FBS 및 1% 항생제(인비트로젠(Invitrogen))와 함께 DMEM(인비트로젠) 중에서 배양시켰다. 얼스 균형 염 용액(EBSS, 10×, 시그마(Sigma))을 2.2g/L 중탄산나트륨(시그마)로 보충한 밀리큐 워터로 1x 희석시켰다. 항체를 셀 시그널링(Cell Signaling)(S6K-pT389, S6K, S6-리보솜-단백질-pS235/236, S6 리보솜 단백질, Rab5 및 Rab7) 및 압캠(Abcam)(LAMP2)으로부터 유래되었다. 다른 생물학적 제제는 호크스트 33342(인비트로젠), 리소센서 옐로/블루 DND 160(인비트로젠), 매직 레드(Magic Red)(상표명) 카텝신 B 분석 키트(이뮤노케미스트리 테크놀로지(Immunochemistry Technology)), 바필로마이신 A1(시그마), 클로로퀸(시그마) 및 BCA 단백질 분석 키트(써모(Thermo))를 포함한다.
3.
염료-
컨쥬게이팅된
PEO
-
b
-(P(R
1
-
r
-R
2
)) 블록 공중합체의 합성
아미노에틸 메타크릴레이트(AMA)는 염료의 컨쥬게이션을 위해 사용하였다. 3개의 1차 아미노기를 AMA 단량체 대 개시제의 공급비(몰 비 = 3)를 제어함으로써 각각의 중합체 쇄에 도입하였다. 합성 후에, PEO-b-(PR-r-AMA)(10㎎)를 2mL DMF 중에 용해시켰다. 이어서, 염료-NHS 에스터(염료-NHS에 대해 1.5 당량)를 첨가하였다. 밤새 반응시킨 후에, 공중합체를 겔 침투 크로마토그래피(PLgel Prep 10㎛ 103Å, 배리언에 의한 300×25mm 칼럼, 용리액으로서 5㎖/분에서 THF)에 의해 정제하여 유리 염료 분자를 제거하였다. 얻어진 공중합체를 동결건조시키고 나서, -20℃에서 저장을 위해 유지하였다. 항상-온/오프-온 UPS 나노입자에 대한 블록 공중합체의 합성에 대한 유일한 차이는 3개의 AMA 기가 보디피 컨쥬게이션의 중합체 쇄에 도입된 반면, 하나의 AMA 기가 Cy3.5 컨쥬게이션을 위해 도입되었다는 것이다.
4.
UPS 나노입자
마이셀의
제조 및 특성규명
전형적인 절차에서, 10㎎ UPS 중합체를 500㎕ THF(염료 컨쥬게이션 없음) 또는 메탄올(염료-컨쥬게이션 있음) 중에 용해시켰다. 항상-on/오프-온 UPS 나노입자에 대해, 보디피-컨쥬게이팅된 중합체 및 Cy3.5-컨쥬게이팅된 중합체를 표시된 중량비로 혼합하여(도 112) 보디피 채널에서 높은 온/오프 비 및 Cy3.5 채널에서 안정한 항상-온 신호를 수득하는 최상의 조합을 결정하였다. 용액을 10㎖ 밀리큐 워터에 한 방울씩 첨가하였다. 미세-한외여과 시스템을 통한 4 내지 5회 여과(<100 kDa, 아미콘 울트라 필터(Amicon Ultra filter) 단위, 밀리포어)를 사용하여 유기 용매를 제거하였다. UPS 나노프로브의 수용액을 0.22㎛ 필터 단위(Millex-GP 주사기 필터 단위, 밀리포어)로 멸균시켰다. 투과 전자 현미경(TEM, JEOL 1200 EX 모델, 일본 도쿄에 소재)을 사용하여 마이셀 크기 및 형태를 시험하였다. 동적 광산란(DLS, 말번 나노-ZS 모델, He-Ne 레이저, λ= 633㎚)을 사용하여 100㎍/㎖ 마이셀 PBS 용액의 유체 역학적 직경(Dh)을 결정하였다. 제시된 데이터를 5개의 독립적 측정으로부터 평균을 내었다. 접이식 모세관 셀(독일 헤렌베어그에 소재한 말번 인스트루먼츠(Malvern Instruments))을 이용하여 제타-퍼텐셜을 측정하였다. 제시 데이터를 3개의 독립적 측정으로부터 평균을 내었다.
5.
UPS
나노프로브의
세포 흡수의 정량화
HeLa 세포(웰 당 1×106개)를 6-웰 조직 배양 접시에서 파종하였다. 12 내지 16시간 후에, 세포를 무혈청 DMEM 중에서 5분 동안 UPS6 .2-TMR 및/또는 UPS5 .3-TMR에 노출시키고, 이어서, PBS로 3회 세척하였다. DMEM + 10% FBS 중에서 추가 2시간 인큐베이션 후에, 메탄올을 이용하여 세포로부터 UPS 나노프로브를 추출하였다. UPS 나노프로브 마이셀은 메탄올 중에서 유니머로 해리된다. 히타치 형광계(F-7500 모델)를 사용하여 570㎚에서 UPS-TMR 유니머 용액의 RFU를 결정하였다. 내재화된 UPS 나노프로브의 용량을 UPS-TMR 용액의 RFU 및 표준 곡선으로부터 계산하였다.
6.
엔도솜
/리소좀 pH의 측정
HeLa 세포를 4- 또는 8-웰 눈크(Nunc)(상표명) 랩-텍(Lab-Tek)(상표명) II 채임버드 커버글라스(Chambered Coverglass)(써모 사이언티픽(Thermo Scientific))에서 플레이팅하고 나서, 48시간 동안 성장시켰다. 이어서, 세포를 37℃에서 5분 동안 무혈청 배지에서 25μM 리소센서 옐로/블루(LysoSensor Yellow/Blue) DND-160 및 1,000㎍/㎖ UPS 나노프로브로 장입하였다. 세포를 2회 세척하고 나서, 즉시 이미징하였다. 디지털 단색 쿨스냅(Coolsnap) HQ2 카메라(로퍼 사이언티픽(Roper Scientific), 아리조나주 투손에 소재)를 구비한 형광 현미경(델타비전(Deltavision), 어플라이드 프레시전(Applied Precision))을 이용하여 이미징을 수행하였다. SoftWoRx v3.4.5(유니버셜 이미징(Universal 이미징), 펜실베니아 다우닝타운에 소재)를 이용하여 형광 이미지를 수집하였다. 360/460㎚ 및 360/520㎚의 여기/방출 파장에서 데이터를 기록하였다. DAPI(360㎚)에 대한 단일 통과대역 여기 필터는 40㎚이고, DAPI(460㎚) 및 FITC(520㎚)에 대한 방출 필터의 통과대역은 각각 50㎚ 및 38㎚였다. 이미지J 소프트웨어를 이용하여 저장된 단일 파장 이미지의 이미지 분석에 의해 세포 형광 비를 결정하였다. 각각의 세포에 대해, 관심 대상의 영역은 UPS 나노프로브와 라이소센서(LysoSensor) 둘 다로부터 형광 신호를 방출한 사이토졸에서의 반점으로서 정의하였다. 형광 강도비는 R = (F1-B1)/(F2-B2)로서 각각의 세포내 반점에 대해 계산하였고, 여기서 F1 및 F2는 각각 360/520 및 360/460에서의 형광 강도이며, B1 및 B2는 사이토졸 중의 반점 근처에 있는 동일한 이미지 상의 영역으로부터 결정된 대응되는 배경 값이다. R과 pH 사이의 관계를 교정하기 위해, 본 명세서는 문헌[Diwu et al. (1999)]에 의해 확립된 변형 프로토콜을 사용하였다. 세포는 라이소센서를 이용하여 장입하였고, 이어서, 10μM 모넨신 및 10μM 니게리신을 이용하여 침투시켰다. 이들 세포를 pH 4.0 내지 7.4에서 변하는 5mM NaCl, 115mM KCl, 1.2mM MgSO4 및 25mM MES(MES 완충제)로 이루어진 평행상태 완충제로 30분 동안 처리하였다. 이미징까지 세포를 완충제 중에서 유지하였다.
7.
공동
국소화
분석
면역형광 분석으로부터의 이미지를 회전 원판 공초점 현미경(앤도르(Andor))를 이용함으로써 촬영하였다. 공동 국소화 분석에서 데콘볼루션 후에 Z-적층 이미지를 사용하였다. 이마리스 7.7(Imaris 7.7)(비트 판(Bitplane))의 콜록(Coloc) 모듈을 이용하여 데이터를 분석하였다. 역치 맨더스 계수(Mander's coefficient)를 총 신호에 걸친 공동국소화된 신호 비율의 지표로서 사용하였다(Manders et al., 1993 및 Bolte & Cordelieres, 2006).
8.
대사체학
분석
HeLa 세포를 80% 합류까지 100 mm 접시에서 성장시키고, 영양소가 가득한 그룹과 영양소 고갈 그룹으로 분리하였다. 영양소 고갈 그룹에서 세포에 대한 배지를 EBSS로 변경한 후에, 식염수로 2회 세척하였다. 이어서, 200 또는 400㎍/㎖ UPS4.4(최대 농도) 또는 동일한 용적의 물(대조군으로서, 각각의 조건은 6회 복제를 포함함)을 그룹 둘 다에 첨가하고 나서, 밤새 남겨두었다. 이 후에, 세포를 빙냉 식염수로 2회 세척하고 나서, 이어서, 500㎕의 찬 메탄올/물(50/50, v/v)을 더하였다. 세포를 에펜도르프 관에 옮기고 나서, 3회 냉동-해동 주기를 실시하였다. 격렬한 교반 후에, 16,000 × g 및 15분 동안 4℃에서 원심분리에 의해 펠렛화하였다. 펠렛을 단백질 정량화(BCA 단백질 분석 키트, 써모)를 위해 사용하였다. 상청액을 새로운 관에 옮기고 나서, 스피드백(SpeedVac) 농축기(뉴욕주, 홀브룩에 소재한 써모 사반트(Thermo Savant))를 이용하여 증발건조시켰다. 대사산물을 분석 등급 물 중의 0.03% 폼산 100㎕ 중에서 재구성하고 나서, 교반 혼합시키고, 원심분리시켜 파편을 제거하였다. 이후에, 상청액을 대사체학 연구를 위해 HPLC 바이알에 옮겼다.
액체 크로마토그래피-질량 분광학(LC/MS/MS) 접근을 이용하여 표적화된 대사산물 프로파일링을 수행하였다. 넥세라 울트라 고성능 액체 크로마토그래프(UHPLC) 시스템(일본 교토에 소재한 시마즈 코포레이션)을 이용하여 페네메넥스 시너지 폴라(Phenomenex Synergi Polar)-RP HPLC 칼럼(150 × 2 mm, 4㎛, 80 Å) 상에서 분리를 달성하였다. 사용한 이동상은 수 중의 0.03% 폼산(A) 및 아세토나이트릴 중의 0.03% 폼산(B)이었다. 구배 프로그램은 다음과 같다: 0 내지 3분, 100% A; 3 내지 15분, 100% 내지 0% A; 15 내지 21분, 0% A; 21 내지 21.1분, 0% 내지 100% A; 21.1 내지 30분, 100% A. 칼럼을 35℃에서 유지하였고, 샘플을 4℃에서 오토샘플러에서 유지하였다. 유속은 0.5㎖/분이었고, 주입 용적은 10㎕였다. 질량 분광기는 다중 반응 모니터링(MRM) 방식으로 전기분무 이온화(ESI) 공급원을 지니는 AB QTRAP 5500(어플라이드 바이오시스템즈(Applied Biosystems) SCIEX, 캘리포니아주 포스터 시티에 소재)였다. 샘플 분석은 양성/음성 스위칭 방식으로 수행하였다. 샘플 분석 전 주사기 펌프를 이용하여 기준 표준의 직접 주입에 의해 각각의 대사산물에 대해 디클러스터링 퍼텐셜(DP) 및 충돌 에너지(CE)을 최적화하였다. MRM MS/MS 검출기 조건은 다음과 같이 설정하였다: 커튼 가스 30 psi; 이온 분무 전압 5000 V(양성) 및 -1500 V(음성); 온도 650℃; 이온 공급원 가스 1 50 psi; 이온 공급원 가스 2 50 psi; 인터페이스 히터 온; 유입 퍼텐셜 10 V. 전체적으로, 69종의 수용성 내인성 대사산물을 무 세포 샘플에 의한 기준 설정 초과로 확신을 가지고 검출하였다. 각각의 전이를 위한 드웰(dwell) 시간은 3 msec로 설정하였다. 세포 샘플을 무작위 순서로 분석하였고, 애널리스트(Analyst) 1.6.1 소프트웨어(캘리포니아주 포스터시티에 소재한 어플라이드 바이오시스템즈 SCIEX(Applied Biosystems SCIEX))를 이용하여 MRM 데이터를 획득하였다.
멀티퀀트(MultiQuant) 소프트웨어 버전 2.1(캘리포니아주 포스터 시티에 소재한 어플라이드 바이오시스템즈 SCIEX)를 이용하여 크로마토그램 검토 및 피크 면적 통합을 수행하였다. 세포의 수준은 유사하고, 각각의 샘플은 동일하게 그리고 무작위로 처리되었지만, 각각의 검출 대사산물에 대한 피크 면적을 기기 분석을 통핸 샘플 조절로부터 도입된 임의의 변화를 수정하기 위해 해당 샘플의 단백질 함량에 대해 정규화시켰다. 다변수 및 단변수 통계 데이터 분석을 위해 변수로서 정규화된 면적 값을 사용하였다. 공유된 MRM 전이를 지니는 크로마토그래피 공용리 대사산물을 그룹화된 형식, 즉, 류신/아이소류신으로 나타내었다. 정규화된 데이터에 대한 모든 다변수 분석 및 모델링을 SIMCA-P(버전 13.0.1, 스웨덴 우메야에 소재한 우메트릭스(Umetrics))를 이용하여 수행하였다. 완전-결합 방법과 함께 무감독 계층적 클러스터링함으로써 전처리된 데이터 세트를 평가하였다.
실시예
8: PET 및 형광
이미징을
이용한 이중
이미징
방법
1.
형광 리포터를 지니는 초-pH 민감(UPS)
나노프로브
최근에 ICG-기능화된 UPS 나노프로브는 6.9에서의 pH 전이에 의해 본 발명자들에 의해 개발되었다. PEPA 세그먼트(40 내지 120, 도 70a)에서 반복 단위를 달리하여 원자-전달 라디칼 중합 방법을 이용하여 PEG-b-PEPA를 합성하였다. 이어서, FDA 승인 근적외선 염료인 ICG를 상이한 염료 밀도(중합체 쇄 당 1, 3 및 6개 ICG)를 지니는 PEPA 세그먼트에 컨쥬게이션시켰다. 정상 조직의 혈액 pH(7.4) 또는 간질성 pH(7.2)에서, I-UPS6 .9 나노프로브는 호모FRET-유도 형광 소광의 결과로서 침묵으로 남아있었다(도 70d)(Zhou et al., 2012 및 Zhou et al., 2011). 이들 pH에서, UPS6 .9는 동적 광산란 분석에 의해 25.3±1.5㎚의 직경을 지니는 자기 조립 마이셀로서 그리고 TEM에 의해 구체 형태로(데이터 미제시) 제공하였다. 전이 pH, 반응의 급격함, 형광 활성화 비 및 나노프로브의 직경에 대한 중합체 쇄 길이 및 ICG 밀도의 효과를 조사하였다. 도 70b는 PEPA 세그먼트 길이를 달리하는 것에 대한 대표적인 연구를 나타낸다. 데이터는 40로부터 120으로 PEPA의 반복 단위를 증가시키는 것이 급격한 pH 전이(예를 들어, ΔpH온 / 오프는 각각 0.30로부터 0.13으로 감소됨) 및 약간 더 낮은 pH 전이(각각 6.96 내지 6.91)를 초래하였다는 것을 나타낸다. 입자 크기는 또한 PC7A 길이(15 내지 30㎚)에 따라 증가되었다. 중합체 쇄 당 3개의 ICG는 온 상태에서 높은 형광 활성화 비 및 밝은 형광 강도와 함께 가장 최적의 염료 밀도를 허용하였다. 이들 데이터에 기반하여, 쇄 당 PC7A 및 3 ICG 염료의 100개 반복 단위를 지니는 UPS 조성물을 선택하였다. 얻어진 UPS 나노프로브는 종양 침투에 대해 급격한 pH 전이(ΔpH온 / 오프 = 0.15), 높은 형광 활성화 비(온 상태와 오프 상태 사이에 100배 초과)(도 70c), 및 최적의 입자 크기(25㎚)를 가진다. 이 전략을 이용하여, 다양한 암 유형 및 기관 부위를 지니는 동물 종양의 넓은 세트에서 거대 종양-대-정상 조직 비를 지니는 광범위 종양 특이성을 입증하였다(Wang et al., 2014). 종양 특이적 이미징은 종양에서 1㎣만큼 작게 달성되었다. 추가적으로, I-UPS6 .9 나노프로브는 48시간에 걸쳐 혈청 함유(20% FBS) 배지에서 안정하고, 급격한 pH 반응 및 높은 형광 활성화 비를 유지한다(도 70b 내지 도 70d).
2.
PET
이미징을
위한 UPS
나노프로브에
대한 방사성
트레이서로서
64
Cu의
도입
다른 비표준 PET 핵종에 비해, 64Cu(t1/2=12.7 h; β+ 0.653 MeV, 17.4%)는 낮은 양전자 범위, 상업적 입수가능성 및 합리적으로 긴 붕괴 반감기에 기인하여 나노입자, 항체 및 펩타이드에 기반하여 다수의 이미징 제제에서 널리 사용되었다(Rossin et al., 2008 및 Haubner & Wester, 2004). 금속과 킬레이터 사이의 안정성은 방사성 의약품 양상 설계의 결과에 대해 중요하다. 다수의 킬레이터는 64Cu에 대한 킬레이팅 리간드, 예컨대 1,4,7,10-테트라아자사이클로도데칸-테트라아세트산(DOTA) 및 1,4,7-트라이아자사이클로노난-트라이아세트산(NOTA) 등으로서 개발하였다(Wadas et al., 2007). 그 중에서, CB-TE2A(도 71)는 선(Sun)과 동료에 의해 64Cu와의 가장 안정한 복합체 중 하나를 형성하는 것이 보고되었고(Sun et al., 2002), Cu(II)-CB-TE2A 복합체는 다른 테트라대환식 복합체보다 환원적 금속 상실에 대해 더 저항성이다(Woodin et al., 2005). CB-TE2A는 UPS에 대한 64Cu의 도입을 위한 킬레이터로서 사용할 것이다. NHS 에스터 기능화된 CB-TE2A를 논문에 보고된 절차에 따라 제조할 것이다(Liu et al., Angew Chem Int Ed Engl., 48:7346-7349, 2009). 나노프로브 측면 상에서, 1차 아미노기는 중합체 쇄의 PEG 말단에 도입될 것이다. NH2-PEG-PC7A는 도 71에 기재된 경로에 의해 합성될 것이다. 상업적으로 입수가능한 Fmoc-PEG-OH는 ATRP에 대한 거대개시제를 제조하기 위해 사용할 것이다. ATRP 후에 중합체의 탈보호 후, 1차 아미노기는 재생될 수 있고, NHS 에스터 기능화된 CB-TE2A에 대한 컨쥬게이션을 위해 사용할 수 있다. 혼성 마이셀은 초음파처리 및 용매 증발 방법에 의해 CB-TE2A-PEG-PC7A와 PEG-PC7A-ICG의 혼합물로부터 형성될 것이다. 혼성 마이셀은 완충 용액 중에서 64CuCl2 및 마이셀을 인큐베이션시킴으로써 64Cu로 표지한 후에 한외여과할 것이다.
3.
이중 양상 UPS 및 PET의 이미징 효능과
FDG
단독의 비교.
정위 HN5 두경부 종양-보유 마우스에서 초기 결과는 3마리 마우스 중 2마리에서 견갑골 사이 BAT로부터의 강한 위양성 신호를 나타낸 반면, I-UPS 형광은 높은 특이성을 지니는 종양을 묘사하였다(도 72). 임상적으로, 두경부암 환자에서 BAT 또는 긴장된 목 근육은 상승된 글루코스 소모에 기인하여 PET 이미징에서의 비정상으로서 오역을 야기할 수 있다. UPS 나노프로브에 64Cu를 도입함으로써, PET 핵종의 분포는 종양 산성혈증을 표적화함으로써 이동될 것으로 예상되고, 따라서 FDG를 이용하여 PET로부터 퍼텐셜 위양성을 제거한다.
이중 양상 UPS가 PET 스캔에 의해 EDG에 걸쳐 더 정확한 종양 검출을 제공할 수 있는지의 여부를 비교하기 위해, 활성화된 BAT를 모델로서 사용하여 이미징 효능을 평가하였다. 마우스에서 정위 두경부 종양 모델이 확립된 후에, 종양 보유 마우스를 PET 이미징 전에 냉장 처리하여 BAT를 활성화시킬 것이다(Wang et al., 2012). 특이적이 되도록, 종양 보유 마우스는 12시간 동안 절식시킬 것이고, PET 이미징 전 4시간 동안 4℃ 냉장실 내의 사전 냉장 우리에 넣을 것이다. 마우스는 3개 그룹으로 균등하게 분할될 것이며, 꼬리 정맥을 통해 다음의 제제를 각각 주사할 것이다: 1) FDG; 2) 이중 양상 UPS; 3) 프로프라놀롤 및 FDG. 프로프라놀롤은 BAT 활성화를 억제하고 음성 대조군으로서 작용하는 β 아드레날린 수용체 저해제이다. PET 이미지는 획득되고, 3D 차 서브세트 예상 최대화(OSEM3D/MAP) 알고리즘을 이용하여 단일 프레임으로 재구성될 것이다. 관심 영역(ROI)은 조직을 포함하는 모든 면에서 종양/BAT를 포함하도록 수동으로 그릴 것이다. 표적 활성은 그램 당 주사 용량의 백분율(%ID/g)로서 계산할 것이다. 표준화된 흡수 값(Standardized uptake value: SUV)을 또한 종양, 견갑골 사이 BAT뿐만 아니라 퍼텐셜 위양성의 평가를 위한 주변 정상 조직에 대해 계산할 것이다. 조직학은 암 조직 또는 BAT의 존재의 결정을 위한 금본위제로서 작용할 것이다. FDG 그룹 또는 UPS 그룹 중 하나로부터의 두경부 영역에서 양성 신호를 나타내는 모든 조직은 파라핀 포매 및 절편화를 위해 수집할 것이다. H&E 염색은 조직학 확인을 위해 이들 슬라이드로부터 제조하여 각각의 그룹으로부터의 결과와 상호관련 지을 것이다. 각각의 표본을 FDG +/-(PET로부터), 64Cu-UPS +/- (PET로부터), 암세포 +/-(조직학으로부터) 및 BAT +/-(조직학으로부터)로서 부여할 것이다. 이중 양상 UPS가 검출 정확성을 유의하게 개선시키는지의 여부를 판단하기 위해 통계학적 분석을 사용하였다.
실시예
9: UPS
나노프로브를
이용하는 암 수술 및 종양 제거 과정
1.
UPS
나노프로브를
이용하는 다중 종양 유형의 광범위 암-특이적
이미징
I-UPS 설계의 한 가지 이점은 개복술(노바덱에 의한 SPY 엘리트(등록상표)), 현미경 수술(레이카, 칼 자이스), 복강경 검사(올림푸스사의 칼 스토츠) 및 로봇 수술(다 빈치(등록상표))에서 ICG-기반 이미징을 위해 이미 승인된 기존의 작업실 카메라 시스템과의 접합성인데, 이는 임상 번역을 위한 장벽을 낮춘다. SPY 카메라를 이용하면, 두경부(SCID 마우스에서 인간 HN5, FaDu 및 HCC4034 정위 이종이식; HCC4034), 유방(SCID 마우스에서 인간 MDA-MB-231 및 BALB/C 마우스에서 뮤린 4T1), 신장(SCID 마우스에서 인간 정위 XP296 종양), 뇌(인간 교모세포종 U87 이종이식), 및 GI관으로부터의 복막 전이(SCID 마우스에서 인간 결장직장 HCT-116 종양, 도 73)를 포함하는 다중 암유형에서 종양 산성혈증을 이미징하는 I-UPS6 .9 나노프로브의 실행가능성을 연구하였다. 결과는 이 광범위 종양 상황에서 높은 종양/정상 조직 콘트라스트(T/N 비 >20)를 나타낸다. 특히, I-UPS 신호는 두경부(예를 들어, 갈색 지방)뿐만 아니라 뇌 유조직(UPS 흡수를 방지하는 혈액-뇌-장벽에 기인할 가능성이 있음(Hawkins & Davis, 2005 및 Kreuter, 2001))에서 전형적인 위양성 조직을 결여하였다. 이들 결과는 암 표적으로서 세포외 산성 pH의 강함 그리고 I-UPS 나노프로브에 의해 광범위하게 적용 가능한 그리고 암-특이적 검출을 입증한다.
실시예
10: 이중 형광 리포터 UPS
나노프로브
1.
이중 형광 리포터를 지니는 UPS
나노프로브
종양 산성혈증 이미징에서 나노프로브 용량 및 pH 활성화를 독립적으로 평가하기 위해, 이중 형광 리포터를 지니는 UPS 나노프로브를 구성할 것이다: pH, 및 pH-활성화 가능한 리포터와 상관없이 나노입자 분포를 추적하기 위한 "항상 ON" 리포터. PEO의 말단 단부(예컨대 UPS 나노프로브의 표면)에 대해 염료(예를 들어, Cy5.5)를 컨쥬세이팅하는 초기 시도는 항상 온 신호에서 이어지지만, 그러나, 얻어진 나노입자는 혈청 단백질에 대한 염료 결합 때문에 불안정하였다. 이 제한을 극복하기 위해, 마이셀의 코어에서 도입된 형광단 쌍을 이용하는 헤테로FRET 설계를 사용할 것이다. 예를 들어, FRET 쌍(예를 들어, 공여체 및 수용체로서 각각 보디피 및 Cy3.5)을 UPS6 .9 공중합체의 PR 세그먼트에 별도로 컨쥬게이션시켰다. 동일한 마이셀 코어 내에서 두 염료-컨쥬게이팅된 공중합체(공여체/수용체의 최적의 몰 비 = 2:1)의 혼합은 더 낮은 pH에서 마이셀 해리 후 유니머 상태에서의 형광 회복을 제외하고, 마이셀 상태(pH > pKa)에서 공여체 염료((예를 들어, 보디피, λex/λem=493/503㎚)의 헤테로FRET-유도 형광 소광을 허용하였다(도 76a 내지 도 76c). "항상 온" 신호를 생성하기 위해, 마이셀에서 Cy3.5-컨쥬게이팅된 공중합체의 중량 분율을 낮게 유지하여(예를 들어, 40%) 마이셀 상태에서 수용체 염료(Cy3.5, λex/λem=591/604㎚)에 대한 호모FRET-유도 형광 소광을 회피하였다(Zhou et al., 2011; 2012). 얻어진 UPS 나노입자는 넓은 pH 범위에 걸쳐 Cy3.5 채널에서 일정한 형광 강도를 나타내었지만, 보디피 신호의 6.9에서 초-pH 민감 활성화를 달성하였다(도 75). 형광단은 둘 다 마이셀 코어 내에 포함되기 때문에, 얻어진 UPS 나노입자는 안정하고, 단백질 파울링으로부터 유리되었다.
현재의 연구에서, 헤테로FRET 설계 및 보디피/Cy3.5 쌍은 UPS 나노프로브에서 항상-온/오프-온 이중 리포터를 도입하는데 사용될 것이다. 마이셀 형성 후에, 나노프로브는 처음에 유체 역학적 직경(Dh) 및 제타-퍼텐셜에 대해 동적 광산란(DLS, 말번 제타시저 나노-ZS 모델)에 의해 특성규명할 것이다. UPS 나노프로브의 크기 및 형태를 투과 전자 현미경(TEM, JEOL 1200 EX 모델)에 의해 추가로 분석할 것이고, DLS 결과와 상호 관련지었다. pH에 반응한 형광 활성화 연구를 위해, 마이셀을 0.1㎎/㎖의 농도로 상이한 pH 완충제 중에서 제조할 것이다(pH를 pH 증분 0.1로 6.0로부터 7.4로 제조할 것이다). 나노프로브는 히타치 형광계(F-7500 모델) 상에서 형광단의 대응하는 파장에서 여기될 것이고, 방출 스펙트럼을 수집할 것이다. 방출 강도는 온/오프 비를 정향화하는데 사용할 것이다. 피렌 방법을 이용하여 임계 마이셀 농도(CMC)를 측정할 것이다(Kalyanasundaram & Thomas, 1977 및 Winnik, 1993). 새로운 마우스 혈청에서 이중 리포터 UPS 나노프로브의 안정성을 또한 앞서 기재한 바와 같이 시험할 것이다(Wang et al., 2014).
2.
6.5로부터 7.1의 pH 전이를 지니는 UPS
나노프로브
.
상이한 정도의 산성혈증을 지니는 종양 pHe를 표적화하기 위해 6.5로부터 7.1까지 미세하게 조정 가능한 일련의 UPS 나노프로브를 합성할 것이다. 작업자 사전결정 pH 전이(4.0 내지 7.4) 및 급격한 pH 반응에 의한 UPS 라이브러리의 구성을 위한 무작위 공중합체 전략을 본 명세서에 그리고 (Ma et al., 2014)에 기록하였다. 3가지 설계 기준을 충족시켜야 한다: (1) PEO-b-PR 공중합체에서, 단일 pH 전이를 보장하기 위해 무작위 PR 블록(P(R1-r-R2), 여기서 R1 및 R2는 3차 아민 상에서 상이한 알킬쇄를 지니는 단량체임)이 사용되어야 한다. 차단된 PR 세그먼트(P(R1-b-R2))는 R1 및 R2 블록의 상이한 이온화 거동을 반영하는 두 pH 전이를 초래하였고; (2) R1 및 R2에서 밀접하게 매칭된 소수성을 지니는 단량체가 급격한 pH 반응을 달성하는데 필수적이다. 하나의 비제한적 예에서, 인접한 알킬기가 사용될 때(예를 들어, R1/R2 =에틸/프로필) ΔpH오프 / 온은 0.25 미만의 pH인 반면, R1/R2가 에틸/펜틸기일 때 ΔpH오프 / 온은 0.5 초과 pH이며; (3) P(R1-r-R2) 세그먼트의 소수성은 R1 및 R2 단량체의 몰분율을 제어함으로써 미세동조될 수 있는데, 이는 정확히 제어된 pH를 야기한다.
상기 기준에 기반하여, 두 단량체, 즉, 다이에틸아미노에틸 메타릴레이트(DEA-MA) 및 다이아이소프로필아미노에틸 메타릴레이트(DPA-MA)의 비를 달리하여(도 76a) 일련의 PEO-b-P(DEAx-r-DPAy) 공중합체를 합성할 것이다. 총 반복 단위를 100(x+y=100)에서 제어할 것이다. 아미노에틸 메타릴레이트(AMA-MA)를 형광단 컨쥬게이션을 위해 도입할 것이다(쇄 당 z=3). 도 76b는 대표적인 염료인 Cy5.5를 이용하는 pH-의존적 UPS 활성화에 대한 데이터를 나타낸다. 결과는 pH 범위 6.3 및 7.8에서 미세동조된 일련의 UPS 나노프로브를 나타낸다. 모든 나노프로브는 급격한 pH 반응을 유지하였다(ΔpH오프 /온 <0.25). 전이 pH 대 DPA 몰 백분율(1H NMR에 의해 정량화)의 플롯은 선형 상관관계를 나타낸다(도 76c). 6.5, 6.7, 6.9 및 7.1에서 pH 전이를 표적화하기 위해 PEO-b-P(DEAx-r-DPAy) 공중합체의 조성을 결정하기 위해 이 상관관계를 표준 곡선으로서 사용할 것이다. 각각의 전이 pH를 위해, 메커니즘 연구를 위한 SPY 이미징 또는 이중 형광 리포터를 위한 ICG 컨쥬게이션을 지니는 나노프로브를 생성할 것이다.
실시예
11: 종양 진행에서 pH 조절 메커니즘의 분석
1.
종양 진행의 상이한 단계에서 상이한
당분해
표현형에서 종양
산성혈증의
pH 조절 메커니즘
본 명세서에 기재된 이중 리포터 UPS 나노프로브를 이용하여, 종양 산성혈증을 달성하기 위해 사용한 상이한 pH 조절 경로를 결정하기 위해 다른 해당과정 경향을 지니는 종양을 연구할 것이다. 더 구체적으로, 고도 당분해 종양이 pH 조절을 위해 모노카복실레이트 수송체(예를 들어, MCT1/4)를 우세하게 사용하는 반면, 해당과정-손상 종양이 종양 산성혈증에서 탄산 무수화 효소 IX를 이용하는지의 여부를 조사할 것이다. 적격 해당과정 두경부암 세포(예를 들어, HN5 또는 FaDu)를 양성 대조군으로서 사용하고, 중요한 당분해 효소(예를 들어, LDHA 또는 PKM2)의 안정한 넉다운에 의해 동질유전자, 해당과정-손상 종양을 생성하였다. 이전의 연구는 LDHA 또는 PKM2의 shRNA 넉다운이 해당과정을 선택적으로 저해하고, OXPHOS 경로에 대해 세포를 재프로그래밍한다는 것을 나타내었다(Christofk et al., 2008; Fantin et al., 2006). 소분자 저해제(예를 들어, MCT1/4에 대해 자살 저해제, 또는 CAIX에 대해 아릴 설폰아마이드)를 MCT1/4 및 CAIX의 면역조직화학과 조합하여 사용할 것이다. UPS 활성화의 패턴은 종양 부문에서 pH 조절 단백질의 공간 발현과 상관관계가 있을 것이다.
2.
소분자
저해제를 이용한 동요에 의한 종양
산성혈증의
메커니즘 연구
종양 생물에너지론은 해당 메커니즘 또는 미토콘드리아의 산화적 인산화(OXPHOS) 경로의 향상을 수반한다. 몇몇 분자의 메커니즘은 암세포에서 알칼리성 pHi 및 종양 미세환경에서 산성 pHe를 유지하는 것을 초래한다(도 77). pH 조절 메커니즘은 모노카복실레이트 수송체(MCT1 및 MCT4)(Enerson & Drewes, 2003 및 Halestrap & Price, 1999), 탄산 무수화 효소(CAIX 및 CAXII)(Supuran, 2008 및 Supuran, 2010), 음이온 교환체(AE1, 2 및 3)(Sterling, et al., 2002; Morgan, 2004), Na+-중탄산염 교환체(NBC)(Pouyssegur et al., 2006), Na+/H+ 교환체(NHE)(Pouyssegur et al., 2006), 및 V-ATP 분해효소(Perez-Sayans et al., 2009)를 포함하는, 다중 단백질의 상호 작용을 수반한다.
상이한 당분해 표현형을 지니는 종양에서 산성혈증 메커니즘을 시험하기 위해, 본 발명자들은 산성혈증 과정에서 2가지 주요 조절 단백질의 저해제를 이용하여 처음 시작할 것이다: MCT1/4(도 78a 내지 도 78e)에 대해 자살 CHC 저해제 및 CAIX에 대해 아세트아졸아마이드. 종양 미세환경에서 pH 조절을 동요시키고, 산성화의 이미징 시공 반응을 위한 이중 리포터 UPS 나노프로브를 사용하기 위해 본 명세서에 기재된 이중 리포터 UPS 나노프로브를 정맥내로 투여할 것이다. 상이한 해당과정 표현형을 갖는 피하 폐 종양을 지니는 마우스의 3개 그룹을 사용할 것이다: 1) 적격 해당과정 속도를 지니는 정위 HN5 또는 FaDu 종양; 2) LDHA의 shRNA 넉다운에 의해 손상된 해당과정을 지니는 정위 HN5 또는 FaDu 종양(Fantin et al., 2006). 종양 크기를 모든 그룹에 대해 대략 200㎣에서 제어할 것이다. 이어서, 각각의 그룹으로부터의 마우스를 4개의 하위 그룹으로 나눌 것이다. 마우스의 각각의 하위 그룹은 1) PBS; 2) CHC 저해제; 3) 아세트아졸아마이드 또는 4) 각각 CHC 저해제 및 아세트아졸아마이드 둘 다, 다음에 이중 리포터 UPS의 투여를 받을 것이다. UPS 주사 후 1, 2, 4, 12 및 24시간에, 각각의 종양으로부터의 보디피(오프-온) 형광 강도(FI) 및 Cy3.5 분포(항상 온)를 마에스트로 작은 동물 이미징 시스템(퍼킨엘머)에 의해 측정하고, 이미지J에 의해 정량화할 것이다. 3개의 상이한 그룹 중에서 FI(하위그룹1)를 비교함으로써, 다른 해당과정 속도를 지니는 암세포가 모두 종양 미세환경에서 산성 pHe를 생성하는지의 여부를 결정할 것이다. 동일한 그룹으로부터의 FI(하위그룹2/3/4)/FI(하위그룹1)의 비를 계산함으로써, 각각의 경로가 상이한 해당과정 속도를 지니는 종양에 대해 전반적인 산성혈증에 기여하는 방법을 결정할 것이다. 각각의 실험의 마지막에, 종양을 수집할 것이고, 냉동 부문을 표본으로부터 제조할 것이다. 각각의 종양 부문에 대해, 활성화된 나노프로브에 대한 보디피 이미지 및 절대 프로브 분포에 대한 Cy3.5 이미지를 캡처할 것이다. 종양 산성혈증에 대한 MCT1/4 또는 CAIX의 상대적 기여는 활성화된 온/오프 보디피 대 항상 온 Cy3.5 형광 강도의 비로부터 정규화할 것이다. 종양에서 MCT1/4 또는 CAIX의 발현 프로파일과 상관관계를 짓기 위해 냉동 박편을 H&E 또는 항체에 의해 염색할 것이다. 활성화된 나노프로브에 의한 분포 패턴을 비교하기 위해 저산소증 바이오마커 HIF1α를 또한 염색할 것이다.
3.
종양 진행의 상이한 단계에서 종양
산성혈정의
종양내
이종성의
연구.
생물 에너지학 리모델링의 연속체는 종양 진행에 따라 존재하는 것으로 알려져 있다(Jose et al., 2011). 작은 종양은 글루코스의 락트산염으로의 낮은 전환 경향을 갖지만, 글루타민의 락트산염으로의 상대적으로 높은 전환을 갖는 반면, 큰 종양은 낮은 산소 및 글루코스에도 불구하고 높은 글루코스 및 산소 이용률을 가진다(Eigenbrodt et al., 1998). 데이터는 I-UPS 방법이 SPY 카메라 하에서 밝은 반점으로서 매우 작은 종양 병변을 검출할 수 있다는 것을 나타낸다(BalB/C 마우스에서 < 1 mm 또는 1백만개 4T1 암세포, 도 79a 내지 도 79c). 이 결과는 I-UPS가 초기 발생 단계에서 작은 종양 결절을 검출하기 위한 적절한 민감도를 가진다는 것을 입증한다.
종양 성장 동안 종양 산성혈증 메커니즘의 퍼텐셜 전환을 모니터링하기 위해, HN5 및 HN5 해당과정-손상 모델을 연구하고, 종양 성장의 상이한 단계에서 나노프로브 활성화를 평가할 것이다. 종양이 10, 100, 500 및 1000㎣의 크기로 성장될 때, 동물을 처음에 MCT1/4 또는 CAIX 저해제의 주사 없이 이미징할 것이다. 이후에, 대응하는 pH 조절 경로를 차단하기 위해 CHC 저해제 또는 아세트아졸아마이드를 정맥내로 주사할 것이고, 동물을 동요 전 및 후에 형광 강도를 비교하기 위해 다시 이미징할 것이다. CHC 저해제 또는 아세트아졸아마이드의 결과로서 형광 강도의 감소 백분율을 정량화하고, 종양 부문에서 MCT1/4 또는 CAIX 각각의 발현 수준과 상관 관계를 지을 것이다. (Wang et al., 2014)에서 기재한 바와 같은 종양 진행의 상이한 단계에서 UPS 활성화에 대한 혈관신생 및 저산소증의 영향을 평가하기 위해 혈관구조(항-CD31) 및 저산소증(피모니다졸) 염색을 또한 수행할 것이다.
실시예
11: 다른
당분해
표현형을 지니는 종양을
검출함에 있어서
UPS
이미징
1.
다른 해당과정 속도를 지니는 마우스 종양 모델.
하나의 시리즈에서, 정위 두경부 종양(HN5, FaDu 또는 HCC4034, 도 73)을 확립하고, 본 명세서에 기재된 LDHA의 안정한 넉다운에 의한 그들의 동질유전자의, 해당과정-손상 종양을 확립할 것이다. 다른 시리즈에서, 앞서 확립한 80개 세포주의 패널로부터의 구성적으로 높은 해당과정 대 낮은 해당과정을 지니는 몇몇 비소세포 폐암 세포주를 선택할 것이다. 다른 당분해 표현형을 지니는 이들 동물 모델을 이용하여, I-UPS 나노프로브에 의한 산설혈증 이미징이 더 높은 암 특이성을 허용한다는 가설은 FDG-PET 이상으로 해당과정-손상 종양에 대해 특별히 시험될 것이다. 추가로, 정상 조직에서 이미징 방법 둘 다로부터의 위양성 신호를 연구할 것이다.
2. 두경부의 정상 및 해당과정-손상 종양모델에서 I-UPS 및
FDG
-PET
이미징의
비교.
적격 해당과정 및 손상 해당과정에 의한 마우스에서의 일련의 정위 두경부 종양 모델을 확립할 것이다. 구체적으로, 106개의 선택된 두경부암 세포(HN5, FaDu 또는 HCC4034)를 SCID 마우스에서 이하삼각 영역에서 주사하고, 종양을 대략 200㎣까지 성장시킬 것이다. 마우스를 2개의 그룹으로 나눌 것이다: 하나의 그룹에 적격 해당과정 그룹으로서 스크램블된 짧은 헤어핀 RNA(shRNAscr)를 주사할 것이고; 다른 하나의 그룹에 락트산 탈수소효소(LDHA) 넉다운 짧은 헤어핀 RNA(shRNALDHA)를 주사하여(Fantin et al., 2006) 해당과정 손상 그룹으로서 락트산염 형성을 차단시킬 것이다. 마우스를 PET 이미징 전 12시간 동안 절식시킬 것이다. 각각의 마우스는 꼬리 정맥 주사를 통해 정맥내로 식염수 중에서 150㎕로 FDG의 150μCi를 받을 것이다. PET 이미지를 주사 후 1시간에 15분 동안 획득할 것이다. PET 이미지를 3D 차 서브세트 예상 최대화(OSEM3D/MAP) 알고리즘을 이용하여 단일 프레임으로 재구성할 것이다. 관심 영역(ROI)은 조직을 포함하는 모든 면에서 종양을 포함하도록 수동으로 그릴 것이다. 표적 활성은 그램 당 주사 용량의 백분율(%ID/g)로서 계산할 것이다. 표준화된 흡수 값(SUV)을 또한 퍼텐셜 위양성의 평가를 위해 종양뿐만 아니라 주위의 정상 조직 및 관심 대상의 다른 기관(예를 들어, 뇌, 신장, 심장 및 편도)에 대해 계산할 것이다. 정위 HN5 두경부 종양-보유 마우스에서의 예비 데이터는 3마리 마우스 중 2마리에서의 갈색 지방 조직으로부터의 강한 위양성 신호를 나타낸 반면(Christofk et al., 2008; Fantin et al., 2006), UPS는 높은 특이성으로 종양을 검출하였다(도 80). 임상적으로, 두경부암 환자에서 견갑골 사이 갈색 지방조직 또는 긴장된 목 근육은 또한 상승된 글루코스 소모에 기인하여 PET 이미징에서 비정상으로서 오해를 야기할 수 있다(Mirbolooki, 2011; Wang et al., 2012). 정상 조직에서의 조직학을 수행하여 위양성 신호의 조직 유래를 입증할 것이다.
PET 이미징 후에, 마우스를 방사성 트레이서(18F, t1/2 = 110분)를 비활성화시키기 위해 밤새 유지시킬 것이다. 이어서, I-UPS(2.5㎎/kg)를 꼬리 정맥을 통해 주사할 것이다. 마우스를 주사 후 24시간에 SPY 엘리트(등록상표) 수술 카메라를 이용하여 이미징시킬 것이다. 전체 신체 이미징 후에, 마우스를 주요 기관(예를 들어, 심장, 간, 신장, 폐, 뇌, 비장 등)을 제거하기 위해 절제할 것이다. 종양 및 정상 조직의 생체밖 이미징은 SPY 엘리트(등록상표) 수술 카메라에 의해 이미징될 것이다. 정상 조직비에 대한 종양(T/N)은 모든 형광 이미지에 대해 이미지 J 소프트웨어를 이용하여 정량화할 것이다. 두 다른 당분해 동물 그룹 간에, 해당과정 정도가 PET 이미징에 대해 ID%/g 또는 SUV 그리고 형광 이미징에 대해 T/N에 영향을 미치는 방법을 비교할 것이다. 형광 이미징 후에, 동물의 주요 기관을 냉동 박편화하고, H&E로 염색할 것이다. 임상 병리학자는 악성종양의 존재 및 조직 유래의 위양성 신호를 입증할 것이다.
3.
비소세포
폐 종양 모델에서 I-UPS
이미징
특이성의 연구.
두경부암 모델에 추가로, 다른 해당과정을 이용하는 선택된 폐암 모델에서 I-UPS 및 FDG-PET의 이미징 특이성을 또한 연구할 것이다. 폐암 SPORE의 부분으로서, 세포 배양물에서 80개 이상의 비소세포 폐암(NSCLC)의 패널에 대한 글루코스 소모율 및 락트산염 분비율(도 81)을 앞서 정량화하였다. 해당과정 속도(락트산염out/글루코스in) 대 세포주의 플롯은 NSCLC 세포에 걸친 세포 자주적, 구성적으로 다른 당분해 표현형을 도시한다. 이 데이터에 기반하여, 높은 해당과정 속도 및 낮은 해당과정 속도를 지니는 폐암 세포의 2개 그룹을 선택할 것이다. 구체적으로, H2170, HCC515 및 H2347을 높은 당분해 패널(락트산염out/글루코스in 대략 2.0)로서 선택할 것이고, H228, H1755 및 HCC78을 낮은 패널(락트산염out/글루코스in <0.5)로서 선택할 것이다. 이들 세포주를 UTSW/MDACC 폐 SPORE로부터 입수 가능하며, SCID 마우스에서 피하 종양을 생성하는 것으로 나타났다. 전형적인 절차에서, 2×106 폐암 세포를 처음에 마우스의 좌측 옆구리에서 피하로 주사하여 SCID 마우스에서 종양 이종이식을 형성하였다. 종양이 대략 200㎣로 성장되었을 때, 마우스를 PET로 처음 이미징한 후, 상기 기재한 절차를 이용하여 I-UPS 나노프로브의 주사 후 형광 이미징하였다. I-UPS 이미징 결과를 FDG-PET로부터의 결과와 비교할 것이다. 특히, I-UPS 이미징이 FDG-PET로부터 입증된 위양성 조직(예를 들어, 갈색 지방, 조직학에 의한 흉근)에서 침묵으로 남아있는지의 여부, 또한 I-UPS 이미징이 FDG-PET에 의해 잠재적으로 검출되지 않은 구성적으로 낮은 해당과정 속도를 지니는 폐 종양을 도시할 수 있는지의 여부를 평가할 것이다.
실시예
12: 암 종양에서 현미경 종양 경계에 대한 UPS
나노프로브
활성화의 최적화
1.
UPS 활성화 프로파일의 정량화 및 현미경의 종양 경계와의
상관 관계
.
선택된 종양 모델에 대해, 항상 온/오프-온 이중 리포터를 지니는 나노프로브를 정맥내로 주사할 것이다. 15분에 시작해서, 주사 후 1, 4 및 24시간에, 종양 및 주변 조직을 수집하고 냉동 박편을 표본으로부터 준비할 것이다. 각각의 종양 박편에 대해, 보디피 이미지를 활성화 나노프로브 및 절대 프로브 분포를 위한 Cy3.5 이미지로부터 캡처할 것이다. 냉동 박편을 H&E에 의해 염색하여 진정한 종양 경계(현재의 임상 금 본위)를 동정할 것이다. 더 큰 종양에 대해, 다중 이미지를 캡처하고, 전체 비교를 위해 그들을 함께 붙여둔다.
정량적 이미지 분석을 위해, (1) 조직학 이미지에 의해 동정되는 진정한 종양 경계 지점(0 지점)으로부터의 접선을 그릴 것이고(도 82), (2) 접선에 수직인 다른 선을 그리며, (3) 이미지J 프로그램을 이용하여 수직선을 따라 보디피 및 Cy3.5 형광 강도(예를 들어, 0점으로부터의 ±500㎛)를 정량화하고, (4) 각각의 종양 슬라이스 및 평균 다중 선형 프로파일에 대해 다중 경계 지점으로부터 단계 1 내지 3을 반복하고, 그리고 (5) 보디피 및 Cy3.5 채널에서 평균화된 형광 강도 대 거리를 플롯팅한다. 도 82는 이중 리포터 나노프로브에 의한 경계 분석의 개략도를 도시한다.
H&E 이미지와 보디피(pH 활성화 가능한 리포터) 맵을 비교함으로써, 프로브가 당분해 암 세포에 의한 pH 활성화를 통해 종양 경계를 묘사할 수 있는지의 여부가 보이도록 프로브를 결정할 것이다. 처리할 일부 구체적 질문은 하기를 포함한다: (1) 락트산염 분비 세포의 분포 및 특성과 락트산염 분비 그리고 그에 따른 종양 크기, 유형 및 병기에 의해 영향받는 경계의 정확성은 무엇인지, 그리고 (2) UPS 나노프로브가 종양 경계 내에서 그리고/또는 종양 경계에 걸쳐 pH 불균일성을 식별할 수 있는지의 여부 및 정상 조직 내로 침윤되는 잔여 암세포가 EPR 효과의 결여에 기인하여 경계 이상으로 검출될 수 있는지의 여부이. CFP 및 Cy3.5(항상 온 리포터) 맵을 비교함으로써, 종양 내부의 프로브의 분포를 시간에 따라 종양 주위의 정상 조직에 대해 결정할 것이다. 보디피 및 Cy3.5 신호를 비교함으로써, 프로브 활성화(I보디피/ICy3 . 5)를 프로브 축적에 대해 결정할 것이다(ICy3 .5). 임의의 이론에 의해 구속되는 일 없이, 이는 EPR 효과 또는 pH 활성화를 통한 용량 축적이 경계 묘사를 유도하는지의 여부를 결정하는 것으로 여겨진다. 6.3 내지 7.1의 상이한 pH 전이를 지니는 일련의 이중 리포터 프로브에 대한 곡선의 이런 세트를 확립할 것이고, pH 전이를 조정하는 것이 종양 경계 묘사의 민감도 및 특이성을 변화시키는지의 여부를 연구한다. 최적의 I-UPS는 시험될 것이 보편적이거나, 또는 종양의 유형 및/또는 크기에 의존한다. 최종적으로, CFP-표지 암세포는 경계를 지나 정상 조직 내로 침윤하는 암세포의 검출을 위해 프로브에 대한 민감성 및 특이성을 추가로 시험하기 위하여 사용할 것이다.
2.
항종양 효능 및 장기간 생존 연구.
정위 종양 이종이식(두경부암에 대해 HN5 및 FaDu, 유방암에 대해 4T1 및 MD-MBA-231)을 사용하여 I-UPS-가이드 절제의 항종양 효능을 평가할 것이다. 각각의 연구를 위해, I-UPS 나노프로브를 수술 전 24시간에 정맥내로 주사할 것이다. 동물을 4그룹으로 나눌 것이다(각각의 그룹에 대해 n = 10 또는 15): (1) 수술 없음; (2) 종양 감량 대조군(가시적 종양이 부분적으로 제거됨); (3) 완전한 제거(외과의사의 최고의 추정에 기반함)를 지니는 백색광 수술 및 (4) SPY-가이드 종양 절제. 이들 실험군은 백색광 및 형광 수술 하에서 통상적인 수술 간의 차이의 연구를 허용할 것이다. I-UPS6 .9 프로브를 이용하여 파일럿 연구를 수행하였다(도 74a 및 도 74b 및 도 78a 내지 도 78e). 추가적인 종양 모델(예를 들어, FaDu 및 MDA-MB-231)에서 최적화된 I-UPS 프로브에 대한 유사한 실험을 수행할 것이다.
수술 후에, 카플란-마이어 생존 곡선을 결정하여 각각의 그룹 간의 항종양 효능을 비교할 것이다. 모든 절제 동물에 대해, 원발성 부위에서 종양 발생을 시험하고 기록할 것이다. 추가로, 마우스의 연하 작용에 대한 수술 효과를 추정할 것이다. 임의의 이론에 의해 구속되는 일 없이, 종양 적출 동안 제거된 정상 조직의 양이 클수록, 동물에 대한 결과적인 기능성 장애가 더 커지며, 따라서 연하하는 것으로 여겨진다. 수술전 및 수술후에 마우스의 체중을 잴 것이다. 매일의 체중을 수술 후 1주 동안 그리고 이후에 1주 2회로 기록할 것이다. 체중감소 백분율을 섭식 및 연하 작용에 대한 대용물로서 사용할 것이다. 체중을 초기 체중에 대해 정규화시켜 동물성장을 설명할 것이다.
실시예
13: 생물학적 프로파일 및
약물동태학
1.
약물동태학
/생체분포(PK/
BD
) 연구.
3H-표지 PEG-b-PC7A(UPS6 .9) 및 PEG-b-PDPA(UPS6.3)를 이용하는 이전의 연구는 유사한 유체 역학적 직경(각각 25.3±1.5 대 24.9±0.8㎚), 제타 퍼텐셜(-0.7±1.1 대 -3.5±0.6 mV), 및 PEG 길이(둘 다 5 kD)에도 불구하고 얻어진 UPS 나노입자가 상당히 상이한 PK/BD 프로파일을 가진다는 것을 나타낸다(도 83). UPS6 .9 및 UPS6 .3 나노입자 각각에 대해 α기 반감기는 1.0±0.2 및 4.3±0.7시간이고(P<0.05), 및 β기는 7.5±0.3 및 19.6±2.1시간이었다(P<0.01). 나노입자 주사 후 24시간에 생체분포 연구는 간과 비장이 나노입자 둘 다의 클리어런스에 중요한 기관이었다는 것을 나타내었다. UPS6 .3 초과로 UPS6 .9의 더 빠른 클리어런스는 UPS 활성화 및 혈액으로부터의 클리어런스에서 그의 더 높은 전이 pH 및 더 높은 감수성에 기인하였다.
이 연구에서, PK/BD 연구는 앞서 확립한 바와 같은 3H-표지 공중합체를 이용하여 본 명세서에 기재된 최적화된 I-UPS 조성물에 대해 처음 수행할 것이다(각각의 그룹에 대해 n=5). 주사 후에 혈액을 2분, 0.5, 1, 3, 6, 12 및 24시간에 수집할 것이다. 실험의 마지막에, 동물을 희생시키고, 종양 조직 및 주요 기관(심장, 간, 비장, 신장 등)을 제거할 것이다. 절제 기관의 중량을 달고, 균질화하고 나서, 신틸레이션 혼합물로 처리할 것이다. 혈액과 조직 샘플을 둘 다 액체 신틸레이션 계수기에 의해 정량화할 것이다(베크만(Beckman) LS 6000 IC). 상이한 기관/조직에서 UPS 분포를 조직의 그램 당 주사 용량의 백분율로서 계산할 것이다. 혈액 및 조직 샘플에 추가로, 소변 및 대변 샘플을 또한 수집하여 신장 분비 및 GI 관을 통한 I-UPS의 클리어런스를 분석할 것이다. 이들 실험을 교정에 대한 지정 동물 시설에서의 대사 우리에서 수행할 것이다.
2.
선천성 면역의 평가.
I-UPS가 강한 선천성 면역을 야기할 수 있는지의 여부를 평가하기 위해, I-UPS 나노프로브를 면역적격 C57bL/6 마우스(각각의 그룹에 대해 n=5)에서 1×, 10× 및 50×의 이미징 용량에서 정맥내로 주사할 것이다. 2, 6 및 24시간에, 꼬리 정맥으로부터의 혈액 샘플(100㎕)을 수집할 것이다. 혈청을 분리하고 나서, 사이토카인 프로파일을 분석할 것이다. 현재의 루미넥스(Luminex)(상표명) 다중복합 분석은 25㎕ 혈청으로부터의 23종의 사이토카인(예를 들어, IFN-α 및 -β, IL-2, IL-4, IL-12, IL-17 등)을 검출할 수 있다. PBS를 음성 대조군으로서 사용할 것이다. 사이토카인에서 상당한 증가가 관찰된다면, 2 내지 4주와 같은 더 긴 시간 틀에 걸쳐 면역 반응에 대해 더 상세한 분석을 수행할 것이다(예를 들어, 호중구 또는 다른 백혈구 생성의 시험, 보체 활성화, 비장 및 림프절에서의 면역 반응).
실시예
14: 다수의 상이한 중합체를 함유하는 UPS 나노입자
1.
다수의 상이한 중합체를 지니는
마이셀의
용도
처음에, 일련의 양친매성 블록 공중합체 PEG-b-PR(여기서, PEG는 폴리(에틸렌 글리콜)이고, PR은 이온화 가능한 세그먼트임(반응식 1 및 표 12))을 합성하였다
반응식 1: 이온화 가능한
세그먼트의
합성
PEG-b-PR 공중합체는 상이한 형광단을 이용하여 암호화하였다. 3가지 예시적인 PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5 형광 중합체를 선택하고, 염료 컨쥬게이션 수 및 효율뿐만 아니란 양자 수율에 대해 특성규명하였다(도 84b 및 표 13). PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5 나노프로브는 6.9, 6.2 및 5.3에서 pH 전이를 가지는데, 이는 클라트린-코팅 소수포(CCV)로부터 초기 엔도좀(pH ~ 6.0)까지, 이어서, 후기 엔도좀/리소좀(pH 대략 5.0 내지 5.5)까지 식균 작용 경로 동안 pH 변화를 아우른다(Huotari & Helenius, 2011). 이들 나노입자의 입자 크기는 좁은 분포로 25 내지 35㎚였다. 형광 활성화 비(R F)는 급격한 pH 반응을 지니는 PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5 나노프로브에 대해 30, 91 및 107이었다(ΔpH10-90% = 0.18-0.22, 표 14 및 도 85 내지 도 88). 초음파 방법을 이용하여, 혼성 UPS 나노프로브 시스템은 3 성분 PEPA-BDY493, PDPA-TMR, 및 PDBA-Cy5으로 이루어지며, 도 84a 내지 도 84c에서 나타내는 바와 같이, 공학처리하였다. 임의의 이론에 의해 구속되는 일 없이, 3가지 형광 중합체는 더 높은 pH에서 상동성 혼성 UPS 나노프로브로 자기 조립될 것으로 여겨진다. 내포작용 후에, 혼성 UPS 나노프로브를 순차적으로 해체되고, 각각의 중합체의 개개 pHt(예를 들어, 6.9, 6.2, 5.3)에서 형광을 내서 살아있는 세포 내 단일 세포 소기관 분해 시 미묘한 pH 변화와 관련되는 엔도좀 성숙 과정을 추적할 것이다(도 84c).
상동성 혼성 나노입자의 형성을 입증하기 위해, 일련의 호모FRET 및 헤테로FRET 실험을 설계하고 수행하였다. 호모FRET 실험은 상이한 pH 전이를 지니는 하나의 형광 PEG-b-PR 중합체 및 다른 무 표지 PEG-b-PR 중합체의 분자 혼합물을 수반한다. 이 실험에서, PEPA-Cy5를 사용하고, 표지 대 무 표지 중합체에 대해 1:19의 몰 비로 PEPA, PDPA 또는 PDBA 중합체와 혼합하였다. 결과는 호모FRET 효과의 극복을 통해 Cy5 형광 신호의 회수에 의해 표시되는 동일한 마이셀에서 PEPA, PDPA 또는 PDBA 중합체를 지니는 PEPA-Cy5의 분자 혼합된 마이셀의 성공적인 형성을 나타내었다(도 114a 및 도 114b)(Zhou et al., 2012). 대조적으로, PEPA-Cy5 및 다른 무 표지 마이셀의 마이셀 혼합물은 Cy5 신호 회수를 나타내지 않았다. PDBA-Cy5와 다른 무 표지 PEG-b-PR 중합체의 분자 혼합된 마이셀에서 동일한 결과를 또한 관찰하였다(도 89a 및 도 89b). 모든 이들 결과는 PEPA, PDPA 및 PDBA 중합체가 상동성 혼성 나노프로브를 형성할 수 있다는 것을 나타내었다.
혼성 나노프로브의 형성을 추가로 입증하기 위해, 형광 전달 효과를 상이한 헤테로-FRET 염료(PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5)를 이용하여 암호화된 공중합체로부터 추출하였다. 호모FRET 효과를 최소화하기 위해, 각각의 공중합체를 소수성 PR 세그먼트에서 하나의 염료를 이용하여 암호화하였다. 2 또는 3개의 공중합체를 THF 중에서 용해시키고, 이어서, 본 명세서에 기재된 바와 같은 분자 혼합된 마이셀을 생성하기 위해 물에 적가하였다. PEPA-BDY 및 PDPA-TMR(몰 비 = 1:1)의 쌍에서, 분자 혼합된 마이셀에서의 BDY493 방출 파장(510㎚)의 형광 강도는 PEPA-BDY493 단독 마이셀 용액에 비해 4배 초과로 감소되었다. 게다가, TMR 방출(580㎚)에서 형광 강도는 PDPA-TMR 마이셀 용액 초과로 혼합 마이셀 용액에 대해 4배 초과로 증가되었다(도 90a). 헤테로-FRET 중합체의 다른 3개 세트: (i) PDPA-TMR과 PDBA-Cy5, (ii) PEPA-BDY493과 PDBA-Cy5; (iii) PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5를 또한 광범위하게 조사하였다(도 90b 내지 도 90d). PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5 형광 중합체의 세트에서, BDY493으로부터 TMR까지의 순차적 FRET 효과를 최종적으로 Cy5 염료에 대해 관찰하였다(도 90d). 혼성 나노프로브에서 BDY493 방출에서 형광 강도는 PEPA-BDY493 단독 마이셀 용액에 비해 4배 초과로 감소되었지만, Cy5 신호는 PDBA-Cy5 마이셀 초과로 혼성 나노프로브에 대해 25배 초과로 증가되었다. 이들 결과는 3가지 PEG-b-PR 공중합체가 상동성 혼성 UPS 나노프로브에 자기 조립될 수 있다는 것을 명확하게 입증하였다.
혼성 UPS 나노프로브의 형성을 입증한 후에, PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5 형광 중합체를 이용하여 혼성 나노프로브 시스템을 생성하였고, 각각의 PR 쇄는 대략 2.2종의 염료에 컨쥬게이션되었다(도 91). 상이한 여기 파장(485, 545, 640㎚) 및 상이한 pH(7.4, 6.7, 5.8 및 5.0)에서 형광 방출 스펙트럼을 수집하고 플롯팅하였다(도 92a 내지 도 92d 및 도 93a 내지 도 93f 및 도 94). 결과는 모두 3가지의 형광 중합체 성분이 중성 pH에서 "침묵"을 유지한다는 것을 나타내었다. pH가 6.7로 감소되었을 때, PEPA-BDY 성분은 처음에 방출되고, 활성화되어 녹색 신호를 생성한 반면, 다른 두 성분은 여전히 "오프"로 남아있었다. pH가 5.8까지 낮아질 때, PDPA-TMR 신호를 활성화시켜 적색 신호를 생성하였고, PDBA-Cy5 성분은 이 단계에서 완전히 "침묵"이었다. 최종적으로, 용액 pH가 5.0으로 감소되었을 때, PDBA-Cy5는 활성화되었다. 이 단계에서, 모두 3종의 형광 중합체가 완전히 활성화되었다. 혼성 UPS 나노프로브의 입자 크기는 pH 7.4 내지 5.8에서 대략 30 내지 40㎚였고, 동적 광산란 분석(DLS)에 의해 결정하여 pH 5.0에서 유니머로서 8.7㎚로 떨어졌다. TEM 분석에 의해 유사한 관찰을 하였다(도 95a 및 도 95b). 혼성 UPS 나노프로브에서 PEPA-BDY493, PDPA-TMR 및 PDBA-Cy5 성분에 대한 pHt 값은 6.9, 6.2, 및 5.3이었는데, 이는 그들의 대응하는 단일 성분 나노프로브와 일치되었다. 전반적으로, PEPA-BDY493, PDPA-TMR, 및 PDBA-Cy5에 대한 형광 활성화 비는 급격한 pH 반응에 의해 74, 123 및 30이었다(ΔpH10 -90% = 0.20-0.25, 부록 표 S4). DLS 분석을 이용하여, 혼성 나노프로브 대 pH 값의 계수율을 플롯팅하고, 또한 도 92e에서 나타낸 바와 같이 다단계 활성화 패턴을 관찰하였다. 각각의 단계에서, 하나의 형광 중합체는 방출되고, 형광을 내며, 최종적으로 모든 중합체는 해리되는데, 0에 도달되는 계수율에 의해 나타난다. 상이한 pH에서 혼성 UPS 나노프로브의 다단계 활성화를 또한 이미징하고, 도 92f에서 나타낸 바와 같은 마에스트로 CRI 이미징 시스템에 의해 입증하였다.
혼성 UPS 나노프로브에서 이들 3가지 구성성분의 동시통합화된 세포 흡수를 확인하기 위해, UPS 나노프로브를 본 명세서에 기재된 바와 같은 티올-말레이미드 결합을 통해 5% 에르비툭스(Erbitux)(인간화된 EGFR 항체)(Adams & Weiner, 2005)로 기능화시켰다. Erb-암호화된 혼성 나노프로브는 ΔpH10 -90% 값 0.20 내지 0.25로 6.9, 6.2 및 5.3에서 3개의 별도의 pH 전이를 가졌다. 혼성 나노프로브의 형광 온/오프 활성화 비는 BDY493, TMR 및 Cy5 채널 각각에 대해 200, 191 및 35배였다. Erb-암호화된 UPS 나노프로브의 특이성을 연구하기 위해, A549 세포를 Erb-암호화된 PDPA-TMR 나노프로브와 함께 인큐베이션시켰다. Erb-암호화된 PDPA-TMR 인큐베이션의 15분 후에, 세포 내에서 반점 형광 활성화를 관찰하였다. 1시간에, Erb-암호화된 PDPA-TMR 나노프로브에서 250배 초과의 형광 증가가 PDPA-TMR 나노프로브 대조군에 대해 관찰되었는데, 이는 EGFR 바이오마커에 대한 높은 특이성을 입증한다(도 96). Erb-컨쥬게이팅된 UPS 나노프로브의 특이성을 입증한 후에, Erb-암호화된 혼성 UPS 나노프로브의 동시통합화된 흡수를 확인하였다(도 97). A549 세포를 3시간 동안 Erb-암호화된 혼성 UPS 나노프로브와 함께 인큐베이션시키고 나서, 공초점 현미경에 의해 이미징하였다. 대조군에서, A549 세포를 PEPA-BDY493, Erb-암호화된 PDPA-TMR 및 PDBA-Cy5 3개 나노프로브의 칵테일과 함께 인큐베이션시켰다. 단일 식균 작용 세포 소기관에서 Erb-암호화된 혼성 나노프로브의 동시통합화된 흡수를 관찰한 반면, 대조군 내 Erb-암호화된 PDPA-TMR 나노프로브 만을 내재화하고, 세포 내에서 활성화시켰다. 중요하게는, 모든 반점 청색 및 적색 형광 점을 녹색 형광 점의 하위집단과 함께 공동 국소화시켰는데, 이는 혼성 나노프로브가 식균 작용의 세포 소기관 성숙의 평가를 위해 이용될 수 있다는 것을 나타낸다.
실시간으로 엔도좀 성숙을 추적하기 위해, A549 세포를 Erb-암호화된 혼성 UPS 나노프로브를 30분 동안 4℃에서 인큐베이션시켜 특이적 세포 결합을 가능하게 하고, 이어서 배지를 제거하고 나서 3회 세척하였다. 37℃에서 혼성 나노프로브의 세포내 흡수 및 활성화를 공초점 현미경에 의해 이미징하였다. 예상한 바와 같이, PEPA-BDY493 구성성분을 처음으로 방출시키고 나서, 활성화시켜 10분에 녹색 형광 점을 생성하였고, 강도는 증가되었고, 30분 인큐베이션 후에 안정기에 도달되었다(도 98). 이어서, 적색 PDPA-TMR 신호는 20 내지 30분에 나타나기 시작하였다. 모든 적색 점을 이 단계에서 녹색 점의 서브세트와 함께 공동국소화시켰다. 최종적으로, PDBA-Cy5 구성성분을 90 내지 180분에 의사 색상 청색 점과 함께 활성화시키고 나서, 모든 청색 점을 이 기간에 적색 점의 서브세트와 함께 공동국소화시켰다. 식균 작용의 세포 소기관을 3개 집단((i) 녹색 점(6.2< pH <6.9); (ii) 황색 점(5.3< pH <6.2); (iii) 백색 점(pH < 5.3))으로 나눌 수 있는데, 이는 각각 클라트린-코팅 소수포에 대해 pH 대략 6.8, 초기 엔도좀에 대해 pH 대략 6.0 및 엔도좀/리소좀에 대해 pH 5.0 내지 5.5에서 인큐베이션시켰다. 유사하게, 순차적 활성화를 HN5 두경부암 세포주 내 단일 산성 세포 소기관 내에서 관찰하였다(도 99). 따라서, 혼성 UPS 나노프로브는 단일 세포 소기관 분해에서 특이적 식균 작용 경로를 따라 시공적 pH 변화를 성공적으로 보고하였다.
혼성 UPS 나노프로브의 독특한 능력을 입증하도록, 세포 소기관 성숙 동안 산성화 속도의 극적인 증가를 초래하는 독특한 종양 발생 특징을 연구하였다. 상이한 유전자 돌연변이 배경을 지니는 7개의 폐암 세포주를 선택하고 평가하였다(표 15). 세포를 4℃에서 30분 동안 100㎍/㎖ Erb-암호화된 혼성 UPS 나노프로브와 함께 인큐베이션시키고 나서, 3회 세척하고, 이어서, 37℃에서 실시간으로 이미징하여 나노프로브 활성화 속도를 추적하였는데, 이는 세포 소기관 산성화 능력을 나타낸다(도 100 내지 도 102). 결과는 HCC44, H2009, H460 및 A549를 포함하는 KRAS 돌연변이 세포의 활성화 속도가 KRAS 야생형 세포(H2882, H1991 및 H1819)보다 상당히 더 빠르다는 것을 나타내었다. 상이한 세포주에서 흡수 차이를 정규화하기 위해, PDPA-TMR(초기 엔도좀) 및 PDBA-Cy5(후기 엔도좀/리소좀) 신호의 형광 강도를 PEPA-BDY493 신호로 나누었는데, 이는 15분만큼 빨리 활성화되었다. 시간의 함수로서 I 6.2/I 6.9 및 I 5.3/I 6.9를 플롯팅하였다(도 103a 및 도 103b 및 도 104a 내지 도 104d). 30분 후에, TMR 채널(I 6.2/I 6.9)의 상당한 활성화 차이가 없음이 관찰되었다. 75분에, KRAS 돌연변이 세포에 대한 I 5.3/I 6.9 비는 70% 청색-양성 세포 소기관에 도달된 반면, KRAS 야생형 세포만이 40% 미만의 청색-양성 세포 소기관을 가졌다. 이들 결과는 KRAS 돌연변이가 pH 조절과 관련된 리소좀 이화작용을 초래한다는 것을 나타내었다.
KRAS 돌연변이가 리소좀의 상향조절된 산성화를 초래할 가능성이 있다는 것을 고려하여, 세포 소기관 pH가 유전자 돌연변이와 상관관계가 있다는 것을 직접적으로 캡처하기 위해 혼성 UPS 나노프로브를 이용하였다. 모델 시스템으로서, TP53의 단계적 안정성 억제(HBEC30KT-shTP53), KRASG12V의 안정한 발현(HBEC30KT-shTP53/KRAS G12V ), 및 LKB1의 안정한 억제(HBEC30KT-shTP53 / KRAS G12V / shLKB1)를 지니는 일련의 HBEC30KT의 동질 유전자 진행 시리즈와 함께 동일한 폐암 환자로부터의 종양-유래(HCC4017) 및 정상 세기관지 상피 유래(HBEC30KT) 세포주를 선택하였고, 이미징하였다(Ramirez et al., 2004). 도 105a 및 도 105b는 HBEC30KT 상피세포에 대해 악성종양 HCC4017 세포에서 식균 작용의 세포 소기관의 더 빠른 성숙 속도에 대한 극적인 차이를 나타내었다(도 106 및 도 107). 모 종양 및 HCC4017 세포주의 유전형 분석은 TP53, LKB1 및 KRAS에서 돌연변이를 나타내었다. 데이터는 KRAS/LKB1 돌연변이 세포가 성장 및 생존을 위한 리소좀 이화작용에 의존한다는 이전의 발견과 일치된다(Kim et al., 2013). 종양 발생 특징이 세포 소기관 성숙에서의 차이를 초래한다는 것을 추가로 기술하기 위해, HBEC30KT의 동질유전자 진행 시리즈에서 혼성 나노프로브의 형광 활성화 패턴을 이미징하였다(도 108 내지 도 110). 시간의 함수로서 I 6.2/I 6.9 및 I 5.3/I 6.9를 플롯팅하였다(도 111a 내지 도 111d). 결과는 KRAS 돌연변이가 식균 작용의 세포 소기관의 산성화 및 성숙에서 극적인 증가를 초래한다는 것을 나타내었다.
2.
방법 및 물질
1.
혼성
나노프로브의
합성 및 특성규명
염료 컨쥬게이션된 PEG-b-PR 및 말레이미드-말단 PEG-b-PDPA(Mal-PEG-PDPA) 블록 공중합체를 원자 이동 라디칼 중합 방법에 의해 합성하였다. 혼성 나노프로브를 앞서 공개된 절차에 따라 제조하였다(Wang et al., 2014). 전형적인 절차에서, 5㎎의 각각 PEG-b-PEPA-BDY493, PEG-b-PDPA-TMR 및 PEG-b-PDBA-Cy5 중합체를 1㎖ THF 중에 용해시켰다. 이어서, 혼합물을 초음파 처리 하에서 10㎖의 밀리큐 워터에 첨가하였다. 미세 한외여과 시스템을 이용하여 THF를 제거하기 위해 혼합물을 4회 여과시켰다. 이어서, 증류수를 첨가하여 최종 중합체 농도 5㎎/㎖로 조절하였다. 에르비툭스-컨쥬게이트 혼성 나노프로브를 제조하기 위해, Mal-PEG-PDPA 0.6㎎, 각각 PEG-b-PEPA-BDY493, PEG-b-PDPA-TMR 및 PEG-b-PDBA-Cy5 중합체 4㎎을 1㎖ THF 중에 용해시켰고, 상기 기재한 것과 동일한 절차를 사용하여 5% 말레이미드-변형 혼성 나노프로브를 제조하였다. 한편으로, 공개된 절차 후에 에르비툭스 Fab'-SH 단편(3㎎, Mw = 55 kDa)을 제조하였다. 이어서, 말레이미드-변형 혼성 나노프로브와 에르비툭스 Fab'-SH 용액을 혼합하고 나서, 1mM EDTA를 함유하는 100mM 인산염 완충 식염수(PBS, pH 7.4) 중에서 밤새 실온에서 반응시켰다. 이어서, 혼합물을 6회 여과시켜 마이크로-초원심분리 시스템(MWCO = 100K, 밀리포어)을 이용하여 유리 Fab'-SH를 제거하였다. 이어서, 100mM PBS(pH 7.4)를 첨가하여 최종 중합체 농도를 5㎎/㎖로 조절하였다. 투과 전자 현미경을 1% 포스포텅스텐산 음성 염색법을 이용하여 수행하고 나서, JEOL 1200EX 전자 현미경(JEOL 1200EX) 상에서 시각화하였다. 나노입자의 입자 크기 및 분포를 동적 광산란(DLS) 분석에 의해 결정하였다. pH 값의 함수로서 나노입자의 평균 계수율을 또한 DLS 분석에 의해 결정하였다.
2.
UPS
나노프로브의
형광 활성화
상이한 pH 완충제 용액 중의 혼성 UPS 나노프로브의 형광 방출 스펙트럼을 히타치 형광계(F-7500 모델) 상에서 얻었다. 상이한 pH 값을 지니는 100mM PBS를 이용하여 최종 중합체 농도를 100㎍/㎖로 조절하였다. 혼성 나노프로브를 각각 485, 545 및 640㎚에서 여기시켰다. 대응되는 방출 스펙트럼을 각각 490 내지 750, 560 내지 750, 및 650 내지 750㎚에서 수집하였다. 510, 580 및 710㎚에서 방출 피크를 사용하여 BDY493, TMR 및 Cy5 채널에 대한 형광 활성화 비를 정량화하였다. 상이한 pH 값에서 혼성 나노프로브 용액(100㎍/㎖)의 형광 이미지를 청색(515㎚ LP), 녹색(580㎚ LP), 및 오렌지색(645㎚ LP) 필터를 이용하여 마에스트로 이미징 시스템(CRI) 상에서 캡처하였다. 이어서, 다색 이미지를 얻기 위해 이미지를 개개 염료의 표준 형광 스펙트럼을 이용하여 스펙트럼으로 혼합하지 않았다.
3.
세포 배양
폐암 세포주 A549 및 두경부암 세포주 HN5를 10% 소 태아 혈청(인비트로젠), 100 IU/㎖ 페니실린, 및 100㎍/㎖ 스트렙토마이신(인비트로젠)을 함유하는 DMEM (인비트로젠) 중에서 배양시켰다. HBEC30KT 진행 시리즈 및 HCC4017 세포를 37℃에서 5% CO2 분위기에서 2% 소 태아 혈청 및 항생제로 보충한 ACL4 배지 중에서 배양시켰다.
4. 세포
이미징
A549 및 HN5 세포를 2㎖ 완전 DMEM 배지 내 유리 바닥 접시(매사추세츠주에 소재한 매트텍(MatTek))에서 플레이팅하였다. 에르비툭스-컨쥬게이팅된 나노프로브의 특이성을 시험하기 위해, 완전 배지 내 A549 세포를 4℃에서 10분 동안 유지하였고, 이어서, 100㎍/㎖의 Erb-PDPA-TMR 마이셀을 첨가하고 나서, 표피성장인자 수용기(EGFR) 결합을 위해 30분 동안 4℃에서 유지하고, 이어서, 배지를 제거하고, 빙냉 PBS로 3회 세척하였다. 이후에, 세포를 2시간 동안 37℃에서 완전 배지와 함께 인큐베이션시켰다. 공초점 이미지를 60× 대물렌즈를 지니는 니콘(Nikon) ECLIPSE TE2000-E 공초점 현미경에 의해 캡처하였다.
혼성 나노프로브의 3개 구성성분의 동시통합화된 흡수를 입증하기 위해, 완전 배지 내 A549 세포를 4℃에서 10분 동안 유지하고, 이어서, 100㎍/㎖의 Erb-컨쥬게이팅된 혼성 나노프로브를 첨가하고 나서, 30분 동안 4℃에서 EGFR 결합 동안 유지하였다. 배지를 제거하고 나서, 3회 세척하였다. 이후에, 세포를 3시간 동안 37℃에서 완전 배지와 함께 인큐베이션시켰다. BDY493, TMR 및 Cy5를 각각 488, 543 및 633㎚에서 여기시켰다. FITC(515 ± 15㎚), TRITC(590 ± 25㎚) 및 Cy5(650㎚ LP) 필터를 각각 BDY493, TMR 및 Cy5 이미징을 위해 사용하였다. 대조군에 대해, PEPA-BDY493, Erb-PDPA-TMR, 및 PDBA-Cy5 마이셀을 제조하고 나서, 혼합하고 A549 세포와 함께 인큐베이션시켰다. 세포 이미징을 위해 동일한 절차를 이용하였다.
엔도좀 성숙 과정을 추적하기 위해, 세포 샘플을 상기 기재한 것과 동일한 절차를 이용하여 제조하였다. 공초점 이미지를 37℃에서 인큐베이션 후 0, 15, 30, 60분, 2.5 및 5시간에 100× 대물렌즈를 지는 니콘 ECLIPSE TE2000-E 공초점 현미경에 의해 캡처하였다. BDY493, TMR 및 Cy5 3 채널을 여기시키고, 상기 기재한 것과 동일한 상황을 이용하여 수집하였다. 이미지-J 소프트웨어를 이용하여 이미지를 분석하였다. 5회의 독립적 측정을 평균 ± 표준 편차로서 제시하였다.
5.
통계적 분석
데이터를 평균 ± s.d로서 표현하였다. 그룹 간의 차이를 쌍별, 양측 스튜던트 t-검정을 이용하여 평가하였다. * P < 0.05를 유의한 것으로 고려하고, ** P < 0.01은 고도로 유의한 것으로 고려하였다.
6.
물질
테트라메틸로다민 숙신이미딜 에스터(TMR-NHS) 및 보디피(등록상표)493/503 숙신이미딜 에스터(BDY493-NHS)를 인비트로젠 인코포레이티드로부터 구입하였다. Cy5 NHS 에스터(Cy5-NHS)를 루미프로브사로부터 구입하였다. 2-(다이프로필아미노) 에틸 메타크릴레이트(DPA-MA) 및 2-(다이부틸아미노) 에틸 메타크릴레이트(DBA-MA)를 포함하는 단량체를 최근에 기록하였다(Zhou et al., 2011; Ma et al., 2014). 2-아미노에틸 메타크릴레이트(AMA)를 폴리사이언스사(Polyscience Company)로부터 구입하였다. AMA를 아이소프로판올 및 에틸 아세테이트(3:7)로 2회 재결정화시켰다. PEG 거대개시제, MeO-PEG114-Br를 문헌의 절차에 따라 α-브로모아이소부티릴 브로마이드 및 MeO-PEG114-OH로부터 제조하였다(Zhou et al., 2011). 다른 용매 및 시약을 시그마 알드리치사 또는 피셔 사이언티픽 인코포레이티드로부터 받은 대로 사용하였다.
7.
PEG-b-(PR-r-염료) 블록 공중합체의 합성
PEG-b-(PR-r-AMA) 공중합체(반응식 1)을 원자 이동 라디칼 중합(ATRP) 방법에 의해 처음 합성하였다. 1차 아미노기를 AMA 단량체 대 개시재의 공급비(비 = 3)를 제어함으로써 각각의 중합체 쇄에 도입하였다. 무 염료 공중합체를 중합체 특성규명에서 사용하였다(표 12). 절차를 예시하기 위한 예로서 PEG-b-P(DPA-r-AMA)를 사용하였다. 처음에, DPA-MA(1.7g, 8m㏖), AMA(50㎎, 3m㏖), PMDETA(21㎕, 0.1m㏖) 및 MeO-PEG114-Br(0.5g, 0.1m㏖)을 중합관에 채웠다. 이어서, 2-프로판올(2㎖)과 DMF(2㎖)의 혼합물을 첨가하여 단량체와 개시제를 용해시켰다. 산소를 제거하기 위해 냉동-펌프-해동의 3회 주기 후, CuBr(14.4㎎, 0.1m㏖)을 질소 분위기 하에 반응관에 첨가하고, 관을 진공에서 밀봉시켰다. 중합을 40℃에서 12시간 동안 수행하였다. 중합 후, 반응 혼합물을 10㎖ THF로 희석시키고 나서, Al2O3 칼럼을 통해 통과시켜 촉매를 제거하였다. THF 용매를 회전증발기에 의해 제거하였다. 잔사를 증류수 중에서 투석시키고 나서, 동결건조시켜 백색 분말을 얻었다. 얻어진 PEG-b-(PR-r-AMA) 공중합체를 500 MHz 1H-NMR, 겔 침투 크로마토그래피(비스코텍(Viscotech) GPCmax, 폴리머 랩스사(Polymer Labs)에 의한 PLgel 5㎛ MIXED-D 칼럼, 용리액으로서 1㎖/분에서 THF)에 의해 특성규명하였다. 표 12는 각각의 공중합체의 수율, 분자량(M n 및 M w ) 및 다분산 지수(PDI)를 넣은 것이다.
염료-컨쥬게이팅된 공중합체의 합성은 이하에 기재한 대표적인 절차를 따랐다. TMR 컨쥬게이션을 위해, PEG-b-P(DPA-r-AMA)(50㎎)를 2㎖ DMF 중에서 처음 용해시켰다. 이어서, TMR-NHS 에스터(1차 아미노기의 몰량에 대해 1.5 당량)를 첨가하였다. 반응 혼합물을 실온에서 24시간 동안 교반시켰다. 공중합체를 분취 겔 침투 크로마토그래피(배리언에 의한 PLgel Prep 10㎛ 10E3Å 300×25mm 칼럼, 5㎖/분에서 용리액으로서 THF)에 의해 정제하여 무 염료 분자를 제거하였다. 생성된 PEG-b-P(DPA-TMR) 공중합체를 동결건조시키고 나서, 추가 연구를 위해 -20℃에서 저장하였다. 염료 컨쥬게이션 효율 및 양자 수율을 문헌의 절차에 따라 결정하였다(Ma et al., 2014).
8.
마이셀
나노입자의 제조
마이셀을 앞서 기재한 절차에 따라 제조하였다. 전형적인 절차에서, 10㎎의 PDPA-TMR을 0.5㎖ THF 중에 용해시켰다. 이어서, 혼합물을 초음파 처리 하에 4㎖의 밀리큐 워터에 서서히 첨가하였다. 혼합물을 4회 여과시켜, 미세 한외여과 시스템을 이용하여 THF를 제거하였다. 이어서, 증류수를 첨가하여 저장 용액으로서 중합체 농도를 5㎎/㎖로 조절하였다. 다색 혼성 나노입자에 대해, 5㎎의 PEPA-BDY, 5㎎의 PDPA-TMR 및 5㎎의 PDBA-Cy5를 1㎖ THF 중에 용해시켰다. 이어서, 동일한 절차를 사용하여 혼성 나노입자를 제조하였다. 나노입자를 마이셀 크기 및 형태에 대해 투과 전자 현미경(TEM, JEOL 1200 EX 모델) 및 유체 역학적 직경(D h )에 대해 동적 광산란(DLS, 말번 제타시저 나노-ZS, λ = 632㎚)에 의해 특성규명하였다.
에르비툭스-컨쥬게이팅된 혼성 나노프로브에 대해, 4㎎의 PEPA-BDY, 4㎎의 PDPA-TMR, 4㎎의 PDBA-Cy5 및 0.6㎎의 MAL-PEG-PDPA를 1㎖ THF 중에 용해시켰다. 이어서, 동일한 절차를 사용하여 Mal-혼성 나노프로브를 제조하였다. 마이셀 형성 후에, 1mM EDTA를 함유하는 PBS 완충제 중의 과량의 에르비툭스 Fab'-SH 단편(55 kD)를 첨가하였다. 밤새 N2 분위기 하에 컨쥬게이션이 일어나게 한 다음, 6회 초원심분리시켜 유리 Fab'-SH를 제거하였다. 얻어진 Erb-컨쥬게이팅된 혼성 나노프로브를 세포 이미징 연구를 위해 5㎎/㎖ 중합체 농도로 조절하였다. 동일한 절차를 이용하여 Erb-컨쥬게이팅된 PDPA-TMR 마이셀을 또한 제조하였다.
9.
형광 특성규명
상이한 pH 완충제 용액 중의 형광 방출 스펙트럼을 히타치 형광계(F-7500 모델) 상에서 얻었다. 각각의 중합체 마이셀에 대해, 샘플(5㎎/㎖)을 밀리큐 워터에서 제조하였다. 이어서, 용액을 상이한 pH 값으로 100mM 인산염 완충 식염수(PBS) 중에서 희석시켰다. 최종 중합체 농도를 0.1㎎/㎖에서 제어하였다.
상이한 중합체가 상동성 혼성 마이셀을 형성할 수 있는지의 여부를 입증하기 위해, 본 발명자들은 형광 공명 에너지 전이(FRET) 실험을 이용하여 혼성 마이셀의 형광 특성을 시험하였다. 각각의 나노프로브에 대해, 샘플(5㎎/㎖)을 밀리큐 워터에서 제조하였다. 용액을 100mM PBS 완충제(pH 7.4) 중에서 100㎍/㎖로 희석시켰다. 이어서, 나노프로브를 적절한 여기광(λex= 485, 545 및 640㎚)에 의해 여기시키고, 방출 스펙트럼을 수집하였다.
상이한 pH에서 혼성 나노프로브 용액(0.1㎎/㎖)의 형광 이미지를 적절한 통과대역 여기 필터 및 적절한 롱 패스 방출 필터를 이용하는 마이세트로 생체내 이미징 시스템(매사추세츠주 우번에 소재한 CRI 인코포레이티드) 상에서 캡처하였다.
10.
세포 배양물
인간 폐 소세포 폐암 A549 세포 및 두경부암 HN5 세포를 37℃에서 5% CO2 분위기에서 10% 소 태아 혈청(FBS), 100 IU/㎖ 페니실린 및 100㎍/㎖ 스트렙토마이신으로 보충한 DMEM 배지(캘리포니아주에 소재한 인비트로젠)에서 배양시켰다.
동일한 폐암 환자로부터의 종양-유래(HCC4017) 및 정상 세기관지 상피-유래(HBEC30) 세포주를 얻었다. 정상 기관지 상피세포를 CDK4 및 hTERT의 안정한 발현에 의해 불멸화시켜 HBEC30KT를 생성하였다. p53의 단계적 안정성 억제(HBEC30KT-shTP53), KRASG12V의 안정한 발현(HBEC30KT-shTP53 / KRAS G12V ), 및 LKB1의 안정한 억제(HBEC30KT-shTP53 / KRAS G12V / shLKB1)를 지니는 HBEC30KT 유도체의 일련의 세포주를 또한 얻었다.
HBEC30KT 진행 시리즈 및 HCC4017 세포를 37℃에서 5% CO2 분위기에서 2% 소 태아 혈청(FBS), 100 IU/㎖ 페니실린 및 100 ㎍/㎖ 스트렙토마이신으로 보충한 ACL4 배지에서 배양시켰다.
11.
살아있는 세포에서
에르비툭스
-
컨쥬게이팅된
혼성
나노프로브의
다단계 활성화
A549 및 HN5 세포를 2㎖ 완전 DMEM 배지 내 유리 바닥 접시(매사추세츠주에 소재한 매트텍)에서 플레이팅하였다. 에르비툭스-컨쥬게이팅된 나노프로브의 특이성을 시험하기 위해, A549 세포를 37℃에서 1시간 동안 Erb-PDPA-TMR 마이셀을 함유하는 완전 배지와 함께 인큐베이션시키고, 이어서, 배지를 제거하고 나서, 3회 세척하였다. 공초점 이미지를 60× 대물렌즈를 지니는 니콘 ECLIPSE TE2000-E 공초점 현미경에 의해 캡처하였다.
혼성 나노프로브 내 3개 구성성분의 동시통합화된 흡수를 입증하기 위해, 완전 배지 내 A549 세포를 4℃에서 10분 동안 유지하고, 이어서, 100㎍/㎖의 Erb-컨쥬게이팅된 혼성 나노프로브를 첨가하고 나서, 30분 동안 4℃에서 표피성장인자 수용기(EGFR) 결합 동안 유지하였다. 배지를 제거하고 나서, 빙냉 PBS로 3회 세척하였다. 이후에, 세포를 3시간 동안 37℃에서 완전 배지와 함께 인큐베이션시켰다. BDY493, TMR 및 Cy5를 각각 488, 543 및 633㎚에서 여기시켰다. FITC(515 ± 15㎚), TRITC(590 ± 25㎚) 및 Cy5(650㎚ LP) 필터를 각각 BDY493, TMR 및 Cy5 이미징을 위해 사용하였다. 대조군에 대해, PEPA-BDY493, Erb-PDPA-TMR, 및 PDBA-Cy5 마이셀을 제조하고 나서, 혼합하고 A549 세포와 함께 인큐베이션시켰다. 펄스 추적 연구를 위해 동일한 절차를 이용하였다.
12.
에르비툭스
-
컨쥬게이팅된
혼성
나노프로브를
이용하는
내포작용
동안의
엔도좀
성숙 추적
펄스 추적 실험을 이용하여 엔도좀 성숙 과정을 추적하였다. 완전 배지 내 세포를 4℃에서 10분 동안 유지하고, 이어서, 100㎍/㎖의 Erb-컨쥬게이팅된 혼성 나노프로브를 첨가하고 나서, EGFR 결합을 위해 30분 동안 4℃에서 유지시켰다. 배지를 제거하고 나서, 빙냉 PBS로 3회 세척하였다. 이후에, 세포를 37℃에서 완전 배지와 함께 인큐베이션시켰다. 공초점 이미지를 마이셀의 첨가 후 0, 15, 30, 60분, 2.5 및 5시간에 100× 대물렌즈를 지는 니콘 ECLIPSE TE2000-E 공초점 현미경에 의해 캡처하였다. BDY493, TMR 및 Cy5를 각각 488, 543 및 633㎚에서 여기시켰다. FITC(515 ± 15㎚), TRITC(590 ± 25㎚) 및 Cy5(650㎚ LP) 필터를 각각 BDY493, TMR 및 Cy5 이미징을 위해 사용하였다. 이미지-J 소프트웨어를 이용하여 이미지를 분석하였다. 5회의 독립적 측정을 평균 ± 표준 편차로서 제시하였다.
실시예
15:
삼블록
공중합체
PEO
-
b
-P(R
1
-
b
-R
2
)의 합성
PEG-b-P(R1-b-R2) 삼블록 공중합체를 앞서 보고한 것과 유사한 절차에 따른 ATRP 방법에 의해 합성하였다. 절차를 예시하기 위한 예로서 PEO-b-P(D5a-b-DEA)를 사용하였다. 처음에, D5a-MA(0.54g, 2m㏖), PMDETA(12㎕, 0.05m㏖) 및 MeO-PEO114-Br(0.25g, 0.05m㏖)을 중합관에 채웠다. 이어서, 2-프로판올(1㎖)과 DMF(1㎖)의 혼합물을 첨가하여 단량체와 개시제를 용해시켰다. 산소를 제거하기 위해 냉동-펌프-해동의 3회 주기 후, CuBr(7㎎, 0.05m㏖)을 질소 분위기 하에 반응관에 첨가하고, 관을 진공에서 밀봉시켰다. 40℃에서 8시간 동안 중합을 수행한 후, 탈산소화된 DEA-MA(0.368, 2m㏖)를 기밀 주사기를 통해 반응 용액에 주사하고, 반응 혼합물을 40℃에서 추가 8시간 동안 교반시켰다. 중합 후, 반응 혼합물을 10㎖ THF로 희석시키고 나서, 중성 Al2O3 칼럼을 통해 통과시켜 촉매를 제거하였다. THF 용매를 회전증발기에 의해 제거하였다. 잔사를 증류수 중에서 투석시키고 나서, 동결건조시켜 백색 분말을 얻었다. DEA 및 D5a의 공급 순서를 반대로 함으로써 PEO-b-P(DEA-b-D5a)를 또한 합성할 수 있다. pH 적정 실험은 PEO-b-P(D5a40-b-DEA40) 또는 PEO-b-P(DEA 40-b-D5a40)에 대한 두 독특한 이온 전이를 나타내었다. 대조적으로, 단지 하나의 pH 전이를 대응하는 무작위 PR 블록 공중합체에 대해 관찰하였다(도 113a 및 도 113b).
* * * * * * * * * * * * * * * * * * * * *
본 명세서에 개시되고 청구된 모든 조성물 및 방법을 본 개시내용에 비추어 과도한 실험 없이 제조하고 실행할 수 있다. 본 개시내용의 조성물 및 방법은 특정 실시형태에 관해 기재하였지만, 변화가 조성물 및 방법에 그리고 개시내용의 개념, 정신 및 범주로부터 벗어나는 일 없이 본 명세서에 기재된 방법 단계의 순서에서 적용될 수 있다는 것은 당업자에게 분명할 것이다. 더 구체적으로, 화학적으로 그리고 생리학적으로 관련된 특정 제제는 본 명세서에 기재된 제제로 치환될 수 있는 한편, 동일 또는 유사한 결과가 달성된다는 것은 명확할 것이다. 당업자에게 명확한 모든 이러한 유사한 치환체 및 변형은 첨부된 청구범위에 의해 정해지는 개시내용의 정신, 범주 및 개념 내인 것으로 여겨진다.
참고문헌
다음의 참고문헌은 그들이 본 명세서에 제시된 것에 대해 보충적인 예시적인 절차 또는 다른 상세한 설명을 제공하는 정도로 본 명세서에 참고로 구체적으로 포함된다.
Claims (164)
- 하기 화학식의 중합체:
식 중:
R1은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 치환된 사이클로알킬(C≤12),, 또는 금속 킬레이트기이고;
n은 1 내지 500의 정수이며;
R2 및 R2'는 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고;
R3은 하기 화학식의 기이며:
식 중:
nx는 1 내지 10이며;
X1, X2 및 X3은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고; 그리고
X4 및 X5는 알킬(C≤12), 사이클로알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4 및 X5는 함께 취해지고 알칸다이일(C≤12), 알콕시다이일(C≤12), 알킬아미노다이일(C≤12), 또는 임의의 이들 기의 치환된 형태이며;
x는 1 내지 150의 정수이고;
R4는 하기 화학식의 기이며:
식 중:
ny는 1 내지 10이며;
X1', X2' 및 X3'는 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고; 그리고
X4' 및 X5'는 알킬(C≤12), 사이클로알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4' 및 X5'는 함께 취해지고, 알칸다이일(C≤12), 알콕시다이일(C≤12), 알킬아미노다이일(C≤12), 또는 임의의 이들 기의 치환된 형태이며;
y는 1 내지 150의 정수이고;
R5는 하기 화학식의 기이며:
식 중:
nz는 1 내지 10이고;
Y1, Y2 및 Y3은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되며; 그리고
Y4는 수소, 알킬(C≤12), 아실(C≤12), 치환된 알킬(C≤12), 치환된 아실(C≤12), 염료, 또는 형광 소광제이며;
z는 0 내지 6의 정수이고; 그리고
R6은 수소, 할로, 하이드록시, 알킬(C≤12), 또는 치환된 알킬(C≤12)이되,
R3, R4 및 R5는 중합체 내에서 임의의 순서로 생길 수 있고, 단, R3과 R4는 동일한 기가 아니다. - 제1항에 있어서, 하기 화학식에 의해 추가로 나타내는, 중합체:
R1은 수소, 알킬(C≤12), 치환된 알킬(C≤12), 또는 , 또는 금속 킬레이트기이고;
n은 10 내지 500의 정수이며;
R2 및 R2'는 수소, 알킬(C≤12) 또는 치환된 알킬(C≤12)로부터 각각 독립적으로 선택되고;
R3은 하기 화학식의 기이며:
식 중: X1, X2 및 X3은 수소, 알킬(C≤12) 또는 치환된 알킬(C≤12)로부터 각각 독립적으로 선택되고; 그리고
X4 및 X5는 알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4 및 X5는 함께 취해지고, 알칸다이일(C≤8), 알콕시다이일(C≤8), 알킬아미노다이일(C≤8), 또는 임의의 이들 기의 치환된 형태이며;
x는 1 내지 100의 정수이고;
R4는 하기 화학식의 기이며:
식 중: X1', X2' 및 X3'는 수소, 알킬(C≤12), 또는 치환된 알킬(C≤12)로부터 각각 독립적으로 선택되고; 그리고
X4' 및 X5'는 알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4' 및 X5'는 함께 취해지고, 알칸다이일(C≤8), 알콕시다이일(C≤8), 알킬아미노다이일(C≤8), 또는 임의의 이들 기의 치환된 형태이며;
y는 1 내지 100의 정수이고;
R5는 하기 화학식의 기이며,
식 중: Y1, Y2 및 Y3은 수소, 알킬(C≤12), 치환된 알킬(C≤12)로부터 각각 독립적으로 선택되고; 그리고
Y4는 수소, 아실(C≤12), 치환된 아실(C≤12), 염료, 또는 형광 소광제이며;
z는 0 내지 6의 정수이고; 그리고
R6은 수소, 할로, 알킬(C≤12), 또는 치환된 알킬(C≤12)이되,
R3, R4 및 R5는 중합체 내에서 임의의 순서로 일어날 수 있고, 단, R3 및 R4는 동일한 기가 아니다. - 제1항 또는 제2항에 있어서, 하기 화학식에 의해 추가로 나타내는, 중합체:
R1은 수소, 알킬(C≤8), 치환된 알킬(C≤8), 또는 , 또는 금속 킬레이트기이고;
n은 10 내지 200의 정수이며;
R2 및 R2'는 수소, 알킬(C≤8), 또는 치환된 알킬(C≤8)로부터 각각 독립적으로 선택되고;
R3은 하기 화학식의 기이며:
식 중: X1, X2 및 X3은 수소, 알킬(C≤8), 또는 치환된 알킬(C≤8)로부터 각각 독립적으로 선택되고; 그리고
X4 및 X5는 알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4 및 X5는 함께 취해지고 알칸다이일(C≤8) 또는 치환된 알칸다이일(C≤8)이며;
x는 1 내지 100의 정수이고;
R4는 하기 화학식의 기이며:
식 중: X1', X2' 및 X3'는 수소, 알킬(C≤8), 또는 치환된 알킬(C≤8)로부터 각각 독립적으로 선택되고; 그리고
X4' 및 X5'는 알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4' 및 X5'는 함께 취해지고, 알칸다이일(C≤8) 또는 치환된 알칸다이일(C≤8)이며;
y는 1 내지 100의 정수이고;
R5는 하기 화학식의 기이다:
식 중:
Y1, Y2 및 Y3는 수소, 알킬(C≤8), 치환된 알킬(C≤8)로부터 각각 독립적으로 선택되고;
Y4는 수소, 염료, 또는 형광 소광제이고;
z는 0 내지 6의 정수이며; 그리고
R6은 수소, 할로, 알킬(C≤6), 또는 치환된 알킬(C≤6)이되,
R3, R4 및 R5는 중합체 내에서 임의의 순서로 생길 수 있고, 단, R3과 R4는 동일한 기가 아니다. - 제1항 내지 제3항 중 어느 한 항에 있어서, R1은 수소인, 중합체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, R1은 알킬(C≤6)인, 중합체.
- 제5항에 있어서, R1은 메틸인, 중합체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, R1은 금속 킬레이트기인, 중합체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, R1은 DOTA, TETA, 다이암사르(Diamsar), NOTA, NETA, TACN-TM, DTPA, TRAP, NOPO, AAZTA, DATA, HBED, SHBED, BPCA, CP256, DFO, PCTA, HEHA, PEPA, 또는 이들의 유도체로부터 선택된 금속 킬레이트기인, 중합체.
- 제8항에 있어서, 상기 금속 킬레이트기는 질소 함유 거대고리인, 중합체.
- 제8항에 있어서, 상기 질소 함유 거대고리는 하기 화학식의 화합물인, 중합체:
식 중:
R7, R8, R9, R10, R7', R8' 및 R9'는 수소, 알킬(C≤12), 아실(C≤12), -알칸다이일(C≤12)-아실(C≤12), 또는 임의의 이들 기의 치환된 형태; 또는 링커로부터 각각 독립적으로 선택되되, 상기 링커는 알칸다이일(C≤12)-C(O)NH- 또는 치환된 알칸다이일(C≤12)-C(O)NH-이거나; 또는
R7은 R8, R9 또는 R10 중 하나와 함께 취해지고, 알칸다이일(C≤6)이거나; 또는
R8은 R7, R9 또는 R10 중 하나와 함께 취해지고, 알칸다이일(C≤6)이거나; 또는
R9는 R7, R8 또는 R10 중 하나와 함께 취해지고, 알칸다이일(C≤6)이거나; 또는
R10은 R7, R8 또는 R9 중 하나와 함께 취해지고 알칸다이일(C≤6)이거나; 또는
R7'는 R8' 또는 R9' 중 하나와 함께 취해지고, 알칸다이일(C≤6)이거나; 또는
R8'는 R7' 또는 R9' 중 하나와 함께 취해지고, 알칸다이일(C≤6)이거나; 또는
R9'는 R7' 또는 R8' 중 하나와 함께 취해지고, 알칸다이일(C≤6)이고; 그리고
a, b, c, d, a', b', 및 c'는 1, 2, 3 또는 4로부터 각각 독립적으로 선택된다. - 제11항에 있어서, a, b, c, d, a', b' 및 c'는 2 또는 3으로부터 각각 독립적으로 선택되는, 중합체.
- 제1항 내지 제3항 및 제8항 내지 제13항 중 어느 한 항에 있어서, 상기 금속 킬레이팅 착물은 금속 이온에 결합되는, 중합체.
- 제14항에 있어서, 상기 금속 이온은 방사성핵종 또는 방사성금속인, 중합체.
- 제14항에 있어서, 상기 금속 이온은 PET 또는 SPECT 이미징에 적합한, 중합체.
- 제14항에 있어서, 상기 금속 킬레이팅 착물은 전이 금속 이온에 결합되는, 중합체.
- 제14항에 있어서, 상기 금속 이온은 구리 이온, 갈륨 이온, 스칸듐 이온, 인듐 이온, 루테튬 이온, 이테르븀 이온, 지르코늄 이온, 비스무트 이온, 납 이온, 악티튬 이온, 또는 테크네튬 이온인, 중합체.
- 제18항에 있어서, 상기 금속 이온은 99 m Tc, 60Cu, 61Cu, 62Cu, 64Cu, 86Y, 90Y, 89Zr, 44Sc, 47Sc, 66Ga, 67Ga, 68Ga, 111In, 177Lu, 225ac, 212Pb, 212bi, 213bi, 111In, 114 m In, 114In, 186Re 또는 188Re로부터 선택되는 동위원소인, 중합체.
- 제17항에 있어서, 상기 전이 금속은 구리(II) 이온인, 중합체.
- 제20항에 있어서, 상기 구리(II) 이온은 64Cu2 + 이온인, 중합체.
- 제1항 내지 제7항 중 어느 한 항에 있어서, R2는 알킬(C≤6)인, 중합체.
- 제23항에 있어서, R2은 메틸인, 중합체.
- 제1항 내지 제24항 중 어느 한 항에 있어서, R2'는 알킬(C≤6)인, 중합체.
- 제25항에 있어서, R2'는 메틸인, 중합체.
- 제27항에 있어서, X1은 알킬(C≤6)인, 중합체.
- 제28항에 있어서, X1은 메틸인, 중합체.
- 제27항 내지 제29항 중 어느 한 항에 있어서, X4는 알킬(C≤8)인, 중합체.
- 제30항에 있어서, X4는 메틸, 에틸, 프로필, 부틸 또는 펜틸인, 중합체.
- 제27항 내지 제31항 중 어느 한 항에 있어서, X5는 알킬(C≤8)인, 중합체.
- 제32항에 있어서, X5는 메틸, 에틸, 프로필, 부틸 또는 펜틸인, 중합체.
- 제34항에 있어서, X1'는 알킬(C≤6)인, 중합체.
- 제35항에 있어서, X1은 메틸인, 중합체.
- 제34항 내지 제36항 중 어느 한 항에 있어서, X4'는 알킬(C≤8)인, 중합체.
- 제37항에 있어서, X4'는 메틸, 에틸, 프로필, 부틸 또는 펜틸인, 중합체.
- 제34항 내지 제38항 중 어느 한 항에 있어서, X5'는 알킬(C≤8)인, 중합체.
- 제39항에 있어서, X5'는 메틸, 에틸, 프로필, 부틸 또는 펜틸인, 중합체.
- 제1항 내지 제40항 중 어느 한 항에 있어서, 각각의 R3은 구성적으로 혼입되어 블록을 형성하는, 중합체.
- 제1항 내지 제41항 중 어느 한 항에 있어서, 각각의 R4는 구성적으로 혼입되어 블록을 형성하는, 중합체.
- 제1항 내지 제42항 중 어느 한 항에 있어서, R3은 블록으로서 존재하고, R4는 블록으로서 존재하는, 중합체.
- 제1항 내지 제40항 중 어느 한 항에 있어서, R3 및 R4는 상기 중합체 내에 무작위로 혼입되는, 중합체.
- 제45항에 있어서, Y1은 알킬(C≤6)인, 중합체.
- 제46항에 있어서, Y1은 메틸인, 중합체.
- 제45항 내지 제47항 중 어느 한 항에 있어서, Y4는 수소인, 중합체.
- 제45항 내지 제47항 중 어느 한 항에 있어서, Y4는 염료인, 중합체.
- 제49항에 있어서, Y4는 형광 염료인, 중합체.
- 제50항에 있어서, 상기 형광 염료는 쿠마린, 플루오레세인, 로다민, 잔텐, 보디피(BODIPY)(등록상표), 알렉사 플루오르(Alexa Fluor)(등록상표) 또는 사이아닌 염료인, 중합체.
- 제50항에 있어서, 상기 형광 염료는 인도사이아닌 그린, AMCA-x, 마리나 블루, PyMPO, 로다민 그린(Rhodamine Green)(상표명), 테트라메틸로다민, 5-카복시-X-로다민, 보디피493, 보디피 TMR-x, 보디피630, 사이아닌3.5, 사이아닌5, 사이아닌5.5, 및 사이아닌7.5인, 중합체.
- 제50항에 있어서, 상기 형광 염료는 인도사이아닌 그린인, 중합체.
- 제45항 내지 제47항 중 어느 한 항에 있어서, Y4는 형광 소광제인, 중합체.
- 제54항에 있어서, 상기 형광 소광제는 QSY7, QSY21, QSY35, BHQ1, BHQ2, BHQ3, TQ1, TQ2, TQ3, TQ4, TQ5, TQ6 및 TQ7인, 중합체.
- 제1항 내지 제52항 중 어느 한 항에 있어서, n은 75 내지 150인, 중합체.
- 제56항에 있어서, n은 100 내지 125인, 중합체.
- 제1항 내지 제57항 중 어느 한 항에 있어서, x는 1 내지 99인, 중합체.
- 제58항에 있어서, x는 1 내지 5, 5 내지 10, 10 내지 15, 15 내지 20, 20 내지 25, 25 내지 30, 30 내지 35, 35 내지 40, 40 내지 45, 45 내지 50, 50 내지 55, 55 내지 60, 60 내지 65, 65 내지 70, 70 내지 75, 75 내지 80, 80 내지 85, 85 내지 90, 90 내지 95, 95 내지 99 또는 이 안에서 유도될 수 있는 임의의 범위인, 중합체.
- 제1항 내지 제59항 중 어느 한 항에 있어서, y는 1 내지 99인, 중합체.
- 제60항에 있어서, y는 1 내지 5, 5 내지 10, 10 내지 15, 15 내지 20, 20 내지 25, 25 내지 30, 30 내지 35, 35 내지 40, 40 내지 45, 45 내지 50, 50 내지 55, 55 내지 60, 60 내지 65, 65 내지 70, 70 내지 75, 75 내지 80, 80 내지 85, 85 내지 90, 90 내지 95, 95 내지 99 또는 이 안에서 유도될 수 있는 임의의 범위인, 중합체.
- 제1항 내지 제61항 중 어느 한 항에 있어서, z는 0 내지 6인, 중합체.
- 제1항 내지 제61항 중 어느 한 항에 있어서, z는 1 내지 6인, 중합체.
- 제62항에 있어서, z는 0 내지 2, 2 내지 4, 4 내지 6, 또는 이 안에서 유도될 수 있는 임의의 범위인, 중합체.
- 제1항 내지 제64항 중 어느 한 항에 있어서, R3, R4 및 R5는 중합체 내에서 임의의 순서로 생길 수 있는, 중합체.
- 제1항 내지 제64항 중 어느 한 항에 있어서, R3, R4 및 R5는 화학식 I에서 기재된 순서로 일어나는, 중합체.
- 제1항 내지 제66항 중 어느 한 항에 있어서, 상기 중합체는 표적 모이어티를 추가로 포함하는, 중합체.
- 제67항에 있어서, 상기 표적 모이어티는 소분자, 항체, 항체 단편, 또는 신호전달 펩타이드인, 중합체.
- 제1항 내지 제69항 중 어느 한 항에 있어서, 상기 중합체는 PEO114-P(DEA20-D5a60), PEO114-P(DEA40-D5a40), PEO114-P(DEA60-D5a20), PEO114-P(DPA60-DBA20), PEO114-P(DPA40-DBA40), PEO114-P(DPA20-DBA60), PEO114-P(DEA76-DPA24), PEO114-P(DEA58-DPA42), PEO114-P(DEA39-DPA61), PEO114-P(DEA21-DPA79), PEO114-P(DPA30-DBA50), PEO114-P(DBA28-D5a52), PEO114-P(DBA56-D5a24), PEO114-P(DEA20-D5a60-AMA3), PEO114-P(DEA40-D5a40-AMA3), PEO114-P(DEA60-D5a20-AMA3), PEO114-P(DPA60-DBA20-AMA3), PEO114-P(DPA40-DBA40-AMA3), PEO114-P(DPA20-DBA60-AMA3), PEO114-P(DEA76-DPA24-AMA3), PEO114-P(DEA58-DPA42-AMA3), PEO114-P(DEA39-DPA61-AMA3), PEO114-P(DEA21-DPA79-AMA3), PEO114-P(DPA30-DBA50-AMA3), PEO114-P(DBA28-D5a52-AMA3), PEO114-P(DBA56-D5a24-AMA3), PEO114-P(DEA11-EPA89), PEO114-P(DEA22-EPA78), PEO114-P(EPA90-DPA10) 또는 PEO114-P(EPA79-DPA21)인, 중합체.
- 하기 화학식의 중합체:
식 중:
R1은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 치환된 사이클로알킬(C≤12), 또는, 또는 금속 킬레이트기이고;
n은 1 내지 500의 정수이며;
R2 및 R2'는 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고;
R3은 하기 화학식의 기이며:
식 중:
nx는 1 내지 10이고;
X1, X2 및 X3은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고;
X4는 펜틸, n-프로필 또는 에틸이며; 그리고
X5는 펜틸 또는 n-프로필이고;
x는 1 내지 100의 정수이며;
R4는 하기 화학식의 기이고:
식 중:
Y1, Y2 및 Y3은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고; 그리고
Y4는 수소, 알킬(C≤12), 아실(C≤12), 치환된 알킬(C≤12), 치환된 아실(C≤12), 염료, 또는 형광 소광제이며;
y는 1 내지 6의 정수이고; 그리고
R5는 수소, 할로, 하이드록시, 알킬(C≤12), 또는 치환된 알킬(C≤12)이다. - 제71항에 있어서, Y4는 형광 염료인, 중합체.
- 제72항에 있어서, 상기 형광 염료는 인도사이아닌 그린인, 중합체.
- 제71항에 있어서, 상기 중합체는 PEO114-P(D5a80), PEO114-P(D5a100), PEO114-P(DPA80), PEO114-P(DPA100), PEO114-P(EPA80) 및 PEO114-P(EPA100)인, 중합체.
- 제1항 내지 제74항 중 어느 한 항에 따른 중합체의 마이셀.
- 제1 중합체의 마이셀을 포함하는 pH 반응 시스템으로서, 상기 제1 중합체는 제1항 내지 제74항 중 어느 한 항의 화학식을 가지며, z는 0이 아니고, Y4는 염료이며, 상기 마이셀은 pH 전이점 및 방출 스펙트럼을 갖는, pH 반응 시스템.
- 제77항에 있어서, 상기 마이셀은 제1항 내지 제74항 중 어느 한 항의 화학식을 지니는 제2 중합체를 더 포함하되, z는 0이 아니고, Y4는 형광 소광제인, pH 반응 시스템.
- 제78항에 있어서, 상기 제2 중합체는 Y4가 형광 소광제인 것을 제외하고, 제1 중합체와 동일한 화학식을 갖는, pH 반응 시스템.
- 제77항에 있어서, 상기 마이셀은 제1항 내지 제74항 중 어느 한 항의 화학식을 지니는 제2 중합체를 포함하는 조성물을 포함하되, 상기 제2 중합체는 상기 제1 중합체와 상이한 화학식을 갖는, pH 반응 시스템.
- 제80항에 있어서, 상기 제2 중합체 상의 Y4는 상기 제1 중합체 상의 상기 Y4와 상이한 염료인, pH 반응 시스템.
- 제80항에 있어서, 상기 마이셀은 1 내지 6개의 추가적인 중합체를 더 포함하되, 단, 각각의 중합체가 상기 제1 중합체 및 상기 제2 중합체와 상이하다는 점에서 각각의 중합체는 독특한, pH 반응 시스템.
- 제77항 내지 제82항 중 어느 한 항에 있어서, 상기 pH 전이점은 3 내지 9인, pH 반응 시스템.
- 제83항에 있어서, 상기 pH 전이점은 4 내지 8인, pH 반응 시스템.
- 제83항에 있어서, 상기 pH 전이점은 4 내지 6인, pH 반응 시스템.
- 제83항에 있어서, 상기 pH 전이점은 6 내지 7.5인, pH 반응 시스템.
- 제84항에 있어서, 상기 pH 전이점은 4.38, 4.67, 4.96, 5.27, 5.63, 5.91, 6.21, 6.45, 6.76, 7.08 또는 7.44인, pH 반응 시스템.
- 제77항 내지 제87항 중 어느 한 항에 있어서, 상기 방출 스펙트럼은 400 내지 850㎚인, pH 반응 시스템.
- 제77항 내지 제88항 중 어느 한 항에 있어서, 상기 시스템은 pH 반응(ΔpH10 -90%)이 1 미만의 pH 단위인, pH 반응 시스템.
- 제89항에 있어서, 상기 pH 반응은 0.25 미만의 pH 단위인, pH 반응 시스템.
- 제90항에 있어서, 상기 pH 반응은 0.15 미만의 pH 단위인, pH 반응 시스템.
- 제77항 내지 제91항 중 어느 한 항에 있어서, 상기 형광 신호는 형광 활성화 비가 25 초과인, pH 반응 시스템.
- 제92항에 있어서, 상기 형광 활성화 비는 50 초과의, pH 반응 시스템.
- 세포내 또는 세포외 환경의 pH를 이미징하는 방법으로서,
(a) 제77항 내지 제93항의 pH 반응 시스템을 상기 환경과 접촉시키는 단계; 및
(b) 상기 환경으로부터의 하나 이상의 광학 신호를 검출하는 단계를 포함하되, 상기 광학 신호의 상기 검출은 상기 마이셀이 그의 pH 전이점에 도달되었고, 해리되었음을 나타내는, pH를 이미징하는 방법. - 제94항에 있어서, 상기 광학 신호는 형광 신호인, pH를 이미징하는 방법.
- 제94항 또는 제95항에 있어서, 상기 세포내 환경이 이미징될 때, 상기 세포는 상기 pH 반응 시스템의 흡수를 야기하는데 적합한 조건 하에서 상기 pH 반응 시스템과 접촉되는, pH를 이미징하는 방법.
- 제94항 내지 제96항 중 어느 한 항에 있어서, 상기 세포내 환경은 세포의 부분인, pH를 이미징하는 방법.
- 제97항에 있어서, 상기 세포의 부분은 리소좀 또는 엔도좀인, pH를 이미징하는 방법.
- 제94항 또는 제96항에 있어서, 상기 세포외 환경은 종양 또는 혈관 세포의 환경인, pH를 이미징하는 방법.
- 제94항 또는 제96항에 있어서, 상기 세포외 환경은 혈관내 또는 혈관외인, pH를 이미징하는 방법.
- 제99항에 있어서, 상기 종양 환경의 상기 pH를 이미징하는 것은 감시림프절 또는 결절을 이미징하는 것을 포함하는, pH를 이미징하는 방법.
- 제101항에 있어서, 이미징 감시림프절 또는 결절은 상기 종양의 상기 수술적 절제 또는 상기 종양 전이의 병기화를 허용하는, pH를 이미징하는 방법.
- 제99항 내지 제102항 중 어느 한 항에 있어서, 상기 종양 환경의 상기 pH를 이미징하는 것은 상기 종양 크기 및 경계의 결정을 허용하는, pH를 이미징하는 방법.
- 제103항에 있어서, 상기 종양 환경의 상기 pH를 이미징하는 것은 수술 동안 상기 종양의 더 정확한 제거를 허용하는, pH를 이미징하는 방법.
- 제103항에 있어서, 상기 감시 림프절 또는 결절의 상기 pH를 이미징하는 것은 수술 동안 감시 림프절 또는 결절의 더 정확한 제거를 허용하는, pH를 이미징하는 방법.
- 제94항에 있어서, 상기 방법은 하기 단계들을 더 포함하는, pH를 이미징하는 방법:
(a) 상기 세포를 관심 대상의 화합물과 접촉시키는 단계;
(b) 상기 환경에서 하나 이상의 광학 신호를 검출하는 단계; 및
(c) 상기 광학 신호에서의 변화가 상기 세포를 상기 관심 대상의 화합물과 접촉시킨 후 생기는지의 여부를 결정하는 단계. - 제106항에 있어서, 상기 관심 대상의 화합물은 약물, 항체, 펩타이드, 단백질, 핵산 또는 소분자인, pH를 이미징하는 방법.
- 관심 대상의 화합물을 표적 세포에 전달하는 방법으로서,
(a) 상기 관심 대상의 화합물을 제1항 내지 제74항의 중합체의 pH 반응 시스템과 함께 캡슐화하는 단계; 및
(b) 상기 표적 세포의 상기 pH를 상기 pH 반응 시스템의 해리 및 화합물의 방출을 촉발시키는 조건 하에서 상기 표적 세포를 상기 pH 반응 시스템과 접촉시킴으로써, 상기 관심 대상의 화합물을 전달하는 단계를 포함하는, 상기 관심 대상의 화합물을 표적 세포에 전달하는 방법. - 제108항에 있어서, 상기 관심 대상의 화합물을 상기 세포에 전달하는, 관심 대상의 화합물을 표적 세포에 전달하는 방법.
- 제108항에 있어서, 상기 관심 대상의 화합물을 상기 세포에 전달하는, 관심 대상의 화합물을 표적 세포에 전달하는 방법.
- 제108항 내지 제110항 중 어느 한 항에 있어서, 상기 관심 대상의 화합물은 약물, 항체, 펩타이드, 단백질, 핵산 또는 소분자인, 관심 대상의 화합물을 표적 세포에 전달하는 방법.
- 제108항 내지 제111항 중 어느 한 항에 있어서, 상기 pH 반응 시스템을 환자에게 투여하는 단계를 포함하는, 관심 대상의 화합물을 표적 세포에 전달하는 방법.
- 환자에서 종양을 절제하는 방법으로서,
(a) 상기 환자에게 유효량의 제77항 내지 제93항 중 어느 한 항에 따른 pH 반응 시스템을 투여하는 단계;
(b) 상기 환자에 대해 하나 이상의 광학 신호를 검출하는 단계로서, 상기 광학 신호는 종양의 존재를 나타내는, 상기 광학 신호를 검출하는 단계; 및
(c) 수술을 통해 상기 종양을 절제하는 단계를 포함하는, 환자에서 종양을 절제하는 방법. - 제113항에 있어서, 상기 광학 신호는 상기 종양의 상기 경계를 나타내는, 환자에서 종양을 절제하는 방법.
- 제113항 또는 제114항에 있어서, 상기 종양은 90% 절제된, 환자에서 종양을 절제하는 방법.
- 제115항에 있어서, 상기 종양은 95% 절제된, 환자에서 종양을 절제하는 방법.
- 제116항에 있어서, 상기 종양은 99% 절제된, 환자에서 종양을 절제하는 방법.
- 제113항 내지 제117항 중 어느 한 항에 있어서, 상기 종양은 고형 종양인, 환자에서 종양을 절제하는 방법.
- 제118항에 있어서, 상기 고형 종양은 암으로부터 유래된, 환자에서 종양을 절제하는 방법.
- 제119항에 있어서, 상기 암은 유방암 또는 두경부암인, 환자에서 종양을 절제하는 방법.
- 제120항에 있어서, 상기 암은 두경부 편평 세포 암종인, 환자에서 종양을 절제하는 방법.
- 암 치료가 필요한 환자에게 제77항 내지 제93항 중 어느 한 항에 따른 pH 반응 시스템을 투여하는 단계를 포함하는, 환자에서 엔도좀/리소좀 pH 저지에 민감한 암을 치료하는 방법.
- 제123항에 있어서, 상기 암은 폐암인, 암을 치료하는 방법.
- 제124항에 있어서, 상기 암은 비소세포 폐암인, 암을 치료하는 방법.
- 제123항 내지 제125항 중 어느 한 항에 있어서, 상기 암은 KRAS 유전자에서의 돌연변이를 포함하는, 암을 치료하는 방법.
- 제123항 내지 제125항 중 어느 한 항에 있어서, 상기 암은 LKB1 유전자에서의 돌연변이를 포함하는, 암을 치료하는 방법.
- 제123항 내지 제127항 중 어느 한 항에 있어서, 상기 암은 KRAS와 LKB1 유전자 둘 다에서 돌연변이를 포함하는, 암을 치료하는 방법.
- 제123항 내지 제128항 중 어느 한 항에 있어서, 상기 방법은 세포자멸사를 유도하는데 충분한, 암을 치료하는 방법.
- 세포 내 유전자 돌연변이의 존재를 동정하는 방법으로서,
(a) 제77항 내지 제93항의 2 이상의 마이셀을 포함하는 pH 반응 시스템을 상기 세포 또는 세포의 환경과 접촉시키는 단계; 및
(b) 상기 환경으로부터의 2 이상의 광학 신호를 검출하는 단계로서, 상기 광학 신호의 상기 검출은 상기 마이셀 중 하나가 그의 pH 전이점에 도달되고, 해리되었음을 나타내는, 상기 광학 신호를 검출하는 단계; 및
(c) 2 이상의 광학 신호를 상호 관련지어서 상기 세포 내 상기 유전자 돌연변이의 존재를 결정하는 단계를 포함하는, 세포 내 유전자 돌연변이의 존재를 동정하는 방법. - 제130항에 있어서, 상기 유전자 돌연변이는 KRAS 유전자 내 돌연변이인, 세포 내 유전자 돌연변이의 존재를 동정하는 방법.
- 제130항 또는 제131항에 있어서, 상기 2 이상의 마이셀은 6.9, 6.2 및 5.3에서 pH 전이점을 지니는 3개의 마이셀을 포함하는, 세포 내 유전자 돌연변이의 존재를 동정하는 방법.
- 제130항 내지 제132항 중 어느 한 항에 있어서, 각각 3개의 마이셀은 PDPA-TMR, PEPA-BDY493 및 PDBA-Cy5로부터 선택된 중합체로부터 제조된, 세포 내 유전자 돌연변이의 존재를 동정하는 방법.
- 제130항 내지 제133항 중 어느 한 항에 있어서, 상기 방법은 생체내에서 수행되고, 상기 하나 이상의 마이셀을 환자에게 투여하는 것을 포함하여 세포를 접촉시키는, 세포 내 유전자 돌연변이의 존재를 동정하는 방법.
- 종양 산성혈증 경로를 동정하는 방법으로서,
(a) 제77항 내지 제93항의 하나 이상의 마이셀을 포함하는 pH 반응 시스템을 세포 또는 세포 환경과 접촉시키는 단계;
(b) 상기 세포를 상기 pH 조절 경로의 저해제와 접촉시키는 단계;
(c) 상기 세포 또는 세포의 환경으로부터 2 이상의 광학 신호를 검출하는 단계로서, 상기 광학 신호의 상기 검출은 상기 마이셀 중 하나가 그의 pH 전이점에 도달되고 해리되었음을 나타내는, 상기 광학 신호를 검출하는 단계; 및
(d) 2 이상의 광학 신호를 상기 종양 산성혈증 경로에서의 변형과 상호 연관 짓는 단계를 포함하는, 종양 산성혈증 경로를 동정하는 방법. - 제135항에 있어서, 상기 pH 조절 경로의 상기 저해제는 모노카복실레이트 수송체, 탄산 무수화 효소, 음이온 교환체, Na+-중탄산염 교환체, Na+/H+ 교환체 또는 V-ATP 분해효소의 저해제인, 종양 산성혈증 경로를 동정하는 방법.
- 제135항 또는 제136항에 있어서, 상기 하나 이상의 마이셀은 상기 중합체 백본에 부착된 2 이상의 형광단을 지니는 중합체를 포함하는, 종양 산성혈증 경로를 동정하는 방법.
- 제135항 내지 제137항 중 어느 한 항에 있어서, 상기 방법은 하나의 마이셀을 포함하고, 상기 마이셀은 상이한 형광단 또는 상이한 R3기를 지니는 2 이상의 중합체를 포함하는, 종양 산성혈증 경로를 동정하는 방법.
- 제138항에 있어서, 상기 마이셀은 상이한 형광단 및 상이한 R3기를 지니는 2 이상의 중합체를 포함하는, 종양 산성혈증 경로를 동정하는 방법.
- 종양의 존재를 결정하기 위해 환자를 이미징하는 방법으로서,
(a) 제77항 내지 제93항의 하나 이상의 마이셀을 포함하는 pH 반응 시스템을 상기 종양과 접촉시키는 단계로서, 상기 마이셀은 R1에서 금속 킬레이트기를 더 포함하는, 상기 접촉시키는 단계;
(b) 하나 이상의 PET 또는 SPECT 이미징 스캔을 수집하는 단계; 및
(c) 하나 이상의 광학적 이미징 스캔을 수집하는 단계로서, 상기 광학 신호의 상기 검출은 상기 마이셀 중 하나가 그의 pH 전이점에 도달되고 해리되었음을 나타내는, 상기 광학적 이미징 스캔을 수집하는 단계를 포함하되,
상기 하나 이상의 PET 또는 SPECT 이미징 스캔 및 상기 하나 이상의 광학적 이미징 스캔은 종양의 동정을 초래하는, 종양의 존재를 결정하기 위해 환자를 이미징하는 방법. - 제140항에 있어서, 상기 광학적 이미징 스캔은 상기 PET 또는 SPECT 이미징 스캔 전에 수집되는, 종양의 존재를 결정하기 위해 환자를 이미징하는 방법.
- 제140항에 있어서, 상기 광학적 이미징 스캔은 상기 PET 또는 SPECT 이미징 스캔 후에 수집되는, 종양의 존재를 결정하기 위해 환자를 이미징하는 방법.
- 제140항에 있어서, 상기 광학적 이미징 스캔은 상기 PET 또는 SPECT 이미징 스캔과 동시에 수집되는, 종양의 존재를 결정하기 위해 환자를 이미징하는 방법.
- 제140항 내지 제143항 중 어느 한 항에 있어서, 상기 이미징 스캔은 PET 이미징 스캔인, 종양의 존재를 결정하기 위해 환자를 이미징하는 방법.
- 제140항 내지 제143항 중 어느 한 항에 있어서, 상기 이미징 스캔은 SPECT 이미징 스캔인, 종양의 존재를 결정하기 위해 환자를 이미징하는 방법.
- 제140항 내지 제145항 중 어느 한 항에 있어서, 상기 금속 킬레이트기는 64Cu 이온에 결합되는, 종양의 존재를 결정하기 위해 환자를 이미징하는 방법.
- 제146항에 있어서, 상기 금속 킬레이트기는 질소 함유 거대고리인, 종양의 존재를 결정하기 위해 환자를 이미징하는 방법.
- 하기 화학식의 중합체:
식 중:
R1은 금속 킬레이트기이고;
n은 1 내지 500의 정수이며;
R2 및 R2'는 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고;
R3은 하기 화학식의 기이며:
식 중:
nx는 1 내지 10이고;
X1, X2 및 X3은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되고; 그리고
X4 및 X5는 알킬(C≤12), 사이클로알킬(C≤12), 아릴(C≤12), 헤테로아릴(C≤12) 또는 임의의 이들 기의 치환된 형태로부터 각각 독립적으로 선택되거나, 또는 X4와 X5는 함께 취해지고, 알칸다이일(C≤12), 알콕시다이일(C≤12), 알킬아미노다이일(C≤12), 또는 임의의 이들 기의 치환된 형태이며;
x는 1 내지 150의 정수이고;
R4는 하기 화학식의 기이며:
식 중:
nz는 1 내지 10이고;
Y1, Y2 및 Y3은 수소, 알킬(C≤12), 사이클로알킬(C≤12), 치환된 알킬(C≤12), 또는 치환된 사이클로알킬(C≤12)로부터 각각 독립적으로 선택되며; 그리고
Y4는 수소, 알킬(C≤12), 아실(C≤12), 치환된 알킬(C≤12), 치환된 아실(C≤12), 염료, 또는 형광 소광제이고;
y는 0 내지 6의 정수이며; 그리고
R4는 수소, 할로, 하이드록시, 알킬(C≤12), 또는 치환된 알킬(C≤12)이고,
R3 및 R4는 상기 중합체 내에서 임의의 순서로 생길 수 있고, 단, R3 및 R4는 동일한 기가 아니다. - 제150항 또는 제151항에 있어서, X1은 알킬(C≤12)인, 중합체.
- 제152항에 있어서, X1은 메틸인, 중합체.
- 제150항 내지 제153항 중 어느 한 항에 있어서, X4와 X5는 함께 취해지고, 알칸다이일(C≤12) 또는 치환된 알칸다이일(C≤12)인, 중합체.
- 제154항에 있어서, X4와 X5는 함께 취해지고 -CH2CH2CH2CH2CH2CH2-인, 중합체.
- 제156항에 있어서, Y4는 염료인, 중합체.
- 제157항에 있어서, Y4는 형광 염료인, 중합체.
- 제156항 내지 제158항 중 어느 한 항에 있어서, Y1은 알킬(C≤12)인, 중합체.
- 제159항에 있어서, Y1은 메틸인, 중합체.
- 제150항 내지 제160항 중 어느 한 항에 있어서, x는 40, 60, 80, 100 또는 120인, 중합체.
- 제150항 내지 제161항 중 어느 한 항에 있어서, y는 1, 2 또는 3인, 중합체.
- 제162항에 있어서, y는 3인, 중합체.
- 제150항 내지 제163항 중 어느 한 항에 있어서, 상기 중합체는 PEO114-P(C7A40-r-ICG3), PEO114-P(C7A60-r-ICG3), PEO114-P(C7A80-r-ICG3), PEO114-P(C7A100-r-ICG3) 또는 PEO114-P(C7A120-r-ICG3)이되, 상기 PEO 기는 금속 킬레이트기로 캡핑된, 중합체.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462009019P | 2014-06-06 | 2014-06-06 | |
| US62/009,019 | 2014-06-06 | ||
| PCT/US2015/034575 WO2015188157A1 (en) | 2014-06-06 | 2015-06-05 | Library of ph responsive polymers and nanoprobes thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170029430A true KR20170029430A (ko) | 2017-03-15 |
Family
ID=54767484
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167035901A KR20170029430A (ko) | 2014-06-06 | 2015-06-05 | Ph 반응성 중합체의 라이브러리 및 이의 나노프로브 |
Country Status (11)
| Country | Link |
|---|---|
| US (4) | US10098971B2 (ko) |
| EP (1) | EP3151867A4 (ko) |
| JP (1) | JP6598161B2 (ko) |
| KR (1) | KR20170029430A (ko) |
| CN (1) | CN106573076A (ko) |
| AU (1) | AU2015269068A1 (ko) |
| CA (1) | CA2951180A1 (ko) |
| IL (1) | IL249363A0 (ko) |
| MX (1) | MX2016016135A (ko) |
| SG (1) | SG11201610180YA (ko) |
| WO (1) | WO2015188157A1 (ko) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN106573076A (zh) * | 2014-06-06 | 2017-04-19 | 德克萨斯大学系统董事会 | pH响应聚合物库及其纳米探针 |
| MX2018010586A (es) * | 2016-03-02 | 2019-03-28 | Univ Texas | Nanovacuna de activacion de "sting" para inmunoterapia. |
| CN107389636B (zh) * | 2017-07-13 | 2019-09-10 | 湖南科技大学 | 一种可检测内源性谷胱甘肽的荧光传感器的制备及应用 |
| WO2019094906A1 (en) * | 2017-11-13 | 2019-05-16 | The Board Of Regents Of The University Of Texas System | Novel tfeb pathway agonists for metabolic diseases and ageing |
| JP7398115B2 (ja) * | 2017-12-22 | 2023-12-14 | ノース カロライナ ステート ユニバーシティ | ポリマーフルオロフォア、それを含む組成物、ならびにその調製および使用方法 |
| CN110856750B (zh) * | 2018-08-16 | 2024-01-19 | 北京大学 | pH敏感缀合物、胶束及其制备方法和用途 |
| US20200087451A1 (en) * | 2018-09-15 | 2020-03-19 | The Board Of Regents Of The University Of Texas System | Dual modality ups nanoprobes for tumor acidosis imaging |
| WO2020243217A1 (en) * | 2019-05-28 | 2020-12-03 | The Board Of Regents Of The University Of Texas System | pH RESPONSIVE COMPOSITIONS AND USES THEREOF |
| CN110201189B (zh) * | 2019-06-03 | 2021-12-07 | 沈阳药科大学 | 白蛋白结合型近红外荧光染料-马来酰亚胺共轭物 |
| EP3986467A4 (en) * | 2019-06-22 | 2023-07-19 | The Board Of Regents Of The University Of Texas System | BIODEGRADABLE ULTRA PH SENSITIVE POLYMERS |
| CN110272539B (zh) * | 2019-07-04 | 2021-09-17 | 广东工业大学 | 一种用于结合pmsa的配体缀合物、探针及其制备方法和应用 |
| CN110551263B (zh) * | 2019-09-05 | 2021-09-24 | 华南师范大学 | 一种多嵌段聚合物及其合成方法和肿瘤检测用荧光探针 |
| CA3159915A1 (en) * | 2019-11-04 | 2021-05-14 | Onconano Medicine, Inc. | Ph responsive block copolymer compositions, micelles, and methods of use |
| WO2021101905A1 (en) * | 2019-11-18 | 2021-05-27 | Onconano Medicine, Inc. | Ph responsive compositions, formulations, and methods of imaging a tumor |
| CN111159932B (zh) * | 2019-12-10 | 2022-09-27 | 中国船舶重工集团公司第七一九研究所 | 一种针对Mullins效应参数的优化反演方法 |
| US11928193B2 (en) | 2019-12-10 | 2024-03-12 | Winkk, Inc. | Multi-factor authentication using behavior and machine learning |
| CN111154118B (zh) * | 2020-01-19 | 2022-12-16 | 浙江理工大学 | 一种具有不同长径比的单晶聚合物胶束及其制备方法 |
| CN113916844A (zh) * | 2020-07-08 | 2022-01-11 | 长春工业大学 | 一种蓝红光双发射纳米杂化探针的制备方法及其在离子检测中的应用 |
| WO2023018743A1 (en) * | 2021-08-10 | 2023-02-16 | Wisconsin Alumni Research Foundation | Ph-responsive nanoparticle for delivery of ribonucleoproteins |
| CN115337398B (zh) * | 2022-09-07 | 2023-09-12 | 大连理工大学 | 一种atp响应的用于肿瘤化疗与光动力联合治疗的纳米药物及其制备方法 |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020028474A1 (en) * | 1996-09-19 | 2002-03-07 | Daiichi Pure Chemical Co., Ltd. | Composition for immunohistochemical staining |
| EP1429783A4 (en) * | 2001-09-04 | 2006-08-09 | Univ Texas Tech | MULTIMODAL IMAGING CHELATES FOR MULTIPLE USES |
| WO2007141050A2 (de) * | 2006-06-08 | 2007-12-13 | Bayer Schering Pharma Aktiengesellschaft | Funktionalisierte, feste polymernanopartikel für diagnostische und therapeutische anwendungen |
| RU2596495C2 (ru) * | 2008-09-12 | 2016-09-10 | Нитто Денко Корпорейшн | Визуализирующие агенты для фиброзных заболеваний |
| JPWO2011083845A1 (ja) * | 2010-01-08 | 2013-05-16 | 富士フイルム株式会社 | 腫瘍部位に対する標的化剤 |
| EP2619238B1 (en) * | 2010-09-22 | 2017-03-08 | The Board of Regents of the University of Texas System | Novel block copolymer and micelle compositions and methods of use thereof |
| WO2012040513A1 (en) | 2010-09-22 | 2012-03-29 | The Board Of Regents Of The University Of Texas System | Compositions and methods for the delivery of beta lapachone |
| US9511152B2 (en) | 2012-04-05 | 2016-12-06 | The Board Of Regents Of The University Of Texas System | Multicolored pH-activatable fluorescence nanoplatform |
| CN106573076A (zh) * | 2014-06-06 | 2017-04-19 | 德克萨斯大学系统董事会 | pH响应聚合物库及其纳米探针 |
-
2015
- 2015-06-05 CN CN201580042073.XA patent/CN106573076A/zh active Pending
- 2015-06-05 SG SG11201610180YA patent/SG11201610180YA/en unknown
- 2015-06-05 MX MX2016016135A patent/MX2016016135A/es unknown
- 2015-06-05 CA CA2951180A patent/CA2951180A1/en not_active Abandoned
- 2015-06-05 KR KR1020167035901A patent/KR20170029430A/ko unknown
- 2015-06-05 AU AU2015269068A patent/AU2015269068A1/en not_active Abandoned
- 2015-06-05 EP EP15803416.5A patent/EP3151867A4/en not_active Withdrawn
- 2015-06-05 JP JP2016571093A patent/JP6598161B2/ja not_active Expired - Fee Related
- 2015-06-05 WO PCT/US2015/034575 patent/WO2015188157A1/en active Application Filing
-
2016
- 2016-12-04 IL IL249363A patent/IL249363A0/en unknown
- 2016-12-05 US US15/369,701 patent/US10098971B2/en active Active
-
2018
- 2018-08-27 US US16/114,187 patent/US11013818B2/en active Active
-
2021
- 2021-04-15 US US17/231,922 patent/US11723990B2/en active Active
-
2023
- 2023-08-14 US US18/449,675 patent/US20240115741A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| EP3151867A4 (en) | 2018-05-16 |
| US10098971B2 (en) | 2018-10-16 |
| US11723990B2 (en) | 2023-08-15 |
| US11013818B2 (en) | 2021-05-25 |
| US20240115741A1 (en) | 2024-04-11 |
| IL249363A0 (en) | 2017-02-28 |
| US20170143852A1 (en) | 2017-05-25 |
| SG11201610180YA (en) | 2017-01-27 |
| JP2017526753A (ja) | 2017-09-14 |
| EP3151867A1 (en) | 2017-04-12 |
| CN106573076A (zh) | 2017-04-19 |
| US20180369424A1 (en) | 2018-12-27 |
| MX2016016135A (es) | 2017-10-20 |
| US20210338840A1 (en) | 2021-11-04 |
| CA2951180A1 (en) | 2015-12-10 |
| AU2015269068A1 (en) | 2016-12-22 |
| JP6598161B2 (ja) | 2019-10-30 |
| WO2015188157A1 (en) | 2015-12-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11013818B2 (en) | Library of pH responsive polymers and nanoprobes thereof | |
| Chen et al. | Smart self‐assembly amphiphilic cyclopeptide‐dye for near‐infrared window‐II imaging | |
| CN104334162B (zh) | 多色的pH可激活的荧光纳米平台 | |
| JP6793122B2 (ja) | 術中イメージング | |
| Wang et al. | Synergistic enhancement of fluorescence and magnetic resonance signals assisted by albumin aggregate for dual-modal imaging | |
| Gamage et al. | Targeted theranostic approach for glioma using dendrimer-based curcumin nanoparticle | |
| Lee et al. | pH-Sensitive polymeric micelle-based pH probe for detecting and imaging acidic biological environments | |
| Sun et al. | A targeting theranostics nanomedicine as an alternative approach for hyperthermia perfusion | |
| Zhang et al. | Novel self‐assembled multifunctional nanoprobes for second‐near‐infrared‐fluorescence‐image‐guided breast cancer surgery and enhanced radiotherapy efficacy | |
| EP3553074A1 (en) | Vap polypeptide and use thereof in preparation of drug for targeted diagnosis and treatment of tumor | |
| US9290539B2 (en) | Melanotropin ligands for skin care | |
| WO2020243217A1 (en) | pH RESPONSIVE COMPOSITIONS AND USES THEREOF | |
| AU2019339428A1 (en) | Dual modality ups nanoprobes for tumor acidosis imaging | |
| Yuan et al. | A dual-channel fluorescent ratio probe with hypoxia targeting and hypoxia activation capacity for tumour imaging | |
| Pan et al. | Tuning nanoparticle core composition drives orthogonal fluorescence amplification for enhanced tumour imaging | |
| Li et al. | Enhanced tumor targeting and penetration of fluorophores via iRGD peptide conjugation: a strategy for the precision targeting of lung cancer | |
| JP2023537627A (ja) | 腫瘍検出及びサージカルガイダンスのための化合物及び組成物 | |
| Vistain | Opening the Proteome to Analysis By Magnetic Resonance Imaging | |
| AU2023200964A1 (en) | Theranostic agents | |
| EP3996753A2 (en) | Methods and agents for the detection and treatment of cancer |