KR20170007480A - 약제학적 제형에 사용하기 위한 pi3k 델타 선택적 억제제의 개선된 형태 - Google Patents
약제학적 제형에 사용하기 위한 pi3k 델타 선택적 억제제의 개선된 형태 Download PDFInfo
- Publication number
- KR20170007480A KR20170007480A KR1020167036318A KR20167036318A KR20170007480A KR 20170007480 A KR20170007480 A KR 20170007480A KR 1020167036318 A KR1020167036318 A KR 1020167036318A KR 20167036318 A KR20167036318 A KR 20167036318A KR 20170007480 A KR20170007480 A KR 20170007480A
- Authority
- KR
- South Korea
- Prior art keywords
- salt
- disease
- lymphoma
- tgr
- cancer
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C309/00—Sulfonic acids; Halides, esters, or anhydrides thereof
- C07C309/01—Sulfonic acids
- C07C309/28—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton
- C07C309/29—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton of non-condensed six-membered aromatic rings
- C07C309/30—Sulfonic acids having sulfo groups bound to carbon atoms of six-membered aromatic rings of a carbon skeleton of non-condensed six-membered aromatic rings of six-membered aromatic rings substituted by alkyl groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
본 발명은 선택적인 PI3K 델타 억제제 (S)-2-(1-(4-아미노-3-(3-플루오로-4-아이소프로폭시페닐)-1H-피라졸로[3,4-d]피리미딘-1-일)에틸)-3-(3-플루오로페닐)-4H-크로멘-4-온(TGR-1202)의 p-톨루엔설폰산 염(PTSA)의 고체상 형태에 관한 것이다. 본 발명은 또한 이의 제조 방법, 이를 함유하는 약제학적 조성물, 및 이를 투여하여, PI3K 키나제 매개 질환 또는 장애, 예컨대 암을 치료하는 방법에 관한 것이다.
Description
본 발명은, 2014년 5월 27일자로 출원된 인도 특허 출원 제2596/CHE/2014호, 및 2014년 5월 27일자로 출원된 2597/CHE/2014의 혜택을 주장하며, 이들 각각은 그들 전문이 참고로 본 명세서에 편입된다.
발명의 분야
본 발명은 선택적인 PI3K 델타 억제제 (S)-2-(1-(4-아미노-3-(3-플루오로-4-아이소프로폭시페닐)-1H-피라졸로[3,4-d]피리미딘-1-일)에틸)-3-(3-플루오로페닐)-4H-크로멘-4-온(TGR-1202)의 P-톨루엔설폰산 염(PTSA)의 고체상 형태에 관한 것이다. 본 발명은 또한 이를 제조하는 방법, 이를 함유하는 약제학적 조성물, 및 이를 투여하여, PI3K 키나제 매개 질환 또는 장애, 예컨대 암을 치료하는 방법에 관한 것이다.
(S)-2-(1-(4-아미노-3-(3-플루오로-4-아이소프로폭시페닐)-1H-피라졸로[3,4-d]피리미딘-1-일)에틸)-3-(3-플루오로페닐)-4H-크로멘-4-온으로서 화학적으로 알려진, TGR-1202는 다음의 화학 구조를 갖는다:
TGR-1202 및 이의 염의 제조는 국제 특허 공개 제WO 2014/006572호 및 미국 특허 공개 제2014/0011819호에 기술되어 있고, 이들 각각은 모든 목적을 위해 그 전문이 참고로 본 명세서에 편입된다. TGR-1202는 혈액학적 악성 종양 영역에서 다수의 임상 실험이 현재 진행중인 연구 약물이다.
WO 2014/006572 및 US 2014/0011819는 TGR-1202의 합성(실시예 B1)을 기술하고 있고, 또한 PI3K의 신호 전달을 억제, 조절 및/또는 조정하는 이 분자의 치료 활성을 개시한다.
본 발명은 선택적인 PI3K 델타 억제제 (S)-2-(1-(4-아미노-3-(3-플루오로-4-아이소프로폭시페닐)-1H-피라졸로[3,4-d]피리미딘-1-일)에틸)-3-(3-플루오로페닐)-4H-크로멘-4-온(TGR-1202)의 p-톨루엔설폰산 염(PTSA)(예를 들어, (S)-2-(1-(4-아미노-3-(3-플루오로-4-아이소프로폭시페닐)-1H-피라졸로[3,4-d]피리미딘-1-일)에틸)-3-(3-플루오로페닐)-4H-크로멘-4-온(TGR-1202)(예를 들어, (S)-2-(1-(4-아미노-3-(3-플루오로-4-아이소프로폭시페닐)-1H-피라졸로[3,4-d]피리미딘-1-일)에틸)-3-(3-플루오로페닐)-4H-크로멘-4-온 4-메틸벤젠설포네이트)의 새로운 고체상 형태에 관한 것이다.
본 발명의 발명자들은 일정 입자 크기를 갖는 TGR-1202의 PTSA 염의 입자가 경구 투여 시 향상된 가용성 및 약동학을 나타낸다는 것을 발견하였다.
일 실시형태에서, PTSA 염은 d(0.9)가 약 5 내지 약 50㎛, 예컨대 약 5 내지 약 25㎛ 또는 약 5 내지 약 15㎛일 수 있다. PTSA 염은 또한 d(0.5)가 약 1 내지 약 10㎛, 예컨대 약 2.0 내지 약 10㎛, 약 1 내지 약 5㎛, 또는 약 2.0 내지 약 5㎛일 수 있다. PTSA 염은 d(0.1)가 약 0.5 내지 약 1.5㎛, 예컨대 약 0.5 내지 약 1.0㎛일 수 있다.
다른 실시형태에서, TGR-1202의 PTSA 염은 d(0.5)가 약 1 내지 약 10㎛, 예컨대 약 2.0 내지 약 10㎛, 약 1 내지 약 5㎛, 또는 약 2.0 내지 약 5㎛이다. PTSA 염은 또한 d(0.1)이 약 0.5 내지 약 1.5㎛, 예컨대 약 0.5 내지 약 1.0㎛일 수 있다. PTSA 염은 d(0.9)가 약 5 내지 약 50㎛, 예컨대 약 5 내지 약 25㎛ 또는 약 5 내지 약 15㎛일 수 있다.
또 다른 실시형태에서, PTSA 염은 d(0.1)가 약 0.5 내지 약 1.5㎛, 예컨대 약 0.5 내지 약 1.0㎛이다. PTSA 염은 또한 d(0.9)가 약 5 내지 약 50㎛, 예컨대 약 5 내지 약 25㎛ 또는 약 5 내지 약 15㎛일 수 있다. PTSA 염은 d(0.9)가 약 5 내지 약 50㎛, 예컨대 약 5 내지 약 25㎛ 또는 약 5 내지 약 15㎛일 수 있다.
다른 실시형태에서, TGR-1202의 PTSA 염은
(i) d(0.1)이 약 0.5 내지 약 1.5㎛, d(0.5)가 약 2.0 내지 약 10㎛ 및 d(0.9)가 약 5.0 내지 약 50㎛;
(ii) d(0.1)이 약 0.5 내지 약 1.5㎛, d(0.5)가 약 2.0 내지 약 5.0㎛ 및 d(0.9)가 약 5.0 내지 약 50㎛;
(iii) d(0.1)이 약 0.5 내지 약 1.5㎛, d(0.5)가 약 2.0 내지 약 10㎛ 및 d(0.9)가 약 5.0 내지 약 25㎛; 또는
(iv) d(0.1)이 약 0.5 내지 약 1.0㎛, d(0.5)가 약 2.0 내지 약 5㎛ 및 d(0.9)가 약 5.0 내지 약 15㎛
인 입자 크기 분포(PSD)를 갖는다.
또 다른 실시형태에서, TGR-1202의 PTSA 염은 d(0.1)이 약 0.5 내지 약 1.5㎛, d(0.5)가 약 2.0 내지 약 10㎛ 및 d(0.9)가 약 5.0 내지 약 50㎛인 입자 크기 분포(PSD)를 갖는다.
또 다른 실시형태에서, TGR-1202의 PTSA 염은 d(0.1)이 약 0.5 내지 약 1.5㎛, d(0.5)가 약 2.0 내지 약 5.0㎛ 및 d(0.9)가 약 5.0 내지 약 50㎛인 입자 크기 분포(PSD)를 갖는다.
또 다른 실시형태에서, TGR-1202의 PTSA 염은 d(0.1)이 약 0.5 내지 약 1.0㎛, d(0.5)가 약 2.0 내지 약 10.0㎛ 및 d(0.9)가 약 5.0 내지 약 15㎛인 입자 크기 분포(PSD)를 갖는다.
또 다른 실시형태에서, TGR-1202의 PTSA 염은 d(0.1)이 약 0.5 내지 약 1.0㎛, d(0.5)가 약 2.0 내지 약 5.0㎛ 및 d(0.9)가 약 5.0 내지 약 15㎛인 입자 크기 분포(PSD)를 갖는다.
또 다른 실시형태에서, TGR-1202의 PTSA 염의 입자의 최대 5%, 최대 3%, 최대 2%, 또는 최대 1%는 입자 크기가 1.0 마이크론 미만이다. 동시에 TGR-1202의 PTSA 염의 입자의 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 또는 적어도 99.5%는 입자 크기가 100 마이크론 미만이다. 일 특정 실시형태에서, TGR-1202의 PTSA 염은 또한 d(0.1)이 약 0.5 내지 약 1.5㎛이고, d(0.5)가 약 2.0 내지 약 10㎛이고 d(0.9)가 약 5.0 내지 약 50㎛이다. 다른 실시형태에서, TGR-1202의 PTSA 염은 또한 d(0.1)이 약 0.5 내지 약 1.5㎛이고, d(0.5)가 약 2.0 내지 약 5.0㎛이고, d(0.9)가 약 5.0 내지 약 50㎛이다. 또 다른 실시형태에서, TGR-1202의 PTSA 염은 또한 d(0.1)이 약 0.5 내지 약 1.5㎛이고, d(0.5)가 약 2.0 내지 약 10㎛이고, d(0.9)가 약 5.0 내지 약 25㎛이다. 또 다른 실시형태에서, TGR-1202의 PTSA 염은 d(0.1)이 약 0.5 내지 약 1.0㎛이고, d(0.5)가 약 2.0 내지 약 5.0㎛이고, d(0.9)가 약 5.0 내지 약 15㎛이다.
또 다른 실시형태에서, TGR-1202의 PTSA 염의 입자의 최대 5%, 최대 3%, 최대 2%, 또는 최대 1%는 입자 크기가 1.0 마이크론 미만이다. 동시에, TGR-1202의 PTSA 염의 입자의 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 또는 적어도 99.5%는 입자 크기가 50 마이크론 미만이다. 일 특정 실시형태에서, TGR-1202의 PTSA 염은 또한 d(0.1)이 약 0.5 내지 약 1.5㎛이고, d(0.5)가 약 2.0 내지 약 10㎛이고, d(0.9)가 약 5.0 내지 약 50㎛이다. 다른 실시형태에서, TGR-1202의 PTSA 염은 또한 d(0.1)이 약 0.5 내지 약 1.5㎛이고, d(0.5)가 약 2.0 내지 약 5.0㎛이고, d(0.9)가 약 5.0 내지 약 50㎛이다. 또 다른 실시형태에서, TGR-1202의 PTSA 염은 또한 d(0.1)이 약 0.5 내지 약 1.5㎛이고, d(0.5)가 약 2.0 내지 약 10㎛이고, d(0.9)가 약 5.0 내지 약 25㎛이다. 또 다른 실시형태에서, TGR-1202의 PTSA 염은 d(0.1)가 약 0.5 내지 약 1.0㎛이고, d(0.5)가 약 2.0 내지 약 5.0㎛이고 d(0.9)가 약 5.0 내지 약 15㎛이다.
또 다른 실시형태에서, TGR-1202의 PTSA 염의 입자의 최대 5%, 최대 3%, 최대 2%, 또는 최대 1%는 입자 크기가 1.0 마이크론 미만이다. 동시에, TGR-1202의 PTSA 염의 입자의 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 또는 적어도 99.5%는 입자 크기가 25 마이크론 미만이다. 일 특정 실시형태에서, TGR-1202의 PTSA 염은 또한 d(0.1)이 약 0.5 내지 약 1.5㎛이고, d(0.5)가 약 2.0 내지 약 10㎛이고 d(0.9)가 약 5.0 내지 약 25㎛이다. 또 다른 실시형태에서, TGR-1202의 PTSA 염은 d(0.1)이 약 0.5 내지 약 1.0㎛이고, d(0.5)가 약 2.0 내지 약 5.0㎛이고, d(0.9)가 약 5.0 내지 약 15㎛이다.
또 다른 실시형태에서, TGR-1202의 PTSA 염의 입자의 최대 5%, 최대 3%, 최대 2%, 또는 최대 1%는 입자 크기가 1.0 마이크론 미만이다. 동시에, TGR-1202의 PTSA 염의 입자의 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 또는 적어도 99.5%는 입자 크기가 15 마이크론 미만이다. 일 특정 실시형태에서, TGR-1202의 PTSA 염은 또한 d(0.1)이 약 0.5 내지 약 1.5㎛이고, d(0.5)가 약 2.0 내지 약 10㎛이고, d(0.9)가 약 5.0 내지 약 25㎛이다. 또 다른 실시형태에서, TGR-1202의 PTSA 염은 d(0.1)이 약 0.5 내지 약 1.0㎛이고, d(0.5)가 약 2.0 내지 약 5.0㎛이고, d(0.9)가 약 5.0 내지 약 15㎛이다.
또 다른 실시형태에서, TGR-1202의 PTSA 염은 도 1에 도시된 바와 실질적으로 같은 X-선 분말 회절(XRPD) 패턴을 나타낸다(이하에서 A형이라고 함).
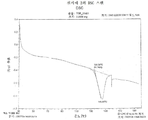
또 다른 실시형태에서, TGR-1202의 PTSA 염은 약 154℃에서 특징적인 흡열 피크를 갖는 시차 주사 열량계(DSC) 패턴을 나타낸다(A형).
또 다른 실시형태에서, TGR-1202의 PTSA 염은 5.0, 10.1, 15.9, 16.1, 16.3, 20.0, 22.1, 및 24.4 ± 0.05, 0.1, 또는 0.2 °2θ에서 선택된 1개 이상의 피크를 나타내는 XRPD 패턴을 나타낸다. 예를 들어, 상기 염은 5.01, 10.09, 15.91, 16.13, 16.34, 20.00, 22.06 및 24.42 ± 0.05, 0.1, 또는 0.2 °2θ에서 선택된 1개 이상의 피크(예컨대 2, 3, 4, 5, 6, 7 또는 8 피크)를 갖는 XRPD 패턴을 나타낼 수 있다.
또 다른 실시형태에서, TGR-1202의 PTSA 염은 도 2에 도시된 바와 실질적으로 같은 XRPD 패턴을 나타낸다(이하에서 B형이라고 함).
또 다른 실시형태에서, TGR-1202의 PTSA 염은 약 146℃에서 특징적인 흡열 피크를 갖는 시차 주사 열량계(DSC) 패턴을 나타낸다(B형).
또 다른 실시형태에서, TGR-1202의 PTSA 염은 5.0, 10.1, 22.1, 및 24.5 ± 0.05, 0.1, 또는 0.2 °2θ에서 선택된 1개 이상의 피크를 갖는 XRPD 패턴을 나타낸다. 예를 들어, 상기 염은 5.04, 10.13, 22.11 및 24.45 ± 0.05, 0.1, 또는 0.2 °2θ에서 선택된 1개 이상의 피크를 갖는 XRPD 패턴을 나타낼 수 있다.
또 다른 실시예는 약 0.5 내지 약 1.5㎛의 d(0.1), 약 2.0 내지 10㎛의 d(0.5) 및 약 5 내지 약 50㎛의 d(0.9)에 의해 정의된 입자 크기 분포(PSD)를 갖는 TGR-1202의 PTSA 염의 결정질 B형이다.
또 다른 실시형태는 약 0.5 내지 약 1.5㎛의 d(0.1), 약 2.0 내지 약 5㎛의 d(0.5) 및 약 5 내지 약 25㎛의 d(0.9)로 정의되는 입자 크기 분포(PSD)를 갖는 TGR-1202의 PTSA 염의 결정질 B형이다.
또 다른 실시형태는 약 0.5 내지 약 1.0㎛의 d(0.1), 약 2.0 내지 약 5㎛의 d(0.5) 및 약 5 내지 약 15㎛의 d(0.9)에 의해 정의되는 입자 크기 분포(PSD)를 갖는 TGR-1202의 PTSA 염의 결정질 B형이다.
본 발명은 본 명세서에 기술된 임의의 실시형태에 따른(예를 들어, 본 명세서의 임의의 실시형태에서 정의된 바와 같은 입자 크기 분포를 갖는) TGR-1202의 PTSA 염 및 약제학적으로 허용 가능한 부형제를 포함하는 약제학적 조성물을 더 제공한다.
본 발명은 본 명세서의 임의의 실시형태에서 기술한 바와 같은 TGR-1202의 PTSA 염의 결정질 B형 및 약제학적으로 허용 가능한 부형제를 포함하는 약제학적 조성물을 더 제공한다.
본 발명은 본 명세서의 임의의 실시형태에서 정의된 바와 같은 입자 크기 분포를 갖는 TGR-1202의 PTSA 염의 결정질 B형 및 약제학적으로 허용 가능한 부형제를 포함하는 약제학적 조성물을 더 제공한다.
다른 실시형태는 PI3K 연관된 질환, 장애 또는 병태, 예를 들어 증식성 질환, 예컨대 암의 치료를 위해 약제학적 조성물에 사용하기 적합한, 도 2에 도시된 것과 실질적으로 같은 XRPD 패턴을 갖는 TGR-1202의 PTSA 염이다.
다른 실시형태는 PI3K 연관된 질환, 장애 또는 병태, 예를 들어, 증식성 질환, 예컨대 암의 치료를 위한 약제학적 조성물에 사용하기 적합한, 본 명세서의 임의의 실시형태에서 정의된 바와 같은 입자 크기 분포를 갖는 TGR-1202의 PTSA 염이다.
본 발명은 본 명세서의 임의의 실시형태에서 정의된 바와 같은 입자 크기 분포를 갖는 TGR-1202의 PTSA 염의 결정질 B형 및 약제학적으로 허용 가능한 부형제를 포함하는 약제학적 조성물을 더 제공한다. 상기 약제학적 조성물은 추가 활성 성분, 예컨대 다른 활성제(예컨대, 이하에 기술된 항암제 및 이하에 활성제) 중 1종 이상을 더 포함할 수 있다.
본 발명은 본 명세서의 임의의 실시형태에서 정의된 바와 같은 입자 크기 분포를 갖는 TGR-1202의 PTSA 염 및 약제학적으로 허용 가능한 부형제를 포함하는 약제학적 조성물을 더 제공한다. 상기 약제학적 조성물은 추가 활성 성분, 예컨대 다른 활성제(예컨대, 이하에 기술된 항암제 및 활성제) 중 1종 이상을 더 포함할 수 있다.
일 실시형태는 본 명세서에 기술된 바와 같은 TGR-1202의 PTSA 염 및 1종 이상의 가용화제(예컨대, 하이드록시프로필 베타덱스)를 포함하는 고형 경구 약제학적 조성물(예컨대, 정제)이다. PTSA 염 대 가용화제(예컨대 하이드록시프로필 베타덱스)의 중량비는 약 1.5:1 내지 약 1:1.5 범위이다. 상기 조성물은 현탁제(예컨대 하이드록시프로필 셀룰로스), 분산제(예컨대 미세결정질 셀룰로스), 붕해제(예컨대 크로스카멜로스 나트륨), 윤활제(예컨대 스테아르산마그네슘), 및 전술한 어느 것들의 임의 조합에서 선택된 1종 이상의 부형제를 더 포함할 수 있다.
추가 실시형태에서, 본 명세서의 임의의 실시형태에서 정의된 바와 같은 PTSA 염은 거울상 이성질체 과잉율(e.e.)이 적어도 약 60%, 적어도 약 75%, 적어도 약 80%, 적어도 약 85%, 적어도 약 90%, 적어도 약 95%, 적어도 약 98%, 적어도 약 99%, 적어도 약 99.5% 또는 적어도 약 99.9%이다.
또 다른 실시형태는 TGR-1202의 결정질 PTSA 염으로서, (i) 상기 결정질 염은 5.0, 10.1, 22.1, 및 24.5 ± 0.2 °2θ에서 선택된 1개 이상의 피크(예컨대, 2, 3 또는 4 피크)를 갖는 XRPD 패턴을 나타내고, (ii) 상기 결정질 염은 PTSA 염의 다른 고체상 형태가 실질적으로 없다.
또 다른 실시형태는 TGR-1202의 결정질 PTSA 염으로서, (i) 상기 결정질 염은 5.0, 10.1, 22.1, 및 24.5 ± 0.2 °2θ에서 선택된 1개 이상의 피크(예컨대, 2, 3, 또는 4 피크)를 갖는 XRPD 패턴을 나타내고, (ii) 상기 결정질 염은 PTSA 염의 다른 고체상 형태를 5% 미만(예컨대 4% 미만, 3% 미만, 2% 미만 또는 1% 미만)으로 함유한다.
다른 측면에서, 본 발명은 TGR-1202의 결정질 PTSA 염(즉, (S)-2-(1-(4-아미노-3-(3-플루오로-4-아이소프로폭시페닐)-1H-피라졸로[3,4-d]피리미딘-1-일)에틸)-3-(3-플루오로페닐)-4H-크로멘-4-온의 p-톨루엔설폰산 염)을 제조하는 방법에 관한 것이다. 일 실시형태에서, 상기 방법은 TGR-1202의 PTSA 염 및 에터 용매, 예컨대 다이-tert-부틸 에터, 다이에틸 에터, 다이에틸렌 글리콜 다이에틸 에터, 다이아이소프로필 에터, 다이메톡시에탄, 메톡시메탄, 에틸 tert-부틸 에터, 메톡시에탄, 2-(2-메톡시에톡시)에탄올, 메틸 tert-부틸 에터, 2-메틸테트라하이드로퓨란, 테트라하이드로퓨란 및 테트라하이드로피란의 혼합물로부터 용매를 제거하는 단계를 포함한다. 상기 혼합물은 바람직하게는 용매를 제거하기 전에 교반된다(예를 들어, 3, 6, 12, 또는 그 이상의 시간 동안). 용매는 건조에 의해 제거될 수 있다. 바람직한 일 실시형태에서, 상기 방법은 TGR-1202의 PTSA 염 및 에터 용매의 혼합물을 교반하는 단계, 여과하는 단계 및 건조하는 단계를 포함한다. 상기 혼합물은 바람직하게, 에터 용액에 TGR-1202의 PTSA 염을 현탁시켜 형성될 수 있는, 현탁물이다.
다른 측면에서, 본 발명은 유효량의 본 명세서에 기술된 바와 같은 TGR-1202의 PTSA 염(예를 들어, TGR-1202의 PTSA 염의 결정질 B형) 그리고 본 명세서의 임의 실시형태에 정의된 바와 같은 입자 크기 분포를 가짐)을 환자에게 투여하여 이를 필요로 하는 환자에서 PI3K 델타를 억제하는 방법에 관한 것이다.
또 다른 실시형태는 유효량의 본 명세서에 기술된 바와 같은 TGR-1202의 PTSA 염(예를 들어, TGR-1202의 PTSA 염의 결정질 B형)을 환자에게 투여하여 환자에서 PI3K 단백질 키나제 매개 질환, 장애 또는 병태(예컨대, 암 또는 다른 증식성 질환 또는 장애)를 치료, 예방, 및/또는 억제하는 방법이다.
또 다른 실시형태는 유효량의 본 명세서에 기술된 바와 같은 TGR-1202의 PTSA 염(예를 들어, TGR-1202의 PTSA 염의 결정질 B형)을 환자에게 투여하여 환자에서 PI3K 연관된 질환, 장애 또는 병태를 치료하는 방법이다. 일 실시형태에서, 투여되는 TGR-1202의 PTSA 염의 결정질 B형의 양은 PI3K 델타의 억제에 의해 PI3K 연관된 질환, 장애 또는 병태를 치료하는데 충분하다.
본 발명의 또 다른 실시형태는 유효량의 본 명세서에 기술된 바와 같은 TGR-1202의 PTSA 염(예를 들어, TGR-1202의 PTSA 염의 결정질 B형)을 이러한 치료가 필요한 환자에게 투여하여 증식성 질환을 치료하는 방법이다. 일 실시형태에서, 투여되는 TGR-1202의 PTSA 염의 결정질 B형의 양은 PI3K 델타의 억제에 의해 증식성 질환을 치료하는데 충분하다.
본 발명의 또 다른 실시형태는 적어도 하나의 다른 항암제와 (동시에 또는 순차적으로) 조합하여, 유효량의 본 명세서에 기술된 바와 같은 TGR-1202의 PTSA 염(예를 들어, TGR-1202의 PTSA 염의 결정질 B형)을 이러한 치료가 필요한 환자에게 투여하여 증식성 질환을 치료하기 위한 방법이다. 일 실시형태에서, 투여되는 TGR-1202의 PTSA 염(예를 들어, TGR-1202의 PTSA 염의 B형)의 양은 PI3K 델타의 억제에 의해 증식성 질환을 치료(또는 이의 치료를 촉진)하는데 충분하다.
환자에서 PI3K 연관된 질환, 장애 또는 병태를 치료하는 방법이고, 경우에 따라 적어도 하나의 약제학적으로 허용 가능한 부형제와 혼합하여, 유효량의 본 명세서에 기술된 바와 같은 TGR-1202의 PTSA 염(예를 들어, TGR-1202의 PTSA 염의 결정질 B형)을 이러한 치료가 필요한 환자에게 투여하는 단계를 포함한다. 구체적인 실시형태에서, 상기 조성물은 PI3K 연관된 질환, 장애 또는 병태의 치료를 위한 본 명세서의 임의의 실시형태에 따른 TGR-1202의 PTSA 염의 결정질 B형(예를 들어, 본 명세서의 임의의 실시형태에서 정의된 바와 같은 입자 크기 분포를 갖는 TGR-1202의 PTSA 염의 결정질 B형)의 치료적 유효량을 포함한다.
특별한 실시형태는, 환자에서 암을 치료하는 방법을 제공하고, 이 방법은 경우에 따라 적어도 하나의 약제학적으로 허용 가능한 부형제와 혼합하여, 본 명세서에 기술된 바와 같은 TGR-1202의 PTSA 염(예를 들어, TGR-1202의 PTSA 염의 결정질 B형)을 포함하는 약제학적 조성물을 환자에게 투여하는 단계를 포함한다. 구체적인 실시형태에서, 상기 조성물은 환자에서 암의 치료를 위한 본 명세서의 임의의 실시형태에 따른 TGR-1202의 PTSA 염의 결정질 B형(예를 들어, 본 명세서의 임의의 실시형태에서 정의된 바와 같은 입자 크기 분포를 갖는 TGR-1202의 PTSA 염의 결정질 B형)의 치료적 유효량을 포함한다.
본 명세서의 임의의 실시형태에 따른 TGR-1202의 PTSA 염의 결정질 B형(예를 들어, 본 명세서의 임의의 실시형태에서 정의된 바와 같은 입자 크기 분포를 갖는 TGR-1202의 PTSA 염의 결정질 B형)은 제한 없이, 다음을 포함하는, 다양한 암의 치료에 유용하다:
방광, 유방, 결장, 신장, 간, 폐(소세포 폐암 포함), 식도, 담낭, 자궁, 난소, 고환, 후두, 구강, 위장관(예를 들어, 식도, 위, 췌장), 뇌, 자궁경부, 갑상선, 전립선, 혈액, 및 피부(편평 세포 암종 포함)의 암종을 포함하는, 암종;
백혈병, 급성 림프구성 백혈병, 급성 림프아구성 백혈병, B-세포 림프종, T-세포 림프종, 호지킨 림프종, 비호지킨 림프종, 모발 세포 림프종 및 버킷 림프종을 포함하는, 림프 계통의 조혈세포 종양;
아폽토시스의 조절인자로서 본 명세서에 기술된 TGR-1202의 PTSA 염(결정질 B형 포함)은 암(제한 없이, 본 명세서에 언급한 유형들 포함)의 치료, 예방 및 억제에 유용하다.
본 명세서에 기술된 TGR-1202의 PTSA 염(결정질 B형 포함)은 암의 화학예방에서 유용하다. 화학예방은 돌연변이유발 사건의 개시를 차단하여 침윤성 암의 발병을 억제, 이미 상해를 겪은 전암성 세포의 진행의 억제, 또는 종양 재발 억제를 포함한다. 그의 B형을 포함하는, PTSA 염은 또한 종양 혈관생성 및 전이를 억제하는데 유용하다. 본 발명의 일 실시형태는 유효량의 TGR-1202의 PTSA 염(예컨대, TGR-1202의 PTSA 염의 결정질 B형)을 투여하여 환자에서 종양 혈관생성 또는 전이를 억제하는 방법이다.
본 발명의 다른 실시형태는 면역계-관련 질환(예를 들어, 자가면역 질환), 염증을 포함하는 질환 또는 장애(예를 들어, 천식, 만성 폐쇄성 폐질환, 류마티스성 관절염, 염증성 장질환, 사구체신염, 신경염증성 질환, 다발성 경화증, 포도막염 및 면역계의 장애), 암 또는 다른 증식성 질환, 간 질환 또는 장애, 또는 신장 질환 또는 장애를 치료하는 방법이다. 본 발명은 유효량의 본 발명의 1종 이상의 화합물을 투여하는 단계를 포함한다.
본 발명의 화합물에 의해 치료될 수 있는 면역 장애의 예에는 제한 없이, 건선, 류마티스성 관절염, 혈관염, 염증성 장질환, 피부염, 골관절염, 천식, 염증성 근육 질환, 알레르기성 비염, 질염, 간질성 방광염, 경피증, 골다공증, 습진, 동종 또는 이종 이식(장기, 골수, 줄기 세포 및 다른 세포와 조직) 이식편 거부증, 이식편대 숙주 질환, 홍반성 루푸스, 염증성 질환, 제I형 당뇨병, 특발성 폐섬유증(IPF)(또는 잠재성 섬유성 폐포염(CFA) 또는 특발성 섬유성 간질성 폐렴), 폐섬유증, 피부근염, 쇠그렌 증후군, 갑상선염(예를 들어, 하시모토 및 자가면역성 갑상선염), 중증 근무력증, 자가면역성 용혈성 빈혈증, 다발성 경화증, 낭포성 섬유증, 만성 재발성 간염, 원발성 담즙성 간경화증, 알레르기성 결막염 및 아토피성 피부염이 포함된다.
또 다른 실시형태는 치료적 유효량의 본 발명의 화합물을 투여하여 환자에서 백혈병을 치료하는 방법이다. 예를 들어, 본 발명의 화합물은 만성 림프구성 백혈병(CLL), 비호지킨 림프종(NHL), 급성 골수성 백혈병(AML), 다발성 골수종(MM), 소형 림프구성 림프종(SLL), 및 무통성 비호지킨 림프종(I-NHL)을 치료하는데 효과적이다.
상기 언급한 치료 방법들에서, 1종 이상의 추가 활성제가 TGR-1202의 PTSA 염, 예컨대 본 명세서의 임의의 실시형태에 기술된 바와 같은 TGR-1202의 PTSA 염의 결정질 B형과 함께 투여될 수 있다. 예를 들어, 본 명세서의 임의의 실시형태에 기술된 바와 같은 TGR-1202의 PTSA 염은 기지의 항암 치료 예컨대 화학요법, 방사선 요법, 생물학적 요법, 골수 이식, 줄기 세포 이식 또는 임의의 다른 항암요법과 조합(함께 또는 순차적으로 투여)하거나 또는 단독으로 또는 1종 이상의 세포정지제, 세포독성제 또는 항암제 또는 표적 요법, 예컨대 제한 없이, 예를 들어, DNA 상호작용제, 예컨대 플루다라빈, 시스플라틴, 클로람부실, 벤다무스틴 또는 독소구비신; 알킬화제, 예컨대 사이클로포스파마이드; 토포아이소머라제 II 억제제, 예컨대 에토포사이드; 토포아이소머라제 I 억제제, 예컨대 CPT-11 또는 토포테칸; 천연 유래 또는 합성의 튜불린 상호작용제, 예컨대 파클리탁셀, 도세탁셀 또는 에포틸론(예를 들어 익사베필론); 호르몬제, 예컨대 타콕시펜; 티미딜레이트 신타제 억제제, 예컨대 5-플루오로우라실; 항대사제, 예컨대 메토트렉세이트; 다른 티로신 키나제 억제제 예컨대 이레사 및 OSI-774; 혈관생성 억제제; EGF 억제제; VEGF 억제제; CDK 억제제; SRC 억제제; c-키트(c-Kit) 억제제; Her1/2 억제제 및 성장 인자 수용기에 대한 단클론성 항체 예컨대 얼비툭스(EGF) 및 허셉틴(Her2); CD20 단클론성 항체 예컨대 리툭시맙, 우블릭스투맙(TGR-1101), 오파투무맙(휴맥스; 인트라셀(Intracel)), 오크렐리주맙, 벨투주맙, GA101(오비누투주맙), AME-133v(LY2469298, 어플라이드 몰레큘러 에볼루션사(Applied Molecular Evolution)), 오카라투주맙(멘트릭 바이오테크사(Mentrik Biotech)), PRO131921, 토시투모맙, hA20(이뮤노메딕스사(Immunomedics, Inc.)), 이브리투모맙-티욱세탄, BLX-301(바이오렉스 테라퓨틱스사(Biolex Therapeutics)), 레디툭스(닥터 레디즈 라보라토리즈(Dr. Reddy's Laboratories)), 및 PRO70769(WO2004/056312에 기술됨); 다른 B-세포 표적 단클론성 항체 예컨대 벨리무맙, 아타시셉트 또는 융합 단백질 예컨대 블리시비모드 및 BR3-Fc; 다른 단클론성 항체 예컨대 알렘투주맙; CHOP(사이클로포스파마이드, 독소루비신, 빈크리스틴, 브레드니손); R-CHOP(리툭시맙-CHOP); 하이퍼CV AD(과분할 사이클로포스파마이드, 빈크리스틴, 독소루비신, 덱사메타손, 메토트렉세이트, 시타라빈); R-하이버CV AD(리툭시맙-하이퍼CV AD); FCM(플루다라빈, 사이클로포스파마이드, 미톡산트론); R-FCM(리툭시맙, 플루다라빈, 사이클로포스파마이드, 미톡산트론); 볼테조밉 및 리툭시맙; 템시롤리무스 및 리툭시맙; 템시롤리무스 및 벨카드(Velcade)(등록상표); 아이오딘-131 토시투모맙(벡사르(Bexxar)(등록상표)) 및 CHOP-CVP(사이클로포스파마이드, 빈크리스틴, 프레드니손); R-CVP(리툭시맙-CVP); ICE(아이포스파마이드, 카보플라틴, 에토포시드); R-ICE(리툭시맙-ICE); FCR(플루다라빈, 사이클로포스파마이드, 리툭시맙); FR(플루다라빈, 리툭시맙); 및 D.T. PACE(덱사메타손, 탈리도마이드, 시스플라틴, 아드리아마이신, 사이클로포스파마이드, 에토포시드); 및 다른 단백질 조절인자와의 조합에 유용하다.
본 명세서의 임의의 실시형태에서 기술된 바와 같은 TGR-1202의 PTSA 염의 결정질 B형은 또한 1종 이상의 스테로이드성 항염증 약물, 비스테로이드성 항염증 약물(NSAID) 또는 면역 선택적인 항염증 유도체(ImSAID)와의 조합(함께 또는 순차적으로 투여)에서 유용하다.
도 1은 실시예 1에 기술된 방법으로 제조된 TGR-1202의 PTSA 염에 대한 XRPD 스펙트럼이다(A형).
도 2는 실시예 2에 기술된 방법으로 제조된 TGR-1202의 PTSA 염에 대한 XRPD 스펙트럼이다(B형).
도 3은 실시예 1에 기술된 방법으로 제조된 TGR-1202의 PTSA 염에 대한 DSC 기록이다(A형).
도 4는 실시예 2에 기술된 방법으로 제조된 TGR-1202의 PTSA 염에 대한 DSC 기록이다(B형).
도 2는 실시예 2에 기술된 방법으로 제조된 TGR-1202의 PTSA 염에 대한 XRPD 스펙트럼이다(B형).
도 3은 실시예 1에 기술된 방법으로 제조된 TGR-1202의 PTSA 염에 대한 DSC 기록이다(A형).
도 4는 실시예 2에 기술된 방법으로 제조된 TGR-1202의 PTSA 염에 대한 DSC 기록이다(B형).
달리 표시하지 않으면 본 명세서에서 사용되는 바와 같이 다음의 정의들이 적용된다.
물리적 특성, 예컨대 분자량, 또는 화학적 특성, 예컨대 화학식에 대해 본 명세서에서 범위를 사용하는 경우, 범위 및 그의 특정 실시형태의 모든 조합 및 하위조합을 포함하고자 한다. 수치 또는 수치 범위를 언급할 때 용어 "약"은 언급하는 수치 또는 수치 범위가 실험 가변성 이내(또는 통계적 실험 오차 이내)의 근사치여서, 그러한 수치 또는 수치 범위가 예를 들면, 규정된 수치 또는 수치 범위의 1% 내지 15%로 다양할 수 있음을 의미한다. 용어 "포함하는"(및 관련 용어 예컨대 "포함하다" 또는 "포함한다" 또는 "가지는" 또는 "포괄하는")은 실시형태들, 예를 들어 기술한 특징으로 "이루어지거나" 또는 "필수적으로 이루어지는" 대상, 조성물, 방법 또는 공정의 임의 조합의 실시형태들을 포괄한다.
다음의 용어 및 약어는 전반에서 표시한 의미를 갖는다: PI3-K = 포스포이노시타이드 3-키나제; 및 AIDS = 후천성 면역 결핍 증후군.
본 명세서에서 사용되는 약어는 달리 언급하지 않으면, 화학 및 생물학 분야에서 그들의 통상적인 의미를 갖는다.
용어 "세포 증식"은 세포수가 분열의 결과로서 변화되는 현상을 의미한다. 이 용어는 또한 증식 신호와 일치되게 세포 형태가 변화(예를 들어, 크기 증가)하는 세포 성장을 포함한다.
본 명세서에서 사용되는 용어 "공동 투여", "∼와 조합하여 투여되는" 및 그들의 문법적 동의어는 활성제 및/또는 그들 대사산물이 동시에 동물에 존재하도록 2종 또는 그 이상의 작용제의 투여를 포함한다. 공동 투여는 개별 조성물의 동시 투여, 개별 조성물의 상이한 시점의 투여, 또는 두 작용제가 존재하는 하나의 조성물의 투여를 포함한다.
용어 "유효량" 또는 "치료적 유효량"은 제한 없이, 질환 치료를 포함하여, 의도하는 용도에 영향을 주기에 충분한 본 명세서에 기술된 화합물의 양을 의미한다. 치료적 유효량은 의도하는 용도(시험관 내 또는 생체 내), 또는 치료하려는 대상체 및 질환 상태, 예를 들어, 대상체의 체중 및 연령, 질환 상태의 중증도, 투여 방식 등에 좌우되어 다양할 수 있고, 당업자 중 한 명이 쉽게 결정할 수 있다. 이 용어는 또한 표적 세포에서 구체적인 반응, 예를 들어 세포 이동 및/또는 혈소판 부착의 감소를 유도하는 용량에도 적용된다. 특정 용량은 선택된 특정 화합물, 후속되는 투약 계획, 다른 화합물과 조합하여 투여하는지 여부, 투여 시기, 투여되는 조직, 및 운반하는 물리적 전달 시스템에 의존하여 다양하다.
본 명세서에서 사용하는 용어 "치료" 및 "치료하는"은 제한 없이, 치료적 유익 및/또는 예방적 유익을 포함하는 유리하거나 또는 바람직한 결과를 획득하기 위한 접근법을 의미한다. 치료적 유익이란 치료하려는 근본적인 장애의 근절 또는 완화를 의미한다. 또한, 치료적 유익은 환자가 여전히 근본적인 장애를 앓을지라도, 환자에서 호전이 관찰되도록 근본적인 장애와 연관된 생리적 증상 중 하나 이상의 근절 또는 완화로 획득된다. 예방적 유익의 경우, 그러한 질환의 진단을 받지 않았더라고, 조성물을 특정 질환이 발병될 위험성이 있는 환자, 또는 질환의 생리적 증상 중 하나 이상이 보고된 환자에게 투여할 수 있다.
본 명세서에서 사용되는 "치료적 효과"는 상기 기술된 바와 같은 치료적 유익 및/또는 예방적 유익을 포함한다. 예방적 효과는 질환 또는 병태의 출현을 지연 또는 제거, 질환 또는 병태의 증상의 개시를 지연 또는 제거, 질환 또는 병태의 진행을 지연, 중지, 또는 역전, 또는 이의 임의 조합을 포함한다.
용어 "대상체" 또는 "환자"는 동물, 예컨대 포유동물, 예를 들어 인간을 의미한다. 본 명세서에 기술된 방법은 인간 치료법 및 수의학적 용도 둘 모두에서 유용하다. 일부 실시형태에서, 환자는 포유동물이고, 일부 실시형태에서, 환자는 인간이다. 수의학적 목적의 경우, 용어 "대상체" 및 "환자"는 제한 없이, 소, 양, 돼지, 말 및 염소를 포함하는 가축; 반려 동물 예컨대 개 및 고양이: 외래 및/또는 동물원 동물; 마우스, 래트, 토끼, 기니 피그, 및 햄스터를 포함하는 실험실 동물; 및 가금류 예컨대 닭, 칠면조, 오리, 거위를 포함한다.
"방사선 요법"은 의사에게 알려진 방법 및 조성물을 사용하여, 환자를 방사선 방사기 예컨대, 알파-입자 방사 방사성핵종(예를 들어, 악티늄 및 토륨 방사성핵종), 저선형 에너지 전달(LET) 방사선 방사기(즉, 베타 방사기), 전환 전자 방사기(예를 들어, 스트론튬-89 및 사마륨-153-EDTMP), 또는 제한 없이, X-선, 감마선, 및 뉴트론을 포함하는, 고에너지 방사선에 노출시키는 것을 의미한다.
"신호 전달"은 자극 또는 억제 신호가 세포 안으로 그리고 세포 내부에서 전달되어 세포내 반응을 유발시키는 동안의 과정이다. 신호 전달 경로의 조절인자는 동일한 특이적 신호 전달 경로에 대해 지도가 그려진 1종 이상의 세포 단백질의 활성을 조정하는 화합물이다. 조절인자는 신호전달 분자의 활성을 상승(효현제(agonist)) 또는 억제(길항제)시킬 수 있다.
생물학적 활성제에 적용되는 용어 "선택적 억제" 또는 "선택적으로 억제하다"는 표적과의 직접 또는 간접 상호작용을 통해, 표적을 벗어난 신호전달 활성과 비교하여 표적 신호전달 활성을 선택적으로 감소시키는 작용제의 능력을 의미한다.
본 명세서에서 사용되는 용어 "PI3-키나제 델타 선택적 억제제" 및 "PI3-키나제 δ 선택적 억제제"는 대체로 PI3K 패밀리의 다른 아이소자임(알파, 베타 및 감마)보다 더 효과적으로 PI3K-키나제 δ 아이소자임의 활성을 억제하는 화합물을 의미하다. 예를 들어, PI3-키나제 δ 선택적 억제제는 나머지 다른 I형 PI3-키나제(즉, 알파, 베타 및 감마)에 대한 억제제의 50% 억제 농도(IC50)보다, 적어도 10배, 적어도 20배, 적어도 50배, 적어도 100배 낮은 델타 I형 PI3-키나제에 대한 IC50을 나타내는 화합물을 의미한다.
PI3-키나제 δ의 억제는 다양한 병태, 예를 들어, 제한 없이 자가면역 질환, 알레르기성 질환, 및 관절염 질환을 포함하는 염증 반응을 특징으로 하는 병태의 치료에서의 치료적 유익일 수 있다. 중요하게는, PI3-키나제 δ 기능의 억제가 생물학적 기능, 예컨대 생존력 및 생식력에 영향을 주는 것으로 보이지 않는다.
본 명세서에서 사용하는 "염증 반응"은 발적, 열감, 종창 및 통증(즉, 염증)을 특징으로 하고 전형적으로 조직 손상 또는 파괴를 포함한다. 염증 반응은 일반적으로 손상을 주는 작용제 및 손상된 조직 둘 모두를 파괴, 희석 또는 벽으로 분리(격리)하도록 제공되는, 조직의 손상 또는 파괴에 의해 유발된 국소적, 보호 반응이다. 염증 반응은 특히 백혈구들 및/또는 백혈구(예를 들어, 호중구) 화학주성의 유입과 연관된다. 염증 반응은 병원성 유기체 및 바이러스에 의한 감염, 심근경색 또는 뇌졸중 후 재관류 또는 외상과 같은 비감염성 수단, 외래 항원에 대한 면역 반응, 및 자가면역 질환에 의할 수 있다. 본 발명에 따른 방법 및 화합물을 사용한 치료를 할 수 있는 염증 반응은 특별한 방어계의 반응과 연관된 병태를 비롯하여 비특이적 방어계의 반응과 연관된 병태를 포함한다.
본 발명의 치료적 방법은 염증성 세포 활성과 연관된 병태의 치료를 위한 방법을 포함한다. "염증성 세포 활성화"는 증식성 세포 반응의 자극(제한 없이, 사이토카인, 항원 또는 자가항체 포함)에 의한 유도, 가용성 매개인자(제한 없이, 사이토카인, 산소 라디칼, 효소, 프로스타노이드 또는 혈관작용성 아민 포함)의 생산, 또는 염증성 세포(제한 없이, 단핵구, 마크로파지, T 림프구, B 림프구, 과립구(호중구, 호염기구 및 호산구를 포함하는 다형핵 백혈구), 비만 세포, 수지상 세포, 랑게한스 세포, 및 내피 세포 포함)에서 새로운 또는 증가된 수의 매개인자의 세포 표면 발현을 의미한다. 이들 세포에서 이들 표현형 중 하나 또는 그의 조합의 활성화가 염증성 병태의 개시, 영속화 또는 악화의 원인이 될 수 있음을 당업자는 이해한다.
본 명세서에서 사용되는 "자가면역 질환"은 조직 손상이 신체 자신의 성분에 대한 체액성 또는 세포-매개 반응과 연관된 장애의 임의 군을 의미한다.
본 명세서에서 사용되는 "이식 거부증"은 이식된 조직(이식 및 주변 조직의 기능 상실, 통증, 부종, 백혈구 증가증 및 혈소판 감소증을 특징으로 하는, 이식된 조직(장기 또는 세포(예를 들어, 골수)) 포함)에 대한 면역 반응을 의미한다.
본 명세서에서 사용되는 "알레르기성 질환"은 알레르기로 인한 임의의 증상, 조직 손상, 또는 조직 기능의 상실을 의미한다.
본 명세서에서 사용되는 "관절염 질환"은 다양한 병인에 기인한 관절의 염증성 병변을 특징으로 하는 임의의 질환을 의미한다.
본 명세서에서 사용되는 "피부염"은 다양한 병인에 기인한 피부의 염증을 특징으로 하는 피부 질환의 임의의 거대 패밀리를 의미한다.
본 명세서에서 사용되는 유체에 분산된 입자들, 또는 과립 재료, 또는 분말의 "입자 크기 분포도"라는 용어는 크기에 따라서 분류된, 존재 입자의 상대량을 정의한 값 또는 수학 함수의 목록이다. d(0.1), d(0.5) 및 d(0.9) 값은 측정된 입자의 10%, 50% 및 90%가 명시된 크기보다 작거나 또는 같았음을 의미한다. 예를 들어, d(0.1) = 3, d(0.5) = 10 및 d(0.9) = 100의 값은 입자의 10%가 3㎛보다 작거나 또는 같고, 50%는 10㎛보다 작거나 또는 같고, 90%는 100㎛보다 작거나 또는 같았음을 의미한다.
용어 d(0.1), d(0.5), 및 d(0.9)는 샘플의 모든 총 입자의 10%, 50%, 또는 90%가 통과할 수 있는 단일한 가공 체의 메쉬 크기를 의미한다. 따라서, d(0.1) = 2 - 100㎛는 샘플 내 최소 입자의 10%를 한정하는 입자 크기 범위의 상한치가 2㎛ 내지 100㎛임을 의미한다. 따라서, 총 입자의 10%가, 이 경우에는 그들이 2㎛ 내지 100㎛의 최대 크기를 가짐을 의미하는 d(0.1) 값을 넘지 않는 입자 크기를 갖는다.
약제학적 조성물
본 발명은 본 명세서에 기술된 바와 같은 TGR-1202의 PTSA 염 및 1종 이상의 약제학적으로 허용 가능한 부형제를 포함하는 약제학적 조성물을 제공한다. 예를 들어, TGR-1202의 PTSA 염은 본 명세서에 기술된 입자 크기 분포 및/또는 본 명세서에 기술된 결정질 특성을 가질 수 있다.
일 측면에서, 본 발명은 본 명세서의 임의의 실시형태에 따른 TGR-1202의 PTSA 염의 결정질 B형(예를 들어, 본 명세서의 임의의 실시형태에서 정의된 바와 같은 입자 크기 분포를 갖는 TGR-1202의 PTSA 염의 결정질 B형) 및 1종 이상의 약제학적으로 허용 가능한 부형제를 포함하는 약제학적 조성물을 제공한다. 일 실시형태에서, 약제학적 조성물은 본 명세서의 임의의 실시형태에 따른 TGR-1202의 PTSA 염의 결정질 B형(예를 들어, 본 명세서의 임의의 실시형태에 정의된 바와 같은 입자 크기 분포를 갖는 TGR-1202의 PTSA 염의 결정질 B형)의 치료적 유효량을 포함한다. 약제학적 조성물은 본 명세서에 기술된 바와 같은 1종 이상의 추가 활성 성분을 포함할 수 있다.
부형제는 희석제, 충전제, 염, 붕해제, 결합제, 윤활제, 활택제, 분산제, 현탁제, 습윤제, 제어 방출 매트릭스, 착색제, 풍미제, 완충제, 안정화제, 가용화제, 및 이의 조합에서 선택될 수 있다.
본 발명의 약제학적 조성물은 단독으로 또는 1종 이상의 다른 활성제와 조합하여 투여될 수 있다. 바람직한 경우, 대상 화합물 및 다른 작용제(들)는 조제물로 혼합되거나 또는 양쪽 성분들은 그들을 개별적으로 또는 동시에 조합해서 사용하도록 개별 조제물로 제제화될 수 있다.
TGR-1202의 PTSA 염 및 본 명세서에 기술된 약제학적 조성물은 작용 부위에 TGR-1202를 전달할 수 있는 임의 경로, 예컨대 경구, 구강, 비내, 국소(예를 들어, 경피), 십이지장내, 비경구(정맥내, 동맥내, 근육내, 혈관내, 복강내 또는 주사나 주입을 포함), 피부내, 유선내, 척추강내, 안내, 후안구, 폐내(예를 들어, 에어로졸화된 약물) 또는 피하(예를 들어, 지라 피막, 뇌, 또는 각막 하에 삽입된, 장기 방출을 위한 데포 투여를 포함), 설하, 항문, 직장, 질, 또는 외과적 이식(예를 들어, 지라 피막, 뇌, 또는 각막 하에 삽입)에 의해 투여될 수 있다.
조성물은 고체, 반고체, 액체 또는 기체 형태로 투여될 수 있거나, 또는 건조 분말, 예컨대 동결건조 형태일 수 있다. 약제학적 조성물은 예를 들어, 고체 투약 형태(즉, 제형), 예컨대, 캡슐, 샤세, 카셰, 젤라틴, 종이, 정제, 좌제, 펠렛, 알약, 트로키, 및 로젠지를 포함하는, 전달에 편리한 형태로 포장될 수 있다. 포장 유형은 일반적으로 원하는 투여 경로에 따라 좌우된다. 경피 제형처럼, 이식가능한 지속 방출 제형이 또한 고려된다.
투여되는 TGR-1202의 PTSA 염의 양은 치료하려는 포유동물, 장애 또는 병태의 중증도, 투여 경로, 화합물의 성질 및 처방 의사의 판단에 따라 좌우된다. 그러나, 유효 용량은 단일 또는 분할 용량으로, 1일 당 체중 kg 당 약 0.001 내지 약 100 mg, 바람직하게 약 1 내지 약 35 mg/kg/일 범위이다. 70 kg 인간의 경우, 용량은 약 0.05 내지 7 g/일, 바람직하게 약 0.05 내지 약 2.5 g/일에 달한다. 본 명세서에 기술된 TGR-1202의 PTSA 염의 유효량은 단일 또는 다수 용량(예를 들어, 1일 2회 또는 3회)으로 투여될 수 있다.
본 명세서에 기술된 TGR-1202의 PTSA 염은 1종 이상의 항암제(예를 들어, 화학치료제), 치료 항체, 및 방사선 치료와 조합하여 사용될 수 있다.
본 명세서에 기술된 TGR-1202의 PTSA 염은 염증성 병태의 증상 예컨대 뇌척수염, 천식, 및 본 명세서에 기술된 다른 질환의 증상을 경감시키는 작용을 하는 다른 작용제와 함께 제제화되거나 또는 투여될 수 있다. 이들 작용제는 비스테로이드성 항염증 약물(NSAID)을 포함한다.
다양한 약제학적 조성물의 제조는 당분야에 공지이다. 예를 들어, 다음의 문헌들을 참조하고, 이들 모두를 그들 전체로 참조로 본 명세서에 편입시킨다: Anderson, Philip O.; Knoben, James E.; Troutman, William G, eds., Handbook of Clinical Drug Data, Tenth Edition, McGraw-Hill, 2002; Pratt and Taylor, eds., Principles of Drug Action, Third Edition, Churchill Livingston, New York, 1990; Katzung, ed., Basic and Clinical Pharmacology, Ninth Edition, McGraw Hill, 2003; Goodman and Gilman, eds., The Pharmacological Basis of Therapeutics, Tenth Edition, McGraw Hill, 2001; Remingtons Pharmaceutical Sciences, 20th Ed., Lippincott Williams & Wilkins., 2000; Martindale, The Extra Pharmacopoeia, Thirty-Second Edition (The Pharmaceutical Press, London, 1999).
일 실시형태에서, 본 명세서에 기술된 TGR-1202의 PTSA 염은 약 20 내지 5,000 ng/mL의 혈중 화합물 농도가 야기되도록 선택된 용량에서 선택되고, 투여 후 약 6 내지 24시간 동안 그러한 농도를 유지한다. 다른 특정 실시형태에서, 용량 크기 및 빈도는 약 50 내지 2,500 ng/mL의 혈중 화합물 농도가 달성되도록 선택되고 투여 시점으로부터 약 6 내지 24시간의 기간 동안 상기 농도를 유지한다. 일부 실시형태에서, 용량 크기 및 빈도는 투여 후 약 100 내지 1,500 ng/mL의 혈중 TGR-1202 농도가 달성되도록 선택된다. 일부 실시형태에서, 용량 크기 및 빈도는 투여 시점으로부터 약 6 내지 24시간의 기간 동안 약 100 내지 750 ng/mL의 혈중 TGR-1202 농도가 달성되도록 선택된다. 추가 실시형태에서, 용량 크기 및 빈도는 적어도 약 300 ng/mL이고, 약 10,000 ng/mL를 넘지 않는 TGR-1202의 PTSA 염의 Cmax, 혈장 수준이 달성되도록 선택된다.
치료 방법
본 발명은 또한, 제한 없이 PI3 키나제의 1종 이상의 유형의 기능 부전과 연관된 질환을 포함하는, 질환 상태를 치료하기 위해 본 발명의 화합물 및 약제학적 조성물을 사용하는 방법을 제공한다.
PI3 δ 키나제 활성에 의해 매개되는 병태 및 장애에 관한 상세 설명은, 예를 들어, 국제 특허 공개 제WO 2001/81346호, 제WO 2010/123931호, 제WO 2010/0111432호 및 제WO 2010/057048호, 및 미국 특허 공개 제2005/043239호에 기술되어 있고, 이들 각각을 모든 목적을 위해 그 전체로 참조로 본 명세서에 편입시킨다.
본 명세서에 제공된 치료 방법은 치료적 유효량의 본 발명의 화합물을 대상체에게 투여하는 단계를 포함한다. 일 실시형태에서, 본 발명은 포유동물에서 자가면역 질환을 포함하는, 염증 질환을 치료하는 방법을 제공한다. 이 방법은 치료적 유효량의 본 발명의 화합물을 상기 포유동물에게 투여하는 단계를 포함한다.
본 발명의 치료 방법이 인간 의학 및 수의학 분야에서 유용함을 이해하게 될 것이다. 따라서, 치료하려는 개체는 포유동물, 바람직하게 인간, 또는 다른 동물일 수 있다. 수의학적 목적의 경우, 개체는 제한 없이, 소, 양, 돼지, 말 및 염소를 포함하는 가축; 반려 동물 예컨대 개 및 고양이; 외래 및/또는 동물원 동물; 마우스, 래트, 토끼, 기니 피그, 및 햄스터를 포함하는 실험실 동물; 가금류 예컨대 닭, 칠면조, 오리 및 거위를 포함한다.
본 발명은 또한 대상체에서 과증식성 장애를 치료하는 방법에 관한 것이고, 치료적 유효량의 본 발명의 화합물 또는 이의 약제학적으로 허용 가능한 염을 상기 포유동물에게 투여하는 단계를 포함한다. 일부 구체예에서, 상기 방법은 암 예컨대 급성 골수성, 백혈병, 흉선, 뇌, 폐, 편평 세포, 피부, 눈, 망막아세포종, 안내 흑색종, 구강 및 구강인두, 방광, 위, 위, 췌장, 방광, 유방, 자궁경부, 머리, 목, 신장, 신장, 간, 난소, 전립선, 결장직장, 식도, 고환, 부인과, 갑상선, CNS, PNS, AIDS-관련(예를 들어, 림프종 및 카포시 육종) 또는 바이러스-유도 암의 치료에 관한 것이다. 일부 실시형태에서, 상기 방법은 비암성 과증식성 장애, 예컨대 피부의 양성 과형성증(예를 들어, 건선), 재협착증, 또는 전립선(예를 들어, 양성 전립선 비대증(BPH))의 치료에 관한 것이다.
실시예
이하에 제공되는 실시예 및 제조 방법은 본 발명의 화합물 및 조성물을 제조하는 방법을 더욱 예시하고 용례를 들어 설명한다. 본 발명의 범주가 이하의 실시예 및 제조 방법의 범주에 의해 임의 방식으로 제한되는 것이 아님을 이해한다.
XPRD 패턴은 하기의 측정 변수를 사용해서 Cu LFF X-선 관(45 kV, 40 mA)이 장착된 엑스퍼트프로(X'PertPRO) MPD 회절계에서 획득하였다:
스캔 방식: 연속
PSD 방식: 스캐닝
PSD 길이: 2.12 °2θ
스캔 범위: 2.5∼40 °2θ
스텝 크기: 0.017/스텝
스캔 스탭 시간: 12.065초
발산 슬릿 유형: 자동
단색 입사빔: 없음
스피닝: 있음
DSC 스펙트럼은 DSCQ2000 V24.11 빌드 124에서 획득하였다.
실시예 1: TGR-1202의 PTSA 염(A형)의 제조
7100g의 TGR-1202를 56.8 리터의 아세톤을 함유하는 반응기에 충전시켰고 대기 온도에서 교반시켰다. 4680g의 p-톨루엔 설폰산을 부가하고 반응 혼합물을 60-65℃의 온도에서 약 6시간 동안 가열하였다. 용매를 감압 하에서 증류에 의해 제거시켜 습윤 잔류물을 얻었다. 이 습윤 잔류물을 가스 제거하고 20℃ 미만으로 냉각시켰다. 대략 142 리터의 다이에틸 에터를 이어서 부가하고 얻어진 혼합물을 밤새 교반시킨 후, 여과하여 고체 덩어리를 얻고 다이에틸 에터로 세척하고 진공 건조시켜 고체 덩어리를 생산하였다. 상기 고체 덩어리를 다이에틸 에터에 재현탁시키고, 6시간 동안 교반한 후, 여과하여 고체 덩어리를 얻고, 후속하여 56.8 리터의 아세톤에 용해시켰으며, 하이플로우(HiFlow) 층을 통해 여과시키고 감압 하에 농축시켰다. 최종 잔류물 덩어리를 밤새 물과 교반한 후, 여과하고 진공 건조시켜 6600g의 TGR-1202의 PTSA 염을 산출하였다. HPLC: 99.21% 및 99.64:0.36(S:R)의 키랄 순도.
실시예 2: TGR-1202의 PTSA 염(B형)의 제조
1000g의 TGR-1202를 8리터의 아세톤을 함유하는 반응기에 충전하고 대기 온도에서 교반하였다. 666g의 p-톨루엔 설폰산을 이어서 부가하고 이 반응 혼합물을 60-65℃에서 6시간 동안 가열하였다. 용매를 감압 하에 증류에 의해 제거하고 습윤 잔류물을 얻었다. 습윤 잔류물을 가스 제거하였고 20℃ 미만으로 냉각시켰다. 대략 20리터의 다이에틸 에터를 부가하고 얻어진 혼합물을 밤새 교반한 후, 여과하여 고체 덩어리를 얻고, 다이에틸 에터로 세척하고 진공 건조시켜 고체 덩어리를 산출한 후 진공 건조시켜 1150g의 TGR-1202의 PTSA 염을 산출하였다. HPLC: 99.33% 및 키랄 순도: 99.61:0.39(S:R).
표 1은 실시예 1 및 2의 생성물에 대한 XRPD 패턴 피크 및 상대적 피크 강도를 열거한다.
| 실시예 1 | 실시예 2 | ||
| 2 세타 | 상대 강도(%) | 2 세타 | 상대 강도(%) |
| 5.0111 | 90.45 | 5.0368 | 99.91 |
| 6.1947 | 17.54 | 6.2245 | 23.13 |
| 7.3344 | 28.14 | 7.3722 | 27.98 |
| 7.8955 | 23.93 | 7.9120 | 15.31 |
| 8.4677 | 5.77 | 8.4862 | 3.10 |
| 10.0914 | 95.66 | 10.1351 | 100.00 |
| 12.2407 | 38.58 | 12.2720 | 25.41 |
| 13.0311 | 18.40 | 12.4494 | 28.74 |
| 13.3639 | 18.53 | 13.0607 | 18.06 |
| 15.9118 | 43.52 | 13.3947 | 6.18 |
| 16.1260 | 62.05 | 15.9313 | 18.53 |
| 16.3442 | 43.31 | 16.1429 | 30.80 |
| 17.3580 | 33.21 | 16.3476 | 17.15 |
| 17.7652 | 36.83 | 16.7829 | 3.73 |
| 18.1828 | 34.80 | 17.0690 | 9.84 |
| 19.0276 | 20.04 | 17.3057 | 9.38 |
| 19.5461 | 38.96 | 17.4929 | 9.78 |
| 20.0004 | 50.44 | 17.7730 | 16.33 |
| 20.8037 | 38.08 | 18.2136 | 15.19 |
| 21.1204 | 27.38 | 18.4160 | 12.24 |
| 21.7227 | 32.60 | 18.7137 | 6.65 |
| 22.0621 | 78.29 | 19.1252 | 12.24 |
| 22.8416 | 33.03 | 19.6214 | 21.10 |
| 23.1627 | 26.64 | 20.0040 | 25.77 |
| 24.4157 | 100.00 | 20.8028 | 15.49 |
| 25.3391 | 39.04 | 21.1629 | 11.75 |
| 26.9321 | 23.79 | 21.4304 | 8.00 |
| 27.8349 | 14.56 | 21.7505 | 13.89 |
| 28.4163 | 12.04 | 22.1114 | 47.85 |
| 29.2666 | 25.40 | 22.8531 | 9.68 |
| 30.3829 | 10.40 | 23.1912 | 10.23 |
| 34.2390 | 3.40 | 24.4503 | 62.76 |
| 35.8360 | 4.32 | 25.0031 | 15.78 |
| 38.0065 | 6.35 | 25.4128 | 18.58 |
| 38.9170 | 1.78 | 26.6621 | 4.52 |
| 26.9692 | 14.35 | ||
| 27.4037 | 4.15 | ||
| 27.8432 | 9.39 | ||
| 28.5253 | 6.78 | ||
| 29.3252 | 17.35 | ||
| 29.6443 | 6.08 | ||
| 30.4781 | 5.95 | ||
| 31.1600 | 1.72 | ||
| 32.5213 | 2.02 | ||
| 32.9371 | 2.57 | ||
| 34.1290 | 1.91 | ||
| 35.6680 | 3.36 | ||
| 36.0502 | 2.33 | ||
| 36.7594 | 2.46 | ||
| 37.1729 | 1.34 | ||
| (도 1도 참조) | (도 2도 참조) | ||
표 1A는 실시예 1 및 2에서 제조된 PTSA 염의 DSC 흡열성을 열거한다.
[표 1A]
실시예 3: 입자 크기 분석
실시예 1 및 2에서 제조된 TGR-1202의 PTSA 염의 입자 크기(PSD) 분석은 시로코(Scirocco) 2000 건조 분말 시스템과 말번 마스터 사이저(Malvern Master Sizer) 2000을 사용해서 이하에 기술된 바와 같이 수행하였다. 장비 변수는 다음과 같다:
절차: 5g의 TGR-1202를 샘플 측정 셀(즉, 시로코 2000)에 전달하고 기류를 시작하였다. 레이저 강도는 70% 초과로 유지하였다. 측정을 시작하였고 진동 공급률은 한계치 내로 암흑화를 획득하기 위해 증가시켰다. 암흑화가 한계치 내에 오면, 측정치를 기록하였다. 분석은 삼중으로 수행하였고 제공된 결과는 3회 실험의 평균이다.
실시예 1 및 2의 생성물의 입자 크기 분포(PSD)를 하기 표 2에 나타낸다.
| TGR-1202의 PTSA 염 | |||
| 실시예 | d(0.1)㎛ | d(0.5)㎛ | d(0.9)㎛ |
| 실시예 1 | 8.01 | 147.41 | 510.73 |
| 실시예 2 | 1.07 | 3.98 | 12.18 |
실시예 4: TGR-1202의 PTSA의 정제화
200 ㎎(유리 염기 형태로 계산)의 실시예 1 및 2의 TGR-1202의 PTSA 염을 함유하는 정제 코어를 그들의 용해 특성을 실험하기 위해 제조하였다. 이들 제형은 각각 실시예 4a 및 4b로 표시한다. 실시예 1 및 2에서 제조된 TGR-1202의 PTSA 염의 입자 크기 분포는 실시예 3에서 제공하였다.
실시예 4a: 실시예 1에서 제조된 TGR-1202의 PTSA 염을 함유하는 6종의 상이한 정제를 제조하였다(T1, T2, T3, T4, T5 및 T6).
실시예 4b: 실시예 2에서 제조된 TGR-1202의 PTSA 염을 함유하는 6종의 상이한 정제를 제조하였다(T1, T2, T3, T4, T5 및 T6).
사용된 장비: 사용된 정제화 장비를 표 3에 도시하였다.
| 단계 | 장비 명칭 |
| 제작 | 체 20 또는 24#, 40#, 및 60# 체 |
| 고속 혼합기 제립기(RMG) | |
| 교반기 | |
| SS 용기 | |
| FBD | |
| 1.0㎜ SS 스크린의 다중밀 | |
| 콘타 블렌더 | |
| 압착 | 압착 기계 캐드프레스 |
| 17.8 x 8.8㎜, 타원형 D-압형 | |
| 정제 집진기 | |
| 금속 검출기(선택) | |
| 피복 | 피복기 |
| 교반기 | |
| SS 용기 | |
| 포장 | 열유도 밀봉기 |
정제의 제조: 정제의 제형을 하기 표 4에 나타내었다.
| 제형 200 mg 용량 농도(유리 염기 형태로서 계산) | |||
| 일련 번호 | 성분 | 실시예 4a |
실시예 4b |
| 1 | TGR-1202의 PTSA 염 | 260.20 (염) | 260.20 (염) |
| 2 | 하이드록시프로필 베타덱스 | 270.00 | 270.00 |
| 3 | 미세결정질 셀룰로스(아비셀 PH101) | 41.80 | 41.80 |
| 4 | 크로스카멜로스 나트륨(Ac-Di-Sol) | 20.00 | 20.00 |
| 5 | 하이드록시프로필 셀룰로스(클루셀 LF) | 6.00 | 6.00 |
| 6 | 정제수 | 충분량 | 충분량 |
| 7 | 크로스카멜로스 나트륨(Ac-Di-Sol) | 70.00 | 70.00 |
| 8 | 스테아르산마그네슘 | 2.00 | 2.00 |
| 코어 정제 중량 | 670.00 | 670.00 | |
| 피복부 | |||
| 9 | 오파드라이 II 브라운 40L565004 | -- | 20.10 |
| 10 | 정제수 | -- | 충분량 |
| 피복된 정제 중량 | -- | 690.10 | |
제작 과정: 정제를 다음과 같이 제조하였다:
1. 제법에서 필요한 원재료 분량을 분배한다.
2. #40 메쉬를 통해 하이드록시프로필 베타덱스, 크로스카멜로스 나트륨 및 미세결정질 셀룰로스와 API를 공동 체질하고 제조 과정의 벌크 용기 또는 이중 폴리에틸렌 백에 수집한다.
3. 스테인레스강 용기에서 교반 하에 정제수에 계량된 분량의 하이드록시프로필 셀룰로스(클루셀 LF)를 용해하여 투명한 용액(결합제 용액)을 제공한다.
4. 고속 혼합기 제립기(RMG)에 단계 2의 블렌드를 적재하고 초퍼는 끄고 저속 임펠러에서 8분간 혼합한다.
5. 단계 3의 결합제 용액과 단계 4의 블렌드를 과립화한다. 적절한 점조도의 과립을 얻기 위해 필요하면 추가의 물을 부가한다. 필요하면 추가 혼련을 수행한다. 과립화 동안, 필요한 경우, 간헐적인 스크래핑을 수행한다.
6. 건조 감량(LOD)이 3.0% w/w 이하일 때까지 65℃가 넘지 않는 입구 온도에서 유동층 건조기(FBD)에서 습윤 덩어리를 건조시킨다. 필요한 경우, 간헐적인 스크래핑을 수행한다.
7. 단계 6의 건조 과립을 24# 체를 통과시키고 체질된 과립을 개별적으로 수집한다. 칼날을 앞쪽으로 하고 고속으로 1.0㎜ 스테인레스강 스크린이 장착된 다중밀을 통해 24# 보유된 과립을 밀링한다. 밀링된 과립을 수집하고 진동식 체가 장착된 24# 체를 통해 체질한다. 24# 통과한 과립을 개별 폴리백에 수집한다.
8. 필요하면, 24#에 보유된 과립에 대해 다시 한번 단계 7을 반복한다. 제조 과정 벌크 용기 또는 이중 폴리에틸렌 백에 수집한다.
9. #40을 통해서 크로스카멜로스 나트륨을 체질하고 12 rpm에서 8분간 콘타 블렌더에서 단계의 과립들과 혼합한다.
10. #60 메쉬를 통해 스테아르산마그네슘을 체질하고 12 rmp에서 3분간 콘타 블렌더에서 단계 9의 블렌드와 혼합한다.
11. 윤활된 과립을 이중 폴리텐 백에 장입한다. 윤활된 과립의 무게를 칭량하고 기록한다.
12. 17.8 × 8.8㎜로 윤활 블렌드를 압착하고, 670.00 mg/정제의 평균 중량의 난형을 타정한다.
이하에 기술한 피복 절차는 실시예 4b의 정제에 대해서만 수행하였다.
13. 피복 용액 제조: 칭량된 분량의 정제수를 기계 교반기가 장착된 용기에 전달한다. 연속 교반하면서 정제수에 오파드라이(Opadry) II 브라운 40L565004을 분산시키고 45분간 혼합한다. 100# 체 또는 나일론 천을 통해 얻어진 현탁물을 여과시킨다.
14. 압착된 정제를 피복팬에 적재하고 필요한 중량 증가(2.5 내지 3.5%)가 달성될 때까지 계속 피복시킨다.
실시예 4a 및 4b의 정제에 대한 제조 과정 점검(IPC) 데이터를 각각 표 5 및 6에 나타낸다.
| 실시예 4a: IPC 데이터 200 mg 농도 | |||
| 변수 | 명목 | 평균 | 범위 |
| 중량 [mg] | 670.00 ± 5% | 669.70 | 664.8 - 678.6 |
| 두께 [mm] | - | 5.31 | 5.27 - 5.35 |
| 경도 [Kp] | 12.0 ± 4.0 | 12.2 | 11.2 - 13.1 |
| 붕해도 [분] | 오직 기록용 | 14-15분 | |
| 마손도 | 1% 미만 | 0.018% | |
| 실시예 4b: IPC 데이터 200 mg 농도 | |||
| 변수 | 명목 | 평균 | 범위 |
| 중량 [mg] | 670.00 ± 5% | 671.10 | 650 - 683 |
| 두께 [mm] | - | -- | 5.33 - 5.42 |
| 경도 [Kp] | 12.0 ± 4.0 | -- | 12.53 - 14.83 |
| 붕해도 [분] | 오직 기록용 | 16-17분 | |
| 마손도 | 1% 미만 | 0.04% | |
경구 섭취된 정제는 여전히 이용할 수 있는 가장 효과적인 치료 수단 중 하나이다. 이러한 투약 형태의 효능은 전신 순환계로 흡수 전 위장관 유체 중 약물 용해능에 의존적이다. 그러므로, 정제의 용해율은 그 성능과 관련된다.
실시예 4a 및 4b에 의한 코어의 용해는 다음의 변수들을 사용해서 수행하였다: 900 mL의 1% 라우릴황산나트륨(SLS)과 0.1N HCl의 수용액, USP 장비 1에 따른 패들 기기, 분 당 100회의 패들 속도, 및 6회 연속 실행(n=6). pH가 1인 매질에서 용해를 위한 기준은 120분간 75%(Q = 75) 이상이다. 용해 결과를 하기 표 7에 나타내었다.
| 시간 (분) | 실시예 4a | 실시예 4b | ||
| 약물 방출률% | RSD | 약물 방출률% | RSD | |
| 10 | 24 | 10.1 | 7 | 11.7 |
| 15 | 39 | 8.3 | 15 | 12.4 |
| 30 | 70 | 10.3 | 44 | 8.9 |
| 45 | 78 | 12.3 | 72 | 5.6 |
| 60 | 79 | 13.3 | 91 | 2.3 |
| 90 | 81 | 12.8 | 98 | 2.4 |
| 120 | 82 | 12.1 | 100 | 2.6 |
실시예 5
약동학
정제(실시예 4a 및 4b)의 경구 생체이용률은 건강한 인간 지원자에서 평가하였다. 약동학 실험의 프로토콜을 하기에 제공한다.
모든 건강한 지원자들은 투약 전에 밤새(12시간) 단식하였고 시험 제형의 투여 후 4.0시간까지 단식을 지속하였다. 시험 제형(정제)은 실시예 4a 및 4b에서 제공한 대로 제조하였다. 혈액 샘플을 채취하고, 항응고제를 함유한 미세원심분리 튜브에 넣었다. 혈액 샘플을 즉시 원심분리하였고 분리된 혈장 샘플을 -80℃ 이하로 냉동시키고 분석까지 저장하였다. 모든 샘플의 검사 항목의 혈장 농도는 LC-MS/MS로 분석하였다. 약동학 변수(즉, Cmax, AUC0-t, Tmax 및 t1/2)를 추산하였다.
실시예 2에 따라 제조된 TGR-1202의 PTSA 염을 포함하는 정제 조성물은 실시예 1에 따라 제조된 TGR-1202의 PTSA 염을 포함하는 정제 조성물보다 약 2.5배 큰 Cmax 및 약 1.9배 큰 곡선하 면적(AUC)을 나타냈다. 그 결과를 하기 표 8에 제공한다.
| 인간 약동학 | ||
| 변수 | 실시예 4a의 정제 | 실시예 4b의 정제 |
| # 건강한 지원자 | 12 | 12 |
| 용량 (mg) | 200 | 200 |
| 중간 Tmax (시간) | 2 | 3 |
| Cmax (ng/mL) | 155.97 | 395.49 |
| *T1/2 (시간) | 74.92 | 73.59 |
| AUC0-t (㎍x 시간/mL) | 5.06 | 9.43 |
| AUC0-inf (㎍ x 시간/mL) |
7.28 | 13.92 |
본 명세서의 발명을 특정 실시형태를 참조하여 설명하였지만, 이들 실시형태는 단지 본 발명의 원리 및 응용의 일례임을 이해해야 한다. 따라서, 상기 기술된 바와 같이 본 발명의 정신 및 범주를 벗어나지 않고 수많은 변형들이 상기 예시적인 실시형태에 가해질 수 있고 다른 방식들이 고안될 수 있음을 이해한다. 첨부된 청구항이 본 발명의 범주를 한정하고, 이들 청구항의 범주에 속하는 방법 및 구조와 그들의 균등물을 그에 따라 포괄하고자 한다.
본 출원에서 인용한 모든 간행물, 특허 및 특허 출원은 각각의 개별 간행물, 특허 또는 특허 출원이 참조로 본 명세서에 편입된다고 구체적이고 개별적으로 표시한 바와 같이 동일한 정도로 참조로 본 명세서에 편입된다.
Claims (43)
- (S)-2-(1-(4-아미노-3-(3-플루오로-4-아이소프로폭시페닐)-1H-피라졸로[3,4-d]피리미딘-1-일)에틸)-3-(3-플루오로페닐)-4H-크로멘-4-온의 p-톨루엔설폰산 염으로서, 상기 염은 약 5 내지 약 50㎛의 d(0.9)를 갖는, 염.
- 제1항에 있어서, 상기 염은 약 5 내지 약 25㎛의 d(0.9)를 갖는, 염.
- 제1항 또는 제2항에 있어서, 상기 염은 약 5 내지 약 15㎛의 d(0.9)를 갖는, 염.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 염은 약 1 내지 약 10㎛의 d(0.5)를 갖는, 염.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 염은 약 2 내지 약 5㎛의 d(0.5)를 갖는, 염.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 염은 약 0.5 내지 약 1.5㎛의 d(0.1)을 갖는, 염.
- 제1항 내지 제6항 중 어느 한 항에 있어서, 상기 염은 약 0.5 내지 약 1.0㎛의 d(0.1)을 갖는, 염.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 상기 염은 5.0, 10.1, 22.1, 및 24.5 ± 0.2 °2θ에서 선택된 1개 이상의 피크를 갖는 XRPD 패턴을 나타내는, 염.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 상기 염은 약 146℃에서 특징적인 흡열 피크를 갖는 시차 주사 열량계(DSC) 패턴을 나타내는, 염.
- 제1항 내지 제9항 중 어느 한 항에 있어서, p-톨루엔설폰산 대 (S)-2-(1-(4-아미노-3-(3-플루오로-4-아이소프로폭시페닐)-1H-피라졸로[3,4-d]피리미딘-1-일)에틸)-3-(3-플루오로페닐)-4H-크로멘-4-온의 비율은 약 1:1인, 염.
- (S)-2-(1-(4-아미노-3-(3-플루오로-4-아이소프로폭시페닐)-1H-피라졸로[3,4-d]피리미딘-1-일)에틸)-3-(3-플루오로페닐)-4H-크로멘-4-온의 결정질 p-톨루엔설폰산 염으로서, 상기 결정질 염은 5.0, 10.1, 22.1, 및 24.5 ± 0.2 °2θ에서 선택된 1개 이상의 피크를 갖는 XRPD 패턴을 나타내는, 염.
- 제11항에 있어서, 상기 염은 도 2에 도시된 바와 실질적으로 같은 XRPD 패턴을 나타내는, 염.
- 제11항 또는 제12항에 있어서, 상기 염은 약 1 내지 약 10㎛의 d(0.5)를 갖는, 염.
- 제11항 내지 제13항 중 어느 한 항에 있어서, 상기 염은 약 2 내지 약 5㎛의 d(0.5)를 갖는, 염.
- 제11항 내지 제14항 중 어느 한 항에 있어서, 상기 염은 약 5 내지 약 50㎛의 d(0.9)를 갖는, 염.
- 제11항 내지 제15항 중 어느 한 항에 있어서, 상기 염은 약 5 내지 약 25㎛의 d(0.9)를 갖는, 염.
- 제11항 내지 제16항 중 어느 한 항에 있어서, 상기 염은 약 5 내지 약 15㎛의 d(0.9)를 갖는, 염.
- 제11항 내지 제17항 중 어느 한 항에 있어서, 상기 염은 약 0.5 내지 약 1.5㎛의 d(0.1)을 갖는, 염.
- 제11항 내지 제18항 중 어느 한 항에 있어서, 상기 염은 약 0.5 내지 약 1.0㎛의 d(0.1)을 갖는, 염.
- (S)-2-(1-(4-아미노-3-(3-플루오로-4-아이소프로폭시페닐)-1H-피라졸로[3,4-d]피리미딘-1-일)에틸)-3-(3-플루오로페닐)-4H-크로멘-4-온의 결정질 p-톨루엔설폰산 염으로서, 상기 결정질 염은 5.01, 10.09, 15.91, 16.13, 16.34, 20.00, 22.06 및 24.42 ± 0.2 °2θ에서 선택된 1개 이상의 피크를 갖는 XRPD 패턴을 나타내는, 염.
- 제20항에 있어서, 상기 염은 도 1에 도시된 바와 실질적으로 같은 XRPD 패턴을 나타내는, 염.
- 제20항 또는 제21항에 있어서, 상기 염은 약 146℃에서 특징적인 흡열 피크를 갖는 시차 주사 열량계(DSC) 패턴을 나타내는, 염.
- 제20항 내지 제22항 중 어느 한 항에 있어서, 상기 염은 상기 p-톨루엔설폰산 염의 다른 고체상 형태가 실질적으로 없는, 염.
- 제20항 내지 제23항 중 어느 한 항에 있어서, 상기 염은 상기 p-톨루엔설폰산 염의 다른 고체상 형태를 5% 미만으로 함유하는, 염.
- 제1항 내지 제24항 중 어느 한 항의 염 및 약제학적으로 허용 가능한 부형제를 포함하는 약제학적 조성물.
- 세포에 존재하는 PI3 δ 키나제의 촉매 활성을 억제하는 방법으로서, 유효량의 제1항 내지 제24항 중 어느 한 항의 염을 상기 세포와 접촉시키는 단계를 포함하는, PI3 δ 키나제의 촉매 활성을 억제하는 방법.
- 제26항에 있어서, 상기 억제는 암, 골 질환, 염증성 질환, 면역 질환, 신경계 질환, 대사 질환, 호흡기 질환, 혈전증, 또는 심장 질환인 질환 또는 장애를 앓는 대상체에서 일어나는, 방법.
- PI3K 연관된 질환 또는 장애의 치료를 위한 방법으로서, 유효량의 제1항 내지 제24항 중 어느 한 항의 염을 상기 치료를 필요로 하는 대상체에게 투여하는 단계를 포함하는, PI3K 연관된 질환 또는 장애의 치료를 위한 방법.
- 제28항에 있어서, 적어도 하나의 다른 항암제, 항염증제, 면역억제제, 스테로이드, 비스테로이드성 항염증제, 항히스타민제, 진통제, 또는 이의 혼합물을 이를 필요로 하는 대상체에게 동시에 또는 순차적으로 투여하는 단계를 더 포함하는, 방법.
- 제28항 또는 제29항에 있어서, 상기 PI3K 연관된 질환, 장애 또는 병태는 면역계-관련 질환, 염증을 포함하는 질환 또는 장애, 암 또는 다른 증식성 질환, 간 질환 또는 장애, 또는 신장 질환 또는 장애인, 방법.
- 제28항 내지 제30항 중 어느 한 항에 있어서, 상기 PI3K 연관된 질환, 장애 또는 병태는 염증, 사구체신염, 포도막염, 간 질환 또는 장애, 신장 질환 또는 장애, 만성 폐쇄성 폐질환, 류마티스성 관절염, 염증성 장질환, 혈관염, 피부염, 골관절염, 염증성 근육 질환, 알레르기성 비염, 질염, 간질성 방광염, 경피증, 골다공증, 습진, 동종 또는 이종 이식, 이식편 거부증, 이식편대 숙주 질환, 홍반성 루푸스, 폐 섬유증, 피부근염, 갑상선염, 중증 근무력증, 자가면역성 용혈성 빈혈증, 낭포성 섬유증, 만성 재발성 간염, 원발성 담즙성 간경화증, 알레르기성 결막염, 간염, 아토피성 피부염, 천식, 쇠그렌 증후군, 장기 이식 거부증, 다발성 경화증, 길랭-바레, 자가면역성 포도막염, 자가면역성 용혈성 빈혈증, 악성 빈혈, 자가면역성 혈소판 감소증, 측두 동맥염, 항-인지질 증후군, 맥관염 예컨대 베게너 육아종증, 베체트병, 건선, 포진성 피부염, 심상성 천포창, 백반증, 크론병, 대장염, 궤양성 대장염, 원발성 담즙성 간경화증, 자가면역성 간염, 1형 또는 면역-매개 진성 당뇨병, 그레이브스병. 하시모토 갑상선염, 자가면역성 난소염 및 고환염, 부신의 자가면역 장애, 전신 홍반성 루푸스, 다발성 근염, 피부근염, 강직성 척추염, 이식 거부증, 피부 이식편 거부증, 관절염, 높은 골흡수와 연관된 골질환, 회장염, 바레트 증후군, 성인 호흡 곤란 증후군, 만성 폐쇄성 기도 질환; 각막 이상증, 트라코마, 회선사상충증, 교감성 안구염, 내안구염; 치은염, 치주염; 결핵; 한센병; 요독 합병증, 신증; 경화성피부염, 건선, 신경계의 만성 탈수초성 질환, AIDS-관련 신경퇴화증, 알츠하이머병, 감염성 수막염, 뇌척수염, 파키슨병, 헌팅톤병, 근위축성 측삭 경화증, 바이러스성 또는 자가면역성 뇌염; 자가면역성 장애, 면역-복합 혈관염, 전신 루푸스 및 홍반; 전신 홍반성 루푸스(SLE); 심근증, 허혈성 심장 질환, 고콜레스테롤혈증, 아테롬성 동맥 경화증, 자간전증; 만성 간부전, 뇌 및 척수 외상, 및 암에서 선택되는, 방법.
- 제28항 내지 제31항 중 어느 한 항에 있어서, 상기 PI3K 연관된 질환, 장애 또는 병태는 림프 계통의 조혈세포 종양, 백혈병, 급성 림프구성 백혈병, 급성 림프아구성 백혈병, B-세포 림프종, T-세포 림프종, 호지킨 림프종, 비호지킨 림프종, 모발 세포 림프종 및 버킷 림프종; 골수 계통의 조혈세포 종양, 급성 골수성 백혈병, 만성 골수성 백혈병, 골수이형성 증후군, 전골수구성 백혈병; 방광의 암종, 유방의 암종, 결장의 암종, 신장의 암종, 간의 암종, 폐의 암종, 소세포 폐암, 식도암, 담낭암, 난소암, 췌장암, 위암, 자궁경부암, 갑상선암, 전립선암, 피부암, 편평 세포 암종; 간엽 기원의 종양, 섬유육종, 횡문근육종; 중추 및 말초 신경계의 종양, 성상세포종, 신경아세포종, 신경교종, 신경초종; 흑색종, 정상피종, 기형암종, 골육종, 색소성 건피증, 각질극세포종, 갑상선 소포성 암 및 카포시 육종에서 선택되는, 방법.
- 제28항 내지 제32항 중 어느 한 항에 있어서, PI3K 연관된 질환, 장애 또는 병태는 만성 폐쇄성 폐질환, 천식, 류마티스성 관절염, 만성 기관지염, 아토피성 피부염, 다발성 경화증, 염증성 장질환, 알레르기성 비염, 홍반성 루푸스 및 궤양성 대장염에서 선택되는, 방법.
- 제28항 내지 제33항 중 어느 한 항에 있어서, 상기 PI3K 연관된 질환, 장애 또는 병태는 림프 계통의 조혈세포 종양, 백혈병, 급성 림프구성 백혈병, 급성 림프아구성 백혈병, B-세포 림프종, T-세포 림프종, 호지킨 림프종, 비호지킨 림프종, 만성 림프구성 백혈병, 모발 세포 림프종 및 버킷 림프종, 골수 계통의 조혈세포 종양, 급성 골수성 백혈병, 만성 골수성 백혈병, 골수이형성 증후군, 전골수구성 백혈병 또는 무증상 다발성 골수종을 포함하는 다발성 골수종, 비분비성 골수종, 골경화 골수종, 혈장 세포 백혈병, 고립성 형질세포종, 및 수질회 형질세포종에서 선택되는, 방법.
- 제28항 내지 제34항 중 어느 한 항에 있어서, 상기 PI3K 연관된 질환, 장애 또는 병태는 만성 림프구성 백혈병(CLL), 비호지킨 림프종(NHL), 급성 골수성 백혈병(AML), 다발성 골수종(MM), 소형 림프구성 림프종(SLL), 무통성 비호지킨 림프종(I-NHL), 급성 림프구성 백혈병(ALL), 외투 세포 림프종(MCL), 소포성 림프종, 발데스트롬 마크로글로불린혈증(WM), T-세포 림프종, B-세포 림프종, 및 미만성 거대 B-세포 림프종(DLBCL)에서 선택되는, 방법.
- 재발성 또는 난치성 혈액 악성 종양의 치료를 위한 방법으로서, 유효량의 제1항 내지 제24항 중 어느 한 항의 염을 상기 치료를 필요로 하는 대상체에게 투여하는 단계를 포함하는, 재발성 또는 난치성 혈액 악성 종양의 치료를 위한 방법.
- 제36항에 있어서, 상기 악성 종양은 비호지킨 림프종, 만성 림프구성 백혈병, 말초 T-세포 림프종, 및 호지킨 림프종에서 선택되는, 방법.
- 비호지킨 림프종, 만성 림프구성 백혈병, 말초 T-세포 림프종, 및 호지킨 림프종의 치료를 위한 방법으로서, 유효량의 제1항 내지 제24항 중 어느 한 항의 염을 상기 치료를 필요로 하는 대상체에게 투여하는 단계를 포함하는, 비호지킨 림프종, 만성 림프구성 백혈병, 말초 T-세포 림프종, 및 호지킨 림프종의 치료를 위한 방법.
- (S)-2-(1-(4-아미노-3-(3-플루오로-4-아이소프로폭시페닐)-1H-피라졸로[3,4-d]피리미딘-1-일)에틸)-3-(3-플루오로페닐)-4H-크로멘-4-온의 p-톨루엔설폰산 염 및 에터 용매의 혼합물에서 용매를 제거하는 단계를 포함하는, (S)-2-(1-(4-아미노-3-(3-플루오로-4-아이소프로폭시페닐)-1H-피라졸로[3,4-d]피리미딘-1-일)에틸)-3-(3-플루오로페닐)-4H-크로멘-4-온의 결정질 p-톨루엔설폰산 염의 제조 방법.
- 제39항에 있어서, 상기 혼합물은 에터 용매 중의 (S)-2-(1-(4-아미노-3-(3-플루오로-4-아이소프로폭시페닐)-1H-피라졸로[3,4-d]피리미딘-1-일)에틸)-3-(3-플루오로페닐)-4H-크로멘-4-온의 결정질 p-톨루엔설폰산 염의 현탁물인, 방법.
- 제39항 또는 제40항에 있어서, 상기 방법은 용매를 제거하기 전에 상기 혼합물을 교반하는 단계를 포함하는, 방법.
- 제41항에 있어서, 상기 교반은 적어도 3시간 동안 수행되는, 방법.
- 제39항 내지 제42항 중 어느 한 항에 있어서, 상기 용매는 건조에 의해 제거되는, 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| IN2597/CHE/2014 | 2014-05-27 | ||
| IN2597CH2014 | 2014-05-27 | ||
| IN2596CH2014 | 2014-05-27 | ||
| IN2596/CHE/2014 | 2014-05-27 | ||
| PCT/IB2015/053940 WO2015181728A1 (en) | 2014-05-27 | 2015-05-26 | Improved forms of a pi3k delta selective inhibitor for use in pharmaceutical formulations |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170007480A true KR20170007480A (ko) | 2017-01-18 |
Family
ID=53499042
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167036318A KR20170007480A (ko) | 2014-05-27 | 2015-05-26 | 약제학적 제형에 사용하기 위한 pi3k 델타 선택적 억제제의 개선된 형태 |
Country Status (21)
| Country | Link |
|---|---|
| US (4) | US9969740B2 (ko) |
| EP (2) | EP3149000B1 (ko) |
| JP (3) | JP6987501B2 (ko) |
| KR (1) | KR20170007480A (ko) |
| CN (2) | CN106661030B (ko) |
| AU (1) | AU2015265542B2 (ko) |
| BR (1) | BR112016027674A2 (ko) |
| CA (1) | CA2949932C (ko) |
| CY (1) | CY1124316T1 (ko) |
| DK (1) | DK3149000T3 (ko) |
| EA (1) | EA032506B1 (ko) |
| ES (1) | ES2880999T3 (ko) |
| HR (1) | HRP20211151T1 (ko) |
| HU (1) | HUE054916T2 (ko) |
| IL (1) | IL249058B2 (ko) |
| LT (1) | LT3149000T (ko) |
| PL (1) | PL3149000T3 (ko) |
| PT (1) | PT3149000T (ko) |
| RS (1) | RS62136B1 (ko) |
| SI (1) | SI3149000T1 (ko) |
| WO (1) | WO2015181728A1 (ko) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6987501B2 (ja) * | 2014-05-27 | 2022-01-05 | ライゼン・ファーマシューティカルズ・エスアー | 医薬製剤用pi3kデルタ選択的抑制剤の改良形態 |
| WO2017205843A1 (en) | 2016-05-27 | 2017-11-30 | Tg Therapeutics, Inc. | Combination of anti-cd20 antibody, p13 kinase-delta selective inhibitor, and btk inhibitor to treat b-cell proliferative disorders |
| CN110191720A (zh) | 2016-09-09 | 2019-08-30 | Tg治疗有限公司 | 用于治疗血液学癌症的抗-CD20抗体、PI 3激酶-δ抑制剂以及抗-PD-1或抗-PD-L1抗体的组合 |
| JP2022540466A (ja) * | 2019-07-15 | 2022-09-15 | ジョンソン、マッセイ、パブリック、リミテッド、カンパニー | 非晶質ウムブラリシブモノトシレート |
| WO2022104150A1 (en) | 2020-11-12 | 2022-05-19 | Tg Therapeutics, Inc. | Triple combination to treat b-cell malignancies |
| US11814439B1 (en) | 2022-06-01 | 2023-11-14 | Tg Therapeutics, Inc. | Anti-CD20 antibody compositions |
| US11807689B1 (en) | 2022-06-01 | 2023-11-07 | Tg Therapeutics, Inc. | Anti-CD20 antibody compositions |
| US11884740B1 (en) | 2022-06-01 | 2024-01-30 | Tg Therapeutics, Inc. | Anti-CD20 antibody compositions |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001081346A2 (en) * | 2000-04-25 | 2001-11-01 | Icos Corporation | Inhibitors of human phosphatidyl-inositol 3-kinase delta |
| EP1572744B1 (en) | 2002-12-16 | 2010-06-09 | Genentech, Inc. | Immunoglobulin variants and uses thereof |
| WO2005016348A1 (en) | 2003-08-14 | 2005-02-24 | Icos Corporation | Method of inhibiting immune responses stimulated by an endogenous factor |
| CA2975473C (en) | 2008-11-13 | 2021-01-19 | Gilead Calistoga Llc | Therapies for hematologic malignancies |
| JP2012521994A (ja) | 2009-03-24 | 2012-09-20 | ギリアード カリストガ エルエルシー | 2−プリニル−3−トリル−キナゾリノン誘導体のアトロプ異性体および使用方法 |
| ES2548253T3 (es) | 2009-04-20 | 2015-10-15 | Gilead Calistoga Llc | Métodos para el tratamiento de tumores sólidos |
| SI3260455T1 (sl) | 2012-07-04 | 2019-07-31 | Rhizen Pharmaceuticals S.A. | Selektivni inhibitorji PI3K-delta |
| JP6987501B2 (ja) * | 2014-05-27 | 2022-01-05 | ライゼン・ファーマシューティカルズ・エスアー | 医薬製剤用pi3kデルタ選択的抑制剤の改良形態 |
-
2015
- 2015-05-26 JP JP2016569636A patent/JP6987501B2/ja active Active
- 2015-05-26 PT PT157335324T patent/PT3149000T/pt unknown
- 2015-05-26 AU AU2015265542A patent/AU2015265542B2/en active Active
- 2015-05-26 SI SI201531656T patent/SI3149000T1/sl unknown
- 2015-05-26 LT LTEPPCT/IB2015/053940T patent/LT3149000T/lt unknown
- 2015-05-26 DK DK15733532.4T patent/DK3149000T3/da active
- 2015-05-26 PL PL15733532T patent/PL3149000T3/pl unknown
- 2015-05-26 US US15/313,454 patent/US9969740B2/en active Active
- 2015-05-26 RS RS20210920A patent/RS62136B1/sr unknown
- 2015-05-26 EP EP15733532.4A patent/EP3149000B1/en active Active
- 2015-05-26 EA EA201692255A patent/EA032506B1/ru unknown
- 2015-05-26 CA CA2949932A patent/CA2949932C/en active Active
- 2015-05-26 WO PCT/IB2015/053940 patent/WO2015181728A1/en active Application Filing
- 2015-05-26 CN CN201580034288.7A patent/CN106661030B/zh active Active
- 2015-05-26 EP EP21182208.5A patent/EP3971188A1/en not_active Withdrawn
- 2015-05-26 BR BR112016027674A patent/BR112016027674A2/pt not_active Application Discontinuation
- 2015-05-26 ES ES15733532T patent/ES2880999T3/es active Active
- 2015-05-26 CN CN202010471226.5A patent/CN111635406A/zh active Pending
- 2015-05-26 KR KR1020167036318A patent/KR20170007480A/ko not_active Application Discontinuation
- 2015-05-26 HU HUE15733532A patent/HUE054916T2/hu unknown
-
2016
- 2016-11-20 IL IL249058A patent/IL249058B2/en unknown
-
2018
- 2018-04-11 US US15/950,606 patent/US10414773B2/en active Active
-
2019
- 2019-08-30 US US16/557,091 patent/US10947244B2/en active Active
-
2020
- 2020-05-20 JP JP2020088147A patent/JP2020122022A/ja active Pending
- 2020-12-23 US US17/247,806 patent/US20210269446A1/en not_active Abandoned
-
2021
- 2021-07-19 HR HRP20211151TT patent/HRP20211151T1/hr unknown
- 2021-07-21 CY CY20211100652T patent/CY1124316T1/el unknown
-
2022
- 2022-04-05 JP JP2022062937A patent/JP2022082680A/ja active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10947244B2 (en) | Forms of a PI3K delta selective inhibitor for use in pharmaceutical formulations | |
| CN103874689B (zh) | Akt抑制剂化合物和威罗菲尼的组合及使用方法 | |
| JP2020528884A (ja) | キナーゼを調節する化合物の製剤 | |
| CN103403005B (zh) | 5-([1,2,3]-三唑-4-基)-7H-吡咯并[2,3-d]嘧啶衍生物 | |
| TW201919612A (zh) | 包含帕博西尼(palbociclib)及6-(2,4-二氯苯基)-5-[4-[(3s)-1-(3-氟丙基)吡咯啶-3-基]氧基苯基]-8,9-二氫-7h-苯并[7]輪烯-2-甲酸的組合 | |
| JP2020526492A (ja) | G1t38の形態及びその製造方法 | |
| TW202131930A (zh) | 抗癌核荷爾蒙受體標靶化合物 | |
| EP1864974B1 (en) | Potentiator for radiation therapy comprising pyridine derivative as active ingredient | |
| TW202115091A (zh) | 喹啉類似物之結晶型及其鹽類、組合物、及彼等之使用方法 | |
| CA2603809C (en) | Radiotherapy enhancer | |
| US7932383B2 (en) | Crystalline forms of [(1R), 2S]-2-aminopropionic acid 2-[4-(4-fluoro-2-methyl-1H-indol-5-yloxy)-5-methylpyrrolo[2,1-f][1,2,4]triazin-6-yloxy]-1-methylethyl ester | |
| TW202108570A (zh) | 抗癌核荷爾蒙受體標靶化合物 | |
| CN109415382A (zh) | 皮质抑素类似物 | |
| EA042667B1 (ru) | Улучшенные формы селективного ингибитора pi3k-дельта для применения в фармацевтических препаратах | |
| KR20230026415A (ko) | 경구 제제 및 이의 용도 | |
| CA3218977A1 (en) | A plurality of tasquinimod particles and use thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| A302 | Request for accelerated examination | ||
| E902 | Notification of reason for refusal | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |