KR20160065952A - 제아 메이스 메탈로티오네인-유사 조절 요소 및 그의 용도 - Google Patents
제아 메이스 메탈로티오네인-유사 조절 요소 및 그의 용도 Download PDFInfo
- Publication number
- KR20160065952A KR20160065952A KR1020167011722A KR20167011722A KR20160065952A KR 20160065952 A KR20160065952 A KR 20160065952A KR 1020167011722 A KR1020167011722 A KR 1020167011722A KR 20167011722 A KR20167011722 A KR 20167011722A KR 20160065952 A KR20160065952 A KR 20160065952A
- Authority
- KR
- South Korea
- Prior art keywords
- sequence
- seq
- transgene
- promoter
- plant
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/82—Vectors or expression systems specially adapted for eukaryotic hosts for plant cells, e.g. plant artificial chromosomes (PACs)
- C12N15/8216—Methods for controlling, regulating or enhancing expression of transgenes in plant cells
- C12N15/8222—Developmentally regulated expression systems, tissue, organ specific, temporal or spatial regulation
- C12N15/8223—Vegetative tissue-specific promoters
- C12N15/8227—Root-specific
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01H—NEW PLANTS OR NON-TRANSGENIC PROCESSES FOR OBTAINING THEM; PLANT REPRODUCTION BY TISSUE CULTURE TECHNIQUES
- A01H5/00—Angiosperms, i.e. flowering plants, characterised by their plant parts; Angiosperms characterised otherwise than by their botanic taxonomy
- A01H5/10—Seeds
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01H—NEW PLANTS OR NON-TRANSGENIC PROCESSES FOR OBTAINING THEM; PLANT REPRODUCTION BY TISSUE CULTURE TECHNIQUES
- A01H6/00—Angiosperms, i.e. flowering plants, characterised by their botanic taxonomy
- A01H6/14—Asteraceae or Compositae, e.g. safflower, sunflower, artichoke or lettuce
- A01H6/1464—Helianthus annuus [sunflower]
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01H—NEW PLANTS OR NON-TRANSGENIC PROCESSES FOR OBTAINING THEM; PLANT REPRODUCTION BY TISSUE CULTURE TECHNIQUES
- A01H6/00—Angiosperms, i.e. flowering plants, characterised by their botanic taxonomy
- A01H6/46—Gramineae or Poaceae, e.g. ryegrass, rice, wheat or maize
- A01H6/463—Lolium [ryegrass]
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01H—NEW PLANTS OR NON-TRANSGENIC PROCESSES FOR OBTAINING THEM; PLANT REPRODUCTION BY TISSUE CULTURE TECHNIQUES
- A01H6/00—Angiosperms, i.e. flowering plants, characterised by their botanic taxonomy
- A01H6/46—Gramineae or Poaceae, e.g. ryegrass, rice, wheat or maize
- A01H6/4636—Oryza sp. [rice]
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01H—NEW PLANTS OR NON-TRANSGENIC PROCESSES FOR OBTAINING THEM; PLANT REPRODUCTION BY TISSUE CULTURE TECHNIQUES
- A01H6/00—Angiosperms, i.e. flowering plants, characterised by their botanic taxonomy
- A01H6/46—Gramineae or Poaceae, e.g. ryegrass, rice, wheat or maize
- A01H6/4666—Sorghum, e.g. sudangrass
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01H—NEW PLANTS OR NON-TRANSGENIC PROCESSES FOR OBTAINING THEM; PLANT REPRODUCTION BY TISSUE CULTURE TECHNIQUES
- A01H6/00—Angiosperms, i.e. flowering plants, characterised by their botanic taxonomy
- A01H6/46—Gramineae or Poaceae, e.g. ryegrass, rice, wheat or maize
- A01H6/4678—Triticum sp. [wheat]
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01H—NEW PLANTS OR NON-TRANSGENIC PROCESSES FOR OBTAINING THEM; PLANT REPRODUCTION BY TISSUE CULTURE TECHNIQUES
- A01H6/00—Angiosperms, i.e. flowering plants, characterised by their botanic taxonomy
- A01H6/54—Leguminosae or Fabaceae, e.g. soybean, alfalfa or peanut
- A01H6/542—Glycine max [soybean]
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01H—NEW PLANTS OR NON-TRANSGENIC PROCESSES FOR OBTAINING THEM; PLANT REPRODUCTION BY TISSUE CULTURE TECHNIQUES
- A01H6/00—Angiosperms, i.e. flowering plants, characterised by their botanic taxonomy
- A01H6/60—Malvaceae, e.g. cotton or hibiscus
- A01H6/604—Gossypium [cotton]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/82—Vectors or expression systems specially adapted for eukaryotic hosts for plant cells, e.g. plant artificial chromosomes (PACs)
- C12N15/8216—Methods for controlling, regulating or enhancing expression of transgenes in plant cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/82—Vectors or expression systems specially adapted for eukaryotic hosts for plant cells, e.g. plant artificial chromosomes (PACs)
- C12N15/8216—Methods for controlling, regulating or enhancing expression of transgenes in plant cells
- C12N15/8222—Developmentally regulated expression systems, tissue, organ specific, temporal or spatial regulation
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Genetics & Genomics (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Chemical & Material Sciences (AREA)
- Environmental Sciences (AREA)
- Developmental Biology & Embryology (AREA)
- Botany (AREA)
- Physiology (AREA)
- Natural Medicines & Medicinal Plants (AREA)
- Physics & Mathematics (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Cell Biology (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Breeding Of Plants And Reproduction By Means Of Culturing (AREA)
Abstract
제아 메이스 메탈로티오네인-유사 유전자 조절 요소를 이용하여 식물 세포 및/또는 식물 조직에서 트랜스진을 발현하기 위한 구조물 및 방법이 제공된다.
Description
관련 출원에 대한 상호 참조
본 출원은 35 U.S.C. § 119(e) 하에 2013년 10월 4일에 출원된 미국 가출원 번호 61/886,943을 우선권 주장하며, 이는 그 전문이 본원에 참조로 포함된다.
전자적으로 제출된 자료의 참조 포함
본 명세서와 공동으로 제출되고 다음과 같이 확인된, 컴퓨터 판독 가능한 뉴클레오티드/아미노산 서열 목록이 그 전문이 참조로 포함된다: 2014년 9월 29일에 새롭게 작성된 1개의 16 KB ACII (Text) 파일명 "224883_ST25".
식물 형질전환은 작물학적으로 바람직한 형질 또는 특징을 상이한 농작물 종 내로 도입하는 데 사용하기 위한 매력적인 기술이다. 특별히 바람직한 형질을 갖는 식물 종이 개발되고/되거나 이러한 형질을 갖도록 변형된다. 일반적으로, 바람직한 형질은, 예를 들어 영양가 품질을 개선시키고, 수율을 증가시키며, 해충 또는 질환 저항성을 부여하고, 가뭄 및 스트레스 내성을 증가시키며, 원예 품질 (예를 들어, 색소침착 및 생장)을 개선시키고, 제초제 저항성을 부여해 주고, 식물로부터 산업상 유용한 화합물 및/또는 물질의 생산을 가능하게 해주고/해주거나 제약의 생산을 가능하게 해주는 것을 포함한다.
단일 게놈 유전자 자리에 스태킹된(stacked) 다중 트랜스진(transgene)을 포함하는 트랜스제닉 식물이 식물 형질전환 기술을 통하여 생산된다. 식물 형질전환 기술로 인해, 특정 트랜스진이 식물 세포 내로 도입되고, 이러한 트랜스진의 안정적으로 통합된 카피를 식물 게놈 내에 함유하는 생식력 있는 트랜스제닉 식물이 회수되며, 상기 트랜스진(들)의 전사와 번역을 통한 후속 트랜스진 발현으로 인해서는, 목적하는 형질과 표현형을 보유하고 있는 트랜스제닉 식물이 생성된다. 스택(stack) 내의 각각의 트랜스진은 전형적으로, 유전자 발현을 위한 독립적인 프로모터를 요구하므로, 다중의 프로모터가 트랜스진 스택에 사용된다.
동일한 형질을 조절하기 위해서는 다중의 트랜스진을 공동-발현해야 할 필요가 있으므로, 종종 다중 트랜스진의 발현을 구동하기 위해 동일한 프로모터가 반복해서 사용된다. 그러나, 고 수준의 서열 동일성을 공유하는 서열을 포함하는 프로모터를 반복해서 사용하면, 상동성-기반 유전자 침묵 (HBGS)이 초래될 수 있다. 반복되는 DNA 서열을 트랜스진 내에 사용하는 경우에는 HBGS가 종종 트랜스제닉 식물에서 발생하는 것으로 관찰되었다 (Peremarti et al., 2010). 또한, 유사한 DNA 서열을 트랜스진 구조물(construct)에 반복해서 사용하면, 플라스미드의 불안정성 및 재조합으로 인해 아그로박테리움 (Agrobacterium)에서 문제가 되는 것으로 밝혀졌다.
본원에는 제아 메이스 (Zea mays) 메탈로티오네인-유사 유전자 조절 요소 (예를 들어, 프로모터, 5'-UTR, 및 3'-UTR)가 기재된다. 추가로, 제아 메이스 메탈로티오네인-유사 유전자 조절 요소를 활용하는 구조물 및 방법이 기재된다.
본원에는 식물 세포 및/또는 식물 조직에서 트랜스진을 발현하기 위한 구조물 및 방법이 개시되어 있다. 한 실시양태에서, 제아 메이스 메탈로티오네인-유사 유전자의 조절 요소를 옥수수 게놈으로부터 정제하고, 이를 상기 조절 요소와 천연적으로 연결되지 않는 서열과 재조합하여, 제아 메이스 메탈로티오네인-유사 조절 서열에 대해 천연이 아닌 식물 세포에서 트랜스진을 발현하기 위한 발현 벡터를 창출시킨다. 한 실시양태에서 제아 메이스 메탈로티오네인-유사 유전자의 조절 요소를 폴리링커 서열에 작동가능하게 연결시킨 발현 벡터가 제공된다. 이러한 발현 벡터는 특정 유전자 또는 유전자 카세트가, 제아 메이스 메탈로티오네인-유사 유전자 조절 서열에 작동가능하게 연결된 상태로 벡터 내로 삽입되는 것을 용이하게 한다.
특정 실시양태에서, 제아 메이스 메탈로티오네인-유사 프로모터를 포함하는 구조물이 제공된다. 특정 실시양태에서, 트랜스진에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 프로모터를 포함하는 유전자 발현 카세트가 제공된다. 특정 실시양태에서, 유전자 발현 카세트는 트랜스진에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함한다. 특정 실시양태에서, 유전자 발현 카세트는 프로모터에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함한다. 특정 실시양태에서, 유전자 발현 카세트는 트랜스진에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 5'-UTR을 포함한다. 특정 실시양태에서, 유전자 발현 카세트는 프로모터에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 5'-UTR을 포함한다. 특정 실시양태에서, 유전자 발현 카세트는 적어도 1개, 2개, 3개, 5개, 6개, 7개, 8개, 9개, 10개 또는 그 초과의 트랜스진을 포함한다.
특정 실시양태에서, 유전자 발현 카세트는 독립적으로, a) 제아 메이스 메탈로티오네인-유사 프로모터, b) 제아 메이스 메탈로티오네인-유사 5'-UTR, 및 c) 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함한다.
한 실시양태에 따라서 트랜스진에 작동가능하게 연결된 프로모터를 포함하는 (여기서, 이러한 프로모터는 서열 1, 또는 서열 1과 90% 서열 동일성을 갖는 서열로 이루어진다) 핵산 벡터가 제공된다. 추가 실시양태에서 이러한 핵산 벡터는 유전자 카세트를 포함하는데, 여기서 이러한 유전자 카세트는 프로모터, 트랜스진 및 3' 비번역 영역을 포함하고, 상기 프로모터는 트랜스진의 제1 말단에 작동가능하게 연결된 서열 1로 이루어지고, 트랜스진의 제2 말단은 서열 3으로 이루어진 3' 비번역 서열에 작동가능하게 연결된다. 추가 실시양태에서 상기 핵산 벡터는 유전자 카세트를 포함하는데, 여기서 이러한 유전자 카세트는 프로모터, 트랜스진 및 3' 비번역 영역을 포함하고, 상기 프로모터는 트랜스진의 제1 말단에 작동가능하게 연결된 서열 1로 이루어지고, 트랜스진의 제2 말단은 서열 4로 이루어진 3' 비번역 서열에 작동가능하게 연결된다.
한 실시양태에 따라서 트랜스진에 작동가능하게 연결된 프로모터를 포함하는 (여기서, 이러한 프로모터는 서열 2, 또는 서열 2와 90% 서열 동일성을 갖는 서열로 이루어진다) 핵산 벡터가 제공된다. 추가 실시양태에서 이러한 핵산 벡터는 유전자 카세트를 포함하는데, 여기서 이러한 유전자 카세트는 프로모터, 트랜스진 및 3' 비번역 영역을 포함하고, 상기 프로모터는 트랜스진의 제1 말단에 작동가능하게 연결된 서열 2로 이루어지고, 트랜스진의 제2 말단은 서열 3으로 이루어진 3' 비번역 서열에 작동가능하게 연결된다. 추가 실시양태에서 상기 핵산 벡터는 유전자 카세트를 포함하는데, 여기서 이러한 유전자 카세트는 프로모터, 트랜스진 및 3' 비번역 영역을 포함하고, 상기 프로모터는 트랜스진의 제1 말단에 작동가능하게 연결된 서열 2로 이루어지고, 트랜스진의 제2 말단은 서열 4로 이루어진 3' 비번역 서열에 작동가능하게 연결된다.
제아 메이스 메탈로티오네인-유사 프로모터, 5'-UTR, 및 3'-UTR을 이용하여 트랜스진을 발현하는 식물을 재배하는 방법이 본원에 개시되어 있다. 제아 메이스 메탈로티오네인-유사 프로모터, 5'-UTR, 및 3'-UTR을 이용하여 트랜스진을 발현하는 식물 조직 및 세포를 배양하는 방법이 또한, 본원에 개시되어 있다. 특정 실시양태에서, 본원에 개시된 바와 같은 방법은 식물 뿌리에서의 조직-특이적 유전자 발현을 포함한다.
한 실시양태에 따라서 트랜스진에 작동가능하게 연결된 프로모터를 포함하는 (여기서, 이러한 프로모터는 서열 1을 포함한다) 식물, 식물 조직, 또는 식물 세포가 제공된다. 한 실시양태에 따라서 서열 1, 또는 트랜스진에 작동가능하게 연결된 서열 1과 90% 서열 동일성을 갖는 서열을 포함하는 비-제아 메이스 식물 또는 식물 세포가 제공된다. 또 다른 실시양태에 따라서 트랜스진에 작동가능하게 연결된 프로모터를 포함하는 (여기서, 이러한 프로모터는 서열 2를 포함한다) 식물, 식물 조직, 또는 식물 세포가 제공된다. 한 실시양태에 따라서 서열 2, 또는 트랜스진에 작동가능하게 연결된 서열 2와 90% 서열 동일성을 갖는 서열을 포함하는 비-제아 메이스 식물 또는 식물 세포가 제공된다.
한 실시양태에서 상기 식물은 옥수수 품종이다. 한 실시양태에서 트랜스진에 작동가능하게 연결된 프로모터를 포함하는 (여기서, 이러한 프로모터는 서열 1 또는 2로 이루어진다) 식물, 식물 조직, 또는 식물 세포가 제공된다. 한 실시양태에서 유전자 카세트를 포함하는 비-제아 메이스 식물 또는 식물 세포가 제공되는데, 여기서 이러한 유전자 카세트는 트랜스진에 작동가능하게 연결된 프로모터를 포함하고, 추가로 여기서 상기 프로모터는 서열 1로 이루어진다. 또 다른 실시양태에서 유전자 카세트를 포함하는 비-제아 메이스 식물 또는 식물 세포가 제공되는데, 여기서 이러한 유전자 카세트는 트랜스진에 작동가능하게 연결된 프로모터를 포함하고, 추가로 여기서 상기 프로모터는 서열 2로 이루어진다. 추가 실시양태에서 상기 프로모터는 트랜스진의 제1 말단에 작동가능하게 연결되고, 트랜스진의 제2 말단은 서열 3으로 이루어진 3' 비번역 서열에 작동가능하게 연결된다. 또한 추가 실시양태에서, 상기 프로모터는 트랜스진의 제1 말단에 작동가능하게 연결되고, 트랜스진의 제2 말단은 서열 4로 이루어진 3' 비번역 서열에 작동가능하게 연결된다.
도 1은 데이터베이스로부터 수득된 게놈 서열 데이터를 분석하기 위하여 생물 정보학 접근 방식을 이용하여, 옥수수에서의 고 발현성 유전자를 확인하는 과정을 디스플레이한 도식적 플로 차트이다.
도 2는 차세대 서열 분석 (NGS)을 동반한 전사 프로파일링 접근 방식을 이용하여, 옥수수에서의 고 발현성 유전자를 확인하는 과정을 디스플레이한 도식적 플로 차트이다.
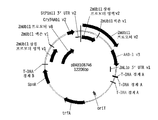
도 3은 cry34Ab1 리포터(reporter) 유전자의 발현을 제어하는 완전한 길이의 제아 메이스 메탈로티오네인-유사 프로모터 및 3'-UTR 조절 요소를 포함하는 유전자 발현 카세트를 묘사하는 pDAB113029 벡터 플라스미드 맵을 도시한 것이다.
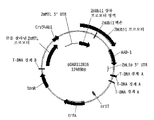
도 4는 시험 프로모터 구조물인 pDAB113029에 존재하는 cry34Ab1 리포터 유전자 대신 yfp 리포터 유전자를 함유하는 pDAB101556 대조군 벡터의 맵을 도시한 것이다. yfp 유전자 발현은 제아 메이스 유비퀴틴-1 (ZmUbi1) 프로모터에 의해 구동되고 제아 메이스 Per5 (ZmPer5) 3'-UTR에 의해 종결되었다.
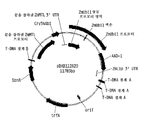
도 5는 ZmUbi1 프로모터에 의해 구동되고 StPinII 3'-UTR에 의해 종결된 cry34Ab1 리포터 유전자를 함유하는 양성 대조군 벡터인 pDAB108746의 맵을 도시한 것이다.
도 6a 내지 6d는 끝을 잘라낸(truncated) 제아 메이스 메탈로티오네인-유사 프로모터와 완전한 길이의 제아 메이스 메탈로티오네인-유사 프로모터의 정렬을 도시한 것이다.
도 7은 끝을 잘라낸 제아 메이스 메탈로티오네인-유사 프로모터, cry34Ab1 리포터 유전자 및 완전한 길이의 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는 유전자 발현 카세트를 묘사한, pDAB112816의 벡터 플라스미드 맵을 도시한 것이다.
도 8a 내지 8b는 끝을 잘라낸 제아 메이스 메탈로티오네인-유사 3'-UTR과 완전한 길이의 제아 메이스 메탈로티오네인-유사 3'-UTR의 정렬을 도시한 것이다.
도 9는 끝을 잘라낸 제아 메이스 메탈로티오네인-유사 프로모터, cry34Ab1 리포터 유전자 및 끝을 잘라낸 제아 메이스 메탈로티오네인-유사 3'-UTR로 구성된 유전자 발현 카세트를 묘사한, pDAB112820의 플라스미드 벡터 맵을 도시한 것이다.
도 2는 차세대 서열 분석 (NGS)을 동반한 전사 프로파일링 접근 방식을 이용하여, 옥수수에서의 고 발현성 유전자를 확인하는 과정을 디스플레이한 도식적 플로 차트이다.
도 3은 cry34Ab1 리포터(reporter) 유전자의 발현을 제어하는 완전한 길이의 제아 메이스 메탈로티오네인-유사 프로모터 및 3'-UTR 조절 요소를 포함하는 유전자 발현 카세트를 묘사하는 pDAB113029 벡터 플라스미드 맵을 도시한 것이다.
도 4는 시험 프로모터 구조물인 pDAB113029에 존재하는 cry34Ab1 리포터 유전자 대신 yfp 리포터 유전자를 함유하는 pDAB101556 대조군 벡터의 맵을 도시한 것이다. yfp 유전자 발현은 제아 메이스 유비퀴틴-1 (ZmUbi1) 프로모터에 의해 구동되고 제아 메이스 Per5 (ZmPer5) 3'-UTR에 의해 종결되었다.
도 5는 ZmUbi1 프로모터에 의해 구동되고 StPinII 3'-UTR에 의해 종결된 cry34Ab1 리포터 유전자를 함유하는 양성 대조군 벡터인 pDAB108746의 맵을 도시한 것이다.
도 6a 내지 6d는 끝을 잘라낸(truncated) 제아 메이스 메탈로티오네인-유사 프로모터와 완전한 길이의 제아 메이스 메탈로티오네인-유사 프로모터의 정렬을 도시한 것이다.
도 7은 끝을 잘라낸 제아 메이스 메탈로티오네인-유사 프로모터, cry34Ab1 리포터 유전자 및 완전한 길이의 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는 유전자 발현 카세트를 묘사한, pDAB112816의 벡터 플라스미드 맵을 도시한 것이다.
도 8a 내지 8b는 끝을 잘라낸 제아 메이스 메탈로티오네인-유사 3'-UTR과 완전한 길이의 제아 메이스 메탈로티오네인-유사 3'-UTR의 정렬을 도시한 것이다.
도 9는 끝을 잘라낸 제아 메이스 메탈로티오네인-유사 프로모터, cry34Ab1 리포터 유전자 및 끝을 잘라낸 제아 메이스 메탈로티오네인-유사 3'-UTR로 구성된 유전자 발현 카세트를 묘사한, pDAB112820의 플라스미드 벡터 맵을 도시한 것이다.
정의
본 발명을 설명하고 청구하는 데 있어서, 다음 전문 용어는 다음에 제시된 정의에 따라서 사용될 것이다.
본원에 사용된 바와 같은 용어 "약"은 언급된 값 또는 값의 범위 보다 10% 정도 더 크거나 더 적은 것을 의미하지만, 어떠한 값 또는 값의 범위도 이러한 폭넓은 정의로만 지정되지 않는다. 용어 "약" 다음에 오는 각각의 값 또는 값의 범위는 또한, 언급된 절대 값 또는 값의 범위의 실시양태를 포괄하고자 한다.
본원에 사용된 바와 같은 용어 "역교배"는 육종자가 하이브리드 자손을 부모 중 하나, 예를 들어 F1 하이브리드의 부모 유전자형 중 하나를 수반하는 제1세대 하이브리드 F1과 다시 교배하는 과정을 지칭한다.
"프로모터"는 세포에서 RNA 중합효소와 결합할 수 있고 하류 (3' 방향) 코딩 서열의 전사를 개시할 수 있는 DNA 조절 영역이다. 프로모터는 전사 인자에 의해 인식되는 특이적 서열을 함유할 수 있다. 이들 인자는 프로모터 DNA 서열과 결합할 수 있는데, 이로써 RNA 중합효소가 동원된다. 본 발명을 규정할 목적으로, 프로모터 서열은 그의 3' 말단에서 전사 개시 부위로써 경계를 이루고 있고, 상류 (5' 방향) 연장되어, 배경 초과의 탐지가능한 수준으로 전사를 개시하는 데 필요한 최소 수의 염기 또는 요소를 포함한다. 이러한 프로모터 서열 내에는, 전사 개시 부위 (예를 들어, 뉴클레아제 S1과 매핑함으로써 편리하게 정의됨) 뿐만 아니라 RNA 중합효소의 결합에 대해 책임이 있는 단백질 결합성 도메인 (컨센서스 서열)이 발견될 것이다. 프로모터는 증강인자(enhancer) 및 억제인자(repressor) 서열을 포함한 다른 발현 제어 서열에 작동가능하게 회합될 수 있다.
본 개시내용의 목적상, "유전자"는 유전자 산물 (하기 참조)을 코딩하는 DNA 영역 뿐만 아니라 조절 서열이 코딩 및/또는 전사된 서열과 인접하든지 아니든지 간에, 유전자 산물의 생성을 조절하는 DNA 영역을 포함한다. 따라서, 유전자는 프로모터 서열, 종결인자, 번역 조절 서열, 예컨대 리보솜 결합 부위 및 내부 리보솜 유입 부위, 증강인자, 침묵인자, 절연인자, 경계 요소, 복제 기점, 매트릭스 부착 부위 및 유전자 자리 제어 영역을 포함하지만, 반드시 이에 제한되지는 않는다.
본원에 사용된 바와 같은 용어 "천연" 또는 "자연"은 자연에서 발견된 상태를 규정한다. "천연 DNA 서열"은 자연적 수단 또는 전통적인 육종 기술에 의해서는 생성되었지만, 유전적 조작 (예를 들어, 분자 생물학/형질전환 기술을 이용함)에 의해서는 생성되지 않는, 자연에 존재하는 DNA 서열이다.
본원에 사용된 바와 같은 "트랜스진"은 유전자 산물 (이는 예를 들어, mRNA를 포함하지만, 이에 제한되지 않는다)을 코딩하는 핵산 서열인 것으로 정의된다. 한 실시양태에서 트랜스진은 외인성 핵산인데, 여기서는 트랜스진 서열이 유전적 조작에 의해 숙주 세포 (또는 그의 자손) 내로 도입되었고 이러한 트랜스진은 정상적으로는 발견되지 않는다. 한 예에서, 트랜스진은 산업상 또는 제약상 유용한 화합물, 또는 바람직한 농업적 형질을 코딩하는 유전자 (예를 들어, 제초제-저항성 유전자)를 코딩한다. 또한 또 다른 예에서, 트랜스진은 안티센스 핵산 서열인데, 여기서 이러한 안티센스 핵산 서열의 발현은 표적 핵산 서열의 발현을 억제한다. 한 실시양태에서 트랜스진은 내인성 핵산 (여기서, 이러한 내인성 핵산의 추가의 게놈 카피가 요망된다), 또는 숙주 유기체 내의 표적 핵산의 서열에 대하여 안티센스 배향으로 존재하는 핵산이다.
본원에 정의된 바와 같은 "유전자 발현"은 유전자 내에 함유된 정보를 유전자 산물로 전환시키는 것이다.
본원에 정의된 바와 같은 "유전자 산물"은 이러한 유전자에 의해 생성된 모든 생성물이다. 예를 들어, 유전자 산물은 유전자의 직접적인 전사 생성물 (예를 들어, mRNA, tRNA, rRNA, 안티센스 RNA, 간섭 RNA, 리보자임, 구조적 RNA 또는 다른 모든 유형의 RNA), 또는 mRNA의 번역에 의해 생성된 단백질일 수 있다. 유전자 산물은 또한, 캡핑, 폴리아데닐화, 메틸화 및 편집과 같은 과정에 의해 변형되는 RNA, 및 예를 들어, 메틸화, 아세틸화, 인산화, 유비퀴틴화, ADP-리보실화, 미리스틸화 및 글리코실화에 의해 변형된 단백질을 포함한다. 유전자 발현은 외부 신호, 예를 들어 유전자 발현을 증가 또는 감소시키는 작용제에 대한 세포, 조직 또는 유기체의 노출에 의해 영향을 받을 수 있다. 유전자의 발현은 또한, DNA로부터 RNA 내지 단백질로의 경로 어디에서도 조절될 수 있다. 유전자 발현의 조절은, 예를 들어 전사, 번역, RNA 수송 및 프로세싱, 중간 분자, 예컨대 mRNA의 분해에 대해 작용하는 제어를 통하여, 또는 특이적 단백질 분자가 만들어진 후 이러한 분자의 활성화, 불활성화, 구획화 또는 분해를 통하여, 또는 그의 조합에 의해 일어난다. 유전자 발현은 관련 기술분야에 공지된 모든 방법 [노던(Northern) 블롯, RT-PCR, 웨스턴(Western) 블롯, 또는 시험관내, 계내 또는 생체내 단백질 활성 검정(들)을 포함하지만, 이에 제한되지 않는다]에 의해 RNA 수준 또는 단백질 수준으로 측정될 수 있다.
본원에 사용된 바와 같은 용어 "인트론"은 전사되긴 하지만 번역되지는 않은, 유전자 내에 포함된 모든 핵산 서열 (또는 발현된 관심 뉴클레오티드 서열)로서 정의된다. 인트론은 DNA의 발현된 서열 내의 비번역 핵산 서열 뿐만 아니라 그로부터 전사된 RNA 분자 내의 상응하는 서열을 포함한다.
본원에 기재된 구조물은 또한, 번역 및/또는 mRNA 안정성을 증강시키는 서열, 예컨대 인트론을 함유할 수 있다. 이러한 하나의 인트론의 예는 아라비돕시스 탈리아나 (Arabidopsis thaliana)의 히스톤 H3 변이체의 유전자 II의 제1 인트론, 또는 통상적으로 공지된 다른 모든 인트론 서열이다. 인트론은 프로모터 서열과 조합하여 번역 및/또는 mRNA 안정성을 증강시키기 위해 사용될 수 있다.
본원에 사용된 바와 같은 용어 "5' 비번역 영역" 또는 "5'-UTR"은 mRNA 전구 또는 성숙한 mRNA의 5' 말단에서의 비번역 절편으로서 정의된다. 예를 들어, 성숙한 mRNA 상에서는, 전형적으로 5'-UTR의 5' 말단 상에 7-메틸구아노신 캡이 정착되어 있고, 이는 많은 과정, 예컨대 스플라이싱, 폴리아데닐화, 세포질로의 mRNA 외수송, 번역 기구에 의한 mRNA의 5' 말단의 확인, 및 분해에 대항한 mRNA의 보호에 관여한다.
본원에 사용된 바와 같은 용어 "전사 종결인자"는 mRNA 전구 또는 성숙한 mRNA의 3' 말단에서 전사된 절편으로서 정의된다. 예를 들어, "폴리아데닐화 신호" 부위를 벗어난 DNA의 보다 긴 연장물은 mRNA 전구로서 전사된다. 이러한 DNA 서열은 통상적으로, mRNA 전구를 성숙한 mRNA로 적당히 프로세싱하기 위한 하나 이상의 전사 종결 신호를 함유한다.
본원에 사용된 바와 같은 용어 "3' 비번역 영역" 또는 "3'-UTR"은 mRNA 전구 또는 성숙한 mRNA의 3' 말단 내의 비번역 절편으로서 정의된다. 예를 들어, 성숙한 mRNA 상에서는 이러한 영역에 폴리-(A) 미부(tail)가 정착되어 있고, 이는 mRNA 안정성, 번역 개시 및 mRNA 외수송에 있어서 많은 역할을 하는 것으로 공지되어 있다.
본원에 사용된 바와 같은 용어 "폴리아데닐화 신호"는 폴리-(A) 중합효소의 존재 하에 있는 경우에, 전사물이 폴리아데닐화 부위, 예를 들어 폴리-(A) 신호의 하류에 위치한 10 내지 30개 염기 상에서 폴리아데닐화될 수 있게 해주는, mRNA 전사물에 존재하는 핵산 서열을 지칭한다. 많은 폴리아데닐화 신호가 관련 기술분야에 공지되어 있고 본 발명에 유용하다. 예시되는 서열은 문헌 ([Loke J., et al., (2005) Plant Physiology 138(3); 1457-1468])에 기재된 바와 같은, AAUAAA 및 그의 변이체를 포함한다.
본원에 사용된 바와 같은 용어 "단리된"은 그의 자연 환경으로부터 제거되었거나, 또는 화합물이 처음 형성될 때 존재한 다른 화합물로부터 제거된 것을 의미한다. 용어 "단리된"은 자연 공급원으로부터 단리된 물질 뿐만 아니라 숙주 세포에서의 재조합 발현에 의한 제조 후 회수된 물질 (예를 들어, 핵산 및 단백질), 또는 화학적으로 합성된 화합물, 예컨대 핵산 분자, 단백질, 및 펩티드를 포괄한다.
본원에 사용된 바와 같은 용어 "정제된"은 천연 또는 자연 환경에서 특정 분자 또는 화합물과 정상적으로 회합된 오염물질이 실질적으로 없는 형태, 또는 이러한 화합물이 처음 형성될 때 존재한 다른 화합물과 비교해서 농도에 있어서 실질적으로 강화된 형태로 상기 분자 또는 화합물을 단리하는 것에 관한 것이고, 본래의 조성물의 다른 성분으로부터 분리됨에 따른 결과로서 순도가 증가되었다는 것을 의미한다. 용어 "정제된 핵산"은 성분 상의 화학적 또는 기능적 변화를 수행하면서도, 기타 생물학적 화합물 (폴리펩티드, 지질 및 탄수화물을 포함하지만, 이에 제한되지 않는다)로부터 분리되고, 격리 생성되는 핵산 서열을 기재하기 위해 본원에 사용된다 (예를 들어, 핵산은 단백질 오염물질을 제거하고, 이러한 핵산을 염색체 내의 나머지 DNA와 연결시켜 주는 화학적 결합을 절단함으로써 염색체로부터 정제될 수 있다).
용어 "재조합"은 유전적 재조합이 발생한 세포 또는 유기체를 의미한다. 이는 또한, 인간의 개입에 의해 인공적으로 또는 합성적으로 (즉, 비-자연적으로) 변경시킨 분자 (예를 들어, 벡터, 플라스미드, 핵산 또는 폴리펩티드)를 포함한다. 이러한 변경은 그의 자연 환경 또는 상태 내의 분자, 또는 이러한 자연 환경 또는 분자로부터 제거된 분자 상에서 수행될 수 있다.
본원에 사용된 바와 같은 용어 "상동성-기반 유전자 침묵" 또는 "HBGS"는 전사 유전자 침묵과 전사 후 유전자 침묵 둘 다를 포함하는 일반 용어이다. 연결되지 않은 침묵 유전자 자리에 의한 표적 유전자 자리의 침묵은 프로모터 또는 전사된 서열 각각에 상응하는 이중 가닥 RNA (dsRNA)의 생성에 기인한 전사 억제 (전사 유전자 침묵; TGS) 또는 mRNA 분해 (전사 후 유전자 침묵; PTGS)로부터 비롯될 수 있다. 각 과정에 별개의 세포성 성분이 연루되었다는 것은, dsRNA-유도된 TGS 및 PTGS가 아주 오래된 통상적 기전의 다양화로부터 비롯되는 것으로 예상된다는 것을 제안한다. 그러나, TGS와 PTGS를 엄격하게 비교하는 것이 어려웠는데, 이는 이러한 비교가 일반적으로, 별개의 침묵 유전자 자리의 분석에 의존하기 때문이다. 단일 트랜스진 유전자 자리는 상이한 표적 유전자의 전사된 서열 및 프로모터에 상응하는 dsRNA의 생성에 기인한 TGS와 PTGS 둘 다를 촉발시키는 것으로 설명될 수 있다.
본원에 사용된 바와 같은 용어 "핵산 분자", "핵산", 또는 "폴리뉴클레오티드" (3개 용어 모두는 서로 같은 것을 의미한다)는 중합체성 형태의 뉴클레오티드를 지칭하는데, 이는 RNA, cDNA, 게놈 DNA, 및 합성 형태의 센스 가닥과 안티센스 가닥 둘 다, 및 그들의 혼합된 중합체를 포함할 수 있다. "뉴클레오티드"는 리보뉴클레오티드, 데옥시리보뉴클레오티드, 또는 어느 한 가지 유형의 뉴클레오티드의 변형된 형태를 지칭할 수 있다. 핵산 분자는 통상적으로, 달리 명시되지 않는 한 10개 이상 염기 길이이다. 상기 용어는 미결정 길이의 RNA 또는 DNA의 분자를 지칭할 수 있다. 상기 용어는 DNA의 단일 가닥 형태 및 이중 가닥 형태를 포함한다. 핵산 분자는 자연 발생적 및/또는 비-자연 발생적 뉴클레오티드 연쇄에 의해 함께 연결된 자연 발생적 뉴클레오티드 및 변형된 뉴클레오티드 중 어느 하나 또는 둘 다를 포함할 수 있다.
핵산 분자는 관련 기술분야의 통상의 기술자에 의해 용이하게 인지되는 바와 같이, 화학적으로 또는 생화학적으로 변형될 수 있거나, 또는 비-자연 또는 유도체화 뉴클레오티드 염기를 함유할 수 있다. 이러한 변형은, 예를 들어 표지, 메틸화, 자연 발생적 뉴클레오티드 중 하나 이상을 유사체로 치환시키는 것, 뉴클레오티드간 변형 (예를 들어, 전하를 띠지 않은 연쇄: 예를 들어, 메틸 포스포네이트, 포스포트리에스테르, 포스포르아미데이트, 카르바메이트 등; 전하를 띤 연쇄: 예를 들어, 포스포로티오에이트, 포스포로디티오에이트 등; 펜던트 모이어티(moiety): 예를 들어, 펩티드; 삽입제: 예를 들어, 아크리딘, 프솔라렌 등; 킬레이트제; 알킬화제; 및 변형된 연쇄: 예를 들어, 알파 아노머성 핵산 등)을 포함한다. 용어 "핵산 분자"는 또한, 모든 위상학적 입체 형태를 포함하는데, 이는 단일 가닥, 이중 가닥, 부분적 이중체화, 삼중체화, 헤어핀 형성된, 환상 및 패드락킹(padlocked) 입체 형태를 포함한다.
전사는 DNA 가닥을 따라 5'에서 3' 방식으로 진행된다. 이는 RNA가 리보뉴클레오티드-5'-트리포스페이트를 (피로포스페이트의 필수 제거와 함께) 성장하는 쇄의 3' 말단에 순차적으로 부가함으로써 만들어진다는 것을 의미한다. 선형 또는 환상 핵산 분자에서는, 개별 요소 (예를 들어, 특별한 뉴클레오티드 서열)가 이러한 요소로부터 5' 방향에서 동일한 핵산과 결합되거나 또는 결합될 것인 경우에는, 추가 요소와 비교해서 "상류"인 것으로서 지칭될 수 있다. 유사하게, 개별 요소가 이러한 요소로부터 3' 방향에서 동일한 핵산과 결합되거나 또는 결합될 것인 경우에는, 추가 요소와 비교해서 "하류"일 수 있다.
본원에 사용된 바와 같은 용어 "염기 위치"는 지명된 핵산 내의 소정의 염기 또는 뉴클레오티드 잔기의 위치를 지칭한다. 지명된 핵산은 참조 핵산과의 정렬에 의해 규정될 수 있다.
본원에 사용된 바와 같은 용어 "혼성화"는 올리고뉴클레오티드 및 그들의 유사체가 상보적 염기들 간의 수소 결합 [이는 왓슨-크릭(Watson-Crick), 훅스틴(Hoogsteen) 또는 역전된 훅스틴 수소 결합을 포함한다]에 의해 혼성화되는 과정을 지칭한다. 일반적으로, 핵산 분자는 피리미딘 (시토신 (C), 우라실 (U), 및 티민 (T)) 또는 퓨린 (아데닌 (A) 및 구아닌 (G))인 질소성 염기로 이루어진다. 이들 질소성 염기는 피리미딘과 퓨린 간의 수소 결합을 형성하고, 피리미딘이 퓨린과 결합하는 것이 "염기 쌍 형성"으로서 지칭된다. 보다 구체적으로 언급하면, A는 T 또는 U와 수소 결합될 것이고, G는 C와 수소 결합될 것이다. "상보적"은 2개의 별개의 핵산 서열, 또는 동일한 핵산 서열의 2개의 별개의 영역 간에 발생하는 염기 쌍 형성을 지칭한다.
본원에 사용된 바와 같은 용어 "특이적으로 혼성화 가능한" 및 "특이적으로 상보적"은 올리고뉴클레오티드와 DNA 또는 RNA 표적 간에 안정하면서도 특이적인 결합이 발생하기에 충분한 정도의 상보성을 지칭한다. 올리고뉴클레오티드는 특이적으로 혼성화하기 위해 표적 서열에 대해 100% 상보적일 필요는 없다. 올리고뉴클레오티드가 표적 DNA 또는 RNA 분자와 결합하는 것이 표적 DNA 또는 RNA의 정상적인 기능을 방해하는 경우에, 이러한 올리고뉴클레오티드는 특이적으로 혼성화 가능하고, 특이적 결합이 요망되는 조건, 예를 들어 생체내 검정 또는 시스템의 경우에 생리학적 조건 하에, 올리고뉴클레오티드가 비-표적 서열과 비-특이적으로 결합되는 것을 피하기에 충분한 정도의 상보성이 있다. 이러한 결합은 특이적 혼성화로서 지칭된다. 특별한 정도의 엄격성을 초래하는 혼성화 조건은 선택된 혼성화 방법의 성질, 및 혼성화되는 핵산 서열의 조성과 길이에 따라서 다양할 것이다. 일반적으로, 혼성화 온도, 및 혼성화 완충제의 이온 강도 (특히 Na+ 및/또는 Mg2 + 농도)가 혼성화의 엄격성에 기여할 것이지만, 세척 시간 또한 엄격성에 영향을 미친다. 특별한 정도의 엄격성을 획득하는 데 요구되는 혼성화 조건에 관한 계산은 문헌 ([Sambrook et al. (ed.), Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989])에 논의되어 있다.
본원에 사용된 바와 같은 용어 "엄격한 조건"은 혼성화 분자와 DNA 표적 간에 50% 미만의 미스매치가 존재하는 경우에만 혼성화가 발생하게 되는 조건을 포괄한다. "엄격한 조건"은 추가의 특별한 수준의 엄격성을 포함한다. 따라서, 본원에 사용된 바와 같은, "중간 수준으로 엄격한" 조건은 50% 초과의 서열 미스매치를 수반한 분자는 혼성화되지 않는 조건이고; "고도로 엄격한" 조건은 20% 초과의 미스매치를 수반한 서열은 혼성화되지 않는 조건이며; "극히 고도로 엄격한" 조건은 10% 초과의 미스매치를 수반한 서열은 혼성화되지 않는 조건이다. 특별한 실시양태에서, 엄격한 조건은 65℃ 하에 혼성화한 다음, 40분 동안 0.1 x SSC/0.1% SDS를 이용하여 65℃ 하에 세척하는 것을 포함할 수 있다. 다음은 대표적이고 비제한적인 혼성화 조건이다:
● 극히 고도의 엄격성: 16시간 동안 65℃ 하에 5 x SSC 완충제에서 혼성화시키고; 각각 15분 동안 실온 하에 2 x SSC 완충제에서 2회 세척하며; 각각 20분 동안 65℃ 하에 0.5 x SSC 완충제에서 2회 세척한다.
● 고도의 엄격성: 16 내지 20시간 동안 65 내지 70℃ 하에 5 내지 6 x SSC 완충제에서 혼성화시키고; 각각 5 내지 20분 동안 실온 하에 2 x SSC 완충제에서 2회 세척하며; 각각 30분 동안 55 내지 70℃ 하에 1 x SSC 완충제에서 2회 세척한다.
● 중간 수준의 엄격성: 16 내지 20시간 동안 실온 내지 55℃ 하에 6 x SSC 완충제에서 혼성화시키고; 각각 20 내지 30분 동안 실온 내지 55℃ 하에 2 내지 3 x SSC 완충제에서 2회 이상 세척한다.
특정 실시양태에서, 특이적으로 혼성화 가능한 핵산 분자는 극히 고도로 엄격한 혼성화 조건 하에 여전히 결합될 수 있다. 특정 실시양태에서, 특이적으로 혼성화 가능한 핵산 분자는 고도로 엄격한 혼성화 조건 하에 여전히 결합될 수 있다. 특정 실시양태에서, 특이적으로 혼성화 가능한 핵산 분자는 중간 수준으로 엄격한 혼성화 조건 하에 여전히 결합될 수 있다.
본원에 사용된 바와 같은 용어 "올리고뉴클레오티드"는 짧은 핵산 중합체를 지칭한다. 올리고뉴클레오티드는 더 긴 핵산 절편의 절단에 의해 형성될 수 있거나 또는 개개의 뉴클레오티드 전구체를 중합시킴으로써 형성될 수 있다. 자동화 합성기는 수백개 이하 염기 쌍 길이의 올리고뉴클레오티드의 합성을 허용해준다. 올리고뉴클레오티드는 상보적 뉴클레오티드 서열과 결합할 수 있기 때문에, 이들은 DNA 또는 RNA를 탐지하기 위한 프로브로서 사용될 수 있다. DNA (올리고데옥시리보뉴클레오티드)로 구성된 올리고뉴클레오티드는 작은 DNA 서열의 증폭을 위한 기술인 중합효소 연쇄 반응에 사용될 수 있다. 중합효소 연쇄 반응에서는, 올리고뉴클레오티드가 전형적으로, 이러한 올리고뉴클레오티드를 연장시키고 상보적 가닥을 복제시키는 DNA 중합효소를 허용하는 "프라이머"로서 지칭된다.
본원에 사용된 바와 같은 용어 "중합효소 연쇄 반응" 또는 "PCR"은 극미량의 핵산, RNA 및/또는 DNA를 미국 특허 번호 4,683,195에 기재된 바와 같이 증폭시키는 과정 또는 기술을 규정한다. 일반적으로, 관심 영역의 말단으로부터 또는 그를 벗어난 곳으로부터의 서열 정보를 사용할 수 있어야 하므로, 올리고뉴클레오티드 프라이머가 설계될 수 있고; 이들 프라이머는 증폭될 주형의 반대 가닥과 서열상 동일하거나 유사할 것이다. 두 프라이머의 5' 말단 뉴클레오티드는 증폭된 물질의 말단과 일치할 수 있다. PCR을 이용하여 특이적 RNA 서열, 전체 게놈 DNA로부터의 특이적 DNA 서열, 및 전체 세포성 RNA, 박테리오파지(bacteriophage) 또는 플라스미드 서열 등으로부터 전사된 cDNA를 증폭시킬 수 있다 (일반적으로, 문헌 [Mullis et al., Cold Spring Harbor Symp . Quant . Biol., 51:263 (1987)]; [Erlich, ed., PCR Technology, (Stockton Press, NY, 1989)] 참조).
본원에 사용된 바와 같은 용어 "프라이머"는 조건이 프라이머 연장 생성물의 합성에 적합한 경우에 상보적 가닥을 따라 합성 개시점으로서 작용할 수 있는 올리고뉴클레오티드를 지칭한다. 합성 조건은 4가지 상이한 데옥시리보뉴클레오티드 트리포스페이트 및 하나 이상의 중합-유도성 작용제, 예컨대 역전사효소 또는 DNA 중합효소의 존재를 포함한다. 이들은 조인자이거나 또는 각종 적합한 온도 하에 pH 등과 같은 조건에 영향을 미치는 구성분을 포함할 수 있는 적합한 완충제에 존재한다. 프라이머는 바람직하게, 단일 가닥 서열이므로, 증폭 효율은 최적화되지만, 이중 가닥 서열을 활용할 수 있다.
본원에 사용된 바와 같은 용어 "프로브"는 표적 서열과 혼성화되는 올리고뉴클레오티드 또는 폴리뉴클레오티드 서열을 지칭한다. 태크만(TaqMan®) 또는 태크만®-스타일 검정 과정에서는, 프로브가 두 프라이머의 어닐링 부위 사이에 설정된 표적의 특정 부분과 혼성화된다. 프로브는 약 8개 뉴클레오티드, 약 10개 뉴클레오티드, 약 15개 뉴클레오티드, 약 20개 뉴클레오티드, 약 30개 뉴클레오티드, 약 40개 뉴클레오티드, 또는 약 50개 뉴클레오티드를 포함한다. 일부 실시양태에서, 프로브는 약 8개 뉴클레오티드 내지 약 15개 뉴클레오티드를 포함한다.
서던(Southern) 블롯 검정 과정에서는, 프로브가 막에 부착되는 DNA 단편과 혼성화된다. 프로브는 약 10개 뉴클레오티드, 약 100개 뉴클레오티드, 약 250개 뉴클레오티드, 약 500개 뉴클레오티드, 약 1,000개 뉴클레오티드, 약 2,500개 뉴클레오티드, 또는 약 5,000개 뉴클레오티드를 포함한다. 일부 실시양태에서, 프로브는 약 500개 뉴클레오티드 내지 약 2,500개 뉴클레오티드를 포함한다.
프로브는 탐지 가능한 표지, 예를 들어 방사성 표지, 바이오티닐화 표지, 형광단 [텍사스-레드((Texas-Red®), 플루오레스세인 이소티오시아네이트 등]을 추가로 포함할 수 있다. 이러한 탐지 가능한 표지는 프로브 올리고뉴클레오티드에 직접적으로 공유 부착될 수 있는데, 예를 들어 프로브의 5' 말단에 또는 프로브의 3' 말단에 위치할 수 있다. 형광단을 포함하는 프로브는 또한, 켄쳐, 예를 들어 블랙 홀 켄쳐(Black Hole Quencher™), 아이오와 블랙(Iowa Black™) 등을 추가로 포함할 수 있다.
본원에 사용된 바와 같은 용어 "서열 동일성" 또는 "동일성"은 상호 교환적으로 사용될 수 있고, 명시된 비교 윈도 전반에 걸쳐 최대의 상응도를 위해 정렬된 경우에 동일한 두 서열 내의 핵산 잔기를 지칭한다.
본원에 사용된 바와 같은 용어 "서열 동일성의 비율 (%)"은 비교 윈도 전반에 걸쳐 최적으로 정렬된 두 서열 (예를 들어, 핵산 서열 또는 아미노산 서열)을 비교함으로써 결정된 값을 지칭하는데, 여기서 상기 비교 윈도 내의 서열의 일부는 두 서열의 최적의 정렬을 위하여 참조 서열 (부가 또는 결실을 포함하지 않는다)과 비교해서 부가 또는 결실 (즉, 갭)을 포함할 수 있다. %는 매칭된 위치의 수를 산출하기 위하여 동일한 핵산 또는 아미노산 잔기가 양 서열 내에 존재하는 위치의 수를 결정하고, 매칭된 위치의 수를 비교 윈도 내의 총 위치의 수로 나눈 다음, 그 결과에 100을 곱하여 서열 동일성 %를 산출함으로써 계산한다. 비교를 위해 서열을 정렬하는 방법은 널리 공지되어 있다. 각종 프로그램 및 정렬 알고리즘이, 예를 들어 문헌 ([Smith and Waterman (1981) Adv . Appl . Math. 2:482]; [Needleman and Wunsch (1970) J. Mol . Biol . 48:443]; [Pearson and Lipman (1988) Proc . Natl . Acad . Sci . U.S.A. 85:2444]; [Higgins and Sharp (1988) Gene 73:237-44]; [Higgins and Sharp (1989) CABIOS 5:151-3]; [Corpet et al. (1988) Nucleic Acids Res. 16:10881-90]; [Huang et al. (1992) Comp. Appl. Biosci. 8:155-65]; [Pearson et al. (1994) Methods Mol . Biol. 24:307-31]; [Tatiana et al. (1999) FEMS Microbiol . Lett. 174:247-50])에 기재되어 있다.
미국 국립 생명공학 정보 센터 (NCBI) 기본 로컬 정렬 검색 도구 (BLAST™; 문헌 [Altschul et al. (1990) J. Mol . Biol. 215:403-10])는 몇 가지 서열 분석 프로그램과 연계해서 사용하기 위하여, 미국 국립 생명공학 정보 센터 (미국 메릴랜드주 베데스다)를 포함한 몇 가지 공급처로부터, 및 인터넷 상에서 이용 가능하다. 상기 프로그램을 이용하여 서열 동일성을 결정하는 방법에 관한 설명은 BLAST™에 대한 "도움" 섹션 하에 인터넷 상에서 이용 가능하다. 핵산 서열을 비교하기 위하여, BLAST™ (Blastn) 프로그램의 "Blast 2 서열" 기능은 디폴트 파라미터를 사용하여 이용될 수 있다. 참조 서열과 훨씬 더 큰 유사성을 갖는 핵산 서열은 상기 방법에 의해 평가된 경우에 증가된 % 동일성을 나타낼 것이다.
본원에 사용된 바와 같은 용어 "작동가능하게 연결된"은 서로 기능적 관계로 배치된 두 성분을 지칭한다. 조절 서열 및 코딩 서열과 관련하여 사용되는 경우의 용어 "작동가능하게 연결된"은 조절 서열이, 연결된 코딩 서열의 발현에 영향을 미치는 것을 의미한다. "조절 서열", "조절 요소", 또는 "제어 요소"는 전사, RNA 프로세싱 또는 안정성, 또는 회합된 코딩 서열의 번역의 시기 및 수준/양에 영향을 미치는 핵산 서열을 지칭한다. 조절 서열은 프로모터; 번역 리더 서열; 5' 및 3' 비번역 영역, 인트론; 증강인자; 줄기-루프 구조물; 억제인자 결합성 서열; 종결 서열; 폴리아데닐화 인식 서열 등을 포함할 수 있다. 특별한 조절 서열은 이에 작동가능하게 연결된 코딩 서열의 상류 및/또는 하류에 위치할 수 있다. 또한, 코딩 서열에 작동가능하게 연결된 특별한 조절 서열은 이중 가닥 핵산 분자의 회합된 상보적 가닥 상에 위치할 수 있다. 연결은 편리한 제한 부위에서 라이게이션시킴으로써 달성될 수 있다. 이러한 부위가 존재하지 않는 경우에는, 합성 올리고뉴클레오티드 적응인자 또는 링커를 핵산에 라이게이션 또는 어닐링시키고, 이를 사용하여 연속되는 폴리뉴클레오티드 단편을 연결시킨다. 그러나, 요소가 연속적으로 작동가능하게 연결될 필요는 없다.
본원에 사용된 바와 같은 용어 "형질전환"은 핵산 분자를 세포 내로 도입할 수 있는 모든 기술을 포괄한다. 그의 예는 바이러스 벡터를 이용한 형질감염; 플라스미드 벡터를 이용한 형질전환; 전기천공; 리포펙션(lipofection); 미세주사 (문헌 [Mueller et al. (1978) Cell 15:579-85]); 아그로박테리움-매개된 전이; 직접적인 DNA 흡수; WHISKERS™-매개된 형질전환; 및 미소발사체 충격을 포함하지만, 이에 제한되지 않는다. 이들 기술은 식물 세포의 안정적 형질전환과 일시적 형질전환 둘 다를 위해 사용될 수 있다. "안정적 형질전환"은 핵산 단편을 숙주 유기체의 게놈 내로 도입하여, 유전적으로 안정한 유전적 형질을 초래하는 것을 지칭한다. 일단 안정적으로 형질전환되면, 상기 핵산 단편은 숙주 유기체 및 모든 후속 세대의 게놈 내에 안정적으로 통합된다. 이와 같이 형질전환된 핵산 단편을 함유하는 숙주 유기체는 "트랜스제닉" 유기체로서 지칭된다. "일시적 형질전환"은 핵산 단편을 숙주 유기체의 핵 또는 DNA-함유 세포 소기관 내로 도입하여, 유전적으로 안정한 유전적 형질을 수반하지 않는 유전자 발현을 초래하는 것을 지칭한다.
본원에 사용된 바와 같은 용어 "형질도입"은 바이러스가 핵산을 세포 내로 전이시키는 과정을 지칭한다.
본원에 사용된 바와 같은 용어 "폴리링커" 또는 "다중 클로닝 부위"는 핵산 서열 상에서 서로의 10개 뉴클레오티드 이내에 위치한 3개 이상의 유형-2 제한 효소 부위의 클러스터(cluster)를 규정한다. 폴리링커를 포함하는 구조물은 유전자의 코딩 영역과 같은 핵산 서열의 삽입 및/또는 절제를 위해 활용된다.
본원에 사용된 바와 같은 용어 "제한 엔도뉴클레아제" 및 "제한 효소"는 박테리아 효소를 지칭하는데, 그의 각각은 특이적 뉴클레오티드 서열에서 또는 그 근처에서 이중 가닥 DNA를 절단한다. 유형-2 제한 효소는 동일한 부위에서 DNA를 인식하고 절단하며, 이는 XbaI, BamHI, HindIII, EcoRI, XhoI, SalI, KpnI, AvaI, PstI 및 SmaI를 포함하지만, 이에 제한되지 않는다.
용어 "벡터"는 용어 "구조물(construct)", "클로닝 벡터" 및 "발현 벡터"와 상호 교환적으로 사용되고, 이는 숙주를 형질전환시키고 도입된 서열의 발현 (예를 들어, 전사 및 번역)을 증진시키도록, DNA 또는 RNA 서열 (예를 들어, 외래 유전자)을 숙주 세포 내로 도입시킬 수 있는 비히클을 의미한다. "비-바이러스성 벡터"는 바이러스 또는 레트로바이러스를 포함하지 않는 모든 벡터를 의미한다. 일부 실시양태에서 "벡터"는 하나 이상의 DNA 복제 기점과 하나 이상의 선별성 마커 유전자를 포함하는 DNA의 서열이다. 그의 예는 플라스미드, 코스미드, 박테리오파지, 박테리아 인공 염색체 (BAC), 또는 외인성 DNA를 세포 내로 운반하는 바이러스를 포함하지만, 이에 제한되지 않는다. 벡터는 또한, 하나 이상의 유전자, 안티센스 분자 및/또는 선별성 마커 유전자, 및 관련 기술분야에 공지된 기타 유전적 요소를 포함할 수 있다. 벡터는 특정 세포를 형질도입, 형질전환 또는 감염시킬 수 있으므로, 이러한 세포가 벡터에 의해 코딩된 핵산 분자 및/또는 단백질을 발현시킬 수 있다. 용어 "플라스미드"는 원핵성 또는 진핵성 숙주 세포에서 상염색체성 복제할 수 있는 핵산의 환상 가닥을 규정한다. 상기 용어는 DNA 또는 RNA일 수 있고 단일 가닥 또는 이중 가닥일 수 있는 핵산을 포함한다. 이러한 정의의 플라스미드는 또한, 박테리아 복제 기점에 상응하는 서열을 포함할 수 있다.
본원에 사용된 바와 같은 용어 "선별성 마커 유전자"는 선별성 마커 유전자가 삽입되는 세포의 확인을 촉진시키는 단백질을 코딩하는 유전자 또는 기타 발현 카세트를 규정한다. 예를 들어, "선별성 마커 유전자"는 리포터 유전자 뿐만 아니라, 예를 들어 식물 세포를 선별 제제로부터 보호하거나 또는 선별 제제에 대한 저항성/내성을 제공하기 위하여 식물 형질전환에 사용된 유전자를 포괄한다. 한 실시양태에서 기능성 선별성 마커가 제공된 세포 또는 식물만이 선별 제제를 갖는 조건 하에 분할 또는 성장할 수 있다. 선별 제제의 예는, 예를 들어 스펙티노마이신, 네오마이신, 카나마이신, 파로모마이신, 젠타미신 및 히그로마이신을 포함한 항생제를 포함할 수 있다. 이들 선별성 마커는 항생제 카나마이신에 대한 저항성을 부여해 주는 효소를 발현하는 네오마이신 포스포트랜스퍼라제 (npt II), 및 관련 항생제 네오마이신, 파로모마이신, 젠타미신 및 G418에 대한 유전자, 또는 히그로마이신에 대한 저항성을 부여해 주는 효소를 발현하는 히그로마이신 포스포트랜스퍼라제 (hpt)에 대한 유전자를 포함한다. 기타 선별성 마커 유전자는 bar 또는 pat (글루포시네이트 암모늄 또는 포스피노트리신에 대항한 저항성)를 포함한 제초제 저항성, 아세토락테이트 합성효소 [ALS; 측쇄 아미노산의 합성에 있어서 첫 번째 단계를 방지하는 억제제, 예컨대 술포닐우레아 (SU), 이미다졸리논 (IMI), 트리아졸로피리미딘 (TP), 피리미디닐 옥시벤조에이트 (POB) 및 술포닐아미노 카르보닐 트리아졸리논에 대항한 저항성], 글리포세이트, 2,4-D, 및 금속 저항성 또는 감수성을 코딩하는 유전자를 포함할 수 있다. 선별성 마커 유전자로서 사용될 수 있는 "리포터 유전자"의 예는 발현된 리포터 유전자 단백질, 예컨대 β-글루쿠로니다제 (GUS), 루시페라제, 그린 형광성 단백질 (GFP), 옐로우 형광성 단백질 (YFP), DsRed, β-갈락토시다제, 클로람페니콜 아세틸트랜스퍼라제 (CAT), 알칼리성 포스파타제 등을 코딩하는 단백질의 가시적 관찰을 포함한다. "마커-양성"은 선별성 마커 유전자를 포함하도록 형질전환시킨 식물을 지칭한다.
본원에 사용된 바와 같은 용어 "탐지 가능한 마커"는 탐지할 수 있는 표지, 예컨대 예를 들어, 방사성 동위원소, 형광성 화합물, 생물발광성 화합물, 화학발광성 화합물, 금속 킬레이트제 또는 효소를 지칭한다. 탐지 가능한 마커의 예는 다음을 포함하지만, 그에 제한되지 않는다: 형광성 표지 (예를 들어, FITC, 로다민, 란타나이드 인광체), 효소 표지 (예를 들어, 서양고추냉이 퍼옥시다제, β-갈락토시다제, 루시페라제, 알칼리성 포스파타제), 화학발광체, 바이오티닐 기, 이차 리포터 (예를 들어, 루이신 지퍼 쌍 서열, 2차 항체에 대한 결합 부위, 금속 결합성 도메인, 에피토프 태그)에 의해 인식된 미리 결정된 폴리펩티드 에피토프. 특정 실시양태에서, 탐지 가능한 마커는 각종 길이의 스페이서 아암(arm)에 의해 부착되어 잠재적 입체 방해를 저하시킬 수 있다.
본원에 사용된 바와 같은 용어 "탐지하는"은 가장 광범위한 의미로 사용되어, 특이적 분자, 예를 들어 특이적 폴리펩티드의 정성적 측정과 정량적 측정 둘 다를 포함한다.
본원에 사용된 바와 같은 용어 "카세트", "발현 카세트" 및 "유전자 발현 카세트"는 특이적 제한 부위에서 또는 상동 재조합에 의해 핵산 또는 폴리뉴클레오티드 내로 삽입될 수 있는 DNA의 절편을 지칭한다. 본원에 사용된 바와 같은 DNA의 절편은 관심 폴리펩티드를 코딩하는 관심 유전자를 함유하는 폴리뉴클레오티드를 포함하고, 카세트 및 제한 부위는 전사 및 번역에 적당한 판독 프레임 내에서 상기 카세트의 삽입이 반드시 이루어지도록 설계된다. 특정 실시양태에서, 발현 카세트는 관심 폴리펩티드를 코딩하고 특별한 숙주 세포의 형질전환을 촉진시키는 폴리뉴클레오티드 이외의 요소를 갖는 폴리뉴클레오티드를 포함할 수 있다. 특정 실시양태에서, 유전자 발현 카세트는 또한, 숙주 세포에서 관심 폴리펩티드를 코딩하는 폴리뉴클레오티드의 증강된 발현을 허용해주는 요소를 포함할 수 있다. 이들 요소는 프로모터, 최소 프로모터, 증강인자, 반응 요소, 인트론, 5' 비번역 영역 서열, 3' 비번역 영역 서열, 종결인자 서열, 폴리아데닐화 서열 등을 포함할 수 있지만, 이에 제한되지 않는다.
본원에 사용된 바와 같은 "링커" 또는 "스페이서"는 2개의 별도의 실체를 서로 결합시키는 결합, 분자 또는 분자 군이다. 링커 및 스페이서는 두 실체의 최적의 간격을 제공할 수 있거나 또는 두 실체를 서로 분리시킬 수 있는 불안정한 연쇄를 추가로 제공할 수 있다. 불안정한 연쇄는 광분해 가능한 기, 산-불안정한 모이어티, 염기-불안정한 모이어티 및 효소-절단 가능한 기를 포함한다.
본원에 사용된 바와 같은 용어 "이종 코딩 서열"은 숙주 유기체에서는 정상적으로 존재하지 않고 적당한 조건 하에 숙주 세포에서 발현될 수 있는 펩티드 또는 단백질 또는 그의 등가 아미노산 서열, 예를 들어 효소를 코딩하거나 또는 이를 궁극적으로 코딩하는 모든 폴리뉴클레오티드를 표시하기 위해 사용된다. 따라서, "이종 코딩 서열"은 숙주 세포에서는 정상적으로 존재하지 않는 코딩 서열의 1개 또는 부가의 카피를 포함할 수 있으므로, 이러한 세포는 이에 정상적으로 존재하지 않는 코딩 서열의 부가의 카피를 발현한다. 이종 코딩 서열은 RNA 또는 그의 모든 유형, 예를 들어 mRNA, DNA 또는 그의 모든 유형, 예를 들어 cDNA, 또는 RNA/DNA의 혼성체일 수 있다. 코딩 서열의 예는 상기 코딩 서열, 인트론, 프로모터 영역, 5'-UTR, 3'-UTR 및 증강인자 영역과 같은 특징을 포함하는 완전한 길이의 전사 단위를 포함하지만, 이에 제한되지 않는다.
"이종 코딩 서열"은 또한, 펩티드 또는 효소의 코딩 부분, 즉 펩티드 또는 효소의 cDNA 또는 mRNA 서열 뿐만 아니라 완전한 길이의 전사 단위의 코딩 부분, 즉 인트론 및 엑손을 포함하는 유전자, 및 "코돈 최적화" 서열, 끝을 잘라낸 서열, 또는 효소를 코딩하거나 그의 등가의 아미노산 서열을 코딩하는 기타 형태의 변경된 서열을 포함하는데, 단 상기 등가의 아미노산 서열은 기능성 단백질을 생성시켜야 한다. 상기 등가의 아미노산 서열은 하나 이상의 아미노산의 결실을 가질 수 있는데, 이러한 결실은 N-말단, C-말단 또는 내부이다. 끝을 잘라낸 형태가 고려되는데, 이들 형태는 본원에 표시된 촉매적 능력을 지녀야 한다.
본원에 사용된 바와 같은 용어 "대조군"은 비교 목적을 위해 분석적 과정에 사용된 샘플을 지칭한다. 대조군은 "양성" 또는 "음성"일 수 있다. 예를 들어, 분석적 과정의 목적이 세포 또는 조직에서 시차적으로 발현된 전사물 또는 폴리펩티드를 탐지하기 위한 경우에는, 일반적으로 양성 대조군, 예컨대 목적하는 발현을 나타내는 공지된 식물로부터의 샘플, 및 음성 대조군, 예컨대 목적하는 발현이 결여된 것으로 공지된 식물로부터의 샘플을 포함하는 것이 바람직하다.
본원에 사용된 바와 같은 용어 "식물"은 완전 식물, 및 식물의 모든 자손, 세포, 조직 또는 부분을 포함한다. 본 발명에 사용될 수 있는 식물 부류는 일반적으로, 돌연변이 유발되기 쉬운 고등 및 하등 식물 부류로서 광범위한데, 이는 속씨 식물 (외떡잎 및 쌍떡잎 식물), 겉씨 식물, 양치류 및 다세포 해조류를 포함한다. 따라서, "식물"은 쌍떡잎 식물과 외떡잎 식물을 포함한다. 용어 "식물 부분"은 식물의 모든 부분(들), 예를 들어 다음을 제한없이 포함한다: 종자 (성숙한 종자 및 미숙한 종자 포함); 식물 삽목; 식물 세포; 식물 세포 배양물; 식물 기관 (예를 들어, 화분, 배아, 꽃, 과실, 어린 가지(shoot), 잎, 뿌리, 줄기, 및 외식편). 식물 조직 또는 식물 기관은 종자, 원형질체, 캘러스, 또는 구조적 또는 기능적 단위로 체계화되는 식물 세포의 다른 모든 군일 수 있다. 식물 세포 또는 조직 배양물은 그로부터 세포 또는 조직을 수득한 식물의 생리학적 및 형태학적 특징을 갖는 식물을 재생할 수 있고, 식물과 실질적으로 동일한 유전자형을 갖는 식물을 재생할 수 있다. 이와는 달리, 일부 식물 세포는 식물을 생산하도록 재생될 수 없다. 식물 세포 또는 조직 배양물에서 재생 가능한 세포는 배아, 원형질체, 중간엽 세포, 캘러스, 화분, 잎, 꽃밥, 뿌리, 근단, 생사, 꽃, 알맹이, 이삭, 속대, 겉껍질, 또는 꽃자루일 수 있다. 특정 실시양태에서, 식물 재료는 뿌리 조직, 및 지하에 위치한 기타 식물 조직을 포함한다.
식물 부분은 수확 가능한 부분과, 자손 식물의 번식에 유용한 부분을 포함한다. 번식에 유용한 식물 부분은, 예를 들어 다음을 포함하지만, 그에 제한되지 않는다: 종자; 과실; 삽목; 묘목; 괴경; 및 근경. 식물의 수확 가능한 부분은 식물의 모든 유용한 부분일 수 있는데, 예를 들어 다음을 포함하지만, 그에 제한되지 않는다: 꽃; 화분; 묘목; 괴경; 잎; 줄기; 과실; 종자; 및 뿌리.
식물 세포는 원형질체 및 세포벽을 포함하는, 식물의 구조적 및 생리학적 단위이다. 식물 세포는 단리된 단일 세포, 또는 세포의 집합체의 형태 (예를 들어, 무른 캘러스 및 배양된 세포)일 수 있고, 고등 체계화 단위 (예를 들어, 식물 조직, 식물 기관, 및 식물)의 일부일 수 있다. 따라서, 식물 세포는 원형질체, 배우자 생산 세포, 또는 완전 식물로 재생될 수 있는 세포 또는 세포 컬렉션일 수 있다. 따라서, 다중의 식물 세포를 포함하고 완전 식물로 재생할 수 있는 종자가 본원의 실시양태에서 "식물 세포"로 간주된다.
본원에 사용된 바와 같은 용어 "원형질체"는 그의 세포벽이 완전히 또는 부분적으로 제거되었고, 그의 지질 이층 막이 노출된 식물 세포를 지칭하므로, 이는 그의 세포벽이 완전히 제거된 원형질체, 및 그의 세포벽이 단지 부분적으로 제거된 스페로플라스트(spheroplast)를 포함하지만, 이에 제한되지 않는다. 전형적으로, 원형질체는 세포 배양물 또는 완전 식물로 재생할 수 있는 효력을 지닌, 세포벽을 수반하지 않는 단리된 식물 세포이다.
달리 구체적으로 설명되지 않는 한, 본원에 사용된 모든 기술적 및 과학적 용어는 본 개시내용이 속하는 관련 기술분야의 통상의 기술자에 의해 통상적으로 이해되는 바와 동일한 의미를 갖는다. 분자 생물학에서 통상적인 용어의 정의는, 예를 들어 문헌 ([Lewin, Genes V, Oxford University Press, 1994; Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, Blackwell Science Ltd., 1994]; 및 [Meyers (ed.), Molecular Biology and Biotechnology: A Comprehensive Desk Reference, VCH Publishers, Inc., 1995])에서 찾을 수 있다.
실시양태
본원에 개시된 바와 같이, 제아 메이스 메탈로티오네인-유사 유전자의 조절 서열을 이용하여 트랜스진을 발현하기 위한 신규 재조합 구조물이 제공된다. 이들 구조물을 사용하여 식물 세포를 포함한 세포를 형질전환시켜, 그들의 세포에서 트랜스진 유전자 산물을 발현하는 완전한 유기체를 생성시킬 수 있다.
조절 요소
기본 연구 또는 생명공학적 적용에 사용되는 식물 프로모터는 일반적으로, 그의 3' 말단 (하류)에서 융합된 하나의 유전자만을 지시하는 단일 방향성이다. 이는 종종, 대사 조작 및 형질 스태킹을 위하여 다중 유전자를 식물 내로 도입하는 데 필요하므로, 다중 유전자의 발현을 구동시키기 위해서는 다중의 신규 프로모터가 트랜스제닉 작물에 전형적으로 요구된다.
트랜스제닉 생성물을 개발하는 것은 점점 더 복잡해지는데, 이를 위해서는 다중 트랜스진을 단일 유전자 자리 내로 스태킹해야 한다. 전통적으로, 각 트랜스진은 통상적으로, 발현을 위해 독특한 프로모터를 요구하는데, 여기서 하나의 유전자 스택 내에 상이한 트랜스진을 발현하기 위해서는 다중의 프로모터가 요구된다. 이로써 종종, 단일의 다유전자성 형질의 발현을 위해 상이한 트랜스진의 유사한 수준의 발현 패턴을 수득하기 위해 하나의 트랜스진 스택 내에 동일한 프로모터를 반복해서 사용하게 된다. 동일한 프로모터에 의해 구동된 다유전자 구조물이 유전자 침묵을 유발시켜, 현장에서 덜 효능있는 트랜스제닉 생성물을 생성시키는 것으로 공지되어 있다. 프로모터 반복에 기인한 과도한 전사 인자 (TF)-결합 부위는 내인성 TF의 고갈을 유발시켜 전사 불활성화를 초래할 수 있다. 트랜스진의 침묵은 트랜스진을 발현하기 위해 생성된 트랜스제닉 식물의 성능에 바람직하지 못하게 영향을 미치는 것으로 예상될 것이다. 트랜스진 내에서 반복되는 서열로 인해, 유전자 자리내 유전자 상동 재조합이 유발되어, 폴리뉴클레오티드가 재배열될 수 있다.
식물에서 트랜스진을 발현하기 위해 제아 메이스 메탈로티오네인-유사 유전자 조절 요소를 이용하는 방법 및 구조물이 제공된다. 특정 실시양태에서, 프로모터는 다음의 제아 메이스 메탈로티오네인-유사 프로모터일 수 있다:
특정 실시양태에서, 프로모터는 다음의 제아 메이스 메탈로티오네인-유사 프로모터의 끝을 잘라낸 것일 수 있다:
특정 실시양태에서, 프로모터를 포함하는 핵산 구조물이 제공된다. 특정 실시양태에서, 이러한 프로모터는 제아 메이스 메탈로티오네인-유사 유전자 프로모터이다. 특정 실시양태에서, 프로모터를 포함하는 핵산 구조물이 제공되는데, 여기서 이러한 프로모터는 서열 1 또는 서열 2와 적어도 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5%, 99.8%, 또는 100% 동일하다. 특정 실시양태에서, 폴리링커에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 유전자 프로모터를 포함하는 핵산 구조물이 제공된다. 특정 실시양태에서, 유전자 발현 카세트는 트랜스진에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 유전자 프로모터를 포함한다. 한 실시양태에서 상기 프로모터는 서열 1 또는 서열 2로 이루어진다. 예시되는 실시양태에서, 트랜스진의 5' 말단에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 유전자 프로모터를 포함하는 유전자 발현 카세트가 제공되는데, 여기서 상기 트랜스진은 살곤충제 저항성 트랜스진, 제초제 내성 트랜스진, 질소 사용 효율 트랜스진, 용수 효율 트랜스진, 영양 품질 트랜스진, DNA 결합성 트랜스진, 선별성 마커 트랜스진, 또는 그의 조합일 수 있다.
프로모터 이외에도, mRNA의 전사, 종결 및 폴리아데닐화를 위해서는 3'-비번역 유전자 영역 (즉, 3'-UTR) 또는 종결인자가 필요하다. mRNA의 적당한 전사 종결 및 폴리아데닐화가 트랜스진의 안정적 발현에 중요하다. 전사 종결은 다유전자 스택이 다음 트랜스진으로의 전사 연속 판독을 피하는 데 있어서 보다 중요해진다. 유사하게, 비-폴리아데닐화 이상 RNA (aRNA)는 식물 RNA-의존성 RNA 중합효소 (RdRP)가 aRNA를 이중 가닥 RNA (dsRNA)로 전환시켜 저분자 RNA 생성과 트랜스진 침묵을 초래하는 기질이다. 따라서, 강력한 전사 종결인자는 단일 유전자 스택과 다중 유전자 스택 둘 다에 매우 유용하다. 프로모터가 전사를 구동하는 데 필요하긴 하지만, 3'-UTR 유전자 영역은 전사를 종결시킬 수 있고, 번역과 단백질 합성을 위해, 이로써 생성되는 mRNA 전사물의 폴리아데닐화를 개시할 수 있다. 3'-UTR 유전자 영역은 트랜스진의 안정적 발현을 도와준다.
한 실시양태에 따라서, 전사 종결인자를 포함하는 핵산 구조물이 제공된다. 특정 실시양태에서, 이러한 전사 종결인자는 제아 메이스 메탈로티오네인-유사 유전자 전사 종결인자이다. 특정 실시양태에서, 전사 종결인자를 포함하는 핵산 구조물이 제공되는데, 여기서 이러한 전사 종결인자는 서열 3 또는 서열 4와 적어도 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5%, 99.8%, 또는 100% 동일하다. 특정 실시양태에서, 폴리링커에 작동가능하게 연결되는 전사 종결인자를 포함하는 핵산 구조물이 제공된다. 특정 실시양태에서, 트랜스진의 3' 말단에 작동가능하게 연결되는 전사 종결인자를 포함하는 유전자 발현 카세트가 제공된다. 한 실시양태에서, 상기 전사 종결인자는 서열 3 또는 서열 4로 이루어진다. 예시되는 실시양태에서, 유전자 발현 카세트는 트랜스진에 작동가능하게 연결되는 전사 종결인자를 포함하는데, 여기서 이러한 트랜스진은 살곤충제 저항성 트랜스진, 제초제 내성 트랜스진, 질소 사용 효율 트랜스진, 용수 효율 트랜스진, 영양 품질 트랜스진, DNA 결합성 트랜스진, 선별성 마커 트랜스진, 또는 그의 조합일 수 있다. 한 실시양태에서, 폴리링커 서열, 트랜스진, 또는 둘 다의 조합에 작동가능하게 연결된 전사 종결인자를 포함하는 핵산 벡터가 제공된다. 한 실시양태에서, 이러한 전사 종결인자는 1 kb 미만 길이이다.
특정 실시양태에서, 본원에 기재된 바와 같은 프로모터, 및 3'-UTR을 포함하는 핵산 구조물이 제공된다. 특정 실시양태에서, 이러한 핵산 구조물은 3'-UTR을 포함한다. 특정 실시양태에서, 3'-UTR은 제아 메이스 메탈로티오네인-유사 3'-UTR이다.
특정 실시양태에서, 3'-UTR은 다음의 제아 메이스 메탈로티오네인-유사 3'-UTR일 수 있다:
특정 실시양태에서, 3'-UTR은 다음의 제아 메이스 메탈로티오네인-유사 3'-UTR의 끝을 잘라낸 것일 수 있다:
특정 실시양태에서, 본원에 기재된 바와 같은 프로모터, 및 3'-UTR을 포함하는 핵산 구조물이 제공된다. 특정 실시양태에서, 3'-UTR은 제아 메이스 메탈로티오네인-유사 유전자 3'-UTR일 수 있다. 특정 실시양태에서, 상기 3'-UTR은 서열 3 또는 서열 4와 적어도 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5%, 99.8%, 또는 100% 동일하다. 특정 실시양태에서, 본원에 기재된 바와 같은 프로모터, 및 3'-UTR을 포함하는 핵산 구조물이 제공되는데, 여기서 상기 프로모터와 3'-UTR은 둘 다, 폴리링커의 반대 말단에 작동가능하게 연결된다. 특정 실시양태에서, 본원에 기재된 바와 같은 프로모터, 및 3'-UTR을 포함하는 유전자 발현 카세트가 제공되는데, 여기서 상기 프로모터와 3'-UTR은 둘 다, 트랜스진의 반대 말단에 작동가능하게 연결된다. 한 실시양태에서 상기 3'-UTR은 서열 3 또는 서열 4로 이루어진다. 한 실시양태에서, 본원에 기재된 바와 같은 프로모터, 및 3'-UTR을 포함하는 유전자 발현 카세트가 제공된다. 한 실시양태에서 상기 프로모터는 서열 1 또는 서열 2로 이루어지고 상기 3'-UTR은 서열 3 또는 서열 4로 이루어진다.
예시되는 실시양태에서, 유전자 발현 카세트는 트랜스진에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 유전자 3'-UTR을 포함한다. 예시되는 실시양태에서, 유전자 발현 카세트는 트랜스진에 작동가능하게 연결되는 3'-UTR을 포함하는데, 여기서 상기 트랜스진은 살곤충제 저항성 트랜스진, 제초제 내성 트랜스진, 질소 사용 효율 트랜스진, 용수 효율 트랜스진, 영양 품질 트랜스진, DNA 결합성 트랜스진, 선별성 마커 트랜스진, 또는 그의 조합일 수 있다. 추가 실시양태에서, 상기 트랜스진은 동일한 제아 메이스 메탈로티오네인-유사 유전자로부터의 3'-UTR 및 프로모터에 작동가능하게 연결된다.
특정 실시양태에서, 본원에 기재된 바와 같은 프로모터, 및 5'-UTR을 포함하는 핵산 구조물이 제공된다. 한 실시양태에서, 인트론이 상기 프로모터에 작동가능하게 연결된다. 특정 실시양태에서, 제아 메이스 메탈로티오네인-유사 단백질을 코딩하는 옥수수 유전자로부터 단리된 프로모터, 또는 이러한 프로모터 서열의 유도체에 작동가능하게 연결된 인트론을 포함하는 핵산 구조물이 제공된다. 특정 실시양태에서, 상기 5'-UTR은 다음의 제아 메이스 메탈로티오네인-유사 5'-UTR일 수 있다:
특정 실시양태에서, 본원에 기재된 바와 같은 프로모터, 및 5'-UTR을 포함하는 핵산 구조물이 제공되는데, 여기서 상기 5'-UTR은 서열 5와 적어도 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5%, 99.8%, 또는 100% 동일하다. 특정 실시양태에서, 본원에 기재된 바와 같은 프로모터, 5'-UTR 서열 및 폴리링커를 포함하는 핵산 구조물이 제공되는데, 여기서 상기 프로모터와 5'-UTR은 폴리링커에 작동가능하게 연결된다. 특정 실시양태에서, 본원에 기재된 바와 같은 프로모터, 5'-UTR 서열 및 트랜스진을 포함하는 유전자 발현 카세트가 제공되는데, 여기서 상기 프로모터와 5'-UTR은 트랜스진의 5' 말단에 작동가능하게 연결된다. 임의로, 상기 구조물은 추가로, 트랜스진 또는 폴리링커의 3' 말단에 작동가능하게 연결되는 3'-UTR을 포함한다. 한 실시양태에서 상기 프로모터 및 3'-UTR 서열은 본원에 기재된 것으로부터 선택되고 5'-UTR 서열은 서열 5로 이루어진다. 특정 실시양태에서, 유전자 발현 카세트는 프로모터에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 단백질을 코딩하는 옥수수 유전자로부터의 5'-UTR을 포함하는데, 여기서 상기 프로모터는 제아 메이스 메탈로티오네인-유사 유전자 프로모터이거나, 또는 식물로부터 유래되는 프로모터 (예를 들어, 제아 메이스 유비퀴틴 1 프로모터), 바이러스로부터 유래되는 프로모터 [예를 들어, 카사바(Cassava) 잎맥 모자이크 바이러스 프로모터] 또는 박테리아로부터 유래되는 프로모터 [예를 들어, 아그로박테리움 투메파시엔스 델타 마스(delta mas)]이다. 예시되는 실시양태에서, 유전자 발현 카세트는 트랜스진에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 단백질을 코딩하는 옥수수 유전자로부터의 5'-UTR을 포함하는데, 여기서 상기 트랜스진은 살곤충제 저항성 트랜스진, 제초제 내성 트랜스진, 질소 사용 효율 트랜스진, 용수 효율 트랜스진, 영양 품질 트랜스진, DNA 결합성 트랜스진, 선별성 마커 트랜스진, 또는 그의 조합일 수 있다.
한 실시양태에서, 프로모터 및 폴리링커 및 임의로 다음 요소들 중 하나 이상을 포함하는 핵산 구조물이 제공된다:
a) 5' 비번역 영역; 및
b) 3' 비번역 영역
[여기서,
상기 프로모터는 서열 1 또는 서열 2, 또는 서열 1 또는 서열 2와 98% 서열 동일성을 갖는 서열로 이루어지고;
5' 비번역 영역은 서열 5, 또는 서열 5와 98% 서열 동일성을 갖는 서열로 이루어지며;
3' 비번역 영역은 서열 3 또는 서열 4, 또는 서열 3 또는 서열 4와 98% 서열 동일성을 갖는 서열로 이루어지고; 추가로 여기서 상기 프로모터는 상기 폴리링커에 작동가능하게 연결되며, 존재하는 경우 각 임의의 요소 또한, 상기 프로모터 및 폴리링커 둘 다에 작동가능하게 연결된다].
한 실시양태에서, 프로모터 및 트랜스진 및 임의로 다음 요소들 중 하나 이상을 포함하는 핵산 구조물이 제공된다:
a) 5' 비번역 영역; 및
b) 3' 비번역 영역
[여기서,
상기 프로모터는 서열 1 또는 서열 2, 또는 서열 1 또는 서열 2와 98% 서열 동일성을 갖는 서열로 이루어지고;
5' 비번역 영역은 서열 5, 또는 서열 5와 98% 서열 동일성을 갖는 서열로 이루어지며;
3' 비번역 영역은 서열 3 또는 서열 4, 또는 서열 3 또는 서열 4와 98% 서열 동일성을 갖는 서열로 이루어지고; 추가로 여기서 상기 프로모터는 상기 트랜스진에 작동가능하게 연결되며, 존재하는 경우 각각의 임의의 요소 또한, 상기 프로모터 및 트랜스진 둘 다에 작동가능하게 연결된다]. 추가 실시양태에서 바로 위에 개시된 핵산 구조물을 포함하는 트랜스제닉 세포가 제공된다. 한 실시양태에서 이러한 트랜스제닉 세포은 식물 세포이고, 추가 실시양태에서 식물이 제공되는데, 여기서 이러한 식물은 상기 트랜스제닉 세포를 포함한다.
특정 실시양태에서, 유전자 발현 카세트는 제아 메이스 메탈로티오네인-유사 프로모터, 제아 메이스 메탈로티오네인-유사 5'-UTR, 및 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함한다. 특정 실시양태에서, 유전자 발현 카세트는 a) 프로모터 (여기서, 프로모터는 서열 1 또는 서열 2와 적어도 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5%, 99.8%, 또는 100% 동일하다); b) 5'-UTR (여기서, 5'-UTR은 서열 5와 적어도 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5%, 99.8%, 또는 100% 동일하다); 및 c) 3'-UTR (여기서, 3'-UTR은 서열 3 또는 서열 4와 적어도 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5%, 99.8%, 또는 100% 동일하다)을 포함한다.
예를 들어, 유전자 발현 카세트는 프로모터, 5'-UTR, 및 3'-UTR를 포함할 수 있는데, 여기서 상기 프로모터는 서열 1의 폴리뉴클레오티드이고, 5'-UTR은 서열 5의 폴리뉴클레오티드이며, 3'-UTR은 서열 3의 폴리뉴클레오티드이다. 마찬가지로, 유전자 발현 카세트는 프로모터, 5'-UTR, 및 3'-UTR을 포함할 수 있는데, 여기서 상기 프로모터는 서열 2의 폴리뉴클레오티드이고, 5'-UTR은 서열 5의 폴리뉴클레오티드이며, 3'-UTR은 서열 4의 폴리뉴클레오티드이다. 더욱이, 유전자 발현 카세트는 프로모터, 5'-UTR, 및 3'-UTR를 포함할 수 있는데, 여기서 상기 프로모터는 서열 2의 폴리뉴클레오티드이고, 5'-UTR은 서열 5의 폴리뉴클레오티드이며, 3'-UTR은 서열 3의 폴리뉴클레오티드이다. 또한, 유전자 발현 카세트는 프로모터, 5'-UTR, 및 3'-UTR를 포함할 수 있는데, 여기서 상기 프로모터는 서열 1의 폴리뉴클레오티드이고, 5'-UTR은 서열 5의 폴리뉴클레오티드이며, 3'-UTR은 서열 4의 폴리뉴클레오티드이다.
특정 실시양태에서, 유전자 발현 카세트는 트랜스진 또는 이종 코딩 서열에 작동가능하게 연결되는, 제아 메이스 메탈로티오네인-유사 프로모터, 제아 메이스 메탈로티오네인-유사 5'-UTR, 및 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함한다. 프로모터, 5'-UTR, 및 3'-UTR은 유전자 발현 카세트가 하나 이상의 트랜스진을 포함하는 경우에, 유전자 발현 카세트 내의 상이한 트랜스진에 작동가능하게 연결될 수 있다. 예시되는 실시양태에서, 유전자 발현 카세트는 트랜스진에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 프로모터를 포함하는데, 여기서 상기 트랜스진은 살곤충제 저항성 트랜스진, 제초제 내성 트랜스진, 질소 사용 효율 트랜스진, 용수 효율 트랜스진, 영양 품질 트랜스진, DNA 결합성 트랜스진, 선별성 마커 트랜스진, 또는 그의 조합일 수 있다. 예시되는 실시양태에서, 유전자 발현 카세트는 트랜스진에 작동가능하게 연결되는, 제아 메이스 메탈로티오네인-유사 프로모터, 제아 메이스 메탈로티오네인-유사 5'-UTR, 및 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는데, 여기서 상기 트랜스진은 살곤충제 저항성 트랜스진, 제초제 내성 트랜스진, 질소 사용 효율 트랜스진, 용수 효율 트랜스진, 영양 품질 트랜스진, DNA 결합성 트랜스진, 선별성 마커 트랜스진, 또는 그의 조합일 수 있다. 예시되는 실시양태에서, 유전자 발현 카세트는 트랜스진에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는데, 여기서 상기 트랜스진은 살곤충제 저항성, 제초제 내성, 질소 사용 효율, 용수 효율, 영양 품질, 또는 그의 조합을 증강시키는 유전자 산물을 코딩한다.
제아 메이스 메탈로티오네인-유사 5'-UTR 및 제아 메이스 메탈로티오네인-유사 3'-UTR은 유전자 발현 카세트 내의 상이한 프로모터에 작동가능하게 연결될 수 있다. 예시되는 실시양태에서, 프로모터는 식물로부터 유래되거나 (예를 들어, 제아 메이스 유비퀴틴 1 프로모터), 바이러스로부터 유래되거나 (예를 들어, 카사바 잎맥 모자이크 바이러스 프로모터) 또는 박테리아로부터 유래된다 (예를 들어, 아그로박테리움 투메파시엔스 델타 마스). 추가 실시양태에서, 유전자 발현 카세트는 트랜스진에 작동가능하게 연결되는 프로모터를 포함하는데, 여기서 상기 트랜스진은 살곤충제 저항성 트랜스진, 제초제 내성 트랜스진, 질소 사용 효율 트랜스진, 용수 효율 트랜스진, 영양 품질 트랜스진, DNA 결합성 트랜스진, 선별성 마커 트랜스진, 또는 그의 조합일 수 있다.
특정 실시양태에서, 벡터는 본원에 개시된 바와 같은 유전자 발현 카세트를 포함한다. 특정 실시양태에서, 벡터는 공여자 DNA와 같은 형질전환 또는 유전자 표적화에 사용하기 위한, 플라스미드, 코스미드, 박테리아 인공 염색체 (BAC), 박테리오파지, 바이러스, 또는 절제된 폴리뉴클레오티드 단편일 수 있다.
한 실시양태에 따라서, 재조합 유전자 카세트를 포함하는 핵산 벡터가 제공되는데, 여기서 이러한 재조합 유전자 카세트는 폴리링커 서열, 트랜스진, 또는 그의 조합에 작동가능하게 연결된 프로모터를 포함한다. 한 실시양태에서 상기 재조합 유전자 카세트는 트랜스진에 작동가능하게 연결된 프로모터를 포함한다. 한 실시양태에서 재조합 유전자 카세트는 폴리링커 서열에 작동가능하게 연결된, 본원에 개시된 바와 같은 프로모터를 포함한다. 이러한 폴리링커는 코딩 서열을 폴리링커의 제한 부위 중 하나 내로 삽입하는 것이, 벡터가 숙주 세포 내로 형질감염되는 경우에 코딩 서열의 발현을 허용해 주면서 코딩 서열에 작동가능하게 연결되는 방식으로 프로모터에 작동가능하게 연결된다.
한 실시양태에 따라서 프로모터는 서열 1, 또는 서열 1과 90, 95 또는 99% 서열 동일성을 갖는 서열을 포함한다. 한 실시양태에 따라서 프로모터 서열은 1.5, 2, 2.5, 3 또는 4 kb 이하의 총 길이를 갖는다. 한 실시양태에 따라서 프로모터는 서열 1, 또는 서열 1과 90, 95 또는 99% 서열 동일성을 갖는 2061 bp 서열로 이루어진다.
한 실시양태에 따라서 프로모터는 서열 2, 또는 서열 2와 90, 95 또는 99% 서열 동일성을 갖는 서열을 포함한다. 한 실시양태에 따라서 프로모터 서열은 1.5, 2, 2.5, 3 또는 4 kb 이하의 총 길이를 갖는다. 한 실시양태에 따라서 프로모터는 서열 2, 또는 서열 2와 90, 95 또는 99% 서열 동일성을 갖는 1498 bp 서열로 이루어진다.
한 실시양태에 따라서 서열 1, 트랜스진 및 3'-UTR로 이루어진 유전자 카세트를 포함하는 핵산 벡터가 제공되는데, 여기서 서열 1은 트랜스진의 5' 말단에 작동가능하게 연결되고 3'-UTR은 트랜스진의 3' 말단에 작동가능하게 연결된다. 추가 실시양태에서 3' 비번역 서열은 서열 3, 또는 서열 3과 90, 95, 99 또는 100% 서열 동일성을 갖는 서열을 포함한다. 한 실시양태에 따라서 서열 1, 또는 서열 1과 90, 95 또는 99% 서열 동일성을 갖는 2061 bp 서열, 트랜스진 및 3'-UTR로 이루어진 유전자 카세트를 포함하는 핵산 벡터가 제공되는데, 여기서 서열 1은 트랜스진의 5' 말단에 작동가능하게 연결되고 3'-UTR은 트랜스진의 3' 말단에 작동가능하게 연결된다. 추가 실시양태에서 3' 비번역 서열은 서열 3, 또는 서열 3과 90, 95, 99 또는 100% 서열 동일성을 갖는 서열을 포함한다. 추가 실시양태에서 3' 비번역 서열은 서열 3, 또는 서열 3과 90, 95 또는 99% 서열 동일성을 갖는 1080 bp 서열로 이루어진다.
한 실시양태에 따라서 서열 2, 트랜스진 및 3'-UTR로 이루어진 유전자 카세트를 포함하는 핵산 벡터가 제공되는데, 여기서 서열 2는 트랜스진의 5' 말단에 작동가능하게 연결되고 3'-UTR은 트랜스진의 3' 말단에 작동가능하게 연결된다. 추가 실시양태에서 3' 비번역 서열은 서열 4, 또는 서열 4와 90, 95, 99 또는 100% 서열 동일성을 갖는 서열을 포함한다. 한 실시양태에 따라서 서열 2, 또는 서열 2와 90, 95 또는 99% 서열 동일성을 갖는 1498 bp 서열, 트랜스진 및 3'-UTR로 이루어진 유전자 카세트를 포함하는 핵산 벡터가 제공되는데, 여기서 서열 2는 트랜스진의 5' 말단에 작동가능하게 연결되고 3'-UTR은 트랜스진의 3' 말단에 작동가능하게 연결된다. 추가 실시양태에서 3' 비번역 서열은 서열 4, 또는 서열 4와 90, 95, 99 또는 100% 서열 동일성을 갖는 서열을 포함한다. 추가 실시양태에서 3' 비번역 서열은 서열 4, 또는 서열 4와 90, 95 또는 99% 서열 동일성을 갖는 376 bp 서열로 이루어진다.
한 실시양태에 따라서 상기 핵산 벡터는 선별성 마커를 코딩하는 서열을 추가로 포함한다. 한 실시양태에 따라서 재조합 유전자 카세트는 아그로박테리움 T-DNA 경계에 작동가능하게 연결된다. 한 실시양태에 따라서 재조합 유전자 카세트는 제1 및 제2 T-DNA 경계를 추가로 포함하는데, 여기서 제1 T-DNA 경계는 유전자 구조물의 하나의 말단에 작동가능하게 연결되고, 제2 T-DNA 경계는 유전자 구조물의 다른 말단에 작동가능하게 연결된다. 상기 제1 및 제2 아그로박테리움 T-DNA 경계는 노팔린(nopaline) 합성 아그로박테리움 T-DNA 경계, 옥토핀(octopine) 합성 아그로박테리움 T-DNA 경계, 숙시나모핀(succinamopine) 합성 아그로박테리움 T-DNA 경계, 또는 그의 모든 조합으로 이루어진 군으로부터 선택된 박테리아 균주로부터 유래되는 T-DNA 경계 서열로부터 독립적으로 선택될 수 있다. 한 실시양태에서 노팔린 합성 균주, 만노핀(mannopine) 합성 균주, 숙시나모핀 합성 균주, 또는 옥토핀 합성 균주로 이루어진 군으로부터 선택된 아그로박테리움 균주가 제공되는데, 여기서 상기 균주는 플라스미드를 포함하는데, 여기서 이러한 플라스미드는 서열 1, 서열 2, 또는 서열 1 또는 서열 2와 90, 95, 또는 99% 서열 동일성을 갖는 서열로부터 선택된 서열에 작동가능하게 연결된 트랜스진을 포함한다.
본 발명에 개시된 구조물에 사용하기 적합한 관심 트랜스진은 (1) 해충 또는 질환에 대한 저항성을 부여해 주는 코딩 서열, (2) 제초제에 대한 저항성을 부여해 주는 코딩 서열, 및 (3) WO2013116700 (DGT-28), US20110107455 (DSM-2), 미국 특허 번호 8,283,522 (AAD-12); 7,838,733 (AAD-1); 5,188,960; 5,691,308; 6,096,708; 및 6,573,240 (Cry1F); 미국 특허 번호 6,114,138; 5,710,020; 및 6,251,656 (Cry1Ac); 미국 특허 번호 6,127,180; 6,624,145 및 6,340,593 (Cry34Ab1); 미국 특허 번호 6,083,499; 6,548,291 및 6,340,593 (Cry35Ab1) (이들 특허의 개시내용은 본원에 포함된다)에 개시된 바와 같은 가치 부가된 형질을 부여해 주는 코딩 서열을 포함하지만, 이에 제한되지 않는다. 한 실시양태에 따라서 상기 트랜스진은 선별성 마커를 코딩하거나 또는 살곤충제 저항성, 제초제 내성, 질소 사용 효율, 용수 효율, 또는 영양 품질을 부여해 주는 유전자 산물을 코딩한다.
한 실시양태에 따라서 유전자 카세트를 포함하는 핵산 벡터가 제공되는데, 여기서 이러한 유전자 카세트는 트랜스진의 5' 말단에 작동가능하게 연결된 프로모터 영역을 포함하고, 트랜스진의 3' 말단은 3' 비번역 영역과 연결된다. 한 실시양태에서 상기 프로모터 영역은 서열 1, 또는 서열 1과 90, 95 또는 99% 서열 동일성을 갖는 서열을 포함한다. 또 다른 실시양태에서 상기 프로모터 영역은 서열 2, 또는 서열 2와 90, 95 또는 99% 서열 동일성을 갖는 서열을 포함한다. 한 실시양태에 따라서 상기 프로모터 영역은 서열 1 또는 서열 2로 이루어진다. 한 실시양태에서 3' 비번역 서열은 서열 3, 또는 서열 3과 90, 95 또는 99% 서열 동일성을 갖는 서열을 포함하고, 한 실시양태에서 3' 비번역 서열은 서열 3, 또는 서열 3과 90, 95 또는 99% 서열 동일성을 갖는 1080 bp 서열로 이루어진다. 또 다른 실시양태에서 3' 비번역 서열은 서열 4, 또는 서열 4와 90, 95 또는 99% 서열 동일성을 갖는 서열을 포함하고, 한 실시양태에서 3' 비번역 서열은 서열 4, 또는 서열 4와 90, 95 또는 99% 서열 동일성을 갖는 376 bp 서열로 이루어진다.
한 실시양태에 따라서 유전자 카세트를 포함하는 핵산 벡터가 제공되는데, 여기서 이러한 유전자 카세트는 5' 비번역 서열의 5' 말단에 작동가능하게 연결된 프로모터 영역을 포함하는데, 상기 5' 비번역 서열의 3' 말단은 트랜스진의 5' 말단에 작동가능하게 연결되고 트랜스진의 3' 말단은 3' 비번역 영역과 연결된다. 한 실시양태에서 상기 프로모터 영역은 서열 1, 또는 서열 1과 90, 95 또는 99% 서열 동일성을 갖는 서열을 포함하거나 또는 이로 이루어진다. 한 실시양태에서 상기 프로모터 영역은 서열 1, 또는 서열 1과 90, 95 또는 99% 서열 동일성을 갖는 2061 bp 서열로 이루어진다. 한 실시양태에서 상기 프로모터 영역은 서열 2, 또는 서열 2와 90, 95 또는 99% 서열 동일성을 갖는 서열을 포함하거나 또는 이로 이루어진다. 한 실시양태에서 상기 프로모터 영역은 서열 2, 또는 서열 2와 90, 95 또는 99% 서열 동일성을 갖는 1498 bp 서열로 이루어진다. 한 실시양태에 따라서 상기 5' 비번역 서열은 서열 5, 또는 서열 5와 90% 서열 동일성을 갖는 서열을 포함하거나 또는 이로 이루어진다. 한 실시양태에서 상기 5' 비번역 서열은 서열 5, 또는 서열 5와 90% 서열 동일성을 갖는 84 bp 서열로 이루어진다. 한 실시양태에서 상기 3' 비번역 서열은 서열 3, 또는 서열 3과 90, 95 또는 99% 서열 동일성을 갖는 서열을 포함하거나 또는 이로 이루어진다. 한 실시양태에서 상기 3' 비번역 서열은 서열 3, 또는 서열 3과 90, 95 또는 99% 서열 동일성을 갖는 1080 bp 서열로 이루어진다. 한 실시양태에서 상기 3' 비번역 서열은 서열 4, 또는 서열 4와 90, 95 또는 99% 서열 동일성을 갖는 서열을 포함하거나 또는 이로 이루어진다. 한 실시양태에서 상기 3' 비번역 서열은 서열 4, 또는 서열 4와 90, 95 또는 99% 서열 동일성을 갖는 376 bp 서열로 이루어진다.
한 실시양태에 따라서 유전자 카세트를 포함하는 핵산 벡터가 제공되는데, 여기서 이러한 유전자 카세트는 트랜스진의 5' 말단에 작동가능하게 연결된 프로모터 영역을 포함하는데, 상기 트랜스진의 3' 말단은 3' 비번역 영역과 연결된다. 한 실시양태에서 상기 프로모터 영역은 서열 1, 또는 서열 1과 90, 95 또는 99% 서열 동일성을 갖는 서열을 포함한다. 한 실시양태에 따라서 상기 프로모터 영역은 서열 1, 또는 서열 1과 90, 95 또는 99% 서열 동일성을 갖는 2061 bp 서열로 이루어진다. 한 실시양태에 따라서 상기 프로모터 영역은 서열 1로 이루어진다. 한 실시양태에서 상기 프로모터 영역은 서열 2, 또는 서열 2와 90, 95 또는 99% 서열 동일성을 갖는 서열을 포함한다. 한 실시양태에 따라서 상기 프로모터 영역은 서열 2, 또는 서열 2와 90, 95 또는 99% 서열 동일성을 갖는 1498 bp 서열로 이루어진다. 한 실시양태에 따라서 상기 프로모터 영역은 서열 2로 이루어진다. 한 실시양태에서 상기 3' 비번역 서열은 서열 3, 또는 서열 3과 90, 95 또는 99% 서열 동일성을 갖는 1080 bp 서열로 이루어지고, 한 실시양태에서 상기 3' 비번역 서열은 서열 3으로 이루어진다. 한 실시양태에서 상기 3' 비번역 서열은 서열 4, 또는 서열 4와 90, 95 또는 99% 서열 동일성을 갖는 376 bp 서열로 이루어지고, 한 실시양태에서 상기 3' 비번역 서열은 서열 4로 이루어진다.
특정 실시양태에서, 본원에 개시된 바와 같은 유전자 발현 카세트를 포함하는 세포 또는 식물이 제공된다. 특정 실시양태에서, 세포 또는 식물은 본원에 개시된 바와 같은 유전자 발현 카세트를 포함하는 벡터를 포함한다. 특정 실시양태에서, 벡터는 플라스미드, 코스미드, 박테리아 인공 염색체 (BAC), 박테리오파지, 또는 바이러스일 수 있다. 이로써, 본원에 개시된 바와 같은 유전자 발현 카세트를 포함하는 세포 또는 식물은 각각 트랜스제닉 세포 또는 트랜스제닉 식물이다. 특정 실시양태에서, 트랜스제닉 식물은 외떡잎 식물일 수 있다. 특정 실시양태에서, 트랜스제닉 외떡잎 식물은 옥수수, 밀, 벼, 수수, 귀리, 호밀, 바나나, 사탕수수 및 기장일 수 있지만, 이에 제한되지 않는다. 특정 실시양태에서, 트랜스제닉 식물은 쌍떡잎 식물일 수 있다. 특정 실시양태에서, 트랜스제닉 쌍떡잎 식물은 대두, 목화, 해바라기 및 캐놀라일 수 있지만, 이에 제한되지 않는다. 특정 실시양태는 또한, 본원에 개시된 바와 같은 트랜스제닉 식물로부터의 트랜스제닉 종자를 포함한다.
특정 실시양태에서, 유전자 발현 카세트는 2개 이상의 트랜스진을 포함한다. 이러한 2개 이상의 트랜스진은 본원에 개시된 바와 같은, 동일한 프로모터, 5'-UTR, 또는 3'-UTR에 작동가능하게 연결될 수 없다. 특정 실시양태에서, 유전자 발현 카세트는 1개 이상의 트랜스진을 포함한다. 1개 이상의 트랜스진을 수반한 특정 실시양태에서, 적어도 하나의 트랜스진이 본 개시내용의 프로모터, 5'-UTR, 또는 3'-UTR에 작동가능하게 연결된다.
선별성 마커
리포터 유전자로서 또한 기재된 각종 선별성 마커가 선택된 발현 벡터 내로 혼입되어, 형질전환된 식물 ("형질전환체")의 확인 및 선별을 허용할 수 있다. 형질전환된 식물에서 선별성 마커의 발현을 확증하기 위한 많은 방법이 이용 가능한데, 이러한 방법은, 예를 들어 DNA 서열 분석 및 PCR (중합효소 연쇄 반응), 서던 블롯팅, RNA 블롯팅, 벡터로부터 발현된 단백질, 예를 들어 포스피노트리신 저항성을 매개하는 침전된 단백질의 탐지를 위한 면역학적 방법, 또는 기타 단백질, 예컨대 β-글루쿠로니다제 (GUS), 루시페라제, 그린 형광성 단백질 (GFP), 옐로우 형광성 단백질 (YFP), DsRed, β-갈락토시다제, 클로람페니콜 아세틸트랜스퍼라제 (CAT), 알칼리성 포스파타제 등을 코딩하는 리포터 유전자의 가시적 관찰을 포함한다 (문헌 [Sambrook, et al., Molecular Cloning: A Laboratory Manual, Third Edition, Cold Spring Harbor Press, N.Y., 2001] 참조; 그 전문이 본원에 참조로 포함된다).
선별성 마커 유전자는 형질전환된 세포 또는 조직의 선별을 위해 활용된다. 선별성 마커 유전자는 항생제 저항성을 코딩하는 유전자, 예컨대 네오마이신 포스포트랜스퍼라제 II (NEO) 및 히그로마이신 포스포트랜스퍼라제 (HPT)를 코딩하는 유전자 뿐만 아니라 제초제 화합물에 대한 저항성을 부여해 주는 유전자를 포함한다. 제초제 저항성 유전자는 일반적으로, 제초제에 대해 불감성인 변형된 표적 단백질을 코딩하거나 또는 제초제가 작용하기 전에 식물 내의 제초제를 분해시키거나 또는 해독시키는 효소를 코딩한다. 예를 들어, 글리포세이트에 대한 저항성은 돌연변이체 표적 효소, 5-엔올피루빌쉬키메이트-3-포스페이트 합성효소 (EPSPS)를 코딩하는 유전자를 사용함으로써 획득되었다. EPSPS에 대한 유전자 및 돌연변이체는 널리 공지되어 있고, 다음에 추가로 기재되어 있다. 글루포시네이트 암모늄, 브로목시닐, 및 2,4-디클로로페녹시아세테이트 (2,4-D)에 대한 저항성은 pat 또는 DSM -2를 코딩하는 박테리아 유전자, 니트릴라제, aad-1 또는 aad-12 유전자 (각각의 제초제를 해독한다)를 이용함으로써 획득되었다.
특정 실시양태에서, 제초제는 생장점 또는 분열 조직을 억제할 수 있는데, 이는 이미다졸리논 또는 술포닐우레아를 포함하고, 이들 제초제에 대한 아세토히드록시산 합성효소 (AHAS) 및 아세토락테이트 합성효소 (ALS)의 저항성/내성에 대한 유전자가 널리 공지되어 있다. 글리포세이트 저항성 유전자는 돌연변이체 5-엔올피루빌쉬키메이트-3-포스페이트 합성효소 (EPSP) 및 dgt-28 유전자 (재조합 핵산의 도입을 통하고/통하거나 천연 EPSP 유전자, aroA 유전자 및 글리포세이트 아세틸 트랜스퍼라제 (GAT) 유전자 각각의 각종 형태의 생체내 돌연변이유발의 도입을 통함)를 포함한다. 기타 포스포노 화합물에 대한 저항성 유전자는 스트렙토미세스 (Streptomyces) 종 [스트렙토미세스 히그로스코피쿠스 (Streptomyces hygroscopicus) 및 스트렙토미세스 비리디크로모게네스 (Streptomyces viridichromogenes) 포함]으로부터의 bar 유전자, 및 피리디녹시 또는 페녹시 프로프리온산 및 시클로헥손 (ACCase 억제제-코딩 유전자)을 포함한다. 시클로헥산디온 및/또는 아릴옥시페녹시프로파노산 [할록시포프(Haloxyfop), 디클로포프(Diclofop), 페녹시프롭(Fenoxyprop), 플루아지포프(Fluazifop), 퀴잘로포프(Quizalofop) 포함]에 대한 저항성을 부여해 주는 것으로 예시되는 유전자는 아세틸 조효소 A 카르복실라제 (ACCase)의 유전자--Acc1-S1, Acc1-S2 및 Acc1-S3을 포함한다. 특정 실시양태에서, 제초제는 광합성을 억제할 수 있는데, 이는 트리아진 (psbA 및 1s+ 유전자) 또는 벤조니트릴 (니트릴라제 유전자)을 포함한다.
특정 실시양태에서, 선별성 마커 유전자는 다음을 코딩하는 유전자를 포함하지만, 그에 제한되지 않는다: 네오마이신 포스포트랜스퍼라제 II; 시안아미드 수화효소; 아스파르테이트 키나제; 디히드로디피콜리네이트 합성효소; 트립토판 데카르복실라제; 디히드로디피콜리네이트 합성효소 및 탈감작된 아스파르테이트 키나제; bar 유전자; 트립토판 데카르복실라제; 네오마이신 포스포트랜스퍼라제 (NEO); 히그로마이신 포스포트랜스퍼라제 (HPT 또는 HYG); 디히드로폴레이트 환원효소 (DHFR); 포스피노트리신 아세틸트랜스퍼라제; 2,2-디클로로프로피온산 데할로게나제; 아세토히드록시산 합성효소; 5-에놀피루빌-시키메이트-포스페이트 합성효소 (aroA); 할로아릴니트릴라제; 아세틸-조효소 A 카르복실라제; 디히드롭테로에이트 합성효소 (sul I); 및 32 kD 광화학계 II 폴리펩티드 (psbA).
특정 실시양태는 또한, 다음에 대한 저항성을 코딩하는 유전자를 포함한다: 클로람페니콜; 메토트렉세이트; 히그로마이신; 스펙티노마이신; 브로목시닐; 글리포세이트; 및 포스피노트리신.
선별성 마커 유전자의 상기 목록은 제한적이지 않다. 어떠한 리포터 또는 선별성 마커 유전자도 본 발명에 포괄된다.
선별성 마커 유전자는 식물에서의 최적의 발현을 위해 합성된다. 예를 들어, 특정 실시양태에서, 유전자의 코딩 서열은 식물에서의 발현을 증강시키기 위해 코돈 최적화함으로써 변형되었다. 선별성 마커 유전자는 특별한 식물 종에서의 발현을 위해 최적화할 수 있거나 또는 또 다른 한편으론, 쌍떡잎 또는 외떡잎 식물에서의 최적의 발현을 위해 변형될 수 있다. 특별한 관심 식물 종에서 가장 많은 양으로 발현된 단백질에서 가장 높은 빈도의 코돈으로부터 식물 선호 코돈을 결정할 수 있다. 특정 실시양태에서, 보다 높은 형질전환 효율을 초래하는 보다 높은 수준으로 식물에서 발현될 선별성 마커 유전자를 설계한다. 유전자의 식물 최적화를 위한 방법은 널리 공지되어 있다. 합성 폴리뉴클레오티드 서열의 최적화 및 제조에 관한 안내는, 예를 들어 WO2013016546, WO2011146524, WO1997013402, 미국 특허 번호 6166302, 및 미국 특허 번호 5,380,831 (본원에 참조로 포함된다)에서 찾을 수 있다.
형질전환
식물의 적합한 형질전환 방법은 DNA를 세포 내로 도입할 수 있는 모든 방법, 예를 들어 전기천공 (예를 들어, 미국 특허 번호 5,384,253 참조); 미소발사체 충격 (예를 들어, 미국 특허 번호 5,015,580; 5,550,318; 5,538,880; 6,160,208; 6,399,861; 및 6,403,865 참조); 아그로박테리움-매개된 형질전환 (예를 들어, 미국 특허 번호 5,635,055; 5,824,877; 5,591,616; 5,981,840; 및 6,384,301 참조); 및 원형질체 형질전환 (예를 들어, 미국 특허 번호 5,508,184 참조)을 포함하지만, 이에 제한되지 않는다. 이들 방법을 이용하여 식물을 안정적으로 형질전환시키거나 또는 일시적으로 형질전환시킬 수 있다.
탄화규소 섬유를 이용한 교반과 같은 기술 (예를 들어, 미국 특허 번호 5,302,523 및 5,464,765 참조)을 이용하여 DNA 구조물을 식물 세포의 게놈 DNA 내로 직접적으로 도입할 수 있거나, 또는 바이오리스틱(biolistic) 방법, 예컨대 DNA 입자 충격 (예를 들어, 문헌 [Klein et al., (1987) Nature 327:70-73] 참조)을 이용하여 상기 DNA 구조물을 식물 조직 내로 직접적으로 도입할 수 있다. 또 다른 한편으론, 나노입자 형질전환 (예를 들어, 미국 특허 공개 번호 2009/0104700 참조; 그 전문이 본원에 참조로 포함된다)을 통하여 DNA 구조물을 식물 세포 내로 도입할 수 있다.
또한, 비-아그로박테리움 박테리아 또는 바이러스, 예컨대 리조비움 (Rhizobium) 종 NGR234, 시노리조비움 멜리로티 (Sinorhizobium meliloti), 메소리조비움 로티 (Mesorhizobium loti), 감자 바이러스 X, 콜리플라워 모자이크 바이러스 및 카사바 잎맥 모자이크 바이러스 및/또는 담배 모자이크 바이러스를 이용하여 유전자 전이를 달성할 수 있다 (예를 들어, 문헌 [Chung et al., (2006) Trends Plant Sci. 11(1):1-4] 참조).
형질전환 기술의 적용을 통하여, 사실상 모든 식물 종의 세포를 안정적으로 형질전환시킬 수 있고, 이들 세포를 널리 공지된 기술에 의해 트랜스제닉 식물로 성장시킬 수 있다. 예를 들어, 목화 형질전환의 맥락에서 특히 유용할 수 있는 기술은 미국 특허 번호 5,846,797; 5,159,135; 5,004,863; 및 6,624,344에 기재되어 있고; 특히 브라시카 (Brassica) 식물을 형질전환시키기 위한 기술은, 예를 들어 미국 특허 번호 5,750,871에 기재되어 있으며; 대두를 형질전환시키기 위한 기술은, 예를 들어 미국 특허 번호 6,384,301에 기재되어 있고; 옥수수를 형질전환시키기 위한 기술은, 예를 들어 미국 특허 번호 7,060,876 및 5,591,616, 및 국제 PCT 공개 번호 WO 95/06722에 기재되어 있다.
외인성 핵산을 수용자 세포에 전달한 후, 형질전환된 세포는 일반적으로, 추가의 배양과 식물 재생을 위해 확인된다. 형질전환체를 확인할 수 있는 능력을 개선시키기 위하여, 이러한 형질전환체를 발생시키기 위해 사용된 형질전환 벡터를 동반한 선별성 마커 유전자를 이용하는 것이 요망될 수 있다. 예시되는 실시양태에서, 형질전환된 세포 집단은 이러한 세포를 선별 제제(들)에 노출시킴으로써 검정할 수 있거나, 또는 상기 세포를 대상으로 하여, 목적하는 마커 유전자 형질에 관하여 스크리닝할 수 있다.
선별 제제에 대한 노출에 살아남은 세포, 또는 스크리닝 검정에서 양성으로 스코어링된 세포를, 식물의 재생을 뒷받침해주는 배지에서 배양할 수 있다. 특정 실시양태에서, 추가 물질, 예컨대 성장 조절인자를 포함시킴으로써, 적합한 모든 식물 조직 배양 배지를 변형시킬 수 있다. 식물 재생 노력을 시작하기에 충분한 조직이 입수 가능할 때까지, 또는 수동 선별 라운드를 반복한 후, 조직의 형태가 재생에 적합할 때까지 (예를 들어, 적어도 2주), 성장 조절인자를 수반한 기본 배지 상에 조직을 유지시킨 다음, 이를 어린 가지가 형성되기 쉬운 배지로 옮길 수 있다. 충분한 어린 가지 형성이 발생할 때까지 배양물을 주기적으로 옮긴다. 일단 어린 가지가 형성되면, 이를 뿌리가 형성되기 쉬운 배지로 옮긴다. 일단 충분한 뿌리가 형성되면, 추가의 생장과 성숙을 위해 식물을 토양에 옮길 수 있다.
식물을 재생하는 데 제공된 구조물을 포함하는 목적하는 핵산의 존재를 확증하기 위하여, 각종 검정을 수행할 수 있다. 이러한 검정은 다음을 포함할 수 있다: 분자 생물학적 검정, 예컨대 서던 및 노던 블롯팅 및 PCR; 생화학적 검정, 예컨대 예를 들어, 면역학적 수단 (ELISA, 웨스턴 블롯, 및/또는 LC-MS MS 분광광도 측정법)에 의해 또는 효소적 기능에 의해 단백질 생성물의 존재를 탐지하는 것; 식물 부분 검정, 예컨대 잎 또는 뿌리 검정; 및/또는 완전히 재생된 식물의 표현형의 분석.
트랜스제닉 현상(transgenic event)은, 예를 들어 관심 핵산 분자에 대해 특이적인 올리고뉴클레오티드 프라이머를 이용하여, 예를 들어 PCR 증폭시킴으로써 스크리닝할 수 있다. PCR 유전자형별 검사는 게놈 내로 통합된 관심 핵산 분자를 함유하는 것으로 예상되는 단리된 숙주 식물 캘러스 조직으로부터 유래된 게놈 DNA를 중합효소-연쇄 반응 (PCR) 증폭시킨 다음, PCR 증폭 생성물을 표준 클로닝 및 서열 분석하는 것을 포함하지만, 이에 제한되지 않는 것으로 이해된다. PCR 유전자형별 검사 방법은 널리 보고되었고 (예를 들어, 문헌 [Rios et al. (2002) Plant J. 32:243-53] 참조), 세포 배양물을 포함한 모든 식물 종 또는 조직 유형으로부터 유래된 게놈 DNA에 적용할 수 있다. 표적 서열과 도입된 서열 둘 다와 결합되는 올리고뉴클레오티드 프라이머의 조합물을 PCR 증폭 반응에 순차적으로 사용할 수 있거나 또는 이러한 반응에서 다중화시킬 수 있다. 표적 부위, 도입된 핵산 서열 및/또는 이 둘의 조합물과 어닐링되도록 설계된 올리고뉴클레오티드 프라이머가 생성될 수 있다. 따라서, PCR 유전자형별 검사 전략은, 예를 들어 식물 게놈 내에서 특이적 서열의 증폭; 식물 게놈 내에서 다중 특이적 서열의 증폭; 식물 게놈 내에서 비-특이적 서열의 증폭; 및 이들 어느 것의 조합을 포함할 수 있지만, 이에 제한되지 않는다. 통상의 기술자는 게놈의 정보를 얻기 위해 프라이머의 부가의 조합물 및 증폭 반응을 고안할 수 있다. 예를 들어, 도입된 핵산 서열의 경계 외부에 있는 표적에 대해 특이적인 핵산 서열(들)과 어닐링하도록 정배향 올리고뉴클레오티드 프라이머와 역배향 올리고뉴클레오티드 프라이머 세트를 설계할 수 있다.
정배향 및 역배향 올리고뉴클레오티드 프라이머는, 예를 들어 핵산 분자 내에 포함된 관심 뉴클레오티드 서열 내의 코딩 영역에 상응하는 서열에서 도입된 핵산 분자, 또는 핵산 분자의 다른 부분과 특이적으로 어닐링하도록 설계될 수 있다. 프라이머는 본원에 기재된 프라이머와 연계해서 사용될 수 있다. 올리고뉴클레오티드 프라이머는 목적하는 서열에 따라서 합성될 수 있고, 시판중이다 [예를 들어, 인티그레이티드 DNA 태크놀로지, 인크. (Integrated DNA Technologies, Inc.; 미국 아이오와주 코럴빌)로부터 시판되고 있음]. 증폭에 이어, 증폭 생성물을 클로닝 및 서열 분석하거나 또는 직접적으로 서열 분석할 수 있다. 특정 실시양태에서, 유전자 표적에 대해 특이적인 올리고뉴클레오티드 프라이머가 PCR 증폭에 이용된다.
트랜스진의 발현 방법
특정 실시양태에서, 식물에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 프로모터를 포함하는 식물을 재배하는 것을 포함한다. 특정 실시양태에서, 식물에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는 식물을 재배하는 것을 포함한다. 특정 실시양태에서, 식물에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 5'-UTR을 포함하는 식물을 재배하는 것을 포함한다. 특정 실시양태에서, 식물에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된, 제아 메이스 메탈로티오네인-유사 프로모터, 및/또는 제아 메이스 메탈로티오네인-유사 3'-UTR, 및/또는 제아 메이스 메탈로티오네인-유사 5'-UTR을 포함하는 식물을 재배하는 것을 포함한다.
특정 실시양태에서, 식물 조직 또는 식물 세포에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 프로모터를 포함하는 식물 조직 또는 식물 세포를 배양하는 것을 포함한다. 특정 실시양태에서, 식물 조직 또는 식물 세포에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는 식물 조직 또는 식물 세포를 배양하는 것을 포함한다. 특정 실시양태에서, 식물 조직 또는 식물 세포에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 5'-UTR을 포함하는 식물 조직 또는 식물 세포를 배양하는 것을 포함한다. 특정 실시양태에서, 식물 조직 또는 식물 세포에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된, 제아 메이스 메탈로티오네인-유사 프로모터, 및 제아 메이스 메탈로티오네인-유사 3'-UTR, 및 제아 메이스 메탈로티오네인-유사 5'-UTR을 포함하는 식물 조직 또는 식물 세포를 배양하는 것을 포함한다.
특정 실시양태에서, 식물에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 프로모터를 포함하는 유전자 발현 카세트를 포함하는 식물을 재배하는 것을 포함한다. 한 실시양태에서 상기 프로모터는 서열 1 및 서열 2, 또는 서열 1 및 서열 2로부터 선택된 서열과 90, 95 또는 99% 서열 동일성을 갖는 서열로부터 선택된 서열로 이루어진다. 특정 실시양태에서, 식물에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 5'-UTR을 포함하는 유전자 발현 카세트를 포함하는 식물을 재배하는 것을 포함한다. 특정 실시양태에서, 식물에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는 유전자 발현 카세트를 포함하는 식물을 재배하는 것을 포함한다. 특정 실시양태에서, 식물에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된, 제아 메이스 메탈로티오네인-유사 프로모터, 및 제아 메이스 메탈로티오네인-유사 3'-UTR, 및 제아 메이스 메탈로티오네인-유사 5'-UTR을 포함하는 유전자 발현 카세트를 포함하는 식물을 재배하는 것을 포함한다. 특정 실시양태에서, 식물에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된 3'-UTR을 포함하는 유전자 발현 카세트를 포함하는 식물을 재배하는 것을 포함한다.
특정 실시양태에서, 식물 조직 또는 식물 세포에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 프로모터를 포함하는 유전자 발현 카세트를 포함하는 식물 조직 또는 식물 세포를 배양하는 것을 포함한다. 특정 실시양태에서, 식물 조직 또는 식물 세포에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는 유전자 발현 카세트를 포함하는 식물 조직 또는 식물 세포를 배양하는 것을 포함한다. 특정 실시양태에서, 식물 조직 또는 식물 세포에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된, 제아 메이스 메탈로티오네인-유사 프로모터 및 제아 메이스 메탈로티오네인-유사 3'-UTR, 및 제아 메이스 메탈로티오네인-유사 5'-UTR을 포함하는 유전자 발현 카세트를 포함하는 식물 조직 또는 식물 세포를 배양하는 것을 포함한다. 특정 실시양태에서, 식물 조직 또는 식물 세포에서 하나 이상의 트랜스진을 발현하는 방법은 하나 이상의 트랜스진에 작동가능하게 연결된 3'-UTR을 포함하는 유전자 발현 카세트를 포함하는 식물 조직 또는 식물 세포를 배양하는 것을 포함한다.
특정 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 제아 메이스 메탈로티오네인-유사 옥수수 유전자 프로모터를 포함한다. 특정 실시양태에서, 제아 메이스 메탈로티오네인-유사 프로모터는 서열 1 또는 서열 2일 수 있다. 특정 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 프로모터를 포함하는 유전자 발현 카세트를 포함하는데, 여기서 이러한 프로모터는 서열 1 또는 서열 2와 적어도 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5%, 99.8%, 또는 100% 동일하다. 특정 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 트랜스진에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 프로모터를 포함하는 유전자 발현 카세트를 포함한다. 예시되는 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 트랜스진에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 프로모터를 포함하는 유전자 발현 카세트를 포함하는데, 여기서 상기 트랜스진은 살곤충제 저항성 트랜스진, 제초제 내성 트랜스진, 질소 사용 효율 트랜스진, 용수 효율 트랜스진, 영양 품질 트랜스진, DNA 결합성 트랜스진, 선별성 마커 트랜스진, 또는 그의 조합일 수 있다.
특정 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 제아 메이스 메탈로티오네인-유사 5'-UTR을 포함한다. 특정 실시양태에서, 제아 메이스 메탈로티오네인-유사 5'-UTR은 서열 5의 폴리뉴클레오티드일 수 있다. 특정 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 5'-UTR을 포함하는 유전자 발현 카세트를 포함하는데, 여기서 상기 5'-UTR은 서열 5와 적어도 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5%, 99.8%, 또는 100% 동일하다. 특정 실시양태에서, 유전자 발현 카세트는 프로모터에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 5'-UTR을 포함하는데, 여기서 상기 프로모터는 제아 메이스 메탈로티오네인-유사 프로모터이거나, 또는 식물로부터 유래되는 프로모터 (예를 들어, 제아 메이스 유비퀴틴 1 프로모터), 바이러스로부터 유래되는 프로모터 (예를 들어, 카사바 잎맥 모자이크 바이러스 프로모터) 또는 박테리아로부터 유래되는 프로모터 (예를 들어, 아그로박테리움 투메파시엔스 델타 마스)이다. 특정 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 트랜스진에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 5'-UTR을 포함하는 유전자 발현 카세트를 포함한다. 예시되는 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 트랜스진에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 5'-UTR을 포함하는 유전자 발현 카세트를 포함하는데, 여기서 상기 트랜스진은 살곤충제 저항성 트랜스진, 제초제 내성 트랜스진, 질소 사용 효율 트랜스진, 용수 효율 트랜스진, 영양 품질 트랜스진, DNA 결합성 트랜스진, 선별성 마커 트랜스진, 또는 그의 조합일 수 있다.
트랜스제닉 식물
특정 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 3'-UTR을 포함하는 유전자 발현 카세트를 포함한다. 특정 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는 유전자 발현 카세트를 포함한다. 특정 실시양태에서, 이러한 제아 메이스 메탈로티오네인-유사 3'-UTR은 서열 3 또는 서열 4의 폴리뉴클레오티드이다. 특정 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 3'-UTR을 포함하는 유전자 발현 카세트를 포함하는데, 여기서 상기 3'-UTR은 서열 3 또는 서열 4와 적어도 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5%, 99.8%, 또는 100% 동일하다.
특정 실시양태에서, 유전자 발현 카세트는 프로모터에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는데, 여기서 상기 프로모터는 제아 메이스 메탈로티오네인-유사 프로모터이거나, 또는 식물로부터 유래되는 프로모터 (예를 들어, 제아 메이스 유비퀴틴 1 프로모터), 바이러스로부터 유래되는 프로모터 (예를 들어, 카사바 잎맥 모자이크 바이러스 프로모터) 또는 박테리아로부터 유래되는 프로모터 (예를 들어, 아그로박테리움 투메파시엔스 델타 마스)이다. 특정 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 트랜스진에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는 유전자 발현 카세트를 포함한다. 예시되는 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 트랜스진에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는 유전자 발현 카세트를 포함하는데, 여기서 상기 트랜스진은 살곤충제 저항성 트랜스진, 제초제 내성 트랜스진, 질소 사용 효율 트랜스진, 용수 효율 트랜스진, 영양 품질 트랜스진, DNA 결합성 트랜스진, 선별성 마커 트랜스진, 또는 그의 조합일 수 있다.
특정 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 트랜스진에 작동가능하게 연결되는, 제아 메이스 메탈로티오네인-유사 프로모터, 제아 메이스 메탈로티오네인-유사 5'-UTR, 및 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는 유전자 발현 카세트를 포함한다. 상기 프로모터, 5'-UTR, 및 3'-UTR은, 유전자 발현 카세트가 2개 이상의 트랜스진을 포함하는 경우에 유전자 발현 카세트 내의 상이한 트랜스진에 작동가능하게 연결될 수 있다. 예시되는 실시양태에서, 유전자 발현 카세트는 트랜스진에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 프로모터를 포함하는데, 여기서 상기 트랜스진은 살곤충제 저항성 트랜스진, 제초제 내성 트랜스진, 질소 사용 효율 트랜스진, 용수 효율 트랜스진, 영양 품질 트랜스진, DNA 결합성 트랜스진, 선별성 마커 트랜스진, 또는 그의 조합일 수 있다. 예시되는 실시양태에서, 유전자 발현 카세트는 트랜스진에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 5'-UTR을 포함하는데, 여기서 상기 트랜스진은 살곤충제 저항성 트랜스진, 제초제 내성 트랜스진, 질소 사용 효율 트랜스진, 용수 효율 트랜스진, 영양 품질 트랜스진, DNA 결합성 트랜스진, 선별성 마커 트랜스진, 또는 그의 조합일 수 있다. 특정 실시양태에서, 유전자 발현 카세트는 프로모터에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 5'-UTR을 포함하는데, 여기서 상기 프로모터는 제아 메이스 메탈로티오네인-유사 프로모터이거나, 또는 식물로부터 유래되는 프로모터 (예를 들어, 제아 메이스 유비퀴틴 1 프로모터), 바이러스로부터 유래되는 프로모터 (예를 들어, 카사바 잎맥 모자이크 바이러스 프로모터) 또는 박테리아로부터 유래되는 프로모터 (예를 들어, 아그로박테리움 투메파시엔스 델타 마스)이다. 예시되는 실시양태에서, 유전자 발현 카세트는 트랜스진에 작동가능하게 연결되는 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는데, 여기서 상기 트랜스진은 살곤충제 저항성 트랜스진, 제초제 내성 트랜스진, 질소 사용 효율 트랜스진, 용수 효율 트랜스진, 영양 품질 트랜스진, DNA 결합성 트랜스진, 선별성 마커 트랜스진, 또는 그의 조합일 수 있다.
특정 실시양태에서, 본원에 기재된 방법을 이용한 트랜스진 발현은 식물의 뿌리에 대해 특이적이다. 특정 실시양태에서, 트랜스진 발현은 뿌리에서 발현된 2개 이상의 트랜스진을 포함한다. 특정 실시양태에서, 본원에 기재된 바와 같은 트랜스제닉 식물을 재배하는 방법은 뿌리-특이적 트랜스진 발현을 포함한다. 특정 실시양태에서, 식물 조직 또는 식물 세포에서 트랜스진을 발현하는 방법은 뿌리-특이적 조직 및 뿌리-특이적 세포를 포함한다. 특정 실시양태에서, 뿌리-특이적 발현은 옥수수 뿌리-특이적 발현을 포함한다.
특정 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 본원에 개시된 바와 같은 제아 메이스 메탈로티오네인-유사 프로모터, 제아 메이스 메탈로티오네인-유사 5'-UTR, 및/또는 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는 벡터를 포함한다. 특정 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 트랜스진에 작동가능하게 연결된, 본원에 개시된 바와 같은 제아 메이스 메탈로티오네인-유사 프로모터, 제아 메이스 메탈로티오네인-유사 5'-UTR, 및/또는 제아 메이스 메탈로티오네인-유사 3'-UTR을 포함하는 벡터를 포함한다. 특정 실시양태에서, 식물, 식물 조직, 또는 식물 세포는 본원에 개시된 바와 같은 유전자 발현 카세트를 포함하는 벡터를 포함한다. 특정 실시양태에서, 벡터는 플라스미드, 코스미드, 박테리아 인공 염색체 (BAC), 박테리오파지, 또는 바이러스일 수 있다.
한 실시양태에 따라서 식물, 식물 조직, 또는 식물 세포가 제공되는데, 여기서 이러한 식물, 식물 조직, 또는 식물 세포는 트랜스진에 작동가능하게 연결된 비-내인성 프로모터 서열을 포함하는데, 여기서 이러한 프로모터 서열은 서열 1 또는 서열 2, 또는 서열 1 또는 서열 2와 90. 95, 98 또는 99% 서열 동일성을 갖는 서열을 포함한다. 한 실시양태에서 식물, 식물 조직, 또는 식물 세포가 제공되는데, 여기서 이러한 식물, 식물 조직, 또는 식물 세포는 트랜스진에 작동가능하게 연결된, 서열 1, 또는 서열 1과 90% 서열 동일성을 갖는 서열을 포함한다. 한 실시양태에서 식물, 식물 조직, 또는 식물 세포가 제공되는데, 여기서 이러한 식물, 식물 조직, 또는 식물 세포는 트랜스진에 작동가능하게 연결된, 서열 2, 또는 서열 2와 90% 서열 동일성을 갖는 서열을 포함한다. 한 실시양태에서 상기 식물, 식물 조직, 또는 식물 세포는 쌍떡잎 또는 외떡잎 식물이거나, 또는 쌍떡잎 또는 외떡잎 식물로부터 유래된 세포 또는 조직이다. 한 실시양태에서 상기 식물은 옥수수, 밀, 벼, 수수, 귀리, 호밀, 바나나, 사탕수수, 대두, 목화, 해바라기 및 캐놀라로 이루어진 군으로부터 선택된다. 한 실시양태에서 상기 식물은 제아 메이스이다. 한 실시양태에 따라서 상기 식물, 식물 조직, 또는 식물 세포는 트랜스진에 작동가능하게 연결된, 서열 1 또는 서열 2, 또는 서열 1 또는 서열 2와 90, 95, 98 또는 99% 서열 동일성을 갖는 서열을 포함한다. 한 실시양태에서 상기 식물, 식물 조직, 또는 식물 세포는 트랜스진에 작동가능하게 연결된 프로모터를 포함하는데, 여기서 이러한 프로모터는 서열 1 또는 서열 2, 또는 서열 1 또는 서열 2와 90, 95, 98 또는 99% 서열 동일성을 갖는 서열로 이루어진다. 한 실시양태에 따라서 트랜스진에 작동가능하게 연결된 비-내인성 프로모터 서열을 포함하는 유전자 구조물이 상기 식물, 식물 조직, 또는 식물 세포의 게놈 내로 혼입된다.
한 실시양태에서 트랜스진에 작동가능하게 연결된, 서열 1 또는 서열 2, 또는 서열 1 또는 서열 2와 90, 95, 98 또는 99% 서열 동일성을 갖는 서열을 포함하는 비-제아 식물 (즉, 제아 과의 구성원이 아니다), 식물 조직, 또는 식물 세포가 제공된다. 한 실시양태에 따라서 상기 비-제아 식물, 식물 조직, 또는 식물 세포는 쌍떡잎 또는 외떡잎 식물이거나, 또는 쌍떡잎 또는 외떡잎 식물로부터 유래된 식물 세포 또는 조직이다. 한 실시양태에서 상기 식물은 밀, 벼, 수수, 귀리, 호밀, 바나나, 사탕수수, 대두, 목화, 해바라기 및 캐놀라로 이루어진 군으로부터 선택된다. 한 실시양태에 따라서 트랜스진에 작동가능하게 연결된 프로모터 서열이 상기 식물, 식물 조직, 또는 식물 세포의 게놈 내로 혼입된다. 한 실시양태에서 상기 식물, 식물 조직, 또는 식물 세포는 서열 5, 또는 서열 5와 90% 서열 동일성을 갖는 서열을 포함하는 5' 비번역 서열을 추가로 포함하는데, 여기서 이러한 5' 비번역 서열은 상기 프로모터와 상기 트랜스진 사이에 삽입되고, 그에 작동가능하게 연결된다.
한 실시양태에서 트랜스진의 5' 말단에 작동가능하게 연결된, 서열 1 또는 서열 2, 또는 서열 1 또는 서열 2와 90, 95, 98 또는 99% 서열 동일성을 갖는 서열; 및 서열 3 또는 서열 4, 또는 서열 3 또는 서열 4와 90% 서열 동일성을 갖는 서열을 포함하는 3' 비번역 서열을 포함하는 비-제아 식물, 식물 조직, 또는 식물 세포가 제공되는데, 여기서 상기 3' 비번역 서열은 상기 트랜스진에 작동가능하게 연결된다. 한 실시양태에 따라서 상기 비-제아 식물, 식물 조직, 또는 식물 세포는 쌍떡잎 또는 외떡잎 식물이거나, 또는 쌍떡잎 또는 외떡잎 식물로부터 유래된 식물 조직 또는 세포이다. 한 실시양태에서 상기 식물은 밀, 벼, 수수, 귀리, 호밀, 바나나, 사탕수수, 대두, 목화, 해바라기 및 캐놀라로 이루어진 군으로부터 선택된다. 한 실시양태에 따라서 트랜스진에 작동가능하게 연결된 프로모터 서열이 상기 식물, 식물 조직, 또는 식물 세포의 게놈 내로 혼입된다. 한 실시양태에서 상기 식물, 식물 조직, 또는 식물 세포는 서열 5, 또는 서열 5와 90% 서열 동일성을 갖는 서열을 포함하는 5' 비번역 서열을 추가로 포함하는데, 여기서 이러한 5' 비번역 서열은 상기 프로모터와 상기 트랜스진 사이에 삽입되고, 그에 작동가능하게 연결된다. 한 실시양태에서 상기 5' 비번역 서열은 서열 5로 이루어진다.
한 실시양태에서 트랜스진에 작동가능하게 연결된, 서열 39, 또는 서열 1 또는 서열 2와 90% 서열 동일성을 갖는 서열을 포함하는 비-제아 식물, 식물 조직, 또는 식물 세포가 제공된다. 한 실시양태에서 트랜스진에 작동가능하게 연결된 프로모터를 포함하는 비-제아 식물, 식물 조직, 또는 식물 세포가 제공되는데, 여기서 상기 프로모터는 서열 1 또는 서열 2, 또는 서열 1 또는 서열 2와 90% 서열 동일성을 갖는 서열로 이루어진다. 한 실시양태에서 상기 3' 비번역 서열은 서열 3 또는 서열 4, 또는 서열 3 또는 서열 4와 90% 서열 동일성을 갖는 서열을 포함하거나 또는 이로 이루어지는데, 여기서 상기 3' 비번역 서열은 트랜스진의 3' 말단에 작동가능하게 연결된다.
특정 실시양태에서, 본원에 개시된 방법에 따르는 식물, 식물 조직, 또는 식물 세포는 외떡잎 식물일 수 있다. 이러한 외떡잎 식물, 식물 조직, 또는 식물 세포는 옥수수, 벼, 밀, 사탕수수, 보리, 호밀, 수수, 난과 식물, 대나무, 바나나, 부들(cattail), 백합, 귀리, 양파, 기장 및 라이밀(triticale)일 수 있지만, 이에 제한되지 않는다.
특정 실시양태에서, 본원에 개시된 방법에 따르는 식물, 식물 조직, 또는 식물 세포는 쌍떡잎 식물일 수 있다. 이러한 쌍떡잎 식물, 식물 조직, 또는 식물 세포는 평지씨, 캐놀라, 갓, 에티오피아 겨자, 대두, 해바라기 및 목화일 수 있지만, 이에 제한되지 않는다.
유전적으로 변형된 식물의 생산과 관련하여, 식물을 유전적으로 조작하는 방법이 관련 기술분야에 널리 공지되어 있다. 예를 들어, 수많은 식물 형질전환 방법이 개발되었는데, 이는 쌍떡잎 식물 뿐만 아니라 외떡잎 식물에 대한 생물학적 및 물리적 형질전환 프로토콜을 포함한다 (예를 들어, 문헌 [Goto-Fumiyuki et al., Nature Biotech 17:282-286 (1999)]; [Miki et al., Methods in Plant Molecular Biology and Biotechnology, Glick, B. R. and Thompson, J. E. Eds., CRC Press, Inc., Boca Raton, pp. 67-88 (1993)]). 또한, 식물 세포 또는 조직 형질전환 및 식물의 재생을 위한 벡터 및 시험관내 배양 방법은, 예를 들어 문헌 ([Gruber et al., Methods in Plant Molecular Biology and Biotechnology, Glick, B. R. and Thompson, J. E. Eds., CRC Press, Inc., Boca Raton, pp. 89-119 (1993)])에서 이용 가능하다.
관련 기술분야의 통상의 기술자는 외인성 서열을 트랜스제닉 식물에 안정적으로 혼입하고 작동 가능한지를 확증한 후, 이를 유성 교배에 의해 다른 식물 내로 도입할 수 있다는 것을 인식할 것이다. 교배하고자 하는 종에 따라서, 수많은 어떠한 표준 육종 기술도 사용할 수 있다.
형질전환된 식물 세포, 캘러스, 조직 또는 식물은, 형질전환되는 DNA 상에 존재하는 마커 유전자에 의해 코딩된 형질에 관하여 알아보기 위하여 조작된 식물 재료를 선별 및 스크리닝함으로써 확인 및 단리될 수 있다. 예를 들어, 형질전환되는 유전자 구조물이 저항성을 부여하는 항생제 또는 제초제의 억제량을 함유하는 배지 상에서 상기 조작된 식물 재료를 재배함으로써 선별을 수행할 수 있다. 추가로, 형질전환된 세포는 또한, 재조합 핵산 구조물 상에 존재할 수 있는 모든 가시적 마커 유전자 (예를 들어, yfp, gfp, β-글루쿠로니다제, 루시페라제, B 또는 C1 유전자)의 활성에 관하여 스크리닝함으로써 확인될 수 있다. 이러한 선별 및 스크리닝 방법론은 관련 기술분야의 통상의 기술자에게 널리 공지되어 있다.
물리적 및 생화학적 방법을 또한 사용하여, 삽입된 유전자 구조물을 함유하는 식물 또는 식물 세포 형질전환체를 확인할 수 있다. 이들 방법은 다음을 포함하지만, 그에 제한되지 않는다: 1) 재조합 DNA 삽입물의 구조를 탐지 및 결정하기 위한 서던 분석 또는 PCR 증폭; 2) 유전자 구조물의 RNA 전사물을 탐지 및 조사하기 위한 노던 블롯, S1 RNase 보호, 프라이머-연장 또는 역전사효소-PCR 증폭; 3) 효소 또는 리보자임 활성을 탐지하기 위한 효소적 검정 (여기서, 상기 유전자 산물은 유전자 구조물에 의해 코딩된다); 4) 차세대 서열 분석 (NGS) 분석; 5) 단백질 겔 전기영동, 웨스턴 블롯 기술, 면역침전, 또는 효소 결합 면역흡착 검정 (ELISA) (여기서, 유전자 구조물 생성물은 단백질이다). 부가의 기술, 예컨대 계내 혼성화, 효소 염색, 및 면역염색을 또한 사용하여, 특이적 식물 기관 및 조직에서의 재조합 구조물의 존재 또는 발현을 탐지할 수 있다. 이들 모든 검정을 수행하는 방법은 관련 기술분야의 통상의 기술자에게 널리 공지되어 있다.
본원에 개시된 방법을 이용한 유전자 조작의 효과는, 예를 들어 관심 조직으로부터 단리된 RNA (예를 들어, mRNA)의 노던 블롯에 의해 관찰될 수 있다. 전형적으로, 이러한 mRNA가 존재하거나 또는 mRNA의 양이 증가된 경우에는, 상응하는 트랜스진이 발현되는 것으로 추정할 수 있다. 유전자 및/또는 코딩된 폴리펩티드 활성을 측정하는 다른 방법을 이용할 수 있다. 사용된 기질, 및 반응 생성물 또는 부산물의 증가 또는 감소를 탐지하는 방법에 따라서, 상이한 유형의 효소적 검정을 이용할 수 있다. 또한, 발현된 폴리펩티드의 수준은 면역화학적으로, 즉 ELISA, RIA, EIA, 및 관련 기술분야의 통상의 기술자에게 널리 공지된 기타 항체 기반 검정, 예컨대 전기영동적 탐지 검정 (염색 또는 웨스턴 블롯팅을 동반함)에 의해 측정할 수 있다. 한 가지 비-제한적 예로서, ELISA 검정을 이용하여 AAD-1 (아릴옥시알카노에이트 디옥시게나제; WO 2005/107437 참조) 및 PAT (포스피노트리신-N-아세틸-트랜스퍼라제) 단백질을 탐지하는 것이 미국 특허 공개 번호 2009/0093366 (그 전문이 본원에 참조로 포함된다)에 기재되어 있다. 트랜스진은 식물의 일부 세포 유형 또는 조직에서 또는 일부 발육 단계에서 선택적으로 발현될 수 있거나, 또는 트랜스진은 실질적으로 그의 전체 생명 주기를 따라 실질적으로 모든 식물 조직에서 발현될 수 있다. 그러나, 어떠한 조합 발현 방식도 또한 적용 가능하다.
본 개시내용은 또한, 상기 언급된 트랜스제닉 식물의 종자를 포괄하는데, 여기서 이러한 종자는 트랜스진 또는 유전자 발현 카세트를 포함한다. 본 개시내용은 추가로, 상기 언급된 트랜스제닉 식물의 자손, 클론, 세포주 또는 세포를 포괄하는데, 여기서 상기 자손, 클론, 세포주 또는 세포는 트랜스진 또는 유전자 구조물을 포함한다.
본 발명이 특이적 방법 및 실시양태를 참조로 하여 기재되긴 하였지만, 각종 변형 및 변화가 본 발명으로부터 벗어나지 않고서도 만들어질 수 있는 것을 알 수 있을 것이다.
실시예
실시예 1: 고 발현성 조절 요소의 확인
다음 2가지 접근 방식을 통하여 신규 제아 메이스 메탈로티오네인-유사 조절 요소를 확인하였다: 1) 공개 유전자 발현 데이터를 프로파일링하는 생물 정보학 접근 방식, 2) 차세대 서열 분석 (NGS)을 이용하는 전사 프로파일링 접근 방식. 이어서, 이들 조절 요소를 확인하고, 단리하며 클로닝하여, 트랜스제닉 식물에 사용하기 위한 조절 요소의 발현 프로파일을 명확히 규명하였다. 바실루스 투린기엔시스 (Bacillus thuringiensis)로부터 단리된 cry34Ab1 유전자 및 aad-1 선별성 마커 유전자로 안정적으로 형질전환시킨 트랜스제닉 옥수수 계통을 생산하였고, 트랜스진 발현 수준과 조직 특이성을 평가하였다. 그것으로서, 신규 제아 메이스 메탈로티오네인-유사 조절 요소를 확인하고 명확히 규명하였다. 유전자 발현 구조물에 사용하기 위한 프로모터, 5'-UTR 및 3'-UTR 조절 요소가 처음으로 개시된다.
생물 정보학 접근 방식
3가지 데이터 공급원을 활용하여, 옥수수 묘목의 뿌리 및 어린 가지 조직에서의 고 발현성 옥수수 유전자를 확인하였다: 1) 2010년의 옥수수 데이터베이스에 존재하는 35,000개 옥수수 유전자 서열 및 그들의 주석 (www.maizegdb.org에서 입수 가능함); 2) V4 어린 가지 및 뿌리에 대한 전체 옥수수 전사체에 대한 유전자 발현 데이터 (문헌 [Wang, et al., (2009): Genome-Wide and Organ-Specific Landscapes of Epigenetic Modifications and Their Relationships to mRNA and Small RNA Transcriptomes in Maize. Plant Cell 21:1053-1069]); 및 3) 9,000개 유전자의 완전한 길이의 cDNA 서열 (문헌 [Alexandrov N., et al., (2009): Insights into corn genes derived from large-scale cDNA sequencing. Plant Molecular Biology 69:179-194]). 상기 유전자 발현 데이터를 상기 9,000개의 완전한 길이의 cDNA 서열 및 35,000개 옥수수 유전자에 대하여 정렬시켰다. 매핑된 1백만개 단편당 엑손 킬로 염기당 단편 (FPKM) 값 (유전자 발현의 정량적 측정 기준)에 근거하여, 각각의 옥수수 뿌리 및 어린 가지 유전자 발현 데이터 세트로부터 100개의 고 발현성 유전자를 확인하였다 (도 1). 그 다음, 이들 서열을, 500개 발현성 유전자와 정렬시킨 35,000개 옥수수 유전자, 또는 옥수수 게놈의 가장 높은 발현성 유전자의 약 1.4%와 매핑하였다. 이러한 데이터 세트로부터, 잎 및 뿌리 조직 발현을 알아보기 위하여 100개 발현성 유전자를 확인하였다. 유전자의 수를 추가로 감소시키기 위하여, 각각 유전자-특이적 프라이머를 이용하여 3가지 잎 및 뿌리 발육 단계로부터 단리된 cDNA 샘플 상에서 정량적 PCR을 수행하였다.
전사 프로파일링 접근 방식
유전자 발현 카세트에 사용하기 위한 목적하는 발현 프로파일을 수반한 천연 옥수수 유전자의 조절 요소를 확인 및 선별하기 위해 전사 프로파일링하기 위한 식물 생장 및 발육의 상이한 단계로 재배된 식물로부터 옥수수 조직을 수득하였다. 예를 들어, 잎 [V4 (사본), V12 및 R3] 및 뿌리 (V4 및 V12 마디 및 섬유성 조직) 발육, 화분, 생사, 속대, 미숙한 알맹이 (수분 후 20일), 겉껍질 및 줄기 (V4 및 R1)의 3가지 단계로부터의 조직 샘플을 수집하였다. 상기 언급된 조직 모두로부터 전체 mRNA를 단리하였고, 목적하는 양의 고 품질 mRNA를 수득하였다.
이어서, 각 mRNA 샘플로부터 cDNA 라이브러리를 제조하였고, 일루미나(Illumina) HiSeq® 2000 [일루미나 인크. (Illumina Inc.; 미국 캘리포니아주 샌디에이고)]을 이용하여 고 처리량 서열 분석을 완료하였다. 또한, RNAseq 샘플 제조를 위한 제조업자의 권장된 프로토콜에 따라서 상기 일루미나 TruSeq® RNA 샘플 제조 키트를 사용하였다. 간략하게 언급하면, 폴리-T 올리고-부착된 자기 비드를 이용하여 5 ㎍의 전체 RNA를 정제한 다음, 고온 하에 2가 양이온을 이용하여 보다 작은 조각 (약 200 bp 평균 길이)으로 단편화하였다. 이어서, 슈퍼스크립트(SuperScript®) II 역전사효소 및 무작위 프라이머를 이용하여, 상기 단편화된 mRNA를 제1 가닥 cDNA로 카피하였다. DNA 중합효소 I 및 RNase H를 이용하여 상기 cDNA를 이중 가닥 cDNA (ds cDNA)로 추가로 전환시켰다. 이어서, 이러한 이중 가닥 cDNA 단편은 말단 수복, A-테일링에 이어 색인된 일루미나 쌍형성-말단 (PE) 적응인자와의 라이게이션을 거쳤다. 최종적으로, 라이브러리 생성물을 정화하고, PCR 15주기로 강화한 다음 정제하였다. 이와 같이 강화된 라이브러리를 2 nM의 농도로 표준화시키고, 수산화나트륨으로 변성시킨 다음, HiSeq® 유동 세포의 단일 레인 상으로 부하하기 위하여 혼성화 완충제 중에서 12 pM으로 희석시켰다. 일루미나 제조업자 권장된 서열 분석 프로토콜에 따라서, 클러스터 생성, 프라이머 혼성화 및 서열 분석 반응을 수행하였다.
이어서, 서열 분석 판독치를 필터링하여 저 품질의 판독치를 제거하였다. 상기 서열 분석 판독치의 약 99.9%가 필터링 후에 보유되었다. 상기 서열 분석 판독치를 옥수수 GDB에서 입수 가능한, 주석이 달린 제아 메이스 c.v. B73 게놈과 정렬하였다. 2개 이상의 유전자 자리에서 옥수수 게놈 상으로 매핑된 서열 분석 판독치를 폐기하여, 고 발현성 유전자의 확인 및 그들의 추가의 성상 확인에 있어서의 혼돈을 피하였다. 이러한 단계로 인해, 각 샘플로부터의 >70% 서열 분석 판독치가 상기 옥수수 게놈과 정렬되었다. 매핑된 1백만개 단편당 엑손 킬로 염기당 단편의 정량적 유전자 발현 단위 또는 FPKM 값을 이용하여, 유전자 발현 구조물에 사용하는 데 바람직한 발현 패턴과 매칭된 안정적인 형질전환 시험을 위해 유전자의 등급을 매겼다. 옥수수에서 가장 고도로 발현된 유전자의 약 0.1%를 나타내는, 대략 15 내지 20개 고 발현성 유전자가 안정적 트랜스제닉 계통에서 시험하기 위하여 우선적으로 처리되었다 (도 2).
실시예 2: 벡터 구축
상기 프로모터, 5'-UTR, 및 3'-UTR 서열을, 앞서 기재된 생물 정보학 및 전사 프로파일링 접근 방식으로부터 확인되었던 제아 메이스 메탈로티오네인-유사 유전자 서열로부터 추출하였다. 제아 메이스 c.v. B73 게놈으로부터의 제아 메이스 메탈로티오네인-유사 유전자의 천연 서열이 서열 6으로서 제공된다. 2,061 bp 프로모터 서열 (서열 1)은 이탤릭체이고; 코딩 서열 양옆에 위치하고 있는 ATG 및 TGA 번역 출발 및 정지 코돈은 볼드체로 나타낸다. 81 bp 5'-UTR 서열 (서열 5)은 대문자로 나타낸다. 1,080 bp 3'-UTR 서열 (서열 3)에는 밑줄이 그어져 있다.
상기 DNA 요소를 합성하고 진입 벡터 내로 클로닝하였다. 프로모터 및 3'-UTR 길이는 각각 2,061 bp 및 1,080 bp였다. 제아 메이스 메탈로티오네인-유사 프로모터, cry34Ab1 [비. 투린기엔시스 (B. thuringiensis)로부터의 리포터 유전자], 및 제아 메이스 메탈로티오네인-유사 3'-UTR을, 그들의 양옆에 위치하고 있는 DNA 요소와 최소 15 bp 중복되는 상동성을 함유하는 프라이머를 이용하여 증폭시켰다. 모든 단편을 겔 정제하였다. 3개 단편 모두를 진입 벡터 골격 pENTR11과 함께, 진아트 심리스(Geneart® Seamless) 클로닝 반응 [인비트로젠 (Invitrogen; 미국 캘리포니아주 칼스배드)]을 통하여 방향적 순서로 어셈블리하였다. 이어서, 게이트웨이(Gateway®) LR 클로나제(Clonase®) (인비트로젠) 반응을, 상기와 같이 생성된 진입 플라스미드 pDAB113010, 및 목표 벡터 pDAB104153 (이로써 최종 발현 벡터 pDAB113029가 초래된다)로 수행하였다. 상기 목표 벡터는 제아 메이스 유비퀴틴-1 프로모터 (문헌 [Christensen et al., (1992) Plant Molecular Biology 18; 675-689])에 의해 구동되고 옥수수 리파제 3'-UTR (미국 특허 번호 7,179,902)에 의해 종결된 aad-1 유전자로 구성된 선별성 마커 카세트를 함유하였다. 이로써 생성된 구조물인 pDAB113029는 aad-1 유전자 발현 카세트 및 cry34Ab1 유전자 발현 구조물을 함유하는 이종 발현 구조물이다 (도 3).
cry34Ab1 유전자 대신 옐로우 형광 단백질 (YFP; 문헌 [Shagin et al., (2004) Mol Biol Evol 21; 841-50]) 리포터 유전자를 함유하고 (도 4), pDAB113029에 존재하는 바와 동일한 aad-1 발현 카세트를 함유하는 음성 대조군 구조물 pDAB101556을 어셈블리하였다. cry34Ab1 유전자의 발현을 제어하는 솔라눔 투베로숨 (Solanum tuberosum) 프로테아제 억제제 유전자 II 3' UTR (StPinII 3'-UTR v2; 문헌 [An et al., (1989) Plant Cell 1; 115-22]) 및 제아 메이스 유비퀴틴-1 프로모터로 구성된 양성 대조군 구조물 pDAB108746을 구축하였다 (도 5). aad-1 카세트는 pDAB113029에 존재하는 바와 동일하였다.
실시예 3: 반복된 DNA 서열을 제거하기 위하여 제아 메이스 메탈로티오네인-유사 프로모터의 끝을 잘라냄
www.maizegdb.org에서 입수 가능한 옥수수 전위 요소 데이터베이스에 기재된 바와 같은 유형/부류 II 트랜스포손(transposon), 부류 I 전위 요소, 부류 II 전위 요소 및 부류 III 전위 요소 (예를 들어, RLX_ruda_AC206281_9164 반복 서열 및 Zm_CACTA_20 반복 서열)를 제거함으로써, pDAB113029의 2,061 bp 제아 메이스 메탈로티오네인-유사 프로모터 서열 (서열 1)의 끝을 잘라내어 1,498 bp 제아 메이스 메탈로티오네인-유사 프로모터 서열 (서열 2)로 만들었다. 이와 같이 끝을 잘라낸 제아 메이스 메탈로티오네인-유사 프로모터와 완전한 길이의 메탈로티오네인-유사 프로모터를 비교하는 정렬이 도 6에 제공된다. 상기 끝을 잘라낸 제아 메이스 메탈로티오네인-유사 프로모터를 cry34Ab1 리포터 및 완전한 길이의 제아 메이스 메탈로티오네인-유사 3'-UTR의 상류에 클로닝하였다. 이로써 생성된 유전자 발현 카세트를, 진아트® 심리스 클로닝 반응 (인비트로젠)을 이용하여 진입 벡터 pENTR11 내로 어셈블리하였다. 이로써 생성된 진입 플라스미드 pDAB112814, 및 목표 벡터 pDAB104153을, 게이트웨이® LR 클로나제® (인비트로젠) 반응을 이용하여 합하여 최종 발현 벡터 pDAB112816이 되도록 하였다. 목표 벡터 pDAB112816은 제아 메이스 유비퀴틴-1 프로모터에 의해 구동되고 옥수수 리파제 3'-UTR에 의해 종결된 aad-1 유전자를 포함하는 선별성 마커 카세트를 함유하였다 (도 7).
실시예 4: 반복된 DNA 서열을 제거하기 위하여 제아 메이스 메탈로티오네인-유사 3'-UTR의 끝을 잘라냄
www.maizegdb.org에서 입수 가능한 옥수수 전위 요소 데이터베이스에 기재된 바와 같은 부류 I 레트로요소(retroelement) 및 유형/부류 II 트랜스포손의 반복 서열을 제거함으로써, pDAB113029의 1,080 bp 제아 메이스 메탈로티오네인-유사 3'-UTR 서열 (서열 3)의 끝을 잘라내어 376 bp 제아 메이스 메탈로티오네인-유사 3'-UTR 서열 (서열 4)로 만들었다. 이와 같이 끝을 잘라낸 제아 메이스 메탈로티오네인-유사 3'-UTR과 완전한 길이의 제아 메이스 메탈로티오네인-유사 3'-UTR을 비교하는 정렬이 도 8에 제공된다. 그 다음, 이로써 생성된, 끝을 잘라낸 제아 메이스 메탈로티오네인-유사 3'-UTR을, 진아트® 심리스 클로닝 반응 (인비트로젠)을 이용하여 제아 메이스 메탈로티오네인-유사 절단된 프로모터 (서열 2) 및 cry34Ab1 리포터 유전자와 함께, 진입 골격 pENTR11 내로 어셈블리하였다. 이로써 생성된 구조물 pDAB112817, 및 목표 벡터 pDAB104153을, 게이트웨이® LR 클로나제® (인비트로젠) 반응을 이용하여 합하여 최종 발현 벡터 pDAB112820이 되도록 하였다. 목표 벡터 pDAB112820은 제아 메이스 유비퀴틴-1 프로모터에 의해 제어되고 옥수수 리파제 3'-UTR에 의해 종결된 aad-1 유전자를 포함하는 선별성 마커 카세트를 함유하였다 (도 9).
실시예 5: 식물 형질전환 및 분자 확증
실험적 구조물을, 근친계 제아 메이스 c.v. B104로부터 단리된 미숙한 배아의 아그로박테리움-매개된 형질전환을 통하여 옥수수 내로 형질전환시켰다. 사용된 방법은 문헌 ([Ishida et al., (1996) and Frame et al., (2006)])에 공개된 바와 유사하지만, 산업 환경에서 고 처리량 형질전환을 잘 받아들이는 방법을 만들기 위해 몇 가지 변형과 개선을 동반하였다 ([Ishida Y. et al., (1996) High efficiency transformation of maize (Zea mays L.) mediated by Agrobacterium tumefaciens. Nature Biotechnol 14:745-750]; 및 [Frame et al., (2006) Improved Agrobacterium-mediated transformation of three maize inbred lines using MS salts. Plant Cell Rep 25: 1024-1034]).
아그로박테리움
투메파시엔스의
형질전환
이원 발현 벡터를 아그로박테리움 투메파시엔스 균주 DAt13192 (RecA 결핍성 3원 균주) 내로 형질전환시켰다 (국제 특허 공개 번호 WO2012016222). 박테리아 집락을 선별하고, 제한 효소 분해를 통하여 이원 플라스미드 DNA를 단리 및 확증하였다.
아그로박테리움 배양 개시
아그로박테리움 배양물을 글리세롤 스톡으로부터 AB 최소 배지 (문헌 [Gelvin, S., 2006, Agrobacterium Virulence Gene Induction, in Wang, K., ed., Agrobacterium Protocols Second Edition Vol. 1, Humana Press, p. 79]; 슈크로스를 수반하지 않고 5 g/L 글루코스 및 15 g/L 박토(Bacto™) 한천을 수반하여 제조됨) 상으로 스트리킹하고, 3일 동안 암실 하 20℃에서 인큐베이션하었다. 이어서, 아그로박테리움 배양물을 YEP 배지 (문헌 [Gelvin, S., 2006, Agrobacterium Virulence Gene Induction, in Wang, K., ed., Agrobacterium Protocols Second Edition Vol. 1, Humana Press, p. 79])의 판 상으로 스트리킹하고, 1일 동안 암실 하 20℃에서 인큐베이션하였다.
실험 당일에는, 접종 배지 (2.2 g/L MS 염, 68.4 g/L 슈크로스, 36 g/L 글루코스, 115 mg/L L-프롤린, 2 mg/L 글리신, 100 mg/L 미오-이노시톨, 0.05 mg/L 니코틴산, 0.5 mg/L 피리독신 HCl, 0.5 mg/L 티아민 HCl)와 아세토시린곤의 혼합물을 실험 크기에 적당한 용적으로 제조하였다. 100% 디메틸 술폭시드 중의 아세토시린곤의 1 M 스톡 용액을 상기 접종 배지에 가하여 200 μM의 최종 아세토시린곤 농도가 되도록 하였다.
각 구조물에 대하여, 상기 YEP 판으로부터의 아그로박테리움 1 내지 2 루프를, 멸균성의 1회용 50 ml 원심분리 튜브 내부에 있는 15 ml의 상기 접종 배지/아세토시린곤 혼합물에 현탁시키고, 상기 용액의 600 nm 하에서의 광학 밀도 (O.D.600)를 분광광도계로 측정하였다. 이어서, 현탁액을 부가의 접종 배지/아세토시린곤 혼합물을 이용하여 0.25 내지 0.35 O.D.600으로 하향 희석시켰다. 그 다음, 아그로박테리움 현탁액의 튜브를, 사용하기 전 1 내지 4시간 동안 실온 하에 약 75 rpm으로 설정된 플랫폼 진탕기 상에 수평으로 놓아두었다.
옥수수
형질전환
실험적 구조물을, 근친계 제아 메이스 c.v. B104로부터 단리된 미숙한 배아의 아그로박테리움-매개된 형질전환을 통하여 옥수수 내로 형질전환시켰다. 사용된 방법은 문헌 ([Ishida et al., (1996) Nature Biotechnol 14:745-750] 및 [Frame et al., (2006) Plant Cell Rep 25: 1024-1034])에 공개된 바와 유사하지만, 고 처리량 형질전환을 잘 받아들이는 방법을 만들기 위해 몇 가지 변형과 개선을 동반하였다. 옥수수에서 수많은 트랜스제닉 현상을 생성시키기 위해 사용된 방법의 특정 예가 미국 특허 출원 공개 번호 US 2013/0157369 A1에 제공되는데, 이는 배아 감염 및 공동-배양 단계로 시작하였다.
추정상의 트랜스제닉 옥수수 식물을 대상으로 하여, cry34Ab1 및 aad-1 정량적 PCR 검정을 이용하여 트랜스진 존재를 알아보기 위하여 V2-3 잎 단계에서 샘플링하였다. 제조업자의 지시에 따라서 매그아트랙트(MagAttract®) DNA 추출 키트 [퀴아젠(Qiagen)]를 이용하여, 전체 DNA를 상기 잎 샘플로부터 추출하였다.
관심 유전자를 탐지하기 위하여, cry34Ab1 유전자에 대한 FAM-표지된 형광성 프로브 및 내인성 전화효소 참조 유전자 대조군에 대한 HEX-표지된 형광성 프로브를 함유하는 태크만® 프라이머/프로브 세트를 이용하여 유전자-특이적 DNA 단편을 증폭시켰다. 다음 프라이머를 cry34Ab1 및 전화효소 내인성 참조 유전자 증폭에 사용하였다. 그 프라이머 서열은 다음과 같다:
Cry34Ab1 프라이머/프로브:
정배향 프라이머: TQ.8v6.1.F: GCCATACCCTCCAGTTG (서열 7)
역배향 프라이머: TQ.8v6.1.R: GCCGTTGATGGAGTAGTAGATGG (서열 8)
프로브: TQ.8v6.1.MGB.P: 5'-/56-FAM/ CCGAATCCAACGGCTTCA / MGB (서열 9)
전화효소 프라이머:
정배향 프라이머: 전화효소F: TGGCGGACGACGACTTGT (서열 10)
역배향 프라이머: 전화효소R: AAAGTTTGGAGGCTGCCGT (서열 11)
전화효소 프로브: 5'-/5HEX/CGAGCAGACCGCCGTGTACTT /3BHQ_1/-3' (서열 12).
이어서, 5 ㎕의 로슈 라이트사이클러(Roche LightCycler®) 480 프로브 마스터 믹스 [로슈 어플라이드 사이언스 (Roche Applied Sciences; 미국 인디애나주 인디애나폴리스)]; 10 μM 스톡에서부터 400 nM의 최종 농도까지 TQ.8v6.1.F, TQ.8v6.1.R, 전화효소 F, 및 전화효소 R 프라이머 각각 0.4 ㎕; 5 μM 스톡에서부터 200 nM의 최종 농도까지 TQ.8v6.1.MGB.P 및 전화효소 프로브 각각 0.4 ㎕, 10% 폴리비닐피롤리돈 (PVP) 내지 0.1%의 최종 농도 0.1 ㎕; 2 ㎕의 10 ng/㎕ 게놈 DNA 및 0.5 ㎕ 물을 함유하는 10 ㎕ 반응물의 최종 용적에서 상기 PCR 반응을 수행하였다. DNA를 다음 조건 하에 로슈 라이트사이클러® 480 시스템에서 증폭시켰다: 10분 동안 95℃의 1주기; 다음 3-단계 40 주기: 95℃ 하에 10초; 58℃ 하에 35초 및 72℃ 하에 1초, 및 10초 동안 4℃의 최종 주기. 공지되지 않은 샘플에 대한 표적 (관심 유전자)/참조 (전화효소 유전자) 값 (라이트사이클러® 480에 의한 출력)을 cry34Ab1 카피 수 대조군의 표적/참조 값과 비교함으로써, Cry34Ab1 카피 수를 결정하였다.
aad-1 유전자의 탐지는 전화효소 내인성 참조 유전자를 이용하여 cry34Ab1 유전자에 대해 상기 언급된 바와 같이 수행하였다. aad -1 프라이머 서열은 다음과 같다:
AAD1 정배향 프라이머: TGTTCGGTTCCCTCTACCAA (서열 13)
AAD1 역배향 프라이머: CAACATCCATCACCTTGACTGA (서열 14)
AAD1 프로브: 5'-FAM/CACAGAACCGTCGCTTCAGCAACA-MGB/BHQ-3' (서열 15).
최종적으로, 관심 유전자를 함유하는 T0 식물을 대상으로 하여, cry34Ab1 및 AAD-1 잎 ELISA 검정하기 위하여 V4-5 하에 샘플링하였다. 4개의 잎 펀치를 샘플링하였다. 또 다른 식물 세트를 대상으로 하여, 상기 단백질 ELISA 검정 둘 다를 위하여 전체 뿌리 질량을 알아보기 위해 V4-5 하에 샘플링하였다. 잎 및 뿌리 Cry34Ab1 [애그디아, 인크. (Agdia, Inc.; 미국 인디애나주 엘카르트)] 및 AAD-1 [아카디아 바이오사이언스(Acadia BioScience)] ELISA 검정을 제조업자의 지시에 따라서 수행하였다. Cry34Ab1 잎 ELISA 검정은 ng/㎠로서 표현한 반면, 뿌리 ELISA 결과는 백만개당 부 (또는 총 식물 단백질 mg 당 단백질 ng)로서 표현하였다. 총 뿌리 단백질 검정을 제조업자의 지시에 따라서 브래드포드(Bradford) 탐지 방법으로 수행하였다.
T0 식물을 자가 수정하고 제아 메이스 c.v. B104 비-트랜스제닉 형질전환 계통과 교배하여 T1 종자를 수득하였다. 시험 조절 요소 구조물 각각의 5 내지 6개 트랜스제닉 계통 또는 현상을 대상으로 하여, T1 단백질 및 RNA 유전자 발현 연구를 진행한 다음, T2 종자 생성에 관하여 진행하였다. 따라서, 이들 현상 각각의 30 내지 40개 T1 종자를 파종하였고; V2 내지 V3 발육 단계에서 묘목에 SureII®를 살포하여 비-트랜스제닉 분리 개체를 사멸시켰다. 상기 트랜스제닉 식물을 대상으로 하여, cry34Ab1 및 AAD-1 ELISA를 위하여 다음과 같이 다중의 식물 발육 단계에서 샘플링하였다: 잎 (V4, V12 및 R3); 뿌리 (V4 및 R1); 줄기 (R1); 화분 (R1); 생사 (R1); 겉껍질 (R3); 알맹이 (R3); 및 속대 (R3). 모든 조직을 단리하고, 이를 드라이 아이스에 매립된 튜브에 놓아둔 다음, -80℃로 옮겼다. ELISA를 위해 단백질 추출하기 전에 냉동된 조직을 동결건조하였다.
cry34Ab1, yfp 및 aad-1 트랜스진을 함유하는 추정상의 트랜스제닉 T1 식물을 대상으로 하여, 잎 ELISA 검정을 위해 V4-5 하에 샘플링하였다. 4개의 잎 펀치를 샘플링하였다. 이러한 잎 펀치를 튜브에 놓아두고, 단일 1/8" 스텐레스 강 비드 [후버 정밀 제품 (Hoover Precision Products; 미국 조지아주 커밍)]를, 300 ㎕ 추출 완충액 (0.05% 트윈(Tween) 20 및 0.5% BSA를 보충시킨 1 X PBST)을 함유하는 각 1.2 ml 튜브에 가하였다. 샘플을 4분 동안 1,500 rpm 하에 제노그라인더(Genogrinder™) [SPEX 샘플프렙 (SPEX SamplePrep; 미국 뉴저지주 메타첸)]에서 처리하였다. 샘플을 소르발 레전드(Sorvall Legend) XFR™ 원심분리기에서 2분 동안 4,000 rpm으로 원심분리시켰다. 이어서, 300 ㎕의 추출 완충액을 더 가하고, 샘플을 2분 동안 제노그라인더™에서 1,500 rpm으로 한 번 더 처리하였다. 샘플을 7분 동안 4,000 rpm으로 한 번 더 원심분리시켰다. 최종적으로, 상등액을 수집하고, 시판용 Cry34Ab1 (애그디아, 인크.) 및 AAD-1 (아카디아 바이오사이언스, 엘엘씨) ELISA 검정 키트를 제조업자의 지시에 따라서 이용하여, 단백질 표준물과 함께 상이한 희석도 하에 ELISA 검정을 완료하였다. 상기 동결건조된 조직을 페인트 셰이커에서 30초 동안 연마함으로써, 각종 조직 유형 ELISA을 위한 단백질 추출을 수행하였다. 추가의 연마를 필요로 하는 조직의 경우에는, 상기 연마 단계를 30초 더 반복하였다. 가넷(Garnet) 분말을 가하여, 튜브의 바닥에 있는 만곡부를 덮었다. 조악하게 연마된 조직을 2 ml 튜브에 옮기고 0.5 ml 마크까지 충전시켰다. 1개의 세라믹 볼을 각 튜브에 가하였는데, 이는 과거엔 0.6 ml의 부분 추출 완충액 (200 ㎕의 프로테아제 억제제 칵테일, 200 ㎕의 500 mM EDTA, 15.5 mg DTT 분말, 및 20 ml가 되도록 하는 PBST)이었다. 모든 튜브를 얼음 상에서 10분 동안 유지시켰다. 찬 튜브를 제노그라인더®의 2 ml 홀더로 옮겼다. 상기 샘플을 30초 동안 2회 연마시켰는데, 그 사이에 얼음 상에서 5분 냉각시켰다. 그 다음, 40 ㎕의 10% 트윈®-20 및 300 ㎕ 추출 완충액을 상기 샘플에 가하였다. 샘플을 30초 더 연마시켰는데, 그 사이에 5분 냉각시켰다. 최종적으로, 각 샘플을 7분 동안 13,000 rpm으로 원심분리시키고, 상등액을 새로운 튜브에 조심스럽게 옮겨 추출물을 수집하였다. 이 추출물을 상기 추출 완충액에 재현탁시키고 ELISA 검정에 필요한 만큼 희석시켰다.
실시예 6: T0 트랜스제닉 식물 발현 스크리닝
ELISA 결과는 제아 메이스 메탈로티오네인-유사 조절 요소가 구조물 pDAB113029로 형질전환시킨 T0 현상에서 Cry34Ab1의 뿌리-특이적 발현을 구동시켰다는 것을 표시하였다. 제아 메이스 메탈로티오네인-유사 조절 요소에 의한 Cry34Ab1의 무시할만한 수준의 발현이 이들 현상의 잎 및 뿌리 (각각 표 1 및 2)에서 관찰되었다. 대조군 구조물 pDAB108746으로부터 생성된 현상은 잎과 뿌리 조직 둘 다에서 Cry34Ab1을 발현하였다. cry34Ab1 유전자를 함유하지 않은 대조군 구조물 pDAB101556으로 형질전환시킨 식물 현상에서는 Cry34Ab1 잎 발현이 전혀 관찰되지 않았다. 모든 구조물은 뿌리와 잎 조직 둘 다에서 aad-1 유전자를 발현하였다.
<표 1> 각종 구조물 현상의 V4 내지 V6 옥수수 잎에서의 cry34Ab1 및 AAD-1 트랜스진 발현을 보여주는 ELISA 결과.
<표 2> 각종 구조물 현상의 V4 내지 V6 옥수수 뿌리에서의 cry34Ab1 및 AAD-1 트랜스진 발현을 보여주는 ELISA 검정 결과.
또한, 표 3 및 4는 각종 구조물 현상의 V4 내지 V6 옥수수 잎 및 뿌리 각각에서의 cry34Ab1 및 AAD-1 트랜스진 발현을 보여주는 T1 ELISA 결과를 나타낸다.
<표 3> V4 내지 V6 옥수수 잎에서의 cry34Ab1 및 AAD-1 트랜스진 발현을 묘사하는 T1 ELISA 결과.
<표 4> V4 내지 V6 옥수수 뿌리에서의 cry34Ab1 및 AAD-1 트랜스진 발현을 묘사하는 T1 ELISA 결과.
그것으로서, 신규 제아 메이스 메탈로티오네인-유사 조절 요소를 확인하고 명확히 규명하였다. 유전자 발현 구조물에 사용하기 위한 프로모터, 5'-UTR 및 3'-UTR 조절 요소가 처음으로 개시된다. MTL 프로모터의 각종 설계는 잎과 비교해서 고도로 뿌리-선호되는 발현을 나타내었다. MTL 프로모터 버전과 그들의 천연 3' UTR의 특정의 조합, 예를 들어 pDAB112816, pDAB112820 및 pDAB113029는 하류 유전자 카세트에 대한 증강인자 효과를 나타내어, 잎과 뿌리 둘 다에서의 AAD-1 발현을 상당히 상향 조절하였다. 이러한 증강인자 효과는 대조군 구조물인 pDAB101556에서는 전혀 관찰되지 않았다.
더욱이, 상기 프로모터는 다중의 조직 유형 (예를 들어, 잎, 뿌리, 화분, 줄기, 생사, 속대, 겉껍질 등)에서의 발현을 증강시키는 것으로 여겨진다. 예를 들어, pDAB113029 구조물 MTL 프로모터/3' UTR이 각종 조직 유형에서 그 자체로의 cry34Ab1 발현을 표현하지 못하긴 하지만, 다중의 조직 유형에서의 하류 AAD1 카세트의 발현을 증강시킨다.
본 명세서에서 인용된 공개 공보, 특허 및 특허 출원을 포함한 모든 참고문헌은 이들이 본 개시내용의 명시적 세부 사항과 일관되는 정도로 본원에 참조로 포함되고, 마치 각각의 참고문헌이 개별적이고도 구체적으로 참조로 포함된다고 표시되고 그 전문에 본원에 제시된 것과 동일한 정도로 참조로 포함된다. 본원에서 논의된 참고문헌은 본 출원의 출원일 이전에 그의 개시내용을 위해서만 제공된다. 본원의 어떠한 것도, 본 발명자가 선행 발명에 의해서 상기 개시내용에 선행할 자격이 없다는 것을 인정하는 것으로 해석되지 않아야 한다. 다음 실시예는 특정의 특별한 특색 및/또는 실시양태를 예시하기 위해 제공된다. 이들 실시예는 본 개시내용을, 예시된 특별한 특색 또는 실시양태로 제한하는 것으로 해석되지 않아야 한다.
SEQUENCE LISTING
<110> Dow AgroSciences LLC
Gupta, Manju
Elango, Navin
Muthuraman, Karthik
Kumar, Sandeep
Beringer, Jeff
Sardesai, Nagesh
Wu, Huixia
<120> Zea mays Metallothionein-like Regulatory Elements and Uses
Thereof
<130> 14764-231756
<150> 61/886,943
<151> 2013-10-04
<160> 15
<170> PatentIn version 3.5
<210> 1
<211> 2061
<212> DNA
<213> Zea mays
<400> 1
accatatcat gtctcaagcc ttaatacact tttaaataaa tttaaatcat ttaatagaaa 60
ctaattacat gttaatacat cactataaaa aaaattaatg gttgcaccgt aaagctttaa 120
cttgtgcatc tatactctaa tagtttgtgg tccaacgcct cggtccgaca tctatagaag 180
tctttttttc tttattattt ggtttctttg tgagcttcac gttcagtttg gccctatttg 240
tactcttgca tatacttata gatatgtaac atgttttcta acatcttgct tgagatgtta 300
ttcattcgaa gcatcccttt gtctaagtcc acttgtgcac cctttgaaaa aatgttagca 360
taaatgattg tgttaaccat caaaacacca aaactttatt ttaaacggac ctaagtctat 420
tttacttgca atgagctagc atgaggaaca tggagcaaca ttaaactcga aacaggaggc 480
agtatcaaat actccctctg tttcttttta ttagtcgctg gatagtgaaa ttttgcacta 540
tccagcgact aataaaaaga aacggaggga gtatgagagt cgatcttaag aacatgacgt 600
atgatccata ccctcaaatc tgtttgagaa aaatcactat cgaaggaggc tacttgtttt 660
cttctttgcg tagaagataa tactcctcct gtcctaaatt aatatttgtt taaacttttt 720
actaaattca tgtaataatt aatgtatgcg ttatatatat atgtctaggt ttataattat 780
tcatatgaat atgaacataa aaatctaggg ctaaaacgac tactattttg aaaacggaag 840
gagtagtaag ttatttaagc ggaggggaac catgatgggc tagtgattta atttacatat 900
atatattggt gttctgggct cttacatgag aagatctagt taactgttgt tactgaacag 960
cgaagacaaa tatataattt aagctcccca actgctagtg attctgttaa gaggtaatgt 1020
ttaaagtaaa tttacaagag cccgtctagc tcagtcggta gagcgcaagg ctcttaacct 1080
tgtggtcgtg ggttcgagcc ccacggtggg cgcacaattt tttgtttttt gacatttttt 1140
gtttgcttag ttgcagacgg tttttcccct gctaggagat ttccgagaga aaaaaaaggc 1200
actacaggtt aaccaaaacc accaaccttt ggagcgtcga ggcgacgggc atttgcgtag 1260
ttgaagctta caaagttgca tatgagatga gtgccggaca tgaagcggat aacgttttaa 1320
actggcaaca atatctagct gtttcaaatt caggcgtggg aagctacgcc tacgcgccct 1380
ggacggcgtg taaagagcca gcatcggcat cattgtcaaa cgatcgacaa ggccaagaaa 1440
ttccaaatat attattaata aaaaagaagg cacaaattag tttggttttt tagtatgtgt 1500
ggcggaggaa attttgagaa cgaacgtatc aaagaaggca caagacgata tagattgacg 1560
cggctagaag ttgcagcaag acagtgggta cggtcttata tatcctaata aataaaaaat 1620
aaaactatag tgtgtcaaat gtcaacaaga ggaggaggca gccaaattag cagagggaga 1680
caagtagagc acgccttatt agcttgctta tttatcgtgg tggtgtactt gttaattact 1740
ggcacgcatt atcaacaacg cagttctgga tgtgaatcta gacaaacatt tgtctaggtt 1800
ccgcacgtat agtttttttt cttttttttt tggggggggg gtgggggggg gggggaacgg 1860
aagctgtaat aaacggtact aggaacgaaa gcaaccgccg cgcgcatgtt tttgcaatag 1920
attacggtga ccttgatgca ccaccgcgtg ctataaaaac cagtgtcccc gagtctactc 1980
atcaaccaat ccataactcg aaaccttttc ttgtgctctg ttctgtctgt gtgtttccaa 2040
agcaaacgaa agaggtcgag g 2061
<210> 2
<211> 1498
<212> DNA
<213> Zea mays
<400> 2
tttaacttgt gcatctatac tctaatagtt tgtggtccaa cgcctcggtc cgacatctat 60
agaagtcttt ttttctttat tatttggttt ctttgtgagc ttcacgttca gtttggccct 120
atttgtactc ttgcatatac ttatagatat gtaacatgtt ttctaacatc ttgcttgaga 180
tgttattcat tcgaagcatc cctttgtcta agtccacttg tgcacccttt gagctagcat 240
gaggaacatg gagcaacatt aaactcgaaa caggaggcag tatcaaatga gagtcgatct 300
taagaacatg acgtatgatc cataccctca aatctgtttg agaaaaatca ctatcgaagg 360
aggctacttg ttttcttctt tgcgtagaag ataagtaagt tatttaagcg gaggggaacc 420
atgatgggct agtgatttaa tttacatata tatattggtg ttctgggctc ttacatgaga 480
agatctagtt aactgttgtt actgaacagc gaagacaaat atataattta agctccccaa 540
ctgctagtga ttctgttaag aggtaatgtt taaagtaaat tgcttagttg cagacggttt 600
ttcccctgct aggagatttc cgagagaaaa aaaaggcact acaggttaac caaaaccacc 660
aacctttgga gcgtcgaggc gacgggcatt tgcgtagttg aagcttacaa agttgcatat 720
gagatgagtg ccggacatga agcggataac gttttaaact ggcaacaata tctagctgtt 780
tcaaattcag gcgtgggaag ctacgcctac gcgccctgga cggcgtgtaa agagccagca 840
tcggcatcat tgtcaaacga tcgacaaggc caagaaattc caaatatatt attaataaaa 900
aagaaggcac aaattagttt ggttttttag tatgtgtggc ggaggaaatt ttgagaacga 960
acgtatcaaa gaaggcacaa gacgatatag attgacgcgg ctagaagttg cagcaagaca 1020
gtgggtacgg tcttatatat cctaataaat aaaaaataaa actatagtgt gtcaaatgtc 1080
aacaagagga ggaggcagcc aaattagcag agggagacaa gtagagcacg ccttattagc 1140
ttgcttattt atcgtggtgg tgtacttgtt aattactggc acgcattatc aacaacgcag 1200
ttctggatgt gaatctagac aaacatttgt ctaggttccg cacgtatagt tttttttctt 1260
ttttttttgg ggggggggtg gggggggggg ggaacggaag ctgtaataaa cggtactagg 1320
aacgaaagca accgccgcgc gcatgttttt gcaatagatt acggtgacct tgatgcacca 1380
ccgcgtgcta taaaaaccag tgtccccgag tctactcatc aaccaatcca taactcgaaa 1440
ccttttcttg tgctctgttc tgtctgtgtg tttccaaagc aaacgaaaga ggtcgagg 1498
<210> 3
<211> 1080
<212> DNA
<213> Zea mays
<400> 3
tcctgctgcg ttgtttcgtt tgcggcatgc atggatgtca cctttttttt actgtctgct 60
ttgtgcttgt ggcgtgtcaa gaataaagga tggagccatc gtctggtctg actctggctc 120
tccgccatgc atgcttggtg tcggttctgt tgtgcttgtg ttggtgcatg taatcgtatg 180
gcatcgttac acaccatgca tctctgatct ctttgcgcca gtgtgtgtga ctatgtccct 240
gtaacgattg gctcagtgat tgaatatata tacaatactg ttttactaag taagtatgat 300
tacctcttat tttaaatttc tctatgtaaa tcatgtcttc tacacagtat gttgtacgac 360
cactatctgc tgaatgtata gatgtctaga aagcacgtgg cccgttagca tgacacgaag 420
cacggttttt tagcacgaca caaattaaca tgggcccagg ctcagcccgg cccagcgagc 480
gtgtcgggct cgacagccat cccgacgcgt tgggctggcc cgagcacggc ccggtggatg 540
ttgggcttag aaaccggccc gctacatttt agcgcagcct aacccactgc ccaccaatac 600
tccgcaattc cgcataaatc ccccagtgcc ccatccccag cccattgacc agcgcgacag 660
ctagggctgg aaaaaaagct cgaggctcgc gagccagctc gggctcgatc aggctcggct 720
cggctcggtg aggctcgcga gcctaaacga gcccgagccg agcctaattc cgcagctcgc 780
tacactaacg agccgagccg gcttggtgag gctcgcgagc gggctcaagg cttggtccaa 840
actactactt actcgtatct ccgttcacca gtgtgtaagt gtgctgtttt ggtcacaact 900
cacaaggaac tagagtgcag ggacataatt ttttattata tggaacatat tgtgcttcaa 960
atttgagcta atgactataa ttattgttgt tgagtacttg agtgtacagg ctcgcgagcc 1020
tatatcgagc cgagcctcat taccgagctc gctaagtgac cgagccgagc ctggctcggc 1080
<210> 4
<211> 376
<212> DNA
<213> Zea mays
<400> 4
tcctgctgcg ttgtttcgtt tgcggcatgc atggatgtca cctttttttt actgtctgct 60
ttgtgcttgt ggcgtgtcaa gaataaagga tggagccatc gtctggtctg actctggctc 120
tccgccatgc atgcttggtg tcggttctgt tgtgcttgtg ttggtgcatg taatcgtatg 180
gcatcgttac acaccatgca tctctgatct ctttgcgcca gtgtgtgtga ctatgtccct 240
gtaacgattg gctcagtgat tgaatatata tacaatactg ttttactaag taagtatgat 300
tacctcttat tttaaatttc tctatgtaaa tcatgtcttc tacacagtat gttgtacgac 360
cactatctgc tgaatg 376
<210> 5
<211> 81
<212> DNA
<213> Zea mays
<400> 5
atcaaccaat ccataactcg aaaccttttc ttgtgctctg ttctgtctgt gtgtttccaa 60
agcaaacgaa agaggtcgag g 81
<210> 6
<211> 3496
<212> DNA
<213> Zea mays
<400> 6
accatatcat gtctcaagcc ttaatacact tttaaataaa tttaaatcat ttaatagaaa 60
ctaattacat gttaatacat cactataaaa aaaattaatg gttgcaccgt aaagctttaa 120
cttgtgcatc tatactctaa tagtttgtgg tccaacgcct cggtccgaca tctatagaag 180
tctttttttc tttattattt ggtttctttg tgagcttcac gttcagtttg gccctatttg 240
tactcttgca tatacttata gatatgtaac atgttttcta acatcttgct tgagatgtta 300
ttcattcgaa gcatcccttt gtctaagtcc acttgtgcac cctttgaaaa aatgttagca 360
taaatgattg tgttaaccat caaaacacca aaactttatt ttaaacggac ctaagtctat 420
tttacttgca atgagctagc atgaggaaca tggagcaaca ttaaactcga aacaggaggc 480
agtatcaaat actccctctg tttcttttta ttagtcgctg gatagtgaaa ttttgcacta 540
tccagcgact aataaaaaga aacggaggga gtatgagagt cgatcttaag aacatgacgt 600
atgatccata ccctcaaatc tgtttgagaa aaatcactat cgaaggaggc tacttgtttt 660
cttctttgcg tagaagataa tactcctcct gtcctaaatt aatatttgtt taaacttttt 720
actaaattca tgtaataatt aatgtatgcg ttatatatat atgtctaggt ttataattat 780
tcatatgaat atgaacataa aaatctaggg ctaaaacgac tactattttg aaaacggaag 840
gagtagtaag ttatttaagc ggaggggaac catgatgggc tagtgattta atttacatat 900
atatattggt gttctgggct cttacatgag aagatctagt taactgttgt tactgaacag 960
cgaagacaaa tatataattt aagctcccca actgctagtg attctgttaa gaggtaatgt 1020
ttaaagtaaa tttacaagag cccgtctagc tcagtcggta gagcgcaagg ctcttaacct 1080
tgtggtcgtg ggttcgagcc ccacggtggg cgcacaattt tttgtttttt gacatttttt 1140
gtttgcttag ttgcagacgg tttttcccct gctaggagat ttccgagaga aaaaaaaggc 1200
actacaggtt aaccaaaacc accaaccttt ggagcgtcga ggcgacgggc atttgcgtag 1260
ttgaagctta caaagttgca tatgagatga gtgccggaca tgaagcggat aacgttttaa 1320
actggcaaca atatctagct gtttcaaatt caggcgtggg aagctacgcc tacgcgccct 1380
ggacggcgtg taaagagcca gcatcggcat cattgtcaaa cgatcgacaa ggccaagaaa 1440
ttccaaatat attattaata aaaaagaagg cacaaattag tttggttttt tagtatgtgt 1500
ggcggaggaa attttgagaa cgaacgtatc aaagaaggca caagacgata tagattgacg 1560
cggctagaag ttgcagcaag acagtgggta cggtcttata tatcctaata aataaaaaat 1620
aaaactatag tgtgtcaaat gtcaacaaga ggaggaggca gccaaattag cagagggaga 1680
caagtagagc acgccttatt agcttgctta tttatcgtgg tggtgtactt gttaattact 1740
ggcacgcatt atcaacaacg cagttctgga tgtgaatcta gacaaacatt tgtctaggtt 1800
ccgcacgtat agtttttttt cttttttttt tggggggggg gtgggggggg gggggaacgg 1860
aagctgtaat aaacggtact aggaacgaaa gcaaccgccg cgcgcatgtt tttgcaatag 1920
attacggtga ccttgatgca ccaccgcgtg ctataaaaac cagtgtcccc gagtctactc 1980
atcaaccaat ccataactcg aaaccttttc ttgtgctctg ttctgtctgt gtgtttccaa 2040
agcaaacgaa agaggtcgag gatgtcttgc agctgcggat caagctgcaa ctgcggatca 2100
agctgcaagt gcgggtaatg taattaaggc tcttattttc ctttctgtaa ctgtgtgatc 2160
gtgtcctttt gtgaattgta cgtggtgtct ttttttttaa tttttttttt tttgcttaat 2220
tctgcgcagc aagatgtacc ctgacctgga ggagaagagc ggcgggggcg ctcaggccag 2280
cgccgccgcc gtcgtcctcg gcgttgcccc tgagacgaag aaggcggcgc agttcgaggc 2340
ggcgggcgag tccggcgagg ccgctcacgg ctgcagctgc ggtgacagct gcaagtgcag 2400
cccctgcaac tgctgatcct gctgcgttgt ttcgtttgcg gcatgcatgg atgtcacctt 2460
ttttttactg tctgctttgt gcttgtggcg tgtcaagaat aaaggatgga gccatcgtct 2520
ggtctgactc tggctctccg ccatgcatgc ttggtgtcgg ttctgttgtg cttgtgttgg 2580
tgcatgtaat cgtatggcat cgttacacac catgcatctc tgatctcttt gcgccagtgt 2640
gtgtgactat gtccctgtaa cgattggctc agtgattgaa tatatataca atactgtttt 2700
actaagtaag tatgattacc tcttatttta aatttctcta tgtaaatcat gtcttctaca 2760
cagtatgttg tacgaccact atctgctgaa tgtatagatg tctagaaagc acgtggcccg 2820
ttagcatgac acgaagcacg gttttttagc acgacacaaa ttaacatggg cccaggctca 2880
gcccggccca gcgagcgtgt cgggctcgac agccatcccg acgcgttggg ctggcccgag 2940
cacggcccgg tggatgttgg gcttagaaac cggcccgcta cattttagcg cagcctaacc 3000
cactgcccac caatactccg caattccgca taaatccccc agtgccccat ccccagccca 3060
ttgaccagcg cgacagctag ggctggaaaa aaagctcgag gctcgcgagc cagctcgggc 3120
tcgatcaggc tcggctcggc tcggtgaggc tcgcgagcct aaacgagccc gagccgagcc 3180
taattccgca gctcgctaca ctaacgagcc gagccggctt ggtgaggctc gcgagcgggc 3240
tcaaggcttg gtccaaacta ctacttactc gtatctccgt tcaccagtgt gtaagtgtgc 3300
tgttttggtc acaactcaca aggaactaga gtgcagggac ataatttttt attatatgga 3360
acatattgtg cttcaaattt gagctaatga ctataattat tgttgttgag tacttgagtg 3420
tacaggctcg cgagcctata tcgagccgag cctcattacc gagctcgcta agtgaccgag 3480
ccgagcctgg ctcggc 3496
<210> 7
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<223> nucleotide primer
<400> 7
gccataccct ccagttg 17
<210> 8
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> nucleotide primer
<400> 8
gccgttgatg gagtagtaga tgg 23
<210> 9
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> nucleotide primer
<400> 9
ccgaatccaa cggcttca 18
<210> 10
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> nucleotide primer
<400> 10
tggcggacga cgacttgt 18
<210> 11
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> nucleotide primer
<400> 11
aaagtttgga ggctgccgt 19
<210> 12
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> nucleotide primer
<400> 12
cgagcagacc gccgtgtact t 21
<210> 13
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> nucleotide primer
<400> 13
tgttcggttc cctctaccaa 20
<210> 14
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> nucleotide primer
<400> 14
caacatccat caccttgact ga 22
<210> 15
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> nucleotide primer
<400> 15
cacagaaccg tcgcttcagc aaca 24
Claims (28)
- i) 폴리링커 서열;
ii) 트랜스진 또는
iii) i)과 ii)의 조합
에 작동가능하게 연결된 프로모터를 포함하며, 여기서 상기 프로모터는 서열 1, 서열 1과 90% 서열 동일성을 갖는 서열, 서열 2, 또는 서열 2와 90% 서열 동일성을 갖는 서열을 포함하는 것인 핵산 벡터. - 제1항에 있어서, 상기 프로모터가 3 kb 미만 길이인 핵산 벡터.
- 제1항에 있어서, 상기 프로모터가 서열 1, 또는 서열 1과 90% 서열 동일성을 갖는 서열을 포함하는 것인 핵산 벡터.
- 제1항에 있어서, 상기 프로모터가 서열 2, 또는 서열 2와 90% 서열 동일성을 갖는 서열을 포함하는 것인 핵산 벡터.
- 제1항에 있어서, 상기 프로모터가 서열 1, 또는 서열 1과 90% 서열 동일성을 갖는 서열로 이루어진 것인 핵산 벡터.
- 제1항에 있어서, 상기 프로모터가 서열 2, 또는 서열 2와 90% 서열 동일성을 갖는 서열로 이루어진 것인 핵산 벡터.
- 제1항 내지 제6항 중 어느 한 항에 있어서, 선별성 마커를 코딩하는 서열을 추가로 포함하는 핵산 벡터.
- 제7항에 있어서, 상기 프로모터가 트랜스진에 작동가능하게 연결된 것인 핵산 벡터.
- 제8항에 있어서, 트랜스진이 선별성 마커를 코딩하거나 또는 살곤충제 저항성, 제초제 내성, 질소 사용 효율, 용수 효율, 또는 영양 품질을 부여해 주는 유전자 산물을 코딩하는 것인 핵산 벡터.
- 제1항 내지 제6항 또는 제8항 중 어느 한 항에 있어서, 서열 3, 서열 3과 90% 서열 동일성을 갖는 서열, 서열 4, 또는 서열 3과 90% 서열 동일성을 갖는 서열을 포함하는 3' 비번역 서열을 추가로 포함하며, 여기서 3' 비번역 서열은 상기 폴리링커 또는 상기 트랜스진에 작동가능하게 연결된 것인 핵산 벡터.
- 제10항에 있어서, 상기 3' 비번역 서열이 서열 3, 또는 서열 3과 90% 서열 동일성을 갖는 서열로 이루어진 것인 핵산 벡터.
- 제10항에 있어서, 상기 3' 비번역 서열이 서열 4, 또는 서열 4와 90% 서열 동일성을 갖는 서열로 이루어진 것인 핵산 벡터.
- 제1항 내지 제3항 또는 제5항 중 어느 한 항에 있어서, 서열 5, 또는 서열 5와 90% 서열 동일성을 갖는 서열을 포함하는 5' 비번역 서열을 추가로 포함하며, 여기서 5' 비번역 서열은 상기 프로모터 서열과 상기 폴리링커 또는 트랜스진 사이에 삽입되고, 그에 작동가능하게 연결된 것인 핵산 벡터.
- 제15항에 있어서, 상기 5' 비번역 서열이 서열 5, 또는 서열 5와 90% 서열 동일성을 갖는 서열로 이루어진 것인 핵산 벡터.
- 트랜스진에 작동가능하게 연결된, 서열 1, 서열 1과 90% 서열 동일성을 갖는 서열, 서열 2, 또는 서열 2와 90% 서열 동일성을 갖는 서열을 포함하는 프로모터 서열을 포함하는 식물.
- 제15항에 있어서, 옥수수, 밀, 벼, 수수, 귀리, 호밀, 바나나, 사탕수수, 대두, 목화, 해바라기 및 캐놀라로 이루어진 군으로부터 선택되는 식물.
- 제15항에 있어서, 제아 메이스 (Zea mays)인 식물.
- 제15항 내지 제17항 중 어느 한 항에 있어서, 트랜스진이 상기 식물의 게놈 내로 삽입된 것인 식물.
- 제15항에 있어서, 상기 프로모터 서열이 서열 1, 또는 서열 1과 90% 서열 동일성을 갖는 서열을 포함하는 것인 식물.
- 제15항에 있어서, 상기 프로모터 서열이 서열 2, 또는 서열 2와 90% 서열 동일성을 갖는 서열을 포함하는 것인 식물.
- 제15항에 있어서, 상기 프로모터 서열이 서열 1, 또는 서열 1과 90% 서열 동일성을 갖는 서열로 이루어진 것인 식물.
- 제15항에 있어서, 상기 프로모터 서열이 서열 2, 또는 서열 2와 90% 서열 동일성을 갖는 서열로 이루어진 것인 식물.
- 제15항에 있어서, 서열 5, 또는 서열 5와 90% 서열 동일성을 갖는 서열을 포함하는 5' 비번역 서열을 추가로 포함하며, 여기서 5' 비번역 서열은 상기 프로모터와 상기 트랜스진 사이에 삽입되고, 그에 작동가능하게 연결된 것인 식물.
- 제23항에 있어서, 서열 3, 서열 3과 90% 서열 동일성을 갖는 서열, 서열 4, 또는 서열 3과 90% 서열 동일성을 갖는 서열을 포함하는 3' 비번역 서열을 추가로 포함하며, 여기서 3' 비번역 서열은 상기 트랜스진에 작동가능하게 연결된 것인 식물.
- 제23항에 있어서, 상기 3' 비번역 서열이 서열 3, 또는 서열 3과 90% 서열 동일성을 갖는 서열을 포함하는 것인 식물.
- 제23항에 있어서, 상기 3' 비번역 서열이 서열 4, 또는 서열 4와 90% 서열 동일성을 갖는 서열을 포함하는 것인 식물.
- 제23항에 있어서, 상기 3' 비번역 서열이 서열 3, 또는 서열 3과 90% 서열 동일성을 갖는 서열로 이루어진 것인 식물.
- 제23항에 있어서, 상기 3' 비번역 서열이 서열 4, 또는 서열 4와 90% 서열 동일성을 갖는 서열로 이루어진 것인 식물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361886943P | 2013-10-04 | 2013-10-04 | |
| US61/886,943 | 2013-10-04 | ||
| PCT/US2014/058753 WO2015051075A1 (en) | 2013-10-04 | 2014-10-02 | Zea mays metallothionein-like regulatory elements and uses thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20160065952A true KR20160065952A (ko) | 2016-06-09 |
Family
ID=52778090
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167011722A KR20160065952A (ko) | 2013-10-04 | 2014-10-02 | 제아 메이스 메탈로티오네인-유사 조절 요소 및 그의 용도 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US9777286B2 (ko) |
| EP (1) | EP3052633B1 (ko) |
| JP (1) | JP2016536978A (ko) |
| KR (1) | KR20160065952A (ko) |
| CN (1) | CN105793427A (ko) |
| AP (1) | AP2016009164A0 (ko) |
| AR (1) | AR097916A1 (ko) |
| AU (1) | AU2014329590B2 (ko) |
| BR (1) | BR102014024813A2 (ko) |
| CA (1) | CA2926197A1 (ko) |
| IL (1) | IL244866A0 (ko) |
| RU (1) | RU2016116914A (ko) |
| UY (1) | UY35773A (ko) |
| WO (1) | WO2015051075A1 (ko) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX2017012936A (es) | 2015-04-15 | 2018-02-01 | Dow Agrosciences Llc | Promotor de plantas para la expresion transgenica. |
| JP2018511331A (ja) * | 2015-04-15 | 2018-04-26 | ダウ アグロサイエンシィズ エルエルシー | 導入遺伝子発現のための植物プロモーター |
| CA3020563A1 (en) * | 2016-05-02 | 2017-11-09 | Dow Agrosciences Llc | Plant promoter and 3'utr for transgene expression |
Family Cites Families (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6114138A (en) | 1984-06-04 | 2000-09-05 | Mycogen Plant Science, Inc. | Insecticidal protein fragments |
| US5380831A (en) | 1986-04-04 | 1995-01-10 | Mycogen Plant Science, Inc. | Synthetic insecticidal crystal protein gene |
| US4683195A (en) | 1986-01-30 | 1987-07-28 | Cetus Corporation | Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
| US5750871A (en) | 1986-05-29 | 1998-05-12 | Calgene, Inc. | Transformation and foreign gene expression in Brassica species |
| US5004863B2 (en) | 1986-12-03 | 2000-10-17 | Agracetus | Genetic engineering of cotton plants and lines |
| EP0270496B1 (de) | 1986-12-05 | 1993-03-17 | Ciba-Geigy Ag | Verbessertes Verfahren zur Transformation von pflanzlichen Protoplasten |
| US5015580A (en) | 1987-07-29 | 1991-05-14 | Agracetus | Particle-mediated transformation of soybean plants and lines |
| US5244802A (en) | 1987-11-18 | 1993-09-14 | Phytogen | Regeneration of cotton |
| US5416011A (en) | 1988-07-22 | 1995-05-16 | Monsanto Company | Method for soybean transformation and regeneration |
| US5302523A (en) | 1989-06-21 | 1994-04-12 | Zeneca Limited | Transformation of plant cells |
| US5188960A (en) | 1989-06-27 | 1993-02-23 | Mycogen Corporation | Bacillus thuringiensis isolate active against lepidopteran pests, and genes encoding novel lepidopteran-active toxins |
| US5550318A (en) | 1990-04-17 | 1996-08-27 | Dekalb Genetics Corporation | Methods and compositions for the production of stably transformed, fertile monocot plants and cells thereof |
| US7705215B1 (en) | 1990-04-17 | 2010-04-27 | Dekalb Genetics Corporation | Methods and compositions for the production of stably transformed, fertile monocot plants and cells thereof |
| WO1991010725A1 (en) | 1990-01-22 | 1991-07-25 | Dekalb Plant Genetics | Fertile transgenic corn plants |
| US5484956A (en) | 1990-01-22 | 1996-01-16 | Dekalb Genetics Corporation | Fertile transgenic Zea mays plant comprising heterologous DNA encoding Bacillus thuringiensis endotoxin |
| US6403865B1 (en) | 1990-08-24 | 2002-06-11 | Syngenta Investment Corp. | Method of producing transgenic maize using direct transformation of commercially important genotypes |
| US5384253A (en) | 1990-12-28 | 1995-01-24 | Dekalb Genetics Corporation | Genetic transformation of maize cells by electroporation of cells pretreated with pectin degrading enzymes |
| US7060876B2 (en) | 1992-07-07 | 2006-06-13 | Japan Tobacco Inc. | Method for transforming monocotyledons |
| DE69334225D1 (de) | 1992-07-07 | 2008-07-31 | Japan Tobacco Inc | Verfahren zur transformation einer monokotyledon pflanze |
| AU687863B2 (en) | 1993-09-03 | 1998-03-05 | Japan Tobacco Inc. | Method of transforming monocotyledon by using scutellum of immature embryo |
| US5635055A (en) | 1994-07-19 | 1997-06-03 | Exxon Research & Engineering Company | Membrane process for increasing conversion of catalytic cracking or thermal cracking units (law011) |
| US5846797A (en) | 1995-10-04 | 1998-12-08 | Calgene, Inc. | Cotton transformation |
| WO1997013402A1 (en) | 1995-10-13 | 1997-04-17 | Dow Agrosciences Llc | Modified bacillus thuringiensis gene for lepidopteran control in plants |
| US6083499A (en) | 1996-04-19 | 2000-07-04 | Mycogen Corporation | Pesticidal toxins |
| US5981840A (en) | 1997-01-24 | 1999-11-09 | Pioneer Hi-Bred International, Inc. | Methods for agrobacterium-mediated transformation |
| AU768246B2 (en) | 1998-10-23 | 2003-12-04 | Mycogen Corporation | Plant-optimized polynucleotides encoding approximately 15 kDa and approximately 45 kDa pesticidal proteins |
| CA2359868A1 (en) | 1999-01-14 | 2000-07-20 | Monsanto Company | Soybean transformation method |
| WO2000053763A1 (en) * | 1999-03-08 | 2000-09-14 | Pioneer Hi-Bred International, Inc. | Maize metallothionein gene and promoter |
| US20100017918A1 (en) | 2000-06-23 | 2010-01-21 | Syngenta Participations Ag | Arabidopsis derived promoters for regulation of plant expression |
| AU2003256373A1 (en) | 2002-06-27 | 2004-01-19 | Dow Agrosciences Llc | Use of regulatory sequences in transgenic plants |
| DE602004023229D1 (de) * | 2003-12-22 | 2009-10-29 | Du Pont | Mais metallothionen promoter 2 und methoden zur verwendung |
| CA2897475C (en) | 2004-04-30 | 2018-07-10 | Dow Agrosciences Llc | Novel herbicide resistance genes |
| DK2484202T3 (en) | 2005-10-28 | 2017-09-11 | Dow Agrosciences Llc | NEW HERBICID RESISTANCE GENES |
| CN106987561A (zh) | 2006-12-07 | 2017-07-28 | 陶氏益农公司 | 新型选择性标记基因 |
| CN101889090B (zh) | 2007-10-05 | 2018-01-23 | 陶氏益农公司 | 用于将分子物质转移入植物细胞中的方法 |
| TW201144442A (en) | 2010-05-17 | 2011-12-16 | Dow Agrosciences Llc | Production of DHA and other LC-PUFAs in plants |
| RU2611188C2 (ru) | 2010-07-29 | 2017-02-21 | ДАУ АГРОСАЙЕНСИЗ ЭлЭлСи | Штаммы agrobacterium, модифицированные для увеличения частоты трансформации растений |
| TW201307553A (zh) | 2011-07-26 | 2013-02-16 | Dow Agrosciences Llc | 在植物中生產二十二碳六烯酸(dha)及其他長鏈多元不飽和脂肪酸(lc-pufa)之技術 |
| TWI582233B (zh) | 2011-12-15 | 2017-05-11 | 陶氏農業科學公司 | 使用農桿菌改良轉形的方法 |
| AR090418A1 (es) | 2012-02-01 | 2014-11-12 | Dow Agrosciences Llc | Peptido de transito al cloroplasto |
-
2014
- 2014-10-02 KR KR1020167011722A patent/KR20160065952A/ko not_active Application Discontinuation
- 2014-10-02 AU AU2014329590A patent/AU2014329590B2/en not_active Ceased
- 2014-10-02 EP EP14850603.3A patent/EP3052633B1/en not_active Not-in-force
- 2014-10-02 CA CA2926197A patent/CA2926197A1/en not_active Abandoned
- 2014-10-02 JP JP2016519784A patent/JP2016536978A/ja not_active Withdrawn
- 2014-10-02 WO PCT/US2014/058753 patent/WO2015051075A1/en active Application Filing
- 2014-10-02 US US14/505,055 patent/US9777286B2/en active Active
- 2014-10-02 RU RU2016116914A patent/RU2016116914A/ru not_active Application Discontinuation
- 2014-10-02 AP AP2016009164A patent/AP2016009164A0/en unknown
- 2014-10-02 CN CN201480065991.XA patent/CN105793427A/zh active Pending
- 2014-10-03 BR BR102014024813A patent/BR102014024813A2/pt not_active Application Discontinuation
- 2014-10-03 AR ARP140103695A patent/AR097916A1/es unknown
- 2014-10-06 UY UY0001035773A patent/UY35773A/es not_active Application Discontinuation
-
2016
- 2016-04-03 IL IL244866A patent/IL244866A0/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| CN105793427A (zh) | 2016-07-20 |
| AP2016009164A0 (en) | 2016-04-30 |
| CA2926197A1 (en) | 2015-04-09 |
| AU2014329590B2 (en) | 2017-10-19 |
| AR097916A1 (es) | 2016-04-20 |
| WO2015051075A1 (en) | 2015-04-09 |
| EP3052633B1 (en) | 2019-06-12 |
| US9777286B2 (en) | 2017-10-03 |
| EP3052633A1 (en) | 2016-08-10 |
| EP3052633A4 (en) | 2017-04-05 |
| BR102014024813A2 (pt) | 2015-10-06 |
| IL244866A0 (en) | 2016-05-31 |
| JP2016536978A (ja) | 2016-12-01 |
| RU2016116914A (ru) | 2017-11-13 |
| US20150101083A1 (en) | 2015-04-09 |
| UY35773A (es) | 2015-04-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2017203180B2 (en) | Constructs for expressing transgenes using regulatory elements from Brachypodium ubiquitin genes | |
| AU2017234672B2 (en) | Zea mays regulatory elements and uses thereof | |
| KR20160111450A (ko) | 제아 메이스 조절 요소 및 그의 용도 | |
| AU2017235944B2 (en) | Zea mays regulatory elements and uses thereof | |
| KR20160065952A (ko) | 제아 메이스 메탈로티오네인-유사 조절 요소 및 그의 용도 | |
| AU2014329590A1 (en) | Zea mays metallothionein-like regulatory elements and uses thereof | |
| JP2018511333A (ja) | 導入遺伝子発現のための植物プロモータ |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |