KR20150023027A - 항체 접합체의 제조를 위한 신규한 공정 및 신규한 항체 접합체 - Google Patents
항체 접합체의 제조를 위한 신규한 공정 및 신규한 항체 접합체 Download PDFInfo
- Publication number
- KR20150023027A KR20150023027A KR20157001179A KR20157001179A KR20150023027A KR 20150023027 A KR20150023027 A KR 20150023027A KR 20157001179 A KR20157001179 A KR 20157001179A KR 20157001179 A KR20157001179 A KR 20157001179A KR 20150023027 A KR20150023027 A KR 20150023027A
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- ser
- group
- reagent
- pro
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6889—Conjugates wherein the antibody being the modifying agent and wherein the linker, binder or spacer confers particular properties to the conjugates, e.g. peptidic enzyme-labile linkers or acid-labile linkers, providing for an acid-labile immuno conjugate wherein the drug may be released from its antibody conjugated part in an acidic, e.g. tumoural or environment
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/06—Tripeptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6811—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a protein or peptide, e.g. transferrin or bleomycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6871—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting an enzyme
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/53—Hinge
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Oncology (AREA)
- Cell Biology (AREA)
- Gastroenterology & Hepatology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
본 발명은 이황화결합(disulfide bond)으로부터 유래된 2 개의 시스테인 잔기 간 가교(bridge)를 형성하는 접합 제제와 함께 단일 내부-중쇄 이황화결합(disulfide bond)를 가지는 조작된 항체를 반응하는 단계를 포함하는 항체 접합체(conjugate)의 제조를 위한 공정에 관한 것이다.
Description
본 발명은 항체 접합체(conjugate)를 제조하는 신규한 공정, 및 신규한 항체 접합체에 관한 것이다.
표적 세포 및 분자의 표면의 특이적인 항원에 대한 항체의 특이성(specificity)은 이들이 다양한 진단 및 치료 시약(reagent)의 전달체로서 광범위하게 사용될 수 있도록 한다. 예를 들면, 항체는 정상이고, 건강한 조직으로의 충격을 최소화하면서 화학요법 치료와 연관된 부작용을 유의적으로 감소시킬 수 있는 구체적인 세포 종류 또는 성장 인자와 같은, 세포사멸 물질 및 화학요법 약물과의 접합이 특이적인 조직 또는 구조체에 대한 상기 물질의 표적 하는 전달을 할 수 있도록 하면서, 형광체(fluorophore), 방사성 동위 원소(radioisotope) 및 표지화와 영상화 적용에서 사용될 수 있는 효소와 같은 표지 및 리포터 군과 접합된다. 항체-약물 접합체는 구체적으로 암과 같은, 다양한 질병의 영역에서 넓은 치료 적용법의 가능성을 가진다.
항체를 원하는 부분(moiety)과 접합시키는 이전의 방법은 일반적으로 항체에 따라 위치에서 비-특이적인 접합체와 관련되어(예를 들면, 라이신 측쇄 아민을 통해), 접합체 산물의 불 균일 분포(heterogeneous distribution), 빈번하게는, 특징화하고 정제하기에 어렵고 비싼 복합체 혼합물을 주는 비 접합된 단백질을 결과로 한다. 이러한 혼합물 내 각각의 접합체 산물은 잠재적으로 약물동력적(pharmacokinetic), 분포(distribution), 독성(toxicity) 및 효율적(efficacy) 특성을 다르게 가지며, 비-특이적 접합체 또한 빈번하게 결손된 항체 기능에서 결과된다.
항체에 접합하는 것은 또한 내부사슬 이황화결합 감소로 시스테인 설프히드릴 기(sulfhydryl group)의 활성화에 잇달아, 부착된 부분과 함께 자유 시스테인 잔기의 각각의 알킬화(alkylation)가 수행될 수 있다. 4 개의 내부사슬 이황화결합을 가지는 IgG1 단일클론 항체에서, 이러한 위치-특이적인 접합체는 8 개의 부착된 활성 부위까지 가지는 접합체가 된다. 그러나, 이러한 접합 방법은 다양한 화학양론(stoichiometry)(항체 당 0, 2, 4, 6 또는 8 부위) 및 8 개의 가능한 접합체 부위로 분배되는 부착 부분을 가지는 접합체의 불균질 혼합물을 생산한다. 추가로, 이러한 다양한 시스테인 잔기의 접합 동안에, 원래의 이황화결합은 언제나 재-가교되지 못할 수 있어, 잠재적으로 구조적 변화 및 결손된 항체의 기능을 야기한다.
항체 당 결합되는 부분의 수가 같은 것과 각 부분이 각각의 항체 내 같은 아미노산 잔기에 특이적으로 결합되는 것은 효율을 최적화하고 일관적인 투여량(dose consistency)을 정하는 데에 있어 중요하다. 따라서, 다수의 방법은 항체 접합체의 균질성(homogeneity)을 증가시키기 위해 개발되어 왔다.
WO 2006/065533은 8 개 약물 분자/항체 하에서 항체의 약물 투여 화학양론(drug loading stoichiometry)을 감소시킴으로써 항체-약물 접합체의 치료 지표가 증진될 수 있다는 것을 확인하였고, 화학양론적 약물 부착에 대해 미리 결정된 부위를 가지는 조작된 항체를 밝혔다. 내부사슬 이황화결합의 형성과 관련된 모항체의 8 개의 시스테인 잔기는 6, 4 또는 2 개가 남을 수 있는 시스테인 잔기를 가지는 항체 변이체를 생성하기 위해, 각각 조직적이게 다른 아미노산 잔기와 대체되었다. 4 개의 잔여 시스테인 잔기를 가지는 항체 변이체는 그런 다음 결정된 화학양론(4 약물/항체)를 나타내는 접합체를 생성하기 위해 사용되었고 더욱 이질적인 "부분-투여된" 4 약물/항체 접합체와 유사한 항원-결합 친화력 및 세포독성 활성을 나타내는 약물 부착 부위는 이전 방법으로부터 유래하였다.
WO 2006/065533의 항체가 향상된 수율을 가지는 균일한 접합체를 생성한다고 하더라도, 본래의 내부사슬 이황화결합의 제한점은 항체의 사차원 구조에 의해 방해될 수 있고, 그렇게 함으로써 항체 반응기(effector) 기능의 변화를 포함하는, 생체 내 항체의 행동이 교란되는 것으로 생각된다(Junutula JR, et al. Nat Biotechnol. 2008 Aug; 26(8):925-32).
WO 2008/141044는 항체의 하나 또는 그 이상의 아미노산이 시스테인 아미노산으로 치환된 항체 변이체로 향한다. 조작된 시스테인 아미노산 잔기는 자유 아미노산이며 내부사슬 또는 내부사슬 이황화결합의 부분이 아니고, 정해진 화학양론을 가지며 본래 이황화결합의 방해를 하지 않도록 결합된 약물을 만들게 한다. 그러나, 이는 항체 분자 내로 조작된 자유 시스테인 잔기가 항체 접힘 및 조립(assembly) 동안에, 재배열 및 분자 내에서 존재하게 되는 시스테인 잔기가 혼동 반응(scrambling reactions)을 야기할 수 있거나, 다른 항체 분자에서 자유 시스테인 잔기와의 반응을 통해 이합체화(dimerization)를 결과하여, 결손된 항체 기능 또는 응집(aggregation)을 나타낼 수 있는 위험도(risk)가 남는다.
WO 2005/007197은 신규한 티오에테르(thioether) 접합체를 주는 단백질 내의 이황화결합으로부터 유래된 둘 다의 황 원자(sulfur atom)와 함께 접합체로서의 능력을 가지는 신규한 접합체 시약을 사용하여, 중합체의 단백질로 접합을 위한 공정을 묘사한다. 이러한 방법에서, 이황화결합은 2 개의 자유 시스테인 잔기를 생산하는 것을 감소시키고 그런 다음 구조를 파괴하지 않거나, 단백질의 생물학적 활성을 폐지하지 않으면서, 중합체가 공유적으로 부착된, 가교(bridging) 시약을 사용하여 재형성되었다. 그러나 이러한 방법은 접근도(closeness)가 몇몇의 이황화결합 혼동을 결과할 수 있어, 다른 단백질에 대해 접합된 항체에서 적은 효율을 나타낼 수 있다.
본 발명자들은 항체 접합체의 제조 동안에 이황화결합 혼동의 문제를 감소시키고 항체 접합체의 균일성을 향상시키는 이 공정의 변형을 현재 발견하였다.
따라서, 본 발명은 이황화결합으로부터 유래된 2 개의 시스테인 잔기 사이의 가교를 형성하는 접합 시약과 함께 단일 내부-중쇄 이황화결합을 가지는 조작된 항체를 반응하는 단계를 포함하는 항체 접합체의 제조를 위한 공정을 제공한다.
자연적으로 일어나는 IgG 분자 내에서, 항체 분자의 중쇄는 항체의 경첩 영역 내의 시스테인 잔기 사이의 다중의 내부사슬 이황화결합(내부-중쇄 이황화결합)으로서 연결된다. 본 발명에서 사용하는, "내부-중쇄 시스테인 잔기"는 내부-중쇄 이황화결합의 형성과 연관될 수 있는 항체 중쇄의 시스테인 잔기를 나타낸다.
4 개의 IgG 하위그룹(subclasse)은 경첩영역 내에서 내부-중쇄 이황화결합의 수를 반영하는 것과 다르다: 인간 IgG1, IgG2, IgG3 및 IgG4 동종(isotype)은 각각, 2, 4, 11 및 2 개의 내부-중쇄 이황화결합을 가진다. IgG1 및 IgG4에서, 중쇄는 EU-지표 번호화 시스템에 따라 226 및 229 번째에 해당하는 위치의 내부-중쇄 시스테인 잔기 간의 항체 경첩영역에서 이황화결합에 의해 연결된다(Edelman GM, et al., Proc Natl Acad Sci USA. 1969 May; 63(1):78-85). 본 발명에서 사용된 항체는 항체의 경첩 영역 내에서(즉, 일반적으로 221 및 236 번째 위치 사이) 단일 내부-중쇄 이황화결합을 가진다.
본 명세서 및 청구항에 따르면, 항체 서열 내의 잔기는 EU-지표 번호화 시스템에 따라 관습적으로 번호화된다. EU-지표 번호화 시스템에 따른 226 및 229 번째 위치는 Kabat 지표화 시스템(Kabat et al., 1991, Sequences of Protein of Immunological Interest, 5th Ed., United States Public Health Service, National Institutes of Health, Bethesda) 또는 Chothia 지표화 시스템 (Al-Lazikani et al., (1997) JMB 273, 927-948)을 이용하면 239 및 242 번 위치에 해당한다. EU-지표 잔기는 아미노산 서열 내의 아미노산 잔기의 직선적 번호화와 언제나 직접적으로 연관되는 것은 아니다. 실제적인 직선적 아미노산 서열은 엄격한 EU-지표 번호화에서 보다 더 적거나 부가적인 아미노산을 포함할 수 있다. 올바른 잔기의 EU-지표 번호화는 예를 들면 항체의 경첩영역의 잔기 배열에 의한, "표준적" EU-지표 또는 Kabat 번호화된 서열과 함께 항체의 서열에서 상동성의 잔기 배열에 의해 주어진 항체에 대하여 결정될 수 있다.
단일 내부-중쇄 이황화결합은 모항체 내에서 이황화결합의 위치에 있을 수 있거나, 경첩 영역 내에 있는 것으로 주어진, 다른 위치에 있을 수 있는 둘 중 하나로, 즉, 항체는 모두가 아니라 본래의 모항체의 경첩 이황화결합의 하나가 결여되도록 조작될 수 있거나, 모항체의 경첩 이황화결합의 모두가 제거되어, 새로운 위치에서 조작된 새로운 이황화결합으로 조작될 수 있다.
하나의 실시예에서, 본 발명의 공정은 재조합 발현 또는 화학적 합성에 의해 단일 내부-중쇄 이황화결합을 가지는 조작된(engineered) 항체의 제조를 포함한다. 예를 들면, 모항체(parent antibody) 서열 내의 하나 또는 그 이상의 내부-중쇄 시스테인 잔기는 시스테인을 제외한 아미노산으로 시스테인 잔기(들)가 치환됨으로써 제거될 수 있어, 조작된 항체 결과물은 각각의 중쇄에서, 내부-중쇄 이황화결합 사이에서 형성된 단일 내부-중쇄 시스테인 잔기를 가진다. 그렇지 않으면, 자연적인 모항체 서열에서 하나 또는 그 이상의 내부-중쇄 시스테인 잔기는 결실되고 다른 아미노산으로 대체되지 않을 수 있다. 이러한 공정은 모항체 내의 이황화결합과 동일한 위치에서 단일 이황화결합을 가지는 조작된 항체를 결과한다. 만일 모항체 내에서 이황화결합과는 다른 위치에 단일 내부-중쇄 이황화결합을 도입하기 원한다면, 모항체 서열 내의 내부-중쇄 시스테인 잔기가 치환 또는 결실되고, 경첩영역 안에서 다른 위치에서 항체 내로 새로운 시스테인 잔기가 조작된다.
바람직하게는, 단일 내부-중쇄 이황화결합을 가지는 조작된 항체 제조의 단계는 하기를 포함한다
a) 시스테인을 제외한 다른 아미노산으로 하나 또는 그 이상의 내부-중쇄 시스테인 잔기의 결실 또는 치환을 결과하는, 모항체(parent antibody)를 암호화하는 핵산 서열의 변이;
b) 발현 시스템에서 핵산의 발현; 및
c) 조작된 항체를 분리.
핵산 서열 내로 변이(mutation)을 도입하는 방법은 당업계에 잘 알려져 있다. 이러한 방법은 다음에 해당되는 바와 같이 중쇄 및/또는 경쇄의 다른 부분(portion)을 포함하는 중합화효소 사슬 반응-기반의 돌연변이, 위치 선택적 돌연변이(site directed mutagenesis), 합성된 DNA 올리고머와 함께 중합화효소 사슬 반응(polymerase chain reaction, PCR)을 사용한 유전자 합성, 및 핵산 합성 후에 발현 벡터 내로 합성 DNA의 결찰(ligation)을 포함한다(예를 들면, Sambrook et al., Molecular Cloning, A Laboratory Manual, Third Edition, Cold Spring Harbor Publish., Cold Spring Harbor, New York (2001); 및 Ausubel et al., Current Protocols in Molecular Biology, 4th ed., John Wiley 및 Sons, New York (1999) 참조). 예를 들면, 위치-선택적 돌연변이는 시스테인을 제외한 다른 아미노산으로 하나 또는 그 이상의 내부-중쇄 시스테인 잔기를 치환하기 위해 사용될 수 있다. 구체적으로, PCR 프라이머 올리고뉴클레오티드는 개체 항체의 암호화된 서열 내로 뉴클레오티드 변화가 포함되도록 설계할 수 있다. 예를 들면, 세린 치환 변이는 시스테인을 암호화하는 코돈 TGT 또는 TGC가 세린을 암호화하는 코돈 TCT, TCC, TCA, TCG, AGT 또는 AGC로 변화되도록 하는 프라이머를 설계함으로써 구축될 수 있다.
항체-암호화 핵산을 발현하고 숙주 세포 시스템으로부터 항체를 분리하기 위한 자세한 방법은 또한 잘 알려져 있다(예를 들면, Co et al, J. Immunol, 152:2968-76, 1994; Better 및 Horwitz, Methods Enzymol., 178:476-96, 1989; Pluckthun 및 Skerra, Methods Enzymol, 178:497-515, 1989; Lanioyi, Methods Enzymol, 121 :652-63, 1986; Rousseaux et al., Methods Enzymol., 121:663-9, 1986; Bird 및 Walker, Trends Biotechnol, 9:132-7, 1991을 참고). 적절한 발현 시스템은 항체 암호화 서열을 포함하는 재조합 박테리오파지 DNA, 플라스미드 DNA 또는 코스미드 DNA 발현 벡터로 형질전환된 세균(예를 들어, E. coli)과 같은 미생물; 항체 암호화 서열을 포함하는 재조합 효모 발현 벡터로 형질전환된 효모(예를 들면, 사카로마이세스(Saccharomyces); 피키아(Pichia)); 항체 암호화 서열을 포함하는 재조합 바이러스 발현 벡터로 형질감염된 곤충 세포 시스템(예를 들면, 배큘로바이러스(baculo virus)); 항체 암호화 서열을 포함하는 재조합 바이러스 발현 벡터(예를 들면, 꽃양배추모자이크바이러스(cauliflower mosaic virus), CaMV; 담배 모자이크 바이러스, TMV)로 형질감염되거나 또는 재조합 플라스미드 발현 벡터(예를 들면, Ti plasmid)로 형질전환된 식물 세포; 또는 포유류 세포의 유전체로부터 유래된 프로모터(예를 들면, 메탈로티오네인(metallothionein) 프로모터) 또는 포유류 바이러스로부터 유래된 프로모터(예를 들면, 아데노바이러스 래이트 프로모터; 백시니아바이러스 7.5K 프로모터)를 포함하는 재조합 발현 구축체를 가지는(harbouring) 포유류 세포 시스템(예를 들면, COS, CHO, BHK, HEK 293, NSO, 및 3T3 세포)을 포함한다.
단일 내부-중쇄 이황화결합을 가지는 항체는 합성 단백질 화학의 알려진 방법을 사용하여 화학적 합성에 의해 제조될 수 있음이 또한 고려된다. 예를 들면, 적절한 아미노산 서열, 또는 이의 부분은, 고체상 기술을 이용한 직접적 펩티드 합성과 같이 당업계에서 잘 알려진 펩티드 합성 방법(예를 . Merrifield, 1963, J. Am Chem. Soc. 85, 2149; Stewart et al., 1969, in Solid-Phase Peptide Synthesis, WH Freeman Co, San Francisco Calif.; Matteucci et al. J. Am. Chem. Soc. 103:3185-3191, 1981) 또는 예를 들면 Applied Biosystem 사(California, USA)의 합성기(Synthesiser)를 이용하는, 자동적 합성을 사용하여 제조될 수 있다. 항체의 다양한 부분은 또한 예를 들면, 완전 항체(intact antibody)의 단백질 가수분해성 분해(proteolytic digestion)를 통해 유래되었거나(Morimoto et al (1992) Journal of Biochemical 및 Biophysical Methods 24:107- 117; 및 Brennan et al (1985) Science, 229:81), 재조합 숙주 세포에 의해 직접적으로 제작되었거나, 또는 항체 파아지 라이브러리로부터 분리될 수 있는 항체 단편을 부분적으로 합성하여, 원하는 항체 분자를 생산하기 위한 화학적 커플링 방법을 사용해 연결(combine) 시킬 수 있다.
바람직하게는, 상기 단일 내부-중쇄 이황화결합은 EU-지표 번호화 시스템에 따라 항체의 226 번 또는 229 번 위치에 있다(Kabat 지표화 시스템을 사용하여 239 번 또는 242 번 위치).
바람직하게는, 항체는 EU-지표 번호화 시스템에 따라 226 번 또는 229 번 위치에서 시스테인이 아닌 아미노산을 가진다. 예를 들면, 226 번 또는 229 번 위치에서 본래의 시스테인 잔기는 시스테인이 아닌 아미노산으로 치환될 수 있다. 226 번 또는 229 번 위치에서 본래의 시스테인 잔기에 대해 치환된 아미노산은 티올 부분(thiol moiety)을 포함하지 않으며, 세린(serine), 트레오닌(threonine), 발린(valine), 알라닌(alanine), 글리신(glycine), 류신(leucine) 또는 이소류신(isoleucine), 다른 극성 아미노산, 자연적으로 나타나는 다른 아미노산, 또는 비-자연적으로 나타나는 다른 아미노산일 것이다. 바람직하게는, 226 번 또는 229 번 위치에서 시스테인 잔기는 세린으로 치환된다.
하나의 실시예에서, 항체는 226 번 위치에서 시스테인을 가지고 229 번 위치에서 예를 들면 세린과 같은, 시스테인이 아닌 다른 아미노산을 가진다. 또 다른 실시예에서, 항체는 226 번 위치에서 예를 들면 세린과 같은, 시스테인이 아닌 다른 아미노산을 가지고, 229 번 위치에서 시스테인을 가진다.
예를 들면, 항체는 IgG1 분자이며 EU-지표 번호화 시스템에 따라 226 내지 229번 위치에서 Cys-Pro-Pro-Ser 또는 Ser-Pro-Pro-Cys의 서열을 포함할 수 있다; 다시 말하면 226 번 및 229 번 사이의 서열은 야생형이다. 그렇지 않으면, 항체는 IgG4 분자이며 EU-지표 번호화 시스템에 따라 226 내지 229번 위치에서 Cys-Pro-Ser-Ser 또는 Ser-Pro-Ser-Cys의 서열을 포함할 수 있다; 다시 말하면 226 번 및 229 번 사이의 서열은 야생형이다.
그렇지 않으면, 226 번 및 229 번 잔기 사이의 서열은 야생형으로부터의 변이를 포함할 수 있다. 예를 들면 IgG4에서는 Cys-Pro-Pro-Ser, 및 Ser-Pro-Pro-Cys일 수 있다. 더욱 일반적으로, IgG1 또는 IgG4 내의 서열은 Cys-(Xaa)-(Xaa)-Ser 또는 Ser-(Xaa)-(Xaa)-Cys일 수 있으며, 여기에서 각각의 Xaa는 독립적으로 티올 부분이 결여된 어떠한 아미노산이다. 예를 들면, 각각의 Xaa는 독립적으로 세린(serine), 트레오닌(threonine), 발린(valine), 알라닌(alanine), 글리신(glycine), 류신(leucine) 또는 이소류신(isoleucine), 다른 극성 아미노산, 다른 자연적으로 나타나는 아미노산, 또는 비-자연적으로 나타나는 아미노산으로부터 선택된 아미노산일 수 있다. 예를 들면, 각각의 Xaa는 세린, 트레오닌 및 발린으로부터 선택될 수 있고, 예를 들면, 세린일 수 있다.
보다 대체적으로, 226 번 및 229 번 잔기 사이의 두 개 이상의 아미노산이 될 수 있다. 예를 들면, 서열은 Cys-(Xaa)n-Ser 또는 Ser-(Xaa)n-Cys이 될 수 있으며, n은 3, 4 또는 5이며 각각의 Xaa는 독립적으로 티올 부분이 결여된 어떠한 아미노산이다. 이는 구체적으로 Cys-Pro-(Xaa)m-Pro-Ser, Ser-Pro-(Xaa)m-Pro-Cys, Cys-Pro-Pro-(Xaa)m-Ser, Ser-Pro-Pro-(Xaa)m-Cys, Cys-(Xaa)m-Pro-Pro-Ser 및 Ser-(Xaa)m-Pro-Pro-Cys이 언급될 수 있으며, 여기에서 m은 1, 2 또는 3이고 Xaa는 독립적으로 티올 부분이 결여된 어떠한 아미노산이다. 예를 들면, 각각의 Xaa는 독립적으로 세린(serine), 트레오닌(threonine), 발린(valine), 알라닌(alanine), 글리신(glycine), 류신(leucine) 또는 이소류신(isoleucine), 다른 극성 아미노산, 자연적으로 나타나는 다른 아미노산 또는 비-자연적으로 나타나는 아미노산으로부터 선택된 아미노산일 수 있다. 예를 들면, 각각의 Xaa는 세린, 트레오닌 및 발린으로부터 선택될 수 있고, 예를 들면 세린일 수 있다.
본 명세서에 따르면, 용어 "항체"는 면역글로블린 분자의 가변 영역(variable region) 내의 적어도 하나의 항원 인식 부위에서 단백질, 폴리펩티드, 펩티드, 탄수화물, 폴리뉴클레오티드, 지질(lipid), 또는 이들의 조합과 같은, 표적 항원을 인식하고 특이적으로 결합하는 면역글로블린 분자를 의미하는 것으로 이해되어야 한다. 항체는 바람직한 생물 활성을 나타내기 때문에, 상기 용어 "항체"는 다클론 항체, 단일클론 항체, 이중특이적 항체(bispecific antibody)와 같은 다가특이적항체, 키메라 항체(chimeric antibody), 인간 항체(humanised antibody), 인간 항체, 항체의 항원 결정 부위(antigen determination portion)를 포함하는 융합 단백질(fusion protein) 및 항원 인식 부위를 포함하는 변형된 다른 어떠한 면역글로블린 분자를 포함한다. 항체는 면역글로블린의 5 가지 주요 클래스 중 어떠한 것일 수 있다: 각각 알파, 베타, 입실론, 감마, 및 뮤로서 나타내지는 이들의 중쇄 불변 도메인(heavy-chain constant domain)의 특징에 기반한, IgA, IgD, IgE, IgG, 및 IgM, 또는 이들의 하위그룹(subclasse)(동종(isotype))(예를 들면 IgGl, IgG2, IgG3, IgG4, IgAl 및 IgA2). 면역글로블린의 다른 클래스는 각기 다르고 잘 알려진 서브유닛 구조 및 3차원 구조체(configuration)를 가진다. 구체적으로 IgG1 또는 IgG4의 사용이 바람직하다.
본 명세서 및 청구항에 있어서, 문장 내에서 다른 것을 요구하는 부분을 제외하고, 용어 “항체”는 전장 항체 및 단일 내부-중쇄 이황화결합의 항원-결합 영역을 포함하는 전장 항체 및 항체 단편을 포함한다. 항체 단편은 예를 들면 be F(ab')2 또는 항체 단편으로부터 형성된 다가특이적 항체, 예를 들면scFv 단편 또는 2가 항체(diabody)의 다른 순열(permutation)로 구성된 미니바디(minibody) 및 Fc 단편 또는 scFv-Fc, scFv-Fc-scFv, (Fab'ScFv)2, scDiabody-Fc, scDiabody-CH3, scFv- CH3, scFv-CH2-CH3 융합 단백질과 같은 CH 도메인 등일 수 있다. 항체 단편은 상기 언급된 효소적인 절단(enzymatic cleavage), 합성 기술 또는 재조합 기술에 의해 제조될 수 있다.
바람직하게는, 항체 접합체는 진단 및 치료 목적을 위한 임상적 약제 내에서 용도를 찾는다. 예를 들면, 접합 시약은 진단제 또는 치료제, 또는 진단제 또는 치료제에 결합할 수 있는 결합 시약을 포함할 수 있다. 이러한 접합체는 예를 들면 암의 치료를 위하거나 시험관 내 또는 생체 내 진단의 적용을 위함과 같은, 치료에서 용도를 찾는다. 항체 접합체는 비-임상 적용에서 또한 사용될 수 있다. 예를 들면, 접합 시약은, 표지화 시약 또는 예를 들면 특이적인 항원의 존재를 검출하기 위한 면역분석에서 사용하거나 형광 활성화 세포 분리(fluorescence activated cell sorting, FACS) 분석과 같은 적용을 위해, 표지화 시약에 결합할 수 있는 결합 시약을 포함할 수 있다.
당업계에서 알려진 진단 시약, 치료제 및 표지화 시약의 넓은 다양성은 항체 분자로 접합되어 왔다. 예를 들면, 접합 시약은 예를 들면, 진단 시약, 약물 분자, 예를 들면 세포 사멸 시약, 독소, 방사성 핵종(radionuclide), 형광 시약(예를 들면 5-디메틸아미노나프탈렌-1-(N-(2-아미노에틸))술폰아미드-단실에틸렌디아민(5-dimethylaminonaphthalene-1-(N-(2-aminoethyl))sulfonamide-dansyl ethylenediamine)과 같은 형광 프로브로 유도된 아민, 오레건 그린(Oregon Green)® 488 카타베린(cadaverine)(카탈로그 번호 O-10465, Molecular Probes 사), 단실 카타베린(dansyl cadaverine, N-(2-아미노에틸)-4-아미노-3,6-디술포-1,8-나프탈리미드(N-(2-aminoethyl)-4-amino-3,6-disulfo-1,8-naphthalimide), 디포타슘 염(dipotassium salt)(루시퍼 옐로우 에틸렌디아민, lucifer yellow ethylenediamine), 또는 로다민 B 에틸렌디아민(rhodamine B ethylenediamine)(카탈로그 번호 L-2424, Molecular Probes), 또는 예를 들면 BODIPY® FL L-시스틴(카탈로그 번호 B-20340, Molecular Probes)과 같은 형광 프로브로 유도된 티올; 또는예를 들면 이후 결합에 사용될 수 있는 킬레이트 시약과 같은 결합 시약, 예를 들면 킬레이트, 예를 들면 상기 언급된 것들 중에서 어떠한 다른 바람직한 부분(moiety)을 포함할 수 있다.
접합 시약은 또한 올리고머 또는 중합체를 포함할 수 있다(편의를 위해 본 명세서에서는 공통으로 "중합체"라고 언급함). 수용성, 합성 중합체, 구체적으로 폴리알킬렌 글리콜(polyalkylene glycol)은 항체를 포함하는, 단백질과 같은 치료적으로 활성화된 분자에 접합하기 위해 넓게 사용된다. 이러한 치료 접합체는 순환 시간의 지연 및 제거 비율(clearance rates)의 감소를 통한 약물동력학적(pharmacokinetics)으로 바람직하게 변환되고, 전신 독성(systemic toxicity)을 감소하여, 다양한 경우에서, 임상적인 효율의 증가를 나타내는 것으로 나타났다. 단백질에, 폴리에틸린 글리콜(polyethylene glycol), PEG를 공유적으로 결합하는 공정은 "PEG화(PEGylation)"로서 잘 알려져 있다.
중합체는 예를 들면 폴리알킬렌 글리콜(polyalkylene glycol), 폴리비닐피롤리돈(polyvinylpyrrolidone), 폴리아크릴레이트(polyacrylate), 예를 들면 폴리아크릴로일 모르폴린(polyacryloyl morpholine), 폴리메탈크릴레이트(polymethacrylate), 폴리옥사졸린(polyoxazoline), 폴리비닐알코올(polyvinylalcohol), 폴리아크릴아미드(polyacrylamide) 또는 폴리메타크릴아미드(polymethacrylamide), 예를 들면 폴리카복시메타크릴아미드(polycarboxymethacrylamide), 또는 HPMA 혼성중합체일 수 있다. 추가로, 상기 중합체는 효소적 또는 가수 분해되기 쉬운 중합체일 수 있다. 이러한 중합체는, 예를 들면, 폴리에스터(polyesters), 폴리아세탈(polyacetals), 폴리(오쏘 에스터)(poly(ortho esters)), 폴리카보네이트(polycarbonates), 폴리(이미노 카보네이트)(poly(imino carbonates)), 및 폴리(아미노산)과 같은, 폴리아미드(polyamides)를 포함한다. 중합체는 균일중합체(homocopolymer), 불규칙 공중합체 또는 예를 들면 이것은 2 또는 그 이상의 알킬렌 산화물(alkylene oxides)로부터 유래되거나, 폴리(알킬렌 산화물) 및 폴리에스터, 폴리아세탈, 폴리(오쏘 에스터), 또는 폴리(아미노산) 중 어느 하나로부터 유래된 블록 공중합체일 수 있는, 블록 공중합체와 같은 구조적으로 정의된 공중합체일 수 있다. 사용될 수 있는 다가기능적(Polyfunctional) 중합체는 디비닐에테르-말레산 무수물(divinylether-maleic anhydride) 및 스티렌-말레산 무수물(styrene-maleic anhydride)의 공중합체를 포함한다.
자연적으로 나타나는 중합체는 또한, 예를 들면 키틴(chitin), 덱스트란(dextran), 덱스트린(dextrin), 키토산(chitosan), 전분(starch), 셀룰로오즈(cellulose), 글리코겐(glycogen), 폴리(시알산)(poly(sialylic acid)), 히알루론산(hyaluronic acid) 및 이들의 유도체와 같은 다당류일 수 있다. 단백질은 중합체로서 사용될 수 있다. 이는 예를 들면 효소 또는 다른 활성 단백질과 같은 2차 단백질의 항체 또는 항체 단편 또는 아비딘(avidin)과 같이 바이오틴화된(biotinylated) 분자에 결합할 수 있는 스캣폴딩(scaffolding) 단백질을 접합한다. 또한, 예를 들면 글리코실 전달 효소(glycosyltransferase)에 대한 O-글리칸 수용체 위치와 같이, 촉매 서열을 포함하는 펩티드가 사용된다면, 이는 기질의 포함 또는 이후의 효소 반응에 대한 표적을 허용한다. 또한 폴리글루탐 산과 같은 중합체는 또한 단당류 또는 아미노산과 같은 자연적인 단량체로부터 유래된 혼성 중합체(hybrid polymer) 및 에틸렌 산화물 또는 메타크릴 산(methacrylic acid)과 같은 합성적인 단량체로서, 사용될 수 있다.
중합체가 폴리알킬렌 글리콜이라면, C2 및/또는 C3 단위를 포함하는 것이 바람직하며, 구체적으로 폴리에틸렌 글리콜이다. 중합체, 구체적으로 폴리알킬렌 글리콜은, 단일 선형 사슬을 포함할 수 있거나, 작거나 큰 다수의 사슬로 구성된 분지된 형태(branched morphology)를 가질 수 있다. 소위 이른바 플루론(pluronics)은 PEG 블록 공중합체의 주요 클래스이다. 이들은 에틸렌 산화물 및 프로필렌 산화물(propylene oxide) 블록으로부터 유래된다. 치환되거나, 둘러싸인(capped), 폴리알킬렌 글리콜, 예를 들면 메톡시 폴리에틸렌 글리콜(methoxypolyethylene glycol)이 사용될 수 있다.
중합체는, 예를 들면, 본 명세서에서 인용 문헌으로 포함된 WO 2004/113394에서 기재된 방법에 의해 만들어진 빗살형 중합체(comb copolymer)일 수 있다. 예를 들면, 상기 중합체는 하기 일반식을 가지는 빗살형 중합체일 수 있다:
A-(D)d-(E)e-(F)f
여기에서:
A는 나타나지 않을 수 있고 단백질 또는 폴리펩티드에 접합할 수 있는 부분일 수 있고;
나타난, D는, 하나 또는 그 이상의 E에서 정의되지 않은 올레핀으로 불포화된 단량체의 부가적인 중합체화에 의해 수득되며;
E는 선형, 분지화(branched) 또는 별 모양으로(star-shaped) 치환 또는 비-치환되는 다수의 단량체의 부가적인 중합체에 의해 수득되고, 올레핀으로 불포화된 부분을 가지며;
나타나는 F는, E에서 정의되지 않은 하나 또는 그 이상의 올레핀으로 불포화된 단량체의 부가적인 증합체화에 의해 수득되고;
d 및 f는 0 내지 500 사이의 정수이며;
e는 0 내지 1000의 정수이고;
상기 A가 나타났을 때, D, E 및 F 중 적어도 하나가 나타난다.
상기 중합체는 어떠한 바람직한 방법으로 선택적으로 유래되거나 기능화될 수 있다. 하나의 바람직한 실시예에서, 중합체는 진단 시약, 치료제, 또는 표지화 시약, 예를 들면 상기 언급된 것 중에 하나, 또는 진단 시약, 치료제, 또는 표지화 시약에 결합할 수 있는 결합 시약을 전달한다. 반응기는 중합체 말단(terminus) 또는 끝 기(end group)에 연결되거나, 펜던트 링커(pendent linker)를 통해 중합체 사슬에 따라 연결될 수 있다; 이러한 경우에서, 중합체는 예를 들면 폴리아크릴아미드, 폴리메타크릴아미드, 폴리아크릴레이트, 폴리메탈크릴레이트, 또는 말레산 무수물 혼성중합체이다. 하나 이상의 생물학적 분자를 포함하는 다중의 접합체는 상조적(synergistic)이고 부가적인 이점에서 결과할 수 있다. 만일 필요하다면, 중합체는 종래의 방법을 사용하여 고형 지지체에 결합될 수 있다.
중합체의 최적 분자량은 당연히 해당되는 적용법에 의해 결정될 것이다. 긴-사슬의 중합체는, 예를 들면 500 g/mole 내지 약 75,000 g/mole의 범위가 될 수 있는 평균 분자량이 사용될 수 있다. 그러나, 예를 들면 겨우 2 개의 반복되는 단위, 예를 들면 2 내지 20 개의 반복 단위로 구성되는, 매우 작은 올리고머는, 몇몇의 적용법에서 유용하다. 항체 접합체가 순환을 떠나서 조직으로 들어가려고 하는, 예를 들면 악성 종용(malignancy). 감염(infection) 또는 자가 면역 질환(autoimmune disease)에 의하거나 외상(trauma)에 의한 염증의 치료에 사용하기 위한 때에, 30,000 g/mole까지 범위의 낮은 분자량 중합체를 사용하는 것이 이득이 될 수 있다. 항체 접합체가 순환에 남아있도록 하려고 하는 적용을 위해서는 높은 분자량 중합체, 예를 들면 20,000 내지 75,000 g/mole의 범위에서 사용하는 것이 이득이 될 수 있다.
사용되는 중합체는 이의 의도되는 용도에 따라 용액 수단(solvent medium)에서 녹을 수 있는 접합체가 선택되어야만 한다. 생물학적인 적용을 위해서, 구체적으로 포유 동물의 순환계 치료 관리를 위한 진단법 적용 및 치료 적용에 있어서, 접합체는 수성 용매(aqueous media)에 녹을 수 있을 것이다.
바람직하게 중합체는 합성된 중합체이고, 바람직하게 이는 수용성의(water-soluble) 중합체이다. 수용성의 폴리에틸렌 글리콜의 사용은 구체적으로 많은 적용에서 바람직하다.
이황화결합의 감소에 의해 생성된 티올기 2 개 모두를 통해 항체가 반응할 수 있는 것에 적합한 어떠한 적합 시약이 사용될 수 있다.
시약의 한 군(group)은 Smith et al, J. Am. Chem. Soc. 2010, 132, 1960-1965, 및 Schumaker et al, Bioconj. Chem., 2011, 22, 132-136에 기재된 비스-할로-(bis-halo-) 또는 비스-티오-말레이미드(bis-thio-maleimides) 및 이들의 유도체이다. 이러한 시약은 하기 기능기를 포함한다:
상기 식에서, 각각의 L은 예를 들면 하기 언급한바 중 하나와 같은, 탈리기이다. 바람직한 탈리기는 예를 들면 염소(chlorine), 브로민 원자(bromine atom) 또는 요오드 원자(iodine atom), -S.CH2CH2OH 기, 및 S-phenyl 기와 같은, 할로겐 원자(halogen atom)를 포함한다. 말레이미드 고리(maleimide ring)의 질소 원자(nitrogen atom)는 진단 시약, 치료 시약 또는 표지화 시약, 또는 진단 시약, 치료 시약 또는 표지화 시약에 대한 결합 시약, 예를 들면 하기에서 언급되는 식 D-Q- 중 하나를 운반할 수 있다.
본 발명의 바람직한 실시예에서, 상기 시약은 하기 기능기를 포함한다:
상기 식에서, W는 전자 끄는 기(전자 끄는 기(electron-withdrawing group)), 예를 들면 케토 기(keto group), 에스테르 기(ester) -O-CO-, 술폰 기(sulfone group) -SO2-, 또는 시아노 기(cyano group)를 나타내며; A는 C1-5 알킬렌(alkylen) 또는 알케닐렌(alkenylene) 사슬을 나타내고; B는 결합 또는 C1-4 알킬렌 또는 알케닐렌 사슬을 나타내며; 및 각각의 L은 독립적으로 탈리기(leaving group)를 나타낸다. 이러한 종류의 시약은 Bioconj. Chem 1990(1), 36-50, Bioconj. Chem 1990(1), 51-59, 및(and) J. Am. Chem. Soc. 110, 5211-5212에 기재된다. W, A, B 및(and) L의 바람직한 의미는 하기에서 주어진 바이다.
이러한 시약은 진단 시약, 치료 시약 또는 표지화 시약, 또는 진단 시약, 치료 시약 또는 표지화 시약에 대한 결합 시약을 운반할 수 있다. 이러한 경우에서, 시약은 화학식 (Ia)를 가질 수 있거나, 여기에서 W는 시아노 기를 나타내는, (Ib)일 수 있다:
상기 Q는 가교 기(linking group)를 나타내며 D는 진단 시약, 치료 시약 또는 표지화 시약, 또는 진단 시약, 치료 시약 또는 표지화 시약에 대한 결합 시약을 나타낸다. 바람직한 Q 군은 하기 화학식 II, III 및 IV에서 주어진다.
이러한 형태의 구체적으로 바람직한 기능기(fuctional group)는 하기 화학식을 가진다:
예를 들면, 상기 기(group)는 하기 화학식을 가질 수 있다:
상기 시약이 진단 시약, 치료 시약 또는 표지화 시약, 또는 진단 시약, 치료 시약 또는 표지화 시약에 대한 결합 시약을 운반할 때, 이는 하기 화학식을 가진다:
여기에서 Q 및 D는 상기 주어진 의미를 가진다. 바람직한 Q 그룹은 화학식 II, III 및 IV를 통해 하기에서 주어진다.
이러한 형태의 구체적으로 바람직한 시약은 하기 화학식을 가진다:
여기에서 Ar은 선택적으로 치환된 페닐 기(phenyl group), 예를 들면 화학식 II, III 및 IV의 성분에 대해서 하기에서 목록화된 것 중 하나를 나타낸다. 예를 들면, 상기 시약, 또는 시약의 전구체는, 하기 화학식의 것일 수 있다:
또는
상기 시약은 진단 시약, 치료 시약 또는 표지화 시약, 또는 진단 시약, 치료 시약 또는 표지화 시약에 대한 결합 시약을 운반하기 위해서 기능화된 것일 수 있다. 예를 들면, 상기 화학식 (Ig)에서 나타나는 NH2 기 또는 화학식 (Ih)의 카르복실 산 기(carboxylic acid group)는 진단 시약, 치료 시약 또는 표지화 시약, 또는 진단 시약, 치료 시약 또는 표지화 시약에 대한 결합기(binding group)에 부착되기 위한 어떠한 알맞은 그룹과 반응하기 위해 사용될 수 있어, 그룹 D-Q-으로써 대체될 수 있는 NH2 기 또는 카르복실산 기가 있는 화학식 (Ig) 또는 (Ih)의 구성 요소로서 주어지거나; 또는 상기 화학식 (If), (Ig) 또는 (Ih)의 페닐 기는 적당한 반응 기를 운반할 수 있다.
접합 시약이 중합체를 포함할 때, 상기 시약은, 본 명세서에서 참조로서 포함되는 문서인, WO 99/45964, WO 2005/007197, 또는(or) WO 2010/100430에서 서술하는 시약 중 하나일 수 있다. 바람직하게 중합체를 포함하는 시약은 상기 기재된 바와 같은 기능기 I을 포함하며, 하기 화학식 II, III 또는 IV 중에 있다:
여기에서 X 및 X' 중 하나는 중합체 및 다른 수소원자를 나타내고;
Q는 가교 기(linking group)를 나타내며;
W는 전자 끄는 기(electron-withdrawing group), 예를 들면 케토 기(keto group), 에스터 기 -O-CO-, 디술폰 기 -SO2-, 또는 시아노 기(cyano group)를 나타내거나; 또는, 만일 X'가 중합체인 경우에는, X-Q-W은 같이 전자 끄는 기를 나타낼 수 있으며;
A는 C1-5 알킬렌 또는 알케닐렌 사슬을 나타내고;
B는 결합 또는 C1-4 알킬렌 또는 알케닐렌 사슬을 나타내며; 및
각각의 L은 독립적으로 탈리기(leaving group)를 나타낸다;
여기에서 X, X', Q, W, A 및 L는 상기 일반식 2에서 주어진 의미를 가지며, 추가로 X가 중합체를 나타낸다면, 사이에 있는 원자(interjacent atom)과 같이 X 및 전자 끄는 기 W는 모두 고리로부터 형성될 수 있고, m은 정수 1 내지 4를 의미한다; 또는
X-Q-W-CR1R1'-CR2.L.L'(Ⅳ)
상기 식에서, X, Q 및 W은 일반식 II에 대해 주어진 의미를 가지며, 각각의
R1은 represents a 수소 원자 또는 C1 -4 알킬 기를 나타내며, R1'은 수소 원자를 나타내고, 각각의 L 및 L'는 독립적으로 탈리기를 나타내거나; 또는
R1은 수소 원자 또는 C1 -4 알킬기를 나타내며, L은 탈리기를 나타내고, R1' 및 L'는 함께 결합을 나타내거나; 또는
R1 및 L은 결합을 함께 나타내고 R1' 및 L'는 결합을 함께 나타내고; 및
R2는 수소원자 또는 C1 -4 알킬기를 나타낸다.
가교 기(linking group) Q는 예를 들면 직접적인 결합, 알킬렌 기 (바람직하게는 C1 -10 알킬렌 기), 또는 선택적으로-치환된 아릴(aryl) 또는 헤테로아릴(heteroaryl) 기, 하나 또는 그 이상의 산소 원자, 황 원자, -NR 기(여기에서 R은 수소 원자 또는 알킬(바람직하게는 C1 -6 알킬), 아릴(바람직하게는 페닐), 또는(or) 알킬-아릴(바람직하게는 C1 - 6알킬-페닐) 기), 케토 기, -O-CO- 기, -CO-O- 기, -O-CO-O, -O-CO-NR-, -NR-CO-O-, -CO-NR- 및/또는 -NR.CO- 기에 의해 종결되거나 방해(interrupted)될 수 있는 어떠한 것일 수 있다. 이러한 아릴 및 헤테로아릴 기인 Q는 본 발명의 하나의 바람직한 실시예에서 형성된다. 적절한 아릴 기는 페닐 및 나프틸 기(naphthyl groups)를 포함하는 반면, 적절한 헤테로아릴 기는 피리딘(pyridine), 파이롤(pyrrole), 퓨란(furan), 파이란(pyran), 이미다졸(imidazole), 파이라졸(pyrazole), 옥사졸(oxazole), 피리다진(pyridazine), 피리미딘(primidine) 및 퓨린(purine)을 포함한다.
-NR.CO- 기로 인접한 중합체 X를 종결하게 하는, 헤테로아릴(heteroaryl) 또는, 구체적으로, 아릴기, 구체적으로 페닐 기이다. 중합체로의 가교(linkage)는 가수분해될 수 있도록 불안정한(labile) 결합의 방법에 의하거나 또는 비-불안정한 결합에 의할 수 있다. W는 예를 들면 케토기 CO, 에스터기 -O-CO- 또는 디술폰 기 -SO2-를 나타내거나; 또는, X-Q-W- 가 함께 전자 끄는 기를 나타내는 경우, 이 그룹은 예를 들면, 시아노기일 수 있다. 바람직하게 X는 중합체를 나타내며, X'-Q-는 수소 원자를 나타낸다.
선택적으로 치환된 아릴 또는 헤테로아릴기를 나타낼 수 있는 치환은 예를 들면 알킬(바람직하게는 C1 - 4알킬, 구체적으로 메틸, 선택적으로 OH 또는(or) CO2H 에 의해 치환된 것), -CN, -NO2, -CO2R, -COH, -CH2OH, -COR, -OR, -OCOR, -OCO2R, -SR, -SOR, -SO2R, -NHCOR, -NRCOR, NHCO2R, -NR.CO2R, -NO, -NHOH, -NR.OH, -C=N-NHCOR, -C=N-NR.COR, -N+R3, -N+H3, -N+HR2, -N+H2R, 할로겐(halogen), 예를 들면 플루오린(fluorine) 또는 염소(chlorine), -C=CR, -C=CR2 및 -C=CHR으로부터 선택된 하나 또는 그 이상의 같거나 다른 치환을 포함하고, 각각의 R은 독립적으로 수소 원자 또는 알킬(바람직하게는 C1 - 6알킬), 아릴(바람직하게는 페닐), 또는 알킬-아릴(aryl) (바람직하게는 C1 - 6알킬-페닐)기를 나타낸다. 전자 끄는 치환의 존재는 구체적으로 바람직하다. 바람직한 치환은 예를 들면 구체적으로 바람직하다. 바람직한 치환은 예를 들면 CN, NO2, -또는, -OCOR, -SR, -NHCOR, -NR.COR, -NHOH 및 -NR.COR을 포함한다.
탈리기 L은 예를 들면 -SR, -SO2R, -OSO2R, -N+R3, -N+HR2, -N+H2R, halogen, 또는 -OØ 나타낼 수 있고, 상기 R은 상기 주어진 의미를 가지며, Ø는 적어도 하나의 전자 끄는 치환기(electron withdrawing substituent)에 포함된, 치환된 아릴기, 구체적으로 페닐 기, 예를 들면 -CN,-NO2, -CO2R, -COH, -CH2OH, -COR, -또는(OR), -OCOR, -OCO2R, -SR,-SOR, -SO2R, -NHCOR, -NRCOR, -NHCO2R, -NR'CO2R, -NO, -NHOH, -NR'OH, -C=N-NHCOR, -C=N-NR'COR, -N+R3, -N+HR2, -N+H2R, 할로겐(halogen), 구체적으로 염소 또는, 구체적으로, 플루오린, -C=CR, -C=CR2 및 -C=CHR를 나타내며, 상기 각각의 R은 독립적으로 상기 주어진 의미 중 하나를 가진다.
보다 구체적으로 바람직한 중합체의 접합체 시약은 하기 화학식을 가진다:
또는
여기에서 PEG는 선택적으로 진단 시약, 치료제, 또는 표지화 시약, 예를 들면 상기 언급된 것들 중 하나, 또는 진단 시약, 치료제, 또는 표지화 시약에 결합할 수 있는 결합 시약을 운반할 수 있다.
상기 기재된 시약 중 하나를 사용하는 접합체 공정의 중간체 산물(immediate product)은 전자 끄는 기 W를 포함하는 접합체이다. 그러나, 본 발명의 공정은 적절한 조건에서 가역적이다. 이것은 예를 들면, 항체의 빠른 방출이 필요한 곳과 같은 몇몇의 적용방법에 대하여 바람직할 수 있지만, 다른 적용방법에 있어서, 항체의 빠른 방출은 바람직하지 않을 수 있다. 그러므로 단백질의 분비를 막는 부분을 주는 전자 끄는 부분 W의 감소에 의해서 접합체를 안정화하는 것이 바람직할 수 있다. 따라서, 상기 기재된 방법은 접합체 내에서 전자 끄는 기 W의 감소의 추가적으로 선택적 단계를 포함할 수 있다. 수소화붕소(borohydrid), 예를 들면 수소화붕소 나트륨(sodium borohydrid), 시안화수소화붕소 나트륨(sodium cyanoborohydride), 수소화 붕소 칼륨(potassium borohydrid) 또는 트리아세토옥시수소화 붕소 나트륨(sodium triacetoxyborohydride)의, 감소 시약으로서의 사용은 매우 바람직하다. 사용될 수 있는 다른 감소 시약은 예를 들면 예를 들면 염화 제일주석 염화주석(II)(tin(II) chloride), 및 알루미늄 알콕시화물(aluminium alkoxide), 및 리튬 알루미늄 수소화물(lithium aluminium hydride)과 같은 알콕시화물(alkoxides)을 포함한다.
또한, 예를 들면, 케토 기를 포함하는 부분 W는 CH(OH) 기를 포함하는 부분으로 감소될 수 있다; 에테르 기 CH.OR는 에테르화 하는 시약과 히드록시 기(hydroxy group)의 반응을 통해 수득될 수 있거나; 에테르 기 CH.O.C(O)R는 아실화 시약(acylating agent)와 히드록시기의 반응을 통해 수득될 수 있거나; 아민 기 CH.NH2, CH.NHR 또는 CH.NR2는 환원적 아민화(reductive amination)에 의해 케톤(ketone)으로부터 제조될 수 있거나; 아미드(amide) CH.NHC(O)R 또는 CH.N(C(O)R)2는 아민의 아실화에 의해 형성될 수 있다. 디술폰(disulfone)는 디술폭시드(desulfoxide), 황화물(sulfide) 또는 티올 에테르로 환원될 수 있다. 시아노 기는 아민 기로 환원될 수 있다.
따라서, 예를 들어, 케토 기를 포함하는 부분 W는 CH(OH) 기를 포함하는 부분이 감소될 수 있거나; 에테르 기 CH.OH는 에테르화 물질(etherifying agent)을 가지는 수산기(hydroxy group)의 반응에 의해 수득될 수 있거나; 에스터 기 CH.O.C(O)R는 아실화 물질(acylating agent)을 가지는 수산기의 반응에 의해 수득될 수 있거나; 아민 기 CH.NH2, CH.NHR 또는 CH.NR2는 환원적 아민화(reductive amination)에 의한 케톤으로부터 제조될 수 있거나; 또는 아미드 CH.NHC(O)R 또는 CH.N(C(O)R)2은 아민의 아실화에 의해 형성될 수 있다. 술폰은 술폭시화물(sulfoxide), 황화물(sulfide) 또는 티올 에테르(thiol ether)로 축소시킬 수 있다. 시안 기는 아민 기로 축소시킬 수 있다.
상기 기재된 접합체 시약을 사용하는 주요한 형태는 α-메틸렌 탈리기 및 이중 결합이 Michael 활성 부분으로서 작용하는 전자 끄는 기능(function)을 가지며 교차-접합되는 것이다. 만일 탈리기가 직접적인 이동보다 교차-기능적인 시약에서 제거되는 경향이 있고 전자 끄는 기가 마이클 반응(Michael reaction)에 대해 적절한 활성 부분이라면 순차적인 분자 내 이-알킬화(bis-alkylation)는 순차적 마이클 반응 및 역 마이클 반응(retro Michael reaction)에 의해 나타날 수 있다. 탈리되는 부분은 최초의 알킬화가 일어나고 이-알킬화가 순차적이고 상호적인 마이클 반응 및 역-마이클 반응으로부터 결과할 때까지 나타나지 않는 잠재적으로 접합된 이중 결합을 감추는 것을 제공한다. 전자 끄는 기 및 탈리기는 적절하게 선택되어 이-알킬화가 순차적인 마이클 반응 및 역-마이클 반응에 의해 나타날 수 있다. 이는 또한 이중 결합 또는 탈리기와 전자 끄는 기 사이를 접합하는 추가적인 다가 결합을 가지는 교차-기능적인 알킬화제(alkylating agent)를 만들 수 있다.
일반적으로, 접합 시약 내의 항체의 반응은 항체 내의 경첩 이황화결합의 감소 및 접합 시약과 함께 감소된 산물의 지속적인 반응에 관련된다. 적절한 반응 조건은 상기 언급된 선행 문헌에서 주어진다. 공정은 예를 들면 모든 반응이 모든 반응이 수용성인 용매 또는 용매 혼합물 내에서 수행될 수 있다. 항체는 수용성 반응 배지 내에서 접합체 시약과 직접적으로 반응할 수 있도록 할 수 있다. 이러한 반응 배지는 또한 친핵체(nucleophile)의 pH 요구 조건에 따라, 완충적일 수 있다. 반응에 대한 최적 pH는 일반적으로 적어도 4.5에서, 구체적으로 약 5.0 내지 약 8.5 사이에서, 바람직하게는 약 5.0 내지 7.5일 것이다. 최적 반응 조건은 당연하게 특이적인 반응에 따라서 의존적일 수 있다.
반응 온도는 3 내지 37℃가 일반적으로 사용될 수 있다. 유기 용매(예를 들면 THF, 에틸 아세테이트(ethyl acetate), 아세톤) 내에서 반응 조건은 전형적으로 주변 온도까지 이루진다.
항체는 화학양론적(stoichiometric)으로 동등하거나 또는 과도한 시약을 사용하여 원하는 시약과 효과적으로 접합될 수 있다. 시약은, 예를 들면, 항체의 내부-사슬 이황화결합의 수에 대한 시약의 화학양론적 비율에서 사용될 수 있다. 예를 들면, 시약은 항체의 내부-사슬 이황화결합 당 0.25 내지 4 당량(equivalent)의 양에서, 예를 들면 0.5 내지 2 당량에서 또는 0.5 내지 1.5 당량에서 사용될 수 있다. 시약은, 예를 들면, 항체의 내부-사슬 이황화결합 당 약 1 당량의 양에서 사용될 수 있다. 과잉 시약 및 산물은 예를 들면 표준적인 크로마토그래피 방법, 예를 들면 이온 교환 크로마토그래피, 또는 크기 배제 크로마토그래피, 투석(diafiltration), 또는, 다가 히스티딘 표지(polyhistidine tag)가 존재할 때, 예를 들면 니켈 또는 아연에 기반한, 금속 친화 크로마토그래피를 이용한 분리에 의한 것과 같은 일반적인 정제방법의 동안에 쉽게 분리될 수 있다.
상기 포함된 중합체에서 나타난 바와 같은 화학식 II, III 및 IV의 접합체 시약에 비해, 당업계의 숙련된 사람은 상기 논한 것이 기능기 I을 포함하는 시약을 사용하는 본 발명의 공정과 부합되는 항체에 대한 어떠한 진단 시약, 치료 시약 또는 표지화 시약의 접합체에 대해 동등하게 사용될 수 있다는 것을 인지할 수 있다.
본 발명의 공정은 1, 2, 또는 3 개의 접합 시약, 즉, 항체의 경첩 영역 내의 단일 내부-중쇄 이황화결합에 걸쳐서 및 항체의 경쇄의 CL 도메인 및 중쇄의 CH1 도메인 간에 위치하는 내부사슬 이황화결합에 걸쳐 효과적으로 접합되는 항체를 만들 수 있다. 본 발명에 따른 바람직한 접합체는 항체 당 3 개의 접합된 분자를 포함한다. 구체적으로 바람직한 접합체는 항체 당 3 개의 접합된 약물 또는 진단 분자를 포함한다. 약물/진단 시약은 이미 약물/진단 시약을 운반하는 접합 시약을 사용함에 따라 항체를 직접적으로 접합시킬 수 있거나, 또는 예를 들면 약물/ 진단 시약에 대한 접합기를 포함하는 접합 시약의 사용에 의해 약물/진단 시약을 항체를 가지는 접합 시약의 접합체를 후에 추가할 수 있다.
본 발명의 공정은 따라서 항체 접합체가 향상된 균일성을 가지도록 제조될 수 있게 한다. 구체적으로, 항체의 내부사슬 이황화결합에 걸쳐 결합하는 접합 시약의 사용은 향상된 로딩 화학양론을 가지는 항체 접합체를 제공하여, 부착에 특이적인 위치를 가지고, 항체의 본래의 내부사슬 이황화결합이 파괴되지 않도록 한다. 접합 시약에 의한 본래의 이황화결합의 가교는 또한 항체 접합체에 대한 안전성을 향상시키고 항체 결합 및 기능을 유지한다. 예를 들면 226 또는 229 중 어느 하나의 위치에서, 단일 내부-중쇄 이황화결합을 가지는 항체의 사용은 이황화결합 혼동을 감소시킨다. 이황화 혼동, 말하자면, 이황화결합 내로 시스테인 쌍이 부적절하게 결합되는 것은 항체의 항원-결합 능력에 영향을 미치고 활성을 감소시키는 것으로 알려져 있다. 본 발명의 사용에 의해 최소화된 혼동은 접합된 항체의 균일성을 향상시킨다.
향상된 균일성을 가지는 항체-약물 접합체는 치료에서, 예를 들면 약물의 높은 치료 지표, 향상된 효능 및 감소된 독성과 같은 이득을 제공한다. 균일한 항체 접합체는 또한 진단 및 영상화 적용에서 더욱 정밀하고 일관된 측정을 제공한다.
본 발명의 공정은 또한 항체 접합체가 항체의 4차적인 구조의 파괴를 가져오지 않는 더 낮은 수준의 약물 투여량, 즉, 더 낮은 항체에 대한 약물 비율(drug to antibody ratio, DAR)로 만들어지도록 한다. 시험관 내에서 항체-약물 접합체의 효능이 약물 투여량에 직접적으로 의존적인 것이 나타나 있음에도 불구하고(Hamblett KJ, et al., Clin Cancer Res. 2004 Oct 15;10(20):7063-70) in-vivo antitumour activity of 항체-drug 접합체 with 분자 당 4 약물(DAR 4)을 가지는 항체-약물 접합체의 생체-내 항종양 활성은 동량의 mAb에서 분자 당 8 약물(DAR8)을 가지는 접합체, 심지어는 mAb 당 약물의 양을 절반으로 포함하는 접합체와 비교될 수 있다. 약물-투여량은 또한 DAR 8 접합체가 DAR 4 접합체보다 3-배 빠르고 DAR 2 접합체보다 5-배 빠르게 깨끗해질 수 있도록, 혈장 청소(plasma clearance)에 영향을 받는다. 항체-약물 접합체의 치료 가능성을 최대화하기 위해 높은 치료 지표가 요구되며, 따라서 효능에 있어 감소를 가지지 않는 치료 지표의 증가는 치료법의 향상으로 이어져야 한다(Hamblett KJ, et al., 2004).
본 발명의 공정에 의해서 제조된 항체 접합체는 신규하며, 본 발명은 따라서 이러한 접합체 그 자체뿐 아니라 본 발명의 공정으로 제조된 항체 접합체를 제공한다. 본 발명은 더 나아가 약학적으로 허용 가능한 담체를 가지고, 선택적으로 부가적인 치료제를 함께 가지는, 상기 항체 접합체를 포함하는 약학적 조성물; 약제로서 사용하기 위한 상기 접합체, 구체적으로, 암의 치료를 위한 약제로서의 접합 시약은 세포독성 시약을 포함하고; 및 환자에게 상기 접합체 또는 약학적 조성물의 약학적으로 효과적인 양을 투여하는 것을 포함하는 환자 치료 방법을 제공한다.
본 발명은 이제 하기에 나타난, 도면에 따라 참고될 수 있는 예시의 방법으로 기술될 수 있다:
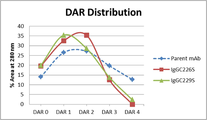
도 1은 중합에 의한 접합 시약 및 i) a 모항체(parent antibody)("parent mAb"), ii) 229번 위치에서 단일의 경첩 이황화결합을 가지는 조작된 항체("IgGC226S"), 및 iii) 226 번 위치에서 단일의 경첩 이황화결합을 가지는 조작된 항체("IgGC229S")를 사용하여, 40℃에서 수행되는 접합체 반응에 대한 약물-항체 비율(drug-antibody ratio, DAR) 분포를 나타낸다.
도 2는 중합에 의한 접합 시약 및 i) a 모항체(parent antibody)("parent mAb"), ii) 229번 위치에서 단일의 경첩 이황화결합을 가지는 조작된 항체("IgGC226S"), 및 iii) 226 번 위치에서 단일의 경첩 이황화결합을 가지는 조작된 항체("IgGC229S")를 사용하여, 22℃에서 수행되는 접합체 반응에 대한 약물-항체 비율(drug-antibody ratio, DAR) 분포를 나타낸다.
도 3은 모항체 및 중합에 의한 접합 시약을 처리하기 전-(pre-) 및 후-(post-)의 항체 변이체 IgGC226S의 SDS-PAGE 분석을 나타낸다.
도 1은 중합에 의한 접합 시약 및 i) a 모항체(parent antibody)("parent mAb"), ii) 229번 위치에서 단일의 경첩 이황화결합을 가지는 조작된 항체("IgGC226S"), 및 iii) 226 번 위치에서 단일의 경첩 이황화결합을 가지는 조작된 항체("IgGC229S")를 사용하여, 40℃에서 수행되는 접합체 반응에 대한 약물-항체 비율(drug-antibody ratio, DAR) 분포를 나타낸다.
도 2는 중합에 의한 접합 시약 및 i) a 모항체(parent antibody)("parent mAb"), ii) 229번 위치에서 단일의 경첩 이황화결합을 가지는 조작된 항체("IgGC226S"), 및 iii) 226 번 위치에서 단일의 경첩 이황화결합을 가지는 조작된 항체("IgGC229S")를 사용하여, 22℃에서 수행되는 접합체 반응에 대한 약물-항체 비율(drug-antibody ratio, DAR) 분포를 나타낸다.
도 3은 모항체 및 중합에 의한 접합 시약을 처리하기 전-(pre-) 및 후-(post-)의 항체 변이체 IgGC226S의 SDS-PAGE 분석을 나타낸다.
실시예
1:
변이체
항체-약물 접합체의 제조
단일 내부-중쇄 이황화결합을 각각 가지는, 2 개의 조작된 항체 변이체는 본 발명의 공정이 항체 접합체(conjugate)를 높은 수준의 균일성에서 낮은 DAR 평균을 가지도록 생산되는지 나타내기 위해 모항체 서열의 PCR-기반의 위치 지정 돌연변이(site-directed mutagenesis)에 의해 만들었다. 이러한 항체 변이체 및 모항체는 그런 다음 접합 시약(비스-술폰-PEG(24)-val-cit-PAB-MMAE)으로 반응하여 이황화결합으로부터 유래된 2 개의 시스테인 잔기 사이에서 가교를 형성하였다.
말단의
비스
-
술폰
기능성(bis-
sulfone
functionality)이 있는 24 개의 반복되는 PEG 단위체를 가지는 발린-
시트로린
-
파라아미노벤질
-
모노메틸
오리스타틴
E(valine-citroline-paraaminobenzyl-monomethyl
auristatin
E, val-cit-PAB-MMAE) 시약 1의 합성.
단계 1: H2N-dPEG(24)-CO-OtBu로 4-[2,2-비스[(p-톨릴디술포닐)-메틸]아세틸]벤조 산-N-하이드록시 숙시니미딜 에스터(비스-디술폰)(4-[2,2-bis[(p-tolylsulfonyl)-methyl]acetyl]benzoic acid-N-hydroxy succinimidyl ester (bis-sulfone))의 접합.
H2N-dPEG(24)-CO-OtBu(1.057 g, Iris Biotech 사)의 톨루엔(3 mL) 용액은 건조를 위해 증발되어 잔기를 디클로로메탄(dichloromethane (25 mL))에 재-용해하였다. 교반 하에서, 4-[2,2-비스[(p-톨릴디술포닐)-메틸]아세틸]벤조 산-N-하이드록시 숙시니미딜 에스터(1.0 g; Nature Protocols, 2006, 1(54), 2241-2252)을 더하고 결과된 용액을 추가로 실온에서 아르곤 기압 하 72 시간 동안 교반하였다. 휘발류(volatile)는 진공에서 제거되어 고형 잔여물은 따뜻한 아세톤(30 mL)에 용해되어 비-흡수성 탈지면(non-absorbent cotton wool)을 통해서 여과하였다. 여과물은 -80℃에서 냉각하고 -9℃, 4000 rpm에서 30 분 동안 원심분리하여 분리된 고형물을 제조하였다. 상층액을 제거하고 침전/분리 과정을 2 회 추가로 반복하였다. 최종적으로 상층액은 제저하고 결과된 고형물은 무색의 무정형 고체로서 비스-술폰을 얻기 위해 진공에서 건조되었다(976 mg, 68%). 1HNMR ∂H(400 MHz CDCl3)1.45(9H, s, OtBu), 2.40-2.45(8H, m, Ts-Me 및 CH2 COOtBu), 3.40-3.46(2H, m, CH2-Ts), 3.52-3.66(m, PEG 및 CH2-Ts), 4.27(1H, q, J 6.3, CH-COAr), 7.30(4H, d, J 8.3, Ts), 7.58(2H, d, J 8.6, Ar), 7.63(4H, d, J 8.3, Ts), 7.75(2H, d, J 8.6, Ar).
단계 2. 터트-부틸 보호기(tert-butyl protection group)의 제거:
디클로로메탄(4 mL) 내 단계 1의 산물(976 mg)을 교반하는 용액에 트리플루오르아세틱 산(4 mL)을 더하고 결과된 용액을 추가로 2 시간 동안 교반하였다. 그런 다음 휘발류는 진공에서 제거되어 잔여물은 따뜻한 아세톤(30 mL)에 용해되었다. 산물은 단계 1에 기재된 바에 따라 아세톤으로부터 침전으로 분리하여 흰색 파우더로서 산물 2를 제공하도록 하였다(816 mg, 85%). 1HNMR ∂H(400 MHz CDCl3) 2.42(6H, s, Ts-Me), 2.52(2H, t, J 6.1, CH2-COOH), 3.42(4H, dd, J 6.3 & 14.5, CH2-Ts), 3.50-3.64(m, PEG), 3.68-3.73(4H, m, PEG), 4.23-4.31(1H, m, CH-COAr), 7.29(2H, d, J 8.1, Ar), 7.55-7.65(6H, m, Ar 및 Ts), 7.77(2H, d, J 8.2, Ar)
단계 3: 접합체 H2N-val-cit-PAB-MMAE를 산 말단의 PEG화된 비스-술폰 2에 접합
N-메틸 모르폴린(N-methyl morpholine)(7.5 mg)은 디클로로메탄-디메틸포름아미드(85:15 v/v, 6 mL) 내 비스-술폰-PEG-COOH(45 mg) 및 HATU(13 mg)의 교반되는 용액(45 mg)에 가하였다. 실온에서 30 분 동안 교반한 뒤, H2N-val-cit-PAB-MMAE(38 mg, Concortis 사, WO 2005/081711에 기재된 대로 제조함)을 가하고 추가로 혼합물을 24 시간 동안 실온에서 교반하였다. 반응 혼합물은 디클로로메탄으로 희석하여 1 M HCl, 10%(w/v) NaHCO3 수용액, 소금저장액(brine)으로 세척한 다음 MgSO4로 건조하였다. 가공하지 않은 물질(crude material)은 추가로 디클로로메탄-메탄올(90:10 v/v)로 용출하는 컬럼 크로마토그래피를 통해 정제되었고, 용매는 진공 하에서 제거하여, 비스-술폰-PEF(24)-MMAE 산물 1은 투명한 무색 고형(31 mg, 41%)으로 분리되었다 m/zM+Na 2758.5; 1HNMR ∂H에 대한 진단 신호(diagnostic signal)(400 MHz CDCl3)0.60-0.99(m, 지방족 측쇄(aliphatic side chains)), 2.43(s, Me-Ts), 3.36-3.66(m, PEG), 7.15-7.28(m, Ar), 7.31(d, J 8.3, Ar), 7.54-7.62(m, Ar), 7.79(d, J 8.3, Ar).
모항체
및 항체
변이체(IgGC226S 및 IgGC229S)의
제조.
인간 IgG1(κ) 골조(framework)에 기반하여 유래된, 인간화 항-Her2 수용체 단일클론 항체 변이체(트라스투주맙 항체(trastuzumab))를 암호화하는 모항체 DNA 서열의 구축은, Carter P. et al. Proc. Natl Acad. Sci. USA, 89, 4285-4289(1992)에서 이전 기재되어 있으며, 상기 항체는 humAb4D5-8로 언급된다. 본 발명 실시예의 목적을 위해서, 중쇄 아미노산 서열의 359 및 361 번째 서열의 아미노산은 Asp 및 Leu로 각각 치환되었다(E359D 및 M361L). 본 발명 실시예에서 사용된 모항체의 경쇄 및 중쇄 아미노산 서열은 또한 본 명세서에서 각각 서열번호: 1 및 2로 나타난다. 모항체의 경첩 영역(경첩영역 서열: PKSCDKTHTCPPCP)에 있어서 2 개의 시스테인은 항체의 2 개의 중쇄 간에 내부-사슬 이황화결합을 형성한다. 이러한 시스테인 잔기는 EU-지표 번호화 시스템에 따라 IgG1의 226 번 및 229 번 위치에 대응하며, 서열번호: 2의 229 번 잔기 및 232 번 잔기이다.
2 개의 조작된 항체 변이체(IgGC226S 및 IgGC229S)는 아미노산 Ser을 가지는 경첩 영역에서 내부-중쇄 시스테인 잔기 중 하나가 치환된 모항체 중쇄 서열의 PCR-기반의 위치-특이적 돌연변이(site-directed mutagenesis)에 의해 만들어졌다. 사용된 PCR 방법은 Ho et al. Gene, 77(1989) 51-59에서 기재된 바와 같은 프라이머 중첩 연장(primer overlapping extension)이며, 경첩 영역 서열에서 변경(modification)이 유도되었다. PCR 프라이머 올리고뉴클레오티드는 항체 개체의 암호화 서열 내부로 뉴클레오티드 변화가 포함되도록 짜였다. Cys226Ser 변이체에서, 코돈의 변화는 TGC(Cys)로부터 AGC(Ser)였다. Cys229Ser 변이체에 있어서, 코돈의 변화는 TGC(Cys)로부터 AGT(Ser)였다. 새로운 서열은 중쇄의 다른 부분을 포함하는, 중쇄 발현 벡터 내로 돌아가 클로닝되었다. 최종적인 구축체(돌연변이 이후)는 삽입체의 전장 서열에 의해 검증되었다.
새롭게 생성된 중쇄 구축체는 대응하는 경쇄 구축체와 함께 폴리에틸렌이민(polyethylenimine)(PEI)을 사용하여 HEK293 세포 내로 공동-감염되어, 6일의 일시적 배양에서 발현하고, “Transient Expression in HEK293-EBNA1 Cells, Chapter 12, in Expression Systems (eds. Dyson and Durocher). Scion Publishing Ltd., Oxfordshire, UK, 2007의 프로토콜에 기반하여, 단백질 A의 결합 및 크기 배제 크로마토그래피를 통해 정제하였다.
모항체
및 항체
변이체로의
비스
-
술폰
-PEG(24)-val-cit-
PAB
-
MMAE
의 접합.
내부-사슬 이황화결합 당 중합에 의한 접합 시약인 비스-술폰-PEG(24)-val-cit-PAB-MMAE의 1, 1.5 또는 2 당량으로 항체 변이체의 접합이 항체 환원(reduction) 이후에 수행되었다. 환원 반응은 22℃ 또는 40℃ 중 어느 하나에서, 1 시간 동안 10 mM DTT를 이용해 4.7 mg/mL 항체 농도에서 수행되었다. 완충용액 교환은 과도한 환원물을 제거하기 위해 각각의 항체 변이체에 대해 수행되었다. 중합에 의한 접합 시약은 pH 8의 50% 아세토니트릴 수용액에서 접합 바로 직전에 제조하였다. 접합 동안의 항체 농도는 3 mg/mL이었고 반응은 40℃ 또는 22℃ 중 어느 하나에서 밤새도록(16 시간) 수행되었다. 접합 반응에 대한 반응 조건은 하기 [표 1]에 요약되어있다:
"IgGC226S" 변이체는 226 번 위치에서 Cys에서 Ser로의 치환을 가지며, 따라서 229 번 위치에서 단일 내부 중쇄 이황화결합을 가진다. "IgGC229S" 변이체는 229 번 위치에서 Cys에서 Ser로의 치환을 가지며, 따라서 226 번 위치에서 단일 내부 중쇄 이황화결합을 가진다. 완충 용액 변경 이후에, 각각의 반응은 280 nm에서의 피크의 % 면적을 이용해 약물 투여량의 화학양론을 결정하기 위해, 이전에 기재된 바에 따라 소수성 상호작용 크로마토그래피(Hydrophobic Interaction Chromatography, HIC)에 의해 분석되었다. 제조된 항체-약물 접합체의 평균 항체로의 약물의 비율(Drug to antibody ration, DAR) 및 약물 접합 종류의 분포(DAR 1-3)는 [표 2]에서 나타낸다.
| 반응 | 평균DAR | DAR 1-3 | 반응 | 평균DAR | DAR 1-3 |
| 1 | 1.41 | 80% | 7 | 1.43 | 78% |
| 2 | 1.99 | 89% | 8 | 1.76 | 83% |
| 3 | 2.42 | 87% | 9 | 2.65 | 76% |
| 4 | 1.33 | 79% | 10 | 1.26 | 76% |
| 5 | 1.96 | 90% | 11 | 2.11 | 88% |
| 6 | 2.40 | 89% | 12 | 2.50 | 83% |
[표 2]에서 나타난 결과와 같이, 본 발명의 가정은 항체가 높은 수준의 균일성에서, 낮은 평균 DAR를 가지도록 효과적으로 접합될 수 있게 한다. 낮은 평균 DAR를 가지는 항체-약물 접합체는, 높은 평균 DAR을 가지는 접합체에 비해, 감소된 제거 비율(clearance rate), 높은 치료 지표 및 낮은 독성을 포함하는, 약간의 유익한 장점을 가진다.
실시예
2: DAR 분포의 분석
실시예 1에서, 단일-경첩 이황화 변이체에 대한 가장 낮은 평균 DAR는 40℃(반응 1 및 7) 및 22℃(반응 4 및 10) 둘 다에서, 내부-사슬 이황화결합 당 중합에 의한 접합 시약의 1 당량을 이용하였을 때 수득되었다. 모항체를 사용하여 수득될 수 있는 것과 이러한 결과를 비교하였을 때, 모항체는 실시예 1 에 사용하여 접합된다.
모항체, IgGC226S 및 IgGC229S에 대한 평균 DAR은 [표 3]에 나타난다.
| 접합 온도 | 모항체 | IgGC226S | IgGC229S |
| 40℃ | 1.91 | 1.41 | 1.43 |
| 22℃ | 1.89 | 1.33 | 1.26 |
표 3의 결과에서 나타난 바와 같이, 모항체에 대한 평균 DAR은, 40℃ 또는 22℃ 모두에서 단일-경첩 이황화물 변이체인 IgGC226S 및 IgGC229S에 비해 유의적으로 높았다.
접합 반응에 의해 생산된 항체-약물 접합체 종류의 분포 곡선 또한 DAR 분포를 결정하기 위해 분석되었다. 낮은 평균 DAR에 따라서, 이는 모항체 사용 하에서 제조된 것보다 감소된 이질성(heterogeneity) 및 증진된 수율을 가지는 항체-약물 접합체(IgGC226S 및 IgGC229S)를 얻은 본 발명의 공정을 도 1(40℃에서의 접합) 및 도 2(22℃에서의 접합)으로부터 나타낼 수 있다. 향상된 균일성을 가지는 항체-약물 접합체는 가능한 화학양론의 혼합물보다 적은 정체를 요구하고, 낮은 독성 및/또는 개선된 약물동력학을 나타내고, 및 그렇게 함으로써 높은 약물-투여 종의 부재로 기인되는 향상된 효능을 나타낸다.
실시예
3:
모항체와
비스
-
술폰
-PEG(24)-val-cit-
PAB
-
MMAE
의 접합 및 항체 변이체
IgGC226S
:
IgGC226S
와 함께 내부사슬 가교의 높은 유지(retention).
모항체 및 내부-사슬 이황화결합 당 1 몰의 동등한 접합체 시약인 비스-술폰-PEG(24)-val-cit-PAB-MMAE을 가지는 단일-경첩 이황화물 변이체 IgGC226S의 접합체는 항체 반응 후에 수행되었다(TCEP, 내부사슬 이황화물 당 동등한 1 몰, 15 분, 40℃). 접합체 시약은 접합 바로 이전에 DMSO(반응 용액 내에 5% (v/v) DMSO로 주어지도록) 내에 제조되었다. 접합 동안의 항체 농도는 4 mg/mL이었다. 반응은 40℃에서 밤새도록(16 시간) 수행된 후, 실온에서 1 시간 동안 10 mM DHA로 반응 혼합물을 처리한 다음 SDS-PAGE로 분석되었다. SDS-PAGE 겔은 인스탄블루™(InstantBlue™)로 염색되어 레인(lane) 내에 나타난 각각의 종류의 %를 결정하기 위해 IMAGEQUANT™ LAS 4010 장치(GE Healthcare 사)를 사용해 영상화하였다. SDS-PAGE 결과는 도 3에서 나타낸다. 도 3에서, M으로 표시된 레인은 노벡스 단백질 표준물질(Novex protein Standards)(Invitrogen)을 나타낸다. 레인 1 및 2는 각각 IgGC226S 전- 및 후- 접합 반응의 이동 양상(migration profile)을 나타낸다. 레인 3 및 4는 모항체에 대한 등가 반응(equivalent reaction)을 나타낸다. 항체의 중쇄에서 중쇄 간 내부사슬 이황화가 따르는 접합체에 공유적으로 가교되지 않는, 예를 들면, 이황화결합 혼동에 기인한 것과 같을 때, 중쇄-경쇄 이량체(H + L)의 80 kDa 마커의 바로 아래 밴드는 SDS-PAGE를 통해 시각화할 수 있다. 대조적으로, 중쇄에서 중쇄 간 내부사슬 이황화가 따르는 접합체에 가교될 때, 항체 중쇄-경쇄 4량체의 160 kDa 마커 바로 위의 밴드는 시각화된다. 레인 2와 4를 비교하면, 이는 단일 내부 중쇄 이황화결합을 가지는, IgGC226S로의 접합은, 단일 내부 중쇄 이황화를 지녀, 모항체와 비교하였을 때 2 개의 중쇄 간 가교의 높은 정도를 나타내어, 2 개의 내부 중쇄 이황화(항체 중쇄-경쇄 4량체의 각각 80% 및 67%) 및 중쇄-경쇄 이량체 형성의 낮은 정도(각각 17% 및 31%)를 가지는 것으로 나타날 수 있다. 본 발명의 공정은 따라서 내부-중쇄 이황화결합의 효과적인 가교에 의하여 항체 접합체의 안정성을 향상시킨다.
[서열 목록]:
<110> Polytherics Limited
<120> Novel Process for Preparation of Antibody Conjugates and Novel
Antibody Conjugates
<130> 2014FPI-11-005
<150> PCT/GB 2013/051593
<151> 2013-06-19
<150> GB 1210838.7
<151> 2012-06-19
<150> GB 1306706.1
<151> 2013-04-12
<160> 17
<170> KopatentIn 2.0
<210> 1
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> sequence is synthesised
<400> 1
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 2
<211> 450
<212> PRT
<213> Artificial Sequence
<220>
<223> sequence is synthesised
<400> 2
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 3
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody varient
<400> 3
Cys Pro Pro Ser
1
<210> 4
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody varient
<400> 4
Ser Pro Pro Cys
1
<210> 5
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody varient
<400> 5
Cys Pro Ser Ser
1
<210> 6
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody varient
<400> 6
Ser Pro Ser Cys
1
<210> 7
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody varient
<220>
<221> PEPTIDE
<222> (2)..(3)
<223> Xaa is independently selected from any amino acid lacking a thiol
moiety
<400> 7
Cys Xaa Xaa Ser
1
<210> 8
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody varient
<220>
<221> PEPTIDE
<222> (2)..(3)
<223> Xaa is independently selected from any amino acid lacking a thiol
moiety
<400> 8
Ser Xaa Xaa Cys
1
<210> 9
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody varient
<220>
<221> PEPTIDE
<222> (2)..(6)
<223> Any 3 or more residues are present
<220>
<221> PEPTIDE
<222> (2)..(6)
<223> Xaa is independently selected from any amino acid lacking a thiol
moiety
<400> 9
Cys Xaa Xaa Xaa Xaa Xaa Ser
1 5
<210> 10
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody varient
<220>
<221> PEPTIDE
<222> (2)..(6)
<223> Any 3 or more residues are present
<220>
<221> PEPTIDE
<222> (2)..(6)
<223> Xaa is independently selected from any amino acid lacking a thiol
moiety
<400> 10
Ser Xaa Xaa Xaa Xaa Xaa Cys
1 5
<210> 11
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody varient
<220>
<221> PEPTIDE
<222> (3)..(5)
<223> Any 1 or more residues are present
<220>
<221> PEPTIDE
<222> (3)..(5)
<223> Xaa is independently selected from any amino acid lacking a thiol
moiety
<400> 11
Cys Pro Xaa Xaa Xaa Pro Ser
1 5
<210> 12
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody varient
<220>
<221> PEPTIDE
<222> (3)..(5)
<223> Any 1 or more residues are present
<220>
<221> PEPTIDE
<222> (3)..(5)
<223> Xaa is independently selected from any amino acid lacking a thiol
moiety
<400> 12
Ser Pro Xaa Xaa Xaa Pro Cys
1 5
<210> 13
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody varient
<220>
<221> PEPTIDE
<222> (4)..(6)
<223> Any 1 or more residues are present
<220>
<221> PEPTIDE
<222> (4)..(6)
<223> Xaa is independently selected from any amino acid lacking a thiol
moiety
<400> 13
Cys Pro Pro Xaa Xaa Xaa Ser
1 5
<210> 14
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody varient
<220>
<221> PEPTIDE
<222> (4)..(6)
<223> Any 1 or more residues are present
<220>
<221> PEPTIDE
<222> (4)..(6)
<223> Xaa is independently selected from any amino acid lacking a thiol
moiety
<400> 14
Ser Pro Pro Xaa Xaa Xaa Cys
1 5
<210> 15
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody varient
<220>
<221> PEPTIDE
<222> (2)..(4)
<223> Any 1 or more residues are present
<220>
<221> PEPTIDE
<222> (2)..(4)
<223> Xaa is independently selected from any amino acid lacking a thiol
moiety
<400> 15
Cys Xaa Xaa Xaa Pro Pro Ser
1 5
<210> 16
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody varient
<220>
<221> PEPTIDE
<222> (2)..(4)
<223> Any 1 or more residues are present
<220>
<221> PEPTIDE
<222> (2)..(4)
<223> Xaa is independently selected from any amino acid lacking a thiol
moiety
<400> 16
Ser Xaa Xaa Xaa Pro Pro Cys
1 5
<210> 17
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> hinge region of antibody varient
<400> 17
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10
Claims (25)
- 이황화결합(disulfide bond)으로부터 유래된 2 개의 시스테인 잔기 간 가교(bridge)를 형성하는 접합 제제와 함께 단일 내부-중쇄 이황화결합을 가지는 조작된 항체를 반응하는 단계를 포함하는 항체 접합체(conjugate)의 제조를 위한 공정.
- 제 1항에 있어서, 상기 항체는 IgG1 또는 IgG4 분자인 공정.
- 제 1 또는 2항에 있어서, 상기 항체는 재조합 발현 또는 화학적 합성으로 제조되는 공정.
- 제 3항에 있어서, 하기를 포함하는 공정:
a) 결실 또는 시스테인을 제외한 다른 아미노산으로 하나 또는 그 이상의 내부-중쇄 시스테인 잔기의 치환을 결과하는, 모항체(parent antibody)를 암호화하는 핵산 서열의 변이;
b) 발현 시스템에서 핵산의 발현; 및
c) 조작된 항체를 분리.
- 제 4항에 있어서, 위치 선택적 돌연변이(site directed mutagenesis)는 모항체의 암호화된 서열 내로 뉴클레오티드 변화가 통합되도록 수행되는 것인 공정.
- 상기 청구항 중 어느 한 항에 있어서, 상기 단일 내부-중쇄 이황화결합은 EU-지표 번호화 시스템(EU-index numbering system)에 따라 항체의 226 또는 229번 위치인 공정.
- 상기 청구항 중 어느 한 항에 있어서, 상기 항체는 EU-지표 번호화 시스템에 따라 226번 위치에서 시스테인(cystein)을 가지고 229번 위치에서 시스테인 외의 아미노산을 가지거나, EU-지표 번호화 시스템에 따라 226번 위치에서 시스테인 외의 아미노산을 가지고 229번 위치에서 시스테인을 가지는 공정.
- 제 7항에 있어서, 상기 시스테인 외의 아미노산은 예를 들면 세린(serine), 트레오닌(threonine), 발린(valine), 알라닌(alanine), 글리신(glycine), 류신(leucine) 또는 이소류신(isoleucine), 다른 극성 아미노산, 다른 자연적으로 생성되는 아미노산, 또는 비-자연적으로 생성되는 아미노산과 같은, 티올 부분(thiol moiety)을 포함하지 않는 것인 공정.
- 상기 청구항 중 어느 한 항에 있어서, 상기 항체는 EU-지표 번호화 시스템에 따라 226번 위치에서 시스테인을 가지고 229번 위치에서 세린을 가지거나, EU-지표 번호화 시스템에 따라 226번 위치에서 세린을 가지고 229번 위치에서 시스테인을 가지는 것인 공정.
- 상기 청구항 중 어느 한 항에 있어서, 상기 항체는 IgG1 분자이고 EU-지표 번호화 시스템에 따라 226 내지 229번 위치에서 Cys-Pro-Pro-Ser 또는 Ser-Pro-Pro-Cys의 서열을 포함하거나; IgG4 분자이고 EU-지표 번호화 시스템에 따라 226 내지 229번 위치에서 Cys-Pro-Ser-Ser 또는 Ser-Pro-Ser-Cys 의 서열을 포함하는 것인 공정.
- 제 1항 내지 제 5항 중 어느 한 항에 있어서, 단일 내부-중쇄 이황화결합은 모항체(parent antibody) 내의 이황화결합과는 다른 위치에서 항체의 경첩영역(hinge region) 내에 있는 것인 공정.
- 상기 청구항 중 어느 한 항에 있어서, 상기 시약(reagent)은 진단, 치료 또는 표지화 시약, 또는 진단, 치료 또는 표지화 시약과 결합할 수 있는 결합 시약을 포함하는 것인 공정.
- 상기 청구항 중 어느 한 항에 있어서, 상기 시약은 중합체(polymer)를 포함하는 공정.
- 제 14항에 있어서, 상기 시약은 하기 [화학식 2], [화학식 3] 또는 [화학식 4] 중의 것인 공정:
[화학식 2]
(Ⅱ)
상기 식에서, X 및 X' 중 하나는 중합체 및 다른 수소원자를 나타내고;
Q는 탈리기를 나타내며;
W는 전자 끄는 기를 나타내거나; 또는, 만일 X'가 중합체인 경우에는, X-Q-W은 같이 전자 끄는 기를 나타낼 수 있으며;
A는 C1-5 알킬렌 또는 알케닐렌 사슬을 나타내고;
B는 결합 또는 C1-4 알킬렌 또는 알케닐렌 사슬을 나타내며; 및
각각의 L은 독립적으로 탈리기(leaving group)를 나타낸다.
[화학식 3]
(Ⅲ)
상기 식에서, X', Q, W, A 및 L은 상기 일반 화학식 2에서 주어진 의미하는 바를 가지며, 추가로 X가 중합체를 나타낸다면, 사이에 있는 원자(interjacent atom)과 같이 X' 및 전자 끄는 기 W는 모두 고리로부터 형성될 수 있고, m은 정수 1 내지 4를 의미한다; 또는
[화학식 4]
X-Q-W-CR1R1'-CR2.L.L'(Ⅳ)
상기 식에서, X, Q 및 W은 일반 화학식 2에 대해 주어진 의미를 가지며, 각각의
R1은 represents a 수소 원자 또는 C1 -4 알킬기를 나타내며, R1'은 수소 원자를 나타내고, 각각의 L 및 L'는 독립적으로 탈리기를 나타내거나; 또는
R1은 수소 원자 또는 C1 -4 알킬기를 나타내며, L은 탈리기를 나타내고, R1' 및 L'는 함께 결합을 나타내거나; 또는
R1은 수소 원자 또는 C1 -4 알킬기를 나타내며, R1'은 수소 원자를 나타내고, 각각의 L 및 L'는 독립적으로 탈리기를 나타내거나; 또는
수소 원자를 나타내고, 각각의 L 및 L'는 독립적으로 탈리기를 나타내거나; 또는 R1 및 L은 결합을 함께 나타내고 R1' 및 L'는 결합을 함께 나타내고; 및 R2는 수소원자 또는 C1 -4 알킬기를 나타낸다.
- 제 14항 또는 제 15항에 있어서, 결과된 접합체 내에서 전자 끄는 기 W을 감소시키는 부가적인 단계를 포함하는 공정.
- 상기 청구항 중 어느 한 항에 있어서, 상기 내부-중쇄 이황화결합으로부터 유래된 2 개의 시스테인 잔기 사이에 가교를 형성하는 접합 시약 중 1 분자와, 항체의 경쇄의 CL 도메인 및 중쇄의 CH1 도메인 사이에 위치하는 내부사슬 이황화결합으로부터 유래된 시스테인 잔기 사이의 가교를 형성하는 접합 시약 중 2 추가적인 분자를 더하는 공정.
- 항체 내의 이황화 가교로부터 유래된 2 개의 황 원자를 통해 항체에 결합되는 접합 시약 내의 항체 접합체; 상기 이황화 가교는 오직 모항체 내의 내부-중쇄 이황화결합인 것을 특징으로 한다.
- 제 18항에 있어서, 항체의 경쇄의 CL 도메인 및 중쇄의 CH1 도메인 사이에 위치하는 내부사슬 이황화결합 유래의 항 원자를 통해 접합되는 2 개의 접합체 시약을 추가적으로 포함하는 항체 접합체.
- 제 18항 또는 제 19항에 있어서, 제 1 내지 17항 중 어느 한 항의 공정에 의해 준비된 항체 접합체.
- 제 18항 내지 제 20항 중 어느 한 항에 있어서, 치료에서 사용하기 위한 항체 접합체.
- 제 18항 내지 제 20항 중 어느 한 항에 있어서, 암의 치료에서 사용하기 위한 항체 접합체.
- 암의 치료를 위한 약제의 제조를 위한, 제 18항 내지 제 20항 중 어느 한 항의 항체 접합체의 용도.
- 제 18항 내지 제 20항 중 어느 한 항의 항체 접합체를 환자로 투여하는 것을 포함하는 암의 치료 방법.
- 선택적으로 부가적인 치료제와 함께; 약학적으로 허용 가능한 담체와 함께, 제 18항 내지 제 20항 중 어느 한 항의 접합체를 포함하는 약학적 조성물.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB1210838.7 | 2012-06-19 | ||
| GBGB1210838.7A GB201210838D0 (en) | 2012-06-19 | 2012-06-19 | Novel process for preparation of antibody conjugates and novel antibody conjugates |
| GB1306706.1 | 2013-04-12 | ||
| GB201306706A GB201306706D0 (en) | 2013-04-12 | 2013-04-12 | Novel process for preparation of antibody conjugates and novel antibody conjugates |
| PCT/GB2013/051593 WO2013190292A2 (en) | 2012-06-19 | 2013-06-19 | Novel process for preparation of antibody conjugates and novel antibody conjugates |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150023027A true KR20150023027A (ko) | 2015-03-04 |
Family
ID=48699187
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR20157001179A KR20150023027A (ko) | 2012-06-19 | 2013-06-19 | 항체 접합체의 제조를 위한 신규한 공정 및 신규한 항체 접합체 |
Country Status (16)
| Country | Link |
|---|---|
| US (1) | US20150125473A1 (ko) |
| EP (1) | EP2861261A2 (ko) |
| JP (1) | JP2015521615A (ko) |
| KR (1) | KR20150023027A (ko) |
| CN (1) | CN104379178A (ko) |
| AU (1) | AU2013279099A1 (ko) |
| BR (1) | BR112014031613A2 (ko) |
| CA (1) | CA2876365A1 (ko) |
| HK (1) | HK1204924A1 (ko) |
| IL (1) | IL235646A0 (ko) |
| IN (1) | IN2014DN10428A (ko) |
| MX (1) | MX2014015682A (ko) |
| RU (1) | RU2015101333A (ko) |
| SG (1) | SG11201407600UA (ko) |
| WO (1) | WO2013190292A2 (ko) |
| ZA (1) | ZA201408916B (ko) |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NO2789793T3 (ko) * | 2012-10-24 | 2018-01-27 | ||
| IN2015DN02349A (ko) * | 2012-10-24 | 2015-08-28 | Polytherics Ltd | |
| US10570151B2 (en) | 2013-03-15 | 2020-02-25 | Regeneron Pharmaceuticals, Inc. | Biologically active molecules, conjugates thereof, and therapeutic uses |
| WO2015031396A1 (en) | 2013-08-26 | 2015-03-05 | Regeneron Pharmaceuticals, Inc. | Pharmaceutical compositions comprising macrolide diastereomers, methods of their synthesis and therapeutic uses |
| EP3145552B1 (en) * | 2014-05-23 | 2020-03-04 | Novartis AG | Methods for making conjugates from disulfide-containing proteins |
| CA2950155C (en) * | 2014-06-02 | 2021-11-23 | Regeneron Pharmaceuticals, Inc. | Biologically active molecule conjugates, reagents and methods of manufacture, and therapeutic uses |
| CN106536540A (zh) * | 2014-07-24 | 2017-03-22 | 基因泰克公司 | 将试剂缀合至含有至少一个三硫键的蛋白质中的巯基部分的方法 |
| US10835616B2 (en) | 2014-10-14 | 2020-11-17 | Polytherics Limited | Process for the conjugation of a peptide or protein with a reagent comprising a leaving group including a portion of PEG |
| ES2960741T3 (es) * | 2014-10-24 | 2024-03-06 | Abzena Uk Ltd | Conjugados y reactivos de conjugación |
| US10077287B2 (en) | 2014-11-10 | 2018-09-18 | Bristol-Myers Squibb Company | Tubulysin analogs and methods of making and use |
| SG11201704458SA (en) * | 2014-12-08 | 2017-06-29 | Sorrento Therapeutics Inc | C-met antibody drug conjugate |
| MX2017009144A (es) | 2015-01-14 | 2017-11-22 | Bristol Myers Squibb Co | Dimeros de benzodiazepina unidos con puentes de heteroarileno, conjugados de estos, y sus metodos de preparacion y uso. |
| AU2016214317B2 (en) * | 2015-02-05 | 2022-01-13 | Ablynx N.V. | Nanobody dimers linked via C-terminally engineered cysteins |
| EP3331569A1 (en) | 2015-08-07 | 2018-06-13 | Gamamabs Pharma | Antibodies, antibody drug conjugates and methods of use |
| TWI660741B (zh) | 2015-11-03 | 2019-06-01 | 財團法人工業技術研究院 | 抗體藥物複合物及其製造方法 |
| BR112018014759B1 (pt) | 2016-01-25 | 2024-02-27 | Regeneron Pharmaceuticals, Inc | Compostos derivados de maitasinoide e seus conjugados, composição compreendendo os mesmos, seus métodos de fabricação e uso |
| WO2017178828A1 (en) | 2016-04-14 | 2017-10-19 | Polytherics Limited | Conjugates and conjugating reagents comprising a linker that includes at least two (-ch2-ch2-0-) units in a ring |
| GB201614162D0 (en) * | 2016-08-18 | 2016-10-05 | Polytherics Ltd | Antibodies, uses thereof and conjugates thereof |
| WO2018085769A1 (en) * | 2016-11-07 | 2018-05-11 | Seattle Genetics, Inc. | Distribution of engineered-cysteine caps |
| PL3765525T3 (pl) * | 2018-03-13 | 2023-12-27 | Zymeworks Bc Inc. | Koniugaty biparatopowe przeciwciało anty-her2 – lek i sposoby stosowania |
| GB201820864D0 (en) * | 2018-12-20 | 2019-02-06 | J A Kemp | Antibody-drug conjugates |
| EP3924378A4 (en) | 2019-02-15 | 2023-04-05 | WuXi Biologics Ireland Limited | METHODS FOR THE PRODUCTION OF ANTIBODY-DRUG CONJUGATES WITH IMPROVED HOMOGENEITY |
| US20220098242A1 (en) * | 2020-02-26 | 2022-03-31 | University Of Maryland, College Park | Compositions and methods for mucosal vaccination against sars-cov-2 |
| CN113164621B (zh) * | 2020-12-08 | 2022-02-18 | 和铂医药(上海)有限责任公司 | 蛋白-药物偶联物和定点偶联方法 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB0316294D0 (en) * | 2003-07-11 | 2003-08-13 | Polytherics Ltd | Conjugated biological molecules and their preparation |
| EP1817341A2 (en) * | 2004-11-29 | 2007-08-15 | Seattle Genetics, Inc. | Engineered antibodies and immunoconjugates |
| WO2009006520A1 (en) * | 2007-07-03 | 2009-01-08 | Medimmune, Llc | Hinge domain engineering |
| SI2247620T1 (sl) * | 2008-01-31 | 2016-09-30 | Genentech, Inc. | Protitelesa proti CD79b in imunokonjugati in postopki za uporabo |
| MX2010011672A (es) * | 2008-04-24 | 2011-03-02 | Celtic Pharma Peg Ltd | Conjugados del factor ix con vidas medias extendidas. |
| WO2011060018A2 (en) * | 2009-11-13 | 2011-05-19 | Ikaria Development Subsidiary Two Llc | Compositions and methods for using peptides, modified peptides, peptidomimetics and fibrin derivatives |
| WO2012088302A2 (en) * | 2010-12-22 | 2012-06-28 | Abbott Laboratories | Half immunoglobulin binding proteins and uses thereof |
| EP2822597A1 (en) * | 2012-03-09 | 2015-01-14 | UCL Business Plc. | Chemical modification of antibodies |
-
2013
- 2013-06-19 IN IN10428DEN2014 patent/IN2014DN10428A/en unknown
- 2013-06-19 JP JP2015517843A patent/JP2015521615A/ja active Pending
- 2013-06-19 EP EP13731444.9A patent/EP2861261A2/en not_active Withdrawn
- 2013-06-19 CN CN201380032701.7A patent/CN104379178A/zh active Pending
- 2013-06-19 AU AU2013279099A patent/AU2013279099A1/en not_active Abandoned
- 2013-06-19 CA CA 2876365 patent/CA2876365A1/en not_active Abandoned
- 2013-06-19 KR KR20157001179A patent/KR20150023027A/ko not_active Application Discontinuation
- 2013-06-19 US US14/407,859 patent/US20150125473A1/en not_active Abandoned
- 2013-06-19 MX MX2014015682A patent/MX2014015682A/es unknown
- 2013-06-19 SG SG11201407600UA patent/SG11201407600UA/en unknown
- 2013-06-19 WO PCT/GB2013/051593 patent/WO2013190292A2/en active Application Filing
- 2013-06-19 BR BR112014031613A patent/BR112014031613A2/pt not_active IP Right Cessation
- 2013-06-19 RU RU2015101333A patent/RU2015101333A/ru not_active Application Discontinuation
-
2014
- 2014-11-11 IL IL235646A patent/IL235646A0/en unknown
- 2014-12-04 ZA ZA2014/08916A patent/ZA201408916B/en unknown
-
2015
- 2015-06-09 HK HK15105477.4A patent/HK1204924A1/xx unknown
Also Published As
| Publication number | Publication date |
|---|---|
| RU2015101333A (ru) | 2016-08-10 |
| CN104379178A (zh) | 2015-02-25 |
| US20150125473A1 (en) | 2015-05-07 |
| JP2015521615A (ja) | 2015-07-30 |
| CA2876365A1 (en) | 2013-12-27 |
| ZA201408916B (en) | 2015-11-25 |
| EP2861261A2 (en) | 2015-04-22 |
| MX2014015682A (es) | 2015-07-23 |
| HK1204924A1 (en) | 2015-12-11 |
| IN2014DN10428A (ko) | 2015-08-21 |
| WO2013190292A3 (en) | 2014-03-20 |
| IL235646A0 (en) | 2015-01-29 |
| AU2013279099A1 (en) | 2014-12-18 |
| WO2013190292A2 (en) | 2013-12-27 |
| BR112014031613A2 (pt) | 2017-07-25 |
| SG11201407600UA (en) | 2014-12-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20150023027A (ko) | 항체 접합체의 제조를 위한 신규한 공정 및 신규한 항체 접합체 | |
| JP6328648B2 (ja) | 新規薬物−タンパク質コンジュゲート | |
| JP6100463B2 (ja) | TNFαを阻害する安定かつ可溶性の抗体 | |
| KR101674784B1 (ko) | 인간 tweak 및 인간 il17에 대한 이중특이적 항체 및 이의 용도 | |
| EP2523972B1 (en) | Threevalent antibodies | |
| ES2656446T3 (es) | Anticuerpos anti-VEGF y sus usos | |
| AU2019272250B2 (en) | Anti-mesothelin antibody and antibody-drug conjugate thereof | |
| JP7402807B2 (ja) | グリピカン3抗体およびそのコンジュゲート | |
| KR102342934B1 (ko) | 항체-약물 접합체 및 면역독소 | |
| ES2717883T3 (es) | Moléculas de DVD-LG estabilizadas con disulfuro | |
| WO2023131219A1 (en) | Conjugates, compositions and methods of use | |
| CN111819200A (zh) | 抗c-met抗体 | |
| JP2022540946A (ja) | コンジュゲーションのためのポリペプチド複合体及びその応用 | |
| WO2022152308A1 (en) | Engineered anti-trop2 antibody and antibody-drug conjugate thereof | |
| AU2019291565A1 (en) | Antibody drug conjugates for ablating hematopoietic stem cells | |
| CN117500527A (zh) | 抗体药物偶联物及其制备方法和用途 | |
| WO2024078586A1 (en) | Antibody-drug conjugate binding to human ptk7 and method for preparation and use thereof | |
| JP2023552733A (ja) | 抗クローディン-18.2抗体及びその抗体薬物複合体 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |