KR20140054030A - 시클로헵텐의 제조 방법 - Google Patents
시클로헵텐의 제조 방법 Download PDFInfo
- Publication number
- KR20140054030A KR20140054030A KR1020147003259A KR20147003259A KR20140054030A KR 20140054030 A KR20140054030 A KR 20140054030A KR 1020147003259 A KR1020147003259 A KR 1020147003259A KR 20147003259 A KR20147003259 A KR 20147003259A KR 20140054030 A KR20140054030 A KR 20140054030A
- Authority
- KR
- South Korea
- Prior art keywords
- derivative
- group
- cycloheptene
- carbon atoms
- formula
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C6/00—Preparation of hydrocarbons from hydrocarbons containing a different number of carbon atoms by redistribution reactions
- C07C6/02—Metathesis reactions at an unsaturated carbon-to-carbon bond
- C07C6/04—Metathesis reactions at an unsaturated carbon-to-carbon bond at a carbon-to-carbon double bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C1/00—Preparation of hydrocarbons from one or more compounds, none of them being a hydrocarbon
- C07C1/20—Preparation of hydrocarbons from one or more compounds, none of them being a hydrocarbon starting from organic compounds containing only oxygen atoms as heteroatoms
- C07C1/207—Preparation of hydrocarbons from one or more compounds, none of them being a hydrocarbon starting from organic compounds containing only oxygen atoms as heteroatoms from carbonyl compounds
- C07C1/2078—Preparation of hydrocarbons from one or more compounds, none of them being a hydrocarbon starting from organic compounds containing only oxygen atoms as heteroatoms from carbonyl compounds by a transformation in which at least one -C(=O)-O- moiety is eliminated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C209/00—Preparation of compounds containing amino groups bound to a carbon skeleton
- C07C209/24—Preparation of compounds containing amino groups bound to a carbon skeleton by reductive alkylation of ammonia, amines or compounds having groups reducible to amino groups, with carbonyl compounds
- C07C209/26—Preparation of compounds containing amino groups bound to a carbon skeleton by reductive alkylation of ammonia, amines or compounds having groups reducible to amino groups, with carbonyl compounds by reduction with hydrogen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C45/00—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds
- C07C45/49—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reaction with carbon monoxide
- C07C45/50—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reaction with carbon monoxide by oxo-reactions
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C51/00—Preparation of carboxylic acids or their salts, halides or anhydrides
- C07C51/347—Preparation of carboxylic acids or their salts, halides or anhydrides by reactions not involving formation of carboxyl groups
- C07C51/353—Preparation of carboxylic acids or their salts, halides or anhydrides by reactions not involving formation of carboxyl groups by isomerisation; by change of size of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C51/00—Preparation of carboxylic acids or their salts, halides or anhydrides
- C07C51/58—Preparation of carboxylic acid halides
- C07C51/60—Preparation of carboxylic acid halides by conversion of carboxylic acids or their anhydrides or esters, lactones, salts into halides with the same carboxylic acid part
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2531/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- C07C2531/16—Catalysts comprising hydrides, coordination complexes or organic compounds containing coordination complexes
- C07C2531/22—Organic complexes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2531/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- C07C2531/16—Catalysts comprising hydrides, coordination complexes or organic compounds containing coordination complexes
- C07C2531/24—Phosphines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/18—Systems containing only non-condensed rings with a ring being at least seven-membered
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/10—Process efficiency
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Catalysts (AREA)
Abstract
본 발명은 8 위치에서의 C-C 이중 결합이 말단이 아닌 것인 비대칭 1,8-디엔의 폐환 복분해에 의한 시클로헵텐 및 그의 유도체의 제조 방법을 제공한다. 시클로헵텐 및 또한 그의 유도체인 시클로헵타논, 시클로헵틸아민, 시클로헵탄카르브알데히드, 시클로헵탄카르복실산 및 시클로헵탄카르보닐 클로라이드, 및 또한 그들의 유도체는 활성 화합물을 위한 중요한 합성 빌딩 블록이다. 폐환 복분해는 바람직하게는 반응 증류로서 수행된다. 폐환 복분해를 위한 비대칭 1,8-디엔은 상응하는 불포화 카르복실산 및/또는 카르복실산 유도체의 촉매적 탈카르보닐화 또는 산화적 탈카르복실화에 의해 수득될 수 있다.
Description
본원은 2011년 7월 12일자로 출원된 미국 가출원 61/506,679를 참고로 포함한다.
본 발명은 8 위치에서의 C-C 이중 결합이 말단이 아닌 것인 1,8-디엔의 폐환 복분해(ring-closing metathesis)에 의한 시클로헵텐의 제조 방법에 관한 것이다. 추가로, 본 발명은 본 발명에 따라 제조된 시클로헵텐으로부터의 시클로헵타논, 시클로헵틸아민, 시클로헵탄카르브알데히드, 시클로헵탄카르복실산 및 시클로헵탄카르보닐 클로라이드 전환 생성물의 제조 방법에 관한 것이다. 유사한 방식으로, 본 방법은 또한 시클로헵텐 고리 상에서 하나 이상의 라디칼에 의해 치환된 상응하는 유도체의 제조 방법에 관한 것이다.
시클로헵탄 고리를 갖는 화합물은 활성 성분으로서 아주 흔히 사용된다. 예를 들어, 칼슘 채널 차단제로서의 벤시클란 (플루딜라트(Fludilat)®, 적당한 기간 동안 작용을 갖는 바르비투레이트로서의 헵타바르비탈 (메도민(Medomin)®, 및 악성 과칼슘혈증에 반작용(counteract)하기 위한 인카드론산 (비스포날(Bisphonal)®에 의해 시장의 성숙이 이루어져 왔다.
이들 모든 활성 성분은 시클로헵타논 또는 시클로헵틸아민으로부터 출발하여 합성된다. 문헌에 기재된 많은 다른 활성 성분은 다른 시클로헵탄 유도체로부터 출발하여 합성된다. 중요한 것에는 시클로헵탄카르브알데히드 및 그로부터 용이하게 제조가능한 시클로헵탄카르복실산, 및 시클로헵탄카르보닐 클로라이드가 포함된다. 그러나, 시클로헵타논 (수베론)만은 현재까지 비교적 시간이 오래 걸리고 복잡한 합성 경로를 통해 산업적으로 입수가능하다.
EP 0 632 004는 Si/Ti 혼합 산화물 촉매 위로의 물의 존재 하에서의 고온에서의 수베로니트릴의 환화에 의한 시클로헵타논의 합성을 기술한다. 그 수율은 85%로 비교적 우수하지만, 촉매의 사용 수명은 그저 보통 수준이다. 수베로니트릴은 다단 합성으로 제조되어야 하는데, 즉 1,6-헥산디올로부터 출발하여 포스젠에 의해 1,6-디클로로헥산으로 전환시키고, 이어서 NaCN과 반응시켜서 제조하거나, 또는 수베르산으로부터 출발하여 수베르아미드를 거쳐 후속으로의 P4O10에 의한 물의 제거에 의해 제조한다. 두 경로 모두 매우 시간이 오래 걸리고 시클로헵타논을 수득하는 단지 한 가지 방법만을 제공한다.
상기에 언급된 모든 출발 단위 (시클로헵타논, 시클로헵틸아민, 시클로헵탄카르브알데히드, 시클로헵탄카르복실산 및 시클로헵탄카르보닐 클로라이드)의 합성은 중심 단위로서 시클로헵텐으로부터 출발하여 훨씬 더 간단하게 달성될 수 있다.
시클로헵텐은 α,ω-올레핀 1,8-노나디엔으로부터 출발하여 폐환 복분해 (RCM)에 의해 제조될 수 있는데, 이때 α,ω-올레핀 1,8-노나디엔은 그의 2개의 말단 C-C 이중 결합에 의해 환화되어 휘발성 에텐을 제거한다 (문헌 [Ben-Asuly et al., Organometallics (2008), 27:811-813)]. 단점은 특히 반응물의 산업적 이용가능성의 결여 및 비교적 높은 희석이다. 비대칭 α,ω-올레핀 또는 심지어는 단지 하나의 말단 C-C 이중 결합을 갖는 디엔으로부터 출발하여 폐환 복분해에 의한 시클로헵텐 및 그의 유도체의 제조는 문헌에 기술되어 있지 않다. 실제로, 문헌에서는 비대칭 디엔을 사용하는 경우, 어시클릭 디엔 복분해(acyclic diene metathesis, ADMET)에 의한 이량체화가 바람직한 것으로 보고 있다 (문헌 [Conrad & Fogg, Curr Org Chemisty (2006), 10:185-202]).
현재로서는, 시클로헵텐에 대한 단순한 산업적 경로가 존재하지 않는다. 따라서, 산업적으로 용이하게 이용가능한 출발 재료로부터 출발하는 그러한 경로가 요망될 것이다.
그러므로, 본 발명의 근간이 되는 목적은 대안적인 출발 물질, 특히 산업적으로 용이하게 이용가능한 출발 물질로부터 출발하는 시클로헵텐의 제조 방법을 제공하는 것으로 여겨질 수 있다.
따라서, 본 발명은 화학식 I의 1,8-디엔 및 그의 유도체의 촉매적 폐환 복분해에 의한 시클로헵텐 또는 그의 유도체의 제조 방법에 관한 것이다.
<화학식 I>
상기 식에서, R1은 1 내지 20개의 탄소 원자를 갖는, 특히 4, 6, 8 또는 10개의 탄소 원자를 갖는 알킬 기이다. 본 발명은 바람직하게는 화학식 I의 1,8-디엔 (여기서, R1은 1 내지 20개의 탄소 원자를 갖는, 특히 4, 6, 8 또는 10개의 탄소 원자를 갖는 알킬 기임)의 촉매적 폐환 복분해에 의한 시클로헵텐의 제조 방법에 관한 것이다. 화학식 I의 1,8-디엔 또는 그의 유도체는 바람직하게는 어떠한 공액 이중 결합도 갖지 않는다. 화학식 I의 1,8-디엔은 바람직하게는 헵타데카-1,8-디엔이다.
본 발명의 맥락에서 알킬 기는 헤테로원자를 갖지 않는 지방족 탄화수소 라디칼이다. 이들은 분지형 또는 비분지형 및 포화 또는 불포화일 수 있다. 이들은 바람직하게는 포화 및 비분지형이다.
화학식 I의 1,8-디엔의 유도체는 화학식 I의 1,8-디엔으로부터 출발하여 위치 2 내지 7에서 하나 이상, 바람직하게는 1 내지 3개의 R2 치환기에 의해 독립적으로 개질된 화합물이다. R2는 1 내지 4개의 탄소 원자를 갖는 알킬 기, 1 내지 4개의 탄소 원자를 갖는 알콕시 기, 페닐 기, 할라이드, 바람직하게는 클로라이드 또는 브로마이드, 아미노 기, 히드록실 기 또는 술포 기이다.
원칙적으로, 생각할 수 있는 모든 복분해 촉매가 화학식 I의 1,8-디엔 또는 그의 유도체의 폐환 복분해에 사용될 수 있다. 이 반응은 양의 활성화 엔트로피 (2개의 분자가 1개의 분자로부터 수득됨)를 갖기 때문에, 이 반응은 더 높은 온도에서 유리하다. 그러므로 이 반응에는, 고온 기체 상 복분해를 위한 종래의 불균일 촉매, 예를 들어 WO3/SiO2 촉매를 사용하는 것이 또한 가능하다. 사용되는 불균일 촉매에는, 예를 들어 WO3/SiO2 촉매뿐만 아니라 Re2O7/Al2O3 촉매도 있다. 사용되는 균일 복분해 촉매는 전형적으로 텅스텐 또는 루테늄의 염 또는 착물 (예: WCl6 또는 CH3Re(CO)5) 또는 루테늄 또는 몰리브데넘을 기재로 한 금속-카르벤 착물 (제1 세대 그럽스(Grubbs) 촉매, 제2 세대 그럽스 촉매, 쉬락(Schrock) 촉매, 호베이다-그럽스(Hoveyda-Grubbs) 촉매)이다. Re계, Mo계 또는 W계 촉매가 공촉매 (통상 주족 원소의 유기금속 착물, 예컨대 알루미늄 알킬, 알루미늄 알킬 클로라이드 또는 아연 알킬) 및 활성화제 (예를 들어, 산소 화합물, 예컨대 에탄올 또는 디에틸 에테르)와 조합하여 빈번하게 사용된다. 적합한 복분해 촉매가 문헌에 기재되어 있다 (예를 들어, US 5,969,170, US 6,111,121, US 6,921,735, US 11/094,102, US 6,759,537, EP 993465, US 6,635,768, WO 2007/003135, WO 2008/065187, EP 1468004, DE 102008008299). 적합한 복분해 촉매는 루테늄-카르벤 착물, 예를 들어 디클로로(3-메틸-2-부테닐리덴)비스(트리시클로펜틸포스핀)루테늄(II), 이소펜테닐리덴(1,3-디메시틸이미다졸리딘-2-일리덴) (트리시클로헥실포스핀)루테늄(II) 디클로라이드, 벤질리덴비스(트리시클로헥실포스핀)디클로로루테늄, 1,3-비스(2,4,6-트리메틸페닐)-2-(이미다졸리디닐리덴)디클로로(페닐메틸렌)(트리시클로헥실포스핀)루테늄, 디클로로(o-이소프로폭시페닐메틸렌)(트리시클로헥실포스핀)루테늄(II), (1,3-비스(2,4,6-트리메틸페닐)-2-이미다졸리디닐리덴)디클로로(o-이소프로폭시페닐메틸렌)루테늄, 1,3-비스(2-메틸페닐)-2-이미다졸리디닐리덴]디클로로(페닐메틸렌)(트리시클로헥실포스핀)루테늄(II), 디클로로[1,3-비스(2-메틸페닐)-2-이미다졸리디닐리덴](2-이소프로폭시페닐메틸렌)루테늄(II), 디클로로[1,3-비스(2,4,6-트리메틸페닐)-2-이미다졸리디닐리덴][3-(2-피리디닐)프로필리덴]루테늄(II), 디클로로[1,3-비스(2,4,6-트리메틸페닐)-2-이미다졸리디닐리덴](벤질리덴)비스(3-브로모피리딘)루테늄(II), [1,3-비스(2,6-디-i-프로필페닐)-4,5-디히드로이미다졸-2-일리덴]-[2-i-프로폭시-5-(트리플루오로아세트아미도)페닐]메틸렌루테늄(II) 디클로라이드, 비스(트리시클로헥실포스핀)-3-페닐-1H-인덴-1-일리덴-루테늄(II) 디클로라이드, 비스(트리시클로헥실포스핀)[(페닐티오)메틸렌]루테늄(II) 디클로라이드, 비스(트리시클로헥실포스핀)[(페닐티오)메틸렌]루테늄(II) 디클로라이드, 1,3-비스(2,4,6-트리메틸페닐)-4,5-디히드로이미다졸-2-일리덴[2-(i-프로폭시)-5-(N,N-디메틸아미노술포닐)페닐]메틸렌 루테늄(II) 디클로라이드, 1,3-비스(2,4,6-트리메틸페닐)-4,5-디히드로이미다졸-2-일리덴[2-(i-프로폭시)-5-(N,N-디메틸아미노술포닐)페닐]메틸렌루테늄(II) 디클로라이드, [1,3-비스(2,4,6-트리메틸페닐)-2-이미다졸리디닐리덴]-[2-[[(4-메틸페닐)이미노]메틸]-4-니트로페놀릴]-[3-페닐-1H-인덴-1-일리덴]루테늄(II) 클로라이드; [1,3-비스(2,4,6-트리메틸페닐)-2-이미다졸리디닐리덴]-[2-[[(2-메틸페닐)이미노]메틸]페놀릴]-[3-페닐-1H-인덴-1-일리덴]루테늄(II) 클로라이드, 3-페닐-1H-인덴-1-일리덴[비스(i-부틸포베인)]루테늄(II) 디클로라이드, {[2-(i-프로폭시)-5-(N,N-디메틸아미노술포닐)페닐]메틸렌}(트리시클로헥실포스핀)루테늄(II) 디클로라이드, 트리시클로헥실포스핀[1,3-비스(2,4,6-트리메틸페닐)-4,5-디히드로이미다졸-2-일리덴][(페닐티오)메틸렌]루테늄(II) 디클로라이드, 트리시클로헥실포스핀[1,3-비스(2,4,6-트리메틸페닐)이미다졸-2-일리덴][3-페닐-1H-인덴-1-일리덴]루테늄(II) 디클로라이드, 트리시클로헥실포스핀[1,3-비스(2,4,6-트리메틸페닐)이미다졸-2-일리덴][2-티에닐메틸렌]루테늄(II) 디클로라이드, 트리시클로헥실포스핀[2,4-디히드로-2,4,5-트리페닐-3H-1,2,4-트리아졸-3-일리덴][2-티에닐메틸렌]루테늄(II) 디클로라이드, 트리시클로헥실포스핀[4,5-디메틸-1,3-비스(2,4,6-트리메틸페닐)이미다졸-2-일리덴][2-티에닐메틸렌]루테늄(II) 디클로라이드, 트리시클로헥실포스핀[3-페닐-1H-인덴-1-일리덴][1,3-비스(2,4,6-트리메틸페닐)-4,5-디히드로이미다졸-2-일리덴]루테늄(II) 디클로라이드, 트리플루오로아세테이토[4,5-디히드로-1,3-비스(2,4,6-트리메틸페닐)이미다졸-2-일리덴]테트라(2,2-디메틸프로판니트릴)루테늄(II) 트리플루오로아세테이트 또는 트리(i-프로폭시)포스핀(3-페닐-1H-인덴-1-일리덴)[1,3-비스(2,4,6-트리메틸페닐)-4,5-디히드로이미다졸-2-일리덴]루테늄(II) 디클로라이드이다.
사용되는 촉매 유형에 따라, 반응은 온화한 온도 (예를 들어, 0 내지 100℃) 또는 승온 (예를 들어, 100 내지 500℃)에서 수행된다.
촉매적 폐환 복분해는 액체 상 또는 기체 상에서 달성될 수 있다. 이는 균일 촉매작용의 형태로 또는 불균일 촉매작용의 형태로 수행될 수 있다.
본 발명의 폐환 복분해에는 Ru 촉매, 예를 들어 화학식 II (Mes = 메시틸, Ph = 페닐, Pr = 프로필), 화학식 III (여기서, Cy = 시클로헥실, Ph= 페닐) 또는 화학식 IV (2세대 호베이다-그럽스 촉매, 여기서 Mes = 메시틸)의 Ru 촉매를 사용하는 것이 바람직하다.
<화학식 II>
<화학식 III>
<화학식 IV>
화학식 I의 1,8-디엔 또는 그의 유도체의 폐환 복분해에서, 부산물로서의 화학식 V의 올레핀의 제거에 의해 시클로헵텐 또는 그의 유도체가 형성된다.
<화학식 V>
이 부산물은 에텐의 제거에 의해 반응 조건 하에서 이량체화되어 화학식 VI의 올레핀을 형성할 수 있다.
<화학식 VI>
헵타데카-1,8-디엔의 폐환 복분해의 경우, 제거된 화학식 V의 부산물은 1-데센이며, 상응하는 화학식 VI의 이량체화 생성물은 9-옥타데센이다. 화학식 V 및 화학식 VI의 올레핀, 특히 1-데센 및 9-옥타데센은 마찬가지로 반응 혼합물로부터 단리될 수 있는 가치가 있는 산업적으로 중요한 생성물이다. 화학식 VI의 올레핀, 예를 들어 9-옥타데센은 전형적으로 본 발명의 폐환 복분해 반응에서 저부 생성물(bottom product)로서 수득된다. 화학식 V 및 화학식 VI의 올레핀은 본 발명에 따른 방법에서 시클로헵텐 또는 그의 유도체에 더하여 공생성(coproduction)으로 수득될 수 있다.
본 발명의 폐환 복분해는 회분식, 반회분식 또는 연속식 방식으로 수행될 수 있다. 본 발명의 폐환 복분해를 반응 증류(reactive distillation)로서 수행하는 것이 바람직하다.
본 발명의 폐환 복분해를 회분식 방식으로 수행하는 경우, 반응물 (화학식 I의 1,8-디엔 또는 그의 유도체) 및 복분해 촉매는, 바람직하게는 불활성 용매 중에 초기에 충전되고, 반응 조건에 노출된다. 이 반응은 바람직하게는 0 내지 500℃, 보다 바람직하게는 20 내지 100℃의 온도에서, 그리고 바람직하게는 1 내지 5 bar의 압력 하에서, 보다 바람직하게는 표준 압력 하에서 달성된다. 압력은 적절한 온도에서의 반응 혼합물의 증기 압력보다 더 크도록 선택되어야 한다. 반응물은 바람직하게는 1.0 mol/l 이하, 바람직하게는 0.5 mol/l 이하의 농도로, 예를 들어 0.01 내지 0.1 mol/l 의 농도 범위로 초기에 충전된다. 용매는 바람직하게는 시클로헵텐 반응 생성물 또는 그의 유도체로부터 용이하게 제거될 수 있도록, 즉 예를 들어 증류 회수(distillative removal)의 경우 충분히 상이한 비점을 갖도록 선택된다. 용매의 비점은 바람직하게는 5 내지 1500 mbar의 압력 범위 내에서 20℃ 이상, 보다 바람직하게는 50℃ 이상으로 시클로헵텐 또는 그의 유도체의 비점과 상이하다. 용매는 바람직하게는 시클로헵텐 또는 그의 유도체보다 더 높은 비점을 갖는다. 용매는 바람직하게는 시클로헵텐 또는 그의 유도체와의 어떠한 공비혼합물도 형성하지 않는다. 적합한 용매는, 예를 들어 디페닐 에테르, 디클로로벤젠, 디클로로에탄, 크실렌, 시멘, 톨루엔 및 디클로로메탄이다. 사용되는 복분해 촉매의 양은 바람직하게는 반응물을 기준으로 0.1 몰% 이하, 보다 바람직하게는 0.05 몰% 이하이다. 반응의 최적 지속시간은 특정 반응 및 특정 반응 조건에 대해 상이할 수 있다. 이는 반응 혼합물로부터 샘플을 취하고 생성물 함량을 분석함으로써 결정될 수 있다. 전형적으로, 반응 시간은 0.5 내지 48 h, 바람직하게는 1 내지 6 h이다. 반응 시간이 너무 짧은 경우에는 반응물의 불완전한 전환으로 인해, 그리고 반응 시간이 너무 긴 경우에는 생성물의 원치 않는 부반응 또는 추가 반응으로 인해, 생성물 수율이 준최적(suboptimal)이다.
본 발명의 폐환 복분해를 회분식 방식으로의 반응 증류로서 수행하는 경우, 반응물 (화학식 I의 1,8-디엔 또는 그의 유도체) 및 복분해 촉매는, 바람직하게는 불활성 용매 중에 초기에 충전되고, 반응 조건에 노출된다. 이 반응은 바람직하게는 0 내지 500℃, 보다 바람직하게는 20 내지 100℃의 온도에서, 그리고 바람직하게는 1 내지 150 mbar, 보다 바람직하게는 5 내지 100 mbar의 압력 하에서 달성된다. 압력은, 적절한 온도에서의 시클로헵텐 반응 생성물 또는 그의 유도체의 증기압이, 생성물이 반응 동안 증류에 의해 회수될 수 있도록, 적용되는 액체 상 압력보다 더 크도록 선택되어야 한다. 반응물은 바람직하게는 2 mol/l 이하, 바람직하게는 1 mol/l 이하의 농도로, 예를 들어 0.01 내지 0.5 mol/l 의 농도 범위로 초기에 충전된다. 용매는 바람직하게는, 선택된 반응 조건 하에서의 반응 동안, 증발하더라도 단지 약간만 (전체 반응 동안 원래 사용된 부피의 10% 미만으로) 증발하도록 선택된다. 5 내지 1500 mbar의 압력 범위 내에서의 용매의 비점은 바람직하게는 시클로헵텐 또는 그의 유도체의 비점보다 20℃ 이상, 보다 바람직하게는 50℃ 이상 더 높다. 용매는 바람직하게는 시클로헵텐 또는 그의 유도체와의 어떠한 공비혼합물도 형성하지 않는다. 적합한 용매는, 예를 들어 고비점 방향족 탄화수소, 예컨대 크실렌, 톨루엔 또는 시멘, 할로겐화 탄화수소, 예컨대 디클로로메탄 또는 디클로로에탄, 할로겐화 방향족 물질, 예컨대 디클로로벤젠 및 디페닐 에테르이다. 사용되는 복분해 촉매의 양은 바람직하게는 반응물을 기준으로 0.1 몰% 이하, 보다 바람직하게는 0.05 몰% 이하이다. 반응의 최적 지속시간은 특정 반응 및 특정 반응 조건에 대해 상이할 수 있다. 이는 반응 혼합물로부터 샘플을 취하고 반응물의 전환을 분석함으로써 결정될 수 있다. 전형적으로, 반응 시간은 0.5 내지 48 h, 바람직하게는 1 내지 6 h이다. 반응 시간이 너무 짧은 경우에는 반응물의 불완전한 전환으로 인해 생성물 수율이 준최적이며; 반응 시간이 너무 긴 경우에는 비경제적이다. 반응 혼합물은 바람직하게는 반응 동안 생성물의 증류 회수를 개선하는 비말동반제를 포함한다. 비말동반제는 바람직하게는 생성물과 유사한 비점 (반응 또는 증류가 수행되는 압력에서 +/- 20℃, 바람직하게는 +/- 10℃)을 갖도록 선택된다. 적합한 비말동반제는 톨루엔이다. 비말동반제는 바람직하게는 증류 회수 후에 생성물로부터 분리되고 반응 혼합물로 되돌려 보낸다. 대안적으로, 새로운 비말동반제를 반응 혼합물에 연속적으로 첨가하는 것이 또한 가능하다. 반응 증류로서의 이러한 조작 방식의 경우, 형성된 생성물은 반응 동안 직접 반응 혼합물로부터 회수되고, 그에 따라 원치 않는 부반응으로부터 보호된다.
본 발명의 폐환 복분해를 반회분식 방식으로의 반응 증류로서 수행하는 경우, 복분해 촉매는 불활성 용매 중에 초기에 충전된다. 반응 조건 하에서, 반응물 (화학식 I의 1,8-디엔 또는 그의 유도체)이 계량 투입된다. 이 반응은 바람직하게는 0 내지 500℃, 보다 바람직하게는 20 내지 100℃의 온도에서, 그리고 바람직하게는 1 내지 200 mbar, 보다 바람직하게는 5 내지 150 mbar의 압력 하에서 달성된다. 압력은, 적절한 온도에서의 시클로헵텐 반응 생성물 또는 그의 유도체의 증기압이, 생성물이 반응 동안 증류에 의해 회수될 수 있도록, 적용되는 액체 상 압력보다 더 크도록 선택되어야 한다. 반응물은 바람직하게는 반응물의 농도가 1 mol/l 이하, 바람직하게는 0.5 mol/l 이하의 값을 초과하지 않으며, 예를 들어 0.005 내지 0.5 mol/l, 바람직하게는 0.01 내지 0.1 mol/l의 농도 범위 내에 있도록 하는 유량으로 계량 투입된다. 용매는 바람직하게는, 선택된 반응 조건 하에서의 반응 동안, 증발하더라도 단지 약간만 (전체 반응 동안 원래 사용된 부피의 10% 미만으로) 증발하도록 선택된다. 5 내지 1500 mbar의 압력 범위 내에서의 용매의 비점은 바람직하게는 시클로헵텐 또는 그의 유도체의 비점보다 20℃ 이상, 보다 바람직하게는 50℃ 이상 더 높다. 용매는 바람직하게는 시클로헵텐 또는 그의 유도체와의 어떠한 공비혼합물도 형성하지 않는다. 적합한 용매는, 예를 들어 고비점 방향족 탄화수소, 예컨대 크실렌, 톨루엔 또는 시멘, 할로겐화 탄화수소, 예컨대 디클로로메탄 또는 디클로로에탄, 할로겐화 방향족 물질, 예컨대 디클로로벤젠 및 디페닐 에테르이다. 사용되는 복분해 촉매의 양은 바람직하게는 반응물을 기준으로 0.1 몰% 이하, 보다 바람직하게는 0.05 몰% 이하이다. 반응 혼합물은 바람직하게는 반응 동안 생성물의 증류 회수를 개선하는 비말동반제를 포함한다. 비말동반제는 바람직하게는 생성물과 유사한 비점 (반응 또는 증류가 수행되는 압력에서 +/- 20℃, 바람직하게는 +/- 10℃)을 갖도록 선택된다. 적합한 비말동반제는 톨루엔이다. 비말동반제는 바람직하게는 증류 회수 후에 생성물로부터 분리되고 반응 혼합물로 되돌려 보낸다. 대안적으로, 새로운 비말동반제를 반응 혼합물에 연속적으로 첨가하는 것이 또한 가능하다. 반응 증류로서의 이러한 조작 방식의 경우, 형성된 생성물은 반응 동안 직접 반응 혼합물로부터 끊임없이 회수되고, 그에 따라 원치 않는 부반응으로부터 보호된다. 반회분식 방식으로의 반응 증류는 반응 혼합물 중의 비교적 낮은 반응물 농도로 높은 전환을 가능하게 하며, 이로써 분자간 부반응, 예를 들어 화학식 I의 1,8-디엔 또는 그의 유도체의 이량체화가 추가로 억제될 수 있다.
본 발명의 폐환 복분해를 연속 반응 증류로서 수행하는 경우, 반응물 (화학식 I의 1,8-디엔 또는 그의 유도체)은, 바람직하게는 불활성 용매 중에, 정유 및 스트립핑 섹션을 갖는 정류 칼럼의 반응 구역에 연속적으로 공급된다. 반응 구역은 복분해 촉매로 초기에 충전된다. 이 반응은 바람직하게는 0 내지 500℃, 보다 바람직하게는 20 내지 100℃의 온도에서, 그리고 바람직하게는 1 내지 200 mbar, 보다 바람직하게는 5 내지 150 mbar의 압력 하에서 달성된다. 생성물 (시클로헵텐 또는 그의 유도체 및 복분해에서 제거된 올레핀 또는 그의 이량체)은 정류 칼럼에서의 증류에 의해 반응 혼합물로부터 회수되고 연속적으로 인출된다. 용매가 칼럼의 반응 구역 내에 아주 실질적으로 남아 있게 할 수 있는 비점을 갖는 용매를 선택하는 것이 바람직하다. 생성물과 함께 칼럼으로부터 인출된 용매는 바람직하게는 (예를 들어, 증류에 의해) 생성물로부터 회수되고, 반응물과 함께 반응으로 다시 공급된다. 반응 조건은 바람직하게는 반응 구역 내의 반응물의 농도가 1 mol/l 이하, 바람직하게는 0.5 mol/l 이하의 값을 초과하지 않으며, 예를 들어 0.005 내지 0.5 mol/l, 바람직하게는 0.01 내지 0.1 mol/l의 농도 범위 내에 있도록 조정된다. 적합한 용매는, 예를 들어 고비점 방향족 탄화수소, 예컨대 크실렌, 톨루엔 또는 시멘, 할로겐화 탄화수소, 예컨대 디클로로메탄 또는 디클로로에탄, 할로겐화 방향족 물질, 예컨대 디클로로벤젠 및 디페닐 에테르이다. 사용되는 복분해 촉매의 양은 바람직하게는 반응물을 기준으로 0.1 몰% 이하, 보다 바람직하게는 0.05 몰% 이하이다. 반응 혼합물에 비말동반제를 첨가하는 것이 바람직한데, 이러한 비말동반제는 반응 동안 생성물의 증류 회수를 개선한다. 비말동반제는 바람직하게는 증류 회수 후에 생성물로부터 분리되고 반응 혼합물로 되돌려 보낸다.
본 발명의 촉매적 폐환 복분해를 위한 화학식 I의 1,8-디엔은 화학식 VII의 카르복실산 또는 카르복실산 유도체의 촉매적 탈카르보닐화 (문헌 [Trost & Fleming (Eds.), Comprehensive Organic Synthesis, 1st. Ed., Elsevier (1991) 3:1040-1042]) 또는 탈카르복실화 (문헌 [Carey & Sundberg, Advanced Organic Chemistry, Plenum Press (1990), 3rd. Ed., New York, p. 649-651])에 의해 제조될 수 있다.
<화학식 VII>
X는 할라이드, 바람직하게는 클로라이드, 수소 원자, OH 기 또는 또 다른 적합한 이탈기, 예를 들어 아실 기, 바람직하게는 아세틸, 피발로일 또는 벤조일이다. 원칙적으로, 다른 카르복실산 활성제, 예컨대 이미다졸리드 또는 활성 에스테르가 또한 가능하다. 화학식 I의 1,8-디엔의 유도체는 화학식 VII의 카르복실산 또는 카르복실산 유도체의 상응하는 유도체로부터 출발하여 유사한 방식으로 제조될 수 있다. 헵타데카-1,8-디엔은, 예를 들어 올레산 또는 올레산 유도체, 예컨대 올레일 클로라이드의 촉매적 탈카르보닐화 또는 산화적 탈카르복실화에 의해 제조될 수 있다. 상응하는 방식으로, 시클로헵텐을 제공하는 위한 폐환 복분해에 적합한 화학식 I의 1,8-디엔이 또한, 예를 들어 미리스톨레산, 팔미톨레산, 엘라이드산 또는 가돌레산, 또는 그의 산 유도체의 촉매적 탈카르보닐화 또는 산화적 탈카르복실화에 의해 제조될 수 있다. 불포화 카르복실산 또는 카르복실산 유도체, 예를 들어 리놀레산의 상응하는 사용이 또한 가능하지만, 폐환 복분해는 원칙적으로 부산물로서 더 큰 고리 크기를 갖는 불포화 시클로지방족으로 이어질 수 있다.
그러한 촉매적 탈카르보닐화 또는 산화적 탈카르복실화는 이미 원칙적으로 문헌에 기술된 바 있다 (문헌 [Blum et al., J Am Chem Soc (1967) 89:2338-2341]; [Ohno & Tsuji, J Am Chem Soc (1968) 90:99-107]; [Tsuji & Ohno, Synthesis (1969) 157-169]). 문헌 [Goossen & Rodriguez (Chem Comm (2004) 724-725)]은, 예를 들어 과량의 피발산 무수물 및 Pd 촉매의 존재 하에서의 69% 수율로의 올레산의 헵타데카-1,8-디엔으로의 전환을 기술한다. 과량의 아세트산 무수물 및 촉매로서의 PdCl2(PPh3)2의 존재 하에서의 올레산의 탈카르보닐화도 마찬가지로 알려져 있다 (문헌 [Miller et al., J Org Chem (1993) 58:18-20]). 유사한 촉매 시스템에 의한 동일한 반응이 이미 US 5,077,447 및 US 3,109,040에 기재된 바 있다.
X = OH인 화학식 VII의 카르복실산, 예를 들어 올레산은 촉매적 탈카르보닐화 또는 산화적 탈카르복실화에서 CO 및 물의 제거에 의해 화학식 I의 1,8-디엔, 예를 들어 헵타데카-1,8-디엔으로 전환된다. 이 전환에서 물은 불량한 이탈기이기 때문에, X = OH인 화학식 VII의 카르복실산은 이 전환을 위한 특별히 우수한 기재(substrate)는 아니다. 유리하게는, X = OH인 화학식 VII의 카르복실산은, 예를 들어 아세트산 무수물 또는 피발산 무수물과의 혼합된 무수물을 형성함으로써 계내에서(in situ) 활성화되거나, 또는 더 우수한 이탈기를 갖는 카르복실산 유도체, 예를 들어 산 클로라이드가 사용된다. 그러면, 이 반응은 역-코흐 카르보닐화(retro-Koch carbonylation)로 간주될 수 있다. 산 대신에, 알데히드를 사용하는 것이 또한 가능한데, 이 경우에는 CO 및 H2가 제거되고, 이 반응은 역-히드로포르밀화로 간주될 수 있다. 화학식 VII의 순수한 카르복실산 또는 카르복실산 유도체, 아니면 그들을 포함하는 혼합물을 사용하는 것이 가능하다. 그러한 혼합물은 화학식 VII의 카르복실산 또는 카르복실산 유도체를 50 중량% 이상의 비율로 포함한다.
올레산 및 올레일 클로라이드는 산업적으로 이용가능하기 때문에, 헵타데카-1,8-디엔의 제조를 위한 그의 사용은 특히 바람직하다.
화학식 VII의 카르복실산 또는 카르복실산 유도체의 촉매적 탈카르보닐화 또는 산화적 탈카르복실화를 위해, 문헌에 기재된 모든 촉매를 사용하는 것이 가능하다. 촉매로서 Pd(II) 및 Rh(I) 착물을 사용하는 것이 특히 바람직하다.
화학식 I의 1,8-디엔을 제공하기 위한 화학식 VII의 카르복실산 또는 카르복실산 유도체의 촉매적 탈카르보닐화 또는 산화적 탈카르복실화는 바람직하게는 반회분식 방식으로의 반응 증류로서 달성되는데, 이 경우에는 화학식 VII의 카르복실산 또는 카르복실산 유도체가 반응기 내로 균일하게 계량투입되고 휘발성 생성물이 매우 신속하게 회수된다. 이를 달성하기 위하여, 반응 온도는 적합한 반응 속도가 얻어지도록 촉매에 따라 선택된다. 이 반응 온도에 따라, 이어서 화학식 I의 1,8-디엔의 비점이 이 압력에서의 반응 온도보다 10℃ 이상 더 낮도록 압력이 선택된다. 이 반응은 반응 조건 하에서 불활성인 고비점 용매의 존재 하에서 또는 물질 중에서 수행될 수 있다. 이 맥락에서 "고비점 용매"는 주어진 반응 조건 하에서의 비등 온도가 선택된 반응 온도보다 더 높은 용매를 의미하는 것으로 이해된다.
이러한 촉매적 탈카르보닐화 또는 산화적 탈카르복실화의 바람직한 변형 형태에서는, 촉매를 고비점 용매 또는 이온성 액체 중에 먼저 용해시키고, 이 용액을 다공성 불활성 지지체에 적용시킨다. 이어서, 촉매를 고정층 반응기 내에서 사용한다.
본 발명의 폐환 복분해에 사용하기 전에, 화학식 I의 1,8-디엔은 바람직하게는 정제된다. 정제는 또한 다단일 수 있다. 예를 들어, 올레일 클로라이드로부터 출발하여, 가스상 반응 산출물(output)이 먼저 응축될 수 있으며, 이어서 형성된 수성 HCl이 상분리에 의해 제거될 수 있으며, 이어서 유기 상이 물 및/또는 희석된 알칼리로, 임의적으로는 또한 1회 초과로 세척될 수 있으며, 마지막으로 유기 상이 증류에 의해 정제될 수 있다.
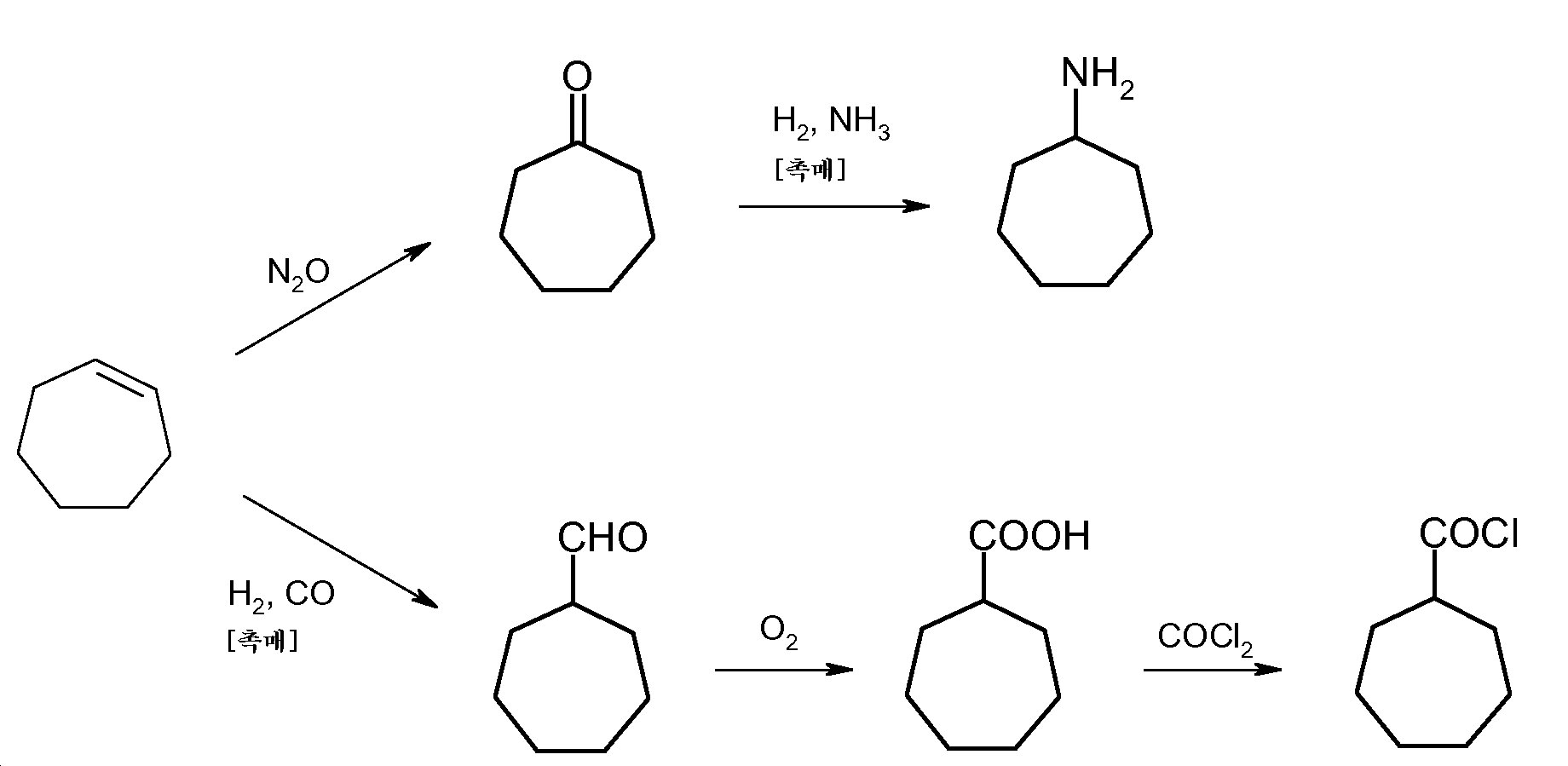
본 발명에 따라 제조된 시클로헵텐은, 추가 단계에서, 예를 들어 N2O에 의해 산화되어 시클로헵타논을 제공할 수 있다. 2-스테이지의 일련의 에폭시화 및 에폭시드의 전위(rearrangement)로 수베론을 제공하는 것이 또한 가능하다. 다시 시클로헵타논은 후속 단계로, 예를 들어 수소 및 암모니아에 의해 촉매적으로 전환되어 시클로헵틸아민 (환원적 아미노화)을 제공할 수 있다. 대안적으로, 본 발명에 따라 제조된 시클로헵텐은 또한, 예를 들어 수소 및 일산화탄소에 의해 시클로헵탄카르브알데히드 (히드로포르밀화)로 촉매적으로 전환될 수 있다. 이는 후속 단계에서, 예를 들어 산소의 첨가에 의해 산화되어 시클로헵탄카르복실산을 제공할 수 있다. 시클로헵탄카르복실산은 또한, 예를 들어 WO 01/05738에 따라 시클로헵텐으로부터 포름산과의 반응에 의해 직접 제조될 수 있다. 다시 시클로헵탄카르복실산은, 예를 들어 포스젠에 의해 시클로헵탄카르보닐 클로라이드로 전환될 수 있다. 유사한 방식으로, 시클로헵타논, 시클로헵틸아민, 시클로헵탄카르브알데히드, 시클로헵탄카르복실산 또는 시클로헵탄카르보닐 클로라이드의 상응하는 유도체가 또한 시클로헵텐 고리 상에 하나 이상의 R2 치환기를 갖는 시클로헵텐의 상응하는 유도체로부터 출발하여 제조될 수 있으며, 이 경우에 상기 시클로헵텐의 상응하는 유도체는 본 발명에 따라 화학식 I의 1,8-디엔으로부터 출발하여 위치 2 내지 7에서 하나 이상, 바람직하게는 1 내지 3개의 R2 치환기에 의해 독립적으로 개질된 화합물로부터 생성된다. R2는 1 내지 4개의 탄소 원자를 갖는 알킬 기, 1 내지 4개의 탄소 원자를 갖는 알콕시 기, 페닐 기, 할라이드, 바람직하게는 클로라이드 또는 브로마이드, 아미노 기, 히드록실 기 또는 술포 기이다.
이제, 본 발명을 하기의 비제한적인 실시예에 의해 상세히 설명할 것이다.
실시예 1
디페닐 에테르 (222 g) 중 복분해 촉매로서의 화학식 II의 Ru 착물 (73 mg, 80 μmol)의 용액을 감압 (8 mbar) 하에서 85℃로 가열하였다. 톨루엔 (22 ml) 중 1,8-헵타데카디엔 (21.9 g, 순도 90 중량%, 83 mmol)의 용액을 4 h의 기간에 걸쳐 시린지 펌프에 의해 이 혼합물에 균일하게 적가하였으며, 이 동안에는 시클로헵텐 생성물 및 다른 저비점 물질(low boiler) (예를 들어, 1-데센 및 톨루엔)을 수용기 내로 끊임없이 증류시켰다. 이 반응의 종료시에, 반응물의 완전한 전환을 검출하였다. 증류물 중의 시클로헵텐의 양을 GC 분석에 의해 결정하였으며, 이는 4.80 g (50 mmol, 이론 수율의 60%)에 상응하였다.
실시예 2
복분해 촉매로서 74.3 mg (83 μmol)의 화학식 III의 Ru 착물을 사용한 것을 제외하고는, 실시예 1과 유사하게 이 반응을 수행하였다. 이 경우에도 역시, 반응물을 완전히 전환시켰다. 증류물은 4.97 g (52 mmol)의 시클로헵텐을 포함하였으며, 이는 이론 수율의 63%에 상응하였다.
실시예 3
단지 36.6 mg (42 μmol)의 화학식 II의 Ru 착물을 사용한 것을 제외하고는, 실시예 1과 유사하게 이 반응을 수행하였다. 이 경우에도 역시, 반응물의 완전한 전환을 반응의 종료시에 검출하였다. 증류물은 4.23 g (44 mmol)의 시클로헵텐을 포함하였으며, 이는 이론 수율의 53%에 상응하였다.
실시예 4
복분해 촉매로서 47.7 mg (76 μmol)의 화학식 IV의 Ru 착물을 사용한 것을 제외하고는, 실시예 1과 유사하게 이 반응을 수행하였다. 이 경우에도 역시, 반응물을 완전히 전환시켰다. 증류물은 5.57 g (58 mmol)의 시클로헵텐을 포함하였으며, 이는 이론 수율의 70%에 상응하였다.
실시예 5
디페닐 에테르 (236 g) 중 1,8-헵타데카디엔 (23.3 g, 순도 90 중량%, 89 mmol)의 용액에 실온에서 50.6 mg (81 μmol)의 화학식 IV의 복분해 촉매를 첨가하였다. 반응 혼합물을 감압 (8 mbar) 하에서 85℃로 가열하였다. 형성된 시클로헵텐 생성물 및 다른 저비점 물질 (예를 들어, 1-데센)을 반응 동안 수용기 내로 균일하게 증류시켰다. 24 h의 반응 시간 후에, GC 분석에 의해 반응물의 전환율이 >95%인 것으로 확인되었다. 증류물은 GC 분석에 따르면 1.78 g (19 mmol)의 양의 시클로헵텐을 포함하였으며, 이는 이론 수율의 20%에 상응하였다. 추가 분량의 복분해 촉매 (50 mg, 80 μmol)의 첨가 후에, 추가 6 h 동안 반응을 계속하였다. 이어서, 단지 미량의 추가 시클로헵텐만을 수용기 내에서 검출할 수 있었다.
실시예 6
디페닐 에테르 (21 g) 중 1,8-헵타데카디엔 (2.12 g, 순도 90 중량%, 8 mmol)의 용액에 85℃에서 2.56 mg (4 μmol, 표준 용액으로부터)의 화학식 IV의 복분해 촉매를 첨가하였다. 3 h의 반응 시간 후, 반응 혼합물을 분석하였다. 반응물은 88% 전환되었으며, 반응 혼합물은 110 mg (1 mmol)의 시클로헵텐을 포함하였으며, 이는 이론 수율의 15%에 상응하였다.
Claims (17)
- 하기 화학식 I의 1,8-디엔 및 그의 유도체의 촉매적 폐환 복분해에 의한 시클로헵텐 또는 그의 유도체의 제조 방법이며,
여기서 화학식 I의 1,8-디엔의 유도체는 화학식 I의 1,8-디엔으로부터 출발하여 위치 2 내지 7에서 하나 이상의 R2 치환기에 의해 독립적으로 개질된 화합물이고, 여기서 R2는 1 내지 4개의 탄소 원자를 갖는 알킬 기, 1 내지 4개의 탄소 원자를 갖는 알콕시 기, 페닐 기, 할라이드, 아미노 기, 히드록실 기 및 술포 기로 이루어진 군으로부터 선택된 라디칼인 제조 방법.
<화학식 I>
상기 식에서, R1은 1 내지 20개의 탄소 원자를 갖는 알킬 기이다. - 제1항에 있어서, 폐환 복분해를 불활성 용매의 존재 하에 반응 혼합물 중에서 수행하는 방법.
- 제2항에 있어서, 형성된 시클로헵텐 또는 그의 유도체를 반응 동안 증류에 의해 반응 혼합물로부터 회수하고 단리시키고, 화학식 I의 1,8-디엔 또는 그의 유도체를 반응 혼합물 중의 화학식 I의 1,8-디엔 또는 그의 유도체의 농도가 1 mol/l를 초과하지 않도록 반응 혼합물 중으로 계량투입하는 방법.
- 제2항에 있어서, 화학식 I의 1,8-디엔 또는 그의 유도체를 2 mol/l를 초과하지 않는 농도로 반응 혼합물 중에 초기에 충전시키고, 형성된 시클로헵텐 또는 그의 유도체를 반응 동안 증류에 의해 반응 혼합물로부터 회수하고 단리시키는 방법.
- 제3항 또는 제4항에 있어서, 반응 혼합물이 비말동반제(entraining agent)를 추가로 포함하는 것인 방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 루테늄-카르벤 착물이 폐환 복분해를 위한 촉매로서 사용되는 것인 방법.
- 제8항에 있어서, 이탈기 X가 수소 원자, 할라이드, OH 기 및 아실 기로 이루어진 군으로부터 선택된 것인 방법.
- 제1항 내지 제9항 중 어느 한 항에 있어서, 화학식 I의 1,8-디엔 또는 그의 유도체를 폐환 복분해 반응에 사용하기 전에 정제하는 방법.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 화학식 I의 1,8-디엔이 헵타데카-1,8-디엔이고, 제8항 내지 제10항의 경우, 화학식 VII의 카르복실산 또는 카르복실산 유도체가 올레산 또는 올레산 유도체인 방법.
- 제1항 내지 제11항 중 어느 한 항에 따라 제조된 시클로헵텐 또는 그의 유도체의 산화에 의한 시클로헵타논 또는 그의 유도체의 제조 방법이며,
여기서 유도체는 시클로헵텐 고리 상에서 하나 이상의 R2 라디칼에 의해 치환된 상응하는 화합물이고, 여기서 R2는 1 내지 4개의 탄소 원자를 갖는 알킬 기, 1 내지 4개의 탄소 원자를 갖는 알콕시 기, 페닐 기, 할라이드, 아미노 기, 히드록실 기 및 술포 기로 이루어진 군으로부터 선택된 라디칼인 방법. - 제12항에 따라 제조된 시클로헵타논 또는 그의 유도체의 전환에 의한 시클로헵틸아민 또는 그의 유도체의 제조 방법이며,
여기서 유도체는 시클로헵텐 고리 상에서 하나 이상의 R2 라디칼에 의해 치환된 상응하는 화합물이고, 여기서 R2는 1 내지 4개의 탄소 원자를 갖는 알킬 기, 1 내지 4개의 탄소 원자를 갖는 알콕시 기, 페닐 기, 할라이드, 아미노 기, 히드록실 기 및 술포 기로 이루어진 군으로부터 선택된 라디칼인 방법. - 제1항 내지 제11항 중 어느 한 항에 따라 제조된 시클로헵텐 또는 그의 유도체의 전환에 의한 시클로헵탄카르브알데히드 또는 그의 유도체의 제조 방법이며,
여기서 유도체는 시클로헵텐 고리 상에서 하나 이상의 R2 라디칼에 의해 치환된 상응하는 화합물이고, 여기서 R2는 1 내지 4개의 탄소 원자를 갖는 알킬 기, 1 내지 4개의 탄소 원자를 갖는 알콕시 기, 페닐 기, 할라이드, 아미노 기, 히드록실 기 및 술포 기로 이루어진 군으로부터 선택된 라디칼인 방법. - 제1항 내지 제11항 중 어느 한 항에 따라 제조된 시클로헵텐 또는 그의 유도체의 전환에 의한 시클로헵탄카르복실산 또는 그의 유도체의 제조 방법이며,
여기서 유도체는 시클로헵텐 고리 상에서 하나 이상의 R2 라디칼에 의해 치환된 상응하는 화합물이고, 여기서 R2는 1 내지 4개의 탄소 원자를 갖는 알킬 기, 1 내지 4개의 탄소 원자를 갖는 알콕시 기, 페닐 기, 할라이드, 아미노 기, 히드록실 기 및 술포 기로 이루어진 군으로부터 선택된 라디칼인 방법. - 제14항에 따라 제조된 시클로헵탄카르브알데히드 또는 그의 유도체의 산화에 의한 시클로헵탄카르복실산 또는 그의 유도체의 제조 방법이며,
여기서 유도체는 시클로헵텐 고리 상에서 하나 이상의 R2 라디칼에 의해 치환된 상응하는 화합물이고, 여기서 R2는 1 내지 4개의 탄소 원자를 갖는 알킬 기, 1 내지 4개의 탄소 원자를 갖는 알콕시 기, 페닐 기, 할라이드, 아미노 기, 히드록실 기 및 술포 기로 이루어진 군으로부터 선택된 라디칼인 방법. - 제15항 또는 제16항에 따라 제조된 시클로헵탄카르복실산 또는 그의 유도체의 전환에 의한 시클로헵탄카르보닐 클로라이드 또는 그의 유도체의 제조 방법이며,
여기서 유도체는 시클로헵텐 고리 상에서 하나 이상의 R2 라디칼에 의해 치환된 상응하는 화합물이고, 여기서 R2는 1 내지 4개의 탄소 원자를 갖는 알킬 기, 1 내지 4개의 탄소 원자를 갖는 알콕시 기, 페닐 기, 할라이드, 아미노 기, 히드록실 기 및 술포 기로 이루어진 군으로부터 선택된 라디칼인 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP11173656.7 | 2011-07-12 | ||
| EP11173656 | 2011-07-12 | ||
| PCT/EP2012/062944 WO2013007561A1 (de) | 2011-07-12 | 2012-07-03 | Verfahren zur herstellung von cyclohepten |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140054030A true KR20140054030A (ko) | 2014-05-08 |
Family
ID=46466512
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147003259A KR20140054030A (ko) | 2011-07-12 | 2012-07-03 | 시클로헵텐의 제조 방법 |
Country Status (6)
| Country | Link |
|---|---|
| EP (1) | EP2731923B1 (ko) |
| JP (1) | JP5916855B2 (ko) |
| KR (1) | KR20140054030A (ko) |
| CN (1) | CN103649027B (ko) |
| IN (1) | IN2014CN00746A (ko) |
| WO (1) | WO2013007561A1 (ko) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013186238A1 (de) | 2012-06-13 | 2013-12-19 | Basf Se | Verfahren zur herstellung makrocyclischer ketone |
| GB201604110D0 (en) * | 2016-03-10 | 2016-04-20 | Givaudan Sa | Preparation of macrocyclic lactones |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3109040A (en) | 1960-05-23 | 1963-10-29 | Armour & Co | Preparation of terminally unsaturated olefins from aliphatic carboxylic acids |
| US5077447A (en) | 1990-09-28 | 1991-12-31 | Henkel Research Corporation | Process for making olefins |
| CA2196061C (en) | 1992-04-03 | 2000-06-13 | Robert H. Grubbs | High activity ruthenium or osmium metal carbene complexes for olefin metathesis reactions and synthesis thereof |
| DE4321692A1 (de) | 1993-06-30 | 1995-01-12 | Basf Ag | Verfahren zur Herstellung von cyclischen Ketonen |
| US5831108A (en) | 1995-08-03 | 1998-11-03 | California Institute Of Technology | High metathesis activity ruthenium and osmium metal carbene complexes |
| WO1999000396A1 (en) | 1997-06-25 | 1999-01-07 | Ciba Specialty Chemicals Holding Inc. | Ruthenium and osmium carbene catalysts |
| DE19815275B4 (de) | 1998-04-06 | 2009-06-25 | Evonik Degussa Gmbh | Alkylidenkomplexe des Rutheniums mit N-heterozyklischen Carbenliganden und deren Verwendung als hochaktive, selektive Katalysatoren für die Olefin-Metathese |
| FR2796639A1 (fr) | 1999-07-21 | 2001-01-26 | Rhodia Chimie Sa | Procede de preparation d'un acide carboxylique |
| DE60140455D1 (de) | 2000-08-10 | 2009-12-24 | Trustees Boston College | Wiederverwendbare methathese-katalysatoren |
| US6759537B2 (en) | 2001-03-23 | 2004-07-06 | California Institute Of Technology | Hexacoordinated ruthenium or osmium metal carbene metathesis catalysts |
| DE60310521T2 (de) | 2002-01-22 | 2007-11-08 | Universiteit Gent | Metallkomplexe für die metathese |
| EP1394190B1 (de) * | 2002-07-31 | 2007-01-03 | Saltigo GmbH | Metathesekatalysatoren |
| US7411093B2 (en) * | 2004-12-20 | 2008-08-12 | Hoffman-La Roche Inc. | Aminocycloalkanes as DPP-IV inhibitors |
| US7632772B2 (en) | 2005-07-04 | 2009-12-15 | Zheng-Yun James Zhan | Recyclable ruthenium catalysts for metathesis reactions |
| US8648003B2 (en) * | 2006-04-11 | 2014-02-11 | Agency For Science, Technology And Research | Catalysts for ring-closing metathesis |
| FR2909382B1 (fr) | 2006-11-30 | 2009-01-23 | Enscr | Complexes catalytiques a base de ruthenium et utilisation de tels complexes pour la metathese d'olefines |
| DE102008008299B3 (de) | 2008-02-08 | 2009-08-13 | Leibniz-Institut für Oberflächenmodifizierung e.V. | Latente photoaktivierbare Präkatalysatoren für die Metathesepolymerisation |
| US8044043B2 (en) * | 2008-04-11 | 2011-10-25 | Bristol-Myers Squibb Company | CGRP receptor antagonists |
| US9410205B2 (en) | 2010-02-18 | 2016-08-09 | New York University | Methods for predicting survival in metastatic melanoma patients |
-
2012
- 2012-07-03 CN CN201280034094.3A patent/CN103649027B/zh not_active Expired - Fee Related
- 2012-07-03 JP JP2014519497A patent/JP5916855B2/ja not_active Expired - Fee Related
- 2012-07-03 WO PCT/EP2012/062944 patent/WO2013007561A1/de active Application Filing
- 2012-07-03 KR KR1020147003259A patent/KR20140054030A/ko not_active Application Discontinuation
- 2012-07-03 IN IN746CHN2014 patent/IN2014CN00746A/en unknown
- 2012-07-03 EP EP12733089.2A patent/EP2731923B1/de not_active Not-in-force
Also Published As
| Publication number | Publication date |
|---|---|
| EP2731923A1 (de) | 2014-05-21 |
| CN103649027B (zh) | 2016-04-20 |
| IN2014CN00746A (ko) | 2015-04-03 |
| JP2014524915A (ja) | 2014-09-25 |
| JP5916855B2 (ja) | 2016-05-11 |
| CN103649027A (zh) | 2014-03-19 |
| WO2013007561A1 (de) | 2013-01-17 |
| EP2731923B1 (de) | 2015-09-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US6613910B2 (en) | One-pot synthesis of group 8 transition metal carbene complexes useful as olefin metathesis catalysts | |
| US9403854B2 (en) | Cross-metathesis reaction of functionalized and substituted olefins using group 8 transition metal carbene complexes as metathesis catalysts | |
| US11577232B2 (en) | Ruthenium-based metathesis catalysts, precursors for their preparation and their use | |
| EP2116302B1 (en) | Catalyst complex with a heterocyclic carbene ligand | |
| JP5787751B2 (ja) | ルテニウムカルベン錯体を製造するための方法 | |
| Barluenga et al. | Synthesis of spiroquinolines through a one‐pot multicatalytic and multicomponent cascade reaction | |
| MXPA00001573A (es) | Preparacion de olefinas sustituidas. | |
| Oppolzer et al. | Nickel-catalyzed intramolecular allylation of alkenes and alkynes coupled with β-elimination or carbonylation | |
| JP2002502832A (ja) | 閉環ジインメタセシスによる大環状生産物の調製法 | |
| De Campo et al. | New copper (I) and iron (II) complexes for atom transfer radical macrocyclisation reactions | |
| Bai et al. | Lewis-acid assisted cross metathesis of acrylonitrile with functionalized olefins catalyzed by phosphine-free ruthenium carbene complex | |
| US8993819B2 (en) | Process for preparing cycloheptene | |
| KR20140054030A (ko) | 시클로헵텐의 제조 방법 | |
| EP3752494A1 (en) | Reactions of olefin derivatives in the presence of metathesis catalysts | |
| US20030220512A1 (en) | Novel transition metal complexes and their use in transition metal-catalysed reactions | |
| Herndon | The chemistry of the carbon–transition metal double and triple bond: annual survey covering the year 1999 | |
| Van de Weghe et al. | Transition Metal Mediated Metathesis | |
| JPH11192434A (ja) | ルテニウムメタセシス触媒およびそれを用いたメタセ シス反応によるオレフィン反応生成物を製造する方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Withdrawal due to no request for examination |