KR20130026428A - 심혈관 질환을 치료 및/또는 예방하기 위한 조성물 및 방법 - Google Patents
심혈관 질환을 치료 및/또는 예방하기 위한 조성물 및 방법 Download PDFInfo
- Publication number
- KR20130026428A KR20130026428A KR1020127024878A KR20127024878A KR20130026428A KR 20130026428 A KR20130026428 A KR 20130026428A KR 1020127024878 A KR1020127024878 A KR 1020127024878A KR 20127024878 A KR20127024878 A KR 20127024878A KR 20130026428 A KR20130026428 A KR 20130026428A
- Authority
- KR
- South Korea
- Prior art keywords
- subject
- ethyl
- baseline
- plasma
- composition
- Prior art date
Links
- 238000000034 method Methods 0.000 title claims abstract description 68
- 239000000203 mixture Substances 0.000 title claims description 125
- 208000024172 Cardiovascular disease Diseases 0.000 title description 4
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 13
- JAZBEHYOTPTENJ-JLNKQSITSA-N all-cis-5,8,11,14,17-icosapentaenoic acid Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O JAZBEHYOTPTENJ-JLNKQSITSA-N 0.000 claims description 108
- 210000002966 serum Anatomy 0.000 claims description 88
- SSQPWTVBQMWLSZ-AAQCHOMXSA-N ethyl (5Z,8Z,11Z,14Z,17Z)-icosapentaenoate Chemical compound CCOC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CC SSQPWTVBQMWLSZ-AAQCHOMXSA-N 0.000 claims description 75
- 229920000064 Ethyl eicosapentaenoic acid Polymers 0.000 claims description 51
- 238000002560 therapeutic procedure Methods 0.000 claims description 47
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 claims description 38
- 230000009467 reduction Effects 0.000 claims description 38
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 claims description 35
- 150000003626 triacylglycerols Chemical class 0.000 claims description 25
- 230000007423 decrease Effects 0.000 claims description 24
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 24
- 239000002775 capsule Substances 0.000 claims description 18
- HOBAELRKJCKHQD-UHFFFAOYSA-N (8Z,11Z,14Z)-8,11,14-eicosatrienoic acid Natural products CCCCCC=CCC=CCC=CCCCCCCC(O)=O HOBAELRKJCKHQD-UHFFFAOYSA-N 0.000 claims description 10
- SNXPWYFWAZVIAU-UHFFFAOYSA-N arachidonic acid ethyl ester Natural products CCCCCC=CCC=CCC=CCC=CCCCC(=O)OCC SNXPWYFWAZVIAU-UHFFFAOYSA-N 0.000 claims description 10
- HOBAELRKJCKHQD-QNEBEIHSSA-N dihomo-γ-linolenic acid Chemical compound CCCCC\C=C/C\C=C/C\C=C/CCCCCCC(O)=O HOBAELRKJCKHQD-QNEBEIHSSA-N 0.000 claims description 10
- SNXPWYFWAZVIAU-GKFVBPDJSA-N ethyl arachidonate Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(=O)OCC SNXPWYFWAZVIAU-GKFVBPDJSA-N 0.000 claims description 10
- GIODNRPAARSHAH-UHFFFAOYSA-N ethyl octadeca-2,4,6,8-tetraenoate Chemical compound CCCCCCCCCC=CC=CC=CC=CC(=O)OCC GIODNRPAARSHAH-UHFFFAOYSA-N 0.000 claims description 10
- 229960002600 icosapent ethyl Drugs 0.000 claims description 10
- GVJHHUAWPYXKBD-UHFFFAOYSA-N d-alpha-tocopherol Natural products OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 claims description 7
- 239000011732 tocopherol Substances 0.000 claims description 7
- 229930003799 tocopherol Natural products 0.000 claims description 7
- FEDXWGXJVSAPGM-UHFFFAOYSA-N ethyl henicosa-2,4,6,8,10-pentaenoate Chemical compound CCCCCCCCCCC=CC=CC=CC=CC=CC(=O)OCC FEDXWGXJVSAPGM-UHFFFAOYSA-N 0.000 claims description 6
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 claims description 5
- 229960001295 tocopherol Drugs 0.000 claims description 4
- 235000010384 tocopherol Nutrition 0.000 claims description 4
- 229940066279 eicosapentaenoate Drugs 0.000 claims description 3
- 229910021642 ultra pure water Inorganic materials 0.000 claims 1
- 239000012498 ultrapure water Substances 0.000 claims 1
- 235000014113 dietary fatty acids Nutrition 0.000 abstract description 16
- 229930195729 fatty acid Natural products 0.000 abstract description 16
- 239000000194 fatty acid Substances 0.000 abstract description 16
- 150000004665 fatty acids Chemical class 0.000 abstract description 16
- JAZBEHYOTPTENJ-UHFFFAOYSA-N eicosapentaenoic acid Natural products CCC=CCC=CCC=CCC=CCC=CCCCC(O)=O JAZBEHYOTPTENJ-UHFFFAOYSA-N 0.000 description 106
- 229960005135 eicosapentaenoic acid Drugs 0.000 description 105
- 235000020673 eicosapentaenoic acid Nutrition 0.000 description 105
- 238000011282 treatment Methods 0.000 description 66
- 230000008859 change Effects 0.000 description 59
- 210000003743 erythrocyte Anatomy 0.000 description 55
- 210000002381 plasma Anatomy 0.000 description 52
- MBMBGCFOFBJSGT-KUBAVDMBSA-N all-cis-docosa-4,7,10,13,16,19-hexaenoic acid Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCC(O)=O MBMBGCFOFBJSGT-KUBAVDMBSA-N 0.000 description 38
- 239000000902 placebo Substances 0.000 description 35
- 229940068196 placebo Drugs 0.000 description 35
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 33
- YZXBAPSDXZZRGB-DOFZRALJSA-N arachidonic acid Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O YZXBAPSDXZZRGB-DOFZRALJSA-N 0.000 description 24
- 235000020669 docosahexaenoic acid Nutrition 0.000 description 23
- 239000003814 drug Substances 0.000 description 21
- 201000010099 disease Diseases 0.000 description 20
- 229940090949 docosahexaenoic acid Drugs 0.000 description 19
- 229940079593 drug Drugs 0.000 description 19
- 108010028554 LDL Cholesterol Proteins 0.000 description 15
- 230000000694 effects Effects 0.000 description 15
- 230000002354 daily effect Effects 0.000 description 13
- 208000035475 disorder Diseases 0.000 description 13
- 230000002829 reductive effect Effects 0.000 description 13
- 238000012360 testing method Methods 0.000 description 13
- YUFFSWGQGVEMMI-JLNKQSITSA-N (7Z,10Z,13Z,16Z,19Z)-docosapentaenoic acid Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCCCCC(O)=O YUFFSWGQGVEMMI-JLNKQSITSA-N 0.000 description 12
- 238000004458 analytical method Methods 0.000 description 12
- 229940114079 arachidonic acid Drugs 0.000 description 12
- 235000021342 arachidonic acid Nutrition 0.000 description 12
- 150000002632 lipids Chemical class 0.000 description 12
- 235000021294 Docosapentaenoic acid Nutrition 0.000 description 11
- 210000004180 plasmocyte Anatomy 0.000 description 11
- 210000004369 blood Anatomy 0.000 description 10
- 239000008280 blood Substances 0.000 description 10
- 230000001149 cognitive effect Effects 0.000 description 9
- 230000015654 memory Effects 0.000 description 9
- 238000012216 screening Methods 0.000 description 9
- 108010007622 LDL Lipoproteins Proteins 0.000 description 8
- 102000007330 LDL Lipoproteins Human genes 0.000 description 8
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 8
- 238000005259 measurement Methods 0.000 description 8
- 108010023302 HDL Cholesterol Proteins 0.000 description 7
- 238000011156 evaluation Methods 0.000 description 7
- 150000003904 phospholipids Chemical class 0.000 description 7
- 230000003442 weekly effect Effects 0.000 description 7
- 235000005911 diet Nutrition 0.000 description 6
- 230000002526 effect on cardiovascular system Effects 0.000 description 6
- 235000004626 essential fatty acids Nutrition 0.000 description 6
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 6
- 108010059886 Apolipoprotein A-I Proteins 0.000 description 5
- 102000005666 Apolipoprotein A-I Human genes 0.000 description 5
- 108010074051 C-Reactive Protein Proteins 0.000 description 5
- 208000032928 Dyslipidaemia Diseases 0.000 description 5
- 208000017170 Lipid metabolism disease Diseases 0.000 description 5
- 230000002411 adverse Effects 0.000 description 5
- 230000000378 dietary effect Effects 0.000 description 5
- 230000003203 everyday effect Effects 0.000 description 5
- 239000002245 particle Substances 0.000 description 5
- 230000035484 reaction time Effects 0.000 description 5
- DVSZKTAMJJTWFG-SKCDLICFSA-N (2e,4e,6e,8e,10e,12e)-docosa-2,4,6,8,10,12-hexaenoic acid Chemical compound CCCCCCCCC\C=C\C=C\C=C\C=C\C=C\C=C\C(O)=O DVSZKTAMJJTWFG-SKCDLICFSA-N 0.000 description 4
- GZJLLYHBALOKEX-UHFFFAOYSA-N 6-Ketone, O18-Me-Ussuriedine Natural products CC=CCC=CCC=CCC=CCC=CCC=CCCCC(O)=O GZJLLYHBALOKEX-UHFFFAOYSA-N 0.000 description 4
- 208000035150 Hypercholesterolemia Diseases 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 239000003963 antioxidant agent Substances 0.000 description 4
- 235000006708 antioxidants Nutrition 0.000 description 4
- 235000012000 cholesterol Nutrition 0.000 description 4
- KAUVQQXNCKESLC-UHFFFAOYSA-N docosahexaenoic acid (DHA) Natural products COC(=O)C(C)NOCC1=CC=CC=C1 KAUVQQXNCKESLC-UHFFFAOYSA-N 0.000 description 4
- 208000010125 myocardial infarction Diseases 0.000 description 4
- 230000036470 plasma concentration Effects 0.000 description 4
- 230000009469 supplementation Effects 0.000 description 4
- 238000012549 training Methods 0.000 description 4
- 230000003936 working memory Effects 0.000 description 4
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 3
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 3
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 3
- 239000011627 DL-alpha-tocopherol Substances 0.000 description 3
- 235000001815 DL-alpha-tocopherol Nutrition 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 208000023105 Huntington disease Diseases 0.000 description 3
- 108010002350 Interleukin-2 Proteins 0.000 description 3
- 102000000588 Interleukin-2 Human genes 0.000 description 3
- 108010033266 Lipoprotein(a) Proteins 0.000 description 3
- 102000057248 Lipoprotein(a) Human genes 0.000 description 3
- 239000005642 Oleic acid Substances 0.000 description 3
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 3
- 235000021314 Palmitic acid Nutrition 0.000 description 3
- 239000005662 Paraffin oil Substances 0.000 description 3
- 206010060753 Type IV hyperlipidaemia Diseases 0.000 description 3
- 235000021068 Western diet Nutrition 0.000 description 3
- 235000020661 alpha-linolenic acid Nutrition 0.000 description 3
- 229940127219 anticoagulant drug Drugs 0.000 description 3
- 230000037007 arousal Effects 0.000 description 3
- 239000002131 composite material Substances 0.000 description 3
- 150000001875 compounds Chemical class 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 238000003745 diagnosis Methods 0.000 description 3
- 210000003617 erythrocyte membrane Anatomy 0.000 description 3
- 239000008103 glucose Substances 0.000 description 3
- 208000006575 hypertriglyceridemia Diseases 0.000 description 3
- 238000003018 immunoassay Methods 0.000 description 3
- 239000012535 impurity Substances 0.000 description 3
- 230000000977 initiatory effect Effects 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 3
- 238000009533 lab test Methods 0.000 description 3
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 3
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 3
- 235000020660 omega-3 fatty acid Nutrition 0.000 description 3
- 229940012843 omega-3 fatty acid Drugs 0.000 description 3
- 108010071584 oxidized low density lipoprotein Proteins 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 208000020016 psychiatric disease Diseases 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 238000012552 review Methods 0.000 description 3
- 231100000279 safety data Toxicity 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 235000019149 tocopherols Nutrition 0.000 description 3
- DCXXMTOCNZCJGO-UHFFFAOYSA-N tristearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(OC(=O)CCCCCCCCCCCCCCCCC)COC(=O)CCCCCCCCCCCCCCCCC DCXXMTOCNZCJGO-UHFFFAOYSA-N 0.000 description 3
- QUEDXNHFTDJVIY-UHFFFAOYSA-N γ-tocopherol Chemical class OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1 QUEDXNHFTDJVIY-UHFFFAOYSA-N 0.000 description 3
- 102000016752 1-Alkyl-2-acetylglycerophosphocholine Esterase Human genes 0.000 description 2
- KZMAWJRXKGLWGS-UHFFFAOYSA-N 2-chloro-n-[4-(4-methoxyphenyl)-1,3-thiazol-2-yl]-n-(3-methoxypropyl)acetamide Chemical compound S1C(N(C(=O)CCl)CCCOC)=NC(C=2C=CC(OC)=CC=2)=C1 KZMAWJRXKGLWGS-UHFFFAOYSA-N 0.000 description 2
- 208000004476 Acute Coronary Syndrome Diseases 0.000 description 2
- 208000000044 Amnesia Diseases 0.000 description 2
- 102000018616 Apolipoproteins B Human genes 0.000 description 2
- 108010027006 Apolipoproteins B Proteins 0.000 description 2
- 108010024976 Asparaginase Proteins 0.000 description 2
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 2
- XUKUURHRXDUEBC-KAYWLYCHSA-N Atorvastatin Chemical compound C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CC[C@@H](O)C[C@@H](O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-KAYWLYCHSA-N 0.000 description 2
- XUKUURHRXDUEBC-UHFFFAOYSA-N Atorvastatin Natural products C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CCC(O)CC(O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-UHFFFAOYSA-N 0.000 description 2
- 208000032170 Congenital Abnormalities Diseases 0.000 description 2
- 206010011224 Cough Diseases 0.000 description 2
- 102000007513 Hemoglobin A Human genes 0.000 description 2
- 108010085682 Hemoglobin A Proteins 0.000 description 2
- 208000001748 Hyperlipoproteinemia Type V Diseases 0.000 description 2
- 206010020751 Hypersensitivity Diseases 0.000 description 2
- 206010020772 Hypertension Diseases 0.000 description 2
- 206010022489 Insulin Resistance Diseases 0.000 description 2
- 102000004895 Lipoproteins Human genes 0.000 description 2
- 108090001030 Lipoproteins Proteins 0.000 description 2
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 2
- 208000026139 Memory disease Diseases 0.000 description 2
- 108010022233 Plasminogen Activator Inhibitor 1 Proteins 0.000 description 2
- 102100039418 Plasminogen activator inhibitor 1 Human genes 0.000 description 2
- RYMZZMVNJRMUDD-UHFFFAOYSA-N SJ000286063 Natural products C12C(OC(=O)C(C)(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 RYMZZMVNJRMUDD-UHFFFAOYSA-N 0.000 description 2
- 235000021355 Stearic acid Nutrition 0.000 description 2
- 208000006011 Stroke Diseases 0.000 description 2
- 206010060755 Type V hyperlipidaemia Diseases 0.000 description 2
- 229960001138 acetylsalicylic acid Drugs 0.000 description 2
- 238000011256 aggressive treatment Methods 0.000 description 2
- 230000007815 allergy Effects 0.000 description 2
- DTOSIQBPPRVQHS-PDBXOOCHSA-N alpha-linolenic acid Chemical compound CC\C=C/C\C=C/C\C=C/CCCCCCCC(O)=O DTOSIQBPPRVQHS-PDBXOOCHSA-N 0.000 description 2
- 229940125715 antihistaminic agent Drugs 0.000 description 2
- 239000000739 antihistaminic agent Substances 0.000 description 2
- 229960005370 atorvastatin Drugs 0.000 description 2
- 230000007211 cardiovascular event Effects 0.000 description 2
- 230000003920 cognitive function Effects 0.000 description 2
- 208000029078 coronary artery disease Diseases 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- CYQFCXCEBYINGO-IAGOWNOFSA-N delta1-THC Chemical compound C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 CYQFCXCEBYINGO-IAGOWNOFSA-N 0.000 description 2
- 208000037765 diseases and disorders Diseases 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 235000013305 food Nutrition 0.000 description 2
- 238000004817 gas chromatography Methods 0.000 description 2
- LNEPOXFFQSENCJ-UHFFFAOYSA-N haloperidol Chemical compound C1CC(O)(C=2C=CC(Cl)=CC=2)CCN1CCCC(=O)C1=CC=C(F)C=C1 LNEPOXFFQSENCJ-UHFFFAOYSA-N 0.000 description 2
- 230000013632 homeostatic process Effects 0.000 description 2
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 229960004488 linolenic acid Drugs 0.000 description 2
- KQQKGWQCNNTQJW-UHFFFAOYSA-N linolenic acid Natural products CC=CCCC=CCC=CCCCCCCCC(O)=O KQQKGWQCNNTQJW-UHFFFAOYSA-N 0.000 description 2
- 229910052744 lithium Inorganic materials 0.000 description 2
- 208000024714 major depressive disease Diseases 0.000 description 2
- 238000002483 medication Methods 0.000 description 2
- 230000006984 memory degeneration Effects 0.000 description 2
- 208000023060 memory loss Diseases 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 235000020925 non fasting Nutrition 0.000 description 2
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 2
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 2
- 229940127240 opiate Drugs 0.000 description 2
- 238000012797 qualification Methods 0.000 description 2
- 230000000306 recurrent effect Effects 0.000 description 2
- 108010076840 remnant-like particle cholesterol Proteins 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 229960000672 rosuvastatin Drugs 0.000 description 2
- BPRHUIZQVSMCRT-VEUZHWNKSA-N rosuvastatin Chemical compound CC(C)C1=NC(N(C)S(C)(=O)=O)=NC(C=2C=CC(F)=CC=2)=C1\C=C\[C@@H](O)C[C@@H](O)CC(O)=O BPRHUIZQVSMCRT-VEUZHWNKSA-N 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 229960002855 simvastatin Drugs 0.000 description 2
- RYMZZMVNJRMUDD-HGQWONQESA-N simvastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)C(C)(C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 RYMZZMVNJRMUDD-HGQWONQESA-N 0.000 description 2
- 239000008117 stearic acid Substances 0.000 description 2
- 239000013589 supplement Substances 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 2
- MKJIEFSOBYUXJB-HOCLYGCPSA-N (3S,11bS)-9,10-dimethoxy-3-isobutyl-1,3,4,6,7,11b-hexahydro-2H-pyrido[2,1-a]isoquinolin-2-one Chemical compound C1CN2C[C@H](CC(C)C)C(=O)C[C@H]2C2=C1C=C(OC)C(OC)=C2 MKJIEFSOBYUXJB-HOCLYGCPSA-N 0.000 description 1
- 125000006724 (C1-C5) alkyl ester group Chemical group 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- YZXBAPSDXZZRGB-DOFZRALJSA-M Arachidonate Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC([O-])=O YZXBAPSDXZZRGB-DOFZRALJSA-M 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- 206010004146 Basal cell carcinoma Diseases 0.000 description 1
- 206010007559 Cardiac failure congestive Diseases 0.000 description 1
- 208000028698 Cognitive impairment Diseases 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- 206010010144 Completed suicide Diseases 0.000 description 1
- 206010010356 Congenital anomaly Diseases 0.000 description 1
- 206010010774 Constipation Diseases 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 206010012289 Dementia Diseases 0.000 description 1
- 208000012661 Dyskinesia Diseases 0.000 description 1
- 208000014094 Dystonic disease Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 238000000729 Fisher's exact test Methods 0.000 description 1
- 208000018522 Gastrointestinal disease Diseases 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- 108010064593 Intercellular Adhesion Molecule-1 Proteins 0.000 description 1
- 102000015271 Intercellular Adhesion Molecule-1 Human genes 0.000 description 1
- 206010027951 Mood swings Diseases 0.000 description 1
- 229940127523 NMDA Receptor Antagonists Drugs 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 1
- 102000019315 Nicotinic acetylcholine receptors Human genes 0.000 description 1
- 108050006807 Nicotinic acetylcholine receptors Proteins 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- QOSMNYMQXIVWKY-UHFFFAOYSA-N Propyl levulinate Chemical compound CCCOC(=O)CCC(C)=O QOSMNYMQXIVWKY-UHFFFAOYSA-N 0.000 description 1
- KXEMQEGRZWUKJS-UHFFFAOYSA-N Raufloridine Natural products COC1=CC=C2C(CCN3CC4C(C)OC=C(C4CC33)C(=O)OC)=C3NC2=C1 KXEMQEGRZWUKJS-UHFFFAOYSA-N 0.000 description 1
- QEVHRUUCFGRFIF-SFWBKIHZSA-N Reserpine Natural products O=C(OC)[C@@H]1[C@H](OC)[C@H](OC(=O)c2cc(OC)c(OC)c(OC)c2)C[C@H]2[C@@H]1C[C@H]1N(C2)CCc2c3c([nH]c12)cc(OC)cc3 QEVHRUUCFGRFIF-SFWBKIHZSA-N 0.000 description 1
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 1
- QWDCYFDDFPWISL-UHFFFAOYSA-N UNPD207407 Natural products CCC=CCC=CCC=CCC=CCC=CCCCC(=O)OC QWDCYFDDFPWISL-UHFFFAOYSA-N 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- 201000004810 Vascular dementia Diseases 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 238000013103 analytical ultracentrifugation Methods 0.000 description 1
- 230000003556 anti-epileptic effect Effects 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 239000001961 anticonvulsive agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 229940114078 arachidonate Drugs 0.000 description 1
- 206010003119 arrhythmia Diseases 0.000 description 1
- 230000006793 arrhythmia Effects 0.000 description 1
- 229910052785 arsenic Inorganic materials 0.000 description 1
- RQNWIZPPADIBDY-UHFFFAOYSA-N arsenic atom Chemical compound [As] RQNWIZPPADIBDY-UHFFFAOYSA-N 0.000 description 1
- 210000001367 artery Anatomy 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000003143 atherosclerotic effect Effects 0.000 description 1
- 230000003416 augmentation Effects 0.000 description 1
- 229940049706 benzodiazepine Drugs 0.000 description 1
- 150000001557 benzodiazepines Chemical class 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 230000007698 birth defect Effects 0.000 description 1
- 238000004820 blood count Methods 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 235000013339 cereals Nutrition 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- QWDCYFDDFPWISL-JEBPEJKESA-N cis-5,8,11,14,17-eicosapentaenoic acid methyl ester Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCCC(=O)OC QWDCYFDDFPWISL-JEBPEJKESA-N 0.000 description 1
- 208000010877 cognitive disease Diseases 0.000 description 1
- 230000003931 cognitive performance Effects 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 238000009223 counseling Methods 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 235000011850 desserts Nutrition 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 229940000406 drug candidate Drugs 0.000 description 1
- 208000010118 dystonia Diseases 0.000 description 1
- -1 eicosapentaenoic acid ester Chemical class 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 125000004494 ethyl ester group Chemical group 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- OLNTVTPDXPETLC-XPWALMASSA-N ezetimibe Chemical compound N1([C@@H]([C@H](C1=O)CC[C@H](O)C=1C=CC(F)=CC=1)C=1C=CC(O)=CC=1)C1=CC=C(F)C=C1 OLNTVTPDXPETLC-XPWALMASSA-N 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 235000019387 fatty acid methyl ester Nutrition 0.000 description 1
- 229940125753 fibrate Drugs 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 235000021588 free fatty acids Nutrition 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 230000005484 gravity Effects 0.000 description 1
- 229960003878 haloperidol Drugs 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- YEXZTHNGURCFSJ-UHFFFAOYSA-N henicosa-2,4,6,8,10-pentaenoic acid Chemical compound CCCCCCCCCCC=CC=CC=CC=CC=CC(O)=O YEXZTHNGURCFSJ-UHFFFAOYSA-N 0.000 description 1
- 208000003532 hypothyroidism Diseases 0.000 description 1
- 230000002989 hypothyroidism Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 206010022000 influenza Diseases 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 229940126602 investigational medicinal product Drugs 0.000 description 1
- 229940057995 liquid paraffin Drugs 0.000 description 1
- 230000003137 locomotive effect Effects 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- BUGYDGFZZOZRHP-UHFFFAOYSA-N memantine Chemical compound C1C(C2)CC3(C)CC1(C)CC2(N)C3 BUGYDGFZZOZRHP-UHFFFAOYSA-N 0.000 description 1
- 229960004640 memantine Drugs 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000006996 mental state Effects 0.000 description 1
- 230000036651 mood Effects 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 239000006014 omega-3 oil Substances 0.000 description 1
- 229940126701 oral medication Drugs 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 239000004031 partial agonist Substances 0.000 description 1
- 150000002978 peroxides Chemical class 0.000 description 1
- 238000009512 pharmaceutical packaging Methods 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- 238000013105 post hoc analysis Methods 0.000 description 1
- 230000000291 postprandial effect Effects 0.000 description 1
- 230000002028 premature Effects 0.000 description 1
- 235000020991 processed meat Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 229940124811 psychiatric drug Drugs 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 235000020989 red meat Nutrition 0.000 description 1
- QEVHRUUCFGRFIF-MDEJGZGSSA-N reserpine Chemical compound O([C@H]1[C@@H]([C@H]([C@H]2C[C@@H]3C4=C(C5=CC=C(OC)C=C5N4)CCN3C[C@H]2C1)C(=O)OC)OC)C(=O)C1=CC(OC)=C(OC)C(OC)=C1 QEVHRUUCFGRFIF-MDEJGZGSSA-N 0.000 description 1
- MDMGHDFNKNZPAU-UHFFFAOYSA-N roserpine Natural products C1C2CN3CCC(C4=CC=C(OC)C=C4N4)=C4C3CC2C(OC(C)=O)C(OC)C1OC(=O)C1=CC(OC)=C(OC)C(OC)=C1 MDMGHDFNKNZPAU-UHFFFAOYSA-N 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- DCKVNWZUADLDEH-UHFFFAOYSA-N sec-butyl acetate Chemical compound CCC(C)OC(C)=O DCKVNWZUADLDEH-UHFFFAOYSA-N 0.000 description 1
- 229910052711 selenium Inorganic materials 0.000 description 1
- 239000011669 selenium Substances 0.000 description 1
- 238000009097 single-agent therapy Methods 0.000 description 1
- 235000011888 snacks Nutrition 0.000 description 1
- KYITYFHKDODNCQ-UHFFFAOYSA-M sodium;2-oxo-3-(3-oxo-1-phenylbutyl)chromen-4-olate Chemical compound [Na+].[O-]C=1C2=CC=CC=C2OC(=O)C=1C(CC(=O)C)C1=CC=CC=C1 KYITYFHKDODNCQ-UHFFFAOYSA-M 0.000 description 1
- 230000007596 spatial working memory Effects 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 238000013517 stratification Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 201000009032 substance abuse Diseases 0.000 description 1
- 231100000736 substance abuse Toxicity 0.000 description 1
- 208000011117 substance-related disease Diseases 0.000 description 1
- 238000011477 surgical intervention Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 235000021147 sweet food Nutrition 0.000 description 1
- 229960005333 tetrabenazine Drugs 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- 229960000984 tocofersolan Drugs 0.000 description 1
- 239000003860 topical agent Substances 0.000 description 1
- 238000005199 ultracentrifugation Methods 0.000 description 1
- 231100000402 unacceptable toxicity Toxicity 0.000 description 1
- 208000019553 vascular disease Diseases 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/20—Carboxylic acids, e.g. valproic acid having a carboxyl group bound to a chain of seven or more carbon atoms, e.g. stearic, palmitic, arachidic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/20—Carboxylic acids, e.g. valproic acid having a carboxyl group bound to a chain of seven or more carbon atoms, e.g. stearic, palmitic, arachidic acids
- A61K31/202—Carboxylic acids, e.g. valproic acid having a carboxyl group bound to a chain of seven or more carbon atoms, e.g. stearic, palmitic, arachidic acids having three or more double bonds, e.g. linolenic
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
- A61K31/22—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin
- A61K31/23—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin of acids having a carboxyl group bound to a chain of seven or more carbon atoms
- A61K31/232—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin of acids having a carboxyl group bound to a chain of seven or more carbon atoms having three or more double bonds, e.g. etretinate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
- A61K31/353—3,4-Dihydrobenzopyrans, e.g. chroman, catechin
- A61K31/355—Tocopherols, e.g. vitamin E
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/22—Heterocyclic compounds, e.g. ascorbic acid, tocopherol or pyrrolidones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4808—Preparations in capsules, e.g. of gelatin, of chocolate characterised by the form of the capsule or the structure of the filling; Capsules containing small tablets; Capsules with outer layer for immediate drug release
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4816—Wall or shell material
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4816—Wall or shell material
- A61K9/4825—Proteins, e.g. gelatin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/02—Nutrients, e.g. vitamins, minerals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P39/00—General protective or antinoxious agents
- A61P39/06—Free radical scavengers or antioxidants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Cardiology (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Heart & Thoracic Surgery (AREA)
- Emergency Medicine (AREA)
- Nutrition Science (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Physiology (AREA)
- Biochemistry (AREA)
- Vascular Medicine (AREA)
- Hospice & Palliative Care (AREA)
- Urology & Nephrology (AREA)
- Toxicology (AREA)
- Psychology (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
다양한 실시양태에서, 본 발명은 지방산을 포함하는 제약 조성물, 및 이를 사용한 대상체의 치료 방법을 제공한다.
Description
심혈관 질환은 미국 및 대부분의 유럽 국가에서의 주요 사망 원인 중 하나이다. 미국에서만 7천만명이 넘는 사람들이 고혈압, 관상동맥 심장 질환, 이상지혈증, 울혈성심부전 및 졸중을 비롯한 (이에 제한되지는 않음) 심혈관 질환 또는 장애로 고통받고 있는 것으로 추정된다. 심혈관-관련 질환 및 장애에 대한 개선된 치료가 필요하다.
다양한 실시양태에서, 본 발명은 제약 조성물, 및 이러한 조성물을 사용하여 혈장, 혈청 및/또는 적혈구 (RBC) EPA 수준을 증가시키고/거나 심혈관-관련 질환을 치료 또는 예방하는 방법을 제공한다.
한 실시양태에서, 본 발명은 95 중량% 이상의 에틸 에이코사펜타에노에이트 (EPA-E), 약 0.2 중량% 내지 약 0.5 중량%의 에틸 옥타데카테트라에노에이트 (ODTA-E), 약 0.05 중량% 내지 약 0.25 중량%의 에틸 노나에카펜타에노에이트 (NDPA-E), 약 0.2 중량% 내지 약 0.45 중량%의 에틸 아라키도네이트 (AA-E), 약 0.3 중량% 내지 약 0.5 중량%의 에틸 에이코사테트라에노에이트 (ETA-E) 및 약 0.05% 내지 약 0.32% 에틸 헨에이코사펜타에노에이트 (HPA-E)를 포함하거나, 이들로 이루어지거나, 또는 본질적으로 이들로 이루어진 제약 조성물을 제공한다. 또 다른 실시양태에서, 조성물은 캡슐 쉘 내에 존재한다. 또 다른 실시양태에서, 조성물은 도코사헥사엔산 (DHA) 또는 그의 유도체, 예컨대 에틸-DHA (DHA-E)를, 예를 들어, 약 0.06 중량%, 약 0.05 중량% 또는 약 0.04 중량% 이하로, 실질적으로 함유하지 않거나 또는 함유하지 않는다.
또 다른 실시양태에서, 본 발명은 증가된 혈청, 혈장 및/또는 적혈구 (RBC) EPA 수준을 필요로 하는 대상체에게 본원에 기재된 조성물을 투여하는 것을 포함하는, 혈청, 혈장 및/또는 RBC EPA 수준을 증가시키는 방법을 제공한다. 관련된 실시양태에서, 대상체는 약 50 μg/g 이하의 기준선 EPA 혈장, 혈청 및/또는 RBC 수준을 가지며, 상기 대상체에게 약 6주 이상의 기간 동안 조성물을 투여할 때 상기 대상체는 혈장, 혈청 및/또는 RBC EPA 수준에서 기준선과 비교하여 100% 이상, 150% 이상, 200% 이상, 250% 이상, 300% 이상, 350% 이상 또는 400% 이상의 증가 (기준선 EPA 수준으로 나눈 EPA 수준의 변화)를 나타낸다. 관련된 실시양태에서, 대상체는 약 50 μg/g 이하의 기준선 EPA 혈장, 혈청 및/또는 RBC 수준을 갖는다. 또 다른 실시양태에서, 대상체는 EPA 수준의 상기 증가를 달성하는 데 효과적인 양의 상기 조성물을 제공받는다. 또 다른 실시양태에서, 대상체는 하루에 약 2 g 내지 약 4 g의 상기 조성물을 제공받는다.
또 다른 실시양태에서, 본 발명은 심혈관-관련 질환의 치료를 필요로 하는 대상체에게 본원에 기재된 바와 같은 조성물을 투여하는 것을 포함하는, 상기 대상체에서의 심혈관-관련 질환의 치료 방법을 제공한다. 관련된 실시양태에서, 대상체는 약 50 μg/g 이하의 기준선 EPA 혈장, 혈청 및/또는 RBC 수준을 가지며, 대상체에게 약 6주 이상의 기간 동안 조성물을 투여할 때 상기 대상체는 혈장, 혈청 및/또는 RBC EPA 수준에서 기준선과 비교하여 약 100% 이상, 약 150% 이상, 약 200% 이상, 약 250% 이상, 약 300% 이상, 약 350% 이상 또는 약 400% 이상의 증가를 나타낸다. 관련된 실시양태에서, 대상체는 약 50 μg/g 이하의 기준선 EPA 혈장, 혈청 및/또는 RBC 수준을 갖는다. 또 다른 실시양태에서, 대상체는 하루에 약 2 g 내지 약 4 g의 상기 조성물을 제공받는다.
본 발명의 이들 및 다른 실시양태는 본원 하기에서 더욱 상세하게 개시될 것이다.
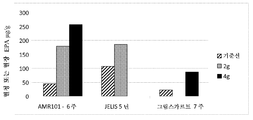
도 1은 다양한 EPA 투여 후의 혈액 EPA 수준을 보여준다.
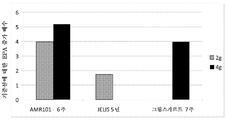
도 2는 다양한 EPA 투여 후의 기준선에 대한 EPA 증가를 보여준다.
도 2는 다양한 EPA 투여 후의 기준선에 대한 EPA 증가를 보여준다.
본 발명은 다양한 형태로 구현될 수 있지만, 하기 여러 실시양태의 기재는 본 개시내용이 본 발명의 예시로서 간주될 것이며 본 발명이 예시된 구체적 실시양태로 한정됨을 의도하지 않는다는 이해로 이루어진다. 표제는 단지 편의를 위해 제공되며 본 발명을 어떠한 방식으로든 한정하는 것으로 해석되어서는 안 된다. 임의의 표제 하에 예시된 실시양태는 임의의 다른 표제 하에 예시된 실시양태와 조합될 수 있다.
본원에 특정된 다양한 정량적 값 중 수치 값의 사용은, 달리 명확히 나타내지 않는 한, 기술된 범위내의 최소 및 최대 값 둘 다의 앞에 단어 "약"이 선행되는 것처럼 근사치로서 기술된다. 또한, 범위의 개시는 인용된 최소 및 최대 값 사이의 모든 값 뿐만 아니라 상기 값에 의해 형성될 수 있는 임의의 범위를 포함하는 연속 범위로서 의도된다. 또한 본원에서 개시된 것은 개시된 수치적인 값을 다른 임의의 개시된 수치적인 값으로 나눔으로써 형성될 수 있는 임의의 및 모든 비율 (및 이러한 임의의 비율의 범위)이다. 따라서, 당업자는 다수의 상기 비율, 범위, 및 비율의 범위가 명백하게 본원에 제공된 수치 값으로부터 유래될 수 있으며, 모든 경우에서 상기 비율, 범위, 및 비율의 범위가 본 발명의 다양한 실시양태를 나타냄을 이해할 것이다.
한 실시양태에서, 본 발명은 에이코사펜타엔산 또는 그의 유도체를 포함하는 제약 조성물을 제공한다. 한 실시양태에서, 이러한 조성물은 에이코사펜타엔산 또는 그의 제약상 허용되는 에스테르, 유도체, 접합체 또는 염, 또는 상기의 것들 중 임의의 것의 혼합물 (집합적으로 본원에서 "EPA"로 지칭됨)을 포함한다. 본 문맥에서 용어 "제약상 허용되는"은 해당 물질이 대상체에게 허용되지 않는 독성을 생성하지 않거나 조성물의 다른 성분과 상호작용하지 않음을 의미한다.
한 실시양태에서, EPA는 올-시스 에이코사-5,8,11,14,17-펜타엔산을 포함한다. 또 다른 실시양태에서, EPA는 에이코사펜타엔산 에스테르를 포함한다. 또 다른 실시양태에서, EPA는 에이코사펜타엔산의 C1 - C5 알킬 에스테르를 포함한다. 또 다른 실시양태에서, EPA는 에이코사펜타엔산 에틸 에스테르, 에이코사펜타엔산 메틸 에스테르, 에이코사펜타엔산 프로필 에스테르 또는 에이코사펜타엔산 부틸 에스테르를 포함한다. 또 다른 실시양태에서, EPA는 올-시스 에이코사-5,8,11,14,17-펜타엔산 에틸 에스테르를 포함한다.
또 다른 실시양태에서, EPA는 에틸-EPA, 리튬 EPA, 모노-, 디- 또는 트리글리세리드 EPA, 또는 EPA의 임의의 다른 에스테르 또는 염의 형태, 또는 EPA의 유리 산 형태로 존재한다. EPA는 또한 2-치환된 유도체, 또는 그의 산화 속도를 늦추지만 그 외에는 그의 생물학적 작용을 어떠한 실질적인 정도로도 변화시키지 않는 다른 유도체의 형태로 존재할 수 있다.
또 다른 실시양태에서, 조성물은 투여량 단위 (예를 들어, 캡슐) 내에 약 50 mg 내지 약 5000 mg, 약 75 mg 내지 약 2500 mg, 또는 약 100 mg 내지 약 1000 mg, 예를 들어 약 75 mg, 약 100 mg, 약 125 mg, 약 150 mg, 약 175 mg, 약 200 mg, 약 225 mg, 약 250 mg, 약 275 mg, 약 300 mg, 약 325 mg, 약 350 mg, 약 375 mg, 약 400 mg, 약 425 mg, 약 450 mg, 약 475 mg, 약 500 mg, 약 525 mg, 약 550 mg, 약 575 mg, 약 600 mg, 약 625 mg, 약 650 mg, 약 675 mg, 약 700 mg, 약 725 mg, 약 750 mg, 약 775 mg, 약 800 mg, 약 825 mg, 약 850 mg, 약 875 mg, 약 900 mg, 약 925 mg, 약 950 mg, 약 975 mg, 약 1000 mg, 약 1025 mg, 약 1050 mg, 약 1075 mg, 약 1100 mg, 약 1025 mg, 약 1050 mg, 약 1075 mg, 약 1200 mg, 약 1225 mg, 약 1250 mg, 약 1275 mg, 약 1300 mg, 약 1325 mg, 약 1350 mg, 약 1375 mg, 약 1400 mg, 약 1425 mg, 약 1450 mg, 약 1475 mg, 약 1500 mg, 약 1525 mg, 약 1550 mg, 약 1575 mg, 약 1600 mg, 약 1625 mg, 약 1650 mg, 약 1675 mg, 약 1700 mg, 약 1725 mg, 약 1750 mg, 약 1775 mg, 약 1800 mg, 약 1825 mg, 약 1850 mg, 약 1875 mg, 약 1900 mg, 약 1925 mg, 약 1950 mg, 약 1975 mg, 약 2000 mg, 약 2025 mg, 약 2050 mg, 약 2075 mg, 약 2100 mg, 약 2125 mg, 약 2150 mg, 약 2175 mg, 약 2200 mg, 약 2225 mg, 약 2250 mg, 약 2275 mg, 약 2300 mg, 약 2325 mg, 약 2350 mg, 약 2375 mg, 약 2400 mg, 약 2425 mg, 약 2450 mg, 약 2475 mg 또는 약 2500 mg의 양으로 존재한다.
또 다른 실시양태에서, 본 발명에 따라 유용한 조성물은, 존재하는 경우에, 도코사헥사엔산 (DHA) 또는 그의 유도체, 예컨대 에틸-DHA를 약 10 중량% 이하, 약 9 중량% 이하, 약 8 중량% 이하, 약 7 중량% 이하, 약 6 중량% 이하, 약 5 중량% 이하, 약 4 중량% 이하, 약 3 중량% 이하, 약 2 중량% 이하, 약 1 중량% 이하, 또는 약 0.5 중량% 이하 함유한다. 또 다른 실시양태에서, 본 발명의 조성물은 DHA 또는 에틸-DHA를 실질적으로 함유하지 않는다. 또 다른 실시양태에서, 본 발명에 유용한 조성물은 DHA 또는 그의 유도체, 예컨대 DHA-E를 함유하지 않는다.
또 다른 실시양태에서, EPA는 본 발명에 따른 조성물에 존재하는 모든 지방산의 70 중량% 이상, 80 중량% 이상, 90 중량% 이상, 95 중량% 이상, 96 중량% 이상, 97 중량% 이상, 98 중량% 이상, 99 중량% 이상 또는 100 중량%를 구성한다.
또 다른 실시양태에서, 본 발명에 따라 유용한 조성물은 총 조성물 또는 총 지방산 함량의 10 중량% 미만, 9 중량% 미만, 8 중량% 미만, 7 중량% 미만, 6 중량% 미만, 5 중량% 미만, 4 중량% 미만, 3 중량% 미만, 2 중량% 미만, 1 중량% 미만, 0.5 중량% 미만 또는 0.25 중량% 미만으로 EPA 이외의 임의의 지방산 또는 그의 유도체를 함유한다. "EPA 이외의 지방산"의 예시적 예는 리놀렌산 (LA), 아라키돈산 (AA), 도코사헥사엔산 (DHA), 알파-리놀렌산 (ALA), 스테아라돈산 (STA), 에이코사트리엔산 (ETA) 및/또는 도코사펜타엔산 (DPA)을 포함한다. 또 다른 실시양태에서, 본 발명에 따라 유용한 조성물은 약 0.1 중량% 내지 약 4 중량%, 약 0.5 중량% 내지 약 3 중량%, 또는 약 1 중량% 내지 약 2 중량%로 EPA 및/또는 DHA 이외의 총 지방산을 함유한다.
또 다른 실시양태에서, 본 발명에 따른 조성물은 하기 특징 중 하나 이상을 갖는다: (a) 에이코사펜타엔산 에틸 에스테르가, 조성물에 존재하는 모든 지방산의 약 96 중량% 이상, 약 97 중량% 이상 또는 약 98 중량% 이상을 나타내고/거나; (b) 조성물이 약 4 중량% 이하, 약 3 중량% 이하 또는 약 2 중량% 이하의 에이코사펜타엔산 에틸 에스테르 이외의 총 지방산을 함유하고/거나; (c) 조성물이 약 0.6% 이하, 약 0.5% 이하 또는 약 0.4% 이하의 에이코사펜타엔산 에틸 에스테르 이외의 임의의 개별 지방산을 함유하고/거나; (d) 조성물이 약 1 내지 약 2, 약 1.2 내지 약 1.8, 또는 약 1.4 내지 약 1.5의 굴절률 (20℃)을 갖고/거나; (e) 조성물이 약 0.8 내지 약 1.0, 약 0.85 내지 약 0.95, 또는 약 0.9 내지 약 0.92의 비중 (20℃)을 갖고/거나; (e) 조성물이 약 20 ppm 이하, 약 15 ppm 이하 또는 약 10 ppm 이하의 중금속을 함유하고/거나; (f) 조성물이 약 5 ppm 이하, 약 4 ppm 이하, 약 3 ppm 이하 또는 약 2 ppm 이하의 비소를 함유하고/거나; (g) 조성물이 약 5 meq/kg 이하, 약 4 meq/kg 이하, 약 3 meq/kg 이하 또는 약 2 meq/kg 이하의 퍼옥시드 값을 갖는다.
또 다른 실시양태에서, 본 발명은 95 중량%, 96 중량% 또는 97 중량% 이상의 에틸 에이코사펜타에노에이트, 약 0.2 중량% 내지 약 0.5 중량%의 에틸 옥타데카테트라에노에이트, 약 0.05 중량% 내지 약 0.25 중량%의 에틸 노나에카펜타에노에이트, 약 0.2 중량% 내지 약 0.45 중량%의 에틸 아라키도네이트, 약 0.3 중량% 내지 약 0.5 중량%의 에틸 에이코사테트라에노에이트 및 약 0.05% 내지 약 0.32%의 에틸 헨에이코사펜타에노에이트를 포함하거나, 본질적으로 이들로 이루어지거나, 또는 이들로 이루어진 조성물을 제공한다. 임의로, 조성물은 약 0.06 중량%, 약 0.05 중량% 또는 약 0.04 중량% 이하의 DHA 또는 그의 유도체, 예컨대 에틸-DHA를 함유한다. 한 실시양태에서, 조성물은 DHA 또는 그의 유도체, 예컨대 에틸-DHA 양을 실질적으로 함유하지 않거나 또는 함유하지 않는다. 조성물은 추가로 약 0.5% 이하 또는 0.05% 이하의 양으로 하나 이상의 항산화제 (예를 들어, 토코페롤) 또는 다른 불순물을 임의로 포함한다. 또 다른 실시양태에서, 조성물은 약 0.05 중량% 내지 약 0.4 중량%, 예를 들어 약 0.2 중량%의 토코페롤을 포함한다. 또 다른 실시양태에서, 약 500 mg 내지 약 1 g의 조성물이 캡슐 쉘 내에 제공된다.
또 다른 실시양태에서, 본 발명은 96 중량% 이상의 에틸 에이코사펜타에노에이트, 약 0.22 중량% 내지 약 0.4 중량%의 에틸 옥타데카테트라에노에이트, 약 0.075 중량% 내지 약 0.20 중량%의 에틸 노나에카펜타에노에이트, 약 0.25 중량% 내지 약 0.40 중량%의 에틸 아라키도네이트, 약 0.3 중량% 내지 약 0.4 중량%의 에틸 에이코사테트라에노에이트 및 약 0.075% 내지 약 0.25%의 에틸 헨에이코사펜타에노에이트를 포함하거나, 이들로 이루어지거나, 또는 본질적으로 이들로 이루어진 조성물을 제공한다. 임의로, 조성물은 약 0.06 중량%, 약 0.05 중량% 또는 약 0.04 중량% 이하의 DHA 또는 그의 유도체, 예컨대 에틸-DHA를 함유한다. 한 실시양태에서, 조성물은 DHA 또는 그의 유도체, 예컨대 에틸-DHA를 실질적으로 함유하지 않거나 또는 함유하지 않는다. 조성물은 추가로 약 0.5% 이하 또는 0.05% 이하의 양으로 하나 이상의 항산화제 (예를 들어, 토코페롤) 또는 다른 불순물을 임의로 포함한다. 또 다른 실시양태에서, 조성물은 약 0.05 중량% 내지 약 0.4 중량%, 예를 들어 약 0.2 중량%의 토코페롤을 포함한다. 또 다른 실시양태에서, 본 발명은 캡슐 쉘 내에 약 500 mg 내지 약 1 g의 상기 조성물을 포함하는 투여 형태를 제공한다.
또 다른 실시양태에서, 본 발명은 96 중량%, 97 중량% 또는 98 중량% 이상의 에틸 에이코사펜타에노에이트, 약 0.25 중량% 내지 약 0.38 중량%의 에틸 옥타데카테트라에노에이트, 약 0.10 중량% 내지 약 0.15 중량%의 에틸 노나에카펜타에노에이트, 약 0.25 중량% 내지 약 0.35 중량%의 에틸 아라키도네이트, 약 0.31 중량% 내지 약 0.38 중량%의 에틸 에이코사테트라에노에이트, 및 약 0.08% 내지 약 0.20%의 에틸 헨에이코사펜타에노에이트를 포함하거나, 이들로 이루어지거나, 또는 본질적으로 이들로 이루어진 조성물을 제공한다. 임의로, 조성물은 약 0.06 중량%, 약 0.05 중량% 또는 약 0.04 중량% 이하의 DHA 또는 그의 유도체, 예컨대 에틸-DHA를 함유한다. 한 실시양태에서, 조성물은 DHA 또는 그의 유도체, 예컨대 에틸-DHA를 실질적으로 함유하지 않거나 또는 함유하지 않는다. 조성물은 추가로 약 0.5% 이하 또는 0.05% 이하의 양으로 하나 이상의 항산화제 (예를 들어, 토코페롤) 또는 다른 불순물을 임의로 포함한다. 또 다른 실시양태에서, 조성물은 약 0.05 중량% 내지 약 0.4 중량%, 예를 들어 약 0.2 중량%의 토코페롤을 포함한다. 또 다른 실시양태에서, 본 발명은 캡슐 쉘 내에 약 500 mg 내지 약 1 g의 상기 조성물을 포함하는 투여 형태를 제공한다.
또 다른 실시양태에서, 본 발명은 혈청, 혈장 및/또는 적혈구 (RBC) EPA 수준을 증가시키는 치료를 필요로 하는 대상체에게 본원에 기재된 바와 같은 조성물을 투여하는 것을 포함하는, 혈청, 혈장 및/또는 적혈구 (RBC) EPA 수준을 증가시키는 방법을 제공한다. 한 실시양태에서, 대상체에게 약 5, 약 10, 약 15, 약 20, 약 25, 약 30, 약 35, 약 40, 약 42, 약 45 또는 약 50일 이상의 기간 동안 본원에 기재된 바와 같은 조성물을 경구 투여할 때, 상기 대상체는 혈청, 혈장 및/또는 RBC EPA에서 약 2배 이상, 약 3배 이상, 약 3.5배 이상, 약 3.75배 이상 또는 약 4배 이상의 변화 (기준선 EPA 수준으로 나눈 최종 절대 EPA 수준)를 나타낸다. 한 실시양태에서, 방법은 상기 투여 단계 전에 혈청, 혈장 및/또는 적혈구 (RBC) EPA의 증가를 필요로 하는 환자를 확인하는 단계를 포함한다. 관련된 실시양태에서, 대상체는 약 50 μg/g 이하의 기준선 EPA 혈장, 혈청 및/또는 RBC 수준을 갖는다. 또 다른 실시양태에서, 대상체는 하루에 약 2 g 내지 약 4 g의 상기 조성물을 제공받는다. 또 다른 실시양태에서, 상기에 따라 대상체에게 조성물을 투여할 때, 상기 대상체는 DHA, AA 및/또는 DGLA 혈장, 혈청 및/또는 RBC 수준의 감소를 나타낸다. 또 다른 실시양태에서, 상기에 따라 대상체에게 조성물을 투여할 때, 상기 대상체는 DPA 혈장, 혈청 및/또는 RBC 수준의 증가를 나타낸다. 또 다른 실시양태에서, 상기에 따라 대상체에게 조성물을 투여할 때, DHA 혈장, 혈청 및/또는 RBC 수준은 16% 이상 감소하고/거나, DGLA 혈장, 혈청 및/또는 RBC 수준은 31% 이상 감소하고/거나, AA 혈장, 혈청 및/또는 RBC 수준은 20% 이상 감소하고/거나, DPA 혈장, 혈청 및/또는 RBC 수준은 130%를 초과하여 증가한다.
또 다른 실시양태에서, 본 발명은 증가된 혈청, 혈장 및/또는 적혈구 (RBC) EPA 수준을 필요로 하는 대상체에게 본원에 기재된 바와 같은 조성물을 투여하는 것을 포함하는, 혈청, 혈장 및/또는 RBC EPA 수준을 증가시키는 방법을 제공한다. 관련된 실시양태에서, 대상체에게 약 5, 약 10, 약 15, 약 20, 약 25, 약 30, 약 35, 약 40, 약 42, 약 45 또는 약 50일 이상의 기간 동안 조성물을 투여할 때, 상기 대상체는 혈장, 혈청 및/또는 RBC EPA 수준에서 기준선과 비교하여 약 100% 이상, 약 150% 이상, 약 200% 이상, 약 250% 이상, 약 300% 이상, 약 350% 이상 또는 약 400% 이상의 증가 (기준선 EPA 수준으로 나눈 기준선으로부터의 EPA 수준의 변화)를 나타낸다. 관련된 실시양태에서, 대상체는 약 50 μg/g 이하의 기준선 EPA 혈장, 혈청 및/또는 RBC 수준을 갖는다. 또 다른 실시양태에서, 대상체는 하루에 약 2 g 내지 약 4 g의 상기 조성물을 제공받는다. 또 다른 실시양태에서, 상기에 따라 대상체에게 조성물을 투여할 때, 상기 대상체는 DHA, AA 및/또는 DGLA 혈장, 혈청 및/또는 RBC 수준의 감소를 나타낸다. 또 다른 실시양태에서, 상기에 따라 대상체에게 조성물을 투여할 때, 상기 대상체는 DPA 혈장, 혈청 및/또는 RBC 수준의 증가를 나타낸다. 또 다른 실시양태에서, 상기에 따라 대상체에게 조성물을 투여할 때, DHA 혈장, 혈청 및/또는 RBC 수준은 16% 이상 감소하고/거나, DGLA 혈장, 혈청 및/또는 RBC 수준은 31% 이상 감소하고/거나, AA 혈장, 혈청 및/또는 RBC 수준은 20% 이상 감소하고/거나, DPA 혈장, 혈청 및/또는 RBC 수준은 130%를 초과하여 증가한다.
관련된 실시양태에서, 대상체에게 약 5, 약 10, 약 15, 약 20, 약 25, 약 30, 약 35, 약 40, 약 45 또는 약 50일 이상의 기간 동안 하루에 약 2 내지 약 4 g의 본원에 기재된 바와 같은 조성물을 경구 투여할 때, 상기 대상체는 혈청, 혈장 및/또는 RBC EPA에서 기준선과 비교하여 약 10 μg/g 이상의 증가, 약 15 μg/g 이상의 증가, 약 20 μg/g 이상의 증가, 약 25 μg/g 이상의 증가, 약 30 μg/g 이상의 증가, 약 35 μg/g 이상의 증가, 약 40 μg/g 이상의 증가, 약 45 μg/g 이상의 증가, 약 50 μg/g 이상의 증가, 약 75 μg/g 이상의 증가, 약 100 μg/g 이상의 증가, 또는 약 150 μg/g 이상의 증가를 나타낸다. 또 다른 실시양태에서, 상기에 따라 대상체에게 조성물을 투여할 때, 상기 대상체는 DHA, AA 및/또는 DGLA 혈장, 혈청 및/또는 RBC 수준의 감소를 나타낸다. 또 다른 실시양태에서, 상기에 따라 대상체에게 조성물을 투여할 때, 상기 대상체는 DPA 혈장, 혈청 및/또는 RBC 수준의 증가를 나타낸다. 또 다른 실시양태에서, 상기에 따라 대상체에게 조성물을 투여할 때, DHA 혈장, 혈청 및/또는 RBC 수준은 16% 이상 감소하고/거나, DGLA 혈장, 혈청 및/또는 RBC 수준은 31% 이상 감소하고/거나, AA 혈장, 혈청 및/또는 RBC 수준은 20% 이상 감소하고/거나, DPA 혈장, 혈청 및/또는 RBC 수준은 130%를 초과하여 증가한다.
또 다른 실시양태에서, 대상체는 본원에 기재된 바와 같은 요법을 개시하기 전에 2주, 3주, 4주, 6주 또는 12주 동안 오메가-3 지방산 요법 또는 보충 중이 아니다.
한 실시양태에서, 본 발명은 심혈관-관련 질환의 치료 또는 예방을 필요로 하는 대상체에게 본원에 기재된 바와 같은 조성물을 투여하는 것을 포함하는, 심혈관-관련 질환의 치료 및/또는 예방 방법을 제공한다. 본원에서 용어 "심혈관-관련 질환"은 심장 또는 혈관 (즉, 동맥 및 정맥)의 임의의 질환 또는 장애 또는 그의 임의의 증상을 지칭한다. 심혈관-관련 질환 및 장애의 비제한적 예는 고트리글리세리드혈증, 고콜레스테롤혈증, 혼합형 이상지혈증, 관상동맥 심장 질환, 혈관 질환, 졸중, 아테롬성동맥경화증, 부정맥, 고혈압, 심근경색 및 다른 심혈관 사건을 포함한다.
주어진 질환 또는 장애와 관련된 용어 "치료"는, 질환 또는 장애를 억제하는 것, 예를 들어 질환 또는 장애의 발달을 저지하는 것; 질환 또는 장애를 완화시키는 것, 예를 들어 질환 또는 장애의 퇴행을 유발하는 것; 또는 질환 또는 장애에 의해 유발되거나 또는 이로부터 초래된 상태를 완화시키는 것, 예를 들어 질환 또는 장애의 증상을 완화, 예방 또는 치료하는 것을 포함하나, 이에 제한되지는 않는다. 주어진 질환 또는 장애와 관련된 용어 "예방"은, 아무 것도 발생하지 않은 경우에 질환 발병의 개시를 예방하는 것, 장애 또는 질환에 취약할 수 있지만 아직 상기 장애 또는 질환을 갖는 것으로 진단되지 않은 대상체에서 질환 또는 장애가 발병하는 것을 예방하는 것, 및/또는 이미 존재하는 경우에는 추가 질환/장애 발병을 예방하는 것을 의미한다.
한 실시양태에서, 본 발명은 혈액 지질 요법을 필요로 하는 대상체 또는 대상체 군에 본원에 기재된 바와 같은 제약 조성물을 투여하는 것을 포함하는, 혈액 지질 요법의 방법을 제공한다. 또 다른 실시양태에서, 상기 대상체 또는 대상체 군은 고트리글리세리드혈증, 고콜레스테롤혈증, 혼합형 이상지혈증 및/또는 매우 높은 트리글리세리드를 갖는다.
또 다른 실시양태에서, 치료될 대상체 또는 대상체 군은 식후 또는 공복에 약 200 mg/dl 내지 약 500 mg/dl의 기준선 트리글리세리드 수준 (또는 대상체 군의 경우에 평균 또는 중앙값 기준선 트리글리세리드 수준)을 갖는다. 또 다른 실시양태에서, 대상체 또는 대상체 군은 스타틴 요법에도 불구하고 약 40 mg/dl 내지 약 100 mg/dl의 기준선 LDL-C 수준 (또는, 평균 또는 중앙값 기준선 LDL-C 수준)을 갖는다.
한 실시양태에서, 본 발명의 방법에 따라 치료되는 대상체 또는 대상체 군은 동시 스타틴 요법, 예를 들어 아토르바스타틴, 로수바스타틴 또는 심바스타틴 요법 (에제티미브의 존재 또는 부재 하에) 중이다. 또 다른 실시양태에서, 대상체는 초순수 EPA 요법의 개시 시점에 안정한 동시 스타틴 요법을 받는다.
또 다른 실시양태에서, 본 발명의 방법에 따라 치료될 대상체 또는 대상체 군은 약 45 kg/m2 이하의 체질량 지수 (BMI 또는 평균 BMI)를 갖는다.
또 다른 실시양태에서, 본 발명은 안정한 스타틴 요법 중이고 트리글리세리드 저하 요법을 필요로 하는 대상체를 확인하는 것, 상기 대상체에게 하루에 약 1 g 내지 약 4 g의 EPA를 포함하는 제약상 허용되는 조성물 (예를 들어, 초순수 E-EPA)을 투여하는 것을 포함하며, 상기 대상체에게 조성물을 투여할 때 상기 대상체가 공복 트리글리세리드에서 대조군과 비교하여 임상적으로 유의한 감소를 나타내는 것인, 안정한 스타틴 요법 중이고 트리글리세리드 저하 요법을 필요로 하는 대상체에서 LDL 제어를 유지하는 방법을 제공한다. 본 발명의 문맥에서, 용어 "공복 트리글리세리드에서의 임상적으로 유의한 감소"는 유해 심장혈관 사건의 위험 감소에 해당하는 양의 트리글리세리드 감소를 의미한다. 전형적으로, 트리글리세리드에서 각각의 10 mg/dl 감소는 사망, 심근경색 및 재발성 급성 관상동맥 증후군의 1.6% 더 낮은 위험을 일으킨다. 예를 들어, 문헌 [Miller et al., Impact of triglyceride level beyond low-density lipoprotein cholesterol after acute coronary syndrome in the PROVE IT-TIMI 22 trial. JACC Vol. 51. No. 7 (2008)] (본원에 참조로 포함됨)을 참조한다. 따라서, 한 실시양태에서, "공복 트리글리세리드에서의 임상적으로 유의한 감소"는 10 mg/dl의 감소를 의미한다. 본 발명의 문맥에서, 용어 "LDL 제어를 유지하는"은 요법 동안 LDL 수준에 어떠한 임상적으로 유의한 유해 변화도 없음을 의미한다.
한 실시양태에서, 본 발명은, 약 200 mg/dl 내지 약 500 mg/dl의 기준선 공복 트리글리세리드를 갖고 안정한 스타틴 요법 중인 대상체에게 약 1 g 내지 약 4 g의 EPA (예를 들어, 초순수 EPA)를 포함하는 제약 조성물을 투여하는 것을 포함하며, 상기 대상체에게 약 12주의 기간 동안 매일 조성물을 투여하였을 때 상기 대상체가 약 12주의 기간 동안 초순수 EPA를 수반하지 않는 안정한 스타틴 요법을 유지한 대조 대상체보다 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 55%, 적어도 60%, 적어도 65%, 적어도 70% 또는 적어도 75% 더 낮은 공복 트리글리세리드를 나타내고, 대조 대상체가 또한 약 200 mg/dl 내지 약 500 mg/dl의 기준선 공복 트리글리세리드를 갖는 것인, 약 200 mg/dl 내지 약 500 mg/dl의 기준선 공복 트리글리세리드를 갖고 안정한 스타틴 요법 중인 대상체에서 트리글리세리드를 저하시키는 방법을 제공한다. 본원에서 용어 "안정한 스타틴 요법"은 해당 대상체, 대상체 군, 대조 대상체 또는 대조 대상체 군이 기준선 공복 트리글리세리드 측정 전에 적어도 4주 동안 ("적격화 기간") 스타틴 (예를 들어, 아토르바스타틴, 로수바스타틴 또는 심바스타틴)의 안정한 1일 용량을 제공받는 것을 의미한다. 예를 들어, 안정한 스타틴 요법 중인 대상체 또는 대조 대상체는 기준선 공복 트리글리세리드 측정 직전 적어도 4주 동안 일정한 1일 (즉, 매일 동일한 용량) 스타틴 용량을 제공받을 것이다. 한 실시양태에서, 대상체 및 대조 대상체의 LDL-C는 적격화 기간 동안 약 40 mg/dl 내지 약 100 mg/dl로 유지된다. 이어서, 대상체 및 대조 대상체는 기준선 이후 12주 기간 동안 이들의 안정한 스타틴 용량을 계속 제공받는다.
한 실시양태에서, 스타틴은 대상체 및 대조 대상체에게 약 1 mg 내지 약 500 mg, 약 5 mg 내지 약 200 mg, 또는 약 10 mg 내지 약 100 mg, 예를 들어 약 1 mg, 약 2 mg, 약 3 mg, 약 4 mg, 약 5 mg, 약 6 mg, 약 7 mg, 약 8 mg, 약 9 mg, 또는 약 10 mg; 약 15 mg, 약 20 mg, 약 25 mg, 약 30 mg, 약 35 mg, 약 40 mg, 약 45 mg, 약 50 mg, 약 55 mg, 약 60 mg, 약 65 mg, 약 70 mg, 약 75 mg, 약 80 mg, 약 90 mg, 약 100 mg, 약 125 mg, 약 150 mg, 약 175 mg, 약 200 mg, 약 225 mg, 약 250 mg, 약 275 mg, 약 300 mg, 약 325 mg, 약 350 mg, 약 375 mg, 약 400 mg, 약 425 mg, 약 450 mg, 약 475 mg, 또는 약 500 mg의 양으로 투여된다. 또 다른 실시양태에서, 대상체 (및 임의로는 대조 대상체)는 안정한 스타틴 요법에도 불구하고 약 40 mg/dl 내지 약 100 mg/dl의 기준선 LDL-C 수준을 갖는다. 다른 실시양태에서, 대상체 및/또는 대조 대상체는 약 45 kg/m2 이하의 체질량 지수 (BMI; 또는 평균 BMI)를 갖는다.
또 다른 실시양태에서, 본 발명은, 약 200 mg/dl 내지 약 500 mg/dl의 평균 기준선 공복 트리글리세리드를 갖고 안정한 스타틴 요법 중인 대상체 군의 구성원에게 하루에 약 1 g 내지 약 4 g의 초순수 EPA를 포함하는 제약 조성물을 투여하는 것을 포함하며, 상기 대상체 군의 구성원에게 약 12주의 기간 동안 매일 조성물을 투여하였을 때 상기 대상체 군이 약 12주의 기간 동안 초순수 EPA를 수반하지 않는 안정한 스타틴 요법을 유지한 대조 대상체 군보다 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 55%, 적어도 60%, 적어도 65%, 적어도 70%, 적어도 75% 더 낮은 평균 공복 트리글리세리드를 나타내고, 대조 대상체 군이 또한 약 200 mg/dl 내지 약 500 mg/dl의 평균 기준선 공복 트리글리세리드를 갖는 것인, 약 200 mg/dl 내지 약 500 mg/dl의 평균 기준선 공복 트리글리세리드를 갖고 안정한 스타틴 요법 중인 대상체 군에서 트리글리세리드를 저하시키는 방법을 제공한다. 관련된 실시양태에서, 안정한 스타틴 요법은 대상체 군이 기준선 공복 트리글리세리드 측정 직전에 4주 동안 약 40 mg/dl 이상 및 약 100 mg/dl 이하의 평균 LDL-C 수준을 갖도록 하기에 충분할 것이다.
또 다른 실시양태에서, 본 발명은, 약 200 mg/dl 내지 약 500 mg/dl의 평균 기준선 공복 트리글리세리드 수준을 갖고 안정한 스타틴 요법 중인 대상체 군의 구성원에게 약 1 g 내지 약 4 g의 초순수 EPA를 포함하는 제약 조성물을 투여하는 것을 포함하며, 상기 대상체 군의 구성원에게 약 12주의 기간 동안 매일 조성물을 투여하였을 때 대상체 군이 (a) 약 12주의 기간 동안 초순수 EPA를 수반하지 않는 안정한 스타틴 요법을 유지한 대조 대상체와 비교하여 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 55%, 적어도 60%, 적어도 65%, 적어도 70% 또는 적어도 75% 더 낮은 평균 공복 트리글리세리드를 나타내고, (b) 기준선과 비교하여 평균 혈청 LDL-C 수준의 증가를 나타내지 않고, 대조 대상체가 또한 약 200 mg/dl 내지 약 500 mg/dl의 평균 기준선 공복 트리글리세리드를 갖는 것인, 약 200 mg/dl 내지 약 500 mg/dl의 평균 기준선 공복 트리글리세리드 수준을 갖고 안정한 스타틴 요법 중인 대상체 군에서 트리글리세리드를 저하시키는 방법을 제공한다.
또 다른 실시양태에서, 본 발명은, 약 200 mg/dl 내지 약 500 mg/dl의 평균 기준선 공복 트리글리세리드 수준을 갖고 안정한 스타틴 요법 중인 대상체에게 약 1 g 내지 약 4 g의 초순수 EPA를 포함하는 제약 조성물을 투여하는 것을 포함하며, 상기 대상체에게 약 12주의 기간 동안 매일 조성물을 투여하였을 때 상기 대상체가 (a) 약 12주의 기간 동안 초순수 EPA를 수반하지 않는 안정한 스타틴 요법을 유지한 대조 대상체와 비교하여 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 55%, 적어도 60%, 적어도 65%, 적어도 70% 또는 적어도 75% 더 낮은 공복 트리글리세리드를 나타내고, (b) 기준선과 비교하여 혈청 LDL-C 수준의 증가를 나타내지 않고, 대조 대상체가 또한 약 200 mg/dl 내지 약 500 mg/dl의 기준선 공복 트리글리세리드를 갖는 것인, 약 200 mg/dl 내지 약 500 mg/dl의 평균 기준선 공복 트리글리세리드 수준을 갖고 안정한 스타틴 요법 중인 대상체에서 트리글리세리드를 저하시키는 방법을 제공한다.
또 다른 실시양태에서, 본 발명은, 약 200 mg/dl 내지 약 500 mg/dl의 평균 기준선 공복 트리글리세리드 수준을 갖고 안정한 스타틴 요법 중인 대상체 군의 구성원에게 약 1 g 내지 약 4 g의 초순수 EPA를 포함하는 제약 조성물을 투여하는 것을 포함하며, 상기 대상체 군의 구성원에게 약 12주의 기간 동안 매일 조성물을 투여하였을 때 상기 대상체 군이 약 12주의 기간 동안 초순수 EPA를 수반하지 않는 안정한 스타틴 요법을 유지한 대조 대상체 군과 비교하여 (a) 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 55%, 적어도 60%, 적어도 65%, 적어도 70%, 적어도 75% 더 낮은 평균 공복 트리글리세리드, 및 (b) 적어도 5%, 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45% 또는 적어도 50% 더 낮은 평균 혈장 또는 혈청 LDL-C 수준을 나타내고, 대조 대상체가 또한 약 200 mg/dl 내지 약 500 mg/dl의 평균 기준선 공복 트리글리세리드를 갖는 것인, 약 200 mg/dl 내지 약 500 mg/dl의 평균 기준선 공복 트리글리세리드 수준을 갖고 안정한 스타틴 요법 중인 대상체 군에서 트리글리세리드를 저하시키는 방법을 제공한다.
또 다른 실시양태에서, 본 발명은, 약 200 mg/dl 내지 약 500 mg/dl의 평균 기준선 공복 트리글리세리드 수준을 갖고 안정한 스타틴 요법 중인 대상체 군의 구성원에게 약 1 g 내지 약 4 g의 초순수 EPA를 포함하는 제약 조성물을 투여하는 것을 포함하며, 상기 대상체 군의 구성원에게 약 12주의 기간 동안 매일 조성물을 투여하였을 때 상기 대상체 군이 약 12주의 기간 동안 초순수 EPA를 수반하지 않는 안정한 스타틴 요법을 유지한 대조 대상체 군과 비교하여 (a) 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 55%, 적어도 60%, 적어도 65%, 적어도 70%, 적어도 75% 더 낮은 평균 공복 트리글리세리드, 및 (b) 적어도 5%, 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45% 또는 적어도 50% 더 낮은 평균 혈장 또는 혈청 LDL-C 수준을 나타내고, 대조 대상체 군이 또한 약 200 mg/dl 내지 약 500 mg/dl의 평균 기준선 공복 트리글리세리드를 갖는 것인, 약 200 mg/dl 내지 약 500 mg/dl의 평균 기준선 공복 트리글리세리드 수준을 갖고 안정한 스타틴 요법 중인 대상체 군에서 트리글리세리드를 저하시키는 방법을 제공한다.
또 다른 실시양태에서, 본 발명의 방법에 따라 치료될 대상체 또는 대상체 군은 약 300 nmol/ml 이하, 약 250 nmol/ml 이하, 약 200 nmol/ml 이하, 약 150 nmol/ml 이하, 약 100 nmol/ml 이하, 또는 약 50 nmol/ml 이하의 유리 총 지방산의 공복 기준선 절대 혈장 수준 (또는 그의 평균)을 나타낸다.
또 다른 실시양태에서, 본 발명의 방법에 따라 치료될 대상체 또는 대상체 군은 약 0.70 nmol/ml 이하, 약 0.65 nmol/ml 이하, 약 0.60 nmol/ml 이하, 약 0.55 nmol/ml 이하, 약 0.50 nmol/ml 이하, 약 0.45 nmol/ml 이하 또는 약 0.40 nmol/ml 이하의 유리 EPA의 공복 기준선 절대 혈장 수준 (또는 대상체 군의 경우에 그의 평균)을 나타낸다. 또 다른 실시양태에서, 본 발명의 방법에 따라 치료될 대상체 또는 대상체 군은 총 유리 지방산의 백분율로 표현된, 약 3% 이하, 약 2.5% 이하, 약 2% 이하, 약 1.5% 이하, 약 1% 이하, 약 0.75% 이하, 약 0.5% 이하, 약 0.25% 이하, 약 0.2% 이하 또는 약 0.15% 이하의 유리 EPA의 공복 기준선 혈장 수준 (또는 그의 평균)을 나타낸다. 한 이러한 실시양태에서, 유리 혈장 EPA 및/또는 총 지방산 수준은 요법 개시 전에 측정된다.
또 다른 실시양태에서, 본 발명의 방법에 따라 치료될 대상체 또는 대상체 군은 약 1 nmol/ml 이하, 약 0.75 nmol/ml 이하, 약 0.50 nmol/ml 이하, 약 0.4 nmol/ml 이하, 약 0.35 nmol/ml 이하 또는 약 0.30 nmol/ml 이하의 유리 EPA의 공복 기준선 절대 혈장 수준 (또는 그의 평균)을 나타낸다.
또 다른 실시양태에서, 본 발명의 방법에 따라 치료될 대상체 또는 대상체 군은 약 150 μg/ml 이하, 약 125 μg/ml 이하, 약 100 μg/ml 이하, 약 95 μg/ml 이하, 약 75 μg/ml 이하, 약 60 μg/ml 이하, 약 50 μg/ml 이하, 약 40 μg/ml 이하, 약 30 μg/ml 이하 또는 약 25 μg/ml 이하의 공복 기준선 혈장, 혈청 또는 적혈구 막 EPA 수준을 나타낸다.
또 다른 실시양태에서, 본 발명의 방법은 요법 개시 전에 대상체의 (또는 대상체 군의 평균) 기준선 지질 프로파일을 측정하는 단계를 포함한다. 또 다른 실시양태에서, 본 발명의 방법은 하기 중 하나 이상을 갖는 대상체 또는 대상체 군을 확인하는 단계를 포함한다: 약 200 mg/dl 내지 약 400 mg/dl, 예를 들어 적어도 약 210 mg/dl, 적어도 약 220 mg/dl, 적어도 약 230 mg/dl, 적어도 약 240 mg/dl, 적어도 약 250 mg/dl, 적어도 약 260 mg/dl, 적어도 약 270 mg/dl, 적어도 약 280 mg/dl, 적어도 약 290 mg/dl, 또는 적어도 약 300 mg/dl의 기준선 비-HDL-C 값; 약 250 mg/dl 내지 약 400 mg/dl, 예를 들어 적어도 약 260 mg/dl, 적어도 약 270 mg/dl, 적어도 약 280 mg/dl 또는 적어도 약 290 mg/dl의 기준선 총 콜레스테롤 값; 약 140 mg/dl 내지 약 200 mg/dl, 예를 들어 적어도 약 150 mg/dl, 적어도 약 160 mg/dl, 적어도 약 170 mg/dl, 적어도 약 180 mg/dl 또는 적어도 약 190 mg/dl의 기준선 vLDL-C 값; 약 10 내지 약 100 mg/dl, 예를 들어 약 90 mg/dl 이하, 약 80 mg/dl 이하, 약 70 mg/dl 이하, 약 60 mg/dl 이하, 약 60 mg/dl 이하, 약 50 mg/dl 이하, 약 40 mg/dl 이하, 약 35 mg/dl 이하, 약 30 mg/dl 이하, 약 25 mg/dl 이하, 약 20 mg/dl 이하, 또는 약 15 mg/dl 이하의 기준선 HDL-C 값; 및/또는 약 30 내지 약 300 mg/dl, 예를 들어 약 40 mg/dl 이상, 약 50 mg/dl 이상, 약 60 mg/dl 이상, 약 70 mg/dl 이상, 약 90 mg/dl 이상 또는 약 90 mg/dl 이상의 기준선 LDL-C 값.
관련된 실시양태에서, 본 발명에 따라, 예를 들어 약 1 내지 약 200주, 약 1 내지 약 100주, 약 1 내지 약 80주, 약 1 내지 약 50주, 약 1 내지 약 40주, 약 1 내지 약 20주, 약 1 내지 약 15주, 약 1 내지 약 12주, 약 1 내지 약 10주, 약 1 내지 약 5주, 약 1 내지 약 2주 또는 약 1주의 기간에 걸쳐 치료시, 대상체 또는 대상체 군은 하기 결과 중 하나 이상을 나타낸다:
(a) 기준선과 비교하여 감소된 트리글리세리드 수준;
(b) 기준선과 비교하여 감소된 Apo B 수준;
(c) 기준선과 비교하여 증가된 HDL-C 수준;
(d) 기준선과 비교하여 증가되지 않은 LDL-C 수준;
(e) 기준선과 비교하여 LDL-C 수준의 감소;
(f) 기준선과 비교하여 비-HDL-C 수준의 감소;
(g) 기준선과 비교하여 vLDL 수준의 감소;
(h) 기준선과 비교하여 apo A-I 수준의 증가;
(i) 기준선과 비교하여 apo A-I/apo B 비율의 증가;
(j) 기준선과 비교하여 지단백질 a 수준의 감소;
(k) 기준선과 비교하여 LDL 입자 수의 감소;
(l) 기준선과 비교하여 LDL 크기의 감소;
(m) 기준선과 비교하여 렘넌트-유사 입자 콜레스테롤의 감소;
(n) 기준선과 비교하여 산화된 LDL의 감소;
(o) 기준선과 비교하여 공복 혈장 혈당 (FPG)의 감소;
(p) 기준선과 비교하여 헤모글로빈 A1c (HbA1c)의 감소;
(q) 기준선과 비교하여 항상성 모델 인슐린 저항성의 감소;
(r) 기준선과 비교하여 지단백질 연관 포스포리파제 A2의 감소;
(s) 기준선과 비교하여 세포내 부착 분자-1의 감소;
(t) 기준선과 비교하여 인터류킨-2의 감소;
(u) 기준선과 비교하여 플라스미노겐 활성화제 억제제-1의 감소;
(v) 기준선과 비교하여 고감도 C-반응성 단백질 (hsCRP)의 감소;
(w) 기준선과 비교하여 혈장 또는 혈청 인지질 EPA의 증가;
(x) 기준선과 비교하여 적혈구 막 EPA의 증가; 및/또는
(y) 기준선과 비교하여 도코사헥사엔산(DHA), 도코사펜타엔산(DPA), 아라키돈산(AA), 팔미트산(PA), 스테아리돈산(SA) 또는 올레산(OA)의 혈장, 혈청 인지질 및/또는 적혈구 함량 중 하나 이상의 감소 또는 증가.
한 실시양태에서, 본 발명의 방법은 대상체 또는 대상체 군에 투여하기 전에 상기 (a) 내지 (y)에 기재된 하나 이상의 마커의 기준선 수준을 측정하는 것을 포함한다. 또 다른 실시양태에서, 상기 방법은 (a) 내지 (y)에 기재된 하나 이상의 마커의 기준선 수준을 측정한 후에 대상체에게 본원에 개시된 조성물을 투여하고, 후속적으로 상기 하나 이상의 마커의 추가 측정을 실시하는 것을 포함한다.
또 다른 실시양태에서, 본 발명의 조성물로, 예를 들어 약 1 내지 약 200주, 약 1 내지 약 100주, 약 1 내지 약 80주, 약 1 내지 약 50주, 약 1 내지 약 40주, 약 1 내지 약 20주, 약 1 내지 약 15주, 약 1 내지 약 12주, 약 1 내지 약 10주, 약 1 내지 약 5주, 약 1 내지 약 2주 또는 약 1주의 기간에 걸쳐 치료시, 대상체 또는 대상체 군은 바로 위에 기재된 결과 (a) 내지 (y) 중 임의의 2개 이상, 임의의 3개 이상, 임의의 4개 이상, 임의의 5개 이상, 임의의 6개 이상, 임의의 7개 이상, 임의의 8개 이상, 임의의 9개 이상, 임의의 10개 이상, 임의의 11개 이상, 임의의 12개 이상, 임의의 13개 이상, 임의의 14개 이상, 임의의 15개 이상, 임의의 16개 이상, 임의의 17개 이상, 임의의 18개 이상, 임의의 19개 이상, 임의의 20개 이상, 임의의 21개 이상, 임의의 22개 이상, 임의의 23개 이상, 임의의 24개 이상, 또는 25개 모두를 나타낸다.
또 다른 실시양태에서, 본 발명의 조성물로 치료시, 대상체 또는 대상체 군은 하기 결과 중 하나 이상을 나타낸다:
(a) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상, 약 55% 이상 또는 약 75% 이상의 트리글리세리드 수준의 감소 (실제 변화 % 또는 중앙값 변화 %);
(b) 기준선과 비교하여 비-HDL-C 수준의 30% 미만의 증가, 20% 미만의 증가, 10% 미만의 증가, 5% 미만의 증가 또는 증가하지 않음, 또는 약 1% 이상, 약 3% 이상, 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상, 약 55% 이상 또는 약 75% 이상의 비-HDL-C 수준의 감소 (실제 변화 % 또는 중앙값 변화 %);
(c) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상, 약 55% 이상 또는 약 75% 이상의 HDL-C 수준의 감소 (실제 변화 % 또는 중앙값 변화 %);
(d) 기준선과 비교하여 LDL-C 수준의 30% 미만의 증가, 20% 미만의 증가, 10% 미만의 증가, 5% 미만의 증가 또는 증가하지 않음, 또는 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상, 약 55% 이상, 약 55% 이상 또는 약 75% 이상의 LDL-C 수준의 감소 (실제 변화 % 또는 중앙값 변화 %);
(e) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상, 약 55% 이상 또는 약 75% 이상의 Apo B 수준의 감소 (실제 변화 % 또는 중앙값 변화 %);
(f) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상 또는 약 100% 이상의 vLDL 수준의 감소 (실제 변화 % 또는 중앙값 변화 %);
(g) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상 또는 약 100% 이상의 apo A-I 수준의 증가 (실제 변화 % 또는 중앙값 변화 %);
(h) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상 또는 약 100% 이상의 apo A-I/apo B 비율의 증가 (실제 변화 % 또는 중앙값 변화 %);
(i) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상 또는 약 100% 이상의 지단백질(a) 수준의 감소 (실제 변화 % 또는 중앙값 변화 %);
(j) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상 또는 약 100% 이상의 평균 LDL 입자 수의 감소 (실제 변화 % 또는 중앙값 변화 %);
(k) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상 또는 약 100% 이상의 평균 LDL 입자 크기의 증가 (실제 변화 % 또는 중앙값 변화 %);
(l) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상 또는 약 100% 이상의 렘넌트-유사 입자 콜레스테롤의 감소 (실제 변화 % 또는 중앙값 변화 %);
(m) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상 또는 약 100% 이상의 산화된 LDL의 감소 (실제 변화 % 또는 중앙값 변화 %);
(n) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상 또는 약 100% 이상의 공복 혈장 혈당 (FPG)의 감소 (실제 변화 % 또는 중앙값 변화 %);
(o) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상 또는 약 50% 이상의 헤모글로빈 A1c (HbA1c)의 감소 (실제 변화 % 또는 중앙값 변화 %);
(p) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상 또는 약 100% 이상의 항상성 모델 지수 인슐린 저항성의 감소 (실제 변화 % 또는 중앙값 변화 %);
(q) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상 또는 약 100% 이상의 지단백질 연관 포스포리파제 A2의 감소 (실제 변화 % 또는 중앙값 변화 %);
(r) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상 또는 약 100% 이상의 세포내 부착 분자-1의 감소 (실제 변화 % 또는 중앙값 변화 %);
(s) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상 또는 약 100% 이상의 인터류킨-2의 감소 (실제 변화 % 또는 중앙값 변화 %);
(t) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상 또는 약 100% 이상의 플라스미노겐 활성화제 억제제-1의 감소 (실제 변화 % 또는 중앙값 변화 %);
(u) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상 또는 약 100% 이상의 고감도 C-반응성 단백질 (hsCRP)의 감소 (실제 변화 % 또는 중앙값 변화 %);
(v) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상, 약 100% 이상, 약 200% 이상 또는 약 400% 이상의 혈장, 혈청 인지질 또는 RBC EPA의 증가 (실제 변화 % 또는 중앙값 변화 %);
(w) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상, 약 100% 이상, 약 200% 이상 또는 약 400% 이상의 혈장, 혈청 인지질 및/또는 RBC 막 EPA의 증가 (실제 변화 % 또는 중앙값 변화 %);
(x) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상, 약 55% 이상 또는 약 75% 이상의 혈장, 혈청 인지질 및/또는 RBC DHA, DPA, AA, PA 및/또는 OA 중 하나 이상의 감소 또는 증가 (실제 변화 % 또는 중앙값 변화 %); 및/또는
(y) 기준선과 비교하여 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상, 약 55% 이상 또는 약 75% 이상의 총 콜레스테롤의 감소 (실제 변화 % 또는 중앙값 변화 %).
한 실시양태에서, 본 발명의 방법은 대상체 또는 대상체 군에 투여하기 전에 (a) 내지 (y)에 기재된 하나 이상의 마커의 기준선 수준을 측정하는 것을 포함한다. 또 다른 실시양태에서, 상기 방법은 (a) 내지 (y)에 기재된 하나 이상의 마커의 기준선 수준을 측정한 후에 대상체에게 본원에 개시된 조성물을 투여하고, 후속적으로 비교를 위해 기준선에서 측정한 바와 같이 하나 이상의 마커의 제2 측정을 실시하는 것을 포함한다.
또 다른 실시양태에서, 본 발명의 조성물로, 예를 들어 약 1 내지 약 200주, 약 1 내지 약 100주, 약 1 내지 약 80주, 약 1 내지 약 50주, 약 1 내지 약 40주, 약 1 내지 약 20주, 약 1 내지 약 15주, 약 1 내지 약 12주, 약 1 내지 약 10주, 약 1 내지 약 5주, 약 1 내지 약 2주 또는 약 1주의 기간에 걸쳐 치료시, 대상체 또는 대상체 군은 바로 위에 기재된 결과 (a) 내지 (y) 중 임의의 2개 이상, 임의의 3개 이상, 임의의 4개 이상, 임의의 5개 이상, 임의의 6개 이상, 임의의 7개 이상, 임의의 8개 이상, 임의의 9개 이상, 임의의 10개 이상, 임의의 11개 이상, 임의의 12개 이상, 임의의 13개 이상, 임의의 14개 이상, 임의의 15개 이상, 임의의 16개 이상, 임의의 17개 이상, 임의의 18개 이상, 임의의 19개 이상, 임의의 20개 이상, 임의의 21개 이상, 임의의 22개 이상, 임의의 23개 이상, 임의의 24개 이상, 또는 26개 모두 또는 그 이상을 나타낸다.
파라미터 (a) 내지 (y)는 임의의 임상적으로 허용되는 방법에 따라 측정할 수 있다. 예를 들어, 트리글리세리드, 총 콜레스테롤, HDL-C 및 공복 혈당은 혈청으로부터 샘플링할 수 있고, 표준 광도측정 기술을 이용하여 분석할 수 있다. VLDL-TG, LDL-C 및 VLDL-C는 정제용 초원심분리에 의한 혈청 지단백질 분획화, 및 굴절률측정 또는 분석적 초원심분리 방법에 의한 후속 정량 분석을 이용하여 계산 또는 측정할 수 있다. Apo A1, Apo B 및 hsCRP는 혈청으로부터 표준 혼탁측정 기술을 이용하여 측정할 수 있다. 지단백질 (a)는 혈청으로부터 표준 비탁 면역검정 기술을 이용하여 측정할 수 있다. LDL 입자 수 및 입자 크기는 핵 자기 공명 (NMR) 분광측정법을 이용하여 측정할 수 있다. 잔유물 지단백질 및 LDL-포스포리파제 A2는 각각 EDTA 혈장 또는 혈청 및 혈청으로부터, 효소적 면역분리 기술을 이용하여 측정할 수 있다. 산화된 LDL, 세포간 부착 분자-1 및 인터류킨-2 수준은 혈청으로부터 표준 효소 면역검정 기술을 이용하여 측정할 수 있다. 이들 기술은 표준 교재, 예를 들어 문헌 [Tietz Fundamentals of Clinical Chemistry, 6th Ed. (Burtis, Ashwood and Borter Eds.), WB Saunders Company]에 상세히 기재되어 있다.
한 실시양태에서, 대상체를 혈액 샘플 수집 전 12시간 이하 동안, 예를 들어 약 10시간 동안 단식시킨다.
또 다른 실시양태에서, 본 발명은 원발성 고콜레스테롤혈증 및/또는 혼합형 이상지혈증 (프레드릭슨 제IIa형 및 제IIb형)의 치료 또는 예방을 필요로 하는 환자에게 본원에 개시된 하나 이상의 조성물을 투여하는 것을 포함하는, 상기 환자에서 원발성 고콜레스테롤혈증 및/또는 혼합형 이상지혈증 (프레드릭슨 제IIa형 및 제IIb형)을 치료 또는 예방하는 방법을 제공한다. 관련된 실시양태에서, 본 발명은 스타틴 또는 니아신 연장-방출 단독요법으로의 치료가 부적절한 것으로 간주되는 경우 (프레데릭슨 제IV형 고지혈증)에 대상체 또는 대상체들에서 트리글리세리드 수준을 감소시키는 방법을 제공한다.
또 다른 실시양태에서, 본 발명은 심근경색의 병력이 있는 환자에게 본원에 개시된 하나 이상의 조성물을 투여하는 것을 포함하는, 상기 환자에서 재발성 비치명적 심근경색을 치료하거나 그의 위험을 예방하는 방법을 제공한다.
또 다른 실시양태에서, 본 발명은 아테롬성동맥경화성 질환의 진행을 더디게 하거나 그의 퇴행을 촉진시키는 것을 필요로 하는 환자에게 본원에 개시된 하나 이상의 조성물을 투여하는 것을 포함하는, 상기 환자에서 아테롬성동맥경화성 질환의 진행을 더디게 하거나 그의 퇴행을 촉진시키는 방법을 제공한다.
또 다른 실시양태에서, 본 발명은 매우 높은 혈청 트리글리세리드 수준 (예를 들어, 제IV형 및 제V형 고지혈증)의 치료 또는 예방을 필요로 하는 환자에게 본원에 개시된 하나 이상의 조성물을 투여하는 것을 포함하는, 상기 환자에서 매우 높은 혈청 트리글리세리드 수준 (예를 들어, 제IV형 및 제V형 고지혈증)을 치료 또는 예방하는 방법을 제공한다.
한 실시양태에서, 본 발명의 조성물은 약 1 mg 내지 약 10,000 mg, 25 내지 약 5000 mg, 약 50 내지 약 3000 mg, 약 75 mg 내지 약 2500 mg 또는 약 100 mg 내지 약 1000 mg, 예를 들어 약 75 mg, 약 100 mg, 약 125 mg, 약 150 mg, 약 175 mg, 약 200 mg, 약 225 mg, 약 250 mg, 약 275 mg, 약 300 mg, 약 325 mg, 약 350 mg, 약 375 mg, 약 400 mg, 약 425 mg, 약 450 mg, 약 475 mg, 약 500 mg, 약 525 mg, 약 550 mg, 약 575 mg, 약 600 mg, 약 625 mg, 약 650 mg, 약 675 mg, 약 700 mg, 약 725 mg, 약 750 mg, 약 775 mg, 약 800 mg, 약 825 mg, 약 850 mg, 약 875 mg, 약 900 mg, 약 925 mg, 약 950 mg, 약 975 mg, 약 1000 mg, 약 1025 mg, 약 1050 mg, 약 1075 mg, 약 1100 mg, 약 1025 mg, 약 1050 mg, 약 1075 mg, 약 1200 mg, 약 1225 mg, 약 1250 mg, 약 1275 mg, 약 1300 mg, 약 1325 mg, 약 1350 mg, 약 1375 mg, 약 1400 mg, 약 1425 mg, 약 1450 mg, 약 1475 mg, 약 1500 mg, 약 1525 mg, 약 1550 mg, 약 1575 mg, 약 1600 mg, 약 1625 mg, 약 1650 mg, 약 1675 mg, 약 1700 mg, 약 1725 mg, 약 1750 mg, 약 1775 mg, 약 1800 mg, 약 1825 mg, 약 1850 mg, 약 1875 mg, 약 1900 mg, 약 1925 mg, 약 1950 mg, 약 1975 mg, 약 2000 mg, 약 2025 mg, 약 2050 mg, 약 2075 mg, 약 2100 mg, 약 2125 mg, 약 2150 mg, 약 2175 mg, 약 2200 mg, 약 2225 mg, 약 2250 mg, 약 2275 mg, 약 2300 mg, 약 2325 mg, 약 2350 mg, 약 2375 mg, 약 2400 mg, 약 2425 mg, 약 2450 mg, 약 2475 mg 또는 약 2500 mg의 에틸-에이코사펜타엔산의 1일 용량을 제공하기에 충분한 양으로 대상체에게 투여된다.
또 다른 실시양태에서, 본원에 개시된 방법 중 임의의 것은 전통적인 서구식 식이를 소비하는 대상체 또는 대상체들의 치료에 사용된다. 한 실시양태에서, 본 발명의 방법은, 대상체를 서구식 식이 소비자 또는 신중한 식이 소비자로서 확인한 다음, 대상체가 서구식 식이 소비자로 여겨지는 경우에 상기 대상체를 치료하는 단계를 포함한다. 본원에서 용어 "서구식 식이"는 일반적으로 총 칼로리에 대한 백분율로서 약 45% 내지 약 50%의 탄수화물, 약 35% 내지 약 40%의 지방, 및 약 10% 내지 약 15%의 단백질로 구성된 전형적 식이를 지칭한다. 서구식 식이는 대안적으로 또는 부가적으로 적색 및 가공 육류, 단 음식, 정제된 곡류 및 디저트류에 대한 비교적 높은 섭취율, 예를 들어 총 칼로리의 50% 초과, 60% 초과 또는 70% 초과가 이들 공급원으로부터 오는 것을 특징으로 할 수 있다.
또 다른 실시양태에서, 본원에 개시된 방법 중 임의의 것은 하루에 (실제 또는 평균) 약 150 g 미만, 약 125 g 미만, 약 100 g 미만, 약 75 g 미만, 약 50 g 미만, 약 45 g 미만, 약 40 g 미만, 약 35 g 미만, 약 30 g 미만, 약 25 g 미만, 약 20 g 미만 또는 약 15 g 미만의 어류를 소비하는 대상체 또는 대상체들의 치료에 사용된다.
또 다른 실시양태에서, 본원에 개시된 방법 중 임의의 것은 식이 공급원으로부터 하루에 (실제 또는 평균) 약 10 g 미만, 약 9 g 미만, 약 8 g 미만, 약 7 g 미만, 약 6 g 미만, 약 5 g 미만, 약 4 g 미만, 약 3 g 미만, 약 2 g 미만의 오메가-3 지방산을 소비하는 대상체 또는 대상체들의 치료에 사용된다.
또 다른 실시양태에서, 본원에 개시된 방법 중 임의의 것은 식이 공급원으로부터 하루에 (실제 또는 평균) 약 2.5 g 미만, 약 2 g 미만, 약 1.5 g 미만, 약 1 g 미만, 약 0.5 g 미만, 약 0.25 g 미만 또는 약 0.2 g 미만의 EPA 및 DHA (조합됨)를 소비하는 대상체 또는 대상체들의 치료에 사용된다.
한 실시양태에서, 본원에 기재된 조성물은 하루에 1회 또는 2회 대상체에게 투여된다. 또 다른 실시양태에서, 본원에 기재된 조성물 약 500 mg 내지 약 1 g을 각각 함유하는 1개, 2개, 3개 또는 4개의 캡슐이 대상체에게 매일 투여된다. 또 다른 실시양태에서, 본원에 기재된 조성물 약 1 g을 각각 함유하는 1개 또는 2개의 캡슐이 대상체에게 아침에, 예를 들어 약 오전 5시에서 약 오전 11시 사이에 투여되고, 본원에 기재된 조성물 약 1 g을 각각 함유하는 1개 또는 2개의 캡슐이 대상체에게 저녁에, 예를 들어 약 오후 5시에서 약 오후 11시 사이에 투여된다.
한 실시양태에서, 본 발명의 방법에 따라 치료될 대상체는 피브레이트 또는 니트레이트 요법 중이 아니다.
또 다른 실시양태에서, 본 발명의 방법에 따라 유용한 조성물은 경구 전달가능하다. 본원에서 용어 "경구 전달가능한" 또는 "경구 투여"는, 치료제 또는 그의 조성물 (이는 이것이 삼켜지는지 여부에 상관없이 대상체의 입에 위치함)의 대상체로의 임의의 전달 형태를 포함한다. 따라서, "경구 투여"는 협측 및 설하 투여, 뿐만 아니라 식도 투여를 포함한다. 한 실시양태에서, 조성물은 캡슐, 예를 들어 연질 젤라틴 캡슐 내에 존재한다.
본 발명에 따라 사용하기 위한 조성물은 하나 이상의 투여 단위로 제제화될 수 있다. 본원에서 용어 "용량 단위" 및 "투여 단위"는, 단일 투여로 치료 효과를 제공하기에 적합한 양의 치료제를 함유하는 제약 조성물의 일부를 지칭한다. 이러한 투여 단위는 하루에 1회 내지 수회 (즉, 1 내지 약 10회, 1 내지 8회, 1 내지 6회, 1 내지 4회, 또는 1 내지 2회), 또는 치료 반응을 도출하기 위해 필요한 만큼 많은 횟수로 투여될 수 있다.
또 다른 실시양태에서, 본 발명은, 약 500 mg/dl 내지 약 1500 mg/dl의 공복 기준선 트리글리세리드 수준을 갖는 대상체를 제공하고, 상기 대상체에게 본원에 기재된 제약 조성물을 투여하는 것을 포함하는, 중등도 내지 중증 고트리글리세리드혈증의 치료를 필요로 하는 대상체에서 중등도 내지 중증 고트리글리세리드혈증을 치료하기 위한 본원에 기재된 임의의 조성물의 용도를 제공한다. 한 실시양태에서, 조성물은 에이코사펜타엔산 에틸 에스테르 약 1 g 내지 약 4 g을 포함하며, 여기서 상기 조성물은 도코사헥사엔산을 실질적으로 함유하지 않는다.
또 다른 실시양태에서, 치료될 대상체는 당뇨병을 앓는다.
실시예
하기 실시예는 단지 예시적 목적을 위한 것이며, 어떠한 방식으로든 제한하는 것으로 해석되어서는 안 된다.
실시예 1
노화 관련 손상 (AAMI)을 앓는 대상체에서의 E-EPA의 단일 중심, 이중 맹검, 무작위, 병행-군, 위약 제어된 용량-범위 연구를 수행하였다. 1차 목표는 6주의 기간에 걸쳐 전산화된 시험 배터리에서 주의력 과제에 의해 측정시, AAMI를 앓는 대상체에서의 인지 수행에 대한 에틸-EPA 대 위약의 효과를 조사하는 것이었다. 2차 목표는:
(1) 전산화된 인지 배터리에서 6주에 걸쳐 하기 시험에 대한 E-EPA 대 위약의 효과: 주의 과제의 연속성; 작업 기억 과제의 품질; 에피소드 기억 과제의 품질; 주의 과제의 속도를 조사하고;
(2) 일상적인 임상 실험실 시험, 유해 사례 (AE) 모니터링 및 활력 징후로부터 E-EPA 대 위약의 안전성 및 허용성을 평가하고;
(3) 혈장 및 적혈구 막 내의 필수 지방산의 측정에 의해 인지 종점에 대한 E-EPA의 잠재적 용량-효과 관계를 평가하는 것이었다. 94명의 대상체를 무작위 분류하였다.
연구 계획은 하기와 같이, 균형 블록 설계 (군 당 24명의 대상체)에서 6주 동안 4개의 가능한 치료군 중 1개에 무작위로 할당될 96명의 대상체를 등록시키는 것이었다:
1. 1일 에틸-EPA 1 g
2. 1일 에틸-EPA 2 g
3. 1일 에틸-EPA 4 g
4. 1일 위약 (파라핀 오일)
에틸-EPA를 >96% 순도의 에틸-EPA, 0.25 중량% 내지 0.38 중량%의 에틸 옥타데카테트라에노에이트, 0.075 중량% 내지 0.15 중량%의 에틸 노나에카펜타에노에이트, 0.25 중량% 내지 0.35 중량%의 에틸 아라키도네이트, 0.3 중량% 내지 0.4 중량%의 에틸 에이코사테트라에노에이트 (ETA-E), 0.075% 내지 0.15% 에틸 헨에이코사펜타에노에이트 및 항산화제로서 0.2%의 dl- -토코페롤을 제공하는 500 mg 연질 겔 캡슐로서 제공하였다. 매칭되는 위약 캡슐은 액상 파라핀 467 g 및 0.2% dl- -토코페롤을 함유하였다. 위약군은 동일한 대상체 수 (8)가 1 g, 2 g 또는 4 g의 위약에 할당되도록 추가로 무작위 분류하였다. 연구 약물은 가벼운 스낵 또는 음식과 함께 분할 용량으로서 1일 2회 (BID) 복용되었다 (예를 들어, 1 g 용량의 경우에, 500 mg을 아침에 제공하고, 추가로 500 mg을 저녁에 제공함).
연구는 스크리닝 방문, 트레이닝 방문, 및 4회의 연구 방문으로 이루어진다. 스크리닝 방문에서, 대상체 부합성은 인지 시험 (구두 쌍 연상 학습 [PAL] 하위규모, 어휘 하위검사, 기억 평가 클리닉 앙케이트 [MAC-Q], 미니 정신 상태 평가 [MMSE] 및 MINI [미니 국제 신경정신 인터뷰; 정신 장애의 진단 및 통계 매뉴얼, 제4판 (DSM-IV)의 섹션 1 및 2, 및 기분저하증]), 혈액학, 임상 화학 및 12-리드 심전도 (ECG)를 통해 결정하였다. 트레이닝 방문에서, 대상체에게 CDR 전산화 시스템을 어떻게 사용하는지 보여주었다. 대상체는 6주 동안 연구 약물을 복용하고, 제0일, 제14일, 제28일 및 제42일에 대상체에게 CDR 인지 시험 배터리를 적용하였다.
포함 기준
1. 문서 사전 동의.
2. 50세 내지 70세의 남성 및 여성 지원자.
3. MAC-Q 앙케이트에서 25 이상의 점수에 의해 결정된, 소개 후 개인의 이름을 기억하기가 어려움, 물건을 잃어버림, 구입할 다수의 품목 또는 수행할 다수의 과제를 기억하기가 어려움, 전화 번호 또는 우편 번호를 기억하는 문제, 및 정보를 신속하게 또는 주의를 환기한 후에 상기해내기가 어려움과 같은 매일의 문제에 반영되는 자가-보고된 기억 상실의 호소증상. 기억 상실의 발병은 최근 몇 개월 내의 갑작스러운 악화 없이 점진적인 것으로 설명되는 것이었다.
4. 웩슬러(Wechsler) 기억 척도의 PAL 하위세트로부터 13 내지 20의 총 점수에 의해 결정된, 연령-매칭된 노인 집단의 평균보다 1 표준 편차 (SD) 이상 낮은 점수를 갖는 주관적 및 객관적 인지 장애의 소유.
5. 웩슬러 성인 지능 척도 (WAIS)의 어휘 하위검사에서 9 이상의 조정 점수 (32 이상의 원점수)에 의해 결정된 적당한 지적 기능의 증거.
6. MMSE에서 24 이상의 점수에 의해 결정된 치매의 부재.
7. 비흡연자 또는 3개월 초과의 금연자.
8. 센터에 다닐 수 있고, 연구 지속기간 동안 다니는 것을 계속하고 연구의 실행 계획에 따를 수 있을 것으로 연구 조사원이 판단한 자.
9. 체질량 지수 (BMI) <29.5 kg/m2.
제외 기준
1. 임상시험용 의약 투약 요구사항에 따를 것 같지 않거나 따를 수 없는 자.
2. MINI / DSM-IV 편집 (TR) 기준에 따라 정의된 주요 우울 장애, 알츠하이머 또는 혈관성 치매의 진단.
3. 인지 기능에 영향을 미칠 수 있는 신경계 또는 정신 장애의 과거 또는 현재 병력.
4. 염증성 위장 질환, 예컨대 크론병 또는 궤양성 결장염의 과거 또는 현재 병력.
5. 적극 치료가 요구되는 변비.
6. 기저 세포 암종의 진단을 제외한, 암의 현재 또는 이전 병력.
7. 12-리드 ECG에 의해 측정된 임상적으로 유의한 심장 이상의 임의의 병력 또는 증거.
8. 연구 조사원의 의견에서 연구에 참여하였을 때 대상체를 위험하게 할 수 있거나 또는 연구 결과에 영향을 미치거나 연구에 참여하기 위한 대상체의 능력에 영향을 미칠 수 있는, 적당하게 제어되지 않는 임의의 다른 의학적 상태 또는 병발성 질병.
9. 연구 조사원의 의견에서 연구를 위한 대상체의 적합성에 영향을 미치는, 스크리닝에서의 임상적으로 유의한 비정상적인 스크리닝 실험실 결과 (혈액학, 생화학) 또는 이 집단에 대해 정상적인 범위를 벗어난 활력 징후.
10. 기준선 방문의 4주 이내의 의학적 상태를 위해 처방된 의약에 대한 임의의 변화.
11. 기준선 방문의 4주 이내 또는 연구 치료 기간 동안의 오메가-3 보충.
12. 현재 복용 중인 항응고제 또는 325 mg 초과의 아스피린 1일 용량.
13. 기준선 방문의 2주 이내 또는 6-주 치료 기간 동안 오피에이트 또는 항히스타민제를 함유하는 기침 또는 감기 치료.
14. 연구 약물 또는 위약의 임의의 성분에 대한 공지된 알레르기.
임의의 대상체는 그의 또는 그의 법적 보호자의 요구에 의하여, 또는 연구 조사원의 자유재량으로, 계속 참여 중인 대상체가 그의 최적 관심대상에 있지 않은 경우에, 또는 심각하거나 예기치 못한 AE의 사건에서 언제든지 연구로부터 탈퇴시킬 수 있다. 대상체 결과 및 탈퇴 이유를 기록하는 데 모든 합리적인 노력을 다하였다. 임의의 진행중인 AE는 사건이 해결되거나, 안정화되거나 또는 달리 설명될 때까지 추적하였다. 탈퇴한 대상체는 대체되지 않았다. 대상체는 카탈렌트 파마 솔루션(Catalent Pharma Solution)에 의해 생성되고 약물 포장에 사용된, 미리 결정된 무작위 분류 목록에 따른 고유 확인 번호를 할당받았다.
연구 약물을 6주 동안 식품과 함께 분할 용량으로서 1일 2회 경구 투여하였다. 대상체를 6개의 가능한 치료군 (표 1) 중 1개로 무작위 분류하였다.
<표 1> 치료군
연구 약물을 방문 3, 4 및 5에 분배하였고; 방문 3과 각각의 후속 방문 사이의 최대 기간은 다음과 같았다:
· 방문 3에서 방문 4 (방문 3으로부터 2주 ±2일).
· 방문 3에서 방문 5 (방문 3으로부터 4주 ±2일).
· 방문 3에서 방문 6 (방문 3으로부터 6주 ±2일).
모든 치료 팩은 연구 전체에 걸쳐 대상체 및 연구 조사원 맹검 상태를 유지하기 위해, 외양에서 동일했다. 연구 조사원, 스폰서/임상 연구 구성 인원 및 대상체는 본 연구 전체에 걸쳐 맹검 상태로 남았다. 연구 조사원은 의학적으로 반드시 필요한 것으로 여겨지는 경우에는 개별 대상체의 맹검 상태를 해제하는 것을 허용하였다. 맹검 상태를 해제하기 위한 과정이 하기 약술되어 있다.
오메가-3 보충은 적어도 기준선 방문 (방문 3) 4주 전에 중단되어야 했다. 오피에이트 또는 항히스타민제를 함유하는 기침 및 인플루엔자 치료는 기준선 방문 (방문 3) 2주 전에 중단되어야 했고, 연구 지속기간 동안 허용되지 않았다.
기존 의약은 기준선 방문 (방문 3) 4주 전에 안정해야 했고, 용량은 연구 지속기간 동안 유지되었다. 용량 변화가 절대적으로 필요한 경우에는 이를 전자 증례 보고 형식 (eCRF)으로 기록하였다.
연구 동안 항응고제 의약을 필요로 한 대상체는 탈퇴될 것이었다. 심리학적 상담 또는 요법이 연구의 결과를 방해할 수 있기 때문에, 이는 연구 지속기간 동안 허용되지 않았다. 미사용된 연구 약물은 연구 지역으로 반환되었다. 처방된 용량의 80% 미만을 사용한 대상체는 비-순응적인 것으로 간주하였다.
스크리닝에서 인지 시험 및 연구에 대한 적합성을 구두 쌍 연상 1 (웩슬러 기억 척도), WAIS의 어휘 하위검사, MAC-Q, MMSE 및 MINI (DSM-IV 섹션 1 및 2, 및 기분저하증)를 이용하여 평가하였다.
CDR 전산화 인지 평가 시스템으로부터의 과제의 선택은 방문 2 (트레이닝 방문), 방문 3 (기준선), 방문 4 (제14일), 방문 5 (제28일) 및 방문 6 (제42일)에 투여되었다 (프로토콜의 부록 8). 병행 형태의 시험이 각각의 시험 세션에 제시되었다. 모든 과제는 컴퓨터-제어되고, 정보는 고해상도 모니터 상에 제시되고, 반응은 2개의 버튼 (하나는 '아니오'로, 다른 하나는 '예'로 표시함)을 포함하는 반응 모델을 통해 기록하였다. 5개의 CDR 종합 점수를 1차/2차 결과 변수로서 이용하였다.
과제 제목은 다음과 같다:
· 단어 제시 · 수치 작업 기억
· 즉시 단어 상기 · 지연된 단어 상기
· 그림 제시 · 단어 재인
· 단순 반응 시간 · 그림 재인
· 숫자 각성 · 기분 및 각성도의 본드-레이더(Bond-Lader) 시각적 아날로그 척도
· 선택 반응 시간 · 컴퓨터 마우스를 이용한 스크리닝
· 공간 작업 기억
접근법의 일관성을 보장하기 위해, 인지 시험 및 CDR 시험 배터리에 대한 모든 트레이닝을 연구 지역 스태프 및 연구 대상체에게 제공하였다. 각각의 변수의 결과를 CDR에 의해 개발된 기기 인터페이스를 사용하여 자동적으로 기록하였다.
AE는 의약품과 관련된 것으로 간주되든지 아니든지 의약품의 사용과 일시적으로 관련된 임의의 부적당한 의학적 사건으로 규정되었다.
연구 조사원은 AE의 검출 및 문서화를 책임졌다. 각 방문에서 대상체에게 비-유도성 질문에 의해 AE에 대해 질문하였다. AE는 대상체가 문서 사전 동의를 제공받고 참여할 자격이 있는 것으로 간주된 시간으로부터 치료 기간의 완료까지 기록하였다. 치료 기간의 종료시에 진행중인 AE는 해결되거나 기준선 또는 정상치로 복귀할 때까지, 또는 사건이 연구 약물에 관련되지 않은 것으로 간주될 때까지 추적하였다.
심각한 유해 사례 (SAE)는 임의의 용량에서 다음과 같은 임의의 AE로 규정되었다:
· 사망을 초래하거나;
· 생명을 위협하거나;
· 입원 또는 기존 입원의 연장을 필요로 하거나;
· 장애 또는 무력을 초래하거나, 또는
· 선천성 이상/출생 결함을 초래한다.
다른 사건은 이들이 상기 열거된 결과 중 하나를 방지하기 위해 대상체를 위태롭게 하거나, 의학적 또는 수술적 개입을 필요로 한 경우에 SAE로 간주하였다.
상기 기준에 상관없이, 스폰서 또는 연구 조사원이 심각한 것으로 간주한 임의의 AE는 즉시 SAE로 기록될 것이었다. 임상시험용 의약품을 투여받는 동안 또는 그의 마지막 투약의 30일 이내에 환자가 경험한 임의의 사망 또는 SAE는 신속하게 (사건 학습 24시간 내에) 약물감시체계에 보고되어야 한다. 모든 AE (SAE 포함)는 임상시험용 의약품의 첫 번째 투여로부터 시작하여 마지막 투약 후 30일까지 대상체의 eCRF의 유해 사례 페이지 상에 정확히 기록되어야 한다.
하기 표 2에 열거된 혈액학 (5 mL 혈액 샘플) 및 임상 화학 (10 mL 혈액 샘플)에 대한 실험실 평가를 위한 혈액 샘플을 스크리닝 방문 (방문 1)에서 수집하였다. 샘플을 심벡 래보러토리즈 리미티드(Simbec Laboratories Ltd.)에 의해 가공 및 분석하였다.
<표 2> 실험실 평가
약력학: 필수 지방산 (EFA) 측정
혈액 샘플 (10 mL)을 방문 1 (스크리닝) 및 방문 4, 5 및 6에서 수집하였다. 분석은 MSR 지질 분석 (스코틀랜드 작물 연구 기관(Scottish Crop Research Institute), 영국 던디)에 의해 수행하였다. 스크리닝 샘플은 EFA 측정을 위한 기준선의 역할을 하였다.
혈장, 혈청 및 RBC 현탁액으로부터 지질을 추출하고, 지방산 메틸 에스테르로 전환시키고, 이를 기체 크로마토그래피에 의해 분석하여 샘플 1 그램 당 지방산 마이크로그램 (μgFA/g) 및 정규화된 면적 백분율로서 지방산 프로파일을 제공하였다. CDR 전산화 시스템을 사용하여 다양한 임상 시험에서 인지 기능에 대한 약제의 효과를 측정하였다. 효능을 CDR에 의해 설계된 인지 시험의 배터리에 의해 평가하였다. 안정성 데이터를 퀀티케이트(Quanticate)에 의해 분석하였다.
분석된 집단은 다음을 포함하였다:
ㆍ 치료 의도 (ITT) 집단: 적어도 1회의 기준선후 방문을 갖는 모든 무작위 분류된 대상체는 실제로 받은 치료에 상관없이 이 집단에 포함되었다.
ㆍ 프로토콜 순응 집단 (PP): 유의한 프로토콜 편차인자를 배제한, 연구가 완료된 모든 무작위 분류된 대상체가 안전성 PP 집단으로 규정되었다. 효능 PP 집단은 효능 컴플리터(completer)를 기반으로 하였다. 안전성 및 효능 PP 집단의 인터셉트는 연구 PP 집단을 규정하였다.
ㆍ 안정성 집단: 연구 의약의 1 용량 이상을 투여받은 모든 무작위 분류된 대상체.
ITT 및 연구 PP 집단에 대해 별도로 모든 종합 점수, 주요 및 지지 변수에 대한 요약 통계를 제공하였다. 요약 통계는 비조정치 및 기준선 데이터로부터의 차이 (즉, 제0일에 시간 매칭 선량 평가로부터의 차이) 둘 모두에 대해 수행하였다. 요약 통계는 치료, 일 및 시점에 의해 계산하였다. 요약 통계는 n, 평균, 중앙값, SD, 평균의 표준 편차 (SEM), 최소 및 최대 값을 포함한다.
각각의 주요 변수에 대한 기준선 데이터로부터의 차이는 SAS? PROC MIXED 버전 8.2를 사용하는 공분산 분석 (ANCOVA)에 의해 평가하였다.
치료, 일, 시점, 주간 치료, 시점에 의한 치료, 주간 시점에 의한 치료에 대한 고정 효과를 피팅하였다. 치료 내의 대상체는 반복된 진술을 이용하여 반복된 효과로 피팅하였다. 화합물 대칭 공분산 구조를 이용하였다. 제0일에 대상체의 시간-매칭 선량 평가를 분석에서 공변량으로 사용하였다. 최소 자승 평균 (LS 평균)을 주간 치료, 시점에 의한 치료 및 시점 상호작용에 의한 주간 치료에 대해 계산하였다. 이 형식적 분석은 ITT 및 연구 PP 집단에 대해 별도로 수행하였다.
안전성 평가는 안전성 집단을 기반으로 하였다. 안전성 및 허용성을 AE, 활력 징후, 12-리드 ECG, 임상 실험실 데이터, 병력 및 연구 약물 순응성의 관점에서 평가하였다. 안전성 및 허용성 데이터를 치료군에 의해 제시하였다. 모든 안전성 데이터는 대상체에 의해 개별적으로 열거하였다.
RBC 및 혈장 EFA 데이터는 기준선, 제14일, 제28일 및 제42일에 수집하고, 각각의 치료군에 대한 방문에 의해 요약되었다. 기준선으로부터의 변화 및 기준선으로부터의 변화율(%)이 또한 요약되었다. 에틸-EPA 용량 군 및 에틸-EPA 대 위약의 ANCOVA 비교를 수행하였다.
샘플 크기 계산은 주의력을 기반으로 하였다. 초기 연구의 반복된 투약의 제21일에 AAMI를 앓는 대상체에서 이스프로니클린 (50 mg), 뉴런 니코틴성 아세틸콜린 수용체 부분 효능제는 주의력에 대해 61 밀리초 (50 mg 평균=-32.54, SD = 61.22; 위약 평균=28.25, SD = 49.64)의 유용성을 보여주었다. 모인 SD를 이용하여, 치료 아암 당 15명의 대상체의 샘플 크기는 80%의 검정력 및 5%의 유의 수준 (다중 시험을 위한 조정은 없음)으로 61 밀리초의 차이를 검출하기에 충분한 것으로 간주되었다. 화합물 또는 이들 인지 측정으로의 작용 메카니즘을 이용한 선행 경험이 없었기 때문에, 치료 아암 당 24명의 대상체의 샘플 크기는 조기 탈퇴를 허용하기에 충분한 것으로 선택되었다.
연구의 수행에는 어떠한 변화도 없었다. 하기 변화는 계획된 분석으로 이루어졌다: 기억의 속도를 계산하기 위한 방정식은 SPEEDMEM (기억의 속도) = SPMRT (공간 작업 기억 속도) + NWMRT (수치 작업 속도) + DRECRT (단어 재인 속도) + DPICRT (그림 재인 속도)로 변화되었다.
· 제0일에 대상체의 시간-매칭 선량 평가를 분석에서 공변량으로 사용하였다.
· 제0일을 ANCOVA 변수 값의 목록에서 일 값으로부터 제거하였다. 공변량 = 기준선을 공변량 = ANCOVA 변수 값의 목록에서 제0일에 시간 매칭 선량 평가로 변경하였다.
· 시점에 의한 일수를 ANCOVA 모델을 위한 SAS? 코드에서 모델 효과의 목록에 추가하였다.
· F 검정 표 및 치료 효과 표를 ANCOVA 요약표의 목록에 추가하였다.
· ANCOVA 요약표를 ANCOVA 원결과로부터 이어지도록 재넘버링하였다.
· ANCOVA LS 평균에 대한 치료, 주간 치료, 시점에 의한 치료, 시점에 의한 주간 치료 효과에 대한 도면을 포함시켰다.
· 위약에 대한 ANCOVA LS 평균 차이 (95% 신뢰 구간 [CI])에 대한 도면을 추가하였다.
· 개별 위약군 (1 g, 2 g 및 4 g 파라핀 오일)을 모인 위약군보다는 상응하는 에틸-EPA 용량과 비교하는 사후 분석을 수행하였다.
91명의 대상체가 연구를 완료하였고, 3명의 대상체가 중단하였다; 에틸-EPA 2 g 치료군으로부터의 2명의 대상체 (연구 약물에 관련되지 않은 SAE로 인한 1명의 대상체, 및 프로토콜 위반으로 인한 1명), 및 AE로 인한 위약 2 g 군으로부터의 1명의 대상체.
주의력의 경우에, 치료, 임의의 주간 치료, 시점에 의한 치료 또는 시점 상호작용에 의한 주간 치료의 통계적으로 유의한 효과는 없었다. 임의의 시점에 적극적 치료와 위약 사이에 어떠한 LS 평균 차이도 없었다. 선택 반응 시간 동안, 위약에 대하여, 제28일에 에틸-EPA 1 g 및 2 g의 경우에 통계적으로 유의한 유용성이 있었고, 제42일에 에틸-EPA 1 및 4 g의 경우에 유용성에 대한 약간의 경향이 있었으나; 어떠한 명백한 치료-관련 패턴도 관찰되지 않았다.
주의 연속성은 단지 ITT 집단에서만 가시적인 2 g 에틸-EPA에서의 전반적 감소를 제외하고는 위약과 에틸-EPA 사이에 차이를 보이지 않았다. 검출된 하위작업 숫자 각성 표적은 적극 치료 대 위약에서의 구분된 감소를 보여주었으나, 어떠한 명백한 치료-관련 패턴도 없었다.
작업 기억의 품질은 F-비에서의 주간 상호작용에 의해 통계적으로 유의한 치료를 보여주는 유일한 종합 점수였다. 그러나, 단지 제14일 및 제28일에 위약에 대하여 에틸-EPA 1 g 및 2 g의 경우에 유일한 구분된 통계적으로 유의한 감소가 있었고, 이들은 필시 치료와 관련되지 않고 우연으로 인한 것이었다.
에피소드 2차 기억의 품질은 다양한 시점에서 에틸-EPA 대 위약의 경우에 통계적으로 유의한 감소를 보여주었다. 그러나, 비조정된 데이터가 제1 평가 세션에서 제0일에 가장 주목할 만한 치료군 사이의 이미 존재하는 차이를 보여준 바와 같이, 이는 적극 치료의 효과일 가능성이 없는 것처럼 보인다. ANCOVA 분석 전에 계산된 기준선 데이터로부터의 차이에서, 이러한 차이는 더이상 분명하지 않았다. 이는 ANCOVA 모델이 기준선 값과 강한 음성 상관 관계로 피팅되었다는 것을 시사한다. 이는 종종 대상체 내의 변동성이 대상체 사이의 변동성과 중첩되는 경우이다.
기억 속도 및 하위과제 공간 및 수치 작업 기억 속도, 및 단어 및 그림 재인 속도는 에틸-EPA와 위약 사이에서, F-비 통계에서, 성능에서 어떠한 차이도 보이지 않았다.
자가-평가된 각성도의 경우에, 에틸-EPA와 위약 사이의 평가에는 어떠한 분명한 차이도 없었다. 적극 치료 대 관련된 화합물일 가능성이 낮은 위약에 대한 평가에서 구분된 감소가 있었다.
자가-평가된 만족감은 제28일에 에틸-EPA 2 g에 대한 평가에서 통계적으로 유의한 감소를 보여주었다. 그러나, 이들 개별적 감소는 통계적으로 유의하지 않았다. 이는 이것이 단일 주간으로 제한되었고 어떠한 다른 용량 수준도 임의의 다른 주간에 유사한 패턴을 보이지 않기 때문에 치료-관련 효과일 가능성이 낮다. 자가-평가된 평온도에 대해, 적극 치료와 위약 사이의 평가에서 어떠한 차이도 없었다.
각각의 에틸-EPA 용량 및 그의 상응하는 위약의 결과를 비교했을 때 (사후 분석), 에틸-EPA 4 g은 주의 과제 (주의력, 단순 반응 시간 및 선택 반응 시간)에서 대상체의 반응 시간을 향상시킨 것으로 나타났다. 이는 선택 반응 시간의 경우에 가장 분명하게 보였고, 여기서 4 g의 경우에 평가일이 지남에 따라 점진적 향상의 패턴이 보였다. 더 긴 투여 기간이 이들 파라미터에 대한 에틸-EPA의 효과를 명확하게 할 것이 가능하다.
EPA (표 3에 나타냄), DPAn-3 및 EPA/AA 비 (데이터는 제시되지 않음) 혈장 및 RBC 값은 AMR-101 1, 2 및 4 g 치료군의 경우에 제42일까지 기준선으로부터 실질적으로 증가했다. AA, DHA 및 DGLA 값은 기준선으로부터 실질적으로 감소했다 (데이터는 제시되지 않음).
<표 3> 기준선으로부터의 평균 (SD) EPA (혈장 및 RBC (μg/g)) 변화.
표 3에서 볼 수 있는 바와 같이, 하루에 2 g의 AMR101 용량에서 혈장 EPA 수준은 42일 후에 기준선과 비교하여 297% 증가하였고, 하루에 4 g의 AMR101 용량에서 혈장 EPA 수준은 기준선과 비교하여 417% 증가하였다.
그림스가르트(Grimsgaard) 등은 기준선에서 및 하루에 4 g의 90% 에틸-DHA, 하루에 4 g의 95% 에틸-EPA (약간의 DHA 존재), 또는 옥수수 오일로의 보충 7주 후의 혈청 인지질 수준을 기재하는 논문을 이전에 발표하였다. 문헌 [Am. J. Clin. Nutr. 1997; 66:649-59 (1997)]. 추가적인 지방산의 완전한 프로파일 및 이들 조성물 중에 존재하는 성분은 공지되어 있지 않다. 7주의 기간에 걸친 보충 후에, 대상체는 본 발명의 조성물을 사용한 상기에 나타낸 417%의 증가와 비교하여 혈청 인지질 EPA의 단지 297%의 증가를 나타내었다. 혈장/혈청 지방산에서의 다른 변화의 비교는 하기 표 4에 나타내었다.
<표 4> 4 g 용량 투여 후의 기준선으로부터의 지방산 변화 백분율
추가로, 일본 에이코사펜타엔산 (EPA) 지질 중재 연구 (JELIS)에서, 요코하마(Yokoyama) 등은 그들이 스타틴을 함유하는 EPA 조성물 (에파델(Epadel)) 1800 mg 또는 스타틴 단독을 수용하도록 무작위로 할당된 18,000명의 환자를 5년의 후속 검사와 함께 추적하였다고 보고하였다. 문헌 [Lancet 2007; 369: 1090-98]. 치료 5년 후에, 대상체는 단지 70%의 혈장 EPA의 증가를 나타내었다 (93 mg/L의 기준선에서 169 mg/L로).
도 1 및 2는 JELIS 연구에서 및 그림스가르트에 의해 다양한 EPA 조성물로 관찰된 것들과 비교하여 현재 연구에서의 AMR101 치료로 관찰된 혈장/혈청 EPA 수준의 변화의 비교를 보여준다. 주목될 바와 같이, 하루에 약 2 g에서, AMR101은 단지 6주 후에 5년의 치료 후에 관찰된 JELIS 연구 (< 2배)보다 훨씬 더 큰 기준선에 비한 혈장 EPA 증가 (약 4배)를 달성했다. 추가로, 하루에 4 g 용량에서, 6주 동안의 AMR101 치료는 7주의 치료 후에 그림스가르트에 의해 보고된 것 (87.66 μg/g 혈청)보다 훨씬 더 높은 (>250 μg/g) 혈장 EPA 수준을 달성하였다. 전반적으로, 하루에 4 g 용량의 AMR101은 하루에 4 g 용량의 그림스가르트 조성물이 3배 미만의 혈청 EPA의 증가를 일으킨 반면에 기준선에 대해 5배 초과의 혈장 EPA의 증가를 일으켰다. 이러한 결과는 예기지 못한 것이었다.
실시예 2
다중-중심, 무작위, 이중-맹검, 위약-대조군 시험을 북아메리카에서 수행하여 6개월 동안 1일 2회 1 그램의 EPA가 헌팅톤병 환자에서 운동 성능을 개선하는지를 결정하였다. 사후 분석을 수행하여 비-공복 트리아실글리세롤에 대한 EPA의 효과를 평가하였다.
헌팅톤병의 진행에 대한 에틸-EPA의 효과의 연구는 캐나다 및 미국 내의 41개 지역에서 연구 참가자를 등록시켰다. 보다 초기의 연구 결과를 기반으로, 연구 참여 기준을, 연구 참가자 또는 연구 조사원에게 확대의 길이를 밝히기 위한 유전자 검사를 요구하지 않으면서 45회 미만의 CAG 반복을 갖는 헌팅톤병을 앓는 개체의 참가를 높이도록 설계하였다. 연구에 참가하기 위해, 개체는 HD의 임상적 특징, 및 확증적인 가족력 또는 공지된 CAG 확대를 가지고 있어야 했다. 적임 기준은 35세의 최소 연령, 7 이상의 총 기능 용량, 최소의 근육긴장이상 (몸통 또는 사지에서 UHDRS 상에서 2를 초과하지 않음), 최소의 운동완만 (운동완만에 대한 UHDRS 품목 상에서 2를 초과하지 않음), 적당한 산아 제한의 이용, 경구 의약 복용 능력, 및 연구 요구사항에 따르기 위한 의향 및 능력을 포함하였다. 개체는, 기준선 방문의 60일 내에, 그들이 오메가-3 지방산 보충, 테트라베나진 또는 레세르핀, 고용량 또는 가변 용량의 경구 항-정신병 의약 (예를 들어, 할로페리돌), 국소 제제 이외의 스테로이드, 고용량 셀레늄 보충, 리튬, 고용량의 벤조디아제핀, 항-응고 의약 (예를 들어, 쿠마딘), 고용량 (하루에 325 mg 초과)의 아스피린, 불안정한 용량의 NMDA 수용체 길항제 (예를 들어, 메만틴), 불안정한 용량의 항-간질환자 의약을 사용했거나, 또는 그들이 다른 임상시험용 약물 연구에 참가한 적이 있는 경우에는 참가하기에 부적격이었다. 추가의 제외 기준은 기준선 방문의 6개월 내의 데포 신경이완제의 사용, 지연성 운동이상증의 병력, 불안정한 의학적 또는 정신의학적 질병, 주요 우울증 (베크 우울증 일람표 II에서 20 초과의 점수로 규정됨), 자살성 사고, 기준선 방문의 12개월 내의 임상적으로 유의한 물질 남용, 임신 또는 수유 중인 여성, 에틸-EPA 또는 위약에 대한 공지된 알레르기, 또는 EPA의 임상시험용 연구의 이전 참여였다.
이는 EPA (1 그램 2회/일)의 무작위, 이중-맹검, 위약-대조군, 병행 군 연구였다. 각각의 참가 지역에서 임상시험 심사 위원회는 연구 계획 및 동의서를 승인하였다. 적격인 연구 참가자는 서면 동의서를 제공하였다. 기준선 방문에, 참가자를 지역에 의해 계층화되고 로체스터 대학교의 생물통계학 센터에 의해 생성된 블록-균형 컴퓨터-생성 무작위 분류 계획에 따라 무작위 분류하였다. 개체를 6개월 동안 경구로 매일 2회 AMR101의 500 mg 캡슐 2개의 형태로 활성 약물 (n=158)을 경구로, 또는 광 파라핀 오일 및 0.2% dl-알파-토코페롤을 함유하는 500 mg 캡슐 2개의 형태로 위약 (n=154)을 수용하도록 1:1 비율로 무작위 분류하였다. 6개월 후, 모든 TREND-HD 참가자를 개방-표지 방식으로 6개월 동안 AMR101로 치료하였다. 단지 처음 6개월로부터의 데이터를 지질에 대한 AMR101의 효과를 평가하는 데 사용하였다.
본 연구의 결과 측정은 위약에 대한 것들과 비교하여 AMR101에 대한 것들에서의 비-공복 트리아실글리세롤 (TG) 수준의 변화였다.
안전성은 유해 사례 및 심각한 유해 사례의 심사 및 평가, 및 임상 실험실 시험 (전혈구 수, 혈청 화학, 및 소변-임신 검사)의 검토를 비롯하여 모든 연구 방문에서 평가하였다. 연구 참가자의 안전성은 스폰서 및 헌팅톤 연구군 둘 다로부터 의학 모니터에 의해 맹검 방식으로 모니터링하였다. 또한, 치료 할당에 접속한 독립적 안전성 모니터링 위원회는 연구 전반에 걸쳐 안전성 데이터를 검토하여 임의의 변형이 시험의 수행에 필요한지를 결정하였다.
지질 수준의 변화를 공분산의 분석 (ANCOVA)을 이용하여 관심 인자로서의 치료군, 계층화 인자로서의 지역, 및 공변량으로서의 기준선 값과 비교하였다. 연구 의약을 수용한 모든 개체를 안전성 분석에 포함시켰다. 유해 사례의 각각의 유형에 대해, 치료군을 피셔의 정확 검정을 이용하여 하나 이상의 사건의 발생에 관하여 비교하였다. 안전성, 예컨대 실험실 시험 결과 및 활력 징후의 연속 측정치를 상기 기재된 것과 유사한 방법을 이용하여 1차 결과 변수 (ANCOVA)에 대해 분석하였다. 안전성 데이터를 평가함에 있어 다중 비교를 위해 어떠한 수정도 하지 않았다.
AMR101에 대한 145명의 대상체 (할당된 대상체의 92%) 및 위약에 대한 141명의 대상체 (할당된 대상체의 92%)는 기준선 및 6개월째에 측정된 EPA의 적혈구 함량을 가졌다. 20:5n3 (EPA)의 기준선 적혈구 함량은 AMR101에 대한 대상체에서 6개월 후에 유의하게 증가하였으나 (평균의 0.52% 내지 3.07%), 위약에 대한 대상체에서는 감소하였다 (평균의 0.61% 내지 0.55%); p<0.0001. 6개월 후, AMR101을 복용하는 개체는 위약에 대한 대상체에서의 187 mg/dL의 기준선으로부터의 11 mg/dL의 감소와 비교하여 171의 기준선으로부터 TG의 26 mg/dL 감소를 가졌다; p=0.007. 총 콜레스테롤은 208 mg/dL의 기준선으로부터 위약 (2.5 mg/dL)을 복용하는 대상체에서보다 204 mg/dL의 기준선으로부터 AMR101 (9.5 mg/dL)을 복용하는 대상체에서 유의하게 더 감소되었다; p=0.009. 지질 및 운동 점수 데이터를 각각 표 5 및 6에 나타내었다.
<표 5> 운동 점수 결과.
<표 6> 지질 파라미터 결과.
AMR101에 대한 이들 데이터와의 비교에 의해, 그림스가르트는 치료 7주 후에 EPA 군에서의 혈청 트리글리세리드의 단지 12%의 감소 (기준선으로부터)를 보고하였다. 추가로, JELIS 연구에서 기존 스타틴 요법에 에파델 EPA 조성물을 첨가하는 것은 치료 5년 후에 트리글리세리드의 단지 9%의 감소를 일으켰다.
실시예 3
에파델 캡슐의 함량을 AMR101 캡슐과 평가 및 비교하기 위한 연구를 수행하였다. 각각의 조성물의 6개의 캡슐을 기체 크로마토그래피에 의한 분석을 위해 선택하였다. 각각의 2종의 조성물에 대한 6개의 캡슐의 평균을 하기 표 7에 나타내었다.
<표 7> AMR101 및 에파델의 측정되고 확인된 성분.
실시예 4
건강한 남성 지원자에서의 제1상, 다중 용량 약동학 연구를 단일 센터에서 수행하였다. 24명의 대상체를 각각 12명의 대상체의 2개의 치료군으로 분할하였다 (군 A 및 B). 두 군 모두는 동일한 총 1일 용량의 AMR101을 수용하였으나, 투약 요법은 상이했다. 모든 대상체는 제1일에 AMR101 2 g의 단일 경구 용량을 수용하였다. 치료군 A는 AMR101 2 g의 28회 연속 1일 1회 용량을 수용하였다. 치료군 B는 AMR101 1 g의 27회 연속 1일 2회 용량 및 제30일에 AMR101 2 g의 단일 용량을 수용하였다.
EPA 및 다른 필수 지방산의 수준을 혈장 및 적혈구에서 측정하였다. 약동학 분석을 위한 혈액 샘플을 치료군 A 및 B에 대해 하기 시점에 채취하였다:
제1일 및 제30일: 투약 전, 투약 후1, 2, 3, 4, 5, 6, 8, 20, 12, 24, 36 및 48시간;
제9일, 제16일, 제23일: 아침 투약 전;
제37일, 제44일, 제58일: 마지막 투약 후.
제1 중간 보고는 치료군 B에 대한 하기 약동학 결과를 제시한다:
혈장 - 제1일 (투약 전, 투약 후 1, 2, 3, 4, 5, 6, 8, 20, 12, 24, 36 및 48시간);
적혈구 - 제1일 (투약 전 및 36시간), 제30일 (투약 후 1시간), 제37일, 제44일, 제58일.
각각의 샘플링에서의 농도에서 투여 전 농도를 차감함으로써 얻은 보정된 값을 이용할 때, AMR101 2 g의 단일 경구 용량은 혈장 지질 EPA의 고속 상승을 일으켰다. 투여 후 48시간째에 기준선을 상회한 채로 남아 있는 EPA 수준으로 투여 후 5시간째에 최대 값을 관찰하였다. 혈장 지질로부터의 EPA의 제거 반감기는 87 ± 65시간 (비-기준선 차감) 및 42 ± 31시간 (기준선 차감)이었다. 요약 약동학적 데이터를 하기 표 8에 나타내었다.
<표 8> 비-구획 분석 - 산술 평균 및 SD.
각 프로토콜 집단에서 AMR101의 경구 투여는 RBC EPA 수준이 제1일에 투약하기 전의 190.4 mg/g의 평균 값으로부터 제30일에 최종 투약 1시간 후에 40.3 mg/g까지 증가되게 하였다.
Claims (21)
- 혈장 및/또는 혈청 EPA의 증가를 필요로 하는 대상체에게 96 중량% 이상의 에틸 에이코사펜타에노에이트, 약 0.2 중량% 내지 약 0.5 중량%의 에틸 옥타데카테트라에노에이트, 약 0.05 중량% 내지 약 0.25 중량%의 에틸 노나에카펜타에노에이트, 약 0.2 중량% 내지 약 0.45 중량%의 에틸 아라키도네이트, 약 0.3 중량% 내지 약 0.5 중량%의 에틸 에이코사테트라에노에이트, 약 0.05% 내지 약 0.32%의 에틸 헨에이코사펜타에노에이트, 및 존재하는 경우에 0.05% 이하의 에틸-DHA를 포함하는 제약 조성물을 상기 대상체에서의 혈장 및/또는 혈청 EPA 수준을 기준선과 비교하여 약 200% 이상 증가시키는 데 충분한 양으로 매일 투여하는 것을 포함하는, 상기 대상체에서 혈장 및/또는 혈청 EPA를 증가시키는 방법.
- 제1항에 있어서, 조성물을 대상체에서의 혈장 및/또는 혈청 EPA 수준을 기준선과 비교하여 300% 이상 증가시키는 데 충분한 양으로 투여하는 방법.
- 제1항에 있어서, 조성물을 대상체에서의 혈장 및/또는 혈청 EPA 수준을 기준선과 비교하여 400% 이상 증가시키는 데 충분한 양으로 투여하는 방법.
- 제3항에 있어서, 조성물을 대상체에게 약 6주 이상의 기간 동안 매일 투여하는 방법.
- 제4항에 있어서, 대상체가 약 50 μg/ml 이하의 기준선 혈장 및/또는 혈청 EPA 수준을 갖는 것인 방법.
- 제1항에 있어서, 대상체에게 약 6주 이상의 기간 동안 매일 조성물 2 g을 투여할 때, 상기 대상체가 혈장 및/또는 혈청 EPA에서 기준선과 비교하여 200% 이상의 증가를 나타내는 것인 방법.
- 제1항에 있어서, 대상체에게 약 6주 이상의 기간 동안 매일 조성물 4 g을 투여할 때, 상기 대상체가 혈장 및/또는 혈청 EPA에서 기준선과 비교하여 300% 이상의 증가를 나타내는 것인 방법.
- 제1항에 있어서, 대상체에게 약 6주 이상의 기간 동안 매일 조성물 4 g을 투여할 때, 상기 대상체가 혈장 및/또는 혈청 EPA에서 기준선과 비교하여 400% 이상의 증가를 나타내는 것인 방법.
- 제1항에 있어서, 대상체에게 매일 조성물을 투여할 때, 상기 대상체가 혈청 및/또는 혈장 DPA 수준의 증가, 및 혈청 및/또는 혈장 AA, DHA 및/또는 DGLA 수준의 감소를 나타내는 것인 방법.
- 제1항에 있어서, 대상체에게 6주 이상의 기간 동안 매일 조성물을 투여할 때, 상기 대상체가 기준선과 비교하여 혈청 및/또는 혈장 DPA 수준의 증가, 및 혈청 및/또는 혈장 AA, DHA 및/또는 DGLA 수준의 감소를 나타내는 것인 방법.
- 제1항에 있어서, 대상체에게 6주 이상의 기간 동안 매일 조성물을 투여할 때, 상기 대상체가 기준선과 비교하여 16% 이상의 혈장 및/또는 혈청 DHA 수준의 감소, 기준선과 비교하여 31% 이상의 DGLA 혈장 및/또는 혈청 수준의 감소, 기준선과 비교하여 20% 이상의 AA 혈장 및/또는 혈청 수준의 감소, 및/또는 기준선과 비교하여 130% 이상의 혈장 및/또는 혈청 DPA 수준의 증가를 나타내는 것인 방법.
- 제1항에 있어서, 조성물이 96 중량% 이상의 에틸 에이코사펜타에노에이트, 약 0.22 중량% 내지 약 0.4 중량%의 에틸 옥타데카테트라에노에이트, 약 0.075 중량% 내지 약 0.20 중량%의 에틸 노나에카펜타에노에이트, 약 0.25 중량% 내지 약 0.40 중량%의 에틸 아라키도네이트, 약 0.3 중량% 내지 약 0.4 중량%의 에틸 에이코사테트라에노에이트 및 약 0.075% 내지 약 0.25%의 에틸 헨에이코사펜타에노에이트를 포함하는 것인 방법.
- 제1항에 있어서, 조성물이 98 중량% 이상의 에틸 에이코사펜타에노에이트, 약 0.25 중량% 내지 약 0.38 중량%의 에틸 옥타데카테트라에노에이트, 약 0.10 중량% 내지 약 0.15 중량%의 에틸 노나에카펜타에노에이트, 약 0.25 중량% 내지 약 0.35 중량%의 에틸 아라키도네이트, 약 0.31 중량% 내지 약 0.38 중량%의 에틸 에이코사테트라에노에이트 및 약 0.08% 내지 약 0.20%의 에틸 헨에이코사펜타에노에이트를 포함하는 것인 방법.
- 제1항에 있어서, 조성물이 토코페롤을 약 0.1 중량% 내지 약 0.3 중량%의 양으로 추가로 포함하는 것인 방법.
- 제1항에 있어서, 조성물이 캡슐 쉘 내에 존재하는 것인 방법.
- 혈장 및/또는 혈청 EPA의 증가를 필요로 하는 대상체에게 96 중량% 이상의 에틸 에이코사펜타에노에이트, 약 0.2 중량% 내지 약 0.5 중량%의 에틸 옥타데카테트라에노에이트, 약 0.05 중량% 내지 약 0.25 중량%의 에틸 노나에카펜타에노에이트, 약 0.2 중량% 내지 약 0.45 중량%의 에틸 아라키도네이트, 약 0.3 중량% 내지 약 0.5 중량%의 에틸 에이코사테트라에노에이트, 약 0.05% 내지 약 0.32%의 에틸 헨에이코사펜타에노에이트 및 0.05% 이하의 에틸-DHA를 포함하는 제약 조성물을 투여하는 것을 포함하며, 상기 대상체에게 약 6주 이상의 기간 동안 매일 조성물 2 g을 투여할 때 상기 대상체가 혈장 및/또는 혈청 EPA에서 기준선과 비교하여 약 200% 이상의 증가를 나타내는 것인, 상기 대상체에서 혈장 및/또는 혈청 EPA를 증가시키는 방법.
- 제15항에 있어서, 대상체가 약 50 μg/ml 이하의 기준선 혈장 또는 혈청 EPA 수준을 갖는 것인 방법.
- 혈장 또는 혈청 EPA의 증가를 필요로 하는 대상체에게 96 중량% 이상의 에틸 에이코사펜타에노에이트, 약 0.2 중량% 내지 약 0.5 중량%의 에틸 옥타데카테트라에노에이트, 약 0.05 중량% 내지 약 0.25 중량%의 에틸 노나에카펜타에노에이트, 약 0.2 중량% 내지 약 0.45 중량%의 에틸 아라키도네이트, 약 0.3 중량% 내지 약 0.5 중량%의 에틸 에이코사테트라에노에이트, 약 0.05% 내지 약 0.32%의 에틸 헨에이코사펜타에노에이트 및 0.05% 이하의 에틸-DHA를 포함하는 제약 조성물을 투여하는 것을 포함하며, 상기 대상체에게 약 6주 이상의 기간 동안 매일 조성물 4 g을 투여할 때 상기 대상체가 혈장 및/또는 혈청 EPA에서 기준선과 비교하여 약 300% 이상의 증가를 나타내는 것인, 상기 대상체에서 혈장 및/또는 혈청 EPA를 증가시키는 방법.
- 제18항에 있어서, 대상체가 약 50 μg/ml 이하의 기준선 혈장 또는 혈청 EPA 수준을 갖는 것인 방법.
- 안정한 스타틴 요법 중이고 트리글리세리드 저하 요법을 필요로 하는 대상체를 확인하는 것, 상기 대상체에게 하루에 약 1 g 내지 약 4 g의 초순수 E-EPA를 포함하는 제약상 허용되는 조성물을 투여하는 것을 포함하며, 상기 대상체에게 조성물을 투여할 때 상기 대상체가 공복 트리글리세리드에서 대조군과 비교하여 임상적으로 유의한 감소를 나타내는 것인, 안정한 스타틴 요법 중이고 트리글리세리드 저하 요법을 필요로 하는 대상체에서 LDL 제어를 유지하는 방법.
- 안정한 스타틴 요법 중이고 트리글리세리드 저하 요법을 필요로 하는 대상체에서 LDL 제어를 유지하는 데 사용하기 위한 약 1 g 내지 약 4 g의 초순수 E-EPA를 포함하는 제약 조성물이며, 상기 대상체에게 상기 조성물을 투여할 때 상기 대상체가 공복 트리글리세리드에서 대조군과 비교하여 임상적으로 유의한 감소를 나타내는 것인 제약 조성물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US31044310P | 2010-03-04 | 2010-03-04 | |
| US61/310,443 | 2010-03-04 | ||
| PCT/US2011/027218 WO2011109724A1 (en) | 2010-03-04 | 2011-03-04 | Compositions and methods for treating and/or preventing cardiovascular disease |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20130026428A true KR20130026428A (ko) | 2013-03-13 |
Family
ID=44531868
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127024878A KR20130026428A (ko) | 2010-03-04 | 2011-03-04 | 심혈관 질환을 치료 및/또는 예방하기 위한 조성물 및 방법 |
Country Status (13)
| Country | Link |
|---|---|
| US (10) | US20110218243A1 (ko) |
| EP (2) | EP2542060B1 (ko) |
| JP (5) | JP6327497B2 (ko) |
| KR (1) | KR20130026428A (ko) |
| AU (1) | AU2011222544A1 (ko) |
| BR (1) | BR112012022336A2 (ko) |
| CA (4) | CA3043081C (ko) |
| ES (1) | ES2750365T3 (ko) |
| MX (1) | MX337315B (ko) |
| PH (2) | PH12018500843B1 (ko) |
| RU (3) | RU2606853C2 (ko) |
| SG (1) | SG183883A1 (ko) |
| WO (1) | WO2011109724A1 (ko) |
Families Citing this family (39)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3578177A1 (en) | 2008-09-02 | 2019-12-11 | Amarin Pharmaceuticals Ireland Limited | Pharmaceutical composition comprising eicosapentaenoic acid and nicotinic acid and methods of using same |
| NZ624963A (en) | 2009-04-29 | 2016-07-29 | Amarin Pharmaceuticals Ie Ltd | Pharmaceutical compositions comprising epa and a cardiovascular agent and methods of using the same |
| BRPI1011876B1 (pt) | 2009-04-29 | 2020-03-31 | Amarin Pharma, Inc. | Composições farmacêuticas estáveis compreendendo etilácido eicosapentaenoico (etil-epa) e uso das mesmas para tratar ou prevenir uma doença relacionada ao cardiovascular |
| CN102625847A (zh) | 2009-06-15 | 2012-08-01 | 阿马里纳制药公司 | 在相伴他汀类疗法的对象中降低甘油三酯、没有增加ldl-c水平的组合物和方法 |
| AU2010298222B2 (en) | 2009-09-23 | 2017-01-05 | Amarin Pharmaceuticals Ireland Limited | Pharmaceutical composition comprising omega-3 fatty acid and hydroxy-derivative of a statin and methods of using same |
| CA3043081C (en) * | 2010-03-04 | 2020-02-11 | Amarin Pharmaceuticals Ireland Limited | Compositions and methods for treating and/or preventing cardiovascular disease |
| AU2011336856A1 (en) | 2010-11-29 | 2013-07-04 | Amarin Pharmaceuticals Ireland Limited | Low eructation composition and methods for treating and/or preventing cardiovascular disease in a subject with fish allergy/hypersensitivity |
| US11712429B2 (en) | 2010-11-29 | 2023-08-01 | Amarin Pharmaceuticals Ireland Limited | Low eructation composition and methods for treating and/or preventing cardiovascular disease in a subject with fish allergy/hypersensitivity |
| US20130131170A1 (en) | 2011-11-07 | 2013-05-23 | Amarin Pharmaceuticals Ireland Limited | Methods of treating hypertriglyceridemia |
| US11291643B2 (en) | 2011-11-07 | 2022-04-05 | Amarin Pharmaceuticals Ireland Limited | Methods of treating hypertriglyceridemia |
| ES2891473T3 (es) | 2012-01-06 | 2022-01-28 | Amarin Pharmaceuticals Ie Ltd | Composiciones y métodos para reducir los niveles de alta sensibilidad (hs-CRP) en un sujeto |
| AU2013277441B2 (en) * | 2012-06-17 | 2017-07-06 | Matinas Biopharma, Inc. | Omega-3 pentaenoic acid compositions and methods of use |
| SG10201913645RA (en) | 2012-06-29 | 2020-03-30 | Amarin Pharmaceuticals Ie Ltd | Methods of reducing the risk of a cardiovascular event in a subject on statin therapy |
| RU2020125675A (ru) * | 2012-06-29 | 2020-09-16 | Амарин Фармасьютикалз Айрлэнд Лимитед | Способы лечения педиатрического метаболического синдрома |
| WO2014004993A2 (en) * | 2012-06-29 | 2014-01-03 | Amarin Pharmaceuticals Ireland Limited | Methods of reducing ldl-p |
| KR20150098611A (ko) * | 2012-10-23 | 2015-08-28 | 디킨 유니버시티 | 트리글리세라이드를 감소시키기 위한 방법 |
| WO2014074552A2 (en) | 2012-11-06 | 2014-05-15 | Amarin Pharmaceuticals Ireland Limited | Compositions and methods for lowering triglycerides without raising ldl-c levels in a subject on concomitant statin therapy |
| US10123986B2 (en) | 2012-12-24 | 2018-11-13 | Qualitas Health, Ltd. | Eicosapentaenoic acid (EPA) formulations |
| US9629820B2 (en) | 2012-12-24 | 2017-04-25 | Qualitas Health, Ltd. | Eicosapentaenoic acid (EPA) formulations |
| US9814733B2 (en) | 2012-12-31 | 2017-11-14 | A,arin Pharmaceuticals Ireland Limited | Compositions comprising EPA and obeticholic acid and methods of use thereof |
| US20140187633A1 (en) | 2012-12-31 | 2014-07-03 | Amarin Pharmaceuticals Ireland Limited | Methods of treating or preventing nonalcoholic steatohepatitis and/or primary biliary cirrhosis |
| US20140221676A1 (en) * | 2013-02-06 | 2014-08-07 | Amarin Pharmaceuticals Ireland Limited | Compositions and methods for treating and/or preventing cardiovascular disease |
| US9452151B2 (en) | 2013-02-06 | 2016-09-27 | Amarin Pharmaceuticals Ireland Limited | Methods of reducing apolipoprotein C-III |
| US9624492B2 (en) | 2013-02-13 | 2017-04-18 | Amarin Pharmaceuticals Ireland Limited | Compositions comprising eicosapentaenoic acid and mipomersen and methods of use thereof |
| US9662307B2 (en) | 2013-02-19 | 2017-05-30 | The Regents Of The University Of Colorado | Compositions comprising eicosapentaenoic acid and a hydroxyl compound and methods of use thereof |
| US9283201B2 (en) | 2013-03-14 | 2016-03-15 | Amarin Pharmaceuticals Ireland Limited | Compositions and methods for treating or preventing obesity in a subject in need thereof |
| US20140271841A1 (en) * | 2013-03-15 | 2014-09-18 | Amarin Pharmaceuticals Ireland Limited | Pharmaceutical composition comprising eicosapentaenoic acid and derivatives thereof and a statin |
| US10966968B2 (en) | 2013-06-06 | 2021-04-06 | Amarin Pharmaceuticals Ireland Limited | Co-administration of rosiglitazone and eicosapentaenoic acid or a derivative thereof |
| US20150065572A1 (en) | 2013-09-04 | 2015-03-05 | Amarin Pharmaceuticals Ireland Limited | Methods of treating or preventing prostate cancer |
| US9585859B2 (en) | 2013-10-10 | 2017-03-07 | Amarin Pharmaceuticals Ireland Limited | Compositions and methods for lowering triglycerides without raising LDL-C levels in a subject on concomitant statin therapy |
| WO2015066512A1 (en) * | 2013-10-31 | 2015-05-07 | Amarin Pharmaceuticals Ireland Limited | Methods of treating hypertriglyceridemia |
| US10561631B2 (en) | 2014-06-11 | 2020-02-18 | Amarin Pharmaceuticals Ireland Limited | Methods of reducing RLP-C |
| WO2015195662A1 (en) | 2014-06-16 | 2015-12-23 | Amarin Pharmaceuticals Ireland Limited | Methods of reducing or preventing oxidation of small dense ldl or membrane polyunsaturated fatty acids |
| US10406130B2 (en) | 2016-03-15 | 2019-09-10 | Amarin Pharmaceuticals Ireland Limited | Methods of reducing or preventing oxidation of small dense LDL or membrane polyunsaturated fatty acids |
| US10966951B2 (en) | 2017-05-19 | 2021-04-06 | Amarin Pharmaceuticals Ireland Limited | Compositions and methods for lowering triglycerides in a subject having reduced kidney function |
| US11058661B2 (en) | 2018-03-02 | 2021-07-13 | Amarin Pharmaceuticals Ireland Limited | Compositions and methods for lowering triglycerides in a subject on concomitant statin therapy and having hsCRP levels of at least about 2 mg/L |
| MA51765A (fr) | 2018-09-24 | 2020-12-16 | Amarin Pharmaceuticals Ie Ltd | Procédés de réduction du risque d'événements cardiovasculaires chez un sujet |
| US11986452B2 (en) | 2021-04-21 | 2024-05-21 | Amarin Pharmaceuticals Ireland Limited | Methods of reducing the risk of heart failure |
| CN113346980B (zh) * | 2021-08-02 | 2023-08-11 | 浙江国利信安科技有限公司 | 用于消息转发的方法、电子设备和计算机存储介质 |
Family Cites Families (56)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4377526A (en) * | 1981-05-15 | 1983-03-22 | Nippon Suisan Kaisha, Ltd. | Method of purifying eicosapentaenoic acid and its esters |
| US4526902A (en) * | 1983-10-24 | 1985-07-02 | Century Laboratories, Inc. | Combined fatty acid composition for treatment or prophylaxis of thrombo-embolic conditions |
| US4920098A (en) * | 1986-09-17 | 1990-04-24 | Baxter International Inc. | Nutritional support or therapy for individuals at risk or under treatment for atherosclerotic vascular, cardiovascular, and/or thrombotic diseases |
| US5252333A (en) * | 1987-04-27 | 1993-10-12 | Scotia Holdings Plc | Lithium salt-containing pharmaceutical compositions |
| US5198468A (en) * | 1987-06-24 | 1993-03-30 | Efamol Holdings Plc | Essential fatty acid composition |
| GB8819110D0 (en) * | 1988-08-11 | 1988-09-14 | Norsk Hydro As | Antihypertensive drug & method for production |
| US5116871A (en) * | 1988-09-13 | 1992-05-26 | Efamol Holdings Plc | Fatty acid therapy and compositions for the treatment of myalgic encephalomyelitis |
| US4935243A (en) * | 1988-12-19 | 1990-06-19 | Pharmacaps, Inc. | Chewable, edible soft gelatin capsule |
| JP2839276B2 (ja) * | 1989-01-23 | 1998-12-16 | 日本分光工業株式会社 | 超臨界流体抽出・分離方法及び装置 |
| US5457130A (en) * | 1989-03-20 | 1995-10-10 | Cancer Research Campaign Technology Limited | Eicosapentaenoic acid used to treat cachexia |
| GB9012651D0 (en) * | 1990-06-06 | 1990-07-25 | Efamol Holdings | Essential fatty acid treatment |
| US5215630A (en) * | 1991-06-04 | 1993-06-01 | Nippon Suisan Kaisha, Ltd. | Method of purifying eicosapentaenoic acid or the ester derivative thereof by fractional distillation |
| DE4133694C2 (de) * | 1991-10-11 | 1993-10-07 | Fresenius Ag | Verwendung einer Emulsion mit mehrfach ungesättigten Fettsären zur i.v.-Verabreichung zur Behandlung von Hauterkrankungen |
| JP3400466B2 (ja) * | 1991-10-28 | 2003-04-28 | 日本水産株式会社 | 高純度エイコサペンタエン酸またはそのエステルの製造方法 |
| JPH0649479A (ja) * | 1992-07-28 | 1994-02-22 | Maruha Corp | ω−3不飽和脂肪酸系化合物の安定化法 |
| GB9217780D0 (en) * | 1992-08-21 | 1992-10-07 | Efamol Holdings | Fatty acid treatment |
| US5888541A (en) * | 1992-08-21 | 1999-03-30 | Scotia Holdings Plc | Fatty acid treatment |
| GB9403857D0 (en) * | 1994-03-01 | 1994-04-20 | Scotia Holdings Plc | Fatty acid derivatives |
| US5760081A (en) * | 1994-05-10 | 1998-06-02 | The General Hospital Corporation | Omega 3 fatty acids in the prevention of ventricular fibrillation |
| AU711482B2 (en) * | 1994-06-28 | 1999-10-14 | Scotia Holdings Plc | Compositions for treatment of diabetic complications |
| IT1274734B (it) * | 1994-08-25 | 1997-07-24 | Prospa Bv | Composizioni farmaceutiche contenenti acidi grassi poliinsaturi, loro esteri o sali, unitamente a vitamine o provitamine antiossidanti |
| MY118354A (en) * | 1995-05-01 | 2004-10-30 | Scarista Ltd | 1,3-propane diol derivatives as bioactive compounds |
| JPH0959206A (ja) * | 1995-08-25 | 1997-03-04 | Nippon Oil & Fats Co Ltd | エイコサペンタエン酸およびエイコサペンタエン酸エステルの製造方法 |
| GB9519661D0 (en) * | 1995-09-27 | 1995-11-29 | Scotia Holdings Plc | Fatty acid treatment |
| US5861399A (en) * | 1996-07-17 | 1999-01-19 | Heart Care Partners | Methods and compositions for the rapid and enduring relief of inadequate myocardial function |
| US20020055539A1 (en) * | 1996-10-02 | 2002-05-09 | Bockow Barry I. | Compositions and methods for treating cardiovascular conditions |
| TR199900786T2 (xx) * | 1996-10-11 | 1999-07-21 | Scotia Holdings Plc | Eykoza penta enoik asit ve/veya stearidonik asit i�eren farmas�tik terkipler. |
| EP1025842B1 (en) * | 1997-10-30 | 2004-07-21 | Morishita Jintan Co., Ltd. | Double-leyered capsule of unsaturated fatty acid or derivative thereof and process for producing the same |
| GB9901809D0 (en) * | 1999-01-27 | 1999-03-17 | Scarista Limited | Highly purified ethgyl epa and other epa derivatives for psychiatric and neurological disorderes |
| US20030104048A1 (en) * | 1999-02-26 | 2003-06-05 | Lipocine, Inc. | Pharmaceutical dosage forms for highly hydrophilic materials |
| US6193999B1 (en) * | 1999-03-01 | 2001-02-27 | Banner Pharmacaps, Inc. | Gum acacia substituted soft gelatin capsules |
| ES2304061T3 (es) * | 1999-07-28 | 2008-09-01 | Swiss Caps Rechte Und Lizenzen Ag | Preparado para el empleo como medicamento y/o para el complemento de articulos comestibles. |
| EP1211955A1 (en) * | 1999-08-30 | 2002-06-12 | Ocean Nutrition Canada Ltd. | A nutritional supplement for lowering serum triglyceride and cholesterol levels |
| JP4170542B2 (ja) * | 1999-11-18 | 2008-10-22 | 日油株式会社 | 高度不飽和脂肪酸誘導体の製造方法及び高純度エイコサペンタエン酸誘導体 |
| ITMI20010129A1 (it) * | 2001-01-25 | 2002-07-25 | Pharmacia & Upjohn Spa | Acidi grassi essenziali nella terapia di insufficienza cardiaca e scompenso cardiaco |
| CA2449199A1 (en) * | 2001-05-30 | 2002-12-05 | Laxdale Limited | Coenzyme q and eicosapentaenoic acid (epa) |
| ITMI20012384A1 (it) * | 2001-11-12 | 2003-05-12 | Quatex Nv | Uso di acidi grassi poliinsaturi per la prevenzione primaria di eventi cardiovascolari maggiori |
| US20030166614A1 (en) * | 2002-03-01 | 2003-09-04 | Harrison Stanley F. | Method for reducing cholesterol and triglycerides |
| WO2004017958A1 (ja) * | 2002-08-20 | 2004-03-04 | Nikken Chemicals Co., Ltd. | 軟カプセル剤 |
| US20060289834A1 (en) * | 2002-11-22 | 2006-12-28 | Nobushige Doisaki | External composition containing Unsaturated fatty acid or its salt or ester |
| WO2005063231A2 (en) * | 2003-12-31 | 2005-07-14 | Igennus Limited | Formulation containing an eicosapentaenoic acid or an ester thereof and a triterpene or esther thereof |
| JP5491697B2 (ja) * | 2004-10-15 | 2014-05-14 | フォトンズ コーポレイション リミテッド | 高レベルオメガ−3および低レベル飽和脂肪酸を含む組成物 |
| US20060211762A1 (en) * | 2004-12-06 | 2006-09-21 | Rongen Roelof M | Omega-3 fatty acids and dyslipidemic agent for lipid therapy |
| US20070191467A1 (en) * | 2004-12-06 | 2007-08-16 | Reliant Pharmaceutical, Inc. | Statin and omega-3 fatty acids for lipid therapy |
| US20060135610A1 (en) * | 2004-12-22 | 2006-06-22 | Bortz Jonathan D | Cardiovascular compositions |
| GB2421909A (en) * | 2004-12-23 | 2006-07-12 | Laxdale Ltd | Pharmaceutical compositions comprising EPA and methods of use |
| US20070104779A1 (en) * | 2005-11-07 | 2007-05-10 | Rongen Roelof M | Treatment with omega-3 fatty acids and products thereof |
| CA2634139C (en) * | 2005-12-20 | 2015-06-23 | Cenestra, Llc. | Omega 3 fatty acid formulations |
| WO2007091338A1 (ja) * | 2006-02-07 | 2007-08-16 | Mochida Pharmaceutical Co., Ltd. | 脳卒中再発予防用組成物 |
| JP5591469B2 (ja) * | 2006-05-31 | 2014-09-17 | 持田製薬株式会社 | 多重リスク患者の心血管イベント発症予防用組成物 |
| AU2007270135B9 (en) * | 2006-07-05 | 2013-06-27 | Fermentalg | Production of ultrapure EPA and polar lipids from largely heterotrophic culture |
| WO2008012329A2 (en) * | 2006-07-28 | 2008-01-31 | V. Mane Fils | Seamless capsules containing high amounts of polyunsaturated fatty acids and a flavouring component |
| US20080125490A1 (en) * | 2006-11-03 | 2008-05-29 | My Svensson | Treatment and prevention of cardiovascular disease in patients with chronic kidney disease by administering Omega-3 Fatty Acids |
| KR20140007973A (ko) * | 2009-02-10 | 2014-01-20 | 아마린 파마, 인크. | 고중성지방혈증 치료 방법 |
| CN102625847A (zh) * | 2009-06-15 | 2012-08-01 | 阿马里纳制药公司 | 在相伴他汀类疗法的对象中降低甘油三酯、没有增加ldl-c水平的组合物和方法 |
| CA3043081C (en) * | 2010-03-04 | 2020-02-11 | Amarin Pharmaceuticals Ireland Limited | Compositions and methods for treating and/or preventing cardiovascular disease |
-
2011
- 2011-03-04 CA CA3043081A patent/CA3043081C/en active Active
- 2011-03-04 AU AU2011222544A patent/AU2011222544A1/en not_active Abandoned
- 2011-03-04 WO PCT/US2011/027218 patent/WO2011109724A1/en active Application Filing
- 2011-03-04 SG SG2012065215A patent/SG183883A1/en unknown
- 2011-03-04 RU RU2012142181A patent/RU2606853C2/ru active
- 2011-03-04 JP JP2012556265A patent/JP6327497B2/ja active Active
- 2011-03-04 EP EP11751431.5A patent/EP2542060B1/en active Active
- 2011-03-04 CA CA2792090A patent/CA2792090C/en active Active
- 2011-03-04 BR BR112012022336-4A patent/BR112012022336A2/pt not_active Application Discontinuation
- 2011-03-04 US US13/040,977 patent/US20110218243A1/en not_active Abandoned
- 2011-03-04 RU RU2016129266A patent/RU2728825C2/ru active
- 2011-03-04 MX MX2012010253A patent/MX337315B/es active IP Right Grant
- 2011-03-04 CA CA3147657A patent/CA3147657C/en active Active
- 2011-03-04 CA CA3066588A patent/CA3066588C/en active Active
- 2011-03-04 ES ES11751431T patent/ES2750365T3/es active Active
- 2011-03-04 KR KR1020127024878A patent/KR20130026428A/ko not_active Application Discontinuation
- 2011-03-04 EP EP19190599.1A patent/EP3583849A1/en active Pending
-
2013
- 2013-08-28 US US14/012,625 patent/US20140128464A1/en not_active Abandoned
-
2015
- 2015-05-28 US US14/723,799 patent/US20150335607A1/en not_active Abandoned
-
2016
- 2016-09-20 JP JP2016183057A patent/JP2017025089A/ja active Pending
-
2017
- 2017-01-23 US US15/413,093 patent/US20170128406A1/en not_active Abandoned
-
2018
- 2018-04-19 PH PH12018500843A patent/PH12018500843B1/en unknown
- 2018-11-05 JP JP2018207855A patent/JP2019048843A/ja active Pending
-
2019
- 2019-05-06 US US16/404,558 patent/US20200297681A1/en not_active Abandoned
-
2020
- 2020-05-13 JP JP2020084402A patent/JP7136526B2/ja active Active
- 2020-07-08 US US16/923,311 patent/US20200360330A1/en not_active Abandoned
- 2020-07-17 RU RU2020123679A patent/RU2020123679A/ru unknown
- 2020-07-21 JP JP2020124388A patent/JP2020183428A/ja active Pending
-
2021
- 2021-01-19 US US17/151,956 patent/US20210260016A1/en not_active Abandoned
- 2021-01-21 US US17/154,357 patent/US20210386701A1/en not_active Abandoned
- 2021-04-06 PH PH12021550756A patent/PH12021550756A1/en unknown
- 2021-12-03 US US17/457,579 patent/US20220323393A1/en not_active Abandoned
-
2024
- 2024-03-13 US US18/603,789 patent/US20240216322A1/en active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20220323393A1 (en) | Compositions and methods for treating and/or preventing cardiovascular disease | |
| US11712428B2 (en) | Low eructation composition and methods for treating and/or preventing cardiovascular disease in a subject with fish allergy/hypersensitivity | |
| US11712429B2 (en) | Low eructation composition and methods for treating and/or preventing cardiovascular disease in a subject with fish allergy/hypersensitivity | |
| KR20120016677A (ko) | 병용 스타틴 요법을 받는 대상체에서 ldl-c 수준을 상승시키지 않으면서 트리글리세리드를 저하시키기 위한 조성물 및 방법 | |
| NZ763702B2 (en) | Low eructation composition and methods for treating and/or preventing cardiovascular disease in a subject with fish allergy/hypersensitivity |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |