KR20120018761A - 섬유증을 치료하기 위한 방법 및 pi-3 키나제 억제제의 조성물 - Google Patents
섬유증을 치료하기 위한 방법 및 pi-3 키나제 억제제의 조성물 Download PDFInfo
- Publication number
- KR20120018761A KR20120018761A KR1020117026616A KR20117026616A KR20120018761A KR 20120018761 A KR20120018761 A KR 20120018761A KR 1020117026616 A KR1020117026616 A KR 1020117026616A KR 20117026616 A KR20117026616 A KR 20117026616A KR 20120018761 A KR20120018761 A KR 20120018761A
- Authority
- KR
- South Korea
- Prior art keywords
- fibrosis
- kinase
- kinase inhibitor
- pulmonary fibrosis
- alkyl
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/365—Lactones
- A61K31/366—Lactones having six-membered rings, e.g. delta-lactones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/365—Lactones
- A61K31/366—Lactones having six-membered rings, e.g. delta-lactones
- A61K31/37—Coumarins, e.g. psoralen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Child & Adolescent Psychology (AREA)
- Pulmonology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
본원은 포유동물에서 PI-3 키나제 활성을 억제하기 위한 방법 및 PI-3 키나제 억제제의 조성물 및 이의 용도 및 피험체에서의 섬유성 증후군의 치료를 기재한다.
Description
상호 참조
본 특허 출원은 2009년 4월 9일자에 출원된 미국 가출원 제61/167,905호 및 2009년 8월 21일자에 출원된 미국 가출원 제61/235,740호의 이익을 주장하고; 모두 그 전문이 본원에서 참조문헌으로 포함된다.
조직 재생 과정 동안 과도한 결합 조직의 침착은 섬유증을 야기한다. 몇몇 경우에, 비정상 및/또는 과도한 섬유성 결합 조직이 확산되거나, 예를 들면 손상, 질환 또는 감염으로 인해 손실된 조직을 대체할 때 섬유증이 발생한다.
본원은 보르트만닌 또는 보르트만닌 유사체를 치료를 필요로 하는 개체에게 투여하는 것을 포함하는 섬유성 증후군의 치료 방법을 제공한다. 또한, 본원은 PI-3 키나제(PI3K) 억제제를 치료를 필요로 하는 개체에게 투여하는 것을 포함하는 폐 섬유증의 치료 방법을 기재한다. 추가로, 본원은 보르트만닌 또는 보르트만닌 유사체를 치료를 필요로 하는 개체에게 투여하는 것을 포함하는 폐 섬유증의 치료 방법을 기재한다. 몇몇 경우에, 섬유증은 장기에서 비정상 섬유성 결합 조직의 발생과 관련된다. 몇몇 경우에, 섬유증은 이환 장기에서 반흔을 야기하여, 기초 장기의 기능적 및/또는 구조적 구성을 파괴한다. 몇몇 경우에, 섬유증은 장기 이식 및/또는 장기 동종이식 수술 이후의 장기에서 발생한다. 몇몇 경우에, PI-3 키나제의 활성화는 본원에 기재된 섬유성 증후군의 발병 및/또는 진행과 관련된다.
따라서, 본원은 PI-3 키나제의 활성을 감소시키거나 부분적으로 감소시켜, 섬유증을 역전시키거나, 섬유증의 진행을 지연시키거나, (예를 들면, 장기 이식 후) 섬유증의 확립을 예방하는 방법을 기재한다. 몇몇 양태에서, 본원에 기재된 보르트만닌 유사체는 PI-3 키나제 억제제이다. 몇몇 양태에서, 본원에 기재된 PI-3 키나제 억제제는 가역적 PI-3 키나제 억제제이다. 다른 양태에서, 본원에 기재된 PI-3 키나제 억제제는 비가역적 PI-3 키나제 억제제이다.
몇몇 양태에서, 본원은 PI-3 키나제 억제제를 치료를 필요로 하는 개체에게 투여하는 것을 포함하는 경증 또는 중등증 또는 중증 폐 섬유증의 치료 방법을 제공한다.
몇몇 양태에서, PI-3 키나제 억제제는 PI-3 키나제 알파, PI-3 키나제 베타, PI-3 키나제 델타 또는 PI-3 키나제 감마 또는 이들의 조합을 선택적으로 억제한다. 몇몇 양태에서, PI-3 키나제 억제제는 PI-3 키나제 알파 또는 PI-3 키나제 베타 또는 이들의 조합을 선택적으로 억제한다.
몇몇 양태에서, PI-3 키나제 억제제는 PI-3 키나제의 가역적 억제제이다. 몇몇 양태에서, PI-3 키나제 억제제는 PI-3 키나제의 비가역적 억제제이다.
몇몇 양태에서, 폐 섬유증은 특발성 폐 섬유증이다. 몇몇 양태에서, 폐 섬유증은 석면증, 낭포성 섬유증, 감염(예를 들면, 폐렴), 환경 알레르겐(예를 들면, 탄진, 석면, 담배 흡연, 디젤 배기가스, 오존, 공업용 배기가스로부터의 미립자)에의 노출, 폐 이식, 자가면역 질환(예를 들면, 강피증)과 관련되거나, 폐 섬유증은 약물 유발 폐 섬유증이다.
상기 기재된 방법의 몇몇 양태에서, PI-3 키나제 억제제의 투여는 폐 섬유증을 축소시키거나 폐 섬유증의 진행을 역전 또는 감소시킨다. 상기 기재된 방법의 몇몇 양태에서, PI-3 키나제 억제제의 투여는 진행성 체중 감소를 예방한다. 상기 기재된 방법의 몇몇 양태에서, PI-3 키나제 억제제의 투여는 폐 역학에서 TGFα 의존성 변화의 진행을 늦춘다. 몇몇 양태에서, PI-3 키나제 억제제의 투여는 폐 섬유증의 확립을 예방한다. 몇몇 양태에서, PI-3 키나제 억제제를 예방적으로(예를 들면, 폐 이식 전에) 투여한다. 몇몇 양태에서, PI-3 키나제 억제제를 치료학적으로(예를 들면, 경증 또는 중등증 또는 중증 폐 섬유증의 발병 후에) 투여한다.
본 방법의 몇몇 양태에서, 1종 이상의 PI-3 키나제 억제제를 경구 투여한다. 본 방법의 몇몇 양태에서, 1종 이상의 PI-3 키나제 억제제를 흡입형 제제로서 투여한다.
또한, 본원은 치료학적 유효량의 보르트만닌 유사체를 치료를 필요로 하는 개체에게 투여하는 것을 포함하는 섬유성 증후군을 앓는 것으로 진단된 또는 섬유성 증후군을 앓는 것으로 의심되는 개체에서 섬유성 증후군을 치료하는 방법을 제공한다.
몇몇 양태에서, 보르트만닌 유사체는 하기 화학식의 화합물이다:
[식 중,
---는 임의의 결합이고;
n은 1~6이고;
Y는 이종 원자이고;
R1 및 R2는 불포화 알킬, 비선형 알킬, 사이클릭 알킬 및 치환 알킬로부터 독립적으로 선택되거나, R1과 R2는 이들이 결합된 원자와 함께 헤테로사이클로알킬 기를 형성하고;
R3은 부재하거나, H, 또는 C1-C6 치환 또는 비치환 알킬이고;
R4는 (C=O)R5, (C=O)OR5, (S=O)R5, (SO2)R5, (PO3)R5, (C=O)NR5R6이고;
R5는 치환 또는 비치환 C1-C6 알킬이고;
R6은 치환 또는 비치환 C1-C6 알킬이다].
몇몇 양태에서, 화학식 IA 또는 화학식 IB의 화합물은 하기 화학식의 화합물로부터 선택된다:
[식 중, Y는 이종 원자이고, R1 및 R2는 불포화 알킬, 비선형 알킬, 사이클릭 알킬 및 치환 알킬로부터 독립적으로 선택된다].
몇몇 양태에서, Y는 질소 및 황로부터 선택된 이종 원자이다. 몇몇 양태에서, R1 및 R2는 불포화 알킬이다. 몇몇 양태에서, 보르트만닌 유사체는 PI-3 키나제 억제제이다. 몇몇 양태에서, PI-3 키나제 억제제는 PX-866이다. 몇몇 양태에서, PI-3 키나제 억제제는 PX-867이다.
몇몇 양태에서, 섬유성 증후군은 경증, 중등증 또는 중증 폐 섬유증, 낭포성 섬유증, 안구 섬유증(예를 들면, 녹내장 여과 수술 후 반흔), 심내막심근 섬유증, 종격동 섬유증, 골수섬유증, 골섬유증, 섬유성 결장병증, 후복막 섬유증, 간질성 폐렴, 진행성 종괴성 폐 섬유증, 켈로이드, 강피증, 비후성 반흔, 신장 섬유증, 장 섬유증, 간 섬유증, 섬유성 담즙울체성 간염, 신원성 전신 섬유증, 장기 이식과 관련된 섬유증, 다발성 섬유경화증, 또는 과민성 쇼크 섬유증이다.
몇몇 양태에서, 섬유성 증후군은 경증, 중등증 또는 중증 특발성 폐 섬유증이다. 몇몇 양태에서, 섬유성 증후군은 석면증, 낭포성 섬유증, 감염, 환경 알레르겐에의 노출, 폐 이식, 자가면역 질환과 관련된 폐 섬유증이거나, 섬유성 증후군은 약물 유발 폐 섬유증이다. 몇몇 양태에서, 섬유성 증후군은 장기 이식과 관련된다.
본원에 기재된 방법, 화합물, 및 조성물의 다른 목적, 특징 및 이점은 하기의 상세한 설명으로부터 명확할 것이다. 그러나, 상세한 설명 및 구체적인 실시예는, 구체적인 양태를 설명하면서, 오직 예의 방식으로 제공된다는 것을 이해해야 한다. 특허, 특허 출원 및 공보를 비롯한 본원에서 인용된 모든 참조문헌은 인용된 목적을 위해 참조문헌으로 본원에 포함된다.
본 발명의 새로운 특징은 특허청구범위에서 특별히 기재되어 있다. 본 발명의 원칙 및 도면을 이용하여 예시적인 양태가 기재된 하기의 상세한 설명을 참조하여 본 발명의 특징 및 이점을 더 잘 이해할 수 있다:
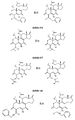
도 1. 도 1a 및 1b는 본 개시내용에 따른 예시적인 보르트만닌 유사체에 대한 화학식 및 대사물질 구조를 도시한 것이다.
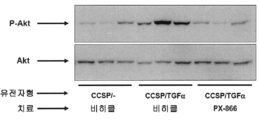
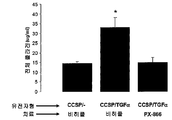
도 2. PX -866은 Akt 의 TGF α 유도 인산화(P- Akt )를 억제한다. CCSP-rtTA/otet-TGFα 형질전환 마우스에서의 P-Akt 수준의 웨스턴 블롯 분석은 Dox 치료된 단일 전이유전자(CCSP/-) 대조군과 비교하여 Dox 유발 TGFα 발현 1일 후 5배 이상 증가하였다. PX-866에 의해 CCSP-rtTA/otet-TGFα 마우스를 전치료하면 대표적인 면역 블로팅(A) 및 밀도측정 분석(B)에 의해 입증되는 Akt의 인산화 증가를 예방하였다. 값은 각 군에서 평균±SE(n=6)이었다. * P<0.05: CCSP/- 대조군 및 PX-866 치료된 마우스와 비교하여.
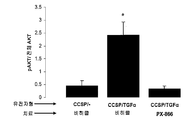
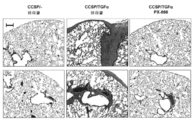
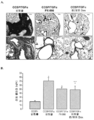
도 3. PX -866은 폐 섬유증의 확립을 예방한다. Dox의 4주 이후 대조군 및 CCSP-rtTA/otet-TGFα 형질전환 마우스로부터 얻은 폐의 섹션을 트라이크롬으로 염색하였다(A). TGFα 유도 개시시 PX-866 투여된 CCSP-rtTA/otet-TGFα 형질전환 마우스는 비히클 치료된 CCSP-rtTA/otet-TGFα 마우스와 비교하여 섬유증의 현저한 약화를 나타냈다. 2마리의 별도의 동물로부터 현미경 사진을 얻었고 각 군에서 5~7마리의 마우스로부터 얻은 대표적인 폐이다. 동일한 확대율로 모든 현미경 사진을 취하고 막대는 200 ㎛이었다. 방법에 기재된 바대로 형질전환 마우스의 폐로부터 폐 콜라겐 함량을 결정하였다. TGFα 유도 시간에 매일 투여되는 PX-866는 폐 콜라겐에서 증가하였다(B). 값은 평균±SE이다. * p<0.05: CCSP/-대조군 및 PX-866 치료된 마우스와 비교하여. + p<0.05: 비히클로 치료된 CCSP-rtTA/otet-TGFα 마우스와 비교하여.
도 4. PX -866은 폐 기능에서 TGF α 의존성 변화를 예방한다. 방법에 기재된 바대로 폐 기계를 결정하였다. TGFα 유도 시간에 매우 투여되는 PX-866은 Dox를 4주 투여받은 비히클 치료된 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여 기도 저항, 기도 및 조직 탄성력의 증가, 및 순응도의 감소를 예방하였다. * p<0.05: CCSP/-대조군 및 PX-866 치료된 마우스와 비교하여. 각 군에서 6~10마리의 마우스로부터 데이터를 유도하였다.
도 5. PX -866은 진행성 체중 감소를 예방한다. 확리된 섬유증에서 PI3K 억제의 효율을 평가하기 위해, CCSP-rtTA/otet-TGFα 형질전환 마우스를 Dox 4주 후 PX-866로 치료하고 추가 4주 동안 Dox에 남았다. 패널 (A)에 치료 프로토콜을 도식으로 나타냈다. 대조군은 비히클로 치료된 CCSP/- 및 CCSP-rtTA/otet-TGFα 마우스를 포함하고 추가 4주 동안 Dox에 남았다. 마우스를 치료 동안 주마다 체중을 쟀다. 8주 동안의 TGFα의 Dox 유도 발현은 비히클 치료 마우스에서 진행성 체중 감소를 발생시켰지만(적색선), TGFα 유도 4주 후 PX-866로 치료된 마우스는 체중 변화가 없었고(녹색선), 중량은 CCSP/- 대조군(청색선), 및 Dox를 4주 투여받고, 이후 Dox를 끊고 비히클로 4주 치료된 CCSP-rtTA/otet-TGFα 마우스(황색선)보다 낮게 머물렀다(B). * p<0.05: CCSP/- 대조군 마우스 및 온 및 오프 Dox에서 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여; # p<0.05: PX-866 치료된 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여. 군에서 10마리의 마우스로부터 데이터를 유도하였다.
도 6. PX -866은 폐 섬유증의 진행을 감소시킨다. TGFα 유도 개시 후 4주 PX-866 투여받은 CCSP-rtTA/otet-TGFα 형질전환 마우스 및 오프 Dox를 받은 CCSP-rtTA/otet-TGFα 형질전환 마우스 둘 다 비히클 치료된 CCSP-rtTA/otet-TGFα 마우스와 비교하여 섬유증 약화를 나타냈다(도 6a). 외막(상부) 및 폐포 부위(바닥)와 함께 늑막 표면에 초점을 맞춰 2마리의 별도의 동물로부터 현미경 사진을 얻었다. 동일한 확대율로 모든 현미경 사진을 취하고 각 군에서 6마리의 마우스로부터 얻은 대표적인 폐이다. PX-866 치료된 마우스에서의 폐 콜라겐은 4주 후 오프 Dox를 받은 마우스와 비교하여 변하지 않았지만(도 6b), CCSP/- 대조군과 비교하여 상승된 채 머물렀다. * p<0.05: CCSP/- 대조군 마우스 및 온 및 오프 Dox에서 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여; # p<0.05: 비히클 치료된 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여. 군에서 10마리의 마우스로부터 데이터를 유도하였다.
도 7. PX -866은 폐 기계에서 TGF α 의존성 변화의 진행을 늦춘다. Dox 치료 후 4주 PX-866 투여받은 CCSP-rtTA/otet-TGFα 형질전환 마우스는 Dox를 8주 투여받은 비히클 치료된 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여 기도 저항, 기도 및 조직 탄성력의 증가, 및 순응도의 감소를 나타냈다. 대조군 및 4주 동안 오프 Dox를 받은 CCSP-rtTA/otet-TGFα 마우스와 비교하여 PX-866 마우스에서 폐 기계는 현저히 변경되었다. * p<0.05: CCSP/- 대조군 마우스 및 온 및 오프 Dox에서 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여; # p<0.05: PX-866 치료된 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여. 군에서 10마리의 마우스로부터 데이터를 유도하였다.
도 1. 도 1a 및 1b는 본 개시내용에 따른 예시적인 보르트만닌 유사체에 대한 화학식 및 대사물질 구조를 도시한 것이다.
도 2. PX -866은 Akt 의 TGF α 유도 인산화(P- Akt )를 억제한다. CCSP-rtTA/otet-TGFα 형질전환 마우스에서의 P-Akt 수준의 웨스턴 블롯 분석은 Dox 치료된 단일 전이유전자(CCSP/-) 대조군과 비교하여 Dox 유발 TGFα 발현 1일 후 5배 이상 증가하였다. PX-866에 의해 CCSP-rtTA/otet-TGFα 마우스를 전치료하면 대표적인 면역 블로팅(A) 및 밀도측정 분석(B)에 의해 입증되는 Akt의 인산화 증가를 예방하였다. 값은 각 군에서 평균±SE(n=6)이었다. * P<0.05: CCSP/- 대조군 및 PX-866 치료된 마우스와 비교하여.
도 3. PX -866은 폐 섬유증의 확립을 예방한다. Dox의 4주 이후 대조군 및 CCSP-rtTA/otet-TGFα 형질전환 마우스로부터 얻은 폐의 섹션을 트라이크롬으로 염색하였다(A). TGFα 유도 개시시 PX-866 투여된 CCSP-rtTA/otet-TGFα 형질전환 마우스는 비히클 치료된 CCSP-rtTA/otet-TGFα 마우스와 비교하여 섬유증의 현저한 약화를 나타냈다. 2마리의 별도의 동물로부터 현미경 사진을 얻었고 각 군에서 5~7마리의 마우스로부터 얻은 대표적인 폐이다. 동일한 확대율로 모든 현미경 사진을 취하고 막대는 200 ㎛이었다. 방법에 기재된 바대로 형질전환 마우스의 폐로부터 폐 콜라겐 함량을 결정하였다. TGFα 유도 시간에 매일 투여되는 PX-866는 폐 콜라겐에서 증가하였다(B). 값은 평균±SE이다. * p<0.05: CCSP/-대조군 및 PX-866 치료된 마우스와 비교하여. + p<0.05: 비히클로 치료된 CCSP-rtTA/otet-TGFα 마우스와 비교하여.
도 4. PX -866은 폐 기능에서 TGF α 의존성 변화를 예방한다. 방법에 기재된 바대로 폐 기계를 결정하였다. TGFα 유도 시간에 매우 투여되는 PX-866은 Dox를 4주 투여받은 비히클 치료된 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여 기도 저항, 기도 및 조직 탄성력의 증가, 및 순응도의 감소를 예방하였다. * p<0.05: CCSP/-대조군 및 PX-866 치료된 마우스와 비교하여. 각 군에서 6~10마리의 마우스로부터 데이터를 유도하였다.
도 5. PX -866은 진행성 체중 감소를 예방한다. 확리된 섬유증에서 PI3K 억제의 효율을 평가하기 위해, CCSP-rtTA/otet-TGFα 형질전환 마우스를 Dox 4주 후 PX-866로 치료하고 추가 4주 동안 Dox에 남았다. 패널 (A)에 치료 프로토콜을 도식으로 나타냈다. 대조군은 비히클로 치료된 CCSP/- 및 CCSP-rtTA/otet-TGFα 마우스를 포함하고 추가 4주 동안 Dox에 남았다. 마우스를 치료 동안 주마다 체중을 쟀다. 8주 동안의 TGFα의 Dox 유도 발현은 비히클 치료 마우스에서 진행성 체중 감소를 발생시켰지만(적색선), TGFα 유도 4주 후 PX-866로 치료된 마우스는 체중 변화가 없었고(녹색선), 중량은 CCSP/- 대조군(청색선), 및 Dox를 4주 투여받고, 이후 Dox를 끊고 비히클로 4주 치료된 CCSP-rtTA/otet-TGFα 마우스(황색선)보다 낮게 머물렀다(B). * p<0.05: CCSP/- 대조군 마우스 및 온 및 오프 Dox에서 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여; # p<0.05: PX-866 치료된 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여. 군에서 10마리의 마우스로부터 데이터를 유도하였다.
도 6. PX -866은 폐 섬유증의 진행을 감소시킨다. TGFα 유도 개시 후 4주 PX-866 투여받은 CCSP-rtTA/otet-TGFα 형질전환 마우스 및 오프 Dox를 받은 CCSP-rtTA/otet-TGFα 형질전환 마우스 둘 다 비히클 치료된 CCSP-rtTA/otet-TGFα 마우스와 비교하여 섬유증 약화를 나타냈다(도 6a). 외막(상부) 및 폐포 부위(바닥)와 함께 늑막 표면에 초점을 맞춰 2마리의 별도의 동물로부터 현미경 사진을 얻었다. 동일한 확대율로 모든 현미경 사진을 취하고 각 군에서 6마리의 마우스로부터 얻은 대표적인 폐이다. PX-866 치료된 마우스에서의 폐 콜라겐은 4주 후 오프 Dox를 받은 마우스와 비교하여 변하지 않았지만(도 6b), CCSP/- 대조군과 비교하여 상승된 채 머물렀다. * p<0.05: CCSP/- 대조군 마우스 및 온 및 오프 Dox에서 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여; # p<0.05: 비히클 치료된 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여. 군에서 10마리의 마우스로부터 데이터를 유도하였다.
도 7. PX -866은 폐 기계에서 TGF α 의존성 변화의 진행을 늦춘다. Dox 치료 후 4주 PX-866 투여받은 CCSP-rtTA/otet-TGFα 형질전환 마우스는 Dox를 8주 투여받은 비히클 치료된 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여 기도 저항, 기도 및 조직 탄성력의 증가, 및 순응도의 감소를 나타냈다. 대조군 및 4주 동안 오프 Dox를 받은 CCSP-rtTA/otet-TGFα 마우스와 비교하여 PX-866 마우스에서 폐 기계는 현저히 변경되었다. * p<0.05: CCSP/- 대조군 마우스 및 온 및 오프 Dox에서 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여; # p<0.05: PX-866 치료된 CCSP-rtTA/otet-TGFα 형질전환 마우스와 비교하여. 군에서 10마리의 마우스로부터 데이터를 유도하였다.
본원은 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA, ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제)를 포함하는 화합물, 약학 조성물 및 의약, 및 PI-3 키나제 활성과 관련된 질환 또는 병증을 치료 또는 예방하기 위해 이러한 화합물을 사용하는 방법을 기재한다. 또한, 본원은, 몇몇 양태에서, PI-3 키나제 활성을 억제하거나 부분적으로 억제하는 화합물(예를 들면, 화학식 ⅠA, ⅠB, ⅡA, ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제), 및 PI-3 키나제 활성과 관련된 섬유성 증후군의 증상을 역전 또는 경감시키기 위해 이러한 화합물 및 조성물을 사용하는 방법을 기재한다. 또한, 본원은 섬유성 증후군의 치료를 위한 보르트만닌 유사체 및 보르트만닌 유사체를 포함하는 약학 조성물 및 의약을 제공한다.
몇몇 경우에, 섬유증은 피브로넥틴을 발현하는 근섬유아세포 및/또는 섬유아세포의 증식과 관련된다. 몇몇 경우에, 이환 장기에서 피브로넥틴 발현 근섬유아세포 및/또는 섬유아세포의 생존은 섬유증의 진행의 결정 요인이다. 몇몇 경우에, 피브로넥틴 매개 접착은 PI-3 키나제 신호 전달 경로를 활성화하고 섬유증의 발병 및/또는 진행에 기여한다. 몇몇 경우에, 장기 구조에서의 변경된 피브로넥틴 발현 및/또는 저하는 섬유증의 병리학적 양상과 관련된다.
몇몇 경우에, 게피티닙 또는 엘로티닙과 같은 EGFR 티로신 키나제 억제제로 치료되는 폐암을 앓는 환자는 약물 유발 간질성 폐 질환을 발생시킨다. 몇몇 양태에서, 본원에 기재된 PI-3 키나제 억제제는 약물 유발 섬유성 증후군, 예컨대 간질성 폐 질환을 발생시키는 환자의 치료(예를 들면, 섬유증의 감소 또는 역전)를 허용한다. 몇몇 양태에서, 본원에 기재된 치료 방법은 현행 치료 방법(예를 들면, 면역 억제제, EFGR 티로신 키나제 억제제에 의한 치료)에 불응성인 섬유성 증후군의 치료를 허용한다.
PI-3 키나제는 포스파티딜이노시톨의 이노시톨 고리의 3번 하이드록실 기를 인산화할 수 있는 관련 효소의 패밀리이다. 이것은 세포 성장, 증식, 분화, 운동성, 생존 및 세포내 전달을 비롯한 다양한 목록의 세포 기능과 관련된다. 이러한 많은 기능은 단백질 키나제 B(Akt)를 활성화하는 PI-3 키나제의 능력과 관련된다. PI-3 키나제의 p110δ 이소폼의 유전적 및 약리학적 불활성화는 이러한 효소가 T 세포, B 세포, 비만 세포 및 호중구의 기능에 중요하다는 것을 나타낸다. 몇몇 경우에, PI-3 키나제는 염증성 반응의 개시 및/또는 유지를 비롯한 면역계 반응에서 역할을 한다. 몇몇 경우에, PI-3 키나제 신호 전달의 억제는 세포외 기질 침착을 억제하고, 전섬유발생 인자의 발현을 감소시킨다. 전섬유발생 인자는 결합 조직 성장 인자(CTGF), 섬유아세포 성장 인자(FGF), 형질전환 성장 인자 알파(TGFα), 형질전환 성장 인자 베타(TGFβ) 등을 포함하고 이들로 제한되지 않는다.
몇몇 경우에, PI3K-Akt는 1차 다운스트림 신호 전달 경로 매개 EGFR 유발 신생 과정이고, TGFα 유발 섬유성 병증(예를 들면, 폐 섬유증)을 매개한다. 몇몇 경우에, 활성 섬유화 동안 간 세포에서 PI-3 키나제 신호 전달의 억제는 세포외 기질 침착을 억제하고, 전섬유발생 인자의 발현을 감소시켜 간 섬유증의 진행을 역전 또는 감소시킨다. 문헌[Son et al. Hepatology. 2009, 50, 1512-23]을 참조한다. 몇몇 경우에, α8β1은 섬유증 및 장기 손상의 다른 모델에서 근섬유아세포에서 상향 조절된다. 몇몇 경우에, α8β1 발현 근섬유아세포의 생존은 PI-3 키나제에 의해 매개된다. 몇몇 경우에, PI-3 키나제의 억제는 장기 손상과 관련된 지속성 섬유증을 감소 또는 역전시킨다. 문헌[Farias et al. Biochemical and Biophysical Research Communications, 329, 2005, Page 305-311] 참조.
따라서, (예를 들면, 화학식 ⅠA, ⅠB, ⅡA, ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제의 투여를 통한) PI-3 키나제 활성의 억제는 치료를 필요로 하는 개체에서 섬유증의 진행을 역전, 감소 또는 지연시킨다. 또한, (예를 들면, 화학식 ⅠA, ⅠB, ⅡA, ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체의 투여를 통한) PI-3 키나제 억제는 섬유증이 현저하고 진행된 후에 확립된 섬유증을 경감 및/또는 치료한다. 몇몇 양태에서, (예를 들면, 화학식 ⅠA, ⅠB, ⅡA, ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체의 투여를 통한) PI-3 키나제 활성의 억제는 섬유성 증후군의 소인을 갖는 개체(예를 들면, 낭포성 섬유증의 가족력을 갖는 개체)에서 섬유증의 발병을 지연시킨다. 몇몇 양태에서, (예를 들면, 화학식 ⅠA, ⅠB, ⅡA, ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체의 투여를 통한) PI-3 키나제 활성의 억제는 (예를 들면, 장기 이식 후) 섬유증의 발병을 감소 또는 예방한다.
따라서, 본원은 치료를 필요로 하는 개체에서 PI-3 키나제의 활성을 감소시키거나 부분적으로 감소시켜, 섬유증을 역전시키거나 섬유증의 진행을 지연시키는 방법을 기재한다. 몇몇 양태에서, 상기 방법은 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA, ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체)를 치료를 필요로 하는 개체에게 투여하는 것을 포함한다. 몇몇 양태에서, 본원에 기재된 PI-3 키나제 억제제는 가역적 PI-3 키나제 억제제이다. 다른 양태에서, 본원에 기재된 PI-3 키나제 억제제는 비가역적 PI-3 키나제 억제제이다. 몇몇 양태에서, 본원에 기재된 PI-3 키나제 억제제는 PI-3 키나제 델타 또는 PI-3 키나제 감마에 대한 억제 활성과 비교하여 PI-3 키나제 알파 또는 PI-3 키나제 베타의 더 강력한 억제제이다.
특정한 정의
또한, 본원 및 특허청구범위에서 사용되는 단수는 문맥상 명확히 달리 기술하지 않는 한 복수를 포함한다는 것에 주의해야 한다. 따라서, 예를 들면 "세포"란 언급은 1종 이상의 세포 및 당업자에게 공지된 이의 등가물 및 기타 등등에 대한 언급이다. 달리 정의되지 않은 한, 본원에서 사용되는 모든 기술적 및 과학적 용어는 당업자가 통상 이해하는 동일한 의미를 가진다. 본원에 기재된 방법 및 물질과 유사한 또는 동등한 임의의 방법 및 물질을 본원에 기재된 양태의 실행 또는 교시에서 사용할 수 있지만, 특정한 바람직한 방법, 장치, 및 물질을 여기에 기재하였다.
본원에서 사용되는, "약"이란 용어는 이것이 사용되는 숫자 값의 ±10%를 의미한다. 따라서, 약 50%는 45%~55% 범위에 있는 것을 의미한다. "임의의" 또는 "임의로"는 뒤에 기재된 구조, 사례 또는 상황이 일어나거나 일어나지 않을 수 있다는 것, 및 그러한 기재가 그 사례가 일어나는 경우 및 그 사례가 일어나지 않는 경우를 포함한다는 것을 의미하도록 취할 수 있다.
치료제와 관련하여 사용될 때 "투여"는 표적 조직 내에 또는 그 위에 직접 치료제를 전신으로 또는 국소로 투여하는 것, 또는 치료제를 환자에게 투여하여 치료제가 표적으로 하는 조직에 긍정적으로 영향을 미치는 것을 의미한다. 따라서, 보르트만닌 유사체 또는 이의 대사물질과 관련하여 사용될 때 본원에서 사용되는 "투여"란 용어는 표적 조직 내에 또는 그 위에 보르트만닌 유사체 또는 이의 대사물질을 제공하는 것; 보르트만닌 유사체 또는 이의 대사물질을 전신으로, 예를 들면 정맥내 주사에 의해 환자에게 제공하여 치료제가 표적 조직 또는 세포에 도달하게 하는 것을 포함할 수 있지만, 이들로 제한되지는 않는다. 조성물 "투여"는 주사, 국소 투여, 및 경구 투여에 의해 또는 다른 방법 단독에 의해 또는 다른 공지된 기술과 조합하여 성취할 수 있다.
본원에서 사용되는 "치료제"란 용어는 환자의 원치않는 병증 또는 질환을 치료, 퇴치, 경감, 예방 또는 개선하도록 사용되는 제제를 의미한다. 몇몇 양태에서, 치료제는 본원에 기재된 섬유성 병증의 치료 및/또는 이의 증상의 경감 또는 역전과 관련된다. 몇몇 양태에서, 본원에 기재된 치료제는 폐 섬유증의 치료 및/또는 폐 섬유증의 증상의 경감 또는 역전과 관련된다.
본원에서 사용되는 "동물"이란 용어는 인간 및 비인간 척추동물, 예컨대 야생, 가축 및 사육 동물을 포함하지만, 이들로 제한되지는 않는다. "환자" 및 "피험체" 및 "개체"란 용어는 상호 교환 가능하고 본 개시내용의 화합물에 의해 치료될 수 있는 임의의 살아있는 유기체를 의미하기 위해 취할 수 있다. 그러므로, "환자" 및 "피험체"란 용어는 임의의 비인간 포유동물, 임의의 영장류 또는 인간을 포함할 수 있지만, 이들로 제한되지는 않는다.
용어 "억제"란 용어는 증상의 발병을 예방하거나, 증상을 경감시키거나, 질환, 병증 또는 질병을 제거하는 본 개시내용의 화합물의 투여를 포함한다.
"약학적으로 허용되는"이란 담체, 희석제 또는 부형제가 제제의 다른 성분과 상용성이어야 하고 이의 수혜자에게 해가 되지 않아야 한다는 것을 의미한다.
"약학 조성물"이란 용어는 하나 이상의 활성 성분을 포함하는 조성물을 의미해야 하고, 여기서 조성물은 포유동물(예를 들면, 인간(제한되지 않음))에서 구체적이고 유효한 결과에 대한 조사에 수정될 수 있다. 당업자는 활성 성분이 원하는 기능자의 필요에 기초하여 바람직한 유효한 결과를 갖는지를 결정하기에 적절한 기술을 이해하고 인식할 것이다.
본원에서 사용되는 "치료학적 유효량" 또는 "유효량"이란 (1) 질환의 예방; 예를 들면 질환, 병증 또는 질병에 대한 소인을 가질 수 있지만 질환의 병리학 또는 징후학을 아직 경험하거나 나타나지 않은 개체에서 질환, 병증 또는 질병의 예방, (2) 질환의 억제; 예를 들면 질환, 병증 또는 질병의 병리학 또는 징후학을 경험하거나 나타난 개체에서 질환, 병증 또는 질병의 억제(즉, 추가로 병리학 및/또는 징후학의 발생의 정지), 및 (3) 질환의 경감; 예를 들면 질환, 병증 또는 질병의 병리학 또는 징후학을 경험하거나 나타난 개체에서 질환, 병증 또는 질병의 경감(즉, 병리학 및/또는 징후학의 역전) 중 1 이상을 포함하는 조사원, 수의사, 의사 또는 다른 임상의가 추구하는 조직, 시스템, 동물, 개체 또는 인간에서의 생물학적 또는 의학적 반응을 이끌어내는 활성 화합물 또는 약학 제제의 양을 의미한다. 그러므로, 본 개시내용의 조성물의 "치료학적 유효량" 또는 "유효량"의 비제한적인 예는 세포의 활성화, 이동, 또는 증식을 억제, 차단, 또는 역전시기기 위해 또는 암을 효과적으로 치료하거나 암의 증상을 경감시키기 위해 사용할 수 있다.
"섬유증" 또는 "섬유성 증후군" 또는 "섬유성 병증"이란 용어는 상호 교환되어 사용된다. 본원에서 사용되는 "섬유증" 또는 "섬유성 증후군" 또는 "섬유성 병증"이란 용어는 급성 또는 만성 염증 및/또는 손상 후의 병증을 의미하고 염증 또는 손상 부위에서의 세포 및/또는 콜라겐의 비정상 축척과 관련되고, 개별 장기 또는 조직, 예컨대 심장, 신장, 관절, 폐, 또는 피부의 섬유증을 포함하지만, 이들로 제한되지는 않는다. "섬유증" 또는 "섬유성 증후군" 또는 "섬유성 병증"이란 용어는 폐 섬유증, 특발성 폐 섬유증, 잠재성 섬유성 폐포염, 안구 섬유증(예를 들면, 나이 관련 황반 변성과 관련되는 반흔, 또는 녹내장 여과 수술 후 반흔), 낭포성 섬유증, 심내막심근 섬유증, 종격동 섬유증, 골수섬유증, 골섬유증, 섬유성 결장병증, 후복막 섬유증, 간질성 폐렴, 진행성 종괴성 폐 섬유증(탄광 부진 폐증의 합병증), 켈로이드, 강피증, 비후성 반흔, 신장 섬유증(예를 들면, 간질성 섬유증), 장 섬유증(예를 들면, 크론씨병, 염증성 장 질환과 관련된 장 섬유증), 간 섬유증, 섬유성 담즙울체성 간염, 신원성 전신 섬유증, 다발성 섬유경화증, 과민성 쇼크 섬유증 등을 비롯한 간질성 폐 질환을 포함한다. 몇몇 양태에서, 임의의 섬유증 또는 본원에 기재된 섬유성 증후군은 미지의 기원(특발성)이다. 몇몇 양태에서, 임의의 섬유증 또는 본원에 기재된 섬유성 증후군은 낭포성 섬유증과 관련된다. 몇몇 양태에서, 임의의 본원에 기재된 섬유성 증후군은 자가면역 질환, 염증, 암 등과 관련된다. 몇몇 양태에서, 임의의 본원에 기재된 섬유성 증후군은 감염(예를 들면, 폐렴, 결핵, 조류 인플루엔자 등)과 관련된다. 몇몇 양태에서, 임의의 섬유증 또는 본원에 기재된 섬유성 증후군은 장기 이식(예를 들면, 폐 이식, 간 이식, 신장 이식)과 관련된다. 몇몇 양태에서, 임의의 섬유증 또는 본원에 기재된 섬유성 증후군은 석면, 탄진, 담배 흡연, 디젤 배기가스, 오존, 대기 미립자 등(이들로 제한되지는 않음)을 포함하는 알레르겐 및/또는 환경 오염원에의 노출과 관련된다. 몇몇 양태에서, 임의의 섬유증 또는 본원에 기재된 섬유성 증후군은 약물 유발 섬유증이다.
본 발명의 방법은 적절한 바대로 의학적인 치료학적 및/또는 예방적 치료 둘 다를 포함한다. 치료학적 및/또는 예방적 효과를 얻기 위해 투여되는 화합물의 특정 용량은, 물론, 예를 들면 투여되는 화합물, 투여 경로, 및 치료되는 병증을 비롯한 사례를 둘러싼 특정 상황에 의해 결정될 수 있다. 화합물은 광범위한 용량 범위에 걸쳐 효과적이고, 예를 들면 1일 용량은 통상적으로 0.001 내지 100 ㎎/㎏의 범위, 더 일반적으로 0.01 내지 1 ㎎/㎏의 범위 내에 해당한다. 그러나, 치료하고자 하는 병증, 투여하고자 하는 화합물의 선택, 및 선택된 투여 경로를 비롯한 관련 상황의 견지에서 주치의가 투여되는 유효량을 결정하는 것으로 이해된다. 치료학적 유효량의 본원에 기재된 화합물을 전형적으로 생리학적 내약성 부형제 조성물로 투여할 때, 조직에서 효과적인 전신 농도 또는 국소 농도를 성취하기에 충분한 양이다.
본원에서 사용되는 "치료한다", "치료된" 또는 "치료하는"이란 용어는 치료학적 치료 및 예방적 또는 예방학적 수단 둘 다를 의미하고, 목적은 바람직하지 않은 생리학적 병증, 질병 또는 질환을 예방 또는 지연(감퇴)시키거나, 유리한 또는 바람직한 임상 결과를 얻기 위한 것이다. 본원에 기재된 목적을 위해, 유리한 또는 바람직한 임상 결과는 증상의 경감; 병증, 질병 또는 질환의 정도의 저하; 병증, 질병 또는 질환의 상태의 안정화(즉, 악화가 아님); 병증, 질병 또는 질환의 발병의 지연 또는 이의 진행의 지연; 병증, 질병 또는 질환 상태의 경감; 및 검출 가능하든지 또는 검출 불가능하든지 (부분 또는 전체든지) 차도, 또는 병증, 질병 또는 질환의 향상 또는 개선을 포함하지만, 이들로 제한되지는 않는다. 치료는 과도한 수준의 부작용 없이 임상적으로 유의적인 반응을 이끌어내는 것을 포함한다. 치료는 또한 치료를 받지 않는 경우 예상된 생존과 비교하여 생존을 연장시키는 것을 포함한다.
"보르트만닌 유사체" 또는 "보르트만닌의 유사체"란 용어는 보르트만닌 내 1개 이상의 원자, 작용성 기, 또는 하위 구조가 보르트만닌의 기능적 활성시 보유 또는 개선하고/하거나 PK 프로파일을 개선하고/하거나 보르트만닌의 독성을 감소시키면서 상이한 원자, 기, 또는 하위 구조로 대체되는 임의의 화합물을 의미한다.
"알킬" 기는 지방족 탄화수소 기를 의미한다. "알킬" 기는 치환 및 비치환 알킬 기를 포함한다. 알킬 기에 대한 언급은 "포화 알킬" 및/또는 "불포화 알킬"을 포함한다. 알킬 기는, 포화이든 또는 불포화이든, 분지형, 선형, 또는 고리형 기를 포함한다. 오로지 예의 방식으로, 알킬은 메틸, 에틸, 프로필, 이소-프로필, n-부틸, 이소-부틸, 초-부틸, t-부틸, 펜틸, 이소-펜틸, 네오-펜틸, 및 헥실을 포함한다. 몇몇 양태에서, 알킬 기는 메틸, 에틸, 프로필, 이소프로필, 부틸, 이소부틸, tert-부틸, 펜틸, 헥실, 에테닐, 프로페닐, 부테닐, 사이클로프로필, 사이클로부틸, 사이클로펜틸, 사이클로헥실 등을 포함하지만, 어떠한 방식으로든 이들로 제한되지는 않는다. "저급 알킬"은 C1-C6 알킬이다. "헤테로알킬" 기는 적절한 수의 수소 원자를 갖는 이종 원자가 부착된 알킬 기의 탄소 중 임의의 1개를 치환한다(예를 들면, NH 기 또는 O 기에 대한 CH2 기).
"사이클로알킬" 또는 "사이클릭 알킬"이란 용어는 고리를 형성하는 원자(즉, 골격 원자)가 각각 탄소 원자인 단환식 또는 다환식 비방향족 라디칼을 의미한다. "사이클로알킬" 기는 치환 및 비치환 사이클로알킬 기를 포함한다. 다양한 양태에서, 사이클로알킬은 포화, 또는 부분 불포화이다. 몇몇 양태에서, 사이클로알킬은 방향족 고리와 축합된다. 몇몇 양태에서, 사이클로알킬은 헤테로아릴 고리와 축합된다. 사이클로알킬 기는 3개 내지 10개의 고리 원자를 갖는 기를 포함한다. 사이클로알킬 기의 예시적인 예로는
등의 부분을 들 수 있지만, 이들로 제한되지는 않는다. 단환식 사이클로알킬로는 사이클로프로필, 사이클로부틸, 사이클로펜틸, 사이클로헥실, 사이클로헵틸, 및 사이클로옥틸을 들 수 있지만, 이들로 제한되지는 않는다. 이환식 사이클로알킬로는 테트라하이드로나프틸, 인다닐, 테트라하이드로펜탈렌 등을 들 수 있지만, 이들로 제한되지는 않는다. 다환식 사이클로알킬로는 아다만탄, 노르보르난 등을 들 수 있다. 사이클로알킬이란 용어는 "불포화 비방향족 탄소환" 또는 "비방향족 불포화 탄소환"을 포함하고, 둘 다 1개 이상의 탄소-탄소 이중 결합 또는 1개의 탄소-탄소 삼중 결합을 포함하는 본원에 정의된 비방향족 탄소환을 의미한다.
"헤테로지환식" 기 또는 "헤테로사이클로" 기 또는 "헤테로사이클로알킬" 기는 1개 이상의 골격 고리 원자가 질소, 산소 및 황으로부터 선택되는 이종 원자인 사이클로알킬 기를 의미한다. "헤테로사이클로알킬" 기는 치환 및 비치환 헤테로사이클로알킬 기를 포함한다. 다양한 양태에서, 라디칼은 아릴 또는 헤테로아릴과 축합된다. 비방향족 헤테로사이클이라고도 칭하는 헤테로사이클로 기의 예시적인 예로는
등을 들 수 있다. 헤테로지환식이란 용어는 또한 모노사카라이드, 디사카라이드 및 올리고사카라이드(이들로 제한되지는 않음)를 비롯한 탄수화물의 모든 고리 형태를 포함한다.
보르트만닌
유사체
보르트만닌은 균류 페니실리움 보르트만닌의 배양액으로부터 단리된 천연 화합물이다. 보르트만닌은 비가역적으로 키나제 상에 특이적 리신과의 공유 상호작용을 통해 PI-3 키나제를 억제한다: pi 10a 이소폼의 촉매 자리의 ATP 결합 포켓의 Lys802 또는 pi 105 이소폼의 Lys883. p110α, p110β, p110δ 및 p110γ와 같은 PI-3 키나제의 대부분의 이소폼은, 예를 들면 보르트만닌에 의해 동등하게 억제된다. 보르트만닌은 간 및 혈액 독성을 나타내지만, 생물학적으로 불안정한 분자이다. 중성 pH에서 37℃ 또는 0℃에서 수용액으로서 저장되는 샘플을 푸란 고리의 가수분해 개환에 의해 분해한다. 푸란 고리의 친전자성이 보르트만닌의 억제 활성에 중추적이라는 것을 보여준다. PI-3 키나제의 비가역적 억제는 보르트만닌의 C(20) 위치에서 푸란 고리 상의 키나제의 활성 리신의 공격 이후 엔아민 형성에 의해 발생한다. 따라서, 보르트만닌의 분해는 PI-3 키나제 상에 이의 억제 활성으로 방해된다.
몇몇 양태에서, 본원에 기재된 보르트만닌의 유사체 및 대사물질은 개선된 생물학적 안정성 및 감소된 전신성 독성을 나타낸다. 몇몇 양태에서, 본원에 기재된 보르트만닌의 유사체 및 대사물질은 PI-3 키나제 억제제이다. 따라서, 본원에 기재된 보르트만닌 유사체의 방법 및 조성물은 예를 들면 폐 섬유증을 비롯한 섬유성 병증을 치료하는 개선된 방법을 허용한다.
몇몇 양태에서, 본원에 기재된 치료 방법에 적합한 보르트만닌 유사체는 하기 화학식 IA 또는 화학식 IB의 화합물을 포함한다:
[식 중,
---는 임의의 결합이고;
n은 1~6이고;
Y는 이종 원자이고;
R1 및 R2는 불포화 알킬, 비선형 알킬, 사이클릭 알킬 및 치환 알킬로부터 독립적으로 선택되거나, R1과 R2는 이들이 결합된 원자와 함께 헤테로사이클로알킬 기를 형성하고;
R3은 부재하거나, H, 또는 C1-C6 치환 또는 비치환 알킬이고;
R4는 (C=O)R5, (C=O)OR5, (S=O)R5, (SO2)R5, (PO3)R5, (C=O)NR5R6이고;
R5는 치환 또는 비치환 C1-C6 알킬이고;
R6은 치환 또는 비치환 C1-C6 알킬이다].
몇몇 양태에서, 본원에 기재된 치료 방법에 적합한 보르트만닌 유사체는 하기 화학식의 화합물을 포함한다:
[식 중, Y는 이종 원자이고, R1 및 R2는 불포화 알킬, 비선형 알킬, 사이클릭 알킬 및 치환 알킬로부터 독립적으로 선택된다].
몇몇 양태에서, 섬유성 증후군의 치료에 적합한 본원에 기재된 보르트만닌 유사체는 PX-866, PX-867, PX-868, PX-870, PX-871, PX-880, PX-881, PX-882, PX-889, PX-890, DJM2-170, DJM2-171, DJM2-177, DJM2-181 및 이들의 조합(이들로 제한되지는 않음)으로부터 선택된 화합물 및/또는 이의 대사물질을 포함한다. 몇몇 양태에서, 섬유성 질환의 치료에 적합한 본원에 기재된 보르트만닌 유사체는 화합물이 본원에서 참조문헌으로 포함된 제GB2302021호에 기재된 화합물을 포함한다.
도 1은 섬유성 증후군의 치료에 유용한 예시적인 보르트만닌 유사체 및 이의 대사물질에 대한 화학식을 예시한다.
PI
-3
키나제
억제제
몇몇 양태에서, 본원에 기재된 섬유성 증후군(예를 들면, 폐 섬유증)의 치료에 적합한 PI-3 키나제 억제제로는 보르트만닌 유사체, 보르트만닌 대사물질, NVP-BEZ235, PI-130, LY294002 및 올-트랜스-레티노산(ATRA: all-trans retinoic acid)을 들 수 있지만, 이들로 제한되지는 않는다.
몇몇 양태에서, 섬유성 증후군의 치료에 적합한 본원에 기재된 PI-3 키나제 억제제는 본원에 기재된 화학식 ⅠA, ⅠB, ⅡA 및 ⅡB의 화합물을 포함한다.
몇몇 양태에서, 섬유성 증후군(예를 들면, 폐 섬유증)의 치료에 적합한 PI-3 키나제 억제제는 미국 출원 공보 제20050032727호, 제20070203098호, 제20070259876호, 제20080188423호, 제20090042773호, 제20070021447호, 제20080039459호, 제20080300239호, 제20090018131호, 제20090023742호, 제20090029998호, 제20090048252호, 제20090170848호, 제20090215818호, 제20090306074호, 제20090048252호, 제20080300239호, 제20090018131호, 제20090023742호, 제20090048252호, 제20090170848호, 제20090215818호, 제20090306074호에 기재된 PI-3 키나제 억제제를 들 수 있지만, 이들로 제한되지는 않고, 이들 공보에 기재된 PI-3 키나제 억제제 화합물은 참조문헌으로 포함된 본원에 의해 본원에 포함된다.
섬유성 증후군 및 치료 방법
폐 섬유증
본원은 1종 이상의 PI-3 키나제 억제제를 치료를 필요로 하는 개체에게 투여하는 것을 포함하는 간질성 폐 질환의 치료 방법을 제공한다. 몇몇 양태에서, 간질성 폐 질환은 폐 섬유증이다. 몇몇 양태에서, 간질성 폐 질환은 특발성 폐 섬유증이다.
폐 섬유증은 다수의 소아 및 성인 폐 질환에서의 이환율 및 사망률에 기여한다. 폐 섬유증을 야기하는 임상 질환은 이종성이고, 섬유증은 예컨대 급성 호흡 장애 증후군에서 급성 폐 손상에 부차적으로, 예컨대 낭포성 섬유증(CF)에서 만성 염증성 질환으로부터 발생할 수 있거나, 또는 특발성 폐 섬유증(IPF)에서와 같은 비공지된 원인으로 발생할 수 있다. 폐 섬유증의 병적 실패가 기초 질환 과정에 따라 달라질 수 있지만, 중간엽 세포 증식, 세포외 매트릭스의 확장 및 폐 실질의 개형을 비롯한 다수의 공통적인 특성이 존재한다. 본원에서 사용되는 폐 섬유증은 특발성 폐 섬유증, 미만성 간질성 폐 섬유증, 간질성 폐렴, 진행성 종괴성 폐 섬유증(탄광 부진 폐증의 합병증) 등을 들 수 있다. 또한, 본원에 기재된 양태의 범위 내에 낭포성 섬유증, 또는 자가면역 질환, 예컨대 강피증 등과 같은 잠복 질환으로부터 생기는 폐 섬유증이 고려된다. 본원에서 사용되는 폐 섬유증으로는 석면(즉, 석면증와 관련된 폐 섬유증), 탄진, 담배 흡연, 디젤 배기가스, 다른 대기 오염물질, 예컨대 오존, 산업 배출로부터의 미립자 등(이들로 제한되지는 않음)을 비롯한 환경 알레르겐 또는 오염물질에의 노출로부터 생기는 폐 섬유증을 들 수 있다. 본원에서 사용되는 폐 섬유증으로는 감염, 예컨대 폐렴 또는 임의의 다른 감염과 관련된 폐 섬유증을 들 수 있다. 폐 섬유증은 또한 약물 유발 폐 섬유증(예를 들면, 블레오마이신 등과 같은 약물 투여로부터 생기는 부작용으로 발생하는 섬유증)을 들 수 있다.
따라서, 본원에 제공된 방법 및 조성물은 본원에 기재된 임의의 간질성 폐 질환 및/또는 폐 섬유성 증후군의 진행 및/또는 개시를 감소, 역전, 또는 지연시킬 수 있다. 몇몇 양태에서, 간질성 폐 질환 및/또는 폐 섬유성 증후군은 폐에서의 근섬유아세포의 증식과 관련된다. 몇몇 양태에서, 1종 이상의 PI-3 키나제 억제제(예를 들면, 화학식 IA, IAB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제)를 치료를 필요로 하는 개체에게 투여하는 것은 폐에서의 근섬유아세포 증식을 억제하거나 부분적으로 억제하여, 본원에 기재된 임의의 간질성 폐 질환 및/또는 폐 섬유성 증후군의 진행 및/또는 개시를 감소, 역전, 또는 지연시킨다.
EGFR(HER1)은 또한 HER2/neu, HER3 및 HER4를 포함하는 수용체 티로신 키나제 단백질 패밀리에 속한다. 6개의 EGFR 리간드(TGFα, EGF, HB-EGF, 암피레굴린, 베타셀룰린, 및 헤레굴린)는 폐로 또는 폐 세포에서 국소화된다. 활성화 리간드에 따라, EGFR 패밀리 구성원은 상이한 생물학적 용량을 갖는 다양한 동형이량체 또는 이형이량체를 형성한다. EGFR의 활성화는 다양한 세포 기능을 조절하고, 이의 대부분은 세포 성장, 증식, 분화, 이동, 아폽토시스로부터의 보호, 및 형질전환을 비롯한 섬유화와 관련된다. 구체적으로 폐 상피에서 TGFα를 발현하는 독시사이클린(Dox) 조절 가능한 형질전환 마우스는 염증과 무관한 진행성이고 광범위한 혈관 외막, 기관지 주위, 간질성 및 늑막 섬유증을 나타낸다. 이러한 마우스 폐에서 TGFα의 발현 후 관찰되는 유전자 발현 프로파일은 인간에서 폐 섬유증 질환에서 발견되는 것과 유사하다.
몇몇 경우에, EGFR 활성화의 신호 전달 경로 다운스트림은 TGFα 유발 폐 섬유증을 매개한다. 세포외 도메인에 대한 리간드 결합 이후, 세포질 도메인에서 특정한 잔기 상에 본래 티로신-키나제 활성에 의해 자동 인산화 또는 트랜스-인산화를 발생시키는 수용체 동형이량체 및 이형이량체가 형성된다. 인산화 티로신 잔기는 RA/RAF/미토겐 활성화 단백질 키나제(MAPK) 캐스케이드, JAK/STAT 경로, 포스포리파제 Cγ 경로 및 포스파티딜이노시톨 3'-키나제(PI3K)/Akt(단백질 키나제 B) 신호 전달 경로를 비롯한 다수의 다운스트림 이팩터 경로를 활성화하는 분자를 신호 전달하기 위한 도킹 자리가 된다. PI3K는 수용체 티로신 키나제, G-단백질 커플링 수용체 또는 사이토킨 수용체의 활성화에 대한 반응에서 포스파티딜이노시톨(3,4,5)-트리포스페이트(PIP3)를 형성하기 위해 포스파티딜이노시톨(4,5)-비포스페이트(PIP2)의 인산화를 촉매하는 신호 형질도입 효소이다. PIP3은 결국 Akt를 활성화하고 성장, 증식, 이동, 생존 및 콜라겐 유전자 발현을 비롯한 섬유화와 관련된 다수의 세포 과정과 관련된다. 종양 억제물질 포스파타제 및 텐신 동족체(PTEN)는 PIP3을 PIP2로 탈인산화하는 PI3K-Akt 경로의 음성 성장 조절물질이다. PTEN의 약리학적 억제제로 치료된 야생형 마우스 및 PTEN 단일불충분한 마우스 둘 다 폐 섬유증의 발병에서 이의없는 PI3K-Akt 활성화에 대해 생체내 역할을 지지하는 블레오마이신 유발 폐 손상 이후 증강된 콜라겐 침착 및 근섬유아세포 분화를 나타낸다.
몇몇 양태에서, 1종 이상의 PI-3 키나제 억제제를 치료를 필요로 하는 개체에게 투여하는 것은 폐 세포에서 EGFR의 활성화를 감소 또는 억제한다. 몇몇 양태에서, 1종 이상의 PI-3 키나제 억제제를 치료를 필요로 하는 개체에게 투여하는 것은 EGFR에 대한 TGFα의 결합을 감소 또는 방해하여 PI-3 키나제의 다운스트림 활성화를 억제하거나 부분적으로 억제한다.
PBK-Akt가 EGFR 유발 신생 과정을 매개하는 1차 다운스트림 신호 전달 경로이므로, PBK-Akt는 TGFα 유도 폐 섬유증을 매개할 수 있다. PX-866은 현재 함암제로서 진전된 전임상 개발 중에 있는 PI3K의 신규한 억제제이다. 조절 가능한 형질전환 마우스에서 TGFα 유도 시간에 PX-866을 투여함으로써 폐 섬유증의 개시 및 진행에서의 PBK의 역할은 본원에 도 2 내지 도 7 및 실시예 1 및 실시예 2에 기재되어 있다.
몇몇 경우에, PI3K가 아닌 추가의 다운스트림 신호 전달 경로가 여전히 활성화되어 있고 폐 섬유증의 유지에 계속해서 기여한다. 티로신 키나제 수용체, 예컨대 EGFR은 PI3K 및 세포 성장 및 증식을 조절하는 다른 경로를 활성화한다. 몇몇 양태에서, 폐 섬유증의 유지에서 추가의 신호 전달 경로 활성에서의 표적인 치료학적 중재는 폐 섬유증의 병용 치료를 허용한다.
실시예 1 및 실시예 2 및 도 2 내지 도 7은 PI3K 억제제 PX-866에 의한 치료가 형질전환 마우스에서 EGFR 매개 폐 섬유증 및 폐 역학에서의 관련 변경을 예방한다는 것을 보여준다. 증가된 EGFR 리간드 및 EGFR 활성화가 섬유성 폐 질환을 앓는 환자의 여러 연구에서 확인되었다. IPF를 갖는 환자의 폐 세척액, 및 IPF 샘플의 Ⅱ형 상피 세포에 대한 TGFα 및 EGFR, 섬유아세포 및 혈관 내피에서의 면역조직화학 국소 증가에서 증가된 TGFα가 검출되었다. 증가된 EGFR 및 EGFR 리간드는 또한 낭포성 섬유증, 기관지폐 이형성증 및 천식을 앓는 환자의 개형 조직에서 확인되었다. 몇몇 경우에, EGFR 표적 치료는 폐 섬유증의 블레오마이신, 나프탈렌, 석면증 및 오발부민 모델을 비롯한 다수의 동물 모델에서 섬유증을 차단한다. 따라서, 폐 섬유증의 치료에 대해 EGFR 표적 치료제 및 PI-3 키나제 조절물질의 투여를 포함하는 병용 치료가 본원에 기재된 양태의 범위 내에 또한 고려된다.
몇몇 경우에, EGFR 신호 전달은 간질성 폐 질환을 매개하고 급성 폐 손상 동안 계면활성제 단백질 발현을 유지한다. 특정한 경우에, EGFR의 억제는 계면활성제 단백질 발현을 감소시킴으로써 폐 손상을 악화시킨다. 종합하면, 이러한 발견은 폐 개형에 특이적인 경로를 한정하는 목표로 섬유증을 매개하는 EGFR의 신호 전달 경로 다운스트림의 추가 분석을 지지한다. 본 공개내용은 PI3K-Akt가 폐 섬유증을 매개하는 EGFR 활성화의 1차 이팩터 경로 다운스트림이라는 것을 나타낸다.
PI3K 경로는 폐 섬유증을 매개하는 데 관여한다. 인간 및 마우스 섬유아세포 둘 다에서의 연구는 PI3K 활성화가 증가된 증식, 콜라겐 합성 및 근섬유아세포 분화와 함께 아폽토시스 감소를 발생시킨다는 것을 나타낸다. IPF를 갖는 환자로부터 분리된 섬유아세포는 감소된 PTEN 발현 및 PI3K-Akt의 비이상 활성화와 관련된 활성 및 증가된 증식을 나타낸다. 마우스를 Akt 억제제로 치료할 때 조절 가능한 TGFβ1 형질전환 모델에서의 폐 섬유증은 현저히 약화되었다.
TGFα 형질전환 모델에서의 섬유증은 TGFα 활성화와 무관하게 발전하여 PI3K/Akt 경로가 다수의 전섬유성 자극이 중간엽 증식 및 매트릭스 침착의 세포 반응을 이끌도록 집중되는 포화상태의 가능성 있는 지점을 나타낸다는 것을 제시한다. 혈소판 유도 성장 인자(PDGF) 패밀리는 폐 섬유증의 염증성 모델에 관여하는 다른 전섬유성 사이토킨 패밀리이다. PDGF는 EGFR과 같이 수용체 티로신 키나제인 2개의 수용체를 통해 작용한다. EGFR 및 TGFβ1과 같이, PDGF 수용체는 PI3K를 활성화한다. 종합하면, 이러한 데이터는 다수의 섬유 발생 사이토킨이 집중하는 공통 경로로서 PI3K를 추가로 지지한다.
그러나, TGFα에 대한 반응에서 상피 세포 및 중간엽 세포 증식 둘 다 세포 유형 둘 다에서의 PI3K 활성화가 섬유증을 야기하는지는 불명확하다. Pten 유전자가 폐 상피로부터 조건적으로 결핍되는 형질전환 마우스는 기관지 및 세기관지 루멘으로 돌출되는 유관속 코어를 갖는 과세포 상피 내층 유두를 특징으로 하는 현저한 상피 과형성과 관련된 증가된 상피 PI3K-Akt 활성화를 나타낸다. 그러나, TGFα 마우스와 달리, 과형성은 진행성이 아니고 조직질실 섬유증이 발전되지 않아 섬유아세포의 PI3K 활성화가 PI3K/Akt 매개 섬유증을 매개하는 데 중요하다는 것을 제시한다.
최근 데이터는 인간 섬유증 폐 질환에서 PI3K-Akt의 활성화를 지지한다. IPF 환자로부터 얻은 폐 생검의 면역조직화학 분석은 섬유아세포 병소에서 증가된 인산화된 Akt를 나타낸다. 인간 섬유증 질환에서의 비이상 PI3K 신호 전달의 증거와 커플링된 TGFα 및 TGFβ 형질전환 모델에서의 PI3K 억제는 PI3K-Akt 경로를 약리학적으로 표적화하는 것을 지지한다.
몇몇 양태에서, 본원은 치료학적 유효량의 보르트만닌 유사체 또는 보르트만닌 대사물질을 피험체에게 투여하는 것을 포함하는 피험체에서의 폐 섬유증의 치료 방법을 제공한다.
몇몇 양태에서, 본원은 폐 섬유증의 치료를 위한 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물, 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제)의 사용 방법으로서, 폐 섬유증은 경증 또는 중등증인 사용 방법을 제공한다. 몇몇 양태에서, 본원은 폐 섬유증의 치료를 위한 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물, 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제)의 사용 방법으로서, 폐 섬유증이 뚜렷해지고 진행된 것인 사용 방법을 제공한다. 몇몇 양태에서, PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물, 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제)는 폐 섬유증의 진행을 감소시킨다. 몇몇 양태에서, PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물, 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제)는 폐 기계에서 TGFα 변화의 진행을 늦춘다. 몇몇 양태에서, PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물, 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제)는 진행성 체중 감소를 예방한다.
몇몇 양태에서, 본원은 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물의 대사물질의 투여를 포함하는 폐 섬유증의 치료 방법을 제공한다. 예의 방식으로, 특정한 대사물질을 도 1에 도시하였다. 이러한 양태 중 몇몇에서, 이러한 대사물질은 보르트만닌의 억제 활성과 유사하거나 더 우수한 PI-3 키나제에 대한 억제 활성을 나타낸다.
안구 섬유증
본원은 1종 이상의 보르트만닌 유사체 및/또는 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물)를 치료를 필요로 하는 개체에게 투여하는 것을 포함하는 안구 섬유증(임의의 눈 부위에서의 섬유증 및/또는 반흔)의 치료 방법을 제공한다. 몇몇 경우에, 예를 들면 감염 또는 염증 또는 대사 질환에 의해 눈 항상성이 방해될 때, 섬유증은 신경아교 세포 및/또는 섬유아세포에 의해 매개된다. 몇몇 경우에, 감염(예를 들면, 바이러스 감염) 후 각막의 섬유증(예를 들면, 헤르페스성 각막염)이 발생한다. 몇몇 경우에, 당뇨병 관련 망막 저산소증은 섬유증 및 후속적인 견인성 망막 박리(진행성 당뇨망막병증의 합병증)을 야기한다. 몇몇 경우에, 신생혈관 연령 관련 황반변성(ARMD)과 관련된 망막하 출혈은 망막 아래에 섬유증을 야기한다. 몇몇 경우에, 섬유아세포 및 섬유아세포 유사 세포(예를 들면, 눈에서의 신경아교 세포)의 증식은 세포외 매트릭스를 변경시켜, 반흔 형성 및/또는 시력 저하를 야기한다. 몇몇 경우에, 결막의 퇴행은 각막 표면에서의 섬유증을 야기한다. 몇몇 경우에, 각막 이식 이후에 안구 섬유증이 발생한다. 몇몇 경우에, 미숙아 망막증(ROP; retinopathy of prematurity)은 미숙아의 눈에서 섬유증과 관련된다. 몇몇 경우에, 반흔은 녹내장 여과 수술에서 발생한다.
몇몇 경우에, 안구 섬유증은 혈관생성자극 VEGF의 수준과 전섬유성 CTGF의 수준 간의 균형 이동의 결과이다. 몇몇 양태에서, 1종 이상의 PI-3 키나제 억제제를 치료를 필요로 하는 개체에게 투여하는 것은 CTGF를 억제하거나 부분적으로 억제한다. 몇몇 양태에서, CTGF의 억제 또는 부분 억제는 안구 섬유증의 진행 및/또는 발병을 감소시키거나, 역전시키거나, 지연시킨다. 따라서, 본원에 제공된 방법 및 조성물은 본원에 기재된 임의의 안구 섬유성 증후군의 진행 및/또는 발병을 감소시키거나, 역전시키거나, 지연시킨다.
몇몇 양태에서, 안구 섬유성 증후군은 섬유아세포 또는 섬유아세포 유사 세포의 증식과 관련된다. 몇몇 양태에서, 1종 이상의 보르트만닌 유사체 및/또는 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물)를 치료를 필요로 하는 개체에게 투여하는 것은 섬유아세포의 증식을 억제하거나 부분적으로 억제하여, 본원에 기재된 임의의 안구 섬유성 증후군의 진행 및/또는 발병을 감소시키거나, 역전시키거나, 지연시킨다. 몇몇 양태에서, 1종 이상의 보르트만닌 유사체 및/또는 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물)를 치료를 필요로 하는 개체에게 투여하는 것은 녹내장 여과 수술 후 반흔의 진행 및/또는 발병을 감소시키거나, 역전시키거나, 지연시킨다. 몇몇 양태에서, 1종 이상의 보르트만닌 유사체 및/또는 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물)를 치료를 필요로 하는 개체에게 투여하는 것은 ARMD와 관련된 망막에서의 반흔의 진행 및/또는 발병을 감소시키거나, 역전시키거나, 지연시킨다.
위장관에서의 섬유성 증후군
본원은 1종 이상의 보르트만닌 유사체 및/또는 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물)를 치료를 필요로 하는 개체에게 투여하는 것을 포함하는 위장(GI) 관에서의 섬유성 증후군의 치료 방법을 제공한다. GI 관에서의 섬유성 증후군으로는 섬유성 결장병증, 장 섬유증(예를 들면, 크론씨병과 관련, 염증성 장 질환), 간 섬유증, 섬유성 담즙울체성 간염 등을 들 수 있지만, 이들로 제한되지는 않는다. 이러한 양태 중 몇몇에서, GI 관 섬유성 증후군은 낭포성 섬유증(예를 들면, 섬유성 결장병증)과 관련된다. 몇몇 경우에, 활성화된 섬유아세포는 간 섬유증 동안 섬유증 세포외 매트릭스 축적에 기여한다.
몇몇 양태에서, GI 관 섬유성 증후군은 섬유아세포의 증식과 관련된다. 몇몇 양태에서, 1종 이상의 보르트만닌 유사체 및/또는 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물)를 치료를 필요로 하는 개체에게 투여하는 것은 섬유아세포의 증식을 억제하거나 부분적으로 억제하여, 본원에 기재된 임의의 GI 관 섬유성 증후군의 진행 및/또는 발병을 감소시키거나, 역전시키거나, 지연시킨다.
신장계에서의
섬유성 증후군
본원은 1종 이상의 보르트만닌 유사체 및/또는 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물)를 치료를 필요로 하는 개체에게 투여하는 것을 포함하는 신장계에서의 섬유성 증후군의 치료 방법을 제공한다. 신장계에서의 섬유성 증후군으로는 만성 신장 질환, 후복막 섬유증, 당뇨병성 신증, 만성 사구체경화증, 간질성 섬유증 등을 들 수 있지만, 이들로 제한되지는 않는다.
몇몇 양태에서, 신장 섬유성 증후군은 섬유아세포의 증식 및/또는 활성화와 관련된다. 몇몇 양태에서, 1종 이상의 보르트만닌 유사체 및/또는 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물)를 치료를 필요로 하는 개체에게 투여하는 것은 섬유아세포의 증식을 억제하거나 부분적으로 억제하여, 본원에 기재된 임의의 신장 섬유성 증후군의 진행 및/또는 발병을 감소시키거나, 역전시키거나, 지연시킨다.
진피 섬유성 증후군
본원은 1종 이상의 보르트만닌 유사체 및/또는 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물)를 치료를 필요로 하는 개체에게 투여하는 것을 포함하는 진피 섬유성 증후군의 치료 방법을 제공한다. 진피 섬유성 증후군으로는 켈로이드, 강피증, 비후성 반흔, 신원성 전신 섬유증 등을 들 수 있지만, 이들로 제한되지는 않는다. 몇몇 경우에, 켈로이드는 피부 손상의 치유 후 발생하는 치밀 섬유성 조직의 과성장의 결과이다. 몇몇 경우에, 심부 진피를 포함하는 열 손상 및/또는 다른 손상 후 비후성 반흔이 보인다. 신원성 전신 섬유증(NSF)은 피부에서 뚜렷하고 가시적인 효과를 갖는 전신 장애이다. 몇몇 경우에, NSF로 진단된 환자는 약간 증가된 반점(plaque), 구진, 또는 융합 구진을 갖는 경화된 피부의 넓은 부위를 발전시키고/시키거나 생검은 증가된 수의 섬유아세포, 진피에서 보이는 정상 패턴의 콜라겐층의 변경, 및 증가된 뮤신 진피 침착을 나타낸다.
몇몇 양태에서, 진피 섬유성 증후군은 임의의 진피 층에서의 섬유아세포의 증식 및/또는 활성화와 관련된다. 몇몇 양태에서, 1종 이상의 보르트만닌 유사체 및/또는 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물)를 치료를 필요로 하는 개체에게 투여하는 것은 섬유아세포의 증식을 억제하거나 부분적으로 억제하여, 본원에 기재된 임의의 진피 섬유성 증후군의 진행 및/또는 발병을 감소시키거나, 역전시키거나, 지연시킨다.
장기 이식과 관련된 섬유성 증후군
몇몇 양태에서, 섬유성 증후군은 장기 이식(동종이식편 및/또는 이종이식편 포함), 예컨대 간 동종이식편(예를 들면, 섬유성 담즙울체성 간염, 간 섬유증, 신장 섬유증 등)과 관련되다. 몇몇 양태에서, 1종 이상의 보르트만닌 유사체 및/또는 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물)를 치료를 필요로 하는 개체에게 투여하는 것은 장기이식된 장기 또는 장기이식된 장기 근처에서의 섬유증 발생을 감소시키거나 예방한다.
다른 섬유성 증후군
본원은 1종 이상의 보르트만닌 유사체 및/또는 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물)를 치료를 필요로 하는 개체에게 투여하는 것을 포함하는 특정한 다른 섬유성 증후군의 치료 방법을 제공한다. 이러한 섬유성 증후군으로는 낭포성 섬유증, 심내막심근 섬유증, 종격동 섬유증, 골수섬유증, 골섬유증, 다발성 섬유경화증, 과민성 쇼크 섬유증 등을 들 수 있지만, 이들로 제한되지는 않는다.
실시예 3 내지 실시예 12는 상기 기재된 특정한 섬유성 증후군의 치료를 위한 특정한 보르트만닌 유사체 및/또는 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물, 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제)의 용도를 기재한 것이다.
몇몇 양태에서, 상기 기재된 임의의 섬유성 증후군은 섬유아세포의 증식 및/또는 활성화와 관련된다. 몇몇 양태에서, 1종 이상의 보르트만닌 유사체 및/또는 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물, 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제)를 치료를 필요로 하는 개체에게 투여하는 것은 섬유아세포의 증식을 억제하거나 부분적으로 억제하여, 상기 기재된 임의의 섬유성 증후군의 진행 및/또는 발병을 감소시키거나, 역전시키거나, 지연시킨다.
일 양태에서, 본원은 치료학적 유효량의 하기 구조를 갖는 PX-866을 피험체에게 투여하는 것을 포함하는, 피험체에서의 상기 기재된 임의의 섬유성 증후군(예를 들면, 폐 섬유증)의 치료 방법을 제공한다:
일 양태에서, 본원은 치료학적 유효량의 하기 구조를 갖는 PX-867을 피험체에게 투여하는 것을 포함하는, 치료를 필요로 하는 피험체에서의 상기 기재된 임의의 섬유성 증후군(예를 들면, 폐 섬유증)의 치료 방법을 제공한다:
특정한 추가의 양태는 PX-868, PX-870, PX-871, PX-880, PX-881, PX-882, PX-889, PX-890, DJM2-170, DJM2-171, DJM2-177, DJM2-181 및 이들의 조합(이들로 제한되지는 않음)으로부터 선택되는 보르트만닌 유사체 및 대사물질의 치료학적 유효량을 치료를 필요로 하는 개체에게 투여하는 것을 포함하는 섬유성 증후군(예를 들면, 폐 섬유증)의 치료 방법을 제공한다.
병용 치료
몇몇 양태에서, 본원은 섬유성 증후군(예를 들면, 폐 섬유증)을 치료하기 위한 PI-3 키나제 억제제(예를 들면, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물, 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제)를 2선 치료제와 병용하는 사용 방법을 제공한다.
몇몇 양태에서, 섬유성 증후군(예를 들면, 폐 섬유증)을 치료하기 위한 보르트만닌 유사체 또는 대사물질을 2선 치료제와 병용하는 사용 방법을 제공한다.
2선 치료제의 예로는 면역 억제제, 예를 들면 코티코스테로이드(예를 들면, 프레드니손, 덱사메타손, 트리암시놀론 또는 임의의 다른 코티코스테로이드) 등, 감마-인터페론, 혈청 아밀로이드 P, 사이클로포스파미드, 아자티오프린, 메토트렉세이트, 페니실라민, 사이클로스포린 등을 들 수 있지만, 이들로 제한되지는 않는다. 다른 2선 치료제로는 콜히친, 마이코페놀레이트 모페틸, 페르페니돈 등을 들 수 있다. 몇몇 양태에서, 2선 치료제는 단백질 치료제(예를 들면, 항체)이다.
라파마이신(mTOR)의 포유동물 표적은 PI3K 경로에서 고도로 보존된 세포내 세린/트레오닌 키나제 및 주요 다운스트림 성분이다. 특정 연구는 PI3K-Akt-mTOR 경로가 폐에서의 EGFR 활성화에 의해 유도되는 섬유증 반응을 매개한다는 것을 보여준다. 따라서, 몇몇 양태에서, 본원에 기재된 섬유증의 치료 방법은 확립된 폐 섬유증 및/또는 본원에 기재된 임의의 다른 섬유성 병증의 예방, 지연된 진행, 역전 및/또는 부분 역전을 위해 소분자 EGFR 티로신 키나제 억제제(예를 들면, 게피티닙, 엘로티닙 등)와 PI-3 키나제 억제제와 병용하는 투여를 포함한다. 몇몇 양태에서, 본원에 기재된 섬유증의 치료 방법은 확립된 폐 섬유증 및/또는 본원에 기재된 임의의 다른 섬유성 병증의 예방, 지연된 진행, 역전 및/또는 부분 역전을 위해 라파마이신, 템시롤리무스, 데포로리무스, 에버롤리무스, BEZ235 등(이들로 제한되지는 않음)을 비롯한 소분자 mTor 억제제의 투여를 포함한다.
약학 조성물/제제
몇몇 양태에서, 본원에 기재된 화합물을 약학 조성물로 제제화할 수 있다. 구체적인 양태에서, 약학적으로 사용될 수 있는 제제로 활성 화합물의 가공을 촉진하는 보조제 및 부형제를 포함하는 약학 조성물을 1종 이상의 생리학적으로 허용되는 담체를 사용하여 종래 방식으로 제제화한다. 적절한 제제는 선택된 투여 경로에 따라 달라진다. 임의의 약학적으로 허용되는 기술, 담체, 및 부형제를 본원에 기재된 약학 조성물을 제제화하기에 적합하도록 사용한다: Remington: The Science and Practice of Pharmacy, Nineteenth Ed(Easton, Pa.: Mack Publishing Company, 1995); Hoover, John E., Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania 1975; Liberman, H.A. 및 Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; and Pharmaceutical Dosage Forms and Drug Delivery Systems, Seventh Ed. (Lippincott Williams & Wilkins 1999).
본원은 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체 및 약학적으로 허용되는 희석제(들), 부형제(들), 또는 담체(들)을 포함하는 약학 조성물을 제공한다. 특정한 양태에서, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체가 병용 치료에서처럼 다른 활성 성분과 혼합되는 약학 조성물로서 본원에 기재된 화합물을 투여한다. 본원은 하기 병용 치료 섹션 및 본 공개내용 전체에 걸쳐 기재된 활성 물질의 모든 조합을 포함한다. 구체적인 양태에서, 약학 조성물은 1종 이상의 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물을 포함한다.
본원에서 사용되는 약학 조성물은 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체와 다른 화학 성분, 예컨대 담체, 안정화제, 희석제, 분산제, 현탁제, 점증제 및/또는 부형제의 혼합물을 의미한다. 특정한 양태에서, 약학 조성물은 유기체에의 화합물의 투여를 수월하게 한다. 몇몇 양태에서, 본원에서 제공된 치료 또는 사용 방법을 실행시, 치료학적 유효량의 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 치료하고자 하는 질환 또는 병증을 갖는 포유동물에게 약학 조성물로 투여한다. 구체적인 양태에서, 포유동물은 인간이다. 특정한 양태에서, 치료학적 유효량은 질환의 중증도, 피험체의 연령 및 상대적인 건강, 사용되는 화합물의 효능 및 다른 인자에 따라 달라진다. 본원에 기재된 화합물을 단독으로 또는 혼합물의 성분으로서 1종 이상의 치료제와 병용하여 사용한다.
상기 조성물에서, 약리학적 활성 화합물은 "활성 성분"으로 공지되어 있다. 조성물 제조시, 활성 성분을 일반적으로 담체와 혼합하거나, 담체에 의해 희석하거나, 캡슐, 샤세, 페이퍼 또는 다른 컨테이너의 형태일 수 있는 담체 내에 포함시킬 수 있다. 담체를 희석제로서 제공할 때, 이것은 활성 성분에 대한 매질의 부형제인 비히클로서 작용하는 고체, 반고체, 또는 액체 물질일 수 있다. 따라서, 상기 조성물은 정제, 환제, 분말, 로렌지, 샤세, 카세, 엘릭시르, 에멀션, 용액, 시럽, 현탁액, 연질 및 경질 젤라틴 캡슐, 무균 주사액, 및 무균 팩킹 분말 형태일 수 있다.
적합한 담체, 부형제, 및 희석제의 몇몇 예로는 락토스, 덱스트로스, 수크로스, 소르비톨, 만니톨, 전분, 아카시아 검, 칼슘 포스페이트 알기네이트, 규산칼슘, 미세결정질 셀룰로스, 폴리비닐피롤리돈, 셀룰로스, 트라가칸스, 젤라틴, 시럽, 메틸 셀룰로스, 메틸하이드록시벤조에이트, 프로필하이드록시벤조에이트, 탈크, 스테아르산 마그네슘, 물, 및 광유를 들 수 있다. 상기 조성물은 추가로 활택제, 습윤제, 유화제 및 현탁제, 보존제, 감미제 또는 항료를 포함할 수 있다. 상기 조성물을 당해 분야에서 널리 공지된 절차를 이용하여 환자에게 투여 후 활성 성분의 신속, 지속, 또는 지연 방출을 제공하도록 제제화할 수 있다.
적합한 투여 경로로는 경구, 정맥내, 직장, 에어로졸, 비경구, 안내, 폐, 경점막, 경피, 질내, 귀내, 비강, 및 국소 투여를 들 수 있지만, 이들로 제한되지는 않는다. 또한, 오로지 예의 방식으로, 비경구 전달로는 근육내, 피하, 정맥내, 수질내 주사, 및 척추강내, 직접 심실내, 복강내, 림프내, 및 비강 주사를 들 수 있지만, 이들로 제한되지는 않는다.
특정한 양태에서, 본원에 기재된 화합물을 종종 데폿 제제 또는 지속 방출 제제로, 예를 들면 장기로 바로 화합물의 주사를 통해 전신 방식보다는 국소로 투여한다.
섬유증(예를 들면, 폐 섬유증)의 치료를 위한 활성 화합물의 억제량의 국소 전달을 섬유증 자리에 또는 그 근처에 화합물을 투여하는 각종 기술에 의할 수 있다. 국소 전달 기술의 예는 제한하는 것으로 이해되지 않고 이용 가능한 기술을 예시하는 것이다. 예로는 국소 전달 카테터, 자리 특이적 담체, 임플란트, 직접 주사, 또는 직접 도포를 들 수 있다. 카테터에 의한 국소 전달은 직접 섬유증 자리에의 치료제의 투여를 허용한다.
임플란트에 의한 국소 전달은 치료제를 포함하는 기질의 섬유증 장기(예를 들면, 폐(들))로의 수술 배치를 설명한다. 이식된 기질은 확산, 화학 반응, 또는 용매 활성제에 의해 치료제를 방출한다.
다른 예는 중합체 내막 밀봉에 의한 치료제 전달이다. 이 기술은 루멘의 내부 표면에 중합체 임플란트를 적용하기 위해 카테터를 이용한다. 생분해성 중합체 임플란트에 도입된 치료제는 이에 의해 수술 자리에서 방출한다. 이것은 PCT WO 제90/01969호(Schindler, 1989년 8월 23일)에 기재되어 있다.
임플란트에 의한 국소 전달의 추가 예는 부위로의 소포 또는 마이크로미립자의 직접 주사에 의한 것이다. 이러한 마이크로미립자는 단백질, 지질, 탄수화물 또는 합성 중합체와 같은 물질로 이루어질 수 있다. 이러한 마이크로미립자는 코팅으로서 마이크로입자에 걸쳐 또는 마이크로입자 위로 통합된 치료제를 갖는다. 마이크로미립자가 통합된 전달 시스템은 문헌[Lange, Science 249:1527-1533 (1990); Mathiowitz et al, J. App. Poly. Sci., 26:809(1981)]에 기재되어 있다.
자리 특이적 담체에 의한 국소 전달은 약물을 표적 섬유증 장기(예를 들면, 폐(들))로 지시하는 담체에 대한 치료제의 부착을 기술한다. 이러한 전달 기술의 예로는 담체, 예컨대 단백질 리간드 또는 단일클론 항체의 사용을 포함한다.
몇몇 양태에서, 장기간 작용 제제를 이식(예를 들면, 피하 또는 근육내) 또는 근육내 주사에 의해 투여한다. 더욱이, 다른 양태에서, 약물은 표적 약물 전달 시스템, 예를 들면 장기 특이적 항체로 코팅된 리포솜에서 전달된다. 이러한 양태에서, 리포솜은 장기로 표적화되고 장기에 의해 선택적으로 흡수된다. 또 다른 양태에서, 본원에 기재된 화합물은 신속 방출 제제 형태, 사방 제제 형태, 또는 중간 방출 제제 형태로 제공된다. 또 다른 양태에서, 본원에 기재된 화합물을 국소 투여한다.
일 양태에서, 1종 이상의 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 수용액 중에 제제화한다. 구체적인 양태에서, 수용액은, 오로지 예의 방식으로, 생리학적 상용성 완충제, 예컨대 행크액, 링커액, 또는 생리학적 식염 완충제로부터 선택된다. 다른 양태에서, 1종 이상의 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 경점막 투여를 위해 제제화한다. 구체적인 양태에서, 경점막 제제는 침투하고자 하는 장벽에 적절한 침투제를 포함한다. 본원에 기재된 화합물이 다른 비경구 주사에 대해 제제화되는 또 다른 양태에서, 적절한 제제는 수성 또는 비수성 용액을 포함한다. 구체적인 양태에서, 이러한 용액은 생리학적 상용성 완충제 및/또는 부형제를 포함한다.
다른 양태에서, 본원에 기재된 화합물을 경구 투여를 위해 제제화한다. 활성 화합물을, 예를 들면 약학적으로 허용되는 담체 또는 부형제와 조합하여 본원에 기재된 화합물, 예컨대 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 제제화한다. 다양한 양태에서, 본원에 기재된 화합물을, 오로지 예의 방식으로, 정제, 분말, 환제, 드라제, 캡슐, 액체, 겔, 시럽, 엘릭시르, 슬러리, 현탁액 등을 비롯한 경구 제형으로 제제화한다.
경구 투여를 위해, 화합물을 담체 및 희석제와 혼합하거나, 정제로 성형하거나, 젤라틴 캡슐에 봉합할 수 있다.
특정한 양태에서, 1종 이상의 고체 부형제를 본원에 기재된 1종 이상의 화합물과 혼합하고, 임의로 얻은 혼합물을 분쇄하고, 적합한 보조제 첨가 후 과립 혼합물을 가공하여, 원하는 경우, 정제 또는 드라제 코어를 얻음으로써 경구 용도를 위한 약학 제제를 얻는다. 적합한 부형제는 특히 충전제, 예컨대 락토스, 수크로스, 만니톨, 또는 소르비톨 등을 비롯한 당; 예를 들면 옥수수 전분, 밀 전분, 쌀 전분, 감자 전분, 젤라틴, 검 트라가칸스, 메틸셀룰로스, 미세결정질 셀룰로스, 하이드록시프로필메틸셀룰로스, 나트륨 카르복시메틸셀룰로스 등을 비롯한 셀룰로스 제제; 또는 다른 것들, 예컨대: 폴리비닐피롤리돈(PVP 또는 포비돈) 또는 인산칼슘이다. 구체적인 양태에서, 붕괴제를 임의로 첨가한다. 붕괴제로는, 오로지 예의 방식으로, 가교 결합된 크로스카르벨로스 나트륨, 폴리비닐피롤리돈, 한천, 또는 알긴산 또는 이들의 염, 예컨대 알긴산나트륨을 들 수 있다.
일 양태에서, 1종 이상의 적합한 코팅제를 갖는 드라제 코어 및 정제와 같은 제형을 제공한다. 구체적인 양태에서, 코팅 제형에 농축 당 용액을 사용한다. 당 용액은 임의로 추가의 성분, 예컨대 오로지 예의 방식으로, 아라비아 검, 탈크, 폴리비닐피롤리돈, 카보폴 겔, 폴리에틸렌 글리콜 및/또는 이산화티탄, 락커액, 및 적합한 유기 용매 또는 용매 혼합물을 포함한다. 염료 및/또는 안료를 또한 확인 목적을 위해 코팅에 임의로 첨가한다. 추가로, 상이한 활성 화합물 용량 조합을 규명하기 위해 염료 및/또는 안료를 임의로 사용한다.
특정한 양태에서, 치료학적 유효량의 본원에 기재된 1종 이상의 화합물을 다른 경구 제형으로 제제화한다. 경구 제형으로는 젤라틴으로 제조된 푸쉬-핏 캡슐, 및 젤라틴 및 가소제, 예컨대 글리세롤 또는 소르비톨로 제조된 연질 밀봉 캡슐을 포함한다. 구체적인 양태에서, 푸쉬-핏 캡슐은 활성 성분을 1종 이상의 충전제와 혼합하여 포함한다. 충전제로는, 오로지 예의 방식으로, 락토스, 결합제, 예컨대 전분 및/또는 활택제, 예컨대 탈크 또는 스테아르산 마그네슘 및, 임의로, 안정화제를 들 수 있다. 다른 양태에서, 연질 캡슐은 적합한 액체 중에 용해된 또는 현탁된 1종 이상의 활성 화합물을 포함한다. 적합한 액체로는, 오로지 예의 방식으로, 1종 이상의 지방유, 액체 파라핀, 또는 액체 폴리에틸렌 글리콜을 들 수 있다. 또한, 안정화제를 임의로 첨가한다.
다른 양태에서, 치료학적 유효량의 본원에 기재된 1종 이상의 화합물을 협측 또는 설하 투여를 위해 제제화한다. 협측 또는 설하 투여에 적합한 제제로는, 오로지 예의 방식으로, 정제, 로렌지, 또는 겔을 들 수 있다.
또 다른 양태에서, 본원에 기재된 화합물을 볼루스 주사 또는 연속 주입에 적합한 제제를 비롯하여 비경구 주사를 위해 제제화한다. 대안적으로, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 10% 수성 포도당액, 등장 식염수, 무균수 등과 같은 액체 중에 용해하고, 정맥내 또는 주사로 투여할 수 있다.
구체적인 양태에서, 주사용 제제는 단위 제형(예를 들면, 앰플) 또는 다용량 컨테이너로 제시한다. 보존제를 임의로 주사 제제에 첨가한다. 또 다른 양태에서, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체의 약학 조성물이 유성 또는 수성 비히클 중의 무균 현탁액, 용액 또는 에멀션으로서 비경구 주사에 적합한 형태로 제제화한다. 비경구 주사 제제는 임의로 제제화 물질, 예컨대 현탁제, 안정화제 및/또는 분산제를 포함한다. 구체적인 양태에서, 비경구 투여용 약학 제제로는 수용성 형태의 활성 화합물의 수용액을 포함한다. 추가의 양태에서, 활성 화합물의 현탁액을 적절한 유성 주사 현탁액으로서 제조한다. 본원에 기재된 약학 조성물에 사용하기 위한 적합한 친유성 용매 또는 비히클로는, 오로지 예의 방식으로, 지방유, 예컨대 세서미유, 또는 합성 지방산 에스테르, 예컨대 에틸 올레이트 또는 트리글리세라이드, 또는 리포솜을 들 수 있다. 특정한 구체적인 양태에서, 수성 주사 현탁액은 현탁액의 점도를 증가시키는 물질, 예컨대 나트륨 카르복시메틸 셀룰로스, 소르비톨, 또는 덱스트란을 포함한다. 임의로, 현탁액은 적합한 안정화제 또는 화합물의 용해도를 증가시켜 고농축 용액이 제조되게 하는 물질을 포함한다. 대안적으로, 다른 양태에서, 활성 성분은 사용 전 적합한 비히클, 예를 들면 무균 발열원 비함유 물로 용시제조하기 위한 분말 형태이다.
일 양태에서, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 본원에 기재되거나 당해 분야에 공지된 바대로 비경구 주사용 용액으로서 제조하고 자동 분사기로 투여한다. 예컨대 미국 특허 제4,031,893호, 제5,358,489호; 제5,540,664호; 제5,665,071호, 제5,695,472호 및 WO 제2005/087297호(이들 각각 그 공개내용에 대해 참조문헌으로 본원에 포함됨)에 개시된 것과 같은 자동 분사기가 공지되어 있다. 일반적으로, 모든 자동 분사기는 주사하고자 하는 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체의 용액의 용적을 포함한다. 일반적으로, 자동 분사기는 약물을 전달하기 위해 바늘침과 유체 소통하는 용액을 보유하기 위한 저장소, 및 바늘침을 자동으로 배치하고, 바늘침을 환자에게 삽입하고 용량을 환자에게 전달하기 위한 메커니즘을 포함한다. 예시적인 분사기는 용액 1 ㎖당 약 0.5 ㎎ 내지 10 ㎎의 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체 농도로 약 0.3 ㎖의 용액을 제공한다. 각각의 분사기는 오직 1 용량의 화합물을 전달할 수 있다.
또 다른 양태에서, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 국소 투여한다. 본원에 기재된 화합물을 각종 국소 투여 가능한 조성물, 예컨대 용액, 현탁액, 로션, 겔, 페이스트, 의학용 스틱, 밤, 크림 또는 연고로 제제화한다. 이러한 약학 조성물은 임의로 가용화제, 안정화제, 긴장성 강화제, 완충제 및 보존제를 포함한다.
또 다른 양태에서, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 경피 투여를 위해 제제화한다. 구체적인 양태에서, 경피 제제는 경피 전달 장치 및 경피 전달 패치를 이용하고/하거나 친유성 에멀션 또는 완충 수용액일 수 있고/있거나, 중합체 또는 접착제 중에 용해되고/되거나 분산될 수 있다. 다양한 양태에서, 이러한 패치는 연속 박동을 위해, 또는 약학 물질의 요구 전달에 따라 구축한다. 추가의 양태에서, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체의 경피 전달을 이온영동 패치 등에 의해 수행한다. 특정한 양태에서, 경피 패치는 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체의 조절된 전달을 제공한다. 구체적인 양태에서, 속도 조절 막을 사용함으로써 또는 화합물을 중합체 매트릭스 또는 겔 내에 포획함으로써 흡수율을 늦춘다. 대안적인 양태에서, 흡수를 증가시키기 위해 흡수 증진제를 사용한다. 흡수 증진제 또는 담체는 피부를 통한 통과를 돕는 흡수 가능한 약학적으로 허용되는 용매를 포함한다. 예를 들면, 일 양태에서, 경피 장치는 백킹 부재, 화합물을 임의로 담체와 포함하는 저장소, 임의로 연장된 시간에 걸쳐 조절되고 예정된 속도로 숙주의 피부에 화합물을 전달하기 위한 속도 조절 장벽, 및 장치를 피부에 고정하기 위한 수단을 포함하는 붕대 형태이다.
본원에 기재된 경피 제제를 당해 분야에서 기재된 각종 장치를 사용하여 투여할 수 있다. 예를 들면, 이러한 장치의 예로는 미국 특허 제3,598,122호, 제3,598,123호, 제3,710,795호, 제3,731,683호, 제3,742,951호, 제3,814,097호, 제3,921,636호, 제3,972,995호, 제3,993,072호, 제3,993,073호, 제3,996,934호, 제4,031,894호, 제4,060,084호, 제4,069,307호, 제4,077,407호, 제4,201,211호, 제4,230,105호, 제4,292,299호, 제4,292,303호, 제5,336,168호, 제5,665,378호, 제5,837,280호, 제5,869,090호, 제6,923,983호, 제6,929,801호 및 제6,946,144호를 들 수 있지만, 이들로 제한되지는 않는다.
본원에 기재된 경피 제형에 당해 분야에서 통상적인 특정한 약학적으로 허용되는 부형제가 혼입할 수 있다. 일 양태에서, 본원에 기재된 경피 제제는 (1) 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체의 제제; (2) 침투 증진제; 및 (3) 수성 면역보강제의 적어도 3개의 구성성분을 포함한다. 또한, 경피 제제는 겔화제, 크림 및 연고 기제 등(이들로 제한되지는 않음)과 같은 추가의 성분을 포함할 수 있다. 몇몇 양태에서, 경피 제제는 흡수를 증진시키고 피부로부터의 경피 제제의 제거를 방지하기 위한 직조 또는 부직 백킹 물질을 더 포함한다. 다른 양태에서, 본원에 기재된 경피 제제는 피부로의 확산을 촉진하기 위한 포화 또는 과포화 상태를 유지한다.
다른 양태에서, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 흡입에 의한 투여를 위해 제제화한다. 흡입에 의한 투여에 적합한 다양한 형태로는 에어로졸, 미스트 또는 분말을 들 수 있지만, 이들로 제한되지는 않는다. 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체의 약학 조성물을 편리하게 적합한 압축가스(예를 들면, 디클로로디플루오로메탄, 트리클로로플루오로메탄, 디클로로테트라플루오로에탄, 이산화탄소 또는 다른 적합한 가스)의 사용으로 가압 팩 또는 분무기로부터 에어로졸 스프레이 제시의 형태로 전달한다. 구체적인 양태에서, 계량된 양을 전달하기 위한 밸브를 제공함으로써 가압 에어로졸의 용량 단위를 결정한다. 특정한 양태에서, 화합물의 분말 혼합물 및 적합한 분말 기제, 예컨대 락토스 또는 전분을 포함하는, 흡입기 또는 취입기에 사용하기 위한, 예컨대, 오로지 예의 방식으로, 젤라틴의 캡슐 및 카트리지를 제제화한다.
비강 제제가 당해 분야에서 공지되어 있고, 예를 들면 미국 특허 제4,476,116호, 제5,116,817호 및 제6,391,452호(각각 구체적으로 참조문헌으로 포함됨)에 기재되어 있다. 벤질 알콜 또는 다른 적합한 보존제, 불화탄소 및/또는 당해 분야에서 공지된 다른 가용화제 또는 분산제를 사용하여 상기 기술 및 당해 분야에서 널리 공지된 다른 기술에 따라 제조된 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 포함하는 제제를 식염수 중 용액으로서 제조한다. 예를 들면, 문헌[Ansel, H. C. et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, Sixth Ed. (1995)]을 참조한다. 바람직하게는 적합한 비독성 약학적으로 허용되는 성분에 의해 이러한 조성물 및 제제를 제조한다. 이러한 성분을 자료, 예컨대 당해 분야에서 표준 문헌[REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY, 21st edition, 2005]에서 확인한다. 적합한 담체의 선택은 원하는 비강 제형, 예를 들면 용액, 현탁액, 연고, 또는 겔의 정확한 성질에 매우 달라진다. 비강 제형은 일반적으로 활성 성분 이외에 다량의 물을 포함한다. 소량의 다른 성분, 예컨대 pH 조정제, 유화제 또는 분산제, 보존제, 계면활성제, 겔화제, 또는 완충제 및 다른 안정화제 및 가용화제가 또한 존재할 수 있다. 바람직하게는, 비강 제형은 비강 분비물과 등장성이다.
흡입에 의한 투여를 위해, 본원에 기재된 화합물은 에어로졸, 미스트 또는 분말 형태일 수 있다. 본원에 기재된 약학 조성물을 편리하게 적합한 압축가스, 예를 들면 디클로로디플루오로메탄, 트리클로로플루오로메탄, 디클로로테트라플루오로에탄, 이산화탄소 또는 다른 적합한 가스의 사용으로 가압 팩 또는 분무기로부터 에어로졸 스프레이 제시의 형태로 전달한다. 가압 에어로졸의 경우에, 계량된 양을 전달하기 위한 밸브를 제공함으로써 가압 에어로졸의 용량 단위를 결정한다. 본원에 기재된 화합물의 분말 혼합물 및 적합한 분말 기제, 예컨대 락토스 또는 전분을 포함하는, 흡입기 또는 취입기에 사용하기 위한, 예컨대, 오로지 예의 방식으로, 젤라틴의 캡슐 및 카트리지를 제제화할 수 있다.
또 다른 양태에서, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 종래 좌제 기제, 예컨대 코코아 버터 또는 다른 글리세라이드, 및 합성 중합체, 예컨대 폴리비닐피롤리돈, PEG 등을 포함하는 직장 조성물, 예컨대 관장제, 직장 겔, 직장 폼, 직장 에어로졸, 좌제, 젤리 좌제, 또는 보유 관장제로 제제화한다. 상기 조성물의 좌제 형태에서, 임의로 코코아 버터와 조합된 지방산 글리세라이드의 혼합물(이들로 제한되지는 않음)을 비롯한 저융점 왁스를 우선 용융한다.
특정한 양태에서, 약학적으로 사용할 수 있는 제제로의 활성 화합물의 가공을 촉진하는 부형제 및 보조제를 포함하는 1종 이상의 생리학적으로 허용되는 담체를 사용하여 임의의 종래 방식으로 약학 조성물을 제제화한다. 적절한 제제는 선택된 투여 경로에 따라 달라진다. 임의의 약학적으로 허용되는 기술, 담체, 및 부형제를 임의로 당해 분야에서 적합하고 이해되는 바대로 사용한다. 종래 방식으로, 예컨대, 오로지 예의 방식으로, 종래 혼합, 용해, 과립화, 드라제 제조, 가루화, 유화, 캡슐화, 포획 또는 압축 공정에 의해 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 포함하는 약학 조성물을 제조할 수 있다.
약학 조성물은 1종 이상의 약학적으로 허용되는 담체, 희석제 또는 부형제 및 활성 성분으로서의 1종 이상의 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 포함한다. 활성 성분은 유리 산 또는 유리 염기 형태, 또는 약학적으로 허용되는 염 형태이다. 또한, 본원에 기재된 방법 및 약학 조성물은 N-옥사이드, (다형으로도 공지된) 결정 형태, 및 동일한 유형의 활성을 갖는 이러한 화합물의 활성 대사물질의 용도를 포함한다. 본원에 기재된 화합물의 모든 호변이체는 본원에서 제시되는 화합물의 범위 내에 포함된다. 추가로, 본원에 기재된 화합물은 약학적으로 허용되는 용매, 예컨대 물, 에탄올 등과의 비용매화 및 용매화 형태를 포함한다. 본원에서 제시되는 화합물의 용매화 형태는 또한 본원에서 개시되어 있는 것으로 생각된다. 또한, 약학 조성물은 임의로 다른 의학적 또는 약학 물질, 담체, 면역보강제, 예컨대 보존제, 안정화제, 습윤제 또는 유화제, 용액 프로모터, 삼투압 조절 염, 완충제 및/또는 다른 치료학적으로 귀중한 물질을 포함한다.
본원에 기재된 화합물을 포함하는 조성물의 제조 방법은 그 화합물을 1종 이상의 불활성의 약학적으로 허용되는 부형제 또는 담체와 제제화하여 고체, 반고체 또는 액체를 형성하는 것을 포함한다. 고체 조성물로는 분말, 정제, 분산성 산제, 캡슐, 카셰, 및 좌제를 들 수 있지만, 이들로 제한되지는 않는다. 액체 조성물은 화합물이 용해된 용액, 화합물 포함 에멀션, 또는 본원에서 개시된 화합물을 포함하는 리포솜, 미셀, 또는 나노입자를 포함하는 용액을 포함한다. 반고체 조성물로는 겔, 현탁액 및 크림을 들 수 있지만, 이들로 제한되지는 않는다. 본원에 기재된 약학 조성물의 형태로는 액체 용액 또는 현탁액, 사용 전 액체 중 용액 또는 현탁액에, 또는 에멀션으로서 적합한 고체 형태를 포함한다. 이러한 조성물은 또한 임의로 소량의 비독성 보조 물질, 예컨대 습윤제 또는 유화제, pH 완충제 및 기타 등등을 포함한다.
몇몇 양태에서, 1종 이상의 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 포함하는 약학 조성물은 예시적으로 상기 물질들이 용액 중, 현탁액 중 또는 둘 다에 존재하는 액체 형태를 취한다. 전형적으로 상기 조성물을 용액 또는 현탁액으로서 투여할 때, 그 물질의 제1 부분은 용액으로 존재하고 그 물질의 제2 부분은 액체 매트릭스 중의 현탁액 중 미립자 형태로 존재한다. 몇몇 양태에서, 액체 조성물은 겔 제제를 포함한다. 다른 양태에서, 액체 조성물은 수성이다.
특정한 양태에서, 약학 수성 현탁액은 현탁제로서 1종 이상의 중합체를 포함한다. 상기 중합체는 수용성 중합체, 예컨대 셀룰로스 중합체, 예를 들면 하이드록시프로필 메틸셀룰로스, 및 수불용성 중합체, 예컨대 가교 결합된 카르복실 함유 중합체를 포함한다. 본원에 기재된 특정한 약학 조성물은 예를 들면 카르복시메틸셀룰로스, 카보머(아크릴산 중합체), 폴리(메틸메타크릴레이트), 폴리아크릴아미드, 폴리카보필, 아크릴산/부틸 아크릴레이트 공중합체, 알긴산나트륨 및 덱스트란으로부터 선택되는 점막 부착성 중합체를 포함한다.
약학 조성물은 또한 임의로 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체의 용해도의 돕는 가용화제를 포함한다. "가용화제"란 용어는 일반적으로 물질의 미셀 용액 또는 참용액을 형성시키는 물질을 포함한다. 특정한 허용되는 비이온성 계면활성제, 예를 들면 폴리소르베이트 80은 가용화제로서 안과학적으로 허용되는 글리콜, 폴리글리콜, 예를 들면 폴리에틸렌 글리콜 400, 및 글리콜 에테르만큼 유용하다.
더욱이, 약학 조성물은 임의로 아세트산, 붕산, 시트르산, 락트산, 인산 및 염산; 염기, 예컨대 수산화나트륨, 인산나트륨, 붕산나트륨, 시트르산 나트륨, 아세트산 나트륨, 락트산 나트륨 및 트리스-하이드록시메틸아미노메탄; 및 완충제, 예컨대 시트레이트/덱스트로스, 탄산수소나트륨 및 염화암모늄과 같은 산을 비롯한 1종 이상의 pH 조정제 또는 완충제를 포함한다. 이러한 산, 염기 및 완충제는 조성물의 pH를 허용되는 범위로 유지하는 데 필요한 양으로 포함된다.
추가로, 약학 조성물은 임의로 조성물의 삼투압을 허용되는 범위로 하는 데 필요한 양으로 1종 이상의 염을 포함한다. 이러한 염으로는 나트륨, 칼륨 또는 암모늄 양이온 및 클로라이드, 시트레이트, 아스코르베이트, 보레이트, 포스페이트, 비카보네이트, 설페이트, 티오설페이트 또는 비설파이트 음이온을 갖는 것을 들 수 있고; 적합한 염으로는 염화나트륨, 염화칼륨, 나트륨 티오설페이트, 나트륨 비설파이트 및 황산암모늄을 들 수 있다.
다른 약학 조성물은 임의로 미생물 활성을 억제하는 1종 이상의 보존제를 포함한다. 적합한 보존제로는 수은 함유 물질, 예컨대 메르펜 및 티오메르살; 안정화된 이산화염소; 및 4급 암모늄 화합물, 예컨대 벤잘코늄 클로라이드, 세틸트리메틸암모늄 브로마이드 및 세틸피리디늄 클로라이드를 들 수 있다.
또 다른 약학 조성물은 물리적 안정성을 증진시키기 위해 또는 다른 목적을 위해 1종 이상의 계면활성제를 포함한다. 적합한 비이온성 계면활성제로는 폴리옥시에틸렌 지방산 글리세라이드 및 식물성 오일, 예를 들면 폴리옥시에틸렌(60) 수소화 캐스터유; 및 폴리옥시에틸렌 알킬에테르 및 알킬페닐 에테르, 예를 들면 옥토시놀 10, 옥토시놀 40을 들 수 있다.
또 다른 약학 조성물은 필요한 바대로 화학 안정성을 증진시키기 위해 1종 이상의 항산화제를 포함할 수 있다. 적합한 항산화제로는, 오로지 예의 방식으로, 아스코르브산 및 나트륨 메타비설파이트를 들 수 있다.
특정한 양태에서, 약학 수성 현탁액 조성물은 단일 용량 비재밀폐 가능한 컨테이너에 팩킹할 수 있다. 대안적으로, 다용량 재밀폐 가능한 컨테이너를 사용하고, 이런 경우 조성물 중에 보존제가 포함되는 것이 통상적이다.
대안적인 양태에서, 소수성 약학 화합물을 위한 다른 전달 시스템을 사용한다. 리포솜 및 에멀션은 본원에서의 전달 비히클 또는 담체의 예이다. 특정한 양태에서, 유기 용매, 예컨대 N-메틸피롤리돈을 또한 사용한다. 추가의 양태에서, 치료제를 포함하는 고체 소수성 중합체의 서방 시스템, 예컨대 반투과성 매트릭스를 사용하여 본원에 기재된 화합물을 전달한다. 본원에서 다양한 서방 물질이 유용하다. 몇몇 양태에서, 서방 캡슐은 몇 시간 내지 24시간 이하 동안 화합물을 방출한다. 치료 시약의 화학 성질 및 생물학적 안정성에 따라, 단백질 안정화에 추가 전략을 이용할 수 있다.
특정한 양태에서, 본원에 기재된 제제는 1종 이상의 항산화제, 금속 킬레이트화제, 티올 함유 화합물 및/또는 다른 일반적인 안정화제를 포함한다. 이러한 안정화제의 예로는 (a) 약 0.5% 내지 약 2% w/v의 글리세롤, (b) 약 0.1% 내지 약 1% w/v의 메티오닌, (c) 약 0.1% 내지 약 2% w/v의 모노티오글리세롤, (d) 약 1 mM 내지 약 10 mM의 EDTA, (e) 약 0.01% 내지 약 2% w/v의 아스코르브산, (f) 0.003% 내지 약 0.02% w/v의 폴리소르베이트 80, (g) 0.001% 내지 약 0.05% w/v의 폴리소르베이트 20, (h) 아르기닌, (i) 헤파린, (j) 덱스트란 설페이트, (k) 사이클로덱스트린, (l) 펜토산 폴리설페이트 및 다른 헤파리노이드, (m) 2가 양이온, 예컨대 마그네슘 및 아연; 또는 (n) 이들의 조합을 들 수 있지만, 이들로 제한되지는 않는다.
투약 방법 및 치료 요법
일 양태에서, 섬유성 병증의 치료를 위한 의약의 제조에서 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 사용한다. 또한, 치료를 필요로 하는 피험체에서 본원에 기재된 임의의 질환 또는 병증을 치료하는 방법은 1종 이상의 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체, 또는 이의 약학적으로 허용되는 염, 약학적으로 활성 대사물질, 약학적으로 허용되는 프로드럭, 또는 약학적으로 허용되는 용매화물을 포함하는 약학 조성물을 치료학적 유효량으로 상기 피험체에게 투여하는 것을 포함한다.
특정한 양태에서, 본원에 기재된 화합물(들)을 포함하는 조성물을 예방적 및/또는 치료학적 치료에 투여한다. 특정한 치료 용도에서, 질환 또는 병증의 증상을 치유하거나 적어도 부분적으로 정지시키기에 충분한 양으로 질환 또는 병증을 이미 앓고 있는 환자에게 상기 조성물을 투여한다. 이러한 용도에 효과적인 양은 질환 또는 병증의 중증도 및 과정, 선행 치료, 환자의 건강 상태, 체중, 및 약물에 대한 반응, 및 주치의의 판단에 따라 달라진다. 용량 상승 임상 실험(이들로 제한되지는 않음)을 비롯한 방법에 의해 치료학적 유효량을 임의로 결정한다.
예방 용도에서, 본원에 기재된 화합물을 포함하는 조성물을 특정한 질환, 질병 또는 병증에 감수성이거나 아니면 이의 위험이 있는 환자에게 투여한다. 이 양을 "예방적 유효량 또는 용량"이라 정의한다. 이러한 사용에서, 정확한 양은 또한 환자의 건강 상태, 체중 등에 따라 달라진다. 환자에 사용할 때, 이러한 용도를 위한 유효량은 질환, 질병 또는 병증의 중증도 및 과정, 선행 치료, 환자의 건강 상태 및 약물에 대한 반응, 및 주치의의 판단에 따라 달라진다.
환자의 병증이 개선되지 않는 특정한 양태에서, 의사의 결정에 따라 만성으로, 즉 환자의 질환 또는 병증의 증상을 경감하거나 또는 그렇지 않으면 조절 또는 제한하기 위해 환자의 수명 동안을 비롯하여 연장된 시간 동안 화합물을 투여한다.
환자의 상태가 개선되지 않는 특정한 양태에서, 투여되는 약물의 용량을 특정 시간(즉, "약물 휴지") 동안 일시적으로 감소시키거나 일시적으로 현탁시킨다. 구체적인 양태에서, 약물 휴지 기간은, 오로지 예의 방식으로, 2일, 3일, 4일, 5일, 6일, 7일, 10일, 12일, 15일, 20일, 28일, 35일, 50일, 70일, 100일, 120일, 150일, 180일, 200일, 250일, 280일, 300일, 320일, 350일 및 365일을 비롯한 2일 내지 1년이다. 약물 휴지 동안의 용량 감소는, 오로지 예의 방식으로, 10%~100%, 예컨대 오로지 예의 방식으로 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 및 100%이다.
환자의 병증 개선이 발생하자마자, 필요한 경우 유지 용량을 투여한다. 이후, 구체적인 양태에서, 투여의 용량 또는 빈도, 또는 둘 다를, 증상의 함수로서, 개선된 질환, 질병 또는 병증이 유지되는 수준으로 감소시킨다. 그러나, 특정한 양태에서, 환자는 임의의 증상 재발시 장기간 기준으로 간헐 치료를 요한다.
일정 양에 해당하는 소정 물질의 양은 특정한 화합물, 질환 조건 및 이의 중증도, 치료를 필요로 하는 피험체 또는 숙주의 정체(예를 들면, 체중, 성병)와 같은 인자에 따라 변할 수 있지만, 그럼에도 불구하고, 예를 들면 투여되는 특정한 물질, 투여 경로, 치료되는 병증, 및 치료되는 피험체 또는 숙주를 비롯한 사례를 둘러싼 특정한 상황에 따라 결정할 수 있다. 일반적으로, 그러나, 성인 인간 치료에 사용되는 용량은 전형적으로 1일 0.02 ㎎~5000 ㎎, 바람직하게는 1일 1~1500 ㎎ 범위이다. 일 양태에서, 원하는 용량을 편리하게 단일 용량 또는 동시에(또는 짧은 시간 동안) 또는 적절한 간격으로 투여되는 분할 용량으로, 예를 들면 1일 2회, 3회, 4회 이상의 부분용량으로서 제시한다.
몇몇 양태에서, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 만성적으로 투여한다. 몇몇 양태에서, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 간헐적으로(예를 들면, 화합물이 투여되지 않거나 감소된 양으로 투여되는 시간 기간을 포함하는 약물 휴지) 투여한다. 몇몇 양태에서, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 (a) 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체의 1일 투여를 포함하는 제1 기간; 이어서 (b) 투여되는 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체의 1일 양의 용량 감소를 포함하는 제2 기간을 포함하는 사이클로 투여한다. 몇몇 양태에서, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체를 제2 기간 내에 투여하지 않는다. 몇몇 양태에서, 본원에 기재된 또는 당해 분야에 공지된 방법을 이용하여 제1 기간 및 제2 기간, 및 용량 양을 결정한다. 몇몇 경우에, 활성 물질의 약동학적 프로파일에 따라 약물 휴지 또는 용량 감소 기간이 적절하다.
특정한 양태에서, 본원에 기재된 약학 조성물은 정확한 용량의 단일 투여에 적합한 단위 제형이다. 단위 제형에서, 상기 제제를 1종 이상의 화합물의 적절한 양을 포함하는 단위 용량으로 분할한다. 구체적인 양태에서, 단위 용량은 제제의 별개 양을 포함하는 팩키지 형태이다. 비제한적인 예로 팩키징된 정제 또는 캡슐, 및 바이알 또는 앰플 내 분말이 있다. 수성 현탁액 조성물을 임의로 단일 용량 비재밀봉 가능한 컨테이너 중에 팩키징한다. 대안적으로, 다용량 재밀봉 가능한 컨테이너를 사용하고, 이런 경우 조성물 중에 보존제가 포함되는 것이 통상적이다. 오로지 예의 방식으로, 비경구 주사용 제제는, 몇몇 양태에서, 첨가된 보존제와 함께 앰플(이것으로 제한되지는 않음)을 비롯한 단위 제형 중에, 또는 다용량 컨테이너 중에 제시된다.
일 양태에서, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체에 적절한 1일 용량은 체중당 약 0.001 내지 약 100 ㎎/㎏이다. 일 양태에서, 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물 또는 본원에 기재된 임의의 다른 PI-3 키나제 억제제 및/또는 보르트만닌 유사체에 적절한 1일 용량은 체중당 약 0.01 내지 약 10 ㎎/㎏이다. 몇몇 양태에서, 인간(이것으로 제한되지는 않음)을 비롯한 큰 포유동물에서의 표시된 1일 용량은 1일 4회 이하(이것으로 제한되지는 않음)를 비롯한 분할 용량으로 편리하게 투여되는 약 0.5 ㎎ 내지 약 1000 ㎎ 범위이다. 일 양태에서, 1일 용량을 연장 방출 형태로 투여한다. 특정한 양태에서, 경구 투여에 적합한 단위 제형은 약 1 내지 500 ㎎의 활성 성분을 포함한다. 다른 양태에서, 제형 중 활성 물질의 1일 용량 또는 양은 각각의 치료 섭생과 관련하여 여러 변수에 기초하여 본원에 기재된 범위보다 낮거나 높다. 다양한 양태에서, 1일 및 단위 용량을 사용되는 화합물의 활성, 치료하고자 하는 질환 또는 병증, 투여 방식, 각각의 피험체의 요구사항, 치료하고자 하는 질환 또는 병증의 중증도, 및 주치의의 판단(이들로 제한되지는 않음)을 비롯한 여러 변수에 따라 변경한다.
LD50(집단의 50%에 치명적인 용량) 및 ED50(집단의 용량 50%에서 치료학적으로 효과적인 용량)의 결정(이들로 제한되지는 않음)을 비롯하여 세포 배양 또는 실험 동물에서 표준 약학 절차에 의해 이러한 치료 요법의 독성 및 치료 효율을 결정한다. 독성과 치료 효과 간의 용량 비는 치료 지수이고 LD50과 ED50 간의 비율로서 표현해야 한다. 특정한 양태에서, 인간을 비롯한 포유동물에서 치료학적으로 효과적인 1일 용량 범위 및/또는 치료학적으로 효과적인 단위 용량 양을 제제화하는 데 세포 배양 분석 및 동물 연구로부터 얻은 데이터를 사용한다. 몇몇 양태에서, 본원에 기재된 화합물의 1일 용량 양은 최소 독성을 갖는 ED50을 포함하는 순환 농도의 범위 내에 있다. 특정한 양태에서, 1일 용량 범위 및/또는 단위 용량 양은 사용되는 제형 및 이용되는 투여 경로에 따라 이 범위 내에서 변한다.
사용되는 방법 및 물질을 설명하는 본 발명 및 양태는 하기 비제한적인 실시예를 참조하여 추가로 이해할 수 있다.
[실시예]
실시예
1
형질전환 마우스 및
PX
-866의 투여:
2.3 kb 랫트 Clara Cell Secretory Protein(CCSP), a.k.a. 세크레토글로빈, 패밀리 1A, 구성원 1(Scgblal) 유전자 프로모터의 조절 하에 리버스 테트라사이클린 반응성 트랜스액티베이터(rtTA)를 발현하는 CCSP-rtTA 액티베이터 마우스를 7카피의 테트라사이클린 오페론((TetO)7-cmv TGFα) + 최소 CMV 프로모터의 조절 하에 인간 TGFα cDNA를 포함하는 조건적 독시사이클린(Dox) 조절된 형질전환 마우스에 짝짓기시켰다. 동형접합성 CCSP-rtTA+/+ 마우스를 반접합성(TetO)7-cmv TGFα+/- 마우스에 짝짓기시킴으로써 단일 형질전환(CCSP-rtTA+/-) 및 혼합 형질전환 CCSP-rtTA+/-/(TetO)7-cmv TGFα+/- 마우스를 동일한 리터 내에서 제조하였다. FVB/NJ 근교계로부터 모든 마우스를 유도하였다. 마우스를 바이러스 비함유 견제로 유지시켰다. 모든 동물 프로토콜을 검토하고 신시내티 어린이 병원 연구 재단(Cincinnati Children's Hospital Research Foundation)의 동물실험 관련 위원회(Institutional Animal Use and Care Committee)에 의해 승인받았다. TGFα 발현을 유도하기 위해, Dox[Sigma(미주리주 세인트 루이스 소재)]를 0.5 ㎎/ml의 최종 농도의 식음수 중에 그리고 식품(62.5 ㎎/㎏) 중에 투여하였다. 물을 1주 3회 교체하였다. 마우스를 당해 분야에서 공지된 바대로 표현형 분석하였다.
PI3K 억제제 PX-866[ProIX Pharmaceuticals(미국 애리조나주 투스칸)]을 5% EtOH 중에 현탁시켜 5 ㎎/ml 스톡 용액을 만들었다. 투여 3시간 전, 우리로부터 식품 및 물을 제거하였다. 이후, 마우스를 마취시키고[이소플루란; Abbott Labs(미국 일리노이주 시카고)], 20 게이지 공급 카테터[Harvard Apparatus(미국 마이애미주 홀리스톤)]를 사용하여 경구영양법에 의해 무균 비히클 또는 약물(3 ㎎/㎏)을 투여하였다. 마우스를 4주 이하 동안 하루걸러 비히클 또는 PX-866으로 처리하였다. Dox 및 비히클 또는 PX-866 치료 1일 또는 4주 후 펜토바비탈 나트륨(65 ㎎/ml) 안락사 용액[Fort Dodge Animal Health(미국 아이오와주 포트다지)]으로 마우스를 죽였다.
웨스턴 블롯: 이미 기재된 바대로 폐 세포분쇄액에서 웨스턴 블롯 분석을 수행하였다. 블롯을 전체 및 인산화 Akt(Ser 473 및 Thr 308, 세포 신호 전달 기술)에 대해 항체로 항온처리하고 Phosphorlmager 소프트웨어 Imagequant 5.2[Molecular Dynamics(미국 캘리포니아주 써니베일)]에서 용적 적분 함수를 이용하여 정량화하였다.
폐 역학, 면역염색 및 전체 폐 콜라겐: 폐를 이미 기재된 바대로 팽창 고정하였다. 절편(5 wm)을 이미 기재된 바대로 트라이크롬 염색을 위해 폴리신 슬라이드 위에 놓았다. 이미 기재된 바대로 전체 수용성 콜라겐[Sircol Collagen Assay, Biocolor(아일랜드)]을 정량화하여 전체 폐 콜라겐을 결정하였다.
폐 역학: 컴퓨터화 Flexi Vent 시스템[SCIREQ, Montreal(캐나다)]으로 마우스에서 폐 역학을 평가하였다. 마우스를 케타민 및 크실라진으로 마취시키고, 기관절개하고 이후 450회 호흡/분의 속도로 8 ml/㎏의 일호흡 용적 및 SCIREQ 시스템에 의해 컴퓨터화된 2 ㎝ H2O의 양종말호기압(PEEP; positive end-expiratory pressure)으로 호흡시켜 동적 폐 탄성을 분석하였다. 호흡 방식을 강제 진동 신호(0.5~19.6 Hz)로 변화시키고, 호흡 저항을 측정하였다. 모델을 각 저항 스펙트럼으로 맞춤으로써 2 ㎝ H2O PEEP에서 마우스에 대해 조직 탄성을 얻었다. 이 시스템으로, 보정 절차는 장비 및 기관절개용 관의 저항을 제거하였다.
PX -866은 Akt 의 TGF α 유도 인산화를 억제한다: CCSP-rtTA/otet-TGFα 마우스를 Dox 1일으로 처리하여 TGFα 발현을 유도하였다. 웨스턴 블롯 분석에 의해 측정된 Ser 473에 대한 인산화된 Akt(P-Akt) 수준은 Dox 치료 대조군 마우스에 비해 5배 이상 증가하였다. Thr 308에 대한 P-Akt는 다음의 TGFα 발현(데이터는 도시하지 않음)을 변경하지 않았다. CCSP-rtTA/otet-TGFα 마우스에서의 PX-866 치료는 P-Akt에서의 TGFα 유도를 예방하였다(도 2a 및 도 2b).
통계학: 마우스 군(CCSP/-비히클, CCSP/TGFα 비히클, CCSP/ TGFα PX-866)에 의해 평균(+/- SEM)을 계산하고 각각의 변수에 대해 좌표 표시하였다. 좌표 및 Shapiro-Wilk 시험을 이용하여 정상성에 대한 데이터를 평가하였다. 정상성 가정이 충족되지 않을 때, 군 간의 차이를 시험하기 위해 로그 변환 값을 1방향 ANOVA에서 사용하였다. 로그 변환이 정상성을 개선하지 않을 때, 비매개변수 1방향 ANOVA를 사용하였다. 모든 쌍 비교에 시뮬레이션 기반 스텝다운 다중 비교 조정을 이용하였다. 비매개변수 ANOVA를 위해, Bonferroni-Holm 다중 비교 조정을 이용하였다.
기준선에서 매주 1회 다음 8주 동안 동등한 간격으로 4개의 다른 군에서 마우스의 체중을 측정하였다. 군×시간 평균에서의 차이를 컴퓨터화하기 위해 인자로서 군×시간 및 기준선으로 반복 측정 분석을 수행하였다. 각 군에 별개의 Toepliz 분산/공분산 구조를 사용하였다. 선택된 (priori) 군×시간 평균에서의 차이를 계산하고 다중 비교를 위한 시뮬레이션 기반 조정을 이용하여 시험하였다.
실시예
2
PX
-866은
TGF
α 유발 폐 섬유증을 억제한다:
TGFα 발현을 유도하기 위해 CCSP-rtTA/otet-TGFα 마우스를 Dox로 치료하고 동시에 PX-866(4 ㎎/㎏ 하루걸러) 또는 비히클로 4주 동안 치료하였다. TGFα의 유발은 광범위한 늑막, 혈관 주위 및 기관지 주위 섬유증을 야기하였다(도 3a). 전체 폐 콜라겐 수준은 Dox 치료 대조군 마우스와 비교하여 CCSP-rtTA/otet-TGFα 마우스에서 2배 이상 높았다. PX-866으로 치료된 마우스는 Dox 치료 대조군 마우스와 비교하여 역학 및 전체 폐 콜라겐에 의해 평가되는 폐 섬유증에서의 어떠한 차이도 나타내지 않았다(도 3a 및 도 3b). 폐 탄성이 30% 더 감소하였고, 기도 저항, 탄성 및 조직 탄성이 Dox 치료 대조군 마우스와 비교하여 CCSP-rtTA/otet-TGFα 마우스에서 2배 더 증가하였다. PX-866으로 치료된 마우스는 Dox 치료 대조군 마우스와 비교하여 폐 역학에서 어떠한 차이도 나타내지 않았다(도 4).
PX
-866은 확립된
TGF
α 유발 폐 섬유증의 진행을 예방한다:
PX-866이 확립된 섬유증의 진행에 영향을 미치는지를 결정하기 위해, 4주 Dox 치료 후, CCSP-rtTA/otet-TGFα 마우스에 PX-866을 투여하였고, 추가 4주(전체 8주) 동안 Dox에 머무르게 하였다. 대조군은 비히클로 치료된 CCSP/- 및 CCSP-rtTA/otet-TGFα 마우스를 포함하였고, Dox 추가 4주에 머무르게 하였다. 대조군의 제3 세트는 4주 Dox를 투여받고, 이후 Dox를 중단하고 4주 비히클 치료받은 CCSP-rtTA/otet-TGFα 마우스를 포함하였다(도 5a). 마우스에 대한 EGFR 활성화가 진행중이었고 EGFR 활성화가 없어진 마우스에서의 섬유증을 역전시키는 데 있어서 PX-866의 효율을 비교하기 위해 온-오프 Dox 군을 첨가하였다. 비히클로 치료된 CCSP-rtTA/otet-TGFα 마우스의 체중을 8주 Dox 후 기준선으로부터 26% 이상 감소하였다(도 5b). 시작 5주에 투여된 PX-866은 추가로 비히클 치료된 CCSP-rtTA/otet-TGFα 마우스와 비교하여 체중 감소를 예방하였지만, 중량이 CCSP/- 대조군 마우스 또는 CCSP-rtTA/otet-TGFα 마우스 오프 Dox보다 낮았다. 8주 동안 Dox 및 비히클로 치료된 CCSP-rtTA/otet-TGFα 마우스는 섬유증이 간질로 진행되고 폐포 건축을 없애면서 현저한 늑막 비후를 나타냈다(도 6a). 또한, 대혈관 및 소혈관 및 기도에서 진행된 혈관 주위 및 기관지 주위 섬유증이 존재하였다. PX-866으로 치료된 CCSP-rtTA/otet-TGFα 마우스는 비히클 치료 마우스와 비교하여 늑막 섬유증 감소 및 혈관 주위 및 기관지 주위 섬유증 감소를 나타냈다. CCSP-rtTA/otet-TGFα 마우스 오프 Dox는 또한 소기도 및 혈관에서 약간의 섬유증이 보이면서 유사한 늑막 및 외막 섬유증 감소를 나타냈다. 전체 폐 콜라겐 수준은 8주 Dox 후 Dox 치료된 CCSP/- 대조군 마우스와 비교하여 CCSP-rtTA/otet-TGFα 마우스에서 거의 4배 높았다(도 6b). PX-866 및 마우스 오프 Dox로 치료된 CCSP-rtTA/otet-TGFα 마우스 둘 다 비히클 치료 마우스와 비교하여 폐 콜라겐 수준 감소를 나타냈지만, CCSP/- 대조군 마우스와 비교하여 수준이 현저히 상승하였다. PX-866으로 치료된 CCSP-rtTA/otet-TGFα 마우스의 폐 역학은 비히클 치료 마우스와 비교하여 현저히 개선되었지만, 또한 4주 동안 대조군 및 CCSP-rtTA/otet-TGFα 마우스 오프 Dox와 비교하여 현저히 변경되었다(도 7).
폐 섬유증을 개체의 임상 치료를 더 밀접하게 반영하기 위해, 확립된 TGFα 유발 섬유증의 유지를 위해 PI3K 신호 전달의 역할을 결정하였다. Dox로 PX-866 4주에 의해 치료된 마우스는 비히클 치료 마우스와 비교하여 체중 정상화, 폐 역학에서의 섬유증 감소 및 폐 역학 개선을 나타냈다. 그러나, 체중, 폐 역학 및 콜라겐 및 폐 역학은 모두 CCSP/- 대조군 마우스와 비교하여 변경되어 섬유증 표현형의 불완전 역전을 입증하였다. 섬유증 과정이 완전히 치료에 4주 결정되는 것으로 예상될 수 없으므로, Dox를 제거함으로써 TGFα 과발현이 없어진 마우스에서 종점을 비교하였다. 섬유증 종점이 PX-866 군과 오프 Dox 군과 사이에 유사한 경우, PI3K 억제가 마찬가지로 폐 섬유증을 역전시키는 데 있어서 효과적일 것이다. 본 연구는 PX-866 치료 마우스가 마우스 오프 Dox와 비교하여 폐 콜라겐 및 역학에 의해 측정되는 유사한 정도의 섬유증을 나타내지만, 체중 및 폐 역학을 비롯한 섬유증의 생리학적 측정값이 PX-866 치료 마우스에서 변경되었다는 것을 보여준다. 섬유증을 역전시키는 데 있어서 PI3K 억제를 추가로 평가하기 위해, PX-866 치료 마우스를 오직 4주 Dox 후 마우스와 비교하였다. 4주 Dox 군에서의 섬유증 종점(도 3 및 4)은 마우스가 치료를 시작하는 폐 섬유증의 새로운 출발점을 나타낸다. PI3K 억제가 섬유증을 역전시키는 경우, 섬유증 종점은 4주 Dox 마우스와 비교하여 개선되는 것으로 예상되었다. PX-866 치료 마우스는 4주 Dox 마우스에 비해 폐 역학 및 콜라겐에 의해 측정되는 유사한 정도의 섬유증을 나타내지만, PX-866 치료 마우스에서 폐 역학은 현저히 변경되었다. 종합하면, 역전 연구는 섬유증이 확립된 후 PI3K 억제가 폐 섬유증의 진행을 예방하지만 생리학적 변경을 약화시킨다는 것을 보여준다. PX-866 치료 마우스에서의 매주 체중 값이 최종 2주 치료 동안 올라가는 경향을 보이면서 PX-866 치료 마우스에서 섬유증의 회복 및 해결 지연을 제시한다.
실시예
3
블레오마이신
유발 마우스 폐 섬유증 모델
이 연구에서 약물 유발 폐 섬유증의 마우스 모델을 사용하였다. 문헌[Walters et al. in Current Protocols in Pharmacology, 2008년 3월에 온라인 기재]에 기재된 프로토콜 프로토콜을 채택하였다. 블레오마이신을 폐로 직접 또는 전신으로 전달하여, 마우스에서의 폐 섬유증의 모델을 생성하였다. PX-866 또는 PX-867을 포함하는 제제를 치료학적으로 또는 예방적으로 투여하였다. Sircol Soluble Collagen Assay(Biocolor, Ltd.; 구입처: Accurate Chemical and Scientific)을 이용하여 폐 콜라겐 함량을 결정하였다. 폐에서의 콜라겐 함량 감소는 이 모델에서 치료 효과를 나타낸다.
실시예
4
장 섬유증에 대한 동물 모델
이 연구에서 문헌[Gastroenterology 2003, 125, 1750-61]에 기재된 만성 장 섬유증의 쥐과 모델을 사용하였다. 트리니트로소벤젠 설폰산(TNBS)의 매주 주사에 의해 만성 염증을 확립하였다. 섬유증이 전형적으로 TNBS 주사 중지 후 2~4주 지속되었다. PX-866을 포함하는 제제를 치료학적으로 또는 예방적으로 투여하였다.
역학에 의해 결장 섬유증을 결정하였다. 문헌[Kivirikko et al., Anal Biochem. 1967 19:249-55]에 기재된 바대로 하이드록시프롤린 정량화에 의해 전체 콜라겐 수준을 조사하였다. 형태학 및 표현형에 의해 대조군 및 TNBS 치료 결장 중간엽 세포를 규명하였다. 전환 성장 인자 베타-1(TGFβ-1)의 결장 발현을 반정량적 폴리머라제 연쇄 반응에 의해 결정하였다. TGFβ-1의 콜라겐 수준 및 발현의 감소는 이 모델에서 장 섬유증에 대한 치료 효과를 나타낸다.
실시예
5
래빗
상처 치유 및 비후성 반흔 모델
마취 이후, 10마리의 어린 성인 암컷 뉴질랜드 래빗에서 동물마다 전체 8개소 상처에 대해 각 귀마다 4개소 상처의 귀 상처를 만들었다. 7 ㎜ 생검 펀치를 사용하여 상처를 만들어 상처가 연골로 진행하였다. 해부 현미경을 사용하여 각 상처에서의 표피, 진피 및 연골막의 완전한 제거를 보장하였다. 비후성 반흔 모델의 경우, 상승된 반흔을 생성시키는 것은 연골막 층의 제거 및 이후 결함의 재상피화의 지연이었다. 각 상처를 독립적으로 치유하고 별개 샘플인 것으로 생각하였다.
연구 초기 단계 및 상처 치유의 마지막 단계에 2개의 치료 군을 조사하였다. 초기 치료 군(n = 15 래빗, 120개소 상처)을 상처 0일, 1일, 2일, 3일, 4일, 5일, 6일 및 7일 후에 0.05~1.5중량% 국소 제제(용액, 크림, 연고 또는 겔)로서 제제화된 시험 화합물 또는 국소 비히클 제제를 사용하는 위약으로 치료하고, 상처 28일 후에 수확하였다. 마지막 치료 군(n = 15 래빗, 120개소 상처)을 상처 7일, 8일, 9일, 10일, 11일, 12일, 13일 및 14일 후에 0.05~1.5% 국소 제제(용액, 크림, 연고 또는 겔)로서 제제화된 시험 화합물 또는 국소 비히클 제제를 사용하는 위약으로 치료하고, 상처 28일 후에 수확하였다. 각 군에서의 상처의 반을 활성 화합물로 치료하고 반을 위약으로 치료하였다. 각 상처를 무균 드레싱(Tegaderm; 3M)으로 도포하고, 각 치료 후 상처가 광대한 실험에서 재상피화될 때까지 필요한 바대로 드레싱을 매일 변경하였다. 감염, 건조 또는 괴사의 증가가 있는 경우, 분석으로부터 상처를 배제하였다.
각 연구 종료시, 주변 상처가 없는 조직의 5 ㎜ 여백으로 상처를 수확하였다. 반흔을 2등분하고 각 상처의 반을 4% 중성 완충 포름알데하이드 중에 고정하고, 탈수하고, 파라핀 중에 포매하고, 4 ㎛ 절편으로 절단하고, Masson 트라이크롬 또는 시러스 레드로 염색하였다. 각 상처의 나머지 반을 액체 질소 중에 섬광 동결시키고 RNA 추출을 위해 저장하였다.
조직학 분석
광 현미경 관찰을 사용하여 각 조직 섹션 및 상처 치유 정도를 조사하고 맹검 방식으로 렌즈 십자선을 보정하여 반흔 비후를 측정하였다. 상처 치유 매개변수: 관련 측정은 성장 용적 및 높이에서의 과립화 조직, 상처 상피화, 및 상처 봉합이었다. 각 매개변수를 2회 평가하고 결과를 평균하였다.
반흔 비후 매개변수: 문헌[Lu et al, J. Am. Coll. Surg., 2005, 201, p391-397]에 기재된 바대로 반흔 상승 지수를 결정하였다. 맹검 방식으로 값을 결정하고 결과를 평균하였다.
실시예
6
신장 섬유증의 동물 모델
마우스를 일반 마취로 진정시키고, 등의 오른편에서 절개하였다. 오른쪽 근위뇨관을 노출시키고 2중 결찰시켰다. Sham 작동 마우스는 이들의 위뇨관을 노출시켰지만 결찰하지 않았다. 이후, 간질의 개형을 연구하였다. 수술 약 15일 후 전형적으로 간질성 신장 섬유증을 확립하였다. 마우스의 파괴된 신장은 섬유아세포 세포의 증식 및 염증성 단핵 세포의 유입에 의해 세뇨관이 팽창되면서 섬유증 변경을 나타냈고, 작동 마우스에서 정상 건축이 보존되었다.
화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물의 경구 제제를 치료학적으로 또는 예방적으로 투여하였다. 풀 컬러 3CCD 카메라 및 KS-400 이미지 분석 소프트웨어가 장착된 Zeiss 현미경(Zeiss-Kontron)을 사용하여 간질성 구획에서의 조직형태학적 변경을 기록하였다. 위 근육 알파-액틴의 간질성 발현에 대해 조직을 또한 관찰하였다. 면역퍼옥시다제 및 시러스 레드 염색에 의해 간질성 콜라겐의 축적을 결정하였다. 섬유증의 역전 또는 감소는 PX-866의 경구 용량의 치료 효율을 나타낸다.
실시예
7
녹내장 여과 수술 후 반흔에 대한 동물 모델
3월령 내지 6월령이고 체중이 1.5 내지 2.5 ㎏인 암컷 친칠라 새끼 래빗(ChBB:CH)으로 모든 실험을 수행하였다. 실험 1주 전 동물을 수용하였다.
케타민 및 크실라진의 근육내 주사에 의한 일반 마취 및 옥시부프로카인 점안액에 의한 국소 마취 하에 오른쪽 귀에서 수술을 수행하였다. 문헌[Grisanti et al. Investigative Ophthalmology and Visual Science, 2005;46:191-196]에 기재된 바대로 주변홍채절를 수행하였다. 수술 후 3회 연속일에, 각 동물에게 PX-866 또는 PX-867을 포함하는 1일 1회 점안액을 투여하였다.
치료된 눈의 일반적인 외관을 평가하고, 국소 독성 및 안과 과민증을 평가하고, 안압을 측정하기 위한 임상 조사를 수행하였다. 섬유증 조직의 침착으로 인한 결막 투명도 손실 및 비후를 임상적으로 조사하여 상처 치유를 결정하였다. 반흔 억제는 반투명 결막을 유지할 것으로 예상되었다.
14일 시술 후 모든 래빗을 죽이고, 조직학 검사를 위해 치료된 눈을 적출하였다. 홍채절제술 자리로 표시된 공막절개술 자리의 중심에서 견본의 조직학 분석을 수행하였다.
조직을 헤마톡실린 및 에오신으로 염색하여 전체 자국(impression)을 발생시키기고 Masson 기술로 염색하여 콜라겐 세포외 매트릭스(ECM) 침착을 결정하였다. ECM 침착 감소는 치료 효과를 나타낸다.
실시예
8
약학 조성물
실시예
8a:
비경구
조성물
주사에 의한 투여에 적합한 비경구 약학 조성물을 제조하기 위해, 본원에 기재된 화합물의 수용성 염 100 ㎎을 무균수 중에 용해시키고 이후 0.9% 무균 식염수 10 ㎖와 혼합하였다. 혼합물을 주사에 의한 투여에 적합한 용량 단위 형태에 혼입하였다.
실시예
8b: 경구 조성물
경구 전달을 위한 약학 조성물을 제조하기 위해, 본원에 기재된 화합물 100 ㎎을 전분 750 ㎎과 혼합하였다. 혼합물을 경구 투여에 적합한, 예컨대 경질 젤라틴 캡슐을 위한 경구 용량 단위에 혼입하였다.
실시예
8c:
설하
(경질
로렌지
) 조성물
경질 로렌지와 같은 협측 전달을 위한 약학 조성물을 제조하기 위해, 본원에 기재된 화합물 100 ㎎, 혼합된 분말 당 420 ㎎, 라이트 옥수수 시럽 1.6 ㎖, 증류수 2.4 ㎖, 및 민트 추출물 0.42 ㎖와 혼합하였다. 혼합물을 약하게 블렌딩하고 금형에 부어 협측 투여에 적합한 로렌지를 형성하였다.
실시예
8d: 흡입 조성물
흡입 전달을 위한 약학 조성물을 제조하기 위해, 본원에 기재된 화합물 20 ㎎을 무수 시트르산 50 ㎎ 및 0.9% 염화나트륨 용액 100 ㎖와 혼합하였다. 혼합물을 흡입 투여에 적합한 흡입 전달 단위, 예컨대 네불라이저에 혼입하였다.
실시예
8e: 직장 겔 조성물
직장 전달을 위한 약학 조성물을 제조하기 위해, 본원에 기재된 화합물 100 ㎎을 메틸셀룰로스(1500 mPa) 2.5 g, 메틸파라벤 100 ㎎, 글리세린 5 g 및 정제수 100 ㎖와 혼합하였다. 이후, 얻은 겔 혼합물을 직장 투여에 적합한 직장 전달 단위, 예컨대 시린지에 혼입하였다.
실시예
8f: 국소 겔 조성물
약학 국소 겔 조성물을 제조하기 위해, 본원에 기재된 화합물 100 ㎎을 하이드록시프로필 셀룰로스 1.75 g, 프로필렌 글리콜 10 ㎖, 이소프로필 미리스테이트 10 ㎖ 및 정제 알콜 USP 100 ㎖와 혼합하였다. 이후, 얻은 겔 혼합물을 국소 투여에 적합한 컨테이너, 예컨대 관에 혼입하였다.
실시예
8g:
점안액
조성물
약학 점안액 조성물을 제조하기 위해, 본원에 기재된 화합물 100 ㎎을 정제수 100 ㎖ 중 NaCl 0.9 g과 혼합하고 0.2 마이크론 필터를 사용하여 여과시켰다. 이후, 얻은 등장성 용액을 눈 투여에 적합한 눈 전달 단위, 예컨대 점안 컨테이너에 혼입하였다.
실시예
9
절개된 켈로이드의 재발의 치료 및 예방에 대한
PI
-3
키나제
억제제 화합물의 효과를 평가하는 임상 실험. 수술 7일 후 치료를 시작한다.
2중 맹검 무작위 위약 조절 임상 연구로 귓볼 켈로이드 반흔 절개 후 국소 투여되는 화합물의 안전성 및 효율을 평가하였다. 각 환자는 양측 켈로이드 반흔 절개를 겪었고 한쪽 귓볼을 본 화합물로 치료하고 다른 귓볼을 위약으로 치료하여 각 환자가 그 자체 대조군으로서 행동하였다.
18~65세 연령의 10명 내지 12명의 피험체가 이 연구에 참여하였다. 모든 피험체 수술 절개에 적합한 양측 켈로이드 반흔을 가져야 하고, 절개 후, 그 결과는 각 귓볼에 길이 2 ㎝ 이하의 단일 상처일 것이다. 상처는 귓볼의 피부, 지방 및 섬유성 조직으로 제한될 것이다.
피험체는 연구 12주 전 조사, 냉동외과수술, 코티코스테로이드 또는 다른 약리 제제에 의한 켈로이드 치료를 경험하지 않았다. 피험체는 출혈 장애의 병력을 갖지 않아야 하고 진행중인 건선 또는 습진 또는 악성 피부 종양을 경험하거나 앓지 않아야 한다. 가능성을 갖는 어린이 여성 피험체는 음성 요 임신 검사를 입증해야 하고 연구 기간 동안 의학적으로 증명된 피임 형태를 실시해야 한다. 각 피험체로부터 동의서를 얻었다.
수술 켈로이드 절제 및 치료 프로토콜
10명 내지 12명의 환자가 양측 켈로이드 절제를 겪었다. 각 환자는 상처 봉합 7일 후 이후 반복적으로 4주 동안 24시간마다 하나의 귓볼 상처 여백의 각 직선 센티미터로 임상적으로 허용되고 안전한 국소 제제(용액, 크림, 연고 또는 겔) 중에 0.05 내지 1.5%의 적절한 농도로 제제화되는 PI-3 키나제 억제제 화합물의 진피 투여를 받았다. 다른 귓볼을 상처 봉합 직후 이후 반복적으로 4주 동안 24시간마다 귓볼 상처 여백의 각 직선 센티미터로 투여되는 위약(치료 군에서 사용되는 것과 동일하지만, 활성 약학 성분이 부족한 임상적으로 허용되고 안전한 국소 제제)으로 국소로 치료하였다. 1차 평가는 시각 통증 등급을 이용하는 수술 후 4주 내지 6달 기간 동안 레이 패널(lay panel)에 의한 사진 평가에 기초하였다.
1차 결과 측정은 52주 시간 틀 동안 켈로이드 적응증에서 시험 화합물에 의해 사전 안전 경험을 얻는 것이다. 2차 결과 측정은 (i) 켈로이드 재발 감소(시간 틀 52주) 및 (ii) 의사 전체 평가 및 피험체 평가(시간 틀 52주)이었다.
실시예
10
폐 섬유증의 치료에 미치는
PI
-3
키나제
억제제 화합물의 효과를 평가하는 I상 임상 실험
이 연구는 선행 치료에 실패하였던 특발성 폐 섬유증을 앓는 환자에 대한 PI-3 키나제 억제제의 투여 안전성을 평가하는 것이다.
연구 유형: 중재적
연구 설계: 치료, 비무작위, 개방, 비조절, 단일 군 배정, 안전성/효율 연구. 각 환자에게 화학식 ⅠA, ⅠB, ⅡA 또는 ⅡB의 화합물의 2회 1일 용량을 투여하였다.
적격성: 35세 내지 80세; 연구에 성별 둘 다 적격; 건강한 지원자: 허용되지 않음.
포함 기준: 특발성 폐 섬유증의 진단; 증상 증가, 적어도 10%의 노력성 폐활량의 감소, 적어도 20%의 일산화탄소에 대한 확산능의 감소, CXR 또는 고해상도 CT 스캔에서의 침윤 증가, 스크리닝 전 적어도 30일 동안 15 ㎎ 미만의 프레드니손의 투약 중 하나 이상으로 정의되는 6달 치료(아자티오프린 또는 사이클로포스파미드 존재/부재 하 스테로이드)에도 불구하고 질환 진행
배제 기준: 상당한 환경 노출, 콜라겐 혈관 질환의 진단, 활성 감염, 임상적으로 상당한 심장 질환, 심근경색증, 6달 내에 관상동맥 우회술 또는 혈관성형술, 불안정 협심증, 6달 내 입원치료를 요하는 울혈성 심부전, 비조절 부정맥, 빈약하게 조절되는 또는 중증 당뇨병, 임신 또는 수유, 현재 다른 실험 프로토콜 등록의 증거
생리학적 기준: 0.60 미만의 FEV1/FVC
실험실 기준: 1.5배 초과의 상한 정상의 총 빌리루빈, 3배 초과의 상한 정상의 AST 또는 ALT, 3배 초과의 상한 정상의 알칼리 포스파타제, 2,500/㎣ 미만의 백혈구 세포수, 30% 미만의 헤마토크릿, 100,000/㎣ 미만의 혈소판, 1.5 초과의 프로트롬빈 시간 INR.
이 연구에 대한 1차 종점은 안전성이다.
2차 종점: 폐 기능, 운동 능력, 및 삶의 질의 변화.
실시예
11
간 섬유증의 치료에 미치는
PI
-3
키나제
억제제 화합물의 효과를 평가하는 임상 실험
이 연구의 목적은 C형 간염 간경병증에 대한 간 이식 이후 환자에서 간 섬유증 발병이 감소하는지를 평가하는 것이다. 이 연구는 심지어 다시 감염되는 경우에도 섬유증 발병이 감소 또는 지연되는지를 평가한다.
연구 유형: 중재적
연구 설계: C형 간염 간경병증에 대한 이식 12 달 후에 간 섬유증의 전개를 비교하기 위한 치료, 비무작위, 개방 연구. 각 환자에게 PX-866 또는 PX-867의 3회 1일 용량을 투여하였다.
적격성: 18세 내지 75세; 성별 둘 다
포함 기준: 이식 이유는 C형 간염 간경병증으로 인한 말기 간 질환; 사망 또는 살아 있는 기증자로부터 처음 간 이식을 받은 환자; HCV+, HIV+ 또는 HBV+ 기증자로부터 얻은 간의 수혜자; 미리 결정된 크기를 넘는 간암에 대한 이식; 적어도 6달 동안 절주하지 않은 병존하는 알콜성 질환을 앓는 환자이다.
1차 결과 측정: 섬유증 등급(2 단계 또는 [Ishak-Knodell FS>2] 초과)
2차 결과 측정: 사망 또는 이식편 손실 또는 FS>2의 종점 조합에 대한 등급; 평균 섬유증 점수, 섬유증에서의 적어도 1 단계 증가를 갖는 환자의 백분율; 섬유성 담즙울체성 간염의 발병
실시예
12
신장 섬유증의 치료에 미치는
PI
-3
키나제
억제제 화합물의 효과를 평가하는 임상 실험
PX-866 치료된 신장 동종이식편 수혜자에서 6달에 프로토콜 생검에서 간질성섬유증 및 동맥경화증의 발병 및 정도, 및 사구체 부피를 결정하기 위한 것이다.
연구 유형: 중재적
연구 설계: 무작위, 개방, 동시 배정, 활성 대조군. 각 환자에게 PX-866 또는 PX-867의 3회 1일 용량을 투여하였다.
적격성: 18세 초과
포함 기준: 살아 있는 기증자로부터의 신장 동종이식편을 위해, 하나 이상의 HLA 불일치가 필요하다; 국내 법규에 따른 동의서.
배제 기준: 거부로 인한 이식 실패의 과거 병력을 갖는 제2 또는 제3 신장 동종이식편의 수혜자; 단상형 동일 살아 있는 기증자 또는 심정지 기증자로부터 얻은 신장 동종이식편의 수혜자.
1차 결과 측정: 이 연구의 1차 종점은 6달에 프로토콜 생검에서 피질 분획 간질성 섬유증 부피이다.
2차 결과 측정: 1년에 환자 및 이식 생존; 6달 및 12달에 혈청 크레아티닌 및 예상된 크레아티닌 청소율; 6달에 프로토콜 생검에서 내막 부위 및 동맥벽 두께 및 사구체 부피; 초년 동안 급성 거부 에피소드의 발생; 치료 실패 발생
몇몇 바람직한 양태와 관련하여 본 발명을 상당히 자세히 기재하였지만, 다른 버전이 가능하다. 따라서, 특허청구범위의 정신 및 범위는 본 명세서 내 포함된 설명 및 바람직한 버전으로 국한되어서는 안 된다.
Claims (25)
- PI-3 키나제 억제제를 치료를 필요로 하는 개체에게 투여하는 것을 포함하는 경증 또는 중등증 또는 중증 폐 섬유증의 치료 방법.
- 제1항에 있어서, PI-3 키나제 억제제는 PI-3 키나제 알파, PI-3 키나제 베타, PI-3 키나제 델타 또는 PI-3 키나제 감마 또는 이들의 조합을 선택적으로 억제하는 것인 치료 방법.
- 제1항에 있어서, PI-3 키나제 억제제는 PI-3 키나제 알파 또는 PI-3 키나제 베타 또는 이들의 조합을 선택적으로 억제하는 것인 치료 방법.
- 제1항에 있어서, PI-3 키나제 억제제는 PI-3 키나제의 가역적 억제제인 치료 방법.
- 제1항에 있어서, PI-3 키나제 억제제는 PI-3 키나제의 비가역적 억제제인 치료 방법.
- 제1항에 있어서, 폐 섬유증은 특발성 폐 섬유증인 치료 방법.
- 제1항에 있어서, 상기 폐 섬유증은 석면증, 낭포성 섬유증, 감염, 환경 알레르겐에의 노출, 폐 이식, 자가면역 질환과 관련되거나, 상기 폐 섬유증은 약물 유발 폐 섬유증인 치료 방법.
- 제1항에 있어서, 상기 PI-3 키나제 억제제는 폐 섬유증을 축소시키거나 폐 섬유증의 진행을 역전 또는 감소시키는 것인 치료 방법.
- 제1항에 있어서, 상기 PI-3 키나제 억제제는 진행성 체중 감소를 예방하는 것인 치료 방법.
- 제1항에 있어서, 상기 PI-3 키나제 억제제는 폐 역학에서 TGFα 의존성 변화의 진행을 늦추는 것인 치료 방법.
- 제1항에 있어서, 상기 PI-3 키나제 억제제는 폐 섬유증의 확립을 예방하는 것인 치료 방법.
- 제1항에 있어서, 상기 PI-3 키나제 억제제를 경구 투여하는 것인 치료 방법.
- 제1항에 있어서, 상기 PI-3 키나제 억제제를 흡입형 제제로서 투여하는 것인 치료 방법.
- 치료학적 유효량의 보르트만닌 또는 보르트만닌 유사체를 치료를 필요로 하는 개체에게 투여하는 것을 포함하는 섬유성 증후군을 앓는 것으로 진단된 또는 섬유성 증후군을 앓는 것으로 의심되는 개체에서 섬유성 증후군을 치료하는 방법.
- 제14항에 있어서, 보르트만닌 유사체는 하기 화학식의 화합물인 치료 방법:
또는
[식 중,
---는 임의의 결합이고;
n은 1~6이고;
Y는 이종 원자이고;
R1 및 R2는 불포화 알킬, 비선형 알킬, 사이클릭 알킬 및 치환 알킬로부터 독립적으로 선택되거나, R1과 R2는 이들이 결합된 원자와 함께 헤테로사이클로알킬 기를 형성하고;
R3은 부재하거나, H, 또는 C1-C6 치환 또는 비치환 알킬이고;
R4는 (C=O)R5, (C=O)OR5, (S=O)R5, (SO2)R5, (PO3)R5, (C=O)NR5R6이고;
R5는 치환 또는 비치환 C1-C6 알킬이고;
R6은 치환 또는 비치환 C1-C6 알킬이다]. - 제16항에 있어서, Y는 질소 및 황으로부터 선택되는 이종 원자인 치료 방법.
- 제16항에 있어서, 상기 R1 및 R2는 불포화 알킬인 치료 방법.
- 제14항에 있어서, 보르트만닌 유사체는 PI-3 키나제 억제제인 치료 방법.
- 제19항에 있어서, 상기 PI-3 키나제 억제제는 PX-866인 치료 방법.
- 제19항에 있어서, 상기 PI-3 키나제 억제제는 PX-867인 치료 방법.
- 제14항에 있어서, 섬유성 증후군은 경증, 중등증 또는 중증 폐 섬유증, 낭포성 섬유증, 안구 섬유증, 심내막심근 섬유증, 종격동 섬유증, 골수섬유증, 골섬유증, 섬유성 결장병증, 후복막 섬유증, 간질성 폐렴, 진행성 종괴성 폐 섬유증, 켈로이드, 강피증, 비후성 반흔, 신장 섬유증, 장 섬유증, 간 섬유증, 섬유성 담즙울체성 간염, 신원성 전신 섬유증, 장기 이식과 관련된 섬유증, 다발성 섬유경화증, 또는 과민성 쇼크 섬유증인 치료 방법.
- 제14항에 있어서, 섬유성 증후군은 경증, 중등증 또는 중증 특발성 폐 섬유증인 치료 방법.
- 제14항에 있어서, 섬유성 증후군은 석면증, 낭포성 섬유증, 감염, 환경 알레르겐에의 노출, 자가면역 질환과 관련된 폐 섬유증이거나, 섬유성 증후군은 약물 유발 폐 섬유증인 치료 방법.
- 제14항에 있어서, 섬유성 증후군은 장기 이식과 관련되는 것인 치료 방법.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US16790509P | 2009-04-09 | 2009-04-09 | |
| US61/167,905 | 2009-04-09 | ||
| US23574009P | 2009-08-21 | 2009-08-21 | |
| US61/235,740 | 2009-08-21 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120018761A true KR20120018761A (ko) | 2012-03-05 |
Family
ID=42936877
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117026616A KR20120018761A (ko) | 2009-04-09 | 2010-04-08 | 섬유증을 치료하기 위한 방법 및 pi-3 키나제 억제제의 조성물 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US20120046333A1 (ko) |
| EP (1) | EP2416771A4 (ko) |
| JP (1) | JP2012523429A (ko) |
| KR (1) | KR20120018761A (ko) |
| CN (1) | CN102395363A (ko) |
| AU (1) | AU2010234360A1 (ko) |
| BR (1) | BRPI1015940A2 (ko) |
| CA (1) | CA2754343A1 (ko) |
| MX (1) | MX2011010631A (ko) |
| WO (1) | WO2010118250A2 (ko) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102727478A (zh) * | 2012-06-14 | 2012-10-17 | 合肥博太医药生物技术发展有限公司 | 视黄酸及其衍生物在制备防治肾纤维化药物中的应用 |
| SG10201805670QA (en) | 2014-01-28 | 2018-08-30 | Buck Inst Res Aging | Methods and compositions for killing senescent cells and for treating senescence-associated diseases and disorders |
| WO2015116735A1 (en) | 2014-01-28 | 2015-08-06 | Mayo Foundation For Medical Education And Research | Methods and combinations for killing senescent cells and for treating senescence-associated diseases and disorders |
| CN110917351A (zh) * | 2018-09-20 | 2020-03-27 | 华中科技大学同济医学院附属同济医院 | Mbd2抑制剂在预防和治疗纤维化疾病中的用途 |
| JP2022065212A (ja) * | 2019-02-28 | 2022-04-27 | 国立大学法人京都大学 | 組織線維化による疾患の予防又は治療のための医薬 |
| US20220249511A1 (en) * | 2019-03-29 | 2022-08-11 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for the treatment of keloid, hypertrophic scars and/or hyperpigmentation disorders |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004075917A1 (ja) * | 2003-02-28 | 2004-09-10 | Toudai Tlo, Ltd. | 器官または組織の線維化抑制剤 |
| CA2578336C (en) * | 2004-07-09 | 2013-09-24 | Prolx Pharmaceuticals Corp. | Wortmannin analogs and methods of using same in combination with chemotherapeutic agents |
| CN101180055A (zh) * | 2005-05-27 | 2008-05-14 | 拜耳医药保健股份公司 | 用于治疗疾病的包含二芳基脲的组合治疗 |
| JP2008545670A (ja) * | 2005-05-27 | 2008-12-18 | バイエル・ヘルスケア・アクチェンゲゼルシャフト | 疾患を処置するためのジアリールウレア類を含む組合せ治療 |
| ES2378780T3 (es) * | 2005-12-30 | 2012-04-17 | Arizona Board Of Regents, Acting On Behalf Of The University Of Arizona | Metabolitos de análogos de wortmanina y métodos de uso de los mismos |
| JO2660B1 (en) * | 2006-01-20 | 2012-06-17 | نوفارتيس ايه جي | Pi-3 inhibitors and methods of use |
-
2010
- 2010-04-08 CN CN2010800151213A patent/CN102395363A/zh active Pending
- 2010-04-08 AU AU2010234360A patent/AU2010234360A1/en not_active Abandoned
- 2010-04-08 WO PCT/US2010/030420 patent/WO2010118250A2/en active Application Filing
- 2010-04-08 CA CA2754343A patent/CA2754343A1/en not_active Abandoned
- 2010-04-08 US US13/262,906 patent/US20120046333A1/en not_active Abandoned
- 2010-04-08 MX MX2011010631A patent/MX2011010631A/es not_active Application Discontinuation
- 2010-04-08 KR KR1020117026616A patent/KR20120018761A/ko not_active Application Discontinuation
- 2010-04-08 JP JP2012504871A patent/JP2012523429A/ja active Pending
- 2010-04-08 EP EP10762450A patent/EP2416771A4/en not_active Withdrawn
- 2010-04-08 BR BRPI1015940A patent/BRPI1015940A2/pt not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| CN102395363A (zh) | 2012-03-28 |
| AU2010234360A1 (en) | 2011-09-29 |
| BRPI1015940A2 (pt) | 2016-04-19 |
| EP2416771A4 (en) | 2012-10-31 |
| WO2010118250A3 (en) | 2011-03-31 |
| EP2416771A2 (en) | 2012-02-15 |
| MX2011010631A (es) | 2012-01-20 |
| WO2010118250A2 (en) | 2010-10-14 |
| US20120046333A1 (en) | 2012-02-23 |
| CA2754343A1 (en) | 2010-10-14 |
| JP2012523429A (ja) | 2012-10-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20200338094A1 (en) | Use of a Heterocyclic Bcl-xL Inhibitor and Related Analogs for Removing Senescent Cells in the Treatment of Eye Diseases and Other Age-Related Conditions | |
| TWI532480B (zh) | 以斑馬魚模組進行藥物篩選之方法及篩選所得藥物 | |
| JP2018521120A (ja) | 翼状片を治療するための組成物及び方法 | |
| KR20120018761A (ko) | 섬유증을 치료하기 위한 방법 및 pi-3 키나제 억제제의 조성물 | |
| EA030651B1 (ru) | Замещенные ароматические соединения и связанный с ними способ лечения фиброза | |
| JP2020508971A (ja) | 老化細胞が介在する疾患を治療するためのペプチド系プロテアソーム阻害物質、およびがんを治療するためのペプチド系プロテアソーム阻害物質 | |
| EP3352759A1 (en) | Treatment of neurodegenerative diseases | |
| JP2024003130A (ja) | 糖尿病性腎症の予防薬及び/又は治療薬 | |
| CN112469411B (zh) | 供在由衰老细胞引起或介导的状况的临床管理中使用和用于治疗癌症的作为Bcl家族拮抗剂的氨基膦酸酯 | |
| WO2008001369A1 (en) | Use of cb2 receptor agonists for promoting neurogenesis | |
| JP2010509247A (ja) | Acat阻害剤及び線維症の予防又は治療におけるその使用 | |
| JP6700312B2 (ja) | 組織再生及び衰えた組織機能の回復を刺激するための作用物質としてのジカルボン酸のビスアミド誘導体 | |
| JP2023518375A (ja) | 治療方法 | |
| KR20230004650A (ko) | 호흡기 병태를 치료하기 위한 trpc6의 억제제 | |
| US20210379078A1 (en) | Killing Senescent Cells And Treating Senescence-Associated Conditions Using A Bcl Inhibitor And An Mcl-1 Inhibitor | |
| US20210386754A1 (en) | Compositions and methods for treating atherosclerotic vascular disease | |
| WO2016085981A1 (en) | Method of inhibiting or treating fibrosis | |
| US10745429B2 (en) | Phospholidines that are Bcl family antagonists for use in clinical management of conditions caused or mediated by senescent cells and for treating cancer | |
| US20210069189A1 (en) | Treatment of neurodegenerative diseases | |
| WO2007094193A1 (ja) | 血管新生阻害剤及び血管新生を伴う疾病に対する予防又は治療剤並びに食品 | |
| US9498458B2 (en) | Method of inhibiting or treating fibrosis | |
| WO2014065370A1 (ja) | 肺高血圧症治療剤 | |
| WO2018137701A1 (zh) | 靶向cxcr7的药物组合物和方法 | |
| WO2016085954A1 (en) | Geranygeranylacetone and analogs thereof and phenoxyalkylcarboxlic acids for treating fibrosis | |
| WO2019133988A1 (en) | Peptide-based proteasome inhibitors for treating conditions mediated by senescent cells and for treating cancer |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |