KR20100136453A - 누관 임플란트 및 이와 관련된 방법 - Google Patents
누관 임플란트 및 이와 관련된 방법 Download PDFInfo
- Publication number
- KR20100136453A KR20100136453A KR1020107019589A KR20107019589A KR20100136453A KR 20100136453 A KR20100136453 A KR 20100136453A KR 1020107019589 A KR1020107019589 A KR 1020107019589A KR 20107019589 A KR20107019589 A KR 20107019589A KR 20100136453 A KR20100136453 A KR 20100136453A
- Authority
- KR
- South Korea
- Prior art keywords
- fistula
- implant
- retention
- retention structure
- fluid
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F9/00—Methods or devices for treatment of the eyes; Devices for putting-in contact lenses; Devices to correct squinting; Apparatus to guide the blind; Protective devices for the eyes, carried on the body or in the hand
- A61F9/0008—Introducing ophthalmic products into the ocular cavity or retaining products therein
- A61F9/0017—Introducing ophthalmic products into the ocular cavity or retaining products therein implantable in, or in contact with, the eye, e.g. ocular inserts
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F9/00—Methods or devices for treatment of the eyes; Devices for putting-in contact lenses; Devices to correct squinting; Apparatus to guide the blind; Protective devices for the eyes, carried on the body or in the hand
- A61F9/007—Methods or devices for eye surgery
- A61F9/00772—Apparatus for restoration of tear ducts
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M29/00—Dilators with or without means for introducing media, e.g. remedies
- A61M29/02—Dilators made of swellable material
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M31/00—Devices for introducing or retaining media, e.g. remedies, in cavities of the body
- A61M31/002—Devices for releasing a drug at a continuous and controlled rate for a prolonged period of time
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2210/00—Particular material properties of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2210/0061—Particular material properties of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof swellable
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F9/00—Methods or devices for treatment of the eyes; Devices for putting-in contact lenses; Devices to correct squinting; Apparatus to guide the blind; Protective devices for the eyes, carried on the body or in the hand
- A61F9/007—Methods or devices for eye surgery
- A61F9/00781—Apparatus for modifying intraocular pressure, e.g. for glaucoma treatment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
- A61K9/0051—Ocular inserts, ocular implants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2207/00—Methods of manufacture, assembly or production
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2210/00—Anatomical parts of the body
- A61M2210/06—Head
- A61M2210/0612—Eyes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M31/00—Devices for introducing or retaining media, e.g. remedies, in cavities of the body
Abstract
눈의 누점내에서의 견고한 유지를 제공하는 누관 임플란트(306) 및 관련 방법에 관한 것이다. 누관 임플란트는 누점을 통해 누소관으로 적어도 일부분 삽입될 수 있는 임플란트 본체(302)를 포함할 수 있다. 임플란트 본체는 실질적으로 확장성 체류 부재를 둘러쌀 수 있게 구성될 수 있는 변형가능한 체류 구조(308)를 포함할 수 있다. 일부 예에서, 확장성 체류 부재는, 예컨대 유체 투과성 유지 장치 또는 유체 투과성 구멍(320)을 통해서, 유체에 노출될 수 있는 유체 흡수성 물질을 포함할 수 있다. 유체 흡수성 물질이 유체를 보유(즉 체류 구조에 유체 수용)함에 따라, 그 크기는 증가하고, 형태는 예컨대 누소관의 벽 방향으로 체류 구조의 한 곳 이상을 바깥쪽으로 압박하여, 누점 내부에서 누관 임플란트가 견고하게 유지되도록 바뀔 수 있다.
Description
본 출원은 2008년 2월 18일자 미국 가출원번호 61/066,233 및 2008년 4월 30일자 미국 가출원번호 61/049,347에 대한 우선권을 주장하며, 이들 내용은 그 전체가 원용에 의해 본 명세서에 포함된다.
본 특허문헌은 일반적으로 눈 임플란트에 관한 것이다. 보다 상세하게는, 본 특허문헌은 누관 임플란트(예컨대, 누점 플러그), 그러한 임플란트의 제조 방법 및 그러한 임플란트를 이용한 눈 질환의 치료 방법에 관한 것이나, 이러한 내용으로만 한정되는 것은 아니다.
눈으로의 약물 전달 및 안구 건조증 치료 등의 눈 질환 관리 분야에서 환자와 의사들은 매우 다양한 난관에 직면한다. 건성 각결막염을 포함하는 안구 건조증은 치료가 필요할 수 있는 흔한 눈 질환이다. 안구 건조증은 광범위한 인구 범위에서 나타나고 있으며, 장년층에서 흔히 나타난다. 현재의 다양한 치료 방식들은 안구 건조증에 기여하는 생리적 증상을 표적으로 하고 있는데, 정상적인 눈물의 증대, 눈물막 성분의 생성 증강 및 눈에서 누소관(canaliculus)을 통한 눈물 흐름의 차단과 같은 눈물의 체류 시간을 증가시키는 방법이 이에 포함된다.
현재 다수의 눈물 흐름 차단 기술들은 본래 비가역적인 점 등의 여러가지 문제점들을 가지고 있다. 예를 들면, 몇가지 눈물 흐름 차단 기술들은, 누점 개구(punctal opening)를 봉합하여 닫음으로써, 또는 누점 개구를 밀폐하기 위해 전기 또는 레이저 부식(cauterization)을 사용함으로써, 누소관을 폐쇄시키는 방법을 포함한다. 그러한 시술들은 안구 건조증을 치료하기 위해 눈물 흐름을 차단하는 바람직한 결과를 가져다 줄 수 있지만, 공교롭게도 재생 수술 없이는 되돌릴 수가 없다.
눈 질환 또는 장애 관리 분야에서, 환자와 의사는, 안구 건조증의 완화 뿐만 아니라, 눈으로의 적합한 전달 또는 기타 치료 제제 전달 등의 다양한 문제에 직면하고 있다. 눈 관리에서, 예를 들면, 현재의 다수의 약제의 눈 전달 시스템은 반복적인 수동 투여를 요하고 있어, 환자의 치료 순응도(compliance) 부족 또는 눈에 도달하는 약제의 부적절한 농도로 인해 대게 비효율적이다.
눈의 감염, 눈의 염증, 녹내장, 및 기타 눈 질환 또는 장애를 치료하기 위해, 눈에 약물이나 기타 치료 제제를 자주 투여하여야 한다. 종래의 약물 전달 방법은 눈의 표면에 국소 점적하는 방식에 의한 것이다. 국소 점안제는 효과적이기는 하지만 비효율적일 수 있다. 일 예로, 점안제를 눈에 주입할 때, 흔히 결막낭(conjinctival sac)(즉, 눈과 눈꺼풀 사이의 포켓)에 과도하게 채워져, 눈꺼풀 가장자리에서 넘쳐 볼로 흘러내리게 되어, 점안제가 상당량 소실되게 된다. 또한, 안구 표면에 남아 있는 다량의 점안제가 누소관으로 들어가 씻겨져 버릴 수 있으며, 그로 인해 눈에 흡수되어 눈을 치료하기 전에, 약물의 농도가 묽게 된다. 또한, 국소적으로 적용된 약물은 대게 적용 후 두 시간 동안 최대 효과를 나타내기 때문에, 이 후에 바람직한 약물 치료 효과를 유지하기 위해, 자주는 아니지만 약물의 추가 적용이 요구된다.
눈 관리를 더욱 어렵게 하는 것은, 환자가 점안제를 종종 처방된 대로 사용하지 않는다는 것이다. 이렇게 치료 순응도가 좋지 못한 것은, 예를 들면 점안제에 의해 생기는 초기의 쓰라림 또는 화끈거림을 환자가 경험하게 되기 때문이다. 자신의 눈에 점안제를 주입하는 행위는, 부분적으로는 눈을 보호하려는 정상적인 반사작용으로 인해 어려울 수 있다. 그래서, 점안제가 한 방울 또는 몇 방울도 눈에 들어가지 않을 수 있다. 고령의 환자는 관절염, 떨림 및 시력 감소로 인해 추가적인 문제가 있을 수 있다. 소아 및 정신질환자 역시 어려움이 있다.
본 발명자들은, 눈물이 눈에 체류하는 시간을 증가시키고 약물 또는 기타 치료 제제를 눈에 전달하는데 있어 유망한 다양한 기법들을 인지하고 있었다. 이러한 기법들은, 분리가능하며, 선택적으로, 누점을 통해 연결된 누소관으로 약물을 방출하는 누관 임플란트를 포함할 수 있다. 본 발명의 누관 임플란트는, 약물의 지속적인 방출을 가능하게 함으로써, 낮은 환자 순응도, 낭비적인 또는 시기적절치 못한 적용 등의 문제가 되는 점적 투여와 관련된 일부의 문제점들을 극복할 수 있을 것으로 여겨진다. 눈으로부터의 눈물 흐름을 성공적으로 차단하는 유용한 방법은, 누점에 분리가능한 누관 임플란트를 장착하는 것이다.
또한, 본 발명자들은, 누관 임플란트가, 누점 또는 연결된 누소관을 크게 편향시키지 않으면서 쉽게 이식 및 제거되는 능력, 이식시에 누점내에서 견고하게 유지되는 능력, 약물 전달 시스템으로 제조하여 사용하였을 때, 장기간 바람직한 치료학적 수준으로 약물의 지속적인 방출을 가능하게 하는 능력 중 한가지 이상을 가지고 있어야 한다는 것을 인식하였다.
질병 또는 장애를 치료하기 위한 누관 임플란트가 기술된다. 보다 상세하게는, 누관 임플란트, 이러한 임플란트의 제조 방법, 및 이러한 임플란트를 이용한 눈 질환 또는 장애의 치료 방법이 기술된다. 본원에 기술된 내용을 보다 잘 설명하기 위해, 예시적인 측면과 구현예들에 대한 비제한적인 리스트를 본원에 제공한다.
1. 누소관(lacrimal canaliculus)에 삽입할 수 있는 누관 임플란트로서,
상기 누관 임플란트는,
유체 투과성 유지 장치(retainer)를 가지고 있는 체류 구조를 포함하는 임플란트 본체;
상기 체류 구조에 의해 실질적으로 둘러싸여 있고, 상기 체류 구조를 누소관에 이식하였을 때 확장가능한, 하이드로겔 체류 부재를 포함하며,
상기 유체 투과성 유지 장치는 상기 체류 구조로의 유체의 투과를 허용하며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조의 바깥쪽으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 누관 임플란트.
2. 상기 체류 구조는 상기 하이드로겔 체류 부재가 배치되는 1개 이상의 챔버를 포함하는, 제1 측면에 따른 누관 임플란트.
3. 상기 임플란트 본체의 적어도 일부가 상기 누점의 외부에 잔류하는, 제1 또는 제2 측면에 따른 누관 임플란트.
4. 상기 임플란트 본체가 상기 누점 안으로 완전히 삽입가능한, 제1 또는 제2 측면에 따른 누관 임플란트.
5. 상기 유체 투과성 유지 장치는 상기 확장된 하이드로겔 체류 부재가 상기 체류 구조의 외부로 돌출되는 것을 80% 이상 저지하는, 제1 내지 제4 중 어느 한 측면에 따른 누관 임플란트.
6. 상기 유체 투과성 유지 장치가, 50 중량% 이상의 실리콘과, 콘택트 렌즈 물질, 소듐 클로라이드, 폴리에틸렌 산화물, 폴리에틸렌 글리콜, 폴리비닐 피릴리돈, 폴리비닐 알코올 및 이의 임의 조합으로 이루어진 군으로부터 선택되는 1종 이상의 친수성 폴리머를 조합하여 포함하는, 유체 투과부를 포함하는, 제1 내지 제5 중 어느 한 측면에 따른 누관 임플란트.
7. 상기 유체 투과성 유지 장치가 약 80 중량% 이상의 실리콘을 포함하는, 제6 측면에 따른 누관 임플란트.
8. 상기 유체 투과성 유지 장치가 약 60 중량%의 실리콘과 약 40 중량%의 소듐 클로라이드를 포함하는, 제6 측면에 따른 누관 임플란트.
9. 상기 유체 투과성 유지 장치가 약 70 중량%의 실리콘과 약 30 중량%의 폴리비닐 피릴리돈을 포함하는, 제6 측면에 따른 누관 임플란트.
10. 상기 유체 투과성 유지 장치가 약 75 중량%의 실리콘과 약 25 중량%의 폴리에틸렌 산화물을 포함하는, 제6 측면에 따른 누관 임플란트.
11. 상기 유체 투과성 유지 장치가 약 80 중량%의 실리콘과 약 20 중량%의 콘텍트 렌즈 물질을 포함하는, 제6 측면에 따른 누관 임플란트.
12. 상기 콘택트 렌즈 물질이 하이드로겔, 2-하이드록시에틸 메타크릴레이트(HEMA) 공중합체 또는 폴리(메틸 메타크릴레이트)(PMMA) 공중합체 중 한가지 이상을 포함하는, 제6 측면에 따른 누관 임플란트.
13. 상기 하이드로겔 체류 부재는 폴리우레탄 또는 실리콘 중 한가지 이상을 포함하는, 제1 내지 제12 중 어느 한 측면에 따른 누관 임플란트.
14. 상기 하이드로겔 체류 부재는 미확장 체적의 최대 1배에 해당하는 확장력을 가지는, 제1 내지 제13 중 어느 한 측면에 따른 누관 임플란트.
15. 상기 하이드로겔 체류 부재는 미확장 체적의 최대 10배에 해당하는 확장력을 가지는, 제1 내지 제13 중 어느 한 측면에 따른 누관 임플란트.
16. 상기 하이드로겔 체류 부재는 미확장 체적의 최대 100배에 해당하는 확장력을 가지는, 제1 내지 제13 중 어느 한 측면에 따른 누관 임플란트.
17. 상기 임플란트 본체는 외표면부가 상기 하이드로겔 체류 부채의 확장시에 바깥쪽으로 변형될 수 있는, 제1 내지 제16 중 어느 한 측면에 따른 누관 임플란트.
18. 상기 임플란트 본체가 실리콘, 폴리우레탄 또는 아크릴 중 한가지 이상을 포함하는 탄성 물질을 포함하는, 제17 측면에 따른 누관 임플란트.
19. 상기 임플란트 본체의 근단부나 그 주위로부터 적어도 부분적으로 연장되며 누점에 받쳐져서 놓이는 임플란트 본체 돌출부를 포함하는, 제1 내지 제18 중 어느 한 측면에 따른 누관 임플란트.
20. 상기 돌출부의 근단부는 볼록 형태인, 제19 측면에 따른 누관 임플란트.
21. 상기 임플란트 본체의 외표면부 상에 배치되며, 상기 누소관에 위치되었을 때 상기 임플란트 본체의 제2 확장을 제공하는, 유체 팽윤성 물질을 포함하는, 제1 내지 제20 중 어느 한 측면에 따른 누관 임플란트.
22. 상기 체류 구조의 길이가 상기 임플란트 본체 길이의 약 1/5 이상인, 제1 내지 제21 중 어느 한 측면에 따른 누관 임플란트.
23. 상기 체류 구조의 길이가 상기 임플란트 본체 길이의 약 1/4 이상인, 제1 내지 제21 중 어느 한 측면에 따른 누관 임플란트.
24. 상기 체류 구조의 길이가 상기 임플란트 본체 길이의 약 1/3 이상인, 제1 내지 제21 중 어느 한 측면에 따른 누관 임플란트.
25. 상기 체류 구조의 길이가 상기 임플란트 본체 길이의 약 1/2 이상인, 제1 내지 제21 중 어느 한 측면에 따른 누관 임플란트.
26. 상기 체류 구조의 길이가 상기 임플란트 본체 길이의 약 3/4 이상인, 제1 내지 제21 중 어느 한 측면에 따른 누관 임플란트.
27. 상기 체류 구조의 길이가 상기 임플란트 본체 길이와 거의 동일한, 제1 내지 제21 중 어느 한 측면에 따른 누관 임플란트.
28. 눈으로 제제를 방출하기 위한, 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는,
근단부에서 원단부 방향으로 연장되며, 상기 근단부나 그 근처에 약물 코어를, 상기 원단부나 그 근처에 체류 구조를 포함하는, 임플란트 본체를 포함하며,
상기 약물 코어는 제제를 포함하며, 눈으로 제제를 방출하는 하나 이상의 표면을 가지며,
상기 체류 구조는 유체 투과성 유지 장치를 가지며, 실질적으로 하이드로겔 체류 부재를 둘러싸고 있으며, 상기 체류 구조가 누소관 안에 있을 때 상기 하이드로겔 체류 부재는 확장될 수 있으며,
상기 유체 투과성 유지 장치는 상기 체류 구조로의 유체의 투과를 허용하며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조의 외부로 돌출되는 것을 저지하는, 누관 임플란트.
29. 상기 임플란트 본체가 상기 약물 코어를 보유하는 제1 챔버와 상기 하이드로겔 체류 부재를 보유하는 제2 챔버를 포함하며, 상기 제2 챔버는 상기 제1 챔버의 원단부에 배치되는, 제28 측면에 따른 누관 임플란트.
30. 상기 약물 코어는, 고체 매트릭스에 분산되어 있으며, 외피 바디에 의해 적어도 부분적으로 덮혀져 하나 이상의 노출된 약물 코어 표면을 형성하고, 하나 이상의 치료 제제 봉입체를 포함하는, 제28 또는 제29 측면에 따른 누관 임플란트.
31. 상기 하나 이상의 약물 코어 표면은 상기 임플란트 본체의 근단부에 인접하게 배치되어, 임플란트 본체를 누점에 삽입하였을 때, 눈물과 접촉하여 상기 치료 제제를 장시간 방출하는, 제30 측면에 따른 누관 임플란트.
32. 상기 약물 코어와 상기 체류 구조는 함께 일체형(single piece)으로 성형가능한, 제28 내지 제31 중 어느 한 측면에 따른 누관 임플란트.
33. 상기 약물 코어는 제1 일체형으로 제조되고, 상기 체류 구조는 제2 일체형으로 제조되며, 상기 제1 일체형은 상기 제2 일체형과 커플링될 수 있는, 제28 내지 제31 중 어느 한 측면에 따른 누관 임플란트.
34. 상기 유체 투과성 유지 장치는, 약 50 중량% 이상의 실리콘과, 콘택트 렌즈 물질, 소듐 클로라이드, 폴리에틸렌 산화물, 폴리에틸렌 글리콜, 폴리비닐 피릴리돈, 폴리비닐 알코올 및 이의 임의 조합으로 이루어진 군으로부터 선택되는 1종 이상의 친수성 폴리머를 조합하여 포함하는 유체 투과부를 포함하는, 제28 내지 제33 중 어느 한 측면에 따른 누관 임플란트.
35. 상기 약물 코어를 포함하는 상기 임플란트 본체의 근단부는 제1 물질을 포함하며, 상기 체류 구조를 포함하는 상기 임플란트 본체의 원단부는 상기 제1 물질과 상이한 제2 물질을 포함하는, 제28 내지 제34 중 어느 한 측면에 따른 누관 임플란트.
36. 상기 임플란트 본체의 근단부의 인접 위치로부터 적어도 부분적으로 연장되며, 누점에 받쳐져서 놓여지는, 임플란트 본체 돌출부를 포함하는, 제28 내지 제35 중 어느 한 측면에 따른 누관 임플란트.
37. 상기 약물 코어와 상기 하이드로겔 체류 부재 사이에 위치하는 임플란트 본체 격막을 포함하며, 상기 격막은 상기 약물 코어와 상기 하이드로겔 체류 부재 간의 물질의 이동을 방지하는, 제28 내지 제36 중 어느 한 측면에 따른 누관 임플란트.
38. 상기 임플란트 본체의 외표면부 상에 배치되며, 상기 누소관 내부에 위치되었을 때 상기 임플란트 본체의 제2 확장을 제공하는, 유체 팽윤성 물질을 포함하는 것을 특징으로 하는, 제28 내지 제37 중 어느 한 측면에 따른 누관 임플란트.
39. 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는
유체 투과성 구멍을 가진 체류 구조를 포함하는 임플란트 본체;
상기 체류 구조에 의해 실질적으로 둘러싸여 있으며, 상기 체류 구조를 누소관에 이식하였을 때, 확장가능한, 하이드로겔 체류 부재를 포함하며;
상기 유체 투과성 구멍은 상기 체류 구조로의 유체의 흐름을 허용하는 크기와 형태를 가지며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 누관 임플란트.
40. 상기 유체 투과성 구멍의 크기 및 형태는 상기 하이드로겔 체류 부재의 이탈을 확장된 하이드로겔 체류 부재의 10% 미만으로 저지하는, 제39 측면에 따른 누관 임플란트.
41. 상기 유체 투과성 구멍의 크기 및 형태는 상기 하이드로겔 체류 부재의 이탈을 확장된 하이드로겔 체류 부재의 5% 미만으로 저지하는, 제39 또는 제40 측면에 따른 누관 임플란트.
42. 상기 유체 투과성 구멍의 크기 및 형태는 상기 하이드로겔 체류 부재의 이탈을 확장된 하이드로겔 체류 부재의 1% 미만으로 저지하는, 제39 내지 제41 중 어느 한 측면에 따른 누관 임플란트.
43. 상기 유체 투과성 구멍의 크기 및 형태는 초기 건조 상태와 확장된 수화 상태 모두에서 하이드로겔 체류 부재의 유출을 방지하는, 제39 내지 제42 중 어느 한 측면에 따른 누관 임플란트.
44. 상기 유체 투과성 구멍의 크기 및 형태는 약 0.3 mm 이하의 직경을 포함하는, 제39 내지 제43 중 어느 한 측면에 따른 누관 임플란트.
45. 상기 임플란트 본체의 근단부에 커플링되는 비투과성, 비친수성 캡 부재를 포함하는, 제39 내지 제44 중 어느 한 측면에 따른 누관 임플란트.
46. 상기 유체 투과성 구멍을 덮을 수 있으며, 상기 체류 구조의 내부 또는 외부에 배치되며, 분자량이 10,000 달톤 이하인, 구멍막을 포함하는, 제39 내지 제45 중 어느 한 측면에 따른 누관 임플란트.
47. 눈으로 제제를 방출하기 위한, 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는,
근단부에서 원단부 방향으로 연장되며, 상기 근단부나 그 근처에 약물 코어를, 상기 원단부나 그 근처에 체류 구조를 포함하는, 임플란트 본체;
상기 체류 구조에 의해 실질적으로 둘러싸여 있으며, 상기 체류 구조를 누소관에 이식하였을 때, 확장가능한, 하이드로겔 체류 부재를 포함하며,
상기 약물 코어는 눈에 상기 제제의 방출을 제공하는 하나 이상의 표면을 가지며, 상기 체류 구조는 유체 투과성 구멍을 가지며,
상기 유체 투과성 구멍이 상기 체류 구조로의 유체 흐름을 허용하는 크기와 형태를 가지며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 누관 임플란트.
48. 상기 유체 투과성 구멍의 크기 및 형태가 약 0.3 mm 이하의 직경을 포함하는, 제47 측면에 따른 누관 임플란트.
49. 상기 임플란트 본체의 근단부에 커플링되는 비투과성, 비친수성 캡 부재를 포함하는, 제47 또는 제48 측면에 따른 누관 임플란트.
50. 상기 유체 투과성 구멍을 덮을 수 있으며, 상기 체류 구조의 내부 또는 외부에 배치되고, 분자량이 10,000 달톤 이하인, 구멍막을 포함하는, 제47 내지 제49 중 어느 한 측면에 따른 누관 임플란트.
51. 상기 약물 코어와 상기 하이드로겔 체류 부재 사이에 위치되며, 상기 약물 코어와 상기 하이드로겔 체류 부재 간의 물질의 이동을 방지하는, 임플란트 본체 격막을 포함하는, 제47 내지 제50 중 어느 한 측면에 따른 누관 임플란트.
52. 누점으로 삽입가능한 누관 임플란트로서,
근단부에서 원단부 방향으로 연장되며, 원단부에서 커플링되는 유체 투과성 또는 친수성 캡 부재를 포함하는, 체류 구조를 가지는, 임플란트 본체;
상기 체류 구조에 의해 실질적으로 둘러싸여 있으며, 상기 체류 구조가 누소관 안에 있을 때, 확장가능한, 하이드로겔 체류 부재를 포함하며,
상기 캡 부재는 상기 체류 구조로의 유체 투과를 허용하며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 누관 임플란트.
53. 상기 캡 부재가, 약 50 중량% 이상의 실리콘과, 콘택트 렌즈 물질, 소듐 클로라이드, 폴리에틸렌 산화물, 폴리에틸렌 글리콜, 폴리비닐 피릴리돈, 폴리비닐 알코올 및 이의 임의 조합으로 이루어진 군으로부터 선택되는 1종 이상의 친수성 폴리머를 조합하여 포함하는, 제52 측면에 따른 누관 임플란트.
54. 상기 캡 부재가 상기 누점내로의 비외상성 삽입을 용이하게 하기 위해 데이퍼형 원위팁부를 포함하는 제52 또는 제53 측면에 따른 누관 임플란트.
55. 상기 캡 부재가 상기 체류 구조의 원단부만 덮는, 제52 내지 제54 중 어느 한 측면에 따른 누관 임플란트.
56. 상기 캡 부재가 상기 체류 구조의 원단부에 꼭 맞는, 제55 측면에 따른 누관 임플란트.
57. 상기 캡 부재가 상기 체류 구조의 내벽 방향으로 적어도 부분적으로 오목하게 들어간 것인, 제55 측면에 따른 누관 임플란트.
58. 상기 캡 부재가 상기 체류 구조의 원단부와 측표면을 덮는, 제52 내지 제54 중 어느 한 측면에 따른 누관 임플란트.
59. 눈으로 제제를 방출하기 위한, 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는
근단부에서 원단부 방향으로 연장되며, 상기 근단부나 그 근처에 약물 코어를, 상기 원단부나 그 근처에 체류 구조를 가지는, 임플란트 본체;
상기 체류 구조에 의해 실질적으로 둘러싸여 있으며, 상기 체류 구조가 누소관 안에 있을 때 확장될 수 있는, 하이드로겔 체류 부재를 포함하며,
상기 약물 코어는 눈에 상기 제제의 방출을 제공하는 하나 이상의 표면을 포함하며, 상기 체류 구조는 상기 임플란트 본체의 상기 원단부에 커플링되는 유체 투과성 또는 친수성 캡 부재를 가지며,
상기 캡 부재는 상기 체류 구조로의 유체의 투과를 허용하며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 누관 임플란트.
60. 상기 약물 코어의 하나 이상의 표면 주위에서 적어도 부분적으로 연장되며, 볼록형 근단부를 포함하는, 임플란트 본체 돌출부를 포함하는 것을 특징으로 하는, 제59 측면에 따른 누관 임플란트.
61. 상기 약물 코어와 상기 하이드로겔 체류 부재 사이에 위치되는 임플란트 본체 격막을 포함하며, 상기 격막은 상기 약물 코어와 상기 하이드로겔 체류 부재 간의 물질의 이동을 방지하는, 제59 또는 제60 측면에 따른 누관 임플란트.
62. 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는
하나 이상의 영역이 유체 투과성 또는 친수성 물질로 구성된 체류 구조를 포함하는 임플란트 본체와;
상기 체류 구조에 의해 실질적으로 둘러싸여 있으며, 상기 체류 구조를 누소관에 이식하였을 때, 확장될 수 있는, 하이드로겔 체류 부재를 포함하며;
상기 체류 투과성 또는 친수성 물질로 구성된 상기 체류 구조는 상기 체류 구조로의 유체의 투과를 허용하며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 누관 임플란트.
63. 상기 유체 투과성 또는 친수성 물질은 약 50 중량% 이상의 실리콘과, 콘택트 렌즈 물질, 소듐 클로라이드, 폴리에틸렌 산화물, 폴리에틸렌 글리콜, 폴리비닐 피릴리돈, 폴리비닐 알코올 및 이의 임의 조합으로 이루어진 군으로부터 선택되는 1종 이상의 친수성 폴리머를 조합하여 포함하는, 제62 측면에 따른 누관 임플란트.
64. 상기 유체 투과성 또는 친수성 물질이 하이드로겔을 포함하는, 제62 또는 제63 측면에 따른 누관 임플란트.
65. 상기 유체 투과성 또는 친수성 물질로 구성된 상기 체류 구조가 누소관에 있을 때, 상기 체류 구조가 유체에 노출가능한 측표면에 배치되는, 제62 내지 제64 중 어느 한 측면에 따른 누관 임플란트.
66. 상기 유체 투과성 또는 친수성 물질로 구성된 체류 구조가 상기 체류 구조의 전체 측표면의 약 5% 내지 약 50%에 해당하는, 제65 측면에 따른 누관 임플란트.
67. 상기 유체 투과성 또는 친수성 물질로 구성된 체류 구조가 상기 체류 구조의 전체 측표면의 50% 이상인, 제65 측면에 따른 누관 임플란트.
68. 상기 유체 투과성 또는 친수성 물질로 구성된 체류 구조가 상기 체류 구조의 전체 측표면의 약 100%에 해당하는, 제65 측면에 따른 누관 임플란트.
69. 상기 체류 구조는 상기 임플란트 본체의 근단부에서 커플링되는 유체 투과성 또는 친수성 캡 구성을 포함하는, 제62 내지 제68 중 어느 한 측면에 따른 누관 임플란트.
70. 눈으로 제제를 방출하기 위한, 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는,
근단부에서 원단부 방향으로 연장되며, 상기 근단부나 그 근처에 약물 코어를, 상기 원단부의 근처에 유체 투과성 또는 친수성 물질로 적어도 부분적으로 구성된 체류 구조를 포함하는, 임플란트 본체와;
상기 체류 구조에 의해 실질적으로 둘러싸여 있으며, 상기 체류 구조를 누소관에 이식하였을 때 확장될 수 있는, 하이드로겔 체류 부재를 포함하며;
상기 약물 코어는 눈에 상기 제제의 방출을 제공하는 하나 이상의 표면을 포함하며,
상기 체류 구조의 상기 유체 투과성 또는 친수성 물질 부분이 상기 체류 구조로의 유체의 투과를 허용하며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 누관 임플란트.
71. 상기 체류 구조가 상기 임플란트 본체의 원단부에 커플링되는 유체 투과성 또는 친수성 캡 부재를 포함하는, 제70 측면에 따른 누관 임플란트.
72. 상기 임플란트 본체의 근단부가 비투과성 및 비친수성 물질을 포함하는, 제70 또는 제71 측면에 따른 누관 임플란트.
73. 상기 약물 코어의 하나 이상의 표면 주위로부터 적어도 부분적으로 연장되며, 볼록한 근단부를 포함하는, 임플란트 본체 돌출부를 포함하는, 제70 내지 제72 중 어느 한 측면에 따른 누관 임플란트.
74. 상기 약물 코어와 상기 하이드로겔 체류 부재 사이에 위치되는 임플란트 본체 격막을 포함하며, 상기 격막은 상기 약물 코어와 상기 하이드로겔 체류 부재 간의 물질의 이동을 방지하는, 제70 내지 제73 중 어느 한 측면에 따른 누관 임플란트.
75. 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는
체류 구조를 포함하는 임플란트 본체와;
상기 체류 구조에 의해 실질적으로 완전히 둘러싸여 있으며, 상기 체류 구조가 누소관 안에 있을 때 확장가능한, 유체 비흡수성 체류 부재를 포함하며,
상기 체류 구조가 확장된 동안에 상기 체류 구조 밖으로 상기 유체 비흡수성 체류 부재가 나가지 못하도록 저지하는 것을 특징으로 하는, 누관 임플란트.
76. 상기 유체 비흡수성 체류 부재가 형상-기억 열가소성 물질을 포함하는, 제75 측면에 따른 누관 임플란트.
77. 상기 형상-기억 열가소성 물질이 우레탄계(urethane-based)인, 제76 측면에 따른 누관 임플란트.
78. 상기 유체 비흡수성 체류 부재가 산화물 생성 시스템을 포함하며, 상기 산화물 생성 시스템은 상기 누점 안에 삽입시 상기 체류 구조 내부에서 복수의 산화물을 생성 및 방출하는, 제75 측면에 따른 누관 임플란트.
79. 상기 체류 구조는 유체 비흡수성 체류 부재가 배치되는 하나 이상의 챔버를 포함하는, 제75 내지 제78 중 어느 한 측면에 따른 누관 임플란트.
80. 상기 임플란트 본체의 근단부나 그 주위에서 적어도 부분적으로 연장되며, 누점에 받쳐져서 놓이는, 임플란트 본체 돌출부를 포함하는, 제75 내지 제79 중 어느 한 측면에 따른 누관 임플란트.
81. 상기 돌출부의 상기 근단부가 볼록 형태인, 제80 측면에 따른 누관 임플란트.
82. 상기 임플란트 본체의 외표면 상에 배치되며, 임플란트 본체의 이차적인 유지를 제공하는, 유체 팽윤성 물질을 포함하는, 제75 내지 제81 중 어느 한 측면에 따른 누관 임플란트.
83. 눈으로 제제를 방출하기 위한, 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는,
근단부에서 원단부 방향으로 연장되며, 상기 근단부나 그 근처에 약물 코어를, 상기 원단부나 그 근처에 체류 구조를 포함하는, 임플란트 본체와;
상기 체류 구조에 의해 실질적으로 완전히 둘러싸여 있으며, 상기 체류 구조가 누소관 안에 있을 때 확장가능한, 유체 비흡수성 체류 부재를 포함하며,
상기 약물 코어가 눈에 상기 제제의 방출을 제공하는 하나 이상의 표면을 포함하고,
상기 체류 구조는, 확장된 동안에, 상기 유체 비흡수성 체류 부재가 상기 체류 구조 밖으로 나가는 것을 저지하는 것을 특징으로 하는, 누관 임플란트.
84. 상기 임플란트 본체가 상기 약물 코어를 보유하는 제1 챔버와 상기 유체 비흡수성 체류 부재를 보유하는 제2 챔버를 포함하며, 상기 제2 챔버는 상기 제1 챔버의 원단부에 배치되는, 제83 측면에 따른 누관 임플란트.
85. 상기 임플란트 본체의 근단부 상에서 상기 약물 코어의 하나 이상의 표면 주위에서 적어도 부분적으로 연장되는 임플란트 본체 돌출부를 포함하는, 제83 또는 제84 측면에 따른 누관 임플란트.
86. 상기 약물 코어와 상기 유체 비흡수성 체류 부재 사이에 위치되는 임플란트 본체 격막을 포함하며, 상기 격막은 상기 약물 코어와 상기 유체 비흡수성 체류 부재 간의 물질의 이동을 방지하는, 제83 내지 제85 중 어느 한 측면에 따른 누관 임플란트.
87. 상기 약물 코어를 포함하는 임플란트 본체의 근단부는 제1 물질을 포함하고, 상기 유체 비흡수성 체류 구조를 포함하는 임플란트 본체의 상기 원단부는 제1 물질과는 상이한 제2 물질을 포함하는, 제83 내지 제86 중 어느 한 측면에 따른 누관 임플란트.
88. 1, 28, 39, 47, 52, 59, 62, 70, 75 또는 83 측면에 따른 누관 임플란트; 및
안 질환을 치료하기 위한 상기 누관 임플란트의 이용법에 대한 설명서를 포함하는 안 질환 치료용 키트.
89. 1, 28, 39, 47, 52, 59, 62, 70, 75 또는 83 측면에 따른 누관 임플란트; 및
안 질환을 치료하기 위한 상기 누관 임플란트의 이용법에 대한 설명서를 포함하며,
상기 누관 임플란트는 1회 사용 용도로 개별 포장된, 안 질환 치료용 키트.
90. 누점으로 삽입가능한 누관 임플란트의 제조 방법으로서,
체류 구조의 영역을 통해 유체 투과성 유지 장치를 형성하는 것을 포함하는, 체류 구조를 포함하는 임플란트 본체를 형성하는 단계;
상기 체류 구조를 이용하여, 상기 체류 구조가 누소관 안에 있을 때 확장가능한 하이드로겔 체류 부재를 실질적으로 둘러싸는 단계를 포함하며,
상기 유체 투과성 유지 장치를 형성하는 단계는 상기 체류 구조로의 유체의 투과를 허용하는 구조를 형성하는 단계를 포함하며, 확장시에 상기 하이드로겔 체류 부재가 상기 체류 구조 외부 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는 방법.
91. 상기 하이드로겔 체류 부재를 실질적으로 둘러싸는 단계는 상기 체류 구조의 하나 이상의 챔버 안에 상기 하이드로겔 체류 부재를 배치하는 단계를 포함하는, 제90 측면에 따른 방법.
92. 상기 하이드로겔 체류 부재를 실질적으로 둘러싸는 단계는 상기 임플란트 본체의 외표면 경계내에 상기 하이드로겔 체류 부재를 위치시키는 단계를 포함하는, 제90 또는 제91 측면에 따른 방법.
93. 상기 유체 투과성 유지 장치를 형성하는 단계는 상기 체류 구조로부터 상기 하이드로겔 체류 부재의 유출을 저지하는 크기와 형태를 가진 유체 투과성 구멍을 형성하는 단계를 포함하는, 제90 내지 제92 측면 중 어느 하나의 측면에 따른 방법.
94. 상기 유체 투과성 유지 장치를 형성하는 단계는 상기 임플란트 본체의 근단부와 커플링가능한 유체 투과성 또는 친수성 캡 부재를 형성하는 단계를 포함하는, 제90 내지 제93 측면 중 어느 하나의 측면에 따른 방법.
95. 상기 유체 투과성 또는 친수성 캡 부재를 형성하는 단계는 약 50 중량% 이상의 실리콘과, 콘택트 렌즈 물질, 소듐 클로라이드, 폴리에틸렌 산화물, 폴리에틸렌 글리콜, 폴리비닐 피릴리돈 또는 폴리비닐 알코올 중 한가지 이상을 조합하는 단계를 포함하는, 제94 측면에 따른 방법.
96. 상기 유체 투과성 유지 장치를 형성하는 단계는 유체 투과성 또는 친수성 임플란트 본체 부분을 형성하는 단계를 포함하는, 제90 내지 제95 측면 중 어느 하나의 측면에 따른 방법.
97. 상기 투과성 또는 친수성 임플란트 본체 부분은, 약 50 중량% 이상의 실리콘과, 콘택트 렌즈 물질, 소듐 클로라이드, 폴리에틸렌 산화물, 폴리에틸렌 글리콜, 폴리비닐 피릴리돈 또는 폴리비닐 알코올 중 한가지 이상을 조합하여 포함하는, 제96 측면에 따른 방법.
98. 상기 임플란트 본체를 형성하는 단계는 비투과성, 비친수성 탄성 물질을 이용하여 제1 임플란트 본체 부분을 사출 성형하는 단계, 및 적어도 부분적으로 유체 투과성 또는 친수성 탄성 물질을 이용하여 제2 임플란트 본체 부분을 사출 성형하는 단계를 포함하는, 제90 내지 제97 측면 중 어느 하나의 측면에 따른 방법.
99. 상기 임플란트 본체를 형성하는 단계는 볼록 근단부를 가지며 누점 보다 직경 크기가 큰 임플란트 본체 돌출부를 성형하는 단계를 포함하는, 제90 내지 제98 측면 중 어느 하나의 측면에 따른 방법.
100. 약물 유출부를 통해 제제의 방출이 이루어지도록 상기 약물 코어의 위치를 설정하는 단계를 포함하는, 상기 임플란트 본체의 근단부에 약물 코어를 배치하는 단계를 포함하는, 제90 내지 제99 측면 중 어느 하나의 측면에 따른 방법.
101. 상기 임플란트 본체를 형성하는 단계는 상기 약물 코어와 상기 체류 구조 사이에 임플란트 본체 격막을 성형하는 단계를 포함하는, 제90 내지 제100 측면 중 어느 하나의 측면에 따른 방법.
102. 약 1분 내지 약 60분의 시간 안에 보유 크기 및 형태로 확장될 수 있는 하이드로겔 체류 부재를 형성하는 것을 포함하는, 상기 확장성 하이드로겔 체류 부재를 형성하는 단계를 포함하는, 제90 내지 제101 측면 중 어느 하나의 측면에 따른 방법.
103. 상기 임플란트 본체에 유체 팽윤성 물질을 부착시키기 위해 상기 임플란트 본체의 외표면을 표면 처리하는 단계를 포함하는, 제90 내지 제102 측면 중 어느 하나의 측면에 따른 방법.
104. 상기 임플란트 본체의 외표면부를 표면 처리하는 단계는 상기 임플란트 본체 부분을 플라즈마 처리하는 단계를 포함하는, 제103 측면에 따른 방법.
105. 상기 임플란트 본체의 외표면부를 상기 유체 팽윤성 물질로 코팅하는 단계를 포함하는, 제103 또는 제104 측면에 따른 방법.
106. 상기 하이드로겔 체류 부재의 직접 확장을 유도하기 위해, 상기 임플란트 본체의 일부분을 예비-압박하는 단계를 포함하는, 제90 내지 제105 측면 중 어느 하나의 측면에 따른 방법.
107. 상기 임플란트 본체의 예비-압박된 부분이 상기 임플란트 본체의 축에 대해 실질적으로 수직 방향으로 상기 하이드로겔 체류 부재의 확장을 유도하는, 제106 측면에 따른 방법.
108. 상기 하이드로겔에 대한 폴리우레탄 또는 실리콘의 비율을 변경시키는 단계를 포함하는, 상기 하이드로겔 체류 부재의 팽윤 정도를 조절하는, 제90 내지 제107 측면 중 어느 하나의 측면에 따른 방법.
109. 안 질환 개체의 치료 방법으로서,
상기 개체의 하나 이상의 누점에 누관 임플란트를 삽입하는 단계를 포함하며,
상기 누관 임플란트는, 근단부에서 원단부 방향으로 연장되며, 상기 근단부 근처에 약물 코어를, 상기 원단부나 그 근처에 체류 구조를 포함하는, 임플란트 본체와; 유체 투과성 유지 장치를 가지며, 상기 체류 구조가 누소관 안에 있을 때 확장가능한 하이드로겔 체류 부재를 실질적으로 둘러싸고 있는 체류 구조를 포함하며,
상기 약물 코어는 제제를 포함하며, 상기 제제의 눈으로의 방출을 제공하는 하나 이상의 표면을 가지며,
상기 유체 투과성 유지 장치는 상기 체류 구조로의 유체의 투과를 허용하며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 치료 방법.
110. 47, 59, 70 또는 83 측면에 따른 하나 이상의 누관 임플란트를 개체의 하나 이상의 누점에 삽입하는 단계를 포함하는 눈 장애를 가진 개체의 치료 방법.
111. 상기 개체가 인간인, 제109 또는 110 측면에 따른 방법.
112. 상기 눈 장애가 녹내장 질환인, 제109 또는 110 측면에 따른 방법
113. 상기 녹내장 질환이 안압 또는 원발성 개방우각 녹내장(primary open angle glaucoma)인, 제112 측면에 따른 방법.
114. 상기 제제가 녹내장 치료제인, 제113 측면에 따른 방법.
115. 상기 눈 장애가 알레르기와 관련있는, 제109 또는 110 측면에 따른 방법.
116. 상기 누관 임플란트의 교체는 1년에 2회 반복되는, 제115 측면에 따른 방법.
117. 상기 누관 임플란트의 삽입을 누점 바깥쪽에 임플란트 본체의 최근단부가 있도록 상기 누점을 통해 부분적으로 이루어지는, 제109 또는 110 측면에 따른 방법.
118. 삽입된 누관 임플란트를 시간 간격 경과 후 동일하거나 적거나 또는 많은 용량의 약제를 가진 제2 누관 임플란트로 교체하는 단계를 포함하는, 제109 또는 110 측면에 따른 방법.
119. 상기 시간 간격은 1달 이상인, 제118 측면에 따른 방법.
120. 상기 누관 임플란트의 교체는 2회 이상, 3회 이상, 4회 이상 또는 5회 이상 반복되는, 제118 또는 119 측면에 따른 방법.
121. 상기 누관 임플란트의 교체는 개체에게 더 이상 치료가 필요하지 않을 때까지 반복되는, 제118 내지 제120 중 한 측면에 따른 방법.
122. 상기 제제가 방출되는 시간 간격은 1주일 이상, 1달 이상 또는 3달 이상인, 제109 내지 제121 중 어느 한 측면에 따른 방법.
123. 상기 제제의 눈으로의 방출은 눈에 상기 제제의 지속적인 방출을 제공하는, 제109 내지 제122 중 어느 한 측면에 따른 방법.
124. 상기 제제의 눈으로의 방출은 약제의 눈으로의 방출을 포함하는, 제109 내지 제123 중 어느 한 측면에 따른 방법.
125. 상기 방출은 지속적인 방출인, 제29, 48, 60, 71 또는 84 중 어느 한 측면에 따른 방법.
본 발명의 누관 임플란트 및 방법에 대한 이들 구현예 및 다른 구현예, 이점 및 측면들이 다음의 상세한 설명에서 부분적으로 설명될 것이다. 본 개요는 본 특허출원의 주제에 대한 개괄을 제공하고자 하는 것이다. 그것은 본 발명에 대한 배타적이고 총괄적인 설명을 제공하고자 하는 것은 아니다. 상세한 설명은 본 특허출원에 대한 추가적 정보를 제공하고자 포함된다.
본 특허 문헌에는 유색으로 도시된 하나 이상의 도면이 포함되어 있다. 본 특허 문헌의 유색 도면의 복사본은 요청서와 필수 비용을 지불하면 사무국으로부터 제공받을 수 있다.
도면에서, 유사한 숫자가 여러 가지 시각에서 유사한 컴포넌트를 설명하기 위해 사용될 수 있다. 다른 문자 첨자를 가진 유사한 숫자는 유사한 컴포넌트의 다른 예를 나타내기 위해 사용될 수 있다. 도면은 본 문헌에서 논의되는 여러 가지 구현예를 일반적으로 예로서 그러나 제한을 목적으로 하지 않으면서 설명한다.
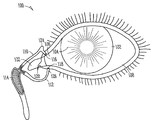
도 1 및 도 2는 누관 임플란트가 사용될 수 있는 적절한 환경을 가진 조직 구조물과 같은, 눈에 부속된 해부학적 조직 구조물의 개략도를 예시적으로 나타낸 것이다.
도 3a는 임플란트 본체의 체류 구조로 실질적으로 둘러싸인 확장성 체류 부재를 포함하는 임플란트 본체의 등각 투상도의 예를 나타낸 것이다.
도 3b는 선 3B-3B를 따르는 것과 같이, 임플란트의 길이방향 축에 평행한 선을 따라 취한 누관 임플란트의 일예의 횡단도이다.
도 3c는 임플란트의 길이방향 축에 평행한 선을 따라 취한 다른 누관 임플란트의 일예의 횡단도이다.
도 3D는 임플란트의 길이방향 축에 평행한 선을 따라 취한 다른 누관 임플란트의 일예의 횡단도이다.
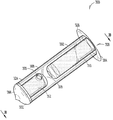
도 4는 실질적으로 둘러싸인 체류 부재의 크기 증가로부터 적어도 부분적으로 형성되는, 확장된 상태의 누관 임플란트의 일예의 등각 투상도이다.
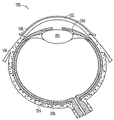
도 5는 확장된 상태이며, 누점 안에 장착되어 있는, 누관 임플란트의 일예의 개략도이다.
도 6은 임플란트 본체의 체류 구조에 의해 실질적으로 둘러싸여있는 확장성 체류 부재를 포함하는, 다른 누관 임플란트의 일예의 등각 투상도이다.
도 7은 임플란트 본체의 체류 구조에 의해 실질적으로 둘러싸여있는 확장성 체류 부재를 포함하는, 다른 누관 임플란트의 일예의 등각 투상도이다.
도 8은 임플란트 본체의 체류 구조에 의해 실질적으로 둘러싸여있는 확장성 체류 부재를 포함하는, 다른 누관 임플란트의 일예의 등각 투상도이다.
도 9는 임플란트 본체의 체류 구조에 의해 실질적으로 둘러싸여있는 확장성 체류 부재를 포함하는, 또다른 누관 임플란트의 일예의 등각 투상도이다.
도 10은 임플란트 본체의 체류 구조에 의해 실질적으로 둘러싸여있는 확장성 체류 부재를 포함하는 누관 임플란트의 제조 방법의 예를 도시한 것이다.
도 12 내지 18은 본 발명의 누관 임플란트의 실험 결과를 예시하고 그래프로 나타낸 것이다.
도면에서, 유사한 숫자가 여러 가지 시각에서 유사한 컴포넌트를 설명하기 위해 사용될 수 있다. 다른 문자 첨자를 가진 유사한 숫자는 유사한 컴포넌트의 다른 예를 나타내기 위해 사용될 수 있다. 도면은 본 문헌에서 논의되는 여러 가지 구현예를 일반적으로 예로서 그러나 제한을 목적으로 하지 않으면서 설명한다.
도 1 및 도 2는 누관 임플란트가 사용될 수 있는 적절한 환경을 가진 조직 구조물과 같은, 눈에 부속된 해부학적 조직 구조물의 개략도를 예시적으로 나타낸 것이다.
도 3a는 임플란트 본체의 체류 구조로 실질적으로 둘러싸인 확장성 체류 부재를 포함하는 임플란트 본체의 등각 투상도의 예를 나타낸 것이다.
도 3b는 선 3B-3B를 따르는 것과 같이, 임플란트의 길이방향 축에 평행한 선을 따라 취한 누관 임플란트의 일예의 횡단도이다.
도 3c는 임플란트의 길이방향 축에 평행한 선을 따라 취한 다른 누관 임플란트의 일예의 횡단도이다.
도 3D는 임플란트의 길이방향 축에 평행한 선을 따라 취한 다른 누관 임플란트의 일예의 횡단도이다.
도 4는 실질적으로 둘러싸인 체류 부재의 크기 증가로부터 적어도 부분적으로 형성되는, 확장된 상태의 누관 임플란트의 일예의 등각 투상도이다.
도 5는 확장된 상태이며, 누점 안에 장착되어 있는, 누관 임플란트의 일예의 개략도이다.
도 6은 임플란트 본체의 체류 구조에 의해 실질적으로 둘러싸여있는 확장성 체류 부재를 포함하는, 다른 누관 임플란트의 일예의 등각 투상도이다.
도 7은 임플란트 본체의 체류 구조에 의해 실질적으로 둘러싸여있는 확장성 체류 부재를 포함하는, 다른 누관 임플란트의 일예의 등각 투상도이다.
도 8은 임플란트 본체의 체류 구조에 의해 실질적으로 둘러싸여있는 확장성 체류 부재를 포함하는, 다른 누관 임플란트의 일예의 등각 투상도이다.
도 9는 임플란트 본체의 체류 구조에 의해 실질적으로 둘러싸여있는 확장성 체류 부재를 포함하는, 또다른 누관 임플란트의 일예의 등각 투상도이다.
도 10은 임플란트 본체의 체류 구조에 의해 실질적으로 둘러싸여있는 확장성 체류 부재를 포함하는 누관 임플란트의 제조 방법의 예를 도시한 것이다.
도 12 내지 18은 본 발명의 누관 임플란트의 실험 결과를 예시하고 그래프로 나타낸 것이다.
본 특허 문헌에서, 눈의 누점내에서의 견고한 유지를 제공하는 누관 임플란트 및 관련 방법이 기술된다. 누관 임플란트는 누점을 통해 누소관으로의 적어도 부분적으로 삽입할 수 있는 임플란트 본체를 포함할 수 있다. 임플란트 본체는 확장성 체류 부재를 실질적으로 둘러쌀 수 있는 변형성 체류 구조를 포함할 수 있다. 일부 구현예들에서, 확장성 체류 부재는 유체 투과성 유지 장치를 통하는 등에 의해 유체에 노출될 수 있는 하이드로겔 물질(예, 하이드로겔 체류 부재)을 포함할 수 있다. 하이드로겔 물질은 (즉, 유체의 수용시) 이러한 유체를 흡수하거나 보유(예, 흡수)하기 때문에, 체류 구조의 한곳 이상의 부분이 누소관의 벽 방향과 같이 바깥쪽으로 가압할 정도로, 이것의 크기는 커지고 형태는 변하게 되며, 그로 인해 누관 임플란트는 누점 안에서 견고하게 유지되게 된다. 다른 구현예에서, 확장성 체류 부재는 누점을 통해 누소관으로 삽입시 확장하도록 또는 확장되도록 구성될 수 있는, 실질적으로 유체 비흡수성 물질을 포함할 수 있다. 여러가지 구현예에서, 누관 임플란트는, 치료 제제의 지속적인 방출을 눈에 제공하기 위해, 임플란트 본체에 의해 보유된 약물-방출성 또는 다른 제제-방출성 코어를 추가로 포함할 수 있다.
본 발명의 누관 임플란트는 눈물의 흐름을 성공적으로 차단하거나, 또는 눈에 약물 또는 그외 치료 제제의 지속적인 전달을 제공하기 위해서와 같이, 눈 내부에 또는 눈 근처에서 견고하게 유지될 수 있다. 임플란트 본체의 일부분(예, 임플란트 본체의 체류 구조)을 이용한 확장성 체류 부재의 실질적인 캡슐화는 체류 구조가 임플란트의 외부로 돌출되는 것을 저해할 수 있다. 나아가, 체류 구조의 확장 특성은, 체류 부재의 큰 확장이 임플란트를 적절하게 이식한 후에 이루어지도록 구성될 수 있기 때문에, 이식을 더 쉽게 해준다.
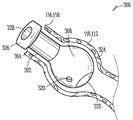
도 1 및 도 2는 눈(100)에 부속된 해부학적 조직 구조의 일예의 개략도이다. 도시된 해부학적 조직 구조는, 실질적으로 캡슐화된 체류 부재를 포함할 수 있는 본원에서 설명되는 여러 가지 누관 임플란트 및 방법을 사용하여 치료하기에 적합하다. 눈(100)은 각막(102), 공막(106)으로 둘러싸인 홍채(104)를 포함한다. 공막(106) 위에 투명한 결막층(108)이 배치되어 있다. 수정체(202)는 눈(100)의 내부에 위치되어 있으며, 망막(204)은 눈(100)의 후면 부근에 위치되어 있다. 망막(204)은 눈(100)에 우수한 시력과 색각을 제공하는 와(206)를 포함하고 있다. 작동시, 각막(102)과 수정체(202)가 빛을 굴절시켜, 와(206)와 망막(2-4)에 상을 형성시킨다.
눈(100)에 부속된 다른 해부학적 조직 구조로, 상부 누소관(110)과 하부 누소관(112)을 포함하는 누액계와, 비루관 또는 누낭(114)을 포함한다. 상부(11) 및 하부(112) 누소관은 상누점(116)과 하누점(118)에서 끝난다. 상누점(116) 및 하누점(118)은 내안각(112) 근처 누액계 부분과 모양체의 정션부(120)에서 눈꺼풀 가장자리의 내측 단부 약간 위에 있다. 상누점(116) 및 하누점(118)은 조직의 연결 링에 의해 둘러 싸여져 있는 대체로 원형 또는 약간 타원형의 개구이다. 누점(116, 118) 각각은 각각의 누소관의 수직부(124, 126)로 이어지며, 수평 회전하여 누낭(114)의 입구와 연결된다. 누소관(1101 112)은 대체로 관 모양이며, 이를 팽창시키는 탄성 조직으로 둘러싸인 중층 편평 상피가 라이닝(line)되어 있다.
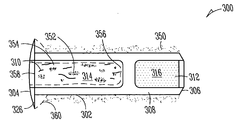
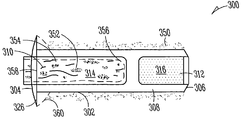
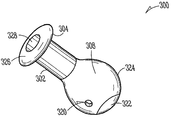
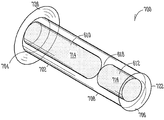
도 3A는 누점에 삽입가능한 누관 임플란트(300)의 일예를 나타낸다. 누관 임플란트(300)의 누점(116, 118) 내부로의 삽입(도 1)은 이곳을 통한 눈물의 흐름 저지 또는 차단(예, 안구 건조증을 치료하기 위해), 또는 눈에 치료 제제의 지속적인 전달(예, 감염, 염증, 녹내장 또는 그외 안 질환 중 한가지 이상을 치료하기 위해) 중 한가지 이상을 가능하게 한다. 이러한 예로, 누관 임플란트(300)는 근단부(304)에서 원단부(306) 방향으로 연장되며 체류 구조(308)를 가지고 있는, 임플란트 본체(302)를 포함한다. 다양한 구현예들에서, 임플란트 본체(302)는 실리콘, 폴리우레탄 또는 다른 우레탄계 물질, 또는 비-생분해성, 부분 생분해성 또는 생분해성 특징(즉, 체내에서 분해가능)의 아크릴을 포함하여, 상기 체류 구조의 적어도 일부분은 외관 변형될 수 있다. 일부 구현예들에서, 상기 생분해성 탄성 물질은 가교 폴리머, 예컨대 폴리(비닐 알코올)을 포함한다. 일부 구현예들에서, 임플란트 본체(302)의 여러가지 부분들은 상이한 물질들로 구성된다. 예컨대, 임플란트 본체의 근단부(304)는 실리콘/폴리우레탄 공중합체로 구성되고, 임플란트 본체 원단부(306)는 폴리우레탄 하이드로겔 또는 기타 고체 하이드로겔로 구성될 수 있다. 특정 구현예에서, 임플란트 본체 근단부(304)는 실리콘으로 구성될 수 있으며, 임플란트 본체 원단부(306)는 친수성 실리콘 혼합물로 구성될 수 있다. 임플란트 본체(302)를 제조하는데 사용할 수 있는 그외 공중합체로는, 실리콘/우레탄, 실리콘/폴리(에틸렌 글리콜)(PEG) 및 실리콘/2하이드록시에틸 메타크릴레이트(HEMA)를 포함한다.
특정 구현예에서, 임플란트 본체(302)는 근단부나 그 근처에 제1 챔버(310)를, 원단부나 그 근처에 제2 챔버(312)를 가지는, 실린더형 구조를 포함할 수 있다. 약물-방출형 또는 그외 제제-방출형 약물 코어(314) 또는 다른 공급물질이 상기 제1 챔버(310)에 배치되고, 상기 제2 챔버(312)에는 생분해성 또는 비-생분해성 특성을 가진, 하이드로겔 또는 다른 확장성 체류 부재가 배치될 수 있다. 일부 예로, 상기 생분해성 체류 부재로는 염- 및 셀룰로스-기반의 혼합물을 포함한다. 일부 예로, 상기 비-생분해성 체류 부재로는 우레탄계 하이드로겔 등의 하이드로겔, 또는 그외 합성 폴리머를 포함한다. 공동으로 소유하는 Uthhede 등의 미국 특허 출원번호 12/231,986, Attorney Docket No. 2755.045US1, 표제 "치료 제제의 지속적인 방출을 위한 약물 코어"에 상세하게 기술된 바와 같이, 우레탄계 폴리머와 공중합체 물질은 서로 다양한 제조 방법과 결합이 가능하다. 임플란트 본체 격막(318)이 제1 챔버(310)와 제2 챔버(316) 사이에 위치될 수 있으며, 약물 코어(314)와 하이드로겔 체류 부재(316) 간의 물질 이동을 저지하거나 방지하기 위해 사용될 수 있다.
다양한 예로, 상기 확장성 하이드로겔 체류 부재(316)는 체류 구조(308)의 일부분의 안과 같이, 실질적으로 캡슐화할 수 있다. 다양한 예로, 체류 구조(308)는 누점 안으로 삽입되었을 때, 유체가 내부로 들어와 하이드로겔 체류 부재(316)에 의해 보유되거나 흡수되게 할 수 있는, 유체 투과성 유지 장치를 포함할 수 있다. 하이드로겔 체류 부재(316)는, 체류 구조(308)의 한 곳 이상의 누소관 벽과 접촉하도록 압박하여, 임플란트의 적어도 일부가 누점 안에서 유지되거나 유지를 돕는, 크기 또는 형태 등으로 확장될 수 있다. 일부 구현예예에서, 상기 유체 투과성 유지 장치는, 예컨대 체류 구조(308)의 측벽에 배치된 유체 투과성 구멍(320)을 포함할 수 있다. 일부 구현예들에서, 상기 유체 투과성 유지 장치는 유체 투과성 또는 친수성 캡 부재(322)이나 다른 구성을 포함할 수 있다. 일부 구현예들에서, 상기 유체 투과성 유지 장치는 유체 투과성 또는 친수성 임플란트 본체 부분(324)을 포함할 수 있다. 이러한 유체 투과성 유지 장치의 예들(320, 322, 324)은 또한 확장시 하이드로겔 체류 부재(316)가 체류 구조(308) 외부로 돌출되는 것을 저지할 수 있다.
임플란트 본체(302)는, 임플란트 본체(302)의 근단부(304)로부터 또는 그 주변에서 적어도 부분적으로 측방향으로 연장된 피드백 또는 다른 돌출부(projection, 326)(예, 제거 루프)를 포함할 수 있다. 일부 구현예에서, 돌출부(326)는 제거 루프를 포함할 수 있다. 일부 구현예에서, 예컨대, 누관 임플란트가 누소관(110, 112) 안으로 완전히 들어가는 것을 저지 또는 방지하거나, 또는 이러한 점에 대해 이식 사용자에게 촉각 또는 시각 피드백 정보를 제공하기 위해서, 돌출부(326)가 (예, 경사부 360를 통해) 누점 개구(116, 118)를 마주대하거나 또는 부근에 놓일 수 있다(도 1). 일부 구현예에서, 돌출부(326)의 근단은 이식되었을 때 환자에게 편안함을 제공하기 위해 볼록 형태를 취할 수 있다. 일부 구현예에서, 돌출부(326)는 약 0.8 mm의 볼록형 반경을 가질 수 있다. 일부 구현예에서, 돌출부(326)는 직경이 약 0.7 mm 내지 약 0.9 mm이다. 일부 구현예에서, 돌출부(326)는 직경 약 0.5 mm - 약 1.5 mm에, 두께 약 0.1 mm - 약 0. 75 mm의, 비-볼록 형상일 수 있다. 일부 구현예에서, 돌출부(326)는, 컬럼형 돌출부가 임플란트 근단(304)의 반대쪽으로 연장된, 날개형 형상을 가진다. 일부 구현예에서, 도 5에 나타낸 바와 같이, 돌출부(326)는 근단(304) 주위 360도로 임플란트 본체 외표면으로부터 연장되는 부분적으로 설비된 테(partially trimmed collar)를 포함한다. 일부 구현예에서, 도 4에 나타낸 바와 같이, 돌출부(326)는 근단(304) 주위 360도로 임플란트 본체 외표면으로부터 연장되는 완전한 테를 포함한다. 일 구현예에서, 돌출부(326)는 평평한 디스크와 비슷한 (즉, 비교적 평평한 상부 및 하부 표면) 단면을 포함한다. 눈에 약물 코어(314) 제제의 지속적인 방출을 제공하기 위해, 약물 또는 그외 제제의 유출 포트(328)가 돌출부(326)를 관통하여 이어질 수 있다.
나타낸 구현예에서, 약물 코어(314)는 적어도 그 일부분 위에 배치된 외피 바디(356)를 가지며, 약물의 하나 이상의 노출면(358)을 규정한다. 노출면(358)은 임플란트 본체의 근단부(304)에 또는 그 근처에 위치되어, 누관 임플란트(300)를 누점에 삽입하였을 때, 노출면이 눈물 또는 눈물막 유체와 접촉하여, 한가지 이상의 치료학적 수준으로 치료제를 장기간 방출시킬 수 있다. 일 구현예에서, 도 3B에 나타낸 바와 같이, 약물 코어(314)의 노출면(358)은, 약물 코어가 임플란트 본체(302)에서 외부로 돌출되지 않도록, 돌출부(326)의 근단과 같은 높이이거나 약간 낮을 수 있다. 일 구현예에서, 도 3D에 나타낸 바와 같이, 노출면(358)은 약물 코어(314)가 적어도 부분적으로 임플란트 본체(302) 외부로 돌출되도록, 돌출부(326)의 근단 보다 높게 위치될 수 있다.
일부 구현예에서, 약물 코어(314)의 노출면(358) 부근의 약물 농도 구배 또는 구조를 조절함으로써, 사전 결정된 약물 또는 제제 방출 속도를 달성할 수 있다. 예컨대, 노출면(358)은, 예컨대 외래 환자 내원 사이의 단기 또는 장기적인 복용(chronic basis)으로, 눈(100)에 약물 또는 다른 제제의 방출 속도를 조절하는데 적합한 특수 구조나 다른 기법으로 제조될 수 있다. 약물 공급물(32)로부터 하나 이상의 약물 또는 다른 제제의 효과적인 방출 속도에 대한 추가적인 내용은 공동 출원된 DeJuan 등의 미국 특허 출원번호 11/695,545 표제 "약물 전달용 비루 배액 시스템 임플란트"에서 볼 수 있다.
도 3b는 도 3a의 선 3B-3B를 따른 것과 같은, 임플란트의 길이 방향 축에 평행한 선에 따라 취한 누관 임플란트(300)의 일 예의 단면도이다. 도 3b에 나타낸 바와 같이, 누관 임플란트는 임플란트 본체 원단부(306) 또는 그 근처에 하이드로겔 체류 부재(316)를 실질적으로 둘러싸는 체류 구조(308)와, 예컨대 근단부(304) 또는 그 근처에, 임플란트 본체 내부에 배치된 약물-방출성 또는 다른 제제-방출성 코어(314)를 가진, 임플란트 본체(302)를 포함할 수 있다. 이러한 예에서, 약물 코어(314)는 제1 임플란트 본체 챔버(31)에 배치되며, 하이드로겔 체류 부재(316)는 제2 임플란트 본체 챔버(312)에 배치된다. 상기에 기술된 바와 같이, 하이드로겔 체류 부재(316)는, 누점(116, 118)(도 1) 내부에서 적어도 일부분의 임플란트(300)의 유지 또는 유지를 돕는, 크기나 형태로 확장될 수 있다. 일부 구현예에서, 하이드로겔 체류 부재(350)는 피복되거나, 또는 임플란트 본체(302)의 외표면 영역 상에 제공되어, 누점 내부에서의 적어도 일부분의 임플란트(300)를 유지하거나 또는 유지하는 것을 보조하기 위한 다른(예, 제2) 메카니즘을 제공한다.
실질적으로 하이드로겔 체류 부재(316)를 둘러싸기 위해 사용될 수 있는 체류 구조(308)는 임플란트 본체(302)의 크기에 따라 크기가 다양할 수 있다. 일부 구현예에서, 체류 구조(308)는 임플란트 본체(302) 길이의 약 1/5 이상이다. 일부 구현예에서, 체류 구조(308)는 임플란트 본체(302) 길이의 약 1/4 이상이다. 일부 구현예에서, 체류 구조(308)는 임플란트 본체(302) 길이의 약 1/3 이상이다. 일부 구현예에서, 체류 구조(308)는 임플란트 본체(302) 길이의 약 1/2 이상이다. 일부 구현예에서, 체류 구조(308)는 임플란트 본체(302) 길이의 약 3/4 이상이다. 일부 구현예에서, 체류 구조(308)는 거의 임플란트 본체(302) 전체 길이이다.
도 3b의 예로 나타낸 바와 같이, 하이드로겔 체류 부재(316)는 비확장된 "건조 상태"일 수 있으며, 이는 누점(116, 118)을 통해 누소관(110, 112)(도 1)으로 삽입되는 것을 돕는다. 누소관에 장착되면, 하이드로겔 체류 부재(316)는, 예컨대 유체 투과성 유지 장치(320, 322, 324)(도 3a)를 통해 유체를 흡수하거나 누소관에서 유지되어, 확장된 구조를 형성할 수 있다. 일부 구현예에서, 하이드로겔 체류 부재(316)는 비-생분해성 물질을 포함할 수 있다. 일부 구현예에서, 하이드로겔 체류 부재(316)는 생분해성 물질을 포함할 수 있다. 하이드로겔 체류 부재(316)에 대한 다른 선택도 사용할 수 있다. 예컨대, 하이드로겔 체류 부재(316)는 일체형으로 체류 구조(308)와 함께 성형하거나, 또는 하나씩 각각 제조한 다음 체류 구조(308)와 커플링시킬 수 있다.
일부 구현예에서, 임플란트 본체(302)의 근단부(304)나 그 근처에 배치되는 약물 코어(314)는 다수의 치료 제제 봉입체(352)를 포함할 수 있으며, 상기 봉입체는 매트릭스(354)에 분산될 수 있다. 일부 구현예에서, 봉입체(352)는 농축된 형태의 치료 제제(예, 결정 제제 형태)를 포함한다. 일부 구현예에서, 매트릭스(354)는 실리콘 매트릭스 등을 포함할 수 있으며, 매트릭스내 봉입체(352)의 분산은 균일하지 않을 수 있다. 일부 구현예에서, 제제 봉입체(352)는 란타노프로스트 오일과 같은 오일 액적(droplet)을 포함한다. 또다른 구현예에서, 제제 봉입체(352)는 고형 입자, 예컨대 결정 형태의 비마토프로스트 입자를 포함한다. 일부 구현예에서, 약물 코어(314)는 공동 소유의 Utkhede 등의 미국 특허 출원 번호 12/231,986, Attorney Docket No. 2755.045US1, 표제 "치료 제제의 지속적인 방출용 약물 코어"에 기술되어 있는 바와 같이, 눈이나 주변 조직으로 전달가능한 치료 제제 봉입체를 포함하는, 우레탄계(예, 폴리우레탄) 폴리머 또는 공중합체를 포함한다. 봉입체는 다양한 크기와 형태를 가질 수 있다. 예컨대, 봉입체는 약 1 ㎛ 내지 약 100 ㎛ 크기를 가지는 미세입자일 수 있다.
나타낸 구현예에서, 약물 코어(314)는 약물 코어의 하나 이상의 노출면(358)을 규정하기 위해 적어도 일부분의 영역 상에 배치된 외피 바디(356)를 가진다. 노출면(358)은, 누관 임플란트(300)를 누점에 삽입하였을 때, 눈물이나 눈물막 유체와 접촉하여 장기간 한가지 이상의 치료 수준으로 치료 제제를 방출하도록, 임플란트 본체의 근단부(304)나 그 근처에 위치될 수 있다.
도 3c는 임플란트의 길이 방향 축과 평행한 선을 따라 취한 누관 임플란트(300)의 일 예의 단면도이다. 도 3c에 나타낸 바와 같이, 누관 임플란트는 피드백 또는 다른 돌출부(326)가 없는 임플란트 본체(302)(도 3a)를 포함한다. 여기에서, 임플란트(300)는 누점(116, 118) 내부에 완전히 삽입될 수 있다(도 1). 일부 구현예에서, 제1 챔버(310)는 약 0.013 인치 x 약 0.045 인치의 크기를 포함할 수 있다. 일부 구현예에서, 제2 챔버(312)는 약 0.013 인치 x 약 0.020 인치의 크기를 포함할 수 있다.
도 4는 실질적으로 둘러싸여진 하이드로겔 체류 부재(316)(도 3a)의 크기 증가로 인해 형성된, 확장된 수화된 상태의 누관 임플란트(300)의 등각 투상도이다. 실질적으로 둘러싸여진 하이드로겔 체류 부재(316)의 확장으로 인해, 임플란트 본체의 체류 구조(308)의 한 곳 이상의 외표면이, 도 5에 나타낸 바와 같이, 임플란트(300)의 바람직한 위치를 견고하게 유지하도록, 바깥으로, 예컨대 누소관 벽의 크기 및 형태로 압박될 수 있다. 선택적으로, 임플란트 본체(302)의 근단부나 그 주위로부터 적어도 부분적으로 연장되는 피드백 또는 다른 돌출부(326)는, 도 5에 추가적으로 나타낸 바와 같이, 임플란트가 누소관에 과도하게 삽입되는 것을 저지 또는 방지하기 위해, 누점(116, 118)에 마주대이도록 놓일 수 있다.
전술한 바와 같이, 일부 구현예에서, 체류 구조(308)는, 누점(116, 118)(도 1)을 통해 누소관(110, 112)(도 1)에 삽입되었을 때와 같이, 유체를 받아들여 하이드로겔 체류 부재(316)에 의해 흡수 또는 보유할 수 있는 유체 투과성 유지 장치를 포함할 수 있다. 본원에 나타낸 매우 다양할 수 있는 구현예에서, 유체 투과성 유지 장치는 예컨대 체류 구조(308)의 측벽에 배치된 하나 이상의 유체 투과성 구멍(320)을 포함한다. 일부 구현예에서, 유체 투과성 유지 장치는 유체 투과성 또는 친수성 캡 부재(322)(도 3a)을 포함할 수 있다. 일부 구현예에서, 유체 투과성 유지 장치는 유체 투과성 또는 친수성 임플란트 본체 부분(324)(도 3a)을 포함할 수 있다. 이들 유체 투과성 유지 장치(320, 322, 324) 각각은, 체류 구조(308)로의 흐름을 허용할 뿐만 아니라, 확장된 동안과 확장시에 체류 구조로부터 하이드로겔 체류 부재(316)의 돌출을 저지 또는 방지할 수 있다.
하이드로겔 체류 부재(316)의 조성물을 조절함으로써, 다양한 확장 특징들을 달성할 수 있다. 일부 구현예에서, 하이드로겔 체류 부재 조성물은 "건조" 부피의 최대 1배까지 확장이 가능하다. 일부 구현예에서, 하이드로겔 체류 부재 조성물은 "건조" 부피의 최대 10배까지 확장이 가능하다. 일부 구현예에서, 하이드로겔 체류 부재 조성물은 "건조" 부피의 최대 100배까지 확장이 가능하다.
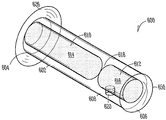
도 6은 누점을 통해 누소관에 적어도 부분적으로 삽입할 수 있는 누관 임플란트(600)의 다른 예를 도시한다. 이러한 예의 누관 임플란트(600)는 근단부(604)로부터 원단부(606) 방향으로 연장되며, 변형가능한 체류 구조(608)를 가지는, 임플란트 본체(602)를 포함한다. 다양한 구현예에서, 임플란트 본체(602)는 비-생분해성 또는 생분해성 특성의, 실리콘 또는 폴리우레탄 등의, 탄성 물질을 포함할 수 있다. 일부 구현예에서, 임플란트 본체(602)의 여러 부분들은 상이한 물질로 제조된다.
본원에 나타낸 구현예에서, 임플란트 본체(602)는 근단이나 그 근처에 제1 챔버(610)를, 원단부나 그 근처에 제2 챔버(612)를 가지는, 실린더형 구조를 포함한다. 약물 코어(614)는 제1 챔버(610)에 배치될 수 있으며, 제2 챔버(616)에는 확장성 하이드로겔 체류 부재(616)가 배치될 수 있다. 제1 챔버(610)와 제2 챔버(616) 사이에 위치한 임플란트 본체 격막(618)을 이용하여, 약물 코어(614)와 하이드로겔 체류 부재(616) 사이의 유체나 다른 물질의 이동을 저지 또는 방지할 수 있다. 일부 구현예에서, 임플란트 본체(602)는 임플란트 본체(602)의 근단부(604)나 그 근처에서 적어도 부분적으로 연장되는 피드백 또는 다른 돌출부(626), 또는 임플란트 본체의 원단부(606)에 커플링된 비-투과성, 비-친수성 캡 부재(650)을 포함할 수 있다.
여러가지 방식으로, 확장성 하이드로겔 체류 부재(616)를 체류 구조(608)의 적어도 일부분의 영역 내부로 실질적으로 캡슐화할 수 있다. 다양한 구현예에서, 체류 구조(608)는 하나 이상의 유체 투과성 구멍(620)을 포함할 수 있는 유체 투과성 유지 장치를 포함할 수 있으며, 상기 구멍은, 예컨대 누점(116, 118)(도 1)을 통해 누소관(110, 112)(도 1)에 삽입시, 하이드로겔 체류 부재(616)가 유체를 받아들여 흡수 또는 보유할 수 있게 한다. 구멍(620)은 체류 구조(608)로 유체를 받아들일 만큼 충분히 크고, 확장시 및 확장시에 하이드로겔 체류 부재(616)가 체류 구조 외부로 인지할 수 있는 수준으로 돌출되지 않도록 저지할 수 있을 만큼 충분히 작은, 크기 또는 형태를 포함할 수 있다. 일부 구현예에서, 구멍의 직경은 약 0.30 mm 이하, 예컨대 약 0.30 mm 이하 또는 약 0.15 mm이하이다. 일부 구현예에서, 구멍의 직경은 약 0.12 mm 이하이다. 다양한 구현예에서, 구멍은, 하이드로겔 체류 부재의 방출이 확장된 하이드로겔 체류 부재의 10% 미만, 5% 미만 또는 1% 미만으로 한정되도록, 하이드로겔 체류 부재(616)의 유출을 저해하는 크기와 형태이다. 다른 구현예에서, 하이드로겔 체류 부재(616)의 유출을 추가로 저지하기 위해서, 저분자량의 막 또는 기타 배리어를 구멍(620)의 적어도 일부분의 영역 위에 배치한다. 다양한 구현예에서, 저분자량 막은 체류 부재 보다 낮은 분자량을 포함한다. 이러한 예에서, 저분자량 막은 분자량이 10,000 달톤 미만이다.
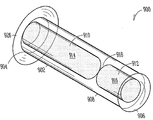
도 7은 누점을 통해 누소관으로 적어도 부분적으로 삽입할 수 있는 누관 임플란트(700)의 다른 예를 도시한다. 누관 임플란트(700)는 근단부(704)에서 원단부(706) 방향으로 연장되며 변형가능한 체류 구조(708)를 가진, 임플란트 본체(702)를 포함할 수 있다. 다양한 구현예에서, 임플란트 본체(702)는 비-생분해성 또는 생분해성 특성의, 실리콘 또는 폴리우레탄 등의, 탄성 물질을 포함할 수 있다. 일부 구현예에서, 임플란트 본체(702)의 여러 부분들은 상이한 물질로 제조된다.
본원에 나타낸 구현예에서, 임플란트 본체(702)는 근단이나 그 근처에 제1 챔버(710)를, 원단부나 그 근처에 제2 챔버(712)를 가지는, 실린더형 구조를 포함한다. 약물 코어(714)는 제1 챔버(710)에 배치될 수 있으며, 제2 챔버(716)에는 확장성 하이드로겔 또는 다른 체류 부재(716)가 배치될 수 있다. 제1 챔버(710)와 제2 챔버(716) 사이에 위치한 임플란트 본체 격막(718)을 이용하여, 약물 코어(714)와 하이드로겔 체류 부재(716) 사이의 유체나 다른 물질의 이동을 저지 또는 방지할 수 있다. 일부 구현예에서, 임플란트 본체(702)는, 상기에 기술한 바와 같이, 예컨대 시각 또는 촉각 피드백을 사용자에게 제공하기 위해, 임플란트 본체(702)의 근단부(704)나 그 근처에서 적어도 부분적으로 연장되는 피드백 또는 다른 돌출부(726)를 포함할 수 있다.
여러가지 방식으로, 확장성 하이드로겔 체류 부재(716)를 체류 구조(708)의 적어도 일부분의 영역 내부로 실질적으로 캡슐화할 수 있다. 다양한 구현예에서, 체류 구조(708)는 유체 투과성 또는 친수성 캡 부재(722)와 같은 유체 투과성 유지 장치를 포함할 수 있으며, 상기 캡 부재는, 예컨대 누점(116, 118)(도 1)을 통해 누소관(110, 112)(도 1) 삽입시에, 하이드로겔 체류 부재(716)가 유체를 받아들여 흡수 또는 보유(흡착)할 수 있게 한다. 캡 부재(722)는 체류 구조(708)로의 유체를 흐르게 하지만 확장시 및 확장시에 하이드로겔 체류 부재(716)가 체류 구조 외부로 인지할 수 있는 수준으로 돌출되지 않도록 저지할 수 있도록 구성될 수 있다. 일부 구현예에서, 캡 부재(722)은, 예컨대 누점을 통한 누소관으로의 임플란트(700)의 비외상성 삽입을 용이하게 하기 위해, 데이퍼형 원위팁부를 포함할 수 있다. 일부 구현예에서, 캡 부재(722)은 50 중량% 이상의 실리콘과, 콘택트 렌즈 물질(예, 하이드로겔 또는 HEMA 공중합체, PMMA 공중합체; 또는 VSO 75 중 하나 이상을 포함하는 콘택트 렌즈 물질), 소듐 클로라이드, 폴리에틸렌 산화물, 폴리에틸렌 글리콜, 폴리비닐 피릴리돈(예, 폴리(1-(2-옥소-1-피롤리디닐)에틸렌), 또는 폴리비닐 알코올 중 1종 이상과 조합하여 포함할 수 있다. 예컨대, 캡 부재(722)은 80% 실리콘과, 20%의, Vista Optics 사로부터 구입가능한 형태의 콘택트 렌즈 물질을 포함할 수 있다. 다양한 구현예에서, 콘택트 렌즈 물질은 수분율 50% 미만의 비이온성 폴리머(예, 테필콘 (38%), 테트라필콘 A (43%), 크로필콘 (38%), 헬필콘 (45%), 마필콘 (33%), 또는 폴리마콘 (38%)), 수분율 50% 이상의 비이온성 폴리머(예, 리도필콘 B (79%), 서필콘 A (74%), 리도필콘 A (70%), 네트라필콘 A (65%), 헤필콘 C (57%), 알파필콘 A (66%), 오마필콘 A (59%), 바서필콘 A (74%), 히옥시필콘 A (59%), 넬필콘 A (69%), 힐라필콘 A (70%), 또는 힐라필콘 B (59%)), 수분율 50% 미만의 이온성 폴리머(예, 부필콘 A (45%), 델타필콘 A (43%), 또는 펨필콘 (38%)), 또는 수분율 50% 이상의 이온성 폴리머(예, 부필콘 A (55%), 퍼필콘 A (71%), 에타필콘 A (58%), 포코필콘 A (55%), 오쿠필콘 B (53%), 오쿠필콘 C (55%), 오쿠필콘 D (55%), 오쿠필콘 E (65%), 오쿠필콘 F (60%), 펨필콘 A (55%), 메타필콘 A (55%), 메타필콘 B (55%), 또는 빌필콘 A (55%))를 포함할 수 있다.
캡 부재(722)에 대한 몇가지 추가적인 옵션의 예로 하기를 들 수 있다. 일부 구현예에서, 캡 부재(722)은 체류 구조(708)의 원단부에 배치된다. 일부 구현예에서, 캡 부재(722)은 체류 구조(708)의 원단부만 덮는 크기와 형태이다. 일부 구현예에서, 캡 부재(722)은 체류 구조(708)의 원단부와 같은 높이이다. 일부 구현예에서, 캡 부재(722)은 체류 구조(708)의 내벽 안쪽으로 오목하게 들어간다.
도 8은 누점을 통해 누소관으로 적어도 부분적으로 삽입할 수 있는 누관 임플란트(800)의 다른 예를 도시한다. 누관 임플란트(800)는 근단부(804)에서 원단부(806) 방향으로 연장되며 체류 구조(808)를 가진, 임플란트 본체(802)를 포함할 수 있다. 다양한 구현예에서, 임플란트 본체(802)는 비-생분해성 또는 생분해성 특성의, 실리콘 또는 폴리우레탄 등의, 탄성 물질을 포함할 수 있다. 일부 구현예에서, 임플란트 본체(802)의 여러 부분들은 상이한 물질로 제조된다.
본원에 나타낸 구현예에서, 임플란트 본체(802)는 근단이나 그 근처에 제1 챔버(810)를, 원단부나 그 근처에 제2 챔버(816)를 가지는, 실린더형 구조를 포함한다. 약물 코어(814)는 제1 챔버(810)에 배치될 수 있으며, 제2 챔버(816)에는 확장성 하이드로겔 체류 부재(816)가 배치될 수 있다. 제1 챔버(810)와 제2 챔버(816) 사이에 위치한 임플란트 본체 격막(818)을 이용하여, 약물 코어(814)와 하이드로겔 체류 부재(816) 사이의 유체나 다른 물질의 이동을 저지 또는 방지할 수 있다. 임플란트 본체(802)는, 예컨대 이식하는 동안에 시각 또는 촉각 피드백을 사용자에게 제공하기 위해, 임플란트 본체(802)의 근단부(804)나 그 근처에서 적어도 부분적으로 연장되는 피드백 또는 다른 돌출부(826)를 포함할 수 있다.
여러가지 방식으로, 확장성 하이드로겔 체류 부재(816)를 체류 구조(808)의 적어도 일부분의 영역 내부로 실질적으로 캡슐화할 수 있다. 다양한 구현예에서, 체류 구조(808)는 유체 투과성 또는 친수성 임플란트 본체 부분(824)의 형태에 유체 투과성 유지 장치를 포함할 수 있으며, 이는, 예컨대 누점(116, 118)(도 1)을 통해 누소관(110, 112)(도 1) 삽입시에, 하이드로겔 체류 부재(816)가 유체를 받아들여 흡수 또는 보유(흡착)할 수 있게 한다. 일부 구현예에서, 유체 투과성 또는 친수성 본체 부분(824)은, 50 중량% 이상의 실리콘과, 콘택트 렌즈 물질(예, 하이드로겔, HEMA 공중합체 또는 PMMA 공중합체 중 하나 이상을 포함하는 콘택트 렌즈 물질), 소듐 클로라이드, 폴리에틸렌 산화물, 폴리에틸렌 글리콜, 폴리비닐 피릴리돈 또는 폴리비닐 알코올 중 1종 이상과 조합하여 포함할 수 있다. 일부 구현예에서, 유체 투과성 또는 친수성 본체 부분(824)은 누점 내부에 있는 임플란트 본체(802) 측면 표면적의 약 5% 내지 약 50%를 구성할 수 있다. 일부 구현예에서, 유체 투과성 또는 친수성 본체 부분(824)은 누점 내부에 있는 임플란트 본체(802) 측면 표면적의 50% 이상, 예컨대 이식된 임플란트 본체 표면적의 약 100%에 해당할 수 있다.
도 9는 누점을 통해 누소관으로 적어도 부분적으로 삽입할 수 있는 누관 임플란트(900)의 다른 예를 도시한다. 누관 임플란트(900)는 근단부(904)에서 원단부(906) 방향으로 연장되며 변형가능한 체류 구조(908)를 가진, 임플란트 본체(902)를 포함할 수 있다. 다양한 구현예에서, 임플란트 본체(902)는 비-생분해성 또는 생분해성 특성의, 실리콘 또는 폴리우레탄 등의, 탄성 물질을 포함할 수 있다. 일부 구현예에서, 임플란트 본체(902)의 여러 부분들은 상이한 물질로 제조된다.
본원에 나타낸 구현예에서, 임플란트 본체(902)는 근단이나 그 근처에 제1 챔버(910)와 원단부나 그 근처에 제2 챔버(912)를 가지는, 실린더형 구조를 포함한다. 약물 코어(914)는 제1 챔버(910)에 배치될 수 있으며, 제2 챔버(916)에는 확장성의 실질적으로 유체 비흡수성 체류 부재(950)가 배치될 수 있다. 제1 챔버(910)와 제2 챔버(916) 사이에 위치한 임플란트 본체 격막(918)을 이용하여, 약물 코어(914)와 유체 비흡수성 체류 부재(916) 사이의 유체나 다른 물질의 이동을 저지 또는 방지할 수 있다. 일부 구현예에서, 임플란트 본체(902)는, 예컨대 이식하는 사용자에게 시각 또는 촉각 피드백을 제공하기 위해, 임플란트 본체(902)의 근단부(904)나 그 근처에서 적어도 부분적으로 연장되는 피드백 또는 다른 돌출부(926)를 포함할 수 있다.
여러가지 방식으로, 유체 비흡수성 체류 부재(950)를 체류 구조(908)의 영역 내부로 실질적으로 캡슐화할 수 있다. 하이드로겔 체류 부재와는 대조적인, 유체 비흡수성 체류 부재(950)는 유체의 수용을 허용하기 위한 유체 투과성 유지 장치를 사용할 필요가 없다. 그보다, 유체 비흡수성 체류 부재(950)는, 확장된 크기나 형태로의 이행이, 예컨대 특정 온도(예, 그 속에 삽입하였을 때, 누점 또는 누소관 내부의 온도)를 통해 달성되도록, 구성될 수 있다. 일부 구현예에서, 유체 비흡수성 체류 부재(950)는 형상-기억 열가소성 물질을 포함할 수 있다. 이러한 구현예에서, 유체 비흡수성 체류 부재(950)는 우레탄계이다. 일부 구현예에서, 유체 비흡수성 체류 부재(950)는, 체류 구조(908)에 의해 제공되는 캡슐환된 상태에서 포집되는, 하나 또는 복수의 산화물을 생성 및 방출할 수 있는, 산화-생성 시스템을 포함할 수 있다.
도 10은 누점에 적어도 부분적으로 삽입할 수 있도록 구성된 누관 임플란트(1000)의 제조 방법의 일예를 나타낸 블럭 다이아그램이다. 1002에서, 근단부에서 원단부 방향으로 연장되고 체류 구조를 포함하는, 임플란트 본체를 형성한다. 일부 구현예에서, 임플란트 본체의 근단부는, 임플란트 본체 돌출부, 예컨대 환자 편리를 위해, 시각 또는 촉각 피드백을 제공하거나, 또는 누점의 영역에 받쳐져서 놓이도록 구성되며, 중앙이 볼록한 형태를 가지는, 돌출부를 추가로 포함하도록, 제조한다. 일부 구현예에서, 임플란트 본체의 중간 부분은, 제1 임플란트 본체 부분과 제2 임플란트 본체 부분을 분리시키는 격막을 포함하도록 제조한다. 일부 구현예에서, 임플란트 본체는 제1 임플란트 본체 부분과 제2 임플란트 본체 부분을 동시에 또는 연속하여 사출 성형함으로써 제조한다. 이러한 구현예에서, 제1 임플란트 본체 부분은 비-투과성, 비-친수성 물질을 사출 성형함으로써 제조하며, 제2 임플란트 본체 부분은 유체 투과성 또는 친수성 물질을 사출 성형함으로써 제조한다.
1004에서, 확장성 체류 부재를 제조한다. 일부 구현예에서, 확장성 체류 부재는, 임플란트 본체의 체류 구조로 실질적으로 둘러싸였을 때, 누점 안에서 임플란트를 적어도 일부분 견고하게 보유하는, 크기나 형태로 확장할 수 있는, 하이드로겔계 물질 혼합물을 포함할 수 있다. 이러한 일부 구현예에서, 하이드로겔 물질은 약 1분 내지 약 60분의 시간안에, 예컨대 약 20분 내지 약 30분의 시간안에 누점 또는 누소관의 벽쪽으로 확장할 수 있다. 하이드로겔 물질의 확장 수준(예, 팽창)은 물질 혼합물내 하이드로겔 : 폴리머(예, 폴리우레탄 또는 실리콘)의 비율을 변경함으로써 조절할 수 있다. 다른 구현예에서, 확장성 체류 부재는 크기 및 형태의 증가를 위해 온도 활성화될 수 있는, 형성-기억 열가소성 물질 또는 산화 생성 시스템과 같은, 유체 비흡수성 물질을 포함할 수 있다.
1006에서, 확장성 체류 부재는 임플란트 본체의 체류 구조를 이용하여 실질적으로 캡슐화할 수 있다. 그 결과, 체류 부재가 크기 및 형태 측면에서 확장될 때, 예컨대 유체 보유로 팽창될 때, 체류 구조의 한 곳 이상의 외표면 부분은 누소관의 벽 방향으로 압박을 받게 된다. 일부 구현예에서, 체류 부재의 실질적인 캡슐화는 체류 구조의 챔버내에 체류 부재의 배치를 포함할 수 있다.
선택적으로, 1008에서, 체류 부재와 누소관 사이의 유체 투과성 유지 장치를 제조한다. 유체 투과성 유지 장치는 흡수성- 또는 그외 다른 유체-보유성 체류 부재, 예컨대 하이드로겔이 실질적으로 캡슐화된 위치에서 있으면서 유체를 수용 및 취할 수 있게 한다. 일부 구현예에서, 유체 투과성 유지 장치의 형성은, 임플란트 본체의 벽에 유체 투과성 구멍 또는 다른 유체 통로를 형성함으로써 실시한다. 다양한 구현예에서, 구멍은 체류 구조로부터 체류 부재의 유출을 저지하는 크기와 형태를 가진다. 일부 구현예에서, 유체 투과성 유지 장치의 형성은, 유체 투과성 또는 친수성 캡 부재를 형성하여 임플란트 본체의 원단부에 커플링시킴으로써, 달성한다. 일부 구현예에서, 유체 투과성 유지 장치의 형성은 전체 유체 투과성 또는 친수성 임플란트 본체 부분을 제조함으로써 이루어진다. 그외 물질 혼합물 중에서도, 캡 부재 및 임플란트 본체의 전체 유체 수용 부분은 약 50 중량% 이상의 실리콘과, 콘택트 렌즈 물질, 소듐 클로라이드, 폴리에틸렌 산화물, 폴리에틸렌 글리콜, 폴리비닐 피릴리돈 또는 폴리비닐 알코올 중 1종 이상의, 혼합물 또는 다른 조합을 포함할 수 있다.
선택적으로, 1010에서, 약물 코어는, 제제의 지속적인 방출이 인접한 눈에 전달될 수 있도록, 임플란트 본체의 근단부에 배치된다. 일부 구현예에서, 약물 코어는 체류 부재의 임플란트 본체 챔버 근위부에 배치되며, 임플란트 본체 격막을 통해 그로부터 분리된다. 선택적으로, 1012에서, 임플란트 본체의 외표면부는 여기에 유체 팽윤성 물질 코팅의 부착을 가능하도록 플라즈마 처리된다. 일부 구현예에서, 유체 팽윤성 물질 코팅은 하이드로겔 물질을 포함할 수 있는데, 이것은 유체와 접촉하였을 때, 확장하여, 예컨대 누소관 안에 적어도 일부분의 임플란트 본체를 유지시키는 이차적인 메카니즘을 제공한다. 일부 구현예에서, 유체 팽윤성 물질은 실리콘/폴리우레탄 임플란트 본체의 플라즈마 무처리 외표면 상에 코팅된다. 그외 기법들 중에, 유체 팽윤성 물질은 침지 코팅 또는 분무 코팅을 통해 임플란트 본체의 외표면 상에 코팅될 수 있다.
선택적으로, 임플란트 본체의 외표면부는, 누관 임플란트에 박테리아의 부착 및 증식을 저해하기 위해, 대체로 매끈하도록 형성되거나 표면 처리될 수 있다. 대체로 매끈한 외표면은, 또한 이식하는 동안에 누점 또는 조합된 누소관과 같은 수용하는 해부학적 조직의 내부 라이닝에 대한 손상을 방지할 수 있다. 라파키 등에 의해 공동 소유되고, 발명의 명칭이 "임플란트의 표면처리 및 관련 방법"인 미국 특허출원 번호 12/283,002, 대리인 문서 번호 2755.036US1에서 더욱 논의되어진 바와 같이, 임플란트 본체의 외표면은 예컨대 디클로라이드 메탄 또는 그외 적합한 매질을 이용한 연마 프로세스를 텀플러 프로세스와 조합 실시하여, 개선시킬 수 있다.
눈 장애를 가진 개체(예, 인간)의 치료 방법의 예는, 하기 내용 중 한가지 이상을 포함할 수 있다. 누관 임플란트를 누점으로 적어도 일부분을 삽입하여, 임플란트 본체 체류 구조로 실질적으로 둘러싸여 있으며 유체 투과성 유지 장치를 통해 접근할 수 있는 체류 부재가 누소관 내부에 배치되게 할 수 있다. 일부 구현예에서, 누관 임플란트는 데주안 등이 공동 소유하는 발명의 명칭이 "약물 치료를 위한 비루 배수 시스템 임플랜트"인 국제 특허출원 PCT/US2007/065789에 논의된 것과 같은, 삽입 도구를 이용하여 누점 안으로 위치시킨다. 선택적으로, 임플란트 본체의 근단부로부터 연장되는 피드백 또는 그외 돌출부는, 예컨대 체류 부재가 적절하게 위치 선정되었음을 보장하기 위한 시각 또는 촉각적 피드백을 사용자에게 제공하기 위한 목적으로, 누점 부분에 맞대게 놓을 수 있다.
유체는 선택적으로 교류 수단 내부로의 이동 및 관통이 허용되며, 체류 부재에 의해 수용된다. 체류 부재에 의해 선택적으로 수용되는 유체는 흡수되거나 보유될 수 있으며, 그로 인해 체류 부재는 누점 내부에 삽입가능한 제1 크기 및 형태에서, 누점 내부에 있는 임플란트 본체의 적어도 일부분의 부분이 유지되거나 또는 유지를 보조하는 제2 크기 및 형태로 확장될 수 있다. 일부 구현예에서, 체류 부재의 확장은 누소관 또는 누호의 벽에 실질적으로 둘러싸고 있는 체류 구조의 외표면이 접촉되도록 압박한다. 일부 구현예에서, 체류 부재의 확장은 약 1분 내지 약 60분 동안의 유체 흡수 또는 그외 유체 보유로 인한 것이다.
체류 부재는 부분적으로는 유체 투과성 유지 장치에 의해 제공되는 구조적인 지지로 인해, 체류 구조의 실질적인 캡슐화로부터의 이탈로부터 저지될 수 있다. 일부 구현예에서, 체류 부재의 이탈은 직경 크기가 약 0.30 mm 이하인 유체 투과성 구멍 형태에 유체 투과성 유지 장치를 사용함으로써 저지된다. 일부 구현예에서, 체류 부재의 이탈 저해는 임플란트 본체의 원단부에 커플링된 유체 투과성 또는 친수성의 캡 부재 형태에 유체 투과성 유지 장치를 사용함으로써 구현된다. 일부 구현예에서, 체류 부재의 이탈 저해는 전체 유체 투과성 또는 친수성 임플란트 본체 형태에 유체 투과성 유지 장치를 사용함으로써 구현된다.
선택적으로, 약물 또는 그외 치료 제제와 같은 약물 코어 제제는 1주일 이상, 1달 이상 또는 3달 이상 동안 임플란트 본체의 근단부에서 약물 용출 포트로부터 서서히 방출될 수 있다. 일부 구현예에서, 방출되는 제제는 높은 안압 또는 원발성 개방우각 녹내장과 같은 녹내장 질환을 치료하기 위한 약물이다. 선택적으로, 1달, 2달, 3달 또는 그 이상의 기간이 경과된 후, 임플란트 본체 돌출부를 잡아 당기는 등에 의해 누소관으로부터 제거할 수 있으며, 또는 새로운 약물 코어를 임플란트가 있는 상태에서 삽입하거나 제거한 후 삽입한다. 일부 구현예에서, 제1 임플란트를 제거하고, 약물 코어내 제제의 용량이 동일하거나, 낮거나 또는 높은 제2 임플란트를 누점으로 삽입한다. 일부 구현예에서, 누관 임플란트의 제거와 교체는 개체에 더 이상 치료가 필요하지 않을 때까지, 예컨대 2회, 3외, 4회 또는 5회로 반복된다.
외피
바디의
예:
여러 가지 방식으로, 외피 바디는, 약물 코어로부터의 약물 또는 다른 치료 제제의 이동을 제어하도록 적절한 형상 및 재료를 포함할 수 있다. 논의된 바와 같이, 몇몇 구현예에서, 외피 바디는 코어를 보유하고 있으며, 코어에 꼭 들어맞을 수 있다. 외피 바디는, 외피 바디로 덮여지지 않은 약물 코어의 노출된 표면 영역에 의해 제제의 이동 속도가 대부분 제어되도록, 제제에 실질적으로 비투과성인 재료로 이루어질 수 있다. 많은 구현예에서, 외피 바디를 통한 제제의 이동은, 약물 코어의 노출된 표면을 통한 제제의 이동의 약 1/10 또는 미만일 수 있다. 적절한 외피 바디의 재료에는, 우선적으로, 폴리이미드, 폴리에틸렌 테레프탈레이트(PET)가 포함된다. 외피 바디는, 코어에 인접한 외피면으로부터 코어에서 멀리 떨어져 있는 반대쪽 외피면까지로 정의하였을 때, 약 0.00025 인치 내지 약 0.0015 인치의 두께를 가질 수 있다. 약물 코어를 가로질러 연장되는 외피의 전체 직경은, 약 0.2 mm 내지 약 1.2 mm의 범위에 있다. 약물 코어는, 매트릭스를 외피 바디에 코어를 침지 코팅(dip coating)함으로써 형성될 수 있다. 일부 구현예에서, 외피 바디는, 코어가 도입되는 튜브를 포함할 수 있다. 외피 바디는 또한 코어 주위에서 침지 코팅될 수 있고, 예를 들면 사전 형성된(pre-formed) 코어 주위에서 침지 코팅될 수 있다.
외피 바디에, 예를 들면 상술한 누관 임플란트의 임상 사용을 편리하게 하기 위해, 하나 이상의 추가적 형상부가 제공될 수 있다. 예를 들면, 외피는, 체류 구조와 외피 바디가 환자에게 이식된 상태로 유지되는 동안에 또는 제거 후에, in situ 교체할 수 있는 약물 코어를 수용할 수 있다. 일부 구현예에서, 외피 바디에, 코어를 외피 바디로부터 빼기 위해 압착하엿을 때 외피 바디에 힘을 인가하는 하나 이상의 외부 돌출부가 구비될 수 있다. 그런 다음, 교체 약물 코어를 외피 바디 내에 위치시킬 수 있다. 일부 구현예에서, 외피 바디 또는 체류 구조는 구분되는 형상, 예컨대 구분되는 색상을 가져, 누소관내의 올바른 장착을 확인할 수 있다.
치료 제제의 예:
치료 제제(또는 간단하게 "제제")는 그외에도 하기 제제 또는 이의 등가체, 유도체 또는 유사체들 중 하나 또는 임의 조합으로 제조된 약제, 예컨대 항-녹내장 약제(예, 아드레날린 작용제, 아드레날린 길항제(베타 차단제), 탄산탈수효소 저해제(CAI: carbonic anhydrase inhibitor)(전신적 및 국소적), 부교감신경흥분제, 프로스타글란딘 및 저혈압성 지질(hypotensive lipid) 및 이들의 조합), 항미생물제(예, 항생제, 항바이러스제, 항기생충제, 항진균제 등), 코르티코스테로이드 또는 그외 항염증제(예, NSAID 또는 그외 진통성 및 통증 제어 화합물), 충혈 완화제(예, 혈관 수축제), 알레르기 반응 예방 또는 변형제(예, 항히스타민, 사이토카인 저해제, 루코트리엔 저해제, IgE 저해제, 면역조절제), 비만 세포 안정화제, 안근 마비제(cycloplegic) 등을 포함할 수 있다.
예시적인 제제로는, 트롬빈 저해제; 항혈전 약제(antithrombogenic agents); 혈전 용해제(thrombolytic agents); 섬유소 용해제(fibrinolytic agents); 혈관경련 저해제(vasospasm inhibitors); 혈관 확장제(vasodilators); 항고혈압 약제(antihypertensive agents); 항미생물 약제, 예를 들어 항생제(예, 테트라사이클린, 클로르테트라사이클린, 박시트라신, 네오마이신, 폴리믹신, 그라미시딘, 세팔렉신, 옥시테트라사이클린, 클로람페니콜, 리팜피신, 시프로플록사신, 토브라마이신, 젠타마이신, 에리트로마이신, 페니실린, 설폰아미드, 설파디아진, 설파세타미드, 설파메티졸, 설피속사졸, 니트로푸라존, 소듐 프로피오네이트), 항진균제(예, 암포테리신 B 및 미코나졸), 및 항바이러스제(예, 이독수리딘 트리플루오로티미딘, 아시클로비어, 갱시클로비어, 인터페론); 표면 당단백질 수용체의 저해제(surface glycoprotein receptor); 항혈전제; 유사분열 저해제; 미세소관 저해제(microtubule inhibitor); 분비억제제(anti-secretory agent); 활성 저해제(active inhibitor); 재구성 저해제(remodeling inhibitor); 안티센스 뉴클레오티드(antisense nucleotide); 항-대사 물질(anti-metabolite); 항증식제(예, 혈관신생 억제제); 항암 화학요법 약제; 항-염증제(예, 하이드로코르티손, 하이드로코르티손 아세테이트, 덱사메타손 21-포스페이트, 플루오시놀론, 메드리손, 메틸프레드니솔론, 프레드니솔론 21-포스페이트, 프레드니솔론 아세테이트, 플루오로메탈론, 베타메타손, 트리암시놀론, 트리암시놀론 아세토니드); 비-스테로이드성 항-염증제(NSAID) (예, 살리실레이트, 인도메타신, 이부프로펜, 디클로페낙, 플루비프로펜, 피록시캄, 인도메타신, 이부프로펜, 낙소프렌(naxopren), 피록시캄 및 나부메톤)를 포함하나, 이들로 한정되지 않는다. 본 발명의 방법에 사용이 고려되는 이러한 항염증 스테로이드의 예로는, 트리암시놀론 아세토니드(일반명) 및 코르티코스테로이드, 예를 들어 트리암시놀론, 덱사메타손, 플루오시놀론, 코르티손, 프레드니솔론, 플루메톨론, 및 그의 유도체; 항알러지제(예, 소듐 크로모글리케이트(sodium chromoglycate), 안타졸린, 메타피릴린, 클로르페니라민, 세트리진, 피릴아민, 프로펜피리다민); 항증식 약제(예, 1,3-시스 레티노산, 5-플루오로우라실, 탁솔, 라파마이신, 마이토마이신 C, 및 시스플라틴); 출혈 완화제(예, 페닐에프린, 나파졸린, 테트라하이드라졸린); 동공 축소제(miotic) 및 항-콜린에스테라제(예, 필로카르핀, 살리실레이트, 카바콜, 아세틸콜린 클로라이드, 파이소스티그민, 에세린, 디이소프로필 플루오로포스페이트, 포스폴린 아이오딘, 데메카리움 브로마이드); 항종양제(예, 카르무스틴, 시스플라틴, 플루오로우라실3); 면역제(예, 백신 및 면역 자극제); 호르몬제(예, 에스트로겐, -에스트라디올, 프로게스타오널(progestational), 프로게스테론, 인슐린, 칼시토닌, 부갑상선 호르몬, 펩타이드, 및 바소프레신 시상하부 분비 인자(vasopressin hypothalamus releasing factor)); 면역억제제, 성장 호르몬 길항제, 성장 인자(예, 상피세포 성장 인자, 섬유모세포 성장 인자, 혈소판 유래 성장 인자, 형질전환 성장 인자 베타, 소마토트랩핀, 피브로넥틴); 혈관신생 저해제(예, 안지오스타틴, 아네코르타브 아세테이트, 트롬보스폰딘, 항-VEGF 항체); 도파민 작용제; 방사선 요법제; 펩타이드; 단백질; 효소; 세포외 매트릭스; 컴포넌트(component); ACE 저해제; 유리 라디칼 소거제(free radical scavengers); 킬레이트제(chelator); 항산화제: 항-폴리머라제(anti polymerase); 광역학 치료제(photodynamic therapy agent); 유전자 치료제; 및 다른 치료 제제, 예를 들어 프로스타글란딘, 항프로스타글란딘, 프로스타글란딘 전구체, 예를 들어 항녹내장 약제, 예를 들어 베타-차단제, 예를 들어 티몰롤, 베탁솔롤, 레보부놀롤, 아테놀롤, 및 프로스타글란딘 유사체, 예를 들어 비마토프로스트, 트라보프로스트, 라타노프로스트 등; 탄산탈수효소 저해제, 예를 들어 아세타졸아미드, 도르졸아미드, 브린졸아미드, 메타졸아미드, 디클로르펜아미드, 디아목스; 및 신경 보호제, 예를 들어 루베졸, 니모디핀 및 관련 화합물; 및 부교감신경 흥분제, 예를 들어 필로카르핀, 카바콜, 파이소스티그민 등을 포함한다. 본 발명에 따른 누관 임플란트와 함께 사용할 수 있는 추가적인 제제로는, 미국 연방 식품, 의약품 및 화장품 법률 505조에 의거하여 승인받았거나, 또는 공중 보건 서비스 법률에 의거하여 승인받은 약제를 포함하나, 이들로 한정되지 않으며, 일부는 미국 식의약청(FDA) 웹사이트 http://www.accessdata.fda.gov/scripts/cder/drugsatfda/index에서 확인할 수 있다. 또한, 본 발명의 누관 임플란트는, 본 특허 문헌의 출원일과 동일, 일찍 또는 늦은 일자가 찍혀있거나 기록되어 있는, FDA 오렌지북 웹사이트(http://www.fda.gov/cder/ob/)에서 확인할 수 있는, 전자 형태나 종이 형태의 오렌지북에 열거된 약제과 함께 사용할 수 있다. 예로, 이들 약제들은, 특히 도르졸아미드(dorzolamide), 올로파타딘(olopatadine), 트라보프로스트(travoprost), 비마토프로스트(bimatoprost), 사이클로스포린(cyclosporin), 브리모니딘(brimonidine), 목시플록삭신(moxifloxacin), 토브라마이신(tobramycin), 브린졸아미드(brinzolamide), 아시클로비르 티몰롤 말레이트(aciclovir timolol maleate), 케토롤락 트로메타민(ketorolac tromethamine), 프레드니솔론 아세테이트(prednisolone acetate), 소듐 히알루로네이트(sodium hyaluronate), 네파페낙(nepafenac), 브롬페낙(bromfenac), 디클로페낙(diclofenac), 플루르비프로펜(flurbiprofen), 수프로페낙(suprofenac), 비녹산(binoxan), 파타놀(patanol), 덱사메타손/토브라마이신 조합물(dexamethasone/tobramycin combination), 목시플록삭신(moxifloxacin) 또는 어사이클로비르(acyclovir)를 포함할 수 있다.
전술한 제제(들)로 치료할 수 있는 증상의 예는, 녹내장, 수술 전후 눈 치료, 안구 건조증, 알레르기를 포함하지만, 이들로 한정되는 것은 아니다. 일부 구현예에서, 치료 제제는 윤활제 또는 계면활성제, 예를 들어 안구 건조증 치료를 위한 윤활제를 포함할 수 있다. 다른 구현예들에서, 치료 제제는 눈에서 눈물을 흡수할 수 있는 흡수제를 포함할 수 있다.
약물 코어의 예
약물 코어는 제제(들)를 포함할 수 있으며, 일부 구현예에서는, 제제(들)의 지속적인 방출을 제공하기 위한 한가지 이상의 제제를 포함할 수 있다. 상기 제제는 약물 코어로부터 표적 조직, 예컨대 눈의 모양체근으로 이동한다. 제제는 선택적으로 매트릭스에 제제 소량이 용해되도록 매트릭스에 매우 조금 용해될 수 있으며, 약물 코어의 표면으로부터의 방출에 의해 이용될 수 있다. 제제가 코어의 노출면으로부터 눈물 또는 눈물막으로 확산 또는 이동하기 때문에, 코어에서의 눈물 또는 눈물막으로의 이동 속도는 매트릭스에 용해된 제제의 농도와 관련있을 수 있다. 그외에도, 또는 이와 더불어, 코어에서 눈물 또는 눈물막으로의 제제의 이동 속도는 제제가 용해되는 매트릭스의 한가지 이상의 특성과 관련있을 수 있다. 일부 구현예에서, 상기 약물 코어에서 눈물 또는 눈물막까지의 이동 속도는 실리콘 제형을 기준으로 할 수 있다. 일부 구현예에서, 약물 코어에 용해된 제제의 농도는 제제의 바람직한 방출 속도를 제공하도록 조절할 수 있다. 일부 구현예에서, 코어에 포함되는 제제는 액체, 고체, 고체 겔, 고체 결정, 고체 비정질, 고체 미립자 또는 치료 제제가 용해된 형태일 수 있다. 제제는, 실리콘 매트릭스에 분산된, 액체 또는 고형 봉입체, 예컨대 액체 란타노프로스트 점적제 또는 고체 비마토프로스트 미립자 각각을 포함할 수 있다.
약물 코어는 제제의 지속적인 방출을 제공할 수 있는 하나 이상의 생체친화성 물질을 포함할 수 있다. 약물 코어는 매트릭스 내에 위치하여 용해가능한 봉입체를 가진 실질적으로 비-생분해성인 실리콘 매트릭스 등의 매트릭스를 포함하는 구체예를 들어 상기와 같이 기술되어 있지만, 약물 코어는 제제의 지속적인 방출을 제공하는 다른 구조물, 예컨대 생분해성 매트릭스, 유공성 약물 코어, 액체 약물 코어 또는 고체 약물 코어를 포함할 수 있다. 제제를 포함하는 매트릭스는, 생분해성 또는 비-생분해성 폴리머로부터 제조할 수 있다. 일부 구현예에서, 비-생분해성 약물 코어는 실리콘, 아크릴레이트, 폴리에틸렌, 폴리우레탄, 폴리우레탄, 하이드로겔, 폴리에스테르(예, DACRON.RTM., E. I. Du Pont de Nemours and Company, Wilmington, Del.), 폴리프로필렌, 폴리테트라플루오로에틸렌(PTFE), 팽창(expanded) PTFE (ePTFE), 폴리에테르 에테르 케톤(PEEK), 나일론, 압출 콜라겐, 폴리머 폼(polymer foam), 실리콘 고무, 폴리에틸렌 테레프탈레이트, 초고분자량 폴리에틸렌, 폴리카보네이트 우레탄, 폴리우레탄, 폴리이미드, 스테인레스 스틸, 니켈-티타늄 합금(예, 니티놀), 티타늄, 스테인레스 스틸, 코발트-크롬 합금(예, ELGILOY.RTM., Elgin Specialty Metals, Elgin, Ill.; CONICHROME.RTM., Carpenter Metals Corp., Wyomissing, Pa.)을 포함할 수 있다. 일부 구현예에서, 생분해성 약물 코어는 하나 이상의 생분해성 폴리머, 예를 들어 단백질, 하이드로겔, 폴리글리콜산(PGA), 폴리락트산(PLA), 폴리(L-락트산)(PLLA), 폴리(L-글리콜산)(PLGA), 폴리글리콜리드, 폴리-L-락티드, 폴리-D-락티드, 폴리(아미노산), 폴리디옥사논, 폴리카프로락톤, 폴리글루코네이트, 폴리락트산-폴리에틸렌 옥사이드 공중합체, 개질된 셀룰로스, 콜라겐, 폴리오르토에스테르, 폴리하이드록시부티레이트, 폴리안하이드라이드, 폴리포스포에스테르, 폴리(알파-하이드록시산) 및 그들의 조합을 포함할 수 있다. 일부 구현예에서, 약물 코어는 한가지 이상의 하이드로겔 폴리머를 포함할 수 있다.
실험예
본 발명의 누관 임플란트에 대해 보다 충분한 이해를 구하기 위해, 하기 실시예들을 예시적으로 제공한다.
실시예
1
도 12는 체류 구조를 포함하는 임플란트 본체를 포함하는 누관 임플란트(1200)을 나타낸다. 본 실시예에서, 체류 구조는 오아시스 하이드로겔 체류 부재를 둘러 싸고 있다. 오아시스 하이드로겔 체류 부재에 유체가 수용되도록, 체류 구조는 실리콘/콘택트 렌즈 친수성 캡 부재의 형태로 유체 투과성 유지 장치를 포함한다. 본 실시예에서, 캡 부재는 80% 실리콘과 20% 콘택트 렌즈 물질(비스타 옵틱스 75)을 포함한다. 실리콘/콘택트 렌즈 캡 부재는, 체류 구조에 의한 유체 수용을 가능하게 할 뿐만 아니라, 확장된 동안에 체류 구조 바깥으로의 오아시스 하이드로겔의 돌출을 또한 저지한다.
1202는, t=0분의, 오아시스 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1203은, t=5분의, 오아시스 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1204는, t=10분의, 오아시스 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1206은, t=30분의, 오아시스 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1208은, t=1시간의, 오아시스 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1210은, t=12일의 60℃에서의, 오아시스 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1212는, 1시간의 기간 동안, 오아시스 하이드로겔 체류 부재가 0.29 mm 초기 직경에서 0.78 mm의 확장된 직경으로 크기가 증가함을 나타내며, 또한, 임플란트내에서 오아시스 하이드로겔 체류 부재가 1시간의 기간 동안, 0.29 mm의 초기 직경에서 0.74 mm의 확장된 직경으로 크기가 증가함을 나타낸다.
실시예
2
도 13은 체류 구조를 포함하는 임플란트 본체를 포함하는 누관 임플란트(1300)를 나타낸다. 본 실시예에서, 체류 구조는 TG-2000 하이드로겔 체류 부재를 둘러싸고 있다. TG-2000 하이드로겔 체류 부재에 유체가 수용되도록, 체류 구조는 실리콘/콘택트 렌즈 친수성 캡 부재의 형태로 유체 투과성 유지 장치를 포함한다. 본 실시예에서, 캡 부재는 80% 실리콘과 20% 콘택트 렌즈 물질(비스타 옵틱스 75)을 포함한다. 실리콘/콘택트 렌즈 캡 부재는, 체류 구조에 의한 유체 수용을 가능하게 할 뿐만 아니라, 확장된 동안에 체류 구조 바깥으로의 TG-2000 하이드로겔의 돌출을 또한 저지한다.
1302는, t=0분의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1304는, t=5분의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1306은, t=10분의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1308은, t=30분의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1310은, t=12일, 60℃에서의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1312는, 1시간의 기간 동안, TG-2000 하이드로겔 체류 부재가 0.32 mm 초기 직경에서 0.70 mm의 확장된 직경으로 크기가 증가함을 나타내며, 또한, 임플란트내에서 TG-2000 하이드로겔 체류 부재가 1시간의 기간 동안, 0.32 mm의 초기 직경에서 0.69 mm의 확장된 직경으로 크기가 증가함을 나타낸다.
실시예
3
도 14는 체류 구조를 포함하는 임플란트 본체를 포함하는 누관 임플란트(1400)를 나타낸다. 본 실시예에서, 체류 구조는 Contamac-78% 하이드로겔 체류 부재를 둘러싸고 있다. Contamac-78% 하이드로겔 체류 부재에 유체가 수용되도록, 체류 구조는 실리콘/콘택트 렌즈 친수성 캡 부재의 형태로 유체 투과성 유지 장치를 포함한다. 본 실시예에서, 캡 부재는 80% 실리콘과 20% 콘택트 렌즈 물질(비스타 옵틱스 75)을 포함한다. 실리콘/콘택트 렌즈 캡 부재는, 체류 구조에 의한 유체 수용을 가능하게 할 뿐만 아니라, 확장된 동안에 체류 구조 바깥으로의 Contamac-78% 하이드로겔의 돌출을 또한 저지한다.
1402는, t=0분의, Contamac-78% 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1404는, t=5분의, Contamac-78% 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1406은, t=10분의, Contamac-78% 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1408은, t=30분의, Contamac-78% 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1410은, t=12일, 60℃에서의, Contamac-78% 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1412는, 1시간의 기간 동안, Contamac-78% 하이드로겔 체류 부재가 0.27 mm 초기 직경에서 0.46 mm의 확장된 직경으로 크기가 증가함을 나타내며, 또한, 임플란트내에서 Contamac-78% 하이드로겔 체류 부재가 1시간의 기간 동안, 0.27 mm의 초기 직경에서 0.48 mm의 확장된 직경으로 크기가 증가함을 나타낸다.
실시예
4
도 15는 체류 구조를 포함하는 임플란트 본체를 포함하는 누관 임플란트(1500)를 나타낸다. 본 실시예에서, 체류 구조는 TG-2000 하이드로겔 체류 부재를 둘러싸고 있다. TG-2000 하이드로겔 체류 부재에 유체가 수용되도록, 체류 구조는 실리콘/염 친수성 캡 부재의 형태로 유체 투과성 유지 장치를 포함한다. 본 실시예에서, 캡 부재는 60% 실리콘과 40% 염(NaCl)을 포함한다. 실리콘/염 캡 부재는, 체류 구조에 의한 유체 수용을 가능하게 할 뿐만 아니라, 확장된 동안에 체류 구조 바깥으로의 TG-2000 하이드로겔의 돌출을 또한 저지한다.
1502는, t=0분의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1504는, t=5분의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1506은, t=10분의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1508은, t=30분의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1510은, t=12일, 60℃에서의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1512는, 1시간의 기간 동안, TG-2000 하이드로겔 체류 부재가 0.32 mm 초기 직경에서 0.70 mm의 확장된 직경으로 크기가 증가함을 나타내며, 또한, 임플란트내에서 TG-2000 하이드로겔 체류 부재가 1시간의 기간 동안, 0.32 mm의 초기 직경에서 0.91 mm의 확장된 직경으로 크기가 증가함을 나타낸다.
실시예
5
도 16은 체류 구조를 포함하는 임플란트 본체를 포함하는 누관 임플란트(1600)을 나타낸다. 본 실시예에서, 체류 구조는 오아시스 하이드로겔 체류 부재를 둘러싸고 있다. 오아시스 하이드로겔 체류 부재에 유체가 수용되도록, 체류 구조는 실리콘/염 친수성 캡 부재의 형태로 유체 투과성 유지 장치를 포함한다. 본 실시예에서, 캡 부재는 60% 실리콘과 40% 염(NaCl)을 포함한다. 실리콘/염 캡 부재는, 체류 구조에 의한 유체 수용을 가능하게 할 뿐만 아니라, 확장된 동안에 체류 구조 바깥으로의 오아시스 하이드로겔의 돌출을 또한 저지한다.
1602는, t=0분의, 오아시스 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1604는, t=5분의, 오아시스 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1606은, t=10분의, 오아시스 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1608은, t=30분의, 오아시스 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1610은, t=12일의 60℃에서의, 오아시스 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1612는, 1시간의 기간 동안, 오아시스 하이드로겔 체류 부재가 0.29 mm 초기 직경에서 0.78 mm의 확장된 직경으로 크기가 증가함을 나타내며, 또한, 임플란트내에서 오아시스 하이드로겔 체류 부재가 1시간의 기간 동안, 0.29 mm의 초기 직경에서 0.84 mm의 확장된 직경으로 크기가 증가함을 나타낸다.
실시예
6
도 17은 체류 구조를 포함하는 임플란트 본체를 포함하는 누관 임플란트(1700)를 나타낸다. 본 실시예에서, 체류 구조는 TG-2000 하이드로겔 체류 부재를 둘러싸고 있다. TG-2000 하이드로겔 체류 부재에 유체가 수용되도록, 체류 구조는 실리콘/가교된 폴리(1-(2-옥소-1-피롤리디닐)에틸렌(PVP) 친수성 캡 부재의 형태로 유체 투과성 유지 장치를 포함한다. 본 실시예에서, 캡 부재는 70% 실리콘과 30% 가교된 PVP(분자량 111.14의 포비돈®)를 포함한다. 실리콘/가교된 PVP 캡 부재는, 체류 구조에 의한 유체 수용을 가능하게 할 뿐만 아니라, 확장된 동안에 체류 구조 바깥으로의 TG-2000 하이드로겔의 돌출을 또한 저지한다.
1702는, t=0분의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1704는, t=30분의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1706은, t=2시간의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다.
실시예
7
도 18은 체류 구조를 포함하는 임플란트 본체를 포함하는 누관 임플란트(1800)를 나타낸다. 본 실시예에서, 체류 구조는 TG-2000 하이드로겔 체류 부재를 둘러싸고 있다. TG-2000 하이드로겔 체류 부재에 유체가 수용되도록, 체류 구조는 실리콘/폴리(에틸렌 산화물)(PEO) 친수성 캡 부재의 형태로 유체 투과성 유지 장치를 포함한다. 본 실시예에서, 캡 부재는 75% 실리콘과 25% PEO(분자량 8,000,000달톤)을 포함한다. 실리콘/PEO 캡 부재는, 체류 구조에 의한 유체 수용을 가능하게 할 뿐만 아니라, 확장된 동안에 체류 구조 바깥으로의 TG-2000 하이드로겔의 돌출을 또한 저지한다.
1802는, t=0분의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1804는, t=15분의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1806은, t=30분의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다. 1808은, t=1시간의, TG-2000 하이드로겔과 둘러싸고 있는 체류 구조를 나타낸다.
결어
우선, 눈의 누소관내에서 견고하게 유지하게 하는 눈액 임플란트 및 관련 방법이 본원에 기술되어 있다. 누관 임플란트는, 누점을 통해 누소관 내에 적어도 부분적으로 삽입할 수 있는 임플란트 본체를 포함할 수 있다. 임플란트 본체는 확장성 체류 부재를 실질적으로 둘러싸도록 구성되는 체류 구조를 포함할 수 있다. 즉, 체류 부재가 확장됨에 따라, 체류 구조의 한곳 이상의 외표면 부분은 누소관의 벽 방향으로 압력을 받게 된다. 다양한 구현예들에서, 누관 임플란트는 눈에 제제의 지속적인 방출을 제공하기 위해 임플란트 본체에 삽입할 수 있는 약물 코어를 추가로 포함할 수 있다.
이롭게도, 몇몇 구현예에서, 본 발명의 누관 임플란트는, 몇일, 몇달 내지는 몇년과 같이 다양한 기간 동안, 눈물의 흐름을 성공적으로 차단하고, 눈에 지속적인 치료 제제의 전달을 제공할 수 있다. 또한, 임플란트 본체를 이용하여 확장성 체류 부재를 둘러싸므로써, 체류 부재의 부분(외부 영역 포함)은 잔류 임플란트로부터 분리되지 않게 하여, 깨끗한 제거와, 어쩌면 임플란트 보유를 강화할 수 있다. 나아가, 체류 부재의 확장 특성은 체류 부재의 큰 확장이 임플란트를 바람직하게 이식하였을 때 이루어지도록 구성되어 있기 때문에, 용이한 이식이 가능하다. 또한, 본 발명의 누관 임플란트는, 체류 부재의 확장 특성이 다양한 크기의 속이 빈 조직 구조물에 맞게 임플란트를 이식시켜 주기 때문에, 모든 요법에 한가지 크기(one-size-fits-all regime)를 제공하도록 이식할 수 있다.
상기 상세한 설명은, 상세 설명의 일부를 형성하는 첨부된 도면을 참조한다. 도면은, 설명의 목적으로, 본 발명이 실시될 수 있는 특정 실시예를 도시한다. 이들 실시예들은 여기에서 "예"로 언급된다.
본 문헌에서, 특허 문헌에서 일반적이듯이, "하나"라는 용어는, 임의의 다른 어떤 경우 또는 "적어도 하나" 또는 "하나 이상"이라는 용어를 사용한 것과는 상관없이, 하나 또는 하나 이상을 포함하기 위해 사용된다. 본 문헌에서, "또는"이라는 용어는 배타적이 아니며, 다시 말해서, 다르게 언급된 경우를 제외하고는, "A 또는 B"는 "B가 아니고 A", "A가 아니고 B", 및 "A 및 B"를 포함한다. 본 문헌에서, "약"이라는 용어는, 언급된 양과 대략, 가까이, 거의 같거나 그 부근에 있는 양을 지칭한다.
본 문헌에서, 용어 "하이드로겔"은, 예를 들면 초흡수(super-absorbent) 폴리머, 하이드로콜로이드, 및 물-흡수성 친수성 폴리머와 같은 흡수 또는 보유하는 물질(예, 흡수 물질)을 지칭한다. 몇몇 예에서, 용어 "하이드로겔"은 "건조" 상태의 초-흡수 폴리머 입자, 보다 상세하게는, 물을 포함하지 않거나 입자의 중량보다 적은 양의 물, 예를 들면 약 5 중량% 미만의 물을 포함하는 입자를 지칭한다. 몇몇 예에서, 용어 "하이드로겔"은, 하이드로겔이 팽창성이 아닐 때에는 "건조" 상태의 초-흡수 폴리머를 지칭하며, 또한, 수화되거나 팽창된 상태, 더욱 구체적으로는, 하이드로겔의 중량 이상의 물, 예를 들면 하이드로겔의 중량의 여러 배수의 물을 흡수한 하이드로겔을 지칭한다. 하이드로겔 물질은 유체를 흡수하기 때문에, 그 크기가 증가할 수 있고, 그 형태는 예를 들면 누소관의 벽 방향으로 체류 구조의 일부분이 압박되도록 바뀔 수 있다.
본 문헌에서, 용어 "실질적으로 둘러싸는"은 부재 외표면적의 90% 이상이 둘러싸인 구조로 부재가 둘러싸여진 배열을 의미한다. 일부 예에서, 용어 "실질적으로 둘러싸는"은 부재 외표면적의 95% 이상이 둘러싸인 구조로 부재가 둘러싸여진 배열을 의미한다. 용어 "실질적으로 둘러싸는"은 부재 외표면적의 98% 이상이 둘러싸인 구조로 부재가 둘러싸여진 배열을 의미한다.
첨부된 청구범위에서, "포함하는(including)" 및 "여기에서(in which)"라는 용어는 "포함하는(comprising)" 및 "여기에서(wherein)"라는 각각의 용어의 통상적 영어(English)의 동등어로서 사용된다. 또한, 하기 청구범위에서, 용어 "포함하는(including)" 및 "포함하는(comprising)"은 개방적이며, 즉, 청구항에서 그러한 용어 뒤에 열거된 것 이외의, 요소를 포함하는 시스템, 어셈블리, 장치, 물품 또는 프로세스는 여전히 청구범위에 포함되는 것으로 간주된다. 또한, 하기 청구범위에서, "제1", "제2", "제3" 등의 용어는 단순히 라벨(label)로서 사용되었으며, 그 대상물에 수치적 요구사항을 부와하는 것은 아니다.
상기 설명은 설명을 위한 것이지 제한을 목적으로 하는 것은 아니다. 예를 들면, 상술한 예들(또는 그것의 하나 이상의 측면)은 서로 조합으로 사용될 수 있다. 상기 설명을 검토할 때 예를 들면 당해 기술 분야의 당업자는 다른 실시예들도 이용할 수 있다. 또한, 상기 상세한 설명에서, 본 명세서의 내용을 간소화하기 위해 함께 그룹지을 수 있다. 이것은, 설명은 되었지만 청구되지는 않은 측면이 임의의 청구항에 필수적인 것으로 해석해서는 안된다. 오히려, 본 발명의 내용은 특정하게 기술된 구현예의 모든 측면보다 작을 수 있다. 따라서, 하기 청구범위는 상세한 설명에 포함되며, 각각의 청구항은 그 자체로서 별개의 구현예를 나타낸다. 본 발명의 범위는, 첨부된 청구범위가 부여하는 균등물의 전체 범위와 함께, 청구범위를 참조하여 정해져야 한다.
요약서는 독자가 기술적 내용의 특성을 신속히 파악할 수 있게 하기 위해 37 C.F.R. §1.72(b)에 따라 제공된다. 요약서는 청구범위의 범위 또는 의미를 해석하거나 제한하기 위한 목적으로 사용되지 않을 것으로 이해하며, 제출한다.
Claims (125)
- 누소관(lacrimal canaliculus)에 삽입할 수 있는 누관 임플란트로서,
상기 누관 임플란트는,
유체 투과성 유지 장치(retainer)를 가지고 있는 체류 구조를 포함하는 임플란트 본체;
상기 체류 구조에 의해 실질적으로 둘러싸여 있고, 상기 체류 구조를 누소관에 이식하였을 때 확장가능한, 하이드로겔 체류 부재를 포함하며,
상기 유체 투과성 유지 장치는 상기 체류 구조로의 유체의 투과를 허용하며, 확장시 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조의 바깥쪽으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 누관 임플란트. - 제1항에 있어서, 상기 체류 구조가 상기 하이드로겔 체류 부재가 배치되는 1개 이상의 챔버를 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제1항 또는 제2항에 있어서, 상기 임플란트 본체의 적어도 일부가 상기 누점의 외부에 잔류하는 것을 특징으로 하는, 누관 임플란트.
- 제1항 또는 제2항에 있어서, 상기 임플란트 본체가 상기 누점 안으로 완전히 삽입가능한 것을 특징으로 하는, 누관 임플란트.
- 제1항 내지 제4항 중 어느 한항에 있어서, 상기 유체 투과성 유지 장치는 상기 확장된 하이드로겔 체류 부재가 상기 체류 구조의 외부로 돌출되는 것을 80% 이상 저지하는 것을 특징으로 하는, 누관 임플란트.
- 제1항 내지 제5항 중 어느 한항에 있어서, 상기 유체 투과성 유지 장치는, 50 중량% 이상의 실리콘과, 콘택트 렌즈 물질, 소듐 클로라이드, 폴리에틸렌 산화물, 폴리에틸렌 글리콜, 폴리비닐 피릴리돈, 폴리비닐 알코올 및 이의 임의 조합으로 이루어진 군으로부터 선택되는 1종 이상의 친수성 폴리머를 조합하여 포함하는, 유체 투과부를 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제6항에 있어서, 상기 유체 투과성 유지 장치는 약 80 중량% 이상의 실리콘을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제6항에 있어서, 상기 유체 투과성 유지 장치는 약 60 중량%의 실리콘과 약 40 중량%의 소듐 클로라이드를 포함하는 것을 특징으로 하는, 누관 임플란트..
- 제6항에 있어서, 상기 유체 투과성 유지 장치는 약 70 중량%의 실리콘과 약 30 중량%의 폴리비닐 피릴리돈을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제6항에 있어서, 상기 유체 투과성 유지 장치는 약 75 중량%의 실리콘과 약 25 중량%의 폴리에틸렌 산화물을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제6항에 있어서, 상기 유체 투과성 유지 장치는 약 80 중량%의 실리콘과 약 20 중량%의 콘텍트 렌즈 물질을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제6항에 있어서, 상기 콘택트 렌즈 물질은 하이드로겔, 2-하이드록시에틸 메타크릴레이트(HEMA) 공중합체 또는 폴리(메틸 메타크릴레이트)(PMMA) 공중합체 중 한가지 이상을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제 1항 내지 제12항 중 어느 한항에 있어서, 상기 하이드로겔 체류 부재는 폴리우레탄 또는 실리콘 중 한가지 이상을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제1항 내지 제13항 중 어느 한항에 있어서, 상기 하이드로겔 체류 부재는 미확장 체적의 최대 1배에 해당하는 확장력을 가지는 것을 특징으로 하는, 누관 임플란트.
- 제1항 내지 제13항 중 어느 한항에 있어서, 상기 하이드로겔 체류 부재는 미확장 체적의 최대 10배에 해당하는 확장력을 가지는 것을 특징으로 하는, 누관 임플란트.
- 제1항 내지 제13항 중 어느 한항에 있어서, 상기 하이드로겔 체류 부재는 미확장 체적의 최대 100배에 해당하는 확장력을 가지는 것을 특징으로 하는, 누관 임플란트.
- 제1항 내지 제16항 중 어느 한항에 있어서, 상기 임플란트 본체는 외표면부가 상기 하이드로겔 체류 부채의 확장시에 바깥쪽으로 변형될 수 있는 것을 특징으로 하는, 누관 임플란트.
- 제17항에 있어서, 상기 임플란트 본체는 실리콘, 폴리우레탄 또는 아크릴 중 한가지 이상을 포함하는 탄성 물질을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제1항 내지 제18항 중 어느 한항에 있어서, 상기 임플란트 본체의 근단부나 그 주위로부터 적어도 부분적으로 연장되며 누점에 받쳐져서 놓이는 임플란트 본체 돌출부를 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제19항에 있어서, 상기 돌출부의 근단부는 볼록 형태인 것을 특징으로 하는, 누관 임플란트.
- 제1항 내지 제20항 중 어느 한항에 있어서, 상기 임플란트 본체의 외표면부 상에 배치되며, 상기 누소관에 위치되었을 때 상기 임플란트 본체의 제2 확장을 제공하는, 유체 팽윤성 물질을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제1항 내지 제21항 중 어느 한항에 있어서, 상기 체류 구조의 길이가 상기 임플란트 본체 길이의 약 1/5 이상인 것을 특징으로 하는, 누관 임플란트.
- 제1항 내지 제21항 중 어느 한항에 있어서, 상기 체류 구조의 길이가 상기 임플란트 본체 길이의 약 1/4 이상인 것을 특징으로 하는, 누관 임플란트.
- 제1항 내지 제21항 중 어느 한항에 있어서, 상기 체류 구조의 길이가 상기 임플란트 본체 길이의 약 1/3 이상인 것을 특징으로 하는, 누관 임플란트.
- 제1항 내지 제21항 중 어느 한항에 있어서, 상기 체류 구조의 길이가 상기 임플란트 본체 길이의 약 1/2 이상인 것을 특징으로 하는, 누관 임플란트.
- 제1항 내지 제21항 중 어느 한항에 있어서, 상기 체류 구조의 길이가 상기 임플란트 본체 길이의 약 3/4 이상인 것을 특징으로 하는, 누관 임플란트.
- 제1항 내지 제21항 중 어느 한항에 있어서, 상기 체류 구조의 길이가 상기 임플란트 본체 길이와 거의 동일한 것을 특징으로 하는, 누관 임플란트.
- 눈에 제제의 방출을 제공하기 위한 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는,
근단부에서 원단부 방향으로 연장되며, 상기 근단부나 그 근처에 약물 코어를, 상기 원단부나 그 근처에 체류 구조를 포함하는, 임플란트 본체를 포함하며,
상기 약물 코어는 제제를 포함하며, 눈에 제제의 방출을 제공하는 하나 이상의 표면을 가지며,
상기 체류 구조는 유체 투과성 유지 장치를 가지며, 실질적으로 하이드로겔 체류 부재를 둘러싸고 있으며, 상기 체류 구조가 누소관 안에 있을 때 상기 하이드로겔 체류 부재는 확장될 수 있으며,
상기 유체 투과성 유지 장치는 유체의 상기 체류 구조로의 투과를 허용하며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조의 외부로 돌출되는 것을 저지하는, 누관 임플란트. - 제28항에 있어서, 상기 임플란트 본체뭄 상기 약물 코어를 보유하는 제1 챔버와 상기 하이드로겔 체류 부재를 보유하는 제2 챔버를 포함하며, 상기 제2 챔버는 상기 제1 챔버의 원단부에 배치되는 것을 특징으로 하는, 누관 임플란트.
- 제28항 또는 제29항에 있어서, 상기 약물 코어는, 고체 매트릭스에 분산되어 있으며, 외피 바디에 의해 적어도 부분적으로 덮혀져 하나 이상의 노출된 약물 코어 표면을 형성하며, 하나 이상의 치료 제제 봉입체를 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제30항에 있어서, 상기 하나 이상의 약물 코어 표면은 상기 임플란트 본체의 근단부에 인접하게 배치되어, 임플란트 본체를 누점에 삽입하였을 때, 눈물과 접촉하여 상기 치료 제제를 장시간 방출하는 것을 특징으로 하는, 누관 임플란트.
- 제28항 내지 제31항 중 어느 한항에 있어서, 상기 약물 코어와 상기 체류 구조는 함께 일체형(single piece)으로 성형가능한 것을 특징으로 하는, 누관 임플란트.
- 제28항 내지 제31항 중 어느 한항에 있어서, 상기 약물 코어는 제1 일체형으로 제조되고, 상기 체류 구조는 제2 일체형으로 제조되며, 상기 제1 일체형은 상기 제2 일체형과 커플링될 수 있는 것을 특징으로 하는, 누관 임플란트.
- 제28항 내지 제33항 중 어느 한항에 있어서, 상기 유체 투과성 유지 장치는, 약 50 중량% 이상의 실리콘과, 콘택트 렌즈 물질, 소듐 클로라이드, 폴리에틸렌 산화물, 폴리에틸렌 글리콜, 폴리비닐 피릴리돈, 폴리비닐 알코올 및 이의 임의 조합으로 이루어진 군으로부터 선택되는 1종 이상의 친수성 폴리머를 조합하여 포함하는 유체 투과부를 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제28항 내지 제34항 중 어느 한항에 있어서, 상기 약물 코어를 포함하는 상기 임플란트 본체의 근단부는 제1 물질을 포함하며, 상기 체류 구조를 포함하는 상기 임플란트 본체의 원단부는 상기 제1 물질과 상이한 제2 물질을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제28항 내지 제35항 중 어느 한항에 있어서, 상기 임플란트 본체의 근단부의 인접 위치로부터 적어도 부분적으로 연장되며, 누점에 받쳐져서 놓이는, 임플란트 본체 돌출부를 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제28항 내지 제36항 중 어느 한항에 있어서, 상기 약물 코어와 상기 하이드로겔 체류 부재 사이에 위치하는 임플란트 본체 격막을 포함하며, 상기 격막은 상기 약물 코어와 상기 하이드로겔 체류 부재 간의 물질의 이동을 방지하는 것을 특징으로 하는, 누관 임플란트.
- 제28항 내지 제37항 중 어느 한항에 있어서, 상기 임플란트 본체의 외표면부 상에 배치되며, 상기 누소관 내부에 위치되었을 때 상기 임플란트 본체의 제2 확장을 제공하는, 유체 팽윤성 물질을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는
유체 투과성 구멍을 가진 체류 구조를 포함하는 임플란트 본체;
상기 체류 구조에 의해 실질적으로 둘러싸여 있으며, 상기 체류 구조를 누소관에 이식하였을 때, 확장가능한, 하이드로겔 체류 부재를 포함하며;
상기 유체 투과성 구멍은 상기 체류 구조로의 유체의 흐름을 허용하는 크기와 형태를 가지며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 누관 임플란트. - 제39항에 있어서, 상기 유체 투과성 구멍의 크기 및 형태는 상기 하이드로겔 체류 부재의 이탈을 확장된 하이드로겔 체류 부재의 10% 미만으로 저지하는 것을 특징으로 하는, 누관 임플란트.
- 제39항 또는 제40항 중 어느 한항에 있어서, 상기 유체 투과성 구멍의 크기 및 형태는 상기 하이드로겔 체류 부재의 이탈을 확장된 하이드로겔 체류 부재의 5% 미만으로 저지하는 것을 특징으로 하는, 누관 임플란트.
- 제39항 내지 제41항 중 어느 한항에 있어서, 상기 유체 투과성 구멍의 크기 및 형태는 상기 하이드로겔 체류 부재의 이탈을 확장된 하이드로겔 체류 부재의 1% 미만으로 저지하는 것을 특징으로 하는, 누관 임플란트.
- 제39항 내지 제42항 중 어느 한항에 있어서, 상기 유체 투과성 구멍의 크기 및 형태는 초기 건조 상태와 확장된 수화 상태 모두에서 하이드로겔 체류 부재의 유출을 방지하는 것을 특징으로 하는, 누관 임플란트.
- 제39항 내지 제43항 중 어느 한항에 있어서, 상기 유체 투과성 구멍의 크기 및 형태는 약 0.3 mm 이하의 직경을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제39항 내지 제44항 중 어느 한항에 있어서, 상기 임플란트 본체의 근단부에 커플링되는 비투과성, 비친수성 캡 부재를 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제39항 내지 제45항 중 어느 한항에 있어서, 상기 유체 투과성 구멍을 덮을 수 있으며, 상기 체류 구조의 내부 또는 외부에 배치되며, 분자량이 10,000 달톤 이하인, 구멍막을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 눈으로 제제를 방출하기 위한, 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는,
근단부에서 원단부 방향으로 연장되며, 상기 근단부나 그 근처에 약물 코어를, 상기 원단부나 그 근처에 체류 구조를 포함하는, 임플란트 본체;
상기 체류 구조에 의해 실질적으로 둘러싸여 있으며, 상기 체류 구조를 누소관에 이식하였을 때, 확장가능한, 하이드로겔 체류 부재를 포함하며,
상기 약물 코어는 눈에 상기 제제의 방출을 제공하는 하나 이상의 표면을 가지며, 상기 체류 구조는 유체 투과성 구멍을 가지며,
상기 유체 투과성 구멍이 상기 체류 구조로의 유체 흐름을 허용하는 크기와 형태를 가지며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 누관 임플란트. - 제47항에 있어서, 상기 유체 투과성 구멍의 크기 및 형태가 약 0.3 mm 이하의 직경을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제47항 또는 제48항에 있어서, 상기 임플란트 본체의 근단부에 커플링되는 비투과성, 비친수성 캡 부재를 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제47항 내지 제49항 중 어느 한항에 있어서, 상기 유체 투과성 구멍을 덮을 수 있으며, 상기 체류 구조의 내부 또는 외부에 배치되고, 분자량이 10,000 달톤 이하인, 구멍막을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제47항 내지 제50항 중 어느 한항에 있어서, 상기 약물 코어와 상기 하이드로겔 체류 부재 사이에 위치되며, 상기 약물 코어와 상기 하이드로겔 체류 부재 간의 물질의 이동을 방지하는, 임플란트 본체 격막을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 누점으로 삽입가능한 누관 임플란트로서,
근단부에서 원단부 방향으로 연장되며, 원단부에서 커플링되는 유체 투과성 또는 친수성 캡 부재를 포함하는, 체류 구조를 가지는, 임플란트 본체;
상기 체류 구조에 의해 실질적으로 둘러싸여 있으며, 상기 체류 구조가 누소관 안에 있을 때, 확장가능한, 하이드로겔 체류 부재를 포함하며,
상기 캡 부재는 상기 체류 구조로의 유체 투과를 허용하며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 누관 임플란트. - 제52항에 있어서, 상기 캡 부재가, 약 50 중량% 이상의 실리콘과, 콘택트 렌즈 물질, 소듐 클로라이드, 폴리에틸렌 산화물, 폴리에틸렌 글리콜, 폴리비닐 피릴리돈, 폴리비닐 알코올 및 이의 임의 조합으로 이루어진 군으로부터 선택되는 1종 이상의 친수성 폴리머를 조합하여 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제52항 또는 제53항에 있어서, 상기 캡 부재가 상기 누점내로의 비외상성 삽입을 용이하게 하기 위해 데이퍼형 원위팁부를 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제52항 내지 제54항 중 어느 한항에 있어서, 상기 캡 부재가 상기 체류 구조의 원단부만 덮는 을 특징으로 하는, 누관 임플란트.
- 제55항에 있어서, 상기 캡 부재가 상기 체류 구조의 원단부에 꼭 맞는 것을 특징으로 하는, 누관 임플란트.
- 제55항에 있어서, 상기 캡 부재가 상기 체류 구조의 내벽 방향으로 적어도 일부분 오목하게 들어간 것을 특징으로 하는, 누관 임플란트.
- 제52항 내지 제54항 중 어느 한항에 있어서, 상기 캡 부재가 상기 체류 구조의 원단부와 측표면을 덮는 것을 특징으로 하는, 누관 임플란트.
- 눈으로 제제를 방출하기 위한, 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는
근단부에서 원단부 방향으로 연장되며, 상기 근단부나 그 근처에 약물 코어를, 상기 원단부나 그 근처에 체류 구조를 가지는, 임플란트 본체;
상기 체류 구조에 의해 실질적으로 둘러싸여 있으며, 상기 체류 구조가 누소관 안에 있을 때 확장될 수 있는, 하이드로겔 체류 부재를 포함하며,
상기 약물 코어는 눈에 상기 제제의 방출을 제공하는 하나 이상의 표면을 포함하며, 상기 체류 구조는 상기 임플란트 본체의 상기 원단부에 커플링되는 유체 투과성 또는 친수성 캡 부재를 가지며,
상기 캡 부재는 상기 체류 구조로의 유체의 투과를 허용하며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 누관 임플란트. - 제59항에 있어서, 상기 약물 코어의 하나 이상의 표면 주위에서 적어도 부분적으로 연장되며, 볼록형 근단부를 포함하는, 임플란트 본체 돌출부를 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제59항 또는 제60항에 있어서, 상기 약물 코어와 상기 하이드로겔 체류 부재 사이에 위치하는 임플란트 본체 격막을 포함하며, 상기 격막은 상기 약물 코어와 상기 하이드로겔 체류 부재 간의 물질의 이동을 방지하는 것을 특징으로 하는, 누관 임플란트.
- 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는
하나 이상의 영역이 유체 투과성 또는 친수성 물질로 구성된 체류 구조를 포함하는 임플란트 본체와;
상기 체류 구조에 의해 실질적으로 둘러싸여 있으며, 상기 체류 구조를 누소관에 이식하였을 때, 확장될 수 있는, 하이드로겔 체류 부재를 포함하며;
상기 체류 투과성 또는 친수성 물질로 구성된 상기 체류 구조는 상기 체류 구조로의 유체의 투과를 허용하며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 누관 임플란트. - 제62항에 있어서, 상기 유체 투과성 또는 친수성 물질은 약 50 중량% 이상의 실리콘과, 콘택트 렌즈 물질, 소듐 클로라이드, 폴리에틸렌 산화물, 폴리에틸렌 글리콜, 폴리비닐 피릴리돈, 폴리비닐 알코올 및 이의 임의 조합으로 이루어진 군으로부터 선택되는 1종 이상의 친수성 폴리머를 조합하여 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제62항 또는 제63항에 있어서, 상기 유체 투과성 또는 친수성 물질이 하이드로겔을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제62항 내지 제64항 중 어느 한항에 있어서, 상기 유체 투과성 또는 친수성 물질로 구성된 상기 체류 구조가 누소관에 있을 때, 상기 체류 구조가 유체에 노출가능한 측표면에 배치되는 것을 특징으로 하는, 누관 임플란트.
- 제65항에 있어서, 상기 유체 투과성 또는 친수성 물질로 구성된 체류 구조는 상기 체류 구조의 전체 측표면의 약 5% 내지 약 50%에 해당하는 것을 특징으로 하는, 누관 임플란트.
- 제56항에 있어서, 상기 유체 투과성 또는 친수성 물질로 구성된 체류 구조가 상기 체류 구조의 전체 측표면의 50% 이상인 것을 특징으로 하는, 누관 임플란트.
- 제65항에 있어서, 상기 유체 투과성 또는 친수성 물질로 구성된 체류 구조가 상기 체류 구조의 전체 측표면의 약 100%에 해당하는 것을 특징으로 하는, 누관 임플란트.
- 제62항 내지 제68항 중 어느 한항에 있어서, 상기 체류 구조는 상기 임플란트 본체의 근단부에서 커플링되는 유체 투과성 또는 친수성 캡 구성을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 눈으로 제제를 방출하기 위한, 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는,
근단부에서 원단부 방향으로 연장되며, 상기 근단부나 그 근처에 약물 코어를, 상기 원단부의 근처에 유체 투과성 또는 친수성 물질로 적어도 부분적으로 구성된 체류 구조를 포함하는, 임플란트 본체와;
상기 체류 구조에 의해 실질적으로 둘러싸여 있으며, 상기 체류 구조를 누소관에 이식하였을 때 확장될 수 있는, 하이드로겔 체류 부재를 포함하며;
상기 약물 코어는 눈에 상기 제제의 방출을 제공하는 하나 이상의 표면을 포함하며,
상기 체류 구조의 상기 유체 투과성 또는 친수성 물질 부분이 상기 체류 구조로의 유체의 투과를 허용하며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 누관 임플란트. - 제70항에 있어서, 상기 체류 구조가 상기 임플란트 본체의 원단부에 커플링되는 유체 투과성 또는 친수성 캡 부재를 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제70항 또는 제71항에 있어서, 상기 임플란트 본체의 근단부가 비투과성 및 비친수성 물질을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제70항 내지 제72항 중 어느 한항에 있어서, 상기 약물 코어의 하나 이상의 표면 주위로부터 적어도 부분적으로 연장되며, 볼록한 근단부를 포함하는, 임플란트 본체 돌출부를 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제70항 내지 제73항 중 어느 한항에 있어서, 상기 약물 코어와 상기 하이드로겔 체류 부재 사이에 위치되는 임플란트 본체 격막을 포함하며, 상기 격막은 상기 약물 코어와 상기 하이드로겔 체류 부재 간의 물질의 이동을 방지하는 것을 특징으로 하는, 누관 임플란트.
- 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는
체류 구조를 포함하는 임플란트 본체와;
상기 체류 구조에 의해 실질적으로 완전히 둘러싸여 있으며, 상기 체류 구조가 누소관 안에 있을 때 확장가능한, 유체 비흡수성 체류 부재를 포함하며,
상기 체류 구조가 확장된 동안에 상기 체류 구조 밖으로 상기 유체 비흡수성 체류 부재가 나가지 못하도록 저지하는 것을 특징으로 하는, 누관 임플란트. - 제75항에 있어서, 상기 유체 비흡수성 체류 부재가 형상-기억 열가소성 물질을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제76항에 있어서, 상기 형상-기억 열가소성 물질이 우레탄계(urethane-based)인 것을 특징으로 하는, 누관 임플란트.
- 제75항에 있어서, 상기 유체 비흡수성 체류 부재가 산화물 생성 시스템을 포함하며, 상기 산화물 생성 시스템은 상기 누점 안에 삽입시 상기 체류 구조 내부에서 복수의 산화물을 생성 및 방출하는 것을 특징으로 하는, 누관 임플란트.
- 제75항 내지 제78항 중 어느 한항에 있어서, 상기 체류 구조는 유체 비흡수성 체류 부재가 배치되는 하나 이상의 챔버를 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제75항 내지 제79항 중 어느 한항에 있어서, 상기 임플란트 본체의 근단부나 그 주위에서 적어도 부분적으로 연장되며, 누점에 받쳐져서 놓이는, 임플란트 본체 돌출부를 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제80항에 있어서, 상기 돌출부의 상기 근단부가 볼록 형태인 을 특징으로 하는, 누관 임플란트.
- 제75항 내지 제81항 중 어느 한항에 있어서, 상기 임플란트 본체의 외표면 상에 배치되며, 임플란트 본체의 이차적인 유지를 제공하는, 유체 팽윤성 물질을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 눈으로 제제를 방출하기 위한, 누점으로 삽입가능한 누관 임플란트로서, 상기 누관 임플란트는,
근단부에서 원단부 방향으로 연장되며, 상기 근단부나 그 근처에 약물 코어를, 상기 원단부나 그 근처에 체류 구조를 포함하는, 임플란트 본체와;
상기 체류 구조에 의해 실질적으로 완전히 둘러싸여 있으며, 상기 체류 구조가 누소관 안에 있을 때 확장가능한, 유체 비흡수성 체류 부재를 포함하며,
상기 약물 코어가 눈에 상기 제제의 방출을 제공하는 하나 이상의 표면을 포함하고,
상기 체류 구조는, 확장된 동안에, 상기 유체 비흡수성 체류 부재가 상기 체류 구조 밖으로 나가는 것을 저지하는 것을 특징으로 하는, 누관 임플란트. - 제83항에 있어서, 상기 임플란트 본체가 상기 약물 코어를 보유하는 제1 챔버와 상기 유체 비흡수성 체류 부재를 보유하는 제2 챔버를 포함하며, 상기 제2 챔버는 상기 제1 챔버의 원단부에 배치되는 것을 특징으로 하는, 누관 임플란트.
- 제83항 또는 제84항 중 어느 한항에 있어서, 상기 임플란트 본체의 근단부 상에서 상기 약물 코어의 하나 이상의 표면 주위에서 적어도 부분적으로 연장되는 임플란트 본체 돌출부를 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제83항 내지 제85항 중 어느 한항에 있어서, 상기 약물 코어와 상기 유체 비흡수성 체류 부재 사이에 위치되는 임플란트 본체 격막을 포함하며, 상기 격막은 상기 약물 코어와 상기 유체 비흡수성 체류 부재 간의 물질의 이동을 방지하는 것을 특징으로 하는, 누관 임플란트.
- 제83항 내지 제86항 중 어느 한항에 있어서, 상기 약물 코어를 포함하는 임플란트 본체의 근단부는 제1 물질을 포함하고, 상기 유체 비흡수성 체류 구조를 포함하는 임플란트 본체의 상기 원단부는 제1 물질과는 상이한 제2 물질을 포함하는 것을 특징으로 하는, 누관 임플란트.
- 제1항, 제28항, 제39항, 제47항, 제52항, 제59항, 제62항, 제70항, 제75항 또는 제83항 중 어느 한항에 따른 누관 임플란트; 및
안 질환을 치료하기 위한 상기 누관 임플란트의 이용법에 대한 설명서를 포함하는 안 질환 치료용 키트. - 제1항, 제28항, 제39항, 제47항, 제52항, 제59항, 제62항, 제70항, 제75항 또는 제83항 중 어느 한항에 따른 누관 임플란트; 및
안 질환을 치료하기 위한 상기 누관 임플란트의 이용법에 대한 설명서를 포함하며,
상기 누관 임플란트는 1회 사용 용도로 개별 포장된, 안 질환 치료용 키트. - 누점으로 삽입가능한 누관 임플란트의 제조 방법으로서,
체류 구조의 영역을 통해 유체 투과성 유지 장치를 형성하는 것을 포함하는, 체류 구조를 포함하는 임플란트 본체를 형성하는 단계;
상기 체류 구조를 이용하여, 상기 체류 구조가 누소관 안에 있을 때 확장가능한 하이드로겔 체류 부재를 실질적으로 둘러싸는 단계를 포함하며,
상기 유체 투과성 유지 장치를 형성하는 단계는 상기 체류 구조로의 유체의 투과를 허용하는 구조를 형성하는 단계를 포함하며, 확장시에 상기 하이드로겔 체류 부재가 상기 체류 구조 외부 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는 제조 방법. - 제90항에 있어서, 상기 하이드로겔 체류 부재를 실질적으로 둘러싸는 단계는 상기 체류 구조의 하나 이상의 챔버 안에 상기 하이드로겔 체류 부재를 배치하는 단계를 포함하는 것을 특징으로 하는, 제조 방법.
- 제90항 또는 제91항에 있어서, 상기 하이드로겔 체류 부재를 실질적으로 감싸는 단계는 상기 임플란트 본체의 외표면 경계내에 상기 하이드로겔 체류 부재를 위치시키는 단계를 포함하는 것을 특징으로 하는, 제조 방법.
- 제90항 내지 제92항 중 어느 한항에 있어서, 상기 유체 투과성 유지 장치를 형성하는 단계는 상기 체류 구조로부터 상기 하이드로겔 체류 부재의 유출을 저지하는 크기와 형태를 가진 유체 투과성 구멍을 형성하는 단계를 포함하는 것을 특징으로 하는, 제조 방법.
- 제90항 내지 제93항 중 어느 한항에 있어서, 상기 유체 투과성 유지 장치를 형성하는 단계는 상기 임플란트 본체의 근단부와 커플링가능한 유체 투과성 또는 친수성 캡 부재를 형성하는 단계를 포함하는 것을 특징으로 하는, 제조 방법.
- 제94항에 있어서, 상기 유체 투과성 또는 친수성 캡 부재를 형성하는 단계는 약 50 중량% 이상의 실리콘과, 콘택트 렌즈 물질, 소듐 클로라이드, 폴리에틸렌 산화물, 폴리에틸렌 글리콜, 폴리비닐 피릴리돈 또는 폴리비닐 알코올 중 한가지 이상을 조합하는 단계를 포함하는 것을 특징으로 하는, 제조 방법.
- 제90항 내지 제95항 중 어느 한항에 있어서, 상기 유체 투과성 유지 장치를 형성하는 단계는 유체 투과성 또는 친수성 임플란트 본체 부분을 형성하는 단계를 포함하는 것을 특징으로 하는, 제조 방법.
- 제96항에 있어서, 상기 투과성 또는 친수성 임플란트 본체 부분은, 약 50 중량% 이상의 실리콘과, 콘택트 렌즈 물질, 소듐 클로라이드, 폴리에틸렌 산화물, 폴리에틸렌 글리콜, 폴리비닐 피릴리돈 또는 폴리비닐 알코올 중 한가지 이상을 조합하여 포함하는 것을 특징으로 하는, 제조 방법.
- 제90항 내지 제97항 중 어느 한항에 있어서, 상기 임플란트 본체를 형성하는 단계는 비투과성, 비친수성 탄성 물질을 이용하여 제1 임플란트 본체 부분을 사출 성형하는 단계, 및 적어도 부분적으로 유체 투과성 또는 친수성 탄성 물질을 이용하여 제2 임플란트 본체 부분을 사출 성형하는 단계를 포함하는 것을 특징으로 하는, 제조 방법.
- 제90항 내지 제98항 중 어느 한항에 있어서, 상기 임플란트 본체를 형성하는 단계는 볼록 근단부를 가지며 누점 보다 직경 크기가 큰 임플란트 본체 돌출부를 성형하는 단계를 포함하는 것을 특징으로 하는, 제조 방법.
- 제90항 내지 제99항 중 어느 한항에 있어서, 약물 유출부를 통해 제제의 방출이 이루어지도록 상기 약물 코어의 위치를 설정하는 단계를 포함하는, 상기 임플란트 본체의 근단부에 약물 코어를 배치하는 단계를 포함하는 것을 특징으로 하는, 제조 방법.
- 제90항 내지 제100항 중 어느 한항에 있어서, 상기 임플란트 본체를 형성하는 단계는 상기 약물 코어와 상기 체류 구조 사이에 임플란트 본체 격막을 성형하는 단계를 포함하는 것을 특징으로 하는, 제조 방법.
- 제90항 내지 제101항 중 어느 한항에 있어서, 약 1분 내지 약 60분의 시간 안에 보유 크기 및 형태로 확장될 수 있는 하이드로겔 체류 부재를 형성하는 것을 포함하는, 상기 확장성 하이드로겔 체류 부재를 형성하는 단계를 포함하는 것을 특징으로 하는, 제조 방법.
- 제90항 내지 제102항 중 어느 한항에 있어서, 상기 임플란트 본체에 유체 팽윤성 물질을 부착시키기 위해 상기 임플란트 본체의 외표면을 표면 처리하는 단계를 포함하는 것을 특징으로 하는, 제조 방법.
- 제103항에 있어서, 상기 임플란트 본체의 외표면을 표면 처리하는 단계는 상기 임플란트 본체 부분을 플라즈마 처리하는 단계를 포함하는 것을 특징으로 하는, 제조 방법.
- 제103항 또는 제104항 중 어느 한항에 있어서, 상기 임플란트 본체의 외표면을 상기 유체 팽윤성 물질로 코팅하는 단계를 포함하는 것을 특징으로 하는, 제조 방법.
- 제90항 내지 제105항 중 어느 한항에 있어서, 상기 하이드로겔 체류 부재에 의한 직접 확장을 유도하기 위해 상기 임플란트 본체의 일부분을 예비-압박하는 단계를 포함하는 것을 특징으로 하는, 제조 방법.
- 제106항에 있어서, 상기 임플란트 본체에서 예비-압박된 부분이 상기 임플란트 본체의 축에 실질적으로 수직 방향으로 상기 하이드로겔 체류 부재의 확장을 유도하는 것을 특징으로 하는, 제조 방법.
- 제90항 내지 제107항 중 어느 한항에 있어서, 상기 하이드로겔에 대한 폴리우레탄 또는 실리콘의 비율을 변경시키는 단계를 포함하는, 상기 하이드로겔 체류 부재의 팽윤 정도를 조절하는 것을 특징으로 하는, 제조 방법.
- 안 질환 개체의 치료 방법으로서,
상기 개체의 하나 이상의 누점에 누관 임플란트를 삽입하는 단계를 포함하며,
상기 누관 임플란트는, 근단부에서 원단부 방향으로 연장되며, 상기 근단부 근처에 약물 코어를, 상기 원단부나 그 근처에 체류 구조를 포함하는, 임플란트 본체와; 유체 투과성 유지 장치를 가지며, 상기 체류 구조가 누소관 안에 있을 때 확장가능한 하이드로겔 체류 부재를 실질적으로 둘러싸고 있는 체류 구조를 포함하며,
상기 약물 코어는 제제를 포함하며, 상기 제제의 눈으로의 방출을 제공하는 하나 이상의 표면을 가지며,
상기 유체 투과성 유지 장치는 상기 체류 구조로의 유체의 투과를 허용하며, 확장된 동안에 상기 하이드로겔 체류 부재가 상기 체류 구조 밖으로 돌출되지 않도록 저지하는 것을 특징으로 하는, 치료 방법. - 제47항, 제59항, 제70항 또는 제83항 중 어느 한항에 따른 하나 이상의 누관 임플란트를 개체의 하나 이상의 누점에 삽입하는 단계를 포함하는 눈 장애를 가진 개체의 치료 방법.
- 제109항 또는 제110항 중 어느 한항에 있어서, 상기 개체가 인간인 것을 특징으로 하는, 치료 방법.
- 제109항 또는 제110항 중 어느 한항에 있어서, 상기 눈 장애가 녹내장 질환인 것을 특징으로 하는, 치료 방법.
- 제112항에 있어서, 상기 녹내장 질환이 안압 또는 원발성 개방우각 녹내장(primary open angle glaucoma)인 것을 특징으로 하는, 치료 방법.
- 제113항에 있어서, 상기 제제가 녹내장 치료제인 것을 특징으로 하는, 치료 방법.
- 제109항 또는 제110항에 있어서, 상기 눈 장애가 알레르기와 관련있는 것을 특징으로 하는, 치료 방법.
- 제115항에 있어서, 상기 누관 임플란트의 교체는 1년에 2회 반복되는 것을 특징으로 하는, 치료 방법.
- 제109항 또는 제110항에 있어서, 상기 누관 임플란트의 삽입은 누점 바깥쪽에 임플란트 본체의 최근단부가 있도록 상기 누점을 통해 부분적으로 이루어지는 것을 특징으로 하는, 치료 방법.
- 제109항 또는 제110항에 있어서, 삽입된 누관 임플란트를 시간 간격 경과 후 동일하거나 적거나 또는 많은 용량의 약제를 가진 제2 누관 임플란트로 교체하는 단계를 포함하는 것을 특징으로 하는, 치료 방법.
- 제118항에 있어서, 상기 시간 간격은 1달 이상인 것을 특징으로 하는, 치료 방법.
- 제118항 또는 제119항에 있어서, 상기 누관 임플란트의 교체는 2회 이상, 3회 이상, 4회 이상 또는 5회 이상 반복되는 것을 특징으로 하는, 치료 방법.
- 제118항 내지 제120항 중 어느 한항에 있어서, 상기 누관 임플란트의 교체는 개체에게 더 이상 치료가 필요하지 않을 때까지 반복되는 것을 특징으로 하는, 치료 방법.
- 제109항 내지 제121항 중 어느 한항에 있어서, 상기 제제가 방출되는 시간 간격은 1주일 이상, 1달 이상 또는 3달 이상인 것을 특징으로 하는, 치료 방법.
- 제109항 내지 제122항 중 어느 한항에 있어서, 상기 제제의 눈으로의 방출은 눈에 상기 제제의 지속적인 방출을 제공하는 것을 특징으로 하는, 치료 방법.
- 제109항 내지 제123항 중 어느 한항에 있어서, 상기 제제의 눈으로의 방출은 눈으로의 약제 방출을 포함하는 것을 특징으로 하는, 치료 방법.
- 제29항, 제48항, 제60항, 제71항 또는 제84항 중 어느 한항에 있어서, 상기 방출은 지속적인 방출인 것을 특징으로 하는, 치료 방법.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US6623308P | 2008-02-18 | 2008-02-18 | |
| US61/066,233 | 2008-02-18 | ||
| US4934708P | 2008-04-30 | 2008-04-30 | |
| US61/049,347 | 2008-04-30 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20100136453A true KR20100136453A (ko) | 2010-12-28 |
Family
ID=40848555
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107019589A KR20100136453A (ko) | 2008-02-18 | 2009-02-17 | 누관 임플란트 및 이와 관련된 방법 |
Country Status (17)
| Country | Link |
|---|---|
| US (2) | US9216108B2 (ko) |
| EP (1) | EP2254536A2 (ko) |
| JP (2) | JP5528356B2 (ko) |
| KR (1) | KR20100136453A (ko) |
| CN (2) | CN104825270B (ko) |
| AU (1) | AU2009215897A1 (ko) |
| BR (1) | BRPI0907890A2 (ko) |
| CA (1) | CA2715489C (ko) |
| HK (1) | HK1155937A1 (ko) |
| IL (1) | IL207564A0 (ko) |
| MX (1) | MX2010008998A (ko) |
| NZ (1) | NZ587335A (ko) |
| RU (1) | RU2010136822A (ko) |
| SG (1) | SG188155A1 (ko) |
| TW (1) | TW200946093A (ko) |
| WO (1) | WO2009105178A2 (ko) |
| ZA (1) | ZA201005753B (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20130126266A (ko) * | 2012-05-11 | 2013-11-20 | 서강대학교산학협력단 | 안내 약물 전달 임플란트 및 이의 제조방법 |
Families Citing this family (39)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7431710B2 (en) | 2002-04-08 | 2008-10-07 | Glaukos Corporation | Ocular implants with anchors and methods thereof |
| AU2005269988B2 (en) | 2004-07-02 | 2012-02-02 | Mati Therapeutics Inc. | Treatment medium delivery device and methods for delivery |
| KR20090006153A (ko) | 2006-03-31 | 2009-01-14 | 큐엘티 플러그 딜리버리, 인코포레이티드 | 비루관계에 대한 약물 전달 방법, 구조, 및 조성물 |
| RU2010112417A (ru) | 2007-09-07 | 2011-10-10 | Клт Плаг Диливери, Инк. (Us) | Обнаружение лакримальных имплантатов |
| US9132088B2 (en) * | 2008-04-30 | 2015-09-15 | Mati Therapeutics Inc. | Composite lacrimal insert and related methods |
| CA2728623A1 (en) * | 2008-06-24 | 2010-01-21 | Qlt Plug Delivery, Inc. | Combination treatment of glaucoma |
| TW201006453A (en) * | 2008-07-08 | 2010-02-16 | Qlt Plug Delivery Inc | Lacrimal implant body including comforting agent |
| EP2376019A1 (en) * | 2008-12-19 | 2011-10-19 | QLT, Inc. | Substance delivering punctum implants and methods |
| KR20110129869A (ko) * | 2009-01-23 | 2011-12-02 | 큐엘티 인코포레이티드 | 하나 이상의 제제의 서방형 전달 |
| CA2750242C (en) | 2009-02-12 | 2018-05-22 | Incept, Llc | Drug delivery through hydrogel plugs |
| US10206813B2 (en) | 2009-05-18 | 2019-02-19 | Dose Medical Corporation | Implants with controlled drug delivery features and methods of using same |
| WO2011066479A1 (en) | 2009-11-27 | 2011-06-03 | Qlt Plug Delivery, Inc. | Lacrimal implants including split and insertable drug core |
| US9668915B2 (en) * | 2010-11-24 | 2017-06-06 | Dose Medical Corporation | Drug eluting ocular implant |
| DK3290024T3 (da) * | 2011-08-29 | 2019-06-03 | Mati Therapeutics Inc | Vedvarende indgivelse af aktive midler til behandling af glaukom og okulær hypertension |
| US9974685B2 (en) | 2011-08-29 | 2018-05-22 | Mati Therapeutics | Drug delivery system and methods of treating open angle glaucoma and ocular hypertension |
| US10226417B2 (en) | 2011-09-16 | 2019-03-12 | Peter Jarrett | Drug delivery systems and applications |
| KR20190090048A (ko) | 2011-12-05 | 2019-07-31 | 인셉트, 엘엘씨 | 의료용 유기젤 방법 및 조성물 |
| US20130220346A1 (en) * | 2012-02-28 | 2013-08-29 | Victor Lust | Balloon punctal plug |
| US10517759B2 (en) | 2013-03-15 | 2019-12-31 | Glaukos Corporation | Glaucoma stent and methods thereof for glaucoma treatment |
| CN103349588A (zh) * | 2013-07-15 | 2013-10-16 | 广州卫视博生物科技有限公司 | 泪小管阻芯 |
| CA2950187A1 (en) | 2014-05-29 | 2015-12-03 | Glaukos Corporation | Implants with controlled drug delivery features and methods of using same |
| RU2595501C1 (ru) * | 2015-04-17 | 2016-08-27 | федеральное государственное бюджетное учреждение "Межотраслевой научно-технический комплекс "Микрохирургия глаза" имени академика С.Н. Федорова" Министерства здравоохранения Российской Федерации | Лакримальный обтуратор |
| WO2017040853A1 (en) | 2015-09-02 | 2017-03-09 | Glaukos Corporation | Drug delivery implants with bi-directional delivery capacity |
| US11564833B2 (en) | 2015-09-25 | 2023-01-31 | Glaukos Corporation | Punctal implants with controlled drug delivery features and methods of using same |
| US11458041B2 (en) * | 2015-10-08 | 2022-10-04 | Ocular Therapeutix, Inc. | Punctal plug and bioadhesives |
| CA3022830A1 (en) | 2016-04-20 | 2017-10-26 | Harold Alexander Heitzmann | Bioresorbable ocular drug delivery device |
| CN107997802B (zh) * | 2018-01-11 | 2020-06-30 | 四川大学华西医院 | 骨间隙精确止血装置 |
| CN108295318B (zh) * | 2018-01-31 | 2021-07-06 | 西安泰科迈医药科技股份有限公司 | 一种温敏可注射型泪道栓及其制备方法 |
| US11147735B2 (en) | 2018-02-26 | 2021-10-19 | Olympic Ophthalmics, Inc. | Therapeutic handheld devices for disorders |
| CN108404225A (zh) * | 2018-03-08 | 2018-08-17 | 广州锐澄医疗技术有限公司 | 一种泪小管栓及其制备方法 |
| CN109350355B (zh) * | 2018-11-30 | 2023-09-12 | 西安市第四医院 | 一种smile手术来源角膜基质透镜泪道栓及其制备方法 |
| WO2021071975A1 (en) * | 2019-10-07 | 2021-04-15 | Glaukos Corporation | Punctal implants, insertion systems and methods of using the same |
| US20210169690A1 (en) * | 2019-12-10 | 2021-06-10 | Goldenbiotech, Llc | Self-Retaining Implantable Drug Delivery Device |
| CN111150545A (zh) * | 2020-01-02 | 2020-05-15 | 首都医科大学附属北京同仁医院 | 一种相变降温支架及其制备方法和相变降温组合支架 |
| CN111821098A (zh) * | 2020-08-20 | 2020-10-27 | 蒋正轩 | 一种泪道插管 |
| AU2022283386A1 (en) | 2021-05-27 | 2023-11-30 | W. L. Gore & Associates, Inc. | Drug therapy delivery systems and methods |
| CN113288579B (zh) * | 2021-06-21 | 2022-07-12 | 卢国华 | 一种新型人工泪管 |
| CN115531620B (zh) * | 2022-10-30 | 2023-07-07 | 北京医院 | 缓释氟米龙的泪小管栓及其制备方法 |
| CN115531619B (zh) * | 2022-10-30 | 2023-07-21 | 北京医院 | 缓释奥洛他定的泪小管栓及其制备方法 |
Family Cites Families (128)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3659600A (en) * | 1970-02-24 | 1972-05-02 | Estin Hans H | Magnetically operated capsule for administering drugs |
| US3865108A (en) | 1971-05-17 | 1975-02-11 | Ortho Pharma Corp | Expandable drug delivery device |
| US3949750A (en) * | 1974-10-07 | 1976-04-13 | Freeman Jerre M | Punctum plug and method for treating keratoconjunctivitis sicca (dry eye) and other ophthalmic aliments using same |
| US4014335A (en) | 1975-04-21 | 1977-03-29 | Alza Corporation | Ocular drug delivery device |
| US5053030A (en) | 1984-11-07 | 1991-10-01 | Herrick Robert S | Intracanalicular implant for horizontal canalicular blockade treatment of the eye |
| US4660546A (en) | 1984-11-07 | 1987-04-28 | Robert S. Herrick | Method for treating for deficiency of tears |
| US5049142A (en) | 1984-11-07 | 1991-09-17 | Herrick Robert S | Intracanalicular implant for horizontal canalicular blockade treatment of the eye |
| US5229128A (en) | 1986-06-11 | 1993-07-20 | Haddad Heskel M | Drug delivery ophthalmic insert and method of preparing same |
| US5322691A (en) | 1986-10-02 | 1994-06-21 | Sohrab Darougar | Ocular insert with anchoring protrusions |
| US4886488A (en) | 1987-08-06 | 1989-12-12 | White Thomas C | Glaucoma drainage the lacrimal system and method |
| US4915684A (en) | 1988-06-21 | 1990-04-10 | Mackeen Donald L | Method and apparatus for modulating the flow of lacrimal fluid through a punctum and associated canaliculus |
| US5133159A (en) | 1989-01-13 | 1992-07-28 | Nestle S.A. | Method for polishing silicone products |
| US4959048A (en) | 1989-01-17 | 1990-09-25 | Helix Medical, Inc. | Lacrimal duct occluder |
| US5128058A (en) | 1989-05-31 | 1992-07-07 | Hoya Corporation | Contact lens cleaner containing a microcapsular polishing agent |
| IE910450A1 (en) | 1990-02-15 | 1991-08-28 | Bausch & Lomb | Soft contact lens processing aid |
| US5163959A (en) | 1990-03-29 | 1992-11-17 | Herrick Robert S | Method for treating an eye with a canalicular implant having a collapsible flared section |
| US5171270A (en) | 1990-03-29 | 1992-12-15 | Herrick Robert S | Canalicular implant having a collapsible flared section and method |
| US5041081A (en) | 1990-05-18 | 1991-08-20 | Odrich Ronald B | Ocular implant for controlling glaucoma |
| US5258042A (en) * | 1991-12-16 | 1993-11-02 | Henry Ford Health System | Intravascular hydrogel implant |
| US5283063A (en) * | 1992-01-31 | 1994-02-01 | Eagle Vision | Punctum plug method and apparatus |
| US5334137A (en) | 1992-02-21 | 1994-08-02 | Eagle Vision, Inc. | Lacrimal fluid control device |
| US5469867A (en) | 1992-09-02 | 1995-11-28 | Landec Corporation | Cast-in place thermoplastic channel occluder |
| US5318513A (en) | 1992-09-24 | 1994-06-07 | Leib Martin L | Canalicular balloon fixation stent |
| US5707643A (en) | 1993-02-26 | 1998-01-13 | Santen Pharmaceutical Co., Ltd. | Biodegradable scleral plug |
| US5417651A (en) | 1993-07-01 | 1995-05-23 | Guena; Nicolas | Punctum plug and monocanalicular probe for lacrimal pathology |
| US5423777A (en) | 1993-10-27 | 1995-06-13 | Tajiri; Akira | Punctum plug |
| US5466233A (en) | 1994-04-25 | 1995-11-14 | Escalon Ophthalmics, Inc. | Tack for intraocular drug delivery and method for inserting and removing same |
| JP3486758B2 (ja) | 1994-06-24 | 2004-01-13 | 株式会社高研 | 注入可能な涙小管閉鎖剤 |
| US6149684A (en) | 1995-06-07 | 2000-11-21 | Herrick; Robert S. | Punctum plug having a thin elongated lip and a distal starting tip and method of using |
| US5723005A (en) | 1995-06-07 | 1998-03-03 | Herrick Family Limited Partnership | Punctum plug having a collapsible flared section and method |
| US5766243A (en) | 1995-08-21 | 1998-06-16 | Oasis Medical, Inc. | Abrasive polished canalicular implant |
| US5773019A (en) | 1995-09-27 | 1998-06-30 | The University Of Kentucky Research Foundation | Implantable controlled release device to deliver drugs directly to an internal portion of the body |
| US5824073A (en) | 1996-03-18 | 1998-10-20 | Peyman; Gholam A. | Macular indentor for use in the treatment of subretinal neovascular membranes |
| JPH1033584A (ja) | 1996-07-26 | 1998-02-10 | M L C:Kk | 涙道挿管器具 |
| US5993407A (en) | 1996-10-25 | 1999-11-30 | Moazed; Kambiz Thomas | Transnasal lacrimal insert |
| AU716980B2 (en) | 1996-11-01 | 2000-03-16 | Alcon Laboratories, Inc. | Cryogenic polishing method for soft acrylic articles |
| US6254562B1 (en) | 1997-02-04 | 2001-07-03 | Alain Fouere | Meatus plug for lachrymal canal capable of being screwed |
| US6082362A (en) | 1997-03-27 | 2000-07-04 | Eagle Vision, Inc. | Punctum plug |
| US6027470A (en) | 1998-06-10 | 2000-02-22 | Eagle Vision, Inc. | Punctum plug and method for inserting the same into the punctual opening |
| US6041785A (en) | 1997-03-27 | 2000-03-28 | Eaglevision, Inc. | Punctum plug |
| US6016806A (en) | 1997-03-27 | 2000-01-25 | Eaglevision, Inc | Punctum plug |
| US5961370A (en) | 1997-05-08 | 1999-10-05 | Chiron Vision Corporation | Intraocular lens tumbling process using coated beads |
| MY125870A (en) | 1997-07-25 | 2006-08-30 | Alza Corp | Osmotic delivery system flow modulator apparatus and method |
| US6306426B1 (en) | 1997-08-11 | 2001-10-23 | Allergan Sales, Inc. | Implant device with a retinoid for improved biocompatibility |
| US5830171A (en) | 1997-08-12 | 1998-11-03 | Odyssey Medical, Inc. | Punctal occluder |
| US6060439A (en) | 1997-09-29 | 2000-05-09 | Kyzen Corporation | Cleaning compositions and methods for cleaning resin and polymeric materials used in manufacture |
| NL1008090C2 (nl) | 1998-01-22 | 1999-07-26 | Lubberman Bernardus H M | Plug voor het afsluiten van een traanbuis. |
| US6290684B1 (en) | 1998-03-02 | 2001-09-18 | Herrick Family Limited Partnership | Punctum plug having a collapsible expanded section and distal tip extending substantially perpendicular thereto and method of inserting same |
| WO1999044553A1 (en) | 1998-03-02 | 1999-09-10 | Herrick Family Limited Partnership | A punctum plug having a collapsible flared section and method |
| US6196993B1 (en) | 1998-04-20 | 2001-03-06 | Eyelab Group, Llc | Ophthalmic insert and method for sustained release of medication to the eye |
| US6306114B1 (en) | 1998-06-16 | 2001-10-23 | Eagle Vision, Inc. | Valved canalicular plug for lacrimal duct occlusion |
| JP2000070296A (ja) | 1998-08-27 | 2000-03-07 | M L C:Kk | 涙道内挿管器具 |
| US6095901A (en) | 1998-12-09 | 2000-08-01 | Alcon Laboratories, Inc. | Polishing method for soft acrylic articles |
| US20040121014A1 (en) | 1999-03-22 | 2004-06-24 | Control Delivery Systems, Inc. | Method for treating and/or preventing retinal diseases with sustained release corticosteroids |
| US6234175B1 (en) * | 1999-03-23 | 2001-05-22 | Medennium, Inc. | Smart ocular plug design and method of insertion for punctal and intracanalicular implants |
| US6383192B1 (en) | 1999-04-28 | 2002-05-07 | Mlc Limited Company | Apparatus for intubation of lacrimal duct |
| US6428502B1 (en) | 1999-06-25 | 2002-08-06 | Alcon Manufacturing, Ltd. | Punctal cannula |
| US6706275B1 (en) | 1999-09-08 | 2004-03-16 | Matthew W. Camp | Scleral plug system |
| US6331313B1 (en) | 1999-10-22 | 2001-12-18 | Oculex Pharmaceticals, Inc. | Controlled-release biocompatible ocular drug delivery implant devices and methods |
| US6264971B1 (en) | 1999-11-04 | 2001-07-24 | Btg International Limited | Ocular insert |
| US7708711B2 (en) | 2000-04-14 | 2010-05-04 | Glaukos Corporation | Ocular implant with therapeutic agents and methods thereof |
| US7867186B2 (en) | 2002-04-08 | 2011-01-11 | Glaukos Corporation | Devices and methods for treatment of ocular disorders |
| US6638239B1 (en) | 2000-04-14 | 2003-10-28 | Glaukos Corporation | Apparatus and method for treating glaucoma |
| KR100467362B1 (ko) * | 2000-04-25 | 2005-01-24 | 간사이 페인트 가부시키가이샤 | 함수 폴리우레탄 겔, 그 제조 방법 및 그 용도 |
| US20040175410A1 (en) * | 2000-04-26 | 2004-09-09 | Control Delivery Systems, Inc. | Sustained release device and method for ocular delivery of carbonic anhydrase inhibitors |
| US6375972B1 (en) | 2000-04-26 | 2002-04-23 | Control Delivery Systems, Inc. | Sustained release drug delivery devices, methods of use, and methods of manufacturing thereof |
| US6371122B1 (en) | 2000-06-20 | 2002-04-16 | Robert M. Mandelkorn | Gauge/dilator apparatus |
| US6629533B1 (en) | 2000-06-30 | 2003-10-07 | Eagle Vision, Inc. | Punctum plug with at least one anchoring arm |
| JP2004505679A (ja) | 2000-08-04 | 2004-02-26 | メデニアム インコーポレーテッド | 涙点および涙小管内インプラントのための眼用プラグ |
| US20020034200A1 (en) * | 2000-09-21 | 2002-03-21 | Randy Wickman | Method of monitoring light from a VCSEL |
| CA2434156A1 (en) | 2000-12-29 | 2002-07-25 | Bausch & Lomb Incorporated | Sustained release drug delivery devices |
| JP2004521882A (ja) | 2001-01-03 | 2004-07-22 | ボシュ・アンド・ロム・インコーポレイテッド | 組立式透過性プラグを備えた徐放薬剤送達装置 |
| US6991808B2 (en) | 2001-01-26 | 2006-01-31 | Bausch & Lomb Inc. | Process for the production of sustained release drug delivery devices |
| ES2304438T3 (es) | 2001-04-07 | 2008-10-16 | Glaukos Corporation | Stent de glaucoma para el tratamiento del glaucoma. |
| US7431710B2 (en) | 2002-04-08 | 2008-10-07 | Glaukos Corporation | Ocular implants with anchors and methods thereof |
| US6605108B2 (en) * | 2001-04-13 | 2003-08-12 | Eagle Vision, Inc. | Monocanalicular stent |
| US6982090B2 (en) | 2001-05-10 | 2006-01-03 | Gillespie Donald E | More easily visualized punctum plug configurations |
| US7404825B2 (en) | 2001-06-11 | 2008-07-29 | Herrick Ii Robert S | Implant capable of forming a differential image in an eye |
| FR2829019B3 (fr) | 2001-08-31 | 2003-10-31 | Alain Fouere | Bouchons lacrymaux et methodes de mise en place de ces dispositifs |
| US6729939B2 (en) | 2001-12-17 | 2004-05-04 | Bausch & Lomb Incorporated | Polishing method for intraocular lens |
| FR2834446B1 (fr) | 2002-01-08 | 2004-02-13 | Ioltechnologie Production | Clou meatique a expansion |
| US7204995B2 (en) | 2002-01-31 | 2007-04-17 | El-Sherif Dalia M | Treatment and control of dry eye by use of biodegradable polymer capsules |
| US20040147870A1 (en) | 2002-04-08 | 2004-07-29 | Burns Thomas W. | Glaucoma treatment kit |
| US9301875B2 (en) | 2002-04-08 | 2016-04-05 | Glaukos Corporation | Ocular disorder treatment implants with multiple opening |
| US6866563B2 (en) | 2002-06-27 | 2005-03-15 | Bausch & Lomb Incorporated | Apparatus and method for target polishing intraocular lenses |
| FR2841770B1 (fr) | 2002-07-05 | 2004-10-01 | Ioltechnologie Production | Clou meatique d'obturation d'un meat lacrymal |
| FR2844182B1 (fr) | 2002-09-11 | 2004-12-03 | Humanoptics Ag | Bouchon d'obturation d'un canalicule lacrymal |
| US7169163B2 (en) | 2002-09-30 | 2007-01-30 | Bruce Becker | Transnasal method and catheter for lacrimal system |
| US20050283109A1 (en) | 2003-03-07 | 2005-12-22 | Peyman Gholam A | Method and apparatus for lacrimal canal obstruction |
| JP4824549B2 (ja) | 2003-05-02 | 2011-11-30 | サーモディクス,インコーポレイティド | 制御放出型の生体活性物質デリバリー・デバイス |
| US7204253B2 (en) | 2003-05-22 | 2007-04-17 | Clarity Corporation | Punctum plug |
| US7017580B2 (en) | 2003-05-22 | 2006-03-28 | Clarity Corporation | Punctum plug system including a punctum plug and passive insertion tool therefor |
| WO2005018683A2 (en) * | 2003-05-23 | 2005-03-03 | Angiotech International Ag | Anastomotic connector devices |
| JP4104137B2 (ja) | 2003-05-30 | 2008-06-18 | 有限会社エム・エル・シー | 涙点プラグ |
| JP4339635B2 (ja) | 2003-06-12 | 2009-10-07 | 有限会社エム・エル・シー | 涙点プラグ |
| US6994684B2 (en) | 2003-06-16 | 2006-02-07 | Alphamed Inc. | Punctum plugs having fluid collecting recesses and methods of punctal occlusion |
| US20040265356A1 (en) | 2003-06-30 | 2004-12-30 | Bausch & Lomb Incorporated | Drug delivery device |
| JP4280128B2 (ja) | 2003-08-19 | 2009-06-17 | 有限会社エム・エル・シー | 涙点プラグ |
| US20050181018A1 (en) * | 2003-09-19 | 2005-08-18 | Peyman Gholam A. | Ocular drug delivery |
| JP2005110765A (ja) | 2003-10-03 | 2005-04-28 | M L C:Kk | 涙点プラグセット |
| JP2005110930A (ja) | 2003-10-07 | 2005-04-28 | M L C:Kk | 涙点プラグセット |
| US20050095269A1 (en) | 2003-11-04 | 2005-05-05 | Ainpour Parviz R. | Gel plug for blockage of the canaliculus |
| US20050220882A1 (en) * | 2004-03-04 | 2005-10-06 | Wilson Pritchard | Materials for medical implants and occlusive devices |
| US20050197614A1 (en) | 2004-03-04 | 2005-09-08 | Wilson Pritchard | Occlusive biomedical devices, punctum plugs, and methods of use thereof |
| US20050232972A1 (en) | 2004-04-15 | 2005-10-20 | Steven Odrich | Drug delivery via punctal plug |
| JP2004202276A (ja) | 2004-04-16 | 2004-07-22 | M L C:Kk | 涙道再建用挿管器具 |
| US20050244469A1 (en) | 2004-04-30 | 2005-11-03 | Allergan, Inc. | Extended therapeutic effect ocular implant treatments |
| JP2005312835A (ja) | 2004-04-30 | 2005-11-10 | M L C:Kk | 糸で補強した涙道ステント |
| JP4644438B2 (ja) | 2004-05-11 | 2011-03-02 | 有限会社エム・エル・シー | ツバつき涙道ステント |
| JP4510511B2 (ja) | 2004-05-18 | 2010-07-28 | 有限会社エム・エル・シー | ツバを円盤で補強した涙道ステント及び涙道プラグ |
| AU2005269988B2 (en) | 2004-07-02 | 2012-02-02 | Mati Therapeutics Inc. | Treatment medium delivery device and methods for delivery |
| US20060020253A1 (en) | 2004-07-26 | 2006-01-26 | Prescott Anthony D | Implantable device having reservoir with controlled release of medication and method of manufacturing the same |
| US7117870B2 (en) | 2004-07-26 | 2006-10-10 | Clarity Corporation | Lacrimal insert having reservoir with controlled release of medication and method of manufacturing the same |
| US20080038317A1 (en) | 2004-09-10 | 2008-02-14 | Chin-Ming Chang | Therapeutic Lacrimal Canalicular Inserts And Related Methods |
| US20060074370A1 (en) | 2004-09-24 | 2006-04-06 | Medennium, Inc. | Ocular occluder and method of insertion |
| US20060233858A1 (en) | 2005-03-08 | 2006-10-19 | Allergan, Inc. | Systems and methods providing targeted intraocular drug delivery |
| WO2007035356A2 (en) * | 2005-09-16 | 2007-03-29 | Bg Implant, Inc. | Glaucoma treatment devices and methods |
| US7862532B2 (en) | 2005-10-07 | 2011-01-04 | Delta Life Sciences, Inc. | Punctum plugs having insertion guides and strengthening beams |
| US20070132125A1 (en) | 2005-12-08 | 2007-06-14 | Bausch & Lomb Incorporated | Use of a super-cooled fluid in lens processing |
| JP4078371B2 (ja) | 2006-01-27 | 2008-04-23 | 章弘 小栗 | 涙点プラグ |
| KR20090006153A (ko) | 2006-03-31 | 2009-01-14 | 큐엘티 플러그 딜리버리, 인코포레이티드 | 비루관계에 대한 약물 전달 방법, 구조, 및 조성물 |
| US9173773B2 (en) | 2006-06-21 | 2015-11-03 | Johnson & Johnson Vision Care, Inc. | Punctal plugs for the delivery of active agents |
| US9474645B2 (en) | 2006-06-21 | 2016-10-25 | Johnson & Johnson Vision Care, Inc. | Punctal plugs for the delivery of active agents |
| US20080045911A1 (en) | 2006-06-21 | 2008-02-21 | Borgia Maureen J | Punctal plugs for the delivery of active agents |
| FR2908042B1 (fr) | 2006-11-08 | 2009-06-05 | Bruno Fayet | Ensemble d'intubation monocanaliculonasal et/ou monocanaliculaire,notamment pour l'imperforation lacrymonasale. |
| RU2010112417A (ru) * | 2007-09-07 | 2011-10-10 | Клт Плаг Диливери, Инк. (Us) | Обнаружение лакримальных имплантатов |
| EP2207529B1 (en) * | 2007-09-07 | 2014-12-31 | Mati Therapeutics Inc. | Drug cores for sustained release of therapeutic agents |
| TWI542338B (zh) * | 2008-05-07 | 2016-07-21 | 壯生和壯生視覺關懷公司 | 用於活性劑之控制釋放的眼用裝置 |
-
2009
- 2009-02-17 NZ NZ587335A patent/NZ587335A/en not_active IP Right Cessation
- 2009-02-17 MX MX2010008998A patent/MX2010008998A/es not_active Application Discontinuation
- 2009-02-17 BR BRPI0907890-8A patent/BRPI0907890A2/pt not_active IP Right Cessation
- 2009-02-17 WO PCT/US2009/000963 patent/WO2009105178A2/en active Application Filing
- 2009-02-17 RU RU2010136822/14A patent/RU2010136822A/ru not_active Application Discontinuation
- 2009-02-17 CA CA2715489A patent/CA2715489C/en active Active
- 2009-02-17 JP JP2010546796A patent/JP5528356B2/ja active Active
- 2009-02-17 CN CN201510109774.2A patent/CN104825270B/zh active Active
- 2009-02-17 US US12/378,710 patent/US9216108B2/en active Active
- 2009-02-17 EP EP09711554A patent/EP2254536A2/en not_active Withdrawn
- 2009-02-17 SG SG2013011309A patent/SG188155A1/en unknown
- 2009-02-17 AU AU2009215897A patent/AU2009215897A1/en not_active Abandoned
- 2009-02-17 KR KR1020107019589A patent/KR20100136453A/ko not_active Application Discontinuation
- 2009-02-17 CN CN200980109710.5A patent/CN102014816B/zh active Active
- 2009-02-18 TW TW098105152A patent/TW200946093A/zh unknown
-
2010
- 2010-08-12 IL IL207564A patent/IL207564A0/en unknown
- 2010-08-12 ZA ZA2010/05753A patent/ZA201005753B/en unknown
-
2011
- 2011-10-06 HK HK11110624.0A patent/HK1155937A1/xx unknown
-
2014
- 2014-04-15 JP JP2014083415A patent/JP5819468B2/ja active Active
-
2015
- 2015-12-14 US US14/967,842 patent/US20160166430A1/en not_active Abandoned
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20130126266A (ko) * | 2012-05-11 | 2013-11-20 | 서강대학교산학협력단 | 안내 약물 전달 임플란트 및 이의 제조방법 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2715489A1 (en) | 2009-08-27 |
| CN102014816A (zh) | 2011-04-13 |
| HK1155937A1 (en) | 2012-06-01 |
| AU2009215897A2 (en) | 2010-09-16 |
| AU2009215897A1 (en) | 2009-08-27 |
| CN104825270B (zh) | 2017-10-24 |
| US20090264861A1 (en) | 2009-10-22 |
| US9216108B2 (en) | 2015-12-22 |
| CA2715489C (en) | 2017-09-19 |
| MX2010008998A (es) | 2010-11-26 |
| WO2009105178A3 (en) | 2010-06-03 |
| JP2011512194A (ja) | 2011-04-21 |
| ZA201005753B (en) | 2011-09-28 |
| JP5819468B2 (ja) | 2015-11-24 |
| JP5528356B2 (ja) | 2014-06-25 |
| SG188155A1 (en) | 2013-03-28 |
| CN104825270A (zh) | 2015-08-12 |
| TW200946093A (en) | 2009-11-16 |
| US20160166430A1 (en) | 2016-06-16 |
| NZ587335A (en) | 2012-05-25 |
| EP2254536A2 (en) | 2010-12-01 |
| CN102014816B (zh) | 2015-04-15 |
| RU2010136822A (ru) | 2012-03-10 |
| IL207564A0 (en) | 2010-12-30 |
| BRPI0907890A2 (pt) | 2015-07-28 |
| WO2009105178A2 (en) | 2009-08-27 |
| JP2014208009A (ja) | 2014-11-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20100136453A (ko) | 누관 임플란트 및 이와 관련된 방법 | |
| US11951038B2 (en) | Lacrimal implants and related methods | |
| US11712370B2 (en) | Lacrimal implants and related methods | |
| JP5819919B2 (ja) | 複合涙管挿入物および関連する方法 | |
| JP2011525388A (ja) | 緑内障の併用治療 | |
| WO2010006053A1 (en) | Lacrimal implant body including comforting agent | |
| US20110251568A1 (en) | Punctal plugs for controlled release of therapeutic agents | |
| US20110301555A1 (en) | Porous matrix drug core for lacrimal insert device |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| N231 | Notification of change of applicant | ||
| N231 | Notification of change of applicant | ||
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |