KR20100126361A - 치료용 펩티드유사 거대고리 - Google Patents
치료용 펩티드유사 거대고리 Download PDFInfo
- Publication number
- KR20100126361A KR20100126361A KR1020107020028A KR20107020028A KR20100126361A KR 20100126361 A KR20100126361 A KR 20100126361A KR 1020107020028 A KR1020107020028 A KR 1020107020028A KR 20107020028 A KR20107020028 A KR 20107020028A KR 20100126361 A KR20100126361 A KR 20100126361A
- Authority
- KR
- South Korea
- Prior art keywords
- peptide
- amino acid
- cancer
- macrocycle
- macrocycles
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/64—Cyclic peptides containing only normal peptide links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/12—Cyclic peptides, e.g. bacitracins; Polymyxins; Gramicidins S, C; Tyrocidins A, B or C
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- A61K38/1761—Apoptosis related proteins, e.g. Apoptotic protease-activating factor-1 (APAF-1), Bax, Bax-inhibitory protein(s)(BI; bax-I), Myeloid cell leukemia associated protein (MCL-1), Inhibitor of apoptosis [IAP] or Bcl-2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Epidemiology (AREA)
- Gastroenterology & Hepatology (AREA)
- Organic Chemistry (AREA)
- Hematology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Molecular Biology (AREA)
- Oncology (AREA)
- Zoology (AREA)
- Marine Sciences & Fisheries (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Diabetes (AREA)
- Obesity (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
Abstract
본 발명에서는 세포 증식성 질환, 예를 들면, 암과 면역증식성 질환의 치료를 위한 생물학적 활성 펩티드유사 거대고리(peptidomimetic macrocycle)를 제시한다.
Description
교차-참조
본 출원은 2008년 2월 8일 제출된 U.S. 가출원 제61/027,326호 및 2008년 12월 5일 제출된 U.S. 가출원 제61/120,380호에 우선권을 주장하며, 이들 각 출원은 본 발명에 순전히 참조로서 편입된다.
본 발명의 배경기술
통제되지 않은 세포 증식은 암에서부터 면역증식성 질환까지 다양한 질환에 연관된다. 가령, 미국 한 나라에서만, 암은 전체 인구 중에서 최대 부분에 대한 주요 사망 원인으로서 심장병을 뛰어넘어(Journal of the National Cancer Institute, Vol. 97, No. 5, March 2, 2005, p. 330), 매년 500,000명 이상의 사망의 원인이 되고 있다. 이 분야에서 수십 년간의 집중적인 연구 노력에도 불구하고, 세포 증식성 질환의 치료는 여전히 과제로서 남아있다.
암의 치료 방법, 예를 들면, 수술 또는 화학요법은 효능(efficacy), 부작용 프로필(side effect profile) 및 비용(cost)의 관점에서 여전히 제한적이다. 특히, 가용한 치료 옵션의 효능(efficacy)과 적용가능성(applicability)은 종양과 질환의 특정 유형에 의해 상당히 변한다. 따라서 세포 증식성 질환 및 기타 질환을 치료하기 위한 조성물과 방법이 여전히 요구된다.
본 발명의 요약
본 발명은 이와 같은 요구를 충족시킨다. 본 발명에서는 일정한 펩티드유사 거대고리(macrocycle)가 세포 증식성 질환의 치료에 이용될 때, 예상치 못한 특이성(specificity), 효능(efficacy) 및 효과(potency)를 나타낸다는 놀라운 발견에 기초하여, 치료 조성물과 방법을 제시한다.
한 측면에서, 본 발명에서는 치료가 필요한 인간 환자에서 암을 치료하는 방법을 제시하는데, 상기 방법은 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함하고, 여기서 암은 소형 세포 폐 암종, 흑색종, 난소암, 전립선암, 신장암, 유방암, 췌장암, 그리고 Ph+ 급성 림프구성 백혈병(Ph+ ALL)으로 구성된 군에서 선택된다. 한 구체예에서, 펩티드유사 거대고리는 α-나선을 포함한다. 다른 구체예에서, 펩티드유사 거대고리는 BH3 도메인을 포함한다. 상기 펩티드유사 거대고리는 예로써, BIM 폴리펩티드일 수 있다. 일부 사례에서, BIM 폴리펩티드의 아미노산 서열은 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 60% 이상 동일하고, 여기서 *는 속박된(tethered) 아미노산이다. 대안으로, BIM 폴리펩티드의 아미노산 서열은 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 80% 이상 동일하고, 여기서 *는 속박된 아미노산이다. 게다가, 상기 BIM 폴리펩티드의 아미노산 서열은 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 95% 이상 동일할 수 있고, 여기서 *는 속박된 아미노산이다. 일부 구체예에서, 암은 시험관내 세포 생존능 분석에서 측정된 바와 같이, 상응하는 가교된 BID 폴리펩티드를 이용한 치료에 적어도 2-배 덜 민감하다. 다른 구체예에서, 암은 시험관내 세포 생존능 분석에서 측정된 바와 같이, 상응하는 가교된 BID 폴리펩티드를 이용한 치료에 적어도 5-배 덜 민감하다. 또 다른 구체예에서, 암은 시험관내 세포 생존능 분석에서 측정된 바와 같이, 상응하는 가교된 BID 폴리펩티드를 이용한 치료에 적어도 8-배 덜 민감하다.
선별된 구체예에서, 암은 유방암, 예를 들면, 침습성(invasive) 유방 암종, 예를 들면, 침습성 관상 암종이다. 대안으로, 암은 전립선암이다. 다른 구체예에서, 암은 난소암이다. 또 다른 구체예에서, 암은 췌장암이다. 진전된 구체예에서, 암은 신장암이다. 대안으로, 암은 Ph+ 급성 림프구성 백혈병(Ph+ ALL)이다.
본 발명에서는 또한, 치료가 필요한 인간 환자에서 암을 치료하는 방법을 제시하는데, 상기 방법은 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함하고, 여기서 암은 결장암이다. 한 구체예에서, 펩티드유사 거대고리는 α-나선을 포함한다. 다른 구체예에서, 펩티드유사 거대고리는 BH3 도메인을 포함한다. 펩티드유사 거대고리는 예로써, BID 폴리펩티드일 수 있다. 일부 사례에서, BID 폴리펩티드의 아미노산 서열은 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 60% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신이다. 대안으로, BID 폴리펩티드의 아미노산 서열은 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 80% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신이다. 게다가, 상기 BID 폴리펩티드의 아미노산 서열은 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 95% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신이다. 일부 구체예에서, 암은 시험관내 세포 생존능 분석에서 측정된 바와 같이, 상응하는 가교된 BIM 폴리펩티드를 이용한 치료에 적어도 2-배 덜 민감하다. 다른 구체예에서, 암은 시험관내 세포 생존능 분석에서 측정된 바와 같이, 상응하는 가교된 BIM 폴리펩티드를 이용한 치료에 적어도 5-배 덜 민감하다. 또 다른 구체예에서, 암은 시험관내 세포 생존능 분석에서 측정된 바와 같이, 상응하는 가교된 BIM 폴리펩티드를 이용한 치료에 적어도 8-배 덜 민감하다.
또한, 치료가 필요한 인간 환자에서 암을 치료하는 방법이 제시되는데, 상기 방법은 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함하고, 여기서 상기 펩티드유사 거대고리는 상기 암으로부터 유래된 세포주에 대한 시험관내 세포 생존능 분석에서 조사될 때, 대략 5 μM 미만의 EC50을 나타낸다. 일부 구체예에서, EC50은 대략 4 μM 미만이다. 다른 구체예에서, EC50은 대략 3 μM 미만이다. 또 다른 구체예에서, EC50은 대략 2 μM 미만이다. 또 다른 구체예에서, EC50은 대략 1 μM 미만이다. 일부 구체예에서, 혈청의 존재에서 시험관내 분석이 수행된다. 가령, 상기 분석은 10% 인간 혈청에서 수행될 수 있다. 일부 측면에서, 암은 난소암, 피부암, 전립선암, 신장암, 유방암, 췌장암, 소형-세포 폐암, 결장암, 간암, 다발성 골수종, 버킷 림프종, T 세포 계통 또는 B 세포 계통 또는 혼성 계통의 급성 림프구성 백혈병(ALL), 만성 림프구성 백혈병(CLL), 피부 T 세포 림프종(CTCL), 급성 골수성 백혈병(AML), 만성 골수성 백혈병, 그리고 여포성 림프종으로 구성된 군에서 선택된다.
한 측면에서, 본 발명에서는 치료가 필요한 인간 환자에서 암을 치료하는 방법을 제시하는데, 상기 방법은 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함하고, 여기서 암은 난소암, 전립선암, 신장암, 유방암, 췌장암, 그리고 Ph+ 급성 림프구성 백혈병으로 구성된 군에서 선택된다. 한 구체예에서, 펩티드유사 거대고리는 α-나선을 포함한다. 다른 구체예에서, 펩티드유사 거대고리는 BH3 도메인을 포함한다. 펩티드유사 거대고리는 예로써, BIM 폴리펩티드일 수 있다. 일부 사례에서, BIM 폴리펩티드의 아미노산 서열은 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 60% 이상 동일하고, 여기서 *는 속박된 아미노산이다. 대안으로, BIM 폴리펩티드의 아미노산 서열은 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 80% 이상 동일하고, 여기서 *는 속박된 아미노산이다. 게다가, 상기 BIM 폴리펩티드의 아미노산 서열은 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 95% 이상 동일할 수 있고, 여기서 *는 속박된 아미노산이다.
일부 구체예에서, 암은 결장암, 소형-세포 폐암, 간암, 난소암, 피부암, 전립선암, 신장암, 유방암, 췌장암, 신경교종, 다발성 골수종, 버킷 림프종, T 세포 계통 또는 B 세포 계통 또는 혼성 계통의 급성 림프구성 백혈병(ALL), 만성 림프구성 백혈병(CLL), 피부 T 세포 림프종(CTCL), 급성 골수성 백혈병(AML), 만성 골수성 백혈병, 그리고 여포성 림프종으로 구성된 군에서 선택된다. 한 구체예에서, 펩티드유사 거대고리는 α-나선을 포함한다. 다른 구체예에서, 펩티드유사 거대고리는 BH3 도메인을 포함한다. 펩티드유사 거대고리는 예로써, BID 폴리펩티드일 수 있다. 일부 사례에서, BID 폴리펩티드의 아미노산 서열은 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 60% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신이다. 대안으로, BID 폴리펩티드의 아미노산 서열은 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 80% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신이다. 게다가, 상기 BID 폴리펩티드의 아미노산 서열은 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 95% 이상 동일할 수 있고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신이다.
또한, 본 발명에서는 펩티드유사 거대고리를 치료가 필요한 인간 환자에 투여함으로써 상기 환자에서 질환을 치료하는 방법을 제시하는데, 상기 방법은 a) 폴리펩티드의 2개의 아미노산 잔기 사이에 가교를 도입함으로써 펩티드유사 거대고리를 제조하는 단계; b) 면역학적 반응의 존재 또는 부재에 대하여 펩티드유사 거대고리를 조사하는 단계; 그리고 c) 상기 면역학적 반응이 실질적인 부작용을 유발하지 않으면, 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 비-면역원성(non-immunogenicity)은 설치류, 예를 들면, 생쥐, 비-인간 영장류, 또는 인간에서 생체내 분석에서 최소 항체 반응(minimal antibody response)으로서 증명될 수 있다. 인간 환자에 투여될 때, 비-면역원성인 화합물은 환자에서 면역원성과 관련된 실질적인 부작용을 유발하지 않거나, 또는 최소한의 부작용을 유발한다. 질환은 예로써, 암(cancer), 대사 질환(metabolic disease), 심혈관 질환(cardiovascular disease), 염증성 질환(inflammatory disease) 또는 퇴행성 질환(degenerative disease)일 수 있다. 한 구체예에서, 펩티드유사 거대고리는 α-나선을 포함한다. 다른 구체예에서, 펩티드유사 거대고리는 BH3 도메인을 포함한다. 펩티드유사 거대고리는 예로써, BID 폴리펩티드일 수 있다. 일부 사례에서, BID 폴리펩티드의 아미노산 서열은 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 60% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신이다. 대안으로, BID 폴리펩티드의 아미노산 서열은 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 80% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신이다. 게다가, 상기 BID 폴리펩티드의 아미노산 서열은 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 95% 이상 동일할 수 있고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신이다. 펩티드유사 거대고리는 또한, 예로써 BIM 폴리펩티드일 수 있다. 일부 사례에서, BIM 폴리펩티드의 아미노산 서열은 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 60% 이상 동일하고, 여기서 *는 속박된 아미노산이다. 대안으로, BIM 폴리펩티드의 아미노산 서열은 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 80% 이상 동일하고, 여기서 *는 속박된 아미노산이다. 게다가, 상기 BIM 폴리펩티드의 아미노산 서열은 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 95% 이상 동일할 수 있고, 여기서 *는 속박된 아미노산이다.
다른 측면에서, 본 발명에서는 치료가 필요한 인간 환자에서 면역증식성 질환을 치료하는 방법을 제시하는데, 상기 방법은 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 펩티드유사 거대고리는 시험관내 BrdU 합병 분석에서, 활성화된 hPBL 증식을 대략 5%, 10%, 20%, 30%, 40%, 또는 50% 이상 감소시킬 수 있다. 면역증식성 질환은 예로써, 림프증식성 질환, 또는 자가면역 질환, 예를 들면, 전신성 홍반성 낭창일 수 있다. 펩티드유사 거대고리는 예로써, BID 폴리펩티드일 수 있다. 일부 사례에서, BID 폴리펩티드의 아미노산 서열은 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 60% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신이다. 대안으로, BID 폴리펩티드의 아미노산 서열은 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 80% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신이다. 게다가, 상기 BID 폴리펩티드의 아미노산 서열은 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 95% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신이다. 펩티드유사 거대고리는 또한, 예로써 BIM 폴리펩티드일 수 있다. 일부 사례에서, BIM 폴리펩티드의 아미노산 서열은 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 60% 이상 동일하고, 여기서 *는 속박된 아미노산이다. 대안으로, BIM 폴리펩티드의 아미노산 서열은 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 80% 이상 동일하고, 여기서 *는 속박된 아미노산이다. 게다가, 상기 BIM 폴리펩티드의 아미노산 서열은 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 95% 이상 동일할 수 있고, 여기서 *는 속박된 아미노산이다.
앞서 개시된 임의의 펩티드유사 거대고리의 경우에, 상기 펩티드유사 거대고리 내에 α-탄소 원자는 화학식 R-의 독립된 치환기로 추가적으로 치환될 수 있고, 여기서 R-은 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬알킬, 헤테로알킬, 또는 헤테로시클로알킬이고, 치환되지 않거나 할로-로 치환된다. 일부 구체예에서, 가교제(crosslinker)가 부착된 α-탄소 원자는 화학식 R-의 치환기로 추가적으로 치환된다. 다른 구체예에서, 가교제가 부착되지 않은 α-탄소 원자는 화학식 R-의 치환기로 추가적으로 치환된다. 대안으로, 펩티드유사 거대고리 내에 2개의 α-탄소 원자는 화학식 R-의 독립된 치환기로 추가적으로 치환된다. 일부 구체예에서, 가교제가 부착된 2개의 α-탄소 원자는 화학식 R-의 독립된 치환기로 추가적으로 치환된다. 다른 구체예에서, 가교제가 부착되지 않은 2개의 α-탄소 원자는 화학식 R-의 독립된 치환기로 추가적으로 치환된다. R-은 예로써, 알킬, 예를 들면, 메틸, 에틸, 프로필 또는 이소프로필일 수 있다. 가교제는 2개의 α-탄소 원자를 연결할 수 있다. 일부 구체예에서, R- 및 가교제의 일부분은 서로 합쳐 환형 구조(cyclic structure)를 형성한다. 다른 구체예에서, 가교제는 연속 탄소-탄소 결합으로 형성된다. 또 다른 구체예에서, 가교제는 대략 6, 7, 8, 9, 10, 11, 12 또는 13개의 연속 결합을 보유한다. 또 다른 구체예에서, 가교제는 적어도 대략 5, 6, 7, 8, 또는 9개의 탄소 원자를 포함한다.
또한, 치료가 필요한 인간 환자에서 암을 치료하는 방법이 제시되는데, 상기 방법은 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함하고, 여기서 상기 펩티드유사 거대고리는 Mcl-1과 상호작용한다. 일부 구체예에서, 펩티드유사 거대고리는 Mcl-1과 친-아폽토시스 단백질, 예를 들면, Bid, Bim, Bax 또는 Bak 사이에 상호작용을 길항한다. 다른 구체예에서, 본 발명의 펩티드유사 거대고리는 인간 환자에서 암을 치료하는데 이용되는데, 여기서 암은 ABT-737 또는 이의 유사체에 내성이거나, 또는 Mcl-1에 대하여 1, 2, 5 또는 10 μM 이상의 친화력(affinity)을 갖는 화합물에 내성이다.
게다가, 본 발명에서는 치료가 필요한 인간 환자에서 ABT-737 내성 소형 세포 폐암을 치료하는 방법을 제시하는데, 상기 방법은 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함하고, 여기서 펩티드유사 거대고리는 BH3 도메인을 포함한다. 본 발명에서는 또한, 치료가 필요한 인간 환자에서 전립선암을 치료하는 방법을 제시하는데, 상기 방법은 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함하고, 여기서 펩티드유사 거대고리는 BH3 도메인을 포함한다.
본 발명에서 지시된 임의의 치료 방법에서, 펩티드유사 거대고리는 표준 치료 방법과 함께 투여된다. 표준 치료 방법은 예로써, 화학요법이다. 대안으로, 표준 치료 방법은 방사선요법이다. 진전된 구체예에서, 표준 치료 방법은 수술이다.
참고문헌으로서 편입
본 명세서에 언급된 모든 간행물, 특허, 그리고 특허 출원은 각각의 개별 간행물, 특허, 또는 특허 출원이 참조로서 편입되는 것으로 개별적으로 명확하게 지시되는 것처럼 본 발명에 참조로서 편입된다.
도면의 간단한 설명
본 발명의 신규한 특징(feature)은 첨부된 특허청구범위에서 구체적으로 열거된다. 본 발명의 원리가 활용되는 예시적인 구체예를 열거하는 상세한 설명 및 첨부된 도면을 참조하면, 본 발명의 특징과 이점에 관한 보다 나은 이해가 획득될 것이다:
도 1에서는 20 μM SP-1로 처리에 대한 24가지 상이한 종양 세포주의 민감도를 보여준다.
도 2에서는 5 μM의 SP-1 또는 SP-4로 처리에 대한 7가지 인간 백혈병/림프종 세포주의 민감도를 보여준다.
도 3에서는 20 μM의 SP-1 또는 SP-4로 처리에 대한 12가지 인간 고형 종양 세포주의 민감도를 도시한다.
도 4에서는 다양한 세포주에 대하여 조사된 SP-1 또는 SP-4에 대한 EC50 곡선을 도시한다.
도 5-15에서는 여러 개별 세포주에 대하여 조사된 SP-1, SP-2, SP-3, SP-4, SP-5와 SP-6에 대한 EC50 곡선을 도시한다.
도 16에서는 SP-1이 휴지기 인간 말초 림프구(hPBL)의 예정된 세포 사멸(programmed cell death)을 유도하지 않는다는 것을 지시한다.
도 17에서는 PMA + 이노마이신(ionomycin) + LPS 처리에 의해 활성화된 hPBL의 증식을 차단함에 있어서 SP-1이 라파마이신(rapamycin)만큼 효과적이라는 것을 예증한다.
도 18과 19에서는 SP-1이 SEMK2 인간 백혈병 이종이식 모형에서 종양 부담(tumor burden)을 감소시킨다는 것을 보여준다.
도 20에서는 SP-1이 설치류에서 항체 반응을 유도하지 않는다는 것을 보여준다.
도 21에서는 SP-1이 고도로 안정하고, 그리고 온도가 64℃까지 증가하는 동안 나선 형태를 유지한다는 것을 예증한다.
도 22에서는 본 발명의 일련의 펩티드유사 거대고리의 인간 혈장 안정성을 도시한다.
도 23에서는 본 발명의 일련의 펩티드유사 거대고리의 생쥐 혈장 안정성을 도시한다.
도 24에서는 SP-1과 SP-4가 쥐에서 나타내는 약동학적 특성을 도시한다.
도 25에서는 인간 혈청의 부재에서 본 발명의 펩티드유사 거대고리에 의한 Jurkat 종양 세포주에서 예정된 세포 사멸의 유도를 보여주고, BCL-2/BCL-XL-특이적 길항물질, 예를 들면, ABT-737과 본 발명의 BH3 펩티드유사 거대고리의 효능을 비교한다.
도 26에서는 10% 인간 혈청의 존재에서 본 발명의 펩티드유사 거대고리에 의한 Jurkat 종양 세포에서 예정된 세포 사멸의 유도를 보여주고, BCL-2/BCL-XL-특이적 길항물질, 예를 들면, ABT-737과 본 발명의 BH3 펩티드유사 거대고리의 효능을 비교한다.
도 27에서는 Bcl-XL, Bcl-2, 그리고 Mcl-1에 대한 본 발명의 여러 BH3 펩티드유사 거대고리 및 ABT-737의 결합 친화력을 비교한다.
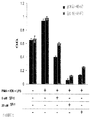
도 28에서는 다수의 혈액 종양(hematological malignancy)에 대한 펩티드유사 거대고리의 효능을 도시한다.
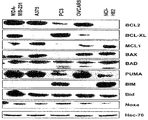
도 29에서는 본 발명의 조성물에 의한 치료에 민감한 세포주의 변화된 Bcl-2 집단 단백질 발현 프로필을 예시한다.
도 30에서는 ABT-737 내성 버킷 림프종 세포주인 Raji에서, 펩티드유사 거대고리와 ABT-737의 효능을 비교한다.
도 31에서는 다양한 고형 종양 세포주에 대한 BH3 펩티드유사 거대고리의 효능을 예증한다.
도 32에서는 ABT-737 내성 소형 세포 폐암 세포주(NCI-H82)에서 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 33에서는 본 발명의 화합물에 의한 NOD-SCID 생쥐에서 SEMK-2 종양 진행의 억제를 보여준다.
도 34에서는 혈청의 부재에서 처리된 난소 종양 세포주(OVCAR8)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 35에서는 2% 인간 혈청의 존재에서 처리된 난소 종양 세포주(OVCAR8)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 36에서는 혈청의 부재에서 처리된 흑색종 세포주(A375)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 37에서는 2% 인간 혈청의 존재에서 처리된 흑색종 세포주(A375)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 38에서는 혈청의 부재에서 처리된 유방 종양 세포주(MDA-MD-231-Met)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 39에서는 2% 인간 혈청에서 처리된 유방 종양 세포주(MDA-MD-231-Met)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 40에서는 혈청의 부재에서 처리된 전립선 종양 세포주(PC3)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 41에서는 2% 인간 혈청에서 처리된 전립선 종양 세포주(PC3)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 42에서는 혈청의 부재에서 처리된 소형 세포 폐암 세포주(NCI-H-82)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 43에서는 본 발명의 펩티드유사 거대고리에 민감한 암에서 다양한 BCL-집단 단백질의 다양한 발현을 보여주는 웨스턴 블롯(Western Blot)을 도시한다.
도 44에서는 전립선암 동소 이종이식 모형에서 생쥐 치료를 위한 시간표를 도시한다.
도 45에서는 전립선암 동소 이종이식 모형에서 본 발명의 펩티드유사 거대고리의 효능을 보여준다.
도 46에서는 혈청의 부재에서 처리된 T-세포 백혈병 세포주(Jurkat)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 47에서는 혈청의 부재에서 처리된 혼성-계통 T/B-세포 백혈병 세포주(SEMK2)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 48에서는 혈청의 부재에서 처리된 T-세포 백혈병 세포주(MOLT-4)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 49에서는 혈청의 부재에서 처리된 산재성 대형 B-세포 림프종 세포주(DHL-6)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 50에서는 혈청의 부재에서 처리된 혼성-계통 T/B-세포 백혈병 세포주(RS4;11)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 51에서는 혈청의 부재에서 처리된 버킷 림프종 세포주(Raji)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 52에서는 혈청의 부재에서 처리된 다발성 골수종 세포주(MM1S)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 53에서는 치료된 동물에서 감소된 종양 부담으로 측정된, SEMK2 백혈병 동소 이종이식 모형에서, 본 발명의 펩티드유사 거대고리의 효능을 보여준다.
도 54에서는 치료된 동물에서 감소된 종양 부담으로 측정된, SEMK2 백혈병 동소 이종이식 모형에서 본 발명의 펩티드유사 거대고리의 효능을 보여준다.
도 55에서는 치료된 동물의 증가된 생존으로 측정된, SEMK2 백혈병 동소 이종이식 모형에서 본 발명의 펩티드유사 거대고리의 효능을 보여준다.
도 56에서는 꺽쇠 고정된 SP-4 펩티드로 면역침전(immunoprecipitation)에 의해 증명되는 바와 같이, 다발성 골수종 (MM1S) 세포 용해질에서 친-아폽토시스 표적 단백질 BAX에 본 발명의 펩티드유사 거대고리의 서열-특이적 및 구조-특이적 결합을 보여준다.
본 발명의 신규한 특징(feature)은 첨부된 특허청구범위에서 구체적으로 열거된다. 본 발명의 원리가 활용되는 예시적인 구체예를 열거하는 상세한 설명 및 첨부된 도면을 참조하면, 본 발명의 특징과 이점에 관한 보다 나은 이해가 획득될 것이다:
도 1에서는 20 μM SP-1로 처리에 대한 24가지 상이한 종양 세포주의 민감도를 보여준다.
도 2에서는 5 μM의 SP-1 또는 SP-4로 처리에 대한 7가지 인간 백혈병/림프종 세포주의 민감도를 보여준다.
도 3에서는 20 μM의 SP-1 또는 SP-4로 처리에 대한 12가지 인간 고형 종양 세포주의 민감도를 도시한다.
도 4에서는 다양한 세포주에 대하여 조사된 SP-1 또는 SP-4에 대한 EC50 곡선을 도시한다.
도 5-15에서는 여러 개별 세포주에 대하여 조사된 SP-1, SP-2, SP-3, SP-4, SP-5와 SP-6에 대한 EC50 곡선을 도시한다.
도 16에서는 SP-1이 휴지기 인간 말초 림프구(hPBL)의 예정된 세포 사멸(programmed cell death)을 유도하지 않는다는 것을 지시한다.
도 17에서는 PMA + 이노마이신(ionomycin) + LPS 처리에 의해 활성화된 hPBL의 증식을 차단함에 있어서 SP-1이 라파마이신(rapamycin)만큼 효과적이라는 것을 예증한다.
도 18과 19에서는 SP-1이 SEMK2 인간 백혈병 이종이식 모형에서 종양 부담(tumor burden)을 감소시킨다는 것을 보여준다.
도 20에서는 SP-1이 설치류에서 항체 반응을 유도하지 않는다는 것을 보여준다.
도 21에서는 SP-1이 고도로 안정하고, 그리고 온도가 64℃까지 증가하는 동안 나선 형태를 유지한다는 것을 예증한다.
도 22에서는 본 발명의 일련의 펩티드유사 거대고리의 인간 혈장 안정성을 도시한다.
도 23에서는 본 발명의 일련의 펩티드유사 거대고리의 생쥐 혈장 안정성을 도시한다.
도 24에서는 SP-1과 SP-4가 쥐에서 나타내는 약동학적 특성을 도시한다.
도 25에서는 인간 혈청의 부재에서 본 발명의 펩티드유사 거대고리에 의한 Jurkat 종양 세포주에서 예정된 세포 사멸의 유도를 보여주고, BCL-2/BCL-XL-특이적 길항물질, 예를 들면, ABT-737과 본 발명의 BH3 펩티드유사 거대고리의 효능을 비교한다.
도 26에서는 10% 인간 혈청의 존재에서 본 발명의 펩티드유사 거대고리에 의한 Jurkat 종양 세포에서 예정된 세포 사멸의 유도를 보여주고, BCL-2/BCL-XL-특이적 길항물질, 예를 들면, ABT-737과 본 발명의 BH3 펩티드유사 거대고리의 효능을 비교한다.
도 27에서는 Bcl-XL, Bcl-2, 그리고 Mcl-1에 대한 본 발명의 여러 BH3 펩티드유사 거대고리 및 ABT-737의 결합 친화력을 비교한다.
도 28에서는 다수의 혈액 종양(hematological malignancy)에 대한 펩티드유사 거대고리의 효능을 도시한다.
도 29에서는 본 발명의 조성물에 의한 치료에 민감한 세포주의 변화된 Bcl-2 집단 단백질 발현 프로필을 예시한다.
도 30에서는 ABT-737 내성 버킷 림프종 세포주인 Raji에서, 펩티드유사 거대고리와 ABT-737의 효능을 비교한다.
도 31에서는 다양한 고형 종양 세포주에 대한 BH3 펩티드유사 거대고리의 효능을 예증한다.
도 32에서는 ABT-737 내성 소형 세포 폐암 세포주(NCI-H82)에서 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 33에서는 본 발명의 화합물에 의한 NOD-SCID 생쥐에서 SEMK-2 종양 진행의 억제를 보여준다.
도 34에서는 혈청의 부재에서 처리된 난소 종양 세포주(OVCAR8)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 35에서는 2% 인간 혈청의 존재에서 처리된 난소 종양 세포주(OVCAR8)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 36에서는 혈청의 부재에서 처리된 흑색종 세포주(A375)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 37에서는 2% 인간 혈청의 존재에서 처리된 흑색종 세포주(A375)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 38에서는 혈청의 부재에서 처리된 유방 종양 세포주(MDA-MD-231-Met)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 39에서는 2% 인간 혈청에서 처리된 유방 종양 세포주(MDA-MD-231-Met)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 40에서는 혈청의 부재에서 처리된 전립선 종양 세포주(PC3)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 41에서는 2% 인간 혈청에서 처리된 전립선 종양 세포주(PC3)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 42에서는 혈청의 부재에서 처리된 소형 세포 폐암 세포주(NCI-H-82)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 43에서는 본 발명의 펩티드유사 거대고리에 민감한 암에서 다양한 BCL-집단 단백질의 다양한 발현을 보여주는 웨스턴 블롯(Western Blot)을 도시한다.
도 44에서는 전립선암 동소 이종이식 모형에서 생쥐 치료를 위한 시간표를 도시한다.
도 45에서는 전립선암 동소 이종이식 모형에서 본 발명의 펩티드유사 거대고리의 효능을 보여준다.
도 46에서는 혈청의 부재에서 처리된 T-세포 백혈병 세포주(Jurkat)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 47에서는 혈청의 부재에서 처리된 혼성-계통 T/B-세포 백혈병 세포주(SEMK2)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 48에서는 혈청의 부재에서 처리된 T-세포 백혈병 세포주(MOLT-4)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 49에서는 혈청의 부재에서 처리된 산재성 대형 B-세포 림프종 세포주(DHL-6)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 50에서는 혈청의 부재에서 처리된 혼성-계통 T/B-세포 백혈병 세포주(RS4;11)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 51에서는 혈청의 부재에서 처리된 버킷 림프종 세포주(Raji)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 52에서는 혈청의 부재에서 처리된 다발성 골수종 세포주(MM1S)에서, 본 발명의 펩티드유사 거대고리에 의한 예정된 세포 사멸의 유도를 보여준다.
도 53에서는 치료된 동물에서 감소된 종양 부담으로 측정된, SEMK2 백혈병 동소 이종이식 모형에서, 본 발명의 펩티드유사 거대고리의 효능을 보여준다.
도 54에서는 치료된 동물에서 감소된 종양 부담으로 측정된, SEMK2 백혈병 동소 이종이식 모형에서 본 발명의 펩티드유사 거대고리의 효능을 보여준다.
도 55에서는 치료된 동물의 증가된 생존으로 측정된, SEMK2 백혈병 동소 이종이식 모형에서 본 발명의 펩티드유사 거대고리의 효능을 보여준다.
도 56에서는 꺽쇠 고정된 SP-4 펩티드로 면역침전(immunoprecipitation)에 의해 증명되는 바와 같이, 다발성 골수종 (MM1S) 세포 용해질에서 친-아폽토시스 표적 단백질 BAX에 본 발명의 펩티드유사 거대고리의 서열-특이적 및 구조-특이적 결합을 보여준다.
본 발명의 상세한 설명
본 명세서에서, 용어 “치료하는” 및 “치료하기 위하여”는 증상을 완화시키거나, 일시적인 또는 영구적인 기준에서 원인을 제거하거나, 증상을 예방하거나, 또는 증상의 출현을 지연시키는 것을 의미한다. 용어 “치료”는 임의의 장애와 연관된 증상과 이상의 완화, 원인(일시적인 또는 영구적인)의 제거, 또는 예방을 포함한다. 치료는 전-치료(pre-treatment), 그리고 증상의 발생 시점에 치료일 수 있다.
용어 “표준 치료 방법”은 특정한 징후에 대한 표준 치료의 일부가 되는 임의의 치료 또는 진단 방법, 화합물, 또는 관례를 지칭한다. “표준 치료”는 임상의가 일정한 유형의 환자, 질환, 또는 임상적 환경에서 준수해야 하는 임의의 진단 또는 치료 과정에 대하여, 임의의 권위자, 예를 들면, 건강 관리 제공자(health care provider), 또는 국가 또는 지역 연구소에 의해 확립될 수 있다. 다양한 유형의 암에 대한 예시적인 표준 치료 방법은 예로써, National Cancer Institute에 의해 제공된다.
본 명세서에서, 용어 “세포 증식성 질환”에는 암(cancer), 과다증식성(hyperproliferative) 질환, 신생성(neoplastic) 질환, 면역증식성(immunoproliferative) 질환 및 기타 질환이 포함된다. “세포 증식성 질환”은 자율 성장(autonomous growth)의 능력을 갖는 세포, 다시 말하면, 급속하게 확산되는 세포 성장으로 특징되는 비정상적 상태 또는 장애에 관계한다. 과다증식성과 신생성 질환 상태는 병리학적으로, 다시 말하면, 질환 상태를 특징짓거나 구성하는 것으로 분류되거나, 또는 비-병리학적으로, 다시 말하면, 정상으로부터 일탈하지만 질환 상태와 연관되지 않는 것으로 분류될 수 있다. 상기 용어는 조직병리학적 유형 또는 침입(invasiveness) 단계에 상관없이, 모든 유형의 암성 성장 또는 종양 진행, 전이성(metastatic) 조직 또는 악성 형질전환된 세포, 조직, 또는 장기를 포함하는 것으로 의도된다. 전이성 종양은 유방, 폐, 간, 결장과 난소 기원의 종양이 포함되지만 이들에 국한되지 않는 다수의 원발성(primary) 종양 유형으로부터 발생할 수 있다. “병리학적 과다증식성” 세포는 악성 종양 성장 및 면역증식성 질환으로 특징되는 질환 상태에서 발생한다. 비-병리학적 과다증식성 세포의 실례에는 상처 회복(wound repair)과 연관된 세포의 증식이 포함된다. 세포 증식성 및/또는 분화성 질환의 실례에는 암, 예를 들면, 암종, 육종, 또는 전이성 질환이 포함된다.
세포주 및 관련된 암 사이에 상관관계의 배경에서, 용어 “로부터 유래된”은 상기 세포주가 암의 특정한 범주 내에 임의의 암으로부터 확립될 수 있음을 의미한다.
본 명세서에서, 용어 “거대고리”는 적어도 9개의 공유 결합된 원자에 의해 형성된 고리 또는 환을 포함하는 화학 구조를 보유하는 분자를 지칭한다.
본 명세서에서, 용어 “펩티드유사 거대고리”, “가교된 폴리펩티드” 또는 “꺽쇠 고정된 펩티드”는 복수의 펩티드 결합에 의해 연결된 복수의 아미노산 잔기 및 동일한 분자 내에서 첫 번째 자연-발생 또는 비-자연-발생 아미노산 잔기(또는 유사체)와 두 번째 자연-발생 또는 비-자연-발생 아미노산 잔기(또는 유사체) 사이에 거대고리를 형성하는 적어도 하나의 거대고리-형성 링커(linker)를 포함하는 화합물을 지칭한다. 펩티드유사 거대고리는 거대고리-형성 링커가 첫 번째 아미노산 잔기(또는 유사체)의 α 탄소를 두 번째 아미노산 잔기(또는 유사체)의 α 탄소에 연결하는 구체예를 포함한다. 이들 펩티드유사 거대고리는 선택적으로, 하나 이상의 아미노산 잔기 및/또는 아미노산 유사체 잔기 사이에 하나 이상의 비-펩티드 결합을 포함하고, 그리고 선택적으로 거대고리를 형성하는 것들 이외에 하나 이상의 비-자연-발생 아미노산 잔기 또는 아미노산 유사체 잔기를 포함한다.
본 명세서에서, 용어 “안정성(stability)”은 원편광 이색성(circular dichroism), NMR 또는 다른 생물물리학적 척도에 의해 측정되는, 본 발명의 펩티드유사 거대고리에 의한 한정된 이차 구조의 용해 상태에서 유지, 또는 시험관내 또는 생체내에서 단백분해성 붕괴(proteolytic degradation)에 저항을 지칭한다. 본 발명에서 예기되는 이차 구조의 무제한적 실례는 α-나선(helix), β-회전(turn), 그리고 β-플리트 시트(pleated sheet)이다.
본 명세서에서, 용어 “나선 안정성(helical stability)”은 원편광 이색성 또는 NMR에 의해 측정되는, 본 발명의 펩티드유사 거대고리에 의한 α 나선 구조의 유지를 지칭한다. 가령, 일부 구체예에서, 본 발명의 펩티드유사 거대고리는 상응하는 가교되지 않은 폴리펩티드와 비교하여, 원편광 이색성에 의한 측정되는 α-헬리시티(helicity)에서 적어도 1.25, 1.5, 1.75 또는 2-배 증가를 나타낸다.
용어 “α-아미노산” 또는 간단하게, “아미노산”은 α-탄소로 명명되는 탄소에 결합된 아미노 기와 카르복실 기를 모두 보유하는 분자를 지칭한다. 적절한 아미노산에는 제한 없이, 자연-발생 아미노산의 D-과 L-이성질체 둘 모두, 그리고 유기 합성 또는 다른 대사 경로에 의해 제조된 비-자연 발생 아미노산이 포함된다. 본문에서 구체적으로 달리 명시되지 않으면, 본 명세서에서, 용어 아미노산은 아미노산 유사체를 포함하는 것으로 의도된다.
용어 “자연 발생 아미노산”은 자연에서 합성된 펩티드에서 공통적으로 발견되고, 그리고 한 문자 약어 A, R, N, C, D, Q, E, G, H, I, L, K, M, F, P, S, T, W, Y와 V로 알려져 있는 20개의 아미노산 중에서 임의의 한 가지를 지칭한다.
용어 “아미노산 유사체” 또는 “비-자연 아미노산”은 아미노산에 구조적으로 유사하고, 펩티드유사 거대고리의 형성에서 아미노산에 대하여 치환될 수 있는 분자를 지칭한다. 아미노산 유사체에는 제한 없이, 아미노 기와 카르복실 기 사이에 하나 이상의 추가적인 메틸렌 기의 포함(가령, α-아미노 β-카르복시 산), 또는 유사한 반응성 기에 의한 아미노 기 또는 카르복시 기의 치환(가령, 이차 또는 삼차 아민으로 일차 아민의 치환, 또는 에스테르로 카르복시 기의 치환)을 제외하고, 본 명세서에서 정의된 바와 같은 아미노산에 구조적으로 동일한 화합물이 포함된다.
“비-필수” 아미노산 잔기는 필수적인 생물학적 또는 생화학적 활성(가령, 수용체 결합 또는 활성화)을 소멸시키거나 실질적으로 변화시키지 않으면서, 폴리펩티드(가령, BH3 도메인 또는 p53 MDM2 결합 도메인)의 야생형 서열로부터 변형될 수 있는 잔기이다. “필수” 아미노산 잔기는 폴리펩티드의 야생형 서열로부터 변경될 때, 상기 폴리펩티드의 필수적인 생물학적 또는 생화학적 활성을 소멸시키거나 실질적으로 소멸시키는 잔기이다.
“보존성 아미노산 치환”은 아미노산 잔기가 유사한 측쇄(side chain)를 보유하는 아미노산 잔기로 치환되는 것이다. 유사한 측쇄를 보유하는 아미노산 잔기 집단은 당분야에서 정의되어 있다. 이들 집단에는 염기성 측쇄(가령, K, R, H), 산성 측쇄(가령, D, E), 하전되지 않은 극성 측쇄(가령, G, N, Q, S, T, Y, C), 무극성 측쇄(가령, A, V, L, I, P, F, M, W), 베타-가지화 측쇄(가령, T, V, I), 그리고 방향족 측쇄(가령, Y, F, W, H)를 보유하는 아미노산이 포함된다. 따라서 BH3 폴리펩티드 내에서 예측된 비-필수 아미노산 잔기는 바람직하게는, 동일한 측쇄 집단으로부터 다른 아미노산 잔기로 대체된다. 인정되는 치환의 다른 실례는 등전자적(isosteric) 고려(가령, 메티오닌에 대한 노르류신 치환) 또는 기타 특성(가령, 페닐알라닌에 대한 2-티에닐알라닌 치환)에 기초된 치환이다.
본 명세서에서, 거대고리 또는 거대고리-형성 링커와 관련하여 용어 “구성원”은 거대고리를 형성하거나 형성할 수 있는 원자를 지칭하고, 치환기 또는 측쇄 원자를 배제한다. 유사하게, 시클로데칸, 1,2-디플루오르-데칸 및 1,3-디메틸 시클로데칸 모두, 수소 또는 플루오르 치환기 또는 메틸 측쇄가 거대고리를 형성하는데 참여하지 않기 때문에, 10-원 거대고리인 것으로 간주된다.
용어 “아미노산 측쇄”는 아미노산 내에서 α-탄소에 부착된 모이어티(moiety)를 지칭한다. 가령, 알라닌에 대한 아미노산 측쇄는 메틸이고, 페닐알라닌에 대한 아미노산 측쇄는 페닐메틸이고, 시스테인에 대한 아미노산 측쇄는 티오메틸이고, 아스파라진산염에 대한 아미노산 측쇄는 카르복시메틸이고, 티로신에 대한 아미노산 측쇄는 4-히드록시페닐메틸이고, 그외 기타 등등이다. 다른 비-자연 발생 아미노산 측쇄에는 예로써, 자연에서 발생하는 것들(가령, 아미노산 대사산물) 또는 인위적으로 합성된 것들(가령, α,α 이중치환된 아미노산) 역시 포함된다.
용어 “α,α 이중치환된 아미노” 산은 2개의 자연 또는 비-자연 아미노산 측쇄에 부착되는 탄소(α-탄소)에 결합된 아미노 기와 카르복실 기를 둘 모두 보유하는 분자 또는 모이어티를 지칭한다.
용어 “폴리펩티드”는 공유 결합(가령, 아미드 결합)에 의해 연합된 2개 이상의 자연-발생 또는 비-자연-발생 아미노산을 포괄한다. 본 명세서에서 기술된 바와 같은 폴리펩티드는 전장 단백질(가령, 완전하게 처리된 단백질), 그리고 더욱 짧은 아미노산 서열(가령, 자연-발생 단백질의 단편 또는 합성 폴리펩티드 단편)을 포함한다.
본 명세서에서, 용어 “거대고리화(macrocyclization) 시약” 또는 “거대고리-형성 시약”은 2개의 반응성 기 사이에 반응을 매개함으로써 본 발명의 펩티드유사 거대고리를 제조하는데 이용될 수 있는 임의의 시약을 지칭한다. 반응성 기는 예로써, 아지드와 알킨일 수 있는데, 이러한 경우에 거대고리화 시약에는 제한 없이, Cu 시약, 예를 들면, 반응성 Cu(I) 화학종을 제공하는 시약, 예를 들면, CuBr, CuI 또는 CuOTf, 그리고 환원제(reducing agent), 예를 들면, 아스코르빈산 또는 아스코르빈산나트륨의 첨가에 의해 활성 Cu(I) 시약으로 in situ 전환될 수 있는 Cu(II) 염, 예를 들면, Cu(CO2CH3)2, CuSO4, 그리고 CuCl2가 포함된다. 거대고리화 시약에는 부가적으로, 예로써 당분야에 공지된 Ru 시약, 예를 들면, Cp*RuCl(PPh3)2, [Cp*RuCl]4, 또는 반응성 Ru(II) 화학종을 제공할 수 있는 기타 Ru 시약이 포함된다. 다른 사례에서, 반응성 기는 말단 올레핀(terminal olefin)이다. 이런 구체예에서, 거대고리화 시약 또는 거대고리-형성 시약은 안정화된 후기 전이 금속(late transition metal) 카르벤 복합 촉매, 예를 들면, VIII족 전이 금속 카르벤 촉매가 포함되지만 이들에 국한되지 않는 복분해(metathesis) 촉매이다. 가령, 이런 촉매는 +2 산화 상태(oxidation state), 16의 전자 수(electron count) 및 5배위(pentacoordination)를 갖는 Ru와 Os 금속 중심(metal center)이다. 추가적인 촉매는 Grubbs et al., "Ring Closing Metathesis and Related Processes in Organic Synthesis" Acc. Chem. Res. 1995, 28, 446-452, 그리고 U.S. 특허 5,811,515에서 개시된다. 또 다른 사례에서, 반응성 기는 티올 기이다. 이런 구체예에서, 거대고리화 시약은 예로써, 2개의 티올-반응성 기, 예를 들면, 할로겐 기로 기능체화된 링커이다.
용어 “할로” 또는 “할로겐”은 플루오르, 클로르, 브롬 또는 요오드 또는 이들의 라디칼을 지칭한다.
용어 “알킬”은 지정된 숫자의 탄소 원자를 내포하는, 직쇄 또는 분지쇄의 탄화수소 사슬을 지칭한다. 가령, C1-C10은 그 내부에 1개 내지 10개(포함적)의 탄소 원자가 존재한다는 것을 지시한다. 임의의 수치적 지정의 부재에서, “알킬”은 그 내부에 1개 내지 20개(포함적)의 탄소 원자를 내포하는 사슬(직쇄 또는 분지쇄)이다.
용어 “알킬렌”은 2가 알킬(즉, -R-)을 지칭한다.
용어 “알케닐”은 하나 이상의 탄소-탄소 이중 결합을 보유하는, 직쇄 또는 분지쇄의 탄화수소 사슬을 지칭한다. 알케닐 모이어티는 지정된 숫자의 탄소 원자를 내포한다. 가령, C2-C10은 그 내부에 2개 내지 10개(포함적)의 탄소 원자가 존재한다는 것을 지시한다. 용어 “저급 알케닐”은 C2-C6 알케닐 사슬을 지칭한다. 임의의 수치적 지정의 부재에서, “알케닐”은 그 내부에 2개 내지 20개(포함적)의 탄소 원자를 내포하는 사슬(직쇄 또는 분지쇄)이다.
용어 “알키닐”은 하나 이상의 탄소-탄소 삼중 결합을 보유하는, 직쇄 또는 분지쇄의 탄화수소 사슬을 지칭한다. 알키닐 모이어티는 지정된 숫자의 탄소 원자를 내포한다. 가령, C2-C10은 그 내부에 2개 내지 10개(포함적)의 탄소 원자가 존재한다는 것을 지시한다. 용어 “저급 알키닐”은 C2-C6 알키닐 사슬을 지칭한다. 임의의 수치적 지정의 부재에서, “알키닐”은 그 내부에 2개 내지 20개(포함적)의 탄소 원자를 내포하는 사슬(직쇄 또는 분지쇄)이다.
용어 “아릴”은 각 고리의 0, 1, 2, 3, 또는 4개 원자가 치환기에 의해 치환되는 6-탄소 단일환형 또는 10-탄소 이중환형 방향족 고리 시스템을 지칭한다. 아릴 기의 실례에는 페닐, 나프틸 등이 포함된다. 용어 “아릴알킬” 또는 용어 “아르알킬”은 아릴로 치환된 알킬을 지칭한다. 용어 “아릴알콕시”는 아릴로 치환된 알콕시를 지칭한다.
“아릴알킬”은 아릴 기의 수소 원자 중에서 하나가 앞서 정의된 바와 같은 C1-C5 알킬 기로 치환된, 앞서 정의된 바와 같은 아릴 기를 지칭한다. 아릴알킬 기의 대표적인 실례에는 2-메틸페닐, 3-메틸페닐, 4-메틸페닐, 2-에틸페닐, 3-에틸페닐, 4-에틸페닐, 2-프로필페닐, 3-프로필페닐, 4-프로필페닐, 2-부틸페닐, 3-부틸페닐, 4-부틸페닐, 2-펜틸페닐, 3-펜틸페닐, 4-펜틸페닐, 2-이소프로필페닐, 3-이소프로필페닐, 4-이소프로필페닐, 2-이소부틸페닐, 3-이소부틸페닐, 4-이소부틸페닐, 2-sec-부틸페닐, 3-sec-부틸페닐, 4-sec-부틸페닐, 2-t-부틸페닐, 3-t-부틸페닐 및 4-t-부틸페닐이 포함되지만 이들에 국한되지 않는다.
“아릴아미도”는 아릴 기의 수소 원자 중에서 하나가 하나 이상의 -C(O)NH2 기로 치환된, 앞서 정의된 바와 같은 아릴 기를 지칭한다. 아릴아미도 기의 대표적인 실례에는 2-C(O)NH2-페닐, 3-C(O)NH2-페닐, 4-C(O)NH2-페닐, 2-C(O)NH2-피리딜, 3-C(O)NH2-피리딜, 그리고 4-C(O)NH2-피리딜이 포함된다.
“알킬헤테로환”은 C1-C5 알킬 기의 수소 원자 중에서 하나가 헤테로환으로 치환된, 앞서 정의된 바와 같은 C1-C5 알킬 기를 지칭한다. 알킬헤테로환 기의 대표적인 실례에는 -CH2CH2-모르폴린, -CH2CH2-피페리딘, -CH2CH2CH2-모르폴린, 그리고 -CH2CH2CH2-이미다졸이 포함되지만 이들에 국한되지 않는다.
“알킬아미도”는 C1-C5 알킬 기의 수소 원자 중에서 하나가 -C(O)NH2 기로 대체된 앞서 정의된 바와 같은 C1-C5 알킬 기를 지칭한다. 알킬아미도 기의 대표적인 실례에는 -CH2-C(O)NH2, -CH2CH2-C(O)NH2, -CH2CH2CH2C(O)NH2, -CH2CH2CH2CH2C(O)NH2, -CH2CH2CH2CH2CH2C(O)NH2, -CH2CH(C(O)NH2)CH3, -CH2CH(C(O)NH2)CH2CH3, -CH(C(O)NH2)CH2CH3, -C(CH3)2CH2C(O)NH2, -CH2-CH2-NH-C(O)-CH3, -CH2-CH2-NH-C(O)-CH3-CH3 및 -CH2-CH2-NH-C(O)-CH=CH2가 포함되지만 이들에 국한되지 않는다.
“알칸올”은 C1-C5 알킬 기의 수소 원자 중에서 하나가 히드록실 기로 치환된, 앞서 정의된 바와 같은 C1-C5 알킬 기를 지칭한다. 알칸올 기의 대표적인 실례에는 -CH2OH, -CH2CH2OH, -CH2CH2CH2OH, -CH2CH2CH2CH2OH, -CH2CH2CH2CH2CH2OH, -CH2CH(OH)CH3, -CH2CH(OH)CH2CH3, -CH(OH)CH3, 그리고 -C(CH3)2CH2OH가 포함되지만 이들에 국한되지 않는다.
“알킬카르복시”은 C1-C5 알킬 기의 수소 원자 중에서 하나가 --COOH 기로 치환된 앞서 정의된 바와 같은 C1-C5 알킬 기를 지칭한다. 알킬카르복시 기의 대표적인 실례에는 -CH2COOH, -CH2CH2COOH, -CH2CH2CH2COOH, -CH2CH2CH2CH2COOH, -CH2CH(COOH)CH3, -CH2CH2CH2CH2CH2COOH, -CH2CH(COOH)CH2CH3, -CH(COOH)CH2CH3 및 -C(CH3)2CH2COOH가 포함되지만 이들에 국한되지 않는다.
본 명세서에서, 용어 “시클로알킬”은 3개 내지 12개의 탄소, 바람직하게는 3개 내지 8개의 탄소, 그리고 더욱 바람직하게는 3개 내지 6개의 탄소를 내포하는 포화된, 그리고 부분적으로 불포화된 환형 탄화수소 기를 포함하는데, 여기서 부가적으로, 시클로알킬 기가 선택적으로 치환된다. 일부 시클로알킬 기에는 시클로프로필, 시클로부틸, 시클로펜틸, 시클로펜테닐, 시클로헥실, 시클로헥세닐, 시클로헵틸, 그리고 시클로옥틸이 포함되지만 이들에 국한되지 않는다.
용어 “헤테로아릴”은 1-3개의 헤테로원자(단일환형의 경우), 1-6개의 헤테로원자(이중환형의 경우), 또는 1-9개의 헤테로원자(삼중환형의 경우)를 내포하는 방향족 5-8 원 단일환형, 8-12 원 이중환형, 또는 11-14 원 삼중환형 고리 시스템을 지칭하는데, 상기 헤테로원자는 O, N, 또는 S에서 선택되고(가령, 탄소 원자 및 단일환형, 이중환형, 또는 삼중환형의 경우에, 각각 O, N, 또는 S의 1-3개, 1-6개, 또는 1-9개 헤테로원자), 여기서 각 고리의 0, 1, 2, 3, 또는 4개의 원자가 치환기에 의해 치환된다. 헤테로아릴 기의 실례에는 피리딜, 푸릴 또는 푸라닐, 이미다졸릴, 벤즈이미다졸릴, 피리미디닐, 티오페닐 또는 티에닐, 퀴놀리닐, 인돌릴, 티아졸릴 등이 포함된다.
용어 “헤테로아릴알킬” 또는 용어 “헤테로아르알킬”은 헤테로아릴로 치환된 알킬을 지칭한다. 용어 “헤테로아릴알콕시”는 헤테로아릴로 치환된 알콕시를 지칭한다.
용어 “헤테로아릴알킬” 또는 용어 “헤테로아르알킬”은 헤테로아릴로 치환된 알킬을 지칭한다. 용어 “헤테로아릴알콕시”는 헤테로아릴로 치환된 알콕시를 지칭한다.
용어 “헤테로시클릴”은 1-3개의 헤테로원자(단일환형의 경우), 1-6개의 헤테로원자(이중환형의 경우), 또는 1-9개의 헤테로원자(삼중환형의 경우)를 내포하는 비-방향족 5-8 원 단일환형, 8-12 원 이중환형, 또는 11-14 원 삼중환형 고리 시스템을 지칭하는데, 상기 헤테로원자는 O, N, 또는 S에서 선택되고(가령, 탄소 원자 및 단일환형, 이중환형, 또는 삼중환형의 경우에, 각각 O, N, 또는 S의 1-3개, 1-6개, 또는 1-9개 헤테로원자), 여기서 각 고리의 0, 1, 2, 또는 3개의 원자가 치환기에 의해 치환된다. 헤테로시클릴 기의 실례에는 피페라지닐, 피롤리디닐, 디옥사닐, 모르폴리닐, 테트라히드로푸라닐 등이 포함된다.
용어 “치환기”는 임의의 분자, 화합물 또는 모이어티 상에서 두 번째 원자 또는 기, 예를 들면, 수소 원자를 대체하는 기를 지칭한다. 적절한 치환기에는 할로, 히드록시, 메르캅토, 옥소, 니트로, 할로알킬, 알킬, 알크아릴, 아릴, 아르알킬, 알콕시, 티오알콕시, 아릴옥시, 아미노, 알콕시카르보닐, 아미도, 카르복시, 알칸설포닐, 알킬카르보닐, 그리고 시아노 기가 포함되지만 이들에 국한되지 않는다.
일부 구체예에서, 본 발명의 화합물은 하나 이상의 비대칭 중심(asymmetric center)을 내포하고, 따라서 라셈체(racemate)와 라세미 혼합물(racemic mixture), 단일 거울상이성질체(enantiomer), 개별 부분입체이성질체(diastereomer) 및 부분입체이성질성 혼합물(diastereomeric mixture)로서 존재한다. 이들 화합물의 이와 같은 모든 이성질체 형태는 달리 명시되지 않으면, 본 발명에 포함된다. 일부 구체예에서, 본 발명의 화합물은 또한, 다중 호변이성 형태(multiple tautomeric form)로 존재하는데, 이런 경우에, 본 발명은 본 명세서에 기술된 화합물의 모든 호변이성 형태를 포함한다(가령, 고리 시스템의 알킬화가 다중 부위에서 알킬화를 유발하면, 본 발명은 이와 같은 모든 반응 산물을 포함한다). 이들 화합물의 이와 같은 모든 이성질체 형태는 달리 명시되지 않으면, 본 발명에 포함된다. 본 명세서에 기술된 화합물의 모든 결정 형태는 달리 명시되지 않으면, 본 발명에 포함된다.
본 명세서에서, 용어 “증가” 및 “감소”는 각각, 적어도 5%의 통계학적으로 유의한(즉, p < 0.1) 증가 또는 감소를 유도하는 것을 의미한다.
본 명세서에서, 변수에 대한 수치 범위의 상술은 본 발명이 상기 범위 내에 임의의 수치에 동등한 변수로 실행될 수 있음을 뜻하는 것으로 의도된다. 따라서 본질적으로 불연속적인 변수의 경우에, 이러한 변수는 수치 범위의 종점(end-point)을 비롯한, 상기 수치 범위 내에 임의의 정수(integer value)에 동등하다. 유사하게, 본질적으로 연속적인 변수의 경우에, 이러한 변수는 수치 범위의 종점(end-point)을 비롯한, 상기 수치 범위 내에 임의의 실수(real value)에 동등하다. 실례로써, 그리고 제한 없이, 0 내지 2의 수치를 갖는 것으로 기술되는 변수는 이러한 변수가 본질적으로 불연속적인 경우에 정수 0, 1 또는 2를 취하고, 그리고 이러한 변수가 본질적으로 연속적인 경우에, 실수 0.0, 0.1, 0.01, 0.001, 또는 ≥ 0 및 ≤ 2에서 임의의 다른 실수를 취한다.
본 명세서에서, 달리 명시되지 않으면, 단어 “또는”은 “및/또는”의 포함적 의미(inclusive sense)로 이용되고, “어느 한쪽/또는”의 배타적 의미(exclusive sense)로서 이용되지 않는다.
용어 “평균적으로”는 각 데이터 포인트(data point)에 대한 적어도 3회 독립된 반복을 수행함으로써 도출된 평균 수치를 나타낸다.
용어 “생물학적 활성”은 본 발명의 거대고리의 구조적, 기능적 특성을 포괄한다. 생물학적 활성은 예로써, 구조적 안정성, 알파-헬리시티, 표적에 대한 친화력, 단백분해성 붕괴에 대한 저항, 세포 침투성(cell penetrability), 세포내 안정성, 생체내에서 안정성, 또는 이들의 임의의 조합이다.
본 발명의 하나 이상의 특정 구체예의 상세는 첨부된 도면 및 상세한 설명에서 열거된다. 본 발명의 기타 특징, 목적, 그리고 이점은 상세한 설명, 도면, 그리고 특허청구범위로부터 명백할 것이다.
본 발명의
펩티드유사
거대고리의 설계
생물학적 활성을 부여하는 것으로 생각되는 나선 구조를 내포하는 공지된 일차 아미노산 서열을 포함하는 임의의 단백질 또는 폴리펩티드가 본 발명의 요지이다. 가령, 상기 폴리펩티드의 서열이 분석될 수 있고, 거대고리화 시약과 반응하는 기를 보유하는 아미노산 유사체는 적절한 위치에서 치환될 수 있다. 이들 적절한 위치는 이차 구조의 어떤 분자 표면(들)이 생물학적 활성에 요구되고, 그 결과로써, 어떤 다른 표면(들)을 교차하여 본 발명의 거대고리 형성 링커가 생물학적 활성에 요구되는 표면(들)을 입체적으로 차단하지 않으면서 거대고리를 형성할 수 있는 지를 확인함으로써 결정된다. 이런 결정은 이차 구조 및 활성에 결정적인 잔기(및 표면)를 가시화시키는 자연 결합 대응물 사이에 복합체의 X-선 결정학(crystallography)과 같은 방법을 이용하여; 활성에 결정적인 잔기(및 표면)를 기능적으로 확인하는 이차 구조 내에서 잔기의 순차적 돌연변이(sequential mutagenesis)에 의해; 또는 기타 방법에 의해 달성된다. 이런 결정에 의해, 적절한 아미노산은 본 발명의 아미노산 유사체와 거대고리-형성 링커로 치환된다. 가령, α-나선 이차 구조의 경우에, 생물학적 활성을 위하여 생체내에서 또는 시험관내에서 다른 생물분자와 접촉하기 위하여, 나선의 표면(가령, 나선의 축을 따라서 종축으로, 그리고 나선의 축으로부터 45-135˚ 방사상으로 확장하는 분자 표면)이 요구될 수 있다. 이런 경우에, 거대고리-형성 링커는 활성에 직접적으로 요구되지 않는 표면의 일부분에서 나선의 표면을 따라 종축으로 확장하면서, 상기 나선의 2개의 α-탄소를 연결하도록 설계된다.
본 발명의 일부 구체예에서, 펩티드 서열은 단백질의 BCL-2 집단으로부터 유래된다. BCL-2 집단은 BH1, BH2, BH3과 BH4로 명명된 최대 4개의 보존된 BCL-2 상동성(BH) 도메인의 존재에 의해 정의되는데, 이들 모두 α-나선 분절을 포함한다(Chittenden et al. (1995), EMBO 14:5589; Wang et al. (1996), Genes Dev. 10:2859). 항-아폽토시스 단백질, 예를 들면, BCL-2와 BCL-XL은 모든 BH 도메인에서 서열 보존을 나타낸다. 친-아폽토시스 단백질은 BH1, BH2, 그리고 BH3 도메인에서 상동성을 갖는 “다중도메인” 집단 구성원(가령, BAK, BAX), 그리고 BH3 친양쪽성 α-나선 분절에서만 서열 상동성을 갖는 “BH3-도메인 단독” 집단 구성원(가령, BID, BAD, BIM, BIK, NOXA, PUMA)으로 분류된다. BCL-2 집단 구성원은 동형- 및 이형이합체를 형성하는 능력을 갖는데, 이는 경쟁적 결합 및 친-아폽토시스와 항-아폽토시스 단백질 수준 사이의 비율이 사멸 자극에 대한 감수성을 지배한다는 것을 암시한다. 항-아폽토시스 단백질은 친-아폽토시스 과잉, 다시 말하면, 과도한 예정된 세포 사멸로부터 세포를 보호하는 기능을 한다. 부가적인 “보안” 조치에는 친-아폽토시스 단백질의 전사를 조절하고 이들을 불활성 컨포머(conformer)로서 유지하며, 단백분해 활성화, 탈인산화(dephosphorylation), 또는 친-사멸 기능을 활성화시키는 리간드-유도된 리간드-유도된 형태 변화를 요구하는 것 등이 포함된다. 일정한 세포 유형에서, 혈장 막(plasma membrane)에서 접수된 사멸 신호(death signal)는 미토콘드리아 경로(mitochondrial pathway)를 통해 아폽토시스(apoptosis)를 유발한다. 미토콘드리아는 카스파제(caspase) 9를 활성화시키고, 치명적인 하류 단백분해 현상(downstream proteolytic event)을 유발하는 세포질 복합체(cytosolic complex)의 결정적인 성분인 시토크롬(cytochrome) c를 격리시킴으로써 세포 사멸의 게이트키퍼(gatekeeper)로서 기능할 수 있다. 다중도메인 단백질, 예를 들면, BCL-2/BCL-XL 및 BAK/BAX는 미토콘드리아 막에서 수호자(guardian)와 집행자(executioner)의 듀얼(dueling) 역할을 수행하며, 이들의 활성은 BCL-2 집단의 상류 BH3-단독 구성원에 의해 더욱 조절된다. 가령, BID는 친-아폽토시스 단백질의 BH3-도메인 단독 집단의 구성원이고, 혈장 막에서 접수된 사멸 신호를 미토콘드리아 막에서 작동체 친-아폽토시스 단백질에 전달한다. BID는 친-아폽토시스와 항-아폽토시스 단백질 둘 모두와 상호작용하는 능력을 갖고, 그리고 카스파제 8에 의한 활성화 이후에, 시토크롬 c 방출 및 미토콘드리아 아폽토시스를 유발한다. 결실 및 돌연변이유발 연구에서, 친-아폽토시스 집단 구성원의 친양쪽성 α-나선 BH3 분절은 사멸 도메인으로서 기능하고, 따라서 다중도메인 아폽토시스 단백질과 상호작용하기 위한 결정적인 구조 모티프(structural motif)를 대표할 수 있는 것으로 결정되었다. 구조 연구에서, BH3 나선은 BH1, 2와 3 도메인의 접촉면에 의해 형성된 소수성 그루브(hydrophobic groove) 내로 끼어들어감으로써 항-아폽토시스 단백질과 상호작용할 수 있는 것으로 밝혀졌다. 활성화된 BID는 항-아폽토시스 단백질(가령, BCL-2와 BCL-XL)에 의해 결합되고 격리될 수 있으며, 시토크롬 c 방출 및 미토콘드리아 아폽토시스 프로그램으로 이어지는 친-아폽토시스 단백질 BAX와 BAK의 활성화를 유발할 수 있다. BAD는 또한, BH3-도메인 단독 친-아폽토시스 집단 구성원인데, 이의 발현은 BAX/BAK의 활성화를 유발한다. BID에 대조적으로, BAD는 항-아폽토시스 집단 구성원, BCL-2와 BCL-XL에 우선적인 결합을 나타낸다. BAD BH3 도메인은 BCL-2에 높은 친화력 결합을 나타내는 반면, BAD BH3 펩티드는 시험관내에서 미토콘드리아로부터 시토크롬 c 방출을 활성화시킬 수 없는데, 이는 BAD가 BAX/BAK의 직접적인 활성인자가 아니라는 것을 암시한다. BCL-2를 과다-발현하는 미토콘드리아는 BID-유도된 시토크롬 c 방출에 저항하지만, BAD로 공동-처리는 BID 민감도를 복원할 수 있다. BAD에 의한 미토콘드리아 아폽토시스의 유도는 (1) BCL-2/BCL-XL 결합 포켓으로부터 BAX/BAK 활성인자, 예를 들면, BID와 BID-유사 단백질의 이동, 또는 (2) 항-아폽토시스 단백질에 의한 BID-유사 단백질의 격리를 예방하기 위한 BAD에 의한 BCL-2/BCL-XL 결합 포켓의 선별적 점유에 기인하는 것으로 보인다. 따라서 2가지 부류의 BH3-도메인 단독 단백질이 출현하였다: 미토콘드리아 아폽토시스를 직접적으로 활성화시키는 BID-유사 단백질, 그리고 다중도메인 항-아폽토시스 단백질의 결합 포켓을 점유함으로써 BID-유사 친-아폽토시스에 미토콘드리아를 감작화시키는 능력을 갖는 BAD-유사 단백질. 본 명세서에 개시된 방법이 적용될 수 있는 BCL-2 집단 구성원 단백질의 다양한 α-나선 도메인은 개시되어 있다(Walensky et al. (2004), Science 305:1466; 그리고 Walensky et al., U.S. 특허 출원 2005/0250680, 이들의 전체 내용은 본 발명에 참조로서 편입됨).
본 발명에 이용하기 적합한 펩티드 서열의 무제한적이고 예시적인 목록이 하기에 제공된다:
| 명칭 | 서열 (굵은 글씨 = 결정적인 잔기 ) |
가교된 서열 ( X = x-연결 잔기 ) |
| BH3 펩티드 | ||
| BID-BH3 | QEDIIRNIARHLAQVGDSMDRSIPP | QEDIIRNIARHLA X VGD X MDRSIPP |
| BIM-BH3 | DNRPEIWIAQELRRIGDEFNAYYAR | DNRPEIWIAQELR X IGD X FNAYYAR |
| BAD-BH3 | NLWAAQRYGRELRRMSDEFVDSFKK | NLWAAQRYGRELR X MSD X FVDSFKK |
| PUMA-BH3 | EEQWAREIGAQLRRMADDLNAQYER | EEQWAREIGAQLR X MAD X LNAQYER |
| Hrk-BH3 | RSSAAQLTAARLKALGDELHQRTM | RSSAAQLTAARLK X LGD X LHQRTM |
| NOXAA-BH3 | AELPPEFAAQLRKIGDKVYCTW | AELPPEFAAQLR X IGD X VYCTW |
| NOXAB-BH3 | VPADLKDECAQLRRIGDKVNLRQKL | VPADLKDECAQLR X IGD X VNLRQKL |
| BMF-BH3 | QHRAEVQIARKLQCIADQFHRLHT | QHRAEVQIARKLQ X IAD X FHRLHT |
| BLK-BH3 | SSAAQLTAARLKALGDELHQRT | SSAAQLTAARLK X LGD X LHQRT |
| BIK-BH3 | CMEGSDALALRLACIGDEMDVSLRA | CMEGSDALALRLA X IGD X MDVSLRA |
| Bnip3 | DIERRKEVESILKKNSDWIWDWSS | DIERRKEVESILK X NSD X IWDWSS |
| BOK-BH3 | GRLAEVCAVLLRLGDELEMIRP | GRLAEVCAVLL X LGD X LEMIRP |
| BAX-BH3 | PQDASTKKSECLKRIGDELDSNMEL | PQDASTKKSECLK X IGD X LDSNMEL |
| BAK-BH3 | PSSTMGQVGRQLAIIGDDINRR | PSSTMGQVGRQLA X IGD X INRR |
| BCL2L1-BH3 | KQALREAGDEFELR | KQALR X AGD X FELR |
| BCL2-BH3 | LSPPVVHLALALRQAGDDFSRR | LSPPVVHLALALR X AGD X FSRR |
| BCL-XL-BH3 | EVIPMAAVKQALREAGDEFELRY | EVIPMAAVKQALR X AGD X FELRY |
| BCL-W-BH3 | PADPLHQAMRAAGDEFETRF | PADPLHQAMR X AGD X FETRF |
| MCL1-BH3 | ATSRKLETLRRVGDGVQRNHETA | ATSRKLETLR X VGD X VQRNHETA |
| MTD-BH3 | LAEVCTVLLRLGDELEQIR | LAEVCTVLL X LGD X LEQIR |
| MAP-1-BH3 | MTVGELSRALGHENGSLDP | MTVGELSRALG X ENG X LDP |
| NIX-BH3 | VVEGEKEVEALKKSADWVSDWS | VVEGEKEVEALK X SAD X VSDWS |
| 4ICD(ERBB4)-BH3 | SMARDPQRYLVIQGDDRMKL | SMARDPQRYLV X QGD X RMKL |
표 1에서는 BH3 결합 부위를 표적으로 하고, 암, 자가면역 질환, 대사 질환 및 기타 인간 질환 상태에 관여하는 인간 서열의 목록을 제시한다.
| 명칭 | 서열 (굵은 글씨 = 결정적인 잔기 ) |
가교된 서열 ( X = x-연결 잔기 ) |
| BH3 펩티드 | ||
| BID-BH3 | QEDIIRNIARHLAQVGDSMDRSIPP | QEDIIRNI X RHL X QVGDSMDRSIPP |
| BIM-BH3 | DNRPEIWIAQELRRIGDEFNAYYAR | DNRPEIWI X QEL X RIGDEFNAYYAR |
| BAD-BH3 | NLWAAQRYGRELRRMSDEFVDSFKK | NLWAAQRY X REL X RMSDEFVDSFKK |
| PUMA-BH3 | EEQWAREIGAQLRRMADDLNAQYER | EEQWAREI X AQL X RMADDLNAQYER |
| Hrk-BH3 | RSSAAQLTAARLKALGDELHQRTM | RSSAAQLT X ARL X ALGDELHQRTM |
| NOXAA-BH3 | AELPPEFAAQLRKIGDKVYCTW | AELPPEF X AQL X KIGDKVYCTW |
| NOXAB-BH3 | VPADLKDECAQLRRIGDKVNLRQKL | VPADLKDE X AQL X RIGDKVNLRQKL |
| BMF-BH3 | QHRAEVQIARKLQCIADQFHRLHT | QHRAEVQI X RKL X CIADQFHRLHT |
| BLK-BH3 | SSAAQLTAARLKALGDELHQRT | SSAAQLT X ARL X ALGDELHQRT |
| BIK-BH3 | CMEGSDALALRLACIGDEMDVSLRA | CMEGSDAL X LRL X CIGDEMDVSLRA |
| Bnip3 | DIERRKEVESILKKNSDWIWDWSS | DIERRKEV X SIL X KNSDWIWDWSS |
| BOK-BH3 | GRLAEVCAVLLRLGDELEMIRP | GRLAEV X AVL X RLGDELEMIRP |
| BAX-BH3 | PQDASTKKSECLKRIGDELDSNMEL | PQDASTKK X ECL X RIGDELDSNMEL |
| BAK-BH3 | PSSTMGQVGRQLAIIGDDINRR | PSSTMGQV X RQL X IIGDDINRR |
| BCL2L1-BH3 | KQALREAGDEFELR | X QAL X EAGDEFELR |
| BCL2-BH3 | LSPPVVHLALALRQAGDDFSRR | LSPPVVHL X LAL X QAGDDFSRR |
| BCL-XL-BH3 | EVIPMAAVKQALREAGDEFELRY | EVIPMAAV X QAL X EAGDEFELRY |
| BCL-W-BH3 | PADPLHQAMRAAGDEFETRF | PADPL X QAM X AAGDEFETRF |
| MCL1-BH3 | ATSRKLETLRRVGDGVQRNHETA | ATSRK X ETL X RVGDGVQRNHETA |
| MTD-BH3 | LAEVCTVLLRLGDELEQIR | LAEV X TVL X RLGDELEQIR |
| MAP-1-BH3 | MTVGELSRALGHENGSLDP | MTVGEL X RAL X HENGSLDP |
| NIX-BH3 | VVEGEKEVEALKKSADWVSDWS | VVEGEKE X EAL X KSADWVSDWS |
| 4ICD(ERBB4)-BH3 | SMARDPQRYLVIQGDDRMKL | SMARDP X RYL X IQGDDRMKL |
표 2에서는 BH3 결합 부위를 표적으로 하고, 암, 자가면역 질환, 대사 질환 및 기타 인간 질환 상태에 관여하는 인간 서열의 목록을 제시한다.
본 발명의
펩티드유사
거대고리
본 발명의 방법의 일부 구체예에서, 본 발명의 폴리펩티드는 하나의 가교를 내포한다. 본 발명의 방법의 다른 구체예에서, 상기 폴리펩티드는 2개의 가교를 내포한다. 본 발명의 방법의 일부 구체예에서, 하나의 가교는 2개의 α-탄소 원자를 연결한다. 본 발명의 방법의 다른 구체예에서, 하나의 가교가 부착된 하나의 α-탄소 원자는 화학식 R-의 치환기로 치환된다. 본 발명의 방법의 다른 구체예에서, 하나의 가교가 부착된 2개의 α-탄소 원자는 화학식 R-의 독립된 치환기로 치환된다. 본 발명의 방법의 한 구체예에서, R-은 알킬이다. 가령, R-은 메틸이다. 대안으로, R- 및 하나의 가교의 임의의 일부분은 서로 합쳐 환형 구조를 형성할 수 있다. 본 발명의 방법의 다른 구체예에서, 하나의 가교는 연속 탄소-탄소 결합으로 형성된다. 가령, 하나의 가교는 적어도 8, 9, 10, 11, 또는 12개의 연속 결합을 포함한다. 다른 구체예에서, 하나의 가교는 적어도 7, 8, 9, 10, 또는 11개의 탄소 원자를 포함한다.
본 발명의 방법의 다른 구체예에서, 가교된 폴리펩티드는 BCL-2 집단 구성원의 α-나선 도메인을 포함한다. 가령, 가교된 폴리펩티드는 BH3 도메인을 포함한다. 다른 구체예에서, 가교된 폴리펩티드는 표 1, 2, 3과 4에서 임의의 서열에 적어도 60%, 70%, 80%, 85%, 90% 또는 95%인 서열을 포함한다. 본 발명의 방법의 일부 구체예에서, 가교된 폴리펩티드는 에너지-의존성 과정(energy-dependent process)으로 세포 막을 침투하고, 세포내 표적에 결합한다.
일부 구체예에서, 상기 나선 폴리펩티드는 하나의 가교를 내포한다. 다른 구체예에서, 상기 나선 폴리펩티드는 2개의 가교를 내포한다.
일부 구체예에서, 하나의 가교는 2개의 α-탄소 원자를 연결한다. 다른 구체예에서, 하나의 가교가 부착된 하나의 α-탄소 원자는 화학식 R-의 치환기로 치환된다. 다른 구체예에서, 하나의 가교가 부착된 2개의 α-탄소 원자는 화학식 R-의 독립된 치환기로 치환된다. 본 발명의 한 구체예에서, R-은 알킬이다. 가령, R-은 메틸이다. 대안으로, R- 및 하나의 가교의 임의의 일부분은 서로 합쳐 환형 구조를 형성할 수 있다. 다른 구체예에서, 하나의 가교는 연속 탄소-탄소 결합으로 형성된다. 가령, 하나의 가교는 적어도 8, 9, 10, 11, 또는 12개의 연속 결합을 포함한다. 다른 구체예에서, 하나의 가교는 적어도 7, 8, 9, 10, 또는 11개의 탄소 원자를 포함한다.
다른 구체예에서, 가교된 폴리펩티드는 BCL-2 집단 구성원의 α-나선 도메인을 포함한다. 가령, 가교된 폴리펩티드는 BH3 도메인을 포함한다. 다른 구체예에서, 가교된 폴리펩티드는 표 1, 2, 3과 4에서 임의의 서열에 적어도 60%, 70%, 80%, 85%, 90% 또는 95%인 서열을 포함한다. 일부 구체예에서, 가교된 폴리펩티드는 에너지-의존성 과정(energy-dependent process)으로 세포 막을 침투하고, 세포내 표적에 결합한다.
일부 구체예에서, 본 발명의 펩티드유사 거대고리는 화학식 (I)을 보유한다:
[화학식 (I)]
여기서:
각 A, C, D, 그리고 E는 독립적으로 자연 또는 비-자연 아미노산이고;
R1과 R2는 독립적으로 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 시클로알킬알킬, 헤테로알킬, 또는 헤테로시클로알킬이고, 치환되지 않거나 할로-로 치환되며;
R3은 수소, 알킬, 알케닐, 알키닐, 아릴알킬, 헤테로알킬, 시클로알킬, 헤테로시클로알킬, 시클로알킬알킬, 시클로아릴, 또는 헤테로시클로아릴이고, R5로 선택적으로 치환되며;
L은 화학식 -L1-L2-의 거대고리-형성 링커이고;
L1과 L2는 독립적으로 알킬렌, 알케닐렌, 알키닐렌, 헤테로알킬렌, 시클로알킬렌, 헤테로시클로알킬렌, 시클로아릴렌, 헤테로시클로아릴렌, 또는 [R4-K-R4]n이고, 각각 R5로 선택적으로 치환되며;
R4는 각각 알킬렌, 알케닐렌, 알키닐렌, 헤테로알킬렌, 시클로알킬렌, 헤테로시클로알킬렌, 아릴렌, 또는 헤테로아릴렌이고;
K는 각각 O, S, SO, SO2, CO, CO2, 또는 CONR3이고;
R5는 각각 독립적으로 할로겐, 알킬, -OR6, -N(R6)2, -SR6, -SOR6, -SO2R6, -CO2R6, 형광 모이어티, 방사성동위원소 또는 치료제이고;
R6은 각각 독립적으로 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬알킬, 헤테로시클로알킬, 형광 모이어티, 방사성동위원소 또는 치료제이고;
R7은 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 헤테로알킬, 시클로알킬알킬, 헤테로시클로알킬, 시클로아릴, 또는 헤테로시클로아릴이고, R5로 선택적으로 치환되며, 또는 D 잔기를 보유하는 환형 구조의 일부이며;
R8은 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 헤테로알킬, 시클로알킬알킬, 헤테로시클로알킬, 시클로아릴, 또는 헤테로시클로아릴이고, R5로 선택적으로 치환되며, 또는 E 잔기를 보유하는 환형 구조의 일부이며;
v와 w는 각각 독립적으로 1-1000의 정수이고;
x, y와 z는 각각 독립적으로 0-10의 정수이고; u는 1-10의 정수이고; 그리고
n은 1-5의 정수이다.
한 가지 실례에서, R1과 R2 중에서 적어도 하나는 알킬이고, 치환되지 않거나 할로-로 치환된다. 다른 실례에서, R1과 R2 둘 모두 독립적으로 알킬이고, 치환되지 않거나 할로-로 치환된다. 일부 구체예에서, R1과 R2 중에서 적어도 하나는 메틸이다. 다른 구체예에서, R1과 R2는 메틸이다.
본 발명의 일부 구체예에서, x+y+z는 적어도 3이다. 본 발명의 다른 구체예에서, x+y+z는 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10이다. 본 발명의 거대고리 또는 거대고리 전구체 내에서 A, B, C, D 또는 E의 각 존재는 독립적으로 선택된다. 가령, 화학식 [A]x(x는 3)로 표시되는 서열은 아미노산이 동일하지 않은 구체예, 예를 들면, Gln-Asp-Ala, 그리고 아미노산이 동일한 구체예, 예를 들면, Gln-Gln-Gln을 포괄한다. 이는 지정된 범위 내에서 x, y, 또는 z의 임의의 값에 적용된다.
일부 구체예에서, 본 발명의 펩티드유사 거대고리는 α-나선이고, R8이 -H이며, 나선내 수소 결합을 가능하게 하는 이차 구조를 포함한다. 일부 구체예에서, A, B, C, D 또는 E 중에서 적어도 하나는 α,α-이중치환된 아미노산이다. 한 가지 실례에서, B는 α,α-이중치환된 아미노산이다. 가령, A, B, C, D 또는 E 중에서 적어도 하나는 2-아미노이소부티르산이다. 다른 구체예에서, A, B, C, D 또는 E 중에서 적어도 하나는 이다.
다른 구체예에서, 첫 번째 Cα와 두 번째 Cα 사이에서 측정되는, 거대고리-형성 링커 L의 길이는 원하는 이차 펩티드 구조, 예를 들면, 첫 번째 Cα와 두 번째 Cα 사이에 것들이 포함되지만 이들에 국한되지 않는 펩티드유사 거대고리의 잔기에 의해 형성된 α-나선을 안정화시키도록 선택된다.
한 구체예에서, 화학식 (I)의 펩티드유사 거대고리는 아래와 같다:
여기서 R1과 R2는 각각 독립적으로 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 시클로알킬알킬, 헤테로알킬, 또는 헤테로시클로알킬이고, 치환되지 않거나 할로-로 치환된다.
관련된 구체예에서, 화학식 (I)의 펩티드유사 거대고리는 아래와 같다:
또는
다른 구체예에서, 화학식 (I)의 펩티드유사 거대고리는 하기에 도시된 임의의 화학식의 화합물이다:
여기서 “AA”는 임의의 자연 또는 비-자연 아미노산 측쇄를 나타내고, “ ”는 앞서 정의된 바와 같은 [D]v, 또는 [E]w이고, 그리고 n은 0 내지 20, 50, 100, 200, 300, 400 또는 500의 정수이다. 일부 구체예에서, n은 0이다. 다른 구체예에서, n은 50 미만이다.
거대고리-형성 링커 L의 예시적인 구체예는 하기에 도시된다.
본 발명의 펩티드유사 거대고리의 예시적인 구체예는 하기에 도시된다:
본 발명의 펩티드유사 거대고리의 다른 구체예에는 상기에 도시된 거대고리의 유사체가 포함된다.
일부 구체예에서, 본 발명의 펩티드유사 거대고리는 화학식 (II)를 보유한다:
[화학식 (II)]
여기서:
A, C, D, 그리고 E는 각각 독립적으로 자연 또는 비-자연 아미노산이고;
R1과 R2는 독립적으로 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 시클로알킬알킬, 헤테로알킬, 또는 헤테로시클로알킬이고, 치환되지 않거나 할로-로 치환되며;
R3은 수소, 알킬, 알케닐, 알키닐, 아릴알킬, 헤테로알킬, 시클로알킬, 헤테로시클로알킬, 시클로알킬알킬, 시클로아릴, 또는 헤테로시클로아릴이고, R5로 선택적으로 치환되며;
L1, L2와 L3은 독립적으로 알킬렌, 알케닐렌, 알키닐렌, 헤테로알킬렌, 시클로알킬렌, 헤테로시클로알킬렌, 시클로아릴렌, 헤테로시클로아릴렌, 또는 [R4-K-R4]n이고, 각각 R5로 선택적으로 치환되며;
R4는 각각 알킬렌, 알케닐렌, 알키닐렌, 헤테로알킬렌, 시클로알킬렌, 헤테로시클로알킬렌, 아릴렌, 또는 헤테로아릴렌이고;
K는 각각 O, S, SO, SO2, CO, CO2, 또는 CONR3이고;
R5는 각각 독립적으로 할로겐, 알킬, -OR6, -N(R6)2, -SR6, -SOR6, -SO2R6, -CO2R6, 형광 모이어티, 방사성동위원소 또는 치료제이고;
R6은 각각 독립적으로 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬알킬, 헤테로시클로알킬, 형광 모이어티, 방사성동위원소 또는 치료제이고;
R7은 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 헤테로알킬, 시클로알킬알킬, 헤테로시클로알킬, 시클로아릴, 또는 헤테로시클로아릴이고, R5로 선택적으로 치환되며, 또는 D 잔기를 보유하는 환형 구조의 일부이며;
R8은 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 헤테로알킬, 시클로알킬알킬, 헤테로시클로알킬, 시클로아릴, 또는 헤테로시클로아릴이고, R5로 선택적으로 치환되며, 또는 E 잔기를 보유하는 환형 구조의 일부이며;
v와 w는 각각 독립적으로 1-1000의 정수이고;
x, y와 z는 각각 독립적으로 0-10의 정수이고; u는 1-10의 정수이고; 그리고
n은 1-5의 정수이다.
한 가지 실례에서, R1과 R2 중에서 적어도 하나는 알킬이고, 치환되지 않거나 할로-로 치환된다. 다른 실례에서, R1과 R2 둘 모두 독립적으로 알킬이고, 치환되지 않거나 할로-로 치환된다. 일부 구체예에서, R1과 R2 중에서 적어도 하나는 메틸이다. 다른 구체예에서, R1과 R2는 메틸이다.
본 발명의 일부 구체예에서, x+y+z는 적어도 3이다. 본 발명의 다른 구체예에서, x+y+z는 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10이다. 본 발명의 거대고리 또는 거대고리 전구체 내에서 A, B, C, D 또는 E의 각 존재는 독립적으로 선택된다. 가령, 화학식 [A]x(x는 3)로 표시되는 서열은 아미노산이 동일하지 않은 구체예, 예를 들면, Gln-Asp-Ala, 그리고 아미노산이 동일한 구체예, 예를 들면, Gln-Gln-Gln을 포괄한다. 이는 지정된 범위 내에서 x, y, 또는 z의 임의의 값에 적용된다.
일부 구체예에서, 본 발명의 펩티드유사 거대고리는 α-나선이고, R8이 -H이며, 나선내 수소 결합을 가능하게 하는 이차 구조를 포함한다. 일부 구체예에서, A, B, C, D 또는 E 중에서 적어도 하나는 α,α-이중치환된 아미노산이다. 한 가지 실례에서, B는 α,α-이중치환된 아미노산이다. 가령, A, B, C, D 또는 E 중에서 적어도 하나는 2-아미노이소부티르산이다. 다른 구체예에서, A, B, C, D 또는 E 중에서 적어도 하나는 이다.
다른 구체예에서, 첫 번째 Cα와 두 번째 Cα 사이에서 측정되는, 거대고리-형성 링커 L의 길이는 원하는 이차 펩티드 구조, 예를 들면, 첫 번째 Cα와 두 번째 Cα 사이에 것들이 포함되지만 이들에 국한되지 않는 펩티드유사 거대고리의 잔기에 의해 형성된 α-나선을 안정화시키도록 선택된다.
거대고리-형성 링커 L의 예시적인 구체예는 하기에 도시된다.
다른 구체예에서, 본 발명에서는 화학식 (III)의 펩티드유사 거대고리를 제시한다:
[화학식 (III)]
여기서:
A, C, D, 그리고 E는 각각 독립적으로 자연 또는 비-자연 아미노산이고;
R1과 R2는 독립적으로 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 시클로알킬알킬, 헤테로알킬, 또는 헤테로시클로알킬이고, 치환되지 않거나 할로-로 치환되며;
R3은 수소, 알킬, 알케닐, 알키닐, 아릴알킬, 헤테로알킬, 시클로알킬, 헤테로시클로알킬, 시클로알킬알킬, 시클로아릴, 또는 헤테로시클로아릴이고, 치환되지 않거나 R5로 치환되며;
L1, L2, L3과 L4는 독립적으로 알킬렌, 알케닐렌, 알키닐렌, 헤테로알킬렌, 시클로알킬렌, 헤테로시클로알킬렌, 시클로아릴렌, 헤테로시클로아릴렌 또는 [-R4-K-R4-]n이고, 각각은 치환되지 않거나 R5로 치환되며;
K는 O, S, SO, SO2, CO, CO2, 또는 CONR3이고;
R4는 각각 알킬렌, 알케닐렌, 알키닐렌, 헤테로알킬렌, 시클로알킬렌, 헤테로시클로알킬렌, 아릴렌, 또는 헤테로아릴렌이고;
R5는 각각 독립적으로 할로겐, 알킬, -OR6, -N(R6)2, -SR6, -SOR6, -SO2R6, -CO2R6, 형광 모이어티, 방사성동위원소 또는 치료제이고;
R6은 각각 독립적으로 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬알킬, 헤테로시클로알킬, 형광 모이어티, 방사성동위원소 또는 치료제이고;
R7은 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 헤테로알킬, 시클로알킬알킬, 헤테로시클로알킬, 시클로아릴, 또는 헤테로시클로아릴이고, 치환되지 않거나 R5로 치환되며, 또는 D 잔기를 보유하는 환형 구조의 일부이며;
R8은 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 헤테로알킬, 시클로알킬알킬, 헤테로시클로알킬, 시클로아릴, 또는 헤테로시클로아릴이고, 치환되지 않거나 R5로 치환되며, 또는 E 잔기를 보유하는 환형 구조의 일부이며;
v와 w는 각각 독립적으로 1-1000의 정수이고;
x, y와 z는 각각 독립적으로 0-10의 정수이고; u는 1-10의 정수이고; 그리고
n은 1-5의 정수이다.
한 가지 실례에서, R1과 R2 중에서 적어도 하나는 알킬이고, 치환되지 않거나 할로-로 치환된다. 다른 실례에서, R1과 R2 둘 모두 독립적으로 알킬이고, 치환되지 않거나 할로-로 치환된다. 일부 구체예에서, R1과 R2 중에서 적어도 하나는 메틸이다. 다른 구체예에서, R1과 R2는 메틸이다.
본 발명의 일부 구체예에서, x+y+z는 적어도 3이다. 본 발명의 다른 구체예에서, x+y+z는 3, 4, 5, 6, 7, 8, 9 또는 10이다. 본 발명의 거대고리 또는 거대고리 전구체 내에서 A, B, C, D 또는 E의 각 존재는 독립적으로 선택된다. 가령, 화학식 [A]x(x는 3)로 표시되는 서열은 아미노산이 동일하지 않은 구체예, 예를 들면, Gln-Asp-Ala, 그리고 아미노산이 동일한 구체예, 예를 들면, Gln-Gln-Gln을 포괄한다. 이는 지정된 범위 내에서 x, y, 또는 z의 임의의 값에 적용된다.
일부 구체예에서, 본 발명의 펩티드유사 거대고리는 α-나선이고, R8이 -H이며, 나선내 수소 결합을 가능하게 하는 이차 구조를 포함한다. 일부 구체예에서, A, B, C, D 또는 E 중에서 적어도 하나는 α,α-이중치환된 아미노산이다. 한 가지 실례에서, B는 α,α-이중치환된 아미노산이다. 가령, A, B, C, D 또는 E 중에서 적어도 하나는 2-아미노이소부티르산이다. 다른 구체예에서, A, B, C, D 또는 E 중에서 적어도 하나는 이다.
다른 구체예에서, 첫 번째 Cα와 두 번째 Cα 사이에서 측정되는, 거대고리-형성 링커 [-L1-S-L2-S-L3-]의 길이는 원하는 이차 펩티드 구조, 예를 들면, 첫 번째 Cα와 두 번째 Cα 사이에 것들이 포함되지만 이들에 국한되지 않는 펩티드유사 거대고리의 잔기에 의해 형성된 α-나선을 안정화시키도록 선택된다.
거대고리 또는 거대고리 전구체는 예로써, 액상(solution phase) 또는 고상(solid phase) 방법에 의해 합성되고, 그리고 자연-발생 아미노산과 비-자연-발생 아미노산을 둘 모두 내포할 수 있다. 예로써, Hunt, "The Non-Protein Amino Acids" in Chemistry and Biochemistry of the Amino Acids, edited by G.C. Barrett, Chapman and Hall, 1985를 참조한다. 일부 구체예에서, 티올 모이어티는 아미노산 잔기 L-시스테인, D-시스테인, α-메틸-L 시스테인, α-메틸-D-시스테인, L-호모시스테인, D-호모시스테인, α-메틸-L-호모시스테인 또는 α-메틸-D-호모시스테인의 측쇄이다. 비스-알킬화 시약은 일반식 X-L2-Y를 갖는데, 여기서 L2는 링커 모이어티이고, X와 Y는 L2와의 결합을 형성하기 위하여 -SH 모이어티에 의해 치환되는 이탈기(leaving group)이다. 일부 구체예에서, X와 Y는 할로겐, 예를 들면, I, Br, 또는 Cl이다.
다른 구체예에서, 화학식 I, II 또는 III의 화합물 내에서 D 및/또는 E는 세포 흡수(cellular uptake)를 촉진하기 위하여 더욱 변형된다. 일부 구체예에서, 펩티드유사 거대고리의 지질화(lipidating) 또는 PEG화(PEGylating)는 세포 흡수를 촉진하고, 생체이용효율(bioavailability)을 증가시키고, 혈액 순환(blood circulation)을 증가시키고, 약물동력학(pharmacokinetics)을 변화시키고, 면역원성(immunogenicity)을 감소시키고 및/또는 필요한 투여 빈도를 감소시킨다.
다른 구체예에서, 화학식 I, II 또는 III의 화합물 내에서 [D]와 [E] 중에서 적어도 하나는 펩티드유사 거대고리가 적어도 2개의 거대고리-형성 링커를 포함하도록 추가의 거대고리-형성 링커를 포함하는 모이어티를 나타낸다. 특정한 구체예에서, 펩티드유사 거대고리는 2개의 거대고리-형성 링커를 포함한다.
본 발명의 펩티드유사 거대고리에서, 본 명세서에 기술된 임의의 거대고리-형성 링커는 표 1-4에 도시된 임의의 서열, 그리고 본 명세서에 지시된 임의의 R- 치환기와 공동으로 이용될 수 있다.
일부 구체예에서, 펩티드유사 거대고리는 적어도 하나의 α-나선 모티프를 포함한다. 가령, 화학식 I, II 또는 III의 화합물 내에서 A, B 및/또는 C는 하나 이상의 α-나선을 포함한다. 일반적으로, α-나선은 회전(turn)당 3개 내지 4개의 아미노산 잔기를 포함한다. 일부 구체예에서, 펩티드유사 거대고리의 α-나선은 1회 내지 5회 회전을 포함하고, 그 결과로써, 3개 내지 20개의 아미노산 잔기를 포함한다. 특정한 구체예에서, α-나선은 1회 회전, 2회 회전, 3회 회전, 4회 회전, 또는 5회 회전을 포함한다. 일부 구체예에서, 거대고리-형성 링커는 펩티드유사 거대고리에 내포된 α-나선 모티프를 안정화시킨다. 따라서 일부 구체예에서, 첫 번째 Cα와 두 번째 Cα 사이에서 거대고리-형성 링커 L의 길이는 α-나선의 안정성이 증가하도록 선택된다. 일부 구체예에서, 거대고리-형성 링커는 α-나선의 1회 회전과 5회 회전 사이에 걸쳐진다. 일부 구체예에서, 거대고리-형성 링커는 α-나선의 대략 1회 회전, 2회 회전, 3회 회전, 4회 회전, 또는 5회 회전에 걸쳐있다. 일부 구체예에서, 거대고리-형성 링커의 길이는 α-나선의 회전당 대략 5 Å 내지 9 Å, 또는 α-나선의 회전당 대략 6 Å 내지 8 Å이다. 거대고리-형성 링커가 α-나선의 대략 1회 회전에 걸쳐있는 경우에, 길이는 대략 5개의 탄소-탄소 결합 내지 13개의 탄소-탄소 결합, 대략 7개의 탄소-탄소 결합 내지 11개의 탄소-탄소 결합, 또는 대략 9개의 탄소-탄소 결합에 필적한다. 거대고리-형성 링커가 α-나선의 대략 2회 회전에 걸쳐있는 경우에, 길이는 대략 8개의 탄소-탄소 결합 내지 16개의 탄소-탄소 결합, 대략 10개의 탄소-탄소 결합 내지 14개의 탄소-탄소 결합, 또는 대략 12개의 탄소-탄소 결합에 필적한다. 거대고리-형성 링커가 α-나선의 대략 3회 회전에 걸쳐있는 경우에, 길이는 대략 14개의 탄소-탄소 결합 내지 22개의 탄소-탄소 결합, 대략 16개의 탄소-탄소 결합 내지 20개의 탄소-탄소 결합, 또는 대략 18개의 탄소-탄소 결합에 필적한다. 거대고리-형성 링커가 α-나선의 대략 4회 회전에 걸쳐있는 경우에, 길이는 대략 20개의 탄소-탄소 결합 내지 28개의 탄소-탄소 결합, 대략 22개의 탄소-탄소 결합 내지 26개의 탄소-탄소 결합, 또는 대략 24개의 탄소-탄소 결합에 필적한다. 거대고리-형성 링커가 α-나선의 대략 5회 회전에 걸쳐있는 경우에, 길이는 대략 26개 탄소-탄소 결합 내지 34개의 탄소-탄소 결합, 대략 28개의 탄소-탄소 결합 내지 32개의 탄소-탄소 결합, 또는 대략 30개의 탄소-탄소 결합에 필적한다. 거대고리-형성 링커가 α-나선의 대략 1회 회전에 걸쳐있는 경우에, 이러한 연쇄(linkage)는 대략 4개의 원자 내지 12개의 원자, 대략 6개의 원자 내지 10개의 원자, 또는 대략 8개의 원자를 내포한다. 거대고리-형성 링커가 α-나선의 대략 2회 회전에 걸쳐있는 경우에, 이러한 연쇄는 대략 7개의 원자 내지 15개의 원자, 대략 9개의 원자 내지 13개의 원자, 또는 대략 11개의 원자를 내포한다. 거대고리-형성 링커가 α-나선의 대략 3회 회전에 걸쳐있는 경우에, 이러한 연쇄는 대략 13개의 원자 내지 21개의 원자, 대략 15개의 원자 내지 19개의 원자, 또는 대략 17개의 원자를 내포한다. 거대고리-형성 링커가 α-나선의 대략 4회 회전에 걸쳐있는 경우에, 이러한 연쇄는 대략 19개의 원자 내지 27개의 원자, 대략 21개의 원자 내지 25개의 원자, 또는 대략 23개의 원자를 내포한다. 거대고리-형성 링커가 α-나선의 대략 5회 회전에 걸쳐있는 경우에, 이러한 연쇄는 대략 25개의 원자 내지 33개의 원자, 대략 27개의 원자 내지 31개의 원자, 또는 대략 29개의 원자를 내포한다. 거대고리-형성 링커가 α-나선의 대략 1회 회전에 걸쳐있는 경우에, 결과의 거대고리는 대략 17개의 구성원 내지 25개의 구성원, 대략 19개의 구성원 내지 23개의 구성원, 또는 대략 21개의 구성원을 내포하는 고리를 형성한다. 거대고리-형성 링커가 α-나선의 대략 2회 회전에 걸쳐있는 경우에, 결과의 거대고리는 대략 29개의 구성원 내지 37개의 구성원, 대략 31개의 구성원 내지 35개의 구성원, 또는 대략 33개의 구성원을 내포하는 고리를 형성한다. 거대고리-형성 링커가 α-나선의 대략 3회 회전에 걸쳐있는 경우에, 결과의 거대고리는 대략 44개의 구성원 내지 52개의 구성원, 대략 46개의 구성원 내지 50개의 구성원, 또는 대략 48개의 구성원을 내포하는 고리를 형성한다. 거대고리-형성 링커가 α-나선의 대략 4회 회전에 걸쳐있는 경우에, 결과의 거대고리는 대략 59개의 구성원 내지 67개의 구성원, 대략 61개의 구성원 내지 65개의 구성원, 또는 대략 63개의 구성원을 내포하는 고리를 형성한다. 거대고리-형성 링커가 α-나선의 대략 5회 회전에 걸쳐있는 경우에, 결과의 거대고리는 대략 74개의 구성원 내지 82개의 구성원, 대략 76개의 구성원 내지 80개의 구성원, 또는 대략 78개의 구성원을 내포하는 고리를 형성한다.
다른 구체예에서, 본 발명에서는 화학식 (IV) 또는 (IVa)의 펩티드유사 거대고리를 제시한다:
[화학식 (IV)]
[화학식 (IVa)]
여기서:
A, C, D, 그리고 E는 각각 독립적으로 자연 또는 비-자연 아미노산이고;
R1과 R2는 독립적으로 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 시클로알킬알킬, 헤테로알킬, 또는 헤테로시클로알킬이고, 치환되지 않거나 할로-로 치환되며, 또는 E 잔기를 보유하는 환형 구조의 일부이며;
R3은 수소, 알킬, 알케닐, 알키닐, 아릴알킬, 헤테로알킬, 시클로알킬, 헤테로시클로알킬, 시클로알킬알킬, 시클로아릴, 또는 헤테로시클로아릴이고, R5로 선택적으로 치환되며;
L은 화학식 -L1-L2-의 거대고리-형성 링커이고;
L1과 L2는 독립적으로 알킬렌, 알케닐렌, 알키닐렌, 헤테로알킬렌, 시클로알킬렌, 헤테로시클로알킬렌, 시클로아릴렌, 헤테로시클로아릴렌, 또는 [R4-K-R4]n이고, 각각 R5로 선택적으로 치환되며;
R4는 각각 알킬렌, 알케닐렌, 알키닐렌, 헤테로알킬렌, 시클로알킬렌, 헤테로시클로알킬렌, 아릴렌, 또는 헤테로아릴렌이고;
K는 각각 O, S, SO, SO2, CO, CO2, 또는 CONR3이고;
R5는 각각 독립적으로 할로겐, 알킬, -OR6, -N(R6)2, -SR6, -SOR6, -SO2R6, -CO2R6, 형광 모이어티, 방사성동위원소 또는 치료제이고;
R6은 각각 독립적으로 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬알킬, 헤테로시클로알킬, 형광 모이어티, 방사성동위원소 또는 치료제이고;
R7은 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 헤테로알킬, 시클로알킬알킬, 헤테로시클로알킬, 시클로아릴, 또는 헤테로시클로아릴이고, R5로 선택적으로 치환되며;
v는 1-1000의 정수이고;
w는 1-1000의 정수이고;
x는 0-10의 정수이고;
y는 0-10의 정수이고;
z는 0-10의 정수이고; 그리고
n은 1-5의 정수이다.
한 가지 실례에서, R1과 R2 중에서 적어도 하나는 알킬이고, 치환되지 않거나 할로-로 치환된다. 다른 실례에서, R1과 R2 둘 모두 독립적으로 알킬이고, 치환되지 않거나 할로-로 치환된다. 일부 구체예에서, R1과 R2 중에서 적어도 하나는 메틸이다. 다른 구체예에서, R1과 R2는 메틸이다.
본 발명의 일부 구체예에서, x+y+z는 적어도 3이다. 본 발명의 다른 구체예에서, x+y+z는 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10이다. 본 발명의 거대고리 또는 거대고리 전구체 내에서 A, B, C, D 또는 E의 각 존재는 독립적으로 선택된다. 가령, 화학식 [A]x(x는 3)로 표시되는 서열은 아미노산이 동일하지 않은 구체예, 예를 들면, Gln-Asp-Ala, 그리고 아미노산이 동일한 구체예, 예를 들면, Gln-Gln-Gln을 포괄한다. 이는 지정된 범위 내에서 x, y, 또는 z의 임의의 값에 적용된다.
일부 구체예에서, 본 발명의 펩티드유사 거대고리는 α-나선이고, R8이 -H이며, 나선내 수소 결합을 가능하게 하는 이차 구조를 포함한다. 일부 구체예에서, A, B, C, D 또는 E 중에서 적어도 하나는 α,α-이중치환된 아미노산이다. 한 가지 실례에서, B는 α,α-이중치환된 아미노산이다. 가령, A, B, C, D 또는 E 중에서 적어도 하나는 2-아미노이소부티르산이다. 다른 구체예에서, A, B, C, D 또는 E 중에서 적어도 하나는 이다.
다른 구체예에서, 첫 번째 Cα와 두 번째 Cα 사이에서 측정되는, 거대고리-형성 링커 L의 길이는 원하는 이차 펩티드 구조, 예를 들면, 첫 번째 Cα와 두 번째 Cα 사이에 것들이 포함되지만 이들에 국한되지 않는 펩티드유사 거대고리의 잔기에 의해 형성된 α-나선을 안정화시키도록 선택된다.
거대고리-형성 링커 L의 예시적인 구체예는 하기에 도시된다.
펩티드유사
거대고리의 제조
본 발명의 펩티드유사 거대고리는 당분야에 공지된 다양한 방법에 의해 제조될 수 있다. 가령, 표 1, 2, 3 또는 4에서 “X”로 표시된 임의의 잔기는 이런 잔기의 동일한 분자 또는 전구체 내에서 두 번째 잔기와 가교를 형성할 수 있는 잔기로 치환될 수 있다.
펩티드유사 거대고리의 형성을 달성하는 다양한 방법이 당분야에 공지되어 있다. 가령, 화학식 I의 펩티드유사 거대고리의 제조는 Schafmeister et al., J. Am. Chem. Soc. 122:5891-5892 (2000); Schafmeister & Verdine, J. Am. Chem. Soc. 122:5891 (2005); Walensky et al., Science 305:1466-1470 (2004); 그리고 US Patent No. 7,192,713에서 기술된다. α,α-이중치환된 아미노산 및 인용된 참고문헌에서 개시된 아미노산 전구체는 펩티드유사 거대고리 전구체 폴리펩티드의 합성에 이용될 수 있다. 전구체 폴리펩티드 내로 이들 아미노산의 통합 이후에, 말단 올레핀은 복분해 촉매와 반응되고, 펩티드유사 거대고리의 형성으로 이어진다.
다른 구체예에서, 본 발명의 펩티드유사 거대고리는 화학식 IV 또는 IVa를 보유한다. 이런 거대고리의 제조 방법은 예로써, US 특허 7,202,332에서 기술된다.
일부 구체예에서, 이들 펩티드유사 거대고리의 합성은 아지드 모이어티와 알킨 모이어티를 내포하는 펩티드유사 전구체의 합성; 그 이후에, 트리아졸-연결된 펩티드유사 거대고리를 산출하기 위한 거대고리화 시약과 펩티드유사 전구체의 접촉을 특징으로 하는 다단계 과정을 수반한다. 거대고리 또는 거대고리 전구체는 예로써, 액상 또는 고상 방법에 의해 합성되고, 자연-발생 아미노산과 비-자연-발생 아미노산을 둘 모두 내포할 수 있다. 예로써, Hunt, "The Non-Protein Amino Acids" in Chemistry and Biochemistry of the Amino Acids, edited by G.C. Barrett, Chapman and Hall, 1985를 참조한다.
일부 구체예에서, 아지드는 잔기의 α-탄소에 연결되고, 알킨은 다른 잔기의 α-탄소에 부착된다. 일부 구체예에서, 아지드 모이어티는 아미노산 L-리신, D-리신, 알파-메틸-L-리신, 알파-메틸-D-리신, L-오르니틴, D-오르니틴, 알파-메틸-L-오르니틴 또는 알파-메틸-D-오르니틴의 아지도-유사체이다. 다른 구체예에서, 알킨 모이어티는 L-프로파르길글리신이다. 또 다른 구체예에서, 알킨 모이어티는 L-프로파르길글리신, D-프로파르길글리신, (S)-2-아미노-2-메틸-4-펜틴산(pentynoic acid), (R)-2-아미노-2-메틸-4-펜틴산, (S)-2-아미노-2-메틸-5-헥신산(hexynoic acid), (R)-2-아미노-2-메틸-5-헥신산, (S)-2-아미노-2-메틸-6-헵틴산(heptynoic acid), (R)-2-아미노-2-메틸-6-헵틴산, (S)-2-아미노-2-메틸-7-옥틴산(octynoic acid), (R)-2-아미노-2-메틸-7-옥틴산, (S)-2-아미노-2-메틸-8-노닌산(nonynoic acid) 및 (R)-2-아미노-2-메틸-8-노닌산으로 구성된 군에서 선택되는 아미노산이다.
일부 구체예에서, 본 발명에서는 펩티드유사 거대고리를 합성하는 방법을 제시하는데, 상기 방법은 화학식 V 또는 화학식 VI의 펩티드유사 전구체를 거대고리화 시약과 접촉시키는 단계를 포함하고:
[화학식 V]
[화학식 VI]
여기서 v, w, x, y, z, A, B, C, D, E, R1, R2, R7, R8, L1과 L2는 화학식 (II)에서 정의된 바와 같고; R12는 거대고리화 시약은 Cu 시약일 때 -H이고, R12는 거대고리화 시약이 Ru 시약일 때 -H 또는 알킬이고; 그리고 게다가, 상기 접촉 단계는 화학식 III 또는 화학식 IV에서 알킨과 아지드 모이어티 사이에 형성되는 공유 결합을 산출한다. 가령, R12는 거대고리화 시약이 Ru 시약일 때 메틸일 수 있다.
본 발명의 펩티드유사 거대고리에서, R1과 R2 중에서 적어도 하나는 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 시클로알킬알킬, 헤테로알킬, 또는 헤테로시클로알킬이고, 치환되지 않거나 할로-로 치환된다. 일부 구체예에서, R1과 R2 둘 모두 독립적으로 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 시클로알킬알킬, 헤테로알킬, 또는 헤테로시클로알킬이고, 치환되지 않거나 할로-로 치환된다. 일부 구체예에서, A, B, C, D 또는 E 중에서 적어도 하나는 α,α-이중치환된 아미노산이다. 한 가지 실례에서, B는 α,α-이중치환된 아미노산이다. 가령, A, B, C, D 또는 E 중에서 적어도 하나는 2-아미노이소부티르산이다.
가령, R1과 R2 중에서 적어도 하나는 알킬이고, 치환되지 않거나 할로-로 치환된다. 다른 실례에서, R1과 R2 둘 모두 독립적으로 알킬이고, 치환되지 않거나 할로-로 치환된다. 일부 구체예에서, R1과 R2 중에서 적어도 하나는 메틸이다. 다른 구체예에서, R1과 R2는 메틸이다. 거대고리화 시약은 Cu 시약 또는 Ru 시약일 수 있다.
일부 구체예에서, 펩티드유사 전구체는 접촉 단계 이전에 정제된다. 다른 구체예에서, 펩티드유사 거대고리는 접촉 단계 이후에 정제된다. 또 다른 구체예에서, 펩티드유사 거대고리는 접촉 단계 이후에 재접힘(refolding)된다. 상기 방법은 용액에서 수행되거나, 또는 대안으로, 상기 방법은 고형 서포트(solid support)에서 수행될 수 있다.
또한, 펩티드유사 전구체 또는 펩티드유사 거대고리에 결합하는 표적 거대분자의 존재에서, 상기 결합에 우호적인 조건 하에 본 발명의 방법을 수행하는 것이 고려된다. 일부 구체예에서, 상기 방법은 펩티드유사 전구체 또는 펩티드유사 거대고리에 우선적으로 결합하는 표적 거대분자의 존재에서, 상기 결합에 우호적인 조건 하에 수행된다. 상기 방법은 또한, 펩티드유사 거대고리의 라이브러리를 합성하는데 적용될 수 있다.
일부 구체예에서, 화학식 V 또는 화학식 VI의 펩티드유사 전구체의 알킨 모이어티는 L-프로파르길글리신, D-프로파르길글리신, (S)-2-아미노-2-메틸-4-펜틴산, (R)-2-아미노-2-메틸-4-펜틴산, (S)-2-아미노-2-메틸-5-헥신산, (R)-2-아미노-2-메틸-5-헥신산, (S)-2-아미노-2-메틸-6-헵틴산, (R)-2-아미노-2-메틸-6-헵틴산, (S)-2-아미노-2-메틸-7-옥틴산, (R)-2-아미노-2-메틸-7-옥틴산, (S)-2-아미노-2-메틸-8-노닌산, 그리고 (R)-2-아미노-2-메틸-8-노닌산으로 구성된 군에서 선택되는 아미노산의 측쇄(side chain)이다. 다른 구체예에서, 화학식 V 또는 화학식 VI의 펩티드유사 전구체의 아지드 모이어티는 ε-아지도-L-리신, ε-아지도-D-리신,ε-아지도-α-메틸-L-리신, ε-아지도-α-메틸-D-리신, δ-아지도-α-메틸-L-오르니틴, 그리고 δ-아지도-α-메틸-D-오르니틴으로 구성된 군에서 선택되는 아미노산의 측쇄이다.
일부 구체예에서, x+y+z는 3이고, 그리고 A, B와 C는 독립적으로 자연 또는 비-자연 아미노산이다. 다른 구체예에서, x+y+z는 6이고, 그리고 A, B와 C는 독립적으로 자연 또는 비-자연 아미노산이다.
본 발명의 펩티드유사 거대고리의 일부 구체예에서, [D]v 및/또는 [E]w는 추가적인 펩티드유사 거대고리 또는 거대환형 구조를 포함한다. 가령, [D]v 는 아래의 화학식을 보유한다:
또는
여기서 A, C, D’, 그리고 E’는 각각 독립적으로 자연 또는 비-자연 아미노산이고;
R1과 R2는 독립적으로 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 시클로알킬알킬, 헤테로알킬, 또는 헤테로시클로알킬이고, 치환되지 않거나 할로-로 치환되며, 또는 E 잔기를 보유하는 환형 구조의 일부이며;
R3은 수소, 알킬, 알케닐, 알키닐, 아릴알킬, 헤테로알킬, 시클로알킬, 헤테로시클로알킬, 시클로알킬알킬, 시클로아릴, 또는 헤테로시클로아릴이고, R5로 선택적으로 치환되며;
L1과 L2는 독립적으로 알킬렌, 알케닐렌, 알키닐렌, 헤테로알킬렌, 시클로알킬렌, 헤테로시클로알킬렌, 시클로아릴렌, 헤테로시클로아릴렌, 또는 [R4-K-R4]n이고, 각각 R5로 선택적으로 치환되며;
R4는 각각 알킬렌, 알케닐렌, 알키닐렌, 헤테로알킬렌, 시클로알킬렌, 헤테로시클로알킬렌, 아릴렌, 또는 헤테로아릴렌이고;
K는 각각 O, S, SO, SO2, CO, CO2, 또는 CONR3이고;
R5는 각각 독립적으로 할로겐, 알킬, -OR6, -N(R6)2, -SR6, -SOR6, -SO2R6, -CO2R6, 형광 모이어티, 방사성동위원소 또는 치료제이고;
R6은 각각 독립적으로 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬알킬, 헤테로시클로알킬, 형광 모이어티, 방사성동위원소 또는 치료제이고;
R7은 -H, 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬, 헤테로알킬, 시클로알킬알킬, 헤테로시클로알킬, 시클로아릴, 또는 헤테로시클로아릴이고, R5로 선택적으로 치환되며;
v는 1-1000의 정수이고;
w는 1-1000의 정수이고; 그리고
x는 0-10의 정수이다.
다른 구체예에서, [E]w는 아래의 화학식을 보유한다:
여기서 치환기들은 앞선 단락에서 정의된 바와 동일하다.
일부 구체예에서, 접촉 단계는 양성자성 용매, 수성 용매, 유기 용매, 그리고 이들의 혼합물로 구성된 군에서 선택되는 용매에서 수행된다. 가령, 용매는 H2O, THF, THF/H2O, tBuOH/H2O, DMF, DIPEA, CH3CN 또는 CH2Cl2, ClCH2CH2Cl 또는 이들의 혼합물로 구성된 군에서 선택될 수 있다. 용매는 나선 형성에 우호적인 용매일 수 있다.
대안적이지만 동등한 보호기, 이탈기 또는 시약은 치환되고, 그리고 일정한 합성 단계는 원하는 화합물을 생산하기 위하여 대안적 순서 또는 차례로 수행된다. 본 명세서에 기술된 화합물을 합성하는데 유용한 합성 화학 변형 및 보호기 방법(보호와 탈보호)에는 예로써, Larock, Comprehensive Organic Transformations, VCH Publishers (1989); Greene and Wuts, Protective Groups in Organic Synthesis, 2d. Ed., John Wiley and Sons (1991); Fieser and Fieser, Fieser and Fieser's Reagents for Organic Synthesis, John Wiley and Sons (1994); 그리고 Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995), 그리고 이들의 후속 판(版)에서 기술된 것들이 포함된다.
본 발명의 펩티드유사 거대고리는 예로써, Fields et al., Chapter 3 in Synthetic Peptides: A User's Guide, ed. Grant, W. H. Freeman & Co., New York, N. Y., 1992, p. 77에서 기술된 화학 합성 방법에 의해 만들어진다. 따라서 펩티드는 예로써, 자동화 펩티드 합성장치(가령, Applied Biosystems (Foster City, CA), Model 430A, 431, 또는 433) 상에서, 측쇄 보호된 아미노산을 이용한 tBoc 또는 Fmoc 화학에 의해 보호된 아민으로 고상 합성의 자동화 Merrifield 기술을 이용하여 합성된다.
본 명세서에서 기술된 펩티드유사 전구체와 펩티드유사 거대고리를 생산하는 한 가지 방식은 고상 펩티드 합성(SPPS)을 이용한다. C-말단 아미노산은 링커 분자와의 산 불안정성 결합을 통해, 가교된 폴리스티렌 수지에 부착된다. 이러한 수지는 합성에 이용되는 용매에서 불용성이기 때문에, 과량의 시약과 부산물을 씻어내는 것이 상대적으로 간단하고 신속하다. N-말단은 산에서 안정하지만 염기에 의해 제거될 수 있는 Fmoc 기로 보호된다. 측쇄 기능기는 필요에 따라, 염기 안정성, 산 불안정성 기로 보호된다.
더욱 긴 펩티드유사 전구체는 예로써, 고유 화학 결찰을 이용하여 개별 합성 펩티드를 결합시킴으로써 생산된다. 대안으로, 더욱 긴 합성 펩티드는 널리 공지된 재조합 DNA와 단백질 발현 기술에 의해 생합성된다. 이런 기술은 상세한 프로토콜이 기재된 널리-공지된 표준 매뉴얼로 제공된다. 본 발명의 펩티드유사 전구체를 인코딩하는 유전자를 작제하기 위하여, 아미노산 서열은 상기 아미노산 서열을 인코딩하는 핵산 서열, 바람직하게는 상기 유전자가 발현되는 생물체에 최적인 코돈(codon)을 보유하는 핵산 서열을 수득하기 위하여 역으로 번역된다. 그 다음, 전형적으로 상기 펩티드 및 필요한 경우에, 임의의 조절 요소(regulatory element)를 인코딩하는 올리고뉴클레오티드를 합성함으로써 합성 유전자가 만들어진다. 상기 합성 유전자는 적절한 클로닝 벡터(cloning vector)에 삽입되고 숙주 세포 내로 형질감염(transfection)된다. 상기 펩티드는 이후, 선택된 발현 시스템과 숙주에 적합한 조건 하에 발현된다. 상기 펩티드는 정제되고 표준 방법에 의해 특성화된다.
이들 펩티드유사 전구체는 예로써, 고성능 다중채널 조합 합성장치(high-throughput polychannel combinatorial synthesizer)(가령, Thuramed TETRAS 다중채널 펩티드 합성장치(CreoSalus, Louisville, KY) 또는 Model Apex 396 다중채널 펩티드 합성장치(AAPPTEC, Inc., Louisville, KY))를 이용한 고속 조합 방식(high-throughput, combinatorial fashion)으로 만들어진다.
아래의 합성 반응식은 본 발명을 예시하는 목적으로만 제공되고, 본 명세서에 기술된 바와 같은 본 발명의 범위를 제한하는 것으로 의도되지 않는다. 이들 제도(製圖)를 단순화시키기 위하여, 예시적인 반응식에서는 아지도 아미노산 유사체 ε-아지도-α-메틸-L-리신 및 ε-아지도-α-메틸-D-리신, 그리고 알킨 아미노산 유사체 L-프로파르길글리신, (S)-2-아미노-2-메틸-4-펜틴산, 그리고 (S)-2-아미노-2-메틸-6-헵틴산을 묘사한다. 따라서 아래의 합성 반응식에서, R1, R2, R7과 R8은 각각 -H이고; L1은 각각 -(CH2)4-이고; 그리고 L2는 각각 -(CH2)-이다. 하지만, 상기 상세한 설명 전반에서 기재된 바와 같이, R1, R2, R7, R8, L1과 L2가 본 명세서에서 개시된 다양한 구조에서 독립적으로 선택될 수 있는 많은 다른 아미노산 유사체가 이용될 수 있다.
합성 반응식 1:
합성 반응식 1에서는 여러 본 발명의 화합물의 제조를 기술한다. 키랄 보조 (S)-2-[N-(N’-벤질프롤릴)아미노]벤조페논(BPB)으로부터 유래된 Schiff 염기 및 아미노산, 예를 들면, 글리신 또는 알라닌의 Ni(II) 복합체는 Belokon et al . (1998), Tetrahedron Asymm . 9:4249-4252에서 기술된 바와 같이 제조된다. 이들 생성된 복합체는 차후에, 아지도 또는 알키닐 모이어티를 포함하는 알킬화 시약과 반응되어 본 발명의 거울상이성질에서 농축된 화합물을 산출한다. 원하는 경우에, 이들 생성된 화합물은 펩티드 합성에서 이용을 위하여 보호될 수 있다.
합성 반응식 2:
합성 반응식 2에 도시된 펩티드유사 거대고리의 합성을 위한 일반적인 방법에서, 펩티드유사 전구체는 아지드 모이어티와 알킨 모이어티를 내포하고, 상업적으로 가용한 아미노산 N-α-Fmoc-L-프로파르길글리신 및 아미노산 (S)-2-아미노-2-메틸-4-펜틴산, (S)-2-아미노-6-헵틴산, (S)-2-아미노-2-메틸-6-헵틴산, N-메틸-ε-아지도-L-리신, 그리고 N-메틸-ε-아지도-D-리신의 N-α-Fmoc-보호된 형태를 이용한 액상 또는 고상 펩티드 합성(SPPS)에 의해 합성된다. 펩티드유사 전구체는 이후, 탈보호되고 표준 조건(가령, 강산, 예를 들면, 95% TFA)에 의해 고상 수지로부터 절단된다. 펩티드유사 전구체는 가공되지 않은 혼합물로서 반응되거나, 또는 유기 또는 수성 용액에서 거대고리화 시약, 예를 들면, Cu(I)와의 반응에 앞서 정제된다(Rostovtsev et al . (2002), Angew . Chem . Int . Ed . 41:2596-2599; Tornoe et al . (2002), J. Org . Chem . 67:3057-3064; Deiters et al . (2003), J. Am . Chem . Soc . 125:11782-11783; Punna et al . (2005), Angew . Chem . Int . Ed . 44:2215-2220). 한 구체예에서, 트리아졸 형성 반응은 α-나선 형성에 우호적인 조건 하에 수행된다. 한 구체예에서, 거대고리화 단계는 H2O, THF, CH3CN, DMF , DIPEA, tBuOH 또는 이들의 혼합물로 구성된 군에서 선택되는 용매에서 수행된다. 다른 구체예에서, 거대고리화 단계는 DMF에서 수행된다. 일부 구체예에서, 거대고리화 단계는 완충된 수성 또는 부분적으로 수성 용매에서 수행된다.
합성 반응식 3:
합성 반응식 3에 도시된 펩티드유사 거대고리의 합성을 위한 일반적인 방법에서, 펩티드유사 전구체는 아지드 모이어티와 알킨 모이어티를 내포하고, 상업적으로 가용한 아미노산 N-α-Fmoc-L-프로파르길글리신 및 아미노산 (S)-2-아미노-2-메틸-4-펜틴산, (S)-2-아미노-6-헵틴산, (S)-2-아미노-2-메틸-6-헵틴산, N-메틸-ε-아지도-L-리신, 그리고 N-메틸-ε-아지도-D-리신의 N-α-Fmoc-보호된 형태를 이용한 고상 펩티드 합성(SPPS)에 의해 합성된다. 펩티드유사 전구체는 수지 상에서 가공되지 않은 혼합물로서, 거대고리화 시약, 예를 들면, Cu(I) 시약과 반응된다(Rostovtsev et al . (2002), Angew . Chem . Int . Ed . 41:2596-2599; Tornoe et al . (2002), J. Org . Chem . 67:3057-3064; Deiters et al . (2003), J. Am . Chem . Soc . 125:11782-11783; Punna et al . (2005), Angew . Chem . Int . Ed . 44:2215-2220). 생성된 트리아졸-내포 펩티드유사 거대고리는 이후, 탈보호되고 표준 조건(가령, 강산, 예를 들면, 95% TFA)에 의해 고상 수지로부터 절단된다. 일부 구체예에서, 거대고리화 단계는 CH2Cl2, ClCH2CH2Cl, DMF, THF, NMP, DIPEA, 2,6-루티딘, 피리딘, DMSO, H2O 또는 이들의 혼합물로 구성된 군에서 선택되는 용매에서 수행된다. 일부 구체예에서, 거대고리화 단계는 완충된 수성 또는 부분적으로 수성 용매에서 수행된다.
합성 반응식 4:
합성 반응식 4에 도시된 펩티드유사 거대고리의 합성을 위한 일반적인 방법에서, 펩티드유사 전구체는 아지드 모이어티와 알킨 모이어티를 내포하고, 상업적으로 가용한 아미노산 N-α-Fmoc-L-프로파르길글리신 및 아미노산 (S)-2-아미노-2-메틸-4-펜틴산, (S)-2-아미노-6-헵틴산, (S)-2-아미노-2-메틸-6-헵틴산, N-메틸-ε-아지도-L-리신, 그리고 N-메틸-ε-아지도-D-리신의 N-α-Fmoc-보호된 형태를 이용한 액상 또는 고상 펩티드 합성(SPPS)에 의해 합성된다. 펩티드유사 전구체는 이후, 탈보호되고 표준 조건(가령, 강산, 예를 들면, 95% TFA)에 의해 고상 수지로부터 절단된다. 펩티드유사 전구체는 가공되지 않은 혼합물로서 반응되거나, 또는 거대고리화 시약, 예를 들면, Cp*RuCl(PPh3)2 또는 [Cp*RuCl]4와 같은 Ru(II) 시약과의 반응에 앞서 정제된다(Rasmussen et al . (2007), Org . Lett . 9:5337-5339; Zhang et al . (2005), J. Am . Chem. Soc . 127:15998-15999). 일부 구체예에서, 거대고리화 단계는 DMF, CH3CN과 THF로 구성된 군에서 선택되는 용매에서 수행된다.
합성 반응식 5:
합성 반응식 5에 도시된 펩티드유사 거대고리의 합성을 위한 일반적인 방법에서, 펩티드유사 전구체는 아지드 모이어티와 알킨 모이어티를 내포하고, 상업적으로 가용한 아미노산 N-α-Fmoc-L-프로파르길글리신 및 아미노산 (S)-2-아미노-2-메틸-4-펜틴산, (S)-2-아미노-6-헵틴산, (S)-2-아미노-2-메틸-6-헵틴산, N-메틸-ε-아지도-L-리신, 그리고 N-메틸-ε-아지도-D-리신의 N-α-Fmoc-보호된 형태를 이용한 고상 펩티드 합성(SPPS)에 의해 합성된다. 펩티드유사 전구체는 수지 상에서 가공되지 않은 혼합물로서, 거대고리화 시약, 예를 들면, Ru(II) 시약과 반응된다. 가령, 시약은 Cp*RuCl(PPh3)2 또는 [Cp*RuCl]4일 수 있다(Rasmussen et al . (2007), Org . Lett. 9:5337-5339; Zhang et al . (2005), J. Am . Chem . Soc . 127:15998-15999). 일부 구체예에서, 거대고리화 단계는 CH2Cl2, ClCH2CH2Cl, CH3CN, DMF, 그리고 THF로 구성된 군에서 선택되는 용매에서 수행된다.
여러 예시적인 펩티드유사 거대고리는 표 5에 도시된다. “Nle”은 노르류신을 나타내고, 메티오닌 잔기를 대체한다. 표 1 내지 표 4에 개시된 폴리펩티드 서열에 기초된 펩티드유사 거대고리를 합성하는데 유사한 링커가 이용되는 것으로 생각된다.
표 5에서는 본 발명의 예시적인 펩티드유사 거대고리를 도시한다. “Nle”은 노르류신을 나타낸다.
본 발명에서는 본 명세서에 기술된 펩티드유사 거대고리의 합성에서 비-자연-발생 아미노산과 아미노산 유사체의 이용을 고려한다. 안정적인 트리아졸-내포 펩티드유사 거대고리의 합성을 위한 합성 방법에 이용될 수 있는 임의의 아미노산 또는 아미노산 유사체가 본 발명에 이용될 수 있다. 가령, L-프로파르길글리신이 본 발명에서 유용한 아미노산으로서 고려된다. 하지만, 상이한 아미노산 측쇄를 내포하는 다른 알킨-내포 아미노산 역시 본 발명에 유용하다. 가령, L-프로파르길글리신은 상기 아미노산의 α-탄소 및 아미노산 측쇄의 알킨 사이에 하나의 메틸렌 단위를 내포한다. 본 발명에서는 또한, α-탄소 및 알킨 사이에 다중 메틸렌 단위를 보유하는 아미노산의 이용을 고려한다. 또한, 아미노산 L-리신, D-리신, 알파-메틸-L-리신, 그리고 알파-메틸-D-리신의 아지도-유사체가 본 발명에서 유용한 아미노산으로서 고려된다. 하지만, 상이한 아미노산 측쇄를 내포하는 다른 말단 아지드 아미노산 역시 본 발명에 유용하다. 가령, L-리신의 아지도-유사체는 상기 아미노산의 α-탄소 및 아미노산 측쇄의 말단 아지드 사이에 4개의 메틸렌 단위를 내포한다. 본 발명에서는 또한, α-탄소 및 말단 아지드 사이에 4개 미만 또는 4개 초과의 메틸렌 단위를 보유하는 아미노산의 이용을 고려한다. 표 6에서는 본 발명의 펩티드유사 거대고리의 제조에서 유용한 일부 아미노산을 도시한다.
표 6에서는 본 발명의 펩티드유사 거대고리의 제조에서 유용한 예시적인 아미노산을 도시한다.
일부 구체예에서, 아미노산과 아미노산 유사체는 D-배열(configuration)을 갖는다. 다른 구체예에서, 이들은 L-배열을 갖는다. 일부 구체예에서, 펩티드유사체에 내포된 아미노산과 아미노산 유사체 중에서 일부는 D-배열을 갖는 반면, 이들 아미노산과 아미노산 유사체 중에서 일부는 L-배열을 갖는다. 일부 구체예에서, 아미노산 유사체는 α,α-이중치환된다, 예를 들면, α-메틸-L-프로파르길글리신, α-메틸-D-프로파르길글리신, ε-아지도-알파-메틸-L-리신, 그리고 ε-아지도-알파-메틸-D-리신이다. 일부 구체예에서, 아미노산 유사체는 N-알킬화된다, 예를 들면, N-메틸-L-프로파르길글리신, N-메틸-D-프로파르길글리신, N-메틸-ε-아지도-L-리신, 그리고 N-메틸-ε-아지도-D-리신이다.
일부 구체예에서, 아미노산의 -NH 모이어티는 -Fmoc와 -Boc가 포함되지만 이들에 국한되지 않는 보호기를 이용하여 보호된다. 다른 구체예에서, 아미노산은 펩티드유사 거대고리의 합성에 앞서 보호되지 않는다.
다른 구체예에서, 화학식 III의 펩티드유사 거대고리가 합성된다. 아래의 합성 반응식에서는 이런 화합물의 제조를 기술한다. 이들 제도(製圖)를 단순화시키기 위하여, 예시적인 반응식에서는 L- 또는 D-시스테인으로부터 유래된 아미노산 유사체를 묘사하는데, 여기서 L1과 L3은 둘 모두 -(CH2)-이다. 하지만, 상기 상세한 설명 전반에서 기재된 바와 같이, L1과 L3이 본 명세서에 개시된 다양한 구조에서 독립적으로 선택될 수 있는 많은 다른 아미노산 유사체가 이용될 수 있다. 기호 “[AA]m”, “[AA]n”, “[AA]o”는 아미드 결합-연결된 모이어티, 예를 들면, 자연 또는 비-자연 아미노산의 서열을 나타낸다. 앞서 기술된 바와 같이, “AA”의 각 존재는 “AA”의 임의의 다른 존재와 독립적이고, 그리고 “[AA]m”과 같은 화학식은 예로써, 비-동일한 아미노산의 서열, 그리고 동일한 아미노산의 서열을 포괄한다.
합성 반응식 6:
반응식 6에서, 펩티드유사 전구체는 2개의 -SH 모이어티를 내포하고, 상업적으로 가용한 N-α-Fmoc 아미노산, 예를 들면, N-α-Fmoc-S-트리틸-L-시스테인 또는 N-α-Fmoc-S-트리틸-D-시스테인을 이용한 고상 펩티드 합성(SPPS)에 의해 합성된다. D-시스테인 또는 L-시스테인의 알파-메틸화된 이형은 공지된 방법(Seebach et al. (1996), Angew . Chem . Int . Ed . Engl. 35:2708-2748, 그리고 여기에 인용된 참고문헌)에 의해 산출되고, 이후 공지된 방법("Bioorganic Chemistry: Peptides and Proteins", Oxford University Press, New York: 1998, 이의 전체 내용은 본 발명에 참조로서 편입됨)에 의해, 적절하게 보호된 N-α-Fmoc-S-트리틸 단량체로 전환된다. 펩티드유사 전구체는 이후, 탈보호되고 표준 조건(가령, 강산, 예를 들면, 95% TFA)에 의해 고상 수지로부터 절단된다. 펩티드유사 전구체는 가공되지 않은 혼합물로서 반응되거나, 또는 유기 또는 수성 용액에서 X-L2-Y와의 반응에 앞서 정제된다. 일부 구체예에서, 알킬화 반응은 거대고리화에 우호적이고 중합화(polymerization)를 피하는 희석 조건(즉, 0.15 mmol/ℓ) 하에 수행된다. 일부 구체예에서, 알킬화 반응은 유기 용액, 예를 들면, 액상 NH3(Mosberg et al. (1985), J. Am.Chem. Soc. 107:2986-2987; Szewczuk et al. (1992), Int. J. Peptide Protein Res. 40 :233-242), NH3/MeOH, 또는 NH3/DMF(Or et al. (1991), J. Org. Chem. 56:3146-3149)에서 수행된다. 다른 구체예에서, 알킬화는 수성 용액, 예를 들면, 6M 구아니디늄(guanidinium) HCL, pH 8에서 수행된다(Brunel et al. (2005), Chem. Commun. (20):2552-2554). 다른 구체예에서, 알킬화 반응에 이용되는 용매는 DMF 또는 디클로로에탄이다.
합성 반응식 7:
반응식 7에서, 펩티드유사 전구체는 2개 이상의 -SH 모이어티를 내포하는데, 이들 중에서 2개는 거대고리 형성을 위한 선별적 탈보호 및 차후 알킬화가 가능하도록 특수하게 보호된다. 펩티드유사 전구체는 상업적으로 가용한 N-α-Fmoc 아미노산, 예를 들면, N-α-Fmoc-S-p-메톡시트리틸-L-시스테인 또는 N-α-Fmoc-S-p-메톡시트리틸-D-시스테인을 이용한 고상 펩티드 합성(SPPS)에 의해 합성된다. D-시스테인 또는 L-시스테인의 알파-메틸화된 이형은 공지된 방법(Seebach et al. (1996), Angew . Chem . Int . Ed . Engl. 35:2708-2748, 그리고 여기에 인용된 참고문헌)에 의해 산출되고, 이후 공지된 방법("Bioorganic Chemistry : Peptides and Proteins", Oxford University Press, New York: 1998, 이의 전체 내용은 본 발명에 참조로서 편입됨)에 의해, 적절하게 보호된 N-α-Fmoc-S-p-메톡시트리틸 단량체로 전환된다. 이후, 펩티드유사 전구체의 Mmt 보호기는 표준 조건(가령, 약산, 예를 들면, DCM에서 1% TFA)에 의해 선별적으로 절단된다. 이후, 펩티드유사 전구체는 수지 상에서 유기 용액에서, X-L2-Y와 반응된다. 가령, 반응은 부자유 염기(hindered base), 예를 들면, 디이소프로필에틸아민의 존재에서 발생한다. 일부 구체예에서, 알킬화 반응은 유기 용액, 예를 들면, 액상 NH3(Mosberg et al. (1985), J. Am . Chem . Soc. 107:2986-2987; Szewczuk et al. (1992), Int . J. Peptide Protein Res. 40:233-242), NH3/MeOH 또는 NH3/DMF(Or et al. (1991), J. Org . Chem. 56:3146-3149)에서 수행된다. 다른 구체예에서, 알킬화 반응은 DMF 또는 디클로로에탄에서 수행된다. 이후, 펩티드유사 거대고리는 탈보호되고, 표준 조건(가령, 강산, 예를 들면, 95% TFA)에 의해 고상 수지로부터 절단된다.
합성 반응식 8:
반응식 8에서, 펩티드유사 전구체는 2개 이상의 -SH 모이어티를 내포하는데, 이들 중에서 2개는 거대고리 형성을 위한 선별적 탈보호 및 차후 알킬화가 가능하도록 특수하게 보호된다. 펩티드유사 전구체는 상업적으로 가용한 N-α-Fmoc 아미노산, 예를 들면, N-α-Fmoc-S-p-메톡시트리틸-L-시스테인, N-α-Fmoc-S-p-메톡시트리틸-D-시스테인, N-α-Fmoc-S-S-t-부틸-L-시스테인, 그리고 N-α-Fmoc-S-S-t-부틸-D-시스테인을 이용한 고상 펩티드 합성(SPPS)에 의해 합성된다. D-시스테인 또는 L-시스테인의 알파-메틸화된 이형은 공지된 방법(Seebach et al. (1996), Angew. Chem . Int . Ed . Engl. 35:2708-2748, 그리고 여기에 인용된 참고문헌)에 의해 산출되고, 이후 공지된 방법("Bioorganic Chemistry : Peptides and Proteins", Oxford University Press, New York: 1998, 이의 전체 내용은 본 발명에 참조로서 편입됨)에 의해, 적절하게 보호된 N-α-Fmoc-S-p-메톡시트리틸 또는 N-α-Fmoc-S-S-t-부틸 단량체로 전환된다. 펩티드유사 전구체의 S-S-t부틸 보호기는 공지된 조건(가령, DMF에서 20% 2-메르캅토에탄올, 참고문헌: Galande et al. (2005), J. Comb . Chem. 7:174-177)에 의해 선별적으로 절단된다. 이후, 펩티드유사 전구체는 수지 상에서 유기 용액에서, 과잉 몰(molar excess)의 X-L2-Y와 반응된다. 가령, 반응은 부자유 염기(hindered base), 예를 들면, 디이소프로필에틸아민의 존재에서 발생한다. 이후, 펩티드유사 전구체의 Mmt 보호기는 표준 조건(가령, 약산, 예를 들면, DCM에서 1% TFA)에 의해 선별적으로 절단된다. 이후, 펩티드유사 전구체는 유기 용액에서 부자유 염기로 처리에 의해 수지 상에서 고리화된다. 일부 구체예에서, 알킬화 반응은 유기 용액, 예를 들면, NH3/MeOH 또는 NH3/DMF에서 수행된다(Or et al. (1991), J. Org . Chem. 56:3146-3149). 이후, 펩티드유사 거대고리는 탈보호되고, 표준 조건(가령, 강산, 예를 들면, 95% TFA)에 의해 고상 수지로부터 절단된다.
합성 반응식 9:
반응식 9에서, 펩티드유사 전구체는 2개의 L-시스테인 모이어티를 내포한다. 펩티드유사 전구체는 살아있는 세포 내에서 공지된 생물학적 발현 시스템에 의해, 또는 공지된 시험관내, 세포-없는, 발현 방법에 의해 합성된다. 펩티드유사 전구체는 가공되지 않은 혼합물로서 반응되거나, 또는 유기 또는 수성 용액에서 X-L2-Y와의 반응에 앞서 정제된다. 일부 구체예에서, 알킬화 반응은 거대고리화에 우호적이고 중합화(polymerization)를 피하는 희석 조건(즉, 0.15 mmol/ℓ) 하에 수행된다. 일부 구체예에서, 알킬화 반응은 유기 용액, 예를 들면, 액상 NH3(Mosberg et al. (1985), J. Am.Chem. Soc. 107:2986-2987; Szewczuk et al. (1992), Int. J. Peptide Protein Res. 40 :233-242), NH3/MeOH, 또는 NH3/DMF(Or et al. (1991), J. Org. Chem. 56:3146-3149)에서 수행된다. 다른 구체예에서, 알킬화는 수성 용액, 예를 들면, 6M 구아니디늄(guanidinium) HCL, pH 8에서 수행된다(Brunel et al. (2005), Chem. Commun. (20):2552-2554). 다른 구체예에서, 알킬화는 DMF 또는 디클로로에탄에서 수행된다. 다른 구체예에서, 알킬화는 비-변성 수성 용액에서 수행되고, 그리고 또 다른 구체예에서, 알킬화는 α-나선 구조 형성에 우호적인 조건 하에 수행된다. 또 다른 구체예에서, 알킬화는 이러한 알킬화 동안 결합된 α-나선 형태의 형성을 유도하기 위하여, 다른 단백질에 펩티드유사 전구체의 결합에 우호적인 조건 하에 수행된다.
티올 기와의 반응에 적합한, X와 Y에 대한 다양한 구체예가 계획된다. 일반적으로, X 또는 Y는 각각 독립적으로, 표 5에 도시된 포괄적인 범주로부터 선택된다. 가령, X와 Y는 할로겐화합물(halide), 예를 들면, -Cl, -Br 또는 -I이다. 본 명세서에 기술된 임의의 거대고리-형성 링커는 표 1-4에 도시된 임의의 서열, 그리고 본 명세서에 지시된 임의의 R- 치환기와 공동으로 이용될 수 있다.
| (1) X 또는 Y | (2) 결과적인 공유 연쇄 |
| (3) 아크릴아미드 | (4) 티오에테르 |
| (5) 할로겐화합물(가령, 알킬 또는 아릴 할로겐화합물) | (6) 티오에테르 |
| (7) 설포네이트 | (8) 티오에테르 |
| (9) 아지리딘 | (10) 티오에테르 |
| (11) 에폭시드 | (12) 티오에테르 |
| (13) 할로아세트아미드 | (14) 티오에테르 |
| (15) 말레이미드 | (16) 티오에테르 |
| (17) 설포네이트 에스테르 | (18) 티오에테르 |
표 8에서는 본 발명의 예시적인 거대고리를 도시한다. “NL”은 노르류신을 나타내고, 메티오닌 잔기를 대체한다. 표 1 내지 표 4에 개시된 폴리펩티드 서열에 기초된 펩티드유사 거대고리를 합성하는데 유사한 링커가 이용되는 것으로 생각된다.
상기 표에서 도시된 실례에서, “NL”은 노르류신을 나타낸다.
본 발명에서는 화학식 (III)의 펩티드유사 거대고리의 합성에서 자연-발생과 비-자연-발생 아미노산과 아미노산 유사체 둘 모두의 이용을 고려한다. 안정한 비스-설피드릴 내포 펩티드유사 거대고리의 합성을 위한 합성 방법에 이용되는 임의의 아미노산 또는 아미노산 유사체가 본 발명에 이용될 수 있다. 가령, 시스테인이 본 발명에서 유용한 아미노산으로서 고려된다. 하지만, 시스테인 이외에, 상이한 아미노산 측쇄를 내포하는 황-내포 아미노산 역시 유용하다. 가령, 시스테인은 상기 아미노산의 α-탄소 및 아미노산 측쇄의 말단 -SH 사이에 하나의 메틸렌 단위를 내포한다. 본 발명에서는 또한, α-탄소 및 말단 -SH 사이에 다중 메틸렌 단위를 보유하는 아미노산의 이용을 고려한다. 무제한적 실례에는 α-메틸-L-호모시스테인과 α-메틸-D-호모시스테인이 포함된다. 일부 구체예에서, 아미노산과 아미노산 유사체는 D-배열(configuration)을 갖는다. 다른 구체예에서, 이들은 L-배열을 갖는다. 일부 구체예에서, 펩티드유사체에 내포된 아미노산과 아미노산 유사체 중에서 일부는 D-배열을 갖는 반면, 이들 아미노산과 아미노산 유사체 중에서 일부는 L-배열을 갖는다. 일부 구체예에서, 아미노산 유사체는 α,α-이중치환된다, 예를 들면, α-메틸-L-시스테인과 α-메틸-D-시스테인이다.
본 발명에는 본 발명의 펩티드유사 거대고리를 형성하기 위하여 펩티드유사 전구체 내에서 2개 이상의 -SH 모이어티를 연결하는데 거대고리-형성 링커가 이용되는 거대고리가 포함된다. 앞서 기술된 바와 같이, 거대고리-형성 링커는 형태 강직(conformational rigidity), 증가된 대사 안정성 및/또는 증가된 세포 침투성을 부여한다. 게다가, 일부 구체예에서, 이들 거대고리-형성 연쇄는 펩티드유사 거대고리의 α-나선 이차 구조를 안정화시킨다. 거대고리-형성 링커는 화학식 X-L2-Y를 보유하는데, 여기서 X와 Y 둘 모두, 앞서 정의된 바와 같은 동일하거나 상이한 모이어티이다. X와 Y 둘 모두, 하나의 거대고리-형성 링커 -L2-가 비스-설피드릴 내포 펩티드유사 전구체를 비스 알킬화시킬 수 있도록 하는 화학적 특징을 갖는다. 앞서 정의된 바와 같이, 링커 -L2-에는 알킬렌, 알케닐렌, 알키닐렌, 헤테로알킬렌, 시클로알킬렌, 헤테로시클로알킬렌, 시클로아릴렌, 또는 헤테로시클로아릴렌, 또는 -R4-K-R4-가 포함되는데, 이들 모두 앞서 정의된 바와 같이 R5 기로 선택적으로 치환될 수 있다. 게다가, 설피드릴 내포 아미노산의 -SH에 부착된 탄소를 제외하고, 거대고리-형성 링커s -L2- 내에서 1개 내지 3개의 탄소 원자가 헤테로원자, 예를 들면, N, S 또는 O로 선택적으로 치환된다.
거대고리-형성 링커 X-L2-Y의 L2 성분은 특히, 펩티드유사 거대고리를 형성하는데 이용되는 2개의 아미노산 유사체의 위치 사이의 거리에 따라 길이가 변할 수 있다. 게다가, 거대고리-형성 링커의 L1 및/또는 L3 성분의 길이가 변함에 따라서, 안정한 펩티드유사 거대고리를 형성하는데 적합한 전체 길이의 링커를 산출하기 위하여 L2의 길이 역시 변할 수 있다. 가령, 이용되는 아미노산 유사체가 L1과 L3 각각에 추가적인 메틸렌 단위를 부가함으로써 변한다면, L2의 길이는 L1과 L3의 증가된 길이를 보상하기 위하여 대략 2개 메틸렌 단위의 당량 길이(equivalent length)로 감소한다.
일부 구체예에서, L2는 화학식 -(CH2)n-의 알킬렌 기인데, 여기서 n은 대략 1 내지 대략 15의 정수이다. 가령, n은 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10이다. 다른 구체예에서, L2는 알케닐렌 기이다. 또 다른 구체예에서, L2는 아릴 기이다.
표 9에서는 X-L2-Y 기의 추가적인 구체예를 도시한다.
상기 표에서 X와 Y는 예로써, 각각 독립적으로 Cl-, Br- 또는 I-이다.
본 발명을 수행하기 적합한 것으로 생각되는 펩티드유사 거대고리를 형성하는 추가적인 방법에는 Mustapa, M. Firouz Mohd et al., J. Org. Chem (2003), 68, pp. 8193-8198; Yang, Bin et al. Bioorg Med. Chem. Lett. (2004), 14, pp. 1403-1406; U.S. 특허 5,364,851; U.S. 특허 5,446,128; U.S. 특허 5,824,483; U.S. 특허 6,713,280; 그리고 U.S. 특허 7,202,332에서 개시된 것들이 포함된다. 이런 구체예에서, 알파 위치에서 추가적인 치환기 R-을 보유하는 아미노산 전구체가 이용된다. 이런 아미노산은 원하는 위치에서 거대고리 전구체 내로 통합되며, 이들 위치는 가교제가 치환되는 위치이거나, 또는 대안으로, 거대고리 전구체의 서열에서 다른 곳일 수 있다. 이후, 전구체의 고리화(cyclization)가 지시된 방법에 따라서 달성된다.
분석법
본 발명의 펩티드유사 거대고리의 특성은 예로써, 하기에 기술된 방법을 이용함으로써 분석된다.
α-
헬리시티를
결정하는 분석.
용해 상태에서, α-나선 도메인을 보유하는 폴리펩티드의 이차 구조는 종종, “헬리시티 비율”로 표시되는 무작위 코일 구조와 α-나선 구조 사이에 동적 평형(dynamic equilibrium)에 도달할 것이다. 따라서 변형되지 않은 친-아폽토시스 BH3 도메인은 용해 상태에서 주로 무작위 코일이고, α-나선 함량은 일반적으로 25% 미만이다. 다른 한편, 최적화된 링커를 보유하는 펩티드유사 거대고리는 예로써, 상응하는 가교되지 않은 폴리펩티드의 알파-헬리시티보다 적어도 2-배 큰 알파-헬리시티를 갖는다. 일부 구체예에서, 본 발명의 거대고리는 50% 이상의 알파-헬리시티를 가질 것이다. 본 발명의 펩티드유사 거대고리, 예를 들면, BH3 도메인-기초된 거대고리의 헬리시티를 분석하기 위하여, 이들 화합물은 수용액(가령, 50 mM 인산칼륨 용액, pH 7, 또는 증류된 H2O, 25-50 μM의 농도로) 용해된다. 원편광 이색성(CD) 스펙트럼은 표준 측정 파라미터(standard measurement parameter)(가령, 온도, 20℃; 파장, 190-260 nm; 단계 분해(step resolution), 0.5 nm; 속도, 20 nm/sec; 축적, 10; 반응, 1 sec; 대역너비, 1 nm; 경로 길이, 0.1 cm)를 이용하여 분광편광계(spectropolarimeter)(가령, Jasco J-710)에서 획득된다. 각 펩티드의 α-나선 함량은 모형 나선 데카펩티드에 대한 보고된 값으로 평균 잔기 타원율(ellipticity)(가령, [Φ]222obs)을 나눗셈함으로써 계산된다(Yang et al. (1986), Methods Enzymol. 130:208)).
용융 온도(
Tm
)를 결정하는 분석.
이차 구조, 예를 들면, α-나선을 포함하는 본 발명의 펩티드유사 거대고리는 예로써, 상응하는 가교되지 않은 폴리펩티드보다 높은 융융 온도(melting temperature)를 나타낸다. 전형적으로, 본 발명의 펩티드유사 거대고리는 >60℃의 Tm을 보이고, 수성 용액에서 고도로 안정한 구조를 나타낸다. 용융 온도에 대한 거대고리 형성의 효과를 분석하기 위하여, 펩티드유사 거대고리 또는 변형되지 않은 펩티드를 증류된 H2O(가령, 50 μM의 최종 농도로)에 용해시키고, 표준 파라미터(가령, 파장 222nm; 단계 분해, 0.5 nm; 속도, 20 nm/sec; 축적, 10; 반응, 1 sec; 대역너비, 1 nm; 온도 증가률: 1℃/min; 경로 길이, 0.1 cm)를 이용하여 분광편광계(가령, Jasco J-710)에서 일정한 온도 범위(가령, 4 내지 95 ℃)에서 타원율의 변화를 측정함으로써 Tm을 측정한다.
프로테아제 저항 분석.
펩티드 골격의 아미드 결합이 프로테아제에 의한 가수분해에 민감하기 때문에, 펩티드성 화합물은 생체내에서 급속하게 분해되기 쉽다. 하지만, 펩티드 나선 형성은 전형적으로, 아미드 골격을 감추고, 따라서 이를 단백분해 절단(proteolytic cleavage)으로부터 보호할 수 있다. 본 발명의 펩티드유사 거대고리는 상응하는 가교되지 않은 폴리펩티드와 비교하여 분해 속도에서 임의의 변화를 평가하는 시험관내 트립신 단백분해가 수행될 수 있다. 가령, 펩티드유사 거대고리 및 상응하는 가교되지 않은 폴리펩티드는 트립신 아가로즈(trypsin agarose)와 함께 항온 처리되고, 반응물은 280 nm에서 자외선 흡수로 잔류 잔기(residual substrate)를 정량하기 위하여 원심분리 및 차후 HPLC 주입에 의해 다양한 시점에서 소멸된다. 간단히 말하면, 펩티드유사 거대고리와 펩티드유사 전구체(5 mcg)는 0, 10, 20, 90, 그리고 180분 동안 트립신 아가로즈(Pierce)(S/E ~125)와 함께 항온 처리된다. 반응은 고속에서 테이블탑 원심분리(tabletop centrifugation)에 의해 소멸된다; 분리된 상층액 내에 남아있는 기질은 280 nm에서 HPLC-기초된 피크 검출에 의해 정량된다. 단백분해 반응은 일차 동역학(first order kinetics)을 나타내고, 반응 상수(rate constant), k는 ln[S] 대(對) 시간의 플롯(plot) (k=-1 X 기울기)로부터 측정된다.
체외 안정성 분석.
최적화된 링커를 보유하는 펩티드유사 거대고리는 예로써, 상응하는 가교되지 않은 폴리펩티드의 체외 반감기보다 적어도 2-배 큰 체외 반감기를 갖고, 그리고 12 시간 이상의 체외 반감기를 갖는다. 체외 혈청 안정성 연구를 위하여, 다양한 분석법이 이용될 수 있다. 가령, 펩티드유사 거대고리 및/또는 상응하는 가교되지 않은 폴리펩티드(2 mcg)는 각각, 37℃에서 0, 1, 2, 4, 8, 그리고 24시간 동안, 새로운 생쥐, 쥐 및/또는 인간 혈청(가령, 1-2 ㎖)과 함께 배양된다. 상이한 거대고리 농도의 샘플은 혈청으로 연속 희석(serial dilution)에 의해 준비될 수 있다. 본래 화합물의 수준을 결정하기 위하여, 아래의 절차가 이용될 수 있다: 샘플은 100 ㎕의 혈청을 2 ㎖ 원심분리 튜브로 이전하고, 그 이후에 10 ㎕의 50% 포름산과 500 ㎕ 아세토니트릴의 첨가 및 4± 2℃에서 10분 동안 14,000 RPM에서 원심분리에 의해 추출된다. 상층액은 이후, 새로운 2 ㎖ 튜브로 이전되고 N2 < 10 psi, 37℃ 하에 Turbovap에서 증발된다. 샘플은 100 ㎕의 50:50 아세토니트릴:물에서 재구성되고 LC-MS/MS 분석이 수행된다. 체외 안정성을 조사하기 위한 동등한 또는 유사한 절차는 공지되어 있고, 혈청 내에서 거대고리의 안정성을 측정하는데 이용될 수 있다.
시험관내
결합 분석.
수용자 단백질에 대한 펩티드유사 거대고리와 펩티드유사 전구체의 결합과 친화력을 평가하기 위하여, 예로써 형광 편광 분석법(fluorescence polarization assay, FPA)이 이용된다. FPA 기술은 편광(polarized light)과 형광 추적자(fluorescent tracer)를 이용하여 분자 배향과 이동성을 측정한다. 편광으로 여기(excitation)될 때, 높은 겉보기 분자량(apparent molecular weight)을 갖는 분자에 부착된 형광 추적자(가령, FITC)(가령, 대형 단백질에 결합된 FITC-표지된 펩티드)는 더욱 작은 분자에 부착된 형광 추적자(가령, 용해 상태에서 자유로운 FITC-표지된 펩티드)와 비교하여 더욱 느린 회전 속도로 인하여 더욱 높은 수준의 편광 형광(polarized fluorescence)을 방출한다.
가령, 플루오레세인(fluorescein)화 펩티드유사 거대고리(25 nM)가 실온에서 30분 동안, 결합 완충액 (140 mM NaCl, 50 mM Tris-HCL, pH 7.4) 내에서 수용자 단백질(25-1000nM)과 함께 항온 처리된다. 결합 활성은 예로써, 형광 분광계(luminescence spectrophotometer)(가령, Perkin-Elmer LS50B)에서 형광 편광(fluorescence polarization)에 의해 측정된다. Kd 값은 예로써, Graphpad Prism 소프트웨어(GraphPad Software, Inc., San Diego, CA)를 이용한 비선형 회귀 분석(nonlinear regression analysis)에 의해 측정될 수 있다. 본 발명의 펩티드유사 거대고리는 일부 사례에서, 상응하는 가교되지 않은 폴리펩티드와 유사하거나 이보다 낮은 Kd를 보인다.
BH3-펩티드, 예를 들면, BCL-2, BCL-XL, BAX 또는 MCL1에 대한 수용자 단백질이 예로써, 이러한 분석에 이용될 수 있다. 이런 분석을 수행하기 위한 추가적인 방법은 하기 실시예 섹션에서 기술된다.
펩티드-단백질 상호작용의 길항물질을 특징짓는
시험관내
치환 분석.
펩티드(가령, BH3 펩티드 또는 p53 펩티드)와 수용자 단백질 사이에 상호작용을 길항하는 화합물의 결합과 친화력을 평가하기 위하여, 예로써 펩티드유사 전구체 서열로부터 유래된 플루오레세인화 펩티드유사 거대고리를 활용하는 형광 편광 분석법(fluorescence polarization assay, FPA)이 이용된다. FPA 기술은 편광(polarized light)과 형광 추적자(fluorescent tracer)를 이용하여 분자 배향과 이동성을 측정한다. 편광으로 여기(excitation)될 때, 높은 겉보기 분자량(apparent molecular weight)을 갖는 분자에 부착된 형광 추적자(가령, FITC)(가령, 대형 단백질에 결합된 FITC-표지된 펩티드)는 더욱 작은 분자에 부착된 형광 추적자(가령, 용해 상태에서 자유로운 FITC-표지된 펩티드)와 비교하여 더욱 느린 회전 속도로 인하여 더욱 높은 수준의 편광 형광(polarized fluorescence)을 방출한다. 플루오레세인화 펩티드유사 거대고리와 수용자 단백질 사이에 상호작용을 길항하는 화합물은 경쟁 결합 FPA 실험에서 검출될 것이다.
가령, 추정 길항물질 화합물(1 nM 내지 1 mM)과 플루오레세인화 펩티드유사 거대고리(25 nM)는 실온에서 30분 동안, 결합 완충액(140 mM NaCl, 50 mM Tris-HCL, pH 7.4) 내에서 수용자 단백질(50 nM)과 함께 항온 처리된다. 길항물질 결합 활성은 예로써, 형광 분광계(luminescence spectrophotometer)(가령, Perkin-Elmer LS50B)에서 형광 편광(fluorescence polarization)에 의해 측정된다. Kd 값은 예로써, Graphpad Prism 소프트웨어(GraphPad Software, Inc., San Diego, CA)를 이용한 비선형 회귀 분석(nonlinear regression analysis)에 의해 측정될 수 있다.
임의의 부류의 분자, 예를 들면, 소형 유기 분자, 펩티드, 올리고뉴클레오티드 또는 단백질은 본 분석에서 추정 길항물질로서 시험될 수 있다. BH3-펩티드, 예를 들면, BCL-2, BCL-XL, BAX 또는 MCL1에 대한 수용자 단백질이 이러한 분석에 이용될 수 있다. 이런 분석을 수행하기 위한 추가적인 방법은 하기 실시예 섹션에서 기술된다.
세포 용해질 또는 본래 세포에서 결합 분석.
세포 용해질 또는 본래 세포 내에서 자연 수용자에 펩티드 또는 펩티드유사 거대고리의 결합을 면역침전과 풀-다운(pull-down) 실험으로 측정하는 것이 가능하다. 가령, 본래 세포는 혈청의 부재에서 4시간 동안 플루오레세인화(FITC-표지된) 또는 비오틴화 화합물과 함께 배양되고, 그 이후에 혈청 교체 및 4 내지 18시간 범위에서 추가적인 배양이 수행된다. 대안으로, 세포는 Opti-MEM(Invitrogen) 내에서 실험의 지속 기간 동안 배양될 수 있다. 이후, 세포는 작은 덩어리로 뭉쳐지고 4℃에서 10분 동안 용해 완충액(50mM Tris [pH 7.6], 150 mM NaCl, 1% CHAPS와 프로테아제 저해물질 칵테일)에서 배양된다. CHAPS 대신에, 1% NP-40 또는 Triton X-100이 이용될 수 있다. 추출물은 15분 동안 14,000 rpm으로 원심분리되고, 상층액은 수집되고 2시간 동안 10 ㎕ 염소 항-FITC 항체 또는 스트렙타비딘-코팅된 비드와 함께 배양되며, 4℃에서 회전되고, 그 이후에 4℃에서 단백질 A/G Sepharose(50 ㎕의 50% 비드 슬러리)와 함께 추가로 2시간 동안 배양된다. 비오틴화 화합물을 끌어내기 위하여 스트렙타비딘 비드를 이용하는 경우에는 이차 단계가 불필요하다. 대안으로, FITC-표지된 또는 비오틴화 화합물은 앞서 기술된 바와 같이 준비된 세포 용해질과 함께, 2시간 동안 배양되고, 4℃에서 회전되고, 그 이후에 2시간 동안 10 ㎕ 염소 항-FITC 항체 또는 스트렙타비딘-코팅된 비드와 함께 배양되며, 4℃에서 회전되고, 그 이후에 4℃에서 단백질 A/G Sepharose(50 ㎕의 50% 비드 슬러리)와 함께 추가로 2시간 동안 배양된다. 비오틴화 화합물을 끌어내기 위하여 스트렙타비딘 비드를 이용하는 경우에는 이차 단계가 불필요하다. 신속한 원심분리후, 펠릿(pellet)은 증가하는 염 농도(가령, 150, 300, 500 mM의 NaCl)를 갖는 용해 완충액에서 세척될 수 있다. 이들 비드는 이후, SDS-내포 샘플 완충액의 첨가 및 끓임(boiling)에 앞서, 150 mM NaCl에서 재-평형화될 수 있다. 비드와 세포 용해질은 4%-12% 구배 Bis-Tris 겔을 이용하여 전기영동되고, 그 이후에 Immobilon-P 막으로 이전될 수 있다. 차단후, 블롯(blot)은 각각, FITC 또는 비오틴(biotin)을 검출하는 항체와 함께, 그리고 BCL2, MCL1, BCL-XL, A1, BAX와 BAK를 비롯하여 펩티드유사 거대고리에 결합하는 단백질을 검출하는 하나 이상의 항체와 함께 배양될 수 있다. 용해질 블롯은 또한, 적하 대조(loading control)를 위하여 항-Hsc-70로 탐침된다. 대안으로, 전기영동후, FITC-표지된 또는 비오틴화 화합물과 함께 특이적으로 하락하는 단백질을 검출하기 위하여 겔이 은으로 염색될 수 있다.
세포
침투성
분석.
펩티드유사 거대고리는 예로써, 상응하는 가교되지 않은 폴리펩티드와 비교하여 더욱 강한 세포 침투성을 갖는다. 일부 구체예에서, 펩티드유사 거대고리는 상응하는 가교되지 않은 폴리펩티드보다 더욱 강한 세포 투과성을 갖는다. 최적화된 링커를 보유하는 펩티드유사 거대고리는 예로써, 상응하는 가교되지 않은 폴리펩티드보다 적어도 2-배 큰 세포 침투성을 갖고, 그리고 종종, 적용된 펩티드유사 거대고리 중에서 20% 이상이 4시간후 세포를 침투하는 것으로 관찰될 것이다. 펩티드유사 거대고리와 상응하는 가교되지 않은 폴리펩티드의 세포 침투성을 측정하기 위하여, 본래 세포를 37℃에서 4시간 동안 혈청 없는 배지에서 플루오레세인화 펩티드유사 거대고리 또는 상응하는 가교되지 않은 폴리펩티드(10 μM)와 함께 배양하고, 배지로 2회 세척하고, 37℃에서 10분 동안 트립신(0.25%)과 함께 배양하였다. 이들 세포를 다시 세척하고, PBS에서 재현탁시켰다. 세포 형광은 예로써, FACSCalibur 유세포 분석기(flow cytometer) 또는 Cellomics의 KineticScan ®HCS Reader를 이용함으로써 분석된다. 세포 침투를 정량하는 추가적인 방법이 이용될 수 있다. 특정한 방법은 하기 실시예에서 더욱 상세하게 기술된다.
세포 효능 분석.
일정한 펩티드유사 거대고리의 효능은 예로써, 다양한 발암성(tumorigenic)과 비-발암성 세포주 및 인간 또는 생쥐 세포 개체군으로부터 유래된 일차 세포를 이용한 세포-기초된 사멸 분석에서 측정된다. 세포 생존능은 예로써, EC50 < 10 μM으로 사멸시키는 것들을 확인하기 위하여, 펩티드유사 거대고리(0.5 내지 50 μM)와 함께 24-96시간의 배양 동안 모니터된다. 이러한 배경에서, EC50은 개체군 중에서 50%가 생존하는 펩티드유사 거대고리의 농도인 반극대(half maximal) 효과적 농도를 지칭한다. 세포 생존을 측정하는 여러 표준 분석법은 상업적으로 가용하고 펩티드유사 거대고리의 효능을 평가하는데 선택적으로 이용된다. 이에 더하여, 펩티드유사 거대고리가 아폽토시스 기구를 활성화시킴으로써 세포를 사멸시키는 지를 평가하기 위하여, Annexin V와 카스파제 활성화를 측정하는 분석법이 선택적으로 이용된다. 가령, 세포내 ATP 농도의 함수로서 세포 생존능을 측정하는 Cell Titer-glo 분석법이 이용된다.
생체내에서 안정성 분석.
펩티드유사 거대고리의 생체내 안정성을 조사하기 위하여, 화합물은 예로써, 0.1 내지 50 ㎎/㎏ 범위의 농도에서 IV, IP, SC, PO 또는 흡입 경로로 생쥐 및/또는 쥐에 투여된다. 혈액 표본(blood specimen)은 주입후 0', 5', 15', 30', 1시간, 4시간, 8시간, 12시간, 24시간 및 48시간 시점에 채취된다. 이후, 25 ㎕의 새로운 혈청 내에서 본래 화합물의 수준이 본 명세서에 기술된 바와 같은 LC-MS/MS에 의해 측정된다.
동물 모형에서
생체내
효능.
생체내에서 본 발명의 펩티드유사 거대고리의 항-종양원성 활성을 측정하기 위하여, 화합물이 예로써, 단독으로(IP, IV, SC, PO, 흡입 또는 비강 경로로) 또는 준최적(sub-optimal) 용량의 적절한 화학요법(가령, 시클로포스파미드(cyclophosphamide), 독소루비신(doxorubicin), 에토포시드(etoposide))과 공동으로 제공된다. 한 가지 실례에서, 루시페라제를 안정적으로 발현하는 5 x 106개 SEMK2 세포(급성 림프아구성 백혈병(acute lymphoblastic leukemia)을 앓는 환자의 골수로부터 확립됨)가 전신 방사선조사(total body irradiation)후 3시간 시점에, NOD-SCID, SCID-beige 또는 NOD.IL2rg KO 생쥐에 꼬리 정맥(tail vein)으로 주입되었다. 방사선 조사되지 않은 생쥐 역시 이들 연구에 이용될 수 있다. 치료되지 않고 방치되면, 이러한 형태의 백혈병은 상기 모형에서 3주 내에 치명적이다. 상기 백혈병은 예로써, 생쥐에 D-루시페린(60 ㎎/㎏)을 주입하고 마취된 동물을 이미지화(가령, Xenogen 생체내 이미지화 시스템, Caliper Life Sciences, Hopkinton, MA)함으로써 용이하게 모니터된다. 전신 생물발광(total body bioluminescence)은 Living Image Software(Caliper Life Sciences, Hopkinton, MA)에 의한 광자 유동(photonic flux)(광자/sec)의 적분에 의해 정량된다. 단독으로 또는 준최적 용량의 적절한 화학치료제와 공동으로 펩티드유사 거대고리는 예로써, 7 내지 21일 동안 0.1 ㎎/㎏ 내지 50 ㎎/㎏ 범위의 용량에서 꼬리 정맥 또는 IP 경로로 백혈병 생쥐(주입후 8-10일/실험 1일, 14-16의 생물발광 범위에서)에 투여된다. 선택적으로, 이들 생쥐는 전체 실험 기간 동안 격일로 이미지화되고, 전체 실험 기간 동안 생존이 매일 모니터된다. 기간 만료된 생쥐는 선택적으로, 실험의 종결 시점에서 검시된다. 다른 동물 모형은 루시페라제를 안정적으로 발현하는, 인간 여포성 림프종으로부터 유래된 세포주인 DoHH2의 NOD-SCID 생쥐 내로 이식이다. 이들 생체내 검사는 선택적으로, 예비 약동학, 약역학 및 독성 데이터를 산출한다.
임상 시험.
인간 치료에서 본 발명의 펩티드유사 거대고리의 적합성(suitability)을 결정하기 위하여, 임상 시험이 수행된다. 가령, 암으로 진단되고 치료가 필요한 환자가 선별되고 치료 군과 하나 이상의 대조 군으로 분리되는데, 여기서 치료 군은 본 발명의 펩티드유사 거대고리가 투여되는 반면, 대조 군은 위약(placebo), 공지된 항암제, 또는 표준 치료가 제공된다. 본 발명의 펩티드유사 거대고리의 치료 안전성(treatment safety)과 효능은 생존 및 삶의 질(quality-of-life)과 같은 인자에 관하여, 이들 환자 군의 비교를 수행함으로써 평가될 수 있다. 본 실시예에서, 펩티드유사 거대고리로 치료된 환자 군은 위약 또는 표준 치료로 치료된 환자 대조 군과 비교하여 향상된 장기 생존(long-term survival)을 보였다.
제약학적 조성물 및 투여 경로
투여 방법에는 피내(intradermal), 근육내(intramuscular), 복막내(intraperitoneal), 정맥내(intravenous), 피하(subcutaneous), 비강내(intranasal), 경막외(epidural), 경구(oral), 설하(sublingual), 뇌내(intracerebral), 질내(intravaginal), 경피(transdermal), 직장(rectal), 흡입(inhalation)으로, 또는 귀, 코, 눈 또는 피부 적용에 의한 국소(topical)가 포함되지만 이들에 국한되지 않는다.
본 발명의 펩티드유사 거대고리는 또한, 제약학적으로 허용되는 유도체(derivative) 또는 이의 전구약물(prodrug)을 포함한다. “제약학적으로 허용되는 유도체”는 수용자에 투여 이후에, 본 발명의 화합물을 제공(직접적으로 또는 간접적으로)할 수 있는, 본 발명의 화합물의 임의의 제약학적으로 허용되는 염, 에스테르, 에스테르의 염, 전구약물 또는 기타 유도체를 의미한다. 가령, 제약학적으로 허용되는 유도체는 포유동물에 투여될 때 본 발명의 화합물의 생체이용효율(bioavailability)을 증가(가령, 경구 투여된 화합물의 혈액 내로의 흡수를 증가시킴으로써)시키거나, 또는 부모 화학종(parent species)과 비교하여 활성 화합물의 생물학적 구획(가령, 뇌 또는 림프계(lymphatic system))으로의 전달을 증가시킨다. 일부 제약학적으로 허용되는 유도체는 수성 용해도(aqueous solubility) 또는 위점막(gastrointestinal mucosa)을 가로질러 능동 수송(active transport)을 증가시키는 화학 기(chemical group)를 보유한다.
일부 구체예에서, 본 발명의 펩티드유사 거대고리는 선별적인 생물학적 특성을 강화시키기 위하여 적절한 기능기(functional group)를 공유 또는 비-공유 연결함으로써 변형된다. 이런 변형에는 소정의 생물학적 구획(가령, 혈액, 림프계, 중추신경계) 내로 생물학적 침투를 증가시키고, 경구 이용성(oral availability)을 증가시키고, 주사에 의한 투여가 가능하도록 용해도를 증가시키고, 물질대사를 변경하고, 그리고 배출 속도를 변경하는 것들이 포함된다.
본 발명의 화합물의 제약학적으로 허용되는 염에는 제약학적으로 허용되는 무기와 유기 산과 염기로부터 유래된 것들이 포함된다. 적절한 산 염(acid salt)의 실례에는 아세테이트(acetate), 아디페이트(adipate), 벤조에이트(benzoate), 벤젠설포네이트(benzenesulfonate), 부티레이트(butyrate), 시트레이트(citrate), 디글루코네이트(digluconate), 도데실설페이트(dodecylsulfate), 포르메이트(formate), 푸마레이트(fumarate), 글리콜레이트(glycolate), 헤미설페이트(hemisulfate), 헵타노에이트(heptanoate), 헥사노에이트(hexanoate), 염산염(hydrochloride), 브롬화수소산염(hydrobromide), 요오드화수소산염(hydroiodide), 락테이트(lactate), 말레이트(maleate), 말로네이트(malonate), 메탄설포네이트(methanesulfonate), 2-나프탈렌설포네이트(naphthalenesulfonate), 니코티네이트(nicotinate), 니트레이트(nitrate), 팔모에이트(palmoate), 포스페이트(phosphate), 피크레이트(picrate), 피발레이트(pivalate), 프로피오네이트(propionate), 살리실레이트(salicylate), 숙시네이트(succinate), 설페이트(sulfate), 타르트레이트(tartrate), 토실레이트(tosylate) 및 운데카노에이트(undecanoate)가 포함된다. 적절한 염기로부터 유래된 염에는 알칼리 금속(alkali metal)(가령, 나트륨), 알칼리 토류 금속(alkaline earth metal)(가령, 마그네슘), 암모늄 및 N-(알킬)4 + 염이 포함된다.
본 발명의 화합물로부터 제약학적 조성물을 제조하기 위하여, 제약학적으로 허용되는 담체에는 고형 또는 액상 담체가 포함된다. 고형 형태 제조물에는 분말(powder), 정제(tablet), 알약(pill), 캡슐(capsule), 교갑(cachet), 좌약(suppository), 그리고 분산성 과립(dispersible granule)이 포함된다. 고형 담체는 희석제(diluent), 향료(flavoring agent), 접합제(binder), 보존제(preservative), 정제 붕해제(tablet disintegrating agent), 또는 캡슐화 물질(encapsulating material)로서도 기능하는 한 가지 이상의 물질일 수 있다. 조제(formulation)와 투여(administration)를 위한 기술에 관한 상세는 과학 문헌과 특허 문헌에서 충분히 기술되며, 예로써 Remington's Pharmaceutical Sciences, Maack Publishing Co, Easton PA의 최신 판(版)을 참조한다.
분말에서, 담체는 미세하게 분열된 고체이고, 이는 미세하게 분열된 활성 성분과의 혼합물로 존재한다. 정제에서, 활성 성분은 필요한 결합 특성을 갖는 담체와 적절한 비율로 혼합되고, 원하는 형상과 크기로 성형된다.
적절한 고형 부형제(excipient)는 덱스트로스(dextrose), 락토오스(lactose), 수크로오스(sucrose), 만니톨(mannitol), 또는 소르비톨(sorbitol)을 비롯한 당(sugar); 옥수수, 밀, 쌀, 감자, 또는 기타 식물로부터 전분(starch); 셀룰로오스(cellulose), 예를 들면, 메틸 셀룰로오스, 히드록시프로필메틸-셀룰로오스, 또는 나트륨 카르복시메틸셀룰로오스; 그리고 아라비아(arabic)와 트래거캔스(tragacanth)를 비롯한 검(gum); 그리고, 단백질, 예를 들면, 젤라틴(gelatin)과 콜라겐(collagen)이 포함되지만 이들에 국한되지 않는 탄수화물 또는 단백질 충전제이다. 원하는 경우에, 붕해제(disintegrating agent) 또는 용해제(solubilizing agent), 예를 들면, 가교된 폴리비닐 피롤리돈(polyvinyl pyrrolidone), 한천(agar), 알긴산(alginic acid), 또는 이들의 염, 예를 들면, 알긴산나트륨(sodium alginate)이 첨가된다.
액상 형태 제조물에는 용액(solution), 현탁액(suspension), 그리고 에멀젼(emulsion), 예를 들면, 물 또는 물/프로필렌 글리콜 용액이 포함된다. 비경구 주사를 위하여, 액상 제조물은 수성 폴리에틸렌 글리콜 용액에서 용액으로 조제될 수 있다. 본 명세서에서 용어 “비경구”는 정맥내(intravenous), 동맥내(intraarterial), 근육내(intramuscular), 복막내(intraperitoneal), 흉골내(intrasternal), 그리고 피하(subcutaneous)를 비롯한 투여 방식을 지칭한다.
제약학적 제조물은 바람직하게는, 단위 약형(unit dosage form)으로 존재한다. 이런 형태에서, 제조물은 적절한 양의 활성 성분을 내포하는 단위 복용량(unit dose)으로 세분된다. 이러한 단위 약형은 포장된 제조물일 수 있는데, 상기 포장은 바이알 또는 앰플 내에 구별된 양의 제조물, 예를 들면, 패킷(packeted) 정제, 캡슐, 그리고 분말을 내포한다. 또한, 단위 약형은 캡슐, 정제, 교갑, 또는 마름모꼴 정제 자체이거나, 또는 포장된 형태에서 이들의 임의의 적절한 총수일 수 있다.
본 발명의 조성물이 펩티드유사 거대고리 및 하나 이상의 추가적인 치료제 또는 예방제의 조합을 포함할 때, 상기 화합물 및 추가의 작용제는 단일요법 섭생(monotherapy regimen)에서 통상적으로 투여되는 용량의 대략 1 내지 100%, 그리고 더욱 바람직하게는, 대략 5 내지 95%의 용량 수준으로 존재해야 한다. 일부 구체예에서, 추가의 작용제는 본 발명의 화합물로부터 복수 투약 섭생(multiple dose regimen)의 일부로서, 독립적으로 투여된다. 대안으로, 이들 작용제는 단일 조성물에서 본 발명의 화합물과 함께 혼합된, 단일 약형(single dosage form)의 일부이다.
이용 방법
한 측면에서, 본 발명에서는 펩티드유사 거대고리의 모델이 되는 단백질 또는 펩티드의 자연 리간드(들)에 결합하는 작용제를 확인하는 경쟁 결합 분석에 유용한 신규한 펩티드유사 거대고리를 제시한다. 가령, BH3/BCL-XL 항-아폽토시스 시스템에서, BH3에 기초된 표지된 펩티드유사 거대고리가 BCL-XL에 경쟁적으로 결합하는 소형 분자와 함께, BCL-XL 결합 분석에 이용될 수 있다. 경쟁 결합 연구는 BH3/BCL-XL 시스템에 특이적인 약물 후보(drug candidate)의 신속한 시험관내 평가와 결정을 가능하게 한다. 본 발명에서는 또한, 펩티드유사 거대고리에 대한 항체의 생산을 제시한다. 일부 구체예에서, 이들 항체는 펩티드유사 거대고리 및 이들 펩티드유사 거대고리가 유래되는 BH3 펩티드유사 전구체 둘 모두에 특이적으로 결합한다. 이런 항체는 예로써, 각각 BH3/BCL-XL 시스템을 파괴한다.
다른 측면에서, 본 발명에서는 이상형(異常型)(가령, 불충분한 또는 과도한) BCL-2 집단 구성원 발현 또는 활성(가령, 외인성 또는 내인성 아폽토시스 경로 비정상)과 연관된 질환의 위험이 있는(또는 이러한 질환에 취약한) 개체, 또는 이러한 질환을 앓고 있는 개체를 치료하는 예방 방법과 치료 방법 둘 모두를 제시한다. 일부 BCL-2 타입 질환은 적어도 부분적으로, 하나 이상의 BCL-2 집단 구성원의 비정상적인 수준(가령, 과다발현 또는 과소발현)에 의해, 또는 비정상적인 활성을 나타내는 하나 이상의 BCL-2 집단 구성원의 존재에 의해 유발되는 것으로 생각된다. 따라서 BCL-2 집단 구성원의 수준 및/또는 활성의 감소 또는 BCL-2 집단 구성원의 수준 및/또는 활성의 강화는 예로써, 상기 질환을 완화시키거나, 또는 상기 질환의 유해한 증상을 감소시키는데 이용된다.
한 구체예에서, 본 발명의 화합물은 Mcl-1의 발현 또는 과다발현과 연관된 질환을 치료하는데 이용된다. Mcl-1은 다수의 조직 및 신생성 세포주에서 발현되는 것으로 밝혀졌고, 악성 종양의 발생에 참여하는 것으로 생각된다(Thallinger et al. (2004) Clin. Cancer Res. 10:4185-4191). 본 발명의 펩티드유사 거대고리는 이런 악성 종양의 치료에 이용될 수 있다.
한 구체예에서, 치료되는 질환(가령, 암)은 본 발명의 펩티드유사 거대고리에 차별적으로 반응한다. 일부 구체예에서, 암은 BIM 펩티드유사 거대고리로 치료되고 시험관내 세포 생존능 분석에서 측정된 바와 같이, BID 폴리펩티드(가령, BID 펩티드유사 거대고리 또는 가교되지 않은 폴리펩티드)를 이용한 치료에 적어도 2-배 덜 민감하다. 다른 구체예에서, 암은 시험관내 세포 생존능 분석에서 측정된 바와 같이, BID 폴리펩티드를 이용한 치료에 적어도 5-배 덜 민감하다. 또 다른 구체예에서, 암은 시험관내 세포 생존능 분석에서 측정된 바와 같이, BID 폴리펩티드를 이용한 치료에 적어도 8-배 덜 민감하다. 다른 구체예에서, 암은 BID 펩티드유사 거대고리로 치료되고 시험관내 세포 생존능 분석에서 측정된 바와 같이, BIM 폴리펩티드(가령, BIM 펩티드유사 거대고리 또는 가교되지 않은 폴리펩티드)를 이용한 치료에 적어도 2-배 덜 민감하다. 다른 구체예에서, 암은 시험관내 세포 생존능 분석에서 측정된 바와 같이, BID 폴리펩티드를 이용한 치료에 적어도 5-배 덜 민감하다. 또 다른 구체예에서, 암은 시험관내 세포 생존능 분석에서 측정된 바와 같이, BID 폴리펩티드를 이용한 치료에 적어도 8-배 덜 민감하다.
다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 BCL-집단 단백질의 수준을 평가하는 분석을 수행하고, BCL-집단 단백질의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. BCL-집단 단백질에는 예로써, BCL-2, BCL-XL, MCL-1, Bfl1/A1, BOO/DIVA, NRH/NR13, BAX, BAD, BAK, BOK, BIK, PUMA, BIM, BMF, BLK, BNIP3,HRK, NIX, SPIKE, 그리고 Noxa가 포함된다. 한 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 BCL-2의 수준을 평가하는 분석을 수행하고, BCL-2의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 BCL-XL의 수준을 평가하는 분석을 수행하고, BCL-XL의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 MCL-1의 수준을 평가하는 분석을 수행하고, MCL-1의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 BAX의 수준을 평가하는 분석을 수행하고, BAX의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 BAD의 수준을 평가하는 분석을 수행하고, BAD의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 BAK의 수준을 평가하는 분석을 수행하고, BAK의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 PUMA의 수준을 평가하는 분석을 수행하고, PUMA의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 Noxa의 수준을 평가하는 분석을 수행하고, Noxa의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 Noxa의 수준을 평가하는 분석을 수행하고, Noxa의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 Bfl1/A1의 수준을 평가하는 분석을 수행하고, Bfl1/A1의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 BOO/DIVA의 수준을 평가하는 분석을 수행하고, BOO/DIVA의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 NRH/NR13의 수준을 평가하는 분석을 수행하고, NRH/NR13의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 BOK의 수준을 평가하는 분석을 수행하고, BOK의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 BIK의 수준을 평가하는 분석을 수행하고, BIK의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 BMF의 수준을 평가하는 분석을 수행하고, BMF의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 BLK의 수준을 평가하는 분석을 수행하고, BLK의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 BNIP3의 수준을 평가하는 분석을 수행하고, BNIP3의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 HRK의 수준을 평가하는 분석을 수행하고, HRK의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 Nix의 수준을 평가하는 분석을 수행하고, Nix의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다. 다른 구체예에서, 인간 환자를 치료하는 방법이 제시되는데, 상기 방법은 환자에서 SPIKE의 수준을 평가하는 분석을 수행하고, SPIKE의 비정상적인 또는 불규칙한 수준의 발현이 검출되면 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함한다.
본 명세서에서, 용어 “치료”는 질환, 질환의 증상, 또는 질환에 대한 소인(predisposition)을 제거, 치료, 완화, 경감, 변경, 교정, 개선, 또는 호전시키는 목적으로, 이러한 질환, 질환의 증상, 또는 질환에 대한 소인을 나타내는 환자에 치료제의 적용 또는 투여, 또는 이러한 환자로부터 분리된 조직 또는 세포주에 치료제의 적용 또는 투여로서 정의된다.
일부 구체예에서, 본 발명의 펩티드유사 거대고리는 암 및 신생성 장애를 치료, 예방 및/또는 진단하는데 이용된다. 본 명세서에서, 용어 “암”, “과다증식성” 및 “신생성”은 자율 성장(autonomous growth)의 능력을 갖는 세포, 다시 말하면, 급속하게 확산되는 세포 성장으로 특징되는 비정상적 상태 또는 장애를 지칭한다. 과다증식성과 신생성 질환 상태는 병리학적으로, 다시 말하면, 질환 상태를 특징짓거나 구성하는 것으로 분류되거나, 또는 비-병리학적으로, 다시 말하면, 정상으로부터 일탈하지만 질환 상태와 연관되지 않는 것으로 분류될 수 있다. 상기 용어는 조직병리학적 유형 또는 침입(invasiveness) 단계에 상관없이, 모든 유형의 암성 성장 또는 종양 진행, 전이성(metastatic) 조직 또는 악성 형질전환된 세포, 조직, 또는 장기를 포함하는 것으로 의도된다. 전이성 종양은 유방, 폐, 간, 결장과 난소 기원의 종양이 포함되지만 이들에 국한되지 않는 다수의 원발성(primary) 종양 유형으로부터 발생할 수 있다. “병리학적 과다증식성” 세포는 악성 종양 성장으로 특징되는 질환 상태에서 발생한다. 비-병리학적 과다증식성 세포의 실례에는 상처 회복(wound repair)과 연관된 세포의 증식이 포함된다. 세포 증식성 및/또는 분화성 질환의 실례에는 암, 예를 들면, 암종, 육종, 또는 전이성 질환이 포함된다. 일부 구체예에서, 이들 펩티드유사 거대고리는 유방암, 난소암, 결장암, 폐암, 이런 암의 전이 등을 통제하기 위한 신규한 치료제이다.
암 또는 신생성 장애의 실례에는 섬유육종(fibrosarcoma), 근육종(myosarcoma), 지방육종(liposarcoma), 연골육종(chondrosarcoma), 골원성 육종(osteogenic sarcoma), 척삭종(chordoma), 혈관육종(angiosarcoma), 내피육종(endotheliosarcoma), 림프관육종(lymphangiosarcoma), 림프관내피육종(lymphangioendotheliosarcoma), 윤활막종(synovioma), 중피종(mesothelioma), 유잉 종양(Ewing's tumor), 평활근육종(leiomyosarcoma), 횡문근육종(rhabdomyosarcoma), 위암, 식도암, 직장암, 췌장암, 난소암, 전립선암, 자궁암, 두경부암, 피부암, 뇌암, 편평 세포 암종(squamous cell carcinoma), 피지선 암종(sebaceous gland carcinoma), 유두모양 암종(papillary carcinoma), 유두모양 선암종(papillary adenocarcinoma), 낭샘암종(cystadenocarcinoma), 수질성 암종(medullary carcinoma), 기관지원성 암종(bronchogenic carcinoma), 신장 세포 암종(renal cell carcinoma), 간종양(hepatoma), 담즙관 암종(bile duct carcinoma), 융모막암종(choriocarcinoma), 고환종(seminoma), 배아 암종(embryonal carcinoma), 윌름 종양(Wilm's tumor), 자궁경부암, 고환암, 소형 세포 폐 암종, 비-소형 세포 폐 암종, 방광 암종, 상피 암종, 신경교종(glioma), 별아교세포종(astrocytoma), 속질모세포종(medulloblastoma), 두개인두종(craniopharyngioma), 상의세포종(ependymoma), 송과체종(pinealoma), 혈관모세포종(hemangioblastoma), 청신경초종(acoustic neuroma), 희돌기교종(oligodendroglioma), 수막종(meningioma), 흑색종, 신경모세포종(neuroblastoma), 망막모세포종(retinoblastoma), 백혈병, 림프종, 또는 카포시 육종(Kaposi sarcoma)이 포함되지만 이들에 국한되지 않는다.
증식성 질환의 실례에는 조혈 신생성 질환이 포함된다. 본 명세서에서, 용어 “조혈 신생성 질환”에는 조혈 기원(hematopoietic origin)의 과형성/신생성 세포를 수반하는, 예를 들면, 골수(myeloid), 림프(lymphoid) 또는 적혈(erythroid) 계통, 또는 이들의 전구체 세포로부터 발생하는 질환이 포함된다. 바람직하게는, 이들 질환은 불량하게 분화된 급성 백혈병, 예를 들면, 적혈모구 백혈병(erythroblastic leukemia) 백혈병 및 급성 거핵아구성 백혈병(acute megakaryoblastic leukemia)으로부터 발생한다. 추가적인 예시적인 골수 질환에는 급성 전골수성 백혈병(acute promyeloid leukemia, APML), 급성 골수성 백혈병(acute myelogenous leukemia, AML) 및 만성 골수성 백혈병(chronic myelogenous leukemia, CML)이 포함되지만 이들에 국한되지 않는다(Vaickus (1991), Crit Rev . Oncol ./ Hemotol. 11:267-97에서 검토됨); 림프성 악성 종양(lymphoid malignancy)에는 B-계통 ALL과 T-계통 ALL을 비롯한 급성 림프모구성 백혈병(acute lymphoblastic leukemia, ALL), 만성 림프구성 백혈병(chronic lymphocytic leukemia, CLL), 전림프구성 백혈병(prolymphocytic leukemia, PLL), 모발성 세포 백혈병(hairy cell leukemia, HLL) 및 왈덴스트롬 마크로글로불린혈증(Waldenstrom's macroglobulinemia, WM)이 포함되지만 이들에 국한되지 않는다. 추가적인 형태의 악성 림프종에는 비-호지킨 림프종(non-Hodgkin lymphoma)과 이의 변이체, 말초 T 세포 림프종, 성체 T 세포 백혈병/림프종(ATL), 피부 T-세포 림프종(CTCL), 거대 과립 림프구성 백혈병(large granular lymphocytic leukemia, LGF), 호지킨병(Hodgkin's disease) 및 리드-스템베르그 병(Reed-Stemberg disease)이 포함되지만 이들에 국한되지 않는다.
유방의 세포 증식성 및/또는 분화성 질환의 실례에는 예로써, 상피 증식증(epithelial hyperplasia), 경화 샘증(sclerosing adenosis), 그리고 소담관 유두종(small duct papilloma)을 비롯한 증식성 유방 질환; 예로써, 간질성 종양(stromal tumor), 예를 들면, 섬유샘종(fibroadenoma), 엽상 종양(phyllodes tumor), 육종(sarcoma), 그리고 상피 종양(epithelial tumor), 예를 들면, 대담관 유두종(large duct papilloma)을 비롯한 종양; 관상 피내 암종(ductal carcinoma in situ)(파제트병(Paget's disease) 포함)과 상피내 소엽성 암종(lobular carcinoma in situ)을 비롯한 in situ(비-침습성) 암종, 그리고 침습성 관상 암종, 침습성 소엽성 암종, 수질성 암종(medullary carcinoma), 콜로이드(점액) 암종(colloid(mucinous) carcinoma), 관상 암종(tubular carcinoma), 그리고 침습성 유두모양 암종이 포함되지만 이들에 국한되지 않는 침습성(침윤성) 암종을 비롯한 유방의 암종; 그리고 기타 악성 신생물이 포함되지만 이들에 국한되지 않는다. 남성 유방에서 질환에는 유방 이상 비대(gynecomastia) 및 암종이 포함되지만 이들에 국한되지 않는다.
폐의 세포 증식성 및/또는 분화성 질환의 실례에는 종양부수 증후군(paraneoplastic syndrome), 세기관지폐포 암종(bronchioloalveolar carcinoma), 신경내분비 종양(neuroendocrine tumor), 예를 들면, 기관지 카르시노이드(bronchial carcinoid), 기타 종양, 전이성 종양을 비롯한 기관지유래 암종(bronchogenic carcinoma); 염증성 흉막 유출(inflammatory pleural effusion), 비-염증성 흉막 유출(noninflammatory pleural effusion), 기흉(pneumothorax)을 비롯한 흉막의 병리; 그리고 고립 섬유 종양(solitary fibrous tumor)(흉막 섬유종(pleural fibroma))과 악성 중피종(malignant mesothelioma)을 비롯한 흉막 종양이 포함되지만 이들에 국한되지 않는다.
결장의 세포 증식성 및/또는 분화성 질환의 실례에는 비-신생성 폴립(polyp), 선종(adenoma), 가족성 증후군(familial syndrome), 결장직장 발암(colorectal carcinogenesis), 결장직장 암종(colorectal carcinoma), 그리고 카르시노이드 종양(carcinoid tumor)이 포함되지만 이들에 국한되지 않는다.
간의 세포 증식성 및/또는 분화성 질환의 실례에는 결절 과형성(nodular hyperplasia), 선종(adenoma), 그리고 간의 원발성 암종과 전이성 종양을 비롯한 악성 종양이 포함되지만 이들에 국한되지 않는다.
난소의 세포 증식성 및/또는 분화성 질환의 실례에는 난소 종양, 예를 들면, 체강 상피(coelomic epithelium)의 종양, 장액 종양(serous tumor), 점액 종양(mucinous tumor), 자궁내막양 종양(endometrioid tumor), 투명 세포 선암종(clear cell adenocarcinoma), 낭샘섬유종(cystadenofibroma), 브렌너 종양(Brenner tumor), 표면 상피 종양(surface epithelial tumor); 생식세포 종양(germ cell tumor), 예를 들면, 성숙(양성) 기형종(teratoma), 단배엽성 기형종(monodermal teratoma), 미성숙 악성 기형종, 미분화세포종(dysgerminoma), 내배엽성 동 종양(endodermal sinus tumor), 융모막암종(choriocarcinoma); 성기삭 간질성 종양(sex cord-stomal tumor), 예를 들면, 과립막-난포막세포 종양(granulosa-theca cell tumor), 난포막종-섬유종(thecoma-fibroma), 남성모세포종(androblastoma), 힐 세포 종양(hill cell tumor), 생식샘모세포종(gonadoblastoma); 그리고 전이성 종양, 예를 들면, 쿠르켄버그 종양(Krukenberg tumor)이 포함되지만 이들에 국한되지 않는다.
유방암
한 측면에서, 본 발명에서는 본 발명의 펩티드유사 거대고리를 투여함으로써 유방암을 치료하는 방법을 제시한다. 유방암에는 침습성 유방 암종, 예를 들면, 침습성 관상 암종, 침습성 소엽성 암종, 관상 암종, 침습성 사상 암종(cribriform carcinoma), 수질성 암종, 점액 암종과 점액을 가진 기타 종양, 낭샘암종(cystadenocarcinoma), 원주 세포 점액 암종(columnar cell mucinous carcinoma), 원발성 반지 세포 암종(signet ring cell carcinoma), 신경내분비 종양(neuroendocrine tumour)(고형 신경내분비 암종, 비정형 카르시노이드 종양(atypical carcinoid tumour), 소세포(small cell)/귀리 세포(oat cell) 암종, 또는 대세포(large cell) 신경내분비 암종 포함), 침습성 유두모양 암종, 침습성 미세유두 암종(micropapillary carcinoma), 아포크린 암종(apocrine carcinoma), 화생 암종(metaplastic carcinoma), 순수 상피 화생 암종(pure epithelial metaplastic carcinoma), 혼성 상피/중간엽 화생 암종, 지방-과다 암종(lipid-rich carcinoma), 분비성 암종(secretory carcinoma), 호산성 세포 암종(oncocytic carcinoma), 선양 낭성 암종(adenoid cystic carcinoma), 선방 세포 암종(acinic cell carcinoma), 당원풍부 투명 세포 암종(glycogen-rich clear cell carcinoma), 피지샘 암종(sebaceous carcinoma), 염증성 암종 또는 양측 유방 암종; 중간엽 종양(mesenchymal tumor), 예를 들면, 혈관종(haemangioma), 혈관종증(angiomatosis), 혈관주위세포종(haemangiopericytoma), 가성혈관양 간질 증식(pseudoangiomatous stromal hyperplasia), 근섬유모세포종(myofibroblastoma), 섬유종증(fibromatosis)(공격적), 염증성 근섬유모세포 종양(inflammatory myofibroblastic tumour), 지방종(lipoma), 혈관지방종(angiolipoma), 과립 세포 종양(granular cell tumour), 신경섬유종(neurofibroma), 신경초종(schwannoma), 혈관육종(angiosarcoma), 지방육종(liposarcoma), 횡문근육종(rhabdomyosarcoma), 골육종(osteosarcoma), 평활근종(leiomyoma), 또는 평활근육종(leiomysarcoma); 근육상피 병소(myoepithelial lesion), 예를 들면, 근육상피증(myoepitheliosis), 샘근육상피 선증(adenomyoepithelial adenosis), 샘근육상피종(adenomyoepithelioma), 또는 악성 근육상피종(malignant myoepithelioma); 섬유상피성 종양(fibroepithelial tumour), 예를 들면, 섬유샘종(fibroadenoma), 엽상 종양(phyllodes tumour), 하위 등급 관주위 간질성 육종(low grade periductal stromal sarcoma), 또는 유방 과오종(mammary hamartoma); 그리고 유두(nipple)의 종양, 예를 들면, 유두 선종(nipple adenoma), 한관성 선종(syringomatous adenoma), 또는 유두의 파제트병(Paget's disease)이 포함된다.
유방암의 치료는 임의의 추가적인 요법, 예를 들면, 표준 치료의 일부가 되는 요법과 함께 실행될 수 있다. 외과적 기술, 예를 들면, 유방종양절제술(lumpectomy) 또는 유방절제술(mastectomy)이 본 발명의 펩티드유사 거대고리로 치료에 앞서, 치료 동안, 치료 이후에 수행될 수 있다. 대안으로, 방사선요법이 본 발명의 펩티드유사 거대고리와 함께, 유방암의 치료에 이용될 수 있다. 다른 사례에서, 본 발명의 펩티드유사 거대고리는 두 번째 치료제와 공동으로 투여된다. 이런 치료제는 화학치료제, 예를 들면, 개별 약물 또는 약물과 요법의 조합일 수 있다. 가령, 화학치료제는 어쥬번트 화학치료 물질, 예를 들면, CMF(시클로포스파미드(cyclophosphamide), 메토트렉세이트(methotrexate), 그리고 5-플루오르우라실(fluorouracil); FAC 또는 CAF(5-플루오르우라실, 독소루비신(doxorubicin), 시클로포스파미드); AC 또는 CA(독소루비신 및 시클로포스파미드); AC-탁솔(Taxol)(AC와 그 이후에 파클리탁셀(paclitaxel)); TAC(도세탁셀(docetaxel), 독소루비신, 그리고 시클로포스파미드); FEC(5-플루오르우라실, 에피루비신(epirubicin), 시클로포스파미드); FECD(FEC와 그 이후에, 도세탁셀); TC(도세탁셀 및 시클로포스파미드)일 수 있다. 화학요법 이외에, 종양 특징(즉, HER2/neu 상태) 및 재발 위험에 따라, 트라스투주맙(trastuzumab)이 상기 섭생에 추가될 수 있다. 호르몬요법 역시 화학치료 이전에, 동안, 또는 이후에 적합할 수 있다. 가령, 타목시펜(tamoxifen)이 투여되거나, 또는 아미노글루테티미드(aminogluthetimide), 아나스트로졸(anastrozole), 엑세메스탄(exemestane), 포르메스탄(formestane), 레트로졸(letrozole), 또는 보로졸(vorozole)이 포함되지만 이들에 국한되지 않는 아로마타아제 저해물질(aromatase inhibitor) 범주의 화합물이 투여될 수 있다. 다른 구체예에서, 항혈관형성제(antiangiogenic agent)가 유방암의 치료를 위한 복합 요법(combination therapy)에 이용될 수 있다. 항혈관형성제는 베바시주맙(bevacizumab)이 포함되지만 이들에 국한되지 않는 항-VEGF 치료제일 수 있다.
난소암
다른 측면에서, 본 발명의 펩티드유사 거대고리는 난소암을 치료하는데 이용될 수 있다. 난소암에는 난소 종양, 예를 들면, 체강 상피(coelomic epithelium)의 종양, 장액 종양(serous tumor), 점액 종양(mucinous tumor), 자궁내막양 종양(endometrioid tumor), 투명 세포 선암종(clear cell adenocarcinoma), 낭샘섬유종(cystadenofibroma), 브렌너 종양(Brenner tumor), 표면 상피 종양(surface epithelial tumor); 생식세포 종양(germ cell tumor), 예를 들면, 성숙(양성) 기형종(teratoma), 단배엽성 기형종(monodermal teratoma), 미성숙 악성 기형종, 미분화세포종(dysgerminoma), 내배엽성 동 종양(endodermal sinus tumor), 융모막암종(choriocarcinoma); 성기삭 간질성 종양(sex cord-stomal tumor), 예를 들면, 과립막-난포막세포 종양(granulosa-theca cell tumor), 난포막종-섬유종(thecoma-fibroma), 남성모세포종(androblastoma), 힐 세포 종양(hill cell tumor), 생식샘모세포종(gonadoblastoma); 그리고 전이성 종양, 예를 들면, 쿠르켄버그 종양(Krukenberg tumor)이 포함된다.
본 발명의 펩티드유사 거대고리는 두 번째 요법, 예를 들면, 표준 치료의 일부가 되는 요법과 함께 투여될 수 있다. 수술, 면역요법, 화학요법, 호르몬요법, 방사선요법, 또는 이들의 조합이 난소암에 가용한 일부 치료법이다. 일부 가용한 외과적 절차에는 덩어리 절제술(debulking), 그리고 일측(unilateral) 또는 양측(bilateral) 난소절제술(oophorectomy) 및/또는 일측 또는 양측 난관절제술(salpingectomy)이 포함된다.
이용될 수 있는 항암 약물에는 시클로포스파미드, 에토포시드(etoposide), 알트레타민(altretamine), 그리고 이포스파미드(ifosfamide)가 포함된다. 난소 종양을 축소시키기 위하여, 약물 타목시펜으로 호르몬요법이 이용될 수 있다. 방사선요법은 외부 방사선요법(external beam radiation therapy) 및/또는 근접요법(brachytherapy)일 수 있다.
전립선암
다른 측면에서, 본 발명의 펩티드유사 거대고리는 전립선암을 치료하는데 이용될 수 있다. 전립선암에는 선암종과 전이된 선암종이 포함된다. 본 발명의 펩티드유사 거대고리는 두 번째 요법, 예를 들면, 표준 치료의 일부가 되는 요법과 함께 투여될 수 있다. 전립선암의 치료는 수술, 방사선요법, 고강도 초음파 집속술(High Intensity Focused Ultrasound, HIFU), 화학요법, 냉동요법(cryotherapy), 호르몬요법, 또는 이들의 임의의 조합을 수반한다. 수술은 전립선절제술(prostatectomy), 회음부 근치적 전립선절제술(radical perineal prostatectomy), 복강경 근치적 전립선절제술(laparoscopic radical prostatectomy), 전립선의 경요도 절제술(transurethral resection) 또는 고환절제술(orchiectomy)을 수반할 수 있다. 방사선요법에는 외부 방사선요법 및/또는 근접요법이 포함된다. 호르몬요법에는 고환절제술(orchiectomy); 항안드로겐(antiandrogen), 예를 들면, 플루타미드(flutamide), 비칼루타미드(bicalutamide), 닐루타미드(nilutamide), 또는 시프로테론 아세테이트(cyproterone acetate)의 투여; 부신 안드로겐(adrenal androgen), 예를 들면, DHEA의 생산을 저해하는 약물, 예를 들면, 케토코나졸(ketoconazole) 및 아미노글루테티미드(aminoglutethimide); 그리고 GnRH 길항물질 또는 작동물질, 예를 들면, 아바렐릭스(Abarelix)(Plenaxis®), 세트로렐릭스(Cetrorelix)(Cetrotide®), 가니렐릭스(Ganirelix)(Antagon®), 레우프롤리드(leuprolide), 고세렐린(goserelin), 트립토렐린(triptorelin), 또는 부세렐린(buserelin)이 포함된다. 체내에서 안드로겐 활성을 차단하는 항-안드로겐제(anti-androgen agent)로 치료는 다른 가용한 요법이다. 이런 치료제에는 플루타미드, 비칼루타미드, 그리고 닐루타미드가 포함된다. 이러한 요법은 전형적으로, LHRH 유사체 투여 또는 고환절제술(orchiectomy)과 복합되는데, 이는 병용 안드로겐 차단요법(combined androgen blockade, CAB)으로 불린다. 화학요법에는 예로써, 코르티코스테로이드(corticosteroid), 예를 들면, 프레드니손(prednisone)과 함께 도세탁셀의 투여가 포함되지만 이에 국한되지 않는다. 항암제, 예를 들면, 독소루비신, 에스트라무스틴(estramustine), 에토포시드, 미톡산트론(mitoxantrone), 빈블라스틴(vinblastine), 파클리탁셀, 카보플라틴(carboplatin) 역시 전립선암의 성장을 지연시키고, 증상을 감소시키고, 삶의 질을 향상시키기 위하여 투여될 수 있다. 추가적인 화합물, 예를 들면, 비스포스포네이트(bisphophonate) 약물 역시 투여될 수 있다.
신장암
다른 측면에서, 본 발명의 펩티드유사 거대고리는 신장암을 치료하는데 이용될 수 있다. 신장암에는 신장 세포 암종(renal cell carcinoma), 신장외 원발성 신생물(extra-renal primary neoplasm)로부터 전이, 신장 림프종, 편평 세포 암종, 사구체옆 종양(juxtaglomerular tumor)(레닌종(reninoma)), 이행 세포 암종(transitional cell carcinoma), 혈관근육지방종(angiomyolipoma), 호산성세포종(oncocytoma) 및 윌름 종양(Wilm's tumor)이 포함되지만 이들에 국한되지 않는다. 본 발명의 펩티드유사 거대고리는 두 번째 요법, 예를 들면, 표준 치료의 일부가 되는 요법과 함께 투여될 수 있다. 신장암의 치료는 수술, 경피 요법, 방사선요법, 화학요법, 백신, 또는 기타 약물을 수반할 수 있다. 본 발명의 펩티드유사 거대고리와 공동으로, 신장암의 치료에 유용한 외과적 기술에는 부신(adrenal gland), 후복막 림프절(retroperitoneal lymph node), 그리고 종양의 침입에 의해 피해를 입은 임의의 다른 주변 조직의 제거를 포함하는 신장절제술(nephrectomy)이 포함된다. 경피 요법에는 예로써, 종양의 이미지화와 그 이후에, 방사주파 절제술(radiofrequency ablation)에 의한 종양의 표적화된 파괴를 수반하는 이미지-유도 요법(image-guided therapy) 또는 냉동요법(cryotherapy)이 포함된다. 일부 사례에서, 신장암을 치료하는데 유용한 다른 화학치료제 또는 다른 약물은 알파-인터페론, 인터루킨-2, 베바시주맙, 소라페닙(sorafenib), 수니팁(sunitib), 템시롤리무스(temsirolimus) 또는 기타 키나아제 저해물질(kinase inhibitor)일 수 있다.
췌장암
다른 측면에서, 본 발명에서는 본 발명의 펩티드유사 거대고리를 투여함으로써 췌장암, 예를 들면, 췌장관 조직에서 상피모양 암종(epitheliod carcinoma) 및 췌장관에서 선암종에서 선택되는 췌장암을 치료하는 방법을 제시한다. 가장 일반적인 유형의 췌장암은 췌장관의 내막(lining)에서 발생하는 선암종이다. 췌장암에 가용한 치료법에는 수술, 면역요법, 방사선요법, 그리고 화학요법이 포함된다. 가능한 외과적 치료 옵션에는 원위 또는 전체 췌장절제술(pancreatectomy) 및 이자샘창자절제술(pancreaticoduodenectomy)(Whipple 절차)이 포함된다. 방사선요법, 구체적으로 신체 외부에서 기계에 의해 방사선이 종양에 집중되는 외부 방사(external beam radiation)가 췌장암 환자에 한 가지 옵션일 수 있다. 다른 옵션은 수술 동안 제공되는 수술중 전자 방사(intraoperative electron beam radiation)이다. 화학요법 역시 췌장암 환자를 치료하는데 이용될 수 있다. 적절한 항암제에는 5-플루오르우라실(5-FU), 미토마이신(mitomycin), 이포스파미드, 독소루비신, 스트렙토조신(streptozocin), 클로로조토신(chlorozotocin), 그리고 이들의 조합이 포함되지만 이들에 국한되지 않는다. 본 발명에 의해 제공되는 방법은 본 발명의 폴리펩티드의 투여에 의해, 또는 펩티드유사 거대고리의 투여 및 수술, 방사선요법, 또는 화학요법의 조합에 의해 췌장암 환자에 유익한 효과를 제공할 수 있다.
결장암
한 측면에서, 본 발명의 펩티드유사 거대고리는 비-신생성 폴립(polyp), 선종(adenoma), 가족성 증후군(familial syndrome), 결장직장 발암(colorectal carcinogenesis), 결장직장 암종(colorectal carcinoma), 그리고 카르시노이드 종양(carcinoid tumor)이 포함되지만 이들에 국한되지 않는 결장암의 치료에 이용될 수 있다. 본 발명의 펩티드유사 거대고리와 함께 이용될 수 있는 결장암에 가용한 치료법에는 수술, 화학요법, 방사선요법 또는 표적화된 약물 요법이 포함된다.
방사선요법에는 외부 방사선요법 및/또는 근접요법이 포함된다. 화학요법은 전이 발생의 가능성을 감소시키거나, 종양 크기를 축소하거나, 또는 종양 성장을 지연시키는데 이용될 수 있다. 화학요법은 종종, 수술(어쥬번트) 이후에, 수술(네오-어쥬번트) 이전에, 또는 수술이 처방되지 않으면 일차 요법(primary therapy)(경감)으로서 적용된다. 가령, 어쥬번트 화학요법에 대한 예시적인 섭생은 주입성(infusional) 5-플루오르우라실, 류코보린(leucovorin), 그리고 옥살리플라틴(oxaliplatin)의 조합(FOLFOX)을 수반한다. 제1선 화학요법 섭생은 표적화된 약물, 예를 들면, 베바시주맙, 세툭시맙(cetuximab) 또는 파니투무맙(panitumumab)과 함께 주입성 5-플루오르우라실, 류코보린, 그리고 옥살리플라틴(FOLFOX)의 조합, 또는 표적화된 약물, 예를 들면, 베바시주맙, 세툭시맙 또는 파니투무맙과 함께 주입성 5-플루오르우라실, 류코보린, 그리고 이리노테칸(irinotecan)(FOLFIRI)의 조합을 수반할 수 있다. 본 발명의 펩티드유사 거대고리와 공동으로, 결장암의 치료 또는 예방에 유용한 기타 화학치료제는 보르테조밉(Bortezomib)(Velcade®), 오블리메르센(Oblimersen)(Genasense®, G3139), 제피티닙(Gefitinib)과 엘로티닙(Erlotinib)(Tarceva®) 및 토포테칸(Hycamtin®)이다.
폐암
일부 구체예에서는 본 발명의 펩티드유사 거대고리를 이용하여 폐암을 치료하는 방법을 제시한다. 폐의 세포 증식성 및/또는 분화성 질환의 실례에는 종양부수 증후군(paraneoplastic syndrome), 세기관지폐포 암종(bronchioloalveolar carcinoma), 신경내분비 종양(neuroendocrine tumor), 예를 들면, 기관지 카르시노이드(bronchial carcinoid), 기타 종양, 전이성 종양을 비롯한 기관지유래 암종(bronchogenic carcinoma); 염증성 흉막 유출(inflammatory pleural effusion), 비-염증성 흉막 유출(noninflammatory pleural effusion), 기흉(pneumothorax)을 비롯한 흉막의 병리; 그리고 고립 섬유 종양(solitary fibrous tumor)(흉막 섬유종(pleural fibroma))과 악성 중피종(malignant mesothelioma)을 비롯한 흉막 종양이 포함되지만 이들에 국한되지 않는다.
가장 일반적인 유형의 폐암은 비-소형 세포 폐암(NSCLC)인데, 이는 폐암의 대략 80-85%를 차지하고, 편평 세포 암종, 선암종, 그리고 대세포 미분화 암종으로 구분된다. 소형 세포 폐암, 예를 들면, 소형 세포 폐 암종은 폐암의 15-20%를 차지한다. 폐암에 대한 치료 옵션에는 수술, 면역요법, 방사선요법, 화학요법, 광역학 요법(photodynamic therapy), 또는 이들의 조합이 포함된다. 폐암 치료를 위한 일부 가능한 외과적 옵션은 부분 또는 쐐기 절제술, 폐엽절제술(lobectomy), 또는 폐절제술(pneumonectomy)이다. 방사선요법은 외부 방사선요법 또는 근접요법이다. 본 발명의 펩티드유사 거대고리와 공동으로, 폐암을 치료하는 화학요법에 이용될 수 있는 일부 항암제에는 시스플라틴(cisplatin), 카보플라틴, 파클리탁셀, 도세탁셀, 젬시타빈(gemcitabine), 비노렐빈(vinorelbine), 이리노테칸, 에토포시드, 빈블라스틴, 제피티닙, 이포스파미드, 메토트렉세이트, 또는 이들의 조합이 포함된다. 광역학 요법(PDT)이 폐암 환자를 치료하는데 이용될 수 있다. 본 명세서에 기술된 방법은 펩티드유사 거대고리의 투여에 의해, 또는 펩티드유사 거대고리의 투여 및 수술, 방사선요법, 화학요법, 광역학 요법, 또는 이들의 조합의 조합에 의해, 폐암 환자에 유익한 효과를 제공할 수 있다.
간의 세포 증식성 및/또는 분화성 질환의 실례에는 결절 과형성(nodular hyperplasia), 선종(adenoma), 그리고 간의 원발성 암종과 전이성 종양을 비롯한 악성 종양이 포함되지만 이들에 국한되지 않는다.
면역증식성 질환
면역증식성 질환(일명, “면역증식성 장애” 또는 “면역증식성 신생물”)은 B 세포, T 세포와 자연 킬러(NK) 세포를 비롯한 면역계(immune system)의 일차 세포의 비정상적인 증식, 또는 면역글로불린(immunoglobulin)(일명, 항체)의 과도한 생산으로 특징되는 면역계의 질환이다. 이런 질환에는 일반적인 범주의 림프증식성 질환, 고감마글로불린혈증(hypergammaglobulinemia), 그리고 파라단백혈증(paraproteinemia)이 포함된다. 이런 질환의 실례에는 X-염색체 연관 림프증식성 질환, 성염색체(autosomal) 림프증식성 질환, 과(過) IgM 증후군(Hyper-IgM syndrome), 중쇄 질환(heavy chain disease), 그리고 한랭글로불린혈증(cryoglobulinemia)이 포함되지만 이들에 국한되지 않는다. 다른 면역증식성 질환은 이식편 대 숙주 질환(graft versus host disease, GVHD); 건선(psoriasis); 이식 장기 거부반응과 연관된 면역질환; T 세포 림프종; T 세포 급성 림프모구성 백혈병; 고환 혈관중심성(angiocentric) T 세포 림프종; 양성 림프구 혈관염(benign lymphocytic angiitis); 그리고 자가면역 질환, 예를 들면, 홍반성 낭창(lupus erythematosus), 하시모토 갑상선염(Hashimoto's thyroiditis), 원발성 점액수종(primary myxedema), 그레이브씨병(Graves' disease), 악성 빈혈(pernicious anemia), 자가면역 위축성 위염(autoimmune atrophic gastritis), 애디슨병(Addison's disease), 인슐린 의존성 당뇨병(insulin dependent diabetes mellitis), 굿 패스츄어 증후군(good pasture's syndrome), 중증근무력증(myasthenia gravis), 천포창(pemphigus), 크론병(Crohn's disease), 교감성 안결막염(sympathetic ophthalmia), 자가면역 포도막염(autoimmune uveitis), 다발성 경화증(multiple sclerosis), 자가면역성 용혈성 빈혈(autoimmune hemolytic anemia), 특발성 혈소판감소성 자반병(idiopathic thrombocytopenia), 원발성 담즙성 간경변(primary biliary cirrhosis), 만성 활동 간염(chronic action hepatitis), 궤양성 대장염(ulceratis colitis), 쇼그렌 증후군(Sjogren's syndrome), 류머티스성 관절염(rheumatoid arthritis), 다발근육염(polymyositis), 경피증(scleroderma), 그리고 혼성 연결 조직 질환(mixed connective tissue disease)일 수 있다.
복합 치료
한 구체예에서, 본 발명의 펩티드유사 거대고리는 알킬화제와 알킬화-유사제와 함께, 암의 치료에 이용될 수 있다. 이런 작용제에는 예로써, 질소 겨자(nitrogen mustard), 예를 들면, 클로람부실(chlorambucil), 클로르메틴(chlormethine), 시클로포스파미드, 이포스파미드, 그리고 멜팔란(melphalan); 니트로소우레아(nitrosourea), 예를 들면, 카르무스틴(carmustine), 포테무스틴(fotemustine), 로무스틴(lomustine), 스트렙토조신; 백금(platinum) 치료제, 예를 들면, 카보플라틴, 시스플라틴, 옥살리플라틴, BBR3464, 사트라플라틴(satraplatin); 또는 부설판(busulfan), 다카르바진(dacarbazine), 프로카르바진(procarbazine), 테모졸로미드(temozolomide), 티오테파(thiotepa), 트레오설판(treosulfan), 또는 우라무스틴(uramustine)이 포함되지만 이들에 국한되지 않는 작용제가 포함된다.
다른 구체예에서, 본 발명의 펩티드유사 거대고리는 항대사산물인 항신생물제(antineoplastic agent)와 병용될 수 있다. 가령, 이런 항신생물제는 엽산(folic acid), 예를 들면, 아미노프테린(aminopterin), 메토트렉세이트, 페메트렉세드(pemetrexed), 또는 랄티트렉세드(raltitrexed)일 수 있다. 대안으로, 항신생물제는 클라드리빈(cladribine), 클로파라빈(clofarabine), 플루다라빈(fludarabine), 메르캅토퓨린(mercaptopurine), 펜토스타틴(pentostatin), 티오구아닌(thioguanine)이 포함되지만 이들에 국한되지 않는 퓨린(purine)일 수 있다. 진전된 구체예에서, 항신생물제는 피리미딘(pyrimidine), 예를 들면, 카페시타빈(capecitabine), 시타라빈(cytarabine), 플루오르우라실, 플록수리딘(floxuridine), 그리고 젬시타빈일 수 있다.
또 다른 구체예에서, 본 발명의 펩티드유사 거대고리는 독물/유사분열 저해물질(mitotic inhibitor)인 항신생물제와 병용될 수 있다. 이러한 범주의 작용제에는 탁산(taxane), 예를 들면, 도세탁셀과 파클리탁셀; 그리고 빈카 알카로이드(vinca alkaloid), 예를 들면, 빈블라스틴, 빈크리스틴(vincristine), 빈데신(vindesine), 비노렐빈이 포함된다. 또 다른 구체예에서, 본 발명의 펩티드유사 거대고리는 안트라사이클린(anthracycline) 집단으로부터 세포독성/항종양 항생제인 항신생물제, 예를 들면, 다우노루비신(daunorubicin), 독소루비신, 에피루비신, 이다루비신(idarubicin), 미톡산트론, 픽산트론(pixantrone), 또는 발루비신(valrubicin); 스트렙토미세스균(streptomyces) 과(科)로부터 항생제, 예를 들면, 악티노마이신(actinomycin), 블레오마이신(bleomycin), 미토마이신, 또는 플리카마이신(plicamycin); 또는 히드록시우레아(hydroxyurea)와 병용될 수 있다. 대안으로, 복합 요법에 이용되는 작용제는 캄포테신(camptothecin), 토포테칸, 이리노테칸, 에토포시드, 또는 테니포시드(teniposide)가 포함되지만 이들에 국한되지 않는 국소이성화효소 저해물질(topoisomerase inhibitor)일 수 있다.
대안으로, 항신생물제는 항체 또는 항체-유래된 작용제일 수 있다. 가령, 수용체 티로신 키나아제-표적화된 항체, 예를 들면, 세툭시맙, 파니투무맙, 또는 트라스투주맙(trastuzumab)이 이용될 수 있다. 대안으로, 항체는 항-CD20 항체, 예를 들면, 리툭시맙(rituximab) 또는 토시투모맙(tositumomab), 또는 알렘투주맙(alemtuzumab), 베바시주맙, 그리고 젬투주맙(gemtuzumab)이 포함되지만 이들에 국한되지 않는 임의의 다른 적절한 항체일 수 있다. 다른 구체예에서, 항신생물제는 광민감물질(photosensitizer), 예를 들면, 아미노레불린산(aminolevulinic acid), 메틸 아미노레불린산염, 포르피머 나트륨(porfimer sodium), 또는 베르테포르핀(verteporfin)이다. 또 다른 구체예에서, 항신생물제는 티로신 키나아제 저해물질, 예를 들면, 데디라닙(dediranib), 다사티닙(dasatinib), 엘로티닙, 제피티닙(gefitinib), 이마티닙(imatinib), 라파티닙(lapatinib), 닐로티닙(nilotinib), 소라페닙, 수니티닙(sunitinib), 또는 반데타닙(vandetanib)이다. 본 발명에 이용하기 적합한 다른 신생물제에는 예로써, 알리트레티노인(alitretinoin), 트레티노인(tretinoin), 알트레타민, 암사크린(amsacrine), 아나그렐리드(anagrelide), 삼산화비소(arsenic trioxide), 아스파라기나아제(asparaginase)(페가스파라가아제(pegaspargase)), 벡사로텐(bexarotene), 보르테조밉, 데닐류킨 디프티녹스(denileukin diftitox), 에스트라무스틴, 익사베필론(ixabepilone), 마소프로콜(masoprocol), 또는 미토탄(mitotane)이 포함된다.
다른 또는 진전된 구체예에서, 본 명세서에 기술된 펩티드유사 거대고리는 과다활성 세포 사멸 또는 생리학적 손상(physiologic insult) 등에 기인한 세포 사멸로 특징되는 질환을 치료, 예방 또는 진단하는데 이용된다. 조기 또는 원치 않는 세포 사멸, 또는 대안으로, 원치 않는 또는 과도한 세포 증식으로 특징되는 질환의 일부 실례에는 저세포성(hypocellular)/저형성(hypoplastic), 무세포성(acellular)/무형성(aplastic), 또는 고세포성(hypercellular)/고형성(hyperplastic) 장애가 포함되지만 이들에 국한되지 않는다. 일부 실례에는 판코니 빈혈(fanconi anemia), 재생불량빈혈(aplastic anemia), 지중해빈혈(thalaessemia), 선천성 호중구감소증(congenital neutropenia), 척수형성이상증(myelodysplasia)이 포함되지만 이들에 국한되지 않는 혈액 이상(hematologic disorder)이 포함된다.
다른 또는 진전된 구체예에서, 아폽토시스를 감소시키는 기능을 하는 본 발명의 펩티드유사 거대고리는 원치 않는 수준의 세포 사멸과 연관된 질환을 치료하는데 이용된다. 따라서 일부 구체예에서, 본 발명의 항-아폽토시스 펩티드유사 거대고리는 바이러스 감염과 연관된 세포 사멸로 이어지는 질환, 예를 들면, 인간 면역결핍 바이러스(human immunodeficiency virus, HIV)로 감염과 연관된 감염과 같은 질환을 치료하는데 이용된다. 다양한 신경학적 질환(neurological disease)이 특정한 뉴런(neuron) 세트의 점진적인 감소로 특징되며, 본 발명의 항-아폽토시스 펩티드유사 거대고리가 일부 구체예에서, 이들 질환의 치료에 이용된다. 이런 질환에는 알츠하이머병(Alzheimer's disease), 파킨슨씨병(Parkinson's disease), 근위축성 축삭 경화증(amyotrophic lateral sclerosis, ALS), 망막세포변성(retinitis pigmentosa), 척수성 근위축증(spinal muscular atrophy), 그리고 다양한 형태의 소뇌 변성(cerebellar degeneration)이 포함된다. 이들 질환에서 세포 손실은 염증 반응(inflammatory response)을 유도하지 않으며, 아폽토시스가 세포 사멸의 기전인 것으로 생각된다. 이에 더하여, 다수의 혈액 질환이 혈액 세포의 감소된 생산과 연관된다. 이들 질환에는 만성 질환과 연관된 빈혈, 재생불량빈혈, 만성 백혈구감소증(chronic neutropenia), 골수이형성 증후군(myelodysplastic syndrome)이 포함된다. 혈액 세포 생산의 장애, 예를 들면, 골수이형성 증후군 및 재생불량빈혈의 일부 형태는 골수(bone marrow) 내에서 증가된 아폽토시스 세포 사멸과 연관된다. 이들 질환은 아폽토시스, 간질 세포 또는 조혈 생존 인자(hematopoietic survival factor)의 후천적 결핍(acquired deficiency), 또는 독소 및 면역 반응의 매개자의 직접적인 효과를 촉진하는 유전자의 활성화로부터 기인할 수 있다. 세포 사멸과 연관된 2가지 일반적인 질환은 심근 경색(myocardial infarction)과 뇌졸중(stroke)이다. 양쪽 질환에서, 혈류(blood flow)의 급성 감소의 현상 동안 생성되는, 허혈(ischemia)의 중심 부위 내에 세포는 괴사(necrosis)의 결과로써 급속하게 사멸하는 것으로 보인다. 하지만, 중심 허혈 구역(central ischemic zone) 외부에서, 세포는 더욱 연장된 기간에 걸쳐 사멸하고 형태학적으로, 아폽토시스에 의해 사멸하는 것으로 보인다.
기타 이용 방법
다른 또는 진전된 구체예에서, 본 발명의 항-아폽토시스 펩티드유사 거대고리는 바람직하지 않은 세포 사멸과 연관된 이와 같은 모든 질환을 치료하는데 이용된다.
본 명세서에 기술된 펩티드유사 거대고리로 치료되는 면역질환의 일부 실례에는 이식 장기 거부반응, 관절염, 낭창, IBD, 크론병, 천식, 다발성 경화증, 당뇨병 등이 포함되지만 이들에 국한되지 않는다.
본 명세서에 기술된 펩티드유사 거대고리로 치료되는 신경질환의 일부 실례에는 알츠하이머병(Alzheimer's Disease), 다운 증후군(Down's Syndrome), 네덜란드 타입 유전성 뇌출혈 아밀로이드증(Dutch Type Hereditary Cerebral Hemorrhage Amyloidosis), 반동적 아밀로이드증(Reactive Amyloidosis), 두드러기와 난청을 동반하는 가족성 아밀로이드 신경병증(Familial Amyloid Nephropathy), 머클 웰스 증후군(Muckle-Wells Syndrome), 특발성 골수종(Idiopathic Myeloma); 마크로글로불린혈증-연관된 골수종(Macroglobulinemia-Associated Myeloma), 가족성 아밀로이드 다발신경병증병리(Familial Amyloid Polyneuropathy), 가족성 아밀로이드 심근증(Familial Amyloid Cardiomyopathy), 국한된 심장 아밀로이드(Isolated Cardiac Amyloid), 전신 노인성 아밀로이드증(Systemic Senile Amyloidosis), 성년 개시 당뇨병(Adult Onset Diabetes), 도선종(Insulinoma), 국한된 심방 아밀로이드(Isolated Atrial Amyloid), 갑상선의 수질성 암종, 가족성 아밀로이드증(Familial Amyloidosis), 아밀로이드증을 동반하는 유전성 뇌출혈(Hereditary Cerebral Hemorrhage), 가족적 아밀로이드 다발신경병증병리(Familial Amyloidotic Polyneuropathy), 스크래피(Scrapie), 크로이츠펠트-야콥병(Creutzfeldt-Jacob Disease), 게스트만-스트러슬러-샤인커 증후군(Gerstmann Straussler-Scheinker Syndrome), 소 해면상 뇌증(Bovine Spongiform Encephalitis), 프리온-매개된 질환(prion-mediated disease), 그리고 헌팅턴병(Huntington's Disease)이 포함되지만 이들에 국한되지 않는다.
본 명세서에 기술된 펩티드유사 거대고리로 치료되는 내분비 장애(endocrinologic disorder)의 일부 실례에는 당뇨병(diabetes), 갑상선 기능저하증(hypothyroidism), 뇌하수체저하증(hypopituitarism), 부갑상샘저하증(hypoparathyroidism), 생식샘저하증(hypogonadism) 등이 포함되지만 이들에 국한되지 않는다.
본 발명의 펩티드유사 거대고리로 치료 또는 예방되는 심혈관 질환(cardiovascular disorder)(가령, 염증 질환(inflammatory disorder))의 실례에는 동맥경화증(atherosclerosis), 심근 경색(myocardial infarction), 뇌졸중(stroke), 혈전증(thrombosis), 맥류(aneurism), 심부전(heart failure), 허혈성 심장 질환(ischemic heart disease), 협심증(angina pectoris), 심장 돌연사(sudden cardiac death), 고혈압 심장병(hypertensive heart disease); 비-관상 혈관 질환(non-coronary vessel disease), 예를 들면, 세동맥경화증(arteriolosclerosis), 소혈관 질환(small vessel disease), 신경병증(nephropathy), 고중성지방혈증(hypertriglyceridemia), 고콜레스테롤혈증(hypercholesterolemia), 고지질혈증(hyperlipidemia), 황색종증(xanthomatosis), 천식(asthma), 고혈압(hypertension), 기종(emphysema) 및 만성 폐 질환(chronic pulmonary disease); 또는 개입 절차(interventional procedure)와 연관된 심혈관 장애(“절차적 혈관 외상(procedural vascular trauma)”), 예를 들면, 혈관성형술(angioplasty), 션트(shunt), 스텐트(stent), 합성 또는 자연 절단 이식편(excision graft), 내재 카테터(indwelling catheter), 밸브(valve) 또는 다른 삽입형 장치의 배치 이후에 재협착증(restenosis)이 포함되지만 이들에 국한되지 않는다. 우선되는 심혈관 질환에는 동맥경화증(atherosclerosis), 심근 경색(myocardial infarction), 맥류(aneurism), 그리고 뇌졸중(stroke)이 포함된다.
실시예
아래의 섹션에서는 본 발명의 예시적인 실례를 제공한다.
실시예 1. 본 발명의 펩티드유사 거대고리의 합성.
α-나선 BID와 BIM 펩티드유사 거대고리는 기존 문헌(Walensky et al (2004) Science 305:1466-70; Walensky et al (2006) Mol Cell 24:199-210)에서 기술되고, 그리고 하기에 지시된 바와 같이 합성되고, 정제되고, 분석되었다. 본 연구에 이용되는 거대고리는 하기에 도시된다. 상응하는 가교되지 않은 폴리펩티드는 “WT 서열”로서 지시되고, 본 발명의 펩티드유사 거대고리의 자연 대응물을 나타낸다.
올레핀 측쇄를 내포하는 알파, 알파-이중치환된 비-자연 아미노산은 Williams et al. (1991) J. Am. Chem. Soc. 113:9276; 그리고 Schafmeister et al. (2000) J. Am. Chem Soc. 122:5891에 따라 합성되었다. BID-BH3과 BIM-BH3 펩티드유사 거대고리는 2개의 자연 발생 아미노산을 상응하는 합성 아미노산으로 치환함으로써 설계되었다. 치환은 i와 i+4 위치에서 만들어졌다. BID BH3과 BIM-BH3 거대고리는 고상 펩티드 합성, 그 이후에 올레핀-내포 측쇄를 통해 이들 합성 아미노산의 올레핀 복분해-기초된 가교에 의해 산출되었다. BID와 BIM 펩티드유사 거대고리에 대한 조절 서열(control sequence), 그리고 발생된 특정한 서열 돌연변이는 상기에 도시된다.
도시된 서열에서, “Nle”은 노르류신을 나타내고, “Aib”는 2-아미노이소부티르산을 나타내고, “Chg”는 시클로헥실글리신을 나타내고, “Ac”는 아세틸을 나타내고, “Pr”은 프로피오닐을 나타낸다. $로 표시된 아미노산은 하나의 이중 결합을 포함하는 전체-탄소 가교제를 연결하고, 그리고 여기서 가교제가 부착된 각 α-탄소 원자는 메틸 기로 추가적으로 치환된다. 모든 경우에, 가교제는 각 아미노산의 알파 탄소 사이에 8개의 탄소 원자를 포함하는 선형 전체-탄소 가교제이다. 이중 결합이 존재하면, 네 번째와 다섯 번째 탄소 원자 사이에 배치된다.
비-자연 아미노산(5-탄소 올레핀 아미노산의 R과 S 거울상이성질체 및 8-탄소 올레핀 아미노산의 S 거울상이성질체)은 핵 자기 공명(nuclear magnetic resonance, NMR) 분광법(Varian Mercury 400) 및 질량 분석법(mass spectrometry)(Micromass LCT)에 의해 특성화되었다. 펩티드 합성은 고상 조건, 링크 아미드 AM 수지(Novabiochem), 그리고 Fmoc 주쇄 보호기 화학을 이용하여 수작업으로, 또는 자동화 펩티드 합성장치(Applied Biosystems, model 433A)에서 수행되었다. 자연 Fmoc-보호된 아미노산(Novabiochem)의 커플링(coupling)을 위하여, 10 당량의 아미노산 및 1:1:2 몰 비율(molar ratio)의 커플링 시약 HBTU/HOBt(Novabiochem)/DIEA가 이용되었다. 비-자연 아미노산(4 당량)이 1:1:2 몰 비율의 HATU(Applied Biosystems)/HOBt/DIEA와 연결되었다. 올레핀 복분해는 탈기(degassing)된 디클로로메탄에 용해되고 실온에서 2시간 동안 반응된 10 mM Grubbs 촉매(Blackewell et al. 1994 supra)(Strem Chemicals)를 이용하여 고상에서 수행되었다. 복분해된 화합물의 분리는 가공되지 않은 산물을 산출하는 트리플루오르아세트산-매개된 탈보호와 절단, 에테르 침전, 그리고 순수한 화합물을 산출하는, 역상 C18 칼럼(Varian)에서 고성능 액체 크로마토그래피(high performance liquid chromatography, HPLC)(Varian ProStar)의해 달성되었다. 순수한 산물의 화학적 조성은 LC/MS 질량 분석법(Agilent 1100 HPLC 시스템과 인터페이스로 접속된 Micromass LCT) 및 아미노산 분석(Applied Biosystems, 420A 모델)에 의해 확인되었다.
세포주:
본 연구에 이용된 세포주는 하기 표에 지시된다:
실시예 2. 세포 생존능 분석:
도 1-32에 도시된 세포 생존능 분석은 아래의 프로토콜에 따라 수행되었다. 필요한 경우에, 종양 세포주를 특수한 혈청-보충된 배지(성장 배지)에서 성장시켰다. 연구 개시 전일에, 세포를 마이크로역가 평판 내에 200 ㎕ 성장 배지에서 최적 세포 밀도(cell density)(15,000 내지 25,000개 세포/웰)로 도말하였다. 익일에, 세포를 혈청-없는/페놀 레드(phenol red)-없는 RPMI 완전 배지(분석 완충액)에서 2회 세척하고, 100 ㎕ 최종 부피의 분석 완충액을 각 웰에 첨가하였다. 인간 말초혈 림프구(human peripheral blood lymphocyte, hPBL)를 Ficoll-Paque 구배 분리(gradient separation)로 버피 코트(Buffy coat)(San Diego Blood Bank)로부터 분리하고, 실험 당일에 25,000개 세포/웰로 도말하였다.
펩티드유사 거대고리를 무균수에서 1 mM 스톡(stock)(100% DMSO)으로부터 희석하여 400 μM 작업 용액(working solution)을 준비하였다. 이후, 펩티드유사 거대고리와 대조를 10 또는 40배 희석하거나, 또는 대안으로, 약액주입 평판(dosing plate) 내에 분석 완충액에서 연속으로 2-배 희석하여 각각, 40과 20 μM 또는 1.2 내지 40 μM의 농도를 제공하였다. 이후, 각각 20 또는 5 μM, 또는 0.6 내지 20 μM에 상당하는 펩티드유사 거대고리의 최종 농도를 달성하기 위하여, 100 ㎕의 각 희석액을 검사 평판의 적절한 웰에 첨가하였다. 대조에는 펩티드유사 거대고리를 내포하는 웰에서와 동일한 농도의 DMSO를 내포하지만 펩티드유사 거대고리가 없는 웰, 0.1% Triton X-100을 내포하는 웰, 1 μM 벨케이트(Velcade), 100 μM 에토포시드(Etoposide)와 20 μM 탁솔(Taxol)로 구성되는 케모 칵테일(chemo cocktail)을 내포하는 웰, 그리고 세포를 내포하지 않는 웰이 포함되었다. 평판을 가습된 5% CO2 공기에서 37℃에서 4시간 동안 배양하였다.
4시간 배양 시간의 종결 무렵에, 10% FBS의 총 농도를 위하여 22 ㎕ FBS를 각 웰에 첨가하였다. 혈청의 첨가후, 평판을 가습된 5% CO2 공기에서 37℃에서 추가로 44시간 동안 배양하였다. 배양 기간의 종결 시점에서, 제조업체의 사용설명서(Sigma, 카탈로그 #M2128)에 따라 MTT 분석을 수행하고, Dynex Opsys MR 평판 판독기를 이용하여 560nm에서 흡광도(absorbance)를 측정하였다.
도 1-3에서, 값은 세포독성 비율(percent cytotoxicity), 다시 말하면, 100% 세포 사멸에 상응하는 양성 대조(positive control)의 비율로서 플롯팅(plotting)되었다. 도 4-15, 25와 26에서, 값은 생존 비율(percent viable), 다시 말하면, 100% 생존 세포에 상응하는 음성 대조(negative control)의 비율로서 플롯팅되었다. 모든 분석은 4중으로 수행되었다.
도 1에서는 SP-1(20 μM)로 처리되고 검사 물품 첨가 48시간 전에 MTT 분석으로 세포 생존능에 대하여 평가된 인간 종양 세포주를 도시한다. 조사된 모든 백혈병/림프종 세포주는 SP-1에 민감하였다. 이에 더하여, SP-1은 3가지 소형 세포 폐 암종(SCLC) 세포주, NCI-H220, NCI-H128와 NCI-H146을 비롯한 여러 고형 종양 세포주의 아폽토시스를 유도하였다. 역으로, 비-소형 세포 폐 암종(NSCLC) 세포주 A-549와 H-460, MCF7(유방암) 및 U251(신경교종)을 비롯한, SP-1에 내성인 여러 고형 종양 세포주가 존재하였다. 도 2에서는 48시간 동안 5 μM의 SP-1 또는 SP-4로 처리되고, 세포 생존능에 대하여 평가된 7가지 백혈병/림프종 인간 세포주를 도시한다. 도시된 바와 같이, 모든 세포주는 상기 농도에서, 양쪽 거대고리에 유사한 민감도를 나타냈다.
도 3에서는 SP-1 또는 SP-4(20 μM)에 대한 민감도에 대하여 조사된 12가지 인간 고형 종양 세포주를 도시한다. 도시된 바와 같이, 조사된 각 거대고리에 대한 민감도의 세포-특이적 차이가 존재하는 것으로 보인다. 개별 세포주에 대한 SP-1, SP-2, SP-3, SP-4, SP-5와 SP-6의 EC50 곡선은 도 4-15에 도시된다.
도 34-52에 도시된 세포 생존능 분석은 유사한 프로토콜에 따라 수행되었다. 세포를 연구 개시 전일에 최적 세포 밀도에서 분할하였다. 익일에, 세포를 혈청-없는 Opti-MEM 배지에서 2회 세척하고, 4000개 세포/웰을 100 ㎕ Opti-MEM의 최종 부피로 각 웰에 첨가하였다. 혈청-없는 실험을 위하여, 거대고리를 무균수에서 2 mM 스톡(100% DMSO)으로부터 희석하여 400 μM 작업 용액을 준비하였다. 이후, 분석 완충액에서 10-배 희석으로 40 μM 용액을 산출하였다. 이후, 거대고리와 대조를 약액주입 평판 내에 분석 완충액에서 연속으로 2-배 희석하여 각각 1.2 내지 40 μM의 농도를 제공하였다. 2% 인간 혈청에서 실험을 위하여, 거대고리를 무균수에서 10 mM 스톡(100% DMSO)으로부터 희석하여 1 mM 작업 용액을 준비하였다. 이후, 분석 완충액에서 10-배 희석으로 100 μM 용액을 산출하였다. 이후, 거대고리와 대조를 약액주입 평판 내에 분석 완충액에서 연속으로 2-배 희석하여 각각 3 내지 100 μM의 농도를 제공하였다. 이후, 각각 0.6 또는 20 μM(혈청-없는 실험의 경우), 또는 1.5 내지 50 μM(2% 혈청 실험의 경우)에 상당하는 펩티드유사 거대고리의 최종 농도를 달성하기 위하여, 50 ㎕의 각 희석액을 검사 평판의 적절한 웰에 첨가하였다. 대조에는 펩티드유사 거대고리를 내포하는 웰에서와 동일한 농도의 DMSO를 내포하지만 펩티드유사 거대고리가 없는 웰, 0.1% Triton X-100을 내포하는 웰, 그리고 세포를 내포하지 않는 웰이 포함되었다. 평판을 가습된 5% CO2 공기에서 37℃에서 24시간 동안 배양하였다. 24시간 배양 기간의 종결 시점에서, 제조업체의 사용설명서(Promega, 카탈로그 #G7571)에 따라 CellTiter-Glo 발광 세포 생존능 분석을 수행하고, BIO-TEK 시너지 HT 평판 판독기를 이용하여 발광(luminescence)을 측정하였다. 값은 생존 비율(percent viable), 다시 말하면, 음성 대조 값(DMSO 단독에 노출된 세포로부터 획득됨)의 비율로서 플롯팅되었다. 모든 분석은 이중으로 수행되었다.
아래의 표에서는 다양한 세포주에서 본 발명의 펩티드유사 거대고리로 관찰된 EC50 값()을 요약한다:
혈청-없는 배지에서 EC50 값
2% 인간 혈청에서 EC50 값
다양한 액상 종양(liquid tumor)에 대한 EC50 값
실시예 3. BrdU 세포 증식 분석.
2가지 상이한 공여자로부터 분리된 hPBL는 5 ㎍/㎖ PHA, 1 μM 이노마이신과 1 ㎍/㎖ LPS로 자극되거나 자극되지 않고, 분석 완충액에서 5 또는 20 μM의 SP-1로 처리되었다. 1 μM 라파마이신이 BrdU 통합을 저해하는 양성 대조로서 이용되었다. 이들 세포를 도 17에서 지시된 조건 하에 48시간 동안 배양하였다. 제조업체의 사용설명서(Roche, 카탈로그 번호 11444611001)에 따라 ELISA로 BrdU 통합을 분석하였다. 도 7에서, Y 축은 OD= 흡광도(A405nm/A492 nm.)를 나타낸다.
실시예
4. 인간 백혈병 이종이식 모형에서
펩티드유사
거대고리의 효능
루시페라제를 안정적으로 발현하는 SEMK2-LN 세포는 기존 문헌(Armstrong et al (2003) Cancer Cell 3:173-83)에서 기술된 바와 같이 산출되었다. 6-8주령 암컷 NOD-SCID 생쥐(Jackson Laboratory)의 꼬리 정맥(tail vein)에 5 x 106개 SEMK2-LN 세포를 주입하였다. 이들 동물은 기존 문헌(Walensky et al., Science 305:1466-1470 (2004))에서 기술된 바와 같이, Xenogen의 생체내 이미지화 시스템(Caliper Life Sciences)을 이용하여 이미지화되고, 전신 생물발광(total body bioluminescence)이 광자 유동(photonic flux)(광자/sec)의 적분(Xenogen 생체내 이미지화 시스템의 경우에 Living Imaging Software, Caliper Life Sciences)에 의해 정량되었다. 동물은 백혈병 세포의 주입후 8일과 12일에, 확립된 백혈병을 갖는 동물을 확인하기 위하여 이미지화되었다. 12일에, 치료 개시(치료 1일)에 앞서, 동물은 통계학적으로 동등한 생물발광을 나타내는 무리로 분할되었다. 백혈병 생쥐의 꼬리 정맥에, 21일 동안 3 또는 10 ㎎/㎏/day, 또는 12일 동안 30 ㎎/㎏/day의 펩티드유사 거대고리가 매일 주입되었다. 동물은 치료 동안 1일, 3일, 5일, 7일, 9일, 13일과 17일에 이미지화되었고, 결과의 종양 감소는 도 18에 도시된다.
실시예 5. 면역원성 결정:
6-8 주령 Balb/c 또는 KM 암컷 생쥐는 접합되지 않은 SP-1 또는 SP-4로 면역화되었다. 면역화에 앞서 혈청이 수집되고, 아래의 면역화 일정을 이용하여 D5W에서 25 ㎍의 각 펩티드가 꼬리 정맥에 주입되었다: 1일과 14일에 첫 2번의 면역화 이후 7일 시점, 그리고 세 번째와 네 번째 면역화 이후 14일 시점에, 혈청이 수집되었다. 항체 역가(antibody titer)는 간접 ELISA에 의해 측정되었다. 간단히 말하면, 마이크로역가 평판을 4℃에서 하룻밤동안 SP-1 또는 SP-3(5 ㎍/㎖)로 코팅하였다. 익일에, 이들 평판을 PBS/0.05% Tween20(PBST)로 5회 세척하고, 5% 탈지유/PBST로 37℃에서 1시간 동안 차단하며, 그 이후에 PBST로 추가로 세척하였다. 항-혈청을 연속적으로 희석하고, 코팅된 평판에 37℃에서 1시간 동안 첨가하였다. 이후, 이들 평판은 PBST로 충분히 세척하고, HRP-접합된 항-생쥐 IgG 또는 IgM과 함께 37℃에서 1시간 동안 더욱 배양하고, HRP 기질(substrate)의 첨가에 앞서 PBST로 5회 세척하였다. 평판을 실온에서 10분 동안 배양하고, 0.5 M 옥살산 용액으로 반응을 중단시켰다. ELISA 마이크로평판 판독기에서 450 nm에서 흡광도를 판독하였다. 1:100 희석도에서 대조 혈청과 항-혈청 둘 모두에 대하여 OD 값을 측정하였다. 도 20에서 그래프는 OD 항-혈청/OD 대조 혈청의 비율로서 플롯팅된다. 4 미만의 비율은 음성으로 간주되었다.
실시예 6. 용융 온도( T m ) 결정:
동결 건조된 SP-1은 50 μM의 최종 농도로 ddH2O에 용해되었다. Tm은 5-95℃의 온도에서 222 nm의 고정 파장(fixed wavelength)에서 Jasco-810 분광편광계(spectropolarimeter)에서 원편광 이색성(CD) 스펙트럼을 측정함으로써 결정되었다. 아래의 파라미터가 측정에 이용되었다: 데이터 피치(data pitch), 0.1℃; 대역너비(bandwidth), 1 nm; 그리고 경로 길이(path length), 16초 동안 신호를 평균할 때 0.1cm. 결과는 도 21에 도시된다.
실시예 7. 혈장 안정성 결정을 위한 샘플 준비:
체외 혈장 안정성 연구를 위하여, 10 μM의 SP-1, SP-3, SP-4와 SP-6을 37℃에서 0분, 15분과 120분 동안, 미리-정화된 인간과 생쥐 혈장과 함께 배양하였다. 각 배양 기간의 종결 시점에서, 100 ㎕의 샘플을 이전하고, 300 ㎕의 차가운 MEOH를 포함하는 새로운 낮은 유지 에펜도르프 튜브(low retention eppendorf tube)에 위치시켰다. 이들 샘플을 10,000 rpm에서 원심분리하고, 상층액을 이전하고, 낮은 유지 에펜도르프 튜브에 위치시키고, 200 ㎕의 물을 각 샘플에 첨가하였다. 이후, 샘플을 하기에 지시된 바와 같이 LC-MS/MS로 분석하였다. 이의 결과는 도 22와 23에 도시된다.
실시예 8. 정맥내 약동학적 분석:
IV 투약 제제(dose formulation)는 10 ㎎/㎏/dose을 달성하기 위하여 SP-1 또는 SP-4를 5% DMSO/D5W에 용해시킴으로써 준비되었다. 캐뉼러 삽입된 Crl:CD®(SD) 수컷 쥐(7-8 주령, Charles River Laboratories)가 이들 연구에 이용되었다. 정맥내 복용량(intravenous dose)은 대퇴부 캐뉼러(femoral cannula)를 통해 투여되고, 이들 동물은 단일 주사(single injection)당 10 ㎖/㎏으로 투약되었다. 약동학적 분석을 위한 혈액은 10개 시점(투약후 0.0833, 0.25, 0.5,1, 2, 4, 6, 8, 12와 24 시간)에서 수집되었다. 동물은 최종 샘플 수집 이후에 희생되었다(검시 없음).
전혈 샘플(whole blood sample)은 ~4℃에서 10분 동안 원심분리(~1500 x g)되었다. 혈장은 준비되고, 30분의 혈액 수집/원심분리 이내에, 동결된 새로운 튜브로 이전되고, LC-MS/MS 분석에 준비될 때까지 ~-70℃에서 어둠 하에 보관되었다.
샘플 추출은 100 ㎕ 혈장(샘플 또는 기준)에 10 ㎕의 50% 포름산을 첨가하고, 그 이후에 10초 동안 와동(vortexing)시킴으로써 달성되었다. 500 ㎕ 아세토니트릴을 첨가하고, 그 이후에 2분 동안 와동(vortexing)시키고 ~4℃에서 10분 동안 14,000rpm에서 원심분리하였다. 상층액은 깨끗한 튜브로 이전되고 37℃에서 <10 psi turbovap에서 증발되었다. LC-MS/MS 분석에 앞서, 샘플은 100 ㎕의 50:50 아세토니트릴:물로 재구성되었다.
피크 혈장 농도(peak plasma concentration)(Cmax), 피크 혈장 농도를 달성하는데 요구되는 시간(tmax), 혈장 말단 반감기(plasma terminal half-life)(t1 /2), 혈장 농도 시간 곡선 아래 영역(AUC), 제거율(clearance) 및 분포 체적(volume of distribution)은 혈장 농도 데이터로부터 계산되었다. 모든 약동학적 계산은 WinNonlin version 4.1(Pharsight Corp)을 이용하여, 비-구획 분석(non-compartmental analysis)에 의해 수행되었다. 도 24에서는 관찰된 결과를 요약한다.
아래의 LC-MS/MS 방법이 이용되었다. 간단히 말하면, 이용된 LC-MS/MS 기구는 API 365(Applied Biosystems)이었다. 분석 칼럼은 Phenomenex Synergi(4, Polar-RP, 50mm x 2 mm)이고, 이동상(mobile phase) A(물에서 0.1% 포름산)와 B(메탄올에서 0.1% 포름산)는 아래의 농도구배를 달성하기 위하여 0.4 ㎖/min의 유속으로 펌핑(pumping)되었다:
MRM: 814.0 내지 374.2 (양성 이온화)
실시예
9. 처리된 세포에서
FITC
-
표지된
펩티드유사
거대고리의 검출의
FACS
분석
2 mM L-글루타민(Invitrogen)을 포함하고 10% FBS와 1% 페니실린(penicillin)-스트렙토마이신(Streptomycin)으로 보충된 RPMI1640 배지에서 세포(가령, Jurkat 세포)를 현탁 배양하였다. 세포를 지수 성장기(exponential growing phase)에 유지시키기 위하여, 이들을 실험 전일에 계대배양(subculture)하였다. FACS에 의한 FITC-표지된 펩티드유사 거대고리의 흡수(uptake)를 분석하기 위하여, 지수 성장 Jurkat 세포를 1 X 106개 세포의 밀도로 0.9 ㎖의 혈청-없는 배지에 접종하였다. 화합물이 희석될 때까지, 세포를 가라앉혔다. 검사 화합물을 DMSO에서 2 mM 스톡으로 희석하고, 그 이후에 무균수에서 400 μM로 희석하였다; 100 μM로 추가의 희석은 OptiMEM을 이용하여 수행되었다. 이후, 1 ㎖ 부피에서 10 μM의 최종 농도를 달성하기 위하여, 100 ㎕의 100 μM FITC-표지된 펩티드유사 거대고리를 적절한 웰에 첨가하였다. 평판을 지정된 시점 동안 37℃, 5% CO2 배양기로 환원시켰다. 각 시점의 종결에서, 세포 현탁액을 배지로 희석하고, 2회 세척하고, 37℃에서 15분 동안 트립신(0.25%)으로 처리하였다. 이후, 세포를 OptiMem으로 세척하고 500 ㎕의 PBS에서 최종적으로 현탁시켰다. 샘플당 적어도 20000개의 현상(event)을 계산하는 Beckman Coulter FACS 기구를 이용하여 세포 형광(cellular fluorescence)을 측정하였다. 분석은 Summit version 4(Dako Colorado, Inc)를 이용하여 수행되었다.
실시예
10. 단백질-
리간드
결합 실험
단백질-리간드 결합 실험은 1 μM SP-4 + 5 μM Bcl-xL을 이용한 범(汎) 시스템 대조 실험(system-wide control experiment)에서 개설된 아래의 대표적인 절차에 따라서 수행되었다. 펩티드유사 거대고리의 40 μM 저장 용액(stock solution)의 1 ㎕ DMSO 분취량(aliquot)을 19 ㎕의 PBS(인산염-완충액: 150 mM NaCl을 포함하는 50 mM, pH 7.5 인산염 완충액)에 용해시켰다. 생성된 용액을 반복된 피펫팅(pipetting)으로 혼합하고, 10분 동안 10,000g에서 원심분리로 맑게 하였다. 생성된 상층액의 4 ㎕ 분취량에 PBS에서 4 ㎕의 10 μM BCL-xL을 첨가하였다. 따라서 각 8.0 ㎕ 실험 샘플은 PBS + 1 μM 펩티드유사 거대고리 및 2.5% DMSO에서 5.0 μM 농도로 40 pmol(1.5 ㎍)의 단백질을 내포하였다. 각 농도 점(concentration point)에 대하여 이렇게 준비된 중복 샘플을 실온에서 60분 동안 항온 처리하고, 이후 5.0 ㎕ 주입액의 크기 배제 크로마토그래피(size-exclusion chromatography)-LC-MS 분석에 앞서 4℃로 냉각하였다. 표적 단백질, 단백질-리간드 복합체, 그리고 결합되지 않은 화합물을 내포하는 샘플을 SEC 칼럼에 주입하였는데, 여기서 이들 복합체는 급속 SEC 단계에 의해 비-결합 성분으로부터 분리되었다. SEC 칼럼의 틈새 부피(void volume)에서 용리하는 조기-용리 단백질 분획물이 상기 칼럼에 유지되는 결합되지 않은 성분으로부터 충분히 분해된다는 것을 확인하기 위하여, SEC 칼럼 용출액을 UV 검출기로 모니터하였다. 단백질과 단백질-리간드 복합체를 내포하는 피크는 일차 UV 검출기로부터 용리한 이후에, 샘플 루프(sample loop)로 들어가고, 여기서 SEC 단계의 유동(flow stream)으로부터 절제되고 밸브 장치(valving mechanism)을 통해 LC-MS로 직접적으로 이전되었다. ALRN-0034의 (M + 3H)3+ 이온을 m/z 883.8에서 ESI-MS로 관찰하여 단백질-리간드 복합체의 검출을 확증하였다.
실시예
11. 경쟁 결합 실험
3가지 화합물 각각의 400 μM 스톡의 2 ㎕ 분취량을 14 ㎕의 DMSO와 혼합함으로써 성분당 40 μM로 리간드의 혼합물을 준비하였다. 이후, 성분 혼합물당 40 μM의 1 ㎕ 분취량을 적정제 펩티드유사 거대고리의 연속 희석된 저장 용액(10, 5, 2.5, ..., 0.078 mM)의 1 ㎕ DMSO 분취량과 혼합하였다. 이들 2 ㎕ 샘플을 38 ㎕의 PBS에 용해시켰다. 생성된 용액을 반복된 피펫팅으로 혼합하고 10분 동안 10,000g에서 원심분리로 맑게 하였다. 생성된 상층액의 4.0 ㎕ 분취량에 PBS에서 4.0 ㎕의 10 μM BCL-xL을 첨가하였다. 따라서 각 8.0 ㎕ 실험 샘플은 PBS + 0.5 μM 리간드, 2.5% DMSO에서 5.0 μM 농도로 40 pmol(1.5 ㎍)의 단백질, 그리고 변하는 농도(125, 62.5, ..., 0.98 μM)의 적정제 펩티드유사 거대고리를 내포하였다. 각 농도 점(concentration point)에 대하여 이렇게 준비된 중복 샘플을 실온에서 60분 동안 항온 처리하고, 이후 2.0 ㎕ 주입액의 크기 배제 크로마토그래피(size-exclusion chromatography)-LC-MS 분석에 앞서 4℃로 냉각하였다. 이들 방법에 관한 추가적인 상세는 "A General Technique to Rank Protein - Ligand Binding Affinities and Determine Allosteric vs . Direct Binding Site Competition in Compound Mixtures." Annis, D. A.; Nazef, N.; Chuang, C. C.; Scott, M. P.; Nash, H. M. J. Am . Chem. Soc. 2004, 126, 15495-15503; 그리고, "ALIS : An Affinity Selection - Mass Spectrometry System for the Discovery and Characterization of Protein - Ligand Interactions" D. A. Annis, C.-C.Chuang, and N. Nazef. In Mass Spectrometry in Medicinal Chemistry. Edited by Wanner K, HG: Wiley-VCH; 2007:121-184. Mannhold R, Kubinyi H, Folkers G (Series Editors): Methods and Principles in Medicinal Chemistry에서 제공된다.
실시예 12. 형광분석법( fluorimetry )을 이용한 FITC - 표지된 펩티드유사 거대고리 흡수의 정량적 분석.
세포(가령, INA-6 또는 Jurkat 세포)는 2 mM L-글루타민(Invitrogen)을 포함하고, 10% FBS와 1% 페니실린-스트렙토마이신, 그리고 INA-6 세포의 경우에 1 ng/㎖의 재조합 인간 IL-6 보충물(supplement)로 보충된 RPMI1640 배지에서 현탁 배양되었다. 세포를 지수 성장기(exponential growing phase)에 유지시키기 위하여, 이들을 실험 전일에 계대배양(subculture)하였다. 세포 내에서 FITC-표지된 펩티드유사 거대고리의 흡수(uptake)를 분석하기 위하여, 지수 성장 세포를 0.5 X 106개 세포의 밀도로 0.9 ㎖의 혈청-없는 배지에 접종하였다. 화합물이 희석될 때까지, 세포를 가라앉혔다. 검사 화합물을 DMSO에서 2 mM 스톡으로 희석하고, 그 이후에 무균수에서 400 μM로 희석하였다; 100 μM로 추가의 희석은 OptiMEM을 이용하여 수행되었다. 이후, 1 ㎖ 부피에서 10 μM의 최종 농도를 달성하기 위하여, 100 ㎕의 100 μM FITC-표지된 펩티드유사 거대고리를 적절한 웰에 첨가하였다. 평판을 지정된 시점 동안 37℃, 5% CO2 배양기로 환원시켰다. 필요한 경우에, OptiMEM에서 검사 화합물의 추가 희석액을 준비하였다. 각 시점의 종결에서, 세포를 수확하고, FBS로 보충된 RPMI로 2회 세척하고, 그리고 PBS + 0.5% BSA로 1회 세척하였다. 작은 덩어리로 뭉쳐진 세포를 재현탁시키고 37℃, 5%CO2에서 15분 동안 0.25% 트립신-EDTA와 함께 배양하였다. 배양후, 세포를 혈청 포함 배지로 1회, 그리고 0.5% BSA 포함 PBS로 2회 세척하였다. 세척의 종결에서, 세포를 Triton X-100-내포 세포 용해 완충액(cell lysis buffer)(Cell Signaling Technologies)으로 용해시켰다. BioTek Synergy 4 기구에서 형광 강도(fluorescence intensity)를 측정하였다. 표준 곡선을 위한 FITC-표지된 펩티드유사 거대고리의 희석액을 세포 용해 완충액에서 만들고, 세포 내에서 펩티드유사 거대고리의 양의 정량에 이용하였다. 분석은 Biotek Inc에 의해 제공된 Gen 5 소프트웨어를 이용하여 수행되었다.
실시예 13. 동소 전립선 종양 모형에서 펩티드유사 거대고리의 효능.
실험은 Bioware® 세포주(PC-3M-Luc-C6) 및 5x106개 세포/생쥐/100㎕에서 수행되었다. 총 70마리의 nu/nu 수컷 생쥐(7-10 주령)가 이용되었다. 수컷 nu/nu 생쥐를 마취시키고, 전립선 바로 위에 복부의 배면 중간선(posterior midline)을 따라 절개(incision)를 발생시켰다. 방광을 위축시키고 가볍게 압박하여 전립선을 노출시켰다. PC-3M-luc-C6 세포(5x105개)를 한쪽 배면 전립선엽(dorsal prostatic lobe) 내로 천천히 주입하였다. 복막 절개(peritoneal incision)를 봉합하고, 피부를 닫았다. 이러한 외과적 절차 이후에, 생쥐에 부프레노르핀(buprenorphine)(50㎕에서 0.1㎎/㎏)을 피하 제공하였다. 동물은 상처 회복후 7일 시점에 최초 이미지화되었다. 최종 50마리 생쥐를 치료의 시작에 앞서, BLI에 기초하여 5개 군(군당 10마리 생쥐)으로 분류하였다. 이들 실험 생쥐는 14일부터 시작하여, 2.5주 동안 주2회 이미지화되었다. 실험의 종결 시점에서, 종양을 절개하고 칭량하였다. 이후, 이들 종양을 스냅 동결(snap freeze)을 위한 2개의 조각으로 절단하고 10% 포르말린(formalin)에서 고정시켰다. 검사 화합물 치료는 종양 세포 접종 부위로부터 2개의 안정적인 또는 증가하는 생물발광 신호가 기록된 이후에 시작되었다. 여러 시험 군이 이용되었다: 1군(운반제, IV 매일 투약), 2군(검사 화합물, 10 ㎎/㎏으로 IV 매일 투약), 3군(운반제, i.p. 매일 투약), 4군(검사 화합물, 10 ㎎/㎏으로 i.p. 매일 투약), 그리고 5군(Taxotere, 30 ㎎/㎏으로 2회 투약을 위한 IV 매주 투약). 검사 펩티드유사 거대고리는 아래와 같이 제제화되었다. 낮은 유지/실리콘화된 플라스틱 튜브와 팁(tip)만 이용되었다. 140 ㎎의 각 거대고리를 2.3 ㎖의 100% DMSO에 용해시킴으로써, 각 펩티드유사 거대고리의 60 ㎎/㎖ 저장 용액을 준비하였다. 저장 용액을 매일 투약(바이알당 14 ㎎)을 위한 0.23 ㎖의 10개 분취량으로 분할하고 -20C에서 동결 유지시켰다. 각 투약일에 1개의 바이알을 해동시켰다. 저장 용액의 한 분취량을 6.5 ㎖의 필터 멸균된 5% 덱스트로스에 희석함으로써 작업 농도(working concentration)(2 ㎎/㎖)의 각 거대고리를 준비하였다. 일정하게 교반하면서, DMSO 스톡을 D5W에 방울방울 첨가하였다. 상기 용액은 최종 투약 형태(dose formation)의 필터 멸균 없이, 5% 덱스트로스로 7 ㎖의 최종 부피로 조정되었다. 약액주입 부피(dosing volume)는 5 ㎕/g(25g 생쥐의 경우 125 ㎕)이었다. 용량(dose)은 정맥 주사(slow bolus)(30초 동안)에 의해 생쥐로 전달된다. 도 45에서는 전립선암 동소 이종이식 모형에 대한 치료 시간(time treatment)을 도시한다. 각 실험 동물의 전립선 영역의 생물발광이 측정되고 광자(photon)/sec로서 표시되었다. 생체내에서 종양 성장 동역학은 그래프로 도시되고, 반복된 측정(2가지 주요 인자로서 시간과 치료가 이용됨)에 대한 2원(two-way) ANOVA가 이용되었다. 각 군의 대표적인 생쥐로부터 동역학적 생쥐 이미지가 획득되었고 도 43에 도시된다.
실시예 14. 난소 암( SKOV3 - Luc ) 종양을 이용한 동소 이종이식 종양 모형.
개똥벌레 루시페라제를 안정적으로 발현하는 1 X 106개 SKOV3-Luc 세포를 마취된 SCID-beige 생쥐(9 주령, 암컷)의 난소낭(ovarian bursa) 내로 주입한다. 이들 동물은 생물발광 이미지화(bioluminescent imaging)(BLI)에 의해 매주 모니터된다. 검사 화합물 치료는 종양 세포 접종 부위로부터 2개의 안정적인 또는 증가하는 생물발광 신호가 기록된 이후(이러한 모형에서 9주까지) 시작된다. 치료 시작에 앞서, 동물은 대조 군과 치료 군(10마리 생쥐/군)으로 무작위화된다. 동물은 필요에 따라, 10, 14 및/또는 21일 동안 검사 화합물(저용량, 중간 용량, 고용량) 및 운반제 대조의 매일 주사(IP, IV 또는 SC)에 의해 치료된다. 효능은 펩티드유사 거대고리 치료된 동물과 운반제 대조 치료된 동물 사이에 종양 부담의 비교에 의해 결정된다. 종양 성장/체적은 150 ㎎/㎏ D-루시페린(luciferin)의 IP 주입 이후에 BLI에 의해 모니터되고 IVIS Imaging System에 의해 등 쪽과 배 쪽 둘 모두에서 이미지화된다. 전이성 병소는 원발성 종양 생물발광을 숨김으로써 이미지화될 수 있다. 실험의 종결 시점에서, 동물은 인도적으로 안락사되고, 난소 종양은 절개되고, 칭량되고, 차후 분석을 위하여 준비된다.
실시예 15. 유방암( MDA - MB -231- Luc ) 종양을 이용한 동소 이종이식 종양 모형.
개똥벌레 루시페라제를 안정적으로 발현하는 1 X 106개 MDA-MB-231-Luc 세포 세포를 마취된 SCID-beige 생쥐(9 주령, 암컷)의 유방 조직 내로 주입한다. 이들 동물은 생물발광 이미지화(bioluminescent imaging)(BLI)에 의해 매주 모니터된다. 검사 화합물 치료는 종양 세포 접종 부위로부터 2개의 안정적인 또는 증가하는 생물발광 신호가 기록된 이후 시작된다. 치료 시작에 앞서, 동물은 대조 군과 치료 군(10마리 생쥐/군)으로 무작위화된다. 동물은 필요에 따라, 10, 14 및/또는 21일 동안 검사 화합물(저용량, 중간 용량, 고용량) 및 운반제 대조의 매일 주사(IP, IV 또는 SC)에 의해 치료된다. 효능은 검사 화합물 치료된 동물과 운반제 대조 치료된 동물 사이에 종양 부담의 비교에 의해 결정된다. 종양 성장/체적은 150 ㎎/㎏ D-루시페린(luciferin)의 IP 주입 이후에 생물발광 이미지화(BLI)에 의해 모니터되고 IVIS Imaging System에 의해 등 쪽과 배 쪽 둘 모두에서 이미지화된다. 전이성 병소는 원발성 종양 생물발광을 숨김으로써 이미지화될 수 있다. 실험의 종결 시점에서, 동물은 인도적으로 안락사되고, 난소 종양은 절개되고, 칭량되고, 차후 분석을 위하여 준비된다.
실시예 16. 흑색종(A375) 또는 소형 세포 폐암( NCI -H-82) 종양을 이용한 피하 이종이식 종양 모형.
필요한 경우에, 마취된 NOD/SCID 또는 nu/nu 생쥐의 옆구리 내로 최적량의 종양 세포가 피하 주입에 의해 주입된다. 종양이 20-50 ㎣의 평균 체적(average volume)에 도달할 때, 이들 동물은 대조 군과 치료 군(10마리 생쥐/군)으로 분류된다. 동물은 필요에 따라, 10, 14 및/또는 21일 동안 검사 화합물(저용량, 중간 용량, 고용량) 및 운반제 대조의 매일 주사(IP, IV 또는 SC)에 의해 치료된다. 효능은 검사 화합물 치료된 동물과 운반제 대조 치료된 동물 사이에 종양 체적의 비교에 의해 결정된다. 종양 성장/체적은 외부 캘리퍼스 측정(external caliper measurement)(LxWxD)에 의해 모니터된다. 실험의 종결 시점에서, 동물은 인도적으로 안락사되고, 종양은 절개되고, 칭량되고, 차후 분석을 위하여 준비된다.
실시예 17. 전이성 유방암( MDA - MB -231- Met - Luc ) 종양을 이용한 전이성 종양 모형.
마취된 NOD/SCID 생쥐 (9 주령, 암컷)의 심장의 좌심실(left ventricle) 내로(따라서 동맥계(arterial system) 내로 직접적으로), 개똥벌레 루시페라제를 안정적으로 발현하는 최적량의 MDA-MB-213-MET-Luc 세포가 주입된다. 성공적인 심장내 주입(intracardiac injection)은 이들 동물 전체에서 분포된 전신 생물발광을 보여주는 0일 이미지에 의해 지시되며, 성공적인 주입이 증명된 생쥐만 본 실험에 계속 남아있을 것이다. 이들 동물은 대조 군과 치료 군(10마리 생쥐/군)으로 분류된다. 동물은 필요에 따라, 10, 14 및/또는 21일 동안 검사 화합물(저용량, 중간 용량, 고용량) 및 운반제 대조의 매일 주사(IP, IV 또는 SC)에 의해 치료된다. 차후 전이의 발생은 150 ㎎/㎏ D-루시페린(luciferin)의 IP 주입 이후에 생물발광 이미지화(BLI)에 의해 생체내에서 주2회 모니터되고 IVIS Imaging System에 의해 등 쪽과 배 쪽 둘 모두에서 이미지화된다. 특히, 폐와 골 전이가 모니터된다. 실험의 종결 시점에서, 동물은 인도적으로 안락사되고, 관심 조직은 절개되고 체외 이미지화(ex vivo imaging) 및 차속 분석을 위하여 준비된다.
이들 종양 모형은 Jenkins, D. E. et al., Clin. & Exp. Metastasis. 2003, 20, 745-756.; Scatena C. D. et al., Prostate 2004, 59, 292-303; Greenaway J. Et al., Mol. Cancer Ther. 2009, 8, 64-74 Guan, J. et al., Cancer Chemo Pharma. 2008, Online Pub Dec. 24; 그리고 Lelekakis, M. et al., Clin & Exp Metastasis. 1999, 163-170에서 더욱 상세하게 기술된다.
본 발명의 바람직한 구체예가 본 명세서에서 도시되고 기술되긴 했지만, 이런 구체예가 단지 실례로서 제공된다는 것은 당업자에게 명백할 것이다. 본 발명의 범위를 벗어나지 않는 다수의 변이, 변화, 그리고 치환은 당업자에 의해 고안될 것이다. 본 명세서에 기술된 본 발명의 구체예에 대한 다양한 대안이 본 발명을 실시하는데 이용될 수 있음이 이해되어야 한다. 아래의 특허청구범위는 본 발명의 범위를 정의하고, 이들 특허청구범위 및 이들의 등가물의 범위 내에 방법과 구조는 그것에 의해 커버되는 것으로 의도된다.
SEQUENCE LISTING
<110> NASH, HUW M.
ANNIS, DAVID ALLEN
KAPELLER-LIBERMANN, ROSANA
SAWYER, TOMI K.
KAWAHATA, NORIYUKI
HAN, JIAWEN
<120> THERAPEUTIC PEPTIDOMIMETIC MACROCYCLES
<130> 35224-710.601
<150> 61/120,380
<151> 2008-12-05
<150> 61/027,326
<151> 2008-02-08
<160> 120
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 1
Ile Trp Ile Ala Gln Glu Leu Arg Xaa Ile Gly Asp Xaa Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 2
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<400> 2
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 3
<211> 25
<212> PRT
<213> Homo sapiens
<400> 3
Gln Glu Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Gln Val Gly
1 5 10 15
Asp Ser Met Asp Arg Ser Ile Pro Pro
20 25
<210> 4
<211> 25
<212> PRT
<213> Homo sapiens
<400> 4
Asp Asn Arg Pro Glu Ile Trp Ile Ala Gln Glu Leu Arg Arg Ile Gly
1 5 10 15
Asp Glu Phe Asn Ala Tyr Tyr Ala Arg
20 25
<210> 5
<211> 25
<212> PRT
<213> Homo sapiens
<400> 5
Asn Leu Trp Ala Ala Gln Arg Tyr Gly Arg Glu Leu Arg Arg Met Ser
1 5 10 15
Asp Glu Phe Val Asp Ser Phe Lys Lys
20 25
<210> 6
<211> 25
<212> PRT
<213> Homo sapiens
<400> 6
Glu Glu Gln Trp Ala Arg Glu Ile Gly Ala Gln Leu Arg Arg Met Ala
1 5 10 15
Asp Asp Leu Asn Ala Gln Tyr Glu Arg
20 25
<210> 7
<211> 24
<212> PRT
<213> Homo sapiens
<400> 7
Arg Ser Ser Ala Ala Gln Leu Thr Ala Ala Arg Leu Lys Ala Leu Gly
1 5 10 15
Asp Glu Leu His Gln Arg Thr Met
20
<210> 8
<211> 22
<212> PRT
<213> Homo sapiens
<400> 8
Ala Glu Leu Pro Pro Glu Phe Ala Ala Gln Leu Arg Lys Ile Gly Asp
1 5 10 15
Lys Val Tyr Cys Thr Trp
20
<210> 9
<211> 25
<212> PRT
<213> Homo sapiens
<400> 9
Val Pro Ala Asp Leu Lys Asp Glu Cys Ala Gln Leu Arg Arg Ile Gly
1 5 10 15
Asp Lys Val Asn Leu Arg Gln Lys Leu
20 25
<210> 10
<211> 24
<212> PRT
<213> Homo sapiens
<400> 10
Gln His Arg Ala Glu Val Gln Ile Ala Arg Lys Leu Gln Cys Ile Ala
1 5 10 15
Asp Gln Phe His Arg Leu His Thr
20
<210> 11
<211> 22
<212> PRT
<213> Homo sapiens
<400> 11
Ser Ser Ala Ala Gln Leu Thr Ala Ala Arg Leu Lys Ala Leu Gly Asp
1 5 10 15
Glu Leu His Gln Arg Thr
20
<210> 12
<211> 25
<212> PRT
<213> Homo sapiens
<400> 12
Cys Met Glu Gly Ser Asp Ala Leu Ala Leu Arg Leu Ala Cys Ile Gly
1 5 10 15
Asp Glu Met Asp Val Ser Leu Arg Ala
20 25
<210> 13
<211> 24
<212> PRT
<213> Homo sapiens
<400> 13
Asp Ile Glu Arg Arg Lys Glu Val Glu Ser Ile Leu Lys Lys Asn Ser
1 5 10 15
Asp Trp Ile Trp Asp Trp Ser Ser
20
<210> 14
<211> 22
<212> PRT
<213> Homo sapiens
<400> 14
Gly Arg Leu Ala Glu Val Cys Ala Val Leu Leu Arg Leu Gly Asp Glu
1 5 10 15
Leu Glu Met Ile Arg Pro
20
<210> 15
<211> 25
<212> PRT
<213> Homo sapiens
<400> 15
Pro Gln Asp Ala Ser Thr Lys Lys Ser Glu Cys Leu Lys Arg Ile Gly
1 5 10 15
Asp Glu Leu Asp Ser Asn Met Glu Leu
20 25
<210> 16
<211> 22
<212> PRT
<213> Homo sapiens
<400> 16
Pro Ser Ser Thr Met Gly Gln Val Gly Arg Gln Leu Ala Ile Ile Gly
1 5 10 15
Asp Asp Ile Asn Arg Arg
20
<210> 17
<211> 14
<212> PRT
<213> Homo sapiens
<400> 17
Lys Gln Ala Leu Arg Glu Ala Gly Asp Glu Phe Glu Leu Arg
1 5 10
<210> 18
<211> 22
<212> PRT
<213> Homo sapiens
<400> 18
Leu Ser Pro Pro Val Val His Leu Ala Leu Ala Leu Arg Gln Ala Gly
1 5 10 15
Asp Asp Phe Ser Arg Arg
20
<210> 19
<211> 23
<212> PRT
<213> Homo sapiens
<400> 19
Glu Val Ile Pro Met Ala Ala Val Lys Gln Ala Leu Arg Glu Ala Gly
1 5 10 15
Asp Glu Phe Glu Leu Arg Tyr
20
<210> 20
<211> 20
<212> PRT
<213> Homo sapiens
<400> 20
Pro Ala Asp Pro Leu His Gln Ala Met Arg Ala Ala Gly Asp Glu Phe
1 5 10 15
Glu Thr Arg Phe
20
<210> 21
<211> 23
<212> PRT
<213> Homo sapiens
<400> 21
Ala Thr Ser Arg Lys Leu Glu Thr Leu Arg Arg Val Gly Asp Gly Val
1 5 10 15
Gln Arg Asn His Glu Thr Ala
20
<210> 22
<211> 19
<212> PRT
<213> Homo sapiens
<400> 22
Leu Ala Glu Val Cys Thr Val Leu Leu Arg Leu Gly Asp Glu Leu Glu
1 5 10 15
Gln Ile Arg
<210> 23
<211> 19
<212> PRT
<213> Homo sapiens
<400> 23
Met Thr Val Gly Glu Leu Ser Arg Ala Leu Gly His Glu Asn Gly Ser
1 5 10 15
Leu Asp Pro
<210> 24
<211> 22
<212> PRT
<213> Homo sapiens
<400> 24
Val Val Glu Gly Glu Lys Glu Val Glu Ala Leu Lys Lys Ser Ala Asp
1 5 10 15
Trp Val Ser Asp Trp Ser
20
<210> 25
<211> 20
<212> PRT
<213> Homo sapiens
<400> 25
Ser Met Ala Arg Asp Pro Gln Arg Tyr Leu Val Ile Gln Gly Asp Asp
1 5 10 15
Arg Met Lys Leu
20
<210> 26
<211> 25
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (14)..(18)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (18)..(18)
<223> Cross linked amino acid residue
<400> 26
Gln Glu Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly
1 5 10 15
Asp Xaa Met Asp Arg Ser Ile Pro Pro
20 25
<210> 27
<211> 25
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (14)..(18)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (18)..(18)
<223> Cross linked amino acid residue
<400> 27
Asp Asn Arg Pro Glu Ile Trp Ile Ala Gln Glu Leu Arg Xaa Ile Gly
1 5 10 15
Asp Xaa Phe Asn Ala Tyr Tyr Ala Arg
20 25
<210> 28
<211> 25
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (14)..(18)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (18)..(18)
<223> Cross linked amino acid residue
<400> 28
Asn Leu Trp Ala Ala Gln Arg Tyr Gly Arg Glu Leu Arg Xaa Met Ser
1 5 10 15
Asp Xaa Phe Val Asp Ser Phe Lys Lys
20 25
<210> 29
<211> 25
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (14)..(18)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (18)..(18)
<223> Cross linked amino acid residue
<400> 29
Glu Glu Gln Trp Ala Arg Glu Ile Gly Ala Gln Leu Arg Xaa Met Ala
1 5 10 15
Asp Xaa Leu Asn Ala Gln Tyr Glu Arg
20 25
<210> 30
<211> 24
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (14)..(18)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (18)..(18)
<223> Cross linked amino acid residue
<400> 30
Arg Ser Ser Ala Ala Gln Leu Thr Ala Ala Arg Leu Lys Xaa Leu Gly
1 5 10 15
Asp Xaa Leu His Gln Arg Thr Met
20
<210> 31
<211> 22
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (13)..(17)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Cross linked amino acid residue
<400> 31
Ala Glu Leu Pro Pro Glu Phe Ala Ala Gln Leu Arg Xaa Ile Gly Asp
1 5 10 15
Xaa Val Tyr Cys Thr Trp
20
<210> 32
<211> 25
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (14)..(18)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (18)..(18)
<223> Cross linked amino acid residue
<400> 32
Val Pro Ala Asp Leu Lys Asp Glu Cys Ala Gln Leu Arg Xaa Ile Gly
1 5 10 15
Asp Xaa Val Asn Leu Arg Gln Lys Leu
20 25
<210> 33
<211> 24
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (14)..(18)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (18)..(18)
<223> Cross linked amino acid residue
<400> 33
Gln His Arg Ala Glu Val Gln Ile Ala Arg Lys Leu Gln Xaa Ile Ala
1 5 10 15
Asp Xaa Phe His Arg Leu His Thr
20
<210> 34
<211> 22
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (13)..(17)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Cross linked amino acid residue
<400> 34
Ser Ser Ala Ala Gln Leu Thr Ala Ala Arg Leu Lys Xaa Leu Gly Asp
1 5 10 15
Xaa Leu His Gln Arg Thr
20
<210> 35
<211> 25
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (14)..(18)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (18)..(18)
<223> Cross linked amino acid residue
<400> 35
Cys Met Glu Gly Ser Asp Ala Leu Ala Leu Arg Leu Ala Xaa Ile Gly
1 5 10 15
Asp Xaa Met Asp Val Ser Leu Arg Ala
20 25
<210> 36
<211> 24
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (14)..(18)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (18)..(18)
<223> Cross linked amino acid residue
<400> 36
Asp Ile Glu Arg Arg Lys Glu Val Glu Ser Ile Leu Lys Xaa Asn Ser
1 5 10 15
Asp Xaa Ile Trp Asp Trp Ser Ser
20
<210> 37
<211> 22
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<400> 37
Gly Arg Leu Ala Glu Val Cys Ala Val Leu Leu Xaa Leu Gly Asp Xaa
1 5 10 15
Leu Glu Met Ile Arg Pro
20
<210> 38
<211> 25
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (14)..(18)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (18)..(18)
<223> Cross linked amino acid residue
<400> 38
Pro Gln Asp Ala Ser Thr Lys Lys Ser Glu Cys Leu Lys Xaa Ile Gly
1 5 10 15
Asp Xaa Leu Asp Ser Asn Met Glu Leu
20 25
<210> 39
<211> 22
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (14)..(18)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (18)..(18)
<223> Cross linked amino acid residue
<400> 39
Pro Ser Ser Thr Met Gly Gln Val Gly Arg Gln Leu Ala Xaa Ile Gly
1 5 10 15
Asp Xaa Ile Asn Arg Arg
20
<210> 40
<211> 14
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (6)..(10)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (10)..(10)
<223> Cross linked amino acid residue
<400> 40
Lys Gln Ala Leu Arg Xaa Ala Gly Asp Xaa Phe Glu Leu Arg
1 5 10
<210> 41
<211> 22
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (14)..(18)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (18)..(18)
<223> Cross linked amino acid residue
<400> 41
Leu Ser Pro Pro Val Val His Leu Ala Leu Ala Leu Arg Xaa Ala Gly
1 5 10 15
Asp Xaa Phe Ser Arg Arg
20
<210> 42
<211> 23
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (14)..(18)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (18)..(18)
<223> Cross linked amino acid residue
<400> 42
Glu Val Ile Pro Met Ala Ala Val Lys Gln Ala Leu Arg Xaa Ala Gly
1 5 10 15
Asp Xaa Phe Glu Leu Arg Tyr
20
<210> 43
<211> 20
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (11)..(11)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (11)..(15)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (15)..(15)
<223> Cross linked amino acid residue
<400> 43
Pro Ala Asp Pro Leu His Gln Ala Met Arg Xaa Ala Gly Asp Xaa Phe
1 5 10 15
Glu Thr Arg Phe
20
<210> 44
<211> 23
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (11)..(11)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (11)..(15)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (15)..(15)
<223> Cross linked amino acid residue
<400> 44
Ala Thr Ser Arg Lys Leu Glu Thr Leu Arg Xaa Val Gly Asp Xaa Val
1 5 10 15
Gln Arg Asn His Glu Thr Ala
20
<210> 45
<211> 19
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (10)..(10)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (10)..(14)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Cross linked amino acid residue
<400> 45
Leu Ala Glu Val Cys Thr Val Leu Leu Xaa Leu Gly Asp Xaa Leu Glu
1 5 10 15
Gln Ile Arg
<210> 46
<211> 19
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<400> 46
Met Thr Val Gly Glu Leu Ser Arg Ala Leu Gly Xaa Glu Asn Gly Xaa
1 5 10 15
Leu Asp Pro
<210> 47
<211> 22
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (13)..(17)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Cross linked amino acid residue
<400> 47
Val Val Glu Gly Glu Lys Glu Val Glu Ala Leu Lys Xaa Ser Ala Asp
1 5 10 15
Xaa Val Ser Asp Trp Ser
20
<210> 48
<211> 20
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<400> 48
Ser Met Ala Arg Asp Pro Gln Arg Tyr Leu Val Xaa Gln Gly Asp Xaa
1 5 10 15
Arg Met Lys Leu
20
<210> 49
<211> 25
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 49
Gln Glu Asp Ile Ile Arg Asn Ile Xaa Arg His Leu Xaa Gln Val Gly
1 5 10 15
Asp Ser Met Asp Arg Ser Ile Pro Pro
20 25
<210> 50
<211> 25
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 50
Asp Asn Arg Pro Glu Ile Trp Ile Xaa Gln Glu Leu Xaa Arg Ile Gly
1 5 10 15
Asp Glu Phe Asn Ala Tyr Tyr Ala Arg
20 25
<210> 51
<211> 25
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 51
Asn Leu Trp Ala Ala Gln Arg Tyr Xaa Arg Glu Leu Xaa Arg Met Ser
1 5 10 15
Asp Glu Phe Val Asp Ser Phe Lys Lys
20 25
<210> 52
<211> 25
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 52
Glu Glu Gln Trp Ala Arg Glu Ile Xaa Ala Gln Leu Xaa Arg Met Ala
1 5 10 15
Asp Asp Leu Asn Ala Gln Tyr Glu Arg
20 25
<210> 53
<211> 24
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 53
Arg Ser Ser Ala Ala Gln Leu Thr Xaa Ala Arg Leu Xaa Ala Leu Gly
1 5 10 15
Asp Glu Leu His Gln Arg Thr Met
20
<210> 54
<211> 22
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (8)..(8)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (8)..(12)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<400> 54
Ala Glu Leu Pro Pro Glu Phe Xaa Ala Gln Leu Xaa Lys Ile Gly Asp
1 5 10 15
Lys Val Tyr Cys Thr Trp
20
<210> 55
<211> 25
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 55
Val Pro Ala Asp Leu Lys Asp Glu Xaa Ala Gln Leu Xaa Arg Ile Gly
1 5 10 15
Asp Lys Val Asn Leu Arg Gln Lys Leu
20 25
<210> 56
<211> 24
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 56
Gln His Arg Ala Glu Val Gln Ile Xaa Arg Lys Leu Xaa Cys Ile Ala
1 5 10 15
Asp Gln Phe His Arg Leu His Thr
20
<210> 57
<211> 22
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (8)..(8)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (8)..(12)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<400> 57
Ser Ser Ala Ala Gln Leu Thr Xaa Ala Arg Leu Xaa Ala Leu Gly Asp
1 5 10 15
Glu Leu His Gln Arg Thr
20
<210> 58
<211> 25
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 58
Cys Met Glu Gly Ser Asp Ala Leu Xaa Leu Arg Leu Xaa Cys Ile Gly
1 5 10 15
Asp Glu Met Asp Val Ser Leu Arg Ala
20 25
<210> 59
<211> 24
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 59
Asp Ile Glu Arg Arg Lys Glu Val Xaa Ser Ile Leu Xaa Lys Asn Ser
1 5 10 15
Asp Trp Ile Trp Asp Trp Ser Ser
20
<210> 60
<211> 22
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (7)..(7)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (7)..(11)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (11)..(11)
<223> Cross linked amino acid residue
<400> 60
Gly Arg Leu Ala Glu Val Xaa Ala Val Leu Xaa Arg Leu Gly Asp Glu
1 5 10 15
Leu Glu Met Ile Arg Pro
20
<210> 61
<211> 25
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 61
Pro Gln Asp Ala Ser Thr Lys Lys Xaa Glu Cys Leu Xaa Arg Ile Gly
1 5 10 15
Asp Glu Leu Asp Ser Asn Met Glu Leu
20 25
<210> 62
<211> 22
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 62
Pro Ser Ser Thr Met Gly Gln Val Xaa Arg Gln Leu Xaa Ile Ile Gly
1 5 10 15
Asp Asp Ile Asn Arg Arg
20
<210> 63
<211> 14
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (1)..(5)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (5)..(5)
<223> Cross linked amino acid residue
<400> 63
Xaa Gln Ala Leu Xaa Glu Ala Gly Asp Glu Phe Glu Leu Arg
1 5 10
<210> 64
<211> 22
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 64
Leu Ser Pro Pro Val Val His Leu Xaa Leu Ala Leu Xaa Gln Ala Gly
1 5 10 15
Asp Asp Phe Ser Arg Arg
20
<210> 65
<211> 23
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 65
Glu Val Ile Pro Met Ala Ala Val Xaa Gln Ala Leu Xaa Glu Ala Gly
1 5 10 15
Asp Glu Phe Glu Leu Arg Tyr
20
<210> 66
<211> 20
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (6)..(10)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (10)..(10)
<223> Cross linked amino acid residue
<400> 66
Pro Ala Asp Pro Leu Xaa Gln Ala Met Xaa Ala Ala Gly Asp Glu Phe
1 5 10 15
Glu Thr Arg Phe
20
<210> 67
<211> 23
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (6)..(6)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (6)..(10)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (10)..(10)
<223> Cross linked amino acid residue
<400> 67
Ala Thr Ser Arg Lys Xaa Glu Thr Leu Xaa Arg Val Gly Asp Gly Val
1 5 10 15
Gln Arg Asn His Glu Thr Ala
20
<210> 68
<211> 19
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (5)..(5)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (5)..(9)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<400> 68
Leu Ala Glu Val Xaa Thr Val Leu Xaa Arg Leu Gly Asp Glu Leu Glu
1 5 10 15
Gln Ile Arg
<210> 69
<211> 19
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (7)..(7)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (7)..(11)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (11)..(11)
<223> Cross linked amino acid residue
<400> 69
Met Thr Val Gly Glu Leu Xaa Arg Ala Leu Xaa His Glu Asn Gly Ser
1 5 10 15
Leu Asp Pro
<210> 70
<211> 22
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (8)..(8)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (8)..(12)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<400> 70
Val Val Glu Gly Glu Lys Glu Xaa Glu Ala Leu Xaa Lys Ser Ala Asp
1 5 10 15
Trp Val Ser Asp Trp Ser
20
<210> 71
<211> 20
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (7)..(7)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (7)..(11)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (11)..(11)
<223> Cross linked amino acid residue
<400> 71
Ser Met Ala Arg Asp Pro Xaa Arg Tyr Leu Xaa Ile Gln Gly Asp Asp
1 5 10 15
Arg Met Lys Leu
20
<210> 72
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<400> 72
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 73
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 73
Ile Trp Ile Ala Gln Glu Leu Arg Xaa Ile Gly Asp Xaa Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 74
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 74
Arg Trp Ile Ala Gln Ala Leu Arg Xaa Ile Gly Asp Xaa Phe Asn Ala
1 5 10 15
Phe Tyr Ala Arg Arg
20
<210> 75
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 75
Arg Trp Ile Ala Gln Ala Leu Arg Xaa Ile Gly Asn Xaa Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 76
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<400> 76
Ile Trp Ile Ala Gln Ala Leu Arg Xaa Ile Gly Asn Xaa Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 77
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 77
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 78
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 78
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 79
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 79
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 80
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 80
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 81
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 81
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 82
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 82
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 83
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 83
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 84
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 84
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 85
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 85
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 86
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 86
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 87
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 87
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 88
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 88
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 89
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 89
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 90
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 90
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 91
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 91
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 92
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 92
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 93
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 93
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 94
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 94
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 95
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 95
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 96
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (12)..(16)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (16)..(16)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 96
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Xaa Val Glu Asp Xaa
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 97
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (17)..(17)
<223> Norleucine
<220>
<223> C-term amidated
<400> 97
Asp Ile Ile Arg Asn Ile Ala Arg His Leu Ala Gln Val Gly Asp Ser
1 5 10 15
Xaa Asp Arg Ser Ile
20
<210> 98
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 98
Ile Trp Ile Ala Gln Glu Leu Arg Xaa Ile Gly Asp Xaa Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 99
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 99
Ile Trp Ile Ala Gln Glu Leu Arg Xaa Ile Glu Asp Xaa Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 100
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<223> C-term amidated
<400> 100
Ile Trp Ile Ala Gln Glu Leu Arg Arg Ile Gly Asp Glu Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 101
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Propionyl-Arg
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (11)..(11)
<223> 2-aminoisobutyric acid
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Norleucine
<220>
<223> C-term amidated
<400> 101
Arg Asn Ile Ala Arg His Leu Ala Xaa Val Xaa Asp Xaa Xaa Asp Arg
1 5 10 15
Ser Ile
<210> 102
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Propionyl-Arg
<220>
<221> MOD_RES
<222> (8)..(8)
<223> 2-aminoisobutyric acid
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (11)..(11)
<223> 2-aminoisobutyric acid
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Norleucine
<220>
<223> C-term amidated
<400> 102
Arg Asn Ile Ala Arg His Leu Xaa Xaa Val Xaa Asp Xaa Xaa Asp Arg
1 5 10 15
Ser Ile
<210> 103
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Propionyl-Arg
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (11)..(11)
<223> 2-aminoisobutyric acid
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 103
Arg Asn Ile Ala Arg His Leu Ala Xaa Val Xaa Asp Xaa Phe Ala Arg
1 5 10 15
Ser Ile
<210> 104
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Propionyl-Arg
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (14)..(14)
<223> Norleucine
<220>
<221> MOD_RES
<222> (15)..(15)
<223> 2-aminoisobutyric acid
<220>
<223> C-term amidated
<400> 104
Arg Asn Ile Ala Arg His Leu Ala Xaa Val Gly Asp Xaa Xaa Xaa Arg
1 5 10 15
Ser Ile
<210> 105
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 105
Ile Trp Ile Ala Gln Ala Leu Arg Xaa Ile Gly Asp Xaa Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 106
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Norleucine
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 106
Arg Trp Ile Ala Gln Ala Leu Arg Xaa Ile Gly Xaa Xaa Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 107
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Propionyl-Arg
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Cyclohexylglycine
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (11)..(11)
<223> 2-aminoisobutyric acid
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 107
Arg Asn Xaa Ala Arg His Leu Ala Xaa Val Xaa Asp Xaa Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 108
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (16)..(16)
<223> 2-aminoisobutyric acid
<220>
<223> C-term amidated
<400> 108
Ile Trp Ile Ala Gln Ala Leu Arg Xaa Ile Gly Asp Xaa Phe Asn Xaa
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 109
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 109
Arg Trp Ile Ala Gln Ala Leu Arg Xaa Ile Gly Asp Xaa Phe Asn Ala
1 5 10 15
Phe Tyr Ala Arg Arg
20
<210> 110
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 110
Arg Trp Ile Ala Gln Ala Leu Arg Xaa Ile Gly Ala Xaa Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 111
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (6)..(6)
<223> 2-aminoisobutyric acid
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<221> MOD_RES
<222> (16)..(16)
<223> 2-aminoisobutyric acid
<220>
<223> C-term amidated
<400> 111
Ile Trp Ile Ala Gln Xaa Leu Arg Xaa Ile Gly Asp Xaa Phe Asn Xaa
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 112
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 112
Ile Trp Ile Ala Gln Gln Leu Arg Xaa Ile Gly Asp Xaa Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 113
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 113
Arg Trp Ile Ala Gln Gln Leu Arg Xaa Ile Gly Asp Xaa Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 114
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 114
Ile Trp Ile Ala Gln Ala Leu Arg Xaa Ile Gly Asp Xaa Phe Asn Ala
1 5 10 15
Arg Arg Ala
<210> 115
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 115
Ile Trp Ile Ala Gln Ala Leu Arg Xaa Ile Gly Asp Xaa Phe Asn Ala
1 5 10 15
Tyr Lys Ala
<210> 116
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 116
Ile Trp Ile Ala Gln Ala Leu Arg Xaa Ile Gly Asp Xaa Phe Asn Ala
1 5 10 15
Tyr Lys
<210> 117
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 117
Arg Trp Ile Ala Gln Ala Leu Arg Xaa Ile Gly Asn Xaa Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 118
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 118
Ile Trp Ile Ala Gln Ala Ala Arg Xaa Asp Ile Gly Xaa Ala Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 119
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<221> MOD_RES
<222> (9)..(9)
<223> Cross linked amino acid residue
<220>
<221> misc_feature
<222> (9)..(13)
<223> Crosslink between residues
<220>
<221> MOD_RES
<222> (13)..(13)
<223> Cross linked amino acid residue
<220>
<223> C-term amidated
<400> 119
Ile Trp Ile Ala Gln Ala Leu Arg Xaa Ile Gly Asn Xaa Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
<210> 120
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<220>
<223> N-term acetylated
<220>
<223> C-term amidated
<400> 120
Ile Trp Ile Ala Gln Ala Leu Arg Arg Ile Gly Asp Glu Phe Asn Ala
1 5 10 15
Tyr Tyr Ala Arg Arg
20
Claims (87)
- 치료가 필요한 인간 환자에서 암을 치료하는 방법에 있어서, 상기 방법은 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함하고, 여기서 암은 난소암, 전립선암, 신장암, 유방암, 췌장암, 그리고 Ph+ 급성 림프구성 백혈병으로 구성된 군에서 선택되는 것을 특징으로 하는 치료 방법.
- 청구항 1에 있어서, 펩티드유사 거대고리는 α-나선을 포함하는 것을 특징으로 하는 치료 방법.
- 청구항 1에 있어서, 펩티드유사 거대고리는 BH3 도메인을 포함하는 것을 특징으로 하는 치료 방법.
- 청구항 1에 있어서, 펩티드유사 거대고리는 BIM 폴리펩티드인 것을 특징으로 하는 치료 방법.
- 청구항 4에 있어서, BIM 폴리펩티드의 아미노산 서열은 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 60% 이상 동일하고, 여기서 *는 속박된(tethered) 아미노산인 것을 특징으로 하는 치료 방법.
- 청구항 4에 있어서, BIM 폴리펩티드의 아미노산 서열은 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 80% 이상 동일하고, 여기서 *는 속박된 아미노산인 것을 특징으로 하는 치료 방법.
- 청구항 4에 있어서, BIM 폴리펩티드의 아미노산 서열은 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 95% 이상 동일하고, 여기서 *는 속박된 아미노산인 것을 특징으로 하는 치료 방법.
- 청구항 1에 있어서, 암은 유방암인 것을 특징으로 하는 치료 방법.
- 청구항 8에 있어서, 유방암은 침습성(invasive) 유방 암종인 것을 특징으로 하는 치료 방법.
- 청구항 9에 있어서, 침습성 유방 암종은 침습성 관상 암종인 것을 특징으로 하는 치료 방법.
- 청구항 1에 있어서, 암은 전립선암인 것을 특징으로 하는 치료 방법.
- 청구항 1에 있어서, 암은 난소암인 것을 특징으로 하는 치료 방법.
- 청구항 1에 있어서, 암은 췌장암인 것을 특징으로 하는 치료 방법.
- 청구항 1에 있어서, 암은 신장암인 것을 특징으로 하는 치료 방법.
- 청구항 1에 있어서, 암은 백혈병인 것을 특징으로 하는 치료 방법.
- 청구항 1에 있어서, 암은 Ph+ 급성 림프구성 백혈병인 것을 특징으로 하는 치료 방법.
- 치료가 필요한 인간 환자에서 암을 치료하는 방법에 있어서, 상기 방법은 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함하고, 여기서 암은 결장암인 것을 특징으로 하는 치료 방법.
- 청구항 17에 있어서, 펩티드유사 거대고리는 α-나선을 포함하는 것을 특징으로 하는 치료 방법.
- 청구항 17에 있어서, 펩티드유사 거대고리는 BH3 도메인을 포함하는 것을 특징으로 하는 치료 방법.
- 청구항 19에 있어서, 펩티드유사 거대고리는 BID 폴리펩티드인 것을 특징으로 하는 치료 방법.
- 청구항 20에 있어서, BID 폴리펩티드의 아미노산 서열은 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 60% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신인 것을 특징으로 하는 치료 방법.
- 청구항 20에 있어서, BID 폴리펩티드의 아미노산 서열은 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 80% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신인 것을 특징으로 하는 치료 방법.
- 청구항 20에 있어서, BID 폴리펩티드의 아미노산 서열은 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 95% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신인 것을 특징으로 하는 치료 방법.
- 치료가 필요한 인간 환자에서 암을 치료하는 방법에 있어서, 상기 방법은 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함하고, 여기서 상기 펩티드유사 거대고리는 상기 암으로부터 유래된 세포주에 대한 시험관내 세포 생존능 분석에서 조사될 때, 5 μM 미만의 EC50을 나타내는 것을 특징으로 하는 치료 방법.
- 청구항 24에 있어서, EC50은 EC50은 3 μM 미만인 것을 특징으로 하는 치료 방법.
- 청구항 24에 있어서, 암은 난소암, 피부암, 전립선암, 신장암, 유방암, 췌장암, 소형-세포 폐암, 결장암, 간암, 다발성 골수종, 버킷 림프종, T 세포 계통 또는 B 세포 계통 또는 혼성 계통의 급성 림프구성 백혈병(ALL), 만성 림프구성 백혈병(CLL), 피부 T 세포 림프종(CTCL), 급성 골수성 백혈병(AML), 만성 골수성 백혈병, 그리고 여포성 림프종으로 구성된 군에서 선택되는 것을 특징으로 하는 치료 방법.
- 청구항 26에 있어서, 펩티드유사 거대고리는 α-나선을 포함하는 것을 특징으로 하는 치료 방법.
- 청구항 26에 있어서, 펩티드유사 거대고리는 BH3 도메인을 포함하는 것을 특징으로 하는 치료 방법.
- 청구항 26에 있어서, 펩티드유사 거대고리는 BIM 폴리펩티드인 것을 특징으로 하는 치료 방법.
- 청구항 29에 있어서, BIM 폴리펩티드는 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 60% 이상 동일하고, 여기서 *는 속박된 아미노산인 것을 특징으로 하는 치료 방법.
- 청구항 29에 있어서, BIM 폴리펩티드는 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 80% 이상 동일하고, 여기서 *는 속박된 아미노산인 것을 특징으로 하는 치료 방법.
- 청구항 29에 있어서, BIM 폴리펩티드는 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 95% 이상 동일하고, 여기서 *는 속박된 아미노산인 것을 특징으로 하는 치료 방법.
- 청구항 24에 있어서, 암은 결장암, 소형-세포 폐암, 간암, 난소암, 피부암, 전립선암, 신장암, 유방암, 췌장암, 다발성 골수종, 버킷 림프종, T 세포 계통 또는 B 세포 계통 또는 혼성 계통의 급성 림프구성 백혈병(ALL), 만성 림프구성 백혈병(CLL), 피부 T 세포 림프종(CTCL), 급성 골수성 백혈병(AML), 만성 골수성 백혈병, 그리고 여포성 림프종으로 구성된 군에서 선택되는 것을 특징으로 하는 치료 방법.
- 청구항 33에 있어서, 펩티드유사 거대고리는 α-나선을 포함하는 것을 특징으로 하는 치료 방법.
- 청구항 33에 있어서, 펩티드유사 거대고리는 BH3 도메인을 포함하는 것을 특징으로 하는 치료 방법.
- 청구항 33에 있어서, 펩티드유사 거대고리는 BID 폴리펩티드인 것을 특징으로 하는 치료 방법.
- 청구항 36에 있어서, BID 폴리펩티드는 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 60% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신인 것을 특징으로 하는 치료 방법.
- 청구항 36에 있어서, BID 폴리펩티드는 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 80% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신인 것을 특징으로 하는 치료 방법.
- 청구항 36에 있어서, BID 폴리펩티드는 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 95% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신인 것을 특징으로 하는 치료 방법.
- 치료가 필요한 인간 환자에서 질환을 치료하는 방법에 있어서,
a) 폴리펩티드의 2개의 아미노산 잔기 사이에 가교를 도입함으로써 펩티드유사 거대고리를 제조하는 단계;
b) 면역학적 반응의 존재 또는 부재에 대하여 펩티드유사 거대고리를 조사하는 단계; 그리고
c) 상기 면역학적 반응이 실질적인 부작용을 유발하지 않으면, 환자에 펩티드유사 거대고리를 투여하는 단계를 포함하는 것을 특징으로 하는 치료 방법. - 청구항 40에 있어서, 면역원성 반응은 설치류에서 생체내 분석에서 최소 항체 반응(minimal antibody response)으로서 증명되는 것을 특징으로 하는 치료 방법.
- 청구항 40에 있어서, 질환은 암(cancer)인 것을 특징으로 하는 치료 방법.
- 청구항 40에 있어서, 질환은 대사 질환(metabolic disease)인 것을 특징으로 하는 치료 방법.
- 청구항 40에 있어서, 펩티드유사 거대고리는 α-나선을 포함하는 것을 특징으로 하는 치료 방법.
- 청구항 40에 있어서, 펩티드유사 거대고리는 BH3 도메인을 포함하는 것을 특징으로 하는 치료 방법.
- 치료가 필요한 인간 환자에서 면역증식성 질환을 치료하는 방법에 있어서, 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함하는 것을 특징으로 하는 치료 방법.
- 청구항 46에 있어서, 펩티드유사 거대고리는 α-나선을 포함하는 것을 특징으로 하는 치료 방법.
- 청구항 46에 있어서, 펩티드유사 거대고리는 BH3 도메인을 포함하는 것을 특징으로 하는 치료 방법.
- 청구항 46에 있어서, 펩티드유사 거대고리는 BID 폴리펩티드인 것을 특징으로 하는 치료 방법.
- 청구항 49에 있어서, BID 폴리펩티드는 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 60% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신인 것을 특징으로 하는 치료 방법.
- 청구항 49에 있어서, BID 폴리펩티드는 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 80% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신인 것을 특징으로 하는 치료 방법.
- 청구항 49에 있어서, BID 폴리펩티드는 서열 DIIRNIARHLA*VGD*NleDRSI에 대략 95% 이상 동일하고, 여기서 *는 속박된 아미노산이고 Nle은 노르류신인 것을 특징으로 하는 치료 방법.
- 청구항 46에 있어서, 펩티드유사 거대고리는 BIM 폴리펩티드인 것을 특징으로 하는 치료 방법.
- 청구항 53에 있어서, BIM 폴리펩티드는 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 60% 이상 동일하고, 여기서 *는 속박된 아미노산인 것을 특징으로 하는 치료 방법.
- 청구항 53에 있어서, BIM 폴리펩티드는 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 80% 이상 동일하고, 여기서 *는 속박된 아미노산인 것을 특징으로 하는 치료 방법.
- 청구항 53에 있어서, BIM 폴리펩티드는 아미노산 서열 IWIAQELR*IGD*FNAYYARR에 대략 95% 이상 동일하고, 여기서 *는 속박된 아미노산인 것을 특징으로 하는 치료 방법.
- 청구항 46에 있어서, 펩티드유사 거대고리는 활성화된 hPBL 증식을 감소시키는 것을 특징으로 하는 치료 방법.
- 청구항 57에 있어서, 펩티드유사 거대고리는 시험관내 BrdU 통합 분석에서, 활성화된 hPBL 증식을 20% 이상 감소시키는 것을 특징으로 하는 치료 방법.
- 청구항 46에 있어서, 면역증식성 질환은 림프증식성 질환인 것을 특징으로 하는 치료 방법.
- 청구항 1, 17, 24, 40 또는 46중 어느 한 항에 있어서, 펩티드유사 거대고리 내에 α-탄소 원자는 화학식 R-의 독립된 치환기로 추가적으로 치환되고, 여기서 R-은 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬알킬, 헤테로알킬, 또는 헤테로시클로알킬이고, 치환되지 않거나 할로-로 치환되는 것을 특징으로 하는 치료 방법.
- 청구항 60에 있어서, 가교제(crosslinker)가 부착된 α-탄소 원자는 화학식 R-의 치환기로 추가적으로 치환되고, 여기서 R-은 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬알킬, 헤테로알킬, 또는 헤테로시클로알킬이고, 치환되지 않거나 할로-로 치환되는 것을 특징으로 하는 치료 방법.
- 청구항 60에 있어서, 가교제가 부착되지 않은 α-탄소 원자는 화학식 R-의 치환기로 추가적으로 치환되고, 여기서 R-은 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬알킬, 헤테로알킬, 또는 헤테로시클로알킬이고, 치환되지 않거나 할로-로 치환되는 것을 특징으로 하는 치료 방법.
- 청구항 1, 17, 24, 40 또는 46중 어느 한 항에 있어서, 펩티드유사 거대고리 내에 2개의 α-탄소 원자는 화학식 R-의 독립된 치환기로 추가적으로 치환되고, 여기서 R-은 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬알킬, 헤테로알킬, 또는 헤테로시클로알킬이고, 치환되지 않거나 할로-로 치환되는 것을 특징으로 하는 치료 방법.
- 청구항 63에 있어서, 가교제가 부착된 2개의 α-탄소 원자는 화학식 R-의 독립된 치환기로 추가적으로 치환되고, 여기서 R-은 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬알킬, 헤테로알킬, 또는 헤테로시클로알킬이고, 치환되지 않거나 할로-로 치환되는 것을 특징으로 하는 치료 방법.
- 청구항 63에 있어서, 가교제가 부착되지 않은 2개의 α-탄소 원자는 화학식 R-의 독립된 치환기로 추가적으로 치환되고, 여기서 R-은 알킬, 알케닐, 알키닐, 아릴알킬, 시클로알킬알킬, 헤테로알킬, 또는 헤테로시클로알킬이고, 치환되지 않거나 할로-로 치환되는 것을 특징으로 하는 치료 방법.
- 청구항 60 또는 63에 있어서, R-은 알킬인 것을 특징으로 치료 방법.
- 청구항 60 또는 63에 있어서, R-은 메틸인 것을 특징으로 치료 방법.
- 청구항 60 또는 63에 있어서, 가교제는 2개의 α-탄소 원자를 연결하는 것을 특징으로 하는 치료 방법.
- 청구항 60 또는 63에 있어서, R- 및 가교제의 일부분은 서로 합쳐 환형 구조(cyclic structure)를 형성하는 것을 특징으로 하는 치료 방법.
- 청구항 60 또는 63에 있어서, 가교제는 연속 탄소-탄소 결합으로 형성되는 것을 특징으로 하는 치료 방법.
- 청구항 60 또는 63에 있어서, 가교제는 대략 9개의 연속 결합을 보유하는 것을 특징으로 하는 치료 방법.
- 청구항 60 또는 63에 있어서, 가교제는 대략 12개의 연속 결합을 보유하는 것을 특징으로 하는 치료 방법.
- 청구항 60 또는 63에 있어서, 가교제는 적어도 대략 6개의 탄소 원자를 포함하는 것을 특징으로 하는 치료 방법.
- 청구항 60 또는 63에 있어서, 가교제는 적어도 대략 9개의 탄소 원자를 포함하는 것을 특징으로 하는 치료 방법.
- 청구항 1, 17, 24, 40 또는 46중 어느 한 항에 있어서, 펩티드유사 거대고리는 표준 치료 방법과 함께 투여되는 것을 특징으로 하는 치료 방법.
- 청구항 75에 있어서, 표준 치료 방법은 화학요법인 것을 특징으로 하는 치료 방법.
- 청구항 75에 있어서, 표준 치료 방법은 방사선요법인 것을 특징으로 하는 치료 방법.
- 청구항 75에 있어서, 표준 치료 방법은 수술인 것을 특징으로 하는 치료 방법.
- 청구항 1, 17, 24, 40 또는 46중 어느 한 항에 있어서, 펩티드유사 거대고리는 세포 침투성인 것을 특징으로 하는 치료 방법.
- 청구항 24에 있어서, 분석은 10% 혈청의 존재에서 수행되는 것을 특징으로 하는 치료 방법.
- 청구항 80에 있어서, 혈청은 인간 혈청인 것을 특징으로 하는 치료 방법.
- 청구항 24에 있어서, 펩티드유사 거대고리는 Mcl-1에 대한 10 μM 미만의 친화력을 갖는 것을 특징으로 하는 치료 방법.
- 청구항 82에 있어서, 펩티드유사 거대고리는 Mcl-1과 친-아폽토시스 단백질 사이에 상호작용을 길항하는 것을 특징으로 하는 치료 방법.
- 청구항 24에 있어서, 암은 Mcl-1에 대한 10 μM 이상의 친화력을 갖는 화합물에 내성인 것을 특징으로 하는 치료 방법.
- 청구항 84에 있어서, 암은 ABT-737 또는 이의 유사체에 내성인 것을 특징으로 하는 치료 방법.
- 치료가 필요한 인간 환자에서 ABT-737 내성 소형 세포 폐암을 치료하는 방법에 있어서, 상기 방법은 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함하고, 여기서 펩티드유사 거대고리는 BH3 도메인을 포함하는 것을 특징으로 하는 치료 방법.
- 치료가 필요한 인간 환자에서 전립선암을 치료하는 방법에 있어서, 상기 방법은 상기 환자에 펩티드유사 거대고리를 투여하는 단계를 포함하고, 여기서 펩티드유사 거대고리는 BH3 도메인을 포함하는 것을 특징으로 하는 치료 방법.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US2732608P | 2008-02-08 | 2008-02-08 | |
| US61/027,326 | 2008-02-08 | ||
| US12038008P | 2008-12-05 | 2008-12-05 | |
| US61/120,380 | 2008-12-05 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20100126361A true KR20100126361A (ko) | 2010-12-01 |
Family
ID=40952614
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107020028A KR20100126361A (ko) | 2008-02-08 | 2009-02-09 | 치료용 펩티드유사 거대고리 |
Country Status (12)
| Country | Link |
|---|---|
| US (4) | US20090275519A1 (ko) |
| EP (2) | EP2242503A4 (ko) |
| JP (2) | JP2011511076A (ko) |
| KR (1) | KR20100126361A (ko) |
| CN (2) | CN104474529A (ko) |
| BR (1) | BRPI0907754A2 (ko) |
| CA (1) | CA2714251C (ko) |
| DE (1) | DE112009000300T5 (ko) |
| GB (1) | GB2471588A (ko) |
| IL (2) | IL207421A0 (ko) |
| WO (1) | WO2009099677A2 (ko) |
| ZA (1) | ZA201005741B (ko) |
Families Citing this family (52)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2489360A1 (en) * | 2006-11-15 | 2012-08-22 | Dana-Farber Cancer Institute, Inc. | Stabilized MAML peptides and uses thereof |
| AU2007333846B2 (en) * | 2006-12-14 | 2014-01-23 | Aileron Therapeutics, Inc. | Bis-sulfhydryl macrocyclization systems |
| US7981998B2 (en) * | 2006-12-14 | 2011-07-19 | Aileron Therapeutics, Inc. | Bis-sulfhydryl macrocyclization systems |
| ES2558928T3 (es) | 2007-01-31 | 2016-02-09 | Dana-Farber Cancer Institute, Inc. | Péptidos p53 estabilizados y usos de los mismos |
| CN109627287A (zh) * | 2007-02-23 | 2019-04-16 | 爱勒让治疗公司 | 三唑大环系统 |
| US8592377B2 (en) | 2007-03-28 | 2013-11-26 | President And Fellows Of Harvard College | Stitched polypeptides |
| JP2011511076A (ja) | 2008-02-08 | 2011-04-07 | エイルロン セラピューティクス,インコーポレイテッド | 治療用ペプチド模倣大環状分子 |
| CA2737922A1 (en) * | 2008-09-22 | 2010-03-25 | Aileron Therapeutics, Inc. | Peptidomimetic macrocycles |
| CA2743177A1 (en) | 2008-11-24 | 2010-05-27 | Aileron Therapeutics, Inc. | Peptidomimetic macrocycles with improved properties |
| CA2744088A1 (en) | 2009-01-14 | 2010-07-22 | Aileron Therapeutics, Inc. | Peptidomimetic macrocycles |
| US20130072439A1 (en) * | 2009-09-22 | 2013-03-21 | Huw M. Nash | Peptidomimetic macrocycles |
| EP2488193A4 (en) * | 2009-10-14 | 2013-07-03 | Aileron Therapeutics Inc | IMPROVED PEPTIDOMIMETIC MACROCYCLES |
| GB0918579D0 (en) | 2009-10-22 | 2009-12-09 | Imp Innovations Ltd | Gadd45beta targeting agents |
| JP2013528174A (ja) | 2010-05-28 | 2013-07-08 | ザ ボード オブ リージェンツ オブ ザ ユニバーシティー オブ テキサス システム | オリゴベンズアミド化合物およびそれらの使用 |
| JP2013535514A (ja) | 2010-08-13 | 2013-09-12 | エイルロン セラピューティクス,インコーポレイテッド | ペプチド模倣大環状分子 |
| WO2012051405A1 (en) | 2010-10-13 | 2012-04-19 | Bristol-Myers Squibb Company | Methods for preparing macrocycles and macrocycle stabilized peptides |
| JP2014502152A (ja) | 2010-11-12 | 2014-01-30 | ダナ ファーバー キャンサー インスティテュート,インコーポレイテッド | 癌の治療及び診断 |
| WO2012083078A2 (en) | 2010-12-15 | 2012-06-21 | The Research Foundation Of State University Of New York | Croos-linked peptides and proteins, methods of making same, and uses thereof |
| TW201806968A (zh) | 2011-10-18 | 2018-03-01 | 艾利倫治療公司 | 擬肽巨環化合物 |
| WO2013078288A1 (en) * | 2011-11-23 | 2013-05-30 | The Board Of Regents Of The University Of Texas System | Oligo-benzamide compounds for use in treating cancers |
| US8754124B2 (en) | 2011-11-23 | 2014-06-17 | Board Of Regents, The University Of Texas System | Oligo-benzamide compounds and their use in treating cancers |
| WO2013116829A1 (en) * | 2012-02-03 | 2013-08-08 | The Trustees Of Princeton University | Novel engineered potent cytotoxic stapled bh3 peptides |
| WO2013123267A1 (en) | 2012-02-15 | 2013-08-22 | Aileron Therapeutics, Inc. | Triazole-crosslinked and thioether-crosslinked peptidomimetic macrocycles |
| CN104159595A (zh) | 2012-02-15 | 2014-11-19 | 爱勒让治疗公司 | 拟肽大环化合物 |
| SG10201805807PA (en) * | 2012-06-26 | 2018-08-30 | Del Mar Pharmaceuticals | Methods for treating tyrosine-kinase-inhibitor-resistant malignancies in patients with genetic polymorphisms or ahi1 dysregulations or mutations employing dianhydrogalactitol, diacetyldianhydrogalactitol, dibromodulcitol, or analogs or derivatives thereof |
| MX2015005244A (es) | 2012-11-01 | 2015-07-14 | Aileron Therapeutics Inc | Aminoacidos disustituidos y metodos de preparacion y el uso de los mismos. |
| WO2014138429A2 (en) | 2013-03-06 | 2014-09-12 | Aileron Therapeutics, Inc. | Peptidomimetic macrocycles and use thereof in regulating hif1alpha |
| WO2014168986A1 (en) | 2013-04-08 | 2014-10-16 | Brown Dennis M | Therapeutic benefit of suboptimally administered chemical compounds |
| AU2014318579A1 (en) | 2013-09-13 | 2016-04-14 | The California Institute For Biomedical Research | Modified therapeutic agents and compositions thereof |
| EP4212180A1 (en) | 2013-12-18 | 2023-07-19 | The Scripps Research Institute | Modified therapeutic agents, stapled peptide lipid conjugates, and compositions thereof |
| CN106604928A (zh) * | 2014-04-02 | 2017-04-26 | 罗契斯特大学 | 用于α‑螺旋拟态的大环肽模拟物 |
| MX2016013027A (es) | 2014-04-04 | 2017-05-23 | Del Mar Pharmaceuticals | Uso de dianhidrogalactitol y analogos o derivados del mismo para tratar cancer de celulas no pequeñas del pulmon y cancer de ovario. |
| AU2015320549A1 (en) | 2014-09-24 | 2017-04-13 | Aileron Therapeutics, Inc. | Peptidomimetic macrocycles and uses thereof |
| JP2018503595A (ja) * | 2014-09-24 | 2018-02-08 | エルロン・セラピューティクス・インコーポレイテッドAileron Therapeutics,Inc. | ペプチド模倣大環状分子およびその製剤 |
| EP3270945A4 (en) * | 2015-03-18 | 2018-09-05 | Massachusetts Institute of Technology | Selective mcl-1 binding peptides |
| BR112017019738A2 (pt) | 2015-03-20 | 2018-05-29 | Aileron Therapeutics Inc | macrociclos peptidomiméticos e usos dos mesmos |
| US10059741B2 (en) | 2015-07-01 | 2018-08-28 | Aileron Therapeutics, Inc. | Peptidomimetic macrocycles |
| US10023613B2 (en) | 2015-09-10 | 2018-07-17 | Aileron Therapeutics, Inc. | Peptidomimetic macrocycles as modulators of MCL-1 |
| CA2998528A1 (en) | 2015-09-22 | 2017-03-30 | The Regents Of The University Of California | Modified cytotoxins and their therapeutic use |
| US10286079B2 (en) | 2015-09-22 | 2019-05-14 | The Regents Of The University Of California | Modified cytotoxins and their therapeutic use |
| EP3368544B1 (en) | 2015-10-27 | 2020-06-17 | H. Hoffnabb-La Roche Ag | Peptide macrocycles against acinetobacter baumannii |
| US20190077840A1 (en) * | 2015-10-30 | 2019-03-14 | Massachusetts Institute Of Technology | Selective mcl-1 binding peptides |
| WO2017210489A1 (en) | 2016-06-01 | 2017-12-07 | M3 Biotechnology, Inc. | Compounds |
| US11198715B2 (en) | 2016-07-22 | 2021-12-14 | Massachusetts Institute Of Technology | Selective Bfl-1 peptides |
| EP3388444A1 (en) | 2017-04-10 | 2018-10-17 | F. Hoffmann-La Roche AG | Anti-bacterial peptide macrocycles and use thereof |
| US11524979B2 (en) | 2017-06-15 | 2022-12-13 | University Of Washington | Macrocyclic polypeptides |
| US11505573B2 (en) | 2018-03-28 | 2022-11-22 | Hoffmann-La Roche Inc. | Peptide macrocycles against Acinetobacter baumannii |
| US11819532B2 (en) | 2018-04-23 | 2023-11-21 | Hoffmann-La Roche Inc. | Peptide macrocycles against Acinetobacter baumannii |
| WO2020023502A1 (en) | 2018-07-23 | 2020-01-30 | Aileron Therapeutics, Inc. | Peptidomimetic macrocycles and uses thereof |
| US11286299B2 (en) | 2018-09-17 | 2022-03-29 | Massachusetts Institute Of Technology | Peptides selective for Bcl-2 family proteins |
| AU2020241429A1 (en) * | 2019-03-15 | 2021-10-07 | Aileron Therapeutics, Inc. | Peptidomimetic macrocycles and uses thereof |
| WO2023069332A1 (en) * | 2021-10-22 | 2023-04-27 | Merck Sharp & Dohme Llc | Cell permeable macrocyclic peptides useful for eif4e cap-binding site inhibition |
Family Cites Families (64)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US753819A (en) * | 1903-04-08 | 1904-03-01 | George Jones Atkins | Electrode. |
| US5712418A (en) * | 1989-10-23 | 1998-01-27 | Research Corporation Technologies, Inc. | Synthesis and use of amino acid fluorides as peptide coupling reagents |
| DE69118826T2 (de) | 1990-11-27 | 1996-11-14 | Fuji Photo Film Co Ltd | Propenamidderivate, deren Polymere, Copolymere und deren Verwendung |
| US5364851A (en) | 1991-06-14 | 1994-11-15 | International Synthecon, Llc | Conformationally restricted biologically active peptides, methods for their production and uses thereof |
| CA2196061C (en) * | 1992-04-03 | 2000-06-13 | Robert H. Grubbs | High activity ruthenium or osmium metal carbene complexes for olefin metathesis reactions and synthesis thereof |
| US5411860A (en) * | 1992-04-07 | 1995-05-02 | The Johns Hopkins University | Amplification of human MDM2 gene in human tumors |
| US5446128A (en) | 1993-06-18 | 1995-08-29 | The Board Of Trustees Of The University Of Illinois | Alpha-helix mimetics and methods relating thereto |
| US5622852A (en) * | 1994-10-31 | 1997-04-22 | Washington University | Bcl-x/Bcl-2 associated cell death regulator |
| US5824483A (en) | 1994-05-18 | 1998-10-20 | Pence Inc. | Conformationally-restricted combinatiorial library composition and method |
| US6407059B1 (en) * | 1994-06-08 | 2002-06-18 | Peptor Limited | Conformationally constrained backbone cyclized peptide analogs |
| IL109943A (en) * | 1994-06-08 | 2006-08-01 | Develogen Israel Ltd | Conformationally constrained backbone cyclized peptide analogs |
| US5807746A (en) | 1994-06-13 | 1998-09-15 | Vanderbilt University | Method for importing biologically active molecules into cells |
| US7553929B2 (en) * | 1994-06-13 | 2009-06-30 | Vanderbilt University | Cell permeable peptides for inhibition of inflammatory reactions and methods of use |
| US5770377A (en) * | 1994-07-20 | 1998-06-23 | University Of Dundee | Interruption of binding of MDM2 and P53 protein and therapeutic application thereof |
| US5672584A (en) * | 1995-04-25 | 1997-09-30 | The University Of Kansas | Cyclic prodrugs of peptides and peptide nucleic acids having improved metabolic stability and cell membrane permeability |
| US5811515A (en) | 1995-06-12 | 1998-09-22 | California Institute Of Technology | Synthesis of conformationally restricted amino acids, peptides, and peptidomimetics by catalytic ring closing metathesis |
| AU4385696A (en) * | 1996-01-18 | 1997-08-11 | Christian Gronhoj Larsen | Synthetic il-10 analogues |
| US5663316A (en) * | 1996-06-18 | 1997-09-02 | Clontech Laboratories, Inc. | BBC6 gene for regulation of cell death |
| US7083983B2 (en) * | 1996-07-05 | 2006-08-01 | Cancer Research Campaign Technology Limited | Inhibitors of the interaction between P53 and MDM2 |
| US5955593A (en) * | 1996-09-09 | 1999-09-21 | Washington University | BH3 interacting domain death agonist |
| US5965703A (en) * | 1996-09-20 | 1999-10-12 | Idun Pharmaceuticals | Human bad polypeptides, encoding nucleic acids and methods of use |
| US5856445A (en) * | 1996-10-18 | 1999-01-05 | Washington University | Serine substituted mutants of BCL-XL /BCL-2 associated cell death regulator |
| US6271198B1 (en) * | 1996-11-06 | 2001-08-07 | Genentech, Inc. | Constrained helical peptides and methods of making same |
| JP2001524301A (ja) * | 1997-09-17 | 2001-12-04 | ザ・ワルター・アンド・エリザ・ホール・インスティテュート・オヴ・メディカル・リサーチ | 新規治療用分子 |
| US6165732A (en) | 1997-10-14 | 2000-12-26 | Washington University | Method for identifying apoptosis modulating compounds |
| US6030997A (en) * | 1998-01-21 | 2000-02-29 | Eilat; Eran | Acid labile prodrugs |
| UA72460C2 (en) | 1998-04-15 | 2005-03-15 | Aventic Pharmaceuticals Inc | A process for the preparation of polymer- bound cyclic peptides |
| US6326354B1 (en) * | 1998-08-19 | 2001-12-04 | Washington University | Modulation of apoptosis with bid |
| SK13082001A3 (sk) * | 1999-03-29 | 2002-03-05 | The Procter & Gamble Company | Cyklický peptidový analóg a jeho výroba |
| EP1210098A1 (en) * | 1999-04-07 | 2002-06-05 | Thomas Jefferson University | Enhancement of peptide cellular uptake |
| US6713280B1 (en) | 1999-04-07 | 2004-03-30 | Thomas Jefferson University | Enhancement of peptide cellular uptake |
| US7192713B1 (en) * | 1999-05-18 | 2007-03-20 | President And Fellows Of Harvard College | Stabilized compounds having secondary structure motifs |
| US6495674B1 (en) | 2000-02-25 | 2002-12-17 | The Salk Institute For Biological Studies | Evectins and their use |
| US6703382B2 (en) * | 2000-08-16 | 2004-03-09 | Georgetown University Medical Center | Small molecule inhibitors targeted at Bcl-2 |
| WO2002064790A2 (en) | 2000-12-19 | 2002-08-22 | The Johns Hopkins University | Jfy1 protein induces rapid apoptosis |
| US6815426B2 (en) * | 2001-02-16 | 2004-11-09 | E. I. Du Pont De Nemours And Company | Angiogenesis-inhibitory tripeptides, compositions and their methods of use |
| EP1469871A4 (en) * | 2001-12-31 | 2006-08-23 | Dana Farber Cancer Inst Inc | METHOD FOR TREATING APOPTOSIS AND COMPOSITIONS THEREFOR |
| SE0201863D0 (en) | 2002-06-18 | 2002-06-18 | Cepep Ab | Cell penetrating peptides |
| US20040171809A1 (en) * | 2002-09-09 | 2004-09-02 | Korsmeyer Stanley J. | BH3 peptides and method of use thereof |
| US7166575B2 (en) * | 2002-12-17 | 2007-01-23 | Nastech Pharmaceutical Company Inc. | Compositions and methods for enhanced mucosal delivery of peptide YY and methods for treating and preventing obesity |
| WO2004058804A1 (en) | 2002-12-24 | 2004-07-15 | Walter And Eliza Hall Institute Of Medical Research | Peptides and therapeutic uses thereof |
| EP1581904A2 (en) * | 2003-01-08 | 2005-10-05 | Xencor, Inc. | Novel proteins with altered immunogenicity |
| EP1673386A2 (en) | 2003-10-16 | 2006-06-28 | AplaGen GmbH | Stabilized alpha-helical peptides |
| CN1906209A (zh) * | 2003-11-05 | 2007-01-31 | 达纳-法伯癌症研究所股份有限公司 | 稳定的α螺旋肽及其用途 |
| WO2005090388A1 (en) | 2004-03-19 | 2005-09-29 | The University Of Queensland | Alpha helical mimics, their uses and methods for their production |
| WO2005118620A2 (en) | 2004-05-27 | 2005-12-15 | New York University | Methods for preparing internally constraied peptides and peptidomimetics |
| WO2005118634A2 (en) | 2004-06-04 | 2005-12-15 | The Brigham And Women's Hospital, Inc. | Helical peptidomimetics with enhanced activity against beta-amyloid production |
| US7851637B2 (en) * | 2004-06-17 | 2010-12-14 | Infinity Pharmaceuticals, Inc. | Compounds and methods for inhibiting the interaction of BCL proteins with binding partners |
| US7842815B2 (en) * | 2004-06-17 | 2010-11-30 | Infinity Pharmaceuticals, Inc. | Compounds and methods for inhibiting the interaction of BCL proteins with binding partners |
| WO2006103666A2 (en) | 2005-03-28 | 2006-10-05 | Yeda Research And Development Co. Ltd. | Isolated bid polypeptides, polynucleotides encoding same and antibodies directed thereagainst and methods of using same for inducing cell cycle arrest or apoptosis |
| US7538190B2 (en) | 2006-02-17 | 2009-05-26 | Polychip Pharmaceuticals Pty Ltd | Methods for the synthesis of two or more dicarba bridges in organic compounds |
| US7745573B2 (en) * | 2006-02-17 | 2010-06-29 | Polychip Pharmaceuticals Pty Ltd. | Conotoxin analogues and methods for synthesis of intramolecular dicarba bridge-containing peptides |
| US7981998B2 (en) * | 2006-12-14 | 2011-07-19 | Aileron Therapeutics, Inc. | Bis-sulfhydryl macrocyclization systems |
| AU2007333846B2 (en) * | 2006-12-14 | 2014-01-23 | Aileron Therapeutics, Inc. | Bis-sulfhydryl macrocyclization systems |
| CN109627287A (zh) * | 2007-02-23 | 2019-04-16 | 爱勒让治疗公司 | 三唑大环系统 |
| US8592377B2 (en) * | 2007-03-28 | 2013-11-26 | President And Fellows Of Harvard College | Stitched polypeptides |
| WO2008137633A2 (en) * | 2007-05-02 | 2008-11-13 | Dana-Farber Cancer Institute, Inc. | Methods of modulating cellular homeostatic pathways and cellular survival |
| WO2009042237A2 (en) * | 2007-09-26 | 2009-04-02 | Dana Farber Cancer Institute | Methods and compositions for modulating bcl-2 family polypeptides |
| CA2705876C (en) * | 2007-11-20 | 2012-10-30 | Asahi Kasei Construction Materials Corporation | Process for producing heat curing resin foamed plate |
| JP2011511076A (ja) | 2008-02-08 | 2011-04-07 | エイルロン セラピューティクス,インコーポレイテッド | 治療用ペプチド模倣大環状分子 |
| EP2310407A4 (en) | 2008-04-08 | 2011-09-14 | Aileron Therapeutics Inc | BIOLOGIC EFFECTIVE PEPTIDOMIMETIC MACROCYCLES |
| CA2737922A1 (en) * | 2008-09-22 | 2010-03-25 | Aileron Therapeutics, Inc. | Peptidomimetic macrocycles |
| CA2743177A1 (en) | 2008-11-24 | 2010-05-27 | Aileron Therapeutics, Inc. | Peptidomimetic macrocycles with improved properties |
| EP2488193A4 (en) * | 2009-10-14 | 2013-07-03 | Aileron Therapeutics Inc | IMPROVED PEPTIDOMIMETIC MACROCYCLES |
-
2009
- 2009-02-09 JP JP2010545895A patent/JP2011511076A/ja active Pending
- 2009-02-09 KR KR1020107020028A patent/KR20100126361A/ko active Search and Examination
- 2009-02-09 WO PCT/US2009/000837 patent/WO2009099677A2/en active Application Filing
- 2009-02-09 CN CN201410541607.0A patent/CN104474529A/zh active Pending
- 2009-02-09 EP EP09707916A patent/EP2242503A4/en not_active Withdrawn
- 2009-02-09 BR BRPI0907754-5A patent/BRPI0907754A2/pt not_active Application Discontinuation
- 2009-02-09 US US12/378,047 patent/US20090275519A1/en not_active Abandoned
- 2009-02-09 GB GB1014734A patent/GB2471588A/en not_active Withdrawn
- 2009-02-09 CN CN200980108027XA patent/CN101980718A/zh active Pending
- 2009-02-09 DE DE112009000300T patent/DE112009000300T5/de not_active Withdrawn
- 2009-02-09 CA CA2714251A patent/CA2714251C/en not_active Expired - Fee Related
- 2009-02-09 EP EP15153712.3A patent/EP2926827A3/en not_active Withdrawn
-
2010
- 2010-08-04 IL IL207421A patent/IL207421A0/en active IP Right Grant
- 2010-08-11 ZA ZA2010/05741A patent/ZA201005741B/en unknown
-
2012
- 2012-01-17 US US13/352,223 patent/US8808694B2/en not_active Expired - Fee Related
-
2014
- 2014-07-08 US US14/325,933 patent/US20150038430A1/en not_active Abandoned
- 2014-12-02 JP JP2014244169A patent/JP2015078208A/ja active Pending
-
2015
- 2015-12-20 IL IL243240A patent/IL243240A/en active IP Right Grant
-
2018
- 2018-06-29 US US16/023,606 patent/US20190071469A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| JP2015078208A (ja) | 2015-04-23 |
| WO2009099677A3 (en) | 2009-12-17 |
| CA2714251C (en) | 2017-08-15 |
| US20090275519A1 (en) | 2009-11-05 |
| US8808694B2 (en) | 2014-08-19 |
| GB201014734D0 (en) | 2010-10-20 |
| EP2926827A2 (en) | 2015-10-07 |
| CN101980718A (zh) | 2011-02-23 |
| DE112009000300T5 (de) | 2011-01-20 |
| EP2242503A4 (en) | 2012-04-25 |
| US20190071469A1 (en) | 2019-03-07 |
| WO2009099677A2 (en) | 2009-08-13 |
| JP2011511076A (ja) | 2011-04-07 |
| US20120149648A1 (en) | 2012-06-14 |
| CN104474529A (zh) | 2015-04-01 |
| ZA201005741B (en) | 2018-11-28 |
| IL243240A (en) | 2016-11-30 |
| EP2926827A3 (en) | 2015-11-04 |
| BRPI0907754A2 (pt) | 2015-07-21 |
| IL207421A0 (en) | 2010-12-30 |
| AU2009210682A1 (en) | 2009-08-13 |
| GB2471588A (en) | 2011-01-05 |
| US20150038430A1 (en) | 2015-02-05 |
| EP2242503A2 (en) | 2010-10-27 |
| CA2714251A1 (en) | 2009-08-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20190071469A1 (en) | Therapeutic peptidomimetic macrocycles | |
| US20200102351A1 (en) | Peptidomimetic macrocycles | |
| EP1997828B1 (en) | Stabilized alpha helical peptides from BCL-2 and uses thereof | |
| AU2008218116B2 (en) | Triazole macrocycle systems | |
| JP6067626B2 (ja) | ペプチド模倣大環状分子 | |
| US20130072439A1 (en) | Peptidomimetic macrocycles | |
| WO2012173846A2 (en) | Peptidomimetic macrocycles | |
| CA2864120A1 (en) | Triazole-crosslinked and thioether-crosslinked peptidomimetic macrocycles | |
| AU2009294871A1 (en) | Peptidomimetic macrocycles | |
| CA2777700A1 (en) | Improved peptidomimetic macrocycles | |
| WO2014110420A1 (en) | Peptidomimetic compounds | |
| AU2014201269B2 (en) | Therapeutic peptidomimetic macrocycles | |
| AU2009210682B2 (en) | Therapeutic peptidomimetic macrocycles |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| AMND | Amendment | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E90F | Notification of reason for final refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| E801 | Decision on dismissal of amendment | ||
| AMND | Amendment | ||
| J201 | Request for trial against refusal decision | ||
| B601 | Maintenance of original decision after re-examination before a trial | ||
| J301 | Trial decision |
Free format text: TRIAL NUMBER: 2016101005680; TRIAL DECISION FOR APPEAL AGAINST DECISION TO DECLINE REFUSAL REQUESTED 20160929 Effective date: 20180119 |