KR20100107028A - 라사길린 제형, 그들의 제법 및 용도 - Google Patents
라사길린 제형, 그들의 제법 및 용도 Download PDFInfo
- Publication number
- KR20100107028A KR20100107028A KR1020107016952A KR20107016952A KR20100107028A KR 20100107028 A KR20100107028 A KR 20100107028A KR 1020107016952 A KR1020107016952 A KR 1020107016952A KR 20107016952 A KR20107016952 A KR 20107016952A KR 20100107028 A KR20100107028 A KR 20100107028A
- Authority
- KR
- South Korea
- Prior art keywords
- pharmaceutical composition
- plasticizer
- coating
- talc
- rasagiline
- Prior art date
Links
- IOFBTKHYVWSEKS-UHFFFAOYSA-N CC(C(C1)C1(C)C(N=O)O)C(OC)=O Chemical compound CC(C(C1)C1(C)C(N=O)O)C(OC)=O IOFBTKHYVWSEKS-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2833—Organic macromolecular compounds
- A61K9/284—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone
- A61K9/2846—Poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
Abstract
특정 약동학적 특성을 유지하면서 라사길린 메실레이트를 방출하도록 설계된 제형이 개시되어 있다.
Description
본 출원은 미국 가출원 제61/010,860호(출원일: 2008년 1월 11일)의 이득을 주장하며, 이 기초 출원은 참조로 본원에 포함된다.
이 출원의 도처에서 각종 간행물, 간행된 특허 출원 및 특허 공보 등이 인용된다. 이들 문헌의 개시 내용은 전체로서 본 발명이 속하는 기술의 설명을 더욱 충분히 기술하기 위하여 본 출원에 참조로 포함된다.
미국 특허 제5,532,415호, 제5,387,612호, 제5,453,446호, 제5,457,133호, 제5,599,991호, 제5,744,500호, 제5,891,923호, 제5,668,181호, 제5,576,353호, 제5,519,061호, 제5,786,390호, 제6,316,504호 및 제6,630,514호 공보는 라사길린으로도 공지된 R(+)-N-프로파길-1-아미노인단("R-PAI")을 개시하고 있다. 라사길린은 효소인 모노아민 옥시다제의 B-형태("MAO-B")의 선택적 억제제인 것으로 보고되어 있고, 이것은 뇌 속의 MAO-B의 억제에 의해 파킨슨 병 및 각종 기타 병상을 치료하는 데 유용하다.
미국 특허 제 6,126,968호 및 국제 특허공개 공보 WO 95/11016호 공보는 라사길린을 포함하는 약제학적 조성물을 개시하고 있으며, 이들 공보는 참조로 본원에 포함된다.
PCT 공개 제WO 2006/014973호 공보는 라사길린을 포함하는 약제학적 조성물을 개시하고 있으며, 이 공보는 참조로 본원에 포함된다.
모노아민 옥시다제("MAO") 억제제를 이용함에 있어서의 문제는 "치즈 효과"(cheese effect)로 종종 불리는 고혈압성 위기의 위험이다(Simpson, G. M. and White K. "Tyramine studies and the safety of MAOI drugs." J Clin Psychiatry. 1984 JuI; 45(7 pt 2): 59-91). 이 효과는 주변 MAO(peripheral MAO)의 억제에 의해 유발된다. 고농도의 주변 MAO는 위에서 발견된다.
파킨슨병 환자에 있어서의 또 다른 문제는 많은 환자가 위 배출지연(delayed gastric emptying)을 앓는다는 점이다(Pfeiffer, R. F. and Quigley, E. M. M. "Gastrointestinal motility problems in patients with Parkinson's disease: Epidemiology, pathophysiology, and guidelines for management," CNS-Drugs, 1999, 11(6): 435-448; Jost, W. H., "Gastrointestinal motility problems in patients with Parkinson's disease: Effects of antiparkinsonian treatment and guidelines for management", Drug sand Aging, 1997, 10(4) : 249-258). 위 배출지연(장기 위 체류)은 주변 MAO의 증가된 억제의 원인일 수 있고, 치즈 효과에 기여할 수 있다.
아질렉트(AZILECT)(등록상표)는 초기의 단독 요법으로서 그리고 레보도파에 대한 보조요법으로서 특발성 파킨슨병의 징후 및 증상의 치료를 위한 필요성을 나타내고 있다. 아질렉트(등록상표)의 활성 성분인 라사길린은 신속하게 흡수되어 대략 1시간 내에 최고 혈장 농도(Cmax)에 도달한다. 라사길린의 절대 생체이용률(absolute bioavailability)은 약 36%이다(Azilect® Product Label, May 2006).
음식물은 라사길린의 Tmax에 영향을 미치지 않지만, 해당 약물이 고지방 식사와 함께 섭취된 경우, Cmax 및 노출(AUC)은 각각 대략 60% 및 20%만큼 감소된다. AUC는 상당히 영향받지 않으므로, 아질렉트(등록상표)는 음식물과 함께 혹은 음식물 없이 투여될 수 있다(Azilect® Product Label, May 2006).
정상 상태에서의 분포의 평균 체적은 87ℓ이며, 이것은 라사길린의 조직 결합이 혈장 단백질 결합을 초과하는 것을 나타낸다. 혈장 단백질 결합은 88 내지 94%의 범위로, 1 내지 100ng/㎖의 농도 범위에 걸쳐 인간 알부민에 대한 결합의 평균 정도는 61 내지 63%이다(Azilect® Product Label, May 2006).
라사길린은 분비 전에 간에서 거의 완전한 생체내변환을 받는다. 라사길린의 대사작용은 두 주된 경로인 N-탈알킬화 및/또는 하이드록실화를 통해 진행되어, 1-아미노인단(AI), 3-하이드록시-N-프로파길-1 아미노인단(3-OH-PAI) 및 3-하이드록시-1-아미노인단(3-OH-AI)을 수득한다. 시험관내 실험은, 라사길린 대사작용의 두 경로가 사이토크롬 P450(CYP) 시스템에 의존하고, CYP1A2가 라사길린 대사작용에 내포된 주된 동종효소인 것을 나타낸다. 후속 소변 배출에 의한 라사길린의 글루쿠로나이드 컨쥬게이션 및 그의 대사산물은 주된 제거 경로이다(Azilect® Product Label, May 2006).
14C-표지화 라사길린의 경구 투여 후, 제거는 최초로 소변을 통해서 이어서 대변을 통해서 일어났으며(7일에 걸쳐서 소변의 총 용량의 62%, 대변의 총 용량의 7%), 38일의 기간에 걸쳐서 용량의 84%의 계산된 총 회복률을 보였다. 라사길린의 1% 이하가 소변 중에 미변화 약물로서 분비되었다(Azilect® Product Label, May 2006).
라사길린은 강력한 비가역성 MAO-B 선택적 억제제인 것으로 밝혀졌다. MAO-B 억제는 선조체(striatum) 내의 도파민의 세포외 수준의 증가를 초래한다. 상승된 도파민 수준 및 후속의 증가된 도파민 작용성 활성은 도파민 작용성 운동 기능장애의 모델에서 보여지는 라사길린의 유익한 효과를 매개하는 것으로 여겨진다(Rasagiline mesylate. TVP-1012 for Parkinson's disease. Investigator's Brochure. Edition number 18. Teva Pharmaceuticals Ltd. September 2006).
본 발명은 라사길린 메실레이트(rasagiline mesylate)와 적어도 1종의 약제학적으로 허용가능한 부형제를 포함하는 코어부(core); 및 약제학적으로 허용가능한 내산성 피복부(coating)를 포함하는 약제학적 조성물을 제공하되, 해당 약제학적 조성물이 이하의 pH 조건 하에서 60분 동안 37℃, 75rpm에서 500㎖의 완충된 수성 매체 중에서 바스켓 장치(basket apparatus) 내에 놓일 경우 이하의 퍼센트의 라사길린 메실레이트를 방출한다:
a) 0.1N HCl에서 0%;
b) pH 6.0의 인산염 완충 용액 중에서 0 내지 20%.
본 발명은 또한 라사길린 메실레이트와 적어도 1종의 약제학적으로 허용가능한 부형제를 포함하는 코어부; 및 약제학적으로 허용가능한 내산성 피복부를 포함하는 약제학적 조성물을 제공하되, 해당 약제학적 조성물이, 인체에 섭취된 경우, 동일 용량 요법 간격에 걸쳐서 속방성 제형(immediate release formulation)으로서 섭치된 대응하는 양의 라사길린의 AUC(곡선하 면적: area under the curve) 값의 80 내지 130%의 라사길린의 AUC 값을 제공한다.
본 발명은 라사길린 메실레이트와 적어도 1종의 약제학적으로 허용가능한 부형제를 포함하는 코어부; 및 약제학적으로 허용가능한 내산성 피복부를 포함하는 약제학적 조성물을 제공하되, 해당 약제학적 조성물은, 인체에 섭취된 경우, 동일 용량 요법 간격에 걸쳐서, 속방성 제형으로서 섭취된 대응하는 양의 라사길린의 Cmax의 80 내지 145%의 라사길린의 Cmax를 제공한다.
본 발명은 또한 라사길린 메실레이트와 적어도 1종의 약제학적으로 허용가능한 부형제를 포함하는 코어부; 및 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1)와 적어도 1종의 가소제를 포함하는 피복부를 포함하되, 상기 피복부에 있어서 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1) 대 가소제의 비는 10 대 1 내지 2 대 1인 것인 약제학적 조성물을 제공한다.
본 발명은 또한 상기 약제학적 조성물을 환자에게 투여하는 단계를 포함하는, 파킨슨병을 앓고 있는 환자를 치료하는 방법도 제공한다.
도 1: 각 임상 시험 피험자(피검체)에 대한 혈장 농도(0 - 24시간) - 시험 제품 A - 1일
도 2: 각 임상 시험 피험자에 대한 혈장 농도(0 - 36시간) - 시험 제품 A - 10일
도 3: 각 임상 시험 피험자에 대한 혈장 농도(0 - 24시간) - 참고 제품 C - 1일
도 4: 각 임상 시험 피험자에 대한 혈장 농도(0 - 36시간) - 참고 제품 C - 10일
도 5: 평균 혈장 농도(0 - 24시간) - 1일
도 6: 평균 혈장 농도(0 - 36시간) - 10일
도 7: 평균 혈장 농도(0 - 24시간) - 1일 - 반대수 눈금(Semi-Logarithmic Scale)
도 8: 평균 혈장 농도(0 - 36시간) - 10일 - 반대수 눈금
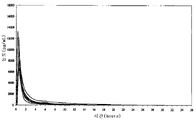
도 9: 상이한 라사길린 제형에 의한 1일 및 10일째 투여 6시간 후의 MAO-B 억제%(평균치 ± 평균표준오차).
도 2: 각 임상 시험 피험자에 대한 혈장 농도(0 - 36시간) - 시험 제품 A - 10일
도 3: 각 임상 시험 피험자에 대한 혈장 농도(0 - 24시간) - 참고 제품 C - 1일
도 4: 각 임상 시험 피험자에 대한 혈장 농도(0 - 36시간) - 참고 제품 C - 10일
도 5: 평균 혈장 농도(0 - 24시간) - 1일
도 6: 평균 혈장 농도(0 - 36시간) - 10일
도 7: 평균 혈장 농도(0 - 24시간) - 1일 - 반대수 눈금(Semi-Logarithmic Scale)
도 8: 평균 혈장 농도(0 - 36시간) - 10일 - 반대수 눈금
도 9: 상이한 라사길린 제형에 의한 1일 및 10일째 투여 6시간 후의 MAO-B 억제%(평균치 ± 평균표준오차).
본 발명은 라사길린 메실레이트와 적어도 1종의 약제학적으로 허용가능한 부형제를 포함하는 코어부; 및 약제학적으로 허용가능한 내산성 피복부를 포함하는 약제학적 조성물을 제공하되, 해당 약제학적 조성물이 이하의 pH 조건 하에서 60분 동안 37℃, 75rpm에서 500㎖의 완충된 수성 매체 중에서 바스켓 장치 내에 놓일 경우 이하의 퍼센트의 라사길린 메실레이트를 방출한다:
a) 0.1N HCl에서 0%;
b) pH 6.0의 인산염 완충 용액 중에서 0 내지 20%.
상기 약제학적 조성물의 일 실시형태에 있어서, 60분 동안 pH 6.2, 37℃, 75rpm에서 500㎖의 완충된 수성 매체 중에서 바스켓 장치 내에 놓일 경우 80 내지 100%의 라사길린 메실레이트를 방출한다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 20분 동안 pH 6.8, 37℃, 75rpm에서 500㎖의 완충된 수성 매체 중에서 바스켓 장치 내에 놓일 경우 80 내지 100%의 라사길린 메실레이트를 방출한다.
본 발명은 또한 라사길린 메실레이트와 적어도 1종의 약제학적으로 허용가능한 부형제를 포함하는 코어부; 및 약제학적으로 허용가능한 내산성 피복부를 포함하는 약제학적 조성물을 제공하되, 해당 약제학적 조성물은, 인체에 섭취된 경우, 동일 용량 요법 간격에 걸쳐서, 속방성 제형으로서 섭취된 대응하는 양의 라사길린의 AUC 값의 80 내지 130%의 라사길린의 AUC 값을 제공한다.
상기 약제학적 조성물의 일 실시형태에 있어서, 상기 약제학적 조성물은, 인체에 투여 시, 동일 용량 요법 간격에 걸쳐서, 속방성 제형으로서 섭취된 대응하는 양의 라사길린의 AUC 값의 80 내지 125%의 라사길린의 AUC 값을 제공한다.
본 발명은 또한 라사길린 메실레이트와 적어도 1종의 약제학적으로 허용가능한 부형제를 포함하는 코어부; 및 약제학적으로 허용가능한 내산성 피복부를 포함하는 약제학적 조성물을 제공하되, 해당 약제학적 조성물은, 인체에 섭취된 경우, 동일 용량 요법 간격에 걸쳐서, 속방성 제형으로서 섭취된 대응하는 양의 라사길린의 Cmax의 80 내지 145%의 라사길린의 Cmax를 제공한다.
상기 약제학적 조성물의 일 실시형태에 있어서, 상기 약제학적 조성물은, 인체에 투여 시, 동일 용량 요법 간격에 걸쳐서, 속방성 제형으로서 섭취된 대응하는 양의 라사길린의 AUC 값의 80 내지 125%의 라사길린의 AUC 값을 제공한다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 코어부는 태블릿(tablet), 즉, 정제의 형태이다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 코어부는 태블릿의 형태이고, 적어도 1종의 붕해제(disintegrant)를 추가로 포함한다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 내산성 피복부는 상기 약제학적 조성물의 5% 내지 12%를 구성한다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 내산성 피복부는 상기 약제학적 조성물의 8%를 구성한다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 약제학적 조성물은 태블릿 형태이다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 피복부는 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1) 및 가소제를 포함한다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 피복부 중의 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1) 대 가소제의 중량비는 10 대 1 내지 2 대 1이다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 피복부 중의 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1) 대 가소제의 중량비는 5 대 1이다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 가소제는 트라이에틸 시트레이트(triethyl citrate)이다
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 피복부는 메타크릴산 에틸 아크릴레이트 공중합체 (1:1), 가소제 및 탤크(talc)를 포함한다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 약제학적 조성물은 내부 피복층을 포함한다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 약제학적 조성물은 내부 피복층을 포함하며, 해당 내부 피복층은 하이프로멜로스(hypromellose)를 포함한다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 약제학적 조성물은 150㎎ 이하의 중량을 지닌다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 약제학적 조성물은 1.56㎎의 라사길린 메실레이트를 포함한다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 약제학적 조성물은 0.78㎎의 라사길린 메실레이트를 포함한다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 약제학적 조성물은 1.56㎎ 혹은 0.78㎎의 라사길린 메실레이트, 그리고, 만니톨, 콜로이드성 이산화규소, 전분 NF, 호화 전분, 스테아르산, 탤크, 하이프로멜로스, 메타크릴산 - 에틸 아크릴레이트 공중합체, 탤크 엑스트라 파인 및 트라이에틸 시트레이트를 포함한다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 약제학적 조성물은 만니톨 79.84㎎, 콜로이드성 이산화규소 0.6㎎, 라사길린 메실레이트 1.56㎎, 전분 NF 10.0㎎, 호화 전분 20.0㎎, 스테아르산 2.0㎎, 탤크 2.0㎎, 하이프로멜로스 4.8㎎, 메타크릴산 - 에틸 아크릴레이트 공중합체 6.25㎎, 트라이에틸 시트레이트 1.25㎎ 및 탤크 엑스트라 파인 3.1㎎으로 구성되어 있다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 약제학적 조성물은 만니톨 80.62㎎, 콜로이드성 이산화규소 0.6㎎, 라사길린 메실레이트 0.78㎎, 전분 NF 10.0㎎, 호화 전분 20.0㎎, 스테아르산 2.0㎎, 탤크 2.0㎎, 하이프로멜로스 4.8㎎, 메타크릴산 - 에틸 아크릴레이트 공중합체 6.25㎎, 트라이에틸 시트레이트 1.25㎎ 및 탤크 엑스트라 파인 3.1㎎으로 구성되어 있다.
본 발명은 또한 a) 라사길린 메실레이트와 적어도 1종의 약제학적으로 허용가능한 부형제를 포함하는 코어부; 및 b) 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1)와 적어도 1종의 가소제를 포함하는 피복부를 포함하되, 상기 피복부에 있어서 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1) 대 가소제의 비는 10 대 1 내지 2 대 1인 약제학적 조성물을 제공한다.
상기 약제학적 조성물의 일 실시형태에 있어서, 상기 피복부 중의 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1) 대 가소제의 비는 5 대 1이다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 피복부는 상기 약제학적 조성물의 5% 내지 12%를 구성한다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 피복부는 상기 약제학적 조성물의 8%를 구성한다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 가소제(들)는 수 가용성이다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 가소제(들)는 수종의 수 가용성 가소제의 조합물이다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 가소제(들)는 수 가용성 가소제와 수 불용성 가소제의 조합물이다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 가소제는 트라이에틸 시트레이트이다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 피복부는 윤활제(들)를 추가로 포함한다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 피복부는 윤활제(들)를 포함하되, 해당 윤활제는 탤크 엑스트라 파인이다
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 피복부는 탤크 엑스트라 파인을 추가로 포함한다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 코어부는 태블릿 형태이다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 코어부는 적어도 1종의 붕해제를 포함한다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 코어부는 붕해제를 0.5중량% 내지 20중량% 포함한다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 코어부는 호화 전분을 포함하는 붕해제를 0.5중량% 내지 20중량% 포함한다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 약제학적 조성물은 150㎎ 이하의 중량을 지닌다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 약제학적 조성물은 1.56㎎의 라사길린 메실레이트를 포함한다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 약제학적 조성물은 1.56㎎의 라사길린을 포함한다.
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 약제학적 조성물은 0.78㎎의 라사길린을 포함한다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 약제학적 조성물은 만니톨, 콜로이드성 이산화규소, 전분 NF, 호화 전분, 스테아르산, 탤크, 하이프로멜로스, 메타크릴산 - 에틸 아크릴레이트 공중합체, 탤크 엑스트라 파인 및 트라이에틸 시트레이트를 추가로 포함한다
상기 약제학적 조성물의 다른 실시형태에 있어서, 상기 약제학적 조성물은 만니톨 79.84㎎, 콜로이드성 이산화규소 0.6㎎, 라사길린 메실레이트 1.56㎎, 전분 NF 10.0㎎, 호화 전분 20.0㎎, 스테아르산 2.0㎎, 탤크 2.0㎎, 하이프로멜로스 4.8㎎, 메타크릴산 - 에틸 아크릴레이트 공중합체 6.25㎎, 트라이에틸 시트레이트 1.25㎎ 및 탤크 엑스트라 파인 3.1㎎으로 구성되어 있다.
상기 약제학적 조성물의 또 다른 실시형태에 있어서, 상기 약제학적 조성물은 만니톨 80.62㎎, 콜로이드성 이산화규소 0.6㎎, 라사길린 메실레이트 0.78㎎, 전분 NF 10.0㎎, 호화 전분 20.0㎎, 스테아르산 2.0㎎, 탤크 2.0㎎, 하이프로멜로스 4.8㎎, 메타크릴산 - 에틸 아크릴레이트 공중합체 6.25㎎, 트라이에틸 시트레이트 1.25㎎ 및 탤크 엑스트라 파인 3.1㎎으로 구성되어 있다.
본 발명은 상기 약제학적 조성물을 환자에게 투여하는 단계를 포함하는, 파킨슨병을 앓고 있는 환자의 치료방법도 제공한다.
상기 방법의 일 실시형태에 있어서, 상기 환자는 위 배출지연을 앓고 있는 환자이다.
라사길린의 속방성 제형은 특발성 파킨슨병의 치료를 위해 필요로 되는 프로파길아민계 약물인 라사길린(메실레이트로서)을 함유하는 아질렉트(등록상표)로서 규정된다. 이것은 화학적으로 1H-인덴-1-아민, 2,3-다이하이드로-N-2-프로피닐-, (1R)-, 메테인설포네이트로서 명명된다. 라사길린 메실레이트는 물이나 에탄올에는 자유로이 용해되고 아이소프로판올에는 난용성인 백색 내지 회색을 띤 백색 분말이다. 경구 투여용의 각 아질렉트 태블릿은 라사길린 염기 0.5㎎ 혹은 1㎎과 등가인 라사길린 메실레이트를 함유한다.
각 아질렉트 태블릿은 또한 이하의 활성 성분, 즉, 만니톨, 전분, 호화 전분, 콜로이드성 이산화규소, 스테아르산 및 탤크를 함유한다.
아질렉트는 특발성 파킨슨병의 치료를 위해 필요한 비가역성 모노아민 옥사다제이다. 아질렉트는 MAO B형을 억제하지만, 라사길린이 인간에게 있어 MAO B형(MAO-B)에 대해 선택적인지의 여부를 확립하는 적절한 연구는 아직 행해져 있지 않다.
플라빈 함유 효소인 MAO는 두 주된 분자종 A 및 B로 분류되고, 신경 말단, 뇌, 간 및 창자 점막에서 신체의 전체에 걸쳐서 미토콘드리아막에 국한되어 있다. MAO는 CNS 및 주변 조직에서 카테콜아민 및 세로토닌의 대사작용 저하를 조절한다. MAO-B는 인간 뇌에서의 주된 형태이다. 뇌, 간 및 창자 조직에서의 생체외 동물 연구에서, 라사길린은 강력한 비가역성 모노아민 옥사다제 B형(MAO-B) 선택적 억제제인 것으로 판명되었다. 권장되는 치료적 용량에서의 라사길린은 또한 혈소판에서의 MAO-B의 강력한 비가역적 억제제인 것으로 판명되었다. 인간에서의 MAO-B(MAO-A가 아니라)만을 억제하는 라사길린의 선택성 및 소정 용량에서의 라사길린 치료 동안 티라민에 대한 감수성은 약물에 함유된 식사의 티라민 및 아민류의 규제를 피하는 것을 충분히 특징으로 하지 않게 되었다.
라사길린의 작용의 정확한 기전은 알려져 있지 않다. 하나의 기전은 그의 MAO-B 억제 활성에 관련된 것으로 여겨지고, 이것은 선상체 내의 도파민의 세포외 수준을 증가시킨다. 상승된 도파민 수준 및 후속의 증가된 도파민 작용성 활성은 도파민 작용성 운동 기능장애의 모델에서 보여지는 라사길린의 유익한 효과를 매개하는 것으로 여겨진다.
건강한 피험자 및 파킨슨병 환자의 연구는 라사길린이 혈소판 MAO-B를 비가역적으로 억제하는 것을 밝히고 있다. 해당 억제는 최종 투여 후 적어도 1주일 지속된다. 거의 25 내지 35%의 MAO-B 억제가 1㎎/day의 단독 라사길린 투약 후 달성되었고, 55% 이상의 MAO-B 억제는 2㎎/day의 단독 라사길린 투약 후 달성되었다. 90% 이상의 억제는 2㎎/day의 라사길린 매일 투약 후 3일째에 달성되었으며, 이 억제 수준은 투약 후 3일에 유지되었다. 1일당 0.5㎎, 1㎎ 및 2㎎의 라사길린의 다회 투약 결과 완전한 MAO-B 억제가 얻어졌다.
라사길린의 약동학(pharmacokinetics)은 1 내지 10㎎의 범위에 걸쳐서 용량에 따라 선형이다. 그의 정상 상태의 반감기는 3시간이지만, 그의 MAO-B의 비가역적 억제 때문에 그의 약리학적 효과와 약동학적 효과의 상관은 없다.
라사길린은 신속하게 흡수되어 대략 1시간 내에 최고 혈장 농도(Cmax)에 도달한다. 라사길린의 절대 생체이용률은 약 36%이다.
음식물은 라사길린의 Tmax에 영향을 미치지 않지만, 해당 약물이 고지방 식사와 함께 섭취된 경우, Cmax 및 노출(AUC)은 각각 대략 60% 및 20%만큼 감소된다. AUC는 유의하게 영향받지 않으므로, 아질렉트는 음식물과 함께 혹은 음식물 없이 투여될 수 있다(Physician' Desk Reference, 63rd Edition, 2009, p3106).
MAO-B를 선택적으로 억제하는 MAO 억제제는 "치즈 효과"를 일으키는 잠재력이 크게 없다. 그럼에도 불구하고, R-PAI의 위 배출지연이 이 현상에 기여할 수 있는 가능성은 존재한다. 따라서, 본 발명의 제형의 개발의 주된 목표는, 위를 통과하여 십이지장 및 빈 창자에서 활성 성분을 방출하는, 라사길린 염기 1㎎과 등가인 양으로 라사길린 메실레이트를 포함하는 서방성의 장용 피복 제형을 개발하는 데 있었다.
본 발명의 제형의 개발 동안, 해당 제형이 건강한 피험자에서의 단일 용량 생물학적 동등성(single dose bio-equivalence) 연구에서 (실시예에서 개시된 바와 같은) 기지의 속방성 라사길린 메실레이트 제형에 대한 생물학적 동등성의 기준에 부합할 필요가 있는 것으로 결정되었다. 이들 기준은 신규의 제형과 기지의 속방성 제형 간에 90% 신뢰 구간 내에서 80 내지 125%의 범위 내에서 Cmax 및 AUC0 -t(곡선하 면적)의 상사성을 포함한다. 두 제형 간의 차이는 tmax의 차로서 생물학적 동등성 연구에서 명백할 것이다. 즉, 본 발명의 제형의 평균 약동학 프로파일은, tmax가 속방성 제형에 대한 것보다 서방성 제형(delayed release formulation)에 대해서 커야만 하는 것을 제외하고, 기지의 속방성 제형의 평균 약동학 프로파일과 부합할 필요가 있다.
기지의 속방성 제형의 평균 Cmax 및 AUC0 -t와 부합시키기 위한(즉, 생물학적 동등성인 서방성 제형을 조제하기 위한) 시도의 이유는 속방성 제형의 효능이 입증되었다는 점이고, 상기 제형의 효능은 그의 평균 Cmax 및/또는 AUC와 관련되는 것으로 여겨진다(Arch Neurol. 2002; 59: 1937-1943).
이 목표에 도달하기 위하여, 개발은 매우 특정 범위의 pH에서 라사길린 메실레이트의 방출을 허용하는 장용 피복과 함께 신속하게 분해하는 코어부를 지닌 장용 피복 정제에 관한 것이었다. 이 특정 pH 범위는 상기 제형이 위에서의 라사길린 메실레이트를 방출하는 것을 방지할 것이며, 또한 상기 제형이 창자의 생리학적 조건 하에서 신속하게 라사길린 메실레이트를 방출하는 것을 허용할 것이다.
PCT 출원 공보 제WO 2006/014973호에서, 장용 피복된 라사길린 메실레이트 약제학적 제형이 개시되어 있다. 개시된 제형(실시예 1, 2 및 4)에서는, 유드라지트(Eudragit)(등록상표) L-30 D-55로서 공지된 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1) 30% 분산액이 이용되었다. 상기 공보에서 명백한 바와 같이, 이들 제형은 실제로 그들의 용해 프로파일(dissolution profile)에 의해 그리고 생체내 데이터에 의해 표시된 바와 같은 서방성 제형이었지만, 평균 Cmax로 환산한 약동학 프로파일은, 속방성 라사길린 메실레이트 제형의 약동학 프로파일과 부합되지 않았다.
상기 공보 제WO 2006/014973호에서 이용되는 유드라지트(등록상표) L-30 D-55로서 공지된 부형제인 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1) 30% 분산제는, 태블릿 혹은 구형상체 상에 수성 분산액으로서 도포된 경우, 낮은 산성 pH에서 피복된 조성물의 용해를 방지한다. 이 폴리머의 구조는 다음과 같다:
에스터기에 대한 유리 카복실기의 비는 대략 1:1이다. 그 평균분자량은 대략 250,000이다.
이 부형제가 수성 분산액 혹은 유기 용액 중에 이용되어 약제학적 제형의 필름 코팅으로 형성되는 경우, 약 5.5의 pH에서 용해되도록 의도되어 있다(Aqueous Polymeric Coatings for Pharmaceutical Dosage Forms; Second Edition, Revised and Expanded. Ed. James W. McGinity, 1997). 이들 종래 기술의 제형은, 아마도 위 속의 pH를 상승시킬 수 있는 음식물의 존재 하에, 위 속에서 용해되기 시작하여, 십이지장 및 빈 창자 내에서 연장된 기간에 걸쳐서 계속 용해될 것이다. 이 연장된 용해 기간은 이들 종래의 제형의 Cmax가 비교되는 속방성 제형의 Cmax보다 유의하게 낮은 이유를 설명할 수 있었다.
본 발명의 조성물은 6.0의 pH 조건에 견디도록 의도되어 있고, 그 pH 이상에서만 활성 성분을 방출하도록 의도되어 있다. 이 특정 pH는 위 속에서 본 발명의 약제학적 조성물의 용해를 피하고 또한 십이지장 및 빈 창자 속에서 본 발명의 약제학적 조성물의 신속한 용해를 허용하기 위하여 채택되었다. 십이지장 속에서 라사길린 메실레이트를 방출하고 이어서 신속하게 라사길린 메실레이트를 방출하기 전에 십이지장으로 유입되는 약제학적 제형의 능력은 약동학 프로파일, 구체적으로는 공지의 속방성 제형의 것과 유사한 Cmax 및 AUC0 -t를 제공한다.
Cmax가 대응하는 속방성 제형과 유사한 서방성 약제학적 제형의 목표를 달성하는 것은 자명하지 않다. 일반적으로, 서방성 제형이 생체 연구에서의 그들의 속방성 등가체와 비교될 경우, 서방성 제형의 Cmax는 대응하는 속방성 제형의 Cmax보다 낮다(Mascher, et al. Arneimittelforschung. 2001; 51(6) : 465-9. Behr, et al. J. Clin Pharmacol. 2002; 42(7): 791-7).
또한, 본 발명은 위 속에서의 라사길린의 방출이나 흡수를 억제하도록(즉, 상기 투약 형태(즉, 제형)의 적어도 일부가 위를 횡단할 때까지 라사길린의 방출을 지연시키도록) 적합화된 라사길린을 포함하는 약제학적 투약 형태(즉, 제형)를 제공함으로써 주변 MAO 억제의 문제에 대한 해결책을 제공한다. 이것은 위 속에서의 라사길린의 흡수를 피하거나 최소화함으로써, 잠재적인 치즈 효과를 피하거나 최소화한다.
상기 약제학적 투약 형태는 해당 투약 형태 혹은 그의 일부가 위의 산성 환경과 접촉하는 것을 방지하는 내산성 부형제로 구성될 수 있다. 해당 내산성 부형제는 장용 피복된 태블릿, 캡슐 혹은 젤라틴 캡슐의 형태로 라사길린을 피복할 수 있다. 본 발명의 본문에서 장용 피복은 위 속의 산성 성분의 용해를 방지하는 피복이다. 이것은 미국 약전 방법에 의해 규정된 바와 같이 산성 용액 중에서 약제학적 투약 형태의 용해를 측정함으로써 결정된다. 장용 약제학적 투약 형태에서도, 투약 형태의 일부는 위 속에서 용해될 수 있지만, 해당 투약 형태는 미국 약전 표준에 따라 여전히 장용인 것으로 여겨질 수 있다.
본 발명은, 그의 측면들 모두에 있어서, 공지된 경구 투약 형태에 의한 라사길린의 투여와 전형적으로 연관된 주변 MAO 억제의 저감된 위험성을 지니지만, 파킨슨병, 뇌 허혈, 두부 외상, 척수 외상, 신경외상, 신경변성 질환, 신경독성 손상, 신경 손상, 치매, 알츠하이머형 치매, 노인 치매, 우울증, 기억 장애, 과다활동 증후군, 주의력 결핍장애, 다발경화증, 정신분열증 및 정동 질환(affective illness)으로 이루어진 군으로부터 선택된 병상을 치료하는 데 유용한 경구 약제학적 투약 형태를 제공한다.
본 발명의 경구 투약 형태를 조제하는 데 이용될 수 있는 약제학적으로 허용가능한 담체 및 부형제의 구체예는 예를 들어 미국 특허 제6,126,968호(Peskin et al., 발행일: 2000년 10월 3일)에 기재되어 있다. 본 발명에 이용가능한 투약 형태를 제조하기 위한 기술 및 조성물은 예를 들어 이하의 문헌들에 기재되어 있다: 7 Modern Pharmaceutics, Chapters 9 and 10 (Banker & Rhodes, Editors, 1979); Pharmaceutical Dosage Forms: Tablets (Lieberman et al., 1981); Ansel, Introduction to Pharmaceutical Dosage Forms 2nd Edition (1976); Remington's Pharmaceutical Sciences, 17th ed. (Mack Publishing Company, Easton, Pa., 1985); Advances in Pharmaceutical Sciences (David Ganderton, Trevor Jones, Eds., 1992); Advances in Pharmaceutical Sciences Vol 7. (David Ganderton, Trevor Jones, James McGinity, Eds., 1995); Aqueous Polymeric Coatings for Pharmaceutical Dosage Forms (Drugs and the Pharmaceutical Sciences, Series 36 (James McGinity, Ed., 1989); Pharmaceutical Particulate Carriers: Therapeutic Applications: Drugs and the Pharmaceutical Sciences, Vol 61 (Alain Rolland, Ed., 1993); Drug Delivery to the Gastrointestinal Tract (Ellis Horwood Books in the Biological Sciences. Series in Pharmaceutical Technology; J. G. Hardy, S. S. Davis, Clive G. Wilson, Eds.); Modern Pharmaceutics Drugs and the Pharmaceutical Sciences, Vol 40 (Gilbert S. Banker, Christopher T. Rhodes, Eds).
태블릿은 적절한 바인더, 윤활제, 붕해제, 착색제, 향미제, 흐름 유발제, 용융제 및 가소제를 함유할 수 있다. 예를 들어, 태블릿 혹은 캡슐의 투약 단위 형태의 경구 투여를 위해서, 활성 약물 성분은 자일로스, 젤라틴, 한천, 전분, 메틸 셀룰로스, 인산 이칼슘, 황산 칼슘, 만니톨, 솔비톨, 미세결정성 셀룰로스 등의 경구 방식이면서 비독성인 약제학적으로 허용가능한 불활성 담체와 조합될 수 있다. 적절한 바인더로는 전분, 젤라틴, 옥수수 전분 등의 천연당, 아카시아, 트래거캔스 등의 천연 및 합성 고무, 또는 알긴산 나트륨, 포비돈, 카복시메틸셀룰로스, 폴리에틸렌 글라이콜, 왁스 등을 들 수 있다. 이들 투약 형태에서 이용되는 윤활제로는 올레산 나트륨, 스테아르산 나트륨, 벤조산 나트륨, 아세트산 나트륨, 스테아르산, 스테아릴푸마르산 나트륨, 탤크 등을 들 수 있다. 붕해제로는, 이들로 제한되지는 않지만, 전분, 메틸 셀룰로스, 한천, 벤토나이트, 잔탄 고무, 크로스카멜로스 나트륨, 전분 글리콜산 나트륨 등을 들 수 있고, 적절한 가소제로는 트라이아세틴, 트라이에틸 시트레이트, 다이뷰틸 세바케이트, 폴리에틸렌 글라이콜 등을 들 수 있다.
본 발명에서 이용되는 바스켓형 장치는 문헌[United States Pharmacopeia, 29th Edition, chapter 711]에 기재된 장치 1이다. 이 장치는 다음과 같이 구성되어 있다:
이러한 조립체는 다음과 같이 구성되어 있다: 유리 혹은 기타 불활성의 투명한 재료로 이루어진 덮개 달린 용기; 모터; 금속성 구동 샤프트; 및 원통형 바스켓. 상기 용기는 가열 재킷 내에 위치되거나 임의의 편리한 크기의 적절한 수조 속에 부분적으로 침지된다. 수조 혹은 가열 재킷은 시험 동안 용기 내부의 온도를 37 ± 0.5℃에서 유지하는 것을 허용하고, 또한 일정하고도 원활한 움직임으로 수조의 유체를 유지하는 것을 허용한다. 조립체가 놓여 있는 환경을 비롯하여, 해당 조립체의 어느 부분도 상당한 움직임, 교반, 혹은 원활하게 회전하는 교반 요소로 인한 것을 넘는 진동에 기여하지 않는다. 시험 동안 시험편 및 교반 요소의 관찰을 허용하는 장치가 바람직하다. 상기 용기는 반구형 바닥과 이하의 치수 및 용량 중 하나를 지니는 원통이다: 즉, 공칭 용량 1ℓ에 대해서, 높이 160㎜ 내지 210㎜, 내경 98㎜ 내지 106㎜; 공칭 용량 2ℓ에 대해서, 높이 280㎜ 내지 300㎜, 내경 98㎜ 내지 106㎜; 공칭 용량 4ℓ에 대해서, 높이 280㎜ 내지 300㎜, 내경 145㎜ 내지 155㎜. 그의 측면들은 상부에 플랜지가 부착되어 있다. 끼워맞춤된 덮개는 증발을 지연시키는 데 이용될 수 있다. 상기 샤프트는 그의 축이 상기 용기의 수직축으로부터 임의의 지점에서 2㎜ 이하이고 상당한 비틀거림 없이 원활하게 회전하도록 위치결정되어 있다. 샤프트 회전 속도가 개별의 모노그래프(monograph)에 규정된 속도에서 ±4% 이내에서 선택되고 유지될 수 있게 하는 속도 조절 장치가 이용된다. 교반 요소의 샤프트 및 바스켓 부품은 스테인레스 강 316 타입 혹은 등가물로 제작된다.
개별의 모노그래프에서 달리 규정된 경우를 제외하고, 40-메쉬 천(40-mesh cloth)을 이용한다. 0.0001인치(2.5㎛) 두께의 금 피복을 지닌 바스켓이 이용될 수 있다. 투약 단위는 각 시험의 개시 시 건조 바스켓 내에 놓인다. 용기의 내부 바닥부와 바스켓 사이의 거리는 시험 동안 25 ± 2㎜에서 유지된다.
본 발명의 본문 내에서, 용해는 6개의 약제학적 투약 형태, 예를 들어, 캡슐 혹은 태블릿의 평균 측정치로서 측정된다.
본 발명은 이하의 실험적인 상세로부터 더욱 잘 이해될 것이다. 그러나, 당업자라면 구체적인 방법 및 개시된 결과는 단지 본 발명을 설명하기 위한 것임을 쉽게 이해할 수 있을 것이며 본 발명은 첨부된 특허청구범위에서 더욱 충분히 기재되어 있다.
실시예
1:
라사길린
속방성
태블릿
라사길린 속방성 태블릿은 이하의 표 1에 기재된 성분을 이용해서 제조되었다.
라사길린 메실레이트, 만니톨, 절반량의 콜로이드성 이산화규소, 전분 및 호화 전분을 Diosna P-800 믹서에서 혼합하였다. 물을 첨가하고 이 혼합물을 더욱 혼합하였다. 얻어진 과립체(granulate)를 건조시키고 콜로이드성 이산화규소의 나머지 부분을 첨가하였다. 상기 과립체를 프레위트 밀(Frewitt mill)에서 분쇄시키고, 스테아르산과 탤크를 첨가하였다. 상기 과립체를 5분 동안 텀블러에서 혼합하고 태블릿으로 만들었다.
실시예
2:
장용
피복 입자를 포함하는
라사길린
캡슐
라사길린 캡슐은 PCT 출원 공보 제WO 2006/014973호의 실시예 3에 따라 제조하였다.
이들 캡슐은 HCl 용액을 이용해서 2.4 내지 3.6의 목표 pH로 조정되고 NaOH 용액을 이용해서 4.2 내지 5.2의 목표 pH로 조정된 프탈산염 완충액으로부터 제조된 각종 수용성의 산성 매체 500㎖ 중에서 용해 시험되었다.
상기 캡슐 제형은 pH 5.2의 매체 내에서 60분 후에 용해되기 시작한다. 이것은 실시예 1의 속방성 제형과 비교할 경우 이 제형에 기인된 단식 상태에서 12명의 건강한 남성 지원자에서 단일 용량의 교차 비교 약동학 연구에서의 보다 낮은 Cmax 값을 설명할 수 있다. 이 제형의 용해는, 해당 제형이 십이지장에 유입되는 시간에서부터 해당 제형이 창자에서 빈 창자로 진행할 때까지 서서히 일어나는 것으로 여겨진다. 이론에 얽매이는 일없이, 이것은 위 속에서 캡슐이 분해되어 피복된 펠릿이 창자를 통해 상이한 속도로 움직여, 장시간에 걸쳐서 보다 큰 창자 표면적에 대해서 라사길린을 방출하는 사실에 기인될 수 있다.
실시예
3:
라사길린
태블릿
코어부
실시예 1의 속방성 제형과 닮은 약동학 프로파일(Cmax 및 AUC)을 지니는 태블릿 코어부를 조제하는 시도를 행하였다.
미국 특허 제6,126,968호 공보에 개시된 태블릿 제형에 의거한 일련의 태블릿 코어부 제형은 표 1의 부형제의 양을 이용해서 제조되었다.
상기 태블릿은 습식 과립화 기술을 이용해서 조제되었고 붕해제의 양은 변화시켰다.
[표 3a]
[표 3b]
태블릿 코어부는 다음과 같이 제조되었다: 만니톨, 절반량의 콜로이드성 이산화규소, 라사길린 메실레이트, 전분 NF, 호화 전분 및 크로스카멜로스 나트늄(적용가능한 경우)를 고전단 과립화 믹서에서 혼합하였다. 여기에 정제수를 첨가하고 계속 혼합하였다. 얻어진 과립체를 유동상 건조기에서 건조시키고 약 25℃로 냉각시켰다. 나머지 콜로이드성 이산화규소를 더욱 첨가하고 얻어진 과립체를 0.6㎜ 스크린을 구비한 진동 과립화기에서 분쇄시켰다. 스테아르산과 탤크를 첨가하고, 이 과립체를 Y자 형상 콘 믹서(Y-cone mixer)에서 혼합시켰다. 이어서, 과립체를 태블릿으로 가압시켰다.
상기 개시된 부형제를 이용해서 제조된 태블릿 코어부는 시험되어, 고속 분해 및 용해 방출을 지니는 것으로 판정되었다.
제형 B에 따른 태블릿 코어부는, 신속한 분해를 유지하면서 다른 제형에 비해서 더욱 양호한 압축성 및 보다 높은 경도값을 부여하였기 때문에 계속적인 개발을 위해 채택되었다.
제형 B에 따른 태블릿 코어부의 용해%는, 500㎖의 용해 매체 중, 50rpm에서 작동되는 패들 장치, 0.1N HCl을 이용해서 시험되었다. 그 결과는 이하의 표 3c에 기재되어 있다.
[표 3c]
이 실시예는 제형 B에 따른 라사길린 메실레이트 태블릿 코어부의 용해가 신속한 것을 나타낸다.
실시예
4:
라사길린
메실레이트
피복 태블릿
이하의 부형제를 이용해서 실시예 3의 제형 B에 따라 제조된 태블릿 코어부를 이용해서 태블릿을 제조하였다:
[표 4a]
유드라지트(등록상표) L-100(메타크릴산 - 메틸 메타크릴레이트 공중합체 [1:1])과 트라이에틸 시트레이트를 에탄올에 가하여 용액을 얻었다. 오하라 코터 피복팬(Ohara coater coating pan)에서 이 용액을 이용해서 상기 태블릿에 분사하였다. 입구 공기 온도는 30 내지 40℃였고, 출구 공기 온도는 30 내지 35℃의 범위였다. 팬 속도는 7rpm으로 설정되었고, 분사 속도는 10 내지 20rpm이었다. 노즐 직경은 0.8㎜ 내지 1.2㎜이었다. 해당 태블릿은, 최소 팬 속도 상에서, 상기 피복 팬에서의 동일한 조건에서 2시간 동안 건조되었다.
상기 피복 태블릿의 0.1N HCl 중에서의 용해 프로파일은 서방성(장용 피복) 제품에 대한 미국 약전 규정(제29판, 챕터 724)에 따라 허용가능하였고, 이것은 120분 후 10% 이하의 방출을 보였다.
75rpm, 37℃에서 바스켓 장치 내에서 상이한 pH 매체(5.4-6.8) 500㎖ 중에서의 상기 제품의 용해 프로파일은 표 4b에 제공되어 있다. pH 6.0 내지 6.8의 매체는 NaOH 용액에 의해 목표 pH로 조절된 인산칼륨 완충액 매체였다. pH 5.4 내지 5.6의 매체는 NaOH 용액에 의해 목표 pH로 조절된 프탈산염 완충액 매체였다.
[표 4b]
표 4b에서 명백한 바와 같이, pH 5.4 혹은 5.6에서 방출은 없었지만, pH 6.0 이상으로부터, 라사길린의 느린 방출이 관찰되었다.
실시예
5: 추가의
라사길린
메실레이트
피복 태블릿
60분 후 바스켓 장치에서 pH 6.0-6.4에서 용해되지 않지만 pH 6.6-6.8에서 용해되는 태블릿을 제조하기 위하여, 코어부에 대한 피복층의 퍼센트를 증가시키면서 수 가용성 가소제인 트라이에틸 시트레이트의 양을 피복의 20%까지 감소시켰다. 제형 G에 이용된 부형제는 표 5a에 기재되어 있다.
[표 5a]
제형 G에 따른 태블릿은 다음과 같이 제조되었다. 피복 및 가소제의 양을 조절한 것을 제외하고 실시예 4에서와 마찬가지로 코어부를 피복시켰다.
상기 피복 태블릿의 0.1N HCl 중에서의 용해 프로파일은 서방성(장용 피복) 제품에 대한 미국 약전 규정(제29판, 챕터 724)에 따라 허용가능하였고, 이것은 120분 후 10% 이하의 방출을 보였다.
75rpm, 37℃에서 바스켓 장치 내에서 상이한 pH 매체(6.2-6.8) 중에서의 상기 제형 G의 용해 프로파일은 표 5a에 제공되어 있다. 상기 매체는 NaOH 용액에 의해 목표 pH로 조절된 인산칼륨 완충액 매체를 이용해서 제조되었다.
[표 5b]
표 5b로부터 명백한 바와 같이, pH 6.2-6.6에서는 60분에 걸쳐서 용해가 관찰되지 않았다. pH 6.8에서, 필요에 따라 충분히 빠른 방출이 얻어졌다.
실시예
6: 추가의
라사길린
메실레이트
피복 태블릿
실시예 5로부터의 제형 G는 코어부 크기를 축소시킴으로써 변형시켰다. 코어부 크기의 축소는, 창자 속으로 더욱 신속하게 통과할 수 있는 보다 작은 태블릿을 가능하게 하는 동기를 부여하였고, 이에 따라 태블릿 부식을 저감시켰다. 이 변형에 부가해서, 코어부에서의 라사길린 메실레이트와 유드라지트(등록상표) L 폴리머 간의 어떠한 가능한 상호작용도 방지하기 위하여 추가의 피복(프레-코트: pre-coat)이 추가되었다.
표 6a에 기재된 성분을 이용해서 제형 H에 따른 피복 태블릿이 제조되었다.
[표 6a]
제형 H에 따른 피복 태블릿의 제조는 다음과 같이 진행되었다:
만니톨 USP, 절반량의 콜로이드성 이산화규소, 라사길린 메실레이트, 전분 NF 및 호화 전분을 혼합하였다. 물을 혼합하여 물과 과립화하고 태블릿으로 압착시켰다.
코어부에서의 라사길린 메실레이트와 유드라지트(등록상표) L 폴리머 간의 어떠한 가능한 상호작용도 방지하기 위하여, 태블릿 코어부가 우선 프레코팅으로서 하이프로멜로스(파마코트(Pharmacoat)(등록상표) 606G)로 피복되었고, 이어서 메타크릴산 - 메틸 메타크릴레이트 공중합체[1:1](유드라지트(등록상표) L-100)로 피복되었다.
파마코트(등록상표) 606G(하이프로멜로스 USP) 용액은 아이소프로파일 알코올 1,000g 및 정제수 500g 중에 파마코트(등록상표) 606G 156g을 이용해서 제조되었다.
오하라 코터 피복팬에서 이 용액을 이용해서 상기 태블릿 코어부에 분사하였다. 입구 공기 온도는 30 내지 40℃였고, 출구 공기 온도는 30 내지 35℃의 범위였다. 팬 속도는 7rpm으로 설정되었고, 분사 속도는 10 내지 20rpm이었다. 해당 태블릿은 1시간 동안 건조되었다.
유드라지트(등록상표) L-100 및 트라이에틸 시트레이트를 아이소프로파일 알코올에 첨가하여 용액을 제조하였다. 건조를 1시간 대신에 2시간 지속시킨 것을 제외하고 파마코트(등록상표) 606G 중간 피복과 동일한 조건에서 오하라 코터 피복 팬에서 상기 용액을 이용해서 상기 태블릿에 분사하였다.
상기 피복 태블릿의 0.1N HCl 중에서의 용해 프로파일은 서방성(장용 피복) 제품에 대한 미국 약전 규정(제29판, 챕터 724)에 따라 허용가능하였고, 이것은 120분 후 10% 이하의 방출을 보였다.
pH 6.8 완충액 중에서의 용해는 표 6b에 개시되어 있다.
[표 6b]
실시예
7 -
라사길린
메실레이트
서방성
태블릿
[표 7]
유드라지트(등록상표) L 100-55는 메타크릴산과 에틸 아크릴레이트에 의거한 음이온성 공중합체를 함유한다. 이것은 또한 메타크릴산 공중합체 C 타입으로도 공지되어 있다. 에스터기에 대한 유리 카복실기의 비는 대략 1:1이다. 평균분자량은 대략 250,000이다.
만니톨, 절반량의 콜로이드성 이산화규소, 라사길린 메실레이트, 전분 및 호화 전분을 혼합하였다. 여기에 정제수를 첨가하여 과립체를 형성하였다. 이 과립체를 건조(입력 온도 55℃, 출력 온도 37℃)시켰다. 이 과립체에 콜로이드성 이산화규소의 나머지 부분을 첨가하고, 해당 과립체를 분쇄(0.6㎜ 메쉬)시켰다. 그 후, 스테아르산과 탤크를 첨가하고, 이어서 해당 과립체를 태블릿으로 압착시켰다.
코어부에서의 라사길린 메실레이트와 유드라지트(등록상표) L 폴리머 간의 어떠한 가능한 상호작용도 방지하기 위하여, 태블릿 코어부가 우선 프레-코팅으로서 하이프로멜로스(파마코트(등록상표) 606G)로 피복되었고, 이어서 메타크릴산 - 에틸 아크릴레이트 공중합체인 유드라지트(등록상표) L 100-55로 피복되었다.
파마코트(등록상표) 606G(하이프로멜로스 USP) 용액은 아이소프로파일 알코올 1,000g 및 정제수 500g 중에 파마코트(등록상표) 606G 155g을 이용해서 제조되었다.
오하라 코터 피복팬에서 상기 용액을 이용해서 상기 태블릿 코어부에 분사하였다. 입구 공기 온도는 35 내지 40℃였고, 출구 공기 온도는 30 내지 35℃의 범위였다. 팬 속도는 8 내지 12rpm으로 설정되었고, 분사 속도는 10 내지 20g/min이었다. 해당 태블릿은 2시간 동안 건조되었다.
유드라지트(등록상표) L-100-55(236.5g)를 아이소프로판올 1.250㎏ 및 정제수 119g에 가하고, 맑은 용액이 형성될 때까지 혼합하였다. 아이소프로판올 637g 내 트라이에틸 시트레이트(47.3g)를 가하였다. 탤크 USP 엑스트라 파인 117.304g과 아이소프로판올 500g을 함께 10분 동안 혼합하고 나서, 상기 용액에 가하였다. 얻어진 태블릿에 오하라 코터 피복팬에서 상기 용액을 분사하였다. 입구 공기 온도는 35 내지 38℃였고, 출구 공기 온도는 30 내지 35℃의 범위였다. 팬 속도는 14 내지 18rpm으로 설정되었고, 분사 속도는 5 내지 20g/min이었다. 해당 태블릿은 2시간 동안 건조되었다.
상기 피복 태블릿의 0.1N HCl 중에서의 용해 프로파일은 서방성(장용 피복) 제품에 대한 미국 약전 규정(제29판, 챕터 724)에 따라 허용가능하였고, 이것은 120분 후 10% 이하의 방출을 보였다.
실시예
8 -
실시예
7에 따른 태블릿의 용해 결과
A 내지 D로 표기된 4개의 상이한 배취(batch)로부터 실시예 7에 따라 제조된 태블릿에 대해서 미국 약전 규정에 따라 각종 매체에서의 용해 프로파일을 시험하였다. 이하의 데이터는 6개의 태블릿에 대한 평균치를 나타낸다. 사용된 장치는 각종 pH 레벨의 인산염 완충용액 500㎖를 구비한 75rpm에서의 바스켓 장치였다. 태블릿은 0.1N HCl에서 2시간 마찬가지 장치에 유지한 후 상기 인산염 완충용액 속으로 옮겼다.
[표 8a]
[표 8b]
[표 8c]
[표 8d]
용해:
실시예 7에 따라 제조된 태블릿은 6.0 이하의 pH에서 라사길린의 방출이 일어나지 않는다. pH 6.8에서, 라사길린의 신속한 방출이 있고, 20분 이내에 라사길린의 90% 이상이 상기 제형으로부터 방출된다.
본 발명의 제형의 개발 동안, 해당 제형은 건강한 피험자에서의 단일 용량생물학적 동등성에서 기지의 속방성 라사길린 메실레이트 제형(실시예 1에 개시되어 있음)에 대한 생물학적 동등성의 기준과 부합될 필요가 있는 것을 판정되었다. 이들 기준은 이 신규의 제형과 기지의 속방성 제형 간에 90% 신뢰 구간 내 80 내지 125%의 범위 내에서 Cmax 및/또는 AUC0 -t(곡선하 면적)의 상사성을 포함한다. 상기 두 제형 간의 차이는 tmax의 차이로서 생물학적 동등성 연구에서 명백하게 되었다. 즉, 본 발명의 제형의 평균 약동학 프로파일은, tmax가 속방성 제형에 대한 것보다 서방성 제형에 대한 것이 큰 것을 제외하고, 기지의 속방성 제형의 평균 약동학 프로파일과 부합될 필요가 있다.
기지의 속방성 제형의 평균 Cmax 및 AUC0 -t와 부합하도록(즉, 생물학적 동등성이 있는 서방성 제형을 조제하도록 시도하는 이유는, 속방성 제형의 효능이 입증되어 있기 때문이고, 해당 제형의 효능은 그의 평균 Cmax 및/또는 AUC와 관련되는 것으로 여겨진다(Arch Neurol. 2002; 59:1937-1943).
이 목표에 도달하기 위하여, 개발은 매우 특정 범위의 pH에서 라사길린 메실레이트의 방출을 허용하는 장용 피복과 함께 신속하게 분해하는 코어부를 지닌 장용 피복 정제에 관한 것이었다. 이 특정 pH 범위는 상기 제형이 위에서의 라사길린 메실레이트를 방출하는 것을 방지할 것이며, 또한 상기 제형이 창자의 생리학적 조건 하에서 신속하게 라사길린 메실레이트를 방출하는 것을 허용할 것이다.
실시예 7의 태블릿은 PCT 출원 공보 제WO 2006/014973호에서의 조성이었던 메타크릴산 에틸 아크릴레이트 공중합체를 포함하는 장용 피복으로 피복되어 있지만, 실시예 7에 따른 태블릿은 6.0 이하의 pH에서 견딜 수 있는 능력이 있는 반면, PCT 출원 공보 제WO 2006/014973호의 조성물은 그렇지 못하였다.
용해 프로파일의 차이는 가소제에 대한 폴리머의 보다 낮은 비가 본 발명의 조성물에 이용된 사실에 기인한다. 10:1 내지 2:1, 특히 5:1의 비는 개선된 시험관내 용해 프로파일을 허용한다.
실시예 7의 제형의 용해 프로파일은, 현재 시판되고 있는 속방성 제형과 마찬가지로, 조성물이 개선된 약동학적 특성을 지니도록 허용한다.
실시예
9 - 용매로서 물을 단독으로 이용해서 제조된
라사길린
메실레이트
서방성 태블릿
위에서 상세히 설명된 바와 같이, 실시예 7에서의 피복 현탁액의 제제는 용매로서 아이소프로판올을 이용하였다. 실시예 7에 따른 추가의 제형은 아이소프로판올을 이용하는 일없이, 즉 "물 제형"(water formulation)으로 제조되었다. 라사길린 메실레이트 장용 피복 제형 배취 X 및 배취 Y는 이러한 "물 제형"의 예이다.
[표 9a]
[표 9b]
배취
X 및 Y에 대한 용해 결과
상기 피복 태블릿의 0.1N HCl 중에서의 용해 프로파일은 서방성(장용 피복) 제품에 대한 미국 약전 규정(제29판, 챕터 724)에 따라 허용가능하였고, 이것은 120분 후 10% 이하의 방출을 보였다.
75rpm, 37℃에서 바스켓 장치 내에서 상이한 pH 매체(6.0-6.8) 500㎖ 중에서의 상기 제품의 용해 프로파일은 이하의 표에 제공되어 있다. pH 6.0 내지 6.8의 매체는 NaOH 용액에 의해 목표 pH로 조절된 인산칼륨 완충액 매체였다.
[표 9c]
[표 9d]
"물 제형"의 이들 용해 결과는 실시예 8에서의 용해 결과와 양호하게 상관성이 있다.
실시예
10 -
실시예
7에 따른 태블릿에 의거한 임상 연구
이 연구는 건강한 성인 피험자에서 10일 연속해서 1일 1회 경구 투약(1×1㎎ 태블릿 혹은 1×1㎎ 캡슐)에 따른 아질렉트(등록상표) 태블릿과 비교하여 라사길린 서방성 태블릿(1㎎ 라사길린 염기)과 라사길린 메실레이트 EC SGC(1㎎ 라사길린 염기)의 주변 MAO-B 억제의 정도 및 상대 생체 이용률을 평가하였다.
1. 연구 설계
이 연구는 개방 실험(open-label), 무작위 추출, 다회 용량, 3-주기, 3-수순(sequence), 비교 교차 연구였다. 연구 종료까지 검사되는 연구의 총 기간은 기간들 사이에 적어도 21일의 약효세척단계(washout)를 포함하여 대략 12주이다. 연구 체크 인에서, 피험자들은 투약 1일 및 10일 전 적어도 10.5시간에 임상 사이트에 보고되었고, 투약 1일 및 10일 후 24시간 동안 체류가 요구되었다. 피험자들은 이 연구의 가정에서의 투약 부분을 준수하고 연구 관련 활동을 완료하는 각 연구 기간마다 3개의 개별의 시기에 임상 사이트에 보고할 것이 요구되었다.
2. 피험자 선택
총 12명의 건강한 남성 및 여성 피험자(수순당 4명)가 18 내지 55세의 연령에서 선택되었다. 충분한 수의 피험자를 선별하여 12명의 피험자가 등록되었다. 피험자는 전 지역 사회의 일원을 구성하는 공공 시설에 수용되지 않은 피험자들로부터 선택되었다. 피험자들은 연구 동안 저-티라민 식사를 유지하였다.
3. 연구 제품 및 무작위 추출
시험 제품 A
실온수 대략 240㎖(8 액량 온스)를 이용해서 실시예 7에 따라 제조된 1 태블릿의 시험 제품[테바 파마슈티컬 인더스트리즈 리미티드에 의한 라사길린 서방성 태블릿(1㎎ 라사길린 염기)].
시험 제품 B
연구 1일 내지 10일의 아침에 1회 실온수 대략 240㎖(8 액량 온스)를 이용한 1 캡슐의 시험 제품 B[라사길린 메실레이트 장용 피복 연질 젤라틴 캡슐(1㎎ 라사길린 염기].
참고 제품 C
실온수 대략 240㎖(8 액량 온스)를 구비한 1 태블릿의 참고 제품[테바 파마슈티컬 인더스트리즈 리미티드에 의한 아질렉트(등록상표) 태블릿(1㎎ 라사길린 염기); 테바 뉴로사이언스사에 의해 시판됨].
무작위 추출
수순
수순 1 = A B C
수순 2 = B C A
수순 3 = C A B
적어도 10시간의 하룻밤 절식 후 연구일 1 및 10일째에 용량 투여를 실시하였다.
두 시험 제품은 라사길린 염기(메실레이트로서) 1㎎을 함유하는 라사길린의 장용 피복된 서방성 제형이다. "장용 피복"(EC: enteric-coated) 및 서방성"(DR: delayed release)이란 용어는 이 연구의 목적을 위해 호환가능하다. 약어 SGC는 이 연구의 목적을 위해 연질 젤라틴 캡슐을 표시하는데 이용된다.
연구 동안 피험자의 안전성 평가는 필요에 따라 수행되었다.
4. 샘플 수집 및 취급 절차
약동학적 샘플링(무작위 추출에 의함)은 대응하는 시점에서 이하의 일자에 행하였다:
a) 시험 제품 A 및 B:
· 투약 전(0시간) 90분 이내의 1일째 및 용량 투여 후 0.5, 1, 1.33, 1.67, 2, 2.33, 2.67, 3, 3.33, 3.67, 4, 4.5, 5, 6, 7, 8, 9, 12 및 24시간
· 투약 전(0시간) 8일 및 9일째
· 투약 전(0시간) 10일째 및 용량 투여 후 0.5, 1, 1.33, 1.67, 2, 2.33, 2.67, 3, 3.33, 3.67, 4, 4.5, 5, 6, 7, 8, 9, 12, 24 및 36시간
b) 참고 제품 C:
· 투약 전(0시간) 90분 이내의 1일째 및 용량 투여 후 0.25, 0.5, 0.75, 1, 1.5, 2, 3, 4, 5, 6, 7, 8, 12 및 24시간
· 투약 전(0시간) 8일 및 9일째
· 투약 전(0시간) 10일째 및 용량 투여 후 0.25, 0.5, 0.75, 1, 1.5, 2, 3, 4, 5, 6, 7, 8, 12, 24 및 36시간
약동학적 샘플을 위하여 총 76개의 혈액 샘플[시험 제품 A 및 시험 제품 B에 대해서 43개 그리고 참고 제품 C에 대해서 33개]을 수집하였다.
약역학적
샘플 수집
스케쥴
· 투약 전(0시간) 90분 이내의 1일째 및 용량 투여 후 6시간
· 용량 투여 후 6시간에서 10일째
약역학적 샘플링을 위해서 기간당 3개의 혈액 샘플 × 2 연구 기간(총 6개의 샘플)이 수집되었다.
5. 샘플 분석
a) 라사길린 및 아미노인단 혈장 농도는 승인된 생물학적 분석 방법을 이용해서 그리고 생물학적 분석 실험실 표준 조작 절차(Bioanalytical Laboratory's Standard Operating Procedures) 및 FDA 지침에 따라 측정되었다.
b) 혈소판 내의 MAO-B 활성의 측정은 보증된 GLP인 실험실에서 GLP의 원리에 따라 비승인된 방법으로 수행되었다.
c) 동의를 철회하거나 이 연구를 그만둔 피험자들로부터의 샘플은 분석하지 않았다.
모든 피험자에 대해서, 각 주기의 개시 전에 얻어진 혈소판 MAO-B 활성은 대조값인 것으로 생각되었다. 약물 노출 동안 혈소판 MAO-B 활성은 대조군의 %로서 표현되었다. 혈소판에서의 MAO-B 활성의 측정은 보증된 GLP인 실험실 내에서 SOP에 따라 수행되었다.
약동학적 및 통계학적 분석이 라사길린 및 아미노인단 혈장 데이터에 대해서 수행되었다. 피험자 번호 1 내지 12로부터의 데이터는 피험자가 적어도 2 주기를 종료하고 주기들 중 하나에서 참고 제품이 투약된 경우 분석되었다.
각 제형 및 각 투여일에 대해 개별적으로 분석이 제공되었다. 라사길린 및 아미노인단 혈장 농도에 대한 약동학적 변수는 1일 동안의 비교에 대해서 이하에 나타낸 바와 같은 표준 비구획화 접근법을 이용해서 산출되었다(Gibaldi M, Perrier D., Pharmacokinetics, 2nd edition, New York: Marcel Dekker Inc., 1982):
AUC0 -t: 선형 사다리꼴 공식(linear trapezoidal rule)을 이용해서 산출된, 제로 시간으로부터 최종 정량화가능한 농도의 시간(t)까지의 농도-시간 곡선 하의 면적.
AUC0 - inf: 제로 시간으로부터 무한대까지 외삽된 농도-시간 곡선 하의 면적.
AUC0 -t/AUC0 - inf: AUC0 - inf에 대한 AUC0 -t의 비(%) .
Cmax: 검사에 의해 얻어진 최대 혹은 최고 농도.
Tmax: 검사에 의해 얻어진 최대 혹은 최고 농도의 시간.
Tlag: 첫번째로 측정가능한(비제로) 농도에 대응하는 시간 전의 시간.
Kel: 반대수 농도 대 시간 곡선의 말기 상에 대한 선형 회귀에 의해 추정된 말단 소실 속도 상수(terminal elimination rate constant).
T½: 제품의 반감기.
라사길린 및 아미노인단 혈장 농도에 대한 약동학적 변수는 10일째의 비교용으로 이하에 표시된 바와 같은 표준 비구획화 접근법을 이용해서 산출되었다(Gibaldi M., Perrier D., Pharmacokinetics, 2nd edition, New York: Marcel Dekker Inc., 1982):
AUC0 -t: 선형 사다리꼴 공식을 이용해서 산출된, 제로 시간으로부터 최종 정량화가능한 농도의 시간(t)까지의 농도-시간 곡선 하의 면적.
AUC0 -t( ss ): 선형 사다리꼴 공식을 이용해서 산출된, 정상 상태에서의 투약 간격(τ)에 대한 농도 대 시간 곡선 하의 면적.
Cmax ( ss ): 정상 상태에서의 최대 혹은 최고 측정 혈장 농도.
Cmin ( ss ): 정상 상태에서의 최소 혹은 최저 측정 혈장 농도.
Cav ( ss ): 계산: AUC0 -τ/τ(여기서 τ는 투약 간격임)에 의해 얻어진 정상 상태에서의 평균 혈장농도.
변동 지수: [(Cmax ( ss )-Cmin ( ss ))/Cav ( ss )]로서 계산된 정상 상태에서의 변동
Tmax ( ss ): 검사에 의해 얻어진, 정상 상태에서의 최대 혹은 최고 측정 혈장농도의 시간.
Tlag ( ss ): 첫번째로 측정가능한(비제로) 농도에 대응하는 시간 전의 시간.
최고 대 최저 변동치%: 100*[(Cmax ( ss )-Cmin ( ss ))/Cmin ( ss )]로서 계산됨.
최고 대 최저 요동치: (Cmax ( ss )-Cmin ( ss ))로서 계산됨.
Kel: 반대수 농도 대 시간 곡선의 말기 상에 대한 선형 회귀에 의해 추정된 말단 소실 속도 상수.
T½: 제품의 반감기.
1일째의 상대 생체이용률은 AUC0 - inf(시험)/AUC0 - inf(참조)로서 규정됨.
10일째의 상대 생체이용률은 AUC0 -τ(시험)/AUC0 -τ(참조)로서 규정됨.
LOQ(limit of quantitization) 이하의 혈장 농도는 혈장 농도 데이터 리스트에서 "BLQ"로서 표지되고, 각 주기의 첫번째 측정가능한 값 이전에 기록된다면 0으로 설정되었다. 농도가 BLQ 투약 후이고 이어서 LOQ 이상의 농도로 되었다면, 이 값은 기술 통계에 대해서 ½LOQ로 설정되었다. 다른 경우에는, BLQ 값은 PK 분석으로부터 배제되었다. 실제의 샘플링 시간은 약동학적 분석에 이용되었다.
1일째 혹은 10일째의 비교를 위한 농도 대 시간 프로파일에서의 말기 로그 직선 상을 나타내지 않는 경우에 대해서는 Kel, AUC0 - inf 혹은 T½은 보고되지 않았다.
기타 약동학적 변수는 필요한 경우 계산된다.
통계학적 분석은 1일 및 10일에서의 라사길린 및 아미노인단 혈장 농도 데이터에 대해서 수행되었다. 피험자 번호 1 내지 12로부터의 데이터는 피험자가 참고 제품 및 적어도 하나의 시험 제품의 첫번째 투약을 받은 경우 단일 용량(1일) 분석에 대해 분석되었다. 피험자 번호 1 내지 12로부터의 데이터는 피험자가 적어도 두 기간을 완료하고 기간들 중 하나에서 참고 제품이 투약된다면 다회 용량(10일)에 대해서 분석되었다.
개별의 그리고 평균 MAO-B 억제 퍼센트가 각 치료의 최초 및 최종 투약 후 6시간째의 다회 용량 투여 후에 표로 작성되었고, 또한 N, 산술 평균, 표준 편차 및 변동 계수(coefficient of variation)(CV%)에 의해 요약되었다.
라사길린 및 아미노인단의 개별의 및 평균 혈장 농도는 각 치료 동안 각각 예정된 시점에서 단일 및 다회 용량 투여 후에 표로 작성되었고, 또한 N, 산술 평균, 표준 편차 및 변동 계수(CV%)에 의해 요약되었다. 농도 BLQ는 1/2LOQ로 설정된 값을 제외하고 기술 통계에 대해서 0으로서 취해졌다.
그래픽 표시는 각 피험자에 대해서 측정된 각 주기 및 로그-변환 후에 생성되었다. 평균(±SD) 농도-시간 곡선은 약물 흡입에 대한 예정된 샘플링 시간에 의거해서 표시된다.
산술 평균, 표준 편차 및 변동 계수는 위에서 열거된 변수에 대해서 계산되었다. 또한, 기하학적 평균은 1일 및 10일에 대해서 AUC0 -t, AUC0 - inf(1일 단독), AUC0-t 및 Cmax에 대해 계산되었다. 모든 완료된 기간으로부터의 데이터는 이들 분석에 포함되었다.
변량분석(Analyses of variance: ANOVA)은 1일째에 Ln-변환된 약동학적 변수 AUC0 -t, AUC0 - inf 및 Cmax에 대해 그리고 10일째에 Ln-변환된 약동학적 변수 AUC0 -τ 및 Cmax에 대해 개별적으로 수행되었다. ANOVA 모델은 고정된 효과로서의 수순, 제형 및 기간, 그리고 랜덤한 효과로서 수순 내에 수속된 피험자를 포함하였다. 수순은 에러 항으로서 수순 내에 소속된 피험자를 이용해서 시험되었다. 5% 유의수준이 수순 효과를 시험하는 데 이용되었다. 각 변량 분석은 최소자승평균의 계산, 조정된 제형 제품 간의 차이 및 이 차이와 연관된 표준 오차를 포함하였다. 상기 통계학적 분석은 MIXED 절차(SAS(등록상표))를 이용해서 수행되었다.
Tmax는 비모수 분석(nonparametric analysis)(윌곡슨 부호 순위검정(Wilcoxon Signed Rank Test))을 이용해서 분석되었다.
생물학적 동등성에 대한 두 편측 검정(one-sided test)(Schuirmann DJ., A comparison of the two one-sided tests procedure and the power approach for assessing the equivalence of average bioavailability, J Pharmacokinet Biopharm 1987; 15:657-80)에 따라서, 해당 검정과 참조 제형 최소자승평균(LSM) 간의 차이에 대한 90% 신뢰 구간은, 1일째에 대한 Ln-변환된 데이터를 이용한 변수 AUC0 -t, AUC0 - inf 및 Cmax 그리고 10일째에 대한 AUC0 -t 및 Cmax를 이용해서 상기 변수에 대해 산출되었다. 이들 제형 간의 비에 대한 신뢰 구간은 Ln-변환된 데이터에 대한 신뢰 구간의 역변환(back-transformation)을 이용해서 계산되었다. 상기 신뢰 구간은 참조 제형의 LMS에 대한 퍼센트로서 표현되었다.
시험 대 참조 제형의 비는 Ln-변환된 AUC0 -t, AUC0 - inf 및 Cmax(1일) 그리고 AUC0-t 및 Cmax(10일)에 대한 LSM을 이용해서 계산되었다. 기하 평균값이 기록되었다. 상기 제형들의 비는 참조 제형에 대한 LSM의 퍼센트로서 표현되었다.
결과
임상 시험의 결과는 이하의 표에 요약되어 있다.
[표 10a]
상기 결과 요약표는 시험된 서방성 제형(실시예 7)이 기지의 속방성 제형에 대한 생물학적 동등성에 대한 기준과 부합된 것을 나타낸다.
이하에 표시된 표들은 그 상세한 결과를 나타낸다.
[표 10b]
[표 10c]
[표 10d]
[표 10e]
[표 10f]
[표 10g]
[표 10h]
[표 10i]
[표 10j]
[표 10k]
[표 10l]
[표 10m]
[표 10n]
[표 10o]
MAO
분석평가:
상기 표준 방법은 MAO의 효소 측정[IRD-MB-051: "Determination of monoamine oxidase (MAO) by an extraction method using radiolabelled substrate in various tissues"]을 위해 이용되었다.
요컨대, 균질액 50㎕를 0.1M 인산염 완충액(pH-7.4) 100 ㎕에 첨가하였다. 37℃에서 20분간 예비배양 후, 14C-페닐에틸아민 하이드로클로라이드 50 ㎕(10μM 최종 농도)를 첨가하고 그 다음 20분 동안 계속 배양하였다. 이어서 시트르산 2M의 첨가에 의해 반응을 중지시켰다.
방사성 대사산물을 톨루엔/아세트산 에틸(1:1 v/v.) 내로 추출하였고, 2,5-다이페닐옥사졸 용액을 0.4%의 최종 농도가 되도록 가하고 나서, 대사산물 함량을 액체 섬광 계수기를 이용해서 추정하였다.
토끼 뇌 균질물의 활성이 이 검정에 대한 표준(양성 대조군)으로서 제공되었다.
단백질 측정은 로리법(Lowrey method)에 의해 수행되었다.
[표 10p]
표 10p 및 도 9는 기준선과 비교한 MAO-B 억제%를 나타낸다.
단독 투여 후, 3종의 제형은 모두 혈소판 MAO-B의 약 40% 억제(DR 태블릿에 의하면 38%, EC 캡슐에 의하면 41%, 아질렉트에 의하면 44%)를 일으켰다. 완전한 MAO-B 억제는 10일 동안 모든 치료 약물 투여에 의해 관찰되었다. 기준선 활성은 대부분의 피험자에 있어서 유사하였는 바, 이것은 충분한 약효 세척 기간을 나타낸다.
Claims (47)
- 라사길린 메실레이트(rasagiline mesylate)와 적어도 1종의 약제학적으로 허용가능한 부형제를 포함하는 코어부(core); 및 약제학적으로 허용가능한 내산성 피복부(coating)를 포함하는 약제학적 조성물로서,
해당 약제학적 조성물은 이하의 pH 조건 하에서 60분 동안 37℃, 75rpm에서 500㎖의 완충된 수성 매체 중에서 바스켓 장치(basket apparatus) 내에 놓일 경우 이하의 퍼센트의 라사길린 메실레이트를 방출하는 것인 약제학적 조성물;
a) 0.1N HCl에서 0%;
b) pH 6.0의 인산염 완충 용액 중에서 0 내지 20%. - 제1항에 있어서, 60분 동안 pH 6.2, 37℃, 75rpm에서 500㎖의 완충된 수성 매체 중에서 바스켓 장치 내에 놓일 경우 80 내지 100%의 라사길린 메실레이트를 방출하는 약제학적 조성물.
- 제1항에 있어서, 20분 동안 pH 6.8, 37℃, 75rpm에서 500㎖의 완충된 수성 매체 중에서 바스켓 장치 내에 놓일 경우 80 내지 100%의 라사길린 메실레이트를 방출하는 약제학적 조성물.
- 라사길린 메실레이트와 적어도 1종의 약제학적으로 허용가능한 부형제를 포함하는 코어부; 및 약제학적으로 허용가능한 내산성 피복부를 포함하는 약제학적 조성물로서,
해당 약제학적 조성물은, 인체에 섭취된 경우, 동일 용량 요법 간격에 걸쳐서, 속방성 제형(immediate released formulation)으로서 섭취된 대응하는 양의 라사길린의 AUC 값의 80 내지 130%의 라사길린의 AUC 값을 제공하는 것인 약제학적 조성물. - 제4항에 있어서, 인체에 투여 시, 동일 용량 요법 간격에 걸쳐서, 속방성 제형으로서 섭취된 대응하는 양의 라사길린의 AUC(곡선하 면적: : area under the curve) 값의 80 내지 125%의 라사길린의 AUC 값을 제공하는 것인 약제학적 조성물.
- 라사길린 메실레이트와 적어도 1종의 약제학적으로 허용가능한 부형제를 포함하는 코어부; 및 약제학적으로 허용가능한 내산성 피복부를 포함하는 약제학적 조성물로서,
해당 약제학적 조성물은, 인체에 섭취된 경우, 동일 용량 요법 간격에 걸쳐서, 속방성 제형으로서 섭취된 대응하는 양의 라사길린의 Cmax의 80 내지 145%의 라사길린의 Cmax를 제공하는 것인 약제학적 조성물. - 제6항에 있어서, 인체에 섭취된 경우, 동일 용량 요법 간격에 걸쳐서, 속방성 제형으로서 섭취된 대응하는 용량의 라사길린의 Cmax의 80 내지 125%의 라사길린의 Cmax를 제공하는 것인 약제학적 조성물.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 상기 코어부는 태블릿(tablet)의 형태인 것인 약제학적 조성물.
- 제1항 내지 제8항 중 어느 한 항에 있어서, 상기 코어부는 적어도 1종의 붕해제(disintegrant)를 추가로 포함하는 것인 약제학적 조성물.
- 제1항 내지 제9항 중 어느 한 항에 있어서, 상기 내산성 피복부는 상기 약제학적 조성물의 5% 내지 12%를 구성하는 것인 약제학적 조성물.
- 제10항에 있어서, 상기 내산성 피복부는 상기 약제학적 조성물의 8%를 구성하는 것인 약제학적 조성물.
- 제1항에 있어서, 태블릿 형태인 약제학적 조성물.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 상기 피복부는 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1) 및 가소제를 포함하는 것인 약제학적 조성물.
- 제13항에 있어서, 상기 피복부에 있어서 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1) 대 가소제의 중량비는 10 대 1 내지 2 대 1인 것인 약제학적 조성물.
- 제14항에 있어서, 상기 피복부에 있어서 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1) 대 가소제의 중량비는 5 대 1인 것인 약제학적 조성물.
- 제13항 내지 제15항 중 어느 한 항에 있어서, 상기 가소제는 트라이에틸 시트레이트(triethyl citrate)인 것인 약제학적 조성물.
- 제13항 내지 제15항 중 어느 한 항에 있어서, 상기 피복부는 탤크(talc)를 추가로 포함하는 것인 약제학적 조성물.
- 제13항 내지 제17항 중 어느 한 항에 있어서, 내부 피복층을 추가로 포함하는 것인 약제학적 조성물.
- 제18항에 있어서, 상기 내부 피복층은 하이프로멜로스(hypromellose)를 포함하는 것인 약제학적 조성물.
- 제1항 내지 제19항 중 어느 한 항에 있어서, 150㎎ 이하의 중량을 지니는 약제학적 조성물.
- 제1항 내지 제20항 중 어느 한 항에 있어서, 1.56㎎의 라사길린 메실레이트를 포함하는 약제학적 조성물.
- 제1항 내지 제20항 중 어느 한 항에 있어서, 0.78㎎의 라사길린 메실레이트를 포함하는 약제학적 조성물.
- 제21항 또는 제22항에 있어서, 만니톨, 콜로이드성 이산화규소, 전분 NF, 호화 전분(pregelatinized starch), 스테아르산, 탤크, 하이프로멜로스, 메타크릴산 에틸 아크릴레이트 공중합체, 탤크 엑스트라 파인(talc extra fine) 및 트라이에틸 시트레이트를 추가로 포함하는 약제학적 조성물.
- 제21항에 있어서, 만니톨 79.84㎎, 콜로이드성 이산화규소 0.6㎎, 라사길린 메실레이트 1.56㎎, 전분 NF 10.0㎎, 호화 전분 20.0㎎, 스테아르산 2.0㎎, 탤크 2.0㎎, 하이프로멜로스 4.8㎎, 메타크릴산 - 에틸 아크릴레이트 공중합체 6.25㎎, 트라이에틸 시트레이트 1.25㎎ 및 탤크 엑스트라 파인 3.1㎎으로 구성된 약제학적 조성물.
- 제22항에 있어서, 만니톨 80.62㎎, 콜로이드성 이산화규소 0.6㎎, 라사길린 메실레이트 0.78㎎, 전분 NF 10.0㎎, 호화 전분 20.0㎎, 스테아르산 2.0㎎, 탤크 2.0㎎, 하이프로멜로스 4.8㎎, 메타크릴산 - 에틸 아크릴레이트 공중합체 6.25㎎, 트라이에틸 시트레이트 1.25㎎ 및 탤크 엑스트라 파인 3.1㎎으로 구성된 약제학적 조성물.
- a) 라사길린 메실레이트와 적어도 1종의 약제학적으로 허용가능한 부형제를 포함하는 코어부; 및
b) 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1)와 적어도 1종의 가소제를 포함하는 피복부를 포함하되,
상기 피복부에 있어서 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1) 대 가소제의 중량비는 10 대 1 내지 2 대 1인 것인 약제학적 조성물. - 제26항에 있어서, 상기 피복부에 있어서 메타크릴산 - 에틸 아크릴레이트 공중합체(1:1) 대 가소제의 중량비는 5 대 1인 것인 약제학적 조성물.
- 제26항 또는 제27항에 있어서, 상기 피복부는 상기 약제학적 조성물의 5중량% 내지 12중량%를 구성하는 것인 약제학적 조성물.
- 제28항에 있어서, 상기 피복부는 상기 약제학적 조성물의 6중량%를 구성하는 것인 약제학적 조성물.
- 제26항 내지 제29항 중 어느 한 항에 있어서, 상기 가소제(들)는 수 가용성인 것인 약제학적 조성물.
- 제30항에 있어서, 상기 가소제(들)는 수종의 수 가용성 가소제의 조합물인 것인 약제학적 조성물.
- 제26항 내지 제29항 중 어느 한 항에 있어서, 상기 가소제(들)는 수 가용성 가소제와 수 불용성 가소제의 조합물인 것인 약제학적 조성물.
- 제26항 내지 제29항 중 어느 한 항에 있어서, 상기 가소제는 트라이에틸 시트레이트인 것인 약제학적 조성물.
- 제26항 내지 제33항 중 어느 한 항에 있어서, 상기 피복부는 윤활제(들)를 추가로 포함하는 것인 약제학적 조성물.
- 제33항에 있어서, 상기 윤활제는 탤크 엑스트라 파인인 것인 약제학적 조성물.
- 제26항 내지 제35항 중 어느 한 항에 있어서, 상기 코어부는 태블릿 형태인 것인 약제학적 조성물.
- 제26항 내지 제36항 중 어느 한 항에 있어서, 상기 코어부는 적어도 1종의 붕해제를 추가로 포함하는 것인 약제학적 조성물.
- 제37항에 있어서, 상기 코어부는 붕해제를 0.5중량% 내지 20중량% 포함하는 것인 약제학적 조성물.
- 제38항에 있어서, 상기 붕해제는 호화 전분을 포함하는 것인 약제학적 조성물.
- 제26항 내지 제39항 중 어느 한 항에 있어서, 150㎎ 이하의 중량을 지니는 약제학적 조성물.
- 제26항 내지 제40항 중 어느 한 항에 있어서, 1.56㎎의 라사길린 메실레이트를 포함하는 약제학적 조성물.
- 제26항 내지 제40항 중 어느 한 항에 있어서, 0.78㎎의 라사길린 메실레이트를 포함하는 약제학적 조성물.
- 제41항 또는 제42항에 있어서, 만니톨, 콜로이드성 이산화규소, 전분 NF, 호화 전분, 스테아르산, 탤크, 하이프로멜로스, 메타크릴산 - 에틸 아크릴레이트 공중합체, 탤크 엑스트라 파인 및 트라이에틸 시트레이트를 추가로 포함하는 것인 약제학적 조성물.
- 제41항에 있어서, 만니톨 79.84㎎, 콜로이드성 이산화규소 0.6㎎, 라사길린 메실레이트 1.56㎎, 전분 NF 10.0㎎, 호화 전분 20.0㎎, 스테아르산 2.0㎎, 탤크 2.0㎎, 하이프로멜로스 4.8㎎, 메타크릴산 - 에틸 아크릴레이트 공중합체 6.25㎎, 트라이에틸 시트레이트 1.25㎎ 및 탤크 엑스트라 파인 3.1㎎으로 구성된 약제학적 조성물.
- 제42항에 있어서, 만니톨 80.62㎎, 콜로이드성 이산화규소 0.6㎎, 라사길린 메실레이트 0.78㎎, 전분 NF 10.0㎎, 호화 전분 20.0㎎, 스테아르산 2.0㎎, 탤크 2.0㎎, 하이프로멜로스 4.8㎎, 메타크릴산 - 에틸 아크릴레이트 공중합체 6.25㎎, 트라이에틸 시트레이트 1.25㎎ 및 탤크 엑스트라 파인 3.1㎎으로 구성된 약제학적 조성물.
- 제1항 내지 제45항 중 어느 한 항의 약제학적 조성물을 환자에게 투여하는 단계를 포함하는, 파킨슨병을 앓고 있는 환자의 치료방법.
- 제46항에 있어서, 상기 환자는 위 배출지연(delayed gastric emptying)을 앓고 있는 것인, 파킨슨병을 앓고 있는 환자의 치료방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US1086008P | 2008-01-11 | 2008-01-11 | |
| US61/010,860 | 2008-01-11 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20100107028A true KR20100107028A (ko) | 2010-10-04 |
Family
ID=40850833
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107016952A KR20100107028A (ko) | 2008-01-11 | 2009-01-09 | 라사길린 제형, 그들의 제법 및 용도 |
Country Status (15)
| Country | Link |
|---|---|
| US (1) | US20090181086A1 (ko) |
| EP (1) | EP2234478A4 (ko) |
| JP (2) | JP5583597B2 (ko) |
| KR (1) | KR20100107028A (ko) |
| CN (1) | CN101909438A (ko) |
| AU (1) | AU2009204454B2 (ko) |
| BR (1) | BRPI0905680A2 (ko) |
| CA (1) | CA2711817A1 (ko) |
| EA (1) | EA201070842A1 (ko) |
| IL (1) | IL206136A0 (ko) |
| MX (1) | MX2010007601A (ko) |
| NZ (1) | NZ586025A (ko) |
| SG (1) | SG187455A1 (ko) |
| WO (1) | WO2009089049A1 (ko) |
| ZA (1) | ZA201004086B (ko) |
Families Citing this family (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060018957A1 (en) * | 2004-07-26 | 2006-01-26 | Lerner E I | Pharmaceutical dosage forms including rasagiline |
| ES2371883T3 (es) * | 2004-11-24 | 2012-01-11 | Teva Pharmaceutical Industries Ltd. | Composiciones de rasagilina de disgregación oral. |
| NZ560660A (en) * | 2005-02-23 | 2010-11-26 | Teva Pharma | Rasagiline ( R(+)-N-propargyl-1-aminodan ) formulations of improved content uniformity |
| ES2551481T3 (es) * | 2006-02-21 | 2015-11-19 | Teva Pharmaceutical Industries, Ltd. | Uso de rasagilina para el tratamiento de atrofia multisistémica |
| MX2008012781A (es) * | 2006-04-03 | 2008-10-14 | Teva Pharma | Uso de rasagilina para el tratamiento de sindrome de piernas inquietas. |
| EP1892233A1 (de) | 2006-08-18 | 2008-02-27 | Ratiopharm GmbH | Neue Salze des Wirkstoffs Rasagilin |
| ATE528989T1 (de) * | 2006-12-14 | 2011-11-15 | Teva Pharma | Kristalline feste rasagilin-base |
| EP1987816A1 (de) * | 2007-04-30 | 2008-11-05 | Ratiopharm GmbH | Adsorbate eines Rasagilinsalzes mit einem wasserlöslichen Hilfsstoff |
| US20090062400A1 (en) * | 2007-09-05 | 2009-03-05 | Laurence Oron | Method of treating glaucoma using rasagiline |
| US8188149B2 (en) * | 2007-09-17 | 2012-05-29 | Teva Pharmaceutical Industries, Ltd. | Use of R(+)-N-propargy1-1-aminoindan to treat or prevent hearing loss |
| WO2009151594A1 (en) * | 2008-06-10 | 2009-12-17 | Teva Pharmaceutical Industries, Ltd. | Rasagiline soft gelatin capsules |
| EP2296462A4 (en) * | 2008-06-13 | 2011-06-15 | Teva Pharma | RASAGILINE FOR INFLUENCING MORBUS PARKINSON |
| EA021472B1 (ru) | 2008-06-19 | 2015-06-30 | Тева Фармасьютикал Индастриз, Лтд. | Способ получения и сушки твердого разагилина в форме основания |
| WO2009154782A1 (en) * | 2008-06-19 | 2009-12-23 | Teva Pharmaceutical Industries, Ltd. | Process for purifying rasagiline base |
| US8080584B2 (en) * | 2009-01-23 | 2011-12-20 | Teva Pharmaceuticals Industries, Ltd. | Delayed release rasagiline citrate formulation |
| EP2451771B1 (en) | 2009-07-09 | 2014-06-18 | Ratiopharm GmbH | Salts of rasagiline and pharmaceutical preparations thereof |
| EP2939669A1 (en) | 2009-12-22 | 2015-11-04 | Teva Pharmaceutical Industries, Ltd. | 3-keto-n-propargyl-1-aminoindan |
| AU2011282716A1 (en) | 2010-07-27 | 2013-03-14 | Teva Pharmaceutical Industries Ltd. | Dispersions of rasagiline citrate |
| US8569379B2 (en) | 2010-07-27 | 2013-10-29 | Teva Pharmaceutical Industries Ltd. | Use of rasagiline for the treatment of olfactory dysfunction |
| US9339469B2 (en) | 2011-10-10 | 2016-05-17 | Teva Pharmaceutical Industries, Ltd. | R(+)-N-methyl-propargyl-aminoindan |
| BR112014008555A2 (pt) | 2011-10-10 | 2017-04-18 | Teva Pharma | r(+)-n-formil-propargil-aminoindano |
| US9308182B2 (en) | 2012-08-17 | 2016-04-12 | Teva Pharmaceutical Industries, Ltd. | Parenteral formulations of rasagiline |
Family Cites Families (36)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL92952A (en) * | 1990-01-03 | 1994-06-24 | Teva Pharma | R-enantiomers of n-propargyl-1-aminoindan compounds, their preparation and pharmaceutical compositions containing them |
| US5744500A (en) * | 1990-01-03 | 1998-04-28 | Teva Pharmaceutical Industries, Ltd. | Use of R-enantiomer of N-propargyl-1-aminoindan, salts, and compositions thereof |
| IL112819A (en) * | 1991-10-16 | 2001-11-25 | Teva Pharma | Fluorinated 1-aminoindan compounds and a process for their preparation |
| CZ284822B6 (cs) * | 1993-06-14 | 1999-03-17 | Janssen Pharmaceutica N. V. | Tableta a způsob její výroby |
| IL115357A (en) * | 1995-09-20 | 2000-01-31 | Teva Pharma | Stable compositions containing N-propargyl-1-aminoindan and polyhydric alcohols |
| IL118836A (en) * | 1996-07-11 | 2001-01-11 | Teva Pharma | Pharmaceutical compositions comprising s-(-)-n-propargyl-1-aminoindan |
| EP1535902B1 (en) * | 1996-12-18 | 2007-11-07 | Teva Pharmaceutical Industries, Ltd. | Aminoindan derivatives |
| SI1567152T1 (sl) * | 2002-11-15 | 2013-10-30 | Teva Pharmaceutical Industries Ltd. | Uporaba rasagilina z riluzolom za zdravljenje amiotrofične lateralne skleroze |
| US20050220864A1 (en) * | 2004-04-02 | 2005-10-06 | Chien-Hsuan Han | Pharmaceutical dosage forms having controlled release properties that contain a GABAB receptor agonist |
| EA200700158A1 (ru) * | 2004-07-26 | 2007-08-31 | Тева Фармасьютикал Индастриес Лтд. | Лекарственные формы с ядром таблетки, покрытым энтеросолюбильной оболочкой |
| US20060018957A1 (en) * | 2004-07-26 | 2006-01-26 | Lerner E I | Pharmaceutical dosage forms including rasagiline |
| ES2371883T3 (es) * | 2004-11-24 | 2012-01-11 | Teva Pharmaceutical Industries Ltd. | Composiciones de rasagilina de disgregación oral. |
| NZ560660A (en) * | 2005-02-23 | 2010-11-26 | Teva Pharma | Rasagiline ( R(+)-N-propargyl-1-aminodan ) formulations of improved content uniformity |
| US7572834B1 (en) * | 2005-12-06 | 2009-08-11 | Teva Pharmaceutical Industries, Ltd. | Rasagiline formulations and processes for their preparation |
| ES2551481T3 (es) * | 2006-02-21 | 2015-11-19 | Teva Pharmaceutical Industries, Ltd. | Uso de rasagilina para el tratamiento de atrofia multisistémica |
| EP1892233A1 (de) * | 2006-08-18 | 2008-02-27 | Ratiopharm GmbH | Neue Salze des Wirkstoffs Rasagilin |
| ATE528989T1 (de) * | 2006-12-14 | 2011-11-15 | Teva Pharma | Kristalline feste rasagilin-base |
| EP1987816A1 (de) * | 2007-04-30 | 2008-11-05 | Ratiopharm GmbH | Adsorbate eines Rasagilinsalzes mit einem wasserlöslichen Hilfsstoff |
| US20090062400A1 (en) * | 2007-09-05 | 2009-03-05 | Laurence Oron | Method of treating glaucoma using rasagiline |
| US8188149B2 (en) * | 2007-09-17 | 2012-05-29 | Teva Pharmaceutical Industries, Ltd. | Use of R(+)-N-propargy1-1-aminoindan to treat or prevent hearing loss |
| WO2009151594A1 (en) * | 2008-06-10 | 2009-12-17 | Teva Pharmaceutical Industries, Ltd. | Rasagiline soft gelatin capsules |
| EP2296462A4 (en) * | 2008-06-13 | 2011-06-15 | Teva Pharma | RASAGILINE FOR INFLUENCING MORBUS PARKINSON |
| WO2009154782A1 (en) * | 2008-06-19 | 2009-12-23 | Teva Pharmaceutical Industries, Ltd. | Process for purifying rasagiline base |
| EA021472B1 (ru) * | 2008-06-19 | 2015-06-30 | Тева Фармасьютикал Индастриз, Лтд. | Способ получения и сушки твердого разагилина в форме основания |
| EA201170181A1 (ru) * | 2008-07-11 | 2011-08-30 | Синтон Бв | Полиморфные формы разагилина гидрохлорида |
| US20100029987A1 (en) * | 2008-07-29 | 2010-02-04 | Dipharma Francis S.R.I. | Crystalline Form of Rasagiline and Process for the Preparation Thereof |
| DE102008064061A1 (de) * | 2008-12-19 | 2010-06-24 | Ratiopharm Gmbh | Feste Zusammensetzung mit dem Wirkstoff Rasagilin |
| US8080584B2 (en) * | 2009-01-23 | 2011-12-20 | Teva Pharmaceuticals Industries, Ltd. | Delayed release rasagiline citrate formulation |
| US20110130466A1 (en) * | 2009-10-09 | 2011-06-02 | Stefan Lorenzl | Use of rasagiline for the treatment of progressive supranuclear palsy |
| EP2939669A1 (en) * | 2009-12-22 | 2015-11-04 | Teva Pharmaceutical Industries, Ltd. | 3-keto-n-propargyl-1-aminoindan |
| AU2011282716A1 (en) * | 2010-07-27 | 2013-03-14 | Teva Pharmaceutical Industries Ltd. | Dispersions of rasagiline citrate |
| US8569379B2 (en) * | 2010-07-27 | 2013-10-29 | Teva Pharmaceutical Industries Ltd. | Use of rasagiline for the treatment of olfactory dysfunction |
| KR20140023872A (ko) * | 2010-10-26 | 2014-02-27 | 테바 파마슈티컬 인더스트리즈 리미티드 | 중수소 농축 라사길린 |
| MX2014004196A (es) * | 2011-10-10 | 2014-05-28 | Teva Pharma | Citramida de rasagilina. |
| US9339469B2 (en) * | 2011-10-10 | 2016-05-17 | Teva Pharmaceutical Industries, Ltd. | R(+)-N-methyl-propargyl-aminoindan |
| BR112014008555A2 (pt) * | 2011-10-10 | 2017-04-18 | Teva Pharma | r(+)-n-formil-propargil-aminoindano |
-
2009
- 2009-01-09 SG SG2013002241A patent/SG187455A1/en unknown
- 2009-01-09 WO PCT/US2009/000134 patent/WO2009089049A1/en active Application Filing
- 2009-01-09 CN CN2009801017416A patent/CN101909438A/zh active Pending
- 2009-01-09 KR KR1020107016952A patent/KR20100107028A/ko not_active Application Discontinuation
- 2009-01-09 AU AU2009204454A patent/AU2009204454B2/en not_active Ceased
- 2009-01-09 NZ NZ586025A patent/NZ586025A/xx unknown
- 2009-01-09 BR BRPI0905680-7A patent/BRPI0905680A2/pt not_active IP Right Cessation
- 2009-01-09 EA EA201070842A patent/EA201070842A1/ru unknown
- 2009-01-09 EP EP20090700388 patent/EP2234478A4/en not_active Withdrawn
- 2009-01-09 US US12/319,576 patent/US20090181086A1/en not_active Abandoned
- 2009-01-09 MX MX2010007601A patent/MX2010007601A/es not_active Application Discontinuation
- 2009-01-09 JP JP2010542277A patent/JP5583597B2/ja not_active Expired - Fee Related
- 2009-01-09 CA CA2711817A patent/CA2711817A1/en not_active Abandoned
-
2010
- 2010-06-02 IL IL206136A patent/IL206136A0/en unknown
- 2010-06-08 ZA ZA2010/04086A patent/ZA201004086B/en unknown
-
2014
- 2014-07-16 JP JP2014146160A patent/JP2014237668A/ja not_active Withdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| IL206136A0 (en) | 2010-11-30 |
| EP2234478A4 (en) | 2013-01-23 |
| NZ586025A (en) | 2012-08-31 |
| JP2011509295A (ja) | 2011-03-24 |
| BRPI0905680A2 (pt) | 2015-07-07 |
| CN101909438A (zh) | 2010-12-08 |
| JP5583597B2 (ja) | 2014-09-03 |
| US20090181086A1 (en) | 2009-07-16 |
| AU2009204454A1 (en) | 2009-07-16 |
| EA201070842A1 (ru) | 2011-04-29 |
| AU2009204454B2 (en) | 2015-02-05 |
| MX2010007601A (es) | 2010-08-03 |
| SG187455A1 (en) | 2013-02-28 |
| ZA201004086B (en) | 2011-08-31 |
| CA2711817A1 (en) | 2009-07-16 |
| WO2009089049A1 (en) | 2009-07-16 |
| EP2234478A1 (en) | 2010-10-06 |
| JP2014237668A (ja) | 2014-12-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20100107028A (ko) | 라사길린 제형, 그들의 제법 및 용도 | |
| US8080584B2 (en) | Delayed release rasagiline citrate formulation | |
| AU2005269416B2 (en) | Pharmaceutical dosage forms including rasagiline | |
| US6576260B2 (en) | Sustained-release form of administration containing tramadol saccharinate | |
| US20030147955A1 (en) | Tamsulosin tablets | |
| CA2795324C (en) | Pharmaceutical compositions comprising hydromorphone and naloxone | |
| US20040057999A1 (en) | Fenofibrate compositions having enhanced bioavailability | |
| WO2003072025A2 (en) | Modified release formulations of at least one form of tramadol | |
| IL148407A (en) | Pharmacological forms for providing pony-suspended activity | |
| KR20130030260A (ko) | 히드로모르폰 및 날록손을 포함하는 제약 조성물 | |
| US20100003322A1 (en) | Enteric coated hydrophobic matrix formulation | |
| US20100286260A1 (en) | Milnacipran formulations | |
| JP2002332226A (ja) | 薬物顆粒の製造方法、および薬物顆粒、ならびにそれを用いた医薬製剤 | |
| US9504657B2 (en) | Fixed dose combination therapy of Parkinson's disease | |
| US20110206769A1 (en) | Oral antidepressant formulation with reduced excipient load |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |