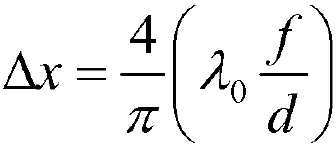KR101791126B1 - 안과 수술을 위한 광간섭성 단층촬영 시스템 - Google Patents
안과 수술을 위한 광간섭성 단층촬영 시스템 Download PDFInfo
- Publication number
- KR101791126B1 KR101791126B1 KR1020127024412A KR20127024412A KR101791126B1 KR 101791126 B1 KR101791126 B1 KR 101791126B1 KR 1020127024412 A KR1020127024412 A KR 1020127024412A KR 20127024412 A KR20127024412 A KR 20127024412A KR 101791126 B1 KR101791126 B1 KR 101791126B1
- Authority
- KR
- South Korea
- Prior art keywords
- imaging
- image
- eye
- oct
- images
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B3/00—Apparatus for testing the eyes; Instruments for examining the eyes
- A61B3/10—Objective types, i.e. instruments for examining the eyes independent of the patients' perceptions or reactions
- A61B3/102—Objective types, i.e. instruments for examining the eyes independent of the patients' perceptions or reactions for optical coherence tomography [OCT]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F9/00—Methods or devices for treatment of the eyes; Devices for putting-in contact lenses; Devices to correct squinting; Apparatus to guide the blind; Protective devices for the eyes, carried on the body or in the hand
- A61F9/007—Methods or devices for eye surgery
- A61F9/008—Methods or devices for eye surgery using laser
- A61F9/00825—Methods or devices for eye surgery using laser for photodisruption
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01B—MEASURING LENGTH, THICKNESS OR SIMILAR LINEAR DIMENSIONS; MEASURING ANGLES; MEASURING AREAS; MEASURING IRREGULARITIES OF SURFACES OR CONTOURS
- G01B9/00—Measuring instruments characterised by the use of optical techniques
- G01B9/02—Interferometers
- G01B9/02041—Interferometers characterised by particular imaging or detection techniques
- G01B9/02044—Imaging in the frequency domain, e.g. by using a spectrometer
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01B—MEASURING LENGTH, THICKNESS OR SIMILAR LINEAR DIMENSIONS; MEASURING ANGLES; MEASURING AREAS; MEASURING IRREGULARITIES OF SURFACES OR CONTOURS
- G01B9/00—Measuring instruments characterised by the use of optical techniques
- G01B9/02—Interferometers
- G01B9/02055—Reduction or prevention of errors; Testing; Calibration
- G01B9/02075—Reduction or prevention of errors; Testing; Calibration of particular errors
- G01B9/02078—Caused by ambiguity
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01B—MEASURING LENGTH, THICKNESS OR SIMILAR LINEAR DIMENSIONS; MEASURING ANGLES; MEASURING AREAS; MEASURING IRREGULARITIES OF SURFACES OR CONTOURS
- G01B9/00—Measuring instruments characterised by the use of optical techniques
- G01B9/02—Interferometers
- G01B9/0209—Low-coherence interferometers
- G01B9/02091—Tomographic interferometers, e.g. based on optical coherence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0059—Measuring for diagnostic purposes; Identification of persons using light, e.g. diagnosis by transillumination, diascopy, fluorescence
- A61B5/0062—Arrangements for scanning
- A61B5/0066—Optical coherence imaging
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/72—Signal processing specially adapted for physiological signals or for diagnostic purposes
- A61B5/7235—Details of waveform analysis
- A61B5/7253—Details of waveform analysis characterised by using transforms
- A61B5/7257—Details of waveform analysis characterised by using transforms using Fourier transforms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F9/00—Methods or devices for treatment of the eyes; Devices for putting-in contact lenses; Devices to correct squinting; Apparatus to guide the blind; Protective devices for the eyes, carried on the body or in the hand
- A61F9/007—Methods or devices for eye surgery
- A61F9/008—Methods or devices for eye surgery using laser
- A61F2009/00844—Feedback systems
- A61F2009/00851—Optical coherence topography [OCT]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F9/00—Methods or devices for treatment of the eyes; Devices for putting-in contact lenses; Devices to correct squinting; Apparatus to guide the blind; Protective devices for the eyes, carried on the body or in the hand
- A61F9/007—Methods or devices for eye surgery
- A61F9/008—Methods or devices for eye surgery using laser
- A61F2009/00861—Methods or devices for eye surgery using laser adapted for treatment at a particular location
- A61F2009/0087—Lens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F9/00—Methods or devices for treatment of the eyes; Devices for putting-in contact lenses; Devices to correct squinting; Apparatus to guide the blind; Protective devices for the eyes, carried on the body or in the hand
- A61F9/007—Methods or devices for eye surgery
- A61F9/008—Methods or devices for eye surgery using laser
- A61F2009/00861—Methods or devices for eye surgery using laser adapted for treatment at a particular location
- A61F2009/00872—Cornea
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F9/00—Methods or devices for treatment of the eyes; Devices for putting-in contact lenses; Devices to correct squinting; Apparatus to guide the blind; Protective devices for the eyes, carried on the body or in the hand
- A61F9/007—Methods or devices for eye surgery
- A61F9/008—Methods or devices for eye surgery using laser
- A61F9/009—Auxiliary devices making contact with the eyeball and coupling in laser light, e.g. goniolenses
Landscapes
- Health & Medical Sciences (AREA)
- Physics & Mathematics (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- General Physics & Mathematics (AREA)
- Ophthalmology & Optometry (AREA)
- Public Health (AREA)
- Biomedical Technology (AREA)
- Heart & Thoracic Surgery (AREA)
- Veterinary Medicine (AREA)
- Surgery (AREA)
- Animal Behavior & Ethology (AREA)
- Radiology & Medical Imaging (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Medical Informatics (AREA)
- Optics & Photonics (AREA)
- Vascular Medicine (AREA)
- Pathology (AREA)
- Mathematical Physics (AREA)
- Physiology (AREA)
- Psychiatry (AREA)
- Signal Processing (AREA)
- Computer Vision & Pattern Recognition (AREA)
- Artificial Intelligence (AREA)
- Investigating Or Analysing Materials By Optical Means (AREA)
- Eye Examination Apparatus (AREA)
Abstract
광학 이미징 기술들 및 시스템들은 광간섭성 단층촬영 이미징에 기초한 높은 충실도의 광학 이미징을 제공하고, 안과 수술 및 이미징-가이드된 수술에서 눈의 이미징을 위해 사용될 수 있다. 눈을 이미징하기 위한 한 방법은, 스펙트럼 영역 광간섭성 단층촬영(SD-OCT : Spectral Domain Optical Coherence Tomographic) 이미징 시스템에 대해 눈의 위치를 설정하는 것 - 상기 눈은 제 1 및 제 2 구조를 가짐 -, 및 제 1 눈-구조의 직접 이미지 또는 미러 이미지 중 하나를 선택하고 제 1 눈-구조의 선택된 이미지에 대응하는 제 1 이미지-부분을 생성하고, 상기 제 2 눈-구조의 직접 이미지 또는 미러 이미지 중 하나를 선택하고 제 상기 2 눈-구조의 선택된 이미지에 대응하는 제 2 이미지-부분을 생성하고, 및 상기 제 1 및 제 2 구조들의 선택되지 않은 이미지들을 억압함으로써, SD-OCT 이미징 시스템을 통해 눈을 이미징하는 것을 포함한다.
Description
본 특허 문서는 안과 수술을 위한 광간섭성 단층 사진 촬영 이미징 시스템들을 포함하는 이미징 기술들 및 시스템들에 관한 것이다.
눈은 특히 고령자에 대해 다수의 문제점들을 발현할 수 있고, 이러한 문제점들은 눈의 시력의 효율성과 정밀도를 감소시킬 수 있다. 안과 의술은 눈의 악화된 기능들을 개선하고자 한다. 심각한 눈의 질병들 중 하나는, 수정체의 얼룩 및 수정체의 투명도의 손상을 야기할 수 있고 시력의 손상을 초래할 수 있는 백내장의 발현이다. 백내장 수술의 주된 목표는 기능장애의 자연 수정체를 인공 수정체로 대체하여 눈의 시력을 복원하는 것이다.
본 문서에서 기술된 눈의 이미징 기술들 및 시스템들은 광간섭성 단층촬영 이미징에 기초한 고-충실도 눈의 이미징을 제공하고, 다른 애플리케이션들 중에서 안과 수술과 이미징-가이드된 수술에서 눈의 이미징을 위해 사용될 수 있다.
컨대, 눈을 이미징하기 위한 방법은, 스펙트럼 영역 광간섭성 단층촬영(SD-OCT : Spectral Domain Optical Coherence Tomographic) 이미징 시스템에 대해 눈의 위치를 설정하는 단계 - 상기 눈은 제 1 및 제 2 구조를 가짐 -; 및 제 1 눈-구조의 직접 이미지와 미러(mirror) 이미지 중 하나를 선택하고 제 1 눈-구조의 선택된 이미지에 대응하는 제 1 이미지-부분을 생성함으로써, 제 2 눈-구조의 직접 이미지와 미러 이미지 중 하나를 선택하고 제 2 눈-구조의 선택된 이미지에 대응하는 제 2 이미지-부분을 생성함으로써, 그리고 제 1 및 제 2 구조들의 선택되지 않은 이미지들을 억압함으로써 SD-OCT 이미징 시스템을 통해 눈을 이미징하는 단계를 포함한다.
일부 구현들에 있어서, 선택되지 않은 이미지들을 억압하는 단계는, 생성된 선택되지 않은 이미지들의 디스플레이를 방지하는 것, 선택되지 않은 이미지들을 디스플레이하지 않고 선택되지 않은 이미지들을 생성하는 것, 또는 선택되지 않은 이미지들의 생성을 방지하기 위하여 계산 단계를 수행하는 것 중 적어도 하나를 포함한다.
일부 구현들에 있어서, 제 1 및 제 2 이미지-부분들을 생성하는 것은, 제 1 및 제 2 이미지-부분들 중 적어도 하나가 미러 이미지일 때, 제 1 및 제 2 구조들의 생물학적 대표 이미지를 생성하기 위하여 제 1 및 제 2 이미지-부분들 중 하나에 대한 변환을 수행하는 것을 포함한다.
일부 구현들에 있어서, 눈을 이미징하는 단계는, 제 1 및 제 2 눈-구조들의 직접 및 미러 이미지들이 서로 구별될 수 있도록, 대응하는 이미지 깊이들에서 제 1 및 제 2 눈-구조들의 직접 및 미러 이미지들을 생성하기 위하여 SD-OCT 이미징 시스템의 기준 깊이를 조절하는 것을 포함한다.
일부 구현들에 있어서, 제 1 및 제 2 눈-구조들의 직접 및 미러 이미지들을 구별하는 단계는, 이미지들의 공간 간격을 인식하는 것, 패턴 인식 접근법을 적용하는 것, 이미지들의 신호 특성을 구별하는 것, 눈에 대해 이미 존재하는 지식을 이용하는 것, 또는 진단에 기초한 눈에 대한 지식을 이용하는 것 중 적어도 하나를 포함한다.
일부 구현들에 있어서, 기준 깊이를 조절하고, 제 1 및 제 2 눈-구조들의 직접 및 미러 이미지들을 구별하는 단계들은 반복적으로 수행된다.
일부 구현들에 있어서, 제 1 구조는 눈의 수정체의 수정체 전낭 층이고, 제 2 구조는 눈의 수정체의 수정체 후낭 층이다.
일부 구현들에 있어서, 눈을 이미징하는 단계는, 제 1 이미지-부분, 제 2 이미지 부분 및 각막 이미지의 깊이-시퀀스가 각막의 직접 이미지-수정체 전낭 층의 직접 이미지-수정체 후낭 층의 미러 이미지; 각막의 직접 이미지-수정체 후낭 층의 미러 이미지-수정체 전낭 층의 직접 이미지; 및 수정체 후낭 층의 미러 이미지- 각막의 직접 이미지- 수정체 전낭 층의 직접 이미지 중 하나가 되도록, SD-OCT 이미징 시스템의 기준 깊이를 조절하는 것을 포함한다.
일부 구현들에 있어서, 눈을 이미징하는 단계는, 제 1 이미지-부분, 제 2 이미지 부분 및 각막 이미지의 깊이-시퀀스가 각막의 미러 이미지-수정체 전낭 층의 미러 이미지-수정체 후낭 층의 직접 이미지; 각막의 미러 이미지-수정체 후낭 층의 직접 이미지-수정체 전낭 층의 미러 이미지; 및 수정체 후낭 층의 직접 이미지- 각막의 미러 이미지- 수정체 전낭 층의 미러 이미지 중 하나가 되도록, SD-OCT 이미징 시스템의 기준 깊이를 조절하는 것을 포함한다.
일부 구현들에 있어서, 기준 깊이를 조절하는 단계는, SD-OCT 이미징 시스템의 기준 미러의 위치를 조절하는 것과, SD-OCT 이미징 시스템의 지연 요소를 튜닝하는 것을 포함한다.
일부 구현들에 있어서, 눈을 이미징하는 단계는 호모다인(homodyne) 이미징을 포함한다.
일부 구현들에 있어서, 눈을 이미징하는 단계는 제 1 및 제 2의 구조들이 이미징 범위 내에 위치하되게 하기 위하여 기준 깊이 주위의 이미징 범위를 조절하는 하는 것을 포함한다.
일부 구현들에 있어서, 이미징 범위를 조절하는 단계는 SD-OCT 이미징 시스템의 중심 파장과 파장 해상도 중 적어도 하나를 조절하는 것을 포함한다.
일부 구현들에 있어서, 조절 단계는 이미징 범위를 0-15 mm의 범위 내가 되도록 조절하는 것을 포함한다.
일부 구현들에 있어서, 조절 단계는 이미징 범위를 5-15 mm의 범위 내가 되도록 조절하는 것을 포함한다.
일부 구현들에 있어서, 눈을 이미징하는 단계는 이미징 범위가 레일리(Rayleigh) 범위의 4배 미만이 되게 하기 위하여 초점 깊이 주위의 레일리 범위를 조절하는 것을 포함한다.
일부 구현들에 있어서, 기준 깊이를 조절하는 단계는 기준 깊이를 2-15 mm의 범위 내가 되도록 조절하는 것을 포함한다.
일부 구현들에 있어서, 눈의 위치를 설정하는 단계는 눈을 SD-OCT 이미징 시스템의 접촉부에 결합시키는 것, 눈을 고정시키는 것, 또는 SD-OCT 이미징 시스템에 대해 눈의 이동 범위를 최소화시키는 것 중 적어도 하나를 포함한다.
일부 구현들에 있어서, SD-OCT 이미징 시스템은 분광계 기반 OCT(Spectrometer Based OCT : SB-OCT) 및 스위프 소스 OCT(a Swept Source OCT : SS-OCT) 이미징 시스템 중 하나이다.
일부 구현들에 있어서, 눈의 이미징은, 단일 z-스캔을 생성하는 것, 평면의 z-스캔을 생성하는 것, 스캐닝 라인을 따라 z-스캔을 생성하는 것, 또는 래스터(raster) 패턴으로 z-스캔을 생성하는 것 중 적어도 하나를 포함한다.
일부 구현들에 있어서, 눈을 이미징하기 위한 이미징 시스템은, 스펙트럼 영역 광간섭성 단층촬영(SD-OCT) 이미징 시스템에 대해 눈-눈은 제 1 및 제 2 구조를 갖는다-의 위치를 설정하고; 제 1 구조의 직접 이미지 및 미러 이미지로부터 선택된 제 1 이이지-부분을 생성하고; 제 2 구조의 직접 이미지 및 미러 이미지로부터 선택된 제 2 이미지-부분을 생성하고; 그리고 제 1 및 제 2 구조들의 선택되지 않은 이미지들을 억압하는; SD-OCT 이미징 시스템을 포함한다.
일부 구현들에 있어서, SD-OCT 이미징 시스템은, 이미징 광을 출력하는 이미징 광원; 이미징 광을 이미징 빔과 기준 빔으로 분할하고, 반환된 이미징 광-부분과 반환된 기준 광-부분을 간섭 광으로 통합하는 하나 또는 그 초과의 빔 스플리터들; 기준 거리에 비례하는 시간 차이를 통해 기준 광-부분을 반환하는 기준 디바이스; 및 간섭 광을 수신하고, 눈의 SD-OCT 이미지를 생성하는 간섭 분석기;를 포함한다.
일부 구현들에 있어서, SD-OCT는 분광계 기반 OCT(SB-OCT) 및 스위프 소스 OCT(SS-OCT) 중 하나이다.
일부 구현들에 있어서, 기준 디바이스는, 반환된 기준 광-부분이 반환된 이미징 광-부분에 대해 앞선 또는 지연된 것 중 하나가 되도록, 구성된다.
일부 구현들에 있어서, 기준 미러의 기준 거리는 눈의 기준 깊에 관련되고, 여기에서 간섭 분석기는 기준 깊이에서 최대 이미징 감도를 갖는다.
일부 구현들에 있어서, 제 1 구조는 눈의 수정체의 수정체 전낭 층이고; 제 2 구조는 눈의 수정체의 수정체 후낭 층이고; 제 1 이미지-부분, 제 2 이미지 부분 및 각막 이미지의 깊이-시퀀스가, 수정체 후낭 층의 미러 이미지-수정체 전낭 층의 직접 이미지-각막의 직접 이미지; 수정체 전낭 층의 직접 이미지-수정체 후낭 층의 미러 이미지-각막의 직접 이미지; 및 수정체 전낭 층의 직접 이미지-각막의 직접 이미지-수정체 후낭 층의 미러 이미지; 중 하나가 되도록, 기준 거리는 기준 깊이를 설정하도록 조절 가능하다.
일부 구현들에 있어서, 제 1 구조는 눈의 수정체의 수정체 전낭 층이고; 제 2 구조는 눈의 수정체의 수정체 후낭 층이고; 제 1 이미지-부분, 제 2 이미지 부분 및 각막 이미지의 깊이-시퀀스가, 수정체 후낭 층의 직접 이미지-수정체 전낭 층의 미러 이미지-각막의 미러 이미지; 수정체 전낭 층의 미러 이미지-수정체 후낭 층의 직접 이미지-각막의 미러 이미지; 및 수정체 전낭 층의 미러 이미지-각막의 미러 이미지-수정체 후낭 층의 직접 이미지; 중 하나가 되도록, 기준 거리는 기준 깊이를 설정하도록 조절 가능하다.
일부 구현들에 있어서, 기준 거리는 기준 깊이를 2-15 mm의 범위 내로 제어하도록 조절 가능하다.
일부 구현들에 있어서, SD-OCT 이미징 시스템은 기준 깊이 주위의 이미징 범위를 0mm - 15mm와 5mm - 15mm 중 하나의 범위 내로 제어한다.
일부 구현들에 있어서, SD-OCT 이미징 시스템은, 생성된 선택되지 않은 이미지들의 디스플레이를 방지하는 것; 선택되지 않은 이미지들을 디스플레이하지 않고 선택되지 않은 이미지들을 생성하는 것; 또는 선택되지 않은 이미지들의 생성을 방지하기 위하여 계산 단계를 수행하는 것; 중 적어도 하나를 통해 선택되지 않은 이미지들을 억압한다.
일부 구현들에 있어서, 방법은 스펙트럼 영역 광간섭성 단층촬영(SD-OCT) 이미징 시스템에 대해 물체-물체는 낮은 콘트라스 매체 내에서 높은 콘트라스트의 구조를 포함한다-의 위치를 설정하는 단계; SD-OCT 이미징 시스템을 통해, 높은 콘트라스트 구조의 직접 이미지와 미러 이미지 중 하나에 대응하는 높은 콘트라스트 구조의 이미지를 생성하는 단계; 및 높은 콘트라스트 구조의 선택되지 않은 이미지들을 억압하는 단계;를 포함한다.
일부 구현들에 있어서, 높은 콘트라스트 구조의 이미지를 생성하는 단계는, 높은 콘트라스트 구조의 이미지가 제 1 구조의 제 1 이미지와 구별될 수 있도록, 이미지 깊이에서 높은 콘트라스트 구조의 이미지를 생성하기 위하여, SD-OCT 이미징 시스템의 기준 깊이를 조절하는 것을 포함한다.
일부 구현들에 있어서, 기준 깊이를 조절하는 단계는, 제 1 이미지로부터 높은 콘트라스트 구조의 이미지의 공간 간격을 인식하는 것; 패턴 인식 접근법을 적용하는 것; 높은 콘트라스트 구조의 이미지와 제 1 이미지의 신호 특성을 구별하는 것; 물체에 대한 이미 존재하는 지식을 이용하는 것; 또는 진단에 기초한 물체에 대한 지식을 이용하는 것; 중 적어도 하나를 통해, 높은 콘트라스트 구조의 이미지를 제 1 이미지와 구별하는 것을 포함한다.
일부 구현들에 있어서, 높은 콘트라스트 구조의 이미지를 생성하는 단계는 호모다인 이미징을 포함한다.
일부 구현들에 있어서, 높은 콘트라스트 구조의 이미지를 생성하는 단계는, SD-OCT 이미징 시스템의 기준 깊이를 설정하는 것과 이미징 범위가 높은 콘트라스트 구조를 커버하게 하기 위하여 기준 깊이 주위의 이미징 범위를 조절하는 것을 포함한다.
일부 구현들에 있어서, 이미징 범위를 조절하는 단계는, 이미징 범위가 높은 콘트라스트 구조를 커버하게 하기 위하여, SD-OCT 이미징 시스템의 중심 파장과 파장 해상도 중 적어도 하나를 조절하는 것을 포함한다.
일부 구현들에 있어서, 이미징 범위를 조절하는 단계는 이미징 범위를 0mm - 15mm와 5mm - 15 mm 중 하나의 범위 내가 되도록 조절하는 것을 포함한다.
일부 구현들에 있어서, 이미징 범위를 조절하는 단계는 기준 깊이를 2mm - 15mm의 범위 내가 되도록 조절하는 것을 포함한다.
일부 구현들에 있어서, 이미징 범위를 조절하는 단계는, SD-OCT 이미징 시스템의 초점 깊이를 조절하는 것과, 이미징 범위가 레일리 범위의 4배 미만이 되게 하기 위하여 SD-OCT 이미징 시스템의 초점 깊이 주위의 레일리 범위를 조절하는 것을 포함한다.
일부 구현들에 있어서, 수술 레이저 시스템은, 수술 레이저 전달 시스템과, 수술 레이저 전달 시스템에 접속된 스펙트럼 영역 광간섭성 단층촬영(SD-OCT) 이미징 시스템을 포함하는데, SD-OCT 이미징 시스템은, 낮은 콘트라스트 매체 내에서 높은 콘트라스트 구조를 갖는 물체를 이미징하고, 높은 콘트라스트 구조의 직접 이미지 및 미러 이미지 중 하나에 대응하는 높은 콘트라스트 구조의 이미지를 생성하고, 높은 콘트라스트 구조의 선택되지 않은 이미지들을 억압한다.
일부 구현들에 있어서, SD-OCT 이미징 시스템은, 이미징 광을 출력하기 위한 이미징 광원, 이미징 광을 이미징 빔과 기준 빔으로 분할하고 반환된 이미징 빔-부분과 반환된 기준 빔-부분을 간섭 빔으로 통합하는 하나 또는 그 초과의 빔 스플리터들; 기준 빔-부분을 반환하고 기준 거리에 위치한 기준 미러, 및 간섭 빔을 수신하고 눈의 SD-OCT 이미지를 생성하는 간섭 분석기를 포함한다.
일부 구현들에 있어서, SD-OCT는 분광계 기반 OCT(SB-OCT) 및 스위프 소스 OCT(SS-OCT) 중 하나이다.
일부 구현들에 있어서, 기준 미러의 기준 거리는 눈에서의 기준 깊이에 관련되는데, 간섭 분석기는 기준 깊이에서 최대 이미징 감도를 갖는다.
일부 구현들에 있어서, 기준 거리는 기준 깊이를 2 - 15mm의 범위 내가 되도록 제어하도록 조절 가능하다.
일부 구현들에 있어서, SD-OCT 이미징 시스템은 기준 깊이 주위의 이미징 범위를 0mm - 15mm와 5mm - 15 mm 중 하나의 범위 내로 제어하도록 구성된다.
일부 구현들에 있어서, SD-OCT 이미징 시스템은, 생성된 선택되지 않은 이미지의 디스플레이를 방지하는 것, 선택되지 않은 이미지를 디스플레이하지 않고 선택되지 않은 이미지를 생성하는 것, 또는 선택되지 않은 이미지의 생성을 방지하기 위한 계산 단계를 수행하는 것 중 적어도 하나를 통해, 선택되지 않은 이미지를 억압한다.
눈의 이미징을 위한 기술 및 시스템들의 상기 및 다른 양상들은 도면들, 상세한 설명 및 청구항들에서 상세하게 기술된다.
도 1a 및 도 1b는 눈의 주요 구조의 구성요소들을 도시한다.
도 2는 OCT 이미징의 복합 불명료 문제를 도시한다.
도 3a는 예시적인 이미징 방법의 단계들을 도시한다.
도 3b는 예시적인 이미징 방법의 단계들을 도시한다.
도 4a 내지 도 4f는 이미지-부분의 시퀀스들의 예들을 도시한다.
도 5a는 이미징 깊이의 함수로서 SB-OCT 시스템의 감도를 도시한다.
도 5b는 이미징 범위, 기준 깊이, 초점 깊이 및 레일리 범위 사이의 관계를 도시한다.
도 6a 및 도 6b는 OCT 이미징 시스템의 두 개의 예들을 도시한다.
도 7은 타깃의 이미징을 레이저 제어부에 제공하기 위하여 이미징 모듈이 제공되는, 이미징-가이드된 레이저 수술 시스템의 예를 도시한다.
도 8 내지 도 16은 레이저 수술 시스템과 이미징 시스템의 집적도가 변하는 이미징-가이드된 레이저 수술 시스템들의 예들을 도시한다.
도 17은 이미징-가이드된 레이저 수술 시스템을 청함으로써 레이저 수술을 수행하기 위한 방법의 예를 도시한다.
도 2는 OCT 이미징의 복합 불명료 문제를 도시한다.
도 3a는 예시적인 이미징 방법의 단계들을 도시한다.
도 3b는 예시적인 이미징 방법의 단계들을 도시한다.
도 4a 내지 도 4f는 이미지-부분의 시퀀스들의 예들을 도시한다.
도 5a는 이미징 깊이의 함수로서 SB-OCT 시스템의 감도를 도시한다.
도 5b는 이미징 범위, 기준 깊이, 초점 깊이 및 레일리 범위 사이의 관계를 도시한다.
도 6a 및 도 6b는 OCT 이미징 시스템의 두 개의 예들을 도시한다.
도 7은 타깃의 이미징을 레이저 제어부에 제공하기 위하여 이미징 모듈이 제공되는, 이미징-가이드된 레이저 수술 시스템의 예를 도시한다.
도 8 내지 도 16은 레이저 수술 시스템과 이미징 시스템의 집적도가 변하는 이미징-가이드된 레이저 수술 시스템들의 예들을 도시한다.
도 17은 이미징-가이드된 레이저 수술 시스템을 청함으로써 레이저 수술을 수행하기 위한 방법의 예를 도시한다.
도 1a는 일반적인 사람의 눈(1)을 도시한다. 눈(1)의 잘 알려진 주된 구조 요소들은 수정체(5), 각막(10), 동공(20), 홍채(30), 망막(40), 초자체액(a vitreous humor)으로 채워지는 눈의 중앙 챔버, 및 시신경을 통해 뇌를 향해 출발하는 시각 자극들을 포함한다.
도 1b는 수정체(5) 자체의 측면도를 보다 더 접근하여 도시한다. 미세한 세부사항에서, 수정체(5)는 수정체낭(51) 내에 포함되고, 수정체낭(51)의 두께는 일반적으로 20 미크론 정도이다. 수정체낭은 입사 광의 방향을 기준 축으로 사용하여 수정체낭 전면 표면(51A)과 수정체낭 후면 표면(51P)을 구비한다. 수정체는 수정체 전면 표면(52A)과 수정체 후면 표면(52P)에 의해 한정된다. 수정체(5)의 내부에서, 단단한 핵(53)은, 간혹 외피(54)로 불리는 더 부드러운 외측 껍질에 삽입된, 투명도의 백내장 손상부를 나타낸다. 수정체의 총 크기는 환자의 나이를 포함하여 수 가지 인자들에 의존한다. z-크기는 6-8 mm 범위 내에서 변할 수 있고, 방사상 크기(z축을 가로지르는)는 5mm 정도이다. 일반적으로 단단한 핵(53)인 백내장 부분은 많은 인자들에 의존하여 간혹 2-6 mm의 z-크기를 갖는다.
백내장 수술에서, 단단한 핵(53)은, 간혹 소위 말하는 파코 기술(phaco technology) 동안에 초음파의 인가에 도움을 받아, 삽입된 수술 디바이스들에 의해 일반적으로 절단되거나, 잘게 썰어지거나(chopped), 또는 분해된다. 단단한 핵(53)의 조각들 또는 파편들과 더 부드럽고 더 유동적인 외피(54)는 그 후 후속적으로 진공 흡입을 적용함으로써 수정체 전면 표면(52A)과 수정체낭(51) 상의 원형 개구부를 통해 수정체낭(51)으로부터 제거된다. 이러한 원형 개구부는 수정체낭절개(capsulotomy) 또는 캡슐로렉시스(capsulorhexys)로 불리는 프로세스에 의해 형성된다. 수술은 눈의 시각 성능과 실제적인 시력을 회복하기 위하여 인공 수정체(Intra Ocular Lens : IOL)를 빈 수정체낭(51) 내에 삽입함으로써 완결된다.
과거 40년에 걸쳐, 백내장 수술은 초음파 파코 디바이스들 및/또는 가열된 유체 디바이스들에 의해 도움을 받아, 주로 핸드-헬드형 수술 도구들을 통해 수행되었다. 수술의 민감한 타깃이 주어지면, 증가된 정밀도를 갖는 안과 수술 시스템들을 개발하는데 상당한 노력이 집중되어 왔다. 오로지 매우 최근에, 전통적인 도구들을 수술 레이저 시스템들로 대체하려 시도되었다. 이들 레이저 시스템들은 수정체낭(51)과 핵(53)을 절단할 때 극적으로 더 양호한 정밀도, 파코 기술들에 대해 일반적인 수백 미크론 또는 심지어 수 밀리미터 대신에 수 미크론의 정밀도를 약속한다.
레이저-기반 백내장 수술 시스템들의 정밀도는 이미징 시스템과 수술 레이저 시스템을 통합함으로써 향상될 수 있다. 이러한 이미징 시스템은 수정체-수술 프로세스들을 가이드하기 위하여 높은 정밀도로 수정체 전면 및 수정체 후면 표면들(52A-52P)의 위치를 결정할 수 있다.
이들 수정체-수술 프로세스들은 수정체낭절개, 캡슐로렉시스 및 수정체낭분해(capsulolysis)를 포함한다. 수정체낭절개의 정밀도는 IOL의 중심잡기(centration)를 제어하는 주된 인자이다. 중심잡기는 삽입된 IOL의 성능을 최적화하기 위하여 필수적인데, 왜냐하면 IOL의 중심이 벗어난 배치는 수술된 눈에서 난시들 또는 다른 시각 왜곡들을 초래할 수 있기 때문이다. 수정체 분해의 정밀도는 전체 수정체가 적절하게 분해되는 것을 확실하게 하기 위하여 동등하게 중요하다.
특별히 효율적인 이미징 기술은 광간섭성 단층촬영(optical coherence tomograph : OCT)로 불린다. OCT 기술에서, 이미징 광은 이미지 빔과 기준 빔으로 분할된다. 이들 빔들은 이미징된 물체와 기준 미러에 의해 이미징 시스템으로 반환되고, 결합된 간섭 빔으로 통합된다. 이러한 간섭 빔은 OCT 기술들의 두 가지 주된 구현들인 시간 영역에서 또는 주파수 영역에서 분석된다.
그러나 심지어 OCT 기술조차 다양한 단점들에 의해 방해받고, 따라서 OCT 기술의 개선들이 레이저-기반 백내장 수술 시스템들의 효율을 증진시키기 위하여 필요하다.
OCT 기술의 잘 알려진 난제는 소위 말하는 "복합 불명료"이다. 간섭 패턴이 간섭 이미지 빔과 기준 빔의 합의 크기의 제곱에 관련되고, 따라서 에르미트 대칭(Hermitean symmetry)을 나타내기 때문에, 이러한 문제가 드러난다. 달리 말하면, 광 파동이 검출될 때, 오로지 진폭이 기록되고, 위상 정보는 손실된다. 따라서, 파동과 그 복합 켤레는 동일한 간섭 패턴을 생성한다. 이는, 원래의 광 파동을 재구성하려 시도할 때, 불명료를 생성한다. 이러한 불명료를 해결하지 못하는, OCT 이미징 시스템들은, 복합 불명료의 아티팩트인 타깃화된 물체의 직접 이미지와 미러 이미지 모두를 생성한다.
도 2는 OCT 내에서 이미지들의 중복으로부터 발생할 수 있는 복합 불명료 문제를 도시한다. 좌측 패널은 수정체 후낭 층의 미러 이미지가 수정체 후낭 층의 직접 이미지와 중첩하는 경우를 도시한다. 우측 패널은 수정체 후낭 층의 미러 이미지가 수정체 전낭 층의 직접 이미지와 중첩하는 경우를 도시한다. 양 경우에, 이들 중첩하는 이미지들은 구별될 수 없고, 불명료를 초래하며, 가능하게는 의사를 혼란시키고, 따라서 안과 절차의 성공을 위태롭게 한다. 기존의 방법들이 불명료를 해결하지 못하고, 또한 타깃화된 물체의 직접 이미지를 분리 및 생성하지 못하기 때문에, 복합 불명료의 이러한 난제는 지금까지 시스템 설계자들을 난처하게 하였지만, 반면 수정체의 수정체낭절개와 분해를 가이드하기 위하여 수정체 전낭 및 후낭 층들 모두를 정확하게 이미징할 절박한 필요성이 존재한다.
본 문서에서 기술된 눈의 이미징 기술들과 시스템들은 광간섭성 단층촬영 이미징에 기반한 고-충실도의 눈의 이미징을 제공하고, 다른 응용들 중에서 안과 수술과 이미징-가이드된 수술에서 눈의 이미징에 사용될 수 있다. 기술된 눈의 이미징 기술들과 시스템들은 OCT 내에서 복합 불명료와 관련된 기술적인 문제점들을 경감시키는 방식으로 구현될 수 있다.
도 3a는 OCT 기술의 복합 불명료를 제거하는 안과 수술 응용들을 위해 이미지들을 제공하기 위한 방법(100)의 구현을 도시한다.
눈을 이미징하기 위한 방법(100)의 일부 구현들은:
(110)- 스펙트럼 영역 광간섭성 단층촬영(SD-OCT : Spectral Domain Optical Coherence Tomographic) 이미징 시스템에 대해 눈의 위치를 설정하는 단계 - 상기 눈은 제 1 및 제 2 구조를 가짐 - ; 및
(120)-SD-OCT 이미징 시스템을 통해,
(130)-제 1 눈-구조의 직접 이미지와 미러 이미지 중 하나를 선택하고 제 1 눈-구조의 선택된 이미지에 대응하는 제 1 이미지-부분을 생성함으로써;
(140)-제 2 눈-구조의 직접 이미지와 미러 이미지 중 하나를 선택하고 제 2 눈-구조의 선택된 이미지에 대응하는 제 2 이미지-부분을 생성함으로써; 및
(150)-제 1 및 제 2 구조들의 선택되지 않은 이미지들을 억압함으로써;
눈을 이미징하는 단계를 포함한다. 이들 단계들은 아래에서 상세하게 기술될 것이다.
여기에서 그리고 본 발명의 명세서 전체를 통해, 용어 "이미지" 및 "눈-구조"는, OCT 스캐닝이 일반적으로 완전한 타깃의 오로지 부분들만을 이미징하고, 따라서 생성된 이미지는 일반적으로 눈-구조의 일부를 나타내는 부분 이미지이기 때문에, 부분적인 이미지 및 부분적인 눈-구조를 언급할 수 있다. 그런 것에 따라, 눈의 단일 이미지는 이미지-부분들로서 다양한 눈-구조들의 수 개의 이미지들을 결합함으로써 생성될 수 있다.
단계(110)에서, 눈은 OCT 이미징 시스템에 대해 위치 설정될 수 있다. 환자 접촉부(patient interface) 또는 대물렌즈의 전면 세그먼트가 눈과 접촉할 때까지 받침대를 눈을 향해 낮추는 것을 포함하여, 눈을 위치 설정하기 위한 많은 수의 방법들이 존재한다. 일부 시스템들은 환자 접촉부와 눈 사이의 파지력을 생성하고, 이미징 시스템에 대해 눈을 효과적으로 고정하기 위하여 진공 시스템을 사용한다. 다른 시스템들은 각막에 부드럽게 압축되는 주름진 표면과 같은 기계적인 수단들을 사용한다.
이미징 시스템은 광간섭성 단층촬영(OCT) 이미징 시스템이 될 수 있다. 방법(100)의 실시예들은 일반적으로 시간 영역의 OCT 기술 대신에 스펙트럼 영역(SD)의 OCT 기술을 사용한다. SD-OCT 기술은 분광계 기반 OCT(SB-OCT) 또는 스위프 소스 OCT(SS-OCT) 이미징 시스템에 의해 실시될 수 있다. 스펙트럼 영역의 OCT 기술들이 시간 영역의 OCT 시스템들보다 질적으로 더 빨리 그리고 더 높은 정밀도를 갖고 수행되는 것이 폭넓게 증명되어 왔다.
단계(120)에서, SD-OCT 시스템은 눈의 이미지를 생성하기 위하여 사용될 수 있다. SD-OCT가 방법(100)의 단계들을 따르지 않고 실시된다면, 이미징된 물체들의 직접 및 미러 이미지들을 생성한다. 위에서 설명한 바와 같이, 이미지들의 이러한 확산은 이미지 불명료를 초래하고, 따라서 안과 또는 다른 응용들에 대한 OCT 이미징 시스템의 실익을 손상시킨다.
도 2는 SD-OCT에 의해 이미징되는 수정체낭(51)의 예를 도시하고, 수정체낭의 두 개의 가장 두드러진 요소들, 즉 수정체 전낭 층과 수정체 후낭 층은 각각 직접 및 미러 이미지를 생성하여, 잠재적으로 수정체낭(51)의 중첩되고 불명료한 이미징을 초래한다. 이러한 불명료와 정밀도의 결과적인 손실은 의사를 혼란케하고, 따라서 특히 백내장 수술의 효율성과 정밀도를 손상시킨다.
방법(100)은 수정체 전낭 및 후낭 층들(51A-P)과 관련하여 기본적으로 설명될 것인데, 왜냐하면 이들 층들이 높은 시각 콘트라스트를 갖고, 따라서 OCT 이미징 프로세스에서 가장 뚜렷한 이미지를 생성하기 때문이다. 하지만, 전면 수정체 표면(52A) 및 후면 수정체 표면(52P), 그리고 단단한 핵의 전면 및 후면 표면들(53A-P)은 낮은 콘트라스트를 갖지만, 이들 또한 OCT 이미지 내에서 보일 수 있다. 그러므로 복합 불명료의 문제는 또한, 수정체낭 층들(51A-P)의 직접 또는 미러 이미지들과 중첩하는 수정체 표면들(52A-P) 또는 핵의 표면들(53A-P)의 직접 또는 미러 이미지들에 의해 그 자체를 드러낸다. 이들 중첩들은 서로 중첩하는 수정체낭 층들의 직접 및 미러 이미지들과 유사한 문제들을 야기하고, 따라서 중첩들의 다양한 조합들 모두를 상세하게 설명하지 않고 오로지 참조될 것이다. 이러한 단순화는 오로지 설명의 간결함을 유지하기 위하여 사용되고, 본 발명의 범주는 이들 이미징된 눈-구조들의 모든 가능한 중첩 조합들을 포함한다.
모든 이들 가능한 조합들을 캡쳐하기 위하여, 방법은 제 1 눈-구조와 제 2 눈-구조에 관해 기술될 것이다. 위에서 기술된 수정체 전낭 및 후낭 층들(51A-P)은 이들 눈-구조들에 대한 예들이다. 다른 눈-구조들은 전면 및 후면 수정체 표면들(52A-P)과 전면 및 후면 핵 표면들(53A-P), 그리고 홍체, 동공, 각막 또는 임의의 다른 눈-구조들을 포함한다.
더욱이, 본 출원 전체를 통해 용어 "표면"이 넓은 의미로 사용됨을 주목해야 한다: 표면은 기하학적인 가장 밖의 표면뿐만 아니라 일부 두께의 생물학적 층도 언급할 수 있다. 표면의 두께, 또는 표면층은 기능적, 생물학적 또는 기계적인 기준에 기초하여 한정될 수 있고, 1 ㎛ 미만으로부터 1mm 초과까지 확장될 수 있다. 또한, 용어 "층"은 명확하게 한정된 경계들을 갖는 잘 분리된 층들을 언급할 수 있을 뿐만 아니라, 보통의 콘트라스트가 이웃 구조들로부터 구별을 여전히 가능케 하는 한, 이웃들에 대해 오로지 보통인 콘트라스트를 갖는 경계에 의해 한정된 층들을 포함하여, 더 넓은 의미를 내포할 수도 있다.
복합 불명료를 제거하기 위하여, 단계들(120-150)에서 눈의 이미지는 이미징된 눈-구조들의 미러 및 직접 이미지들 중 오로지 하나만을 선택함으로써 조립될 수 있다. 자세하게, 단계(130)에서, 수정체 전낭 층과 같은 제 1 눈-구조의 직접 이미지 또는 미러 이미지 중 어느 하나에 대응하는 제 1 이미지-부분이 생성된다. 단계(140)에서, 수정체 전낭과 같은 제 2 눈-구조의 미러 또는 직접 이미지 중 어느 하나에 대응하는 제 2 이미지-부분이 생성된다.
그 후, 단계(150)에서, 제 1 및 제 2 눈-구조들의 선택되지 않은 이미지들은 억압될 수 있어서, 생성된 제 1 및 제 2 이미지-부분들로부터 이미지의 조립을 허용한다.
단계들(120-140)의 배경에서, 이미징 시스템의 기준 깊이가 미러 이미지들의 깊이 또는 Z 좌표들을 설정하는 제어 파라미터들 중 하나임이 주목된다. 다른 구현들에서, 다른 제어 파라미터들이 기준 깊이의 역할을 할 수 있다.
이미징 단계(120)의 구성요소는, 제 1 및 제 2 눈-구조들의 직접 및 미러 이미지들이 서로로부터 구별될 수 있도록 이들 이미지들을 생성하기 위하여, SD-OCT 이미징 시스템의 이러한 깊이, 또는 다른 유사한 제어 파라미터를 조절하는 것이 될 수 있다. 기준 깊이는 예컨대 SD-OCT 이미징 시스템의 기준 암(arm) 내의 기준 미러를 이동시킴으로써 조절될 수 있다. 다른 구현들에 있어서, 가변 지연 요소는 SD-OCT 시스템의 기준 암 내에 또는 이미징 암 내에서 사용될 수 있다.
기준 깊이의 이러한 현명한 선택은, 제 1 및 제 2 눈-구조들의 직접 및 미러 이미지들 사이의 구별 단계를 적어도 더 쉽게, 그리고 간혹 실제로 가능하게 한다. 제 1 및 제 2 눈-구조들의 직접 및 미러 이미지들이 일단 구별되면, 눈의 이미지의 제 1 및 제 2 이미지-부분들로서 오로지 선택된 이미지들을 디스플레이하고, 선택되지 않은 이미지들을 억압하는 것이 가능하게 된다. 이들 단계들은 복합 불명료를 제거하기 위한 효율적인 방법이다.
제 1 및 제 2 눈-구조들의 직접 및 미러 이미지들의 구별은, 이미지들의 공간 간격을 시각적으로 인식하는 것, 또는 패턴 인식 접근법을 적용하는 것, 또는 이미지들의 신호 또는 잡음 특성을 구별하는 것, 또는 눈에 대해 이미 존재하는 지식을 이용하는 것, 또는 진단 프로세스에 기초한 눈에 대한 지식을 이용하는 것을 포함하는 다양한 방법들에 의해 수행될 수 있다.
이들 이미지 구별 방법들은 기준 깊이를 조절하는 단계와 반복적으로 결합될 수 있다. 일부 구현들에 있어서, 이미지들의 구별 단계는 미리 세트된 또는 디폴트 깊이와 같은 특정 기준 깊이를 사용하여 시도될 수 있다. 이미지들이 높은 신뢰 레벨을 갖고 구별될 수 있다면, 기준 깊이의 어떠한 조절도 요구되지 않는다. 그러나 이미지-부분들을 구별하려는 시도가 성공하지 못하거나, 또는 필요한 신뢰 레벨에 도달하지 못하면, 기준 깊이는 조절될 수 있고, 구별 단계는 다시 수행될 수 있다. 이들 단계들은, 기준 깊이가 이미지-부분들의 높은 신뢰 레벨의 구별이 달성되는 레벨로 기준 깊이가 조절될 때까지, 반복적으로 실시될 수 있다.
제 1 및 제 2 눈-구조들의 직접 및 미러 이미지들이 구별될 수 있도록 기준 깊이가 일단 선택되면, 선택되지 않은 이미지들은, 생성된 선택되지 않은 이미지들의 디스플레이를 방지하는 것, 선택되지 않은 이미지들을 디스플레이하지 않고 선택되지 않은 이미지들을 생성하는 것, 및 심지어 선택되지 않은 이미지들의 생성을 방지하기 위한 계산 단계를 수행하는 것을 포함하는 다양한 방식들로 단계(150)에서 억제될 수 있다. 다른 소프트웨어 및 하드웨어 구현들은 또한 선택되지 않은 이미지들을 마찬가지로 억제할 수 있다.
결국, 다양한 눈-구조 이미지들을 구별하고, 구별된 이미지들의 일부를 선택하고, 및 선택되지 않은 이미지들을 억압하는 방법(100)은, 일부 구현들에서, (a) 하나 또는 그 초과의 눈-구조들의 직접 및 미러 이미지들을 구별하려 시도하고; (b) 구별하는 단계(a)의 효율을 개선하기 위하여 시도된 구별 단계에 응답하여 필요하다면 기준 깊이와 같은 제어 파라미터를 조정하고; 및 (c) 구별 단계의 결과를 최적화하기 위하여 아마도 단계들{(a) 및 (b)}을 반복적인 방식으로 수행하는 것;을 포함한다.
2×2 = 4개의 이미지들(두 개의 주된 눈-구조들의 직접 및 미러 이미지들)에 대한 이미징 프로세스의 경우, 이러한 구별 단계는 이미징 시스템이, 두 개의 선택되지 않은 이미지들을 억압하고, 두 개의 선택된 영역을 복합 불명료가 없는 수정체의 수술 영역의 정확하고 유용한 이미지를 조립하기 위한 이미지 부분들로서 사용하는 것을 가능케 한다.
궁극적으로 디스플레이된 이미지를 조립하는 것은, 제 1 및 제 2 이미지-부분들 중 적어도 하나가 미러 이미지일 때, 제 1 및 제 2 눈-구조들의 생물학적 대표 이미지를 단계(150)에서 생성하기 위하여, 제 1 및 제 2 이미지-부분들 중 하나에 대한 변환을 수행하는 것을 포함한다. 이러한 변환은 예컨대 적절하게 선택된 미러 평면 또는 라인에 대한 미러 이미지의 미러링(mirroring), 따라서 직접 이미지를 생성하는 것이 될 수 있다. 이러한 변환은 제 1 및 제 2 이미지-부분들이 직접 이미지들일 때 필요하지 않을 수 있다.
도 3b는 이미징의 관련된 방법(100')을 도시한다. 방법(100')은:
(110')- 스펙트럼 영역 광간섭성 단층촬영(SD-OCT) 이미징 시스템에 대해 물체-물체는 낮은 콘트라스트 매질 내에서 높은 콘트라스트 구조를 포함한다-의 위치를 설정하는 단계;
(120')-높은 콘트라스트 구조의 직접 이미지 및 미러 이미지 중 하나에 대응하는 높은 콘트라스트 구조의 이미지를 SD-OCT 이미징 시스템을 통해 생성하는 단계; 및
(130')-높은 콘트라스트 구조의 선택되지 않은 이미지를 억압하는 단계;를 포함한다.
방법(100')은 단계(120')에서 높은 콘트라스트 물체의 직접 이미지 및 미러 이미지를 구별하는 것과, 흥미가 있는 다른 이미지로부터 이들 이미지들 중 어느 하나를 구별하는 것에 초점을 맞춘다. 방법은 또한 다른 선택되지 않은 이미지를 억압하면서 이들 이미지들 중 하나를 또한 디스플레이한다. 방법(100')은, 높은 콘트라스트의 구조의 이미지가 제 1 구조의 제 1 이미지로부터 구별 가능하도록, 높은 콘트라스트 구조의 이미지를 적절한 이미지 깊이로 생성하기 위하여, 예컨대 SD-OCT 이미징 시스템의 기준 깊이를 조절함으로써, 미러 이미지, 직접 이미지 및 임의의 다른 이미지를 구별할 수 있다.
위와 같이, 구별 단계는, 제 1 이미지로부터 높은 콘트라스트 구조의 이미지의 공간 간격을 시각적으로 인식하는 것; 패턴 인식 접근법을 적용하는 것; 높은 콘트라스트 구조의 이미지와 제 1 이미지의 신호 특성을 구별하는 것; 및 물체에 대해 이미 존재하는 지식을 이용하는 것; 및 진단에 기초한 물체에 대한 지식을 이용하는 것;을 포함한다.
최종적으로, 기준 깊이를 조절하고 다양한 이미지들을 구별하는 단계들은 최적화된 성능을 위하여 반복적으로 수행될 수 있다.
도 4a 내지 도 4d는, 눈의 얇은 각막과 수정체 전낭 및 후낭 층들에 대해 SD-OCT 절차에 의해 눈이 이미징될 때, 수 개의 다른 이미지 시퀀스들은 기준 깊이(Zref)의 선택에 따라 발생할 수 있는 것을 도시한다. 위에서 언급한 바와 같이, 수정체낭 층들에 부가하여, 수정체 표면과 핵 표면이 OCT 이미지 내에서 또한 출현한다. 따라서, 아래에서 이미지 시퀀스들이 오로지 수정체낭 층들에 관해서만 논의되지만, 부가적인 이미지들의 위치들의 다양한 조합들은 수 가지 부가적인 시퀀스들을 생성한다. 이들 부가적인 이미지 시퀀스들이 질적으로 새로운 문제를 야기하지 않기 때문에, 방법(100)의 자연적인 확장들을 수행하는 것은 대응하는 복합 불명료를 제거하는데 충분하다.
도 4a에 도시된 바와 같이, 각막의 직접 이미지(201)의 깊이(Zdc)(=Z직접,각막)는 Z 깊이 스케일의 0으로서 사용될 수 있다. 그 후, 수정체 전낭 층의 직접 이미지(211)가 깊이(Zda)에 있을 수 있고, 수정체 후낭 층의 직접 이미지(213)가 깊이(Zdp)에 있을 수 있다.
도 4a는 또한 기준 깊이(203)의 특별한 깊이 선택(Zref)에 대해, SD-OCT 이미징 시스템이 반사 중심으로서 기준 깊이(Zref)를 갖는 표면들의 미러 이미지들을 생성할 수 있는 것을 도시한다. 일반적으로, 미러 이미지의 Z 깊이는 Z미러 = Zref-(Z미러-Zref)에 위치한다.
위의 표면들의 미러 이미지들과 이들의 깊이들은 따라서 다음과 같다: 수정체 전낭 층의 미러 이미지(212)는 깊이(Zmp)에 있고, 수정체 전낭 층의 미러 이미지(214)는 깊이(Zma)에 있어서, 이미지 깊이의 시퀀스는 다음과 같다 : Zdc - Zda - Zmp - Zdp - Zma.
도 4b 내지 도 4c는, 기준 깊이(203)의 Z 좌표(Zref)가 조정될 때 이미지 시퀀스들이 변할 수 있는 것을 도시한다. 실제적으로 관련된 경우들에 있어서, 전형적으로 수정체 전낭 층의 미러 이미지(214)는 Zma에서 가장 깊은 Z 깊이를 갖고, 뒤이어 Zdp에서 수정체 후낭 층의 직접 이미지의 Z 깊이를 수반하기 때문에, 이들 두 개의 이미지들은 논의를 단순화하기 위하여 명시적으로 언급되지 않을 것이다. 따라서, 설명은 다른 이미지 깊이들(Zdc 와 Zda)에 대한 수정체 후낭 층의 미러 이미지(212)의 Z 깊이(Zmp)에 집중된다.
이러한 단순화를 통해, 전형적인 이미지 깊이 시퀀스는 다음을 포함한다:
도 4a : Zdc-Zda-Zmp, 즉 : 각막의 직접 이미지(201)-수정체 전낭 층의 직접 이미지(211)-수정체 후낭 층의 미러 이미지(212);
도 4b : Zdc-Zmp-Zda, 즉 : 각막의 직접 이미지(201)-수정체 후낭 층의 미러 이미지(212)-수정체 전낭 층의 직접 이미지(211); 및
도 4c : Zmp-Zdc-Zda, 즉 : 수정체 후낭 층의 미러 이미지(212)-각막의 직접 이미지(201)-수정체 전낭 층의 직접 이미지(211).
도 4d는 관련된 방법(100')에 대한 유사한 이미지 시퀀스를 도시한다 : 물체 경계의 직접 이미지(201')-높은 콘트라스트 물체의 미러 이미지(212')-높은 콘트라스트 물체의 직접 이미지(213').
상보적인 실시예들에 있어서, 위의 시퀀스들은, 모든 직접 이미지를 대응하는 미러 이미지로 그리고 모든 미러 이미지를 대응하는 직접 이미지로 변경하여, 정확히 상보적인 시퀀스를 취할 수 있다.
문헌의 다른 용어들과 연결하기 위하여, 위에서 기술된 이미징 방법이 간혹 호모다인 이미징으로 언급됨이 주목된다.
도 4e 내지 도 4f는 이미징된 물체의 3차원 성질에 관련되는 방법(100)의 구현을 도시한다. 이전에 기술된 구현들에 있어서, z-스캐닝은 간혹 단일 라인을 따라 수행된다: 이러한 접근법은 간혹 A-스캔으로 언급된다. 그러나 이미징된 물체가 회전 대칭이 아니라면, A-스캔은 불완전한 정보를 제공할 수 있다. 이러한 상황은, 예컨대 안과 수술 절차 도중에 수정체가 비대칭 위치로 밀쳐지는 경우, 발생할 수 있다.
도 4e는 수정체의 중심이 광축으로부터 이동하고, 수정체가 역시 기울어질 때: 수정체의 z 축이 광축과 평행하지 않게 될 때의 상황을 도시한다. 이러한 경우에, x1 평면 위치에서 수행된 A-스캔은 깊이(Zmp(x1))에서의 수면 수정체낭 층의 미러 이미지가 수정체 전낭 층의 직접 이미지(Zda(x1))와 구별될 수 있는 것을 발견할 것이다. 여기에서, x1 평면 위치 벡터는 예컨대 데카르트(Cartesian) 또는 방사상 좌표들로 표시될 수 있다.
그러나 예컨대 안과 수술을 가이드하기 위하여 수정체의 보다 더 완벽한 OCT 이미지가 요구된다면, 수 개의 Z-스캔들이 평면 위치들(x1, x2, ... xn)에서 수행될 수 있다. 도 4e에 도시된 바와 같이, A-스캔이 x2 평면 위치에서 수행된다면, Zmp(x2)는 본질적으로 Zda(x2)와 동일할 수 있고, 그러므로 수정체 후낭 층의 미러 이미지는 수정체 전낭 층의 직집 이미지와 구별될 수 있다.
도 4f는, 방법(100'')이 따라서 눈, 또는 임의의 다른 이미징된 물체가, 단일 Z-스캔("A 스캔", 좌측 패널)을 따라, (ii) 한 세트의 Z-스캔들("B 스캔", 중앙 패널)에 의한 이미징 평면에서, 또는 가능하게는 원형 B-스캔에서, 및 (iii) x-y 세트의 Z-스캔들(우측 패널)에 의한 이미징 영역 내에서 이미징될 수 있는 수정된 단계(120'')를 포함할 수 있는 것을 도시한다.
그 후, 수정된 단계들(130''와 140'')에서, 제 1 및 제 2 눈-구조들의 미러 또는 직접 이미지 중 하나가 구별되어 선택될 수 있다. 이들 단계들은, 미러 및 직접 이미지들이 Z-스캔 위치들 중 어느 위치에서든지 중첩하지 않고 따라서 구별될 수 있을 때까지, 기준 깊이(Zref)와 같은 방법 파라미터들을 조절하는 것을 포함한다. 최종적으로 수정된 단계(150'')에서, 선택되지 않은 이미지들은 억압될 수 있고, 선택된 이미지들은 디스플레이될 수 있다.
도 5a는 전형적인 SD-OCT 이미징 시스템 내에서 감도가 기준 깊이(Zref)에 대한 이미징된 물체의 깊이, 또는 Z 좌표에 어떻게 의존하는 지를 도시한다. 도시된 바와 같이, 물체의 Z 좌표가 기준 깊이(Zref)로부터 이동하는 일부 SD-OCT 이미징 시스템들에 있어서, 감도는 빠르게 갑자기 내려갈 수 있다. 도 5a는 일부 예들에서 이미지의 Z 좌표가 Zref로부터 4 mm만큼 벗어날 때, 감도는 거의 100% 값으로부터 거의 6% 값으로 감소할 수 있다. (Z-Zref)가 6-7 mm로 더 증가될 때, 감도는 거의 100% 값으로부터 대략 1% 값으로 감소한다. 이들 값들은 오로지 특정 예들에 대한 예시이다. 일반적으로, SD-OCT 감도는 가우스, 지수 또는 로렌츠 형태에 따라 (Z-Zref)에 의존할 수 있다.
감도의 이러한 감소는, 인가된 광원의 코히어런스 길이의 유한성, 잡음, 신호 강도의 손실, 큰 경로 차이들에서 간섭 패턴들을 분석하는 것의 어려움, 및 다양한 광학 수차들 및 난시들을 포함하여, 다수의 소스들을 갖는다. 감도의 이러한 손실은 OCT 이미징 기술의 응용 가능성 범위의 주요 제한 인자들 중 하나이다.
도 5a에 도시된 바와 같이, SD-OCT 시스템의 이미징 범위(L'max)를 정의하는 다른 방식들이 존재한다. 단순한 변환은 SD-OCT 시스템의 감도가, 예컨대 최대값의 5-10%의 범위 내의 임계값 아래로 줄어드는 (Z-Zref) 값을 이미징 범위(L'max)의 절반으로 사용하는 것이다: L'max = |Z-Zref|(6%). 여기에서, 6%의 임계값이 선택되었다. 눈에 보이게, 이러한 정의는 Z 깊이 스케일의 0이 어느 곳에 설정되는 지에 의존하지 않는데, 왜냐하면 SD-OCT 감도가 오로지 두 개의 Z 깊이들의 차이에 의존하기 때문이다. 다른 임계값들 역시 사용될 수 있다.
타깃화된 눈-구조들의 높은 품질의 SD-OCT 이미지들을 생성하기 위하여, 방법들(100과 100')의 구현들은, 방법(100)의 제 1 및 제 2 눈-구조들 또는 방법(100')의 높은 콘트라스트 물체가 기준 깊이(Zref)의 L'max/2 근처 내에 들도록, 기준 깊이(Zref)와 기준 깊이(Zref) 주위의 이미징 범위(L'max)를 조절한다. 기준 깊이는 예컨대 SD-OCT 이미징 시스템의 기준 암 내에서 기준 미러를 이동시킴으로써 조절될 수 있다. 다른 구현들에 있어서, 가변 지연 요소는 SD-OCT 시스템의 기준 암 또는 이미징 암 중 어느 하나 내에서 사용될 수 있다.
이미징 범위(L'max)는 예컨대 SD-OCT 이미징 시스템의 중심 파장 및 파장 해상도 중 적어도 하나를 조절함으로써 조절될 수 있다. 이들 개념들은 아래에서 SD-OCT 시스템이 기술될 때 상세하게 설명될 것이다.
SD-OCT 시스템을 백내장 수술들에 적절하게 하기 위하여, 방법들(100과 100')의 일부 구현들은 이미징 범위(L'max)를 5 mm 범위 내가 되도록 조절한다. 백내장 절차들이 각막 절차들로 보완되는 구현들은 0-15 mm 범위 내의 이미징 범위(L'max)를 가질 수 있다.
도 5b는 이미징 레이저 빔의 일부 특성들을 도시한다. 이미징 빔은 일반적으로 이미징 레이저 시스템 내에서 확장되고, 그 후 작은 개구수(NA)와 초점 깊이(Zf)에서의 좁은 "빔 허리"를 통해 초점 깊이(Zf)에서 다시 집속된다.
이러한 빔 허리 주위에서, 레일리 범위(220), 또는 그 두 배의 Z 방향의 "초점의 깊이"의 개념이 도입될 수 있고, 여기에서 빔은 충분히 높은 해상도로 물체를 이미징하기에 여전히 충분히 좁다. 이들 양들에 대한 정형화된 표현들은 이후에 시스템의 설명의 배경에서 주어질 것이다. 여기에서, 방법의 구현들은, 이미징 범위(L'max)가 레일리 범위의 4배 미만이 되게 하기 위하여, 이러한 레일리 범위를 초점 깊이(Zf) 주위로 조절할 수 있다. 다른 경우들에 있어서, 이러한 수치적인 인자는 예컨대 1 - 10의 범위 내로 4와 다를 수 있다.
조절될 수 있는 다른 길이 스케일은 기준 깊이(Zref)이다. 일부 구현들, 예컨대 백내장 응용들에 있어서, Zref 기준 깊이(203)는 2-15 mm 범위 내가 되도록 조절될 수 있다. 위에서 기술된 바와 같이, 기준 깊이는 예컨대 SD-OCT 이미징 시스템의 기준 암 내의 기준 미러를 이동시킴으로써 조절될 수 있다. 다른 구현들에 있어서, 가변 지연 요소는 SD-OCT 시스템의 기준 암 또는 이미징 암 중 어느 하나 내에서 사용될 수 있다.
도 6a 및 도 6b는 방법들(100과 100')이 실시될 수 있는 SD-OCT 이미징 시스템들(300과 300')의 두 개의 실시예들을 도시한다.
도 6a는 이미징 시스템(300)이 광원(310)을 포함할 수 있는 것을 도시하는데, 광원(310)은 평균 파장(λ0)과 상대적으로 넓은 유한 대역폭(W)을 갖는 광을 생성한다. 일부 일반적인 실시예들에 있어서, λ0는 800-1100 nm 범위 내에 들 수 있고, W는 10-50 nm 범위 내에 들 수 있다. 생성된 빔은 빔 스플리터(320)에 도달할 수 있고, 빔 스플리터(320)는 생성된 광 빔을 이미지 빔(361)과 기준 빔(362)으로 분할한다. 이미지 빔(361)은 제 2 빔 스플리터(330)를 향해 지속하고, 빔 스플리터(330)는 수술 빔(수술 레이저 엔진(301)에 의해 생성된)의 광학계로 이미지 빔의 방향을 바꾼다. 이러한 공유된 빔 경로의 마지막 요소는 일반적으로 대물렌즈(302)이다. 대물렌즈(302)는 방법(100)의 단계(110)에서 기술된 바와 같이, 눈(1)과 같은 이미징된 물체와 직접 또는 간접 접촉할 수 있다. 이러한 접촉의 기능은, 높은 정밀도의 이미징과 후속적인 안과 수술 절차를 허용하기 위하여, 대물렌즈(302)에 대해 눈의 위치를 설정하고 눈을 고정시키는 것이다. 일부 경우들에서, 진공 흡입을 사용하여 이러한 접촉을 효율적으로 용이하게 하기 위하여 환자 접촉부가 대물렌즈(302)의 단부에 부착된다.
점선들은 눈(1) 또는 방법(100')의 높은 콘트라스트 물체와 같은 이미징된 물체로부터 반환된 이미지 빔의 부분을 나타낸다. 이미지 빔(361)의 이러한 반환된 부분은 그 경로로 되돌아가 빔 스플리터(320)에 다시 도달한다.
빔 스플리터(320)는 광원(310)에 의해 생성된 광의 다른 부분의 방향을 기준 빔(362)으로서 미러(340)를 향해 바꾼다. 기준 미러(340)는 기준 빔의 일 부분을 빔 스플리터(320)를 향해 반환한다. 여기에서, 이미징된 물체(1)와 기준 미러(340) 모두가 그들에 입사한 광의 오로지 한 부분만을 반환할 수 있기 때문에, 반사 대신에 더 넓은 용어 "반환한다"가 사용된다. 이러한 점은 기준 미러(340) 대신에 또는 이와 관련하여 지연 요소를 사용하는 실시예들에서 특히 그러하다.
빔 스플리터(320)는 반환된 이미지 빔 부분들과 기준 빔 부분들을 결합된 또는 간섭 빔(363)으로 재결합시킬 수 있다. 일부 구현들에 있어서, 빔 스플리터(320)의 빔 분할 기능과 빔 재결합 기능은 두 개의 빔 스플리터들과 같은 두 개의 상이한 광 유닛들에 의해 수행될 수 있다.
이미징 시스템들(300 및 300')은 기준 미러(340)에 대한 거리가 조정 가능한 마이켈슨-모올리(Michelson-Morley) 구조를 사용할 수 있다. 일반적으로, 최대 보강간섭(constructive interference)은 기준 빔(362)과, 동일한 광학 길이를 갖는 경로를 이동한 이미지 빔(361)의 부분 사이에서 얻어진다. 그러므로 빔 스플리터/결합기(320)에 대한 기준 미러(340)의 거리는 기준 깊이(203)의 Z 좌표(Zref)를 결정하는 주요 인자이다. 따라서, 기준 미러(340)에 대한 광학 경로의 간격 또는 길이를 조절하는 것은, Zref 기준 깊이를 2-15 mm 범위 내로 조정하는 것과 같은, 방법(100)의 일부 단계들을 실시하는 한 가지 방식이다. 일반적으로, 광학 경로의 길이는 거리뿐만 아니라, 광이 전파하는 매질의 굴절률에도 의존한다. 일반적으로, 기준 미러(340)에 대한 거리는, 기준 빔(362)이 빔 결합기(320)에 시간 지연을 갖고 반환되거나 또는 시간적으로 앞서 반환되도록, 조정될 수 있다.
SD-OCT 시스템들에 있어서, 부가적인 특징은 유한 대역폭(W)을 갖는 광원(310)의 사용이다. 이들 시스템들은 다른 파장들에서 평행하게 동작하는 많은 마이켈슨-모올리(MM) 간섭계들로서 생각될 수 있다. 상이한 파장들에서 동작하는 MM 시스템들이 상이한 깊이에서 물체(1)를 이미징하기 때문에, 결합된 빔(363)은 간섭, 및 따라서 물체(1)의 모든 깊이들로부터의 이미지 정보를 전달한다.
각 깊이에 대해 이미지 정보를 복구하기 위하여, 결합된 빔(363)은 상이한 파장들의 성분들로 분해된다. 각 파장 성분의 간섭 데이터는 각 깊이에 대응하는 이미지 데이터를 복구하기 위하여 동시에 분석된다. 그 후 이들 이미지 데이터는 전체 이미지를 구성하기 위하여 사용된다. 실제, 상이한 파장 성분들에 의해 전달된 간섭 데이터는 이미징된 물체의 동시의 또는 본질적으로 순간적인 Z 스캐닝으로 변환될 수 있다. Z-스캐닝 데이터로 간섭 데이터의 이러한 변환은 간섭 분석기(350)에 의해 수행된다.
도 6a는, OCT 시스템(300)의 일부 구현들에 있어서, 간섭 분석기(350)가 분광계에 기반한(SB) 시스템인 것을 도시한다. 표준 광학 분석을 사용하여, SB-OCT 시스템(300) 및 SS-OCT 시스템(300')의 임계 이미징 및 성능 파라미터들은 다음과 같은 구조적 및 설계 파라미터들에 의해 특징지워질 수 있다.
SB 간섭 분석기(350)는 격자, 프리즘 또는 등가물이 될 수 있는 스펙트럼 분해기(351)를 포함할 수 있다. 스펙트럼 분해기(351)는 결합된 또는 간섭 빔(363)을 분해할 수 있고, 파장(λi)의 좁은 근처 내의 각 광 성분을 각(φi)을 갖는 상이한 방향으로 보낼 수 있다.
간섭 분석기(350)는 이들 발산하는 빔 성분들을 본질적으로 동시에 검출하기 위하여 센서 또는 픽셀 어레이(353)를 더 포함할 수 있다. 각 픽셀은 좁은 δλ 파장 범위 내에서 결합된 빔(363)의 λi 파장 성분에 의해 전달된 간섭 데이터를 기록한다. 이들 간섭 데이터는 물체(1) 내의 특정 깊이에 대응하는 이미지 데이터를 나타낸다. 상세한 분석이 나타내는 바와 같이, 물체의 완전한 Z-스캔을 나타내는 이미지 데이터는 픽셀들/센서들에 의해 기록된 간섭 데이터에 대한 (고속) 푸리에 변환(FFT)을 수행함으로써 재구성될 수 있다. FFT는 자신의 이미지 데이터 출력을 이미지 생성기(359)에 보내는 FFT 프로세서(357)에 의해 수행될 수 있다. 이미지 생성기(359)는 Z-스캔을 나타내는 이들 이미지 데이터로부터 실제 이미지를 생성할 t수 있고, 그 출력을 디스플레이 유닛에 보낼 수 있어서, 안과 수술을 지원한다.
개별 픽셀들이 더 적게 그리고 더 조밀하게 묶일수록, 더 좁은 δλ 파장 범위를 분해할 수 있다. 픽셀 밀도 이외에 δλ를 결정하는 다른 양은 이미징 광원(310)의 총 파장 범위, 즉 "대역폭(W)"이다. 단순한 배치에서, δλ는 대역폭(W)에 비례하고, 센서 어레이(353)의 한 행 내의 픽셀들의 수에 반비례한다. δλ 파장 범위들이 더 좁을수록, 이들 두 가지 양들이 역 푸리에 변환에 의해 연결되기 때문에 z 방향에서 이미징 범위는 더 넓어진다. 특히, 이론적인 최대 이미징 범위는 다음과 같이 주어진다.
값(λ0)은 OCT 광원(310)의 평균 또는 중심 파장을 언급하고, Nf는 나이퀴스트 주파수를 나타낸다. 이러한 Lmax는 이미징 범위의 이론적인 한계이다. 실제, 신호대 잡음비와 같은 추가적인 인자들은 유효 이미징 범위를 이러한 이론적인 최대값 아래로 제한할 수 있다. 그러므로 앞서 도입된 이미징 범위(L'max)는 일반적으로 이러한 이론적인 값(Lmax)보다 작거나 이와 같다.
"축 해상도"로도 알려진 z 방향에서 해상도인 Δz는 다음과 같이 주어진다.
x 방향에서 해상도인 Δx, 또는 "횡방향 해상도"는 개구수(NA)와 이미징 광원(310)의 파장에 의해 좌우되고, 다음과 같이 표시될 수 있다.
여기에서, f는 초점 길이이고, d는 대물렌즈(302)의 동공이다.
최종적으로 위에서 논의된 레일리 범위는 다음과 같이 주어진다.
레일리 범위(R)는, 간혹 초점 깊이와, 빔 폭이 초점 깊이에서의 빔 폭의 배가 되는 깊이 사이의 z 방향의 거리로서 정의된다. 따라서 R은 기하학적인 및 파동 광학계들에 의해 제한된 높은 해상도 이미징을 가능케 하기에 빔이 충분히 좁은 z-범위를 특징지운다. Lmax는 광원(310)과 센서 어레이(353)의 해상도에 의해 제한된 z-이미징 범위를 특징지우는 것으로 생각될 수 있다. 최적의, 예컨대 가우스 빔들로 간혹 생각되는 시스템 설계 원리는 이들 두 개의 z-범위들을 서로 정렬되게 하는 것이다. 예컨대, 일부 구현들에 있어서, Lmax = 4R이다. 동일한 설계 원리는, 간혹 레일리 범위의 두 배로서 정의된 "초점의 깊이"에 의해 획득될 수 있다.
위의 수학식들은 λ,δλ, W, f 및 d를 포함하는 구조적 및 시스템 파라미터들에 관해, Lmax, Zref 및 R을 포함하는 방법 파라미터들을 표시하고, 따라서 시스템 파라미터들을 조절함으로써 방법 파라미터들을 조절하기 위한 특정 방식들을 계획한다.
예컨대, 수학식 1은 이미징 범위(Lmax)의 방법 파라미터가 OCT 광원(310)의 중심 파장(λ0) 및/또는 센서 어레이(353)의 파장 해상도(δλ)를 조절함으로써 조절될 수 있는 것을 나타낸다. 더욱이, 기준 깊이(Zref)의 방법 파라미터는 기준 미러(340)에 대한 거리의 시스템 파라미터를 변경함으로써 또는 가변 지연 요소를 기준 빔(362)의 경로에 배치함으로써 조절될 수 있다. 대안적으로, 이미지 빔(361)의 경로는, 예컨대 빔 스플리터들(320 및 330) 사이의 거리를 변경함으로써, 또는 이들 사이에 가변 지연 요소를 배치함으로써, 또한 수정될 수 있다.
도 6b는 OCT 시스템(300')의 다른 실시예를 도시한다. 이러한 실시예(300')는 소위 말하는 "스위프된 소스"(SS) 광원, 또는 스위핑 파장 광원(310')을 사용한다. 이러한 SS 광원(310')은 분광계에 기반한 SB 광원(310)보다 훨씬 더 좁은 대역폭을 갖는 코히어런스 광을 방출한다. 만족스러운(clever) 변조 기술들을 통해, SS 광원(310')은 방출된 광의 파장을 변경시켜, 파장(λ)을 대역폭(W)을 가로질러 "스위핑"한다. 그러므로 이러한 SS-OCT 시스템(300')에서, Z-스캔된 이미지 데이터는, 파장(λ)이 스위프됨에 따라, 공간적으로가 아니라 시간 시퀀스로서 획득된다. 이러한 SS-OCT 시스템(300')에서, 실제 Z-스캔된 이미지는 결합된 빔(363)의 스펙트럼에 대해 고속 푸리에 변환을 수행함으로써 생성될 수 있다.
이러한 기능을 실행하기 위하여, SS-OCT 시스템들(300')의 간섭 분석기(350')는, 스위핑 광원(310')과 동기화될 수 있는 결합된 또는 간섭 빔(363)을 수신하기 위하여 검출기(351')를 사용할 수 있다. 검출기(351')는 간섭 데이터의 인입 시퀀스를, 광원(310')이 대응하는 짧은 시간 간격에서 어떤 파장 광을 방출하였는지에 따라, 데이터 저장소(data binner; 353')에 저장할 수 있다. SS-OCT 시스템들에서 시간 시퀀스를 해결하는 것이 SB-OCT 시스템들에서 결합된 빔의 파장 혼합물을 해결하는 것과 어떤 의미에서는 유사하므로, 간섭 분석기(350')의 나머지는 SB-OCT 시스템(300)과 유사할 수 있다. 따라서, SS-OCT 간섭 분석기(350')는 또한 고속 푸리에 변환(FFT) 프로세서(357)를 포함하고, FFT 프로세서(357)는 이제 이미지 데이터를 생성하기 위하여 간섭 데이터의 시간 시퀀스의 스펙트럼을 푸리에 변환하며, 그 출력을 이미지 생성기(359)에 전달하고, 이미지 생성기(359)는 눈(1)과 같은 이미징된 물체의 Z-스위프된 이미지를 조립한다.
어느 하나의 구조에서 이미지 생성기(359)의 기능은 제 1 및 제 2 눈-구조들의 직접 및 미러 이미지들을 구별하는 프로세스에 기여하는 것이다. 일부 구현들에 있어서, 이러한 목표를 달성하기 위하여 별도의 프로세서가 이미지 생성기(359)와 함께 작동한다. 위에서 논의된 바와 같이, 이러한 구별 단계는, 예컨대 제 1 이미지로부터 높은 콘트라스트 구조의 이미지의 공간 간격을 시각적으로 인식하는 것, 패턴 인식 접근법을 적용하는 것, 높은 콘트라스트 구조의 이미지와 제 1 이미지의 신호 특성을 구별하는 것, 및 물체에 대해 이미 존재하는 지식을 이용하는 것, 및 진단에 기초한 물체에 대한 지식을 이용하는 것을 포함할 수 있다.
더욱이, 이미지 생성기(359)와 별도의 이미지 프로세서는 예컨대, 생성된 선택되지 않은 이미지들의 디스플레이를 방지함으로써, 선택되지 않은 이미지들을 디스플레이하지 않고 선택되지 않은 이미지들을 생성함으로써, 및 선택되지 않은 이미지들의 생성을 방지하기 위한 계산 단계를 수행함으로써, 선택되지 않은 이미지들을 억압할 수 있다.
도 7 내지 도 17은 SD-OCT 이미징 서브시스템을 사용하는 안과 레이저 수술 시스템의 실시예들을 도시한다.
레이저 수술 절차들의 한 가지 중요한 양상은 레이저 빔, 예컨대 빔 위치 및 빔 집속의 정확한 제어 및 조준이다. 레이저 수술 시스템들은 레이저 펄스들을 조직 내의 특정 타깃에 정확하게 타깃화하기 위하여 레이저 제어 및 조준 도구들을 포함하도록 설계될 수 있다. Nd:YAG 레이저 시스템들과 같은, 다양한 나노초 광-파괴 레이저 수술 시스템들에 있어서, 타깃화하는 정밀도의 필요한 레벨은 상대적으로 낮다. 이는 부분적으로, 사용된 레이저 에너지가 상대적으로 높고 따라서 영향을 받는 조직 영역이 또한 상대적으로 커서, 간혹 수백 미크론 크기를 갖는 충돌 영역을 커버하기 때문이다. 이러한 시스템들에서 레이저 펄스들 사이의 시간은 긴 경향이 있고, 수동 제어되는 타깃화는 실행 가능하고 공통적으로 사용된다. 이러한 수동 타깃화 메커니즘들의 한 가지 예는, 조준 빔으로서 사용된 2차 레이저 소스와 조합하여 타깃 조직을 시각화하기 위한 생체현미경이다. 의사는, 현미경을 통한 이미지와 (오프셋을 갖거나 갖지 않은 상태로) 초점면이 같은 레이저 집속 렌즈의 초점을, 일반적으로 조이스틱 제어기를 통해 수동으로 이동시켜, 수술 빔 또는 조준 빔은 의도된 타깃 상의 최상 초점 내에 있게 된다.
낮은 반복률의 레이저 수술 시스템들과 함께 사용하기 위해 설계된 이러한 기술들은, 초당 수천 샷들(shots)로 그리고 펄스당 상대적으로 낮은 에너지로 동작하는 높은 반복률의 레이저들과 함께 사용하기 어려울 수 있다. 높은 반복률의 레이저들을 이용한 외과 수술들에 있어서, 각 단일 레이저 펄스의 작은 효과들로 인해 훨씬 더 높은 정밀도가 요구될 수 있고, 수천 펄스들을 새로운 치료 영역들에 매우 신속하게 전달할 필요로 인해 훨씬 더 높은 위치 설정 속도가 요구될 수 있다.
레이저 수술 시스템들을 위한 높은 반복률의 펄스화된 레이저들의 예들은, 펄스당 상대적으로 낮은 에너지로 초당 수천 샷들 또는 그 이상의 펄스 반복률로 펄스화된 레이저들을 포함한다. 이러한 레이저들은, 레이저 유도된 광파괴에 의해 초래된 조직의 효과를, 예컨대 광파괴에 의해 충돌된 조직 영역을 수 미크론 또는 수십 미크론 정도로 국한시키기 위하여, 펄스당 상대적으로 낮은 에너지를 사용한다. 이러한 국한된 조직의 영향은 레이저 수술의 정밀도를 향상시키고, 레이저 눈 수술과 같은 특정 수술 절차들에서 바람직할 수 있다. 이러한 수술의 한 예에 있어서, 조직의 절개, 분할, 또는 파쇄와 같은 특정 원하는 수술 효과들을 달성하기 위하여, 알려진 거리들만큼 분리된 수백, 수천 또는 수백만의 연속된, 거의 연속된 펄스들의 배치가 사용될 수 있다.
더 짧은 레이저 펄스 지속기간을 갖는 높은 반복률의 광파괴 레이저 수술 시스템들을 사용하는 다양한 수술 절차들은, 타깃 조직 상의 타깃 위치에 대한 절대적 위치 및 선행하는 펄스들에 대한 상대 위치 모두에서 수술하의 타깃 조직 내에서 각 펄스를 위치설정하는데 높은 정밀도를 요구할 수 있다. 예컨대, 일부 경우들에 있어서, 레이저 펄스들은, 수 마이크로초 정도가 될 수 있는 펄스들 사이의 시간 내에서 수 미크론의 정밀도로 서로 나란히 전달되도록 요구될 수 있다. 두 개의 순차적인 펄스들 사이의 시간이 짧고, 펄스 정렬을 위한 정밀도 요건이 높기 때문에, 낮은 반복률의 펄스화된 레이저 시스템들에서 사용된 수동 타깃화는 더 이상 적절하거나 사용가능하지 않을 수 있다.
조직 내로 레이저 펄스들의 전달을 위한 정밀하고 높은 속도의 위치설정 요건을 용이하게 하고 제어하기 위한 한 가지 기술은, 압평 플레이트(applanation plate)의 접촉 표면이 조직과의 잘 한정된 광 접촉부를 형성하도록, 조직에 대한 미리 한정된 접촉 표면을 갖는 유리와 같은 투명 재질로 만들어진 압평 플레이트를 획득하는 것이다. 잘 한정된 접촉부는, 눈에서는 각막의 전면 표면인 공기-조직 접촉부에서 가장 중요한 광학 수차들 또는 변동들(특정 눈의 시각 특성들 또는 표면 건조로 발생하는 변화들에 기인하는 것과 같은)을 제어하거나 줄이기 위하여, 조직 내로 레이저 광의 투과 및 집속을 용이하게 할 수 있다. 일회용 또는 재사용 가능한 것들을 포함하는 콘택트 렌즈들은 눈 및 다른 조직들 내부의 다양한 응용들과 타깃들을 위하여 설계될 수 있다. 타깃 조직의 표면상의 접촉 유리 또는 압평 플레이트는, 레이저 전달 시스템 내에서 집속 요소들의 조절을 통해 어떤 레이저 펄스들이 집속되는 지에 대한 기준 플레이트로서 사용될 수 있다. 접촉 유리 또는 압평 플레이트의 이러한 사용은 조직 표면의 광학적 품질들의 더 양호한 제어를 제공하고, 따라서 레이저 펄스들이, 압평 기준 플레이트에 대해 타깃 조직 내에서 원하는 위치(상호작용 점)에, 레이저 펄스들의 광 왜곡이 거의 없이, 높은 속도로 정확하게 배치되는 것을 허용한다.
눈 위에 압평 플레이트를 구현하는 한 가지 방식은 눈 안의 타깃 조직 내로 레이저 펄스들을 전달하기 위한 위치 기준을 제공하기 위하여 압평 플레이트를 사용하는 것이다. 위치 기준으로서 압평 플레이트의 이러한 사용은, 레이저 펄스들을 발사하기 전에 충분한 정밀도를 갖는, 타깃 내의 레이저 펄스 초점의 알려진 요구되는 위치, 및 기준 플레이트와 개별 내부 조직 타깃의 그러한 상대적인 위치들이 레이저 발사 도중에 일정하게 남아 있어야만 된다는 것에 기초할 수 있다. 덧붙여, 이러한 방법은, 원하는 위치에 레이저 펄스의 집속이 눈들 사이에서 또는 동일한 눈내의 다른 영역들에서 예측될 수 있고 반복될 수 있어야 하는 것을 필요로 할 수 있다. 실제 시스템들에 있어서, 위의 조건들이 실제 시스템들에서 충족되지 않을 수 있기 때문에, 레이저 펄스들을 눈 내부로 정확하게 국한하기 위하여 압평 플레이트를 위치 기준으로서 사용하는 것은 어려울 수 있다.
예컨대, 수정체가 수술 타깃이라면, 눈의 표면상의 기준 플레이트로부터 타깃까지의 정밀한 거리는, 각막 자체, 전면 챔버, 및 홍체와 같은 붕괴 가능한 구조들의 존재에 기인하여 변하는 경향이 있다. 의사에 의해 사용된 특정 수술 및 압평 기술에 따라, 개별 눈들 사이에서 압평된 각막과 수정체 사이의 거리에서 상당한 변이성뿐만 아니라, 동일한 눈 내에서의 변동도 존재할 수 있다. 덧붙여, 수술 효과를 달성하기 위하여 필요한 수천 레이저 펄스들을 발사하는 도중에 압평된 표면에 대해 타깃화된 수정체 조직의 움직임이 존재할 수 있어서, 펄스들의 정확한 전달을 더 복잡하게 한다. 덧붙여, 눈 내의 구조는 공동 기포들과 같은 광파괴 부산물들의 구축으로 인해 움직일 수 있다. 예컨대, 수정체에 전달된 레이저 펄스들은 수정체낭이 전방으로 부풀어 오르게 할 수 있어서, 레이저 펄스들의 후속 배치를 위해 이러한 조직을 타깃화하기 위한 조절을 필요로 한다. 더욱이, 압평 플레이트가 제거된 후 타깃 조직들의 실제 위치를 충분한 정확도로 예측하고, 압평 없이 원하는 국부화를 달성하기 위해 레이저 펄스들의 배치를 조절하기 위하여 컴퓨터 모델들 및 시뮬레이션들을 사용하는 것은 어려울 수 있는데, 이는 부분적으로, 개별 각막 또는 눈에 특정한 인자들, 및 의사에 의해 사용된 특정 수술 및 압평 기술에 의존할 수 있는 압평 효과들의 높은 가변 성질들 때문이다.
일부 수술 프로세스들에서, 내부 조직 구조들의 국부화에 어울리지 않게 영향을 미치는 압평의 물리적인 효과들에 덧붙여, 타깃화 시스템이 짧은 펄스 지속기간의 레이저들을 사용할 때 발생할 수 있는 광파괴의 비선형 특성들을 예상하거나 고려하는 것이 바람직할 수 있다. 광파괴는 조직 재질 내에서 비선형 광학 프로세스이고, 빔 정렬 및 빔 타깃화시 합병증들을 야기할 수 있다. 예컨대, 광파괴 도중에 레이저 펄스들과 상호작용할 때 조직 재질 내의 비선형 광학 효과들 중 하나는 레이저 펄스들이 겪는 조직 재질의 굴절률이 더 이상 일정하지 않고 오히려 광의 강도에 따라 변한다는 점이다. 레이저 펄스들 내의 광의 강도가 펄스화된 레이저 빔의 전파 방향을 따라 및 이 방향을 가로질러, 펄스화된 레이저 빔 내에서 공간적으로 변하기 때문에, 조직 재질의 굴절률은 또한 공간적으로 변한다. 이러한 비선형 굴절률의 한 가지 결과는 조직 내부의 펄스화된 레이저 빔의 실제 초점을 변화시키고 초점의 위치를 이동시키는, 조직 재질 내의 자체-집속 또는 자체-초점이탈이다.
그러므로 타깃 조직 내의 각 타깃 조직 위치에 대한 펄스화된 레이저 빔의 정확한 정렬은 레이저 빔에 대한 조직 재질의 비선형 광학 효과들을 고려하는 것을 또한 필요로 할 수 있다. 덧붙여, 경도와 같은 상이한 물리적인 특성들에 기인하여, 또는 특정 영역으로 이동하는 레이저 펄스 광의 흡수 또는 산란과 같은 광학적 고려사항들에 기인하여, 타깃의 상이한 영역들 내에 동일한 물리적인 효과를 전달하기 위하여 각 펄스 내의 에너지를 조절하는 것이 필요할 수 있다. 이러한 경우들에 있어서, 상이한 에너지 값들의 펄스들 사이의 비선형 집속 효과들의 차이점들은 또한 수술 펄스들의 레이저 정렬 및 레이저 타깃화에 영향을 미칠 수 있다.
따라서, 어떠한 표면 구조들도 타깃화되지 않는 수술 절차들에 있어서, 압평 플레이트에 의해 제공된 위치 기준에 기초한 표면 압평 플레이트의 사용은 내부 조직 타깃들 내에서 정확한 레이저 펄스 국부화를 달성하기 위하여 불충분할 수 있다. 레이저 전달을 가이드하기 위한 기준으로서 압평 플레이트의 사용은, 공칭 값으로부터의 변동이 깊이 정확도 오차로 직접 변환되기 때문에, 높은 정확도로 압평 플레이트의 두께 및 플레이트 위치의 측정들을 필요로 할 수 있다. 높은 정확도의 압평 렌즈들은 특히 단일 사용의 1회용 압평 플레이트들을 위해 비용이 많이 들 수 있다.
본 문서에서 기술된 기술들, 장치 및 시스템들은, 레이저 펄스들을 발사하기 전에 충분한 정밀도로 타깃 내의 레이저 펄스 초점의 알려진 원하는 위치를 필요로 하지 않고, 또한 기준 플레이트와 개별 내부 조직 타깃의 상대적인 위치들이 레이저 발사 도중에 일정하게 남이 있을 것을 요구하지 않고, 짧은 레이저 펄스들을 압평 플레이트를 통해 정밀도를 갖고 또한 높은 속도로 눈의 내부의 원하는 국부화로 전달하기 위한 타깃화 메커니즘을 제공하는 방식들로 구현될 수 있다. 그런 것에 따라, 본 기술들, 장치 및 시스템들은, 수술 하의 타깃 조직의 물리적인 조건들이 변하는 경향이 있고 제어하기 어려우며, 압평 렌즈의 크기가 렌즈마다 변하는 경향이 있는 다양한 수술 절차들을 위하여 사용될 수 있다. 본 기술들, 장치 및 시스템들은 또한, 구조의 표면에 대한 수술 타깃의 왜곡 또는 움직임이 존재하거나, 비선형 광학 효과들이 정확한 타깃화를 문제가 되게 하는 다른 수술 타깃들을 위해 사용될 수 있다. 눈과 상이한 이러한 수술 타깃들에 대한 예들은 심장, 피부 내의 더 깊은 조직, 등을 포함한다.
본 기술들, 장치 및 시스템들은, 압평된 표면의 내부 구조들에 대한 광파괴의 정밀한 국부화를 제공하면서, 예컨대 표면의 형태 및 수화(hydration)의 제어와 광학 왜곡의 감소를 포함하는, 압평 플레이트에 의해 제공된 이점들을 유지하는 방식들로 구현될 수 있다. 이것은 전달 시스템의 집속 광학계들에 대해 타깃 조직을 국부화하기 위하여 통합된 이미징 디바이스의 사용을 통해 달성될 수 있다. 이미징 디바이스 및 방법의 정확한 유형은 변할 수 있고, 타깃의 특정 성질 및 정밀도의 필요한 레벨에 의존할 수 있다.
압평 렌즈는 눈을 고정하여 눈의 병진 및 회전 움직임을 방지하기 위한 다른 메커니즘과 함께 구현될 수 있다. 이러한 고정 디바이스들의 예들은 흡입 링의 사용을 포함한다. 이러한 고정 메커니즘은 수술 타깃의 원하지 않는 왜곡 또는 움직임을 야기할 수 있다. 본 기술들, 장치 및 시스템들은, 비표면 수술 타깃들을 위한 압평 플레이트 및/또는 고정 수단을 사용하는 높은 반복률의 레이저 수술 시스템들에, 수술중의 이미징을 제공하여 수술 타깃의 이러한 왜곡 및 움직임을 모니터하기 위한 타깃화 메커니즘을 제공하도록 구현될 수 있다.
예컨대, 수술 절차 전에 및 도중에 타깃 조직의 위치설정 정보를 얻기 위하여 타깃 조직의 이미지들을 획득하기 위한 광학 이미징 모듈을 사용하는, 레이저 수술 기술들, 장치 및 시스템들의 특정 예들은 아래에서 기술된다. 이와 같이 얻어진 위치설정 정보는, 타깃 조직 내의 수술 레이저 빔의 위치설정 및 집속을 제어하여, 높은 반복률의 레이저 수술 시스템들에서 수술 레이저 펄스들의 배치의 정확한 제어를 제공하도록 사용될 수 있다. 일 구현에 있어서, 수술 절차 도중에 광학 이미징 모듈에 의해 획득된 이미지들은 수술 레이저 빔의 위치 및 초점을 동적으로 제어하기 위하여 사용될 수 있다. 덧붙여, 더 낮은 에너지 및 짧은 레이저 펄스들은 광학 왜곡들에 민감한 경향이 있고, 이러한 레이저 수술 시스템은, 타깃 조직과 수술 레이저 시스템 사이의 제어되고 안정된 광학 접촉부를 제공하고, 조직 표면에서 광학 수차들을 경감 및 제어하기 위하여 타깃 조직에 부착하는 편평한 또는 굴곡진 접촉부를 통해 압평 플레이트를 구현할 수 있다.
일 예로서, 도 7은 광학 이미징 및 압평에 기반한 레이저 수술 시스템을 도시한다. 이러한 시스템은, 레이저 펄스들의 수술 레이저 빔(1012)을 생성하기 위한 펄스화된 레이저(1010), 및 수술 레이저 빔(1012)을 수신하고 집속시켜, 집속된 수술 레이저 빔(1022)의 방향을 눈과 같은 타깃 조직(1001)으로 정하여, 타깃 조직(1001) 내의 광파괴를 야기하는 광학 모듈(1020)을 포함한다. 압평 플레이트는 접촉부를 생성하기 위해 타깃 조직(1001)과 접촉하도록 제공될 수 있고, 접촉부는 레이저 펄스들을 타깃 조직(1001)으로 투과시키고, 타깃 조직(1001)으로부터 나오는 광을 자신을 통해 투과시킨다. 명료하게, 광학 이미징 디바이스(1030)은, 타깃 조직 이미지(1050)를 전달하는 광(1050) 또는 타깃 조직(1001)으로부터의 이미징 정보를 획득하여, 타깃 조직(1001)의 이미지를 생성하기 위하여 제공된다. 이미징 디바이스(1030)로부터 이미징 신호(1032)는 시스템 제어 모듈(1040)로 전달된다. 시스템 제어 모듈(1040)은, 획득된 이미지들로부터의 정보에 기초하여, 이미지 디바이스(1030)로부터 획득된 이미지들을 처리하고, 광 모듈(1020)을 제어하여, 타깃 조직(1001)에서 수술 레이저 빔(1022)의 위치 및 초점을 조절하도록, 동작한다. 광 모듈(1020)은 하나 또는 그 초과의 렌즈들을 포함할 수 있고, 하나 또는 그 초과의 반사기들을 더 포함할 수 있다. 제어 엑추에이터는 시스템 제어 모듈(1040)로부터의 빔 제어 신호(1044)에 응답하여 집속 및 빔 방향을 조절하기 위하여 광 모듈(1020)에 포함될 수 있다. 제어 모듈(1040)은 또한 레이저 제어 신호(1042)를 통해 펄스화된 레이저(1010)를 제어할 수 있다.
광 이미징 디바이스(1030)는 타깃 조직(1001)을 시험하기 위하여 수술 레이저 빔(1022)과는 별도인 광 이미징 빔을 생성하기 위하여 구현될 수 있고, 광 이미징 빔의 반환된 광은 타깃 조직(1001)의 이미지들을 얻기 위하여 광 이미징 디바이스(1030)에 의해 획득된다. 이러한 광 이미징 디바이스(1030)의 한 예는 광간섭성 단층 사진 촬영(OCT) 이미징 모듈이고, 이러한 모듈은 타깃 조직(1001)의 이미지들을 얻기 위하여 광학적으로 서로 간섭하는, 두 개의 이미징 빔들, 즉 압평 플레이트를 통해 타깃 조직(1001)으로 향한 하나의 시험 빔과 기준 광 경로에서의 다른 기준 빔을 사용한다. 다른 구현들에 있어서, 광 이미징 디바이스(1030)는, 지정된 광 이미징 빔을 타깃 조직(1001)에 보내지 않고, 이미지들을 획득하기 위하여 타깃 조직(1001)으로부터 산란되거나 반사된 광을 사용할 수 있다. 예컨대, 이미징 디바이스(1030)는 CCD 또는 CMS 센서들과 같은 감지 요소들의 감지 어레이일 수 있다. 예컨대, 예컨대, 수술 레이저 빔(1022)에 의해 생성된 광파괴 부산물의 이미지들은, 수술 레이저 빔(1022)의 집속 및 위치설정을 제어하기 위해 광 이미징 디바이스(1030)에 의해 획득될 수 있다. 광 이미징 디바이스(1030)가 광파괴 부산물의 이미지를 사용하여 수술 레이저 빔 정렬을 가이드하도록 설계될 때, 광 이미징 디바이스(1030)는 레이저 유도된 기포들 또는 공동들과 같은 광파괴 부산물의 이미지들을 획득한다. 이미징 디바이스(1030)는 또한 음향 이미지들에 기초한 이미지들을 획득하기 위한 초음파 이미징 디바이스가 될 수 있다.
시스템 제어 모듈(1040)은, 타깃 조직(1001) 내에서 타깃 조직의 위치로부터 광파괴 부산물을 위한 위치 오프셋 정보를 포함하는, 이미징 디바이스(1030)로부터의 이미지 데이터를 처리한다. 이미지로부터 얻어진 정보에 기초하여, 빔 제어 신호(1044)는, 레이저 빔(1022)을 조절하는 광 모듈(1020)을 제어하기 위하여, 생성된다. 디지털 처리 유닛은 레이저 정렬을 위한 다양한 데이터 처리를 수행하기 위하여 시스템 제어 모듈(1040)에 포함될 수 있다.
위의 기술들 및 시스템들은, 절단 또는 체적 파괴 응용들을 위해 필요할 때, 연속 펄스 배치를 위해 필요한 정밀도로 높은 반복률의 레이저 펄스들을 표면 아래의 타깃들에 전달하기 위하여 사용될 수 있다. 이는 타깃의 표면 위에 기준 소스의 사용을 통해 또는 기준 소스의 사용 없이 달성될 수 있고, 평압을 따르는 또는 레이저 펄스들의 배치 도중에 타깃의 움직임을 고려할 수 있다.
본 시스템들 내에서 압평 플레이트는 레이저 펄스의 조직 내로의 전달을 위한 정밀하고 높은 속도의 위치설정 요건을 용이하게 하고 제어하기 위해 제공된다. 이러한 압평 플레이트는, 압평 플레이트의 접촉 표면이 조직과의 잘 한정된 광 접촉부를 형성하도록, 조직에 대한 미리 한정된 접촉 표면을 갖는 유리와 같은 투명 재질로 만들어질 수 있다. 이러한 잘 한정된 접촉부는, 눈에서는 각막의 전면 표면인 공기-조직 접촉부에서 가장 중요한 광학 수차들 또는 변동들(특정 눈의 시각 특성들 또는 표면 건조로 발생하는 변화들에 기인하는 것과 같은)을 제어하거나 줄이기 위하여, 조직 내로 레이저 광의 투과 및 집속을 용이하게 할 수 있다. 일회용 또는 재사용 가능한 것들을 포함하는 다수의 콘택트 렌즈들은 눈 및 다른 조직들 내부의 다양한 응용들과 타깃들을 위하여 설계되어 왔다. 타깃 조직의 표면상의 접촉 유리 또는 압평 플레이트는, 레이저 전달 시스템 관계물 내에서 집속 요소들의 조절을 통해 어떤 레이저 펄스들이 집속되는 지에 대한 기준 플레이트로서 사용될 수 있다. 이러한 접근법에서 고유한 것은, 조직 표면의 광학적 품질들의 제어를 포함하여, 이전에 기술된 접촉 유리 또는 압평 플레이트에 의해 제공된 부가적인 이점들이다. 따라서 레이저 펄스들은, 압평 기준 플레이트에 대해 타깃 조직 내에서 원하는 위치(상호작용 점)에서, 레이저 펄스들의 작은 광 왜곡을 통해, 높은 속도로 정확하게 배치될 수 있다.
도 7 내의 광학 이미징 디바이스(1030)는 압평 플레이트를 통해 타깃 조직(1001)의 이미지들을 획득한다. 제어 모듈(1040)은 획득된 이미지들로부터 위치 정보를 추출하기 위하여 획득된 이미지들을 처리하고, 수술 레이저 빔(1022)의 위치 및 초점을 제어하기 위하여 위치 기준 또는 가이드로서 추출된 위치 정보를 사용한다. 이미징-가이드된 레이저 수술은, 압평 플레이트의 위치가 위에서 논의된 바와 같이 다양한 인자들로 인해 변하는 경향이 있기 때문에, 위치 기준으로서 압평 플레이트에 의존하지 않고 구현될 수 있다. 따라서, 압평 플레이트가 수술 레이저 빔이 타깃 조직으로 들어가, 타깃 조직의 이미지들을 획득하기 위한 원하는 광 접촉부를 제공하지만, 레이저 펄스들의 정확한 전달을 위한 수술 레이저 빔의 위치 및 초점을 정렬하고 제어하기 위해 압평 플레이트를 위치 기준으로서 사용하는 것은 어려울 수 있다. 이미징 디바이스(1030)와 제어 모듈(1040)에 기초한 수술 레이저 빔의 위치와 초점의 이미징-가이드된 제어는, 위치 기준을 제공하기 위한 압평 플레이트를 사용하지 않고, 타깃 조직(1001)의 이미지들, 예컨대 눈의 내부 구조들의 이미지들이 위치 기준들로서 사용되는 것을 허용한다.
일부 수술 프로세스들에서, 내부 조직 구조들의 국부화에 어울리지 않게 영향을 미치는 압평의 물리적인 효과들에 덧붙여, 타깃화 시스템이 짧은 펄스 지속기간의 레이저들을 사용할 때 발생할 수 있는 광파괴의 비선형 특성들을 예상하거나 고려하는 것이 바람직할 수 있다. 광파괴는 빔 정렬 및 빔 타깃화시 합병증들을 야기할 수 있다. 예컨대, 광파괴 도중에 레이저 펄스들과 상호작용할 때 조직 재질 내의 비선형 광학 효과들 중 하나는 레이저 펄스들이 겪는 조직 재질의 굴절률이 더 이상 일정하지 않고 오히려 광의 강도에 따라 변한다는 점이다. 레이저 펄스들 내의 광의 강도가 펄스화된 레이저 빔의 전파 방향을 따라 및 이 방향을 가로질러, 펄스화된 레이저 빔 내에서 공간적으로 변하기 때문에, 조직 재질의 굴절률은 또한 공간적으로 변한다. 이러한 비선형 굴절률의 한 가지 결과는 조직 내부의 펄스화된 레이저 빔의 실제 초점을 변화시키고 초점의 위치를 이동시키는, 조직 재질 내의 자체-집속 또는 자체-초점이탈이다. 그러므로 타깃 조직 내의 각 타깃 조직 위치에 대한 펄스화된 레이저 빔의 정확한 정렬은 레이저 빔에 대한 조직 재질의 비선형 광학 효과들을 고려하는 것을 또한 필요로 할 수 있다. 레이저 펄스들의 에너지는, 경도와 같은 상이한 물리적인 특성들에 기인하여, 또는 특정 영역으로 이동하는 레이저 펄스 광의 흡수 또는 산란과 같은 광학적 고려사항들에 기인하여, 타깃의 상이한 영역들 내에 동일한 물리적인 효과를 전달하도록 조절될 수 있다. 이러한 경우들에 있어서, 상이한 에너지 값들의 펄스들 사이의 비선형 집속 효과들의 차이점들은 또한 수술 펄스들의 레이저 정렬 및 레이저 타깃화에 영향을 미칠 수 있다. 이러한 점에 관해서, 이미징 디바이스(1030)에 의해 타깃 조직으로부터 얻어진 직접 이미지들은, 타깃 조직 내의 비선형 광학 효과들의 결합된 효과들을 반영하는 수술 레이저 빔(1022)의 실제 위치를 모니터하고, 빔 위치 및 빔 초점의 제어를 위한 위치 기준들을 제공하기 위하여 사용될 수 있다.
본 명세서에서 기술된 기술들, 장치 및 시스템들은, 표면의 형태 및 수화의 제어를 제공하고, 광학 왜곡을 감소시키고, 또한 압평된 표면을 통해 내부 구조들에 대한 광파괴의 정밀한 국부화를 제공하기 위하여, 압평 플레이트와 조합하여 사용될 수 있다. 본 명세서에서 기술된 빔의 위치와 초점의 이미징-가이드된 제어는, 수술 타깃의 왜곡 또는 움직임을 초래할 수 있는 흡입 링의 사용을 포함하는, 눈을 고정하기 위한, 압평 플레이트들 이외의 수단들을 사용하는 수술 시스템들 및 절차들에 적용될 수 있다.
다음의 절들은 먼저, 시스템들의 레이저 제어 부분에 이미징 기능들의 변하는 집적도들에 기초하여 자동화된 이미징-가이드된 레이저 수술을 위한 기술들, 장치 및 시스템들의 예들을 기술한다. OCT 이미징 모듈과 같은 광학 또는 다른 양식의 이미징 모듈은 타깃 조직, 예컨대 눈 내부의 구조들의 이미지들을 획득하기 위하여 시험 광 또는 다른 유형의 빔의 방향을 정하도록 사용될 수 있다. 펨토초 또는 피코초 레이저 펄스들과 같은 레이저 펄스들의 수술 레이저 빔은 수술 도중에 수술 레이저 빔의 집속 및 위치설정을 제어하기 위하여 획득된 이미지들 내의 위치 정보에 의해 가이드될 수 있다. 수술 레이저 빔과 시험 광 빔 모두, 수술 레이저 빔이 획득된 이미지들을 기초로 제어되어 수술의 정밀도와 정확도를 보장할 수 있도록, 수술 도중에 순차적으로 또는 동시에 타깃 조직으로 방향이 정해질 수 있다.
이러한 이미징-가이드된 레이저 수술은 수술 도중에 수술 레이저 빔의 정확하고 정밀한 집속과 위치설정을 제공하기 위하여 사용될 수 있는데, 왜냐하면 빔 제어가 수술 펄스들의 전달 직전에 또는 거의 동시에 타깃 조직의 압평 또는 고정에 뒤이어 타깃 조직의 이미지들에 기초하기 때문이다. 명료하게, 수술 전에 측정된 눈과 같은 타깃 조직의 특정 파라미터들은, 타깃 조직의 준비(예, 압평 렌즈에 눈을 고정하는 것), 및 외과 수술들에 의한 타깃 조직의 교체와 같은 다양한 인자에 기인하여 수술 도중에 변할 수 있다. 그러므로 이러한 인자들 및/또는 수술에 앞서 타깃 조직의 측정된 파라미터들은 수술 도중에 타깃 조직의 물리적인 조건들을 더 이상 반영하지 않을 수 있다. 본 이미징-가이드된 레이저 수술은, 수술 전 및 동안에 수술 레이저 빔을 집속하고 위치설정하기 위한 이러한 변화들에 관한 기술적인 문제들을 경감시킬 수 있다.
본 이미징-가이드된 레이저 수술은 타깃 조직 내부의 정확한 외과 수술들을 위해 효과적으로 사용될 수 있다. 예컨대, 눈 내부에서 레이저 수술을 수행할 때, 타깃화된 조직의 광학 붕괴를 달성하기 위하여 레이저 광은 눈 내부에 집속되고, 이러한 광학 상호작용들은 눈의 내부 구조를 변화시킬 수 있다. 예컨대, 수정체는 이전 측정과 수술 사이뿐만 아니라 수술 도중에도, 원근 조절 중에 수정체의 위치, 형태, 두께 및 직경을 변화시킬 수 있다. 기계적인 수단들에 의해 눈을 수술 도구에 부착시키는 것은 잘 한정되지 못한 방식으로 눈의 형태를 변화시킬 수 있고, 더욱이 이러한 변화는 다양한 인자들, 예컨대 환자의 움직임에 기인하여 수술 도중에 변할 수 있다. 부착 수단들은 흡입 링을 통해 눈을 고정시키는 것과 편평하거나 굴곡진 렌즈를 통해 눈을 압평하는 것을 포함한다. 이들 변화들은 수 밀리미터 정도에 달한다. 각막 또는 가장자리의 전면 표면과 같은 눈의 표면을 기계적인 참조 및 고정하는 것은, 눈의 내부에서 정밀한 레이저 미세수술을 수행할 때, 잘 작동하지 않는다.
본 이미징-가이드된 레이저 수술에서 준비 후 또는 거의 동시 이미징은, 수술에 앞서 및 도중에 변화들이 발생하는 환경에서 눈의 형상들 내부와 수술 도구 사이의 3차원 위치 기준들을 구축하기 위하여 사용될 수 있다. 눈의 압평 및/또는 고정에 앞서, 또는 실제 수술 도중의 이미징에 의해 제공된 위치 기준 정보는 눈 내의 변화들의 효과들을 반영하고, 따라서 수술 레이저 빔의 집속 및 위치설정에 대한 정확한 안내를 제공한다. 본 이미징-가이드된 레이저 수술에 기초한 시스템은 구조에서 단순하게 그리고 비용 효율적으로 구성될 수 있다. 예컨대, 수술 레이저 빔을 가이드하는 것과 관련된 광 성분들의 일 부분은, 디바이스 구조, 및 이미징 및 수술 광 빔들의 광 정렬 및 교정을 단순화하기 위하여, 타깃 조직을 이미징하기 위한 시험 광 빔을 가이드하기 위한 광 성분들과 공유될 수 있다.
아래에서 기술된 본 이미징-가이드된 레이저 수술 시스템들은 이미징 기구의 일 예로서 OCT 이미징을 사용하고, 다른 비-OCT 이미징 디바이스들이 또한 수술 도중에 수술 레이저들을 제어하기 위한 이미지들을 획득하기 위해 사용될 수 있다. 아래의 예들에서 도시된 바와 같이, 이미징 및 수술 서브시스템들의 통합은 다양한 정도들로 구현될 수 있다. 하드웨어를 통합하지 않는 가장 단순한 형태에서, 이미징 및 레이저 수술 서브시스템들은 분리되고, 인터페이스들을 통해 서로 통신할 수 있다. 이러한 설계들은 두 가지 서브시스템들의 설계들에서 유연성을 제공할 수 있다. 환자 접촉부와 같은 일부 하드웨어 구성요소들에 의한 두 개의 서브시스템들 사이의 통합은 하드웨어 구성요소들에 대한 수술 영역의 더 양호한 정합, 보다 더 정확한 교정을 제공함으로써 기능성을 더 확장하고, 작업 흐름을 개선시킬 수 있다. 두 개의 서브시스템들 사이의 통합의 정도가 증가함에 따라, 이러한 시스템은 점점 더 비용 효율적이고 간결하게 만들어질 것이고, 시스템 교정은 더 단순화될 것이고, 시간에 걸쳐 더 안정될 것이다. 도 8 내지 도 16에서 이미징-가이드된 레이저 시스템들의 예들은 통합의 다양한 정도들로 통합된다.
본 이미징-가이드된 레이저 수술 시스템의 일 구현은 예컨대, 수술 하에서 타깃 조직 내의 수술 변화들을 야기하는 수술 레이저 펄스들의 수술 레이저 빔을 생성하는 수술 레이저; 타깃 조직을 제 위치에 고정하기 위하여 환자 접촉부를 타깃 조직과 접촉하여 결합시키는 환자 접촉부용 장착부; 및 수술 레이저와 환자 접촉부 사이에 위치하고, 수술 레이저 빔의 방향을 환자 접촉부를 통해 타깃 조직으 정하도록 구성되는 레이저 빔 전달 모듈;을 포함한다. 이러한 레이저 빔 전달 모듈은 미리 결정된 수술 패턴을 따라 타깃 조직 내의 수술 레이저 빔을 스캔하도록 동작 가능하다. 이러한 시스템은 또한, 미리 결정된 수술 패턴을 생성하기 위하여 수술 레이저의 동작을 제어하고 레이저 빔 전달 모듈을 제어하는 레이저 제어 모듈과, 환자 접촉부에 대해 위치되어 환자 접촉부에 대해, 그리고 환자 접촉에 고정된 타깃 조직에 대해 알려진 공간 관계를 갖는 OCT 모듈을 포함한다. 이러한 OCT 모듈은, 광학 시험 빔과 수술 레이저 빔이 동시에 타깃 조직 내에 존재하도록, 수술 레이저 빔의 방향이 외과 수술을 수행하기 위하여 타깃 조직으로 정해지는 동안, 타깃 조직의 OCT 이미지들을 획득하기 위하여 광학 시험 빔의 방향을 타깃 조직으로 정하고 타깃 조직으로부터 광학 시험 빔의 반환된 시험 광을 수신하도록 구성된다. OCT 모듈은, 획득된 OCT 이미지들의 정보를 레이저 제어 모듈에 보내기 위하여 레이저 제어 모듈과 통신한다.
덧붙여, 이러한 특별한 시스템 내의 레이저 제어 모듈은 수술 레이저 빔의 집속 및 스캐닝에 레이저 빔 전달 모듈을 동작시키기 위하여 획득된 OCT 이미지들의 정보에 응답하고, 획득된 OCT 이미지들 내의 위치설정 정보에 기초하여 타깃 조직 내에서 수술 레이저 빔의 집속 및 스캐닝을 조절한다.
일부 구현들에 있어서, 타깃 조직의 완전한 이미지를 취득하는 것은 타깃을 수술 도구에 정합시키기 위하여 필요하지 않을 수 있고, 타깃 조직의 일부, 예컨대 자연적인 또는 인공적인 경계표들과 같은 수술 영역으로부터 수 개의 점들을 획득하는 것으로 충분할 수 있다. 예컨대, 단단한 몸체는 3D 공간에서 6개의 자유도들을 갖고, 6개의 독립적인 점들은 단단한 몸체를 한정하는데 충분할 것이다. 수술 영역의 정확한 크기가 알려지지 않았을 때, 위치 기준을 제공하기 위하여 부가적인 점들이 요구된다. 이 점에 관해 수 개의 점들이, 인간 눈의 수정체의 두께 및 직경, 그리고 보통은 상이한 전면 및 후면 표면들의 위치 및 곡률을 결정하기 위하여 사용될 수 있다. 이들 데이터에 기초로, 주어진 파라미터들을 갖는 타원 몸체들의 두 개의 절반부로 이루어진 몸체는, 실제 목적들을 위해 수정체를 근사 및 시각화할 수 있다. 다른 구현에 있어서, 획득된 이미지로부터의 정보는, 제어기를 위한 입력으로서 사용되는 수정체 두께의 수술전의 측정들과 같은 다른 소스들로부터의 정보와 결합될 수 있다.
도 8은 분리된 레이저 수술 시스템(2100)과 이미징 시스템(2200)을 갖는 이미징-가이드된 레이저 수술 시스템의 한 예를 도시한다. 레이저 수술 시스템(2100)은 수술 레이저 펄스들의 수술 레이저 빔(2160)을 생성하는 수술 레이저를 갖는 레이저 엔진(2130)을 포함한다. 레이저 빔 전달 모듈(2140)은 레이저 엔진(2130)으로부터의 수술 레이저 빔(2160)의 방향을 환자 접촉부(2150)를 통해 타깃 조직(1001)으로 정하기 위하여 제공되고, 미리 결정된 수술 패턴을 따라 타깃 조직(1001) 내에서 수술 레이저 빔(2160)을 스캔하도록 동작 가능하다. 레이저 제어 모듈(2120)은 통신 채널(2121)을 통해 레이저 엔진(2130) 내에서 수술 레이저의 동작을 제어하기 위하여 제공되고, 미리 결정된 수술 패턴을 생성하기 위하여 통신 채널(2122)을 통해 레이저 빔 전달 모듈(2140)을 제어한다. 환자 접촉부의 장착부는 타깃 조직(1001)을 제 위치에 고정하기 위하여 환자 접촉부(2150)를 타깃 조직(1001)과 접촉하게 결합시키기 위하여 제공된다. 환자 접촉부(2150)는, 눈의 전면 표면에 같은 모양이 되게 결합하고, 눈을 제 위치에 고정하기 위하여 편평하거나 굴곡진 표면을 갖는 콘택트 렌즈 또는 압평 렌즈를 포함하도록 구현될 수 있다.
도 8의 이미징 시스템(2200)은 환자 접촉부(2150)와 환자 접촉부(2150)에 고정된 타깃 조직(1001)에 대해 알려진 공간 관계를 갖기 위하여 수술 시스템(2100)의 환자 접촉부(2150)에 대해 위치한 OCT 모듈이 될 수 있다. OCT 모듈(2200)은 타깃 조직(1001)과 상호작용하기 위한 자신의 환자 접촉부(2240)를 갖도록 구성될 수 있다. 이미징 시스템(2200)은 이미징 제어 모듈(2220)과 이미징 서브시스템(2230)을 포함한다. 서브시스템(2230)은, 이미징 빔(2250)을 생성하여 타깃(1001)을 이미징하기 위한 광원; 및 광 시험 빔 또는 이미징 빔(2250)의 방향을 타깃 조직(1001)으로 정하고 타깃 조직(1001)으로부터 광 이미징 빔(2250)의 반환된 시험 광(2260)을 수신하여 타깃 조직(1001)의 OCT 이미지를 획득하기 위한 이미징 빔 전달 모듈;을 포함한다. 광 이미징 빔(2250)과 수술 빔(2160) 모두 순차적이거나 동시의 이미징 및 외과 수술을 허용하기 위하여 방향이 동시에 타깃 조직(1001)으로 정해질 수 있다.
도 8에 도시된 바와 같이, 통신 인터페이스들(2110 및 2210)은, OCT 모듈(2200)이 획득된 OCT 이미지들의 정보를 레이저 제어 모듈(2120)에 보낼 수 있도록, 레이저 제어 모듈(2120)에 의한 레이저 제어와 이미징 시스템(2200)에 의한 이미징 사이의 통신을 용이하게 하기 위하여 레이저 수술 시스템(2100)과 이미징 시스템(2200) 모두에 제공된다. 본 시스템 내의 레이저 제어 모듈(2120)은, 수술 레이저 빔(2160)의 집속 및 스캐닝에 레이저 빔 전달 모듈(2140)을 동작시키기 위하여 획득된 OCT 이미지들의 정보에 응답하고, 획득된 OCT 이미들 내의 위치설정 정보에 기초하여 타깃 조직(1001) 내에서 수술 레이저 빔(2160)의 집속 및 스캐닝을 동적으로 조절한다. 레이저 수술 시스템(2100)과 이미징 시스템(2200) 사이의 통합은 주로 소프트웨어 레벨에서 통신 인터페이스들(2110 및 2210) 사이의 통신을 통해 이루어진다.
이러한 및 다른 예들에 있어서, 다양한 서브시스템들 또는 디바이스들은 역시 통합될 수 있다. 예컨대, 파면 분석기들(wavefront aberrometers)과 같은 특정 진단 기기들, 각막 지형 측정 디바이스들은 시스템 내에 제공될 수 있고, 이들 디바이스들로부터 수술 전의 정보는 수술중의 이미징을 보강하기 위하여 사용될 수 있다.
도 9는 부가적인 통합 특징들을 갖는 이미징-가이드된 레이저 수술 시스템의 예를 도시한다. 이미징 및 수술 시스템들은 도 8에서와 같이 두 개의 별도의 환자 접촉부를 갖지 않고 타깃 조직(1001; 예컨대 눈)을 고정시키는 공통의 환자 접촉부(3300)를 공유한다. 수술 빔(3210)과 이미징 빔(3220)은 환자 접촉부(3330)에서 결합되고, 공통의 환자 접촉부(3330)에 의해 타깃(1001)으로 방향이 정해진다. 덧붙여, 공통 제어 모듈(3100)은 이미징 서브시스템(2230)과 수술 부분(레이저 엔진(2130)과 빔 전달 시스템(3140))을 모두 제어하기 위하여 제공된다. 이미징 및 수술 부분들 사이에서 이러한 증가된 통합은 두 개의 서브시스템들의 정확한 교정과, 환자 및 수술 체적의 위치의 안정성을 허용한다. 공통 하우징(3400)은 수술 및 이미징 서브시스템들 모두를 감싸기 위하여 제공된다. 두 개의 시스템들이 공통 하우징 내에 통합되지 않을 때, 공통 환자 접촉부(3330)는 이미징 또는 수술 서브시스템 중 어느 하나의 부분이 될 수 있다.
도 10은, 레이저 수술 시스템과 이미징 시스템이 공통 빔 전달 모듈(4100)과 공통 환자 접촉부(4200) 모두를 공유하는 이미징-가이드된 레이저 수술 시스템의 예를 도시한다. 통합은 시스템 구조와 시스템 제어 수술을 더욱 단순화시킨다.
일 구현에 있어서, 위의 및 다른 예들에서 이미징 시스템은 광학 계산된 단층 사진 촬영(OCT) 시스템이 될 수 있고, 레이저 수술 시스템은 펨토초 또는 피코초 레이저에 기초한 안관 수술 시스템이다. OCT에 있어서, 초 발광성 다이오드와 같은 낮은 코히어런스, 광대역 광원으로부터의 광은 별도의 기준 및 신호 빔들로 분할된다. 이러한 신호 빔은 수술 타깃으로 보내지는 이미징 빔이고, 이미징 빔의 반환된 광은 간섭계를 형성하기 위하여 수집되어 기준 빔과 코히어런트하게 재결합된다. 광학 열의 광축 또는 광의 전파 방향과 수직으로 신호 빔을 스캐닝하는 것은 x-y 방향의 공간 해상도를 제공하는 반면, 깊이 해상도는 간섭계의 기준 암의 경로 길이와 신호 암 내의 반환된 신호 빔 사이의 차이들을 추출하는 것으로부터 유래된다. 상이한 OCT 구현들의 x-y 스캐너가 본질적으로 동일하지만, 경로 길이들을 비교하고 Z-스캔 정보를 얻는 것은 상이한 방식들로 발생할 수 있다. 시간 영역 OCT로서 알려진 일 구현에 있어서, 예컨대 기준 암은 연속적으로 변하여 그 경로 길이를 변경시키는 반면 광검출기는 재결합된 빔의 강도의 간섭 변조를 검출한다. 상이한 구현에 있어서, 기준 암은 본질적으로 정적이고, 결합된 광의 스펙트럼은 간섭을 위해 분석된다. 결합된 빔의 스펙트럼의 푸리에 변환은 샘플의 내부로부터 산란에 대한 공간 정보를 제공한다. 이 방법은 스펙트럼 영역 또는 푸리에 OCT 방법으로 알려져 있다. 주파수 스위프된 OCT로서 알려진 상이한 구현(S.R. Chinn 등, Opt.Lett. 22, 1997)에 있어서, 좁은 대역의 광원은 스펙트럼 범위를 가로질러 주파수가 신속하게 스위핑되는 상태로 사용된다. 기준 및 신호 암들 사이의 간섭은 고속 검출기 및 동적 신호 분석기에 의해 검출된다. 이러한 목적을 위해 개발된 외부 공동 조정된 다이오드 레이저 또는 주파수 영역 모드 잠금(frequency domain mode-locked : DMML)의 주파수 동조된 레이저(R. Huber 등, Opt. Express, 13, 2005)(S.H. Yun, IEEE J. of Sel.Q.El. 3(4)p. 1087-1096, 1997)는 이들 예들에서 광원으로서 사용될 수 있다. OCT 시스템에서 광원으로 사용된 펨토초 레이저는 충분한 대역폭을 갖고, 증가된 신호대 잡음비들의 부가적인 장점들을 제공할 수 있다.
본 문서 내의 시스템들내의 OCT 이미징 디바이스는 다양한 이미징 기능들을 수행하기 위하여 사용될 수 있다. 예컨대 OCT는, 시스템의 광학 구성 또는 압평 플레이트의 존재로부터 초래되는 복합 켤레들을 억압하기 위하여, 타깃 조직 내부의 수술 레이저 빔의 집속 및 스캐닝을 제어하기 위한 3차원 위치설정 정보를 제공하기 위해 타깃 조직 내부의 선택된 위치들의 OCT 이미지들을 획득하기 위하여, 또는 수직으로부터 수평으로와 같은 타깃의 위치 변화들과 함께 발생하는 배향의 변화들을 제어하기 위한 위치설정 정합을 제공하기 위하여 타깃 조직의 표면 위 또는 압평 플레이트 위의 선택된 위치들의 OCT 이미지를 획득하기 위하여, 사용될 수 있다. OCT는 타깃의 하나의 위치 배향에서 표지들(marks) 또는 마커들(markers)의 배치에 기초하여 위치설정 정합 프로세스에 의해 교정될 수 있는데, 타깃이 다른 위치 배향에 있을 때, 타깃은 이 후 OCT 모듈에 의해 검출될 수 있다. 다른 구현들에 있어서, OCT 이미징 시스템은 눈의 내부 구조상의 정보를 광학적으로 모으기 위하여 편광되는 시험 광 빔을 생성하기 위하여 사용될 수 있다. 레이저 빔과 시험 광 빔은 상이한 편광들로 편광될 수 있다. OCT는, 상기 광 단층 사진 촬영을 위해 사용된 시험 광이 눈을 향해 이동할 때 하나의 편광으로 편광되고 눈으로부터 멀어지게 이동할 때 상이한 편광으로 편광되도록, 시험 광을 제어하는 편광 제어 메커니즘을 포함할 수 있다. 편광 제어 메커니즘은 예컨대 파장판 또는 패러데이 회전자를 포함할 수 있다.
도 10의 시스템은 스펙트럼 OCT 구성으로 도시되었고, 수술 및 이미징 시스템들 사이에서 빔 전달 모듈의 집속 광학계 부분을 공유하도록 구성될 수 있다. 광학계들에 대한 주된 요건들은 동작 파장, 이미지 품질, 해상도, 왜곡 등에 관련된다. 레이저 수술 시스템은 예컨대 약 2 내지 3 마이크로메터의 회절 제한된 초점 스폿 크기들을 달성하도록 설계된 높은 개구수의 시스템을 갖는 펨토초 레이저 시스템이 될 수 있다. 다양한 펨토초 안과 수술 레이저들은 대략 1.05 마이크로메터의 파장들과 같은 다양한 파장들에서 동작할 수 있다. 이미징 디바이스의 동작 파장은, 광학계가 두 파장들에 대해 채색적으로 보상되도록 레이저 파장에 근접하게 되도록 선택될 수 있다. 이러한 시스템은 타깃 조직의 이미지들을 획득하기 위한 추가적인 이미징 디바이스를 제공하기 위하여 제 3 광학 채널, 수술 현미경과 같은 시각 관측 채널을 포함할 수 있다. 이러한 제 3 광학 채널에 대한 광 경로가 수술 레이저 빔 및 OCT 이미징 디바이스의 광과 광학계들을 공유하면, 공유된 광학계들은 제 3 광학 채널을 위한 가시 스펙트럼 대역 및 수술 레이저 빔과 OCT 이미징 빔을 위한 스펙트럼 대역들에서 채색 보상을 통해 구성될 수 있다.
도 11은, 수술 레이저 빔을 스캐닝하기 위한 스캐너(5100)와, 수술 레이저 빔을 조정(시준 및 집속)하기 위한 빔 조정기(5200)가 OCT를 위한 이미징 빔을 제어하기 위한 OCT 이미징 모듈(5300)의 광학계로부터 분리된, 도 9의 설계의 특별한 예를 도시한다. 수술 및 이미징 시스템들은 대물 렌즈(5600) 모듈과 환자 접촉부(3300)를 공유한다. 대물 렌즈(5600)는 수술 레이저 빔과 이미징 빔 모두의 방향을 환자 접촉부(3300)로 정하여 집속시키고, 그 집속은 제어 모듈(3100)에 의해 제어된다. 두 개의 빔 스플리터들(5410 및 5420)은 수술 및 이미징 빔들의 방향을 정하기 위하여 제공된다. 빔 스플리터(5420)는 또한 반환된 이미징 빔의 방향을 다시 OCT 이미징 모듈(5300)로 정하기 위하여 사용된다. 두 개의 빔 스플리터들(5410 및 5420)은 또한 타깃(1001)의 직접 관찰 또는 이미지를 제공하기 위하여 타깃(1001)으로부터의 광의 방향을 시각 관측 광학계 유닛(5500)으로 정한다. 유닛(5500)은 의사가 타깃(1001)을 관찰하게 하기 위한 수정체 이미징 시스템, 또는 타깃(1001)의 이미지 또는 비디오를 획득하기 위한 카메라가 될 수 있다. 이색 및 편광 빔 스플리터들, 광학 격자, 홀로그래픽 빔 스플리터, 또는 이들의 조합들과 같은 다양한 빔 스플리터들이 사용될 수 있다.
일부 구현들에 있어서, 광학 구성요소들은 광학 빔 경로의 다중 표면들로부터 눈부심을 줄이기 위하여 수술 및 OCT 파장 모두에 대한 반사방지 코팅으로 적절하게 코팅될 수 있다. 그렇지 않을 경우 반사들은 OCT 이미징 유닛 내의 배경 광을 증가시킴으로써 시스템의 처리량을 줄이고, 신호대 잡음비를 줄인다. OCT 에서 눈부심을 줄이기 위한 한 가지 방식은, 타깃 조직에 근접하여 배치된 패러데이 분리기의 파장판을 통해 샘플로부터의 반환된 광의 편광을 회전시키고, OCT 검출기의 전면의 편광자를 샘플로부터 반환된 광을 우선적으로 검출하고 광학 구성요소들로부터 산란된 광을 억압하도록 배향시키는 것이다.
레이저 수술 시스템에 있어서, 수술 레이저와 OCT 시스템은 각각 타깃 조직 내에서 동일한 수술 영역을 담당하기 위한 빔 스캐너를 구비할 수 있다. 따라서, 수술 레이저 빔을 위한 빔 스캐닝과 이미징 빔을 위한 빔 스캐닝은 공통의 스캐닝 디바이스들을 공유하도록 통합될 수 있다.
도 12는 이러한 시스템의 일 예를 상세하게 도시한다. 이러한 구현에 있어서, x-y 스캐너(6410)와 z 스캐너(6420)는 두 서브시스템들에 의해 공유된다. 공통 제어기(6100)는 수술 및 이미징 동작들 모두를 위한 시스템 동작들을 제어하기 위하여 제공된다. OCT 서브시스템은, 빔 스플리터(6210)에 의해 이미징 빔과 기준 빔으로 분할되는 이미징 광을 생성하는 OCT 광원(6200)을 포함한다. 이미징 빔은 빔 스플리터(6310)에서 수술 빔과 결합되어 타깃(1001)으로 인도하는 공통의 광 경로를 따라 전파된다. 스캐너들(6410과 6420)과 빔 조절기 유닛(6430)은 빔 스플리터(6310)로부터 하류에 위치한다. 빔 스플리터(6440)는 이미징 및 수술 빔들의 방향을 대물 렌즈(5600)와 환자 접촉부(3300)로 정하기 위하여 사용된다.
OCT 서브시스템에 있어서, 기준 빔은 빔 스플리터(6210)를 통해 광학 지연 디바이스(6220)에 전달되고, 반환 미러(6230)에 의해 반사된다. 타깃(1001)으로부터 반환된 이미징 빔은 다시 빔 스플리터(6310)로 방향이 정해지고, 빔 스플리터(6310)는 반환된 이미징 빔의 적어도 일부를 빔 스플리터(6210)로 반사시키고, 빔 스플리터(6210)에서 반사된 기준 빔과 반환된 이미징 빔은 중첩되어 서로 간섭한다. 간섭계 검출기(6240)는 간섭을 검출하고 타깃(1001)의 OCT 이미지를 생성하기 위하여 사용된다. OCT 이미지 정보는, 수술 레이저 빔을 제어하기 위하여 수술 레이저 엔진(2130), 스캐너들(6410 및 6420) 및 대물 렌즈(5600)를 제어하기 위한 제어 시스템(6100)에 보내진다. 일 구현에 있어서, 광학 지연 디바이스(6220)는 타깃 조직(1001) 내의 다양한 깊이들을 검출하기 위하여 광 지연을 변경하도록 변할 수 있다.
OCT 시스템이 시간 영역의 시스템이라면, 두 개의 스캐너들이 상이한 방식들로 동작하기 때문에, 두 개의 서브시스템들은 두 개의 상이한 Z-스캐너들을 사용한다. 이러한 예에 있어서, 수술 시스템의 z 스캐너는, 수술 빔 경로 내의 빔의 경로 길이를 변경시키지 않고, 빔 조정 유닛 내에서 수술 빔의 발산을 변경시킴으로써 동작한다. 다른 한 편으로, 시간 영역의 OCT는, 가변 지연을 통해 또는 기준 빔 반환 미러의 위치를 이동시킴으로써, 빔 경로를 물리적으로 변경시켜 z-방향을 스캔한다. 교정 이후, 두 개의 z-스캐너들은 레이저 제어 모듈에 의해 동기화될 수 있다. 두 개의 움직임들 사이의 관계는, 제어 모듈이 처리할 수 있거나, 또는 대안적으로 교정 점들이 적절한 크기조정을 제공하기 위한 룩업 테이블을 한정할 수 있는 선형 또는 다항식 의존으로 단순화될 수 있다. 스펙트럼/푸리에 영역 및 주파수 스위프된 소스의 OCT 디바이스들은 z-스캐너를 전혀 갖지 않고, 기준 암의 길이는 정적이다. 비용들을 줄이는 것 이외에, 두 개 시스템들의 교차 교정은 상대적으로 간단할 것이다. 두 개의 시스템들의 집속 광학계들에서의 이미지 왜곡들로부터 또는 스캐너들의 차이들로부터 발생하는 차이점들을 보상할 필요성이 없는데, 왜냐하면 이들이 공유되기 때문이다.
수술 시스템들의 실제 구현들에 있어서, 집속 대물 렌즈(5600)는 베이스 위에 미끄러지도록 또는 움직이도록 장착되고, 대물 렌즈의 무게는 환자의 눈에 대한 힘을 제한하도록 균형을 이룬다. 환자 접촉부(3300)는 환자 접촉부의 장착부에 부착된 압평 렌즈를 포함할 수 있다. 환자 접촉부의 장착부는 집속 대물 렌즈를 고정하는 장착 유닛에 부착된다. 이러한 장착 유닛은, 환자의 피할 수 없는 움직임의 경우에 환자 접촉부와 시스템 사이의 안정적인 연결을 보장하도록 설계되고, 눈에 대한 환자 접촉부의 더 부드러운 결합을 허용한다. 집속 대물 렌즈를 위한 다양한 구현들이 사용될 수 있고, 하나의 예는 Hsueh에 의한 US 특허 제5,336,215호에 기술되었다. 조절 가능한 집속 대물 렌즈의 이러한 존재는 OCT 서브시스템을 위한 광학 간섭계의 부분으로서 광학 시험 광의 광학 경로 길이를 변경할 수 있다. 대물 렌즈(5600)와 환자 접촉부(3300)의 움직임은 OCT의 기준 빔과 이미징 신호 빔 사이의 경로 길이 차이들을 제어되지 않는 방식으로 변경시킬 수 있고, 이는 OCT에 의해 검출된 OCT 깊이 정보를 악화시킬 수 있다. 이는 시간 영역뿐만 아니라 스펙트럼/푸리에 영역 및 주파수 스위프된 OCT 시스템들에서도 발생할 것이다.
도 13과 도 14는 조절 가능한 집속 대물 렌즈와 관련된 기술적인 문제를 다루는 예시적인 이미징-가이드된 레이저 수술 시스템들을 도시한다.
도 13의 시스템은 미끄러질 수 있는 장착부 상에서 대물렌즈(7100)의 위치를 측정하기 위하여 이동 가능한 집속 대물렌즈(7100)에 결합된 위치 감지 디바이스(7110)를 제공하고, 측정된 위치를 OCT 시스템 내의 제어 모듈(7200)에 전달한다. 제어 시스템(6100)은 OCT 동작을 위한 이미징 신호 빔이 이동하는 광 경로 길이를 조절하기 위하여 대물렌즈(7100)의 위치를 제어 및 이동시킬 수 있고, 렌즈(7100)의 위치는 위치 인코더(7110)에 의해 측정 및 모니터링되고, OCT 제어기(7200)에 직접 공급된다. OCT 시스템 내의 제어 모듈(7200)은, OCT 데이터의 프로세싱에 있어 3D 이미지를 조립할 때, 환자 접촉부(3300)에 대해 집속 대물렌즈(7100)의 움직임에 의해 야기되는 OCT 내부의 간섭계의 기준 암 및 신호 암 사이의 차이들을 보상하기 위하여 알고리즘을 적용한다. OCT 제어 모듈(7200)에 의해 계산된 렌즈(7100)의 위치 변화의 적절한 양은, 렌즈(7100)를 제어하여 그 위치를 변화시키는 제어기(6100)로 보내진다.
도 14는, OCT 시스템의 간섭계의 기준 암 내의 반환 미러(6230) 또는 OCT 시스템의 광 경로 길이 지연 조립체 내의 적어도 일부가 이동 가능한 집속 대물렌즈(7100)에 단단하게 부착되어, 대물렌즈(7100)가 이동할 때 신호 암과 기준 암이 광 경로 길이에서 동일한 양의 변화를 겪는, 다른 예시적인 시스템을 도시한다. 그런 것에 따라, 슬라이드 상의 대물렌즈(7100)의 움직임은, 계산상의 보상에 대한 추가적인 필요성 없이, OCT 시스템 내의 경로 길이 차이들에 대해 자동적으로 보상된다.
이미징-가이드된 레이저 수술 시스템들, 레이저 수술 시스템 및 OCT 시스템에 대한 위의 예들은 상이한 광원들을 사용한다. 레이저 수술 시스템과 OCT 시스템 사이의 심지어 더 완벽한 통합에 있어서, 수술 레이저 빔을 위한 광원으로서 펨토초 수술 레이저는 또한 OCT 시스템을 위한 광원으로서 사용될 수도 있다.
도 15는 광 모듈(9100) 내의 펨토초 펄스 레이저가 외과 수술들을 위한 수술 레이저 빔과 OCT 이미징을 위한 시험 광 빔 모두를 생성하기 위하여 사용되는 예를 도시한다. 빔 스플리터(9300)는 레이저 빔을, 수술 레이저 빔과 OCT를 위한 신호 빔 모두로서의 제 1 빔과, OCT를 위한 기준 빔으로서의 제 2 빔으로 분할하기 위하여 제공된다. 제 1 빔은, 제 1 빔의 전파 방향에 수직으로 x 및 y 방향들로 빔을 스캔하는 x-y 스캐너(6410)와, 타깃 조직(1001)에서 제 1 빔의 집속을 조절하기 위하여 빔의 발산을 변화시키는 제 2 스캐너(z 스캐너; 6420)를 통해 방향이 정해진다. 이러한 제 1 빔은 타깃 조직(1001)에서 외과 수술들을 수행하고, 이러한 제 1 빔의 일부는 환자 접촉부로 다시 산란되고, OCT 시스템의 광 간섭계의 신호 암을 위한 신호 빔으로서 대물렌즈에 의해 수집된다. 이러한 반환된 광은 기준 암 내의 반환 미러(6230)에 의해 반사된 제 2 빔과 결합되고, 시간-영역의 OCT가 타깃 조직(1001)의 상이한 깊이를 이미징하는데 신호 및 기준 빔들 사이의 경로 차이를 제어하도록, 조절 가능한 광 지연 요소(6220)에 의해 지연된다. 제어 시스템(9200)은 시스템 동작들을 제어한다.
각막 상의 수술 실시는, 양호한 수술 성능을 달성하기 위하여 수백 펨토초의 펄스 지속기간이 충분할 수 있는 반면, 충분한 깊이 해상도의 OCT를 위해 예컨대 수십 펨토초 이하의 더 짧은 펄스들에 의해 생성된 더 넓은 스펙트럼 대역폭이 요구되는 것을 나타내었다. 이러한 배경에서, OCT 디바이스의 설계는 펨토초 수술 레이저로부터의 펄스들의 지속기간을 지시한다.
도 16은 수술 광과 이미징 광을 생성하기 위하여 단일 펄스화된 레이저(9100)를 사용하는 다른 이미징-가이드된 시스템을 도시한다. 비선형 스펙트럼 확장 매체(9400)는, 수술에서 정상적으로 사용되는 상대적으로 긴 펄스들, 수백 펨토초의 레이저 소스로부터 펄스들의 스펙트럼 대역폭을 확장하기 위한 백색 광 생성 또는 스펙트럼 확장과 같은 광학 비선형 프로세스를 사용하기 위하여, 펨토초 펄스화된 레이저의 출력 광 경로 내에 배치된다. 매체(9400)는 예컨대 광섬유 재질이 될 수 있다. 두 개 시스템들의 광 강도 요건들은 상이하고, 빔 강도들을 조절하기 위한 메커니즘은 두 개 시스템들 내에서 이러한 요건들을 충족시키기 위하여 구현될 수 있다. 예컨대, 빔 조향 미러들, 빔 셔터들, 또는 감쇄기들은, 환자 및 민감한 기기들을 과도한 광 강도로부터 보호하기 위하여, OCT 이미지를 취하거나 수술을 수행할 때, 빔의 존재 및 강도를 적절하게 제어하기 위하여 두 개의 시스템들의 광 경로들 내에 제공될 수 있다.
동작시, 도 8 내지 도 16의 위의 예들은 이미징-가이드된 레이저 수술을 수행하기 위하여 사용될 수 있다.
도 17은 이미징-가이드된 레이저 수술 시스템을 사용함으로써 레이저 수술을 수행하기 위한 방법의 일 예를 도시한다. 이 방법은 수술 하의 타깃 조직에 결합하고 타깃 조직을 제 위치에 고정하기 위하여 시스템 내의 환자 접촉부를 사용하고, 시스템 내의 레이저로부터 나오는 레이저 펄스들의 수술 레이저 빔과, 시스템 내의 OCT 모듈로부터 나오는 광 시험 빔을 동시에 환자 접촉부로 그리고 타깃 조직 내로 방향을 정한다. 수술 레이저 빔은 타깃 조직 내의 레이저 수술을 수행하도록 제어되고, OCT 모듈은 타깃 조직으로부터 반환되는 광 시험 빔의 광으로부터 타깃 조직 내부의 OCT 이미지들을 얻기 위하여 작동된다. 얻어진 OCT 이미지들 내의 위치 정보는 수술 전에 또는 도중에 타깃 조직 내의 수술 레이저 빔의 집속 및 스캐닝을 조절하기 위하여 수술 레이저 빔의 집속 및 스캐닝에 적용된다.
본 문서가 많은 상세 사항들을 포함하지만, 이들은 임의의 발명 또는 청구될 수 있는 것에 대한 제한들로서 해석되지 않아야하며, 오히려 특별한 실시예들에 특정된 특징들의 설명들로서 해석되어야 한다. 독립된 실시예들의 배경 하에 본 문서에서 기술된 특정 특징들은 단일 실시예 내에서 조합되어 구현될 수도 있다. 역으로, 단일 실시예의 배경 하에 기술된 다양한 특징들은 다수의 실시예들에서 독립적으로 또는 임의의 적합한 하위조합으로 구현될 수도 있다. 더욱이, 특징들이 특정 조합들 내에서 작용하는 것으로 위에서 기술되거나, 심지어 초기에 그와 같이 청구될 수도 있지만, 청구된 조합으로부터 하나 또는 그 초과의 특징들이 일부 경우에 조합으로부터 삭제될 수 있고, 청구된 조합은 하위조합 또는 하위조합의 변형에 관한 것일 수 있다.
눈을 이미징하기 위한 기술들 및 시스템들의 다수의 구현들과 이들의 응용들이 개시되었다. 기술된 구현들 및 다른 구현들의 변형들 및 개선들은 기술된 것에 기초하여 이루어질 수 있다.
Claims (45)
- 눈을 이미징하기 위한 방법으로서,
스펙트럼 영역 광간섭성 단층촬영(SD-OCT: Spectral Domain Optical Coherence Tomographic) 이미징 시스템에 대해 상기 눈의 위치를 설정하는 단계 - 상기 눈은 제 1 및 제 2 구조를 가짐 - ; 및
상기 제 1 눈-구조의 직접 이미지 또는 미러(mirror) 이미지 중 하나를 선택하고, 상기 제 1 눈-구조의 선택된 이미지에 대응하는 제 1 이미지-부분을 생성하는 단계;
상기 제 2 눈-구조의 직접 이미지 또는 미러 이미지 중 하나를 선택하고 상기 제 2 눈-구조의 선택된 이미지에 대응하는 제 2 이미지-부분을 생성하는 단계; 및
상기 제 1 및 제 2 구조들의 선택되지 않은 이미지들을 억압하는 단계
에 의해 상기 SD-OCT 이미징 시스템을 통해 상기 눈을 이미징(imaging)하는 단계
를 포함하고,
상기 선택되지 않은 이미지들을 억압하는 단계는,
생성된 선택되지 않은 이미지들의 디스플레이를 방지하는 단계;
상기 선택되지 않은 이미지들을 디스플레이하지 않고 상기 선택되지 않은 이미지들을 생성하는 단계; 또는
상기 선택되지 않은 이미지들의 생성을 방지하기 위하여 계산 단계를 수행하는 단계
중 적어도 하나를 포함하며,
상기 제 1 구조는 상기 눈의 수정체의 수정체 전낭(anterior capsule) 층이고;
상기 제 2 구조는 상기 눈의 수정체의 수정체 후낭(posterior capsule) 층이며,
상기 눈을 이미징하는 단계는,
상기 제 1 및 제 2 눈-구조들의 직접 및 미러 이미지들이 서로 구별될 수 있도록, 대응하는 이미지 깊이들로 상기 제 1 및 제 2 눈-구조들의 직접 및 미러 이미지들을 생성하기 위하여,
상기 제 1 이미지-부분, 상기 제 2 이미지-부분 및 각막 이미지의 깊이-시퀀스가,
상기 각막의 직접 이미지 ― 상기 수정체 전낭 층의 직접 이미지 ― 상기 수정체 후낭 층의 미러 이미지;
상기 각막의 직접 이미지 ― 상기 수정체 후낭 층의 미러 이미지 ― 상기 수정체 전낭 층의 직접 이미지; 또는
상기 수정체 후낭 층의 미러 이미지 ― 상기 각막의 직접 이미지 ― 상기 수정체 전낭 층의 직접 이미지 중 하나가 되도록,
상기 SD-OCT 이미징 시스템의 기준 깊이를 조절하는 단계
를 포함하는,
눈을 이미징하기 위한 방법. - 삭제
- 제 1 항에 있어서,
상기 제 1 및 제 2 이미지-부분들을 생성하는 것은,
상기 제 1 또는 제 2 이미지-부분들 중 적어도 하나가 미러 이미지일 때, 상기 제 1 및 제 2 구조들의 생물학적 대표 이미지를 생성하기 위하여 상기 제 1 또는 제 2 이미지-부분들 중 하나에 대한 변환을 수행하는 것을 포함하는,
눈을 이미징하기 위한 방법. - 삭제
- 제 1 항에 있어서,
상기 제 1 및 제 2 눈-구조들의 직접 및 미러 이미지들을 구별하는 단계는,
상기 이미지들의 공간 간격을 인식하는 단계;
패턴 인식 접근법을 적용하는 단계;
상기 이미지들의 신호 특성을 구별하는 단계;
상기 눈에 대한 이미-존재하는 지식을 이용하는 단계; 또는
진단에 기초한 상기 눈에 대한 지식을 이용하는 단계
중 적어도 하나를 포함하는,
눈을 이미징하기 위한 방법. - 제 1 항에 있어서,
상기 기준 깊이를 조절하는 단계, 및 상기 제 1 및 제 2 눈-구조들의 직접 및 미러 이미지들을 구별하는 단계는 반복적으로 수행되는,
눈을 이미징하기 위한 방법. - 삭제
- 삭제
- 제 1 항에 있어서,
상기 기준 깊이를 조절하는 단계는,
상기 SD-OCT 이미징 시스템의 기준 미러의 위치를 조절하는 단계; 또는
상기 SD-OCT 이미징 시스템의 지연 요소를 조정(tune)하는 단계
중 적어도 하나를 포함하는,
눈을 이미징하기 위한 방법. - 제 1 항에 있어서,
상기 눈을 이미징하는 단계는,
호모다인(homodyne) 이미징을 포함하는,
눈을 이미징하기 위한 방법. - 제 1 항에 있어서,
상기 눈을 이미징하는 단계는,
상기 기준 깊이 주위의 이미징 범위를, 상기 제 1 및 제 2의 구조들이 상기 이미징 범위 내에 위치되게 하도록 조절하는 단계를 포함하는,
눈을 이미징하기 위한 방법. - 제 11 항에 있어서,
상기 이미징 범위를 조절하는 단계는,
상기 SD-OCT 이미징 시스템의 중심 파장 또는 파장 해상도 중 적어도 하나를 조절하는 단계를 포함하는,
눈을 이미징하기 위한 방법. - 제 11 항에 있어서,
상기 조절하는 단계는,
상기 이미징 범위가 0-15 mm의 범위 이내가 되도록 조절하는 단계를 포함하는,
눈을 이미징하기 위한 방법. - 제 11 항에 있어서,
상기 조절하는 단계는,
상기 이미징 범위가 5-15 mm의 범위가 되도록 조절하는 단계를 포함하는,
눈을 이미징하기 위한 방법. - 제 11 항에 있어서,
상기 눈을 이미징하는 단계는,
상기 이미징 범위가 레일리(Rayleigh) 범위의 4배 미만이 되도록 초점 깊이 주위의 레일리 범위를 조절하는 단계를 포함하는,
눈을 이미징하기 위한 방법. - 제 1 항에 있어서,
상기 기준 깊이를 조절하는 단계는,
상기 기준 깊이가 2-15 mm의 범위 이내가 되도록 조절하는 단계를 포함하는,
눈을 이미징하기 위한 방법. - 제 1 항에 있어서,
상기 눈의 위치를 설정하는 단계는,
상기 눈을 SD-OCT 이미징 시스템의 접촉부(interface)에 결합(docking)시키는 단계;
상기 눈을 고정시키는 단계; 또는
상기 SD-OCT 이미징 시스템에 대해 상기 눈의 이동 범위를 최소화시키는 단계
중 적어도 하나를 포함하는,
눈을 이미징하기 위한 방법. - 제 1 항에 있어서,
상기 SD-OCT 이미징 시스템은,
분광계 기반 OCT(Spectrometer Based OCT : SB-OCT) 및 스위프 소스 OCT(Swept Source OCT : SS-OCT) 이미징 시스템 중 하나인,
눈을 이미징하기 위한 방법. - 제 1 항에 있어서,
상기 눈을 이미징하는 단계는,
단일 z-스캔을 생성하는 단계;
평면의 z-스캔을 생성하는 단계;
스캐닝 라인을 따라 z-스캔을 생성하는 단계; 또는
래스터(raster) 패턴으로 z-스캔을 생성하는 단계
중 적어도 하나를 포함하는,
눈을 이미징하기 위한 방법. - 눈을 이미징하기 위한 이미징 시스템으로서,
스펙트럼 영역 광간섭성 단층촬영(SD-OCT) 이미징 시스템을 포함하고,
상기 SD-OCT 이미징 시스템은,
상기 SD-OCT 이미징 시스템에 대해 상기 눈의 위치를 설정하고 ― 상기 눈은 제 1 및 제 2 구조를 가짐 ―;
상기 제 1 구조의 직접 이미지 및 미러 이미지로부터 선택된 제 1 이미지-부분을 생성하고;
상기 제 2 구조의 직접 이미지 및 미러 이미지로부터 선택된 제 2 이미지-부분을 생성하며; 그리고
상기 제 1 및 제 2 구조들의 선택되지 않은 이미지들을 억압하고,
상기 선택되지 않은 이미지들을 억압하는 것은,
생성된 선택되지 않은 이미지들의 디스플레이를 방지하는 것;
상기 선택되지 않은 이미지들을 디스플레이하지 않고 상기 선택되지 않은 이미지들을 생성하는 것; 또는
상기 선택되지 않은 이미지들의 생성을 방지하기 위하여 계산 단계를 수행하는 것
중 적어도 하나를 포함하며,
상기 SD-OCT 이미징 시스템은,
이미징 광을 출력하는 이미징 광원;
상기 이미징 광을 이미징 빔과 기준 빔으로 분할하고, 반환된 이미징 광-부분과 반환된 기준 광-부분을 간섭 광으로 통합하는 하나 또는 그 초과의 빔 스플리터들;
기준 거리에 비례하는 시간 차이를 두고 상기 기준 광-부분을 반환하는 기준 디바이스; 및
상기 간섭 광을 수신하고, 상기 눈의 SD-OCT 이미지를 생성하는 간섭 분석기
를 포함하고,
상기 기준 디바이스의 기준 거리는 상기 눈의 기준 깊이에 관련되며,
상기 간섭 분석기는 상기 기준 깊이에서 최대 이미징 감도를 갖고,
상기 제 1 구조는 상기 눈의 수정체의 수정체 전낭 층이며;
상기 제 2 구조는 상기 눈의 수정체의 수정체 후낭 층이고;
상기 기준 거리는, 상기 제 1 이미지-부분, 상기 제 2 이미지-부분 및 각막 이미지의 깊이-시퀀스가,
상기 수정체 후낭 층의 미러 이미지 ― 상기 수정체 전낭 층의 직접 이미지 ― 각막의 직접 이미지;
상기 수정체 전낭 층의 직접 이미지 ― 상기 수정체 후낭 층의 미러 이미지 ― 상기 각막의 직접 이미지; 또는
상기 수정체 전낭 층의 직접 이미지 ― 상기 각막의 직접 이미지 ― 상기 수정체 후낭 층의 미러 이미지 중 하나가 되도록,
상기 기준 깊이를 설정하도록 조절 가능한,
눈을 이미징하기 위한 이미징 시스템. - 삭제
- 제 20 항에 있어서,
상기 SD-OCT는,
분광계 기반 OCT(SB-OCT) 또는 스위프 소스 OCT(SS-OCT) 중 하나인,
눈을 이미징하기 위한 이미징 시스템. - 제 20 항에 있어서,
상기 기준 디바이스는,
상기 반환된 기준 광-부분이 상기 반환된 이미징 광-부분에 대해 앞선 것 또는 지연된 것 중 하나가 되도록 구성되는,
눈을 이미징하기 위한 이미징 시스템. - 삭제
- 삭제
- 눈을 이미징하기 위한 이미징 시스템으로서,
스펙트럼 영역 광간섭성 단층촬영(SD-OCT) 이미징 시스템을 포함하고,
상기 SD-OCT 이미징 시스템은,
상기 SD-OCT 이미징 시스템에 대해 상기 눈의 위치를 설정하고 ― 상기 눈은 제 1 및 제 2 구조를 가짐 ―;
상기 제 1 구조의 직접 이미지 및 미러 이미지로부터 선택된 제 1 이미지-부분을 생성하고;
상기 제 2 구조의 직접 이미지 및 미러 이미지로부터 선택된 제 2 이미지-부분을 생성하며; 그리고
상기 제 1 및 제 2 구조들의 선택되지 않은 이미지들을 억압하고,
상기 선택되지 않은 이미지들을 억압하는 것은,
생성된 선택되지 않은 이미지들의 디스플레이를 방지하는 것;
상기 선택되지 않은 이미지들을 디스플레이하지 않고 상기 선택되지 않은 이미지들을 생성하는 것; 또는
상기 선택되지 않은 이미지들의 생성을 방지하기 위하여 계산 단계를 수행하는 것
중 적어도 하나를 포함하며,
상기 SD-OCT 이미징 시스템은,
이미징 광을 출력하는 이미징 광원;
상기 이미징 광을 이미징 빔과 기준 빔으로 분할하고, 반환된 이미징 광-부분과 반환된 기준 광-부분을 간섭 광으로 통합하는 하나 또는 그 초과의 빔 스플리터들;
기준 거리에 비례하는 시간 차이를 두고 상기 기준 광-부분을 반환하는 기준 디바이스; 및
상기 간섭 광을 수신하고, 상기 눈의 SD-OCT 이미지를 생성하는 간섭 분석기
를 포함하고,
상기 기준 디바이스의 기준 거리는 상기 눈의 기준 깊이에 관련되며,
상기 간섭 분석기는 상기 기준 깊이에서 최대 이미징 감도를 갖고,
상기 제 1 구조는 상기 눈의 수정체의 수정체 전낭 층이며;
상기 제 2 구조는 상기 눈의 수정체의 수정체 후낭 층이고;
상기 기준 거리는, 상기 제 1 이미지-부분, 상기 제 2 이미지-부분 및 각막 이미지의 깊이-시퀀스가,
상기 수정체 후낭 층의 직접 이미지 ― 상기 수정체 전낭 층의 미러 이미지 ― 각막의 미러 이미지;
상기 수정체 전낭 층의 미러 이미지 ― 상기 수정체 후낭 층의 직접 이미지 ― 상기 각막의 미러 이미지; 또는
상기 수정체 전낭 층의 미러 이미지 ― 상기 각막의 미러 이미지 ― 상기 수정체 후낭 층의 직접 이미지 중 하나가 되도록,
상기 기준 깊이를 설정하도록 조절 가능한,
눈을 이미징하기 위한 이미징 시스템. - 제 20 항 또는 제 26 항에 있어서,
상기 기준 거리는,
상기 기준 깊이를 2-15 mm의 범위 이내로 제어하도록 조절 가능한,
눈을 이미징하기 위한 이미징 시스템. - 제 20 항 또는 제 26 항에 있어서,
상기 SD-OCT 이미징 시스템은,
상기 기준 깊이 주위의 이미징 범위를 0mm - 15mm와 5mm - 15mm 중 하나의 범위 내로 제어하는,
눈을 이미징하기 위한 이미징 시스템. - 삭제
- 물체를 이미징하는 방법으로서,
스펙트럼 영역 광간섭성 단층촬영(SD-OCT) 이미징 시스템에 대해 상기 물체의 위치를 설정하는 단계 ― 상기 물체는 미리결정된 기준보다 낮은 콘트라스트(contrast)를 갖는 매체 내에서 상기 미리결정된 기준보다 높은 콘트라스트를 갖는 구조를 포함함 ―;
상기 SD-OCT 이미징 시스템을 통해, 상기 구조의 직접 이미지와 미러 이미지 중 하나에 대응하는 상기 구조의 이미지를 생성하는 단계; 및
상기 구조의 선택되지 않은 이미지를 억압하는 단계
를 포함하고,
상기 선택되지 않은 이미지들을 억압하는 단계는,
생성된 선택되지 않은 이미지들의 디스플레이를 방지하는 단계;
상기 선택되지 않은 이미지들을 디스플레이하지 않고 상기 선택되지 않은 이미지들을 생성하는 단계; 또는
상기 선택되지 않은 이미지들의 생성을 방지하기 위하여 계산 단계를 수행하는 단계
중 적어도 하나를 포함하며,
상기 구조의 이미지를 생성하는 단계는,
상기 SD-OCT 이미징 시스템의 기준 깊이를 설정하는 단계; 및
이미징 범위가 상기 구조를 커버하도록 상기 기준 깊이 주위의 상기 이미징 범위를 조절하는 단계
를 포함하고,
상기 이미징 범위를 조절하는 단계는,
상기 SD-OCT 이미징 시스템의 초점 깊이를 조절하는 단계; 및
상기 이미징 범위가 레일리 범위의 4배 미만이 되도록 상기 SD-OCT 이미징 시스템의 초점 깊이 주위의 레일리 범위를 조절하는 단계
를 포함하는,
물체를 이미징하는 방법. - 제 30 항에 있어서,
상기 구조의 이미지를 생성하는 단계는,
상기 구조의 이미지가 제 1 구조의 제 1 이미지와 구별될 수 있도록 이미지 깊이로 상기 구조의 이미지를 생성하기 위하여, 상기 SD-OCT 이미징 시스템의 기준 깊이를 조절하는 단계를 포함하는,
물체를 이미징하는 방법. - 제 31 항에 있어서,
상기 기준 깊이를 조절하는 단계는,
상기 제 1 이미지로부터 상기 구조의 이미지의 공간 간격을 인식하는 단계;
패턴 인식 접근법을 적용하는 단계;
상기 제 1 이미지 및 상기 구조의 이미지의 신호 특성을 구별하는 단계;
상기 물체에 대한 이미 존재하는 지식을 이용하는 단계; 또는
진단에 기초한 상기 물체에 대한 지식을 이용하는 단계
중 적어도 하나에 의해, 상기 구조의 이미지를 상기 제 1 이미지와 구별하는 단계를 포함하는,
물체를 이미징하는 방법. - 제 30 항에 있어서,
상기 구조의 이미지를 생성하는 단계는,
호모다인 이미징을 포함하는,
물체를 이미징하는 방법. - 삭제
- 제 30 항에 있어서,
상기 이미징 범위를 조절하는 단계는,
상기 이미징 범위가 상기 구조를 커버하도록 상기 SD-OCT 이미징 시스템의 중심 파장과 파장 해상도 중 적어도 하나를 조절하는 단계를 포함하는,
물체를 이미징하는 방법. - 제 30 항에 있어서,
상기 이미징 범위를 조절하는 단계는,
상기 이미징 범위가 0mm - 15mm와 5mm - 15 mm 중 하나의 범위 이내가 되도록 조절하는 단계를 포함하는,
물체를 이미징하는 방법. - 제 30 항에 있어서,
상기 이미징 범위를 조절하는 단계는,
상기 기준 깊이가 2mm - 15mm의 범위 이내가 되도록 조절하는 단계를 포함하는,
물체를 이미징하는 방법. - 삭제
- 수술 레이저 시스템으로서,
수술 레이저 전달 시스템; 및
상기 수술 레이저 전달 시스템에 연결된 스펙트럼 영역 광간섭성 단층촬영(SD-OCT) 이미징 시스템을 포함하며,
상기 SD-OCT 이미징 시스템은,
미리결정된 기준보다 낮은 콘트라스트를 갖는 매체 내에서 상기 미리결정된 기준보다 높은 콘트라스트를 갖는 구조를 갖는 물체를 이미징하고;
상기 구조의 직접 이미지 및 미러 이미지 중 하나에 대응하는 상기 구조의 이미지를 생성하고; 그리고
상기 구조의 선택되지 않은 이미지를 억압하며,
상기 선택되지 않은 이미지들을 억압하는 것은,
생성된 선택되지 않은 이미지들의 디스플레이를 방지하는 것;
상기 선택되지 않은 이미지들을 디스플레이하지 않고 상기 선택되지 않은 이미지들을 생성하는 것; 또는
상기 선택되지 않은 이미지들의 생성을 방지하기 위하여 계산 단계를 수행하는 것
중 적어도 하나를 포함하며,
상기 구조의 이미지를 생성하는 것은,
상기 SD-OCT 이미징 시스템의 기준 깊이를 설정하는 것; 및
이미징 범위가 상기 구조를 커버하도록 상기 기준 깊이 주위의 상기 이미징 범위를 조절하는 것
을 포함하고,
상기 이미징 범위를 조절하는 것은,
상기 SD-OCT 이미징 시스템의 초점 깊이를 조절하는 것; 및
상기 이미징 범위가 레일리 범위의 4배 미만이 되도록 상기 SD-OCT 이미징 시스템의 초점 깊이 주위의 레일리 범위를 조절하는 것
을 포함하는,
수술 레이저 시스템. - 제 39 항에 있어서,
상기 SD-OCT 이미징 시스템은,
이미징 광을 출력하기 위한 이미징 광원;
상기 이미징 광을 이미징 빔과 기준 빔으로 분할하고; 그리고 반환된 이미징 빔-부분과 반환된 기준 빔-부분을 간섭 빔으로 통합하는 하나 또는 그 초과의 빔 스플리터;
기준 거리에 위치한, 상기 기준 빔-부분을 반환하는 기준 미러; 및
상기 간섭 빔을 수신하고, 및 상기 물체의 SD-OCT 이미지를 생성하는 간섭 분석기를 포함하는,
수술 레이저 시스템. - 제 40 항에 있어서,
상기 SD-OCT는,
분광계 기반 OCT(SB-OCT) 및 스위프 소스 OCT(SS-OCT) 중 하나인,
수술 레이저 시스템. - 제 40 항에 있어서,
상기 기준 미러의 기준 거리는 상기 물체에서의 기준 깊이에 관련되고,
상기 간섭 분석기는 상기 기준 깊이에서 최대 이미징 감도를 갖는,
수술 레이저 시스템. - 제 42 항에 있어서,
상기 기준 거리는,
상기 기준 깊이를 2 - 15mm의 범위 이내로 제어하도록 조절 가능한,
수술 레이저 시스템. - 제 42항에 있어서,
상기 SD-OCT 이미징 시스템은, 상기 기준 깊이 주위의 이미징 범위를 0mm - 15mm와 5mm - 15 mm 중 하나의 범위 내로 제어하도록 구성되는,
수술 레이저 시스템. - 삭제
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US12/708,450 | 2010-02-18 | ||
| US12/708,450 US8414564B2 (en) | 2010-02-18 | 2010-02-18 | Optical coherence tomographic system for ophthalmic surgery |
| PCT/US2011/025332 WO2011103357A2 (en) | 2010-02-18 | 2011-02-17 | Optical coherence tomographic system for ophthalmic surgery |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20120131186A KR20120131186A (ko) | 2012-12-04 |
| KR101791126B1 true KR101791126B1 (ko) | 2017-10-27 |
Family
ID=44370169
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127024412A KR101791126B1 (ko) | 2010-02-18 | 2011-02-17 | 안과 수술을 위한 광간섭성 단층촬영 시스템 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US8414564B2 (ko) |
| EP (1) | EP2536326B1 (ko) |
| JP (1) | JP5844748B2 (ko) |
| KR (1) | KR101791126B1 (ko) |
| CN (1) | CN102762143B (ko) |
| AU (1) | AU2011217975B2 (ko) |
| BR (1) | BR112012019873A2 (ko) |
| CA (1) | CA2788219C (ko) |
| ES (1) | ES2545894T3 (ko) |
| MX (1) | MX2012009575A (ko) |
| TW (1) | TWI583348B (ko) |
| WO (1) | WO2011103357A2 (ko) |
Families Citing this family (144)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8394084B2 (en) | 2005-01-10 | 2013-03-12 | Optimedica Corporation | Apparatus for patterned plasma-mediated laser trephination of the lens capsule and three dimensional phaco-segmentation |
| US20070027438A1 (en) * | 2005-07-26 | 2007-02-01 | Frieder Loesel | System and method for compensating a corneal dissection |
| US9232959B2 (en) | 2007-01-02 | 2016-01-12 | Aquabeam, Llc | Multi fluid tissue resection methods and devices |
| US8088124B2 (en) * | 2007-01-19 | 2012-01-03 | Technolas Perfect Vision Gmbh | System and method for precise beam positioning in ocular surgery |
| WO2008112292A1 (en) | 2007-03-13 | 2008-09-18 | Optimedica Corporation | Apparatus for creating ocular surgical and relaxing incisions |
| EP2194903B1 (en) | 2007-09-06 | 2017-10-25 | Alcon LenSx, Inc. | Precise targeting of surgical photodisruption |
| US20100249761A1 (en) * | 2007-12-17 | 2010-09-30 | Luis Antonio Ruiz | System and method for altering the optical properties of a material |
| EP2259742B1 (en) | 2008-03-06 | 2020-01-01 | AquaBeam LLC | Tissue ablation and cautery with optical energy carried in fluid stream |
| US10080684B2 (en) | 2008-03-13 | 2018-09-25 | Optimedica Corporation | System and method for laser corneal incisions for keratoplasty procedures |
| US9901503B2 (en) | 2008-03-13 | 2018-02-27 | Optimedica Corporation | Mobile patient bed |
| EP2395906A4 (en) | 2009-02-12 | 2017-06-28 | Novartis Ag | Method and apparatus for ocular surface imaging |
| US9241622B2 (en) * | 2009-02-12 | 2016-01-26 | Alcon Research, Ltd. | Method for ocular surface imaging |
| US9492322B2 (en) * | 2009-11-16 | 2016-11-15 | Alcon Lensx, Inc. | Imaging surgical target tissue by nonlinear scanning |
| US10085886B2 (en) | 2010-01-08 | 2018-10-02 | Optimedica Corporation | Method and system for modifying eye tissue and intraocular lenses |
| US9833358B2 (en) | 2010-01-08 | 2017-12-05 | Optimedica Corporation | Method and system for modifying eye tissue and intraocular lenses |
| WO2011091326A1 (en) | 2010-01-22 | 2011-07-28 | Optimedica Corporation | Apparatus for automated placement of scanned laser capsulorhexis incisions |
| WO2011097647A1 (en) | 2010-02-08 | 2011-08-11 | Optimedica Corporation | System for plasma-mediated modification of tissue |
| EP2536339B1 (en) | 2010-02-18 | 2024-05-15 | Maui Imaging, Inc. | Point source transmission and speed-of-sound correction using multi-aperture ultrasound imaging |
| US8979270B2 (en) * | 2010-05-04 | 2015-03-17 | Akkolens International B.V. | Corneal topographer |
| CA2796425A1 (en) * | 2010-05-06 | 2011-11-10 | Alcon Research, Ltd. | Devices and methods for assessing changes in corneal health |
| US9351879B2 (en) | 2010-09-02 | 2016-05-31 | Optimedica Corporation | Patient interface for ophthalmologic diagnostic and interventional procedures |
| KR101906838B1 (ko) | 2010-10-13 | 2018-10-11 | 마우이 이미징, 인코포레이티드 | 오목한 초음파 트랜스듀서들 및 3d 어레이들 |
| WO2012051490A1 (en) * | 2010-10-15 | 2012-04-19 | Lensar, Inc. | System and method of scan controlled illumination of structures within an eye |
| US10716706B2 (en) | 2011-04-07 | 2020-07-21 | Bausch & Lomb Incorporated | System and method for performing lens fragmentation |
| US8459794B2 (en) | 2011-05-02 | 2013-06-11 | Alcon Lensx, Inc. | Image-processor-controlled misalignment-reduction for ophthalmic systems |
| JP6023406B2 (ja) * | 2011-06-29 | 2016-11-09 | キヤノン株式会社 | 眼科装置、評価方法および当該方法を実行するプログラム |
| PT2736465T (pt) | 2011-07-28 | 2018-07-27 | Wavelight Gmbh | Dispositivo para auxiliar na preparação de uma operação no olho humano |
| US9044302B2 (en) | 2011-10-21 | 2015-06-02 | Optimedica Corp. | Patient interface for ophthalmologic diagnostic and interventional procedures |
| US9237967B2 (en) | 2011-10-21 | 2016-01-19 | Optimedica Corporation | Patient interface for ophthalmologic diagnostic and interventional procedures |
| US8863749B2 (en) | 2011-10-21 | 2014-10-21 | Optimedica Corporation | Patient interface for ophthalmologic diagnostic and interventional procedures |
| US20130103011A1 (en) * | 2011-10-21 | 2013-04-25 | Robert Edward Grant | System and Method for Lowering IOP by Creation of Microchannels in Trabecular Meshwork Using a Femtosecond Laser |
| US20130204236A1 (en) * | 2011-12-01 | 2013-08-08 | Nanophthalmos, Llc | Method and system for laser ocular surgery |
| US9504604B2 (en) | 2011-12-16 | 2016-11-29 | Auris Surgical Robotics, Inc. | Lithotripsy eye treatment |
| US9066784B2 (en) * | 2011-12-19 | 2015-06-30 | Alcon Lensx, Inc. | Intra-surgical optical coherence tomographic imaging of cataract procedures |
| TWI554244B (zh) * | 2011-12-19 | 2016-10-21 | 愛爾康眼科手術激光股份有限公司 | 用於雷射白內障程序之手術內光學同調斷層掃描成像的影像處理器 |
| US9023016B2 (en) | 2011-12-19 | 2015-05-05 | Alcon Lensx, Inc. | Image processor for intra-surgical optical coherence tomographic imaging of laser cataract procedures |
| US20130163003A1 (en) * | 2011-12-21 | 2013-06-27 | Ole Massow | Apparatus and method for optical swept-source coherence tomography |
| JP2015503404A (ja) | 2011-12-29 | 2015-02-02 | マウイ イマギング,インコーポレーテッド | 任意経路のmモード超音波イメージング |
| WO2013112700A1 (en) * | 2012-01-24 | 2013-08-01 | Duke University | Systems and methods for obtaining low-angle circumferential optical access to the eye |
| US9095281B2 (en) | 2012-02-10 | 2015-08-04 | Carl Zeiss Meditec, Inc. | Segmentation and enhanced visualization techniques for full-range fourier domain optical coherence tomography |
| CN104135937B (zh) | 2012-02-21 | 2017-03-29 | 毛伊图像公司 | 使用多孔超声确定材料刚度 |
| CN108606773B (zh) | 2012-02-29 | 2020-08-11 | 普罗赛普特生物机器人公司 | 自动化图像引导的组织切除和处理 |
| US8807752B2 (en) | 2012-03-08 | 2014-08-19 | Technolas Perfect Vision Gmbh | System and method with refractive corrections for controlled placement of a laser beam's focal point |
| US9629750B2 (en) | 2012-04-18 | 2017-04-25 | Technolas Perfect Vision Gmbh | Surgical laser unit with variable modes of operation |
| US10137035B1 (en) | 2012-04-20 | 2018-11-27 | Gustavo Tamayo | Round posterior capsulotomy for the opacification of a posterior capsule and lens |
| US9216066B2 (en) | 2012-04-20 | 2015-12-22 | Bausch & Lomb Incorporated | System and method for creating a customized anatomical model of an eye |
| US10383765B2 (en) | 2012-04-24 | 2019-08-20 | Auris Health, Inc. | Apparatus and method for a global coordinate system for use in robotic surgery |
| US20140142591A1 (en) * | 2012-04-24 | 2014-05-22 | Auris Surgical Robotics, Inc. | Method, apparatus and a system for robotic assisted surgery |
| WO2014011231A1 (en) | 2012-07-13 | 2014-01-16 | Bausch & Lomb Incorporated | Posterior capsulotomy using laser techniques |
| WO2014026185A1 (en) | 2012-08-10 | 2014-02-13 | Maui Imaging, Inc. | Calibration of multiple aperture ultrasound probes |
| KR101963749B1 (ko) * | 2012-08-22 | 2019-03-29 | 웨이브라이트 게엠베하 | 눈-수술용 레이저 장치 및 눈의 각막 조직을 스캔하는 방법 |
| US10143590B2 (en) | 2012-09-07 | 2018-12-04 | Optimedica Corporation | Methods and systems for performing a posterior capsulotomy and for laser eye surgery with a penetrated cornea |
| US10702209B2 (en) | 2012-10-24 | 2020-07-07 | Amo Development, Llc | Graphical user interface for laser eye surgery system |
| US10292863B2 (en) | 2012-11-02 | 2019-05-21 | Optimedica Corporation | Interface force feedback in a laser eye surgery system |
| US9987165B2 (en) | 2012-11-02 | 2018-06-05 | Optimedica Corporation | Liquid optical interface for laser eye surgery system |
| US10624786B2 (en) | 2012-11-02 | 2020-04-21 | Amo Development, Llc | Monitoring laser pulse energy in a laser eye surgery system |
| US9445946B2 (en) | 2012-11-02 | 2016-09-20 | Optimedica Corporation | Laser eye surgery system |
| US10314746B2 (en) | 2012-11-02 | 2019-06-11 | Optimedica Corporation | Laser eye surgery system calibration |
| AU2013337653B2 (en) | 2012-11-02 | 2017-11-30 | Optimedica Corporation | Optical surface identification for laser surgery |
| US10285860B2 (en) | 2012-11-02 | 2019-05-14 | Optimedica Corporation | Vacuum loss detection during laser eye surgery |
| US9332899B2 (en) * | 2012-11-06 | 2016-05-10 | Clarity Medical Systems, Inc. | Electronic eye marking/registration |
| US9592157B2 (en) | 2012-11-09 | 2017-03-14 | Bausch & Lomb Incorporated | System and method for femto-fragmentation of a crystalline lens |
| US10231867B2 (en) | 2013-01-18 | 2019-03-19 | Auris Health, Inc. | Method, apparatus and system for a water jet |
| US10080576B2 (en) | 2013-03-08 | 2018-09-25 | Auris Health, Inc. | Method, apparatus, and a system for facilitating bending of an instrument in a surgical or medical robotic environment |
| US10149720B2 (en) | 2013-03-08 | 2018-12-11 | Auris Health, Inc. | Method, apparatus, and a system for facilitating bending of an instrument in a surgical or medical robotic environment |
| US9867635B2 (en) | 2013-03-08 | 2018-01-16 | Auris Surgical Robotics, Inc. | Method, apparatus and system for a water jet |
| US9398979B2 (en) | 2013-03-11 | 2016-07-26 | Technolas Perfect Vision Gmbh | Dimensional compensator for use with a patient interface |
| EP3434235B1 (en) | 2013-03-13 | 2023-04-26 | AMO Development, LLC | Laser eye surgery system |
| WO2014163897A1 (en) | 2013-03-13 | 2014-10-09 | Optimedica Corporation | Free floating patient interface for laser surgery system |
| AU2014228568B2 (en) | 2013-03-14 | 2018-06-14 | Amo Development, Llc | Laser capsulovitreotomy |
| EP4112019A1 (en) | 2013-03-15 | 2023-01-04 | AMO Development, LLC | Microfemtotomy methods and systems |
| US20140276670A1 (en) * | 2013-03-15 | 2014-09-18 | Technolas Perfect Vision Gmbh | System and method for controlling the focal point locations of a laser beam |
| US9844318B2 (en) * | 2013-03-26 | 2017-12-19 | Novartis Ag | Devices, systems, and methods for calibrating an OCT imaging system in a laser surgical system |
| US9955865B2 (en) * | 2013-04-11 | 2018-05-01 | Novartis Ag | Method and system to detect ophthalmic tissue structure and pathologies |
| US10369053B2 (en) | 2013-04-17 | 2019-08-06 | Optimedica Corporation | Corneal topography measurements and fiducial mark incisions in laser surgical procedures |
| JP6549099B2 (ja) | 2013-04-17 | 2019-07-24 | オプティメディカ コーポレイション | 白内障手術における軸アラインメントのためのレーザ基準 |
| CN109009658B (zh) | 2013-04-18 | 2021-03-05 | 光学医疗公司 | 角膜手术程序的角膜形貌测量和对准 |
| TWI486625B (zh) * | 2013-05-16 | 2015-06-01 | Univ Nat Central | 數位全像顯微鏡 |
| CN104166228B (zh) * | 2013-05-16 | 2017-03-01 | 中央大学 | 数字全像显微镜 |
| WO2014201165A1 (en) | 2013-06-11 | 2014-12-18 | Auris Surgical Robotics, Inc. | System for robotic assisted cataract surgery |
| JP6434015B2 (ja) | 2013-07-25 | 2018-12-05 | オプティメディカ コーポレイション | 物体の屈折率のインサイチュー算定 |
| CN103584868B (zh) * | 2013-07-26 | 2016-03-02 | 童毓华 | 一种测量视网膜血管直径和血管壁厚度的方法 |
| US10426661B2 (en) | 2013-08-13 | 2019-10-01 | Auris Health, Inc. | Method and apparatus for laser assisted cataract surgery |
| US9883848B2 (en) | 2013-09-13 | 2018-02-06 | Maui Imaging, Inc. | Ultrasound imaging using apparent point-source transmit transducer |
| AU2014331896B2 (en) | 2013-10-08 | 2019-04-04 | Optimedica Corporation | Laser eye surgery system calibration |
| KR102332023B1 (ko) | 2013-10-24 | 2021-12-01 | 아우리스 헬스, 인크. | 로봇-보조식 내강 내부 수술용 시스템 및 이와 관련된 방법 |
| US9737373B2 (en) | 2013-10-24 | 2017-08-22 | Auris Surgical Robotics, Inc. | Instrument device manipulator and surgical drape |
| CN104706316A (zh) * | 2013-12-13 | 2015-06-17 | 明达医学科技股份有限公司 | 用于角膜测量的光学影像装置以及角膜测量的方法 |
| US9597009B2 (en) * | 2013-12-19 | 2017-03-21 | Novartis Ag | Marker-based tool tracking |
| EP3084717B1 (en) | 2013-12-19 | 2022-09-14 | Carl Zeiss Meditec, Inc. | Systems & methods for ocular anterior segment tracking, alignment, and dewarping using optical coherence tomography |
| RU2675688C2 (ru) * | 2013-12-23 | 2018-12-21 | Новартис Аг | Хирургическая система визуализации oct широкого поля обзора без использования микроскопа |
| US10070788B2 (en) * | 2014-01-31 | 2018-09-11 | Thorlabs Gmbh | Method for filtering reflexes in full-field setups for ophthalmologic imaging by separated illumination and detection apertures |
| EP3102167A1 (en) | 2014-02-04 | 2016-12-14 | Optimedica Corporation | Confocal detection to minimize capsulotomy overcut while dynamically running on the capsular surface |
| US10363173B2 (en) | 2014-02-04 | 2019-07-30 | Optimedica Corporation | Confocal detection to minimize capsulotomy overcut while dynamically running on the capsular surface |
| EP3102093B1 (en) | 2014-02-04 | 2018-06-20 | Optimedica Corporation | System for laser corneal incisions for keratoplasty procedures |
| US10105261B2 (en) | 2014-03-24 | 2018-10-23 | Optimedica Corporation | Automated calibration of laser system and tomography system with fluorescent imaging of scan pattern |
| JP6498692B2 (ja) | 2014-03-26 | 2019-04-10 | オプティメディカ コーポレイション | 共焦点レーザ眼球手術システム |
| US10441463B2 (en) | 2014-03-26 | 2019-10-15 | Optimedica Corporation | Confocal laser eye surgery system and improved confocal bypass assembly |
| US10441465B2 (en) | 2014-03-26 | 2019-10-15 | Optimedica Corporation | Registration of LOI fiducials with camera |
| KR101609365B1 (ko) * | 2014-05-27 | 2016-04-21 | 주식회사 고영테크놀러지 | 착탈식 oct 장치 |
| US10792464B2 (en) | 2014-07-01 | 2020-10-06 | Auris Health, Inc. | Tool and method for using surgical endoscope with spiral lumens |
| US9788910B2 (en) | 2014-07-01 | 2017-10-17 | Auris Surgical Robotics, Inc. | Instrument-mounted tension sensing mechanism for robotically-driven medical instruments |
| US9724239B2 (en) | 2014-07-14 | 2017-08-08 | Novartis Ag | Movable wide-angle ophthalmic surgical system |
| US20160022484A1 (en) * | 2014-07-25 | 2016-01-28 | Novartis Ag | Optical coherence tomography-augmented surgical instruments and systems and methods for correcting undesired movement of surgical instruments |
| JP2016041162A (ja) * | 2014-08-18 | 2016-03-31 | 株式会社トーメーコーポレーション | 前眼部解析装置 |
| US9721351B2 (en) | 2014-09-25 | 2017-08-01 | Optimedica Corporation | Methods and systems for corneal topography, blink detection and laser eye surgery |
| JP2016073409A (ja) * | 2014-10-03 | 2016-05-12 | ソニー株式会社 | 情報処理装置、情報処理方法及び手術顕微鏡装置 |
| EP3206646B1 (en) | 2014-10-17 | 2021-01-06 | AMO Development, LLC | Vacuum loss detection during laser eye surgery |
| WO2016061511A1 (en) | 2014-10-17 | 2016-04-21 | Optimedica Corporation | Laser eye surgery lens fragmentation |
| WO2016061547A1 (en) | 2014-10-17 | 2016-04-21 | Optimedica Corporation | Automatic patient positioning within a laser eye surgery system |
| USD900316S1 (en) | 2014-12-03 | 2020-10-27 | Amo Development, Llc | Docking assembly |
| AU2015362573A1 (en) | 2014-12-19 | 2017-07-13 | Optimedica Corporation | Liquid loss detection during laser eye surgery |
| CA2976025A1 (en) | 2015-02-06 | 2016-08-11 | Optimedica Corporation | Closed-loop laser eye surgery treatment |
| US10743758B2 (en) | 2015-03-25 | 2020-08-18 | Amo Development, Llc | Multiple depth optical coherence tomography system and method and laser eye surgery system incorporating the same |
| JP6607346B2 (ja) * | 2015-06-11 | 2019-11-20 | 株式会社トーメーコーポレーション | 前眼部光干渉断層撮影装置および前眼部光干渉断層撮影方法 |
| US10485705B2 (en) | 2015-07-01 | 2019-11-26 | Optimedica Corporation | Sub-nanosecond laser cataract surgery system |
| US11083625B2 (en) | 2015-07-01 | 2021-08-10 | Amo Development, Llc | Sub-nanosecond laser surgery system utilizing multiple pulsed laser beams |
| CA2991479A1 (en) | 2015-07-08 | 2017-01-12 | Optimedica Corporation | Image processing method and system for edge detection and laser eye surgery system incorporating the same |
| EP4023196A1 (en) | 2015-07-08 | 2022-07-06 | AMO Development, LLC | Laser surgical systems with laser scan location verification |
| KR102569960B1 (ko) | 2015-09-09 | 2023-08-24 | 아우리스 헬스, 인크. | 수술 로봇 시스템을 위한 기구 장치 조작기 |
| US10584954B2 (en) | 2015-09-16 | 2020-03-10 | The General Hospital Corporation | Apparatus and methods for mirror tunnel imaging device and for providing pseudobessel beams in a miniaturized optical system for imaging |
| US10667949B2 (en) | 2015-10-21 | 2020-06-02 | Amo Development, Llc | Laser beam calibration and beam quality measurement in laser surgery systems |
| CN113729764A (zh) | 2016-01-27 | 2021-12-03 | 毛伊图像公司 | 具有稀疏阵列探测器的超声成像 |
| US10219948B2 (en) | 2016-02-24 | 2019-03-05 | Perfect Ip, Llc | Ophthalmic laser treatment system and method |
| EP3451985B1 (en) * | 2016-05-02 | 2020-07-08 | Alcon Inc. | Femtosecond laser ophthalmic surgery docking cone image processing and presentation |
| US10555835B2 (en) | 2016-05-10 | 2020-02-11 | Optimedica Corporation | Laser eye surgery systems and methods of treating vitreous and ocular floaters |
| CA3026538C (en) | 2016-08-01 | 2021-01-05 | Novartis Ag | Integrated ophthalmic surgical system |
| US10786389B2 (en) | 2016-10-26 | 2020-09-29 | Amo Development, Llc | Ophthalmic laser delivery apparatus using MEMS micromirror arrays for scanning and focusing laser beam |
| CA3039471A1 (en) * | 2016-11-30 | 2018-06-07 | Novartis Ag | Visualization systems and methods for optimized optical coherence tomography |
| WO2018119009A1 (en) * | 2016-12-19 | 2018-06-28 | Visunex Medical Systems Co. Ltd. | An ultra-wide field of view optical coherence tomography imaging system |
| US11166630B2 (en) * | 2017-01-28 | 2021-11-09 | Cylite Pty Ltd | Optical coherence metrology and tomography with improved registration |
| WO2018144644A1 (en) | 2017-01-31 | 2018-08-09 | Optimedica Corporation | Methods and systems for laser ophthalmic surgery that provide for iris exposures below a predetermined exposure limit |
| WO2018145114A1 (en) | 2017-02-06 | 2018-08-09 | Optimedica Corporation | Additive manufacturing inside the human eye |
| WO2018203196A1 (en) * | 2017-05-02 | 2018-11-08 | Narayana Nethralaya Foundation | A method to quantify the quality of corneal donor tissue for transplantation using tomography imaging |
| US20190117459A1 (en) * | 2017-06-16 | 2019-04-25 | Michael S. Berlin | Methods and Systems for OCT Guided Glaucoma Surgery |
| US20180360655A1 (en) | 2017-06-16 | 2018-12-20 | Michael S. Berlin | Methods and systems for oct guided glaucoma surgery |
| JP7092131B2 (ja) * | 2017-07-12 | 2022-06-28 | ソニーグループ株式会社 | 画像処理装置、眼科用観察装置及び眼科用観察システム |
| JP7417524B2 (ja) * | 2017-11-30 | 2024-01-18 | アルコン インコーポレイティド | 光コヒーレンストモグラフィ撮像におけるセグメント化の改善 |
| WO2019214064A1 (zh) * | 2018-05-11 | 2019-11-14 | 苏州源泽光电科技有限公司 | 一种复眼检测装置 |
| CN111024659B (zh) * | 2019-11-28 | 2020-12-11 | 浙江大学 | 一种基于并行探测的多图像重建显微成像方法和装置 |
| US20230148858A1 (en) | 2020-03-10 | 2023-05-18 | Hansford Hendargo | Systems, Methods and Computer Program Products for Identifying Presence of a Conjugate in an Image |
| CN111407508B (zh) * | 2020-04-27 | 2024-03-15 | 季华实验室 | 一种眼科切割系统及眼科切割方法 |
| DE102020114791B4 (de) * | 2020-06-04 | 2024-06-27 | Schwind Eye-Tech-Solutions Gmbh | Verfahren zur Steuerung eines augenchirurgischen Lasers und Behandlungsvorrichtung |
| KR102491522B1 (ko) * | 2020-12-15 | 2023-01-26 | 이민희 | 비침습 3d 혈액 영상 및 성분 분석 장치 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007007297A (ja) * | 2005-07-01 | 2007-01-18 | Nidek Co Ltd | 被検物体の測定方法、及び該方法を用いた眼科装置 |
| US20090149742A1 (en) * | 2007-12-11 | 2009-06-11 | Tomey Corporation | Apparatus and method for imaging anterior eye part by optical coherence tomography |
Family Cites Families (202)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU728869A1 (ru) | 1976-07-12 | 1980-04-25 | Физический Институт Им. П.Н.Лебедева Ан Ссср | Лазерна офтальмологическа установка |
| JPS5926298B2 (ja) | 1977-02-18 | 1984-06-26 | 東京光学機械株式会社 | 水晶体断面撮影装置 |
| JPS5926300B2 (ja) | 1977-02-21 | 1984-06-26 | 東京光学機械株式会社 | 眼球水晶体断面撮影装置 |
| JPS5663330A (en) | 1979-10-25 | 1981-05-29 | Canon Kk | Inspecting machine for eye |
| DE3045139A1 (de) | 1980-11-29 | 1982-07-01 | Fa. Carl Zeiss, 7920 Heidenheim | Vorrichtung zur subjektiven und objektiven refraktionsbestimmung |
| FR2524298A1 (fr) | 1982-04-01 | 1983-10-07 | Essilor Int | Appareil de chirurgie ophtalmologique a laser |
| US4520816A (en) | 1983-01-12 | 1985-06-04 | Schachar Ronald A | Method and apparatus for delivering laser energy for ophthalmic use |
| US4638801A (en) | 1983-07-06 | 1987-01-27 | Lasers For Medicine | Laser ophthalmic surgical system |
| US4538608A (en) | 1984-03-23 | 1985-09-03 | Esperance Jr Francis A L | Method and apparatus for removing cataractous lens tissue by laser radiation |
| US4764005A (en) | 1985-09-17 | 1988-08-16 | Eye Research Institute Of Retina Foundation | Double scanning optical apparatus |
| US4901718A (en) | 1988-02-02 | 1990-02-20 | Intelligent Surgical Lasers | 3-Dimensional laser beam guidance system |
| US4881808A (en) | 1988-02-10 | 1989-11-21 | Intelligent Surgical Lasers | Imaging system for surgical lasers |
| US4907586A (en) | 1988-03-31 | 1990-03-13 | Intelligent Surgical Lasers | Method for reshaping the eye |
| US5098426A (en) | 1989-02-06 | 1992-03-24 | Phoenix Laser Systems, Inc. | Method and apparatus for precision laser surgery |
| US6099522A (en) | 1989-02-06 | 2000-08-08 | Visx Inc. | Automated laser workstation for high precision surgical and industrial interventions |
| IL89874A0 (en) | 1989-04-06 | 1989-12-15 | Nissim Nejat Danon | Apparatus for computerized laser surgery |
| US5054907A (en) | 1989-12-22 | 1991-10-08 | Phoenix Laser Systems, Inc. | Ophthalmic diagnostic apparatus and method |
| US5048946A (en) | 1990-05-15 | 1991-09-17 | Phoenix Laser Systems, Inc. | Spectral division of reflected light in complex optical diagnostic and therapeutic systems |
| US5779696A (en) | 1990-07-23 | 1998-07-14 | Sunrise Technologies International, Inc. | Method and apparatus for performing corneal reshaping to correct ocular refractive errors |
| CA2069895C (en) | 1990-08-22 | 2002-09-17 | William D. Fountain | System for scanning a surgical laser beam |
| US5139022A (en) | 1990-10-26 | 1992-08-18 | Philip Lempert | Method and apparatus for imaging and analysis of ocular tissue |
| US5162641A (en) | 1991-02-19 | 1992-11-10 | Phoenix Laser Systems, Inc. | System and method for detecting, correcting and measuring depth movement of target tissue in a laser surgical system |
| US5321501A (en) | 1991-04-29 | 1994-06-14 | Massachusetts Institute Of Technology | Method and apparatus for optical imaging with means for controlling the longitudinal range of the sample |
| US5255025A (en) | 1991-10-15 | 1993-10-19 | Volk Donald A | Measurement apparatus for indirect ophthalmoscopy |
| US5246435A (en) | 1992-02-25 | 1993-09-21 | Intelligent Surgical Lasers | Method for removing cataractous material |
| US5439462A (en) | 1992-02-25 | 1995-08-08 | Intelligent Surgical Lasers | Apparatus for removing cataractous material |
| US5549632A (en) | 1992-10-26 | 1996-08-27 | Novatec Laser Systems, Inc. | Method and apparatus for ophthalmic surgery |
| US5336215A (en) | 1993-01-22 | 1994-08-09 | Intelligent Surgical Lasers | Eye stabilizing mechanism for use in ophthalmic laser surgery |
| US5954711A (en) | 1993-12-28 | 1999-09-21 | Nidek Co., Ltd. | Laser treatment apparatus |
| US5656186A (en) | 1994-04-08 | 1997-08-12 | The Regents Of The University Of Michigan | Method for controlling configuration of laser induced breakdown and ablation |
| EP1231496B1 (en) | 1994-08-18 | 2004-12-29 | Carl Zeiss AG | Optical coherence tomography assisted surgical apparatus |
| US5493109A (en) | 1994-08-18 | 1996-02-20 | Carl Zeiss, Inc. | Optical coherence tomography assisted ophthalmologic surgical microscope |
| US20020169104A1 (en) * | 1997-05-01 | 2002-11-14 | Glenn Frank | Novel ectoparasite saliva proteins and apparatus to collect such proteins |
| US5738676A (en) | 1995-01-03 | 1998-04-14 | Hammer; Daniel X. | Laser surgical probe for use in intraocular surgery |
| US6454761B1 (en) | 1995-01-30 | 2002-09-24 | Philip D. Freedman | Laser surgery device and method |
| EP0836438B1 (en) | 1996-04-29 | 2004-09-22 | Northern Digital Inc. | Image guided surgery system |
| US5795295A (en) | 1996-06-25 | 1998-08-18 | Carl Zeiss, Inc. | OCT-assisted surgical microscope with multi-coordinate manipulator |
| US6167296A (en) | 1996-06-28 | 2000-12-26 | The Board Of Trustees Of The Leland Stanford Junior University | Method for volumetric image navigation |
| US6437867B2 (en) | 1996-12-04 | 2002-08-20 | The Research Foundation Of The City University Of New York | Performing selected optical measurements with optical coherence domain reflectometry |
| US5777719A (en) | 1996-12-23 | 1998-07-07 | University Of Rochester | Method and apparatus for improving vision and the resolution of retinal images |
| US5994690A (en) | 1997-03-17 | 1999-11-30 | Kulkarni; Manish D. | Image enhancement in optical coherence tomography using deconvolution |
| DE19718139A1 (de) | 1997-04-30 | 1998-11-05 | Aesculap Meditec Gmbh | Verfahren und Anordnung zur Phacoemulsifikation |
| JP3313309B2 (ja) | 1997-08-21 | 2002-08-12 | 株式会社トプコン | 眼科装置 |
| ES2183447T3 (es) | 1998-03-09 | 2003-03-16 | Medizinisches Laserzentrum Lub | Procedimiento y dispositivo destinados a examinar un segmento ocular. |
| DE19814057B4 (de) | 1998-03-30 | 2009-01-02 | Carl Zeiss Meditec Ag | Anordnung zur optischen Kohärenztomographie und Kohärenztopographie |
| EP1227750A4 (en) | 1998-04-27 | 2003-04-16 | Katana Technologies Gmbh | OPTICAL TRACKING DEVICE |
| US6137585A (en) | 1998-05-15 | 2000-10-24 | Laser Diagnostic Technologies, Inc. | Method and apparatus for recording three-dimensional distribution of light backscattering potential in transparent and semi-transparent structures |
| JP2003524758A (ja) | 1998-09-11 | 2003-08-19 | ジョセフ エイ. イザット, | 相反光学素子を用いた光コヒーレンス領域反射測定法および光コヒーレンス断層撮影法のための干渉計 |
| US6623476B2 (en) | 1998-10-15 | 2003-09-23 | Intralase Corp. | Device and method for reducing corneal induced aberrations during ophthalmic laser surgery |
| US6254595B1 (en) | 1998-10-15 | 2001-07-03 | Intralase Corporation | Corneal aplanation device |
| US6497701B2 (en) | 1999-04-30 | 2002-12-24 | Visx, Incorporated | Method and system for ablating surfaces with partially overlapping craters having consistent curvature |
| DE19930408A1 (de) | 1999-07-02 | 2001-01-04 | Zeiss Carl Fa | OCT-gestütztes Chirurgiesystem |
| US6817998B2 (en) | 1999-07-23 | 2004-11-16 | Lahaye Leon C. | Method and apparatus for monitoring laser surgery |
| US6314311B1 (en) | 1999-07-28 | 2001-11-06 | Picker International, Inc. | Movable mirror laser registration system |
| US6932807B1 (en) | 1999-09-01 | 2005-08-23 | Nidek Co., Ltd. | Laser treatment apparatus |
| US6687010B1 (en) | 1999-09-09 | 2004-02-03 | Olympus Corporation | Rapid depth scanning optical imaging device |
| DE50015215D1 (de) | 1999-09-10 | 2008-07-31 | Haag Ag Streit | Vorrichtung zur fotoablation der kornea mit einem laserstrahl |
| US6317616B1 (en) | 1999-09-15 | 2001-11-13 | Neil David Glossop | Method and system to facilitate image guided surgery |
| US6337925B1 (en) | 2000-05-08 | 2002-01-08 | Adobe Systems Incorporated | Method for determining a border in a complex scene with applications to image masking |
| DE10024079A1 (de) | 2000-05-17 | 2001-11-22 | Asclepion Meditec Ag | Verfahren und Vorrichtung zur Kontrolle der Energie und/oder Position eines gepulsten und gescannten Laserstrahles |
| EP2210575B1 (en) | 2000-06-01 | 2017-01-04 | The General Hospital Corporation | Selective photocoagulation |
| US6652459B2 (en) | 2000-06-28 | 2003-11-25 | Peter Alfred Payne | Ophthalmic uses of lasers |
| US7025459B2 (en) | 2000-07-14 | 2006-04-11 | Visual Pathways, Inc. | Ocular fundus auto imager |
| US6451009B1 (en) | 2000-09-12 | 2002-09-17 | The Regents Of The University Of California | OCDR guided laser ablation device |
| US20020082466A1 (en) | 2000-12-22 | 2002-06-27 | Jeongho Han | Laser surgical system with light source and video scope |
| DE10100857B4 (de) | 2001-01-11 | 2006-05-18 | Carl Zeiss Jena Gmbh | Laserspaltlampe mit Laserstrahlungsquelle |
| US6863667B2 (en) | 2001-01-29 | 2005-03-08 | Intralase Corp. | Ocular fixation and stabilization device for ophthalmic surgical applications |
| WO2002071042A2 (en) | 2001-01-29 | 2002-09-12 | Izatt Joseph A | Frequency-encoded parallel oct and associated systems and methods |
| US6899707B2 (en) | 2001-01-29 | 2005-05-31 | Intralase Corp. | Applanation lens and method for ophthalmic surgical applications |
| US20080071254A1 (en) | 2001-01-29 | 2008-03-20 | Advanced Medical Optics, Inc. | Ophthalmic interface apparatus and system and method of interfacing a surgical laser with an eye |
| US6579282B2 (en) | 2001-04-25 | 2003-06-17 | 20/10 Perfect Vision Optische Geraete Gmbh | Device and method for creating a corneal reference for an eyetracker |
| JP2002345758A (ja) | 2001-05-25 | 2002-12-03 | Canon Inc | 眼科撮影装置 |
| US7061622B2 (en) | 2001-08-03 | 2006-06-13 | Case Western Reserve University | Aspects of basic OCT engine technologies for high speed optical coherence tomography and light source and other improvements in optical coherence tomography |
| US6751033B2 (en) | 2001-10-12 | 2004-06-15 | Intralase Corp. | Closed-loop focal positioning system and method |
| US7027233B2 (en) | 2001-10-12 | 2006-04-11 | Intralase Corp. | Closed-loop focal positioning system and method |
| US6980299B1 (en) | 2001-10-16 | 2005-12-27 | General Hospital Corporation | Systems and methods for imaging a sample |
| US7006231B2 (en) | 2001-10-18 | 2006-02-28 | Scimed Life Systems, Inc. | Diffraction grating based interferometric systems and methods |
| CN100333684C (zh) | 2001-11-15 | 2007-08-29 | 株式会社拓普康 | 视力检查装置和视力检查图 |
| JP2005530128A (ja) | 2002-01-11 | 2005-10-06 | ザ・ジェネラル・ホスピタル・コーポレイション | 解像度と深さ領域を改善するための軸方向線焦点を用いたoct撮像用装置 |
| US7072045B2 (en) * | 2002-01-16 | 2006-07-04 | The Regents Of The University Of California | High resolution optical coherence tomography with an improved depth range using an axicon lens |
| US7355716B2 (en) | 2002-01-24 | 2008-04-08 | The General Hospital Corporation | Apparatus and method for ranging and noise reduction of low coherence interferometry LCI and optical coherence tomography OCT signals by parallel detection of spectral bands |
| CA2475389C (en) | 2002-02-11 | 2009-07-14 | Visx, Inc. | Closed loop system and method for ablating lenses with aberrations |
| US20030171809A1 (en) | 2002-03-05 | 2003-09-11 | Phillips Andrew F. | Axial-displacement accommodating intraocular lens |
| US7006232B2 (en) | 2002-04-05 | 2006-02-28 | Case Western Reserve University | Phase-referenced doppler optical coherence tomography |
| US7113818B2 (en) | 2002-04-08 | 2006-09-26 | Oti Ophthalmic Technologies Inc. | Apparatus for high resolution imaging of moving organs |
| US6741359B2 (en) | 2002-05-22 | 2004-05-25 | Carl Zeiss Meditec, Inc. | Optical coherence tomography optical scanner |
| US6730074B2 (en) | 2002-05-24 | 2004-05-04 | 20/10 Perfect Vision Optische Geraete Gmbh | Cornea contact system for laser surgery |
| AU2003245458A1 (en) | 2002-06-12 | 2003-12-31 | Advanced Research And Technology Institute, Inc. | Method and apparatus for improving both lateral and axial resolution in ophthalmoscopy |
| US7133137B2 (en) | 2002-06-27 | 2006-11-07 | Visx, Incorporated | Integrated scanning and ocular tomography system and method |
| CA2390072C (en) | 2002-06-28 | 2018-02-27 | Adrian Gh Podoleanu | Optical mapping apparatus with adjustable depth resolution and multiple functionality |
| US7072047B2 (en) | 2002-07-12 | 2006-07-04 | Case Western Reserve University | Method and system for quantitative image correction for optical coherence tomography |
| AU2003275002A1 (en) | 2002-10-17 | 2004-05-04 | Lumenis Inc. | System, method, and apparatus to provide laser beams of two or more wavelengths |
| JP4072897B2 (ja) | 2002-10-28 | 2008-04-09 | 創輝H・S株式会社 | ギアポンプ、およびその成形方法 |
| US6887232B2 (en) | 2002-11-13 | 2005-05-03 | 20/10 Perfect Vision Optische Geraete Gmbh | Closed loop control for intrastromal wavefront-guided ablation |
| DE10252837B4 (de) | 2002-11-13 | 2005-03-24 | Carl Zeiss | Untersuchungssystem und Untersuchungsverfahren |
| DE10300091A1 (de) | 2003-01-04 | 2004-07-29 | Lubatschowski, Holger, Dr. | Mikrotom |
| WO2004068218A2 (en) | 2003-01-24 | 2004-08-12 | University Of Washington | Optical beam scanning system for compact image display or image acquisition |
| DE10304221A1 (de) | 2003-01-30 | 2004-08-12 | Carl Zeiss | Vorrichtung zum Behandeln von Körpergewebe |
| US7846152B2 (en) | 2004-03-24 | 2010-12-07 | Amo Manufacturing Usa, Llc. | Calibrating laser beam position and shape using an image capture device |
| US7079254B2 (en) | 2003-03-26 | 2006-07-18 | Southwest Sciences Incorporated | Method and apparatus for imaging internal structures of transparent and translucent materials |
| US7742804B2 (en) | 2003-03-27 | 2010-06-22 | Ivan Faul | Means of tracking movement of bodies during medical treatment |
| WO2004098396A2 (en) | 2003-05-01 | 2004-11-18 | The Cleveland Clinic Foundation | Method and apparatus for measuring a retinal sublayer characteristic |
| US6927860B2 (en) | 2003-05-19 | 2005-08-09 | Oti Ophthalmic Technologies Inc. | Optical mapping apparatus with optimized OCT configuration |
| US7035025B2 (en) | 2003-05-28 | 2006-04-25 | Agilent Technologies, Inc. | Compact precision beam manipulators |
| US7311723B2 (en) | 2003-07-11 | 2007-12-25 | University Of Washington | Scanning laser device and methods of use |
| DE10360570B4 (de) | 2003-12-22 | 2006-01-12 | Carl Zeiss | Optisches Meßsystem und optisches Meßverfahren |
| US7252661B2 (en) | 2003-12-23 | 2007-08-07 | Alcon Refractivehorizons, Inc. | Method and system for patient optical fixation |
| US7145661B2 (en) | 2003-12-31 | 2006-12-05 | Carl Zeiss Meditec, Inc. | Efficient optical coherence tomography (OCT) system and method for rapid imaging in three dimensions |
| JP4391259B2 (ja) | 2004-02-03 | 2009-12-24 | 株式会社ニデック | 眼科装置 |
| WO2005077256A1 (en) | 2004-02-06 | 2005-08-25 | Optovue, Inc. | Optical apparatus and methods for performing eye examinations |
| EP1713377A1 (en) | 2004-02-10 | 2006-10-25 | Optovue, Inc. | High efficiency low coherence interferometry |
| GB2411066B (en) | 2004-02-14 | 2009-04-29 | Oti Ophthalmic Technologies | Compact high resolution imaging apparatus |
| US7402159B2 (en) | 2004-03-01 | 2008-07-22 | 20/10 Perfect Vision Optische Geraete Gmbh | System and method for positioning a patient for laser surgery |
| KR101000926B1 (ko) | 2004-03-11 | 2010-12-13 | 삼성전자주식회사 | 영상의 불연속성을 제거하기 위한 필터 및 필터링 방법 |
| JP4522724B2 (ja) | 2004-03-16 | 2010-08-11 | 株式会社トプコン | 光画像計測装置 |
| US7126693B2 (en) | 2004-03-29 | 2006-10-24 | Carl Zeiss Meditec, Inc. | Simple high efficiency optical coherence domain reflectometer design |
| JP4409332B2 (ja) | 2004-03-30 | 2010-02-03 | 株式会社トプコン | 光画像計測装置 |
| US7813644B2 (en) | 2004-05-10 | 2010-10-12 | Raytheon Company | Optical device with a steerable light path |
| US7184148B2 (en) | 2004-05-14 | 2007-02-27 | Medeikon Corporation | Low coherence interferometry utilizing phase |
| WO2005122872A2 (en) | 2004-06-10 | 2005-12-29 | Optimedica Corporation | Scanning ophthalmic fixation method and apparatus |
| US20050284774A1 (en) | 2004-06-24 | 2005-12-29 | Mordaunt David H | Ophthalmic lens assembly utilizing replaceable contact element |
| US7352444B1 (en) | 2004-06-24 | 2008-04-01 | Cypress Semiconductor Corp. | Method for arranging and rotating a semiconductor wafer within a photolithography tool prior to exposing the wafer |
| ES2405274T3 (es) | 2004-06-28 | 2013-05-30 | Topcon Medical Laser Systems, Inc. | Dispositivo para terapia oftálmica óptica |
| DE102004035269A1 (de) | 2004-07-21 | 2006-02-16 | Rowiak Gmbh | Laryngoskop mit OCT |
| JP4409384B2 (ja) | 2004-08-03 | 2010-02-03 | 株式会社トプコン | 光画像計測装置及び光画像計測方法 |
| US7433046B2 (en) | 2004-09-03 | 2008-10-07 | Carl Ziess Meditec, Inc. | Patterned spinning disk based optical phase shifter for spectral domain optical coherence tomography |
| US7365859B2 (en) | 2004-09-10 | 2008-04-29 | The General Hospital Corporation | System and method for optical coherence imaging |
| JP4633423B2 (ja) | 2004-09-15 | 2011-02-16 | 株式会社トプコン | 光画像計測装置 |
| US7347553B2 (en) | 2004-09-24 | 2008-03-25 | Canon Kabushiki Kaisha | Ophthalmic image sensing apparatus |
| JP4566685B2 (ja) | 2004-10-13 | 2010-10-20 | 株式会社トプコン | 光画像計測装置及び光画像計測方法 |
| JP4494160B2 (ja) | 2004-10-14 | 2010-06-30 | 株式会社トプコン | 光画像計測装置 |
| US7445336B2 (en) | 2004-10-21 | 2008-11-04 | Nidek Co., Ltd. | Fundus camera |
| US7252662B2 (en) | 2004-11-02 | 2007-08-07 | Lenticular Research Group Llc | Apparatus and processes for preventing or delaying one or more symptoms of presbyopia |
| US7388672B2 (en) | 2004-11-19 | 2008-06-17 | Carl Ziess Meditec, Inc. | High efficiency balanced detection interferometer |
| US8221399B2 (en) | 2004-12-01 | 2012-07-17 | Nidek Co., Ltd. | Ophthalmic apparatus |
| JP4537192B2 (ja) | 2004-12-21 | 2010-09-01 | キヤノン株式会社 | 眼科装置 |
| US8394084B2 (en) | 2005-01-10 | 2013-03-12 | Optimedica Corporation | Apparatus for patterned plasma-mediated laser trephination of the lens capsule and three dimensional phaco-segmentation |
| WO2006078839A2 (en) | 2005-01-20 | 2006-07-27 | Duke University | Methods, systems and computer program products for characterizing structures based on interferometric phase data |
| US7336366B2 (en) | 2005-01-20 | 2008-02-26 | Duke University | Methods and systems for reducing complex conjugate ambiguity in interferometric data |
| WO2006078802A1 (en) | 2005-01-21 | 2006-07-27 | Massachusetts Institute Of Technology | Methods and apparatus for optical coherence tomography scanning |
| US7330270B2 (en) | 2005-01-21 | 2008-02-12 | Carl Zeiss Meditec, Inc. | Method to suppress artifacts in frequency-domain optical coherence tomography |
| US7365856B2 (en) | 2005-01-21 | 2008-04-29 | Carl Zeiss Meditec, Inc. | Method of motion correction in optical coherence tomography imaging |
| US7342659B2 (en) | 2005-01-21 | 2008-03-11 | Carl Zeiss Meditec, Inc. | Cross-dispersed spectrometer in a spectral domain optical coherence tomography system |
| WO2006080239A1 (ja) | 2005-01-31 | 2006-08-03 | Olympus Corporation | 画像処理装置、顕微鏡システム、及び領域特定プログラム |
| US7390089B2 (en) | 2005-02-25 | 2008-06-24 | 20/10 Perfect Vision Optische Geraete Gmbh | Device and method for aligning an eye with a surgical laser |
| JP4837300B2 (ja) | 2005-03-24 | 2011-12-14 | 株式会社トプコン | 光画像計測装置 |
| EP2457546A3 (en) | 2005-04-26 | 2013-02-20 | Biolase, Inc. | Methods for treating eye conditions |
| US7207983B2 (en) | 2005-04-29 | 2007-04-24 | University Of Florida Research Foundation, Inc. | System and method for real-time feedback of ablation rate during laser refractive surgery |
| US7394546B2 (en) * | 2005-05-23 | 2008-07-01 | Southwest Sciences Incorporated | Method and apparatus for full phase interferometry |
| ES2669059T3 (es) | 2005-07-28 | 2018-05-23 | Bioptigen, Inc. | Sistema de formación de imagen de tomografía de coherencia óptica en el dominio de la frecuencia |
| GB2429522A (en) | 2005-08-26 | 2007-02-28 | Univ Kent Canterbury | Optical mapping apparatus |
| US10488606B2 (en) | 2005-09-19 | 2019-11-26 | Topcon Medical Laser Systems, Inc. | Optical switch and method for treatment of tissue |
| US20070129775A1 (en) | 2005-09-19 | 2007-06-07 | Mordaunt David H | System and method for generating treatment patterns |
| US7400410B2 (en) | 2005-10-05 | 2008-07-15 | Carl Zeiss Meditec, Inc. | Optical coherence tomography for eye-length measurement |
| US10524656B2 (en) | 2005-10-28 | 2020-01-07 | Topcon Medical Laser Systems Inc. | Photomedical treatment system and method with a virtual aiming device |
| US20070121069A1 (en) | 2005-11-16 | 2007-05-31 | Andersen Dan E | Multiple spot photomedical treatment using a laser indirect ophthalmoscope |
| WO2007061769A2 (en) | 2005-11-18 | 2007-05-31 | Duke University | Method and system of coregistrating optical coherence tomography (oct) with other clinical tests |
| JP4837982B2 (ja) | 2005-11-30 | 2011-12-14 | 株式会社ニデック | 眼科装置 |
| US9681985B2 (en) | 2005-12-01 | 2017-06-20 | Topcon Medical Laser Systems, Inc. | System and method for minimally traumatic ophthalmic photomedicine |
| US7599591B2 (en) | 2006-01-12 | 2009-10-06 | Optimedica Corporation | Optical delivery systems and methods of providing adjustable beam diameter, spot size and/or spot shape |
| CA2637508C (en) | 2006-01-19 | 2014-07-08 | Optovue, Inc. | A fourier-domain optical coherence tomography imager |
| US8262646B2 (en) | 2006-01-20 | 2012-09-11 | Lensar, Inc. | System and method for providing the shaped structural weakening of the human lens with a laser |
| US10842675B2 (en) | 2006-01-20 | 2020-11-24 | Lensar, Inc. | System and method for treating the structure of the human lens with a laser |
| US20070173791A1 (en) | 2006-01-20 | 2007-07-26 | Intralase Corp. | System for ophthalmic laser surgery |
| US9889043B2 (en) | 2006-01-20 | 2018-02-13 | Lensar, Inc. | System and apparatus for delivering a laser beam to the lens of an eye |
| US9545338B2 (en) | 2006-01-20 | 2017-01-17 | Lensar, Llc. | System and method for improving the accommodative amplitude and increasing the refractive power of the human lens with a laser |
| JP4890878B2 (ja) * | 2006-02-16 | 2012-03-07 | 株式会社トプコン | 眼底観察装置 |
| DE102006053580A1 (de) * | 2006-03-10 | 2007-09-13 | Carl Zeiss Meditec Ag | System zur Behandlung oder Diagnose am Auge |
| US20070219541A1 (en) | 2006-03-14 | 2007-09-20 | Intralase Corp. | System and method for ophthalmic laser surgery on a cornea |
| US7768652B2 (en) | 2006-03-16 | 2010-08-03 | Carl Zeiss Meditec, Inc. | Methods for mapping tissue with optical coherence tomography data |
| JP4864516B2 (ja) | 2006-04-07 | 2012-02-01 | 株式会社トプコン | 眼科装置 |
| US7828436B2 (en) | 2006-04-11 | 2010-11-09 | Neuroptix Corporation | Ocular imaging |
| US8771261B2 (en) | 2006-04-28 | 2014-07-08 | Topcon Medical Laser Systems, Inc. | Dynamic optical surgical system utilizing a fixed relationship between target tissue visualization and beam delivery |
| US7648242B2 (en) | 2006-05-01 | 2010-01-19 | Physical Sciences, Inc. | Hybrid spectral domain optical coherence tomography line scanning laser ophthalmoscope |
| WO2007143111A2 (en) | 2006-06-01 | 2007-12-13 | University Of Southern California | Method and apparatus to guide laser corneal surgery with optical measurement |
| US7488930B2 (en) | 2006-06-02 | 2009-02-10 | Medeikon Corporation | Multi-channel low coherence interferometer |
| US20070291277A1 (en) | 2006-06-20 | 2007-12-20 | Everett Matthew J | Spectral domain optical coherence tomography system |
| US7452077B2 (en) | 2006-08-29 | 2008-11-18 | Carl Zeiss Meditec, Inc. | Image adjustment derived from optical imaging measurement data |
| US8223143B2 (en) | 2006-10-27 | 2012-07-17 | Carl Zeiss Meditec, Inc. | User interface for efficiently displaying relevant OCT imaging data |
| US8088124B2 (en) * | 2007-01-19 | 2012-01-03 | Technolas Perfect Vision Gmbh | System and method for precise beam positioning in ocular surgery |
| CA2678506C (en) | 2007-02-23 | 2016-10-18 | Mimo Ag | Ophthalmologic apparatus for imaging an eye by optical coherence tomography |
| US8568393B2 (en) | 2007-03-13 | 2013-10-29 | Topcon Medical Laser Systems, Inc. | Computer guided patterned laser trabeculoplasty |
| WO2008112292A1 (en) | 2007-03-13 | 2008-09-18 | Optimedica Corporation | Apparatus for creating ocular surgical and relaxing incisions |
| JP4896794B2 (ja) | 2007-03-30 | 2012-03-14 | 株式会社トプコン | 光画像計測装置、それを制御するプログラム及び光画像計測方法 |
| US7575322B2 (en) | 2007-05-11 | 2009-08-18 | Amo Development Llc. | Auto-alignment and auto-focus system and method |
| EP2194903B1 (en) | 2007-09-06 | 2017-10-25 | Alcon LenSx, Inc. | Precise targeting of surgical photodisruption |
| US20100324543A1 (en) | 2007-09-18 | 2010-12-23 | Kurtz Ronald M | Method And Apparatus For Integrating Cataract Surgery With Glaucoma Or Astigmatism Surgery |
| US8409182B2 (en) | 2007-09-28 | 2013-04-02 | Eos Holdings, Llc | Laser-assisted thermal separation of tissue |
| US8230866B2 (en) | 2007-12-13 | 2012-07-31 | Carl Zeiss Meditec Ag | Systems and methods for treating glaucoma and systems and methods for imaging a portion of an eye |
| US7792249B2 (en) | 2007-12-23 | 2010-09-07 | Oraya Therapeutics, Inc. | Methods and devices for detecting, controlling, and predicting radiation delivery |
| US7878651B2 (en) | 2007-12-26 | 2011-02-01 | Carl Zeiss Meditec, Inc. | Refractive prescription using optical coherence tomography |
| US8783866B2 (en) | 2008-04-24 | 2014-07-22 | Bioptigen, Inc. | Optical coherence tomography (OCT) imaging systems having adaptable lens systems and related methods and computer program products |
| US7898712B2 (en) | 2008-06-27 | 2011-03-01 | Lockheed Martin Corporation | Risley integrated steering module |
| JP5255524B2 (ja) * | 2008-07-04 | 2013-08-07 | 株式会社ニデック | 光断層像撮影装置、光断層像処理装置。 |
| EP3884844A1 (en) * | 2008-07-18 | 2021-09-29 | Doheny Eye Institute | Optical coherence tomography-based ophthalmic testing methods, devices and systems |
| CA2731226A1 (en) * | 2008-07-21 | 2010-01-28 | Optovue, Inc. | Extended range imaging |
| US20100022996A1 (en) | 2008-07-25 | 2010-01-28 | Frey Rudolph W | Method and system for creating a bubble shield for laser lens procedures |
| US8480659B2 (en) | 2008-07-25 | 2013-07-09 | Lensar, Inc. | Method and system for removal and replacement of lens material from the lens of an eye |
| US8500723B2 (en) | 2008-07-25 | 2013-08-06 | Lensar, Inc. | Liquid filled index matching device for ophthalmic laser procedures |
| JP2013500086A (ja) | 2009-07-24 | 2013-01-07 | レンサー, インク. | Ladarを利用した手順を眼の水晶体に実施するシステムおよび方法 |
| US9492322B2 (en) | 2009-11-16 | 2016-11-15 | Alcon Lensx, Inc. | Imaging surgical target tissue by nonlinear scanning |
| US8845624B2 (en) | 2010-06-25 | 2014-09-30 | Alcon LexSx, Inc. | Adaptive patient interface |
-
2010
- 2010-02-18 US US12/708,450 patent/US8414564B2/en active Active
-
2011
- 2011-02-17 WO PCT/US2011/025332 patent/WO2011103357A2/en active Application Filing
- 2011-02-17 JP JP2012554039A patent/JP5844748B2/ja active Active
- 2011-02-17 AU AU2011217975A patent/AU2011217975B2/en not_active Ceased
- 2011-02-17 BR BR112012019873A patent/BR112012019873A2/pt not_active Application Discontinuation
- 2011-02-17 ES ES11745275.5T patent/ES2545894T3/es active Active
- 2011-02-17 CN CN201180009880.3A patent/CN102762143B/zh not_active Expired - Fee Related
- 2011-02-17 EP EP11745275.5A patent/EP2536326B1/en active Active
- 2011-02-17 KR KR1020127024412A patent/KR101791126B1/ko active IP Right Grant
- 2011-02-17 CA CA2788219A patent/CA2788219C/en not_active Expired - Fee Related
- 2011-02-17 MX MX2012009575A patent/MX2012009575A/es active IP Right Grant
- 2011-02-18 TW TW100105386A patent/TWI583348B/zh not_active IP Right Cessation
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007007297A (ja) * | 2005-07-01 | 2007-01-18 | Nidek Co Ltd | 被検物体の測定方法、及び該方法を用いた眼科装置 |
| US20090149742A1 (en) * | 2007-12-11 | 2009-06-11 | Tomey Corporation | Apparatus and method for imaging anterior eye part by optical coherence tomography |
Also Published As
| Publication number | Publication date |
|---|---|
| ES2545894T3 (es) | 2015-09-16 |
| JP5844748B2 (ja) | 2016-01-20 |
| BR112012019873A2 (pt) | 2018-06-05 |
| TWI583348B (zh) | 2017-05-21 |
| WO2011103357A2 (en) | 2011-08-25 |
| CN102762143B (zh) | 2016-02-10 |
| WO2011103357A3 (en) | 2011-11-10 |
| US20110202044A1 (en) | 2011-08-18 |
| TW201138715A (en) | 2011-11-16 |
| CA2788219A1 (en) | 2011-08-25 |
| JP2013520236A (ja) | 2013-06-06 |
| EP2536326A2 (en) | 2012-12-26 |
| US8414564B2 (en) | 2013-04-09 |
| AU2011217975B2 (en) | 2015-08-27 |
| EP2536326B1 (en) | 2015-07-08 |
| CA2788219C (en) | 2018-08-14 |
| EP2536326A4 (en) | 2013-08-21 |
| KR20120131186A (ko) | 2012-12-04 |
| AU2011217975A1 (en) | 2012-08-23 |
| MX2012009575A (es) | 2012-10-01 |
| CN102762143A (zh) | 2012-10-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101791126B1 (ko) | 안과 수술을 위한 광간섭성 단층촬영 시스템 | |
| JP6178388B2 (ja) | レーザ手術において眼へのインタフェースを提供する装置、システム及び技術 | |
| KR101735573B1 (ko) | 비선형 스캐닝에 의해 수술 타겟 조직을 이미지화하는 방법 | |
| JP5956554B2 (ja) | レーザ手術システム | |
| JP5623907B2 (ja) | レーザ手術におけるレーザ誘起保護シールド | |
| EP3273839B1 (en) | Multiple depth optical coherence tomography system and method and laser eye surgery system incorporating the same | |
| JP2010538704A (ja) | 重力場における有効なレーザ光破壊手術 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |