최대 메탄올 소모율은, 어떤 배양 기간 동안 및 상기 미생물의 어떤 상태하에서, 그리고 메탄올 농도가 메탄올 소모율을 결정하지 않는 상태하에서 미생물에 의한 메탄올의 소모율을 의미한다. 메탄올이 최대 메탄올 소모율과 같거나 빠른 속도로 첨가된다면, 메탄올 농도는 일정한 수준으로 유지되거나 점진적으로 증가하기 때문에, 상기 미생물의 최대 메탄올 소모율과 같거나 낮은 메탄올 첨가 속도는 배지중의 메탄올 농도가 실질적으로 영(zero)에 가까운 수준으로 유지될때의, 그리고 실제적으로 메탄올 농도가 0.1%(v/v) 이하로 유지되는 수준일때의 메탄올 첨가 속도를 의미한다.
상기한 바와 같은 메탄올 첨가의 속도를 얻기 위하여, 본 발명에서 주기적인 메탄올 첨가 단계를 포함하는 방법을 사용하는 것이 가장 전형적인 수단이다. 이러한 주기적인 첨가 방법은, 배양하는 동안 어떤 시기에 걸쳐 어떤 시간 간격으로 규정된 양의 메탄올을 첨가하는 것을 의미한다. 이러한 주기, 즉 시간 간격은 통상 1 내지 20분이며, 바람직하게는 5 내지 10분이다. 후술될 바와 같이, 본 발명의 발명자의 새로운 발견에 따르면, 메탄올 첨가 속도, 즉 어떤 단위 시간내에 첨가된 메탄올의 양(본 발명에서는 배양 배지의 리터당 시간당 메탄올의 밀리리터의 수로서 표현된다)이 낮을때에, 배양 배지중의 용존 산소 농도의 수준은 메탄올 첨가 주기에 따라 변동되고, 상기 경우에 배양 배지중의 메탄올 농도는 0.1%(v/v)이고 실질적으로는 0%에 가깝다.
반대로, 메탄올 첨가의 속도가 최대 메탄올 소모율과 같거나 큰 경우에, 메탄올 첨가 주기에 따른 용존 산소 농도의 수준의 변동이 실질적으로 일어나지 않는다. 이러한 경우에, 어떤 농도 수준의 메탄올이 배양 배지에 축적되는 것이 관찰된다. 따라서, 배양 배지중의 용존 산소의 농도 수준이 메탄올 첨가 주기에 따라 변동되도록 메탄올 첨가의 속도를 조정함으로써, 메탄올 첨가 속도를 미생물에 의한 최대 메탄올 소모율과 같거나 적게 조정할 수 있다.
그러나, 상술한 방법이, 메탄올 첨가의 속도를 미생물에 의해 최대 메탄올 소모율과 같거나 적은 속도로 조정하는 유일한 방법은 아니다. 예를 들면, 어떤 미생물이 일정한 조성을 갖는 배지의 일정한 상태하에서 배양될 수 있고, 유사한 배양 진행과정이 재생될 수 있다면, 본 실험에 의해 수득된 메탄올 첨가 속도 또는 시간 경과에 따른 이의 변화는 배양 배지 중의 용존 산소의 변동과 무관한 또다른 배양에 적용될 수 있다. 이러한 방법에서, 메탄올의 첨가는 주기적으로 또는 계속적으로 수행될 수 있다.
추가로, 상술된, 용존 산소의 농도 수준의 주기적 변동에서, 용존 산소의 농도 수준의 상승은 첨가된 메탄올의 소모로 인한 고갈의 결과이다. 만일 용존 산소의 농도 수준의 감소가 새로이 첨가된 메탄올의 소모에 의한 용존 산소의 소모의 결과라면, 메탄올 첨가의 속도는, 용존 산소의 농도 수준의 증가를 검출하고, 일정한 양의 메탄올을 첨가하고, 용존 산소의 농도 수준이 상기 첨가로 인한 메탄올의 소모에 의해 감소되고 메탄올 고갈에 의해 재증가된후, 첨가된 메탄올의 소모를 검출한 후 다음 주기의 메탄올을 첨가하는 것으로 이루어진 주기를 반복함으로써 미생물에 의한 최대 메탄올 소모 속도 이하의 속도로 조정될 수 있다.
본 발명에서, 유도가능한 프로모터란, 효모와 같은 미생물에서 메탄올 대사에 관련된 효소를 암호화하는 유전자 프로모터, 예를 들면, 알콜 옥시다제 유전자의 프로모터[참조문헌 : Japanese Unexamined Patent Publication No. 5-344895; Ellis, S. B. et al., Mol. Cell. Biol. 5, 1111-1112, 1985], 포름산 디하이드로게나제 유전자의 프로모터[참조문헌 : Hollenberg, C.P. et al., EPA No. 0299108, 1988], 및 메탄올 옥시다제 유전자의 프로모터[참조문헌 : Ledeboer, A.M. et al., Nucleic Acids Res. 13, 3063-3082, 1985]를 의미한다.
본 발명에서, 발현 단위란 발현 플라스미드와 같은 발현 벡터를 의미한다.
본 발명에서, 표적 유전자란, 예를 들면 유용한 단백질을 암호화하는 유전자를 의미한다. 본원에서, 유용한 단백질이란, 예를 들면 효소 또는 그밖의 생리학적으로 유용한 단백질을 의미한다. 다양한 효소의 예에는 Kex2 프로테아제, 프로호르몬 컨버타제 1/3 (PC1/3), 프로호르몬 컨버타제 2 (PC2), 푸린, 펩타이드 C 말단 α-아미다제, 스타필로코커스(Staphylococcal) 프로테아제 V8, 아크로박터 프로테아제 I(API), 태반 루신 아미노펩티다제, 세포질성 혈소판 인자 아세틸 하이드라제 및 이들의 유도체가 포함된다.
추가로, 그밖의 생리학적으로 활성인 물질의 예에는 성장 호르몬, 성장 호르몬 방출 호르몬, 항부신피질성 호르몬(ACTH) 방출 호르몬, 글루카곤, 글루카곤-형 펩타이드 I, 글루카곤-형 펩타이드 II, 인터페론 α, 인터페론 β, 인터페론 γ, 에리트로포이에틴(EPO), 트롬보포이에틴(TPO), G-CSF, HGF, 조직 플라스미노겐 활성인자(tPA), 간 세포 인자, TGF계 및 이들의 유도체가 포함된다.
본 발명에서 전 배양기간 동안 메탄올을 계속적으로 또는 주기적으로 첨가할 필요는 없다. 본 발명의 바람직한 구체예에 따르면, 배지는 배양 시점에 1 내지 2%(v/v) 메탄올을 함유하며, 배양 시작후 12시간 이상 동안, 예를 들면 15 내지 20시간 동안 메탄올을 추가하지 않은 상태로 배양이 수행된다. 메탄올 농도가 약 0.5%(v/v) 이하, 예를 들면 0.2 내지 0.5%(v/v)로 감소되면, 계속적 또는 주기적인 메탄올의 첨가가 시작된다. 이 시점에, 상기 미생물은 상당히 광범위하게 증식되고 메탄올이 왕성하게 소모되기 때문에, 배지중의 메탄올 농도는 계속적으로 감소될 것이며, 결국에는 메탄올 첨가 속도가 적당하다면 실질적으로 0% 내지 0.1%로 낮아질 것이다.
이어서, 이러한 상태하에서 메탄올의 첨가가 계속된다. 상기 방법에서 메탄올의 첨가되는 시간 동안, 상기 프로모터는, 표적 유전자의 발현을 야기시키는 메탄올에 의해 유도된다. 이와 동시에, 첨가된 메탄올이 적어도 성장 물질의 일부로서 사용되어 상기 미생물이 증식된다. 즉, 본 발명에 따르면, 미생물의 증식과 함께, 메탄올에 의한 프로모터의 유도에 기인한 유전자의 발현, 및 특히 유용한 표적 단백질의 생산은, 배양기 동안의 적어도 어떤 시긴에 걸쳐 동시에 내지 병행하여 수행된다. 따라서, 본 발명의 방법에서, 배양기를, 메탄올에 의해 프로모터가 유도되어지는 기간 및 미생물 증식을 위한 기간으로 구분할 필요는 없다.
본 발명의 방법에서 사용되는 미생물은 바람직하게는 메틸 영양성 효모이고, 더 바람직하게는 피키아, 한세눌라 또는 캔디다 속에 속하는 미생물이다. 이러한 속에 속하는 효모의 예에는 피키아 파스토리스, 한세눌라 폴리모파 및 캔디다 보이디니이가 포함된다.
이제부터, 하기 내용은 본 발명을 더욱 상세히 설명해줄 것이다. 본 발명은, 메탄올에 의해 유도가능한 프로모터 및 숙주로서 메탄올 대사 경로를 가진 미생물을 사용하여 유전자 발현 시스템에서 표적 유전자 산물을 효율적으로 생산하는데 사용될 수 있다. 본 발명에서, 비록 캔디다 보이디니이가 메탄올 대사 경로를 가진 미생물의 구체적인 예로서 지목되고, 캔디다 보이디니이의 알콜 옥시다제 유전자의 프로모터가 프로모터의 구체적인 예로서 지목되고, 분비성 Kex2 유도체가 표적 유전자 산물의 구체적예로서 지목되었지만, 이들은 지목된 구체적인 예에 국한되지 않는다.
배양 조건의 연구는 캔디다 보이디니이 균주 TK62(pCU 660) #10을 사용하여 행해졌다. 균주 TK62(pCU660) #10은 분비성 Kex2 유도체를 고생산하는 균주이며, 이는 시험관 규모의 배양에서 분비성 Kex2 유도체 발현 벡터 pCU660을 함유하는 TK62 균주의 20 클론으로부터 Kex2 유도체의 생산 및 분비를 토대로하여 선별된 것이다. 하기 내용은, Kex2 유도체 발현 벡터 pCU 660 및 숙주의 균주 TK62의 생산에 관한 설명을 제공해준다.
플라스미드 pCU 660은, AOD 프로모터에 의해 분비성 Kex2 유도체를 발현할 수 있는 플라스미드이며, 분비성 Kex2 유도체 유전자를 함유하는 DNA 단편을 pNOTelI의 NOt I 부위에 삽입함으로써 제조된다[참조문헌 : 심사청구되지 않은 일본 특허 공보 제5-344895호]. 사카로마이스 세레비지애의, Kex2 프로테아제의 C 말단에 존재하는 막에 걸친 영역(814 아미노산 잔기)이 상실된 N-말단으로부터 660번째 아미노산 잔기의 폴리펩타이드(Kex2-660으로 지칭됨)가 분비성 Kex2 유도체로 사용된다.
NKEX2-660 유전자를 함유하는 DNA 단편[-132 내지 1980 뉴클레오티드; Kex2 유전자(Kex2 프로테아제의 구조 유전자)의 개시 메티오닌 코돈의 A을 1로 취할때; 문헌 참조: Mizuno, et al., Biochem. Biophys. Res. Commun. 156, pp. 246-254, 1988]은 NKEX2 및 KM088을 프라이머로 그리고 KEX2 유전자를 암호화하는 DNA를 주형으로 사용하여 PCR로 증식시킴으로써 제조된다.
프라이머 NKEX2는, KEX2 유전자의 개시 메티오닌 코돈 상류의 107 내지 132 뉴클레오티드에 상응하는 DNA 서열, 및 이의 5' 플랭킹 영역에 NotI 제한 효소 인식 부위를 첨가함으로서 수득된 서열을 함유하는 DNA 올리고머이다. KM088은, 해독 종결 코돈 TAA를 Kex2 프로테아제의 654 내지 660번째 아미노산에 상응하는 DNA에 첨가함으로써 수득되는 뉴클레오티드 서열에 상보적인 서열을 지닌 DNA 올리고머이다. 추가로, pCU660은, 선별 표지인자(marker)로서 URA 3 유전자(단 하나의 BamHI 제한 효소 부위가 상기 유전자에 위치하고 있다)를 갖는 염색체에 삽입되는 발현 벡터이다. URA 돌연변이에 의해 수득된 우라실을 요구하는 균주가 사용되면, 형질전환체는 우라실 요구의 상보성에 따라 선별될 수 있다.
균주 TK62는, URA3 돌연변이에 의해 수득된, 캔디다 보이디니이 균주 S2 AOU-1으로부터 유래된 우라실을 요구하는 균주이며, 알콜 옥시다제와 같은 메탄올 대사 경로를 위한 효소의 그룹을 가지므로, 메탄올을 탄소원으로서 사용하여 증식할 수 있다. 추가로, 균주 TK62에 의해 발현되는 알콜 옥시다제의 양은, 메탄올을 탄소원으로서 사용하는 배양에서 세포내 단백질의 약 40%에 이를 정도로 많으며, 상기 프로모터를 사용하는 이종성 유전자 발현 시스템은 앞서 기술되어졌다[참조문헌: 심사청구되지 않은 특허 공보 제5-344895호].
다음, 상기 균주 TK62(pCU66) #10을 사용하는 배양 조건의 연구가 행해졌다. 배양 배지 중의 메탄올 농도는, 메탄올 대사 경로를 가진 미생물을 증식하는데 그리고 메탄올에 의해 유도가능한 프로모터로부터 전사를 효율적으로 유도하는데 있어서의 매우 중요한 변수이다. 그러므로, 메탄올이 배양 배지에 첨가되어지는 상태와 같이 숙주의 증식에 영향을 미치는 상태를 연구하기 위하여, 균주 TK62(pCU 660) #10를, 항아리(jar) 발효기를 사용하여 배양하였다.
먼저, 메탄올 및 글리세롤을 탄소원으로서 사용하여 배양하였다. 배양 시점에, 세포 밀도는 배양 배지 혼탁도 OD600=0.2로 정하는 한편, 초기의 탄소원은 세포 독성을 고려하여 메탄올 농도를 1.5%(v/v)로 그리고 삼투압을 고려하여 글리세롤의 농도를 3%(v/v)로 정했다. 배양 배지의 메탄올 농도를 3시간 마다 측정하고, 메탄올을 배양 배지에 첨가한 횟수 양을 2 내지 3시간 전의 농도의 관점에서 결정하였다. 7.5분마다 한번씩 일정한 양 메탄올 및 글리세롤을, 단위시간당 일정한 양을 운반해 주는 연동 펌프를 작동시켜 주기적으로 첨가하였다.
첨가 속도를, 시간당 배양 배지 1리터당 첨가된 메탄올(ml/L·h) 또는 글리세롤(g/L·h)로 나타낸다. 배양을 시작한지 15시간 후에 배양 배지의 메탄올 농도가 0.42%(v/v)로 감소되기 때문에, 메탄올의 첨가가, 배양한지 18시간 후에, 0.75mL/L·h의 속도로 시작된다. 게다가, 배양 배지의 메탄올 농도는, 첨가물 시작하기 직전인 배양을 시작한지 18시간 후에, 0.26%(v/v)로 감소하였다.
배양을 시작한지 21시간 후에 배양 배지의 메탄올 농도가 0.1%(v/v) 이하로 감소되기 때문에, 메탄올 첨가 속도를 배양을 시작한지 23시간후에 처음으로 7.5ml/L·h로 증가시켰다. 이러한 첨가후 즉시, 교반 속도를 신속히 감소시키자, 효모의 산소 소모 속도의 급격한 감소, 즉 세포 활성의 감소가 관찰되었다. 이러한 감소후, 세포 밀도가 감소되고 효모가 용해될 것이 기대되었다. 메탄올 첨가 속도를 증가한지 1시간후(배양을 시작한지 24시간후)에 배양 배지의 메탄올 농도는 0.76%(v/v)이었고, 메탄올이 축적되는 것이 발견되었다.
상기 결과를 토대로 하여, 1) 메탄올을 배양 배지에 첨가하기 시작하기에 좋은 시기가 배양을 시작한지 18시간후인때(OD 600=대략 50)이며, 2) 메탄올 첨가 속도 0.75ml/L·h로 첨가한지 3시간내에 배양 배지의 메탄올 농도는 0.1%(v/v) 이하로 감소되기 때문에, 탄소원인 메탄올이 결핍될 가능성이 있으며, 3) 과도하게 높은 첨가 속도 7.5ml/L·h로 인한 배양 배지 중의 메탄올 농도의 축적 때문에 세포 독성이 존재할 가능성이 있다는 것을 알았다. 추가로, 메탄올 대사 경로를 가진 효모 균주 TK62(pCU 660)을 배양할때, 배양 배지의 메탄올 농도를 0.1%(v/v) 이하의 상태를 계속 유지한 후에, 메탄올을 갑자기 첨가되면 균주 TK62(pCU 660) #10가 사멸된다는 것을 알았다.
게다가, 메탄올 첨가 주기(급격한 증가, 높은 값의 유지, 급격한 감소로 이루어짐)에 따른 용존 산소값의 변동이, 배양을 시작한지 20 내지 23시간 후에 관찰되었다. 상기 기간은, 배양 배지의 메탄올 농도가 0.1% 이하로 감소되는 시기로부터 메탄올을 배양 배지에 빠르게 첨가함에 따라 메탄올이 축적되기 시작되는 시기(즉, 배양 배지의 메탄올 농도가 0.1%(v/v) 이하인 시기)까지의 기간과 일치하기 때문에, 용존 산소값의 주기적 변동과 배양 배지 중의 메탄올 농도간에 관계가 있다는 것이 제시되었다.
용존 산소량은 통상적으로 배양 통제를 위하여 모니터되는 변수이며, 용존 산소 전극을 사용하여 측정된다. 만일 메탄올 대사 경로를 가진 미생물의 배양시에 용존 산소량의 변화를 토대로 하여 메탄올의 요구량을 예측하는 것이 가능하다면, 안정하고 효율적인 배양 상태를 용이하게 정하는 것이 가능할 것이다. 그러므로, 메탄올 첨가 주기에 따른 용존 산소값의 변동과 배양 배지의 메탄올 농도간의 관계를 상세히 조사하기 위하여, 메탄올 첨가 속도를 2.25ml/L·h로 맞추어 놓고, 중간에, 배양 배지 중의 메탄올 농도가 배양중에 빠르게 감소될때에는 0.75m/L 속도로, 그리고 상술한 배양에서 배양 배지에 메탄올이 축적될때에는 7.5ml/L·h 속도로 첨가하면서 배양하였다.
메탄올을, 배양을 시작한지 18시간후에 처음으로 글리세롤을 첨가했다(0.15ml/L·h). 탄소원의 첨가 주기에 따른, 용존 산소값의 변동이 배양을 시작한지 23시간후부터 배양이 종료될때(배양을 시작한지 49시간후)까지 관찰되었다.
상기 기간 동안의 배양 배지 중의 메탄올 농도는 0.1%(v/v) 이하이었다. 즉, 메탄올 첨가 주기에 따른 용존 산소값의 변동이 관찰되어지는 기간 동안, 메탄올은 배양 배지에 축적되지 않으며, 상기 농도는 0.1%(v/v) 이하임이 확인될 수 있을 것이다. 추가로, 메탄올 농도가 0.1%(v/v) 이하인 기간(배양을 시작한후 23시간 내지 49시간 경과기간) 동안에, 세포의 수는 2배 이상 증가되는 것이 분명했다. 환언하면, 세포는, 배양 배지의 메탄올 농도가 0.1%(v/v) 이하이라 일지라도 증식될 수 있었다.
게다가, 배양 배지의 메탄올 농도가 0.1%(v/v) 이하이고 글리세롤의 농도가 0.1%(w/v)이하일때, 탄소원 용액의 첨가 주기에 따른 용존 산소값의 주기적 변동에서의 변화량이 증가했다. 상기 시점에 배양액 중의 최농 농도가 1.25%(w/v) 되도록 글리세롤을 첨가하면, 비록 증가된 변화량은 정상으로 복귀되더라도, 탄소원 용액의 첨가 주기에 따른 용존 산소값의 주기적 변동은 계속되었다.
즉, 용존 산소 값의 주기적 변동은 배양 배지의 메탄올 농도가 0.1%(v/v) 이하라는 것을 나타내며, 그러한 변화량의 증가는 배양 배지 중의 메탄올 농도가 0.1%(v/v) 이하라는 것을 그리고 글리세롤 농도가 0.1%(w/v) 이하라는 것을 나타낸다는 것이 분명하였다. 이러한 인디케이터를 사용하여, 메탄올 농도가 0.1%(v/v) 이하이고 글리세롤 농도가 0.1%(w/v) 이하인 상태를 모니터할 수 있으므로, 상기 탄소원을 보충하기에 적당한 첨가량을 결정할 수 있다.
본 발명의 발명자들은, 메탄올 대사 경로를 가진 메틸 영양성 효모의 배양시에, 상기 효모를 사멸시키지 않으면서 증식시킬 수 있는 메탄올의 첨가 속도를 메탄올의 주기적 첨가 및 그러한 첨가에 따른 용존 산소값의 변동에 의해 모니터할 수 있다는 것을 분명히하였다. 게다가, 주기적 메탄올 첨가와 동시에 용존 산소값의 주기적 변동이 관찰되어지는 기간 동안에, 상기 배양 상태는 메탄올 농도가 0.1%(v/v) 이하이고 배양 배지에 메탄올이 축적되지 않은 상태, 즉 첨가된 메탄올의 양이 상기 효모에 의해 소모된 메탄올의 양과 동일한 상태라는 것도 또한 분명히 보여졌다. 그러므로, 높은 세포 밀도 상태에서, 메탄올의 첨가에 따른 용존 산소 값의 주기적 변동을 인디케이터로서 사용하여 메탄올의 소모 속도를 측정하려는 시도가 행해졌다.
유사하게, 균주 TK62(pCU 660) #10을 65g DCW/L(OD 600=270)의 세포 밀도로 배양하는 동안, 메탄올을 1.5, 2.2, 4.7 및 6.4ml/L·h의 첨가 속도(효모 건식 중량 1g당 시간당 0.023 내지 0.098ml의 첨가(ml/g DCW·h)와 등가임)로 첨가하고, 용존 산소값의 주기적 변동 패턴 및 이시점의 배양 배지중의 메탄올 농도를 조사하였다. 결과로서, 메탄올 첨가 속도가 1.5 내지 4.7ml/L·h일때 용존 산소값이 메탄올 첨가에 따라 변동되며, 이 시점에서 배양 배지 중의 메탄올 농도는 항상 0.1%(v/v) 이하라는 것을 알았다.
게다가, 변동 패턴은 메탄올 첨가 속도의 증가로 인해 변하며, 메탄올 첨가에 따른 단위 시간당 용존 산소 값의 증가는 더욱 점진적이 된다는 것을 알았다. 메탄올 첨가 속도가 6.4ml/L·h가 될때, 메탄올 첨가 주기에 따른 용존 산소값의 주기적 변동이 더이상 관찰되지 않았다. 비록 메탄올 첨가 속도가 더이상 증가되지 않는 상기 시점에 배양 배지 중의 메탄올 농도는 0.1%(v/v) 이하이더라도, 배양 배지에 메탄올이 축적된다는 것을 알았다.
상기한 바와 같이, 본 발명의 발명자들은, 메탄올 첨가 속도가 변화되어지는 배양에서, 메탄올의 주기적 첨가에 따라 용존 산소값이 변동되어지는 경우에는 적어도, 배양 배지에 첨가된 메탄올이 즉시 소모되며 배양 배지에 축적되지 않는다는 것을 확인하였다. 환언하면, 첨가된 메탄올의 양이 효모에 의해 소모된 메탄올의 양과 동일하게 되는 상태에 도달하게 된다. 게다가, 첨가된 메탄올의 양에 따라 또는, 환언하면, 메탄올이 완전히 소모되어질때까지의 시간에 따라 용존 산소값의 주기적 변동 패턴이 변화하며, 각 시점에 효모에 의해 소모된 최대 메탄올 양(축적되기 직전에 첨가된 메탄올의 양)이 샘플을 취하지 않고도 모니터될 수 있다는 것이 명백하게 보여졌다.
세포 밀도가 65g DCW/L(OD 600=270)인 상태에서 최대 메탄올 소모율은 상기 발견들을 토대로할때 0.098ml/g DCW·h로 결정되어졌다.
균주 TK62(pCU660) #10의 세포 밀도가 OD600=270(배양 배지의 L당 건식 세포 중량 65g)일때 최대 메탄올 소모율은 0.098ml/g DCW·h이며, 메탄올 첨가 속도가 상기 값 이하인 경우에, 메탄올은 배양 배지에 축적되지 않는다. 그러나, 비록 균주 TK62(pCU 660) #10의 증식 및 Kex2-660의 분비적 생산에 적합한 메탄올 첨가 속도가 최대 메탄올 소모 속도의 이하라는 용이하게 예측할 수 있더라도, 가장 적합한 첨가 속도에 관하여지 공지되어 있지 않았다.
균주 TK62(pCU 660) #10의 증식 및 Kex2-660의 분비적 생산에 적합한 메탄올 첨가 속도를 조사하기 위하여, 2.25ml/L·h 또는 4.5ml/L·h의 메탄올 첨가 속도를 사용하여 배양하고, 이 경우에 세포 증식 속도 및 Kex2-660의 분비적 생산을 조사하였다. 결과로서, 메탄올 첨가 주기에 따른 용존 산소 값의 변동이 관찰되어지는 때의 배양 배지 중의 메탄올 농도가 0.1%(v/v) 이하인 기간 동안에 세포가 증가하고 Kex2-660이 발현되고 배양 배지에 분비되어진다는 것이 명백하게 보여졌다.
즉, 배양 배지의 메탄올 농도가 0.1%(v.v) 이하이고 용존 산소값이 주기적 메탄올 첨가에 따라 변동되어지는 때의 메탄올 첨가 속도가 세포 증식 및 표적 산물의 발현에 적합한 속도라는 것을 알았다. 게다가, 2.25ml/L·h 및 4.5ml/L·h의 메탄올 첨가 속도를 사용하는 배양을 비교한 결과, 배양을 시작한지 48시간 후의 세포수가 배양 시작시보다 각기 1,400배 및 1,800배 증가하고, 한편 생산되고 분비된 Kex2-660의 양은 배양 상등액의 리터당 각기 1260MU 및 2850MU(각기 대략 150mg 및 340mg과 등가임)(표 1)이었다. 용존 산소 값의 주기적 변동이 계속되어지는 것과 같은 메탄올 첨가 조건이 유지되어지는한, 첨가되는 메탄올의 양이 증가함에 따라 세포 증식이 증가되고 Kex2-660의 생산이 증가된다는 것이 명백하게 보여졌다.
게다가, 배양을 시작한지 18일 후에 메탄올이 처음으로 2.25ml/L·h 및 4.5ml/L·h의 속도로 첨가되어지는 동안의 균주 TK62(pCU 660) #10의 배양에서, 건식 효모 중량이 0.5g/L(OD 600=2) 이상일때 메탄올 소모 속도는 0.03 내지 0.16ml/g DCW·h (표 2)이라는 것이 명백하였다.
| 첨가 속도(ml/L·h) |
OD600 |
Kex2 활성 (KU/ml 상등액) |
| 2.25 |
284 |
1260 |
| 4.5 |
353 |
2850 |
* 글리세롤 첨가속도는 5g/L·h이다.
OD 600 Kex2 활성은 배양을 시작한지 48시간내에 측정한 것이다.
| |
DCW(g/L) |
MeOH 소모율 (ml/g DCW·h) |
| MeOH첨가속도(ml/L·h) |
2.25 |
4.5 |
2.25 |
4.5 |
| 배양시간 (h) |
| 6 |
0.2 |
0.5 |
4.24 |
1.77 |
| 12 |
2.4 |
3,3 |
0.10 |
0.05 |
| 18 |
12 |
13 |
0.11 |
0.09 |
| 24 |
28 |
31 |
0.09 |
0.16 |
| 30 |
43 |
48 |
0.05 |
0.09 |
| 36 |
44 |
59 |
0.05 |
0.08 |
| 42 |
60 |
71 |
0.04 |
0.06 |
| 48 |
68 |
85 |
0.03 |
0.05 |
DCW : 배양액 ℓ당 효모 세포의 건조 중량.
MeOH 소모율 : 배양 시간이 6시간인 경우 0 내지 6시간의 평균치, 기타 배양 시간에 대해서도 마찬가지로 적용됨
또한, 상술한 Kex2를 생성하는 48시간의 배양 시간은, 메틸 영양성 효모 성장기(약 40시간) 및 생성기 (60 내지 120시간)로 분열하여 표적 유전자 생성물을 수득하는데 필요한 100 내지 160시간의 단지 1/3 내지 1/2과 같이 짧으며(WO 95/21928에 나타남), 이는 산업 수준으로 물질을 생성하는 경우 본 발명의 유용성을 명백히 나타낸다.
또한, 메탄올을 주기적으로 첨가하여 나타나는 용존 산소값의 주기적 동요가 컴퓨터에 의해 평가되어 배양이 자동적으로 조절되는 실시에 대해서는 나타내지 않았다. 그러나, 단지(jar) 발효기를 사용한 배양에서, 용존 산소량, pH 및 온도는 배양을 조절하기 위한 기본적 변수로서, 이들 값은 각각 DO 센서, pH 센서 및 온도 센서로 시간내내 측정하여 컴퓨터로 이들 값을 평가하고 배양을 자동 조절한다.
이들 변수들을 조절하는 경우, 배양은 각각의 변수들의 값 및 단위 시간당 각각의 변수들의 변화량에 의해서 조절된다. 즉, 당 분야의 전문가라면, 메탄올의 주기적 첨가와 동시에 나타나는 용존 산소값의 주기적 동요와 관련한 발견 및 동물 양상이 본 발명의 발명자에 의해 해결되는 바와 같이 메탄올 첨가 속도에 따라 변화된다는 발견에 기초하여 첨가되는 메탄올의 적당량을 결정함으로써 첨가되는 메탄올의 양을 자동 조절할 수 있다.
실시예
하기 실시예는 메탄올 대사 경로를 갖는 미생물의 일례로서 캔디다 보이디니이를 사용하여 본 발명의 상세히 설명하지만, 본 발명이 이러한 예로서 한정되지는 않는다. 또한, 알콜 옥시다제의 프로모터가 메탄올에 의해 발현이 유도되는 프로모터의 예로서 사용되고 Kex2-660이 자세한 설명을 돕기 위한 유전자 생성물의 일례로서 사용되었으나, 본 발명이 이러한 예들로써 한정되지는 않는다.
실시예 1
NKEX2-660 유전자 및 발현 벡터 pCU660의 제조
분비성 Kex2 유도체 Kex-660(Kex2 엔도프로테아제의 N-말단 아미노산으로부터 660번 아미노산까지의 아미노산으로 이루어진 단백질)을 암호화하는 유전자(NKEX2-660 유전자) 및 NKEX2-660 발현 벡터 pUC660은 하기와 같이 제조한다.
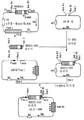
1) NKEX2-660 유전자의 제조(도 1 참조)
NKEX2-660 유전자를 함유하는 DNA 단편을 플라스미드 pYE-KEX2(5.0)b를 사용하여 PCR로 제조하고, 제한효소 EcoRI으로 절단한후, 주형으로 사용하기 위해 또한 NKEX2 (서열 1) 및 KM088(서열 2)를 사용하는 프라이머로 사용하기 위해 직쇄[참조: Mizuno et al., Biochem. Biophys. Res. Commun. 156, 246-254,1988]로 만든다.
NKEX2 및 KM088은 도 1a에 나타낸 KEX2 유전자 영역에 상응하고, NKEX2는 KEX2 유전자의 메티오닌 개시 코돈으로부터 이의 상부에 있는 107 내지 132개 뉴클레오타이드에 상응하는 서열을 포함하며, KM088은 해독 정지 코돈인 TAA부터 Kex2 프로테아제의 아미노산 654번부터 아미노산 660번까지의 아미노산에 상응하는 DNA까지를 첨가하여 생기는 뉴클레오타이드 서열에 상보적인 뉴클레오타이드 서열을 갖는다[참조: Mizuno, et al., Biochem. Biophys. Res. Commun. 156, p. 246-254, 1988]. 또한, NKEX2는 이의 5' 말단에 제한 효소 NotI 부위(밑줄그음)의 뉴클레오타이드 서열을 갖고, KM088은 제한 효소 SalI 부위(밑줄그음)의 뉴클레오타이드 서열을 갖는다(도 1b 참조). 이들 프라이머는 포스포아미다이드법으로 자동 합성기(Applied Biosystems Model 380A)를 사용하여 합성한다.
2) 발현 벡터 pCU660의 제조(도 2 참조)
발현 벡터 pCU660은 NKEX2-660 유전자를 함유하는 NotI DNA 단편을 발현 플라스미드 pNOTelI (일본 미심사된 공개특허공보 제5-344895호)의 NotI 제한효소 부위로 삽입시켜 제조하고 숙주로서 캔디다 보이디니이를 사용하여 KEX2-660 유전자를 알콜 옥시다제 유전자(AOD) 프로모터의 조절하에서 발현시킬수 있다(도 2).
상기 벡터를 작제하기 위해서, pNOTelI을 제한효소 NotI으로 절단하고 약 7.4kb DNA 단편을 정제한다. NKEX2-660 유전자를 포함하는 단계 1)의 NKEX2-660 유전자를 포함하는 DNA 단편을 pCRII(Invitrogen)으로 클로닝하고, NKEX2 및 pCRII에 존재하는 제한효소 NotI 부위를 사용해 절단함으로써 NotI DNA 단편을 제조한다. pNOTelI은, AOD 프로모터에 의해 표전 유전자를 발현시키며, 숙주로서의 효모를 사용하는 경우 선별 마커용으로 URA3 유전자를 갖고 숙주로서 이.콜라이를 사용하는 경우엔 앰피실린 내성을 갖는 벡터이다. 따라서, 효모를 우라실을 필요로 하는 숙주로서 사용하는 경우, 형질전환체 균주를 우라실 비함유 플레이트상에서 선별할 수 있다.
실시예 2
형질전환체 및 Kex2-생성 균주의 분리
제한효소 BamHI으로 절단되고 직쇄로 만든 플라스미드 pCU660을 우라실-요구 균주 TK62로 도입시키고, 염색체-삽입 재조합 균주 TK62(pCU660)을 우라실 요구의 보완성을 이용해 선별한다. 균주 TK62는 캔디다 보이디니이 균주 S2 AOU-1으로부터 유도된 URA3 돌연변이로 생성된 우라실-요구 균주이며, 균주 TK62의 돌연변이 방법이 문헌[참조: Sakai, Y. et al., J. Bacteriol., 173, 7450-7463, 1991]에 보고되어 있다. 균주 S2 AOU-1은 캔디다 보이디니이 SAM 1958로 명명되었으며 기탁기관(Institute of Bioengireering and Humar Technology Agercy of Industrial Science and Technology)에 1992년 2월 25일자로 기탁번호 제FERM BP 3766호로서 기탁되었다.
pCU660은 염색체-삽입 발현 벡터이고, 생성 형질전환체 TK62(pCU660)에 대해서 발현된 Kex2 유도체의 양 및 분비량은 유전자의 염색체 삽입 부위, 복제수 등에 따라 다를수 있다. 20개의 형질전환체 클론(#1 내지 #20)이 시험관 수준으로 배양되었으며, 배양 배지내로 분비된 Kex2 유도체의 양(Kex2 프로테아제 활성)을 조사하여 Kex2 유도체를 다량 분비하는 클론을 선별한다.
먼저, TK62(pCU660) #1 내지 #20의 20개 균주를 BMGY 배지[1%(w/v) 효모 추출물, 2%(w/v) 펩톤, 1%(w/v) 글리세롤, 1.34%(w/v) YNB wo AA: 아미노산이 없는 효모 질소 기재, 0.4mg/L 바이오틴 및 100mM 인산칼륨(pH 6.0)]중 27℃에서 진탕배양한다. 2일후, 배양 배지를 BMMY 배지[1%(w/v) 효모 추출물, 2%(w/v) 펩톤, 0.5%(w/v) 메탄올, 1.34%(w/v) YNB wo AA, 0.4mg/L 바이오틴 및 100mM 인산칼륨(pH 6.0)] 1ml에 접종시켜 OD600이 10이 되게 한후, 27℃에서 진탕 배양한다. 30시간후, 상등액의 Kex2 활성을 측정하고, 최고 활성을 갖는 5개의 균주를 선별한다. 이들 5개의 균주를 유사한 방법으로 배양한후, TK62(pCU660) 균주 #10을 선별하고, 일관되게 고수준인 Kex2 활성에 기인하여 하기 실험을 수행한다.
Kex2 활성을 문헌[참조: Mizuno et al., Biochem. Biophys. Res. Commun., f156, 246-254, 1988]의 방법에 따라 수행한다. 즉, 100mM 트리스-HCl로 희석된 Kex2-600 100㎕를 2mM CaCl2, 0.2%(w/v) 루부롤 및 10μM Boc-Leu-Arg-Arg-MCA (Peptide Research)를 함유하는 200mM 트리스-HCl(pH 7.0) 용액 100㎕에 가하고 37℃에서 30분 동안 정치시킨다. 25mM EGTA 50㎕를 첨가한후, 절단된 AMC의 형광 강도를 PANDEX FCA 시스템(Boxter-Travenol : Model 10-015-1, 여기=365nm, 방사=450nm)을 사용하여 측정한다. 상술한 조건하에서 1분내에 AMC 1pmol을 방출하는 Kex2 활성량을 1U 활성으로 정의한다.
실시예 3
배양 조건의 설정(도 3 참조)
1) 기초 배양 조건
글리세롤 동결 스톡으로부터 1ml의 균주 TK62 (pCU660) #10을 YPD 배지[1% (w/v) 효모 추출물, 2%(w/v) 펩톤, 2%(w/v) 글루코즈] 25ml을 함유하는 300ml 삼각 플라스크에 접종시키고 27℃에서 16시간동안 진탕 배양하여 예비배양을 수행한다.
상술한 예비 배양물을 배양 배지[1.5%(v/v), 메탄올 3%(w/v), 글리세롤, 1%(w/v) 효모 추출물, 2%(w/v) 펩톤, 50mM 인산칼륨(pH 6.0) 및 1.34%(w/v) YNB wo AA] 2ℓ에 접종하고 배양 개시시의 세포 밀도를 OD 600이 0.2가 되게한후 5ℓ 용적의 발효기(Mitsuwa Scientific Instruments, Model KMJ-5B-4U-FP)를 사용하여 27℃에서 통기시키면서 교반하여 주배양을 수행한다. 통기속도는 4ℓ/분이고, 교반속도는 용존 산소량이 2.5ppm 이하로 떨어지지 않도록 조절한다. 배양물의 질소는 질소원 재공급 용액[5%(w/v) 효모 추출물, 10%(w/v) 펩톤, 6.7%(w/v) YNB wo AA] 80ml로 적당히 재보충시키고 pH는 7.5% 암모니아수를 첨가하여 5.5 이하로 떨어지지 않도록 조절한다.
소포제(Disfoam CC-222, Nippon Yushi) 0.5ml/l를 배양 개시시 첨가한후, 필요할때마다 첨가한다. 탄소원의 재보충은 15 내지 45%(v/v) 메탄올 용액 및 10 내지 50%(w/v) 글리세롤 용액(농도는 배양에 따라 달라질 수 있다)을 사용하여 수행한다. 메탄올 및 글리세롤을 매 7.5분마다 1회씩 고정량을 공급하도록 단위 시간당 일정 공급 용적을 갖는 연동 펌프를 주기적으로 작동시켜 첨가한다. 첨가 속도는 시간당 배양 배지 ℓ당 첨가되는 메탄올 양(ml/ℓ·h) 또는 글리세롤 양(g/ℓ·h) 또는 글리세롤 양(g/ℓ·h)으로 표시된다.
2) 메탄올 첨가 조건의 조사
배양 배지중의 메탄올의 농도는 메탄올 대사 경로를 갖는 메틸 영양성 효모 균주 TK62(pCU660) #10의 성장, 및 메탄올에 의해 발현이 유도되는 AOD 프로모터로부터 Kex2-660의 발현에 있어 중요한 변수이다. 본 발명의 발명자는 먼저, 메탄올 첨가 조건을 배양 배지중의 메탄올 농도가 효모 성장용 탄소원으로서 충분하고 세포 독성을 나타내지 않기에 충분한 농도로 유지되도록 설정하고자 했다. 배양은 기본 배양 조건에 따라 수행한다.
배양 배지의 메탄올 농도는 3일마다 측정하고, 배양 배지로의 메탄올 첨가 횟수 및 양은 초기 2 내지 3시간의 농도를 참조로하여 결정한다. 배양 배지중의 메탄올 농도는 배양을 개시한지 15시간후 (OD660=22) 0.42%(v/v)로 감소되므로, 메탄올 첨가를 배양 개시 18시간후 (OD600=52) 개시하여 0.75ml/ℓ·h의 속도로 개시한다. 또한, 메탄올 첨가 직전 배양 개시후 18시간내 배양 배지중의 메탄올 농도는 0.26%(v/v)로 감소된다.
배양 개시후 21시간내 배양 배지중의 메탄올 농도는 0.1%(v/v) 이하로 감소되므로, 메탄올 첨가 속도는 배양개시후 23시간에 개시하여 7.5ml/ℓ·h로 증가된다(초기 첨가 속도의 10배). 첨가 속도를 증가시킨 직후, 교반 속도를 신속히 감소시키면 효모에 의한 산소 소모율이 급격히 저하된다. 즉, 세포 활성의 감소가 관측된다. 그후, 세포 밀도가 낮아지고, 효모는 용해되는 것으로 생가고딘다. 메탄올 첨가 1시간후 배양 배지중의 메탄올 농도가 증가되므로 (배양 개시 24시간후), 이는 메탄올이 배양 배지중에 축적된다는 것을 나타낸다.
상기한 결과에 근거하여, 1) 배양 배지에 메탄올 첨가를 개시하기에 양호한 시간을 배양을 개시한지 18시간내이며 (OD600=약 50), 2) 배양 배지의 메탄올 농도는 0.75ml/ℓ·h의 메탄올 첨가 속도에서 3시간내에 0.1%(v/v) 이하로 감소되므로, 탄소원용 메탄올이 부족할 수 있으며, 3) 7.5ml/ℓ·h의 첨가 속도에 의해 배양 배지중에 메탄올이 과도하게 빠르게 축적되어 세포 독성이 일어날 수 있다는 것을 밝혀내었다. 또한, 배양 배지중의 메탄올 농도가 0.1%(v/v) 이하인 상태가 계속된후, 메탄올을 신속히 첨가하면 균주 TK62(pCU660) #10을 죽게할 수 있다는 것을 밝혀내었다.
메탄올 첨가 주기와 동시에 나타나는 용존 산소값의 동요가 배양 개시후 20시간부터 23시간까지 관측되었다. 이러한 주기는, 배양 배지의 메탄올 농도가 0.1%(v/v) 이하로 감소되는 시간부터 배양 배지에 메탄올을 신속히 투여하여 메탄올에 축적되는 시간까지(즉, 배양 배지의 메탄올 농도가 0.1%(v/v) 이하인 시간)의 시간과 일치되므로, 용존 산소값의 주기적 동요와 배양 배지중 메탄올 농도간에 상호관련이 있음을 제시한다.
3) 배양 배지중 용존 산소값 및 메탄올 농도의 동요
메탄올이 전술한 단략에서와 같이 주기적으로 첨가되는 배양에서, 메탄올 첨가 주기와 동시에 발생하는 용존 산소값의 동요는 배양 배지중의 메탄올 농도가 0.1%(v/v) 이하인 경우 관측되고 메탄올이 배양 배지중에 축적되기 시작하면 더 이상 관측되지 않는다는 것을 제시한다. 용존 산소량은 배양을 조절하기 위해 통상적으로 모니터링되는 변수이며, 용존 산소 전극을 사용하여 측정한다. 메탄올 대사 경로를 가진 미생물을 배양시의 용존 산소량 변화에 근거하여 메탄올 요구량을 예측할 수 있다면, 안정하고 유효한 배양 조건을 설정할 수 있을 것이다.
따라서, 메탄올 첨가 주기와 동시에 발생하는 용존 산소값의 동요와, 배양 배지중의 메탄올 농도가 급속히 감소되는 속도인 0.75ml/ℓ·h와 메탄올이 단락 2)의 상술한 배양에서와 같이 배양 배지중에 축적되는 속도인 7.5ml/ℓ·h의 중간인 2.25ml/ℓ·h의 메탄올 첨가 속도로 배양한 배양 배지의 메탄올 농도간의 상호관련에 대해 면밀한 조사를 수행하였다.
단락 2)의 결과를 근거로하여, 메탄올 첨가 개시 시간을 OD 600이 약 50에 도달하는 시간으로 설정하고 (배양 개시후 약 18시간째), 탄소원의 첨가 속도는 메탄올에 대해서는 2.25ml/ℓ·h로 설정하고 글리세롤에 대해서는 0.15g/ℓ·h로 설정한다. 탄소원 첨가 주기와 동시에 발생하는 용존 산소값의 동요는 배양 개시후 23시간내에 관측되기 시작하여 배양 완료때까지(배양 개시후 49시간 : OD600=198) 계속된다.
이러한 시간동안 배양 배지중의 메탄올 농도는 0.1% (v/v) 이하이다. 또한, 배양 배지중의 메탄올 농도가 0.1%(v/v) 이하가 되고 글리세롤 농도가 0.1%(w/v) 이하가 되면, 탄소원 첨가 용액의 첨가 주기와 동시에 발생하는 용존 산소값의 주기적 동요의 변화량이 증가한다(도 3). 글리세롤이 첨가되어 이때 배양 배지중의 최종 농도가 1.25%(w/v)로 증가되면, 변화량의 증가가 정상이되더라도, 탄소원 첨가 용액 자체의 첨가 주기와 동시에 발생하는 용존 산소값의 주기적 동요가 계속되는 것으로 밝혀졌다(도 3).
즉, 용존 산소값의 주기적 동요는 배양 배지중의 메탄올 농도가 0.1%(v/v) 이하이고 변화량의 증가는 배양 배지중의 메탄올 농도가 0.1%(v/v) 이하이고 글리세롤 농도가 0.1%(w/v) 이하인 상태를 나타낸다는 것이 확실하다. 이러한 지시자를 이용하여, 메탄올 농도가 0.1%(v/v) 이하이고 글리세롤 농도가 0.1%(w/v) 이하인 상태를 모니터링할 수 있다.
또한, 메탄올 농도가 0.1%(v/v) 이하인 시간 동안(배양 개시후 23 내지 49시간), 세포 증가수는 2배이상 배가된다는 것이 확실하다. 달리 표현하면, 배양 배지중의 메탄올 농도가 0.1%(v/v) 이하일지라도 세포는 성장할 수 있다.
실시예 4
용존 산소값의 주기적 동요 양상에 근거한 메탄올 첨가 속도의 최적화
본 발명의 발명자들은, 실시예 3의 배양 배지중 메탄올 농도가 0.1%(v/v) 이하이고 메탄올이 배지중에 축적되지 않는 시간동안, 용존 산소값의 동요가 메탄올의 주기적 첨가와 동시에 발생하고 메탄올이 축적되기 시작하면 더이상 관측되지 않는다는 것을 명백히 입증하였다. 또한, 메탄올 첨가와 동시에 발생하는 용존 산소값의 동요가 관측되는 상태에서 세포가 성장한다는 것이 명백히 밝혀졌다. 따라서, 메탄올 첨가 속도와 용존 산소값의 주기적 동요 사이의 상호관계를 결정하고 메탄올 첨가 속도와 Kex2-660 분비 생성물 양 사이의 상호관계를 규명하는 조사를 수행하였다.
1) 메탄올 첨가 속도와 용존 산소값의 주기적 동요 사이의 관계
메탄올 첨가 속도의 변화시 주기적인 메탄올 첨가와 동시에 발생하는 용존 산소값의 동요 양상 변화를 조사하여 이 변화가 배양 배지에 메탄올을 첨가하는 것을 조절하는 지시자로서 이용될 수 있는가를 결정한다.
배양 개시후 세포 밀도가 OD600에서 270(65g DCW/ℓ 배양배지)가 되면, 메탄올 첨가 속도를 1.5, 2.2, 4.7 및 6.4ml/ℓ·h로 변화시키고 이때 배양 배지중의 메탄올 농도 및 용존 산소값의 주기적 동요 양상을 조사한다. 동시에 글리세롤은 5g/ℓ·h의 속도로 첨가한다. 메탄올 첨가 속도가 1.5, 2.2 또는 4.7ml/ℓ·h이고 이때 배양 배지중의 메탄올 농도가 0.1%(v/v) 이하이며 메탄올이 축적되지 않는 경우, 메탄올 첨가와 동시에 발생하는 용존 산소값의 동요가 관측되는 것으로 밝혀졌다. 또한, 동요 양상이 메탄올 첨가 속도의 증가와 함께 변화되고, 메탄올 첨가후 단위 시간당 용존 산소값의 증가율이 보다 완만해지는 것으로 밝혀졌다(도 4).
또한, 메탄올 첨가 속도가 6.4ml/ℓ·h이 되면, 메탄올 첨가 주기와 동시에 발생하는 용존 산소값의 주기적 동요가 더이상 관측되지 않는다(도 4). 이때 배양 배지중의 메탄올 농도가 0.1%(v/v) 이하이더라도, 메탄올 첨가 속도가 더욱 증가되면, 배양 배지중의 메탄올이 축적되는 것으로 밝혀졌다. 메탄올을 소모하는 효모의 능력이 배양 배지중의 메탄올 농도를 측정하는 것만으로는 측정될 수 없으나, 실시예 3의 단락 2) 기술 및 상기한 결과에 근거하여, 효모는 단위 시간당 용존 산소값의 증가가 급속한 경우에는 메탄올 소모에 있어 상당한 여유가 있는 반면, 증가가 완만한 경우 메탄올 소모에 있어 여유가 없는 것으로 나타났다.
달리 표현하면, 메탄올 첨가 속도 조절을 용존 산소값의 주기적 동요 양상을 관측함으로써 결정할 수 있다. 또한, 세포 밀도가 OD600에서 270인 상태에서, 메탄올 첨가 속도가 4.7ml/ℓ·h를 초과하지 않는한, 용존 산소값의 주기적 동요가 관측되고, 메탄올이 축적되지 않으며, 균주 TK62(pCU660) #10이 죽지 않고 성장한다는 것이 명백히 밝혀졌다.
2) 메탄올 첨가 속도 및 생성분비된 Kex2-660의 양
균주 TK62(pCU660) #10의 세포 밀도가 OD600에서 270(65g DCW/ℓ 배양 배지)이 되는 경우, 메탄올이 배양 배지중에 축적되지 않고 효모가 죽지 않는 메탄올 첨가 속도는 1.5 내지 4.7ml/ℓ·h의 범위이다. 따라서, 메탄올이 배양 배지중에 축적되지 않는 메탄올 첨가 속도중 균주 TK62(pCU660) #10의 성장 속도 및 생성 분비된 Kex2-660의 양에 있어 최적인 속도를 조사하기 위해, 2.25ml/ℓ·h 또는 4.5ml/ℓ·h의 첨가 속도에서 배양하고 이때 세포 성장 속도 및 분비된 Kex2-660 생성량을 측정한다. 두 경우 모두에서 글리세롤 첨가 속도는 5g/ℓ·h이다.
2.25 및 4.5ml/ℓ·h의 메탄올 첨가 속도에서 배양하는 동안, 용존 산소값은 배양 개시후 각각 22시간 및 25시간에서 개시하여 주기적인 메탄올 첨가와 동시에 발생하는 동요를 나타내기 시작하여 배양이 완결된 48시간까지 계속된다. 이때 배양 배지중 메탄올 농도는 모두 0.1%(v/v) 이하이다.
어떤 조건하에서라도 용존 산소값의 동요가 관축되는 때 세포 밀도와 생성 분비된 Kex2-660의 양이 증가되는 동안(예: 4.5ml/ℓ·h의 메탄올 첨가 속도에서 배양을 개시한지 24시간 내지 48시간 동안 세포 밀도 및 생성 분비된 Kex2-660이 각각 약 2.5배 및 약 7.4배 증가하였다, 도 5) 및 메탄올 첨가 주기와 동시에 발생하는 용존 산소값의 동요가 관측되는 때 배양 배지중의 메탄올 농도가 0.1%(v/v) 이하인 동안, 명백히 메탄올 첨가 속도와 무관하게 세포수가 증가하고 Kex2-660이 발현되고 배양 배지중에 분비되었다(도 5 및 도 6). 즉, 배양 배지중의 메탄올 농도가 0.1%(v/v) 이하이고 용존 산소값이 메탄올의 주기적 첨가와 동시에 발생하는 메탄올 첨가 속도가, 표적 생성물의 발현 및 세포 성장에 적합한 속도인 것으로 밝혀졌다.
2.25 및 4.5ml/ℓ·h의 메탄올 첨가 속도에서 배양하는 동안, 세포수는 배양 개시후 48시간에 각각 1,400배 및 1,800배가 증가하였고, 배양 상등액 ℓ당 각각 1,260MU 및 2,850MU(약 150mg 및 340mg과 동일)의 Kex2-660이 발현되고 분비되었다(표 1). 따라서, 용존 산소값의 주기적 동요가 계속되도록 메탄올 첨가 조건이 유지되는한(달리 표현하면, 효모의 최대 메탄올 소모율과 같거나 그 이하인 속도로 유지되는한), 메탄올 첨가량이 증가하는 경우 세포 성장 속도가 증가하고 생성된 Kex2-660의 양이 증가한다는 것이 명백하다.
또한, 이러한 배양에 필요한 시간(48시간)은 성장기 배양, 및 메탄올 대사 경로의 효소가 부족한 메틸 영양성 효모의 생성기 배양을 위한 시간(100 내지 160시간)과 비교해 짧으므로, 본 발명의 유용성을 입증한다.
도 6은 문헌[참조: Laemmli et al., Nature, 227, 680-685, 1970]의 방법에 따라 수행한 SDS-PAGE의 결과를 나타낸다. 즉, 7㎕ 4ㅧ SDS 샘플 완충액[375mM 트리스-HCl(pH 6.8), 30%(w/v) 글리세롤, 7%(w/v) SDS, 15%(v/v) 2-머캅토에탄올, 0.1%(w/v) 브로모페놀 블루]을 배양 상등액 20㎕에 가한후 95℃에서 5분 동안 가열하여 SDS-PAGE 샘플을 제조한다. 6% SDS-PAGE를 18mA 및 90분의 조건하에 상술한 샘플 7㎕을 사용하여 수행한다. 영동후, 겔을 염색 용액[10% (v/v) 아세트산, 40%(v/v) 메탄올, 0.25%(w/v) 코마시 블릴리언트 블루 R250]으로 염색한다. 그 결과가 도 6에 나타나 있다.
3) 메탄올 소모율
2.25 및 4.5ml/ℓ·h의 메탄올 첨가 속도에서 배양하는 동안, DCW 효모 1g당 메탄올 소모율(6시간마다의 평균값)을 측정한다(표 2). 배양 배지 ℓ당 메탄올 소모율은 첨가된 메탄올 양에서 남아 있는 메탄올 양을 뺀 값에서 취한 것이고, 효모 세포 건조 중량(DCW)는 둘간의 관계에 기초하여 결정된 전환식에 배양 배지의 OD600 값을 삽입시켜 계산한다.
또한, 환기 및 교반에 의한 열 발생과 같은 인자의 영향이 DCW가 0.5g 이하인 경우 유의할 것으로 예측되고, 메탄올 소모율의 정확한 양이 계산될 수 없는 가능성이 크므로 상기한 인자가 평가시 제거되어야 한다. 용존 산소값의 주기적 동요에 근거하여 균주 TK62(pCU660) #10을 배양하는 동안 메탄올 소모율은 DCW가 0.5g 이상인 경우 0.03 내지 0.16ml/g DCW·h인 것으로 측정되었다.