説明
FGFR4選択的阻害剤としての化合物のクラスが本明細書に開示される。これらの低分子阻害剤は、がんを治療するための標的治療薬として使用することができる。
線維芽細胞成長因子受容体(FGFR)は、細胞外リガンド結合ドメイン、膜貫通セグメント、および細胞質チロシンキナーゼドメインからなる高度に保存された受容体である。ヒトFRFRファミリーは、FGFR1、FGFR2、FGFR3、およびFGFR4の4つのメンバーを含み、これらは、線維芽細胞成長因子(FGF)と呼ばれる18個の異なるリガンドによって結合され得る。各受容体は、3つの免疫グロブリン様ドメイン(IgI、IgII、およびIgIII)および酸ボックスからなる細胞外ドメイン、FGFリガンド結合部位を構成するIgIIおよびIgIIIドメイン、膜貫通ドメイン、ならびにチロシンキナーゼ細胞質ドメインから構成される。FGFRはまた、ATP結合部位(配列番号:57~60)の近くに位置するヒンジ領域(サブドメインV)を含む。mRNAをコードするFGFRは、選択的スプライシングに供されて、いくつかのタンパク質コードスプライスバリアントまたはアイソフォーム(配列番号:1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、および55)が生じる。表3に示すように、ヒトFGFR1遺伝子は、9つのタンパク質コードスプライスバリアント(配列番号:2、4、6、8、10、12、14、16、および18)をコードし、ヒトFGFR2遺伝子は、11個のタンパク質コードスプライスバリアント(配列番号:20、22、24、26、28、30、32、34、36、38、および40)をコードし、ヒトFGFR3遺伝子は、4つのタンパク質コードスプライスバリアント(配列番号:42、44、46、および48)をコードし、ヒトFGFR4遺伝子は、4つのタンパク質コードスプライスバリアント(配列番号:50、52、54、および56)をコードする。
リガンドのFGFファミリーには、18個のメンバー(FGF1~FGF10およびFGF16~FGF23)が存在する。リガンドがFGFRの細胞外ドメインに結合することにより、受容体の二量体化が生じ、これが自己リン酸化によるチロシンキナーゼドメインの活性化をもたらす。続いて、活性化されたFGFRは、細胞質基質、例えば、FGFR基質2(FRS2)およびホスホリパーゼCγ(PLCγ)をリン酸化し、これにより、下流シグナル伝達カスケードが引き起こされる。活性化されたFRS2は、細胞の増殖、分化、および生存を調節するRAS-マイトジェン活性化プロテインキナーゼ(MAPK)またはホスホイノシチド3-キナーゼ(PI3K)-AKT経路を促進する。一方、PLCγの活性化により、カルシウム放出が生じ、細胞運動性を媒介する事象が調節される。
FGFRシグナル伝達の調節解除は、受容体の構成的活性化を生じさせる、活性化変異、遺伝子増幅または転写後プロセシングの変化、および転座を含むいくつかの作用機序を介して発がんに関連している。
具体的には、FGFR4の増幅および活性化変異が、横紋筋肉腫を有する患者で説明されており、FGFR4過剰発現は、前立腺がん、結腸がん、乳がん、および肝臓がんに関連付けられている。FGFR4は、ヒンジ領域にシステインが存在することで他のFGFRと異なり、これは、FGFRファミリー内で独自であり、他のキナーゼの中でも希である。アイソフォームに応じて、システインは、異なる位置:配列番号:52のCys484、配列番号:56のCys512、または配列番号:50もしくは54のCys552に位置する。非常に良好な特異性を示すFGFR4特異的阻害剤の設計のために、この特有のシステインを標的化することができる。
本明細書で使用される場合、「FGFR阻害剤」または「FGFRi」という用語は、FGFRの酵素活性を阻害することができる任意の化合物を指し、FGFR自体の自己リン酸化およびキナーゼ活性が含まれる。このような阻害剤は、FGFRを効率的に阻害し、FGFRの生物活性を「阻害する」、「低減する」、または「減少させる」と言われる。本開示のFGFR阻害剤は、「汎阻害剤(pan-inhibitor)」であり得、GFR1~FGFR4のうちの1つ以上の阻害において幅広い効率性を示すことができ、または1つのFGFRのみ、例えばFGFR4の阻害に特異的な効率性を示し得る。
化合物の効率は、そのIC50値によって参照することができる。「IC50」は、化合物の最大半減阻害濃度(IC50)である。本明細書で使用される場合、FGFRiのIC50は、指定された曝露時間後におけるベースラインと最大値との中間のFGFRの酵素活性の阻害を誘導するのに十分な阻害剤の濃度を指す。本開示のIC50値は、1つ以上のFGFR、すなわち、FGFR1、FGFR2、FGFR3および/またはFGFR4の阻害を誘導するのに十分なFGFR阻害剤の濃度を具体的に指す。
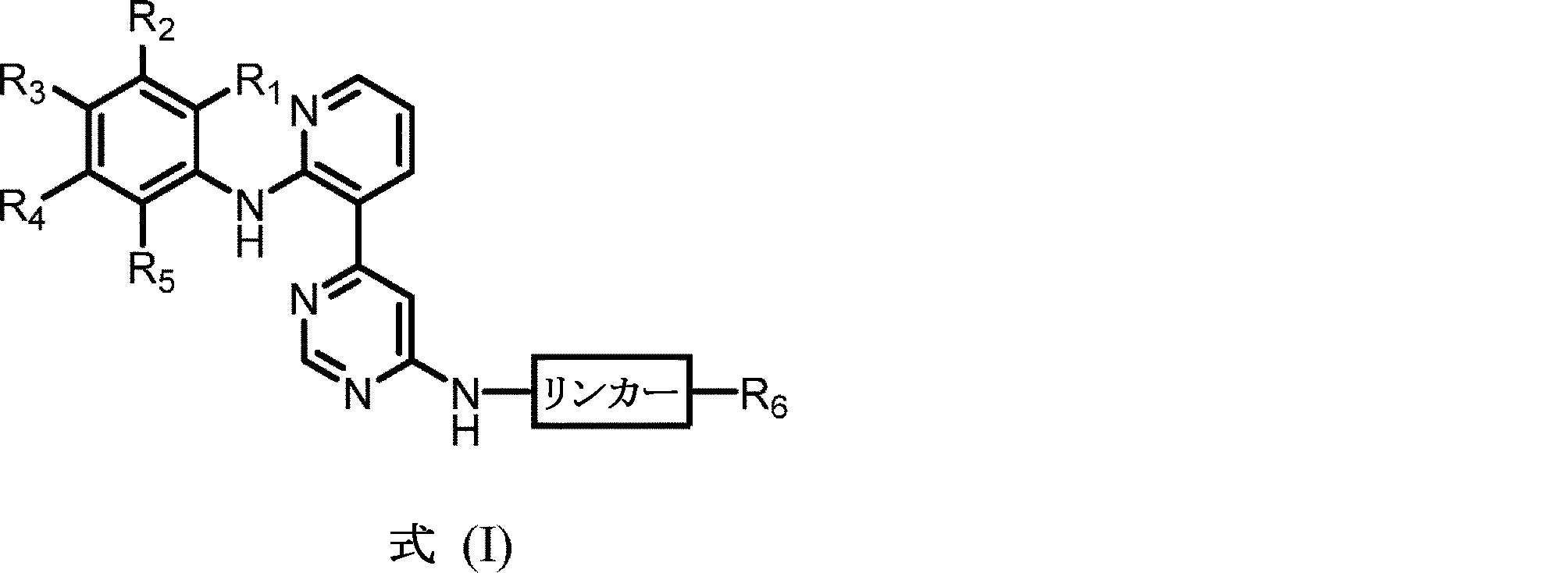
いくつかの実施形態では、本開示は、式(I)の化合物
、またはその光学的に純粋な立体異性体、溶媒和物、もしくは薬学的に許容される塩を提供する。
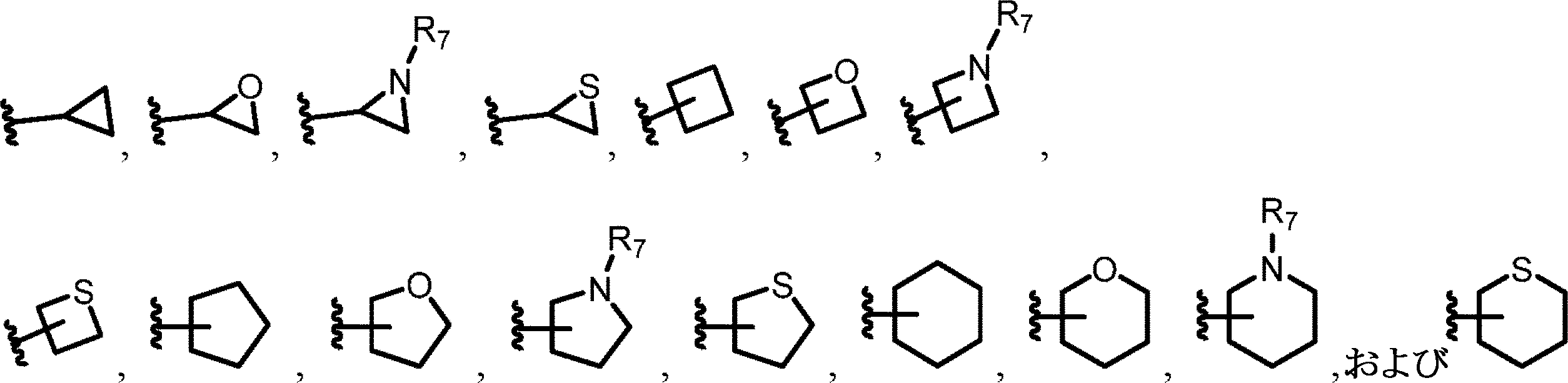
いくつかの実施形態では、各R1、R2、R3、R4、およびR5は、独立して、H、F、Cl、Br、C1-4アルキル、シクロプロピル、N3、NH2、NO2、CF3、OCF3、OCHF2、またはOC1-4アルキルであり得る。いくつかの実施形態では、R6は、(CH2)0-5CH=CH2、(CH2)0-5C≡CH、NHCO(CH2)0-5CH=CH2、NH(CH2)0-5CH=CH2、OCO(CH2)0-5CH=CH2、O(CH2)0-5CH=CH2、NHCO(CH2)0-5C≡CH、またはOCO(CH2)0-5C≡CHであり得る。
いくつかの実施形態では、リンカーは、F、Cl、Br、C
1-4アルキル、CF
3、CHF
2、NO
2、-NR
7-(CH
2)
n-R
8、-CONR
7-(CH
2)
n-R
8、-CO-(CH
2)
n-R
8、-OCO-(CH
2)
n-R
8、および-O-(CH
2)
n-R
8からなる群から選択される1つ以上の置換基で置換されていてもよい、C
1-20アルキル、COC
1-20アルキル、CO
2C
1-20アルキル、
フェニル、ナフチル、アントラセン、
からなる群から選択することができる。任意選択による置換基の数は、0~4から選択される整数であり得る。
いくつかの実施形態では、nは、0~5から選択される整数であり得る。いくつかの実施形態では、R7は、H、C1-4アルキル、およびCOC1-4アルキルからなる群から選択することができる。
いくつかの実施形態では、R
8は、F、Cl、Br、C
1-4アルキル、CF
3、CHF
2、およびNO
2.からなる群から選択される1つ以上の置換基で置換されていてもよい、C
1-20アルキル、COC
1-20アルキル、CO
2C
1-20アルキル、
からなる群から選択することができる。
いくつかの実施形態では、R1およびR5は、Clであり、R2およびR4は、OMeであり、R3は、Hである。
本開示はまた、式(II)の化合物
、またはその光学的に純粋な立体異性体、溶媒和物、もしくは薬学的に許容される塩を提供する。
いくつかの実施形態では、R1は、(CH2)0-5CH=CH2、(CH2)0-5C≡CH、NHCO(CH2)0-5CH=CH2、NH(CH2)0-5CH=CH2、OCO(CH2)0-5CH=CH2、O(CH2)0-5CH=CH2、NHCO(CH2)0-5C≡CH、またはOCO(CH2)0-5C≡CHであり得る。
リンカーは、F、Cl、Br、C
1-4アルキル、CF
3、CHF
2、NO
2、-NR
2-(CH
2)
n-R
3、-CONR
2-(CH
2)
n-R
3、-CO-(CH
2)
n-R
3、-OCO-(CH
2)
n-R
3、および-O-(CH
2)
n-R
3からなる群から選択される1つ以上の置換基で置換されていてもよい、C
1-20アルキル、COC
1-20アルキル、CO
2C
1-20アルキル、
フェニル、ナフチル、アントラセン、
からなる群から選択することができる。任意選択による置換基の数は、0~4から選択される整数であり得る。
いくつかの実施形態では、R2は、H、C1-4アルキル、およびCOC1-4アルキルからなる群から選択され得る。nは、0~5から選択される整数である。
いくつかの実施形態では、R
3は、F、Cl、Br、C
1-4アルキル、CF
3、CHF
2、およびNO
2からなる群から選択される1つ以上の置換基で置換されていてもよい、C
1-20アルキル、COC
1-20アルキル、CO
2C
1-20アルキル、
からなる群から選択することができる。
本開示はまた、式(III)の化合物
、またはその光学的に純粋な立体異性体、溶媒和物、もしくは薬学的に許容される塩を提供する。
いくつかの実施形態では、各R1、R2、R3、R4、およびR5は、独立して、H、F、Cl、Br、C1-4アルキル、シクロプロピル、N3、NH2、NO2、CF3、OCF3、OCHF2、およびOC1-4アルキルからなる群から選択することができる。nは、0~5から選択される整数であり得る。
いくつかの実施形態では、R
6は、F、Cl、Br、C
1-4アルキル、CF
3、CHF
2、およびNO
2からなる群から選択される1つ以上の置換基で置換されていてもよい、C
1-20アルキル、COC
1-20アルキル、CO
2C
1-20アルキル、
からなる群から選択することができる。R
7は、H、C
1-4アルキル、およびCOC
1-4アルキルからなる群から選択することができる。任意選択による置換基の数は、0~4から選択される整数であり得る。
いくつかの実施形態では、R1およびR5は、Clであり、R2およびR4は、OMeであり、R3は、Hである。
いくつかの実施形態では、本開示は、式(IV)の化合物
、またはその光学的に純粋な立体異性体、溶媒和物、もしくは薬学的に許容される塩を提供する。
いくつかの実施形態では、各R1、R2、R3、R4、およびR5は、独立して、H、F、Cl、Br、C1-4アルキル、シクロプロピル、N3、NH2、NO2、CF3、OCF3、OCHF2、またはOC1-4アルキルであり得る。いくつかの実施形態では、R6は、(CH2)0-5CH=CH2、(CH2)0-5C≡CH、NHCO(CH2)0-5CH=CH2、NH(CH2)0-5CH=CH2、OCO(CH2)0-5CH=CH2、O(CH2)0-5CH=CH2、NHCO(CH2)0-5C≡CH、またはOCO(CH2)0-5C≡CHであり得る。
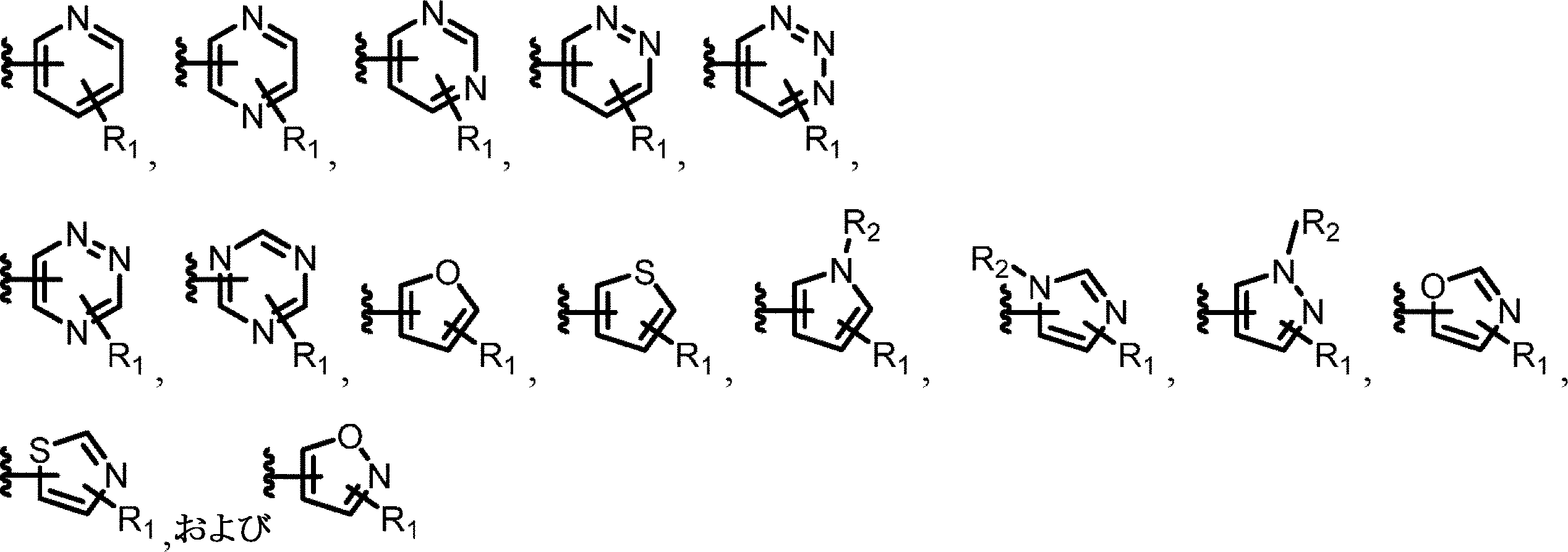
いくつかの実施形態では、各AおよびBは、独立して、NR7、CONR7、O、CO、またはOCOであり得る。
いくつかの実施形態では、コアは、
からなる群から選択することができる。各Dは、独立して、NまたはCHであり得る。
いくつかの実施形態では、リンカーは、F、Cl、Br、C
1-4アルキル、CF
3、CHF
2、NO
2、-NR
7-(CH
2)
n-R
8、-CONR
7-(CH
2)
n-R
8、-CO-(CH
2)
n-R
8、-OCO-(CH
2)
n-R
8、および-O-(CH
2)
n-R
8からなる群から選択される1つ以上の置換基で置換されていてもよい、C
1-20アルキル、COC
1-20アルキル、CO
2C
1-20アルキル、
フェニル、ナフチル、アントラセン、
からなる群から選択することができる。任意選択による置換基の数は、0~4から選択される整数であり得る。
いくつかの実施形態では、nは、0~5から選択される整数であり得る。いくつかの実施形態では、R7は、H、C1-4アルキル、およびCOC1-4アルキルからなる群から選択することができる。
いくつかの実施形態では、R
8は、F、Cl、Br、C
1-4アルキル、CF
3、CHF
2、およびNO
2.からなる群から選択される1つ以上の置換基で置換されていてもよい、C
1-20アルキル、COC
1-20アルキル、CO
2C
1-20アルキル、
からなる群から選択することができる。
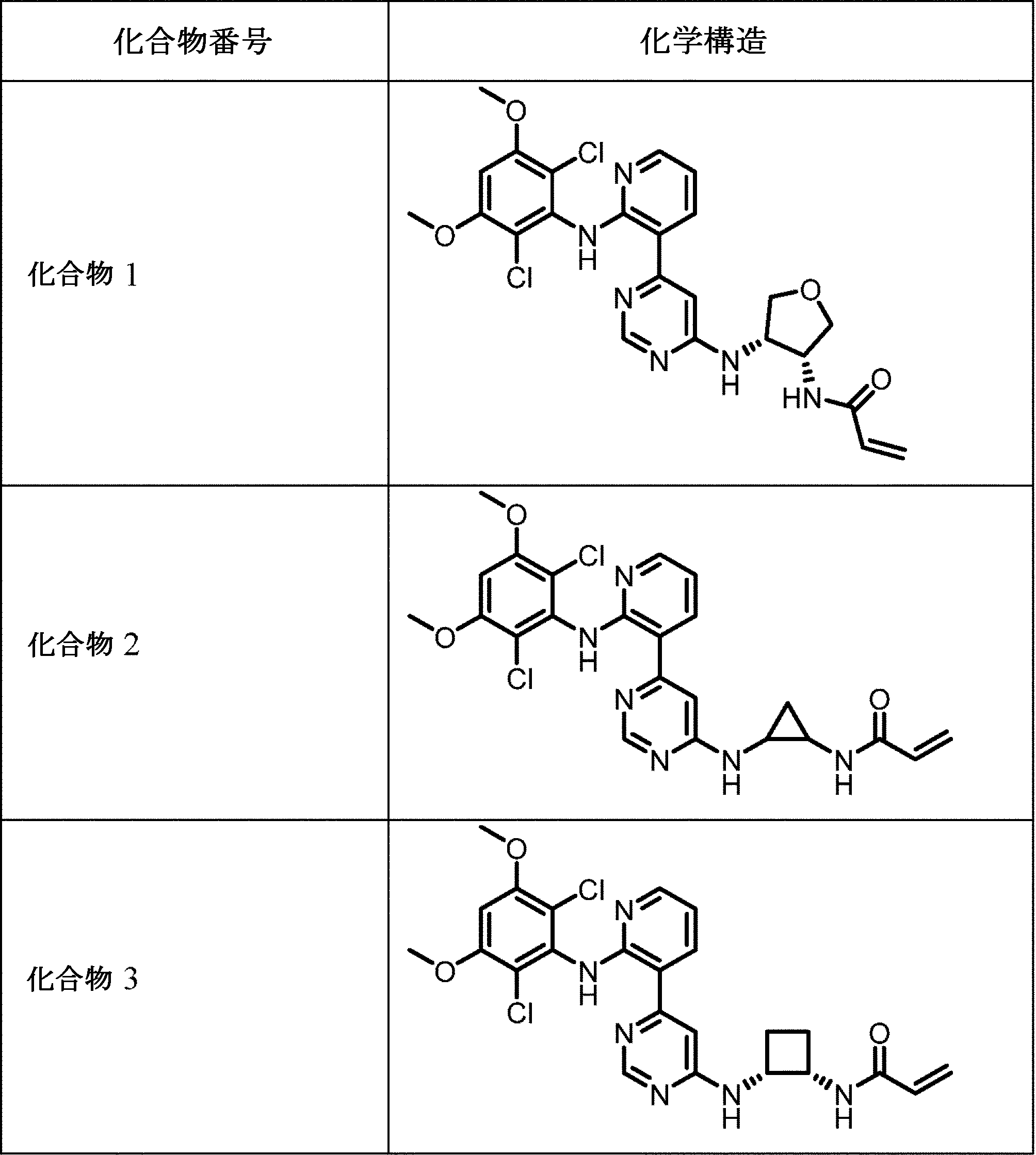
いくつかの実施形態では、本開示の化合物は、表1に示される化合物1~4および6~16からなる群から選択される。
本開示はまた、式(I)、式(II)、式(III)による化合物またはその光学的に純粋な立体異性体もしくは薬学的に許容される塩を含む、医薬製剤を提供する。本開示はさらに、式(I)、式(II)、式(III)の構造を有する化合物またはその光学的に純粋な立体異性体もしくは薬学的に許容される塩を対象に投与する工程を含む、対象におけるがんを治療するための方法を提供する。本開示はまた、細胞を式(I)、式(II)、式(III)の構造を有する化合物またはその光学的に純粋な立体異性体もしくは薬学的に許容される塩と接触させる工程を含む、キナーゼ活性を阻害する方法を提供する。いくつかの実施形態では、キナーゼは、未分化リンパ腫キナーゼ(ALK)、上皮成長因子受容体(EGFR)、エフリン3型受容体3(EPH-B3)、接着斑キナーゼ(FAK)、線維芽細胞成長因子受容体1(FGFR1)、線維芽細胞成長因子受容体2(FGFR2)、線維芽細胞成長因子受容体3(FGFR3)、線維芽細胞成長因子受容体4(FGFR4)、肥満細胞/幹細胞成長因子受容体(SCFRまたはKIT)、マイトジェン活性化タンパク質キナーゼキナーゼ1(MAP2K1またはMEK1)、肝細胞成長因子受容体(HGFRまたはMET)、血小板由来成長因子受容体α(PDGFRA)、血小板由来成長因子受容体β(PDGFRB)、癌原遺伝子チロシンキナーゼ受容体(RET)、癌原遺伝子チロシンプロテインキナーゼ(ROS)、またはチロシンプロテインキナーゼ受容体(TYRO3)であり得る。細胞は、がん細胞であり得る。がん細胞は、乳がん、肺がん、膀胱がん、前立腺がん、卵巣がん、子宮内膜がん、横紋筋肉腫、肝臓がん、または胃がんの細胞であり得る。
本開示は、以下の構造を有する化合物5
などの対照構造と比較して、非自明な特性改善を有する化合物を具体的に提供する。該化合物のIUPAC名は、N-(2-((6-(2-((2,6-ジクロロ-3,5-ジメトキシフェニル)アミノ)ピリジン-3-イル)ピリミジン-4-イル)アミノ)-3-メチルフェニル)アクリルアミドである。
「約」という用語は、当業者によって理解されるであろう。「約」という用語が明示的に使用されるか否かにかかわらず、本明細書で付与されている全ての量は、実際の所与の値を指し、それはまた、当業者に基づいて合理的に推測されるであろうそのような所与の値に対する近似を指すことを意味する。
アルキル基は、任意の炭素原子から水素原子を除去することによってアルカンから誘導される一価の基を指し、該基としては、1~12個の炭素原子、典型的には、1~約10個の炭素、またはいくつかの実施形態では、1~約6個の炭素原子、または他の実施形態では、1、2、3、または4個の炭素原子を有する、直鎖および分枝鎖が挙げられる。直鎖アルキル基の例としては、メチル基、エチル基、n-プロピル基、n-ブチル基、n-ペンチル基、およびn-ヘキシル基が挙げられるが、これらに限定されない。分枝鎖アルキル基の例としては、イソプロピル基、イソブチル基、sec-ブチル基、tert-ブチル基が挙げられるが、これらに限定されない。アルキル基は、置換または非置換であってもよい。代表的な置換アルキル基は、一置換、二置換、または三置換などであるがこれらに限定されない、一置換または二以上置換されてもよい。本明細書で使用される場合、アルキルという用語は、別段の記載がない限り、環式基および非環式基の両方を指す。
「環式アルキル」または「シクロアルキル」という用語は、環炭素原子から水素原子を除去することによってシクロアルカンから誘導される一価の基を指す。シクロアルキル基は、3~14個の炭素原子、またはいくつかの実施形態では、3~12個、もしくは3~10個、もしくは3~8個、もしくは3個、4個、5個、6個、もしくは7個の炭素原子を有する、単離環系、縮合環系、架橋環系、およびスピロ環系を含む、単環または複数環を有する飽和または部分飽和非芳香族構造である。シクロアルキル基は、置換または非置換であってもよい。代表的な置換シクロアルキル基は、一置換、二置換、または三置換などであるがこれらに限定されない、一置換または複数回置換されてもよい。単環式シクロアルキル基の例としては、シクロプロピル基、シクロブチル基、シクロペンチル基、およびシクロヘキシル基が挙げられるが、これらに限定されない。多環式環系の例としては、ビシクル[4.4.0]デカン、ビシクル[2.2.1]ヘプタン、スピロ[2.2]ペンタンなどが挙げられるが、これらに限定されない。
アルケニル基は、2つの炭素原子間に1つ以上の二重結合を有する、上記で定義される直鎖および分枝鎖ならびにシクロアルキル基を指す。アルケニル基は、2~約12個の炭素原子を有してもよく、またはいくつかの実施形態では、1~約10個の炭素を有してもよく、または他の実施形態では、1~約6個の炭素原子を有してもよく、または他の実施形態では、1、2、3、もしくは4個の炭素原子を有してもよい。アルケニル基は、置換または非置換であってもよい。代表的な置換アルケニル基は、一置換、二置換、または三置換などであるがこれらに限定されない、一置換または複数回置換されてもよい。アルケニル基の例としては、特に、ビニル、アリル、-CH=CH(CH3)、-CH=C(CH3)2、-C(CH3)=CH2、シクロペンテニル、シクロヘキセニル、ブタジエニル、ペンタジエニル、およびヘキサジエニルが挙げられるが、これらに限定されない。
アルキニル基は、2つの炭素原子間に1つ以上の三重結合を有する、上で定義される直鎖および分枝鎖およびシクロアルキル基を指す。アルキニル基は、2~約12個の炭素原子を有してもよく、またはいくつかの実施形態では、1~約10個の炭素を有してもよく、または他の実施形態では、1~約6個の炭素原子を有してもよく、または他の実施形態では、1、2、3、もしくは4個の炭素原子を有してもよい。アルキニル基は、置換または非置換であってもよい。代表的な置換アルキニル基は、一置換、二置換、または三置換などであるがこれらに限定されない、一置換または複数回置換されてもよい。例示的なアルキニル基には、特に、エチニル、プロパルギル、および-C≡C(CH3)が含まれるが、これらに限定されない。
アリール基は、単一および複数の環式化合物を含む環式芳香族炭化水素であり、別のアリール基および/または縮合アリール基を含む複数環の化合物が含まれる。アリール基は、6~約18個の環炭素を有してもよく、またはいくつかの実施形態では、6~14個の環炭素を有してもよく、または他の実施形態では、さらには6~10個の環炭素を含有してもよい。アリール基はまた、5つ以上の環員を含む芳香族環化合物であるヘテロアリール基を含み、その1つ以上の環炭素原子は、N、O、およびSなどのヘテロ原子で置換されるが、これらに限定されない。アリール基は、置換または非置換であってもよい。代表的な置換アリール基は、一置換、二置換、または三置換などであるがこれらに限定されない、一置換または複数回置換されてもよい。アリール基としては、フェニル基、ビフェニレニル基、トリフェニレニル基、ナフチル基、アントリル基、およびピレニル基が挙げられるが、これらに限定されない。
好適なヘテロシクリル基は、少なくとも2つの異なる元素の原子を環員として有する環式基を含み、該環員のうちの1つ以上は、N、O、またはSなどのヘテロ原子であるが、これらに限定されない。ヘテロシクリル基は、3~約20個の環員、またはいくつかの実施形態では、3~18個の環員、または約3~15個、3~12個、3~10個、もしくは3~6個の環員を含んでもよい。ヘテロシクリル基中の環系は、不飽和、部分飽和、および/または飽和であってもよい。ヘテロシクリル基は、置換または非置換であってもよい。代表的な置換ヘテロシクリル基は、一置換、二置換、または三置換などであるがこれらに限定されない、一置換または複数回置換されてもよい。例示的なヘテロシクリル基としては、ピロリジニル、テトラヒドロフリル、ジヒドロフリル、テトラヒドロチエニル、テトラヒドロチオピラニル、ピペリジル、モルホリニル、チオモルホリニル、チオキサニル、ピペラジニル、アゼチジニル、アジリジニル、イミダゾリジニル、ピラゾリジニル、チアゾリジニル、テトラヒドロチオフェニル、テトラヒドロフラニル、ジオキソリル、フラニル、チオフェニル、ピロリル、イミダゾリル、ピラゾリル、ピラゾリニル、トリアゾリル、テトラゾリル、オキサゾリル、イソキサゾリル、チアゾリル、チアゾリニル、オキセタニル、チエタニル、ホモピペリジル、オキセパニル、チエパニル、オキサゼピニル、ジアゼピニル、チアゼピニル、1,2,3,6-テトラヒドロピリジル、インドリニル、2H-ピラニル、4H-ピラニル、ジオキソラニル、ジオキサニル、プリニル、キノリジニル、シンノリニル、フタラジニル、プテリジニル、およびベンゾチアゾリル基が挙げられるが、これらに限定されない。
多環式基またはポリシクリル基は、2つ以上の炭素が2つの隣接する環に共通し、かつ、環が「縮合環」である、2つ以上の環を指し、環が1つの共通の炭素原子によって連結されている場合、これらは「スピロ」環系である。非隣接原子を介して連結される環は、「架橋された」環である。多環式基は、置換または非置換であってもよい。代表的な多環式基は、1つ以上置換されていてもよい。
ハロゲン基としては、F、Cl、Br、およびIが挙げられ、ニトロ基は-NO2を指し、シアノ基は-CNを指し、イソシアノ基は-N≡Cを指し、エポキシ基は、本質的に環式エーテル構造である、酸素原子が炭素鎖または環系の2つの隣接または非隣接炭素原子に直接結合している構造を包含する。エポキシドは、3つの原子の環を有する環式エーテルである。
アルコキシ基は、酸素に単結合している、上記で定義された置換または非置換アルキル基である。アルコキシ基は、置換または非置換であってもよい。代表的な置換アルコキシ基は、1つ以上置換されてもよい。例示的なアルコキシ基としては、メトキシ基、エトキシ基、プロポキシ基、ブトキシ基、ペントキシ基、ヘキソキシ基、イソプロポキシ基、sec-ブトキシ基、tert-ブトキシ基、シクロプロピルオキシ基、シクロブチルオキシ基、シクロペンチルオキシ基、およびシクロヘキシルオキシ基が挙げられるが、これらに限定されない。
「アミン」および「アミノ」という用語は、1つ以上の水素原子が、アルキル、アルケニル、アリール、およびヘテロシクリル基を含むがこれらに限定されない置換基によって置き換えられた、アンモニアの誘導体を指す。カルバメート基は、-O(C=O)NR1R2を指し、式中、R1およびR2は、独立して、水素、脂肪族基、アリール基、またはヘテロシクリル基である。
「置換されていてもよい」という用語は、先に記載の基が置換または非置換であってもよいことを意味する。置換される場合、「置換されていてもよい」基の置換基は、単独でまたは組み合わせて、以下の基または特定の指定された基のセットから独立して選択される1つ以上の置換基を含んでもよいが、これらに限定されない:低級アルキル、低級アルケニル、低級アルキニル、低級アルカノイル、低級ヘテロアルキル、低級ヘテロシクロアルキル、低級ハロアルキル、低級ハロアルケニル、低級ハロアルキニル、低級ペルハロアルキル(lower perhaloalkyl)、低級ペルハロアルコキシ(lower perhaloalkoxy)、低級シクロアルキル、フェニル、アリール、アリールオキシ、低級アルコキシ、低級ハロアルコキシ、オキソ、低級アシルオキシ、カルボニル、カルボキシル、低級アルキルカルボニル、低級カルボキシエステル、低級カルボキサミド、シアノ、水素、ハロゲン、ヒドロキシ、アミノ、低級アルキルアミノ、アリールアミノ、アミド、ニトロ、チオール、低級アルキルチオ、低級ハロアルキルチオ、低級ペルハロアルキルチオ(lower perhaloalkylthio)、アリールチオ、スルホネート、スルホン酸、三置換シリル、N3、SH、SCH3、C(O)CH3、CO2CH3、CO2H、ピリジニル、チオフェン、フラニル、低級カルバメート、および低級尿素。2つの置換基は、一緒に結合されて、例えばメチレンジオキシまたはエチレンジオキシを形成する、0~3個のヘテロ原子からなる縮合された5員、6員、または7員の炭素環式環または複素環式環を形成してもよい。任意に置換された基は、非置換(例えば、-CH2CH3)、完全置換(例えば、-CF2CF3)、一置換(例えば、-CH2CH2F)、または完全置換と一置換との間の任意のレベルで置換されてもよい(例えば、-CH2CF3)。置換基が置換に関して無条件で記載されている場合、置換形態および非置換形態の両方が包含される。置換基が「置換された」として条件がある場合、置換形態が具体的に意図される。さらに、特定の部分に対する任意選択による置換基の異なるセットは、必要に応じて定義されてもよい。これらの場合、任意選択による置換は、しばしば、「置換されていてもよい」の語句の直後に定義される。
本明細書に記載の化合物の薬学的に許容される塩としては、例えば非毒性有機酸または無機酸由来の、化合物の従来の非毒性塩または四級アンモニウム塩が挙げられる。例えば、このような従来の非毒性塩としては、塩酸、臭化水素酸、硫酸、スルファミン酸、リン酸、硝酸などの無機酸に由来する塩;および酢酸、プロピオン酸、コハク酸、グリコール酸、ステアリン酸、乳酸、リンゴ酸、酒石酸、クエン酸、アスコルビン酸、パルミチン酸、マレイン酸、ヒドロキシマレイン酸、フェニル酢酸、グルタミン酸、安息香酸、サリチル酸、スルファニル酸、2-アセトキシ安息香酸、フマル酸、トルエンスルホン酸、メタンスルホン酸、エタンジスルホン酸、シュウ酸、イソチオン酸などの有機酸から調製された塩が挙げられる。他の場合には、記載の化合物は、1つ以上の酸性官能基を含んでもよく、したがって、薬学的に許容される塩基を用いて薬学的に許容される塩を形成することができる。これらの塩は同様に、投与ビヒクルまたは剤形製造プロセスにおいてインサイチューで、あるいは、その遊離酸形態の精製化合物を好適な塩基、例えば、薬学的に許容される金属カチオンの水酸化物、炭酸塩、もしくは重炭酸塩、アンモニア、または薬学的に許容される有機第一級、第二級もしくは第三級アミンと別々に反応させることによって調製することができる。代表的なアルカリまたはアルカリ土類塩としては、リチウム、ナトリウム、カリウム、カルシウム、マグネシウム、およびアルミニウム塩などが挙げられる。塩基付加塩の形成に有用な代表的な有機アミンとしては、エチルアミン、ジエチルアミン、エチレンジアミン、エタノールアミン、ジエタノールアミン、ピペラジンなどが挙げられる。
「治療(treatment)」という用語は、本明細書では、「治療方法(therapeutic method)」という用語と互換的に使用され、1)診断された病理的状態、疾患、もしくは障害の治癒、遅延、症状の軽減、および/または進行の停止、ならびに2)予防/予防手段の両方を指す。治療を必要としているものとしては、既に特定の医学的疾患または障害を有する個体、および最終的に障害を獲得し得る個体(すなわち、予防手段を必要としている個体)が挙げられてもよい。
「対象」という用語は、本明細書で使用される場合、対象方法が実施される任意の個体または患者を指す。概して、対象はヒトであるが、当業者には理解されるであろうが、対象は動物であってもよい。
「治療有効量」、「有効用量」、「治療有効用量」、「有効量」などの用語は、対象化合物を投与することによって求められる、組織、システム、動物、またはヒトにおける生物学的または医学的応答を誘発する対象化合物の量を指す。概して、応答は、患者における症状の緩和または所望の生物学的転帰のいずれかである。このような量は、FGFR酵素活性を阻害するのに十分である必要がある。
式(I)、式(II)、または式(III)の構造を有する化合物を含む医薬組成物も、本明細書に開示される。「薬学的に許容される担体」は、本開示の化合物と一緒に患者に投与されてもよく、かつ、その薬理学的活性を壊さない、非毒性担体を指す。これらの組成物中で使用されてもよい薬学的に許容される担体としては、イオン交換剤、アルミナ、ステアリン酸アルミニウム、レシチン、血清タンパク質、例えば、ヒト血清アルブミン、緩衝物質、例えば、リン酸塩、グリシン、ソルビン酸、ソルビン酸カリウム、飽和植物性脂肪酸の部分グリセリド混合物、水、塩または電解質、例えば、硫酸プロタミン、リン酸水素二ナトリウム、リン酸水素カリウム、塩化ナトリウム、亜鉛塩、コロイド状シリカ、三ケイ酸マグネシウム、ポリビニルピロリドン、セルロース系物質、ポリエチレングリコール、カルボキシメチルセルロースナトリウム、ポリアクリレート、ワックス、ポリエチレン-ポリオキシプロピレン-ブロックポリマー、ポリエチレングリコール、および羊毛脂が挙げられるが、これらに限定されない。
本開示の医薬組成物中で使用されてもよい薬学的に許容される担体としては、イオン交換剤、アルミナ、ステアリン酸アルミニウム、レシチン、血清タンパク質、例えば、ヒト血清アルブミン、緩衝物質、例えば、リン酸塩、グリシン、ソルビン酸、ソルビン酸カリウム、飽和植物性脂肪酸の部分グリセリド混合物、水、塩または電解質、例えば、硫酸プロタミン、リン酸水素二ナトリウム、リン酸水素カリウム、塩化ナトリウム、亜鉛塩、コロイド状シリカ、三ケイ酸マグネシウム、ポリビニルピロリドン、セルロース系物質、ポリエチレングリコール、カルボキシメチルセルロースナトリウム、ポリアクリレート、ワックス、ポリエチレン-ポリオキシプロピレン-ブロックポリマー、羊毛脂、および自己乳化薬物送達系(SEDDS)、例えばα-トコフェロール、ポリエチレングリコール1000スクシネート、または他の同様の高分子送達ポリマトリックスが挙げられるが、これらに限定されない。
活性成分として本明細書に記載される化合物のみを含む医薬組成物において、これらの組成物を投与する方法は、追加の薬剤または療法を対象に投与する工程をさらに含んでもよい。このような療法としては、貧血療法、糖尿病療法、高血圧療法、コレステロール療法、神経薬理学的薬物、心血管機能を調節する薬物、炎症を調節する薬物、免疫機能、血液細胞の産生、ホルモンおよびアンタゴニスト、消化管機能に影響を与える薬物、微生物疾患の化学療法、ならびに/または腫瘍性疾患の化学療法が挙げられるが、これらに限定されない。他の薬理学的療法には、任意の薬物クラスに見出される任意の他の薬物または生物学的薬剤を含むことができる。例えば、他の薬物クラスとしては、アレルギー/風邪/ENT療法、鎮痛剤、麻酔剤、抗炎症剤、抗菌剤、抗ウイルス剤、喘息/肺療法、心血管療法、皮膚科療法、内分泌/代謝療法、胃腸療法、がん療法、免疫療法、神経療法、眼科療法、精神科療法、またはリウマチ療法を挙げることができる。本明細書に記載の化合物と共に投与することができる薬剤または療法の他の例としては、マトリックスメタロプロテアーゼ阻害剤、リポキシゲナーゼ阻害剤、サイトカインアンタゴニスト、免疫抑制剤、サイトカイン、成長因子、免疫調節剤、プロスタグランジン、または抗血管過剰増殖化合物が挙げられる。
本明細書で使用される場合、「治療有効量」という用語は、研究者、獣医、医師、または他の臨床医によって求められる組織、システム、動物、個体、またはヒトにおける生物学的または医学的応答を誘発する活性化合物または薬剤の量を指し、該応答には、以下のうちの1つ以上が含まれる:(1)疾患を予防すること、例えば、疾患、状態、もしくは障害の素因があり得るが、まだ疾患の病理または症状を経験または示していない個体における疾患、状態、または障害を予防すること、(2)疾患を阻害すること、例えば、疾患、状態、または障害の病理または症状を経験または示している個体における疾患、状態、または障害を阻害すること(すなわち、病理および/または症状のさらなる発達を阻止すること)、ならびに(3)疾患を改善すること、例えば、疾患、状態、または障害の病理または症状を経験または示している個体における疾患、状態、または障害を改善すること(すなわち、病理および/または症状を逆転させること)。
本開示の化合物は、がんを含むがこれらに限定されない本明細書に記載の疾患を制御するための従来の方法で用いられてもよい。このような治療方法、それらの投与量レベルおよび要件は、利用可能な方法および技術から当業者によって選択されてもよい。例えば、本開示の化合物は、薬学的に許容される様式で、かつ、がんを治療するのに有効な量で、がんに罹患している患者に投与するための薬学的に許容される補助剤と組み合わせてもよい。
あるいは、本開示の化合物は、がんを含むがこれらに限定されない本明細書に記載される疾患から個体を長期間にわたって治療または保護するための組成物および方法において使用されてもよい。化合物は、医薬組成物中のそのような化合物の従来の利用に合致する様式で、単独でまたは本開示の他の化合物と共に、そのような組成物において用いられてもよい。例えば、本開示の化合物は、ワクチンに従来用いられ、かつ、がんを含むがこれらに限定されない本明細書に記載の疾患に対して長期間にわたって個体を保護するために予防有効量で投与される、薬学的に許容される補助剤と組み合わせてもよい。
本明細書で使用される場合、「組み合わせ」、「組み合わされた」、および関連する用語は、本開示による治療剤の同時または逐次投与を指す。例えば、記載の化合物は、別の治療剤とともに、別々の単位剤形で同時にもしくは逐次的に、または単一の単位剤形で一緒に投与されてもよい。したがって、本開示は、記載の化合物、追加の治療剤、および薬学的に許容される担体、補助剤、またはビヒクルを含む、単一の単位剤形を提供する。2つ以上の薬剤は、患者または個体が両方の薬剤に同時に曝露される場合、典型的には、「組み合わせて」投与されるとみなされる。多くの実施形態では、患者または個体が、特定の標的組織または試料中(例えば、脳中、血清中など)における治療的に関連する薬剤レベルを同時に示す場合、2つ以上の薬剤は、「組み合わせて」投与されるとみなされる。
本開示の化合物が他の薬剤との併用療法で投与される場合、それらは患者に逐次または同時に投与されてもよい。あるいは、本開示による医薬組成物または予防組成物は、イベルメクチンまたは本明細書に記載の任意の他の化合物と別の治療剤または予防剤との組み合わせを含む。特定の疾患または状態を治療するために通常投与される追加の治療剤は、「治療される疾患または状態に適切な薬剤」と称してもよい。
本開示の組成物および方法で利用される化合物は、選択的生物学的特性を増強するために適切な官能基を付加することによって修飾されてもよい。このような修飾は、当該技術分野で既知であり、所与の生物学的システム(例えば、血液、リンパ系、または中枢神経系)への生物学的浸透を増加させる修飾、経口利用可能性を増加させる修飾、注射による投与を可能にするために溶解性を増加させる修飾、代謝を変化させる修飾、および/または排泄速度を変化させる修飾を含む。
好ましい実施形態によれば、本開示の組成物は、対象または患者、例えば、哺乳動物、好ましくはヒトへの薬学的投与用に製剤化される。このような医薬組成物は、対象におけるがんを含むがこれらに限定されない、本明細書に記載される疾患のいずれかを改善、治療、または予防するために使用される。
本開示の薬剤は、活性治療剤、すなわち、および種々の他の薬学的に許容される成分を含む医薬組成物としてしばしば投与される。Remington’s Pharmaceutical Science(15th ed.,Mack Publishing Company,Easton,Pa.,1980)を参照されたい。好ましい形態は、意図される投与様式および治療用途に依存する。組成物はまた、所望の製剤に応じて、動物またはヒト投与のための医薬組成物を製剤化するために一般的に使用されるビヒクルとして定義される、薬学的に許容される非毒性担体または希釈剤を含むことができる。希釈剤は、組み合わせの生物学的活性に影響を及ぼさないように選択される。そのような希釈剤の例は、蒸留水、リン酸緩衝生理食塩水、リンガー溶液、デキストロース溶液、およびハンクス溶液である。さらに、医薬組成物または製剤はまた、他の担体、補助剤、または非毒性、非治療的、非免疫原性安定剤などを含んでもよい。
いくつかの実施形態では、本開示は、がんを含むがこれらに限定されない本明細書に記載の疾患の治療に使用するために、1つ以上の薬学的に許容される担体(添加剤)および/または希釈剤と共に製剤化される、治療有効量の1つ以上の記載の化合物を含む薬学的に許容される組成物を提供する。記載の化合物を単独で投与することは可能であるが、本明細書に記載の医薬製剤(組成物)として、記載の化合物を投与することが好ましい。記載の化合物は、他の医薬品と同様に、ヒトまたは獣医学における使用のための任意の好都合な方法での投与用に製剤化されてもよい。
詳細に記載されるように、本開示の医薬組成物は、固体または液体形態での投与のために特に製剤化されてもよく、例えば、経口投与、例えば、ドレンチ剤(drenches)(水性または非水性溶液剤または懸濁剤)、錠剤、例えば、口腔、舌下、および全身吸収用に標的化された錠剤、ボーラス剤、散剤、粒剤、舌への適用のためのペースト剤;例えば、皮下、筋肉内、静脈内、または硬膜外注射、例えば、滅菌溶液剤もしくは懸濁剤など、または持続放出製剤による、非経口投与;例えば、皮膚、肺、または口腔に適用されるクリーム剤、軟膏剤、もしくは制御放出パッチ剤、またはスプレー剤としての局所適用;例えば、ペッサリー剤、クリーム剤、またはフォーム剤としての膣内、直腸内;舌下;眼内;経皮;または経鼻、肺、および他の粘膜表面のために適合されたものを含む。
湿潤剤、乳化剤、および滑沢剤、例えばラウリル硫酸ナトリウムおよびステアリン酸マグネシウム、ならびに着色剤、離型剤(release agent)、コーティング剤、甘味剤、香味剤、および芳香剤、防腐剤、ならびに抗酸化剤がまた、組成物中に存在してもよい。
薬学的に許容される抗酸化物質の例としては、水溶性抗酸化物質、例えば、アスコルビン酸、塩酸システイン、重硫酸ナトリウム、メタ重亜硫酸ナトリウム、亜硫酸ナトリウムなど;油溶性抗酸化物質、例えば、パルミチン酸アスコルビル、ブチル化ヒドロキシアニソール(BHA)、ブチル化ヒドロキシトルエン(BHT)、レシチン、没食子酸プロピル、α-トコフェロールなど;および金属キレート剤、例えば、クエン酸、エチレンジアミン四酢酸(EDTA)、ソルビトール、酒石酸、リン酸などが挙げられる。
本開示による使用のための製剤としては、経口、経鼻、局所(口腔および舌下を含む)、直腸、膣内、および/または非経口投与に好適な製剤が挙げられる。製剤は、単位剤形で好都合に提供されてもよく、薬学分野で周知の任意の方法によって調製されてもよい。単一の剤形を生成するために担体材料と組み合わせることができる活性成分の量は、治療される宿主および特定の投与様式に応じて変動する。単一の剤形を作製するために担体材料と組み合わせることができる活性成分の量は、概して、治療効果を生成する化合物の量である。概して、この量は、活性成分の約1%~約99%の範囲である。いくつかの実施形態では、この量は、約5%~約70%、約10%~約50%、または約20%~約40%の範囲である。
特定の実施形態では、本明細書に記載の製剤は、シクロデキストリン、リポソーム、ミセル形成剤、例えば、胆汁酸、ならびに高分子担体、例えば、ポリエステルおよびポリ無水物からなる群から選択される賦形剤と、本開示の化合物と、を含む。特定の実施形態では、上記の製剤は、本開示の記載の化合物を経口的に生物学的に利用可能にする。
記載の化合物を含む製剤または組成物を調製する方法は、本開示の化合物を担体および任意選択で1つ以上の付属成分と組み合わせる工程を含む。一般に、製剤は、本開示の化合物を液体担体もしくは細分化固体担体またはその両方と均一かつ密接に組み合わせ、次いで必要に応じて生成物を成形することにより、調製してもよい。
医薬組成物は、滅菌注射可能調製物の形態、例えば、滅菌注射可能水性懸濁剤または油性懸濁剤の形態であってもよい。この懸濁剤は、好適な分散剤または湿潤剤(例えば、Tween80など)および懸濁化剤を使用して、当該技術分野で既知の技法に従って製剤化されてもよい。滅菌注射可能調製物はまた、例えば1,3-ブタンジオール中の溶液剤として、非毒性の非経口的に許容される希釈剤または溶媒中の滅菌注射可能溶液剤または懸濁剤であってもよい。使用されてもよい許容されるビヒクルおよび溶媒の中には、マンニトール、水、リンガー溶液、および等張塩化ナトリウム溶液がある。さらに、滅菌固定油は、溶媒または懸濁媒体として従来用いられている。この目的のために、合成モノグリセリドまたはジグリセリドを含む、任意の無刺激(bland)固定油が用いられてもよい。オレイン酸およびそのグリセリド誘導体などの脂肪酸は、特にポリオキシエチル化型での、オリーブ油またはヒマシ油などの天然の薬学的に許容される油と同様に、注射剤の調製に有用である。これらの油溶液剤または懸濁剤はまた、長鎖アルコール希釈剤もしくは分散剤、例えば、Pharmacopeia Helveticaに記載されているもの、または類似のアルコールを含んでもよい。他の一般的に使用される界面活性剤、例えば、Tweens、Spans、および薬学的に許容される固体、液体、または他の剤形の製造において一般的に使用される他の乳化剤または生物学的利用能増強剤も、製剤化の目的のために使用されてもよい。
いくつかの場合では、薬物の効果を延長するために、皮下または筋肉内注射からの薬物の吸収を遅延させることが望ましいものであり得る。これは、水溶性が低い結晶性または非晶質材料の液体懸濁剤の使用によって達成され得る。次いで、薬物の吸収速度は、その溶解速度に依存し、次いで、その溶解速度は、結晶サイズおよび結晶形態に依存し得る。あるいは、非経口投与された薬物形態の遅延吸収は、薬物を油ビヒクルに溶解または懸濁することによって達成される。
注射可能なデポー形態は、記載の化合物のマイクロカプセルマトリックスをポリラクチド-ポリグリコリドなどの生分解性ポリマー中に形成することによって作製される。薬物とポリマーとの比率および用いられる特定のポリマーの性質に応じて、薬物放出速度を制御することができる。他の生分解性ポリマーの例としては、ポリ(オルトエステル)およびポリ(無水物)が挙げられる。デポー注射可能製剤はまた、薬物を、体組織と適合性であるリポソームまたはマイクロエマルジョンに封入することによって調製される。
本開示の医薬組成物は、カプセル剤、錠剤、ならびに水性懸濁剤および溶液剤を含むがこれらに限定されない、任意の経口的に許容される剤形で経口投与されてもよい。経口用の錠剤の場合、一般的に使用される担体としては、ラクトースおよびトウモロコシデンプンが挙げられる。ステアリン酸マグネシウムなどの滑沢剤も典型的に添加される。カプセル形態での経口投与のために、有用な希釈剤としては、ラクトースおよび乾燥トウモロコシデンプンが挙げられる。水性懸濁剤、溶液剤、およびプロピレングリコールを経口投与する場合、活性成分は、乳化剤および懸濁化剤と組み合わされる。所望される場合、特定の甘味剤および/または香味剤および/または着色剤を添加してもよい。
経口投与に好適な本明細書に記載の製剤は、カプセル剤、カシェ剤、丸剤、錠剤、ロゼンジ剤(風味付けベース、通常はスクロースおよびアカシアもしくはトラガカントを使用する)、散剤、粒剤、または水性もしくは非水性液体中の溶液剤もしくは懸濁剤として、または水中油型もしくは油中水型液体乳剤として、またはエリキシル剤もしくはシロップ剤として、またはパステル剤(pastilles)(ゼラチンおよびグリセリン、もしくはスクロースおよびアカシアなどの不活性塩基を使用する)として、および/あるいは口腔洗浄剤などの形態であってよく、それぞれ、活性成分として所定量の本開示の化合物を含む。本明細書に記載の化合物はまた、ボーラス剤、舐剤、またはペースト剤として投与されてもよい。
経口投与用の固体剤形(カプセル剤、錠剤、丸剤、糖衣錠、散剤、粒剤など)において、活性成分は、クエン酸ナトリウムもしくはリン酸二カルシウムなどの1つ以上の薬学的に許容される担体、および/または以下のいずれかと混合される:充填剤または増量剤(extender)、例えば、デンプン、ラクトース、スクロース、グルコース、マンニトール、および/またはケイ酸など;結合剤、例えば、カルボキシメチルセルロース、アルギネート、ゼラチン、ポリビニルピロリドン、スクロース、および/またはアカシア;湿潤剤、例えば、グリセロール;崩壊剤、例えば、寒天、炭酸カルシウム、ジャガイモもしくはタピオカデンプン、アルギン酸、ある種のケイ酸塩、および炭酸ナトリウム;溶液遅延剤、例えば、パラフィン;吸収促進剤、例えば、第四級アンモニウム化合物;湿潤剤、例えば、セチルアルコール、モノステアリン酸グリセロール、および非イオン性界面活性剤;吸収剤、例えば、カオリン、およびベントナイト粘土;滑沢剤、例えば、タルク、ステアリン酸カルシウム、ステアリン酸マグネシウム、固体ポリエチレングリコール、ラウリル硫酸ナトリウム、およびそれらの混合物、ならびに着色剤。カプセル剤、錠剤、および丸剤の場合、医薬組成物はまた、緩衝剤を含んでもよい。同様の種類の固体組成物はまた、ラクトースまたは乳糖(milk sugar)、ならびに高分子量ポリエチレングリコールなどの賦形剤を使用して、軟質および硬質シェルゼラチンカプセル中の充填剤として用いられてもよい。
錠剤は、任意選択で1つ以上の付属成分と共に、圧縮または成形によって作製されてもよい。圧縮錠剤は、結合剤(例えば、ゼラチンまたはヒドロキシプロピルメチルセルロース)、滑沢剤、不活性希釈剤、保存剤、崩壊剤(例えば、デンプングリコール酸ナトリウムまたは架橋カルボキシメチルセルロースナトリウム)、表面活性剤、または分散剤を使用して調製されてもよい。成形錠剤は、粉末化合物の混合物が不活性液体希釈剤で湿潤される好適な機械で作製されてもよい。固体担体が使用される場合、調製物は、錠剤形態であるか、粉末もしくはペレット形態の硬質ゼラチンカプセル中に入れられるか、またはトローチもしくはロゼンジの形態であり得る。固体担体の量は、例えば、約25~800mg、好ましくは約25mg~400mgで変動する。液体担体が使用される場合、調製物は、例えば、シロップ剤、乳剤、軟質ゼラチンカプセル剤、アンプルまたは非水液体懸濁剤などの滅菌注射可能液体の形態であってもよい。組成物がカプセル形態である場合、任意のルーチンのカプセル化は、例えば、硬質ゼラチンカプセルシェル中で上記の担体を使用するのに好適である。
錠剤および他の固体剤形、例えば、糖衣錠、カプセル剤、丸剤、および粒剤は、任意選択で、薬学的製剤化技術分野において周知の腸溶性コーティングおよび他のコーティングなどのコーティングおよびシェルを用いて入手または調製されてもよい。代替的または追加的に、それらは、例えば、所望の放出プロファイルを提供するための様々な割合のヒドロキシプロピルメチルセルロース、他のポリマーマトリックス、リポソーム、および/またはマイクロスフィアを使用して、中にある活性成分の遅延放出または制御放出を提供するように製剤化されてもよい。それらは、凍結乾燥などの急速な放出用に製剤化されてもよい。それらは、例えば、細菌保持フィルターを通して濾過することによって、または使用直前に滅菌水またはいくつかの他の滅菌注射可能媒体に溶解させることができる滅菌固体組成物の形態で滅菌剤を組み込むことによって滅菌され得る。これらの組成物はまた、任意選択で不透明剤を含んでもよく、活性成分を胃腸管の特定の部分でのみ、または優先的に、任意選択で、遅延様式で放出する組成物であってもよい。使用することができる包埋組成物の例としては、高分子物質およびワックスが挙げられる。活性成分はまた、適切な場合には上記の賦形剤のうちの1つ以上と共に、マイクロカプセル化形態中にあり得る。
本開示の化合物の経口投与のための液体剤形としては、薬学的に許容される乳剤、マイクロエマルジョン、溶液剤、懸濁剤、シロップ剤、およびエリキシル剤が挙げられる。活性成分に加えて、液体剤形は、当技術分野で一般的に使用される不活性希釈剤、例えば、水または他の溶媒、可溶化剤および乳化剤、例えば、エチルアルコール、イソプロピルアルコール、炭酸エチル、酢酸エチル、ベンジルアルコール、安息香酸ベンジル、プロピレングリコール、1,3-ブチレングリコール、油(特に、綿実油、落花生油、トウモロコシ油、胚芽油、オリーブ油、ヒマシ油、およびゴマ油)、グリセロール、テトラヒドロフリルアルコール、ポリエチレングリコール、およびソルビタンの脂肪酸エステル、ならびにそれらの混合物を含んでもよい。
不活性希釈剤に加えて、経口組成物はまた、湿潤剤、乳化剤および懸濁化剤、甘味剤、香味剤、着色剤、芳香剤、および防腐剤などの補助剤を含むことができる。
懸濁剤は、活性化合物に加えて、例えば、エトキシル化イソステアリルアルコール、ポリオキシエチレンソルビトールおよびソルビタンエステル、微結晶セルロース、アルミニウムメタヒドロキシド、ベントナイト、寒天およびトラガカント、ならびにそれらの混合物などの懸濁化剤を含んでもよい。
本開示の医薬組成物はまた、直腸投与用の坐剤の形態で投与されてもよい。これらの組成物は、本開示の化合物を、室温では固体であるが、直腸温度では液体であり、したがって、直腸で溶解して活性成分を放出する、好適な非刺激性賦形剤と混合することによって調製することができる。このような材料としては、カカオバター、蜜蝋、およびポリエチレングリコールが挙げられるが、これらに限定されない。
本開示の医薬組成物の局所投与は、所望の治療が、局所適用によって容易にアクセス可能な領域または臓器を含む場合に特に有用である。皮膚に局所的に適用するために、医薬組成物は、担体中に懸濁または溶解された活性成分を含む好適な軟膏剤で製剤化される必要がある。本開示の化合物の局所投与のための担体としては、鉱油、液化石油、白色ワセリン、プロピレングリコール、ポリオキシエチレンポリオキシプロピレン化合物、乳化ワックス、および水が挙げられるが、これらに限定されない。あるいは、医薬組成物は、担体中に懸濁または溶解された活性化合物を含む好適なローション剤またはクリーム剤で製剤化することができる。好適な担体としては、鉱油、ソルビタンモノステアレート、ポリソルベート60、セチルエステルワックス、セテアリルアルコール、2-オクチルドデカノール、ベンジルアルコール、および水が挙げられるが、これらに限定されない。本開示の医薬組成物はまた、直腸坐剤製剤により、または好適な浣腸製剤中で、下部腸管に局所的に適用されてもよい。局所投与される経皮パッチ剤も本開示に含まれる。
本開示の医薬組成物は、経鼻エアロゾルまたは吸入によって投与されてもよい。そのような組成物は、医薬製剤の分野で既知の技術に従って調製され、ベンジルアルコールもしくは他の好適な保存剤、生物学的利用能を高めるための吸収促進剤、フルオロカーボン、および/または当該技術分野で既知の他の可溶化剤もしくは分散剤を使用して、生理食塩水中の溶液剤として調製されてもよい。
眼科的使用のために、医薬組成物は、等張pH調整無菌生理食塩水中の微粒子化懸濁剤として、または好ましくは、塩化ベンジルアルコニウムなどの防腐剤を含むまたは含まない等張pH調整無菌生理食塩水中の溶液剤として、製剤化されてもよい。あるいは、眼科用に、医薬組成物は、ワセリンなどの軟膏中に製剤化されてもよい。
経皮パッチ剤は、身体への本開示の化合物の制御された送達を提供する追加の利点を有する。化合物を適切な培地中に溶解または分散させることで、そのような剤形を作製することができる。皮膚を通る化合物のフラックスを増加させるために、吸収促進剤を使用することもできる。速度制御膜を提供すること、またはポリマーマトリックスもしくはゲル中に化合物を分散させることのいずれかにより、そのようなフラックスの速度を制御することができる。
本開示の医薬組成物に用いてもよい好適な水性および非水担体の例としては、水、エタノール、ポリオール(グリセロール、プロピレングリコール、ポリエチレングリコールなど)、およびそれらの好適な混合物、オリーブ油などの植物油、ならびにオレイン酸エチルなどの注射可能な有機エステルが挙げられる。適切な流動性は、例えば、レシチンなどのコーティング材料の使用によって、分散液の場合は必要な粒径の維持によって、および界面活性剤の使用によって維持することができる。
このような組成物はまた、防腐剤、湿潤剤、乳化剤、および分散剤などの補助剤を含んでもよい。特定の実施形態では、例えば、パラベン、クロロブタノール、フェノールソルビン酸などの1つ以上の抗菌剤および/または抗真菌剤を含めることが望ましい場合がある。代替的または追加的に、糖類、塩化ナトリウムなどの等張剤を組成物に含めることが望ましい場合がある。さらに、注射可能な医薬形態の持続的吸収は、モノステアリン酸アルミニウムおよびゼラチンなどの吸収を遅延させる薬剤を含めることによってもたらされてもよい。
特定の実施形態では、記載される化合物または医薬調製物は、経口投与される。他の実施形態では、記載される化合物または医薬調製物は、静脈内に投与される。代替的な投与経路としては、舌下投与、筋肉内投与、および経皮投与が挙げられる。
本明細書に記載される化合物が医薬としてヒトおよび動物に投与される場合、該化合物は、それ自体で、または薬学的に許容される担体と組み合わせて、例えば、0.1%~99.5%(より好ましくは、0.5%~90%)の活性成分を含む医薬組成物として投与することができる。
本明細書に記載される調製物は、経口、非経口、局所、または直腸付与されてもよい。それらは、もちろん、関連する投与経路に好適な形態で付与される。例えば、それらは、注射、注入による錠剤またはカプセル剤で、注射、注入、または吸入による点眼剤(eye lotion)、軟膏剤、坐剤などで、ローション剤または軟膏剤による局所で、および坐剤による直腸で投与される。経口投与が好ましい。
このような化合物は、経口、例えばスプレーなどによる経鼻、直腸、膣内、非経口、槽内、および散剤、軟膏剤、点滴剤などによる局所を含み、口腔および舌下を含む、任意の好適な投与経路によって、療法のためにヒトおよび他の動物に投与されてもよい。
選択される投与経路にかかわらず、好適な水和形態で使用され得る本明細書に記載の化合物、および/または本開示の医薬組成物は、当業者に既知の従来の方法によって薬学的に許容される剤形に製剤化される。
本開示の医薬組成物中の活性成分の実際の用量レベルは、患者に対する毒性なしに、特定の患者、組成物、および投与様式についての所望の治療応答を達成するのに有効な活性成分の量を得るために変動してもよい。
「投与」および/または「投与すること」という用語は、治療を必要とする対象に治療有効量の医薬組成物を付与することを意味すると理解されるべきである。投与経路は、経腸、局所、または非経口であり得る。したがって、投与経路としては、皮内(intracutaneous)、皮下、静脈内、腹腔内、動脈内、髄腔内、嚢内、眼窩内、心臓内、皮内(intradermal)、経皮、経気管(transtracheal)、表皮下、関節内、嚢下、くも膜下、脊髄内、および胸骨内、経口、舌下、口腔、直腸、膣内、経鼻、眼の投与、ならびに注入、吸入、および噴霧が挙げられるが、これらに限定されない。
「がん」という用語は、がん(悪性腫瘍)を良性腫瘍から分化させる他の部位(続発性部位、転移)に浸潤および拡散する可能性を有する、1つの部位(原発部位)から始まる異常で制御できない細胞増殖を特徴とする疾患群を指す。ほとんどすべての臓器が罹患し得、ヒトに罹患し得る100種類を超えるがんを生じさせる。がんは、遺伝的素因、ウイルス感染、電離放射線への曝露、環境汚染物質への曝露、タバコおよび/またはアルコールの使用、肥満、偏った食事、身体活動の欠如、またはそれらの任意の組み合わせを含む、多くの原因から生じ得る。
国立がん研究所によって説明される例示的ながんとしては、急性リンパ芽球性白血病、成人;急性リンパ芽球性白血病、小児;急性骨髄性白血病、成人;副腎皮質がん;副腎皮質がん、小児;AIDS関連リンパ腫;AIDS関連悪性腫瘍;肛門がん;星状細胞腫、小児小脳;星状細胞腫、小児脳;胆管がん、肝外;膀胱がん;膀胱がん、小児;骨のがん、骨肉腫/悪性線維性組織球腫;脳幹神経膠腫、小児;脳腫瘍、成人;脳腫瘍、脳幹神経膠腫、小児;脳腫瘍、小脳星状細胞腫、小児;脳腫瘍、脳星状細胞腫/悪性神経膠腫、小児;脳腫瘍、上衣腫、小児;脳腫瘍、髄芽腫、小児;脳腫瘍、テント上原始神経外胚葉性腫瘍、小児;脳腫瘍、視経路および視床下部神経膠腫、小児;脳腫瘍、小児(その他);乳がん;乳がんおよび妊娠;乳がん、小児;乳がん、男性;気管支腺腫/カルチノイド、小児:カルチノイド腫瘍、小児;カルチノイド腫瘍、胃腸管;がん腫、副腎皮質;がん腫、膵島細胞;原発不明がん;中枢神経系リンパ腫、原発性;小脳星状細胞腫、小児;脳星状細胞腫/悪性神経膠腫、小児;子宮頸がん;小児がん;慢性リンパ性白血病;慢性骨髄性白血病;慢性骨髄増殖性疾患;腱鞘の明細胞肉腫;結腸がん;結腸直腸がん、小児;皮膚T細胞リンパ腫;子宮内膜がん;上衣腫、小児;上皮がん、卵巣;食道(Esophageal Cancer)がん;食道がん(Esophageal Cancer)、小児;ユーイングファミリー腫瘍;頭蓋外胚細胞腫瘍、小児;性腺外胚細胞腫瘍;肝外胆管がん;眼のがん、眼内黒色腫;眼のがん、網膜芽細胞腫;胆嚢がん;胃(Gastric)(胃(Stomach))がん;胃(Gastric)(胃(Stomach))がん、小児;胃腸管カルチノイド腫瘍;胚細胞腫瘍、頭蓋外、小児;胚細胞腫瘍、性腺外;胚細胞腫瘍、卵巣;妊娠性絨毛腫瘍;神経膠腫、小児脳幹;神経膠腫、小児視経路および視床下部;有毛細胞白血病;頭頸部がん;肝細胞(肝臓)がん、成人(原発性);肝細胞(肝臓)がん、小児(原発性);ホジキンリンパ腫、成人;ホジキンリンパ腫、小児;妊娠中のホジキンリンパ腫;下咽頭がん;視床下部および視経路神経膠腫、小児;眼内黒色腫;膵島細胞がん(内分泌膵臓);カポジ肉腫;腎臓がん;喉頭がん;喉頭がん、小児;白血病、急性リンパ芽球性、成人;白血病、急性リンパ芽球性、小児;白血病、急性骨髄性、成人;白血病、急性骨髄性、小児;白血病、慢性リンパ性;白血病、慢性骨髄性;白血病、有毛細胞;口唇がんおよび口腔がん;肝臓がん、成人(原発性);肝臓がん、小児(原発性);肺がん、非小細胞;肺がん、小細胞;リンパ芽球性白血病、成人急性;リンパ芽球性白血病、小児急性;リンパ球性白血病、慢性;リンパ腫、AIDS関連;リンパ腫、中枢神経系(原発性);リンパ腫、皮膚T細胞;リンパ腫、ホジキンリンパ腫、成人;リンパ腫、ホジキンリンパ腫、小児;リンパ腫、妊娠中のホジキン;リンパ腫、非ホジキン、成人;リンパ腫、非ホジキンリンパ腫、小児;リンパ腫、妊娠中の非ホジキン;リンパ腫、原発性中枢神経系;マクログロブリン血症、ワルデンシュトレーム型;男性の乳がん;悪性中皮腫、成人;悪性中皮腫、小児;悪性胸腺腫;髄芽腫、小児;黒色腫;黒色腫、眼内;メルケル細胞がん;中皮腫、悪性;原発不明の転移性扁平頸部上皮がん;多発性内分泌腺腫症症候群、小児;多発性骨髄腫/形質細胞新生物;菌状息肉腫;骨髄異形成症候群;骨髄性白血病、慢性;骨髄性白血病、小児急性;骨髄腫、多発性;骨髄増殖性疾患、慢性;鼻腔および副鼻腔がん;上咽頭がん;鼻咽頭がん、小児;神経芽細胞腫;非ホジキンリンパ腫、成人;非ホジキンリンパ腫、小児;妊娠中の非ホジキンリンパ腫;非小細胞肺がん;口腔がん、小児;口腔がんおよび口唇がん;中咽頭がん;骨肉腫/骨の悪性線維性組織球腫;卵巣がん、小児;卵巣上皮がん;卵巣胚細胞腫瘍;卵巣低悪性度腫瘍;膵臓がん;膵臓がん、小児、膵臓がん、膵島細胞;副鼻腔がんおよび鼻腔がん;副甲状腺がん;陰茎がん;褐色細胞腫;松果体およびテント上原始神経外胚葉性腫瘍、小児;下垂体腫瘍;形質細胞新生物/多発性骨髄腫;胸膜肺芽腫;妊娠および乳がん;妊娠およびホジキンリンパ腫;妊娠および非ホジキンリンパ腫;原発性中枢神経系リンパ腫;原発性肝臓がん、成人;原発性肝臓がん、小児;前立腺がん;直腸がん;腎細胞(腎臓)がん;腎細胞がん、小児;腎盂尿管、移行上皮がん;網膜芽細胞腫;横紋筋肉腫、小児;唾液腺がん;唾液腺がん、小児;肉腫、ユーイングファミリー腫瘍;肉腫、カポジ肉腫;肉腫(骨肉腫V骨の悪性線維性組織球腫;肉腫、横紋筋肉腫、小児;肉腫、軟部組織、成人;肉腫、軟部組織、小児;セザリー症候群;皮膚ガン;皮膚がん、小児;皮膚がん(黒色腫);皮膚がん、メルケル細胞;小細胞肺がん;小腸がん;軟部組織肉腫、成人;軟部組織肉腫、小児;原発不明の頸部扁平上皮がん、転移性;胃(胃)がん;胃(Stomach)(胃(Gastric))がん、小児;テント上原発性神経外胚葉性腫瘍、小児;T細胞リンパ腫、皮膚;精巣がん;胸腺腫、小児;胸腺腫、悪性;甲状腺がん;甲状腺がん、小児;腎盂および尿管の移行細胞がん;絨毛性腫瘍、妊娠中;原発部位不明のがん、小児;小児の異常ながん;尿管および腎盂、移行上皮がん;尿道がん;子宮肉腫;膣がん;視経路および視床下部神経膠腫、小児;外陰がん;ワルデンシュトレーム型マクログロブリン血症;およびウィルムス腫瘍が挙げられる。
特定の態様では、がんとしては、肺がん、乳がん、結腸直腸がん、前立腺がん、胃がん、肝がん、子宮頸がん、食道がん、膀胱がん、非ホジキンリンパ腫、白血病、膵臓がん、腎臓がん、子宮内膜がん、頭頸部がん、口唇がん、口腔がん、甲状腺がん、脳がん、卵巣がん、黒色腫、胆嚢がん、喉頭がん、多発性骨髄腫、鼻咽頭がん、ホジキンリンパ腫、精巣がん、およびカポジ肉腫が挙げられる。
特定の態様では、本方法は、化学療法剤を投与する工程をさらに含む。本開示の化合物は、1つ以上の追加の治療剤と組み合わせて投与することができる。「併用療法」、「と組み合わせた」などの語句は、応答を増加させるために2つ以上の薬物または治療を同時に使用することを指す。本開示のFGFR阻害剤は、例えば、がんを治療するために使用される他の薬物または治療と併用され得る。様々な態様では、化合物は、化学療法剤の投与の前に、該投与と同時に、または該投与の後に投与される。
「抗がん療法」という用語は、がんの治療に使用することができる任意の療法または治療を指す。抗がん療法には、手術、放射線療法、化学療法、免疫療法、および標的療法が含まれるが、これらに限定されない。
化学療法剤または抗がん剤の例としては、アクチノマイシン、アザシチジン、アザチオプリン、ブレオマイシン、ボルテゾミブ、カルボプラチン、カペシタビン、シスプラチン、クロランブシル、シクロホスファミド、シタラビン、ダウノルビシン、ドセタキセル、ドキシフルリジン、ドキソルビシン、エピルビシン、エポチロン、エトポシド、フルオロウラシル、ゲムシタビン、ヒドロキシ尿素、イダルビシン、イマチニブ、イリノテカン、メクロレタミン、メルカプトプリン、メトトレキサート、ミトキサントロン、オキサリプラチン、パクリタキセル、ペメトレキセド、テニポシド、チオグアニン、トポテカン、バルビシン、ビンブラスチン、ビンクリスチン、ビンデシン、ビノレルビン、パニツママブ、アービタックス(セツキシマブ)、マツズマブ、IMC-IIF8、TheraCIM hR3、デノスマブ、アバスチン(ベバシズマブ)、ヒュミラ(アダリムマブ)、ハーセプチン(トラスツズマブ)、レミケード(インフィリキシマブ)、リツキシマブ、シナギス(パリビズマブ)、ミロタルグ(ゲムツズマブオゾガマイシン)、ラプチバ(エファリズマブ)、タイサブリ(ナタリズマブ)、ゼナパックス(ダクリキシマブ)、NeutroSpec(テクネチウム(99mTc)ファノレソマブ)、トシリズマブ、ProstaScint(インジウム-Ill標識カプロマブペンデチド)、ベキサール(トシツモマブ)、イットリウム90に結合したゼバリン(イブリツモマブチウキセタン(IDEC-Y2B8)、ゾレア(オマリズマブ)、MabThera(リツキシマブ)、ReoPro(アブシキシマブ)、MabCampath(バシリキシマブ)、LeukoScan(スレソマブ)、CEA-スキャン(アルシツモマブ)、ベルルマ(ノフェツモマブ)、パノレックス(エドレコロマブ)、アレムツズマブ、CDP870、ナタリズマブギロトリフ(アファチニブ)、リンパルザ(オラパリブ)、ペルジェタ(ペルツズマブ)、オプチーボ(ニボルマブ)、ボシュリフ(ボスチニブ)、カボメティクス(カボザンチニブ)、オギブリ(トラスツズマブ-dkst)、スーテント(リンゴ酸スニチニブ)、アドセトリス(ブレンツキシマブベドチン)、アレセンサ(アレクチニブ)、カルケンス(アカラブルチニブ)、イエスカルタ(シロレウセル)、ヴェルゼニオ(アベマシクリブ)、キイトルーダ(ペムブロリズマブ)、アリコパ(コパンリシブ)、ネルリンクス(ネラチニブ)、イミフィンジ(デュルバルマブ)、ダラザレックス(ダラツムマブ)、テセントリク(アテゾリズマブ)、およびタルセバ(エルロチニブ)が挙げられるが、これらに限定されない。免疫療法剤の例としては、インターロイキン(Il-2、Il-7、Il-12)、サイトカイン(インターフェロン、G-CSF、イミキモド)、ケモカイン(CCL3、CCl26、CXCL7)、免疫調節イミド薬(サリドマイドおよびその類似体)が挙げられるが、これらに限定されない。
さらなる実施形態では、本開示は、細胞を式(I)、式(II)、または式(III)の化合物と接触させる工程を含む、キナーゼ活性を阻害する方法を提供する。一態様では、キナーゼは、ALK、EGFR、EPH-B3、FAK、FGFR1、FGFR2、FGFR3、FGFR4、KIT、MEK1、MET、PDGFR-ALPHA、PDGFR-BETA、RET、ROS、およびTYRO3からなる群から選択される。特定の態様では、キナーゼは、FGFR1、FGFR2、FGFR3、および/またはFGFR4である。別の態様では、キナーゼは、FGFR4である。様々な態様では、細胞は、がん細胞である。多くの態様では、がん細胞は、乳がん、肺がん、膀胱がん、前立腺がん、卵巣がん、子宮内膜がん、横紋筋肉腫、肝臓がん、または胃がんの細胞である。
図1を参照すると、FGFR4キナーゼは、受容体のヒンジ領域におけるATP結合部位の近くに位置するシステイン(Cys552)を含み、これはFGFRファミリー内で特有であり、他のキナーゼの中では稀である。FGFR4キナーゼの共有結合阻害剤は、システイン残基中のチオール基(SH)を共有結合的に標的化することにより、FGFRの強力かつ選択的な阻害をもたらす。
いくつかの実施形態による本開示で用いるスクリーニング方法は、以下のように記載される。生細胞または生きた動物に対するスクリーニングプローブは、(1)生細胞を求電子プローブで処理することにより、標的タンパク質とプローブとの間の共有結合が生じる工程、(2)細胞を溶解する工程、(3)ビオチン-アジドを添加して、銅触媒アジド-アルキン環化付加(CuAAC)クリック反応により、ビオチンをプローブ修飾タンパク質にコンジュゲートする工程、(4)ストレプトアビジン樹脂を使用して、ビオチン結合タンパク質をプルダウンし、濃縮する工程、(5)樹脂結合タンパク質をトリプシンで消化する工程、(6)得られたトリプチンペプチドを液体クロマトグラフィー-質量分析(LC-MS)またはMSで分析する工程、(7)標的タンパク質の同一性および細胞中のプローブ標的相互作用の強度に関する情報を得る工程を含むことができる。標的の確認および選択は、(1)ウェスタンブロットなどの直交(orthogonal)方法を使用して、同定されたタンパク質がプローブに実際に結合することを確認する工程、ならびに(2)さらなる前臨床および臨床研究のために最も疾患に関連する標的リード対を選択する工程を含むことができる。
以下に、考察された用途のために企図される、新規のピリジニルピリミジン系FGFR阻害剤の設計および有効性の評価を論じる実施例を提示する。以下の実施例は、本開示の実施形態をさらに例示するために提供されるが、本開示の範囲を限定することを意図するものではない。それらは、使用され得るものの典型であるが、当業者に既知の他の手順、方法、または技術が代替的に使用されてもよい。
実施例1:ピリジニルピリミジン系FGFR阻害剤(化合物1~4)の合成および特徴付け
スキーム1.化合物1の合成
化合物1を合成スキーム1に基づいて合成した。
化合物2を合成スキーム2に基づいて合成した。
化合物3を合成スキーム3に基づいて合成した。
化合物4を合成スキーム4に基づいて合成した。
実施例2:化合物6の合成
(N-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-5-(1-メチルアゼチジン-3-イル)オキシ-フェニル]プロプ-2-エンアミド)
スキーム5.化合物6の合成
化合物6を合成スキーム5に基づいて合成した。各工程の合成プロセスを以下に記載する。
化合物6を合成するための工程1:DMF(60mL)中の4-アミノ-3-ニトロ-フェノール(3g、19.46mmol)、tert-ブチル3-ヨードアゼチジン-1-カルボキシレート(6.06g、21.41mmol)、Cs
2CO
3(9.51g、29.20mmol)の溶液を、N
2雰囲気下、90℃で16時間撹拌した。混合物を水(5mL)で希釈し、EtOAc(10mL×3)で抽出し、次いで、合わせた有機層を飽和NaCl(5mL×7)水溶液で洗浄し、Na
2SO
4で乾燥させ、濾過し、濃縮した。残渣をシリカゲルクロマトグラフィー(PE/EtOAc=1/0~3/1)により精製し、tert-ブチル3-(4-アミノ-3-ニトロ-フェノキシ)アゼチジン-1-カルボキシレート(5.4g、17.46mmol、収率90%)を赤色固体として得た。
化合物6を合成するための工程2:DMAc(15mL)中のN-(2,6-ジクロロ-3,5-ジメトキシ-フェニル)-3-(6-メチルスルホニルピリミジン-4-イル)ピリジン-2-アミン(800mg、1.76mmol)、tert-ブチル3-(4-アミノ-3-ニトロ-フェノキシ)アゼチジン-1-カルボキシレート(652mg、2.11mmol)の溶液に、t-BuOK(595mg、5.31mmol)を添加した。混合物を45℃で2時間撹拌した。混合物を水(20mL)で希釈し、EtOAcで抽出し(30mL×3)、次いで、合わせた有機層を飽和NaCl(20mL×7)水溶液で洗浄し、Na2SO4で乾燥させ、濾過し、濃縮した。残渣をシリカゲルクロマトグラフィー(PE/EtOAc=1/0~3/1)により精製し、tert-ブチル3-[4-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-3-ニトロ-フェノキシ]アゼチジン-1-カルボキシレート(648mg、0.947mmol、収率54%)を黄色固体として得た。
化合物6を合成するための工程3:ジオキサン(10mL)中のtert-ブチル3-[4-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-3-ニトロ-フェノキシ]アゼチジン-1-カルボキシレート(648mg、0.947mmol)の溶液に、HCl/ジオキサン(4M、2.37mL)を添加した。混合物を25℃で2時間撹拌した。混合物を濃縮して、N-[4-(アゼチジン-3-イルオキシ)-2-ニトロ-フェニル]-6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-アミン(550mg、0.886mmol、収率93%、HCl塩)を黄色固体として得た。
化合物6を合成するための工程4:MeOH(15mL)中のN-[4-(アゼチジン-3-イルオキシ)-2-ニトロ-フェニル]-6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-アミン(550mg、0.886mmol、HCl塩)の溶液に、HCHO水溶液(2.88g、35.43mmol、2.64mL、37%純度)、NaBH(OAc)3(376mg、1.77mmol)、CH3COOH(213mg、3.54mmol)を添加した。混合物を25℃で4時間撹拌した。混合物を濃縮し、残渣をシリカゲルクロマトグラフィー(DCM/MeOH=1/0~10/1)で精製して、6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-[4-(1-メチルアゼチジン-3-イル)オキシ-2-ニトロ-フェニル]ピリミジン-4-アミン(450mg、0.752mmol、収率85%)を赤色固体として得た。
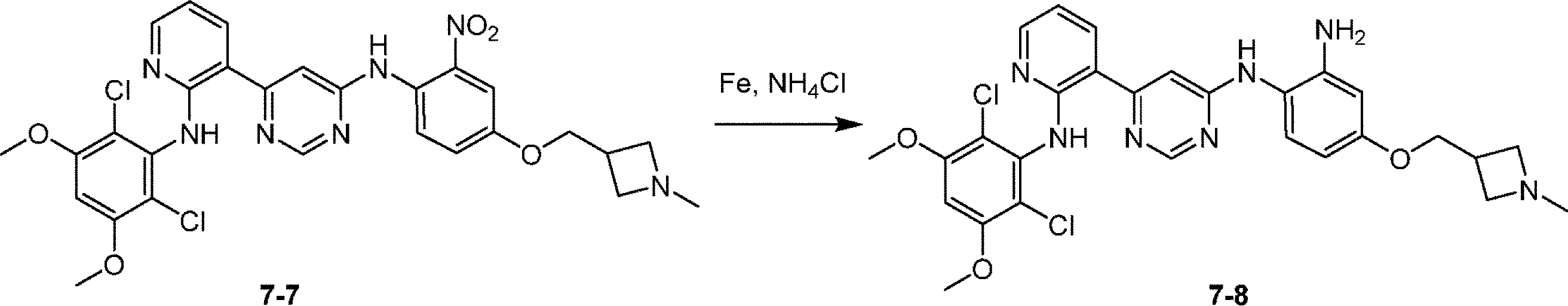
化合物6を合成するための工程5:THF(15mL)およびH2O(15mL)中の6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-[4-(1-メチルアゼチジン-3-イル)オキシ-2-ニトロ-フェニル]ピリミジン-4-アミン(450mg、0.752mmol)の溶液に、NH4Cl(201mg、3.76mmol)、Fe(210mg、3.76mmol)を添加した。混合物を65℃で4時間撹拌した。混合物を濾過し、濾液を濃縮して、N1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-4-(1-メチルアゼチジン-3-イル)オキシ-ベンゼン-1,2-ジアミン(400mg、0.704mmol、収率93%)を黄色固体として得た。
化合物6を合成するための工程6:DCM(10mL)中のN
1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-4-(1-メチルアゼチジン-3-イル)オキシ-ベンゼン-1,2-ジアミン(200mg、0.352mmol)の溶液に、Et
3N(36mg、0.352mmol)およびプロプ-2-エノイルクロリド(32mg、0.352mmol)を添加した。混合物を25℃で0.5時間撹拌した。混合物を水(10mL)で希釈し、DCM(10mL×3)で抽出し、次いで、合わせた有機層をNa
2SO
4で乾燥させ、濾過し、濃縮した。残渣を分取HPLC(水(0.225%FA)-ACN)により精製し、N-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-5-(1-メチルアゼチジン-3-イル)オキシ-フェニル]プロプ-2-エンアミド(8.5mg、収率4%、純度96%)を白色固体として得た。LCMS:t
R=2.928min in 0-60CD_4min_Pos_220&254_Shimadzu.lcm,
実施例3:化合物7の合成
N-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-5-[(1-メチルアゼチジン-3-イル)メトキシ]フェニル]プロプ-2-エンアミド
スキーム6.化合物7の合成
化合物7を合成スキーム6に基づいて合成した。各工程の合成プロセスを以下に記載する。
化合物7を合成するための工程1:DCM(5mL)中のtert-ブチル3-(ヒドロキシメチル)アゼチジン-1-カルボキシレート(2g、10.68mmol)の溶液に、DABCO(2.40g、21.36mmol)およびTsCl(2.44g、12.82mmol)を添加した。混合物を0℃で0.5時間撹拌した。混合物を濾過し、濾液をH2O(50mL)で希釈し、DCM(50mL×3)で抽出した。合わせた有機層を食塩水(50mL)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮して、tert-ブチル3-(p-トリルスルホニルオキシメチル)アゼチジン-1-カルボキシレート(3g、8.79mmol、収率82%)を無色の油状物として得、これを次の工程で直接使用した。
化合物7を合成するための工程2:DMF(20mL)のtert-ブチル3-(p-トリルスルホニルオキシメチル)アゼチジン-1-カルボキシレート(2g、5.86mmol)の溶液に、Cs2CO3(3.82g、11.72mmol)および4-アミノ-3-ニトロ-フェノール(1.35g、8.79mmol)を添加した。混合物を80℃で12時間撹拌した。混合物をH2O(50mL)を25℃で添加することによってクエンチし、次いでH2O(50mL)で希釈し、EtOAc(50mL×3)で抽出した。合わせた有機層を食塩水(50mL)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮して、残渣を得た。その後、残渣をフラッシュシリカゲルクロマトグラフィー(ISCO(登録商標);12gのSepaFlash(登録商標)シリカフラッシュカラム、0~50%酢酸エチル/石油エーテル勾配(40mL/分)の溶出液)により精製し、tert-ブチル3-[(4-アミノ-3-ニトロ-フェノキシ)メチル]アゼチジン-1-カルボキシレート(1.4g、4.33mmol、収率74%)を褐色固体として得た。
化合物7を合成するための工程3:DMF(5mL)中のtert-ブチル3-[(4-アミノ-3-ニトロ-フェノキシ)メチル]アゼチジン-1-カルボキシレート(1.4g、4.33mmol)の溶液に、t-BuOK(583mg、5.20mmol)およびN-(2,6-ジクロロ-3,5-ジメトキシ-フェニル)-3-(6-メチルスルホニルピリミジン-4-イル)ピリジン-2-アミン(1.97g、4.33mmol)を添加した。混合物を40℃で2時間撹拌した。混合物をH2O(50mL)を25℃で添加することによってクエンチし、次いでH2O(50mL)で希釈し、EtOAc(50mL×3)で抽出した。合わせた有機層を食塩水(50mL)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮して、残渣を得た。その後、残渣をフラッシュシリカゲルクロマトグラフィー(ISCO(登録商標);12gのSepaFlash(登録商標)シリカフラッシュカラム、0~70%酢酸エチル/石油エーテル勾配(40mL/分)の溶出液)により精製し、tert-ブチル3-[[[4-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシアニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-3-ニトロ-フェノキシ]メチル]アゼチジン-1-カルボキシレート(1g、1.29mmol、収率30%、純度90%)を黄色固体として得た。
化合物7を合成するための工程4:HCl/ジオキサン(4M、10mL)中のtert-ブチル3-[[4-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-3-ニトロ-フェノキシ]メチル]アゼチジン-1-カルボキシレート(0.95g、1.36mmol)の溶液を、25℃で0.5時間撹拌した。混合物を減圧下で濃縮し、N-[4-(アゼチジン-3-イルメトキシ)-2-ニトロ-フェニル]-6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-アミン(1.17g,1.35mmol、収率99%、純度69%)を黄色固体として得て、これを次の工程で直接使用した。
化合物7を合成するための工程5:MeOH(10mL)中のN-[4-(アゼチジン-3-イルメトキシ)-2-ニトロ-フェニル]-6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-アミン(1g,1.22mmol)の溶液に、HCHO水溶液(3.96g,48.79mmol、3.63mL、純度37%)、CH3COOH(293mg、4.88mmol)、およびNaBH(OAc)3(517mg、2.44mmol)を添加した。混合物を25℃で4時間撹拌した。混合物を減圧下で濃縮し、残渣を得た。その後、残渣をフラッシュシリカゲルクロマトグラフィー(ISCO(登録商標);12gのSepaFlash(登録商標)シリカフラッシュカラム、0~80%の酢酸エチル/石油エーテル勾配(60mL/分)の溶出液)により精製し、6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-[4-[(1-メチルアゼチジン-3-イル)メトキシ]-2-ニトロ-フェニル]ピリミジン-4-アミン(0.5g、0.735mmol、収率60%、純度90%)を黄色固体として得た。
化合物7を合成するための工程6:THF(1mL)およびH2O(1mL)の6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-[4-[(1-メチルアゼチジン-3-イル)メトキシ]-2-ニトロ-フェニル]ピリミジン-4-アミン(0.5g,0.816mmol)の溶液に、Fe(228mg、4.08mmol)およびNH4 Cl(218mg、4.08mmol)を添加した。混合物を60℃で5時間撹拌した。混合物を濾過し、濾液を減圧下で濃縮して残渣を得た。その後、混合物をH2O(50mL)を25℃で添加することによってクエンチし、次いで、H2O(50mL)で希釈し、EtOAc(50mL×3)で抽出した。合わせた有機層を食塩水(50mL)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮して、N1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-4-[(1-メチルアゼチジン-3-イル)メトキシ]ベンゼン-1,2-ジアミン(350mg、0.60mmol、収率74%)を褐色固体として得た。
化合物7を合成するための工程7:DCM(5mL)中のN
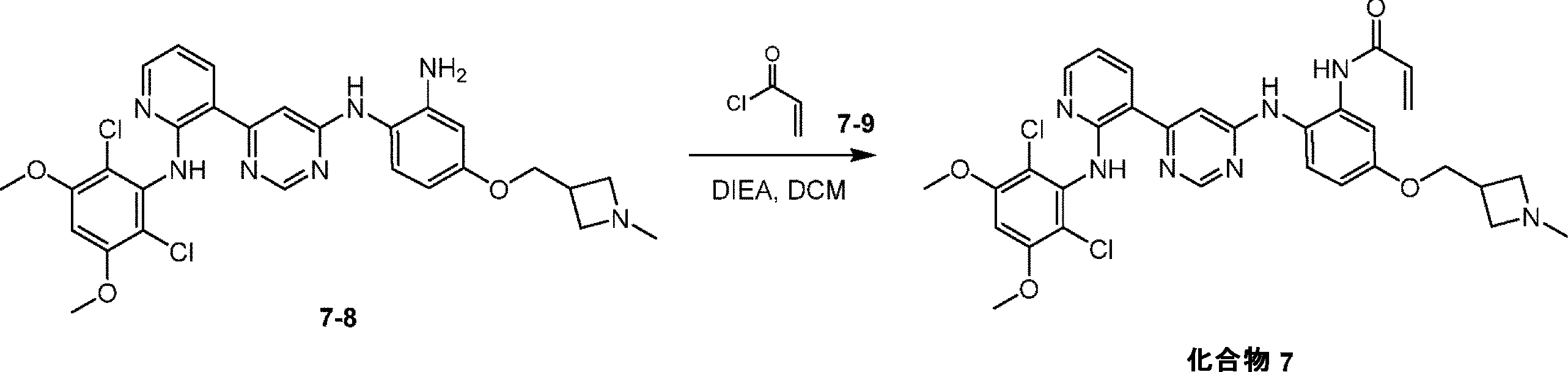
1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-4-[(1-メチルアゼチジン-3-イル)メトキシ]ベンゼン-1,2-ジアミン(0.2g、0.343mmol)の溶液に、DIEA(133mg、1.03mmol)およびプロプ-2-エノイルクロリド(34mg、0.378mmol)を添加した。混合物を0℃で0.5時間撹拌した。混合物をH
2O(50mL)を25℃で添加することによってクエンチした後、H
2O(50mL)で希釈し、DCM(50mL×3)で抽出した。合わせた有機層を食塩水(50mL)で洗浄し、Na
2SO
4で乾燥させ、濾過し、減圧下で濃縮して、残渣を得た。その後、残渣を分取HPLC(水(0.225% FA)-ACN)により精製し、N-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-5-[(1-メチルアゼチジン-3-イル)メトキシ]フェニル]プロプ-2-エンアミド(4.8mg、収率2%、純度92.8%)を白色固体として得た。LCMS:t
R=1.425 min in 10-80AB_4min_220&254_Shimadzu.lcm,
実施例4:化合物8の合成
N-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-5-[(1-メチル-4-ピペリジル)オキシ]フェニル]プロプ-2-エンアミド
スキーム7.化合物8の合成
化合物8を合成スキーム7に基づいて合成した。各工程の合成プロセスを以下に記載する。
化合物8を合成するための工程1:THF(10mL)中の1-メチルピペリジン-4-オール(1.3g、11.29mmol)の溶液に、KOH(2.53g、45.15mmol)およびTsCl(3.23g、16.93mmol)を0℃で添加した。混合物を25℃で16時間撹拌した。混合物を水(30mL)中に注ぎ、濾過した。濾過ケーキを収集し、乾燥させて、(1-メチル-4-ピペリジル)4-メチルベンゼンスルホネート(1.8g、6.68mmol、収率59%)を黄色の油状物として得た。
化合物8を合成するための工程2:DMF(20mL)中の4-アミノ-3-ニトロ-フェノール(400mg、2.60mmol)および(1-メチル-4-ピペリジル)4-メチルベンゼンスルホネート(1.05g、3.89mmol)の溶液に、Cs2CO3(1.69g、5.19mmol)を添加した。混合物を80℃で8時間撹拌した。残渣をEtOAc(20mL)で希釈し、H2O(60mL)で抽出した。合わせた有機層をH2O(30mL×2)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮して、残渣を得た。残渣をフラッシュシリカゲルクロマトグラフィー(ISCO(登録商標);12gのSepaFlash(登録商標)シリカフラッシュカラム、0~10%メタノール/ジクロロメタンの溶出液(40mL/分))により精製し、5-[(1-メチル-4-ピペリジル)オキシ]-2-ニトロ-アニリン(230mg、0.915mmol、収率35%)を褐色固体として得た。
化合物8を合成するための工程3:DMAc(10mL)中の4-[(1-メチル-4-ピペリジル)オキシ]-2-ニトロ-アニリン(138mg、0.549mmol)およびN-(2,6-ジクロロ-3,5-ジメトキシ-フェニル)-3-(6-メチルスルホニルピリミジン-4-イル)ピリジン-2-アミン(300mg、0.659mmol)の溶液に、tBuOK(123mg、1.10mmol)を添加した。混合物を50℃で2時間撹拌した。残渣をH2O(20mL)で希釈し、EtOAc(20mL×3)で抽出した。合わせた有機層をH2O(30mL×2)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮して、残渣を得た。残渣をフラッシュシリカゲルクロマトグラフィー(ISCO(登録商標);12gのSepaFlash(登録商標)シリカフラッシュカラム、0~10%メタノール/ジクロロメタンの溶出液(40mL/分))により精製し、6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-[4-[(1-メチル-4-ピペリジル)オキシ]-2-ニトロ-フェニル]ピリミジン-4-アミン(200mg、0.16mmol、収率29%)を褐色固体として得た。
化合物8を合成するための工程4:THF(10mL)中の6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-[4-[(1-メチル-4-ピペリジル)オキシ]-2-ニトロ-フェニル]ピリミジン-4-アミン(200mg、0.16mmol)の溶液に、NH4Cl(43mg、0.8mmol)およびFe(45mg、0.8mmol)を添加した。混合物を65℃で3時間撹拌した。混合物を珪藻土で濾過し、濾液を減圧下で濃縮して、残渣を得た。残渣をフラッシュシリカゲルクロマトグラフィー(ISCO(登録商標);12gのSepaFlash(登録商標)シリカフラッシュカラム、0~10%メタノール/ジクロロメタンの溶出液(40mL/分))により精製し、N1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-4-[(1-メチル-4-ピペリジル)オキシ]ベンゼン-1,2-ジアミン(38mg、0.064mmol、収率40%)を黄色固体として得た。
化合物8を合成するための工程5:DCM(10mL)およびDIEA(16mg、0.127mmol)中のN1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-4-[(1-メチル-4-ピペリジル)オキシ]ベンゼン-1,2-ジアミン(38mg、0.064mmol)の溶液に、プロプ-2-エノイルクロリド(7mg、0.076mmol)を添加した。混合物を0℃で0.5時間撹拌した。混合物を減圧下で濃縮し、残渣を得た。残渣を分取HPLC(水(0.225% FA)-ACN)により精製し、N-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-5-[(1-メチル-4-ピペリジル)オキシ]フェニル]プロプ-2-エンアミド(11.1mg、0.017mmol、収率27%、純度99.30%)を黄色固体として得た。
実施例5:化合物9の合成
N-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-5-(1-メチルピロリジン-3-イル)オキシ-フェニル]プロプ-2-エンアミド
スキーム8.化合物9の合成
化合物9を合成スキーム8に基づいて合成した。各工程の合成プロセスを以下に記載する。
化合物9を合成するための工程1:THF(30mL)中の1-メチルピロリジン-3-オール(1.0g、9.89mmol)およびKOH(2.22g、39.55mmol)の溶液に、TsCl(2.83g、14.83mmol)を0℃で添加した。混合物を25℃で16時間撹拌した。混合物を濾過し、濾液を濃縮して、(1-メチルピロリジン-3-イル)4-メチルベンゼンスルホネート(1.1g、4.31mmol、収率44%)を黄色油状物として得た。
化合物9を合成するための工程2:DMF(20mL)中の4-アミノ-3-ニトロ-フェノール(600mg、3.89mmol)の溶液に、Cs2CO3(2.54g、7.79mmol)を添加した。混合物を25℃で0.5時間撹拌し、次いで、(1-メチルピロリジン-3-イル)4-メチルベンゼンスルホネート(1.09g、4.28mmol)を添加した。混合物を80℃で6時間撹拌した。混合物を水(20mL)で希釈し、EtOAc(50mL×3)で抽出し、次いで、合わせた有機層を飽和NaCl(20mL×7)水溶液で洗浄し、Na2SO4で乾燥させ、濾過し、濃縮した。残渣をシリカゲルクロマトグラフィー(DCM/MeOH=1/0~10/1)により精製し、4-(1-メチルピロリジン-3-イル)オキシ-2-ニトロ-アニリン(600mg、2.53mmol、収率65%)を赤色固体として得た。
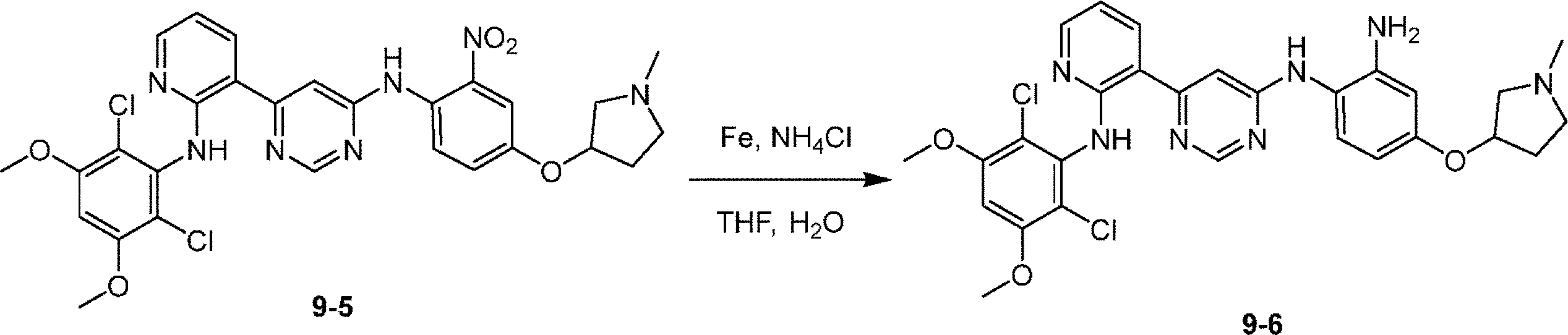
化合物9を合成するための工程3:DMAC(10mL)中の4-(1-メチルピロリジン-3-イル)オキシ-2-ニトロ-アニリン(200mg、0.843mmol)、N-(2,6-ジクロロ-3,5-ジメトキシ-フェニル)-3-(6-メチルスルホニルピリミジン-4-イル)ピリジン-2-アミン(422mg、0.927mmol)の溶液に、t-BuOK(286mg、2.55mmol)を添加した。混合物を40℃で2時間撹拌した。混合物を水(20mL)で希釈し、EtOAcで抽出し(50mL×3)、次いで、合わせた有機層をNa2SO4で乾燥させ、濾過し、濃縮して、6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-[4-(1-メチルピロリジン-3-イル)オキシ-2-ニトロ-フェニル]ピリミジン-4-アミン(500mg、粗製物)を黄色固体として得た。
化合物9を合成するための工程4:THF(10mL)およびH2O(10mL)中の6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-[4-(1-メチルピロリジン-3-イル)オキシ-2-ニトロ-フェニル]ピリミジン-4-アミン(300mg、0.49mmol)の溶液に、Fe(137mg、2.45mmol)およびNH4Cl(131mg、2.45mmol)を添加した。混合物を65℃で4時間撹拌した。混合物を濾過し、濾液をEtOAcで抽出し(30mL×3)、次いで、合わせた有機層をNa2SO4で乾燥させ、濾過し、濃縮して、N1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-4-(1-メチルピロリジン-3-イル)オキシ-ベンゼン-1,2-ジアミン(150mg、0.258mmol、収率52%)を黄色固体として得た。
化合物9を合成するための工程5:DCM(10mL)中のN
1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-4-(1-メチルピロリジン-3-イル)オキシ-ベンゼン-1,2-ジアミン(120mg、0.206mmol)の溶液に、プロプ-2-エノイルクロリド(19mg、0.206mmol)およびDIEA(27mg、0.206mmol)を添加した。混合物を25℃で1時間撹拌した。混合物を水(5mL)で希釈し、DCM(10mL×3)で抽出し、次いで、合わせた有機層をNa
2SO
4で乾燥させ、濾過し、濃縮した。残渣を分取HPLC(水(0.225% FA)-ACN)により精製し、N-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-5-(1-メチルピロリジン-3-イル)オキシ-フェニル]プロプ-2-エンアミド(50mg、0.0778mmol、収率38%、純度99%)を黄色固体として得た。LCMS:t
R=1.129min in10-80AB_4 min_220&254_Shimadzu.lcm,
実施例6:化合物10の合成
N-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-5-テトラヒドロフラン-3-イルオキシ-フェニル]プロプ-2-エンアミド
スキーム9.化合物10の合成
化合物10を合成スキーム9に基づいて合成した。各工程の合成プロセスを以下に記載する。
化合物10を合成するための工程1:THF(25mL)中の4-アミノ-3-ニトロ-フェノール(4g、25.95mmol)、テトラヒドロフラン-3-オール(2.29g、25.95mmol)、およびPPh
3(8.17g、31.14mmol)の溶液に、THF(25mL)中のDTBAD(8.96g、38.93mmol)の溶液を、N
2下、0℃で滴下して添加した。混合物を0℃で0.5時間撹拌し、次いで、25℃に15.5時間温めた。混合物を濃縮した。残渣をカラムクロマトグラフィー(SiO
2、石油エーテル/酢酸エチル=5/1~3/1)により精製し、残渣をCH
3CNから再結晶して、2-ニトロ-4-テトラヒドロフラン-3-イルオキシ-アニリン(1.1g、4.78mmol、収率18%、純度97.5%)を赤色固体として得た。LCMS:t
R=0.824 min in0-30AB_4 min_220&254_Shimadzu.lcm,
化合物10を合成するための工程2:DMAc(30mL)中のN-(2,6-ジクロロ-3,5-ジメトキシ-フェニル)-3-(6-メチルスルホニルピリミジン-4-イル)ピリジン-2-アミン(300mg、0.66mmol)および2-ニトロ-4-テトラヒドロフラン-3-イルオキシ-アニリン(296mg、1.32mmol)の溶液に、tBuOK(148mg、1.32mmol)を添加した。混合物を40℃で2時間撹拌した。混合物を水(60mL)中に注ぎ、濾過し、濾過ケーキを真空中で収集し、6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-(2-ニトロ-4-テトラヒドロフラン-3-イルオキシ-フェニル)ピリミジン-4-アミン(240mg、0.40mmol、収率61%)を黄色固体として得た。
化合物10を合成するための工程3:THF(10mL)およびH2O(10mL)中の6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-(2-ニトロ-4-テトラヒドロフラン-3-イルオキシ-フェニル)ピリミジン-4-アミン(240mg,0.40mmol)の溶液に、Fe(112mg、2.00mmol)およびNH4Cl(107mg、2.00mmol)を添加した。混合物を65℃で3時間撹拌した。混合物を珪藻土で濾過し、濾液を減圧下で濃縮して、N1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-4-テトラヒドロフラン-3-イルオキシ-ベンゼン-1,2-ジアミン(300mg、0.368mmol、収率92%、純度90%)を赤色固体として得た。LCMS:tR=0.922min in0-60AB_2min_220&254_Shimadzu.lcm,MS(ESI)m/z=569.1 [M+H]+。
化合物10を合成するための工程4:DCM(10mL)中のN
1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-4-テトラヒドロフラン-3-イルオキシ-ベンゼン-1,2-ジアミン(220mg、0.386mmol)の溶液、ならびにDIEA(100mg、0.772mmol)およびプロプ-2-エノイルクロリド(31mg、0.348mmol)を0℃で。混合物を0℃で0.5時間撹拌した。混合物を減圧下で濃縮した。残渣を分取HPLC(水(0.225% FA)-ACN)により精製し、N-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-5-テトラヒドロフラン-3-イルオキシ-フェニル]プロプ-2-エンアミド(100mg、0.159mmol、収率41%、純度99.2%)を黄色固体として得た。LCMS:t
R=2.148min in 0-60AB_4min_220&254_Shimadzu.lcm,
実施例7:化合物11の合成
N-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-5-(オキセタン-3-イルオキシ)フェニル]プロプ-2-エンアミド
スキーム10.化合物11の合成
化合物11を合成スキーム10に基づいて合成した。各工程の合成プロセスを以下に記載する。
化合物11を合成するための工程1:DMF(5mL)中の4-アミノ-3-ニトロ-フェノール(200mg、1.30mmol)の溶液に、Cs
2CO
3(846mg、2.60mmol)を添加した。混合物を25℃で0.5時間撹拌し、次いで、オキセタン-3-イル4-メチルベンゼンスルホネート(444mg、1.95mmol)を添加した。混合物を80℃に6時間加熱した。混合物を水(10mL)で希釈し、EtOAcで抽出し(20mL×3)、次いで、合わせた有機層をNa
2SO
4で乾燥させ、濾過し、濃縮した。残渣をシリカゲルクロマトグラフィー(PE/EtOAc=1/0~3/1)により精製し、2-ニトロ-4-(オキセタン-3-イルオキシ)アニリン(100mg、0.476mmol、収率37%)を赤色固体として得た。
化合物11を合成するための工程2:DMAc(10mL)中のN-(2,6-ジクロロ-3,5-ジメトキシ-フェニル)-3-(6-メチルスルホニルピリミジン-4-イル)ピリジン-2-アミン(300mg、0.659mmol)、2-ニトロ-4-(オキセタン-3-イルオキシ)アニリン(138mg、0.659mmol)の溶液に、t-BuOK(223mg、1.99mmol)を0℃で添加した。次いで、混合物を40℃に2時間加熱した。混合物を水(10mL)で希釈し、EtOAc(20mL×3)で抽出した。次いで、合わせた有機層を飽和NaCl水溶液(10mL×7)で洗浄し、Na2SO4で乾燥させ、濾過し、濃縮した。残渣をCH3CN(5mL)で25℃で5分間粉砕した。沈殿物を濾過し、乾燥させて、6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-[2-ニトロ-4-(オキセタン-3-イルオキシ)フェニル]ピリミジン-4-アミン(300mg、0.512mmol、収率78%)を黄色固体として得た。
化合物11を合成するための工程3:THF(10mL)およびH2O(10mL)中の6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-[2-ニトロ-4-(オキセタン-3-イルオキシ)フェニル]ピリミジン-4-アミン(200mg、0.34mmol)の溶液に、Fe(95mg、1.71mmol)およびNH4Cl(91mg、1.71mmol)を添加した。混合物を65℃で4時間撹拌した。混合物を室温に冷却し、濾過し、濾液を濃縮して、N1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-4-(オキセタン-3-イルオキシ)ベンゼン-1,2-ジアミン(180mg、粗製物)を黄色固体として得た。
化合物11を合成するための工程4:DCM(15mL)中のN
1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-4-(オキセタン-3-イルオキシ)ベンゼン-1,2-ジアミン(150mg、0.27mmol)の溶液に、プロプ-2-エノイルクロリド(19mg、0.216mmol)を0℃で添加した。混合物を25℃で0.5時間撹拌した。混合物を水(10mL)でクエンチし、次いで、DCM(50mL×3)で抽出し、Na
2SO
4で乾燥させ、濾過し、濃縮した。残渣を分取HPLC(カラム:Xtimate C18100*30mm*3um、水(0.04% NH
3・H
2O+10mM NH
4HCO
3)-ACN;63~83%のB;勾配時間:30分;流量:25mL/分)により精製し、次いでキラルSFC(機器:CAS-QD-ANA-SFC-SD(DAD検出器を備えたAgilent 1260)、カラム:Chiralcel OJ-3 100×4.6mm内径、3um.移動相:A:CO
2B:エタノール(0.05% DEA)、勾配:5%~40%のBを4.5分間、40%を2.5分間保持、次いで5%のBを1分間、流速:2.8mL/分、カラム温度:40℃)によりさらに精製し、N-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-5-(オキセタン-3-イルオキシ)フェニル]プロプ-2-エンアミド(30mg、0.049mmol、収率18%、純度100%)を黄色固体として得た。LCMS:t
R=2.023 min in:10-80CD_4min_Pos_220&254_Shimadzu.lcm,
実施例8:化合物12の合成
N-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-5-(2-ピロリジン-1-イルエトキシ)フェニル]プロプ-2-エンアミド
スキーム11.化合物12の合成
化合物12を合成スキーム11に基づいて合成した。各工程の合成プロセスを以下に記載する。
化合物12を合成するための工程1:DCM(10mL)中に溶解した4-アミノ-3-ニトロ-フェノール(1.5g、9.73mmol)、Boc2O(3.19g、14.60mmol)、およびEt3NN(984mg、9.73mmol)。次いで、DMAP(118mg、0.973mmol)のDCM溶液(10mL)を上記溶液にゆっくりと滴下して添加した。次いで、混合物を25℃で2時間撹拌した。混合物を減圧下で濃縮し、DCMを除去した。残渣をシリカゲルクロマトグラフィー(ISCO(登録商標);20gのSepaFlash(登録商標)シリカフラッシュカラム、0~30%酢酸エチル/石油エーテル勾配(40mL/分)の溶出液)により精製し、tert-ブチルN-(4-ヒドロキシ-2-ニトロ-フェニル)カルバメート(2.35g、収率95%)を黄色固体として得た。LCMS:tR=1.169min in 10-80AB_2min_220&254_Shimadzu.lcm,MS(ESI)m/z=255.1[M+H]+。
化合物12を合成するための工程2:DMF(100mL)中の1-(2-クロロエチル)ピロリジン(2.25g、13.22mmol、HCl塩)、tert-ブチルN-(4-ヒドロキシ-2-ニトロ-フェニル)カルバメート(2.8g、11.01mmol)、Cs2CO3(7.18g、22.03mmol)の溶液を50℃で8時間撹拌した。混合物をEtOAc(200mL×5)で抽出した。合わせた有機層をH2O(50mL×6)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮して、残渣を得た。残渣をフラッシュシリカゲルクロマトグラフィー(ISCO(登録商標);20gのSepaFlash(登録商標)シリカフラッシュカラム、0~35%酢酸エチル/石油エーテル勾配(40mL/分)の溶出液)により精製し、tert-ブチルN-[2-ニトロ-4-(2-ピロリジン-1-イルエトキシ)フェニル]カルバメート(1.2g、収率31%)を黒色固体として得た。LCMS:tR=0.980min in 10-80 AB_2min_220&254_Shimadzu.lcm,MS(ESI)m/z=352.1[M+H]+。
化合物12を合成するための工程3:MeOH(20mL)中のtert-ブチルN-[2-ニトロ-4-(2-ピロリジン-1-イルエトキシ)フェニル]カルバメート(1.2g、3.41mmol)、HCl/ジオキサン(4M、0.85mL)の混合物を25℃で1時間撹拌した。飽和水溶液をNaHCO3添加することにより混合物をpH=8に調整し、得られた混合物を濃縮して、2-ニトロ-4-(2-ピロリジン-1-イルエトキシ)アニリン(1.0g、粗製物)を黄色固体として得た。LCMS:tR=0.882 min in 0-60 AB_2min_220&254_Shimadzu.lcm,MS(ESI)m/z=252.1[M+H]+。
化合物12を合成するための工程4:DMF(30mL)中のN-(2,6-ジクロロ-3,5-ジメトキシ-フェニル)-3-(6-メチルスルホニルピリミジン-4-イル)ピリジン-2-アミン(352mg、0.659mmol)、2-ニトロ-4-(2-ピロリジン-1-イルエトキシ)アニリン(500mg、1.99mmol)の溶液に、t-BuOK(223mg、1.99mmol)を0℃で添加した。次いで、混合物をN2雰囲気下、40℃で2時間撹拌した。混合物をEtOAc(150mL×5)で抽出した。合わせた有機層をH2O(30mL×6)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮して、残渣を得た。残渣をフラッシュシリカゲルクロマトグラフィー(ISCO(登録商標);12gのSepaFlash(登録商標)シリカフラッシュカラム、0~15%MeOH/DCM勾配(20mL/分)の溶出液)により精製し、6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-[2-ニトロ-4-(2-ピロリジン-1-イルエトキシ)フェニル]ピリミジン-4-アミン(539mg、収率69%、純度53%)を黄色固体として得た。LCMS:tR=1.004 min in 10-80 AB_2min_220&254_Shimadzu.lcm,MS(ESI)m/z=626.1[M+H]+。
化合物12を合成するための工程5:MeOH(30mL)中の6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-[2-ニトロ-4-(2-ピロリジン-1-イルエトキシ)フェニル]ピリミジン-4-アミン(400mg、0.638mmol)およびPd/C(500mg、10%純度)の混合物を、H2雰囲気下、25℃で2時間撹拌した。混合物を濾過し、減圧下で濃縮して、残渣を得た。混合物を濃縮して、N1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-4-(2-ピロリジン-1-イルエトキシ)ベンゼン-1,2-ジアミン(200mg、粗製物)を黒色固体として得た。LCMS:tR=1.218min in 10-80 AB_4min_220&254_Shimadzu.lcm,MS(ESI)m/z=596.3[M+H]+。
化合物12を合成するための工程6:DCM(4mL)中のN
1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-4-(2-ピロリジン-1-イルエトキシ)ベンゼン-1,2-ジアミン(150mg、0.251mmol)およびEt
3N(28mg、0.277mmol)の溶液に、DCM(3mL)中のプロプ-2-エノイルクロリド(25mg、0.277mmol)の溶液を0℃で滴下して添加した。混合物を25℃で0.5時間撹拌した。混合物を減圧下で濃縮し、DCMを除去した。残渣を分取HPLC(カラム:Xtimate C18100*30mm*3um水(0.04% NH
3.H
2O+10mM NH
4HCO
3)-ACN;63~83%のB;勾配時間:30分;流量:25mL/分)により精製し、N-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-5-(2-ピロリジン-1-イルエトキシ)フェニル]プロプ-2-エンアミド(9.1mg、収率5%、純度98%)を白色固体として得た。LCMS:t
R=1.550min in 10-80CD_4min_220&254_Shimadzu.lcm,
実施例9:化合物13の合成
N-[5-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-1-メチル-イミダゾール-4-イル]プロプ-2-エンアミド
スキーム12.化合物13の合成
化合物13を合成スキーム12に基づいて合成した。各工程の合成プロセスを以下に記載する。
化合物13を合成するための工程1:NH
3/MeOH(10mL、7M)中の5-クロロ-1-メチル-4-ニトロイミダゾール(2g、12.38mmol)の混合物を、オートクレーブ中で100℃で16時間撹拌した。混合物を室温に冷却し、沈殿物を濾過し、MeOH(10mL×2)で洗浄し、乾燥させて、3-メチル-5-ニトロ-イミダゾール-4-アミン(1.6g、11.26mmol、収率91%)を黄色固体として得た。
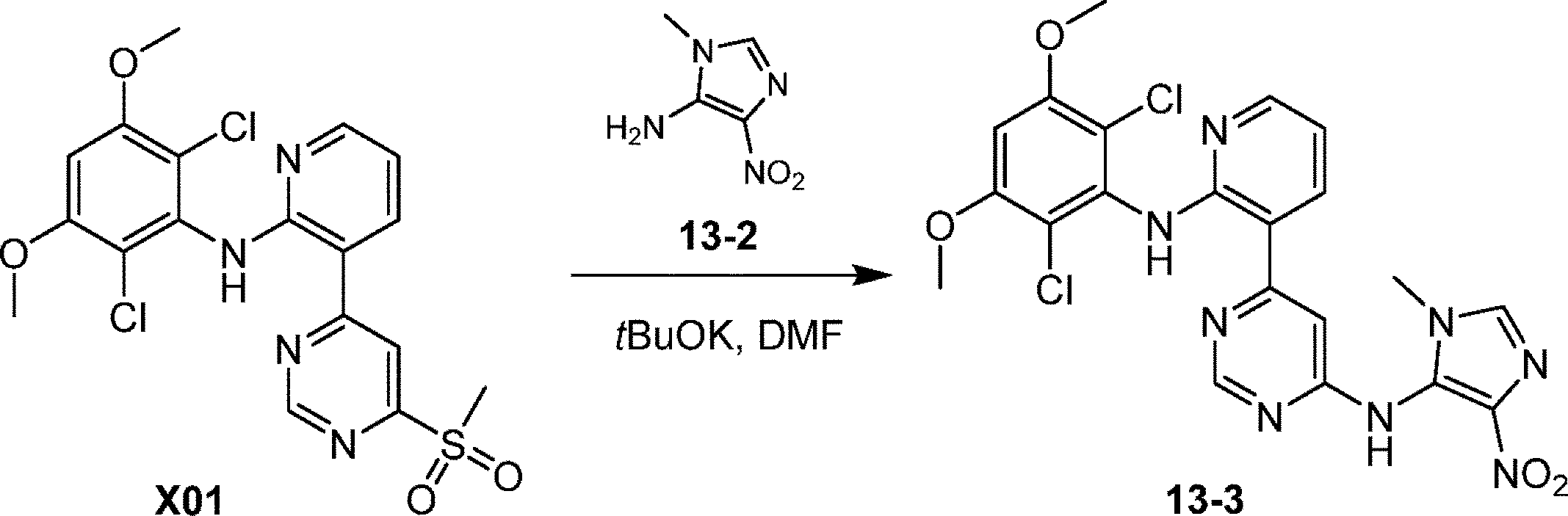
化合物13を合成するための工程2:DMF(20mL)中のN-(2,6-ジクロロ-3,5-ジメトキシ-フェニル)-3-(6-メチルスルホニルピリミジン-4-イル)ピリジン-2-アミン(500mg、1.10mmol)および3-メチル-5-ニトロ-イミダゾール-4-アミン(312mg、2.20mmol)の溶液に、tBuOK(246mg、2.20mmol)を添加した。混合物をN2雰囲気下、40℃で12時間撹拌した。混合物をH2O(20mL)で希釈し、EtOAc(10mL×2)で抽出した。合わせた有機層をH2O(10mL×3)で洗浄し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮して、残渣を得た。残渣をフラッシュシリカゲルクロマトグラフィー(ISCO(登録商標);12gのSepaFlash(登録商標)シリカフラッシュカラム、0~10%酢酸エチル/石油エーテル勾配(50mL/分)の溶出液)により精製し、6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-(3-メチル-5-ニトロ-イミダゾール-4-イル)ピリミジン-4-アミン(320mg、0.619mmol、収率56%)を黄色固体として得た。
化合物13を合成するための工程3:MeOH(5mL)中の6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]-N-(3-メチル-5-ニトロ-イミダゾール-4-イル)ピリミジン-4-アミン(300mg、0.58mmol)の溶液に、Pd/C(5mg、10%純度)をN2雰囲気下で添加した。懸濁液を脱気し、H2で3回パージした。混合物をH2(15psi)下、25℃で2時間撹拌した。液体を珪藻土で濾過し、濾液を減圧下で濃縮して、N5-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-1-メチル-イミダゾール-4,5-ジアミン(200mg、0.41mmol、収率71%)を褐色固体として得た。
化合物13を合成するための工程4:DCM(10mL)中のN
5-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]-1-メチル-イミダゾール-4,5-ジアミン(100mg、0.205mmol)およびDIEA(53mg、0.41mmol)の溶液に、プロプ-2-エノイルクロリド(15mg、0.164mmol)を0℃で添加した。混合物を0℃で0.5時間撹拌した。混合物を減圧下で濃縮し、残渣を分取HPLC(カラム:Phenomenex Luna C18 100*40mm*3um;水(0.225% FA)-ACN;20~40%のB;勾配時間:9分;流量:25mL/分)により精製し、N-[5-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]-1-メチル-イミダゾール-4-イル]プロプ-2-エンアミド(13.6mg、0.024mmol、収率12%、純度95.34%)を黄色固体として得た。LCMS:t
R=0.968min in10-80AB_4 min_220&254_Shimadzu.lcm,
実施例10:化合物14の合成
スキーム13.化合物14の合成
化合物14を合成スキーム13に基づいて合成した。各工程の合成プロセスを以下に記載する。
化合物14を合成するための工程1:酢酸エチル(600mL)中の化合物14-2(30.0g、194.8mmol、1.0当量)の混合物に、化合物14-1(19g、214mmol、1.1当量)およびトリフェニルホスフィン(56.0g、214.1mmol、1.1当量)を添加した。次いで、アゾジカルボン酸ジエチル(33.5mL、214.1mmol、1.1当量)を滴下して添加した。混合物を室温で一晩撹拌した。反応をTLCにより監視した。次いで、混合物をセライトのパッドを通して濾過し、漏斗を焼結した。得られた混合物を酢酸エチル(3×600mL)で抽出し、1NのHClおよび水を添加した。水相を酢酸エチルおよび水酸化アンモニウムで抽出した。合わせた有機相を無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲル(ジクロロメタン:メタノール、100:1~50:1~30:1)上のカラムクロマトグラフィーにより精製し、化合物14-3(4.6g、11%)を得た。
化合物14を合成するための工程2:ジメチルホルムアミド(60mL)中の化合物14-3(10.0g、44.4mmol、1.1当量)および化合物14-4(18.4g、40.4mmol、1.0当量)の混合物に、tert-ブトキシドカリウム(13.6g、121.2mmol、3.0当量)を窒素雰囲気下で添加した。次いで、混合物を40℃で2時間撹拌した。反応混合物のTLC分析は、所望の生成物への部分的な変換を示した。混合物を室温に冷却し、酢酸エチルおよび水で抽出した。合わせた有機物を食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲル(ジクロロメタン:メタノール、100:1~50:1)上のカラムクロマトグラフィーにより精製し、化合物14-5(5g、21%)を得た。
化合物14を合成するための工程3:エタノール/水(100mL/20mL)中の化合物14-5(5.0g、8.3mmol、1.0当量)の混合物に、Fe(2.33g、41.7mmol、5.0当量)および塩化アンモニウム(4.46g、83.4mmol、10.0当量)を添加した。次いで、混合物を85℃で2時間撹拌した。反応混合物のTLC分析は、所望の生成物への部分的な変換を示した。混合物を濾過し、酢酸エチル(120mL×3)で抽出した。合わせた有機物を食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲル(ジクロロメタン:メタノール、10:1)上のカラムクロマトグラフィーにより精製し、化合物14-6(4g、85%)を得た。
化合物14を合成するための工程4:ジクロロメタン(40mL)中の化合物14-6(4.0g、7.03mmol、1.0当量)の混合物に、化合物14-7(632.6mg、7.03mmol、1.0当量)を0℃で添加した。混合物を室温で2時間撹拌した。反応混合物のTLC分析は、所望の生成物への完全な変換を示した。次いで、混合物を水(200mL)でクエンチし、ジクロロメタン(40mL×2)で抽出した。合わせた有機層を無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲル(ジクロロメタン:メタノール、10:1)上のカラムクロマトグラフィーにより精製し、粗生成物(純度:90%)を得た。粗生成物をジクロロメタン(50mL)に溶解した。次いで、混合物を20%水酸化ナトリウム溶液(10mL)に添加した。混合物を室温で30分間撹拌した。次いで、混合物をジクロロメタンで抽出し、食塩水で洗浄した。合わせた有機層を無水硫酸ナトリウムで乾燥させ、減圧下で濃縮して、化合物14(2.0g、46%)を黄色固体として得た。
実施例11:化合物15の合成
スキーム14.化合物15の合成
化合物15を合成スキーム14に基づいて合成した。各工程の合成プロセスを以下に記載する。
化合物15を合成するための工程1:酢酸エチル(600mL)中の化合物15-2(30.0g、194.6mmol、1.0当量)の混合物に、化合物15-1(25.1g、214mmol、1.1当量)およびトリフェニルホスフィン(56.0g、214.1mmol、1.1当量)を添加した。次いで、アゾジカルボン酸ジエチル(33.5mL、214.1mmol、1.1当量)を滴下して添加した。混合物を室温で一晩撹拌した。反応をTLCにより監視した。次いで、混合物をセライトのパッドを通して濾過し、漏斗を焼結した。得られた混合物を酢酸エチル(3×600mL)で抽出し、1NのHClおよび水を添加した。水相を酢酸エチルおよび水酸化アンモニウムで抽出した。合わせた有機相を無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲル(ジクロロメタン:メタノール、100:1~50:1~30:1)上のカラムクロマトグラフィーにより精製し、化合物15-3(17.5g、36%)を得た。
化合物15を合成するための工程2:ジメチルホルムアミド(30mL)中の化合物15-3(2.2g、8.8mmol、2.0当量)および化合物15-4(2.0g、4.4mmol、1.0当量)の混合物に、tert-ブトキシドカリウム(1.48g、13.2mmol、3.0当量)を窒素雰囲気下で添加した。次いで、混合物を40℃で2時間撹拌した。反応混合物のTLC分析は、所望の生成物への部分的な変換を示した。混合物を室温に冷却し、酢酸エチルおよび水で抽出した。合わせた有機物を食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲル(ジクロロメタン:メタノール、100:1~50:1)上のカラムクロマトグラフィーにより精製し、化合物15-5(550mg、20%)を得た。
化合物15を合成するための工程3:エタノール/水(20mL/4mL)中の化合物15-5(1.0g、1.6mmol、1.0当量)の混合物に、Fe(446mg、8.0mmol、5.0当量)および塩化アンモニウム(880mg、16mmol、10.0当量)を添加した。次いで、混合物を80℃で2時間撹拌した。反応混合物のTLC分析は、所望の生成物への部分的な変換を示した。混合物を濾過し、酢酸エチル(20mL×3)で抽出した。合わせた有機物を食塩水で洗浄し、無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲル(ジクロロメタン:メタノール、10:1)上のカラムクロマトグラフィーにより精製し、化合物15-6(280mg、29%)を得た。
化合物15を合成するための工程4:ジクロロメタン(5mL)中の化合物15-6(280mg、0.47mmol、1.0当量)の混合物に、化合物15-7(42.5mg、0.47mmol、1.0当量)を0℃で添加した。混合物を室温で2時間撹拌した。反応混合物のTLC分析は、所望の生成物への完全な変換を示した。次いで、混合物を水(20mL)でクエンチし、ジクロロメタン(5mL×2)で抽出した。合わせた有機層を無水硫酸ナトリウムで乾燥させ、減圧下で濃縮した。残渣をシリカゲル(ジクロロメタン:メタノール、10:1)上のカラムクロマトグラフィーにより精製し、化合物15(81mg、29%)を黄色固体として得た。
実施例12:化合物16の合成
スキーム15.化合物16の合成
化合物16を合成スキーム15に基づいて合成した。各工程の合成プロセスを以下に記載する。
化合物16を合成するための工程1:I-PrOH(40mL)中の6-オキサビシクロ[3.1.0]ヘキサン(7g、83.22mmol)の溶液に、NH
3・H
2O(35.00g、249.65mmol、純度25%)を添加した。この混合物を密封チューブ中で60℃で16時間撹拌した。混合物を減圧下で濃縮し、トランス-2-アミノシクロペンタノール(26g、粗製物)を褐色油状物として得た。
化合物16を合成するための工程2:THF(220mL)中のトランス-2-アミノシクロペンタノール(22g、217.51mmol)の溶液に、TEA(26.41g、261.01mmol)およびBoc
2O(52.22g、239.26mmol、54.97mL、1.1当量)を添加した。混合物を15℃で16時間撹拌した。混合物を減圧下で濃縮し、THFを除去した。残渣をEtOAc(20mL)で希釈し、H
2O(20mL×3)で抽出し、Na
2SO
4で乾燥させ、濾過し、減圧下で濃縮して、残渣を得た。残渣をフラッシュシリカゲルクロマトグラフィー(ISCO(登録商標);80gのSepaFlash(登録商標)シリカフラッシュカラム、0~30%の酢酸エチル/石油エーテル勾配(60mL/分)の溶出液)により精製し、tert-ブチルN-[トランス-2-ヒドロキシシクロペンチル]カルバメート(14g、69.56mmol、収率32%)を白色固体として得た。
化合物16を合成するための工程3:THF(150mL)中のtert-ブチルN-[トランス-2-ヒドロキシシクロペンチル]カルバメート(14g、69.56mmol)、イソインドリン-1,3-ジオン(11.26g、76.52mmol)、PPh
3(20.07g、76.52mmol)、およびDIAD(16.18g、80.00mmol)の混合物を脱気し、N
2で3回パージし、次いで、0℃で1時間撹拌した。混合物を減圧下で濃縮し、THFを除去した。残渣をH
2O(150mL)で希釈し、EtOAc(150mL×3)で抽出し、Na
2SO
4で乾燥させ、濾過し、減圧下で濃縮して、残渣を得た。残渣をフラッシュシリカゲルクロマトグラフィー(ISCO(登録商標);80gのSepaFlash(登録商標)シリカフラッシュカラム、0~30%の酢酸エチル/石油エーテル勾配(80mL/分)の溶出液)により精製した。粗生成物をさらにEtOH(100mL)から80℃で再結晶し、次いで、沈殿物を濾過し、乾燥させて、tert-ブチルN-[シス-2-(1,3-ジオキソイソインドリン-2-イル)シクロペンチル]カルバメート(15g、45.40mmol、収率65%)を白色固体として得た。
化合物16を合成するための工程4:MeOH(50mL)中のtert-ブチルN-[シス-2-(1,3-ジオキソイソインドリン-2-イル)シクロペンチル]カルバメート(5g、15.13mmol)の溶液に、NH2NH2(709mg、16.65mmol、純度80%)を添加した。混合物を50℃で1.5時間撹拌した。混合物を減圧下で濃縮し、MeOHを除去した。残渣をH2O(50mL)で希釈し、次いでEtOAc(50mL×3)で抽出し、Na2SO4上で乾燥させ、濾過し、濃縮して、tert-ブチルN-[シス-2-アミノシクロペンチル]カルバメート(1.1g、5.49mmol、収率36%)を黄色の油状物として得た。
化合物16を合成するための工程5:DMAc(10mL)中のN-(2,6-ジクロロ-3,5-ジメトキシ-フェニル)-3-(6-メチルスルホニルピリミジン-4-イル)ピリジン-2-アミン(758mg、1.66mmol)およびtert-ブチルN-[シス-2-アミノシクロペンチル]カルバメート(1g、4.99mmol)の溶液に、DIEA(430mg、3.33mmol)を添加した。混合物を130℃で12時間撹拌した。混合物をH2O(20mL)で希釈し、EtOAc(20mL×3)で抽出し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮して、残渣を得た。残渣をフラッシュシリカゲルクロマトグラフィー(ISCO(登録商標);12gのSepaFlash(登録商標)シリカフラッシュカラム、0~30%の酢酸エチル/石油エーテル勾配(40mL/分)の溶出液)により精製し、tert-ブチルN-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]シクロペンチル]カルバメート(シス混合物、500mg、0.869mmol、収率52%)を黄色固体として得た。LCMS:tR=1.412 min in 10-80AB_2min_220&254_Shimadzu.lcm,MS(ESI)m/z=575.2[M+H]+。
化合物16を合成するための工程6:HCl/ジオキサン(4M、10mL)中のtert-ブチルN-[2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]シクロペンチル]カルバメート(500mg、0.868mmol、シス混合物)の溶液を25℃で0.5時間撹拌した。混合物を濃縮して、N1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]シクロペンタン-1,2-ジアミン(800mg、粗製物)を白色固体として得た。
化合物16を合成するための工程7:DCM(10mL)中のN1-[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]シクロペンタン-1,2-ジアミン(700mg、1.47mmol、シス混合物)の溶液に、DIEA(190mg、1.47mmol)およびプロプ-2-エノイルクロリド(67mg、0.736mmol)を添加した。混合物を0℃で0.5時間撹拌した。残渣をH2O(20mL)で希釈し、EtOAc(20mL×3)で抽出し、Na2SO4で乾燥させ、濾過し、減圧下で濃縮して、残渣を得た。残渣をフラッシュシリカゲルクロマトグラフィー(ISCO(登録商標);12gのSepaFlash(登録商標)シリカフラッシュカラム、0~10%ジクロロメタン/石油エーテル勾配(40mL/分)の溶出液)により精製して、所望の生成物(170mg、94%の純度)を白色固体として得て、これをSFC(カラム:DAICEL CHIRALPAK AD(250mm*30mm、10um);移動相:[0.1% NH3・H2O ETOH];B%:35%~35%、30分)により精製し、(+)N-[シス-2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]シクロペンチル]プロプ-2-エンアミド(43.7mg、0.081mmol、純度98.85%、単一シス異性体)および(-)N-[シス-2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]シクロペンチル]プロプ-2-エンアミド(46.5mg、087mmol、純度99.10%、単一シス異性体)を白色固体として得た。
(+)N-[シス-2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]シクロペンチル]プロプ-2-エンアミド(キラルSFCにおける第1のピーク)。LCMS:t
R=1.476min in10-80AB_4 min_220&254_Shimadzu.lcm,
キラルSFC:t
R=5.118分(計器列:Chiralpak AD-3 100×4.6mm内径、3um、移動相:A:CO
2B:エタノール(0.05% DEA)、勾配:5%~40%のBを4.5分間、40%を2.5分間保持、次いで5%のBを1分間;流量:2.8mL/分カラム温度:40℃、UV検出:220nm)、ee%=99%。[α]
D
20=+13(c=0.10、MeOH)。
(-)N-[シス-2-[[6-[2-(2,6-ジクロロ-3,5-ジメトキシ-アニリノ)-3-ピリジル]ピリミジン-4-イル]アミノ]シクロペンチル]プロプ-2-エンアミド(キラルSFCにおける第2のピーク)。LCMS:t
R=1.481 min in10-80AB_4 min_220&254_Shimadzu.lcm,
キラルSFC:t
R=6.002分(機器カラム:Chiralpak AD-3 100×4.6mm内径、3um、移動相:A:CO
2B:エタノール(0.05%DEA)、勾配:5%~40%のBを4.5分間、40%を2.5分間保持、次いで5%のBを1分間;流量:2.8mL/分 カラム温度:40℃、UV検出:220nm)、ee%=99.1%。[α]
D
20=-13(c=0.10、MeOH)。
実施例13:FGFR阻害剤のインビトロ有効性の評価
以下の表2は、本発明の化合物1および対照化合物5の特性を比較し、これにより、化合物1が、対照化合物5よりも溶解性、透過性、マウス血漿安定性、マウス肝臓ミクロソーム安定性、インビボ曝露、およびバイオアベイラビリティにおいて優れた特性を示すことが示される。本発明の化合物1は、FGFR4選択的阻害効果を改善する。より重要なことに、本発明化合物の血漿安定性は著しく改善される。また、対照化合物5は、5%DMSOおよび95%PBS(PBS中の20%HPBC)の溶液中の溶解性に乏しい。他方では、本発明の化合物1は、大幅に改善された溶解性を示し、これは投与を容易にする。
(表2)本発明の化合物1と対照化合物5との間の性質の比較
図2および3を参照すると、本発明の化合物5はまた、マウスに投与したときの薬物動態データの非自明な改善を示す。以下の表3は、これらの実験の重要な薬物動態データを要約したものである。
(表3)本発明の化合物1および対照化合物5の薬物動態データ
(表4)開示される化合物のFGFR阻害データ
表中のキナーゼに対するIC
50値の評価基準を以下に示す。
+++ 10nM以下
++ 10~100nM
+ 100~1000nM
- 1000nM以上
ND 未決定
開示される化合物のFGFR阻害データを表4に示す。化合物5を対照として使用する。
(表5)FGFR配列
太字:FGFRサブドメインV
下線:FGFR4サブドメインV中のシステイン
本発明を上記の実施例を参照して説明しているが、修正および変形が本発明の真意および範囲内に包含されることが理解されるであろう。したがって、本発明は、添付の特許請求の範囲によってのみ限定される。