JP7588973B2 - レボカルニチン含有錠剤 - Google Patents
レボカルニチン含有錠剤 Download PDFInfo
- Publication number
- JP7588973B2 JP7588973B2 JP2020108515A JP2020108515A JP7588973B2 JP 7588973 B2 JP7588973 B2 JP 7588973B2 JP 2020108515 A JP2020108515 A JP 2020108515A JP 2020108515 A JP2020108515 A JP 2020108515A JP 7588973 B2 JP7588973 B2 JP 7588973B2
- Authority
- JP
- Japan
- Prior art keywords
- tablet
- film
- mass
- levocarnitine
- calcium silicate
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- PHIQHXFUZVPYII-ZCFIWIBFSA-N (R)-carnitine Chemical compound C[N+](C)(C)C[C@H](O)CC([O-])=O PHIQHXFUZVPYII-ZCFIWIBFSA-N 0.000 title claims description 69
- 229960001518 levocarnitine Drugs 0.000 title claims description 64
- 239000003826 tablet Substances 0.000 claims description 186
- 239000000378 calcium silicate Substances 0.000 claims description 60
- 229910052918 calcium silicate Inorganic materials 0.000 claims description 60
- OYACROKNLOSFPA-UHFFFAOYSA-N calcium;dioxido(oxo)silane Chemical compound [Ca+2].[O-][Si]([O-])=O OYACROKNLOSFPA-UHFFFAOYSA-N 0.000 claims description 60
- 239000007888 film coating Substances 0.000 claims description 51
- 238000009501 film coating Methods 0.000 claims description 51
- 239000004372 Polyvinyl alcohol Substances 0.000 claims description 31
- 229920002451 polyvinyl alcohol Polymers 0.000 claims description 31
- 239000010410 layer Substances 0.000 claims description 29
- 239000007941 film coated tablet Substances 0.000 claims description 27
- WUKWITHWXAAZEY-UHFFFAOYSA-L calcium difluoride Chemical group [F-].[F-].[Ca+2] WUKWITHWXAAZEY-UHFFFAOYSA-L 0.000 claims description 24
- 239000010436 fluorite Substances 0.000 claims description 24
- 238000010521 absorption reaction Methods 0.000 claims description 15
- 238000002360 preparation method Methods 0.000 claims description 11
- 239000013078 crystal Substances 0.000 claims description 7
- 229920001577 copolymer Polymers 0.000 claims description 6
- 229920002554 vinyl polymer Polymers 0.000 claims description 6
- 235000012241 calcium silicate Nutrition 0.000 description 52
- 239000000843 powder Substances 0.000 description 33
- 239000011248 coating agent Substances 0.000 description 19
- 238000000576 coating method Methods 0.000 description 18
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 16
- 238000003860 storage Methods 0.000 description 16
- 239000000203 mixture Substances 0.000 description 15
- 229910052623 talc Inorganic materials 0.000 description 15
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 14
- 239000000126 substance Substances 0.000 description 14
- 239000000454 talc Substances 0.000 description 13
- 239000000047 product Substances 0.000 description 12
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 9
- VJHCJDRQFCCTHL-UHFFFAOYSA-N acetic acid 2,3,4,5,6-pentahydroxyhexanal Chemical compound CC(O)=O.OCC(O)C(O)C(O)C(O)C=O VJHCJDRQFCCTHL-UHFFFAOYSA-N 0.000 description 9
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 9
- 229950008138 carmellose Drugs 0.000 description 9
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 9
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 9
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 8
- 229960003943 hypromellose Drugs 0.000 description 8
- 235000019359 magnesium stearate Nutrition 0.000 description 8
- 239000003921 oil Substances 0.000 description 8
- 235000019198 oils Nutrition 0.000 description 8
- 239000007884 disintegrant Substances 0.000 description 7
- 238000000034 method Methods 0.000 description 7
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 6
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 6
- -1 absorption promoters Substances 0.000 description 6
- 239000011575 calcium Substances 0.000 description 6
- 229910052791 calcium Inorganic materials 0.000 description 6
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 6
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 6
- 238000004806 packaging method and process Methods 0.000 description 6
- 239000000546 pharmaceutical excipient Substances 0.000 description 6
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N Iron oxide Chemical compound [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 description 5
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 5
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 5
- 229920002678 cellulose Polymers 0.000 description 5
- 239000001913 cellulose Substances 0.000 description 5
- 235000010980 cellulose Nutrition 0.000 description 5
- 239000011247 coating layer Substances 0.000 description 5
- 229940031703 low substituted hydroxypropyl cellulose Drugs 0.000 description 5
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 5
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 5
- 206010058892 Carnitine deficiency Diseases 0.000 description 4
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 4
- 235000010724 Wisteria floribunda Nutrition 0.000 description 4
- 239000003795 chemical substances by application Substances 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 239000001530 fumaric acid Substances 0.000 description 4
- 239000008187 granular material Substances 0.000 description 4
- 239000000314 lubricant Substances 0.000 description 4
- 239000004570 mortar (masonry) Substances 0.000 description 4
- 229920003023 plastic Polymers 0.000 description 4
- 239000004033 plastic Substances 0.000 description 4
- 238000003756 stirring Methods 0.000 description 4
- 208000016505 systemic primary carnitine deficiency disease Diseases 0.000 description 4
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- 229920002785 Croscarmellose sodium Polymers 0.000 description 3
- 239000004698 Polyethylene Substances 0.000 description 3
- 239000000654 additive Substances 0.000 description 3
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 3
- 229910052782 aluminium Inorganic materials 0.000 description 3
- 238000007906 compression Methods 0.000 description 3
- 230000006835 compression Effects 0.000 description 3
- 229960001681 croscarmellose sodium Drugs 0.000 description 3
- 229960000913 crospovidone Drugs 0.000 description 3
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 3
- 238000001035 drying Methods 0.000 description 3
- 239000012467 final product Substances 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 238000005469 granulation Methods 0.000 description 3
- 230000003179 granulation Effects 0.000 description 3
- 229920000609 methyl cellulose Polymers 0.000 description 3
- 239000001923 methylcellulose Substances 0.000 description 3
- 235000010981 methylcellulose Nutrition 0.000 description 3
- NDLPOXTZKUMGOV-UHFFFAOYSA-N oxo(oxoferriooxy)iron hydrate Chemical compound O.O=[Fe]O[Fe]=O NDLPOXTZKUMGOV-UHFFFAOYSA-N 0.000 description 3
- 229920000573 polyethylene Polymers 0.000 description 3
- 229920000523 polyvinylpolypyrrolidone Polymers 0.000 description 3
- 235000013809 polyvinylpolypyrrolidone Nutrition 0.000 description 3
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 3
- 235000012239 silicon dioxide Nutrition 0.000 description 3
- 239000008109 sodium starch glycolate Substances 0.000 description 3
- 229920003109 sodium starch glycolate Polymers 0.000 description 3
- 229940079832 sodium starch glycolate Drugs 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 235000013311 vegetables Nutrition 0.000 description 3
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- 229920000881 Modified starch Polymers 0.000 description 2
- AUNGANRZJHBGPY-SCRDCRAPSA-N Riboflavin Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-SCRDCRAPSA-N 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- 239000003463 adsorbent Substances 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 229960005069 calcium Drugs 0.000 description 2
- 235000001465 calcium Nutrition 0.000 description 2
- PHIQHXFUZVPYII-UHFFFAOYSA-N carnitine Chemical compound C[N+](C)(C)CC(O)CC([O-])=O PHIQHXFUZVPYII-UHFFFAOYSA-N 0.000 description 2
- 229960004203 carnitine Drugs 0.000 description 2
- 229960000678 carnitine chloride Drugs 0.000 description 2
- 239000003086 colorant Substances 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 230000006866 deterioration Effects 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- JFVXEJADITYJHK-UHFFFAOYSA-L disodium 2-(3-hydroxy-5-sulfonato-1H-indol-2-yl)-3-oxoindole-5-sulfonate Chemical compound [Na+].[Na+].Oc1c([nH]c2ccc(cc12)S([O-])(=O)=O)C1=Nc2ccc(cc2C1=O)S([O-])(=O)=O JFVXEJADITYJHK-UHFFFAOYSA-L 0.000 description 2
- 239000002270 dispersing agent Substances 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 235000021388 linseed oil Nutrition 0.000 description 2
- 239000000944 linseed oil Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 208000030159 metabolic disease Diseases 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 239000004014 plasticizer Substances 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- 229940069328 povidone Drugs 0.000 description 2
- 238000005070 sampling Methods 0.000 description 2
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- OGIDPMRJRNCKJF-UHFFFAOYSA-N titanium oxide Inorganic materials [Ti]=O OGIDPMRJRNCKJF-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- WSVLPVUVIUVCRA-KPKNDVKVSA-N Alpha-lactose monohydrate Chemical compound O.O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O WSVLPVUVIUVCRA-KPKNDVKVSA-N 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N Alumina Chemical compound [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 101710147349 Carnitine transporter Proteins 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- AUNGANRZJHBGPY-UHFFFAOYSA-N D-Lyxoflavin Natural products OCC(O)C(O)C(O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-UHFFFAOYSA-N 0.000 description 1
- 239000004386 Erythritol Substances 0.000 description 1
- UNXHWFMMPAWVPI-UHFFFAOYSA-N Erythritol Natural products OCC(O)C(O)CO UNXHWFMMPAWVPI-UHFFFAOYSA-N 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 1
- 208000026019 Fanconi renotubular syndrome Diseases 0.000 description 1
- 201000006328 Fanconi syndrome Diseases 0.000 description 1
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 1
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 229920003110 Primojel Polymers 0.000 description 1
- 239000001744 Sodium fumarate Substances 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 1
- 229940124532 absorption promoter Drugs 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- OENHQHLEOONYIE-UKMVMLAPSA-N all-trans beta-carotene Natural products CC=1CCCC(C)(C)C=1/C=C/C(/C)=C/C=C/C(/C)=C/C=C/C=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C OENHQHLEOONYIE-UKMVMLAPSA-N 0.000 description 1
- 239000002518 antifoaming agent Substances 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 235000013734 beta-carotene Nutrition 0.000 description 1
- 239000011648 beta-carotene Substances 0.000 description 1
- TUPZEYHYWIEDIH-WAIFQNFQSA-N beta-carotene Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CCCC1(C)C)C=CC=C(/C)C=CC2=CCCCC2(C)C TUPZEYHYWIEDIH-WAIFQNFQSA-N 0.000 description 1
- 229960002747 betacarotene Drugs 0.000 description 1
- 239000002981 blocking agent Substances 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- UGGQKDBXXFIWJD-UHFFFAOYSA-N calcium;dihydroxy(oxo)silane;hydrate Chemical compound O.[Ca].O[Si](O)=O UGGQKDBXXFIWJD-UHFFFAOYSA-N 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 208000019425 cirrhosis of liver Diseases 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 238000005336 cracking Methods 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- MSJMDZAOKORVFC-SEPHDYHBSA-L disodium fumarate Chemical compound [Na+].[Na+].[O-]C(=O)\C=C\C([O-])=O MSJMDZAOKORVFC-SEPHDYHBSA-L 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- UNXHWFMMPAWVPI-ZXZARUISSA-N erythritol Chemical compound OC[C@H](O)[C@H](O)CO UNXHWFMMPAWVPI-ZXZARUISSA-N 0.000 description 1
- 235000019414 erythritol Nutrition 0.000 description 1
- 229940009714 erythritol Drugs 0.000 description 1
- MVPICKVDHDWCJQ-UHFFFAOYSA-N ethyl 3-pyrrolidin-1-ylpropanoate Chemical compound CCOC(=O)CCN1CCCC1 MVPICKVDHDWCJQ-UHFFFAOYSA-N 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000013373 food additive Nutrition 0.000 description 1
- 239000002778 food additive Substances 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 239000003349 gelling agent Substances 0.000 description 1
- 238000012812 general test Methods 0.000 description 1
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 1
- 208000016245 inborn errors of metabolism Diseases 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 229960003511 macrogol Drugs 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 1
- 229960002900 methylcellulose Drugs 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- MKTRXTLKNXLULX-UHFFFAOYSA-P pentacalcium;dioxido(oxo)silane;hydron;tetrahydrate Chemical compound [H+].[H+].O.O.O.O.[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-][Si]([O-])=O.[O-][Si]([O-])=O.[O-][Si]([O-])=O.[O-][Si]([O-])=O.[O-][Si]([O-])=O.[O-][Si]([O-])=O MKTRXTLKNXLULX-UHFFFAOYSA-P 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229920000191 poly(N-vinyl pyrrolidone) Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 239000004848 polyfunctional curative Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 239000008213 purified water Substances 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 239000002151 riboflavin Substances 0.000 description 1
- 235000019192 riboflavin Nutrition 0.000 description 1
- 229960002477 riboflavin Drugs 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000007873 sieving Methods 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- 229940005573 sodium fumarate Drugs 0.000 description 1
- 235000019294 sodium fumarate Nutrition 0.000 description 1
- 229940045902 sodium stearyl fumarate Drugs 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 229920003169 water-soluble polymer Polymers 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000811 xylitol Substances 0.000 description 1
- 235000010447 xylitol Nutrition 0.000 description 1
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 1
- 229960002675 xylitol Drugs 0.000 description 1
- OENHQHLEOONYIE-JLTXGRSLSA-N β-Carotene Chemical compound CC=1CCCC(C)(C)C=1\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C OENHQHLEOONYIE-JLTXGRSLSA-N 0.000 description 1
Landscapes
- Medicinal Preparation (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
ルミPTP包装が用いられている。しかし、これらの包装形態では、錠剤を取り出しにくい、錠剤が見えないため確認できない、つぶれる等の問題があり、錠剤の包装形態として一般的に用いられているPTP包装品(プラスチックとアルミで挟んだもの)での提供や一包化が可能な、小型で保存安定性の高い錠剤が求められている。
項1.
レボカルニチン(フリー体)と多孔性ケイ酸カルシウムとを、質量比1:0.25~2で含有する素錠、及び
当該素錠を被覆するフィルムコーティング層
を備えるフィルムコーティング錠剤。
項2.
多孔性ケイ酸カルシウムがジャイロライト型ケイ酸カルシウムである、項1に記載のフィルムコーティング錠剤。
項3.
多孔性ケイ酸カルシウムが、100gあたりの吸油量が300mL以上の多孔性ケイ酸カルシウムである、項1又は2に記載のフィルムコーティング錠剤。
項4.
多孔性ケイ酸カルシウムが、式:
2CaO・3SiO2・mSiO2・nH2O
(式中、1<m<2、且つ、2<n<3)
で表される多孔性ケイ酸カルシウムである、
項1~3のいずれかに記載のフィルムコーティング錠剤。
項5.
前記素錠が、レボカルニチン(フリー体)と多孔性ケイ酸カルシウムとを、質量比1:0.25~0.5で含有する素錠である、項1~3のいずれかに記載のフィルムコーティング錠剤。
項6.
フィルムコーティング層が、ポリビニルアルコール及び/又はポリビニルアルコール共重合体を含有する、項1~5のいずれかに記載のフィルムコーティング錠剤。
項7.
ポリビニルアルコール共重合体が、ポリビニルアルコール・アクリル酸・メタクリル酸メチル共重合体である、項6に記載のフィルムコーティング錠剤。
項8.
フィルムコーティング層を、素錠に対して10~40質量%備える、項1~7に記載のフィルムコーティング錠剤。
項9.
レボカルニチン(フリー)が、素錠の50~80質量%含有されている、項1~8のいずれかに記載のフィルムコーティング錠剤。
項10.
レボカルニチン(フリー体)と多孔性ケイ酸カルシウムとを、質量比1:0.25~2で含有する素錠、及び
当該素錠を被覆するフィルムコーティング層を素錠に対して10~40質量%
備え、
前記多孔性ケイ酸カルシウムが、100gあたりの吸油量が300mL以上のジャイロライト型ケイ酸カルシウムであり、
前記フィルムコーティング層が、ポリビニルアルコール及び/又はポリビニルアルコール共重合体を含有し、
レボカルニチン(フリー)が、素錠の50~80質量%含有されている、
フィルムコーティング錠剤。
生じやすくなり好ましくない。また、2質量部より多い場合には錠剤が大型化し、服用に問題が生じる場合がある。
る錠剤が得られる。
造粒末1 (ケイ酸カルシウム、 0.2倍量)
多孔性のケイ酸カルシウム(フローライトPS200、富田製薬(株))600gを撹拌造粒機(VG-25、(株)パウレック)に投入し、続いて、レボカルニチン(フリー
体)(ILS(株))3000gを水1200 gに溶解させた溶液を投入し、ブレード回転数150rpm、チョッパー回転数1500rpmで、ケイ酸カルシウム及びレボカルニチン(フリー体)が均一に分散するまで撹拌して、撹拌造粒を行い、湿性造粒物を得た。得られた湿性造粒物を、真空乾燥機(LCV-232、TABAI ESPEC CORP.)を用いて、80℃、12時間乾燥した。乾燥後、850μmのメッシュスクリーンを用いて篩過し、造粒末1を得た。
ケイ酸カルシウム(フローライトPS200、富田製薬(株))を750g用いる以外は、造粒末1の調製と同様にして、造粒末2を得た。
ケイ酸カルシウム(フローライトPS200、富田製薬(株))を900g用いる以外は、造粒末1の調製と同様にして、造粒末3を得た。
ケイ酸カルシウム(フローライトPS200、富田製薬(株))を1200g用いる以外は、造粒末1の調製と同様にして、造粒末4を得た。
用いるケイ酸カルシウムの種類及び量を、多孔性のケイ酸カルシウム(フローライトR、富田製薬(株))を900g用いることとした以外は、造粒末1の調製と同様にして、造粒末5を得た。
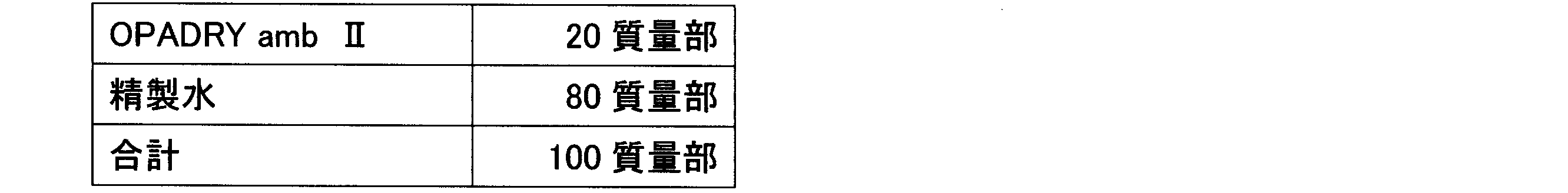
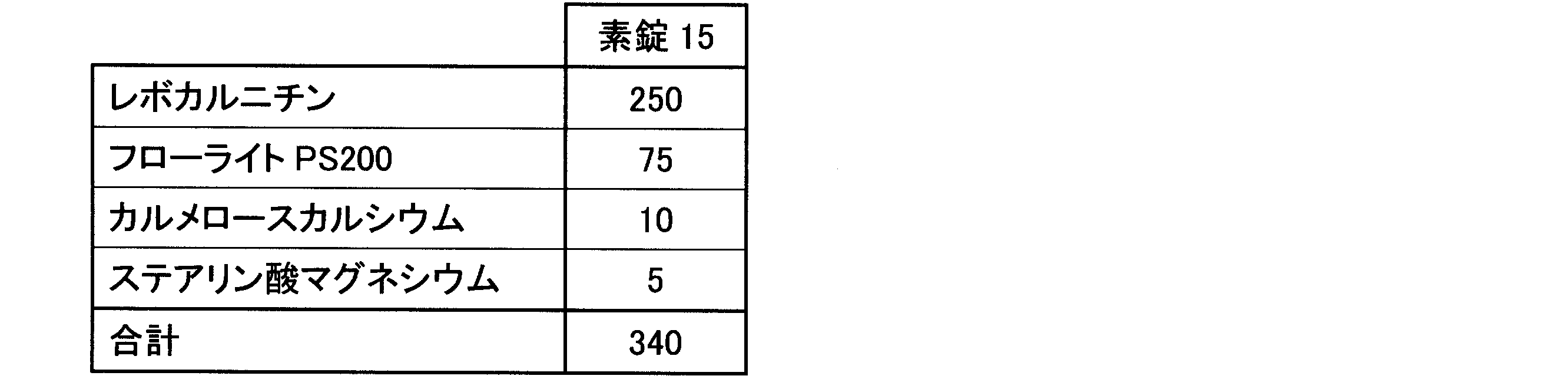
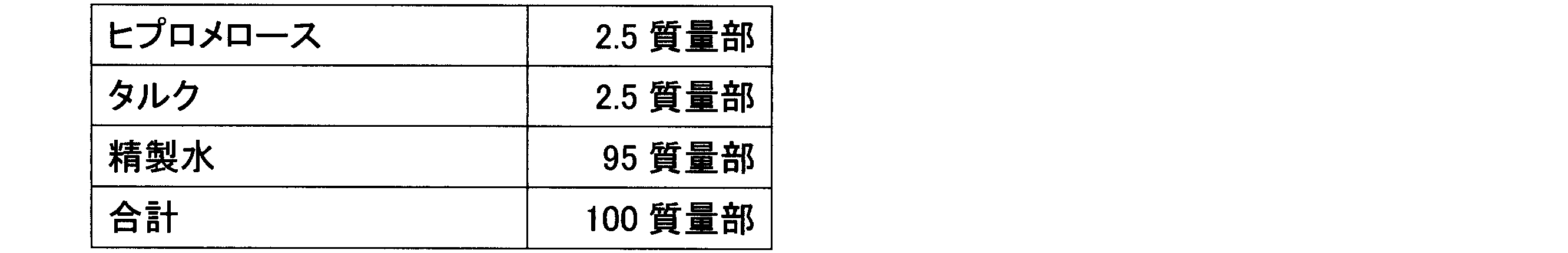
表1に従い、造粒末1~5に対してカルメロースカルシウム(商品名:ECG-505、ニチリン化学工業(株))、カルメロース(商品名:NS-300、ニチリン化学工業(株))、クロスカルメロースナトリウム(商品名:Parteck CCS、メルク)、デンプングリコール酸ナトリウム(商品名:Primojel、DFE Pharma)、クロスポビドン(商品名:Kollidon CL-F、BASF)、及び低置換度ヒドロキシプロピルセルロース(商品名:LH-11、信越化学工業(株))の6種の崩壊剤のうち1種を加え、ポリエチレン袋で混合後、ステアリン酸マグネシウム(ステアリン酸マグネシウム植物性,太平化学産業(株))を添加してさらに混合して、打錠用粉末を得た。なお、表1に記載の各成分の値の単位は、質量部を示す。
含有する素錠1~素錠14を調製した。なお、打錠圧は、6、8、又は10kNとした。
れた。
質量増加量(水分吸湿量) =加湿保存後のFC錠質量 -初期FC錠質量
また、FC錠3、7、12、13、5、14の結果を表5に示した。
ケイ酸カルシウム(フローライトPS200、富田製薬(株))75gを撹拌造粒機(NSK150、岡田精工(株))に投入し、続いて、レボカルニチン(フリー体)(ILS(株))250gを水100 gに溶解させた溶液を投入し、回転数500rpmで、ケイ酸カルシウム及びレボカルニチン(フリー体)が均一に分散するまで撹拌して、撹拌造粒した。得られた湿性造粒物を60℃で24時間乾燥した後、850μmのメッシュスクリーンを用いて篩過することにより整粒して、造粒末を得た。
。
とが確認された。
表1の素錠11の処方の打錠用粉末を、直径9.5mmスミ角Rの臼杵を付けたロータリー打錠機(VIRGO、(株)菊水製作所)を用いて、8kNの打錠圧で打錠し、1錠あたり250mgのレボカルニチンを含有する素錠16を得た。素錠16の錠剤厚みは5.23mm(n=10)、錠剤硬度は265N(n=10)、錠剤強度は5.33N/mm2(n=10)、崩壊時間は10.8分(n=6)であった。
ック)を使用しておこなった。
存時の質量増加を算出し、結果を図3に示した。
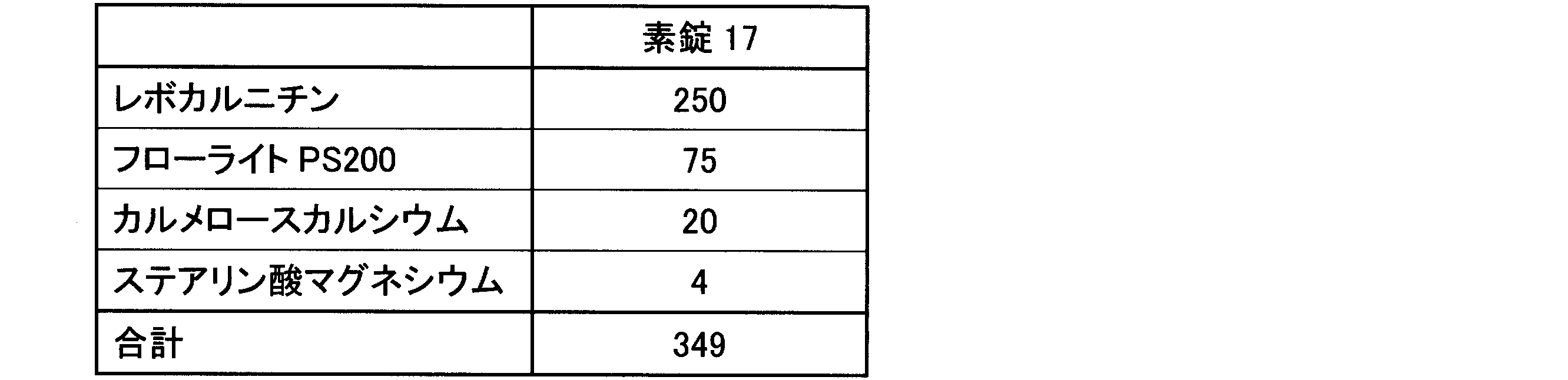
造粒末3に、カルメロースカルシウム(商品名:ECG-505、ニチリン化学工業(株))を加え、ポリエチレン袋で混合後、ステアリン酸マグネシウム(ステアリン酸マグネシウム植物性、太平化学産業(株))を添加してさらに混合して、打錠用粉末を得た。当該打錠用粉末を、直径10mmスミ角Rの臼杵を付けたロータリー打錠機(VELA5、(株)菊水製作所)を用いて、8kNの打錠圧で打錠し、1錠あたり250mgのレボカルニチンを含有する素錠17を得た。
ライト)とポリビニルアルコールを含有するフィルムコーティングを組み合わせる事で顕著な安定性改善を達成できることが確認できた。
Claims (10)
- レボカルニチン(フリー体)と多孔性ケイ酸カルシウムとを、質量比1:0.25~2で含有する素錠、及び
当該素錠を被覆するフィルムコーティング層
を備え、
前記多孔性ケイ酸カルシウムが、
式:
2CaO・3SiO 2 ・mSiO 2 ・nH 2 O
(式中、1<m<2、且つ、2<n<3)
で表される、
100gあたりの吸油量が300mL以上の、
花弁状結晶構造を持つジャイロライト型ケイ酸カルシウムである、
フィルムコーティング錠剤。 - 多孔性ケイ酸カルシウムが、フローライトPS200又はフローライトRである、請求項1に記載のフィルムコーティング錠剤。
- レボカルニチン(フリー)を、50~1000mg含有する、
請求項1又は2に記載のフィルムコーティング錠剤。 - 前記素錠が、レボカルニチン(フリー体)と多孔性ケイ酸カルシウムとを、質量比1:0.25~0.5で含有する素錠である、請求項1~3のいずれかに記載のフィルムコーティング錠剤。
- フィルムコーティング層が、ポリビニルアルコール及び/又はポリビニルアルコール共重合体を含有する、請求項1~4のいずれかに記載のフィルムコーティング錠剤。
- ポリビニルアルコール共重合体が、ポリビニルアルコール・アクリル酸・メタクリル酸メチル共重合体である、請求項5に記載のフィルムコーティング錠剤。
- フィルムコーティング層を、素錠に対して10~40質量%備える、請求項1~6に記載のフィルムコーティング錠剤。
- レボカルニチン(フリー)が、素錠の50~80質量%含有されている、請求項1~7のいずれかに記載のフィルムコーティング錠剤。
- レボカルニチン(フリー体)と多孔性ケイ酸カルシウムとを、質量比1:0.25~2で含有する素錠、及び
当該素錠を被覆するフィルムコーティング層を素錠に対して10~40質量%
備え、
前記多孔性ケイ酸カルシウムが、
式:
2CaO・3SiO 2 ・mSiO 2 ・nH 2 O
(式中、1<m<2、且つ、2<n<3)
で表され、100gあたりの吸油量が300mL以上の、花弁状結晶構造を持つジャイロライト型ケイ酸カルシウムであり、
前記フィルムコーティング層が、ポリビニルアルコール及び/又はポリビニルアルコール共重合体を含有し、
レボカルニチン(フリー)が、素錠の50~80質量%含有されている、
フィルムコーティング錠剤。 - 多孔性ケイ酸カルシウムが、フローライトPS200又はフローライトRである、請求項9に記載のフィルムコーティング錠剤。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2024197398A JP2025013661A (ja) | 2019-06-24 | 2024-11-12 | レボカルニチン含有錠剤 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2019116554 | 2019-06-24 | ||
| JP2019116554 | 2019-06-24 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024197398A Division JP2025013661A (ja) | 2019-06-24 | 2024-11-12 | レボカルニチン含有錠剤 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2021001168A JP2021001168A (ja) | 2021-01-07 |
| JP7588973B2 true JP7588973B2 (ja) | 2024-11-25 |
Family
ID=73994161
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020108515A Active JP7588973B2 (ja) | 2019-06-24 | 2020-06-24 | レボカルニチン含有錠剤 |
| JP2024197398A Pending JP2025013661A (ja) | 2019-06-24 | 2024-11-12 | レボカルニチン含有錠剤 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024197398A Pending JP2025013661A (ja) | 2019-06-24 | 2024-11-12 | レボカルニチン含有錠剤 |
Country Status (1)
| Country | Link |
|---|---|
| JP (2) | JP7588973B2 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7366612B2 (ja) * | 2019-07-09 | 2023-10-23 | 東和薬品株式会社 | レボカルニチンを含有する錠剤 |
| CN112826803B (zh) * | 2021-02-24 | 2024-01-19 | 东北制药集团沈阳第一制药有限公司 | 一种左卡尼汀片及其制备方法 |
| JP2022171507A (ja) * | 2021-04-30 | 2022-11-11 | 日本ジェネリック株式会社 | 安定性に優れたリナグリプチン含有製剤 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102349881A (zh) | 2011-10-26 | 2012-02-15 | 东北制药(沈阳)科技发展有限公司 | 一种左卡尼汀薄膜衣片及其制备方法 |
| JP2012193175A (ja) | 2011-03-02 | 2012-10-11 | Daiichi Sankyo Healthcare Co Ltd | 速溶性防湿フィルムコーティング製剤及びその製造方法 |
| JP2014047183A (ja) | 2012-08-31 | 2014-03-17 | Asahi Food & Healthcare Ltd | 顆粒及びその製造方法、並びに、錠剤及びその製造方法 |
| JP2014091714A (ja) | 2012-11-05 | 2014-05-19 | Nof Corp | 錠剤用粉粒体および錠剤 |
| JP2016050206A (ja) | 2014-08-29 | 2016-04-11 | 大塚製薬株式会社 | レボカルニチンを含有する医薬錠剤 |
-
2020
- 2020-06-24 JP JP2020108515A patent/JP7588973B2/ja active Active
-
2024
- 2024-11-12 JP JP2024197398A patent/JP2025013661A/ja active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012193175A (ja) | 2011-03-02 | 2012-10-11 | Daiichi Sankyo Healthcare Co Ltd | 速溶性防湿フィルムコーティング製剤及びその製造方法 |
| CN102349881A (zh) | 2011-10-26 | 2012-02-15 | 东北制药(沈阳)科技发展有限公司 | 一种左卡尼汀薄膜衣片及其制备方法 |
| JP2014047183A (ja) | 2012-08-31 | 2014-03-17 | Asahi Food & Healthcare Ltd | 顆粒及びその製造方法、並びに、錠剤及びその製造方法 |
| JP2014091714A (ja) | 2012-11-05 | 2014-05-19 | Nof Corp | 錠剤用粉粒体および錠剤 |
| JP2016050206A (ja) | 2014-08-29 | 2016-04-11 | 大塚製薬株式会社 | レボカルニチンを含有する医薬錠剤 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2021001168A (ja) | 2021-01-07 |
| JP2025013661A (ja) | 2025-01-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2025013661A (ja) | レボカルニチン含有錠剤 | |
| WO1995010264A1 (en) | Tablet containing enteric granules | |
| JP7005687B2 (ja) | レボカルニチンを含有する医薬錠剤 | |
| JP2023156269A (ja) | テネリグリプチン含有医薬組成物 | |
| TWI708603B (zh) | 含有芳基烷基胺化合物之醫藥組合物 | |
| CN105434377A (zh) | 美索舒利片剂及其制备方法 | |
| JP6183979B2 (ja) | アリピプラゾール無水物を含有する固形製剤の製造方法 | |
| JP4901966B2 (ja) | 小型化塩酸サルポグレラート経口投与製剤 | |
| JP5490347B2 (ja) | 経口投与用製剤 | |
| WO2024248079A1 (ja) | ミロガバリンを含有する医薬組成物 | |
| JP4329947B1 (ja) | 内服用錠剤 | |
| JP4567640B2 (ja) | 小型化塩酸サルポグレラート経口投与製剤 | |
| JP7264711B2 (ja) | レベチラセタム含有医薬組成物の製造方法 | |
| JP2013216701A (ja) | 経口投与用製剤 | |
| JP2010001242A (ja) | レバミピド固形製剤及びその製造方法 | |
| CN112190583B (zh) | 一种乐伐替尼药物组合物及其制备方法 | |
| EP3511001B1 (en) | Pirfenidone-containing tablet and capsule formulation | |
| JP2021155359A (ja) | レボカルニチンを有効成分とする錠剤 | |
| EP4652990A1 (en) | A solid composition package of valsartan and sacubitril | |
| JP2020147542A (ja) | ダビガトランエテキシラートまたはその薬学的に許容される塩を含有する多層錠 | |
| JP5282644B2 (ja) | 内服用錠剤 | |
| JP2025087253A (ja) | マシテンタン含有製剤 | |
| JP6336651B1 (ja) | 化学的安定性が改善されたエソメプラゾール塩を含有する錠剤 | |
| CN120022270A (zh) | 一种吲哚布芬缓释制剂及其制备方法和应用 | |
| WO2007033515A1 (fr) | Formulation orale contenant de la moxifloxacine et son procédé de préparation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230623 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20240426 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240507 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240705 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20241015 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20241113 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7588973 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |