JP7584536B2 - 新規なポリペプチドおよびこれを利用したl-ロイシンの生産方法 - Google Patents
新規なポリペプチドおよびこれを利用したl-ロイシンの生産方法 Download PDFInfo
- Publication number
- JP7584536B2 JP7584536B2 JP2022562152A JP2022562152A JP7584536B2 JP 7584536 B2 JP7584536 B2 JP 7584536B2 JP 2022562152 A JP2022562152 A JP 2022562152A JP 2022562152 A JP2022562152 A JP 2022562152A JP 7584536 B2 JP7584536 B2 JP 7584536B2
- Authority
- JP
- Japan
- Prior art keywords
- amino acid
- seq
- leucine
- acid sequence
- mutant polypeptide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/52—Genes encoding for enzymes or proenzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/74—Vectors or expression systems specially adapted for prokaryotic hosts other than E. coli, e.g. Lactobacillus, Micromonospora
- C12N15/77—Vectors or expression systems specially adapted for prokaryotic hosts other than E. coli, e.g. Lactobacillus, Micromonospora for Corynebacterium; for Brevibacterium
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/1025—Acyltransferases (2.3)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P13/00—Preparation of nitrogen-containing organic compounds
- C12P13/04—Alpha- or beta- amino acids
- C12P13/06—Alanine; Leucine; Isoleucine; Serine; Homoserine
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y203/00—Acyltransferases (2.3)
- C12Y203/03—Acyl groups converted into alkyl on transfer (2.3.3)
- C12Y203/03012—3-Propylmalate synthase (2.3.3.12)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y203/00—Acyltransferases (2.3)
- C12Y203/03—Acyl groups converted into alkyl on transfer (2.3.3)
- C12Y203/03013—2-Isopropylmalate synthase (2.3.3.13)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2800/00—Nucleic acids vectors
- C12N2800/10—Plasmid DNA
- C12N2800/101—Plasmid DNA for bacteria
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12R—INDEXING SCHEME ASSOCIATED WITH SUBCLASSES C12C - C12Q, RELATING TO MICROORGANISMS
- C12R2001/00—Microorganisms ; Processes using microorganisms
- C12R2001/01—Bacteria or Actinomycetales ; using bacteria or Actinomycetales
- C12R2001/15—Corynebacterium
-
- C—CHEMISTRY; METALLURGY
- C40—COMBINATORIAL TECHNOLOGY
- C40B—COMBINATORIAL CHEMISTRY; LIBRARIES, e.g. CHEMICAL LIBRARIES
- C40B40/00—Libraries per se, e.g. arrays, mixtures
- C40B40/02—Libraries contained in or displayed by microorganisms, e.g. bacteria or animal cells; Libraries contained in or displayed by vectors, e.g. plasmids; Libraries containing only microorganisms or vectors
-
- C—CHEMISTRY; METALLURGY
- C40—COMBINATORIAL TECHNOLOGY
- C40B—COMBINATORIAL CHEMISTRY; LIBRARIES, e.g. CHEMICAL LIBRARIES
- C40B40/00—Libraries per se, e.g. arrays, mixtures
- C40B40/04—Libraries containing only organic compounds
- C40B40/06—Libraries containing nucleotides or polynucleotides, or derivatives thereof
- C40B40/08—Libraries containing RNA or DNA which encodes proteins, e.g. gene libraries
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Genetics & Genomics (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Plant Pathology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Medicinal Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Enzymes And Modification Thereof (AREA)
- Peptides Or Proteins (AREA)
Description
本出願は、2020年5月20日付大韓民国特許出願第10-2020-0060578号に基づいた優先権の利益を主張し、当該韓国特許出願の文献に開示された全ての内容は本明細書の一部として組み含まれる。
配列番号1のアミノ酸配列で558番目(またはこれに相応する位置)アルギニン(arginine)アミノ酸残基がアルギニン以外の他のアミノ酸残基に置換、
配列番号1のアミノ酸配列で561番目(またはこれに相応する位置)グリシン(glycine)アミノ酸残基がグリシン以外の他のアミノ酸残基に置換、またはこれら全てによりさらに変異されたものであり得る。
配列番号16のアミノ酸配列で523番目(またはこれに相応する位置)アルギニン(arginine)アミノ酸残基がアルギニン以外の他のアミノ酸残基に置換、
配列番号16のアミノ酸配列で526番目(またはこれに相応する位置)グリシン(glycine)アミノ酸残基がグリシン以外の他のアミノ酸残基に置換、またはこれら全てによりさらに変異されたものであり得る。
配列番号1のアミノ酸配列で558番目アルギニン(arginine)アミノ酸残基がヒスチジン(histidine)アミノ酸残基に置換、
配列番号1のアミノ酸配列で561番目グリシン(glycine)アミノ酸残基がアスパラギン酸(aspartic acid)アミノ酸残基に置換、または、
これら全てによりさらに変異されたものであり得る。
(i)野生型菌株に由来するイソプロピルマレートシンターゼ(例えば、配列番号1または配列番号16のアミノ酸配列を含むイソプロピルマレートシンターゼ)または(ii)配列番号1(または配列番号16)のアミノ酸配列で247番目(または212番目)プロリンアミノ酸残基がプロリン以外の他のアミノ酸残基に置換された変異型ポリペプチドより、
下記(1)~(3)からなる群より選択された1種以上の効果が増加したものであり得る:
(1)L-ロイシン生産活性の増加;
(2)イソプロピルマレートシンターゼの酵素活性の増加;および
(3)L-ロイシンおよび/またはその誘導体によるフィードバック抑制の減少。
(1)L-ロイシン生産活性の増加;
(2)イソプロピルマレートシンターゼの酵素活性の増加;および
(3)L-ロイシンおよび/またはその誘導体によるフィードバック抑制の減少。
イソプロピルマレートシンターゼ活性を有する変異体をコードするleuA変異ライブラリーを作製するために、まずleuAを含む組換えベクターを作製した。
前記実施例1-1で作製されたベクターを基盤としてerror-prone PCR kit(clontech Diversify(登録商標)PCR Random Mutagenesis Kit)を利用してleuA変異ライブラリーを作製した。1000bp当たり0~3個の変異が発生し得る条件で、pCR-leuAベクターを鋳型として配列番号7および配列番号8のプライマーを用いてPCR反応を行った。具体的に、1000bp当たり0~3個の変異が発生する条件として、94℃で30秒間プレヒーティング(pre-heating)後、94℃で30秒、68℃で1分30秒の過程を25回(cycle)繰り返してPCR反応を行った。得られたPCR産物をメガプライマー(megaprimer)(50~125ng)として95℃で50秒、60℃で50秒、68℃で12分の過程を25回繰り返してPCR反応を行った後、DpnI処理し、DpnIが処理されたPCR産物を大腸菌DH5αにヒートショック法を通じて形質転換してカナマイシン(25mg/L)が含まれているLB固体培地に塗抹した。形質転換されたコロニー20種を選別した後、プラスミドを獲得して塩基配列を分析した結果、2mutations/kb頻度に互いに異なる位置に変異が導入されたことを確認した。約20,000個の形質転換された大腸菌コロニーを取ってプラスミドを抽出し、これを「pTOPO-leuA-ライブラリー」と命名した。
前記実施例1-2で作製されたpTOPO-leuA-ライブラリーを野生型コリネバクテリウム・グルタミクム(Corynebacterium glutamicum)ATCC13032に電気穿孔法で形質転換し、形質転換された菌株をカナマイシン25mg/Lを含有する栄養培地(表2)に塗抹して変異遺伝子が挿入された菌株10,000個のコロニーを選別した。選別された各コロニーをATCC13032/pTOPO_leuA(mt)1~ATCC13032/pTOPO_leuA(mt)10,000と命名した。確保された10,000個のコロニー中のL-ロイシン生産量が増加されたコロニーを確認するためにそれぞれのコロニーに対して下記のような方法で発酵力価評価を行った。
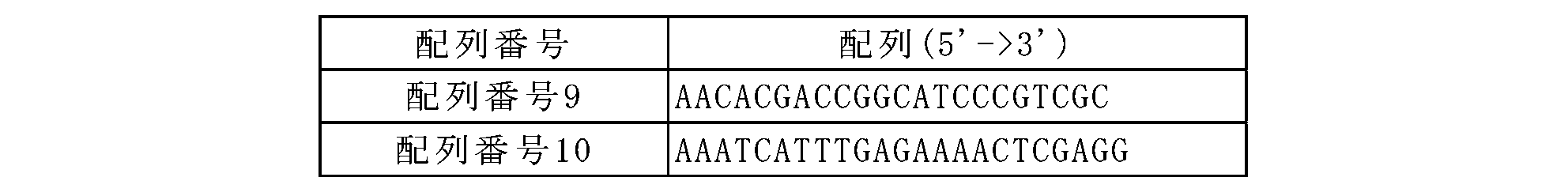
コリネバクテリウム・グルタミクムATCC13032/pTOPO_leuA(mt)5306菌株のleuA遺伝子変異を確認するために、表4に記載された配列番号9と配列番号10のプライマーを利用してATCC13032/pTOPO_leuA(mt)5306菌株のDNAを鋳型として94℃で5分間変性後、94℃で30秒、55℃で30秒、72℃で1分30秒を30回繰り返した後、72℃で5分の条件でPCRを行ってDNAシーケンシングを行った。
以下、実施例では、前記変異(P247C)がコリネバクテリウム属微生物のL-ロイシン生産量に影響を与えるか否かを確認しようとした。
本実施例では部位指定突然変異生成(Site directed mutagenesis)方法を用いて選別された変異(P247C)を菌株内に導入するために、挿入用ベクターを作製しようとした。コリネバクテリウム・グルタミクム野生型(ATCC13032)の染色体を鋳型として配列番号11および12のプライマーと配列番号13および14のプライマー対を利用してPCRを行った。具体的に、94℃で5分間変性後、94℃で30秒、55℃で30秒、72℃で1分30秒を30回繰り返した後、72℃で5分の条件でPCRを行った。使用したプライマーの具体的な配列は表5に記載した。
前記実施例3-1で作製したpDZ-leuA(P247C)ベクターをATCC13032に電気穿孔法で形質転換し、カナマイシン(kanamycin)25mg/Lを含有する培地で相同性配列の組換えにより染色体上にベクターが挿入された菌株を選別した。選別された1次菌株は再び2次交差(cross-over)を経て、leuA遺伝子に変異が導入された菌株を選定した。最終的に形質転換された菌株のleuA遺伝子変異導入の有無は配列番号9と配列番号15のプライマーを利用してPCR(94℃で5分後、94℃で30秒/55℃で30秒/72℃で90秒の30回反復、72℃で5分)行った後、塩基配列分析を通じて確認した。塩基配列分析の結果、菌株染色体内leuA遺伝子の739番目、740番目ヌクレオチドであるCCがTGに置換されて、247番目アミノ酸であるプロリン(Pro)がシステイン(Cys)に置換されたLeuAをコードするleuA変異が菌株内に導入されたことを確認した。作製された菌株は「ATCC13032_leuA_P247C」と命名した。使用したプライマーの具体的な配列は表4および表6に記載した。
前記実施例3-2で作製されたATCC13032_leuA_P247C菌株のL-ロイシン生産能を評価するために、前記実施例2の方法と類似に、フラスコ発酵力価評価を行った。生産培地25mlを含有する250mlコーナーバッフルフラスコに親菌株であるコリネバクテリウム・グルタミクムATCC13032およびATCC13032_leuA_P247Cをそれぞれ1白金耳ずつ接種した後、30℃で60時間200rpmで振とう培養してL-ロイシンを生産した。培養終了後、HPLCでL-ロイシンの生産量を測定して、各菌株に対する培養液中のL-ロイシン濃度は下記表7に記載した。
コリネバクテリウム属野生型の菌株は、L-ロイシンを微量生産するため、ATCC13032由来のロイシン生産菌株を作製し、前記実施例2で選別した変異(P247C)を導入してL-ロイシン生産能を確認した。具体的な実験は次のとおりである。
高濃度のL-ロイシン生産のための菌株として(1)leuA遺伝子の1673番目ヌクレオチドであるGがAに置換されてLeuA蛋白質の558番目アミノ酸であるアルギニンがヒスチジンに置換される変異(R558H)と(2)leuA遺伝子の1682番目、1683番目ヌクレオチドであるGCがATに置換されて561番目アミノ酸であるグリシンがアスパラギン酸に置換される変異(G561D)を含むATCC13032由来の菌株を製造した。
具体的に前記のleuA遺伝子変異を含むpDZ-leuA(R558H、G561D)ベクター(大韓民国公開特許第10-2018-0077008号)をコリネバクテリウム・グルタミクムATCC13032に電気穿孔法で形質転換し、カナマイシン(kanamycin)25mg/Lを含有する培地で相同性配列の組換えにより染色体上にベクターが挿入された菌株を選別した。選別された1次菌株は再び2次交差(cross-over)を経て、leuA遺伝子の変異が導入された菌株を選定した。最終的に形質転換された菌株の変異導入の有無は配列番号7と配列番号13のプライマーを利用してPCR(94℃で5分後、94℃で30秒/55℃で30秒/72℃で90秒の30回反復、72℃で5分)を行い、塩基配列を分析してR558H、G561D変異が導入されたことを確認した。使用したプライマーの具体的な配列は表1および表5に記載した。pDZ-leuA(R558H、G561D)ベクターに形質転換されたATCC13032_leuA_(R558H、G561D)菌株を「CJL-8100」と命名した。
本実施例ではLeuAに2個の変異(R558H、G561D)が導入されたL-ロイシン生産菌株であるCJL-8100に前記実施例2で選別された変異(P247C)を導入するために挿入用ベクターを作製しようとした。
CJL-8100菌株の染色体を鋳型として配列番号9および10のプライマー、配列番号11および12のプライマー対を利用してPCRを行った。PCRは、94℃で5分間変性後、94℃で30秒、55℃で30秒、72℃で1分30秒を30回繰り返した後、72℃で5分間重合反応を行った。その結果で得られたPCR産物をSmaI制限酵素で切断させた線状のpDZベクターとIn-Fusion酵素を利用してDNA断片間の末端15baseの相同配列をfusionさせてクローニングして、野生型菌株のLeuAアミノ酸配列で558番目アミノ酸であるアルギニンがヒスチジンに置換され、561番目アミノ酸であるグリシンがアスパラギン酸に置換されたLeuA変異体をコードするleuA変異を含み、LeuAの247番目アミノ酸であるプロリン(Pro)をシステイン(Cys)に置換するベクターpDZ-leuA(P247C、R558H、G561D)を作製した。
L-ロイシン生産菌株であるCJL-8100を前記実施例4-2で作製したpDZ-leuA(P247C、R558H、G561D)ベクターに形質転換し、相同性配列の組換えにより染色体上にベクターが挿入された菌株は、カナマイシン(kanamycin)25mg/Lを含有する培地で選別した。選別された1次菌株は再び2次交差(cross-over)を経て、目標遺伝子の変異が導入された菌株を選定した。最終的に形質転換された菌株のleuA遺伝子変異導入の有無は配列番号9と配列番号15のプライマーを利用してPCR(94℃で5分後、94℃で30秒/55℃で30秒/72℃で90秒の30回反復、72℃で5分)を行った後、塩基配列を分析した。塩基配列分析の結果、菌株染色体内leuA遺伝子の1673番目ヌクレオチドであるGがAに置換され、1682番目、1683番目ヌクレオチドであるGCがATに置換され、739番目、740番目ヌクレオチドであるCCがTGに置換されてLeuA蛋白質の558番目アミノ酸であるアルギニンがヒスチジンに置換され、561番目アミノ酸であるグリシンがアスパラギン酸に置換され、247番目アミノ酸であるプロリン(Pro)がシステイン(Cys)に置換されたLeuA変異体(P247C、R558H、G561D)をコードするleuA変異が菌株内に導入されたことを確認した。作製されたCJL8100_leuA_P247Cを「CA13-8105」と命名し、ブダペスト条約下の国際寄託機関である韓国微生物保存センター(Korean Culture Center of Microorganisms、KCCM)に2020年4月29日付で寄託して寄託番号KCCM12709Pが付与された。前記総3種の変異を含むLeuA変異体(P247C、R558H、G561D)のアミノ酸配列およびこれをコードするleuA変異体の塩基配列は、それぞれ配列番号5および配列番号6のとおりである。
前記実施例4-3で作製したL-ロイシン生産菌株であるCJL-8100およびCA13-8105でイソプロピルマレートシンターゼの活性を測定するために、下記のような方法で実験を行った。
寄託機関名:韓国微生物保存センター
受託番号:KCCM12709P
受託日付:20200429
Claims (16)
- イソプロピルマレートシンターゼ(isopropylmalate synthase)活性を有し、配列番号1のアミノ酸配列と94%以上の同一性を有する変異型ポリペプチドであって、
配列番号1のアミノ酸配列で247番目に対応する位置のプロリン(proline)アミノ酸残基がシステイン(cysteine)に置換された、変異型ポリペプチド。 - 配列番号1のアミノ酸配列で247番目のプロリンアミノ酸残基がシステイン(cysteine)に置換された、請求項1に記載の変異型ポリペプチド。
- 配列番号16のアミノ酸配列で212番目のプロリンアミノ酸残基がシステインに置換された、請求項1に記載の変異型ポリペプチド。
- 配列番号3のアミノ酸配列を含む、請求項1に記載の変異型ポリペプチド。
- 前記変異型ポリペプチドは、
配列番号1のアミノ酸配列で558番目アルギニン(arginine)アミノ酸残基がヒスチジン(histidine)アミノ酸残基に置換、
配列番号1のアミノ酸配列で561番目グリシン(glycine)アミノ酸残基がアスパラギン酸(aspartic acid)アミノ酸残基に置換、または、
これら全てによりさらに変異されたものである、請求項1に記載の変異型ポリペプチド。 - 前記変異型ポリペプチドは、配列番号5のアミノ酸配列を含む、請求項5に記載の変異型ポリペプチド。
- 請求項1~6のいずれか一項に記載の変異型ポリペプチドをコードする、ポリヌクレオチド。
- 請求項7に記載のポリヌクレオチドを含む、ベクター。
- 請求項1~6のいずれか一項に記載の変異型ポリペプチド、前記変異型ポリペプチドをコードするポリヌクレオチドおよび前記ポリヌクレオチドを含むベクターからなる群より選択された1種以上を含む、微生物。
- 前記微生物は、L-ロイシン生産能を有するものである、請求項9に記載の微生物。
- 前記微生物は、コリネバクテリウム属(Corynebacterium sp.)である、請求項9に記載の微生物。
- 前記コリネバクテリウム属微生物は、コリネバクテリウム・グルタミクム(Corynebacterium glutamicum)である、請求項11に記載の微生物。
- 請求項9に記載の微生物を培地で培養する工程を含む、L-ロイシンの生産方法。
- 前記方法は、培養された培地または微生物からL-ロイシンを回収する工程を追加的に含む、請求項13に記載のL-ロイシンの生産方法。
- 請求項1~6のいずれか一項に記載の変異型ポリペプチド;前記変異型ポリペプチドをコードするポリヌクレオチド;前記ポリヌクレオチドを含むベクター;および前記ポリペプチド、前記ポリヌクレオチド、または前記ベクターを含む微生物からなる群より選択された1種以上を含む、L-ロイシン生産用組成物。
- 請求項1~6のいずれか一項に記載の変異型ポリペプチド;前記変異型ポリペプチドをコードするポリヌクレオチド;前記ポリヌクレオチドを含むベクター;および前記ポリペプチド、前記ポリヌクレオチド、または前記ベクターを含む微生物からなる群より選択された1種以上の、L-ロイシンの生産のための使用方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR10-2020-0060578 | 2020-05-20 | ||
| KR1020200060578A KR102360900B1 (ko) | 2020-05-20 | 2020-05-20 | 신규한 폴리펩티드 및 이를 이용한 l-류신의 생산 방법 |
| PCT/KR2021/006033 WO2021235775A1 (ko) | 2020-05-20 | 2021-05-13 | 신규한 폴리펩티드 및 이를 이용한 l-류신의 생산 방법 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2023521189A JP2023521189A (ja) | 2023-05-23 |
| JP7584536B2 true JP7584536B2 (ja) | 2024-11-15 |
Family
ID=78698094
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022562152A Active JP7584536B2 (ja) | 2020-05-20 | 2021-05-13 | 新規なポリペプチドおよびこれを利用したl-ロイシンの生産方法 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US20230088135A1 (ja) |
| EP (1) | EP4155395A4 (ja) |
| JP (1) | JP7584536B2 (ja) |
| KR (1) | KR102360900B1 (ja) |
| CN (1) | CN115516087B (ja) |
| AR (1) | AR122115A1 (ja) |
| AU (1) | AU2021276867B2 (ja) |
| MX (1) | MX2022014581A (ja) |
| WO (1) | WO2021235775A1 (ja) |
| ZA (1) | ZA202209243B (ja) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN119752821B (zh) * | 2024-12-31 | 2025-09-26 | 深圳瑞德林生物技术有限公司 | 酶突变体及其在制备异亮氨酰精氨酸中的应用 |
| CN119799671B (zh) * | 2024-12-31 | 2025-10-17 | 宁夏伊品生物科技股份有限公司 | 蛋白质突变体及其生物材料在生产l-异亮氨酸中的应用 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN109456987A (zh) | 2018-10-26 | 2019-03-12 | 天津科技大学 | 高产l-亮氨酸的相关基因及工程菌构建方法与应用 |
| CN110540976A (zh) | 2019-08-29 | 2019-12-06 | 天津科技大学 | 一种异丙基苹果酸合成酶及其应用 |
| JP2020503045A (ja) | 2016-12-28 | 2020-01-30 | シージェイ チェイルジェダン コーポレーション | 新規なイソプロピルリンゴ酸シンターゼ変異体及びそれを用いたl−ロイシンの生産方法 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2201454C2 (ru) * | 1999-07-09 | 2003-03-27 | Закрытое акционерное общество "Научно-исследовательский институт Аджиномото-Генетика" | Мутантная альфа-изопропилмалат синтаза (ipms), днк, кодирующая мутантную ipms, способ получения штамма escherichia coli, способ получения l-лейцина |
| JP4623825B2 (ja) * | 1999-12-16 | 2011-02-02 | 協和発酵バイオ株式会社 | 新規ポリヌクレオチド |
| WO2010141468A1 (en) * | 2009-06-01 | 2010-12-09 | Way Jeffrey C | Methods and molecules for yield improvement involving metabolic engineering |
| DK2841568T3 (en) * | 2012-04-27 | 2018-05-22 | Evonik Technochemie Gmbh | FEEDBACK-RESISTANT ALFA ISOPROPYL MALATE SYNTHETAS |
| KR101796830B1 (ko) | 2015-08-25 | 2017-11-13 | 씨제이제일제당 (주) | L-류신 생산능을 가지는 미생물 및 이를 이용한 l-류신의 제조방법 |
| CN106754807B (zh) * | 2016-12-29 | 2020-10-30 | 廊坊梅花生物技术开发有限公司 | 生产l-亮氨酸菌株和生产l-亮氨酸的方法 |
| CN110551670B (zh) * | 2019-09-19 | 2020-09-25 | 天津科技大学 | 一种生产l-亮氨酸的基因工程菌及其应用 |
-
2020
- 2020-05-20 KR KR1020200060578A patent/KR102360900B1/ko active Active
-
2021
- 2021-05-13 CN CN202180027726.2A patent/CN115516087B/zh active Active
- 2021-05-13 AU AU2021276867A patent/AU2021276867B2/en active Active
- 2021-05-13 JP JP2022562152A patent/JP7584536B2/ja active Active
- 2021-05-13 EP EP21809542.0A patent/EP4155395A4/en active Pending
- 2021-05-13 WO PCT/KR2021/006033 patent/WO2021235775A1/ko not_active Ceased
- 2021-05-13 US US17/760,462 patent/US20230088135A1/en active Pending
- 2021-05-13 MX MX2022014581A patent/MX2022014581A/es unknown
- 2021-05-17 AR ARP210101354A patent/AR122115A1/es unknown
-
2022
- 2022-08-17 ZA ZA2022/09243A patent/ZA202209243B/en unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2020503045A (ja) | 2016-12-28 | 2020-01-30 | シージェイ チェイルジェダン コーポレーション | 新規なイソプロピルリンゴ酸シンターゼ変異体及びそれを用いたl−ロイシンの生産方法 |
| CN109456987A (zh) | 2018-10-26 | 2019-03-12 | 天津科技大学 | 高产l-亮氨酸的相关基因及工程菌构建方法与应用 |
| CN110540976A (zh) | 2019-08-29 | 2019-12-06 | 天津科技大学 | 一种异丙基苹果酸合成酶及其应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2021276867B2 (en) | 2024-07-11 |
| KR102360900B1 (ko) | 2022-02-09 |
| AR122115A1 (es) | 2022-08-17 |
| MX2022014581A (es) | 2023-01-16 |
| CA3172407A1 (en) | 2021-11-25 |
| EP4155395A4 (en) | 2024-05-15 |
| EP4155395A1 (en) | 2023-03-29 |
| KR20210143591A (ko) | 2021-11-29 |
| WO2021235775A1 (ko) | 2021-11-25 |
| ZA202209243B (en) | 2023-12-20 |
| AU2021276867A1 (en) | 2022-09-15 |
| CN115516087B (zh) | 2025-04-15 |
| CN115516087A (zh) | 2022-12-23 |
| JP2023521189A (ja) | 2023-05-23 |
| US20230088135A1 (en) | 2023-03-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11697810B2 (en) | Adenylosuccinate synthetase and method for producing purine nucleotides using the same | |
| CN108884449B (zh) | 新型异丙基苹果酸合酶变异体及使用其生产l-亮氨酸的方法 | |
| US11008599B2 (en) | Variant phosphoribosylpyrophosphate amidotransferase and method of preparing purine nucleotide using the same | |
| CN106029879B (zh) | 具有提高的l-苏氨酸生产能力的微生物以及使用其生产l-苏氨酸的方法 | |
| JP2023503077A (ja) | 新規な分枝鎖アミノ酸アミノトランスフェラーゼ変異体及びそれを用いたロイシン生産方法 | |
| JP2025168674A (ja) | L-リジン生産能が向上したコリネバクテリウム・グルタミカム変異株およびこれを用いたl-リジンの生産方法 | |
| KR102589135B1 (ko) | 3-메틸-2-옥소뷰타노에이트 하이드록시 메틸트랜스퍼라아제의 활성이 강화된 미생물, 및 이의 용도 | |
| JP7584536B2 (ja) | 新規なポリペプチドおよびこれを利用したl-ロイシンの生産方法 | |
| KR20220003476A (ko) | 3-메틸-2-옥소뷰타노에이트 하이드록시 메틸트랜스퍼라아제의 활성이 강화된 미생물, 및 이의 용도 | |
| JP7766704B2 (ja) | L-リシン生産能が向上したコリネバクテリウム・グルタミカム変異株及びそれを用いたl-リシン生産方法 | |
| JP7576180B2 (ja) | GlxR蛋白質変異体またはこれを利用したスレオニン生産方法 | |
| JP2024544690A (ja) | L-リジン生産能が向上したコリネバクテリウム・グルタミカム変異株およびこれを用いたl-リジンの生産方法 | |
| RU2811433C1 (ru) | Новый полипептид и способ получения l-лейцина с его использованием | |
| JP7683040B2 (ja) | L-リシン生産能が向上したコリネバクテリウム・グルタミカム変異株及びそれを用いたl-リシンの生産方法 | |
| CA3172407C (en) | Novel polypeptide and method for producing l-leucine using same | |
| JP2023540518A (ja) | L-リジン生産能が向上したコリネバクテリウムグルタミクム変異株およびこれを用いたl-リジンの生産方法 | |
| JP7683041B2 (ja) | L-リシン生産能が向上したコリネバクテリウム・グルタミカム変異株及びそれを用いたl-リシンの生産方法 | |
| JP7620123B2 (ja) | L-リシン生産能が向上したコリネバクテリウム・グルタミカム変異株及びそれを用いたl-リシン生産方法 | |
| JP7475408B2 (ja) | L-アルギニンまたはl-シトルリン生産能が向上したコリネバクテリウム属微生物およびこれを用いたl-アルギニンまたはl-シトルリンの生産方法 | |
| JP7683011B2 (ja) | イソプロピルリンゴ酸シンターゼ変異体及びそれを用いたl-ロイシンの生産方法 | |
| KR102685495B1 (ko) | L-라이신 생산능이 향상된 코리네박테리움 글루타미쿰 변이주 및 이를 이용한 l-라이신의 생산 방법 | |
| US20180037615A1 (en) | Microorganism with enhanced l-lysine producibility and method for producing l-lysine using the same | |
| HK1258202B (en) | Novel isopropylmalate synthase mutant and production method of l-leucine using same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20221011 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20221011 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20231128 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240221 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240423 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240722 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20241008 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20241105 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7584536 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |