JP7572945B2 - テロメラーゼホロ酵素複合体およびその使用方法 - Google Patents
テロメラーゼホロ酵素複合体およびその使用方法 Download PDFInfo
- Publication number
- JP7572945B2 JP7572945B2 JP2021512660A JP2021512660A JP7572945B2 JP 7572945 B2 JP7572945 B2 JP 7572945B2 JP 2021512660 A JP2021512660 A JP 2021512660A JP 2021512660 A JP2021512660 A JP 2021512660A JP 7572945 B2 JP7572945 B2 JP 7572945B2
- Authority
- JP
- Japan
- Prior art keywords
- cells
- telomerase
- cell
- holoenzyme
- telomerase holoenzyme
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/12—Transferases (2.) transferring phosphorus containing groups, e.g. kinases (2.7)
- C12N9/1241—Nucleotidyltransferases (2.7.7)
- C12N9/1276—RNA-directed DNA polymerase (2.7.7.49), i.e. reverse transcriptase or telomerase
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6844—Nucleic acid amplification reactions
- C12Q1/686—Polymerase chain reaction [PCR]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y207/00—Transferases transferring phosphorus-containing groups (2.7)
- C12Y207/07—Nucleotidyltransferases (2.7.7)
- C12Y207/07049—RNA-directed DNA polymerase (2.7.7.49), i.e. telomerase or reverse-transcriptase
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/502—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing non-proliferative effects
- G01N33/5023—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing non-proliferative effects on expression patterns
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5044—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics involving specific cell types
- G01N33/5047—Cells of the immune system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/70—Enzymes
- C12N2501/72—Transferases [EC 2.]
- C12N2501/727—Kinases (EC 2.7.)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/16011—Human Immunodeficiency Virus, HIV
- C12N2740/16041—Use of virus, viral particle or viral elements as a vector
- C12N2740/16043—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2563/00—Nucleic acid detection characterized by the use of physical, structural and functional properties
- C12Q2563/159—Microreactors, e.g. emulsion PCR or sequencing, droplet PCR, microcapsules, i.e. non-liquid containers with a range of different permeability's for different reaction components
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/90—Enzymes; Proenzymes
- G01N2333/91—Transferases (2.)
- G01N2333/912—Transferases (2.) transferring phosphorus containing groups, e.g. kinases (2.7)
- G01N2333/91205—Phosphotransferases in general
- G01N2333/91245—Nucleotidyltransferases (2.7.7)
- G01N2333/9125—Nucleotidyltransferases (2.7.7) with a definite EC number (2.7.7.-)
- G01N2333/9128—RNA-directed DNA polymerases, e.g. RT (2.7.7.49)
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Molecular Biology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Wood Science & Technology (AREA)
- Biochemistry (AREA)
- Zoology (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Biotechnology (AREA)
- Hematology (AREA)
- Microbiology (AREA)
- Urology & Nephrology (AREA)
- Medicinal Chemistry (AREA)
- General Engineering & Computer Science (AREA)
- Cell Biology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Food Science & Technology (AREA)
- Tropical Medicine & Parasitology (AREA)
- General Physics & Mathematics (AREA)
- Toxicology (AREA)
- Pathology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Enzymes And Modification Thereof (AREA)
Description
本出願は、2018年9月6日に出願された米国仮特許出願第62/727,743号に対する優先権の恩典を主張するものであり、その全内容は参照により本明細書に組み入れられる。
本開示は、細胞生物学、分子生物学、タンパク質生物学、および医学の分野に関する。より具体的には、本開示は、テロメア短縮を遅らせるかまたは修正するためのテロメラーゼホロ酵素複合体の生産および細胞へのその送達を記載する。
テロメアは、線状染色体の末端をキャップして、それらを分解から保護し、かつ染色体の融合を防ぐタンデムリピートである [1]。正常なヒト増殖細胞では、テロメアは細胞分裂のたびに徐々に短くなり [2]、最終的にはDNA損傷反応、複製老化、またはアポトーシスを引き起こす [3]。増殖の1つの結果として、テロメア長は加齢に伴い短縮し [4]、がん [3]、認知症 [6、7]、および循環器疾患 [5] を含む様々な加齢性病態とも相関する生物学的年齢(暦年齢ではない)のバイオマーカーと見なされる [5]。マウスにおける最近の研究により、加齢の1つの特徴であるテロメア短縮を防ぐことで、健康寿命と寿命の両方が延びることが示されている [8、9]。
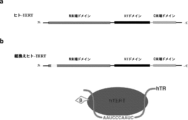
以下に記載するように、本発明者らは、ビオチンタグ付き組換えhTERTを操作し、それをhTR(テロメラーゼの機能的RNA構成成分)と共にヒト細胞株H1299において過剰発現させることに成功した。本発明者らはまた、細胞溶解物から組換えテロメラーゼを精製するための3段階精製手順戦略を開発した。この多段階精製手順により、本発明者らは、高度に濃縮された、触媒活性のある酵素を得ることが可能になった。重要なことには、本発明者らは自身が開発したビオチンタグを利用し、それによって、テロメラーゼ(hTERT+hTR)のみならず、その他の必須のテロメラーゼ関連タンパク質、例えば、ジスケリン (DKC1)、リボ核タンパク質NOP10およびNHP2などを含む再構成テロメラーゼホロ酵素複合体全体をプルダウンすることが可能になった。本発明者らは、細胞透過性ペプチドと、NaClを介した高浸透圧によって誘導される能動的取り込み機構の組み合わせを用いることにより、精製テロメラーゼホロ酵素を正常な若齢および老齢のヒト細胞(例えば、抗原刺激末梢血単核細胞および肺線維芽細胞)に送達した。送達されたテロメラーゼは、細胞質画分および核区画の両方で強い活性を保持した。本発明者らはまた、インビトロにおけるテロメラーゼの3回連続送達(3日ごと)は、テロメア長および細胞の複製寿命の両方を有意に延長するのに十分であることを実証した。重要なことには、この処理は、最終的に老化を起こした細胞を不死化または形質転換させず、送達されたテロメラーゼホロ酵素は、限られた時間枠(最大で24~36時間まで)で活性を維持した。このヒト組換えテロメラーゼホロ酵素を利用して、テロメアを一過性に伸長させ、したがって老齢ヒト細胞の複製寿命を延長することができる。
テロメア長を増加させる、および/または細胞の増殖能を増加させる方法であって、
(i) 細胞集団を提供する段階;
(ii) 該細胞集団の少なくとも第1部分を精製組換えテロメラーゼホロ酵素と接触させる段階;および
(iii) 該第1部分からの細胞において、テロメア長によって調節される1つまたは複数の標的遺伝子の発現を測定する段階
を含む、前記方法。
[本発明1002]
(iv) 前記細胞集団の第2部分からの未処理細胞などの未処理細胞と比較して、前記標的遺伝子のうちの1つまたは複数が、テロメラーゼ活性を示唆する発現プロファイルを示す場合に、前記第1部分からの第2細胞を対象に導入する段階
をさらに含む、本発明1001の方法。
[本発明1003]
段階 (ii) の前に、前記細胞集団の第3細胞において、テロメア長によって調節される1つまたは複数の標的遺伝子の発現を測定する段階
をさらに含む、本発明1001または1002の方法。
[本発明1004]
前記1つまたは複数の標的遺伝子が、ISG15、TEAD4、PD-1、および/またはBAXである、本発明1001~1003のいずれかの方法。
[本発明1005]
前記細胞集団がPBMCである、本発明1001~1004のいずれかの方法。
[本発明1006]
前記細胞集団が、CD3 + /CD28 + T細胞などのT細胞である、本発明1001~1004のいずれかの方法。
[本発明1007]
段階 (i) の前に、前記細胞集団を対象から取り出す段階
をさらに含む、本発明1001の方法。
[本発明1008]
対象がヒト対象である、本発明1002~1007のいずれかの方法。
[本発明1009]
対象が、臍帯血幹細胞を有するNOD SCID γマウスなどのヒト化マウスである、本発明1002~1008のいずれかの方法。
[本発明1010]
前記テロメラーゼホロ酵素が細胞透過性ペプチドに結合されている、本発明1001~1009のいずれかの方法。
[本発明1011]
細胞の増殖能を増加させる方法であって、
(i) 細胞集団を提供する段階;
(ii) 該細胞集団の第1部分を組換えテロメラーゼホロ酵素と接触させる段階;
(iii) 老化またはアポトーシスが誘発される前に該第1部分からの第1細胞が行う細胞分裂の総数を測定する段階;
(iv) 老化またはアポトーシスが誘発される前に該細胞集団の第2部分だがテロメラーゼ未処理である部分からの細胞が行う細胞分裂の総数を測定する段階;および
(v) 該第1部分からの第2細胞ががんの特徴を示さないかどうかを判定する段階
を含む、前記方法。
[本発明1012]
(iv) 段階 (iii) で測定された細胞分裂の総数が段階 (iv) で測定された細胞分裂の総数よりも大きい場合、かつ前記第1部分からの前記第2細胞ががんの特徴を示さない場合に、該第1部分からの第3細胞を対象に導入する段階
をさらに含む、本発明1011の方法。
[本発明1013]
(a) 段階 (iii) の一部として、または (b) 前記細胞集団からの第4細胞の場合には段階 (ii) の前に、テロメア長、および/またはテロメア長によって調節される1つもしくは複数の標的遺伝子の発現を測定する段階
をさらに含む、本発明1011または1012の方法。
[本発明1014]
1つまたは複数の標的遺伝子が、ISG15、TEAD4、PD-1、および/またはBAXである、本発明1013の方法。
[本発明1015]
細胞の細胞第1集団がPBMCである、本発明1011~1014のいずれかの方法。
[本発明1016]
細胞の第1集団が、CD3 + /CD28 + T細胞などのT細胞である、本発明1011~1014のいずれかの方法。
[本発明1017]
段階 (i) の前に、前記細胞集団を対象から取り出す段階
をさらに含む、本発明1011の方法。
[本発明1018]
対象がヒト対象である、本発明1012~1017のいずれかの方法。
[本発明1019]
対象が、臍帯血幹細胞を有するNOD SCID γマウスなどのヒト化マウスである、本発明1012~1018のいずれかの方法。
[本発明1020]
前記テロメラーゼホロ酵素が細胞透過性ペプチドに結合されている、本発明1011~1019のいずれかの方法。
本開示のその他の目的、特徴、および利点は、以下の詳細な説明から明らかになるであろう。しかしながら、本開示の精神および範囲の範囲内の様々な変更および修正が、この詳細な説明から当業者に明らかとなると考えられるため、詳細な説明および具体例は、本開示のある特定の態様を示しながら、例示として与えられているに過ぎないことが理解されるべきである。
上述したように、老化細胞は、養子免疫療法などの治療への使用の可能性がかなり限られている。したがって、インビトロでの急速な増殖中のテロメアの消失から細胞を効率的に保護する手段を提供する技術は、抗原特異的T細胞のような細胞の臨床適用の成功のために非常に有利であると考えられる。
テロメアは、TTAGGG DNAリピートの複数コピーからなる、線状の真核生物染色体の末端に見出される保護構造である。テロメアは、6つのタンパク質:テロメアリピート結合因子 (TRF) 1、TRF2、TIN2、Rap1、TPP1、およびPOT1と会合しており、これらはすべて一緒になってシェルタリン複合体と称される [42]。ヒトのテロメアは、通常、線状DNA鎖の末端を、切断されて修復が必要なものとして扱う細胞機構から保護されている。2つの主要なテロメア結合タンパク質であるTRF1およびTRF2は、すべてのヒト細胞で発現しており、細胞周期を通してテロメアリピートDNA配列と会合している [43]。TRF1およびTRF2は、hRap1およびMre11/Rad50/Nbs1 DNA修復複合体と会合することが公知である [44、45]。TRF2はまた、Ku70/80ヘテロ二量体などの、その他のDNA損傷検出および修復因子に結合することも公知である [46、47]。ヘテロ核RNP (hnRNP)、毛細血管拡張性運動失調症変異 (ATM) キナーゼ、およびポリ(ADP-リボース)ポリメラーゼ (PARP) は、テロメア長に影響を及ぼすことが確認されている [48~55]。テロメア末端を含む遠くの3'末端は、tループと称される高度に秩序だった構造を形成し得る一本鎖オーバーハングを有する [56]。これらの集合的な構成成分およびDNA構造は、DNA末端の保護および維持に関与している。
本開示は、1つの局面において、テロメラーゼホロ酵素複合体の生産および製剤、ならびに細胞、組織、または対象へのそれらの送達に関する。一般に、タンパク質の組換え生産は周知であり、したがって本明細書では詳細に説明しない。
1. 生産
組換えヒトテロメラーゼ(hTERT+hTR)の開発および過剰発現、ならびに安定した細胞株「Super H1299」の作製に関する詳細な情報は、以下の実施例に見出される。加えて、現在および今後のいくつかの実験において、組換え酵素の開発、生産、および精製に関する修正が採用されることが指摘されるべきである。以下のリストは、考えられる修正を含む:
1) 組換えテロメラーゼの過剰発現のための付加的な細胞株:ヒト組換えタンパク質の生産用のFDA承認細胞株(例えば、HEK293、PER.C6、CHO、P. パストリス (P. pastoris))。
2) 精製目的のための付加的なTERTタグ:a) 3×Flag-GS10-TERT;b) HA-GS10-TERT;c) ZZ-TEV-SS-TERT;d) ビオチン-TEV-cMYC-TERT。
‐タグはすべて、本発明者らが開発したビオチンタグについて説明したのと全く同じように、N末端局在化を有する。
‐実験によっては、タグは、プロテアーゼ特異的切断(TEV部位)により、精製後に除去される。
3) TERT配列への付加的な改変:テロメアにおける組換えテロメラーゼの活性、安定性、および処理能力に及ぼすリン酸化事象またはその欠如の影響を解析するためのリン酸部位置換。
i) アスパラギン酸によって置換されたセリン227、
ii) アスパラギン酸によって置換されたセリン824、
iii) アスパラギン酸によって置換されたセリン921、および/または
iv) アラニンによって置換されたスレオニン249
本開示に従ってテロメラーゼホロ酵素を精製することが望ましいと考えられる。タンパク質精製技法は、当業者に周知である。これらの技法は、1つのレベルにおいて、ポリペプチド画分および非ポリペプチド画分への細胞環境の粗分画を伴う。他のタンパク質からポリペプチドを分離した後、関心対象のポリペプチドを、部分精製または完全精製(または均一になるまでの精製)を達成するために、クロマトグラフィー技法および電気泳動技法を使用してさらに精製することができる。純粋なペプチドの調製に特に適した分析法は、イオン交換クロマトグラフィー、排除クロマトグラフィー;ポリアクリルアミドゲル電気泳動;等電点電気泳動である。ペプチドを精製する特に効率的な方法は、高速タンパク質液体クロマトグラフィーまたはさらにはHPLCである。
本開示は、テロメラーゼに連結された細胞透過性ペプチド(CPP、細胞送達ペプチドまたは細胞形質導入ドメインとも称される)の使用を企図する。CPPの本質的な性質により、CPPが将来の薬物および疾患診断剤の潜在的な構成成分となり得ることが示される [67、68]。CPPは、合成および特徴づけが比較的簡単であり、主にエンドサイトーシスを介して、毒性のない様式で、結合された生理活性タンパク質を細胞内に送達することができる。重要なことには、CPPは、受動的かつ非選択的(すべての細胞型に普遍的に適用可能)であるが、特定の細胞もしくは組織(またはPBMCなどの不均一な細胞集団中の特定の細胞型)を標的とする効果的な送達ベクターを作製するために機能化または化学修飾することもできる。したがって、CPPは、長い間治療には不可能であると考えられていた、テロメラーゼなどの複雑なタンパク質を用いた医学的治療の開発可能性のための有用なプラットフォームを提供する。
A. 細胞および培養
上述したように、本開示は、細胞におけるテロメア長を増加させることを提供する。一般に、処理される細胞は任意の細胞であってよいが、特に、本発明者らは、養子免疫療法において使用するための操作されたT細胞を処理することを企図する。しかしながら、関心対象の他の特定の細胞型には、骨髄由来の造血幹細胞、肺上皮細胞、肝細胞、および未受精卵(体外受精前の)が含まれる。
臨床適用が企図される場合、細胞製剤は、意図される適用に適した形態で調製される。一般的に、これは、発熱物質、および細胞、ヒト、または動物にとって有害であり得る他の不純物を本質的に含まない組成物を調製することを要する。
以下の実施例は、本開示の様々な局面をさらに例示するために含めるものである。以下の実施例において開示される技法は、本開示の実施において良好に機能することが本発明者によって発見された技法および/または組成物を表し、したがってその実施のための好ましい様式を構成すると見なされ得ることが、当業者によって認識されるべきである。しかしながら、当業者は、本開示を考慮して、本開示の精神および範囲から逸脱することなく、開示される特定の態様において多くの変更を行い、なお同様のまたは類似の結果を得ることができることを認識すべきである。
組換えヒトテロメラーゼ(hTERT+hTR)の開発および過剰発現、ならびに安定した細胞株Super H1299の作製
操作された組換えhTERTは、hTERTのN末端の前にインビボビオチン化配列、Tevプロテアーゼ切断部位、cMycタグを含み、hTERT配列の前に99アミノ酸残基を付加する。付加された配列は、
である。保存されたビオチン化配列は、哺乳動物細胞において保存されたMKM部位でビオチン化される。改変されたhTERTプラスミドおよび外因性hTRプラスミドをそれぞれレトロウイルスベクターおよびレンチウイルスベクターにパッケージングし、それらを使用してトランスフェクトし、本発明者らがSuper H1299と称する安定した細胞株を作製した。ハイグロマイシン選択後、細胞を増殖させ、週ベースで回収し、様々な実験に使用した。
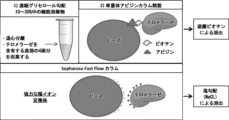
super H1299細胞の2億個の凍結細胞ペレットを、1.5% CHAPS溶解緩衝液(10%グリセロール、1 mM EGTA pH8.0、0.1 mM MgCl2、10 mM Tris-HCL、0.01 mM PMSF、1単位のRiboLock RNAse阻害剤、および1単位のPIカクテル)中で、4℃で回転させながら30分間溶解した。次いで、細胞を17,500×gで4℃で1時間遠心分離した。上清を収集し、清潔なチューブに入れた。10 mlの連続グリセロール勾配(10~30%)を、勾配メーカー(グリセロール、20 mM HEPES pH7.5、300 mM KCl、0.1 mM MgCl2、0.1% Triton X-100、および1 mM EGTA)で作製した。細胞溶解物試料を勾配の上部に負荷した後、超遠心分離を126,000×gで4℃で19時間行った(SW41 Beckmanローター)。勾配を11画分(各1 mL)に分画した。底部の5画分が、ほぼすべてのテロメラーゼ活性を含んでいた。これらの5画分(7~11)を共にプールし、単量体アビジンビーズ (Peirce) と共に4℃で2時間インキュベートした。インキュベーション後、ビーズをマイクロバイオスピンクロマトグラフィーカラム (BioRad) に入れた。フロースルー溶液を収集し、ビーズを、150 mMリン酸ナトリウム、pH7.0および100 mM NaClを含有する5 mlの緩衝液で2回洗浄した。次いで、濃縮されたテロメラーゼを、400 mM NaCl、150 mMリン酸ナトリウム緩衝液 pH7.0、および4 mM D-ビオチン (Pierce) で溶出した。テロメラーゼ活性は、各1 mlの3つの画分に溶出された。これらの溶出画分を共にプールし、最終カラムであるSP(スルホプロピル)Sepharose Fast Flow (SPFF) と共にインキュベートした。SPFF樹脂は、テロメラーゼとのインキュベーションの前に、50 mMリン酸ナトリウム (pH 7.0) および50 mM NaCl中で平衡化した。テロメラーゼをSPFFビーズと共に4℃で2時間インキュベートした。インキュベーション後、ビーズをマイクロバイオスピンカラムに負荷した。フロースルーを収集し、SPFFビーズを、20 mMリン酸ナトリウム pH7.0および50 mM NaClで作製された5 mlの緩衝液で2回洗浄した。次いで、テロメラーゼをNaCl塩勾配(200 mM~500 mMの6段階)で溶出した。これを6つの別々の溶出画分 (500μl) で行った。500 mMからの溶出液は、テロメラーゼ活性の大部分を含んでいた。これらの溶出画分(E2、E3、およびE4)を共にプールし、その後のアッセイおよび実験に使用した。
末梢血単核細胞 (PBMC) を、Ficoll-Paque Plus (GE Healthcare) を用いた遠心分離により健常ボランティアの末梢血から単離し、次いで分析するまで-140℃で凍結保存した。細胞は、マイトジェン刺激の24時間前に融解し、10%ウシ胎児血清、10 ng/ml IL-2、1%ペニシリン、ストレプトマイシン、およびアンホテリシンBを添加したRPMI+GlutaMAX-Iで培養した。24時間後、細胞懸濁液を新しいフラスコに移して、単球(フラスコのプラスチックに付着した)を除去した。
ホロ酵素の生産
本発明者らは、ビオチンタグ付き組換えhTERTを操作し、それをhTR(テロメラーゼの機能的RNA構成成分)と共にヒト細胞において過剰発現させることに成功した。本発明者らはまた、組換え酵素を得るための3段階精製手順戦略を開発した。
PBMCは、ヒト免疫応答の主要な構成成分であるT細胞から主としてなる不均一な細胞集団である。T細胞は、刺激を受けていない場合には静止または休止状態にあり、増殖活性をほとんどまたは全く示さない。対照的に、抗原特異的に活性化されると、T細胞は急速に分裂し、遺伝子発現の劇的な変化を示す [72]。
テロメラーゼ活性を測定するために、本発明者らは、以前に本発明者らの研究室で開発された液滴デジタルPCRアッセイ (ddTRAP) を利用した [71]。ddTRAPは、単一細胞レベルでテロメラーゼ活性の絶対的定量をもたらす、デジタルで、ハイスループットで、かつ高感度なアッセイである。重要なことには、この改良された技術は、ゲルベースのTRAP(当分野においていまだに主に利用されているが、半定量的でしかない)とは対照的に、テロメラーゼ活性にわずか10%の差しかない試料間で識別することができる。
テロメア長は、本発明者らの研究室で最近開発された、高感度かつ高精度の新たなアッセイ(TeSLA、テロメア最短長アッセイ (Telomere Shortest Length Assay))を用いることによって測定した [74]。TeSLAにより、平均テロメア長および最短20%のテロメアの長さの両方を同時に測定することができる。重要なことには、TRFおよびQ-FISH(現在、当分野における絶対的基準)の両方とは対照的に、TeSLAは、1年の期間にわたってヒト免疫細胞で起こる生理的テロメア消耗などのテロメア長のわずかな変動を検出することができる [74]。TeSLAを用いて、本発明者らは、インビトロで増殖させた刺激済みのPBMCにおいて、10日間にわたる漸進的なテロメア短縮を実証することができた。
Claims (8)
- 細胞の増殖能を増加させるインビトロの方法であって、該方法が、細胞集団の細胞をhTERT、hTR、DKC1、NOP10およびNHP2を含む組換えテロメラーゼホロ酵素と接触させる段階であって、該組換えテロメラーゼホロ酵素が該細胞に導入され、該導入された組換えテロメラーゼホロ酵素が、該細胞の複製寿命を延長させる、段階を含み、該細胞集団が、末梢血単核細胞(PBMC)の集団である、前記方法。
- 前記細胞集団を提供する前に、前記細胞集団が対象から取り出されるものである、請求項1に記載の方法。
- 前記細胞集団が、前記接触させる段階の前に1つまたは複数の異種構築物でインビトロで操作される、請求項1または2に記載の方法。
- 前記接触させた細胞がT細胞である、請求項1または2に記載の方法。
- 前記T細胞が、CD3+/CD28+ T細胞である、請求項4に記載の方法。
- 前記組換えテロメラーゼホロ酵素が細胞透過性ペプチドに結合している、請求項1または2に記載の方法。
- (i)対象から取り出されたT細胞またはそのインビトロで増殖させた細胞を1つまたは複数の異種構築物で操作する段階;および
(ii)該操作されたT細胞を、hTERT、hTR、DKC1、NOP10およびNHP2を含む組換えテロメラーゼホロ酵素と接触させる段階であって、該組換えテロメラーゼホロ酵素が該操作されたT細胞に導入され、該導入された組換えテロメラーゼホロ酵素が、該細胞の複製寿命を延長させる、段階;
を含む、T細胞の増殖能を増加させる方法。 - 前記組換えテロメラーゼホロ酵素が細胞透過性ペプチドに結合している、請求項7に記載の方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2024126506A JP2024156858A (ja) | 2018-09-06 | 2024-08-02 | テロメラーゼホロ酵素複合体およびその使用方法 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862727743P | 2018-09-06 | 2018-09-06 | |
| US62/727,743 | 2018-09-06 | ||
| PCT/US2019/049271 WO2020051102A1 (en) | 2018-09-06 | 2019-09-03 | Telomerase holoenzyme complex and methods of use thereof |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024126506A Division JP2024156858A (ja) | 2018-09-06 | 2024-08-02 | テロメラーゼホロ酵素複合体およびその使用方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2021536258A JP2021536258A (ja) | 2021-12-27 |
| JPWO2020051102A5 JPWO2020051102A5 (ja) | 2022-09-09 |
| JP7572945B2 true JP7572945B2 (ja) | 2024-10-24 |
Family
ID=69722030
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021512660A Active JP7572945B2 (ja) | 2018-09-06 | 2019-09-03 | テロメラーゼホロ酵素複合体およびその使用方法 |
| JP2024126506A Withdrawn JP2024156858A (ja) | 2018-09-06 | 2024-08-02 | テロメラーゼホロ酵素複合体およびその使用方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024126506A Withdrawn JP2024156858A (ja) | 2018-09-06 | 2024-08-02 | テロメラーゼホロ酵素複合体およびその使用方法 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US20210238564A1 (ja) |
| EP (1) | EP3846621A4 (ja) |
| JP (2) | JP7572945B2 (ja) |
| KR (1) | KR20210057024A (ja) |
| CN (2) | CN112654244B (ja) |
| AU (1) | AU2019333905B2 (ja) |
| CA (1) | CA3109063A1 (ja) |
| WO (1) | WO2020051102A1 (ja) |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5830644A (en) * | 1992-05-13 | 1998-11-03 | Geron Corporation | Method for screening for agents which increase telomerase activity in a cell |
| DE69723531T3 (de) * | 1996-10-01 | 2012-09-06 | Geron Corp. | Katalytische Untereinheit der menschlichen Telomerase |
| US6337200B1 (en) * | 1998-03-31 | 2002-01-08 | Geron Corporation | Human telomerase catalytic subunit variants |
| AU7350800A (en) * | 1999-09-07 | 2001-04-10 | Advanced Cell Technology, Inc. | Telomere restoration and extension of cell life-span in animals cloned from senescent somatic cells |
| JP2005500032A (ja) * | 2001-06-15 | 2005-01-06 | インターリューキン ジェネティックス インコーポレイテッド | 老化関連症状の早期発現を検出および治療する方法 |
| CN102861340A (zh) * | 2012-03-15 | 2013-01-09 | 杨文莉 | 智能型纳米递送系统、制备方法及其应用 |
| DK2959005T3 (da) * | 2013-02-22 | 2022-01-03 | Univ Leland Stanford Junior | Medicinsk anvendelse relateret til telomer forlængelse |
| CN108473956B (zh) * | 2015-10-09 | 2022-04-05 | 北昊干细胞与再生医学研究院有限公司 | 增强外源性施用t细胞的体内持久性和功效的方法、基因修饰的t细胞和方法以及使用方法 |
-
2019
- 2019-09-03 US US17/273,880 patent/US20210238564A1/en active Pending
- 2019-09-03 JP JP2021512660A patent/JP7572945B2/ja active Active
- 2019-09-03 WO PCT/US2019/049271 patent/WO2020051102A1/en not_active Ceased
- 2019-09-03 EP EP19856987.3A patent/EP3846621A4/en active Pending
- 2019-09-03 AU AU2019333905A patent/AU2019333905B2/en active Active
- 2019-09-03 KR KR1020217006356A patent/KR20210057024A/ko not_active Ceased
- 2019-09-03 CN CN201980058294.4A patent/CN112654244B/zh active Active
- 2019-09-03 CA CA3109063A patent/CA3109063A1/en active Pending
- 2019-09-03 CN CN202310817854.8A patent/CN117568273A/zh active Pending
-
2024
- 2024-08-02 JP JP2024126506A patent/JP2024156858A/ja not_active Withdrawn
Non-Patent Citations (1)
| Title |
|---|
| Cell,2015年,161,p. 674-690 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN117568273A (zh) | 2024-02-20 |
| JP2021536258A (ja) | 2021-12-27 |
| JP2024156858A (ja) | 2024-11-06 |
| AU2019333905A1 (en) | 2021-03-04 |
| CA3109063A1 (en) | 2020-03-12 |
| WO2020051102A1 (en) | 2020-03-12 |
| US20210238564A1 (en) | 2021-08-05 |
| AU2019333905B2 (en) | 2025-12-11 |
| EP3846621A1 (en) | 2021-07-14 |
| CN112654244B (zh) | 2023-07-25 |
| EP3846621A4 (en) | 2022-07-06 |
| KR20210057024A (ko) | 2021-05-20 |
| CN112654244A (zh) | 2021-04-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7761293B2 (ja) | Mage-b2特異性を有するt細胞受容体およびその使用 | |
| TWI846697B (zh) | 工程化細胞外囊泡及其用途 | |
| KR102615681B1 (ko) | 변형된 t 세포에 대한 조건부 활성 키메라 항원 수용체 | |
| KR20190120233A (ko) | Rna 암 백신 | |
| KR20190008890A (ko) | 인터류킨-12 (il12)를 코딩하는 폴리뉴클레오티드 및 그의 용도 | |
| KR20190111022A (ko) | T-세포 조절 다량체 폴리펩타이드 및 이의 사용 방법 | |
| KR100786054B1 (ko) | 세포상해성 림프구의 제조방법 | |
| CN116162658A (zh) | 用于稳定慢病毒制剂的缓冲液 | |
| US20180360924A1 (en) | Telomere extension and anti-inflammatory agents for cell regeneration | |
| KR20200125574A (ko) | 공여자 변형된 세포의 선택을 위해 조절가능한 스위치 | |
| CA2192844A1 (en) | Fas associated proteins | |
| JP2022519275A (ja) | エクソソーム操作のための膜タンパク質足場 | |
| AU2015225496A1 (en) | Chimeric dystrophin-VSV-G-protein to treat dystrophinopathies | |
| Wensveen et al. | CD70-driven costimulation induces survival or Fas-mediated apoptosis of T cells depending on antigenic load | |
| JP7432250B2 (ja) | 修飾t細胞に対する条件的活性型キメラ抗原受容体 | |
| WO2020018578A1 (en) | Compositions and methods related to aptamer-based reversible cell selection | |
| JP7572945B2 (ja) | テロメラーゼホロ酵素複合体およびその使用方法 | |
| EP1363940A1 (de) | Tumor-peptidantigen aus humanem mdm2 proto-onkogen | |
| KR20220022126A (ko) | Tert 활성화 치료요법을 포함하는 방법 및 조성물 | |
| WO2024148233A1 (en) | Agonist extracellular vesicles | |
| EP4346883A1 (en) | Methods of treating or preventing autoimmune diseases | |
| HK40050897B (zh) | 端粒酶全酶复合体及其使用方法 | |
| WO2025043177A1 (en) | Akt1 fusion proteins and methods of use | |
| WO2025021979A1 (en) | Novel t cell receptors targeting melanoma-associated antigen (mage) b2 and immune therapy using the same | |
| WO2025064883A2 (en) | Engineered chimeric fusion protein compositions and methods of use thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220901 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20220901 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20230720 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20230821 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230906 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20231121 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240306 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20240306 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20240408 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240802 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240819 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20240906 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20241003 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20241011 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7572945 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |