JP7520719B2 - 生成が改良されたウイルス及び非ウイルスのナノプラスミドベクター - Google Patents
生成が改良されたウイルス及び非ウイルスのナノプラスミドベクター Download PDFInfo
- Publication number
- JP7520719B2 JP7520719B2 JP2020551263A JP2020551263A JP7520719B2 JP 7520719 B2 JP7520719 B2 JP 7520719B2 JP 2020551263 A JP2020551263 A JP 2020551263A JP 2020551263 A JP2020551263 A JP 2020551263A JP 7520719 B2 JP7520719 B2 JP 7520719B2
- Authority
- JP
- Japan
- Prior art keywords
- rna
- origin
- seq
- replication
- vector
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/70—Vectors or expression systems specially adapted for E. coli
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15041—Use of virus, viral particle or viral elements as a vector
- C12N2740/15043—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15051—Methods of production or purification of viral material
- C12N2740/15052—Methods of production or purification of viral material relating to complementing cells and packaging systems for producing virus or viral particles
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
- C12N2750/14143—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14151—Methods of production or purification of viral material
- C12N2750/14152—Methods of production or purification of viral material relating to complementing cells and packaging systems for producing virus or viral particles
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2800/00—Nucleic acids vectors
- C12N2800/10—Plasmid DNA
- C12N2800/101—Plasmid DNA for bacteria
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2800/00—Nucleic acids vectors
- C12N2800/24—Vectors characterised by the absence of particular element, e.g. selectable marker, viral origin of replication
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2800/00—Nucleic acids vectors
- C12N2800/90—Vectors containing a transposable element
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2820/00—Vectors comprising a special origin of replication system
- C12N2820/55—Vectors comprising a special origin of replication system from bacteria
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12R—INDEXING SCHEME ASSOCIATED WITH SUBCLASSES C12C - C12Q, RELATING TO MICROORGANISMS
- C12R2001/00—Microorganisms ; Processes using microorganisms
- C12R2001/01—Bacteria or Actinomycetales ; using bacteria or Actinomycetales
- C12R2001/185—Escherichia
- C12R2001/19—Escherichia coli
Landscapes
- Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Wood Science & Technology (AREA)
- Biomedical Technology (AREA)
- Organic Chemistry (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Zoology (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Virology (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Carbon And Carbon Compounds (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Saccharide Compounds (AREA)
Description
該当せず。
本出願は、2018年3月21日に出願された「生成が改良されたウイルス及び非ウイルスナノプラスミドベクター」と題する米国仮特許出願第62/645,892号に対する優先権を主張し、その全内容は参照により本明細書に組み込まれる。
本発明は、組換えDNA分子、即ち、ウイルス及び非ウイルス遺伝子治療、ウイルス及び非ウイルス細胞治療に有用なベクター、より具体的には、ウイルス及び非ウイルスベクターの製造収量及び品質を改良し、トランスフェクション関連毒性を低減し、非ウイルス性トランスポゾンベクターからの転移(transposition)を改良し、ウイルスベクターからのパッケージング力価を改良し、ウイルス及び非ウイルスベクターにコードされた遺伝子の発現を改良し、並びにウイルスベクター及び非ウイルスベクターが媒介する抗生物質選択マーカー遺伝子移入を排除するためのものである。
表2:NTC8685哺乳動物発現ベクタースペーサー領域(SR)誘導体の発現レベル。
表3:様々なウイルスベクター及び非ウイルスベクタープラットフォームを用いたミニサークル適用。
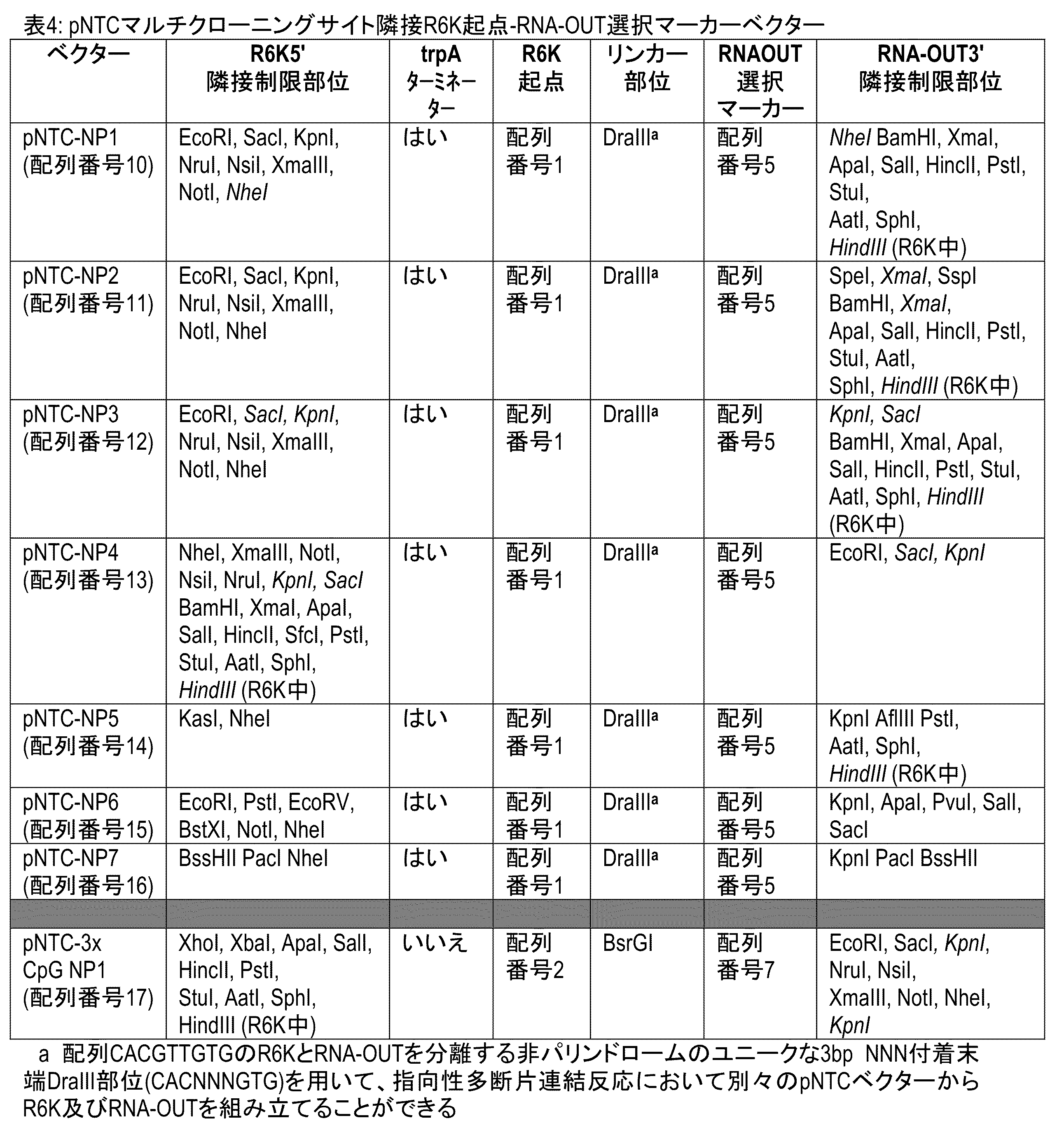
表4:pNTCマルチクローニングサイトが隣接するR6K起点-RNA-OUT選択マーカーベクター。
表5:SV40起点レンチウイルスベクター:pUC 対 R6K 起点振とうフラスコ生成収量/品質。
表6:スリーピング・ビューティトランスポゾンベクター:pUC 対 R6K起点振とうフラスコ生成収量/品質。
表7:AAVベクター:pUC 対 R6K起点振とうフラスコ生成収量/品質。
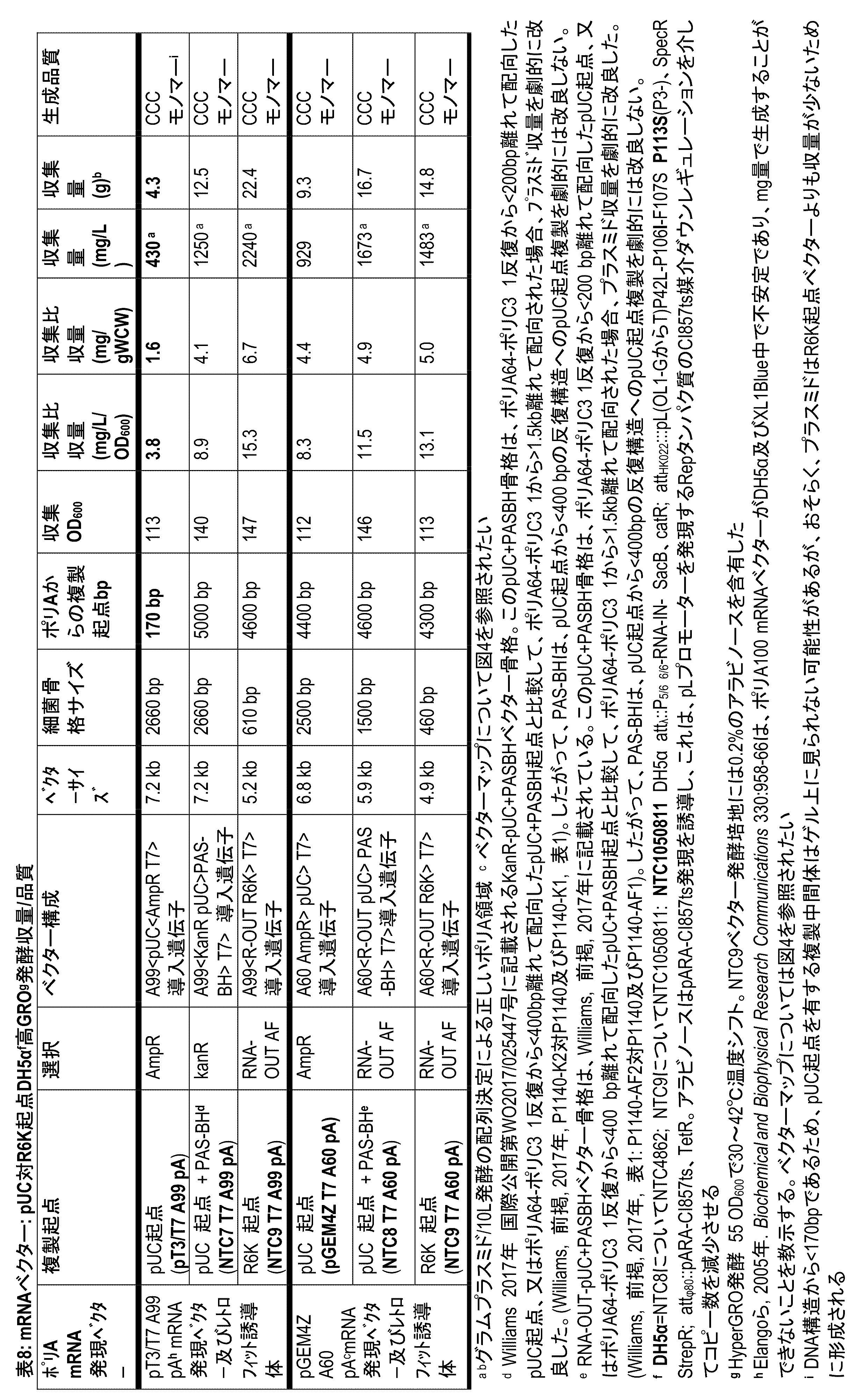
表8:mRNAベクター:pUC 対 R6K起点DH5α HyperGRO発酵収量/品質。
表9:AAVヘルパーベクター:pUC 対 R6K起点プラスミド生成収量/品質。
配列番号2:1 CpG R6Kガンマ起点
配列番号3:CpG不含R6Kガンマ起点
配列番号4:拡張R6Kガンマ起点
配列番号5:RNA-OUT選択マーカー
配列番号6:RNA-OUTアンチセンスリプレッサーRNA
配列番号7:2CpG RNA-OUT選択マーカー
配列番号8:NheIとKpnI制限部位が隣接するR6Kガンマ起点-RNA-OUT細菌領域
配列番号9:NpeIとKpnI制限部位が隣接する1CpG R6Kガンマ起点-2 CpG RNA-OUT細菌領域
配列番号10:pNTC-NP1ポリリンカーtrpA R6K-RNA-OUTポリリンカークローニングカセット:EcoRI/HindIII
配列番号11:pNTC-NP2ポリリンカーtrpA R6K-RNA-OUTポリリンカークローニングカセット:EcoRI/HindIII
配列番号12:pNTC-NP3ポリリンカーtrpA R6K-RNA-OUTポリリンカークローニングカセット:EcoRI/HindIII
配列番号13:pNTC-NP4ポリリンカーtrpA R6K-RNA-OUTポリリンカークローニングカセット:EcoRI/HinndIII
配列番号14:pNTC-NP5ポリリンカーtrpA R6K-RNA-OUTポリリンカークローニングカセット:KasI/HinndIII
配列番号15:pNTC-NP6ポリリンカーtrpA R6K-RNA-OUTポリリンカークローニングカセット:EcoRI/SacI
配列番号16:pNTC-NP7ポリリンカーtrpA R6K-RNA-OUTポリリンカークローニングカセット:BssHII/BssHII
配列番号17:pNTC-3xCpG NP1ポリリンカーR6K-RNA-OUTポリリンカークローニングカセット:HindIII/EcoRI
配列番号18:R6Kガンマ起点(7イテロン)
配列番号19:R6Kガンマ起点 22bpのイテロン反復
配列番号20:R6Kガンマ起点 22bpのイテロン反復
配列番号21:R6Kガンマ起点 22bpのイテロン反復
配列番号22:R6Kガンマ起点 22bpのイテロン反復
配列番号23:R6Kガンマ起点 22bpのイテロン反復
AAVベクター:アデノ随伴ウイルスベクター、エピソームウイルスベクター。自己相補的(sc)アデノ随伴ウイルスベクター(scAAV)及び一本鎖(ss)アデノ随伴ウイルスベクター(ssAAV)を含む。
AF:抗生物質不含。
amp:アンピシリン。
ampR:アンピシリン耐性遺伝子。
抗生物質選択マーカー:抗生物質に対する耐性を付与する遺伝子、例えば、アンピシリン耐性遺伝子、カナマイシン耐性遺伝子、クロラムフェニコール耐性遺伝子、テトラサイクリン耐性遺伝子。
およそ:本明細書で使用するとき、「およそ」又は「約」という用語は、1つ以上の関心のある値に適用される場合、記述された参照値と同じあるかまた類似している値を指す。
細菌領域:細菌宿主における増幅及び選択に必要とされるプラスミドベクターの領域。
bp:塩基対
cI:ラムダリプレッサー。
cITs857:温度感受性を付与するCからTへの(AlaからThrへの)突然変異をさらに組み込んだラムダリプレッサー。cITs857は、28~30℃で機能的なリプレッサーであるが、37~42℃ではほとんど不活性である。cI857とも呼ばれる。
CatR:クロラムフェニコール耐性遺伝子。
cmv:サイトメガロウイルス。
dcmメチル化:2番目のシトシンのC5位にある配列CC(A/T)GGをメチル化した大腸菌(E. coli)メチルトランスフェラーゼ。
DNAレプリコン:それ自体の制御下で複製できる遺伝的エレメント。例としては、プラスミド、コスミド、細菌人工染色体(BAC)、バクテリオファージ、ウイルスベクター、及びそれらのハイブリッドなどが挙げられる。
EGFP:増強された緑色蛍光タンパク質。
EP:エレクトロポレーション。
真核生物発現ベクター:RNAポリメラーゼI、II又はIIIプロモーターを用いて、標的真核生物においてmRNA、タンパク質抗原、タンパク質治療薬、shRNA、RNA又はマイクロRNA遺伝子を発現させるためのベクター。
真核生物領域:真核生物配列及び/又は標的生物におけるプラスミド機能に必要とされる配列をコードするプラスミドの領域。これは、RNA Pol IIエンハンサー、プロモーター、導入遺伝子及びポリA配列を含む標的生物における1つ以上の導入遺伝子の発現に必要とされるプラスミドベクターの領域を含む。これはまた、RNA Pol I若しくはRNA Pol IIIプロモーター、RNA Pol I若しくはRNA Pol III発現導入遺伝子又はRNAを用いた標的生物における1つ以上の導入遺伝子の発現に必要とされるプラスミドベクターの領域も含む。真核生物領域は、他の機能的配列、例えば、真核生物転写ターミネーター、スーパーコイル誘導DNA二本鎖不安定化(SIDD)構造、S/MAR、境界エレメント等を任意に含み得る。レンチウイルス又はレトロウイルスベクターにおいて、真核生物領域は、隣接する定方向反復LTRを含み、AAVベクターにおいて、真核生物領域は、隣接する逆方向(inverted)末端反復を含み、一方、トランスポゾンベクターにおいて、真核生物領域は、隣接するトランスポゾン逆方向(inverted)末端反復又はIR/DR末端(例えば、スリーピング・ビューティ)を含む。ゲノム組み込み型ベクターでは、真核生物領域は、標的化組み込みを指示するための相同性アームをコードしてもよい。
エクソン:転写され、イントロンを除去するためのRNAスプライシングが完了した後に成熟mRNA産物内に存在する遺伝子によってコードされるヌクレオチド配列。
発現ベクター:標的生物におけるmRNA、タンパク質抗原、タンパク質治療薬、shRNA、RNA又はマイクロRNA遺伝子を発現させるためのベクター。
目的の遺伝子:標的生物において発現される遺伝子。タンパク質又はペプチド抗原をコードするmRNA遺伝子、タンパク質治療薬又はペプチド治療薬、及びRNA治療薬をコードするmRNA、shRNA、RNA又はマイクロRNA、並びにRNAワクチンをコードするmRNA、shRNA、RNA又はマイクロRNAなどが含まれる。
Hr:時間(複数可)。
ID:皮内。
IM:筋肉内。
免疫反応:抗原反応性細胞(例えば、抗原反応性T細胞)又は抗体(例えば、抗原反応性IgG)反応。
イントロン:遺伝子によってコードされる、転写され、続いてRNAスプライシングによって成熟mRNA産物から除去されるヌクレオチド配列。
IR/DR:それぞれが定方向反復(Directly Repeated)を2回繰り返す逆方向反復(Inverted Repeat)。例えば、スリーピング・ビューティトランスポゾンIR/DR反復。
イテロン(Iteron):複製開始に必要な複製起点における定方向反復DNA配列。R6K起点のイテロン反復は22bp。
ITR:逆方向末端反復。
kanR:カナマイシン耐性遺伝子。
Kd:キロダルトン。
コザック配列:効率的な翻訳開始を確実にするATG開始コドンのすぐ上流の最適化コンセンサスDNA配列gccRccATG(R=G又はA)。ATG開始コドン(GTCGACATG)のすぐ上流にあるSalI部位(GTCGAC)は、有効コザック配列である。
レンチウイルスエンベロープベクター:エンベロープ糖タンパク質をコードするプラスミド。
レンチウイルスパッケージングベクター:レンチウイルストランスファーベクターをパッケージングするのに必要なgag、pol及びRev機能を発現する1つ又は2つのプラスミド。
ミニサークル:細菌領域がインビボ若しくはインビトロの部位特異的組換え又はインビトロ制限消化/ライゲーションによって親プラスミドから除去されている共有結合閉環状プラスミド誘導体。ミニサークルベクターは、細菌細胞では複製不能である。
mRNA:メッセンジャーRNA。
mSEAP:マウス分泌アルカリホスファターゼ。
ナノプラスミド(商標)ベクター:RNA選択マーカーとR6K、ColE2又はColE2関連複製起点を組み合わせたベクター。例えば、NTC9385C、NTC9685C、NTC9385R、NTC9685Rベクター、及びWilliams、前掲2014年(これは参照により本明細書に含まれる)に記載されている修飾。
NTC8385:NTC8385、NTC8485及びNTC8685プラスミドは、抗生物質耐性マーカー、例えば、kanRの代わりに短いRNA(RNA-OUT)選択マーカーを含む抗生物質不含pUC起点ベクターである。これらのRNA-OUTに基づく抗生物質不含ベクターの作製及び適用は、参照により本明細書に含まれるWilliams, JA 2008年、国際特許出願第WO2008/153733号に記載されている。
NTC8485:NTC8485は、抗生物質耐性マーカー、例えば、kanRの代わりに短いRNA(RNA-OUT)選択マーカーを含む、抗生物質不含pUC起点ベクターである。NTC8485の作製及び適用は、参照により本明細書に含まれるWilliams, JA 2010年、米国特許出願第2010/0184158号に記載されている。
NTC8685:NTC8685は、抗生物質耐性マーカー、例えば、kanRの代わりに短いRNA(RNA-OUT)選択マーカーを含む、抗生物質不含pUC由来のベクターである。NTC8685の作製及び適用は、参照により本明細書に含まれるWilliams、前掲、2010年に記載されている。
NTC9385R:参照により本明細書に含まれるWilliams、前掲、2014年に記載されたNTC9385Rナノプラスミド(商標)ベクターは、隣接するNheI及びKpNI部位を介して真核生物領域に連結されたスペーサー領域をコードしたNheItrpAターミネーターR6K起点RNA-OUT-KpNI細菌領域(配列番号8)を有する。
PAS:プリモソーム集合部位(Primosomal assembly site)。一本鎖DNA ssi部位でのDNA合成のプライミング。φX174型PAS:priAと結合するDNAヘアピン配列であり、それにより残りのタンパク質をリクルートしてプレプリモソームを形成し[priB、dnaTはdnaB(dnaCによって送達される)をリクルートする]、それによりプライマーゼ(dnaG)もリクルートし、最終的にはDNAポリメラーゼIの短いRNA基質を生成する。ABC型PAS:DNAヘアピンがdnaAと結合し、dnaB(dnaCによって送達される)をリクルートし、次いでプライマーゼ(dnaG)もリクルートし、次いで、最終的にDNAポリメラーゼIのための短いRNA基質を作る。例えば、R6KプラスミドCpG遊離ssiAプリモソーム集合部位、又は代替的なφX174型又はABC型プリモソーム集合部位。
PAS-BH:重(リーディング)鎖におけるプリモソーム集合部位。
PAS-BH領域:ROPとPAS-BLの間のpBR322起点領域(およそpBR322 2067~2351)。
PAS-BL:軽(ラギング)鎖におけるプリモソーム集合部位。
PBS:リン酸緩衝生理食塩水。
PCR:ポリメラーゼ連鎖反応。
pDNA:プラスミドDNA。
PiggyBacトランスポゾン:PB トランスポゾン:PBトランスポザーゼにより媒介される単純なカット及びペーストメカニズムによりITRが隣接するPBトランスポゾンをゲノムに組み込むトランスポゾンシステム。トランスポゾンベクターは典型的に、切除されてゲノムに組み込まれる、PB ITR間にプロモーター-導入遺伝子-polyA発現カセットを含む。
pINT pR pLベクター:pINT pR pL attHK022組込み発現ベクターは、参照により本明細書に含まれるLukeら、2011年 Mol Biotechnol 47巻:43頁に記載されている。発現させる標的遺伝子は、pLプロモーターの下流にクローン化される。ベクターは温度誘導性cI857リプレッサーをコードし、熱誘導性標的遺伝子の発現を可能にする。
PLプロモーター:ラムダプロモーター左(left)。PLは、cIリプレッサーがOL1、OL2及びOL3リプレッサー結合部位に結合することによって抑制される強力なプロモーターである。温度感受性cI857リプレッサーは、熱誘導による遺伝子発現の制御を可能にし、これは30℃でcI857リプレッサーが機能的であり、遺伝子発現を抑制するが、37~42℃でリプレッサーは不活性化され、そのため遺伝子発現が起こるためである。
PL(OL1 G→T)プロモーター:ラムダプロモーター左。PLは、cIリプレッサーがOL1、OL2及びOL3リプレッサー結合部位に結合することによって抑制される強力なプロモーターである。温度感受性cI857リプレッサーは、熱誘導による遺伝子発現の制御を可能にし、これは30℃でcI857リプレッサーが機能的であり、遺伝子発現を抑制するが、37~42℃でリプレッサーは不活性化され、そのため遺伝子の発現が起こるためである。OL1へのcIリプレッサーの結合は、Williams、前掲、2014年に記載されるように、30℃及び37~42℃でプロモーター活性の増加をもたらすOL1 GからTへの突然変異により減少する。
プラスミド:染色体DNAとは独立して複製することができる、染色体DNAと区別される余分な染色体DNA分子。
プラスミドコピー数:細胞あたりのプラスミドのコピー数。プラスミドコピー数の増加はプラスミド生成収率を増加させる。
Pol:ポリメラーゼ。
Pol I:大腸菌(Escherichia coli)DNAポリメラーゼI
Pol I依存性複製起点:Pol I、例えばpMB1、ColE1若しくはpBR322又は誘導体を必要とする複製起点(例えば高コピーpUC起点など)。これらの起点では、RNAIIプライマーがRNA:DNA Rループを形成し、それはRNase Hによって切断されて、DNA pol I指向性DNA合成のためのプライマーを形成する。その後、DNA合成はDNA pol IIIに変換される。数多くの追加のPol I依存性複製起点が当技術分野で知られており、その多くはdel Solar et al., 1998 Microbiol. Mol. Biol. Rev 62:434-464に要約されており、これは参照により本明細書に含まれる。
Pol III:大腸菌(Escherichia coli)DNAポリメラーゼIII。
Pol III依存性複製起点:Pol Iを必要としない複製起点、例えば、repタンパク質依存性R6Kガンマ複製起点。多数の追加のPol III依存性の複製起点が当技術分野で知られており、その多くは、del Solar et al., 1998(前掲)(参照により本明細書に含まれる)に要約されている。
ポリA(polyA):ポリアデニル化シグナル又は部位。ポリアデニル化は、RNA分子へのポリ(A)テールの付加である。ポリアデニル化シグナルは、RNA切断複合体によって認識される配列モチーフを含む。ほとんどのヒトポリアデニル化シグナルは、AAUAAAモチーフとそれに対する5'及び3'の保存配列を含む。一般的に利用されるポリAシグナルは、ウサギβグロビン、ウシ成長ホルモン、SV40初期、又はSV40後期ポリAシグナルに由来する。
pUC起点:高温でコピー数を増加させるGからAへの転移、及びROP陰性調節因子の欠失を伴うpBR322由来の複製起点。
pUC不含:pUC起点を含有しないプラスミド。pUC起点の非複製フラグメント、例えば、RNAI選択マーカーが含まれ得る。
pUCプラスミド:pUC起点を含むプラスミド。
R6K複製起点:DNA複製を開始するためにR6K Repタンパク質によって特異的に認識される領域。限定されないが、配列番号1、配列番号2、配列番号4及び配列番号18として開示されているR6Kガンマ複製起点配列を含む。また、Drocourtら、米国特許第7,244,609号に記載され、参照により本明細書に組み込まれるCpG不含バージョン(例えば、配列番号3)が含まれる。
R6K複製起点-RNA-OUT細菌領域:増幅のためのR6K複製起点及びRNA-OUT選択マーカーを含む(例えば、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17)。
Rep:複製。
複製中間体:プラスミド複製の早発終結から生じる線状DNAフラグメント。
Repタンパク質依存性プラスミド:複製がTransに提供される複製(Rep)タンパク質に依存するプラスミド。例えば、Repタンパク質が宿主株ゲノムから発現されるR6K複製起点、ColE2-P9複製起点及びColE2関連複製起点プラスミド。多数のさらなるRepタンパク質依存性プラスミドは当技術分野において公知であり、それらの多くは、参照により本明細書に含まれるdel Solarら、前掲、1998年に要約されている。
レトロウイルスベクター:分裂細胞に感染することができる組込みウイルスベクター。トランスファープラスミドとも呼ばれる。プラスミドは、レトロウイルスLTRが隣接する発現単位をコードする。トランスファープラスミドは、ウイルス粒子を作製するのに必要なエンベロープ及びパッケージングプラスミドとともに産生細胞にトランスフェクトされる。
レトロウイルスエンベロープベクター:エンベロープ糖タンパク質をコードするプラスミド。
レトロウイルスパッケージングベクター:レトロウイルストランスファー(transfer)ベクターに必要なレトロウイルスgag、pol遺伝子をコードするプラスミド。
RNA-IN:挿入配列10(IS10)をコードするRNA-IN、RNA-OUTの一部に対して相補的であり、アンチセンスであるRNA。RNA-INがmRNAの非翻訳リーダーにクローニングされている場合、RNA-OUTへのRNA-INのアニーリングは、RNA-INの下流にコードされる遺伝子の翻訳を減少させる。
RNA-IN調節選択マーカー:遺伝的に発現されるRNA-IN調節選択マーカー。プラスミド保有のRNA-OUTアンチセンスリプレッサーRNA(配列番号6)の存在下で、RNA-INの下流にコードされるタンパク質の発現が抑制される。RNA-IN調節選択マーカーは、RNA-INが、1)上記細胞それ自体に対して又は毒性物質(例えば、SacB)を生じさせることによって、致死的若しくは毒性であるタンパク質、或いは2)上記細胞の増殖に必須である遺伝子(例えば、RNA-IN tetRリプレッサー遺伝子によって調節されるmurA必須遺伝子)の転写を抑制することによって、上記細菌細胞に対して致死的又は毒性であるリプレッサータンパク質、のいずれかを調節するように構成される。例えば、RNA-OUTプラスミド選択/増幅のための遺伝的に発現されたRNA-IN-SacB細胞株は、参照により本明細書に含まれるWilliams、前掲、2008年に記載されている。当技術分野において記載されている代替の選択マーカーは、SacBの代わりに使用され得る。
RNA-OUT:挿入配列10(IS10)をコードするRNA-OUT、RNA-INの下流に発現されるトランスポゾン遺伝子にハイブリダイズし、その翻訳を減少させるアンチセンスRNA。RNA-OUT RNAの配列(配列番号6)及び相補的RNA-IN SacBを遺伝的に発現するRNA-IN-SacB細胞株は修飾されて、代替の機能的RNA-IN/RNA-OUT結合対、例えば、Mutalikら、2012年 Nat Chem Biol 8巻:447頁に記載されている対を組み込むことができ、これには、限定されないが、RNA-OUT A08/RNA-IN S49対、RNA-OUT A08/RNA-IN S08対、及びRNA-OUT 5'TTCGC配列中のCGを非CpG配列に修飾するRNA-OUT A08のCpG不含修飾が含まれる。RNA-OUT RNA中の2つのCpGモチーフ(そのうちの1つはRNA-IN相補的領域中に存在する)が除去されているCpG不含RNA-OUT選択マーカーの例は、Williams 2015に記載されていた。発現が改善された複製ミニサークルベクター。米国特許出願第2015/0275221号は、参照により本明細書に含まれる。2つのCpGモチーフを除去するための多数の代替置換(各CpGをCpA、CpC、CpT、ApG、GpG、又はTpGのいずれかに突然変異させる)を利用して、CpG不含RNA-OUTを作製し得る。
RNA-OUT選択マーカー: RNA-OUT RNAに隣接する大腸菌転写プロモーター及びターミネーター配列を含むRNA-OUT選択マーカーDNAフラグメント。DraIIIとKpnI制限酵素部位が隣接する、RNA-OUTプロモーター及びターミネーター配列を利用するRNA-OUT選択マーカー、並びにRNA-OUTプラスミド増幅のためのデザイナー遺伝的に発現するRNA-IN-SacB細胞株は、参照により本明細書に含まれるWilliams、前掲、2008年に記載されている。RNA-OUT RNA(配列番号6、図1B)に隣接する配列番号5中のRNA-OUTプロモーター及びターミネーター配列は、異種プロモーター及びターミネーター配列で置換され得る。例えば、RNA-OUTプロモーターは、当技術分野において公知であるCpG不含プロモーター、例えば、I-EC2Kプロモーター、又は参照により本明細書に含まれるWilliams、前掲、2008年に記載されているP5/6 5/6若しくはP5/6 6/6プロモーターに置換され得る。RNA-OUTプロモーター中の2つのCpGモチーフが除去されている2CpG RNA-OUT選択マーカーは、配列番号7として示される。RNA-OUT RNA中の2つのCpGモチーフ(そのうちの1つはRNA-IN相補的領域に存在する)及びRNA-OUTプロモーター中の2つのCpGモチーフが除去されているCpG不含RNA-OUT転写単位の例は、参照により本明細書に含まれるWilliams、前掲、2015年に記載されている。CpG不含RNA-OUT選択マーカーを組み込んだベクターは、Williams、前掲、2008年に記載されているRNA-OUTプラスミド増幅のためのRNA-IN-SacB細胞株を用いて、スクロース耐性について選択され得る。或いは、これらの細胞株中のRNA-IN配列は、RNA-INに相補的なCpG不含RNA-OUT領域と完全に一致するのに必要な1bpの変化を組み込むように修飾することができる。
RNAポリメラーゼIIプロモーター:RNAポリメラーゼIIを動員してmRNA、ほとんどの小核RNA及びマイクロRNAを合成するプロモーター。例として、構成的プロモーター、例えば、ヒト又はマウスのCMVプロモーター、伸長因子1(EF1)プロモーター、ニワトリβ-アクチンプロモーター、他の種由来のβ-アクチンプロモーター、伸長因子-1α(EF1α)プロモーター、ホスホグリセロキナーゼ(PGK)プロモーター、ラウス肉腫ウイルス(RSV)プロモーター、ヒト血清アルブミン(SA)プロモーター、脾臓フォーカス形成ウイルス(SFFV)プロモーター、α-1アンチトリプシン(AAT)プロモーター、チロキシン結合グロブリン(TBG)プロモーター、チトクロームP450 2E1(CYP2E1)プロモーターなど。ベクターはまた、組み合わせプロモーター、例えば、ニワトリβ-アクチン/CMVエンハンサー(CAG)プロモーター、伸長因子1α(EF1α)プロモーターと組み合わせたヒト若しくはマウスCMV由来エンハンサーエレメント、伸長因子1α(EF1α)プロモーターと組み合わせたヒト若しくはマウスCMV由来のエンハンサーエレメントのCpG不含バージョン、α-フェトプロテインMERIIエンハンサーと組み合わせたアルブミンプロモーター等、又は当技術分野において公知である多様な組織特異的若しくは誘導性プロモーター、例えば、筋肉特異的プロモーター筋肉クレアチンキナーゼ(MCK)、及びC5-12又は肝臓特異的プロモーターアポリポタンパク質A-1(ApoAI)などを利用し得る。
RNAポリメラーゼIIIプロモーター:RNAポリメラーゼIIIを動員して、tRNA、5SリボソームRNA、及び他の低分子RNAを合成するプロモーター。例として、クラスIプロモーター、例えば5s rRNAプロモーター、クラスIIプロモーター、例えばtRNAプロモーター、クラスIIIプロモーター、例えばU6小核RNAプロモーター又はH1核RNase Pプロモーターなど。
RNA選択マーカー:RNA選択マーカーは、染色体上に発現される標的遺伝子を調節して選択を可能にするプラスミド保有の発現非翻訳RNAである。これは、参照により本明細書に含まれるCrouzet J及びSoubrier F 2005年、米国特許第6,977,174号に記載されるナンセンス抑制性選択可能染色体標的を調節するプラスミド保有のナンセンス抑制tRNAであり得る。これはまた、プラスミド保有のアンチセンスリプレッサーRNAであり得、参照により本明細書に含まれる非限定的なリストには、RNA-IN調節標的を抑制するRNA-OUT(Williams、前掲、2008年)、RNAII調節標的を抑制するRNAIをコードするpMB1プラスミド起点(Grabherr R、PfaffeNzeller I. 2006年、米国特許出願公開第2006/0063232号;CraNeNburgh RM. 2009年;米国特許第7,611,883号)、RNAII調節標的を抑制するRNAIをコードするIncBプラスミドpMU720起点(Wilson IW、Siemering KR、Praszkier J、Pittard AJ. 1997年. J Bacteriol 179巻:742-53頁)、Hok調節標的を抑制するプラスミドR1のParB遺伝子座Sok、flmA調節標的を抑制するFプラスミドのFlm遺伝子座FlmB(Morsey MA、1999年、米国特許第5,922,583号)を含む。RNA選択マーカーは、当技術分野において公知である別の天然アンチセンスリプレッサーRNA、例えば、Wagner EGH、Altuvia S、Romby P. 2002年. Adv Genet 46巻:361-98頁、Franch T及びGerdes K. 2000年. Current Opin Microbiol 3巻:159-64頁に記載されているものであり得る。RNA選択マーカーはまた、操作されたリプレッサーRNA、例えば、Na D、Yoo SM、Chung H、Park H、Park JH、Lee SY. 2013年. Nat Biotechnol 31巻:170-4頁に記載されるSgrS、MicC又はMicF足場を発現する合成低分子RNAであり得る。RNA選択マーカーはまた、調節される標的遺伝子に融合した標的RNAを抑制する選択マーカーの一部としての操作されたリプレッサーRNA、例えば、Williams、前掲、2015年に記載されるSacBであり得る。
ROP:プライマーのリプレッサー。
RSM:RNA選択マーカー。
SD:標準偏差。
SEAP:分泌型アルカリホスファターゼ。
選択(selectable)マーカー:選択マーカー、例えば、カナマイシン耐性遺伝子又はRNA選択マーカー。
選択(selection)マーカー:選択マーカー、例えば、カナマイシン耐性遺伝子又はRNA選択マーカー。
SIDD:スーパーコイル誘導DNA二本鎖不安定化(SIDD)構造。これらの部位は、ベクターに組み込まれた場合、不安定化されるようにベクター内の他の配列の感受性を変更し得る。これは機能を変更することができる。例えば、発現ベクターへのSIDD部位の付加は、プロモーターのらせん不安定化を減少させ得る。これは、一部のプロモーターがプロモーターのらせん状不安定化により発現が増加し、一方、他のものはプロモーターのらせん状不安定化により発現が減少したため、プロモーターに応じてプロモーター活性を増加又は減少させ得る。
shRNA:短鎖ヘアピンRNA。
S/MAR:足場/マトリックス付着領域。核マトリックスへのDNAの付着を媒介する真核生物の配列。
スリーピング・ビューティ(Sleeping Beauty)トランスポゾン:SBトランスポゾン。SBトランスポザーゼによって媒介される単純なカット及びペーストメカニズムによりIR/DRが隣接するSBトランスポゾンをゲノムに組み込むトランスポゾンシステム。トランスポゾンベクターは典型的に、切除されてゲノムに組み込まれる、IR/DR間にプロモーター-導入遺伝子-polyA発現カセットを含む。
スペーサー領域:本明細書で使用するとき、スペーサー領域は、真核生物領域配列の5'及び3'末端を連結する領域である。真核生物領域の5'及び3'末端は、典型的には、プラスミドベクター(細菌領域)中の細菌複製起点及び細菌選択マーカーによって分離され、多くのスペーサー領域が細菌領域からなる。本発明の複製ベクターのPol III依存性起点において、このスペーサー領域は好ましくは1000bp未満である。
SR:スペーサー領域。
ssi一本鎖開始配列。
構造化DNA配列:本明細書で使用されるように、複製阻害二次構造を形成することが可能なDNA配列(Mirkin and Mirkin, 2007. Microbiology and Molecular Biology Reviews 71:13-35)。これには、逆方向反復、パリンドローム、定方向反復、IR/DR、ホモポリマー反復、又は真核生物プロモーターエンハンサーを含む反復、又は真核生物複製起点を含む反復が含まれるが、これらに限定されない。
SV40起点:複製起点を含むシミアンウイルス40ゲノムDNA。
SV40エンハンサー:72bp及び場合により21bpのエンハンサー反復を含むシミアンウイルス40ゲノムDNA。
TEバッファー:約10mMのTris(pH8)及び1mMのEDTAを含む溶液。
TetR:テトラサイクリン耐性遺伝子。
Tol2トランスポゾン:Tol2トランスポザーゼによって媒介される単純なカット及びペーストメカニズムによりITRが隣接するTol2トランスポゾンをゲノムに組み込むトランスポゾンシステム。トランスポゾンベクターは典型的に、切除されてゲノムに組み込まれる、Tol2 ITR間にプロモーター-導入遺伝子-polyA発現カセットを含む。
転写ターミネーター:細菌: 転写のために遺伝子又はオペロンの末端をマークするDNA配列。これは、内在性転写ターミネーター又はRho依存性転写ターミネーターであり得る。内在性ターミネーター、例えば、trpAターミネーターの場合、mRNA-DNA-RNAポリメラーゼ三元複合体を破壊するヘアピン構造が転写物内に形成される。或いは、Rho依存性転写ターミネーターは、新生mRNA-DNA-RNAポリメラーゼ三元複合体を破壊するためにRho因子、RNAヘリカーゼタンパク質複合体を必要とする。真核生物:PolyAシグナルは「ターミネーター」ではなく、代わりにPolyA部位での内部切断はヌクレアーゼ消化のために3'UTR RNAに、キャップされていない5'末端を残す。ヌクレアーゼは、RNA Pol IIに追いつき、終結を引き起こす。RNA Pol II休止部位(真核生物転写ターミネーター)の導入により、終結はポリA部位の短い領域内で促進することができる。RNA Pol IIの休止は、PolyA切断後に3'UTR mRNAに導入されたヌクレアーゼが休止部位でRNA Pol IIに追いつくことを可能にする。当技術分野において公知である真核生物転写ターミネーターの非限定的なリストには、C2×4及びガストリンターミネーターが含まれる。真核生物転写ターミネーターは、mRNAの適切な3'末端プロセシングを増強することによって、mRNAレベルを上昇させ得る。
トランスフェクション:当技術分野において公知であり、参照により本明細書に含まれる、核酸を細胞内に送達させるための方法[例えば、ポリ(ラクチド-co-グリコリド)(PLGA)、ISCOM、リポソーム、ニオソーム、ビロソーム、ブロックコポリマー、プルロニック(登録商標)ブロックコポリマー、キトサン、及び他の生分解性ポリマー、ミクロ粒子、ミクロスフェア、リン酸カルシウムナノ粒子、ナノ粒子、ナノカプセル、ナノスフェア、ポロキサミンナノスフェア、エレクトロポレーション、ヌクレオフェクション、圧電透過処理、ソノポレーション、イオントフォレシス、超音波、SQZ高速細胞変形媒介膜破壊、コロナプラズマ、プラズマ促進送達、組織耐性プラズマ、レーザーマイクロポレーション、衝撃波エネルギー、磁場、非接触透磁性、遺伝子銃、マイクロニードル、マイクロダーマブレーション(microdermabrasion)、流体力学的送達、高圧尾静脈注射など]。
導入遺伝子:標的生物における発現のためにベクターにクローニングされた目的の遺伝子。
トランスポザーゼベクター:トランスポザーゼをコードするベクター。
トランスポゾンベクター:トランスポザーゼが媒介する遺伝子組み込みの基質であるトランスポゾンをコードするベクター。
ts:温度感受性。
μl:マイクロリットル。
UTR:mRNAの非翻訳領域(5'又は3'からコード領域まで)。
ベクター:ウイルス(例えば、アルファウイルス、ポックスウイルス、レンチウイルス、レトロウイルス、アデノウイルス、アデノウイルス関連ウイルスなど)及び非ウイルス(例えば、プラスミド、MIDGE、転写活性PCRフラグメント、ミニサークル、バクテリオファージなど)ベクターを含む遺伝子送達ビヒクル。これらは、当技術分野において周知であり、参照により本明細書に含まれる。
ベクター骨格:導入遺伝子又は標的抗原コード領域を含まない、ベクターの真核生物領域及び細菌領域。
本技術は、一般的に、短い1kb未満の細菌領域プラスミドDNAベクターの方法及び組成物に関し、これはプラスミドの製造収量及び品質を改善し、トランスフェクションに関連する毒性を低減し、導入遺伝子発現を増大する。本技術は、ベクター、例えば、非ウイルスベクター(トランスポゾンベクター、トランスポザーゼベクター、スリーピング・ビューティトランスポゾンベクター、スリーピング・ビューティトランスポザーゼベクター、PiggyBacトランスポゾンベクター、PiggyBacトランスポザーゼベクター、発現ベクターなど)、及びウイルスベクター(例えば、AAVベクター、AAV rep capベクター、AAVヘルパーベクター、Adヘルパーベクター、レンチウイルスベクター、レンチウイルスエンベロープベクター、レンチウイルスパッケージングベクター、レトロウイルスベクター、レトロウイルスエンベロープベクター、レトロウイルスパッケージングベクターなど)の発現及び製造を改善するために実施することができる。
本発明は、例えば以下の実施形態を包含する:
[実施形態1]共有結合閉環状プラスミドの複製を改善する方法であって、
a.以下:
i.Pol I依存性複製起点、及び
ii.逆方向反復配列、定方向反復配列、ホモポリマー反復配列、真核生物複製起点又は真核生物プロモーターエンハンサー配列からなる群から選択される構造化DNA配列を含む挿入物であって、構造化DNA配列が複製の方向におけるPol I依存性複製起点から1000bp未満の距離に位置する、上記挿入物
を含む共有結合閉環状プラスミドを提供するステップ、並びに
b.a.の共有結合閉環状組換え分子を修飾して、Pol I依存性複製起点をPol III依存性複製起点に置換するステップを含み、それにより、得られたPol III依存性複製起点により共有結合閉環状プラスミドは複製が改良される、上記方法。
[実施形態2]前記Pol I依存性複製起点が、pUC起点、pMB1起点、及びColE1起点からなる群から選択される、実施形態1に記載の方法。
[実施形態3]前記Pol III依存性複製起点がR6Kガンマ複製起点である、実施形態1に記載の方法。
[実施形態4]前記Pol III依存性複製起点が、配列番号1、配列番号2、配列番号3、配列番号4及び配列番号18からなる群から選択される配列と少なくとも95%の配列同一性を有するR6Kガンマ複製起点である、実施形態1に記載の方法。
[実施形態5]前記構造化DNA配列が、ポリA反復、SV40複製起点、ウイルスLTR、レンチウイルスLTR、レトロウイルスLTR、トランスポゾンIR/DR反復、スリーピング・ビューティトランスポゾンIR/DR反復、AAV ITR、トランスポゾンITR、PiggyBacトランスポゾンITR、CMVエンハンサー、及びSV40エンハンサーからなる群から選択される、実施形態1に記載の方法。
[実施形態6]前記改良された複製が、複製中間体の生成の減少及びプラスミドコピー数の増加からなる群から選択される、実施形態1に記載の方法。
[実施形態7]共有結合閉環状プラスミドの複製を改良する方法であって、
a.以下:
i.Pol I依存性複製起点及び抗生物質選択マーカーを含む細菌複製-選択領域、及び
ii.逆方向反復配列、定方向反復配列、ホモポリマー反復配列、真核生物複製起点、及び真核生物プロモーターエンハンサー配列からなる群から選択される構造化DNA配列を含む挿入物であって、構造化DNA配列が複製の方向におけるPol I依存性複製起点から1000bp未満の距離に位置する、上記挿入物
を含む共有結合閉環状プラスミドを提供するステップ、並びに
b.a.の共有結合閉環状組換え分子を修飾して、抗生物質選択マーカーをRNA選択マーカーに置換し、Pol I依存性複製起点をPol III依存性複製起点に置換するステップを含み、それにより、得られたPol III依存性複製起点により共有結合閉環状プラスミドは複製が改良される、上記方法。
[実施形態8]前記Pol I依存性複製起点が、pUC起点、pMB1起点、及びColE1起点からなる群から選択される、実施形態7に記載の方法。
[実施形態9]前記Pol III依存性複製起点がR6Kガンマ複製起点である、実施形態7に記載の方法。
[実施形態10]前記Pol III依存性複製起点が、配列番号1、配列番号2、配列番号3、配列番号4及び配列番号18からなる群から選択される配列と少なくとも95%の配列同一性を有するR6Kガンマ複製起点である、実施形態7に記載の方法。
[実施形態11]前記RNA選択マーカーが、配列番号5及び配列番号7からなる群から選択される配列と少なくとも95%の配列同一性を有するRNA-IN調節RNA-OUT機能性変異体である、実施形態7に記載の方法。
[実施形態12]前記RNA選択マーカーが、配列番号6と少なくとも95%の配列同一性を有するRNA-IN調節RNA-OUT RNAをコードするRNA-OUT RNA選択マーカーである、実施形態7に記載の方法。
[実施形態13]Pol I依存性複製起点及び抗生物質選択マーカーを含む前記細菌複製-選択領域が、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、及び配列番号17からなる群から選択される配列と少なくとも95%の配列同一性を有するPol III依存性R6K起点-RNA-OUT RNA選択マーカー細菌複製-選択領域で置換される、実施形態7に記載の方法。
[実施形態14]前記構造化DNA配列が、ポリA反復、SV40複製起点、ウイルスLTR、レンチウイルスLTR、レトロウイルスLTR、トランスポゾンIR/DR反復、スリーピング・ビューティトランスポゾンIR/DR反復、AAV ITR、トランスポゾンITR、PiggyBacトランスポゾンITR、CMVエンハンサー、及びSV40エンハンサーからなる群から選択される、実施形態7に記載の方法。
[実施形態15]前記改良された複製が、複製中間体の生成の減少及びプラスミドコピー数の増加からなる群から選択される、実施形態7に記載の方法。
[実施形態16]抗生物質マーカー不含の共有結合閉環状組換えDNA分子であって、
a.逆方向反復配列、定方向反復配列、ホモポリマー反復配列、真核生物複製起点、及び真核生物プロモーターエンハンサー配列からなる群から選択される構造化DNA配列を含む抗生物質マーカー不含挿入物、
b.配列番号1、配列番号2、配列番号3、配列番号4及び配列番号18からなる群から選択される配列と少なくとも95%の配列同一性を有するR6Kガンマ複製起点を含む、Pol III依存性複製起点、並びに
c.配列番号6と少なくとも95%の配列同一性を有するRNA-IN調節RNA-OUT RNAを含むRNA-OUT RNA選択マーカー
を含む組換えDNA分子。
[実施形態17]前記RNA-OUT RNA選択マーカーが、配列番号5及び配列番号7からなる群から選択される配列と少なくとも95%の配列同一性を有するRNA-IN調節RNA-OUT機能性変異体である、実施形態16に記載の組換えDNA分子。
[実施形態18]前記R6Kガンマ複製起点及び前記RNA-OUT RNA選択マーカーが、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、及び配列番号17からなる群から選択される配列と少なくとも95%の配列同一性を有するR6K起点-RNA-OUT RNA選択マーカー細菌複製-選択領域を含む、実施形態16に記載の組換えDNA分子。
[実施形態19]前記構造化DNA配列が、ポリA反復、SV40複製起点、ウイルスLTR、レンチウイルスLTR、レトロウイルスLTR、トランスポゾンIR/DR反復、スリーピング・ビューティトランスポゾンIR/DR反復、AAV ITR、トランスポゾンITR、PiggyBacトランスポゾンITR、CMVエンハンサー、及びSV40エンハンサーからなる群から選択される、実施形態16に記載の組換えDNA分子。
[実施形態20]前記組換えDNA分子が、ウイルスベクター、レンチウイルスベクター、レトロウイルスベクター、AAVベクター、Adベクター、非ウイルス性トランスポゾンベクター、スリーピング・ビューティトランスポゾンベクター、PiggyBacトランスポゾンベクター、Tol2トランスポゾンベクター、及びポリA含有mRNAベクターからなる群から選択される、実施形態16に記載の組換えDNA分子。
pUC起点ベクターの複製及び生成の背景:治療用プラスミドの大部分は、pMB1起点(ColE1起点と密接に関連している)の高コピー誘導体であるpUC起点を使用している。pMB1複製では、プラスミドDNA合成は一方向性であり、プラスミドが有する開始因子タンパク質を必要としない。pUC起点は、アクセサリROP(rom)タンパク質を欠失し、RNAI/RNAII相互作用を不安定化させる温度感受性の変異を付加したpMB1起点のコピーアップ(copy up)誘導体である。これらの起点を含む培養物を30℃から42℃に変化させると、プラスミドのコピー数が増加する。pUCプラスミドは多数の大腸菌細胞株において生成することができる。
NTC821601 DH5α attλ::P5/6 6/6-RNA-IN- SacB, catR; attHK022:: pL (OL1-G→T) P42L-P106L-F107S (P3-), SpecR StrepR = NTC711772のdcm+バージョン。
NTC940211 DH5α attλ::P5/6 6/6-RNA-IN- SacB, catR; attHK022::pL (OL1-G→T) P42L-P106I-F107S
P113S (P3-), SpecR StrepR = P106IのP106Lへの高コピー置換をP113Sと組み合わせて、NTC821601の四重コピー数増加変異repタンパク質誘導体を作出した。
NTC1050811 DH5α attλ::P5/6 6/6-RNA-IN- SacB, catR; attHK022::pL (OL1-G→T) P42L-P106I-F107S
P113S (P3-), SpecR StrepR; attφ80::pARA-CI857ts, tetR = NTC940211のpARA-CI857ts誘導体。この株は、アラビノース誘導性CI857ts遺伝子のファージφ80付着部位染色体組み込みコピーを含む。アラビノースをプレート又は培地に添加すると(例えば、最終濃度0.2~0.4%)、pARAを介したCI857tsリプレッサーの発現が誘導され、Repタンパク質を発現するpLプロモーターのCI857ts媒介ダウンレギュレーションによって30℃でのコピー数が減少する[すなわち、追加のCI857tsは30℃でのpL(OL1-G→T)プロモーターのより効果的なダウンレギュレーションを媒介している]。37~42℃への温度シフト後のコピー数誘導は、これらの高温ではCI857tsリプレッサーが不活性化されているため、損なわれていない。dcmのメチル化が望ましくない場合には、dcm-誘導体(NTC1050811 dcm-)が使用される。
NTC1011641;Stbl4 attλ::P5/6 6/6-RNA-IN- SacB, catR; attHK022::pL P42L-P106L-F107S (P3-) SpecR StrepR = NTC661135のStbl4バージョン(XL1Blue- dcm- attλ::P5/6 6/6-RNA-IN- SacB, catR; attHK022::pR pL P42L-P106L-F107S (P3-) SpecR StrepR、Williams, 前掲, 2014に記載)。
振とうフラスコ生成:振とうフラスコの生成は、所有のPlasmid+振とう培養培地を用いて行われた。シード培養をグリセロールストック又はコロニーから開始し、50μg/mL抗生物質(ampR若しくはkanR選択プラスミド用)又は6%スクロース(RNA-OUT選択プラスミド用)を含むLB培地寒天プレート上に画線した。プレートを30~32℃で増殖させた。細胞を培地に再懸濁し、使用して、amp-R又はkanR選択プラスミド用の50μg/mL抗生物質又はRNA-OUTプラスミド選択用の0.5%スクロースを含む500mLプラスミド+振とうフラスコに対して約2.5のOD600接種材料を提供した。表5、6、7及び9に示した増殖温度でフラスコを飽和するまで振とうしながら増殖させた。
pUC起点-AmpR又はKanR抗生物質選択宿主
DH5α
Stbl4
NTC4862 DH5α attλ::P5/6 6/6-RNA-IN- SacB, catR
NTC1011592 Stbl4 attλ::P5/6 6/6-RNA-IN- SacB, catR
NTC1050811 DH5α attλ::P5/6 6/6-RNA-IN- SacB, catR; attHK022::pL (OL1-G→T) P42L-P106I-F107S P113S (P3-), SpecR StrepR; attφ80::pARA-CI857ts, tetR
NTC1011641 Stbl4 attλ::P5/6 6/6-RNA-IN- SacB, catR; attHK022::pL P42L-P106L-F107S (P3-) SpecR StrepR
R6Kガンマ起点(配列番号1;図1E)-RNA-OUT(配列番号5;図1B)細菌複製-選択領域(配列番号8;図1C)を、様々なpUC57ベースのベクターのポリリンカー領域にクローニングし、pNTC-NP1、pNTC-NP2、pNTC-NP3、pNTC-NP4、pNTC-NP5、pNTC-NP6、pNTC-NP7ベクターを作製した。各ベクターは、R6K複製-RNA-OUT選択に対して標的ベクターをレトロフィットするために使用することができる様々な隣接制限部位を有する。pNTC-NP1~7ベクター中のR6K-RNA-OUTインサートに隣接する5'及び3'ポリリンカー配列を表4に示す。1 CpG R6Kガンマ起点- 2 CpG RNA-OUT細菌複製-選択領域(配列番号9;図1D)のpUC57ベースのバージョンも作製し(pNTC-3xCpG NP1)、表4に示す。
1)標的ウイルス及び非ウイルスベクター中のpUC起点及び抗生物質選択マーカー領域に隣接する制限部位を選択し、
2)pNTC-NP適合性ポリリンカー-R6K-RNA-OUTポリリンカーカセット(pNTC-NP1、2、3、4、5、6、又は7のいずれか、表4)を同定し、
3)選択された制限消化アプローチ及び標準的なリガーゼ媒介クローニングを使用して、pUC起点抗生物質選択マーカー領域を切り出し、選択されたR6K起点RNA-OUT領域と置換する。
本発明のベクターは、ウイルスベクター及び非ウイルスベクターによる抗生物質耐性マーカー遺伝子移入の排除、トランスフェクション関連毒性の低減、非ウイルス性トランスポゾンベクターからの転移の改良、ウイルスベクターからのパッケージング力価の改良、ウイルス及び非ウイルスベクターにコードされた導入遺伝子の発現の改良などにさらに有用である。
上述の説明は多数の例を含むが、これらは、開示の範囲の限定として解釈されるべきではなく、むしろ、それらの好ましい実施形態の例示として見なされるべきである。他にも多数のバリエーションが可能である。
Claims (14)
- 共有結合閉環状プラスミドを複製するための方法であって、以下のステップ:
a.以下:
i. Pol III依存性R6K複製起点、及びRNA-OUT RNA選択マーカーを含む骨格であって、1000bp未満である、上記骨格、及び
ii. 逆方向反復配列、定方向反復配列、真核生物複製起点、又は真核生物プロモーターエンハンサー配列の1つ以上を含む挿入物
を含む共有結合閉環状プラスミドを含む、遺伝子操作された、Repタンパク質を発現する大腸菌細胞を提供するステップ、並びに
b.上記細胞を発酵プロセスに供するステップ
を含み、上記逆方向反復配列、上記定方向反復配列、上記真核生物複製起点、又は上記真核生物プロモーターエンハンサー配列が、複製の方向における上記Pol III依存性R6K複製起点から1000bp未満の距離に位置する、上記方法。 - 前記遺伝子操作された、Repタンパク質を発現する大腸菌細胞が、染色体に組み込まれたアラビノース誘導性CI857ts遺伝子を含み、Repタンパク質がpLプロモーターの制御下にある、請求項1に記載の方法。
- Repタンパク質が、以下の変異:P42L;P106I;F107S;及びP113Sを含む、請求項2に記載の方法。
- 前記挿入物が、逆方向反復配列を含むトランスポゾンベクターである、請求項1に記載の方法。
- 前記挿入物がトランスポザーゼベクターである、請求項1に記載の方法。
- 前記挿入物がウイルスベクターであり、ウイルスベクターがAAVベクターである、請求項1に記載の方法。
- 前記AAVベクターが、前記逆方向反復配列を含む、請求項6に記載の方法。
- 前記挿入物がウイルスベクターであり、ウイルスベクターがレンチウイルスベクターである、請求項1に記載の方法。
- 前記レンチウイルスベクターが、前記定方向反復配列又は前記真核生物複製起点を含む、請求項8に記載の方法。
- 前記Pol III依存性R6K複製起点が、配列番号1、配列番号2、配列番号3、配列番号4及び配列番号18からなる群から選択される配列と少なくとも95%の配列同一性を有する、請求項1に記載の方法。
- 前記RNA-OUT RNA選択マーカーが、配列番号5及び配列番号7からなる群から選択される配列と少なくとも95%の配列同一性を有するRNA-IN調節RNA-OUT機能性変異体である、請求項1に記載の方法。
- 前記発酵プロセスが、アラビノースを含む培地中で細胞を増殖させることを含む、請求項2に記載の方法。
- 前記Pol III依存性R6K複製起点が、配列番号1、配列番号2、配列番号3、配列番号4及び配列番号18からなる群から選択される配列と少なくとも95%の配列同一性を有し、前記RNA-OUT RNA選択マーカーが、配列番号5及び配列番号7からなる群から選択される配列と少なくとも95%の配列同一性を有するRNA-IN調節RNA-OUT機能性変異体である、請求項2に記載の方法。
- 前記発酵プロセス後の前記共有結合閉環状プラスミドの収量が0.5g/L以上である、請求項13に記載の方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2024110895A JP2024138410A (ja) | 2018-03-21 | 2024-07-10 | 生成が改良されたウイルス及び非ウイルスのナノプラスミドベクター |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862645892P | 2018-03-21 | 2018-03-21 | |
| US62/645,892 | 2018-03-21 | ||
| PCT/US2019/023209 WO2019183248A1 (en) | 2018-03-21 | 2019-03-20 | Viral and non-viral nanoplasmid vectors with improved production |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024110895A Division JP2024138410A (ja) | 2018-03-21 | 2024-07-10 | 生成が改良されたウイルス及び非ウイルスのナノプラスミドベクター |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2021518150A JP2021518150A (ja) | 2021-08-02 |
| JPWO2019183248A5 JPWO2019183248A5 (ja) | 2022-03-29 |
| JP7520719B2 true JP7520719B2 (ja) | 2024-07-23 |
Family
ID=66001381
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020551263A Active JP7520719B2 (ja) | 2018-03-21 | 2019-03-20 | 生成が改良されたウイルス及び非ウイルスのナノプラスミドベクター |
| JP2024110895A Pending JP2024138410A (ja) | 2018-03-21 | 2024-07-10 | 生成が改良されたウイルス及び非ウイルスのナノプラスミドベクター |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024110895A Pending JP2024138410A (ja) | 2018-03-21 | 2024-07-10 | 生成が改良されたウイルス及び非ウイルスのナノプラスミドベクター |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20210010021A1 (ja) |
| EP (2) | EP4151735A1 (ja) |
| JP (2) | JP7520719B2 (ja) |
| KR (1) | KR20210016330A (ja) |
| CN (2) | CN112154208B (ja) |
| AU (2) | AU2019240068B2 (ja) |
| CA (1) | CA3093346A1 (ja) |
| DK (1) | DK3768846T5 (ja) |
| ES (1) | ES2950736T3 (ja) |
| FI (1) | FI3768846T3 (ja) |
| LT (1) | LT3768846T (ja) |
| SG (1) | SG11202009009UA (ja) |
| WO (1) | WO2019183248A1 (ja) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP4151735A1 (en) * | 2018-03-21 | 2023-03-22 | Nature Technology Corporation | Viral and non-viral nanoplasmid vectors with improved production |
| AU2019401282A1 (en) * | 2018-12-20 | 2021-07-15 | Poseida Therapeutics, Inc. | Nanotransposon compositions and methods of use |
| TW202124722A (zh) | 2019-09-18 | 2021-07-01 | 美商英特佳樂帝克醫療公司 | 合成dna載體及其使用方法 |
| CA3170890A1 (en) * | 2020-03-11 | 2021-09-16 | Nature Technology Corporation | Bacterial host strains |
| CA3201499A1 (en) | 2020-11-13 | 2022-05-19 | Catamaran Bio, Inc. | Genetically modified natural killer cells and methods of use thereof |
| WO2022272296A2 (en) | 2021-06-25 | 2022-12-29 | Homology Medicines, Inc. | Adeno-associated virus packaging systems |
| CA3228262A1 (en) | 2021-08-04 | 2023-02-09 | The Regents Of The University Of Colorado, A Body Corporate | Lat activating chimeric antigen receptor t cells and methods of use thereof |
| CN114045305B (zh) * | 2021-10-15 | 2023-03-24 | 深圳市深研生物科技有限公司 | 多转座子系统 |
| WO2023114901A2 (en) | 2021-12-15 | 2023-06-22 | Oxford Biomedica Solutions Llc | Methods and compositions for the production of adeno-associated virus |
| WO2023172514A1 (en) | 2022-03-07 | 2023-09-14 | Catamaran Bio, Inc. | Engineered immune cell therapeutics targeted to her2 and methods of use thereof |
| WO2023241567A1 (zh) * | 2022-06-13 | 2023-12-21 | 南京金斯瑞生物科技有限公司 | 一种可提高无筛选标签质粒制备效率的野生型-突变体π蛋白切换表达系统 |
| AU2023308977A1 (en) | 2022-07-19 | 2025-03-06 | Rampart Bioscience, Inc. | Non-immunogenic circular, non-viral dna vectors |
| CN117305339B (zh) * | 2023-11-30 | 2024-02-06 | 苏州左旋星生物科技有限公司 | 优化大肠杆菌基因编辑的载体及其应用 |
| WO2025160245A1 (en) | 2024-01-25 | 2025-07-31 | Aldevron, L.L.C. | Viral and non-viral nanoplasmid vectors with improved production |
| WO2025231315A2 (en) | 2024-05-03 | 2025-11-06 | Aldevron, L.L.C. | Bacterial host strains |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002013602A1 (fr) | 2000-08-16 | 2002-02-21 | Kansai Technology Licensing Organization Co., Ltd. | Mammifere transgenique non humain et procede de realisation de ce dernier, modele de maladie animale et procede de clarification de la fonction genique |
| US20040072326A1 (en) | 2000-08-30 | 2004-04-15 | Alfonso Cayota Guzicovsky | Methods for preparing human thrombopoietin polypeptides by mammalian cell cultures |
| WO2005003342A1 (ja) | 2003-07-08 | 2005-01-13 | Japan Science And Technology Agency | メチル化を利用したトランスジェニック生物を作製する方法およびシステム |
| WO2007004642A1 (ja) | 2005-07-05 | 2007-01-11 | Juridical Foundation The Chemo-Sero-Therapeutic Research Institute | 改変トランスポゾンベクター及びその利用方法 |
| WO2014035457A1 (en) | 2012-08-29 | 2014-03-06 | Nature Technology Corporation | Dna plasmids with improved expression |
| WO2014077863A1 (en) | 2012-11-19 | 2014-05-22 | Nature Technology Corporation | Replicative minicircle vectors with improved expression |
| JP2016521553A (ja) | 2013-06-06 | 2016-07-25 | ノバルティス アーゲー | インフルエンザウイルス再集合 |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH04197185A (ja) * | 1990-11-28 | 1992-07-16 | Mitsui Toatsu Chem Inc | 酵母発現ベクター及びこれを用いた誘導的発現 |
| GB9506051D0 (en) * | 1995-03-24 | 1995-05-10 | Univ Singapore | Gene expression |
| FR2738842B1 (fr) | 1995-09-15 | 1997-10-31 | Rhone Poulenc Rorer Sa | Molecule d'adn circulaire a origine de replication conditionnelle, leur procede de preparation et leur utilisation en therapie genique |
| US7279313B2 (en) | 1995-09-15 | 2007-10-09 | Centelion | Circular DNA molecule having a conditional origin of replication, process for their preparation and their use in gene therapy |
| US5922583A (en) | 1995-10-17 | 1999-07-13 | Biostar Inc. | Methods for production of recombinant plasmids |
| US6709844B1 (en) * | 2000-11-16 | 2004-03-23 | Mannkind Corporation | Avoidance of undesirable replication intermediates in plasmid propagation |
| FR2821855B1 (fr) | 2001-03-09 | 2004-04-02 | Cayla | Genes synthetiques et plasmides bacteriens depourvus de cpg |
| CA2794446C (en) * | 2001-04-04 | 2015-09-08 | Genencor International, Inc. | Uncoupled productive and catabolic host cell pathways |
| CA2484079A1 (en) * | 2002-04-26 | 2003-11-06 | National Institute Of Advanced Industrial Science And Technology | Expression systems for stem-loop rna molecule having rnai effect |
| GB0327056D0 (en) | 2003-11-20 | 2003-12-24 | Cobra Biolog Ltd | Plasmid maintenance |
| NZ553945A (en) | 2004-08-19 | 2010-03-26 | Nature Technology Corp | Process for plasmid DNA fermentation |
| ATE483815T1 (de) * | 2004-08-23 | 2010-10-15 | Alnylam Pharmaceuticals Inc | Expressionskonstrukte mit mehreren rna-polymerase-iii-promotoren |
| TWI311152B (en) | 2004-09-17 | 2009-06-21 | Boehringer Ingelheim Rcv Gmbh & Co K | Host-vector system for antibiotic-free cole1 plasmid propagation |
| EP2152889B1 (en) * | 2007-05-29 | 2017-03-15 | Nature Technology Corporation | Vectors and methods for genetic immunization |
| CN101932708A (zh) * | 2007-08-14 | 2010-12-29 | 联邦科学工业研究组织 | 改进的基因沉默方法 |
| US9045759B2 (en) | 2009-01-21 | 2015-06-02 | James Arthur Williams | DNA plasmids with improved copy number |
| KR102135745B1 (ko) * | 2011-12-07 | 2020-07-21 | 아이크노스 사이언스 에스. 아. | 발현 카세트 |
| WO2017066579A1 (en) | 2015-10-14 | 2017-04-20 | Audentes Therapeutics, Inc. | Nucleic acid molecules containing spacers and methods of use thereof |
| EP4151735A1 (en) * | 2018-03-21 | 2023-03-22 | Nature Technology Corporation | Viral and non-viral nanoplasmid vectors with improved production |
| AU2019401282A1 (en) * | 2018-12-20 | 2021-07-15 | Poseida Therapeutics, Inc. | Nanotransposon compositions and methods of use |
-
2019
- 2019-03-20 EP EP22194460.6A patent/EP4151735A1/en active Pending
- 2019-03-20 WO PCT/US2019/023209 patent/WO2019183248A1/en not_active Ceased
- 2019-03-20 JP JP2020551263A patent/JP7520719B2/ja active Active
- 2019-03-20 CN CN201980034026.9A patent/CN112154208B/zh active Active
- 2019-03-20 ES ES19715345T patent/ES2950736T3/es active Active
- 2019-03-20 SG SG11202009009UA patent/SG11202009009UA/en unknown
- 2019-03-20 LT LTEPPCT/US2019/023209T patent/LT3768846T/lt unknown
- 2019-03-20 DK DK19715345.5T patent/DK3768846T5/da active
- 2019-03-20 FI FIEP19715345.5T patent/FI3768846T3/fi active
- 2019-03-20 CN CN202510450562.4A patent/CN120249340A/zh active Pending
- 2019-03-20 AU AU2019240068A patent/AU2019240068B2/en active Active
- 2019-03-20 EP EP19715345.5A patent/EP3768846B1/en active Active
- 2019-03-20 KR KR1020207030139A patent/KR20210016330A/ko not_active Ceased
- 2019-03-20 CA CA3093346A patent/CA3093346A1/en active Pending
-
2020
- 2020-09-18 US US17/026,101 patent/US20210010021A1/en active Pending
-
2024
- 2024-07-10 JP JP2024110895A patent/JP2024138410A/ja active Pending
-
2025
- 2025-05-08 AU AU2025203312A patent/AU2025203312A1/en active Pending
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002013602A1 (fr) | 2000-08-16 | 2002-02-21 | Kansai Technology Licensing Organization Co., Ltd. | Mammifere transgenique non humain et procede de realisation de ce dernier, modele de maladie animale et procede de clarification de la fonction genique |
| US20040072326A1 (en) | 2000-08-30 | 2004-04-15 | Alfonso Cayota Guzicovsky | Methods for preparing human thrombopoietin polypeptides by mammalian cell cultures |
| WO2005003342A1 (ja) | 2003-07-08 | 2005-01-13 | Japan Science And Technology Agency | メチル化を利用したトランスジェニック生物を作製する方法およびシステム |
| WO2007004642A1 (ja) | 2005-07-05 | 2007-01-11 | Juridical Foundation The Chemo-Sero-Therapeutic Research Institute | 改変トランスポゾンベクター及びその利用方法 |
| WO2014035457A1 (en) | 2012-08-29 | 2014-03-06 | Nature Technology Corporation | Dna plasmids with improved expression |
| WO2014077863A1 (en) | 2012-11-19 | 2014-05-22 | Nature Technology Corporation | Replicative minicircle vectors with improved expression |
| JP2016521553A (ja) | 2013-06-06 | 2016-07-25 | ノバルティス アーゲー | インフルエンザウイルス再集合 |
Non-Patent Citations (2)
| Title |
|---|
| Carnes A et al,Production of a Nanoplasmid with a large gene insert using the HyperGRO fermentation process,Engineering Conferences International ECI Digital Archives VACCINE TECHNOLOGY VI,2016年 |
| Lu J et al.,A 5 Noncoding Exon Containing Engineered Intron Enhances Transgene Expression from Recombinant AAV Vectors in vivo,HUMAN GENE THERAPY,2016年,28(1),p125-134, Supplemetary FigureS2 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA3093346A1 (en) | 2019-09-29 |
| KR20210016330A (ko) | 2021-02-15 |
| DK3768846T5 (da) | 2024-08-19 |
| AU2019240068B2 (en) | 2025-03-13 |
| CN112154208A (zh) | 2020-12-29 |
| FI3768846T3 (fi) | 2023-06-30 |
| EP4151735A1 (en) | 2023-03-22 |
| EP3768846A1 (en) | 2021-01-27 |
| JP2021518150A (ja) | 2021-08-02 |
| US20210010021A1 (en) | 2021-01-14 |
| AU2019240068A1 (en) | 2020-10-01 |
| CN120249340A (zh) | 2025-07-04 |
| WO2019183248A1 (en) | 2019-09-26 |
| ES2950736T3 (es) | 2023-10-13 |
| LT3768846T (lt) | 2023-08-10 |
| JP2024138410A (ja) | 2024-10-08 |
| SG11202009009UA (en) | 2020-10-29 |
| CN112154208B (zh) | 2025-04-15 |
| AU2025203312A1 (en) | 2025-05-29 |
| DK3768846T3 (da) | 2023-07-24 |
| EP3768846B1 (en) | 2023-06-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7520719B2 (ja) | 生成が改良されたウイルス及び非ウイルスのナノプラスミドベクター | |
| US12215335B2 (en) | Non-integrating DNA vectors for the genetic modification of cells | |
| US10167478B2 (en) | Replicative minicircle vectors with improved expression | |
| US9550998B2 (en) | DNA plasmids with improved expression | |
| US20230132250A1 (en) | Bacterial host strains | |
| WO2019057774A1 (en) | NON-INTEGRATING DNA VECTORS FOR THE GENETIC MODIFICATION OF CELLS | |
| WO2025160245A1 (en) | Viral and non-viral nanoplasmid vectors with improved production | |
| US20170096679A1 (en) | Eukaryotic expression vectors resistant to transgene silencing | |
| KR20220018410A (ko) | 세포질에서 자가전사가 가능하고 유전체 편집을 제공하는 rna/dna 시스템 | |
| WO2025231315A2 (en) | Bacterial host strains | |
| HK40031637B (en) | Non-integrating dna vectors for the genetic modification of cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD01 | Notification of change of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7426 Effective date: 20211110 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20211110 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220318 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20220318 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20230224 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230314 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230614 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230808 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20231107 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240109 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A712 Effective date: 20240119 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20240119 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240408 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20240611 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20240710 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7520719 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |