JP7169979B2 - 補体関連腎症および肝線維症の候補治療剤の治療有効性を評価する方法 - Google Patents
補体関連腎症および肝線維症の候補治療剤の治療有効性を評価する方法 Download PDFInfo
- Publication number
- JP7169979B2 JP7169979B2 JP2019546343A JP2019546343A JP7169979B2 JP 7169979 B2 JP7169979 B2 JP 7169979B2 JP 2019546343 A JP2019546343 A JP 2019546343A JP 2019546343 A JP2019546343 A JP 2019546343A JP 7169979 B2 JP7169979 B2 JP 7169979B2
- Authority
- JP
- Japan
- Prior art keywords
- gene
- rodent
- human
- mouse
- agent
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New breeds of animals
- A01K67/027—New breeds of vertebrates
- A01K67/0275—Genetically modified vertebrates, e.g. transgenic
- A01K67/0276—Knockout animals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/0004—Screening or testing of compounds for diagnosis of disorders, assessment of conditions, e.g. renal clearance, gastric emptying, testing for diabetes, allergy, rheuma, pancreas functions
- A61K49/0008—Screening agents using (non-human) animal models or transgenic animal models or chimeric hosts, e.g. Alzheimer disease animal model, transgenic model for heart failure
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New breeds of animals
- A01K67/027—New breeds of vertebrates
- A01K67/0275—Genetically modified vertebrates, e.g. transgenic
- A01K67/0278—Humanized animals, e.g. knockin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/472—Complement proteins, e.g. anaphylatoxin, C3a, C5a
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/8509—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells for producing genetically modified animals, e.g. transgenic
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5082—Supracellular entities, e.g. tissue, organisms
- G01N33/5088—Supracellular entities, e.g. tissue, organisms of vertebrates
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6893—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to diseases not provided for elsewhere
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/05—Animals comprising random inserted nucleic acids (transgenic)
- A01K2217/054—Animals comprising random inserted nucleic acids (transgenic) inducing loss of function
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/07—Animals genetically altered by homologous recombination
- A01K2217/072—Animals genetically altered by homologous recombination maintaining or altering function, i.e. knock in
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/07—Animals genetically altered by homologous recombination
- A01K2217/075—Animals genetically altered by homologous recombination inducing loss of function, i.e. knock out
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/15—Animals comprising multiple alterations of the genome, by transgenesis or homologous recombination, e.g. obtained by cross-breeding
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/20—Animal model comprising regulated expression system
- A01K2217/206—Animal model comprising tissue-specific expression system, e.g. tissue specific expression of transgene, of Cre recombinase
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/105—Murine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2267/00—Animals characterised by purpose
- A01K2267/03—Animal model, e.g. for test or diseases
- A01K2267/0306—Animal model for genetic diseases
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2267/00—Animals characterised by purpose
- A01K2267/03—Animal model, e.g. for test or diseases
- A01K2267/035—Animal model for multifactorial diseases
- A01K2267/0368—Animal model for inflammation
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2267/00—Animals characterised by purpose
- A01K2267/03—Animal model, e.g. for test or diseases
- A01K2267/0393—Animal model comprising a reporter system for screening tests
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/8509—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells for producing genetically modified animals, e.g. transgenic
- C12N2015/8527—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells for producing genetically modified animals, e.g. transgenic for producing animal models, e.g. for tests or diseases
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/8509—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells for producing genetically modified animals, e.g. transgenic
- C12N2015/8527—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells for producing genetically modified animals, e.g. transgenic for producing animal models, e.g. for tests or diseases
- C12N2015/8536—Animal models for genetic diseases
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2800/00—Nucleic acids vectors
- C12N2800/30—Vector systems comprising sequences for excision in presence of a recombinase, e.g. loxP or FRT
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2830/00—Vector systems having a special element relevant for transcription
- C12N2830/008—Vector systems having a special element relevant for transcription cell type or tissue specific enhancer/promoter combination
Description
本出願は、2017年2月27日出願の米国仮特許出願第62/464,262号、2017年7月7日出願の米国仮特許出願第62/529,916号、および2017年11月9日出願の米国仮特許出願第62/583,780号の利益を主張するものであり、これらの仮特許出願の内容全体は参照により本明細書に組み込まれる。
2018年2月12日に作製され、EFS-Webを介して米国特許商標庁に提出された35469_10207US01_SequenceListing.txtという名称の6KBのASCIIテキストファイルの配列表が、参照により本明細書に組み込まれる。
本明細書に引用されるすべての特許、特許出願、およびその他の出版物の開示は、全ての目的に対してその全体が参照により本明細書に援用される。
「補体関連腎症」または「補体関連ネフローゼ」という用語は、本明細書で使用する場合、これらに限定されないが、腎組織におけるC3および/またはC5b-9膜侵襲複合体、具体的にはネフロン、より具体的には糸球体などの望ましくない代替補体経路活性化および/または補体活性化産物の沈着に関連する疾患/障害を含む、腎臓の損傷、または疾患もしくは障害を指す。一部の実施形態では、補体関連腎症は、非典型溶血性尿毒症症候群(aHUS)および/またはC3糸球体症(C3G)、デンスデポジット病(DDD)およびC3糸球体炎(C3GN)を包含する膜性増殖性糸球体腎炎の形態として知られる一つまたは複数の状態を含む。
A.C3および補体系
免疫系の必須成分である補体は、三つのリンクされた生化学的カスケード、古典的経路、レクチン経路および代替経路に関与する、30を超える循環性タンパク質および細胞タンパク質からなる。補体は、免疫系を補助して、侵入した微生物を破壊し、組織のホメオスタシスを維持するために機能する。ヒトにおけるC3欠損症は、細菌感染症の感受性の増加と関連する。しかしながら、補体の過剰または未制御の活性化は、組織損傷に寄与し、異常な補体活性化によって特徴付けられる様々なヒトの疾患、障害、および状態に関連付けられる。
いくつかの補体関連腎症は、腎臓、特にネフロンの糸球体に異常に高いレベルのC3沈着を伴うことが知られている。
溶血性尿毒症症候群(またはhaemolytic-uraemic syndrome)は、HUSと短縮され、溶血性貧血(赤血球の破壊によって生じる貧血)、急性腎不全(尿症)、および低血小板数(血小板減少)によって特徴付けられる疾患である。それは主に子どもたちに影響するが、子どもたちに限らない。ほとんどの症例の前には、食中毒として、または大腸菌O157:H7、その他の非O157:H7大腸菌血清型、赤痢菌、およびカンピロバクターによって引き起こされる汚染された給水から生じる感染性の、時には出血を伴う下痢が発症する。
デンスデポジット病(DDD)は、腎糸球体中の大量のC3の蓄積によって特徴付けられる希少な障害である。この状態は、透過電子顕微鏡を使用して、糸球体基底膜(GBM)中に過剰に蓄積された非常に高密度の沈着物にちなんで命名された。2013年には、コンセンサス会議の結果として、科学者らは新しい表題「C3糸球体症」の下でDDDをサブグループ化することを推奨している(C3G;Pickeringら。Kidney Intl.、2013、84:1079-89)。この新しい用語は、DDDを思わせる腎生検で糸球体疾患を示す患者の別のグループがあるという認識によってもたらされた。これらの個体では、C3沈着は、電子顕微鏡を使用して見ると、より薄い色であり、より広範囲にある。しかしながら、免疫蛍光評価では、DDD患者と同様に、腎糸球体に大量のC3が存在する。従って、これらの患者は、「C3糸球体腎炎」または「C3GN」と診断されている。それらの症候性類似性を認識すると、DDDおよびC3GNの両方が、C3Gのサブタイプとして分類される。
本明細書に開示される方法で使用されるヒト化C3動物は、当該技術分野で公知の方法論を使用して生成することができる(一般に、“Gene Targeting:A Practical Approach”、Joyner、ed.、Oxford University Press、Inc.(2000)を参照のこと)。一実施形態では、マウスの生成は、マウスC3遺伝子の破壊、およびヒトまたはヒト化C3をコードする遺伝子のマウスゲノムへの導入を任意に含み得る。一実施形態では、ヒトまたはヒト化C3をコードする遺伝子の導入は、内因性マウスC3遺伝子と同じ位置にある。
A.補体関連腎症または肝線維症を改善する薬剤の特定
一部の態様では、1)候補薬剤を特定する方法(すなわち、化合物または治療剤分子)または2)補体関連腎症、例えば、これらに限定されないが、aHUS、DDD、C3糸球体腎炎、および/またはC3糸球体症などの治療における使用のための候補薬剤の治療有効性をインビボで評価する方法が本明細書に提供される。本方法は、本明細書に開示されるヒト化C3非ヒト動物(例えば、マウスまたはラット)のいずれかを利用する。一部の実施形態では、候補化合物は、補体関連腎症の症状を示す非ヒト動物に直接投与され、薬剤または化合物が補体関連腎症および/または肝線維症の一つまたは複数の症状を軽減できるかどうかを決定する。その他の実施形態では、候補化合物は、これら非ヒト動物から得られた血清と接触し、補体活性は、一般的に使用されるいかなるインビトロでの評価技術(CH50アッセイなどがあるがこれに限定されない)を用いて評価される。
候補治療剤または化合物は、限定されないが、小分子化学物質、抗体、タンパク質、阻害性核酸、またはそれらの任意の組み合わせであり得る。
一部の態様では、候補薬剤または化合物は、補体タンパク質(C5、C3、またはそのタンパク質分解産物(例えば、C3aまたはC3b)など)および抗体に結合(例えば、優先的に結合)する。「抗体(antibody)」および「抗体(antibodies)」という用語は、完全ヒト抗体、ヒト化抗体、ラクダ化(camelised)抗体、キメラ抗体、CDR融合抗体、単鎖Fvs(scFv)、ジスルフィド結合型Fvs(sdFv)、Fab断片、F(ab′)断片、および前述のいずれかの抗原結合断片を指す。特に、抗体は、免疫グロブリン分子および免疫グロブリン分子の抗原結合活性断片、すなわち抗原結合部位を含有する分子を含む。こうした断片は、それに限定されないが、Fc領域またはその断片を含む別の免疫グロブリンドメインに融合されてもよく、または融合されなくてもよい。当業者であれば、scFv-Fc融合物、可変領域(例えばVLおよびVH)-Fc融合物、およびscFv-scFv-Fc融合物を含むがこれらに限定されない、その他の融合生成物が生成され得ることを理解するであろう。免疫グロブリン分子は、IgG、IgE、IgM、IgD、IgAおよびIgYを含む任意のタイプ、ならびにIgG1、IgG2、IgG3、IgG4、IgA1およびIgA2を含む任意のクラス、または任意のサブクラスであり得る。一部の実施形態では、抗体はC5および/またはC3拮抗薬であり、補体活性化(例えば、腎臓または肝臓における代替的補体経路活性化など)を減少させ得る。その他の実施形態では、抗体はC5および/またはC3作動薬であり、補体活性化を増加させ得る。
一部の態様では、候補化合物は、補体タンパク質(C5、C3、またはそのタンパク質分解産物(例えば、C3aまたはC3b)など)に結合(例えば、優先的に結合)し、非抗体結合ポリペプチドである。一部の実施形態では、非抗体結合ポリペプチドは、C5および/またはC3拮抗薬であり、補体活性化(例えば、腎臓または肝臓における代替的補体経路活性化など)を減少させ得る。その他の実施形態では、非抗体結合ポリペプチドは、C5および/またはC3作動薬であり、補体活性化を増加させ得る。
一部の態様では、候補化合物は、補体タンパク質(C5、C3、またはそのタンパク質分解産物(例えば、C3aまたはC3b)など)に結合(例えば、優先的に結合)し、小分子である。一部の実施形態では、小分子はC5および/またはC3であり、補体活性化(例えば、腎臓または肝臓における代替的補体経路活性化など)を減少させ得る。その他の実施形態では、小分子はC5および/またはC3作動薬であり、補体活性化を増加させ得る。
本開示の一態様では、候補補体調節化合物は、補体系の成分(mRNAなど)を標的とする一つまたは複数のオリゴヌクレオチドである。阻害性核酸は、限定されないが、アンチセンスオリゴヌクレオチド、小型の抑制性RNA(siRNA)、またはリボザイムとすることができる。
さらに、本明細書には、一つまたは複数の補体関連神経障害(例えば、非典型溶血性尿毒症症候群(aHUS)またはC3糸球体症(デンスデポジット病(DDD)またはC3糸球体腎炎(C3GN)などのC3Gなど)を治療するための方法が提供される。実施例6~7に示されるように、C5の発現または活性を阻害する臨床的に有効な量の治療剤による補体関連腎症の一つまたは複数の症状を示すヒト化C3マウスの治療は、生存率および腎機能の改善、腎臓の組織学的徴候および補体関連神経障害に関連する糸球体損傷の減少、および疾患シグネチャー遺伝子発現の完全または部分的な逆転をもたらし得る。さらに、実施例9に示すように、C3の活性の発現、またはそのタンパク質切断産物(C3aまたはC3b)の活性を阻害する臨床的に有効な量の治療剤を伴う補体関連神経障害の一つまたは複数の症状を示すヒト化C3マウスの治療は、生存率の改善にもつながり得る。
一部の実施形態では、治療剤は、本明細書で議論される、抗体、阻害性核酸(アンチセンスオリゴヌクレオチド、siRNA、マイクロRNA(miR)、またはリボザイムなどがあるがこれらに限定されない)、もしくは非抗体結合ポリペプチドなどの阻害性核酸、非抗体結合ポリペプチド、または小分子化学物質のうちの一つまたは複数である。
(I)MAID6149 HOおよびMAID6156 HOマウスの作製
MAID6149マウス-ヒトC3プロモーターおよびコーディングエクソン1~41を用いた置換:5’調節エレメントおよびヒトC3遺伝子のコーディングエクソン1~41のすべてを含むヒトC3遺伝子は、5’調節エレメントおよびコーディングエクソン1~41のすべてにわたるマウスC3遺伝子座を置換した(図1A)。
ELISAおよびウエスタンブロットを使用して、血清C3濃度をMAID6149マウスおよびMAID6156マウスに分析した。簡潔に述べると、ウエスタンブロット分析を以下のように行った:マウスまたは正常なヒト血清(NHS)をPBS中で希釈した。精製ヒトC3bタンパク質(Calbiochem)を陽性対照として使用した。マウスC3欠損血清を陰性対照として使用した。血清または精製されたhC3タンパク質を、メルカプトエタノールおよびSDSを含む電気泳動サンプルロード緩衝液に加え、還元/変性条件下でポリアクリルアミドゲル上で処理し、次いでニトロセルロース膜上に移した。ブロットをブロックし、ポリクローナルヤギ抗マウスC3一次抗体(Abnova)またはヒトC3(Quidel)に対するポリクローナルヤギ抗血清のいずれかでプローブし、その後、抗ヤギIgG HRP(Santa Cruz)を検出した。ThermoScientific Super Signal West Pico Chemiluminescent Substrateを使用してブロットを展開した。イメージングには、GE Image Quant LAS4000を使用した。血清C3濃度は、製造業者の指示に従って、補体C3ヒトELISAキットおよび補体C3マウスELISAキット(Abcam)で決定された。以下のように、ELISAによりタンパク質レベルをアッセイした:マウスおよびヒトC3は、それぞれ製造業者の指示に従って、補体C3マウスELISAキット(Abcam)および補体C3 ヒトELISAキット(Abcam)で測定された。ヒトC3aを、BD OptEIA(商標)ヒトC3a ELISAキット(BD Biosciences)で測定した。マウスC3aは、BD Biosciencesの以下の試薬で測定した。製造業者の指示に従って、精製ラット抗マウスC3a抗体、ビオチンラット抗マウスC3a抗体、および精製マウスC3aタンパク質(未変性)。
(I)C3ヒト化マウス対野生型の平均死亡年齢および体重。
これらの実験については、死亡率および死亡年齢を動物施設の記録から取得した。さらに、MAID6156ホモ接合性マウスおよびMAID6149ホモ接合性マウスの体重は、マウスのコホートでモニターされた。最後に、除脂肪組織体積、全身脂肪体積、および脂肪体積%は、以下のように決定された:マウスをインビボQuantum μCTシステム(PerkinElmer)を用いてスキャンした。X線源は、電流160μA、電圧90kVpに設定された。マウスをイソフルランで麻酔し、頭部を除いた全身を60mm×120mmの視野でスキャンした。スキャンは34秒かかり、ボクセルサイズは240μmであった。結像を解析ソフトウェア(Mayo Clinic)により解析した。骨、脂肪、および除脂肪組織を灰色の値で区分し、組織体積、脂肪体積画分、骨ミネラル密度(BMD)および骨ミネラル含有量を計算した。
(II)C3ヒト化マウス対野生型の肉眼形態
MAID6156ホモ接合性C3ヒト化マウスにおいて肉眼形態を評価したのち、有資格獣医師により自然死が判断された。死後検査により、ホモ接合性マウスは脆い骨(肋骨、頭蓋骨およびその他すべての骨)を呈し、野生型と比較して皮下脂肪の顕著な欠如が明らかになった。
(I)腎病理組織学
簡潔に述べると、ヘマトキシリンおよびエオシン(H&E)染色には、ヘマトキシリンでの染色、酸アルコールでの分化、それに続くエオシンでの染色が含まれる。腎臓切片の過ヨウ素酸シッフ(PAS)染色は、商業ベンダー(Histoserv Inc.)を使用して実施した。簡潔に述べると、5ミクロンの薄い切片を、腎臓のすべての解剖学的領域を含むように、矢状面に沿ってホルマリン固定、パラフィン包埋されたマウス腎臓組織から作製した。切片を脱パラフィンし、PASで染色して、組織中の糖タンパク質、糖脂質、およびムチンを検出した。PAS染色切片におけるメサンギウム基質増加の定量決定を以下のように行った。簡潔に述べると、PAS染色された切片を、40倍の対物レンズのAperio AT2スライドスキャナーで撮像した。メサンギウム細胞基質増加の測定については、切片あたり少なくとも25個の糸球体をPAS陽性領域の測定に供した。Indica Labs Area Quantificationアルゴリズムの修飾を使用して、各糸球体係蹄に光学密度ベースの閾値が適用し、シッフ陽性基質(明るい紫)から核染色(暗い青色)および背景(薄いピンク)を分離した。基質および総係蹄の面積を測定し、係蹄面積の割合としてのメサンギウム細胞基質とともに報告した。
ナトリウム、カリウム、塩化物、カルシウム、グルコース、BUN、リパーゼ、総タンパク質、クレアチニン、クレアチンキナーゼ、アルブミン、アミラーゼ、ビリルビン、マグネシウム、リン酸、尿酸、亜リン酸、遊離脂肪酸、コレステロール、トリグリセリド、HDL、非HDL、およびLDLの血清レベルが以下のように決定された。簡潔に述べると、製造業者の指示に従って、ADVIA Chemistry Systemで血清を試験した。同様に、製造業者の指示に従って、ADVIA Chemistry Systemで血清肝酵素を試験した。
実施例4:C3ヒト化マウスにおける腎臓内の異常な補体沈着
MAID6149ホモ接合性および野生型のマウスからの腎臓組織の断面を、以下のプロトコルに従い、C3沈着およびC5b-9膜侵襲複合体の存在について免疫蛍光性で評価した。簡潔に述べると、矢状切片は、凍結OCT組み込み腎臓から作製され、ラット-抗マウスC3モノクローナル抗体(Abcam)またはウサギポリクローナルC5b-9抗体(Abcam)のどちらかで染色された。Cy3ロバ抗ラット(Jackson ImmunOresearch)またはCy3ロバ抗ウサギ二次抗体(Jackson ImmunOresearch)を使用して、染色をそれぞれ可視化した。蛍光画像はそれぞれ、Leica DM5500またはDM6000顕微鏡を使用して撮影された。
実施例5:C3ヒト化マウスのRNA配列シグネチャー
MAID6149とMAID6156の両方のホモ接合性マウスを互いに比較するとともに、野生型と比較する発現RNA配列シグネチャーの決定を以下のように行った。
実施例6:補体関連腎症の治療における抗C5抗体の有効性
上述のように、C3にヒト化されたマウスは、自然死、正常から低い溶血活性、低循環C3(正常なマウスで見られる1000ug/mLに対して約40ug/mL)、ならびに腎臓炎症および腎臓内のC3沈着の存在を含む多臓器病理を有することが見いだされた。
実施例7:抗C5治療が、ヒト化C3マウス(MAID6149)の疾患遺伝子シグネチャーの深部の救済をもたらした。
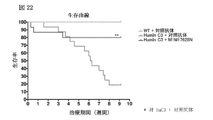
ヒト化C3マウスを、マウス抗マウスC5抗体、またはアイソタイプ対照抗体(n=15)のいずれかで処置し、8週齢から開始した。抗体を50mg/kgで、週三回、皮下投与した。治療は24週齢で停止した。
ヒト化C3マウス(MAID6149)を、抗C3b結合/遮断抗体(n=14)またはアイソタイプ対照抗体(n=14)のいずれかで処置し、8週齢から開始した。抗体を50mg/kgで、週三回、皮下投与した。治療は、18週齢まで続く(合計10週間の治療期間)。
Claims (28)
- 補体関連腎症の治療に使用するための薬剤のインビボでの治療有効性を評価する方法であって、前記方法が、
(a)ゲノムがC3遺伝子のエクソンを含む齧歯類遺伝子配列の内因性齧歯類C3遺伝子座において、ヒトC3遺伝子の少なくとも一つのエクソンを含む核酸配列による置換を含むことで修飾C3遺伝子を形成している齧歯類に前記薬剤を投与することであって、
(i)前記ヒトC3遺伝子の少なくとも一つのエクソンを含む核酸配列は、前記ヒトC3遺伝子のエクソン2からエクソン41を含み、かつ前記修飾C3遺伝子の発現が、前記内因性齧歯類C3遺伝子座で齧歯類調節エレメントの制御下にあるか、または
(ii)前記ヒトC3遺伝子の少なくとも一つのエクソンを含む核酸配列は、前記ヒトC3遺伝子のエクソン1からエクソン41を含み、
前記齧歯類はマウスまたはラットであり、かつ前記腎症の一つまたは複数の症状を示す、投与することと、
(b)前記薬剤が投与されていない対照齧歯類と比較して、前記腎症の一つまたは複数の症状を阻害するかどうかを評価することと、を含む方法。 - 前記齧歯類が、マウスC3タンパク質を発現する能力を有しないマウスである、請求項1に記載の方法。
- 前記齧歯類が、内因性マウスC5遺伝子によってコードされたマウスC5タンパク質を発現するマウスである、請求項1または2に記載の方法。
- 前記薬剤が、小分子化学物質、ペプチド、および抗体からなる群から選択される、請求項1~3のいずれか一項に記載の方法。
- 前記薬剤が、抗体である、請求項4に記載の方法。
- 前記薬剤が、モノクローナル抗体またはその機能的結合断片である、請求項5に記載の方法。
- 前記薬剤が、阻害性核酸である、請求項4に記載の方法。
- 前記阻害性核酸が、siRNA、shRNA、アプタマー、アンチセンスオリゴヌクレオチド、三重鎖形成オリゴヌクレオチド、およびリボザイムからなる群から選択される、請求項7に記載の方法。
- 前記腎症の一つまたは複数の症状が自然死を含む、請求項1~8のいずれか一項に記載の方法。
- 前記腎症の一つまたは複数の症状が、体重減少、骨密度の減少、体脂肪の減少、またはそれらの組み合わせを含む、請求項1~8のいずれか一項に記載の方法。
- 前記腎症の一つまたは複数の症状が、糸球体腎炎、好塩基球細管、硬化糸球体、蛋白円柱を有する拡張細管、メサンギウム基質増加、糸球体肥大、および単核間質性炎症からなる群の一つまたは複数から選択される、請求項1~8のいずれか一項に記載の方法。
- 前記腎症の一つまたは複数の症状が、腎臓におけるC3タンパク質沈着を含む、請求項1~8のいずれか一項に記載の方法。
- 前記腎症の一つまたは複数の症状が、腎臓におけるC5b-9膜侵襲複合体沈着を含む、請求項1~8のいずれか一項に記載の方法。
- 前記腎症の一つまたは複数の症状が、高血中尿素窒素(BUN)、血清リパーゼ、血清シスタチンC、または血清非高密度リポタンパク質のうちの一つまたは複数を含む、請求項1~8のいずれか一項に記載の方法。
- 前記腎症の一つまたは複数の症状が、尿アルブミンまたはC5aの増加を含む、請求項1~8のいずれか一項に記載の方法。
- 前記腎症の一つまたは複数の症状が、腎症シグネチャー遺伝子の一つまたは複数の発現を決定することに基づいて評価される、請求項1~8のいずれか一項に記載の方法。
- 肝線維症の治療に使用するための薬剤のインビボでの治療有効性を評価する方法であって、前記方法が、
(a)C3遺伝子のエクソンを含む齧歯類遺伝子配列の内因性齧歯類C3遺伝子座において、ヒトC3遺伝子の少なくとも一つのエクソンを含む核酸配列による置換を含むことで修飾C3遺伝子を形成している齧歯類に前記薬剤を投与することであって、
(i)前記ヒトC3遺伝子の少なくとも一つのエクソンを含む核酸配列は、前記ヒトC3遺伝子のエクソン2からエクソン41を含み、かつ前記修飾C3遺伝子の発現が、前記内因性齧歯類C3遺伝子座で齧歯類調節エレメントの制御下にあるか、または
(ii)前記ヒトC3遺伝子の少なくとも一つのエクソンを含む核酸配列は、前記ヒトC3遺伝子のエクソン1からエクソン41を含み、
前記齧歯類はマウスまたはラットであり、かつ肝線維症の一つまたは複数の症状を示す、投与することと、
(b)前記薬剤が投与されていない対照齧歯類と比較して、前記肝線維症の一つまたは複数の症状を阻害するかどうかを評価することと、を含む方法。 - 前記齧歯類が、マウスC3タンパク質を発現する能力を有しないマウスである、請求項17に記載の方法。
- 前記齧歯類が、内因性マウスC5遺伝子によってコードされたマウスC5タンパク質を発現するマウスである、請求項17に記載の方法。
- 前記薬剤が、小分子化学物質、ペプチド、および抗体からなる群から選択される、請求項17~19のいずれか一項に記載の方法。
- 前記薬剤が、抗体である、請求項20に記載の方法。
- 前記薬剤が、モノクローナル抗体またはその機能的結合断片である、請求項21に記載の方法。
- 前記薬剤が、阻害性核酸である、請求項20に記載の方法。
- 前記阻害性核酸が、siRNA、shRNA、アプタマー、アンチセンスオリゴヌクレオチド、三重鎖形成オリゴヌクレオチド、およびリボザイムからなる群から選択される、請求項23に記載の方法。
- 前記肝線維症の一つまたは複数の症状が、高アラニンアミノトランスフェラーゼ(ALT)、高アスパラギン酸アミノトランスフェラーゼ(AST)、または高アルカリホスファターゼ(ALP)のうちの一つまたは複数である、請求項17~24のいずれか一項に記載の方法。
- 前記肝線維症の一つまたは複数の症状が、肝線維症シグネチャー遺伝子の一つまたは複数の発現を決定することに基づいて評価される、請求項17~24のいずれか一項に記載の方法。
- ゲノムがC3遺伝子のエクソンを含む齧歯類遺伝子配列の内因性齧歯類C3遺伝子座において、ヒトC3遺伝子の少なくとも一つのエクソンを含む核酸配列による置換を含むことで修飾C3遺伝子を形成している齧歯類における補体関連腎症の症状を阻害する薬剤を特定するための方法であって、(i)前記ヒトC3遺伝子の少なくとも一つのエクソンを含む核酸配列は、前記ヒトC3遺伝子のエクソン2からエクソン41を含み、かつ前記修飾C3遺伝子の発現が、前記内因性齧歯類C3遺伝子座で齧歯類調節エレメントの制御下にあるか、または(ii)前記ヒトC3遺伝子の少なくとも一つのエクソンを含む核酸配列は、前記ヒトC3遺伝子のエクソン1からエクソン41を含み、前記齧歯類はマウスまたはラットであり、かつ補体関連腎症の一つまたは複数の症状を示し、前記方法が、(a)前記齧歯類に前記薬剤を投与することと、(b)前記薬剤が前記齧歯類における前記補体関連腎症の一つまたは複数の症状を阻害する場合、補体関連腎症の症状を阻害する薬剤として前記薬剤を特定することと、を含む方法。
- ゲノムがC3遺伝子のエクソンを含む齧歯類遺伝子配列の内因性齧歯類C3遺伝子座において、ヒトC3遺伝子の少なくとも一つのエクソンを含む核酸配列による置換を含むことで修飾C3遺伝子を形成している齧歯類における肝線維症を阻害する薬剤を特定するための方法であって、(i)前記ヒトC3遺伝子の少なくとも一つのエクソンを含む核酸配列は、前記ヒトC3遺伝子のエクソン2からエクソン41を含み、かつ前記修飾C3遺伝子の発現が、前記内因性齧歯類C3遺伝子座で齧歯類調節エレメントの制御下にあるか、または(ii)前記ヒトC3遺伝子の少なくとも一つのエクソンを含む核酸配列は、前記ヒトC3遺伝子のエクソン1からエクソン41を含み、前記齧歯類はマウスまたはラットであり、かつ肝線維症の一つまたは複数の症状を示し、前記方法が、(a)前記齧歯類に前記薬剤を投与することと、(b)前記薬剤が前記齧歯類中の前記肝線維症の一つまたは複数の症状を阻害する場合、肝線維症を阻害する薬剤として前記薬剤を特定することと、を含む方法。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762464262P | 2017-02-27 | 2017-02-27 | |
| US62/464,262 | 2017-02-27 | ||
| US201762529916P | 2017-07-07 | 2017-07-07 | |
| US62/529,916 | 2017-07-07 | ||
| US201762583780P | 2017-11-09 | 2017-11-09 | |
| US62/583,780 | 2017-11-09 | ||
| PCT/US2018/019651 WO2018157027A1 (en) | 2017-02-27 | 2018-02-26 | Humanized model of kidney and liver disorders |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020510827A JP2020510827A (ja) | 2020-04-09 |
| JP2020510827A5 JP2020510827A5 (ja) | 2021-04-01 |
| JP7169979B2 true JP7169979B2 (ja) | 2022-11-11 |
Family
ID=61617150
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019546343A Active JP7169979B2 (ja) | 2017-02-27 | 2018-02-26 | 補体関連腎症および肝線維症の候補治療剤の治療有効性を評価する方法 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US10765762B2 (ja) |
| EP (1) | EP3585445B1 (ja) |
| JP (1) | JP7169979B2 (ja) |
| KR (1) | KR102602199B1 (ja) |
| CN (1) | CN110494168B (ja) |
| AU (1) | AU2018225745B2 (ja) |
| CA (1) | CA3054167A1 (ja) |
| IL (1) | IL268748A (ja) |
| MX (1) | MX2019010219A (ja) |
| SG (2) | SG11201907606XA (ja) |
| WO (1) | WO2018157027A1 (ja) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN112638154B (zh) | 2018-07-16 | 2022-10-18 | 瑞泽恩制药公司 | Ditra疾病的非人动物模型及其用途 |
| CA3112612C (en) * | 2018-09-13 | 2024-02-27 | Regeneron Pharmaceuticals, Inc. | Complement factor h gene knockout rat as a model of c3 glomerulopathy |
| ES2966625T3 (es) | 2019-04-04 | 2024-04-23 | Regeneron Pharma | Roedores que comprenden un locus del factor de coagulación 12 humanizado |
| JP2022534867A (ja) | 2019-06-04 | 2022-08-04 | リジェネロン・ファーマシューティカルズ・インコーポレイテッド | ベータスリップ変異を有するヒト化ttr遺伝子座を含む非ヒト動物と使用方法 |
| EP3796776A1 (en) | 2019-06-07 | 2021-03-31 | Regeneron Pharmaceuticals, Inc. | Non-human animals comprising a humanized albumin locus |
| JPWO2021112235A1 (ja) * | 2019-12-05 | 2021-06-10 | ||
| CA3191836A1 (en) * | 2020-10-01 | 2022-04-07 | Andrew J. Murphy | Rodent animals expressing human cr1 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015171523A1 (en) | 2014-05-05 | 2015-11-12 | Regeneron Pharmaceuticals, Inc. | Humanized c5 and c3 animals |
Family Cites Families (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0138854B1 (en) | 1983-03-08 | 1992-11-04 | Chiron Mimotopes Pty. Ltd. | Antigenically active amino acid sequences |
| NZ207394A (en) | 1983-03-08 | 1987-03-06 | Commw Serum Lab Commission | Detecting or determining sequence of amino acids |
| WO1984003506A1 (en) | 1983-03-08 | 1984-09-13 | Commw Serum Lab Commission | Antigenically active amino acid sequences |
| US6492107B1 (en) | 1986-11-20 | 2002-12-10 | Stuart Kauffman | Process for obtaining DNA, RNA, peptides, polypeptides, or protein, by recombinant DNA technique |
| DE3546807C2 (ja) | 1985-03-30 | 1991-03-28 | Marc Genf/Geneve Ch Ballivet | |
| NZ215865A (en) | 1985-04-22 | 1988-10-28 | Commw Serum Lab Commission | Method of determining the active site of a receptor-binding analogue |
| DE3883899T3 (de) | 1987-03-18 | 1999-04-22 | Sb2 Inc | Geänderte antikörper. |
| US5266684A (en) | 1988-05-02 | 1993-11-30 | The Reagents Of The University Of California | Peptide mixtures |
| US5571689A (en) | 1988-06-16 | 1996-11-05 | Washington University | Method of N-acylating peptide and proteins with diheteroatom substituted analogs of myristic acid |
| US5663143A (en) | 1988-09-02 | 1997-09-02 | Dyax Corp. | Engineered human-derived kunitz domains that inhibit human neutrophil elastase |
| US5223409A (en) | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| US5427908A (en) | 1990-05-01 | 1995-06-27 | Affymax Technologies N.V. | Recombinant library screening methods |
| US5723286A (en) | 1990-06-20 | 1998-03-03 | Affymax Technologies N.V. | Peptide library and screening systems |
| US5770434A (en) | 1990-09-28 | 1998-06-23 | Ixsys Incorporated | Soluble peptides having constrained, secondary conformation in solution and method of making same |
| US5698426A (en) | 1990-09-28 | 1997-12-16 | Ixsys, Incorporated | Surface expression libraries of heteromeric receptors |
| WO1992009300A1 (en) | 1990-11-21 | 1992-06-11 | Iterex Pharmaceuticals Ltd. Partnership | Synthesis of equimolar multiple oligomer mixtures, especially of oligopeptide mixtures |
| ES2113940T3 (es) | 1990-12-03 | 1998-05-16 | Genentech Inc | Metodo de enriquecimiento para variantes de proteinas con propiedades de union alteradas. |
| US5270170A (en) | 1991-10-16 | 1993-12-14 | Affymax Technologies N.V. | Peptide library and screening method |
| US5644048A (en) | 1992-01-10 | 1997-07-01 | Isis Pharmaceuticals, Inc. | Process for preparing phosphorothioate oligonucleotides |
| EP0714409A1 (en) | 1993-06-16 | 1996-06-05 | Celltech Therapeutics Limited | Antibodies |
| GB9521943D0 (en) | 1995-10-26 | 1996-01-03 | Univ Hertfordshire | Coded particles for process sequence tracking in combinatorial compound library preparation |
| JP2002510481A (ja) | 1998-04-02 | 2002-04-09 | ジェネンテック・インコーポレーテッド | 抗体変異体及びその断片 |
| US6335155B1 (en) | 1998-06-26 | 2002-01-01 | Sunesis Pharmaceuticals, Inc. | Methods for rapidly identifying small organic molecule ligands for binding to biological target molecules |
| US6280946B2 (en) | 1998-08-07 | 2001-08-28 | Boston Probes, Inc. | PNA probes, probe sets, methods and kits pertaining to the universal detection of bacteria and eucarya |
| EP1141708A1 (en) | 1998-12-28 | 2001-10-10 | Sunesis Pharmaceuticals Inc. | Identifying small organic molecule ligands for binding |
| US20090032592A1 (en) | 2006-01-11 | 2009-02-05 | Novo Nordisk A/S | Spherical encoded beads |
| MX2009013082A (es) * | 2007-06-07 | 2010-01-15 | Genentech Inc | Anticuerpos contra c3b y metodos para la prevencion y el tratamiento de trastornos asociados con el complemento. |
| EP3101031A1 (en) | 2008-11-10 | 2016-12-07 | Alexion Pharmaceuticals, Inc. | Methods and compositions for treating complement-associated disorders |
| JP6262715B2 (ja) * | 2012-04-03 | 2018-01-17 | ノーベルメッド セラピューティクス インコーポレイテッド. | ヒト化およびキメラ抗c3因子抗体、ならびにその使用 |
| ES2647124T3 (es) * | 2012-06-28 | 2017-12-19 | Novartis Ag | Derivados de pirrolidina y su uso como moduladores de la ruta del complemento |
| CN105683759B (zh) * | 2013-08-07 | 2019-03-29 | 瑞颂医药公司 | 非典型溶血性尿毒综合征(aHUS)生物标志物蛋白 |
| US9659904B2 (en) * | 2013-12-12 | 2017-05-23 | Intel Corporation | Distributed on-package millimeter-wave radio |
| AU2015223068B2 (en) * | 2014-02-25 | 2020-07-30 | Achillion Pharmaceuticals, Inc. | Aryl, heteroaryl, and heterocyclic compounds for treatment of complement mediated disorders |
-
2018
- 2018-02-26 JP JP2019546343A patent/JP7169979B2/ja active Active
- 2018-02-26 US US15/904,808 patent/US10765762B2/en active Active
- 2018-02-26 EP EP18710242.1A patent/EP3585445B1/en active Active
- 2018-02-26 SG SG11201907606XA patent/SG11201907606XA/en unknown
- 2018-02-26 WO PCT/US2018/019651 patent/WO2018157027A1/en active Application Filing
- 2018-02-26 SG SG10202111663PA patent/SG10202111663PA/en unknown
- 2018-02-26 AU AU2018225745A patent/AU2018225745B2/en active Active
- 2018-02-26 CA CA3054167A patent/CA3054167A1/en active Pending
- 2018-02-26 CN CN201880021486.3A patent/CN110494168B/zh active Active
- 2018-02-26 MX MX2019010219A patent/MX2019010219A/es unknown
- 2018-02-26 KR KR1020197027971A patent/KR102602199B1/ko active IP Right Grant
-
2019
- 2019-08-18 IL IL26874819A patent/IL268748A/en unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015171523A1 (en) | 2014-05-05 | 2015-11-12 | Regeneron Pharmaceuticals, Inc. | Humanized c5 and c3 animals |
Non-Patent Citations (2)
| Title |
|---|
| B de Vries et al,Inhibition of complement factor C5 protects against renal ischemia-reperfusion injury: inhibition of late apotosis and inflammation,Transplantation,vol15,2003年12月31日,375-382 |
| Chia-chao Wu et al,Experimental model of membranous nephropathy in mice: sequence of histological and biochemical events,Laboratory Animals,2008年01月01日,vol 42,350-359 |
Also Published As
| Publication number | Publication date |
|---|---|
| US10765762B2 (en) | 2020-09-08 |
| EP3585445C0 (en) | 2024-02-07 |
| US20180243450A1 (en) | 2018-08-30 |
| CA3054167A1 (en) | 2018-08-30 |
| MX2019010219A (es) | 2020-02-07 |
| EP3585445A1 (en) | 2020-01-01 |
| SG11201907606XA (en) | 2019-09-27 |
| EP3585445B1 (en) | 2024-02-07 |
| CN110494168A (zh) | 2019-11-22 |
| SG10202111663PA (en) | 2021-12-30 |
| RU2019126691A (ru) | 2021-03-29 |
| IL268748A (en) | 2019-10-31 |
| WO2018157027A1 (en) | 2018-08-30 |
| KR20190122231A (ko) | 2019-10-29 |
| KR102602199B1 (ko) | 2023-11-15 |
| CN110494168B (zh) | 2023-02-03 |
| JP2020510827A (ja) | 2020-04-09 |
| AU2018225745A1 (en) | 2019-09-19 |
| RU2019126691A3 (ja) | 2021-10-04 |
| AU2018225745B2 (en) | 2023-12-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7169979B2 (ja) | 補体関連腎症および肝線維症の候補治療剤の治療有効性を評価する方法 | |
| US11178860B2 (en) | Humanized C5 animals | |
| Jones et al. | A cre-inducible DUX4 transgenic mouse model for investigating facioscapulohumeral muscular dystrophy | |
| NZ563341A (en) | Methods for identifying agents that modulate a gene that encodes for a PRO1568 polypeptide | |
| ZA200904184B (en) | Novel gene disruptions, compositions and methods relating thereto | |
| JP5080988B2 (ja) | 線維性疾患のためのモデルとしての遺伝子導入動物 | |
| RU2772583C2 (ru) | Гуманизированная модель нарушений со стороны почек и печени | |
| KR20240058090A (ko) | 이종이식을 위한 방법 및 조성물 | |
| KR20230066376A (ko) | 이종이식을 위한 유전자 변형 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210215 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210215 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20220131 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220208 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220509 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220805 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20221004 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20221031 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7169979 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |