JP7127023B2 - 核酸検出方法、核酸検出用プライマー及び核酸検出用キット - Google Patents
核酸検出方法、核酸検出用プライマー及び核酸検出用キット Download PDFInfo
- Publication number
- JP7127023B2 JP7127023B2 JP2019525677A JP2019525677A JP7127023B2 JP 7127023 B2 JP7127023 B2 JP 7127023B2 JP 2019525677 A JP2019525677 A JP 2019525677A JP 2019525677 A JP2019525677 A JP 2019525677A JP 7127023 B2 JP7127023 B2 JP 7127023B2
- Authority
- JP
- Japan
- Prior art keywords
- nucleic acid
- polynucleotide portion
- detected
- acid detection
- dna
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6844—Nucleic acid amplification reactions
- C12Q1/686—Polymerase chain reaction [PCR]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/178—Oligonucleotides characterized by their use miRNA, siRNA or ncRNA
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Genetics & Genomics (AREA)
- Analytical Chemistry (AREA)
- General Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biomedical Technology (AREA)
- Plant Pathology (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Enzymes And Modification Thereof (AREA)
Description
また、本発明は、核酸検出用プライマー及び核酸検出用キットに関する。
これらの短鎖核酸のうち、miRNA(microRNA)と呼ばれる短鎖核酸は、遺伝子発現の調節に重要な役割を果たすことが明らかになっている。miRNAは、20~25塩基の一本鎖RNAであり、その前駆体として、染色体上のmiRNA遺伝子がRNAポリメラーゼで転写されることによって、ヘアピン構造を含むpri-miRNA(primary miRNA)が産生され、次に、核内RNaseであるDroshaによりpri-miRNAが切断されて、ヘアピン構造をした60~70塩基のpre-miRNA(precursor miRNA)が産生される。pre-miRNAは、核内から細胞質に輸送され、細胞質内のRNaseであるDicerによって切断され、21~24塩基の二本鎖RNA(miRNA duplex)となる。二本鎖RNAは、Agoタンパク質に取り込まれ、片側のRNA鎖(成熟型miRNA)だけが最終的にAgoタンパク質と安定な複合体を形成し、RNA誘導型サイレンシング複合体(RNA-induced silencing complex:RISC)を形成する。RISCは、RISCに取り込まれた成熟型miRNAと部分的に相補的な配列を有する標的mRNAに結合し、標的mRNAの翻訳を抑制することで、遺伝子発現を調節している。
核酸増幅法を用いたmiRNAの検出方法としては、miRNAをポリアデニル化してポリA配列を付加した上で、ポリT配列とmiRNAに相補的な塩基を含むプライマーを用いた逆転写反応によりcDNAの合成を行い、このcDNAに相補的なプライマーを用いてcDNAの核酸増幅を行うことにより、miRNAを検出する方法が開発されている(特許文献1)。
また、miRNAに特異的な3´領域とステムループとを有するプライマーに、miRNAをハイブリダイズさせて、プライマーの伸長反応を行い、伸長反応させたプライマーを鋳型に増幅反応を行うことで、miRNAを検出する方法も開発されている(特許文献2)。
そこで、本発明は、上記従来の状況に鑑み、短鎖核酸の検出にも好適に用いることができる、新しい方式の核酸検出法を開発することを目的とする。
(1) 第1の発明は、検出対象核酸を検出する核酸検出方法に関するものであり、かかる核酸検出方法は、
A)増幅されて検出の指標となる鋳型核酸と、
B)前記検出対象核酸の少なくとも一部と相補的な塩基配列を有する第1のポリヌクレオチド部分と、前記鋳型核酸の一部に相補的な塩基配列を有する第2のポリヌクレオチド部分とを含む核酸検出用プライマーであって、
前記検出対象核酸がRNAである場合には、少なくとも前記第1のポリヌクレオチド部分の5´末端がDNAであり、前記検出対象核酸がDNAである場合には、少なくとも前記第1のポリヌクレオチド部分の5´末端がRNAであり、
前記第1のポリヌクレオチド部分の5´側に前記第2のポリヌクレオチド部分が連結している、
核酸検出用プライマーと、
C)DNA/RNA複合体を分解するヌクレアーゼと、
D)ポリメラーゼと
を少なくとも使用し、
i)前記検出対象核酸を含む被検試料と、前記核酸検出用プライマーとを接触させることにより、前記検出対象核酸と前記核酸検出用プライマーとをハイブリダイズさせて、DNA/RNA複合体を形成し、
ii)前記DNA/RNA複合体の少なくとも一部を前記ヌクレアーゼで分解することにより、前記核酸検出用プライマーから前記第1のポリヌクレオチド部分を除去し、
iii)前記核酸検出用プライマーを前記鋳型核酸にハイブリダイズさせて、前記ポリメラーゼにより前記鋳型核酸を増幅する反応を行う
ことを含むことを特徴とする。
(2) 第1の発明の核酸検出方法においては、前記検出対象核酸が、10~100塩基の短鎖核酸であることが好ましい。
(3) 前記いずれかの核酸検出方法においては、前記核酸検出用プライマーが、前記第2のポリヌクレオチド部分の5´側にさらに、前記鋳型核酸において前記第2のポリヌクレオチド部分と相補的な領域よりも5´側の領域の塩基配列の一部と同一の塩基配列を含む第3のポリヌクレオチド部分を有することができる。
(4) 前記いずれかの核酸検出方法においては、
前記検出対象核酸がRNAであり、前記ヌクレアーゼがDNA/RNA複合体中のDNAを分解するヌクレアーゼであることが好ましい。
(5) 前記いずれかの核酸検出方法においては、
前記核酸検出用プライマーの3´末端に、増幅反応を停止する修飾を有することが好ましい。
(6) 前記いずれかの核酸検出方法においては、前記核酸検出用プライマーが、前記第1のポリヌクレオチド部分の3´側にさらに非自然人工塩基配列を有しかつ前記鋳型核酸ともハイブリダイズしない第4のポリヌクレオチド部分を有することができる。
(7) 前記いずれかの核酸検出方法においては、前記iii)において、LAMP法による核酸増幅又はPCR法による核酸増幅を行うことが好ましい。
(8) 前記いずれかの核酸検出方法においては、前記鋳型核酸が、非自然人工塩基配列を有する鋳型核酸であることが好ましい。
(9) 前記いずれかの核酸検出方法においては、前記鋳型核酸が、前記検出対象核酸の一部と同一である共通塩基配列を有しており、
前記第2のポリヌクレオチド部分における3´側の部分が、前記共通塩基配列と相補的なものとすることができる。
(10) 第2の発明は、検出対象核酸を検出するために用いる核酸検出用プライマーに関し、かかる核酸検出用プライマーは、
前記検出対象核酸の少なくとも一部に相補的な塩基配列を有する第1のポリヌクレオチド部分と、
増幅されて検出の指標となる鋳型核酸の一部に相補的な塩基配列を有する第2のポリヌクレオチド部分と
を含み、
前記検出対象核酸がRNAである場合には、少なくとも前記第1のポリヌクレオチド部分の5´末端がDNAであり、前記検出対象核酸がDNAの場合には、少なくとも前記第1のポリヌクレオチド部分の5´末端がRNAであり、
前記第1のポリヌクレオチド部分の5´側に第2のポリヌクレオチド部分が連結していることを特徴とする。
(11) 第2の発明の核酸検出用プライマーにおいては、前記第1のポリヌクレオチド部分が10~100塩基であることが好ましい。
(12) 前記いずれかの核酸検出用プライマーにおいては、第2のポリヌクレオチド部分の5´側に、さらに、前記鋳型核酸において前記第2のポリヌクレオチド部分と相補的な領域よりも5´側の領域の塩基配列の一部と同一の塩基配列を含む第3のポリヌクレオチド部分を有することができる。
(13) 前記いずれかの核酸検出用プライマーにおいては、前記核酸検出用プライマーの3´末端に、増幅反応を停止する修飾を有することが好ましい。
(14) 前記いずれかの核酸検出用プライマーにおいては、前記第1のポリヌクレオチド部分の3´側に、さらに非自然人工塩基配列を有しかつ前記鋳型核酸ともハイブリダイズしない第4のポリヌクレオチド部分を有することができる。
(15) 前記いずれかの核酸検出用プライマーにおいては、前記第2のポリヌクレオチド部分における3´側の部分を、前記鋳型核酸の一部に相補的であるだけでなく、前記検出対象核酸の一部とも相補的にすることができる。
(16) 第3の発明は、検出対象核酸を検出するために用いる核酸検出用キットに関し、かかる核酸検出用キットは、
A)増幅されて検出の指標となる鋳型核酸と、
B)前記検出対象核酸の少なくとも一部と相補的な塩基配列を有する第1のポリヌクレオチド部分と、前記鋳型核酸の一部に相補的な塩基配列を有する第2のポリヌクレオチド部分とを含む核酸検出用プライマーであって、
前記検出対象核酸がRNAである場合には、少なくとも前記第1のポリヌクレオチド部分の5´末端がDNAであり、前記検出対象核酸がDNAである場合には、少なくとも前記第1のポリヌクレオチド部分の5´末端がRNAであり、
前記第1のポリヌクレオチド部分の5´側に前記第2のポリヌクレオチド部分が連結している、
核酸検出用プライマーと、
C)DNA/RNA複合体を分解するヌクレアーゼと
を含むことを特徴とする。
(17) 第3の発明の核酸検出用キットにおいては、前記第1のポリヌクレオチド部分が10~100塩基であることが好ましい。
(18) 前記いずれかの核酸検出用キットにおいては、前記核酸検出用プライマーが、前記第2のポリヌクレオチド部分の5´側にさらに、前記鋳型核酸において前記第2のポリヌクレオチド部分と相補的な領域よりも5´側の領域の塩基配列の一部と同一の塩基配列を含む第3のポリヌクレオチド部分を有することができる。
(19) 前記いずれかの核酸検出用キットにおいては、前記検出対象核酸がRNAであり、前記ヌクレアーゼがDNA/RNA複合体中のDNAを分解するヌクレアーゼであることが好ましい。
(20) 前記いずれかの核酸検出用キットにおいては、さらに、D)ポリメラーゼを含むことが好ましい。
(21) 前記いずれかの核酸検出用キットにおいては、前記核酸検出用プライマーが、前記第1のポリヌクレオチド部分の3´側にさらに非自然人工塩基配列を有しかつ前記鋳型核酸ともハイブリダイズしない第4のポリヌクレオチド部分を有することができる。
(22) 前記いずれかの核酸検出用キットにおいては、前記鋳型核酸が、前記検出対象核酸の一部と同一である共通塩基配列を有しており、
前記第2のポリヌクレオチド部分における3´側の部分が、前記共通塩基配列と相補的なものとすることができる。
1-1. 本発明の核酸検出方法の概要
本発明の第1の発明の核酸検出方法は、少なくとも次のA)~D)の試薬を使用することを特徴とする。
A)増幅されて検出の指標となる鋳型核酸
B)検出対象核酸の少なくとも一部と相補的な塩基配列を有する第1のポリヌクレオチド部分と、鋳型核酸の一部に相補的な塩基配列を有する第2のポリヌクレオチド部分とを含む核酸検出用プライマーであって、
検出対象核酸がRNAである場合には、少なくとも第1のポリヌクレオチド部分の5´末端がDNAであり、検出対象核酸がDNAである場合には、少なくとも第1のポリヌクレオチド部分の5´末端がRNAであり、
第1のポリヌクレオチド部分の5´側に第2のポリヌクレオチド部分が連結している、
核酸検出用プライマー
C)DNA/RNA複合体を分解するヌクレアーゼ
D)ポリメラーゼ
i)検出対象核酸を含む被検試料と、前記B)の核酸検出用プライマーとを接触させることにより、検出対象核酸と核酸検出用プライマーとをハイブリダイズさせて、DNA/RNA複合体を形成し、
ii)DNA/RNA複合体の少なくとも一部を、前記C)のヌクレアーゼで分解することにより、核酸検出用プライマーから第1のポリヌクレオチド部分を除去し、
iii)前記核酸検出用プライマーを、前記A)の鋳型核酸にハイブリダイズさせて、前記D)のポリメラーゼにより鋳型核酸を増幅する反応を行う。
図1は、本発明の核酸検出方法の一例である第1の実施形態を模式的に示す図面である。
図1(A)は、検出対象核酸を含む被検試料と反応溶液とを混合した状態を示し、混合された反応溶液中には、検出対象核酸1と、鋳型核酸2と、核酸検出用プライマー3と、ヌクレアーゼ4と、ポリメラーゼ5とが存在している。
鋳型核酸2と、ヌクレアーゼ4と、ポリメラーゼ5については、図1に示される第1の実施形態のように最初から混合しておいてもよいが、反応段階に応じて後から添加してもよい。
検出対象核酸1は、RNA又はDNAであり、検出対象核酸1がRNAである場合には、第1のポリヌクレオチド部分301はDNAとなるように設計し、検出対象核酸1がDNAである場合には、第1のポリヌクレオチド部分302はRNAとなるように設計する。
図1(B)に示されるように、核酸検出用プライマー3の第1のポリヌクレオチド部分301は、検出対象核酸1の少なくとも一部と相補的な塩基配列を有するので、第1のポリヌクレオチド部分301と検出対象核酸1とがハイブリダイズし、DNA/RNA複合体を形成する。
図1(C)に示されるように、DNA/RNA複合体が形成されると、ヌクレアーゼ4がこれを認識して結合する。
検出対象核酸1がRNAである場合には、第1のポリヌクレオチド部分がDNAとなるため、ヌクレアーゼ4として、DNA/RNA複合体中のDNAを分解するデオキシリボヌクレアーゼ(DNase)を用い、これにより第1のポリヌクレオチド部分301のDNAを分解する。また、検出対象核酸1がDNAである場合には、第1のポリヌクレオチド部分がRNAとなるため、ヌクレアーゼ4として、DNA/RNA複合体中のRNAを分解するリボヌクレアーゼ(RNase)を用い、これにより第1のポリヌクレオチド部分301のRNAを分解する。
第1の実施形態では、ヌクレアーゼ4としてエンドヌクレアーゼを使用しており、第1のポリヌクレオチド部分301と第2のポリヌクレオチド部分302との連結部分から分解が開始され、これにより、第1のポリヌクレオチド部分301と第2のポリヌクレオチド部分302とが切り離される。このように、ヌクレアーゼ4によって、核酸検出用プライマー3から第1のポリヌクレオチド部分301が除去されて、核酸検出用プライマー3が活性化する。
本発明において、ヌクレアーゼとしてエキソヌクレアーゼを用いる場合には、3´末端から核酸を分解するエキソヌクレアーゼを用いることが好ましく、これにより、第1のポリヌクレオチド部分が3´末端から分解され、第1のポリヌクレオチド部分が完全に分解されることにより、核酸検出用プライマーが活性化する。
第1のポリヌクレオチドを速く確実に除去するためには、ヌクレアーゼとしてエンドヌクレアーゼを用いることが好ましい。
核酸検出用プライマー3は、第1のポリヌクレオチド部分301が除去されているため、鋳型核酸2を増幅するためのプライマーとして活性化されている。すなわち、図1(D)に示すように、核酸検出用プライマー3が鋳型核酸2にハイブリダイズした場合に、核酸検出用プライマー3の3´末端側の塩基が鋳型核酸2と塩基対を形成するため、図1(E)に示すように、ポリメラーゼ5による増幅反応が可能となる。
一方、本発明の核酸検出方法において、検出対象核酸が存在しない場合には、第1のポリヌクレオチド部分が核酸検出用プライマーから除去されず、核酸検出用プライマーが鋳型核酸にハイブリダイズしても、核酸検出用プライマーの3´末端側の塩基が鋳型核酸と塩基対を形成しないため、鋳型核酸の増幅反応を正常に行うことができない。
したがって、本発明の核酸検出方法によれば、検出対象核酸が存在する場合にのみ鋳型核酸の正常な増幅反応が生じることとなる。
LAMP法では、プライマーとして、鋳型核酸上の6つの領域の塩基配列に基づいて設計される、少なくとも4種類のプライマーが使用され、それぞれのプライマーは、インナープライマーF(FIP)、インナープライマーB(BIP)、アウタープライマーF(F3)、アウタープライマーB(B3)と呼ばれる。この他に、ループプライマーF(LF)とループプライマーB(LB)を用いることもできる。
本発明の核酸検出用プライマーをインナープライマーとして設計する場合には、核酸検出用プライマーの第2のポリヌクレオチド部分の5´側に第3のポリヌクレオチド部分を設ける。第3のポリヌクレオチド部分の塩基配列は、鋳型核酸において第2のポリヌクレオチド部分と相補的な領域よりも5´側の領域の塩基配列の一部と同一の塩基配列を含むように設計する。
一方、本発明の核酸検出用プライマーをアウタープライマーとしても設計する場合には、第3のポリヌクレオチド部分を設ける必要はない。
また、本発明の核酸検出方法は、核酸増幅を利用した方法でありながら、検出対象核酸を直接増幅することがないため、直接増幅することが難しい10~100塩基の短鎖核酸であっても好適に検出することができるという効果を奏する。
本発明において、検出の対象となる「検出対象核酸」は、DNA(デオキシリボ核酸)又はRNA(リボ核酸)であるが、DNA/RNA複合体を形成することができ、ヌクレアーゼで分解可能なものであれば、一部に人工核酸を有しているDNA又はRNAや、他の物質と結合したDNA又はRNAであってもよい。
臨床診断の目的のためには、生体内に存在する天然のDNA又はRNAを人工的に抽出したものを「検出対象核酸」とすることが好ましい。
生体内に存在する天然のDNA又はRNAとしては、これらに限定されるわけではないが、例えば、ゲノムDNA、ミトコンドリアDNA(mtDNA)、メッセンジャーRNA(mRNA)、トランスファーRNA(tRNA)、リボソームRNA(rRNA)、核内低分子RNA(small nuclear RNA:snRNA)、核小体低分子RNA(small nucleolar RNA:snoRNA)、microRNA(miRNA)、small interfering RNA(siRNA)等が存在する。
また、本発明の核酸検出方法は、核酸増幅を利用した方法でありながら、検出対象核酸を直接増幅することがないため、直接増幅することが難しい10~100塩基の短鎖核酸であっても好適に検出することができる。
検出対象核酸は、より好ましくは、20~50塩基とするのがよく、miRNAについても好適に検出することが可能である。
本発明において、人工核酸としては、例えば、糖とリン酸からなるヌクレオチド骨格を修飾した人工核酸、塩基部分を修飾した人工核酸を用いることができる。ヌクレオチド骨格を修飾した人工核酸としては、これらに限定されるわけではないが、例えば、ペプチド鎖を骨格としたペプチド核酸(Peptide Nucleic Acid: PNA)、糖に架橋構造を持たせたロックト核酸(Locked Nucleic Acid: LNA)、ホスホジエステル結合で連結したグリコールを骨格とするグリコール核酸(Glycol Nucleic Acid: GNA)等を挙げることができる。また、塩基部分を修飾した人工核酸としては、これらに限定されるわけではないが、例えば、塩基として、2-アミノ-6-ジメチルアミノプリン、ピリドン-2-オン、2-アミノ-6-(2-チエニル)プリン、ピロロピリジン、メチルイソカルボステリル、アザアデニン、アザグアニン等を用いた人工核酸が挙げられる。
より好ましくは、「鋳型核酸」として、非自然人工塩基配列を有する鋳型核酸を使用するのがよい。ここで、「非自然人工塩基配列」とは、生物由来の核酸の塩基配列ではなく人工的に作成された塩基配列をいい、遺伝子データベースに登録された生物由来の核酸の塩基配列のいずれに対しても相同性が低いものが好ましい。非自然人工塩基配列を用いることにより、鋳型核酸が核酸検出用プライマーの第1のポリヌクレオチド部分とハイブリダイズしてしまうことや、鋳型核酸が被検試料中に存在する生体由来の核酸とハイブリダイズしてしまうことを防止することができ、さらに、コンタミネーションリスクを低減することができる。
ここで、第1のポリヌクレオチド部分は、検出対象核酸の全ての塩基配列と相補的な塩基配列を有するものであってもよく、また、検出対象核酸の一部のみと相補的な塩基配列を有するものであってもよい。
第3のポリヌクレオチド部分は、特定の機能を持たせることもできる。例えば、これらに限定されるわけではないが、鋳型核酸において第2のポリヌクレオチド部分と相補的な領域よりも5´側の領域の塩基配列の一部と同一の塩基配列を含むように、第3のポリヌクレオチド部分を設計することにより、核酸検出用プライマーをLAMP法のインナープライマーとして使用することが可能となる。
また、第4のポリヌクレオチド部分についても、特定の機能を持たせることができる。例えば、これらに限定されるわけではないが、第4のポリヌクレオチド部分が非自然人工塩基配列を有しかつ鋳型核酸ともハイブリダイズしないように設計することにより、第1のポリヌクレオチド部分が被検試料中の検出対象核酸以外の核酸等とハイブリダイズしてしまった場合や、検出対象核酸が鋳型核酸と相同性が高く、第1のポリヌクレオチド部分が鋳型核酸にハイブリダイズしてしまった場合でも、第4のポリヌクレオチド部分が被検試料中の核酸や鋳型核酸とハイブリダイズしないため、意図しない増幅反応を防止することができる。
図2(A)は、検出対象核酸を含む被検試料と反応溶液とを混合した状態を示しているが、核酸検出用プライマー3は、第1のポリヌクレオチド部分301と第2のポリヌクレオチド部分302の他に、第3のポリヌクレオチド部分303と第4のポリヌクレオチド部分304を含んでいる。そして、第1のポリヌクレオチド部分301は、検出対象核酸1の一部のみと相補的な塩基配列を有している。
図2(C)は、DNA/RNA複合体がヌクレアーゼによって分解される状態を示すが、第1のポリヌクレオチド部分301と第2のポリヌクレオチド部分302との連結部分から分解が開始され、これにより、第1のポリヌクレオチド部分301と第2のポリヌクレオチド部分302とが切り離される。
このように、第1のポリヌクレオチド部分301が、検出対象核酸1の一部のみと相補的な塩基配列を有している場合でも、核酸検出用プライマー3から第1のポリヌクレオチド部分301を除去して、核酸検出用プライマー3を活性化することができる。
核酸検出用プライマー3は、第3のポリヌクレオチド部分303を有しているが、その塩基配列は、第2のポリヌクレオチド部分302がハイブリダイズする鋳型核酸2の領域の5´側の領域の塩基配列の一部と同一である。これにより、核酸検出用プライマー3を、LAMP法のインナープライマーとして使用することができ、さらに、もう一方のインナープライマーと、2つのアウタープライマーを設計し、ポリメラーゼ5を用いて、鋳型核酸2をLAMP法により等温増幅することが可能となる。
第1のポリヌクレオチド部分は、検出対象核酸の少なくとも一部と相補的な塩基配列となるものであれば、その塩基長や配列は特に限定されないが、ハイブリダイズに適したTm値となるように塩基長と配列を設計することが好ましい。第1のポリヌクレオチド部分の塩基長は、通常、5~5000塩基であり、より好ましくは10~100塩基であり、さらに好ましくは20~50塩基である。
第1のポリヌクレオチド部分は、検出対象核酸と相補的であるのと同時に鋳型核酸とも相補的な部分を有していてもよい。また、第2のポリヌクレオチド部分は、鋳型核酸と相補的であるのと同時に検出対象核酸とも相補的な部分を有していてもよい。
検出対象核酸がDNAである場合には、少なくとも第1のポリヌクレオチド部分の5´末端をRNAとする。この場合、第1のポリヌクレオチド部分の全体をRNAとすることもできるが、第1のポリヌクレオチド部分の5´末端のみをRNAとすることもできる。
検出対象核酸と核酸検出用プライマーとがハイブリダイズした場合に、DNA/RNA複合体が形成されるように核酸検出用プライマーを設計し、DNA/RNA複合体の少なくとも一部においてヌクレアーゼによる分解を行うことにより、核酸検出用プライマーを活性化することが可能となる。
図3(A)は、検出対象核酸を含む被検試料と反応溶液とを混合した状態を示しているが、試薬の1つである核酸検出用プライマー3は、第1のポリヌクレオチド部分301と、第2のポリヌクレオチド部分302を有している。第3の実施形態においては、検出対象核酸1は全長がDNAとなっている。そして、核酸検出用プライマー3の第1のポリヌクレオチド部分301は、検出対象核酸1の一部と相補的な塩基配列を有しているが、5´末端がRNAとなっており、それ以外の部分がDNAとなっている。
第3の実施形態において、第2のポリヌクレオチド部分302は、鋳型核酸2の一部に相補的な塩基配列を有するDNAからなるが、3´側の部分302aと5´側の部分302bとに分けて設計されている。そして、3´側の部分302aは、鋳型核酸2の一部に相補的であるだけでなく、検出対象核酸1の一部に対しても相補的であるように設計されている。鋳型核酸2には、検出対象核酸1の一部と同一の塩基配列(共通塩基配列)201aが挿入されており、これにより302aが鋳型核酸2の一部に相補的であるだけでなく、検出対象核酸1の一部に対しても相補的であるように設計することが可能となる。
図3(B)に示されるように、第1のポリヌクレオチド部分301と、第2のポリヌクレオチド部分の3´側の部分302aは、検出対象核酸1とハイブリダイズする。ここで、第1のポリヌクレオチド部分301の5´末端のみがRNAとなっているので、この部分においてDNA/RNA複合体が形成される。
図3(C)に示されるように、DNA/RNA複合体が形成されると、ヌクレアーゼ4がこれを認識して結合し、DNA/RNA複合体中のRNAを分解する。第3の実施形態においては、ヌクレアーゼとしてRNase Hを使用しており、DNA/RNA複合体が1塩基対だけである場合でも、これを認識して分解することができる。1塩基のみの分解ではあるものの、第1のポリヌクレオチド部分301と第2のポリヌクレオチド部分302との境界が切断されることとなる。
第3の実施形態においては、図3(C)に示されるように、第1のポリヌクレオチド部分301と第2のポリヌクレオチド部分302との境界が切断されているものの、第2のポリヌクレオチド部分の3´側の部分302aが検出対象核酸1とハイブリダイズしているため、そのままでは第1のポリヌクレオチド部分301は核酸検出用プライマー3から切り離されていない状態にある。しかしながら、塩基対の形成と分離は動的平衡状態にあるため、図3(D)に示されるように、核酸検出用プライマー3から第1のポリヌクレオチド部分301は分離することが可能である。あるいは、反応溶液を加熱することによって、第1のポリヌクレオチド部分の分離を促進することもできる。
図3(E)に示されるように、第1のポリヌクレオチド部分301が除去されて活性化した核酸検出用プライマー3は、鋳型核酸2にハイブリダイズする。第2のポリヌクレオチド部分の3´側の部分302aは、検出対象核酸1の一部と相補的であるが、同時に鋳型核酸2の共通塩基配列201aとも相補的であるように設計されているため、核酸検出用プライマー3の3´末端の塩基が鋳型核酸2と塩基対を形成する。このため、図3(F)に示すように、ポリメラーゼ5による増幅反応が可能となる。
第2のポリヌクレオチド部分は、鋳型核酸の一部と相補的な塩基配列となるものであれば、その塩基長や配列は特に限定されないが、ハイブリダイズに適したTm値となるように塩基長と配列を設計することが好ましい。
第2のポリヌクレオチド部分は、第3の実施形態の例のように、3´側の部分が、鋳型核酸と相補的であるのと同時に、検出対象核酸とも相補的であるものとすることもできる。
増幅反応を停止する修飾としては、これらに限定されるわけではないが、例えば、ポリヌクレオチドの末端のリボースの3´位のOH基を、リン酸基等の他の物質に置換する修飾を行うことにより、ポリメラーゼによる伸長反応を停止させることができる。
あるいは、前記のとおり、第1のポリヌクレオチド部分の3´末端に第4のポリヌクレオチド部分を連結し、第4のポリヌクレオチド部分が非自然人工塩基配列を有しかつ鋳型核酸ともハイブリダイズしないように設計することにより、第1のポリヌクレオチド部分が被検試料中の検出対象核酸以外の核酸等とハイブリダイズしてしまった場合や、第1のポリヌクレオチド部分が鋳型核酸にハイブリダイズしてしまった場合でも、第4のポリヌクレオチド部分が被検試料中の核酸や鋳型核酸とハイブリダイズしないので、意図しない核酸増幅反応を生じてしまうことを防ぐことができる。
本発明で使用するヌクレアーゼは、核酸配列の内部で核酸を分解するエンドヌクレアーゼを用いることができ、また、核酸配列において外側から核酸を分解するエキソヌクレアーゼを用いることもできる。
第1のポリヌクレオチドを速く確実に除去するためには、ヌクレアーゼとしてエンドヌクレアーゼを用いることが好ましい。また、エキソヌクレアーゼを用いる場合には、3´末端から核酸を分解するエキソヌクレアーゼを用いることが好ましい。
図4(A)は、検出対象核酸を含む被検試料と反応溶液とを混合した状態を示す。図4(A)において、試薬の1つである核酸検出用プライマー3は、第1のポリヌクレオチド部分301と、第2のポリヌクレオチド部分302と、第3のポリヌクレオチド部分303と、第4のポリヌクレオチド部分304とを有している。第4の実施形態においては、検出対象核酸1は全長がRNAである。そして、核酸検出用プライマー3の第1のポリヌクレオチド部分301は、検出対象核酸1の少なくとも一部と相補的な塩基配列を有している。
第4の実施形態において、第2のポリヌクレオチド部分302は、鋳型核酸2の一部に相補的な塩基配列を有するDNAからなるが、3´側の部分302aと5´側の部分302bとに分けて設計されている。そして、3´側の部分302aは、鋳型核酸2の一部に相補的であるだけでなく、検出対象核酸1の一部に対しても相補的であるように設計されている。NmeCas9を用いる場合には、このような302aの部分を、1塩基以上設ける必要があり、より好ましくは、2~20塩基設ける。鋳型核酸2には、検出対象核酸1の一部と同一の塩基配列(共通塩基配列)201aが挿入されており、これにより302aが鋳型核酸2の一部に相補的であるだけでなく、検出対象核酸1の一部に対しても相補的であるように設計することが可能となる。
図4(B)に示されるように、第1のポリヌクレオチド部分301と、第2のポリヌクレオチド部分の3´側の部分302aは、連続的に検出対象核酸1とハイブリダイズすることにより、DNA/RNA複合体を形成する。
図4(C)に示されるように、DNA/RNA複合体が形成されると、ヌクレアーゼ4(NmeCas9)がこれを認識して結合し、DNA/RNA複合体中のDNA鎖の5´末端から2~5塩基の距離にあるDNA鎖を切断する。切断する箇所は、tracrRNAを加えること等により若干シフトさせることが可能である。ヌクレアーゼ4によって切断する箇所は、第2のポリヌクレオチド部分にあるが、第1のポリヌクレオチド部分と第2のポリヌクレオチド部分の境界であってもよい。
第4の実施形態においては、図4(C)に示されるように、核酸検出用プライマー3が切断されているものの、第2のポリヌクレオチド部分の3´側の部分302aの一部が検出対象核酸1とハイブリダイズしているため、そのままでは第1のポリヌクレオチド部分301は核酸検出用プライマー3から切り離されていない状態にある。しかしながら、塩基対の形成と分離は動的平衡状態にあるため、図4(D)に示されるように、核酸検出用プライマー3から第1のポリヌクレオチド部分301は分離することが可能である。あるいは、反応溶液を加熱することによって、第1のポリヌクレオチド部分の分離を促進することもできる。
図4(E)に示されるように、第1のポリヌクレオチド部分301が除去されて活性化した核酸検出用プライマー3は、鋳型核酸2にハイブリダイズする。第2のポリヌクレオチド部分の3´側の部分302aは、検出対象核酸1の一部と相補的であるが、同時に鋳型核酸2の共通塩基配列201aとも相補的であるように設計されているため、核酸検出用プライマー3の3´末端の塩基が鋳型核酸2と塩基対を形成する。このため、図4(F)に示すように、ポリメラーゼ5による増幅反応が可能となる。
ここで、「ハイブリダイズ」とは、検出対象核酸の塩基と第1のポリヌクレオチド部分の塩基とが水素結合により結合し、検出対象核酸と第1のポリヌクレオチド部分とが複合体を形成することである。
検出対象核酸がRNAである場合には、少なくとも第1のポリヌクレオチド部分の5´末端がDNAであり、検出対象核酸がDNAである場合には、少なくとも第1のポリヌクレオチド部分の5´末端がRNAであるため、検出対象核酸と第1のポリヌクレオチド部分がハイブリダイズすると、少なくとも第1のポリヌクレオチド部分の5´末端において、DNA/RNA複合体が形成される。
そのような反応条件は、検出対象核酸の塩基配列と第1のポリヌクレオチド部分の塩基配列を考慮した上で、温度、塩濃度、pH、添加する有機溶媒等の条件を設定することができる。
ここで、「DNA/RNA複合体の少なくとも一部」とは、その部分がヌクレアーゼで分解されることにより、核酸検出用プライマーから第1のポリヌクレオチド部分が除去できる部分であればよい。例えば、エンドヌクレアーゼを用いて第1のポリヌクレオチド部分を分解する場合には、少なくとも第1のポリヌクレオチド部分の5´末端におけるDNA/RNA複合体が分解されればよい。
また、「分解」とは、少なくともヌクレオチド骨格の少なくとも一部の共有結合が分解されることにより、ヌクレオチド骨格が切断される分解であればよい。
ここで、鋳型核酸を増幅する反応は、プライマーを必要とする核酸増幅法であれば特に限定されず、これらに限定されるわけではないが、例えば、PCR法、LAMP法、SDA法等を用いて行うことができる。
PCR法のアニーリングにおいては、本発明の核酸検出用プライマーの第2のポリヌクレオチド部分の塩基配列やもう一方のプライマーの塩基配列に基づいて、Tm(融解温度)を算出し、アニーリングの温度はTmよりも低い温度に設定することが好ましい。
また、伸長反応は、通常67~77℃程度で行い、熱変成は、通常90~98℃程度で行う。
アニーリング、伸長反応、及び熱変成は、それぞれ異なる温度で行うため、これらの温度の移行を速やかに行うための機器として、通常、サーマルサイクラーを用いる。
PCR法には、通常、耐熱性DNAポリメラーゼを用い、その場合には、4種類の基質(dATP、dGTP、dCTP、dTTP)と2価のマグネシウムイオンを含み、至適pHを保つ緩衝液となる反応バッファーを用いる。
LAMP法では、インナープライマーのペア(FIPとBIP)と、アウタープライマーのペア(F3とB3)を使用し、この他に、ループプライマーのペア(LFとLB)を用いることができる。
LAMP法の核酸増幅反応の概要を図8及び9に模式的に示す。
インナープライマー(BIP)は、図8の(6)に示されるように、鋳型核酸のもう一方の鎖に存在する任意配列B1cとその3´側に存在する任意配列B2cを選択したとき、B2cに相補的な配列B2とB1cと同一な配列B1cとを3´から5´に向けてこの順に有するプライマーである。
本発明の核酸検出方法において、核酸検出用プライマーをLAMP法のインナープライマーとする場合には、第2のポリヌクレオチド部分がF2又はB2となるように設計するとともに、さらに第3のポリヌクレオチド部分としてF1c又はB1cを有するように設計する。
図8の(3)に示されるように、インナープライマー(FIP)の外側にアウタープライマー(F3)がアニールする。次に、アウタープライマー(F3)を起点として、鎖置換型ポリメラーゼによって鋳型核酸と相補的な核酸が合成され、先にインナープライマー(FIP)を起点として合成されている核酸を剥がしながら核酸が合成されていく。これにより、図8の(4)に示されるように、アウタープライマー(F3)を起点として合成された二本鎖核酸が生成する。
図8の(6)に示されるように、ループを形成した核酸に対しては、インナープライマー(BIP)がアニールし、これを起点として相補的な核酸の合成が行われる。この過程で、ループは剥がされて伸びた状態となる。さらに、インナープライマー(BIP)の外側にアウタープライマー(B3)がアニールし、これを起点として鎖置換型ポリメラーゼによって相補的な核酸が合成され、先にインナープライマー(BIP)を起点として合成されている核酸を剥がしながら核酸が伸長いく。これにより、図8の(7)に示されるように、アウタープライマー(B3)を起点として合成された二本鎖核酸が生成する。
まず、図9の(8)に示されるように、ダンベル型の核酸の3´末端のF1を起点として自己を鋳型とした核酸合成が行われ、これにより、5´末端のループが剥がされて伸びる。さらに、3´末端側にあるループのF2cは一本鎖であるため、インナープライマー(FIP)又はループプライマーがアニールすることができ、FIPのF2を起点とした核酸合成が行われ、先にF1を起点として合成された核酸を剥がしながら核酸が伸長していく。
上記の過程によって、FIPを起点として合成された核酸は剥がされて一本鎖となるが、図9の(11)に示されるように、その両端に相補的な領域を有するため、両末端においてループを形成しダンベル型の核酸となる。
このような核酸合成のサイクルを繰り返す中で、(10)のような核酸が次々と合成されていく。
LAMP法では、以上のような増幅反応により、核酸が指数関数的に増幅される。
LAMP法の反応温度は、通常50~70℃、好ましくは55~70℃である。また、反応時間は、通常1分~10時間、好ましくは5分~4時間である。
鋳型核酸の増幅を確認する方法は、これらに限定されるわけではないが、例えば、増幅された核酸をインターカレーターと反応させて染色することにより光学的に検出することができ、また、プライマーを蛍光色素で予め標識しておいて、増幅された核酸に蛍光色素を取り込ませることにより光学的に検出することができる。また、増幅された核酸を確認するにあたっては、電気泳動により分子量の大きな増幅核酸を分離してもよく、また、蛍光色素によるFRET(蛍光共鳴エネルギー移動)を利用して増幅核酸の検出を行ってもよい。
インターカレーターとしては、これらに限定されるわけではないが、例えば、エチジウムブロマイド、SYBR Green(登録商標)、Pico Green(登録商標)のような二本鎖核酸に特異的に結合するインターカレーターを用いることができる。
本発明の第2の発明の核酸検出用プライマーは、目的とする核酸の検出に用いる試薬であり、前記1.に記載した核酸検出用プライマーを用いることができる。
核酸検出用プライマーは、バッファー溶液に溶解された状態で製品としてもよく、また、乾燥された状態で製品としてもよい。
バッファー溶液については、核酸検出用プライマーを安定に溶解することができる組成となっていれば、どのような溶液であってもよい。例えば、これらに限定されるわけではないが、トリス塩酸を溶解したバッファーや、トリス塩酸とEDTAを溶解したTEバッファー等を用いることができる。
本発明の第3の発明の核酸検出用キットは、少なくとも、
A)増幅されて検出の指標となる鋳型核酸と、
B)検出対象核酸の少なくとも一部と相補的な塩基配列を有する第1のポリヌクレオチド部分と、鋳型核酸の一部に相補的な塩基配列を有する第2のポリヌクレオチド部分とを含む核酸検出用プライマーであって、
検出対象核酸がRNAである場合には、少なくとも第1のポリヌクレオチド部分の5´末端がDNAであり、検出対象核酸がDNAである場合には、少なくとも第1のポリヌクレオチド部分の5´末端がRNAであり、
第1のポリヌクレオチド部分の5´側に第2のポリヌクレオチド部分が連結している、
核酸検出用プライマーと、
C)DNA/RNA複合体を分解するヌクレアーゼと
を試薬として含むことを特徴とする。
本発明の核酸検出用キットは、市販のポリメラーゼと組み合わせて使用することができるが、本発明の核酸検出用キット自体にさらに
D)ポリメラーゼ
を試薬として含むことが好ましい。
これらのA)~D)の試薬については、前記1.及び2.に記載した試薬と同一のものを用いることができる。
i)検出対象核酸を含む被検試料と、核酸検出用プライマーとを接触させることにより、検出対象核酸と核酸検出用プライマーとをハイブリダイズさせて、DNA/RNA複合体を形成し、
ii)DNA/RNA複合体の少なくとも一部をヌクレアーゼで分解することにより、核酸検出用プライマーから第1のポリヌクレオチド部分を除去し、
iii)核酸検出用プライマーを鋳型核酸にハイブリダイズさせて、鋳型核酸を増幅する反応を行う
ことを記載した説明書を含ませることができる。
本発明の核酸検出法を用いて短鎖DNAの検出を行った。
検出対象核酸として、MIR21遺伝子によってコードされる塩基配列を有するDNA(miR-21)を用い、鋳型核酸として、ARITA人工遺伝子を用いた。
核酸検出用プライマーとして、miR-21の一部に相補的な塩基配列を有するRNAを第1のポリヌクレオチド部分とし、ARITA人工遺伝子の一部に相補的な塩基配列を有するDNAを第2のポリヌクレオチド部分とし、さらにLAMP法のインナープライマーとするための第3のポリヌクレオチド部分を有するART7-BIP-Rを設計した。
また、ART7-BIP-Rにおいて、第1のポリヌクレオチド部分をDNA配列に置換したART7-BIP-Dを、対照とするプライマーとして設計した。
さらに、ART7-BIP-Rにおいて、第1のポリヌクレオチド部分が除去されているART7-BIPを、対照とするプライマーとして設計した。
さらに、LAMP法におけるもう一つのインナープライマーとしてART7-FIPを設計し、アウタープライマーとしてART7-F3及びART7-B3を設計し、ループプライマーとしてART7-LF及びART7-LBを設計した。
ヌクレアーゼとしては、RNase(Hybridase(登録商標) Thermostable RNase H、epicentre社製)を用い、ポリメラーゼとしては、Bst-LF(Bst DNA Polymerase, Large Fragment、New England Biolabs社製)を用いた。
短鎖DNAの検出の実験に用いた各プライマーの配列等を図5に示す。
図5において、miR-21と、ART7-BIP-D及びART7-BIP-Rとで相補的な配列となっている部分を下線で示す。
まず、200pmolのART7-BIP、ART7-BIP-D、及びART7-BIP-Rを、それぞれ50pmolのmiR-21と混合し、熱安定性RNase Hで処理した後、その他のLAMP法用プライマー(ART7-F3、ART7-B3、ART7-FIP、ART7-LF、及びART7-LB)とARITA人工遺伝子を加えて、LAMP法による核酸増幅反応を行った。また、対照として、miR-21ではなくDW(Distilled Water)を用いて、ART7-BIP、ART7-BIP-D、及びART7-BIP-Rと、それぞれ混合し、それらを熱安定性RNase Hで処理した後、その他のLAMP法用プライマーとARITA人工遺伝子を加えて、LAMP法による核酸増幅反応を行った。
熱安定性RNase H処理においては、KClやMgSO4を含む反応液を用いて、40℃において30分間酵素処理した。酵素反応後、95℃で10分間酵素失活処理を行った。
LAMP法の核酸増幅反応は、KCl、MgSO4、dNTPs及びBst-LFを含む反応液を用いて、65℃において60分間行った。
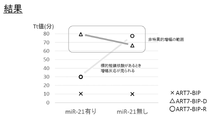
図7に示されるように、本発明の核酸検出用プライマーであるART7-BIP-Rを使用した場合には、検出対象核酸であるmiR-21が存在するときに、正常な核酸増幅反応が生じて、短時間で増幅が確認でき、miR-21が存在しない場合には、増幅時間が遅く、特異的な増幅は確認されなかった。
通常のインナープライマーであるART7-BIPを用いた場合には、miR-21の有無に関わらず、正常な核酸増幅反応が生じて、短時間で増幅が確認できた。
また、第1のポリヌクレオチド部分としてRNAではなくDNAを有するART-BIP-Dを用いた場合には、miR-21の有無に関わらず増幅時間が遅く、特異的な増幅は確認されなかった。
2 鋳型核酸
201a 共通塩基配列
3 核酸検出用プライマー
301 第1のポリヌクレオチド部分
302 第2のポリヌクレオチド部分
302a 第2のポリヌクレオチド部分の3´側の部分
302b 第2のポリヌクレオチド部分の5´側の部分
303 第3のポリヌクレオチド部分
304 第4のポリヌクレオチド部分
4 ヌクレアーゼ
5 ポリメラーゼ
Claims (19)
- 検出対象核酸を検出する核酸検出方法において、
A)増幅されて検出の指標となる鋳型核酸と、
B)前記検出対象核酸の少なくとも一部と相補的な塩基配列を有する第1のポリヌクレオチド部分と、前記鋳型核酸の一部に相補的な塩基配列を有する第2のポリヌクレオチド部分と、前記鋳型核酸において前記第2のポリヌクレオチド部分と相補的な領域よりも5´側の領域の塩基配列の一部と同一の塩基配列を含む第3のポリヌクレオチド部分とを含む核酸検出用プライマーであって、
前記検出対象核酸がRNAである場合には、少なくとも前記第1のポリヌクレオチド部分の5´末端がDNAであり、前記検出対象核酸がDNAである場合には、少なくとも前記第1のポリヌクレオチド部分の5´末端がRNAであり、
前記第1のポリヌクレオチド部分の5´側に前記第2のポリヌクレオチド部分が連結し、前記第2のポリヌクレオチド部分の5´側に前記第3のポリヌクレオチド部分が連結している、
核酸検出用プライマーと、
C)DNA/RNA複合体を分解するヌクレアーゼと、
D)ポリメラーゼと
を少なくとも使用し、
i)前記検出対象核酸を含む被検試料と、前記核酸検出用プライマーとを接触させることにより、前記検出対象核酸と前記核酸検出用プライマーとをハイブリダイズさせて、DNA/RNA複合体を形成し、
ii)前記DNA/RNA複合体の少なくとも一部を前記ヌクレアーゼで分解することにより、前記核酸検出用プライマーから前記第1のポリヌクレオチド部分を除去し、
iii)前記核酸検出用プライマーを前記鋳型核酸にハイブリダイズさせて、前記ポリメラーゼにより前記鋳型核酸を増幅する反応を行う
ことを含む核酸検出方法。 - 前記検出対象核酸が、10~100塩基の短鎖核酸である、請求項1に記載の核酸検出方法。
- 前記検出対象核酸がRNAであり、前記ヌクレアーゼがDNA/RNA複合体中のDNAを分解するヌクレアーゼである、請求項1又は2に記載の核酸検出方法。
- 前記核酸検出用プライマーの3´末端に、増幅反応を停止する修飾を有する、請求項1~3のいずれか1項に記載の核酸検出方法。
- 前記核酸検出用プライマーが、前記第1のポリヌクレオチド部分の3´側にさらに非自然人工塩基配列を有しかつ前記鋳型核酸ともハイブリダイズしない第4のポリヌクレオチド部分を有している、請求項1~4のいずれか1項に記載の核酸検出方法。
- 前記iii)において、LAMP法による核酸増幅又はPCR法による核酸増幅を行う、請求項1~5のいずれか1項に記載の核酸検出方法。
- 前記鋳型核酸が、非自然人工塩基配列を有する鋳型核酸である、請求項1~6のいずれか1項に記載の核酸検出方法。
- 前記鋳型核酸が、前記検出対象核酸の一部と同一である共通塩基配列を有しており、
前記第2のポリヌクレオチド部分における3´側の部分が、前記共通塩基配列と相補的である、請求項1~7のいずれか1項に記載の核酸検出方法。 - 検出対象核酸を検出するために用いる核酸検出用プライマーにおいて、
前記検出対象核酸の少なくとも一部に相補的な塩基配列を有する第1のポリヌクレオチド部分と、
増幅されて検出の指標となる鋳型核酸の一部に相補的な塩基配列を有する第2のポリヌクレオチド部分と、
前記鋳型核酸において前記第2のポリヌクレオチド部分と相補的な領域よりも5´側の領域の塩基配列の一部と同一の塩基配列を含む第3のポリヌクレオチド部分と
を含み、
前記検出対象核酸がRNAである場合には、少なくとも前記第1のポリヌクレオチド部分の5´末端がDNAであり、前記検出対象核酸がDNAの場合には、少なくとも前記第1のポリヌクレオチド部分の5´末端がRNAであり、
前記第1のポリヌクレオチド部分の5´側に第2のポリヌクレオチド部分が連結し、前記第2のポリヌクレオチド部分の5´側に前記第3のポリヌクレオチド部分が連結している
ことを特徴とする核酸検出用プライマー。 - 前記第1のポリヌクレオチド部分が10~100塩基である、請求項9に記載の核酸検出用プライマー。
- 前記核酸検出用プライマーの3´末端に、増幅反応を停止する修飾を有する、請求項9又は10に記載の核酸検出用プライマー。
- 前記第1のポリヌクレオチド部分の3´側に、さらに非自然人工塩基配列を有しかつ前記鋳型核酸ともハイブリダイズしない第4のポリヌクレオチド部分を有している、請求項9~11のいずれか1項に記載の核酸検出用プライマー。
- 前記第2のポリヌクレオチド部分における3´側の部分が、前記鋳型核酸の一部に相補的であるだけでなく、前記検出対象核酸の一部とも相補的である、請求項9~12のいずれか1項に記載の核酸検出用プライマー。
- 検出対象核酸を検出するために用いる核酸検出用キットにおいて、
A)増幅されて検出の指標となる鋳型核酸と、
B)前記検出対象核酸の少なくとも一部と相補的な塩基配列を有する第1のポリヌクレオチド部分と、前記鋳型核酸の一部に相補的な塩基配列を有する第2のポリヌクレオチド部分と、前記鋳型核酸において前記第2のポリヌクレオチド部分と相補的な領域よりも5´側の領域の塩基配列の一部と同一の塩基配列を含む第3のポリヌクレオチド部分とを含む核酸検出用プライマーであって、
前記検出対象核酸がRNAである場合には、少なくとも前記第1のポリヌクレオチド部分の5´末端がDNAであり、前記検出対象核酸がDNAである場合には、少なくとも前記第1のポリヌクレオチド部分の5´末端がRNAであり、
前記第1のポリヌクレオチド部分の5´側に前記第2のポリヌクレオチド部分が連結し、前記第2のポリヌクレオチド部分の5´側に前記第3のポリヌクレオチド部分が連結している、
核酸検出用プライマーと、
C)DNA/RNA複合体を分解するヌクレアーゼと
を含むことを特徴とする核酸検出用キット。 - 前記第1のポリヌクレオチド部分が10~100塩基である、請求項14に記載の核酸検出用キット。
- 前記検出対象核酸がRNAであり、前記ヌクレアーゼがDNA/RNA複合体中のDNAを分解するヌクレアーゼである、請求項14又は15に記載の核酸検出用キット。
- さらに、D)ポリメラーゼを含むことを特徴とする、請求項14~16のいずれか1項に記載の核酸検出用キット。
- 前記核酸検出用プライマーが、前記第1のポリヌクレオチド部分の3´側にさらに非自然人工塩基配列を有しかつ前記鋳型核酸ともハイブリダイズしない第4のポリヌクレオチド部分を有している、請求項14~17のいずれか1項に記載の核酸検出用キット。
- 前記鋳型核酸が、前記検出対象核酸の一部と同一である共通塩基配列を有しており、
前記第2のポリヌクレオチド部分における3´側の部分が、前記共通塩基配列と相補的である、請求項14~18のいずれか1項に記載の核酸検出用キット。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2017123247 | 2017-06-23 | ||
| JP2017123247 | 2017-06-23 | ||
| PCT/JP2018/023537 WO2018235886A1 (ja) | 2017-06-23 | 2018-06-20 | 核酸検出方法、核酸検出用プライマー及び核酸検出用キット |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2018235886A1 JPWO2018235886A1 (ja) | 2020-07-30 |
| JP7127023B2 true JP7127023B2 (ja) | 2022-08-29 |
Family
ID=64736001
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019525677A Active JP7127023B2 (ja) | 2017-06-23 | 2018-06-20 | 核酸検出方法、核酸検出用プライマー及び核酸検出用キット |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20200263233A1 (ja) |
| EP (1) | EP3643790A4 (ja) |
| JP (1) | JP7127023B2 (ja) |
| CN (1) | CN111742056B (ja) |
| WO (1) | WO2018235886A1 (ja) |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008307029A (ja) | 2007-06-18 | 2008-12-25 | Olympus Corp | 標的dnaを検出する方法 |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5282574A (en) | 1975-12-28 | 1977-07-09 | Sanbui Kk | Producing method of bag with mouth clasp |
| ES2165402T3 (es) * | 1994-07-16 | 2002-03-16 | Roche Diagnostics Gmbh | Procedimiento para la deteccion sensible de acidos nucleicos. |
| DE4441626A1 (de) * | 1994-11-23 | 1996-05-30 | Boehringer Mannheim Gmbh | Verfahren zum besonders sensitiven Nachweis von Nukleinsäuren |
| AU4938497A (en) * | 1996-11-12 | 1998-06-03 | Visible Genetics Inc. | Method and kit for direct isothermal sequencing of nucleic acids |
| DE69937223T3 (de) | 1998-11-09 | 2011-05-05 | Eiken Kagaku K.K. | Verfahren zur synthese von nukleinsäuren |
| US6951722B2 (en) * | 1999-03-19 | 2005-10-04 | Takara Bio Inc. | Method for amplifying nucleic acid sequence |
| US6794141B2 (en) * | 2000-12-22 | 2004-09-21 | Arcturus Bioscience, Inc. | Nucleic acid amplification |
| EP1488001B1 (en) * | 2002-03-11 | 2008-08-20 | Nugen Technologies, Inc. | Methods for generating double stranded dna comprising a 3' single stranded portion and uses of these complexes for recombination |
| EP1668158B1 (en) * | 2003-08-11 | 2010-10-20 | Georgia State University Research Foundation, Inc. | Rna detection and quantitation |
| WO2005030983A2 (en) * | 2003-09-26 | 2005-04-07 | Circleamp, Inc. | Amplification of polynucleotides by rolling circle amplification |
| US7575863B2 (en) | 2004-05-28 | 2009-08-18 | Applied Biosystems, Llc | Methods, compositions, and kits comprising linker probes for quantifying polynucleotides |
| US20060078894A1 (en) * | 2004-10-12 | 2006-04-13 | Winkler Matthew M | Methods and compositions for analyzing nucleic acids |
| WO2006095981A1 (en) * | 2005-03-05 | 2006-09-14 | Seegene, Inc. | Processes using dual specificity oligonucleotide and dual specificity oligonucleotide |
| US20090220969A1 (en) | 2007-09-28 | 2009-09-03 | North Carolina State University | Identifying and quantifying small RNAs |
| US8420323B2 (en) * | 2007-11-14 | 2013-04-16 | Fujifilm Corporation | Nucleic acid amplification method |
| US10227641B2 (en) * | 2008-04-30 | 2019-03-12 | Integrated Dna Technologies, Inc. | RNase H-based assays utilizing modified RNA monomers |
| WO2011049964A1 (en) * | 2009-10-19 | 2011-04-28 | Lab Scientific Group | Rna detection and quantitation |
| US8759036B2 (en) * | 2011-03-21 | 2014-06-24 | Affymetrix, Inc. | Methods for synthesizing pools of probes |
| CN103534358B (zh) * | 2011-03-29 | 2015-03-25 | Seegene株式会社 | 基于pto切割以及延伸-依赖性切割的靶核酸序列的检测 |
| US20130302794A1 (en) * | 2012-05-09 | 2013-11-14 | Samsung Techwin Co., Ltd. | Nucleic acid detection by oligonucleotide probes cleaved by both exonuclease and endonuclease |
| US20140274729A1 (en) * | 2013-03-15 | 2014-09-18 | Nugen Technologies, Inc. | Methods, compositions and kits for generation of stranded rna or dna libraries |
| WO2014190181A1 (en) | 2013-05-22 | 2014-11-27 | Northwestern University | Rna-directed dna cleavage and gene editing by cas9 enzyme from neisseria meningitidis |
-
2018
- 2018-06-20 WO PCT/JP2018/023537 patent/WO2018235886A1/ja not_active Ceased
- 2018-06-20 EP EP18819599.4A patent/EP3643790A4/en active Pending
- 2018-06-20 US US16/623,544 patent/US20200263233A1/en not_active Abandoned
- 2018-06-20 CN CN201880041664.9A patent/CN111742056B/zh active Active
- 2018-06-20 JP JP2019525677A patent/JP7127023B2/ja active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008307029A (ja) | 2007-06-18 | 2008-12-25 | Olympus Corp | 標的dnaを検出する方法 |
Non-Patent Citations (2)
| Title |
|---|
| "LAMP法とは", [online], 2017.5.30, 栄研化学株式会社, [2018.9.7 検索], インターネット<URL: https://web.archive.org/web/20170530003750 /http://www.loopamp.eiken.co.jp:80/lamp/index.html> |
| Mol. Cell,2015年,Vol.60,pp.242-255 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20200263233A1 (en) | 2020-08-20 |
| EP3643790A1 (en) | 2020-04-29 |
| EP3643790A4 (en) | 2021-03-24 |
| WO2018235886A1 (ja) | 2018-12-27 |
| CN111742056B (zh) | 2023-09-01 |
| JPWO2018235886A1 (ja) | 2020-07-30 |
| CN111742056A (zh) | 2020-10-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8314220B2 (en) | Methods compositions, and kits for detection of microRNA | |
| AU2005338632B2 (en) | Selective terminal tagging of nucleic acids | |
| EP3143139B1 (en) | Synthesis of double-stranded nucleic acids | |
| US20050153333A1 (en) | Selective terminal tagging of nucleic acids | |
| EP3601593B1 (en) | Universal hairpin primers | |
| WO2011140510A2 (en) | Oligonucleotide ligation, barcoding and methods and compositions for improving data quality and throughput using massively parallel sequencing | |
| EP1871897A2 (en) | Methods for production of oligonucleotides | |
| JP2023002557A (ja) | シングルプライマーからデュアルプライマーのアンプリコンへのスイッチング | |
| US11015192B2 (en) | Method for generating a stranded RNA library | |
| JP7333171B2 (ja) | Rna検出方法、rna検出用核酸及びrna検出用キット | |
| JP7127023B2 (ja) | 核酸検出方法、核酸検出用プライマー及び核酸検出用キット | |
| JP5129498B2 (ja) | 核酸クローニング法 | |
| US20120156729A1 (en) | Selective terminal tagging of nucleic acids | |
| JP2009219445A (ja) | Vkorc1遺伝子上の1塩基多型を検出する方法およびプライマーセット |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| AA64 | Notification of invalidation of claim of internal priority (with term) |
Free format text: JAPANESE INTERMEDIATE CODE: A241764 Effective date: 20200313 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200512 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20200716 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210329 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210401 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220228 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220414 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20220810 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20220817 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7127023 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |