JP6997800B2 - 神経炎症性障害の処置に使用される小有機分子 - Google Patents
神経炎症性障害の処置に使用される小有機分子 Download PDFInfo
- Publication number
- JP6997800B2 JP6997800B2 JP2019557789A JP2019557789A JP6997800B2 JP 6997800 B2 JP6997800 B2 JP 6997800B2 JP 2019557789 A JP2019557789 A JP 2019557789A JP 2019557789 A JP2019557789 A JP 2019557789A JP 6997800 B2 JP6997800 B2 JP 6997800B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- bmp
- alkyl
- pharmaceutical composition
- compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 238000011282 treatment Methods 0.000 title claims description 60
- 208000036110 Neuroinflammatory disease Diseases 0.000 title claims description 51
- 150000001875 compounds Chemical class 0.000 claims description 95
- 125000000217 alkyl group Chemical group 0.000 claims description 66
- 239000008194 pharmaceutical composition Substances 0.000 claims description 65
- 150000003839 salts Chemical class 0.000 claims description 56
- 201000006417 multiple sclerosis Diseases 0.000 claims description 55
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 49
- 125000003118 aryl group Chemical group 0.000 claims description 47
- 229910052736 halogen Inorganic materials 0.000 claims description 42
- 150000002367 halogens Chemical class 0.000 claims description 42
- 229910052739 hydrogen Inorganic materials 0.000 claims description 35
- 125000001072 heteroaryl group Chemical group 0.000 claims description 29
- 125000003545 alkoxy group Chemical group 0.000 claims description 26
- 150000001412 amines Chemical class 0.000 claims description 23
- 239000003814 drug Substances 0.000 claims description 15
- 229910052760 oxygen Inorganic materials 0.000 claims description 14
- 229940124597 therapeutic agent Drugs 0.000 claims description 14
- 229910052717 sulfur Inorganic materials 0.000 claims description 13
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 11
- 208000007400 Relapsing-Remitting Multiple Sclerosis Diseases 0.000 claims description 10
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 8
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims 1
- 102100024506 Bone morphogenetic protein 2 Human genes 0.000 description 85
- 108010049931 Bone Morphogenetic Protein 2 Proteins 0.000 description 84
- 210000004027 cell Anatomy 0.000 description 72
- 230000000694 effects Effects 0.000 description 52
- 238000000034 method Methods 0.000 description 46
- 241000699670 Mus sp. Species 0.000 description 42
- 150000003384 small molecules Chemical class 0.000 description 37
- 102000007350 Bone Morphogenetic Proteins Human genes 0.000 description 36
- 108010007726 Bone Morphogenetic Proteins Proteins 0.000 description 36
- 229940112869 bone morphogenetic protein Drugs 0.000 description 35
- 201000002491 encephalomyelitis Diseases 0.000 description 33
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 26
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 26
- 102100024505 Bone morphogenetic protein 4 Human genes 0.000 description 25
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 24
- 241000699666 Mus <mouse, genus> Species 0.000 description 21
- 201000010099 disease Diseases 0.000 description 20
- 208000024891 symptom Diseases 0.000 description 20
- 101000720704 Homo sapiens Neuronal migration protein doublecortin Proteins 0.000 description 19
- 102100025929 Neuronal migration protein doublecortin Human genes 0.000 description 19
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 18
- 229930002330 retinoic acid Natural products 0.000 description 18
- 229960001727 tretinoin Drugs 0.000 description 18
- 239000003981 vehicle Substances 0.000 description 18
- 108010049955 Bone Morphogenetic Protein 4 Proteins 0.000 description 17
- 150000001350 alkyl halides Chemical class 0.000 description 17
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 17
- 210000002569 neuron Anatomy 0.000 description 17
- 230000000638 stimulation Effects 0.000 description 17
- 230000014509 gene expression Effects 0.000 description 15
- 208000016192 Demyelinating disease Diseases 0.000 description 14
- 239000003112 inhibitor Substances 0.000 description 14
- 125000004432 carbon atom Chemical group C* 0.000 description 13
- 208000033068 episodic angioedema with eosinophilia Diseases 0.000 description 13
- 238000002474 experimental method Methods 0.000 description 12
- -1 n - propyl Chemical group 0.000 description 12
- 230000011664 signaling Effects 0.000 description 12
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 11
- 102100023174 Methionine aminopeptidase 2 Human genes 0.000 description 11
- 230000003833 cell viability Effects 0.000 description 11
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 11
- 239000002953 phosphate buffered saline Substances 0.000 description 11
- 102000004169 proteins and genes Human genes 0.000 description 11
- 108090000623 proteins and genes Proteins 0.000 description 11
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 10
- 101001092197 Homo sapiens RNA binding protein fox-1 homolog 3 Proteins 0.000 description 10
- 108090000192 Methionyl aminopeptidases Proteins 0.000 description 10
- 102100035530 RNA binding protein fox-1 homolog 3 Human genes 0.000 description 10
- 238000004166 bioassay Methods 0.000 description 10
- 238000013537 high throughput screening Methods 0.000 description 10
- 230000001965 increasing effect Effects 0.000 description 10
- 230000005764 inhibitory process Effects 0.000 description 10
- 206010012305 Demyelination Diseases 0.000 description 9
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 9
- 101000762379 Homo sapiens Bone morphogenetic protein 4 Proteins 0.000 description 9
- 241001465754 Metazoa Species 0.000 description 9
- 239000003937 drug carrier Substances 0.000 description 9
- 238000000338 in vitro Methods 0.000 description 9
- 210000003141 lower extremity Anatomy 0.000 description 9
- 239000003550 marker Substances 0.000 description 9
- 208000015122 neurodegenerative disease Diseases 0.000 description 9
- 229910052757 nitrogen Inorganic materials 0.000 description 9
- 238000011002 quantification Methods 0.000 description 9
- 208000032116 Autoimmune Experimental Encephalomyelitis Diseases 0.000 description 8
- 102000006386 Myelin Proteins Human genes 0.000 description 8
- 108010083674 Myelin Proteins Proteins 0.000 description 8
- 238000004458 analytical method Methods 0.000 description 8
- 238000010171 animal model Methods 0.000 description 8
- 125000004429 atom Chemical group 0.000 description 8
- 210000003169 central nervous system Anatomy 0.000 description 8
- 230000004069 differentiation Effects 0.000 description 8
- 208000012997 experimental autoimmune encephalomyelitis Diseases 0.000 description 8
- 230000002401 inhibitory effect Effects 0.000 description 8
- 238000004519 manufacturing process Methods 0.000 description 8
- 230000001537 neural effect Effects 0.000 description 8
- 230000004770 neurodegeneration Effects 0.000 description 8
- 210000000278 spinal cord Anatomy 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- 239000010432 diamond Substances 0.000 description 7
- 238000002649 immunization Methods 0.000 description 7
- 230000003053 immunization Effects 0.000 description 7
- 239000002609 medium Substances 0.000 description 7
- 210000005012 myelin Anatomy 0.000 description 7
- 210000004248 oligodendroglia Anatomy 0.000 description 7
- 239000000546 pharmaceutical excipient Substances 0.000 description 7
- 102000005962 receptors Human genes 0.000 description 7
- 108020003175 receptors Proteins 0.000 description 7
- 238000011084 recovery Methods 0.000 description 7
- 206010033799 Paralysis Diseases 0.000 description 6
- 125000003342 alkenyl group Chemical group 0.000 description 6
- 210000004556 brain Anatomy 0.000 description 6
- 229910052799 carbon Inorganic materials 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 238000011161 development Methods 0.000 description 6
- 229910003460 diamond Inorganic materials 0.000 description 6
- 239000003085 diluting agent Substances 0.000 description 6
- 230000004766 neurogenesis Effects 0.000 description 6
- 201000008628 secondary progressive multiple sclerosis Diseases 0.000 description 6
- 241000282414 Homo sapiens Species 0.000 description 5
- 102000002233 Myelin-Oligodendrocyte Glycoprotein Human genes 0.000 description 5
- 108010000123 Myelin-Oligodendrocyte Glycoprotein Proteins 0.000 description 5
- 238000003556 assay Methods 0.000 description 5
- 230000009286 beneficial effect Effects 0.000 description 5
- 210000000988 bone and bone Anatomy 0.000 description 5
- 125000000392 cycloalkenyl group Chemical group 0.000 description 5
- 230000018109 developmental process Effects 0.000 description 5
- UKWLRLAKGMZXJC-QIECWBMSSA-L disodium;[4-chloro-3-[(3r,5s)-1-chloro-3'-methoxyspiro[adamantane-4,4'-dioxetane]-3'-yl]phenyl] phosphate Chemical compound [Na+].[Na+].O1OC2([C@@H]3CC4C[C@H]2CC(Cl)(C4)C3)C1(OC)C1=CC(OP([O-])([O-])=O)=CC=C1Cl UKWLRLAKGMZXJC-QIECWBMSSA-L 0.000 description 5
- 125000005843 halogen group Chemical group 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 238000002372 labelling Methods 0.000 description 5
- 230000000670 limiting effect Effects 0.000 description 5
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 5
- 150000002894 organic compounds Chemical class 0.000 description 5
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 5
- 230000026731 phosphorylation Effects 0.000 description 5
- 238000006366 phosphorylation reaction Methods 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 230000008569 process Effects 0.000 description 5
- 230000004044 response Effects 0.000 description 5
- 239000000758 substrate Substances 0.000 description 5
- 206010061818 Disease progression Diseases 0.000 description 4
- 108010072051 Glatiramer Acetate Proteins 0.000 description 4
- 102000004243 Tubulin Human genes 0.000 description 4
- 108090000704 Tubulin Proteins 0.000 description 4
- 125000000304 alkynyl group Chemical group 0.000 description 4
- 210000001130 astrocyte Anatomy 0.000 description 4
- 238000004113 cell culture Methods 0.000 description 4
- 239000000460 chlorine Substances 0.000 description 4
- 230000001684 chronic effect Effects 0.000 description 4
- 230000003247 decreasing effect Effects 0.000 description 4
- 230000005750 disease progression Effects 0.000 description 4
- 208000035475 disorder Diseases 0.000 description 4
- 150000002148 esters Chemical class 0.000 description 4
- 229960000556 fingolimod Drugs 0.000 description 4
- KKGQTZUTZRNORY-UHFFFAOYSA-N fingolimod Chemical compound CCCCCCCCC1=CC=C(CCC(N)(CO)CO)C=C1 KKGQTZUTZRNORY-UHFFFAOYSA-N 0.000 description 4
- 230000006870 function Effects 0.000 description 4
- 125000005842 heteroatom Chemical group 0.000 description 4
- 125000000623 heterocyclic group Chemical group 0.000 description 4
- 230000002055 immunohistochemical effect Effects 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 230000006698 induction Effects 0.000 description 4
- 230000001939 inductive effect Effects 0.000 description 4
- 230000002757 inflammatory effect Effects 0.000 description 4
- 238000004020 luminiscence type Methods 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 108020004999 messenger RNA Proteins 0.000 description 4
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 4
- 125000002950 monocyclic group Chemical group 0.000 description 4
- 125000004433 nitrogen atom Chemical group N* 0.000 description 4
- 206010063401 primary progressive multiple sclerosis Diseases 0.000 description 4
- 108090000765 processed proteins & peptides Proteins 0.000 description 4
- 230000019491 signal transduction Effects 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 210000000130 stem cell Anatomy 0.000 description 4
- 125000001424 substituent group Chemical group 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- 0 **C(C(*)=C(*)c1c(*)c(*)c(*)c(*)c1*)=N Chemical compound **C(C(*)=C(*)c1c(*)c(*)c(*)c(*)c1*)=N 0.000 description 3
- 208000024827 Alzheimer disease Diseases 0.000 description 3
- 102000001893 Bone Morphogenetic Protein Receptors Human genes 0.000 description 3
- 108010040422 Bone Morphogenetic Protein Receptors Proteins 0.000 description 3
- 206010010904 Convulsion Diseases 0.000 description 3
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 3
- 101000762366 Homo sapiens Bone morphogenetic protein 2 Proteins 0.000 description 3
- 102100025744 Mothers against decapentaplegic homolog 1 Human genes 0.000 description 3
- 241000699660 Mus musculus Species 0.000 description 3
- 241000283973 Oryctolagus cuniculus Species 0.000 description 3
- 102000016202 Proteolipids Human genes 0.000 description 3
- 108010010974 Proteolipids Proteins 0.000 description 3
- 101700032040 SMAD1 Proteins 0.000 description 3
- 238000000692 Student's t-test Methods 0.000 description 3
- 239000002671 adjuvant Substances 0.000 description 3
- 150000001349 alkyl fluorides Chemical group 0.000 description 3
- 239000000427 antigen Substances 0.000 description 3
- 102000036639 antigens Human genes 0.000 description 3
- 108091007433 antigens Proteins 0.000 description 3
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 230000008499 blood brain barrier function Effects 0.000 description 3
- 210000001218 blood-brain barrier Anatomy 0.000 description 3
- 230000022159 cartilage development Effects 0.000 description 3
- 229910052801 chlorine Inorganic materials 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- LDCRTTXIJACKKU-ONEGZZNKSA-N dimethyl fumarate Chemical compound COC(=O)\C=C\C(=O)OC LDCRTTXIJACKKU-ONEGZZNKSA-N 0.000 description 3
- 230000009266 disease activity Effects 0.000 description 3
- 231100000673 dose–response relationship Toxicity 0.000 description 3
- 239000012091 fetal bovine serum Substances 0.000 description 3
- 229960002897 heparin Drugs 0.000 description 3
- 229920000669 heparin Polymers 0.000 description 3
- 208000010726 hind limb paralysis Diseases 0.000 description 3
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 3
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 3
- 210000003007 myelin sheath Anatomy 0.000 description 3
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 210000003757 neuroblast Anatomy 0.000 description 3
- 230000002314 neuroinflammatory effect Effects 0.000 description 3
- 230000004031 neuronal differentiation Effects 0.000 description 3
- 229950005751 ocrelizumab Drugs 0.000 description 3
- 239000001301 oxygen Substances 0.000 description 3
- 230000007170 pathology Effects 0.000 description 3
- 230000000750 progressive effect Effects 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 231100000331 toxic Toxicity 0.000 description 3
- 230000002588 toxic effect Effects 0.000 description 3
- 238000011830 transgenic mouse model Methods 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- TYAUIXPYQSXZBS-OQLLNIDSSA-N COC(c([s]cc1)c1N/N=C(\C#N)/S(c1ccc[s]1)(=O)=O)=O Chemical compound COC(c([s]cc1)c1N/N=C(\C#N)/S(c1ccc[s]1)(=O)=O)=O TYAUIXPYQSXZBS-OQLLNIDSSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical class OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- ZRALSGWEFCBTJO-UHFFFAOYSA-N Guanidine Chemical compound NC(N)=N ZRALSGWEFCBTJO-UHFFFAOYSA-N 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 108010005716 Interferon beta-1a Proteins 0.000 description 2
- 108090000467 Interferon-beta Proteins 0.000 description 2
- 102000003996 Interferon-beta Human genes 0.000 description 2
- 229930195725 Mannitol Chemical class 0.000 description 2
- 208000012902 Nervous system disease Diseases 0.000 description 2
- 208000018737 Parkinson disease Diseases 0.000 description 2
- 108010081690 Pertussis Toxin Proteins 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 241000283984 Rodentia Species 0.000 description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 2
- 230000005856 abnormality Effects 0.000 description 2
- 125000000738 acetamido group Chemical group [H]C([H])([H])C(=O)N([H])[*] 0.000 description 2
- FHEAIOHRHQGZPC-KIWGSFCNSA-N acetic acid;(2s)-2-amino-3-(4-hydroxyphenyl)propanoic acid;(2s)-2-aminopentanedioic acid;(2s)-2-aminopropanoic acid;(2s)-2,6-diaminohexanoic acid Chemical compound CC(O)=O.C[C@H](N)C(O)=O.NCCCC[C@H](N)C(O)=O.OC(=O)[C@@H](N)CCC(O)=O.OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 FHEAIOHRHQGZPC-KIWGSFCNSA-N 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- 239000005557 antagonist Substances 0.000 description 2
- 239000012911 assay medium Substances 0.000 description 2
- 210000003050 axon Anatomy 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 208000029028 brain injury Diseases 0.000 description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000004452 carbocyclyl group Chemical group 0.000 description 2
- 150000001768 cations Chemical class 0.000 description 2
- 238000000423 cell based assay Methods 0.000 description 2
- 230000024245 cell differentiation Effects 0.000 description 2
- 230000005754 cellular signaling Effects 0.000 description 2
- 210000001638 cerebellum Anatomy 0.000 description 2
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 229940038717 copaxone Drugs 0.000 description 2
- 230000001472 cytotoxic effect Effects 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 229960004419 dimethyl fumarate Drugs 0.000 description 2
- 230000000763 evoking effect Effects 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 210000003194 forelimb Anatomy 0.000 description 2
- 229960003776 glatiramer acetate Drugs 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 102000045896 human BMP2 Human genes 0.000 description 2
- 239000001257 hydrogen Chemical group 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 210000004263 induced pluripotent stem cell Anatomy 0.000 description 2
- 208000014674 injury Diseases 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 239000007928 intraperitoneal injection Substances 0.000 description 2
- 201000010901 lateral sclerosis Diseases 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000002595 magnetic resonance imaging Methods 0.000 description 2
- 239000000594 mannitol Chemical class 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 230000010534 mechanism of action Effects 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 210000002901 mesenchymal stem cell Anatomy 0.000 description 2
- 239000000203 mixture Substances 0.000 description 2
- 208000005264 motor neuron disease Diseases 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 230000023105 myelination Effects 0.000 description 2
- 229960005027 natalizumab Drugs 0.000 description 2
- 230000000626 neurodegenerative effect Effects 0.000 description 2
- 230000001272 neurogenic effect Effects 0.000 description 2
- 210000004498 neuroglial cell Anatomy 0.000 description 2
- 208000008795 neuromyelitis optica Diseases 0.000 description 2
- 238000006386 neutralization reaction Methods 0.000 description 2
- 210000003458 notochord Anatomy 0.000 description 2
- 230000011164 ossification Effects 0.000 description 2
- 125000004430 oxygen atom Chemical group O* 0.000 description 2
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 2
- 229920000729 poly(L-lysine) polymer Polymers 0.000 description 2
- 125000003367 polycyclic group Chemical group 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 230000007115 recruitment Effects 0.000 description 2
- 238000007665 sagging Methods 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 230000006641 stabilisation Effects 0.000 description 2
- 238000011105 stabilization Methods 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 229960005322 streptomycin Drugs 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 239000011593 sulfur Substances 0.000 description 2
- UTNUDOFZCWSZMS-YFHOEESVSA-N teriflunomide Chemical compound C\C(O)=C(/C#N)C(=O)NC1=CC=C(C(F)(F)F)C=C1 UTNUDOFZCWSZMS-YFHOEESVSA-N 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 2
- IHIXIJGXTJIKRB-UHFFFAOYSA-N trisodium vanadate Chemical compound [Na+].[Na+].[Na+].[O-][V]([O-])([O-])=O IHIXIJGXTJIKRB-UHFFFAOYSA-N 0.000 description 2
- 229940079023 tysabri Drugs 0.000 description 2
- 230000035899 viability Effects 0.000 description 2
- 230000004393 visual impairment Effects 0.000 description 2
- BICGOULMPJLRQV-MYINAIGISA-N 1-[(2s,4s,5r)-2-bromo-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidine-2,4-dione Chemical compound C1[C@H](O)[C@@H](CO)O[C@@]1(Br)N1C(=O)NC(=O)C=C1 BICGOULMPJLRQV-MYINAIGISA-N 0.000 description 1
- KZDCMKVLEYCGQX-UDPGNSCCSA-N 2-(diethylamino)ethyl 4-aminobenzoate;(2s,5r,6r)-3,3-dimethyl-7-oxo-6-[(2-phenylacetyl)amino]-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxylic acid;hydrate Chemical group O.CCN(CC)CCOC(=O)C1=CC=C(N)C=C1.N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 KZDCMKVLEYCGQX-UDPGNSCCSA-N 0.000 description 1
- KISWVXRQTGLFGD-UHFFFAOYSA-N 2-[[2-[[6-amino-2-[[2-[[2-[[5-amino-2-[[2-[[1-[2-[[6-amino-2-[(2,5-diamino-5-oxopentanoyl)amino]hexanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxypropanoyl]amino]-5-oxopentanoyl]amino]-5-(diaminomethylideneamino)p Chemical compound C1CCN(C(=O)C(CCCN=C(N)N)NC(=O)C(CCCCN)NC(=O)C(N)CCC(N)=O)C1C(=O)NC(CO)C(=O)NC(CCC(N)=O)C(=O)NC(CCCN=C(N)N)C(=O)NC(CO)C(=O)NC(CCCCN)C(=O)NC(C(=O)NC(CC(C)C)C(O)=O)CC1=CC=C(O)C=C1 KISWVXRQTGLFGD-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- 238000010175 APPswe/PSEN1dE9 Methods 0.000 description 1
- 239000012099 Alexa Fluor family Substances 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical class O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 206010003591 Ataxia Diseases 0.000 description 1
- 238000009020 BCA Protein Assay Kit Methods 0.000 description 1
- 208000009137 Behcet syndrome Diseases 0.000 description 1
- 201000004569 Blindness Diseases 0.000 description 1
- 108010049870 Bone Morphogenetic Protein 7 Proteins 0.000 description 1
- 102100022544 Bone morphogenetic protein 7 Human genes 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- NVFCESNENXWBJB-FOKLQQMPSA-N CC(C)(C)NC(N/N=C(\C)/c(cc1)ccc1Oc(c(Cl)cnc1)c1Cl)=S Chemical compound CC(C)(C)NC(N/N=C(\C)/c(cc1)ccc1Oc(c(Cl)cnc1)c1Cl)=S NVFCESNENXWBJB-FOKLQQMPSA-N 0.000 description 1
- DJALIOOHHCVQKU-UHFFFAOYSA-N CC(NC(CCSc(cccc1)c1C(NC(C)=O)=O)=O)=O Chemical compound CC(NC(CCSc(cccc1)c1C(NC(C)=O)=O)=O)=O DJALIOOHHCVQKU-UHFFFAOYSA-N 0.000 description 1
- 108700012434 CCL3 Proteins 0.000 description 1
- DIAVOKVWGGRSEL-UHFFFAOYSA-N CCOC(c([n]1Cc2ccc[s]2)c(NC(c2ccc([N+]([O-])=O)[o]2)=O)nc1SC)=O Chemical compound CCOC(c([n]1Cc2ccc[s]2)c(NC(c2ccc([N+]([O-])=O)[o]2)=O)nc1SC)=O DIAVOKVWGGRSEL-UHFFFAOYSA-N 0.000 description 1
- DYKYDADKFZLQAX-UHFFFAOYSA-N CNc1c(Nc2c(C(F)(F)F)cccc2)[s]nc1O Chemical compound CNc1c(Nc2c(C(F)(F)F)cccc2)[s]nc1O DYKYDADKFZLQAX-UHFFFAOYSA-N 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 206010057248 Cell death Diseases 0.000 description 1
- 238000003734 CellTiter-Glo Luminescent Cell Viability Assay Methods 0.000 description 1
- 102000000013 Chemokine CCL3 Human genes 0.000 description 1
- 102000001327 Chemokine CCL5 Human genes 0.000 description 1
- 108010055166 Chemokine CCL5 Proteins 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 208000003164 Diplopia Diseases 0.000 description 1
- 208000035859 Drug effect increased Diseases 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- 208000027534 Emotional disease Diseases 0.000 description 1
- 241000289669 Erinaceus europaeus Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 206010017577 Gait disturbance Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Chemical class OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 102000003693 Hedgehog Proteins Human genes 0.000 description 1
- 108090000031 Hedgehog Proteins Proteins 0.000 description 1
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 description 1
- 208000005176 Hepatitis C Diseases 0.000 description 1
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 description 1
- 101000979001 Homo sapiens Methionine aminopeptidase 2 Proteins 0.000 description 1
- 101000969087 Homo sapiens Microtubule-associated protein 2 Proteins 0.000 description 1
- 101001059454 Homo sapiens Serine/threonine-protein kinase MARK2 Proteins 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical group [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 108010005714 Interferon beta-1b Proteins 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Chemical class OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- LUWJPTVQOMUZLW-UHFFFAOYSA-N Luxol fast blue MBS Chemical compound [Cu++].Cc1ccccc1N\C(N)=N\c1ccccc1C.Cc1ccccc1N\C(N)=N\c1ccccc1C.OS(=O)(=O)c1cccc2c3nc(nc4nc([n-]c5[n-]c(nc6nc(n3)c3ccccc63)c3c(cccc53)S(O)(=O)=O)c3ccccc43)c12 LUWJPTVQOMUZLW-UHFFFAOYSA-N 0.000 description 1
- 102100025725 Mothers against decapentaplegic homolog 4 Human genes 0.000 description 1
- 101710143112 Mothers against decapentaplegic homolog 4 Proteins 0.000 description 1
- 102100030610 Mothers against decapentaplegic homolog 5 Human genes 0.000 description 1
- 101710143113 Mothers against decapentaplegic homolog 5 Proteins 0.000 description 1
- 101100437777 Mus musculus Bmpr1a gene Proteins 0.000 description 1
- 206010052904 Musculoskeletal stiffness Diseases 0.000 description 1
- 241001049988 Mycobacterium tuberculosis H37Ra Species 0.000 description 1
- 102000055324 Myelin Proteolipid Human genes 0.000 description 1
- 101710094913 Myelin proteolipid protein Proteins 0.000 description 1
- CHJJGSNFBQVOTG-UHFFFAOYSA-N N-methyl-guanidine Natural products CNC(N)=N CHJJGSNFBQVOTG-UHFFFAOYSA-N 0.000 description 1
- 229910020700 Na3VO4 Inorganic materials 0.000 description 1
- 206010029350 Neurotoxicity Diseases 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 208000007542 Paresis Diseases 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- 201000005702 Pertussis Diseases 0.000 description 1
- 229940122907 Phosphatase inhibitor Drugs 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 208000028017 Psychotic disease Diseases 0.000 description 1
- 239000012083 RIPA buffer Substances 0.000 description 1
- 230000010799 Receptor Interactions Effects 0.000 description 1
- 102100028904 Serine/threonine-protein kinase MARK2 Human genes 0.000 description 1
- 108020004459 Small interfering RNA Proteins 0.000 description 1
- 229920002472 Starch Chemical class 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical class O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Chemical class 0.000 description 1
- 206010044221 Toxic encephalopathy Diseases 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 206010044565 Tremor Diseases 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 206010047115 Vasculitis Diseases 0.000 description 1
- 206010047571 Visual impairment Diseases 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- AAXPHZSTFUDCNF-UHFFFAOYSA-N [O-][N+](c1cc2cccc(C(N(c(cc3)ccc3S(Nc3ccc(C(F)(F)F)cc3)(=O)=O)C3=O)=O)c2c3c1)=O Chemical compound [O-][N+](c1cc2cccc(C(N(c(cc3)ccc3S(Nc3ccc(C(F)(F)F)cc3)(=O)=O)C3=O)=O)c2c3c1)=O AAXPHZSTFUDCNF-UHFFFAOYSA-N 0.000 description 1
- XRYAGGCLDGQPOK-UHFFFAOYSA-N [O-][N+](c1ccc(C(Nc2cc(C(F)(F)F)ccc2)=O)[o]1)=O Chemical compound [O-][N+](c1ccc(C(Nc2cc(C(F)(F)F)ccc2)=O)[o]1)=O XRYAGGCLDGQPOK-UHFFFAOYSA-N 0.000 description 1
- 210000001015 abdomen Anatomy 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 208000002552 acute disseminated encephalomyelitis Diseases 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 206010064930 age-related macular degeneration Diseases 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 125000006193 alkinyl group Chemical group 0.000 description 1
- 125000002521 alkyl halide group Chemical group 0.000 description 1
- 125000002947 alkylene group Chemical group 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O ammonium group Chemical group [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 125000003710 aryl alkyl group Chemical group 0.000 description 1
- 150000001502 aryl halides Chemical class 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 229940057415 aubagio Drugs 0.000 description 1
- 229940003504 avonex Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical class OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 230000014461 bone development Effects 0.000 description 1
- 230000018678 bone mineralization Effects 0.000 description 1
- 230000006931 brain damage Effects 0.000 description 1
- 231100000874 brain damage Toxicity 0.000 description 1
- 230000004641 brain development Effects 0.000 description 1
- 210000000133 brain stem Anatomy 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- VEYRTZVLYXCVCX-UHFFFAOYSA-N c(cc1)ccc1C1=NNC(c2ccccc2)=NN1 Chemical compound c(cc1)ccc1C1=NNC(c2ccccc2)=NN1 VEYRTZVLYXCVCX-UHFFFAOYSA-N 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 229940112129 campath Drugs 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 150000007942 carboxylates Chemical class 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 210000000845 cartilage Anatomy 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 238000012054 celltiter-glo Methods 0.000 description 1
- 230000033077 cellular process Effects 0.000 description 1
- 239000001913 cellulose Chemical class 0.000 description 1
- 229920002678 cellulose Chemical class 0.000 description 1
- 208000015114 central nervous system disease Diseases 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 125000004218 chloromethyl group Chemical group [H]C([H])(Cl)* 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 230000006999 cognitive decline Effects 0.000 description 1
- 208000010877 cognitive disease Diseases 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 239000006059 cover glass Substances 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000002498 deadly effect Effects 0.000 description 1
- 230000005786 degenerative changes Effects 0.000 description 1
- 230000005595 deprotonation Effects 0.000 description 1
- 238000010537 deprotonation reaction Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- SWSQBOPZIKWTGO-UHFFFAOYSA-N dimethylaminoamidine Natural products CN(C)C(N)=N SWSQBOPZIKWTGO-UHFFFAOYSA-N 0.000 description 1
- 230000006806 disease prevention Effects 0.000 description 1
- 239000002612 dispersion medium Substances 0.000 description 1
- 208000002173 dizziness Diseases 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 230000001212 effect on astrocytes Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 230000013020 embryo development Effects 0.000 description 1
- 210000002257 embryonic structure Anatomy 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000007705 epithelial mesenchymal transition Effects 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 210000003414 extremity Anatomy 0.000 description 1
- 208000027993 eye symptom Diseases 0.000 description 1
- 206010016256 fatigue Diseases 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 230000005021 gait Effects 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 239000008103 glucose Chemical class 0.000 description 1
- 210000004565 granule cell Anatomy 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 210000002064 heart cell Anatomy 0.000 description 1
- 125000004475 heteroaralkyl group Chemical group 0.000 description 1
- 125000004415 heterocyclylalkyl group Chemical group 0.000 description 1
- 230000005936 hippocampal cell proliferation Effects 0.000 description 1
- 230000000971 hippocampal effect Effects 0.000 description 1
- 210000001320 hippocampus Anatomy 0.000 description 1
- 239000000710 homodimer Substances 0.000 description 1
- 102000046148 human BMP4 Human genes 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 238000010166 immunofluorescence Methods 0.000 description 1
- 238000002991 immunohistochemical analysis Methods 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 230000037456 inflammatory mechanism Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical compound C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 description 1
- 150000003854 isothiazoles Chemical class 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 239000008101 lactose Chemical class 0.000 description 1
- 210000003140 lateral ventricle Anatomy 0.000 description 1
- 229940047834 lemtrada Drugs 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 230000006517 limb development Effects 0.000 description 1
- 208000018769 loss of vision Diseases 0.000 description 1
- 231100000864 loss of vision Toxicity 0.000 description 1
- 238000009593 lumbar puncture Methods 0.000 description 1
- 210000005230 lumbar spinal cord Anatomy 0.000 description 1
- 210000004705 lumbosacral region Anatomy 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 208000002780 macular degeneration Diseases 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- 239000001095 magnesium carbonate Substances 0.000 description 1
- 229910000021 magnesium carbonate Inorganic materials 0.000 description 1
- 235000014380 magnesium carbonate Nutrition 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 239000007758 minimum essential medium Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 239000003068 molecular probe Substances 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 210000001577 neostriatum Anatomy 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 230000010004 neural pathway Effects 0.000 description 1
- 210000005155 neural progenitor cell Anatomy 0.000 description 1
- 230000007472 neurodevelopment Effects 0.000 description 1
- 230000016273 neuron death Effects 0.000 description 1
- 230000007511 neuronal proliferation Effects 0.000 description 1
- 231100000189 neurotoxic Toxicity 0.000 description 1
- 230000002887 neurotoxic effect Effects 0.000 description 1
- 231100000228 neurotoxicity Toxicity 0.000 description 1
- 230000007135 neurotoxicity Effects 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 102000045246 noggin Human genes 0.000 description 1
- 108700007229 noggin Proteins 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 230000005937 nuclear translocation Effects 0.000 description 1
- 230000032724 odontogenesis Effects 0.000 description 1
- 150000002892 organic cations Chemical class 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 208000010713 partial hind limb paralysis Diseases 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 125000004817 pentamethylene group Chemical group [H]C([H])([*:2])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[*:1] 0.000 description 1
- 239000003614 peroxisome proliferator Substances 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 210000001778 pluripotent stem cell Anatomy 0.000 description 1
- 229920001515 polyalkylene glycol Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 230000005588 protonation Effects 0.000 description 1
- 150000003222 pyridines Chemical class 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 229940038850 rebif Drugs 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000008886 response to retinoic acid Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical class C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 238000007127 saponification reaction Methods 0.000 description 1
- 201000000306 sarcoidosis Diseases 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 230000022379 skeletal muscle tissue development Effects 0.000 description 1
- 235000020183 skimmed milk Nutrition 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 239000007909 solid dosage form Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 210000004500 stellate cell Anatomy 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000005720 sucrose Chemical class 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000009747 swallowing Effects 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 229940121136 tecfidera Drugs 0.000 description 1
- 229960000331 teriflunomide Drugs 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 238000011287 therapeutic dose Methods 0.000 description 1
- 229940126585 therapeutic drug Drugs 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- GPRLSGONYQIRFK-MNYXATJNSA-N triton Chemical compound [3H+] GPRLSGONYQIRFK-MNYXATJNSA-N 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 208000029257 vision disease Diseases 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/38—Heterocyclic compounds having sulfur as a ring hetero atom
- A61K31/381—Heterocyclic compounds having sulfur as a ring hetero atom having five-membered rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/34—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having five-membered rings with one oxygen as the only ring hetero atom, e.g. isosorbide
- A61K31/345—Nitrofurans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4178—1,3-Diazoles not condensed 1,3-diazoles and containing further heterocyclic rings, e.g. pilocarpine, nitrofurantoin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/42—Oxazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Neurology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Psychiatry (AREA)
- Hospice & Palliative Care (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
X1及びX2は各々独立にS、O又はN-R4であり、R4は、H、アルキル、シクロアルキル、アリール及びヘテロアリールからなる群から選択され、
X3は、CN、ハロゲン、ニトロ、CO-X9及びSO2X9からなる群から選択され、X9は、OH、O-及びNH2からなる群から選択され、
X4、X5、X6、X7及びX8は、H、アルキル、シクロアルキル、アリール、アミン、ハロゲン、アルコキシ、ヒドロキシ、ヘテロアリール、CN、ニトロ、CO-X10及びSO2X10からなる群から各々独立に選択され、X10は、OH、O-及びNH2からなる群から選択され、
R1とR2の一方は存在せず、他方のR1及びR2は、H、アルキル、シクロアルキル、アリール、アミン、ハロゲン、アルコキシ、ヘテロアリール、CN、CO-X11及びSO2X11からなる群から選択され、X11は、OH、O-及びNH2からなる群から選択され、
R3は、OR5、O-及びNR6R7からなる群から選択され、R5、R6及びR7は、H、アルキル、シクロアルキル及びアリールからなる群から各々独立に選択され、
点線の各々は独立に単結合又は二重結合である。
X12、X13、X15及びX16は、H、アルキル、シクロアルキル、アリール、アミン、ハロゲン、アルコキシ、ヒドロキシ、ヘテロアリール、CN、NO2、CO-X19及びSO2X19からなる群から各々独立に選択され、X19は、OH、O-及びNH2からなる群から選択され、
X14及びX18は、H、アルキル、シクロアルキル、アリール、アミン、ハロゲン、アルコキシ、ヒドロキシ、ヘテロアリール、CN、NO2、CO-X20及びSO2X20からなる群から各々独立に選択され、X20は、OH、O-及びNH2からなる群から選択され、
X17はS、O又はN-R9であり、R9は、H、アルキル、シクロアルキル、アリール及びヘテロアリールからなる群から選択され、
nは1又は2であり、
R8は、アルキル、ハロゲン化アルキル、シクロアルキル及びアリールからなる群から選択される。
X1及びX2は各々独立にS、O又はN-R4であり、R4は、H、アルキル、シクロアルキル、アリール及びヘテロアリールからなる群から選択され、
X3は、CN、ハロゲン、ニトロ、CO-X9及びSO2X9からなる群から選択され、X9は、OH、O-及びNH2からなる群から選択され、
X4、X5、X6、X7及びX8は、H、アルキル、シクロアルキル、アリール、アミン、ハロゲン、アルコキシ、ヒドロキシ、ヘテロアリール、CN、ニトロ、CO-X10及びSO2X10からなる群から各々独立に選択され、X10は、OH、O-及びNH2からなる群から選択され、
R1とR2の一方は存在せず、他方のR1及びR2は、H、アルキル、シクロアルキル、アリール、アミン、ハロゲン、アルコキシ、ヘテロアリール、CN、CO-X11及びSO2X11からなる群から選択され、X11は、OH、O-及びNH2からなる群から選択され、
R3は、OR5、O-及びNR6R7からなる群から選択され、R5、R6及びR7は、H、アルキル、シクロアルキル及びアリールからなる群から各々独立に選択され、
点線の各々は独立に単結合又は二重結合である。
X12、X13、X15及びX16は、H、アルキル、シクロアルキル、アリール、アミン、ハロゲン、アルコキシ、ヒドロキシ、ヘテロアリール、CN、NO2、CO-X19及びSO2X19からなる群から各々独立に選択され、X19は、OH、O-及びNH2からなる群から選択され、
X14及びX18は、H、アルキル、シクロアルキル、アリール、アミン、ハロゲン、アルコキシ、ヒドロキシ、ヘテロアリール、CN、NO2、CO-X20及びSO2X20からなる群から各々独立に選択され、X20は、OH、O-及びNH2からなる群から選択され、
X17はS、O又はN-R9であり、R9は、H、アルキル、シクロアルキル、アリール及びヘテロアリールからなる群から選択され、
nは1又は2であり、
R8は、アルキル、ハロゲン化アルキル、シクロアルキル及びアリールからなる群から選択される。
X21及びR10は、アルキル、ハロゲン化アルキル、シクロアルキル、アリール、アミン、ハロゲン、アルコキシ、ヒドロキシ、ヘテロアリール、CN、NO2、CO-X23及びSO2X23からなる群から各々独立に選択され、X23は、OH、O-及びNH2からなる群から選択され、
X22は、OR12、O-及びNR13R14からなる群から選択され、R12、R13及びR14は、H、アルキル、シクロアルキル及びアリールからなる群から各々独立に選択され、
R11は、H、アルキル、シクロアルキル、アリール、アミン、ハロゲン、アルコキシ、ヘテロアリール、CN、CO-X24及びSO2X24からなる群から選択され、X24は、OH、O-及びNH2からなる群から選択される。
X24はO又はSである。
R16は、H、アルキル、シクロアルキル、アリール、アミン、ハロゲン、アルコキシ、ヘテロアリール、CN、CO-X24及びSO2X24からなる群から選択され、X24は、OH、O-及びNH2からなる群から選択される。
R17及びR18は各々独立に、任意に置換されているフェニル環であり、
R19は、H、アルキル、シクロアルキル及びアリールからなる群から選択され、
R20とR21の一方は存在せず、他方のR20又はR21は、H、アルキル、シクロアルキル及びアリールからなる群から選択され、
点線の各々は独立に単結合又は二重結合である。
R22及びR23は、H、アルキル、シクロアルキル及びアリールからなる群から各々独立に選択され、
X27は、ハロゲン化アルキル、アミン、ハロゲン、アルコキシ、ヒドロキシ、CN及びNO2からなる群から選択される。
X28は、ハロゲン化アルキル、アミン、ハロゲン、アルコキシ、ヒドロキシ、CN及びNO2からなる群から選択される。
R25は、アルキル、ハロゲン化アルキル、シクロアルキル、アリール、アミン、ハロゲン、アルコキシ、ヒドロキシ、ヘテロアリール、CN及びNO2からなる群から選択される。
X29は、OR26、O-及びNR27R28からなる群から選択され、R26、R27及びR28は、H、COR29、アルキル、シクロアルキル及びアリールからなる群から各々独立に選択され、R29は、H、アルキル、シクロアルキル及びアリールからなる群から選択され、
X30は、OR30、O-及びNR31R32からなる群から選択され、R30、R31及びR32は、H、COR33、アルキル、シクロアルキル及びアリールからなる群から各々独立に選択され、R33は、H、アルキル、シクロアルキル及びアリールからなる群から選択される。
X31は、S及びOから選択され、
R34は、ハロゲン化アリール及びハロゲン化ヘテロアリールから選択され、
R35及びR36は、H、アルキル、シクロアルキル及びアリールからなる群から各々独立に選択される。
本明細書では「小分子」と「小有機分子」という用語は、互換性があり、分子量2000g/mol以下の有機分子を指す。一部の実施形態によれば、小分子の分子量は1000g/mol以下である。一部の実施形態によれば、小分子の分子量は750g/mol以下である。一部の実施形態によれば、小分子の分子量は500g/mol以下である。
小分子-SM
実験的自己免疫性脳脊髄炎-EAE、
再発寛解型-RR、
多発性硬化症-MS、
再発寛解型実験的自己免疫性脳脊髄炎-RR-EAE、
プロテオリピドタンパク質ペプチド-PLP、
ミエリン-乏突起膠細胞糖タンパク質ペプチド-MOG、
リン酸緩衝食塩水-PBS(Phosphate buffered saline)、
完全フロイントアジュバント-CFA(Complete Freund’s Adjuvant)、
百日咳毒素-PTX、
骨形成タンパク質-BMP、
血液脳関門-BBB、
中枢神経系-CNS、
時間-hr、h、
分-min。
ハイスループットスクリーニング(HTS)バイオアッセイ
ポリ-L-リジン(Sigma-Aldrich)を384ウェルプレートに添加し、室温で30分インキュベーション後に除去した。DMEM/F12、2%FBS、ペニシリン100単位/ml、ストレプトマイシン(Biological industries)100mg/mlを含むアッセイ培地を、各ウェルに添加した。次いで、組換えヒトBMP-2(rhBMP-2、R&D Systems)を、最終濃度2μg/mlまで各ウェルに添加した。ATDC5細胞(Sigma-Aldrich)を収集し、アッセイ培地に再懸濁し、最終濃度2000細胞/ウェルまで添加した。最後に、ヘパリン(Sigma-Aldrich)を、最終濃度2μg/mlまで添加した。細胞を、48時間37℃で5%CO2と一緒に加湿チャンバ中でBPM-2の潜在的小分子阻害剤の存在又は非存在下でインキュベーションした。インキュベーション後、ALPレベル及び細胞生存率を、完全に自動化された手順で測定した。細胞をPBSで洗浄し、プロテアーゼ阻害剤カクテル(Sigma-Aldrich)を補充したPBS中に0.2%Triton X-100を含む溶解緩衝剤を用いて溶解し、室温で25分間インキュベーションした。次いで、CDP-Star(登録商標)化学発光基質(Sigma-Aldrich)を添加し、25分間室温で暗所でインキュベーション後に発光を測定して、ALPレベルを求めた。最後に、CellTiter-Glo(登録商標)試薬(Biological Industries)を添加し、10分間インキュベーション後に発光を測定して、細胞生存率を求めた。
SJL雌性マウス(6~8週齢)において0.1ml PBS中のプロテオリピドタンパク質ペプチド(Sigma-Aldrichによって合成されたPLP139-151)100μg/マウスで皮下免疫処置して(0日目)、RR-EAEを誘導した。結核菌H37RA(MT、DIFCO製)500μgを含む等量の完全フロイントアジュバント(CFA、DIFCO製)でペプチドを乳化した。0.2ml PBS中の百日咳毒素(PTX、Sigma-Aldrich製)300ngも、マウスに腹腔内注射した。2回目のPTX注射(300ng/マウス)を、48時間後に行った。
7.5%子ウシ血清、2.5%ウシ胎仔血清及び0.4μl/mlペニシリン-ストレプトマイシン(Gibco)を含む最少必須培地(aMEM:a-minimum essential medium)(Gibco)中で37℃、5%CO2でP19細胞を成長させた。細胞に新しい培地を48時間毎に補充した。分化検査の場合、P19細胞を濃度2×105細胞/60mm細菌皿で培養し、刺激しないか、又は以下の刺激と一緒にインキュベーションした。
1)5×10-7M全トランス型レチノイン酸(RA:retinoic acid)(Sigma)
2)RA+5ng/ml rhBMP2(R&D systems)
3)RA+rhBMP-2+500ng/mlマウス抗ヒトBMP-2/4mAb(R&D systems)
4)RA+rhBMP-2+SM1/SM7/SM9(Maybridge(HitFinder(商標)コレクション))濃度:0.625、1.25及び2.5μM。
P19細胞を6ウェルプレートに播いた(3.5×105細胞/ウェル)。翌日、細胞を処理しないか、又は5×10-7M RA、5ng/ml BMP-2若しくはSMで4時間処理した。細胞を氷冷PBSで洗浄し、収集し、プロテアーゼ阻害剤カクテル及びホスファターゼ阻害剤としてオルトバナジン酸ナトリウム(Na3VO4)(Sigma-Aldrich)を補充した氷冷RIPA緩衝剤(Sigma-Aldrich)を用いて溶解した。タンパク質濃度を、BCAタンパク質アッセイキット(Pierce、Rockford、IL)を用いて測定した。細胞溶解物(タンパク質40~60μg)を、4~15%SDS-PAGEゲル電気泳動によって分離し、次いでニトロセルロース膜に0.2Aで2時間転写した。膜を5%(w/v)脱脂粉乳で室温で1時間ブロックし、次いで抗ホスホSmad1/5/9、抗Smad1(Cell signaling Technology、Beverly、MA、USA)及び抗チューブリン(Sigma-Aldrich)抗体と一緒に室温で2時間インキュベーションした。膜を洗浄し、アルカリホスファターゼ複合二次抗体(Jackson Laboratories Immune Research、PA、USA)と一緒にインキュベーションした。シグナルを、増感化学発光キット(Clarity、BioRad Laboratories、Richmond、CA)を用いて検出し、デジタル画像を、MicroChemi(DNR Bio-imaging Systems、Jerusalem、Israel)によってキャプチャーした。タンパク質レベルを、ImageJソフトウェアを用いて定量化し、{アルファ}-チューブリンに対して規準化した。
小分子のハイスループットスクリーニング
BMP-2とBMP受容体IAの構造-機能関係を評価するATDC5細胞アッセイが、Kellerら(Nature Structural&Molecular Biology 2004 11、481~488)に最初に記載された。多量の治療薬候補をスクリーニングするために、BMP阻害を検出するATDC5細胞バイオアッセイを、ハイスループットスクリーニングに使用するように改作した。バイオアッセイは、BMP-2及びヘパリンの投与によるマウスATDC5細胞におけるアルカリホスファターゼ(ALP)産生の刺激、並びに阻害剤候補の存在下におけるALPレベルの測定に基づく。アッセイは、以下の特徴によって特徴付けられる。
Z’=1-3(σp+σn)/Iμp+μnI
ここで、σ=標準偏差、μ=平均、p=陽性(BMPあり)、n=陰性(BMPなし)及びI=値
RR-EAEモデルを用いた疾患進行に対するインビボでのSMの効果
上記実施例1で確認された小分子阻害剤の効果を、SJLマウスにおいて実験的自己免疫性脳脊髄炎(EAE)モデルを用いてインビボで更に試験した。EAEは、再発寛解型多発性硬化症(MS)のモデルとして役立つ。EAEを実験手順の項に記載のように誘導した。SM1~9又はビヒクル単独(5%DMSOのPBS溶液)を、250μg/マウス(10mg/kg/日)の腹腔内注射によって、免疫化後9日目から開始して次の30日間毎日投与した。動物を誘導後45日目までEAEの症候についてモニターし、以下のようにスコア化した:0=疾患なし、1=尾部麻痺、2=後肢虚弱、3=後肢麻痺、4=後肢+前肢麻痺及び5=瀕死。
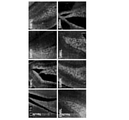
EAEにおける脱髄に対するSM1、SM6、SM7及びSM9の効果
脱髄及び再ミエリン化プロセスに対するSMの直接効果を分析した。脊髄を各群の6匹のマウスから取り出し、脊髄の腰部を切断し(10μm冠状パラフィン切片)、ミエリン及び浸潤部染色のためにLFB-H&E(ルクソールファストブルーとH&E)処理した。図6Aに示すように、浸潤部及び脱髄の数の増加がビヒクル処置群において認められた。すべての検査したSMで有髄領域%のわずかな上昇傾向があったが(図6B)、有意な効果は、10mg/kg SM7(10mg/kg SM7処置群における34.0±0.8%対ビヒクルにおける28.3±1.8% p=0.04、高投与量は毒性のために検査されなかった)、20mg/kg SM9(34.6±1.6%、p=0.03)、及び10mg/kg SM6(34.8±1.6%=p,0.03)で認められた。これらの結果は、これらのSM処置に応答した再ミエリン化プロセスの増加若しくは脱髄の減少又はその両方を示している可能性がある。
インビトロでの神経形成に対するSM1、SM7及びSM9の効果
次に、P19分化モデルにおける神経形成に対する小分子の効果を測定した。マウス胚由来の奇形癌腫細胞であるP19細胞は、レチノイン酸(RA)刺激に応答してニューロンに分化し、この分化は、rhBMP-2(骨形成タンパク質-2)の添加によって阻止され得ることが実証された[8]。ニューロン分化はニューロンマーカーMAP-2の発現によって表され、BMP-2の添加はこのマーカーのレベルを低下させる。マウス抗BMP-2/4モノクローナル抗体の添加は、BMP-2の効果を逆転させ、ニューロン表現型の獲得を誘導する。したがって、P19細胞におけるニューロンマーカーMAP-2の発現に対するSM1、SM7及びSM9の効果をRA及びBMP-2の存在下で調べた。3つの分子濃度を試験した:0.625μM、1.25μM及び2.5μM。
P19細胞におけるSMADシグナル伝達に対するSM1、SM7及びSM9の効果
標準的なBMPシグナルは、SMADリン酸化を介して媒介されることが知られている。BMPは、I及びII型セリン/スレオニンキナーゼ受容体の複合体に結合することによってシグナルを伝達する。リガンド結合は、受容体のリン酸化を誘導し、次いで受容体Smad(R-Smad)1、5及び8を介して標準的なシグナル伝達を活性化する。R-Smadは、活性化I型受容体によってリン酸化される。次いで、それらはSmad4と複合し、核移行を誘発する[16]。P19細胞においてBMP-2による刺激に応答して誘導される標準的なSMAD1/5/8シグナル伝達のリン酸化に対するSMの効果を調べた。
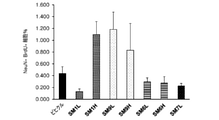
BMP-4阻害に対するSM1、SM7、SM9及びSM6の効果
BMP-2とBMP-4の高い相同性のために、BMP-2及びBMP-4シグナル伝達を阻害するSMの能力も調べた(抗BMP-2/4mAbの効果と同様)。ATDC5細胞の刺激のためにrhBMP-4をrhBMP-2の代わりに使用した以外は、スクリーニングに使用した同じバイオアッセイ(すなわち、ALP及び生存率検出を伴うATDC5バイオアッセイ)によってBMP-4中和を分析した。
図9に示すように、SM1とSM6は、BMP-4及びBMP-2によって誘導されるALP産生に対して同じ効果を有した。SM7とSM9のどちらも、BMP-4よりもわずかに大きくBMP-2を阻害すると思われた(2.5μM SM7の場合、BMP-4の29.8%阻害に比べてBMP-2の47.3%阻害、及び2.5μM SM9の場合、BMP-4の18.9%阻害に比べてBMP-2の29.1%阻害)。
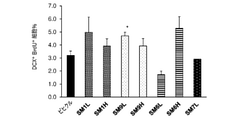
脳室下帯(SVZ)及び顆粒細胞下層(SGZ)における神経芽細胞マーカーダブルコルチン(DCX)の新規発現に対するSM1、SM7、SM9及びSM6の効果
RR-EAEを誘導したマウスに小分子SM1、SM7、SM9、SM6又は対応するビヒクル250μg/マウス(低-L)又は500μg/マウス(高-H)を腹腔内注射した。SMを免疫化後9日目から30日間毎日注射した。免疫組織化学分析では、各群の3匹のマウスに免疫化後9日目から8日間ブロモ-2’-デオキシウリジン(BrdU)を毎日腹腔内注射した。図10A~10Bを見て分かるように、EAEマウスのSVZにおけるBrdU+DCX+細胞の定量化によれば、SM9L(低用量のSM9)はBrdU+DCX+細胞において有意な増加をもたらした。対照ビヒクルに比べてSM9H、SM1L、SM1H及びSM6HによるBrdU+DCX+細胞の誘導の増加傾向も結果から明らかである。
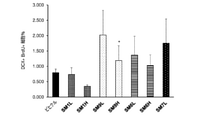
図11A~11Bは、SM又はビヒクル処置後のEAEマウスにおけるBrdU+DCX+細胞の免疫組織化学的標識化を示す。BrdU+DCX+細胞の定量化から、ビヒクル処置に比べてSM9L、SM6L及びSM7Lによって誘導されたBrdU+DCX+細胞の増加傾向と共に、SM9HによるSGZにおけるBrdU+DCX+細胞の有意な誘導増加が明らかになった。
SGZにおける成熟ニューロンマーカーNeuNの新規発現に対するSM1、SM7、SM9及びSM6の効果。
この実験では、マウスのSGZにおけるBrdU+NeuN+細胞の量を評価した。図12A~12Bは、Olympus8.1顕微鏡(倍率10倍)を用いた、SM又はビヒクルで処置されたEAEマウスにおけるBrdU+NeuN+細胞の免疫組織化学的標識化を示す。BrdU+NeuN+細胞の定量化から、ビヒクル処置に比べてSM9Hによって誘導されたBrdU+NeuN+細胞の増加傾向と共に、SM1H及びSM9L処置マウスによるSGZにおけるBrdU+NeuN+細胞の有意な誘導増加が明らかになった。
背景として本開示の主題に関連すると考えられる参考文献を以下に示す。
[1]Trapp,B.D.and Nave,K.A.Annu.Rev.Neurosci.2008;31:247-269.
[2]Grinspan J.B.(2015)Vitamins and Hormones,Chapter 6,volume 99,pages 195-222.
[3]US 2015/139983
[4]US 2008/0249038
[5]Simonini M.V.et al.ASN Neuro.2010 Jan 15;2(1);e00025
[6]Li D.et al.Hippocampus 2008;18:692-8
[7]Mabie P.C.et al.J.Neurosci.1997,17:4112-4120
[8]Gross R.E.et al.Neuron 1996,17:595-606
[9]Gomes W.A.et al.Dev.Biol.2003,255:164-177
[10]Lim D.A.et al.Neuron 2000,28:713-726
[11]WO 11/019678
[12]US 2006217390
[13]WO 03/105857
[14]US 2004039037
[15]Kurtzke,J.F.neurology 1983:33(11):1444-1452
[16]Bani-Yaghoub M,Felker JM,Sans C,Naus CC.Exp Neurol.2000;162:13-26.
[17]WO 2013/186777
Claims (12)
- 一般式(I)の化合物又はその塩を含む医薬組成物であって、
X1及びX2は各々独立にS、O又はN-R4であり、R4は、H、アルキル、シクロアルキル、アリール及びヘテロアリールからなる群から選択され、
X3は、CN、ハロゲン、NO2、CO-X9及びSO2X9からなる群から選択され、X9は、OH、O-及びNH2からなる群から選択され、
X4、X5、X6、X7及びX8は、H、アルキル、シクロアルキル、アリール、アミン、ハロゲン、アルコキシ、ヒドロキシ、ヘテロアリール、NO2、CN、CO-X10及びSO2X10からなる群から各々独立に選択され、X10は、OH、O-及びNH2からなる群から選択され、
R1とR2の一方は存在せず、他方のR1及びR2は、H、アルキル、シクロアルキル、アリール、アミン、ハロゲン、アルコキシ、ヘテロアリール、CN、CO-X11及びSO2X11からなる群から選択され、X11は、OH、O-及びNH2からなる群から選択され、
R3は、OR5、O-及びNR6R7からなる群から選択され、R5、R6及びR7は、H、アルキル、シクロアルキル及びアリールからなる群から各々独立に選択され、
点線の各々は独立に単結合又は二重結合である、
医薬組成物。 - 神経炎症性疾患の処置に使用される、請求項1に記載の医薬組成物。
- 前記処置が追加の治療薬を更に含む、請求項2に記載の医薬組成物。
- 前記神経炎症性疾患が多発性硬化症である、請求項2又は3に記載の医薬組成物。
- 前記多発性硬化症が再発寛解型多発性硬化症である、請求項4に記載の医薬組成物。
- X 1 及びX 2 は各々Sである請求項6に記載の医薬組成物。
- X 3 はCNである請求項6に記載の医薬組成物。
- X 4 、X 5 、X 6 、X 7 及びX 8 は各々Hである請求項6に記載の医薬組成物。
- R 1 はHである請求項6に記載の医薬組成物。
- R 3 はOR 5 であり、R 5 はメチル又はエチルである請求項6に記載の医薬組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| IL251949A IL251949A0 (en) | 2017-04-26 | 2017-04-26 | Small organic molecules for use in the treatment of neuro-inflammatory diseases |
| IL251949 | 2017-04-26 | ||
| PCT/IL2018/050463 WO2018198123A1 (en) | 2017-04-26 | 2018-04-26 | Small organic molecules for use in the treatment of neuroinflammatory disorders |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020517678A JP2020517678A (ja) | 2020-06-18 |
| JP2020517678A5 JP2020517678A5 (ja) | 2021-04-01 |
| JP6997800B2 true JP6997800B2 (ja) | 2022-02-04 |
Family
ID=62454780
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019557789A Active JP6997800B2 (ja) | 2017-04-26 | 2018-04-26 | 神経炎症性障害の処置に使用される小有機分子 |
Country Status (9)
| Country | Link |
|---|---|
| US (2) | US11103479B2 (ja) |
| EP (1) | EP3615022B1 (ja) |
| JP (1) | JP6997800B2 (ja) |
| CN (1) | CN110869015B (ja) |
| AU (1) | AU2018260535B2 (ja) |
| CA (1) | CA3061296A1 (ja) |
| ES (1) | ES2948767T3 (ja) |
| IL (2) | IL251949A0 (ja) |
| WO (1) | WO2018198123A1 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019122202A1 (en) * | 2017-12-20 | 2019-06-27 | Ecole Polytechnique Federale De Lausanne (Epfl) | Sting inhibitors |
| WO2019236890A1 (en) * | 2018-06-07 | 2019-12-12 | Disarm Therapeutics, Inc. | Inhibitors of sarm1 |
| US12083114B2 (en) * | 2018-12-19 | 2024-09-10 | Disarm Therapeutics, Inc. | Inhibitors of SARM1 in combination with neuro-protective agents |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005538060A (ja) | 2002-06-12 | 2005-12-15 | ケモセントリックス, インコーポレイテッド | 抗炎症性組成物および使用の方法 |
| CN1807411A (zh) | 2006-02-20 | 2006-07-26 | 中国医学科学院医药生物技术研究所 | 一组具有上调骨形成蛋白bmp-2表达活性的五元不饱和杂环化合物 |
| JP2011514908A (ja) | 2008-03-13 | 2011-05-12 | ザ ジェネラル ホスピタル コーポレイション | Bmpシグナル伝達経路のインヒビター |
| JP2012105555A (ja) | 2010-11-15 | 2012-06-07 | Kitasato Institute | 骨分化阻害剤およびその製造方法 |
| JP2012533545A (ja) | 2009-07-14 | 2012-12-27 | ベス・イスラエル・ディーコネス・メディカル・センター,インコーポレイテッド | 肝臓の増殖を増大させる方法 |
| WO2013186777A2 (en) | 2012-06-14 | 2013-12-19 | The Medical Researth, Infrastructure, And Health Services Fund Of The Tel Aviv Medical Center | Use of blocking agents of bone morphogenie protein (bmp) signaling for the treatment of neuroinflammatory and neurodegenerative diseases |
| JP2016515119A (ja) | 2013-03-14 | 2016-05-26 | ザ ブリガム アンド ウィメンズ ホスピタル インコーポレイテッドThe Brigham and Women’s Hospital, Inc. | Bmp阻害剤およびその使用方法 |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MY109202A (en) | 1992-07-10 | 1996-12-31 | Nihon Nohyaku Co Ltd | Isothiazole derivatives and processes for preparing the same as well as termite controlling agents comprising the same as active ingredient |
| IT1313601B1 (it) | 1999-08-05 | 2002-09-09 | Isagro Ricerca Srl | Fenilpirazoli ad attivita' erbicida |
| EP1088822A1 (en) * | 1999-09-28 | 2001-04-04 | Applied Research Systems ARS Holding N.V. | Pharmaceutically active sulfonyl hydrazide derivatives |
| US6989451B2 (en) | 2002-06-04 | 2006-01-24 | Valeant Research & Development | Heterocyclic compounds and uses thereof |
| GB0306357D0 (en) | 2003-03-20 | 2003-04-23 | Astrazeneca Ab | Chemical compounds |
| US20080249038A1 (en) | 2003-10-07 | 2008-10-09 | Quark Biotech, Inc. | Bone Morphogenetic Protein (Bmp) 2A and Uses Thereof |
| US20060217390A1 (en) | 2005-02-24 | 2006-09-28 | Esmir Gunic | Cycloalkl, aryl and heteroaryl amino isothiazoles for the treatment of Hepatitis C virus |
| WO2006124874A2 (en) | 2005-05-12 | 2006-11-23 | Kalypsys, Inc. | Inhibitors of b-raf kinase |
| JP2010501560A (ja) * | 2006-08-21 | 2010-01-21 | シンタ ファーマシューティカルズ コーポレーション | 増殖性障害を治療するための化合物 |
| WO2008118626A2 (en) | 2007-03-08 | 2008-10-02 | Burnham Institute For Medical Research | Inhibitors of jnk and methods for identifying inhibitors of jnk |
| CA2770894A1 (en) | 2009-08-11 | 2011-02-17 | Allergan, Inc. | Isothiozoles for treating conditions of the eye |
| WO2016025129A1 (en) | 2014-08-14 | 2016-02-18 | Alhamadsheh Mamoun M | Conjugation of pharmaceutically active agents with transthyretin ligands through adjustable linkers to increase serum half-life |
-
2017
- 2017-04-26 IL IL251949A patent/IL251949A0/en unknown
-
2018
- 2018-04-26 EP EP18791845.3A patent/EP3615022B1/en active Active
- 2018-04-26 AU AU2018260535A patent/AU2018260535B2/en active Active
- 2018-04-26 CN CN201880043208.8A patent/CN110869015B/zh active Active
- 2018-04-26 US US16/606,114 patent/US11103479B2/en active Active
- 2018-04-26 JP JP2019557789A patent/JP6997800B2/ja active Active
- 2018-04-26 CA CA3061296A patent/CA3061296A1/en active Pending
- 2018-04-26 WO PCT/IL2018/050463 patent/WO2018198123A1/en unknown
- 2018-04-26 ES ES18791845T patent/ES2948767T3/es active Active
-
2019
- 2019-10-07 IL IL269894A patent/IL269894B/en unknown
-
2021
- 2021-07-22 US US17/382,664 patent/US11779565B2/en active Active
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005538060A (ja) | 2002-06-12 | 2005-12-15 | ケモセントリックス, インコーポレイテッド | 抗炎症性組成物および使用の方法 |
| CN1807411A (zh) | 2006-02-20 | 2006-07-26 | 中国医学科学院医药生物技术研究所 | 一组具有上调骨形成蛋白bmp-2表达活性的五元不饱和杂环化合物 |
| JP2011514908A (ja) | 2008-03-13 | 2011-05-12 | ザ ジェネラル ホスピタル コーポレイション | Bmpシグナル伝達経路のインヒビター |
| JP2012533545A (ja) | 2009-07-14 | 2012-12-27 | ベス・イスラエル・ディーコネス・メディカル・センター,インコーポレイテッド | 肝臓の増殖を増大させる方法 |
| JP2012105555A (ja) | 2010-11-15 | 2012-06-07 | Kitasato Institute | 骨分化阻害剤およびその製造方法 |
| WO2013186777A2 (en) | 2012-06-14 | 2013-12-19 | The Medical Researth, Infrastructure, And Health Services Fund Of The Tel Aviv Medical Center | Use of blocking agents of bone morphogenie protein (bmp) signaling for the treatment of neuroinflammatory and neurodegenerative diseases |
| JP2016515119A (ja) | 2013-03-14 | 2016-05-26 | ザ ブリガム アンド ウィメンズ ホスピタル インコーポレイテッドThe Brigham and Women’s Hospital, Inc. | Bmp阻害剤およびその使用方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN110869015A (zh) | 2020-03-06 |
| ES2948767T3 (es) | 2023-09-18 |
| EP3615022C0 (en) | 2023-06-07 |
| CN110869015B (zh) | 2023-08-18 |
| US11779565B2 (en) | 2023-10-10 |
| AU2018260535A1 (en) | 2019-10-31 |
| JP2020517678A (ja) | 2020-06-18 |
| AU2018260535B2 (en) | 2023-09-28 |
| EP3615022A1 (en) | 2020-03-04 |
| IL269894B (en) | 2022-03-01 |
| US20210393582A1 (en) | 2021-12-23 |
| IL251949A0 (en) | 2017-07-31 |
| WO2018198123A1 (en) | 2018-11-01 |
| EP3615022B1 (en) | 2023-06-07 |
| US11103479B2 (en) | 2021-08-31 |
| EP3615022A4 (en) | 2021-03-31 |
| CA3061296A1 (en) | 2018-11-01 |
| US20200046680A1 (en) | 2020-02-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11912998B2 (en) | Method of treating aging-associated cognitive impairment by reducing CCR3 | |
| US10626399B2 (en) | Methods of treating cognitive symptoms of an aging-associated impairment by modulating C-C chemokine receptor type 3 (CCR3) | |
| JP7323561B2 (ja) | 老化に関連した障害を処置するための方法及び組成物 | |
| JP5704785B2 (ja) | 免疫抑制のためのflt3阻害剤 | |
| Zhang et al. | Protective effect of melatonin on soluble Aβ 1–42-induced memory impairment, astrogliosis, and synaptic dysfunction via the Musashi1/Notch1/Hes1 signaling pathway in the rat hippocampus | |
| US9469653B2 (en) | Pharmaceutical compositions for preventing or treating degenerative brain disease and method of screening the same | |
| JP6870988B2 (ja) | 神経細胞増幅及び中枢神経系障害治療のためのセレブロンの活性化因子の使用方法 | |
| JP7212781B2 (ja) | 神経保護剤と組み合わせたsarm1の阻害剤 | |
| US11779565B2 (en) | Small organic molecules for use in the treatment of neuroinflammatory disorders | |
| US20030082802A1 (en) | Method for neural stem cell differentiation using 5ht1a agonists | |
| WO2018183679A1 (en) | Methods and compositions for modulating gene expression | |
| US10149836B2 (en) | Isoxazole treatments for frontotemporal dementia | |
| JP6709493B2 (ja) | 進行性骨化性線維異形成症治療剤 | |
| JP2023505063A (ja) | トレフォイル因子ファミリーメンバー2モジュレーターによる老化関連障害処置のための方法および組成物 | |
| US20180298102A1 (en) | Methods and compositions for treating aging-associated impairments | |
| JP2020500197A (ja) | 骨格筋肥大誘発剤としてのlsd1阻害剤 | |
| McPhail | Targeting neuroinflammation in mTORC1 driven brain tumours | |
| WO2020186217A1 (en) | Methods and compositions for treatment of lysosomal storage disorder | |
| JP2017132742A (ja) | Aβオリゴマー特異的抗体の新規薬理用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210217 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210217 |
|
| TRDD | Decision of grant or rejection written | ||
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20211116 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20211124 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20211217 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6997800 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |