JP6992960B2 - キナーゼ阻害剤の用途 - Google Patents
キナーゼ阻害剤の用途 Download PDFInfo
- Publication number
- JP6992960B2 JP6992960B2 JP2016536145A JP2016536145A JP6992960B2 JP 6992960 B2 JP6992960 B2 JP 6992960B2 JP 2016536145 A JP2016536145 A JP 2016536145A JP 2016536145 A JP2016536145 A JP 2016536145A JP 6992960 B2 JP6992960 B2 JP 6992960B2
- Authority
- JP
- Japan
- Prior art keywords
- benzo
- compound
- kinase
- pyridazine
- kinases
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 229940043355 kinase inhibitor Drugs 0.000 title description 6
- 239000003757 phosphotransferase inhibitor Substances 0.000 title description 6
- -1 6,7-dihydro-5H-benzo [6,7] cyclohepta [1,2-c] pyridazine- 3 -yl Chemical group 0.000 claims description 84
- 101100262697 Mus musculus Axl gene Proteins 0.000 claims description 45
- 150000001875 compounds Chemical class 0.000 claims description 45
- 230000035772 mutation Effects 0.000 claims description 36
- 201000010099 disease Diseases 0.000 claims description 35
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 35
- 230000002018 overexpression Effects 0.000 claims description 24
- 101100268645 Caenorhabditis elegans abl-1 gene Proteins 0.000 claims description 16
- 230000004913 activation Effects 0.000 claims description 15
- 230000002265 prevention Effects 0.000 claims description 9
- 229940079593 drug Drugs 0.000 claims description 6
- 239000003814 drug Substances 0.000 claims description 6
- 125000004214 1-pyrrolidinyl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 claims description 4
- 206010016654 Fibrosis Diseases 0.000 claims description 3
- 230000004761 fibrosis Effects 0.000 claims description 3
- 239000008186 active pharmaceutical agent Substances 0.000 claims description 2
- 206010019668 Hepatic fibrosis Diseases 0.000 claims 1
- 239000000825 pharmaceutical preparation Substances 0.000 claims 1
- 229940127557 pharmaceutical product Drugs 0.000 claims 1
- DMEGYFMYUHOHGS-UHFFFAOYSA-N cycloheptane Chemical compound C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 120
- 108091000080 Phosphotransferase Proteins 0.000 description 115
- 102000020233 phosphotransferase Human genes 0.000 description 115
- 210000004027 cell Anatomy 0.000 description 82
- 229940126062 Compound A Drugs 0.000 description 68
- NLDMNSXOCDLTTB-UHFFFAOYSA-N Heterophylliin A Natural products O1C2COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC2C(OC(=O)C=2C=C(O)C(O)=C(O)C=2)C(O)C1OC(=O)C1=CC(O)=C(O)C(O)=C1 NLDMNSXOCDLTTB-UHFFFAOYSA-N 0.000 description 68
- 230000000694 effects Effects 0.000 description 28
- 238000000034 method Methods 0.000 description 28
- 238000003556 assay Methods 0.000 description 23
- 101000932478 Homo sapiens Receptor-type tyrosine-protein kinase FLT3 Proteins 0.000 description 22
- 206010028980 Neoplasm Diseases 0.000 description 21
- 102100020718 Receptor-type tyrosine-protein kinase FLT3 Human genes 0.000 description 21
- 238000012360 testing method Methods 0.000 description 19
- 230000005764 inhibitory process Effects 0.000 description 18
- 102000001253 Protein Kinase Human genes 0.000 description 17
- 108060006633 protein kinase Proteins 0.000 description 17
- 108090000623 proteins and genes Proteins 0.000 description 15
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 description 12
- 108090000672 Annexin A5 Proteins 0.000 description 11
- 102000004121 Annexin A5 Human genes 0.000 description 11
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 11
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 11
- 241000699670 Mus sp. Species 0.000 description 11
- 201000011510 cancer Diseases 0.000 description 11
- 102200039431 rs121913488 Human genes 0.000 description 11
- 102100022014 Angiopoietin-1 receptor Human genes 0.000 description 10
- 230000027455 binding Effects 0.000 description 10
- 238000001516 cell proliferation assay Methods 0.000 description 10
- 125000001072 heteroaryl group Chemical group 0.000 description 10
- 125000003710 aryl alkyl group Chemical group 0.000 description 9
- 239000003112 inhibitor Substances 0.000 description 9
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 8
- 125000000217 alkyl group Chemical group 0.000 description 8
- 201000011243 gastrointestinal stromal tumor Diseases 0.000 description 8
- 230000014509 gene expression Effects 0.000 description 8
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 8
- 229960002411 imatinib Drugs 0.000 description 8
- 230000002401 inhibitory effect Effects 0.000 description 8
- 238000003752 polymerase chain reaction Methods 0.000 description 8
- JUJBNYBVVQSIOU-UHFFFAOYSA-M sodium;4-[2-(4-iodophenyl)-3-(4-nitrophenyl)tetrazol-2-ium-5-yl]benzene-1,3-disulfonate Chemical compound [Na+].C1=CC([N+](=O)[O-])=CC=C1N1[N+](C=2C=CC(I)=CC=2)=NC(C=2C(=CC(=CC=2)S([O-])(=O)=O)S([O-])(=O)=O)=N1 JUJBNYBVVQSIOU-UHFFFAOYSA-M 0.000 description 8
- 206010051066 Gastrointestinal stromal tumour Diseases 0.000 description 7
- 230000001640 apoptogenic effect Effects 0.000 description 7
- 238000005259 measurement Methods 0.000 description 7
- 101150082854 Mertk gene Proteins 0.000 description 6
- 125000003342 alkenyl group Chemical group 0.000 description 6
- 230000006907 apoptotic process Effects 0.000 description 6
- 125000003118 aryl group Chemical group 0.000 description 6
- 210000001185 bone marrow Anatomy 0.000 description 6
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 6
- 125000001188 haloalkyl group Chemical group 0.000 description 6
- 125000000623 heterocyclic group Chemical group 0.000 description 6
- 108020004414 DNA Proteins 0.000 description 5
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 5
- 125000002947 alkylene group Chemical group 0.000 description 5
- 125000004093 cyano group Chemical group *C#N 0.000 description 5
- 238000011161 development Methods 0.000 description 5
- 125000004415 heterocyclylalkyl group Chemical group 0.000 description 5
- 229910052739 hydrogen Inorganic materials 0.000 description 5
- 239000001257 hydrogen Substances 0.000 description 5
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 5
- 239000002609 medium Substances 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 238000012163 sequencing technique Methods 0.000 description 5
- 125000003107 substituted aryl group Chemical group 0.000 description 5
- 125000005346 substituted cycloalkyl group Chemical group 0.000 description 5
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 4
- 101150077555 Ret gene Proteins 0.000 description 4
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 4
- 102100037236 Tyrosine-protein kinase receptor UFO Human genes 0.000 description 4
- 101150040313 Wee1 gene Proteins 0.000 description 4
- 125000004450 alkenylene group Chemical group 0.000 description 4
- 125000000304 alkynyl group Chemical group 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 230000003833 cell viability Effects 0.000 description 4
- 238000006243 chemical reaction Methods 0.000 description 4
- 125000005356 cycloalkylalkenyl group Chemical group 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- 125000000262 haloalkenyl group Chemical group 0.000 description 4
- 125000000232 haloalkynyl group Chemical group 0.000 description 4
- 125000004447 heteroarylalkenyl group Chemical group 0.000 description 4
- 125000005312 heteroarylalkynyl group Chemical group 0.000 description 4
- 125000004449 heterocyclylalkenyl group Chemical group 0.000 description 4
- 238000000338 in vitro Methods 0.000 description 4
- 238000001727 in vivo Methods 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- 230000001338 necrotic effect Effects 0.000 description 4
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 4
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 4
- 230000035755 proliferation Effects 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 238000003753 real-time PCR Methods 0.000 description 4
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 4
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 4
- 229960001796 sunitinib Drugs 0.000 description 4
- 229940104230 thymidine Drugs 0.000 description 4
- 102000004506 Blood Proteins Human genes 0.000 description 3
- 108010017384 Blood Proteins Proteins 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 101000753291 Homo sapiens Angiopoietin-1 receptor Proteins 0.000 description 3
- 101001018141 Homo sapiens Mitogen-activated protein kinase kinase kinase 2 Proteins 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 102100033058 Mitogen-activated protein kinase kinase kinase 2 Human genes 0.000 description 3
- 101100335081 Mus musculus Flt3 gene Proteins 0.000 description 3
- 102100028286 Proto-oncogene tyrosine-protein kinase receptor Ret Human genes 0.000 description 3
- 101150094923 STK10 gene Proteins 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 150000001413 amino acids Chemical class 0.000 description 3
- 239000012472 biological sample Substances 0.000 description 3
- 230000003197 catalytic effect Effects 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 125000005357 cycloalkylalkynyl group Chemical group 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 231100000673 dose–response relationship Toxicity 0.000 description 3
- 102000037865 fusion proteins Human genes 0.000 description 3
- 108020001507 fusion proteins Proteins 0.000 description 3
- 125000005843 halogen group Chemical group 0.000 description 3
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 102000054765 polymorphisms of proteins Human genes 0.000 description 3
- 125000006413 ring segment Chemical group 0.000 description 3
- 239000007790 solid phase Substances 0.000 description 3
- 125000001424 substituent group Chemical group 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 230000002103 transcriptional effect Effects 0.000 description 3
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 2
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 2
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 2
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 2
- 102000053602 DNA Human genes 0.000 description 2
- 101150009958 FLT4 gene Proteins 0.000 description 2
- 101150048336 Flt1 gene Proteins 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- 206010064571 Gene mutation Diseases 0.000 description 2
- 101000648174 Homo sapiens Serine/threonine-protein kinase 10 Proteins 0.000 description 2
- 101000820294 Homo sapiens Tyrosine-protein kinase Yes Proteins 0.000 description 2
- 101000807561 Homo sapiens Tyrosine-protein kinase receptor UFO Proteins 0.000 description 2
- 101000851018 Homo sapiens Vascular endothelial growth factor receptor 1 Proteins 0.000 description 2
- 101000621390 Homo sapiens Wee1-like protein kinase Proteins 0.000 description 2
- 101000621401 Homo sapiens Wee1-like protein kinase 2 Proteins 0.000 description 2
- 238000003563 KINOMEScan assay Methods 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 201000003793 Myelodysplastic syndrome Diseases 0.000 description 2
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 2
- 108010014608 Proto-Oncogene Proteins c-kit Proteins 0.000 description 2
- 102000016971 Proto-Oncogene Proteins c-kit Human genes 0.000 description 2
- 102100028900 Serine/threonine-protein kinase 10 Human genes 0.000 description 2
- 108020004682 Single-Stranded DNA Proteins 0.000 description 2
- 108091077436 Tam family Proteins 0.000 description 2
- 102100022356 Tyrosine-protein kinase Mer Human genes 0.000 description 2
- 102100021788 Tyrosine-protein kinase Yes Human genes 0.000 description 2
- 102000016663 Vascular Endothelial Growth Factor Receptor-3 Human genes 0.000 description 2
- 108010053100 Vascular Endothelial Growth Factor Receptor-3 Proteins 0.000 description 2
- 102100033178 Vascular endothelial growth factor receptor 1 Human genes 0.000 description 2
- 102100033179 Vascular endothelial growth factor receptor 3 Human genes 0.000 description 2
- 102100023037 Wee1-like protein kinase Human genes 0.000 description 2
- 102100023040 Wee1-like protein kinase 2 Human genes 0.000 description 2
- 108700025690 abl Genes Proteins 0.000 description 2
- 125000004419 alkynylene group Chemical group 0.000 description 2
- 229940024606 amino acid Drugs 0.000 description 2
- 125000000539 amino acid group Chemical group 0.000 description 2
- 238000003782 apoptosis assay Methods 0.000 description 2
- 108010023337 axl receptor tyrosine kinase Proteins 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 238000001574 biopsy Methods 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000002798 bone marrow cell Anatomy 0.000 description 2
- 108010018804 c-Mer Tyrosine Kinase Proteins 0.000 description 2
- 238000012875 competitive assay Methods 0.000 description 2
- 238000007405 data analysis Methods 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- 238000003364 immunohistochemistry Methods 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 238000011068 loading method Methods 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 208000023356 medullary thyroid gland carcinoma Diseases 0.000 description 2
- 238000011880 melting curve analysis Methods 0.000 description 2
- 239000000203 mixture Substances 0.000 description 2
- 230000000869 mutational effect Effects 0.000 description 2
- 208000025113 myeloid leukemia Diseases 0.000 description 2
- 230000001613 neoplastic effect Effects 0.000 description 2
- 125000004043 oxo group Chemical group O=* 0.000 description 2
- 208000028591 pheochromocytoma Diseases 0.000 description 2
- 210000004214 philadelphia chromosome Anatomy 0.000 description 2
- 239000000902 placebo Substances 0.000 description 2
- 229940068196 placebo Drugs 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 238000007619 statistical method Methods 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 238000010998 test method Methods 0.000 description 2
- 125000000464 thioxo group Chemical group S=* 0.000 description 2
- 241001430294 unidentified retrovirus Species 0.000 description 2
- 230000035899 viability Effects 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- KZKRRZFCAYOXQE-UHFFFAOYSA-N 1$l^{2}-azinane Chemical group C1CC[N]CC1 KZKRRZFCAYOXQE-UHFFFAOYSA-N 0.000 description 1
- TZCPCKNHXULUIY-RGULYWFUSA-N 1,2-distearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCC TZCPCKNHXULUIY-RGULYWFUSA-N 0.000 description 1
- IEQAICDLOKRSRL-UHFFFAOYSA-N 2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-(2-dodecoxyethoxy)ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethanol Chemical compound CCCCCCCCCCCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCO IEQAICDLOKRSRL-UHFFFAOYSA-N 0.000 description 1
- WEVYNIUIFUYDGI-UHFFFAOYSA-N 3-[6-[4-(trifluoromethoxy)anilino]-4-pyrimidinyl]benzamide Chemical compound NC(=O)C1=CC=CC(C=2N=CN=C(NC=3C=CC(OC(F)(F)F)=CC=3)C=2)=C1 WEVYNIUIFUYDGI-UHFFFAOYSA-N 0.000 description 1
- 102000000412 Annexin Human genes 0.000 description 1
- 108050008874 Annexin Proteins 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 1
- 101100421200 Caenorhabditis elegans sep-1 gene Proteins 0.000 description 1
- 101100315627 Caenorhabditis elegans tyr-3 gene Proteins 0.000 description 1
- 208000002177 Cataract Diseases 0.000 description 1
- 101710088194 Dehydrogenase Proteins 0.000 description 1
- 208000007342 Diabetic Nephropathies Diseases 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 201000009273 Endometriosis Diseases 0.000 description 1
- 101150022345 GAS6 gene Proteins 0.000 description 1
- 206010018364 Glomerulonephritis Diseases 0.000 description 1
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 description 1
- 102100031487 Growth arrest-specific protein 6 Human genes 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000650322 Homo sapiens E3 ubiquitin-protein ligase Arkadia Proteins 0.000 description 1
- 101000923005 Homo sapiens Growth arrest-specific protein 6 Proteins 0.000 description 1
- 101001005556 Homo sapiens Mitogen-activated protein kinase kinase kinase 19 Proteins 0.000 description 1
- 101001059991 Homo sapiens Mitogen-activated protein kinase kinase kinase kinase 1 Proteins 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- 208000019693 Lung disease Diseases 0.000 description 1
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 1
- 239000007993 MOPS buffer Substances 0.000 description 1
- 102100025217 Mitogen-activated protein kinase kinase kinase 19 Human genes 0.000 description 1
- 102100028199 Mitogen-activated protein kinase kinase kinase kinase 1 Human genes 0.000 description 1
- 241000713869 Moloney murine leukemia virus Species 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 101001033276 Mus musculus Interleukin-3 Proteins 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- 150000001204 N-oxides Chemical class 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- 201000000023 Osteosclerosis Diseases 0.000 description 1
- 102000004316 Oxidoreductases Human genes 0.000 description 1
- 108090000854 Oxidoreductases Proteins 0.000 description 1
- 208000031481 Pathologic Constriction Diseases 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 206010036790 Productive cough Diseases 0.000 description 1
- 229940096437 Protein S Drugs 0.000 description 1
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 239000012979 RPMI medium Substances 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 229940127361 Receptor Tyrosine Kinase Inhibitors Drugs 0.000 description 1
- 208000006265 Renal cell carcinoma Diseases 0.000 description 1
- 208000017442 Retinal disease Diseases 0.000 description 1
- 206010038923 Retinopathy Diseases 0.000 description 1
- 208000034189 Sclerosis Diseases 0.000 description 1
- 102000040739 Secretory proteins Human genes 0.000 description 1
- 108091058545 Secretory proteins Proteins 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 208000007536 Thrombosis Diseases 0.000 description 1
- 206010052779 Transplant rejections Diseases 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 101150098329 Tyro3 gene Proteins 0.000 description 1
- 208000024248 Vascular System injury Diseases 0.000 description 1
- 208000012339 Vascular injury Diseases 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 206010047571 Visual impairment Diseases 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 239000011543 agarose gel Substances 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 230000000735 allogeneic effect Effects 0.000 description 1
- 230000008850 allosteric inhibition Effects 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000000118 anti-neoplastic effect Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 1
- 238000012742 biochemical analysis Methods 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 125000006309 butyl amino group Chemical group 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- 230000005907 cancer growth Effects 0.000 description 1
- 208000035269 cancer or benign tumor Diseases 0.000 description 1
- 230000001364 causal effect Effects 0.000 description 1
- 238000000423 cell based assay Methods 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 238000010822 cell death assay Methods 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 238000013043 cell viability test Methods 0.000 description 1
- 230000017455 cell-cell adhesion Effects 0.000 description 1
- 230000005754 cellular signaling Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 208000019425 cirrhosis of liver Diseases 0.000 description 1
- 230000015271 coagulation Effects 0.000 description 1
- 238000005345 coagulation Methods 0.000 description 1
- 230000006957 competitive inhibition Effects 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 239000013068 control sample Substances 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- 125000006311 cyclobutyl amino group Chemical group [H]N(*)C1([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000006312 cyclopentyl amino group Chemical group [H]N(*)C1([H])C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 238000004163 cytometry Methods 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 208000033679 diabetic kidney disease Diseases 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- 125000004914 dipropylamino group Chemical group C(CC)N(CCC)* 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 210000003608 fece Anatomy 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 102000034356 gene-regulatory proteins Human genes 0.000 description 1
- 108091006104 gene-regulatory proteins Proteins 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 238000012268 genome sequencing Methods 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 238000010562 histological examination Methods 0.000 description 1
- 102000049850 human FLT3 Human genes 0.000 description 1
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 1
- 238000007901 in situ hybridization Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 230000006662 intracellular pathway Effects 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 108020001756 ligand binding domains Proteins 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 230000000938 luteal effect Effects 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 230000002438 mitochondrial effect Effects 0.000 description 1
- 239000003068 molecular probe Substances 0.000 description 1
- VMGAPWLDMVPYIA-HIDZBRGKSA-N n'-amino-n-iminomethanimidamide Chemical compound N\N=C\N=N VMGAPWLDMVPYIA-HIDZBRGKSA-N 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 210000005170 neoplastic cell Anatomy 0.000 description 1
- 230000009826 neoplastic cell growth Effects 0.000 description 1
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 230000009437 off-target effect Effects 0.000 description 1
- 229940127084 other anti-cancer agent Drugs 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 230000002028 premature Effects 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 210000001948 pro-b lymphocyte Anatomy 0.000 description 1
- 125000006308 propyl amino group Chemical group 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 239000002287 radioligand Substances 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- BOLDJAUMGUJJKM-LSDHHAIUSA-N renifolin D Natural products CC(=C)[C@@H]1Cc2c(O)c(O)ccc2[C@H]1CC(=O)c3ccc(O)cc3O BOLDJAUMGUJJKM-LSDHHAIUSA-N 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 210000003296 saliva Anatomy 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000007480 sanger sequencing Methods 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- UNFWWIHTNXNPBV-WXKVUWSESA-N spectinomycin Chemical compound O([C@@H]1[C@@H](NC)[C@@H](O)[C@H]([C@@H]([C@H]1O1)O)NC)[C@]2(O)[C@H]1O[C@H](C)CC2=O UNFWWIHTNXNPBV-WXKVUWSESA-N 0.000 description 1
- 210000003802 sputum Anatomy 0.000 description 1
- 208000024794 sputum Diseases 0.000 description 1
- 208000037804 stenosis Diseases 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 238000012916 structural analysis Methods 0.000 description 1
- 125000004426 substituted alkynyl group Chemical group 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 208000019553 vascular disease Diseases 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 208000029257 vision disease Diseases 0.000 description 1
- 230000004393 visual impairment Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/50—Pyridazines; Hydrogenated pyridazines
- A61K31/502—Pyridazines; Hydrogenated pyridazines ortho- or peri-condensed with carbocyclic ring systems, e.g. cinnoline, phthalazine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4196—1,2,4-Triazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Hematology (AREA)
- Oncology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Description
R1、R4およびR5はそれぞれ独立して、水素、アルキル、アルケニル、アリール、アラルキル、-C(O)R8、-C(O)N(R6)R7、および-C(=NR6)N(R6)R7からなる群から選択され;
R2およびR3はそれぞれ独立して、オキソ、チオキソ、シアノ、ニトロ、ハロ、ハロアルキル、アルキル、置換されていてもよいシクロアルキル、置換されていてもよいシクロアルキルアルキル、置換されていてもよいアリール、置換されていてもよいアラルキル、置換されていてもよいヘテロアリール、置換されていてもよいヘテロシクリル、-R9-OR8、-R9-O-R10-OR8、-R9-O-R10-O-R10-OR8、-R9-O-R10-CN、-R9-O-R10-C(O)OR8、-R9-O-R10-C(O)N(R6)R7、-R9-O-R10-S(O)pR8(式中、pは0、1または2である)、-R9-O-R10-N(R6)R7、-R9-O-R10-C(NR11)N(R11)H、-R9-OC(O)-R8、-R9-N(R6)R7、-R9-C(O)R8、-R9-C(O)OR8、-R9-C(O)N(R6)R7、-R9-N(R6)C(O)OR8、-R9-N(R6)C(O)R8、-R9-N(R6)S(O)tR8(式中、tは1または2である)、-R9-S(O)tOR8(式中、tは1または2である)、-R9-S(O)pR8(式中、pは0、1または2である)、および-R9-S(O)tN(R6)R7(式中、tは1または2である)からなる群から選択される一つまたは複数の置換基により置換されていてもよい15個以上の環原子を含有する多環式ヘテロアリールであり;
あるいは、R2は上記のような15個以上の環原子を含有する多環式ヘテロアリールであり、R3はアリールおよびヘテロアリールからなる群から選択され、ここで前記アリールおよび前記ヘテロアリールはそれぞれ独立して、アルキル、アルケニル、アルキニル、ハロ、ハロアルキル、ハロアルケニル、ハロアルキニル、オキソ、チオキソ、シアノ、ニトロ、置換されていてもよいアリール、置換されていてもよいアラルキル、置換されていてもよいアラルケニル、置換されていてもよいアラルキニル、置換されていてもよいシクロアルキル、置換されていてもよいシクロアルキルアルキル、置換されていてもよいシクロアルキルアルケニル、置換されていてもよいシクロアルキルアルキニル、置換されていてもよいヘテロシクリル、置換されていてもよいヘテロシクリルアルキル、置換されていてもよいヘテロシクリルアルケニル、置換されていてもよいヘテロシクリルアルキニル、置換されていてもよいヘテロアリール、置換されていてもよいヘテロアリールアルキル、置換されていてもよいヘテロアリールアルケニル、置換されていてもよいヘテロアリールアルキニル、-R13-OR12、-R13-OC(O)-R12、-R13-O-R14-N(R12)2、-R13-N(R12)-R14-N(R12)2、-R13-N(R12)-R14-N(R12)2、-R13-N(R12)2、-R13-C(O)R12、-R13-C(O)OR12、-R13-C(O)N(R12)2、-R13-C(O)N(R12)-R14-N(R12)R13、-R13-C(O)N(R12)-R14-OR12、-R13-N(R12)C(O)OR12、-R13-N(R12)C(O)R12、-R13-N(R12)S(O)tR12(式中、tは1または2である)、-R13-S(O)tOR12(式中、tは1または2である)、-R13-S(O)pR12(式中、pは0,1または2である)、および-R13-S(O)tN(R12)2(式中、tは1または2である)からなる群から選択される一つまたは複数の置換基により置換されていてもよく;
あるいは、R3は上記のような15個以上の環原子を含有する多環式ヘテロアリールであり、R2はアリールおよびヘテロアリールからなる群から選択され、ここで前記アリールおよび前記ヘテロアリールはそれぞれ独立して、アルキル、アルケニル、アルキニル、ハロ、ハロアルキル、ハロアルケニル、ハロアルキニル、オキソ、チオキソ、シアノ、ニトロ、置換されていてもよいアリール、置換されていてもよいアラルキル、置換されていてもよいアラルケニル、置換されていてもよいアラルキニル、置換されていてもよいシクロ
アルキル、置換されていてもよいシクロアルキルアルキル、置換されていてもよいシクロアルキルアルケニル、置換されていてもよいシクロアルキルアルキニル、置換されていてもよいヘテロシクリル、置換されていてもよいヘテロシクリルアルキル、置換されていてもよいヘテロシクリルアルケニル、置換されていてもよいヘテロシクリルアルキニル、置換されていてもよいヘテロアリール、置換されていてもよいヘテロアリールアルキル、置換されていてもよいヘテロアリールアルケニル、置換されていてもよいヘテロアリールアルキニル、-R13-OR12、-R13-OC(O)-R12、-R13-O-R14-N(R12)2、-R13-N(R12)-R14-N(R12)2、-R13-N(R12)-R14-N(R12)2、-R13-N(R12)2、-R13-C(O)R12、-R13-C(O)OR12、-R13-C(O)N(R12)2、-R13-C(O)N(R12)-R14-N(R12)R13、-R13-C(O)N(R12)-R14-OR12、-R13-N(R12)C(O)OR12、-R13-N(R12)C(O)R12、-R13-N(R12)S(O)tR12(式中、tは1または2である)、-R13-S(O)tOR12(式中、tは1または2である)、-R13-S(O)pR12(式中、pは0,1または2である)、および-R13-S(O)tN(R12)2(式中、tは1または2である)からなる群から選択される一つまたは複数の置換基により置換されていてもよく;
それぞれのR6およびR7は独立して、水素、アルキル、アルケニル、アルキニル、ハロアルキル、ハロアルケニル、ハロアルキニル、ヒドロキシアルキル、置換されていてもよいアリール、置換されていてもよいアラルキル、置換されていてもよいアラルケニル、置換されていてもよいアラルキニル、置換されていてもよいシクロアルキル、置換されていてもよいシクロアルキルアルキル、置換されていてもよいシクロアルキルアルケニル、置換されていてもよいシクロアルキルアルキニル、置換されていてもよいヘテロシクリル、置換されていてもよいヘテロシクリルアルキル、置換されていてもよいヘテロシクリルアルケニル、置換されていてもよいヘテロシクリルアルキニル、置換されていてもよいヘテロアリール、置換されていてもよいヘテロアリールアルキル、置換されていてもよいヘテロアリールアルケニル、置換されていてもよいヘテロアリールアルキニル、-R10-OR8、-R10-CN、-R10-NO2、-R10-N(R8)2、-R10-C(O)OR8および-R10-C(O)N(R8)2からなる群から選択され、あるいは、あらゆるR6およびR7は、それらが共に結合している共通の窒素と一緒になって、置換されていてもよいN-ヘテロアリールまたは置換されていてもよいN-ヘテロシクリルを形成し;
各R8は独立して、水素、アルキル、アルケニル、アルキニル、ハロアルキル、ハロアルケニル、ハロアルキニル、置換されていてもよいアリール、置換されていてもよいアラルキル、置換されていてもよいアラルケニル、置換されていてもよいアラルキニル、置換されていてもよいシクロアルキル、置換されていてもよいシクロアルキルアルキル、置換されていてもよいシクロアルキルアルケニル、置換されていてもよいシクロアルキルアルキニル、置換されていてもよいヘテロシクリル、置換されていてもよいヘテロシクリルアルキル、置換されていてもよいヘテロシクリルアルケニル、置換されていてもよいヘテロシクリルアルキニル、置換されていてもよいヘテロアリール、置換されていてもよいヘテロアリールアルキル、置換されていてもよいヘテロアリールアルケニル、および置換されていてもよいヘテロアリールアルキニルからなる群から選択され;
各R9は独立して、直接的な結合、置換されていてもよい直鎖または分岐状のアルキレン鎖、置換されていてもよい直鎖または分岐状のアルケニレン鎖および置換されていてもよい直鎖または分岐状のアルキニレン鎖からなる群から選択され;
各R10は独立して、置換されていてもよい直鎖または分岐状のアルキレン鎖、置換されていてもよい直鎖または分岐状のアルケニレン鎖および置換されていてもよい直鎖または分岐状のアルキニレン鎖からなる群から選択され;
各R11は独立して、水素、アルキル、シアノ、ニトロおよび-OR8からなる群から選択され;
各R12は独立して、水素、アルキル、アルケニル、ハロアルキル、置換されていてもよいシクロアルキル、置換されていてもよいシクロアルキルアルキル、置換されていてもよいアリール、置換されていてもよいアラルキル、置換されていてもよいヘテロシクリル、置換されていてもよいヘテロシクリルアルキル、置換されていてもよいヘテロアリール、置換されていてもよいヘテロアリールアルキル、-R10-OR8、-R10-CN、-R10-NO2、-R10-N(R8)2、-R10-C(O)OR8および-R10-C(O)N(R8)2からなる群から選択され、あるいは、2つのR12は、それらが共に結合している共通の窒素と一緒になって、置換されていてもよいN-ヘテロシクリルまたは置換されていてもよいN-ヘテロアリールを形成し;
各R13は独立して、直接的な結合、置換されていてもよい直鎖または分岐状のアルキレン鎖および置換されていてもよい直鎖または分岐状のアルケニレン鎖からなる群から選択され;
各R14は独立して、置換されていてもよい直鎖または分岐状のアルキレン鎖および置換されていてもよい直鎖または分岐状のアルケニレン鎖からなる群から選択される。
症および腎移植拒絶反応)、肺障害(例えば、COPD)、骨粗しょう症、変形性関節症、ウイルス感染、線維症(例えば、肝線維症)並びに白内障が挙げられる。
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-(7-(ピロリジン-1-イル)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7-(S)-ピロリジン-1-イル)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7-(R)-ピロリジン-1-イル)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ピリド[2’,3’:6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-(3-フルオロ-4-(4-(ピロリジン-1-イル)ピペリジン-1-イル)フェニル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N5-(7-(ピロリジン-1-イル)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-1-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N5-(7-(S)-ピロリジン-1-イル-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(t-ブトキシカルボニルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-(7-(アセトアミド)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジア
ミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-(7-((2R)-2-(メトキシカルボニル)ピロリジン-1-イル)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-(7-(4,4-ジフルオロピペリジン-1-イル)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-(7-((メトキシカルボニルメチル)(メチル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-(7-((2R)-2-(カルボキシ)ピロリジン-1-イル)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-(7-(4-(エトキシカルボニル)ピペリジン-1-イル)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-(7-(4-(カルボキシ)ピペリジン-1-イル)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-(7-((カルボキシメチル)(メチル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-(7-(4-(エトキシカルボニルメチル)ピペラジン-1-イル)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-(7-(4-(カルボキシメチル)ピペラジン-1-イル)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-(7-(ピロリジン-1-イル)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-1-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-アミノ-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7s)-7-(ジ(シクロプロピルメチル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジ
ン-3-イル)-N3-((7S)-7-((2-メチルプロピル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-((プロピル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(ジプロピルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(ジエチルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(シクロヘキシルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(シクロペンチルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-((1-シクロペンチルエチル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(2-プロピルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-((3,3-ジメチルブタ-2-イル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-((シクロヘキシルメチル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(ジ(シクロヘキシルメチル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-((5-クロロチエノ-2-イル)メチル)アミノ-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-((2-カルボキシフェニル)メチル)アミノ-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1
,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-((3-ブロモフェニル)メチル)アミノ-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(ジメチルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(シクロブチルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(3-ペンチルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-((2,2-ジメチルプロピル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(ジ(シクロペンチルメチル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-((シクロペンチルメチル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(ジ(ビシクロ[2.2.1]ヘプタ-2-エン-5-イルメチル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-((ビシクロ[2.2.1]ヘプタ-2-エン-5-イルメチル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(3-メチルブチルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(ジ(3-メチルブチル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(2-エチルブチルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジ
ン-3-イル)-N3-((7S)-7-(ブタ-2-エニルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(ブチル(ブタ-2-エニル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ピリド[2’,3’:6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N5-((7S)-7-(t-ブトキシカルボニルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ピリド[2’,3’:6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-アミノ-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ピリド[2’,3’:6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(ジメチルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ピリド[2’,3’:6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(ジエチルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ピリド[2’,3’:6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(ジプロピルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ピリド[2’,3’:6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(ジ(シクロプロピルメチル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ピリド[2’,3’:6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(ジ(3-メチルブチル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ピリド[2’,3’:6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(シクロブチルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ピリド[2’,3’:6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(シクロヘキシルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ピリド[2’,3’:6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-((メチルエチル)アミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン;
1-(6,7-ジヒドロ-5H-ピリド[2’,3’:6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(シクロペンチルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,
4-トリアゾール-3,5-ジアミン;および
1-(6,7-ジヒドロ-5H-ピリド[2’,3’:6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7S)-7-(2-ブチルアミノ)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン。
防または治療を提供し得る。第三の態様の特定の実施形態では、前記キナーゼの活性が他の健常者集団における正常な活性レベルと比較して増加される。活性の増加は、例えば、前記キナーゼの過剰発現または変異によるものであり得る。
et al., Scand J Clin Lab Invest. 68(2):93-8 (2008))または転写レベル配列決定法
;(iii)十分な性能特性を有する試験法によるキナーゼ(例えば、表4に列挙されるキナーゼ)の変異状態の判定。変異状態を判定するためのこのような方法には、以下が含まれ得る:PCRに基づく増幅および配列決定(Guo JJ, et al. J Clin Oncol. Aug 10;29(23):e672-4 (2011); Ouerhani S, Cancer Genet. Sep;205(9):436-41 (2012); Sritana N, Exp Mol Pathol. Dec;85(3):227-31. (2008); Bains A, et al., Am J Clin Pathol. Jan;135(1):62-9. (2011))、PCRおよび一本鎖DNA高次構造多型(SSCP)(ss二次構造解析)(Stirewalt DL, et al., Nat Rev Cancer. Sep;3(9):650-65.(2003)2.)、腫瘍ゲノム配列決定(Love C, et al., Nat Genet. Dec;44(12):1321-5. (2012); Kanagal-Shamanna R et al., Mod Pathol. Aug 2. (2013))、多重ハイスループット遺伝子変異解析(Dunlap J, et al., Hum Pathol. Dec;43(12):2167-76 (2012))、融解曲線解析(Polakova KM, et al., Leuk Res. Aug;32(8):1236-43 (2008))。
1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-(7-(S)-(ピロリジン-1-イル)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン(以下、「化合物A」)は、0.4nMのKd(KinomeScan(商標)法)、および血清タンパク質の非存在下におけるキナーゼ活性の阻害において5~15nMのIC50(KinaseProfiler(商標)および細胞ベースアッセイ)を有する、Axlキナーゼの強力な選択的阻害剤である。
示しているが、これらの結果は他の式(I)の化合物の阻害活性も示していると見なされるべきである。国際公開第2008/083367号に示されているように、種々様々な式(I)の化合物がAxlにおいて同様の結合および活性を有しているため、このような同種の一連の化合物は、他のキナーゼの阻害において、化合物Aについて本明細書で示されるものと同様の適用性を有すると予想される。
化合物Aは、例えばがん治療に適した、経口投与可能なAxlキナーゼ阻害剤である。前記化合物は、原発腫瘍および転移性腫瘍の増殖制限において、単剤活性および他の抗がん剤と組み合わせた活性を示している。
eScanアッセイは、化合物Aと前記キナーゼとの結合定数Kdを評価する。
詳細なアッセイ方法は、必要に応じて、本明細書で引用される関連の参考文献、またはEMDミリポア社(www.emdmillipore.com)もしくはKinomeScanウェブサイト(www.kinomescan.com)から入手できるKinaseProfiler Service Assay Protocols(v54、2011)に見出すことができる(KINOMEscanのアッセイ方法のより詳細な説明については、Fabian et al. A small molecule-kinase interaction map for clinical
kinase inhibitors. Nat. Biotechnol. 23, 329-336 (2005)を参照されたい)。概要を以下に示す。
Axlキナーゼに対する作用強度
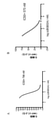
試験2における11点のKd測定は、KinomeScanアッセイにおける0.4nMのKd(図1A)を示している。451種のキナーゼの全検討で使用された5点測定から推定された値は、0.7nMにおいて、ほぼ一致している。
以下の表2は、本明細書で要約された様々な試験で得られた結果を比較している。前記生化学分析の少なくとも1つにおいて、Axlキナーゼの反応の10倍以内の平均IC50またはKdで、化合物Aと明らかに反応する種々の野生型キナーゼを表に列挙する。同じアッセイで同じキナーゼが複数回試験された場合は、平均値を示す。Tyro3キナーゼは、受容体型チロシンキナーゼのTAMファミリー(Axlと最も密接な関係があるキナーゼ(Tyro3、Axl、MerTK))のメンバーであるため、表に含まれる。また、前記キナーゼについて得られた値と、同じアッセイでAxlについて得られた平均値が、何倍の差であるかも示される。
KinomeScan試験番号2はヒト腫瘍で見られるいくつかの変異キナーゼを含んでいるが、そのうちのいくつかはがん増殖を駆動する変異であることが知られている。こ
れらのうちのいくつかは、これらの野生型よりも予想外に高い化合物A結合を示した。従って、利用可能である場合は、これらおよび関連する変異キナーゼもKinaseProfilerアッセイ(試験3)で試験して、第二のアッセイ系での確認を得た。結果を表3に要約する。
Natl. Acad. Sci. 106:1542-7 (2009))。
Axl阻害に加えて、化合物Aは、いくつかの他のキナーゼに対する有意な活性も示した。いくつかの場合において、化合物Aは、がんに関連する変異キナーゼに対して有意な活性を示したが、未変異キナーゼに対しては有意な活性を示さなかった。
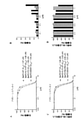
図2は、T315I変異型Bcr-Abl1融合タンパク質を発現するBa/F3骨髄由来マウス細胞が、非変異型Bcr-Abl1キナーゼ(IC50 796nM)を発現する細胞と比較して、化合物Aに対してより感受性が高い(IC50 570nM)ことを示している。
0μg/mLストレプトマイシン(シグマ-アルドリッチ社)を添加した血清非含有RPMI-1640培地中で、一晩培養した。次の日、細胞を、96ウェルプレート内に、各ウェルが100μl体積の血清非含有RMPI培地中で2000個の細胞を含むように、播種した。続いて、異なる濃度の化合物Aを含有する50μlの血清非含有RPMI培地を加えた(3連)。各ウェルの化合物Aの最終濃度は、0、250、500、1000、2000、3000、4000および5000nMであった。96ウェルプレートを48時間インキュベートし、細胞生存率をWST-1アッセイ(ロシュ社)で測定した。簡潔に説明すると、5μlのWST-1溶液を各ウェルに加え、96ウェルプレートをさらに2時間インキュベートした。読み取りは480nm(測定)/620nm(基準)でELSAリーダー内で行った。その後、Microsoft Excel 2003およびGraphPad Prism 4.0を用いてデータ解析を行った。
化合物Aは、血清タンパク質非存在下でのキナーゼ活性の阻害において0.4nMのKdおよび5~15nMのIC50を有する、Axlキナーゼの強力な阻害剤である。他の非変異型キナーゼ(例えば、Ysk4、MerTK、Stk10、TEK、Wee1、およびYes)への結合/阻害は、4~10倍より高い濃度範囲で生じ得る。化合物Aはまた、Axl阻害と比較して10倍未満のより高い濃度で、慢性骨髄性白血病における「ゲートキーパー」変異、Abl(T315I)、cKit(D816H)、Flt3(D835Y)、Ret(V804LおよびM)およびTEK(Y897SおよびR849W)を含むいくつかの変異キナーゼと結合しそれを阻害したが、このことは、いくつかの変異キナーゼがこの化合物および式(I)の関連化合物の代替標的となり得ることを示唆している。Abl(T315I)は、CMLにおけるAblキナーゼ阻害剤イマチニブへの耐性発現時にしばしば見られ、一方、cKit(D816H)は、GISTにおけるイマチニブおよびスニチニブへの耐性発現後にしばしば見られる。
目的
本研究の目的は、急性骨髄性白血病(AML)の治療において、Axl受容体型チロシンキナーゼの新規の高度に選択的な小分子阻害剤である化合物Aの評価を行うことであった。化合物Aへの暴露後の、4つの異なるBa/F3細胞株(野生型Ba/F3細胞または野生型もしくは変異型FLT3を発現するBa/F3細胞)の細胞生存率を評価することにより、化合物Aの有効性を評価することが望まれた。化合物Aを8つの濃度(0、0.01、0.1、0.3、0.5、1、3、10μM)でBa/F3細胞に添加し、48時間インキュベートした。処理したBa/F3細胞を、増殖(WST-1および3H-チミジン取り込み)について、並びにアポトーシスマーカーであるアネキシンVおよびヨウ化プロピジウム(PI)の検出についてアッセイして、EC50値およびIC50値を決定した。
細胞株
マウスのプロBリンパ球系Ba/F3野生型(Ba/F3 WT)、および野生型ヒトFLT3(Ba/F3 FLT3 WT細胞)またはタンパク質の恒常的な機能的活性化をもたらすITD変異(Ba/F3-ITD細胞)もしくはD835Y(Ba/F3 D835Y細胞)点変異を含有するヒトFLT3をコードする発現ベクターにより安定に形質導入されたBa/F3系を、Bjorn Tore Gjertsen(臨床科学科、血液学部門、 ベルゲン大学、ベルゲン、ノルウェイ)から入手した。Ba/F3 WT
細胞、Ba/F3 FLT3 WT細胞およびBa/F3 835Y細胞を、10%ウシ胎仔血清(FCS、ハイクローン社(HyClone)、ユタ州ローガン)、2mM L-グルタミンおよび50U/mLペニシリン-ストレプトマイシン(シグマ-アルドリッチ社、米国ミズーリ州セントルイス)、並びにマウスインターロイキン-3(mIL-3)の供給源としての10%WEHI-3B条件培地を含有するRPMI-1640培地中で維持した。Ba/F3-ITD細胞はmIL-3非存在下で維持した。
化合物AをDMSO中に溶解し-20℃で保存した。細胞培養の作業で使用する場合、DMSOの最終濃度は0.05%を超えないようにした。
Ba/F3細胞を、0.1ng/mLのmIL-3(プロスペックBIO社(Prospec BIO)、米国)を含有する培地中で、治療期間の前に一晩および治療期間の間、インキュベートした。
アポトーシス細胞および壊死細胞の定量化は、Alexa(登録商標)Fluor647(インビトロジェン社、Molecular Probes、米国オレゴン州)結合型アネキシンVでホスファチジルセリンの外在化を測定することにより、およびヨウ化プロピジウム(PI;シグマ-アルドリッチ社)を死細胞対比染色剤として用いて、定量した。インビトロでBa/F3細胞(WT、FLT3 WT、FLT3-ITD、D835Y)の細胞生存率を評価するために、細胞を24ウェルプレート上に1x105細胞/培地mlの密度で播種し、その後、化合物A(0、0.01、0.1、0.3、0.5、1、3、10μM)で48時間処理した。薬剤処理の後、細胞を製造会社のプロトコルに従って染色し、その後、Accuri C6フローサイトメーター(ベクトン・ディッキンソン・イミュノサイトメトリー・システムズ社(Becton Dickinson Immunocytometry Systems)、米国カリフォルニア州サンノゼ)で解析した。FlowJoソフトウェアバージョン10(ツリースター社(Tree Star, Inc.)、米国オレゴン州アシュランド)をデータ解析に用いた。早期アポトーシス細胞(アネキシンV陽性、PI陰性)、後期アポトーシス細胞(アネキシンV陽性およびPI陽性)の両方および壊死細胞(アネキシンV陰性およびPI陽性)を細胞死判定に含めた。生細胞率は単独の実験で行われた未処理細胞の割合として表した。IC50値を阻害剤のEC50として決定した;最大(図3A上段)反応と最大阻害(図3A下段)反応の中間の反応を誘発する濃度。
生細胞内のミトコンドリア脱水素酵素によって色素生産性ホルマザン色素へと切断されるテトラゾリウム塩WST-1を用いて、細胞の増殖を評価した。Ba/F3細胞を、96ウェルプレート上に1ウェル当たり100μLの培地中10×103細胞の密度で3連で播種し、化合物A(0、0.01、0.1、0.3、0.5、1、3、10μM)で48時間処理し、1:11希釈したWST-1(ロシュ社、バーゼル、スイス)を治療期間の最後の4時間各ウェルに添加した。試料の吸光度をSpectramax Plus 384分光光度計(モレキュラーデバイス社.、米国カリフォルニア州サニーベール)で測定し、増殖の割合を以下の式を用いて算出した:
Ba/F3細胞を96ウェルプレート上に1ウェル当たり100μLの培地中10×1
03細胞の密度で3連で播種し、化合物A(0、0.01、0.1、0.3、0.5、1、3、10μM)で30時間処理し、3H-チミジン(1μCi/ウェル;TRA310、アマシャム・インターナショナル社(Amersham International)、アマーシャム、UK)を添加した。18時間のインキュベーションの後、DNAを回収し、放射活性を液体シンチレーション計測(Packard Microplate Scintillation and Luminescence counter、パーキンエルマー・ライフ・アンド・アナリティカル・サイエンス社(Perkin Elmer Life and Analytical Science, Inc.)、米国ウォルサム)で評価した。
Prism Version 5.0ソフトウェア(グラフパッド・ソフトウェア社、カリフォルニア州ラ・ホーヤ)を用いて統計解析を行った。増殖アッセイの結果を平均値±SEMとして示す。独立した両側スチューデントt検定を用いてデータを比較した。P=0.05よりも大きな差異を有意と見なした。
アポトーシス検出および細胞増殖アッセイ
化合物A処理(0、0.01、0.1、0.3、0.5、1、3および10μM)から48時間後の生存率を、4つのBa/F3細胞株クローンについて、アネキシンV-PIアッセイを用いて評価した。用量反応曲線(図3Aおよび図3C)は、調べられたBa/F3細胞株における、化合物Aの狭い治療濃度域(0.5~3μM)を示した。1μMの化合物Aでの48時間の処理が、細胞株間で有効性における最も大きな差異を示した(図3Bおよび図3D)。変異型Ba/F3 D835Y細胞株が、化合物A処理に対して最も感受性が高いと思われる(図3)。
細胞増殖アッセイの結果は、Ba/F3細胞が非常に狭い化合物Aの濃度範囲内で極めて応答性が高いことを示している。3μMの化合物Aにより、細胞株に関係なく全ての細胞が死滅する。それでもなお、Ba/F3 FLT3 D835Y細胞株が最も感受性が高いことが分かる。Ba/F3 FLT3 ITDは、Ba/F3 WTおよびBaF3
FLT3 WTに匹敵する感受性を示す(図4)。
本研究では、Axl受容体型チロシンキナーゼの高度に選択的な小分子阻害剤である化合物Aが、調べられたBa/F3細胞株クローンにおいて狭い治療濃度域(0.5~3μM)を有することが示された。アポトーシスアッセイおよび増殖アッセイの両方が類似の結果を示し、Ba/F3 D835Y細胞株が化合物A処理によるAxl阻害に対し最も感受性が高いということが確認された。
図5は、化合物Aが、骨髄細胞にT315I変異型BCR-ABL1を含有するコンストラクトをレトロウイルスによって形質導入した侵襲性前臨床CMLモデルにおける白血病細胞負荷量を減少させたことを示している。
6~8週齢の雄Balb/cマウスを亜致死線量照射し、0.5x106個のレトロウイルス導入性BM細胞(pMSCV_gfp/BCR-ABL_T315I)を静脈内注射した。3日後、マウスを無作為化し、化合物A(25(または50)mg/Kgマウス)またはプラセボで1日に2回処置した。
図6は、化合物AがT315I変異型および野生型CMLをインビボで阻害し得ることを示している。
6~8週齢の雄NSGマウスの右脇腹に、マウス当たり1×107個のBaF3/wt-BCR-ABL細胞または1×107個のBaF3/T315I細胞を皮下移植した。移植の5日後、マウスをおよそ100mm3の平均体積を有する群に無作為化した。動物には化合物A(25(または50)mg/kgマウス)またはプラセボを(胃管栄養法で)1日2回処置した。腫瘍体積を2~3毎に測定した。動物を12日目に屠殺し、腫瘍を組織学的検査用に包埋した。
Claims (3)
- Axlの過剰発現ならびにAbl1の活性化、変異および/または過剰発現と関連した疾患の治療または予防に使用するための医薬であって、
前記疾患が、線維症であって、ならびに
前記医薬が、
(a)1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-(7-(ピロリジン-1-イル)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン、および
(b)1-(6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジン-3-イル)-N3-((7-(S)-ピロリジン-1-イル)-6,7,8,9-テトラヒドロ-5H-ベンゾ[7]アヌレン-2-イル)-1H-1,2,4-トリアゾール-3,5-ジアミン、から成る群から選択される化合物を含む、
医薬。 - 前記線維症が肝線維症である、請求項1に記載の医薬。
- 前記化合物が、一つまたは複数の追加の医薬品有効成分との順次または同時の組合せにおいて使用される、請求項1又は2に記載の医薬。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB1321227.9 | 2013-12-02 | ||
| GB201321227A GB201321227D0 (en) | 2013-12-02 | 2013-12-02 | Use of kinase inhibitors |
| GB201323021A GB201323021D0 (en) | 2013-12-24 | 2013-12-24 | Use of kinase inhibitors |
| GB1323021.4 | 2013-12-24 | ||
| PCT/GB2014/053548 WO2015082887A2 (en) | 2013-12-02 | 2014-11-28 | Use of kinase inhibitors |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020080908A Division JP2020128402A (ja) | 2013-12-02 | 2020-05-01 | キナーゼ阻害剤の用途 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2016539138A JP2016539138A (ja) | 2016-12-15 |
| JP2016539138A5 JP2016539138A5 (ja) | 2017-12-28 |
| JP6992960B2 true JP6992960B2 (ja) | 2022-02-03 |
Family
ID=52016110
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016536145A Active JP6992960B2 (ja) | 2013-12-02 | 2014-11-28 | キナーゼ阻害剤の用途 |
| JP2020080908A Pending JP2020128402A (ja) | 2013-12-02 | 2020-05-01 | キナーゼ阻害剤の用途 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020080908A Pending JP2020128402A (ja) | 2013-12-02 | 2020-05-01 | キナーゼ阻害剤の用途 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US9801880B2 (ja) |
| EP (1) | EP3076966A2 (ja) |
| JP (2) | JP6992960B2 (ja) |
| WO (1) | WO2015082887A2 (ja) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX2012013467A (es) | 2010-05-20 | 2013-04-29 | Array Biopharma Inc | Compuestos macrociclicos como inhibidores de trk cinasa. |
| BR112018000808A2 (pt) | 2015-07-16 | 2018-09-04 | Array Biopharma Inc | compostos de pirazolo[1,5-a]piridina substituída como inibidores de ret cinase |
| JOP20190077A1 (ar) | 2016-10-10 | 2019-04-09 | Array Biopharma Inc | مركبات بيرازولو [1، 5-a]بيريدين بها استبدال كمثبطات كيناز ret |
| TWI704148B (zh) | 2016-10-10 | 2020-09-11 | 美商亞雷生物製藥股份有限公司 | 作為ret激酶抑制劑之經取代吡唑并[1,5-a]吡啶化合物 |
| WO2018136663A1 (en) | 2017-01-18 | 2018-07-26 | Array Biopharma, Inc. | Ret inhibitors |
| US11168090B2 (en) | 2017-01-18 | 2021-11-09 | Array Biopharma Inc. | Substituted pyrazolo[1,5-a]pyrazines as RET kinase inhibitors |
| JOP20190213A1 (ar) | 2017-03-16 | 2019-09-16 | Array Biopharma Inc | مركبات حلقية ضخمة كمثبطات لكيناز ros1 |
| TWI791053B (zh) | 2017-10-10 | 2023-02-01 | 美商亞雷生物製藥股份有限公司 | 6-(2-羥基-2-甲基丙氧基)-4-(6-(6-((6-甲氧基吡啶-3-基)甲基)-3,6-二氮雜雙環[3.1.1]庚-3-基)吡啶-3-基)吡唑并[1,5-a]吡啶-3-甲腈之結晶形式及其醫藥組合物 |
| TWI876442B (zh) | 2017-10-10 | 2025-03-11 | 美商絡速藥業公司 | 6-(2-羥基-2-甲基丙氧基)-4-(6-(6-((6-甲氧基吡啶-3-基)甲基)-3,6-二氮雜雙環[3.1.1]庚-3-基)吡啶-3-基)吡唑并[1,5-a]吡啶-3-甲腈之調配物 |
| US11603374B2 (en) | 2018-01-18 | 2023-03-14 | Array Biopharma Inc. | Substituted pyrrolo[2,3-d]pyrimidines compounds as ret kinase inhibitors |
| CN111615514B (zh) | 2018-01-18 | 2022-10-11 | 奥瑞生物药品公司 | 作为ret激酶抑制剂的取代的吡唑并[4,3-c]吡啶化合物 |
| EP3740490A1 (en) | 2018-01-18 | 2020-11-25 | Array Biopharma, Inc. | Substituted pyrazolo[3,4-d]pyrimidine compounds as ret kinase inhibitors |
| ES2922314T3 (es) | 2018-09-10 | 2022-09-13 | Array Biopharma Inc | Compuestos heterocíclicos condensados como inhibidores de cinasa RET |
| PT3873903T (pt) | 2018-10-31 | 2024-05-16 | Gilead Sciences Inc | Compostos 6-azabenzimidazol substituídos como inibidores de hpk1 |
| TWI721624B (zh) | 2018-10-31 | 2021-03-11 | 美商基利科學股份有限公司 | 經取代之6-氮雜苯并咪唑化合物 |
| TWI826690B (zh) | 2019-05-23 | 2023-12-21 | 美商基利科學股份有限公司 | 經取代之烯吲哚酮化物及其用途 |
| CN115504967A (zh) * | 2021-06-23 | 2022-12-23 | 南京正大天晴制药有限公司 | 作为axl抑制剂的1,2,4-三唑化合物 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010517412A (ja) | 2007-06-21 | 2010-05-20 | エルジー エレクトロニクス インコーポレイティド | 直交周波数分割多重化システムで制御チャネルを受信する方法 |
| JP2011522212A (ja) | 2007-10-19 | 2011-07-28 | セル・シグナリング・テクノロジー・インコーポレイテツド | 癌の分類および使用法 |
| JP2012515225A (ja) | 2009-01-16 | 2012-07-05 | ライジェル ファーマシューティカルズ, インコーポレイテッド | 転移性癌の予防、治療、または管理のための併用療法に用いるためのaxl阻害薬 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1646695A (zh) * | 2002-02-12 | 2005-07-27 | 夸克生物技术公司 | Axl受体在诊断和治疗肾病中的应用 |
| EP1673399B1 (en) * | 2003-08-11 | 2017-04-05 | Monogram BioSciences, Inc. | Detecting and profiling molecular complexes |
| MXPA06005598A (es) * | 2003-11-18 | 2006-08-11 | Novartis Ag | Inhibidores de la forma mutante de kit. |
| CA2710234C (en) * | 2006-12-29 | 2015-10-20 | Rigel Pharmaceuticals, Inc. | Polycyclic heteroaryl substituted triazoles useful as axl inhibitors |
| JP5908728B2 (ja) * | 2009-01-06 | 2016-04-26 | ダナ ファーバー キャンサー インスティテュート インコーポレイテッド | ピリミド−ジアゼピノンキナーゼ骨格化合物及び疾患を治療する方法 |
| US9050341B2 (en) * | 2009-07-14 | 2015-06-09 | Natco Pharma Limited | Methods of treating drug resistant and other tumors by administering 6,7-dialkoxy quinazoline derivatives |
| US8603740B2 (en) * | 2010-12-29 | 2013-12-10 | Quest Diagnostics Investments Incorporated | BCR-ABL1 splice variants and uses thereof |
| EA034193B1 (ru) * | 2011-04-21 | 2020-01-15 | Оригенис Гмбх | Гетероциклические соединения в качестве ингибиторов киназ |
-
2014
- 2014-11-28 WO PCT/GB2014/053548 patent/WO2015082887A2/en active Application Filing
- 2014-11-28 JP JP2016536145A patent/JP6992960B2/ja active Active
- 2014-11-28 EP EP14809501.1A patent/EP3076966A2/en not_active Withdrawn
- 2014-11-28 US US15/100,891 patent/US9801880B2/en active Active
-
2020
- 2020-05-01 JP JP2020080908A patent/JP2020128402A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010517412A (ja) | 2007-06-21 | 2010-05-20 | エルジー エレクトロニクス インコーポレイティド | 直交周波数分割多重化システムで制御チャネルを受信する方法 |
| JP2011522212A (ja) | 2007-10-19 | 2011-07-28 | セル・シグナリング・テクノロジー・インコーポレイテツド | 癌の分類および使用法 |
| JP2012515225A (ja) | 2009-01-16 | 2012-07-05 | ライジェル ファーマシューティカルズ, インコーポレイテッド | 転移性癌の予防、治療、または管理のための併用療法に用いるためのaxl阻害薬 |
Non-Patent Citations (9)
| Title |
|---|
| Biochimica et Biophysica Acta 1832,2013年,p.897-904 |
| Blood,2002年,Vol.99,Issue.1p.381-383 |
| Blood,2011年,Vol.117,Issue.6,p.1928-1937 |
| Blood,2011年,Vol.118,Issue.21,p.421 |
| Blood,2013年,Vol.122,Issue.21,p.1469 |
| Cancer Research,2010年,Vol.70,No.4,p.1544-1554 |
| Disease Markers,2019年,Vol.2019,Article ID 2304931,p.1-15 |
| Molecular Cancer Therapeutics,2011年,Vol.10, No.10,p.1763-1773 |
| Nature Medicine,2013年,Vol.18,No.7,p.1028-1040 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2015082887A2 (en) | 2015-06-11 |
| WO2015082887A3 (en) | 2015-07-30 |
| EP3076966A2 (en) | 2016-10-12 |
| US20160339021A1 (en) | 2016-11-24 |
| JP2020128402A (ja) | 2020-08-27 |
| JP2016539138A (ja) | 2016-12-15 |
| US9801880B2 (en) | 2017-10-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6992960B2 (ja) | キナーゼ阻害剤の用途 | |
| Canning et al. | Inflammatory signaling by NOD-RIPK2 is inhibited by clinically relevant type II kinase inhibitors | |
| Minzel et al. | Small molecules co-targeting CKIα and the transcriptional kinases CDK7/9 control AML in preclinical models | |
| Uras et al. | Palbociclib treatment of FLT3-ITD+ AML cells uncovers a kinase-dependent transcriptional regulation of FLT3 and PIM1 by CDK6 | |
| Ren | Mechanisms of BCR–ABL in the pathogenesis of chronic myelogenous leukaemia | |
| Frazer et al. | Chronic myeloid leukaemia in the 21st century | |
| Shah et al. | Sequential ABL kinase inhibitor therapy selects for compound drug-resistant BCR-ABL mutations with altered oncogenic potency | |
| El‐Deeb et al. | ROS receptor tyrosine kinase: a new potential target for anticancer drugs | |
| Wicki et al. | Acquired resistance to clinical cancer therapy: a twist in physiological signaling | |
| Corbacioglu et al. | Newly identified c-KIT receptor tyrosine kinase ITD in childhood AML induces ligand-independent growth and is responsive to a synergistic effect of imatinib and rapamycin | |
| Song et al. | ERBB3, IGF1R, and TGFBR2 expression correlate with PDGFR expression in glioblastoma and participate in PDGFR inhibitor resistance of glioblastoma cells | |
| Eda et al. | A novel Bruton’s tyrosine kinase inhibitor CC-292 in combination with the proteasome inhibitor carfilzomib impacts the bone microenvironment in a multiple myeloma model with resultant antimyeloma activity | |
| WO2015066452A2 (en) | Methods of treating pediatric cancers | |
| Alves et al. | IGF1R/IRS1 targeting has cytotoxic activity and inhibits PI3K/AKT/mTOR and MAPK signaling in acute lymphoblastic leukemia cells | |
| Uehling et al. | Design, synthesis, and characterization of 4-aminoquinazolines as potent inhibitors of the G protein-coupled receptor kinase 6 (GRK6) for the treatment of multiple myeloma | |
| Tang et al. | Dual targeting of salt inducible kinases and CSF1R uncouples bone formation and bone resorption | |
| JPWO2006137469A1 (ja) | 代謝型グルタミン酸受容体活性化剤 | |
| Murugesan et al. | Tyrosine kinase inhibitors (TKIs) in lung cancer treatment: a comprehensive analysis | |
| Hu et al. | Discovery of highly potent and efficient CBP/p300 degraders with strong in vivo antitumor activity | |
| Tan et al. | Inhibition of type 4 cyclic nucleotide phosphodiesterase blocks intracellular TLR signaling in chronic lymphocytic leukemia and normal hematopoietic cells | |
| Kaelin Jr | Molecular biology of kidney cancer | |
| EP2443255B1 (en) | Csf1r-derived polynucleotides for medical use | |
| Ihle | Differential Activity of the KRAS Oncogene by Method of Activation: Implications for Signaling and Therapeutic Intervention | |
| KR20110095878A (ko) | Abl 티로신 키나제 억제제를 이용하여 만성 골수성 백혈병의 치료를 최적화하는 방법 | |
| Carreau | Rsk2 and Lrp5 deficiency limit osteosarcoma growth in cFos-transgenic mice by different mechanisms |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20171115 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20171115 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20180725 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180807 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20181107 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20181221 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190521 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20190814 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191118 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20200107 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200501 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20200501 |
|
| C11 | Written invitation by the commissioner to file amendments |
Free format text: JAPANESE INTERMEDIATE CODE: C11 Effective date: 20200519 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20200707 |
|
| C21 | Notice of transfer of a case for reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C21 Effective date: 20200714 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20200807 |
|
| C211 | Notice of termination of reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C211 Effective date: 20200818 |
|
| C22 | Notice of designation (change) of administrative judge |
Free format text: JAPANESE INTERMEDIATE CODE: C22 Effective date: 20210105 |
|
| C22 | Notice of designation (change) of administrative judge |
Free format text: JAPANESE INTERMEDIATE CODE: C22 Effective date: 20210413 |
|
| C13 | Notice of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: C13 Effective date: 20210511 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210806 |
|
| C22 | Notice of designation (change) of administrative judge |
Free format text: JAPANESE INTERMEDIATE CODE: C22 Effective date: 20210928 |
|
| C23 | Notice of termination of proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C23 Effective date: 20211005 |
|
| C03 | Trial/appeal decision taken |
Free format text: JAPANESE INTERMEDIATE CODE: C03 Effective date: 20211109 |
|
| C30A | Notification sent |
Free format text: JAPANESE INTERMEDIATE CODE: C3012 Effective date: 20211109 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20211202 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6992960 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |