JP6979397B2 - ソルチリンに結合し、プログラニュリンの結合を阻害する抗体 - Google Patents
ソルチリンに結合し、プログラニュリンの結合を阻害する抗体 Download PDFInfo
- Publication number
- JP6979397B2 JP6979397B2 JP2018501182A JP2018501182A JP6979397B2 JP 6979397 B2 JP6979397 B2 JP 6979397B2 JP 2018501182 A JP2018501182 A JP 2018501182A JP 2018501182 A JP2018501182 A JP 2018501182A JP 6979397 B2 JP6979397 B2 JP 6979397B2
- Authority
- JP
- Japan
- Prior art keywords
- seq
- chain variable
- variable region
- antibody
- light chain
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/286—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against neuromediator receptors, e.g. serotonin receptor, dopamine receptor
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Neurosurgery (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Hospice & Palliative Care (AREA)
- Psychiatry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Endocrinology (AREA)
- Epidemiology (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
本出願は、米国特許法施行規則(37 C.F.R.)第1.821条に従う1つまたは複数の配列表(以下参照)を含み、これは、コンピュータ可読媒体(ファイル名:0993_ST25.txt、2016年6月22日に作成され、144kBのサイズを有する)で開示され、このファイルは、全体が参照により本明細書に援用される。
(i)0.5〜10nM、例えば1〜5nMまたは1〜2nMのソルチリンに対する結合親和性(KD);
(ii)ソルチリンへのPGRN結合を減少させ、および/または阻害する能力;
(iii)ソルチリン発現細胞によってPGRNのクリアランスを減少させ、および/または阻害する能力;
(iv)ソルチリン発現細胞によってPGRNのエンドサイトーシスを減少させ、および/または阻害する能力;
(v)ヒト−ソルチリン発現ノックインマウスにおいて血漿中のPGRNの量および/または濃度を増加させる能力
の1つまたは複数を示す抗体、またはその抗原結合フラグメントに関する。
したがって、本発明は、
(a)配列番号1のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号2のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号3のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号4のアミノ酸配列を有する重鎖CDR1;
(e)配列番号5のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号6のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号9のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号10のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号11のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号12のアミノ酸配列を有する重鎖CDR1;
(e)配列番号13のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号14のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号17のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号18のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号19のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号20のアミノ酸配列を有する重鎖CDR1;
(e)配列番号21のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号22のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号25のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号26のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号27のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号28のアミノ酸配列を有する重鎖CDR1;
(e)配列番号29のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号30のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号33のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号34のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号35のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号36のアミノ酸配列を有する重鎖CDR1;
(e)配列番号37のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号38のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号41のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号42のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号43のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号44のアミノ酸配列を有する重鎖CDR1;
(e)配列番号45のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号46のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号49のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号50のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号51のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号52のアミノ酸配列を有する重鎖CDR1;
(e)配列番号53のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号54のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号57のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号58のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号59のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号60のアミノ酸配列を有する重鎖CDR1;
(e)配列番号61のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号62のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号65のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号66のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号67のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号68のアミノ酸配列を有する重鎖CDR1;
(e)配列番号69のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号70のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号73のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号74のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号75のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号76のアミノ酸配列を有する重鎖CDR1;
(e)配列番号77のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号78のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号81のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号82のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号83のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号84のアミノ酸配列を有する重鎖CDR1;
(e)配列番号85のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号86のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号89のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号90のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号91のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号92のアミノ酸配列を有する重鎖CDR1;
(e)配列番号93のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号94のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号97のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号98のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号99のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号100のアミノ酸配列を有する重鎖CDR1;
(e)配列番号101のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号102のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号105のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号106のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号107のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号108のアミノ酸配列を有する重鎖CDR1;
(e)配列番号109のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号110のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号113のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号114のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号115のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号116のアミノ酸配列を有する重鎖CDR1;
(e)配列番号117のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号118のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号121のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号122のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号123のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号124のアミノ酸配列を有する重鎖CDR1;
(e)配列番号125のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号126のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号129のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号130のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号131のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号132のアミノ酸配列を有する重鎖CDR1;
(e)配列番号133のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号134のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号137のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号138のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号139のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号140のアミノ酸配列を有する重鎖CDR1;
(e)配列番号141のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号142のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号145のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号146のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号147のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号148のアミノ酸配列を有する重鎖CDR1;
(e)配列番号149のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号150のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号153のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号154のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号155のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号156のアミノ酸配列を有する重鎖CDR1;
(e)配列番号157のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号158のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
別の実施形態によれば、本発明は、
(a)配列番号161のアミノ酸配列を有する軽鎖CDR1;
(b)配列番号162のアミノ酸配列を有する軽鎖CDR2;
(c)配列番号163のアミノ酸配列を有する軽鎖CDR3;
(d)配列番号164のアミノ酸配列を有する重鎖CDR1;
(e)配列番号165のアミノ酸配列を有する重鎖CDR2;および
(f)配列番号166のアミノ酸配列を有する重鎖CDR3
を含むかまたはそれからなる抗体、またはその抗原結合フラグメントに関する。
(i)本明細書に記載される本発明の抗体の可変領域または前記領域の抗原結合部分、および
(ii)免疫グロブリンのCH領域またはCH2およびCH3領域を含むその領域
を含む一価抗体であり、ここで、CH領域またはその領域は、ヒンジ領域に対応する領域および、免疫グロブリンがIgG4サブタイプでない場合、CH3領域などのCH領域の他の領域が、ポリクローナルヒトIgGの存在下で、同一のCH領域とともにジスルフィド結合を形成するか、または同一のCH領域とともに他の共有結合または安定した非共有重鎖間結合を形成することが可能なアミノ酸残基を含まないように修飾されている。
(i)ソルチリンに対する結合親和性(KD);
(ii)ソルチリンへのPGRN結合を減少させ、および/または阻害する能力;
(iii)ソルチリン発現細胞によってPGRNのクリアランスを減少させ、および/または阻害する能力;
(iv)ソルチリン発現細胞によってPGRNのエンドサイトーシスを減少させ、および/または阻害する能力;
(v)ヒト−ソルチリン発現ノックインマウスにおいて血漿中のPGRNの量および/または濃度を増加させる能力;脳内のPGRNの量および/または濃度を増加させる能力および/または
(vi)慢性的に投与されるときの、前頭側頭認知症(FTD)および/または筋萎縮性側索硬化症(ALS)の治療を提供する能力
である。
(i)ソルチリンに対する結合親和性(KD);
(ii)ソルチリンへのPGRN結合を減少させ、および/または阻害する能力;
(iii)ソルチリン発現細胞によってPGRNのクリアランスを減少させ、および/または阻害する能力;
(iv)ソルチリン発現細胞によってPGRNのエンドサイトーシスを減少させ、および/または阻害する能力;
(vi)ヒト−ソルチリン発現ノックインマウスにおいて血漿中のPGRNの量および/または濃度を増加させる能力;
(vii)脳内のPGRNの量および/または濃度を増加させる能力および/または
(vi)慢性的に投与されるときの、前頭側頭認知症(FTD)、筋萎縮性側索硬化症(ALS)および/またはアルツハイマー病(AD)の治療を提供する能力
であり、特に、このような変化した機能性が構造変化の結果であり、したがってそれと切り離すことができない調製物に関する。
(i)本明細書に定義される抗ソルチリン抗体またはその抗原結合フラグメント、または調製物であって、このような用語が本明細書において定義される際、このような抗ソルチリン抗体またはその抗原結合フラグメントを含む調製物、および
(ii)薬学的に許容できる担体
を含む医薬組成物に関する。
本文および実施例から明らかであろうように、本発明はさらに、以下の実施形態に関する。
(i)0.5〜10nM、例えば1〜5nMまたは1〜2nMのソルチリンに対する結合親和性(KD)、
(ii)ソルチリンへのPGRN結合を減少させ、および/または阻害する能力;
(iii)ソルチリン発現細胞によってPGRNのクリアランスを減少させ、および/または阻害する能力;
(iv)ソルチリン発現細胞によってPGRNのエンドサイトーシスを減少させ、および/または阻害する能力;
(v)ヒト−ソルチリン発現ノックインマウスにおいて血漿中のPGRNの量および/または濃度を増加させる能力
の1つまたは複数を示す、いずれかの先行する実施形態に記載の抗体、またはその抗原結合フラグメント。
(i)ソルチリンに対する結合親和性(KD);
(ii)ソルチリンへのPGRN結合を減少させ、および/または阻害する能力;
(iii)ソルチリン発現細胞によってPGRNのクリアランスを減少させ、および/または阻害する能力;
(iv)ソルチリン発現細胞によってPGRNのエンドサイトーシスを減少させ、および/または阻害する能力;
(v)ヒト−ソルチリン発現ノックインマウスにおいて血漿中のPGRNの量および/または濃度を増加させる能力;および/または
(vi)慢性的に投与されるときの、前頭側頭認知症(FTD)および/または筋萎縮性側索硬化症(ALS)の治療を提供する能力
からなる群から選択される調製物。
(i)ソルチリンに対する結合親和性(KD);
(ii)ソルチリンへのPGRN結合を減少させ、および/または阻害する能力;
(iii)ソルチリン発現細胞によってPGRNのクリアランスを減少させ、および/または阻害する能力;
(iv)ソルチリン発現細胞によってPGRNのエンドサイトーシスを減少させ、および/または阻害する能力;
(v)ヒト−ソルチリン発現ノックインマウスにおいて血漿中のPGRNの量および/または濃度を増加させる能力;および/または
(vi)慢性的に投与されるときの、前頭側頭認知症(FTD)および/または筋萎縮性側索硬化症(ALS)の治療を提供する能力
である調製物。
実施例1は、シャッフル構築物を開示する。実施例2は、ソルチリン構築物の発現を開示する。実施例3は、ソルチリン構築物の精製を開示する。
実施例4は、免疫化およびハイブリドーマを開示する。実施例5は、配列分析を開示する。実施例6は、抗体の精製を開示する。実施例7は、マウス抗体の生成を開示する。
実施例8は、ソルチリンへの結合を開示する。実施例9は、ソルチリン抗体のクロスブロッキング能力を開示する。実施例10は、HTRF PGRN−ソルチリン結合を開示する。実施例11は、NTS結合を開示する。実施例12は、細胞PGRN結合およびエンドサイトーシスを開示する。実施例13は、細胞外PGRNレベルを開示する。実施例14は、iPSC PGRNレベルを開示する。実施例15は、血漿PGRNレベルを開示する。実施例16は、HDXによるエピトープマッピングを開示する。実施例17は、脳内のPGRNの微小透析を開示する。
ハイブリドーマスクリーニングプロセスおよび抗体のパネルの多様化の両方に使用するために、いわゆる「シャッフル構築物」を設計し、構築し、産生し、ヒトソルチリンおよび著しく低い配列相同性を有する遠縁の種(テトラオドン)の両方に由来するアミノ酸配列を含有する一連のキメラソルチリン分子を作製した。特定のキメラ構築物への抗体の結合の喪失を除いて、これらのキメラ構築物のソルチリン構造全体および機能性が保持され得るという原理は、特定の交換された領域の結合の改善を示すであろう。可溶性細胞外領域(ECD、aa 1−755)構築物を、BAPタグ(ビオチンアクセプタペプチド)のいずれかで標識し、ビオチンリガーゼまたはHisタグの共発現によってタンパク質の「インビトロ」ビオチン化を可能にして、容易な精製を可能にした。以下のタンパク質をコードする発現ベクターを調製した:SORT−ECDBAP、SORT−ECDBAP−hB01−05、SORT−ECDBAP−hB06−10、SORT−ECDBAP−hB12390、SORT−ECDBAP−hB45678、SORT−ECDBAP−tetra、SORT、SORT−tetra。
抗体の発現の場合、実施例4、5および6に記載されるような、適切な重鎖および軽鎖ベクターを、HEK−293F細胞において共発現させた。
SORTECDHisを、HEK−293F細胞において発現させた。タンパク質中のHis−タグは、固定化金属親和性クロマトグラフィーによる精製を可能にする。このプロセスにおいて、NiNTA Superflow Cartridge(Qiagen)を、50mMのNAH2PO4、300mMのNaClおよび10mMのイミダゾールpH8.0で平衡化する。カラムに、1分間の滞留時間で、Hisタグ化タンパク質を充填する。カラムを、50mMのNAH2PO4、300mMのNaClおよび20mMのイミダゾールpH8.0で洗浄する。タンパク質を、50mMのNAH2PO4、300mMのNaClおよび250mMのイミダゾールpH8.0で溶離する。続いて、タンパク質を、10.000mwcoのカットオフを有するSlide−A−Lyzer(Thermo Scientific)を用いてPBSへと透析する。透析の後、タンパク質を、0.2ミクロンのSFCAフィルタ(Thermo Scientific)を用いて滅菌ろ過する。
A−トランスジェニックマウスの免疫化手順
抗体HuMabソルチリンは、HuMAbマウス株HCo12、HCo17、HCo20、HCo12−BALB/c、HCo17−BALB/cおよびHCo20−BALB/c(ヒトモノクローナル抗体;Medarex Inc.,San Jose,CA,USA)の免疫化から得られた。これらのマウスは、マウス免疫グロブリン(Ig)重鎖およびマウスκ軽鎖をダブルノックアウトされ、これは、完全マウスの抗体の発現を実質的に不活性化する。様々なマウス株を、ヒトIg重鎖およびヒトIgκ軽鎖遺伝子座の挿入によってトランスジェニックにし、これは、ヒトVH(重鎖の可変領域)およびVL(軽鎖の可変領域)遺伝子の数が異なる。HCo12−BALB/cマウスは、KCo5−BALB/c(κ軽鎖トランスジェニック)マウスとの異種交配によって得られた。
上に定義されるような十分な抗原特異的抗体価発現を有するHuMAbマウスを殺処分し、腹部大動脈および大静脈に隣接する脾臓およびリンパ節を採取した。マウス骨髄腫細胞株との脾細胞およびリンパ節細胞の融合は、基本的に製造業者の指示にしたがって、CEEF 50 Electrofusion System(Cyto Pulse Sciences,Glen Burnie,MD,USA)を用いた電気融合によって行った。融合細胞を、HyQ mADCF−Mab(Perbio)中の10%のFetal Clone I Bovine血清(Perbio)、1mMのピルビン酸ナトリウム(Cambrex)、0.5U/mLのペニシリン、0.5U/mLのストレプトマイシン(Cambrex)、50μMの2−メルカプトエタノール(Invitrogen)、600ng/mLのインターロイキン6(IL−6)(Strathmann)、1×HAT(Sigma)および0.5mg/mLのカナマイシン(Invitrogen)を含有する融合培地に播種した。10日後、上清を収集し、細胞を、HyQ mADCF−Mab中の10%のFetal Clone I Bovine血清、0.5U/mLのペニシリン、0.5U/mLのストレプトマイシン、600ng/mLのIL−6および1×proHT(Cambrex)を含有する収集培地で洗浄した。ハイブリドーマ培養物の上清を、一次スクリーニングアッセイおよびSORTECDBAP(配列番号171)、SORTECDBAPhB06−10(配列番号176)、SORTECDBAPhB12390(配列番号177)に結合されたストレプトアビジンビーズによってスクリーニングして、ハイブリドーマ産生ヒト(またはキメラ)抗ソルチリン抗体を検出した。最も良好な一次ウェルからのハイブリドーマ細胞を、40%のCloneMedia(Genetix,Hampshire,UK)および60%のHyQ 2×完全培地(Hyclone,Waltham,USA)から作製された半固形培地に播種した。各一次ウェルについて、Genetix黒色6ウェルプレートのウェルを播種した。各ウェルから、ClonePix system(Genetix)を用いて25個のサブクローンを採取した。サブクローンを収集培地中に採取した。7日後、サブクローンの上清を、ソルチリン特異的ヒトIgG結合について再度スクリーニングし、ヒトIgG濃度を、Octet 384red(Fortebio,Menlo Park,USA)を用いて測定した。各一次ウェルから、最も良好なサブクローンを選択し、600ng/mLのIL−6、0.5U/mLのペニシリン、0.5U/mLのストレプトマイシンおよび1×proHTのみを含有する展開培地(expansion medium)中で展開させた。このサブクローンを、1つの96ウェルプレートウェルから1つの24ウェルプレートウェルへ、4つの24ウェルプレートウェルへ、6つの6ウェルプレートウェルへと展開させた。このプロセスによって得られたクローンを、初代クローン(PC)と表した。
製造業者の指示にしたがって、SMART RACE cDNA Amplificationキット(Clontech)を用いて、全RNAを、0.2〜5×106個のハイブリドーマ細胞から調製し、5’−RACE−相補的DNA(cDNA)を、100ngの全RNAから調製した。VHおよびVLコード領域を、PCRによって増幅させ、ライゲーション非依存クローニング(Aslanidis,C.and P.J.de Jong,Nucleic Acids Res 1990;18(20):6069−74)によって、p33G1fおよびp33κ発現ベクター(ヒトIgG1/κ定常領域コード配列を含む)中で、フレーム内で、直接クローニングした。各抗体について、16個のVLクローンおよび16個のVHクローンをシークエンシングした。適切なオープンリーディングフレーム(ORF)を有するクローンを、さらなる研究および発現のために選択した。重鎖および軽鎖の全ての組合せのベクターを、293fectinを用いて、FreestyleTM 293−F細胞中で一時的に共発現させた。
培養物の上清を、0.2μmのデッドエンドフィルタ上でろ過し、5mLのタンパク質Aカラム(rProtein A FF,Amersham Bioscience)に充填し、0.1Mのクエン酸−NaOH、pH3で溶離した。溶出液を、2Mのトリス−HCl、pH9で直ちに中和し、12.6mMのNaH2PO4、140mMのNaCl、pH7.4(B.Braun)に対してO/N(一晩)透析した。透析の後、試料を、0.2μmのデッドエンドフィルタ上で滅菌ろ過した。純度をSDS−PAGEによって決定し、濃度を比濁法および280nmでの吸光度によって測定した。精製された抗体を分割し、−80℃で貯蔵した。解凍してから、精製された抗体アリコートを4℃に保持した。質量分析法を行って、ハイブリドーマによって発現される抗体重鎖および軽鎖の分子量を特定した。
免疫原
キメラ免疫原hソルチリン−FC、(配列番号169からのヒトソルチリンAA(78−756))および配列番号169からのヒトIgG1−FC AA(104−330)をコードする合成遺伝子を、pcDNA3.1へとクローニングし、Invitrogen製のfreestyleシステムを用いた発現に使用した。抗原を、ヒト抗体について上述される抗体精製のための標準的な手順を用いたタンパク質−A親和性クロマトグラフィーによって、細胞培養物上清から精製した。
hソルチリン−FCを免疫原として使用し、5匹のBALB/cマウスを免疫した。十分な免疫応答を有するマウスを、細胞融合およびハイブリドーマ生成のために選択した。ハイブリドーマ上清を、コーティング抗原としてhソルチリン−ECDを用いたELISAによってスクリーニングした。9個の親クローンから得られた合計で18個のハイブリドーマ細胞株を生成した。
ハイブリドーマを、完全増殖培地、10%のFBS+抗生物質を含むDMEM中で最初に増殖させ、続いて、発現実験のためのCDハイブリドーマ培地(Invitrogen)に適応させた。
マウスモノクローナル抗体を、供給業者(GE healthcare)によって推奨される標準的な手順にしたがって、タンパク質−Gセファロースによってハイブリドーマ細胞培養物上清から精製した。
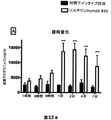
ソルチリンへの抗ソルチリンHuMab抗体の結合反応速度を、Octet 384RED(Fortebio,Menlo Park,USA)を用いて決定した。2μg/mlのHuMab溶液を、試料希釈剤(ForteBio,art.No.18−5028)中での希釈によって作製した。Prot Aセンサー(ForteBio,art.no.18−0004)を、少なくとも600秒間にわたってキネティクス緩衝液(kinetics buffer)(PBS中1:10の試料希釈剤)で予め湿らせた。続いて、センサーを、600秒間にわたってHuMab溶液で固定した。ベースライン反応は、120秒間にわたってキネティクス緩衝液に浸漬することによって得られた。SORTECD構築物の会合が、1000秒間のインキュベーション中に行われた。この後、100秒間にわたるキネティクス緩衝液中での解離が続いた。解離の後、センサーを再生し(10mMのグリシンpH1.0)、5秒間にわたって3回中和した(キネティクス緩衝液)。全てのHuMabを、4つの濃度のSORTECD構築物(10、5、2.5および1.25μg/ml)を用いて分析した。76.8kDAの分子量を、SORTECDHisに使用した。データを、グローバルフルフィット(global full fit)を用いて、ForteBio Analysis 6.4ソフトウェアと適合させた。結果が図3および図4に示される。
抗体クロスブロック試験を、Octet 384RED(Fortebio,Menlo Park,USA)を用いて行った。2μg/mlのHuMab抗体溶液を、試料希釈剤(ForteBio,art.No.18−5028)中での希釈によって作製した。アミン反応性センサー(ForteBio,art.no.18−0008)を、HuMabの固定化に使用した。アミン反応性センサーへのカップリングの前に、HuMabを、MES pH6.0緩衝液(18−5027)中で希釈した。カップリングを、30℃および1000rpmで、以下のとおりに行った:アミン反応性センサーを、PBS中で予め湿らせ、続いて、300秒間にわたって(製造業者の指示にしたがって)EDC/NHS(ForteBio.Art.no.18−1033/18−1034)活性化溶液で活性化した。活性化センサーを、600秒間、HuMabで固定化した。固定化センサーを、エタノールアミンとの残っているアミン反応性のためにクエンチした(ForteBio,cat no.18−1039)。クエンチの後、センサーを、使用するまでPBS中に入れた。クロスブロック分析は、30℃および1000rpmでベースライン反応を設定することから開始する。ベースライン反応は、120秒間にわたって試料希釈剤に浸漬することによって得られた。SORTECDHisの会合は、300秒間にわたって行われ、その直後に、300秒間にわたってHuMabの会合が行われた。HuMabの会合の後、センサーを再生し(10mMのグリシンpH1.0)、5秒間にわたって3回中和した(試料希釈剤)。データを、ForteBio Analysis 6.4ソフトウェアを用いて処理した。
抗体のIC50値を、均一性時間分解蛍光(HTRF、CisBio)アッセイを用いて、ソルチリンへのPGRN結合の移動を測定することによって決定した(図5および図6を参照)。
ソルチリン特異的化合物AF38469(Schroeder et al,Bioorg Med Chem Lett.2014 Jan 1;24(1):177−80,2014)のIC50を、シンチレーション近接アッセイ(SPA)を用いて、ソルチリンへの3H−ニューロテンシン結合の移動を測定することによって決定した。
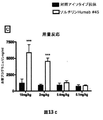
ソルチリンで一過性にトランスフェクトした細胞および安定した細胞株S18−HEK細胞(ヒトソルチリン過剰発現HEK細胞)の両方を、このアッセイに使用した。細胞をトリプシン処理し、96ウェルプレートにおいてウェル当たり42,000個の細胞の密度で平板培養した。一過性にトランスフェクトした細胞の場合、細胞を、96ウェルプレートにおけるトランスフェクションの24時間後に平板培養した。翌日、培地を完全に交換し、培地中で希釈された試験化合物を、30分間にわたって細胞に加えてから、4時間にわたってPGRNを加えた。試験の最後に(4.5時間後)、細胞を固定し、PGRNについて染色した。全ての染色されたプレートを、Cellomics Array Scan(Thermo Fischer)によって分析し、PGRN/細胞/ウェルの平均染色強度を、分析に使用した。
HEK293細胞およびS18−HEK細胞は両方とも、刺激なしで、PGRNを連続して培地中に分泌することが分かった。
誘導された多能性幹細胞(iPSC)を、他で記載されるように(Rasmussen et al.,Stem Cell Reports.2014 Sep 9;3(3):404−13.)ヒト線維芽細胞(18歳の男性の正常なヒト皮膚線維芽細胞;Lonza)の非統合的(non−integrative)再プログラミングによって生成した。NHDF K1_shp53系統を、これらの試験に使用した。iPSCを、mTESR培地中で最初に生成し、続いて、Pluripro(Cell Guidance System)において単層中で培養した。ポリ−L−オルニチン/ラミニン被覆皿上で細胞を再度平板培養し、それらを、500ng/mLの脳(noggin)および10μMのSB431542とともにN3培地(RA、0.5mMのGlutaMAX、0.5& NEA、50μMの2−メルカプトエタノールおよび2.5mg/mLのインスリンとともに0.5%のN2、1%のB27が補充された、50%のDMEM/F12+50%のNeurobasal培地)中で培養することによって、神経分化を0日目に開始させた。培地を、毎日新しくした。脳/SB431542誘導の11日後、細胞を、dispaseで分割し、N3培地中でポリ−L−オルニチン/ラミニンにおいて再度平板培養した。その時点から、N3培地を、2〜3日ごとに新しくし、細胞を、accutaseを用いて、ほぼ10〜14日ごとに分割した。
血漿中のPGRNレベルに対する抗体の効果を分析するために、ヒト化ソルチリンKIマウスに、単回または複数回注入(10mg/kg)のソルチリン抗体またはアイソタイプ対照を、皮下注入によって与えた。動物に麻酔をかけ、投与後の様々な時点で殺処分し、血漿PGRNレベルをELISAによって決定した。
水素/重水素交換、続いて質量分析法(HDX−MS)において、タンパク質中の骨格アミド水素の交換速度が測定される。これによって、プロリン残基を除く全タンパク質骨格の立体配座動態を調べることが可能である。交換反応の速度は、骨格アミドの水素結合状態およびより低い程度に溶媒露出度(solvent accessibility)によって決定される。例えばリガンドの存在によって引き起こされるこれらの2つのパラメータのわずかな変化が、重水素取り込みの変化として観察され得る。
ソルチリン(配列番号188)の細胞外領域の重水素取り込みを、mAb45、mAb68、mAb811およびD領域に結合しないmAb30と示される抗体の非存在下および存在下で測定した。測定を定常状態条件下で行うのを確実にするために、複合体を25℃で15分間平衡化してから、交換反応を開始させた。交換反応を、重水素化緩衝液(99%のD2O、20mMのトリス、150mMのNaCl、pDread=7.6)中へのタンパク質試料の1:9(v/v)の希釈によって開始させた。様々な時点(15秒、1分、10分、1時間および8時間)の後、交換反応を、氷冷クエンチ緩衝液(2Mのグリシン、0.8Mのトリス−(2−カルボキシエチル)ホスフィン(TCEP)、pH=2.3)による1:1(v/v)の希釈によってクエンチし、それによって、pHを2.46に低下させた。クエンチされた試料を、直ぐに−80°の冷凍庫の中に入れ、分析するまで貯蔵した。完全に重水素化された対照試料を、重水素化変性緩衝液(6Mの塩化グアニジウム、99%のD2O、20mMのトリス、150mMのNaCl、pDread=7.6)中へのソルチリン試料の1:9(v/v)の希釈によって調製し、続いて、25℃で16時間インキュベートしてから、それらをクエンチし、上述されるように処理した。
ペプチドの同定
収集された質量スペクトルは、GFPに対して補正されたロックマス(lock mass)であり、前駆体およびフラグメントイオンを局所タンパク質データベースに適合させるPLGS 3.0において分析された。全てのペプチドの同定を、手動で注意深く評価した。
プッシュプル微小透析方法を用いて、覚醒および自由行動マウスに由来する脳ISFプログラニュリン(PRGN)を評価した。マウスを、制御された温度(22±1.5℃)および湿度条件(55〜65%)において単一の小屋に収容し、12:12時間の明/暗サイクル(06:00hで照明をオンにする)で飼育した。食物および水は自由に摂取可能であった。この試験を、ヒトソルチリンノックイン(hSORT1)マウス(22週齢)の海馬において行った。海馬における微小透析を可能にするために、マウスにイソフルランで麻酔をかけ、大脳内ガイドカニューレ(CMA)を、脳内に定位に埋め込み、PaxinosおよびFranklin 2001の図解にしたがって、微小透析プローブを海馬内で位置決めした(プローブ先端の配置:ブレグマの3.1mm後方および2.8mm側方、および硬膜に対して1.3mm)。アクリルセメントを、ガイドカニューレの固定に使用した。カニューレの埋め込みの後、マウスを、透析前の7日間にわたって外科手術から回復させた。外科手術の日を含む最初の5日間、動物は、疼痛を有し、抗生物質処理を与えられた(RimadylおよびNoromox Prolongatum)。微小透析実験の開始の24時間前に、かん流液を管から引き出すことによって、プローブからのかん流液損失を防ぐために、蠕動ポンプをさらに出口管に連結した。かん流緩衝液として、25%のウシアルブミン画分V(Sigma)を、使用当日に人工CSF(aCSF;mM単位:147NaCl、2.7KCl、1.2CaCl2、0.85MgCl2)で0.2%に希釈し、0.1μmの膜に通してろ過した。ポンプの実際の流量を、プローブを連結させずに測定した。試料管を、所与の期間にわたって試料採取する前および後に秤量し、流量を計算した。次に、ポンプを、1μL/分の一定流量を有するように設定した。120分のサンプリング計画を、実験期間を通して使用し、12の試料(12時間の収集)を収集した(手順については、図17)。実験の最後に、血液を動物から採取し、動物をかん流させ、脳を収集した。透析液、血漿および脳を、ELISAによるPRGNの決定まで−80℃で貯蔵した。
時間後の12の透析試料の平均±SEMを、ベースラインとして取った(図18b)。m
ab #45およびPBSで処理された動物間の差を、対応のないt検定を用いて分析し
た。mab #45で処理された動物におけるPRGNの基底レベルは、PBSで処理さ
れた動物からのものと比較したとき、有意に増加された(p<0.001、F10.0、
DFn、9 Dfd 7;3.3±0.3ng/ml、n=10対1.1±0.1ng/
ml、n=8)(図18b)。
本発明は以下の態様も含み得る。
[1]
ソルチリンに特異的に結合し、ソルチリンへのPGRNの結合を阻害するかまたは減少
させることが可能な抗体、またはその抗原結合フラグメント。
[2]
前記抗原結合フラグメントが、Fvフラグメント(例えば一本鎖Fvまたはジスルフィ
ド結合Fv);Fab様フラグメント(例えばFabフラグメント、Fab’フラグメン
トまたはF(ab)2フラグメント);およびドメイン抗体(例えば単一のVH可変領域
またはVL可変領域)からなる群から選択される、請求項1に記載の抗体、またはその抗
原結合フラグメント。
[3]
前記抗体が、無傷の抗体からなる、請求項1または2に記載の抗体。
[4]
前記抗体が、サブタイプIgG1、IgG2、IgG3またはIgG4の抗体からなる
群から選択される、請求項1〜3のいずれか一項に記載の抗体、またはその抗原結合フラ
グメント。
[5]
前記抗体またはその抗原結合フラグメントが、配列番号170によって定義されるソル
チリンのD領域に結合する、請求項1〜4のいずれか一項に記載の抗体、またはその抗原
結合フラグメント。
[6]
前記抗体またはその抗原結合フラグメントが、配列番号185、186または187の
いずれか1つによって定義されるソルチリンのD領域に結合する、請求項1〜5のいずれ
か一項に記載の抗体、またはその抗原結合フラグメント。
[7]
前記抗体またはその抗原結合フラグメントが、配列番号180によって定義されるソル
チリンのA領域にさらに結合する、請求項5または6に記載の抗体、またはその抗原結合
フラグメント。
[8]
前記抗体またはその抗原結合フラグメントが、配列番号181、182、183または
184のいずれか1つによって定義されるソルチリンのA領域にさらに結合する、請求項
5または6に記載の抗体、またはその抗原結合フラグメント。
[9]
前記抗体またはその抗原結合フラグメントが、配列番号170によって定義されるソル
チリンのD領域内の、少なくとも3連続アミノ酸、例えば4、5、6または7連続アミノ
酸に結合する、請求項1〜8のいずれか一項に記載の抗体、またはその抗原結合フラグメ
ント。
[10]
前記抗体または抗原結合フラグメントが、以下の特性:
a.0.5〜10nM、例えば1〜5nMまたは1〜2nMの、ソルチリンに対する結
合親和性(KD);
b.ソルチリンへのPGRN結合を減少させ、および/または阻害する能力;
c.ソルチリン発現細胞によってPGRNのクリアランスを減少させ、および/または
阻害する能力;
d.ソルチリン発現細胞によってPGRNのエンドサイトーシスを減少させ、および/
または阻害する能力;
e.脳内のPGRNの量および/または濃度を増加させる能力、および/または
f.ヒト−ソルチリン発現ノックインマウスにおいて血漿中のPGRNの量および/ま
たは濃度を増加させる能力
の1つまたは複数を示す、請求項1〜9のいずれか一項に記載の抗体、またはその抗原結
合フラグメント。
[11]
ソルチリンへのPGRN結合を減少させ、および/または阻害する前記抗体またはその
抗原結合フラグメントの前記能力が、時間分解蛍光アッセイ(HTFR)を用いて、50
nM未満であるが、好ましくは、10nM〜0.2nMのIC50におけるものである、
請求項1〜9のいずれか一項に記載の抗体、またはその抗原結合フラグメント。
[12]
ソルチリンへのPGRN結合を減少させ、および/または阻害する前記抗体またはその
抗原結合フラグメントの前記能力が、22nM以下、例えば22nM〜1nM、または1
0nM〜1nM、または5nM〜1nMのIC50で、ソルチリンへのPGRN結合を減
少させ、および/または阻害することを含む、請求項1〜9のいずれか一項に記載の抗体
、またはその抗原結合フラグメント。
[13]
前記抗体またはその抗原結合フラグメントが、ヒト、ヒト化、組み換えまたはキメラ抗
体である、請求項1〜12のいずれか一項に記載の抗体、またはその抗原結合フラグメン
ト。
[14]
前記抗体またはその抗原結合フラグメントが、
a.配列番号1を含む軽鎖可変領域L−CDR1;
b.配列番号2を含む軽鎖可変領域L−CDR2;
c.配列番号3を含む軽鎖可変領域L−CDR3;
d.配列番号4を含む重鎖可変領域H−CDR1;
e.配列番号5を含む重鎖可変領域H−CDR2;および
f.配列番号6を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[15]
前記抗体またはその抗原結合フラグメントが、配列番号8を含む重鎖可変領域を含む、
請求項14に記載の抗体、またはその抗原結合フラグメント。
[16]
前記抗体またはその抗原結合フラグメントが、配列番号7を含む軽鎖可変領域を含む、
請求項14に記載の抗体、またはその抗原結合フラグメント。
[17]
前記抗体またはその抗原結合フラグメントが、請求項15および16に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項14に記載の抗体、またはその抗原結合フ
ラグメント。
[18]
前記抗体またはその抗原結合フラグメントが、
a.配列番号9を含む軽鎖可変領域L−CDR1;
b.配列番号10を含む軽鎖可変領域L−CDR2;
c.配列番号11を含む軽鎖可変領域L−CDR3;
d.配列番号12を含む重鎖可変領域H−CDR1;
e.配列番号13を含む重鎖可変領域H−CDR2;および
f.配列番号14を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[19]
前記抗体またはその抗原結合フラグメントが、配列番号16を含む重鎖可変領域を含む
、請求項18に記載の抗体、またはその抗原結合フラグメント。
[20]
前記抗体またはその抗原結合フラグメントが、配列番号15を含む軽鎖可変領域を含む
、請求項18に記載の抗体、またはその抗原結合フラグメント。
[21]
前記抗体またはその抗原結合フラグメントが、請求項19および20に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項18に記載の抗体、またはその抗原結合フ
ラグメント。
[22]
前記抗体またはその抗原結合フラグメントが、
a.配列番号17を含む軽鎖可変領域L−CDR1;
b.配列番号18を含む軽鎖可変領域L−CDR2;
c.配列番号19を含む軽鎖可変領域L−CDR3;
d.配列番号20を含む重鎖可変領域H−CDR1;
e.配列番号21を含む重鎖可変領域H−CDR2;および
f.配列番号22を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[23]
前記抗体またはその抗原結合フラグメントが、配列番号24を含む重鎖可変領域を含む
、請求項22に記載の抗体、またはその抗原結合フラグメント。
[24]
前記抗体またはその抗原結合フラグメントが、配列番号23を含む軽鎖可変領域を含む
、請求項22に記載の抗体、またはその抗原結合フラグメント。
[25]
前記抗体またはその抗原結合フラグメントが、請求項23および24に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項22に記載の抗体、またはその抗原結合フ
ラグメント。
[26]
前記抗体またはその抗原結合フラグメントが、
a.配列番号25を含む軽鎖可変領域L−CDR1;
b.配列番号26を含む軽鎖可変領域L−CDR2;
c.配列番号27を含む軽鎖可変領域L−CDR3;
d.配列番号28を含む重鎖可変領域H−CDR1;
e.配列番号29を含む重鎖可変領域H−CDR2;および
f.配列番号30を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[27]
前記抗体またはその抗原結合フラグメントが、配列番号32を含む重鎖可変領域を含む
、請求項26に記載の抗体、またはその抗原結合フラグメント。
[28]
前記抗体またはその抗原結合フラグメントが、配列番号31を含む軽鎖可変領域を含む
、請求項26に記載の抗体、またはその抗原結合フラグメント。
[29]
前記抗体またはその抗原結合フラグメントが、請求項27および28に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項26に記載の抗体、またはその抗原結合フ
ラグメント。
[30]
前記抗体またはその抗原結合フラグメントが、
a.配列番号33を含む軽鎖可変領域L−CDR1;
b.配列番号34を含む軽鎖可変領域L−CDR2;
c.配列番号35を含む軽鎖可変領域L−CDR3;
d.配列番号36を含む重鎖可変領域H−CDR1;
e.配列番号37を含む重鎖可変領域H−CDR2;および
f.配列番号38を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[31]
前記抗体またはその抗原結合フラグメントが、配列番号40を含む重鎖可変領域を含む
、請求項30に記載の抗体、またはその抗原結合フラグメント。
[32]
前記抗体またはその抗原結合フラグメントが、配列番号39を含む軽鎖可変領域を含む
、請求項30に記載の抗体、またはその抗原結合フラグメント。
[33]
前記抗体またはその抗原結合フラグメントが、請求項31および32に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項30に記載の抗体またはその抗原結合フラ
グメント。
[34]
前記抗体またはその抗原結合フラグメントが、
a.配列番号41を含む軽鎖可変領域L−CDR1;
b.配列番号42を含む軽鎖可変領域L−CDR2;
c.配列番号43を含む軽鎖可変領域L−CDR3;
d.配列番号44を含む重鎖可変領域H−CDR1;
e.配列番号45を含む重鎖可変領域H−CDR2;および
f.配列番号46を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[35]
前記抗体またはその抗原結合フラグメントが、配列番号48を含む重鎖可変領域を含む
、請求項34に記載の抗体、またはその抗原結合フラグメント。
[36]
前記抗体またはその抗原結合フラグメントが、配列番号47を含む軽鎖可変領域を含む
、請求項34に記載の抗体、またはその抗原結合フラグメント。
[37]
前記抗体またはその抗原結合フラグメントが、請求項35および36に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項34に記載の抗体、またはその抗原結合フ
ラグメント。
[38]
前記抗体またはその抗原結合フラグメントが、
a.配列番号49を含む軽鎖可変領域L−CDR1;
b.配列番号50を含む軽鎖可変領域L−CDR2;
c.配列番号51を含む軽鎖可変領域L−CDR3;
d.配列番号52を含む重鎖可変領域H−CDR1;
e.配列番号53を含む重鎖可変領域H−CDR2;および
f.配列番号54を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[39]
前記抗体またはその抗原結合フラグメントが、配列番号56を含む重鎖可変領域を含む
、請求項38に記載の抗体、またはその抗原結合フラグメント。
[40]
前記抗体またはその抗原結合フラグメントが、配列番号55を含む軽鎖可変領域を含む
、請求項38に記載の抗体、またはその抗原結合フラグメント。
[41]
前記抗体またはその抗原結合フラグメントが、請求項39および40に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項38に記載の抗体、またはその抗原結合フ
ラグメント。
[42]
前記抗体またはその抗原結合フラグメントが、
a.配列番号57を含む軽鎖可変領域L−CDR1;
b.配列番号58を含む軽鎖可変領域L−CDR2;
c.配列番号59を含む軽鎖可変領域L−CDR3;
d.配列番号60を含む重鎖可変領域H−CDR1;
e.配列番号61を含む重鎖可変領域H−CDR2;および
f.配列番号62を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[43]
前記抗体またはその抗原結合フラグメントが、配列番号64を含む重鎖可変領域を含む
、請求項42に記載の抗体、またはその抗原結合フラグメント。
[44]
前記抗体またはその抗原結合フラグメントが、配列番号63を含む軽鎖可変領域を含む
、請求項42に記載の抗体、またはその抗原結合フラグメント。
[45]
前記抗体またはその抗原結合フラグメントが、請求項43および44に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項42に記載の抗体、またはその抗原結合フ
ラグメント。
[46]
前記抗体またはその抗原結合フラグメントが、
a.配列番号65を含む軽鎖可変領域L−CDR1;
b.配列番号66を含む軽鎖可変領域L−CDR2;
c.配列番号67を含む軽鎖可変領域L−CDR3;
d.配列番号68を含む重鎖可変領域H−CDR1;
e.配列番号69を含む重鎖可変領域H−CDR2;および
f.配列番号70を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[47]
前記抗体またはその抗原結合フラグメントが、配列番号72を含む重鎖可変領域を含む
、請求項46に記載の抗体またはその抗原結合フラグメント。
[48]
前記抗体またはその抗原結合フラグメントが、配列番号71を含む軽鎖可変領域を含む
、請求項46に記載の抗体またはその抗原結合フラグメント。
[49]
前記抗体またはその抗原結合フラグメントが、請求項47および48に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項46に記載の抗体またはその抗原結合フラ
グメント。
[50]
前記抗体またはその抗原結合フラグメントが、
a.配列番号73を含む軽鎖可変領域L−CDR1;
b.配列番号74を含む軽鎖可変領域L−CDR2;
c.配列番号75を含む軽鎖可変領域L−CDR3;
d.配列番号76を含む重鎖可変領域H−CDR1;
e.配列番号77を含む重鎖可変領域H−CDR2;および
f.配列番号78を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[51]
前記抗体またはその抗原結合フラグメントが、配列番号80を含む重鎖可変領域を含む
、請求項50に記載の抗体またはその抗原結合フラグメント。
[52]
前記抗体またはその抗原結合フラグメントが、配列番号79を含む軽鎖可変領域を含む
、請求項50に記載の抗体またはその抗原結合フラグメント。
[53]
前記抗体またはその抗原結合フラグメントが、請求項51および52に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項50に記載の抗体またはその抗原結合フラ
グメント。
[54]
前記抗体またはその抗原結合フラグメントが、
a.配列番号81を含む軽鎖可変領域L−CDR1;
b.配列番号82を含む軽鎖可変領域L−CDR2;
c.配列番号83を含む軽鎖可変領域L−CDR3;
d.配列番号84を含む重鎖可変領域H−CDR1;
e.配列番号85を含む重鎖可変領域H−CDR2;および
f.配列番号86を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[55]
前記抗体またはその抗原結合フラグメントが、配列番号88を含む重鎖可変領域を含む
、請求項54に記載の抗体またはその抗原結合フラグメント。
[56]
前記抗体またはその抗原結合フラグメントが、配列番号87を含む軽鎖可変領域を含む
、請求項54に記載の抗体またはその抗原結合フラグメント。
[57]
前記抗体またはその抗原結合フラグメントが、請求項55および56に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項54に記載の抗体またはその抗原結合フラ
グメント。
[58]
前記抗体またはその抗原結合フラグメントが、
a.配列番号89を含む軽鎖可変領域L−CDR1;
b.配列番号90を含む軽鎖可変領域L−CDR2;
c.配列番号91を含む軽鎖可変領域L−CDR3;
d.配列番号92を含む重鎖可変領域H−CDR1;
e.配列番号93を含む重鎖可変領域H−CDR2;および
f.配列番号94を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[59]
前記抗体またはその抗原結合フラグメントが、配列番号96を含む重鎖可変領域を含む
、請求項58に記載の抗体またはその抗原結合フラグメント。
[60]
前記抗体またはその抗原結合フラグメントが、配列番号95を含む軽鎖可変領域を含む
、請求項58に記載の抗体またはその抗原結合フラグメント。
[61]
前記抗体またはその抗原結合フラグメントが、請求項59および60に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項58に記載の抗体またはその抗原結合フラ
グメント。
[62]
前記抗体またはその抗原結合フラグメントが、
a.配列番号97を含む軽鎖可変領域L−CDR1;
b.配列番号98を含む軽鎖可変領域L−CDR2;
c.配列番号99を含む軽鎖可変領域L−CDR3;
d.配列番号100を含む重鎖可変領域H−CDR1;
e.配列番号101を含む重鎖可変領域H−CDR2;および
f.配列番号102を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[63]
前記抗体またはその抗原結合フラグメントが、配列番号104を含む重鎖可変領域を含
む、請求項62に記載の抗体またはその抗原結合フラグメント。
[64]
前記抗体またはその抗原結合フラグメントが、配列番号103を含む軽鎖可変領域を含
む、請求項62に記載の抗体またはその抗原結合フラグメント。
[65]
前記抗体またはその抗原結合フラグメントが、請求項63および64に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項62に記載の抗体またはその抗原結合フラ
グメント。
[66]
前記抗体またはその抗原結合フラグメントが、
a.配列番号105を含む軽鎖可変領域L−CDR1;
b.配列番号106を含む軽鎖可変領域L−CDR2;
c.配列番号107を含む軽鎖可変領域L−CDR3;
d.配列番号108を含む重鎖可変領域H−CDR1;
e.配列番号109を含む重鎖可変領域H−CDR2;および
f.配列番号110を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[67]
前記抗体またはその抗原結合フラグメントが、配列番号112を含む重鎖可変領域を含
む、請求項66に記載の抗体またはその抗原結合フラグメント。
[68]
前記抗体またはその抗原結合フラグメントが、配列番号111を含む軽鎖可変領域を含
む、請求項66に記載の抗体またはその抗原結合フラグメント。
[69]
前記抗体またはその抗原結合フラグメントが、請求項67および68に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項66に記載の抗体またはその抗原結合フラ
グメント。
[70]
前記抗体またはその抗原結合フラグメントが、
a.配列番号113を含む軽鎖可変領域L−CDR1;
b.配列番号114を含む軽鎖可変領域L−CDR2;
c.配列番号115を含む軽鎖可変領域L−CDR3;
d.配列番号116を含む重鎖可変領域H−CDR1;
e.配列番号117を含む重鎖可変領域H−CDR2;および
f.配列番号118を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[71]
前記抗体またはその抗原結合フラグメントが、配列番号120を含む重鎖可変領域を含
む、請求項70に記載の抗体またはその抗原結合フラグメント。
[72]
前記抗体またはその抗原結合フラグメントが、配列番号119を含む軽鎖可変領域を含
む、請求項70に記載の抗体またはその抗原結合フラグメント。
[73]
前記抗体またはその抗原結合フラグメントが、請求項71および72に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項70に記載の抗体またはその抗原結合フラ
グメント。
[74]
前記抗体またはその抗原結合フラグメントが、
a.配列番号121を含む軽鎖可変領域L−CDR1;
b.配列番号122を含む軽鎖可変領域L−CDR2;
c.配列番号123を含む軽鎖可変領域L−CDR3;
d.配列番号124を含む重鎖可変領域H−CDR1;
e.配列番号125を含む重鎖可変領域H−CDR2;および
f.配列番号126を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[75]
前記抗体またはその抗原結合フラグメントが、配列番号128を含む重鎖可変領域を含
む、請求項74に記載の抗体またはその抗原結合フラグメント。
[76]
前記抗体またはその抗原結合フラグメントが、配列番号127を含む軽鎖可変領域を含
む、請求項74に記載の抗体またはその抗原結合フラグメント。
[77]
前記抗体またはその抗原結合フラグメントが、請求項75および76に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項74に記載の抗体またはその抗原結合フラ
グメント。
[78]
前記抗体またはその抗原結合フラグメントが、
a.配列番号129を含む軽鎖可変領域L−CDR1;
b.配列番号130を含む軽鎖可変領域L−CDR2;
c.配列番号131を含む軽鎖可変領域L−CDR3;
d.配列番号132を含む重鎖可変領域H−CDR1;
e.配列番号133を含む重鎖可変領域H−CDR2;および
f.配列番号134を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[79]
前記抗体またはその抗原結合フラグメントが、配列番号136を含む重鎖可変領域を含
む、請求項78に記載の抗体またはその抗原結合フラグメント。
[80]
前記抗体またはその抗原結合フラグメントが、配列番号135を含む軽鎖可変領域を含
む、請求項78に記載の抗体またはその抗原結合フラグメント。
[81]
前記抗体またはその抗原結合フラグメントが、請求項79および80に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項78に記載の抗体またはその抗原結合フラ
グメント。
[82]
前記抗体またはその抗原結合フラグメントが、
a.配列番号137を含む軽鎖可変領域L−CDR1;
b.配列番号138を含む軽鎖可変領域L−CDR2;
c.配列番号139を含む軽鎖可変領域L−CDR3;
d.配列番号140を含む重鎖可変領域H−CDR1;
e.配列番号141を含む重鎖可変領域H−CDR2;および
f.配列番号142を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[83]
前記抗体またはその抗原結合フラグメントが、配列番号144を含む重鎖可変領域を含
む、請求項82に記載の抗体またはその抗原結合フラグメント。
[84]
前記抗体またはその抗原結合フラグメントが、配列番号143を含む軽鎖可変領域を含
む、請求項82に記載の抗体またはその抗原結合フラグメント。
[85]
前記抗体またはその抗原結合フラグメントが、請求項83および84に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項82に記載の抗体またはその抗原結合フラ
グメント。
[86]
前記抗体またはその抗原結合フラグメントが、
a.配列番号145を含む軽鎖可変領域L−CDR1;
b.配列番号146を含む軽鎖可変領域L−CDR2;
c.配列番号147を含む軽鎖可変領域L−CDR3;
d.配列番号148を含む重鎖可変領域H−CDR1;
e.配列番号149を含む重鎖可変領域H−CDR2;および
f.配列番号150を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[87]
前記抗体またはその抗原結合フラグメントが、配列番号152を含む重鎖可変領域を含
む、請求項86に記載の抗体またはその抗原結合フラグメント。
[88]
前記抗体またはその抗原結合フラグメントが、配列番号151を含む軽鎖可変領域を含
む、請求項86に記載の抗体またはその抗原結合フラグメント。
[89]
前記抗体またはその抗原結合フラグメントが、請求項87および88に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項86に記載の抗体またはその抗原結合フラ
グメント。
[90]
前記抗体またはその抗原結合フラグメントが、
a.配列番号153を含む軽鎖可変領域L−CDR1;
b.配列番号154を含む軽鎖可変領域L−CDR2;
c.配列番号155を含む軽鎖可変領域L−CDR3;
d.配列番号156を含む重鎖可変領域H−CDR1;
e.配列番号157を含む重鎖可変領域H−CDR2;および
f.配列番号158を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[91]
前記抗体またはその抗原結合フラグメントが、配列番号160を含む重鎖可変領域を含
む、請求項90に記載の抗体またはその抗原結合フラグメント。
[92]
前記抗体またはその抗原結合フラグメントが、配列番号159を含む軽鎖可変領域を含
む、請求項90に記載の抗体またはその抗原結合フラグメント。
[93]
前記抗体またはその抗原結合フラグメントが、請求項91および92に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項90に記載の抗体またはその抗原結合フラ
グメント。
[94]
前記抗体またはその抗原結合フラグメントが、
a.配列番号161を含む軽鎖可変領域L−CDR1;
b.配列番号162を含む軽鎖可変領域L−CDR2;
c.配列番号163を含む軽鎖可変領域L−CDR3;
d.配列番号164を含む重鎖可変領域H−CDR1;
e.配列番号165を含む重鎖可変領域H−CDR2;および
f.配列番号166を含む重鎖可変領域H−CDR3
を含む、請求項1〜13のいずれか一項に記載の抗体、またはその抗原結合フラグメント
。
[95]
前記抗体またはその抗原結合フラグメントが、配列番号168を含む重鎖可変領域を含
む、請求項94に記載の抗体またはその抗原結合フラグメント。
[96]
前記抗体またはその抗原結合フラグメントが、配列番号167を含む軽鎖可変領域を含
む、請求項94に記載の抗体またはその抗原結合フラグメント。
[97]
前記抗体またはその抗原結合フラグメントが、請求項95および96に記載の重鎖可変
領域および軽鎖可変領域の両方を含む、請求項94に記載の抗体またはその抗原結合フラ
グメント。
[98]
請求項1〜97のいずれか一項に記載の抗体またはその抗原結合フラグメントを含む調
製物であって、前記調製物が、ソルチリンに結合することが可能でないかまたは前記調製
物の抗ソルチリン機能性を実質的に変更しない自然発生する抗体を実質的に含まず、前記
機能性が、
(i)ソルチリンに対する結合親和性(K D );
(ii)ソルチリンへのPGRN結合を減少させ、および/または阻害する能力;
(iii)ソルチリン発現細胞によってPGRNのクリアランスを減少させ、および/
または阻害する能力;
(iv)ソルチリン発現細胞によってPGRNのエンドサイトーシスを減少させ、およ
び/または阻害する能力;
(v)ヒト−ソルチリン発現ノックインマウスにおいて血漿中のPGRNの量および/
または濃度を増加させる能力;
(vi)脳内のPGRNの量および/または濃度を増加させる能力および/または
(vii)慢性的に投与されるときの、前頭側頭認知症(FTD)、筋萎縮性側索硬化
症(ALS)またはアルツハイマー病(AD)の治療を提供する能力
からなる群から選択される調製物。
[99]
請求項1〜98のいずれか一項に記載のモノクローナル抗体またはその抗原結合フラグ
メントを含む調製物であって、前記モノクローナル抗体が、天然抗ソルチリン抗体の構造
と比べて、そのアミノ酸配列の構造変化を有し、前記構造変化
により、前記モノクローナ
ル抗体が、前記天然抗ソルチリン抗体によって示される機能性と比べて変化した機能性を
示し、前記機能性が、
(i)ソルチリンに対する結合親和性(K D );
(ii)ソルチリンへのPGRN結合を減少させ、および/または阻害する能力;
(iii)ソルチリン発現細胞によってPGRNのクリアランスを減少させ、および/
または阻害する能力;
(iv)ソルチリン発現細胞によってPGRNのエンドサイトーシスを減少させ、およ
び/または阻害する能力;
(v)ヒト−ソルチリン発現ノックインマウスにおいて血漿中のPGRNの量および/
または濃度を増加させる能力;
(vi)脳内のPGRNの量および/または濃度を増加させる能力、または
(vii)慢性的に投与されるときの、前頭側頭認知症(FTD)、筋萎縮性側索硬化
症(ALS)および/またはアルツハイマー病(AD)の治療を提供する能力
からなる群から選択される調製物。
[100]
請求項1〜97のいずれか一項に記載の抗体、またはその抗原結合フラグメント、また
は請求項98〜99のいずれか一項に記載の調製物、および薬学的に許容できる担体を含
む医薬組成物。
[101]
医療に使用するための、請求項1〜97のいずれか一項に記載の抗体、またはその抗原
結合フラグメント、または請求項98〜99のいずれか一項に記載の調製物、または請求
項100に記載の医薬組成物。
[102]
患者の脳内の減少したPGRNレベルに関連する疾患を治療するのに使用するための、
請求項1〜97のいずれか一項に記載の抗体、またはその抗原結合フラグメント、または
請求項98〜99のいずれか一項に記載の調製物、または請求項100に記載の医薬組成
物。
[103]
患者の脳内の減少したPGRNレベルに関連する疾患を治療するための薬剤の製造にお
ける、請求項1〜97のいずれか一項に記載の抗体、またはその抗原結合フラグメント、
または請求項98〜99のいずれか一項に記載の調製物、または請求項100に記載の医
薬組成物の使用。
[104]
患者の脳内の減少したPGRNレベルに関連する疾患を予防または治療する方法であっ
て、有効投与量の、請求項1〜97のいずれか一項に記載の抗体、またはその抗原結合フ
ラグメント、または請求項98〜99のいずれか一項に記載の調製物、または請求項10
0に記載の医薬組成物を投与する工程を含む方法。
[105]
前記疾患が、FTD;ALS;またはTDP43タンパク質症(ADなど)である、請
求項102に記載の使用のための抗体、またはその抗原結合フラグメント、または請求項
103に記載の使用、または請求項104に記載の方法。
[106]
前記治療が長期であり、好ましくは、少なくとも2週間、例えば少なくとも1か月間、
または少なくとも6か月間、または少なくとも1年間にわたる、請求項102に記載の使
用のための抗体、またはその抗原結合フラグメント、または請求項103に記載の使用、
または請求項104に記載の方法。
[107]
請求項1〜97のいずれか一項に記載の抗体、またはその抗原結合フラグメント、また
は請求項98〜99のいずれか一項に記載の調製物、または請求項100に記載の医薬組
成物を含むキット。
[108]
ヒト細胞株、非ヒト哺乳動物細胞株、昆虫、酵母または細菌細胞株などの細胞株におい
て生産または製造された、請求項1〜97のいずれか一項に記載の抗体、またはその抗原
結合フラグメント。
[109]
CHO細胞株、HEK細胞株、BHK−21細胞株、マウス細胞株(骨髄腫細胞株など
)、線維肉腫細胞株、PER.C6細胞株、HKB−11細胞株、CAP細胞株およびH
uH−7ヒト細胞株において生産される、請求項108に記載の抗体、またはその抗原結
合フラグメント。
Claims (19)
- 配列番号170に定義されるソルチリンのD領域に特異的に結合することができ、それによってソルチリンへのプログラニュリン(PGRN)の結合を阻害または減少するモノクローナル抗体またはその抗原結合フラグメントであって、
以下の抗体(3)〜(21)からなる群から選択される、抗体またはその抗原結合フラグメント:
以下により特徴付けられる抗体(3):
a.配列番号17を含む軽鎖可変領域L−CDR1;
b.配列番号18を含む軽鎖可変領域L−CDR2;
c.配列番号19を含む軽鎖可変領域L−CDR3;
d.配列番号20を含む重鎖可変領域H−CDR1;
e.配列番号21を含む重鎖可変領域H−CDR2;および
f.配列番号22を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(4):
a.配列番号25を含む軽鎖可変領域L−CDR1;
b.配列番号26を含む軽鎖可変領域L−CDR2;
c.配列番号27を含む軽鎖可変領域L−CDR3;
d.配列番号28を含む重鎖可変領域H−CDR1;
e.配列番号29を含む重鎖可変領域H−CDR2;および
f.配列番号30を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(5):
a.配列番号33を含む軽鎖可変領域L−CDR1;
b.配列番号34を含む軽鎖可変領域L−CDR2;
c.配列番号35を含む軽鎖可変領域L−CDR3;
d.配列番号36を含む重鎖可変領域H−CDR1;
e.配列番号37を含む重鎖可変領域H−CDR2;および
f.配列番号38を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(6):
a.配列番号41を含む軽鎖可変領域L−CDR1;
b.配列番号42を含む軽鎖可変領域L−CDR2;
c.配列番号43を含む軽鎖可変領域L−CDR3;
d.配列番号44を含む重鎖可変領域H−CDR1;
e.配列番号45を含む重鎖可変領域H−CDR2;および
f.配列番号46を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(7):
a.配列番号49を含む軽鎖可変領域L−CDR1;
b.配列番号50を含む軽鎖可変領域L−CDR2;
c.配列番号51を含む軽鎖可変領域L−CDR3;
d.配列番号52を含む重鎖可変領域H−CDR1;
e.配列番号53を含む重鎖可変領域H−CDR2;および
f.配列番号54を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(8):
a.配列番号57を含む軽鎖可変領域L−CDR1;
b.配列番号58を含む軽鎖可変領域L−CDR2;
c.配列番号59を含む軽鎖可変領域L−CDR3;
d.配列番号60を含む重鎖可変領域H−CDR1;
e.配列番号61を含む重鎖可変領域H−CDR2;および
f.配列番号62を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(9):
a.配列番号65を含む軽鎖可変領域L−CDR1;
b.配列番号66を含む軽鎖可変領域L−CDR2;
c.配列番号67を含む軽鎖可変領域L−CDR3;
d.配列番号68を含む重鎖可変領域H−CDR1;
e.配列番号69を含む重鎖可変領域H−CDR2;および
f.配列番号70を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(10):
a.配列番号73を含む軽鎖可変領域L−CDR1;
b.配列番号74を含む軽鎖可変領域L−CDR2;
c.配列番号75を含む軽鎖可変領域L−CDR3;
d.配列番号76を含む重鎖可変領域H−CDR1;
e.配列番号77を含む重鎖可変領域H−CDR2;および
f.配列番号78を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(11):
a.配列番号81を含む軽鎖可変領域L−CDR1;
b.配列番号82を含む軽鎖可変領域L−CDR2;
c.配列番号83を含む軽鎖可変領域L−CDR3;
d.配列番号84を含む重鎖可変領域H−CDR1;
e.配列番号85を含む重鎖可変領域H−CDR2;および
f.配列番号86を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(12):
a.配列番号89を含む軽鎖可変領域L−CDR1;
b.配列番号90を含む軽鎖可変領域L−CDR2;
c.配列番号91を含む軽鎖可変領域L−CDR3;
d.配列番号92を含む重鎖可変領域H−CDR1;
e.配列番号93を含む重鎖可変領域H−CDR2;および
f.配列番号94を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(13):
a.配列番号97を含む軽鎖可変領域L−CDR1;
b.配列番号98を含む軽鎖可変領域L−CDR2;
c.配列番号99を含む軽鎖可変領域L−CDR3;
d.配列番号100を含む重鎖可変領域H−CDR1;
e.配列番号101を含む重鎖可変領域H−CDR2;および
f.配列番号102を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(14):
a.配列番号105を含む軽鎖可変領域L−CDR1;
b.配列番号106を含む軽鎖可変領域L−CDR2;
c.配列番号107を含む軽鎖可変領域L−CDR3;
d.配列番号108を含む重鎖可変領域H−CDR1;
e.配列番号109を含む重鎖可変領域H−CDR2;および
f.配列番号110を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(15):
a.配列番号113を含む軽鎖可変領域L−CDR1;
b.配列番号114を含む軽鎖可変領域L−CDR2;
c.配列番号115を含む軽鎖可変領域L−CDR3;
d.配列番号116を含む重鎖可変領域H−CDR1;
e.配列番号117を含む重鎖可変領域H−CDR2;および
f.配列番号118を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(16):
a.配列番号121を含む軽鎖可変領域L−CDR1;
b.配列番号122を含む軽鎖可変領域L−CDR2;
c.配列番号123を含む軽鎖可変領域L−CDR3;
d.配列番号124を含む重鎖可変領域H−CDR1;
e.配列番号125を含む重鎖可変領域H−CDR2;および
f.配列番号126を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(17):
a.配列番号129を含む軽鎖可変領域L−CDR1;
b.配列番号130を含む軽鎖可変領域L−CDR2;
c.配列番号131を含む軽鎖可変領域L−CDR3;
d.配列番号132を含む重鎖可変領域H−CDR1;
e.配列番号133を含む重鎖可変領域H−CDR2;および
f.配列番号134を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(18):
a.配列番号137を含む軽鎖可変領域L−CDR1;
b.配列番号138を含む軽鎖可変領域L−CDR2;
c.配列番号139を含む軽鎖可変領域L−CDR3;
d.配列番号140を含む重鎖可変領域H−CDR1;
e.配列番号141を含む重鎖可変領域H−CDR2;および
f.配列番号142を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(19):
a.配列番号145を含む軽鎖可変領域L−CDR1;
b.配列番号146を含む軽鎖可変領域L−CDR2;
c.配列番号147を含む軽鎖可変領域L−CDR3;
d.配列番号148を含む重鎖可変領域H−CDR1;
e.配列番号149を含む重鎖可変領域H−CDR2;および
f.配列番号150を含む重鎖可変領域H−CDR3、
以下により特徴付けられる抗体(20):
a.配列番号153を含む軽鎖可変領域L−CDR1;
b.配列番号154を含む軽鎖可変領域L−CDR2;
c.配列番号155を含む軽鎖可変領域L−CDR3;
d.配列番号156を含む重鎖可変領域H−CDR1;
e.配列番号157を含む重鎖可変領域H−CDR2;および
f.配列番号158を含む重鎖可変領域H−CDR3、または
以下により特徴付けられる抗体(21):
a.配列番号161を含む軽鎖可変領域L−CDR1;
b.配列番号162を含む軽鎖可変領域L−CDR2;
c.配列番号163を含む軽鎖可変領域L−CDR3;
d.配列番号164を含む重鎖可変領域H−CDR1;
e.配列番号165を含む重鎖可変領域H−CDR2;および
f.配列番号166を含む重鎖可変領域H−CDR3。 - 前記抗体がさらに以下により特徴付けられる、請求項1に記載の抗体:
前記抗体(3)が、配列番号24を含む重鎖可変領域および配列番号23を含む軽鎖可変領域を含む、
前記抗体(4)が、配列番号32を含む重鎖可変領域および配列番号31を含む軽鎖可変領域を含む、
前記抗体(5)が、配列番号40を含む重鎖可変領域および配列番号39を含む軽鎖可変領域を含む、
前記抗体(6)が、配列番号48を含む重鎖可変領域および配列番号47を含む軽鎖可変領域を含む、
前記抗体(7)が、配列番号56を含む重鎖可変領域および配列番号55を含む軽鎖可変領域を含む、
前記抗体(8)が、配列番号64を含む重鎖可変領域および配列番号63を含む軽鎖可変領域を含む、
前記抗体(9)が、配列番号72を含む重鎖可変領域および配列番号71を含む軽鎖可変領域を含む、
前記抗体(10)が、配列番号80を含む重鎖可変領域および配列番号79を含む軽鎖可変領域を含む、
前記抗体(11)が、配列番号88を含む重鎖可変領域および配列番号87を含む軽鎖可変領域を含む、
前記抗体(12)が、配列番号96を含む重鎖可変領域および配列番号95を含む軽鎖可変領域を含む、
前記抗体(13)が、配列番号104を含む重鎖可変領域および配列番号103を含む軽鎖可変領域を含む、
前記抗体(14)が、配列番号112を含む重鎖可変領域および配列番号111を含む軽鎖可変領域を含む、
前記抗体(15)が、配列番号120を含む重鎖可変領域および配列番号119を含む軽鎖可変領域を含む、
前記抗体(16)が、配列番号128を含む重鎖可変領域および配列番号127を含む軽鎖可変領域を含む、
前記抗体(17)が、配列番号136を含む重鎖可変領域および配列番号135を含む軽鎖可変領域を含む、
前記抗体(18)が、配列番号144を含む重鎖可変領域および配列番号143を含む軽鎖可変領域を含む、
前記抗体(19)が、配列番号152を含む重鎖可変領域および配列番号151を含む軽鎖可変領域を含む、
前記抗体(20)が、配列番号160を含む重鎖可変領域および配列番号159を含む軽鎖可変領域を含む、または
前記抗体(21)が、配列番号168を含む重鎖可変領域および配列番号167を含む軽鎖可変領域を含む。 - 患者の脳内の減少したPGRNレベルに関連する疾患を治療するための、請求項1または2に記載の抗体。
- 請求項1または2に記載の抗体および薬学的に許容できる担体を含む医薬組成物。
- 患者の脳内の減少したPGRNレベルに関連する疾患を治療するための、請求項1または2に記載の抗体および薬学的に許容できる担体を含む医薬組成物。
- 前記疾患が、前頭側頭認知症;筋萎縮性側索硬化症;またはアルツハイマー病などのTAR DNA結合タンパク質−43タンパク質症である、請求項5に記載の医薬組成物。
- 前記治療が、少なくとも2週間の慢性的投与を含む、請求項5または6に記載の医薬組成物。
- 前記治療が、少なくとも1か月間の慢性的投与を含む、請求項5または6に記載の医薬組成物。
- 前記治療が、少なくとも6か月間の慢性的投与を含む、請求項5または6に記載の医薬組成物。
- 前記治療が、少なくとも1年間の慢性的投与を含む、請求項5または6に記載の医薬組成物。
- 患者の脳内の減少したPGRNレベルに関連する疾患を治療するための医薬を製造するための、請求項1または2に記載の抗体の使用。
- 患者の脳内の減少したPGRNレベルに関連する疾患を治療するための医薬を製造するための、請求項4に記載の医薬組成物の使用。
- 前記疾患が、前頭側頭認知症;筋萎縮性側索硬化症;またはアルツハイマー病などのTAR DNA結合タンパク質−43タンパク質症である、請求項11または12に記載の使用。
- 前記治療が、少なくとも2週間の慢性的投与を含む、請求項11または12に記載の使用。
- 前記治療が、少なくとも1か月間の慢性的投与を含む、請求項11または12に記載の使用。
- 前記治療が、少なくとも6か月間の慢性的投与を含む、請求項11または12に記載の使用。
- 前記治療が、少なくとも1年間の慢性的投与を含む、請求項11または12に記載の使用。
- 請求項1または2に記載の抗体または請求項4に記載の医薬組成物を含むキット。
- ヒト細胞株、非ヒト哺乳動物細胞株、昆虫、酵母または細菌細胞株などの細胞株において生産または製造された、請求項1または2に記載の抗体。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2021151783A JP2022003058A (ja) | 2015-07-13 | 2021-09-17 | ソルチリンに結合し、プログラニュリンの結合を阻害する抗体 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GBGB1512215.3A GB201512215D0 (en) | 2015-07-13 | 2015-07-13 | Agents,uses and methods |
| GB1512215.3 | 2015-07-13 | ||
| PCT/EP2016/066516 WO2017009327A1 (en) | 2015-07-13 | 2016-07-12 | Antibodies that bind to sortilin and inhibit the binding of progranulin |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021151783A Division JP2022003058A (ja) | 2015-07-13 | 2021-09-17 | ソルチリンに結合し、プログラニュリンの結合を阻害する抗体 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2018529635A JP2018529635A (ja) | 2018-10-11 |
| JP2018529635A5 JP2018529635A5 (ja) | 2019-08-15 |
| JP6979397B2 true JP6979397B2 (ja) | 2021-12-15 |
Family
ID=54013862
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018501182A Active JP6979397B2 (ja) | 2015-07-13 | 2016-07-12 | ソルチリンに結合し、プログラニュリンの結合を阻害する抗体 |
| JP2021151783A Pending JP2022003058A (ja) | 2015-07-13 | 2021-09-17 | ソルチリンに結合し、プログラニュリンの結合を阻害する抗体 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021151783A Pending JP2022003058A (ja) | 2015-07-13 | 2021-09-17 | ソルチリンに結合し、プログラニュリンの結合を阻害する抗体 |
Country Status (35)
| Country | Link |
|---|---|
| US (6) | US10479835B2 (ja) |
| EP (1) | EP3322726B1 (ja) |
| JP (2) | JP6979397B2 (ja) |
| KR (1) | KR102778576B1 (ja) |
| CN (3) | CN114478775A (ja) |
| AR (1) | AR105335A1 (ja) |
| AU (1) | AU2016292980B2 (ja) |
| BR (1) | BR112018000771A2 (ja) |
| CA (1) | CA2989739A1 (ja) |
| CL (2) | CL2018000092A1 (ja) |
| CO (1) | CO2017012988A2 (ja) |
| CR (1) | CR20180002A (ja) |
| DO (1) | DOP2018000014A (ja) |
| EA (1) | EA201890038A1 (ja) |
| EC (1) | ECSP18002725A (ja) |
| ES (1) | ES3024469T3 (ja) |
| GB (1) | GB201512215D0 (ja) |
| HR (1) | HRP20250602T1 (ja) |
| HU (1) | HUE071424T2 (ja) |
| IL (1) | IL256503B (ja) |
| JO (1) | JO3710B1 (ja) |
| MA (1) | MA42440B1 (ja) |
| MX (1) | MX2018000506A (ja) |
| NI (1) | NI201800007A (ja) |
| PE (1) | PE20181014A1 (ja) |
| PH (1) | PH12018500100A1 (ja) |
| PL (1) | PL3322726T3 (ja) |
| RS (1) | RS66856B1 (ja) |
| RU (1) | RU2735639C2 (ja) |
| SV (1) | SV2018005613A (ja) |
| TN (1) | TN2017000534A1 (ja) |
| TW (1) | TWI760305B (ja) |
| UA (1) | UA125136C2 (ja) |
| WO (1) | WO2017009327A1 (ja) |
| ZA (1) | ZA201708613B (ja) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10849992B1 (en) | 2015-04-07 | 2020-12-01 | Alector Llc | Methods of screening for sortilin binding antagonists |
| JP6999421B2 (ja) | 2015-04-07 | 2022-02-04 | アレクトル エルエルシー | 抗ソルチリン抗体及びその使用方法 |
| GB201512215D0 (en) | 2015-07-13 | 2015-08-19 | Lundbeck & Co As H | Agents,uses and methods |
| US10894833B2 (en) * | 2017-07-20 | 2021-01-19 | H. Lundbeck A/S | Agents, uses and methods for treatment |
| PE20210186A1 (es) * | 2018-07-13 | 2021-02-02 | Alector Llc | Anticuerpos anti-sortilina y metodos para su uso |
| EP3666281A1 (en) * | 2018-12-14 | 2020-06-17 | Insusense ApS | Compositions comprising sortilin-1 |
| KR20220130678A (ko) * | 2019-12-23 | 2022-09-27 | 데날리 테라퓨틱스 인크. | 프로그라눌린 변이체들 |
| CN116249717A (zh) | 2020-06-24 | 2023-06-09 | 普罗塞纳生物科学有限公司 | 识别分拣蛋白的抗体 |
| CA3252861A1 (en) | 2022-06-23 | 2023-12-28 | Draupnir Bio Aps | Bifunctional molecules that selectively induce the degradation of extracellular targets in lysosomes |
| CN118496354A (zh) * | 2023-02-15 | 2024-08-16 | 三优生物医药(上海)有限公司 | 包含共同轻链的抗体库、其制备方法及其用途 |
| WO2025031098A1 (zh) * | 2023-08-09 | 2025-02-13 | 瑞诺元(苏州)生物科技有限公司 | 一种分拣蛋白1特异性的纳米抗体、含有其的重组aav及应用 |
| WO2025132764A1 (en) * | 2023-12-21 | 2025-06-26 | Amylonix Ab | A sortilin-binding polypeptide |
Family Cites Families (59)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4179337A (en) | 1973-07-20 | 1979-12-18 | Davis Frank F | Non-immunogenic polypeptides |
| JPS5896026A (ja) | 1981-10-30 | 1983-06-07 | Nippon Chemiphar Co Ltd | 新規ウロキナ−ゼ誘導体およびその製造法ならびにそれを含有する血栓溶解剤 |
| EP0098110B1 (en) | 1982-06-24 | 1989-10-18 | NIHON CHEMICAL RESEARCH KABUSHIKI KAISHA also known as JAPAN CHEMICAL RESEARCH CO., LTD | Long-acting composition |
| US4681581A (en) | 1983-12-05 | 1987-07-21 | Coates Fredrica V | Adjustable size diaper and folding method therefor |
| US4766106A (en) | 1985-06-26 | 1988-08-23 | Cetus Corporation | Solubilization of proteins for pharmaceutical compositions using polymer conjugation |
| US4735210A (en) | 1985-07-05 | 1988-04-05 | Immunomedics, Inc. | Lymphographic and organ imaging method and kit |
| US5776093A (en) | 1985-07-05 | 1998-07-07 | Immunomedics, Inc. | Method for imaging and treating organs and tissues |
| US5101827A (en) | 1985-07-05 | 1992-04-07 | Immunomedics, Inc. | Lymphographic and organ imaging method and kit |
| US5225539A (en) | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| US5750172A (en) | 1987-06-23 | 1998-05-12 | Pharming B.V. | Transgenic non human mammal milk |
| US5648471A (en) | 1987-12-03 | 1997-07-15 | Centocor, Inc. | One vial method for labeling antibodies with Technetium-99m |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| DE69032742T2 (de) | 1989-08-09 | 1999-06-17 | Rhomed, Inc., Albuquerque, N.Mex. | Direkte radioetikettierung von antikörpern und sonstigen proteinen mittels technetium oder rhenium |
| US5633076A (en) | 1989-12-01 | 1997-05-27 | Pharming Bv | Method of producing a transgenic bovine or transgenic bovine embryo |
| US5859205A (en) | 1989-12-21 | 1999-01-12 | Celltech Limited | Humanised antibodies |
| US5101990A (en) | 1990-03-23 | 1992-04-07 | Continental Pet Technologies, Inc. | Stretch blow molded oblong or oval container |
| JP2938569B2 (ja) | 1990-08-29 | 1999-08-23 | ジェンファーム インターナショナル,インコーポレイティド | 異種免疫グロブリンを作る方法及びトランスジェニックマウス |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5770429A (en) | 1990-08-29 | 1998-06-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5877397A (en) | 1990-08-29 | 1999-03-02 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5814318A (en) | 1990-08-29 | 1998-09-29 | Genpharm International Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5874299A (en) | 1990-08-29 | 1999-02-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US6300129B1 (en) | 1990-08-29 | 2001-10-09 | Genpharm International | Transgenic non-human animals for producing heterologous antibodies |
| US5789650A (en) | 1990-08-29 | 1998-08-04 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| CA2103059C (en) | 1991-06-14 | 2005-03-22 | Paul J. Carter | Method for making humanized antibodies |
| AU2235992A (en) | 1991-06-14 | 1993-01-12 | Genpharm International, Inc. | Transgenic immunodeficient non-human animals |
| DE69224906T2 (de) | 1991-07-08 | 1998-10-29 | Univ Massachusetts | Thermotropes flüssig-kristallines segment-blockcopolymer |
| ATE193301T1 (de) | 1993-03-09 | 2000-06-15 | Genzyme Corp | Verfahren zur isolierung von proteinen aus milch |
| CA2161351C (en) | 1993-04-26 | 2010-12-21 | Nils Lonberg | Transgenic non-human animals capable of producing heterologous antibodies |
| US5827690A (en) | 1993-12-20 | 1998-10-27 | Genzyme Transgenics Corporatiion | Transgenic production of antibodies in milk |
| US6077835A (en) | 1994-03-23 | 2000-06-20 | Case Western Reserve University | Delivery of compacted nucleic acid to cells |
| KR970029803A (ko) | 1995-11-03 | 1997-06-26 | 김광호 | 반도체 메모리장치의 프리차지 회로 |
| DE60013773T2 (de) | 1999-02-03 | 2005-11-10 | Biosante Pharmaceuticals, Inc. | Methoden zur Herstellung von therapeutischen Kalziumphosphat Partikeln |
| US6281005B1 (en) | 1999-05-14 | 2001-08-28 | Copernicus Therapeutics, Inc. | Automated nucleic acid compaction device |
| ATE384744T1 (de) | 1999-07-29 | 2008-02-15 | Medarex Inc | Menschliche antikörper gegen her2/neu |
| EP1212422B1 (en) | 1999-08-24 | 2007-02-21 | Medarex, Inc. | Human ctla-4 antibodies and their uses |
| KR100857943B1 (ko) | 2000-11-30 | 2008-09-09 | 메다렉스, 인코포레이티드 | 인간 항체의 제조를 위한 형질전환 트랜스염색체 설치류 |
| JP2005538706A (ja) | 2001-07-12 | 2005-12-22 | ジェファーソン フーテ, | スーパーヒト化抗体 |
| EP1891966B1 (en) | 2002-12-20 | 2012-02-15 | H. Lundbeck A/S | Modulation of activity of neurotrophins; screening method |
| US10155816B2 (en) | 2005-11-28 | 2018-12-18 | Genmab A/S | Recombinant monovalent antibodies and methods for production thereof |
| WO2008076262A2 (en) | 2006-12-15 | 2008-06-26 | Merck & Co., Inc. | Receptor for amyloid beta and uses thereof |
| DK3225251T3 (da) | 2006-12-21 | 2020-03-16 | H Lundbeck As | Modulering af pro-neurotrofinaktivitet |
| US9693539B2 (en) | 2007-08-10 | 2017-07-04 | E. R. Squibb & Sons, L.L.C. | HCO32 and HCO27 and related examples |
| US8377701B2 (en) | 2008-04-27 | 2013-02-19 | H. Lundbeck A/S | Specific ligands to sortilin |
| JP2011524741A (ja) | 2008-05-27 | 2011-09-08 | 協和発酵キリン株式会社 | インターロイキン10受容体(il−10r)抗体及び使用方法 |
| US20120039865A1 (en) | 2008-08-19 | 2012-02-16 | Yale University | Identification of sortilin as a neuronal receptor for the frontotemporal dementia protein, progranulin |
| EP2379593A2 (en) | 2008-12-19 | 2011-10-26 | H. Lundbeck A/S | Modulation of the vps 10-domain receptor family for the treatment of mental and behavioural disorders |
| RU2536232C2 (ru) * | 2011-07-01 | 2014-12-20 | Олег Ильич Эпштейн | Лекарственное средство для лечения болезни альцгеймера и способ лечения болезни альцгеймера |
| WO2014071131A1 (en) | 2012-11-02 | 2014-05-08 | The Brigham And Women's Hospital, Inc. | Sortilin 1 is a novel inducer of vascular calcification |
| JP6999421B2 (ja) | 2015-04-07 | 2022-02-04 | アレクトル エルエルシー | 抗ソルチリン抗体及びその使用方法 |
| GB201512215D0 (en) | 2015-07-13 | 2015-08-19 | Lundbeck & Co As H | Agents,uses and methods |
| US10894833B2 (en) | 2017-07-20 | 2021-01-19 | H. Lundbeck A/S | Agents, uses and methods for treatment |
| PE20210186A1 (es) | 2018-07-13 | 2021-02-02 | Alector Llc | Anticuerpos anti-sortilina y metodos para su uso |
-
2015
- 2015-07-13 GB GBGB1512215.3A patent/GB201512215D0/en not_active Ceased
-
2016
- 2016-07-11 JO JOP/2016/0141A patent/JO3710B1/ar active
- 2016-07-12 EA EA201890038A patent/EA201890038A1/ru unknown
- 2016-07-12 RU RU2018100824A patent/RU2735639C2/ru active
- 2016-07-12 MX MX2018000506A patent/MX2018000506A/es unknown
- 2016-07-12 CN CN202210124752.3A patent/CN114478775A/zh active Pending
- 2016-07-12 RS RS20250507A patent/RS66856B1/sr unknown
- 2016-07-12 WO PCT/EP2016/066516 patent/WO2017009327A1/en not_active Ceased
- 2016-07-12 ES ES16739087T patent/ES3024469T3/es active Active
- 2016-07-12 UA UAA201800574A patent/UA125136C2/uk unknown
- 2016-07-12 KR KR1020187001192A patent/KR102778576B1/ko active Active
- 2016-07-12 US US15/743,549 patent/US10479835B2/en active Active
- 2016-07-12 CN CN201680040476.5A patent/CN107849135A/zh active Pending
- 2016-07-12 CN CN202210124751.9A patent/CN114478774A/zh active Pending
- 2016-07-12 TW TW105121903A patent/TWI760305B/zh not_active IP Right Cessation
- 2016-07-12 PL PL16739087.1T patent/PL3322726T3/pl unknown
- 2016-07-12 HU HUE16739087A patent/HUE071424T2/hu unknown
- 2016-07-12 PE PE2018000064A patent/PE20181014A1/es unknown
- 2016-07-12 CA CA2989739A patent/CA2989739A1/en active Pending
- 2016-07-12 AU AU2016292980A patent/AU2016292980B2/en active Active
- 2016-07-12 MA MA42440A patent/MA42440B1/fr unknown
- 2016-07-12 EP EP16739087.1A patent/EP3322726B1/en active Active
- 2016-07-12 TN TNP/2017/000534A patent/TN2017000534A1/en unknown
- 2016-07-12 JP JP2018501182A patent/JP6979397B2/ja active Active
- 2016-07-12 CR CR20180002A patent/CR20180002A/es unknown
- 2016-07-12 US US15/207,880 patent/US10428147B2/en active Active
- 2016-07-12 AR ARP160102109A patent/AR105335A1/es not_active Application Discontinuation
- 2016-07-12 BR BR112018000771-4A patent/BR112018000771A2/pt not_active IP Right Cessation
- 2016-07-12 HR HRP20250602TT patent/HRP20250602T1/hr unknown
-
2017
- 2017-12-18 CO CONC2017/0012988A patent/CO2017012988A2/es unknown
- 2017-12-18 ZA ZA2017/08613A patent/ZA201708613B/en unknown
- 2017-12-22 IL IL256503A patent/IL256503B/en unknown
-
2018
- 2018-01-11 SV SV2018005613A patent/SV2018005613A/es unknown
- 2018-01-11 PH PH12018500100A patent/PH12018500100A1/en unknown
- 2018-01-11 NI NI201800007A patent/NI201800007A/es unknown
- 2018-01-11 DO DO2018000014A patent/DOP2018000014A/es unknown
- 2018-01-11 CL CL2018000092A patent/CL2018000092A1/es unknown
- 2018-01-12 EC ECIEPI20182725A patent/ECSP18002725A/es unknown
-
2019
- 2019-07-24 US US16/521,279 patent/US10889650B2/en active Active
-
2020
- 2020-09-24 CL CL2020002468A patent/CL2020002468A1/es unknown
- 2020-11-13 US US17/097,457 patent/US11548950B2/en active Active
-
2021
- 2021-09-17 JP JP2021151783A patent/JP2022003058A/ja active Pending
-
2022
- 2022-11-18 US US18/057,104 patent/US12331123B2/en active Active
-
2025
- 2025-05-16 US US19/210,142 patent/US20250277040A1/en active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6979397B2 (ja) | ソルチリンに結合し、プログラニュリンの結合を阻害する抗体 | |
| JP7012004B2 (ja) | シヌクレイノパチーの治療のための薬剤、使用および方法 | |
| JP7563975B2 (ja) | 治療のための薬剤、使用及び方法 | |
| HK1254356B (en) | Antibodies that bind to sortilin and inhibit the binding of progranulin |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190708 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20190708 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200630 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200910 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201217 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20210518 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210917 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20210917 |
|
| C11 | Written invitation by the commissioner to file amendments |
Free format text: JAPANESE INTERMEDIATE CODE: C11 Effective date: 20211005 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20211018 |
|
| C21 | Notice of transfer of a case for reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C21 Effective date: 20211019 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20211109 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20211115 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6979397 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |