JP6919087B2 - アバロパラチドの製剤、その経皮パッチ、およびその使用 - Google Patents
アバロパラチドの製剤、その経皮パッチ、およびその使用 Download PDFInfo
- Publication number
- JP6919087B2 JP6919087B2 JP2021069599A JP2021069599A JP6919087B2 JP 6919087 B2 JP6919087 B2 JP 6919087B2 JP 2021069599 A JP2021069599 A JP 2021069599A JP 2021069599 A JP2021069599 A JP 2021069599A JP 6919087 B2 JP6919087 B2 JP 6919087B2
- Authority
- JP
- Japan
- Prior art keywords
- avaloparatide
- transdermal
- patch
- transdermal patch
- weight
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/29—Parathyroid hormone, i.e. parathormone; Parathyroid hormone-related peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/06—Aluminium, calcium or magnesium; Compounds thereof, e.g. clay
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/24—Heavy metals; Compounds thereof
- A61K33/30—Zinc; Compounds thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0014—Skin, i.e. galenical aspects of topical compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0021—Intradermal administration, e.g. through microneedle arrays, needleless injectors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
- A61K9/7023—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms
- A61K9/703—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms characterised by shape or structure; Details concerning release liner or backing; Refillable patches; User-activated patches
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Physical Education & Sports Medicine (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Rheumatology (AREA)
- Dermatology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Immunology (AREA)
- Inorganic Chemistry (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Endocrinology (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Peptides Or Proteins (AREA)
- Media Introduction/Drainage Providing Device (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Description
本出願は、2016年4月18日に出願された米国仮特許出願第62/324,336号、2016年6月22日に出願された米国仮特許出願第62/353,249号、および2016年9月18日に出願された米国仮特許出願第62/396,196号、ならびに2016年10月8日に出願された国際出願第PCT/US16/56196号に対する優先権を主張し、これらは全て、図面を含むそれらの全体が参照により本明細書に組み込まれる。
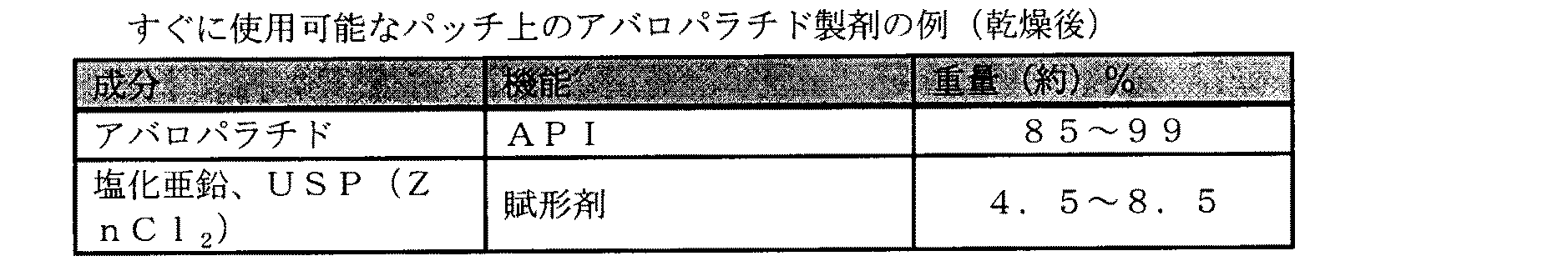
〔1〕約300μgのアバロパラチドおよび1つ以上のZn2+塩を含む賦形剤を含む製剤により少なくとも部分的に覆われる複数の微小突起を含む、ヒト対象において骨粗しょう症を治療するための経皮パッチ、
〔2〕アバロパラチドに対する前記1つ以上のZn2+塩のモル比が、0.1〜3.0である、〔1〕に記載の経皮パッチ、
〔3〕アバロパラチドに対する前記1つ以上のZn2+塩のモル比が、1.5〜2.5である、〔1〕に記載の経皮パッチ、
〔4〕アバロパラチドに対する前記1つ以上のZn2+塩のモル比が、約2.2である、〔1〕に記載の経皮パッチ、
〔5〕前記経皮パッチが、約85〜約99%w/wのアバロパラチドおよび約5〜約8%w/wのZnCl2を含む、〔1〕に記載の経皮パッチ、
〔6〕前記経皮パッチが、約94%w/wのアバロパラチドおよび約6%w/wのZnCl2を含む、〔1〕に記載の経皮パッチ、
〔7〕前記経皮パッチが、約5、10、または15分間投与部位に投与される、〔1〕〜〔6〕のいずれか一項に記載の経皮パッチ、
〔8〕前記経皮パッチが、約5分間投与部位に投与される、〔7〕に記載の経皮パッチ、
〔9〕前記経皮パッチが、少なくとも5分間投与部位に投与される、〔1〕に記載の経皮パッチ、
〔10〕投与部位が、腹部である、〔7〕に記載の経皮パッチ、
〔11〕投与部位が、大腿部である、〔7〕に記載の経皮パッチ、
〔12〕アバロパラチドの経皮送達が、約80μg用量でのアバロパラチドの皮下送達と実質的に生物学的に均等である、〔7〕に記載の経皮パッチ、
〔13〕アバロパラチドの経皮送達が、80μg用量でのアバロパラチドの皮下送達と生物学的に均等である、〔7〕に記載の経皮パッチ、
〔14〕前記ヒト対象が、閉経後の女性である、〔7〕に記載の経皮パッチ、
〔15〕前記ヒト対象が、骨折の高いリスクを有する閉経後の女性である、〔7〕に記載の経皮パッチ、
〔16〕前記ヒト対象が、男性である、〔7〕に記載の経皮パッチ、
〔17〕骨粗しょう症が、グルココルチコイド誘発性骨粗しょう症である、〔7〕に記載の経皮パッチ、
〔18〕経皮パッチが、経皮パッチをアプリケータにより適用することにより約700μmまでの深さまで皮膚を貫通することにより投与される、〔7〕に記載の経皮パッチ
に関する。
本明細書のある特定の実施形態において、アバロパラチドの経皮送達のための調製製剤が提供される。ある特定の実施形態において、経皮送達により、例えばアバロパラチドの(例えば80μgでの)皮下送達との実質的な生物学的均等性または生物学的均等性がもたらされる。これらの製剤は、アバロパラチドと、Zn2+の塩、Mg2+の塩、Ca2+の塩、ヒスチジンの塩、カルボン酸(例えば脂肪酸)の塩、NaCl、PEG、PVP、シクロデキストリン(CD、例えば2−ヒドロキシプロピル−β−シクロデキストリン(HPβCD))、およびそれらの組み合わせからなる群から選択される1つ以上の賦形剤とを含む。ある特定の実施形態において、Zn2+の塩は、Zn(OAc)2、ZnCl2、Zn3(PO4)2、クエン酸亜鉛(クエン酸Zn)、シュウ酸亜鉛(シュウ酸Zn)、およびそれらの組み合わせからなる群から選択され、Ca2+の塩は、ソルビン酸カルシウム(ソルビン酸Ca)、クエン酸カルシウム(クエン酸Ca)、アスコルビン酸カルシウム(アスコルビン酸Ca)、Ca3(PO4)2、CaCl2、CaCO3、CaSO4、Ca(OAc)2、およびそれらの組み合わせからなる群から選択され、Mg2+の塩は、MgO、クエン酸マグネシウム(クエン酸Mg)、MgSO4、オロチン酸マグネシウム(オロチン酸Mg)、乳酸マグネシウム(乳酸Mg)、MgCO3、MgCl2、Mg(OAc)2、およびそれらの組み合わせからなる群から選択される。ある特定の実施形態において、本明細書に記載のようなMg2+、Zn2+、および/またはCa2+のうちの2つ以上の塩が、経皮製剤を目的として互いに組み合わされる。ある特定の実施形態において、調製製剤は、注射用水、ブラインまたはPBSをさらに含む。ある特定の実施形態において、アバロパラチドの経皮送達は、約20μg〜約200μg、約40μg〜約120μg、約60μg〜約100μg、約70μg〜約90μg、または約80μgの投薬量で、アバロパラチドの皮下送達との実質的な生物学的均等性または生物学的均等性をもたらす。ある特定の実施形態において、アバロパラチドの経皮送達は、アバロパラチド−SC処置と実質的に生物学的に均等であるかまたは生物学的に均等である。ある特定の実施形態において、アバロパラチドは、調製製剤を使用して調製された、少なくとも1つの微小突起(例えば微小針)を備える経皮パッチにより送達される。
本明細書において開示される調製製剤を使用して調製された1つ以上の微小針を備えるアバロパラチドの投与のための経皮パッチが、ある特定の実施形態において本明細書で提供され、本パッチを使用するアバロパラチドの経皮送達により、いくつかの事例においては所与の用量での皮下投与と実質的に生物学的に均等であるかまたは生物学的に均等である薬物動態プロファイルがもたらされる。ある特定の実施形態において、アバロパラチドの経皮送達により、約20μg〜約250μg、約20μg〜約200μg、約40μg〜約120μg、約60μg〜約100μg、約70μg〜約90μg、約80μg、約100μg、約150μg、または約200μgの投薬量で、アバロパラチドの皮下送達との実質的な生物学的均等性または生物学的均等性がもたらされる。
本明細書のある特定の実施形態において、本明細書で開示されるアバロパラチドの投与用の経皮パッチを調製する方法であって、本明細書で開示される調製製剤を有する経皮パッチ上に少なくとも1つの微小突起を作製することを含む方法が提供される。ある特定の実施形態において、微小突起は、微小針である。ある特定の実施形態において、アバロパラチドは、アバロパラチドを含む、それからなる、または本質的にそれからなる。ある特定の実施形態において、アバロパラチドの経皮送達は、約20μg〜約200μg、約40μg〜約120μg、約60μg〜約100μg、約70μg〜約90μg、または約80μgの投薬量で、アバロパラチドの皮下送達との実質的な生物学的均等性または生物学的均等性をもたらす。ある特定の実施形態において、アバロパラチドの経皮送達は、アバロパラチド−SC処置と実質的な生物学的均等性または生物学的均等性をもたらす。
本明細書のある特定の実施形態において、対象における骨粗しょう症、骨減少、および変形性関節炎を処置するため、骨ミネラル濃度(BMD)を改善するため、骨梁スコア(TBS)を改善するため、ならびに/または骨折を処置、予防、および/もしくは低減する方法であって、本明細書において提供される調製製剤に含まれる、治療有効量のアバロパラチドを経皮投与することを含む方法が提供される。骨粗しょう症は、処置できる骨粗しょう症の種類に限定されるものではないが、閉経後の骨粗しょう症および重度の閉経後の骨粗しょう症であり得る。骨粗しょう症はまた、男性の骨粗しょう症であり得る。男性および女性における骨粗しょう症は、性腺機能低下症に起因し得るか、またはホルモンレベルが性腺であるが、例えば、患者が抗ホルモン剤で処置されている場合、またはホルモンの性腺機能の正常なレベルに対する患者のホルモン応答が何らかの理由により弱められている場合がある。処置される骨粗しょう症は、栄養欠乏またはコルチコステロイドなどの骨損失を引き起こす他の薬物の摂取によって引き起こされ得る。患者は、骨ミネラル濃度が標準偏差より1標準偏差、標準偏差より2標準偏差、または標準標準より3標準偏差が下回る1つ以上の部位で低骨ミネラル濃度を示す場合に処置され得る。加えて、正常な骨ミネラル濃度を有する患者であっても、骨の質によって骨折のリスクが高い可能性がある。骨の質が低い場合、骨ミネラル濃度の観点からは正常であるように見えるかもしれないが、任意の数の構造的および/または物理化学的要因により、患者をより高い危険にさらし得る。これに関連して、患者は、1つ以上の骨折の病歴を有する高リスクの患者であってもよい。したがって、患者は、本開示のある特定の実施形態の方法および製品による処置に推奨され得る。異なるタイプの骨折の予防または処置は、本明細書に記載の方法および製品によって支援される。例えば、椎骨、非脊椎、臨床的および/または大きな骨粗しょう症性骨折を処置および/または予防することは、開示される方法および製品の特徴である。本明細書に記載される骨粗しょう症治療は、例えば、本明細書に記載の微小突起パッチの1日1回の貼付、およびいくつかの実施形態においては、投与後に、SC注射、例えば、アバロパラチドの80μgのsc注射と生物学的に均等なまたは実質的に生物学的に均等なプロファイルをもたらす微小突起アレイによって達成することができる。
すぐに使用可能な様々なアバロパラチド製剤でコーティングされた微小針経皮パッチを提供し、2〜8℃で冷蔵保存した。使用の少なくとも1時間前に、個々のパウチ内の経皮パッチを室温に置いた。以下に提示する実施例の目的のために、微小針を有する単一のパッチの面積は、典型には、約1.26cm2であった。2つのパッチを使用した場合、それらのパッチの合計面積は、約2.52cm2であった。パッチは、典型的には、皮膚を張らせることで、針が送達されるときにパッチ送達時の皮膚の動きを低減するのを助けるいくらかの力を用いて、パッチを含む送達デバイスを皮膚に押しつけることによって適用される。典型的な力は、15〜25ニュートンであり得る。適切な力が加えられると、デバイスが起動され、パッチが皮膚に押し込まれた。送達時のパッチへの衝撃の際のエネルギーは、一般に、例えば、50ミリ秒未満、またはさらに10ミリ秒未満の浸透時間と、微小突起のうちの1つ以上(理想的には微小突起の全て)が、少なくとも50マイクロメートル、または100マイクロメートル超、一般には500マイクロメートル未満、角質層に浸透するのに十分なエネルギーとによって、角質層に極めて迅速に送達される。
健常な閉経後の女性において、アバロパラチドの経皮投与およびアバロパラチド−SC処置の薬物動態プロファイルを評価した。
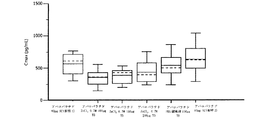
アバロパラチドおよびPBSを含む第1世代アバロパラチド製剤を使用して調製された経皮パッチを使用して、無作為化、並行群間、プラセボ対照、実薬対照第2相試験を行った。6ヶ月間、対象に、50μg、100μg、もしくは150μgのアバロパラチド(それぞれ、TD ABL 50mcg、TD ABL 100mcg、およびTD ABL 150mcg)が投入された経皮パッチ(長さ500マイクロメートルの微小突起を有する)の毎日のTD適用、80μgのアバロパラチド(SC ABL 80mcg)またはプラセボ(TDプラセボ)の毎日のSC−注射を行った(表5)。
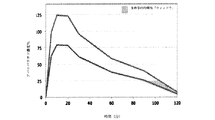
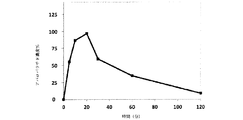
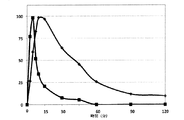
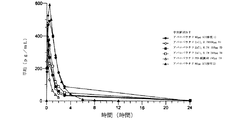
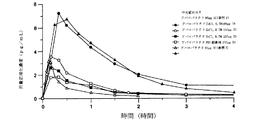
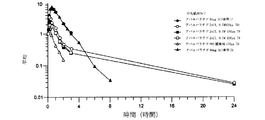
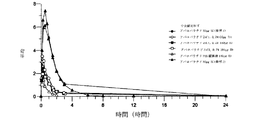
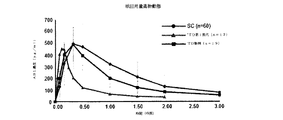
健常な閉経後の志願者を、以前に説明したように80μgのsc注射で、または100、150、もしくは200μgのアバロパラチドを含有するように製剤化された経皮パッチで処置した。経皮製剤を、ほぼ35%w/wのアバロパラチド、約13%w/wのPEG3350NF、約0.89%w/wのZnCl2、および約52%w/wの水からなるコーティング溶液で、PEG3350NF/ZnCl2でコーティングした。乾燥後のPEG/ZnCl2パッチは、本質的に、70〜75%%のアバロパラチドおよび24%〜28%%のPEG33550NF、ならびに約1.5%のZnCl2からなった。貼付部位は腹部であり、15分の着用時間で、pKパラメータは図36〜38に示されている。
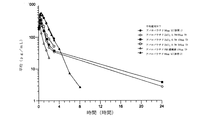
パッチは円形であり、実施例9の記載に従って同じ用量で調製した。これは2×200μgのパッチ試験であり、両方のパッチを、一方の貼付の直後に他方を貼付して大腿部に送達した。2つのパッチを用いたため、単一のパッチとして用いた相当面積はおよそ2.52cm2であり、同等の単一パッチ直径はおよそ2.52cm(それぞれ1.26cm)である。実施例13からのアバロパラチドを投与したパッチの薬物動態曲線に、アバロパラチド80μg SCによる参照データセットを重ね合わせる。
すぐに使用可能な様々なアバロパラチド製剤でコーティングされた微小針経皮パッチを提供し、2〜8℃で冷蔵保存した。使用の少なくとも1時間前に、個々のパウチ内の経皮パッチを室温に置いた。8匹の雌非ナイーブチャイニーズカニクイザル(投薬時2〜4kg)を試験に含めた。各製剤を試験するために同じ8匹の動物を使用し、試験間に3日間のウォッシュアウト期間を設けた。
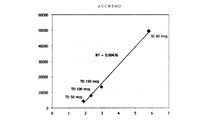
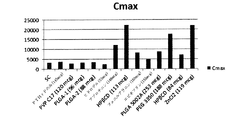
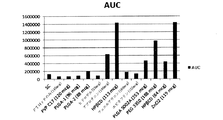
図39および40は、皮下投与されたアバロパラチドのCmaxおよびAUCと比較した、本明細書で開示される様々なコーティング製剤でコーティングされた経皮パッチによる投与後のアバロパラチドの送達のCmaxおよびAUCを示す。
[1]経皮パッチをコーティングするのに好適な調製製剤であって、アバロパラチドと、水と、Zn2+塩、Mg2+塩、Ca2+塩、ポリエチレングリコール、およびヒドロキシプロピルベータ−シクロデキストリンからなる群から選択される1つ以上の賦形剤と、を含む、調製製剤。
[2]前記賦形剤が、ZnCl2、Zn(OAc)2、Zn3(PO4)2、クエン酸Zn、シュウ酸Zn、MgO、クエン酸Mg、MgSO4、オロチン酸Mg、乳酸Mg、MgCO3、ソルビン酸Ca、クエン酸Ca、アスコルビン酸Ca、Ca3(PO4)2、CaCl2、CaCO3、CaSO4、およびCa(OAc)2からなる群から選択される、[1]に記載の調製製剤。
[3]前記賦形剤が、ZnCl2およびZn(OAc)2ならびにそれらの組み合わせから選択される、[2]に記載の調製製剤。
[4]前記治療活性物質に対する前記賦形剤(単数または複数)のモル比が、0.1〜2.0である、[1]〜[3]のいずれかに記載の調製製剤。
[5]前記治療活性物質に対する前記賦形剤(単数または複数)のモル比が、0.2〜1.5である、[1]〜[4]のいずれかに記載の調製製剤。
[6]前記治療活性物質に対する前記賦形剤(単数または複数)のモル比が、0.25〜1.0である、[1]〜[5]のいずれかに記載の調製製剤。
[7]複数の微小突起を備える経皮パッチであって、アレイ内の少なくとも1つの微小突起が、少なくとも部分的にコーティングによりコーティングされ、前記コーティングが、アバロパラチドと、Zn2+塩、Mg2+塩、Ca2+塩、ポリエチレングリコール、およびヒドロキシプロピルベータ−シクロデキストリンからなる群から選択される1つ以上の賦形剤と、を含む、経皮パッチ。
[8]前記微小突起が微小針である、[7]に記載の経皮パッチ。
[9]前記賦形剤が、ZnCl2、Zn(OAc)2、Zn3(PO4)2、クエン酸Zn、シュウ酸Zn、MgO、クエン酸Mg、MgSO4、オロチン酸Mg、乳酸Mg、MgCO3、ソルビン酸Ca、クエン酸Ca、アスコルビン酸Ca、Ca3(PO4)2、CaCl2、CaCO3、CaSO4、およびCa(OAc)2からなる群から選択される、[7]〜[8]のいずれか一項に記載の経皮パッチ。
[10]前記賦形剤が、ZnCl2およびZn(OAc)2ならびにそれらの組み合わせから選択される、[7]〜[9]のいずれか一項に記載の経皮パッチ。
[11]アバロパラチドに対する前記賦形剤(単数または複数)のモル比が、0.1〜2.0である、[7]〜[10]のいずれか一項に記載の経皮パッチ。
[12]アバロパラチドに対する前記賦形剤(単数または複数)のモル比が、0.2〜1.5である、[7]〜[11]のいずれか一項に記載の経皮パッチ。
[13]アバロパラチドに対する前記賦形剤(単数または複数)のモル比が、0.25〜1.0である、[7]〜[12]のいずれか一項に記載の経皮パッチ。
[14]アバロパラチドが、90〜110μg、140〜160μg、185〜220μg、225〜275μg、約100μg、約150μg、約200μg、または約250μgの量で前記微小突起アレイ上に存在する、[7]〜[13]のいずれか一項に記載の経皮パッチ。
[15]対象における骨粗しょう症、骨減少、変形性関節炎、および骨折からなる群から選択される状態を治療する方法であって、[7]〜[14]のいずれか一項に記載の経皮パッチを貼付することを含む、方法。
[16]脊椎、非脊椎、臨床的、および大きな骨粗しょう症性骨折を予防する方法であって、[7]〜[14]のいずれか一項に記載の経皮パッチを貼付することを含む、方法。
[17]対象における骨ミネラル濃度(BMD)を改善する、骨梁スコア(TBS)を改善する、および/または骨折を低減する方法であって、[7]〜[14]のいずれか一項に記載の経皮パッチを前記対象に貼付することを含む、方法。
[18]前記パッチが、300〜750個の微小突起を備える、[7]〜[14]のいずれか一項に記載の方法。
[19]前記貼付が、前記患者の角質層に前記微小突起のうちの1つ以上を突き通すのに十分な力を前記経皮パッチに印加することを含む、[7]〜[15]のいずれか一項に記載の方法。
[20]貼付部位が、腹部または大腿部である、[7]〜[16]のいずれか一項に記載の方法。
[21]複数の微小突起を備える経皮パッチであって、アレイ内の少なくとも1つの微小突起が、少なくとも部分的に製剤によりコーティングされ、前記製剤が、アバロパラチドと、Zn2+塩、Mg2+塩、およびCa2+塩からなる群から選択される1つ以上の賦形剤と、を含む、経皮パッチ。
[22]前記微小突起が、微小針である、[21]に記載の経皮パッチ。
[23]前記賦形剤が、ZnCl2、Zn(OAc)2、Zn3(PO4)2、クエン酸Zn、シュウ酸Zn、MgO、クエン酸Mg、MgSO4、オロチン酸Mg、乳酸Mg、MgCO3、ソルビン酸Ca、クエン酸Ca、アスコルビン酸Ca、Ca3(PO4)2、CaCl2、CaCO3、CaSO4、およびCa(OAc)2からなる群から選択される、[21]〜[22]のいずれか一項に記載の経皮パッチ。
[24]前記賦形剤がZn2+塩を含む、[21]〜[23]のいずれか一項に記載の経皮パッチ。
[25]前記Zn2+塩がZnCl2である、[24]に記載の経皮パッチ。
[26]前記Zn2+塩がZn(OAc)2である、[24]に記載の経皮パッチ。
[27]アバロパラチドに対する前記賦形剤(複数可)のモル比が、0.1〜3.0である、[21]〜[26]のいずれか一項に記載の経皮パッチ。
[28]前記アバロパラチドに対する前記賦形剤(複数可)のモル比が、0.2〜2.5である、[21]〜[27]のいずれか一項に記載の経皮パッチ。
[29]前記アバロパラチドに対する前記賦形剤(複数可)のモル比が、0.25〜1.0である、[21]〜[28]のいずれか一項に記載の経皮パッチ。
[30]前記アバロパラチドに対する前記賦形剤(複数可)のモル比が、1.5〜2.5である、[21]〜[28]のいずれか一項に記載の経皮パッチ。
[31]前記パッチ製剤が、1%〜10%w/wの前記賦形剤を含む、[21]〜[30]のいずれかに記載の経皮パッチ。
[32]前記パッチ製剤が、1.8%〜8.5%w/wの前記賦形剤を含む、[31]に記載の経皮パッチ。
[33]前記パッチ製剤が、2%〜10%w/wの前記賦形剤を含む、[31]に記載の経皮パッチ。
[34]前記パッチ製剤が、5%〜7%w/wの前記賦形剤を含む、[31]に記載の経皮パッチ。
[35]前記パッチ製剤が、1.7%〜2.25%w/wの前記賦形剤を含む、[31]に記載の経皮パッチ。
[36]前記パッチが、約200〜450μgの量のアバロパラチドをさらに含む、[21]〜[35]のいずれかに記載の経皮パッチ。
[37]前記パッチの面積が、約0.8cm2〜約3cm2である、[21]〜[36]のいずれか一項に記載の経皮パッチ。
[38]前記パッチの微小突起密度が、1cm2当たり微小突起150〜350個である、[21]〜[37]のいずれか一項に記載の経皮パッチ。
[39]対象における骨粗しょう症、骨減少、変形性関節炎、および骨折からなる群から選択される状態を治療する方法であって、[21]〜[38]のいずれか一項に記載の経皮パッチを貼付することを含む、方法。
[40]前記状態が骨粗しょう症である、[39]に記載の方法。
[41]前記骨粗しょう症が閉経後骨粗しょう症である、[40]に記載の方法。
[42]前記閉経後骨粗しょう症が重度の閉経後骨粗しょう症である、[41]に記載の方法。
[43]前記骨粗しょう症により、それを有する前記対象が脊椎および/または非脊椎骨折の高いリスクにさらされる、[39]〜[42]のいずれかに記載の方法。
[44]前記骨粗しょう症が男性の骨粗しょう症である、[39]〜[40]のいずれかに記載の方法。
[45]前記治療することが、男性の骨粗しょう症患者の骨ミネラル濃度を増加させることを含む、[44]に記載の方法。
[46]前記骨粗しょう症がグルココルチコイド誘発性骨粗しょう症である、[39]〜[40]および[43]〜[45]のいずれか一項に記載の方法。
[47][21]〜[38]のいずれか一項に記載の経皮パッチを投与することを含む、脊椎、非脊椎、臨床的、および大きな骨粗しょう症性骨折を予防または治療する方法。
[48][21]〜[39]のいずれか一項に記載のパッチの貼付を含む、変形性関節炎を治療する方法。
[49]前記変形性関節炎が、膝、肘、手首、および/または肩に関連する、[48]に記載の方法。
[50]前記変形性関節炎が原発性である、[48]〜[49]に記載の方法。
[51]前記変形性関節炎が続発性である、[48]〜[49]に記載の方法。
[52][21]〜[38]のいずれか一項に記載のパッチの貼付を含む、骨折治癒を加速させるかもしくは促進する、または骨折を治療する方法。
[53]貼付部位が腹部または大腿部である、[39]〜[52]のいずれか一項に記載の方法。
[54]前記貼付部位が前記腹部である、[53]に記載の方法。
[55]前記貼付部位が前記大腿部である、[53]に記載の方法。
[56]前記貼付により、皮下投与された80ug用量のアバロパラチドのプロファイルと実質的に生物学的に均等なプロファイルがもたらされる、[39]〜[55]のいずれか一項に記載の方法。
[57]前記貼付により、アバロパラチドtd対アバロパラチドscの平均比または公比の90%CIの上限および下限が50%〜200%の間になる、Auc(tおよび/またはinf)および/またはCmaxがもたらされる、[56]に記載の方法。
[58]前記貼付により、アバロパラチドtd対アバロパラチドscの平均比または公比の90%CIの上限および下限が70%〜143%の間になる、Auc(tおよび/またはinf)および/またはCmaxがもたらされる、[57]に記載の方法。
[59]前記貼付により、アバロパラチドtd対アバロパラチドscの平均比または公比の90%CIの上限および下限が75%〜133%の間になる、Auc(tおよび/またはinf)および/またはCmaxがもたらされる、[58]に記載の方法。
[60]前記貼付により、アバロパラチドtd対アバロパラチドscの平均比または公比の90%CIの上限および下限が80%〜125%の間になる、Auc(tおよび/またはinf)および/またはCmaxがもたらされる、[58]に記載の方法。
[61]前記貼付により、0.135時間超のTmaxがもたらされる、[39]〜[60]のいずれか一項に記載の方法。
[62]前記貼付により、0.15時間超のTmaxがもたらされる、[61]に記載の方法。
[63]前記貼付により、0.2時間超のTmaxがもたらされる、[61]に記載の方法。
[64]前記貼付により、0.3時間超のTmaxがもたらされる、[61]に記載の方法。
[65]前記貼付により、0.2時間〜0.5時間のTmaxがもたらされる、[61]に記載の方法。
[66]前記パッチが、貼付後約5、10、または15分間、投与部位に残る、[39]〜[65]のいずれか一項に記載の方法。
Claims (18)
- 約300μgのアバロパラチドおよび1つ以上のZn2+塩を含む賦形剤を含む製剤により少なくとも部分的に覆われる複数の微小突起を含む、ヒト対象において骨粗しょう症を治療するための経皮パッチ。
- アバロパラチドに対する前記1つ以上のZn2+塩のモル比が、0.1〜3.0である、請求項1に記載の経皮パッチ。
- アバロパラチドに対する前記1つ以上のZn2+塩のモル比が、1.5〜2.5である、請求項1に記載の経皮パッチ。
- アバロパラチドに対する前記1つ以上のZn2+塩のモル比が、約2.2である、請求項1に記載の経皮パッチ。
- 前記経皮パッチが、約85〜約99%w/wのアバロパラチドおよび約5〜約8%w/wのZnCl2を含む、請求項1に記載の経皮パッチ。
- 前記経皮パッチが、約94%w/wのアバロパラチドおよび約6%w/wのZnCl2を含む、請求項1に記載の経皮パッチ。
- 前記経皮パッチが、約5、10、または15分間投与部位に投与される、請求項1〜6のいずれか一項に記載の経皮パッチ。
- 前記経皮パッチが、約5分間投与部位に投与される、請求項7に記載の経皮パッチ。
- 前記経皮パッチが、少なくとも5分間投与部位に投与される、請求項1に記載の経皮パッチ。
- 投与部位が、腹部である、請求項7に記載の経皮パッチ。
- 投与部位が、大腿部である、請求項7に記載の経皮パッチ。
- アバロパラチドの経皮送達が、約80μg用量でのアバロパラチドの皮下送達と実質的に生物学的に均等である、請求項7に記載の経皮パッチ。
- アバロパラチドの経皮送達が、80μg用量でのアバロパラチドの皮下送達と生物学的に均等である、請求項7に記載の経皮パッチ。
- 前記ヒト対象が、閉経後の女性である、請求項7に記載の経皮パッチ。
- 前記ヒト対象が、骨折の高いリスクを有する閉経後の女性である、請求項7に記載の経皮パッチ。
- 前記ヒト対象が、男性である、請求項7に記載の経皮パッチ。
- 骨粗しょう症が、グルココルチコイド誘発性骨粗しょう症である、請求項7に記載の経皮パッチ。
- 経皮パッチが、経皮パッチをアプリケータにより適用することにより約700μmまでの深さまで皮膚を貫通することにより投与される、請求項7に記載の経皮パッチ。
Applications Claiming Priority (11)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662324336P | 2016-04-18 | 2016-04-18 | |
| US62/324,336 | 2016-04-18 | ||
| US201662353249P | 2016-06-22 | 2016-06-22 | |
| US62/353,249 | 2016-06-22 | ||
| US201662396196P | 2016-09-18 | 2016-09-18 | |
| US62/396,196 | 2016-09-18 | ||
| PCT/US2016/056196 WO2017062922A1 (en) | 2015-10-09 | 2016-10-08 | Formulations of pthrp analogues, transdermal patches thereof, and uses thereof |
| USPCT/US2016/056196 | 2016-10-08 | ||
| US201762479250P | 2017-03-30 | 2017-03-30 | |
| US62/479,250 | 2017-03-30 | ||
| JP2018554479A JP6920341B2 (ja) | 2016-04-18 | 2017-04-06 | アバロパラチドの製剤、その経皮パッチ、およびその使用 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018554479A Division JP6920341B2 (ja) | 2016-04-18 | 2017-04-06 | アバロパラチドの製剤、その経皮パッチ、およびその使用 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2021113209A JP2021113209A (ja) | 2021-08-05 |
| JP6919087B2 true JP6919087B2 (ja) | 2021-08-11 |
Family
ID=60116311
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018554479A Expired - Fee Related JP6920341B2 (ja) | 2016-04-18 | 2017-04-06 | アバロパラチドの製剤、その経皮パッチ、およびその使用 |
| JP2021069599A Expired - Fee Related JP6919087B2 (ja) | 2016-04-18 | 2021-04-16 | アバロパラチドの製剤、その経皮パッチ、およびその使用 |
| JP2021121353A Active JP7139498B2 (ja) | 2016-04-18 | 2021-07-26 | アバロパラチドの製剤、その経皮パッチ、およびその使用 |
| JP2022142197A Pending JP2022171769A (ja) | 2016-04-18 | 2022-09-07 | アバロパラチドの製剤、その経皮パッチ、およびその使用 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018554479A Expired - Fee Related JP6920341B2 (ja) | 2016-04-18 | 2017-04-06 | アバロパラチドの製剤、その経皮パッチ、およびその使用 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021121353A Active JP7139498B2 (ja) | 2016-04-18 | 2021-07-26 | アバロパラチドの製剤、その経皮パッチ、およびその使用 |
| JP2022142197A Pending JP2022171769A (ja) | 2016-04-18 | 2022-09-07 | アバロパラチドの製剤、その経皮パッチ、およびその使用 |
Country Status (7)
| Country | Link |
|---|---|
| US (3) | US10568937B2 (ja) |
| EP (2) | EP3998061A1 (ja) |
| JP (4) | JP6920341B2 (ja) |
| AU (2) | AU2017253674B2 (ja) |
| CA (1) | CA3020333A1 (ja) |
| ES (1) | ES2904891T3 (ja) |
| WO (1) | WO2017184355A1 (ja) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6920341B2 (ja) | 2016-04-18 | 2021-08-18 | ラジウス ヘルス,インコーポレイテッド | アバロパラチドの製剤、その経皮パッチ、およびその使用 |
| US10996208B2 (en) | 2017-04-28 | 2021-05-04 | Radius Health, Inc. | Abaloparatide formulations and methods of testing, storing, modifying, and using same |
| CN113453704A (zh) * | 2019-02-28 | 2021-09-28 | 雷迪厄斯健康公司 | 阿巴帕肽的透皮递送系统及其使用方法 |
| CN110917243B (zh) * | 2019-12-30 | 2021-06-04 | 南京晓庄学院 | 一种含植物提取物的凝胶膏剂及其制备方法 |
| EP4110371A1 (en) | 2020-01-24 | 2023-01-04 | Radius Health, Inc. | Methods of stimulating bone growth with abalopartide and denosumab |
| AU2022205801A1 (en) * | 2021-01-05 | 2023-07-13 | Radius Health, Inc. | Treatment of long bone fractures with abaloparatide |
| US11452474B1 (en) | 2021-04-14 | 2022-09-27 | Satio, Inc. | Dual lever dermal patch system |
| US12048543B2 (en) | 2021-11-08 | 2024-07-30 | Satio, Inc. | Dermal patch for collecting a physiological sample with removable vial |
| US12053284B2 (en) | 2021-11-08 | 2024-08-06 | Satio, Inc. | Dermal patch for collecting a physiological sample |
| US12023156B2 (en) | 2021-10-13 | 2024-07-02 | Satio, Inc. | Dermal patch for collecting a physiological sample |
| US11964121B2 (en) | 2021-10-13 | 2024-04-23 | Satio, Inc. | Mono dose dermal patch for pharmaceutical delivery |
| US12214346B2 (en) | 2021-10-13 | 2025-02-04 | Satio, Inc. | Dermal patch with a diagnostic test strip |
| US11877848B2 (en) | 2021-11-08 | 2024-01-23 | Satio, Inc. | Dermal patch for collecting a physiological sample |
| US12178979B2 (en) | 2021-10-13 | 2024-12-31 | Satio, Inc. | Dermal patch for delivering a pharmaceutical |
| WO2023281447A1 (en) | 2021-07-07 | 2023-01-12 | Radius Health, Inc. | Methods of treating a cardiovascular ischemic event |
| WO2024246840A1 (en) * | 2023-06-01 | 2024-12-05 | Radius Health, Inc. | Methods for identification and quantitation of abaloparatide and related peptide impurities |
| CN119113134B (zh) * | 2024-09-13 | 2025-05-16 | 南京羚诺生物医药技术研究院有限公司 | 一种提升阿巴帕肽半衰期的制备方法及其在治疗骨质疏松症中的用途 |
Family Cites Families (39)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5589452A (en) | 1992-07-14 | 1996-12-31 | Syntex (U.S.A.) Inc. | Analogs of parathyroid hormone and parathyroid hormone related peptide: synthesis and use for the treatment of osteoporosis |
| ZA988030B (en) | 1997-09-09 | 1999-03-09 | Hoffmann La Roche | Fracture healing using pthrp analogs |
| US20040033950A1 (en) | 2000-09-26 | 2004-02-19 | Hock Janet M. | Method of increasing bone toughness and stiffness and reducing fractures |
| GB0017999D0 (en) | 2000-07-21 | 2000-09-13 | Smithkline Beecham Biolog | Novel device |
| WO2002094368A1 (en) | 2000-10-26 | 2002-11-28 | Alza Corporation | Transdermal drug delivery devices having coated microprotrusions |
| US7963935B2 (en) | 2001-04-20 | 2011-06-21 | Alza Corporation | Microprojection array having a beneficial agent containing coating |
| US6881203B2 (en) | 2001-09-05 | 2005-04-19 | 3M Innovative Properties Company | Microneedle arrays and methods of manufacturing the same |
| WO2003068805A2 (en) | 2002-02-14 | 2003-08-21 | Bayer Pharmaceuticals Corporation | Formulation strategies in stabilizing peptides in organic solvents and in dried states |
| WO2003099849A2 (en) * | 2002-05-23 | 2003-12-04 | Michael Holick | Use of a parathyroid hormone peptide analogs for the treatment of vaginal atrophy |
| BR0312671A (pt) | 2002-07-19 | 2005-04-26 | 3M Innovative Properties Co | Dispositivo de microagulhas, método para utilizar um dispositivo de microagulhas, e, método para aplicar um dispositivo de microagulhas |
| AU2004255218A1 (en) | 2003-06-30 | 2005-01-20 | Alza Corporation | Formulations for coated microprojections containing non-volatile counterions |
| US20050032698A1 (en) * | 2003-07-14 | 2005-02-10 | Nps Allelix Corp. | Stabilized formulation of parathyroid hormone |
| CA2536249A1 (en) | 2003-08-25 | 2005-03-10 | 3M Innovative Properties Company | Delivery of immune response modifier compounds |
| EP1744683B1 (en) | 2004-05-13 | 2016-03-16 | Alza Corporation | Apparatus and method for transdermal delivery of parathyroid hormone agents |
| JP5015787B2 (ja) | 2004-11-18 | 2012-08-29 | スリーエム イノベイティブ プロパティズ カンパニー | マイクロニードルアレイの接触コーティング法 |
| US20070270341A1 (en) | 2005-09-06 | 2007-11-22 | Paul Morley | Parathyroid hormone analogues and methods of use |
| JP2009522288A (ja) | 2005-12-28 | 2009-06-11 | アルザ コーポレイション | 安定な治療剤形 |
| CA2680690A1 (en) | 2006-03-15 | 2007-09-20 | Alza Corporation | Apparatus and method for transdermal delivery of parathyroid hormone agents to prevent or treat osteopenia |
| US7803770B2 (en) | 2006-10-03 | 2010-09-28 | Radius Health, Inc. | Method of treating osteoporosis comprising administration of PTHrP analog |
| DK2957278T3 (en) | 2006-10-03 | 2017-07-31 | Radius Health Inc | STABLE COMPOSITION COMPREHENSIVE PTHRP AND APPLICATIONS THEREOF |
| US20090016935A1 (en) * | 2007-07-09 | 2009-01-15 | Andrianov Alexander K | Coating formulations including polyphosphazene polyelectrolytes and biologically active agents and asperities coated with such formulations |
| US20110051041A1 (en) * | 2008-05-16 | 2011-03-03 | Yuji Yashiro | Backlight unit and liquid crystal display device |
| RU2494769C2 (ru) | 2008-11-18 | 2013-10-10 | 3М Инновейтив Пропертиз Компани | Массив полых микроигл и способ его использования |
| JP2012523270A (ja) | 2009-04-10 | 2012-10-04 | スリーエム イノベイティブ プロパティズ カンパニー | 中空マイクロニードルアレイを製造する方法並びにそれに由来する製品及びその使用法 |
| JP5856071B2 (ja) | 2009-12-18 | 2016-02-09 | スリーエム イノベイティブ プロパティズ カンパニー | サーモトロピック液晶ポリマーの成形及びそこから作製される物品 |
| MY158687A (en) | 2010-02-24 | 2016-10-31 | Hisamitsu Pharmaceutical Co | Micro-needle device and preparation method |
| US8637458B2 (en) | 2010-05-12 | 2014-01-28 | Biodel Inc. | Insulin with a stable basal release profile |
| AU2012223279A1 (en) * | 2011-03-01 | 2013-09-26 | Sloan-Kettering Institute For Cancer Research | Parathyroid hormone analogs, compositions and uses thereof |
| US20130006217A1 (en) * | 2011-04-22 | 2013-01-03 | Gary Hattersley | METHOD OF DRUG DELIVERY FOR PTH, PTHrP AND RELATED PEPTIDES |
| BR112014013099A8 (pt) | 2011-11-30 | 2023-05-09 | 3M Innovative Properties Company | Dispositivo de microagulhas incluindo um agente terapêutico peptídeo e um aminoácido e métodos para produzir e usar o dispositivo |
| US9581438B2 (en) | 2012-12-31 | 2017-02-28 | General Electric Company | Systems and methods for control of a non-destructive testing system |
| ES2692722T3 (es) | 2013-02-13 | 2018-12-04 | Hisamitsu Pharmaceutical Co., Inc. | Composición de recubrimiento de microagujas y dispositivo de microagujas |
| KR102166091B1 (ko) | 2013-09-18 | 2020-10-15 | 코스메드 파마소티컬 씨오 쩜 엘티디 | 마이크로니들 패치 적용 장치 및 패치 홀더 |
| DK3006045T3 (en) * | 2014-10-07 | 2017-07-17 | Cyprumed Gmbh | Pharmaceutical formulations for oral administration of peptide or protein drugs |
| EP3265115B1 (en) | 2015-03-03 | 2022-06-22 | Radius Health, Inc. | Abaloparatide combined with alendronate for reducing non-vertebral bone fractures |
| AU2016335287A1 (en) | 2015-10-07 | 2018-04-12 | Cyprumed Gmbh | Pharmaceutical formulations for the oral delivery of peptide drugs |
| SMT202100411T1 (it) | 2015-10-09 | 2021-11-12 | Radius Health Inc | Formulazioni di analoghi di pthrp, loro cerotti transdermici, e loro usi |
| JP7116680B2 (ja) | 2015-10-09 | 2022-08-10 | キンデーバ ドラッグ デリバリー リミティド パートナーシップ | コーティングされたマイクロニードルアレイのための亜鉛組成物 |
| JP6920341B2 (ja) | 2016-04-18 | 2021-08-18 | ラジウス ヘルス,インコーポレイテッド | アバロパラチドの製剤、その経皮パッチ、およびその使用 |
-
2017
- 2017-04-06 JP JP2018554479A patent/JP6920341B2/ja not_active Expired - Fee Related
- 2017-04-06 EP EP21203373.2A patent/EP3998061A1/en not_active Withdrawn
- 2017-04-06 AU AU2017253674A patent/AU2017253674B2/en not_active Ceased
- 2017-04-06 EP EP17786338.8A patent/EP3481414B1/en active Active
- 2017-04-06 CA CA3020333A patent/CA3020333A1/en active Pending
- 2017-04-06 ES ES17786338T patent/ES2904891T3/es active Active
- 2017-04-06 WO PCT/US2017/026462 patent/WO2017184355A1/en not_active Ceased
- 2017-04-06 US US16/092,587 patent/US10568937B2/en active Active
-
2020
- 2020-01-03 US US16/733,779 patent/US10980862B2/en not_active Expired - Fee Related
-
2021
- 2021-03-23 US US17/209,777 patent/US20210369816A1/en not_active Abandoned
- 2021-04-16 JP JP2021069599A patent/JP6919087B2/ja not_active Expired - Fee Related
- 2021-06-23 AU AU2021204233A patent/AU2021204233B2/en not_active Ceased
- 2021-07-26 JP JP2021121353A patent/JP7139498B2/ja active Active
-
2022
- 2022-09-07 JP JP2022142197A patent/JP2022171769A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| EP3481414A4 (en) | 2020-05-13 |
| US20210369816A1 (en) | 2021-12-02 |
| AU2021204233A1 (en) | 2021-07-15 |
| JP2021175744A (ja) | 2021-11-04 |
| JP2019511558A (ja) | 2019-04-25 |
| AU2017253674A1 (en) | 2018-10-25 |
| EP3998061A1 (en) | 2022-05-18 |
| AU2021204233B2 (en) | 2023-07-13 |
| CA3020333A1 (en) | 2017-10-26 |
| EP3481414A1 (en) | 2019-05-15 |
| US20200164045A1 (en) | 2020-05-28 |
| JP7139498B2 (ja) | 2022-09-20 |
| US10980862B2 (en) | 2021-04-20 |
| US10568937B2 (en) | 2020-02-25 |
| EP3481414B1 (en) | 2021-11-03 |
| WO2017184355A1 (en) | 2017-10-26 |
| ES2904891T3 (es) | 2022-04-06 |
| US20190117739A1 (en) | 2019-04-25 |
| AU2017253674B2 (en) | 2021-07-29 |
| JP6920341B2 (ja) | 2021-08-18 |
| JP2021113209A (ja) | 2021-08-05 |
| JP2022171769A (ja) | 2022-11-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6919087B2 (ja) | アバロパラチドの製剤、その経皮パッチ、およびその使用 | |
| JP7146011B2 (ja) | PTHrP類似体の製剤、その経皮パッチ、およびその使用 | |
| US20230277444A1 (en) | FORMULATIONS OF PTHrP ANALOGUES, TRANSDERMAL PATCHES THEREOF, AND USES THEREOF | |
| JP2014517825A (ja) | PTH、PTHrP、および関連ペプチドの薬剤送達方法 | |
| HK40072671A (en) | Formulations of abaloparatide, transdermal patches thereof, and uses thereof | |
| HK40064524A (en) | Formulations of pthrp analogues, transdermal patches thereof, and uses thereof | |
| HK1260883A1 (en) | Formulations of pthrp analogues. transdermal patches thereof, and uses thereof | |
| HK40008968B (en) | Formulations of abaloparatide, transdermal patches thereof, and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210506 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20210506 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210624 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210715 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210721 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6919087 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |