JP6887492B6 - 遺伝子改変細胞で使用するための共刺激ドメイン - Google Patents
遺伝子改変細胞で使用するための共刺激ドメイン Download PDFInfo
- Publication number
- JP6887492B6 JP6887492B6 JP2019518049A JP2019518049A JP6887492B6 JP 6887492 B6 JP6887492 B6 JP 6887492B6 JP 2019518049 A JP2019518049 A JP 2019518049A JP 2019518049 A JP2019518049 A JP 2019518049A JP 6887492 B6 JP6887492 B6 JP 6887492B6
- Authority
- JP
- Japan
- Prior art keywords
- cells
- cell
- car
- domain
- nucleic acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 claims description 232
- 150000007523 nucleic acids Chemical class 0.000 claims description 154
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 138
- 102000039446 nucleic acids Human genes 0.000 claims description 110
- 108020004707 nucleic acids Proteins 0.000 claims description 110
- 230000014509 gene expression Effects 0.000 claims description 103
- 206010028980 Neoplasm Diseases 0.000 claims description 97
- 239000013598 vector Substances 0.000 claims description 88
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 82
- 239000000427 antigen Substances 0.000 claims description 79
- 108091007433 antigens Proteins 0.000 claims description 79
- 102000036639 antigens Human genes 0.000 claims description 79
- 238000000034 method Methods 0.000 claims description 72
- 230000027455 binding Effects 0.000 claims description 57
- 201000011510 cancer Diseases 0.000 claims description 47
- 101710163270 Nuclease Proteins 0.000 claims description 42
- 239000002773 nucleotide Substances 0.000 claims description 41
- 125000003729 nucleotide group Chemical group 0.000 claims description 41
- 239000013603 viral vector Substances 0.000 claims description 33
- 230000003834 intracellular effect Effects 0.000 claims description 27
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 claims description 23
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 claims description 23
- 239000012636 effector Substances 0.000 claims description 21
- 108020004511 Recombinant DNA Proteins 0.000 claims description 20
- 239000008194 pharmaceutical composition Substances 0.000 claims description 19
- 210000003719 b-lymphocyte Anatomy 0.000 claims description 18
- 238000003776 cleavage reaction Methods 0.000 claims description 18
- 230000007017 scission Effects 0.000 claims description 18
- 239000013607 AAV vector Substances 0.000 claims description 16
- 238000004519 manufacturing process Methods 0.000 claims description 13
- 108091033409 CRISPR Proteins 0.000 claims description 12
- 206010039491 Sarcoma Diseases 0.000 claims description 12
- 206010025323 Lymphomas Diseases 0.000 claims description 11
- 230000003612 virological effect Effects 0.000 claims description 11
- 201000001441 melanoma Diseases 0.000 claims description 9
- 108020004999 messenger RNA Proteins 0.000 claims description 9
- 238000010354 CRISPR gene editing Methods 0.000 claims description 8
- 241000702421 Dependoparvovirus Species 0.000 claims description 8
- 108010017070 Zinc Finger Nucleases Proteins 0.000 claims description 8
- 208000032839 leukemia Diseases 0.000 claims description 7
- 206010033128 Ovarian cancer Diseases 0.000 claims description 6
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 6
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 6
- 201000000053 blastoma Diseases 0.000 claims description 6
- 201000008184 embryoma Diseases 0.000 claims description 6
- 206010017758 gastric cancer Diseases 0.000 claims description 6
- 201000011549 stomach cancer Diseases 0.000 claims description 6
- 230000002103 transcriptional effect Effects 0.000 claims description 6
- 201000009030 Carcinoma Diseases 0.000 claims description 5
- 206010029260 Neuroblastoma Diseases 0.000 claims description 5
- 206010060862 Prostate cancer Diseases 0.000 claims description 5
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 5
- 239000003937 drug carrier Substances 0.000 claims description 5
- 206010006187 Breast cancer Diseases 0.000 claims description 4
- 208000026310 Breast neoplasm Diseases 0.000 claims description 4
- 206010009944 Colon cancer Diseases 0.000 claims description 4
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 4
- 208000006265 Renal cell carcinoma Diseases 0.000 claims description 4
- 208000029742 colonic neoplasm Diseases 0.000 claims description 4
- 238000002744 homologous recombination Methods 0.000 claims description 4
- 230000006801 homologous recombination Effects 0.000 claims description 4
- 201000005202 lung cancer Diseases 0.000 claims description 4
- 208000020816 lung neoplasm Diseases 0.000 claims description 4
- 201000008968 osteosarcoma Diseases 0.000 claims description 4
- 208000015347 renal cell adenocarcinoma Diseases 0.000 claims description 4
- 201000009410 rhabdomyosarcoma Diseases 0.000 claims description 3
- 230000001024 immunotherapeutic effect Effects 0.000 claims 1
- 210000004027 cell Anatomy 0.000 description 476
- 230000001939 inductive effect Effects 0.000 description 83
- 230000001105 regulatory effect Effects 0.000 description 78
- 230000000139 costimulatory effect Effects 0.000 description 72
- 108090000623 proteins and genes Proteins 0.000 description 72
- 239000012634 fragment Substances 0.000 description 64
- 102000004127 Cytokines Human genes 0.000 description 49
- 108090000695 Cytokines Proteins 0.000 description 49
- 108091028043 Nucleic acid sequence Proteins 0.000 description 47
- 230000035755 proliferation Effects 0.000 description 45
- 230000028327 secretion Effects 0.000 description 45
- 108091007741 Chimeric antigen receptor T cells Proteins 0.000 description 44
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 description 42
- 102000004169 proteins and genes Human genes 0.000 description 36
- 230000011664 signaling Effects 0.000 description 36
- 108090000765 processed proteins & peptides Proteins 0.000 description 33
- 108010077432 Myeloid Differentiation Factor 88 Proteins 0.000 description 32
- 102000010168 Myeloid Differentiation Factor 88 Human genes 0.000 description 32
- 108020004414 DNA Proteins 0.000 description 31
- 229920001184 polypeptide Polymers 0.000 description 30
- 102000004196 processed proteins & peptides Human genes 0.000 description 30
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 description 29
- GQLCLPLEEOUJQC-ZTQDTCGGSA-N [(1r)-3-(3,4-dimethoxyphenyl)-1-[3-[2-[2-[[2-[3-[(1r)-3-(3,4-dimethoxyphenyl)-1-[(2s)-1-[(2s)-2-(3,4,5-trimethoxyphenyl)butanoyl]piperidine-2-carbonyl]oxypropyl]phenoxy]acetyl]amino]ethylamino]-2-oxoethoxy]phenyl]propyl] (2s)-1-[(2s)-2-(3,4,5-trimethoxyph Chemical compound C([C@@H](OC(=O)[C@@H]1CCCCN1C(=O)[C@@H](CC)C=1C=C(OC)C(OC)=C(OC)C=1)C=1C=C(OCC(=O)NCCNC(=O)COC=2C=C(C=CC=2)[C@@H](CCC=2C=C(OC)C(OC)=CC=2)OC(=O)[C@H]2N(CCCC2)C(=O)[C@@H](CC)C=2C=C(OC)C(OC)=C(OC)C=2)C=CC=1)CC1=CC=C(OC)C(OC)=C1 GQLCLPLEEOUJQC-ZTQDTCGGSA-N 0.000 description 27
- 239000013612 plasmid Substances 0.000 description 27
- 125000006850 spacer group Chemical group 0.000 description 26
- 108010042407 Endonucleases Proteins 0.000 description 24
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 24
- 230000012010 growth Effects 0.000 description 24
- 229950004008 rimiducid Drugs 0.000 description 24
- 102000004533 Endonucleases Human genes 0.000 description 23
- 230000004663 cell proliferation Effects 0.000 description 23
- 210000000822 natural killer cell Anatomy 0.000 description 23
- 238000011282 treatment Methods 0.000 description 23
- 241000699670 Mus sp. Species 0.000 description 22
- 201000010099 disease Diseases 0.000 description 22
- 230000004913 activation Effects 0.000 description 21
- 230000000694 effects Effects 0.000 description 20
- 241000829100 Macaca mulatta polyomavirus 1 Species 0.000 description 19
- 238000003501 co-culture Methods 0.000 description 19
- 102000040430 polynucleotide Human genes 0.000 description 19
- 108091033319 polynucleotide Proteins 0.000 description 19
- 239000002157 polynucleotide Substances 0.000 description 19
- 238000010361 transduction Methods 0.000 description 19
- 230000026683 transduction Effects 0.000 description 19
- 108010076667 Caspases Proteins 0.000 description 18
- 102000011727 Caspases Human genes 0.000 description 18
- 241000713666 Lentivirus Species 0.000 description 18
- 108010002350 Interleukin-2 Proteins 0.000 description 17
- 102000000588 Interleukin-2 Human genes 0.000 description 17
- 241000700605 Viruses Species 0.000 description 17
- 238000002474 experimental method Methods 0.000 description 17
- 230000004068 intracellular signaling Effects 0.000 description 17
- 230000001965 increasing effect Effects 0.000 description 16
- 108091008874 T cell receptors Proteins 0.000 description 15
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 15
- 230000004907 flux Effects 0.000 description 15
- 230000006870 function Effects 0.000 description 15
- 108020001756 ligand binding domains Proteins 0.000 description 15
- 150000003384 small molecules Chemical class 0.000 description 15
- 102100029452 T cell receptor alpha chain constant Human genes 0.000 description 14
- 230000004083 survival effect Effects 0.000 description 14
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 13
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 13
- 238000000684 flow cytometry Methods 0.000 description 13
- 238000003780 insertion Methods 0.000 description 13
- 230000037431 insertion Effects 0.000 description 13
- 239000002245 particle Substances 0.000 description 13
- 238000001727 in vivo Methods 0.000 description 12
- 239000003446 ligand Substances 0.000 description 12
- 238000001516 cell proliferation assay Methods 0.000 description 11
- 238000006471 dimerization reaction Methods 0.000 description 11
- 239000003814 drug Substances 0.000 description 11
- 239000000203 mixture Substances 0.000 description 11
- 230000020411 cell activation Effects 0.000 description 10
- 230000010261 cell growth Effects 0.000 description 10
- 230000022534 cell killing Effects 0.000 description 10
- 238000000338 in vitro Methods 0.000 description 10
- 230000004048 modification Effects 0.000 description 10
- 238000012986 modification Methods 0.000 description 10
- 102000005962 receptors Human genes 0.000 description 10
- 108020003175 receptors Proteins 0.000 description 10
- 230000002441 reversible effect Effects 0.000 description 10
- 108091026890 Coding region Proteins 0.000 description 9
- 241000725303 Human immunodeficiency virus Species 0.000 description 9
- 108010074328 Interferon-gamma Proteins 0.000 description 9
- 108010076504 Protein Sorting Signals Proteins 0.000 description 9
- 238000010790 dilution Methods 0.000 description 9
- 239000012895 dilution Substances 0.000 description 9
- 238000005516 engineering process Methods 0.000 description 9
- 239000002105 nanoparticle Substances 0.000 description 9
- 238000002360 preparation method Methods 0.000 description 9
- 238000006467 substitution reaction Methods 0.000 description 9
- 208000024891 symptom Diseases 0.000 description 9
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 8
- 241000972680 Adeno-associated virus - 6 Species 0.000 description 8
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 8
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 8
- 150000001413 amino acids Chemical class 0.000 description 8
- 230000001086 cytosolic effect Effects 0.000 description 8
- 238000009169 immunotherapy Methods 0.000 description 8
- 230000004044 response Effects 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- 210000001519 tissue Anatomy 0.000 description 8
- 208000003950 B-cell lymphoma Diseases 0.000 description 7
- 230000004568 DNA-binding Effects 0.000 description 7
- 102100037850 Interferon gamma Human genes 0.000 description 7
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 7
- 108700019146 Transgenes Proteins 0.000 description 7
- 238000003556 assay Methods 0.000 description 7
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 7
- 238000012258 culturing Methods 0.000 description 7
- 229920000642 polymer Polymers 0.000 description 7
- 210000004881 tumor cell Anatomy 0.000 description 7
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 6
- 102000004190 Enzymes Human genes 0.000 description 6
- 108090000790 Enzymes Proteins 0.000 description 6
- 101000634853 Homo sapiens T cell receptor alpha chain constant Proteins 0.000 description 6
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 6
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 6
- 210000000662 T-lymphocyte subset Anatomy 0.000 description 6
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 6
- 102100040247 Tumor necrosis factor Human genes 0.000 description 6
- 238000004113 cell culture Methods 0.000 description 6
- 208000015181 infectious disease Diseases 0.000 description 6
- 230000002147 killing effect Effects 0.000 description 6
- 150000002632 lipids Chemical class 0.000 description 6
- 239000000693 micelle Substances 0.000 description 6
- 108091008146 restriction endonucleases Proteins 0.000 description 6
- 230000000638 stimulation Effects 0.000 description 6
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 5
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 5
- 208000028564 B-cell non-Hodgkin lymphoma Diseases 0.000 description 5
- 108010008532 Deoxyribonuclease I Proteins 0.000 description 5
- 102000007260 Deoxyribonuclease I Human genes 0.000 description 5
- 108020005004 Guide RNA Proteins 0.000 description 5
- 239000004698 Polyethylene Substances 0.000 description 5
- 238000007792 addition Methods 0.000 description 5
- 101150087698 alpha gene Proteins 0.000 description 5
- 125000000539 amino acid group Chemical group 0.000 description 5
- 230000001413 cellular effect Effects 0.000 description 5
- 230000007423 decrease Effects 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 239000000839 emulsion Substances 0.000 description 5
- 108010050663 endodeoxyribonuclease CreI Proteins 0.000 description 5
- 210000003527 eukaryotic cell Anatomy 0.000 description 5
- 238000003384 imaging method Methods 0.000 description 5
- 230000000670 limiting effect Effects 0.000 description 5
- 239000003550 marker Substances 0.000 description 5
- 230000001404 mediated effect Effects 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 230000001177 retroviral effect Effects 0.000 description 5
- 238000002864 sequence alignment Methods 0.000 description 5
- 241000894007 species Species 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 208000023275 Autoimmune disease Diseases 0.000 description 4
- 241000701022 Cytomegalovirus Species 0.000 description 4
- 102000053602 DNA Human genes 0.000 description 4
- 230000007018 DNA scission Effects 0.000 description 4
- 208000032612 Glial tumor Diseases 0.000 description 4
- 206010018338 Glioma Diseases 0.000 description 4
- 101000611183 Homo sapiens Tumor necrosis factor Proteins 0.000 description 4
- 208000008839 Kidney Neoplasms Diseases 0.000 description 4
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 4
- 208000034578 Multiple myelomas Diseases 0.000 description 4
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 4
- 206010035226 Plasma cell myeloma Diseases 0.000 description 4
- 208000015634 Rectal Neoplasms Diseases 0.000 description 4
- 206010038389 Renal cancer Diseases 0.000 description 4
- 230000006052 T cell proliferation Effects 0.000 description 4
- 208000006593 Urologic Neoplasms Diseases 0.000 description 4
- 208000002495 Uterine Neoplasms Diseases 0.000 description 4
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 4
- 238000002619 cancer immunotherapy Methods 0.000 description 4
- 210000003169 central nervous system Anatomy 0.000 description 4
- 230000001461 cytolytic effect Effects 0.000 description 4
- 238000012217 deletion Methods 0.000 description 4
- 230000037430 deletion Effects 0.000 description 4
- 230000001419 dependent effect Effects 0.000 description 4
- 238000011156 evaluation Methods 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 201000010982 kidney cancer Diseases 0.000 description 4
- 238000002372 labelling Methods 0.000 description 4
- 230000036210 malignancy Effects 0.000 description 4
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 239000013642 negative control Substances 0.000 description 4
- 201000002528 pancreatic cancer Diseases 0.000 description 4
- 208000008443 pancreatic carcinoma Diseases 0.000 description 4
- 206010038038 rectal cancer Diseases 0.000 description 4
- 201000001275 rectum cancer Diseases 0.000 description 4
- 230000010076 replication Effects 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 238000010186 staining Methods 0.000 description 4
- 210000000130 stem cell Anatomy 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 4
- 230000002459 sustained effect Effects 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 238000012546 transfer Methods 0.000 description 4
- 206010046766 uterine cancer Diseases 0.000 description 4
- 229910052725 zinc Inorganic materials 0.000 description 4
- 239000011701 zinc Substances 0.000 description 4
- 206010061692 Benign muscle neoplasm Diseases 0.000 description 3
- 102100027207 CD27 antigen Human genes 0.000 description 3
- 101150013553 CD40 gene Proteins 0.000 description 3
- 208000017604 Hodgkin disease Diseases 0.000 description 3
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 3
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 3
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 description 3
- 101000599940 Homo sapiens Interferon gamma Proteins 0.000 description 3
- 101001002657 Homo sapiens Interleukin-2 Proteins 0.000 description 3
- 108090000172 Interleukin-15 Proteins 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 201000004458 Myoma Diseases 0.000 description 3
- 102100027913 Peptidyl-prolyl cis-trans isomerase FKBP1A Human genes 0.000 description 3
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 3
- 108010006877 Tacrolimus Binding Protein 1A Proteins 0.000 description 3
- 102100033726 Tumor necrosis factor receptor superfamily member 17 Human genes 0.000 description 3
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 230000000259 anti-tumor effect Effects 0.000 description 3
- 230000004071 biological effect Effects 0.000 description 3
- 229960002685 biotin Drugs 0.000 description 3
- 239000011616 biotin Substances 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 230000037396 body weight Effects 0.000 description 3
- 210000000170 cell membrane Anatomy 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 230000000295 complement effect Effects 0.000 description 3
- -1 cyclic nucleic acid Chemical class 0.000 description 3
- 239000000412 dendrimer Substances 0.000 description 3
- 229920000736 dendritic polymer Polymers 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 239000000539 dimer Substances 0.000 description 3
- 239000013604 expression vector Substances 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 238000010353 genetic engineering Methods 0.000 description 3
- 238000010348 incorporation Methods 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 239000002502 liposome Substances 0.000 description 3
- 239000000178 monomer Substances 0.000 description 3
- 230000035772 mutation Effects 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- 230000008488 polyadenylation Effects 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 102200015453 rs121912293 Human genes 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 238000001890 transfection Methods 0.000 description 3
- 230000004614 tumor growth Effects 0.000 description 3
- 241000701161 unidentified adenovirus Species 0.000 description 3
- 238000012447 xenograft mouse model Methods 0.000 description 3
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 2
- 108700028369 Alleles Proteins 0.000 description 2
- 206010061424 Anal cancer Diseases 0.000 description 2
- 208000007860 Anus Neoplasms Diseases 0.000 description 2
- 208000025324 B-cell acute lymphoblastic leukemia Diseases 0.000 description 2
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 2
- 206010005003 Bladder cancer Diseases 0.000 description 2
- 206010005949 Bone cancer Diseases 0.000 description 2
- 208000018084 Bone neoplasm Diseases 0.000 description 2
- 208000011691 Burkitt lymphomas Diseases 0.000 description 2
- 108091079001 CRISPR RNA Proteins 0.000 description 2
- 102000000844 Cell Surface Receptors Human genes 0.000 description 2
- 108010001857 Cell Surface Receptors Proteins 0.000 description 2
- 206010007953 Central nervous system lymphoma Diseases 0.000 description 2
- 206010008342 Cervix carcinoma Diseases 0.000 description 2
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 2
- 206010011968 Decreased immune responsiveness Diseases 0.000 description 2
- 208000001976 Endocrine Gland Neoplasms Diseases 0.000 description 2
- 206010014733 Endometrial cancer Diseases 0.000 description 2
- 206010014759 Endometrial neoplasm Diseases 0.000 description 2
- 101000889900 Enterobacteria phage T4 Intron-associated endonuclease 1 Proteins 0.000 description 2
- 102000018651 Epithelial Cell Adhesion Molecule Human genes 0.000 description 2
- 108010066687 Epithelial Cell Adhesion Molecule Proteins 0.000 description 2
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 2
- 108090000371 Esterases Proteins 0.000 description 2
- 108700024394 Exon Proteins 0.000 description 2
- 108060002716 Exonuclease Proteins 0.000 description 2
- 201000003741 Gastrointestinal carcinoma Diseases 0.000 description 2
- 101100005713 Homo sapiens CD4 gene Proteins 0.000 description 2
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 2
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 2
- 101000801255 Homo sapiens Tumor necrosis factor receptor superfamily member 17 Proteins 0.000 description 2
- 241000714260 Human T-lymphotropic virus 1 Species 0.000 description 2
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 2
- 102000008070 Interferon-gamma Human genes 0.000 description 2
- 102100027268 Interferon-stimulated gene 20 kDa protein Human genes 0.000 description 2
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 description 2
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 description 2
- 206010027476 Metastases Diseases 0.000 description 2
- 241000192041 Micrococcus Species 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 2
- 208000034176 Neoplasms, Germ Cell and Embryonal Diseases 0.000 description 2
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 2
- 108700026244 Open Reading Frames Proteins 0.000 description 2
- 208000000821 Parathyroid Neoplasms Diseases 0.000 description 2
- 208000002471 Penile Neoplasms Diseases 0.000 description 2
- 206010034299 Penile cancer Diseases 0.000 description 2
- 208000007913 Pituitary Neoplasms Diseases 0.000 description 2
- 201000005746 Pituitary adenoma Diseases 0.000 description 2
- 206010061538 Pituitary tumour benign Diseases 0.000 description 2
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 2
- 108010072866 Prostate-Specific Antigen Proteins 0.000 description 2
- 102100038358 Prostate-specific antigen Human genes 0.000 description 2
- 108700008625 Reporter Genes Proteins 0.000 description 2
- 241000831652 Salinivibrio sharmensis Species 0.000 description 2
- 208000000453 Skin Neoplasms Diseases 0.000 description 2
- 108010090804 Streptavidin Proteins 0.000 description 2
- 230000006044 T cell activation Effects 0.000 description 2
- 206010042971 T-cell lymphoma Diseases 0.000 description 2
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 description 2
- 108010017842 Telomerase Proteins 0.000 description 2
- 208000024313 Testicular Neoplasms Diseases 0.000 description 2
- 206010057644 Testis cancer Diseases 0.000 description 2
- 208000024770 Thyroid neoplasm Diseases 0.000 description 2
- 108010073062 Transcription Activator-Like Effectors Proteins 0.000 description 2
- GLNADSQYFUSGOU-GPTZEZBUSA-J Trypan blue Chemical compound [Na+].[Na+].[Na+].[Na+].C1=C(S([O-])(=O)=O)C=C2C=C(S([O-])(=O)=O)C(/N=N/C3=CC=C(C=C3C)C=3C=C(C(=CC=3)\N=N\C=3C(=CC4=CC(=CC(N)=C4C=3O)S([O-])(=O)=O)S([O-])(=O)=O)C)=C(O)C2=C1N GLNADSQYFUSGOU-GPTZEZBUSA-J 0.000 description 2
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- 201000005188 adrenal gland cancer Diseases 0.000 description 2
- 208000024447 adrenal gland neoplasm Diseases 0.000 description 2
- 201000011165 anus cancer Diseases 0.000 description 2
- 238000002617 apheresis Methods 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 239000008346 aqueous phase Substances 0.000 description 2
- 239000010425 asbestos Substances 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- 210000001185 bone marrow Anatomy 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 208000035269 cancer or benign tumor Diseases 0.000 description 2
- 230000032823 cell division Effects 0.000 description 2
- 230000033077 cellular process Effects 0.000 description 2
- 201000010881 cervical cancer Diseases 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 2
- 230000016396 cytokine production Effects 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- 231100000433 cytotoxic Toxicity 0.000 description 2
- 230000001472 cytotoxic effect Effects 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 238000004520 electroporation Methods 0.000 description 2
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 2
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 2
- 201000004101 esophageal cancer Diseases 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 102000013165 exonuclease Human genes 0.000 description 2
- 201000003444 follicular lymphoma Diseases 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 238000012239 gene modification Methods 0.000 description 2
- 210000004392 genitalia Anatomy 0.000 description 2
- 201000010536 head and neck cancer Diseases 0.000 description 2
- 208000014829 head and neck neoplasm Diseases 0.000 description 2
- 239000000833 heterodimer Substances 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 229960003130 interferon gamma Drugs 0.000 description 2
- 201000002313 intestinal cancer Diseases 0.000 description 2
- 230000031146 intracellular signal transduction Effects 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 201000007270 liver cancer Diseases 0.000 description 2
- 208000014018 liver neoplasm Diseases 0.000 description 2
- 238000004020 luminiscence type Methods 0.000 description 2
- 230000001926 lymphatic effect Effects 0.000 description 2
- 210000004698 lymphocyte Anatomy 0.000 description 2
- 208000029559 malignant endocrine neoplasm Diseases 0.000 description 2
- 208000020984 malignant renal pelvis neoplasm Diseases 0.000 description 2
- 208000026045 malignant tumor of parathyroid gland Diseases 0.000 description 2
- 201000007924 marginal zone B-cell lymphoma Diseases 0.000 description 2
- 208000021937 marginal zone lymphoma Diseases 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 238000010369 molecular cloning Methods 0.000 description 2
- 238000002703 mutagenesis Methods 0.000 description 2
- 231100000350 mutagenesis Toxicity 0.000 description 2
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 2
- 210000003101 oviduct Anatomy 0.000 description 2
- 238000004806 packaging method and process Methods 0.000 description 2
- 230000002688 persistence Effects 0.000 description 2
- 208000021310 pituitary gland adenoma Diseases 0.000 description 2
- 210000004986 primary T-cell Anatomy 0.000 description 2
- 208000016800 primary central nervous system lymphoma Diseases 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 230000006798 recombination Effects 0.000 description 2
- 238000005215 recombination Methods 0.000 description 2
- 201000007444 renal pelvis carcinoma Diseases 0.000 description 2
- 201000006845 reticulosarcoma Diseases 0.000 description 2
- 208000029922 reticulum cell sarcoma Diseases 0.000 description 2
- 229910052895 riebeckite Inorganic materials 0.000 description 2
- 230000019491 signal transduction Effects 0.000 description 2
- 230000003007 single stranded DNA break Effects 0.000 description 2
- 210000003491 skin Anatomy 0.000 description 2
- 201000000849 skin cancer Diseases 0.000 description 2
- 230000009870 specific binding Effects 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- 201000003120 testicular cancer Diseases 0.000 description 2
- 201000002510 thyroid cancer Diseases 0.000 description 2
- 238000004448 titration Methods 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 230000005026 transcription initiation Effects 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- 230000005747 tumor angiogenesis Effects 0.000 description 2
- 241001430294 unidentified retrovirus Species 0.000 description 2
- 230000003827 upregulation Effects 0.000 description 2
- 201000005112 urinary bladder cancer Diseases 0.000 description 2
- 206010046885 vaginal cancer Diseases 0.000 description 2
- 208000013139 vaginal neoplasm Diseases 0.000 description 2
- 230000035899 viability Effects 0.000 description 2
- FFILOTSTFMXQJC-QCFYAKGBSA-N (2r,4r,5s,6s)-2-[3-[(2s,3s,4r,6s)-6-[(2s,3r,4r,5s,6r)-5-[(2s,3r,4r,5r,6r)-3-acetamido-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-2-[(2r,3s,4r,5r,6r)-4,5-dihydroxy-2-(hydroxymethyl)-6-[(e)-3-hydroxy-2-(octadecanoylamino)octadec-4-enoxy]oxan-3-yl]oxy-3-hy Chemical compound O[C@@H]1[C@@H](O)[C@H](OCC(NC(=O)CCCCCCCCCCCCCCCCC)C(O)\C=C\CCCCCCCCCCCCC)O[C@H](CO)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@]2(O[C@@H]([C@@H](N)[C@H](O)C2)C(O)C(O)CO[C@]2(O[C@@H]([C@@H](N)[C@H](O)C2)C(O)C(O)CO)C(O)=O)C(O)=O)[C@@H](O[C@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](CO)O1 FFILOTSTFMXQJC-QCFYAKGBSA-N 0.000 description 1
- BGFTWECWAICPDG-UHFFFAOYSA-N 2-[bis(4-chlorophenyl)methyl]-4-n-[3-[bis(4-chlorophenyl)methyl]-4-(dimethylamino)phenyl]-1-n,1-n-dimethylbenzene-1,4-diamine Chemical compound C1=C(C(C=2C=CC(Cl)=CC=2)C=2C=CC(Cl)=CC=2)C(N(C)C)=CC=C1NC(C=1)=CC=C(N(C)C)C=1C(C=1C=CC(Cl)=CC=1)C1=CC=C(Cl)C=C1 BGFTWECWAICPDG-UHFFFAOYSA-N 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 241000702423 Adeno-associated virus - 2 Species 0.000 description 1
- 101710145634 Antigen 1 Proteins 0.000 description 1
- 206010003445 Ascites Diseases 0.000 description 1
- 108091008875 B cell receptors Proteins 0.000 description 1
- 108010008014 B-Cell Maturation Antigen Proteins 0.000 description 1
- 102100038080 B-cell receptor CD22 Human genes 0.000 description 1
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 1
- 208000035143 Bacterial infection Diseases 0.000 description 1
- 206010006143 Brain stem glioma Diseases 0.000 description 1
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 1
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 1
- 102000008203 CTLA-4 Antigen Human genes 0.000 description 1
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 1
- 229940045513 CTLA4 antagonist Drugs 0.000 description 1
- 102100025570 Cancer/testis antigen 1 Human genes 0.000 description 1
- 235000002566 Capsicum Nutrition 0.000 description 1
- 240000008574 Capsicum frutescens Species 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- 108010051152 Carboxylesterase Proteins 0.000 description 1
- 102000013392 Carboxylesterase Human genes 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 102100025064 Cellular tumor antigen p53 Human genes 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 229920001661 Chitosan Polymers 0.000 description 1
- 241000710177 Citrus tristeza virus Species 0.000 description 1
- 102220605874 Cytosolic arginine sensor for mTORC1 subunit 2_D10A_mutation Human genes 0.000 description 1
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 1
- 230000006820 DNA synthesis Effects 0.000 description 1
- 102000052510 DNA-Binding Proteins Human genes 0.000 description 1
- 101710096438 DNA-binding protein Proteins 0.000 description 1
- CYCGRDQQIOGCKX-UHFFFAOYSA-N Dehydro-luciferin Natural products OC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 CYCGRDQQIOGCKX-UHFFFAOYSA-N 0.000 description 1
- 108010016626 Dipeptides Proteins 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 102100037241 Endoglin Human genes 0.000 description 1
- 108010036395 Endoglin Proteins 0.000 description 1
- 101000889905 Enterobacteria phage RB3 Intron-associated endonuclease 3 Proteins 0.000 description 1
- 101000889904 Enterobacteria phage T4 Defective intron-associated endonuclease 3 Proteins 0.000 description 1
- 101000889899 Enterobacteria phage T4 Intron-associated endonuclease 2 Proteins 0.000 description 1
- 206010015548 Euthanasia Diseases 0.000 description 1
- 102000016359 Fibronectins Human genes 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- 108090000331 Firefly luciferases Proteins 0.000 description 1
- BJGNCJDXODQBOB-UHFFFAOYSA-N Fivefly Luciferin Natural products OC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 BJGNCJDXODQBOB-UHFFFAOYSA-N 0.000 description 1
- 206010064571 Gene mutation Diseases 0.000 description 1
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 description 1
- 102000006771 Gonadotropins Human genes 0.000 description 1
- 108010086677 Gonadotropins Proteins 0.000 description 1
- 208000031886 HIV Infections Diseases 0.000 description 1
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 description 1
- 102000001554 Hemoglobins Human genes 0.000 description 1
- 108010054147 Hemoglobins Proteins 0.000 description 1
- 229920000209 Hexadimethrine bromide Polymers 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000884305 Homo sapiens B-cell receptor CD22 Proteins 0.000 description 1
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 1
- 101000856237 Homo sapiens Cancer/testis antigen 1 Proteins 0.000 description 1
- 101000721661 Homo sapiens Cellular tumor antigen p53 Proteins 0.000 description 1
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 description 1
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 description 1
- 101001103039 Homo sapiens Inactive tyrosine-protein kinase transmembrane receptor ROR1 Proteins 0.000 description 1
- 101000599951 Homo sapiens Insulin-like growth factor I Proteins 0.000 description 1
- 101001014223 Homo sapiens MAPK/MAK/MRK overlapping kinase Proteins 0.000 description 1
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 1
- 101001109501 Homo sapiens NKG2-D type II integral membrane protein Proteins 0.000 description 1
- 101001103036 Homo sapiens Nuclear receptor ROR-alpha Proteins 0.000 description 1
- 101000610551 Homo sapiens Prominin-1 Proteins 0.000 description 1
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 101000884271 Homo sapiens Signal transducer CD24 Proteins 0.000 description 1
- 101000874179 Homo sapiens Syndecan-1 Proteins 0.000 description 1
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 description 1
- 101000946843 Homo sapiens T-cell surface glycoprotein CD8 alpha chain Proteins 0.000 description 1
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 1
- 241000598436 Human T-cell lymphotropic virus Species 0.000 description 1
- 241000713340 Human immunodeficiency virus 2 Species 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 208000029462 Immunodeficiency disease Diseases 0.000 description 1
- 102100039615 Inactive tyrosine-protein kinase transmembrane receptor ROR1 Human genes 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 108090001117 Insulin-Like Growth Factor II Proteins 0.000 description 1
- 102000048143 Insulin-Like Growth Factor II Human genes 0.000 description 1
- 102100037852 Insulin-like growth factor I Human genes 0.000 description 1
- 108010002586 Interleukin-7 Proteins 0.000 description 1
- 108010029660 Intrinsically Disordered Proteins Proteins 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- 101150008942 J gene Proteins 0.000 description 1
- 102100034872 Kallikrein-4 Human genes 0.000 description 1
- 108010028275 Leukocyte Elastase Proteins 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- DDWFXDSYGUXRAY-UHFFFAOYSA-N Luciferin Natural products CCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3C DDWFXDSYGUXRAY-UHFFFAOYSA-N 0.000 description 1
- 102100031520 MAPK/MAK/MRK overlapping kinase Human genes 0.000 description 1
- 108010046938 Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102100028123 Macrophage colony-stimulating factor 1 Human genes 0.000 description 1
- 241000713333 Mouse mammary tumor virus Species 0.000 description 1
- 101100286588 Mus musculus Igfl gene Proteins 0.000 description 1
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 1
- 102000003505 Myosin Human genes 0.000 description 1
- 108060008487 Myosin Proteins 0.000 description 1
- 102100022680 NKG2-D type II integral membrane protein Human genes 0.000 description 1
- 206010061309 Neoplasm progression Diseases 0.000 description 1
- 102100033174 Neutrophil elastase Human genes 0.000 description 1
- 208000030852 Parasitic disease Diseases 0.000 description 1
- 102000010292 Peptide Elongation Factor 1 Human genes 0.000 description 1
- 108010077524 Peptide Elongation Factor 1 Proteins 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 235000016816 Pisum sativum subsp sativum Nutrition 0.000 description 1
- 208000002151 Pleural effusion Diseases 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 102100040120 Prominin-1 Human genes 0.000 description 1
- 108020005067 RNA Splice Sites Proteins 0.000 description 1
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 101001025539 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) Homothallic switching endonuclease Proteins 0.000 description 1
- 102100038081 Signal transducer CD24 Human genes 0.000 description 1
- 241000700584 Simplexvirus Species 0.000 description 1
- 108020004682 Single-Stranded DNA Proteins 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 102100037253 Solute carrier family 45 member 3 Human genes 0.000 description 1
- 102100035721 Syndecan-1 Human genes 0.000 description 1
- 108700042076 T-Cell Receptor alpha Genes Proteins 0.000 description 1
- 238000010459 TALEN Methods 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 108010043645 Transcription Activator-Like Effector Nucleases Proteins 0.000 description 1
- 108700009124 Transcription Initiation Site Proteins 0.000 description 1
- 101800000385 Transmembrane protein Proteins 0.000 description 1
- 108060008683 Tumor Necrosis Factor Receptor Proteins 0.000 description 1
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 1
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 1
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 241000711975 Vesicular stomatitis virus Species 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 241000589634 Xanthomonas Species 0.000 description 1
- PTFCDOFLOPIGGS-UHFFFAOYSA-N Zinc dication Chemical compound [Zn+2] PTFCDOFLOPIGGS-UHFFFAOYSA-N 0.000 description 1
- 101710185494 Zinc finger protein Proteins 0.000 description 1
- 102100023597 Zinc finger protein 816 Human genes 0.000 description 1
- 230000006786 activation induced cell death Effects 0.000 description 1
- 230000033289 adaptive immune response Effects 0.000 description 1
- 208000009956 adenocarcinoma Diseases 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 238000000137 annealing Methods 0.000 description 1
- 238000009175 antibody therapy Methods 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 239000000823 artificial membrane Substances 0.000 description 1
- 208000022362 bacterial infectious disease Diseases 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 238000010170 biological method Methods 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 229920001222 biopolymer Polymers 0.000 description 1
- 210000003969 blast cell Anatomy 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- AIYUHDOJVYHVIT-UHFFFAOYSA-M caesium chloride Chemical compound [Cl-].[Cs+] AIYUHDOJVYHVIT-UHFFFAOYSA-M 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 239000001390 capsicum minimum Substances 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 229920006317 cationic polymer Polymers 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 239000002458 cell surface marker Substances 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 239000013611 chromosomal DNA Substances 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 238000012411 cloning technique Methods 0.000 description 1
- 238000012761 co-transfection Methods 0.000 description 1
- 238000001246 colloidal dispersion Methods 0.000 description 1
- 239000000084 colloidal system Substances 0.000 description 1
- 230000000112 colonic effect Effects 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 210000002808 connective tissue Anatomy 0.000 description 1
- 239000013068 control sample Substances 0.000 description 1
- 239000011258 core-shell material Substances 0.000 description 1
- CVSVTCORWBXHQV-UHFFFAOYSA-N creatine Chemical compound NC(=[NH2+])N(C)CC([O-])=O CVSVTCORWBXHQV-UHFFFAOYSA-N 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 238000003568 cytokine secretion assay Methods 0.000 description 1
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 1
- 229940127089 cytotoxic agent Drugs 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 230000011559 double-strand break repair via nonhomologous end joining Effects 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 244000088681 endo Species 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 230000008472 epithelial growth Effects 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 238000012869 ethanol precipitation Methods 0.000 description 1
- 210000004700 fetal blood Anatomy 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 108700004026 gag Genes Proteins 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 230000005017 genetic modification Effects 0.000 description 1
- 235000013617 genetically modified food Nutrition 0.000 description 1
- 238000003205 genotyping method Methods 0.000 description 1
- 239000003862 glucocorticoid Substances 0.000 description 1
- 239000002622 gonadotropin Substances 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 210000000777 hematopoietic system Anatomy 0.000 description 1
- 208000010726 hind limb paralysis Diseases 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- 229920001477 hydrophilic polymer Polymers 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 230000003463 hyperproliferative effect Effects 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 239000012642 immune effector Substances 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000007813 immunodeficiency Effects 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 210000005007 innate immune system Anatomy 0.000 description 1
- 238000012966 insertion method Methods 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000004073 interleukin-2 production Effects 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 108010024383 kallikrein 4 Proteins 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 230000021633 leukocyte mediated immunity Effects 0.000 description 1
- 238000001638 lipofection Methods 0.000 description 1
- 239000002479 lipoplex Substances 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 210000001161 mammalian embryo Anatomy 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 210000002752 melanocyte Anatomy 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 208000037819 metastatic cancer Diseases 0.000 description 1
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 238000012737 microarray-based gene expression Methods 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 238000008995 multiplex Luminex assay kit Methods 0.000 description 1
- 238000012243 multiplex automated genomic engineering Methods 0.000 description 1
- 239000002088 nanocapsule Substances 0.000 description 1
- 239000007908 nanoemulsion Substances 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 210000003757 neuroblast Anatomy 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 210000004789 organ system Anatomy 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 1
- 239000008177 pharmaceutical agent Substances 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 238000000053 physical method Methods 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 108700004029 pol Genes Proteins 0.000 description 1
- 229920001606 poly(lactic acid-co-glycolic acid) Polymers 0.000 description 1
- 229920001481 poly(stearyl methacrylate) Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 229960003387 progesterone Drugs 0.000 description 1
- 239000000186 progesterone Substances 0.000 description 1
- 230000009682 proliferation pathway Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 108010079891 prostein Proteins 0.000 description 1
- 108020001580 protein domains Proteins 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 108700004030 rev Genes Proteins 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 208000003265 stomatitis Diseases 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 230000004654 survival pathway Effects 0.000 description 1
- 101150047061 tag-72 gene Proteins 0.000 description 1
- 108700004027 tat Genes Proteins 0.000 description 1
- 230000002123 temporal effect Effects 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 210000000115 thoracic cavity Anatomy 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000014621 translational initiation Effects 0.000 description 1
- 230000006433 tumor necrosis factor production Effects 0.000 description 1
- 102000003298 tumor necrosis factor receptor Human genes 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- 241001529453 unidentified herpesvirus Species 0.000 description 1
- 241000712461 unidentified influenza virus Species 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 230000001018 virulence Effects 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/715—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
- C07K14/7151—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons for tumor necrosis factor [TNF], for lymphotoxin [LT]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/38—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/46—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterised by the cancer treated
- A61K2239/48—Blood cells, e.g. leukemia or lymphoma
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4611—T-cells, e.g. tumor infiltrating lymphocytes [TIL], lymphokine-activated killer cells [LAK] or regulatory T cells [Treg]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/463—Cellular immunotherapy characterised by recombinant expression
- A61K39/4631—Chimeric Antigen Receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464402—Receptors, cell surface antigens or cell surface determinants
- A61K39/464411—Immunoglobulin superfamily
- A61K39/464412—CD19 or B4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70517—CD8
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70521—CD28, CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70578—NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/90—Isomerases (5.)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y502/00—Cis-trans-isomerases (5.2)
- C12Y502/01—Cis-trans-Isomerases (5.2.1)
- C12Y502/01008—Peptidylprolyl isomerase (5.2.1.8), i.e. cyclophilin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/02—Fusion polypeptide containing a localisation/targetting motif containing a signal sequence
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/33—Fusion polypeptide fusions for targeting to specific cell types, e.g. tissue specific targeting, targeting of a bacterial subspecies
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/20—Cytokines; Chemokines
- C12N2501/23—Interleukins [IL]
- C12N2501/2302—Interleukin-2 (IL-2)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15041—Use of virus, viral particle or viral elements as a vector
- C12N2740/15043—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
- C12N2750/14143—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Medicinal Chemistry (AREA)
- Zoology (AREA)
- Biochemistry (AREA)
- Cell Biology (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Wood Science & Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Microbiology (AREA)
- Gastroenterology & Hepatology (AREA)
- Toxicology (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Biomedical Technology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Mycology (AREA)
- Oncology (AREA)
- Hematology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Virology (AREA)
- Hospice & Palliative Care (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Developmental Biology & Embryology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
本出願は、EFS−Webを介してASCIIフォーマットで提出された配列表を含み、その全体が参照により本明細書に組み入れられる。2017年10月4日に作成された上記のASCIIコピーは、P109070017WO00SEQ.txtという名称で、サイズが124,207バイトである。
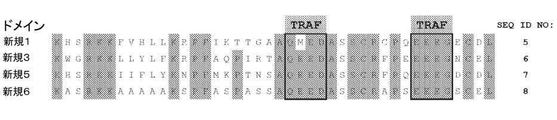
配列番号1は、新規1共刺激ドメインをコードする核酸配列を示す。
本明細書で言及される特許及び科学文献は、当業者に利用可能な知識を確立する。本明細書で引用する発行された米国特許、許可された出願、公開された外国出願、及びGenBankデータベースの配列を含む参考文献は、あたかも各々が具体的且つ個別に参照により組み入れられることが示されるのと同じ程度に参照により本明細書に組み入れられる。
本開示は、部分的には、操作された共刺激ドメインが従来の共刺激ドメインと比較して同等又は優れた活性を示すことができるという発見に基づいている。特定の例において、本明細書に開示の共刺激ドメインは、抗原誘導活性化後の細胞増殖及び/又はサイトカイン分泌に関して同等又は優れた共刺激活性を有する。いくつかの実施形態では、本明細書に開示される共刺激ドメインのうちの1つをコードする核酸配列を含む核酸分子が提供される。いくつかの実施形態では、共刺激ドメインは、例えばキメラ抗原受容体又は誘導性調節構築物等の構築物の一部として遺伝子改変細胞中で発現される。従って、本明細書に開示の新規共刺激ドメインを含む細胞及び新規共刺激ドメインを含む細胞を作成する方法が提供される。更に本明細書では、疾患の症状又は重症度を軽減するために本明細書に開示の共刺激ドメインを含む遺伝子改変細胞を投与する方法が開示される。いくつかの実施形態では、本明細書に開示の共刺激ドメインを含む遺伝子改変細胞の投与は、がん、自己免疫障害、及び本開示の遺伝子改変細胞によって標的とされ得る他の状態等の疾患の症状又は重症度を軽減する。本明細書では、本明細書に開示の遺伝子改変細胞と薬学的に許容される担体とを含む医薬組成物を対象に投与することを含む、それを必要とする対象においてがんを治療するための免疫療法の方法も開示される。
本明細書では、新規共刺激ドメインをコードする核酸分子、及び共刺激活性を有するその変異体(即ち、活性変異体)が提供される。個々のドメインの共刺激活性は、免疫細胞等の細胞の活性化、増殖、及びサイトカイン分泌を測定する当技術分野において公知の任意の方法を使用して決定することができる。そのような方法の一例は、Linsleyら、Journal of Experimental Medicine176(1992)、1595−604に開示されているものである。更なる例には、細胞増殖及びサイトカイン分泌を測定するための本明細書に記載の方法が含まれる。
本明細書では、細胞表面キメラ抗原受容体(CAR)を発現する遺伝子改変細胞が提供される。一般に、本開示のCARは少なくとも細胞外ドメインと細胞内ドメインとを含むであろう。いくつかの実施形態では、細胞外ドメインは、リガンド結合ドメイン又は部分とも呼ばれる標的特異的結合要素を含む。いくつかの実施形態では、細胞内ドメイン、又は細胞質ドメインは、本明細書に開示されているように、少なくとも1つの共刺激ドメイン又はその活性変異体、及び例えばCD3ζ等の1以上のシグナル伝達ドメインを含む。例えば、いくつかの実施形態では、本明細書に開示のCARは、配列番号5〜8に提供されるもの等、少なくとも1つの共刺激ドメインを含む細胞内ドメイン、又はその活性変異体を含む。特定の実施形態では、本明細書に開示のCARは、少なくとも2つの共刺激ドメイン(少なくとも1つの共刺激ドメインは配列番号5〜8に記載されている)又は本明細書に開示の活性断片若しくは変異体を含む。
いくつかの実施形態では、本開示は、本開示の方法で使用するための組換えAAVベクターを提供する。組換えAAVベクターは、典型的には、HEK−293等の哺乳動物細胞株において作製される。ウイルスのcap遺伝子及びrep遺伝子は、その自己複製を防止して治療遺伝子(例えばエンドヌクレアーゼ遺伝子)を送達するための空間を空けるためにベクターから除去されるため、組換えAAVベクターはパッケージング細胞株内にトランスで提供する必要がある。更に、複製を支持するのに必要な「ヘルパー」(例えばアデノウイルス)成分を提供する必要がある(Cots D、Bosch A、Chillon M(2013)Curr.Gene Ther.13(5):370−81)。多くの場合、組換えAAVベクターは、「ヘルパー」成分をコードする第1のプラスミド、cap遺伝子及びrep遺伝子を含む第2のプラスミド、並びにウイルスにパッケージングされる介在DNA配列を含有するウイルスITRを含む第3のプラスミドで細胞株をトランスフェクトするトリプルトランスフェクションを用いて作製される。次いで、キャプシドに包まれたゲノム(ITR及び目的の介在遺伝子)を含むウイルス粒子を、凍結融解サイクル、超音波処理、界面活性剤、又は当該分野で公知の他の手段によって細胞から単離する。次いで、粒子を塩化セシウム密度勾配遠心分離又はアフィニティークロマトグラフィーを使用して精製し、続いて細胞、組織、又はヒト患者等の生物に対して目的の遺伝子に送達する。従って、本明細書に記載の共刺激ドメインをコードする少なくとも1つの核酸配列、例えば配列番号5〜8、又はそれらの活性変異体を含む組換えAAVベクターの作製方法が本明細書に提供される。同様に、本明細書ではCAR、又は本明細書に記載の少なくとも1つの共刺激ドメイン、例えば配列番号5〜8、又はそれらの活性変異体を含む誘導性調節構築物をコードする組換えAAVベクターの作製方法が提供される。
本明細書では、本明細書に開示されるように少なくとも1つの新規共刺激ドメイン(例えば、配列番号5〜8)又はその活性変異体を含むように遺伝子改変された細胞が提供される。特定の実施形態では、遺伝子改変細胞は、本明細書に記載の少なくとも1つの新規共刺激ドメイン(例えば、配列番号5〜8)又はその活性変異体が組み入れられているCAR又は誘導性調節構築物をコードする核酸分子を含む。本開示の異なる変形形態では、本明細書に記載の新規共刺激ドメインをコードする核酸分子又は発現カセットは、遺伝子改変細胞のゲノム内に存在するか、あるいは細胞のゲノムに組み込まれていない。核酸分子又は発現カセットがゲノムに組み込まれていないいくつかの実施形態では、核酸分子又は発現カセットは、組換えDNA構築物中、mRNA中、ウイルスゲノム中、又は細胞のゲノムに組み込まれていない他の核酸の遺伝子改変細胞中に存在する。特定の実施形態では、遺伝子改変細胞は、本明細書に記載の共刺激ドメインをコードする核酸分子を含むことができ、更に、本明細書に開示された共刺激ドメインを含まないCARをコードするヌクレオチド配列及び/又は誘導性調節構築物をコードするヌクレオチド配列を含む本明細書に開示された少なくとも1つの発現カセットを含むことができる。
本開示は、本明細書に開示の新規共刺激ドメイン又はその活性変異体を含む遺伝子改変細胞の作製方法を提供する。特定の実施形態では、少なくとも1つの新規共刺激ドメイン(例えば、配列番号5〜8)又はその活性変異体が組み入れられているCARをコードする核酸配列分子を含むように細胞を改変する方法が提供される。他の実施形態では、少なくとも1つの新規共刺激ドメイン(例えば、配列番号5〜8)又はその活性変異体が組み入れられている誘導性調節構築物をコードする核酸分子を含むように細胞を改変する方法が提供される。本開示の異なる態様では、本明細書に開示の新規共刺激ドメイン又はその活性変異体をコードする核酸分子又は発現カセットは、細胞のゲノムに組み込まれているか、あるいは細胞のゲノムに組み込まれていない。
いくつかの実施形態では、本開示は、本開示の遺伝子改変細胞又は遺伝子改変細胞の集団と薬学的に許容される担体とを含む医薬組成物を提供する。そのような医薬組成物は既知の技術に従って調製することができる。例えば、Remington、The Science and Practice of Pharmacy(21sted.2005)を参照されたい。本開示による医薬製剤の製造において、細胞は典型的には薬学的に許容される担体と混合され、得られた組成物は対象に投与される。担体は、もちろん、製剤中の他の任意の成分と相溶性であるという意味で許容されなければならず、対象にとって有害であってはならない。いくつかの実施形態では、本開示の医薬組成物は、対象における疾患の治療に有用な1以上の追加の薬剤を更に含む。遺伝子改変細胞が遺伝子改変ヒトT細胞若しくはNK細胞(又はそれらに由来する細胞)である更なる実施形態では、本開示の医薬組成物は、インビボでの細胞増殖及び生着を促進するサイトカイン(例えば、IL−2、IL−7、IL−15、及び/又はIL−21)等の生体分子を更に含む。本開示の遺伝子改変細胞を含む医薬組成物は、追加の薬剤又は生物学的分子と同じ組成物中で投与され得るか、あるいは、別々の組成物中で同時投与され得る。
本明細書に開示される別の態様は、本開示の遺伝子改変細胞のそれを必要とする対象への投与である。特定の実施形態では、本明細書に記載の医薬組成物はそれを必要とする対象に投与される。例えば、本明細書に記載の新規共刺激ドメイン又はその活性変異体を含む有効量の細胞集団を、疾患を有する対象に投与することができる。特定の実施形態では、疾患はがん、例えばB細胞起源のがんであり得る。従って、本開示はまた、哺乳動物にCAR−T細胞を投与する工程を含む、哺乳動物中の標的細胞集団又は組織に対するT細胞媒介性免疫応答を提供する方法を提供し、ここで、CARは、所定の標的と特異的に相互作用する細胞外リガンド結合ドメイン(例えば、腫瘍抗原)、並びに少なくとも1つのシグナル伝達ドメイン(例えば、CD3ζ)と本明細書に記載の少なくとも1つの新規共刺激シグナル伝達ドメイン又はその活性変異体とを含む細胞内ドメインを含む。他の実施形態では、CARは本明細書に記載の新規共刺激ドメインを含まないが、細胞は、本明細書に記載の少なくとも1つの新規共刺激ドメインを含む誘導性調節構築物を更に含み、誘導性調節構築物の二量体化が細胞への共刺激シグナルを開始する。そのような実施形態において、方法は、インビボでのCAR−T細胞集団の細胞増殖及び拡大を促進するために、CAR−T細胞において増殖性及び/又は生存シグナルを誘導するために、誘導性調節構築物の二量体化を誘導する小分子、抗体、又は他の分子の投与を更に含む。投与されたCAR−T細胞は、レシピエントにおいて増殖を減少させるか、数を減少させるか、又は標的細胞を殺すことができる。抗体療法とは異なり、本開示の遺伝子改変細胞は、インビボで複製及び増殖することができ、その結果、疾患の持続的な制御につながり得る長期の持続性をもたらす。
本開示を以下の実施例によってさらに説明するが、実施例は限定として解釈されるべきではない。当業者は、日常的な程度の簡単な実験を用いて、本明細書に記載された特定の物質及び手順の多数の等価物を認識するか、又は確認することができるであろう。そのような等価物は、以下の実施例に続く特許請求の範囲に包含されることを意図している。
新規共刺激ドメインを有するCARの発現のためのレンチウイルスベクターの作製
本研究の目的は、抗原刺激後のCAR−T細胞拡大及びサイトカイン分泌を促進するために開発された新規共刺激ドメインを評価し特性化することであった。
ヒトT細胞における新規共刺激ドメインを含むキメラ抗原受容体の発現及び抗原誘発ストレス試験における特性化
本研究の目的は、抗原誘発ストレスにおける新規共刺激ドメインを評価することであった。手短に言えば、レンチウイルスベクターを実施例1に記載したように調製した。レンチウイルス形質導入用のドナーヒトT細胞を調製するために、T細胞をImmunoCult抗CD2/CD3/CD28多量体(StemCellTechnologies)及び20ng/mlのIL−2中で4日間刺激した。次いで細胞を収集し、個々のレンチウイルスベクターによる形質導入のために別々のウェルに入れた。T細胞あたり5個の形質導入可能単位を培養物に添加した。形質導入は、IL−2(20ng/ml)及び8μg/mlのポリブレン(Sigma)のみを添加したX−VIVO15培地(Lonza)中で実施した。培地を交換する前に、ベクターとT細胞の同時インキュベーションを一晩行った(X−Vivo15+20ng/mlIL−2+5%正常ヒト血清)。
CAR−T細胞数を経時的に測定し、図4にプロットした。CAR−T数の違いは、10日目以降に明らかになった。41BBzシグナル伝達ドメインを有するCAR−T細胞は、CD28zドメインを有するものよりも持続的な増殖を示した。この実験において、BBヌル対照は最低レベルのCAR−T拡大を示した。新規ドメインN5及びN6は高レベルの持続的増殖を示した。各サブセットは同様の速度で増殖したため、CD4(図4B)又はCD8(図4C)T細胞拡大に対する選好は観察されなかった。この増殖アッセイにおける性能の降順では、結果は、N6>N5>41BBz>N1>>BBヌル=CD28z>N3である。
第2の実験(図6)では、より頻繁な抗原遭遇及びより高い標的:エフェクター比を使用し、結果の降順に、N3>N5>CD28z>N1>N6>41BBz>BBヌルであった。この実験では、CAR−T細胞は培養期間を通して連続的に拡大した。CD4CAR−T細胞はRaji共培養中で約12日後に拡大を停止したが(図6B)、CD8CAR−T細胞は拡大を続けた(図6C)。
いくつかの新規シグナル伝達ドメインは、比較的低い(図4)又は高い(図6)抗原負荷下で41BBz及び/又はCD28zと同等又はそれ以上の性能を発揮する。N5シグナル伝達ドメインを保有するCARは、両方の条件下で41BBz及びCD28zよりも優れていた。N5は、両方の実験においてCD4コンパートメント中の41BBzと同様の性能を発揮するように見えるが、N5は、両方の実験においてCD8コンパートメント中の41BBzよりも優れている。
41BB、N1、又はN6共刺激ドメインのCARの標的挿入にAAVを使用したストレス試験
新規細胞内シグナル伝達ドメインを評価するために、CAR−T細胞を作製し、抗原遭遇に対するそれらの応答を測定した。CAR−T細胞を作製するために、StemCellTechnologiesCD3陽性選択キットを使用して、健康なヒトドナーから収集したアフェレーシス試料からT細胞を単離した。このアッセイでは、K799及びz4100と称される2つの異なるドナーを使用した。T細胞を、Immunocultanti−CD2/3/28(StemCellTech)を用いて3日間活性化及び拡大させた後、TRC1−2x87EEを用いたヌクレオフェクション(Lonza4Dnucleofector)を行った。ヌクレオフェクション直後に、異なる細胞内シグナル伝達ドメインを特徴とする抗CD19 CARをコードするAAV6ベクターを細胞に形質導入した。この実験に含まれるCAR変異体は、4−1BB、N1、又はN6共刺激ドメインを含んでいた。全てのベクターにおいて、JeTプロモータでCAR発現を促進した。各CARドナー鋳型は、TRC1−2x.87EE認識配列の上流及び下流の領域に対して相同性を有する5’及び3’相同性アームに隣接させた。CARドナー鋳型を更に5’及び3’逆方向末端反復配列に隣接させた。各CARのドナー鋳型を図7に示し、CD19−4−1BBCAR、CD19−N1 CAR、及びCD19−N6 CARをコードするAAVを生成するために使用したベクターの配列を配列番号29〜31にそれぞれ示す。
入力T細胞集団をCAR+細胞の頻度に対して正規化し、同数のCAR−T細胞をE:T、2でK19標的で攻撃した。CAR−T細胞の増殖を、ドナーK799(図8A)及びドナーz4100(図8B)から作製したT細胞について評価した。TRACを含む細胞は編集するが、CAR挿入を含まない(TRCKO)細胞は抗原遭遇に応答して増殖しなかった。対照的に、4−1BBシグナル伝達ドメインを使用して作製したCAR−T細胞は、共培養の最初の1週間は強く増殖し、12日目で収縮した。N1又はN6変異体を用いて作製したCAR−T細胞が示した増殖速度は、4−1BBによって支持される速度と実質的に異なることが見出されなかった。CD19+標的細胞の殺傷も共培養の24時間後及び72時間後に様々なE:T比で評価し、その時点で培養試料を残りのCD19+細胞の数について分析し、同数のK19細胞を含有するがCAR−T細胞を含まない対照ウェルに対して結果をプロットした。無T細胞対照よりも少ないK19の数は細胞殺傷と解釈する。ドナーK799由来の材料を使用して作製したCAR−T細胞は、24時間の時点でほとんど細胞溶解性を示さず、最少の厳しさのE:T比2:1でのみ顕著な殺傷を示した(図9、パネルA)。しかしながら、72時間までに、全てのE:T比で広範囲の殺傷が観察された。N1及びN6は4−1BBと同程度かそれ以上であった。N1は4−1BBと比較して細胞溶解活性が優れているように見えた。ドナーz4100から作製したCAR−T細胞を含有する共培養物では、24時間及び72時間の両方の時点で広範囲の殺傷が観察された(図9B)。上記のように、N1及びN6は、4−1BBと比較した場合、細胞溶解活性に関して同等又は優れていた。一般に、ドナーz4100から作製したCAR−T細胞ではより広範囲の殺傷が観察された。ドナーK799におけるCD4:CD8比はほぼ3:1であり、一方z4100における比は1:1であることに留意することが重要である。従って、(これらの実験の場合のように)固定数の全CAR−T細胞を含有する試料は、細胞傷害性CD8+T細胞のそれぞれの数が異なり、z4100はほぼ2倍の数のCD8+T細胞を含有し、このドナー由来の細胞で観察された致死活性増強を説明する。
新規共刺激シグナル伝達ドメインは、4−1BBシグナル伝達によって支持されるレベルと同等又はそれ以上の増殖及び標的細胞殺傷レベルを支持することが見出された。重要なことに、本発明者らは、ランダムに挿入されたレンチウイルスベクターによってCARが送達された他のデータに加えて、本発明者らの標的挿入戦略によって作製されたCAR−T細胞におけるN1及びN6のこの特徴をここに示す。この方法は、抗原に対するCAR−T応答の差が、異なるCAR−T調製物間の積算コピー数の差に起因し得る可能性を減らす。重要なことに、無作為挿入法及び標的挿入法の両方が、特にN6が天然の4−1BBによって提供される共刺激的支持に対する実行可能な代替法であることを示した。
共刺激ドメインとして41BB、N1、又はN6を有するCAR−T細胞における増殖アッセイ
新規共刺激ドメインを特徴とするCAR要素をレンチウイルス移入ベクターからクローニングし、pDIベクターに結合させた。CAR要素の発現はJeTプロモータによって制御し、標的遺伝子挿入を可能にするためにこの要素をTRAC相同性アームに隣接させる。AAV6粒子へのパッケージングを可能にするために、このドナー鋳型を逆方向末端反復配列に隣接させる。これらのプラスミドを最初に制限エンドヌクレアーゼ消化及びエタノール沈殿により線状化した。次いで、初回抗原刺激を受けたT細胞をTRC1−2×87EE、線状化CARプラスミド、及びSTINGsiRNAでヌクレオフェクトして、細胞内核酸センサーによって媒介される毒性を低減した。Lonza4Dヌクレオフェクターを用いて核酸送達を行った。編集したT細胞を、プールした5%ヒト血清及び30ng/mlのIL−2(Gibco)を添加したXVIVO−15培地(Lonza)中で成長させた。7日間培養を行った後、ヒトCD3陽性選択キット(StemCellTechnologies)を使用して、編集されていないCD3+細胞を磁気的に除去した。細胞を2ng/mlのIL−2中に一晩静置した後、製造元の推奨に従って2μMのセルトレースバイオレット(LifeTechnologies)で標識した。セルトレースバイオレット(CTV)は細胞内エステラーゼの基質であり、カルボキシフルオロセイン−スクシンイミジルエステル(CFSE)とよく似た働きをする。CTVは膜を越えて細胞質に拡散し、そこで生細胞の細胞質に豊富に存在するエステラーゼ酵素によって切断される。切断された生成物は細胞膜を越えて拡散せず、細胞質タンパク質に見られる遊離アミノ基と非常に強く反応し、蛍光性である。標識された細胞が分裂すると、蛍光細胞質タンパク質は娘細胞の間で均等に分裂し、各々が親世代の半分の明るさを有する2つの細胞になる。CTVの蛍光を時間的(0日目の対照等)又は生物学的対照(例えば非刺激細胞)と比較することによって、フローサイトメトリを使用してCTVの薄暗い事象の頻度を比較することによって様々な細胞集団の増殖速度を測定できる。次いで、CAR、CAR−4−1BB、CAR−N1、又はCAR−N6のいずれも発現していないT細胞のCTV標識CD3画分を、抗原を担持する腫瘍細胞で攻撃した。このアッセイのために、CD19を安定に発現するK562細胞を2つの異なるエフェクター対標的(E:T)比、2:1及び1:1で使用した。重要なことに、CAR+頻度は、ビオチン化CD19−Fc及びストレプトアビジン−PEを用いて各共培養物について決定した。T細胞の入力数をそれらのCAR+頻度に基づいて正規化した。T細胞とCD19+K562の共培養を5日間行った後、フローサイトメトリ分析を行った。CD4−PE及びCD8−APC抗体(BioLegend)を用いてT細胞を明確に同定した。FlowJoソフトウェア(TreeStar)を用いてデータを取得及び分析し、色素希釈によって増殖を評価した。
増殖アッセイからの結果を図10に示す。図10Aの重ね合わせたヒストグラムは、2つの異なるE:T比でのCAR−4−1BBCAR−T細胞の増殖及び陰性対照TRCKOT細胞の増殖の欠如を示す。わずかに半分を超えるCAR−4−1BBT細胞がCD19+標的細胞に応答して増殖したが、対照試料では13%が分裂した。図10Bの重ね合わせたヒストグラムは、CAR−N1細胞に対するCAR−4−1BB細胞の増殖速度を示す。ほぼ等しい頻度の分裂細胞が各培養物中に見られる。図10Cの重ね合わせたヒストグラムは、CAR−N6T細胞と比較したCAR−4−1BBT細胞の増殖速度を示す。N6は77%の細胞において増殖を支持し、一方4−1BBは56%の細胞において増殖を支持する。各培養物中の分裂細胞の頻度の表を以下に示す。
レンチウイルスのスクリーニングは、CAR構築物に組み入れるための代替的及び/又は優れたシグナル伝達ドメインを同定する試みにおいて、N6を主要候補として同定した。この実験は、レンチウイルス送達に典型的なランダム挿入/可変コピー数シナリオではなく、単一コピー標的挿入シナリオで機能する新規シグナル伝達ドメインの能力を実証した。これらのデータサポートは、機能的シグナル伝達変異体が設計及び送達され得ることを実証する。重要なことに、N6は、抗原との遭遇後のCD3zに関連する共刺激シグナルトランスデューサーとして4−1BBよりも優れていることが特に見出された。
播種性B細胞リンパ腫のマウス異種移植モデルにおける4−1BBとN6の共刺激ドメインを持つCART細胞の有効性
本研究の目的は、N6共刺激ドメインを含む抗CD19 CAR構築物を発現するように操作されたCART細胞の有効性を評価し、これらの細胞とCARに組み込まれた4−1BB共刺激ドメインを有するCART細胞とを比較することであった。
表3に記載のCAR構築物の有効性を評価する播種性B細胞リンパ腫のマウス異種移植モデルの結果を図12〜図14に示す。
Raji−fflucCD19+細胞を移植したマウスを、N6共刺激ドメインを有する第2世代CARを発現する抗CD19 CAR T細胞で処置すると(7205及び7206構成の両方で)、TCRKO細胞を投与したマウスと比較して、マウスの生存期間延長及び腫瘍負荷の劇的な減少がもたらされた。重要なことに、研究の40日間を通して、7205(N6)構築物は、72414−1BB含有−CARと同等の性能を発揮するように見え、7206(N6)構築物は、Raji細胞成長の持続的抑制の観点から7205(N6)構成及び7241(4−1BB)構成の両方よりも優れているように見えた。全体として、これらのデータは、N6共刺激ドメインが共刺激ドメインとして機能し、構築物のインビトロ活性を評価する実験と一致してインビボでCD19+標的を殺傷するCAR T細胞の能力を支持するというインビトロでの発見を裏付ける。更に、N6共刺激ドメインを有する構築物は、4−1BB共刺激ドメインを有するCAR T構築物の活性と一致するか又はそれを超えた。
複数の共刺激ドメインを含む第3世代CARの特性化
第3世代CARの一部として本発明に包含される新規共刺激ドメインを評価するために更なる構築物を調製し、ここで、細胞内シグナル伝達ドメインは2つの共刺激ドメインと1つのCD3−ζシグナル伝達ドメインとを含む。
いくつかの実験において、MyD88/N6CAR T細胞は、初回抗原刺激を受けたT細胞を線状化CAR鋳型プラスミド、TRC1−2x.87EEメガヌクレアーゼ、及びSTINGsiRNAでヌクレオフェクションして、細胞内核酸センサーにより媒介される毒性を低減することによって、実施例4で上述したように作製する。MyD88/N6CAR T細胞を記載のように更に成長及び拡大させる。
CAR T細胞におけるN6及びMyD88/N6共刺激ドメインの機能を比較するために、N6共刺激ドメイン又はMyD88/N6共刺激ドメインを含む新規第3世代CARを発現する線状化プラスミドDNAを、TRC1−2x.87EE部位特異的エンドヌクレアーゼ及びSTINGsiRNAと共にヒトT細胞にヌクレオフェクトした。MyD88/N6CARコード構築物を図15に示す。N6CARをコードする構築物を7206と呼び、配列番号38として提供する。MyD88/N6CARをコードする構築物を7240と呼び、配列番号40として提供する。
N6及びMyD88/N6共刺激ドメインを比較した増殖アッセイの結果を図16に示す。CAR陰性集団のバックグラウンド増殖を測定するために、TRCのみのヌクレオフェクト対照試料に由来するT細胞におけるCTV希釈物を、K19細胞又はK562細胞と共培養したウェルにおいて比較した。重要なことに、両方のT細胞サブセットは、K19(淡い陰影)及びK562細胞(濃い陰影)の存在下で同様のレベルの非特異的増殖を示し、いずれの増殖もCD19非依存性であることを示唆した(図16A及び図16B)。比較すると、N6共刺激ドメインを発現する線状化プラスミドDNAでヌクレオフェクトしたCD4+及びCD8+T細胞はどちらもK562対照と比較してK19細胞の存在下でより大きいCTV希釈を示し、実質的な抗原特異的増殖を示した(図16C及び図16D)。特に、MyD88/N6共刺激ドメインを発現するT細胞で行った同じ評価においても、K19細胞に応答してCAR T細胞のより大きい増殖を示した(図16E及び図16F)。CTVの全体的な希釈は、N6共刺激ドメイン単独を発現するCAR T細胞と比較してMyD88/N6発現T細胞では少なかったが、いずれかの共刺激ドメインの発現は、TRCのみの対照T細胞と比較してCTVのより大きな希釈をもたらした。
初回抗原刺激を受けたT細胞を、N6又は第3世代MyD88/N6共刺激ドメインのいずれかを発現する線状化プラスミドDNAでヌクレオフェクションすると、CTVの希釈によって示されるように抗原特異的に増殖できるCART細胞が得られた。更に、増殖は、CD4+及びCD8+T細胞サブセットの両方で起こり、非CAR発現対照細胞において見られるバックグラウンドよりも上で起こった。まとめると、この研究は、N6及びMyD88/N6の両方がCAR T細胞において共刺激ドメインとして機能し得ることを実証した。
誘導性構築物における新規共刺激ドメインの特性化
CD3−ζシグナル伝達ドメインを含む第1世代抗CD19 CARと同時発現される誘導性共刺激構築物の一部として本発明に包含される新規共刺激ドメインを評価するために、更なる構築物を調製した。
いくつかの実験において、iN6CAR T細胞又はiMyD88/N6CAR T細胞は、初回抗原刺激を受けたT細胞を線形化鋳型プラスミド、TRC1−2x.87EEメガヌクレアーゼ、及びSTINGsiRNAでヌクレオフェクションして、細胞内核酸センサーにより媒介される毒性を低減することによって、実施例4で上述したように作製する。iN6CAR T細胞又はiMyD88/N6CAR T細胞を記載のように更に成長及び拡大させる。
誘導性構築物中の新規共刺激ドメインの機能性を特性化するために、初回抗原刺激を受けたT細胞を、iMyD88/N6誘導性共刺激構築物を発現する線状化プラスミドDNA、又は対照としてCARの一部として発現させたN6共刺激ドメインでヌクレオフェクトした。細胞を、上記のようにTRC1−2x.87EE部位特異的エンドヌクレアーゼ及びSTINGsiRNAで更にヌクレオフェクトした。陰性対照として、TRC1−2x.87EE部位特異的エンドヌクレアーゼ及びSTINGsiRNAのみを用いて別個の試料をヌクレオフェクトした。CARドナー鋳型構築物を図17に示す。上記のように、N6 CARをコードする構築物を7206と呼び、配列番号38として提供する。iMyD88/N6共刺激ドメインをコードする構築物を7235と呼び、配列番号42として提供する。
新規誘導性共刺激構築物iMyD88/N6をN6CARと比較した増殖アッセイの結果を図18〜図20に示す。非CAR発現TRCのみのヌクレオフェクト細胞からのCD4+及びCD8+T細胞は、K19細胞(淡い陰影)又はK562細胞(濃い陰影)のいずれかと共培養した場合に、同様のレベルの非特異的増殖を示した(図18A及び図18B)。
CAR T細胞上の新規誘導性共刺激構築物iMyD88/N6の発現は、抗原依存性であるCD4+及びCD8+T細胞の両方の増殖をもたらした。驚くべきことに、培養T細胞上のCTVの希釈は、rimiducidの存在下で最大であり、CAR T細胞中で発現された場合の共刺激ドメイン構築物の誘導性の性質を示している。共刺激ドメインがCARの一部として発現される場合に、rimiducidはCAR T細胞増殖に影響を及ぼさなかったため、これらのデータは、CAR T細胞機能に対する新規スイッチ共刺激ドメインの機能性を支持する。
Claims (21)
- 配列番号8に記載のアミノ酸配列を含む共刺激ドメインをコードするヌクレオチド配列を含み、前記ヌクレオチド配列が、前記共刺激ドメインを含むキメラ抗原受容体(CAR)をコードする、核酸分子。
- 前記CARが、CD3ζ細胞内シグナルドメインを含む、請求項1に記載の核酸分子。
- 前記CARが、CD8α膜貫通ドメインを含む、請求項1又は2に記載の核酸分子。
- 前記CARが、CD19特異的抗原結合ドメインを含む、請求項1〜3のいずれか1項に記載の核酸分子。
- 前記CARが、配列番号28のアミノ酸配列を含む、請求項1〜4のいずれか1項に記載の核酸分子。
- 前記核酸分子が、mRNA、組換えDNA構築物、又はウイルスベクターのウイルスゲノムである、請求項1〜5のいずれか1項に記載の核酸分子。
- 請求項1〜5のいずれか1項に記載の前記核酸分子を含む組換えDNA構築物。
- 前記組換えDNA構築物がウイルスベクターをコードし、前記ウイルスベクターが請求項1〜5のいずれか1項に記載の前記核酸分子を含む、請求項7に記載の組換えDNA構築物。
- 前記ウイルスベクターが好ましくは組換えアデノ随伴ウイルス(AAV)ベクターである、請求項8に記載の組換えDNA構築物。
- 請求項1〜5のいずれか1項に記載の前記核酸分子を含むウイルスベクター。
- 前記ウイルスベクターが組換えAAVベクターである、請求項10に記載のウイルスベクター。
- ゲノム内に請求項1〜5のいずれか1項に記載の前記核酸分子を含む発現カセットを含む、遺伝子改変ヒトT細胞。
- ウイルスベクターを用いて、請求項1〜5のいずれか1項に記載の前記核酸分子をヒトT細胞に導入することを含む、CARを含む遺伝子改変ヒトT細胞の作製方法。
- 操作されたヌクレアーゼをコードする第2の核酸分子であって、前記操作されたヌクレアーゼが前記ヒトT細胞中で発現される、第2の核酸分子を前記ヒトT細胞に導入することを更に含み、
前記操作されたヌクレアーゼは、切断部位を生成するために前記ヒトT細胞のゲノム中の認識配列を認識して切断し、
前記CARをコードする前記核酸分子は、前記切断部位で前記ヒトT細胞のゲノムに挿入される、請求項13に記載の方法。 - 前記操作されたヌクレアーゼが、操作されたメガヌクレアーゼ、組換えジンクフィンガーヌクレアーゼ(ZFN)、組換え転写活性化剤様エフェクターヌクレアーゼ(TALEN)、CRISPR/Casヌクレアーゼ、またはmegaTALヌクレアーゼである、請求項14に記載の方法。
- 前記核酸分子は、前記核酸分子が相同組換えによって前記切断部位で前記ヒトT細胞のゲノムに挿入されるように、前記切断部位に隣接する配列に相同な配列を更に含む、請求項14又は15に記載の方法。
- 前記CARをコードする前記核酸分子が、組換えAAVベクターを用いて前記ヒトT細胞に導入される、請求項14〜16のいずれか1項に記載の方法。
- 薬学的に許容される担体と、請求項12に記載の前記遺伝子改変ヒトT細胞と、を含む医薬組成物。
- それを必要とする対象においてがんを治療するための免疫療法の方法に用いるための、請求項12に記載の遺伝子改変ヒトT細胞。
- 前記がんが癌腫、リンパ腫、肉腫、芽細胞腫、又は白血病である、請求項19に記載の遺伝子改変ヒトT細胞。
- 前記がんが、B細胞起源のがん、乳癌、胃癌、神経芽細胞腫、骨肉腫、肺癌、黒色腫、前立腺癌、結腸癌、腎細胞癌、卵巣癌、横紋筋肉腫、白血病、及びホジキンリンパ腫からなる群から選択される、請求項20に記載の遺伝子改変ヒトT細胞。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2021083808A JP7106715B2 (ja) | 2016-10-04 | 2021-05-18 | 遺伝子改変細胞で使用するための共刺激ドメイン |
| JP2022112159A JP2022160443A (ja) | 2016-10-04 | 2022-07-13 | 遺伝子改変細胞で使用するための共刺激ドメイン |
| JP2024013162A JP2024059633A (ja) | 2016-10-04 | 2024-01-31 | 遺伝子改変細胞で使用するための共刺激ドメイン |
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662403880P | 2016-10-04 | 2016-10-04 | |
| US62/403,880 | 2016-10-04 | ||
| US201762501475P | 2017-05-04 | 2017-05-04 | |
| US62/501,475 | 2017-05-04 | ||
| US201762556199P | 2017-09-08 | 2017-09-08 | |
| US62/556,199 | 2017-09-08 | ||
| PCT/US2017/055133 WO2018067697A1 (en) | 2016-10-04 | 2017-10-04 | Co-stimulatory domains for use in genetically-modified cells |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021083808A Division JP7106715B2 (ja) | 2016-10-04 | 2021-05-18 | 遺伝子改変細胞で使用するための共刺激ドメイン |
Publications (4)
| Publication Number | Publication Date |
|---|---|
| JP2019528769A JP2019528769A (ja) | 2019-10-17 |
| JP2019528769A5 JP2019528769A5 (ja) | 2020-11-12 |
| JP6887492B2 JP6887492B2 (ja) | 2021-06-16 |
| JP6887492B6 true JP6887492B6 (ja) | 2021-07-14 |
Family
ID=60382586
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019518049A Active JP6887492B6 (ja) | 2016-10-04 | 2017-10-04 | 遺伝子改変細胞で使用するための共刺激ドメイン |
| JP2021083808A Active JP7106715B2 (ja) | 2016-10-04 | 2021-05-18 | 遺伝子改変細胞で使用するための共刺激ドメイン |
| JP2022112159A Pending JP2022160443A (ja) | 2016-10-04 | 2022-07-13 | 遺伝子改変細胞で使用するための共刺激ドメイン |
| JP2024013162A Pending JP2024059633A (ja) | 2016-10-04 | 2024-01-31 | 遺伝子改変細胞で使用するための共刺激ドメイン |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021083808A Active JP7106715B2 (ja) | 2016-10-04 | 2021-05-18 | 遺伝子改変細胞で使用するための共刺激ドメイン |
| JP2022112159A Pending JP2022160443A (ja) | 2016-10-04 | 2022-07-13 | 遺伝子改変細胞で使用するための共刺激ドメイン |
| JP2024013162A Pending JP2024059633A (ja) | 2016-10-04 | 2024-01-31 | 遺伝子改変細胞で使用するための共刺激ドメイン |
Country Status (8)
| Country | Link |
|---|---|
| US (4) | US11286291B2 (ja) |
| EP (3) | EP4115951A1 (ja) |
| JP (4) | JP6887492B6 (ja) |
| AU (3) | AU2017338846B2 (ja) |
| CA (1) | CA3039014A1 (ja) |
| DK (2) | DK3757120T3 (ja) |
| ES (2) | ES2925644T3 (ja) |
| WO (1) | WO2018067697A1 (ja) |
Families Citing this family (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3331920A4 (en) | 2015-08-07 | 2019-04-03 | Seattle Children's Hospital, dba Seattle Children's Research Institute | T CARRIER CARRIER CELLS FOR BISPECIFICATION OF SOLID TUMOR TARGETING |
| WO2018067697A1 (en) * | 2016-10-04 | 2018-04-12 | Precision Biosciences, Inc. | Co-stimulatory domains for use in genetically-modified cells |
| US11590167B2 (en) | 2016-12-03 | 2023-02-28 | Juno Therapeutic, Inc. | Methods and compositions for use of therapeutic T cells in combination with kinase inhibitors |
| EP3615662A1 (en) * | 2017-04-28 | 2020-03-04 | Precision Biosciences, Inc. | Methods for reducing dna-induced cytotoxicity and enhancing gene editing in primary cells |
| CN111225675B (zh) | 2017-06-02 | 2024-05-03 | 朱诺治疗学股份有限公司 | 使用过继细胞疗法治疗的制品和方法 |
| US11434290B2 (en) * | 2017-06-08 | 2022-09-06 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | Chimeric antigen receptors with enhanced NFκB signaling |
| US10869888B2 (en) | 2018-04-17 | 2020-12-22 | Innovative Cellular Therapeutics CO., LTD. | Modified cell expansion and uses thereof |
| US20220348682A1 (en) | 2018-08-30 | 2022-11-03 | Innovative Cellular Therapeutics Holdings, Ltd. | Chimeric antigen receptor cells for treating solid tumor |
| US10918667B2 (en) | 2018-11-20 | 2021-02-16 | Innovative Cellular Therapeutics CO., LTD. | Modified cell expressing therapeutic agent and uses thereof |
| CA3135799A1 (en) | 2019-04-03 | 2020-10-08 | Precision Biosciences, Inc. | Genetically-modified immune cells comprising a microrna-adapted shrna (shrnamir) |
| CA3136265A1 (en) | 2019-04-05 | 2020-10-08 | Precision Biosciences, Inc. | Methods of preparing populations of genetically-modified immune cells |
| WO2021016608A1 (en) | 2019-07-25 | 2021-01-28 | Precision Biosciences, Inc. | Compositions and methods for sequential stacking of nucleic acid sequences into a genomic locus |
| US20220273720A1 (en) | 2019-08-20 | 2022-09-01 | Precision Biosciences, Inc. | Lymphodepletion dosing regimens for cellular immunotherapies |
| WO2021087305A1 (en) | 2019-10-30 | 2021-05-06 | Precision Biosciences, Inc. | Cd20 chimeric antigen receptors and methods of use for immunotherapy |
| WO2021113543A1 (en) | 2019-12-06 | 2021-06-10 | Precision Biosciences, Inc. | Methods for cancer immunotherapy, using lymphodepletion regimens and cd19, cd20 or bcma allogeneic car t cells |
| JP7439279B2 (ja) * | 2020-02-13 | 2024-02-27 | イミュノファーム テクノロジー カンパニー リミテッド | キメラ抗原受容体の最適化 |
| US12076343B2 (en) | 2020-02-19 | 2024-09-03 | Innovative Cellular Therapeutics Holdings, Ltd. | Engineered safety in cell therapy |
| US20230192807A1 (en) * | 2020-05-15 | 2023-06-22 | Precision Biosciences, Inc. | Methods for immunotherapy |
| US20230190780A1 (en) * | 2020-05-15 | 2023-06-22 | Precision Biosciences, Inc. | Methods for immunotherapy |
| US12043654B2 (en) | 2020-06-02 | 2024-07-23 | Innovative Cellular Therapeutics Holdings, Ltd. | Anti-GCC antibody and CAR thereof for treating digestive system cancer |
| EP4192875A1 (en) | 2020-08-10 | 2023-06-14 | Precision BioSciences, Inc. | Antibodies and fragments specific for b-cell maturation antigen and uses thereof |
| WO2022076547A1 (en) | 2020-10-07 | 2022-04-14 | Precision Biosciences, Inc. | Lipid nanoparticle compositions |
| WO2022165111A1 (en) | 2021-01-28 | 2022-08-04 | Precision Biosciences, Inc. | Modulation of tgf beta signaling in genetically-modified eukaryotic cells |
| WO2023064872A1 (en) | 2021-10-14 | 2023-04-20 | Precision Biosciences, Inc. | Combinations of anti-bcma car t cells and gamma secretase inhibitors |
| WO2023081767A1 (en) | 2021-11-05 | 2023-05-11 | Precision Biosciences, Inc. | Methods for immunotherapy |
| WO2023091910A1 (en) | 2021-11-16 | 2023-05-25 | Precision Biosciences, Inc. | Methods for cancer immunotherapy |
| WO2023108150A1 (en) | 2021-12-10 | 2023-06-15 | Precision Biosciences, Inc. | Methods for cancer immunotherapy |
| AR128124A1 (es) | 2021-12-30 | 2024-03-27 | Tr1X Inc | Células t cd4⁺ que expresan il-10 y receptores de antígenos quiméricos y usos de estos |
| WO2024148167A1 (en) | 2023-01-05 | 2024-07-11 | Precision Biosciences, Inc. | Optimized engineered meganucleases having specificity for the human t cell receptor alpha constant region gene |
Family Cites Families (55)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4873192A (en) | 1987-02-17 | 1989-10-10 | The United States Of America As Represented By The Department Of Health And Human Services | Process for site specific mutagenesis without phenotypic selection |
| US5585362A (en) | 1989-08-22 | 1996-12-17 | The Regents Of The University Of Michigan | Adenovirus vectors for gene therapy |
| US5350674A (en) | 1992-09-04 | 1994-09-27 | Becton, Dickinson And Company | Intrinsic factor - horse peroxidase conjugates and a method for increasing the stability thereof |
| US6140466A (en) | 1994-01-18 | 2000-10-31 | The Scripps Research Institute | Zinc finger protein derivatives and methods therefor |
| DE69534629D1 (de) | 1994-01-18 | 2005-12-29 | Scripps Research Inst | Derivate von zinkfingerproteinen und methoden |
| ATE407205T1 (de) | 1994-08-20 | 2008-09-15 | Gendaq Ltd | Verbesserung in bezug auf bindungsproteine bei der erkennung von dna |
| GB9824544D0 (en) | 1998-11-09 | 1999-01-06 | Medical Res Council | Screening system |
| US5789538A (en) | 1995-02-03 | 1998-08-04 | Massachusetts Institute Of Technology | Zinc finger proteins with high affinity new DNA binding specificities |
| US6013516A (en) | 1995-10-06 | 2000-01-11 | The Salk Institute For Biological Studies | Vector and method of use for nucleic acid delivery to non-dividing cells |
| US5925523A (en) | 1996-08-23 | 1999-07-20 | President & Fellows Of Harvard College | Intraction trap assay, reagents and uses thereof |
| GB9710809D0 (en) | 1997-05-23 | 1997-07-23 | Medical Res Council | Nucleic acid binding proteins |
| US5994136A (en) | 1997-12-12 | 1999-11-30 | Cell Genesys, Inc. | Method and means for producing high titer, safe, recombinant lentivirus vectors |
| US6015832A (en) | 1997-12-31 | 2000-01-18 | The Regents Of The University Of Michigan | Methods of inactivating bacteria including bacterial spores |
| US6559189B2 (en) | 1999-04-28 | 2003-05-06 | Regents Of The University Of Michigan | Non-toxic antimicrobial compositions and methods of use |
| US6506803B1 (en) | 1999-04-28 | 2003-01-14 | Regents Of The University Of Michigan | Methods of preventing and treating microbial infections |
| US7767216B2 (en) | 1999-04-28 | 2010-08-03 | The Regents Of The University Of Michigan | Antimicrobial compositions and methods of use |
| US6635676B2 (en) | 1999-04-28 | 2003-10-21 | Regents Of The University Of Michigan | Non-toxic antimicrobial compositions and methods of use |
| AU1086501A (en) | 1999-10-15 | 2001-04-30 | Carnegie Institution Of Washington | Rna interference pathway genes as tools for targeted genetic interference |
| US6326193B1 (en) | 1999-11-05 | 2001-12-04 | Cambria Biosciences, Llc | Insect control agent |
| US20020061512A1 (en) | 2000-02-18 | 2002-05-23 | Kim Jin-Soo | Zinc finger domains and methods of identifying same |
| US20030044787A1 (en) | 2000-05-16 | 2003-03-06 | Joung J. Keith | Methods and compositions for interaction trap assays |
| WO2001096584A2 (en) | 2000-06-12 | 2001-12-20 | Akkadix Corporation | Materials and methods for the control of nematodes |
| US6555674B2 (en) | 2000-08-09 | 2003-04-29 | Nsgene A/S | JeT promoter |
| GB0108491D0 (en) | 2001-04-04 | 2001-05-23 | Gendaq Ltd | Engineering zinc fingers |
| JP4968498B2 (ja) | 2002-01-23 | 2012-07-04 | ユニバーシティ オブ ユタ リサーチ ファウンデーション | ジンクフィンガーヌクレアーゼを用いる、標的化された染色体変異誘発 |
| US20030232410A1 (en) | 2002-03-21 | 2003-12-18 | Monika Liljedahl | Methods and compositions for using zinc finger endonucleases to enhance homologous recombination |
| JP2006502748A (ja) | 2002-09-05 | 2006-01-26 | カリフォルニア インスティテュート オブ テクノロジー | 遺伝子ターゲッティングを誘発するキメラヌクレアーゼの使用方法 |
| US8409861B2 (en) | 2003-08-08 | 2013-04-02 | Sangamo Biosciences, Inc. | Targeted deletion of cellular DNA sequences |
| US7888121B2 (en) | 2003-08-08 | 2011-02-15 | Sangamo Biosciences, Inc. | Methods and compositions for targeted cleavage and recombination |
| US20130266551A1 (en) | 2003-11-05 | 2013-10-10 | St. Jude Children's Research Hospital, Inc. | Chimeric receptors with 4-1bb stimulatory signaling domain |
| US7435596B2 (en) | 2004-11-04 | 2008-10-14 | St. Jude Children's Research Hospital, Inc. | Modified cell line and method for expansion of NK cell |
| CA2615532C (en) | 2005-07-26 | 2016-06-28 | Sangamo Biosciences, Inc. | Targeted integration and expression of exogenous nucleic acid sequences |
| DK2650365T3 (en) | 2005-10-18 | 2016-12-05 | Prec Biosciences | RATIONAL MEGANUCLEASES constructed with altered sequence specificity and DNA binding affinity |
| EP2215223B1 (en) | 2007-10-31 | 2013-05-01 | Precision Biosciences, Inc. | Rationally-designed single-chain meganucleases with non-palindromic recognition sequences |
| EP2206723A1 (en) | 2009-01-12 | 2010-07-14 | Bonas, Ulla | Modular DNA-binding domains |
| EP2483301A1 (en) * | 2009-10-01 | 2012-08-08 | The United States Of America, As Represented By The Secretary, Department of Health and Human Services | Anti-vascular endothelial growth factor receptor-2 chimeric antigen receptors and use of same for the treatment of cancer |
| JP2013513389A (ja) | 2009-12-10 | 2013-04-22 | リージェンツ オブ ザ ユニバーシティ オブ ミネソタ | Talエフェクターに媒介されるdna修飾 |
| WO2012138939A1 (en) | 2011-04-05 | 2012-10-11 | Philippe Duchateau | New tale-protein scaffolds and uses thereof |
| US9272002B2 (en) * | 2011-10-28 | 2016-03-01 | The Trustees Of The University Of Pennsylvania | Fully human, anti-mesothelin specific chimeric immune receptor for redirected mesothelin-expressing cell targeting |
| US8697359B1 (en) | 2012-12-12 | 2014-04-15 | The Broad Institute, Inc. | CRISPR-Cas systems and methods for altering expression of gene products |
| CN105142677B (zh) * | 2013-02-15 | 2019-08-30 | 加利福尼亚大学董事会 | 嵌合抗原受体及其使用方法 |
| CA2937750A1 (en) | 2014-02-14 | 2015-08-20 | Bellicum Pharmaceuticals, Inc. | Methods for activating t cells using an inducible chimeric polypeptide |
| WO2015193406A1 (en) | 2014-06-17 | 2015-12-23 | Cellectis | Cd123 specific multi-chain chimeric antigen receptor |
| US10568947B2 (en) * | 2014-07-21 | 2020-02-25 | Novartis Ag | Treatment of cancer using a CLL-1 chimeric antigen receptor |
| BR112017001818A2 (pt) * | 2014-07-29 | 2017-11-21 | Pfizer | receptores antigênicos quiméricos específicos para egfrviii para imunoterapia de câncer |
| CA2959168A1 (en) | 2014-09-02 | 2016-03-10 | Bellicum Pharmaceuticals, Inc. | Costimulation of chimeric antigen receptors by myd88 and cd40 polypeptides |
| WO2016055551A1 (en) | 2014-10-07 | 2016-04-14 | Cellectis | Method for modulating car-induced immune cells activity |
| EP3227323B1 (en) * | 2014-12-03 | 2020-08-05 | Juno Therapeutics, Inc. | Methods and compositions for adoptive cell therapy |
| IL252295B2 (en) | 2014-12-19 | 2023-10-01 | Dana Farber Cancer Inst Inc | Chimeric antigen receptors and methods of using them |
| DK3250606T3 (da) * | 2015-01-26 | 2021-01-04 | Cellectis | ANTI-CLL1-specifikke enkeltkædede kimære antigenreceptorer (SCCARS) til cancerimmunterapi |
| US9790490B2 (en) | 2015-06-18 | 2017-10-17 | The Broad Institute Inc. | CRISPR enzymes and systems |
| WO2018067697A1 (en) * | 2016-10-04 | 2018-04-12 | Precision Biosciences, Inc. | Co-stimulatory domains for use in genetically-modified cells |
| CA3135799A1 (en) * | 2019-04-03 | 2020-10-08 | Precision Biosciences, Inc. | Genetically-modified immune cells comprising a microrna-adapted shrna (shrnamir) |
| WO2021087305A1 (en) * | 2019-10-30 | 2021-05-06 | Precision Biosciences, Inc. | Cd20 chimeric antigen receptors and methods of use for immunotherapy |
| WO2021113543A1 (en) * | 2019-12-06 | 2021-06-10 | Precision Biosciences, Inc. | Methods for cancer immunotherapy, using lymphodepletion regimens and cd19, cd20 or bcma allogeneic car t cells |
-
2017
- 2017-10-04 WO PCT/US2017/055133 patent/WO2018067697A1/en unknown
- 2017-10-04 ES ES20176441T patent/ES2925644T3/es active Active
- 2017-10-04 AU AU2017338846A patent/AU2017338846B2/en active Active
- 2017-10-04 US US16/339,699 patent/US11286291B2/en active Active
- 2017-10-04 JP JP2019518049A patent/JP6887492B6/ja active Active
- 2017-10-04 ES ES17800638T patent/ES2811500T3/es active Active
- 2017-10-04 DK DK20176441.2T patent/DK3757120T3/da active
- 2017-10-04 CA CA3039014A patent/CA3039014A1/en active Pending
- 2017-10-04 EP EP22172338.0A patent/EP4115951A1/en active Pending
- 2017-10-04 EP EP17800638.3A patent/EP3523326B1/en active Active
- 2017-10-04 DK DK17800638.3T patent/DK3523326T3/da active
- 2017-10-04 EP EP20176441.2A patent/EP3757120B8/en active Active
-
2019
- 2019-10-11 US US16/600,074 patent/US10800833B2/en active Active
-
2020
- 2020-09-09 US US17/016,016 patent/US20200399346A1/en not_active Abandoned
- 2020-12-11 AU AU2020286323A patent/AU2020286323B2/en active Active
-
2021
- 2021-05-18 JP JP2021083808A patent/JP7106715B2/ja active Active
-
2022
- 2022-07-13 JP JP2022112159A patent/JP2022160443A/ja active Pending
-
2023
- 2023-05-10 AU AU2023202905A patent/AU2023202905A1/en active Pending
- 2023-08-21 US US18/453,022 patent/US20240018215A1/en active Pending
-
2024
- 2024-01-31 JP JP2024013162A patent/JP2024059633A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| JP2021151235A (ja) | 2021-09-30 |
| JP2024059633A (ja) | 2024-05-01 |
| DK3757120T3 (da) | 2022-07-25 |
| EP3523326A1 (en) | 2019-08-14 |
| EP3757120A1 (en) | 2020-12-30 |
| EP3523326B1 (en) | 2020-06-03 |
| US20190233500A1 (en) | 2019-08-01 |
| EP4115951A1 (en) | 2023-01-11 |
| JP6887492B2 (ja) | 2021-06-16 |
| AU2017338846B2 (en) | 2020-09-24 |
| EP3757120B1 (en) | 2022-05-11 |
| US20200399346A1 (en) | 2020-12-24 |
| ES2925644T3 (es) | 2022-10-19 |
| CA3039014A1 (en) | 2018-04-12 |
| ES2811500T3 (es) | 2021-03-12 |
| WO2018067697A1 (en) | 2018-04-12 |
| US11286291B2 (en) | 2022-03-29 |
| AU2020286323A1 (en) | 2021-01-21 |
| US20200031904A1 (en) | 2020-01-30 |
| AU2023202905A1 (en) | 2023-07-27 |
| JP7106715B2 (ja) | 2022-07-26 |
| US10800833B2 (en) | 2020-10-13 |
| EP3757120B8 (en) | 2022-06-15 |
| JP2022160443A (ja) | 2022-10-19 |
| AU2020286323B2 (en) | 2023-02-16 |
| JP2019528769A (ja) | 2019-10-17 |
| AU2017338846A1 (en) | 2019-04-18 |
| US20240018215A1 (en) | 2024-01-18 |
| DK3523326T3 (da) | 2020-08-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6887492B6 (ja) | 遺伝子改変細胞で使用するための共刺激ドメイン | |
| JP7170666B2 (ja) | 操作された抗原受容体をコードする核酸分子及び阻害性核酸分子、並びにそれらの使用方法 | |
| US20230174621A1 (en) | Modified epidermal growth factor receptor peptides for use in genetically-modified cells | |
| US11053484B2 (en) | Genetically-modified T cells comprising a modified intron in the T cell receptor alpha gene | |
| JP7304888B2 (ja) | ヒトt細胞受容体アルファ定常領域遺伝子に特異性を有する最適化された操作されたヌクレアーゼ |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201002 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20201002 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20201002 |
|
| A975 | Report on accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A971005 Effective date: 20201027 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201030 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20201030 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20201201 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210222 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210420 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210518 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6887492 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R154 | Certificate of patent or utility model (reissue) |
Free format text: JAPANESE INTERMEDIATE CODE: R154 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |