JP6532452B2 - ポリ−n−アセチルグルコサミンナノファイバーを有する疾患の処置 - Google Patents
ポリ−n−アセチルグルコサミンナノファイバーを有する疾患の処置 Download PDFInfo
- Publication number
- JP6532452B2 JP6532452B2 JP2016501898A JP2016501898A JP6532452B2 JP 6532452 B2 JP6532452 B2 JP 6532452B2 JP 2016501898 A JP2016501898 A JP 2016501898A JP 2016501898 A JP2016501898 A JP 2016501898A JP 6532452 B2 JP6532452 B2 JP 6532452B2
- Authority
- JP
- Japan
- Prior art keywords
- snag nanofibers
- snag
- composition
- tissue
- subject
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/715—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N25/00—Biocides, pest repellants or attractants, or plant growth regulators, characterised by their forms, or by their non-active ingredients or by their methods of application, e.g. seed treatment or sequential application; Substances for reducing the noxious effect of the active ingredients to organisms other than pests
- A01N25/34—Shaped forms, e.g. sheets, not provided for in any other sub-group of this main group
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/02—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one or more oxygen or sulfur atoms as the only ring hetero atoms
- A01N43/04—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one or more oxygen or sulfur atoms as the only ring hetero atoms with one hetero atom
- A01N43/14—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one or more oxygen or sulfur atoms as the only ring hetero atoms with one hetero atom six-membered rings
- A01N43/16—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one or more oxygen or sulfur atoms as the only ring hetero atoms with one hetero atom six-membered rings with oxygen as the ring hetero atom
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N59/00—Biocides, pest repellants or attractants, or plant growth regulators containing elements or inorganic compounds
- A01N59/16—Heavy metals; Compounds thereof
- A01N59/20—Copper
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/715—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
- A61K31/726—Glycosaminoglycans, i.e. mucopolysaccharides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/02—Cosmetics or similar toiletry preparations characterised by special physical form
- A61K8/0241—Containing particulates characterized by their shape and/or structure
- A61K8/027—Fibers; Fibrils
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/18—Cosmetics or similar toiletry preparations characterised by the composition
- A61K8/72—Cosmetics or similar toiletry preparations characterised by the composition containing organic macromolecular compounds
- A61K8/73—Polysaccharides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0014—Skin, i.e. galenical aspects of topical compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0087—Galenical forms not covered by A61K9/02 - A61K9/7023
- A61K9/0092—Hollow drug-filled fibres, tubes of the core-shell type, coated fibres, coated rods, microtubules or nanotubes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L26/00—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form
- A61L26/0009—Chemical aspects of, or use of materials for, wound dressings or bandages in liquid, gel or powder form containing macromolecular materials
- A61L26/0023—Polysaccharides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/14—Macromolecular materials
- A61L27/20—Polysaccharides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/04—Macromolecular materials
- A61L31/042—Polysaccharides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q19/00—Preparations for care of the skin
- A61Q19/08—Anti-ageing preparations
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L5/00—Compositions of polysaccharides or of their derivatives not provided for in groups C08L1/00 or C08L3/00
- C08L5/08—Chitin; Chondroitin sulfate; Hyaluronic acid; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2800/00—Properties of cosmetic compositions or active ingredients thereof or formulation aids used therein and process related aspects
- A61K2800/40—Chemical, physico-chemical or functional or structural properties of particular ingredients
- A61K2800/41—Particular ingredients further characterized by their size
- A61K2800/412—Microsized, i.e. having sizes between 0.1 and 100 microns
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2800/00—Properties of cosmetic compositions or active ingredients thereof or formulation aids used therein and process related aspects
- A61K2800/40—Chemical, physico-chemical or functional or structural properties of particular ingredients
- A61K2800/41—Particular ingredients further characterized by their size
- A61K2800/413—Nanosized, i.e. having sizes below 100 nm
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2800/00—Properties of cosmetic compositions or active ingredients thereof or formulation aids used therein and process related aspects
- A61K2800/80—Process related aspects concerning the preparation of the cosmetic composition or the storage or application thereof
- A61K2800/91—Injection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/412—Tissue-regenerating or healing or proliferative agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2400/00—Materials characterised by their function or physical properties
- A61L2400/06—Flowable or injectable implant compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2400/00—Materials characterised by their function or physical properties
- A61L2400/12—Nanosized materials, e.g. nanofibres, nanoparticles, nanowires, nanotubes; Nanostructured surfaces
Description
組織の引っ張り強さの低下、組織の伸縮性の低下、組織におけるコラーゲン含有量もしくは異常コラーゲン含有量の増加、組織におけるコラーゲンの異常なもしくはまとまりのない整列、および/または組織における筋線維芽細胞の増加に関連する種々の疾患を処置する方法が、本明細書中に提供される。さらに、組織におけるI型コラーゲン含有量(例えば発現)の増加、組織におけるIII型コラーゲン含有量(例えば発現)の低下、組織におけるエラスチン含有量(例えば発現)の低下、または組織におけるα平滑筋アクチン含有量の増加に関連する種々の疾患の処置の方法が、本明細書中に提供される。
1.ヒト被験体におけるエーラー・ダンロス症候群の症状を処置するための方法であって、sNAGナノファイバーを含有する組成物を、上記ヒト被験体に局所的に投与する工程を包含し、上記sNAGナノファイバーの50%よりも多くが約1〜15μmの間の長さである、方法。
2.上記症状が皮膚に関連する症状である、1に記載の方法。
3.上記皮膚に関連する症状が、柔らかい皮膚、もろい皮膚、容易に傷つく皮膚、過剰に瘢痕化する皮膚、または皮膚における鈍い創傷治癒である、1に記載の方法。
4.上記sNAGナノファイバーが、上記皮膚に関連する症状によって冒される皮膚に直接的に投与される、2または3に記載の方法。
5.ヒト被験体における強皮症の症状を処置するための方法であって、sNAGナノファイバーを含有する組成物を、上記ヒト被験体に局所的に投与する工程を包含し、上記sNAGナノファイバーの50%よりも多くが約1〜15μmの間の長さである、方法。
6.上記症状が皮膚に関連する症状である、5に記載の方法。
7.上記皮膚に関連する症状が、腫れた皮膚、肥厚した皮膚、てかてかした皮膚、皮膚の変色または皮膚のしびれである、6に記載の方法。
8.上記sNAGナノファイバーが、上記皮膚に関連する症状によって冒される皮膚に直接的に投与される、6または7に記載の方法。
9.ヒト被験体における表皮水疱症の症状を処置するための方法であって、sNAGナノファイバーを含有する組成物を、ヒト被験体に局所的に投与する工程を包含し、上記sNAGナノファイバーの50%よりも多くが約1〜15μmの間の長さである、方法。
10.上記症状が皮膚に関連する症状または粘膜に関連する症状である、9に記載の方法。
11.上記皮膚に関連する症状または粘膜に関連する症状が、水疱である、10に記載の方法。
12.上記sNAGナノファイバーが、上記皮膚に関連する症状または粘膜に関連する症状によって冒される皮膚に直接的に投与される、10または11に記載の方法。
13.ヒト被験体の皮膚表面におけるシワまたは窪みを処置または予防するための方法であって、sNAGナノファイバーを含有する組成物を、上記ヒト被験体に局所的に投与する工程を包含し、上記sNAGナノファイバーの50%よりも多くが約1〜15μmの間の長さである、方法。
14.ヒト被験体の皮膚表面におけるシワまたは窪みを処置するための方法であって、sNAGナノファイバーを含有する組成物を、シワまたは窪みを有するヒト被験体に局所的に投与する工程を包含し、上記sNAGナノファイバーの50%よりも多くが約1〜15μmの間の長さである、方法。
15.ヒト被験体における皮膚の外傷に関連する瘢痕を低減ための方法であって、sNAGナノファイバーを含有する組成物を、上記ヒト被験体における皮膚の外傷に局所的に投与する工程を包含し、上記sNAGナノファイバーの50%よりも多くが約1〜15μmの間の長さである、方法。
16.上記被験体が、皮膚の外傷に由来する瘢痕を有し、上記sNAGナノファイバーが、上記瘢痕の領域へ局所的に投与される、15に記載の方法。
17.上記sNAGナノファイバーが21日間にわたって局所的に投与される、15または16に記載の方法。
18.ヒト被験体における骨粗鬆症を処置するための方法であって、sNAGナノファイバーを含有する組成物を、上記ヒト被験体に局所的に投与する工程を包含し、上記sNAGナノファイバーの50%よりも多くが約1〜15μmの間の長さである、方法。
19.上記sNAGナノファイバーが、上記ヒト被験体における骨密度の低い領域に投与される、18に記載の方法。
20.ヒト被験体における椎間板の障害または椎間板の変性を処置するための方法であって、sNAGナノファイバーを含有する組成物を、上記ヒト被験体に局所的に投与する工程を包含し、上記sNAGナノファイバーの50%よりも多くが約1〜15μmの間の長さである、方法。
21.上記sNAGナノファイバーが、上記ヒト被験体における腰痛の領域の上記椎間板に投与される、20に記載の方法。
22.上記sNAGナノファイバーが、局所注射によって局所的に投与される、18〜21のいずれか1つに記載の方法。
23.ヒト被験体における変形性関節症を処置するための方法であって、sNAGナノファイバーを含有する組成物を、上記ヒト被験体に局所的に投与する工程を包含し、上記sNAGナノファイバーの50%よりも多くが約1〜15μmの間の長さである、方法。
24.上記sNAGナノファイバーが、上記ヒト被験体の関節に局所的に投与される、23に記載の方法。
25.上記被験体は、総コラーゲン含有量の増加、I型コラーゲンの発現の増加、III型コラーゲンの発現の低下、エラスチンの発現の低下、および/または平滑筋アクチンの発現の増加を有している、1〜24のいずれか1つに記載の方法。
26.上記被験体は、皮膚の引っ張り強さの低下、および/または皮膚の伸縮性の低下を有している、1〜25のいずれか1つに記載の方法。
27.上記sNAGナノファイバーは、筋肉内への移植試験にて試験された場合に反応性でない、1〜26のいずれか1つに記載の方法。
28.上記sNAGナノファイバーは、MTTアッセイにおいて、血清を枯渇させたヒト臍帯静脈内皮細胞の代謝速度を増加させる、および/または、トリパンブルー排除試験において、血清を枯渇させたヒト臍帯静脈内皮細胞のアポトーシスを救助しない、1〜27のいずれか1つに記載の方法。
29.上記sNAGナノファイバーの50%よりも多くが、約2〜10μmの間の長さである、1〜28のいずれか1つに記載の方法。
30.上記sNAGナノファイバーの50%よりも多くが、約4〜7μmの間の長さである、1〜28のいずれか1つに記載の方法。
31.上記sNAGナノファイバーの100%が約1〜15μmの間の長さである、1〜28のいずれか1つに記載の方法。
32.上記sNAGナノファイバーが、ポリ−N−アセチルグルコサミンおよび/またはその誘導体のγ線照射によって生成され、ポリ−β−N−アセチルグルコサミンおよび/またはその誘導体は、乾燥した繊維の形態にて500〜2000kgyで照射されるか、あるいは、上記ポリ−N−アセチルグルコサミンは、湿った繊維の形態にて100〜500kgyで照射される、1〜31のいずれか1つに記載の方法。
33.上記sNAGナノファイバーは、微細藻類のポリ−N−アセチルグルコサミンから生成された、1〜32のいずれか1つに記載の方法。
34.上記sNAGナノファイバーは、N−アセチルグルコサミン単糖類および/またはグルコサミン単糖類を含み、上記sNAGナノファイバーの上記単糖類の70%よりも多くが、N−アセチルグルコサミン単糖類である、1〜33のいずれか1つに記載の方法。
35.上記sNAGナノファイバーは、N−アセチルグルコサミン単糖類および/またはグルコサミン単糖類を含み、上記sNAGナノファイバーの上記単糖類の90%よりも多くが、N−アセチルグルコサミン単糖類である、1〜34のいずれか1つに記載の方法。
36.上記sNAGナノファイバーは、N−アセチルグルコサミン単糖類および/またはグルコサミン単糖類を含み、上記sNAGナノファイバーの上記単糖類の95%よりも多くが、N−アセチルグルコサミン単糖類である、1〜35のいずれか1つに記載の方法。
1.ヒト被験体の皮膚表面におけるシワまたは窪みを処置または予防するための方法であって、sNAGナノファイバーを含有する組成物を、上記ヒト被験体に投与する工程を包含し、上記sNAGナノファイバーの50%よりも多くが約1〜15μmの間の長さである、方法。
2.前記皮膚表面におけるシワまたは窪みを処置する方法であり、前記ヒト被験体は上記皮膚表面上の領域にシワまたは窪みを有し、前記組成物が該領域に投与される、1に記載の方法。
3.前記組成物が局所的に投与される、1または2に記載の方法。
4.前記組成物が、前記皮膚表面の下の領域へ局所注射によって投与され、上記局所注射が、皮内注射、皮下注射または筋肉内注射である、2に記載の方法。
5.ヒト被験体において組織を再生するかまたは組織にボリュームを加えるための方法であって、sNAGナノファイバーを含有する組成物を、上記ヒト被験体における上記組織に投与する工程を包含し、上記sNAGナノファイバーの50%よりも多くが約1〜15μmの間の長さである、方法。
6.前記投与する工程が、前記組織への局所注射によって行われ、上記局所注射が、皮内注射、皮下注射または筋肉内注射である、5に記載の方法。
7.ヒト被験体における創傷に関連する瘢痕を低減するか、線維化を低減するか、または癒着を低減するための方法であって、sNAGナノファイバーを含有する組成物を、上記ヒト被験体における上記創傷に局所的に投与する工程を包含し、上記sNAGナノファイバーの50%よりも多くが約1〜15μmの間の長さである、方法。
8.前記被験体が、創傷に由来する瘢痕、線維化または癒着を有し、前記sNAGナノファイバーが、上記瘢痕、線維化または癒着の領域へ局所的に投与される、7に記載の方法。
9.前記創傷が皮膚の外傷であるかまたは手術創である、7または8に記載の方法。
10.前記sNAGナノファイバーが21日間にわたって局所的に投与される、7〜9のいずれか1つに記載の方法。
11.瘢痕を低減させるための、7〜10のいずれか1つに記載の方法。
12.ヒト被験体における疾患の症状を処置するための方法であって、
上記疾患は、エーラー・ダンロス症候群、強皮症、表皮水疱症、骨粗鬆症、椎間板障害(intravertebral disc disorder)、椎間板変性、または変形性関節症であり、sNAGナノファイバーを含有する組成物を、上記ヒト被験体に局所的に投与する工程を包含し、上記sNAGナノファイバーの50%よりも多くが約1〜15μmの間の長さである、方法。
13.前記疾患が、エーラー・ダンロス症候群、強皮症、または表皮水疱症であり、前記症状が皮膚に関連する症状である、12に記載の方法。
14.前記疾患がエーラー・ダンロス症候群であり、前記皮膚に関連する症状が、柔らかい皮膚、もろい皮膚、容易に傷つく皮膚、過剰に瘢痕化する皮膚、または皮膚における鈍い創傷治癒である、13に記載の方法。
15.前記疾患が強皮症であり、前記皮膚に関連する症状が、腫れた皮膚、肥厚した皮膚、てかてかした皮膚、皮膚の変色または皮膚のしびれである、13に記載の方法。
16.前記疾患が表皮水疱症であり、前記症状が粘膜に関連する症状、必要に応じて水疱である、12に記載の方法。
17.前記sNAGナノファイバーが前記症状に冒される領域に直接的に投与される、12〜16のいずれか1つに記載の方法。
18.前記疾患が骨粗鬆症であり、前記sNAGナノファイバーが、前記ヒト被験体における骨密度の低い領域に投与される、12に記載の方法。
19.前記疾患が、椎間板の障害または椎間板の変性であり、前記sNAGナノファイバーが、前記ヒト被験体における腰痛の領域の上記椎間板に投与される、12に記載の方法。
20.前記sNAGナノファイバーが局所注射によって投与される、18または19に記載の方法。
21.前記疾患が変形性関節症であり、前記sNAGナノファイバーが、前記ヒト被験体の関節に局所的に投与される、12に記載の方法。
22.前記被験体は、総コラーゲン含有量の増加、I型コラーゲンの発現の増加、III型コラーゲンの発現の低下、エラスチンの発現の低下、平滑筋アクチンの発現の増加、皮膚の引っ張り強さの低下、および/または皮膚の伸縮性の低下を有している、1〜21のいずれか1つに記載の方法。
23.前記sNAGナノファイバーは、筋肉内への移植試験にて試験された場合に反応性でない、1〜22のいずれか1つに記載の方法。
24.前記sNAGナノファイバーは、MTTアッセイにおいて、血清を枯渇させたヒト臍帯静脈内皮細胞の代謝速度を増加させる、および/または、トリパンブルー排除試験において、血清を枯渇させたヒト臍帯静脈内皮細胞のアポトーシスを救助しない、1〜23のいずれか1つに記載の方法。
25.前記sNAGナノファイバーの50%よりも多くが、約2〜10μmの間の長さであるか、または約4〜7μmの間の長さであるか、あるいは上記sNAGナノファイバーの100%が約1〜15μmの間の長さである、1〜24のいずれか1つに記載の方法。
26.前記sNAGナノファイバーが、ポリ−N−アセチルグルコサミンおよび/またはその誘導体のγ線照射によって生成され、ポリ−β−N−アセチルグルコサミンおよび/またはその誘導体は、乾燥した繊維の形態にて500〜2000kgyで照射されるか、あるいは、上記ポリ−N−アセチルグルコサミンは、湿った繊維の形態にて100〜500kgyで照射される、1〜25のいずれか1つに記載の方法。
27.前記sNAGナノファイバーは、微細藻類のポリ−N−アセチルグルコサミンから生成された、1〜26のいずれか1つに記載の方法。
28.前記sNAGナノファイバーは、N−アセチルグルコサミン単糖類および/またはグルコサミン単糖類を含み、上記sNAGナノファイバーの上記単糖類の70%よりも多く、90%よりも多く、または95%よりも多くが、N−アセチルグルコサミン単糖類である、1〜27のいずれか1つに記載の方法。
本明細書中で使用される場合、用語「sNAGナノファイバー」、「sNAG」、「タリデルム(Taliderm)」または「タリム(Talymed)」(以前は「タリデルム」として知られた)は、ポリ−N−アセチルグルコサミンおよび/またはその誘導体の短縮化された繊維に関して、交換可能に使用される。好ましい実施形態において、sNAGナノファイバーは、ポリ−N−アセチルグルコサミンおよび/またはその誘導体の短縮化された繊維の全体からなる。タリデルムまたはタリムは、ポリ−N−アセチルグルコサミンおよび/またはその誘導体の短縮化されたファイバーの全体からなる膜である、sNAGナノファイバーの例である。
図1:sNAGナノファイバーは、組織の抗張力(相対的応力)および弾性を向上させる。損傷を与えた後21日目における、処置済みおよび未処置の創傷の両方、および損傷を与えていないコントロールの皮膚を回収し、Instron5942歪みゲージ伸長計およびBluehill 3試験ソフトウェアを用いた抗張力および弾性試験に供した。皮膚の抗張力を、皮膚が20%破壊される前に耐え得る相対的応力を測定することによって決定し、弾性を、mm伸長によって測定した。(A)は抗張力測定結果であり、(B)は弾性測定結果である。
本発明の発明者らは、sNAGナノファイバーが、組織における抗張力の向上、組織における弾性の向上、組織における総コラーゲン含量または異常なコラーゲンの含量の減少、組織におけるI型コラーゲン発現の減少、組織におけるIII型コラーゲン発現の増加、組織におけるコラーゲンの整列の誘導、組織におけるエラスチン生成の増加、組織における平滑筋アクチン発現の減少、および/または組織における筋線維芽細胞含量の減少、を可能にすることを見出した。特に、以下の項目6に挙げた実施例において実証しているように、本発明の発明者らは、sNAGナノファイバーが、皮膚の創傷治癒中の、抗張力の向上、弾性の向上、エラスチン生成の増加、総コラーゲン含量の減少、I型コラーゲン発現の減少、III型コラーゲン発現の増加、コラーゲンの整列の誘導、およびアルファ平滑筋アクチンの減少、を可能にすることを見出した。
sNAGナノファイバー組成物をここに記載する。sNAGナノファイバーは、ポリ−N−アセチルグルコサミンおよび/またはその誘導体のファイバーを含んでおり、例えば、走査型電子顕微鏡(「SEM」)のような、当業者に公知のいずれかの方法によって測定した長さは概ね30μmよりも短く、少なくとも1μmである。このようなsNAGナノファイバーは、例えば、本明細書に記載したように得ることができる。
米国特許番号5,622,834、5,623,064、5,624,679、5,686,115、5,858,350、6,599,720、6,686,342、7,115,588、および米国特許公開番号2009/0117175(各々の全体が参考として本明細書中に援用される。)は、ポリ−N−アセチルグルコサミンおよびその誘導体、並びに、これらの生成方法について記載されている。いくつかの実施形態において、ポリ−N−アセチルグルコサミンは、β−1→4配置を有する。他の実施形態において、ポリ−N−アセチルグルコサミンは、α−1→4配置を有する。ポリ−N−アセチルグルコサミンおよびその誘導体は、ポリマー形態またはファイバー形態であり得る。
ポリ−N−アセチルグルコサミンポリマーまたはポリ−N−アセチルグルコサミンファイバー、および、上記のいずれかのポリ−N−アセチルグルコサミンポリマー誘導体またはポリ−N−アセチルグルコサミンファイバー誘導体は、乾燥ポリマーもしくは乾燥ファイバー、または、ポリマー膜もしくはファイバー膜として、放射線照射され得る。あるいは、ポリ−N−アセチルグルコサミンポリマーまたはポリ−N−アセチルグルコサミンファイバー、および、上記のいずれかのポリ−N−アセチルグルコサミンポリマー誘導体またはポリ−N−アセチルグルコサミンファイバー誘導体は、湿った状態で放射線照射され得る。放射線照射によってsNAGナノファイバーを生成する方法、および、そのように生成されたsNAGナノファイバーは、米国特許公開番号2009/0117175に記載されており、その全体が参考として本明細書中に援用される。
sNAGナノファイバーは、本明細書中に記載されるように、任意の投与経路(例えば、局所(topical)、経口、筋肉内、静脈内、直腸、皮下、全身、または局所(local))を経る種々の組成物に処方されてもよい。
特定の実施形態において、疾患、障害または症状を有する症候群を妨げるおよび/または処置するために、sNAGナノファイバーまたはその組成物が使用され得る。これらは、引っ張り強さおよび伸縮性の増加、コラーゲンの減少、コラーゲンの組織化、および/または平滑筋アクチン発現の減少、または筋線維芽細胞の含有量の減少に優れている。これらの疾患は、組織の引っ張り強さの低下、組織の伸縮性の低下、組織におけるエラスチン含有量の低下、組織における総コラーゲン含有量もしくは異常コラーゲン含有量の増加、組織におけるI型コラーゲン含有量の増加、組織におけるIII型コラーゲン含有量の低下、組織におけるコラーゲンの異常な整列、組織におけるα平滑筋アクチン含有量の増加、および/または、組織における筋線維芽細胞の増加を含む症状に関連するか、あるいはこのような症状を有する。
本発明者らは、驚くべきことに、sNAGナノファイバーが組織の引っ張り強さおよび伸縮性を増加し得ることを見出した。よって、本明細書中に記載されるsNAGナノファイバーは、組織の引っ張り強さの低下または組織伸縮性の低下に関連する疾患および/または症状を処置および/または予防するために使用され得る。
本発明者らはまた、sNAGナノファイバーがコラーゲンレベルを低減し得ることを見出した。よって、本明細書中に記載されるsNAGナノファイバーは、コラーゲン形成の増加に関連する症状を有する疾患および/または症候群を処置および/または予防するために使用され得る。
本発明者らはさらに、sNAGナノファイバーがコラーゲンファイバーの組織化および/または配向を増加し得ることを見出した。したがって、本明細書中に記載されるsNAGナノファイバーは、コラーゲンファイバーの不完全な組織化に関連する症状を有する疾患および/または症候群を処置または予防するために使用され得る。
本発明者らはまた、sNAGナノファイバーが、平滑筋アクチンの発現を低減し得る、および/または筋線維芽細胞の含有量を低減し得る、ということを見出した。したがって、本明細書中に記載されるsNAGナノファイバーは、平滑筋アクチン発現の増加または筋線維芽細胞含有量の増加に関連する症状を有する疾患および/または症候群を処置および/または予防するために使用され得る。
本発明者らは、sNAGナノファイバーがコラーゲンファイバーの組織化および/または配向を増加し得ること、引っ張り強度を増加し得ること、ならびに組織の伸縮性およびエラスチン含有量を増加し得ることを見出したので、本明細書中に記載されるsNAGナノファイバーは、被験体における組織を再生および/または充填するために使用され得る。
特定の実施形態において、本明細書中に記載されるsNAGナノファイバーまたはその組成物は、1つ以上のディフェンシンペプチドが発現していないかまたは発現が低レベルであるかに関連する、あるいは、1つ以上のディフェンシンペプチドをコードする遺伝子における変異/欠失/低い遺伝子コピー数(GCN)に関連する疾患を処置および/または予防するために使用される。変異しているか/欠失しているか/有しているGCNが低いか/発現していないか/発現が低いかもしくは変更されているディフェンシン遺伝子の例としては、α−ディフェンシンのいずれかが挙げられる。いくつかの実施形態において、本明細書中に記載されるsNAGナノファイバーまたはその組成物は、1つ以上のトール様レセプター(例えば、TLR1、TLR2、TLR3、TLR4、TLR5、TLR6、TLR7、TLR8、TLR9、TLR10、TLR11、および/またはTLR12)が、発現していない/発現レベルが低いかもしくは変更されていることに関連する、あるいは、該トール様レセプターの変異/欠失/低GCNに関連する疾患を処置および/または予防するために使用される。なお別の実施形態において、本明細書中に記載される組成物は、IL−1、CEACAM3、SPAG11、SIGIRR(IL1様レセプター)、IRAK1、IRAK2、IRAK4、TBK1、TRAF6およびIKKiの1つ以上が、発現していない/発現レベルが低いかもしくは変更されていることに関連する、あるいは、IL−1、CEACAM3、SPAG11、SIGIRR(IL1様レセプター)、IRAK1、IRAK2、IRAK4、TBK1、TRAF6およびIKKiの1つ以上の変異/欠失/低GCNに関連する疾患を処置および/または予防するために使用される。
特定の実施形態において、本明細書中に記載される組成物は、ナイーブな被験体(すなわち疾患または障害を有していない被験体)に投与され得る。一実施形態において、本明細書中に記載される組成物は、疾患または障害に罹患する危険性があるナイーブな被験体に投与される。
特定の実施形態において、状態および疾患またはその症状を処置および/または予防する方法が、本明細書中に記載され、sNAGナノファイバーを含有する組成物が、そのような処置の必要性がある患者に局所的に投与される。
種々の実施形態において、本明細書中に記載されるsNAGナノファイバーまたはその組成物は、1つ以上の他の治療と組み合わせて被験体に投与され得る。この1つ以上の他の治療は、疾患の処置または予防に有利であり得、あるいは、症状、または状態および疾患と関連する症状を改善し得る。特定の実施形態において、上記治療は、少なくとも5分間空けて、少なくとも30分間空けて、1時間空けて、約1時間空けて、約1時間〜約2時間空けて、約2時間〜約3時間空けて、約3時間〜約4時間空けて、約4時間〜約5時間空けて、約5時間〜約6時間空けて、約6時間〜約7時間空けて、約7時間〜約8時間空けて、約8時間〜約9時間空けて、約9時間〜約10時間空けて、約10時間〜約11時間空けて、約11時間〜約12時間空けて、約12時間〜18時間空けて、18時間〜24時間空けて、24時間〜36時間空けて、36時間〜48時間空けて、48時間〜52時間空けて、52時間〜60時間空けて、60時間〜72時間空けて、72時間〜84時間空けて、84時間〜96時間空けて、96時間〜120時間空けて、投与される。特定の実施形態において、2つ以上の治療が同一の特許出願(patent visit)内で投与される。
本明細書中に記載されるsNAGナノファイバー組成物の1つ以上を備える薬学的なパックまたはキットがまた、本明細書中に提供される。パックまたはキットは、本明細書中に記載される組成物を含む1以上の成分で充填された1つ以上の容器を備えている。上記組成物は、好ましくは、シールされた、防水の、滅菌されたパッケージ内に含まれ、これは、夾雑が生じることなく組成物の取り出しを容易にする。容器を構成する材料は、アルミホイル、プラスチック、または容易に滅菌される別の慣用的な材料であり得る。キットは、組成物の単回の投与または複数回の投与のための材料を含み得、好ましくは、各投与のための材料は、別々で、防水で滅菌されたパッケージにて提供される。
以下の実施例は、ポリ−N−アセチル−グルコサミンナノファイバー(sNAG)による皮膚創傷の処置が、未処置の創傷と比較した瘢痕サイズの縮小、並びに抗張力および弾性の向上をもたらすことを明らかにする。本発明者らによるMassonトリクロム染色を用いたコラーゲン含量の可視化は、sNAGで処置した創傷が、コラーゲン含量の減少、および損傷を受けていない組織と同様にコラーゲン小繊維が整列したコラーゲン表現型を示すこと、を示唆した。さらに、以下の実施例は、sNAGの処置が、創傷内の平滑筋アクチンの発現を減少させることを明らかにし、筋線維芽細胞含量の減少を示唆している。総合すれば、以下の実施例1から5に示したデータは、sNAGナノファイバーによる組織の処置は、コラーゲン含量の減少、コラーゲン小繊維の適切な配列およびIII型コラーゲン発現の増加、並びに組織弾性の向上およびエラスチン含量の増加をもたらすメカニズムにより、瘢痕形成を低減させることを示唆する。
この実施例は、sNAGナノファイバーが組織の抗張力および弾性を向上させることを明らかにする。特に、この実施例は、sNAGナノファイバーによって処置した皮膚創傷が損傷を受けていない組織と同様の抗張力を示したことを実証する。この実施例はさらに、sNAGナノファイバーによる皮膚創傷の処置により、未処置の皮膚創傷と損傷を受けていないコントロールの皮膚との両方と比較して、組織の弾性が向上したことを実証する。
8週齢〜12週齢の野生型C57B1/6マウスのオス成体8匹を、実験に用いた。そのうちの4匹に21日間損傷を与えず、コントロール群とし(野生型マウスの損傷を受けていない正常な皮膚の代表的なサンプル)、残りの4匹を実験群とした。実験群(4匹のマウス)において、脱毛によって毛を除去し、その部位を洗浄して、70% エタノールを用いて殺菌した。実験群のマウスを、O2/イソフルレン気化麻酔器(VetEquip, Inc.)を用いて麻酔した。イソフルレンは、誘発のために4%を、手術のために2%を用いた。4mm生検パンチ(Miltex)を用いて2つの完全厚皮膚創傷を形成することで、脇腹それぞれに同一の2つの創傷を形成した。一方の脇腹を、蒸留水で湿らせたsNAG薄膜(Marine Polymer Technologies, Inc.)によって処置し、また、他方の脇腹を処置せずに放置した。創傷部位をポリウレタン透明包帯(Tegaderm, 3M)で覆い、治癒するまで21日間放置した。21日目に、創傷部位(処置済および未処置)を回収し、皮膚を切り取って(15mm×7mm)均一な張力を保証した。損傷を与えていないコントロール動物からの脇腹組織を同様の方法で回収した(未処置コントロール)。
図1Aおよび1Bは、抗張力(相対的応力)および弾性の結果を示す。機械試験の分析は、WT動物のsNAGで処置した皮膚創傷の抗張力が、未処置の創傷と比較して、約40%増強したことを示す(図1A)。さらに、sNAGで処置した創傷は、損傷を受けていないコントロールの皮膚と同レベルまで抗張力の回復を示した(図1A)。抗張力の測定中、WT動物のsNAGで処置した皮膚創傷は、コントロールまたは未処置の対応物よりも弾性があったことに、注目した。図1Bは、sNAG処置が、治癒組織の弾性を、未処置の皮膚創傷および損傷を与えていないコントロールの皮膚の両方と比較して、顕著に向上させたことを示す。
この実施例は、sNAGナノファイバーがエラスチン生成を増加させることを示す。特に、この実施例は、sNAGナノファイバーによって処置した皮膚創傷がエラスチン生成を示した一方で、未処置の創傷はエラスチン生成を示さなかったことを実証する。
8週齢〜12週齢の野生型C57B1/6マウスのオス成体4匹を実験に用いた。脱毛によって毛を除去し、その部位を洗浄して、70% エタノールを用いて殺菌した。マウスを、O2/イソフルレン気化麻酔器(VetEquip, Inc.)を用いて麻酔した。イソフルレンは、誘発のために4%を、手術のために2%を用いた。4mm生検パンチ(Miltex)を用いて2つの完全厚皮膚創傷を形成することで、脇腹それぞれに同一の2つの創傷を形成した。一方の脇腹を、蒸留水で湿らせたsNAG薄膜 (Marine Polymer Technologies, Inc.)によって処置し、また、他方の脇腹を処置せずに放置した。創傷部位をポリウレタン透明包帯(Tegaderm, 3M)で覆い、治癒するまで10日間放置した。10日目に、創傷を4℃で一晩、4% パラホルムアルデヒド中に固定し、パラフィン包埋して、分析のために切片化した。
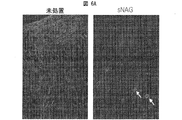
図2は、処置した動物からの創傷が、新たに治癒した部分においてエラスチン生成(薄い黒の構造によって可視化した)を示した一方で、処置していない創傷はエラスチン生成を示さなかったことを示す。
この実施例は、sNAGナノファイバーが組織の瘢痕を縮小させることを示す。特に、この実施例は、sNAGナノファイバーによって処置した皮膚創傷の瘢痕サイズが、未処置の創傷の瘢痕サイズと比較して、約2倍の縮小を示したことを実証する。
8週齢〜12週齢の野生型C57B1/6マウスのオス成体5匹を、実験に用いた。脱毛によって毛を除去し、その部位を洗浄して、70% エタノールを用いて殺菌した。マウスを、O2/イソフルレン気化麻酔器(VetEquip, Inc.)を用いて麻酔した。イソフルレンは、誘発のために4%を、手術のために2%を用いた。4mm生検パンチ(Miltex)を用いて2つの完全厚皮膚創傷を形成することで、脇腹それぞれに同一の2つの創傷を形成した。一方の脇腹を、蒸留水で湿らせたsNAG薄膜(Marine Polymer Technologies, Inc.)によって処置し、また、他方の脇腹を処置せずに放置した。創傷部位をポリウレタン透明包帯(Tegaderm, 3M)で覆い、治癒するまで21日間放置した。21日目に、動物を安楽死させ、キャリパーを用いて瘢痕を測定した。
図3に示すように、sNAGによって処置した創傷は、未処置の創傷と比較して、瘢痕サイズの約2倍の縮小を示す。
この実施例は、sNAGナノファイバーが、組織におけるコラーゲン含量を減少させ、整列したコラーゲンの配列形成を誘導することを示す。特に、この実施例は、sNAGナノファイバーによって処置した皮膚創傷が、未処置の創傷と比較して、コラーゲン含量の減少と、より整列したコラーゲンの配列とを示すことを実証する。
[材料および方法]
8週齢〜12週齢の野生型C57B1/6マウスのオス成体4匹を実験に用いた。脱毛によって毛を除去し、その部位を洗浄して、70% エタノールを用いて殺菌した。マウスを、O2/イソフルレン気化麻酔器(VetEquip, Inc.)を用いて麻酔した。イソフルレンは、誘発のために4%を、手術のために2%を用いた。4mm生検パンチ(Miltex)を用いて2つの完全厚皮膚創傷を形成することで、脇腹それぞれに同一の2つの創傷を形成した。一方の脇腹を、蒸留水で湿らせたsNAG薄膜(Marine Polymer Technologies, Inc.)によって処置し、また、他方の脇腹を処置せずに放置した。創傷部位をポリウレタン透明包帯(Tegaderm, 3M)で覆い、治癒するまで10日間放置した。10日目に、創傷を4℃で一晩、4%パラホルムアルデヒド中に固定し、パラフィン包埋して、分析のために切片化した。
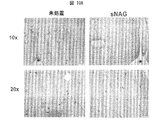
処置済および未処置の創傷におけるコラーゲンの量および質を試験するために、損傷を与えてから10日目の組織切片においてMassonトリクロム染色を行った。図4Aに示すように、皮膚創傷のsNAGによる処置が、青色の染色が少ないことによって示されたコラーゲン含量の減少をもたらし、また、皮膚創傷のsNAGによる処置が、新しいコラーゲンが既存のコラーゲンに対して適切に配列し、特に創傷の輪郭において、より整列したコラーゲンの配列をもたらす。
処置済みおよび未処置の創傷において、コラーゲン堆積量を定量分析することにより、ヒドロキシプロリン分析を行った。
8週齢〜12週齢の野生型C57B1/6マウスのオス成体4匹を実験に用いた。脱毛によって毛を除去し、その部位を洗浄して、70% エタノールを用いて殺菌した。マウスを、O2/イソフルレン気化麻酔器(VetEquip, Inc.)を用いて麻酔した。イソフルレンは、誘発のために4%を、手術のために2%を用いた。4mm生検パンチ(Miltex)を用いて2つの完全厚皮膚創傷を形成することで、脇腹それぞれに同一の2つの創傷を形成した。一方の脇腹を、蒸留水で湿らせたsNAG薄膜(Marine Polymer Technologies, Inc.)によって処置し、また、他方の脇腹を処置せずに放置した。創傷部位をポリウレタン透明包帯(Tegaderm, 3M)で覆い、治癒するまで10日間放置した。10日目に以下の処置を行った:
1.組織を凍結乾燥した。組織の乾燥重量を確認するために、組織を重量測定した;
2.凍結乾燥組織を粉砕し(粉末が細かいほど好ましく、例えば、小さい秤量スパチュラを有するチューブの中で細かくする)、加水分解管(例えば、パイレックス(登録商標)チューブ−Fisher cat. #14-932A)中に載置した。5mLの6N HClをヒュームフードに添加した。チューブを窒素ガス雰囲気下で保持し、空気を放出させた(ほぼ表面の真下に20秒までの秒数の間N2を吹き付ける)。チューブに堅く栓をした。渦を形成しないようにチューブをゆっくりと攪拌した。チューブをオーブン中に載置し、120度で3時間(または一晩中)加水分解した;
3.インキュベートの後、サンプルを、10mLのH2Oおよび2mLの実験用緩衝液を含む50mLの円錐チューブに移した;
4.4N NaOHを用いてpHを7〜8に調整し、6N HClを補正に用いた。pH調整後の量が、サンプル間で顕著に異なり得ることに注目した。量の差は、結果を分析する際に正確な量を得るために補正した;
5.50mgまでの活性炭を各サンプルに添加し、炭が懸濁するように強く攪拌し、3000rpmまでの回転数で10分間遠心分離機にかけた;
6.この間に、標準液を作製した。組織の標準液は、0(ブランク)、1、2、3、4、5、7および10μg/mLのヒドロキシプロリン溶液になる。分析は0.125μg/mLに感度がよく、組織培養におけるコラーゲンレベルを定量化することもできた(例えば)。標準液を、1000μg/mLの凍結ストックを等分したものから溶解させて、サンプルの各セットにフレッシュを作製した。標準液を15mLチューブ中で作製した;
7.サンプル上清の2mLまたは標準液の2mLを、フレッシュの15mLチューブに添加した(各サンプルに1つのチューブが必要とされ、そして各標準液に1つ必要とされた)。ブランク:2mLの作用溶液;
8.1mLのクロラミンTをチューブに添加し、強く攪拌して、20分間室温に立たせた;
9.1mLのエールリッヒ試薬を、反応チューブに添加し、強く攪拌して、60℃のウォーターバス中で15分間インキュベートした;
10.反応チューブを水道水中で冷却し、分光光度計において558nmを読み取った;
11.溶液を適切なハザード容器中に廃棄した;
12.標準曲線からμg/mLに関して読み取った。総ヒドロキシプロリン量のために、pH調整後の終量によって乗じた。μg ヒドロキシプロリン/mg 組織のために、乾燥重量で割った。
10mgのL−ヒドロキシプロリン(Sigma)を測量し、dH2O中に載置して、1mg/mLの濃縮液を作製し、1mL等分を凍結させた。
1mLの1000ug/mL(ストック):9mL dH2O=100ug/mL
1.2mLの100ug/mL:10.8mL dH2O=10ug/mL(11mL必要)
1mLの10ug/mL:9mL dH2O=1ug/mL
7ug/mL……………3.5mLの10ug/mL:1.5mL dH2O
5ug/mL……………2mLの10ug/mL:2mL dH2O
4ug/mL……………2mLの10ug/mL:3mL dH2O
3ug/mL……………1.5mLの10ug/mL:3.5mL dH2O
2ug/mL……………1mLの10ug/mL:4mL dH2O
1ug/mL……………1mLの10ug/mL:9mL dH2O
0.75ug/mL…………3mLの1ug/mL:1mL dH2O
0.50ug/mL…………2mLの1ug/mL:2mL dH2O
0.25ug/mL…………1mLの1ug/mL:3mL dH2O
0.125ug/mL…………0.5mLの1ug/mL:3.5mL dH2O
ブランク
[酢酸(0.5M)]
14.4mL 酢酸
485.6 dH2O
[緩衝液ストック調製(500mL)]
25g 無水クエン酸
6mL 0.5M 酢酸
60g 酢酸ナトリウム
17g 水酸化ナトリウム
試薬をdH2O中に、総量500mLになるように溶解させた.
[実験用緩衝液]
500mL 緩衝液ストック
100mL dH2O
150mL 1−プロパノール
必要に応じて、酢酸を用いてpH7から8に調整。
4℃で数か月安定.
[クロラミンT]
1.41g クロラミンT
10mL dH2O
10mL 1−プロパノール
80mL 実験用緩衝液
pH6から7の間,黒っぽいボトル中に保管.
[エールリッヒ試薬]
7.5g p−ジメチルーアミノーベンズアルデヒド
30mL 1−プロパノール
13mL 過塩素酸 (60%)
50mL作製
数時間のみ安定,各測定セットの前に作製.
すべての試薬をSigma社から購入した。
ヒドロキシプロリン分析を、処置済みおよび未処置の創傷におけるコラーゲン堆積の量を定量分析するために行った。図4Bに示すように、sNAG処置した創傷は、全体のコラーゲン含量が約3倍減少した。
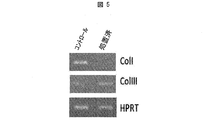
この実施例は、sNAGナノファイバーがI型コラーゲン発現を減少させ、III型コラーゲン発現を増加させることを示す。特に、この実施例は、sNAGナノファイバーによって処置した創傷において、未処置の創傷と比較して、I型コラーゲンの発現が減少し、そしてIII型コラーゲンの発現が増加することを証明する。
8週齢〜12週齢の野生型C57B1/6マウスのオス成体4匹を実験に用いた。脱毛によって毛を除去し、その部位を洗浄して、70% エタノールを用いて殺菌した。マウスをO2/イソフルレン気化麻酔器(VetEquip, Inc.)を用いて麻酔した。イソフルレンは、誘発のために4%を、手術のために2%を用いた。4mm生検パンチ(Miltex)を用いて2つの完全厚皮膚創傷を形成することで、脇腹それぞれに同一の2つの創傷を形成した。一方の脇腹を、蒸留水で湿らせたsNAG薄膜(Marine Polymer Technologies, Inc.)によって処置し、また、他方の脇腹を処置せずに放置した。創傷部位をポリウレタン透明包帯(Tegaderm, 3M)で覆い、治癒するまで5日間放置した。5日目に、創傷(処置済みおよび未処置)から単離したRNAについて、I型コラーゲンおよびIII型コラーゲンの発現を試験した。
sNAGが、発現するコラーゲンの型の変化を誘導するか否かを試験するために、損傷を与えた後5日目の創傷(処置済みおよび未処置)から単離したRNAについて、PCRによってI型コラーゲンおよびIII型コラーゲンの発現を試験した。
この実施例は、sNAGナノファイバーが、アルファ平滑筋アクチンを測定することによって評価する筋線維芽細胞含量を減少させることを証明する。特に、sNAGナノファイバーで処置した皮膚創傷においては、未処置の皮膚創傷と比較して、アルファ平滑筋アクチンが少なくとも2倍減少する。
8週齢〜12週齢の野生型C57B1/6マウスのオス成体4匹を実験に用いた。脱毛によって毛を除去し、その部位を洗浄して、70% エタノールを用いて殺菌した。マウスをO2/イソフルレン気化麻酔器(VetEquip, Inc.)を用いて麻酔した。イソフルレンは、誘発のために4%を、手術のために2%を用いた。4mm生検パンチ(Miltex)を用いて2つの完全厚皮膚創傷を形成することで、脇腹それぞれに同一の2つの創傷を形成した。一方の脇腹を、蒸留水で湿らせたsNAG薄膜(Marine Polymer Technologies, Inc.)によって処置し、また、他方の脇腹を処置せずに放置した。創傷部位をポリウレタン透明包帯(Tegaderm, 3M)で覆い、治癒するまで10放置した。10日目に、創傷を4℃で一晩、4%パラホルムアルデヒド中に固定し、パラフィン包埋して、分析のために切片化した。
筋線維芽細胞は、組織修復における重要な細胞型であり、コラーゲン生成を介した瘢痕の形成に関係している。筋線維芽細胞群は、瘢痕のない胎児の創傷治癒中に減少する。筋線維芽細胞の集合体の分布を可視化するために、α−平滑筋アクチンに対する抗体で創傷切片を標識した。図6Aに示し、図6Bに定量化したように、sNAGで処置した創傷においては、未処置の創傷と比較して、α−平滑筋アクチンの発現が少なくとも2倍減少する。図6Bにおいて、蛍光赤色に含まれるピクセルは、Y軸における「任意単位」として表されており、そのような単位は組織の領域ごとであり、アルファ平滑筋アクチンの発現および筋線維芽細胞含量の定量的評価を提供する。
この実施例は、sNAGナノファイバーによる皮膚創傷の処置が、抗張力および弾性が向上し、コラーゲン含量が減少し、コラーゲンの整列が向上し、そして筋線維芽細胞含量が減少した、より小さい瘢痕をもたらすことを示す。フィブリンゲルアッセイを、インビトロでの線維芽細胞配列の調整を評価するために用いた。この評価において、フィブリン格子を2つのピンを用いて形成し、細胞をポールとポールとの間に並べる力をゲルが付与できる中心点を提供する。張力点を提供する格子内の線維芽細胞配列を評価するためのフィブリンゲルアッセイを用いて、この実施例は、sNAGナノファイバーによる刺激が、Akt1がまた必要とされる方法により、未処置のコントロールと比較して、線維芽細胞の配列を向上させることを示す。この実施例はさらに、sNAGが誘導する抗張力および弾性の向上に、インビボでAkt1が必要とされることを示す。総合すれば、これらの知見は、sNAGナノファイバーがAkt1依存性経路を刺激することにより、皮膚創傷治癒中の、線維芽細胞の適切な配列、瘢痕の縮小、および抗張力の向上をもたらすことを示す。それゆえに、pGlcNAナノファイバーによる処置が、修復された創傷のより良い組織構成をもたらし得る。
成体の創傷治癒においては、外科的および外傷性の損傷の両方に続く瘢痕の形成が避けられない。皮膚創傷に続く瘢痕形成は、正常な皮膚組織に変わる過剰なコラーゲンおよび線維性の組織の未整列の堆積のためである。瘢痕は、多くの場合、組織運動の制限、機能の喪失、審美性の貧しさ、および精神的苦痛をもたらす、主要な医学的副反応である[1]。瘢痕反応(組織再建)を伴わない治癒に対する哺乳動物の能力は、成長のある段階で制限され、その後の創傷治癒は瘢痕形成を伴い進行する。組織再建と瘢痕形成との間の主要な差異の1つは、コラーゲンの整列および堆積である。胎児の再建組織と成体の瘢痕との比較は、それぞれが極めて同様の成分を含むことを示し、組織構造の調節における差異であり、瘢痕の異常な分子組成における差異ではないことを示唆している。それゆえに、組織再建および瘢痕形成組織の修復は、制御が異なり得る共通のメカニズムを共有する[2]。瘢痕形成、並びにシリコンによる手当およびヒドロコルチゾンの注入のような現在の処置の制限された効果に影響を与えるために、新規の処置の開発および特徴付けが必要とされている[3]。
[切除創傷治癒モデル、瘢痕定量化、抗張力測定]
野生型C57B1/6およびAkt1ヌルマウスモデル[4]を、全ての実験において用いた。Akt1ヌル動物を、全タンパク質の発現を阻害する翻訳開始部位における挿入突然変異を用いて作製した[14]。混合した129/C57B16環境におけるAkt1ヌル動物を、C57B1/6に8世代戻し交配した。麻酔した8週齢〜12週齢のマウスのオス成体に損傷を与えた。4mm生検パンチ(Miltex)を用いて2つの完全厚皮膚創傷を形成することで、脇腹それぞれに同一の2つの創傷を形成した。マウスをO2/イソフルレン気化麻酔器(VetEquip, Inc.)を用いて麻酔した。イソフルレンは、誘発のために4%を、手術のために2%を用いた。手術の前に脱毛によって毛を除去し、その部位を洗浄して、70% エタノールを用いて殺菌した。創傷を、Marine Polymer Technologies, Inc.から入手したpGlcNAcの乾燥形態の薄膜を、蒸留水で湿らせたものによって処置するか、処置せずに放置するかのいずれかにした。目的の日に、動物を安楽死させ、8mm生検パンチ(Miltex)を用いて、創傷全体を周囲の皮膚と共に回収した。創傷を4℃で一晩、4%パラホルムアルデヒド中に固定し、パラフィン包埋して、分析のために切片化した。
H&E染色のために、切片をキシレンで清浄し、一連のグレードのアルコールを通して再水和し、ヘマトキシリン中において後、酸アルコール中においた。サンプルを、それからアンモニア水中におき、エタノールでリンスして、エオシンにさらした後、一連のグレードのアルコールを通して再水和し、キシレンで清浄した。切片を、Cytoseal−XYL(Richard-Allan Scientific)を用いて標本したH&E切片を、オリンパスBX40顕微鏡を用いて可視化し、オリンパスカメラ(Model DP25)およびDP2−BSW入力ソフトウェアを用いて記録した。
ヒドロキシプロリン分析を記述の通りに行った[15]。簡単に言うと、同量の創傷組織(8mm生検パンチ)を、損傷を与えてから21日目の処置済みまたは未処置の野生型マウス(それぞれn=4)から回収した。組織を、凍結乾燥させて、一定の乾燥重量を測定し、細かく砕いた。組織コラーゲンについて、120℃で18時間の、6N HClを用いた酸加水分解を完了し、4N NaOHを用いてpH7に中和した。1mLのクロラミンTを、コラーゲンサンプルの2mL量に添加し、室温で20分間インキュベートした。1mLのエールリッヒ試薬(25mL中の、60%過塩素酸、15mL 1−プロパノールおよび3.75g p−ジメチルーアミノーベンズアルデヒド)を添加し、サンプルを60℃で20分間インキュベートした。558の波長における吸収を分光光度計において読み取った。コラーゲンを、創傷組織の乾燥重量グラム当たりのヒドロキシプロリンのミリグラムとして定量化した。
損傷を与えた動物からの組織切片を、上述したように、ワンギーソン(Van Geison)染色手順を用いてエラスチンファイバーを染色した。簡単に言えば、切片をキシレンで清浄し、一連のグレードのアルコールから蒸留水を通して再水和し、ヘマトキシリン(Sigma-Aldrich)で染色し、2%塩化第二鉄中で差別化し、洗浄した。それから、組織切片を、脱水前にワンギーソン(Van Geison)対比染色によって染色し、キシレンで清浄し、Cytoseal−XYL(Richard-Allan Scientific)で標本した。区分化した組織切片を、オリンパスBX40顕微鏡を用いて可視化し、オリンパスカメラ(Model DP25)およびDP2−BSW入力ソフトウェアを用いて記録した。
パラフィン包埋組織切片を、キシレンから一連のグレードのアルコールを通して再水和した。切片を0.01% Triton−X100で処置し、圧力調理器中で5分間、抗原脱マスキング溶液(Vector Laboratories)を用いて抗原回復の被験体とし、冷却した。サンプルを、抗体標識前に、バックグラウンドバスター(Innovex Biosciences)中で30分間インキュベートした。皮膚切片を、マウスモノクローナル抗アクチンα−平滑筋抗体(Sigma)、ビメンチンマウスモノクローナル抗体(Dako)、ファロイジン(Molecular Probes)およびDAPI(Molecular Probes)を用いて標識した。切片を4℃で一晩一次抗体中においてインキュベートし、洗浄し、さらに適切な二次免疫蛍光抗体(Invitrogen)と共に室温で一時間インキュベートした。各抗体に対するコントロールの切片を、一次抗体を用いずに染色した。組織切片をOlympus FluroViewレーザースキャニング共焦点顕微鏡(Model IX70)を用いて可視化し、大気温度でオリンパスカメラ(Model FV5-ZM)およびFluoview 5.0入力ソフトウェアを用いて記録した。
C3H10線維芽細胞を、1% ペニシリン/ストレプトマイシン(Invitrogen)を補ったEarle平衡塩類溶液(MEM/EBSS, Thermo)を含む最小必須培地において、5%CO2、37℃に維持した。正常ヒト線維芽細胞(ATCC)を、20% FCSを補ったMEM中に維持した。血清飢餓を、0.1%ウシ胎仔血清(Valley Biomedical)を補ったMEM/EBSS中で80から90%コンフルエントで24時間行った後、殺菌水(Marine Polymer Technologies, Inc.)中において、高度に精製されたpGlcNAc(50μg/mL)ナノファイバースラリー(sNAG)を用いて刺激した。
Akt1に対するMission shRNAレンチウイルスコンストラクトを、Sigma/Aldrich社から購入した。レンチウイルスを293T細胞中で増殖させ、上述したように補充されたDMEM中に維持した。レンチウイルス生産を、Addgene社からのレンチウイルス粒子生産のための手順にしたがって、Addgene社から購入したpsPAX2およびpMD2.Gパッケージングベクターを用いて行った。標的細胞の感染のために、100mm2プレート上を7.5×105個の細胞で覆い、一晩インキュベートした。次の日、細胞を、最終濃度1mg/mLのポリブレンおよびAkt1 shRNAレンチウイルスを用いて、形質転換した。形質導入の後、一晩血清を枯渇させた線維芽細胞を、sNAG(50mg/mL)で刺激した。適切でない効果はいずれも、非相同のAkt1配列に対するRNAi(Dharmacon)を用いて表現型を検証することによって制御した(データ示さず)。
[sNAG処置は瘢痕サイズの縮小およびコラーゲン配列の向上をもたらす]
この調査において、瘢痕形成におけるsNAGの効果を分析した。切除創傷を野生型動物に形成し、膜状のsNAGによって処置する、または処置せずに放置する、のいずれかを行った。損傷を与えてから21日目に、動物を犠牲にし、瘢痕サイズを測定した。図7Aに定量して示すように、sNAGで処置した創傷は、未処置の創傷と比較して、瘢痕サイズが約2倍縮小したことを示す。処置済みおよび未処置の創傷においてコラーゲンの量および質を調査するために、損傷を与えてから10日目の組織切片においてMassonトリクロム染色を行った。図7Bにおいて見られるように、皮膚創傷のsNAG処置が、特に創傷の境界部分において見られるように、青色染色部分が少ないことによって示されるコラーゲン含量の減少、および、新規のコラーゲンと既存のコラーゲンとが適切に配列し、より整列したコラーゲン配列をもたらす。ヒドロキシプロリン分析を、処置済みおよび未処置の創傷におけるコラーゲン堆積量を定量的に分析するために行った。図7Cに示すように、sNAGで処置した創傷は、全体的なコラーゲン含量を約3倍減少させた。
コラーゲンが強度および機械的特性を付与すること[18]、並びに処置済みおよび未処置の皮膚創傷の間で、コラーゲン堆積および瘢痕形成が異なること、を考慮し、sNAG処置が抗張力および弾性の向上をもたらすか否かを評価した。抗張力および弾性を測定するために、皮膚創傷を、野生型動物に形成した皮膚創傷の、未処置および処置済みの両方を21日後に回収し、歪みゲージ伸長計を用いて機械試験の被験体にした。野生型マウスからの損傷を与えていない正常な皮膚を、コントロールとして用いた。機械試験の分析は、WT動物のsNAG処置した皮膚創傷が、未処置の創傷と比較して、抗張力の約40%の向上を表すことを示す(図9A)。さらに、sNAG処置した創傷は、損傷を与えていないコントロールの皮膚と同等レベルの抗張力回復を表した(図9A)。抗張力測定中に、WT動物からのsNAG処置した皮膚創傷が、コントロールまたは未処置の対応物よりも伸縮性が高いことに注目した。図9Bは、sNAG処置が、未処置の皮膚創傷および損傷を与えていないコントロールの皮膚の両方と比較して、治癒組織の弾性の顕著な向上をもたらすことを示す。皮膚創傷のsNAG処置がエラスチン生成を増加させるか否かを評価するために、ワンギーソン(Van Geison)染色を分析した。図9Cにおいて、処置済み動物由来の創傷は、新たに治癒した創傷においてエラスチン生成を示すが(薄い黒い構造によって表す)、未処置の創傷は示さない。これらの知見は、sNAG処置が弾性の向上と同様に抗張力の向上をもたらし、皮膚創傷のナノファイバー処置が、治癒中の皮膚の機械特性を共に向上させる一方で、瘢痕化を低減するという仮説を支持する。
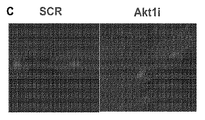
コラーゲンファイバーの配列および整列は線維芽細胞の適切な配列に関連すると思われるため、sNAG処置がインビトロの線維芽細胞の配列をもたらすか否かを評価するために、フィブリンゲルアッセイを用いた[19]。この仮説を試験するために、線維芽細胞をsNAGで処置または未処置で放置した後、フィブリンゲルに包埋した。フィブリンゲルを一晩収縮可能にした後、収縮を分析し、細胞配列の分析のために切片化した。細胞配列を可視化するために、ゲルを切片化してファロイジンまたはH&Eのいずれかで染色した。H&E染色したゲル切片の代表的な画像は、sNAG処置が配列した線維芽細胞をもたらすことを示す(図10A)。黒丸は、ゲルの収縮に沿う張力点として機能するピンの位置を示す。sNAG処置した線維芽細胞は、未処置の細胞の散乱した整列されていない構成と比較して、編制された方式で、ピンから線形に放射状に広がる。ゲル切片のファロイジン染色を、また、sNAG処置細胞の整列した配列を可視化するために行った(図4B)。sNAG依存性線維芽細胞配列を、ヒト皮膚線維芽細胞において確認した(図示せず)。さらに、sNAG処置した線維芽細胞は、未処置のコントロールと比較して向上したゲル収縮と相互に関連がある(以下を参照のこと)。総合すれば、これらのデータは、線維芽細胞のsNAG処置が整理された細胞配列をもたらすことを示す。線維芽細胞のこの配列は、図7から9に示すように、sNAG処置した皮膚創傷において見られる、より整列したコラーゲンファイバーおよび向上した抗張力をもたらすと思われる。
Akt1も線維芽細胞の配列のsNAGに依存した向上に必要とされるか否かを決定するために、線維芽細胞をAkt1に対するレンチウイルスを発現するshRNAを用いて形質導入し、フィブリンゲルに包埋した。図11Aに示すように、sNAG処置した線維芽細胞は、未処置の線維芽細胞を含むゲルと比較して約40%ゲル収縮した。sNAG処置したshAkt1発現する線維芽細胞を含むゲルは、sNAG処置したコントロールよりも収縮が極めて小さかった。フィブリンゲルからのH&E染色切片の分析は、Akt1の発現が阻害された場合に配列が抑制されることを示す(図11B)。図11に示すように、sNAG処置した線維芽細胞は、未処置のコントロールと比較して、促進したAktのリン酸化を有し、Akt経路の活性化を示唆している。Akt1のノックダウンがインビトロで線維芽細胞の配列の低下をもたらすため、Akt1ヌル動物由来の皮膚創傷の抗張力がsNAGの処置によって影響を受けるか否かを評価した。sNAGで処置したまたは処置せずに放置した皮膚創傷を、上述したように、歪みゲージ伸長計を用いる抗張力試験の被験体とした。図11Dに示すように、sNAG処置した創傷と未処置の創傷との間に顕著な差はなかった。総合すれば、これらの知見は、インビボで、sNAGに依存した抗張力の向上と同様に、sNAGに依存した線維芽細胞の配列にAkt1が必要とされることを示している。
上述した知見は、高度に精製されたpGlcNAナノファイバー(sNAG)による皮膚創傷の処置が、瘢痕形成を低減させることを示す。この瘢痕形成の低減は、コラーゲンの整列、抗張力および弾性の向上と、相互に関連がある。Akt1の除去は、sNAG処置によって誘導される抗張力の向上を阻害する。抗張力は、創傷治癒の成熟段階中におけるコラーゲンの再編によって決定され、この再編により、コラーゲンは、生成と代謝との間のバランスによってますます整理される[20]。一般に、瘢痕形成は、コラーゲン生成の増加と、コラーゲンの交差連結および配列の低下とによって特徴付けられ、抗張力の全体的な低下の原因となる。確かに、元々の抗張力の70%のみが、創傷回復および組織再編後に回復する[21]。
1. Ferguson, M.W. and S. O'Kane, Scar-free healing: from embryonic mechanisms to adult therapeutic intervention. Philos Trans R Soc Lond B Biol Sci, 2004. 359(1445): p. 839-50.
2. Occleston, N.L., et al., Therapeutic improvement of scarring: mechanisms of scarless and scar-forming healing and approaches to the discovery of new treatments. Dermatol Res Pract, 2010. 2010.
3. Bayat, A., D.A. McGrouther, and M.W. Ferguson, Skin scarring. BMJ, 2003. 326(7380): p. 88-92.
4. Lindner, H.B., et al., Anti-bacterial effects of poly-N-acetyl-glucosamine nanofibers in cutaneous wound healing: requirement for Akt1. PLoS One, 2011. 6(4): p. e18996.
5. Pietramaggiori, G., et al., Effects of poly-N-acetyl glucosamine (pGlcNAc) patch on wound healing in db/db mouse. J Trauma, 2008. 64(3): p. 803-8.
6. Kelechi, T.J., et al., A randomized, investigator-blinded, controlled pilot study to evaluate the safety and efficacy of a poly-N-acetyl glucosamine-derived membrane material in patients with venous leg ulcers. J Am Acad Dermatol, 2012. 66(6): p. e209-15.
7. Maus, E.A., Successful treatment of two refractory venous stasis ulcers treated with a novel poly-N-acetyl glucosamine-derived membrane. BMJ Case Rep, 2012. 2012.
8. Hankin, C.S., et al., Clinical and cost efficacy of advanced wound care matrices for venous ulcers. J Manag Care Pharm, 2012. 18(5): p. 375-84.
9. Hirsch, J.A., et al., Non-invasive hemostatic closure devices: "patches and pads". Tech Vasc Interv Radiol, 2003. 6(2): p. 92-5.
10. Palmer, B.L., et al., Effectiveness and safety of manual hemostasis facilitated by the SyvekPatch with one hour of bedrest after coronary angiography using six-French catheters. Am J Cardiol, 2004. 93(1): p. 96-7.
11. Scherer, S.S., et al., Poly-N-acetyl glucosamine nanofibers: a new bioactive material to enhance diabetic wound healing by cell migration and angiogenesis. Ann Surg, 2009. 250(2): p. 322-30.
12. Vournakis, J.N., et al., Poly-N-acetyl glucosamine nanofibers regulate endothelial cell movement and angiogenesis: dependency on integrin activation of Ets1. J Vasc Res, 2008. 45(3): p. 222-32.
13. Beeson, C.C., et al., Integrin-dependent Akt1 activation regulates PGC-1 expression and fatty acid oxidation. J Vasc Res. 49(2): p. 89-100.
14. Mao, C., et al., Unequal contribution of Akt isoforms in the double-negative to double-positive thymocyte transition. J Immunol, 2007. 178(9): p. 5443-53.
15. Baicu, C.F., et al., Effects of the absence of procollagen C-endopeptidase enhancer-2 on myocardial collagen accumulation in chronic pressure overload. Am J Physiol Heart Circ Physiol, 2012. 303(2): p. H234-40.
16. van Amerongen, M.J., et al., Bone marrow-derived myofibroblasts contribute functionally to scar formation after myocardial infarction. J Pathol, 2008. 214(3): p. 377-86.
17. Sarrazy, V., et al., Mechanisms of pathological scarring: role of myofibroblasts and current developments. Wound Repair Regen, 2011. 19 Suppl 1: p. s10-5.
18. Buehler, M.J., Nature designs tough collagen: explaining the nanostructure of collagen fibrils. Proc Natl Acad Sci U S A, 2006. 103(33): p. 12285-90.
19. Kalson, N.S., et al., An experimental model for studying the biomechanics of embryonic tendon: Evidence that the development of mechanical properties depends on the actinomyosin machinery. Matrix Biol, 2010. 29(8): p. 678-89.
20. Oxlund, H., et al., Collagen deposition and mechanical strength of colon anastomoses and skin incisional wounds of rats. J Surg Res, 1996. 66(1): p. 25-30.
21. Clark, R.A., Wound repair. Curr Opin Cell Biol, 1989. 1(5): p. 1000-8.
22. Chipev, C.C., et al., Myofibroblast phenotype and apoptosis in keloid and palmar fibroblasts in vitro. Cell Death Differ, 2000. 7(2): p. 166-76.
23. Lee, Y.S. and S. Vijayasingam, Mast cells and myofibroblasts in keloid: a light microscopic, immunohistochemical and ultrastructural study. Ann Acad Med Singapore, 1995. 24(6): p. 902-5.
24. Zhou, G.L., et al., Akt phosphorylation of serine 21 on Pak1 modulates Nck binding and cell migration. Mol Cell Biol, 2003. 23(22): p. 8058-69.
25. Zhu, Q.S., et al., Vimentin is a novel AKT1 target mediating motility and invasion. Oncogene, 2011. 30(4): p. 457-70.
26. Fayard, E., et al., Protein kinase B (PKB/Akt), a key mediator of the PI3K signaling pathway. Curr Top Microbiol Immunol, 2010. 346: p. 31-56.
27. Pierce, R.A., C.H. Moore, and M.C. Arikan, Positive transcriptional regulatory element located within exon 1 of elastin gene. Am J Physiol Lung Cell Mol Physiol, 2006. 291(3): p. L391-9.
28. Vrhovski, B. and A.S. Weiss, Biochemistry of tropoelastin. Eur J Biochem, 1998. 258(1): p. 1-18.
29. Somanath, P.R., et al., Akt1 signaling regulates integrin activation, matrix recognition, and fibronectin assembly. J Biol Chem, 2007. 282(31): p. 22964-76.
30. Beeson, C.C., et al., Integrin-dependent Akt1 activation regulates PGC-1 expression and fatty acid oxidation. J Vasc Res, 2012. 49(2): p. 89-100.
31. Larson, B.J., M.T. Longaker, and H.P. Lorenz, Scarless fetal wound healing: a basic science review. Plast Reconstr Surg, 2010. 126(4): p. 1172-80.
32. Cowin, A.J., et al., Endogenous inflammatory response to dermal wound healing in the fetal and adult mouse. Dev Dyn, 1998. 212(3): p. 385-93。
本明細書に記載した、学術論文、特許および特許出願のような全ての参考文献の開示内容は、個別の論文または特許出願のそれぞれが、特におよび個別に参考として援用されることを示すように、これらの全体が参考として本明細書中に援用され、前述の発明は、明確な理解を目的として図面および実施例の手段により、一部詳細に説明されているけれども、本発明の教示の観点において当該技術分野における通常の知識を有する者に容易に明らかになり、特定の変更および修正は、本発明の特許請求の範囲の精神または範囲から一脱しないようにそこに加え得る。
Claims (25)
- ヒト被験体の皮膚表面におけるシワまたは窪みを処置または予防するための組成物であって、
上記組成物は、ポリ−N−アセチルグルコサミンの短縮化されたファイバー(sNAGナノファイバー)を含有するとともに、上記ヒト被験体のシワまたは窪みへの直接的若しくは近接した局所投与、または直接的な局所注射のために処方され、
上記sNAGナノファイバーは、70%以上のN−アセチルグルコサミン単糖類を含み、
上記sNAGナノファイバーは、1から15μmの長さである組成物。 - 前記皮膚表面におけるシワまたは窪みに対し近接した局所投与のために処方される、請求項1に記載の組成物。
- 前記皮膚表面におけるシワまたは窪みに対する直接的な局所投与のために処方される、請求項1に記載の組成物。
- 前記皮膚表面におけるシワまたは窪みに対する直接的な局所注射のために処方され、
上記局所注射が、皮内注射、皮下注射または筋肉内注射である、請求項1に記載の組成物。 - 直接的な局所注射のために処方され、
前記シワは、皮膚の内部へ数マイクロメートルから数ミリメートルまでである、請求項1に記載の組成物。 - ヒトの被験体において組織を再生するかまたは組織にボリュームを加えるための組成物であって、
上記組成物は、ポリ−N−アセチルグルコサミンの短縮化されたファイバー(sNAGナノファイバー)を含有するとともに、上記ヒト被験体の組織への局所投与または局所注射のために処方され、
上記sNAGナノファイバーは、70%以上のN−アセチルグルコサミン単糖類を含み、
上記sNAGナノファイバーは、1から15μmの長さである組成物。 - 前記組織への局所注射のために処方され、上記局所注射が、皮内注射、皮下注射または筋肉内注射である、請求項6に記載の組成物。
- 上記被験体の粘膜表面への局所投与のために処方される、請求項7に記載の組成物。
- 口腔粘膜への局所投与のために処方される、請求項8に記載の組成物。
- 皮膚フィラーとして処方される、請求項6または7に記載の組成物。
- 上記組織は、結合組織である、請求項6〜10の何れか1項に記載の組成物。
- 上記組織は、骨である、請求項6〜9の何れか1項に記載の組成物。
- 上記組成物は、クリーム、膜、フィルム、液体溶液、懸濁物、パウダー、ペースト、軟膏、噴霧剤、ゲルまたはスプレーとして処方されている、請求項1〜6および8〜12の何れか1項に記載の組成物。
- 上記組成物は、(i)上記被験体への局所送達に好適な形態にて、組成物の用量/適用あたり、0.2〜20mg/cm2のsNAGナノファイバーを含むか、あるいは(ii)上記被験体へ患者への局所送達に好適な形態にて、組成物の用量/適用あたり、5〜50mg/mLのsNAGナノファイバーを含む、請求項1〜6および8〜13の何れか1項に記載の組成物。
- 前記sNAGナノファイバーの50%よりも多くが、2〜10μmの間の長さであるか、または4〜7μmの間の長さである、請求項1〜14のいずれか1項に記載の組成物。
- 前記sNAGナノファイバーは、平均の長さが4〜7μmである、請求項1〜15の何れか1項に記載の組成物。
- 前記sNAGナノファイバーが、放射線照射されていないポリ−β−N−アセチルグルコサミンファイバーの微細構造を有する、請求項1〜16の何れか1項に記載の組成物。
- 前記sNAGナノファイバーは、80%よりも多い、90%よりも多い、95%よりも多い、または100%のN−アセチルグルコサミン単糖類を含む、請求項1〜17のいずれか1項に記載の組成物。
- 上記sNAGナノファイバーの赤外線スペクトルは、放射線照射されていない、微細藻類のポリ−β−1→4−N−アセチルグルコサミンの赤外線スペクトルとおよそ同じである、または同等である、請求項1〜18の何れか1項に記載の組成物。
- 上記組成物は、1週間またはそれ以上に等しいかまたはそれよりも長い期間にわたって、一日に1回または2回、上記被験体に投与されるために、処方される、請求項1〜19の何れか1項に記載の組成物。
- 前記sNAGナノファイバーは、甲殻類のポリ−N−アセチルグルコサミンから生成されない、請求項1〜20のいずれか1項に記載の組成物。
- 前記sNAGナノファイバーは、微細藻類のポリ−N−アセチルグルコサミンから生成された、請求項1〜21のいずれか1項に記載の組成物。
- 前記sNAGナノファイバーは、筋肉内への移植試験にて試験された場合に反応性でない、請求項1〜22のいずれか1項に記載の組成物。
- 前記sNAGナノファイバーは、MTTアッセイにおいて、血清を枯渇させたヒト臍帯静脈内皮細胞の代謝速度を増加させる、および/または、トリパンブルー排除試験において、血清を枯渇させたヒト臍帯静脈内皮細胞のアポトーシスを救助しない、請求項1〜23のいずれか1項に記載の組成物。
- 前記sNAGナノファイバーの投与は、以下の効果
(a)被験体における組織の抗張力の向上、
(b)被験体の組織における弾性の向上、
(c)被験体の組織におけるエラスチン含量または生産の増加、
(d)被験体の組織における総コラーゲン含量の減少、
(e)被験体の組織におけるI型コラーゲン発現または含量の減少、
(f)被験体の組織におけるIII型コラーゲン発現または含量の増加、
(g)被験体の組織における、より整列したコラーゲンの誘導、
(h)被験体の組織における平滑筋アクチン含量もしくは発現の減少、および
(i)被験体の組織における筋線維芽細胞含量の減少、
の少なくとも1つ以上を達成するために有効である、請求項1〜24のいずれか1項に記載の組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361784765P | 2013-03-14 | 2013-03-14 | |
| US61/784,765 | 2013-03-14 | ||
| PCT/US2014/025623 WO2014165302A1 (en) | 2013-03-14 | 2014-03-13 | Treatment of disease with poly-n-acetylglucosamine nanofibers |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2016514150A JP2016514150A (ja) | 2016-05-19 |
| JP2016514150A5 JP2016514150A5 (ja) | 2018-05-10 |
| JP6532452B2 true JP6532452B2 (ja) | 2019-06-19 |
Family
ID=51659125
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016501898A Active JP6532452B2 (ja) | 2013-03-14 | 2014-03-13 | ポリ−n−アセチルグルコサミンナノファイバーを有する疾患の処置 |
Country Status (10)
| Country | Link |
|---|---|
| US (4) | US20160030465A1 (ja) |
| EP (2) | EP2968190B1 (ja) |
| JP (1) | JP6532452B2 (ja) |
| AU (1) | AU2014248454B2 (ja) |
| CA (1) | CA2901617A1 (ja) |
| ES (1) | ES2704681T3 (ja) |
| IL (1) | IL240222B (ja) |
| MX (1) | MX2015011418A (ja) |
| NZ (2) | NZ729181A (ja) |
| WO (1) | WO2014165302A1 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2121048B9 (en) | 2007-02-19 | 2016-02-24 | Marine Polymer Technologies, Inc. | Hemostatic compositions and therapeutic regimens |
| CN107412772A (zh) | 2010-04-15 | 2017-12-01 | 海洋聚合物技术公司 | 聚‑n‑乙酰葡萄糖胺纳米纤维的抗菌应用 |
| EP2696680B1 (en) | 2011-04-15 | 2018-11-28 | Marine Polymer Technologies, Inc. | Treatment of hsv infections with poly-n-acetyl glucosamine nanofibers |
| JP2015048436A (ja) * | 2013-09-03 | 2015-03-16 | 公立大学法人福井県立大学 | 植物の耐病性を向上させる、生物由来キチン質含有物、その使用方法、及びその製造方法 |
| JP6815782B2 (ja) * | 2016-07-29 | 2021-01-20 | 小林製薬株式会社 | α−SMA産生抑制剤 |
| KR102233530B1 (ko) * | 2018-11-22 | 2021-03-31 | (주)프로스테믹스 | 엑소좀 및 이의 다양한 용도 |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2193634A1 (en) | 1972-07-20 | 1974-02-22 | Du Pont | Polyimide semi-permeable membranes |
| JPS6297624A (ja) | 1985-10-24 | 1987-05-07 | イ−・アイ・デユポン・デ・ニモアス・アンド・カンパニ− | ガス分離法及びその膜 |
| US4705540A (en) | 1986-04-17 | 1987-11-10 | E. I. Du Pont De Nemours And Company | Polyimide gas separation membranes |
| US4717394A (en) | 1986-10-27 | 1988-01-05 | E. I. Du Pont De Nemours And Company | Polyimide gas separation membranes |
| US4717393A (en) | 1986-10-27 | 1988-01-05 | E. I. Du Pont De Nemours And Company | Polyimide gas separation membranes |
| US4912197A (en) | 1987-08-14 | 1990-03-27 | E. I. Du Pont De Nemours And Company | Highly soluble clear polyimides |
| US4880442A (en) | 1987-12-22 | 1989-11-14 | E. I. Du Pont De Nemours And Company | Polyimide gas separation membranes |
| US4863496A (en) | 1988-04-13 | 1989-09-05 | E. I. Du Pont De Nemours And Co. | Reactive posttreatment for gas separation membranes |
| US4838900A (en) | 1988-04-13 | 1989-06-13 | E. I. Du Pont De Nemours And Company | Polyimide gas separation membranes |
| US4851505A (en) | 1988-04-13 | 1989-07-25 | E. I. Du Pont De Nemours And Company | Highly soluble aromatic polyimides |
| US4935490A (en) | 1988-04-13 | 1990-06-19 | E. I. Dupont De Nemours And Company | Highly soluble aromatic polyimides |
| US4961539A (en) | 1989-08-01 | 1990-10-09 | Deem K Michael | Truck-mounted pallet chipper |
| DE4200080A1 (de) * | 1992-01-03 | 1993-09-30 | Reinmueller Johannes | Pharmazeutische Zusammensetzung zur Wund-, Narben- und Keloidbehandlung |
| US5686115A (en) | 1993-12-01 | 1997-11-11 | Marine Polymer Technologies, Inc. | Poly-β-1→4-N-acetylucosamine copolymer composition with collagen |
| US5624679A (en) | 1993-12-01 | 1997-04-29 | Marine Polymer Technologies, Inc. | Methods and compositions for poly-β-1-4-N-acetylglucosamine biological barriers |
| US5622834A (en) | 1993-12-01 | 1997-04-22 | Marine Polymer Technologies, Inc. | Method of isolating poly-β-1-4-N-acetylglucosamine from microalgal culture |
| US5858350A (en) * | 1993-12-01 | 1999-01-12 | Marine Polymer Technologies | Methods and compositions for poly-β-1→4-N-acetylglucosamine cell therapy system |
| US7041657B2 (en) | 2001-02-12 | 2006-05-09 | Marine Polymer Technologies Inc. | Compositions and methods for modulation of vascular structure and/or function |
| US8277849B2 (en) * | 2006-01-19 | 2012-10-02 | Solazyme, Inc. | Microalgae-derived compositions for improving the health and appearance of skin |
| EP2121048B9 (en) | 2007-02-19 | 2016-02-24 | Marine Polymer Technologies, Inc. | Hemostatic compositions and therapeutic regimens |
| CN107412772A (zh) * | 2010-04-15 | 2017-12-01 | 海洋聚合物技术公司 | 聚‑n‑乙酰葡萄糖胺纳米纤维的抗菌应用 |
| EP2696680B1 (en) | 2011-04-15 | 2018-11-28 | Marine Polymer Technologies, Inc. | Treatment of hsv infections with poly-n-acetyl glucosamine nanofibers |
-
2014
- 2014-03-13 NZ NZ729181A patent/NZ729181A/en unknown
- 2014-03-13 CA CA2901617A patent/CA2901617A1/en not_active Abandoned
- 2014-03-13 EP EP14779109.9A patent/EP2968190B1/en active Active
- 2014-03-13 AU AU2014248454A patent/AU2014248454B2/en active Active
- 2014-03-13 EP EP18199627.3A patent/EP3494791B1/en active Active
- 2014-03-13 NZ NZ629513A patent/NZ629513A/en unknown
- 2014-03-13 MX MX2015011418A patent/MX2015011418A/es active IP Right Grant
- 2014-03-13 WO PCT/US2014/025623 patent/WO2014165302A1/en active Application Filing
- 2014-03-13 ES ES14779109T patent/ES2704681T3/es active Active
- 2014-03-13 US US14/775,578 patent/US20160030465A1/en not_active Abandoned
- 2014-03-13 JP JP2016501898A patent/JP6532452B2/ja active Active
- 2014-03-13 US US14/210,054 patent/US20150024014A1/en not_active Abandoned
-
2015
- 2015-07-29 IL IL240222A patent/IL240222B/en active IP Right Grant
-
2017
- 2017-12-14 US US15/841,903 patent/US20180360868A1/en not_active Abandoned
-
2018
- 2018-03-15 US US15/922,765 patent/US20190060348A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| CA2901617A1 (en) | 2014-10-09 |
| US20150024014A1 (en) | 2015-01-22 |
| MX2015011418A (es) | 2015-12-16 |
| AU2014248454A1 (en) | 2015-08-13 |
| WO2014165302A1 (en) | 2014-10-09 |
| JP2016514150A (ja) | 2016-05-19 |
| EP2968190A4 (en) | 2016-08-24 |
| ES2704681T3 (es) | 2019-03-19 |
| EP2968190A1 (en) | 2016-01-20 |
| US20160030465A1 (en) | 2016-02-04 |
| EP3494791B1 (en) | 2023-03-01 |
| EP2968190B1 (en) | 2018-10-17 |
| US20190060348A1 (en) | 2019-02-28 |
| AU2014248454B2 (en) | 2018-11-15 |
| NZ629513A (en) | 2017-08-25 |
| IL240222A0 (en) | 2015-09-24 |
| EP3494791A1 (en) | 2019-06-12 |
| NZ729181A (en) | 2018-11-30 |
| US20180360868A1 (en) | 2018-12-20 |
| IL240222B (en) | 2021-05-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6532452B2 (ja) | ポリ−n−アセチルグルコサミンナノファイバーを有する疾患の処置 | |
| Neuman et al. | Hyaluronic acid and wound healing | |
| JP7099822B2 (ja) | コラーゲンで強化した組織移植片 | |
| ES2918452T3 (es) | Composiciones hemostáticas y regímenes terapéuticos | |
| Medberry et al. | Hydrogels derived from central nervous system extracellular matrix | |
| ES2959455T3 (es) | Polvo de membrana amniótica y su uso en cicatrización de heridas y en construcciones de ingeniería de tejidos | |
| WO2016178586A2 (en) | Collagen compositions and preparation and uses thereof | |
| TW201427671A (zh) | 招集及定位幹細胞之組合物及方法 | |
| Klama‐Baryła et al. | Preparation of placental tissue transplants and their application in skin wound healing and chosen skin bullous diseases‐Stevens‐Johnson syndrome and toxic epidermal necrolysis treatment | |
| JP7378486B2 (ja) | 医療用接着剤及びその調製方法、その用途 | |
| AU2012282275B2 (en) | Use of oligosaccharide compounds for the prevention and treatment of pathological scars | |
| US11026980B1 (en) | Flowable birth tissue composition and related methods | |
| US20220088061A1 (en) | Cosmetic/dermatological composition | |
| Ramineni | Mucoadhesive films for treatment of local oral disorders: development, characterization and in vivo testing | |
| US20220062501A1 (en) | Decellularized fetal matrix for tissue regeneration | |
| Dias et al. | Acellular Amniotic Membrane Patch Regeneration for Burn Injury: The Future for Wound Healing | |
| JP2023514702A (ja) | ブタスキャフォールドおよび調製方法 | |
| Aurif | A prospectiv study of comparision between efficacy of topical sucralfate and conventional dressings in the management of chronic lower limb ulcers | |
| Denton et al. | COLLAGEN FILLERS |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170117 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170926 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20171220 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20180326 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180724 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20181022 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190205 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190424 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20190514 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20190521 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6532452 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |