JP5988962B2 - 細胞培養装置および細胞培養方法 - Google Patents
細胞培養装置および細胞培養方法 Download PDFInfo
- Publication number
- JP5988962B2 JP5988962B2 JP2013509561A JP2013509561A JP5988962B2 JP 5988962 B2 JP5988962 B2 JP 5988962B2 JP 2013509561 A JP2013509561 A JP 2013509561A JP 2013509561 A JP2013509561 A JP 2013509561A JP 5988962 B2 JP5988962 B2 JP 5988962B2
- Authority
- JP
- Japan
- Prior art keywords
- carrier
- bioreactor
- cells
- carriers
- open space
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M3/00—Tissue, human, animal or plant cell, or virus culture apparatus
- C12M3/04—Tissue, human, animal or plant cell, or virus culture apparatus with means providing thin layers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M25/00—Means for supporting, enclosing or fixing the microorganisms, e.g. immunocoatings
- C12M25/06—Plates; Walls; Drawers; Multilayer plates
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M1/00—Apparatus for enzymology or microbiology
- C12M1/14—Apparatus for enzymology or microbiology with means providing thin layers or with multi-level trays
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M23/00—Constructional details, e.g. recesses, hinges
- C12M23/02—Form or structure of the vessel
- C12M23/04—Flat or tray type, drawers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M23/00—Constructional details, e.g. recesses, hinges
- C12M23/22—Transparent or translucent parts
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M23/00—Constructional details, e.g. recesses, hinges
- C12M23/44—Multiple separable units; Modules
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M25/00—Means for supporting, enclosing or fixing the microorganisms, e.g. immunocoatings
- C12M25/02—Membranes; Filters
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M41/00—Means for regulation, monitoring, measurement or control, e.g. flow regulation
- C12M41/46—Means for regulation, monitoring, measurement or control, e.g. flow regulation of cellular or enzymatic activity or functionality, e.g. cell viability
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/582—Recycling of unreacted starting or intermediate materials
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Zoology (AREA)
- Organic Chemistry (AREA)
- Wood Science & Technology (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- Sustainable Development (AREA)
- Microbiology (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Clinical Laboratory Science (AREA)
- Immunology (AREA)
- Cell Biology (AREA)
- Analytical Chemistry (AREA)
- Virology (AREA)
- Medicinal Chemistry (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Description
液体培地の(pH、温度、O2濃度、CO2濃度などの)パラメーターの値を検出するステップ、および
このパラメーターの値が所定の値未満または以上である間、循環手段またはポンプの作動によって前記液体培地をバイオリアクター内に循環させるステップ。
液体培地の(例えばO2濃度)パラメーターの値を検出するステップ、および
このパラメーターの値が所定の値未満である間、循環手段またはポンプの作動によって前記液体培地をバイオリアクター内に循環させるステップ。
液体(培養)培地の出口を開けることによってバイオリアクターから液体培地を取り出し、バイオリアクター内を空にするステップ、
放出剤(例えばトリプシン)からなる別な液体培地を導入するステップ、
循環手段またはポンプの作動によってバイオリアクター内にこの別な液体培地を循環させるステップ、および
バイオリアクター内を空にすることによって成長した細胞を収穫するステップ。
本発明の第1態様の任意の実施態様によるバイオリアクターに細胞を有する第1液体培地を導入するステップ、
循環手段またはポンプを作動して、第1液体培地をバイオリアクター内で循環させるステップ、
循環手段またはポンプの作動を停止して、バイオリアクターの担体の第1側に細胞を沈着させるステップ、および
適宜行うステップであって、バイオリアクターから液体培地を取り出し、バイオリアクターに細胞を有する第2液体培地を導入し、循環手段またはポンプを作動して、バイオリアクター内で第1液体培地を循環させ、循環手段またはポンプの作動を停止し、バイオリアクターの上下を逆にし、そしてバイオリアクターの担体の第2側に細胞を沈着させるステップ。
本発明の第1態様の任意の実施態様によるバイオリアクターに細胞を有する第1液体培地を導入するステップ、
循環手段またはポンプを作動して、第1液体培地をバイオリアクター内で循環させるステップ、
循環手段またはポンプの作動を停止して、バイオリアクターの担体の第1側に細胞を沈着させるステップ、および
適宜行うステップであって、バイオリアクターから液体培地を取り出し、バイオリアクターに細胞を有する第2液体培地を導入し、循環手段またはポンプを作動して、バイオリアクター内で第1液体培地を循環させ、循環手段またはポンプの作動を停止し、バイオリアクターの上下を逆にし、そしてバイオリアクターの担体の第2側に細胞を沈着させるステップ、
液体培地のパラメーター(例えば酸素濃度)の値を検出するステップ、
このパラメーターの値が所定の値未満である間、循環手段またはポンプの作動によって前記液体培地をバイオリアクター内に循環させるステップ、
細胞成長後、液体(培養)培地の出口を開けることによってバイオリアクターから液体培地を取り出し、バイオリアクター内を空にするステップ、
放出剤(例えばトリプシン)からなる別な液体培地を導入するステップ、
循環手段またはポンプの作動によってバイオリアクター内にこの別な液体培地を循環させるステップ、および
バイオリアクター内を空にすることによって成長した細胞を収穫するステップ。
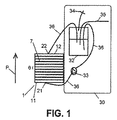
1:バイオリアクター
2:開放スペース
3:下部キャビティ
4:上部キャビティ
5:流体チャネル
6:レベル
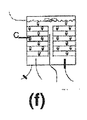
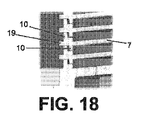
7:担体
9:インペラー
11:第1側
12:第2側
21:入り口ポート
22:出口ポート
30:外部循環システム
32:培地貯蔵タンク
Claims (1)
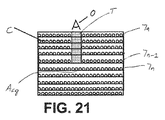
- N個の担体の積層体と、組み込まれた透明材料のカラム(T)とを具備してなり、該カラム(T)により担体N−1の表面上の細胞成長領域を外部の任意の位置からの光学的透明な観察線を形成するようにしたことを特徴とするバイオリアクター(1)。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB1007863.2 | 2010-05-11 | ||
| GBGB1007861.6A GB201007861D0 (en) | 2010-05-11 | 2010-05-11 | Dynamic bioreactor for cell culture |
| GBGB1007863.2A GB201007863D0 (en) | 2010-05-11 | 2010-05-11 | Bioreactor for cell culture |
| GB1007855.8 | 2010-05-11 | ||
| GBGB1007855.8A GB201007855D0 (en) | 2010-05-11 | 2010-05-11 | Bioreactor for the culture of cells |
| GB1007861.6 | 2010-05-11 | ||
| PCT/EP2011/057621 WO2011141512A2 (en) | 2010-05-11 | 2011-05-11 | Apparatus and methods for cell culture |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016054350A Division JP2016144464A (ja) | 2010-05-11 | 2016-03-17 | 細胞培養装置および細胞培養方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2013526269A JP2013526269A (ja) | 2013-06-24 |
| JP2013526269A5 JP2013526269A5 (ja) | 2014-06-19 |
| JP5988962B2 true JP5988962B2 (ja) | 2016-09-07 |
Family
ID=44914753
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013509561A Active JP5988962B2 (ja) | 2010-05-11 | 2011-05-11 | 細胞培養装置および細胞培養方法 |
| JP2016054350A Pending JP2016144464A (ja) | 2010-05-11 | 2016-03-17 | 細胞培養装置および細胞培養方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016054350A Pending JP2016144464A (ja) | 2010-05-11 | 2016-03-17 | 細胞培養装置および細胞培養方法 |
Country Status (9)
| Country | Link |
|---|---|
| US (3) | US9399755B2 (ja) |
| EP (1) | EP2516618B1 (ja) |
| JP (2) | JP5988962B2 (ja) |
| KR (1) | KR20130109000A (ja) |
| CN (1) | CN102947438B (ja) |
| AU (1) | AU2011252063A1 (ja) |
| BR (1) | BR112012028786A2 (ja) |
| SG (2) | SG10201503666UA (ja) |
| WO (1) | WO2011141512A2 (ja) |
Families Citing this family (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9273278B2 (en) * | 2013-01-07 | 2016-03-01 | Cesco Bioengineering Co., Ltd. | Large scale cell harvesting method for pack-bed culture device |
| CN103146578B (zh) * | 2013-03-29 | 2014-11-05 | 东北农业大学 | 转基因细胞培养装置 |
| KR20150117599A (ko) * | 2014-04-09 | 2015-10-20 | 에스케이이노베이션 주식회사 | 바이오매스의 연속당화 반응기 |
| GB2563794B (en) * | 2016-03-14 | 2021-02-24 | Dhirubhai Patel Ravindrakumar | A bioreactor system and method thereof |
| CN116555028A (zh) * | 2016-07-12 | 2023-08-08 | 加州理工学院 | 用于高密度细胞生长和代谢物交换的基质 |
| JP6942448B2 (ja) * | 2016-08-08 | 2021-09-29 | 株式会社カネカ | 細胞培養容器、これを用いた細胞培養システム、および細胞培養方法 |
| WO2018037402A1 (en) | 2016-08-21 | 2018-03-01 | Adva Biotechnology Ltd. | Bioreactor and methods of use thereof |
| BE1024733B1 (fr) | 2016-11-09 | 2018-06-14 | Univercells Sa | Matrice de croissance cellulaire |
| DE102017128489A1 (de) * | 2017-09-26 | 2019-03-28 | Elmos Semiconductor Aktiengesellschaft | Selbsttestfähiges Bussystem und Verwendung dieser Selbsttestfähigkeit zur Vergabe von Busknotenadressen mit einer Erkennung der Vertauschung von Eingängen und Ausgängen |
| EP3493479B1 (de) * | 2017-11-30 | 2020-12-02 | Elmos Semiconductor SE | Verfahren zum einspeisen von adressierungsströmen durch busknoten eines seriellen datenbussystems und busknoten für ein derartiges datenbussystem |
| US10367782B2 (en) * | 2017-12-05 | 2019-07-30 | Elmos Semiconductor Ag | Serial bus auto-addressing |
| CN111801410A (zh) * | 2017-12-20 | 2020-10-20 | 尤尼沃尔塞尔斯技术股份公司 | 生物反应器及相关方法 |
| BE1026108B1 (fr) * | 2018-03-16 | 2019-10-14 | Univercells S.A. | Échantillonneur à lit fixe et procédés associés |
| JP2021531767A (ja) * | 2018-07-27 | 2021-11-25 | ユニバーセルズ テクノロジーズ エス.エー.Univercells Technologies S.A. | 生体分子を製造するためのシステムおよび方法 |
| GB2579673A (en) * | 2018-12-12 | 2020-07-01 | Haemair Ltd | Cell washing apparatus |
| US20200347334A1 (en) * | 2019-04-30 | 2020-11-05 | Pbs Biotech, Inc. | Macrocarriers for cell growth in bioreactors |
| CA3141870C (en) | 2019-05-28 | 2023-08-01 | Upside Foods, Inc. | Apparatuses and methods for preparing a comestible meat product |
| CN114599782A (zh) * | 2019-07-01 | 2022-06-07 | 科学生物技术公司 | 用于在多并联生物反应器中培养粘附细胞的方法 |
| WO2021081170A1 (en) * | 2019-10-24 | 2021-04-29 | Octane Biotech Inc. | Cell culture chamber with improved cell-contacting surfaces |
| WO2021084077A1 (en) | 2019-10-30 | 2021-05-06 | Minaris Regenerative Medicine Gmbh | Bioreactor for adherent cells |
| IL310833A (en) | 2019-11-20 | 2024-04-01 | Upside Foods Inc | Devices and methods for preparing a meat product |
| EP4093846A4 (en) | 2020-01-20 | 2024-04-03 | Adva Biotechnology Ltd | DEVICE AND METHOD FOR CONTROLLING A BIOREACTOR |
| CN113861296A (zh) * | 2020-06-30 | 2021-12-31 | 广州凌腾生物医药有限公司 | 一种使用环轨摇晃式生物反应器制备双特异性抗体的方法 |
| US20240052283A1 (en) * | 2021-01-26 | 2024-02-15 | Hitachi High-Tech Corporation | Aseptic Sampling Apparatus and Aseptic Sampling Method |
| CN114276927B (zh) * | 2021-12-29 | 2024-05-10 | 上海日泰医药设备工程有限公司 | 一种用于生物反应器的折叠式载体柱 |
| US11981884B2 (en) | 2022-10-17 | 2024-05-14 | Upside Foods, Inc. | Pipe-based bioreactors for producing comestible meat products and methods of using the same |
| CN115369036B (zh) * | 2022-10-21 | 2023-07-04 | 天信和(苏州)生物科技有限公司 | 细胞培养载体组件及生物反应器 |
| CN117070451B (zh) * | 2023-10-13 | 2024-01-30 | 北京中卫医正科技有限公司 | 一种间充质干细胞的传代培养方法 |
Family Cites Families (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5299284A (en) | 1976-02-13 | 1977-08-19 | Toray Ind Inc | Cell culturing device |
| US4307193A (en) * | 1978-06-09 | 1981-12-22 | Toray Industries, Inc. | Method of producing interferon |
| US4654308A (en) | 1985-06-19 | 1987-03-31 | La Corporation De L'ecole Polytechnique | Bioreactor |
| US4734373A (en) * | 1986-06-24 | 1988-03-29 | Bartal Arie H | Apparatus for enhancing cell growth, preservation and transport |
| US5079161A (en) * | 1988-06-27 | 1992-01-07 | Snow Brand Milk Products Co., Ltd. | Method and apparatus for cell culture with immobilizing carriers |
| DE3923279A1 (de) * | 1989-07-14 | 1990-01-18 | Will W Prof Dr Minuth | Minusheets ist ein neues produkt, um zellen in beliebigen behaeltnissen in hochdifferenzierter form auf einer moeglichst natuerlichen unterlage zu kultivieren |
| DE4206585C2 (de) * | 1992-03-03 | 1994-11-24 | Augustinus Dr Med Bader | Vorrichtung zur Massenkultur von Zellen |
| US5776748A (en) | 1993-10-04 | 1998-07-07 | President And Fellows Of Harvard College | Method of formation of microstamped patterns on plates for adhesion of cells and other biological materials, devices and uses therefor |
| JP3049183B2 (ja) * | 1994-02-15 | 2000-06-05 | 石川島播磨重工業株式会社 | 光合成生物の培養装置 |
| GB2338243A (en) | 1998-06-11 | 1999-12-15 | Nicholas George Maroudas | Macro carrier for cell culture |
| US6572830B1 (en) * | 1998-10-09 | 2003-06-03 | Motorola, Inc. | Integrated multilayered microfludic devices and methods for making the same |
| JP2002528567A (ja) * | 1998-10-28 | 2002-09-03 | アシュビー・サイエンティフィック・リミテッド | 織り込まれた多孔性シリコーンラバー |
| US6562616B1 (en) * | 1999-06-21 | 2003-05-13 | The General Hospital Corporation | Methods and devices for cell culturing and organ assist systems |
| US6569675B2 (en) * | 2000-06-16 | 2003-05-27 | Corning Incorporated | Cell cultivating flask and method for using the cell cultivating flask |
| ATE277685T1 (de) | 2000-12-20 | 2004-10-15 | Corning Inc | Verfahren unter verwendung eines monolithischen stapelreaktors |
| EP1253196B1 (en) * | 2001-03-29 | 2009-09-02 | Canon Kabushiki Kaisha | Substratum for cell culture, production of the same, cell culture method |
| JP2003093041A (ja) * | 2001-09-25 | 2003-04-02 | Hamamatsu Photonics Kk | 培養試料観察装置 |
| ATE509272T1 (de) * | 2001-11-09 | 2011-05-15 | 3Dbiosurfaces Technologies Llc | Substrate mit hochliegendem oberflächenbereich für mikroarrays sowie verfahren zur herstellung davon |
| JP4049263B2 (ja) * | 2003-05-20 | 2008-02-20 | 株式会社ハイロックス | 多段式培養容器内に培養された細胞の観察装置 |
| CN103173354B (zh) | 2003-10-08 | 2017-07-14 | 威尔森沃尔夫制造公司 | 利用透气性材料进行细胞培养的方法及装置 |
| US7078228B2 (en) | 2003-12-31 | 2006-07-18 | Corning Incorporated | Cell cultivating flask |
| JP4456393B2 (ja) * | 2004-03-26 | 2010-04-28 | 大日本印刷株式会社 | 細胞培養基板の製造方法および細胞培養基板製造装置 |
| JP4699361B2 (ja) | 2004-04-26 | 2011-06-08 | 大日本印刷株式会社 | 細胞培養用パターニング基板およびその製造方法 |
| EP1851304A4 (en) | 2005-02-23 | 2009-10-21 | Cook William A Australia | CULTURE DEVICE |
| US7745209B2 (en) * | 2005-07-26 | 2010-06-29 | Corning Incorporated | Multilayered cell culture apparatus |
| BE1016793A4 (fr) | 2005-10-04 | 2007-06-05 | Artelis | Procede de culture de cellules et dispositif permettant sa mise en oeuvre. |
| JP5157139B2 (ja) * | 2006-11-28 | 2013-03-06 | 大日本印刷株式会社 | 細胞移植用部材 |
| CA2671967A1 (en) * | 2006-12-07 | 2008-06-19 | Wilson Wolf Manufacturing Corporation | Highly efficient devices and methods for culturing cells |
| JP2009124977A (ja) * | 2007-11-21 | 2009-06-11 | Ulvac Japan Ltd | 細胞接着又は培養用基板およびその製造方法 |
| KR100946643B1 (ko) * | 2007-11-30 | 2010-03-09 | 코아스템(주) | 세포배양장치 및 이를 구비한 대용량 자동화 세포배양기 |
| US8216828B2 (en) | 2008-05-30 | 2012-07-10 | Corning Incorporated | Assembly of cell culture vessels |
| US9068156B2 (en) | 2008-07-31 | 2015-06-30 | Advanced Bio Energy Development Llc | Horizontal plate microbial support media |
| US9249383B2 (en) * | 2008-10-08 | 2016-02-02 | Agency For Science Technology & Research | Apparatus for culturing anchorage dependent cells |
| EP2698425B1 (en) | 2009-02-25 | 2015-09-09 | Corning Incorporated | Cell culture system with collector |
-
2011
- 2011-05-11 EP EP11726361.6A patent/EP2516618B1/en active Active
- 2011-05-11 WO PCT/EP2011/057621 patent/WO2011141512A2/en active Application Filing
- 2011-05-11 US US13/697,491 patent/US9399755B2/en active Active
- 2011-05-11 CN CN201180023670.XA patent/CN102947438B/zh active Active
- 2011-05-11 KR KR1020127032214A patent/KR20130109000A/ko not_active Application Discontinuation
- 2011-05-11 SG SG10201503666UA patent/SG10201503666UA/en unknown
- 2011-05-11 SG SG2012081543A patent/SG185434A1/en unknown
- 2011-05-11 AU AU2011252063A patent/AU2011252063A1/en not_active Abandoned
- 2011-05-11 JP JP2013509561A patent/JP5988962B2/ja active Active
- 2011-05-11 BR BR112012028786A patent/BR112012028786A2/pt not_active IP Right Cessation
-
2016
- 2016-03-17 JP JP2016054350A patent/JP2016144464A/ja active Pending
- 2016-07-25 US US15/218,992 patent/US20170015967A1/en not_active Abandoned
-
2021
- 2021-12-30 US US17/566,091 patent/US20220380711A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| US20130059339A1 (en) | 2013-03-07 |
| WO2011141512A2 (en) | 2011-11-17 |
| SG10201503666UA (en) | 2015-06-29 |
| BR112012028786A2 (pt) | 2015-11-24 |
| AU2011252063A1 (en) | 2012-11-29 |
| CN102947438A (zh) | 2013-02-27 |
| SG185434A1 (en) | 2012-12-28 |
| EP2516618B1 (en) | 2020-07-08 |
| US20170015967A1 (en) | 2017-01-19 |
| CN102947438B (zh) | 2017-01-18 |
| KR20130109000A (ko) | 2013-10-07 |
| JP2016144464A (ja) | 2016-08-12 |
| US20220380711A1 (en) | 2022-12-01 |
| JP2013526269A (ja) | 2013-06-24 |
| EP2516618A2 (en) | 2012-10-31 |
| WO2011141512A3 (en) | 2012-03-15 |
| US9399755B2 (en) | 2016-07-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5988962B2 (ja) | 細胞培養装置および細胞培養方法 | |
| ES2955959T3 (es) | Un sistema de biorreactor y método del mismo | |
| CA2923300C (en) | Modular aeration device | |
| US20230348834A1 (en) | Fixed bed bioreactor vessel and methods of using the same | |
| EP4048773A1 (en) | Cell culture chamber with improved cell-contacting surfaces | |
| US20230009199A1 (en) | Stacked fixed bed bioreactor and methods of using the same | |
| US20230010639A1 (en) | Radial flow fixed bed bioreactor and methods of using the same | |
| US20230392105A1 (en) | Bioreactor media condition system and related methods | |
| US20240002771A1 (en) | Cell culture media conditioning vessels and perfusion bioreactor system | |
| JP2023532668A (ja) | 管状の充填床細胞培養容器、そのシステム、および、それに関連する方法 | |
| WO2024107348A1 (en) | Systems and methods for coating a bioreactor substrate | |
| CN116568801A (zh) | 细胞培养基调节容器和灌注生物反应器系统 | |
| CN114798023A (zh) | 一种模块化微流控芯片平台、工作方法及应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140501 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20140501 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20150227 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150310 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150610 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20151117 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160317 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20160413 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20160510 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20160719 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20160809 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5988962 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |