JP5865397B2 - α7nAChRのモジュレータとして使用されるピロール誘導体 - Google Patents
α7nAChRのモジュレータとして使用されるピロール誘導体 Download PDFInfo
- Publication number
- JP5865397B2 JP5865397B2 JP2013552304A JP2013552304A JP5865397B2 JP 5865397 B2 JP5865397 B2 JP 5865397B2 JP 2013552304 A JP2013552304 A JP 2013552304A JP 2013552304 A JP2013552304 A JP 2013552304A JP 5865397 B2 JP5865397 B2 JP 5865397B2
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- optionally substituted
- methyl
- propionyl
- pyrrol
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 108700006085 alpha7 Nicotinic Acetylcholine Receptor Proteins 0.000 title description 3
- 102000047725 alpha7 Nicotinic Acetylcholine Receptor Human genes 0.000 title description 3
- 150000003233 pyrroles Chemical class 0.000 title 1
- 150000001875 compounds Chemical class 0.000 claims description 167
- 125000000217 alkyl group Chemical group 0.000 claims description 116
- -1 cyano, hydroxy Chemical group 0.000 claims description 84
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 claims description 75
- 125000001072 heteroaryl group Chemical group 0.000 claims description 56
- 125000000623 heterocyclic group Chemical group 0.000 claims description 52
- 125000003118 aryl group Chemical group 0.000 claims description 41
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 27
- 150000001408 amides Chemical class 0.000 claims description 26
- 229910052736 halogen Inorganic materials 0.000 claims description 26
- 150000002367 halogens Chemical class 0.000 claims description 25
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 23
- 229910052739 hydrogen Inorganic materials 0.000 claims description 23
- 239000001257 hydrogen Substances 0.000 claims description 23
- 125000001424 substituent group Chemical group 0.000 claims description 22
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 21
- 125000003107 substituted aryl group Chemical group 0.000 claims description 21
- 125000000547 substituted alkyl group Chemical group 0.000 claims description 20
- 125000005346 substituted cycloalkyl group Chemical group 0.000 claims description 20
- 206010012289 Dementia Diseases 0.000 claims description 19
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 19
- 208000010877 cognitive disease Diseases 0.000 claims description 17
- 208000035475 disorder Diseases 0.000 claims description 17
- 239000000126 substance Substances 0.000 claims description 17
- 125000004404 heteroalkyl group Chemical group 0.000 claims description 16
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 16
- 208000024827 Alzheimer disease Diseases 0.000 claims description 14
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 14
- 229910052760 oxygen Inorganic materials 0.000 claims description 14
- 201000000980 schizophrenia Diseases 0.000 claims description 13
- 229910052717 sulfur Inorganic materials 0.000 claims description 13
- 208000002193 Pain Diseases 0.000 claims description 12
- 125000004043 oxo group Chemical group O=* 0.000 claims description 12
- 150000003839 salts Chemical class 0.000 claims description 12
- 125000004432 carbon atom Chemical group C* 0.000 claims description 11
- 208000030886 Traumatic Brain injury Diseases 0.000 claims description 10
- 201000010099 disease Diseases 0.000 claims description 10
- 208000024891 symptom Diseases 0.000 claims description 10
- 208000006096 Attention Deficit Disorder with Hyperactivity Diseases 0.000 claims description 9
- 208000018737 Parkinson disease Diseases 0.000 claims description 9
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 9
- 230000009529 traumatic brain injury Effects 0.000 claims description 9
- KHBQMWCZKVMBLN-UHFFFAOYSA-N Benzenesulfonamide Chemical compound NS(=O)(=O)C1=CC=CC=C1 KHBQMWCZKVMBLN-UHFFFAOYSA-N 0.000 claims description 8
- 208000028698 Cognitive impairment Diseases 0.000 claims description 8
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 8
- 229910052757 nitrogen Inorganic materials 0.000 claims description 8
- 239000008194 pharmaceutical composition Substances 0.000 claims description 8
- DFOIZESJWAQQFQ-UHFFFAOYSA-N 4-[5-(4,4-dimethyl-2,3-dihydrochromen-6-yl)-2-methyl-3-propanoylpyrrol-1-yl]benzenesulfonamide Chemical compound CC1=C(C(=O)CC)C=C(C=2C=C3C(C)(C)CCOC3=CC=2)N1C1=CC=C(S(N)(=O)=O)C=C1 DFOIZESJWAQQFQ-UHFFFAOYSA-N 0.000 claims description 7
- 208000036864 Attention deficit/hyperactivity disease Diseases 0.000 claims description 7
- 102000019315 Nicotinic acetylcholine receptors Human genes 0.000 claims description 7
- 108050006807 Nicotinic acetylcholine receptors Proteins 0.000 claims description 7
- 208000015802 attention deficit-hyperactivity disease Diseases 0.000 claims description 7
- 229910052799 carbon Inorganic materials 0.000 claims description 7
- 125000005842 heteroatom Chemical group 0.000 claims description 7
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims description 6
- 206010061218 Inflammation Diseases 0.000 claims description 6
- 206010040070 Septic Shock Diseases 0.000 claims description 6
- 230000004054 inflammatory process Effects 0.000 claims description 6
- 210000000056 organ Anatomy 0.000 claims description 6
- RHBODKIUOLTNRO-UHFFFAOYSA-N 4-[5-(2,2-dimethyl-3,4-dihydrochromen-6-yl)-2-methyl-3-propanoylpyrrol-1-yl]benzenesulfonamide Chemical compound CC1=C(C(=O)CC)C=C(C=2C=C3CCC(C)(C)OC3=CC=2)N1C1=CC=C(S(N)(=O)=O)C=C1 RHBODKIUOLTNRO-UHFFFAOYSA-N 0.000 claims description 5
- UQUQXVOBIZNVNG-UHFFFAOYSA-N 4-[5-(8-fluoro-4,4-dimethyl-2,3-dihydrochromen-6-yl)-2-methyl-3-propanoylpyrrol-1-yl]benzenesulfonamide Chemical compound CC1=C(C(=O)CC)C=C(C=2C=C3C(C)(C)CCOC3=C(F)C=2)N1C1=CC=C(S(N)(=O)=O)C=C1 UQUQXVOBIZNVNG-UHFFFAOYSA-N 0.000 claims description 5
- 208000030507 AIDS Diseases 0.000 claims description 5
- 230000001154 acute effect Effects 0.000 claims description 5
- 206010003246 arthritis Diseases 0.000 claims description 5
- 230000019771 cognition Effects 0.000 claims description 5
- 208000027061 mild cognitive impairment Diseases 0.000 claims description 5
- QJZJGAGMJJSWRD-UHFFFAOYSA-N 4-[2-methyl-3-propanoyl-5-(1,4,4-trimethyl-2-oxo-3h-quinolin-6-yl)pyrrol-1-yl]benzenesulfonamide Chemical compound CC1=C(C(=O)CC)C=C(C=2C=C3C(C)(C)CC(=O)N(C)C3=CC=2)N1C1=CC=C(S(N)(=O)=O)C=C1 QJZJGAGMJJSWRD-UHFFFAOYSA-N 0.000 claims description 4
- ATVATHGNDUETKK-UHFFFAOYSA-N 4-[5-(2,3-dihydro-1h-inden-4-yl)-2-methyl-3-propanoylpyrrol-1-yl]benzenesulfonamide Chemical compound CC1=C(C(=O)CC)C=C(C=2C=3CCCC=3C=CC=2)N1C1=CC=C(S(N)(=O)=O)C=C1 ATVATHGNDUETKK-UHFFFAOYSA-N 0.000 claims description 4
- KWJALAVCSKHXSA-UHFFFAOYSA-N 4-[5-(4,4-dimethyl-2,3-dihydro-1h-quinolin-7-yl)-2-methyl-3-propanoylpyrrol-1-yl]benzenesulfonamide Chemical compound CC1=C(C(=O)CC)C=C(C=2C=C3C(C(CCN3)(C)C)=CC=2)N1C1=CC=C(S(N)(=O)=O)C=C1 KWJALAVCSKHXSA-UHFFFAOYSA-N 0.000 claims description 4
- 208000020925 Bipolar disease Diseases 0.000 claims description 4
- 201000010374 Down Syndrome Diseases 0.000 claims description 4
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 4
- 230000033115 angiogenesis Effects 0.000 claims description 4
- 210000004204 blood vessel Anatomy 0.000 claims description 4
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 claims description 4
- 230000012010 growth Effects 0.000 claims description 4
- 125000005843 halogen group Chemical group 0.000 claims description 4
- 208000026278 immune system disease Diseases 0.000 claims description 4
- 210000004558 lewy body Anatomy 0.000 claims description 4
- 230000001404 mediated effect Effects 0.000 claims description 4
- LTEZKLTYUKOFNO-UHFFFAOYSA-N 1-(4-sulfamoylphenyl)pyrrole-3-carboxylic acid Chemical compound C1=CC(S(=O)(=O)N)=CC=C1N1C=C(C(O)=O)C=C1 LTEZKLTYUKOFNO-UHFFFAOYSA-N 0.000 claims description 3
- VHWQGUPMLYQUEM-UHFFFAOYSA-N 4-[5-(4,4-dimethyl-2,3-dihydro-1h-isoquinolin-7-yl)-2-methyl-3-propanoylpyrrol-1-yl]benzenesulfonamide Chemical compound CC1=C(C(=O)CC)C=C(C=2C=C3C(C(CNC3)(C)C)=CC=2)N1C1=CC=C(S(N)(=O)=O)C=C1 VHWQGUPMLYQUEM-UHFFFAOYSA-N 0.000 claims description 3
- 208000000094 Chronic Pain Diseases 0.000 claims description 3
- 206010009900 Colitis ulcerative Diseases 0.000 claims description 3
- 208000011231 Crohn disease Diseases 0.000 claims description 3
- 201000011240 Frontotemporal dementia Diseases 0.000 claims description 3
- 208000023105 Huntington disease Diseases 0.000 claims description 3
- 208000022559 Inflammatory bowel disease Diseases 0.000 claims description 3
- 206010033645 Pancreatitis Diseases 0.000 claims description 3
- 208000000609 Pick Disease of the Brain Diseases 0.000 claims description 3
- 208000004550 Postoperative Pain Diseases 0.000 claims description 3
- 206010044248 Toxic shock syndrome Diseases 0.000 claims description 3
- 231100000650 Toxic shock syndrome Toxicity 0.000 claims description 3
- 206010052779 Transplant rejections Diseases 0.000 claims description 3
- 201000006704 Ulcerative Colitis Diseases 0.000 claims description 3
- 208000005298 acute pain Diseases 0.000 claims description 3
- 230000001684 chronic effect Effects 0.000 claims description 3
- 208000035231 inattentive type attention deficit hyperactivity disease Diseases 0.000 claims description 3
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 3
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 3
- 230000036303 septic shock Effects 0.000 claims description 3
- 208000011580 syndromic disease Diseases 0.000 claims description 3
- 206010002556 Ankylosing Spondylitis Diseases 0.000 claims description 2
- 208000015943 Coeliac disease Diseases 0.000 claims description 2
- 206010065390 Inflammatory pain Diseases 0.000 claims description 2
- 201000004681 Psoriasis Diseases 0.000 claims description 2
- 206010039966 Senile dementia Diseases 0.000 claims description 2
- 150000001924 cycloalkanes Chemical class 0.000 claims description 2
- 201000003146 cystitis Diseases 0.000 claims description 2
- 208000004296 neuralgia Diseases 0.000 claims description 2
- 208000021722 neuropathic pain Diseases 0.000 claims description 2
- 201000001245 periodontitis Diseases 0.000 claims description 2
- 201000000306 sarcoidosis Diseases 0.000 claims description 2
- 230000005586 smoking cessation Effects 0.000 claims description 2
- 230000029663 wound healing Effects 0.000 claims description 2
- 150000002431 hydrogen Chemical class 0.000 claims 5
- 125000004070 6 membered heterocyclic group Chemical group 0.000 claims 1
- 208000013677 cerebrovascular dementia Diseases 0.000 claims 1
- 239000003937 drug carrier Substances 0.000 claims 1
- 230000002980 postoperative effect Effects 0.000 claims 1
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 204
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 90
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 85
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 75
- 230000002829 reductive effect Effects 0.000 description 73
- 239000011541 reaction mixture Substances 0.000 description 72
- 239000000243 solution Substances 0.000 description 71
- 238000006243 chemical reaction Methods 0.000 description 56
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 54
- 239000002904 solvent Substances 0.000 description 53
- 238000004809 thin layer chromatography Methods 0.000 description 46
- 238000000034 method Methods 0.000 description 43
- 239000000203 mixture Substances 0.000 description 43
- 239000012044 organic layer Substances 0.000 description 42
- 239000012043 crude product Substances 0.000 description 41
- 239000011734 sodium Substances 0.000 description 41
- 239000003480 eluent Substances 0.000 description 40
- 238000004440 column chromatography Methods 0.000 description 39
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 39
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 36
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 36
- 102000015296 acetylcholine-gated cation-selective channel activity proteins Human genes 0.000 description 32
- 108040006409 acetylcholine-gated cation-selective channel activity proteins Proteins 0.000 description 32
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 28
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 26
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 22
- 239000000741 silica gel Substances 0.000 description 21
- 229910002027 silica gel Inorganic materials 0.000 description 21
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 20
- 102000009660 Cholinergic Receptors Human genes 0.000 description 15
- 108010009685 Cholinergic Receptors Proteins 0.000 description 15
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 15
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 14
- 239000000556 agonist Substances 0.000 description 14
- 238000011282 treatment Methods 0.000 description 14
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 13
- 238000002360 preparation method Methods 0.000 description 13
- 229940124530 sulfonamide Drugs 0.000 description 13
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 12
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 12
- 229910052708 sodium Inorganic materials 0.000 description 12
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 11
- 239000010410 layer Substances 0.000 description 11
- 230000002265 prevention Effects 0.000 description 11
- 229910021529 ammonia Inorganic materials 0.000 description 10
- FDDDEECHVMSUSB-UHFFFAOYSA-N sulfanilamide Chemical compound NC1=CC=C(S(N)(=O)=O)C=C1 FDDDEECHVMSUSB-UHFFFAOYSA-N 0.000 description 10
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- 239000003153 chemical reaction reagent Substances 0.000 description 8
- ORTQZVOHEJQUHG-UHFFFAOYSA-L copper(II) chloride Chemical compound Cl[Cu]Cl ORTQZVOHEJQUHG-UHFFFAOYSA-L 0.000 description 8
- 230000000694 effects Effects 0.000 description 8
- NDOGLIPWGGRQCO-UHFFFAOYSA-N hexane-2,4-dione Chemical compound CCC(=O)CC(C)=O NDOGLIPWGGRQCO-UHFFFAOYSA-N 0.000 description 8
- 230000015654 memory Effects 0.000 description 8
- KKOFYQBBUSZDKJ-UHFFFAOYSA-N 4-oxohexanal Chemical compound CCC(=O)CCC=O KKOFYQBBUSZDKJ-UHFFFAOYSA-N 0.000 description 7
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 7
- OIPILFWXSMYKGL-UHFFFAOYSA-N acetylcholine Chemical compound CC(=O)OCC[N+](C)(C)C OIPILFWXSMYKGL-UHFFFAOYSA-N 0.000 description 7
- 229910052794 bromium Inorganic materials 0.000 description 7
- 210000004027 cell Anatomy 0.000 description 7
- 239000012299 nitrogen atmosphere Substances 0.000 description 7
- 238000002953 preparative HPLC Methods 0.000 description 7
- 238000003756 stirring Methods 0.000 description 7
- LSTRKXWIZZZYAS-UHFFFAOYSA-N 2-bromoacetyl bromide Chemical compound BrCC(Br)=O LSTRKXWIZZZYAS-UHFFFAOYSA-N 0.000 description 6
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 6
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 6
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 6
- 229960004373 acetylcholine Drugs 0.000 description 6
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 6
- 239000003814 drug Substances 0.000 description 6
- 230000004770 neurodegeneration Effects 0.000 description 6
- SNICXCGAKADSCV-JTQLQIEISA-N (-)-Nicotine Chemical compound CN1CCC[C@H]1C1=CC=CN=C1 SNICXCGAKADSCV-JTQLQIEISA-N 0.000 description 5
- 238000005727 Friedel-Crafts reaction Methods 0.000 description 5
- 230000003935 attention Effects 0.000 description 5
- 125000005605 benzo group Chemical group 0.000 description 5
- 210000004556 brain Anatomy 0.000 description 5
- 239000013078 crystal Substances 0.000 description 5
- 125000004122 cyclic group Chemical group 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 238000010438 heat treatment Methods 0.000 description 5
- 239000002207 metabolite Substances 0.000 description 5
- 125000002950 monocyclic group Chemical group 0.000 description 5
- 229960002715 nicotine Drugs 0.000 description 5
- SNICXCGAKADSCV-UHFFFAOYSA-N nicotine Natural products CN1CCCC1C1=CC=CN=C1 SNICXCGAKADSCV-UHFFFAOYSA-N 0.000 description 5
- 230000003287 optical effect Effects 0.000 description 5
- 229940002612 prodrug Drugs 0.000 description 5
- 239000000651 prodrug Substances 0.000 description 5
- 102000005962 receptors Human genes 0.000 description 5
- 108020003175 receptors Proteins 0.000 description 5
- 239000012453 solvate Substances 0.000 description 5
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 4
- FPIRBHDGWMWJEP-UHFFFAOYSA-N 1-hydroxy-7-azabenzotriazole Chemical compound C1=CN=C2N(O)N=NC2=C1 FPIRBHDGWMWJEP-UHFFFAOYSA-N 0.000 description 4
- ZJSQZQMVXKZAGW-UHFFFAOYSA-N 2H-benzotriazol-4-ol hydrate Chemical compound O.OC1=CC=CC2=C1N=NN2 ZJSQZQMVXKZAGW-UHFFFAOYSA-N 0.000 description 4
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 4
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 4
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 4
- 102000015696 Interleukins Human genes 0.000 description 4
- 108010063738 Interleukins Proteins 0.000 description 4
- 102000004086 Ligand-Gated Ion Channels Human genes 0.000 description 4
- 108090000543 Ligand-Gated Ion Channels Proteins 0.000 description 4
- 206010057852 Nicotine dependence Diseases 0.000 description 4
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 4
- 206010036376 Postherpetic Neuralgia Diseases 0.000 description 4
- 208000025569 Tobacco Use disease Diseases 0.000 description 4
- 150000004945 aromatic hydrocarbons Chemical group 0.000 description 4
- 125000002619 bicyclic group Chemical group 0.000 description 4
- 239000011575 calcium Substances 0.000 description 4
- 230000001713 cholinergic effect Effects 0.000 description 4
- QTMDXZNDVAMKGV-UHFFFAOYSA-L copper(ii) bromide Chemical compound [Cu+2].[Br-].[Br-] QTMDXZNDVAMKGV-UHFFFAOYSA-L 0.000 description 4
- 229960003280 cupric chloride Drugs 0.000 description 4
- 230000014509 gene expression Effects 0.000 description 4
- 230000026030 halogenation Effects 0.000 description 4
- 238000005658 halogenation reaction Methods 0.000 description 4
- 239000000543 intermediate Substances 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- BKIMMITUMNQMOS-UHFFFAOYSA-N nonane Chemical compound CCCCCCCCC BKIMMITUMNQMOS-UHFFFAOYSA-N 0.000 description 4
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 4
- 210000001428 peripheral nervous system Anatomy 0.000 description 4
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 4
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 4
- QXHQVRMMMHAXJO-UHFFFAOYSA-N 1-(1-acetyl-4,4-dimethyl-2,3-dihydroquinolin-7-yl)-2-bromoethanone Chemical compound C1=C(C(=O)CBr)C=C2N(C(=O)C)CCC(C)(C)C2=C1 QXHQVRMMMHAXJO-UHFFFAOYSA-N 0.000 description 3
- ANCFIOCIKDKJFE-UHFFFAOYSA-N 1-(2-acetyl-4,4-dimethyl-1,3-dihydroisoquinolin-6-yl)-2-bromoethanone Chemical compound C1=C(C(=O)CBr)C=C2C(C)(C)CN(C(=O)C)CC2=C1 ANCFIOCIKDKJFE-UHFFFAOYSA-N 0.000 description 3
- JSDQXPMCPUSROD-UHFFFAOYSA-N 1-(2-acetyl-4,4-dimethyl-1,3-dihydroisoquinolin-7-yl)-2-bromoethanone Chemical compound BrCC(=O)C1=CC=C2C(C)(C)CN(C(=O)C)CC2=C1 JSDQXPMCPUSROD-UHFFFAOYSA-N 0.000 description 3
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 3
- MBOVJGXZQKHWKU-UHFFFAOYSA-N 2-bromo-1-(4,4-dimethyl-2,3-dihydrochromen-6-yl)ethanone Chemical compound C1=C(C(=O)CBr)C=C2C(C)(C)CCOC2=C1 MBOVJGXZQKHWKU-UHFFFAOYSA-N 0.000 description 3
- CKBMAVBNRWYEGR-UHFFFAOYSA-N 3-acetyl-1-(1-acetyl-4,4-dimethyl-2,3-dihydroquinolin-6-yl)hexane-1,4-dione Chemical compound CC(=O)N1CCC(C)(C)C2=CC(C(=O)CC(C(=O)CC)C(C)=O)=CC=C21 CKBMAVBNRWYEGR-UHFFFAOYSA-N 0.000 description 3
- MLYGAHQZVCMLKW-UHFFFAOYSA-N 3-acetyl-1-(2-acetyl-4,4-dimethyl-1,3-dihydroisoquinolin-7-yl)hexane-1,4-dione Chemical compound C1N(C(C)=O)CC(C)(C)C=2C1=CC(C(=O)CC(C(=O)CC)C(C)=O)=CC=2 MLYGAHQZVCMLKW-UHFFFAOYSA-N 0.000 description 3
- FFTYOJMUJFBPEP-UHFFFAOYSA-N 3-acetyl-1-(4,4-dimethyl-2-oxo-1,3-dihydroquinolin-6-yl)hexane-1,4-dione Chemical compound N1C(=O)CC(C)(C)C2=CC(C(=O)CC(C(=O)CC)C(C)=O)=CC=C21 FFTYOJMUJFBPEP-UHFFFAOYSA-N 0.000 description 3
- GBCXSPCJVLKIQO-UHFFFAOYSA-N 4-(2-fluorophenoxy)-2-methylbutan-2-ol Chemical compound CC(C)(O)CCOC1=CC=CC=C1F GBCXSPCJVLKIQO-UHFFFAOYSA-N 0.000 description 3
- FDQGQEPVQQEDDL-UHFFFAOYSA-N 4-[5-(2-acetyl-4,4-dimethyl-1,3-dihydroisoquinolin-7-yl)-2-methyl-3-propanoylpyrrol-1-yl]benzenesulfonamide Chemical compound CC1=C(C(=O)CC)C=C(C=2C=C3C(C(CN(C3)C(C)=O)(C)C)=CC=2)N1C1=CC=C(S(N)(=O)=O)C=C1 FDQGQEPVQQEDDL-UHFFFAOYSA-N 0.000 description 3
- BSRKPLRAMRAIPM-UHFFFAOYSA-N 6-(2-bromoacetyl)-4,4-dimethyl-1,3-dihydroquinolin-2-one Chemical compound C1=C(C(=O)CBr)C=C2C(C)(C)CC(=O)NC2=C1 BSRKPLRAMRAIPM-UHFFFAOYSA-N 0.000 description 3
- 229930000680 A04AD01 - Scopolamine Natural products 0.000 description 3
- IKHGUXGNUITLKF-UHFFFAOYSA-N Acetaldehyde Chemical compound CC=O IKHGUXGNUITLKF-UHFFFAOYSA-N 0.000 description 3
- 206010001052 Acute respiratory distress syndrome Diseases 0.000 description 3
- RPYWXZCFYPVCNQ-RVDMUPIBSA-N DMXB-A Chemical compound COC1=CC(OC)=CC=C1\C=C/1C(C=2C=NC=CC=2)=NCCC\1 RPYWXZCFYPVCNQ-RVDMUPIBSA-N 0.000 description 3
- 239000007818 Grignard reagent Substances 0.000 description 3
- 239000012981 Hank's balanced salt solution Substances 0.000 description 3
- STECJAGHUSJQJN-GAUPFVANSA-N Hyoscine Natural products C1([C@H](CO)C(=O)OC2C[C@@H]3N([C@H](C2)[C@@H]2[C@H]3O2)C)=CC=CC=C1 STECJAGHUSJQJN-GAUPFVANSA-N 0.000 description 3
- 239000002841 Lewis acid Substances 0.000 description 3
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 3
- 241000699670 Mus sp. Species 0.000 description 3
- STECJAGHUSJQJN-UHFFFAOYSA-N N-Methyl-scopolamin Natural products C1C(C2C3O2)N(C)C3CC1OC(=O)C(CO)C1=CC=CC=C1 STECJAGHUSJQJN-UHFFFAOYSA-N 0.000 description 3
- 206010028980 Neoplasm Diseases 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- 208000028810 Shared psychotic disease Diseases 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 230000003281 allosteric effect Effects 0.000 description 3
- 230000003110 anti-inflammatory effect Effects 0.000 description 3
- 230000033228 biological regulation Effects 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 239000012267 brine Substances 0.000 description 3
- 201000011510 cancer Diseases 0.000 description 3
- 210000003169 central nervous system Anatomy 0.000 description 3
- 238000004587 chromatography analysis Methods 0.000 description 3
- 230000001149 cognitive effect Effects 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 206010013663 drug dependence Diseases 0.000 description 3
- 239000000706 filtrate Substances 0.000 description 3
- 150000007517 lewis acids Chemical class 0.000 description 3
- SGSZUQVSHQHXPK-UHFFFAOYSA-N methyl 3-(2-fluorophenoxy)propanoate Chemical compound COC(=O)CCOC1=CC=CC=C1F SGSZUQVSHQHXPK-UHFFFAOYSA-N 0.000 description 3
- 230000001537 neural effect Effects 0.000 description 3
- 208000015122 neurodegenerative disease Diseases 0.000 description 3
- 230000037361 pathway Effects 0.000 description 3
- 230000000750 progressive effect Effects 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- 238000010992 reflux Methods 0.000 description 3
- 229920006395 saturated elastomer Polymers 0.000 description 3
- STECJAGHUSJQJN-FWXGHANASA-N scopolamine Chemical compound C1([C@@H](CO)C(=O)O[C@H]2C[C@@H]3N([C@H](C2)[C@@H]2[C@H]3O2)C)=CC=CC=C1 STECJAGHUSJQJN-FWXGHANASA-N 0.000 description 3
- 229960002646 scopolamine Drugs 0.000 description 3
- 230000001629 suppression Effects 0.000 description 3
- 230000016978 synaptic transmission, cholinergic Effects 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 210000004515 ventral tegmental area Anatomy 0.000 description 3
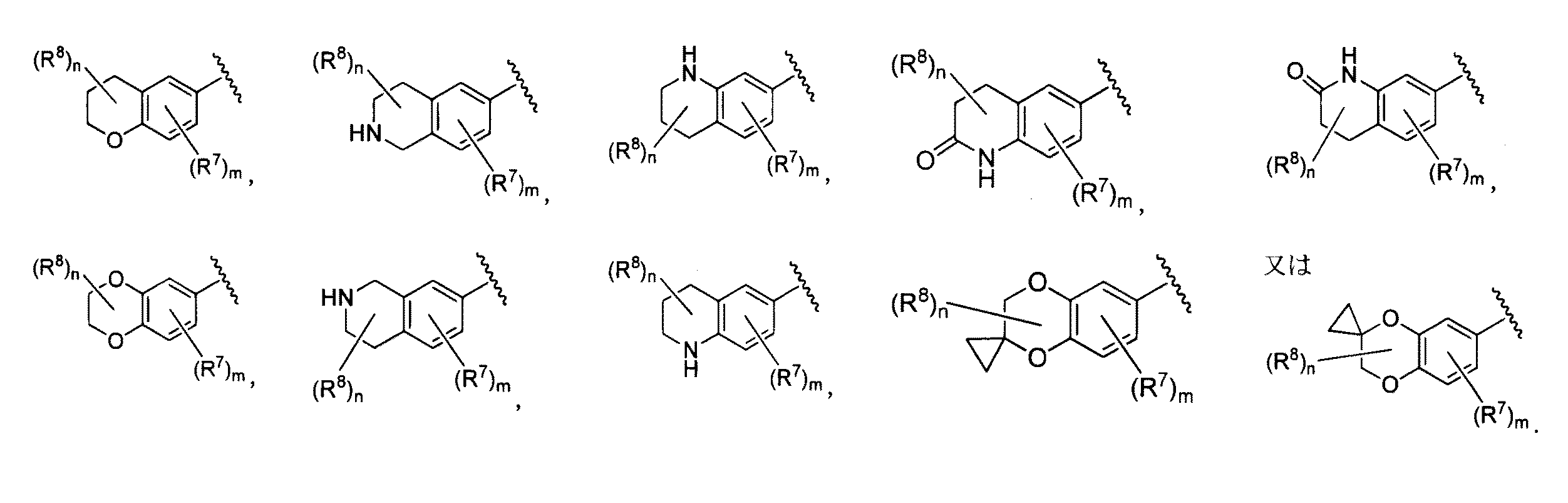
- 125000004607 1,2,3,4-tetrahydroquinolinyl group Chemical group N1(CCCC2=CC=CC=C12)* 0.000 description 2
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- ALYMTVPTIAGQQG-UHFFFAOYSA-N 1-(1-acetyl-4,4-dimethyl-2,3-dihydroquinolin-6-yl)-2-bromoethanone Chemical compound BrCC(=O)C1=CC=C2N(C(=O)C)CCC(C)(C)C2=C1 ALYMTVPTIAGQQG-UHFFFAOYSA-N 0.000 description 2
- DZLKUWXMKWYLGJ-UHFFFAOYSA-N 1-(4,4-dimethyl-1,3-dihydroisoquinolin-2-yl)ethanone Chemical compound C1=CC=C2C(C)(C)CN(C(=O)C)CC2=C1 DZLKUWXMKWYLGJ-UHFFFAOYSA-N 0.000 description 2
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 2
- LMCIDRPOELGNEC-UHFFFAOYSA-N 2-[1-(hydroxymethyl)cyclopropyl]oxyphenol Chemical compound C=1C=CC=C(O)C=1OC1(CO)CC1 LMCIDRPOELGNEC-UHFFFAOYSA-N 0.000 description 2
- VQMYUECCSRKMSL-UHFFFAOYSA-N 2-bromo-1-(2,2-dimethyl-3,4-dihydrochromen-6-yl)ethanone Chemical compound BrCC(=O)C1=CC=C2OC(C)(C)CCC2=C1 VQMYUECCSRKMSL-UHFFFAOYSA-N 0.000 description 2
- ACBQQYVIMILRDO-UHFFFAOYSA-N 2-bromo-1-(2,3-dihydro-1h-inden-4-yl)ethanone Chemical compound BrCC(=O)C1=CC=CC2=C1CCC2 ACBQQYVIMILRDO-UHFFFAOYSA-N 0.000 description 2
- MAELNDCHPUDLEA-UHFFFAOYSA-N 2-bromo-1-(8-fluoro-4,4-dimethyl-2,3-dihydrochromen-6-yl)ethanone Chemical compound C1=C(C(=O)CBr)C=C2C(C)(C)CCOC2=C1F MAELNDCHPUDLEA-UHFFFAOYSA-N 0.000 description 2
- WNWKOXIWOWZQIY-UHFFFAOYSA-N 2-bromo-1-spiro[2h-1,4-benzodioxine-3,1'-cyclopropane]-6-ylethanone Chemical compound O1C2=CC(C(=O)CBr)=CC=C2OCC21CC2 WNWKOXIWOWZQIY-UHFFFAOYSA-N 0.000 description 2
- XCHZRHGWDVVJIP-UHFFFAOYSA-N 3-acetyl-1-(1,4,4-trimethyl-2-oxo-3h-quinolin-6-yl)hexane-1,4-dione Chemical compound CN1C(=O)CC(C)(C)C2=CC(C(=O)CC(C(=O)CC)C(C)=O)=CC=C21 XCHZRHGWDVVJIP-UHFFFAOYSA-N 0.000 description 2
- BGLFTPIFBMYZPS-UHFFFAOYSA-N 3-acetyl-1-(2,2-dimethyl-3,4-dihydrochromen-6-yl)hexane-1,4-dione Chemical compound O1C(C)(C)CCC2=CC(C(=O)CC(C(=O)CC)C(C)=O)=CC=C21 BGLFTPIFBMYZPS-UHFFFAOYSA-N 0.000 description 2
- VRNTYILSFLPAKZ-UHFFFAOYSA-N 3-acetyl-1-(2,3-dihydro-1h-inden-4-yl)hexane-1,4-dione Chemical compound CCC(=O)C(C(C)=O)CC(=O)C1=CC=CC2=C1CCC2 VRNTYILSFLPAKZ-UHFFFAOYSA-N 0.000 description 2
- USQJTDAFHJGXID-UHFFFAOYSA-N 3-acetyl-1-(4,4-dimethyl-2,3-dihydrochromen-6-yl)hexane-1,4-dione Chemical compound O1CCC(C)(C)C2=CC(C(=O)CC(C(=O)CC)C(C)=O)=CC=C21 USQJTDAFHJGXID-UHFFFAOYSA-N 0.000 description 2
- WLFFSTUORXBAMZ-UHFFFAOYSA-N 3-acetyl-1-(4,4-dimethyl-2-oxo-1,3-dihydroquinolin-7-yl)hexane-1,4-dione Chemical compound N1C(=O)CC(C)(C)C=2C1=CC(C(=O)CC(C(=O)CC)C(C)=O)=CC=2 WLFFSTUORXBAMZ-UHFFFAOYSA-N 0.000 description 2
- LCFDUXRDTHUYSS-UHFFFAOYSA-N 3-acetyl-1-(8-fluoro-4,4-dimethyl-2,3-dihydrochromen-6-yl)hexane-1,4-dione Chemical compound O1CCC(C)(C)C2=CC(C(=O)CC(C(=O)CC)C(C)=O)=CC(F)=C21 LCFDUXRDTHUYSS-UHFFFAOYSA-N 0.000 description 2
- BRIDUYWQIZQTIO-UHFFFAOYSA-N 3-acetyl-1-spiro[3h-1,4-benzodioxine-2,1'-cyclopropane]-6-ylhexane-1,4-dione Chemical compound C1OC2=CC(C(=O)CC(C(=O)CC)C(C)=O)=CC=C2OC21CC2 BRIDUYWQIZQTIO-UHFFFAOYSA-N 0.000 description 2
- RUTCKTSOHNZKCY-UHFFFAOYSA-N 4-[5-(1-acetyl-4,4-dimethyl-2,3-dihydroquinolin-6-yl)-2-methyl-3-propanoylpyrrol-1-yl]benzenesulfonamide Chemical compound CC1=C(C(=O)CC)C=C(C=2C=C3C(C)(C)CCN(C3=CC=2)C(C)=O)N1C1=CC=C(S(N)(=O)=O)C=C1 RUTCKTSOHNZKCY-UHFFFAOYSA-N 0.000 description 2
- NHTMSTUAZAUEDM-UHFFFAOYSA-N 5-(4,4-dimethyl-2,3-dihydrochromen-6-yl)-2-methyl-1-(4-sulfamoylphenyl)pyrrole-3-carboxylic acid Chemical compound CC1=C(C(O)=O)C=C(C=2C=C3C(C)(C)CCOC3=CC=2)N1C1=CC=C(S(N)(=O)=O)C=C1 NHTMSTUAZAUEDM-UHFFFAOYSA-N 0.000 description 2
- LHPSGJZOIWNRQH-UHFFFAOYSA-N 6-(2-bromoacetyl)-1,4,4-trimethyl-3h-quinolin-2-one Chemical compound BrCC(=O)C1=CC=C2N(C)C(=O)CC(C)(C)C2=C1 LHPSGJZOIWNRQH-UHFFFAOYSA-N 0.000 description 2
- 208000008811 Agoraphobia Diseases 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonium chloride Substances [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- 208000000044 Amnesia Diseases 0.000 description 2
- HHTNFMDZDWQBHU-UHFFFAOYSA-N CC1(CC(NC2=CC(=CC=C12)C1=CC(=C(N1C1=CC=CC=C1)C)C(CC)=O)=O)C Chemical compound CC1(CC(NC2=CC(=CC=C12)C1=CC(=C(N1C1=CC=CC=C1)C)C(CC)=O)=O)C HHTNFMDZDWQBHU-UHFFFAOYSA-N 0.000 description 2
- 229910021590 Copper(II) bromide Inorganic materials 0.000 description 2
- 208000032131 Diabetic Neuropathies Diseases 0.000 description 2
- 208000037487 Endotoxemia Diseases 0.000 description 2
- 206010071602 Genetic polymorphism Diseases 0.000 description 2
- 239000007995 HEPES buffer Substances 0.000 description 2
- 101000822103 Homo sapiens Neuronal acetylcholine receptor subunit alpha-7 Proteins 0.000 description 2
- 241000725303 Human immunodeficiency virus Species 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- 208000009829 Lewy Body Disease Diseases 0.000 description 2
- 201000002832 Lewy body dementia Diseases 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 208000000112 Myalgia Diseases 0.000 description 2
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 2
- JRNVZBWKYDBUCA-UHFFFAOYSA-N N-Chlorosuccinimide Substances ClN1C(=O)CCC1=O JRNVZBWKYDBUCA-UHFFFAOYSA-N 0.000 description 2
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 2
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Substances BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 2
- LQZMLBORDGWNPD-UHFFFAOYSA-N N-iodosuccinimide Substances IN1C(=O)CCC1=O LQZMLBORDGWNPD-UHFFFAOYSA-N 0.000 description 2
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N N-phenyl amine Natural products NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 2
- 102100021511 Neuronal acetylcholine receptor subunit alpha-7 Human genes 0.000 description 2
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 208000013616 Respiratory Distress Syndrome Diseases 0.000 description 2
- 206010040047 Sepsis Diseases 0.000 description 2
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 2
- 201000004810 Vascular dementia Diseases 0.000 description 2
- SBEJZJTXOHTRKZ-UHFFFAOYSA-N [1-[2-[(4-methoxyphenyl)methoxy]phenoxy]cyclopropyl]methanol Chemical compound C1=CC(OC)=CC=C1COC1=CC=CC=C1OC1(CO)CC1 SBEJZJTXOHTRKZ-UHFFFAOYSA-N 0.000 description 2
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 2
- 239000012346 acetyl chloride Substances 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- ORILYTVJVMAKLC-UHFFFAOYSA-N adamantane Chemical compound C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 description 2
- 201000000028 adult respiratory distress syndrome Diseases 0.000 description 2
- 125000003342 alkenyl group Chemical group 0.000 description 2
- 125000000304 alkynyl group Chemical group 0.000 description 2
- 150000001448 anilines Chemical class 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 230000003502 anti-nociceptive effect Effects 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 239000012131 assay buffer Substances 0.000 description 2
- 150000001721 carbon Chemical group 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- XMPZTFVPEKAKFH-UHFFFAOYSA-P ceric ammonium nitrate Chemical compound [NH4+].[NH4+].[Ce+4].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O XMPZTFVPEKAKFH-UHFFFAOYSA-P 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- NEHMKBQYUWJMIP-UHFFFAOYSA-N chloromethane Chemical compound ClC NEHMKBQYUWJMIP-UHFFFAOYSA-N 0.000 description 2
- GBRBMTNGQBKBQE-UHFFFAOYSA-L copper;diiodide Chemical compound I[Cu]I GBRBMTNGQBKBQE-UHFFFAOYSA-L 0.000 description 2
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 2
- DIOQZVSQGTUSAI-UHFFFAOYSA-N decane Chemical compound CCCCCCCCCC DIOQZVSQGTUSAI-UHFFFAOYSA-N 0.000 description 2
- 230000006735 deficit Effects 0.000 description 2
- 238000000586 desensitisation Methods 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 2
- 239000002158 endotoxin Substances 0.000 description 2
- 238000010931 ester hydrolysis Methods 0.000 description 2
- NLONUIMEVVIARC-UHFFFAOYSA-N ethyl 2-acetyl-4-(4,4-dimethyl-2,3-dihydrochromen-6-yl)-4-oxobutanoate Chemical compound O1CCC(C)(C)C2=CC(C(=O)CC(C(=O)OCC)C(C)=O)=CC=C21 NLONUIMEVVIARC-UHFFFAOYSA-N 0.000 description 2
- RHDIEALQBMOHDX-UHFFFAOYSA-N ethyl 5-(2,3-dihydro-1,4-benzodioxin-6-yl)-2,4-dimethyl-1-(4-sulfamoylphenyl)pyrrole-3-carboxylate Chemical compound CC1=C(C(=O)OCC)C(C)=C(C=2C=C3OCCOC3=CC=2)N1C1=CC=C(S(N)(=O)=O)C=C1 RHDIEALQBMOHDX-UHFFFAOYSA-N 0.000 description 2
- QTORIAPKKNVPJV-UHFFFAOYSA-N ethyl 5-(4,4-dimethyl-2,3-dihydrochromen-6-yl)-2-methyl-1-(4-sulfamoylphenyl)pyrrole-3-carboxylate Chemical compound CC1=C(C(=O)OCC)C=C(C=2C=C3C(C)(C)CCOC3=CC=2)N1C1=CC=C(S(N)(=O)=O)C=C1 QTORIAPKKNVPJV-UHFFFAOYSA-N 0.000 description 2
- 238000000799 fluorescence microscopy Methods 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 150000004795 grignard reagents Chemical class 0.000 description 2
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 2
- 125000005945 imidazopyridyl group Chemical group 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 2
- 125000000842 isoxazolyl group Chemical group 0.000 description 2
- 208000018937 joint inflammation Diseases 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- TZASCNWOCCUKAQ-UHFFFAOYSA-N methyl 1-[2-[(4-methoxyphenyl)methoxy]phenoxy]cyclopropane-1-carboxylate Chemical compound C=1C=CC=C(OCC=2C=CC(OC)=CC=2)C=1OC1(C(=O)OC)CC1 TZASCNWOCCUKAQ-UHFFFAOYSA-N 0.000 description 2
- JBHYERWUNSXHHZ-UHFFFAOYSA-N methyl 4-bromo-2-[2-[(4-methoxyphenyl)methoxy]phenoxy]butanoate Chemical compound COC(=O)C(CCBr)OC1=CC=CC=C1OCC1=CC=C(OC)C=C1 JBHYERWUNSXHHZ-UHFFFAOYSA-N 0.000 description 2
- 230000036651 mood Effects 0.000 description 2
- 201000006417 multiple sclerosis Diseases 0.000 description 2
- 210000002569 neuron Anatomy 0.000 description 2
- LYGJENNIWJXYER-UHFFFAOYSA-N nitromethane Chemical compound C[N+]([O-])=O LYGJENNIWJXYER-UHFFFAOYSA-N 0.000 description 2
- 239000004031 partial agonist Substances 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 208000022821 personality disease Diseases 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- 230000035790 physiological processes and functions Effects 0.000 description 2
- 229910000027 potassium carbonate Inorganic materials 0.000 description 2
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 2
- 230000036278 prepulse Effects 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 230000000698 schizophrenic effect Effects 0.000 description 2
- 230000001953 sensory effect Effects 0.000 description 2
- 230000009151 sensory gating Effects 0.000 description 2
- 230000035939 shock Effects 0.000 description 2
- 230000000391 smoking effect Effects 0.000 description 2
- 239000012312 sodium hydride Substances 0.000 description 2
- 229910000104 sodium hydride Inorganic materials 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 150000003456 sulfonamides Chemical class 0.000 description 2
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- LMBFAGIMSUYTBN-MPZNNTNKSA-N teixobactin Chemical compound C([C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](CCC(N)=O)C(=O)N[C@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H]1C(N[C@@H](C)C(=O)N[C@@H](C[C@@H]2NC(=N)NC2)C(=O)N[C@H](C(=O)O[C@H]1C)[C@@H](C)CC)=O)NC)C1=CC=CC=C1 LMBFAGIMSUYTBN-MPZNNTNKSA-N 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 238000002054 transplantation Methods 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- YNBXNVUZXFMNSJ-UHFFFAOYSA-N (4-bromophenyl) 1,4-diazabicyclo[3.2.2]nonane-4-carboxylate;hydrochloride Chemical compound Cl.C1=CC(Br)=CC=C1OC(=O)N1C(CC2)CCN2CC1 YNBXNVUZXFMNSJ-UHFFFAOYSA-N 0.000 description 1
- TYAGAVRSOFABFO-VIFPVBQESA-N (5s)-spiro[1,3-oxazolidine-5,3'-1-azabicyclo[2.2.2]octane]-2-one Chemical compound O1C(=O)NC[C@]11C(CC2)CCN2C1 TYAGAVRSOFABFO-VIFPVBQESA-N 0.000 description 1
- DNIAPMSPPWPWGF-GSVOUGTGSA-N (R)-(-)-Propylene glycol Chemical compound C[C@@H](O)CO DNIAPMSPPWPWGF-GSVOUGTGSA-N 0.000 description 1
- KWTSXDURSIMDCE-QMMMGPOBSA-N (S)-amphetamine Chemical compound C[C@H](N)CC1=CC=CC=C1 KWTSXDURSIMDCE-QMMMGPOBSA-N 0.000 description 1
- VMAKIACTLSBBIY-BOPFTXTBSA-N (z)-3-(4-chloroanilino)-n-(4-chlorophenyl)-2-(3-methyl-1,2-oxazol-5-yl)prop-2-enamide Chemical compound O1N=C(C)C=C1C(\C(=O)NC=1C=CC(Cl)=CC=1)=C\NC1=CC=C(Cl)C=C1 VMAKIACTLSBBIY-BOPFTXTBSA-N 0.000 description 1
- 0 *C(c(c(*)c1*)c(*)[n]1-c1ccccc1)=O Chemical compound *C(c(c(*)c1*)c(*)[n]1-c1ccccc1)=O 0.000 description 1
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 1
- 125000004605 1,2,3,4-tetrahydroisoquinolinyl group Chemical group C1(NCCC2=CC=CC=C12)* 0.000 description 1
- 125000005871 1,3-benzodioxolyl group Chemical group 0.000 description 1
- IGERFAHWSHDDHX-UHFFFAOYSA-N 1,3-dioxanyl Chemical group [CH]1OCCCO1 IGERFAHWSHDDHX-UHFFFAOYSA-N 0.000 description 1
- JPRPJUMQRZTTED-UHFFFAOYSA-N 1,3-dioxolanyl Chemical group [CH]1OCCO1 JPRPJUMQRZTTED-UHFFFAOYSA-N 0.000 description 1
- ILWJAOPQHOZXAN-UHFFFAOYSA-N 1,3-dithianyl Chemical group [CH]1SCCCS1 ILWJAOPQHOZXAN-UHFFFAOYSA-N 0.000 description 1
- FLOJNXXFMHCMMR-UHFFFAOYSA-N 1,3-dithiolanyl Chemical group [CH]1SCCS1 FLOJNXXFMHCMMR-UHFFFAOYSA-N 0.000 description 1
- GVCMFAGYMNVFSA-UHFFFAOYSA-N 1,4,4-trimethyl-3h-quinolin-2-one Chemical compound C1=CC=C2N(C)C(=O)CC(C)(C)C2=C1 GVCMFAGYMNVFSA-UHFFFAOYSA-N 0.000 description 1
- KVGZZAHHUNAVKZ-UHFFFAOYSA-N 1,4-Dioxin Chemical compound O1C=COC=C1 KVGZZAHHUNAVKZ-UHFFFAOYSA-N 0.000 description 1
- KNRXTFUVMPVXBK-UHFFFAOYSA-N 1-(2,2-dimethyl-3,4-dihydrochromen-6-yl)ethanone Chemical compound O1C(C)(C)CCC2=CC(C(=O)C)=CC=C21 KNRXTFUVMPVXBK-UHFFFAOYSA-N 0.000 description 1
- FPHUGFGBPNVMQR-UHFFFAOYSA-N 1-(2,3-dihydro-1h-inden-4-yl)ethanone Chemical compound CC(=O)C1=CC=CC2=C1CCC2 FPHUGFGBPNVMQR-UHFFFAOYSA-N 0.000 description 1
- APBGIHIRYOFIJA-UHFFFAOYSA-N 1-(4,4-dimethyl-2,3-dihydrochromen-6-yl)ethanone Chemical compound O1CCC(C)(C)C2=CC(C(=O)C)=CC=C21 APBGIHIRYOFIJA-UHFFFAOYSA-N 0.000 description 1
- TXSFXZWERZRCQK-UHFFFAOYSA-N 1-(4,4-dimethyl-2,3-dihydroquinolin-1-yl)ethanone Chemical compound C1=CC=C2N(C(=O)C)CCC(C)(C)C2=C1 TXSFXZWERZRCQK-UHFFFAOYSA-N 0.000 description 1
- CEIIEALEIHQDBX-UHFFFAOYSA-N 1-(5-chloro-2,4-dimethoxyphenyl)-3-(5-methyl-3-isoxazolyl)urea Chemical compound C1=C(Cl)C(OC)=CC(OC)=C1NC(=O)NC1=NOC(C)=C1 CEIIEALEIHQDBX-UHFFFAOYSA-N 0.000 description 1
- KYUKGKXQTHIFOM-UHFFFAOYSA-N 1-[4-(dimethylaminomethylideneamino)sulfonylphenyl]-5-(4,4-dimethyl-2,3-dihydrochromen-6-yl)-N-methoxy-N,2-dimethylpyrrole-3-carboxamide Chemical compound CC1=C(C(=O)N(C)OC)C=C(C=2C=C3C(C)(C)CCOC3=CC=2)N1C1=CC=C(S(=O)(=O)N=CN(C)C)C=C1 KYUKGKXQTHIFOM-UHFFFAOYSA-N 0.000 description 1
- STHHLVCQSLRQNI-UHFFFAOYSA-N 1-azabicyclo[3.2.1]octane Chemical compound C1C2CCN1CCC2 STHHLVCQSLRQNI-UHFFFAOYSA-N 0.000 description 1
- FMEHIMDNLRASDU-UHFFFAOYSA-N 1-azabicyclo[3.3.1]nonane Chemical compound C1CCN2CCCC1C2 FMEHIMDNLRASDU-UHFFFAOYSA-N 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- OBTZDIRUQWFRFZ-UHFFFAOYSA-N 2-(5-methylfuran-2-yl)-n-(4-methylphenyl)quinoline-4-carboxamide Chemical compound O1C(C)=CC=C1C1=CC(C(=O)NC=2C=CC(C)=CC=2)=C(C=CC=C2)C2=N1 OBTZDIRUQWFRFZ-UHFFFAOYSA-N 0.000 description 1
- XQQGKYZQYWJZOU-UHFFFAOYSA-N 2-[(4-methoxyphenyl)methoxy]phenol Chemical compound C1=CC(OC)=CC=C1COC1=CC=CC=C1O XQQGKYZQYWJZOU-UHFFFAOYSA-N 0.000 description 1
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 1
- POPPVIRYGJQIOF-UHFFFAOYSA-N 2-acetyloxyethyl(trimethyl)azanium;3-(1-methylpyrrolidin-2-yl)pyridine Chemical compound CC(=O)OCC[N+](C)(C)C.CN1CCCC1C1=CC=CN=C1 POPPVIRYGJQIOF-UHFFFAOYSA-N 0.000 description 1
- GOJUJUVQIVIZAV-UHFFFAOYSA-N 2-amino-4,6-dichloropyrimidine-5-carbaldehyde Chemical group NC1=NC(Cl)=C(C=O)C(Cl)=N1 GOJUJUVQIVIZAV-UHFFFAOYSA-N 0.000 description 1
- FOTPTWYZBFKZQO-UHFFFAOYSA-N 2-bromo-1-spiro[3h-1,4-benzodioxine-2,1'-cyclopropane]-6-ylethanone Chemical compound C1OC2=CC(C(=O)CBr)=CC=C2OC21CC2 FOTPTWYZBFKZQO-UHFFFAOYSA-N 0.000 description 1
- HPBPNWPROCLLAA-UHFFFAOYSA-N 2-bromoethanone Chemical compound BrC[C]=O HPBPNWPROCLLAA-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- FNMKZDDKPDBYJM-UHFFFAOYSA-N 3-(1,3-benzodioxol-5-yl)-7-(3-methylbut-2-enoxy)chromen-4-one Chemical compound C1=C2OCOC2=CC(C2=COC=3C(C2=O)=CC=C(C=3)OCC=C(C)C)=C1 FNMKZDDKPDBYJM-UHFFFAOYSA-N 0.000 description 1
- HTFQCXHHEIUZPM-UHFFFAOYSA-N 3-(2-fluorophenoxy)propanoic acid Chemical compound OC(=O)CCOC1=CC=CC=C1F HTFQCXHHEIUZPM-UHFFFAOYSA-N 0.000 description 1
- KNUCBRPOUWLBGO-UHFFFAOYSA-N 3-acetyl-1-(1-acetyl-4,4-dimethyl-2,3-dihydroquinolin-7-yl)hexane-1,4-dione Chemical compound CC(=O)N1CCC(C)(C)C=2C1=CC(C(=O)CC(C(=O)CC)C(C)=O)=CC=2 KNUCBRPOUWLBGO-UHFFFAOYSA-N 0.000 description 1
- MZEOWSNRZIWWCM-UHFFFAOYSA-N 3-acetyl-1-(2-acetyl-4,4-dimethyl-1,3-dihydroisoquinolin-6-yl)hexane-1,4-dione Chemical compound C1N(C(C)=O)CC(C)(C)C2=CC(C(=O)CC(C(=O)CC)C(C)=O)=CC=C21 MZEOWSNRZIWWCM-UHFFFAOYSA-N 0.000 description 1
- QGTJSRLJHOOTPC-UHFFFAOYSA-N 3-acetyl-1-spiro[2h-1,4-benzodioxine-3,1'-cyclopropane]-6-ylhexane-1,4-dione Chemical compound O1C2=CC(C(=O)CC(C(=O)CC)C(C)=O)=CC=C2OCC21CC2 QGTJSRLJHOOTPC-UHFFFAOYSA-N 0.000 description 1
- HMOBRUPKXAKFHS-UHFFFAOYSA-N 4,4-dimethyl-1,3-dihydroquinolin-2-one Chemical compound C1=CC=C2C(C)(C)CC(=O)NC2=C1 HMOBRUPKXAKFHS-UHFFFAOYSA-N 0.000 description 1
- QOWZBQAJZICMKD-UHFFFAOYSA-N 4,4-dimethyl-2,3-dihydro-1h-isoquinoline Chemical compound C1=CC=C2C(C)(C)CNCC2=C1 QOWZBQAJZICMKD-UHFFFAOYSA-N 0.000 description 1
- SNETWLSWZMLDGF-UHFFFAOYSA-N 4-[5-(1-acetyl-4,4-dimethyl-2,3-dihydroquinolin-7-yl)-2-methyl-3-propanoylpyrrol-1-yl]benzenesulfonamide Chemical compound CC1=C(C(=O)CC)C=C(C=2C=C3C(C(CCN3C(C)=O)(C)C)=CC=2)N1C1=CC=C(S(N)(=O)=O)C=C1 SNETWLSWZMLDGF-UHFFFAOYSA-N 0.000 description 1
- VOZAKXYVWXBECN-UHFFFAOYSA-N 7-(2-bromoacetyl)-4,4-dimethyl-1,3-dihydroquinolin-2-one Chemical compound BrCC(=O)C1=CC=C2C(C)(C)CC(=O)NC2=C1 VOZAKXYVWXBECN-UHFFFAOYSA-N 0.000 description 1
- FTGFOHYTEZDSSE-UHFFFAOYSA-N 8-fluoro-4,4-dimethyl-2,3-dihydrochromene Chemical compound C1=CC=C2C(C)(C)CCOC2=C1F FTGFOHYTEZDSSE-UHFFFAOYSA-N 0.000 description 1
- 229940100578 Acetylcholinesterase inhibitor Drugs 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 208000031091 Amnestic disease Diseases 0.000 description 1
- 206010002198 Anaphylactic reaction Diseases 0.000 description 1
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 1
- 208000019901 Anxiety disease Diseases 0.000 description 1
- 102100021569 Apoptosis regulator Bcl-2 Human genes 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- 208000000412 Avitaminosis Diseases 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 208000008035 Back Pain Diseases 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 206010006542 Bulbar palsy Diseases 0.000 description 1
- NEWRIPVPDYVJTC-UHFFFAOYSA-N C(C)(=O)N1CCC(C2=CC=C(C=C12)C1=CC(=C(N1C1=CC=CC=C1)C)C(CC)=O)(C)C Chemical compound C(C)(=O)N1CCC(C2=CC=C(C=C12)C1=CC(=C(N1C1=CC=CC=C1)C)C(CC)=O)(C)C NEWRIPVPDYVJTC-UHFFFAOYSA-N 0.000 description 1
- JAJIJNKEPHVJTB-UHFFFAOYSA-N CCC(c(cc1-c(cc2)cc3c2NCCC3(C)C)c(C)[n]1-c(cc1)ccc1S(N)(=O)=O)=O Chemical compound CCC(c(cc1-c(cc2)cc3c2NCCC3(C)C)c(C)[n]1-c(cc1)ccc1S(N)(=O)=O)=O JAJIJNKEPHVJTB-UHFFFAOYSA-N 0.000 description 1
- ORXFSFKPXKCRNP-UHFFFAOYSA-N CCCc(cc1-c(cc2)cc3c2OC(C)(C)CC3)c(C)[n]1-c(cc1)ccc1S(N)(=O)=O Chemical compound CCCc(cc1-c(cc2)cc3c2OC(C)(C)CC3)c(C)[n]1-c(cc1)ccc1S(N)(=O)=O ORXFSFKPXKCRNP-UHFFFAOYSA-N 0.000 description 1
- 206010006895 Cachexia Diseases 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 206010058019 Cancer Pain Diseases 0.000 description 1
- 241000218236 Cannabis Species 0.000 description 1
- 241001459819 Carassius gibelio Species 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- KDXKERNSBIXSRK-RXMQYKEDSA-N D-lysine Chemical compound NCCCC[C@@H](N)C(O)=O KDXKERNSBIXSRK-RXMQYKEDSA-N 0.000 description 1
- 208000027219 Deficiency disease Diseases 0.000 description 1
- 206010012335 Dependence Diseases 0.000 description 1
- 206010012442 Dermatitis contact Diseases 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 208000027534 Emotional disease Diseases 0.000 description 1
- 206010014612 Encephalitis viral Diseases 0.000 description 1
- NLPRAJRHRHZCQQ-UHFFFAOYSA-N Epibatidine Natural products C1=NC(Cl)=CC=C1C1C(N2)CCC2C1 NLPRAJRHRHZCQQ-UHFFFAOYSA-N 0.000 description 1
- 208000001640 Fibromyalgia Diseases 0.000 description 1
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 1
- 206010017533 Fungal infection Diseases 0.000 description 1
- 208000011688 Generalised anxiety disease Diseases 0.000 description 1
- 201000004311 Gilles de la Tourette syndrome Diseases 0.000 description 1
- 208000035895 Guillain-Barré syndrome Diseases 0.000 description 1
- 102000000849 HMGB Proteins Human genes 0.000 description 1
- 108010001860 HMGB Proteins Proteins 0.000 description 1
- 206010019196 Head injury Diseases 0.000 description 1
- 208000007514 Herpes zoster Diseases 0.000 description 1
- 208000029433 Herpesviridae infectious disease Diseases 0.000 description 1
- 101000971171 Homo sapiens Apoptosis regulator Bcl-2 Proteins 0.000 description 1
- 241000700588 Human alphaherpesvirus 1 Species 0.000 description 1
- 241000701074 Human alphaherpesvirus 2 Species 0.000 description 1
- 206010058558 Hypoperfusion Diseases 0.000 description 1
- 206010021135 Hypovitaminosis Diseases 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- 229910010082 LiAlH Inorganic materials 0.000 description 1
- 208000008930 Low Back Pain Diseases 0.000 description 1
- 208000019693 Lung disease Diseases 0.000 description 1
- 208000016604 Lyme disease Diseases 0.000 description 1
- 208000026139 Memory disease Diseases 0.000 description 1
- 206010049567 Miller Fisher syndrome Diseases 0.000 description 1
- 238000006751 Mitsunobu reaction Methods 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 102000014415 Muscarinic acetylcholine receptor Human genes 0.000 description 1
- 108050003473 Muscarinic acetylcholine receptor Proteins 0.000 description 1
- 206010028289 Muscle atrophy Diseases 0.000 description 1
- 208000031888 Mycoses Diseases 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- WECKJONDRAUFDD-ZDUSSCGKSA-N N-[(3R)-1-azabicyclo[2.2.2]octan-3-yl]-4-chlorobenzamide Chemical compound C1=CC(Cl)=CC=C1C(=O)N[C@@H]1C(CC2)CCN2C1 WECKJONDRAUFDD-ZDUSSCGKSA-N 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000009668 Neurobehavioral Manifestations Diseases 0.000 description 1
- 208000027626 Neurocognitive disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- 208000027099 Paranoid disease Diseases 0.000 description 1
- 206010034912 Phobia Diseases 0.000 description 1
- 208000024571 Pick disease Diseases 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 206010036105 Polyneuropathy Diseases 0.000 description 1
- 208000010366 Postpoliomyelitis syndrome Diseases 0.000 description 1
- 208000032319 Primary lateral sclerosis Diseases 0.000 description 1
- 208000024777 Prion disease Diseases 0.000 description 1
- 206010056300 Pseudoparalysis Diseases 0.000 description 1
- 208000028017 Psychotic disease Diseases 0.000 description 1
- 206010037660 Pyrexia Diseases 0.000 description 1
- 206010063837 Reperfusion injury Diseases 0.000 description 1
- 208000019568 Shared Paranoid disease Diseases 0.000 description 1
- 206010041250 Social phobia Diseases 0.000 description 1
- 208000027520 Somatoform disease Diseases 0.000 description 1
- 201000002661 Spondylitis Diseases 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 208000002667 Subdural Hematoma Diseases 0.000 description 1
- 208000000323 Tourette Syndrome Diseases 0.000 description 1
- 208000016620 Tourette disease Diseases 0.000 description 1
- 206010046298 Upper motor neurone lesion Diseases 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 206010046851 Uveitis Diseases 0.000 description 1
- MODGUXHMLLXODK-UHFFFAOYSA-N [Br].CO Chemical compound [Br].CO MODGUXHMLLXODK-UHFFFAOYSA-N 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 125000004103 aminoalkyl group Chemical group 0.000 description 1
- VZTDIZULWFCMLS-UHFFFAOYSA-N ammonium formate Chemical compound [NH4+].[O-]C=O VZTDIZULWFCMLS-UHFFFAOYSA-N 0.000 description 1
- 235000011114 ammonium hydroxide Nutrition 0.000 description 1
- 230000006986 amnesia Effects 0.000 description 1
- 229940025084 amphetamine Drugs 0.000 description 1
- 230000036783 anaphylactic response Effects 0.000 description 1
- 208000003455 anaphylaxis Diseases 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 230000006909 anti-apoptosis Effects 0.000 description 1
- 230000001430 anti-depressive effect Effects 0.000 description 1
- 239000000935 antidepressant agent Substances 0.000 description 1
- 229940005513 antidepressants Drugs 0.000 description 1
- 239000000074 antisense oligonucleotide Substances 0.000 description 1
- 238000012230 antisense oligonucleotides Methods 0.000 description 1
- 230000036506 anxiety Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- 239000003693 atypical antipsychotic agent Substances 0.000 description 1
- 229940127236 atypical antipsychotics Drugs 0.000 description 1
- 210000003192 autonomic ganglia Anatomy 0.000 description 1
- 210000003403 autonomic nervous system Anatomy 0.000 description 1
- 125000005334 azaindolyl group Chemical group N1N=C(C2=CC=CC=C12)* 0.000 description 1
- 125000003725 azepanyl group Chemical group 0.000 description 1
- 125000002393 azetidinyl group Chemical group 0.000 description 1
- 125000004069 aziridinyl group Chemical group 0.000 description 1
- 125000003828 azulenyl group Chemical group 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000005874 benzothiadiazolyl group Chemical group 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000002618 bicyclic heterocycle group Chemical group 0.000 description 1
- GPRLTFBKWDERLU-UHFFFAOYSA-N bicyclo[2.2.2]octane Chemical compound C1CC2CCC1CC2 GPRLTFBKWDERLU-UHFFFAOYSA-N 0.000 description 1
- JAPMJSVZDUYFKL-UHFFFAOYSA-N bicyclo[3.1.0]hexane Chemical compound C1CCC2CC21 JAPMJSVZDUYFKL-UHFFFAOYSA-N 0.000 description 1
- SHOMMGQAMRXRRK-UHFFFAOYSA-N bicyclo[3.1.1]heptane Chemical compound C1C2CC1CCC2 SHOMMGQAMRXRRK-UHFFFAOYSA-N 0.000 description 1
- AWYMFBJJKFTCFO-UHFFFAOYSA-N bicyclo[3.2.0]heptane Chemical compound C1CCC2CCC21 AWYMFBJJKFTCFO-UHFFFAOYSA-N 0.000 description 1
- WNTGVOIBBXFMLR-UHFFFAOYSA-N bicyclo[3.3.1]nonane Chemical compound C1CCC2CCCC1C2 WNTGVOIBBXFMLR-UHFFFAOYSA-N 0.000 description 1
- WMRPOCDOMSNXCQ-UHFFFAOYSA-N bicyclo[3.3.2]decane Chemical compound C1CCC2CCCC1CC2 WMRPOCDOMSNXCQ-UHFFFAOYSA-N 0.000 description 1
- KVLCIHRZDOKRLK-UHFFFAOYSA-N bicyclo[4.2.1]nonane Chemical compound C1C2CCC1CCCC2 KVLCIHRZDOKRLK-UHFFFAOYSA-N 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 239000000090 biomarker Substances 0.000 description 1
- 208000028683 bipolar I disease Diseases 0.000 description 1
- 230000037086 body physiology Effects 0.000 description 1
- 208000019664 bone resorption disease Diseases 0.000 description 1
- OXKRFEWMSWPKKV-RXVVDRJESA-N bradanicline Chemical compound C([C@@H]1N2CCC(CC2)[C@@H]1NC(=O)C=1OC2=CC=CC=C2C=1)C1=CC=CN=C1 OXKRFEWMSWPKKV-RXVVDRJESA-N 0.000 description 1
- 230000003925 brain function Effects 0.000 description 1
- 210000000133 brain stem Anatomy 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 230000005907 cancer growth Effects 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 150000003857 carboxamides Chemical class 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 210000003710 cerebral cortex Anatomy 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 150000008280 chlorinated hydrocarbons Chemical class 0.000 description 1
- 125000004965 chloroalkyl group Chemical group 0.000 description 1
- 239000000544 cholinesterase inhibitor Substances 0.000 description 1
- 230000037410 cognitive enhancement Effects 0.000 description 1
- 230000036992 cognitive tasks Effects 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 239000008139 complexing agent Substances 0.000 description 1
- 208000010247 contact dermatitis Diseases 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 125000000392 cycloalkenyl group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 230000016396 cytokine production Effects 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 206010061811 demyelinating polyneuropathy Diseases 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 125000005959 diazepanyl group Chemical group 0.000 description 1
- 150000001991 dicarboxylic acids Chemical class 0.000 description 1
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 1
- 125000004177 diethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 230000006806 disease prevention Effects 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 229960003638 dopamine Drugs 0.000 description 1
- 239000003136 dopamine receptor stimulating agent Substances 0.000 description 1
- 229940005501 dopaminergic agent Drugs 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 239000012039 electrophile Substances 0.000 description 1
- 230000008451 emotion Effects 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- NLPRAJRHRHZCQQ-IVZWLZJFSA-N epibatidine Chemical compound C1=NC(Cl)=CC=C1[C@@H]1[C@H](N2)CC[C@H]2C1 NLPRAJRHRHZCQQ-IVZWLZJFSA-N 0.000 description 1
- 230000032050 esterification Effects 0.000 description 1
- 238000005886 esterification reaction Methods 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 125000005677 ethinylene group Chemical group [*:2]C#C[*:1] 0.000 description 1
- XYIBRDXRRQCHLP-UHFFFAOYSA-N ethyl acetoacetate Chemical compound CCOC(=O)CC(C)=O XYIBRDXRRQCHLP-UHFFFAOYSA-N 0.000 description 1
- FAMRKDQNMBBFBR-UHFFFAOYSA-N ethyl n-ethoxycarbonyliminocarbamate Chemical compound CCOC(=O)N=NC(=O)OCC FAMRKDQNMBBFBR-UHFFFAOYSA-N 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000000763 evoking effect Effects 0.000 description 1
- 230000009540 excitatory neurotransmission Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 238000003818 flash chromatography Methods 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 238000001640 fractional crystallisation Methods 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 208000029364 generalized anxiety disease Diseases 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 150000008282 halocarbons Chemical class 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 210000001320 hippocampus Anatomy 0.000 description 1
- 230000013632 homeostatic process Effects 0.000 description 1
- 230000009997 humoral pathway Effects 0.000 description 1
- BNRNAKTVFSZAFA-UHFFFAOYSA-N hydrindane Chemical compound C1CCCC2CCCC21 BNRNAKTVFSZAFA-UHFFFAOYSA-N 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 238000005984 hydrogenation reaction Methods 0.000 description 1
- USZLCYNVCCDPLQ-UHFFFAOYSA-N hydron;n-methoxymethanamine;chloride Chemical compound Cl.CNOC USZLCYNVCCDPLQ-UHFFFAOYSA-N 0.000 description 1
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 1
- 208000003532 hypothyroidism Diseases 0.000 description 1
- 230000002989 hypothyroidism Effects 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000003406 indolizinyl group Chemical group C=1(C=CN2C=CC=CC12)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000004941 influx Effects 0.000 description 1
- 230000009539 inhibitory neurotransmission Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 230000010220 ion permeability Effects 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 208000012947 ischemia reperfusion injury Diseases 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000005969 isothiazolinyl group Chemical group 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000003965 isoxazolidinyl group Chemical group 0.000 description 1
- 125000003971 isoxazolinyl group Chemical group 0.000 description 1
- 238000003367 kinetic assay Methods 0.000 description 1
- 201000010901 lateral sclerosis Diseases 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 230000007787 long-term memory Effects 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 230000004758 lung carcinogenesis Effects 0.000 description 1
- NXPHGHWWQRMDIA-UHFFFAOYSA-M magnesium;carbanide;bromide Chemical compound [CH3-].[Mg+2].[Br-] NXPHGHWWQRMDIA-UHFFFAOYSA-M 0.000 description 1
- FRIJBUGBVQZNTB-UHFFFAOYSA-M magnesium;ethane;bromide Chemical compound [Mg+2].[Br-].[CH2-]C FRIJBUGBVQZNTB-UHFFFAOYSA-M 0.000 description 1
- 238000009115 maintenance therapy Methods 0.000 description 1
- 208000024714 major depressive disease Diseases 0.000 description 1
- 201000004792 malaria Diseases 0.000 description 1
- 210000005171 mammalian brain Anatomy 0.000 description 1
- 230000006984 memory degeneration Effects 0.000 description 1
- 208000023060 memory loss Diseases 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- AGJSNMGHAVDLRQ-IWFBPKFRSA-N methyl (2s)-2-[[(2s)-2-[[(2s)-2-[[(2r)-2-amino-3-sulfanylpropanoyl]amino]-3-methylbutanoyl]amino]-3-(4-hydroxy-2,3-dimethylphenyl)propanoyl]amino]-4-methylsulfanylbutanoate Chemical compound SC[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(=O)N[C@@H](CCSC)C(=O)OC)CC1=CC=C(O)C(C)=C1C AGJSNMGHAVDLRQ-IWFBPKFRSA-N 0.000 description 1
- DQHIGEQXJBMKKY-UHFFFAOYSA-N methyl 2,4-dibromobutanoate Chemical compound COC(=O)C(Br)CCBr DQHIGEQXJBMKKY-UHFFFAOYSA-N 0.000 description 1
- 229940050176 methyl chloride Drugs 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 125000002911 monocyclic heterocycle group Chemical group 0.000 description 1
- 201000005518 mononeuropathy Diseases 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 208000005264 motor neuron disease Diseases 0.000 description 1
- HHQJWDKIRXRTLS-UHFFFAOYSA-N n'-bromobutanediamide Chemical compound NC(=O)CCC(=O)NBr HHQJWDKIRXRTLS-UHFFFAOYSA-N 0.000 description 1
- PWBJWDKDPAPGED-UHFFFAOYSA-N n'-chlorobutanediamide Chemical compound NC(=O)CCC(=O)NCl PWBJWDKDPAPGED-UHFFFAOYSA-N 0.000 description 1
- KADXVMRYQRCLAH-UHFFFAOYSA-N n'-iodobutanediamide Chemical compound NC(=O)CCC(=O)NI KADXVMRYQRCLAH-UHFFFAOYSA-N 0.000 description 1
- SSRDSYXGYPJKRR-ZDUSSCGKSA-N n-[(3r)-1-azabicyclo[2.2.2]octan-3-yl]-7-chloro-1-benzothiophene-2-carboxamide Chemical compound C1N(CC2)CCC2[C@H]1NC(=O)C1=CC(C=CC=C2Cl)=C2S1 SSRDSYXGYPJKRR-ZDUSSCGKSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 239000004081 narcotic agent Substances 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000010004 neural pathway Effects 0.000 description 1
- 230000001703 neuroimmune Effects 0.000 description 1
- 230000004751 neurological system process Effects 0.000 description 1
- 210000000715 neuromuscular junction Anatomy 0.000 description 1
- 230000006576 neuronal survival Effects 0.000 description 1
- 230000000324 neuroprotective effect Effects 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 230000003957 neurotransmitter release Effects 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- UMRZSTCPUPJPOJ-KNVOCYPGSA-N norbornane Chemical compound C1C[C@H]2CC[C@@H]1C2 UMRZSTCPUPJPOJ-KNVOCYPGSA-N 0.000 description 1
- 201000003077 normal pressure hydrocephalus Diseases 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- 125000005963 oxadiazolidinyl group Chemical group 0.000 description 1
- 125000005882 oxadiazolinyl group Chemical group 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 125000000160 oxazolidinyl group Chemical group 0.000 description 1
- 125000005968 oxazolinyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 208000027753 pain disease Diseases 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 208000019906 panic disease Diseases 0.000 description 1
- 208000024817 paranoid personality disease Diseases 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 125000006340 pentafluoro ethyl group Chemical group FC(F)(F)C(F)(F)* 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- 208000019899 phobic disease Diseases 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 231100000572 poisoning Toxicity 0.000 description 1
- 230000000607 poisoning effect Effects 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 230000007824 polyneuropathy Effects 0.000 description 1
- 208000028173 post-traumatic stress disease Diseases 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 201000002241 progressive bulbar palsy Diseases 0.000 description 1
- 201000002212 progressive supranuclear palsy Diseases 0.000 description 1
- 230000004224 protection Effects 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 208000020016 psychiatric disease Diseases 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 229940044601 receptor agonist Drugs 0.000 description 1
- 239000000018 receptor agonist Substances 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 206010039083 rhinitis Diseases 0.000 description 1
- 125000006413 ring segment Chemical group 0.000 description 1
- 238000011808 rodent model Methods 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 230000031893 sensory processing Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 230000006886 spatial memory Effects 0.000 description 1
- 208000002320 spinal muscular atrophy Diseases 0.000 description 1
- 125000003003 spiro group Chemical group 0.000 description 1
- KADZWYHUUBXOPO-UHFFFAOYSA-N spiro[2,3,3a,4,5,6a-hexahydro-1H-pentalene-6,1'-cyclopropane] Chemical compound C1CC11C2CCCC2CC1 KADZWYHUUBXOPO-UHFFFAOYSA-N 0.000 description 1
- FOEYMRPOKBCNCR-UHFFFAOYSA-N spiro[2.5]octane Chemical compound C1CC11CCCCC1 FOEYMRPOKBCNCR-UHFFFAOYSA-N 0.000 description 1
- VVQGCSOVWGVVLH-UHFFFAOYSA-N spiro[2h-1,4-benzodioxine-3,1'-cyclopropane] Chemical compound C1CC11OC2=CC=CC=C2OC1 VVQGCSOVWGVVLH-UHFFFAOYSA-N 0.000 description 1
- MOTHUBJOUGRFPE-UHFFFAOYSA-N spiro[bicyclo[4.1.0]heptane-2,1'-cyclopentane] Chemical compound C12CC2CCCC21CCCC2 MOTHUBJOUGRFPE-UHFFFAOYSA-N 0.000 description 1
- CTDQAGUNKPRERK-UHFFFAOYSA-N spirodecane Chemical compound C1CCCC21CCCCC2 CTDQAGUNKPRERK-UHFFFAOYSA-N 0.000 description 1
- 230000000707 stereoselective effect Effects 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 210000000225 synapse Anatomy 0.000 description 1
- 208000006379 syphilis Diseases 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000005958 tetrahydrothienyl group Chemical group 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 125000005304 thiadiazolidinyl group Chemical group 0.000 description 1
- 125000005305 thiadiazolinyl group Chemical group 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000001984 thiazolidinyl group Chemical group 0.000 description 1
- 125000002769 thiazolinyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-N triflic acid Chemical compound OS(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-N 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 125000005455 trithianyl group Chemical group 0.000 description 1
- 230000005747 tumor angiogenesis Effects 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- JQSHBVHOMNKWFT-DTORHVGOSA-N varenicline Chemical compound C12=CC3=NC=CN=C3C=C2[C@H]2C[C@@H]1CNC2 JQSHBVHOMNKWFT-DTORHVGOSA-N 0.000 description 1
- 229960004751 varenicline Drugs 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 201000002498 viral encephalitis Diseases 0.000 description 1
- 208000030401 vitamin deficiency disease Diseases 0.000 description 1
- XCHIZTUBUXZESJ-UHFFFAOYSA-N way-317,538 Chemical compound C=1C=C(C=2C=NC=CC=2)C=CC=1NC(=O)CCCCN1CCOCC1 XCHIZTUBUXZESJ-UHFFFAOYSA-N 0.000 description 1
- 230000003936 working memory Effects 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/30—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members
- C07D207/32—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
- C07D207/33—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms with substituted hydrocarbon radicals, directly attached to ring carbon atoms
- C07D207/333—Radicals substituted by oxygen or sulfur atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/402—1-aryl substituted, e.g. piretanide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/4025—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil not condensed and containing further heterocyclic rings, e.g. cromakalim
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4709—Non-condensed quinolines and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/472—Non-condensed isoquinolines, e.g. papaverine
- A61K31/4725—Non-condensed isoquinolines, e.g. papaverine containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/02—Stomatological preparations, e.g. drugs for caries, aphtae, periodontitis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P23/00—Anaesthetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/34—Tobacco-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P39/00—General protective or antinoxious agents
- A61P39/02—Antidotes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/04—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Psychiatry (AREA)
- Pain & Pain Management (AREA)
- Addiction (AREA)
- Rheumatology (AREA)
- Dermatology (AREA)
- Psychology (AREA)
- Cardiology (AREA)
- Anesthesiology (AREA)
- Toxicology (AREA)
- Hospice & Palliative Care (AREA)
- Heart & Thoracic Surgery (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Transplantation (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Pyrrole Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Plural Heterocyclic Compounds (AREA)
Description
本発明は、一般式Iの新規化合物、
発明の背景:
神経伝達物質アセチルコリン(ACh)を介して主にもたらされるコリン作動性神経伝達は、中枢神経系及び自律神経系を介した身体の生理機能の主要な調節因子である。AChは、あらゆる自律神経節、神経筋接合部、中枢神経系の中に存在する神経細胞のシナプスに作用する。AChの標的受容体の2つの異なるクラス、すなわちムスカリン性(mAChRs)及びニコチン性(nAChRs)が、脳内で同定されており、その記憶を助ける機能及びその他の重要な生理機能を担う受容体の重要な構成要素を形成している。
ACh:アセチルコリン
AD:アルツハイマー病
ADC:AIDSによる認知症
ADHD:注意欠陥多動性障害
AIDS:後天性免疫不全症候群
ARDS:急性呼吸窮迫症候群
DCC:1,3‐ジシクロヘキシルカルボジイミド
DCE:ジクロロエタン
DCM:ジクロロメタン
DLB:レビー小体型認知症
DMF:N、N‐ジメチルホルムアミド
EDCI:1‐(3−ジメチルアミノプロピル)‐3‐エチルカルボジイミド塩酸塩
FLIPR:蛍光イメージングプレートリーダー
HBSS:ハンクス平衡塩溶液
HEPES:4‐(2‐ヒドロキシエチル)ピペラジン‐1‐エタンスルホン酸
HMGB:高移動度群ボックス
HOAT:1‐ヒドロキシ‐7‐アザベンゾトリアゾール
HOBT:ヒドロキシベンゾトリアゾール水和物
HPLC:高速液体クロマトグラフィー
IL:インターロイキン
LDT:背外側被蓋核
LGIC:リガンド依存性イオンチャネル
MCI:軽度認知障害
NBS:N‐ブロモスクシンアミド
NCS:N‐クロロスクシンアミド
NIS:N‐ヨードスクシンアミド
NNRs:神経ニコチン性ACh受容体
PAM:ポジティブアロステリック調節
PD:パーキンソン病
PDN:ポスト糖尿病神経痛
PHN:ヘルペス後神経痛
PMBO:P‐メトキシベンジルオキシ
PNS:末梢神経系
TBI:外傷性脳損傷
THF:テトラヒドロフラン
TLC:薄層クロマトグラフィー
TMS:テトラメチルシラン
TNF‐α:腫瘍壊死因子アルファ
VTA:腹側被蓋野
α7nAChR:ニコチン性アセチルコリン受容体α7サブユニット
発明の目的:
本発明の主な目的は、一般式Iの新規化合物、それらの互変異性体、それらの立体異性体、それらの薬学的に許容される塩、それらを含有する医薬組成物、α7nAChR調節活性を有する上記の前記化合物の製造方法及び中間体を提供することである。
発明の概要
本発明の一局面によれば、一般式Iで表される化合物、その互変異性体形態、その立体異性体、その類似体、そのプロドラッグ、その同位体、その代謝物、その薬学的に許容される塩、その多形体、その溶媒和物、その光学異性体、その包接体、その共結晶、適当な薬剤と、それらを含有する医薬組成物との組み合わせが提供される。
本発明のさらなる局面は、一般式Iの化合物の製造方法において、新規な中間体、それらの製造方法及びその使用法を提供することである
発明の詳細な説明:
本発明は、一般式Iの化合物、その互変異性体形態、その立体異性体、その類似体、そのプロドラッグ、その同位体、その代謝物、その薬学的に許容される塩、その多形体、その溶媒和物、その光学異性体、その包接体、その共結晶、適当な薬剤と、それらを含有する医薬組成物との組み合わせに関し、
R1は、水素、ハロゲン、任意に置換されたアルキル、ペルハロアルキル、任意に置換されたシクロアルキル、任意に置換されたアリール、任意に置換されたヘテロシクリル、任意に置換されたヘテロアリールから選択され;
R2は、任意に置換されたアルキル、任意に置換されたヘテロアルキル、任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換されたシクロアルキル、任意に置換されたヘテロシクリル、又は‐NR5(R6)、‐A1R5、‐N(R5)OR6から選択され;
R3は、水素、任意に置換されたアルキル、ハロ(halo)、任意に置換されたシクロアルキル、任意に置換されたアリール、任意に置換されたヘテロシクリル、任意に置換されたヘテロアリール、シアノ、ニトロ又は‐NR5(R6)、‐OR5から選択され;
R4は
Yは、独立して、‐O‐、‐S‐、‐NH‐、[化4]、または、q=1‐4である[化5]からの各繰返しで選択され;Yが‐NH‐または[化6]として選択される場合、必要に応じて[R8]nで置換され;
R7は、ハロゲン、任意に置換されたアルキル、任意に置換されたシクロアルキルからなる群からそれぞれの発生時に独立して選択され;
R8は、任意に置換されたアルキル、R9A1、R9aC(=A1)‐からなる群からそれぞれの発生時に独立して選択され;
m=0〜2;
n=0〜3;
p=0〜4であって;
どこに現れようともR9は、水素、任意に置換されたC1‐6アルキル、任意に置換されたヘテロアルキル、任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換されたシクロアルキル、及び任意に置換されたヘテロシクリルから選択され;A1は、O及びSから選択され;
どこに現れようともR9aは、任意に置換されたC1‐6、任意に置換されたヘテロアルキル、任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換されたシクロアルキル、及び任意に置換されたヘテロシクリルから選択され;
用語“任意に置換されたアルキル”は、オキソ、ハロゲン、ニトロ、シアノ、アリール、ヘテロアリール、シクロアルキル、R10aSO2‐、R10A1‐、R10aOC(=O)‐、R10aC(=O)O‐、(R10)(H)NC(=O)−、(R10)(アルキル)NC(=O)‐、R10aC(=O)N(H)‐、(R10)(H)N‐、(R10)(アルキル)N‐、(R10)(H)NC(=A1)N(H)‐、(R10)(アルキル)NC(=A1)N(H)‐を含む群から独立して選択される1〜6個の置換基で置換されたアルキル基を意味し;
用語“任意に置換されたヘテロアルキル”は、オキソ、ハロゲン、ニトロ、シアノ、アリール、ヘテロアリール、シクロアルキルを含む群から独立して選択される1〜6個の置換基で置換されたヘテロアルキル基を意味し;
用語“任意に置換されたシクロアルキル”は、オキソ、ハロゲン、ニトロ、シアノ、アリール、ヘテロアリール、アルキル、R10aC(=O)‐、R10aSO2‐、R10A1‐、R10aOC(=O)−、R10aC(=O)O‐、(R10)(H)NC(= O)‐、(R10)(アルキル)NC(=O)‐、R10aC(=O)N(H)‐、(R10)(H)N‐、(R10)(アルキル)N‐、(R10)(H)NC(=A1)N(H)‐、(R10)(アルキル)NC(=A1)N(H)‐を含む群から独立して選択される1〜6個の置換基で置換されたシクロアルキル基を意味し;
用語“任意に置換されたアリール”は、(i)ハロゲン、ニトロ、シアノ、ヒドロキシ、C1〜C6アルキル、C3〜C6シクロアルキル、C1〜C6ペルハロアルキル、アルキル‐O‐、ペルハロアルキル‐O‐、アルキル‐N(アルキル)‐、アルキル‐N(H)‐、H2N‐、アルキル‐SO2−、ペハロアルキル‐SO2‐、アルキル‐C(=O)N(アルキル)‐、アルキル‐C(=O)N(H)‐、アルキル‐N(アルキル)C(=O)‐、アルキル‐N(H)C(=O)‐、H2NC(=O)‐、アルキル‐N(アルキル)SO2‐、アルキル‐N(H)SO2‐、H2NSO2‐、アルキル又はアルキル‐C(=O)‐で任意に置換されたN、O及びSから選択される1〜2個のヘテロ原子を含む3〜6員複素環を含む群から独立して選択される1〜3個の置換基で任意に置換されたアリール基と、(ii)オキソ、アルキル又はアルキル‐C(=O)‐で任意に置換された結合を介してシクロアルカン又は複素環と任意に縮合したアリール環を意味し;
用語“任意に置換されたヘテロシクリル”は、(i)オキソ、ハロゲン、ニトロ、シアノ、アリール、ヘテロアリール、アルキル、R10A1‐、R10aOC(=O)‐、R10aC(=O)O‐、(R10)(H)NC(=O)‐、(R10)(アルキル)NC(O)‐、R10aC(=O)N(H)‐、(R10)(H)N‐、(R10)(アルキル)N‐、(R10)(H)NC(=A1)N(H)‐、(R10)(アルキル)NC(=A1)N(H)‐を含む群から独立して選択される1〜6個の置換基で環炭素原子上に任意に置換されたヘテロシクリル基と、(ii)アリール、ヘテロアリール、アルキル、R10aC(=O)‐、R10aSO2‐、R10aOC(=O)‐、(R10)(H)NC(=O)‐、(R10)(アルキル)NC(=O)‐を含む群から選択される置換基で環窒素(群)上に任意に置換されたヘテロシクリル基を意味し;
用語“任意に置換されたヘテロアリール”は、ハロゲン、ニトロ、シアノ、ヒドロキシ、C1〜C6アルキル、C3〜C6シクロアルキル、C1〜C6ペルハロアルキル、アルキル‐O‐、ペルハロアルキル‐O‐、アルキル‐N(アルキル)‐、アルキル‐N(H)‐、H2N‐アルキル‐SO2−、ペルハロアルキル‐SO2‐、アルキル‐C(=O)N(アルキル)‐、アルキル‐C(=O)N(H)‐、アルキル‐N(アルキル)C(= O)‐、アルキル‐N(H)C(=O)‐、H2NC(=O)‐、アルキル‐N(アルキル)SO2、アルキル‐N(H)SO2‐、H2NSO2‐、アルキル又はアルキル‐C(=O)で任意に置換されたN、O及びSから選択される1〜2個のヘテロ原子を含有する3〜6員複素環を含む群から独立して選択される1〜3個の置換基で任意に置換されたヘテロアリール基を意味し;
R10は、水素、アルキル、アリール、ヘテロアリール、シクロアルキルまたはヘテロシクリルから選択され;A1は、S及びOから選択され;R10aは、アルキル、ペルハロアルキル、アリール、ヘテロアリール、シクロアルキルまたはヘテロシクリルから選択される。
本発明の好ましい実施形態は、上記で定義したような式Iの化合物であり、R1はメチルから選択される。
本発明の別の好ましい実施形態は、上記で定義したような式Iの化合物であり、R3は、水素及びメチルから選択される。
用語“アルキル”は、本明細書で使用される、1〜20個の炭素原子を含む直鎖または分枝鎖炭化水素を意味する。本明細書中で定義される用語は、アルケニル及びアルキニル基のように2〜20個の炭素原子及び1以上の不飽和(二重または三重)結合を含有する不飽和鎖も含む。好ましくは、アルキル鎖は1〜10個の炭素原子を含んでもよく、アルケニル及びアルキニル鎖は2〜10個の炭素を含有してもよい。より好ましくは、アルキル鎖が6個までの炭素原子を含んでいてもよい。アルキルの代表例としては、メチル、エチル、n−プロピル、iso‐プロピル、n−ブチル、sec‐ブチル、iso‐ブチル、tert‐ブチル、n−ペンチル、イソペンチル、ネオペンチル、アリル、ビニル、アセチレン、及びn−ヘキシルが挙げられるが、これらに限定されない。
1. 4‐(5‐(4,4‐ジメチルクロマン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド。
5. 4‐(5‐(2,3‐ジヒドロ‐1H‐インデン‐4‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド。
7. 4‐(5‐(8‐フルオロ‐4,4‐ジメチルクロマン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド。
本発明の別の局面によれば、全ての記号が先に定義されている一般式Iの化合物を、以下のスキーム1に記載の方法により調製した。しかし、本発明はこれらの方法に限定されるものではない。化合物はまた、文献に構造的に関連する化合物について説明された手順を用いて調製することもできる。
R3=Hのときの式Xの化合物は、当技術分野で周知の一般的な官能基の変換手順を使用することにより、R3=アリール、ニトロ、アミノ、アミノアルキル、ハロ、ヒドロキシまたはシアノである式Xの化合物の形成をさらに引き起こすI2、HNO2、HCHOなどを含むがこれらに限定されない求電子試薬によって官能化されることができる。
式XIIIの化合物は、例えば、米国化学会誌、1945、67、9、1510−1512などの文献に記載された手順に従って調製された。
本発明はまた、注意欠陥多動性障害、統合失調症及びアルツハイマー病、パーキンソン認知症、血管認知症やレビー小体型、外傷性脳損傷に関連付けられている認知症などの他の認知障害の治療に用いる薬と組み合わせて、もしくはその補助として、上記で定義されるような式Iの化合物を投与する方法を提供する。
実施例1: 4‐(5‐(4,4‐ジメチルクロマン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド
MS:m/z283(M+1)
1HNMR(CDCl3,400MHz):δ7.98(d,J=2.4Hz,1H),7.70(dd,J=8.4,2.4 Hz,1H),6.82(d,J=8.4Hz,1H),4.38(s,2H),4.26(dt,J=4.4,1.2 Hz,2H),1.85(dt,J=4.4,1.2Hz,2H),1.37(s,6H).
ステップ2: 3‐アセチル‐1‐(4,4‐ジメチルクロマン‐6‐イル)ヘキサン‐1,4‐ジオン
MS:m/z317(M+1)
1HNMR(CDCl3,400MHz):δ7.90(d,J = 2.4Hz,1H),7.68(dd,J=8.4,2.4 Hz,1H),6.79(d,J=8.4Hz,1H),4.3(t,J=6.8Hz,1H),4.25(dt,J=4.4,1.2 Hz,2H),3.52(d,J=6.8Hz,2H),2.67(q,J=7.2Hz,2H),2.31(s,3H),1.84(dt,J=4.4,1.2Hz,2H),1.33(s,6H),1.08(t,J=7.2Hz,3H).
ステップ3: 4‐(5‐(4,4‐ジメチルクロマン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H ‐ピロール‐1‐イル)ベンゼンスルホンアミド
MS:m/z453(M+1)
1HNMR(CDCl3,400MHz):δ7.95(d,J = 8.8Hz,2H),7.26(d,J = 8.8Hz,2H),6.89(dd,J=8.4,2.0 Hz,1H),6.64(m,3H),5.07(bs‐D2Oで交換 2H),4.09(t,J=5.2Hz,2H),2.85(q,J=7.2Hz,2H),2.41(s,3H),1.70(t,J=5.2Hz,2H),1.19(t,J=7.2Hz,3H),1.00(s,6H).
実施例2: 4‐(5‐(4,4‐ジメチルクロマン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド〔代替方法]
ステップ1: 2‐アセチル‐4‐(4,4‐ジメチルクロマン‐6‐イル)‐4‐オキソブタン酸エチル
MS:m/z333(M+1)
ステップ2: 5‐(4,4‐ジメチルクロマン‐6‐イル)‐2‐メチル‐1‐(4‐スルファモイルフェニル)‐1H‐ピロール‐3‐カルボン酸エチル
MS:m/z469(M+1)
ステップ3: 5‐(4,4‐ジメチルクロマン‐6‐イル)‐2‐メチル‐1‐(4‐スルファモイルフェニル)‐1H‐ピロール‐3‐カルボン酸
MS:m/z441(M+1)
ステップ4: 1‐(4‐(N‐((ジメチルアミノ)メチレン)スルファモイル)フェニル)‐5‐(4,4‐ジメチルクロマン‐6‐イル)−N−メトキシ−N,2−ジメチル−1H−ピロール‐3‐カルボキサミド
この残渣に、N,O‐ジメチルヒドロキシルアミン塩酸塩(0.75g、7.72mmol)を乾燥ジクロロメタン(50ml)中に含む溶液を0°Cで加え、続いて撹拌しながらトリエチルアミン(1.56g、2.05ml、15.44mmol)を加えた。反応混合物を室温で2時間攪拌した。反応の完了はTLCデモニターした。溶媒を減圧下で除去した。このようにして得られた残留物を、ジクロロメタン(100ml)中に取り、水(2x10ml)で洗浄し、分離した有機層を無水硫酸ナトリウムで乾燥させ、濾過し、減圧下で濃縮し、粗生成物を得た。それを、溶離剤としてジクロロメタン/0.2%メタノールを用いたシリカゲル(100‐200メッシュ)カラムクロマトグラフィーにより精製し、表題化合物(1.67g、80.6%)を得た。
MS:m/z539(M+1)
ステップ5: 4‐(5‐(4,4‐ジメチルクロマン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド
MS:m/z453(M+1)
1HNMR(CDCl3,400MHz):δ7.95(d,J=8.8Hz,2H),7.26(d,J=8.8Hz,2H),6.90(dd,J=8.4,2.0 Hz,1H),6.65(m,3H),4.90(bs‐D2Oで交換 2H),4.11(t,J=5.2Hz,2H),2.86(q,J=7.2Hz,2H),2.44(s,3H),1.71(t,J=5.2Hz,2H),1.21(t,J=7.2Hz,3H),1.02(s,6H).
実施例3: 以下の本発明の化合物は、適宜必要な反応体を変更することにより、実施例1及び2と類似の方法を用いて調製した。
4‐(5‐(2,3‐ジヒドロベンゾ〔b〕[1,4]ジオキシン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド
1HNMR(CDCl3,400MHz):δ7.96(d,J=8.4Hz,2H),7.28(d,J=8.4Hz,2H),6.64−6.66(m,2H),6.58(d,J=2.0Hz,1H),6.40(dd,J=8.4,2.0 Hz,1H),4.87(bs‐D2Oで交換 2H),4.19−4.22(m,4H),2.86(q,J=7.2Hz,2H),2.42(s,3H),1.20(t,J=7.2Hz,3H).
4‐(2‐(2,3‐ジヒドロベンゾ〔b〕[1,4]ジオキシン‐6‐イル)‐3,5‐ジメチル‐4‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド
1HNMR(CDCl3,400MHz):δ7.87(d,J=8.4Hz,2H),7.19(d,J=8.4Hz,2H),6.67(d,J=8.0Hz,1H),6.56(d,J=2.0Hz,1H),6.39(dd,J=8.0,2.0 Hz,1H),4.88(bs‐D2O2Hで交換),4.13−4.22(m,4H),2.86(q,J=7.2Hz,2H),2.33(s,3H),2.24(s,3H),1.20(t,J=7.2Hz,3H).
5‐(2,3‐ジヒドロベンゾ[b][1,4]ジオキシン‐6‐イル)‐2,4‐ジメチル‐1‐(4‐スルファモイルフェニル)‐1H‐ピロール‐3‐カルボン酸エチル
1HNMR(CDCl3,400MHz):δ7.87(d,J=8.4Hz,2H),7.17(d,J=8.4Hz,2H),6.65(d,J=8.40Hz,1H),6.56(d,J=2.0Hz,1H),6.39(dd,J=8.4,2.0 Hz,1H),4.95(bs‐D2Oで交換 2H),4.22(q,J=6.8Hz,2H),4.14−4.20(m,4H),2.35(s,3H),2.22(s,3H),1.36(t,J=6.8Hz,3H).
4‐(2‐メチル‐3‐プロピオニル‐5‐(5,6,7,8‐テトラヒドロナフタレン‐2‐イル)‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド
1HNMR(CDCl3,400MHz):δ7.95(d,J=8.4Hz,2H),7.28(d,J=8.4Hz,2H),6.80−6.83(m,2H),6.67(s,1H),6.59(dd,J=8.0,2.0 Hz,1H),4.99(bs‐D2Oで交換 2H),2.87(q,J=7.2Hz,2H),2.60−2.68(m,4H),2.42(s,3H),1.72−1.75(m,4H),1.20(t,J=7.2Hz,3H).
実施例4: 4‐(5‐(2,3‐ジヒドロ‐1H‐インデン‐4‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド
MS:m/z240(M+1)、
1HNMR(CDCl3,400MHz):δ7.66(d,J=7.2Hz,1H),7.43(d,J=7.2Hz,1H),7.23−7.27(m,1H),4.49(s,2H),3.25(t,J=7.6Hz,2H),2.92(t,J=7.6Hz,2H),2.08(クインテット,J=7.6Hz,2H).
ステップ2: 3‐アセチル‐1‐(2,3‐ジヒドロ‐1H‐インデン‐4‐イル)ヘキサン‐1,4‐ジオン
MS:m/z273(M+1)、
1HNMR(CDCl3,400MHz):δ7.72(d,J=7.2Hz,1H),7.41(d,J=7.2Hz,1H),7.23−7.26(m,1H),4.36(t,J=7.2Hz,1H),3.56(d,J=7.2Hz,2H),3.23(t,J=7.6Hz,2H),2.91(t,J=7.6Hz,2H),2.69(q,J=7.6Hz,2H),2.31(s,3H),2.07(クインテット,J=7.2Hz,2H),1.08(t,J=7.2Hz,3H).
ステップ3: 4‐(5‐(2,3‐ジヒドロ‐1H‐インデン‐4‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド
MS:m/z409(M+1)、
1HNMR(DMSO,400MHz):δ7.80(d,J=8.4Hz,2H),7.48(bs‐D2Oで交換,2H),7.41(d,J=8.4Hz,2H),7.07(d,J=7.6Hz,1H),6.93(t,J=7.6Hz,1H),6.79(S,1H),6.64(d,J=7.6Hz,1H),2.77−2.85(m,6H),2.34(s,3H),1.91(クインテット,J=7.2Hz,2H),1.08(t,J=7.2Hz,3H).
実施例5: 4−(5−(2,2‐ジメチルクロマン−6−イル)−2− メチル−3−プロピオニル−1H−ピロール−1−イル)ベンゼンスルホンアミドの作製。
MS:m/z284(M+1)、
1HNMR(CDCl3,400MHz):δ7.71−7.76(m,2H),6.80(d,J=8.4Hz,1H),4.35(s,2H),2.82(t,J=6.8Hz,2H),1.84(t,J=6.8Hz,2H),1.35(s,6H).
ステップ2: 3‐アセチル‐1‐(2,2‐ジメチルクロマン−6−イル)ヘキサン‐1,4‐ジオン
MS:m/z317(M+1)、
1HNMR(CDCl3,400MHz):δ7.67−7.77(m,2H),6.72−6.79(m,1H),4.36(t,J=6.8Hz,1H),3.51(d,J=6.8Hz,2H),2.72−2.85(m,4H),2.31(s,3H),1.82(q,J=7.2Hz,2H),1.35(s,6H),1.06(t,J=7.2Hz,3H).
ステップ3: 4−(5−(2,2−ジメチルクロマン−6−イル)−2−メチル‐3‐プロピオニル−1H−ピロール‐1‐イル)ベンゼンスルホンアミド
MS:m/z453(M+1)、
1HNMR(DMSO,400MHz):δ7.87(d,J=8.4Hz,2H),7.50(bs‐D2Oで交換,2H),7.44(d,J=8.4Hz,2H),6.93(d,J=2.04Hz,1H),6.78(s,1H),6.57(dd,J=8.4,2.0Hz,1H),6.47(d,J=8.4Hz,1H),2.82(q,J=7.2Hz,2H),2.60(t,J=6.8Hz,2H),2.31(s,3H),1.70(t,J=6.8Hz,2H),1.22(s,6H),1.07(t,J=7.2Hz,3H).
実施例6: 4‐(5‐(8‐フルオロ‐4,4‐ジメチルクロマン−6−イル)−2−メチル‐3‐プロピオニル−1H−ピロール‐1‐イル)ベンゼンスルホンアミド
MS:m/z221(M+23)、
1HNMR(CDCl3,400MHz):δ6.88−7.09(m,4H),4.32(t,J=6.4Hz,2H),3.72(s,3H),2.84(t,J=6.4Hz,2H).
ステップ2: 4‐(2‐フルオロフェノキシ)‐2‐メチルブタン‐2‐オール
MS:m/z221(M+23)、
1HNMR(CDCl3,400MHz):δ6.88−7.09(m,4H),4.24(t,J=6.4Hz,2H),2.35(bs‐D2Oで交換 1H),2.02(t,J=6.4Hz,2H),1.312(s,6H).
ステップ3: 8‐フルオロ‐4,4‐ジメチルクロマン
MS:m/z非イオン化、
1HNMR(CDCl3,400MHz):δ7.03−7.76(dt,J=1.6Hz,8.0Hz,1H),6.85−6.88(m,1H),6.77−6.8(m,1H),4.24−4.26(m,2H),1.85−1.87(m,2H),1.33(s,6H).
ステップ4: 2‐ブロモ‐1‐(8‐フルオロ‐4,4‐ジメチルクロマン−6−イル)エタノン
MS:m/z301(M+1)、
1HNMR(CDCl3,400MHz):δ7.75−7.76(m,1H),7.28(d,J=11.2Hz,2Hz,1H),4.33−4.35(m,4H),1.89(dd,J=6.0,5.6Hz,2H),1.37(s,6H).
ステップ5: 3‐アセチル‐1‐(8‐フルオロ‐4,4‐ジメチルクロマン−6−イル)ヘキサン‐1,4‐ジオン
MS:m/z373(M+39)、
1HNMR(CDCl3,400MHz):δ7.34−7.43(m,1H),7.12−7.21(m,1H),5.12−5.15(m,1H),4.12−4.34(m,4H),2.04(s,3H),1.84−1.91(m,4H),1.35(s,6H),1.21(t,J=7.2Hz,3H).
ステップ6: 4‐(5‐(8‐フルオロ‐4,4‐ジメチルクロマン−6−イル)‐2‐メチル‐3‐プロピオニル−1H−ピロール‐1‐イル)ベンゼンスルホンアミド
MS:m/z471(M+1)、
1HNMR(CDCl3,400MHz):δ7.99(d,J=8.8Hz,2H),7.28(d,J=8.8Hz,2H),6.74(dd,J=11.6,2.0Hz,1H),6.66(s,1H)),6.42(t,J=2.0Hz,1H),5.02(bs‐D2Oで交換,2H),4.19(t,J=5.2Hz,2H),2.86(q,J=7.2Hz,2H),2.43(s,3H),1.75(t,J=5.2Hz,2H),1.21(t,J=7.2Hz,3H),1.02(s,6H).
実施例7:
4‐(5‐(2‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン‐7‐イル)‐2‐メチル−3−プロピオニル−1H−ピロール‐1‐イル)ベンゼンスルホンアミド
4‐(5‐(2‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン‐6‐イル)‐2‐メチル−3−プロピオニル−1H−ピロール‐1‐イル)ベンゼンスルホンアミドの調製
MS:m/z204(M+1)、
1HNMR(DMSO,400MHz):δ7.04−7.36(m,4H),4.76(s,2H)),3.42(s,2H),2.18(s,3H),1.30(s,3H),1.27(s,3H).
ステップ2: 1‐(2‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン‐7‐イル)−2−ブロモエタノン
1‐(2‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン‐6‐イル)−2−ブロモエタノンの混合物
ステップ3: 3‐アセチル‐1‐(2‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン‐7‐イル)ヘキサン‐1,4‐ジオン
3‐アセチル‐1‐(2‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン‐6‐イル)ヘキサン‐1,4‐ジオンの混合物
ステップ4:4‐(5‐(2‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン‐7‐イル)‐2‐メチル−3−プロピオニル−1H−ピロール‐1‐イル)ベンゼンスルホンアミド
4‐(5‐(2‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン‐6‐イル)‐2‐メチル−3−プロピオニル−1H−ピロール‐1‐イル)ベンゼンスルホンアミド
第1の表題化合物: 4‐(5‐(2‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン−7−イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド
1HNMR(DMSO,400MHz):δ7.89−7.92(m,2H),7.54(bs‐D2Oで交換,2H),7.49(d,J=8.4Hz,2H),7.18(d,J=8.0Hz,1H),7.01(s,1H),6.92(d,J=2.4Hz,1H),6.72−6.74(m,1H),4.56(s,2H),3.42(S,2H),2.84(q,J=7.2Hz,2H),2.30(s,3H),2.05(s,3H),1.17(s,3H),1.11(s,3H),1.05(t,J=7.2Hz,3H).
第2の表題化合物: 4‐(5‐(2‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン−6−イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド
1HNMR(DMSO,400MHz):δ7.89(d,J=8.4Hz,2H),7.51(bs‐D2Oで交換,2H),7.48(d,J=8.4Hz,2H),7.05−7.12(m,2H),6.94(s,1H),6.78−6.81(m,1H),4.57(s,2H),3.17(s,2H),2.85(q,J=7.2Hz,2H),2.34(s,3H),2.04(s,3H),1.08(t,J=7.2Hz,3H),0.94(s,3H),0.89(s,3H).
実施例8: 4‐(5‐(4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン−7−イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミドの調製
MS:m/z452(M+1)、
1HNMR(DMSO,400MHz):δ8.23(bs‐D2Oで交換,1H),7.89(d,J=8.4Hz,2H),7.57(bs‐D2Oで交換,2H),7.19(d,J=8.4Hz,2H),6.88(s,1H),6.85(d,J=2.0Hz,1H),6.76(dd,J=8.4,2.0Hz,2H),3.81(s,2H),2.84(q,J=7.2Hz,2H),2.78(s,2H),2.30(s,3H),1.17(s,6H),1.05(t,J=7.2Hz,3H).
実施例9: 4‐(2‐メチル‐3−プロピオニル−5−(3H−スピロ[ベンゾ[b][1,4]ジオキシン‐2,1’‐シクロプロパン]−7−イル)‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド
4‐(2‐メチル‐3−プロピオニル−5−(3H−スピロ[ベンゾ[b][1,4]ジオキシン‐2,1’‐シクロプロパン]−6−イル)‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミドの調製。
MS:m/z410(M+1)、
1HNMR(CDCl3,400MHz):δ7.34(d,J=8.4Hz,2H),6.90−6.98(m,6H),5.00−5.07(m,2H),4.78(dd,J=8.8.4.0Hz,1H),3.81(s,3H),3.70(s,3H),3.53−3.57(m,2H),2.39−2.52(m,2H).
ステップ2: 1‐(2‐((4‐メトキシベンジル)オキシ)フェノキシ)シクロプロパンカルボン酸メチル
MS:m/z351(M+23)、
1HNMR(CDCl3,400MHz):δ7.34(d,J=8.4Hz,2H),6.84−6.97(m,6H),5.06(s,2H),3.77(s,3H),3.69(s,3H),1.59(t,J=4.4Hz,2H),1.25(t,J=4.4Hz,2H).
ステップ3: (1‐(2‐((4‐メトキシベンジル)オキシ)フェノキシ)シクロプロピル)メタノール
MS:m/z323(M+23)、
1HNMR(CDCl3,400MHz):δ7.36(d,J=8.4Hz,2H),7.13(d,J=7.6Hz,1H),6.88−6.97(m,5H),5.04(s,2H),3.80(s,3H),3.66(d,J=6.0Hz,2H),2.60(t‐D2Oで交換,J=6.0Hz,1H),1.14(t,J=6.4Hz,2H),0.79(t,J=6.4Hz,2H).
ステップ4: 2‐(1‐(ヒドロキシメチル)シクロプロポキシ)フェノール
MS:m/z203(M+23)、
1HNMR(CDCl3,400MHz):δ7.02(d,J=8.4Hz,1H),6.89−6.93(m,2H),6.76−6.81(m,1H),3.78(s,2H),2.30(bs‐D2Oで交換,2H),1.08(t,J=6.4Hz,2H),0.82(t,J=6.4Hz,2H).
ステップ5: 3H‐スピロ[ベンゾ[b][1,4]ジオキシン‐2,1’‐シクロプロパン]
MS:m/z非イオン化、
1HNMR(CDCl3,400MHz):δ6.78−6.93(m,4H),4.14(s,2H),1.09(t,J=6.4Hz,2H),0.79(t,J=6.4Hz,2H).
ステップ6: 2‐ブロモ‐1‐(3H‐スピロ[ベンゾ[b][1,4]ジオキシン‐2,1’‐シクロプロパン]‐7‐イル)エタノン
2‐ブロモ‐1‐(3H‐スピロ[ベンゾ[b][1,4]ジオキシン‐2,1’‐シクロプロパン]‐6‐イル)エタノンとの混合物
ステップ7: 3‐アセチル‐1‐(3H‐スピロ[ベンゾ[b][1,4]ジオキシン‐2,1’‐シクロプロパン]‐7‐イル)ヘキサン‐1,4‐ジオン
3‐アセチル‐1‐(3H‐スピロ[ベンゾ[b][1,4]ジオキシン‐2,1’‐シクロプロパン]‐6‐イル)ヘキサン‐1,4‐ジオンとの混合物
ステップ8: 4‐(2‐メチル‐3‐プロピオニル−5−(3H‐スピロ[ベンゾ[b][1,4]ジオキシン‐2,1’‐シクロプロパン]‐7‐イル)‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
4‐(2‐メチル‐3‐プロピオニル−5−(3H‐スピロ[ベンゾ[b][1,4]ジオキシン‐2,1’‐シクロプロパン]‐6‐イル)‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
第1の表題化合物: 4‐(2‐メチル‐3‐プロピオニル−5−(3H‐スピロ[ベンゾ[b][1,4]ジオキシン‐2,1’‐シクロプロパン]‐7‐イル)‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
1HNMR(DMSO,400MHz):δ7.88(d,J=8.4Hz,2H),7.52(bs‐D2Oで交換,2H),7.44(d,J=8.4Hz,2H),6.80(s,1H),6.72(d,J=8.4Hz,1H),6.55(d,J=2.0Hz,1H),6.47(dd,J=8.4,2.0Hz,1H),4.14(s,2H),2.81(q,J=7.2Hz,2H),2.29(s,3H),1.05(t,J=7.2Hz,3H),0.94(t,J=5.6Hz,2H),0.80(t,J=5.6Hz,2H).
第2の表題化合物: 4‐(2‐メチル‐3‐プロピオニル−5−(3H‐スピロ[ベンゾ[b][1,4]ジオキシン‐2,1’‐シクロプロパン]‐6‐イル)‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
1HNMR(DMSO,400MHz):δ7.89(d,J=8.4Hz,2H),7.53(bs‐D2Oで交換,2H),7.47(d,J=8.4Hz,2H),6.82(s,1H),6.70(d,J=2.0Hz,1H),6.61(d,J=8.4Hz,1H),6.42(dd,J=8.4,2.0Hz,1H),4.13(s,2H),2.82(q,J=7.2Hz,2H),2.29(s,3H),1.06(t,J=7.2Hz,3H),0.96(t,J=5.6Hz,2H),0.85(t,J=5.6Hz,2H).
実施例10: 4‐(5‐(1‐アセチル‐4,4‐ジメチル‐1、2,3,4‐テトラヒドロキノリン‐6‐イル)‐2‐メチル−3−プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド
4‐(5‐(1‐アセチル‐4,4‐ジメチル‐1、2,3,4‐テトラヒドロキノリン‐7‐イル)‐2‐メチル−3−プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミドの調製
1‐(1‐アセチル‐4,4‐ジメチル‐1、2,3,4‐テトラヒドロキノリン‐7‐イル)‐2‐ブロモエタノンの混合物
ステップ2: 3‐アセチル‐1‐(1‐アセチル‐4,4‐ジメチル‐1、2,3,4‐テトラヒドロキノリン−6−イル)ヘキサン‐1,4‐ジオン
3‐アセチル‐1‐(1‐アセチル‐4,4‐ジメチル‐1、2,3,4‐テトラヒドロキノリン−7−イル)ヘキサン‐1,4‐ジオンの混合物
ステップ3: 4‐(5‐(1‐アセチル‐4,4‐ジメチル‐1、2,3,4‐テトラヒドロキノリン‐6‐イル)−2‐メチル‐3‐プロピオニル‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
4‐(5‐(1‐アセチル‐4,4‐ジメチル‐1、2,3,4‐テトラヒドロキノリン‐7‐イル)−2‐メチル‐3‐プロピオニル‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
第1の表題化合物: 4‐(5‐(1‐アセチル‐4,4‐ジメチル‐1、2,3,4‐テトラヒドロキノリン‐6‐イル)−2‐メチル‐3‐プロピオニル‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
1HNMR(DMSO,400MHz):δ7.90(d,J=8.4Hz,2H),7.47−7.53(m,5H),7.05(d,J=8.0Hz,1H),6.94(s,1H),6.75(s,1H),3.62(t,J=5.6Hz,2H),2.85(q,J=7.2Hz,2H),2.34(s,3H),2.08(s,3H),1.60(t,J=5.6Hz,2H),1.08(t,J=7.2Hz,3H),0.92(s,6H).
第2の表題化合物: 4‐(5‐(1‐アセチル‐4,4‐ジメチル‐1、2,3,4‐テトラヒドロキノリン‐7‐イル)−2‐メチル‐3‐プロピオニル‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
1HNMR(DMSO,400MHz):δ7.89(d,J=8.4Hz,2H),7.48−7.54(m,4H),7.29(d,J=8.0Hz,1H),6.86−6.94(m,3H),3.63(t,J=6.0Hz,2H),2.85(q,J=7.2Hz,2H),2.50(s,3H),2.30(s,3H),1.65(t,J=6.0Hz,2H),1.18(s,6H),1.06(t,J=7.2Hz,3H).
実施例11: 4‐(5‐(4,4‐ジメチル‐1、2,3,4‐テトラヒドロキノリン‐6‐イル)−2‐メチル‐3‐プロピオニル‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
4‐(5‐(4,4‐ジメチル‐1、2,3,4‐テトラヒドロキノリン‐7‐イル)−2‐メチル‐3‐プロピオニル‐1H−ピロール‐1‐イル)ベンゼンスルホンアミドの調製
第1の表題化合物: 4‐(5‐(4,4‐ジメチル‐1,2,3,4‐テトラヒドロキノリン‐6‐イル)−2‐メチル‐3‐プロピオニル‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
1HNMR(CDCl3,400MHz):δ7.96(d,J=8.4Hz,2H),7.28(d,J=8.4Hz,2H),6.79(dd,J=8.0,2.0Hz,1H),6.60(s,1H),6.58(d,J=2.0Hz,1H),6.31(d,J=8.0Hz,1H),4.87(bs‐D2Oで交換,2H),3.24(t,J=5.6Hz,2H),2.85(q,J=7.2Hz,2H),2.44(s,3H),1.62(t,J=5.6Hz,2H),1.59(bs−D2Oで交換,1H),1.21(t,J=7.2Hz,3H),0.98(s,6H).
第2の表題化合物: 4‐(5‐(4,4‐ジメチル‐1、2,3,4‐テトラヒドロキノリン‐7‐イル)−2‐メチル‐3‐プロピオニル‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
1HNMR(CDCl3,400MHz):δ7.95(d,J=8.4Hz,2H),7.29(d,J=8.4Hz,2H),6.93(d,J=8.0Hz,1H),6.65(s,1H),6.19(d,J=2.0Hz,1H),6.16(dd,J=8.0,2.0Hz,1H),4.99(bs‐D2Oで交換,2H),3.25(t,J=5.6Hz,2H),2.84(q,J=7.2Hz,2H),2.40(s,3H),1.68(t,J=5.6Hz,2H),1.66(bs‐D2Oで交換,1H),1.22(s,6H),1.20(t,J=7.2Hz,3H).
実施例12: 4‐(5‐(4,4‐ジメチル‐2‐オキソ‐1、2,3,4‐テトラヒドロキノリン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
4‐(5‐(4,4‐ジメチル‐2‐オキソ‐1、2,3,4‐テトラヒドロキノリン‐7‐イル)‐2‐メチル‐3‐プロピオニル‐1H−ピロール‐1‐イル)ベンゼンスルホンアミドの調製
7‐(2‐ブロモアセチル)‐4,4‐ジメチル‐3,4‐ジヒドロキノリン‐2(1H)‐オンとの混合物
ステップ2: 3‐アセチル‐1‐(4,4‐ジメチル‐2‐オキソ‐1,2,3,4‐テトラヒドロキノリン−6−イル)ヘキサン‐1,4‐ジオン
3‐アセチル‐1‐(4,4‐ジメチル‐2‐オキソ‐1、2,3,4‐テトラヒドロキノリン‐7‐イル)ヘキサン‐1,4‐ジオンとの混合物
ステップ3: 4‐(5‐(4,4‐ジメチル‐2‐オキソ‐1,2,3,4‐テトラヒドロキノリン−6−イル)‐2‐メチル‐3‐プロピオニル‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
4‐(5‐(4,4‐ジメチル‐2‐オキソ‐1,2,3,4‐テトラヒドロキノリン−7−イル)‐2‐メチル‐3‐プロピオニル‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
第1の表題化合物: 4‐(5‐(4,4‐ジメチル‐2‐オキソ‐1,2,3,4‐テトラヒドロキノリン−6−イル)‐2‐メチル‐3‐プロピオニル‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
1HNMR(DMSO,400MHz):δ10.46(bs‐D2Oで交換,1H),7.99(d,J=8.4Hz,2H),7.56−7.72(m,6H),6.97(d,J=8.4Hz,1H),6.21(s,1H),2.44(s,2H),2.30(q,J=7.2Hz,2H),2.21(s,3H),1.27(s,6H),1.01(t,J=7.2Hz,3H).
第2の表題化合物: 4‐(5‐(4,4‐ジメチル‐2‐オキソ‐1,2,3,4‐テトラヒドロキノリン−7−イル)‐2‐メチル‐3‐プロピオニル‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
1HNMR(DMSO,400MHz):δ10.13(bs‐D2Oで交換,1H),7.89(d,J=8.4Hz,2H),7.46−7.51(m,4H),7.03(dd,J=8.0,2.0Hz,1H),6.87(s,1H),6.71−6.74(m,2H),2.83(q,J=7.2Hz,2H),2.33(s,3H),2.21(s,2H),1.07(t,J=7.2Hz,3H),0.94(s,6H).
実施例13: 4‐(2‐メチル‐3‐プロピオニル‐5‐(1,4,4−トリメチル‐2‐オキソ‐1,2,3,4‐テトラヒドロキノリン−6−イル)‐1H−ピロール‐1‐イル)ベンゼンスルホンアミドの調製
MS:m/z311(M+1)、
ステップ2: 3‐アセチル‐1‐(1,4,4‐トリメチル‐2‐オキソ‐1,2,3,4‐テトラヒドロキノリン−6 −イル)ヘキサン‐1,4‐ジオン
MS:m/z344(M+1)、
ステップ3: 4‐(2‐メチル‐3‐プロピオニル‐5‐(1,4,4‐トリメチル‐2‐オキソ‐1,2,3,4‐テトラヒドロキノリン−6−イル)‐1H−ピロール‐1‐イル)ベンゼンスルホンアミド
MS:m/z480(M+1)、
1HNMR(CDCl3,400MHz):δ7.99(d,J=8.4Hz,2H),7.32(d,J=8.4Hz,2H),7.03(dd,J=8.4,2.0Hz,1H),6.84(d,J=8.4Hz,1H),6.77(d,J=2.0Hz,1H),6.73(s,1H),4.98(bs‐D2Oで交換,2H),3.33(s,3H),2.89(q,J=7.2Hz,2H),2.46(s,3H),2.41(s,2H),1.22(t,J=7.2Hz,3H),1.07(s,6H).
実施例14: 薬理スクリーニング
化合物を、α7nAChRのネイティブ発現を用いた人間のIMR‐32細胞の細胞ベースのリアルタイムカイネティックアッセイで試験した。細胞内のCa2+レベルの増大を、蛍光イメージングプレートリーダー(FLIPR)で測定した。試験化合物及びアゴニスト溶液を、アッセイ緩衝液(HBSS、pH7.4、20mMのHEPES及び10mMのCaCl2)中で作成した。簡単に述べると、細胞を80,000〜100,000細胞/ウェルの密度でポリ‐D‐リシンコーティングされた裏壁透明底に96ウェルを有するマイクロプレートに播種し、実験前に40‐48時間37°C/5%CO2で培養した。アゴニスト応答の化合物媒介増強の評価のために、増殖培地をウェルから除去し、アッセイ緩衝液中で再構成した200μlのFLIPRカルシウム4色素(モレキュラーデバイス)をウェルに加えた。色素ローディング後、マイクロプレートを37°Cで30分間、室温で30分間培養し、そのままFLIPRに移した。ベースライン蛍光を最初の第10〜30秒間モニターし、25μl試験化合物溶液を加え、続いて最大10分間、蛍光の変化を監視した。この後、25μlのアゴニスト(PNU‐282987、10μM)溶液を加え、4分間の蛍光の測定を行った。(Faghih R.et al.、2009、J.Med.Chem.52、3377‐84)
アゴニストの存在下で試験化合物を用いて得られた最大の効果(マクシミン蛍光)をアゴニストアローン効果と分け合うことにより、アゴニスト応答(倍PAM活性)中の化合物誘発倍増を算出した。EC50の化合物を、倍PAM活性に対する化合物濃度をプロットすることにより、グラフパッドプリズムソフトウェアバージョン5.0を用いて計算した。
本発明の化合物は、1μM濃度で、2〜30倍の活性化を示した。
Claims (10)
- 一般式Iの化合物、その互変異性体形態、その立体異性体及びその薬学的に許容される塩であって;
R1は、水素、ハロゲン、任意に置換されたアルキル、ペルハロアルキル、任意に置換されたシクロアルキル、任意に置換されたアリール、任意に置換されたヘテロシクリル、及び任意に置換されたヘテロアリールから選択され;
R2は、任意に置換されたアルキル、任意に置換されたヘテロアルキル、任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換されたシクロアルキル、任意に置換されたヘテロシクリル、‐NR5(R6)、‐A1R5、及び‐N(R5)OR6から選択され;
R3は、水素、任意に置換されたアルキル、ハロ(halo)、任意に置換されたシクロアルキル、任意に置換されたアリール、任意に置換されたヘテロシクリル、任意に置換されたヘテロアリール、シアノ、ニトロ、‐NR5(R6)、及び‐OR5から選択され:
R4は
Yは、独立して、‐O‐、‐S‐、‐NH‐、[化3]、または、q=1‐4である[化4]からの各繰返しで選択され;Yが‐NH‐または[化4]として選択される場合、必要に応じて[R8]nで置換され;
R7は、ハロゲン、任意に置換されたアルキル、及び任意に置換されたシクロアルキルからなる群からそれぞれの出現時に独立して選択され;
R8は、任意に置換されたアルキル、R9A1‐、及びR9aC(=A1)‐からなる群からそれぞれの出現時に独立して選択され;
m=0〜2;
n=0〜3;
p=0〜4であって;
p=0のとき、nは0でなく、
どこに現れようともR9は、水素、任意に置換されたC1‐6アルキル、任意に置換されたヘテロアルキル、任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換されたシクロアルキル、及び任意に置換されたヘテロシクリルから選択され;A1は、O及びSから選択され;
どこに現れようともR9aは、任意に置換されたC1‐6アルキル、任意に置換されたヘテロアルキル、任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換されたシクロアルキル、及び任意に置換されたヘテロシクリルから選択され;
用語“任意に置換されたアルキル”は、オキソ、ハロゲン、ニトロ、シアノ、アリール、ヘテロアリール、シクロアルキル、R10aSO2‐、R10A1‐、R10aOC(=O)‐、R10aC(=O)O‐、(R10)(H)NC(=O)−、(R10)(アルキル)NC(=O)‐、R10aC(=O)N(H)‐、(R10)(H)N‐、(R10)(アルキル)N‐、(R10)(H)NC(=A1)N(H)‐、及び(R10)(アルキル)NC(=A1)N(H)‐からなる群から独立して選択される1〜6個の置換基で置換されたアルキル基を意味し;
用語“任意に置換されたヘテロアルキル”は、オキソ、ハロゲン、ニトロ、シアノ、アリール、ヘテロアリール、及びシクロアルキルからなる群から独立して選択される1〜6個の置換基で置換されたヘテロアルキル基を意味し;
用語“任意に置換されたシクロアルキル”は、オキソ、ハロゲン、ニトロ、シアノ、アリール、ヘテロアリール、アルキル、R10aC(=O)‐、R10aSO2‐、R10A1‐、R10aOC(=O)−、R10aC(=O)O‐、(R10)(H)NC(= O)‐、(R10)(アルキル)NC(=O)‐、R10aC(=O)N(H)‐、(R10)(H)N‐、(R10)(アルキル)N‐、(R10)(H)NC(=A1)N(H)‐、及び(R10)(アルキル)NC(=A1)N(H)‐からなる群から独立して選択される1〜6個の置換基で置換されたシクロアルキル基を意味し;
用語“任意に置換されたアリール”は、(i)ハロゲン、ニトロ、シアノ、ヒドロキシ、C1〜C6アルキル、C3〜C6シクロアルキル、C1〜C6ペルハロアルキル、アルキル‐O‐、ペルハロアルキル‐O‐、アルキル‐N(アルキル)‐、アルキル‐N(H)‐、H2N‐、アルキル‐SO2−、ペハロアルキル‐SO2‐、アルキル‐C(=O)N(アルキル)‐、アルキル‐C(=O)N(H)‐、アルキル‐N(アルキル)C(=O)‐、アルキル‐N(H)C(=O)‐、H2NC(=O)‐、アルキル‐N(アルキル)SO2‐、アルキル‐N(H)SO2‐、H2NSO2‐、及びアルキル又はアルキル‐C(=O)‐で任意に置換されたN、O及びSから選択される1〜2個のヘテロ原子を含む3〜6員複素環からなる群から独立して選択される1〜3個の置換基で任意に置換されたアリール基と、(ii)オキソ、アルキル又はアルキル‐C(=O)‐で任意に置換された結合を介してシクロアルカン又は複素環と任意に縮合したアリール環を意味し;
用語“任意に置換されたヘテロシクリル”は、(i)オキソ、ハロゲン、ニトロ、シアノ、アリール、ヘテロアリール、アルキル、R10A1‐、R10aOC(=O)‐、R10aC(=O)O‐、(R10)(H)NC(=O)‐、(R10)(アルキル)NC(O)‐、R10aC(=O)N(H)‐、(R10)(H)N‐、(R10)(アルキル)N‐、(R10)(H)NC(=A1)N(H)‐、及び(R10)(アルキル)NC(=A1)N(H)‐からなる群から独立して選択される1〜6個の置換基で環炭素原子上に任意に置換されたヘテロシクリル基と、(ii)アリール、ヘテロアリール、アルキル、R10aC(=O)‐、R10aSO2‐、R10aOC(=O)‐、(R10)(H)NC(=O)‐、及び(R10)(アルキル)NC(=O)‐からなる群から選択される置換基で環窒素(群)上に任意に置換されたヘテロシクリル基を意味し;
用語“任意に置換されたヘテロアリール”は、ハロゲン、ニトロ、シアノ、ヒドロキシ、C1〜C6アルキル、C3〜C6シクロアルキル、C1〜C6ペルハロアルキル、アルキル‐O‐、ペルハロアルキル‐O‐、アルキル‐N(アルキル)‐、アルキル‐N(H)‐、H2N‐、アルキル‐SO2−、ペルハロアルキル‐SO2‐、アルキル‐C(=O)N(アルキル)‐、アルキル‐C(=O)N(H)‐、アルキル‐N(アルキル)C(= O)‐、アルキル‐N(H)C(=O)‐、H2NC(=O)‐、アルキル‐N(アルキル)SO2‐、アルキル‐N(H)SO2‐、H2NSO2‐、及びアルキル又はアルキル‐C(=O)‐で任意に置換されたN、O及びSから選択される1〜2個のヘテロ原子を含有する3〜6員複素環からなる群から独立して選択される1〜3個の置換基で任意に置換されたヘテロアリール基を意味し;
R10は、水素、アルキル、アリール、ヘテロアリール、シクロアルキルまたはヘテロシクリルから選択され;A1は、S及びOから選択され;R10aは、アルキル、ペルハロアルキル、アリール、ヘテロアリール、シクロアルキルまたはヘテロシクリルから選択される、一般式Iの化合物。 - 請求項1に記載の式Iの化合物であって、R1が、メチルとして選択されることを特徴とする式Iの化合物。
- 請求項1に記載の式Iの化合物であって、R2が、エチル及びエトキシから選択されることを特徴とする式Iの化合物。
- 請求項1に記載の式Iの化合物であって、R3が、水素及びメチルから選択されることを特徴とする式Iの化合物。
- 請求項1に記載の式Iの化合物であって、化合物が、
4‐(5‐(4,4‐ジメチルクロマン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(2,3‐ジヒドロベンゾ〔b〕[1,4]ジオキシン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(2‐(2,3‐ジヒドロベンゾ〔b〕[1,4]ジオキシン‐6‐イル)‐3,5‐ジメチル‐4‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
5‐(2,3‐ジヒドロベンゾ[b][1,4]ジオキシン‐6‐イル)‐2,4‐ジメチル‐1‐(4‐スルファモイルフェニル‐1H‐ピロール‐3‐カルボン酸エチル;
4‐(5‐(2,2‐ジメチルクロマン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(8‐フルオロ‐4,4‐ジメチルクロマン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(2‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン‐7‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(2‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン‐7‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(2‐メチル‐3‐プロピオニル‐5‐(3H‐スピロ[ベンゾ[b][1,4]ジオキシン‐2,1’‐シクロプロパン]‐7‐イル)‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(2‐メチル‐3‐プロピオニル‐5‐(3H‐スピロ[ベンゾ[b][1,4]ジオキシン‐2,1’‐シクロプロパン]‐6‐イル)‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(1‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロキノリン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(1‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロキノリン‐7‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(4,4‐ジメチル‐1,2,3,4‐テトラヒドロキノリン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(4,4‐ジメチル‐1,2,3,4‐テトラヒドロキノリン‐7‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(4,4‐ジメチル‐2‐オキソ‐1,2,3,4‐テトラヒドロキノリン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(4,4‐ジメチル‐2‐オキソ‐1,2,3,4‐テトラヒドロキノリン‐7‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(2‐メチル‐3‐プロピオニル‐5‐(1,4,4‐トリメチル‐2‐オキソ‐1,2,3,4‐テトラヒドロキノリン‐6‐イル)‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
から選択されることを特徴とする式Iの化合物。 - 請求項1記載の化合物及び薬学的に許容される担体を含む医薬組成物。
- ニコチン性アセチルコリン受容体によって部分的または完全に媒介される疾患またはその症状または障害を予防または治療するための請求項1に記載の化合物。
- 障害または症状または疾患が、アルツハイマー病、軽度の認知障害、老年性認知症、脳血管性認知症、パーキンソン病の認知症、注意欠陥障害、注意欠陥多動性障害、レビー小体型に関連した認知症、AIDSによる認知症、ピック病、ダウン症候群に関連付けられている認知症、ハンチントン病、外傷性脳損傷に関連付けられている認知障害、認知と統合失調症に関連付けられている感覚運動ゲーティング障害、双極性障害に関連する認知障害、うつ病に関連する認知障害、急性疼痛、術後または術後疼痛、慢性疼痛、炎症、炎症性疼痛、神経因性疼痛、禁煙、創傷治癒に関連付けられた新しい血管の成長の必要性、皮膚移植片の血管新生に関連する新しい血管の成長の必要性、及び循環の欠如、関節炎、関節リウマチ、乾癬、クローン病、潰瘍性大腸炎、回腸嚢炎、炎症性腸疾患、セリアック病、歯周炎、サルコイドーシス、膵炎、臓器移植拒絶反応、臓器移植に関連する急性免疫疾患、臓器移植に関連する慢性免疫疾患、敗血症性ショック、毒素性ショック症候群、敗血症症候群、うつ病、及びリウマチ様脊椎炎、からなる群から選択される障害または症状または疾患に使用される化合物であって、前記化合物が、
4‐(5‐(4,4‐ジメチルクロマン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(2,3‐ジヒドロベンゾ〔b〕[1,4]ジオキシン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(2‐(2,3‐ジヒドロベンゾ〔b〕[1,4]ジオキシン‐6‐イル)‐3,5‐ジメチル‐4‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
5‐(2,3‐ジヒドロベンゾ[b][1,4]ジオキシン‐6‐イル)‐2,4‐ジメチル‐1‐(4‐スルファモイルフェニル‐1H‐ピロール‐3‐カルボン酸エチル;
4‐(5‐(2,3‐ジヒドロ‐1H‐インデン‐4‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(2,2‐ジメチルクロマン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(8‐フルオロ‐4,4‐ジメチルクロマン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(2‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン‐7‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(2‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(4,4‐ジメチル‐1,2,3,4‐テトラヒドロイソキノリン‐7‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(2‐メチル‐3‐プロピオニル‐5‐(3H‐スピロ[ベンゾ[b][1,4]ジオキシン‐2,1’‐シクロプロパン]‐7‐イル)‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(2‐メチル‐3‐プロピオニル‐5‐(3H‐スピロ[ベンゾ[b][1,4]ジオキシン‐2,1’‐シクロプロパン]‐6‐イル)‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(1‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロキノリン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(1‐アセチル‐4,4‐ジメチル‐1,2,3,4‐テトラヒドロキノリン‐7‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(4,4‐ジメチル‐1,2,3,4‐テトラヒドロキノリン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(4,4‐ジメチル‐1,2,3,4‐テトラヒドロキノリン‐7‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(4,4‐ジメチル‐2‐オキソ‐1,2,3,4‐テトラヒドロキノリン‐6‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(5‐(4,4‐ジメチル‐2‐オキソ‐1,2,3,4‐テトラヒドロキノリン‐7‐イル)‐2‐メチル‐3‐プロピオニル‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(2‐メチル‐3‐プロピオニル‐5‐(1,4,4‐トリメチル‐2‐オキソ‐1,2,3,4‐テトラヒドロキノリン‐6‐イル)‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド;
4‐(2‐メチル‐3‐プロピオニル‐5‐(5,6,7,8‐テトラヒドロナフタレン‐2‐イル)‐1H‐ピロール‐1‐イル)ベンゼンスルホンアミド
から選択される、化合物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| IN151KO2011 | 2011-02-03 | ||
| IN151/KOL/2011 | 2011-02-03 | ||
| PCT/IB2012/050442 WO2012104782A1 (en) | 2011-02-03 | 2012-01-31 | Pyrrole derivatives used as modulators of alpha7 nachr |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2014504632A JP2014504632A (ja) | 2014-02-24 |
| JP2014504632A5 JP2014504632A5 (ja) | 2015-02-26 |
| JP5865397B2 true JP5865397B2 (ja) | 2016-02-17 |
Family
ID=45787252
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013552304A Expired - Fee Related JP5865397B2 (ja) | 2011-02-03 | 2012-01-31 | α7nAChRのモジュレータとして使用されるピロール誘導体 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20130310419A1 (ja) |
| EP (1) | EP2670744B1 (ja) |
| JP (1) | JP5865397B2 (ja) |
| KR (1) | KR20140041442A (ja) |
| CN (1) | CN103443092B (ja) |
| AU (1) | AU2012213086B2 (ja) |
| BR (1) | BR112013019893A2 (ja) |
| CA (1) | CA2825519A1 (ja) |
| MX (1) | MX344701B (ja) |
| SG (1) | SG192078A1 (ja) |
| WO (1) | WO2012104782A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014509641A (ja) * | 2011-03-31 | 2014-04-21 | ルピン・リミテッド | アルツハイマー病やパーキンソン病などの神経変性疾患の治療に用いられるニコチン性アセチルコリン受容体モジュレータとしてのピロール誘導体 |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2012221800B2 (en) * | 2011-02-23 | 2016-10-27 | Lupin Limited | Heteroaryl derivatives as alpha7 nAChR modulators |
| EP2822946A1 (en) | 2012-03-06 | 2015-01-14 | Lupin Limited | Thiazole derivatives as alpha 7 nachr modulators |
| EP2945936A1 (en) | 2012-11-12 | 2015-11-25 | Lupin Limited | Thiazole derivatives as alpha 7 nachr modulators |
| US9617211B2 (en) | 2013-01-16 | 2017-04-11 | Lupin Limited | Pyrrole derivatives as alpha 7 nAChR modulators |
| CA2892682A1 (en) * | 2013-03-13 | 2014-09-18 | Lupin Limited | Pyrrole derivatives as alpha 7 nachr modulators |
| TW201446243A (zh) | 2013-06-03 | 2014-12-16 | Lupin Ltd | 4-(5-(4-氯苯基)-2-(2-環丙基乙醯基)-1,4-二甲基-1氫-吡咯-3-基)苯磺醯胺作為α7尼古丁乙醯膽鹼受體調節劑 |
| CA2913987A1 (en) | 2013-06-17 | 2014-12-24 | Lupin Limited | Pyrrole derivatives as alpha 7 nachr modulators |
| GB2516045A (en) * | 2013-07-09 | 2015-01-14 | Neuro Bio Ltd | Neurodegenerative disorders |
| EP3204357B1 (en) * | 2014-10-10 | 2022-01-19 | High Force Research Limited | Fluorescent synthetic retinoids |
| WO2016100184A1 (en) | 2014-12-16 | 2016-06-23 | Forum Pharmaceuticals, Inc. | Geminal substituted quinuclidine amide compounds as agonists of alpha-7 nicotinic acetylcholine receptors |
| WO2016201096A1 (en) | 2015-06-10 | 2016-12-15 | Forum Pharmaceuticals, Inc. | Aminobenzisoxazole compounds as agonists of a7-nicotinic acetylcholine receptors |
| WO2017027600A1 (en) | 2015-08-12 | 2017-02-16 | Forum Pharmaceuticals, Inc. | GEMINAL SUBSTITUTED AMINOBENZISOXAZOLE COMPOUNDS AS AGONISTS OF α7-NICOTINIC ACETYLCHOLINE RECEPTORS |
| WO2017170934A1 (ja) * | 2016-04-01 | 2017-10-05 | 国立大学法人 東京大学 | 新規化合物とその合成方法 |
| HU231414B1 (hu) * | 2018-07-13 | 2023-08-28 | Richter Gedeon Nyrt. | Tiadiazin származékok |
Family Cites Families (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4808597A (en) | 1983-07-05 | 1989-02-28 | Pfizer Inc. | Method for inhibiting the degradation of cartilage |
| AU626881B2 (en) | 1988-07-14 | 1992-08-13 | F. Hoffmann-La Roche Ag | Benzofused heterocyclics used as pharmaceuticals |
| US5756529A (en) * | 1995-09-29 | 1998-05-26 | G.D. Searle & Co. | Substituted pyrazolyl benzenesulfonamides for use in veterinary therapies |
| JPH11180871A (ja) * | 1997-09-26 | 1999-07-06 | Sankyo Co Ltd | 1,2−ジフェニルピロール誘導体を含有する医薬 |
| US6313107B1 (en) | 2000-08-29 | 2001-11-06 | Allergan Sales, Inc. | Methods of providing and using compounds having activity as inhibitors of cytochrome P450RAI |
| EP1680137B1 (en) | 2003-10-14 | 2012-11-21 | F. Hoffmann-La Roche Ltd. | Macrocyclic carboxylic acid and acylsulfonamide compound as inhibitor of HCV replication |
| JP2007530635A (ja) | 2004-03-29 | 2007-11-01 | ノイロサーチ アクティーゼルスカブ | 新規尿素誘導体群およびそれらの利用 |
| US20060142349A1 (en) | 2004-12-23 | 2006-06-29 | Pfizer Inc | Methods of modulating the activities of alpha-7 nicotinic acetylcholine receptor |
| WO2006087305A1 (en) | 2005-02-16 | 2006-08-24 | Neurosearch A/S | Novel diazabicyclic aryl derivatives and their medical use |
| JP2006316054A (ja) * | 2005-04-15 | 2006-11-24 | Tanabe Seiyaku Co Ltd | 高コンダクタンス型カルシウム感受性kチャネル開口薬 |
| ES2632940T3 (es) | 2005-09-13 | 2017-09-18 | Janssen Pharmaceutica Nv | Derivados de tiazol sustituidos con 2-anilin-4-arilo |
| WO2007093602A1 (en) | 2006-02-16 | 2007-08-23 | Neurosearch A/S | Enantiopure quinuclidinyloxy pyridazines and their use as nicotinic acetylcholine receptor ligands |
| CN101384549B (zh) * | 2006-02-20 | 2011-04-13 | 安斯泰来制药株式会社 | 吡咯衍生物或其盐 |
| JO3019B1 (ar) | 2006-04-19 | 2016-09-05 | Janssen Pharmaceutica Nv | ثلاثي مستبدل 4،2،1-ثلاثي زولات |
| KR20090021165A (ko) * | 2006-06-27 | 2009-02-27 | 아보트 러보러터리즈 | 피롤 유도체 및 이의 사용 방법 |
| MX2008016336A (es) | 2006-06-27 | 2009-01-16 | Abbott Lab | Derivados de tiazolina y oxazolina y sus metodos de uso. |
| US20100160335A1 (en) | 2007-06-19 | 2010-06-24 | Kyorin Pharmaceutical Co., Ltd. | Pyridazinone derivative and pde inhibitor containing the same as active ingredient |
| CN101796034A (zh) | 2007-08-08 | 2010-08-04 | 神经研究公司 | 用作烟碱型乙酰胆碱受体的调节剂的新颖的1,2,3-三唑衍生物 |
| MX2010003156A (es) | 2007-10-04 | 2010-04-01 | Hoffmann La Roche | Derivados de aril amida substituida con tetrazol y usos de los mismos. |
| JP5362729B2 (ja) | 2007-10-04 | 2013-12-11 | エフ.ホフマン−ラ ロシュ アーゲー | シクロプロピルアリールアミド誘導体及びその使用 |
| JO2784B1 (en) | 2007-10-18 | 2014-03-15 | شركة جانسين فارماسوتيكا ان. في | 5,3,1 - Triazole substitute derivative |
| CL2009000662A1 (es) | 2008-03-19 | 2010-02-05 | Janssen Pharmaceutica Nv | Compuestos derivados de 1,2,4-triazol trisustituidos, moduladores del receptor de acetilcolina nicotinicos; composicion farmaceutica; su proceso de preparacion; y uso para la prevencion o el tratamiento de trastornos psicoticos, trastornos o enfermedades de daño intelectual, o enfermedades o trastornos inflamatorios. |
| US7786171B2 (en) | 2008-04-04 | 2010-08-31 | Abbott Laboratories | Amide derivatives as positive allosteric modulators and methods of use thereof |
| EA017726B1 (ru) | 2008-04-17 | 2013-02-28 | Глэксо Груп Лимитед | Индолы в качестве модуляторов никотинового рецептора ацетилхолина подтипа альфа-7 |
| CL2009001125A1 (es) | 2008-05-09 | 2011-02-11 | Janssen Pharmaceutica Nv | Compuestos derivados de pirazol trisustituido, moduladores alostericos positivos de los receptores ach nicotinicos; composicion farmaceutica que los comprende; proceso de preparacion de la composicion; y su uso en el tratamiento de enfermedades de snc o inflamatorias. |
| CN102105475B (zh) | 2008-07-28 | 2014-04-09 | 卫材R&D管理有限公司 | 螺氨基二氢噻嗪衍生物 |
| MX2011002794A (es) | 2008-09-25 | 2011-04-05 | Hoffmann La Roche | Indazol 2,3-sustituido o 4,5,6,7-tetrahidro-indazol como moduladores fxr contra dislipidemia y enfermedades relacionadas. |
| EP2387575B1 (en) | 2009-01-15 | 2013-09-04 | Anvyl, LLC | Alpha7 nicotinic acetylcholine receptor allosteric modulators, their derivatives and uses thereof |
| WO2010130768A1 (en) | 2009-05-14 | 2010-11-18 | Neurosearch A/S | Novel 1,4-diaza-bicyclo[3.2.1]octane derivatives useful as nicotinic acetylcholine receptor modulators |
| JO3250B1 (ar) | 2009-09-22 | 2018-09-16 | Novartis Ag | إستعمال منشطات مستقبل نيكوتينيك أسيتيل كولين ألفا 7 |
| JO3078B1 (ar) | 2009-11-27 | 2017-03-15 | Janssen Pharmaceutica Nv | مورفولينوثيازولات بصفتها منظمات الوستيرية نوع الفا 7 موجبة |
-
2012
- 2012-01-31 US US13/983,362 patent/US20130310419A1/en not_active Abandoned
- 2012-01-31 AU AU2012213086A patent/AU2012213086B2/en not_active Ceased
- 2012-01-31 CA CA2825519A patent/CA2825519A1/en not_active Abandoned
- 2012-01-31 MX MX2013008947A patent/MX344701B/es active IP Right Grant
- 2012-01-31 SG SG2013055769A patent/SG192078A1/en unknown
- 2012-01-31 WO PCT/IB2012/050442 patent/WO2012104782A1/en not_active Ceased
- 2012-01-31 CN CN201280013694.1A patent/CN103443092B/zh not_active Expired - Fee Related
- 2012-01-31 KR KR1020137022397A patent/KR20140041442A/ko not_active Ceased
- 2012-01-31 JP JP2013552304A patent/JP5865397B2/ja not_active Expired - Fee Related
- 2012-01-31 EP EP12706923.5A patent/EP2670744B1/en not_active Not-in-force
- 2012-01-31 BR BR112013019893A patent/BR112013019893A2/pt not_active IP Right Cessation
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014509641A (ja) * | 2011-03-31 | 2014-04-21 | ルピン・リミテッド | アルツハイマー病やパーキンソン病などの神経変性疾患の治療に用いられるニコチン性アセチルコリン受容体モジュレータとしてのピロール誘導体 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20130310419A1 (en) | 2013-11-21 |
| CA2825519A1 (en) | 2012-09-08 |
| BR112013019893A2 (pt) | 2016-10-11 |
| NZ613467A (en) | 2015-03-27 |
| JP2014504632A (ja) | 2014-02-24 |
| MX2013008947A (es) | 2014-01-08 |
| WO2012104782A1 (en) | 2012-08-09 |
| AU2012213086B2 (en) | 2016-05-05 |
| AU2012213086A1 (en) | 2013-08-22 |
| CN103443092B (zh) | 2015-11-25 |
| CN103443092A (zh) | 2013-12-11 |
| KR20140041442A (ko) | 2014-04-04 |
| EP2670744B1 (en) | 2015-05-27 |
| SG192078A1 (en) | 2013-08-30 |
| MX344701B (es) | 2017-01-03 |
| EP2670744A1 (en) | 2013-12-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5865397B2 (ja) | α7nAChRのモジュレータとして使用されるピロール誘導体 | |
| JP6118270B2 (ja) | アルファ7nachrモジュレータとしてのヘテロアリール誘導体 | |
| CN103443075A (zh) | 作为烟碱型乙酰胆碱受体调节剂的吡咯衍生物在治疗神经变性障碍,例如阿耳茨海默氏病和帕金森氏病中的用途 | |
| JP2016512225A (ja) | アルファー7nachrモジュレータとしてのピロール誘導体 | |
| US9504680B2 (en) | Pyrrole derivatives as alpha 7 nAChR modulators | |
| EP2945941B1 (en) | Pyrrole derivatives as alpha 7 nachr modulators | |
| NZ613467B2 (en) | Pyrrole derivatives used as modulators of alpha7 nachr | |
| HK1193098B (en) | Heteroaryl derivatives as alpha7 nachr modulators | |
| NZ615583B2 (en) | Pyrrole derivatives as nicotinic acetylcholine receptor modulators for use in the treatment of neurodegenerative disorders such as alzheimer's and parkinson's disease |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150108 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150108 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150804 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20150806 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20151030 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20151208 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20151225 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5865397 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |