JP5529754B2 - Nogginに対する感受性が低下したBMP変異体 - Google Patents
Nogginに対する感受性が低下したBMP変異体 Download PDFInfo
- Publication number
- JP5529754B2 JP5529754B2 JP2010539882A JP2010539882A JP5529754B2 JP 5529754 B2 JP5529754 B2 JP 5529754B2 JP 2010539882 A JP2010539882 A JP 2010539882A JP 2010539882 A JP2010539882 A JP 2010539882A JP 5529754 B2 JP5529754 B2 JP 5529754B2
- Authority
- JP
- Japan
- Prior art keywords
- bmp
- amino acid
- modified
- protein
- noggin
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 102000045246 noggin Human genes 0.000 title claims description 222
- 108700007229 noggin Proteins 0.000 title claims description 222
- 230000002829 reductive effect Effects 0.000 title claims description 13
- 230000035945 sensitivity Effects 0.000 title description 25
- 102000008131 Bone Morphogenetic Protein 7 Human genes 0.000 claims description 346
- 108010049870 Bone Morphogenetic Protein 7 Proteins 0.000 claims description 345
- 238000006467 substitution reaction Methods 0.000 claims description 245
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 223
- 108090000623 proteins and genes Proteins 0.000 claims description 148
- 102000004169 proteins and genes Human genes 0.000 claims description 139
- 230000005764 inhibitory process Effects 0.000 claims description 104
- 150000001413 amino acids Chemical class 0.000 claims description 92
- 102200160798 rs5122 Human genes 0.000 claims description 80
- 210000000988 bone and bone Anatomy 0.000 claims description 52
- 102220344807 c.193T>A Human genes 0.000 claims description 49
- 102220034160 rs113842820 Human genes 0.000 claims description 48
- 102200124656 rs6267 Human genes 0.000 claims description 36
- 150000007523 nucleic acids Chemical class 0.000 claims description 31
- 102000039446 nucleic acids Human genes 0.000 claims description 28
- 108020004707 nucleic acids Proteins 0.000 claims description 28
- 102220055260 rs140446520 Human genes 0.000 claims description 24
- 230000004071 biological effect Effects 0.000 claims description 22
- 102220144494 rs200079698 Human genes 0.000 claims description 21
- 230000008439 repair process Effects 0.000 claims description 15
- 210000000845 cartilage Anatomy 0.000 claims description 14
- 239000008194 pharmaceutical composition Substances 0.000 claims description 13
- 239000013598 vector Substances 0.000 claims description 7
- 239000003937 drug carrier Substances 0.000 claims description 6
- 102220506109 Protein PBDC1_S77T_mutation Human genes 0.000 claims 8
- 102000007350 Bone Morphogenetic Proteins Human genes 0.000 description 428
- 108010007726 Bone Morphogenetic Proteins Proteins 0.000 description 428
- 229940112869 bone morphogenetic protein Drugs 0.000 description 419
- 235000001014 amino acid Nutrition 0.000 description 210
- 102000008154 Bone Morphogenetic Protein 6 Human genes 0.000 description 137
- 108010049974 Bone Morphogenetic Protein 6 Proteins 0.000 description 137
- 235000018102 proteins Nutrition 0.000 description 122
- 210000004027 cell Anatomy 0.000 description 86
- 230000000694 effects Effects 0.000 description 70
- 108010049931 Bone Morphogenetic Protein 2 Proteins 0.000 description 58
- 102100024506 Bone morphogenetic protein 2 Human genes 0.000 description 58
- 230000004048 modification Effects 0.000 description 52
- 238000012986 modification Methods 0.000 description 52
- 238000000034 method Methods 0.000 description 50
- 102100024505 Bone morphogenetic protein 4 Human genes 0.000 description 39
- 108010049955 Bone Morphogenetic Protein 4 Proteins 0.000 description 38
- 210000001519 tissue Anatomy 0.000 description 38
- 230000014509 gene expression Effects 0.000 description 35
- 108090000765 processed proteins & peptides Proteins 0.000 description 33
- 235000018417 cysteine Nutrition 0.000 description 31
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 31
- 230000004069 differentiation Effects 0.000 description 31
- 102000037280 Growth Differentiation Factor 2 Human genes 0.000 description 30
- 108010090290 Growth Differentiation Factor 2 Proteins 0.000 description 29
- 102000008152 Bone Morphogenetic Protein 5 Human genes 0.000 description 28
- 210000004899 c-terminal region Anatomy 0.000 description 28
- 230000012010 growth Effects 0.000 description 28
- 239000000203 mixture Substances 0.000 description 28
- 108010049976 Bone Morphogenetic Protein 5 Proteins 0.000 description 27
- 108010090254 Growth Differentiation Factor 5 Proteins 0.000 description 27
- 102000012966 Growth Differentiation Factor 5 Human genes 0.000 description 27
- 108010090250 Growth Differentiation Factor 6 Proteins 0.000 description 26
- 102000012972 Growth Differentiation Factor 6 Human genes 0.000 description 26
- 239000011159 matrix material Substances 0.000 description 26
- 102220506390 Protein PBDC1_S77C_mutation Human genes 0.000 description 25
- 239000005557 antagonist Substances 0.000 description 25
- 239000007943 implant Substances 0.000 description 25
- 102000005962 receptors Human genes 0.000 description 24
- 108020003175 receptors Proteins 0.000 description 24
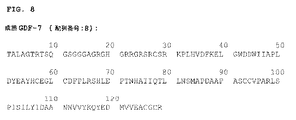
- 101710204283 Growth/differentiation factor 7 Proteins 0.000 description 23
- 102100035363 Growth/differentiation factor 7 Human genes 0.000 description 23
- 238000003556 assay Methods 0.000 description 23
- 230000004927 fusion Effects 0.000 description 20
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 19
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 18
- 230000008468 bone growth Effects 0.000 description 18
- 230000035772 mutation Effects 0.000 description 18
- 238000011282 treatment Methods 0.000 description 18
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 17
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 17
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 17
- 241000283973 Oryctolagus cuniculus Species 0.000 description 16
- 102000007453 TGF-beta Superfamily Proteins Human genes 0.000 description 16
- 108010085004 TGF-beta Superfamily Proteins Proteins 0.000 description 16
- 241000700159 Rattus Species 0.000 description 15
- 125000000539 amino acid group Chemical group 0.000 description 15
- 239000013604 expression vector Substances 0.000 description 15
- 239000011324 bead Substances 0.000 description 14
- 230000037118 bone strength Effects 0.000 description 13
- 238000010586 diagram Methods 0.000 description 13
- 239000003112 inhibitor Substances 0.000 description 13
- 241001465754 Metazoa Species 0.000 description 12
- 239000003636 conditioned culture medium Substances 0.000 description 12
- 230000011164 ossification Effects 0.000 description 12
- 125000001433 C-terminal amino-acid group Chemical group 0.000 description 11
- 101000899390 Homo sapiens Bone morphogenetic protein 6 Proteins 0.000 description 11
- 125000001429 N-terminal alpha-amino-acid group Chemical group 0.000 description 11
- 230000007547 defect Effects 0.000 description 11
- 230000011664 signaling Effects 0.000 description 11
- 102000046095 human BMP6 Human genes 0.000 description 10
- 230000006698 induction Effects 0.000 description 10
- 230000002188 osteogenic effect Effects 0.000 description 10
- 238000010171 animal model Methods 0.000 description 9
- 238000007429 general method Methods 0.000 description 9
- 239000003102 growth factor Substances 0.000 description 9
- 238000001727 in vivo Methods 0.000 description 9
- 108010040422 Bone Morphogenetic Protein Receptors Proteins 0.000 description 8
- 102000001893 Bone Morphogenetic Protein Receptors Human genes 0.000 description 8
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 8
- 239000004472 Lysine Substances 0.000 description 8
- 241000124008 Mammalia Species 0.000 description 8
- 150000001875 compounds Chemical class 0.000 description 8
- 238000009472 formulation Methods 0.000 description 8
- 230000006870 function Effects 0.000 description 8
- 208000014674 injury Diseases 0.000 description 8
- 102220285580 rs1554888119 Human genes 0.000 description 8
- 239000000243 solution Substances 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- 210000000623 ulna Anatomy 0.000 description 8
- 101000899361 Homo sapiens Bone morphogenetic protein 7 Proteins 0.000 description 7
- 208000027418 Wounds and injury Diseases 0.000 description 7
- 238000002513 implantation Methods 0.000 description 7
- 230000001965 increasing effect Effects 0.000 description 7
- 239000003446 ligand Substances 0.000 description 7
- 102000035118 modified proteins Human genes 0.000 description 7
- 108091005573 modified proteins Proteins 0.000 description 7
- -1 sclerostin-like Proteins 0.000 description 7
- 238000012360 testing method Methods 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- 230000017423 tissue regeneration Effects 0.000 description 7
- 102220520196 Barrier-to-autointegration factor_L50K_mutation Human genes 0.000 description 6
- 102100025745 Cerberus Human genes 0.000 description 6
- 101710010675 Cerberus Proteins 0.000 description 6
- 102000038900 DAN family Human genes 0.000 description 6
- 108091065053 DAN family Proteins 0.000 description 6
- 102100033808 Glycoprotein hormone alpha-2 Human genes 0.000 description 6
- 101001069261 Homo sapiens Glycoprotein hormone alpha-2 Proteins 0.000 description 6
- 101000893585 Homo sapiens Growth/differentiation factor 2 Proteins 0.000 description 6
- 102220515504 Interferon gamma_K29Q_mutation Human genes 0.000 description 6
- 102220509305 Small integral membrane protein 10_D34Q_mutation Human genes 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 210000001185 bone marrow Anatomy 0.000 description 6
- 108010008846 chordin Proteins 0.000 description 6
- 102000006533 chordin Human genes 0.000 description 6
- 230000006378 damage Effects 0.000 description 6
- 238000013461 design Methods 0.000 description 6
- 230000001939 inductive effect Effects 0.000 description 6
- 238000003753 real-time PCR Methods 0.000 description 6
- 230000004044 response Effects 0.000 description 6
- 102220238245 rs1555952639 Human genes 0.000 description 6
- 102220005146 rs35262412 Human genes 0.000 description 6
- 102220064893 rs35669569 Human genes 0.000 description 6
- 102200097281 rs35807406 Human genes 0.000 description 6
- 102200105532 rs397509387 Human genes 0.000 description 6
- 102220001969 rs696217 Human genes 0.000 description 6
- 241000283690 Bos taurus Species 0.000 description 5
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 5
- 241000202252 Cerberus Species 0.000 description 5
- 102000008186 Collagen Human genes 0.000 description 5
- 108010035532 Collagen Proteins 0.000 description 5
- 101150047694 ID1 gene Proteins 0.000 description 5
- 102220534852 Kinesin-like protein KIF22_R48A_mutation Human genes 0.000 description 5
- 108060001084 Luciferase Proteins 0.000 description 5
- 239000005089 Luciferase Substances 0.000 description 5
- 241000699666 Mus <mouse, genus> Species 0.000 description 5
- 238000003016 alphascreen Methods 0.000 description 5
- 239000011575 calcium Substances 0.000 description 5
- 229910052791 calcium Inorganic materials 0.000 description 5
- 238000003776 cleavage reaction Methods 0.000 description 5
- 229920001436 collagen Polymers 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 102000046041 human GDF2 Human genes 0.000 description 5
- 210000002901 mesenchymal stem cell Anatomy 0.000 description 5
- 102000004196 processed proteins & peptides Human genes 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 102200079013 rs1554763777 Human genes 0.000 description 5
- 102220112531 rs2240308 Human genes 0.000 description 5
- 102200118306 rs33919924 Human genes 0.000 description 5
- 102220273513 rs373435521 Human genes 0.000 description 5
- 239000000523 sample Substances 0.000 description 5
- 238000002821 scintillation proximity assay Methods 0.000 description 5
- 230000007017 scission Effects 0.000 description 5
- 230000019491 signal transduction Effects 0.000 description 5
- 238000010561 standard procedure Methods 0.000 description 5
- 102220478560 Apoptosis regulator Bcl-2_D36S_mutation Human genes 0.000 description 4
- 101150118570 Msx2 gene Proteins 0.000 description 4
- 208000018737 Parkinson disease Diseases 0.000 description 4
- 108091005682 Receptor kinases Proteins 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 4
- 102220426871 c.117G>C Human genes 0.000 description 4
- 239000001768 carboxy methyl cellulose Substances 0.000 description 4
- 210000003169 central nervous system Anatomy 0.000 description 4
- 230000008878 coupling Effects 0.000 description 4
- 238000010168 coupling process Methods 0.000 description 4
- 238000005859 coupling reaction Methods 0.000 description 4
- 238000001212 derivatisation Methods 0.000 description 4
- 231100000673 dose–response relationship Toxicity 0.000 description 4
- 108020001507 fusion proteins Proteins 0.000 description 4
- 102000037865 fusion proteins Human genes 0.000 description 4
- 239000013642 negative control Substances 0.000 description 4
- 239000000546 pharmaceutical excipient Substances 0.000 description 4
- 229920001223 polyethylene glycol Polymers 0.000 description 4
- 239000002243 precursor Substances 0.000 description 4
- 230000035755 proliferation Effects 0.000 description 4
- 229940076372 protein antagonist Drugs 0.000 description 4
- 238000011069 regeneration method Methods 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- 102200068503 rs121964997 Human genes 0.000 description 4
- 102200158796 rs35885783 Human genes 0.000 description 4
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 4
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 4
- 238000001356 surgical procedure Methods 0.000 description 4
- 238000013518 transcription Methods 0.000 description 4
- 230000035897 transcription Effects 0.000 description 4
- 238000001890 transfection Methods 0.000 description 4
- 238000003146 transient transfection Methods 0.000 description 4
- 102220478542 Apoptosis regulator Bcl-2_E53A_mutation Human genes 0.000 description 3
- 102220520197 Barrier-to-autointegration factor_V51E_mutation Human genes 0.000 description 3
- 102220530630 Beta-galactosidase_L57M_mutation Human genes 0.000 description 3
- 102220485589 CHRNA7-FAM7A fusion protein_Q41A_mutation Human genes 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 206010017076 Fracture Diseases 0.000 description 3
- 102220550869 Fumarate hydratase, mitochondrial_N29Q_mutation Human genes 0.000 description 3
- 102220504907 Galanin receptor type 1_S67A_mutation Human genes 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 102220580969 Induced myeloid leukemia cell differentiation protein Mcl-1_Y46Y_mutation Human genes 0.000 description 3
- 102220534831 Kinesin-like protein KIF22_D55A_mutation Human genes 0.000 description 3
- 108010021466 Mutant Proteins Proteins 0.000 description 3
- 102000008300 Mutant Proteins Human genes 0.000 description 3
- 102220466759 Olfactory receptor 13C5_L69M_mutation Human genes 0.000 description 3
- 108091000080 Phosphotransferase Proteins 0.000 description 3
- 102220642088 Prolactin-inducible protein_V26L_mutation Human genes 0.000 description 3
- 108010076504 Protein Sorting Signals Proteins 0.000 description 3
- 102220493338 Sodium/calcium exchanger 3_H39A_mutation Human genes 0.000 description 3
- 102220526990 Tumor protein D54_K38Q_mutation Human genes 0.000 description 3
- 239000000443 aerosol Substances 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 230000033228 biological regulation Effects 0.000 description 3
- 210000002805 bone matrix Anatomy 0.000 description 3
- 210000004556 brain Anatomy 0.000 description 3
- 102220345409 c.147A>C Human genes 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 238000012512 characterization method Methods 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 230000002648 chondrogenic effect Effects 0.000 description 3
- 238000010835 comparative analysis Methods 0.000 description 3
- 210000002808 connective tissue Anatomy 0.000 description 3
- 238000012217 deletion Methods 0.000 description 3
- 230000037430 deletion Effects 0.000 description 3
- 230000002209 hydrophobic effect Effects 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 239000012669 liquid formulation Substances 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 238000011587 new zealand white rabbit Methods 0.000 description 3
- 230000004819 osteoinduction Effects 0.000 description 3
- 102000020233 phosphotransferase Human genes 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 238000001273 protein sequence alignment Methods 0.000 description 3
- 238000001525 receptor binding assay Methods 0.000 description 3
- 102200009943 rs116840808 Human genes 0.000 description 3
- 102220318682 rs1399431033 Human genes 0.000 description 3
- 102200097256 rs199473492 Human genes 0.000 description 3
- 102220142876 rs200087565 Human genes 0.000 description 3
- 102220005517 rs33931984 Human genes 0.000 description 3
- 102200005620 rs34282046 Human genes 0.000 description 3
- 102220010866 rs397514631 Human genes 0.000 description 3
- 102220044659 rs587781460 Human genes 0.000 description 3
- 102220203572 rs6926224 Human genes 0.000 description 3
- 102220289725 rs778831047 Human genes 0.000 description 3
- 102200089536 rs854560 Human genes 0.000 description 3
- 231100000241 scar Toxicity 0.000 description 3
- 230000003248 secreting effect Effects 0.000 description 3
- 230000028327 secretion Effects 0.000 description 3
- 238000002741 site-directed mutagenesis Methods 0.000 description 3
- 238000010186 staining Methods 0.000 description 3
- 210000000130 stem cell Anatomy 0.000 description 3
- 230000008685 targeting Effects 0.000 description 3
- 230000025934 tissue morphogenesis Effects 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- 102100034111 Activin receptor type-1 Human genes 0.000 description 2
- 108010059616 Activins Proteins 0.000 description 2
- 238000008940 Alkaline Phosphatase assay kit Methods 0.000 description 2
- 108090001008 Avidin Proteins 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 108010049951 Bone Morphogenetic Protein 3 Proteins 0.000 description 2
- 102100024504 Bone morphogenetic protein 3 Human genes 0.000 description 2
- 102100022545 Bone morphogenetic protein 8B Human genes 0.000 description 2
- 102100025423 Bone morphogenetic protein receptor type-1A Human genes 0.000 description 2
- 101710120270 Bone morphogenetic protein receptor type-1A Proteins 0.000 description 2
- 101710120271 Bone morphogenetic protein receptor type-1B Proteins 0.000 description 2
- 102220499104 Cytosol aminopeptidase_L51K_mutation Human genes 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 2
- 206010016654 Fibrosis Diseases 0.000 description 2
- 102100029379 Follistatin-related protein 3 Human genes 0.000 description 2
- 241000233866 Fungi Species 0.000 description 2
- 102000034615 Glial cell line-derived neurotrophic factor Human genes 0.000 description 2
- 108091010837 Glial cell line-derived neurotrophic factor Proteins 0.000 description 2
- 102000005744 Glycoside Hydrolases Human genes 0.000 description 2
- 108010031186 Glycoside Hydrolases Proteins 0.000 description 2
- 102000000594 Growth Differentiation Factor 10 Human genes 0.000 description 2
- 108010041881 Growth Differentiation Factor 10 Proteins 0.000 description 2
- 108010041834 Growth Differentiation Factor 15 Proteins 0.000 description 2
- 102100040898 Growth/differentiation factor 11 Human genes 0.000 description 2
- 101710194452 Growth/differentiation factor 11 Proteins 0.000 description 2
- 102100040896 Growth/differentiation factor 15 Human genes 0.000 description 2
- 102100039939 Growth/differentiation factor 8 Human genes 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 2
- 241000238631 Hexapoda Species 0.000 description 2
- 101000799140 Homo sapiens Activin receptor type-1 Proteins 0.000 description 2
- 101000762366 Homo sapiens Bone morphogenetic protein 2 Proteins 0.000 description 2
- 101000762379 Homo sapiens Bone morphogenetic protein 4 Proteins 0.000 description 2
- 101000899388 Homo sapiens Bone morphogenetic protein 5 Proteins 0.000 description 2
- 101001062529 Homo sapiens Follistatin-related protein 3 Proteins 0.000 description 2
- 101000595923 Homo sapiens Placenta growth factor Proteins 0.000 description 2
- 102100026818 Inhibin beta E chain Human genes 0.000 description 2
- 125000002842 L-seryl group Chemical group O=C([*])[C@](N([H])[H])([H])C([H])([H])O[H] 0.000 description 2
- 208000034693 Laceration Diseases 0.000 description 2
- 206010067125 Liver injury Diseases 0.000 description 2
- 208000029725 Metabolic bone disease Diseases 0.000 description 2
- 108010006519 Molecular Chaperones Proteins 0.000 description 2
- 108010056852 Myostatin Proteins 0.000 description 2
- 108010025020 Nerve Growth Factor Proteins 0.000 description 2
- 102000007072 Nerve Growth Factors Human genes 0.000 description 2
- 102000011830 Neural cell adhesion Human genes 0.000 description 2
- 108050002172 Neural cell adhesion Proteins 0.000 description 2
- 102100035194 Placenta growth factor Human genes 0.000 description 2
- 108010038512 Platelet-Derived Growth Factor Proteins 0.000 description 2
- 102000010780 Platelet-Derived Growth Factor Human genes 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 229920000954 Polyglycolide Polymers 0.000 description 2
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 2
- 101100437153 Rattus norvegicus Acvr2b gene Proteins 0.000 description 2
- 108700008625 Reporter Genes Proteins 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 2
- 102000040945 Transcription factor Human genes 0.000 description 2
- 108091023040 Transcription factor Proteins 0.000 description 2
- 102000010571 Type II Bone Morphogenetic Protein Receptors Human genes 0.000 description 2
- 108010063130 Type II Bone Morphogenetic Protein Receptors Proteins 0.000 description 2
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 2
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 2
- 102100039037 Vascular endothelial growth factor A Human genes 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 239000000488 activin Substances 0.000 description 2
- 238000007792 addition Methods 0.000 description 2
- 230000000735 allogeneic effect Effects 0.000 description 2
- 239000012491 analyte Substances 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 230000001588 bifunctional effect Effects 0.000 description 2
- 238000004166 bioassay Methods 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 230000034127 bone morphogenesis Effects 0.000 description 2
- 230000010478 bone regeneration Effects 0.000 description 2
- 230000010072 bone remodeling Effects 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 150000001720 carbohydrates Chemical group 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 230000022159 cartilage development Effects 0.000 description 2
- 238000000423 cell based assay Methods 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 208000020832 chronic kidney disease Diseases 0.000 description 2
- 208000022831 chronic renal failure syndrome Diseases 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 238000003271 compound fluorescence assay Methods 0.000 description 2
- 229920001577 copolymer Polymers 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 210000003074 dental pulp Anatomy 0.000 description 2
- 210000004268 dentin Anatomy 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 238000002224 dissection Methods 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 230000002255 enzymatic effect Effects 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 239000007850 fluorescent dye Substances 0.000 description 2
- 238000003633 gene expression assay Methods 0.000 description 2
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 description 2
- 230000013595 glycosylation Effects 0.000 description 2
- 238000006206 glycosylation reaction Methods 0.000 description 2
- 231100000753 hepatic injury Toxicity 0.000 description 2
- 102000045896 human BMP2 Human genes 0.000 description 2
- 230000001976 improved effect Effects 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 208000028867 ischemia Diseases 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 208000017169 kidney disease Diseases 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 238000012417 linear regression Methods 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 238000003670 luciferase enzyme activity assay Methods 0.000 description 2
- 238000003468 luciferase reporter gene assay Methods 0.000 description 2
- 210000004705 lumbosacral region Anatomy 0.000 description 2
- 238000013289 male long evans rat Methods 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 238000000520 microinjection Methods 0.000 description 2
- 210000003098 myoblast Anatomy 0.000 description 2
- UMFJAHHVKNCGLG-UHFFFAOYSA-N n-Nitrosodimethylamine Chemical compound CN(C)N=O UMFJAHHVKNCGLG-UHFFFAOYSA-N 0.000 description 2
- 239000007923 nasal drop Substances 0.000 description 2
- 229940100662 nasal drops Drugs 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 210000000963 osteoblast Anatomy 0.000 description 2
- 230000002138 osteoinductive effect Effects 0.000 description 2
- DIVDFFZHCJEHGG-UHFFFAOYSA-N oxidopamine Chemical compound NCCC1=CC(O)=C(O)C=C1O DIVDFFZHCJEHGG-UHFFFAOYSA-N 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 238000000059 patterning Methods 0.000 description 2
- 230000006320 pegylation Effects 0.000 description 2
- 230000003239 periodontal effect Effects 0.000 description 2
- 230000026731 phosphorylation Effects 0.000 description 2
- 238000006366 phosphorylation reaction Methods 0.000 description 2
- 229920000747 poly(lactic acid) Polymers 0.000 description 2
- 239000004626 polylactic acid Substances 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 239000013641 positive control Substances 0.000 description 2
- 230000004481 post-translational protein modification Effects 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 230000001737 promoting effect Effects 0.000 description 2
- 238000000159 protein binding assay Methods 0.000 description 2
- 229940121649 protein inhibitor Drugs 0.000 description 2
- 239000012268 protein inhibitor Substances 0.000 description 2
- GPTFURBXHJWNHR-UHFFFAOYSA-N protopine Chemical compound C1=C2C(=O)CC3=CC=C4OCOC4=C3CN(C)CCC2=CC2=C1OCO2 GPTFURBXHJWNHR-UHFFFAOYSA-N 0.000 description 2
- 208000005069 pulmonary fibrosis Diseases 0.000 description 2
- 238000011552 rat model Methods 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 230000001172 regenerating effect Effects 0.000 description 2
- 230000008929 regeneration Effects 0.000 description 2
- 102200118256 rs33969400 Human genes 0.000 description 2
- 238000002864 sequence alignment Methods 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 238000007910 systemic administration Methods 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 230000000451 tissue damage Effects 0.000 description 2
- 231100000827 tissue damage Toxicity 0.000 description 2
- 230000009772 tissue formation Effects 0.000 description 2
- 230000005030 transcription termination Effects 0.000 description 2
- 230000001052 transient effect Effects 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- 230000008733 trauma Effects 0.000 description 2
- 230000029663 wound healing Effects 0.000 description 2
- FXYPGCIGRDZWNR-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-[[3-(2,5-dioxopyrrolidin-1-yl)oxy-3-oxopropyl]disulfanyl]propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCSSCCC(=O)ON1C(=O)CCC1=O FXYPGCIGRDZWNR-UHFFFAOYSA-N 0.000 description 1
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 1
- PLRACCBDVIHHLZ-UHFFFAOYSA-N 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine Chemical compound C1N(C)CCC(C=2C=CC=CC=2)=C1 PLRACCBDVIHHLZ-UHFFFAOYSA-N 0.000 description 1
- 150000003923 2,5-pyrrolediones Chemical class 0.000 description 1
- BIGBDMFRWJRLGJ-UHFFFAOYSA-N 3-benzyl-1,5-didiazoniopenta-1,4-diene-2,4-diolate Chemical compound [N-]=[N+]=CC(=O)C(C(=O)C=[N+]=[N-])CC1=CC=CC=C1 BIGBDMFRWJRLGJ-UHFFFAOYSA-N 0.000 description 1
- XZKIHKMTEMTJQX-UHFFFAOYSA-N 4-Nitrophenyl Phosphate Chemical compound OP(O)(=O)OC1=CC=C([N+]([O-])=O)C=C1 XZKIHKMTEMTJQX-UHFFFAOYSA-N 0.000 description 1
- NLPWSMKACWGINL-UHFFFAOYSA-N 4-azido-2-hydroxybenzoic acid Chemical compound OC(=O)C1=CC=C(N=[N+]=[N-])C=C1O NLPWSMKACWGINL-UHFFFAOYSA-N 0.000 description 1
- 102220497106 5-hydroxytryptamine receptor 3B_I57A_mutation Human genes 0.000 description 1
- 101150080498 ALP gene Proteins 0.000 description 1
- 102220486151 Alpha-galactosidase A_M72V_mutation Human genes 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 102220468481 Annexin A2_S26E_mutation Human genes 0.000 description 1
- 102220467201 Aquaporin-2_A70D_mutation Human genes 0.000 description 1
- 241000203069 Archaea Species 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- UKGGPJNBONZZCM-WDSKDSINSA-N Asp-Pro Chemical compound OC(=O)C[C@H](N)C(=O)N1CCC[C@H]1C(O)=O UKGGPJNBONZZCM-WDSKDSINSA-N 0.000 description 1
- 102100025440 BMP-binding endothelial regulator protein Human genes 0.000 description 1
- 102220488053 BMP-binding endothelial regulator protein_D32S_mutation Human genes 0.000 description 1
- 238000012492 Biacore method Methods 0.000 description 1
- 229940122361 Bisphosphonate Drugs 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 102100028726 Bone morphogenetic protein 10 Human genes 0.000 description 1
- 101710118482 Bone morphogenetic protein 10 Proteins 0.000 description 1
- 102000003928 Bone morphogenetic protein 15 Human genes 0.000 description 1
- 108090000349 Bone morphogenetic protein 15 Proteins 0.000 description 1
- 102100022525 Bone morphogenetic protein 6 Human genes 0.000 description 1
- 101710117970 Bone morphogenetic protein 8B Proteins 0.000 description 1
- 102220488099 Bone morphogenetic protein receptor type-1A_F58Y_mutation Human genes 0.000 description 1
- 102000004219 Brain-derived neurotrophic factor Human genes 0.000 description 1
- 108090000715 Brain-derived neurotrophic factor Proteins 0.000 description 1
- 102000055006 Calcitonin Human genes 0.000 description 1
- 108060001064 Calcitonin Proteins 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 206010008089 Cerebral artery occlusion Diseases 0.000 description 1
- 102220568693 Claudin-16_H71D_mutation Human genes 0.000 description 1
- 108020004705 Codon Proteins 0.000 description 1
- 241000195493 Cryptophyta Species 0.000 description 1
- 229930105110 Cyclosporin A Natural products 0.000 description 1
- PMATZTZNYRCHOR-CGLBZJNRSA-N Cyclosporin A Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C1=O PMATZTZNYRCHOR-CGLBZJNRSA-N 0.000 description 1
- 108010036949 Cyclosporine Proteins 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 208000007342 Diabetic Nephropathies Diseases 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 201000009051 Embryonal Carcinoma Diseases 0.000 description 1
- 102100040897 Embryonic growth/differentiation factor 1 Human genes 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 108050009340 Endothelin Proteins 0.000 description 1
- 102000002045 Endothelin Human genes 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 102000009109 Fc receptors Human genes 0.000 description 1
- 108010087819 Fc receptors Proteins 0.000 description 1
- 108090000331 Firefly luciferases Proteins 0.000 description 1
- 102100020921 Follistatin Human genes 0.000 description 1
- 108010014612 Follistatin Proteins 0.000 description 1
- 102100035233 Furin Human genes 0.000 description 1
- 108090001126 Furin Proteins 0.000 description 1
- 102220504699 Galanin receptor type 1_S72A_mutation Human genes 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 102000053171 Glial Fibrillary Acidic Human genes 0.000 description 1
- 101710193519 Glial fibrillary acidic protein Proteins 0.000 description 1
- 206010018341 Gliosis Diseases 0.000 description 1
- 206010018364 Glomerulonephritis Diseases 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- SXRSQZLOMIGNAQ-UHFFFAOYSA-N Glutaraldehyde Chemical compound O=CCCCC=O SXRSQZLOMIGNAQ-UHFFFAOYSA-N 0.000 description 1
- 108010007979 Glycocholic Acid Proteins 0.000 description 1
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Polymers OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 1
- 102000006771 Gonadotropins Human genes 0.000 description 1
- 108010086677 Gonadotropins Proteins 0.000 description 1
- 102100038367 Gremlin-1 Human genes 0.000 description 1
- 102100038353 Gremlin-2 Human genes 0.000 description 1
- 108010090296 Growth Differentiation Factor 1 Proteins 0.000 description 1
- 108010090293 Growth Differentiation Factor 3 Proteins 0.000 description 1
- 102000004858 Growth differentiation factor-9 Human genes 0.000 description 1
- 108090001086 Growth differentiation factor-9 Proteins 0.000 description 1
- 101710204270 Growth/differentiation factor 2 Proteins 0.000 description 1
- 102100040892 Growth/differentiation factor 2 Human genes 0.000 description 1
- 102100035364 Growth/differentiation factor 3 Human genes 0.000 description 1
- 101710204281 Growth/differentiation factor 6 Proteins 0.000 description 1
- 102100035368 Growth/differentiation factor 6 Human genes 0.000 description 1
- 229920002971 Heparan sulfate Polymers 0.000 description 1
- 229920000209 Hexadimethrine bromide Polymers 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000934632 Homo sapiens BMP-binding endothelial regulator protein Proteins 0.000 description 1
- 101000899368 Homo sapiens Bone morphogenetic protein 8B Proteins 0.000 description 1
- 101001032872 Homo sapiens Gremlin-1 Proteins 0.000 description 1
- 101001023988 Homo sapiens Growth/differentiation factor 5 Proteins 0.000 description 1
- 101001023964 Homo sapiens Growth/differentiation factor 6 Proteins 0.000 description 1
- 101001023968 Homo sapiens Growth/differentiation factor 7 Proteins 0.000 description 1
- 101001001487 Homo sapiens Phosphatidylinositol-glycan biosynthesis class F protein Proteins 0.000 description 1
- 101001059454 Homo sapiens Serine/threonine-protein kinase MARK2 Proteins 0.000 description 1
- 101000668058 Infectious salmon anemia virus (isolate Atlantic salmon/Norway/810/9/99) RNA-directed RNA polymerase catalytic subunit Proteins 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 1
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 description 1
- 108090001117 Insulin-Like Growth Factor II Proteins 0.000 description 1
- 102000048143 Insulin-Like Growth Factor II Human genes 0.000 description 1
- 102220465478 Insulin-like growth factor II_R48E_mutation Human genes 0.000 description 1
- 102000013691 Interleukin-17 Human genes 0.000 description 1
- 108050003558 Interleukin-17 Proteins 0.000 description 1
- 102220487447 Isoaspartyl peptidase/L-asparaginase_D54R_mutation Human genes 0.000 description 1
- 230000004163 JAK-STAT signaling pathway Effects 0.000 description 1
- 102220534856 Kinesin-like protein KIF22_R48K_mutation Human genes 0.000 description 1
- 241000235058 Komagataella pastoris Species 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 208000019693 Lung disease Diseases 0.000 description 1
- 102000009151 Luteinizing Hormone Human genes 0.000 description 1
- 108010073521 Luteinizing Hormone Proteins 0.000 description 1
- 208000030136 Marchiafava-Bignami Disease Diseases 0.000 description 1
- 102000055008 Matrilin Proteins Human genes 0.000 description 1
- 108010072582 Matrilin Proteins Proteins 0.000 description 1
- 102220512181 Max-interacting protein 1_I57D_mutation Human genes 0.000 description 1
- 102100025744 Mothers against decapentaplegic homolog 1 Human genes 0.000 description 1
- 101001032860 Mus musculus Gremlin-2 Proteins 0.000 description 1
- 101001135571 Mus musculus Tyrosine-protein phosphatase non-receptor type 2 Proteins 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 102220520996 N-chimaerin_D54T_mutation Human genes 0.000 description 1
- 101150079463 NBL1 gene Proteins 0.000 description 1
- RFDAIACWWDREDC-UHFFFAOYSA-N Na salt-Glycocholic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(=O)NCC(O)=O)C)C1(C)C(O)C2 RFDAIACWWDREDC-UHFFFAOYSA-N 0.000 description 1
- 238000011887 Necropsy Methods 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 244000061176 Nicotiana tabacum Species 0.000 description 1
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 108091005461 Nucleic proteins Proteins 0.000 description 1
- 102220486919 Nucleosome-remodeling factor subunit BPTF_V28I_mutation Human genes 0.000 description 1
- 108700026244 Open Reading Frames Proteins 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- 101710160107 Outer membrane protein A Proteins 0.000 description 1
- 108010058846 Ovalbumin Proteins 0.000 description 1
- 102000003982 Parathyroid hormone Human genes 0.000 description 1
- 108090000445 Parathyroid hormone Proteins 0.000 description 1
- 108010066305 Parkinson Disease Associated Proteins Proteins 0.000 description 1
- 102000018315 Parkinson Disease Associated Proteins Human genes 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 208000006735 Periostitis Diseases 0.000 description 1
- 102220642086 Prolactin-inducible protein_S46N_mutation Human genes 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 102220576894 Protein BUD31 homolog_R48D_mutation Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 241000015864 Protobothrops flavoviridis Species 0.000 description 1
- 102220522980 RNA 5'-monophosphate methyltransferase_N76A_mutation Human genes 0.000 description 1
- 102220599096 Ras-related protein Rab-1B_Y78D_mutation Human genes 0.000 description 1
- 102220473730 Ras-related protein Rab-5A_A56E_mutation Human genes 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 102220511953 Replication protein A 70 kDa DNA-binding subunit_R41E_mutation Human genes 0.000 description 1
- 108091027981 Response element Proteins 0.000 description 1
- 101700032040 SMAD1 Proteins 0.000 description 1
- 102220509535 SMAD5 antisense gene protein 1_D47S_mutation Human genes 0.000 description 1
- 102100034201 Sclerostin Human genes 0.000 description 1
- 108050006698 Sclerostin Proteins 0.000 description 1
- 101710169324 Sclerostin domain-containing protein 1 Proteins 0.000 description 1
- 102100022432 Sclerostin domain-containing protein 1 Human genes 0.000 description 1
- 102220492441 Selenoprotein V_F43Y_mutation Human genes 0.000 description 1
- 206010070834 Sensitisation Diseases 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- 102100028904 Serine/threonine-protein kinase MARK2 Human genes 0.000 description 1
- 102100034136 Serine/threonine-protein kinase receptor R3 Human genes 0.000 description 1
- 101710082813 Serine/threonine-protein kinase receptor R3 Proteins 0.000 description 1
- 102000007374 Smad Proteins Human genes 0.000 description 1
- 108010007945 Smad Proteins Proteins 0.000 description 1
- 102220502295 Sodium/calcium exchanger 3_D24N_mutation Human genes 0.000 description 1
- ZSJLQEPLLKMAKR-UHFFFAOYSA-N Streptozotocin Natural products O=NN(C)C(=O)NC1C(O)OC(CO)C(O)C1O ZSJLQEPLLKMAKR-UHFFFAOYSA-N 0.000 description 1
- 102220593709 Stromal interaction molecule 1_N80T_mutation Human genes 0.000 description 1
- 102000008221 Superoxide Dismutase-1 Human genes 0.000 description 1
- 108010021188 Superoxide Dismutase-1 Proteins 0.000 description 1
- 102220608208 TYRO protein tyrosine kinase-binding protein_N69A_mutation Human genes 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 108700009124 Transcription Initiation Site Proteins 0.000 description 1
- 102000046299 Transforming Growth Factor beta1 Human genes 0.000 description 1
- 102000011117 Transforming Growth Factor beta2 Human genes 0.000 description 1
- 108010009583 Transforming Growth Factors Proteins 0.000 description 1
- 102000009618 Transforming Growth Factors Human genes 0.000 description 1
- 101800002279 Transforming growth factor beta-1 Proteins 0.000 description 1
- 101800000304 Transforming growth factor beta-2 Proteins 0.000 description 1
- 102000056172 Transforming growth factor beta-3 Human genes 0.000 description 1
- 108090000097 Transforming growth factor beta-3 Proteins 0.000 description 1
- 102220559475 Transmembrane protein 207_L57V_mutation Human genes 0.000 description 1
- 102100031904 Tumor protein D54 Human genes 0.000 description 1
- 208000004608 Ureteral Obstruction Diseases 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- QYSXJUFSXHHAJI-XFEUOLMDSA-N Vitamin D3 Natural products C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C/C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-XFEUOLMDSA-N 0.000 description 1
- 102220506801 Vitelline membrane outer layer protein 1 homolog_N73T_mutation Human genes 0.000 description 1
- 206010052428 Wound Diseases 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- HMNZFMSWFCAGGW-XPWSMXQVSA-N [3-[hydroxy(2-hydroxyethoxy)phosphoryl]oxy-2-[(e)-octadec-9-enoyl]oxypropyl] (e)-octadec-9-enoate Chemical compound CCCCCCCC\C=C\CCCCCCCC(=O)OCC(COP(O)(=O)OCCO)OC(=O)CCCCCCC\C=C\CCCCCCCC HMNZFMSWFCAGGW-XPWSMXQVSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 108010023082 activin A Proteins 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000032683 aging Effects 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 150000001412 amines Chemical group 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 238000002266 amputation Methods 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 229940005553 analgesics and anesthetics Drugs 0.000 description 1
- 230000019552 anatomical structure morphogenesis Effects 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 210000003423 ankle Anatomy 0.000 description 1
- 230000008485 antagonism Effects 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000840 anti-viral effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 125000000613 asparagine group Chemical group N[C@@H](CC(N)=O)C(=O)* 0.000 description 1
- 108010093581 aspartyl-proline Proteins 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 235000013361 beverage Nutrition 0.000 description 1
- 210000000013 bile duct Anatomy 0.000 description 1
- 239000000227 bioadhesive Substances 0.000 description 1
- 230000008512 biological response Effects 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 150000004663 bisphosphonates Chemical class 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000001218 blood-brain barrier Anatomy 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 102220359602 c.121C>G Human genes 0.000 description 1
- BBBFJLBPOGFECG-VJVYQDLKSA-N calcitonin Chemical compound N([C@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(N)=O)C(C)C)C(=O)[C@@H]1CSSC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1 BBBFJLBPOGFECG-VJVYQDLKSA-N 0.000 description 1
- 229960004015 calcitonin Drugs 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000007355 cartilage morphogenesis Effects 0.000 description 1
- 108010027904 cartilage-derived-morphogenetic protein-2 Proteins 0.000 description 1
- 238000012219 cassette mutagenesis Methods 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 238000001516 cell proliferation assay Methods 0.000 description 1
- 238000010382 chemical cross-linking Methods 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 210000001612 chondrocyte Anatomy 0.000 description 1
- 238000011098 chromatofocusing Methods 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 229960001265 ciclosporin Drugs 0.000 description 1
- 230000007882 cirrhosis Effects 0.000 description 1
- 208000019425 cirrhosis of liver Diseases 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 108010045487 coagulogen Proteins 0.000 description 1
- 229960005188 collagen Drugs 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 210000000877 corpus callosum Anatomy 0.000 description 1
- 230000001054 cortical effect Effects 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000003431 cross linking reagent Substances 0.000 description 1
- QPNKYNYIKKVVQB-UHFFFAOYSA-N crotaleschenine Natural products O1C(=O)C(C)C(C)C(C)(O)C(=O)OCC2=CCN3C2C1CC3 QPNKYNYIKKVVQB-UHFFFAOYSA-N 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 101150118520 dan gene Proteins 0.000 description 1
- 238000007405 data analysis Methods 0.000 description 1
- 230000006240 deamidation Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000022811 deglycosylation Effects 0.000 description 1
- 210000003298 dental enamel Anatomy 0.000 description 1
- 229960003964 deoxycholic acid Drugs 0.000 description 1
- KXGVEGMKQFWNSR-LLQZFEROSA-N deoxycholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-N 0.000 description 1
- KXGVEGMKQFWNSR-UHFFFAOYSA-N deoxycholic acid Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 KXGVEGMKQFWNSR-UHFFFAOYSA-N 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- 208000033679 diabetic kidney disease Diseases 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- XQRLCLUYWUNEEH-UHFFFAOYSA-N diphosphonic acid Chemical compound OP(=O)OP(O)=O XQRLCLUYWUNEEH-UHFFFAOYSA-N 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000005553 drilling Methods 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 210000001513 elbow Anatomy 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- ZUBDGKVDJUIMQQ-UBFCDGJISA-N endothelin-1 Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(O)=O)NC(=O)[C@H]1NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@@H](CC=2C=CC(O)=CC=2)NC(=O)[C@H](C(C)C)NC(=O)[C@H]2CSSC[C@@H](C(N[C@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N2)=O)NC(=O)[C@@H](CO)NC(=O)[C@H](N)CSSC1)C1=CNC=N1 ZUBDGKVDJUIMQQ-UBFCDGJISA-N 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 1
- 229940011871 estrogen Drugs 0.000 description 1
- 239000000262 estrogen Substances 0.000 description 1
- 239000005038 ethylene vinyl acetate Substances 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 210000003414 extremity Anatomy 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 230000004761 fibrosis Effects 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- 238000000198 fluorescence anisotropy Methods 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 210000005046 glial fibrillary acidic protein Anatomy 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-L glutamate group Chemical group N[C@@H](CCC(=O)[O-])C(=O)[O-] WHUUTDBJXJRKMK-VKHMYHEASA-L 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 125000000404 glutamine group Chemical group N[C@@H](CCC(N)=O)C(=O)* 0.000 description 1
- RFDAIACWWDREDC-FRVQLJSFSA-N glycocholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 RFDAIACWWDREDC-FRVQLJSFSA-N 0.000 description 1
- 229940099347 glycocholic acid Drugs 0.000 description 1
- 229930182470 glycoside Natural products 0.000 description 1
- 150000002338 glycosides Chemical class 0.000 description 1
- 239000002622 gonadotropin Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 230000003862 health status Effects 0.000 description 1
- 230000023597 hemostasis Effects 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 238000005734 heterodimerization reaction Methods 0.000 description 1
- 210000001320 hippocampus Anatomy 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 238000010562 histological examination Methods 0.000 description 1
- 238000000265 homogenisation Methods 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 102000046148 human BMP4 Human genes 0.000 description 1
- 102000046096 human BMP5 Human genes 0.000 description 1
- 102000046107 human BMP7 Human genes 0.000 description 1
- 102000046039 human GDF5 Human genes 0.000 description 1
- 102000053737 human GDF6 Human genes 0.000 description 1
- 102000048885 human GDF7 Human genes 0.000 description 1
- 229920002674 hyaluronan Polymers 0.000 description 1
- 229960003160 hyaluronic acid Drugs 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 230000033444 hydroxylation Effects 0.000 description 1
- 238000005805 hydroxylation reaction Methods 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 238000003125 immunofluorescent labeling Methods 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 238000005462 in vivo assay Methods 0.000 description 1
- 210000003000 inclusion body Anatomy 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000004941 influx Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000000893 inhibin Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- ZPNFWUPYTFPOJU-LPYSRVMUSA-N iniprol Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@H]2CSSC[C@H]3C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(N[C@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC=4C=CC=CC=4)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC=4C=CC=CC=4)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC2=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]2N(CCC2)C(=O)[C@@H](N)CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N2[C@@H](CCC2)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)N3)C(=O)NCC(=O)NCC(=O)N[C@@H](C)C(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H](C(=O)N1)C(C)C)[C@@H](C)O)[C@@H](C)CC)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 ZPNFWUPYTFPOJU-LPYSRVMUSA-N 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 238000000021 kinase assay Methods 0.000 description 1
- 210000003127 knee Anatomy 0.000 description 1
- JJTUDXZGHPGLLC-UHFFFAOYSA-N lactide Chemical compound CC1OC(=O)C(C)OC1=O JJTUDXZGHPGLLC-UHFFFAOYSA-N 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 239000006193 liquid solution Substances 0.000 description 1
- 239000006194 liquid suspension Substances 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 210000005228 liver tissue Anatomy 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 210000001161 mammalian embryo Anatomy 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 230000004001 molecular interaction Effects 0.000 description 1
- 239000003068 molecular probe Substances 0.000 description 1
- 238000012900 molecular simulation Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- QVCMHGGNRFRMAD-XFGHUUIASA-N monocrotaline Chemical compound C1OC(=O)[C@](C)(O)[C@@](O)(C)[C@@H](C)C(=O)O[C@@H]2CCN3[C@@H]2C1=CC3 QVCMHGGNRFRMAD-XFGHUUIASA-N 0.000 description 1
- QVCMHGGNRFRMAD-UHFFFAOYSA-N monocrotaline Natural products C1OC(=O)C(C)(O)C(O)(C)C(C)C(=O)OC2CCN3C2C1=CC3 QVCMHGGNRFRMAD-UHFFFAOYSA-N 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 230000001002 morphogenetic effect Effects 0.000 description 1
- 230000000921 morphogenic effect Effects 0.000 description 1
- 150000002790 naphthalenes Chemical class 0.000 description 1
- 230000001338 necrotic effect Effects 0.000 description 1
- 230000003589 nefrotoxic effect Effects 0.000 description 1
- 201000008383 nephritis Diseases 0.000 description 1
- 231100000381 nephrotoxic Toxicity 0.000 description 1
- 210000000944 nerve tissue Anatomy 0.000 description 1
- 210000003757 neuroblast Anatomy 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 230000000926 neurological effect Effects 0.000 description 1
- 230000004031 neuronal differentiation Effects 0.000 description 1
- 230000007171 neuropathology Effects 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 230000000414 obstructive effect Effects 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 238000006384 oligomerization reaction Methods 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 210000002997 osteoclast Anatomy 0.000 description 1
- 230000001009 osteoporotic effect Effects 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 229940092253 ovalbumin Drugs 0.000 description 1
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 239000000199 parathyroid hormone Substances 0.000 description 1
- 229960001319 parathyroid hormone Drugs 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 238000012753 partial hepatectomy Methods 0.000 description 1
- 210000003460 periosteum Anatomy 0.000 description 1
- 210000001322 periplasm Anatomy 0.000 description 1
- NMHMNPHRMNGLLB-UHFFFAOYSA-N phloretic acid Chemical compound OC(=O)CCC1=CC=C(O)C=C1 NMHMNPHRMNGLLB-UHFFFAOYSA-N 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 229920000111 poly(butyric acid) Polymers 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 229920001515 polyalkylene glycol Polymers 0.000 description 1
- 229920001896 polybutyrate Polymers 0.000 description 1
- 239000004633 polyglycolic acid Substances 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- QLNJFJADRCOGBJ-UHFFFAOYSA-N propionamide Chemical compound CCC(N)=O QLNJFJADRCOGBJ-UHFFFAOYSA-N 0.000 description 1
- 150000003180 prostaglandins Chemical class 0.000 description 1
- 108020001580 protein domains Proteins 0.000 description 1
- 238000001742 protein purification Methods 0.000 description 1
- 210000001938 protoplast Anatomy 0.000 description 1
- GJAWHXHKYYXBSV-UHFFFAOYSA-N quinolinic acid Chemical compound OC(=O)C1=CC=CN=C1C(O)=O GJAWHXHKYYXBSV-UHFFFAOYSA-N 0.000 description 1
- 238000011555 rabbit model Methods 0.000 description 1
- 238000002601 radiography Methods 0.000 description 1
- 108700015048 receptor decoy activity proteins Proteins 0.000 description 1
- 108091008597 receptor serine/threonine kinases Proteins 0.000 description 1
- 230000014493 regulation of gene expression Effects 0.000 description 1
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 1
- 230000008844 regulatory mechanism Effects 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 238000003571 reporter gene assay Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 102200087972 rs1042821 Human genes 0.000 description 1
- 102200010360 rs1057520644 Human genes 0.000 description 1
- 102200041248 rs1233331806 Human genes 0.000 description 1
- 102200081898 rs137854512 Human genes 0.000 description 1
- 102200093891 rs1869780 Human genes 0.000 description 1
- 102200029981 rs28936700 Human genes 0.000 description 1
- 102200082810 rs33980484 Human genes 0.000 description 1
- 102200118211 rs33991294 Human genes 0.000 description 1
- 102220022693 rs386833839 Human genes 0.000 description 1
- 102200037023 rs387907270 Human genes 0.000 description 1
- 102220064265 rs531598856 Human genes 0.000 description 1
- 102220269348 rs61747367 Human genes 0.000 description 1
- 102220072552 rs746207 Human genes 0.000 description 1
- 102220082345 rs747846279 Human genes 0.000 description 1
- 102220241914 rs771007866 Human genes 0.000 description 1
- 102220067420 rs778414770 Human genes 0.000 description 1
- 102220168988 rs781108007 Human genes 0.000 description 1
- 102220059219 rs786202857 Human genes 0.000 description 1
- 238000003118 sandwich ELISA Methods 0.000 description 1
- 230000036573 scar formation Effects 0.000 description 1
- 238000007423 screening assay Methods 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 230000011218 segmentation Effects 0.000 description 1
- 230000008313 sensitization Effects 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 230000007781 signaling event Effects 0.000 description 1
- 239000003998 snake venom Substances 0.000 description 1
- 210000004872 soft tissue Anatomy 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000003153 stable transfection Methods 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- 238000012916 structural analysis Methods 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229920002994 synthetic fiber Polymers 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 238000011287 therapeutic dose Methods 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- YUKQRDCYNOVPGJ-UHFFFAOYSA-N thioacetamide Chemical compound CC(N)=S YUKQRDCYNOVPGJ-UHFFFAOYSA-N 0.000 description 1
- DLFVBJFMPXGRIB-UHFFFAOYSA-N thioacetamide Natural products CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 1
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 229960004072 thrombin Drugs 0.000 description 1
- 230000008467 tissue growth Effects 0.000 description 1
- 229950003937 tolonium Drugs 0.000 description 1
- HNONEKILPDHFOL-UHFFFAOYSA-M tolonium chloride Chemical compound [Cl-].C1=C(C)C(N)=CC2=[S+]C3=CC(N(C)C)=CC=C3N=C21 HNONEKILPDHFOL-UHFFFAOYSA-M 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000014621 translational initiation Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 229940078499 tricalcium phosphate Drugs 0.000 description 1
- 229910000391 tricalcium phosphate Inorganic materials 0.000 description 1
- 235000019731 tricalcium phosphate Nutrition 0.000 description 1
- 238000013060 ultrafiltration and diafiltration Methods 0.000 description 1
- 230000009790 vascular invasion Effects 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- QYSXJUFSXHHAJI-YRZJJWOYSA-N vitamin D3 Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C\C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-YRZJJWOYSA-N 0.000 description 1
- 235000005282 vitamin D3 Nutrition 0.000 description 1
- 239000011647 vitamin D3 Substances 0.000 description 1
- 229940021056 vitamin d3 Drugs 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 210000000707 wrist Anatomy 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
- C07K14/51—Bone morphogenetic factor; Osteogenins; Osteogenic factor; Bone-inducing factor
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/04—Drugs for skeletal disorders for non-specific disorders of the connective tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Toxicology (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Genetics & Genomics (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Biomedical Technology (AREA)
- Rheumatology (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Description
この出願は、2007年12月21日に出願された米国仮特許出願第61/008,754号(この内容は、参考として本明細書に援用される)への優先権およびその利益を主張する。
本発明は、BMP−6およびBMP−9が、タンパク質阻害剤Nogginによる阻害に対して、BMPサブファミリーの他のメンバーよりも高い耐性を示すとの観察に関する。詳細には、本発明は、NogginおよびNoggin様タンパク質に対して感受性が低下している、設計または改変された骨形成タンパク質、ならびに上記設計または改変された骨形成タンパク質を利用する組成物の作製および使用方法に関する。
骨形成タンパク質
BMPは、TGF−βスーパーファミリーに属する。TGF−βスーパーファミリータンパク質は、6個の保存されたシステイン残基を特徴とするサイトカインである(Landerら、(2001年)Nature、409巻:860〜921頁)。ヒトゲノムは、TGF−βスーパーファミリータンパク質をコードする約42のオープンリーディングフレームを含む。TGF−βスーパーファミリータンパク質は、配列類似性およびそれらが活性化する特定のシグナル伝達経路に基づいて、少なくともBMPサブファミリーおよびTGF−βサブファミリーに分類することができる。BMPサブファミリーには、BMP−2、BMP−3(オステオゲニン)、BMP−3b(GDF−10)、BMP−4(BMP−2b)、BMP−5、BMP−6、BMP−7(骨形成タンパク質−1またはOP−1)、BMP−8(OP−2)、BMP−8B(OP−3)、BMP−9(GDF−2)、BMP−10、BMP−11(GDF−11)、BMP−12(GDF−7)、BMP−13(GDF−6、CDMP−2)、BMP−15(GDF−9)、BMP−16、GDF−1、GDF−3、GDF−5(CDMP−1)およびGDF−8(ミオスタチン)が含まれるが、これらに限定されない。BMPは、骨形成タンパク質(OP)、成長分化因子(GDF)または軟骨由来形態形成タンパク質(CDMP)と呼ばれることもある。BMPは、他の動物種にも存在する。さらに、ヒト集団の異なるメンバー間で、BMP配列に多少の対立遺伝子変異が存在する。本明細書で用いるように、特に別途指示されない限り、「BMPサブファミリー」、「BMP」、「BMPリガンド」およびそれらの文法同等物は、BMPサブファミリーメンバーを指す。
BMPとそれらのアンタゴニストとの間の相互作用
Nogginのような溶解性BMPアンタゴニストは、BMPに結合することができる。BMP上のNoggin結合部位は、I型およびII型両方の受容体の結合部位と重なる。例えば、BMP−7−Noggin複合体を、図10に図示する。さらに、BMP−7へのNoggin結合は、BMP−7がその受容体に結合することおよび/またはそれを活性化することを阻止し得るであろうBMP−7の立体配座変化を誘導する。NogginのようなDANファミリーアンタゴニストは、システインノットタンパク質ファミリーのメンバーである。DANファミリータンパク質およびNogginはこの構造モチーフを共有するので、それらは類似した方法でBMPに結合し得るであろう。コーディン(Chordin)/SOGアンタゴニストは、同様の方法でBMPに結合すると提案されている。したがって、本発明は、Nogginおよび/または他のNoggin様アンタゴニストによる阻害を逃れることができるBMPタンパク質を設計することを企図する。
改変BMPの生成
本明細書で用いるように、「設計されたBMP」、「改変BMP」、「キメラBMP」、「突然変異体BMP」および「変異体BMP」は、特に明記しない限り同等物として用いられる。本明細書で、「設計されたBMP」または「改変BMP」、およびそれらの文法同等物は、野生型または親のBMPと、少なくとも1つのアミノ酸の挿入、欠失または置換が異なる、天然に存在しないBMPを意味する。特に明記しない限り、設計または改変BMPのすべての位置番号付けは、成熟した天然BMPの配列に基づく点に留意する必要がある。設計されたBMPは、変異の所定の性質によって特徴づけられ、それは、BMP配列の天然の対立遺伝子または種間変異からそれらを区別する特徴である。BMP変異体は、1つまたは複数の細胞型で、野生型BMP活性の少なくとも50%を保持しなければならず、それは、下で記載される適当なアッセイを用いて測定される。野生型活性の少なくとも75%、80%、85%、90%または95%を保持する変異体がより好ましく、野生型よりも活性である変異体が特に好ましい。設計または改変BMPは、N末端、C末端または内部に、挿入、欠失および/または置換を含むことができる。好ましい実施形態では、設計または改変BMPは、最も類似するヒトBMP配列と異なる少なくとも1つの残基を有し、少なくとも2、3、4、5、6、7、8、9、10個またはそれ以上の異なる残基がより好ましい。
改変BMPをコードする核酸の調製
本発明は、本明細書に記載される改変BMPをコードする核酸も含む。本明細書に記載される改変BMPをコードする核酸は、当技術分野で公知である方法によって調製することができる。
発現ベクター
好ましい実施形態では、下記成分、および本発明の改変BMPをコードする遺伝子を含む発現ベクターが調製される。様々な宿主細胞のための多種類の適当な発現ベクターおよび適する調節配列が、当技術分野で公知である。発現ベクターは、それらに限定されないが、プロモーター配列、リボゾーム結合部位、転写開始および終止配列、翻訳開始および終止配列、転写終結シグナル、ポリアデニル化シグナル、ならびに、エンハンサーまたはアクティベーター配列を含む、転写および翻訳の調節配列を含むことができる。好ましい実施形態では、調節配列には、プロモーターならびに転写開始および終止配列が含まれる。さらに、発現ベクターは追加の要素を含むことができる。例えば、発現ベクターは2つの複製系を有することができ、このように、2つの生物体で、例えば発現のためには哺乳動物または昆虫の細胞で、またクローニングおよび増幅のためには原核生物の宿主でそれが維持されることを可能にする。さらに、発現ベクターを組み込むために、発現ベクターは宿主細胞のゲノムと相同的な少なくとも1つの配列を、好ましくは、発現構築物に連なる2つの相同配列を含む。組み込まれるベクターは、ベクター内に含ませるために適当な相同配列を選択することによって、宿主細胞の特定の遺伝子座に誘導することができる。ベクターを組み込むための構築物は、当技術分野においては周知である。さらに、好ましい実施形態では、発現ベクターは、形質転換された宿主細胞の選択を可能にするために、選択可能なマーカー遺伝子を含む。選択遺伝子は当技術分野で周知であり、用いる宿主細胞によって異なる。発現ベクターは、自己複製型の染色体外ベクター、または宿主ゲノムに組み込まれるベクターであることができる。
トランスフェクション/形質転換
改変BMP核酸は、核酸の以降の発現に適する方法で、単独で、または発現ベクターと一緒に細胞に導入される。導入の方法は、標的細胞型によってほぼ決定される。例示的な方法には、CaPO4沈殿、リポソーム融合(例えば、試薬Lipofectin(登録商標)またはFuGeneを用いる)、エレクトロポレーション、ウイルス感染(例えば、PCT/US97/01019に概説されている)、デキストラン媒介トランスフェクション、ポリブレン媒介トランスフェクション、プロトプラスト融合、直接微量注入などが含まれる。改変BMP核酸は、宿主細胞のゲノムに安定して組み込まれることができるか、細胞質中に一時的に、または安定して存在することができる。
改変BMPの発現のための宿主
改変BMPの発現に適当な宿主細胞には、酵母、細菌、古細菌、真菌類、ならびに、哺乳動物の細胞を含む昆虫および動物の細胞が含まれる。特に興味があるのは、Saccharomyces cerevisiaeおよびPichia pastorisなどの真菌類、ならびに、293(例えば、293−Tおよび293−EBNA)、BHK、CHO(例えば、CHOK1およびDG44)、COS、Jurkat、NIH3T3などを含む哺乳動物細胞系である。(ATCC細胞系カタログを参照)。改変BMPは、それらに限定されないが、植物(例えばトウモロコシ、タバコおよび藻)および動物(例えばニワトリ、ヤギ、ウシ)を含む、より複雑な生物体で生成することもできる;例えば、Dove, Nature Biotechnol.、20巻:777〜779頁(2002年)を参照。一実施形態では、細胞は、さらに遺伝子操作すること、すなわち、改変BMP核酸を含む発現ベクター以外の外来性の核酸を含むことができる。
発現方法
本発明の改変BMPは、改変BMPをコードする核酸を含む発現ベクターで形質転換した宿主細胞を、改変BMPの発現を誘導するかまたは引き起こすのに適当な条件下で培養することによって生成される。一時的または安定したトランスフェクション方法を用いることができる。改変BMPの発現に適当な条件は、発現ベクターおよび宿主細胞の選択によって異なり、常用の実験を通して当分野の技術者によって容易に確認される。
精製
好ましい実施形態では、改変BMPは発現後に精製または単離される。標準の精製方法には、電気泳動技術、分子技術、免疫学的技術、ならびに、イオン交換、疎水性、親和性および逆相HPLCクロマトグラフィーを含むクロマトグラフィー技術、ならびにクロマトフォーカシングが含まれる。例えば、改変BMPは、標準の抗組換え体タンパク質抗体カラムを用いて精製することができる。タンパク濃縮と併用される、限外ろ過およびダイアフィルトレーション技術も有用である。適する精製技術の一般指針については、Scopes, R.、Protein Purification、Springer−Verlag、NY、第3版(1994年)を参照。必要な精製度は所望の使用によって異なり、一部の例では、精製を必要としない。
翻訳後修飾および誘導体化
作製されると、改変BMPは共有結合的に修飾することができる。したがって、タンパク質の共有結合的および非共有結合的修飾は、本発明の範囲に含まれる。ポリペプチドの標的アミノ酸残基を、選択される側鎖または末端残基と反応することができる有機誘導体化剤と反応させることによって、そのような修飾を改変BMPポリペプチドに導入することができる。修飾のための最適部位は、それらに限定されないが、目視検査、構造解析、配列分析および分子シミュレーションを含む様々な基準を用いて選択することができる。修飾のための部位は、プロドメインまたは成熟したドメインに位置してもよい。
設計されたBMPの生物物理および生化学特性評価
本発明の設計されたBMPは、当技術分野で公知の方法、例えばBiacore方法を用いて、Nogginなどの阻害剤へのそれらの応答によって特徴づけることができる。改変BMPは、骨形成および軟骨形成因子の評価で通常用いられる細胞ベースおよびインビボのアッセイ、例えば、アルカリホスファターゼアッセイ、骨芽細胞増殖アッセイ、骨ノジュールアッセイ、qPCRに基づく遺伝子発現アッセイ、またはBMP−応答要素(BRE)ルシフェラーゼアッセイを用いて特徴づけることもできる。改変BMPの生物物理的および生物化学的特性評価を、下に詳述する。
改変BMPの活性の分析
好ましい実施形態では、野生型および改変BMPの活性は、インビトロ受容体結合アッセイ、細胞ベースの活性アッセイまたはインビボ活性アッセイを用いて分析される。
受容体結合アッセイ
1つまたは複数のBMP受容体に結合する改変BMPの能力に及ぼすNogginの影響は、受容体結合アッセイで測定することができる。例えば、ALK−2、ALK−3、ALK−6、ActRII、ActRIIbまたはBMPRIIへの親和性を測定することができる。適する結合アッセイには、ELISA、蛍光異方性および強度、シンチレーション近接検定(SPA)、Biacore(Pearceら、Biochemistry 38巻:81〜89頁(1999年))、DELFIAアッセイ、およびAlphaScrceen(商標)(PerkinElmer;Bosse R.(Illy C,、およびChelsky D(2002年)から市販)が含まれるが、これらに限定されない。
細胞ベースの活性アッセイ
BMPは、いくつかの型の細胞の増殖および分化を促進する。BMP活性は、例えば、ヒト骨髄由来の間葉性幹細胞(hMSC)、MC3T3−E1(マウスの頭蓋冠に由来する骨芽細胞様細胞)、C3H10T1/2(胚性結合組織に由来するマウス間葉性幹細胞系)、ATDC5(マウス胚性癌腫細胞)、L−6(ラット筋芽細胞細胞系)またはC2C12(マウス筋芽細胞の細胞系)細胞のBMPによって誘導される分化の測定によって監視することができる。分化は、例えば、アルシアンブルーまたはPNPPなどのアルカリホスファターゼまたは熱量測定試薬の発光レポーターを用いて監視することができる(Laveryら、(2008年)、JBC、283巻:20948〜20958頁;Asahinaら(1996年)Exp. Cell Res.、222巻:38〜47頁;Inadaら(1996年)Biochem. Biophys. Res. Commun.、222巻:317〜322頁;Jortikkaら(1998年)Life Sci.、62巻:2359〜2368頁;Chengら(2003年)J. Bone Joint Surgery 95A巻:1544〜1552頁)。
BMP活性の動物モデル
一般的に、動物のBMP活性は、皮下注射に続く骨誘導によって測定される。好ましい実施形態では、1つまたは複数の改変BMPの活性は、BMP応答性疾患または状態の動物モデルで測定される。例えば、腎疾患の動物モデルには、それらに限定されないが、ラット腎毒性血清腎炎モデル(Zeisbergら、2003年)、ラット慢性シクロスポリンA誘発腎症モデル(Liら(2004年)Am. J. Physiol. Renal Physiol.、286巻:F46〜57頁)、マウス片側尿管閉塞モデル(Schanstraら(2003年)Thromb. Haemost.、89巻:735〜740頁)、ストレプトゾトシン誘発糖尿病ネフロパシー(Tanedaら(2003年)J. Am. Soc. Nephrol.、14巻:968〜980頁)、抗thy 1.1 mAbおよびHabuヘビ毒誘発糸球体腎炎モデル(Dimmlerら(2003年)Diagn. Mol. Pathol.、12巻:108〜117頁)、およびラット5/6レムナント腎臓モデル(Romeroら(1999年)Kidney Int.、55巻:945〜955頁)が含まれる。肝臓疾患の動物モデルには、それらに限定されないが、ラット胆管連結/切断モデル(Parkら(2000年)Pharmacol. Toxicol.、87巻:261〜268頁)、CCI4プラスエタノール誘発肝損傷(Hallら(1991年)Hepatology、12巻:815〜819頁)、ジメチルニトロソアミン誘発肝硬変(Kondouら(2003年)J. Hepatol.、39巻:742〜748頁)、およびチオアセタミド誘発肝損傷(Mullerら(1988年)Exp. Pathol.、34巻:229〜236頁)が含まれる。肺疾患の動物モデルには、それらに限定されないが、オボアルブミン誘発気道線維症(Kenyonら(2003年)Toxicol. Appl. Pharmacol.、186巻:90〜100頁)、ブレオマイシン誘発肺線維症(Izbickiら(2002年)Int. J. Exp. Pathol.、83巻:111〜119頁)、モノクロタリン誘発肺線維症(Hayashiら(1995年)Toxicol. Pathol.、23巻:63〜71頁)、および選択的照射(Pauluhnら(2001年)Toxicology、161巻:153〜163頁)が含まれる。神経系疾患の動物モデルには、それらに限定されないが、パーキンソン病の動物モデル、例えば6−水酸化ドーパミン(6−OHDA)片側病巣ラットモデル、およびMPTP誘発パーキンソン病、ALSの動物モデル、例えば突然変異体SOD1を発現するラットまたはマウス(Shibataら(2002年)Neuropathology、22巻:337〜349頁)、および、エンドセリンまたはキノリン酸の皮質内微量注入(Gilmourら(2004年)Behav. Brain Res.、150巻:171〜183頁)または大脳動脈閉塞(Merchenthalerら(2003年)Ann. NY Acad. Sci. 1007巻:89〜100頁)によって誘発される脳卒中の動物モデルが含まれる。
製剤および投与
本発明の設計されたBMPは、哺乳動物、好ましくは医薬組成物の一部としてそれを必要とするヒトへの投与のために製剤化することができる。組成物は任意の適する手段、例えば非経口的、経口的または局所的に投与することができる。設計されたBMPが、所望の組織部位に、例えば注射によって局所的に投与されるか、または、例えば静脈内、皮下、筋肉内、眼窩内、眼内、心室内、頭蓋内、包内、脊椎内、くも膜内、腹腔内、口内、直腸、膣、鼻腔内もしくはエアゾール投与によって全身的に投与される場合、組成物は好ましくは水溶液を含む。哺乳動物へのその投与が哺乳動物の正常な電解質および流体容量均衡に悪影響を与えないように、溶液は、好ましくは生理的に許容される。したがって、水溶液は、例えば、正常な生理食塩液(0.9%NaCl、0.15M)、pH7〜7.4を含むことができる。
治療使用
本発明の改変BMPは、骨および軟骨の形態形成の発達カスケードを誘導することができる。したがって、本発明の改変BMPは、体の様々な場所での骨および軟骨の増殖を誘導するために用いることができる。例えば、膝、肘、足首および指関節などの関節の修復が、本発明によって企図される。例えば、本発明の改変BMPは、関節炎または他の軟骨変性疾患の罹患患者で、軟骨を再生するために指示される。さらに、本発明の改変BMPは、損傷による軟骨の裂傷を治療するために指示される。さらに、本発明の改変BMPは、患者で骨増殖を誘導するのに有用である。例えば、本発明の改変BMPは、骨折もしくは骨の切断、骨粗しょう症の患者、または脊椎固定が必要な患者の治療での使用、または、脊柱、脊椎などの修復のために指示される。
アルカリホスファターゼ活性のBMP誘導
ラット骨肉腫細胞系ROS 17/2.8でアルカリホスファターゼ(ALP)活性を誘導するBMP−2、BMP−4、BMP−5、BMP−6、BMP−7、GDF−5およびGDF−6の能力を検査した。各成長因子を、9点用量応答において3反復で試験した。詳細には、ROS 17/2.8細胞を、96ウェル組織培養プレートに平板培養した。BMP/GDFを以下の投薬量、6000、2000、666、222、74、24、8、2および0.9ng/mlで細胞に加え、48時間インキュベートした。細胞をその後溶解し、ALP活性を誘導する成長因子の効力を、試料の平均光学濃度(OD)の非線形回帰から誘導されたEC50に基づいて評価した(図26を参照)。
一団の例示的なBMPおよび関連タンパク質のNoggin阻害
NogginによるBMP阻害は、当初、ROS 17/2.8細胞において、当技術分野で認められるアルカリホスファターゼに基づくアッセイを用いて評価した。簡潔には、ROS 17/2.8細胞を、96ウェル組織培養プレートに平板培養した。BMP−2、−4、−6および−7を、濃度を段々と高めたNogginと混合し、室温で30分間インキュベートした。その後、各BMPの最終濃度が50ng/mlであるように、この混合物をROS細胞に加えた。アッセイは、3反復で実施した。対照ウェルは、Nogginの非存在下で各BMP単独で処理した細胞からなった。処理後48時間、細胞をインキュベートした。細胞をその後溶解し、BMPによって誘導されたアルカリホスファターゼ総活性を、標準のプロトコルに従って測定した。Nogginに対する各BMPの感受性は、阻害率で報告した。試験したNoggin濃度の各々について、阻害率を以下の式によって計算した:
阻害率=((AP対照−AP Noggin)/AP対照)×100
上式で、「AP対照」は、Nogginを含まない対照ウェルでの平均(n=3)アルカリホスファターゼ活性であり;「AP Noggin」は、Nogginの指示濃度で処理されたウェルでの平均(n=3)アルカリホスファターゼ活性である。
阻害率=((Luc対照−Luc Noggin)/Luc対照)×100
上式で、「Luc対照」は、Nogginを含まない対照ウェルでの平均(n=3)ルシフェラーゼ活性であり;「Luc Noggin」は、Nogginの指示濃度で処理されたウェルでの平均(n=3)ルシフェラーゼ活性である。
一次ヒト骨髄由来間葉性幹細胞における下流遺伝子のBMP−6誘導は、Noggin阻害に対してより低感受性である。
Noggin阻害への顕著な耐性を有するBMP−7変異体タンパク質
BMP−6がNoggin阻害に耐性であることを考慮すると、この特徴の原因を判断してそれを利用することは、Nogginに同じく耐性である他のBMPの変異体を作出することを可能にするであろう。この目的のために、BMP−6のアミノ酸配列、および、noggin阻害にかなりより感受性であるその最も近いパラログ、BMP−7を比較した。図13は、成熟したBMP−7およびBMP−6の略図を示す。これらの2つのタンパク質は、非常に相同的である。しかし、多様なアミノ酸は、図13に表す3つの領域、領域1〜40、45〜80および90〜120に分類される。BMP−6およびBMP−7の成熟ペプチドの配列アラインメントは、これらの分子がそれらのアミノ末端(図16の残基1〜40)で最も異なることを明らかにした。成熟ペプチドの第一のシステイン以外に、11個の残基だけがBMP−7とBMP−6の間で異なることがわかった(図16を参照)。
BMP−6の単一の残基が、Noggin阻害に対する耐性の媒介で必要不可欠な役割を演ずる
BMP−6およびBMP−7の成熟ペプチドのアラインメントは、残基45〜80から延長する領域の中で、7つの残基がBMP−6とBMP−7との間で異なることを示した(図16を参照)。noggin耐性を与える役割を担う残基(複数可)をさらに絞り込むために、野生型BMP−7と異なる80−1の7つの残基の各々を、図29Aに示すようにBMP−7のその対応する残基に戻し突然変異させた。この方法で生成された80−1の復帰突然変異体(「Rev」と命名)は、前述の通りに、nogginの3つの濃度(N1=100ng/ml、N2=500ng/mlおよびN3=1000ng/ml)に対するそれらの感受性について試験した。結果を、図29A〜Bに要約する。
Noggin感受性を媒介することにおけるBMP−6のK60の機能は、進化の過程で保存されている
細胞外のアンタゴニストとのBMPの相互作用は、これらの成長因子の活性を調節するための重要な負のフィードバックループ機構である。noggin感受性のために重要であることがわかった位置60のBMP−7グルタミン酸残基が他のBMPの間で保存されているかどうかを判断するために、BMP−2、4、5、6、7および9を含む一団のBMPの、この残基を囲むアミノ酸配列を比較したが、それらを、図31Aに示す(アミノ酸はBMP−7に従って番号付けした)。BMP−6およびBMP−9の配列だけが、位置60にリジンを含む。対照的に、BMP−2、−4、−5および−7は、この位置にプロリン残基かグルタミン酸残基を有する。
BMP−6の他の残基がnoggin耐性を与える。
本発明によるBMP突然変異体は、インビボ活性を有する。
ラットモデル
本発明の様々な突然変異体BMPの機能を、インビボバイオアッセイで評価する。参照により本明細書で組み込まれるSampathおよびReddi((1983年)Proc. Natl. Acad. Sci. USA80 6591 6595)によって記載される骨誘導のバイオアッセイを用いて、移植された突然変異体の軟骨内性骨分化活性を監視する。このアッセイは、エーテル麻酔下のレシピエントラットの皮下部位に、検査試料を移植することからなる。28〜32日齢の雄のLong−Evansラットを用いる。無菌条件下で胸部上の皮膚に垂直切開(1cm)を設け、ブラントジセクションによってポケットを作る。適するマトリックスで運ばれる突然変異体BMPの約25mgの試験試料をポケット内に深く移植し、金属皮膚クリップで切開を閉じる。対照ラットには、何も移植しない。移植の日は、実験の1日目と指定する。インプラントは、12日目に除去する。ヘテロトロピック部位は、直伸部位の使用から生じる可能性のある曖昧性なしで、骨誘導の試験を可能にする。
ウサギモデル
X線によって実証される骨端閉鎖をもつ、8匹の成熟した(10ポンド未満)ニュージーランドホワイトウサギを試験する。本発明による1つの突然変異体BMP種をそれぞれ含むマトリックスを移植したウサギに、1.5cmの欠損を形成する。対照欠損には、何も移植しない。
本発明によるBMP突然変異体は、野生型BMPよりも低い量で、インビボ骨形成活性を誘導する。
本発明のBMP突然変異体は、ヒト患者で低い濃度で骨および軟骨の増殖を誘導することにおいて選択的である。
参照による組込み
本出願で引用されるすべての配列および構造のアクセス番号、刊行物および特許文書は、各個々の刊行物または特許文書の内容が本明細書に組み込まれるのと同程度に、すべての目的のために参照によりそれらの全体が組み込まれる。
TGF−βスーパーファミリータンパク質および野生型BMP−6のキメラを含むタンパク質であって、野生型BMP−6の1つまたは複数のアミノ酸配列が、上記TGF−βスーパーファミリータンパク質における対応する残基位置のアミノ酸配列を置換し、上記キメラは上記TGF−βスーパーファミリータンパク質のアンタゴニストによる阻害に耐性であり、上記TGF−βスーパーファミリータンパク質の生物活性よりも大きな生物活性を示し、さらに、上記TGF−βスーパーファミリータンパク質は野生型BMP−6ではないタンパク質。
改変骨形成タンパク質(BMP)または改変成長分化因子(GDF)を含むタンパク質であって、上記改変BMPまたはGDFは、対応する未改変の野生型BMPまたは野生型GDFよりも、アンタゴニストによって阻害されず、上記対応する未改変の野生型BMPまたはGDFよりも大きな生物活性を有するタンパク質。
上記アンタゴニストが、Noggin、Noggin様タンパク質、Cerberus/DANファミリータンパク質、Chordin/SOGファミリータンパク質および上のいずれかの機能的同等物からなる、システインノットタンパク質アンタゴニストの群から選択される、項目1または2に記載のタンパク質。
NogginまたはNoggin様タンパク質による阻害に耐性であるタンパク質であって、改変骨形成タンパク質(BMP)または改変成長分化因子(GDF)を含み、
(a)ヒトBMP−6のVal45、Gln48、Asp49、Lys50、Gln53、Ile57、Lys60、Gly61、Ala63、Asn65、Tyr66、Asp68、Glu70、Ser72、Asn76、Ala77、His78、Met79およびAsn80からなる群より選択される少なくとも3つの置換アミノ酸が、野生型BMPまたは野生型GDFにおける対応する位置の少なくとも3つのアミノ酸を置換し、かつ
(b)上記少なくとも3つの置換アミノ酸が、上記野生型BMPまたは上記野生型GDFの、対応する位置の上記少なくとも3つのアミノ酸と異なる
タンパク質。
NogginまたはNoggin様タンパク質による阻害に耐性であるタンパク質であって、改変骨形成タンパク質(BMP)または改変成長分化因子(GDF)を含み、
(a)野生型ヒトBMP−6のVal45〜Asn80が、他の点では野生型のヒトBMPまたはヒトGDFにおける対応するセグメントを置換し、かつ
(b)置換された上記対応するセグメントが、野生型BMP−6の上記Val45〜Asn80と同一ではない
タンパク質。
D22S、S24Q、V26L、N29Q、V33I、P36K、H39A、F41N、H44D、P48S、A52N、D53AおよびL55Mからなる群より選択される少なくとも1つのアミノ酸置換を含む改変BMP−2タンパク質であって、他のすべての残基が、野生型BMP−2と同一であるか、または野生型BMP−2のC末端領域における保存されたシステインドメインと少なくとも93%のアミノ酸配列同一性を共有する、タンパク質。
D24S、S26Q、V28L、N31Q、V35I、P38K、Q41A、F43N、H46D、D48E、P50S、A54N、D55AおよびL57Mからなる群より選択される少なくとも1つのアミノ酸置換を含む改変BMP−4タンパク質であって、他のすべての残基が、野生型BMP−4と同一であるか、または野生型BMP−4のC末端領域における保存されたシステインドメインと少なくとも93%のアミノ酸配列同一性を共有する、タンパク質。
R41Q、E53KおよびF58Nからなる群より選択される少なくとも1つのアミノ酸置換を含む改変BMP−5タンパク質であって、他のすべての残基が、野生型BMP−5と同一であるか、または野生型BMP−5のC末端領域における保存されたシステインドメインと少なくとも93%のアミノ酸配列同一性を共有する、タンパク質。
R48Q、E60K、E68D、A72SおよびS77Aからなる群より選択される少なくとも1つのアミノ酸置換を含む改変BMP−7タンパク質であって、他のすべての残基が、野生型BMP−7と同一であるか、または野生型BMP−7のC末端領域の保存されたシステインドメインと少なくとも89%のアミノ酸配列同一性を共有する、タンパク質。
R48Q、E60K、Y65N、E68D、A72SおよびS77Aからなる群より選択される少なくとも2つのアミノ酸置換を含む改変BMP−7タンパク質であって、他のすべての残基が、野生型BMP−7と同一であるか、または野生型BMP−7のC末端領域の保存されたシステインドメインと少なくとも89%のアミノ酸配列同一性を共有する、タンパク質。
R48Q、E60K、Y65N、E68D、A72S、S77AおよびY78Hからなる群より選択される少なくとも3つのアミノ酸置換を含む改変BMP−7タンパク質であって、他のすべての残基が、野生型BMP−7と同一であるか、または野生型BMP−7のC末端領域の保存されたシステインドメインと少なくとも89%のアミノ酸配列同一性を共有する、タンパク質。
N27S、K29Q、M31L、D34Q、L41K、E42G、E44A、F46N、H47Y、E49D、L51E、E53S、R57N、S58A、L60MおよびE61Nからなる群より選択される少なくとも1つのアミノ酸置換を含む改変GDF−5タンパク質であって、他のすべての残基が、野生型GDF−5と同一であるか、または野生型GDF−5のC末端領域の保存されたシステインドメインと少なくとも87%のアミノ酸配列同一性を共有する、タンパク質。
N27S、K29Q、E30D、D34Q、L41K、E42G、E44A、Y46N、H47Y、E48D、V51E、D53S、R57N、S58A、L60MおよびE61Nからなる群より選択される少なくとも1つのアミノ酸置換を含む改変GDF−6タンパク質であって、他のすべての残基が、野生型GDF−6と同一であるか、または野生型GDF−6のC末端領域の保存されたシステインドメインと少なくとも97%のアミノ酸配列同一性を共有する、タンパク質。
D36S、K38Q、E39D、D43Q、L50K、D51G、E53A、Y55N、H56Y、E58D、L60E、D62S、R66N、S67A、L69M、E70Nからなる群より選択される少なくとも1つのアミノ酸置換を含む改変GDF−7タンパク質であって、他のすべての残基が、野生型GDF−7と同一であるか、または野生型GDF−7のC末端領域の保存されたシステインドメインと少なくとも87%のアミノ酸配列同一性を共有する、タンパク質。
NogginまたはNoggin様タンパク質による改変骨形成タンパク質(BMP)または改変成長分化因子(GDF)の阻害を調節するための方法であって、
改変骨形成タンパク質(BMP)または改変成長分化因子(GDF)を提供する工程を含み、
(a)ヒトBMP−6のVal45、Gln48、Asp49、Lys50、Gln53、Ile57、Lys60、Gly61、Ala63、Asn65、Tyr66、Asp68、Glu70、Ser72、Asn76、Ala77、Met79およびAsn80からなる群より選択される少なくとも2つの置換アミノ酸が、野生型BMPまたは野生型GDFにおける対応する位置の少なくとも2つのアミノ酸を置換し、かつ
(b)上記少なくとも2つの置換アミノ酸が、上記野生型BMPまたは上記野生型GDFにおける対応する位置の上記少なくとも2つのアミノ酸と異なり、かつ
(c)上記提供する工程が、上記BMPまたはGDFの野生型対応物と比較して、NogginまたはNoggin様タンパク質による上記BMPまたはGDFの阻害の調節をもたらす
方法。
NogginまたはNoggin様タンパク質による骨形成タンパク質(BMP)または成長分化因子(GDF)の阻害を調節するための方法であって、
改変BMPまたはGDFタンパク質を提供する工程であり、上記改変タンパク質は、ヒトBMPまたはヒトGDFにおける対応するセグメントを野生型ヒトBMP−6のVal45〜Asn80で置換することから生成される工程を含み、置換された上記対応するセグメントは、野生型BMP−6の上記Val45〜Asn80と同一でなく、上記提供する工程は、BMPまたはGDFの野生型対応物と比較してNogginまたはNoggin様タンパク質による上記BMPまたはGDFの阻害の調節をもたらす
方法。
野生型のBMPまたはGDFタンパク質に対応するN末端アミノ酸配列およびC末端アミノ酸配列を含む天然に存在しないペプチドであって、
(a)上記天然に存在しないペプチドのN末端アミノ酸配列およびC末端アミノ酸配列の各々が、上記野生型のBMPまたはGDFタンパク質と少なくとも97%のアミノ酸配列同一性を共有し、かつ
(b)上記BMPがBMP−6ではないという条件で、上記天然に存在しないペプチドが、Val45、Gln48、Asp49、Lys50、Gln53、Ile57、Lys60、Gly61、Ala63、Asn65、Tyr66、Asp68、Glu70、Ser72、Asn76、Ala77、Met79およびAsn80からなる群より選択されるBMP−6アミノ酸残基に対応する位置の少なくとも2つのアミノ酸残基を有する、
天然に存在しないペプチド。
上記N末端アミノ酸配列または上記C末端アミノ酸配列が上記野生型BMPまたはGDFタンパク質と同一である、項目17に記載の天然に存在しないペプチド。
上記ペプチドが、その野生型のBMPまたはGDF対応物と比較して、NogginまたはNoggin様タンパク質による生物活性阻害の低減を示す、項目17に記載の天然に存在しないペプチド。
項目17に記載のペプチドを、薬学的に許容される担体と混合されて含む医薬組成物。
アミノ酸置換P36Kを含む、項目6に記載の改変BMP−2。
アミノ酸置換P38Kを含む、項目7に記載の改変BMP−4。
アミノ酸置換E53Kを含む、項目8に記載の改変BMP−5。
アミノ酸置換E60Kを含む、項目9に記載の改変BMP−7。
アミノ酸置換R48QおよびS77Aを含む、項目10に記載の改変BMP−7。
アミノ酸置換R48QおよびE60Kを含む、項目10に記載の改変BMP−7。
アミノ酸置換E60KおよびY765Nを含む、項目10に記載の改変BMP−7。
アミノ酸置換Y65NおよびY78Hを含む、項目10に記載の改変BMP−7。
アミノ酸置換R134Eをさらに含む、項目28に記載の改変BMP−7。
アミノ酸置換R48Q、E60KおよびS77Aを含む、項目11に記載の改変BMP−7。
アミノ酸置換R48Q、E60KおよびY65Nを含む、項目11に記載の改変BMP−7。
アミノ酸置換E60K、Y65NおよびA72Sを含む、項目11に記載の改変BMP−7。
アミノ酸置換R48Q、E60K、Y65NおよびA72Sを含む、項目11に記載の改変BMP−7。
アミノ酸置換L41Kを含む、項目12に記載の改変GDF−5。
アミノ酸置換L41Kを含む、項目13に記載の改変GDF−6。
アミノ酸置換L50Kを含む、項目14に記載の改変GDF−7。
項目1から14および21から36に記載のタンパク質のいずれか1つをコードする核酸。
項目37に記載の核酸を含むベクター。
項目1から14および21から36に記載のタンパク質のいずれか1つを、薬学的に許容される担体と混合されて含む医薬組成物。
骨または軟骨修復が必要な患者を治療する方法であって、上記患者に項目39に記載の医薬組成物を投与することを含む方法。
上記患者がヒトである、項目40に記載の方法。
R48、E60、Y65、E68、A72、S77およびY78からなる群より選択される少なくとも1つの位置でアミノ酸置換を含む改変BMP−7であって、BMP−7活性を有する改変BMP−7。
置換が位置60で起こる、項目42に記載の改変BMP−7。
上記位置60の置換がK、R、H、NまたはQ残基である、項目43に記載の改変BMP−7。
置換が位置48で起こる、項目42に記載の改変BMP−7。
上記位置48の置換がQ、N、W、YまたはF残基である、項目45に記載の改変BMP−7。
置換が位置65で起こる、項目42に記載の改変BMP−7。
上記位置65の置換がN、Q、H、KまたはR残基である、項目47に記載の改変BMP−7。
置換が位置72で起こる、項目42に記載の改変BMP−7。
上記位置72の置換がS、T、Y、NまたはQ残基である、項目49に記載の改変BMP−7。
置換が位置48、60、65および72で起こる、項目42に記載の改変BMP−7。
置換が位置48、60および65で起こる、項目42に記載の改変BMP−7。
NogginまたはNoggin様タンパク質による改変骨形成タンパク質(BMP)または改変成長分化因子(GDF)の阻害を調節するための方法であって、
改変骨形成タンパク質(BMP)または改変成長分化因子(GDF)を提供する工程を含み、
(a)ヒトBMP−9のAsn77、Glu79、Ile81、Asp84、Ser85、Ile88、Lys91、Glu92、Glu94、Tyr96、Glu97、Lys99、Gly101、Phe103、Ala107、Asp108、Asp109、Val110またはThr111からなる群より選択される少なくとも2つの置換アミノ酸が、野生型BMPまたは野生型GDFにおける対応する位置の少なくとも2つのアミノ酸を置換し、かつ
(b)上記少なくとも2つの置換アミノ酸が、上記野生型BMPまたは上記野生型GDFにおける対応する位置の上記少なくとも2つのアミノ酸と異なり、かつ
(c)上記提供する工程が、上記BMPまたはGDFの野生型対応物と比較して、NogginまたはNoggin様タンパク質による上記BMPまたはGDFの阻害の調節ももたらす
方法。
NogginまたはNoggin様タンパク質による骨形成タンパク質(BMP)または成長分化因子(GDF)の阻害を調節するための方法であって、
改変BMPまたはGDFタンパク質を提供する工程であり、上記改変タンパク質は、ヒトBMPまたはヒトGDFにおける対応するセグメントを野生型ヒトBMP−9のVal76〜Thr111で置換することから生成される工程を含み、置換された上記対応するセグメントは、野生型BMP−9の上記Val76〜Thr111と同一でなく、上記提供する工程は、BMPまたはGDFの野生型対応物と比較してNogginまたはNoggin様タンパク質による上記BMPまたはGDFの阻害の調節をもたらす
方法。
野生型のBMPまたはGDFタンパク質に対応するN末端アミノ酸配列およびC末端アミノ酸配列を含む天然に存在しないペプチドであって、
(a)上記天然に存在しないペプチドのN末端アミノ酸配列およびC末端アミノ酸配列の各々が、上記野生型のBMPまたはGDFタンパク質と少なくとも97%のアミノ酸配列同一性を共有し、さらに、
(b)上記天然に存在しないペプチドが、Asn77、Glu79、Ile81、Asp84、Ser85、Ile88、Lys91、Glu92、Glu94、Tyr96、Glu97、Lys99、Gly101、Phe103、Ala107、Asp108、Asp109、Val110またはThr111からなる群より選択されるBMP−9アミノ酸残基に対応する位置の少なくとも2つのアミノ酸残基を有し、かつ上記BMPがBMP−9でない
天然に存在しないペプチド。
Claims (24)
- アミノ酸置換E60KならびにR48Q、Y65N、E68D、A72S、S77AおよびY78Hからなる群より選択される少なくとも1つのアミノ酸置換を含み、かつ野生型BMP−7と少なくとも90%のアミノ酸配列同一性を共有し、かつ、配列番号1のアミノ酸配列においてE60Kのアミノ酸置換を有するタンパク質と同等またはそれ以上のNogginタンパク質による生物活性阻害の低減を示す改変BMP−7タンパク質であって、該野生型BMP−7が配列番号1のアミノ酸配列を有する、タンパク質。
- アミノ酸置換E60KならびにR48Q、Y65N、E68D、A72SおよびS77Aからなる群より選択される少なくとも2つのアミノ酸置換を含み、かつ野生型BMP−7と少なくとも90%のアミノ酸配列同一性を共有し、かつ、配列番号1のアミノ酸配列においてE60Kのアミノ酸置換を有するタンパク質と同等またはそれ以上のNogginタンパク質による生物活性阻害の低減を示す改変BMP−7タンパク質であって、該野生型BMP−7が配列番号1のアミノ酸配列を有する、タンパク質。
- アミノ酸置換E60KならびにR48Q、E68D、A72S、S77A、Y78Hからなる群より選択される少なくとも2つのアミノ酸置換を含み、かつ野生型BMP−7と少なくとも90%のアミノ酸配列同一性を共有し、かつ、配列番号1のアミノ酸配列においてE60Kのアミノ酸置換を有するタンパク質と同等またはそれ以上のNogginタンパク質による生物活性阻害の低減を示す改変BMP−7タンパク質であって、該野生型BMP−7が配列番号1のアミノ酸配列を有する、タンパク質。
- アミノ酸置換E60KならびにR48Q、Y65N、E68D、A72S、S77AおよびY78Hからなる群より選択される少なくとも2つのアミノ酸置換を含み、かつ野生型BMP−7と少なくとも90%のアミノ酸配列同一性を共有し、かつ、配列番号1のアミノ酸配列においてE60Kのアミノ酸置換を有するタンパク質と同等またはそれ以上のNogginタンパク質による生物活性阻害の低減を示す改変BMP−7タンパク質であって、該野生型BMP−7が配列番号1のアミノ酸配列を有する、タンパク質。
- アミノ酸置換E60KならびにR48Q、Y65N、E68D、A72S、S77AおよびY78Hからなる群より選択される少なくとも3つのアミノ酸置換を含み、かつ野生型BMP−7と少なくとも90%のアミノ酸配列同一性を共有し、かつ、配列番号1のアミノ酸配列においてE60Kのアミノ酸置換を有するタンパク質と同等またはそれ以上のNogginタンパク質による生物活性阻害の低減を示す改変BMP−7タンパク質であって、該野生型BMP−7が配列番号1のアミノ酸配列を有する、タンパク質。
- アミノ酸置換E60KならびにR48Q、Y65N、E68D、A72S、S77AおよびY78Hからなる群より選択される少なくとも4つのアミノ酸置換を含み、かつ野生型BMP−7と少なくとも90%のアミノ酸配列同一性を共有し、かつ、配列番号1のアミノ酸配列においてE60Kのアミノ酸置換を有するタンパク質と同等またはそれ以上のNogginタンパク質による生物活性阻害の低減を示す改変BMP−7タンパク質であって、該野生型BMP−7が配列番号1のアミノ酸配列を有する、タンパク質。
- 請求項1に記載のタンパク質を、薬学的に許容される担体と混合されて含む医薬組成物。
- アミノ酸置換R48QおよびS77Aを含む、請求項2または3に記載の改変BMP−7タンパク質。
- アミノ酸置換R48QおよびE60Kを含む、請求項1に記載の改変BMP−7タンパク質。
- アミノ酸置換E60KおよびY65Nを含む、請求項1に記載の改変BMP−7タンパク質。
- アミノ酸置換R48Q、E60KおよびS77Aを含む、請求項4に記載の改変BMP−7タンパク質。
- アミノ酸置換R48Q、E60KおよびY65Nを含む、請求項4に記載の改変BMP−7タンパク質。
- アミノ酸置換E60K、Y65NおよびA72Sを含む、請求項4に記載の改変BMP−7タンパク質。
- アミノ酸置換R48Q、E60K、Y65NおよびA72Sを含む、請求項5に記載の改変BMP−7タンパク質。
- 請求項1〜6および8〜14に記載のタンパク質のいずれか1つをコードする核酸。
- 請求項15に記載の核酸を含むベクター。
- 請求項1〜6および8〜14に記載のタンパク質のいずれか1つを、薬学的に許容される担体と混合されて含む医薬組成物。
- 骨または軟骨修復が必要な患者を治療するための請求項17に記載の医薬組成物。
- 前記患者がヒトである、請求項18に記載の医薬組成物。
- 位置E60ならびにR48、Y65、E68、A72、S77およびY78からなる群より選択される少なくとも1つの他の位置でアミノ酸置換を含み、かつ野生型BMP−7と少なくとも90%のアミノ酸配列同一性を共有し、かつ、配列番号1のアミノ酸配列においてE60Kのアミノ酸置換を有するタンパク質と同等またはそれ以上のNogginタンパク質による生物活性阻害の低減を示す改変BMP−7であって、該野生型BMP−7は配列番号1のアミノ酸配列を有し、該位置E60の置換はK残基であり、そして、存在する場合、位置68の置換はDであり、位置77の置換はAであり、位置78の置換はHであり、位置48の置換はQ、N、W、YまたはF残基であり、位置65の置換はN、Q、H、KまたはR残基であり、位置72の置換はS、T、Y、NまたはQ残基である、改変BMP−7。
- 置換が位置60、65および72で起こる、請求項20に記載の改変BMP−7。
- 置換が位置48、60、65および72で起こる、請求項20に記載の改変BMP−7。
- 置換が位置48、60および65で起こる、請求項20に記載の改変BMP−7。
- 置換が位置48、60および77で起こる、請求項20に記載の改変BMP−7。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US875407P | 2007-12-21 | 2007-12-21 | |
| US61/008,754 | 2007-12-21 | ||
| PCT/US2008/087720 WO2009086131A1 (en) | 2007-12-21 | 2008-12-19 | Bmp mutants with decreased susceptibility to noggin |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014056688A Division JP2014121334A (ja) | 2007-12-21 | 2014-03-19 | Nogginに対する感受性が低下したBMP変異体 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2011507903A JP2011507903A (ja) | 2011-03-10 |
| JP2011507903A5 JP2011507903A5 (ja) | 2013-01-17 |
| JP5529754B2 true JP5529754B2 (ja) | 2014-06-25 |
Family
ID=40424155
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010539882A Expired - Fee Related JP5529754B2 (ja) | 2007-12-21 | 2008-12-19 | Nogginに対する感受性が低下したBMP変異体 |
| JP2014056688A Pending JP2014121334A (ja) | 2007-12-21 | 2014-03-19 | Nogginに対する感受性が低下したBMP変異体 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014056688A Pending JP2014121334A (ja) | 2007-12-21 | 2014-03-19 | Nogginに対する感受性が低下したBMP変異体 |
Country Status (6)
| Country | Link |
|---|---|
| US (2) | US20110039773A1 (ja) |
| EP (1) | EP2222696A1 (ja) |
| JP (2) | JP5529754B2 (ja) |
| AU (1) | AU2008345689B2 (ja) |
| CA (1) | CA2708549C (ja) |
| WO (1) | WO2009086131A1 (ja) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1698691A1 (en) * | 2005-03-04 | 2006-09-06 | Biopharm Gesellschaft zur biotechnologischen Entwicklung von Pharmaka mbH | Growth factor mutants with improved biological activity |
| US20110039773A1 (en) * | 2007-12-21 | 2011-02-17 | Stryker Biotech | BMP Mutants with Decreased Susceptibility to Noggin |
| WO2010103070A2 (en) * | 2009-03-12 | 2010-09-16 | Charité - Universitätsmedizin Berlin | Bone morphogenetic protein 2 (bmp2) variants with reduced bmp antagonist sensitivity |
| AU2010341565A1 (en) * | 2009-12-22 | 2012-07-12 | Stryker Corporation | BMP-7 variants with reduced immunogenicity |
| US9856305B2 (en) | 2010-08-20 | 2018-01-02 | Wyeth Llc | Designer osteogenic proteins |
| RU2013104029A (ru) | 2010-08-20 | 2014-09-27 | ВАЙЕТ ЭлЭлСи | Сконструированные остеогенные белки |
| AU2015202418B2 (en) * | 2010-08-20 | 2017-02-02 | Wyeth Llc | Designer osteogenic proteins |
| US9688735B2 (en) | 2010-08-20 | 2017-06-27 | Wyeth Llc | Designer osteogenic proteins |
| US8956829B2 (en) | 2013-01-25 | 2015-02-17 | Warsaw Orthopedic, Inc. | Human recombinant growth and differentiaton factor-5 (rhGDF-5) |
| US9169308B2 (en) | 2013-01-25 | 2015-10-27 | Warsaw Orthopedic, Inc. | Methods and compositions of human recombinant growth and differentiation factor-5 (rhGDF-5) isolated from inclusion bodies |
| US8945872B2 (en) | 2013-01-25 | 2015-02-03 | Warsaw Orthopedic, Inc. | Methods of purifying human recombinant growth and differentiation factor-5 (rhGDF-5) protein |
| US9359417B2 (en) | 2013-01-25 | 2016-06-07 | Warsaw Orthopedic, Inc. | Cell cultures and methods of human recombinant growth and differentiaton factor-5 (rhGDF-5) |
| US9051389B2 (en) | 2013-01-25 | 2015-06-09 | Warsaw Orthopedic, Inc. | Expression conditions and methods of human recombinant growth and differentiation factor-5 (rhGDF-5) |
| EP2784083A1 (en) * | 2013-03-28 | 2014-10-01 | Charité - Universitätsmedizin Berlin | Bone Morphogenetic Protein (BMP) variants with highly reduced antagonist sensitivity and enhanced specific biological activity |
| AU2015294371B2 (en) * | 2014-07-21 | 2018-02-01 | The Arizona Board Of Regents On Behalf Of The University Of Arizona | Ang-(1-7) derivative oligopeptides and methods for using and producing the same |
| US10183055B2 (en) | 2014-07-21 | 2019-01-22 | Arizona Board Of Regents On Behalf Of The University Of Arizona | Ang-(1-7) derivative oligopeptides for the treatment of pain and other indications |
| EP4406585A3 (en) | 2015-02-13 | 2024-10-23 | Factor Bioscience Inc. | Nucleic acid products and methods of administration thereof |
| PL3288379T3 (pl) | 2015-05-01 | 2022-03-07 | Onl Therapeutics, Inc. | Kompozycje peptydowe i sposoby stosowania |
| CN109803977B (zh) | 2016-08-17 | 2023-03-17 | 菲克特生物科学股份有限公司 | 核酸产品及其施用方法 |
| WO2018200322A1 (en) * | 2017-04-27 | 2018-11-01 | Eli Lilly And Company | Variants of human bmp7 protein |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE10026713A1 (de) * | 2000-05-30 | 2001-12-06 | Walter Sebald | Mutein einer Kette eines Proteins aus der Superfamilie des Wachstumsfaktors TGF-beta |
| EP1730186A2 (en) * | 2004-03-31 | 2006-12-13 | Xencor, Inc. | Bmp-7 variants with improved properties |
| AU2005250441A1 (en) * | 2004-05-27 | 2005-12-15 | Acceleron Pharma Inc. | TGF derepressors and uses related thereto |
| WO2008051526A2 (en) * | 2006-10-23 | 2008-05-02 | Stryker Corporation | Bone morphogenetic proteins |
| US20110039773A1 (en) * | 2007-12-21 | 2011-02-17 | Stryker Biotech | BMP Mutants with Decreased Susceptibility to Noggin |
-
2008
- 2008-12-19 US US12/746,821 patent/US20110039773A1/en not_active Abandoned
- 2008-12-19 WO PCT/US2008/087720 patent/WO2009086131A1/en active Application Filing
- 2008-12-19 JP JP2010539882A patent/JP5529754B2/ja not_active Expired - Fee Related
- 2008-12-19 CA CA2708549A patent/CA2708549C/en not_active Expired - Fee Related
- 2008-12-19 AU AU2008345689A patent/AU2008345689B2/en not_active Ceased
- 2008-12-19 EP EP08867546A patent/EP2222696A1/en not_active Withdrawn
-
2012
- 2012-11-30 US US13/690,211 patent/US20130184208A1/en not_active Abandoned
-
2014
- 2014-03-19 JP JP2014056688A patent/JP2014121334A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| WO2009086131A1 (en) | 2009-07-09 |
| WO2009086131A4 (en) | 2009-09-11 |
| JP2011507903A (ja) | 2011-03-10 |
| US20110039773A1 (en) | 2011-02-17 |
| CA2708549C (en) | 2014-04-01 |
| AU2008345689B2 (en) | 2013-04-18 |
| CA2708549A1 (en) | 2009-07-09 |
| EP2222696A1 (en) | 2010-09-01 |
| JP2014121334A (ja) | 2014-07-03 |
| AU2008345689A1 (en) | 2009-07-09 |
| US20130184208A1 (en) | 2013-07-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5529754B2 (ja) | Nogginに対する感受性が低下したBMP変異体 | |
| TWI444475B (zh) | 經設計之成骨蛋白類 | |
| CN102548617B (zh) | Bmp‑alk3拮抗剂和促进骨生长的用途 | |
| US20160060319A1 (en) | Development of Protein-Based Biotherapeutics That Induced Osteogenesis for Bone Healing Therapy: Cell-Permeable BMP2 and BMP7 Recombinant Proteins (CP-BMP2 & CP-BMP7), Polynucleotides Encoding the Same and Pro-osteogenic Compositions Comprising the Same | |
| US20160376334A1 (en) | Positive modulator of bone morphogenic protein-2 | |
| JP2008500816A (ja) | 改善された性質を有するbmp−7変異体 | |
| DE69333745T2 (de) | Löslicher komplex morphogener proteine und zusammensetzungen davon | |
| ES2382464T3 (es) | Mutantes de factor del crecimiento de actividad elevada | |
| TW202203961A (zh) | 用於遞送靶向治療劑至骨骼之組合物及方法 | |
| WO2008051526A2 (en) | Bone morphogenetic proteins | |
| CA2774024A1 (en) | Buffers for controlling the ph of bone morphogenetic proteins | |
| US9012401B2 (en) | Growth factor mutants with improved biological activity | |
| US20130190236A1 (en) | BMP-7 Variants with Reduced Immunogenicity | |
| CN107636008B (zh) | 改进的成骨蛋白 | |
| AU2018236821B2 (en) | Designer osteogenic proteins | |
| Dreyer | Effect of Recombinant Mouse Sclerostin Proteins on Bone Formation in Vitro and in a Murine Model of Sclerosteosis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111128 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20111128 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121115 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130801 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20130813 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20130820 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20131122 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140214 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140319 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20140402 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20140417 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5529754 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |