以下、本発明の実施の形態を説明する。
図1は本発明に係る光電気素子の層構成の一例を示すものであり、一対の電極1,2間に電子輸送層3と正孔輸送層4を挟んで形成されている。そして電子輸送層3は一方の電極1に接して、また正孔輸送層4は他方の電極2に接して形成されており、電子輸送層3と正孔輸送層4は相互に接している、図1において6,7は、上記の電極1,2を設けた基材である。
上記の一方の電極1は、電子輸送層3と電気的に接続され、電子輸送層3から電子を外部に取り出したり、逆に電子輸送層3に電子を注入したりするために用いる部材であり、電子輸送層3を物理的に保持するための部材でもある。ここで外部とはデバイスに電気的に接続された電源回路や二次電池やキャパシタなどをいう。
この電極1は、金属の単独膜で形成してもよく、またガラスやフィルムなどの絶縁性の基材6の上に導電性材料を積層することで基材6上に電極1を形成するようにしてもよい。導電性材料の好ましい例としては、白金、金、銀、銅、アルミニウム、ロジウム、インジウム等の金属;炭素;インジウム−錫複合酸化物、アンチモンをドープした酸化錫、フッ素をドープした酸化錫等の導電性の金属酸化物;これらの金属や酸化物の複合物;これらの金属や化合物の上に酸化シリコン、酸化スズ、酸化チタン、酸化ジルコニウム、酸化アルミニウムなどをコートした材料などを挙げることができる。電極1の表面抵抗は低い程よいものであり、好ましい表面抵抗は200Ω/□以下、より好ましくは50Ω/□以下である。この表面抵抗の下限に特に制限はないが、通常0.1Ω/□である。
電極1を基材6の上に形成する場合、光電気素子が発電素子、発光素子、光センサなどのように、電極1の基材6に光を通過させる必要のあるときは、基材6は光透過率が高いものが望ましい。好ましい光透過率は、波長500ナノメートルにおいて50%以上であり、より好ましくは80%以上である。また電極1の厚みは、0.1〜10μmの範囲内にあることが好ましい。この範囲内であれば、均一な厚みで電極を形成することができ、また光透過性の低下を抑制し、電極1を通して十分な光を電子輸送層3に入射させることができる。
基材6の上に透明導電性酸化物の層を設けることで電極1を形成するにあたっては、例えばガラスや樹脂などからなる透光性の基材6の上にスパッタ法や蒸着法など真空プロセスを用いて電極1を形成する方法や、スピンコート法、スプレー法、スクリーン印刷など湿式法により、酸化インジウムや酸化スズ、酸化亜鉛などで構成される透明導電性酸化物の層を成膜して電極1を形成する方法などがある。
本発明に係る光電気素子において、電子輸送層3は酸化還元部を有する有機化合物によって形成されるものであり、またこの有機化合物は電解質溶液を含んで膨潤したゲル層5として形成されるものである。すなわち電子輸送層3は酸化還元部を有する有機化合物のゲル層5として形成されるものである。
ここで、有機化合物の分子内の一部で繰り返し酸化還元が可能な酸化還元部が形成され、他の一部で電解質溶液を含んで膨潤してゲルとなる部位(ゲル部位)を有する。酸化還元部はゲル部位に化学的に結合しているものであり、分子内での酸化還元部とゲル部位の位置関係は、特に限定されないが、例えばゲル部位で分子の主鎖などの骨格が形成される場合に、酸化還元部は側鎖として主鎖に結合している。またゲル部位を形成する分子骨格と酸化還元部を形成する分子骨格が交互に結合した構造であってもよい。このように酸化還元部とゲル部位が有機化合物の同一分子内に存在していると、電子輸送層3を形成するゲル層5で酸化還元部を電子を輸送し易い位置にとどまるように保持することができるものである。
酸化還元部とゲル部位を有する有機化合物は、低分子体でもよいし、高分子体でもよい。低分子体である場合,水素結合などを介したいわゆる低分子ゲルを形成する有機化合物を使用することができる。また高分子体の場合、数平均分子量1000以上の有機化合物であれば、自発的にゲルの機能を発現することができるために好ましい。高分子体の場合の有機化合物の分子量の上限は特に制限されないが、100万以下であることが好ましい。またゲル層5のゲルの状態は、例えば、こんにゃく状や、イオン交換膜のような外観形状であることが好ましいが、特に制限されるものではない。
また本発明において、酸化還元部は、酸化還元反応において可逆的に酸化体および還元体となる部位を指すものであり、酸化還元部は酸化体と還元体が同一電荷を持つ酸化還元系構成物質であることが好ましい。
上記のような、酸化還元部とゲル部位とを一つの分子中に有する有機化合物は、次の一般式で表すことができる。
(Xi)nj:Yk
(Xi)nおよび(Xi)njはゲル部位を示し、Xiはゲル部位を形成する化合物のモノマーを示すものであり、ポリマー骨格で形成することができる。モノマーの重合度nは、n=1〜10万の範囲が好ましい。YはXに結合している酸化還元部を示すものである。またj,kはそれぞれ1分子中に含まれる(Xi)n、Yの数を表す任意の整数であり、いずれも1〜10万の範囲が好ましい。酸化還元部Yはゲル部位(Xi)nおよび(Xi)njをなすポリマー骨格のあらゆる部位に結合していてもよい。また酸化還元部Yは種類の異なる材料を含んでいてもよく、この場合は電子交換反応の観点から酸化還元電位が近い材料が好ましい。
このような酸化還元部とゲル部位(Xi)nおよび(Xi)njを一分子中に有する有機化合物としては、キノン類が化学結合したキノン誘導体骨格を有するポリマー、イミドを含有するイミド誘導体骨格を有するポリマー、フェノキシルを含有するフェノキシル誘導体骨格を有するポリマー、ビオロゲンを含有するビオロゲン誘導体骨格を有するポリマーなどが挙げられる。これらの有機化合物では、それぞれポリマー骨格がゲル部位となり、キノン誘導体骨格、イミド誘導体骨格、フェノキシル誘導体骨格、ビオロゲン誘導体骨格がそれぞれ酸化還元部となる。
ここで、上記の有機化合物のうち、キノン類が化学結合したキノン誘導体骨格を有するポリマーの例として、[化1]〜[化4]の化学構造を有するものを挙げることができる。[化1]〜[化4]において、Rはメチレン、エチレン、プロパン−1,3−ジエニル、エチリデン、プロパン−2,2−ジイル、アルカンジイル、ベンジリデン、プロピレン、ビニリデン、プロペン−1,3−ジイル、ブト−1−エン−1,4−ジイルなどの飽和又は不飽和炭化水素類;シクロヘキサンジイル、シクロヘキセンジイル、シクロヘキサジエンジイル、フェニレン、ナフタレン、ビフェニレンなど環状炭化水素類;オキサリル、マロニル、サクシニル、グルタニル、アジポイル、アルカンジオイル、セバコイル、フマロイル、マレオイル、フタロイル、イソフタロイル、テレフタロイルなどケト、二価アシル基;オキシ、オキシメチレノキシ、オキシカルボニルなどエーテル、エステル類;サルファンジイル、サルファニル、サルホニルなど硫黄を含む基;イミノ、ニトリロ、ヒドラゾ、アゾ、アジノ、ジアゾアミノ、ウリレン、アミドなど窒素を含む基;シランジイル、ジシラン−1,2−ジイルなど珪素を含む基;またはこれらの基の末端を置換した基或いは複合した基を示す。
そして[化1]はポリマー主鎖にアントラキノンが化学結合している例である。[化2]はアントラキノンが繰り返しユニットとしてポリマー主鎖に組み込まれている例である。また[化3]はアントラキノンが架橋ユニットとなっている例である。さらに[化4]は酸素原子と分子内水素結合を形成するプロトン供与性基を有するアントラキノンの例を示すものである。
上記のキノンポリマーは、プロトン移動に律速されない高速レドックス反応が可能であり、レドックスサイト(酸化還元部)であるキノン基の間に電子的な相互作用が存在せず、長期使用に耐えうる化学安定性を備える。しかもこのキノンポリマーは電解質溶液中に溶出しないので電極1の表面に保持させて電子輸送層3を形成することができる点で有用である。
また酸化還元部Yがイミドを含有するイミド誘導体骨格を有するポリマーとして、[化5]や[化6]に示すポリイミドを用いることができる。ここで、[化5]や[化6]において、R1〜R3はフェニレン基などの芳香族基、アルキレン基、アルキルエーテルなど脂肪族鎖であり、熱イミド化することによって、上記のようなポリイミドが得られる。ポリイミドポリマー骨格はR1〜R3の部分で架橋していてもよく、また、用いた溶媒中で膨潤するのみで溶出しなければ架橋構造を有さなくてもよい。架橋した場合はその部分がゲル部位(Xi)nおよび(Xi)njに相当する。また架橋構造を導入する場合、架橋ユニットにイミド基が含有されていてもよい。イミド基は、電気化学的に可逆な酸化還元特性を示すのであれば、フタルイミドやピロメリットイミドなどが好適である。
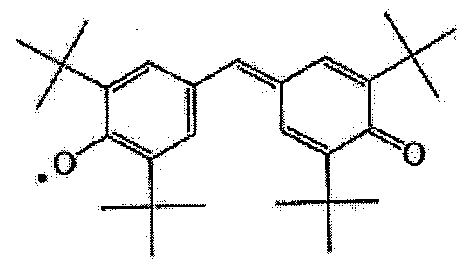
またフェノキシルを含有するフェノキシル誘導体骨格を有するポリマーとして、例えば[化7]に示すようなガルビ化合物をあげることができる。このガルビ化合物において、ガルビノキシル基([化8]参照)が酸化還元部Yに相当し、ポリマー骨格がゲル部位(Xi)nおよび(Xi)njに相当する。
またビオロゲンを含有するビオロゲン誘導体骨格を有するポリマーとして、[化9]や[化10]に示すようなビオロゲン化合物を挙げることができる。このビオロゲン化合物において、[化11]が酸化還元部Yに相当し、ポリマー骨格がゲル部位(Xi)nおよび(Xi)njに相当する。
尚、上記の[化1]〜[化7]、[化9][化10]で示すm、nは、モノマーの重合度を示すものであり、1〜10万の範囲が好ましい。
上記の酸化還元部とポリマー骨格を有する有機化合物は、ポリマー骨格がその骨格間に電解質溶液を含有して膨潤することでゲル層5を形成するものであり、このように電子輸送層3に電解質溶液が含まれることで、酸化還元部の酸化還元反応により形成されるイオン状態が電解質溶液中の対イオンで補償され、酸化還元部を安定化させることができるものである。
電解質溶液は、電解質と溶媒を含むものであればよい。電解質としては、支持塩と、酸化体と還元体からなる酸化還元系構成物質とが挙げられ、これらのうちのいずれか一方であっても、両方であってもよい。支持塩(支持電解質)としては、例えば過塩素酸テトラブチルアンモニウム、六フッ化リン酸テトラエチルアンモニウム、イミダゾリウム塩やピリジニウム塩などのアンモニウム塩、過塩素酸リチウムや四フッ化ホウ素酸カリウムなどアルカリ金属塩などが挙げられる。酸化還元系構成物質とは、酸化還元反応において可逆的に酸化体および還元体の形で存在する物質を意味するものであり、このような酸化還元系構成物質としては、例えば、塩素化合物−塩素、ヨウ素化合物−ヨウ素、臭素化合物−臭素、タリウムイオン(III)−タリウムイオン(I)、水銀イオン(II)−水銀イオン(I)、ルテニウムイオン(III)−ルテニウムイオン(II)、銅イオン(II)−銅イオン(I)、鉄イオン(III)−鉄イオン(II)、ニッケルイオン(II)−ニッケルイオン(III)、バナジウムイオン(III)−バナジウムイオン(II)、マンガン酸イオン−過マンガン酸イオンなどが挙げられるが、これらに限定はされない。この場合、電子輸送層3内の酸化還元部とは区別されて機能する。
また電解質溶液を構成する溶媒としては、水、有機溶媒、イオン液体のいずれか少なくとも一つを含むものを挙げることができる。
電解質溶液の溶媒として水や有機溶媒を用いることによって、有機化合物の酸化還元部の還元状態を安定化することができ、より安定して電子を輸送することができる。溶媒としては水性溶媒及び有機溶媒のいずれも使用できるが、酸化還元部をより安定化するためには、イオン伝導性に優れた有機溶媒が好ましい。このような有機溶媒としては例えば、ジメチルカーボネート、ジエチルカーボネート、メチルエチルカーボネート、エチレンカーボネート、プロピレンカーボネート等のカーボネート化合物、酢酸メチル、プロピオン酸メチル、γ−ブチロラクトン等のエステル化合物、ジエチルエーテル、1,2−ジメトキシエタン、1,3−ジオキソシラン、テトラヒドロフラン、2−メチル−テトラヒドロフラン等のエーテル化合物、3−メチル−2−オキサゾジリノン、2−メチルピロリドン等の複素環化合物、アセトニトリル、メトキシアセトニトリル、プロピオニトリル等のニトリル化合物、スルフォラン、ジメチルスルフォキシド、ジメチルホルムアミド等の非プロトン性極性化合物などが挙げられる。これらの溶媒はそれぞれ単独で用いることができ、2種以上を混合して併用することもできる。また、特に光電気素子を光電変換素子として形成する場合、その太陽電池出力特性を向上させる観点からは、溶媒がエチレンカーボネート、プロピレンカーボネート等のカーボネ−ト化合物、γ―ブチロラクトン、3−メチル−2−オキサゾジリノン、2−メチルピロリドン等の複素環化合物、アセトニトリル、メトキシアセトニトリル、プロピオニトリル、3−メトキシプロピオニトリル、吉草酸ニトリル等のニトリル化合物であることが好ましい。
また電解質溶液の溶媒としてイオン液体を用いることによって、酸化還元部の安定化作用を得ることができるものであり、しかもイオン液体は揮発性がなく、難燃性が高いために安定性に優れるものである。イオン液体としては、公知のイオン性液体全般を用いることができるが、例えば1−エチル−3−メチルイミダゾリウムテトラシアノボレートなどイミダゾリウム系、ピリジン系、脂環式アミン系、脂肪族アミン系、アゾニウムアミン系のイオン性液体や、欧州特許第718288号明細書、国際公開WO95/18456号パンフレット、電気化学第65巻11号923頁(1997年)、J. Electrochem. Soc.143巻,10号,3099頁(1996年)、Inorg. Chem. 35巻,1168頁(1996年)に記載されたものを挙げることができる。
また、電解質溶液は、高分子マトリックスに保持させる構造をとってもよい。高分子マトリックスとして使用するポリフッ化ビニリデン系高分子化合物としては、フッ化ビニリデンの単独重合体、あるいはフッ化ビニリデンと他の重合性モノマー、好適にはラジカル重合性モノマーとの共重合体が挙げられる。フッ化ビニリデンと共重合させる他の重合性モノマーとしては、具体的には、ヘキサフロロプロピレン、テトラフロロエチレン、トリフロロエチレン、エチレン、プロピレン、アクリロニトリル、塩化ビニリデン、メチルアクリレート、エチルアクリレート、メチルメタクリレート、スチレンなどを例示することができる。
そして上記した、酸化還元部を有する有機化合物のゲル層5を電極1の表面に設けることによって、電子輸送層3を形成することができるものである。本発明において電子輸送層3とは、電子がドーパントとして振舞う層をいうものであり、例えば酸化還元電位が銀/塩化銀参照電極に対して+100mVよりも貴であるような酸化還元部を有する層をいう。
電子輸送層3の厚みは、良好な電子輸送性を維持する観点から10nm〜10mmの範囲が好ましく、特に好ましくは100nm〜100μmである。この範囲の厚みであれば電子輸送層3の電子輸送特性と界面の面積をより高いレベルで両立させることができる。
電極1の表面上に電子輸送層3を設けるにあたっては、例えばスパッタ法や蒸着法などの真空プロセスにより電極1の表面に有機化合物を堆積させる方法を採用することができるが、電極1に有機化合物を含有する溶液などを塗布する湿式の形成方法が、より簡便で低コストな製法であることから好ましい。特に電子輸送層3を数平均分子量1000以上のいわゆる高分子の有機化合物で形成する場合は、成形性の観点から湿式の形成方法が好ましい。湿式のプロセスとしては、スピンコート法や液滴を滴下乾燥して得られるドロップキャスト法、スクリーン印刷やグラビア印刷などの印刷法などが挙げられる。
本発明において電子輸送層3は、電子輸送層3が接する電極1側に向けて酸化還元電位が貴から卑に傾斜するように、すなわち電極1に近い側の酸化還元電位の値が、電極から遠い側の酸化還元電位より高になるように、形成されるものである。このように、電子輸送層3が接する電極1側に向けて酸化還元電位が貴から卑に傾斜していると、電子輸送層3内のこの酸化還元電位の勾配によって、電子輸送層3内に電極1側への電子の流れを作ることができるものであり、電子輸送層3から電極1への電子の輸送性が向上し、変換効率を高めることができるものである。
上記のように酸化還元電位が勾配した電子輸送層3を形成する方法としては、例えば、酸化還元電位が異なる複数の有機化合物を用い、各有機化合物の層を積層して電子輸送層3を形成するにあたって、電極1に近い側の層を形成する有機化合物の酸化還元電位が、電極1から遠い側の層を形成する有機化合物の酸化還元電位より高い値になるように、有機化合物を組み合わせる方法がある。例えば図1の例では2つの層3a,3bを積層して電子輸送層3を形成するようにしており、電極1に近い側の層3aを形成する有機化合物の酸化還元電位が卑に、電極1から遠い側の層3bを形成する有機化合物の酸化還元電位より貴になるように、層3a,3bを形成する有機化合物の種類を選定してある。勿論、電子輸送層3は3層以上の積層で形成してもよく、この場合は、電極1に近い側の層ほど、順次、酸化還元電位が卑になるように設定されるものである。
上記のように、電子輸送層3を形成する有機化合物としてイミド誘導体、キノン誘導体、ビオロゲン誘導体、フェノキシル誘導体を用いる場合、これらの有機化合物を2種類以上組み合わせて、電子輸送層3が接する電極1側に向けて酸化還元電位が貴から卑に傾斜するように、電子輸送層3を形成することができる。
また、電子輸送層3と正孔輸送層4の少なくとも一方に接して増感色素を設けることができる。増感色素としては、公知の材料を用いることができるものであり、例えば、9−フェニルキサンテン系色素、クマリン系色素、アクリジン系色素、トリフェニルメタン系色素、テトラフェニルメタン系色素、キノン系色素、アゾ系色素、インジゴ系色素、シアニン系色素、メロシアニン系色素、キサンテン系色素などを挙げることができる。または、RuL2(H2O)2タイプのルテニウム−シス−ジアクア−ビピリジル錯体(ここで、Lは、4,4’−ジカルボキシル−2,2’−ビピリジンを示す)、または、ルテニウム−トリス(RuL3)、ルテニウム−ビス(RuL2)、オスニウム−トリス(OsL3)、オスニウム−ビス(OsL2)などのタイプの遷移金属錯体、または亜鉛−テトラ(4−カルボキシフェニル)ポルフィリン、鉄−ヘキサシアニド錯体、フタロシアニンなどを挙げることができる。例えば、「FPD・DSSC・光メモリーと機能性色素の最新技術と材料開発」(株式会社エヌ・ティー・エス)のDSSCの章にあるような色素を適用することができる。中でも会合性を有する色素は、光電変換時の電荷分離を促進する観点から好ましい。会合体を形成して効果のある色素としては、例えば[化12]の構造式で示される色素が好ましい。
上記構造式において、X1,X2はそれぞれ独立に、アルキル基、アルケニル基、アラルキル基、アリール基、ヘテロ環を少なくとも1種類以上有する有機基であり、それぞれ置換基を有していてもよい。上記の[化12]のような色素は会合性であることが知られている。この場合、電子輸送材料と正孔輸送材料に存在する電子と正孔が再結合点を劇的に減らすことができるものであり、このため光電変換素子の変換効率を向上させることができるものである。
電子輸送層3に増感色素を設ける場合、ゲル層5の表面に増感色素が存在していてもよいし、ゲル層5内に増感色素が存在していてもよい。なかでも電子輸送層3を形成するゲル層5内に増感色素が存在するのが好ましい。ここで「増感色素がゲル層5内に存在している」とは、増感色素がゲル層5の表層のみに存在するのではなく、その内部にも存在していることを意味する。これにより、ゲル層5内に存在する増感色素の量がある値以上にある状態を持続的に保つことができ、光電気素子の出力向上効果がもたらされる。
尚、本発明では増感色素がゲル層5内に存在している状態であればよく、「増感色素がゲル層5内に存在している状態」には、「増感色素がゲル層5を構成する電解質溶液中に存在している状態」と、「増感色素がゲル層5を構成する有機化合物と物理的・化学的に相互作用することによりゲル層5中に存在している状態」とが含まれる。増感色素はゲル層5内の全体に亘って存在していることが好ましい。
特に、増感色素がゲル層5を構成する有機化合物との間の物理的または化学的な相互作用により、ゲル層5内に固定化されて存在していることが好ましい。
ここで、「増感色素がゲル層5を構成する有機化合物と物理的な相互作用によりゲル層5中に存在している状態」は、例えば、ゲル層5を構成する有機化合物として、増感色素の分子の移動を妨げる構造をもつ有機化合物を用いることで達成される。増感色素の分子の移動を妨げる構造としては、有機化合物がアルキル鎖などの各種分子鎖による立体障害を発現する構造、または、有機化合物の分子鎖間に存在する空隙サイズが増感色素の分子の移動を抑制することができる程度に小さくなっている構造などが挙げられる。また、物理的相互作用を発現する要因を色素側にもたらすことも有効である。具体的には、色素にアルキル鎖などの各種分子鎖による立体障害を発現する構造や、色素同士を架橋させるなどして色素の分子サイズを大きくすることも有効である。
また、「増感色素がゲル層5を構成する有機化合物と化学的な相互作用によりゲル層中に存在している状態」は、例えば共有結合、配位結合、イオン結合、水素結合、ファンデルワールス結合などや、疎水性相互作用、親水性相互作用、静電的相互作用に基づく力などの相互作用により、ゲル層5内に増感色素を保持する方法で達成される。特に、増感色素とゲル層5を構成する有機化合物との間の化学的相互作用により増感色素をゲル層5内に固定すると、増感色素と有機化合物との距離を接近させ、効率のよい電子移動を作り出すことが可能になる。
なお、有機化合物と増感色素との間の化学的相互作用によりゲル層5内に増感色素を固定する場合には、有機化合物および増感色素に官能基を適宜設け、この官能基を介した化学反応などにより有機化合物に対して増感色素を固定することが好ましい。このような官能基としては、水酸基、カルボキシル基、リン酸基、スルホ基、ニトロ基、アルキル基、炭酸基、アルデヒド基、チオール基などが挙げられる。また、官能基を介した化学反応の反応形式としては、縮合反応、付加反応、開環反応等が挙げられる。
また、増感色素とゲル層5を構成する有機化合物との化学的結合に際しては、増感色素における官能基が、この増感色素が光励起した状態において電子密度が高くなる部位付近に導入され、且つゲル層5中の有機化合物における官能基が、この有機化合物中の電子輸送に関与する部位付近に導入されていることが好ましい。この場合、増感色素から有機化合物への電子移動の効率および有機化合物中での電子輸送の効率の向上が図れる。また、特に、増感色素とゲル層5を構成する有機化合物との間を、増感色素の電子雲と有機化合物の電子雲とを結び付ける電子輸送性の高い結合基で結合することで、増感色素から有機化合物への効率のよい電子移動を可能にする。具体的には、増感色素のπ電子雲と有機化合物のπ電子雲とを結び付ける化学結合として、π電子系をもつエステル結合などを利用する例が挙げられる。
また、増感色素と有機化合物とを結合させるタイミングは、有機化合物がモノマー状態にあるとき、有機化合物がポリマー化するとき、有機化合物がポリマー化した後、有機化合物がゲル化するとき、有機化合物がゲル化した後、のいずれでもよい。具体的な手法の例としては、有機化合物で形成された電子輸送層3を増感色素を含有する浴に浸漬する方法、有機化合物と増感色素を含有する塗布液を電極1に塗布して成膜することで電子輸送層3を形成する方法などが挙げられ、また複数の方法を組み合わせてもよい。
電子輸送層3を形成するゲル層5内の増感色素の含有量は適宜設定されるが、ゲル層5の有機化合物100質量部に対して0.1〜1000質量部の範囲が好ましい。増感色素の含有量が有機化合物100質量部に対して0.1質量部以上であれば、ゲル層5の単位膜厚あたりの増感色素の量を充分に高くして、増感色素の光吸収能力を向上し、高い電流値を得ることができる。また増感色素の含有量が有機化合物100質量部に対して1000質量部以下であれば、有機化合物の間に過剰量の増感色素が介在することを抑制し、有機化合物内の電子移動が増感色素によって阻害されることを抑制して、高い導電性を確保することができる。
また正孔輸送層4を形成する正孔輸送材料としては、酸化還元対などの電解質を溶媒中に溶解させた電解質溶液、溶融塩のような固体電解質、ヨウ化銅などp型半導体、トリフェニルアミン等のアミン誘導体、ポリアセチレン、ポリアニリン、ポリチオフェン等の導電性高分子などが挙げられる。
正孔輸送層4を電解質溶液で形成する場合には、ゲル層5を構成する電解質溶液で正孔輸送層4を形成することもできる。この場合、ゲル層5を構成する電解質溶液が、正孔輸送層4の一部を構成することになる。
正孔輸送層4には安定ラジカル化合物を含有させることができる。この場合、電荷分離により生成された、正孔を、安定ラジカル化合物の非常に速い電子移動反応によって効率よく対極まで輸送することができ、これにより光電気素子の光電変換効率を向上することができる。
安定ラジカル化合物としては、不対電子を有する化学種、すなわちラジカルを有する化合物であれば特に限定されないが、分子中にニトロキシド(NO・)を有するラジカル化合物が好ましい。また安定ラジカル化合物の分子量(数平均分子量)は1000以上であることが好ましく、この場合、安定ラジカル化合物が常温では固体または固体に近づくため、揮発が起こり難くなり、素子の安定性を向上することができる。
この安定ラジカル化合物についてさらに説明する。安定ラジカル化合物は、電気化学的酸化反応または電気化学的還元反応の少なくとも一方の過程でラジカル化合物を生成する化合物である。ラジカル化合物の種類は特に限定されるものではないが、安定なラジカル化合物であることが好ましい。特に、次の[化13]および[化14]の何れか一方又は両方の構造単位を含む有機化合物であることが好ましい。
上記化学式中、置換基R1は、置換または非置換のC2〜C30のアルキレン基、C2〜C30のアルケニレン基またはC4〜C30のアリーレン基であり、Xは、オキシラジカル基、ニトロキシルラジカル基、硫黄ラジカル基、ヒドラジルラジカル基、炭素ラジカル基またはホウ素ラジカル基であり、n1は、2以上の整数である。
上記化学式中、置換基R2およびR3は相互に独立で、置換または非置換のC2〜C30のアルキレン基、C2〜C30のアルケニレン基またはC4〜C30のアリーレン基であり、Yは、ニトロキシルラジカル基、硫黄ラジカル基、ヒドラジルラジカル基または炭素ラジカル基であり、n2は、2以上の整数である。
[化13]および式[化14]に示されるラジカル化合物としては、例えば、オキシラジカル化合物、ニトロキシルラジカル化合物、炭素ラジカル化合物、窒素ラジカル化合物、ホウ素ラジカル化合物および硫黄ラジカル化合物等を挙げることができる。
上記オキシラジカル化合物の具体例としては、例えば次の[化15]〜[化16]に示されるアリールオキシラジカル化合物や、[化17]に示されるセミキノンラジカル化合物等を挙げることができる。
[化15]〜[化17]で示される化学式中、置換基R4〜R7は相互に独立に、水素原子、置換もしくは非置換の脂肪族または芳香族のC1〜C30の炭化水素基、ハロゲン基、ヒドロキシル基、ニトロ基、ニトロソ基、シアノ基、アルコキシ基、アリールオキシ基またはアシル基である。[化17]の化学式において、n3は、2以上の整数である。
また、上記ニトロキシルラジカル化合物の具体例としては、次の[化18]で示されるピペリジノキシ環を有するラジカル化合物、[化19]で示されるピロリジノキシ環を有するラジカル化合物、[化20] で示されるピロリノキン環を有するラジカル化合物、および[化21]で示されるニトロニルニトロキシド構造を有するラジカル化合物などを挙げることができる。
[化18]〜[化20] で示される化学式中、R8〜R10およびRA〜RLは、それぞれ独立に、水素原子、置換もしくは非置換の脂肪族または芳香族のC1〜C30の炭化水素基、ハロゲン基、ヒドロキシル基、ニトロ基、ニトロソ基、シアノ基、アルコキシ基、アリールオキシ基またはアシル基である。また、[化21]で示される化学式において、n4は2以上の整数である。
また、上記ニトロキシルラジカル化合物の具体例としては、次の[化22] で示される三価のヒドラジル基を有するラジカル化合物、[化23] で示される三価のフェルダジル基を有するラジカル化合物、および[化24]で示されるアミノトリアジン構造を有するラジカル化合物などを挙げることができる。
[化22]〜[化24]の化学式中、R11〜R19は、それぞれ独立に、水素原子、置換もしくは非置換の脂肪族または芳香族のC1〜C30の炭化水素基、ハロゲン基、ヒドロキシル基、ニトロ基、ニトロソ基、シアノ基、アルコキシ基、アリールオキシ基またはアシル基である。
以上の[化13]〜[化24]の何れかの有機高分子化合物は、安定性に優れたものとなり、その結果、光電変換素子やエネルギー蓄積素子として安定して使用できるので、安定性に優れしかも応答速度に優れた光電気素子を容易に得ることができる。
安定ラジカルとして上記した有機化合物の中でも、室温で固体状態の有機化合物を選択して用いることがより好ましい。室温で固体状態のラジカル化合物を用いることにより、ラジカル化合物と半導体との接触を安定に保つことができ、他の化学物質との副反応や溶融、拡散による変成、劣化を抑制することができる。その結果、安定性に優れた光電気素子とすることができる。
上記の電子輸送層3が接する電極1に対して対電極となる、正孔輸送層4が接する電極2を形成するための電極材料としては、作製する素子によるが、例えば白金、金、銀、銅、アルミニウム、ロジウム、インジウム等の金属、又はグラファイト、カーボンナノチューブ、白金を担持したカーボン等の炭素材料、若しくはインジウム−錫複合酸化物、アンチモンをドープした酸化錫、フッ素をドープした酸化錫等の導電性の金属酸化物、さらにポリエチレンジオキシチオフェン、ポリピロール、ポリアニリン等の導電性高分子などを挙げることができる。
光電気素子の作製は、例えば基材6に設けられた電極1の上に有機化合物を湿式法等で積層することによって、電子輸送層3(3a,3b)を電極1の上に固定して形成し、この電子輸送層3の上に正孔輸送層4、対電極となる電極2を積層することによって行なうことができる。正孔輸送層4を電解質溶液で形成する場合には、例えば電子輸送層3と対電極2との間を封止材で封止した状態で、電子輸送層3と対電極2との間の隙間に電解質溶液を充填することで、正孔輸送層4を形成することができる。このとき電解質溶液の一部が電子輸送層3に浸透すると共にこの電子輸送層3を構成する有機化合物が膨潤することでゲル層5が形成される。
上記の説明のように構成される光電気素子は、光電変換素子として機能させることができる。この光電変換素子にあって、基材6の側から電極1を通して光が照射されると、増感色素が光を吸収して励起し、生成した励起電子が電子輸送層3に流れ込んで、電極1を経て外部に取り出されると共に、増感色素における正孔が正孔輸送層4から対電極2を経て外部に取り出される。
尚、本発明の、一対の電極間に電子輸送層と正孔輸送層を挟んで形成される光電気素子を用いて、上記のような光電変換素子を作製する他、有機ELなどの発光素子、エレクトロクロミック表示素子や電子ペーパーなどの光学表示素子、温度・光などを感知するセンサ素子等に、光電気素子などを作製することができる。
次に、本発明を実施例によって具体的に説明する。
(実施例1)
[化25]に示す反応の手順で、既述の[化7]のガルビ(Galvi)化合物を合成した。
(ガルビモノマーの合成)
反応容器に4−ブロモ−2,6−ジ−tert−ブチルフェノール(135.8g;0.476mol)とアセトニトリル(270ml)とを入れ、さらに不活性雰囲気下で、N,O−ビス(トリメチルシリル)アセトアミド(BSA)(106.3g;129.6ml)を加え、70℃で終夜撹拌し、完全に結晶が析出するまで反応した。そして析出した白色結晶を濾過し、真空乾燥した後、エタノールで再結晶して精製することによって、[化25]において符号「1」で示す、(4−ブロモ−2,6−ジ−tert−ブチルフェノキシ)トリメチルシラン(150.0g;0.420mol)の白色板状結晶を得た。
次に、反応容器内で、上記の(4−ブロモ−2,6−ジ−tert−ブチルフェノキシ)トリメチルシラン(9.83g;0.0275mol)を、不活性雰囲気下、テトラヒドロフラン(200ml)に溶解し、この溶液をドライアイス/メタノールを用いて−78℃に冷却した。さらにこの反応容器内に1.58Mのn−ブチルリチウム/ヘキサン溶液(15.8ml;0.025mol)を加え、78℃の温度で30分撹拌することでリチオ化した。次にこの溶液に、4−ブロモ安息香酸メチル(1.08g;0.005mol、Mw:215.0、TCI)のテトラヒドロフラン(75ml)溶液を添加した後、−78℃〜室温で終夜撹拌した。これにより溶液は黄色から薄黄色、さらにアニオンの発生を示す濃青色へと変化した。反応後、反応容器内の溶液に飽和塩化アンモニウム水溶液を、溶液が完全に黄色になるまで加え、この溶液をエーテル/水で分液抽出することにより黄色粘稠液体状の生成物を得た。
次に反応容器に、この生成物、THF(10ml)、メタノール(7.5ml)、撹拌子を入れ、溶解後、10N−HCl(1〜2ml)を反応容器内の溶液が赤橙色に変化するまで徐々に加え、30分間、室温にて撹拌した。次に溶媒除去、エーテル/水による分液抽出、溶媒除去、カラムクロマトグラフィー(ヘキサン/クロロホルム=1/1)による分画、ヘキサンによる再結晶の各操作を経て精製し、[化25]において符号「2」で示す、(p−ブロモフェニル)ヒドロガルビノキシル(2.86g;0.0049mol)の橙色結晶を得た。
次いで、反応容器内で上記の(p−ブロモフェニル)ヒドロガルビノキシル(2.50g;4.33mmol)を、不活性雰囲気下、トルエン(21.6ml;0.2M)に溶解し、これに2,6−ジ−tert−ブチル−p−クレゾール(4.76mg;0.0216mmol)、テトラキス(トリフェニルホスフィン)パラジウム(0)(0.150g;0.130mmol)、トリ−n−ブチルビニルすず(1.65g;5.20mmol,Mw:317.1,TCI)をすばやく加え、100℃で17時間加熱撹拌した。
そして反応性生物をエーテル/水で分液抽出し、溶媒除去した後、フラッシュカラムクロマトグラフィー(ヘキサン/クロロホルム=1/3)にて分画し、さらにヘキサンで再結晶して精製することによって、[化25]において符号「3」で示す、p−ヒドロガルビノキシルスチレン(1.54g;2.93mmol)の橙色微結晶を得た。
(ガルビモノマーの重合)
上記ガルビモノマーの合成で得られたガルビモノマー(p−ヒドロガルビノキシルスチレン)1gと、テトラエチレングリコールジアクリレート57.7mgと、アゾビスイソブチロニトリル15.1mgを、テトラヒドロフラン2mlに溶解した後、窒素置換し、一晩還流することで、ガルビモノマーを重合させ、[化25]において符号「4」で示すガルビポリマーを得た。
(電子輸送層の形成)
一方、電極1が設けられた基材6として、厚み0.7mm、シート抵抗100Ω/□の導電性ガラス基板を用意した。この導電性ガラス基板はガラス基板と、このガラス基板の片面に積層された、フッ素ドープされたSnO2からなるコーティング膜とから構成されるものであり、ガラス基板が基材6、コーティング膜が電極1となる。
そして上記のように重合して得たガルビポリマーをクロロベンゼンに2質量%の割合で溶解し、このガルビポリマー溶液を上記の導電性ガラス基板の電極1の上に2000rpmでスピンコートし、60℃、0.01MPa下で1時間乾燥することによって、厚み60nmの層3aを形成した。
このようにガルビポリマーの層3aを形成した後、濃度0.1Mのテトラブチルアンモニウム水溶液に15分間浸漬することで、層3aを構成するガルビポリマーをアニオン化した。このガルビポリマーの層3aを水洗した後、濃度0.1Mのポリデシルビオロゲン水溶液(pH10)に15分間浸漬することで、アニオン化したガルビポリマーにポリデシルビオロゲンを静電的に結合した層3bを形成し、ガルビポリマーの層3aとポリデシルビオロゲンの層3bからなる電子輸送層3を形成した。この電子輸送層3の各層3a,3bの酸化還元電位を後述の方法で測定したところ、層3aの酸化還元電位は0V、層3bの酸化還元電位は−0.4Vであり、電子輸送層3の酸化還元電位は電極1側に向けて貴から卑に傾斜しているものであった。
次に、このように形成した電子輸送層3を、[化26]で示される増感色素(D131)を0.3mMの濃度で含むアセトニトリル溶液中に1時間浸漬した後、水洗した。これにより電子輸送層3に増感色素を設けた。
(素子の作製)
上記の電子輸送層3の形成の際に用いた導電性ガラス基板と同じ構成を有する導電性ガラス基板を用意した。そして、イソプロピルアルコールに塩化白金酸をその濃度が5mMとなるように溶解し、得られた溶液を上記の導電性ガラス基板のコーティング膜の上にスピンコートした後、400℃で30分間焼成することで、対電極2を形成した。
次に、電子輸送層3が設けられた上記の導電性ガラス基板と、対電極2が設けられた導電性ガラス基板とを、電子輸送層3と対電極2とが対向するように配置し、両者の間の外縁に幅1mm、厚み50μmの熱溶融性接着剤(デュポン社製、バイネル)を介在させた。そしてこの熱溶融性接着剤を加熱しながら上記の二枚の導電性ガラス基板を厚み方向に加圧することで、二枚の導電性ガラス基板を熱溶融性接着剤を介して接合した。このとき、熱溶融性接着剤には、電解液の注入口となる空隙を形成した。
続いて、電子輸送層3と対電極2との間に上記の注入口から電解液を充填した。次に、この注入口にUV硬化性樹脂を塗布した後、UV光を照射してUV硬化性樹脂を硬化させることで、注入口を孔埋めした。これにより、電解液からなる正孔輸送層4を形成すると共にこの電解液を電子輸送層3へ浸透させて電子輸送層3を構成する有機化合物(ガルビポリマー)を膨潤させ、ゲル層5を形成した。この電解液としては、2,2,6,6−テトラメチルピペリジン−1−オキシルを1M、増感色素(D131)を2mM、LiTFSIを0.5M、N−メチルベンズイミダゾールを1.6Mの濃度で含有する、アセトニトリル溶液を用いた。以上のようにして、図1のような層構成の光電気素子を作製した。
(実施例2)
(キノンポリマーの合成)
キノンポリマーとして、[化27]に示す反応で、既述の[化4]のポリ(1-メタクリルアミドアントラキノン)を合成した。
まず、アルゴン雰囲気下、10mlナスフラスコに、1−メタクリルアミドアントラキノン50mg(0.172mmol、1eq)、ジビニルベンゼン25μl(0.172mmol、1eq)、AIBN(アゾビスイソブチロニトリル)0.48g(3.43μmol、0.02eq)を投入し、これらをTHF1.72mlに溶解後、アルゴンにより溶媒に溶存している酸素を除去した。そして脱気後、70℃で48時間反応させた。反応終了後、メタノールで沈殿物を生成させ、THFでソックスレー洗浄し、黄色固体として重合体37.3mgを得た。
(電子輸送層の形成)
実施例1と同様にして、導電性ガラス基板の電極1の上にガルビポリマーの層3aを形成した。次に、上記の重合体10mgをNメチルピロリドン0.1gに溶解させた溶液を、ガルビポリマーの層3aの上に1000rpmでスピンコートし、厚さ100nmのキノンポリマーの層3bを形成して、ガルビポリマーの層3aとキノンポリマーの層3bからなる電子輸送層3を形成した。この電子輸送層3の各層3a,3bの酸化還元電位を後述の方法で測定したところ、層3aの酸化還元電位は0V、層3bの酸化還元電位は−0.8Vであり、電子輸送層3の酸化還元電位は電極1側に向けて貴から卑に傾斜しているものであった。
次に、この電子輸送層3を、既述の[化26]の増感色素(D131)を0.3mMの濃度で含むアセトニトリル溶液中に1時間浸漬した後、水洗し、電子輸送層3に増感色素を設けた。
このようにして電子輸送層3を形成し、あとは実施例1と同様にして、図1のような層構成の光電気素子を作製した。
(実施例3)
(ポリイミドの合成)
アルゴン雰囲気下、30mlのナスフラスコに、4−4’−オキシジフタル酸無水物310.20mg(0.001mol)、N−N−ジメチルアセトアミド2ml、1.4−フェニレンジアミン108.15mg(0.001mol)を加え、室温下で18時間反応させた。反応終了後、アセトンに沈殿させて精製することによって、白色固体として[化28]に示す重合体411.8mgを得た。
(電子輸送層の形成)
実施例1と同様にして、導電性ガラス基板の電極1の上にガルビポリマーの層3aを形成した。次に、上記の重合体5.47mgとN−メチルピロリドン0.1gを混合した溶液を調製し、この溶液をガルビポリマーの層3aの表面に1000rpmでスピンコートにより成膜し100nm厚みとした。これを、150℃、180℃、200℃、220℃で各20分、250℃で30分と段階的に加熱し、[化29]に示すようにイミド化して、ポリイミドの層3bを形成して、ガルビポリマーの層3aとポリイミドの層3bからなる電子輸送層3を形成した。この電子輸送層3の各層3a,3bの酸化還元電位を後述の方法で測定したところ、層3aの酸化還元電位は0V、層3bの酸化還元電位は−1.0Vであり、電子輸送層3の酸化還元電位は電極1側に向けて貴から卑に傾斜しているものであった。
次に、この電子輸送層3を、既述の[化26]の増感色素(D131)を0.3mMの濃度で含むアセトニトリル溶液中に1時間浸漬した後、水洗し、電子輸送層3に増感色素を設けた。
このようにして電子輸送層3を形成し、あとは実施例1と同様にして、図1のような層構成の光電気素子を作製した。
(比較例1)
実施例1において、導電性ガラス基板の電極1の上にガルビポリマーの層3aを形成した(層3bは形成しない)。このガルビポリマーの層3aで形成される電子輸送層3を、既述の[化26]の増感色素(D131)を0.3mMの濃度で含むアセトニトリル溶液中に1時間浸漬した後、水洗し、電子輸送層3に増感色素を設けた。あとは実施例1と同様にして、光電気素子を作製した。
上記の実施例1〜3及び比較例1のガルビポリマーの層、実施例1のポリデシルビオロゲンの層、実施例2のキノンポリマーの層、実施例3のポリイミドの層の、酸化還元電位の測定法を次に示す。
(ガルビポリマー層の酸化還元電位測定)
透明導電膜付のガラス基板の上に実施例1と同様にスピンコートして、厚さ100nmのガルビポリマーの層を形成した。次にガルビポリマー層を設けた電極を電解液に浸して、ガルビポリマー層中の空隙に電解液を染み込ませた。電解液としては0.1mol/lの過塩素酸テトラブチルアンモニウムのアセトニトリル溶液を用いた。そして、対極として白金電極を、参照極にAg/AgCl電極を用いて半電池を作製し、電位の評価を行なったところ、酸化還元電位は0Vであった。
(ポリデシルビオロゲン層の酸化還元電位測定)
透明導電膜付のガラス基板を濃度0.1Mのポリデシルビオロゲン水溶液(pH10)に15分間浸漬することによって、透明導電膜の上にポリデシルビオロゲン層を形成した。次にポリデシルビオロゲン層を設けた電極を電解液に浸して、ポリデシルビオロゲン層中の空隙に電解液を染み込ませた。電解液としては0.1mol/lの過塩素酸テトラブチルアンモニウムのアセトニトリル溶液を用いた。そして、対極として白金電極を、参照極にAg/AgCl電極を用いて半電池を作製し、電位の評価を行なったところ、ポリデシルビオロゲン層の酸化還元電位は−0.4Vであった。
(キノンポリマーの層の酸化還元電位測定)
透明導電膜付のガラス基板上に、実施例3と同様にスピンコートして、キノンポリマーの層を厚み100nmで作製した。次にキノンポリマー層を設けた電極を電解液に浸して、キノンポリマー層中の空隙に電解液を染み込ませた。電解液としては0.1mol/lの過塩素酸テトラブチルアンモニウムのアセトニトリル溶液を用いた。そして、対極として白金電極を、参照極にAg/AgCl電極を用いて半電池を作製し、電位の評価を行なったところ、キノンポリマー層の酸化還元電位は−0.8Vであった。
(ポリイミドの層の酸化還元電位測定法)
透明導電膜付のガラス基板上に、実施例3と同様にスピンコートして、ポリイミド層を厚み100nmで形成した。次にポリイミド層を設けた電極を電解液に浸して、ポリイミド層中の空隙に電解液を染み込ませた。電解液としては0.1mol/lの過塩素酸テトラブチルアンモニウムのアセトニトリル溶液を用いた。そして、対極として白金電極を、参照極にAg/AgCl電極を用いて半電池を作製し、電位の評価を行なったところ、ポリイミド層の酸化還元電位は−1.0Vであった。
上記の各実施例及び比較例で得られた光電気素子について、光電変換部の平面視面積1cm2の領域に200ルックスの光を照射しながら、「Keithley 2400source meter」(ケースレイ社製の2400型汎用ソースメータ)を用いたIV測定により各光電気素子の開放電圧および短絡電流値を測定した。このとき、光源には蛍光灯(パナソニック株式会社製ラピッド蛍光灯「FLR20S・W/M」)を使用し、25℃環境下で測定を行なった。結果を表1に示す。
表1にみられるように、各実施例のものは、比較例のものより開放電圧値や短絡電流値が高く、変換効率が向上していることが確認される。