JP5346216B2 - 治療 - Google Patents
治療 Download PDFInfo
- Publication number
- JP5346216B2 JP5346216B2 JP2008557821A JP2008557821A JP5346216B2 JP 5346216 B2 JP5346216 B2 JP 5346216B2 JP 2008557821 A JP2008557821 A JP 2008557821A JP 2008557821 A JP2008557821 A JP 2008557821A JP 5346216 B2 JP5346216 B2 JP 5346216B2
- Authority
- JP
- Japan
- Prior art keywords
- polypeptide
- tsg
- seq
- opg
- polynucleotide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 238000011282 treatment Methods 0.000 title claims abstract description 15
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 201
- 229920001184 polypeptide Polymers 0.000 claims abstract description 198
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 198
- 108091033319 polynucleotide Proteins 0.000 claims abstract description 87
- 102000040430 polynucleotide Human genes 0.000 claims abstract description 87
- 239000002157 polynucleotide Substances 0.000 claims abstract description 87
- 238000004519 manufacturing process Methods 0.000 claims abstract description 15
- 239000003814 drug Substances 0.000 claims abstract description 13
- 230000002265 prevention Effects 0.000 claims abstract description 5
- 108010035042 Osteoprotegerin Proteins 0.000 claims description 101
- XXUPLYBCNPLTIW-UHFFFAOYSA-N octadec-7-ynoic acid Chemical compound CCCCCCCCCCC#CCCCCCC(O)=O XXUPLYBCNPLTIW-UHFFFAOYSA-N 0.000 claims description 101
- 230000027455 binding Effects 0.000 claims description 60
- 102000014128 RANK Ligand Human genes 0.000 claims description 57
- 108010025832 RANK Ligand Proteins 0.000 claims description 57
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 51
- 239000012634 fragment Substances 0.000 claims description 49
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 26
- 108091026890 Coding region Proteins 0.000 claims description 21
- 150000007523 nucleic acids Chemical group 0.000 claims description 20
- 108090000623 proteins and genes Proteins 0.000 claims description 20
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 12
- 101001082142 Homo sapiens Pentraxin-related protein PTX3 Proteins 0.000 claims description 10
- 102100027351 Pentraxin-related protein PTX3 Human genes 0.000 claims description 10
- 239000000203 mixture Substances 0.000 claims description 10
- 230000002068 genetic effect Effects 0.000 claims description 7
- 208000001132 Osteoporosis Diseases 0.000 claims description 6
- 108060008682 Tumor Necrosis Factor Proteins 0.000 claims description 6
- 229940079593 drug Drugs 0.000 claims description 6
- 238000009472 formulation Methods 0.000 claims description 6
- 102000003390 tumor necrosis factor Human genes 0.000 claims description 6
- 229960001251 denosumab Drugs 0.000 claims description 5
- 230000003278 mimic effect Effects 0.000 claims description 5
- 102000010498 Receptor Activator of Nuclear Factor-kappa B Human genes 0.000 claims description 3
- 108010038036 Receptor Activator of Nuclear Factor-kappa B Proteins 0.000 claims description 3
- 230000004936 stimulating effect Effects 0.000 claims description 2
- 102100032236 Tumor necrosis factor receptor superfamily member 11B Human genes 0.000 claims 16
- 210000002997 osteoclast Anatomy 0.000 abstract description 73
- 208000006386 Bone Resorption Diseases 0.000 abstract description 53
- 230000024279 bone resorption Effects 0.000 abstract description 53
- 208000020084 Bone disease Diseases 0.000 abstract description 10
- 102100032807 Tumor necrosis factor-inducible gene 6 protein Human genes 0.000 abstract 2
- 101710169430 Tumor necrosis factor-inducible gene 6 protein Proteins 0.000 abstract 2
- 102000008108 Osteoprotegerin Human genes 0.000 description 85
- 201000010099 disease Diseases 0.000 description 37
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 37
- 238000000034 method Methods 0.000 description 34
- 230000000694 effects Effects 0.000 description 22
- 125000003729 nucleotide group Chemical group 0.000 description 18
- 101000847156 Homo sapiens Tumor necrosis factor-inducible gene 6 protein Proteins 0.000 description 16
- 210000004027 cell Anatomy 0.000 description 16
- 102000050255 human TNFAIP6 Human genes 0.000 description 16
- 239000002773 nucleotide Substances 0.000 description 16
- 239000013598 vector Substances 0.000 description 16
- 102000004169 proteins and genes Human genes 0.000 description 14
- 206010003246 arthritis Diseases 0.000 description 13
- KIUKXJAPPMFGSW-MNSSHETKSA-N hyaluronan Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)C1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H](C(O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-MNSSHETKSA-N 0.000 description 13
- 150000001413 amino acids Chemical class 0.000 description 12
- 206010039073 rheumatoid arthritis Diseases 0.000 description 12
- 108020004414 DNA Proteins 0.000 description 11
- 210000000988 bone and bone Anatomy 0.000 description 11
- 230000014509 gene expression Effects 0.000 description 11
- 229920002674 hyaluronan Polymers 0.000 description 11
- 229940099552 hyaluronan Drugs 0.000 description 11
- 102000039446 nucleic acids Human genes 0.000 description 11
- 108020004707 nucleic acids Proteins 0.000 description 11
- 230000001681 protective effect Effects 0.000 description 11
- 229920002971 Heparan sulfate Polymers 0.000 description 10
- 241000699670 Mus sp. Species 0.000 description 10
- 210000000845 cartilage Anatomy 0.000 description 10
- 239000003112 inhibitor Substances 0.000 description 9
- 230000002401 inhibitory effect Effects 0.000 description 9
- 238000006467 substitution reaction Methods 0.000 description 9
- 230000003110 anti-inflammatory effect Effects 0.000 description 8
- 230000003993 interaction Effects 0.000 description 8
- 201000008482 osteoarthritis Diseases 0.000 description 8
- 210000001179 synovial fluid Anatomy 0.000 description 8
- 239000013604 expression vector Substances 0.000 description 7
- 108010093564 inter-alpha-inhibitor Proteins 0.000 description 7
- 102000016284 Aggrecans Human genes 0.000 description 6
- 108010067219 Aggrecans Proteins 0.000 description 6
- 102000016359 Fibronectins Human genes 0.000 description 6
- 108010067306 Fibronectins Proteins 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 6
- 241000700159 Rattus Species 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 238000003780 insertion Methods 0.000 description 6
- 230000037431 insertion Effects 0.000 description 6
- 208000024891 symptom Diseases 0.000 description 6
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 5
- 241000288906 Primates Species 0.000 description 5
- 108010076504 Protein Sorting Signals Proteins 0.000 description 5
- 108010046722 Thrombospondin 1 Proteins 0.000 description 5
- 102100036034 Thrombospondin-1 Human genes 0.000 description 5
- 210000004369 blood Anatomy 0.000 description 5
- 239000008280 blood Substances 0.000 description 5
- 229940094517 chondroitin 4-sulfate Drugs 0.000 description 5
- KXKPYJOVDUMHGS-OSRGNVMNSA-N chondroitin sulfate Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](OS(O)(=O)=O)[C@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](C(O)=O)O1 KXKPYJOVDUMHGS-OSRGNVMNSA-N 0.000 description 5
- 230000000295 complement effect Effects 0.000 description 5
- 230000006378 damage Effects 0.000 description 5
- 238000012217 deletion Methods 0.000 description 5
- 230000037430 deletion Effects 0.000 description 5
- 210000004268 dentin Anatomy 0.000 description 5
- 230000006870 function Effects 0.000 description 5
- 229960002897 heparin Drugs 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 239000003446 ligand Substances 0.000 description 5
- 230000001404 mediated effect Effects 0.000 description 5
- 229940012957 plasmin Drugs 0.000 description 5
- 230000010076 replication Effects 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- -1 versican Chemical compound 0.000 description 5
- 229920000045 Dermatan sulfate Polymers 0.000 description 4
- 108010088842 Fibrinolysin Proteins 0.000 description 4
- 101000798130 Homo sapiens Tumor necrosis factor receptor superfamily member 11B Proteins 0.000 description 4
- 206010061218 Inflammation Diseases 0.000 description 4
- 101800001691 Inter-alpha-trypsin inhibitor light chain Proteins 0.000 description 4
- 102400001240 Inter-alpha-trypsin inhibitor light chain Human genes 0.000 description 4
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 4
- 108010046938 Macrophage Colony-Stimulating Factor Proteins 0.000 description 4
- 102100028123 Macrophage colony-stimulating factor 1 Human genes 0.000 description 4
- 241000219061 Rheum Species 0.000 description 4
- 229930006000 Sucrose Natural products 0.000 description 4
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 230000015556 catabolic process Effects 0.000 description 4
- 238000006731 degradation reaction Methods 0.000 description 4
- AVJBPWGFOQAPRH-FWMKGIEWSA-L dermatan sulfate Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@H](OS([O-])(=O)=O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](C([O-])=O)O1 AVJBPWGFOQAPRH-FWMKGIEWSA-L 0.000 description 4
- 229940051593 dermatan sulfate Drugs 0.000 description 4
- 102000052781 human TNFRSF11B Human genes 0.000 description 4
- 230000004054 inflammatory process Effects 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 238000010369 molecular cloning Methods 0.000 description 4
- 210000000440 neutrophil Anatomy 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- 229960004793 sucrose Drugs 0.000 description 4
- 239000003826 tablet Substances 0.000 description 4
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 3
- 206010065687 Bone loss Diseases 0.000 description 3
- 108010002352 Interleukin-1 Proteins 0.000 description 3
- 241000699666 Mus <mouse, genus> Species 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 229920002472 Starch Polymers 0.000 description 3
- 241000700605 Viruses Species 0.000 description 3
- 238000003556 assay Methods 0.000 description 3
- 239000001913 cellulose Substances 0.000 description 3
- 229920002678 cellulose Polymers 0.000 description 3
- 235000010980 cellulose Nutrition 0.000 description 3
- 150000001875 compounds Chemical class 0.000 description 3
- 230000001186 cumulative effect Effects 0.000 description 3
- 235000013681 dietary sucrose Nutrition 0.000 description 3
- 230000004069 differentiation Effects 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 238000009396 hybridization Methods 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 230000001965 increasing effect Effects 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 238000010255 intramuscular injection Methods 0.000 description 3
- 239000007927 intramuscular injection Substances 0.000 description 3
- 210000001503 joint Anatomy 0.000 description 3
- 210000002433 mononuclear leukocyte Anatomy 0.000 description 3
- 230000035772 mutation Effects 0.000 description 3
- 238000003752 polymerase chain reaction Methods 0.000 description 3
- 239000011148 porous material Substances 0.000 description 3
- 238000010188 recombinant method Methods 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- 229940032147 starch Drugs 0.000 description 3
- 235000019698 starch Nutrition 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 239000000829 suppository Substances 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 238000001890 transfection Methods 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- 206010005949 Bone cancer Diseases 0.000 description 2
- 208000018084 Bone neoplasm Diseases 0.000 description 2
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 2
- 206010007710 Cartilage injury Diseases 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- 229920003134 Eudragit® polymer Polymers 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- 201000005569 Gout Diseases 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 102000002274 Matrix Metalloproteinases Human genes 0.000 description 2
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 2
- 241000713869 Moloney murine leukemia virus Species 0.000 description 2
- 101000931108 Mus musculus DNA (cytosine-5)-methyltransferase 1 Proteins 0.000 description 2
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 2
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 2
- 241000714474 Rous sarcoma virus Species 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 108091081024 Start codon Proteins 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 239000012503 blood component Substances 0.000 description 2
- 210000002805 bone matrix Anatomy 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 2
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 2
- 125000002091 cationic group Chemical group 0.000 description 2
- 238000004132 cross linking Methods 0.000 description 2
- 230000002950 deficient Effects 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- XPPKVPWEQAFLFU-UHFFFAOYSA-J diphosphate(4-) Chemical compound [O-]P([O-])(=O)OP([O-])([O-])=O XPPKVPWEQAFLFU-UHFFFAOYSA-J 0.000 description 2
- 235000011180 diphosphates Nutrition 0.000 description 2
- 230000003828 downregulation Effects 0.000 description 2
- 239000003995 emulsifying agent Substances 0.000 description 2
- 238000001476 gene delivery Methods 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 229910052500 inorganic mineral Inorganic materials 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 238000011813 knockout mouse model Methods 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 208000037819 metastatic cancer Diseases 0.000 description 2
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- 235000010981 methylcellulose Nutrition 0.000 description 2
- 238000013508 migration Methods 0.000 description 2
- 230000005012 migration Effects 0.000 description 2
- 239000011707 mineral Substances 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 239000008194 pharmaceutical composition Substances 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 239000008223 sterile water Substances 0.000 description 2
- 238000010254 subcutaneous injection Methods 0.000 description 2
- 239000007929 subcutaneous injection Substances 0.000 description 2
- 230000002195 synergetic effect Effects 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 241000701161 unidentified adenovirus Species 0.000 description 2
- 229960005486 vaccine Drugs 0.000 description 2
- 239000013603 viral vector Substances 0.000 description 2
- OPCHFPHZPIURNA-MFERNQICSA-N (2s)-2,5-bis(3-aminopropylamino)-n-[2-(dioctadecylamino)acetyl]pentanamide Chemical compound CCCCCCCCCCCCCCCCCCN(CC(=O)NC(=O)[C@H](CCCNCCCN)NCCCN)CCCCCCCCCCCCCCCCCC OPCHFPHZPIURNA-MFERNQICSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 208000009746 Adult T-Cell Leukemia-Lymphoma Diseases 0.000 description 1
- 208000016683 Adult T-cell leukemia/lymphoma Diseases 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- 150000008574 D-amino acids Chemical class 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 208000006367 Essential Osteolysis Diseases 0.000 description 1
- 208000006168 Ewing Sarcoma Diseases 0.000 description 1
- 208000009386 Experimental Arthritis Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 229920002683 Glycosaminoglycan Polymers 0.000 description 1
- 208000019683 Gorham-Stout disease Diseases 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 244000043261 Hevea brasiliensis Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 241000701024 Human betaherpesvirus 5 Species 0.000 description 1
- 206010020707 Hyperparathyroidism primary Diseases 0.000 description 1
- 102000000589 Interleukin-1 Human genes 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 102000004889 Interleukin-6 Human genes 0.000 description 1
- 206010023203 Joint destruction Diseases 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 208000010191 Osteitis Deformans Diseases 0.000 description 1
- 208000027868 Paget disease Diseases 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 206010036030 Polyarthritis Diseases 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 201000000981 Primary Hyperparathyroidism Diseases 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 102000016611 Proteoglycans Human genes 0.000 description 1
- 108010067787 Proteoglycans Proteins 0.000 description 1
- 108091030071 RNAI Proteins 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- 241000700584 Simplexvirus Species 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 102000007591 Tartrate-Resistant Acid Phosphatase Human genes 0.000 description 1
- 108010032050 Tartrate-Resistant Acid Phosphatase Proteins 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 208000035896 Twin-reversed arterial perfusion sequence Diseases 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- GAMPNQJDUFQVQO-UHFFFAOYSA-N acetic acid;phthalic acid Chemical compound CC(O)=O.OC(=O)C1=CC=CC=C1C(O)=O GAMPNQJDUFQVQO-UHFFFAOYSA-N 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 201000006966 adult T-cell leukemia Diseases 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 235000010419 agar Nutrition 0.000 description 1
- 239000011543 agarose gel Substances 0.000 description 1
- 108010003059 aggrecanase Proteins 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 230000010072 bone remodeling Effects 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 230000003848 cartilage regeneration Effects 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 210000001612 chondrocyte Anatomy 0.000 description 1
- 238000012411 cloning technique Methods 0.000 description 1
- 239000013599 cloning vector Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 239000000306 component Substances 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- XEYBRNLFEZDVAW-ARSRFYASSA-N dinoprostone Chemical compound CCCCC[C@H](O)\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1C\C=C/CCCC(O)=O XEYBRNLFEZDVAW-ARSRFYASSA-N 0.000 description 1
- 229960002986 dinoprostone Drugs 0.000 description 1
- 230000006806 disease prevention Effects 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- MOTZDAYCYVMXPC-UHFFFAOYSA-N dodecyl hydrogen sulfate Chemical compound CCCCCCCCCCCCOS(O)(=O)=O MOTZDAYCYVMXPC-UHFFFAOYSA-N 0.000 description 1
- 229940043264 dodecyl sulfate Drugs 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 239000013583 drug formulation Substances 0.000 description 1
- 210000003162 effector t lymphocyte Anatomy 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 239000002702 enteric coating Substances 0.000 description 1
- 238000009505 enteric coating Methods 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 239000007888 film coating Substances 0.000 description 1
- 238000009501 film coating Methods 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 230000009368 gene silencing by RNA Effects 0.000 description 1
- 125000000404 glutamine group Chemical group N[C@@H](CCC(N)=O)C(=O)* 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 229960005150 glycerol Drugs 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000003978 infusion fluid Substances 0.000 description 1
- 239000003999 initiator Substances 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 239000000644 isotonic solution Substances 0.000 description 1
- 208000018937 joint inflammation Diseases 0.000 description 1
- 210000005067 joint tissue Anatomy 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 229960004393 lidocaine hydrochloride Drugs 0.000 description 1
- YECIFGHRMFEPJK-UHFFFAOYSA-N lidocaine hydrochloride monohydrate Chemical compound O.[Cl-].CC[NH+](CC)CC(=O)NC1=C(C)C=CC=C1C YECIFGHRMFEPJK-UHFFFAOYSA-N 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- 239000001095 magnesium carbonate Substances 0.000 description 1
- 229910000021 magnesium carbonate Inorganic materials 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 208000027202 mammary Paget disease Diseases 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 238000002715 modification method Methods 0.000 description 1
- 238000001823 molecular biology technique Methods 0.000 description 1
- 210000004487 mononuclear osteoclast Anatomy 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 210000005088 multinucleated cell Anatomy 0.000 description 1
- 210000001721 multinucleated osteoclast Anatomy 0.000 description 1
- 229920003052 natural elastomer Polymers 0.000 description 1
- 229920001194 natural rubber Polymers 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 230000011164 ossification Effects 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 229920001277 pectin Polymers 0.000 description 1
- 239000001814 pectin Substances 0.000 description 1
- 235000010987 pectin Nutrition 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 208000028169 periodontal disease Diseases 0.000 description 1
- 239000008024 pharmaceutical diluent Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 229920001515 polyalkylene glycol Polymers 0.000 description 1
- 208000030428 polyarticular arthritis Diseases 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229950008882 polysorbate Drugs 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 235000019422 polyvinyl alcohol Nutrition 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- XEYBRNLFEZDVAW-UHFFFAOYSA-N prostaglandin E2 Natural products CCCCCC(O)C=CC1C(O)CC(=O)C1CC=CCCCC(O)=O XEYBRNLFEZDVAW-UHFFFAOYSA-N 0.000 description 1
- 230000009993 protective function Effects 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 238000001243 protein synthesis Methods 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 238000000163 radioactive labelling Methods 0.000 description 1
- 230000009103 reabsorption Effects 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 108091006084 receptor activators Proteins 0.000 description 1
- 108700015048 receptor decoy activity proteins Proteins 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 229920003109 sodium starch glycolate Polymers 0.000 description 1
- 229940079832 sodium starch glycolate Drugs 0.000 description 1
- 239000008109 sodium starch glycolate Substances 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 210000002437 synoviocyte Anatomy 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000010474 transient expression Effects 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 210000001215 vagina Anatomy 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/1793—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Physical Education & Sports Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Rheumatology (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Cell Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Epidemiology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Pain & Pain Management (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
本発明によりTSG−6が破骨細胞による骨吸収を抑制することが示された。破骨細胞は単核白血球マクロファージ系列に由来する大型の多核細胞であり、骨吸収の過程で骨の基質及び鉱物質を分解する。本発明者らは更に、TSG−6ノックアウトマウスにおけるTSG−6の不在が破骨細胞による骨吸収の増加をもたらすことを示した。本発明者らは、TSG−6が破骨細胞による骨吸収に伴う骨疾患又は状態の治療又は予防に有用であることを示した。本発明者らは更に、TSG−6を併用するオステオプロテゲリン(OPG)の投与が相乗的な結果を生ずることを示した。TSG−6及びOPGの併用は、破骨細胞による骨吸収を各要素単独の場合の和より大きく抑制した。
破骨細胞による骨吸収に伴う疾病又は状態を治療又は予防する薬品の製造における、
(a)TSG−6ポリペプチド、若しくはTSG−6ポリペプチドをコードするポリヌクレオチド;及び
(b)OPGポリペプチド、OPGポリペプチドをコードするポリヌクレオチド若しくはOPG模倣体の使用、
破骨細胞による骨吸収に伴う疾病又は状態の治療又は予防における、同時、個別又は逐次的な使用のための、
(a)TSG−6ポリペプチド、又はTSG−6ポリペプチドをコードするポリヌクレオチド;及び
(b)OPGポリペプチド、OPGポリペプチドをコードするポリヌクレオチド又はOPG模倣体;を含有する製剤、並びに
破骨細胞による骨吸収に伴う疾病又は状態を、
(a)TSG−6ポリペプチド、又はTSG−6ポリペプチドをコードするポリヌクレオチド;又は
(b)OPGポリペプチド、又はOPGポリペプチドをコードするポリヌクレオチド又はOPG模倣体;を同時、個別又は逐次的に投与し、併用して治療するための薬品の製造における、
(a)又は(b)の使用;
を提供する。
本発明は、破骨細胞による骨吸収に伴う骨疾病又は状態を治療又は予防する方法を提供するが、その方法は、治療上又は予防上に有効な量のTSG−6ポリペプチド又はTSG−6ポリペプチドをコードするポリヌクレオチドを対象に投与することを含む。更に好ましい態様においては、その方法は、更に治療上又は予防上有効な量のOPGポリペプチド、OPGポリペプチドをコードするポリヌクレオチド又はOPG模倣体を前記対象(者)に投与することを含む。
TSG−6ポリペプチドは、好ましくはヒトTSG−6、若しくはRANKL結合活性を保つヒトTSG−6の変異体又は断片である。前記TSG−6ポリペプチドは破骨細胞による骨吸収を抑制する能力がある。前記変異体は霊長類、マウス又はラット等他の生物由来のTSG−6ポリペプチドであってもよい。
(a)配列番号2若しくは5のアミノ酸配列;
(b)前記配列番号2若しくは5のアミノ酸配列と少なくとも50%の同一性を有し、NFκB受容体活性化因子(RANKL)との結合活性を有する(a)の変異体;又は、
(c)RANKLとの結合活性を有する(a)若しくは(b)の断片を含む。
(a)配列番号3若しくは6のアミノ酸配列;
(b)前記配列番号3若しくは6のアミノ酸配列と少なくとも50%の同一性を有し、RANKL結合活性を有する変異体;又は、
(c)RANKLとの結合活性を有する(a)若しくは(b)の断片を含む。
(a)配列番号7のアミノ酸配列;
(b)配列番号7のアミノ酸配列と少なくとも50%の同一性を保ち、RANKLとの結合活性を有する配列番号7のアミノ酸配列の変異体;又は
(c)RANKLとの結合活性を有する(a)若しくは(b)の断片を含む。
(a)配列番号9のアミノ酸配列;
(b)配列番号9のアミノ酸配列と少なくとも50%の同一性を保ち、RANKLとの結合活性を有する配列番号9のアミノ酸配列の変異体;又は
(c)RANKLとの結合活性を有する(a)若しくは(b)の断片
を含む。
(a)配列番号10若しくは11のアミノ酸配列;
(b)配列番号10若しくは11のアミノ酸配列と少なくとも50%の同一性を保ち、RANKLとの結合活性を有する(a)の変異体;又は
(c)RANKLとの結合活性を有する(a)若しくは(b)の断片
を含む。
(a)配列番号13のアミノ酸配列;
(b)配列番号13のアミノ酸配列と少なくとも50%の同一性を保ち、RANKLとの結合活性を有する(a)の変異体;又は
(c)RANKLとの結合活性を有する(a)若しくは(b)の断片
を含む。
本発明に従って、TSG−6ポリペプチドをコードするポリヌクレオチド、変異体又は断片が破骨細胞による骨吸収に伴う疾病又は状態を治療し又は予防するために使用される。特に、前記ポリヌクレオチドは好ましくは、(a)配列番号1、4、8若しくは12のコーディング配列;(b)(a)に示された配列に対し遺伝コードの結果により縮重している配列;(c)(a)若しくは(b)に示された配列と少なくとも60%の同一性を有し、RANKLとの結合活性を有するポリペプチドをコードする配列;又は、(d)RANKLとの結合活性を有するポリペプチドをコードする、(a)、(b)若しくは(c)に示されるいずれか1の配列の断片;を含むか又はそれからなる。前記ポリヌクレオチドは好ましくは、(a)配列番号1、4、8若しくは12のコーディング配列;(b)(a)に示された配列に対し遺伝コードの結果により縮重している配列;(c)(a)若しくは(b)に示された配列と少なくとも60%の同一性を有し、破骨細胞による骨吸収を抑制する能力を有するポリペプチドをコードする配列;又は、(d)破骨細胞による骨吸収を抑制する能力を有するポリペプチドをコードする、(a)、(b)若しくは(c)に示されるいずれか1の配列の断片;を含むか又はそれからなる。
本発明の1の好ましい態様では、OPGポリペプチドは破骨細胞による骨吸収に伴う疾病又は状態を治療又は予防するためTSG−6と組み合わせて投与される。OPGポリペプチドは、好ましくはヒトOPG、又はRANKL結合活性を有するヒトOPGの変異体又は断片である。OPGポリペプチド破骨細胞による骨吸収を抑制する能力を有する。変異体は霊長類、マウス又はラット等の他の生物からのOPGポリペプチドであり得る。
(a)配列番号15のアミノ酸配列;
(b)配列番号15のアミノ酸配列と少なくとも50%の同一性を有する(a)の変異体でRANKL結合活性の受容体活性化因子を有する;又は
(d)RANKL結合活性を有する(a)若しくは(b)の断片
を含む。
本発明の好ましい1の態様では、OPGポリペプチドをコードするポリヌクレオチド、変異体又は断片は、TSG−6と併用して、破骨細胞による骨吸収に伴う疾病又は状態を治療又は予防するために投与される。特に、前記ポリヌクレオチドは好ましくは:(a)配列番号14のコーディング配列;(b)(a)に示された配列に対し遺伝コードの結果により縮重している配列;(c)(a)若しくは(b)に示された配列と少なくとも60%の同一性を有し、RANKLとの結合活性を有するポリペプチドをコードする配列;又は(d)RANKLとの結合活性を有するポリペプチドをコードする、(a)、(b)若しくは(c)に示されるいずれか1の配列の断片;を含むか又はそれからなる。 前記ポリヌクレオチドは好ましくは、(a)配列番号14のコーディング配列;(b)(a)に示された配列に対し遺伝コードの結果により縮重している配列;(c)(a)若しくは(b)に示された配列と少なくとも60%の同一性を有し、破骨細胞による骨吸収を抑制する能力を有するポリペプチドをコードする配列;又は、(d)破骨細胞による骨吸収を抑制する能力を有するポリペプチドをコードする、(a)、(b)若しくは(c)に示されるいずれか1の配列の断片;を含むか又はそれからなる。
本発明の好ましい1の態様においては、OPG模倣体はTSG−6と組み合わせて、破骨細胞による骨吸収に伴う疾病又は状態を治療又は予防するために投与される。OPG模倣体は、RANKLと結合することにより破骨細胞による骨吸収を抑制する要素である。
本発明に従って、TSG−6ポリペプチド、又はポリヌクレオチドは破骨細胞による骨吸収に伴う疾病又は状態を治療又は予防するために利用される。破骨細胞による骨吸収は破骨細胞による骨基質及び鉱物質の破壊である。破骨細胞による骨吸収に伴う疾病又は状態は破骨細胞による骨吸収率が異常となる疾病又は状態である。破骨細胞による骨吸収に伴う疾病又は状態は、破骨細胞が、前記疾病又は状態がみられない比較の対象者で観察される骨吸収(破壊)率よりも高い比率で再吸収(破壊)される疾病又は状態である。前記疾病又は状態は、破骨細胞による骨吸収率の増加を含む。
本発明は破骨細胞による骨吸収に伴う疾病又は状態を治療又は予防するためのTSG−6ポリペプチド及びポリヌクレオチドの使用を提供する。処置は治療的又は予防的であることができる。
状態の1又は2以上の症候の改善に効果的な量である。好ましくは、治療される前記個体はヒトである。
前記TSG−6ポリペプチド又はポリヌクレオチドは単独で又は薬学的に活性なエージェントと併用して投与され得る。1の態様においては、前記TSG−6ポリペプチド又はポリヌクレオチドは、長いペントラキシン3(PTX3)と併用して投与されない。同一の態様では、本発明に従って製造された薬品は、PTX3を含まない。
以下の実験は、TSG−6が骨再吸収の新規な抑制剤であることを示す。
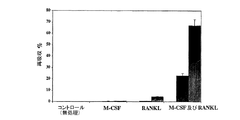
全長ヒトTSG−6タンパクのQ144アロタイプ(配列番号1に示す)をNentwich et al. (2002) J. Biol. Chem. 277, 15354-15362に記載のショウジョウバエS2細胞で発現させた。試験管内で破骨細胞の分化に及ぼすこの組換えタンパクの効果が測定された。ヒト単核白血球が破骨細胞に分化し、21日間で骨―再吸収表現型を展開した。破骨細胞の活性は象牙質スライス上の孔隙再吸収の程度により測定した。ヒト単核白血球はsRANKL(NFκBリガンドの可溶性受容体活性化因子;30ng/ml)及び/又はM−CSF(25ng/ml)の存在下で培養され、組換えTSG−6の存在又は不在下で骨再吸収活性が測定された。この培養システムへのTSG−6の付加は象牙質の劣化を実質的に低下させ(図1)、この効果は薬量に依存している(図2)。それ故、TSG−6は破骨細胞による骨吸収を抑制する。
実施例1と同様の実験がTSG−6-/-マウスの長骨からの破骨細胞前駆体を用いて実行された。sRANKL又はM−CSF及びsRANKLの存在下で培養すると、野生型のコントロール動物からの細胞に比較して、前記破骨細胞は試験管内の孔隙再吸収の顕著な増加を示した(図3)。これらの結果は、PGIAの導入に続くTSG−6―欠損動物にみられるより激しい症候(骨劣化等)においても普遍的である。これらの試験はTSG−6が破骨細胞生成及び/又は破骨細胞の活性化に対する重要で新規な抑制剤であることを示す。
RANKLとその受容体RANKは骨再構成の鍵となるレギュレータで、特にRAに起こる骨欠失と関連付けられていきた。RANKLは膜に結合したTNF−スーパーファミリーリガンドで、破骨細胞及びストローマ組織細胞により産生されるが、RANKは膜間シグナル分子で、単核破骨細胞前駆体の表面で発現する。RANKLは、PGE2、IL−1及びTNF等のカルシウム調節因子に対応してRANKと結合し、この交互作用は破骨細胞の分化を誘導するのみならず、成熟した破骨細胞の骨再吸収活性を促進する(Tanaka et al. (2005) Immunol. Rev. 208, 30-49に総説あり)。まさに、RANKL(M−CSFと組み合わせて)は破骨細胞の分化を制御する主要な因子である(Quinn et al. (1998) Endocrinology 139, 4424-4427)。
我々のデータ(未発表)によれば、OPG(公知のRANKL抑制剤)と組み合わせたTSG−6は培養により作製された酒石酸抵抗性酸ホスファターゼ(TRAP+)多核破骨細胞の数で測定された破骨細胞形成に対する抑制に協働効果を有することが示されている(すなわち、個々のタンパクが存在する実験に比較して、TSG−6とOPGの双方が存在する場合の方が破骨細胞形成がより強く抑制される)。TSG−6とOPGの前記協働効果を説明できる1の可能なメカニズムは、これら双方のタンパク質が安定な三つの要素から成る複合体を作って同時にRANKLと結合できることである。
更に、我々のデータ(未発表)は、単離されたLink及びCUB_C領域は全長タンパクよりも低い活性ではあるが、破骨細胞形成の抑制剤であることを示した。これは、これらのTSG−6の断片が骨再吸収の抑制剤を設計する基礎として利用できることを示す。
我々は種々の骨の不調(例えば、骨関節炎(OA)、リューマチ性関節炎(RA)、痛風及びピロ燐酸関節炎(PPA);図5参照)を患う患者の関節滑液中に高いレベルのTSG−6(0−200ng/ml)を測定した。OAの関節滑液中のTSG−6及びOPGレベルのELISA解析によれば、TSG−6タンパクのレベルにはOPGと比較して患者間に大きな変異が存在することが示された(図6参照)。これは、TSG−6の不在/低レベルが骨疾病の範囲と劇症度に貢献していることを示唆する。
配列番号1はヒトTSG−6の全長Q144アロタイプ変異体をコードする核酸配列を示す。
Claims (13)
- 骨粗鬆症の治療のための薬品の製造における、腫瘍壊死因子刺激遺伝子(TSG−6)ポリペプチド又はTSG−6ポリペプチドをコードするポリヌクレオチドの使用。
- 前記TSG−6ポリペプチドが、
(a)配列番号2のアミノ酸配列;
(b)前記配列番号2のアミノ酸配列と少なくとも97%の同一性を有し、NFκB受容体活性化因子(RANKL)との結合活性を有する(a)の変異体;又は、
(c)RANKLとの結合活性を有する(a)又は(b)の断片を含む、請求項1に記載の使用。 - 前記ポリペプチドが配列番号2、5、又は9に示す前記配列からなる、請求項2に記載の使用。
- 前記ポリヌクレオチドが、
(a)配列番号1若しくは8のコーディング配列;
(b)(a)に示された配列に対し遺伝コードの結果により縮重している配列;
(c)(a)若しくは(b)に示された配列と少なくとも99%の同一性を有し、RANKLとの結合活性を有するポリペプチドをコードする配列;又は、
(d)RANKLとの結合活性を有するポリペプチドをコードする、(a)、(b)若しくは(c)に示すいずれか1の配列の断片を含む、請求項1に記載の使用。 - 前記ポリヌクレオチドが配列番号1、4、又は8に示す核酸配列からなる、請求項4に記載の使用。
- 前記薬品が、薬学的若しくは予防医学的に有効な量のオステオプロテゲリン(Osteoprotegerin)(OPG)ポリペプチド、OPGポリペプチドをコードするポリヌクレオチド又は該OPGの模倣体であるAMG−162と併用して投与される、請求項1ないし5のいずれか1項に記載の使用。
- 前記OPGポリペプチドが、
(a)配列番号15のアミノ酸配列;
(b)配列番号15のアミノ酸配列と少なくとも99%の同一性を有し、RANKLとの結合活性を有する(a)の変異体;又は、
(c)RANKLとの結合活性を有する(a)若しくは(b)の断片を含む、請求項6に記載の使用。 - 前記OPGポリペプチドが配列番号15の前記配列からなる、請求項7に記載の使用。
- 前記OPGポリヌクレオチドが、
(a)配列番号14のコーディング配列、
(b)(a)に示された配列に対し遺伝コードの結果により縮重している配列;
(c)(a)若しくは(b)に示された配列と少なくとも99%の同一性を有し、RANKLとの結合活性を有するポリペプチドをコードする配列;又は、
(d)RANKLとの結合活性を有するポリペプチドをコードする、(a)、(b)若しくは(c)に示すいずれか1の配列の断片を含む、請求項6に記載の使用。 - 該TSG−6ポリペプチド又はポリヌクレオチドが長いペントラキシン3(PTX3)と併用して投与されない、請求項1ないし9のいずれか1項に記載の使用。
- 骨粗鬆症を治療又は予防する薬品の製造における、
(a)TSG−6ポリペプチド、又はTSG−6ポリペプチドをコードするポリヌクレオチド;及び
(b)OPGポリペプチド、OPGポリペプチドをコードするポリヌクレオチド又は該OPGの模倣体であるAMG−162;
の使用。 - 骨粗鬆症の治療又は予防における、同時、個別又は逐次的使用のための、
(a)TSG−6ポリペプチド、又はTSG−6ポリペプチドをコードするポリヌクレオチド;及び
(b)OPGポリペプチド、OPGポリペプチドをコードするポリヌクレオチド又は該OPGの模倣体であるAMG−162;を含有する製剤。 - (a)TSG−6ポリペプチド、若しくはTSG−6ポリペプチドをコードするポリヌクレオチド;又は
(b)OPGポリペプチド、若しくはOPGポリペプチドをコードするポリヌクレオチド若しくは該OPGの模倣体であるAMG−162のうちの1つ;
を同時、個別又は逐次的に投与し、(a)及び(b)の併用により骨粗鬆症を治療又は予防するための薬品の製造における、(a)及び(b)の使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0604460.6 | 2006-03-06 | ||
| GBGB0604460.6A GB0604460D0 (en) | 2006-03-06 | 2006-03-06 | Treatment |
| PCT/GB2007/000772 WO2007101988A2 (en) | 2006-03-06 | 2007-03-06 | Use of tsg-6 for treating bone diseases |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2009532334A JP2009532334A (ja) | 2009-09-10 |
| JP2009532334A5 JP2009532334A5 (ja) | 2010-05-20 |
| JP5346216B2 true JP5346216B2 (ja) | 2013-11-20 |
Family
ID=36219200
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008557821A Expired - Fee Related JP5346216B2 (ja) | 2006-03-06 | 2007-03-06 | 治療 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US9066908B2 (ja) |
| EP (1) | EP2001499B1 (ja) |
| JP (1) | JP5346216B2 (ja) |
| DK (1) | DK2001499T3 (ja) |
| ES (1) | ES2426196T3 (ja) |
| GB (1) | GB0604460D0 (ja) |
| WO (1) | WO2007101988A2 (ja) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2300624B1 (en) | 2008-05-29 | 2015-07-15 | The Regents of The University of California | Biomarkers for painful intervertebral discs and methods of use thereof |
| WO2015094846A2 (en) * | 2013-12-18 | 2015-06-25 | The Texas A&M University System | Treatment of gum diseases and gum disorders with tsg-6 protein |
| CN111273029B (zh) * | 2020-02-25 | 2023-03-31 | 芜湖天明生物技术有限公司 | rhTSG-6双抗体夹心ELISA法定量检测试剂盒及其使用方法和应用 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5194596A (en) * | 1989-07-27 | 1993-03-16 | California Biotechnology Inc. | Production of vascular endothelial cell growth factor |
| US5350836A (en) * | 1989-10-12 | 1994-09-27 | Ohio University | Growth hormone antagonists |
| WO1992012175A1 (en) | 1991-01-14 | 1992-07-23 | New York University | Cytokine-induced protein, tsg-6, dna coding therefor and uses thereof |
| EP0705842A2 (en) | 1994-10-06 | 1996-04-10 | Hoechst Aktiengesellschaft | Regulated genes by stimulation of chondrocytes with 1L-1beta |
| WO1997004075A1 (en) | 1995-07-20 | 1997-02-06 | New York University | Pharmaceutical compositions containing tsg-6 for treating inflammatory diseases and cancer-related pathologies and methods |
| EP1002132A4 (en) * | 1997-08-05 | 2005-04-27 | Human Genome Sciences Inc | HUMAN SECRETED PROTEINS |
| IL158152A0 (en) | 2001-04-03 | 2004-03-28 | Nestle Sa | Osteoprotegerin in milk |
| ITRM20030595A1 (it) * | 2003-12-23 | 2005-06-24 | Sigma Tau Ind Farmaceuti | Uso della ptx3 o di un suo derivato funzionale da sola o in associazione con tsg6 per il trattamento di patologie degenarative dell'osso o della cartilagine e per il trattamento della infertilita' femminile. |
-
2006
- 2006-03-06 GB GBGB0604460.6A patent/GB0604460D0/en not_active Ceased
-
2007
- 2007-03-06 JP JP2008557821A patent/JP5346216B2/ja not_active Expired - Fee Related
- 2007-03-06 EP EP07712838.7A patent/EP2001499B1/en not_active Not-in-force
- 2007-03-06 DK DK07712838.7T patent/DK2001499T3/da active
- 2007-03-06 ES ES07712838T patent/ES2426196T3/es active Active
- 2007-03-06 WO PCT/GB2007/000772 patent/WO2007101988A2/en active Application Filing
- 2007-03-06 US US12/281,920 patent/US9066908B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| WO2007101988A2 (en) | 2007-09-13 |
| EP2001499B1 (en) | 2013-06-05 |
| ES2426196T3 (es) | 2013-10-21 |
| WO2007101988A3 (en) | 2007-11-01 |
| US9066908B2 (en) | 2015-06-30 |
| EP2001499A2 (en) | 2008-12-17 |
| JP2009532334A (ja) | 2009-09-10 |
| US20090099084A1 (en) | 2009-04-16 |
| GB0604460D0 (en) | 2006-04-12 |
| DK2001499T3 (da) | 2013-09-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5822822B2 (ja) | Tnfファミリー受容体を標的とし、tnf作用を拮抗するペプチド、その組成物、方法および使用 | |
| Wang et al. | Extracellular role of HMGB1 in inflammation and sepsis | |
| AU2006256891B2 (en) | Use of the ideS proteinase (from s. pyogenes) for treating autoimmune diseases and graft rejection | |
| EP2892547B1 (en) | A dominant negative tnf-alpha inhibitor for use in treating neurological disorders of the cns | |
| KR20020084842A (ko) | Baff 수용체(bcma), 면역조절제 | |
| US20030171253A1 (en) | Methods and compositions relating to modulation of A20 | |
| US9878003B2 (en) | Method of treating bone disorders using TSG-6 | |
| CN110420331B (zh) | Alkbh5抑制物在治疗病毒感染性疾病中的应用 | |
| US20150139999A1 (en) | Interferon antagonists, antibodies thereto, and associated methods of use | |
| US9403891B2 (en) | Methods and compositions for modulating TNF/TNFR signaling | |
| JP5346216B2 (ja) | 治療 | |
| BG107685A (bg) | Хемокинови мутанти за лечение на мултиплена склероза | |
| JP2007517021A (ja) | 長いペントラキシンptx3の阻害剤を含む医薬 | |
| JP5014999B2 (ja) | 脱グリコシル化された長いペントラキシンptx3および脱シアル酸化された長いペントラキシンptx3 | |
| KR20190131068A (ko) | 인간화된 항-cxcr5 항체를 사용하는 루푸스의 치료 | |
| US20230129938A1 (en) | Methods of treating neurological diseases | |
| JP2005529099A (ja) | 改善された経口生物学的利用能を有するケモカイン変異体 | |
| Fisher | Experimental therapies in primary Sjögren’s syndrome | |
| WO2022056493A1 (en) | Biomarker driven methods for treating major depressive disorder | |
| CN114807134A (zh) | 一种负向调控炎性巨噬细胞活化的鼠源lncRNA及其应用 | |
| CN117838859A (zh) | Kat8抑制剂在制备治疗银屑病药物中的应用 | |
| WO2019038420A1 (en) | PHARMACEUTICAL COMPOSITIONS FOR THE TREATMENT OF OSTEOCLAST DISEASES |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20100227 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100303 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100303 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100329 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120612 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120912 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120920 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20121004 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20121012 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20121112 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20121119 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121212 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20121214 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20130219 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20130220 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20130220 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130619 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20130704 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130723 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130816 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 Ref document number: 5346216 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |