JP5114801B2 - 生体吸収性支持フレームを有するグラフト - Google Patents
生体吸収性支持フレームを有するグラフト Download PDFInfo
- Publication number
- JP5114801B2 JP5114801B2 JP2008532332A JP2008532332A JP5114801B2 JP 5114801 B2 JP5114801 B2 JP 5114801B2 JP 2008532332 A JP2008532332 A JP 2008532332A JP 2008532332 A JP2008532332 A JP 2008532332A JP 5114801 B2 JP5114801 B2 JP 5114801B2
- Authority
- JP
- Japan
- Prior art keywords
- medical device
- bioabsorbable
- support frame
- magnesium
- graft
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/04—Hollow or tubular parts of organs, e.g. bladders, tracheae, bronchi or bile ducts
- A61F2/06—Blood vessels
- A61F2/07—Stent-grafts
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/005—Ingredients of undetermined constitution or reaction products thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/02—Inorganic materials
- A61L31/022—Metals or alloys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L31/148—Materials at least partially resorbable by the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/82—Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/86—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure
- A61F2/89—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure the wire-like elements comprising two or more adjacent rings flexibly connected by separate members
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/82—Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/86—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure
- A61F2/90—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/82—Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/86—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure
- A61F2/90—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure
- A61F2/91—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure made from perforated sheet material or tubes, e.g. perforated by laser cuts or etched holes
- A61F2/915—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure made from perforated sheet material or tubes, e.g. perforated by laser cuts or etched holes with bands having a meander structure, adjacent bands being connected to each other
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/04—Hollow or tubular parts of organs, e.g. bladders, tracheae, bronchi or bile ducts
- A61F2/06—Blood vessels
- A61F2/07—Stent-grafts
- A61F2002/075—Stent-grafts the stent being loosely attached to the graft material, e.g. by stitching
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T156/00—Adhesive bonding and miscellaneous chemical manufacture
- Y10T156/10—Methods of surface bonding and/or assembly therefor
Description
本発明は、金属製生体吸収性材料を含む移植可能なフレームを具備する医療器具に関する。好ましい実施形態は、グラフト材料に取り付けられた移植可能な金属生体吸収性支持フレームを両方具備する医療器具に関する。最も好ましくは、グラフト材料は再構築可能な材料である。
第1の実施形態では、移植可能なフレームは、マグネシウム、チタン、ジルコニウム、ニオブ、タンタル、亜鉛およびケイ素からなる第1の群から選択される金属製生体吸収性材料を含む。また、第1の群から選択されるものを含む、金属製生体吸収性材料の混合物および合金も提供される。例えば、(特許文献1)(ボルツ(Bolz)ら)に記載されているように、亜鉛−チタン合金などの第1の群の材料の様々な合金を金属製生体吸収性材料として使用することもできる。
1.イットリウム3〜6%、希土類金属(例えば、ランタン)1〜5%;
2.イットリウム3.7〜4.3%、希土類金属(好ましくは、ランタン)2.4〜4.4%;
3.WE43(イットリウム3.7〜4.3%、ネオジム2.4〜4.4%、ジルコニウム0.4〜1.%、亜鉛0〜0.2%、およびマグネシウム残部);
4.イットリウム3.7〜5.5%、希土類金属(好ましくは、ランタン)1.5〜4.4%;
5.イットリウム4.0〜5.0%、希土類金属(好ましくは、ランタン)1.5〜4.0%;
6.イットリウム4.75〜5.50%、希土類金属(好ましくは、ランタン)1.5〜4.0%;
7.イットリウム3〜6%、希土類金属(好ましくは、ランタン)1〜5%、ネオジム2〜2.5%;
8.イットリウム3〜6%、希土類金属(好ましくは、ランタン)1〜5%、リチウム0.15〜2.00%、ジルコニウム0.4〜1.0%、亜鉛0.004〜0.200%;
9.イットリウム4.1%、ランタン3.1%、ネオジム2.2%、リチウム0.15%、ジルコニウム0.55%、亜鉛0.10%、マグネシウム91.6%;
10.イットリウム5.1%、ランタン2.8%、ネオジム2.0%、リチウム0.2%、ジルコニウム0.7%、亜鉛0.2%、およびマグネシウム90.8%;
11.ネオジム0〜5%、リチウム0〜40%、鉄0〜5%;
12.アルミニウム2〜5%、希土類金属(好ましくは、ネオジム)1〜4%、リチウム0〜12%;
13.アルミニウム2%、希土類金属(好ましくは、ネオジム)1%、リチウム6〜12%;
14.アルミニウム2〜4%、希土類金属(好ましくは、ネオジム)1〜2%、リチウム0〜8%;
15.アルミニウム8.5〜9.5%、亜鉛0.45〜0.90%、およびマンガン0.15〜0.40%;
16.アルミニウム4.5〜5.3%、希土類金属(好ましくは、ネオジム)0〜5%、リチウム30〜40%。
先に列挙した例示的組成物では、マグネシウムの量が特に表記されていない限り、組成物に任意の好適な量のマグネシウムを添加することができる。パーセンテージは全て、合金組成物の総重量に対する重量で計算されている。合金成分の好ましい重量パーセンテージがゼロを含む場合、合金中のその成分の存在は任意選択的である(即ち、「0%」では、成分は合金中に存在しない)。好ましくは、重量による組成物の残部はマグネシウムであるが、極微量の他の材料も添加してよい。好適な市販の生体吸収性マグネシウム金属合金としては、WE43、AZ91D、AM50A、AE42、およびAE21(アルミニウム原子2%および希土類元素Ce,Pr、Nd1%とマグネシウム)が挙げられる。
金属製生体吸収性材料に加えて、フレームは任意の数の生体吸収性ホモポリマー、コポリマー、又は生体吸収性ポリマーのブレンドから選択される生体吸収性材料を更に含むことができる。幾つかの実施形態では、医療器具フレームは、生体適合性生体吸収性ポリマー若しくはコポリマー;合成生体適合性非生体吸収性ポリマー若しくはコポリマー;又は、これらの組み合わせを含むことができる。一実施形態では、医療器具は、生体吸収性ポリマーでコーティングされた金属生体吸収性フレーム部分を備える。生体吸収性ポリマーコーティングは、金属製生体吸収性材料の溶解速度よりも速い速度で体内で溶解することができる。
任意に、支持フレーム又はグラフト材料は1種類以上の生理活性材料を含むことができる。冠状動脈血管形成術、腎動脈血管形成術、頚動脈手術、腎臓透析フィステル狭窄、又は脈管グラフト狭窄などの適応症を治療するように生理活性材料を選択することができる。投与される治療薬の最大用量は、炎症を効果的に抑制するか又は治癒作用を促進するが、望ましくない又は許容できない副作用を引き起こさない最大用量である。望ましくない副作用としては、臨床的に顕著な抗微生物又は抗菌作用、並びに毒性作用が挙げられる。例えば、約50mg/kg/日を超える用量は、ヒトを含むほとんどの哺乳類で副作用を生じる可能性がある。使用される1種類又は複数種類の生理活性剤の用量は、コーティング自体が生分解性であるかどうかに関わらず、その徐放性(time−release properties)を含むコーティングの特性、および他の特性に応じて変わる。また、使用される1種類又は複数種類の生理活性剤の用量は、効力、代謝経路、吸収の程度、半減期、および生理活性剤自体の排除機構に応じて変わる。いずれの場合も、施術者は当該分野の技術および知識を指針とし、本発明による実施形態は、特に制限されることなく、前述の現象を達成するのに有効な用量を含む。1種類又は複数種類の生理活性剤は、グラフト材料のマトリックス、グラフト材料および/又はフレームに塗布されたコーティング中への吸蔵により結合しても、共有結合によって結合しても、又はマイクロカプセル中に封入されてもよい。ある一定の実施形態では、1種類又は複数種類の生理活性剤は、マイクロスフェア(サイズがナノメートルからマイクロメートルの範囲にわたる)、ペースト、様々なサイズの糸、フィルムおよびスプレーなどの非カプセル配合物で提供される。ある一定の態様では、数時間、数日間、数ヶ月間にわたって1種類又は複数種類の生理活性剤を送達するようにコーティングを配合してもよい。例えば、7〜10日間にわたって1種類又は複数種類の生理活性剤を10%、20%、又は25%(w/v)より多く放出する「速放性(quick release)」又は「バースト(burst)」コーティングが提供される。他の実施形態では、7〜10日間にわたって生理活性剤を1%(w/v)未満放出する1種類又は複数種類の「徐放性(slow release)」生理活性剤が提供される。更に、本発明の1種類又は複数種類の生理活性剤は、好ましくは数ヶ月間安定で、且つ滅菌状態で製造され、滅菌状態に維持されることができなければならない。
を有する。
金属生体吸収性金属に加えて、支持フレームを他の金属又は非金属材料から形成しても又はそれらでコーティングしてもよい。幾つかの実施形態では、金属製生体吸収性材料でコーティングされた、ニチノール、コバルト−クロム又はステンレス鋼などの生体安定生体適合性金属から支持フレームを形成することができる。或いは、支持フレームの一部は、生体吸収性金属材料によって取り囲まれた又は部分的に被覆された金属生体吸収性金属材料のコア層を含むことができる。金属製生体吸収性材料と他の1種類以上の生体適合性材料との混合物から支持フレームを形成することもできる。
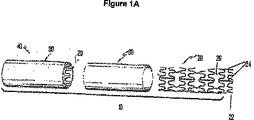
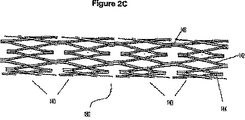
フレームは任意の好適な形状を有することができるが、好ましくはグラフト材料が身体脈管内で所望の形状又は向きに維持されるように付形され、又は構成される。幾つかの実施形態では、フレームは、任意の好適な構造又は向きを有し得る複数の相互接続された支柱およびベンドを備える。一実施形態では、フレームは、交互になっているベンドによって接続された複数の支柱を備える。例えば、フレームは、「ジグザグ」又はシヌソイド状パターンの一連の支柱を備えるシヌソイド状リング部材であってもよい。フレームはまた、例えば、リング部材を端と端を付けて接続することによる「ジグザグ」又はシヌソイド状パターンの、又は重なり合う方式の複数のリング部材と支柱を備えることもできる。幾つかの実施形態では、支柱は、支持フレームの長軸に実質的に平行に、管状の面の表面に沿って実質的に配置されている。図2Aは、蛇行した幾何学的形態に曲げられたワイヤフレームから形成された医療器具フレーム100の図である。図2Bは、編組された形状を有する第2の医療器具フレーム120を示す。図2Cは、ベンド又は接合部分144によって接続された複数の相互接続支柱142から形成された一連のフープ140を接合することによって形成された第4の医療器具フレーム130を示す。医療器具フレーム130は、長手方向の接続部材146によって接合された複数のフープ140を具備する。構成要素フレームに関して医療器具の選択された特徴を示すため、フレーム実施形態のある一定の非限定的例を本明細書に記載する。医療器具は、後述のフレーム実施形態、それらの組み合わせ、変形、又は部分、並びに他のフレーム形状を含むことができる。フレームに取り付けられたリーフレットを形成するのに好適な材料と組み合わせた様々なフレームを備える医療器具は、また、本発明の幾つかの実施形態の範囲に入る。好適なフレーム形状の他の例は、(特許文献30)および(特許文献31)(パウチュニック(Pavcnik))、および20003年11月25日に出願された(特許文献32);2003年8月15日に出願された(特許文献33);および、2002年11月14日に出願された(特許文献34)に記載されており、これらは全て参照によりその内容全体が本明細書に援用される。他の好適なフレーム構造は、(特許文献35);(特許文献36);(特許文献37);(特許文献38);(特許文献39);(特許文献40);(特許文献30);(特許文献41);(特許文献42);(特許文献43);(特許文献44);(特許文献45);(特許文献46);(特許文献47);(特許文献48);(特許文献49);(特許文献31);(特許文献50);(特許文献51);(特許文献52);(特許文献53);(特許文献54);(特許文献55);(特許文献56);(特許文献57);(特許文献58);(特許文献59);(特許文献60);(特許文献61);(特許文献62);(特許文献63);(特許文献64);(特許文献65);(特許文献66);(特許文献67);および(特許文献68)に開示されている移植可能なフレーム構造から選択することができ、これらは全てクック社(Cook Inc.)に譲渡されており、参照によりその内容全体が本明細書に援用される。これらのフレーム形状を本明細書に開示されている金属製生体吸収性材料から形成することができ、グラフト材料に取り付けることができる。好適な金属生体吸収性金属支持構造の一例は、ハーダー(Harder)らによって2003年11月11日に出願され、2004年5月20日に(特許文献3)として公開された(特許文献69)により提供されている。
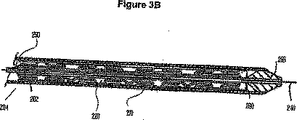
好ましくは、医療器具はフレームと、フレームに取り付けられた材料とを備えることができる。材料は、フレームの外(非ルーメン)面および/又は内(ルーメン)面に接触する1つ以上の管状グラフトを形成することができる。
任意の好適な方法でグラフト材料を支持フレームに取り付けることができる。例えば、熱および圧力を局所的に加えること、又は、接着剤として機能するグラフト材料の濃縮液を塗布することによりグラフト材料を支持フレームに溶接することができる。支持フレームの外側に配置された小さい材料片を使用してグラフトを支持フレームに取り付けてもよい。支持フレームのルーメン又は内面に配置されるグラフト材料を様々な方法で材料に結合させてもよい。これらには、縫合、接着および熱溶接がある。グラフト材料と外側スリーブの組み合わせの場合、同様にこれらの取り付け手段を使用してもよい。一実施形態では、スリーブとして形成されたグラフトを管状の支持フレームの一端又は両端上に延ばし、「カフ」を形成することができる。カフを支持フレームに縫い付けても、1つのカフから別のカフまで縫い付けても、又は、他の方法で支持フレーム若しくは支持フレームの他方側に配置された別のグラフトに結合させてもよい。ラッド(Lad)らによって2005年1月18日に出願され、(特許文献86)として公開され、参照により本明細書に援用される(特許文献85)は、縫合糸を使用してグラフト材料を支持フレームに取り付けるのに好適な様々なグラフト取り付け構造を開示している。
更に別の実施形態は、本明細書に記載の1つ以上の支持フレームを移植する工程を含む、被験者(動物であっても又はヒトであってもよい)の治療方法を提供する。他の方法は、本明細書に記載の1つ以上のグラフト部材に取り付けられた1つ以上のフレームを移植する工程を更に含む。幾つかの実施形態では、治療方法はまた、身体脈管内の治療箇所に医療器具を送達する工程又は治療箇所で医療器具を配備する工程を含んでもよい。
Claims (18)
- ステンレス鋼、コバルト−クロム合金及びニッケル−チタン合金の群から選択されたコア材料及び該コア材料を少なくとも部分的に囲む生体吸収性合金を含む支持フレームと、
グラフト材料と
を備え、
前記支持フレームがグラフト材料に取り付けられて管状のルーメンを画定し、
前記グラフト材料が細胞外マトリックス材料を含み、該細胞外マトリックス材料が、細胞浸潤及び脈管再生を生じる再構築可能な材料とされている、身体脈管内に移植される医療器具。 - 前記生体吸収性合金が、マグネシウム、チタン、ジルコニウム、ニオブ、タンタル、亜鉛およびケイ素からなる第1の群から選択される材料を含む、請求項1に記載の医療器具。
- 前記生体吸収性合金が、マグネシウムおよび1種類以上の金属を含む、請求項1に記載の医療器具。
- 前記生体吸収性合金が、マグネシウム、チタン、ジルコニウム、ニオブ、タンタル、亜鉛、およびケイ素からなる第1の群から選択される第1の金属と、リチウム、ナトリウム、カリウム、カルシウム、鉄、およびマンガンからなる群から選択される第2の金属とを含む、請求項3に記載の医療器具。
- 前記生体吸収性合金が、リチウム−マグネシウム、ナトリウム−マグネシウム、および亜鉛−チタンからなる群から選択される、請求項3に記載の医療器具。
- 前記生体吸収性合金が金を更に含む、請求項3に記載の医療器具。
- 前記生体吸収性合金がマグネシウムを少なくとも90%含む、請求項1に記載の医療器具。
- 前記生体吸収性合金が更に、イットリウムを約3.7%〜5.5%含む、請求項7に記載の医療器具。
- 前記生体吸収性合金が更に、希土類材料を約1.5%〜4.4%含む、請求項8に記載の医療器具。
- 前記生体吸収性合金が、イットリウム0.7〜4.3%、希土類金属2.4〜4.4%、ジルコニウムおよびマグネシウムが少なくとも0.4%からなり、前記希土類金属がネオジム2.0〜2.5%を含む、請求項1に記載の医療器具。
- 前記支持フレームが径方向に圧縮された形状から径方向に拡張された形状に可動であり、前記医療器具の前記径方向に拡張された状態の直径が少なくとも約4mmである、請求項1に記載の医療器具。
- 前記支持フレームが約1〜10%の弾性リコイルを有する、請求項1に記載の医療器具。
- 前記生体吸収性合金が、マグネシウムと、アルミニウム約0.1%〜約2%を含む、請求項2に記載の医療器具。
- 前記生体吸収性合金が更に、希土類金属を最大約1%まで含む、請求項13に記載の医療器具。
- 前記グラフト材料が小腸粘膜下組織を含む、請求項1に記載の医療器具。
- 前記グラフト材料が、約10ミクロン〜100ミクロンのサイズの複数の穴を画定する穿孔された部位を有する、請求項1に記載の医療器具。
- 前記生体吸収性合金が、マグネシウム及び、チタン、ジルコニウム、ニオブ、タンタル、亜鉛、イットリウムおよびケイ素からなる群から選択される1種類以上の金属を含有する第1の生体吸収性合金を含み、前記生体吸収性合金が更に、アルミニウム、リチウム、ナトリウム、カリウム、カルシウム、鉄、金、マンガン、ランタン、セリウム、プラセオジム、ネオジム、プロメチウム、サマリウム、ユーロピウム、ガドリニウム、テルビウム、ジスプロシウム、ホルミウム、エルビウム、ツリウム、イッテルビウム、およびルテチウムからなる群から選択される少なくとも1種類の金属を含み、前記支持フレームが約1〜10%の弾性リコイルを有し、前記グラフト材料が細胞外マトリックス材料と生理活性剤を含む、請求項1に記載の医療器具。
- 前記細胞外マトリックス材料が複数の孔を有する請求項1に記載の医療器具。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US71856705P | 2005-09-19 | 2005-09-19 | |
| US60/718,567 | 2005-09-19 | ||
| PCT/US2006/036578 WO2007035791A2 (en) | 2005-09-19 | 2006-09-19 | Graft with bioabsorbable support frame |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2009508644A JP2009508644A (ja) | 2009-03-05 |
| JP2009508644A5 JP2009508644A5 (ja) | 2009-11-05 |
| JP5114801B2 true JP5114801B2 (ja) | 2013-01-09 |
Family
ID=37807858
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008532332A Active JP5114801B2 (ja) | 2005-09-19 | 2006-09-19 | 生体吸収性支持フレームを有するグラフト |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US8663308B2 (ja) |
| EP (1) | EP1942833B1 (ja) |
| JP (1) | JP5114801B2 (ja) |
| AU (1) | AU2006292237B2 (ja) |
| CA (1) | CA2623123C (ja) |
| WO (1) | WO2007035791A2 (ja) |
Families Citing this family (59)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2002345328A1 (en) | 2001-06-27 | 2003-03-03 | Remon Medical Technologies Ltd. | Method and device for electrochemical formation of therapeutic species in vivo |
| US20050131520A1 (en) | 2003-04-28 | 2005-06-16 | Zilla Peter P. | Compliant blood vessel graft |
| US7998188B2 (en) | 2003-04-28 | 2011-08-16 | Kips Bay Medical, Inc. | Compliant blood vessel graft |
| WO2004096095A2 (en) | 2003-04-28 | 2004-11-11 | Medtronic, Inc. | Compliant venous graft |
| US8840660B2 (en) | 2006-01-05 | 2014-09-23 | Boston Scientific Scimed, Inc. | Bioerodible endoprostheses and methods of making the same |
| US8089029B2 (en) | 2006-02-01 | 2012-01-03 | Boston Scientific Scimed, Inc. | Bioabsorbable metal medical device and method of manufacture |
| DE102006042313A1 (de) * | 2006-09-06 | 2008-03-27 | Biotronik Vi Patent Ag | Biokorrodierbares metallisches Implantat mit einer Beschichtung oder Kavitätenfüllung aus Gelatine |
| WO2008034013A2 (en) | 2006-09-15 | 2008-03-20 | Boston Scientific Limited | Medical devices and methods of making the same |
| EP2068782B1 (en) | 2006-09-15 | 2011-07-27 | Boston Scientific Limited | Bioerodible endoprostheses |
| US8128689B2 (en) | 2006-09-15 | 2012-03-06 | Boston Scientific Scimed, Inc. | Bioerodible endoprosthesis with biostable inorganic layers |
| WO2008034047A2 (en) | 2006-09-15 | 2008-03-20 | Boston Scientific Limited | Endoprosthesis with adjustable surface features |
| JP2010503482A (ja) | 2006-09-18 | 2010-02-04 | ボストン サイエンティフィック リミテッド | 内部人工器官 |
| WO2008083190A2 (en) | 2006-12-28 | 2008-07-10 | Boston Scientific Limited | Bioerodible endoprostheses and methods of making same |
| EP2121062B1 (en) * | 2007-03-07 | 2020-05-06 | Coloplast A/S | Fistula plug comprising ecm |
| US9066993B2 (en) * | 2007-05-10 | 2015-06-30 | Cormatrix Cardiovascular, Inc. | Extracellular matrix encasement structures and methods |
| US9283302B2 (en) | 2011-12-16 | 2016-03-15 | Cormatrix Cardiovascular, Inc. | Extracellular matrix encasement structures and methods |
| WO2009047598A2 (en) * | 2007-05-18 | 2009-04-16 | Fernando Briceno Rincon | Tissue regenerator device based on collagen and process for the production of this device |
| DK2000551T3 (da) * | 2007-05-28 | 2011-01-10 | Acrostak Corp Bvi | Magnesium-baserede legeringer |
| US9034007B2 (en) | 2007-09-21 | 2015-05-19 | Insera Therapeutics, Inc. | Distal embolic protection devices with a variable thickness microguidewire and methods for their use |
| US8118857B2 (en) | 2007-11-29 | 2012-02-21 | Boston Scientific Corporation | Medical articles that stimulate endothelial cell migration |
| US7998192B2 (en) | 2008-05-09 | 2011-08-16 | Boston Scientific Scimed, Inc. | Endoprostheses |
| WO2010003442A2 (de) * | 2008-07-07 | 2010-01-14 | Syntellix Ag | Endoprothese zur implantation in den menschlichen oder tierischen körper |
| US7985252B2 (en) | 2008-07-30 | 2011-07-26 | Boston Scientific Scimed, Inc. | Bioerodible endoprosthesis |
| US9119906B2 (en) * | 2008-09-24 | 2015-09-01 | Integran Technologies, Inc. | In-vivo biodegradable medical implant |
| US8382824B2 (en) | 2008-10-03 | 2013-02-26 | Boston Scientific Scimed, Inc. | Medical implant having NANO-crystal grains with barrier layers of metal nitrides or fluorides |
| DE102008054920A1 (de) * | 2008-12-18 | 2010-07-01 | Biotronik Vi Patent Ag | Implantat sowie Verfahren zur Herstellung einer Schichtstruktur |
| US8267992B2 (en) | 2009-03-02 | 2012-09-18 | Boston Scientific Scimed, Inc. | Self-buffering medical implants |
| US20120283510A1 (en) * | 2009-12-31 | 2012-11-08 | Ams Research Corporation | Pelvic Implants having Perimeter Imaging Features |
| WO2011119573A1 (en) | 2010-03-23 | 2011-09-29 | Boston Scientific Scimed, Inc. | Surface treated bioerodible metal endoprostheses |
| EP2550032B1 (en) * | 2010-03-25 | 2013-11-20 | Biotronik AG | Implant made of a biodegradable magnesium alloy |
| US8888841B2 (en) | 2010-06-21 | 2014-11-18 | Zorion Medical, Inc. | Bioabsorbable implants |
| EP2598181B1 (en) * | 2010-07-31 | 2021-04-21 | Cook Medical Technologies LLC | Collagenous tissue pocket for an implantable medical device, and manufacturing method therefor |
| WO2012075311A2 (en) | 2010-12-01 | 2012-06-07 | Zorion Medical, Inc. | Magnesium-based absorbable implants |
| CN103889474B (zh) * | 2011-08-15 | 2016-09-07 | Meko激光材料加工公司 | 镁合金和包含该镁合金的可吸收的支架 |
| DE102011082210A1 (de) | 2011-09-06 | 2013-03-07 | Syntellix Ag | Medizinisches Implantat für den menschlichen und tierischen Körper |
| ES2418848B1 (es) * | 2012-02-10 | 2014-04-30 | Universidad De Valladolid | Soportes para la regeneración, crecimiento y trasplante de células y tejidos |
| JP5959260B2 (ja) * | 2012-03-26 | 2016-08-02 | オリンパス株式会社 | マグネシウム合金製インプラントの加工方法 |
| DE102012007640A1 (de) * | 2012-04-18 | 2013-10-24 | Rheinisch-Westfälische Technische Hochschule Aachen | Stent und Stent-Implantationskatheter |
| JP2015536185A (ja) * | 2012-10-23 | 2015-12-21 | ゾリオン メディカル インコーポレイテッド | 完全吸収性の管腔内装具およびその製造方法 |
| US9883956B2 (en) * | 2012-10-31 | 2018-02-06 | W. L. Gore & Associates, Inc. | Post-implantation contractible or expandable devices and method of using and making the same |
| CN103110465B (zh) * | 2012-11-08 | 2015-02-25 | 江阴宝易德医疗科技有限公司 | 一种镁合金冠脉支架 |
| US20140172118A1 (en) | 2012-12-19 | 2014-06-19 | Cook Medical Technologies Llc | Bioactive Compositions, Bioactive Eluting Devices and Methods of Use Thereof |
| US8715314B1 (en) | 2013-03-15 | 2014-05-06 | Insera Therapeutics, Inc. | Vascular treatment measurement methods |
| US8679150B1 (en) | 2013-03-15 | 2014-03-25 | Insera Therapeutics, Inc. | Shape-set textile structure based mechanical thrombectomy methods |
| EP3620203A1 (en) | 2013-03-15 | 2020-03-11 | Insera Therapeutics, Inc. | Vascular treatment devices |
| US8715315B1 (en) | 2013-03-15 | 2014-05-06 | Insera Therapeutics, Inc. | Vascular treatment systems |
| JP2014240455A (ja) * | 2013-06-11 | 2014-12-25 | オリンパス株式会社 | 離型材スラリとインプラントの製造方法 |
| WO2015102850A2 (en) | 2014-01-02 | 2015-07-09 | Cook Medical Technologies Llc | Compositions, devices and methods for treating infections |
| US20150283308A1 (en) * | 2014-04-03 | 2015-10-08 | Cook Biotech, Incorporated | Endoluminal device and method of implanting same |
| CN103948453A (zh) * | 2014-04-21 | 2014-07-30 | 上海市第六人民医院 | 一种可降解镁合金覆膜支架及覆膜支架系统 |
| US9238090B1 (en) | 2014-12-24 | 2016-01-19 | Fettech, Llc | Tissue-based compositions |
| CN108697423A (zh) | 2016-02-16 | 2018-10-23 | 伊瑟拉医疗公司 | 抽吸装置和锚定的分流装置 |
| US20190175326A1 (en) * | 2016-08-25 | 2019-06-13 | Mico Innovations, Llc | Neurovascular Stent |
| EP3576803A1 (en) | 2017-02-03 | 2019-12-11 | Zorion Medical, Inc. | Wire-formed bio-absorbable implants and methods for assembly |
| US20190159913A1 (en) * | 2017-11-28 | 2019-05-30 | Covidien Lp | Colorectal stents |
| US10939990B2 (en) * | 2017-11-28 | 2021-03-09 | Medtronic Vascular, Inc. | Graft material having selectively advanced permeability structure and method |
| CN112672698A (zh) * | 2018-09-17 | 2021-04-16 | 实验室和人们有限公司 | 用于埋线疗法的线及包括其的用于埋线疗法的针具 |
| EP3911246A1 (en) | 2019-01-18 | 2021-11-24 | W.L. Gore & Associates, Inc. | Bioabsorbable medical devices |
| CN117412780A (zh) * | 2021-06-03 | 2024-01-16 | 百多力股份公司 | 具有可生物降解支撑结构的植入物 |
Family Cites Families (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4116731A (en) | 1976-08-30 | 1978-09-26 | Nina Mikhailovna Tikhova | Heat treated and aged magnesium-base alloy |
| IL94138A (en) * | 1990-04-19 | 1997-03-18 | Instent Inc | Device for the treatment of constricted fluid conducting ducts |
| US5693085A (en) | 1994-04-29 | 1997-12-02 | Scimed Life Systems, Inc. | Stent with collagen |
| WO1996004409A1 (en) | 1994-08-01 | 1996-02-15 | Franz Hehmann | Selected processing for non-equilibrium light alloys and products |
| CA2178541C (en) * | 1995-06-07 | 2009-11-24 | Neal E. Fearnot | Implantable medical device |
| US5865723A (en) | 1995-12-29 | 1999-02-02 | Ramus Medical Technologies | Method and apparatus for forming vascular prostheses |
| DK0925077T3 (da) | 1996-08-23 | 2003-12-08 | Cook Biotech Inc | Fremgangsmåde til opnåelse af en oprenset collagen-baseret matrice fra submucosavæv |
| DE19731021A1 (de) | 1997-07-18 | 1999-01-21 | Meyer Joerg | In vivo abbaubares metallisches Implantat |
| US6626939B1 (en) | 1997-12-18 | 2003-09-30 | Boston Scientific Scimed, Inc. | Stent-graft with bioabsorbable structural support |
| EP0966979B1 (de) | 1998-06-25 | 2006-03-08 | Biotronik AG | Implantierbare, bioresorbierbare Gefässwandstütze, insbesondere Koronarstent |
| US6395208B1 (en) | 1999-01-25 | 2002-05-28 | Atrium Medical Corporation | Method of making an expandable fluoropolymer device |
| US7637886B2 (en) | 1999-01-25 | 2009-12-29 | Atrium Medical Corporation | Expandable fluoropolymer device and method of making |
| US6312457B1 (en) * | 1999-04-01 | 2001-11-06 | Boston Scientific Corporation | Intraluminal lining |
| DE50107779D1 (de) | 2001-01-05 | 2006-03-02 | Jacqueline Yvonne Hausdorf | Durch korrosion abbaubare metallische medizinische implantate |
| US20020165601A1 (en) | 2001-05-04 | 2002-11-07 | Clerc Claude O. | Bioabsorbable stent-graft and covered stent |
| DE10163106A1 (de) | 2001-12-24 | 2003-07-10 | Univ Hannover | Medizinische Implantate, Prothesen, Protheseteile, medizinische Instrumente, Geräte und Hilfsmittel aus einem halogenid-modifizierten Magnesiumwerkstoff |
| US6939369B2 (en) | 2002-04-03 | 2005-09-06 | Cook Incorporated | Intraluminal graft assembly and vessel repair system |
| US20050202058A1 (en) | 2002-05-02 | 2005-09-15 | Hiles Michael C. | Cell-seeded extracellular matrix grafts |
| DE10237571A1 (de) | 2002-08-13 | 2004-02-26 | Biotronik Meß- und Therapiegeräte GmbH & Co. Ingenieurbüro Berlin | Endovaskuläres Implantat mit aktiver Beschichtung |
| DE10237572A1 (de) | 2002-08-13 | 2004-02-26 | Biotronik Meß- und Therapiegeräte GmbH & Co. Ingenieurbüro Berlin | Stent mit polymerer Beschichtung |
| US7550004B2 (en) * | 2002-08-20 | 2009-06-23 | Cook Biotech Incorporated | Endoluminal device with extracellular matrix material and methods |
| JP2005052419A (ja) * | 2003-08-05 | 2005-03-03 | National Cardiovascular Center | ステント |
| US20060136047A1 (en) | 2002-09-06 | 2006-06-22 | Obermiller F J | Tissue graft prosthesis devices containing juvenile or small diameter submucosa |
| DE10253634A1 (de) | 2002-11-13 | 2004-05-27 | Biotronik Meß- und Therapiegeräte GmbH & Co. Ingenieurbüro Berlin | Endoprothese |
| DE10261822A1 (de) | 2002-12-20 | 2004-07-01 | Biotronik Meß- und Therapiegeräte GmbH & Co. Ingenieurbüro Berlin | Helix-Steg-Verbindung |
| US8734501B2 (en) | 2003-10-10 | 2014-05-27 | Cook Medical Technologies Llc | Composite stent graft |
| JP4887159B2 (ja) | 2004-01-20 | 2012-02-29 | クック・インコーポレイテッド | 腔内人工器官装置およびその形成方法 |
| DE102004026104A1 (de) | 2004-05-25 | 2005-12-15 | Restate Patent Ag | Implantat zur Gefäßligatur |
| DE102004044679A1 (de) | 2004-09-09 | 2006-03-16 | Biotronik Vi Patent Ag | Implantat mit geringer Radialfestigkeit |
| JP2006167078A (ja) * | 2004-12-15 | 2006-06-29 | Terumo Corp | 医療用インプラント |
| US20070050009A1 (en) * | 2005-08-30 | 2007-03-01 | Aiden Flanagan | Bioabsorbable stent |
-
2006
- 2006-09-18 US US11/522,835 patent/US8663308B2/en active Active
- 2006-09-19 WO PCT/US2006/036578 patent/WO2007035791A2/en active Search and Examination
- 2006-09-19 CA CA2623123A patent/CA2623123C/en active Active
- 2006-09-19 AU AU2006292237A patent/AU2006292237B2/en not_active Ceased
- 2006-09-19 JP JP2008532332A patent/JP5114801B2/ja active Active
- 2006-09-19 EP EP06814993.9A patent/EP1942833B1/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| EP1942833A2 (en) | 2008-07-16 |
| AU2006292237B2 (en) | 2012-01-12 |
| CA2623123A1 (en) | 2007-03-29 |
| US8663308B2 (en) | 2014-03-04 |
| CA2623123C (en) | 2014-03-25 |
| EP1942833B1 (en) | 2019-03-06 |
| AU2006292237A1 (en) | 2007-03-29 |
| US20100262221A1 (en) | 2010-10-14 |
| WO2007035791A3 (en) | 2007-05-10 |
| WO2007035791A2 (en) | 2007-03-29 |
| JP2009508644A (ja) | 2009-03-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5114801B2 (ja) | 生体吸収性支持フレームを有するグラフト | |
| Peng et al. | Role of polymers in improving the results of stenting in coronary arteries | |
| JP5932073B2 (ja) | ステントの分解を調節し、pHを中性に維持するためのコーティングを有する吸収性ステント | |
| US7846199B2 (en) | Remodelable prosthetic valve | |
| JP5425364B2 (ja) | 分解コントロールおよびpH中性維持のためのコーティングを含む吸収性ステント | |
| US20110313502A1 (en) | Composite vascular prosthesis | |
| US9254350B2 (en) | Implantable medical devices having bioabsorbable primer polymer coatings | |
| JP5602432B2 (ja) | 経皮的冠動脈インターベンション用の多剤溶出冠動脈ステント | |
| EP1765220A2 (en) | Implantable device for drug delivery and improved visibility | |
| JP4588986B2 (ja) | 体内埋込医療器具 | |
| Im et al. | Current status and future direction of metallic and polymeric materials for advanced vascular stents | |
| Sutton et al. | Titanium-nickel intravascular endoprosthesis: a 2-year study in dogs | |
| Patel et al. | Current status and future prospects of drug eluting stents for restenosis/Sadašnjost i budućnost stentova za restenozu koji otpuštaju lijekove | |
| JP2021515690A (ja) | 生体吸収性の逸流足場 | |
| US20120150282A1 (en) | Implant having a paclitaxel-releasing coating | |
| EP2034927A2 (en) | Medical devices including composites | |
| JP2010155095A (ja) | 体内埋込医療器具 | |
| JP4886939B2 (ja) | 生体内留置用ヨウ素放出性治療材料およびステント | |
| WO2007112025A2 (en) | Composite vascular prosthesis | |
| Banerjee | Biodegradabable [sic] endovascular stents: fulfilling the mission and then stepping away | |
| Grigioni et al. | E DIASTAT VASCULAR ACCEss GRAT pop | |
| PATEL et al. | Sadašnjost i budućnost stentova za restenozu koji otpuštaju lijekove | |
| Kibbe et al. | Lio| uid Cast Arterial Stents: Stents oi the Future |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090911 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090911 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20111006 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20111018 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120116 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120123 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120216 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120223 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120316 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120326 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120418 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120918 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20120918 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120927 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 Ref document number: 5114801 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20151026 Year of fee payment: 3 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |