JP5101288B2 - アプタマー調節される核酸及びその利用 - Google Patents
アプタマー調節される核酸及びその利用 Download PDFInfo
- Publication number
- JP5101288B2 JP5101288B2 JP2007534921A JP2007534921A JP5101288B2 JP 5101288 B2 JP5101288 B2 JP 5101288B2 JP 2007534921 A JP2007534921 A JP 2007534921A JP 2007534921 A JP2007534921 A JP 2007534921A JP 5101288 B2 JP5101288 B2 JP 5101288B2
- Authority
- JP
- Japan
- Prior art keywords
- nucleic acid
- aptamer
- ligand
- cell
- expression
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 108091023037 Aptamer Proteins 0.000 title claims abstract description 410
- 150000007523 nucleic acids Chemical class 0.000 title claims abstract description 355
- 108020004707 nucleic acids Proteins 0.000 title claims abstract description 350
- 102000039446 nucleic acids Human genes 0.000 title claims abstract description 349
- 230000001105 regulatory effect Effects 0.000 title claims description 210
- 239000003446 ligand Substances 0.000 claims abstract description 309
- 239000012636 effector Substances 0.000 claims abstract description 150
- 210000004027 cell Anatomy 0.000 claims description 188
- 108090000623 proteins and genes Proteins 0.000 claims description 185
- 230000014509 gene expression Effects 0.000 claims description 153
- 238000000034 method Methods 0.000 claims description 112
- 229920002477 rna polymer Polymers 0.000 claims description 108
- 230000027455 binding Effects 0.000 claims description 87
- 230000000694 effects Effects 0.000 claims description 85
- 108020004999 messenger RNA Proteins 0.000 claims description 61
- 238000001727 in vivo Methods 0.000 claims description 56
- 239000000758 substrate Substances 0.000 claims description 50
- 238000012228 RNA interference-mediated gene silencing Methods 0.000 claims description 45
- 108020004459 Small interfering RNA Proteins 0.000 claims description 45
- 230000009368 gene silencing by RNA Effects 0.000 claims description 45
- 102000004190 Enzymes Human genes 0.000 claims description 44
- 108090000790 Enzymes Proteins 0.000 claims description 44
- 125000003729 nucleotide group Chemical group 0.000 claims description 43
- 239000002773 nucleotide Substances 0.000 claims description 41
- 230000004044 response Effects 0.000 claims description 39
- 102000004169 proteins and genes Human genes 0.000 claims description 38
- 230000008859 change Effects 0.000 claims description 37
- 239000002679 microRNA Substances 0.000 claims description 37
- 238000000338 in vitro Methods 0.000 claims description 32
- 239000002207 metabolite Substances 0.000 claims description 31
- 150000003839 salts Chemical class 0.000 claims description 27
- 238000013518 transcription Methods 0.000 claims description 20
- 230000035897 transcription Effects 0.000 claims description 20
- 230000003834 intracellular effect Effects 0.000 claims description 18
- 101710163270 Nuclease Proteins 0.000 claims description 17
- 230000037353 metabolic pathway Effects 0.000 claims description 17
- 244000052769 pathogen Species 0.000 claims description 17
- 230000001717 pathogenic effect Effects 0.000 claims description 16
- 239000002243 precursor Substances 0.000 claims description 16
- 108091026890 Coding region Proteins 0.000 claims description 15
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 15
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 15
- 230000010261 cell growth Effects 0.000 claims description 14
- 108700020796 Oncogene Proteins 0.000 claims description 13
- 230000019491 signal transduction Effects 0.000 claims description 13
- 230000024245 cell differentiation Effects 0.000 claims description 12
- 230000001404 mediated effect Effects 0.000 claims description 12
- 230000004663 cell proliferation Effects 0.000 claims description 10
- 208000015181 infectious disease Diseases 0.000 claims description 10
- 230000037361 pathway Effects 0.000 claims description 10
- 150000003384 small molecules Chemical class 0.000 claims description 10
- 230000015572 biosynthetic process Effects 0.000 claims description 9
- 239000003814 drug Substances 0.000 claims description 9
- 239000000284 extract Substances 0.000 claims description 9
- 238000006243 chemical reaction Methods 0.000 claims description 8
- 230000030279 gene silencing Effects 0.000 claims description 8
- 210000000130 stem cell Anatomy 0.000 claims description 8
- 230000004083 survival effect Effects 0.000 claims description 8
- 229940079593 drug Drugs 0.000 claims description 7
- 230000030833 cell death Effects 0.000 claims description 6
- 206010020718 hyperplasia Diseases 0.000 claims description 6
- 230000002503 metabolic effect Effects 0.000 claims description 6
- 239000008194 pharmaceutical composition Substances 0.000 claims description 6
- 239000003937 drug carrier Substances 0.000 claims description 5
- 239000002777 nucleoside Substances 0.000 claims description 5
- 150000003833 nucleoside derivatives Chemical class 0.000 claims description 5
- 241000894007 species Species 0.000 claims description 5
- 231100000419 toxicity Toxicity 0.000 claims description 5
- 230000001988 toxicity Effects 0.000 claims description 5
- 230000001276 controlling effect Effects 0.000 claims description 4
- 230000004069 differentiation Effects 0.000 claims description 4
- 230000002255 enzymatic effect Effects 0.000 claims description 4
- 238000012226 gene silencing method Methods 0.000 claims description 4
- 230000035699 permeability Effects 0.000 claims description 4
- 229920001184 polypeptide Polymers 0.000 claims description 4
- 150000001720 carbohydrates Chemical class 0.000 claims description 3
- 235000014633 carbohydrates Nutrition 0.000 claims description 3
- 206010012601 diabetes mellitus Diseases 0.000 claims description 3
- 125000000524 functional group Chemical group 0.000 claims description 3
- 230000028993 immune response Effects 0.000 claims description 3
- 230000000977 initiatory effect Effects 0.000 claims description 3
- 229910021645 metal ion Inorganic materials 0.000 claims description 3
- 230000035945 sensitivity Effects 0.000 claims description 3
- 150000003431 steroids Chemical class 0.000 claims description 3
- 230000008238 biochemical pathway Effects 0.000 claims description 2
- 125000001369 canonical nucleoside group Chemical group 0.000 claims description 2
- 235000014113 dietary fatty acids Nutrition 0.000 claims description 2
- 231100000673 dose–response relationship Toxicity 0.000 claims description 2
- 230000009483 enzymatic pathway Effects 0.000 claims description 2
- 229930195729 fatty acid Natural products 0.000 claims description 2
- 239000000194 fatty acid Substances 0.000 claims description 2
- 150000004665 fatty acids Chemical class 0.000 claims description 2
- 150000002632 lipids Chemical class 0.000 claims description 2
- 238000012544 monitoring process Methods 0.000 claims description 2
- 229930014626 natural product Natural products 0.000 claims description 2
- 239000000813 peptide hormone Substances 0.000 claims description 2
- 102000035123 post-translationally modified proteins Human genes 0.000 claims description 2
- 108091005626 post-translationally modified proteins Proteins 0.000 claims description 2
- 230000002463 transducing effect Effects 0.000 claims description 2
- 108091070501 miRNA Proteins 0.000 claims 10
- 239000002924 silencing RNA Substances 0.000 claims 4
- 238000002425 crystallisation Methods 0.000 claims 2
- 230000008025 crystallization Effects 0.000 claims 2
- 210000003630 histaminocyte Anatomy 0.000 claims 2
- 230000004565 tumor cell growth Effects 0.000 claims 2
- 102000015271 Intercellular Adhesion Molecule-1 Human genes 0.000 claims 1
- 108010064593 Intercellular Adhesion Molecule-1 Proteins 0.000 claims 1
- 230000002103 transcriptional effect Effects 0.000 claims 1
- ZFXYFBGIUFBOJW-UHFFFAOYSA-N theophylline Chemical compound O=C1N(C)C(=O)N(C)C2=C1NC=N2 ZFXYFBGIUFBOJW-UHFFFAOYSA-N 0.000 description 161
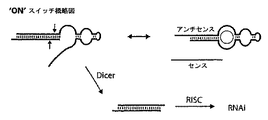
- 230000000692 anti-sense effect Effects 0.000 description 105
- 229960000278 theophylline Drugs 0.000 description 80
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 42
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 42
- 239000005090 green fluorescent protein Substances 0.000 description 42
- 108700011259 MicroRNAs Proteins 0.000 description 31
- 239000002585 base Substances 0.000 description 28
- 230000007246 mechanism Effects 0.000 description 28
- 239000004055 small Interfering RNA Substances 0.000 description 28
- 102100023387 Endoribonuclease Dicer Human genes 0.000 description 26
- 101000907904 Homo sapiens Endoribonuclease Dicer Proteins 0.000 description 26
- 230000008685 targeting Effects 0.000 description 26
- 239000013612 plasmid Substances 0.000 description 25
- 230000001419 dependent effect Effects 0.000 description 22
- 230000000295 complement effect Effects 0.000 description 20
- 239000000203 mixture Substances 0.000 description 20
- 238000013461 design Methods 0.000 description 19
- 238000009396 hybridization Methods 0.000 description 19
- RYYVLZVUVIJVGH-UHFFFAOYSA-N caffeine Chemical compound CN1C(=O)N(C)C(=O)C2=C1N=CN2C RYYVLZVUVIJVGH-UHFFFAOYSA-N 0.000 description 18
- 238000013519 translation Methods 0.000 description 18
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 17
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 17
- 238000003776 cleavage reaction Methods 0.000 description 17
- 230000007017 scission Effects 0.000 description 17
- 238000011282 treatment Methods 0.000 description 16
- 239000004098 Tetracycline Substances 0.000 description 14
- 239000002253 acid Substances 0.000 description 14
- 229960002180 tetracycline Drugs 0.000 description 14
- 229930101283 tetracycline Natural products 0.000 description 14
- 235000019364 tetracycline Nutrition 0.000 description 14
- 150000003522 tetracyclines Chemical class 0.000 description 14
- 210000001519 tissue Anatomy 0.000 description 14
- 239000013604 expression vector Substances 0.000 description 13
- 108091034117 Oligonucleotide Proteins 0.000 description 11
- 238000003556 assay Methods 0.000 description 11
- 238000005516 engineering process Methods 0.000 description 11
- 230000012010 growth Effects 0.000 description 11
- 230000005764 inhibitory process Effects 0.000 description 11
- 230000002265 prevention Effects 0.000 description 11
- YMHOBZXQZVXHBM-UHFFFAOYSA-N 2,5-dimethoxy-4-bromophenethylamine Chemical compound COC1=CC(CCN)=C(OC)C=C1Br YMHOBZXQZVXHBM-UHFFFAOYSA-N 0.000 description 10
- 241001465754 Metazoa Species 0.000 description 10
- 108091081021 Sense strand Proteins 0.000 description 10
- 108091081024 Start codon Proteins 0.000 description 10
- 241000545067 Venus Species 0.000 description 10
- 230000033228 biological regulation Effects 0.000 description 10
- 230000006870 function Effects 0.000 description 10
- 239000000543 intermediate Substances 0.000 description 10
- 108091027963 non-coding RNA Proteins 0.000 description 10
- 102000042567 non-coding RNA Human genes 0.000 description 10
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 9
- LPHGQDQBBGAPDZ-UHFFFAOYSA-N Isocaffeine Natural products CN1C(=O)N(C)C(=O)C2=C1N(C)C=N2 LPHGQDQBBGAPDZ-UHFFFAOYSA-N 0.000 description 9
- 101100144701 Mus musculus Drosha gene Proteins 0.000 description 9
- 101710135898 Myc proto-oncogene protein Proteins 0.000 description 9
- 101710150448 Transcriptional regulator Myc Proteins 0.000 description 9
- 230000004913 activation Effects 0.000 description 9
- VJEONQKOZGKCAK-UHFFFAOYSA-N caffeine Natural products CN1C(=O)N(C)C(=O)C2=C1C=CN2C VJEONQKOZGKCAK-UHFFFAOYSA-N 0.000 description 9
- 229960001948 caffeine Drugs 0.000 description 9
- 239000003795 chemical substances by application Substances 0.000 description 9
- 239000000499 gel Substances 0.000 description 9
- 230000001965 increasing effect Effects 0.000 description 9
- 241000588724 Escherichia coli Species 0.000 description 8
- 102100038895 Myc proto-oncogene protein Human genes 0.000 description 8
- 102000043276 Oncogene Human genes 0.000 description 8
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- 230000003281 allosteric effect Effects 0.000 description 8
- -1 aromatic small molecules Chemical class 0.000 description 8
- 230000001413 cellular effect Effects 0.000 description 8
- 230000002401 inhibitory effect Effects 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- 108700008625 Reporter Genes Proteins 0.000 description 7
- 108091027967 Small hairpin RNA Proteins 0.000 description 7
- 201000010099 disease Diseases 0.000 description 7
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 7
- 238000009472 formulation Methods 0.000 description 7
- 230000004927 fusion Effects 0.000 description 7
- 239000002609 medium Substances 0.000 description 7
- 239000013615 primer Substances 0.000 description 7
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 108010083644 Ribonucleases Proteins 0.000 description 6
- 102000006382 Ribonucleases Human genes 0.000 description 6
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 6
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 6
- 230000000903 blocking effect Effects 0.000 description 6
- 210000000170 cell membrane Anatomy 0.000 description 6
- 239000002299 complementary DNA Substances 0.000 description 6
- 230000007613 environmental effect Effects 0.000 description 6
- 229930182830 galactose Natural products 0.000 description 6
- 230000003993 interaction Effects 0.000 description 6
- 210000004962 mammalian cell Anatomy 0.000 description 6
- 229910052751 metal Inorganic materials 0.000 description 6
- 239000002184 metal Substances 0.000 description 6
- 150000002739 metals Chemical class 0.000 description 6
- 230000004048 modification Effects 0.000 description 6
- 238000012986 modification Methods 0.000 description 6
- 238000012545 processing Methods 0.000 description 6
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 6
- 108090000994 Catalytic RNA Proteins 0.000 description 5
- 102000053642 Catalytic RNA Human genes 0.000 description 5
- 238000011529 RT qPCR Methods 0.000 description 5
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 5
- 150000001412 amines Chemical group 0.000 description 5
- 239000012491 analyte Substances 0.000 description 5
- 239000000074 antisense oligonucleotide Substances 0.000 description 5
- 238000012230 antisense oligonucleotides Methods 0.000 description 5
- 230000006907 apoptotic process Effects 0.000 description 5
- 238000013459 approach Methods 0.000 description 5
- 239000000872 buffer Substances 0.000 description 5
- 238000012512 characterization method Methods 0.000 description 5
- 239000003184 complementary RNA Substances 0.000 description 5
- 230000000875 corresponding effect Effects 0.000 description 5
- 238000010586 diagram Methods 0.000 description 5
- 230000002068 genetic effect Effects 0.000 description 5
- 150000002500 ions Chemical class 0.000 description 5
- 238000013507 mapping Methods 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 230000010076 replication Effects 0.000 description 5
- 208000037803 restenosis Diseases 0.000 description 5
- 108091092562 ribozyme Proteins 0.000 description 5
- 239000000523 sample Substances 0.000 description 5
- 238000006467 substitution reaction Methods 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- 239000013598 vector Substances 0.000 description 5
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 206010028980 Neoplasm Diseases 0.000 description 4
- 108091093037 Peptide nucleic acid Proteins 0.000 description 4
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 4
- 108010057163 Ribonuclease III Proteins 0.000 description 4
- 102000003661 Ribonuclease III Human genes 0.000 description 4
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 4
- 241000700605 Viruses Species 0.000 description 4
- 150000007513 acids Chemical class 0.000 description 4
- 230000009471 action Effects 0.000 description 4
- 230000008860 allosteric change Effects 0.000 description 4
- 239000003242 anti bacterial agent Substances 0.000 description 4
- 150000001875 compounds Chemical class 0.000 description 4
- 238000010276 construction Methods 0.000 description 4
- 239000000975 dye Substances 0.000 description 4
- 150000002148 esters Chemical class 0.000 description 4
- 238000003384 imaging method Methods 0.000 description 4
- 230000001939 inductive effect Effects 0.000 description 4
- 230000010354 integration Effects 0.000 description 4
- 238000002955 isolation Methods 0.000 description 4
- 210000003734 kidney Anatomy 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- 229920005615 natural polymer Polymers 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- 229920001282 polysaccharide Polymers 0.000 description 4
- 239000005017 polysaccharide Substances 0.000 description 4
- 150000004804 polysaccharides Chemical class 0.000 description 4
- 230000035755 proliferation Effects 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 238000011105 stabilization Methods 0.000 description 4
- 229920001059 synthetic polymer Polymers 0.000 description 4
- 238000001890 transfection Methods 0.000 description 4
- 230000001052 transient effect Effects 0.000 description 4
- LRFVTYWOQMYALW-UHFFFAOYSA-N 9H-xanthine Chemical compound O=C1NC(=O)NC2=C1NC=N2 LRFVTYWOQMYALW-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 3
- 108020004705 Codon Proteins 0.000 description 3
- 108020004394 Complementary RNA Proteins 0.000 description 3
- 102000005685 Cyclic AMP-Dependent Protein Kinase Type I Human genes 0.000 description 3
- 108010084920 Cyclic AMP-Dependent Protein Kinase Type I Proteins 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- 108020004414 DNA Proteins 0.000 description 3
- 102000053602 DNA Human genes 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- 108090000288 Glycoproteins Proteins 0.000 description 3
- 102000003886 Glycoproteins Human genes 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 3
- 206010061218 Inflammation Diseases 0.000 description 3
- 108091028043 Nucleic acid sequence Proteins 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 108020004511 Recombinant DNA Proteins 0.000 description 3
- 108010046983 Ribonuclease T1 Proteins 0.000 description 3
- 241000251131 Sphyrna Species 0.000 description 3
- 229960000723 ampicillin Drugs 0.000 description 3
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 3
- 229940088710 antibiotic agent Drugs 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 3
- 201000011510 cancer Diseases 0.000 description 3
- 230000003833 cell viability Effects 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000010367 cloning Methods 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- 230000002950 deficient Effects 0.000 description 3
- 238000010494 dissociation reaction Methods 0.000 description 3
- 230000005593 dissociations Effects 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- 230000003828 downregulation Effects 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 239000012737 fresh medium Substances 0.000 description 3
- 239000005556 hormone Substances 0.000 description 3
- 229940088597 hormone Drugs 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- 230000004054 inflammatory process Effects 0.000 description 3
- 239000000138 intercalating agent Substances 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- YACKEPLHDIMKIO-UHFFFAOYSA-N methylphosphonic acid Chemical class CP(O)(O)=O YACKEPLHDIMKIO-UHFFFAOYSA-N 0.000 description 3
- 150000007522 mineralic acids Chemical class 0.000 description 3
- 230000011278 mitosis Effects 0.000 description 3
- 239000013642 negative control Substances 0.000 description 3
- 230000007935 neutral effect Effects 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 210000004940 nucleus Anatomy 0.000 description 3
- 150000007524 organic acids Chemical class 0.000 description 3
- 150000008298 phosphoramidates Chemical class 0.000 description 3
- 230000006641 stabilisation Effects 0.000 description 3
- 238000010561 standard procedure Methods 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- 239000003053 toxin Substances 0.000 description 3
- 231100000765 toxin Toxicity 0.000 description 3
- 108700012359 toxins Proteins 0.000 description 3
- 230000007704 transition Effects 0.000 description 3
- 230000001960 triggered effect Effects 0.000 description 3
- 210000005253 yeast cell Anatomy 0.000 description 3
- FQVLRGLGWNWPSS-BXBUPLCLSA-N (4r,7s,10s,13s,16r)-16-acetamido-13-(1h-imidazol-5-ylmethyl)-10-methyl-6,9,12,15-tetraoxo-7-propan-2-yl-1,2-dithia-5,8,11,14-tetrazacycloheptadecane-4-carboxamide Chemical compound N1C(=O)[C@@H](NC(C)=O)CSSC[C@@H](C(N)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](C)NC(=O)[C@@H]1CC1=CN=CN1 FQVLRGLGWNWPSS-BXBUPLCLSA-N 0.000 description 2
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 2
- RFLVMTUMFYRZCB-UHFFFAOYSA-N 1-methylguanine Chemical compound O=C1N(C)C(N)=NC2=C1N=CN2 RFLVMTUMFYRZCB-UHFFFAOYSA-N 0.000 description 2
- YSAJFXWTVFGPAX-UHFFFAOYSA-N 2-[(2,4-dioxo-1h-pyrimidin-5-yl)oxy]acetic acid Chemical compound OC(=O)COC1=CNC(=O)NC1=O YSAJFXWTVFGPAX-UHFFFAOYSA-N 0.000 description 2
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 2
- FZWGECJQACGGTI-UHFFFAOYSA-N 2-amino-7-methyl-1,7-dihydro-6H-purin-6-one Chemical compound NC1=NC(O)=C2N(C)C=NC2=N1 FZWGECJQACGGTI-UHFFFAOYSA-N 0.000 description 2
- OVONXEQGWXGFJD-UHFFFAOYSA-N 4-sulfanylidene-1h-pyrimidin-2-one Chemical compound SC=1C=CNC(=O)N=1 OVONXEQGWXGFJD-UHFFFAOYSA-N 0.000 description 2
- OIVLITBTBDPEFK-UHFFFAOYSA-N 5,6-dihydrouracil Chemical compound O=C1CCNC(=O)N1 OIVLITBTBDPEFK-UHFFFAOYSA-N 0.000 description 2
- LQLQRFGHAALLLE-UHFFFAOYSA-N 5-bromouracil Chemical group BrC1=CNC(=O)NC1=O LQLQRFGHAALLLE-UHFFFAOYSA-N 0.000 description 2
- ZLAQATDNGLKIEV-UHFFFAOYSA-N 5-methyl-2-sulfanylidene-1h-pyrimidin-4-one Chemical compound CC1=CNC(=S)NC1=O ZLAQATDNGLKIEV-UHFFFAOYSA-N 0.000 description 2
- 102100034035 Alcohol dehydrogenase 1A Human genes 0.000 description 2
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 2
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 2
- 108020005544 Antisense RNA Proteins 0.000 description 2
- 102100021569 Apoptosis regulator Bcl-2 Human genes 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 2
- 108091032955 Bacterial small RNA Proteins 0.000 description 2
- 101150017888 Bcl2 gene Proteins 0.000 description 2
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 2
- 101100268645 Caenorhabditis elegans abl-1 gene Proteins 0.000 description 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 108091062157 Cis-regulatory element Proteins 0.000 description 2
- 108050006400 Cyclin Proteins 0.000 description 2
- 102000016736 Cyclin Human genes 0.000 description 2
- 102000003903 Cyclin-dependent kinases Human genes 0.000 description 2
- 108090000266 Cyclin-dependent kinases Proteins 0.000 description 2
- RGHNJXZEOKUKBD-SQOUGZDYSA-N D-gluconic acid Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-SQOUGZDYSA-N 0.000 description 2
- 101710177611 DNA polymerase II large subunit Proteins 0.000 description 2
- 101710184669 DNA polymerase II small subunit Proteins 0.000 description 2
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 2
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 2
- 102000012199 E3 ubiquitin-protein ligase Mdm2 Human genes 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 101000892220 Geobacillus thermodenitrificans (strain NG80-2) Long-chain-alcohol dehydrogenase 1 Proteins 0.000 description 2
- 108090001102 Hammerhead ribozyme Proteins 0.000 description 2
- 101000780443 Homo sapiens Alcohol dehydrogenase 1A Proteins 0.000 description 2
- XQFRJNBWHJMXHO-RRKCRQDMSA-N IDUR Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(I)=C1 XQFRJNBWHJMXHO-RRKCRQDMSA-N 0.000 description 2
- 238000012404 In vitro experiment Methods 0.000 description 2
- 102100034343 Integrase Human genes 0.000 description 2
- 108060001084 Luciferase Proteins 0.000 description 2
- 239000005089 Luciferase Substances 0.000 description 2
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 101100444898 Mus musculus Egr1 gene Proteins 0.000 description 2
- HYVABZIGRDEKCD-UHFFFAOYSA-N N(6)-dimethylallyladenine Chemical compound CC(C)=CCNC1=NC=NC2=C1N=CN2 HYVABZIGRDEKCD-UHFFFAOYSA-N 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 108010087776 Proto-Oncogene Proteins c-myb Proteins 0.000 description 2
- 102000009096 Proto-Oncogene Proteins c-myb Human genes 0.000 description 2
- 102000009092 Proto-Oncogene Proteins c-myc Human genes 0.000 description 2
- 108010087705 Proto-Oncogene Proteins c-myc Proteins 0.000 description 2
- 108010029869 Proto-Oncogene Proteins c-raf Proteins 0.000 description 2
- 102100033479 RAF proto-oncogene serine/threonine-protein kinase Human genes 0.000 description 2
- 239000013614 RNA sample Substances 0.000 description 2
- 102000018120 Recombinases Human genes 0.000 description 2
- 108010091086 Recombinases Proteins 0.000 description 2
- 108091028664 Ribonucleotide Proteins 0.000 description 2
- 108091028736 Riboregulator Proteins 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 108010017842 Telomerase Proteins 0.000 description 2
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical class OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 2
- 108091023040 Transcription factor Proteins 0.000 description 2
- 102000040945 Transcription factor Human genes 0.000 description 2
- 238000009825 accumulation Methods 0.000 description 2
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 230000003321 amplification Effects 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 230000002155 anti-virotic effect Effects 0.000 description 2
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 2
- 230000001851 biosynthetic effect Effects 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 150000001768 cations Chemical class 0.000 description 2
- 108010046616 cdc25 Phosphatases Proteins 0.000 description 2
- 102000007588 cdc25 Phosphatases Human genes 0.000 description 2
- 210000002421 cell wall Anatomy 0.000 description 2
- SMNPLAKEGAEPJD-UHFFFAOYSA-N chembl34922 Chemical compound Cl.Cl.Cl.C1CN(C)CCN1C1=CC=C(NC(=N2)C=3C=C4N=C(NC4=CC=3)C=3C=CC(O)=CC=3)C2=C1 SMNPLAKEGAEPJD-UHFFFAOYSA-N 0.000 description 2
- 229960005091 chloramphenicol Drugs 0.000 description 2
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 2
- 239000000460 chlorine Substances 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 230000008260 defense mechanism Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 2
- 230000009977 dual effect Effects 0.000 description 2
- 238000001962 electrophoresis Methods 0.000 description 2
- 229960002949 fluorouracil Drugs 0.000 description 2
- 229940093915 gynecological organic acid Drugs 0.000 description 2
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 230000002390 hyperplastic effect Effects 0.000 description 2
- FDGQSTZJBFJUBT-UHFFFAOYSA-N hypoxanthine Chemical compound O=C1NC=NC2=C1NC=N2 FDGQSTZJBFJUBT-UHFFFAOYSA-N 0.000 description 2
- 238000002513 implantation Methods 0.000 description 2
- 230000002779 inactivation Effects 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 208000027866 inflammatory disease Diseases 0.000 description 2
- 101150066555 lacZ gene Proteins 0.000 description 2
- 210000004698 lymphocyte Anatomy 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- 238000012423 maintenance Methods 0.000 description 2
- 101150024228 mdm2 gene Proteins 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 2
- 238000012269 metabolic engineering Methods 0.000 description 2
- 238000010369 molecular cloning Methods 0.000 description 2
- 238000003199 nucleic acid amplification method Methods 0.000 description 2
- 235000015097 nutrients Nutrition 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 2
- 150000004713 phosphodiesters Chemical class 0.000 description 2
- 230000004962 physiological condition Effects 0.000 description 2
- 229920002401 polyacrylamide Polymers 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 102000016914 ras Proteins Human genes 0.000 description 2
- 108010014186 ras Proteins Proteins 0.000 description 2
- 230000033458 reproduction Effects 0.000 description 2
- 239000002336 ribonucleotide Substances 0.000 description 2
- 125000002652 ribonucleotide group Chemical group 0.000 description 2
- 230000011664 signaling Effects 0.000 description 2
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 2
- 230000009870 specific binding Effects 0.000 description 2
- ATHGHQPFGPMSJY-UHFFFAOYSA-N spermidine Chemical compound NCCCCNCCCN ATHGHQPFGPMSJY-UHFFFAOYSA-N 0.000 description 2
- PFNFFQXMRSDOHW-UHFFFAOYSA-N spermine Chemical compound NCCCNCCCCNCCCN PFNFFQXMRSDOHW-UHFFFAOYSA-N 0.000 description 2
- 230000007480 spreading Effects 0.000 description 2
- 238000003892 spreading Methods 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 2
- 229940104230 thymidine Drugs 0.000 description 2
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 2
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 238000011269 treatment regimen Methods 0.000 description 2
- 210000004881 tumor cell Anatomy 0.000 description 2
- 229940035893 uracil Drugs 0.000 description 2
- 239000013603 viral vector Substances 0.000 description 2
- 230000003612 virological effect Effects 0.000 description 2
- CADQNXRGRFJSQY-UOWFLXDJSA-N (2r,3r,4r)-2-fluoro-2,3,4,5-tetrahydroxypentanal Chemical compound OC[C@@H](O)[C@@H](O)[C@@](O)(F)C=O CADQNXRGRFJSQY-UOWFLXDJSA-N 0.000 description 1
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- TUSDEZXZIZRFGC-UHFFFAOYSA-N 1-O-galloyl-3,6-(R)-HHDP-beta-D-glucose Natural products OC1C(O2)COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC1C(O)C2OC(=O)C1=CC(O)=C(O)C(O)=C1 TUSDEZXZIZRFGC-UHFFFAOYSA-N 0.000 description 1
- WJNGQIYEQLPJMN-IOSLPCCCSA-N 1-methylinosine Chemical compound C1=NC=2C(=O)N(C)C=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O WJNGQIYEQLPJMN-IOSLPCCCSA-N 0.000 description 1
- VGONTNSXDCQUGY-RRKCRQDMSA-N 2'-deoxyinosine Chemical group C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC2=O)=C2N=C1 VGONTNSXDCQUGY-RRKCRQDMSA-N 0.000 description 1
- IQFYYKKMVGJFEH-BIIVOSGPSA-N 2'-deoxythymidine Natural products O=C1NC(=O)C(C)=CN1[C@@H]1O[C@@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-BIIVOSGPSA-N 0.000 description 1
- IHPYMWDTONKSCO-UHFFFAOYSA-N 2,2'-piperazine-1,4-diylbisethanesulfonic acid Chemical compound OS(=O)(=O)CCN1CCN(CCS(O)(=O)=O)CC1 IHPYMWDTONKSCO-UHFFFAOYSA-N 0.000 description 1
- CRDMKNQTGHROAB-UHFFFAOYSA-N 2-(5-methoxy-2,4-dioxo-1H-pyrimidin-6-yl)acetic acid Chemical compound COC=1C(NC(NC=1CC(=O)O)=O)=O CRDMKNQTGHROAB-UHFFFAOYSA-N 0.000 description 1
- SGAKLDIYNFXTCK-UHFFFAOYSA-N 2-[(2,4-dioxo-1h-pyrimidin-5-yl)methylamino]acetic acid Chemical compound OC(=O)CNCC1=CNC(=O)NC1=O SGAKLDIYNFXTCK-UHFFFAOYSA-N 0.000 description 1
- IOOMXAQUNPWDLL-UHFFFAOYSA-N 2-[6-(diethylamino)-3-(diethyliminiumyl)-3h-xanthen-9-yl]-5-sulfobenzene-1-sulfonate Chemical compound C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=C(S(O)(=O)=O)C=C1S([O-])(=O)=O IOOMXAQUNPWDLL-UHFFFAOYSA-N 0.000 description 1
- XMSMHKMPBNTBOD-UHFFFAOYSA-N 2-dimethylamino-6-hydroxypurine Chemical compound N1C(N(C)C)=NC(=O)C2=C1N=CN2 XMSMHKMPBNTBOD-UHFFFAOYSA-N 0.000 description 1
- LXBGSDVWAMZHDD-UHFFFAOYSA-N 2-methyl-1h-imidazole Chemical compound CC1=NC=CN1 LXBGSDVWAMZHDD-UHFFFAOYSA-N 0.000 description 1
- SMADWRYCYBUIKH-UHFFFAOYSA-N 2-methyl-7h-purin-6-amine Chemical compound CC1=NC(N)=C2NC=NC2=N1 SMADWRYCYBUIKH-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- KOLPWZCZXAMXKS-UHFFFAOYSA-N 3-methylcytosine Chemical compound CN1C(N)=CC=NC1=O KOLPWZCZXAMXKS-UHFFFAOYSA-N 0.000 description 1
- GJAKJCICANKRFD-UHFFFAOYSA-N 4-acetyl-4-amino-1,3-dihydropyrimidin-2-one Chemical compound CC(=O)C1(N)NC(=O)NC=C1 GJAKJCICANKRFD-UHFFFAOYSA-N 0.000 description 1
- 101710169336 5'-deoxyadenosine deaminase Proteins 0.000 description 1
- MQJSSLBGAQJNER-UHFFFAOYSA-N 5-(methylaminomethyl)-1h-pyrimidine-2,4-dione Chemical compound CNCC1=CNC(=O)NC1=O MQJSSLBGAQJNER-UHFFFAOYSA-N 0.000 description 1
- WPYRHVXCOQLYLY-UHFFFAOYSA-N 5-[(methoxyamino)methyl]-2-sulfanylidene-1h-pyrimidin-4-one Chemical compound CONCC1=CNC(=S)NC1=O WPYRHVXCOQLYLY-UHFFFAOYSA-N 0.000 description 1
- VKLFQTYNHLDMDP-PNHWDRBUSA-N 5-carboxymethylaminomethyl-2-thiouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=S)NC(=O)C(CNCC(O)=O)=C1 VKLFQTYNHLDMDP-PNHWDRBUSA-N 0.000 description 1
- ZFTBZKVVGZNMJR-UHFFFAOYSA-N 5-chlorouracil Chemical compound ClC1=CNC(=O)NC1=O ZFTBZKVVGZNMJR-UHFFFAOYSA-N 0.000 description 1
- KSNXJLQDQOIRIP-UHFFFAOYSA-N 5-iodouracil Chemical compound IC1=CNC(=O)NC1=O KSNXJLQDQOIRIP-UHFFFAOYSA-N 0.000 description 1
- KELXHQACBIUYSE-UHFFFAOYSA-N 5-methoxy-1h-pyrimidine-2,4-dione Chemical compound COC1=CNC(=O)NC1=O KELXHQACBIUYSE-UHFFFAOYSA-N 0.000 description 1
- LRSASMSXMSNRBT-UHFFFAOYSA-N 5-methylcytosine Chemical compound CC1=CNC(=O)N=C1N LRSASMSXMSNRBT-UHFFFAOYSA-N 0.000 description 1
- LMEHJKJEPRYEEB-UHFFFAOYSA-N 5-prop-1-ynylpyrimidine Chemical compound CC#CC1=CN=CN=C1 LMEHJKJEPRYEEB-UHFFFAOYSA-N 0.000 description 1
- DCPSTSVLRXOYGS-UHFFFAOYSA-N 6-amino-1h-pyrimidine-2-thione Chemical compound NC1=CC=NC(S)=N1 DCPSTSVLRXOYGS-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- MSSXOMSJDRHRMC-UHFFFAOYSA-N 9H-purine-2,6-diamine Chemical compound NC1=NC(N)=C2NC=NC2=N1 MSSXOMSJDRHRMC-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 208000009304 Acute Kidney Injury Diseases 0.000 description 1
- 102000055025 Adenosine deaminases Human genes 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 102000008682 Argonaute Proteins Human genes 0.000 description 1
- 108010088141 Argonaute Proteins Proteins 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 1
- 0 CC*(C(C)C)C1=CN1 Chemical compound CC*(C(C)C)C1=CN1 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 239000004971 Cross linker Substances 0.000 description 1
- 102100033270 Cyclin-dependent kinase inhibitor 1 Human genes 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- GUBGYTABKSRVRQ-CUHNMECISA-N D-Cellobiose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-CUHNMECISA-N 0.000 description 1
- RGHNJXZEOKUKBD-UHFFFAOYSA-N D-gluconic acid Natural products OCC(O)C(O)C(O)C(O)C(O)=O RGHNJXZEOKUKBD-UHFFFAOYSA-N 0.000 description 1
- ZAQJHHRNXZUBTE-WUJLRWPWSA-N D-xylulose Chemical compound OC[C@@H](O)[C@H](O)C(=O)CO ZAQJHHRNXZUBTE-WUJLRWPWSA-N 0.000 description 1
- 102000012410 DNA Ligases Human genes 0.000 description 1
- 108010061982 DNA Ligases Proteins 0.000 description 1
- 239000003155 DNA primer Substances 0.000 description 1
- 102000016911 Deoxyribonucleases Human genes 0.000 description 1
- 108010053770 Deoxyribonucleases Proteins 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 1
- 241000255601 Drosophila melanogaster Species 0.000 description 1
- 108010042407 Endonucleases Proteins 0.000 description 1
- 102000004533 Endonucleases Human genes 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 241000206602 Eukaryota Species 0.000 description 1
- 108060002716 Exonuclease Proteins 0.000 description 1
- 208000007241 Experimental Diabetes Mellitus Diseases 0.000 description 1
- 239000001263 FEMA 3042 Substances 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 208000034951 Genetic Translocation Diseases 0.000 description 1
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical class C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 description 1
- 102100031547 HLA class II histocompatibility antigen, DO alpha chain Human genes 0.000 description 1
- 101000866278 Homo sapiens HLA class II histocompatibility antigen, DO alpha chain Proteins 0.000 description 1
- 206010020880 Hypertrophy Diseases 0.000 description 1
- UGQMRVRMYYASKQ-UHFFFAOYSA-N Hypoxanthine nucleoside Natural products OC1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1 UGQMRVRMYYASKQ-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 229930010555 Inosine Natural products 0.000 description 1
- UGQMRVRMYYASKQ-KQYNXXCUSA-N Inosine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(O)=C2N=C1 UGQMRVRMYYASKQ-KQYNXXCUSA-N 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 241000764238 Isis Species 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- 108091026898 Leader sequence (mRNA) Proteins 0.000 description 1
- 102000003960 Ligases Human genes 0.000 description 1
- 108090000364 Ligases Proteins 0.000 description 1
- 239000006391 Luria-Bertani Medium Substances 0.000 description 1
- 108090000157 Metallothionein Proteins 0.000 description 1
- 108060004795 Methyltransferase Proteins 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 108010021466 Mutant Proteins Proteins 0.000 description 1
- 102000008300 Mutant Proteins Human genes 0.000 description 1
- SGSSKEDGVONRGC-UHFFFAOYSA-N N(2)-methylguanine Chemical compound O=C1NC(NC)=NC2=C1N=CN2 SGSSKEDGVONRGC-UHFFFAOYSA-N 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 108091092724 Noncoding DNA Proteins 0.000 description 1
- 108700026244 Open Reading Frames Proteins 0.000 description 1
- 239000007990 PIPES buffer Substances 0.000 description 1
- 235000021314 Palmitic acid Nutrition 0.000 description 1
- 229920002230 Pectic acid Polymers 0.000 description 1
- LRBQNJMCXXYXIU-PPKXGCFTSA-N Penta-digallate-beta-D-glucose Natural products OC1=C(O)C(O)=CC(C(=O)OC=2C(=C(O)C=C(C=2)C(=O)OC[C@@H]2[C@H]([C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)O2)OC(=O)C=2C=C(OC(=O)C=3C=C(O)C(O)=C(O)C=3)C(O)=C(O)C=2)O)=C1 LRBQNJMCXXYXIU-PPKXGCFTSA-N 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 108010020346 Polyglutamic Acid Proteins 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000055027 Protein Methyltransferases Human genes 0.000 description 1
- 108700040121 Protein Methyltransferases Proteins 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 102000014450 RNA Polymerase III Human genes 0.000 description 1
- 108010078067 RNA Polymerase III Proteins 0.000 description 1
- 238000013381 RNA quantification Methods 0.000 description 1
- 230000007022 RNA scission Effects 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 238000010240 RT-PCR analysis Methods 0.000 description 1
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 description 1
- 208000033626 Renal failure acute Diseases 0.000 description 1
- 206010063837 Reperfusion injury Diseases 0.000 description 1
- 108020005091 Replication Origin Proteins 0.000 description 1
- 108090000621 Ribonuclease P Proteins 0.000 description 1
- 102000004167 Ribonuclease P Human genes 0.000 description 1
- 108020004422 Riboswitch Proteins 0.000 description 1
- 241000714474 Rous sarcoma virus Species 0.000 description 1
- 108091006627 SLC12A9 Proteins 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 230000006052 T cell proliferation Effects 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 108010006785 Taq Polymerase Proteins 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 102000006601 Thymidine Kinase Human genes 0.000 description 1
- 108020004440 Thymidine kinase Proteins 0.000 description 1
- 102000046299 Transforming Growth Factor beta1 Human genes 0.000 description 1
- 101800002279 Transforming growth factor beta-1 Proteins 0.000 description 1
- 101800001690 Transmembrane protein gp41 Proteins 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 description 1
- 108020004417 Untranslated RNA Proteins 0.000 description 1
- 102000039634 Untranslated RNA Human genes 0.000 description 1
- DRTQHJPVMGBUCF-XVFCMESISA-N Uridine Chemical class O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-XVFCMESISA-N 0.000 description 1
- OZKXLOZHHUHGNV-UHFFFAOYSA-N Viomycin Natural products NCCCC(N)CC(=O)NC1CNC(=O)C(=CNC(=O)N)NC(=O)C(CO)NC(=O)C(CO)NC(=O)C(NC1=O)C2CC(O)NC(=N)N2 OZKXLOZHHUHGNV-UHFFFAOYSA-N 0.000 description 1
- 108010015940 Viomycin Proteins 0.000 description 1
- GKMBRSQQKZUCGD-UHFFFAOYSA-M [9-[4-(chloromethyl)phenyl]-6-(dimethylamino)xanthen-3-ylidene]-dimethylazanium;bromide Chemical compound [Br-].C=12C=CC(=[N+](C)C)C=C2OC2=CC(N(C)C)=CC=C2C=1C1=CC=C(CCl)C=C1 GKMBRSQQKZUCGD-UHFFFAOYSA-M 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 150000001241 acetals Chemical class 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 230000013564 activation of immune response Effects 0.000 description 1
- 201000011040 acute kidney failure Diseases 0.000 description 1
- 208000012998 acute renal failure Diseases 0.000 description 1
- 229960000643 adenine Drugs 0.000 description 1
- 229960005305 adenosine Drugs 0.000 description 1
- 210000001789 adipocyte Anatomy 0.000 description 1
- 238000001261 affinity purification Methods 0.000 description 1
- 238000000246 agarose gel electrophoresis Methods 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 150000001447 alkali salts Chemical class 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 230000008848 allosteric regulation Effects 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 238000011319 anticancer therapy Methods 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- PYMYPHUHKUWMLA-WDCZJNDASA-N arabinose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-WDCZJNDASA-N 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 230000003305 autocrine Effects 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 229960004365 benzoic acid Drugs 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 102000005936 beta-Galactosidase Human genes 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 229920001222 biopolymer Polymers 0.000 description 1
- 230000006696 biosynthetic metabolic pathway Effects 0.000 description 1
- 230000008499 blood brain barrier function Effects 0.000 description 1
- 210000001218 blood-brain barrier Anatomy 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 238000005251 capillar electrophoresis Methods 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000036978 cell physiology Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 210000002230 centromere Anatomy 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- VDANGULDQQJODZ-UHFFFAOYSA-N chloroprocaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1Cl VDANGULDQQJODZ-UHFFFAOYSA-N 0.000 description 1
- 229960002023 chloroprocaine Drugs 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 230000002759 chromosomal effect Effects 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 230000008632 circadian clock Effects 0.000 description 1
- 230000004186 co-expression Effects 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 238000011217 control strategy Methods 0.000 description 1
- 239000005289 controlled pore glass Substances 0.000 description 1
- 230000002079 cooperative effect Effects 0.000 description 1
- 238000007887 coronary angioplasty Methods 0.000 description 1
- 239000002537 cosmetic Substances 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 238000013211 curve analysis Methods 0.000 description 1
- 229940104302 cytosine Drugs 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000002716 delivery method Methods 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 230000002074 deregulated effect Effects 0.000 description 1
- 230000001687 destabilization Effects 0.000 description 1
- 230000000368 destabilizing effect Effects 0.000 description 1
- ANCLJVISBRWUTR-UHFFFAOYSA-N diaminophosphinic acid Chemical compound NP(N)(O)=O ANCLJVISBRWUTR-UHFFFAOYSA-N 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- RJBIAAZJODIFHR-UHFFFAOYSA-N dihydroxy-imino-sulfanyl-$l^{5}-phosphane Chemical compound NP(O)(O)=S RJBIAAZJODIFHR-UHFFFAOYSA-N 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- NAGJZTKCGNOGPW-UHFFFAOYSA-K dioxido-sulfanylidene-sulfido-$l^{5}-phosphane Chemical compound [O-]P([O-])([S-])=S NAGJZTKCGNOGPW-UHFFFAOYSA-K 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 229960003638 dopamine Drugs 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- 230000008556 epithelial cell proliferation Effects 0.000 description 1
- 238000012869 ethanol precipitation Methods 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 102000013165 exonuclease Human genes 0.000 description 1
- 230000003631 expected effect Effects 0.000 description 1
- 239000013613 expression plasmid Substances 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 229960003704 framycetin Drugs 0.000 description 1
- PGBHMTALBVVCIT-VCIWKGPPSA-N framycetin Chemical compound N[C@@H]1[C@@H](O)[C@H](O)[C@H](CN)O[C@@H]1O[C@H]1[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](N)C[C@@H](N)[C@@H]2O)O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CN)O2)N)O[C@@H]1CO PGBHMTALBVVCIT-VCIWKGPPSA-N 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 101150045500 galK gene Proteins 0.000 description 1
- 101150041954 galU gene Proteins 0.000 description 1
- LRBQNJMCXXYXIU-QWKBTXIPSA-N gallotannic acid Chemical compound OC1=C(O)C(O)=CC(C(=O)OC=2C(=C(O)C=C(C=2)C(=O)OC[C@H]2[C@@H]([C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)[C@@H](OC(=O)C=3C=C(OC(=O)C=4C=C(O)C(O)=C(O)C=4)C(O)=C(O)C=3)O2)OC(=O)C=2C=C(OC(=O)C=3C=C(O)C(O)=C(O)C=3)C(O)=C(O)C=2)O)=C1 LRBQNJMCXXYXIU-QWKBTXIPSA-N 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 102000034356 gene-regulatory proteins Human genes 0.000 description 1
- 108091006104 gene-regulatory proteins Proteins 0.000 description 1
- 230000007614 genetic variation Effects 0.000 description 1
- 230000001434 glomerular Effects 0.000 description 1
- 239000000174 gluconic acid Substances 0.000 description 1
- 235000012208 gluconic acid Nutrition 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 101150096208 gtaB gene Proteins 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 210000003494 hepatocyte Anatomy 0.000 description 1
- 150000002402 hexoses Chemical class 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000008102 immune modulation Effects 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 230000006882 induction of apoptosis Effects 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 229960003786 inosine Drugs 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 230000004068 intracellular signaling Effects 0.000 description 1
- 230000008863 intramolecular interaction Effects 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229960000318 kanamycin Drugs 0.000 description 1
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 1
- 229930182823 kanamycin A Natural products 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- XIXADJRWDQXREU-UHFFFAOYSA-M lithium acetate Chemical compound [Li+].CC([O-])=O XIXADJRWDQXREU-UHFFFAOYSA-M 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 210000001161 mammalian embryo Anatomy 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- IZAGSTRIDUNNOY-UHFFFAOYSA-N methyl 2-[(2,4-dioxo-1h-pyrimidin-5-yl)oxy]acetate Chemical compound COC(=O)COC1=CNC(=O)NC1=O IZAGSTRIDUNNOY-UHFFFAOYSA-N 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- XLSZMDLNRCVEIJ-UHFFFAOYSA-N methylimidazole Natural products CC1=CNC=N1 XLSZMDLNRCVEIJ-UHFFFAOYSA-N 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 230000009149 molecular binding Effects 0.000 description 1
- 238000001823 molecular biology technique Methods 0.000 description 1
- 239000003068 molecular probe Substances 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 108700024542 myc Genes Proteins 0.000 description 1
- XJVXMWNLQRTRGH-UHFFFAOYSA-N n-(3-methylbut-3-enyl)-2-methylsulfanyl-7h-purin-6-amine Chemical compound CSC1=NC(NCCC(C)=C)=C2NC=NC2=N1 XJVXMWNLQRTRGH-UHFFFAOYSA-N 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- YZMHQCWXYHARLS-UHFFFAOYSA-N naphthalene-1,2-disulfonic acid Chemical compound C1=CC=CC2=C(S(O)(=O)=O)C(S(=O)(=O)O)=CC=C21 YZMHQCWXYHARLS-UHFFFAOYSA-N 0.000 description 1
- PSZYNBSKGUBXEH-UHFFFAOYSA-N naphthalene-1-sulfonic acid Chemical compound C1=CC=C2C(S(=O)(=O)O)=CC=CC2=C1 PSZYNBSKGUBXEH-UHFFFAOYSA-N 0.000 description 1
- 230000008692 neointimal formation Effects 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 108091008104 nucleic acid aptamers Proteins 0.000 description 1
- 238000007899 nucleic acid hybridization Methods 0.000 description 1
- 230000001293 nucleolytic effect Effects 0.000 description 1
- 101150012154 nupG gene Proteins 0.000 description 1
- 108091008819 oncoproteins Proteins 0.000 description 1
- 210000000287 oocyte Anatomy 0.000 description 1
- 230000001151 other effect Effects 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 238000010422 painting Methods 0.000 description 1
- 229940098695 palmitic acid Drugs 0.000 description 1
- 230000003076 paracrine Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 239000003961 penetration enhancing agent Substances 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- PTMHPRAIXMAOOB-UHFFFAOYSA-L phosphoramidate Chemical compound NP([O-])([O-])=O PTMHPRAIXMAOOB-UHFFFAOYSA-L 0.000 description 1
- 125000005642 phosphothioate group Chemical group 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 229920000768 polyamine Polymers 0.000 description 1
- 239000010318 polygalacturonic acid Substances 0.000 description 1
- 229920002643 polyglutamic acid Polymers 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 230000001124 posttranscriptional effect Effects 0.000 description 1
- 230000007859 posttranscriptional regulation of gene expression Effects 0.000 description 1
- BITYAPCSNKJESK-UHFFFAOYSA-N potassiosodium Chemical compound [Na].[K] BITYAPCSNKJESK-UHFFFAOYSA-N 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 108091007428 primary miRNA Proteins 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 239000002213 purine nucleotide Substances 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 239000002719 pyrimidine nucleotide Substances 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 230000023276 regulation of development, heterochronic Effects 0.000 description 1
- 230000008844 regulatory mechanism Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 230000002207 retinal effect Effects 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 239000002342 ribonucleoside Substances 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 1
- 229960001860 salicylate Drugs 0.000 description 1
- HFHDHCJBZVLPGP-UHFFFAOYSA-N schardinger α-dextrin Chemical compound O1C(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(O)C2O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC2C(O)C(O)C1OC2CO HFHDHCJBZVLPGP-UHFFFAOYSA-N 0.000 description 1
- 238000010187 selection method Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 239000013605 shuttle vector Substances 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 210000004927 skin cell Anatomy 0.000 description 1
- 229940126586 small molecule drug Drugs 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 210000001082 somatic cell Anatomy 0.000 description 1
- 238000011895 specific detection Methods 0.000 description 1
- 229940063673 spermidine Drugs 0.000 description 1
- 229940063675 spermine Drugs 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 230000009897 systematic effect Effects 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 229920002258 tannic acid Polymers 0.000 description 1
- 235000015523 tannic acid Nutrition 0.000 description 1
- 229940033123 tannic acid Drugs 0.000 description 1
- 238000002626 targeted therapy Methods 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- 229960000707 tobramycin Drugs 0.000 description 1
- NLVFBUXFDBBNBW-PBSUHMDJSA-N tobramycin Chemical compound N[C@@H]1C[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N NLVFBUXFDBBNBW-PBSUHMDJSA-N 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 108091006106 transcriptional activators Proteins 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- 230000014621 translational initiation Effects 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 210000003556 vascular endothelial cell Anatomy 0.000 description 1
- 229950001272 viomycin Drugs 0.000 description 1
- GXFAIFRPOKBQRV-GHXCTMGLSA-N viomycin Chemical compound N1C(=O)\C(=C\NC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)C[C@@H](N)CCCN)CNC(=O)[C@@H]1[C@@H]1NC(=N)N[C@@H](O)C1 GXFAIFRPOKBQRV-GHXCTMGLSA-N 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 229940075420 xanthine Drugs 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6844—Nucleic acid amplification reactions
- C12Q1/686—Polymerase chain reaction [PCR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/111—General methods applicable to biologically active non-coding nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/115—Aptamers, i.e. nucleic acids binding a target molecule specifically and with high affinity without hybridising therewith ; Nucleic acids binding to non-nucleic acids, e.g. aptamers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/635—Externally inducible repressor mediated regulation of gene expression, e.g. tetR inducible by tetracyline
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6897—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids involving reporter genes operably linked to promoters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
- C12N2310/111—Antisense spanning the whole gene, or a large part of it
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/16—Aptamers
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Genetics & Genomics (AREA)
- Organic Chemistry (AREA)
- Biomedical Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- General Health & Medical Sciences (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Plant Pathology (AREA)
- General Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Immunology (AREA)
- Diabetes (AREA)
- Analytical Chemistry (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
- Child & Adolescent Psychology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Description
最近数年間において、シス及びトランスRNAエレメントは、遺伝子発現の重要なレギュレーターとして十分認識されるようになった。細胞は、種々の非コードRNAベースのエレメントを利用して、複雑な遺伝子ネットワーク例えば発生のタイミング及び概日時計に関与するものを調節する(Banerjee等、Bioessays 24, 119-29(2002);Kramer等、Nature 421, 948-52(2003))。アンチセンスRNAは、小さいトランス作用性RNA(taRNA)であって、標的メッセンジャーRNA(mRNA)の相補性セグメントに結合して、ターゲティングディケイ、翻訳ブロック及び選択的スプライシングパターンなどの機構によって遺伝子発現を調節する(Good, Cell Mol Life Sci 60, 823-4(2003);Good, Cell Mol Life Sci 60, 854-61(2003);及びVacek等、Cell Mol Life Sci 60, 825-33(2003))。ミクロRNA(miRNA)、mRNA及びゲノム中の相補的配列と相互作用することにより翻訳又はRNAディケイに影響を及ぼす小型taRNAが後生動物遺伝子調節に広く行き渡っていることはありそうなことである(Bartel, Cell 116, 281-97(2004))。小さい干渉性RNA(siRNA)及び二本鎖RNA(dsRNA)は、正確にmRNAを標的として、それらの発現を後生動物におけけるRNA干渉(RNAi)経路によって阻害することができ、細胞の宿主防御システムの部分であると考えられている(Scherer, Curr Pharm Biotechnol 5, 355-60(2004))。リボザイムは、触媒機能を示すRNA分子であり、ウイルスによって遺伝子発現を調節するために利用されることが示されている(Lilley, Trends Biochem Sci 28, 495-501(2003))。リボスイッチ、mRNA中のシス作用性の代謝産物結合構造は、遺伝子発現を、翻訳開始の変調、転写終結の破壊又はmRNAのリボザイム機構による開裂により制御する(Mandal等、Nat Struct Mol Biol 11, 29-35(2004);Winkler, Nature 419, 952-6(2002);及びWinkler, Nature 428, 281-6(2004))。最近の研究は、これらのRNAベースのレギュレーターの、原核生物からヒトに至る種々の生物群を横切る普及を示した(Barrick等、Proc.Natl.Acad.Sci.USA 101, 6421-6(2004);Yelin等、Nat Biotechnol 21, 379-86(2003);及びLavorgna等、Trends Biochem Sci 29, 88-94(2004))。
本発明は、アプタマー調節されるトランス作用性核酸、即ち「aptaスイッチ」を提供する。主題のaptaスイッチは、容易に処理して様々なリガンドに応答性とすることができ、多くの応用において有用な用途の広い核酸クラスである。例えば、aptaスイッチは、リガンド依存的様式で標的とした遺伝子の活性を変調するようにデザインすることができ、それ故、内因性又は異質遺伝子の発現を変調するのに有用である。
図1a〜1eは、新規なアンチスイッチレギュレーターのデザイン及び機能活性を示している。図1aは、アンチスイッチ分子がイン・ビボで遺伝子発現を調節するように作用する機構の一般的な図解である。1、アンチセンス配列;2、スイッチする「アプタマーステム」。エフェクターの非存在下では、アンチセンスドメインは、「アンチセンスステム」と呼ばれるRNAの二本鎖領域にて結合され、そのアンチスイッチは、「オフ」状態にある。この状態では、アンチスイッチは、その標的転写物(gfpコード領域をコードする)に結合することができず、その結果、GFP生成はオンである。エフェクターの存在下では、このアンチスイッチは、この分子に結合して、アプタマーステムを形成させ、そのコンホメーションを「オン」状態に切り替える。この状態において、アンチスイッチのアンチセンスドメインは、その標的転写物に結合して、アンチセンス機構により、GFPの生成をオフにする。図1bは、テオフィリン応答性アンチスイッチ、s1及びその標的mRNAの配列及び予想される構造切替えを示している。3、アンチセンス配列;4、スイッチングアプタマーステム配列;5、標的mRNA上の開始コドン。各スイッチングステムの安定性を示してある。図1cは、種々のエフェクター濃度でのs1及び対照のイン・ビボGFP調節活性を示している:テオフィリンの存在下でのアプタマー構築物(負の対照);テオフィリンの存在下でのアンチセンス構築物(正の対照);カフェインの存在下でのs1(負の対照);テオフィリンの存在下でのs1。データは、これらの構築物を有する細胞における、相対的な(GFP発現構築物のみを有する誘導された及び誘導されてない細胞での発現レベルに対する)、標準化されたGFP発現として与えられている。図1dは、蓄積された定常状態レベルのGFP及びアンチスイッチs1を有する細胞へのエフェクターの添加に際しての、GFP発現を阻止するs1のイン・ビボでの一過性応答を示している:テオフィリンなし(−);2mM テオフィリン(+)。図1eは、s1の、標的及びエフェクター分子に対するイン・ビトロアフィニティーアッセイを示している。放射性標識したs1の移動度を、等モル濃度の標的転写物と、示したように濃度を変えたテオフィリンの存在下でモニターした。
図2a及び2bは、アンチスイッチレギュレーターのスイッチ応答のチューニングを示している。図2aは、テオフィリン結合の非存在下で、s1に基づいて同調されたアンチスイッチ(s2〜s4)の予想された構造を示している。6、アンチセンス配列;7、スイッチングアプタマーステム配列;8、改変された配列。各スイッチングステムの安定性を示してある。図2bは、イン・ビボの、s1〜s4の、種々のテオフィリン濃度でのGFP調節活性を示している:s1−最初のアンチスイッチ構築物;s2−不安定化したアンチスイッチ構築物;s3−安定化したアンチスイッチ構築物;s4−不安定化したアンチスイッチ構築物。
図3a及び3bは、アンチスイッチ特性の、モジュレータードメインをデザインプラットフォーム中にスワップすることによる拡大を示している。図3aは、改変アプタマーアンチスイッチ構築物(s5〜s6)の、種々のテオフィリン濃度での、イン・ビボでのGFP調節活性を示している:s5−s1と比べて10倍低いテオフィリンに対する親和性を有するアプタマードメインを有するアンチスイッチ構築物;s6−s5ベースの、不安定化した、改変アプタマーアンチスイッチ構築物。図3bは、種々の小型分子エフェクターに応答性のアンチスイッチ構築物(s1、s7)の、種々のエフェクター濃度での、イン・ビトロでの、GFP調節活性を示している:s1−テオフィリンに応答性の初期のアンチスイッチ構築物;s7−s1ベースの、テトラサイクリンに応答性の、テトラサイクリンアプタマードメインで改変したアンチスイッチ構築物。
図4a及び4bは、新規な「オン」アンチスイッチレギュレーターの再デザイン及び特性表示を示している。図4aは、テオフィリンに応答性の「オン」アンチスイッチレギュレーター(s8)の配列及び構造スイッチングを示している。9、アンチセンス配列;10、スイッチングアプタマーステム配列;11、標的mRNA上の開始コドン。各スイッチングステムの安定性を示してある。s8は、テオフィリンの非存在下でアンチスイッチが「オン」であり又はアンチセンスドメインが自由にその標的に結合するようにデザインされている。テオフィリンの存在下で、アンチスイッチは、アンチセンスドメインが、アプタマーステムの部分である二本鎖RNAステムにて結合するように、「オフ」状態へのコンホメーション変化を受ける。図4bは、種々のテオフィリン濃度での、「オン」及び「オフ」アンチスイッチ構築物のイン・ビボでのGFP調節活性を示している:s1−初期の「オフ」アンチスイッチ構築物;s8−再デザインした「オン」アンチスイッチ構築物(s1ベース)。
図5a及び5bは、多数の遺伝子の、多数のアンチスイッチレギュレーターによる同時調節を示している。図5aは、2つの独立したアンチスイッチ分子が、多数の標的遺伝子の発現をイン・ビボで調節するように作用する機構を示している。それらのそれぞれのエフェクターの非存在下において、アンチスイッチは、「オフ」状態にあり、それらの標的転写物に結合することができない。この状態において、GFP及びYFPの生成は、両方とも、オンである。テオフィリンの存在下では、一つのアンチスイッチがそのコンホメーションを「オン」状態に切り替えて、GFP生成をオフにする。テトラサイクリンの存在下では、第二のアンチスイッチが、そのコンホメーション「オン」状態に切り替えて、YFP生成をオフにする。これらのアンチスイッチは、互いに独立に作用して、遺伝的サーキットにわたる組合せた制御を与える。図5bは、2つのアンチスイッチ構築物(s1、s9)の、それらのそれぞれの標的(GFP、YFP)に対する、それらのそれぞれのエフェクター分子(テオフィリン、テトラサイクリン)の存在下又は非存在下での、イン・ビボでの調節活性を示している。
図6は、ncRNA発現構築物の配列及び開裂機構を示している。この発現構築物は、2つのハンマーヘッドリボザイム配列の間に、ユニークな制限部位BamHI、EcoRI、SalI及びXhoIによって、一般的配列をクローン化することができる(12)。予想された開裂部位を、矢印によって示し、一般的なncRNAインサートを点線で示してある。開裂後に、生成したncRNAは、限定された3’及び5’末端を有する。
図7は、アンチスイッチs1の、ヌクレアーゼマッピングによる構造探査を示している。試料は、濃度を変えたテオフィリン及びRNアーゼT1の存在下でインキュベートしたs1に対応している。RNアーゼT1は、一本鎖G’sの3’を開裂させる。ピーク1は、アンチセンスドメインに対応し、ピーク2は、スイッチングアプタマーステムに対応する。テオフィリンの非存在下及び200μMテオフィリンの両方において、スイッチングアプタマーステムは、開裂され(ピーク2)、これは、このドメインが、一本鎖形態(ヌクレアーゼが接近可能)であることを示している。2mM テオフィリンにおいて、このピークは、存在せず、これは、アプタマーステムが、二本鎖ステム中に防護されていることを示している。その上、2mM テオフィリンにおいて、ピーク2の消失がピーク1の出現と同時に起き、これは、アンチセンスドメインが、ヌクレアーゼに接近可能な一本鎖形態であることを示している。このピークは、一層低レベルのテオフィリンでは存在せず、これは、これらの濃度におけるアンチスイッチのこの領域の接近可能性の変化を支持している。
図8は、リガンド結合の非存在下での、アンチスイッチs5、s6及びs7の配列及び予想された構造を示している。13、アンチセンス配列;14、スイッチングアプタマーステム配列;15、改変配列。各ステム部分の安定性を示してある。s1−s1ベースの改変されたテオフィリンアプタマーアンチスイッチ;s6−不安定化された改変テオフィリンアプタマーアンチスイッチ;s7−s1ベースのテトラサイクリンアプタマーアンチスイッチ。
図9は、テトラサイクリン応答性Venus(YFP)レギュレーター、s9の配列及び構造スイッチング、並びにその標的mRNAを示している。16、アンチセンス配列;17、スイッチングアプタマーステム配列;18、標的mRNA上の開始コドン。各ステムの安定性を示してある。
図10は、イン・ビボのアンチスイッチ特性決定研究で用いられるプラスミドのセットを示している。pTARGET1及びpSWITCH1を単一アンチスイッチ−単一標的研究において用い、pTARGET2及びpSWITCH2を多数のアンチスイッチ−多数の標的研究で用いた。すべての構築物は、誘導可能なガラクトースプロモーターの制御下にあり、酵母の栄養ベースの選択マーカー、酵母の動原体複製起点、大腸菌f1複製起点、及び大腸菌アンピシリン耐性マーカーを含んでいる。
図11は、標的mRNA及びアンチスイッチs1の相対的RNAレベルを示している。相対的レベルは、テオフィリンの非存在下におけるGFPmRNAに対して標準化される。
図12は、この発明で用いることのできるプラスミドの一覧表を示している。
図13は、この発明で用いることのできるアンチスイッチ構築物、対照、及びqRT−PCRプライマーの典型的配列を示している。配列は、5’から3’方向に示されており、それらのRNA形態で示されている。
図14a〜cは、アンチスイッチベースのカフェインセンサー/勾配フィルターを示すグラフである。
図15a〜bは、多数のリガンドに結合して応答して、多数の分子リガンド入力の論理的シグナル統合を与えるアプタマー調節される核酸を示している。
図16は、多数のリガンドに結合して応答する協同的アプタマー調節される核酸の概略図を示している。
図17は、RNA干渉を利用する標的のリガンド制御された調節のためのDicer基質スイッチを示している。図17aにおいて、このスイッチは、リガンドの非存在下で「オン」であり、リガンド結合により「オフ」となる。図17bにおいて、このスイッチは、リガンドの非存在下で「オフ」であり、リガンド結合により「オン」コンホメーションに活性化される。両方の場合において、活性化状態は、エフェクタードメイン及びセンス鎖を、そのドメインをDicerによる開裂のために利用可能にするコンフィギュレーションで与える。この開裂された生成物は、標的活性の調節のためのRNAi機構において機能する。
図18は、RNA干渉を利用する標的のリガンド制御された調節のためのDrosha基質スイッチを示している。図18aにおいて、スイッチは、リガンドの非存在下で「オン」であり、リガンド結合時に「オフ」である。図18bにおいて、このスイッチは、リガンドの非存在下で「オフ」であり、リガンド結合時に「オン」コンホメーションに活性化される。
図19a〜cは、リガンドテオフィリンの結合に応答性のDicer依存性スイッチを示している。図19aは、テオフィリン濃度が、スイッチとセンス鎖との結合に影響を与えることを示している。スイッチへのテオフィリン結合は、スイッチとセンス鎖との減少した結合を生じる。図19bは、スイッチとセンス鎖のDicer依存性の開裂を示している。5’末端放射性標識したミクロスイッチとセンス鎖を、組換えDicerの存在下又は非存在下に、16時間にわたって、テオフィリン濃度を変えてインキュベートした後に、12%非変性ポリアクリルアミドゲル上に展開した。図19cは、Dicer依存性スイッチ機構の概略図を示している。このスイッチは、リガンドの非存在下で「オン」である。
図20a及び20bは、イン・ビボテオフィリン濃度に応答するDicer依存性スイッチに応答したGFP発現の減少を示している。図20aは、10nMミクロスイッチ及びセンス鎖の、テオフィリン濃度を変えて成長させているHeLa細胞へのトランスフェクションを反映するデータを示すグラフである。テオフィリンの結合は、「オフ」スイッチを引き起こす。このスイッチは、一層低いテオフィリン濃度では「オン」であり、GFP発現のRNAi媒介の減衰を引き起こす。エラーバーは、2つの独立の測定を表している。図20bは、Dicer依存性スイッチ機構の概略図を示しており、このスイッチは、リガンドの非存在下で「オン」である。
図21a〜bは、RNAiを利用する標的のリガンド制御された調節のための単一分子Dicer依存性スイッチを示している。図21aでは、このスイッチは、リガンドの非存在下で「オン」であり、リガンド結合時に「オフ」である。図21bでは、このスイッチは、リガンドの非存在下で「オフ」であり、リガンド結合時に「オン」コンホメーションに活性化される。両方の場合に、活性化状態は、エフェクタードメイン及びセンス鎖を、そのドメインをDicerによる開裂に利用可能にするコンフィギュレーションで与える。その開裂産物は、標的活性を調節するためのRNAi機構において機能する。
1.概観
本発明は、リガンド結合に応答する、トランス作用性アプタマー調節される核酸、即ち「aptaスイッチ」を提供する。一つの面は、アプタマー調節される核酸及び方法並びにこれらのアプタマー調節される核酸を含む、細胞における遺伝子発現を変調する(例えば、減衰させる)ための組成物に関係する。他の面は、試料中の分子の存否又は量を検出するためのイン・ビボセンサーとして用いることのできるアプタマー調節される核酸に関係する。トランス作用性とは、本発明のaptaスイッチが、それらのリガンド依存性の活性を、aptaスイッチと異なる分子(例えば、他の核酸)(例えば、ホスホジエステル(又は、同等物)主鎖リンカーを介して結合しておらず、尚一層好ましくは、aptaスイッチと全く共有結合していない)に対して発揮することを意味する。
一具体例において、この発明のアプタマー調節される核酸は、アプタマードメイン及びエフェクター核酸ドメインを含む。この発明のアプタマー調節される核酸には、DNA又はRNAが含まれて、一本鎖であっても二本鎖であってもよい。アプタマー調節される核酸は、多数のモジュラーコンポーネント例えば一つ以上のアプタマードメイン及び一つ以上のエフェクタードメインを含むことができる。アプタマー調節される核酸は、更に、官能基又は官能性薬剤例えば挿入剤又はアルキル化剤を含むことができる。アプタマー調節される核酸は、合成の又は非天然の核酸類似体(例えば、6−メルカプトプリン、5−フルオロウラシル、5−ヨード-2’−デオキシウリジン及び6−チオグアニン)を含むことができ、又は改変核酸を含むことができる。典型的な改変には、シトシン環外アミン、5−ブロモ−ウラシルの置換、主鎖改変、メチル化、及び異常な塩基対合の組合せが含まれる。アプタマー調節される核酸は、蛍光標識、放射性標識、化学標識、又は酵素標識などの標識を含むことができる。アプタマードメインは、リガンド結合に応答して、エフェクタードメインにおけるアロステリック変化を誘導してそのエフェクタードメインの標的分子と相互作用する能力を変える。それ故、リガンド結合は、エフェクタードメインを、「オフ」から「オン」(又は、その逆)に切り替える。それ故、アプタマー調節される核酸は、リガンド結合に応答して活性が「オフ」及び「オン」に切り替わるスイッチとして作用する。アプタマードメインのリガンドに対する応答は又、リガンドの正体及び/又はアプタマードメインに露出されたリガンドの量若しくは濃度にも依存しうる。例えば、アプタマーは、小型分子例えば薬物、代謝産物、中間体、補因子、遷移状態類似体、イオン、金属、核酸、及び毒素に結合することができる。或は、アプタマーは、天然の及び合成のポリマー(タンパク質、ペプチド、核酸、多糖類、糖タンパク質を含む)、ホルモン、レセプター及び細胞表面例えば細胞壁及び細胞膜に結合することができる。ある別の具体例において、リガンド制御される核酸のアプタマードメインは、環境変化に応答性である。環境変化には、制限はしないが、pH、温度、浸透性、又は塩濃度の変化が含まれる。エフェクター核酸ドメインは又、RNAi配列として用いることのできる配列例えばsiRNA又はmiRNAを含みうる。好適具体例において、アプタマードメインへのリガンド結合は、これらの分子のコンホメーション力学の変化を媒介し、それは、エフェクター核酸ドメインが標的核酸例えばmRNAと相互作用することを可能にする。
「アプタマー」は、特異的分子に高い親和性及び特異性で結合することのできる核酸分子例えばRNA又はDNAであってよい(Ellington等、Nature 346, 818-22(1990);及びTuerk等、Science 249, 505-10(1990))。アプタマーに結合する典型的なリガンドには、制限はしないが、小型分子例えば薬物、代謝産物、中間体、補因子、遷移状態類似体、イオン、金属、核酸及び毒素が含まれる。アプタマーは又、天然及び合成のポリマー(タンパク質、ペプチド、核酸、多糖類、糖タンパク質、ホルモンを含む)、レセプター及び細胞表面例えば細胞壁及び細胞膜に結合することもできる。このリガンドのアプタマーへの結合(典型的には、RNA)は、そのエフェクタードメインのコンホメーション変化を引き起こし、その標的分子と相互作用する能力を変える。それ故、リガンド結合は、エフェクタードメインの、遺伝子不活性化、転写、翻訳を媒介し、或は例えば標的遺伝子又はmRNAの正常な活性に干渉する能力に影響を与える。アプタマーは、最も典型的には、標的分子の結合についてのイン・ビトロ選択により得られてきた。しかしながら、アプタマーのイン・ビボ選択も又、可能である。アプタマーは、他の物質がこの核酸と複合体化されない環境において、意図する標的分子との複合体を形成することのできる特異的結合領域を有する。この結合の特異性は、アプタマーのリガンドに対する、環境中の他の物質についての又は一般に無関係の分子についての解離定数と比較した、比較解離定数(Kd)により規定される。リガンドは、アプタマーに、無関係の物質より一層大きい親和性で結合するものである。典型的には、アプタマーの、リガンドに関するKdは、無関係の物質又は環境において付随する物質とのKdより約10倍小さい。尚一層好ましくは、このKdは、少なくとも約50倍小さく、一層好ましくは、少なくとも約100倍小さく、最も好ましくは、少なくとも約200倍小さい。アプタマーは、典型的には、約10〜300ヌクレオチド長である。一層一般的に、アプタマーは、約30〜100ヌクレオチド長である。
この発明のアプタマー調節される核酸は、アンチセンス配列を含んで、標的遺伝子の発現を阻止するためにアンチセンス機構によって作用するエフェクタードメインを含むことができる。ここで用いる場合、かかるアプタマー調節される核酸は又、「アンチスイッチ」とも呼ばれる。アンチセンス技術は、遺伝子発現を調節するために広く利用されてきた(Buskirk等、Chem Biol 11, 1157-63(2004);及びWeiss等、Cell Mol Life Sci 55, 334-58(1999))。ここで用いる場合、「アンチセンス」技術は、細胞条件下で、少なくとも一種の標的タンパク質をコードする関心ある標的核酸(mRNA及び/又はゲノムDNA)と特異的に、該タンパク質の発現を、例えば転写及び/又は翻訳を立体障害などにより阻止すること、選択的スプライシング、又は転写物の開裂誘導若しくは酵素的不活性化によって阻害するようにハイブリダイズする(例えば、結合する)分子又はそれらの誘導体の投与又はイン・シトゥー生成を指す。この結合は、慣用の塩基対相補性によるものであってよく、又は、例えばDNA二本鎖への結合の場合には、二重らせんの大きい溝における特異的相互作用によるものであってよい。一般に、「アンチセンス」技術は、当分野で一般的に用いられる技術の範囲を指し、核酸配列への特異的結合に依存する任意の治療を含む。
RNA干渉(RNAi)は、二本鎖(ds)RNA依存性の遺伝子特異的な転写後サイレンシングを示す現象である。この現象を哺乳動物細胞の実験操作に利用しようとする初期の試みは、長いdsRNA分子に応答して活性化される丈夫な非特異的アンチウイルス防御機構によってくじかれた。Gil等、Apoptosis 2000, 5:107-114。この分野は、合成の二本鎖の21ヌクレオチドのRNAが、遺伝子特異的なRNAiを哺乳動物細胞において、包括的なアンチウイルス防御機構を呼び出すことなく、媒介することができるということが示されて有意に進歩した。Elbashir等、Nature 2001, 411:494-498;Caplen等、Proc.Natl.Acad.Sci.USA 2001, 98:9742-9727。結果として、小さい干渉性RNA(siRNA)及びミクロRNA(miRNA)が、遺伝子機能を分析するための強力なツールとなった。小型RNAの化学合成は、有望な結果を生み出してきた一本の大通りである。やはり多くのグループが、かかるsiRNAを細胞内で生成することのできるDNAベースのベクターの開発を追求してきた。幾つかのグループは、最近、このゴールを確認して、一般に、細胞内で効率的にプロセッシングを受けてsiRNAを形成する短かいヘアピン(sh)RNAの転写を含む類似のストラテジーを公開した。Paddison等、PNAS 2002, 99:1443-1448;Paddison等、Genes & Dev 2002, 16:948-958;Sui等、PNAS 2002, 8:5515-5520;及びBrummelkamp等、Science 2002, 296:550-553。これらの報告は、多くの内因的及び外因的に発現された遺伝子を特異的に標的とすることのできるsiRNAを生成する方法を記載している。
発明の更なる面は、リガンド制御される核酸分子の種々の分野における応用に関係する。例えば、アプタマー調節される核酸を利用して、試料中の標的分子の存否又は量を検出することができる。標的分子は、代謝産物、イオン、ペプチド、核酸などであってよい。同様に、アプタマー調節される核酸を、イメージング目的のために利用することができる。更に、アプタマー調節される核酸は、エフェクター核酸ドメインが、ある環境(例えば、特定の細胞内位置又は細胞膜)を標的とするように利用することができる。
この発明のアプタマー調節される核酸は、細胞における代謝産物のレベルを感知して検出するためのツール(非侵襲的でありうる)として機能することができる。このイメージング又は検出は、少なくとも一種の関心ある代謝産物の定量化のために利用することができる。或は、それを用いて、経路を通る過剰な流れ及び生成物形成を制御するためのシグナリング経路中のある種の酵素を調節すること又は細胞内のタンパク質又は酵素のターゲティングレベルによる代謝状態を変えることができる。
この発明のアプタマー調節される核酸は又、取込み、分配及び/又は吸収を助成するために、他の分子、分子構造、又は化合物の混合物(例えば、リポソーム、ポリマー、レセプター標的分子、経口投与用、局所投与用その他の配合物)と混合し、結合させ、或は会合させることができる。主題のアプタマー調節される核酸は、浸透増進剤、キャリアー化合物及び/又はトランスフェクション剤をも含む配合物にて提供することができる。
この発明の一つの面は、細胞におけるリガンドの量及び/又は活性を変調する方法を提供する。この方法は、リガンドに応答性のアプタマーをデザインして選択すること及び、選択したアプタマー及びエフェクターRNAを含むアプタマー調節される核酸を用意することを含むことができ、このエフェクターRNAは、リガンドを例えば代謝産物又は中間体分子として含む細胞内の、分子、シグナリング及び/又は代謝経路(即ち、リガンドと関係したシグナリング及び/又は代謝経路)を標的とする。この方法は、細胞をアプタマー調節される核酸と、細胞中のリガンドの濃度及び/又は活性を変調するのに十分な量及び/又は時間で接触させることを更に含むことができる(スイッチオンの場合)。
この発明を今や一般的に説明したので、それは、下記の実施例を参照することにより一層容易に理解することができよう。これらは、単に、本発明のある面及び具体例の説明の目的で含むものであり、この発明を制限することを意図したものではない。
標準的分子生物学技術を利用してすべてのプラスミドを構築した(Sambrook等、Molecular cloning:A laboratory manual (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 2001))。4つの異なるプラスミド構築物を、pRS314−Gal及びpRS316−Galシャトルベクター中にクローン化することによって生成した(Sikorski等、Genetics 122, 19-27(1989))。遺伝子及びアンチスイッチ構築物を、GAL1プロモーターの下流のマルチクローニング部位にクローン化した。これらのプラスミド(図10及び12参照)は、大腸菌の複製起点(f1)及びアンピシリン耐性の選択マーカー、並びにS.セレビシエの複製起点(CEN6−ARSH4)及びトリプトファンに対する選択マーカー(TRP1−pRS314)及びウラシル(URA3−pRS316)生合成遺伝子を、これらのプラスミドを有する細胞を、適当なアミノ酸欠落溶液を補った合成の完全培地で選択するために含んでいる(Sambrook等、Molecular cloning:A laboratory manual (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 2001))。第一のプラスミドシステム、pTARGET1において、yEGFPを、マルチクローニング部位にクローン化した(GAL1プロモーターとADH1ターミネーターの間に位置する)。第二のプラスミドシステム、pSWITCH1において、様々なアンチスイッチを、GAL1プロモーターとADH1ターミネーターの間に位置する2つのハンマーヘッドリボザイムの間にクローン化した。第三のプラスミドシステム、pTARGET2において、PGAL−Venus−ADH1term構築物を、pTARGET1中のPGAL−yEGFP−ADH1term構築物の下流にクローン化した。それ故、pTARGET2は、ガラクトースで誘導された場合に、2つの標的転写物を生成する。第四のシステム、pSWITCH2において、PGAL−アンチスイッチ−ADH1term構築物を、pSWITCH1中のPGAL−アンチスイッチ−ADH1term構築物の下流にクローン化した。それ故、pSWITCH2は、ガラクトースの存在により誘導された場合に、2つのアンチスイッチ構築物を生成する。2つのプラスミドのセット、pTARGET1及びpSWITCH1又はpTARGET2及びpSWITCH2を、S.セレビシエ中に同時にトランスフォームして、適当な栄養選択圧を加えて維持した。これら2つのプラスミドセットにおいて、アンチスイッチ構築物及びそれらの標的の発現が、ガラクトースの培地への添加に際して誘導された。オリゴヌクレオチドプライマーは、Integrated DNA Technologies から購入した。すべての遺伝子及びアンチスイッチを、Dyad PCRマシン(MJ Research)にて、TaqDNAポリメラーゼ(Roche)を用いてPCR増幅した。yegfp遺伝子がpSVA1535から得られ、venus遺伝子がpCS2/Venusから得られた(Nagai等、Nat Biotechnol 20, 87-90(2002))。すべてのアンチスイッチ配列は、カスタムオリゴヌクレオチドデザインを利用して得られた(図12参照)。
酵母細胞を、適当な欠落溶液及び糖質源(2% ラフィノース、1% シュークロース)を補った合成完全培地に接種して、一晩、30℃で成長させた。細胞を新鮮な培地に戻して希釈し、0.1のOD600として、30℃で成長させた。アンチスイッチ活性をアッセイするために、この新鮮な培地は、適当な濃度のテオフィリン(Sigma)、カフェイン(Sigma)、テトラサイクリン(Sigma)、又は水(負の対照)を含み、そして発現を2%ガラクトースの終濃度にして誘導し、又は等容積の水を加えた(非誘導対照)。3時間の成長の後に、GFP及びVenusレベルをSafire(Tecan)蛍光プレートリーダーセット上で、適当な励起(GFP−485nm;Venus−515nm)及び放出(GFP−515nm;Venus−508nm)波長についてアッセイした。アンチセンスの一過性応答をアッセイするために、細胞を、2%ガラクトースを含む新鮮な培地に戻して希釈した。誘導培地で3時間成長させた後で、テオフィリン又は水を加えて、蛍光を経時的にモニターした。蛍光を、細胞数につき、相対的蛍光単位(RFU)を培地のOD600で除することによって標準化した。
酵母細胞を、タンパク質発現アッセイに詳述された方法に従って成長させた。全RNAを標準的酸フェノール抽出手順を用いて抽出した(Caponigro等、Mol Cell Biol 13, 5141-8(1993))。簡単にいえば、細胞をペレット化して、液体窒素中で凍結させた。ペレットを、50mM NaOAc(pH5.2)及び10mM EDTA緩衝液に懸濁させた。細胞を、終濃度1.6%のSDSの添加及び等容の酸フェノールの添加によって溶解させた。溶液を65℃に維持して、10分間、間欠的にボルテックスミキサー処理した。氷上で冷却後、水相を抽出して、更に、等容のクロロホルムを用いて抽出を実施した。RNA試料をエタノール沈殿させて、水中に再懸濁させた。全RNAを、OD260の読みにより定量した。RNA試料を、製造業者の指示に従ってDNアーゼ(Invitrogen)処理した。cDNAを、遺伝子特異的なプライマー(図13参照)及びスーパースクリプトIII逆転写酵素(Invitrogen)を利用して、製造業者の指示に従って合成した。qRT−PCRを、このcDNAについて、iCycler iQシステム(BioRAD)を利用して行なった。試料を、iQ SYBRグリーンスーパーミックス及び、種々のテンプレートに特異的なプライマー対(図13参照)を、cDNA希釈シリーズに用いて、製造業者の指示に従って用意した。データを、iCycler iQソフトウェアを利用して分析した。
アンチスイッチ及び標的配列を、T7ポリメラーゼプロモーターを含むプライマーを用いてPCR増幅した。RNAを、AmpliscribeT7転写キット(Epicentre)を製造業者の指示に従って用いて転写した(但し、転写を、42℃で行ない、ゲルシフトアッセイには、アンチスイッチを、[α−32P]−UTPの転写混合物への添加により放射性標識した)。このRNAを、15%変性ゲル上で精製して、溶出させ、エタノール沈殿させて、水中に再懸濁させた。RNAを、OD260の読みによって定量した。ヌクレアーゼマッピングのために、アンチスイッチを、25μgのRNAを、DMSO(Sigma)に溶解させたホスフェート反応性標識と、標識緩衝液(0.12M メチルイミダゾール pH9.0、0.16M EDAC)中で4時間、製造業者の指示に従ってインキュベートすることにより、5’末端で蛍光標識(Molecular Probes)した。標識したRNAを、エタノール沈殿及び12%変性ゲル上での泳動により精製した。蛍光バンドをゲルから切り出して、37℃で3時間にわたって水中に溶出させて、エタノール沈殿させた。
RNAの自由エネルギーを、RNA structure バージョン3.71(Mathews等、Proc.Natl.Acad.Sci.USA 101, 7287-92(2004))を用いて計算した。
アンチセンス技術は、遺伝子発現を調節するために広く利用されてきた(Weiss等、Cell Mol Life Sci 55, 334-58 (1999);及びScherer等、Nat Biotechnol 21, 1457-65 (2003))。アロステリック調節機能性は、プラットフォームであって、その上でリガンド結合構造がアンチセンス分子に付加される当該プラットフォームをデザインすることによって巧みに処理されてきた。このプラットフォームにおいて、アンチセンスドメインは、リガンドの非存在下で、「アンチセンスステム」又は「アンチセンスエフェクタードメイン」中に隔離される。リガンドのアプタマードメインへの結合は、アンチセンスステムのコンホメーション力学を変化させ、それは、一層一本鎖形態であるアンチセンスドメインを生じる(図1a)。かかる機構は、シグナリングアプタマー及び他のアロステリックに制御されるRNAの構築において記載されてきた(Nutiu等、J Am Chem Soc 125, 4771-8(2003))。
S.セレビシエにおけるアンチスイッチの発現を、前に記載された系(Taira等、Nucleic Acids Res 19, 5125-30(1991))と類似の新規な非コードRNA(ncRNA)発現構築物を利用して達成した(図6参照)。簡単にいえば、発現すべきRNAを、イン・ビボで自己開裂することが知られた2つのハンマーヘッドリボザイムの間にクローン化する(Samarsky等、Proc.Natl.Acad.Sci.USA 96, 6609-14(1999))。この二重ハンマーヘッドの構築物を、PolIIプロモーターの制御下に置くことができ、転写された際に、隣接するハンマーヘッドリボザイムは、99%より大きい効率で、所望のRNAから開裂してはずれる(図11参照)。この構築物は、潜在的に干渉する隣接配列を有しない限定された5’及び3’末端を有するncRNAの創作を可能にする。アンチスイッチs1は、この構築物において、酵母細胞におけるガラクトース誘導性(GAL1)プロモーターの制御下で発現された。酵母で増進されるGFP(yEGFP)(Mateus等、Yeast 16, 1313-23(2000))をGAL1プロモーターの制御下に含むプラスミドを、同じ細胞にトランスフォームした(図1a)。
定量的リアルタイムPCR(qRT−PCR)を、種々の条件下で成長させた細胞から抽出したアンチスイッチs1及び標的mRNAについて行なって、相対的RNAレベルを測定した(図11参照)。標的転写物の相対的レベルは、テオフィリンの非存在下及び高レベルのテオフィリンにて成長させたs1を有する細胞間で有意に変わらず、これは、アンチスイッチが、標的RNAレベルに影響するよりも、翻訳の阻害によって機能することを示している。加えて、定常状態のs1の相対的レベルは、アンチスイッチと標的は、同じプロモーターから発現されるにもかかわらずに、標的レベルの約1,000倍であった。これは、アンチスイッチ分子が、おそらく二次構造を安定化するか又は一層効率的に合成されることにより、mRNAより一層高い細胞内安定性を有しうることを示している。アンチスイッチ調節の一過性の応答を、アンチスイッチの活性化を、定常状態レベルのGFP及び「オフ」状態のs1を発現する細胞へのテオフィリンの添加により誘導することによって測定した(図1d)。GFPレベルは、テオフィリンの添加後すぐに、約0.5〜1時間の半減期に相当する速度で減少を開始し、これは、これらの実験で用いたGFP変異体の半減期と一致する(Mateus等、Yeast 16, 1313-23(2000))。このデータは、アンチスイッチ分子が、それらの標的mRNAからの翻訳を、活性化レベルのエフェクターの存在下で阻止するように迅速に作用すること及び標的タンパク質レベルの低減に要する時間は、そのタンパク質の半減期によって決定されることを支持している。
アンチスイッチプラットフォームの切り替え挙動は、RNA構造のコンホメーション力学に依存しており;それ故、アンチスイッチの熱力学的特性を変えることによって、直接的仕方で切り替え挙動を調整することが可能である。アンチセンスステム及びアプタマーステムの絶対的及び相対的安定性は、アンチスイッチのスイッチ挙動の調整において重要なデザインパラメーターであるということが予想される。スイッチ挙動のダイナミックレンジを探究するために、我々は、アンチセンス及びアプタマーステムの安定性を変えて幾つかのアンチスイッチ(s2〜s4)を造った(図2a)。これらの変化させたアンチスイッチは、遺伝子発現における切り替えが認められ且つGFP発現のダイナミックレンジが増大する濃度範囲に広がるということが予想された。
アンチスイッチデザインプラットフォームのモジュール性を示すために、幾つかの異なるアンチスイッチ分子を構築して、種々のアプタマードメイン間で交換することにより特性決定した(図8参照)。アプタマードメインにおけるこれらの変化は、標的転写物を同じに維持したので、アンチセンスステム及びスイッチングアプタマーステムを以前のデザインと同じに維持するようにデザインされたが、アプタマーモジュールの残りは、交換により失われる。デザインしたアンチスイッチのリガンド応答性の範囲を更に探究するために、我々は、スイッチs5を、以前に特性決定された、テオフィリンに対して一層低い親和性を示すアプタマー(Zimmermann等、PNAS 6, 659-67(2000))を利用して構築した。このアプタマーは、s1〜s4で用いられたアプタマーより約10倍高いKdを有している。加えて、このアンチスイッチの応答は、s2と同じ仕方でアンチセンスステムを不安定化させることにより調整され、s6を生じた。このプラットフォームのモジュール性を更に調べるために、アンチスイッチを、以前にテトラサイクリンに対して特性決定したアプタマー(Berens等、Bioorg Med Chem 9, 2549-56(2001))をも用いて構築した。このアプタマーは、s1〜s4で用いたテオフィリンアプタマー(Kd=1μM)と同様に、テトラサイクリンに対する親和性を有している。図3a〜3bのデータは、異なるアプタマードメインに対するアンチスイッチプラットフォームのモジュール性を支持している。これらの改変されたテオフィリンアプタマーは、s1〜s4において、リガンド濃度に対する変化した応答を示している。予想されたように、s5及びs6に関するスイッチングは、一層高濃度のテオフィリンにおいて生じている(図3a)。有意に、s5は、s1のアプタマードメインの10倍のKdを有するアプタマードメインを含み、凡そ10倍高いテオフィリン濃度でスイッチしている。加えて、テトラサイクリンアンチスイッチs7は、s1〜s4と類似のスイッチ力学を示しており、これは、認められた応答曲線が、デザインされたアンチスイッチの一般的特徴であることを示唆している。
アンチスイッチプラットフォームの可撓性を更に調べるために、我々は、このプラットフォームを、s1のデザインにおいて利用したアプタマー及びアンチセンスドメインから「オン」アンチスイッチを構築することを企てて、改めた。テオフィリンの非存在下で発現を阻止するが、テオフィリンの存在下では発現を許すアンチスイッチs8を、類似のデザイン原理を利用して構築した。このスイッチは、そのアンチセンスドメインをリガンドの非存在下で示し、それを、自由に標的mRNAと相互作用させるが、リガンドが存在する場合には、そのアンチセンスをアプタマーステム中に隔離する(図4a)。s8は、s1と類似の力学的挙動を示す(1mM テオフィリン付近でスイッチングする)が、これは、類似の塩基対エネルギー特性のためである(図4b)。この機能的「オン」スイッチは、このスイッチプラットフォームの可撓性及びデザインテーマの一般性を示している。
このアンチスイッチプラットフォームのモジュール性は、遺伝子発現の組み合わせた制御を示すシステムを可能にする。これを説明するために、我々は、細胞に、2つのスイッチを導入した。その各々は、異なるエフェクター分子に応答性であり、各々異なるmRNA標的のタンパク質発現を調節する:s1は、テオフィリン応答性GFPレギュレーターであり、s9(図9参照)は、テトラサイクリン応答性の黄色蛍光性変異タンパク質(Venus)(Nagai等、Nat Biotechnol 20, 87-90(2002))レギュレーターである(図5a)。これらの分子のターゲティング能力の変化を、アンチセンスステムとスイッチングアプタマーステムとを、アプタマー分子の残りを同じに維持しつつ交換することにより生じさせた。これら2つのアンチスイッチの、GFPとVenusを両方有するプラスミドを用いた同時発現は、遺伝子発現のモジュラーアンチスイッチデザインによる同時調節のアッセイを可能にした。図5bに示したように、テオフィリンの添加は、GFPの発現を減少させたが、Venusの発現は、影響されないままであり、テトラサイクリンの添加は、Venusを減少させたが、GFPには影響していない。その上、両リガンドの添加は、GFPとVenusの両方の発現を減少させた。この試料系は、多数のアンチスイッチ構築物によって正確に調節される一層複雑な遺伝子サーキットの構築の潜在的可能性を示している。
2:スイッチする「アプタマーステム」
3:アンチセンス配列
4:スイッチングアプタマーステム配列
5:標的mRNA上の開始コドン
6:アンチセンス配列
7:スイッチングアプタマーステム配列
8:改変された配列
9:アンチセンス配列
10:スイッチングアプタマーステム配列
11:標的mRNA上の開始コドン
12:ユニークな制限部位
13:アンチセンス配列
14:スイッチングアプタマーステム配列
15:改変配列
16:アンチセンス配列
17:スイッチングアプタマーステム配列
18:標的mRNA上の開始コドン
Claims (52)
- (i)外来のRNase酵素活性に対する基質を形成することのできる基質配列、及び(ii)リガンドに結合するアプタマーを包含する核酸であって、リガンドの該アプタマーへの結合が、核酸のコンホメーション変化を引き起こし、それが、基質配列の、該基質を形成する能力を変え及び/又は外来酵素活性の基質のKm及び/若しくはKcatを変える、当該核酸。
- 前記RNase酵素がRNaseIII酵素例えばDicer又はDroshaである請求項1に記載の核酸。
- 前記の核酸が、リボ核酸(RNA)である、請求項1又は2に記載の核酸。
- 前記の核酸が、少なくとも一つの天然にないヌクレオシド類似体及び/又は天然にないヌクレオシド残基間の主鎖リンカーを含む、請求項1又は2に記載の核酸。
- 天然のヌクレオシド及びホスフェート主鎖リンカーの対応する核酸と比較して、異なる安定性、ヌクレアーゼ感受性(又は耐性)及び/又はバイオアベイラビリティーを有する、請求項4に記載の核酸。
- 50〜200ヌクレオチドのサイズの範囲にある、請求項1又は2に記載の核酸。
- コンホメーション変化が、分子内二本鎖特徴(前記の基質配列を含む)を生成し又は除去し、二本鎖特徴が、外来酵素活性の基質である、請求項1又は2に記載の核酸。
- 前記の核酸が、前記のアプタマー、前記のRNaseIII酵素、及び前記の基質配列の配列へのリガンド結合に依存する様式で遺伝子サイレンシングを引き起こす、請求項2に記載の核酸。
- 前記の基質配列が、siRNA、miRNA又はそれらの前駆体若しくは代謝産物をRNA干渉経路で、前記のRNaseIII酵素による反応の産物として生成する、請求項8に記載の核酸。
- コンホメーション変化が、基質配列の能力を変えて第二の核酸種との分子間二本鎖特徴を形成し、二本鎖特徴が外来酵素活性の基質である、請求項1又は2に記載の核酸。
- 第二の核酸種が、mRNAであって、前記の外来酵素活性が、mRNAを、二本鎖特徴の形成に依存する様式で変える、請求項10に記載の核酸。
- 外来酵素活性が、RNaseH酵素及び/又はRNaseP酵素である、請求項1、10又は11の何れかに記載の核酸。
- 前記のリガンドが、前記の基質配列の基質を形成する能力に変化をもたらし及び/又は外来酵素活性の基質のKm及び/若しくはKcatを変えて投与量依存性速度論を示す、請求項1又は2に記載の核酸。
- リガンドが、2500amu未満の分子量を有する小型分子であり且つ/又は細胞透過性である、請求項1又は2に記載の核酸。
- リガンドが、金属イオンである、請求項1又は2に記載の核酸。
- リガンドが、天然産物である、請求項1又は2に記載の核酸。
- リガンドが、シグナル変換二次メッセンジャー分子である、請求項16に記載の核酸。
- リガンドが、翻訳後修飾されたタンパク質である、請求項16に記載の核酸。
- リガンドを、ポリペプチド、ペプチド、核酸、炭水化物、脂肪酸及び脂質、非ペプチドホルモン(ステロイドなど)及びこれらの代謝前駆体又は産物よりなる群から選択する、請求項1又は2に記載の核酸。
- リガンドを、酵素補因子、酵素基質又は酵素媒介反応の産物よりなる群から選択する、請求項1又は2に記載の核酸。
- (i)転写されたとき請求項3に記載のRNAを生成するコード配列、及び(ii)この発現構築物を含む細胞における該RNAの転写を調節する少なくとも一つの転写調節配列を含む発現構築物。
- アプタマー調節される核酸のライブラリーであって、請求項1若しくは2の核酸又は請求項21に記載の発現構築物の何れかの核酸の多彩な集団を含む当該ライブラリー。
- 少なくとも一つの請求項21に記載の発現構築物で巧みに処理された組換え細胞。
- 請求項1又は2に記載の少なくとも一の核酸を含む細胞。
- 請求項1又は2に記載の核酸又は請求項21に記載の発現構築物、及びヒト又は非ヒト患者への投与に適した製薬上許容しうるキャリアーを含む医薬製剤組成物。
- 前記RNaseIII酵素がDrosha又はDicerである請求項2に記載の核酸。
- 前記siRNA、miRNA又はそれらの前駆体若しくは代謝産物のヌクレオチドの長さが19〜35である請求項9に記載の核酸。
- 前記siRNA、miRNA又はそれらの前駆体若しくは代謝産物のヌクレオチドの長さが21〜23である請求項9又は27に記載の核酸。
- 前記基質配列がヘアピンループを有する請求項1又は2に記載の核酸。
- 前記核酸が官能基又は官能性薬剤を更に含む請求項1又は2に記載の核酸。
- 前記アプタマードメインが、pH、温度、浸透性、又は塩濃度に応答性である請求項1又は2に記載の核酸。
- 前記核酸の前記アプタマードメインがリガンド結合に従順である請求項1又は2に記載の核酸。
- 前記核酸が一種以上のアプタマードメイン又は一種以上のエフェクタードメインを含む請求項1又は2に記載の核酸。
- 前記核酸が複数のリガンドと相互作用して応答する請求項1又は2に記載の核酸。
- 請求項1又は2に記載の核酸であって、前記核酸は協同的リガンドに制御された核酸であり、複数のリガンドが、複数のアプタマードメインに順次的に結合して、一つ以上のエフェクタードメインをアロステリック的に調節する、該核酸。
- リガンドの存在又は非存在に依存した細胞内標的遺伝子発現を与える、イン・ビトロ又はエキス・ビボの方法であって、請求項9に記載の核酸を細胞内に導入することを含み、前記siRNA、miRNA又はそれらの前駆体若しくは代謝産物は、前記標的遺伝子の発現を制御する、該方法。
- 標的遺伝子が、細胞の生物学的又は生化学的な応答を変調させる遺伝子である請求項36に記載の方法。
- 細胞内のリガンドの量又は活性を変調するためのイン・ビトロ又はエキス・ビボの方法であって、
請求項9に記載の核酸を細胞に投与することを含み、
前記siRNA、miRNA又はそれらの前駆体若しくは代謝産物は、前記リガンドの量若しくは活性、又は前記リガンドの量若しくは活性に影響を与えるタンパク質、代謝産物、中間体分子、又は酵素を変調する該方法。 - 細胞内のリガンドの量又は濃度をモニターするためのイン・ビトロ又はエキス・ビボの方法であって、
請求項9に記載の核酸を投与することを含み、
前記siRNA、miRNA又はそれらの前駆体若しくは代謝産物は、レポーター分子の量又は活性を変調させ、
前記細胞内のリガンドの量又は濃度は前記レポーター分子の量又は活性と相関する該方法。 - リガンドの量又は活性の存在又は非存在に応答した細胞の生物学的な又は生化学的な応答を変調するためのイン・ビトロ又はエキス・ビボの方法であって、
請求項9に記載の核酸を細胞に投与することを含み、
前記siRNA、miRNA又はそれらの前駆体若しくは代謝産物は、前記リガンドの量若しくは活性、又は前記リガンドの量若しくは活性に影響を与える分子、タンパク質、代謝産物、中間体分子、又は酵素を変調する該方法。 - 条件付遺伝子ネットワークを確立するためのイン・ビトロ又はエキス・ビボの方法であって、
請求項9に記載の核酸を細胞に投与することを含み、
前記siRNA、miRNA又はそれらの前駆体若しくは代謝産物は、シグナリング経路、代謝経路、酵素経路又は該リガンドを生成し若しくはその活性を変調する生化学的経路と関係しない分子を標的とする該方法。 - 内因性又は異質性遺伝子の細胞内標的発現を減衰又は変調させるためのイン・ビトロ又はエキス・ビボの方法であって、
前記標的遺伝子の発現を減衰させ又は変調させるのに充分な量で、請求項9に記載の核酸を、細胞に接触させることを含み、
前記siRNA、miRNA又はそれらの前駆体若しくは代謝産物が、前記標的遺伝子の発現を減衰させ又は変調させる該方法。 - 前記変調又は減衰が細胞の成長、分裂、生存、又は分化を変える請求項42に記載の方法。
- 前記リガンドが組織特異的又は細胞型特異的である請求項42に記載の方法。
- 前記標的遺伝子が糖尿病の開始又は進行に関係する請求項42に記載の方法。
- 前記標的遺伝子がICAM−1である請求項42に記載の方法。
- 請求項9に記載の核酸であって、病原体によって発現する遺伝子を制御するのに充分な量の核酸であり、病原体による感染を治療又は予防する際に用いるための核酸であり、前記遺伝子は病原体の感染性または毒性に影響を与える該核酸。
- 患者の細胞における細胞の増殖、分化、又は生存を制御するためのイン・ビトロ又はエキス・ビボの方法であって、
請求項9に記載の核酸を患者の細胞に導入することを含み、
前記siRNA、miRNA又はそれらの前駆体若しくは代謝産物が、細胞内標的遺伝子の発現を制御し、且つ細胞の増殖、分化、又は生存を制御する該方法。 - 前記核酸が細胞死、細胞の分化、又は細胞の生存を誘導する請求項48に記載の方法。
- 請求項48に記載の方法であって、過形成又は腫瘍細胞の成長を防止するための方法であり、肥満細胞の細胞死を誘導する、幹細胞の増殖若しくは分化を制御する、又は免疫応答の活性化を制御する該方法。
- 前記標的遺伝子が発癌遺伝子である請求項48に記載の方法。
- 請求項9に記載の核酸であって、過形成又は腫瘍細胞の成長を防止するための核酸であり、肥満細胞の細胞死を誘導する、幹細胞の増殖若しくは分化を制御する、又は免疫応答の活性化を制御する該核酸。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US61597704P | 2004-10-05 | 2004-10-05 | |
| US60/615,977 | 2004-10-05 | ||
| US64165805P | 2005-01-06 | 2005-01-06 | |
| US60/641,658 | 2005-01-06 | ||
| PCT/US2005/036161 WO2006042112A2 (en) | 2004-10-05 | 2005-10-05 | Aptamer regulated nucleic acids and uses thereof |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012178625A Division JP5795563B2 (ja) | 2004-10-05 | 2012-08-10 | アプタマー調節される核酸及びその利用 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2008515405A JP2008515405A (ja) | 2008-05-15 |
| JP2008515405A5 JP2008515405A5 (ja) | 2008-11-27 |
| JP5101288B2 true JP5101288B2 (ja) | 2012-12-19 |
Family
ID=36075582
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007534921A Expired - Fee Related JP5101288B2 (ja) | 2004-10-05 | 2005-10-05 | アプタマー調節される核酸及びその利用 |
| JP2012178625A Expired - Fee Related JP5795563B2 (ja) | 2004-10-05 | 2012-08-10 | アプタマー調節される核酸及びその利用 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012178625A Expired - Fee Related JP5795563B2 (ja) | 2004-10-05 | 2012-08-10 | アプタマー調節される核酸及びその利用 |
Country Status (5)
| Country | Link |
|---|---|
| US (3) | US9315862B2 (ja) |
| EP (1) | EP1799825B1 (ja) |
| JP (2) | JP5101288B2 (ja) |
| AT (1) | ATE514776T1 (ja) |
| WO (1) | WO2006042112A2 (ja) |
Families Citing this family (89)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050256071A1 (en) * | 2003-07-15 | 2005-11-17 | California Institute Of Technology | Inhibitor nucleic acids |
| WO2006042112A2 (en) | 2004-10-05 | 2006-04-20 | California Institute Of Technology | Aptamer regulated nucleic acids and uses thereof |
| US7727721B2 (en) | 2005-03-08 | 2010-06-01 | California Institute Of Technology | Hybridization chain reaction amplification for in situ imaging |
| WO2007044727A2 (en) | 2005-10-07 | 2007-04-19 | California Institute Of Technology | Pkr activation via hybridization chain reaction |
| WO2007100412A2 (en) * | 2005-12-21 | 2007-09-07 | Yale University | Methods and compositions related to the modulation of riboswitches |
| US20080026947A1 (en) * | 2006-02-08 | 2008-01-31 | Gmeiner William H | Cytotoxic nucleotides for targeted therapeutics |
| US20090023221A1 (en) * | 2006-05-19 | 2009-01-22 | Exigon A/S | Oligonucleotide probes useful for detection and analysis of microrna precursors |
| WO2007136833A2 (en) * | 2006-05-19 | 2007-11-29 | Codon Devices, Inc. | Methods and compositions for aptamer production and uses thereof |
| US8445655B2 (en) * | 2006-06-16 | 2013-05-21 | Cornell Research Foundation, Inc. | Functional nucleic acid ligands to fluorescent proteins |
| WO2008127382A2 (en) * | 2006-10-19 | 2008-10-23 | Yale University | Computational design of ribozymes |
| WO2008058291A2 (en) | 2006-11-09 | 2008-05-15 | California Institute Of Technology | Modular aptamer-regulated ribozymes |
| KR20100015757A (ko) * | 2007-03-22 | 2010-02-12 | 예일 유니버시티 | 택일적 스플라이싱을 조절하는 리보스위치와 관련된 방법 및 조성물 |
| WO2008122088A1 (en) * | 2007-04-05 | 2008-10-16 | Lifeprint Australia Pty Ltd | Methods for detecting a target nucleotide sequence in a sample utilising a nuclease-aptamer complex |
| JP5223237B2 (ja) * | 2007-05-14 | 2013-06-26 | ソニー株式会社 | 検出用核酸鎖及び物質間の結合又は相互作用検出方法 |
| US9217151B2 (en) * | 2007-05-16 | 2015-12-22 | California Institute Of Technology | Versatile nucleic acid hairpin motif for programming biomolecular self-assembly pathways |
| US20090082217A1 (en) * | 2007-07-16 | 2009-03-26 | California Institute Of Technology | Selection of nucleic acid-based sensor domains within nucleic acid switch platform |
| EP2185706B1 (en) | 2007-08-14 | 2017-09-27 | Commonwealth Scientific and Industrial Research Organisation | Improved gene silencing methods |
| US8367815B2 (en) * | 2007-08-28 | 2013-02-05 | California Institute Of Technology | Modular polynucleotides for ligand-controlled regulatory systems |
| US20120165387A1 (en) | 2007-08-28 | 2012-06-28 | Smolke Christina D | General composition framework for ligand-controlled RNA regulatory systems |
| US8865667B2 (en) | 2007-09-12 | 2014-10-21 | California Institute Of Technology | Higher-order cellular information processing devices |
| US9029524B2 (en) * | 2007-12-10 | 2015-05-12 | California Institute Of Technology | Signal activated RNA interference |
| US8329889B2 (en) | 2008-02-15 | 2012-12-11 | Trustees Of Boston University | In vivo gene sensors |
| JP5463621B2 (ja) * | 2008-02-27 | 2014-04-09 | ソニー株式会社 | 標的物質の定量方法 |
| US8497364B2 (en) * | 2008-02-27 | 2013-07-30 | California Institute Of Technology | Triggered RNAi |
| US20100021904A1 (en) * | 2008-05-21 | 2010-01-28 | Pierce Niles A | Shielded cross-linking probes |
| US8241854B2 (en) * | 2008-05-22 | 2012-08-14 | California Institute Of Technology | Triggered RNAi |
| US20100021901A1 (en) * | 2008-05-22 | 2010-01-28 | Peng Yin | Compositions and methods for detecting analytes |
| JP5594838B2 (ja) * | 2008-07-09 | 2014-09-24 | 公立大学法人大阪市立大学 | オリゴヌクレオチド構造体および遺伝子発現制御方法 |
| US8877908B2 (en) * | 2008-07-11 | 2014-11-04 | The Administrators Of The Tulane Educational Fund | Stimulus-responsive apta chelamers |
| US8329882B2 (en) | 2009-02-18 | 2012-12-11 | California Institute Of Technology | Genetic control of mammalian cells with synthetic RNA regulatory systems |
| US9145555B2 (en) * | 2009-04-02 | 2015-09-29 | California Institute Of Technology | Integrated—ligand-responsive microRNAs |
| US9284559B2 (en) * | 2009-04-14 | 2016-03-15 | Wake Forest University Health Sciences | Multivalent aptamer complexes |
| US8895242B2 (en) * | 2009-10-20 | 2014-11-25 | The Regents Of The University Of California | Single molecule nucleic acid nanoparticles |
| US8658780B2 (en) | 2010-05-18 | 2014-02-25 | California Institute Of Technology | Triggered covalent probes for imaging and silencing genetic expression |
| WO2011163526A2 (en) * | 2010-06-23 | 2011-12-29 | California Institute Of Technology | Signal activated molecular delivery |
| US8877438B2 (en) | 2010-07-20 | 2014-11-04 | California Institute Of Technology | Self-assembled polynucleotide structure |
| US9834439B2 (en) | 2010-07-20 | 2017-12-05 | California Institute Of Technology | Biomolecular self-assembly |
| US8962241B2 (en) | 2010-07-20 | 2015-02-24 | California Institute Of Technology | Triggered molecular geometry based bioimaging probes |
| WO2012056441A1 (en) * | 2010-10-28 | 2012-05-03 | Nanodoc Ltd. | Compositions and methods for specific cleavage of exogenous rna in a cell |
| US9115355B2 (en) | 2011-06-23 | 2015-08-25 | California Institute Of Technology | Exonuclease resistant polynucleotide and related duplex polynucleotides, constructs, compositions, methods and systems |
| US9725715B2 (en) | 2011-06-23 | 2017-08-08 | California Institute Of Technology | Signal activatable constructs and related components compositions methods and systems |
| CA2853829C (en) | 2011-07-22 | 2023-09-26 | President And Fellows Of Harvard College | Evaluation and improvement of nuclease cleavage specificity |
| US9862994B2 (en) | 2012-02-09 | 2018-01-09 | Dana-Farber Cancer Institute, Inc. | Selective nucleic acid amplification from nucleic acid pools |
| WO2013142735A1 (en) | 2012-03-21 | 2013-09-26 | California Institute Of Technology | Targeting domain and related signal activated molecular delivery |
| WO2013161964A1 (ja) * | 2012-04-27 | 2013-10-31 | キリンホールディングス株式会社 | リガンドを高感度に検出する核酸分子並びに該核酸分子のスクリーニング方法および該核酸分子の感度の最適化方法 |
| US9856472B2 (en) | 2013-07-01 | 2018-01-02 | California Institute Of Technology | Small conditional RNAs |
| AU2014290454A1 (en) | 2013-07-18 | 2016-01-28 | President And Fellows Of Harvard College | Specific nucleic acid amplification with compounded selectivity |
| US20150044192A1 (en) | 2013-08-09 | 2015-02-12 | President And Fellows Of Harvard College | Methods for identifying a target site of a cas9 nuclease |
| US9359599B2 (en) | 2013-08-22 | 2016-06-07 | President And Fellows Of Harvard College | Engineered transcription activator-like effector (TALE) domains and uses thereof |
| US9388430B2 (en) | 2013-09-06 | 2016-07-12 | President And Fellows Of Harvard College | Cas9-recombinase fusion proteins and uses thereof |
| US9737604B2 (en) | 2013-09-06 | 2017-08-22 | President And Fellows Of Harvard College | Use of cationic lipids to deliver CAS9 |
| US9228207B2 (en) * | 2013-09-06 | 2016-01-05 | President And Fellows Of Harvard College | Switchable gRNAs comprising aptamers |
| US9486533B2 (en) | 2013-09-27 | 2016-11-08 | Wake Forest University Health Sciences | Pharmaceutical compositions for high-capacity targeted delivery |
| JP6267217B2 (ja) * | 2013-09-30 | 2018-01-24 | Necソリューションイノベータ株式会社 | ターゲットの分析方法および分析キット |
| CA2930015A1 (en) | 2013-11-07 | 2015-05-14 | Editas Medicine, Inc. | Crispr-related methods and compositions with governing grnas |
| US11053481B2 (en) | 2013-12-12 | 2021-07-06 | President And Fellows Of Harvard College | Fusions of Cas9 domains and nucleic acid-editing domains |
| WO2015095633A1 (en) * | 2013-12-20 | 2015-06-25 | Board Of Regents, The University Of Texas System | Methods and compositions related to nucleic acid circuits and signal transducers |
| AU2015277369B2 (en) | 2014-06-16 | 2021-08-19 | The Johns Hopkins University | Compositions and methods for the expression of CRISPR guide RNAs using the H1 promoter |
| US10077453B2 (en) | 2014-07-30 | 2018-09-18 | President And Fellows Of Harvard College | CAS9 proteins including ligand-dependent inteins |
| US10240146B2 (en) * | 2014-07-30 | 2019-03-26 | President And Fellows Of Harvard College | Probe library construction |
| KR101719285B1 (ko) | 2014-11-04 | 2017-03-23 | 한국과학기술원 | 표적 물질에 의해 조절되는 핵산 중합효소 활성을 이용한 생체물질의 검출 및 정량 방법 |
| EA202092665A3 (ru) | 2015-02-02 | 2021-06-30 | МЕИРЭДжТиЭкс ЮКей II ЛИМИТЕД | Регулирование экспрессии генов посредством аптамеропосредованного модулирования альтернативного сплайсинга |
| US9434996B1 (en) * | 2015-03-13 | 2016-09-06 | Tracy Ann Hayden | All mini-STR multiplex with increased C.E. through-put by STR prolongation template fusion |
| US20180094309A1 (en) * | 2015-04-03 | 2018-04-05 | President And Fellows Of Harvard College | Nucleic acid retro-activated primers |
| IL294014B2 (en) | 2015-10-23 | 2024-07-01 | Harvard College | Nucleobase editors and their uses |
| IL302802A (en) | 2016-07-05 | 2023-07-01 | California Inst Of Techn | Hybridization chain reaction based on a minimal initiator |
| IL308426A (en) | 2016-08-03 | 2024-01-01 | Harvard College | Adenosine nuclear base editors and their uses |
| US11661590B2 (en) | 2016-08-09 | 2023-05-30 | President And Fellows Of Harvard College | Programmable CAS9-recombinase fusion proteins and uses thereof |
| US11542509B2 (en) | 2016-08-24 | 2023-01-03 | President And Fellows Of Harvard College | Incorporation of unnatural amino acids into proteins using base editing |
| CA3034617A1 (en) | 2016-08-30 | 2018-03-08 | California Institute Of Technology | Immunohistochemistry via hybridization chain reaction |
| SG11201903089RA (en) | 2016-10-14 | 2019-05-30 | Harvard College | Aav delivery of nucleobase editors |
| WO2018119359A1 (en) | 2016-12-23 | 2018-06-28 | President And Fellows Of Harvard College | Editing of ccr5 receptor gene to protect against hiv infection |
| US11898179B2 (en) | 2017-03-09 | 2024-02-13 | President And Fellows Of Harvard College | Suppression of pain by gene editing |
| WO2018165536A1 (en) * | 2017-03-10 | 2018-09-13 | The Medical College Of Wisconsin, Inc. | Riboswitch modulated gene therapy for retinal diseases |
| EP3592777A1 (en) | 2017-03-10 | 2020-01-15 | President and Fellows of Harvard College | Cytosine to guanine base editor |
| CA3056411A1 (en) * | 2017-03-15 | 2018-09-20 | The Broad Institute, Inc. | Crispr effector system based diagnostics for virus detection |
| JP7191388B2 (ja) | 2017-03-23 | 2022-12-19 | プレジデント アンド フェローズ オブ ハーバード カレッジ | 核酸によってプログラム可能なdna結合蛋白質を含む核酸塩基編集因子 |
| US11560566B2 (en) | 2017-05-12 | 2023-01-24 | President And Fellows Of Harvard College | Aptazyme-embedded guide RNAs for use with CRISPR-Cas9 in genome editing and transcriptional activation |
| US11788123B2 (en) | 2017-05-26 | 2023-10-17 | President And Fellows Of Harvard College | Systems and methods for high-throughput image-based screening |
| WO2018226666A1 (en) * | 2017-06-05 | 2018-12-13 | Maumita Mandal | Methods, compositions, and devices involving pseudoknot formation |
| CN111801345A (zh) | 2017-07-28 | 2020-10-20 | 哈佛大学的校长及成员们 | 使用噬菌体辅助连续进化(pace)的进化碱基编辑器的方法和组合物 |
| US11319532B2 (en) | 2017-08-30 | 2022-05-03 | President And Fellows Of Harvard College | High efficiency base editors comprising Gam |
| CN111757937A (zh) | 2017-10-16 | 2020-10-09 | 布罗德研究所股份有限公司 | 腺苷碱基编辑器的用途 |
| WO2020191243A1 (en) | 2019-03-19 | 2020-09-24 | The Broad Institute, Inc. | Methods and compositions for editing nucleotide sequences |
| AU2021265719A1 (en) * | 2020-03-06 | 2022-11-03 | California Institute Of Technology | Analysis of target molecules within a sample via hybridization chain reaction |
| DE112021002672T5 (de) | 2020-05-08 | 2023-04-13 | President And Fellows Of Harvard College | Vefahren und zusammensetzungen zum gleichzeitigen editieren beider stränge einer doppelsträngigen nukleotid-zielsequenz |
| US11873485B2 (en) | 2021-01-26 | 2024-01-16 | California Institute Of Technology | Allosteric conditional guide RNAs for cell-selective regulation of CRISPR/Cas |
| KR102661292B1 (ko) * | 2021-09-09 | 2024-04-30 | 포항공과대학교 산학협력단 | 금속 이온 반응성 dna 중합 효소 스위치 및 이에 의해 제어되는 등온 증폭 방법 |
| WO2023131811A2 (en) * | 2021-12-15 | 2023-07-13 | Meiragtx Uk Ii Limited | Polycistronic expression of gut peptides |
Family Cites Families (117)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6019A (en) * | 1849-01-09 | Cast-iron car-wheel | ||
| US1000289A (en) | 1910-09-14 | 1911-08-08 | Arthur Low Patterson | Stocking-folder. |
| US4235871A (en) | 1978-02-24 | 1980-11-25 | Papahadjopoulos Demetrios P | Method of encapsulating biologically active materials in lipid vesicles |
| US4534899A (en) | 1981-07-20 | 1985-08-13 | Lipid Specialties, Inc. | Synthetic phospholipid compounds |
| US4426330A (en) | 1981-07-20 | 1984-01-17 | Lipid Specialties, Inc. | Synthetic phospholipid compounds |
| US4501728A (en) | 1983-01-06 | 1985-02-26 | Technology Unlimited, Inc. | Masking of liposomes from RES recognition |
| US4897355A (en) | 1985-01-07 | 1990-01-30 | Syntex (U.S.A.) Inc. | N[ω,(ω-1)-dialkyloxy]- and N-[ω,(ω-1)-dialkenyloxy]-alk-1-yl-N,N,N-tetrasubstituted ammonium lipids and uses therefor |
| US4737323A (en) | 1986-02-13 | 1988-04-12 | Liposome Technology, Inc. | Liposome extrusion method |
| US4902505A (en) | 1986-07-30 | 1990-02-20 | Alkermes | Chimeric peptides for neuropeptide delivery through the blood-brain barrier |
| DE3788914T2 (de) | 1986-09-08 | 1994-08-25 | Ajinomoto Kk | Verbindungen zur Spaltung von RNS an eine spezifische Position, Oligomere, verwendet bei der Herstellung dieser Verbindungen und Ausgangsprodukte für die Synthese dieser Oligomere. |
| US4987071A (en) | 1986-12-03 | 1991-01-22 | University Patents, Inc. | RNA ribozyme polymerases, dephosphorylases, restriction endoribonucleases and methods |
| US5116742A (en) | 1986-12-03 | 1992-05-26 | University Patents, Inc. | RNA ribozyme restriction endoribonucleases and methods |
| US4837028A (en) | 1986-12-24 | 1989-06-06 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US5264423A (en) | 1987-03-25 | 1993-11-23 | The United States Of America As Represented By The Department Of Health And Human Services | Inhibitors for replication of retroviruses and for the expression of oncogene products |
| US5276019A (en) | 1987-03-25 | 1994-01-04 | The United States Of America As Represented By The Department Of Health And Human Services | Inhibitors for replication of retroviruses and for the expression of oncogene products |
| US4904582A (en) | 1987-06-11 | 1990-02-27 | Synthetic Genetics | Novel amphiphilic nucleic acid conjugates |
| US5176996A (en) | 1988-12-20 | 1993-01-05 | Baylor College Of Medicine | Method for making synthetic oligonucleotides which bind specifically to target sites on duplex DNA molecules, by forming a colinear triplex, the synthetic oligonucleotides and methods of use |
| US5354844A (en) | 1989-03-16 | 1994-10-11 | Boehringer Ingelheim International Gmbh | Protein-polycation conjugates |
| US5108921A (en) | 1989-04-03 | 1992-04-28 | Purdue Research Foundation | Method for enhanced transmembrane transport of exogenous molecules |
| ZA902710B (en) | 1989-05-22 | 1991-12-24 | Univ Georgia Res Found | Enzyme luminescence assay |
| US5256775A (en) | 1989-06-05 | 1993-10-26 | Gilead Sciences, Inc. | Exonuclease-resistant oligonucleotides |
| US5227170A (en) | 1989-06-22 | 1993-07-13 | Vestar, Inc. | Encapsulation process |
| US5013556A (en) | 1989-10-20 | 1991-05-07 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US5356633A (en) | 1989-10-20 | 1994-10-18 | Liposome Technology, Inc. | Method of treatment of inflamed tissues |
| US5527528A (en) | 1989-10-20 | 1996-06-18 | Sequus Pharmaceuticals, Inc. | Solid-tumor treatment method |
| US5264564A (en) | 1989-10-24 | 1993-11-23 | Gilead Sciences | Oligonucleotide analogs with novel linkages |
| US5469854A (en) | 1989-12-22 | 1995-11-28 | Imarx Pharmaceutical Corp. | Methods of preparing gas-filled liposomes |
| US5580575A (en) | 1989-12-22 | 1996-12-03 | Imarx Pharmaceutical Corp. | Therapeutic drug delivery systems |
| US5264618A (en) | 1990-04-19 | 1993-11-23 | Vical, Inc. | Cationic lipids for intracellular delivery of biologically active molecules |
| WO1991017424A1 (en) | 1990-05-03 | 1991-11-14 | Vical, Inc. | Intracellular delivery of biologically active substances by means of self-assembling lipid complexes |
| US5270163A (en) | 1990-06-11 | 1993-12-14 | University Research Corporation | Methods for identifying nucleic acid ligands |
| JPH0813274B2 (ja) | 1990-08-13 | 1996-02-14 | アイシス・ファーマシューティカルス・インコーポレーテッド | 遺伝子発現を検出及び変調する糖修飾されたオリゴヌクレオチド |
| US5500357A (en) | 1990-11-02 | 1996-03-19 | Agency Of Industrial Science & Technology, Ministry Of International Trade & Industry | RNA transcription system using novel ribozyme |
| JP3220180B2 (ja) | 1991-05-23 | 2001-10-22 | 三菱化学株式会社 | 薬剤含有タンパク質結合リポソーム |
| US5582981A (en) | 1991-08-14 | 1996-12-10 | Gilead Sciences, Inc. | Method for identifying an oligonucleotide aptamer specific for a target |
| US5214135A (en) | 1991-08-30 | 1993-05-25 | Chemgenes Corporation | N-protected-2'-O-methyl-ribonucleosides and N-protected 2'-O-methyl-3'-cyanoethyl-N-,N-diisopropyl phosphoramidite ribonucleosides |
| US5525719A (en) | 1991-08-30 | 1996-06-11 | Chemgenes Corporation | N-protected-2'-O-methyl-and N-protected-3'-O-methyl-ribonucleosides and their phosphoramidite derivatives |
| NZ244306A (en) | 1991-09-30 | 1995-07-26 | Boehringer Ingelheim Int | Composition for introducing nucleic acid complexes into eucaryotic cells, complex containing nucleic acid and endosomolytic agent, peptide with endosomolytic domain and nucleic acid binding domain and preparation |
| US5521291A (en) | 1991-09-30 | 1996-05-28 | Boehringer Ingelheim International, Gmbh | Conjugates for introducing nucleic acid into higher eucaryotic cells |
| TW393513B (en) | 1991-11-26 | 2000-06-11 | Isis Pharmaceuticals Inc | Enhanced triple-helix and double-helix formation with oligomers containing modified pyrimidines |
| US5756291A (en) | 1992-08-21 | 1998-05-26 | Gilead Sciences, Inc. | Aptamers specific for biomolecules and methods of making |
| US5583020A (en) | 1992-11-24 | 1996-12-10 | Ribozyme Pharmaceuticals, Inc. | Permeability enhancers for negatively charged polynucleotides |
| JP3351476B2 (ja) | 1993-01-22 | 2002-11-25 | 三菱化学株式会社 | リン脂質誘導体及びそれを含有するリポソーム |
| US5395619A (en) | 1993-03-03 | 1995-03-07 | Liposome Technology, Inc. | Lipid-polymer conjugates and liposomes |
| US5462854A (en) | 1993-04-19 | 1995-10-31 | Beckman Instruments, Inc. | Inverse linkage oligonucleotides for chemical and enzymatic processes |
| US5534259A (en) | 1993-07-08 | 1996-07-09 | Liposome Technology, Inc. | Polymer compound and coated particle composition |
| US5543158A (en) | 1993-07-23 | 1996-08-06 | Massachusetts Institute Of Technology | Biodegradable injectable nanoparticles |
| US5417978A (en) | 1993-07-29 | 1995-05-23 | Board Of Regents, The University Of Texas System | Liposomal antisense methyl phosphonate oligonucleotides and methods for their preparation and use |
| US5595756A (en) | 1993-12-22 | 1997-01-21 | Inex Pharmaceuticals Corporation | Liposomal compositions for enhanced retention of bioactive agents |
| US5651981A (en) | 1994-03-29 | 1997-07-29 | Northwestern University | Cationic phospholipids for transfection |
| US5543152A (en) | 1994-06-20 | 1996-08-06 | Inex Pharmaceuticals Corporation | Sphingosomes for enhanced drug delivery |
| US5777153A (en) | 1994-07-08 | 1998-07-07 | Gilead Sciences, Inc. | Cationic lipids |
| US5591721A (en) | 1994-10-25 | 1997-01-07 | Hybridon, Inc. | Method of down-regulating gene expression |
| US5512295A (en) | 1994-11-10 | 1996-04-30 | The Board Of Trustees Of The Leland Stanford Junior University | Synthetic liposomes for enhanced uptake and delivery |
| US5767099A (en) | 1994-12-09 | 1998-06-16 | Genzyme Corporation | Cationic amphiphiles containing amino acid or dervatized amino acid groups for intracellular delivery of therapeutic molecules |
| US5830430A (en) | 1995-02-21 | 1998-11-03 | Imarx Pharmaceutical Corp. | Cationic lipids and the use thereof |
| US5851548A (en) | 1995-06-07 | 1998-12-22 | Gen-Probe Incorporated | Liposomes containing cationic lipids and vitamin D |
| JP4338106B2 (ja) | 1995-06-07 | 2009-10-07 | ライフ テクノロジーズ コーポレーション | ペプチド増強カチオン脂質トランスフェクション |
| WO1997042317A1 (en) | 1996-05-07 | 1997-11-13 | T Cell Sciences, Inc. | APTAMERS FOR COMPLEMENT PROTEIN C3b |
| US5849902A (en) | 1996-09-26 | 1998-12-15 | Oligos Etc. Inc. | Three component chimeric antisense oligonucleotides |
| AU8505898A (en) | 1997-07-22 | 1999-02-16 | Genitrix, Llc | Nucleic acid compositions and methods of introducing nucleic acids into cells |
| AU1252099A (en) | 1997-11-26 | 1999-06-15 | Medical Research Council | Improved selex procedure and an anti-cd4 aptamer |
| US6180348B1 (en) | 1998-04-20 | 2001-01-30 | Weihua Li | Method of isolating target specific oligonucleotide ligands |
| US6458559B1 (en) * | 1998-04-22 | 2002-10-01 | Cornell Research Foundation, Inc. | Multivalent RNA aptamers and their expression in multicellular organisms |
| EP1073732A2 (en) * | 1998-04-29 | 2001-02-07 | Ribozyme Pharmaceuticals, Inc. | Nucleoside triphosphates and their incorporation into ribozymes |
| US7001733B1 (en) * | 1998-05-12 | 2006-02-21 | Rigel Pharmaceuticals, Inc. | Methods and compositions for screening for modulations of IgE synthesis, secretion and switch rearrangement |
| AU5677699A (en) * | 1998-08-21 | 2000-03-14 | Affymetrix, Inc. | Expression monitoring for human cytomegalovirus (hcmv) infection |
| AU1201600A (en) | 1998-10-08 | 2000-04-26 | University Of Massachusetts | Controlling gene expression in living cells |
| US20060172925A1 (en) * | 1998-10-26 | 2006-08-03 | Board Of Regents, The University Of Texas System | Thio-siRNA aptamers |
| US20060121510A1 (en) | 1998-11-03 | 2006-06-08 | Breaker Ronald R | Multidomain polynucleotide molecular sensors |
| US6958215B1 (en) * | 1999-03-15 | 2005-10-25 | Geron Corporation | Methods and compositions for inhibition of RNA splicing |
| US6951722B2 (en) * | 1999-03-19 | 2005-10-04 | Takara Bio Inc. | Method for amplifying nucleic acid sequence |
| US20040072785A1 (en) | 1999-11-23 | 2004-04-15 | Wolff Jon A. | Intravascular delivery of non-viral nucleic acid |
| US7098030B2 (en) | 1999-12-31 | 2006-08-29 | Mirus Bio Corporation | Polyampholytes for delivering polyions to a cell |
| AU2001245793A1 (en) | 2000-03-16 | 2001-09-24 | Cold Spring Harbor Laboratory | Methods and compositions for rna interference |
| WO2001086296A2 (en) | 2000-05-05 | 2001-11-15 | Agilix Corporation | Highly multiplexed reporter carrier systems |
| EP1364009A2 (en) | 2000-06-15 | 2003-11-26 | Board of Regents, The University of Texas System | Regulatable, catalytically active nucleic acids |
| US6706474B1 (en) | 2000-06-27 | 2004-03-16 | Board Of Trustees Of The University Of Illinois | Nucleic acid enzyme biosensors for ions |
| EP1311298A2 (fr) * | 2000-08-18 | 2003-05-21 | Aventis Pharma S.A. | Systeme de regulation in vivo de l'expression d'un transgene par inhibition conditionnelle |
| US7115369B2 (en) * | 2001-03-15 | 2006-10-03 | Iowa State University Research Foundation, Inc. | Functional nucleic acid probes and uses thereof |
| US6951720B2 (en) * | 2001-05-10 | 2005-10-04 | San Diego State University Foundation | Use of phosphorothiolate polynucleotides in ligating nucleic acids |
| EP1390472A4 (en) * | 2001-05-29 | 2004-11-17 | Sirna Therapeutics Inc | NUCLEIC ACID TREATMENT OF DISEASES OR SIDES RELATED TO RAS, HER2 AND HIV LEVELS |
| WO2004033620A2 (en) | 2001-11-02 | 2004-04-22 | Insert Therapeutics, Inc. | Methods and compositions for therapeutic use of rna interference |
| US20040063654A1 (en) | 2001-11-02 | 2004-04-01 | Davis Mark E. | Methods and compositions for therapeutic use of RNA interference |
| US20030124595A1 (en) | 2001-11-06 | 2003-07-03 | Lizardi Paul M. | Sensitive coded detection systems |
| WO2003046173A1 (fr) * | 2001-11-28 | 2003-06-05 | Center For Advanced Science And Technology Incubation, Ltd. | Systeme d'expression d'arn si et procede de production de cellules d'inactivation de genes fonctionnelles et analogues au moyen de ce systeme |
| EP1555874A4 (en) * | 2002-10-10 | 2006-10-04 | Oxford Biomedica Ltd | GENREGULATION WITH APTAMER AND MODULATOR COMPLEXES FOR GENE THERAPY |
| EP1585756B1 (en) | 2002-11-26 | 2010-04-21 | University of Massachusetts | Delivery of sirnas |
| DE10302421A1 (de) | 2003-01-21 | 2004-07-29 | Ribopharma Ag | Doppelsträngige Ribonukleinsäure mit verbesserter Wirksamkeit |
| US20040162235A1 (en) | 2003-02-18 | 2004-08-19 | Trubetskoy Vladimir S. | Delivery of siRNA to cells using polyampholytes |
| US20050026286A1 (en) | 2003-03-05 | 2005-02-03 | Jen-Tsan Chi | Methods and compositions for selective RNAi mediated inhibition of gene expression in mammal cells |
| WO2005001039A2 (en) * | 2003-05-29 | 2005-01-06 | Creighton University | Ribozyme-regulated small inhibitory rna (sirna) production and methods of use thereof |
| US20060178327A1 (en) | 2003-05-30 | 2006-08-10 | Yeung Wah Hin A | Inhibition of gene expression by delivery of specially selected double stranded or other forms of small interfering RNA precursors enabling the formation and function of small interfering RNA in vivo and in vitro |
| US20050026823A1 (en) | 2003-06-20 | 2005-02-03 | Biomarin Pharmaceutical Inc. | Use of the chaperone receptor-associated protein (RAP) for the delivery of therapeutic compounds to the brain and other tissues |
| US7672786B2 (en) | 2003-07-02 | 2010-03-02 | Sergey Krylov | Non-equilibrium capillary electrophoresis of equilibrium mixtures (NECEEM)—based methods for drug and diagnostic development |
| US20050256071A1 (en) * | 2003-07-15 | 2005-11-17 | California Institute Of Technology | Inhibitor nucleic acids |
| EP2567693B1 (en) | 2003-07-16 | 2015-10-21 | Protiva Biotherapeutics Inc. | Lipid encapsulated interfering RNA |
| US20050265957A1 (en) | 2004-04-08 | 2005-12-01 | Monahan Sean D | Polymerized formamides for use in delivery of compounds to cells |
| WO2005111238A2 (en) * | 2004-04-19 | 2005-11-24 | Archemix Corporation | Aptamer-mediated intracellular delivery of therapeutic oligonucleotides |
| WO2005121348A1 (en) | 2004-06-07 | 2005-12-22 | Protiva Biotherapeutics, Inc. | Lipid encapsulated interfering rna |
| WO2006042112A2 (en) | 2004-10-05 | 2006-04-20 | California Institute Of Technology | Aptamer regulated nucleic acids and uses thereof |
| WO2006086669A2 (en) | 2005-02-09 | 2006-08-17 | California Institute Of Technology | Aptamer regulated nucleic acids and uses thereof |
| US20060200878A1 (en) * | 2004-12-21 | 2006-09-07 | Linda Lutfiyya | Recombinant DNA constructs and methods for controlling gene expression |
| US20070231392A1 (en) | 2006-01-23 | 2007-10-04 | Ernst Wagner | CHEMICALLY MODIFIED POLYCATION POLYMER FOR siRNA DELIVERY |
| US7951784B2 (en) | 2006-01-26 | 2011-05-31 | University Of Massachusetts | RNA interference agents for therapeutic use |
| AU2007278899B2 (en) | 2006-06-23 | 2012-09-06 | Engenelc Molecular Delivery Pty. Ltd. | Targeted delivery of drugs, therapeutic nucleic acids and functional nucleic acids to mammalian cells via intact killed bacterial cells |
| JP5274461B2 (ja) | 2006-08-18 | 2013-08-28 | アローヘッド リサーチ コーポレイション | ポリヌクレオチドのインビボ送達のためのポリ結合体 |
| US8809514B2 (en) | 2006-09-22 | 2014-08-19 | Ge Healthcare Dharmacon, Inc. | Tripartite oligonucleotide complexes and methods for gene silencing by RNA interference |
| US8039010B2 (en) | 2006-11-03 | 2011-10-18 | Allergan, Inc. | Sustained release intraocular drug delivery systems comprising a water soluble therapeutic agent and a release modifier |
| WO2008058291A2 (en) | 2006-11-09 | 2008-05-15 | California Institute Of Technology | Modular aptamer-regulated ribozymes |
| US20090082217A1 (en) | 2007-07-16 | 2009-03-26 | California Institute Of Technology | Selection of nucleic acid-based sensor domains within nucleic acid switch platform |
| US8367815B2 (en) | 2007-08-28 | 2013-02-05 | California Institute Of Technology | Modular polynucleotides for ligand-controlled regulatory systems |
| US20120165387A1 (en) | 2007-08-28 | 2012-06-28 | Smolke Christina D | General composition framework for ligand-controlled RNA regulatory systems |
| US8865667B2 (en) | 2007-09-12 | 2014-10-21 | California Institute Of Technology | Higher-order cellular information processing devices |
| US9029524B2 (en) | 2007-12-10 | 2015-05-12 | California Institute Of Technology | Signal activated RNA interference |
| US8329882B2 (en) | 2009-02-18 | 2012-12-11 | California Institute Of Technology | Genetic control of mammalian cells with synthetic RNA regulatory systems |
| US9145555B2 (en) | 2009-04-02 | 2015-09-29 | California Institute Of Technology | Integrated—ligand-responsive microRNAs |
-
2005
- 2005-10-05 WO PCT/US2005/036161 patent/WO2006042112A2/en active Application Filing
- 2005-10-05 US US11/243,889 patent/US9315862B2/en not_active Expired - Fee Related
- 2005-10-05 JP JP2007534921A patent/JP5101288B2/ja not_active Expired - Fee Related
- 2005-10-05 EP EP05803129A patent/EP1799825B1/en not_active Not-in-force
- 2005-10-05 AT AT05803129T patent/ATE514776T1/de not_active IP Right Cessation
-
2006
- 2006-02-09 US US11/884,110 patent/US8772464B2/en active Active
-
2012
- 2012-08-10 JP JP2012178625A patent/JP5795563B2/ja not_active Expired - Fee Related
-
2014
- 2014-05-27 US US14/287,824 patent/US9309568B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| WO2006042112A2 (en) | 2006-04-20 |
| US20150024954A1 (en) | 2015-01-22 |
| US20120035065A1 (en) | 2012-02-09 |
| JP2012223201A (ja) | 2012-11-15 |
| JP2008515405A (ja) | 2008-05-15 |
| WO2006042112A9 (en) | 2006-06-29 |
| EP1799825A2 (en) | 2007-06-27 |
| EP1799825B1 (en) | 2011-06-29 |
| US9315862B2 (en) | 2016-04-19 |
| WO2006042112A3 (en) | 2006-12-21 |
| US8772464B2 (en) | 2014-07-08 |
| ATE514776T1 (de) | 2011-07-15 |
| US20060088864A1 (en) | 2006-04-27 |
| JP5795563B2 (ja) | 2015-10-14 |
| US9309568B2 (en) | 2016-04-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5795563B2 (ja) | アプタマー調節される核酸及びその利用 | |
| Holdt et al. | Circular RNAs as therapeutic agents and targets | |
| US8603996B2 (en) | Modular aptamer-regulated ribozymes | |
| Silverman | In vitro selection, characterization, and application of deoxyribozymes that cleave RNA | |
| US20090082217A1 (en) | Selection of nucleic acid-based sensor domains within nucleic acid switch platform | |
| US8865667B2 (en) | Higher-order cellular information processing devices | |
| Yoon et al. | Targeted delivery of C/EBPα-saRNA by RNA aptamers shows anti-tumor effects in a mouse model of advanced PDAC | |
| US9040495B2 (en) | General composition framework for ligand-controlled RNA regulatory systems | |
| Yang et al. | Phytohormone abscisic acid control RNA-dependent RNA polymerase 6 gene expression and post-transcriptional gene silencing in rice cells | |
| US20100292299A1 (en) | Nucleotide Motifs Providing Localization Elements and Methods of Use | |
| Bansal | MicroRNA therapeutics: Discovering novel targets and developing specific therapy | |
| Lasham et al. | A rapid and sensitive method to detect siRNA-mediated mRNA cleavage in vivo using 5′ RACE and a molecular beacon probe | |
| WO2020033938A1 (en) | Programmable conditional sirnas and uses thereof | |
| CN101072874A (zh) | 适体调节的核酸及其应用 | |
| Rossi | RNA interference: application to drug discovery and challenges to pharmaceutical development | |
| US8604176B2 (en) | Protein-responsive RNA control devices and uses thereof | |
| Crater et al. | Antisense technologies in the studying of Toxoplasma gondii | |
| Yi et al. | Efficient Silencing of Gene Expression by an ASON–Bulge–DNAzyme Complex | |
| Liu et al. | Recent development of RNAi in drug target discovery and validation | |
| Lataniotis et al. | Gene Editing and Specific MicroRNA Inhibition | |
| US20120110686A1 (en) | Cand45 tRNA-Derived Expression System for Gene Modulation | |
| Jain et al. | Technologies, Companies & Markets | |
| Litke | A Ribozyme-Mediated Mammalian Expression System and Its Utility for RNA-Based Devices and Aptamers in Live Cells | |
| Smolke | Higher-order cellular information processing devices | |
| Huang et al. | Nucleic acids as regulatory molecules |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081006 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20081006 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110705 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20111005 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20111013 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111107 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120410 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120710 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120718 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120810 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120904 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120926 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20151005 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5101288 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |