JP4986547B2 - 新規なアセトアセチルCoA合成酵素、それをコードするDNA配列、当該酵素の製造方法および当該酵素を利用したメバロン酸の製造方法 - Google Patents
新規なアセトアセチルCoA合成酵素、それをコードするDNA配列、当該酵素の製造方法および当該酵素を利用したメバロン酸の製造方法 Download PDFInfo
- Publication number
- JP4986547B2 JP4986547B2 JP2006239457A JP2006239457A JP4986547B2 JP 4986547 B2 JP4986547 B2 JP 4986547B2 JP 2006239457 A JP2006239457 A JP 2006239457A JP 2006239457 A JP2006239457 A JP 2006239457A JP 4986547 B2 JP4986547 B2 JP 4986547B2
- Authority
- JP
- Japan
- Prior art keywords
- coa
- acetoacetyl
- dna
- enzyme
- synthase
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/52—Improvements relating to the production of bulk chemicals using catalysts, e.g. selective catalysts
Landscapes
- Enzymes And Modification Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Description
テルペノイドの生合成は、メバロン酸を経由するメバロン酸経路と、メバロン酸を経由しないMEP経路(2-C-methyl-D-erythritol 4-phosphate経路)の全く異なる二つの生合成経路が知られているが、アセトアセチルCoAを経由するのは、メバロン酸経路だけである。
メバロン酸経路では、生理的にはエネルギー代謝、脂肪酸合成、テルペノイド合成の3大代謝経路で重要な役割を演じるアセチルCoAを出発物質として、〔図1〕に記載のスキーム1の反応によりイソペンテニル二リン酸(IPP)が生成することが知られている。
即ち、これまで知られているアセトアセチルCoA合成酵素(以下タイプ1)は、本発明者らによるアセトアセチルCoA合成酵素(たとえば特許文献1参照)を含めてアセチルCoA二分子からアセトアセチルCoAを生成する反応を触媒する酵素であるが、当該発明の酵素、即ちアセチルCoAとマロニルCoAを基質としてアセトアセチルCoAを生成する反応を触媒する酵素(以下タイプ2)は全く知られていなかった。
また、テルペノイドの中には、アブシジン酸、幼若ホルモン、ジベレリン、フォルスコリン、ホルボールなど生理活性を示す化合物も多い。また、構造の一部にイソプレン構造を有する複合テルペンとしてクロロフィル、ビタミンK、ユビキノン、tRNA等があり、これらも有用な生理活性を示す。
また、ユビキノンやビタミンK類には船体や橋脚等の建造物への貝類の付着阻害作用が在り、貝類付着防止塗料への応用が期待される。さらに、カロチノイドには抗酸化作用があり、β−カロチン、アスタキサンチン、クリプトキサンチン等、がん予防や免疫賦活活性を有するものとして期待されているものもある。このように、テルペノイドには生体にとって有用な物質が含まれているが、これらの化合物は全て基本骨格単位であるイソペンテニルピロリン酸(IPP)を経由して生合成されることが知られている。
放線菌Streptomyces sp. CL190株を適当な培地、例えばグルコース2%、可溶性でんぷん2.5%、大豆粉1.5%、ドライイースト0.2%、炭酸カルシウム0.4%、pH 6.2より成るKG培地で適当な温度(例えば30℃)で数日間培養する。培養後、得られた培養液より遠心分離により菌体を取得し、菌体より常法(モレキュラー・クローニング 第二版)に従い染色体DNAを単離精製する。
以下では、放線菌を例に示しながら説明するが、本発明は該菌株由来の酵素遺伝子以外でも、放線菌や微生物、動物細胞、植物細胞由来等メバロン酸経路を持つ生物由来の酵素遺伝子を形質転換してよい。
ちなみに、メバロン酸経路を利用している(メバロン酸経路を有している)宿主細胞では、動物細胞、真菌、酵母、グラム陽性菌であるActinoplanes属、 Lactobacillus属、 Mycoplasma属、Staphylococcu属、Enterococcus属、Streptococcus属、一部のStreptomyces属、グラム陰性菌であるChloropseudomonas属、Flavobacterium属、Myxococcus属、Nannocystis属、Borrelia属、古細菌であるArchaeoglobus属、Methanobacterium属、Methanococcus属、Pyrococcus属、 Cardarella属、 Halobacterium属、 Sulfolobus属、などが知られている。
また、一部のStreptomyces属はメバロン酸経路と非メバロン酸の両方を利用していることが知られている。
上記DNAを組み込んだ組換え体DNAを保有する形質転換体を培地に培養し、培養物中に本発明のアセトアセチルCoA合成酵素(タイプ2)タンパク質を生成させることができる。
本発明の形質転換体は、酵素タンパク質を効率的に発現できる能力を有する宿主細胞であればどのような細胞でも構わないが、大腸菌、パン酵母、放線菌(Streptomyces属)が好ましく、大腸菌がもっとも好ましい。また、得られた酵素タンパク質の精製・活性発現供に容易であるため得られた酵素タンパク質は水溶性であることが好ましいが、水不溶性であっても何らかの方法、例えば界面活性剤添加等、で可溶化しても良い。
本発明の形質転換体により調製した酵素タンパク質は他のタンパク質との融合タンパク質であっても良いが、融合部分がない構造が好ましい。
窒素源としては、アンモニア、塩化アンモニウム、硫酸アンモニウム、酢酸アンモニウム、リン酸アンモニウム、等の各種無機酸や有機酸のアンモニウム塩、その他含窒素化合物、並びに、ペプトン、肉エキス、酵母エキス、コーンスチープリカー、カゼイン加水分解物、大豆粕および大豆粕加水分解物、各種発酵菌体およびその消化物等が用いられる。
無機物としては、リン酸第一カリウム、リン酸第二カリウム、リン酸マグネシウム、硫酸マグネシウム、塩化ナトリウム、硫酸第一鉄、硫酸マンガン、硫酸銅、炭酸カルシウム等が用いられる。
また培養中必要に応じて、アンピシリンやテトラサイクリン、チオストレプトン等の抗生物質を培地に添加してもよい。
以上により得られた酵素タンパク質は菌体内生産の場合は宿主細胞を破壊し塩析、透析、アフィニティクロマトグラフィ、イオン交換クロマトグラフィー、分子篩クロマトグラフィー、有機溶剤処理、加熱処理等公知のタンパク質精製方法の組み合わせにより、必要な精製度まで精製する。また、反応や反応産物に支障がなければ菌体そのものや菌体を破壊した溶液、破壊溶液の可溶性画分でも良い。
(1) アセトアセチルCoA合成酵素の酵素活性の測定
アセトアセチルCoA合成酵素の酵素活性の測定は、通常の酵素の活性測定法に準じて行うことができる。
即ち、活性測定の反応液に用いる緩衝液のpHは、目的とする酵素の活性を阻害しないpH範囲であればよく、最適pHを含む範囲のpHが好ましい。
緩衝液としては、酵素活性を阻害せず、上記pHを達成できるものであればいずれの緩衝液も用いることができる。該緩衝液として、トリス塩酸緩衝液やリン酸緩衝液、硼酸緩衝液、HEPES緩衝液、MOPS緩衝液、炭酸水素緩衝液などを用いることができる。アセトアセチルCoA合成酵素においては、例えば、トリス塩酸緩衝液が好適に用いられる。
緩衝液の濃度は酵素活性に阻害を及ぼさない限りどのような濃度でも用いることができるが、好適には1mMから1Mである。
基質の濃度は反応に支障のない限りどのような濃度でも用いることができるが、好適には反応液中の濃度は0.01mM〜0.2Mである。
反応に用いる酵素濃度に特に制限はないが、通常0.001mg/mlから100mg/mlの濃度範囲で反応を行う。
用いる酵素は必ずしも単一にまで精製されている必要はなく、反応を妨害しない限り、他の侠雑蛋白質が混入した標品であってもよい。
活性の検出は、反応に伴う基質の減少、あるいは反応生成物の増加の変化を測定できる方法を用いて行うことができる。
該方法として、例えば、必要に応じて薄相クロマトグラフィー、カラムクロマトグラフィー、高速液体クロマトグラフィー法(HPLC)等により目的物質を分離定量する方法をあげることができる。また反応の進行に伴ってMg2+イオンをキレートして複合体を形成する場合には、反応液の303nmの吸光度を測定することで活性を直接測定することができる。例えば、アセトアセチルCoA合成酵素においては、生成するアセトアセチルCoAとMg2+イオンからなる複合体のもつ303 nmの吸光の増加を分光光度計で測定することにより、反応の進行に伴い増加するアセトアセチルCoAを定量し活性を検出することができる。なお、この方法は、アセトアセチルCoAの定量だけではなく、3−オキソペンタノイルCoAのような1,3-ジケトン構造を有する化合物の定量にも利用できる。
本発明で使用するHMG CoA合成酵素遺伝子は、実質的にHMG CoA合成酵素、すなわちアセトアセチルCoAとアセチルCoAからHMG CoAを生成する反応を触媒する活性をもつ酵素蛋白質をコードするDNA配列であればよい。また、酵素反応にNADPH等の補助因子を必要としてもしなくても構わない。
本発明のアセトアセチルCoA合成酵素遺伝子、HMG CoA合成酵素遺伝子およびHMG CoA還元酵素遺伝子は、いかなる生物由来であっても構わないが、宿主である放線菌細胞中で酵素遺伝子から産生される酵素蛋白質の発現効率が高いことが好ましい。また発現した酵素蛋白質が高い触媒機能を発現できる細胞との組合せが好ましい。この点から、細胞としてメバロン酸経路を持たない微生物を用いる場合は微生物のメバロン酸経路由来の酵素遺伝子が好ましく、さらに放線菌由来が好ましい。特に放線菌由来の本発明のアセトアセチルCoA合成酵素遺伝子及び、放線菌由来のメバロン酸経路から得たHMG CoA合成酵素遺伝子およびHMG CoA還元酵素遺伝子との3種類の組合せが好ましい。
本発明で使用する宿主細胞は、メバロン酸経路を有しない放線菌、例えばStreptomyces lividans、Streptomyces chromofuscus、Streptomyces exfoliatus、Streptomyces argenteorus、等が好ましい。
上記DNAを組み込んだ組換え体DNAを保有する形質転換体を培地に培養し、培養物中に、本発明のアセトアセチルCoA合成酵素タンパク質、HMG CoA合成酵素タンパク質及びHMG CoA還元酵素タンパク質を生成させ、これらの酵素タンパク質の作用により該培養物からメバロン酸を生成蓄積させ、該培養物よりメバロン酸を採取することにより、メバロン酸を製造することができる。
本発明の形質転換体である放線菌を培養する培地は、該微生物が資化し得る炭素源、窒素源、無機塩類等を含有し、形質転換体の培養を効率的に行える培地であれば天然培地、合成培地のいずれでもよい。
窒素源としては、アンモニア、塩化アンモニウム、硫酸アンモニウム、酢酸アンモニウム、リン酸アンモニウム、等の各種無機酸や有機酸のアンモニウム塩、その他含窒素化合物、並びに、ペプトン、肉エキス、酵母エキス、コーンスチープリカー、カゼイン加水分解物、大豆粕および大豆粕加水分解物、各種発酵菌体およびその消化物等が用いられる。
無機物としては、リン酸第一カリウム、リン酸第二カリウム、リン酸マグネシウム、硫酸マグネシウム、塩化ナトリウム、硫酸第一鉄、硫酸マンガン、硫酸銅、炭酸カルシウム等が用いられる。
また培養中必要に応じて、アンピシリンやテトラサイクリン、チオストレプトン等の抗生物質を培地に添加してもよい。
メバロン酸は分子量(mw:148)が小さいことから、多くの場合形質転換体の細胞膜を透過できるため培養ろ液中に蓄積し、菌体中で検出されるメバロン酸は比較的僅かである。このため、培養ろ液を得るために菌体を遠心分離やろ過を用いて除去することが好ましい。ただし、形質転換体の細胞内に蓄積する場合は菌体もしくは菌体を含めた培養ろ液から抽出してもよい。
また、本発明は宿主にアセトアセチルCoA以降の生合成に関する酵素遺伝子を形質転換することによりさまざまなアセトアセチルCoAから生合成される生理活性物質の生産が可能である。
a)放線菌Streptomyces sp. CL 190株から、配列番号2の全長を含むN末側にBamHIサイト
(GGATCC)を、C末側にEcoRI(GAATTC)サイトを付加した配列番号5のDNA断片の取得、該DNA断片を含む大腸菌用発現ベクターpHIS8ORFnの調製及びこの発現ベクターを用いた大腸菌の形質転換
アセトアセチルCoA合成酵素(タイプ2)タンパク質をコードする遺伝子(ORFn)を十分発現させるような組換え体プラスミドをPCR法〔Science,230,1350 (1985)〕を用いて下記方法により構築した。
配列番号3に示した配列を有するセンスプライマーおよび配列番号4に示した配列を有するアンチセンスプライマーをDNA合成機を用いて合成した。
該センスプライマーの5’末端にはBamHI制限酵素サイトを、アンチセンスプライマーの5’末端にはEcoRIの制限酵素サイトを付加させた。
PCRは、95℃で30秒間、55℃で30秒間、72℃で1分間からなる反応工程を1サイクルと30サイクル行った後、72℃で10分間反応させる条件で行った。
増幅されたDNA断片をアガロースゲル電気泳動によって精製した。
精製された断片とpT7Blueベクター(Novagen社製)を混合した後エタノール沈殿を行い、得られたDNA沈殿物を5μlの蒸留水に溶解し、ライゲーション反応を行うことにより組換え体DNAを取得した。
該形質転換体より定法に従って組換えDNAを含むプラスミドを単離した。
該組換え体DNAがORFnであることをDNA配列を決定することによって確認した。
該組換え体から抽出したプラスミドを、制限酵素制限酵素BamHIとEcoRIとで消化した後、アガロースゲル電気泳動を行いBamHIとEcoRI処理ORFn含有DNA断片を取得した。
pHIS8(Biochemistry 39: 890 (2000))を制限酵素BamHIとEcoRIで消化後、アガロースゲル電気泳動を行いBamHIとEcoRI処理pHIS8断片を取得した。
上記で取得されたBamHIとEcoRI処理ORFn遺伝子含有DNA断片をBamHIとEcoRI消化pHIS8断片と混合した後、エタノール沈殿を行い、得られたDNA沈殿物を5μlの蒸留水に溶解し、ライゲーション反応を行うことにより組換え体DNAを取得した。
上記と同様の方法で、該形質転換体よりプラスミドを単離した。
上記同様、該方法により単離したプラスミドを各種制限酵素で切断して構造を調べ、目的のDNA断片が挿入されているプラスミドであることを確認した。このプラスミドをpHISORFnと命名した。
上記a)で作成したpHISORFnを常法によりDE3を有するE. coli BL21(DE3)株(Novagen社製)に導入し、カナマイシン50μg/mlに耐性を示すBL21(DE3)/ pHISORFn株を得た。
BL21(DE3)/ pHISORFn株をカナマイシン50μg/mlを含むTB液体培地100ml中、37℃で培養し、660nmの濁度が1.5に達した時点で、培養液を10分間氷冷した後、イソプロピルチオガラクトシドを終濃度0.1mMになるように添加した。さらに18℃で18時間培養した後、遠心分離(3000rpm、10分間)によって培養上清を除いた。この菌体を100mMトリス塩酸緩衝液(pH8.0)6mlに懸濁し、超音波破砕機(SONIFIER,BRANSON社製)を用いて氷冷しつつ破砕した。得られた菌体破砕液を遠心分離(10,000rpm、20分間、4℃)にかけ、上清を回収した。この細胞抽出液遠心上清をNi-NTAレジンカラム(QIAGEN社製)に通し、20mlの洗浄緩衝液〔100mM トリス塩酸(pH8.0)、50mM イミダゾール、0.5% Tween20〕で洗浄した。
ついで溶出緩衝液〔100mM トリス塩酸(pH8.0)、200mM イミダゾール〕10mlを通塔し、溶出液を1mlづつ分画した。
各分画について蛋白量を測定(BioRad社の蛋白量定量キット使用)し、蛋白質を含む画分を精製蛋白画分とした。
SDS-アクリルアミドゲル電気泳動により、分子量は34 kDaであった。
HiLoad 26/60 Superdex 200 prep grade (アマシャム社製)カラムを用いたゲル濾過による分子量測定の結果、63 kDaであったことから、本酵素は、2量体であることが分かった。
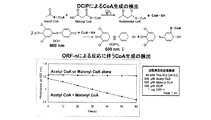
50 mM Tris-HCl (pH 8.0)、5 mM MgCl2、100 μM アセトアセチルCoA、100 μM CoA、20 μg ORF-nを含む反応液1 mlを調製し、30度で保温しながら303 nmの吸光度の変化をUV可視測定装置UV-1600PC(島津社製)で観察した。その結果、303 nmの吸光度の変化は観察されなかった(図3、アセトアセチルCoA分解活性)。このことは、実施例1で得た組換え酵素タンパク質(ORFn)には、アセトアセチルCoAを分解して、アセチルCoAを生成するチオラーゼ活性を有しないことを示している。
次に、まず、本アセトアセチルCoA合成酵素がアセチルCoAからアセトアセチルCoAが生成するかどうか以下の反応条件で調べた。
50 mM Tris-HCl (pH 8.0)、5 mM MgCl2、1 mM アセチルCoA、20 μg ORF-nを含む反応液1 mlを調製し、30度で保温しながら303 nmの吸光度の変化をUV可視測定装置UV-1600PC(島津社製)で観察した。その結果、303 nmの吸光度の変化は観察されなかった(図3、アセトアセチルCoA合成活性)。このことは、実施例1で得た組換え酵素タンパク質(ORFn)には、アセチルCoAからアセトアセチルCoAを生成する本アセトアセチルCoA合成酵素活性を有しないことを示している。
50 mM Tris-HCl (pH 8.0)、5 mM MgCl2、100 μM アセチルCoA、100 μM マロニルCoA、1 μg ORF-nを含む反応液1 mlを調製し、30度で保温しながら303 nmの吸光度の変化をUV可視測定装置UV-1600PC(島津社製)で観察した。その結果、303 nmの吸光度の変化が観察された(図4)。このことは、実施例1で得た組換え酵素タンパク質(ORFn)が、アセチルCoAとマロニルCoAとからアセトアセチルCoAを生成することを示しており、本酵素タンパク質が、アセトアセチルCoA合成酵素であることを示している。
50 mM Tris-HCl (pH 8.0)、5 mM MgCl2、100 μM マロニルCoA、20 μg ORF-nを含む反応液1 mlを調製し、30度で保温しながら303 nmの吸光度の変化をUV可視測定装置UV-1600PC(島津社製)で観察した。その結果、303 nmの吸光度の変化は観察されなかった(図6)。このことは、実施例1で得た組換え酵素タンパク質(ORFn)には、マロニルCoAからアセトアセチルCoAを生成する本アセトアセチルCoA合成酵素活性を有しないことを示している。
本アセトアセチルCoA合成酵素の酵素学的パラメーターは以下のように算出された。
アセチルCoAとマロニルCoAに対するKm値は、それぞれ、75.2±1.4 μM、14.8±0.5 μMであり、kcatは158±1 s-1であった。
50 mM Tris-HCl (pH 8.0)、5 mM MgCl2、50 μM プロピオニルCoA、50 μM マロニルCoA、50 μg ORF-nを含む反応液1 mlを調製し、30度で保温しながら303 nmの吸光度の変化をUV可視測定装置UV-1600PC(島津社製)で観察した。その結果、303 nmの吸光度の変化が観察された(図5)。このことは、実施例1で得た組換え酵素タンパク質(ORFn)が、プロピオニルCoAとマロニルCoAとから3−オキソペンタノイルCoAを生成する酵素活性も持っていることを示している。
その結果、アセチルCoAとマロニルCoAの両基質が存在する場合のみ600 nmにおける吸光度が減少した(図6)。すなわちORF-nによるアセトアセチルCoAの生成に伴い、CoAが生成していることが明らかとなった。
50 mM Tris-HCl (pH 8.0)、5 mM MgCl2、1 mM アセチルCoA、1 mM マロニルCoA、10 μg ORF-nを含む反応液1 mlを調製し、30度で1時間保温した。
この反応液(以下、反応液(酵素有り))のうち10 μlをLC-MS分析装置TSQ7000(Finnigan社製)に供した。HPLCの条件は、0分から20分まで0.1 %ヘプタフルオロ酪酸水溶液から0.1 %ヘプタフルオロ酪酸を含む40 %アセトニトリル水溶液までアセトニトリル濃度を2%/分の割合で変化させて展開した。HPLCカラムは、Develosil AR-5 (2.0 X 150 mm)(野村化学社製)を使用した。流速は0.4 ml/minで、検出は254 nmで行った。
すなわち、ORFnは以下の反応を触媒する。
アセチルCoA + マロニルCoA ( アセトアセチルCoA + CoA + CO2
放線菌用発現プラスミド、pSEMV25(Biosci. Biotech. Biochem. 68: 931 (2004))にはCL190株のメバロン酸経路遺伝子クラスターから取得したHMG CoA合成酵素遺伝子、並びにHMG CoA還元酵素遺伝子がクローニングされている。
このプラスミドのHMG CoA合成酵素遺伝子の上流にある制限酵素サイトXbaIとEcoRIの間に、以下のように、アセトアセチルCoA合成酵素遺伝子(タイプ2)(ORFn)及びそのプロモーター配列を含むと考えられる上流領域をクローニングした。該上流域は、上記HMG CoA合成酵素遺伝子の終止コドンの直後の塩基からORFnの開始コドンの直前の配列(96塩基)までとした。
該センスプライマーの5’末端にはXbaI制限酵素サイトを、アンチセンスプライマーの5’末端にはEcoRIの制限酵素サイトを付加させた。
放線菌Streptomyces sp. CL 190株の染色体DNAを鋳型として、これらプライマーおよびTaq DNA polymerase(ベーリンガー社製)を用い、DNA Thermal Cycler(パーキンエルマージャパン社製)でPCRを行うことによりORFn及びそのプロモーター配列を含むと考えられる上流領域を増幅した。
PCRは、95℃で30秒間、55℃で30秒間、72℃で2分間からなる反応工程を1サイクルと30サイクル行った後、72℃で10分間反応させる条件で行った。
増幅されたDNA断片をアガロースゲル電気泳動によって精製した。
精製された断片とpT7Blueベクター(Novagen社製)を混合した後エタノール沈殿を行い、得られたDNA沈殿物を5μlの蒸留水に溶解し、ライゲーション反応を行うことにより組換え体DNAを取得した。
該形質転換体より定法に従って組換えDNAを含むプラスミドを単離した。
該組換え体DNAがORFn及びそのプロモーター配列を含むと考えられる上流領域であることをDNA配列を決定することによって確認した。
該組換え体からプラスミドを抽出し、制限酵素制限酵素XbaIとEcoRIとで消化後、アガロースゲル電気泳動を行いXbaIとEcoRI処理ORFn及びそのプロモーター配列を含むと考えられる上流領域含有DNA断片を取得した。
pSEMV25を制限酵素XbaIとEcoRIで消化後、アガロースゲル電気泳動を行いXbaIとEcoRI処理pSEMV25断片を取得した。
上記で取得されたXbaIとEcoRI処理ORFn遺伝子及びそのプロモーター配列を含むと考えられる上流含有DNA断片をXbaIとEcoRI消化pSEMV25断片と混合した後、エタノール沈殿を行い、得られたDNA沈殿物を5μlの蒸留水に溶解し、ライゲーション反応を行うことにより組換え体DNAを取得した。
上記と同様の方法で、該形質転換体よりプラスミドを単離した。
上記同様、該方法により単離したプラスミドを各種制限酵素で切断して構造を調べ、目的のDNA断片が挿入されているプラスミドであることを確認した。このプラスミドをpSEMV25ORFnと命名した。
pSEMV25ORFnを用い、S. lividans TK23株を常法に従って形質転換体を得た。該形質転換体をS. lividans TK23 (pSEMV25ORFn)株と命名した。
S. lividans TK23 (pSEMV25ORFn)株を、チオストレプトン5μg/mlを含む10 ml のSK-II液体培地(Biosci. Biotech. Biochem. 68: 931 (2004))に1白金耳植菌し、振とう培養器で30℃、120 rpmで2日間培養を行った。得られた培養液を各2 mlずつ、チオストレプトン5μg/mlを含むKG液体培地100 mlを入れた坂口フラスコに分注し、さらに10日間培養を継続した。得られた培養液を3500 rpmで10分遠心分離を行い培養ろ液を得た。
メバロン酸は培養液から抽出の過程で環化してラクトン体となることが公知であることから、メバロノラクトンとして分析を行った。メバロノラクトンの分析は下記のように行った。
カラム:ヌクレオジル5N(CH3)2 (ドイツ、M. ナーゲル社製)、サイズ直径4.6 mm × 長さ250 mm、4 0 ℃
移動層:N-ヘキサン/イソプロパノール=9/1、流速1.0 ml/分
検出:示差屈折計 ((株)日立ハイテクノロジーズ製、L-2490型)、注入量 0.01 ml
Claims (13)
- 配列番号2の塩基配列と90%以上の相同性を有する塩基配列がコードするタンパク質であって、アセチルCoAとマロニルCoAの両方を基質としてアセトアセチルCoAを生成する反応を触媒する新規なアセトアセチルCoA合成酵素。
- アセトアセチルCoA合成酵素が、メバロン酸経路をもつ放線菌のメバロン酸経路遺伝子クラスター中に含まれるアセトアセチルCoA合成酵素遺伝子がコードするタンパク質である、請求項1記載のアセトアセチルCoA合成酵素。
- 配列番号1のアミノ酸配列を持つポリペプチド。
- 配列番号1において、1から数個のアミノ酸が欠失、置換、付加及び/または挿入されているアミノ酸配列であって、アセトアセチルCoA合成酵素活性を有するアミノ酸配列を持つポリペプチド。
- 配列番号2の塩基配列を持つDNA。
- 配列番号2において、1〜数個の塩基配列が欠失、置換、付加及び/または挿入されている塩基配列であって、アセトアセチルCoA合成酵素を機能させるために必要な配列をすべてコードする塩基配列を持つDNA。
- 配列番号2の塩基配列とストリンジェントな条件でハイブリダイズすることができる塩基配列であって、アセトアセチルCoA合成酵素を機能させるのに必要な配列をすべてコードする塩基配列を持つDNA。
- 請求項5〜7の何れか1項に記載の塩基配列を持つDNAを含むベクター。
- 請求項8に記載のベクターを有する形質転換体。
- 大腸菌である、請求項9に記載の形質転換体。
- 請求項9又は10に記載の形質転換体を培養することを特徴とするアセトアセチルCoA合成酵素の製造方法。
- 少なくとも、請求項1又は2に記載のアセトアセチルCoA合成酵素をコードする塩基配列又は請求項5〜7の何れか1項に記載の塩基配列を持つDNAを含むベクターで宿主を形質転換し、当該形質転換体内に少なくともアセトアセチルCoA合成酵素タンパク質を生成させ、少なくともアセトアセチルCoA合成酵素タンパク質の機能により、アセトアセチルCoAから生合成される生理活性物質を蓄積させることを特徴とする生理活性物質の製造方法。
- 請求項1又は2に記載のアセトアセチルCoA合成酵素をコードする塩基配列、又は請求項5〜7の何れか1項に記載の塩基配列、3−ハイドロキシ−3−メチルグルタリルコエンザイムA合成酵素をコードする塩基配列及び3−ハイドロキシ−3−メチルグルタリルコエンザイムA還元酵素をコードする塩基配列の3種類の塩基配列を持つDNAを含むベクターで放線菌を形質転換し、該形質転換体の放線菌細胞中にアセトアセチルCoA合成酵素、3−ハイドロキシ−3−メチルグルタリルコエンザイムA合成酵素及び3−ハイドロキシ−3−メチルグルタリルコエンザイムA還元酵素の3種類の酵素タンパク質を生成させ、アセトアセチルCoA合成酵素タンパク質、3−ハイドロキシ−3−メチルグルタリルコエンザイムA合成酵素タンパク質および3−ハイドロキシ−3−メチルグルタリルコエンザイムA還元酵素タンパク質の機能によりメバロン酸を蓄積させることを特徴とする新規なメバロン酸の製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006239457A JP4986547B2 (ja) | 2006-09-04 | 2006-09-04 | 新規なアセトアセチルCoA合成酵素、それをコードするDNA配列、当該酵素の製造方法および当該酵素を利用したメバロン酸の製造方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006239457A JP4986547B2 (ja) | 2006-09-04 | 2006-09-04 | 新規なアセトアセチルCoA合成酵素、それをコードするDNA配列、当該酵素の製造方法および当該酵素を利用したメバロン酸の製造方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2008061506A JP2008061506A (ja) | 2008-03-21 |
| JP2008061506A5 JP2008061506A5 (ja) | 2011-10-27 |
| JP4986547B2 true JP4986547B2 (ja) | 2012-07-25 |
Family
ID=39284757
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006239457A Active JP4986547B2 (ja) | 2006-09-04 | 2006-09-04 | 新規なアセトアセチルCoA合成酵素、それをコードするDNA配列、当該酵素の製造方法および当該酵素を利用したメバロン酸の製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4986547B2 (ja) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8173410B2 (en) | 2008-04-23 | 2012-05-08 | Danisco Us Inc. | Isoprene synthase variants for improved microbial production of isoprene |
| WO2010124146A2 (en) | 2009-04-23 | 2010-10-28 | Danisco Us Inc. | Three-dimensional structure of isoprene synthase and its use thereof for generating variants |
| JP4760951B2 (ja) | 2009-05-08 | 2011-08-31 | トヨタ自動車株式会社 | ブタノール生産能を有する組換え微生物及びブタノールの製造方法 |
| BR112012028202A2 (pt) | 2010-05-14 | 2022-08-02 | Toyota Motor Co Ltd | Método para a produção de isopropanol e levedura recombinante capaz de produzir isoprapanol. |
| JP5056897B2 (ja) * | 2010-05-14 | 2012-10-24 | トヨタ自動車株式会社 | 2−ブタノールの製造方法及び2−ブタノール生産能を有する組換え微生物 |
| US9217183B2 (en) | 2010-05-14 | 2015-12-22 | Toyota Jidosha Kabushiki Kaisha | Method for producing isopropanol and recombinant yeast capable of producing isopropanol |
| CN103443271A (zh) | 2010-10-27 | 2013-12-11 | 丹尼斯科美国公司 | 用于增加异戊二烯产量的异戊二烯合酶变体 |
| ES2699747T3 (es) | 2011-04-29 | 2019-02-12 | Danisco Us Inc | Microorganismos recombinantes para la producción potenciada de mevalonato, isopreno e isoprenoides |
| AU2012289886A1 (en) * | 2011-08-04 | 2014-02-20 | Danisco Us Inc. | Production of isoprene, isoprenoid precursors, and isoprenoids using acetoacetyl-CoA synthase |
| DK2764084T4 (da) | 2011-10-07 | 2021-12-06 | Danisco Us Inc | Anvendelse af phosphoketolase i fremstillingen af mevalonat, isoprenoid-udgangsstoffer, og isopren |
| BR112014010053A8 (pt) | 2011-10-27 | 2017-06-20 | Danisco Us Inc | variantes de isopreno sintase com solubilidade aprimorada para produção de isopreno |
| EP2794863A1 (en) | 2011-12-23 | 2014-10-29 | Danisco US Inc. | Enhanced production of isoprene using host cells having decreased ispa activity |
| EP2794876A1 (en) | 2011-12-23 | 2014-10-29 | Danisco US Inc. | Production of isoprene under reduced oxygen inlet levels |
| US9315831B2 (en) | 2012-03-30 | 2016-04-19 | Danisco Us Inc. | Direct starch to fermentable sugar as feedstock for the production of isoprene, isoprenoid precursor molecules, and/or isoprenoids |
| US9163263B2 (en) | 2012-05-02 | 2015-10-20 | The Goodyear Tire & Rubber Company | Identification of isoprene synthase variants with improved properties for the production of isoprene |
| US8895277B2 (en) | 2012-05-02 | 2014-11-25 | Danisco Us Inc. | Legume isoprene synthase for production of isoprene |
| WO2013181647A2 (en) | 2012-06-01 | 2013-12-05 | Danisco Us Inc. | Compositions and methods of producing isoprene and/or industrrial bio-products using anaerobic microorganisms |
| EP2935364A2 (en) | 2012-12-21 | 2015-10-28 | Danisco US Inc. | Production of isoprene, isoprenoid, and isoprenoid precursors using an alternative lower mevalonate pathway |
| ES2735331T3 (es) | 2013-04-10 | 2019-12-18 | Goodyear Tire & Rubber | Fosfocetolasas para mejorar la producción de metabolitos derivados de acetil-coenzima A, isopreno, precursores de isoprenoides e isoprenoides |
| US10648004B2 (en) | 2014-02-20 | 2020-05-12 | Danisco Us Inc. | Recombinant microorganisms for the enhanced production of mevalonate, isoprene, isoprenoid precursors, isoprenoids, and acetyl-CoA-derived products |
-
2006
- 2006-09-04 JP JP2006239457A patent/JP4986547B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2008061506A (ja) | 2008-03-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4986547B2 (ja) | 新規なアセトアセチルCoA合成酵素、それをコードするDNA配列、当該酵素の製造方法および当該酵素を利用したメバロン酸の製造方法 | |
| CN112789505B (zh) | 用于生产大麻素和其它异戊二烯化的化合物的生物合成平台 | |
| KR101983115B1 (ko) | 사프란 화합물의 재조합 생성을 위한 방법 및 물질 | |
| US9752163B2 (en) | Process for the production of isoprenol from mevalonate employing a diphosphomevalonate decarboxylase | |
| KR100657388B1 (ko) | 미생물에 의한 이소프레노이드 화합물의 제조 방법 | |
| DK2478109T3 (en) | A process for the enzymatic preparation of 3-hydroxy-3-methylbutyric acid from acetone and acetyl-CoA | |
| CN112176000B (zh) | 用于生产芳香醇的方法 | |
| Matsuzawa et al. | Alkylresorcylic acid synthesis by type III polyketide synthases from rice Oryza sativa | |
| Lee et al. | Cloning and characterization of the dxs gene, encoding 1-deoxy-d-xylulose 5-phosphate synthase from Agrobacterium tumefaciens, and its overexpression in Agrobacterium tumefaciens | |
| CA3190913A1 (en) | Flavin-dependent oxidases having cannabinoid synthase activity | |
| JP6951702B2 (ja) | トレハンジェリンの製造法 | |
| JP2004236618A (ja) | メバロン酸の製造方法及びそれにかかわる酵素遺伝子 | |
| CA3220674A1 (en) | Novel olivetol synthases for cannabinoid production | |
| AU2015225348B2 (en) | Method for producing methacrylic acid ester, and novel methacrylic acid ester synthase | |
| JP5726172B2 (ja) | アオウキクサ由来の新規アレンオキサイドシンターゼ | |
| JP2008212044A (ja) | 標識されたr−メバロン酸の製造方法 | |
| EP1260590B1 (en) | Method of screening substance specifically inhibiting non-mevalonate pathway | |
| JP5528666B2 (ja) | 新規化合物デヒポキサンチニルフタロシン及びその製造方法 | |
| JP2004187531A (ja) | メバロン酸の製造方法 | |
| JP4401471B2 (ja) | 微生物によるイソプレノイド化合物の製造方法 | |
| JP2005269982A (ja) | 標識されたr−メバロン酸の製造方法 | |
| WO2023168272A2 (en) | Flavin-dependent oxidases having cannabinoid synthase activity | |
| Song | The synthesis, regulation and function of biotin in bacteria | |
| JP4824985B2 (ja) | ファルネシル二リン酸の製造方法 | |
| JP2000300257A (ja) | 抗菌または除草活性化合物の探索方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090727 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110912 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20111115 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120113 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120221 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120403 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120424 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120424 |
|
| R151 | Written notification of patent or utility model registration |
Ref document number: 4986547 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R151 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150511 Year of fee payment: 3 |