JP4897681B2 - イオン・チャネルを通過する時間的に変化する電流を検出するための方法及び装置 - Google Patents
イオン・チャネルを通過する時間的に変化する電流を検出するための方法及び装置 Download PDFInfo
- Publication number
- JP4897681B2 JP4897681B2 JP2007522825A JP2007522825A JP4897681B2 JP 4897681 B2 JP4897681 B2 JP 4897681B2 JP 2007522825 A JP2007522825 A JP 2007522825A JP 2007522825 A JP2007522825 A JP 2007522825A JP 4897681 B2 JP4897681 B2 JP 4897681B2
- Authority
- JP
- Japan
- Prior art keywords
- channel
- electrode
- membrane
- voltage
- detection
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 238000000034 method Methods 0.000 title claims description 22
- 102000004310 Ion Channels Human genes 0.000 title claims description 18
- 238000001514 detection method Methods 0.000 claims description 72
- 239000012528 membrane Substances 0.000 claims description 62
- 239000003792 electrolyte Substances 0.000 claims description 45
- 102000004169 proteins and genes Human genes 0.000 claims description 11
- 108090000623 proteins and genes Proteins 0.000 claims description 11
- 230000008859 change Effects 0.000 claims description 10
- 239000011148 porous material Substances 0.000 claims description 9
- 239000000758 substrate Substances 0.000 claims description 9
- 239000012530 fluid Substances 0.000 claims description 7
- 239000012491 analyte Substances 0.000 claims description 6
- 239000002090 nanochannel Substances 0.000 claims description 5
- 239000004642 Polyimide Substances 0.000 claims description 2
- 229920005570 flexible polymer Polymers 0.000 claims description 2
- 229920001477 hydrophilic polymer Polymers 0.000 claims description 2
- 229920000515 polycarbonate Polymers 0.000 claims description 2
- 239000004417 polycarbonate Substances 0.000 claims description 2
- 229920001721 polyimide Polymers 0.000 claims description 2
- 239000007787 solid Substances 0.000 claims 2
- 150000002500 ions Chemical class 0.000 description 29
- 238000005259 measurement Methods 0.000 description 25
- 230000008901 benefit Effects 0.000 description 14
- 230000008878 coupling Effects 0.000 description 10
- 238000010168 coupling process Methods 0.000 description 10
- 238000005859 coupling reaction Methods 0.000 description 10
- 238000003776 cleavage reaction Methods 0.000 description 9
- 230000005684 electric field Effects 0.000 description 9
- 230000007017 scission Effects 0.000 description 9
- 239000003990 capacitor Substances 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 238000005516 engineering process Methods 0.000 description 6
- 150000002632 lipids Chemical class 0.000 description 6
- 230000035945 sensitivity Effects 0.000 description 6
- 238000010586 diagram Methods 0.000 description 4
- 150000001768 cations Chemical class 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 239000012212 insulator Substances 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000001629 suppression Effects 0.000 description 3
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 2
- 238000009825 accumulation Methods 0.000 description 2
- 238000000151 deposition Methods 0.000 description 2
- 238000009792 diffusion process Methods 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 229910052710 silicon Inorganic materials 0.000 description 2
- 239000010703 silicon Substances 0.000 description 2
- 108010026389 Gramicidin Proteins 0.000 description 1
- 239000000232 Lipid Bilayer Substances 0.000 description 1
- 239000000823 artificial membrane Substances 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000010292 electrical insulation Methods 0.000 description 1
- 239000007772 electrode material Substances 0.000 description 1
- 238000005530 etching Methods 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 229960004905 gramicidin Drugs 0.000 description 1
- ZWCXYZRRTRDGQE-SORVKSEFSA-N gramicidina Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@H](C(C)C)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C)NC(=O)[C@H](NC(=O)[C@H](C)NC(=O)CNC(=O)[C@@H](NC=O)C(C)C)CC(C)C)C(=O)NCCO)=CNC2=C1 ZWCXYZRRTRDGQE-SORVKSEFSA-N 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 230000033116 oxidation-reduction process Effects 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 230000010287 polarization Effects 0.000 description 1
- 238000005295 random walk Methods 0.000 description 1
- 238000006479 redox reaction Methods 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/483—Physical analysis of biological material
- G01N33/487—Physical analysis of biological material of liquid biological material
- G01N33/48707—Physical analysis of biological material of liquid biological material by electrical means
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/483—Physical analysis of biological material
- G01N33/487—Physical analysis of biological material of liquid biological material
- G01N33/48707—Physical analysis of biological material of liquid biological material by electrical means
- G01N33/48728—Investigating individual cells, e.g. by patch clamp, voltage clamp
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01R—MEASURING ELECTRIC VARIABLES; MEASURING MAGNETIC VARIABLES
- G01R19/00—Arrangements for measuring currents or voltages or for indicating presence or sign thereof
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01R—MEASURING ELECTRIC VARIABLES; MEASURING MAGNETIC VARIABLES
- G01R27/00—Arrangements for measuring resistance, reactance, impedance, or electric characteristics derived therefrom
- G01R27/02—Measuring real or complex resistance, reactance, impedance, or other two-pole characteristics derived therefrom, e.g. time constant
- G01R27/26—Measuring inductance or capacitance; Measuring quality factor, e.g. by using the resonance method; Measuring loss factor; Measuring dielectric constants ; Measuring impedance or related variables
- G01R27/2605—Measuring capacitance
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N27/00—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means
- G01N27/02—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating impedance
- G01N27/22—Investigating or analysing materials by the use of electric, electrochemical, or magnetic means by investigating impedance by investigating capacitance
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biomedical Technology (AREA)
- Physics & Mathematics (AREA)
- Chemical & Material Sciences (AREA)
- General Physics & Mathematics (AREA)
- Urology & Nephrology (AREA)
- Molecular Biology (AREA)
- Hematology (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Biophysics (AREA)
- Immunology (AREA)
- Pathology (AREA)
- Investigating Or Analyzing Materials By The Use Of Electric Means (AREA)
Description
本出願は、2004年7月23日に出願された米国特許仮出願第60/590,351号の利益を主張するものである。
米国政府は、本発明における支払い済みの実施権及び米国空軍科学研究局によって裁定された契約書A9550−05−C0050の条項で規定された他の合理的な条項のものを許諾することを特許権者に要求する限定的環境における権利を有する。
本発明は、電気的検出デバイスの技術に関し、より詳細には、膜内に配置されたイオン・チャネルを通過する時変電流を検出するための方法及び装置に関する。
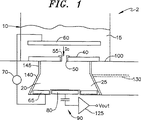
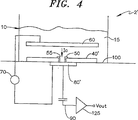
本発明は、膜を通過する時変電流を検出するための検出装置又はシステムを対象とする。本発明によれば、このシステムは、電解質で充填され膜によって分離される第1及び第2のボリュームを含む。第1のボリューム即ち槽は、大きく、複数の膜に共通になり得る。第2のボリューム即ち検出ボリュームは、一般に第1のボリュームより小さい。複数の膜が同じ槽に結合される例では、各検出ボリュームは、対象となる特定の膜へと測定を局所化する働きをする。対象の(複数の)検体が、槽内へ導入される。
Claims (27)
- 膜内に与えられたチャネルを通過する時間的に変化するイオン電流を検出するための装置であって、
内部にチャネルが配置された膜と、
前記膜がその間に配置された第1の電極及び第2の電極に接続された電圧源であって、前記第1の電極と前記第2の電極との間に電圧を印加することによって前記チャネルの両端間に電位差を確立して、前記チャネルを通過するイオン電流を生じさせるための電圧源と、
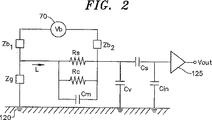
前記膜の電気的特性を測定するために配置された容量性検出電極と、
を備える装置。 - 請求項1に記載の装置であって、
槽と、
前記槽から前記膜によって分離された検出槽と、
を更に備える装置。 - 請求項1に記載の装置であって、
前記イオン電流を決定するために前記容量性検出電極に結合された回路を、
更に備える装置。 - 請求項1に記載の装置であって、前記チャネルが、イオン・チャネルと、タンパク質細孔と、ナノチャネルと、工作された開口とからなる群から選択される、装置。
- 請求項1に記載の装置であって、前記チャネルが、2つの規定された導電状態を有する、装置。
- 請求項1に記載の装置であって、前記膜が、二脂質の流体膜から形成される、装置。
- 請求項1に記載の装置であって、前記膜が、固体を構成する、装置。
- 請求項7に記載の装置であって、前記膜が、ポリカーボネートから形成される、装置。
- 請求項7に記載の装置であって、前記膜が、ポリイミドから形成される、装置。
- 請求項2に記載の装置であって、前記第1の電極が前記槽内に配置され、前記第2の電極が前記検出槽内に配置される、装置。
- 請求項10に記載の装置であって、
前記槽内の第1の電解質と、
前記検出槽内の第2の電解質と、
を更に備え、
前記第2の電極が、前記第2の電解質に容量結合され、抵抗性電流からの寄与が無視できるものである、装置。 - 請求項2に記載の装置であって、前記電圧源が、前記槽内に配置された第1の電極と、前記検出槽内に配置された前記容量性検出電極と、に接続される、装置。
- 請求項12に記載の装置であって、前記検出槽が、約1mm未満の厚さを有する、装置。
- 請求項2に記載の装置であって、前記検出槽が、約1μm未満の厚さを有する、装置。
- 請求項2に記載の装置であって、前記検出槽が、約10nm未満の厚さを有する、装置。
- 請求項1に記載の装置であって、基板を更に備え、前記膜が、前記基板上で支持される装置。
- 請求項16に記載の装置であって、前記基板が、極めて薄い粘性膜と、親水性重合体と、柔軟な重合体クッションと、エアロゲルと、キセロゲルと、テザーとからなる群から選択される、装置。
- 請求項16に記載の装置であって、前記基板が、貫通孔を備える固体表面を構成する、装置。
- 請求項16に記載の装置であって、前記第1の電極が、前記容量性検出電極の反対側の前記チャネルに直接隣接して配置される、装置。
- 請求項1に記載の装置であって、
駆動電圧を低レベルに維持して、前記チャネルを通過する前記イオン電流を最小化するための手段を、
更に備える装置。 - 請求項1に記載の装置であって、
所望期間にわたって正味の増加する信号を有する駆動電流波形を印加することにより、前記チャネルの両端間に直流又は疑似直流の電圧を生成するための手段を、
更に備える装置。 - 請求項2に記載の装置であって、
前記検出槽内の電圧の増加を相殺するために、前記電圧源の電圧の振幅を調節するための手段を、
更に備える装置。 - 槽と検出槽の間に配置された膜内のチャネルを通過する時間的に変化するイオン電流の検出方法であって、
前記槽内に検体を配置するステップ、
前記チャネルの両端間に駆動電圧を印加するステップ、及び
容量性検出電極を用いて前記膜の電気的特性を測定するステップ、
を含み、前記電気的特性は前記槽内の前記検体が原因で変化する、方法。 - 請求項23に記載の方法であって、前記チャネルが、規定された導電性状態の間を確率的な挙動で切り換わる、方法。
- 請求項23に記載の方法であって、
前記電圧の振幅を調節して、前記検出槽内の電圧の増加を相殺するステップ、
を更に含む方法。 - 請求項23に記載の方法であって、
前記駆動電圧を低レベルに維持して、前記チャネルを通過するイオン電流を最小化するステップ、
を更に含む方法。 - 請求項23に記載の方法であって、
所望期間にわたって正味の増加する信号を有する駆動電流波形を印加することにより、前記チャネルの両端間に直流又は疑似直流の電圧を生成するステップ、
を更に含む方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US59035104P | 2004-07-23 | 2004-07-23 | |
| US60/590,351 | 2004-07-23 | ||
| PCT/US2005/026181 WO2006012571A1 (en) | 2004-07-23 | 2005-07-22 | Method and apparatus for sensing a time varying current passing through an ion channel |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2008507703A JP2008507703A (ja) | 2008-03-13 |
| JP2008507703A5 JP2008507703A5 (ja) | 2011-06-02 |
| JP4897681B2 true JP4897681B2 (ja) | 2012-03-14 |
Family
ID=35786545
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007522825A Expired - Fee Related JP4897681B2 (ja) | 2004-07-23 | 2005-07-22 | イオン・チャネルを通過する時間的に変化する電流を検出するための方法及び装置 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US7622934B2 (ja) |
| JP (1) | JP4897681B2 (ja) |
| DE (1) | DE112005001781B4 (ja) |
| GB (1) | GB2431013B (ja) |
| WO (1) | WO2006012571A1 (ja) |
Families Citing this family (50)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7663211B2 (en) | 2006-05-19 | 2010-02-16 | Fairchild Semiconductor Corporation | Dual side cooling integrated power device package and module with a clip attached to a leadframe in the package and the module and methods of manufacture |
| WO2007146158A1 (en) | 2006-06-07 | 2007-12-21 | The Trustees Of Columbia University In The City Of New York | Dna sequencing by nanopore using modified nucleotides |
| DE112007001257T5 (de) | 2006-06-15 | 2009-04-09 | Electronic Bio Sciences, LLC, San Diego | Vorrichtung und Verfahren zum Sensieren eines zeitvarianten Ionenstroms in einem elektrolytischen System |
| US20110121840A1 (en) | 2007-02-20 | 2011-05-26 | Gurdial Singh Sanghera | Lipid Bilayer Sensor System |
| EP3543357A1 (en) | 2007-05-08 | 2019-09-25 | Trustees of Boston University | Chemical functionalization of solid-state nanopores and nanopore arrays and applications thereof |
| US9170228B2 (en) * | 2007-06-08 | 2015-10-27 | Bharath R. Takulapalli | Nano structured field effect sensor and methods of forming and using same |
| GB0724736D0 (en) | 2007-12-19 | 2008-01-30 | Oxford Nanolabs Ltd | Formation of layers of amphiphilic molecules |
| WO2013154750A1 (en) * | 2012-04-10 | 2013-10-17 | The Trustees Of Columbia Unversity In The City Of New York | Systems and methods for biological ion channel interfaces |
| WO2011040996A1 (en) | 2009-09-30 | 2011-04-07 | Quantapore, Inc. | Ultrafast sequencing of biological polymers using a labeled nanopore |
| US9678055B2 (en) | 2010-02-08 | 2017-06-13 | Genia Technologies, Inc. | Methods for forming a nanopore in a lipid bilayer |
| EP2534284B1 (en) * | 2010-02-08 | 2021-03-17 | Genia Technologies, Inc. | Systems and methods for manipulating a molecule in a nanopore |
| US8324914B2 (en) | 2010-02-08 | 2012-12-04 | Genia Technologies, Inc. | Systems and methods for characterizing a molecule |
| US9605307B2 (en) | 2010-02-08 | 2017-03-28 | Genia Technologies, Inc. | Systems and methods for forming a nanopore in a lipid bilayer |
| US20120052188A1 (en) | 2010-02-08 | 2012-03-01 | Genia Technologies, Inc. | Systems and methods for assembling a lipid bilayer on a substantially planar solid surface |
| ES2641871T3 (es) | 2010-12-17 | 2017-11-14 | The Trustees Of Columbia University In The City Of New York | Secuenciación de ADN mediante síntesis usando nucleótidos modificados y detección con nanoporos |
| GB2500360B (en) | 2010-12-22 | 2019-10-23 | Genia Tech Inc | Nanopore-based single DNA molecule characterization, identification and isolation using speed bumps |
| DE102011008206A1 (de) * | 2011-01-10 | 2012-07-12 | Albert-Ludwigs-Universität Freiburg | Mikrostrukturvorrichtung zur Messung an molekularen Membranen und ein Verfahren zur Herstellung dieser Mikrostrukturvorrichtung |
| EP3444600B1 (en) | 2011-01-11 | 2020-05-13 | The Trustees of Columbia University in the City of New York | System and methods for single-molecule detection using nanotubes |
| US9581563B2 (en) | 2011-01-24 | 2017-02-28 | Genia Technologies, Inc. | System for communicating information from an array of sensors |
| US9110478B2 (en) | 2011-01-27 | 2015-08-18 | Genia Technologies, Inc. | Temperature regulation of measurement arrays |
| EP2678669A1 (en) | 2011-02-23 | 2014-01-01 | The Trustees of Columbia University in the City of New York | Systems and methods for single-molecule detection using nanopores |
| GB201202519D0 (en) | 2012-02-13 | 2012-03-28 | Oxford Nanopore Tech Ltd | Apparatus for supporting an array of layers of amphiphilic molecules and method of forming an array of layers of amphiphilic molecules |
| US8986629B2 (en) | 2012-02-27 | 2015-03-24 | Genia Technologies, Inc. | Sensor circuit for controlling, detecting, and measuring a molecular complex |
| US9099436B2 (en) * | 2012-03-29 | 2015-08-04 | California Institute Of Technology | Sensor probe for bio-sensing and chemical-sensing applications |
| US9341592B2 (en) | 2012-04-09 | 2016-05-17 | Bharath Takulapalli | Field effect transistor, device including the transistor, and methods of forming and using same |
| CA2869753A1 (en) | 2012-04-09 | 2013-10-17 | Jingyue Ju | Method of preparation of nanopore and uses thereof |
| WO2013158280A1 (en) | 2012-04-20 | 2013-10-24 | The Trustees Of Columbia University In The City Of New York | Systems and methods for single-molecule nucleic-acid assay platforms |
| CN104350162A (zh) | 2012-06-15 | 2015-02-11 | 吉尼亚科技公司 | 芯片设置和高精确度核酸测序 |
| FR2996737B1 (fr) * | 2012-10-12 | 2015-08-07 | Commissariat Energie Atomique | Recipient pour le stockage d'un fluide destine a interagir avec un utilisateur |
| US20150192540A1 (en) * | 2012-10-18 | 2015-07-09 | Bio Sensor Inc. | Sensor, sensor module, and detection method |
| GB201313121D0 (en) | 2013-07-23 | 2013-09-04 | Oxford Nanopore Tech Ltd | Array of volumes of polar medium |
| US9651539B2 (en) | 2012-10-28 | 2017-05-16 | Quantapore, Inc. | Reducing background fluorescence in MEMS materials by low energy ion beam treatment |
| US9605309B2 (en) | 2012-11-09 | 2017-03-28 | Genia Technologies, Inc. | Nucleic acid sequencing using tags |
| US9759711B2 (en) | 2013-02-05 | 2017-09-12 | Genia Technologies, Inc. | Nanopore arrays |
| CN105102627B (zh) | 2013-03-15 | 2018-10-19 | 纽约哥伦比亚大学理事会 | 用于检测样品中多种预定化合物的方法 |
| WO2014190322A2 (en) | 2013-05-24 | 2014-11-27 | Quantapore, Inc. | Nanopore-based nucleic acid analysis with mixed fret detection |
| US9551697B2 (en) | 2013-10-17 | 2017-01-24 | Genia Technologies, Inc. | Non-faradaic, capacitively coupled measurement in a nanopore cell array |
| US9322062B2 (en) | 2013-10-23 | 2016-04-26 | Genia Technologies, Inc. | Process for biosensor well formation |
| EP3640349A3 (en) | 2013-10-23 | 2020-07-29 | Roche Sequencing Solutions, Inc. | High speed molecular sensing with nanopores |
| WO2015148402A1 (en) | 2014-03-24 | 2015-10-01 | The Trustees Of Columbia Univeristy In The City Of New York | Chemical methods for producing tagged nucleotides |
| CN107109472B (zh) | 2014-10-10 | 2021-05-11 | 昆塔波尔公司 | 利用互相猝灭的荧光标记物的基于纳米孔的聚合物分析 |
| GB201418512D0 (en) | 2014-10-17 | 2014-12-03 | Oxford Nanopore Tech Ltd | Electrical device with detachable components |
| AU2015335616B2 (en) | 2014-10-24 | 2019-09-12 | Quantapore, Inc. | Efficient optical analysis of polymers using arrays of nanostructures |
| US10504656B2 (en) * | 2015-04-29 | 2019-12-10 | General Electric Company | Electrodes for linear switched capacitive devices |
| US10558172B2 (en) | 2015-10-05 | 2020-02-11 | Arizona Board Of Regents On Behalf Of Arizona State University | Timing device using electrodeposit growth |
| US11977069B2 (en) | 2016-04-19 | 2024-05-07 | Bharath Takulapalli | Nanopore sensor, structure and device including the sensor, and methods of forming and using same |
| US10823721B2 (en) | 2016-07-05 | 2020-11-03 | Quantapore, Inc. | Optically based nanopore sequencing |
| GB201611770D0 (en) | 2016-07-06 | 2016-08-17 | Oxford Nanopore Tech | Microfluidic device |
| GB201619930D0 (en) * | 2016-11-24 | 2017-01-11 | Oxford Nanopore Tech | Apparatus and methods for controlling insertion of a membrane channel into a membrane |
| WO2020183172A1 (en) | 2019-03-12 | 2020-09-17 | Oxford Nanopore Technologies Inc. | Nanopore sensing device and methods of operation and of forming it |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5197495A (ja) * | 1975-01-23 | 1976-08-27 | ||
| WO2002029402A2 (en) * | 2000-10-02 | 2002-04-11 | Sophion Bioscience A/S | System for electrophysiological measurements |
| WO2002103354A1 (en) * | 2001-06-20 | 2002-12-27 | Sophion Bioscience A/S | An apparatus and method for determining and/or monitoring electrophysiological properties of ion channels |
| WO2003016555A1 (fr) * | 2001-08-09 | 2003-02-27 | Matsushita Electric Industrial Co., Ltd. | Procede de diagnostic cellulaire, et dispositif et appareil utilises a cet effet |
| WO2004021002A1 (de) * | 2002-08-09 | 2004-03-11 | Bayer Technology Services Gmbh | Vorrichtung und methoden zur durchführung von elektrischen messungen an membrankörpern |
Family Cites Families (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5368712A (en) * | 1989-11-02 | 1994-11-29 | Synporin Technologies, Inc. | Biologically mimetic synthetic ion channel transducers |
| JP3423041B2 (ja) * | 1993-10-07 | 2003-07-07 | 三洋電機株式会社 | 神経モデル素子 |
| US6362002B1 (en) * | 1995-03-17 | 2002-03-26 | President And Fellows Of Harvard College | Characterization of individual polymer molecules based on monomer-interface interactions |
| US5795782A (en) * | 1995-03-17 | 1998-08-18 | President & Fellows Of Harvard College | Characterization of individual polymer molecules based on monomer-interface interactions |
| WO1997005477A1 (en) * | 1995-08-01 | 1997-02-13 | Australian Membrane And Biotechnology Research Institute | Composite membrane sensor |
| US20030054333A1 (en) * | 1996-08-16 | 2003-03-20 | Hickman James J. | Biosensor for use in toxicity assessment and pharmacological screening |
| EP1009802B1 (en) * | 1997-02-12 | 2004-08-11 | Eugene Y. Chan | Methods for analyzimg polymers |
| US7462324B2 (en) * | 1997-08-07 | 2008-12-09 | Panasonic Corporation | Measurement device and method for measuring electric signal from biological sample |
| DE19744649C2 (de) * | 1997-10-09 | 2003-03-27 | Fraunhofer Ges Forschung | Verfahren zur Messung bioelektrischer Signale von Zellen nach der Patch-Clamp-Methode sowie Verwendung einer Vorrichtung hierzu |
| US7244349B2 (en) * | 1997-12-17 | 2007-07-17 | Molecular Devices Corporation | Multiaperture sample positioning and analysis system |
| US6426231B1 (en) * | 1998-11-18 | 2002-07-30 | The Texas A&M University System | Analyte sensing mediated by adapter/carrier molecules |
| US6787368B1 (en) * | 1999-03-02 | 2004-09-07 | Helix Biopharma Corporation | Biosensor method for detecting analytes in a liquid |
| DE19936302A1 (de) * | 1999-08-02 | 2001-02-15 | Niels Fertig | Vorrichtungen und Verfahren zur Untersuchung von Ionenkanälen in Membranen |
| WO2001025769A2 (en) * | 1999-10-01 | 2001-04-12 | Sophion Bioscience A/S | A substrate and a method for determining and/or monitoring electrophysiological properties of ion channels |
| US6570196B1 (en) * | 2000-03-22 | 2003-05-27 | Max-Plank-Gesellschaft Zur Forderung Der Wissenschaften | Lipid vesicles or lipid bilayers on chips |
| US6616895B2 (en) * | 2000-03-23 | 2003-09-09 | Advanced Research Corporation | Solid state membrane channel device for the measurement and characterization of atomic and molecular sized samples |
| IL153545A0 (en) * | 2000-07-07 | 2003-07-06 | Bristol Myers Squibb Co | Apparatus for measuring cellular electrical activity |
| US7312043B2 (en) * | 2000-07-10 | 2007-12-25 | Vertex Pharmaceuticals (San Diego) Llc | Ion channel assay methods |
| US6776896B1 (en) * | 2000-10-11 | 2004-08-17 | Axon Instruments, Inc. | Method of positioning cells for electrophysiological testing |
| US6686800B2 (en) * | 2001-02-13 | 2004-02-03 | Quantum Applied Science And Research, Inc. | Low noise, electric field sensor |
| DE10112505C1 (de) * | 2001-03-15 | 2003-01-30 | Iongate Biosciences Gmbh | Sensoranordnung und Vorrichtung zur amperometrischen und/oder potentiometrischen, pharmakologischen Wirkort- und/oder Wirkstofftestung sowie Verfahren zur amperometrischen und/oder potentiometrischen, pharmakologischen Wirkort- und/oder Wirkstofftestung |
| WO2002077259A2 (en) * | 2001-03-24 | 2002-10-03 | Aviva Biosciences Corporation | Biochips including ion transport detecting structures and methods of use |
| US20040020773A1 (en) * | 2001-06-20 | 2004-02-05 | Lars Thomsen | Apparatus and method for determining and/or monitoring electrophysiological properties of ion channels |
| US20030062657A1 (en) * | 2001-07-31 | 2003-04-03 | Massachusetts Institute Of Technology | On-chip membrane maker |
| US6953958B2 (en) * | 2002-03-19 | 2005-10-11 | Cornell Research Foundation, Inc. | Electronic gain cell based charge sensor |
| GB2398635A (en) * | 2003-02-21 | 2004-08-25 | Sophion Bioscience As | A substrate providing a cell gigaseal for a patch clamp |
| EP1504114B1 (en) | 2002-05-10 | 2017-07-12 | The Texas A & M University System | Stochastic sensing through covalent interactions |
| US7205099B2 (en) * | 2002-05-31 | 2007-04-17 | John Cuppoletti | Methods for studying ion channels incorporated onto a solid-supported membrane |
| US7355216B2 (en) * | 2002-12-09 | 2008-04-08 | The Regents Of The University Of California | Fluidic nanotubes and devices |
| US20040251145A1 (en) * | 2003-02-21 | 2004-12-16 | Robertson Janet Kay | High throughput screening (HTS) method and apparatus for monitoring ion channels |
| US7112433B2 (en) * | 2003-04-24 | 2006-09-26 | Hewlett-Packard Development Company, L.P. | Electrical analysis of biological membranes |
| US20050112557A1 (en) * | 2003-09-25 | 2005-05-26 | Yongcheng Liu | Mesoporous-chip based biosensor for rapid biological agent detection |
| US6846702B1 (en) * | 2003-10-24 | 2005-01-25 | Agilent Technologies, Inc. | Nanopore chip with N-type semiconductor |
-
2005
- 2005-07-22 JP JP2007522825A patent/JP4897681B2/ja not_active Expired - Fee Related
- 2005-07-22 DE DE112005001781.8T patent/DE112005001781B4/de active Active
- 2005-07-22 WO PCT/US2005/026181 patent/WO2006012571A1/en active Application Filing
- 2005-07-22 GB GB0700995A patent/GB2431013B/en active Active
- 2005-07-22 US US11/658,094 patent/US7622934B2/en active Active
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5197495A (ja) * | 1975-01-23 | 1976-08-27 | ||
| WO2002029402A2 (en) * | 2000-10-02 | 2002-04-11 | Sophion Bioscience A/S | System for electrophysiological measurements |
| WO2002103354A1 (en) * | 2001-06-20 | 2002-12-27 | Sophion Bioscience A/S | An apparatus and method for determining and/or monitoring electrophysiological properties of ion channels |
| WO2003016555A1 (fr) * | 2001-08-09 | 2003-02-27 | Matsushita Electric Industrial Co., Ltd. | Procede de diagnostic cellulaire, et dispositif et appareil utilises a cet effet |
| WO2004021002A1 (de) * | 2002-08-09 | 2004-03-11 | Bayer Technology Services Gmbh | Vorrichtung und methoden zur durchführung von elektrischen messungen an membrankörpern |
Also Published As
| Publication number | Publication date |
|---|---|
| GB0700995D0 (en) | 2007-02-28 |
| DE112005001781B4 (de) | 2017-12-14 |
| US20080094076A1 (en) | 2008-04-24 |
| WO2006012571A1 (en) | 2006-02-02 |
| DE112005001781T5 (de) | 2007-05-31 |
| JP2008507703A (ja) | 2008-03-13 |
| US7622934B2 (en) | 2009-11-24 |
| GB2431013B (en) | 2008-05-21 |
| GB2431013A (en) | 2007-04-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4897681B2 (ja) | イオン・チャネルを通過する時間的に変化する電流を検出するための方法及び装置 | |
| US9989516B2 (en) | Electro-diffusion enhanced bio-molecule charge detection using electrostatic interaction | |
| JP2008507703A5 (ja) | ||
| US9201058B2 (en) | Apparatus and method for sensing a time varying ionic current in an electrolytic system | |
| US9322820B2 (en) | System and apparatus for nanopore sequencing | |
| Chen et al. | Single-nanopore investigations with ion conductance microscopy | |
| Ervin et al. | Alternating current impedance imaging of membrane pores using scanning electrochemical microscopy | |
| DE112007001911T5 (de) | Gesteuerte Translokation eines Polymers in einem elektrolytischen Sensiersystem | |
| Zhou et al. | Heterogeneity of multiple-pore membranes investigated with ion conductance microscopy | |
| Pecqueur et al. | Cation discrimination in organic electrochemical transistors by dual frequency sensing | |
| US10281428B2 (en) | Nanospore sensor for detecting molecular interactions | |
| Liu et al. | Polarization-induced local pore-wall functionalization for biosensing: from micropore to nanopore | |
| US20090071824A1 (en) | Integrated Sensing Array for Producing a BioFingerprint of an Analyte | |
| US8936947B2 (en) | Sensor measuring method and sensing apparatus | |
| WO2006045628A1 (en) | Adsorption monitoring device | |
| Marcus et al. | Dielectrophoretic Manipulation and Real‐Time Electrical Detection of Single‐Nanowire Bridges in Aqueous Saline Solutions | |
| Wolff et al. | Modification of ion transport in lipid bilayer membranes by the insecticides DDT and DDE | |
| de Castro | Transducers to Detect Glioma Bursting Activity | |
| SJ et al. | Ion channels on silicon | |
| Janouš et al. | Development of a conductivity microsensor considering electric double layer capacity | |
| JP2020187074A (ja) | 分析システム、便臭ガス分析システム及び呼気ガス分析システム | |
| Wang | Quantification of Nonlinear And Dynamic Charge Transport Through Nanoscale Confinements | |
| JPS6318256A (ja) | 溶存物質の測定方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080521 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080521 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20110118 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110120 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20110418 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110818 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20110915 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111111 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20111202 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20111222 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150106 Year of fee payment: 3 |
|
| LAPS | Cancellation because of no payment of annual fees |