JP4824677B2 - シリンジでの大きな細胞塊の送出、および細胞を凍結保存する関連の方法 - Google Patents
シリンジでの大きな細胞塊の送出、および細胞を凍結保存する関連の方法 Download PDFInfo
- Publication number
- JP4824677B2 JP4824677B2 JP2007522844A JP2007522844A JP4824677B2 JP 4824677 B2 JP4824677 B2 JP 4824677B2 JP 2007522844 A JP2007522844 A JP 2007522844A JP 2007522844 A JP2007522844 A JP 2007522844A JP 4824677 B2 JP4824677 B2 JP 4824677B2
- Authority
- JP
- Japan
- Prior art keywords
- cells
- freezing medium
- freezing
- cell
- medium
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N1/00—Preservation of bodies of humans or animals, or parts thereof
- A01N1/02—Preservation of living parts
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N1/00—Preservation of bodies of humans or animals, or parts thereof
- A01N1/02—Preservation of living parts
- A01N1/0205—Chemical aspects
- A01N1/021—Preservation or perfusion media, liquids, solids or gases used in the preservation of cells, tissue, organs or bodily fluids
- A01N1/0221—Freeze-process protecting agents, i.e. substances protecting cells from effects of the physical process, e.g. cryoprotectants, osmolarity regulators like oncotic agents
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N1/00—Preservation of bodies of humans or animals, or parts thereof
- A01N1/02—Preservation of living parts
- A01N1/0236—Mechanical aspects
- A01N1/0263—Non-refrigerated containers specially adapted for transporting or storing living parts whilst preserving, e.g. cool boxes, blood bags or "straws" for cryopreservation
- A01N1/0268—Carriers for immersion in cryogenic fluid, both for slow-freezing and vitrification, e.g. open or closed "straws" for embryos, oocytes or semen
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M45/00—Means for pre-treatment of biological substances
- C12M45/22—Means for packing or storing viable microorganisms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M5/00—Devices for bringing media into the body in a subcutaneous, intra-vascular or intramuscular way; Accessories therefor, e.g. filling or cleaning devices, arm-rests
- A61M5/178—Syringes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M5/00—Devices for bringing media into the body in a subcutaneous, intra-vascular or intramuscular way; Accessories therefor, e.g. filling or cleaning devices, arm-rests
- A61M5/178—Syringes
- A61M5/31—Details
- A61M5/315—Pistons; Piston-rods; Guiding, blocking or restricting the movement of the rod or piston; Appliances on the rod for facilitating dosing ; Dosing mechanisms
- A61M5/31511—Piston or piston-rod constructions, e.g. connection of piston with piston-rod
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- General Health & Medical Sciences (AREA)
- Dentistry (AREA)
- Environmental Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Sustainable Development (AREA)
- Mechanical Engineering (AREA)
- Biochemistry (AREA)
- General Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Hematology (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
Description
Claims (26)
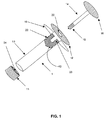
- 細胞を保存および送出するための装置であって、前記細胞は、装置内で凍結保存され、前記装置が、
開いた第1の端部および開いた第2の端部を有する本体と、
開いた第1の端部へと着脱可能に取り付けられるように構成された第1のキャップと、
開いた第2の端部へと着脱可能に取り付けられるように構成された第2のキャップと、
本体内に収容され、前記開いた端部のうちの一方に隣接するプランジャ部と、
プランジャ部へと接続されるように構成されたプランジャ棒と、
を備え、
少なくともその一部が生物学的適合性を有する材料で作られる、装置。 - プランジャ部が、外周に少なくとも1つのリブを含む、請求項1に記載の装置。
- 第1および第2のキャップが、ねじ山によって本体に着脱可能に取り付けられるように構成される、請求項1に記載の装置。
- 細胞を迅速に凍結させる方法であって、
凍結保存のための所望の量の細胞を取得することと、
取得した細胞を、浸透性の凍結防止剤を含有しており、0℃〜4℃の温度に冷却されている凍結媒体へと懸濁させることと、
細胞および凍結媒体を、細胞を保存および送出するように構成された請求項1から3のいずれか一項に記載の装置に配置することと、
細胞および冷却済みの凍結媒体を含む装置を、8℃/分の速度で−130℃以下の温度まで迅速に冷却することと、
を含む、方法。 - 浸透性の凍結防止剤が、DMSOである、請求項4に記載の方法。
- 凍結媒体が、15%〜25%のDMSOを含有する、請求項5に記載の方法。
- 凍結保存された細胞を迅速に解凍する方法であって、
−130℃以下の温度を有する凍結媒体および細胞を含む請求項1から3のいずれか一項に記載の保存装置を取り出すことと、
凍結媒体および細胞を保存装置から37℃の温度の成長培地を含む解凍容器へと移動させて、細胞を解凍することと、
を含む、方法。 - 細胞を凍結保存するための方法であって、
凍結保存のための所望の量の細胞を取得することと、
取得した細胞を、浸透性の凍結防止剤を含有する冷却済みの凍結媒体に配置することと、
細胞および凍結媒体を、細胞を保存および送出するように構成された請求項1から3のいずれか一項に記載の装置に保存し、前記細胞は、装置内で凍結保存されることと、
装置を−130℃以下の温度まで冷却することと、
を含む、方法。 - 浸透性の凍結防止剤が、DMSOである、請求項8に記載の方法。
- 凍結媒体が、15%〜25%のDMSOを含有する、請求項9に記載の方法。
- 細胞および凍結媒体を保存することが、1.5×108個/mlよりも大きい細胞密度で細胞および凍結媒体を保存することを含む、請求項8に記載の方法。
- 凍結媒体が動物の血清を含んでおらず、細胞および凍結媒体を保存することが、3.0×107個/ml〜5.0×108個/mlの細胞密度で細胞および凍結媒体を保存することを含む、請求項8に記載の方法。
- 凍結保存された細胞でバイオリアクタを接種するための方法であって、
凍結保存のための所望の量の細胞を取得することと、
取得した細胞を、浸透性の凍結防止剤を含有する冷却済みの凍結媒体に配置することと、
細胞および凍結媒体を、細胞を保存および送出するように構成された請求項1から3のいずれか一項に記載の装置に保存され、前記細胞は、装置内で凍結保存されることと、
装置を−130℃以下の温度まで冷却することと、
装置を−130℃以下の温度まで冷却することの後で、凍結媒体および細胞を、装置から実質的に0℃よりも温かい温度の成長培地を含む解凍容器へと移動させることと、
解凍容器からの細胞でバイオリアクタを接種することと、
を含む、方法。 - 浸透性の凍結防止剤が、DMSOである、請求項13に記載の方法。
- 凍結媒体が、15%〜25%のDMSOを含有する、請求項14に記載の方法。
- 細胞および凍結媒体を保存することが、1.5×108個/mlよりも大きい細胞密度で細胞および凍結媒体を保存することを含む、請求項13に記載の方法。
- 凍結媒体が動物の血清を含んでおらず、細胞および凍結媒体を保存することが、3.0×107個/ml〜5.0×108個/mlの細胞密度で細胞および凍結媒体を保存することを含む、請求項13に記載の方法。
- 大きな細胞塊を高い密度で凍結させる方法であって、
大きな細胞塊を、浸透性の凍結防止剤を1.5×108個/mlよりも大きい密度での細胞の保存を可能にするために十分な濃度で含む凍結媒体に、懸濁させることと、
細胞および凍結媒体を請求項1から3のいずれか一項に記載の保存装置に配置することと、
細胞および凍結媒体を−130℃以下の温度まで冷却することと、
を含む、方法。 - 凍結媒体が動物の血清を含む、請求項18に記載の方法。
- 浸透性の凍結防止剤がDMSOである、請求項18に記載の方法。
- DMSOの濃度が、15%〜25%である、請求項20に記載の方法。
- 細胞および凍結媒体を冷却することが、細胞を1.5×108個/ml〜5.0×108個/mlの密度で保存することを含む、請求項18に記載の方法。
- 細胞および凍結媒体を冷却することが、細胞を3.0×108個/mlの密度で保存することを含む、請求項18に記載の方法。
- 凍結防止剤の濃度が、少なくとも3.0×108個/mlの密度での細胞の保存を可能にするために十分である、請求項18に記載の方法。
- 大きな凍結済みの細胞塊を迅速に解凍する方法であって、
凍結した細胞塊および凍結媒体を含む請求項1から3のいずれか一項に記載の保存装置を取り出すことと、
凍結した細胞塊および凍結媒体を、保存装置から37℃の温度の成長培地を含む解凍容器へと移動させて、細胞を解凍することと、
を含む、方法。 - 大きな細胞塊を高い密度で凍結させる方法であって、
大きな細胞塊を、20%のDMSOを含み、動物の血清を含んでおらず、DMSOの濃度が3.0×107個/mlよりも大きい密度での細胞の保存を可能にするために十分である凍結媒体に、懸濁させることと、
細胞および凍結媒体を請求項1から3のいずれか一項に記載の保存装置に配置することと、
細胞および凍結媒体を−130℃以下の温度まで冷却することと、
を含む、方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US59043704P | 2004-07-23 | 2004-07-23 | |
| US60/590,437 | 2004-07-23 | ||
| PCT/US2005/026301 WO2006012613A1 (en) | 2004-07-23 | 2005-07-22 | Delivery of high cell mass in a syringe and related methods of cryopreserving cells |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011152539A Division JP2011234727A (ja) | 2004-07-23 | 2011-07-11 | シリンジでの大きな細胞塊の送出、および細胞を凍結保存する関連の方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2008507563A JP2008507563A (ja) | 2008-03-13 |
| JP2008507563A5 JP2008507563A5 (ja) | 2008-09-11 |
| JP4824677B2 true JP4824677B2 (ja) | 2011-11-30 |
Family
ID=35160068
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007522844A Expired - Fee Related JP4824677B2 (ja) | 2004-07-23 | 2005-07-22 | シリンジでの大きな細胞塊の送出、および細胞を凍結保存する関連の方法 |
| JP2011152539A Pending JP2011234727A (ja) | 2004-07-23 | 2011-07-11 | シリンジでの大きな細胞塊の送出、および細胞を凍結保存する関連の方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011152539A Pending JP2011234727A (ja) | 2004-07-23 | 2011-07-11 | シリンジでの大きな細胞塊の送出、および細胞を凍結保存する関連の方法 |
Country Status (7)
| Country | Link |
|---|---|
| US (2) | US20060019233A1 (ja) |
| EP (1) | EP1773117A1 (ja) |
| JP (2) | JP4824677B2 (ja) |
| AU (1) | AU2005266946A1 (ja) |
| CA (1) | CA2574328A1 (ja) |
| MX (1) | MX2007000787A (ja) |
| WO (1) | WO2006012613A1 (ja) |
Families Citing this family (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4983204B2 (ja) * | 2006-10-27 | 2012-07-25 | ニプロ株式会社 | 遠心分離容器及び遠心分離方法 |
| WO2009155430A2 (en) * | 2008-06-18 | 2009-12-23 | The Cleveland Clinic Foundation | Systems and methods for vitrifying tissue |
| DE102008031666B4 (de) * | 2008-07-04 | 2010-05-12 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Kryobehälter |
| WO2011090068A1 (ja) * | 2010-01-19 | 2011-07-28 | 株式会社Reiメディカル | 癌組織由来細胞塊または癌細胞凝集塊の培養方法、評価方法および保存方法 |
| DE102011016977A1 (de) | 2011-04-15 | 2012-10-18 | Sartorius Stedim Biotech Gmbh | Inokulationsspritze |
| FR2995213A1 (fr) * | 2012-09-12 | 2014-03-14 | Lfb Biotechnologies | Seringue contenant une composition, notamment pharmaceutique, comprenant des immunoglobulines, son procede de fabrication et son utilisation |
| ES2529265B1 (es) * | 2013-07-18 | 2015-10-07 | Universidad De Sevilla | Monitorización mediante TAC de procesos de preservación en frío y criopreservación de material biológico |
| US20150048085A1 (en) * | 2013-08-16 | 2015-02-19 | Corning Incorporated | Vessels and methods for cryopreservation |
| US9615570B2 (en) | 2013-11-20 | 2017-04-11 | Cellulis, S.L. | Method of freezing cells |
| JP6905522B2 (ja) | 2015-11-16 | 2021-07-21 | コーニング インコーポレイテッド | 極低温バイアルアセンブリ |
| US10638748B2 (en) | 2015-12-22 | 2020-05-05 | Corning Incorporated | Break away/tear away cryopreservation vial and methods for manufacturing and using same |
| MX2019010385A (es) * | 2017-03-02 | 2019-10-22 | Discgenics Inc | Dispositivos, metodos y composiciones utiles en la crio-conservacion, -almacenamiento, -transporte y aplicacion de celulas terapeuticas de mamiferos. |
| EP3675881A4 (en) * | 2017-09-01 | 2021-05-26 | University of Pittsburgh- Of the Commonwealth System of Higher Education | METHOD AND KIT FOR THE PRESERVATION OF ADAPTIVE TISSUE TRANSPLANTS |
| CN107746799B (zh) * | 2017-11-21 | 2023-10-13 | 新钥(南京)生物科技有限公司 | 一种手持干式细胞复苏仪 |
| FR3075056A1 (fr) * | 2017-12-14 | 2019-06-21 | Etablissement Francais Du Sang | Dispositif d'injection cryoresistant pret a l'emploi |
| CN109350802A (zh) * | 2018-10-12 | 2019-02-19 | 保信亚太生物科技(深圳)有限公司 | 一种冷存注射器 |
| JP7544492B2 (ja) | 2020-03-03 | 2024-09-03 | 株式会社カネカ | 細胞保存容器 |
| US11241330B1 (en) | 2021-04-02 | 2022-02-08 | Brixton Biosciences, Inc. | Apparatus for creation of injectable slurry |
| WO2022229476A1 (es) | 2021-04-27 | 2022-11-03 | Leartiker S.Coop. | Dispositivo y método para almacenar y dispensar una muestra líquida |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004018504A (ja) * | 2002-06-20 | 2004-01-22 | Jms Co Ltd | 細胞保存容器 |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2109690B (en) * | 1981-02-12 | 1985-02-20 | Robert Charles Turner | Dose metering plunger devices for use with syringes |
| US8067149B2 (en) * | 1990-09-12 | 2011-11-29 | Lifecell Corporation | Acellular dermal matrix and method of use thereof for grafting |
| US5688252A (en) * | 1994-09-30 | 1997-11-18 | Takeda Chemical Industries, Ltd. | Syringe |
| US6590033B2 (en) * | 1999-09-09 | 2003-07-08 | Baxter International Inc. | Cycloolefin blends and method for solvent bonding polyolefins |
| US7112576B1 (en) * | 1999-12-10 | 2006-09-26 | Regents Of The University Of Minnesota | Compositions and methods for cryopreservation of peripheral blood lymphocytes |
| US6425885B1 (en) * | 1999-12-20 | 2002-07-30 | Ultradent Products, Inc. | Hydraulic syringe |
| DE10012574A1 (de) * | 2000-03-15 | 2001-09-27 | Schott Glas | Spritze für medizinische Zwecke |
| US6736799B1 (en) * | 2000-10-24 | 2004-05-18 | Vita Licensing, Inc. | Delivery device for biological composites and method of preparation thereof |
| EP1389232B1 (en) * | 2001-05-09 | 2009-09-23 | Bayer Pharmaceuticals Corporation | A cryopreservation bag assembly for mammalian cell lines |
| US9226876B2 (en) * | 2001-10-19 | 2016-01-05 | The Goodyear Tire & Rubber Company | Rubber for baby bottle nipples, pacifiers, and syringe plungers |
| US8404229B2 (en) * | 2001-12-07 | 2013-03-26 | Cytori Therapeutics, Inc. | Methods of using adipose derived stem cells to treat acute tubular necrosis |
| DE10251721B4 (de) * | 2002-11-06 | 2006-06-01 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Verfahren zur Beschickung von Probenkammern mit Suspensionsproben |
-
2005
- 2005-07-22 AU AU2005266946A patent/AU2005266946A1/en not_active Abandoned
- 2005-07-22 JP JP2007522844A patent/JP4824677B2/ja not_active Expired - Fee Related
- 2005-07-22 US US11/186,853 patent/US20060019233A1/en not_active Abandoned
- 2005-07-22 MX MX2007000787A patent/MX2007000787A/es not_active Application Discontinuation
- 2005-07-22 CA CA002574328A patent/CA2574328A1/en not_active Abandoned
- 2005-07-22 WO PCT/US2005/026301 patent/WO2006012613A1/en active Application Filing
- 2005-07-22 EP EP05776585A patent/EP1773117A1/en not_active Withdrawn
-
2008
- 2008-01-03 US US12/003,964 patent/US20080176326A1/en not_active Abandoned
-
2011
- 2011-07-11 JP JP2011152539A patent/JP2011234727A/ja active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004018504A (ja) * | 2002-06-20 | 2004-01-22 | Jms Co Ltd | 細胞保存容器 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2011234727A (ja) | 2011-11-24 |
| MX2007000787A (es) | 2007-03-26 |
| US20060019233A1 (en) | 2006-01-26 |
| JP2008507563A (ja) | 2008-03-13 |
| EP1773117A1 (en) | 2007-04-18 |
| AU2005266946A1 (en) | 2006-02-02 |
| US20080176326A1 (en) | 2008-07-24 |
| WO2006012613A1 (en) | 2006-02-02 |
| CA2574328A1 (en) | 2006-02-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4824677B2 (ja) | シリンジでの大きな細胞塊の送出、および細胞を凍結保存する関連の方法 | |
| Hunt | Cryopreservation: vitrification and controlled rate cooling | |
| US10271543B2 (en) | Systems and methods for cryopreservation of cells | |
| EP2038402B1 (en) | Systems and methods for cryopreservation of cells | |
| US9877475B2 (en) | Systems and methods for cryopreservation of cells | |
| US5863715A (en) | Methods for bulk cryopreservation encapsulated islets | |
| JPS63287479A (ja) | 生物学的凍結保護 | |
| CN102160546B (zh) | 冷冻保存细胞的系统和方法 | |
| JP6667903B2 (ja) | 中空糸凍結保存用具及び細胞凍結保存方法 | |
| WO2012028967A2 (en) | Method for cryopreservation of human spermatozoa free from seminal plasma using a fast and simple aseptic vitrification-devitrification process; portable kit for carrying out the method; and use of the same for treatment of disorders related to reproductive failures | |
| JP2014217356A (ja) | 生殖細胞を凍結保存するための自動植氷機能を持った容器の製造方法 | |
| CA2647664C (en) | Systems and methods for cryopreservation of cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080722 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080722 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20110406 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110412 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110711 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110830 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110908 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140916 Year of fee payment: 3 |
|
| LAPS | Cancellation because of no payment of annual fees |