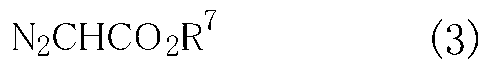JP4635343B2 - 光学活性な銅錯体ならびに光学活性なサリチリデンアミノアルコール化合物およびそれを用いる光学活性なシクロプロパンカルボン酸誘導体の製造方法 - Google Patents
光学活性な銅錯体ならびに光学活性なサリチリデンアミノアルコール化合物およびそれを用いる光学活性なシクロプロパンカルボン酸誘導体の製造方法 Download PDFInfo
- Publication number
- JP4635343B2 JP4635343B2 JP2001007513A JP2001007513A JP4635343B2 JP 4635343 B2 JP4635343 B2 JP 4635343B2 JP 2001007513 A JP2001007513 A JP 2001007513A JP 2001007513 A JP2001007513 A JP 2001007513A JP 4635343 B2 JP4635343 B2 JP 4635343B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- optically active
- atom
- copper
- amino
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 0 *C(C(*)(*)O)N=CC(CC(*)C=C1*)=C1O Chemical compound *C(C(*)(*)O)N=CC(CC(*)C=C1*)=C1O 0.000 description 1
Landscapes
- Catalysts (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Description
【発明の属する技術分野】
本発明は、光学活性な銅錯体ならびに光学活性なサリチリデンアミノアルコール化合物およびそれを用いる光学活性なシクロプロパンカルボン酸誘導体の製造方法に関する。
【0002】
【従来の技術】
(+)−2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸に代表される一般式(4)
(式中、R3、R4、R5およびR6はそれぞれ同一または相異なって、水素原子、ハロゲン原子、アルキル基、アルケニル基、アリール基またはアラルキル基を表わす。ここで、アルキル基、アルケニル基、アリール基またはアラルキル基はそれぞれ置換基を有していてもよい。また、R3とR4が結合してシクロアルキリデン基を形成してもよいし、R3とR5が結合してシクロアルキレン基を形成してもよい。ただし、R3とR5が同一である場合は、R4とR6は相異なる基を表わす。R7は炭素数1〜10のアルキル基、置換されていてもよいベンジル基または置換されていてもよいフェニル基を表わす。)
で示される光学活性なシクロプロパンカルボン酸誘導体は、医薬、農薬等の中間体として重要な化合物である。
【0003】
かかる一般式(4)で示される光学活性シクロプロパンカルボン酸誘導体の製造方法としては、例えば光学活性なサリチリデンアミノアルコール銅錯体触媒の存在下に、2,5−ジメチル−2,4−ヘキサジエン等のプロキラルなオレフィン類とジアゾ酢酸エステルを反応させる方法(特開昭59−225194号公報)が知られている。しかしながら、かかる方法に開示されている光学活性なサリチリデンアミノアルコール銅錯体は、比較的不安定であり、配位子である光学活性なサリチリデンアミノアルコール化合物の回収を試みてもその回収率が非常に低いため、触媒コストが高くなるという点で工業的に必ずしも十分満足しうる方法とは言えなかった。
【0004】
さらに、該触媒は酸素に対しても不安定であるため、例えば原料オレフィン類の酸化物等の酸化剤、酸素等が反応系内へ混入すると、目的とする光学活性なシクロプロパンカルボン酸誘導体の収率、光学純度が低下するという問題もあり、工業的な観点からは酸化剤等に対してより安定な、回収率のよい配位子および触媒となる錯体の開発が望まれていた。
【0005】
【発明が解決しようとする課題】
このような状況の下、本発明者らは、オレフィン類とジアゾ酢酸エステル類とを反応させて光学活性なシクロプロパンカルボン酸誘導体を製造する方法に用いるより安定な配位子について鋭意検討したところ、光学活性なサリチリデンアミノアルコール化合物のサリチリデン部位の3位または5位に、ニトロ基、塩素原子またはフッ素原子を有する光学活性なサリチリデンアミノアルコール化合物が、より安定であり、反応終了後の反応混合物から比較的良好に回収が可能であること、反応系内に酸素、酸化剤等が存在しても、高い光学純度の光学活性なシクロプロパンカルボン酸誘導体が得られることを見出し、本発明に至った。
【0006】
【課題を解決するための手段】
すなわち本発明は、一般式(1)
(式中、R1およびR2はそれぞれ同一または相異なって、低級アルキル基、アリール基またはアラルキル基を表わす。ここで低級アルキル基、アリール基またはアラルキル基はそれぞれ置換基を有していてもよい。X1はニトロ基、塩素原子または水素原子を表わし、X1がニトロ基のとき、X2は水素原子を表わし、X1が塩素原子のとき、X2は塩素原子を表わし、X1が水素原子のとき、X2はフッ素原子を表わす。*は不斉炭素原子を表わす。)
で示される光学活性なサリチリデンアミノアルコール化合物と銅化合物とを反応させてなる新規な光学活性な銅錯体ならびに一般式(1)で示される新規な光学活性なサリチリデンアミノアルコール化合物およびそれを用いる一般式(4)で示される光学活性なシクロプロパンカルボン酸誘導体の製造方法を提供するものである。
【0007】
【発明の実施の形態】
まず、一般式(1)
で示される光学活性なサリチリデンアミノアルコール化合物(以下、サリチリデンアミノアルコール化合物(1)と略記する。)と銅化合物とを反応させてなる光学活性な銅錯体について説明する。
【0008】
上記サリチリデンアミノアルコール化合物(1)の式中、*は不斉炭素原子を表わし、R1およびR2はそれぞれ同一または相異なって、低級アルキル基、アラルキル基またはアリール基を表わし、かかる低級アルキル基、アリール基またはアラルキル基はそれぞれ置換基を有していてもよい。
【0009】
低級アルキル基としては、例えばメチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、tert−ブチル基等の炭素数1〜4のアルキル基が挙げられ、アリール基としては、例えばフェニル基等およびフェニル基等の芳香環に、例えばアルキル基、アルコキシ基等の置換基が置換した2−メトキシフェニル基、2−n−ブトキシ−5−tert−ブチルフェニル、2−オクトキシ−5−tert−ブチルフェニル基等が挙げられる。また、アラルキル基としては、例えば上記したアリール基とアルキル基とから構成されるものが挙げられ、具体的にはベンジル基、2−メトキシベンジル基等が挙げられる。
【0010】
また、上記サリチリデンアミノアルコール化合物(1)の式中、X1はニトロ基、塩素原子または水素原子を表わし、X1がニトロ基のとき、X2は水素原子を表わし、X1が塩素原子のとき、X2は塩素原子を表わし、X1が水素原子のとき、X2はフッ素原子を表わす。
【0011】
かかるサリチリデンアミノアルコール化合物(1)としては、例えば光学活性なN−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール、光学活性なN−(3,5−ジクロロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール、光学活性なN−(3−フルオロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール、光学活性なN−(5−ニトロサリチリデン)−2−アミノ−1,1−ジフェニル−1−プロパノール、光学活性なN−(3,5−ジクロロサリチリデン)−2−アミノ−1,1−ジフェニル−1−プロパノール、光学活性なN−(3−フルオロサリチリデン)−2−アミノ−1,1−ジフェニル−1−プロパノール、光学活性なN−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−ブトキシフェニル)−3−フェニル−1−プロパノール、光学活性なN−(3,5−ジクロロサリチリデン)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−ブトキシフェニル)−3−フェニル−1−プロパノール、光学活性なN−(3−フルオロサリチリデン)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−ブトキシフェニル)−3−フェニル−1−プロパノール、
【0012】
光学活性なN−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−オクチルオキシフェニル)−1−プロパノール、光学活性なN−(3,5−ジクロロサリチリデン)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−オクチルオキシフェニル)−1−プロパノール、光学活性なN−(3−フルオロサリチリデン)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−オクチルオキシフェニル)−1−プロパノール、光学活性なN−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−3−メチル−1−ブタノール、光学活性なN−(3,5−ジクロロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−3−メチル−1−ブタノール、光学活性なN−(3−フルオロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−3−メチル−1−ブタノール等が挙げられる。かかるサリチリデンアミノアルコール化合物(1)には、R体およびS体の2種類の光学活性体があるが、本発明にはそのいずれを用いてもよい。
【0013】
上記サリチリデンアミノアルコール化合物(1)は、例えば一般式(5)
(式中、R1、R2および*は上記と同一の意味を表わす。)
で示される光学活性なアミノアルコール類(以下、アミノアルコール類(5)と略記する。)と一般式(6)
(式中、X1およびX2は、上記と同一の意味を表わす。)
で示されるサリチルアルデヒド類(以下、サリチルアルデヒド類(6)と略記する。)とを反応させることにより製造することができる。
【0014】
アミノアルコール類(5)としては、例えば光学活性な2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール、光学活性な2−アミノ−1,1−ジフェニル−1−プロパノール、光学活性な2−アミノ−1,1−ジ(5−tert−ブチル−2−n−ブトキシフェニル)−3−フェニル−1−プロパノール、光学活性な2−アミノ−1,1−ジ(5−tert−ブチル−2−n−オクチルオキシフェニル)−1−プロパノール、2−アミノ−1,1−ジ(2−メトキシフェニル)−3−メチル−1−ブタノール等が挙げられる。かかるアミノアルコール類(5)には、R体およびS体の2種類の光学活性体があるが、目的とするサリチリデンアミノアルコール化合物(1)に応じて、適宜選択すればよい。
【0015】
また、サリチルアルデヒド類(6)としては、例えば2−ヒドロキシ−5−ニトロベンズアルデヒド、2−ヒドロキシ−3,5−ジクロロベンズアルデヒド、2−ヒドロキシ−3−フルオロベンズアルデヒド等が挙げられ、その使用量は、アミノアルコール類(5)に対して、通常1〜2モル倍、好ましくは1〜1.5モル倍である。
【0016】
アミノアルコール類(5)とサリチルアルデヒド類(6)との反応は、通常その両者を混合することにより行われ、その反応温度は、通常20〜150℃、好ましくは50〜120℃である。かかる反応は、通常溶媒の存在下に行われ、溶媒としては、例えばトルエン、キシレン等の芳香族炭化水素系溶媒、例えばヘキサン、ヘプタン等の脂肪族炭化水素系溶媒、例えばジエチルエーテル、テトラヒドロフラン、メチル−tert−ブチルエーテル等のエーテル系溶媒、例えば酢酸エチル、酢酸ブチル等のエステル系溶媒、例えばクロロベンゼン、ジクロロメタン、ジクロロエタン等のハロゲン化炭化水素系溶媒、例えばメタノール等のアルコール系溶媒等が挙げられ、その使用量は特に限定されない。
【0017】
アミノアルコール類(5)とサリチルアルデヒド類(6)との反応は、通常定量的に進行するため、得られた反応液からサリチリデンアミノアルコール化合物(1)を取り出すことなく、銅化合物との反応に用いてもよいし、該反応液から、濃縮、晶析等の処理により、サリチリデンアミノアルコール化合物(1)を取り出し用いてもよい。もちろん取り出したサリチリデンアミノアルコール化合物(1)は、再結晶等の通常の精製手段により精製した後、用いてもよい。
【0018】
銅化合物としては、一価または二価の銅化合物が用いられ、例えば酢酸銅(I)、酢酸銅(II)、ナフテン酸銅(I)、ナフテン酸銅(II)、オクチル酸銅(I)、オクチル酸銅(II)等の炭素数2〜15のカルボン酸銅、例えば塩化銅(I)、塩化銅(II)、臭化銅(I)、臭化銅(II)等のハロゲン化銅、硝酸銅(I)、硝酸銅(II)、例えばメタンスルホン酸銅(I)、メタンスルホン酸銅(II)、トリフルオロメタンスルホン酸銅(I)、トリフルオロメタンスルホン酸銅(II)等のスルホン酸銅等が挙げられる。かかる銅化合物は、それぞれ単独で用いてもよいし、混合して用いてもよい。また、これら銅化合物は無水物であってもよいし、水和物であってもよい。
【0019】
サリチリデンアミノアルコール化合物(1)の使用量は、銅化合物に対して、通常0.5〜5モル倍、好ましくは0.8〜2.5モル倍である。
【0020】
銅化合物として二価の銅化合物を用いた場合には、例えばフェニルヒドラジン等の還元剤の共存下に反応を実施することが好ましい。還元剤の使用量は、銅化合物に対して、通常0.9〜1.2モル倍である。なお、サリチリデンアミノアルコール化合物(1)と銅化合物を反応せしめて得られた銅錯体を、後述する一般式(1)で示されるプロキラルなオレフィン類と一般式(2)で示されるジアゾ酢酸エステル類との反応の触媒として用いる場合には、かかる還元剤は、一般式(1)で示されるプロキラルなオレフィン類と一般式(2)で示されるジアゾ酢酸エステル類との反応の際に加えてもよい。
【0021】
サリチリデンアミノアルコール化合物(1)と銅化合物の反応は通常溶媒中で行われる。溶媒としては、例えばジクロロメタン、ジクロロエタン、クロロホルム等のハロゲン化炭化水素系溶媒、例えばトルエン、キシレン等の芳香族炭化水素系溶媒、ヘキサン、ヘプタン等の脂肪族炭化水素系溶媒、例えばジエチルエーテル、テトラヒドロフラン、メチル−tert−ブチルエーテル等のエーテル系溶媒、例えば酢酸エチル、酢酸ブチル等のエステル系溶媒等が挙げられ、その使用量は特に制限されない。サリチリデンアミノアルコール化合物(1)と銅化合物を反応させてなる光学活性な銅錯体を、後述する一般式(2)で示されるプロキラルなオレフィン類との反応に供する場合であって、該プロキラルなオレフィン類が液体であるときは、該プロキラルなオレフィン類を、サリチリデンアミノアルコール化合物(1)と銅化合物の反応の溶媒として用いてもよい。
【0022】
サリチリデンアミノアルコール化合物(1)と銅化合物の反応の反応温度は、通常10〜100℃である。
【0023】
かくして、サリチリデンアミノアルコール化合物(1)と銅化合物を反応させることにより、光学活性な銅錯体を調製することができ、該銅錯体は、反応混合物から、例えば晶析処理等により取り出すことができる。なお、かかる銅錯体を後述する一般式(2)で示されるプロキラルなオレフィン類と一般式(3)で示されるジアゾ酢酸エステル類との反応に用いる場合には、銅錯体を上記反応混合物から取り出した後用いてもよいし、取り出すことなく銅錯体を含む反応混合物のまま用いてもよい。
【0024】
また、一般式(2)で示されるプロキラルなオレフィン類を溶媒として用いた場合や得られた銅錯体を一般式(2)で示されるプロキラルなオレフィン類と混合した場合には、該銅錯体に該プロキラルなオレフィン類が付加した新規な付加体が得られ、銅錯体と同様に、例えば反応混合物を晶析処理することにより取り出すことができる。該付加体も、銅錯体と同様に、一般式(2)で示されるプロキラルなオレフィン類と一般式(3)で示されるジアゾ酢酸エステル類との反応において触媒活性を示す。
【0025】
なお、かかる光学活性な銅錯体の推定構造は、銅化合物の使用量等の条件により異なるが、その一例として、例えば下記一般式(7)
(式中、R1、R2、X1およびX2は、それぞれ上記と同一の意味を表わす。)
で示される二核構造が挙げられる。
【0026】
次に、サリチリデンアミノアルコール化合物(1)と銅化合物とを反応せしめてなる光学活性な銅錯体触媒を存在下に、一般式(2)
(式中、R3、R4、R5およびR6はそれぞれ同一または相異なって、水素原子、ハロゲン原子、アルキル基、アルケニル基、アリール基またはアラルキル基を表わす。ここでアルキル基、アルケニル基、アリール基またはアラルキル基はそれぞれ置換基を有していてもよい。また、R3とR4が結合してシクロアルキリデン基を形成してもよいし、R3とR5が結合してシクロアルキレン基を形成してもよい。ただし、R3とR5が同一である場合は、R4とR6は相異なる基を表わす。)
で示されるプロキラルなオレフィン類と一般式(3)
(式中、R7は炭素数1〜10のアルキル基、置換されていてもよいベンジル基または置換されていてもよいフェニル基を表わす。)
で示されるジアゾ酢酸エステル類とを反応させて、一般式(4)
(式中、R3、R4、R5、R6およびR7はそれぞれ上記と同一の意味を表わす。)
で示される光学活性なシクロプロパンカルボン酸誘導体を製造する方法について説明する。
【0027】
一般式(2)
で示されるプロキラルなオレフィン類(以下、オレフィン類(2)と略記する。)の式中、R3、R4、R5およびR6はそれぞれ同一または相異なって、水素原子、ハロゲン原子、アルキル基、アルケニル基、アリール基またはアラルキル基を表わす。ここでアルキル基、アルケニル基、アリール基またはアラルキル基はそれぞれ置換基を有していてもよい。また、R3とR4が結合してシクロアルキリデン基を形成してもよいし、R3とR5が結合してシクロアルキレン基を形成してもよい。ただし、R3とR5が同一である場合は、R4とR6は相異なる基を表わす。
【0028】
ハロゲン原子としては、例えばフッ素原子、塩素原子、臭素原子等が挙げられる。
【0029】
アルキル基としては、例えばメチル基、エチル基、n−プロピル基、イソプロピル基、シクロプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、n−ヘキシル基、n−デシル基等の炭素数1〜10の直鎖状、分枝鎖状または環状のアルキル基が挙げられる。かかるアルキル基は置換基を有していてもよく、置換基としては、例えばハロゲン原子、アルコキシ基、カルボアルコキシ基、例えば窒素原子、酸素原子、硫黄原子、ケイ素原子等のヘテロ原子等が挙げられる。かかる置換基を有するアルキル基としては、例えばクロロメチル基、ジクロロメチル基、トリクロロメチル基、ジフルオロメチル基、トリフルオロメチル基、2,2,2−トリクロロエチル基、2,2−ジフルオロ−2−ブロモエチル基、2,2−ジメチル−2−メトキシエチル基、メトキシメチル基、メトキシエチル基、カルボメトキシメチル基、2−カルボエトキシエチル基等が挙げられる。
【0030】
アルケニル基としては、例えばエテニル基、プロペニル基、2−メチルプロペニル基、1−ブテニル基、2−ブテニル基、ヘキセニル基、シクロペンチリデンメチル基、シクロヘキシリデンメチル基等の炭素数1〜10の直鎖状、分枝鎖状または環状のアルケニル基が挙げられる。かかるアルケニル基は置換基を有していてもよく、置換基としては、例えばハロゲン原子、アルコキシ基、カルボアルコキシ基、アリール基、ハロアリール基、例えば窒素原子、酸素原子、硫黄原子、ケイ素原子等のヘテロ原子等が挙げられる。かかる置換基を有するアルケニル基としては、例えばクロロエテニル基、クロロプロペニル基、2,2−ジクロロエテニル基、2,2−ジフルオロエテニル基、2,2−ジブロモエテニル基、2−フルオロ−2−トリフルオロメチルエテニル基、2−クロロ−2−トリフルオロメチルエテニル基、2−カルボメトキシプロペニル基、2−カルボエトキシプロペニル基、2−クロロ−2−(4−クロロフェニル)エテニル基等が挙げられる。
【0031】
アリール基としては、例えばフェニル基、ナフチル基等が挙げられ、かかるアリール基を構成する芳香環は上記した置換基で置換されていてもよい。また、アラルキル基としては、例えば上記したアルキル基とアリール基とから構成されるものが挙げられる。
【0032】
かかるオレフィン類(2)としては、例えばプロペン、1−ブテン、イソブチレン、1−ペンテン、1−ヘキセン、1−オクテン、4−クロロ−1−ブテン、2−ペンテン、2−ヘプテン、2−メチル−2−ブテン、2−メチル−4−シクロペンチリデン−2−ブテン、1−クロロ−2−メチルプロペン、2,5−ジメチル−2,4−ヘキサジエン、2−クロロ−5−メチル−2,4−ヘキサジエン、2−フルオロ−5−メチル−2,4−ヘキサジエン、1,1,1−トリフルオロ−5−メチル−2,4−ヘキサジエン、1,1,1−トリフルオロ−2−クロロ−5−メチル−2,4−ヘキサジエン、2−メトキシカルボニル−5−メチル−2,4−ヘキサジエン、1,1−ジフルオロ−4−メチル−1,3−ペンタジエン、1,1−ジクロロ−4−メチル−1,3−ペンタジエン、1−クロロ−1−(4−クロロフェニル)−4−メチル−1,3−ペンタジエン、1,1−ジクロロ−2,4−ジメチル−1,3−ペンタジエン、2−メチル−2,4−ヘキサジエン、2,3−ジメチル−2−ペンテン、1,1,1−トリクロロ−4−メチル−3−ペンテン等が挙げられる。
【0033】
一般式(3)
で示されるジアゾ酢酸エステル類(以下、ジアゾ酢酸エステル類(3)と略記する。)の式中、R7は炭素数1〜10のアルキル基、置換されていてもよいベンジル基または置換されていてもよいフェニル基を表わす。
【0034】
炭素数1〜10のアルキル基としては、例えばメチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、tert−ブチル基、シクロヘキシル基、l−メンチル基、d−メンチル基、アダマンチル基等の直鎖状、分枝鎖状または環状のアルキル基が挙げられる。置換されていてもよいベンジル基としては、例えばベンジル基、3−フェノキシベンジル基、2−メチル−3−フェニルベンジル基、2,3,5,6−テトラフルオロベンジル基、2,3,5,6−テトラフルオロ−4−メチルベンジル基等が挙げられる。置換されていてもよいフェニル基としては、例えばフェニル基、2−メチルフェニル基、3,5−ジメチルフェニル基、4−メチル−2,6−ジ−tert−ブチルフェニル基、2−メトキシフェニル基、3,5−ジメトキシフェニル基、3−フェノキシフェニル基等が挙げられる。
【0035】
かかるジアゾ酢酸エステル類(3)としては、例えばジアゾ酢酸エチル、ジアゾ酢酸n−プロピル、ジアゾ酢酸tert−ブチル、ジアゾ酢酸フェニル、ジアゾ酢酸l−メンチル、ジアゾ酢酸(4−メチル−2,6−ジ−tert−ブチルフェニル)、ジアゾ酢酸(3−フェノキシベンジル)、ジアゾ酢酸(2,3,5,6−テトラフルオロベンジル)等が挙げられる。
【0036】
ジアゾ酢酸エステル類(3)は、市販のものを用いてもよいし、例えば対応するアミノ酸エステル類と亜硝酸ナトリウム等のジアゾ化剤を反応させる方法等の公知の方法により製造してもよい。また、蒸留品を用いてもよい。
【0037】
サリチリデンアミノアルコール化合物(1)と銅化合物とを反応せしめてなる光学活性な銅錯体触媒の存在下、プロキラルなオレフィン類(2)とジアゾ酢酸エステル類(3)の反応は、通常該銅錯体触媒とプロキラルなオレフィン類(2)の混合物に、ジアゾ酢酸エステル類(3)を加えることにより実施される。上記した通り、フェニルヒドラジン等の還元剤を共存させて反応を実施してもよい。
【0038】
プロキラルなオレフィン類(2)の使用量は、ジアゾ酢酸エステル類(3)に対して、通常1モル倍以上であり、その上限は特に制限されず、プロキラルなオレフィン類(2)が反応温度で液体である場合には、例えば反応溶媒を兼ねて大過剰量用いてもよい。
【0039】
銅錯体触媒の使用量は、ジアゾ酢酸エステル類(3)に対して、銅換算で、通常0.001モル%以上であり、その上限は特にないが、多すぎると経済的に不利になりやすいため、実用的には5モル%以下、好ましくは1モル%以下である。
【0040】
反応温度は、通常−20〜150℃、好ましくは−10〜120℃である。また反応は通常窒素ガス等の不活性ガス雰囲気下で実施されるが、本発明の銅錯体は、比較的酸素に対して安定であるため、数%の酸素ガスを含む雰囲気下で反応を実施してもよい。
【0041】
反応は、通常溶媒の存在下に実施される。溶媒としては、例えばトルエン、キシレン等の芳香族炭化水素系溶媒、例えばヘキサン、ヘプタン等の脂肪族炭化水素系溶媒、例えば酢酸エチル、酢酸ブチル等のエステル系溶媒、例えばクロロベンゼン、ジクロロメタン、ジクロロエタン等のハロゲン化炭化水素系溶媒等が挙げられ、その使用量は特に限定されない。また、プロキラルなオレフィン類(2)が反応温度で液体である場合には、上記したように、該プロキラルなオレフィン類(2)を溶媒として用いてもよい。
【0042】
かくして、上記した一般式(4)で示される光学活性なシクロプロパンカルボン酸誘導体(以下、シクロプロパンカルボン酸誘導体(4)と略記する。)を含む反応混合物が得られ、例えば該反応混合物に、エチレンジアミン四酢酸等を加え、含有する銅錯体触媒を分解した後、蒸留処理することにより、シクロプロパンカルボン酸誘導体(4)を取り出すことができる。取り出したシクロプロパンカルボン酸誘導体(4)は、例えば蒸留、カラムクロマトグラフィ等によりさらに精製してもよい。
【0043】
かかるシクロプロパンカルボン酸誘導体(4)としては、例えば光学活性な2−メチルシクロプロパンカルボン酸メチル、光学活性な2−メチルシクロプロパンカルボン酸エチル、光学活性な2−メチルシクロプロパンカルボン酸n−プロピル、光学活性な2−メチルシクロプロパンカルボン酸イソプロピル、光学活性な2−メチルシクロプロパンカルボン酸イソブチル、光学活性な2−メチルシクロプロパンカルボン酸tert−ブチル、光学活性な2−メチルシクロプロパンカルボン酸シクロヘキシル、光学活性な2−メチルシクロプロパンカルボン酸メンチル、光学活性な2−メチルシクロプロパンカルボン酸(4−メチル−2,6−ジ−tert−ブチルフェニル)、
【0044】
光学活性な2,2−ジメチルシクロプロパンカルボン酸メチル、光学活性な2,2−ジメチルシクロプロパンカルボン酸エチル、光学活性な2,2−ジメチルシクロプロパンカルボン酸n−プロピル、光学活性な2,2−ジメチルシクロプロパンカルボン酸イソプロピル、光学活性な2,2−ジメチルシクロプロパンカルボン酸イソブチル、光学活性な2,2−ジメチルシクロプロパンカルボン酸tert−ブチル、光学活性な2,2−ジメチルシクロプロパンカルボン酸シクロヘキシル、光学活性な2,2−ジメチルシクロプロパンカルボン酸メンチル、光学活性な2,2−ジメチルシクロプロパンカルボン酸(4−メチル−2,6−ジ−tert−ブチルフェニル)、
【0045】
光学活性な2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸メチル、光学活性な2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチル、光学活性な2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸n−プロピル、光学活性な2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸イソプロピル、光学活性な2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸イソブチル、光学活性な2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸tert−ブチル、光学活性な2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸シクロヘキシル、光学活性な2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸メンチル、光学活性な2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸(4−メチル−2,6−ジ−tert−ブチルフェニル)、光学活性な2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸(3−フェノキシベンジル)、光学活性な2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸(2,3,5,6−テトラフルオロ−4−メトキシベンジル)、
【0046】
光学活性な2,2−ジメチル−3−(2,2−ジクロロエテニル)シクロプロパンカルボン酸メチル、光学活性な2,2−ジメチル−3−(2,2−ジクロロエテニル)シクロプロパンカルボン酸エチル、光学活性な2,2−ジメチル−3−(2,2−ジクロロエテニル)シクロプロパンカルボン酸n−プロピル、光学活性な2,2−ジメチル−3−(2,2−ジクロロエテニル)シクロプロパンカルボン酸イソプロピル、光学活性な2,2−ジメチル−3−(2,2−ジクロロエテニル)シクロプロパンカルボン酸イソブチル、光学活性な2,2−ジメチル−3−(2,2−ジクロロエテニル)シクロプロパンカルボン酸tert−ブチル、光学活性な2,2−ジメチル−3−(2,2−ジクロロエテニル)シクロプロパンカルボン酸シクロヘキシル、光学活性な2,2−ジメチル−3−(2,2−ジクロロエテニル)シクロプロパンカルボン酸l−メンチル、光学活性な2,2−ジメチル−3−(2,2−ジクロロエテニル)シクロプロパンカルボン酸(4−メチル−2,6−ジ−tert−ブチルフェニル)、光学活性な2,2−ジメチル−3−(2,2−ジクロロエテニル)シクロプロパンカルボン酸(3−フェノキシベンジル)、光学活性な2,2−ジメチル−3−(2,2−ジクロロエテニル)シクロプロパンカルボン酸(2,3,5,6−テトラフルオロベンジル)、光学活性な2,2−ジメチル−3−(2,2−ジブロモエテニル)シクロプロパンカルボン酸エチル、
【0047】
光学活性な2,2−ジメチル−3−(2,2,2−トリクロロエチル)シクロプロパンカルボン酸メチル、光学活性な2,2−ジメチル−3−(2,2,2−トリクロロエチル)シクロプロパンカルボン酸エチル、光学活性な2,2−ジメチル−3−(2,2,2−トリクロロエチル)シクロプロパンカルボン酸n−プロピル、光学活性な2,2−ジメチル−3−(2,2,2−トリクロロエチル)シクロプロパンカルボン酸イソプロピル、光学活性な2,2−ジメチル−3−(2,2,2−トリクロロエチル)シクロプロパンカルボン酸イソブチル、光学活性な2,2−ジメチル−3−(2,2,2−トリクロロエチル)シクロプロパンカルボン酸tert−ブチル、光学活性な2,2−ジメチル−3−(2,2,2−トリクロロエチル)シクロプロパンカルボン酸シクロヘキシル、光学活性な2,2−ジメチル−3−(2,2,2−トリクロロエチル)シクロプロパンカルボン酸l−メンチル、光学活性な2,2−ジメチル−3−(2,2,2−トリクロロエチル)シクロプロパンカルボン酸(4−メチル−2,6−ジ−tert−ブチルフェニル)、光学活性な2,2−ジメチル−3−(2,2,2−トリクロロエチル)シクロプロパンカルボン酸(3−フェノキシベンジル)、光学活性な2,2−ジメチル−3−(2,2,2−トリクロロエチル)シクロプロパンカルボン酸(3−フェノキシフェニル)、
【0048】
光学活性な2,2−ジメチル−3−(2−カルボエトキシ−1−プロペニル)シクロプロパンカルボン酸メチル、光学活性な2,2−ジメチル−3−(2−カルボメトキシ−1−プロペニル)シクロプロパンカルボン酸エチル、光学活性な2,2−ジメチル−3−(2−カルボエトキシ−1−プロペニル)シクロプロパンカルボン酸n−プロピル、光学活性な2,2−ジメチル−3−(2−カルボメトキシ−1−プロペニル)シクロプロパンカルボン酸イソプロピル、光学活性な2,2−ジメチル−3−(2−カルボエトキシ−1−プロペニル)シクロプロパンカルボン酸イソブチル、光学活性な2,2−ジメチル−3−(2−カルボメトキシ−1−プロペニル)シクロプロパンカルボン酸tert−ブチル、光学活性な2,2−ジメチル−3−(2−カルボエトキシ−1−プロペニル)シクロプロパンカルボン酸シクロヘキシル、光学活性な2,2−ジメチル−3−(2−カルボメトキシ−1−プロペニル)シクロプロパンカルボン酸メンチル、光学活性な2,2−ジメチル−3−(2−カルボエトキシ−1−プロペニル)シクロプロパンカルボン酸(4−メチル−2,6−ジ−tert−ブチルフェニル)、
【0049】
光学活性な2,2−ジメチル−3−(2−カルボメトキシ−1−プロペニル)シクロプロパンカルボン酸(3−フェノキシベンジル)、光学活性な2,2−ジメチル−3−(2−カルボエトキシ−1−プロペニル)シクロプロパンカルボン酸(3−フェノキシフェニル)、光学活性な2,2−ジメチル−3−[2−クロロ−2−(4−クロロフェニル)−1−エテニル]シクロプロパンカルボン酸エチル、光学活性な2,2−ジメチル−3−(2−クロロ−2−トリフルオロメチル−1−エテニル)シクロプロパンカルボン酸エチル等が挙げられる。
【0050】
また、シクロプロパンカルボン酸誘導体(4)を取り出した後の残分中には、サリチリデンアミノアルコール化合物(1)が含まれており、該残分を、例えば晶析処理、カラムクロマトグラフィ処理等することにより、サリチリデンアミノアルコール化合物(1)を回収することができる。
【0051】
【実施例】
以下、実施例により本発明をさらに詳細に説明するが、本発明はこれら実施例に限定されるものでない。なお、比旋光度は、日本分光工業社製DIP370を用い、室温で測定した。
【0052】
実施例1
窒素ガス雰囲気下、(R)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール1.60g、2−ヒドロキシ−5−ニトロベンズアルデヒド0.98gおよびトルエン30mLを混合し、内温80℃で1時間攪拌、保持した。その後、トルエンを留去し、晶析処理して、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール1.35gを得た。収率74%。
【0053】
1H−NMR(溶媒:CDCl3,TMS基準,単位:ppm)
δ1.41(d,3H,J=6.6Hz),3.62(s,6H),5.26(s,1H),5.66(s,1H),6.65−7.27(m,8H),7.52−7.67(m,2H),8.03−8.10(m,3H)
【0054】
実施例2
窒素置換した100mLシュレンク管に、2,5−ジメチル−2,4−ヘキサジエン66.12gおよびフェニルヒドラジン4μgを加え、内温80℃で、酢酸銅・一水和物3.59mgと(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール17.46mgとから調製した銅錯体/トルエン溶液およびジアゾ酢酸エチル2.28gを含む2,5−ジメチル−2,4−ヘキサジエン溶液9.9gをそれぞれ2時間かけて滴下した。さらに同温度で、30分攪拌、保持し、得られた反応液をガスクロマトグラフィにより分析したところ、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルの収率は、97.4%、トランス体/シス体比=59/41であった。液体クロマトグラフィーにより光学純度を分析したところ、トランス体は56%ee、シス体は50%eeであった。
【0055】
該反応液を減圧条件下で濃縮し、濃縮残渣を液体クロマトグラフィにより分析したところ、該濃縮残渣中に残存する(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノールの回収率は、22%(対仕込(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール)であった。
【0056】
比較例1
実施例2において、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール17.46mgに代えて、(R)−N−サリチリデン−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール14.6mgを用いた以外は実施例2と同様に実施して、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルを得た。収率96.2%、トランス体/シス体比=60/40であった。トランス体の光学純度は35%ee、シス体の光学純度は36%eeであった。
【0057】
また、(R)−N−サリチリデン−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノールの回収率は、5%であった(対仕込(R)−N−サリチリデン−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール)。
【0058】
実施例3
実施例1において、2−ヒドロキシ−5−ニトロベンズアルデヒド0.98gに代えて、2−ヒドロキシ−3、5−ジクロロベンズアルデヒド1.12gを用いた以外は実施例1と同様に実施して、(R)−N−(3、5−ジクロロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール2.00gを得た。収率78%。
【0059】
1H−NMR(溶媒:CDCl3,TMS基準,単位:ppm)
δ1.35(d,3H,J=6.6Hz),3.56(d,6H),5.14(q,1H),5.54(s,1H),6.71−7.28(m,9H),7.50−7.69(m,2H),7.98(s,1H)
【0060】
実施例4
(R)−2−アミノ−1,1−ジフェニル−1−プロパノール2.0g、2−ヒドロキシ−5−ニトロベンズアルデヒド1.47gおよびメタノール30mLを混合し、内温80℃で、1時間攪拌、保持した。その後、内温20℃まで冷却し、析出した結晶を濾取した。濾取した結晶をメタノールで洗浄後、乾燥し、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジフェニル−1−プロパノール3.22gを得た。収率97.2%。融点:208℃。
【0061】
1H−NMR(溶媒:CDCl3,TMS基準,単位:ppm)
δ1.29(d,3H,J=6.6Hz),2.61(s,1H),4.65(q,1H,J=6.6Hz),6.82−6.89(m,1H),7.20−7.54(m,10H),8.12−8.15(m,2H),8.26(s,1H)
【0062】
元素分析値:C 70.1%,H 5.4%,N 7.4%
計算値:C 70.2%,H 5.3%,N 7.5%
【0063】
実施例5
(R)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール3.8g、2−ヒドロキシ−3−フルオロベンズアルデヒド2.0gおよびトルエン22gを混合し、内温80℃で1時間攪拌、保持した。その後、溶媒を留去し、結晶を一旦析出させた。これにトルエン12gを加え、内温80℃に昇温し、溶解させた後、ヘプタン6gを加え、室温まで冷却した。析出した結晶を濾取し、トルエン3g/ヘプタン1.5gの混合溶媒で洗浄し、乾燥して、黄色粉末状の(R)−N−(3−フルオロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール4.37gを得た。収率:80.7%。融点:116〜118℃。
【0064】
1H−NMR(溶媒:CDCl3,TMS基準,単位:ppm)
δ1.34(d,3H),3.56(d,6H),5.14(q,1H),5.49(s,1H),6.47−7.26(m,9H),7.56−7.68(m,2H),8.16(s,1H)
【0065】
実施例6
(R)−2−アミノ−1,1−ジ(2−n−ブトキシ−5−tert−ブチルフェニル)−1−プロパノール0.97gと2−ヒドロキシ−5−ニトロベンズアルデヒド0.33gをエタノール20mL/トルエン20mLの混合溶媒に溶解させ、1時間還流させた。その後、反応混合物を濃縮し、乾燥させ、黄色固体状の(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−n−ブトキシ−5−tert−ブチルフェニル)−1−プロパノール1.2gを得た。融点:67.9℃。比旋光度:[α]546=−308°(C=0.1%クロロホルム)。
【0066】
1H−NMR(溶媒:CDCl3,TMS基準,単位:ppm)
δ0.87−0.93(m,6H),1.15(s,9H),1.29−1.31(m,4H),1.33(s,9H),1.36(s,3H),1.46−1.56(m,4H),3.72−3.85(m,4H),6.63−8.05(m,9H),8.57(s,1H)
【0067】
元素分析値:C 71.5%,H 8.1%,N 4.6%
計算値:C 72.2%,H 8.2%,N 4.4%
【0068】
実施例7
酸素濃度1%の窒素ガスで置換した100mLシュレンク管に、2,5−ジメチル−2,4−ヘキサジエン66.12gおよびフェニルヒドラジン4μgを加え、内温80℃で、30分攪拌、保持した。その後、同温度で、酢酸銅一水和物3.59mgと(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール8.73mgとから調製した銅錯体触媒のトルエン溶液およびジアゾ酢酸エチル2.28gを含む2,5−ジメチル−2,4−ヘキサジエン溶液9.9gをそれぞれ2時間かけて滴下した。その後、さらに同温度で、30分攪拌、保持し、得られた反応混合物をガスクロマトグラフィーにより分析したところ、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルの収率は、93.5%、トランス体/シス体比=59/41であった。液体クロマトグラフィーにより光学純度を分析したところ、トランス体は56%ee、シス体は49%eeであった。
【0069】
実施例8
実施例7において、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール8.73mgに代えて、(R)−N−(3−フルオロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール8.19mgを用いた以外は実施例7と同様に実施して、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルを得た。収率は93.6%、トランス体/シス体比=60/40であった。トランス体の光学純度は46%ee、シス体の光学純度は43%eeであった。
【0070】
実施例9
実施例7において、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール8.73mgに代えて、(R)−N−(3,5−ジクロロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール9.20mgを用いた以外は実施例7と同様に実施して、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルを得た。収率は94.4%、トランス体/シス体比=60/40であった。トランス体の光学純度は58%ee、シス体の光学純度は53%eeであった。
【0071】
比較例2
実施例7において、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール8.73mgに代えて、(R)−N−サリチリデン−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール7.83mgを用いた以外は実施例7と同様に実施して、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルを得た。収率89.3%、トランス体/シス体比=60/40であった。トランス体の光学純度は34%ee、シス体の光学純度は35%eeであった。
【0072】
実施例10
実施例7において、酸素濃度1%の窒素ガスを用いず、酸化剤であるクメンヒドロペルオキシド0.066gを共存させて窒素ガス雰囲気下で反応を実施した以外は実施例7と同様に実施して、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルを得た。収率95.8%、トランス体/シス体比=58/42であった。トランス体の光学純度は61%ee、シス体の光学純度は53%eeであった。
【0073】
比較例3
比較例2において、酸素濃度1%の窒素ガスを用いず、酸化剤であるクメンヒドロペルオキシド0.066gの共存させて窒素ガス雰囲気下で反応を実施した以外は比較例2と同様に実施して、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルを得た。収率94.2%、トランス体/シス体比=60/40であった。トランス体の光学純度は36%ee、シス体の光学純度は36%eeであった。
【0074】
実施例11
実施例10において、クメンヒドロペルオキシドの使用量を0.26gとした以外は実施例10と同様に実施して、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルを得た。収率81.1%、トランス体/シス体比=59/41であった。トランス体の光学純度は46%ee、シス体の光学純度は38%eeであった。
【0075】
実施例12
実施例11において、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール8.73mgに代えて、(R)−N−(3−フルオロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール8.19mgを用いた以外は実施例11と同様に実施して、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルを得た。収率85.6%、トランス体/シス体比=61/39であった。トランス体の光学純度は35%ee、シス体の光学純度は34%eeであった。
【0076】
実施例13
実施例11において、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール8.73mgに代えて、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−ブトキシフェニル)−1−プロパノール12.6mgを用いた以外は実施例11と同様に実施して、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルを得た。収率91.3%、トランス体/シス体比=56/44であった。トランス体の光学純度は51%ee、シス体の光学純度は35%eeであった。
【0077】
比較例4
比較例3において、クメンヒドロペルオキシドの使用量を0.26gとした以外は比較例3と同様に実施して、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルを得た。収率8.5%、トランス体/シス体比=59/41であった。トランス体の光学純度は21%ee、シス体の光学純度は20%eeであった。
【0078】
実施例14
実施例2において、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノールに代えて、(R)−N−(3,5−ジクロロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール5.22mgを用いた以外は実施例2と同様に実施して、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルを得た。収率94.2%、トランス体/シス体比=60/40であった。トランス体の光学純度は65%ee、シス体の光学純度は60%eeであった。
【0079】
実施例15
窒素置換した100mLシュレンク管に、2,5−ジメチル−2,4−ヘキサジエン66.12gおよびフェニルヒドラジン4μgを加え、内温80℃で、ナフテン酸銅/トルエン溶液(銅金属5重量%含有)22.9mgと(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジフェニル−1−プロパノール7.53mgとから調製した銅錯体触媒のトルエン溶液およびジアゾ酢酸エチル2.28gを含む2,5−ジメチル−2,4−ヘキサジエン溶液9.9gをそれぞれ2時間かけて滴下した。その後、同温度で、30分攪拌、保持し、得られた反応混合物をガスクロマトグラフィーにより分析したところ、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルの収率は、96.3%、トランス体/シス体比=61/39であった。液体クロマトグラフィーにより光学純度を分析したところ、トランス体は52%ee、シス体は44%eeであった。
【0080】
実施例16
内容積100mLのガラス製フラスコに、実施例6で調製した(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−ブトキシフェニル)−1−プロパノール0.52gと酢酸銅・一水和物0.164gおよびトルエン40mLを仕込み、内温80℃で1時間反応させた。室温に冷却した後、反応液を分液ロートに移し、0.6重量%水酸化ナトリウム水溶液30mLを加え、振とうし、静置後、下層を分液した。下層をイオン交換水で2回洗浄した後、濃縮処理し、緑色粉末の銅錯体0.54gを得た。
【0081】
分解温度:110〜130℃。比旋光度:[α]546=+314°(C=0.1%クロロホルム)
元素分析値:C 66.9%,H 7.4%,N 3.8%,Cu 7.66%
【0082】
実施例17
実施例1において、(R)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール1.60gに代えて、(R)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−ブトキシフェニル)−1−プロパノール0.968gを、2−ヒドロキシ−5−ニトロベンズアルデヒド0.98gに代えて、2−ヒドロキシ−3−フルオロベンズアルデヒド0.28gをそれぞれ用いた以外は、実施例1と同様に実施して、(R)−N−(3−フルオロサリチリデン)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−ブトキシフェニル)−1−プロパノールを得た。
【0083】
融点:52℃。比旋光度:[α]546=−312°(C=0.1%クロロホルム)
元素分析値:C 75.1%,H 8.5%,N 2.2%
計算値:C 75.4%,H 8.6%,N 2.3%
【0084】
実施例18
実施例1において、(R)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール1.60gに代えて、(R)−2−アミノ−1,1−ジフェニル−1−プロパノール0.455gを、2−ヒドロキシ−5−ニトロベンズアルデヒド0.98gに代えて、2−ヒドロキシ−3−フルオロベンズアルデヒド0.28gをそれぞれ用いた以外は、実施例1と同様に実施して、(R)−N−(3−フルオロサリチリデン)−2−アミノ−1,1−ジフェニル−1−プロパノールを得た。
【0085】
融点:100℃。比旋光度:[α]546=−117°(C=0.1%クロロホルム)
元素分析値:C 75.6%,H 5.8%,N 3.9%
計算値:C 75.6%,H 5.7%,N 4.0%
【0086】
実施例19
実施例1において、(R)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノールの使用量を0.575gとし、2−ヒドロキシ−5−ニトロベンズアルデヒドの使用量を0.334gとした以外は、実施例1と同様に実施して、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノールを得た。
【0087】
比旋光度:[α]546=−180°(C=0.1%クロロホルム)
元素分析値:C 65.9%,H 5.6%,N 6.4%
計算値:C 66.0%,H 5.5%,N 6.4%
【0088】
実施例20
実施例1において、(R)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノールの使用量を0.575gとし、2−ヒドロキシ−5−ニトロベンズアルデヒド0.98gに代えて、2−ヒドロキシ−3−フルオロベンズアルデヒド0.28gを用いた以外は、実施例1と同様に実施して、(R)−N−(3−フルオロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノールを得た。
【0089】
比旋光度:[α]546=−180°(C=0.1%クロロホルム)
元素分析値:C 70.1%,H 6.0%,N 3.4%
計算値:C 70.4%,H 5.9%,N 3.4%
【0090】
実施例21
実施例16において、酢酸銅・一水和物の使用量を0.082gとした以外は実施例16と同様に実施して、銅錯体0.53gを得た。
【0091】
融点:146〜148℃。比旋光度:[α]546=+316°(C=0.1%クロロホルム)
元素分析値:C 68.7%,H 7.7%,N 3.9%,Cu 4.9%
【0092】
実施例22
実施例16において、酢酸銅・一水和物の使用量を0.82gとした以外は実施例16と同様に実施して、銅錯体0.55gを得た。
【0093】
分解温度:65〜72℃。比旋光度:[α]546=+355°(C=0.1%クロロホルム)
元素分析値:C 67.0%,H 7.4%,N 3.8%,Cu 8.0%
【0094】
実施例23
実施例16において、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−ブトキシフェニル)−1−プロパノール0.52gに代えて、実施例17で調製した(R)−N−(3−フルオロサリチリデン)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−ブトキシフェニル)−1−プロパノール0.50gを用い、酢酸銅・一水和物の使用量を0.082gとした以外は実施例16と同様に実施して、銅錯体0.51gを得た。
【0095】
融点:71〜82℃。比旋光度:[α]546=+222°(C=0.1%クロロホルム)
元素分析値:C 70.7%,H 8.0%,N 2.2%,Cu 4.9%
【0096】
実施例24
実施例16において、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−ブトキシフェニル)−1−プロパノール0.52gに代えて、実施例4で調製した(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジフェニル−1−プロパノール0.31gを用いた以外は実施例16と同様に実施して、銅錯体0.35gを得た。
【0097】
分解温度:210℃以上。比旋光度:[α]546=+653°(C=0.1%クロロホルム)
元素分析値:C 63.5%,H 4.8%,N 5.1%,Cu 13.0%
【0098】
実施例25
実施例24において、酢酸銅・一水和物の使用量を0.082gとした以外は、実施例24と同様に実施して、銅錯体0.32gを得た。
【0099】
融点:125〜127℃。比旋光度:[α]546=+539°(C=0.1%クロロホルム)
元素分析値:C 68.0%,H 5.5%,N 5.6%,Cu 8.2%
【0100】
実施例26
実施例24において、酢酸銅・一水和物の使用量を0.82gとした以外は、実施例24と同様に実施して、銅錯体0.35gを得た。
【0101】
分解温度:210℃以上。比旋光度:[α]546=+872°(C=0.05%クロロホルム)
元素分析値:C 63.7%,H 4.8%,N 5.3%,Cu 13.9%
【0102】
実施例27
実施例16において、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−ブトキシフェニル)−1−プロパノール0.52gに代えて、実施例18で調製した(R)−N−(3−フルオロサリチリデン)−2−アミノ−1,1−ジフェニル−1−プロパノール0.286gを用い、酢酸銅・一水和物の使用量を0.082gとした以外は実施例16と同様に実施して、銅錯体0.29gを得た。
【0103】
融点:115〜123℃。比旋光度:[α]546=+532°(C=0.1%クロロホルム)
元素分析値:C 70.5%,H 5.1%,N 3.6%,Cu 8.5%
【0104】
実施例28
実施例16において、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−ブトキシフェニル)−1−プロパノール0.52gに代えて、実施例19で調製した(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール0.358gを用いた以外は実施例16と同様に実施して、銅錯体0.40gを得た。
【0105】
分解温度:180〜185℃。比旋光度:[α]546=+896°(C=0.1%クロロホルム)
元素分析値:C 61.1%,H 4.8%,N 5.0%,Cu 10.3%
【0106】
実施例29
実施例28において、酢酸銅・一水和物の使用量を0.082gとした以外は実施例28と同様に実施して、銅錯体0.39gを得た。
【0107】
融点:107〜119℃。比旋光度:[α]546=+510°(C=0.1%クロロホルム)
元素分析値:C 63.9%,H 5.2%,N 5.2%,Cu 6.6%
【0108】
実施例30
実施例28において、酢酸銅・一水和物の使用量を0.82gとした以外は実施例28と同様に実施して、銅錯体0.41得た。
【0109】
分解温度:142〜152℃。比旋光度:[α]546=+918°(C=0.1%クロロホルム)
元素分析値:C 60.9%,H 5.0%,N 4.9%,Cu 11.0%
【0110】
実施例31
実施例16において、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(5−tert−ブチル−2−n−ブトキシフェニル)−1−プロパノール0.52gに代えて、実施例20で調製した(R)−N−(3−フルオロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール0.336gを用いた以外は実施例16と同様に実施して、銅錯体0.38gを得た。
【0111】
分解温度:210℃以上。比旋光度:[α]546=+1086°(C=0.1%クロロホルム)
元素分析値:C 63.7%,H 5.2%,N 2.6%,Cu 10.6%
【0112】
実施例32
実施例31において、酢酸銅・一水和物の使用量を0.082gとした以外は実施例31と同様に実施して、銅錯体0.36gを得た。
【0113】
融点:86〜93℃。比旋光度:[α]546=+561°(C=0.1%クロロホルム)
元素分析値:C 66.5%,H 5.5%,N 2.8%,Cu 7.6%
【0114】
実施例33
内容積50mLのガラス製シュレンク管内に回転子を入れ、窒素置換後、実施例16で調製した銅錯体6.9mgおよび酢酸エチル10mLを仕込み、触媒液を調製した。内容積100mLのガラス製シュレンク管に回転子を入れ、窒素置換後、2,5−ジメチル−2,4−ヘキサジエン30gおよび先に調製した触媒液4mLを仕込み、さらにフェニルヒドラジン0.4mgを仕込んだ。内温80℃に昇温し、ジアゾ酢酸エチル/トルエン溶液10mL(蒸留したジアゾ酢酸エチル20mmol含有)を2時間かけて仕込んだ。その後、内温80℃で30分保持した後、室温まで冷却し、得られた反応液をガスクロマトグラフィにより分析したところ、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルの収率は、91%、トランス体/シス体比=54/46であった。液体クロマトグラフィにより光学純度を分析したところ、トランス体は70%ee、シス体は48%eeであった。
【0115】
実施例34
実施例6において、(R)−2−アミノ−1,1−ジ(2−n−ブトキシ−5−tert−ブチルフェニル)−1−プロパノール0.968gに代えて、(R)−2−アミノ−1,1−ジフェニル−1−プロパノール0.455gを用いた以外は実施例6と同様に実施して、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジフェニル−1−プロパノールを得た。
内容積50mLのガラス製フラスコに、上記で得られた(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジフェニル−1−プロパノール31mg、酢酸銅(I)10.2mgおよび酢酸エチル20.8mLを仕込み、さらに28重量%ナトリウムメチラート/メタノール溶液16mgを加え、銅錯体溶液を調製した。
【0116】
内容積100mLのガラス製シュレンク管に、銅錯体溶液2.5mLおよび2,5−ジメチル−2,4−ヘキサジエン30gを仕込み、内温80℃に昇温した。ジアゾ酢酸エチル/トルエン溶液10mL(蒸留したジアゾ酢酸エチル20mmol含有)を2時間かけて仕込んだ。その後、同温度で30分保持し、室温まで冷却し、得られた反応液をガスクロマトグラフィにより分析したところ、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルの収率は、93%、トランス体/シス体比=61/39であった。液体クロマトグラフィにより光学純度を分析したところ、トランス体は56%ee、シス体は48%eeであった。
【0117】
実施例35〜46
調製した種々の銅錯体を用い、実施例33と同様に2,5−ジメチル−2,4−ヘキサジエンとジアゾ酢酸エチルとの反応を実施した。結果を表1および表2に示す。
【0118】
【表1】
【0119】
【表2】
【0120】
実施例47
磁気回転子を備えた内容積50mLのガラス製シュレンク管を、窒素置換した後、実施例16で調製した銅錯体6.9mg、酢酸エチル10mLおよびフェニルヒドラジン1.1mgを仕込み、触媒液を調製した。
内容積100mLのステンレス製オートクレーブを窒素置換した後、調製した触媒液5mLおよびイソブチレン3.5gを仕込んだ。内温40℃に昇温し、ジアゾ酢酸エチル/トルエン溶液(蒸留したジアゾ酢酸エチル20mmol含有)10mLを2時間かけて仕込んだ。同温度で30分攪拌、保持した後、室温まで冷却し、2,2−ジメチルシクロプロパンカルボン酸エチルを含む反応液を得た。ガスクロマトグラフィ分析により、収率を求めたところ、91%であった。加水分解後、l−メントール誘導化して、光学純度を測定したところ、87%eeであった。
【0121】
比較例5
実施例6において、2−ヒドロキシ−5−ニトロベンズアルデヒド0.334gに代えて、サリチルアルデヒド0.244gを用いた以外は実施例6と同様に実施して、(R)−N−サリチリデン−2−アミノ−1,1−ジ(2−n−ブトキシ−tert−ブチルフェニル)−1−プロパノールを得た。
【0122】
比較例6
比較例5において、(R)−2−アミノ−1,1−ジ(2−n−ブトキシ−5−tert−ブチルフェニル)−1−プロパノール0.968gに代えて、(R)−2−アミノ−1,1−ジフェニル−1−プロパノール0.455gを用いた以外は比較例5と同様に実施して、(R)−N−サリチリデン−2−アミノ−1,1−ジフェニル−1−プロパノールを得た。
【0123】
比較例7
比較例5において、(R)−2−アミノ−1,1−ジ(2−n−ブトキシ−5−tert−ブチルフェニル)−1−プロパノール0.968gに代えて、(R)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール0.575gを用いた以外は比較例5と同様に実施して、(R)−N−サリチリデン−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノールを得た。
【0124】
比較例8
実施例16において、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−n−ブトキシ−tert−ブチルフェニル)−1−プロパノール0.52gに代えて、比較例5で得られた(R)−N−サリチリデン−2−アミノ−1,1−ジ(2−n−ブトキシ−tert−ブチルフェニル)−1−プロパノール0.482gを用いた以外は実施例16と同様に実施して、銅錯体0.53gを得た。
【0125】
比較例9
実施例16において、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−n−ブトキシ−tert−ブチルフェニル)−1−プロパノール0.52gに代えて、比較例6で得られた(R)−N−サリチリデン−2−アミノ−1,1−ジフェニル−1−プロパノール0.272gを用いた以外は実施例16と同様に実施して、銅錯体0.32gを得た。
【0126】
比較例10
実施例16において、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−n−ブトキシ−tert−ブチルフェニル)−1−プロパノール0.52gに代えて、比較例7で得られた(R)−N−サリチリデン−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール0.321gを用いた以外は実施例16と同様に実施して、銅錯体0.37gを得た。
【0127】
比較例11
実施例33において、実施例16で調製した銅錯体6.9mgに代えて、比較例8で調製した銅錯体(Cu金属換算で、ジアゾ酢酸エチルに対して、0.02mol%使用)を用いた以外は実施例33と同様に実施して、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルを得た。収率:86%。トランス体/シス体比=61/39。トランス体光学純度:24%ee、シス体光学純度:23%ee。
【0128】
比較例12
実施例33において、実施例16で調製した銅錯体6.9mgに代えて、比較例9で調製した銅錯体(Cu金属換算で、ジアゾ酢酸エチルに対して、0.02mol%使用)を用いた以外は実施例33と同様に実施して、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルを得た。収率:91%。トランス体/シス体比=62/38。トランス体光学純度は、15%ee、シス体光学純度は15%eeであった。
【0129】
比較例13
実施例33において、実施例16で調製した銅錯体6.9mgに代えて、比較例10で調製した銅錯体(Cu金属換算で、ジアゾ酢酸エチルに対して、0.02mol%使用)を用いた以外は実施例33と同様に実施して、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルを得た。収率:91%。トランス体/シス体比=62/38。トランス体光学純度は、17%ee、シス体光学純度は19%eeであった。
【0130】
実施例48
内容積100mLのガラス製フラスコに、(R)−N−(5−ニトロサリチリデン)−2−アミノ−1,1−ジ(2−メトキシフェニル)−1−プロパノール9.8g、酢酸銅・一水和物4.0gおよびトルエン550gを仕込み、内温80℃で1時間反応させた。室温に冷却し、28重量%ナトリウムメチラート/メタノール溶液8.7gを仕込み、10分攪拌した後、水200gを仕込み、分液ロートで分液した。油層を濃縮し、緑色粉末の銅錯体11.2gを得た。
【0131】
分解温度:158〜165℃。比旋光度:[α]546=+927°(C=0.1%クロロホルム)
元素分析値:C 60.1%,H 4.9%,N 5.2%,Cu 10.4%
【0132】
実施例49
内容積100mLのガラス製フラスコに、実施例48で得られた銅錯体0.5gおよび2,5−ジメチル−2,4−ヘキサジエン100gを入れ、内温80℃で1時間攪拌、保持した。その後、室温まで冷却すると、緑色固体が析出した。析出固体を濾取し、乾燥させ、緑色粉末の付加体0.4gを得た。
【0133】
元素分析値:C 61.1%,H 5.3%,N 5.0%,Cu 11.7%(銅錯体2分子と2,5−ジメチル−2,4−ヘキサジエン1分子の付加体として計算すると、計算値:C 60.8%,H 5.3%,N 5.1%,Cu 11.5%となる。)
【0134】
実施例50
窒素置換した100mLシュレンク管に、2,5−ジメチル−2,4−ヘキサジエン66.1g、実施例49で得られた付加体5.53mgおよびフェニルヒドラジン4μgを仕込み、内温80℃でジアゾ酢酸エチル2.3gを含む2,5−ジメチル−2,4−ヘキサジエン溶液9.9gを2時間かけて滴下した。同温度で30分攪拌、保持した後、得られた反応液をガスクロマトグラフィ分析したところ、2,2−ジメチル−3−(2−メチル−1−プロペニル)シクロプロパンカルボン酸エチルの収率は、97.2%、トランス体/シス体比=58/42であった。液体クロマトグラフィにより、光学純度を分析したところ、トランス体は62.5%ee、シス体は53.2%eeであった。
【0135】
【発明の効果】
本発明によれば、サリチリデン部位の特定の置換位置にニトロ基、塩素原子またはフッ素原子を有する光学活性なサリチリデンアミノアルコール化合物と銅化合物とを反応せしめてなる銅錯体は、例えばプロキラルなオレフィン類とジアゾ酢酸エステル類との反応に触媒活性を示し、しかも従来の錯体に比べて、反応系中でより安定であり、また酸素等に対してもより安定であるため、反応後の回収率が向上することから、より工業的に有利に光学活性なシクロプロパンカルボン酸誘導体を製造することができる。
Claims (5)
- 銅化合物が、カルボン酸銅、ハロゲン化銅、硝酸銅またはスルホン酸銅である請求項1に記載の光学活性な銅錯体。
- 一般式(2)
(式中、R3、R4、R5およびR6はそれぞれ同一または相異なって、水素原子、ハロゲン原子、アルキル基、アルケニル基、アリール基またはアラルキル基を表わす。ここで、アルキル基、アルケニル基、アリール基またはアラルキル基はそれぞれ置換基を有していてもよい。また、R3とR4が結合してシクロアルキリデン基を形成してもよいし、R3とR5が結合してシクロアルキレン基を形成してもよい。ただし、R3とR5が同一である場合は、R4とR6は相異なる基を表わす。)
で示されるプロキラルなオレフィンと一般式(3)
(式中、R7は炭素数1〜10のアルキル基、置換されていてもよいベンジル基または置換されていてもよいフェニル基を表わす。)
で示されるジアゾ酢酸エステルとを、一般式(1)
(式中、R 1 およびR 2 はそれぞれ同一または相異なって、低級アルキル基(炭素数1〜4)、アリール基またはアラルキル基を表わす。ここでアリール基は、アルキル基およびアルコキシ基からなる群より選ばれる置換基を有していてもよい。X 1 はニトロ基、塩素原子または水素原子を表わし、X 1 がニトロ基のとき、X 2 は水素原子を表わし、X 1 が塩素原子のとき、X 2 は塩素原子を表わし、X 1 が水素原子のとき、X 2 はフッ素原子を表わす。*は不斉炭素原子を表わす。)
で示される光学活性なサリチリデンアミノアルコール化合物と銅化合物とを反応させてなる光学活性な銅錯体触媒の存在下に反応させることを特徴とする一般式(4)
(式中、R3、R4、R5、R6およびR7はそれぞれ上記と同一の意味を表わす。)
で示される光学活性なシクロプロパンカルボン酸誘導体の製造方法。 - 一般式(1)
(式中、R 1 およびR 2 はそれぞれ同一または相異なって、低級アルキル基(炭素数1〜4)、アリール基またはアラルキル基を表わす。ここでアリール基は、アルキル基およびアルコキシ基からなる群より選ばれる置換基を有していてもよい。X 1 はニトロ基、塩素原子または水素原子を表わし、X 1 がニトロ基のとき、X 2 は水素原子を表わし、X 1 が塩素原子のとき、X 2 は塩素原子を表わし、X 1 が水素原子のとき、X 2 はフッ素原子を表わす。*は不斉炭素原子を表わす。)
で示される光学活性なサリチリデンアミノアルコール化合物と銅化合物とを反応させてなる光学活性な銅錯体と一般式(2)
(式中、R 3 、R 4 、R 5 およびR 6 はそれぞれ同一または相異なって、水素原子、ハロゲン原子、アルキル基、アルケニル基、アリール基またはアラルキル基を表わす。ここで、アルキル基、アルケニル基、アリール基またはアラルキル基はそれぞれ置換基を有していてもよい。また、R 3 とR 4 が結合してシクロアルキリデン基を形成してもよいし、R 3 とR 5 が結合してシクロアルキレン基を形成してもよい。ただし、R 3 とR 5 が同一である場合は、R 4 とR 6 は相異なる基を表わす。)
で示されるプロキラルなオレフィンとの付加体。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2001007513A JP4635343B2 (ja) | 2000-01-25 | 2001-01-16 | 光学活性な銅錯体ならびに光学活性なサリチリデンアミノアルコール化合物およびそれを用いる光学活性なシクロプロパンカルボン酸誘導体の製造方法 |
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2000016280 | 2000-01-25 | ||
| JP2000016279 | 2000-01-25 | ||
| JP2000-16279 | 2000-01-27 | ||
| JP2000-16280 | 2000-01-27 | ||
| JP2000-18595 | 2000-01-27 | ||
| JP2000018595 | 2000-01-27 | ||
| JP2001007513A JP4635343B2 (ja) | 2000-01-25 | 2001-01-16 | 光学活性な銅錯体ならびに光学活性なサリチリデンアミノアルコール化合物およびそれを用いる光学活性なシクロプロパンカルボン酸誘導体の製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2001278853A JP2001278853A (ja) | 2001-10-10 |
| JP4635343B2 true JP4635343B2 (ja) | 2011-02-23 |
Family
ID=27480955
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2001007513A Expired - Fee Related JP4635343B2 (ja) | 2000-01-25 | 2001-01-16 | 光学活性な銅錯体ならびに光学活性なサリチリデンアミノアルコール化合物およびそれを用いる光学活性なシクロプロパンカルボン酸誘導体の製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4635343B2 (ja) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4742428B2 (ja) * | 2001-02-19 | 2011-08-10 | 住友化学株式会社 | 不斉銅錯体結晶の製造方法 |
| EP1950208B1 (en) | 2005-11-01 | 2012-05-02 | Sumitomo Chemical Company, Limited | Process for producing 6,6-dimethyl-3-oxabicyclo[3.1.0]hexan-2-one |
| US8153830B2 (en) | 2006-10-26 | 2012-04-10 | Sumitomo Chemical Company, Limited | Production method of asymmetric copper complex crystal |
| JP2008133261A (ja) * | 2006-10-26 | 2008-06-12 | Sumitomo Chemical Co Ltd | 不斉銅錯体結晶の製造方法 |
| ES2401415T3 (es) | 2008-07-11 | 2013-04-19 | Sumitomo Chemical Company, Limited | Procedimiento para producir el ácido (1S, 2R)-2-cloro-2-fluorociclopropanocarboxílico |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5473758A (en) * | 1977-10-27 | 1979-06-13 | Sumitomo Chem Co Ltd | Asymmetric synthesis of chrysanthemumic acid derivative ester |
| JPS59225194A (ja) * | 1983-06-03 | 1984-12-18 | Sumitomo Chem Co Ltd | 新規不斉銅錯体ならびに同錯体を触媒とするシクロプロパンカルボン酸エステルの不斉合成法 |
-
2001
- 2001-01-16 JP JP2001007513A patent/JP4635343B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2001278853A (ja) | 2001-10-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Iseki | Catalytic asymmetric synthesis of chiral fluoroorganic compounds | |
| CN1208295C (zh) | 在锌催化剂存在下通过硅烷还原羰基化合物 | |
| JP4635343B2 (ja) | 光学活性な銅錯体ならびに光学活性なサリチリデンアミノアルコール化合物およびそれを用いる光学活性なシクロプロパンカルボン酸誘導体の製造方法 | |
| US6670500B2 (en) | Chiral copper complex and production processes thereof and using the same | |
| EP0128012B1 (en) | Novel chiral copper complex and asymmetric synthesis of cyclopropanecarboxylate derivatives using said complex as catalyst | |
| US6469198B2 (en) | Chiral copper complex catalyst composition and asymmetric production process using the same | |
| JP5803590B2 (ja) | 光学活性ビスオキサゾリン化合物、不斉触媒およびそれを用いた光学活性シクロプロパン化合物の製造方法 | |
| EP1607136B1 (en) | Optically active copper catalyst composition | |
| JP5002916B2 (ja) | 不斉銅錯体およびそれを用いた光学活性なシクロプロパンカルボン酸エステル化合物の製造方法 | |
| JP4126763B2 (ja) | 光学活性なビスオキサゾリン化合物、その製造法およびその用途 | |
| JP3308989B2 (ja) | フルオロシクロプロパンカルボン酸誘導体の製法 | |
| JP3991455B2 (ja) | 光学活性な菊酸エステルの製造法 | |
| JP4742423B2 (ja) | 不斉銅錯体の製造法およびそれを用いる光学活性シクロプロパン化合物の製造法 | |
| WO2006051595A1 (ja) | 大環状ケトン類の製造方法およびその中間体 | |
| CN1852887B (zh) | 光学活性环丙烷化合物的制备方法及其所用的不对称铜络合物 | |
| JP5002915B2 (ja) | 光学活性なシクロプロパンカルボン酸エステル化合物の製造方法およびそれに用いる不斉銅錯体 | |
| JP4839528B2 (ja) | 不斉コバルト錯体およびそれを触媒とする光学活性シクロプロパン化合物の製造方法 | |
| JP4492130B2 (ja) | 光学活性なビスオキサゾリン化合物、その製造方法およびその用途 | |
| JP2004315503A (ja) | 光学活性な銅錯体およびそれを用いる光学活性なシクロプロパン化合物の製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20071102 |
|
| RD05 | Notification of revocation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7425 Effective date: 20080128 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20100901 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100907 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101007 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20101026 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20101108 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131203 Year of fee payment: 3 |
|
| R151 | Written notification of patent or utility model registration |
Ref document number: 4635343 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R151 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131203 Year of fee payment: 3 |
|
| LAPS | Cancellation because of no payment of annual fees |