JP4617153B2 - 微量塩素イオン濃度分析方法 - Google Patents
微量塩素イオン濃度分析方法 Download PDFInfo
- Publication number
- JP4617153B2 JP4617153B2 JP2004371960A JP2004371960A JP4617153B2 JP 4617153 B2 JP4617153 B2 JP 4617153B2 JP 2004371960 A JP2004371960 A JP 2004371960A JP 2004371960 A JP2004371960 A JP 2004371960A JP 4617153 B2 JP4617153 B2 JP 4617153B2
- Authority
- JP
- Japan
- Prior art keywords
- amount
- chlorine
- electrode
- sample
- standard solution
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Images
Landscapes
- Investigating Or Analyzing Non-Biological Materials By The Use Of Chemical Means (AREA)
Description
(ここで、Aは標準液の塩素イオン濃度)
標準液を所定量の2倍採取する方法としては、所定量を採取できるサンプルループにより2回採取すればよい。
このようにパルス数から塩素イオン濃度を算出することができるので、校正及び分析を自動で行うことも可能である。
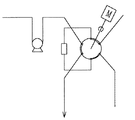
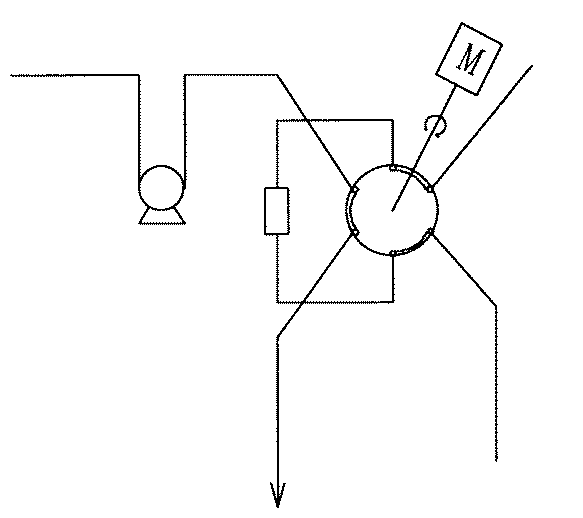
試料電磁弁(1)を開にして採取ポンプ(3)を稼動させサンプリング用6方バルブ(5)を通しサンプリングループ(6)に置換採取する。試料を採取するとサンプリング用6方バルブ(5)を図2に示すように60度回転(一周の六分の一回転)させ、流路を変えて純水電磁弁(7)から純水を試料のたまったサンプルループ(6)に送り込み、送り込んだ純水によってサンプルループ中の試料を滴定槽(8)へ洗いこむ。その後6方バルブ(5)は60度回転して図1のもとの流路にもどしておく。つづいて、試料をサンプリングした滴定槽へ今度は標準液(4)を上記した同じ工程によってサンプリングする。標準液をサンプリングするときは標準液電磁弁(2)を開にして採取ポンプ(3)を稼動させる。
K=A/(Pst2−Pst1) (1)
(ここで、Aは標準液の塩素イオン濃度)
次に、試料と標準液を採取して滴定した際のパルス数から標準液だけを採取して滴定した際のパルス数を差し引き、先に求めた1パルス当りの塩素イオン量を乗じて試料中の塩素イオンを算出する。
C=K×(Ps+st1−Pst1) (2)
下記条件により、イオン交換膜で製造された液体苛性ソーダ(濃度約32重量%)溶液中の塩素イオン濃度を分析した。計測されたパルス数を表1に示した。また、塩素イオン濃度の分析結果を表2に示した。
電量滴定条件
高濃度アルカリ性試料溶液:約32重量%液体苛性ソーダ 5ml
標準液:塩素イオン濃度100mg/mlの塩化ナトリウム水溶液 5ml(1回採取時)、10ml(2回採取時)
中和用酸:8M硝酸水溶液 6.6ml
中和後のpH:5
滴定するときのトータルの液量:50ml
銀電極:10mmφ×40mm銀棒
金属電極:6mmφ×50mm白金棒
電流:50mA直流電流を20Hzで供給
塩素イオン電極:HS−205S(東亜電気化学工業製)
比較電極:MR501C(ToKo製)
(参考例)
実施例と同じ試料について沈殿滴定法による手分析も同時に行った。
(2)標準液電磁弁 (13)電量滴定用Ag電極
(3)採取ポンプ (14)電量滴定用金属電極
(4)標準液 (15)排液電磁弁
(5)サンプリング用6方バルブ (16)定電流装置
(6)サンプルループ (17)イオンメーター
(7)純水電磁弁 (18)制御器
(8)滴定槽 (19)操作パネル
(9)中和用酸 (20)Cl−イオン電極
(10)酸ポンプ (21)比較電極
(11)スターラ
Claims (3)
- イオン交換膜法で製造される液体苛性ソーダ中の微量塩素イオン濃度分析方法であって、
滴定槽、銀電極からなる陽電極、及び金属電極からなる陰電極を有する装置を用い、標準液及び該液体苛性ソーダを該滴定槽にそれぞれ所定量採取して混合液を得、該混合液に中和用酸を添加して弱酸性とした後、前記陽電極と陰電極とに定電流を流して含有塩素イオンが消失するまで電解を行い、該電解に要した電気量を求め、
別途、同一の装置を用い、前記混合液を調製した際と同量の標準液のみを滴定槽に採取し、中和用酸を添加して弱酸性とした後、定電流を流して含有塩素イオンが消失するまで電解を行い、該電解に要した電気量を求め、
前記混合液を電解するのに要した電気量から標準液のみを電解したときの電気量を差し引いて、試料中の塩素イオン量を算出することを特徴とするイオン交換膜法で製造される液体苛性ソーダ中の微量塩素イオン濃度分析方法。 - 混合液及び標準液の電解に際して流す定電流を、パルス状に流す請求項1記載の微量塩素イオン濃度分析方法。
- 含有塩素イオンの消失を、比較電極として内部液にゲル状の塩化カリウムを用いた比較電極を用いて、イオン電極により検出することを特徴とする請求項1又は2記載の微量塩素イオン濃度分析方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004371960A JP4617153B2 (ja) | 2004-12-22 | 2004-12-22 | 微量塩素イオン濃度分析方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004371960A JP4617153B2 (ja) | 2004-12-22 | 2004-12-22 | 微量塩素イオン濃度分析方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006177800A JP2006177800A (ja) | 2006-07-06 |
| JP4617153B2 true JP4617153B2 (ja) | 2011-01-19 |
Family
ID=36732045
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004371960A Expired - Lifetime JP4617153B2 (ja) | 2004-12-22 | 2004-12-22 | 微量塩素イオン濃度分析方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4617153B2 (ja) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4904219B2 (ja) * | 2007-07-24 | 2012-03-28 | 株式会社タニタ | 液体成分測定装置 |
| CN102590316A (zh) * | 2011-11-07 | 2012-07-18 | 郑州飞机装备有限责任公司 | 高浓度铬酐溶液中氯离子杂质的检测方法 |
| NZ701454A (en) * | 2012-05-03 | 2016-05-27 | Buckman Lab Int Inc | Method and apparatus for measuring and controlling electrolytically-active species concentration in aqueous solutions |
| CN109507266A (zh) * | 2017-09-14 | 2019-03-22 | 东莞东阳光科研发有限公司 | 一种阳极箔表面残留氯离子的检测方法 |
| CN110530955A (zh) * | 2019-09-30 | 2019-12-03 | 浙江光年知新仪器有限公司 | 氯离子含量单点测试法 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS58221155A (ja) * | 1982-06-17 | 1983-12-22 | Joko:Kk | 塩素イオンの濃度測定用電解槽 |
| JPS59171853A (ja) * | 1983-03-18 | 1984-09-28 | Joko:Kk | 電量滴定法による微量塩素イオン濃度の自動測定方法 |
| JPH0715468B2 (ja) * | 1986-04-09 | 1995-02-22 | 三菱化学株式会社 | ハロゲンの定量法 |
| JPH01313754A (ja) * | 1988-06-13 | 1989-12-19 | Asahi Raifu Sci Kk | 塩素濃度の測定方法 |
| JPH0915192A (ja) * | 1995-06-27 | 1997-01-17 | Hitachi Ltd | 陰イオン選択性感応膜およびそれを用いたイオン感応性電極 |
| JP2000131276A (ja) * | 1998-10-28 | 2000-05-12 | Masaaki Amano | 携帯型残留塩素計 |
-
2004
- 2004-12-22 JP JP2004371960A patent/JP4617153B2/ja not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| JP2006177800A (ja) | 2006-07-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN212228867U (zh) | 一种铝氧化槽液在线分析智能管控系统 | |
| KR20150051873A (ko) | 화학적 산소 소비량(cod) 자동 측정 장치 | |
| JP4617153B2 (ja) | 微量塩素イオン濃度分析方法 | |
| CN111896676A (zh) | 一种采用抗污染pH电极自动测量水质中离子的装置及方法 | |
| CN112513624A (zh) | 金属酸洗用混合酸溶液的成分浓度测定装置 | |
| JP2530711B2 (ja) | 溶液中遊離酸および第2鉄イオンの同時定量分析方法および装置 | |
| RU2470289C1 (ru) | Состав мембраны ионоселективного электрода для определения ионов свинца | |
| JP6462402B2 (ja) | 塩化ナトリウムの濃度分析方法、塩化ナトリウムの濃度分析計及び次亜塩素酸ナトリウム分析計 | |
| JP3992692B2 (ja) | 還元糖の測定方法および装置 | |
| CN215574914U (zh) | 一种自动测量地层水等水样中离子含量的装置 | |
| CN120064555B (zh) | 锌镍电镀溶液中镍的分析方法 | |
| JP7777062B2 (ja) | イオン濃度測定方法 | |
| Ferreira et al. | Voltammetric determination of chloride ion in automotive fuel ethanol | |
| CN113484462A (zh) | 一种自动测量地层水等水样中离子含量的装置及方法 | |
| US7534394B1 (en) | Potentiometric titration method for quantitative determination of hydrogen peroxide | |
| RU2302628C1 (ru) | Электрохимический способ определения селена и мышьяка в природных объектах | |
| CN113670998A (zh) | 一种废水中铊浓度的自动测定仪器及自动测定方法 | |
| US20240125730A1 (en) | Non-reagent chloride analysis in acid copper plating baths | |
| CN113720960B (zh) | 一种基于orp电极的水样碱度测量装置及方法 | |
| CN217111742U (zh) | 一种在线水质分析仪样品自动稀释装置 | |
| RU223971U1 (ru) | Проточная потенциометрическая ячейка для измерения концентрации хлорид-ионов в высокочистых водных средах | |
| CN216484751U (zh) | 一种高锰酸盐指数在线分析仪滴定终点判断装置 | |
| CN213060471U (zh) | 含氟废水处理系统中的pH及钙离子浓度精准控制系统 | |
| CN110967383B (zh) | 一种测量地表水cod的电化学方法 | |
| JPH0235809Y2 (ja) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070628 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20100125 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100413 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100531 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100810 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100820 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20101012 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20101025 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4617153 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131029 Year of fee payment: 3 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |