JP4540986B2 - ワートマニン類似体およびそれらを用いる方法 - Google Patents
ワートマニン類似体およびそれらを用いる方法 Download PDFInfo
- Publication number
- JP4540986B2 JP4540986B2 JP2003528088A JP2003528088A JP4540986B2 JP 4540986 B2 JP4540986 B2 JP 4540986B2 JP 2003528088 A JP2003528088 A JP 2003528088A JP 2003528088 A JP2003528088 A JP 2003528088A JP 4540986 B2 JP4540986 B2 JP 4540986B2
- Authority
- JP
- Japan
- Prior art keywords
- wortmannin
- compound
- analogs
- present
- drug
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- QDLHCMPXEPAAMD-QAIWCSMKSA-N wortmannin Chemical class C1([C@]2(C)C3=C(C4=O)OC=C3C(=O)O[C@@H]2COC)=C4[C@@H]2CCC(=O)[C@@]2(C)C[C@H]1OC(C)=O QDLHCMPXEPAAMD-QAIWCSMKSA-N 0.000 title abstract description 64
- 238000000034 method Methods 0.000 title description 25
- 150000001875 compounds Chemical class 0.000 claims description 38
- 239000003814 drug Substances 0.000 claims description 23
- 239000000126 substance Substances 0.000 claims description 14
- 239000003085 diluting agent Substances 0.000 claims description 8
- 239000000654 additive Substances 0.000 claims description 6
- 230000000996 additive effect Effects 0.000 claims description 5
- 239000003937 drug carrier Substances 0.000 claims description 5
- 230000000694 effects Effects 0.000 abstract description 14
- 102000003993 Phosphatidylinositol 3-kinases Human genes 0.000 abstract description 13
- 108090000430 Phosphatidylinositol 3-kinases Proteins 0.000 abstract description 13
- 230000002401 inhibitory effect Effects 0.000 abstract description 9
- 241000124008 Mammalia Species 0.000 abstract description 2
- 230000005740 tumor formation Effects 0.000 abstract 1
- QDLHCMPXEPAAMD-UHFFFAOYSA-N wortmannin Natural products COCC1OC(=O)C2=COC(C3=O)=C2C1(C)C1=C3C2CCC(=O)C2(C)CC1OC(C)=O QDLHCMPXEPAAMD-UHFFFAOYSA-N 0.000 description 34
- 229940079593 drug Drugs 0.000 description 20
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 18
- 239000007943 implant Substances 0.000 description 16
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 12
- 208000037803 restenosis Diseases 0.000 description 11
- 238000000855 fermentation Methods 0.000 description 10
- 230000004151 fermentation Effects 0.000 description 10
- 238000011282 treatment Methods 0.000 description 10
- 230000012010 growth Effects 0.000 description 9
- 239000000203 mixture Substances 0.000 description 9
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 9
- 239000000243 solution Substances 0.000 description 9
- 125000000217 alkyl group Chemical group 0.000 description 8
- 206010028980 Neoplasm Diseases 0.000 description 7
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 7
- 239000000969 carrier Substances 0.000 description 7
- 238000009472 formulation Methods 0.000 description 7
- 239000003112 inhibitor Substances 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- 230000002792 vascular Effects 0.000 description 6
- 239000004480 active ingredient Substances 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 238000002347 injection Methods 0.000 description 5
- 239000007924 injection Substances 0.000 description 5
- 238000013508 migration Methods 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- 231100000419 toxicity Toxicity 0.000 description 5
- 230000001988 toxicity Effects 0.000 description 5
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- 206010038563 Reocclusion Diseases 0.000 description 4
- 230000000259 anti-tumor effect Effects 0.000 description 4
- 230000004663 cell proliferation Effects 0.000 description 4
- 238000004587 chromatography analysis Methods 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 239000001963 growth medium Substances 0.000 description 4
- 125000005842 heteroatom Chemical group 0.000 description 4
- 230000003902 lesion Effects 0.000 description 4
- 239000011159 matrix material Substances 0.000 description 4
- 230000037361 pathway Effects 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 210000002460 smooth muscle Anatomy 0.000 description 4
- 125000000547 substituted alkyl group Chemical group 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- 125000004417 unsaturated alkyl group Chemical group 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 206010019851 Hepatotoxicity Diseases 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- 201000011510 cancer Diseases 0.000 description 3
- 230000010261 cell growth Effects 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 201000010099 disease Diseases 0.000 description 3
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 3
- 239000008103 glucose Substances 0.000 description 3
- 230000007686 hepatotoxicity Effects 0.000 description 3
- 231100000304 hepatotoxicity Toxicity 0.000 description 3
- 230000028709 inflammatory response Effects 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- 239000002054 inoculum Substances 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 230000007774 longterm Effects 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 230000005012 migration Effects 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 230000002062 proliferating effect Effects 0.000 description 3
- 235000018102 proteins Nutrition 0.000 description 3
- 102000004169 proteins and genes Human genes 0.000 description 3
- 108090000623 proteins and genes Proteins 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- 239000000377 silicon dioxide Substances 0.000 description 3
- 235000012239 silicon dioxide Nutrition 0.000 description 3
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 3
- 238000001356 surgical procedure Methods 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 239000002028 Biomass Substances 0.000 description 2
- 206010009944 Colon cancer Diseases 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- SRBFZHDQGSBBOR-IOVATXLUSA-N D-xylopyranose Chemical compound O[C@@H]1COC(O)[C@H](O)[C@H]1O SRBFZHDQGSBBOR-IOVATXLUSA-N 0.000 description 2
- 206010025327 Lymphopenia Diseases 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 206010061535 Ovarian neoplasm Diseases 0.000 description 2
- 108091007960 PI3Ks Proteins 0.000 description 2
- 206010060862 Prostate cancer Diseases 0.000 description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- 239000012190 activator Substances 0.000 description 2
- -1 benzylmethylamino Chemical group 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 239000005018 casein Substances 0.000 description 2
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 2
- 235000021240 caseins Nutrition 0.000 description 2
- 230000012292 cell migration Effects 0.000 description 2
- 208000029742 colonic neoplasm Diseases 0.000 description 2
- 239000002131 composite material Substances 0.000 description 2
- 210000004351 coronary vessel Anatomy 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 238000009792 diffusion process Methods 0.000 description 2
- 239000007903 gelatin capsule Substances 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 238000013147 laser angioplasty Methods 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 210000004698 lymphocyte Anatomy 0.000 description 2
- 231100001023 lymphopenia Toxicity 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 230000019491 signal transduction Effects 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 235000013619 trace mineral Nutrition 0.000 description 2
- 239000011573 trace mineral Substances 0.000 description 2
- 210000004509 vascular smooth muscle cell Anatomy 0.000 description 2
- 230000004580 weight loss Effects 0.000 description 2
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 1
- GOLORTLGFDVFDW-UHFFFAOYSA-N 3-(1h-benzimidazol-2-yl)-7-(diethylamino)chromen-2-one Chemical compound C1=CC=C2NC(C3=CC4=CC=C(C=C4OC3=O)N(CC)CC)=NC2=C1 GOLORTLGFDVFDW-UHFFFAOYSA-N 0.000 description 1
- UHPMCKVQTMMPCG-UHFFFAOYSA-N 5,8-dihydroxy-2-methoxy-6-methyl-7-(2-oxopropyl)naphthalene-1,4-dione Chemical compound CC1=C(CC(C)=O)C(O)=C2C(=O)C(OC)=CC(=O)C2=C1O UHPMCKVQTMMPCG-UHFFFAOYSA-N 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 238000011740 C57BL/6 mouse Methods 0.000 description 1
- JUSZLIOETSSZJM-MLYRIWELSA-N C[C@](C[C@H]1OC(C)=O)(C(CC2)C(C3=O)=C1[C@@](C)([C@@H](COC)OC(/C1=C/N4CCCC4)=O)C1=C3O)C2=O Chemical compound C[C@](C[C@H]1OC(C)=O)(C(CC2)C(C3=O)=C1[C@@](C)([C@@H](COC)OC(/C1=C/N4CCCC4)=O)C1=C3O)C2=O JUSZLIOETSSZJM-MLYRIWELSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 229940127291 Calcium channel antagonist Drugs 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 206010053261 Coronary artery reocclusion Diseases 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 235000019733 Fish meal Nutrition 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 241000223218 Fusarium Species 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 238000000134 MTT assay Methods 0.000 description 1
- 231100000002 MTT assay Toxicity 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- QPJVMBTYPHYUOC-UHFFFAOYSA-N Methyl benzoate Natural products COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 240000000249 Morus alba Species 0.000 description 1
- 235000008708 Morus alba Nutrition 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 235000019502 Orange oil Nutrition 0.000 description 1
- 208000012868 Overgrowth Diseases 0.000 description 1
- 208000031481 Pathologic Constriction Diseases 0.000 description 1
- 241000228143 Penicillium Species 0.000 description 1
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 235000019764 Soybean Meal Nutrition 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 description 1
- 102000013530 TOR Serine-Threonine Kinases Human genes 0.000 description 1
- 208000007536 Thrombosis Diseases 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 206010047163 Vasospasm Diseases 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- 239000003463 adsorbent Substances 0.000 description 1
- 238000010564 aerobic fermentation Methods 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 1
- 210000001367 artery Anatomy 0.000 description 1
- UDEWPOVQBGFNGE-UHFFFAOYSA-N benzoic acid n-propyl ester Natural products CCCOC(=O)C1=CC=CC=C1 UDEWPOVQBGFNGE-UHFFFAOYSA-N 0.000 description 1
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 238000004820 blood count Methods 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 229960001714 calcium phosphate Drugs 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 239000000378 calcium silicate Substances 0.000 description 1
- 229910052918 calcium silicate Inorganic materials 0.000 description 1
- 229960003340 calcium silicate Drugs 0.000 description 1
- 235000012241 calcium silicate Nutrition 0.000 description 1
- OYACROKNLOSFPA-UHFFFAOYSA-N calcium;dioxido(oxo)silane Chemical compound [Ca+2].[O-][Si]([O-])=O OYACROKNLOSFPA-UHFFFAOYSA-N 0.000 description 1
- 229940041514 candida albicans extract Drugs 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 230000009087 cell motility Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 239000000919 ceramic Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 235000008504 concentrate Nutrition 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- QYDYPVFESGNLHU-UHFFFAOYSA-N elaidic acid methyl ester Natural products CCCCCCCCC=CCCCCCCCC(=O)OC QYDYPVFESGNLHU-UHFFFAOYSA-N 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 229960001123 epoprostenol Drugs 0.000 description 1
- KAQKFAOMNZTLHT-VVUHWYTRSA-N epoprostenol Chemical compound O1C(=CCCCC(O)=O)C[C@@H]2[C@@H](/C=C/[C@@H](O)CCCCC)[C@H](O)C[C@@H]21 KAQKFAOMNZTLHT-VVUHWYTRSA-N 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 235000021323 fish oil Nutrition 0.000 description 1
- 239000004467 fishmeal Substances 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000013312 flour Nutrition 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 206010020718 hyperplasia Diseases 0.000 description 1
- 230000002390 hyperplastic effect Effects 0.000 description 1
- 230000007954 hypoxia Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000003055 low molecular weight heparin Substances 0.000 description 1
- 229940127215 low-molecular weight heparin Drugs 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 231100000682 maximum tolerated dose Toxicity 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- QYDYPVFESGNLHU-KHPPLWFESA-N methyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC QYDYPVFESGNLHU-KHPPLWFESA-N 0.000 description 1
- 229940073769 methyl oleate Drugs 0.000 description 1
- OLXYLDUSSBULGU-UHFFFAOYSA-N methyl pyridine-4-carboxylate Chemical compound COC(=O)C1=CC=NC=C1 OLXYLDUSSBULGU-UHFFFAOYSA-N 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- RIWRFSMVIUAEBX-UHFFFAOYSA-N n-methyl-1-phenylmethanamine Chemical compound CNCC1=CC=CC=C1 RIWRFSMVIUAEBX-UHFFFAOYSA-N 0.000 description 1
- DYUWTXWIYMHBQS-UHFFFAOYSA-N n-prop-2-enylprop-2-en-1-amine Chemical compound C=CCNCC=C DYUWTXWIYMHBQS-UHFFFAOYSA-N 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000010502 orange oil Substances 0.000 description 1
- 239000005416 organic matter Substances 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 238000011458 pharmacological treatment Methods 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 230000026799 smooth muscle cell apoptotic process Effects 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 239000004455 soybean meal Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 230000036262 stenosis Effects 0.000 description 1
- 208000037804 stenosis Diseases 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 239000010902 straw Substances 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 230000004565 tumor cell growth Effects 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 239000012138 yeast extract Substances 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D311/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings
- C07D311/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D311/94—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings ortho- or peri-condensed with carbocyclic rings or ring systems condensed with rings other than six-membered or with ring systems containing such rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Steroid Compounds (AREA)
- Pyrane Compounds (AREA)
- Medicines Containing Plant Substances (AREA)
- Distillation Of Fermentation Liquor, Processing Of Alcohols, Vinegar And Beer (AREA)
- Compounds Of Unknown Constitution (AREA)
Description
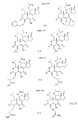
本発明は、ワートマニン類似体ががんの阻害に有用であるという発見に関する。図1は本発明に従う化合物の一般的な構造を示す。図2は本発明に従う特有ワートマニン類似体を示し、図3は本発明に従い、有用である可能性のあるほかのワートマニン類似体を示す。
Claims (8)
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US32214301P | 2001-09-14 | 2001-09-14 | |
| US32213901P | 2001-09-14 | 2001-09-14 | |
| PCT/US2002/029365 WO2003024183A2 (en) | 2001-09-14 | 2002-09-16 | Wortmannin analogs and methods of using same |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2005507880A JP2005507880A (ja) | 2005-03-24 |
| JP2005507880A5 JP2005507880A5 (ja) | 2006-01-05 |
| JP4540986B2 true JP4540986B2 (ja) | 2010-09-08 |
Family
ID=26983283
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003528088A Expired - Fee Related JP4540986B2 (ja) | 2001-09-14 | 2002-09-16 | ワートマニン類似体およびそれらを用いる方法 |
Country Status (8)
| Country | Link |
|---|---|
| EP (1) | EP1435941B8 (ja) |
| JP (1) | JP4540986B2 (ja) |
| AT (1) | ATE334671T1 (ja) |
| AU (1) | AU2002330029B2 (ja) |
| CA (1) | CA2458318C (ja) |
| DE (1) | DE60213633T2 (ja) |
| MX (1) | MXPA04002445A (ja) |
| WO (1) | WO2003024183A2 (ja) |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7081475B2 (en) * | 2001-09-14 | 2006-07-25 | Prolx Pharmaceuticals Corp. | Wortmannin analogs and methods of using same |
| DE10219545A1 (de) * | 2002-04-26 | 2003-11-06 | Lang Florian | Regulation der Apoptose |
| US7230139B2 (en) | 2002-12-05 | 2007-06-12 | Gemin X Biotechnologies | Diterpenoid compounds, compositions thereof and their use as anti-cancer or anti-fungal agents |
| US20040213757A1 (en) * | 2003-04-23 | 2004-10-28 | Wyeth Holdings Corporation | Water soluble wortmannin derivatives |
| DE102004043463A1 (de) * | 2004-06-09 | 2006-02-09 | Heinz Voigt | Mittel zur Krebsbekämpfung unter Verwendung von Schimmelpilzextrakten |
| JP5371426B2 (ja) * | 2004-07-09 | 2013-12-18 | プロルックス ファーマシューティカルズ コープ. | ワートマニン類似体及び化学療法薬と組み合わせた同一物を使用する方法 |
| TW200626610A (en) | 2004-10-13 | 2006-08-01 | Wyeth Corp | Analogs of 17-hydroxywortmannin as PI3K inhibitors |
| US8716299B2 (en) * | 2004-12-20 | 2014-05-06 | University Of South Florida | XIAP-targeted prostate cancer therapy |
| CA2620855A1 (en) * | 2005-09-01 | 2007-08-02 | Beth Israel Deaconess Medical Center | Wortmannin conjugates and uses thereof |
| US20070116736A1 (en) * | 2005-11-23 | 2007-05-24 | Argentieri Dennis C | Local vascular delivery of PI3 kinase inhibitors alone or in combination with sirolimus to prevent restinosis following vascular injury |
| ES2378780T3 (es) * | 2005-12-30 | 2012-04-17 | Arizona Board Of Regents, Acting On Behalf Of The University Of Arizona | Metabolitos de análogos de wortmanina y métodos de uso de los mismos |
| EP2012794B1 (en) * | 2006-04-13 | 2014-09-17 | The Trustees of Columbia University in the City of New York | Compositions and intraluminal devices for inhibiting vascular stenosis |
| JP2013527248A (ja) * | 2010-06-04 | 2013-06-27 | オンコシレオン インク. | ウォルトマンニンアナログによる癌の処置 |
| CA2801426A1 (en) * | 2010-06-04 | 2011-12-08 | Oncothyreon Inc. | Combination cancer therapies with wortmannin analogs |
| US11197854B1 (en) | 2018-11-14 | 2021-12-14 | National Technology & Engineering Solutions Of Sandia, Llc | Inhibitors for targeting flaviviruses |
| US20220040324A1 (en) | 2018-12-21 | 2022-02-10 | Daiichi Sankyo Company, Limited | Combination of antibody-drug conjugate and kinase inhibitor |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2302021A (en) * | 1996-10-16 | 1997-01-08 | Lilly Co Eli | Inhibiting bone loss or resorption |
-
2002
- 2002-09-16 AT AT02766286T patent/ATE334671T1/de not_active IP Right Cessation
- 2002-09-16 EP EP02766286A patent/EP1435941B8/en not_active Expired - Lifetime
- 2002-09-16 JP JP2003528088A patent/JP4540986B2/ja not_active Expired - Fee Related
- 2002-09-16 MX MXPA04002445A patent/MXPA04002445A/es active IP Right Grant
- 2002-09-16 AU AU2002330029A patent/AU2002330029B2/en not_active Ceased
- 2002-09-16 CA CA2458318A patent/CA2458318C/en not_active Expired - Fee Related
- 2002-09-16 DE DE60213633T patent/DE60213633T2/de not_active Expired - Lifetime
- 2002-09-16 WO PCT/US2002/029365 patent/WO2003024183A2/en active IP Right Grant
Also Published As
| Publication number | Publication date |
|---|---|
| EP1435941A4 (en) | 2004-12-08 |
| DE60213633T2 (de) | 2007-11-08 |
| CA2458318C (en) | 2011-03-15 |
| ATE334671T1 (de) | 2006-08-15 |
| AU2002330029B2 (en) | 2006-07-06 |
| EP1435941B8 (en) | 2006-10-25 |
| WO2003024183A2 (en) | 2003-03-27 |
| DE60213633D1 (de) | 2006-09-14 |
| EP1435941A2 (en) | 2004-07-14 |
| JP2005507880A (ja) | 2005-03-24 |
| EP1435941B1 (en) | 2006-08-02 |
| WO2003024183A3 (en) | 2003-06-12 |
| MXPA04002445A (es) | 2005-07-25 |
| CA2458318A1 (en) | 2003-03-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US6703414B2 (en) | Device and method for treating restenosis | |
| JP4540986B2 (ja) | ワートマニン類似体およびそれらを用いる方法 | |
| US5441947A (en) | Methods of inhibiting vascular restenosis | |
| US7335679B2 (en) | Wortmannin analogs and methods of using same | |
| CA2304770C (en) | A use of steroidal saponins for the prophylaxis or treatment of dementia, and novel steroidal saponin compounds | |
| AU2005333515B2 (en) | Wortmannin analogs and methods of using same in combination with chemotherapeutic agents | |
| AU2002330029A1 (en) | Wortmannin analogs and methods of using same | |
| US5514706A (en) | Pharmaceutical compounds | |
| JP3058188B2 (ja) | 抗癌−、抗ウィルス−および植物生長抑制作用をもつ治療用カシノイド製剤 | |
| JPH07112930A (ja) | 血管平滑筋細胞増殖抑制剤 | |
| HUT63843A (en) | Process for producing new kumarin derivatives and their analogs inhibiting mammal cell proliferation and tumour growth, as well as pharmaceutical comkpositions comprising such compounds | |
| JP2004083417A (ja) | 血管新生抑制剤 | |
| ES2307253T3 (es) | Analogos de la wortmannina y procedimientos de uso de los mismos. | |
| AU2006202635B2 (en) | Wortmannin analogs and methods of using same | |
| CA2518766C (en) | Anti-hepatitis c virus agents and anti-hiv agents | |
| US6365610B1 (en) | Ozonide compounds with inhibitory activity for urokinase production and angiogenesis | |
| AU2008201477A1 (en) | Wortmannin analogs and methods of using same | |
| CN104292210A (zh) | 含吡啶的一氧化氮供体类化合物、其制备方法及用途 | |
| JPH01313425A (ja) | 糖ラクタム誘導体及びそれを含有する癌細胞転移抑制剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050914 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050914 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090303 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20090304 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090529 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090605 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090730 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20091006 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20091223 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100106 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100401 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100525 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20100623 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130702 Year of fee payment: 3 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313114 |
|
| R360 | Written notification for declining of transfer of rights |
Free format text: JAPANESE INTERMEDIATE CODE: R360 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |