JP4459435B2 - 新規t細胞膜蛋白質(tirc7)、ペプチドおよびそれに由来する抗体ならびにその使用 - Google Patents
新規t細胞膜蛋白質(tirc7)、ペプチドおよびそれに由来する抗体ならびにその使用 Download PDFInfo
- Publication number
- JP4459435B2 JP4459435B2 JP2000508792A JP2000508792A JP4459435B2 JP 4459435 B2 JP4459435 B2 JP 4459435B2 JP 2000508792 A JP2000508792 A JP 2000508792A JP 2000508792 A JP2000508792 A JP 2000508792A JP 4459435 B2 JP4459435 B2 JP 4459435B2
- Authority
- JP
- Japan
- Prior art keywords
- cell
- tirc7
- leu
- protein
- ala
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
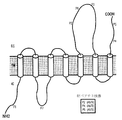
- 101000854875 Homo sapiens V-type proton ATPase 116 kDa subunit a 3 Proteins 0.000 title claims abstract description 227
- 102100020738 V-type proton ATPase 116 kDa subunit a 3 Human genes 0.000 title claims abstract description 182
- 210000001744 T-lymphocyte Anatomy 0.000 title claims abstract description 129
- 108010052285 Membrane Proteins Proteins 0.000 title claims description 23
- 102000018697 Membrane Proteins Human genes 0.000 title claims description 18
- 108090000765 processed proteins & peptides Proteins 0.000 title abstract description 138
- 238000000034 method Methods 0.000 claims abstract description 114
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 51
- 239000000427 antigen Substances 0.000 claims abstract description 32
- 108091007433 antigens Proteins 0.000 claims abstract description 32
- 102000036639 antigens Human genes 0.000 claims abstract description 32
- 238000002054 transplantation Methods 0.000 claims abstract description 31
- 238000011282 treatment Methods 0.000 claims abstract description 24
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 19
- 230000002401 inhibitory effect Effects 0.000 claims abstract description 15
- 210000000056 organ Anatomy 0.000 claims abstract description 14
- 208000023275 Autoimmune disease Diseases 0.000 claims abstract description 13
- 238000002360 preparation method Methods 0.000 claims abstract description 13
- 230000004936 stimulating effect Effects 0.000 claims abstract description 12
- 230000001939 inductive effect Effects 0.000 claims abstract description 8
- 208000035473 Communicable disease Diseases 0.000 claims abstract description 4
- 230000001363 autoimmune Effects 0.000 claims abstract description 4
- 208000026935 allergic disease Diseases 0.000 claims abstract description 3
- 230000000172 allergic effect Effects 0.000 claims abstract description 3
- 108090000623 proteins and genes Proteins 0.000 claims description 119
- 210000004027 cell Anatomy 0.000 claims description 107
- 108091033319 polynucleotide Proteins 0.000 claims description 94
- 239000002157 polynucleotide Substances 0.000 claims description 94
- 102000040430 polynucleotide Human genes 0.000 claims description 94
- 102000004169 proteins and genes Human genes 0.000 claims description 83
- 230000014509 gene expression Effects 0.000 claims description 66
- 239000000126 substance Substances 0.000 claims description 61
- 150000001875 compounds Chemical class 0.000 claims description 50
- 239000003446 ligand Substances 0.000 claims description 48
- 239000013598 vector Substances 0.000 claims description 42
- 102000039446 nucleic acids Human genes 0.000 claims description 37
- 108020004707 nucleic acids Proteins 0.000 claims description 37
- 150000007523 nucleic acids Chemical class 0.000 claims description 37
- 230000006044 T cell activation Effects 0.000 claims description 34
- 238000000338 in vitro Methods 0.000 claims description 33
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 30
- 125000003729 nucleotide group Chemical group 0.000 claims description 30
- 230000006052 T cell proliferation Effects 0.000 claims description 29
- 239000002773 nucleotide Substances 0.000 claims description 29
- 108010002350 Interleukin-2 Proteins 0.000 claims description 21
- 230000003993 interaction Effects 0.000 claims description 19
- 230000000694 effects Effects 0.000 claims description 18
- 239000003112 inhibitor Substances 0.000 claims description 17
- 230000004044 response Effects 0.000 claims description 15
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 claims description 14
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 claims description 14
- 230000000139 costimulatory effect Effects 0.000 claims description 14
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 14
- 230000001105 regulatory effect Effects 0.000 claims description 14
- 210000004881 tumor cell Anatomy 0.000 claims description 14
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 claims description 12
- 101000889276 Homo sapiens Cytotoxic T-lymphocyte protein 4 Proteins 0.000 claims description 12
- 101000934346 Homo sapiens T-cell surface antigen CD2 Proteins 0.000 claims description 12
- 102100025237 T-cell surface antigen CD2 Human genes 0.000 claims description 12
- 230000035755 proliferation Effects 0.000 claims description 12
- 108020003175 receptors Proteins 0.000 claims description 12
- 101150013553 CD40 gene Proteins 0.000 claims description 11
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 11
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 claims description 11
- 238000004519 manufacturing process Methods 0.000 claims description 11
- 239000000203 mixture Substances 0.000 claims description 9
- 238000013519 translation Methods 0.000 claims description 9
- 108090000978 Interleukin-4 Proteins 0.000 claims description 8
- 238000001514 detection method Methods 0.000 claims description 8
- 230000000295 complement effect Effects 0.000 claims description 7
- 208000035475 disorder Diseases 0.000 claims description 7
- 239000003937 drug carrier Substances 0.000 claims description 7
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 6
- 238000013518 transcription Methods 0.000 claims description 6
- 230000035897 transcription Effects 0.000 claims description 6
- 230000002093 peripheral effect Effects 0.000 claims description 5
- 230000002194 synthesizing effect Effects 0.000 claims description 5
- 208000007882 Gastritis Diseases 0.000 claims description 4
- 230000000735 allogeneic effect Effects 0.000 claims description 4
- 210000003719 b-lymphocyte Anatomy 0.000 claims description 4
- 238000010322 bone marrow transplantation Methods 0.000 claims description 4
- 238000012258 culturing Methods 0.000 claims description 4
- 230000009257 reactivity Effects 0.000 claims description 4
- 210000000130 stem cell Anatomy 0.000 claims description 4
- 108010029697 CD40 Ligand Proteins 0.000 claims description 3
- 102100032937 CD40 ligand Human genes 0.000 claims description 3
- 230000003211 malignant effect Effects 0.000 claims description 3
- 241000590002 Helicobacter pylori Species 0.000 claims description 2
- 206010029098 Neoplasm skin Diseases 0.000 claims description 2
- 206010033645 Pancreatitis Diseases 0.000 claims description 2
- 208000000453 Skin Neoplasms Diseases 0.000 claims description 2
- 230000029662 T-helper 1 type immune response Effects 0.000 claims description 2
- 206010047115 Vasculitis Diseases 0.000 claims description 2
- 208000024447 adrenal gland neoplasm Diseases 0.000 claims description 2
- 230000003321 amplification Effects 0.000 claims description 2
- 208000006673 asthma Diseases 0.000 claims description 2
- 210000002798 bone marrow cell Anatomy 0.000 claims description 2
- 206010012601 diabetes mellitus Diseases 0.000 claims description 2
- 206010014599 encephalitis Diseases 0.000 claims description 2
- 229940037467 helicobacter pylori Drugs 0.000 claims description 2
- 208000037841 lung tumor Diseases 0.000 claims description 2
- 206010025135 lupus erythematosus Diseases 0.000 claims description 2
- 201000006417 multiple sclerosis Diseases 0.000 claims description 2
- 210000000822 natural killer cell Anatomy 0.000 claims description 2
- 238000003199 nucleic acid amplification method Methods 0.000 claims description 2
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 2
- 206010043778 thyroiditis Diseases 0.000 claims description 2
- 230000029069 type 2 immune response Effects 0.000 claims description 2
- 230000001154 acute effect Effects 0.000 claims 2
- 208000030090 Acute Disease Diseases 0.000 claims 1
- 208000017667 Chronic Disease Diseases 0.000 claims 1
- 230000001684 chronic effect Effects 0.000 claims 1
- 102000004196 processed proteins & peptides Human genes 0.000 abstract description 97
- 229920001184 polypeptide Polymers 0.000 abstract description 46
- 102000035160 transmembrane proteins Human genes 0.000 abstract description 2
- 108091005703 transmembrane proteins Proteins 0.000 abstract description 2
- 235000018102 proteins Nutrition 0.000 description 70
- 239000002299 complementary DNA Substances 0.000 description 46
- 235000001014 amino acid Nutrition 0.000 description 35
- 150000001413 amino acids Chemical class 0.000 description 31
- 230000000638 stimulation Effects 0.000 description 28
- 108020004414 DNA Proteins 0.000 description 26
- 239000012634 fragment Substances 0.000 description 26
- 210000004698 lymphocyte Anatomy 0.000 description 26
- 239000000523 sample Substances 0.000 description 26
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 21
- 108020001507 fusion proteins Proteins 0.000 description 21
- 102000037865 fusion proteins Human genes 0.000 description 21
- 241001465754 Metazoa Species 0.000 description 20
- 108020004999 messenger RNA Proteins 0.000 description 20
- 102000000588 Interleukin-2 Human genes 0.000 description 19
- 230000008685 targeting Effects 0.000 description 19
- 238000002474 experimental method Methods 0.000 description 17
- 230000027455 binding Effects 0.000 description 16
- 239000003814 drug Substances 0.000 description 16
- 229940079593 drug Drugs 0.000 description 13
- 238000001727 in vivo Methods 0.000 description 13
- SITLTJHOQZFJGG-UHFFFAOYSA-N N-L-alpha-glutamyl-L-valine Natural products CC(C)C(C(O)=O)NC(=O)C(N)CCC(O)=O SITLTJHOQZFJGG-UHFFFAOYSA-N 0.000 description 12
- 108010047620 Phytohemagglutinins Proteins 0.000 description 12
- 241000700159 Rattus Species 0.000 description 12
- 238000004458 analytical method Methods 0.000 description 12
- 230000001885 phytohemagglutinin Effects 0.000 description 12
- 108091023040 Transcription factor Proteins 0.000 description 11
- 239000013604 expression vector Substances 0.000 description 11
- 230000005867 T cell response Effects 0.000 description 10
- 238000009396 hybridization Methods 0.000 description 10
- 239000003226 mitogen Substances 0.000 description 10
- 230000001225 therapeutic effect Effects 0.000 description 10
- 210000001519 tissue Anatomy 0.000 description 10
- 102000004127 Cytokines Human genes 0.000 description 9
- 108090000695 Cytokines Proteins 0.000 description 9
- SNLOOPZHAQDMJG-CIUDSAMLSA-N Gln-Glu-Glu Chemical compound NC(=O)CC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O SNLOOPZHAQDMJG-CIUDSAMLSA-N 0.000 description 9
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 9
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 9
- 230000005764 inhibitory process Effects 0.000 description 9
- 230000003834 intracellular effect Effects 0.000 description 9
- 230000001404 mediated effect Effects 0.000 description 9
- 230000004048 modification Effects 0.000 description 9
- 238000012986 modification Methods 0.000 description 9
- 239000000243 solution Substances 0.000 description 9
- 102000004190 Enzymes Human genes 0.000 description 8
- 108090000790 Enzymes Proteins 0.000 description 8
- DQPQTXMIRBUWKO-DCAQKATOSA-N Leu-Ala-Met Chemical compound C[C@@H](C(=O)N[C@@H](CCSC)C(=O)O)NC(=O)[C@H](CC(C)C)N DQPQTXMIRBUWKO-DCAQKATOSA-N 0.000 description 8
- KAFOIVJDVSZUMD-UHFFFAOYSA-N Leu-Gln-Gln Natural products CC(C)CC(N)C(=O)NC(CCC(N)=O)C(=O)NC(CCC(N)=O)C(O)=O KAFOIVJDVSZUMD-UHFFFAOYSA-N 0.000 description 8
- ZDBMWELMUCLUPL-QEJZJMRPSA-N Leu-Phe-Ala Chemical compound CC(C)C[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](C)C(O)=O)CC1=CC=CC=C1 ZDBMWELMUCLUPL-QEJZJMRPSA-N 0.000 description 8
- 230000004913 activation Effects 0.000 description 8
- 238000013459 approach Methods 0.000 description 8
- 230000000903 blocking effect Effects 0.000 description 8
- 230000006870 function Effects 0.000 description 8
- 108010025306 histidylleucine Proteins 0.000 description 8
- 230000028993 immune response Effects 0.000 description 8
- 230000037361 pathway Effects 0.000 description 8
- 102000005962 receptors Human genes 0.000 description 8
- 239000012190 activator Substances 0.000 description 7
- 230000033228 biological regulation Effects 0.000 description 7
- 238000010790 dilution Methods 0.000 description 7
- 239000012895 dilution Substances 0.000 description 7
- 201000010099 disease Diseases 0.000 description 7
- 210000003734 kidney Anatomy 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- SUMYEVXWCAYLLJ-GUBZILKMSA-N Ala-Leu-Gln Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O SUMYEVXWCAYLLJ-GUBZILKMSA-N 0.000 description 6
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 6
- 108060003951 Immunoglobulin Proteins 0.000 description 6
- 108010074328 Interferon-gamma Proteins 0.000 description 6
- 102000004388 Interleukin-4 Human genes 0.000 description 6
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 6
- 238000000636 Northern blotting Methods 0.000 description 6
- 108010038633 aspartylglutamate Proteins 0.000 description 6
- 210000000170 cell membrane Anatomy 0.000 description 6
- 231100000673 dose–response relationship Toxicity 0.000 description 6
- 238000001415 gene therapy Methods 0.000 description 6
- 108010059898 glycyl-tyrosyl-lysine Proteins 0.000 description 6
- 238000003018 immunoassay Methods 0.000 description 6
- 102000018358 immunoglobulin Human genes 0.000 description 6
- 210000000265 leukocyte Anatomy 0.000 description 6
- 239000003550 marker Substances 0.000 description 6
- 239000012528 membrane Substances 0.000 description 6
- 239000000816 peptidomimetic Substances 0.000 description 6
- -1 radioisotopes Substances 0.000 description 6
- 239000003053 toxin Substances 0.000 description 6
- MCGGOMKMWPPXKQ-JBDRJPRFSA-N Ala-Asn-Gln-Ser Chemical compound C[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(O)=O MCGGOMKMWPPXKQ-JBDRJPRFSA-N 0.000 description 5
- PBAMJJXWDQXOJA-FXQIFTODSA-N Ala-Asp-Arg Chemical compound C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N PBAMJJXWDQXOJA-FXQIFTODSA-N 0.000 description 5
- OVVUNXXROOFSIM-SDDRHHMPSA-N Arg-Arg-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CCCN=C(N)N)N)C(=O)O OVVUNXXROOFSIM-SDDRHHMPSA-N 0.000 description 5
- RCFGLXMZDYNRSC-CIUDSAMLSA-N Asn-Lys-Ala Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(O)=O RCFGLXMZDYNRSC-CIUDSAMLSA-N 0.000 description 5
- NECWUSYTYSIFNC-DLOVCJGASA-N Asp-Ala-Phe Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 NECWUSYTYSIFNC-DLOVCJGASA-N 0.000 description 5
- 108090000994 Catalytic RNA Proteins 0.000 description 5
- 102000053642 Catalytic RNA Human genes 0.000 description 5
- 229930105110 Cyclosporin A Natural products 0.000 description 5
- PMATZTZNYRCHOR-CGLBZJNRSA-N Cyclosporin A Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C1=O PMATZTZNYRCHOR-CGLBZJNRSA-N 0.000 description 5
- 108010036949 Cyclosporine Proteins 0.000 description 5
- ODBLJLZVLAWVMS-GUBZILKMSA-N Gln-Asn-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CCC(=O)N)N ODBLJLZVLAWVMS-GUBZILKMSA-N 0.000 description 5
- LGYZYFFDELZWRS-DCAQKATOSA-N Glu-Glu-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CCC(O)=O LGYZYFFDELZWRS-DCAQKATOSA-N 0.000 description 5
- JQFILXICXLDTRR-FBCQKBJTSA-N Gly-Thr-Gly Chemical compound NCC(=O)N[C@@H]([C@H](O)C)C(=O)NCC(O)=O JQFILXICXLDTRR-FBCQKBJTSA-N 0.000 description 5
- ONSARSFSJHTMFJ-STQMWFEESA-N Gly-Trp-Ser Chemical compound [H]NCC(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CO)C(O)=O ONSARSFSJHTMFJ-STQMWFEESA-N 0.000 description 5
- 102100025390 Integrin beta-2 Human genes 0.000 description 5
- 102100037850 Interferon gamma Human genes 0.000 description 5
- PMGDADKJMCOXHX-UHFFFAOYSA-N L-Arginyl-L-glutamin-acetat Natural products NC(=N)NCCCC(N)C(=O)NC(CCC(N)=O)C(O)=O PMGDADKJMCOXHX-UHFFFAOYSA-N 0.000 description 5
- MJOZZTKJZQFKDK-GUBZILKMSA-N Leu-Ala-Gln Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCC(N)=O MJOZZTKJZQFKDK-GUBZILKMSA-N 0.000 description 5
- SBANPBVRHYIMRR-UHFFFAOYSA-N Leu-Ser-Pro Natural products CC(C)CC(N)C(=O)NC(CO)C(=O)N1CCCC1C(O)=O SBANPBVRHYIMRR-UHFFFAOYSA-N 0.000 description 5
- 108010064548 Lymphocyte Function-Associated Antigen-1 Proteins 0.000 description 5
- AJHCSUXXECOXOY-UHFFFAOYSA-N N-glycyl-L-tryptophan Natural products C1=CC=C2C(CC(NC(=O)CN)C(O)=O)=CNC2=C1 AJHCSUXXECOXOY-UHFFFAOYSA-N 0.000 description 5
- 108020004711 Nucleic Acid Probes Proteins 0.000 description 5
- APMXLWHMIVWLLR-BZSNNMDCSA-N Phe-Tyr-Ser Chemical compound C([C@H](N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(O)=O)C1=CC=CC=C1 APMXLWHMIVWLLR-BZSNNMDCSA-N 0.000 description 5
- PPCZVWHJWJFTFN-ZLUOBGJFSA-N Ser-Ser-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(O)=O PPCZVWHJWJFTFN-ZLUOBGJFSA-N 0.000 description 5
- 108091008874 T cell receptors Proteins 0.000 description 5
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 5
- DEGUERSKQBRZMZ-FXQIFTODSA-N Val-Ser-Ala Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O DEGUERSKQBRZMZ-FXQIFTODSA-N 0.000 description 5
- 108010000134 Vascular Cell Adhesion Molecule-1 Proteins 0.000 description 5
- 102100023543 Vascular cell adhesion protein 1 Human genes 0.000 description 5
- 108010047495 alanylglycine Proteins 0.000 description 5
- KOSRFJWDECSPRO-UHFFFAOYSA-N alpha-L-glutamyl-L-glutamic acid Natural products OC(=O)CCC(N)C(=O)NC(CCC(O)=O)C(O)=O KOSRFJWDECSPRO-UHFFFAOYSA-N 0.000 description 5
- 108010008355 arginyl-glutamine Proteins 0.000 description 5
- 210000001185 bone marrow Anatomy 0.000 description 5
- 239000003795 chemical substances by application Substances 0.000 description 5
- 229960001265 ciclosporin Drugs 0.000 description 5
- 230000016396 cytokine production Effects 0.000 description 5
- 108010055341 glutamyl-glutamic acid Proteins 0.000 description 5
- 108010084389 glycyltryptophan Proteins 0.000 description 5
- 108010037850 glycylvaline Proteins 0.000 description 5
- 238000001990 intravenous administration Methods 0.000 description 5
- 108010038320 lysylphenylalanine Proteins 0.000 description 5
- 210000004962 mammalian cell Anatomy 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 238000010369 molecular cloning Methods 0.000 description 5
- 239000002853 nucleic acid probe Substances 0.000 description 5
- 239000013612 plasmid Substances 0.000 description 5
- 108091092562 ribozyme Proteins 0.000 description 5
- 238000012216 screening Methods 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 238000010561 standard procedure Methods 0.000 description 5
- 231100000765 toxin Toxicity 0.000 description 5
- 108700012359 toxins Proteins 0.000 description 5
- 230000032258 transport Effects 0.000 description 5
- HHGYNJRJIINWAK-FXQIFTODSA-N Ala-Ala-Arg Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCCN=C(N)N HHGYNJRJIINWAK-FXQIFTODSA-N 0.000 description 4
- BUANFPRKJKJSRR-ACZMJKKPSA-N Ala-Ala-Gln Chemical compound C[C@H]([NH3+])C(=O)N[C@@H](C)C(=O)N[C@H](C([O-])=O)CCC(N)=O BUANFPRKJKJSRR-ACZMJKKPSA-N 0.000 description 4
- VBDMWOKJZDCFJM-FXQIFTODSA-N Ala-Ala-Met Chemical compound CSCC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](C)N VBDMWOKJZDCFJM-FXQIFTODSA-N 0.000 description 4
- PIPTUBPKYFRLCP-NHCYSSNCSA-N Ala-Ala-Phe Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 PIPTUBPKYFRLCP-NHCYSSNCSA-N 0.000 description 4
- HGRBNYQIMKTUNT-XVYDVKMFSA-N Ala-Asn-His Chemical compound C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N HGRBNYQIMKTUNT-XVYDVKMFSA-N 0.000 description 4
- BLGHHPHXVJWCNK-GUBZILKMSA-N Ala-Gln-Leu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(O)=O BLGHHPHXVJWCNK-GUBZILKMSA-N 0.000 description 4
- SOBIAADAMRHGKH-CIUDSAMLSA-N Ala-Leu-Ser Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O SOBIAADAMRHGKH-CIUDSAMLSA-N 0.000 description 4
- 108010011667 Ala-Phe-Ala Proteins 0.000 description 4
- ZBLQIYPCUWZSRZ-QEJZJMRPSA-N Ala-Phe-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](C)N)CC1=CC=CC=C1 ZBLQIYPCUWZSRZ-QEJZJMRPSA-N 0.000 description 4
- CQJHFKKGZXKZBC-BPNCWPANSA-N Ala-Pro-Tyr Chemical compound C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 CQJHFKKGZXKZBC-BPNCWPANSA-N 0.000 description 4
- DCVYRWFAMZFSDA-ZLUOBGJFSA-N Ala-Ser-Ala Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O DCVYRWFAMZFSDA-ZLUOBGJFSA-N 0.000 description 4
- SYIFFFHSXBNPMC-UWJYBYFXSA-N Ala-Ser-Tyr Chemical compound C[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)O)N SYIFFFHSXBNPMC-UWJYBYFXSA-N 0.000 description 4
- ARHJJAAWNWOACN-FXQIFTODSA-N Ala-Ser-Val Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O ARHJJAAWNWOACN-FXQIFTODSA-N 0.000 description 4
- IDLBLNBDLCTPGC-HERUPUMHSA-N Ala-Trp-Cys Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)N[C@@H](CS)C(=O)O)N IDLBLNBDLCTPGC-HERUPUMHSA-N 0.000 description 4
- PGNNQOJOEGFAOR-KWQFWETISA-N Ala-Tyr-Gly Chemical compound OC(=O)CNC(=O)[C@@H](NC(=O)[C@@H](N)C)CC1=CC=C(O)C=C1 PGNNQOJOEGFAOR-KWQFWETISA-N 0.000 description 4
- XCIGOVDXZULBBV-DCAQKATOSA-N Ala-Val-Lys Chemical compound CC(C)[C@H](NC(=O)[C@H](C)N)C(=O)N[C@@H](CCCCN)C(O)=O XCIGOVDXZULBBV-DCAQKATOSA-N 0.000 description 4
- VDBKFYYIBLXEIF-GUBZILKMSA-N Arg-Gln-Glu Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O VDBKFYYIBLXEIF-GUBZILKMSA-N 0.000 description 4
- GOWZVQXTHUCNSQ-NHCYSSNCSA-N Arg-Glu-Val Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O GOWZVQXTHUCNSQ-NHCYSSNCSA-N 0.000 description 4
- YBIAYFFIVAZXPK-AVGNSLFASA-N Arg-His-Arg Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O YBIAYFFIVAZXPK-AVGNSLFASA-N 0.000 description 4
- UAOSDDXCTBIPCA-QXEWZRGKSA-N Arg-Ile-Gly Chemical compound CC[C@H](C)[C@@H](C(=O)NCC(=O)O)NC(=O)[C@H](CCCN=C(N)N)N UAOSDDXCTBIPCA-QXEWZRGKSA-N 0.000 description 4
- GNYUVVJYGJFKHN-RVMXOQNASA-N Arg-Ile-Pro Chemical compound CC[C@H](C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N GNYUVVJYGJFKHN-RVMXOQNASA-N 0.000 description 4
- LVMUGODRNHFGRA-AVGNSLFASA-N Arg-Leu-Arg Chemical compound NC(N)=NCCC[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O LVMUGODRNHFGRA-AVGNSLFASA-N 0.000 description 4
- YBZMTKUDWXZLIX-UWVGGRQHSA-N Arg-Leu-Gly Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O YBZMTKUDWXZLIX-UWVGGRQHSA-N 0.000 description 4
- WMEVEPXNCMKNGH-IHRRRGAJSA-N Arg-Leu-His Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N WMEVEPXNCMKNGH-IHRRRGAJSA-N 0.000 description 4
- OGSQONVYSTZIJB-WDSOQIARSA-N Arg-Leu-Trp Chemical compound CC(C)C[C@H](NC(=O)[C@@H](N)CCCN=C(N)N)C(=O)N[C@@H](Cc1c[nH]c2ccccc12)C(O)=O OGSQONVYSTZIJB-WDSOQIARSA-N 0.000 description 4
- BNYNOWJESJJIOI-XUXIUFHCSA-N Arg-Lys-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCN=C(N)N)N BNYNOWJESJJIOI-XUXIUFHCSA-N 0.000 description 4
- CGWVCWFQGXOUSJ-ULQDDVLXSA-N Arg-Tyr-Leu Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(C)C)C(O)=O CGWVCWFQGXOUSJ-ULQDDVLXSA-N 0.000 description 4
- JJGRJMKUOYXZRA-LPEHRKFASA-N Asn-Arg-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(=O)N)N)C(=O)O JJGRJMKUOYXZRA-LPEHRKFASA-N 0.000 description 4
- MSBDSTRUMZFSEU-PEFMBERDSA-N Asn-Glu-Ile Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O MSBDSTRUMZFSEU-PEFMBERDSA-N 0.000 description 4
- GURLOFOJBHRPJN-AAEUAGOBSA-N Asn-Gly-Trp Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)O)NC(=O)CNC(=O)[C@H](CC(=O)N)N GURLOFOJBHRPJN-AAEUAGOBSA-N 0.000 description 4
- UYXXMIZGHYKYAT-NHCYSSNCSA-N Asn-His-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)NC(=O)[C@H](CC(=O)N)N UYXXMIZGHYKYAT-NHCYSSNCSA-N 0.000 description 4
- WCFCYFDBMNFSPA-ACZMJKKPSA-N Asp-Asp-Glu Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CCC(O)=O WCFCYFDBMNFSPA-ACZMJKKPSA-N 0.000 description 4
- BWJZSLQJNBSUPM-FXQIFTODSA-N Asp-Pro-Asn Chemical compound OC(=O)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(N)=O)C(O)=O BWJZSLQJNBSUPM-FXQIFTODSA-N 0.000 description 4
- MVRGBQGZSDJBSM-GMOBBJLQSA-N Asp-Pro-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@@H]1CCCN1C(=O)[C@H](CC(=O)O)N MVRGBQGZSDJBSM-GMOBBJLQSA-N 0.000 description 4
- MGSVBZIBCCKGCY-ZLUOBGJFSA-N Asp-Ser-Ser Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O MGSVBZIBCCKGCY-ZLUOBGJFSA-N 0.000 description 4
- 241000894006 Bacteria Species 0.000 description 4
- 108091026890 Coding region Proteins 0.000 description 4
- GMXSSZUVDNPRMA-FXQIFTODSA-N Cys-Arg-Asp Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(O)=O GMXSSZUVDNPRMA-FXQIFTODSA-N 0.000 description 4
- NDNZRWUDUMTITL-FXQIFTODSA-N Cys-Ser-Val Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O NDNZRWUDUMTITL-FXQIFTODSA-N 0.000 description 4
- ATFSDBMHRCDLBV-BPUTZDHNSA-N Cys-Val-Trp Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)O)NC(=O)[C@H](CS)N ATFSDBMHRCDLBV-BPUTZDHNSA-N 0.000 description 4
- 241000196324 Embryophyta Species 0.000 description 4
- LKUWAWGNJYJODH-KBIXCLLPSA-N Gln-Ala-Ile Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O LKUWAWGNJYJODH-KBIXCLLPSA-N 0.000 description 4
- XXLBHPPXDUWYAG-XQXXSGGOSA-N Gln-Ala-Thr Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O XXLBHPPXDUWYAG-XQXXSGGOSA-N 0.000 description 4
- RGRMOYQUIJVQQD-SRVKXCTJSA-N Gln-Arg-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CCC(=O)N)N RGRMOYQUIJVQQD-SRVKXCTJSA-N 0.000 description 4
- RBWKVOSARCFSQQ-FXQIFTODSA-N Gln-Gln-Ser Chemical compound NC(=O)CC[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(O)=O RBWKVOSARCFSQQ-FXQIFTODSA-N 0.000 description 4
- PNENQZWRFMUZOM-DCAQKATOSA-N Gln-Glu-Leu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O PNENQZWRFMUZOM-DCAQKATOSA-N 0.000 description 4
- XJKAKYXMFHUIHT-AUTRQRHGSA-N Gln-Glu-Val Chemical compound CC(C)[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CCC(=O)N)N XJKAKYXMFHUIHT-AUTRQRHGSA-N 0.000 description 4
- LGIKBBLQVSWUGK-DCAQKATOSA-N Gln-Leu-Gln Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O LGIKBBLQVSWUGK-DCAQKATOSA-N 0.000 description 4
- ZXQPJYWZSFGWJB-AVGNSLFASA-N Glu-Cys-Phe Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)O)NC(=O)[C@H](CS)NC(=O)[C@H](CCC(=O)O)N ZXQPJYWZSFGWJB-AVGNSLFASA-N 0.000 description 4
- UMIRPYLZFKOEOH-YVNDNENWSA-N Glu-Gln-Ile Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O UMIRPYLZFKOEOH-YVNDNENWSA-N 0.000 description 4
- CGOHAEBMDSEKFB-FXQIFTODSA-N Glu-Glu-Ala Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(O)=O CGOHAEBMDSEKFB-FXQIFTODSA-N 0.000 description 4
- GJBUAAAIZSRCDC-GVXVVHGQSA-N Glu-Leu-Val Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(O)=O GJBUAAAIZSRCDC-GVXVVHGQSA-N 0.000 description 4
- WVWZIPOJECFDAG-AVGNSLFASA-N Glu-Phe-Cys Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CCC(=O)O)N WVWZIPOJECFDAG-AVGNSLFASA-N 0.000 description 4
- YQAQQKPWFOBSMU-WDCWCFNPSA-N Glu-Thr-Leu Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O YQAQQKPWFOBSMU-WDCWCFNPSA-N 0.000 description 4
- TZOVVRJYUDETQG-RCOVLWMOSA-N Gly-Asp-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)CN TZOVVRJYUDETQG-RCOVLWMOSA-N 0.000 description 4
- AQLHORCVPGXDJW-IUCAKERBSA-N Gly-Gln-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)CN AQLHORCVPGXDJW-IUCAKERBSA-N 0.000 description 4
- QPDUVFSVVAOUHE-XVKPBYJWSA-N Gly-Gln-Val Chemical compound CC(C)[C@H](NC(=O)[C@H](CCC(N)=O)NC(=O)CN)C(O)=O QPDUVFSVVAOUHE-XVKPBYJWSA-N 0.000 description 4
- XPJBQTCXPJNIFE-ZETCQYMHSA-N Gly-Gly-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)CNC(=O)CN XPJBQTCXPJNIFE-ZETCQYMHSA-N 0.000 description 4
- COVXELOAORHTND-LSJOCFKGSA-N Gly-Ile-Val Chemical compound NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C(C)C)C(O)=O COVXELOAORHTND-LSJOCFKGSA-N 0.000 description 4
- CCBIBMKQNXHNIN-ZETCQYMHSA-N Gly-Leu-Gly Chemical compound NCC(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O CCBIBMKQNXHNIN-ZETCQYMHSA-N 0.000 description 4
- UHPAZODVFFYEEL-QWRGUYRKSA-N Gly-Leu-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)CN UHPAZODVFFYEEL-QWRGUYRKSA-N 0.000 description 4
- NNCSJUBVFBDDLC-YUMQZZPRSA-N Gly-Leu-Ser Chemical compound NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O NNCSJUBVFBDDLC-YUMQZZPRSA-N 0.000 description 4
- GWCJMBNBFYBQCV-XPUUQOCRSA-N Gly-Val-Ala Chemical compound NCC(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C)C(O)=O GWCJMBNBFYBQCV-XPUUQOCRSA-N 0.000 description 4
- BNMRSWQOHIQTFL-JSGCOSHPSA-N Gly-Val-Phe Chemical compound NCC(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 BNMRSWQOHIQTFL-JSGCOSHPSA-N 0.000 description 4
- KSOBNUBCYHGUKH-UWVGGRQHSA-N Gly-Val-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](C(C)C)NC(=O)CN KSOBNUBCYHGUKH-UWVGGRQHSA-N 0.000 description 4
- VSLXGYMEHVAJBH-DLOVCJGASA-N His-Ala-Leu Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O VSLXGYMEHVAJBH-DLOVCJGASA-N 0.000 description 4
- RGPWUJOMKFYFSR-QWRGUYRKSA-N His-Gly-Leu Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)NCC(=O)N[C@@H](CC(C)C)C(O)=O RGPWUJOMKFYFSR-QWRGUYRKSA-N 0.000 description 4
- DPQIPEAHIYMUEJ-IHRRRGAJSA-N His-Lys-Met Chemical compound CSCC[C@@H](C(=O)O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC1=CN=CN1)N DPQIPEAHIYMUEJ-IHRRRGAJSA-N 0.000 description 4
- BSVLMPMIXPQNKC-KBPBESRZSA-N His-Phe-Gly Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)NCC(O)=O BSVLMPMIXPQNKC-KBPBESRZSA-N 0.000 description 4
- XVZJRZQIHJMUBG-TUBUOCAGSA-N His-Thr-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC1=CN=CN1)N XVZJRZQIHJMUBG-TUBUOCAGSA-N 0.000 description 4
- AHEBIAHEZWQVHB-QTKMDUPCSA-N His-Thr-Met Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCSC)C(=O)O)NC(=O)[C@H](CC1=CN=CN1)N)O AHEBIAHEZWQVHB-QTKMDUPCSA-N 0.000 description 4
- GGXUJBKENKVYNV-ULQDDVLXSA-N His-Val-Phe Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)NC(=O)[C@H](CC2=CN=CN2)N GGXUJBKENKVYNV-ULQDDVLXSA-N 0.000 description 4
- 101000854879 Homo sapiens V-type proton ATPase 116 kDa subunit a 2 Proteins 0.000 description 4
- JRHFQUPIZOYKQP-KBIXCLLPSA-N Ile-Ala-Glu Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCC(O)=O JRHFQUPIZOYKQP-KBIXCLLPSA-N 0.000 description 4
- AXNGDPAKKCEKGY-QPHKQPEJSA-N Ile-Ile-Thr Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)O)N AXNGDPAKKCEKGY-QPHKQPEJSA-N 0.000 description 4
- FZWVCYCYWCLQDH-NHCYSSNCSA-N Ile-Leu-Gly Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)O)N FZWVCYCYWCLQDH-NHCYSSNCSA-N 0.000 description 4
- FXJLRZFMKGHYJP-CFMVVWHZSA-N Ile-Tyr-Asn Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CC(=O)N)C(=O)O)N FXJLRZFMKGHYJP-CFMVVWHZSA-N 0.000 description 4
- 108010064593 Intercellular Adhesion Molecule-1 Proteins 0.000 description 4
- 102100037877 Intercellular adhesion molecule 1 Human genes 0.000 description 4
- SENJXOPIZNYLHU-UHFFFAOYSA-N L-leucyl-L-arginine Natural products CC(C)CC(N)C(=O)NC(C(O)=O)CCCN=C(N)N SENJXOPIZNYLHU-UHFFFAOYSA-N 0.000 description 4
- CQQGCWPXDHTTNF-GUBZILKMSA-N Leu-Ala-Glu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CCC(O)=O CQQGCWPXDHTTNF-GUBZILKMSA-N 0.000 description 4
- PBCHMHROGNUXMK-DLOVCJGASA-N Leu-Ala-His Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CN=CN1 PBCHMHROGNUXMK-DLOVCJGASA-N 0.000 description 4
- RFUBXQQFJFGJFV-GUBZILKMSA-N Leu-Asn-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O RFUBXQQFJFGJFV-GUBZILKMSA-N 0.000 description 4
- OGCQGUIWMSBHRZ-CIUDSAMLSA-N Leu-Asn-Ser Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(O)=O OGCQGUIWMSBHRZ-CIUDSAMLSA-N 0.000 description 4
- ZTLGVASZOIKNIX-DCAQKATOSA-N Leu-Gln-Glu Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N ZTLGVASZOIKNIX-DCAQKATOSA-N 0.000 description 4
- QJUWBDPGGYVRHY-YUMQZZPRSA-N Leu-Gly-Cys Chemical compound CC(C)C[C@@H](C(=O)NCC(=O)N[C@@H](CS)C(=O)O)N QJUWBDPGGYVRHY-YUMQZZPRSA-N 0.000 description 4
- KGCLIYGPQXUNLO-IUCAKERBSA-N Leu-Gly-Glu Chemical compound CC(C)C[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CCC(O)=O KGCLIYGPQXUNLO-IUCAKERBSA-N 0.000 description 4
- HYIFFZAQXPUEAU-QWRGUYRKSA-N Leu-Gly-Leu Chemical compound CC(C)C[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CC(C)C HYIFFZAQXPUEAU-QWRGUYRKSA-N 0.000 description 4
- HYMLKESRWLZDBR-WEDXCCLWSA-N Leu-Gly-Thr Chemical compound CC(C)C[C@H](N)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(O)=O HYMLKESRWLZDBR-WEDXCCLWSA-N 0.000 description 4
- AVEGDIAXTDVBJS-XUXIUFHCSA-N Leu-Ile-Arg Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O AVEGDIAXTDVBJS-XUXIUFHCSA-N 0.000 description 4
- JFSGIJSCJFQGSZ-MXAVVETBSA-N Leu-Ile-His Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](CC(C)C)N JFSGIJSCJFQGSZ-MXAVVETBSA-N 0.000 description 4
- HRTRLSRYZZKPCO-BJDJZHNGSA-N Leu-Ile-Ser Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O HRTRLSRYZZKPCO-BJDJZHNGSA-N 0.000 description 4
- KYIIALJHAOIAHF-KKUMJFAQSA-N Leu-Leu-His Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CC1=CN=CN1 KYIIALJHAOIAHF-KKUMJFAQSA-N 0.000 description 4
- XVZCXCTYGHPNEM-UHFFFAOYSA-N Leu-Leu-Pro Natural products CC(C)CC(N)C(=O)NC(CC(C)C)C(=O)N1CCCC1C(O)=O XVZCXCTYGHPNEM-UHFFFAOYSA-N 0.000 description 4
- FLNPJLDPGMLWAU-UWVGGRQHSA-N Leu-Met-Gly Chemical compound OC(=O)CNC(=O)[C@H](CCSC)NC(=O)[C@@H](N)CC(C)C FLNPJLDPGMLWAU-UWVGGRQHSA-N 0.000 description 4
- POMXSEDNUXYPGK-IHRRRGAJSA-N Leu-Met-His Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N POMXSEDNUXYPGK-IHRRRGAJSA-N 0.000 description 4
- MJTOYIHCKVQICL-ULQDDVLXSA-N Leu-Met-Phe Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)N MJTOYIHCKVQICL-ULQDDVLXSA-N 0.000 description 4
- PTRKPHUGYULXPU-KKUMJFAQSA-N Leu-Phe-Ser Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(O)=O PTRKPHUGYULXPU-KKUMJFAQSA-N 0.000 description 4
- WMIOEVKKYIMVKI-DCAQKATOSA-N Leu-Pro-Ala Chemical compound [H]N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C)C(O)=O WMIOEVKKYIMVKI-DCAQKATOSA-N 0.000 description 4
- BMVFXOQHDQZAQU-DCAQKATOSA-N Leu-Pro-Asp Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(=O)O)C(=O)O)N BMVFXOQHDQZAQU-DCAQKATOSA-N 0.000 description 4
- DPURXCQCHSQPAN-AVGNSLFASA-N Leu-Pro-Pro Chemical compound CC(C)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 DPURXCQCHSQPAN-AVGNSLFASA-N 0.000 description 4
- IWMJFLJQHIDZQW-KKUMJFAQSA-N Leu-Ser-Phe Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 IWMJFLJQHIDZQW-KKUMJFAQSA-N 0.000 description 4
- QWWPYKKLXWOITQ-VOAKCMCISA-N Leu-Thr-Leu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CC(C)C QWWPYKKLXWOITQ-VOAKCMCISA-N 0.000 description 4
- CNWDWAMPKVYJJB-NUTKFTJISA-N Leu-Trp-Ala Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](N)CC(C)C)C(=O)N[C@@H](C)C(O)=O)=CNC2=C1 CNWDWAMPKVYJJB-NUTKFTJISA-N 0.000 description 4
- AXVIGSRGTMNSJU-YESZJQIVSA-N Leu-Tyr-Pro Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N2CCC[C@@H]2C(=O)O)N AXVIGSRGTMNSJU-YESZJQIVSA-N 0.000 description 4
- FDBTVENULFNTAL-XQQFMLRXSA-N Leu-Val-Pro Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@@H]1C(=O)O)N FDBTVENULFNTAL-XQQFMLRXSA-N 0.000 description 4
- IRNSXVOWSXSULE-DCAQKATOSA-N Lys-Ala-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCCN IRNSXVOWSXSULE-DCAQKATOSA-N 0.000 description 4
- SSYOBDBNBQBSQE-SRVKXCTJSA-N Lys-Cys-Leu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(C)C)C(O)=O SSYOBDBNBQBSQE-SRVKXCTJSA-N 0.000 description 4
- KXYLFJIQDIMURW-IHPCNDPISA-N Lys-Trp-Leu Chemical compound C1=CC=C2C(C[C@@H](C(=O)N[C@@H](CC(C)C)C(O)=O)NC(=O)[C@@H](N)CCCCN)=CNC2=C1 KXYLFJIQDIMURW-IHPCNDPISA-N 0.000 description 4
- WYEXWKAWMNJKPN-UBHSHLNASA-N Met-Ala-Phe Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)NC(=O)[C@H](CCSC)N WYEXWKAWMNJKPN-UBHSHLNASA-N 0.000 description 4
- GPAHWYRSHCKICP-GUBZILKMSA-N Met-Glu-Glu Chemical compound CSCC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(O)=O GPAHWYRSHCKICP-GUBZILKMSA-N 0.000 description 4
- OIFHHODAXVWKJN-ULQDDVLXSA-N Met-Phe-Leu Chemical compound CSCC[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CC(C)C)C(O)=O)CC1=CC=CC=C1 OIFHHODAXVWKJN-ULQDDVLXSA-N 0.000 description 4
- XIGAHPDZLAYQOS-SRVKXCTJSA-N Met-Pro-Pro Chemical compound CSCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 XIGAHPDZLAYQOS-SRVKXCTJSA-N 0.000 description 4
- GGXZOTSDJJTDGB-GUBZILKMSA-N Met-Ser-Val Chemical compound [H]N[C@@H](CCSC)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O GGXZOTSDJJTDGB-GUBZILKMSA-N 0.000 description 4
- YIGCDRZMZNDENK-UNQGMJICSA-N Met-Thr-Phe Chemical compound [H]N[C@@H](CCSC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O YIGCDRZMZNDENK-UNQGMJICSA-N 0.000 description 4
- CKAVKDJBSNTJDB-SRVKXCTJSA-N Met-Val-Met Chemical compound CSCC[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CCSC CKAVKDJBSNTJDB-SRVKXCTJSA-N 0.000 description 4
- XZFYRXDAULDNFX-UHFFFAOYSA-N N-L-cysteinyl-L-phenylalanine Natural products SCC(N)C(=O)NC(C(O)=O)CC1=CC=CC=C1 XZFYRXDAULDNFX-UHFFFAOYSA-N 0.000 description 4
- AUEJLPRZGVVDNU-UHFFFAOYSA-N N-L-tyrosyl-L-leucine Natural products CC(C)CC(C(O)=O)NC(=O)C(N)CC1=CC=C(O)C=C1 AUEJLPRZGVVDNU-UHFFFAOYSA-N 0.000 description 4
- XMBSYZWANAQXEV-UHFFFAOYSA-N N-alpha-L-glutamyl-L-phenylalanine Natural products OC(=O)CCC(N)C(=O)NC(C(O)=O)CC1=CC=CC=C1 XMBSYZWANAQXEV-UHFFFAOYSA-N 0.000 description 4
- KZNQNBZMBZJQJO-UHFFFAOYSA-N N-glycyl-L-proline Natural products NCC(=O)N1CCCC1C(O)=O KZNQNBZMBZJQJO-UHFFFAOYSA-N 0.000 description 4
- 241000283973 Oryctolagus cuniculus Species 0.000 description 4
- BJEYSVHMGIJORT-NHCYSSNCSA-N Phe-Ala-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC1=CC=CC=C1 BJEYSVHMGIJORT-NHCYSSNCSA-N 0.000 description 4
- CGOMLCQJEMWMCE-STQMWFEESA-N Phe-Arg-Gly Chemical compound NC(N)=NCCC[C@@H](C(=O)NCC(O)=O)NC(=O)[C@@H](N)CC1=CC=CC=C1 CGOMLCQJEMWMCE-STQMWFEESA-N 0.000 description 4
- HGNGAMWHGGANAU-WHOFXGATSA-N Phe-Gly-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CC1=CC=CC=C1 HGNGAMWHGGANAU-WHOFXGATSA-N 0.000 description 4
- WFHRXJOZEXUKLV-IRXDYDNUSA-N Phe-Gly-Tyr Chemical compound C([C@H](N)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)C1=CC=CC=C1 WFHRXJOZEXUKLV-IRXDYDNUSA-N 0.000 description 4
- HQCSLJFGZYOXHW-KKUMJFAQSA-N Phe-His-Cys Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC2=CN=CN2)C(=O)N[C@@H](CS)C(=O)O)N HQCSLJFGZYOXHW-KKUMJFAQSA-N 0.000 description 4
- WKTSCAXSYITIJJ-PCBIJLKTSA-N Phe-Ile-Asn Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(O)=O WKTSCAXSYITIJJ-PCBIJLKTSA-N 0.000 description 4
- SMFGCTXUBWEPKM-KBPBESRZSA-N Phe-Leu-Gly Chemical compound OC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC1=CC=CC=C1 SMFGCTXUBWEPKM-KBPBESRZSA-N 0.000 description 4
- YCCUXNNKXDGMAM-KKUMJFAQSA-N Phe-Leu-Ser Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O YCCUXNNKXDGMAM-KKUMJFAQSA-N 0.000 description 4
- PHJUFDQVVKVOPU-ULQDDVLXSA-N Phe-Lys-Met Chemical compound CSCC[C@@H](C(=O)O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC1=CC=CC=C1)N PHJUFDQVVKVOPU-ULQDDVLXSA-N 0.000 description 4
- CKJACGQPCPMWIT-UFYCRDLUSA-N Phe-Pro-Phe Chemical compound C([C@H](N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CC=CC=C1 CKJACGQPCPMWIT-UFYCRDLUSA-N 0.000 description 4
- GMWNQSGWWGKTSF-LFSVMHDDSA-N Phe-Thr-Ala Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O GMWNQSGWWGKTSF-LFSVMHDDSA-N 0.000 description 4
- NXEYSLRNNPWCRN-SRVKXCTJSA-N Pro-Glu-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O NXEYSLRNNPWCRN-SRVKXCTJSA-N 0.000 description 4
- FYPGHGXAOZTOBO-IHRRRGAJSA-N Pro-Leu-His Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@@H]2CCCN2 FYPGHGXAOZTOBO-IHRRRGAJSA-N 0.000 description 4
- WHNJMTHJGCEKGA-ULQDDVLXSA-N Pro-Phe-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(C)C)C(O)=O WHNJMTHJGCEKGA-ULQDDVLXSA-N 0.000 description 4
- OWQXAJQZLWHPBH-FXQIFTODSA-N Pro-Ser-Asn Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(O)=O OWQXAJQZLWHPBH-FXQIFTODSA-N 0.000 description 4
- FNGOXVQBBCMFKV-CIUDSAMLSA-N Pro-Ser-Glu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(O)=O FNGOXVQBBCMFKV-CIUDSAMLSA-N 0.000 description 4
- BGWKULMLUIUPKY-BQBZGAKWSA-N Pro-Ser-Gly Chemical compound OC(=O)CNC(=O)[C@H](CO)NC(=O)[C@@H]1CCCN1 BGWKULMLUIUPKY-BQBZGAKWSA-N 0.000 description 4
- ITUDDXVFGFEKPD-NAKRPEOUSA-N Pro-Ser-Ile Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O ITUDDXVFGFEKPD-NAKRPEOUSA-N 0.000 description 4
- IALSFJSONJZBKB-HRCADAONSA-N Pro-Tyr-Pro Chemical compound C1C[C@H](NC1)C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)N3CCC[C@@H]3C(=O)O IALSFJSONJZBKB-HRCADAONSA-N 0.000 description 4
- 108010083204 Proton Pumps Proteins 0.000 description 4
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 4
- GXXTUIUYTWGPMV-FXQIFTODSA-N Ser-Arg-Ala Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(O)=O GXXTUIUYTWGPMV-FXQIFTODSA-N 0.000 description 4
- UGJRQLURDVGULT-LKXGYXEUSA-N Ser-Asn-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O UGJRQLURDVGULT-LKXGYXEUSA-N 0.000 description 4
- OHKFXGKHSJKKAL-NRPADANISA-N Ser-Glu-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O OHKFXGKHSJKKAL-NRPADANISA-N 0.000 description 4
- CAOYHZOWXFFAIR-CIUDSAMLSA-N Ser-His-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CO)C(O)=O CAOYHZOWXFFAIR-CIUDSAMLSA-N 0.000 description 4
- FUMGHWDRRFCKEP-CIUDSAMLSA-N Ser-Leu-Ala Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(O)=O FUMGHWDRRFCKEP-CIUDSAMLSA-N 0.000 description 4
- FZEUTKVQGMVGHW-AVGNSLFASA-N Ser-Phe-Gln Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCC(N)=O)C(O)=O FZEUTKVQGMVGHW-AVGNSLFASA-N 0.000 description 4
- QUGRFWPMPVIAPW-IHRRRGAJSA-N Ser-Pro-Phe Chemical compound OC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 QUGRFWPMPVIAPW-IHRRRGAJSA-N 0.000 description 4
- IAOHCSQDQDWRQU-GUBZILKMSA-N Ser-Val-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O IAOHCSQDQDWRQU-GUBZILKMSA-N 0.000 description 4
- IRKWVRSEQFTGGV-VEVYYDQMSA-N Thr-Asn-Arg Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O IRKWVRSEQFTGGV-VEVYYDQMSA-N 0.000 description 4
- YOSLMIPKOUAHKI-OLHMAJIHSA-N Thr-Asp-Asp Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O YOSLMIPKOUAHKI-OLHMAJIHSA-N 0.000 description 4
- NLJKZUGAIIRWJN-LKXGYXEUSA-N Thr-Asp-Cys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CS)C(=O)O)N)O NLJKZUGAIIRWJN-LKXGYXEUSA-N 0.000 description 4
- FHDLKMFZKRUQCE-HJGDQZAQSA-N Thr-Glu-Arg Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O FHDLKMFZKRUQCE-HJGDQZAQSA-N 0.000 description 4
- ZTPXSEUVYNNZRB-CDMKHQONSA-N Thr-Gly-Phe Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O ZTPXSEUVYNNZRB-CDMKHQONSA-N 0.000 description 4
- JKGGPMOUIAAJAA-YEPSODPASA-N Thr-Gly-Val Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](C(C)C)C(O)=O JKGGPMOUIAAJAA-YEPSODPASA-N 0.000 description 4
- WNQJTLATMXYSEL-OEAJRASXSA-N Thr-Phe-Leu Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(C)C)C(O)=O WNQJTLATMXYSEL-OEAJRASXSA-N 0.000 description 4
- NQQMWWVVGIXUOX-SVSWQMSJSA-N Thr-Ser-Ile Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O NQQMWWVVGIXUOX-SVSWQMSJSA-N 0.000 description 4
- VGNLMPBYWWNQFS-ZEILLAHLSA-N Thr-Thr-His Chemical compound C[C@H]([C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N)O VGNLMPBYWWNQFS-ZEILLAHLSA-N 0.000 description 4
- 206010052779 Transplant rejections Diseases 0.000 description 4
- GWQUSADRQCTMHN-NWLDYVSISA-N Trp-Gln-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CC1=CNC2=CC=CC=C21)N)O GWQUSADRQCTMHN-NWLDYVSISA-N 0.000 description 4
- HIZDHWHVOLUGOX-BPUTZDHNSA-N Trp-Ser-Val Chemical compound [H]N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O HIZDHWHVOLUGOX-BPUTZDHNSA-N 0.000 description 4
- LNGFWVPNKLWATF-ZVZYQTTQSA-N Trp-Val-Glu Chemical compound [H]N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O LNGFWVPNKLWATF-ZVZYQTTQSA-N 0.000 description 4
- IYHNBRUWVBIVJR-IHRRRGAJSA-N Tyr-Gln-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 IYHNBRUWVBIVJR-IHRRRGAJSA-N 0.000 description 4
- GULIUBBXCYPDJU-CQDKDKBSSA-N Tyr-Leu-Ala Chemical compound [O-]C(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H]([NH3+])CC1=CC=C(O)C=C1 GULIUBBXCYPDJU-CQDKDKBSSA-N 0.000 description 4
- FMXFHNSFABRVFZ-BZSNNMDCSA-N Tyr-Lys-Leu Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(O)=O FMXFHNSFABRVFZ-BZSNNMDCSA-N 0.000 description 4
- NUQZCPSZHGIYTA-HKUYNNGSSA-N Tyr-Trp-Gly Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)NCC(=O)O)NC(=O)[C@H](CC3=CC=C(C=C3)O)N NUQZCPSZHGIYTA-HKUYNNGSSA-N 0.000 description 4
- 102100020745 V-type proton ATPase 116 kDa subunit a 2 Human genes 0.000 description 4
- REJBPZVUHYNMEN-LSJOCFKGSA-N Val-Ala-His Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](C(C)C)N REJBPZVUHYNMEN-LSJOCFKGSA-N 0.000 description 4
- LTFLDDDGWOVIHY-NAKRPEOUSA-N Val-Ala-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](C)NC(=O)[C@H](C(C)C)N LTFLDDDGWOVIHY-NAKRPEOUSA-N 0.000 description 4
- IDKGBVZGNTYYCC-QXEWZRGKSA-N Val-Asn-Pro Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CC(N)=O)C(=O)N1CCC[C@H]1C(O)=O IDKGBVZGNTYYCC-QXEWZRGKSA-N 0.000 description 4
- JTWIMNMUYLQNPI-WPRPVWTQSA-N Val-Gly-Arg Chemical compound CC(C)[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CCCNC(N)=N JTWIMNMUYLQNPI-WPRPVWTQSA-N 0.000 description 4
- BZWUSZGQOILYEU-STECZYCISA-N Val-Ile-Tyr Chemical compound CC(C)[C@H](N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 BZWUSZGQOILYEU-STECZYCISA-N 0.000 description 4
- HGJRMXOWUWVUOA-GVXVVHGQSA-N Val-Leu-Gln Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](C(C)C)N HGJRMXOWUWVUOA-GVXVVHGQSA-N 0.000 description 4
- UMPVMAYCLYMYGA-ONGXEEELSA-N Val-Leu-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)NCC(O)=O UMPVMAYCLYMYGA-ONGXEEELSA-N 0.000 description 4
- VENKIVFKIPGEJN-NHCYSSNCSA-N Val-Met-Glu Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N VENKIVFKIPGEJN-NHCYSSNCSA-N 0.000 description 4
- RSGHLMMKXJGCMK-JYJNAYRXSA-N Val-Met-Phe Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)N RSGHLMMKXJGCMK-JYJNAYRXSA-N 0.000 description 4
- QPPZEDOTPZOSEC-RCWTZXSCSA-N Val-Met-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CCSC)NC(=O)[C@H](C(C)C)N)O QPPZEDOTPZOSEC-RCWTZXSCSA-N 0.000 description 4
- HJSLDXZAZGFPDK-ULQDDVLXSA-N Val-Phe-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=CC=C1)NC(=O)[C@H](C(C)C)N HJSLDXZAZGFPDK-ULQDDVLXSA-N 0.000 description 4
- USLVEJAHTBLSIL-CYDGBPFRSA-N Val-Pro-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)C(C)C USLVEJAHTBLSIL-CYDGBPFRSA-N 0.000 description 4
- SSKKGOWRPNIVDW-AVGNSLFASA-N Val-Val-His Chemical compound CC(C)[C@@H](C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N SSKKGOWRPNIVDW-AVGNSLFASA-N 0.000 description 4
- 108010087924 alanylproline Proteins 0.000 description 4
- 230000000961 alloantigen Effects 0.000 description 4
- 108010043240 arginyl-leucyl-glycine Proteins 0.000 description 4
- 108010010430 asparagine-proline-alanine Proteins 0.000 description 4
- 230000004071 biological effect Effects 0.000 description 4
- 201000011510 cancer Diseases 0.000 description 4
- 230000001419 dependent effect Effects 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 230000018109 developmental process Effects 0.000 description 4
- 239000000839 emulsion Substances 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 239000003623 enhancer Substances 0.000 description 4
- 230000004927 fusion Effects 0.000 description 4
- 108010078144 glutaminyl-glycine Proteins 0.000 description 4
- 108010049041 glutamylalanine Proteins 0.000 description 4
- VPZXBVLAVMBEQI-UHFFFAOYSA-N glycyl-DL-alpha-alanine Natural products OC(=O)C(C)NC(=O)CN VPZXBVLAVMBEQI-UHFFFAOYSA-N 0.000 description 4
- 108010026364 glycyl-glycyl-leucine Proteins 0.000 description 4
- 108010010147 glycylglutamine Proteins 0.000 description 4
- 108010050848 glycylleucine Proteins 0.000 description 4
- 108010092114 histidylphenylalanine Proteins 0.000 description 4
- 238000009169 immunotherapy Methods 0.000 description 4
- 230000006698 induction Effects 0.000 description 4
- 230000008595 infiltration Effects 0.000 description 4
- 238000001764 infiltration Methods 0.000 description 4
- 108010044374 isoleucyl-tyrosine Proteins 0.000 description 4
- 108010073472 leucyl-prolyl-proline Proteins 0.000 description 4
- 108010000761 leucylarginine Proteins 0.000 description 4
- 108010057821 leucylproline Proteins 0.000 description 4
- 238000011694 lewis rat Methods 0.000 description 4
- 210000005105 peripheral blood lymphocyte Anatomy 0.000 description 4
- 108010073101 phenylalanylleucine Proteins 0.000 description 4
- 108010051242 phenylalanylserine Proteins 0.000 description 4
- 108010015796 prolylisoleucine Proteins 0.000 description 4
- 210000002966 serum Anatomy 0.000 description 4
- 108010026333 seryl-proline Proteins 0.000 description 4
- 108010071207 serylmethionine Proteins 0.000 description 4
- 230000019491 signal transduction Effects 0.000 description 4
- 238000006467 substitution reaction Methods 0.000 description 4
- 230000004083 survival effect Effects 0.000 description 4
- 231100000331 toxic Toxicity 0.000 description 4
- 230000002588 toxic effect Effects 0.000 description 4
- 108010014563 tryptophyl-cysteinyl-serine Proteins 0.000 description 4
- 108010071635 tyrosyl-prolyl-arginine Proteins 0.000 description 4
- 108010078580 tyrosylleucine Proteins 0.000 description 4
- 230000003827 upregulation Effects 0.000 description 4
- 108010009962 valyltyrosine Proteins 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- 239000004475 Arginine Substances 0.000 description 3
- 108700031361 Brachyury Proteins 0.000 description 3
- 101100289995 Caenorhabditis elegans mac-1 gene Proteins 0.000 description 3
- 108020004635 Complementary DNA Proteins 0.000 description 3
- 108010062580 Concanavalin A Proteins 0.000 description 3
- 238000002965 ELISA Methods 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 108010008212 Integrin alpha4beta1 Proteins 0.000 description 3
- 102000004856 Lectins Human genes 0.000 description 3
- 108090001090 Lectins Proteins 0.000 description 3
- 101710135898 Myc proto-oncogene protein Proteins 0.000 description 3
- 102100038895 Myc proto-oncogene protein Human genes 0.000 description 3
- 108091034117 Oligonucleotide Proteins 0.000 description 3
- 102100032709 Potassium-transporting ATPase alpha chain 2 Human genes 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 108090000184 Selectins Proteins 0.000 description 3
- 102000003800 Selectins Human genes 0.000 description 3
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 description 3
- 101710150448 Transcriptional regulator Myc Proteins 0.000 description 3
- 241000700605 Viruses Species 0.000 description 3
- 230000001028 anti-proliverative effect Effects 0.000 description 3
- 230000000692 anti-sense effect Effects 0.000 description 3
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 3
- 235000009697 arginine Nutrition 0.000 description 3
- 210000004899 c-terminal region Anatomy 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 3
- 238000007796 conventional method Methods 0.000 description 3
- 230000008878 coupling Effects 0.000 description 3
- 238000010168 coupling process Methods 0.000 description 3
- 238000005859 coupling reaction Methods 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- 238000012217 deletion Methods 0.000 description 3
- 230000037430 deletion Effects 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 239000008121 dextrose Substances 0.000 description 3
- 239000012636 effector Substances 0.000 description 3
- 239000000284 extract Substances 0.000 description 3
- 230000001605 fetal effect Effects 0.000 description 3
- 239000001963 growth medium Substances 0.000 description 3
- 210000004408 hybridoma Anatomy 0.000 description 3
- 230000002209 hydrophobic effect Effects 0.000 description 3
- 239000003018 immunosuppressive agent Substances 0.000 description 3
- 238000003780 insertion Methods 0.000 description 3
- 230000037431 insertion Effects 0.000 description 3
- 102000006495 integrins Human genes 0.000 description 3
- 108010044426 integrins Proteins 0.000 description 3
- 239000002523 lectin Substances 0.000 description 3
- 239000002502 liposome Substances 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 210000000207 lymphocyte subset Anatomy 0.000 description 3
- 244000005700 microbiome Species 0.000 description 3
- 230000025020 negative regulation of T cell proliferation Effects 0.000 description 3
- 210000002997 osteoclast Anatomy 0.000 description 3
- 239000002953 phosphate buffered saline Substances 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 238000003127 radioimmunoassay Methods 0.000 description 3
- 230000002441 reversible effect Effects 0.000 description 3
- 230000011664 signaling Effects 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 230000001629 suppression Effects 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 229940104230 thymidine Drugs 0.000 description 3
- 210000001541 thymus gland Anatomy 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- 241001430294 unidentified retrovirus Species 0.000 description 3
- 239000013603 viral vector Substances 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- YHKANGMVQWRMAP-DCAQKATOSA-N Ala-Leu-Arg Chemical compound C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C(O)=O)CCCN=C(N)N YHKANGMVQWRMAP-DCAQKATOSA-N 0.000 description 2
- 108700028369 Alleles Proteins 0.000 description 2
- 241000972773 Aulopiformes Species 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 208000011691 Burkitt lymphomas Diseases 0.000 description 2
- 108010084313 CD58 Antigens Proteins 0.000 description 2
- 102000004631 Calcineurin Human genes 0.000 description 2
- 108010042955 Calcineurin Proteins 0.000 description 2
- 102000019034 Chemokines Human genes 0.000 description 2
- 108010012236 Chemokines Proteins 0.000 description 2
- 230000004568 DNA-binding Effects 0.000 description 2
- 241000702421 Dependoparvovirus Species 0.000 description 2
- 102100023471 E-selectin Human genes 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- 101000867232 Escherichia coli Heat-stable enterotoxin II Proteins 0.000 description 2
- 241000206602 Eukaryota Species 0.000 description 2
- 229920001917 Ficoll Polymers 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- 102100039556 Galectin-4 Human genes 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 101000608765 Homo sapiens Galectin-4 Proteins 0.000 description 2
- 206010020751 Hypersensitivity Diseases 0.000 description 2
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 2
- 102100033467 L-selectin Human genes 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- 102000052812 Ornithine decarboxylases Human genes 0.000 description 2
- 108700005126 Ornithine decarboxylases Proteins 0.000 description 2
- 102100023472 P-selectin Human genes 0.000 description 2
- 238000012408 PCR amplification Methods 0.000 description 2
- BYPFEZZEUUWMEJ-UHFFFAOYSA-N Pentoxifylline Chemical compound O=C1N(CCCCC(=O)C)C(=O)N(C)C2=C1N(C)C=N2 BYPFEZZEUUWMEJ-UHFFFAOYSA-N 0.000 description 2
- 108700008625 Reporter Genes Proteins 0.000 description 2
- 238000002105 Southern blotting Methods 0.000 description 2
- 229940126530 T cell activator Drugs 0.000 description 2
- 230000024932 T cell mediated immunity Effects 0.000 description 2
- 102000040945 Transcription factor Human genes 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 230000007815 allergy Effects 0.000 description 2
- 230000000340 anti-metabolite Effects 0.000 description 2
- 210000000612 antigen-presenting cell Anatomy 0.000 description 2
- 230000000890 antigenic effect Effects 0.000 description 2
- 229940100197 antimetabolite Drugs 0.000 description 2
- 239000002256 antimetabolite Substances 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 230000008827 biological function Effects 0.000 description 2
- 229920001222 biopolymer Polymers 0.000 description 2
- 238000010367 cloning Methods 0.000 description 2
- 238000004891 communication Methods 0.000 description 2
- 229910000366 copper(II) sulfate Inorganic materials 0.000 description 2
- JZCCFEFSEZPSOG-UHFFFAOYSA-L copper(II) sulfate pentahydrate Chemical compound O.O.O.O.O.[Cu+2].[O-]S([O-])(=O)=O JZCCFEFSEZPSOG-UHFFFAOYSA-L 0.000 description 2
- 239000012228 culture supernatant Substances 0.000 description 2
- 229960000633 dextran sulfate Drugs 0.000 description 2
- 230000003828 downregulation Effects 0.000 description 2
- VLCYCQAOQCDTCN-UHFFFAOYSA-N eflornithine Chemical compound NCCCC(N)(C(F)F)C(O)=O VLCYCQAOQCDTCN-UHFFFAOYSA-N 0.000 description 2
- 238000001962 electrophoresis Methods 0.000 description 2
- 210000003527 eukaryotic cell Anatomy 0.000 description 2
- 238000001476 gene delivery Methods 0.000 description 2
- 238000010363 gene targeting Methods 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 238000010353 genetic engineering Methods 0.000 description 2
- 230000009036 growth inhibition Effects 0.000 description 2
- 238000002744 homologous recombination Methods 0.000 description 2
- 230000006801 homologous recombination Effects 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 230000001506 immunosuppresive effect Effects 0.000 description 2
- 238000010348 incorporation Methods 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 238000002372 labelling Methods 0.000 description 2
- 230000004807 localization Effects 0.000 description 2
- 210000003563 lymphoid tissue Anatomy 0.000 description 2
- 235000018977 lysine Nutrition 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 229960004452 methionine Drugs 0.000 description 2
- 210000001616 monocyte Anatomy 0.000 description 2
- 230000035772 mutation Effects 0.000 description 2
- 235000015097 nutrients Nutrition 0.000 description 2
- 229960001476 pentoxifylline Drugs 0.000 description 2
- 238000002823 phage display Methods 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 2
- 229920002401 polyacrylamide Polymers 0.000 description 2
- 239000004417 polycarbonate Substances 0.000 description 2
- 238000003752 polymerase chain reaction Methods 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- 210000001236 prokaryotic cell Anatomy 0.000 description 2
- 230000002035 prolonged effect Effects 0.000 description 2
- 238000001742 protein purification Methods 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 230000006798 recombination Effects 0.000 description 2
- 238000005215 recombination Methods 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 230000010076 replication Effects 0.000 description 2
- 238000012552 review Methods 0.000 description 2
- 235000019515 salmon Nutrition 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 230000006641 stabilisation Effects 0.000 description 2
- 238000011105 stabilization Methods 0.000 description 2
- 238000011476 stem cell transplantation Methods 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 230000005026 transcription initiation Effects 0.000 description 2
- 230000005030 transcription termination Effects 0.000 description 2
- 230000001052 transient effect Effects 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- 241000701161 unidentified adenovirus Species 0.000 description 2
- 241001529453 unidentified herpesvirus Species 0.000 description 2
- 229960005486 vaccine Drugs 0.000 description 2
- 238000012725 vapour phase polymerization Methods 0.000 description 2
- 238000001262 western blot Methods 0.000 description 2
- DIGQNXIGRZPYDK-WKSCXVIASA-N (2R)-6-amino-2-[[2-[[(2S)-2-[[2-[[(2R)-2-[[(2S)-2-[[(2R,3S)-2-[[2-[[(2S)-2-[[2-[[(2S)-2-[[(2S)-2-[[(2R)-2-[[(2S,3S)-2-[[(2R)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-2-[[(2R)-2-[[2-[[2-[[2-[(2-amino-1-hydroxyethylidene)amino]-3-carboxy-1-hydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1,5-dihydroxy-5-iminopentylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]hexanoic acid Chemical compound C[C@@H]([C@@H](C(=N[C@@H](CS)C(=N[C@@H](C)C(=N[C@@H](CO)C(=NCC(=N[C@@H](CCC(=N)O)C(=NC(CS)C(=N[C@H]([C@H](C)O)C(=N[C@H](CS)C(=N[C@H](CO)C(=NCC(=N[C@H](CS)C(=NCC(=N[C@H](CCCCN)C(=O)O)O)O)O)O)O)O)O)O)O)O)O)O)O)N=C([C@H](CS)N=C([C@H](CO)N=C([C@H](CO)N=C([C@H](C)N=C(CN=C([C@H](CO)N=C([C@H](CS)N=C(CN=C(C(CS)N=C(C(CC(=O)O)N=C(CN)O)O)O)O)O)O)O)O)O)O)O)O DIGQNXIGRZPYDK-WKSCXVIASA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- WNWVKZTYMQWFHE-UHFFFAOYSA-N 4-ethylmorpholine Chemical compound [CH2]CN1CCOCC1 WNWVKZTYMQWFHE-UHFFFAOYSA-N 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- 108091006112 ATPases Proteins 0.000 description 1
- 102100029457 Adenine phosphoribosyltransferase Human genes 0.000 description 1
- 108010024223 Adenine phosphoribosyltransferase Proteins 0.000 description 1
- 102000057290 Adenosine Triphosphatases Human genes 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- JBVSSSZFNTXJDX-YTLHQDLWSA-N Ala-Ala-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](C)N JBVSSSZFNTXJDX-YTLHQDLWSA-N 0.000 description 1
- VGPWRRFOPXVGOH-BYPYZUCNSA-N Ala-Gly-Gly Chemical compound C[C@H](N)C(=O)NCC(=O)NCC(O)=O VGPWRRFOPXVGOH-BYPYZUCNSA-N 0.000 description 1
- 102100036826 Aldehyde oxidase Human genes 0.000 description 1
- 229920000856 Amylose Polymers 0.000 description 1
- 108010032595 Antibody Binding Sites Proteins 0.000 description 1
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 1
- 108010039627 Aprotinin Proteins 0.000 description 1
- NJIKKGUVGUBICV-ZLUOBGJFSA-N Asp-Ala-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC(O)=O NJIKKGUVGUBICV-ZLUOBGJFSA-N 0.000 description 1
- IVPNEDNYYYFAGI-GARJFASQSA-N Asp-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC(=O)O)N IVPNEDNYYYFAGI-GARJFASQSA-N 0.000 description 1
- 108090001008 Avidin Chemical group 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 102100021277 Beta-secretase 2 Human genes 0.000 description 1
- 101710150190 Beta-secretase 2 Proteins 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 241000701822 Bovine papillomavirus Species 0.000 description 1
- 241001598984 Bromius obscurus Species 0.000 description 1
- 108010041397 CD4 Antigens Proteins 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- 102000000584 Calmodulin Human genes 0.000 description 1
- 108010041952 Calmodulin Proteins 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 102100038385 Coiled-coil domain-containing protein R3HCC1L Human genes 0.000 description 1
- 241000186216 Corynebacterium Species 0.000 description 1
- 101150074155 DHFR gene Proteins 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- 102000016607 Diphtheria Toxin Human genes 0.000 description 1
- 108010053187 Diphtheria Toxin Proteins 0.000 description 1
- 108010024212 E-Selectin Proteins 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 102000004533 Endonucleases Human genes 0.000 description 1
- YQYJSBFKSSDGFO-UHFFFAOYSA-N Epihygromycin Natural products OC1C(O)C(C(=O)C)OC1OC(C(=C1)O)=CC=C1C=C(C)C(=O)NC1C(O)C(O)C2OCOC2C1O YQYJSBFKSSDGFO-UHFFFAOYSA-N 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 108060002716 Exonuclease Proteins 0.000 description 1
- XZWYTXMRWQJBGX-VXBMVYAYSA-N FLAG peptide Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@@H](N)CC(O)=O)CC1=CC=C(O)C=C1 XZWYTXMRWQJBGX-VXBMVYAYSA-N 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- 102000016359 Fibronectins Human genes 0.000 description 1
- 241000192125 Firmicutes Species 0.000 description 1
- 101150094690 GAL1 gene Proteins 0.000 description 1
- 102100028501 Galanin peptides Human genes 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- MCAVASRGVBVPMX-FXQIFTODSA-N Gln-Glu-Ala Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(O)=O MCAVASRGVBVPMX-FXQIFTODSA-N 0.000 description 1
- SJPMNHCEWPTRBR-BQBZGAKWSA-N Glu-Glu-Gly Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)NCC(O)=O SJPMNHCEWPTRBR-BQBZGAKWSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- PNUFMLXHOLFRLD-KBPBESRZSA-N Gly-Tyr-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)CN)CC1=CC=C(O)C=C1 PNUFMLXHOLFRLD-KBPBESRZSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- HVLSXIKZNLPZJJ-TXZCQADKSA-N HA peptide Chemical compound C([C@@H](C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](C)C(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=C(O)C=C1 HVLSXIKZNLPZJJ-TXZCQADKSA-N 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000928314 Homo sapiens Aldehyde oxidase Proteins 0.000 description 1
- 101000743767 Homo sapiens Coiled-coil domain-containing protein R3HCC1L Proteins 0.000 description 1
- 101000622123 Homo sapiens E-selectin Proteins 0.000 description 1
- 101100121078 Homo sapiens GAL gene Proteins 0.000 description 1
- 101000994375 Homo sapiens Integrin alpha-4 Proteins 0.000 description 1
- 101000935043 Homo sapiens Integrin beta-1 Proteins 0.000 description 1
- 101001018097 Homo sapiens L-selectin Proteins 0.000 description 1
- 101000868279 Homo sapiens Leukocyte surface antigen CD47 Proteins 0.000 description 1
- 101000608935 Homo sapiens Leukosialin Proteins 0.000 description 1
- 101100456320 Homo sapiens NR3C2 gene Proteins 0.000 description 1
- 101000622137 Homo sapiens P-selectin Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 108010091358 Hypoxanthine Phosphoribosyltransferase Proteins 0.000 description 1
- 102100029098 Hypoxanthine-guanine phosphoribosyltransferase Human genes 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 1
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 1
- 102000012745 Immunoglobulin Subunits Human genes 0.000 description 1
- 108010079585 Immunoglobulin Subunits Proteins 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 102100032818 Integrin alpha-4 Human genes 0.000 description 1
- 108010041012 Integrin alpha4 Proteins 0.000 description 1
- 102100025304 Integrin beta-1 Human genes 0.000 description 1
- 102000012355 Integrin beta1 Human genes 0.000 description 1
- 108010022222 Integrin beta1 Proteins 0.000 description 1
- 108010064600 Intercellular Adhesion Molecule-3 Proteins 0.000 description 1
- 102100037872 Intercellular adhesion molecule 2 Human genes 0.000 description 1
- 101710148794 Intercellular adhesion molecule 2 Proteins 0.000 description 1
- 102100037871 Intercellular adhesion molecule 3 Human genes 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 102000010789 Interleukin-2 Receptors Human genes 0.000 description 1
- 108010038453 Interleukin-2 Receptors Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- 108010092694 L-Selectin Proteins 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- 108091026898 Leader sequence (mRNA) Proteins 0.000 description 1
- 241000880493 Leptailurus serval Species 0.000 description 1
- REPPKAMYTOJTFC-DCAQKATOSA-N Leu-Arg-Asp Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(O)=O REPPKAMYTOJTFC-DCAQKATOSA-N 0.000 description 1
- DLFAACQHIRSQGG-CIUDSAMLSA-N Leu-Asp-Asp Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O DLFAACQHIRSQGG-CIUDSAMLSA-N 0.000 description 1
- SBANPBVRHYIMRR-GARJFASQSA-N Leu-Ser-Pro Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CO)C(=O)N1CCC[C@@H]1C(=O)O)N SBANPBVRHYIMRR-GARJFASQSA-N 0.000 description 1
- 102100032913 Leukocyte surface antigen CD47 Human genes 0.000 description 1
- 102100039564 Leukosialin Human genes 0.000 description 1
- GDBQQVLCIARPGH-UHFFFAOYSA-N Leupeptin Natural products CC(C)CC(NC(C)=O)C(=O)NC(CC(C)C)C(=O)NC(C=O)CCCN=C(N)N GDBQQVLCIARPGH-UHFFFAOYSA-N 0.000 description 1
- 102000008072 Lymphokines Human genes 0.000 description 1
- 108010074338 Lymphokines Proteins 0.000 description 1
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 1
- 241001049120 Melanis Species 0.000 description 1
- 102000003792 Metallothionein Human genes 0.000 description 1
- 108090000157 Metallothionein Proteins 0.000 description 1
- 101100261636 Methanothermobacter marburgensis (strain ATCC BAA-927 / DSM 2133 / JCM 14651 / NBRC 100331 / OCM 82 / Marburg) trpB2 gene Proteins 0.000 description 1
- 102000003979 Mineralocorticoid Receptors Human genes 0.000 description 1
- 108090000375 Mineralocorticoid Receptors Proteins 0.000 description 1
- 241000713869 Moloney murine leukemia virus Species 0.000 description 1
- 230000004988 N-glycosylation Effects 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 108091093105 Nuclear DNA Proteins 0.000 description 1
- 239000004677 Nylon Substances 0.000 description 1
- 108700026244 Open Reading Frames Proteins 0.000 description 1
- 229940122060 Ornithine decarboxylase inhibitor Drugs 0.000 description 1
- 108010035766 P-Selectin Proteins 0.000 description 1
- 238000010222 PCR analysis Methods 0.000 description 1
- 101150005926 Pc gene Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 101800004191 Peptide P2 Proteins 0.000 description 1
- BPIMVBKDLSBKIJ-FCLVOEFKSA-N Phe-Thr-Phe Chemical compound C([C@H](N)C(=O)N[C@@H]([C@H](O)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CC=CC=C1 BPIMVBKDLSBKIJ-FCLVOEFKSA-N 0.000 description 1
- 101100124346 Photorhabdus laumondii subsp. laumondii (strain DSM 15139 / CIP 105565 / TT01) hisCD gene Proteins 0.000 description 1
- 241000276498 Pollachius virens Species 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 102000006270 Proton Pumps Human genes 0.000 description 1
- 108091008109 Pseudogenes Proteins 0.000 description 1
- 102000057361 Pseudogenes Human genes 0.000 description 1
- 108091034057 RNA (poly(A)) Proteins 0.000 description 1
- 238000002123 RNA extraction Methods 0.000 description 1
- 239000013614 RNA sample Substances 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 238000010240 RT-PCR analysis Methods 0.000 description 1
- 230000010799 Receptor Interactions Effects 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 208000001647 Renal Insufficiency Diseases 0.000 description 1
- 102000006382 Ribonucleases Human genes 0.000 description 1
- 108010083644 Ribonucleases Proteins 0.000 description 1
- 108010039491 Ricin Proteins 0.000 description 1
- 241000220317 Rosa Species 0.000 description 1
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 1
- 241000714474 Rous sarcoma virus Species 0.000 description 1
- 101100221606 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) COS7 gene Proteins 0.000 description 1
- 241000293869 Salmonella enterica subsp. enterica serovar Typhimurium Species 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- SFTZWNJFZYOLBD-ZDLURKLDSA-N Ser-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CO SFTZWNJFZYOLBD-ZDLURKLDSA-N 0.000 description 1
- AABIBDJHSKIMJK-FXQIFTODSA-N Ser-Ser-Met Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(O)=O AABIBDJHSKIMJK-FXQIFTODSA-N 0.000 description 1
- 241000607715 Serratia marcescens Species 0.000 description 1
- 241000700584 Simplexvirus Species 0.000 description 1
- 108010088160 Staphylococcal Protein A Chemical group 0.000 description 1
- 241000191967 Staphylococcus aureus Species 0.000 description 1
- 108010090804 Streptavidin Chemical group 0.000 description 1
- 229940123155 T cell inhibitor Drugs 0.000 description 1
- 208000037913 T-cell disorder Diseases 0.000 description 1
- 210000000662 T-lymphocyte subset Anatomy 0.000 description 1
- 229940119281 TIRC7 inhibitor Drugs 0.000 description 1
- QJJXYPPXXYFBGM-LFZNUXCKSA-N Tacrolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1\C=C(/C)[C@@H]1[C@H](C)[C@@H](O)CC(=O)[C@H](CC=C)/C=C(C)/C[C@H](C)C[C@H](OC)[C@H]([C@H](C[C@H]2C)OC)O[C@@]2(O)C(=O)C(=O)N2CCCC[C@H]2C(=O)O1 QJJXYPPXXYFBGM-LFZNUXCKSA-N 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 102000006601 Thymidine Kinase Human genes 0.000 description 1
- 108020004440 Thymidine kinase Proteins 0.000 description 1
- ARKBYVBCEOWRNR-UBHSHLNASA-N Trp-Ser-Ser Chemical compound [H]N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O ARKBYVBCEOWRNR-UBHSHLNASA-N 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 101710100170 Unknown protein Proteins 0.000 description 1
- 241000700618 Vaccinia virus Species 0.000 description 1
- UDNYEPLJTRDMEJ-RCOVLWMOSA-N Val-Asn-Gly Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)NCC(=O)O)N UDNYEPLJTRDMEJ-RCOVLWMOSA-N 0.000 description 1
- FOADDSDHGRFUOC-DZKIICNBSA-N Val-Glu-Phe Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)N FOADDSDHGRFUOC-DZKIICNBSA-N 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- NUFNQYOELLVIPL-UHFFFAOYSA-N acifluorfen Chemical compound C1=C([N+]([O-])=O)C(C(=O)O)=CC(OC=2C(=CC(=CC=2)C(F)(F)F)Cl)=C1 NUFNQYOELLVIPL-UHFFFAOYSA-N 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 210000000677 aggregate cell Anatomy 0.000 description 1
- 108010076324 alanyl-glycyl-glycine Proteins 0.000 description 1
- 239000013566 allergen Substances 0.000 description 1
- 229940126575 aminoglycoside Drugs 0.000 description 1
- 238000012870 ammonium sulfate precipitation Methods 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 230000002788 anti-peptide Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 239000000074 antisense oligonucleotide Substances 0.000 description 1
- 238000012230 antisense oligonucleotides Methods 0.000 description 1
- 229960004405 aprotinin Drugs 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 210000001367 artery Anatomy 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 238000011948 assay development Methods 0.000 description 1
- 238000000376 autoradiography Methods 0.000 description 1
- 229960002170 azathioprine Drugs 0.000 description 1
- LMEKQMALGUDUQG-UHFFFAOYSA-N azathioprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC=NC2=C1NC=N2 LMEKQMALGUDUQG-UHFFFAOYSA-N 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- YTCZZXIRLARSET-VJRSQJMHSA-M beraprost sodium Chemical compound [Na+].O([C@H]1C[C@@H](O)[C@@H]([C@@H]21)/C=C/[C@@H](O)C(C)CC#CC)C1=C2C=CC=C1CCCC([O-])=O YTCZZXIRLARSET-VJRSQJMHSA-M 0.000 description 1
- 235000021028 berry Nutrition 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000001851 biosynthetic effect Effects 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 239000002981 blocking agent Substances 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 239000008366 buffered solution Substances 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- BPKIGYQJPYCAOW-FFJTTWKXSA-I calcium;potassium;disodium;(2s)-2-hydroxypropanoate;dichloride;dihydroxide;hydrate Chemical compound O.[OH-].[OH-].[Na+].[Na+].[Cl-].[Cl-].[K+].[Ca+2].C[C@H](O)C([O-])=O BPKIGYQJPYCAOW-FFJTTWKXSA-I 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 238000012219 cassette mutagenesis Methods 0.000 description 1
- 238000000423 cell based assay Methods 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 239000013592 cell lysate Substances 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 230000005754 cellular signaling Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 238000010382 chemical cross-linking Methods 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 238000003501 co-culture Methods 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 238000002967 competitive immunoassay Methods 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 238000004624 confocal microscopy Methods 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 229960002086 dextran Drugs 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 206010013023 diphtheria Diseases 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 238000001378 electrochemiluminescence detection Methods 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 210000002308 embryonic cell Anatomy 0.000 description 1
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 102000013165 exonuclease Human genes 0.000 description 1
- 239000012894 fetal calf serum Substances 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 210000004602 germ cell Anatomy 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 102000018146 globin Human genes 0.000 description 1
- 108060003196 globin Proteins 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 230000003862 health status Effects 0.000 description 1
- 101150113423 hisD gene Proteins 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 238000010562 histological examination Methods 0.000 description 1
- 210000003917 human chromosome Anatomy 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 230000003100 immobilizing effect Effects 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000003053 immunization Effects 0.000 description 1
- 238000002649 immunization Methods 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 229940125721 immunosuppressive agent Drugs 0.000 description 1
- 229940124589 immunosuppressive drug Drugs 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 238000007901 in situ hybridization Methods 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- ZPNFWUPYTFPOJU-LPYSRVMUSA-N iniprol Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@H]2CSSC[C@H]3C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(N[C@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC=4C=CC=CC=4)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC=4C=CC=CC=4)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC2=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]2N(CCC2)C(=O)[C@@H](N)CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N2[C@@H](CCC2)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)N3)C(=O)NCC(=O)NCC(=O)N[C@@H](C)C(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H](C(=O)N1)C(C)C)[C@@H](C)O)[C@@H](C)CC)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 ZPNFWUPYTFPOJU-LPYSRVMUSA-N 0.000 description 1
- 238000013383 initial experiment Methods 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 230000004073 interleukin-2 production Effects 0.000 description 1
- 108040006849 interleukin-2 receptor activity proteins Proteins 0.000 description 1
- 230000017307 interleukin-4 production Effects 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- SZVJSHCCFOBDDC-UHFFFAOYSA-N iron(II,III) oxide Inorganic materials O=[Fe]O[Fe]O[Fe]=O SZVJSHCCFOBDDC-UHFFFAOYSA-N 0.000 description 1
- 230000000302 ischemic effect Effects 0.000 description 1
- 201000006370 kidney failure Diseases 0.000 description 1
- 101150066555 lacZ gene Proteins 0.000 description 1
- 238000011031 large-scale manufacturing process Methods 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 230000023404 leukocyte cell-cell adhesion Effects 0.000 description 1
- 230000021633 leukocyte mediated immunity Effects 0.000 description 1
- GDBQQVLCIARPGH-ULQDDVLXSA-N leupeptin Chemical compound CC(C)C[C@H](NC(C)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C=O)CCCN=C(N)N GDBQQVLCIARPGH-ULQDDVLXSA-N 0.000 description 1
- 108010052968 leupeptin Proteins 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 239000002932 luster Substances 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 230000003228 microsomal effect Effects 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 229950007856 mofetil Drugs 0.000 description 1
- 210000005087 mononuclear cell Anatomy 0.000 description 1
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 1
- 229960000951 mycophenolic acid Drugs 0.000 description 1
- 230000017074 necrotic cell death Effects 0.000 description 1
- 230000001338 necrotic effect Effects 0.000 description 1
- 230000007896 negative regulation of T cell activation Effects 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- 231100000957 no side effect Toxicity 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 230000036963 noncompetitive effect Effects 0.000 description 1
- 239000000346 nonvolatile oil Substances 0.000 description 1
- 230000005937 nuclear translocation Effects 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 239000002818 ornithine decarboxylase inhibitor Substances 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000007310 pathophysiology Effects 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 210000001322 periplasm Anatomy 0.000 description 1
- 102000013415 peroxidase activity proteins Human genes 0.000 description 1
- 108040007629 peroxidase activity proteins Proteins 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 108010024607 phenylalanylalanine Proteins 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000004800 polyvinyl chloride Substances 0.000 description 1
- 229920000915 polyvinyl chloride Polymers 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 230000023603 positive regulation of transcription initiation, DNA-dependent Effects 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- AAEVYOVXGOFMJO-UHFFFAOYSA-N prometryn Chemical compound CSC1=NC(NC(C)C)=NC(NC(C)C)=N1 AAEVYOVXGOFMJO-UHFFFAOYSA-N 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- 108010045647 puromycin N-acetyltransferase Proteins 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 238000003259 recombinant expression Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 230000000284 resting effect Effects 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 238000007894 restriction fragment length polymorphism technique Methods 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 239000007320 rich medium Substances 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 239000006152 selective media Substances 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 208000017520 skin disease Diseases 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 239000008279 sol Substances 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 210000004989 spleen cell Anatomy 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 238000003153 stable transfection Methods 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 238000011287 therapeutic dose Methods 0.000 description 1
- 150000007970 thio esters Chemical class 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 239000003440 toxic substance Substances 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 238000003151 transfection method Methods 0.000 description 1
- 230000001131 transforming effect Effects 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 238000003146 transient transfection Methods 0.000 description 1
- 230000014599 transmission of virus Effects 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- GPRLSGONYQIRFK-MNYXATJNSA-N triton Chemical compound [3H+] GPRLSGONYQIRFK-MNYXATJNSA-N 0.000 description 1
- 101150081616 trpB gene Proteins 0.000 description 1
- 101150111232 trpB-1 gene Proteins 0.000 description 1
- 230000009452 underexpressoin Effects 0.000 description 1
- 241001515965 unidentified phage Species 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 238000001086 yeast two-hybrid system Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Biophysics (AREA)
- Gastroenterology & Hepatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Cell Biology (AREA)
- Toxicology (AREA)
- Zoology (AREA)
- Pulmonology (AREA)
- Oncology (AREA)
- Transplantation (AREA)
- Communicable Diseases (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Description
発明の分野
本発明は、全般的に、新規T-細胞膜貫通蛋白質をコードするT細胞免疫応答cDNA 7(TIRC7)と共に、それに由来するペプチドおよびポリペプチド、ならびに該ポリペプチドを認識する抗体に関する。第一の局面において、本発明はTIRC7 cDNAおよびそのコードされる蛋白質に関する。さらなる局面において、本発明はT細胞膜蛋白質(TIRC7)を通じてT細胞刺激を阻害することができるペプチドまたはポリペプチドをコードするTIRC7 cDNAに由来するポリヌクレオチドに関する。さらに、本発明はそのようなポリペプチドを含むベクターおよびそれによって形質転換した宿主細胞と共に、上記で定義したペプチドまたはポリペプチドの産生にそれらを使用することに関する。さらに、本発明は該ポリヌクレオチドによってコードされる、または本発明の方法によって得ることができる(ポリ)ペプチドに関する。もう一つの重要な局面において、本発明は、T-細胞膜蛋白質(TIRC7)を通じてT-細胞刺激を阻害することができるペプチドおよびポリペプチドに対する抗体に関する。本発明はさらに、前記ペプチド、ポリペプチド、または抗体を含む薬学的および診断的組成物に関する。さらに、本発明は、新規TIRC膜蛋白質を通じて免疫応答を調節する方法およびその使用と共に、TIRC7膜蛋白質またはそのリガンドに作用する物質を含む薬学的組成物に関する。同様に、本発明は、臓器移植において用いられる、自己免疫、アレルギーもしくは感染疾患の治療のための、または腫瘍を治療するための薬学的組成物を調製するために、先に記述したポリヌクレオチド、ベクター、ペプチド、ポリペプチド、または抗体を使用することに関する。さらに、本発明は(抗原特異的)T細胞不応性を調節する方法に関する。本発明は、新規TIRC7膜蛋白質を通じて(不応性)T細胞を阻害または刺激することによってT細胞不応性を誘導、維持、または逆転する方法を含む。
【0002】
いくつかの書類を本明細書の本文において引用する。本明細書において引用した書類のそれぞれ(製造元の仕様書、説明書等を含む)は、本明細書において参照として組み入れられる;しかし、引用した如何なる書類も実際に本発明の先行技術であると認めているわけではない。
【0003】
発明の背景
T細胞活性化は、多数のシグナル伝達経路および遺伝子発現の連続的な変化を含む一連のプロセスであり、その結果T細胞は明確な亜集団、すなわちTh1およびTh2に分化し、それらはサイトカイン産生パターンによって識別され、細胞性免疫応答様式の特徴となる(アッバス(Abbas)ら、1996;クラブツリー(Crabtree)、1989)。T細胞反応は抗原特異的T細胞受容体(TCR)と、抗原提示細胞(APC)の表面上の腫瘍組織適合抗原複合体(MHC)分子によって示されるペプチドとの相互作用によって始まる。さらなるシグナルは、集合的に共刺激シグナルと呼ばれる(ペレス(Perez)ら、1997)CD28/CTLA4およびB7、CD40/CD40L、LFA-1ならびにICAM-1のような多くの膜蛋白質(レンショウ(Lenschow)ら、1996;リンスレー&レッドベター(Linsley and Ledbetter)、1993;ユ(Xu)ら、1994;バックマン(Bachmann)ら、1997;シュワルツ(Schwartz)、1992)によって媒介される受容体・リガンド相互作用のネットワークによって提供される。これらの膜蛋白質は、異なる方法でT細胞活性化を変化させることができ(バックマン(Bachmann)、1997)、これらの分子によって提供される陽性および陰性シグナルを組み込むことによって免疫応答を調節する(ブルーストーン(Bluestone)、1995;ペレス(Perez)ら、1997)。細胞性免疫応答を調節するために有効な物質の多くは、T細胞受容体(コシミ(Cosimi)ら、1981)を妨害する、共刺激シグナル伝達を遮断する(ラーセン(Larsen)ら、1996;ブレーザー(Blazar)ら、1996;カーク(Kirk)ら、1997;リンスレー(Linsley)ら、1992;トゥルカ(Turka)ら、1992)、またはこれらの主要な細胞膜誘因物質から下流の細胞内活性化シグナルを阻害する(シュライバー&クラブツリー(Schreiber and Crabtree)、1992)かのいずれかである。臓器移植および自己免疫疾患におけるT細胞活性化の治療的予防は現在、下流の細胞内事象を阻害する全免疫抑制薬に依存している。T細胞応答を特異的に調節することは免疫学的研究における積年の目標となっている。
【0004】
発明の概要
本発明は新規T細胞膜蛋白質をコードするポリヌクレオチドに関する。さらに、本発明はそれに由来するペプチドおよびポリペプチドと共に、新規T細胞膜蛋白質を通じてT細胞刺激を阻害することができる抗体に関する。より詳しく述べると、本発明は、本発明のポリヌクレオチド、ペプチド、(ポリ)ペプチド、および抗体から直接発生する医学分野での応用に関する。さらに、本発明はT細胞増殖の活性化物質および阻害物質を調べる新規方法に関する。本発明の薬学的組成物、方法および使用は、(抗原特異的)免疫応答を調節する、例えば(抗原特異的)T細胞不応性を誘導および維持するまたは(抗原特異的)T細胞反応性を回復することが望ましい場合に治療的に有用である。例えば、TIRC7膜蛋白質を通じて刺激を阻害することによって移植片の拒絶を予防するために、臓器または骨髄移植を受けた被験者にT細胞不応性を誘導するまたは維持することが必要となるかも知れない。さらに、自己免疫疾患を有する被験者では、自己免疫疾患の症状を緩和するために、TIRC7刺激を遮断することによってT細胞不応性を維持することができる。これらの症例では、T細胞不応性を維持するために十分な量および期間にわたって、TIRC7阻害物質を被験者に投与する。または、腫瘍を有する被験者では腫瘍特異的T細胞反応を刺激するため、またはワクチンを接種する被験者ではワクチンの有効性を増強するために、T細胞不応性を逆転させることができる。例えば、細胞(例えば、腫瘍細胞)は、TIRC7リガンドを発現するよう改変することができ、または腫瘍を有する被験者もしくは腫瘍の再発を予防するために腫瘍を外科的に切除した被験者に、TIRC7刺激物質を投与することができる。さらに、TIRC7を通じてT細胞を刺激することによって、インビトロでアネルギー状態のT細胞の抗原特異的反応性を回復することができる。次に、インビトロで産生された反応性T細胞を被験者に投与することができる。
【0005】
発明の詳細な説明
ヒトの免疫応答に関連した疾患の治療に対する治療的手段が必要であるという観点から、本発明の技術的問題は、臓器移植および自己免疫疾患において特に有用であるT細胞反応を調節する手段および方法を提供することである。
【0006】
この技術的問題に対する解決は、請求の範囲に特徴を示す態様を提供すること、すなわちインビトロおよびインビボにおいてT細胞活性化に中心的な役割を果たす、T細胞免疫応答cDNA7(TIRC7)によってコードされる新規T細胞膜蛋白質について記述することによって達成される。TIRC7 mRNAはカルシニューリン依存的経路を通じてT細胞活性化の初期相において一過性にアップレギュレートされている。
【0007】
第一の実験において、cDNAをコードするTIRC7蛋白質をクローニングして特徴付けを行った;実施例1の最初の部分および図1を参照のこと。さらに、該cDNAのインビトロ翻訳を行い、インビトロで翻訳されたTIRC7蛋白質に関して行ったMLR阻害試験において得られた予備的結果から、該蛋白質に免疫抑制能が存在する可能性があることが示唆された。図5Bと共に実施例2を参照のこと。
【0008】
本発明に従って実施した第二の(異なる)実験では(実施例2〜4)、意外にも、特異的抗TIRC7膜蛋白質抗体によってTIRC7膜蛋白質媒介シグナルをインビトロで調節すると、外因性IL-2によって逆転可能なT細胞増殖およびIL-2分泌を効率よく防止することが判明した。抗TIRC7膜蛋白質抗体はTh1サブセット特異的サイトカイン発現を特異的に阻害するが、Th2サイトカイン発現には影響を及ぼさない。ラットにこの抗体を投与すると、腎同種異系移植片の定着を有意に延長する。本発明に従って得られた後者の結果は、T細胞活性化の初期事象にTIRC膜蛋白質が本質的な役割を担っている証拠となる。このように、TIRC7膜蛋白質のターゲティングおよびそのコードする遺伝子は免疫応答の調節に関する新規治療的アプローチを提供する。
【0009】
したがって、本発明は、以下からなる群より選択されるDNA配列を含む、TIRC7膜蛋白質をコードするポリヌクレオチド、またはその生物活性断片に関する:
(i)配列番号:2または配列番号:13のアミノ酸1位〜614位またはアミノ酸1〜601位に示されるアミノ酸配列をコードするヌクレオチド配列を含むDNA配列;
(ii)配列番号:1または配列番号:12に示すヌクレオチド配列を含むDNA配列;
(iii)(i)または(ii)のDNA配列によってコードされる蛋白質の断片または誘導体をコードするヌクレオチド配列を含むDNA配列;および
(iv)その相補鎖が(i)〜(iii)のいずれか1つに定義されるポリヌクレオチドとハイブリダイズする、および少なくとも70%同一であるDNA配列。
【0010】
本発明に従って用いられる「TIRC7膜蛋白質」という用語は、T細胞活性化のシグナル伝達および/または増殖に関係し、好ましくは可溶型でリンパ球混合培養におけるアロ活性化に反応して、または培養に外から加えられたマイトゲンに反応して、T細胞増殖を阻害または抑制することができる蛋白質を指す。本発明の範囲内で行われた試験から、インビトロで翻訳された可溶性のTIRC7蛋白質は、リンパ球混合培養におけるアロ活性化に反応して、またはマイトゲンに反応してT細胞の増殖を用量依存的に有効に抑制できることが判明した;実施例2、図5B参照。
【0011】
「その生物学的に活性な断片」という用語はTIRC7膜蛋白質に由来し、上記のようにT細胞増殖を阻害することができるペプチドおよびポリペプチドを指す。
【0012】
これまで、cDNA断片は、逆転写示差表示ポリメラーゼ連鎖反応(DDRT-PCR)技法によって、リンパ球混合培養(MLC)において刺激された細胞のRNAから増幅していた。このようにして得られた350塩基対(bp)cDNA断片のアミノ酸配列は、そのアミノ酸配列がラットおよびウシ小胞(H+)-ATPアーゼプロトンポンプとそれぞれ実質的な相同性を有するために、アロ活性化リンパ球において示差的に発現された新規ヒト(H+)-ATPアーゼプロトンポンプ相同体に属すると報告された。分子の機能は不明であるが、それがマウスT細胞由来免疫抑制蛋白質(J6B7、リー(Lee)、Molecular Immunology 27(1990)、1137〜1144)と相同性を示すことから、対応する遺伝子が免疫調節に関係していることを示唆するという推測もなされた。活性化ヒトT細胞のライブラリから350塩基対のcDNA断片によって完全長のcDNAクローンを単離した。しかし、新たにクローニングされたcDNAのアミノ酸配列からは、コードされる蛋白質の推定機能に対してさらなる洞察は得られなかったが、350 bp断片およびそれがコードするインビトロで翻訳された蛋白質におそらく対応する遺伝子の発現パターンに関する最初の実験がいくつか報告され、推測が得られた。さらに、350 bp断片または完全長のcDNAのいずれかの助けを借りてマウス相同体をクローニングする試みは失敗に終わった。
【0013】
その後の研究により、刺激されたTリンパ球のRNAのDDRT-PCRによって同定されたcDNA断片は膜貫通領域に対応することが判明した。このように、そのような膜貫通領域の構造およびアミノ酸配列は保存されることから、完全長のcDNAクローンがDDRT-PCRによって同定される断片とは実際に対応しないことを否定できない。例えば、350 bpの断片によってコードされる膜貫通領域のアミノ酸配列とTIRC7蛋白質のアミノ酸配列を比較するとアミノ酸5個が異なる。さらに、ヒトリンパ球RNAのDDRT-PCR分析では、その発現がアロ活性化によって変化するいくつかの遺伝子が同定されたため、類似の構造および/機能を有する(多)遺伝子ファミリーが存在して、実際に上記技法によって同定されたのはそれらの遺伝子メンバーの1個から数個に過ぎない可能性がある。したがって、上記の予備試験結果とこれまで発見されていないこの未知蛋白質の実際の生物機能との関連は全く不明であった。
【0014】
予備試験結果は、リー(Lee)、Biochem. Biophys. Res. Communications 218(1996)、813〜821の最近の論文を見るとますます疑問が強まった、というのも彼らはヒト破骨細胞特異的116 kDaプロトンポンプサブユニットのクローニングおよび特徴付けを行って、そのcDNAが活性化T細胞からクローニングされた遺伝子のそれと実質的に同じであるヌクレオチドおよびアミノ酸配列を含むことを報告したためである。このように、これまでの結果は、人為的誤差の反映であるか、および/または上記のリー(Lee)らが記述した遺伝子の偽遺伝子活性によって得られたかのように思われる。
【0015】
本発明に従って、配列番号:1に示すコード領域のヌクレオチド配列を有するポリヌクレオチドは、分子量75 kDaのアミノ酸614個(配列番号:2)の蛋白質をコードしていることが同定された。本発明に従って実施した実験から、TIRC7膜蛋白質が胸腺、骨髄および胎児肝では発現は低いものの全てのリンパ様組織において発現され、T細胞受容体の刺激後のリンパ球では一過性にアップレギュレートされていることが判明した;実施例1、図3参照。TIRC7コード遺伝子は、蛍光インサイチューハイブリダイゼーション(FISH)法を用いて、白血病に関連したbcl-遺伝子の区切り領域に近接するヒト第10染色体長腕(13.4〜13.5q)上に存在している。TIRC7膜蛋白質は細胞膜に広く発現されており、外部リガンドの標的であることと一致する;実施例1、図4参照。膜貫通ドメイン構造が7個であることから、3個の細胞外ループおよび細胞外方向にカルボキシ末端が存在すると予想される;図2参照。
【0016】
これらのことから、配列番号:1に示すヌクレオチド配列は新規クラスのT細胞膜蛋白質をコードすることは明らかである。このヌクレオチド配列を提供することによって、他の種または生体からのTIRC7の生物活性を有する蛋白質をコードする同一または類似のポリヌクレオチドの単離が可能となる。そのような関連配列を同定および単離するための十分に確立されたアプローチは、例えば、開示された配列の全体もしくは一部をプローブとして用いるゲノムもしくはcDNAライブラリからの単離、または特異的プライマーを用いたポリメラーゼ連鎖反応による対応するポリヌクレオチドの増幅である。本発明に従って、TIRC7膜蛋白質をコードするさらなるポリヌクレオチドは、配列番号:1のコード配列を含む核酸分子をプローブとして用いて単離された。配列番号:13のアミノ酸配列を有する蛋白質をコードするポリヌクレオチドのヌクレオチド配列を配列番号:12に示す。該TIRC7膜蛋白質のヌクレオチドおよびアミノ酸配列は、配列番号;1によってコードされるTIRC7膜蛋白質と、アミノ酸121位(アルギニン→グリシン)を除いて実質的に同一であり、したがって、おそらく対立遺伝子変種を表している。
【0017】
このように、本発明はまた、それらが上記のTIRC7膜蛋白質をコードする限り、上記ポリヌクレオチドとハイブリダイズするがこれらの配列と比較すると1個以上の位置が異なるポリヌクレオチドにも関する。そのような分子は、上記ポリヌクレオチドと比較して、例えば、欠失、挿入、変化または当技術分野において既知のその他の改変によって変化している分子を単独または併用して含む。本発明のポリヌクレオチドにおいてそのような改変を導入する方法は、当業者に周知である;例えば、サムブルック(Sambrook)ら、(「分子のクローニング:実験マニュアル(Molecular Cloning ;A Laboratory Manual)」、第二版、コールド・スプリング・ハーバー研究所出版、コールド・スプリング・ハーバー、ニューヨーク州(1989))を参照のこと。本発明はまた、そのヌクレオチド配列が遺伝子コードの縮重のために上記ポリヌクレオチドのヌクレオチド配列とは異なるポリヌクレオチドに関する。
【0018】
上記の(iv)において特徴付けがなされたDNA配列に関して、本文における「ハイブリダイズ」という用語は、従来のハイブリダイゼーション条件、好ましくはハイブリダイゼーション温度が37℃以上であり、洗浄温度が0.1×SSC/0.1%SDS中で55℃以上である、50%ホルムアミド/6×SSC/0.1%SDS/100 μg/ml ssDNAにおけるハイブリダイゼーションを指すと理解される。より好ましくは「ハイブリダイズする」という用語は、ストリンジェントなハイブリダイゼーション条件、例えば上記のサムブルック(Sambrook)らが記述したような条件を指す。
【0019】
特に好ましいのは、上記ポリヌクレオチドの1つと70%、好ましくは少なくとも85%、より好ましくは90〜95%および最も好ましくは96〜99%の配列同一性を有し、しかも同じ生物活性を有するポリヌクレオチドである。そのようなポリヌクレオチドはまた、例えばヌクレオチド欠失(複数)、挿入(複数)、置換(複数)、付加(複数)および/または組換えおよび/または当技術分野で既知の他の何らかの改変(複数)を単独でまたは組み合わせることによって、上記ポリヌクレオチドと比較して変化しているポリヌクレオチドを含む。そのような改変を本発明のポリヌクレオチドのヌクレオチド配列に導入する方法は、当技術分野において周知である。このように、本発明は、遺伝子操作によって上記のポリヌクレオチドに由来することができる、および発現時にTIRC7膜蛋白質またはその生物学的活性断片をコードするポリヌクレオチドを含む。
【0020】
調節配列を本発明のポリヌクレオチドに加えてもよいことも当業者に直ちに明白である。例えばプロモーター、転写エンハンサーおよび/または本発明のポリヌクレオチドを発現させる配列を用いてもよい。適した誘導系は例えば、ゴッセン&ブヤール(Gossen and Bujard)(Proc. Natl. Acad. Sci. USA 89(1992)、5547〜5551)およびゴッセン(Gossen)ら(Trends Biotech. 12(1994)、58〜62)によって記述されるテトラサイクリン調節遺伝子発現である。
【0021】
さらなる態様において、本発明は上記のポリヌクレオチドまたはその相補鎖と特異的にハイブリダイズする長さが少なくとも15ヌクレオチドである核酸分子に関する。特異的なハイブリダイゼーションは好ましくはストリンジェントな条件下で起こり、蛋白質をコードしない、または実質的に異なる蛋白質をコードするヌクレオチド配列とは全くまたはほとんど交叉ハイブリダイゼーションがないことを意味する。そのような核酸分子はプローブとしておよび/または遺伝子発現を制御するために用いてもよい。核酸プローブ技術は当業者に周知であり、当業者はそのようなプローブの長さが変化してもよいことを容易に認識するであろう。長さが17〜35ヌクレオチドの核酸プローブが好ましい。当然、長さが最大で100ヌクレオチド以上の核酸を用いることが適当である場合もある。本発明の核酸プローブは様々な応用に有用である。一方でそれらは本発明のポリヌクレオチドを増幅するためのPCRプライマーとして用いてもよい。もう一つの応用はゲノムDNAライブラリの相同性スクリーニングによって本発明のポリヌクレオチドとハイブリダイズするポリヌクレオチドを同定するために、ハイブリダイゼーションプローブとして用いることである。本発明のこの好ましい態様に従う上記のポリヌクレオチドと相補的である核酸分子はまた、例えばアンチセンスまたは3重らせん効果によりそのようなポリヌクレオチドを含む遺伝子の発現を抑制するために、または本発明のポリヌクレオチドを含む遺伝子の(プレ)mRNAを特異的に切断する適当なリボザイム(例えば、欧州特許B1 0 291 533号、欧州特許A1 0 321 201号、欧州特許A2 0 360 257号)を構築するために用いてもよい。適当な標的部位および対応するリボザイムの選択は例えば、スタイネッケ(Steinecke)の「リボザイム、細胞生物学における方法(Ribozyme, Methods in Cell Biology)」50、ガルブレイス(Galbraith)ら編、アカデミックプレスインク、(1995)、449〜460に記載のように行うことができる。アンチセンス技術に関する標準的な方法はもまた記述されている(メラニ(Melani)、Cancer Res. 51(1991)、2897〜2901)。さらに当業者は、生体に由来する試料中での本発明のポリヌクレオチドの有無を検出する場合のような、特定の応用のために適当なマーカーでそのような核酸プローブを標識することが可能であることを承知している。
【0022】
上記核酸分子はDNAまたはRNAまたはそのハイブリッドのいずれかであってもよい。さらに、核酸分子は例えば、チオエステル結合および/またはオリゴヌクレオチドアンチセンスアプローチにおいて一般的に用いられるヌクレオチド類似体を含んでもよい。そのような改変は核酸分子を細胞内のエンドおよび/またはエキソヌクレアーゼに対して安定にするために有用である。核酸分子は、細胞内に該核酸分子の転写を可能にするキメラ遺伝子を含む適当なベクターによって転写してもよい。そのような核酸分子はさらに、上記のリボザイム配列を含んでもよい。
【0023】
この局面において、本発明のポリヌクレオチドは、変異遺伝子を回復するために、または相同組換えを通じて変異遺伝子を作製するために、「遺伝子ターゲティング」および/または「遺伝子置換」のために用いることができる;例えば、モウエリック(Mouellic)、Proc. Natl. Acad. Sci. USA 87(1990)、4712〜4716;ジョイナー(Joyner)、「遺伝子のターゲティング、実際のアプローチ(Gene Targeting, A Practical Approach)」、オックスフォード大学出版を参照のこと。
【0024】
好ましい態様において、上記核酸分子は標識される。核酸の検出法は当技術分野において周知であり、例えば、サザンおよびノザンブロッティング、PCRまたはプライマー伸長等である。もう一つの好ましい態様において、核酸分子はTIRC7発現を抑制するために用いてもよい。
【0025】
上記TIRC膜蛋白質またはその生物学的活性断片をコードする本発明のポリヌクレオチドは、例えば、DNA、cDNA、RNAまたは合成されたDNAもしくはRNAまたはこれらのポリヌクレオチドのいかなるものも単独または組み合わせて含む組換え的に産生されたキメラ核酸分子であってもよい。好ましくは、ポリヌクレオチドはベクターの一部である。そのようなベクターはさらに、適した宿主細胞においておよび適した条件下で該ベクターが選択されるマーカー遺伝子のような遺伝子を含む。好ましくは本発明のポリヌクレオチドは、原核または真核細胞において発現を可能にする発現制御配列と機能的に結合している。ポリヌクレオチドの発現は、翻訳可能mRNAへのポリヌクレオチドの転写を含む。真核生物、好ましくは哺乳類細胞において発現を確実にする調節エレメントは、当技術分野で周知である。それらは通常、転写の開始を確実にする調節配列および選択的に転写の終了および転写物の安定化を確実にするポリAシグナルを含む。さらなる調節エレメントは、転写と共に翻訳エンハンサー、および/または天然に関連するまたは異種プロモーター領域を含んでもよい。原核宿主細胞において発現させる可能性がある調節エレメントは、例えば大腸菌におけるPL、lac、trp、またはtacプロモーターを含み、真核宿主細胞において発現させる調節エレメントの例は、酵母におけるAOX1もしくはGAL1プロモーター、またはCMV-、SV40-、RSV-プロモーター(ラウス肉腫ウイルス)、CMV-エンハンサー、SV40-エンハンサーまたは哺乳類およびその他の動物細胞におけるグロビンイントロンである。転写開始の責を負うエレメントのほかに、そのような調節エレメントはまた、SV40-ポリA部位またはtk-ポリA部位のような転写終了シグナルをポリヌクレオチドの下流に含んでもよい。さらに、用いる発現系に応じて、ポリペプチドを細胞内成分に向ける、またはそれを培地中に分泌させることができるリーダー配列を本発明のポリヌクレオチドのコード配列に加えてもよく、それらは当技術分野において周知である。リーダー配列(単数および複数)は翻訳、開始および終了配列と適当な段階で集合し、好ましくはリーダー配列は翻訳された蛋白質またはその一部をペリプラスム間隙または細胞外培地に分泌させることができる。選択的に、異種配列は、所望の特徴、例えば発現された組換え産物の安定化または精製の単純化、を付与するC-またはN-末端同定ペプチドを含む融合蛋白質をコードすることができる。この意味において、オカヤマ・ベルグ(Okayama-Berg)cDNA発現ベクターpcDV1(ファルマシア)、pCDM8、pRc/CMV、pcDNA1、pcDNA3(インビトロゲン)、またはpSPORT1(ギブコBRL)のような適した発現ベクターが当技術分野において既知である。
【0026】
好ましくは発現制御配列は、真核宿主細胞を形質転換またはトランスフェクトすることができるベクターにおける真核生物プロモーター系であるが、原核宿主に対する制御配列を用いてもよい。ベクターが適当な宿主に組み入れられれば、宿主をヌクレオチド配列の高レベル発現に適した条件下で維持して、望ましければ本発明の蛋白質の回収および精製をその後に行う;例えば添付の請求の範囲参照。
【0027】
上記に従って、本発明はベクター、特に遺伝子操作において従来的に用いられ、本発明のポリヌクレオチドを含むプラスミド、コスミド、ウイルスおよびバクテリオファージに関する。当業者に周知の方法を用いて、組換えベクターを構築することができる;例えば、サムブルック(Sambrook)ら、(「分子のクローニング:実験マニュアル(Molecular Cloning ;A Laboratory Manual)」、コールド・スプリング・ハーバー研究所(1989)、ニューヨーク州、およびアウスユベール(Ausubel)の「分子生物学の現行プロトコール(Current Protocols in Molecular Biology)」、グリーン・パブリッシングアソシエーツ&ウィリーインターサイエンス、ニューヨーク(1989))に記載の技術を参照のこと。または、本発明のポリヌクレオチドおよびベクターは標的細胞に輸送するためにリポソームに再構成することができる。本発明のポリヌクレオチドを含むベクターは周知の技法によって宿主細胞に移すことができ、これは細胞宿主のタイプによって異なる。例えば、塩化カルシウムトランスフェクションは原核細胞に一般的に用いられるが、リン酸カルシウム処置または電気穿孔は他の細胞宿主に用いてもよい;例えば、上記のサムブルック(Sambrook)を参照のこと。
【0028】
なおさらなる態様において、本発明は上記のポリヌクレオチドまたはベクターを含む細胞に関する。好ましくは細胞は真核細胞であり、最も好ましくは蛋白質の治療的利用が予見される場合には哺乳類細胞である。当然、酵母およびあまり好ましくない原核生物、例えば細菌細胞も、特に産生された蛋白質を診断手段として用いる場合には有用となる可能性がある。
【0029】
宿主細胞に存在する本発明のポリヌクレオチドまたはベクターは、宿主細胞のゲノムに組み入れられるか、または染色体外で維持してもよい。
【0030】
「原核生物」という用語は本発明の蛋白質の発現に関してDNAまたはRNA分子で形質転換またはトランスフェクトすることができる全ての細菌を含むことを意味する。原核宿主には、例えば大腸菌、ネズミチフス菌(S. typhimurium)、セラチア・マルッセンス(Serratia marcescens)、および枯草菌(Bacillus subtillis)のようなグラム陰性菌と共にグラム陽性菌が含まれる。「真核生物」という用語は酵母、高等植物、昆虫および好ましくは哺乳類細胞を含むことを意味する。組換え産生技法において用いる宿主に応じて、本発明のポリヌクレオチドによってコードされる蛋白質はグリコシル化されていても、グリコシル化されていなくてもよい。本発明のTIRC7蛋白質はまた、最初のメチオニンアミノ酸残基を含んでもよい。本発明のポリヌクレオチドは、当業者に一般的に既知の技法のいずれかを用いて宿主を形質転換またはトランスフェクトすることができる。さらに、融合した、機能的結合した遺伝子を調製してそれらを例えば哺乳類細胞および細菌細胞に発現させる方法は当技術分野において周知である(サムブルック(Sambrook)ら、(「分子のクローニング:実験マニュアル(Molecular Cloning ;A Laboratory Manual)」、コールド・スプリング・ハーバー研究所、コールド・スプリング・ハーバー、ニューヨーク州(1989))。その出版物に記載された遺伝子構築物および方法は、本発明のTIRC7蛋白質の真核または原核宿主における発現のために利用することができる。一般に、挿入されたポリペプチドの効率的な転写を促進するプロモーター配列を含む発現ベクターは宿主と関連して用いられる。発現ベクターは典型的に複製起点、プロモーター、およびターミネーターと共に、形質転換した細胞の表現型選択を提供することができる特定の遺伝子を含む。さらに、本発明の細胞を含むトランスジェニック動物、好ましくは哺乳類を本発明のTIRC7蛋白質の大規模産生のために用いてもよい。
【0031】
または、動物、好ましくは本来本発明のポリヌクレオチドがそのゲノムに存在する哺乳類細胞を用いて、該細胞が異種プロモーターの制御下で本発明のポリヌクレオチドに対応する内因性遺伝子を発現するように改変することができる。本発明のポリヌクレオチドの発現を本来制御しない異種プロモーターの導入は標準的な方法に従って行うことができ、上記を参照のこと。適したプロモーターには先に言及したプロモーターが含まれる。
【0032】
このように、さらなる態様において、本発明は以下を含むTIRC7膜蛋白質またはその生物活性断片を製造する方法を含む:
(a)蛋白質を発現させる条件下で本発明の宿主を培養する段階;または
(b)本発明のポリヌクレオチドのインビトロ翻訳;
および(a)または(b)において産生された蛋白質を回収する段階。
【0033】
形質転換した宿主は発酵器内で増殖させて、当技術分野で既知の技法に従って最適な細胞増殖が得られるように培養する。次に、本発明のTIRC7蛋白質を、増殖培地、細胞溶解物、または細胞膜分画から単離することができる。本発明の蛋白質は、発現されれば、硫酸アンモニウム沈殿、アフィニティカラム、カラムクロマトグラフィー、ゲル電気泳動等を含む当技術分野で標準的な技法に従って精製することができる;スコープス(Scopes)、「蛋白質の精製(Protein Purification)」、スプリンガー・バーラグ、ニューヨーク州(1982)を参照のこと。薬学的に利用するためには、少なくとも約90〜95%の均一性を有する実質的に純粋な蛋白質が好ましく、98〜99%以上の均一性が最も好ましい。望ましいように部分的にまたは均一になるまで精製すれば、次に蛋白質を治療的に(体外を含む)、またはアッセイ法の開発および実施に用いてもよい。
【0034】
したがって、なおさらなる態様において、本発明は本発明のポリヌクレオチドによってコードされた、または上記の方法によって産生されたTIRC7膜蛋白質またはその生物活性断片に関する。本発明の蛋白質はさらに、例えば薬剤のターゲティングおよび撮像応用のために上記のような他の部分とカップリングさせることができる。そのようなカップリングは、蛋白質の発現後に結合部位に化学的に行ってもよく、またはカップリング産物をDNAレベルで本発明の蛋白質の中に組み入れられるように操作してもよい。次にDNAを適した宿主系において発現させ、発現した蛋白質を回収して、必要であれば復元する。さらに、本発明のTIRC7蛋白質の提供によって、TIRC7特異的抗体の産生が可能となる。この点において、ハイブリドーマ技術によって、免疫応答を産生する本質的に如何なる所望の物質に対する抗体も産生する細胞株の産生が可能となる。次に免疫グロブリンの軽鎖および重鎖をコードするRNAをハイブリドーマの細胞質から得ることができる。mRNAの5'末端部分を用いて、発現ベクターに挿入するcDNAを調製することができる。その後、抗体またはその免疫グロブリン鎖をコードするDNAを細胞、好ましくは哺乳類細胞に発現させることができる。
【0035】
宿主細胞に応じて、抗体の適当な立体配座を得るために復元技術を必要とすることがある。必要であれば、従来のカセット変異誘発または本明細書に開示するようなその他の蛋白質操作方法論を用いて、結合を最適にするための点置換をDNAに行ってもよい。
【0036】
このように、本発明はまた、本発明のペプチド、またはポリペプチドを特異的に認識する抗体にも関する。
【0037】
なおさらなる態様において、本発明は本発明のTIRC7蛋白質または抗体を発現するよう改変された細胞に関する。この態様は、例えば抗原に対するT細胞反応性を回復させるため、特にT細胞増殖を刺激することができる本発明の抗体が細胞表面上での提示に適した形状で発現される場合に、特に適している。
【0038】
その上、本発明は、TIRC7膜蛋白質を通じてT細胞刺激を阻害することができる、および/または上記のポリヌクレオチドの断片によってコードされるTIRC膜蛋白質を通じてT細胞刺激を阻害することができる抗体またはペプチドもしくはポリペプチドを特異的に認識する抗体によって認識されるペプチドまたはポリペプチドを含む薬学的組成物に関する。「TIRC7膜蛋白質を通じてT細胞刺激を阻害することができる」という用語は、TIRC7蛋白質またはTIRC7とも呼ばれる本明細書のTIRC7膜蛋白質の生物活性を遮断するまたは拮抗することによって、リンパ球混合培養においてアロ活性化に反応した、またはマイトゲンに反応したT細胞増殖の抑制能を指す。「TIRC7膜蛋白質を通じてT細胞刺激を阻害することができる」という用語および「TIRC活性を阻害する」という用語は本明細書において互換に用いられる。
【0039】
本発明の範囲内で行われた実験により、意外にも、蛋白質の細胞外ドメインに対して向けられたが推定細胞内ドメインを認識しない抗TIRC7抗体が、リンパ球混合培養におけるアロ活性化に反応した、またはマイトゲンに反応したT細胞の増殖を有効に抑制することができることが判明した;実施例2、図5参照。類似の結果はインビトロで翻訳された可溶性TIRC7蛋白質についても得られた。多様な異なる刺激経路によって誘発されるT細胞に対しても抗TIRC7抗体が阻害作用を示すことから、TIRC7がT細胞活性化において中心的な役割を果たしていることが示唆される。その上、TIRC7の抗体ターゲティングによってMLRにおいてT細胞増殖が阻害されることから、TIRC7と特異的に相互作用するリガンドの存在が示唆される。この仮説の根拠は、インビトロで翻訳された可溶性TIRC蛋白質の存在下では、MLRにおけるT細胞増殖が用量依存的に阻害されることによって得られる。
【0040】
さらに、本発明に従って、IL-2およびIFN-γサイトカイン産生は阻害されるがIL-4サイトカイン産生は阻害されないことから、TIRC7の抗体ターゲティングがTh1リンパ球サブセットに対して選択的な阻害作用を有することが示された;実施例3、図5参照。抗TIRC7抗体処置によって、細胞は不応性のままであるように思われるが、外から組換え型IL-2を加えると抗TIRC7抗体の抗増殖作用は逆転するため、機能的状態である。
【0041】
上記の結果は新規TIRC7蛋白質およびその抗体が治療的に有用であるかもしれないという見込みを有するが、本発明の考え方に対する証明、すなわち免疫応答の調節に対する上記化合物の有用性と共に、それに由来し、下記に特徴付けを行う態様は、抗TIRC7抗体がラット腎移植のインビボモデルにおいて同種異系移植片の拒絶を防止することができることを示す、本発明に従って実施されたさらなる実験から得られた;実施例4、図6および7参照。その上、都合のよいことに、TIRC7の抗体ターゲティングの作用は共刺激分子のターゲティングによって認められた作用とかなり類似していることを本発明に従って証明することができた。共刺激分子を抗体によって遮断するとヒトT細胞増殖を阻害することが示されている(リンスレー(Linsley)ら、1992;ウォルナス(Walunas)ら、1994)。さらに、CD28/B7と可溶性蛋白質CTLA4Igとの相互作用を妨害すると、T細胞増殖の阻害が認められた(リンスレー(Linsley)ら、1992;レンショウ(Lenshow)ら、1992;ラーセン(Larsen)ら、1996)。TIRC7抗体ターゲティングの作用は、CTLA4Igが選択的にTh1を遮断するが、Th2リンパ球反応は容認することによってさらに類推される(モハメド(Mohammed)ら、1995)。CTLA4Igをインビボ腎同種異系移植モデルにおいて投与すると、移植片の定着を延長し(モハメド(Mohammed)ら、1995)、これは本実施例においてTIRC7抗体ターゲティングによっても同様に認められることが示された。これらの類似性は共刺激機能を示唆している可能性があるが、TIRC7は既知の如何なるT細胞アクセサリ細胞とも構造的または配列相同性を示さない。このように、TIRC7はT細胞活性化の過程の初期に誘導される明確なシグナル伝達経路に関与する可能性がある。この可能性は、既知の共刺激蛋白質以外の分子によって媒介される経路を妨害するとT細胞反応を調節することができるという最近の報告によって支持される。例えば、共通の白血球抗原CD45RBの抗体ターゲティングによってマウスにおいて移植片拒絶が防止されることが示された(ラザロビッツ(Lazarovits)ら、1996)、TIRC7と既知のT細胞アクセサリ分子との間に機能的類似性があると仮定すれば、TIRC7の構造が新規であることはT細胞反応の明確な機構の理解に貢献すると予想される。その上、抗TIRC7抗体がインビボで同種異系移植片の定着を著しく有意に延長することができることは、ヒト臓器移植および自己免疫疾患における望ましからぬT細胞活性化の選択的阻害に対する新規アプローチとなる。
【0042】
本発明の好ましい態様において、上記ポリヌクレオチドによってコードされるペプチドまたはポリペプチドは、配列番号:3〜9のいずれか1つに示されるアミノ酸配列を含む。添付の実施例において記述するように、上記アミノ酸配列を含むペプチドはTIRC7蛋白質の細胞外ドメインの一部に相当し、T細胞不応性を誘導することができる抗体の産生に都合よく用いることができる。
【0043】
したがって、特に好ましい態様において、本発明の薬学的組成物はペプチドまたはポリペプチドの可溶型を含む。一つの態様において、TIRC7またはTIRC7リガンドの可溶性型はTIRCの細胞外ドメインまたはその機能的部分を含む切断型分子である。TIRC7リガンドとの結合能を保持しているTIRC7の細胞外ドメインの一部を用いることができる。同様に、TIRC7との結合能を保持しているTIRCリガンドの細胞外ドメインの一部を用いることができる。本発明に従って用いられるTIRC7またはTIRC7リガンドのもう一つの可溶型は、融合蛋白質である。本明細書において用いられる「融合蛋白質」という用語は、第二の蛋白質の第二のポリペプチドに隣接するアミノ酸配列において第一の蛋白質からの第一のポリペプチドを含む蛋白質を指す。融合蛋白質は、第一のポリペプチドをコードするヌクレオチド配列を、第二のポリペプチドをコードするヌクレオチド配列とインフレームでライゲーションし、融合蛋白質を産生するためにこれらのヌクレオチド配列を発現させる(例えば、宿主細胞に導入された組換え型発現ベクターを用いて)、標準的な組換えDNA技術によって作製することができる。好ましい融合蛋白質は、免疫グロブリン重鎖定常領域(例えば、IgG1のような、ヒト免疫グロブリンのヒンジ、CH2およびCH3領域)と結合したTIRC7またはTIRC7リガンドの細胞外ドメインまたは機能的部分を含む免疫グロブリン融合蛋白質である。免疫グロブリン融合蛋白質は、例えばカポン(Capon)、Nature 337(1989)、525〜531の教えに従って調製することができる。
【0044】
本発明の薬学的組成物に含まれる抗体は、好ましくは、特にT細胞刺激が所望される場合、本発明のTIRC7蛋白質の天然に存在するリガンドの結合特異性と少なくとも実質的に同一である特異性を有する。そのような抗体は、T細胞刺激が予見される場合には少なくとも10-5 M、好ましくは10-7 Mを超えない、およびT細胞抑制が媒介される場合には10-10 Mまでの結合親和性を有すると都合がよい。好ましい態様において、抗体は
(a)T細胞抑制抗体が少なくとも約10-7 M、好ましくは少なくとも約10-9 Mおよび最も好ましくは少なくとも約10-11 Mの親和性を有する;および
(b)T細胞刺激抗体が約10-7 M未満、好ましくは約10-6 M未満、および最も好ましくは10-5 Mの次数である親和性を有する。
【0045】
特異性の一つが、破壊される標的細胞、例えば腫瘍細胞に向けられる双特異的抗体の場合には、腫瘍抗原を認識する結合部位が、高率で破壊される標的細胞を捕獲するために高親和性を有すると都合がよい。一方で、本発明のTIRC7蛋白質を認識する結合部位の結合親和性は、天然のTIRC7リガンド、またはT細胞共刺激分子とその受容体との相互作用に関して通常認められる結合親和性と同じ次数となるはずである。
【0046】
本発明の好ましい態様において、抗体は、双特異的抗体、合成抗体、Fab、Fv、またはscFv断片のような抗体断片等またはこれらのいずれかの化学的改変誘導体を含む、ペプチドまたはポリペプチドと特異的に結合するモノクローナル抗体、ポリクローナル抗体、一本鎖抗体、ヒト化抗体、またはその断片である。モノクローナル抗体は例えば、当技術分野によって開発された改変を伴う免疫した哺乳類に由来する脾細胞とマウス骨髄細胞との融合を含む、ケーラー&ミルスタイン(Kohler and Miletein)、Nature 256(1975)、495およびガルフレ(Galfre)、Meth. Enzymol. 73(1981)、3に最初に記述された技法によって調製することができる。さらに、上記ペプチドに対する抗体またはその断片は、例えばハーロウ&レーン(Harlow and Lane)の「抗体、実験マニュアル(Antibodies, A Laboratory Manual)」、CSHプレス、コールドスプリングハーバー、1988に記述された方法を用いて得ることができる。抗体の誘導体をファージディスプレイ技術によって得る場合、BIAコアシステムにおいて用いられるように表面プラズモン共鳴を用いて、ファージ抗体が本発明のペプチドまたはポリペプチドのエピトープと結合する効率を増加させることができる(シアー(Schier)、Human Antibodies Hybridomas 7(1996)、97〜105;マルムボルグ(Malmborg)、J. Immunol. Methods 183(1995)、7〜13)、キメラ抗体の産生は、例えば国際公開公報第89/09622号に記述されている。ヒト化抗体の産生法は、例えば、欧州特許A1 0 239 400号、および国際公開公報第90/07861号に記述されている。本発明に従って利用されるさらなる抗体源は、いわゆる異種抗体である。マウスにおけるヒト抗体のような異種抗体産生の一般的原理は、例えば、国際公開公報第91/10741号、国際公開公報第94/02602号、国際公開公報第96/34096号、および国際公開公報第96/33735号に記述されている。
【0047】
本発明に従って用いられる抗体またはその対応する免疫グロブリン鎖は、当技術分野で既知の従来の技法を用いて、例えばアミノ酸欠失(複数)、挿入(複数)、置換(複数)、付加(複数)および/または組換え(複数)および/または当技術分野で既知のその他の改変(複数)を単独または組み合わせて用いることによってさらに改変することができる。免疫グロブリン鎖のアミノ酸配列の基礎となるDNA配列にそのような改変を導入する方法は、当業者には周知である;例えばサムブルック(Sambrook)の「分子クローニング、実験マニュアル(Molecular Cloning, A Laboratory Manual)」、コールドスプリングハーバー研究所、(1989)、ニューヨーク州を参照のこと。
【0048】
本発明の薬学的組成物に含まれるペプチド、ポリペプチド、および抗体は、ドメインが共有結合または非共有結合によって結合している、さらなるドメインを含むことができる。結合は当技術分野において既知の上記の方法に従って遺伝子融合に基づくことができ、例えば、国際公開公報第94/04686号に記述された化学クロスリンクによって行うことができる。本発明に従って用いられるペプチド、ポリペプチド、または抗体を含む癒合蛋白質に存在するさらなるドメインは、ポリペプチドリンカーが、さらなるドメインのC-末端と、ペプチド、ポリペプチド、または抗体のN-末端との距離、またはその逆に及ぶために十分な長さである複数の親水性ペプチド結合アミノ酸を含む好ましくはフレキシブルリンカーに結合してもよく、ポリペプチドリンカーに結合すると都合がよい。上記融合蛋白質はさらに、切断可能なリンカーまたはプロテナーゼ切断部位を含んでもよい。
【0049】
さらに、さらなるドメインは既定の特異性または機能を有してもよい。例えば、文献は、悪性細胞を破壊もしくはその位置を特定するために、または局所での薬物または酵素の作用を誘導するために、薬剤、毒素、および酵素のような生物活性物質を生体内の特定の点にターゲティングする考え方に対して参考となる宿主を含む。生物活性物質をモノクローナル抗体に結合させることによって、この作用を得ることが提唱されている(例えば、ニューヨーク、オックスフォード大学出版;およびゴース(Ghose)、(1978)、J. Natl. Cancer Inst. 61:657〜676を参照のこと)。
【0050】
これに関連して、本発明の薬学的組成物に存在するポリペプチドは、当技術分野で既知の従来の方法によってさらに改変することができる。これによって本発明のペプチド、ポリペプチドまたは抗体および他の機能的アミノ酸配列、例えば異種蛋白質に由来してもよい核移動シグナル、トランス活性化ドメイン、DNA結合ドメイン、ホルモン結合ドメイン、蛋白質タグ(GST、GFP、h-mycペプチド、FLAG、HAペプチド)を含む、融合蛋白質の構築が可能となる。このように、本発明の組成物の投与には標識した(ポリ)ペプチドまたは抗体と共に標識しないで用いることができる。
【0051】
例えば、ペプチド、ポリペプチドおよび抗体は治療物質によって標識して投与することができる。これらの物質は、上記を参照して本発明の抗体または(ポリ)ペプチドと直接または間接的にカップリングすることができ、標的部位で薬剤を抗原から放出することができるように選択することができる。免疫療法のためにポリペプチドおよび抗体とカップリングすることができる治療物質の例は薬剤、放射性同位元素、レクチン、および毒素である。本発明のポリペプチドに結合することができる薬剤は、マイトマイシンC、ダウノルビシン、およびビンブラスチンのような薬剤として古典的に呼ばれる化合物を含む。本発明の放射性同位元素と結合した(ポリ)ペプチドまたは抗体を例えば免疫療法に用いる場合、白血球の分布と共に安定性および放出のような要因に応じて、特定の同位元素が他の元素より好ましいことがある。自己免疫反応によっては、放射体の中には他より好ましいものがあるかも知れない。一般に、免疫療法ではαおよびβ粒子放出放射性同位元素が好ましい。好ましいのは、212Biのような飛程の短い高エネルギーα放出体である。治療目的のために本発明の(ポリ)ペプチドおよび抗体に結合することができる放射性同位元素の例は、125I、131I、90Y、67Cu、212Bi、212At、211Pb、47Sc、109Pdおよび188Reである。
【0052】
通常植物材料から単離されるレクチンは、特定の糖部分に結合する蛋白質である。多くのレクチンは細胞を凝集してリンパ球を活性化することもできる。しかし、リシンは免疫療法で用いられている毒性レシチンである。これは、毒性に関係するリシンのαペプチド鎖を、毒性効果の部位特異的輸送を可能にするポリペプチドと結合させることによって得られる。
【0053】
毒素は植物、動物、または微生物によって産生される毒性物質であり、十分量ではしばしば致命的となる。ジフテリア毒素はジフテリア菌(Corynebacterium diphtheria)によって産生される物質で、これは治療的に用いることができる。この毒素は、適当な条件下で分離することができるαおよびβサブユニットを含む。毒性A成分は本発明の抗体に結合することができ、相互作用T細胞への部位特異的輸送に用いることができる。
【0054】
本発明のポリペプチドにカップリングすることができる上記のようなその他の治療物質は、対応するエクスビボおよびインビボ治療プロトコールと共に既知であり、当業者によって容易に確認することができる。適当であれば、当業者は、上記(ポリ)ペプチドおよび抗体のそれぞれいずれか1つをコードする下記に記載の本発明のポリヌクレオチドまたは対応するベクターを、毒性材料そのものの代わりに用いてもよい。
【0055】
このように、当業者は本発明の(ポリ)ペプチドおよび抗体を、所望の特異性および生物機能を有する融合蛋白質の構築に用いることができると容易に認識するであろう。次に、本発明に従って選択的に用いられる(ポリ)ペプチドおよび抗体は、その融合蛋白質と共に、特に医学の分野において、例えば特定のタイプの癌および自己免疫疾患のようなT細胞関連障害に対する新規治療アプローチの開発に、または対応する細胞シグナル伝達経路の分析および調節に関する興味深いツールとして重要な治療的および科学的役割を果たすと予想される。
【0056】
好ましくは、さらなるドメインは、生物活性に適した立体配座を有するイフェクター分子、イオンを封鎖することができるアミノ酸配列、および固相支持体または予め選択した抗原と選択的に結合することができるアミノ酸配列、からなる群より選択される分子を含む。ドメインは酵素、毒素、受容体、結合部位、生合成抗体結合部位、増殖因子、細胞分化因子、リンフォカイン、サイトカイン、ホルモン、遠位検出可能部分、抗代謝物質、放射活性原子または抗原を含んでもよい。抗原は例えば、腫瘍抗原、ウイルス抗原、微生物抗原、アレルゲン、自己抗原、ウイルス、微生物、ポリペプチド、ペプチド、または多数の腫瘍細胞となりうる。さらに、イオンを封鎖することができる配列には、カルモジュリン、メタロチオネイン、その断片、またはグルタミン酸、アスパラギン酸、リジンおよびアルギニンの少なくとも1つに富むアミノ酸配列が含まれる。さらに、固相支持体に選択的に結合することができるポリペプチド配列は、陽性または陰性荷電アミノ酸配列、システイン含有アミノ酸配列、アビジン、ストレプトアビジン、ブドウ球菌プロテインA断片、GST、His-タグ、FLAGタグ、Lex A、または添付の実施例において用いられるc-mycとなりうる。上記のイフェクター分子およびアミノ酸配列のいくつかは、それ自身が活性であってもなくてもよく、しかも例えば特定の細胞環境に入ると取り除かれる前駆体型として存在してもよい。
【0057】
本発明の薬学的組成物はさらに薬学的に許容される担体を含んでもよい。適した薬学的担体の例は当技術分野において周知であり、リン酸緩衝生理食塩液、水、油/水乳剤のような乳剤、様々なタイプの湿潤剤、滅菌溶液等が含まれる。そのような担体を含む組成物は、周知の従来の技法によって製剤化することができる。これらの薬学的組成物は適した用量で被験者に投与することができる。適した組成物の投与は例えば、静脈内、腹腔内、皮下、筋肉内、局所または皮内投与によって異なるように行ってもよい。投与レジメは主治医および臨床要因によって決定されるであろう。医学の分野において周知であるように、1人の患者の用量は患者の体格、体表面積、年齢、投与する特定の化合物、性別、投与時間および経路、全身健康状態、ならびに同時投与される他の薬剤を含む多くの要因に依存する。典型的な用量は例えば、0.001〜1000 μgの範囲となりうる(または発現のため、または発現を阻害するための核酸の用量はこの範囲内);しかし、特に上記要因を考慮する場合、この例とした範囲より下または上の用量も含まれる。一般的に薬学的組成物の定期的な投与としてのレジメは1日あたり1μg〜10 mg単位の範囲となるであろう。レジメが連続的な点滴注入である場合には、それぞれ1分間に体重1kgあたり1μg〜10 mg単位となるであろう。投与状況は定期的な評価によってモニターすることができる。用量は変化するが、DNAの静脈内投与に関して好ましい用量は、DNA分子約106〜1012コピーである。本発明の組成物は局所的または全身的に投与してもよい。投与は一般的に非経口、例えば静脈内であろう;DNAはまた、例えば内部または外部標的部位へのバイオリスティック(biolistic)輸送によって、または動脈内の部位へカテーテルによって、標的部位に直接投与してもよい。非経口投与用調製物には、滅菌水溶液または非水溶液、懸濁液および乳液が含まれる。非水性溶媒の例には、プロピレングリコール、ポリエチレングリコール、オリーブ油のような植物油、およびオレイン酸エチルのような注射可能な有機エステルである。水溶性担体には、生理食塩液および緩衝液を含む、水、アルコール/水溶液、乳液または懸濁液が含まれる。非経口溶媒には、塩化ナトリウム溶液、リンゲルデキストロース、デキストロースおよび塩化ナトリウム、乳酸リンゲル液、または固定油が含まれる。静脈内投与用溶媒には液体および栄養補給液、電解質補給液(リンゲルデキストロースに基づく液のような)等が含まれる。抗菌剤、抗酸化剤、キレート剤および不活性ガス等の保存剤およびその他の添加剤が存在してもよい。さらに、本発明の薬学的組成物は、当技術分野で既知のT細胞共刺激分子もしくはサイトカインのようなさらなる物質または薬学的組成物の目的とする用途に応じてその阻害剤または活性化剤を含んでもよい。
【0058】
さらに、標準的なベクターおよび/または遺伝子輸送系を用いて、および選択的に薬学的に許容される担体または賦形剤と共に、上記ペプチドまたはポリペプチドをコードする様々なポリヌクレオチドおよびベクターを単独または組み合わせて投与することは、本発明に含まれる。例えば、本発明のポリヌクレオチドは、細胞において本発明のポリヌクレオチドを発現させるために、例えばT細胞障害に関連した疾患の遺伝子治療または診断のために、単独でまたはベクターの一部として用いることができる。本発明のポリヌクレオチドまたはベクターは、逆に(ポリ)ペプチドを産生するように細胞内に導入される。投与後、ポリヌクレオチドまたはベクターは被験体のゲノムに安定に組み入れられてもよい。一方、特定の細胞または組織に特異的で、しかもその細胞に残存するウイルスベクターを用いてもよい。適した薬学的担体および賦形剤は当技術分野で周知である。本発明に従って調製された薬学的組成物は、T細胞関連免疫欠損および悪性物に関連している様々な種類の疾患の予防、治療または疾患を遅らせるために用いることができる。
【0059】
さらに、本発明のポリヌクレオチドまたはベクターを含む本発明の薬学的組成物を遺伝子療法に用いることが可能である。エクスビボまたはインビボ技法によって治療遺伝子を細胞に導入することに基づく遺伝子療法は、遺伝子トランスファーの最も重要な応用の一つである。インビトロおよびインビボ遺伝子療法に適したベクターおよび方法は文献に記述されており、当業者に既知である;例えばジオルダーノ(Giordano)、Nature Medicine 2(1996)、534〜539;シェーパー(Schaper)、Circ. Res. 79(1996)、911〜919;アンダーソン(Anderson)、Science 256(1992)、808〜813;アイスナー(Isner)、Lancet 348(1996)、370〜374;ムールハウザー(Muhlhauser)、Circ. Res. 77(1995)、1077〜1086;ワン(Wang)、Nature Medicine 2(1996)、714〜716;国際公開公報第94/29469号;国際公開公報第97/00957号、またはシェーパー(Schaper)、Current Opnion in Biotechnology 7(1996)、635〜640および本明細書に引用した文献を参照のこと。本発明のポリヌクレオチドおよびベクターは、細胞に直接導入またはリポソームもしくはウイルスベクター(例えばアデノウイルス、レトロウイルス)を通じて導入するためにデザインしてもよい。好ましくはベクターは発現ベクターおよび/または遺伝子トランスファーまたはターゲティングベクターである。レトロウイルス、ワクシニアウイルス、アデノ関連ウイルス、ヘルペスウイルス、またはウシパピローマウイルスのようなウイルスに由来する発現ベクターを、標的とする細胞集団に本発明のポリヌクレオチドまたはベクターを輸送するために用いてもよい。好ましくは細胞は生殖系列細胞、胚細胞、または卵細胞、またはそれらに由来する細胞であり、最も好ましくは細胞は幹細胞である。上記のように、適した遺伝子輸送系は、リポソーム、受容体媒介輸送系、裸核DNA、およびヘルペスウイルス、レトロウイルス、アデノウイルス、およびとりわけアデノ関連ウイルスのようなウイルスベクターを含んでもよい。遺伝子療法のために体内の特定の部位に核酸を輸送することは、ウィリアムス(Williams、Proc. Natl. Acad. Sci. USA 88(1991)、2726〜2729)によって記述された系のようなバイオリスティック(biolistic)輸送系を用いて行ってもよい。導入されたポリヌクレオチドおよびベクターは細胞への導入後に遺伝子産物を発現し、好ましくは細胞の生存中その状態で留まると理解される。例えば、適当な調節配列の制御下でポリヌクレオチドを安定に発現する細胞株を当技術分野で周知の方法を用いて操作してもよい。ウイルス複製起点を含む発現ベクターを用いるより、宿主細胞を同じまたは異なるプラスミド上で、本発明のポリヌクレオチドおよび選択マーカーによって形質転換することができる。外来DNAを導入した後、操作した細胞を栄養に富む培地中で1〜2日増殖させてもよく、その後選択培地に切り替える。組換えプラスミド中の選択マーカーは選択に対する抵抗性を付与し、プラスミドをその染色体に安定に組み込んだ細胞の選択を可能にし、細胞塊を形成するまで増殖させてこれをクローニングして細胞株に発展させる。そのような操作した細胞株もまた、例えばT細胞活性化または刺激に関係する化合物を検出するスクリーニング法において特に有用である。
【0060】
単純ヘルペスウイルスチミジンキナーゼ(ウィグラー(Wigler)、Cell 11(1997)、223)、ヒポキサンチン・グアニンホスホリボシルトランスフェラーゼ(スジバルスカ(Szybalska)、Proc. Natl. Acad. Sci. USA 48(1962)、2026)、およびアデニンホスホリボシルトランスフェラーゼ(ロウイ(Lowy)、Cell 22(1980)、817)を含む多くの選択系をそれぞれ、tk-、hgprt-またはaprt-細胞において用いてもよい。同様に、メトトレキサートに対する抵抗性を付与するdhfr(ウィグラー(Wigler)、Proc. Natl. Acad. Sci. USA 77(1980)、3567;オヘール(O'Hare)、Proc. Natl. Acad. Sci. USA 78(1981)、1527);ミコフェノール酸に対する抵抗性を付与するgpt(ムリガン(Mulligan)、Proc. Natl. Acad. Sci. USA 78(1981)、2072);アミノグリコシドG418に対する抵抗性を付与するneo(コルベール・ガラピン(Colberre-Garapin)、J. Mol. Biol. 150(1981)、1);ヒグロマイシンに対する抵抗性を付与するhygro(サンテール(Santerre)、Gene 30(1984)、147);またはピューロマイシン(pat、ピューロマイシンN-アセチルトランスフェラーゼ)のような、抗代謝物質抵抗性を選択の基礎として用いることができる。さらなる選択遺伝子、例えば細胞にトリプトファンの代わりにインドールを利用させるtrpB;細胞にヒスチジンの代わりにヒスチノールを利用させるhisD(ハートマン(Hartman)、Proc. Natl. Acad. Sci. USA 85(1988)、8047);およびオルニチンデカルボキシラーゼ阻害剤である2-(ジフルオロメチル)-DL-オルニチン、DFMOに対する抵抗性を付与するODC(オルニチンデカルボキシラーゼ)(マッコンログ(McConlogue)、1987、「分子生物学における現在の伝達(Current Communications in Molecular Biology)」、コールドスプリングハーバー研究所編)が記述されている。
【0061】
もう一つの態様において、本発明は上記蛋白質、抗体、(ポリ)ペプチド、ポリヌクレオチド、ベクターまたは細胞のいずれか一つ、選択的に適した検出手段を含む診断的組成物に関する。上記の(ポリ)ペプチドおよび抗体は、例えば液体相において、または固相担体に結合して用いることができるイムノアッセイ法での使用に適している。(ポリ)ペプチドを利用することができるイムノアッセイ法の例には直接または間接型の競合的および非競合的イムノアッセイ法である。そのようなイムノアッセイ法の例はラジオイムノアッセイ(RIA)、サンドイッチ(免疫測定解析)およびウェスタンブロット解析である。(ポリ)ペプチドおよび抗体は、多くの異なる担体に結合することができ、およびポリペプチドに特異的に結合した細胞を単離するために用いることができる。周知の担体の例にはガラス、ポリスチレン、ポリ塩化ビニル、ポリプロピレン、ポリエチレン、ポリカーボネート、デキストラン、ナイロン、アミロース、天然および改変セルロース、ポリアクリルアミド、アガロース、および磁鉄鉱が含まれる。担体の性質は本発明の目的にとって可溶性とも不溶性ともなりうる。
【0062】
当業者に既知の異なる多くの標識および標識法が存在する。本発明において用いることができる標識のタイプの例には酵素、放射性同位元素、コロイド金属、蛍光化合物、化学発光化合物、および生物発光化合物が含まれる;上記の態様も参照のこと。
【0063】
診断的組成物はまた、細胞からmRNAを得る段階、本発明のポリヌクレオチドと適したハイブリダイズ条件下で特異的にハイブリダイズすることができる少なくとも15ヌクレオチドの核酸分子を含むプローブに、そのようにして得られたmRNAを接触させる段階、およびプローブとハイブリダイズしたmRNAの存在を検出して、それによって細胞によるTIRC7蛋白質発現を検出する段階を含む、TIRC7膜蛋白質をコードするmRNAの有無を検出することによって本発明のポリヌクレオチドの発現を検出する方法に用いてもよい。
【0064】
さらに、本発明は、被験者から細胞試料を得る段階、TIRC7蛋白質に対して抗体が結合するような条件下で該試料を上記抗体の一つと接触させる段階、および例えばラジオイムノアッセイまたは酵素イムノアッセイのようなイムノアッセイ技術を用いて、そのように結合した抗体の有無を検出する段階を含む、試料中に、例えば細胞試料中にTIRC7膜蛋白質の有無を検出する方法を含む。さらに、当業者は、TIRC7活性を有する(ポリ)ペプチドを特異的に認識するがその不活性型は認識しない抗体、または不活性型は特異的に認識するがTIRC7活性を有する対応するポリペプチドは認識しないいずれかの抗体を用いて、機能的TIRC7蛋白質であるポリペプチドと、T細胞刺激活性が失われているもしくは変化している変異型とを特異的に検出および識別してもよい。本発明の抗体はまた、様々な種からTIRC7膜蛋白質、または上記(ポリ)ペプチドを精製して、それらを単離するためにアフィニティクロマトグラフィーにおいて用いてもよい。
【0065】
本発明はまた、TIRC7蛋白質の過小発現または過剰発現に関連した障害の犠牲者からDNAを単離する段階;単離したDNAを少なくとも1つの制限酵素で消化する段階;得られたDNA断片をサイズ分離ゲル上で電気泳動的に分離する段階;得られたゲルを、上記のようにTIRC7蛋白質をコードするDNAと特異的にハイブリダイズすることができ、検出マーカーによって標識した核酸プローブと接触させる段階;上記段階に従ってゲル上の検出可能に標識されたバンドを産生するために被験者のDNAを調製する段階;およびパターンが同じであるか異なるかを決定するためにおよびパターンが同じであればそれによって障害に対する素因を診断するために、TIRC7蛋白質の発現に関連した障害の犠牲者のDNAに特異的なバンドパターンと、被験者のDNAのバンドパターンを比較する段階を含む、被験者においてTIRC7対立遺伝子の発現に関連した障害に対する素因を診断する方法を含む。本発明の検出マーカーは、例えば32Pおよび35Sのような一般的に用いられる放射活性標識によって標識してもよいが、ビオチンまたは水銀と共に上記のようなその他の標識も同様に用いてもよい。当業者に周知である様々な方法を用いて検出マーカーを標識してもよい。例えば、DNA配列およびRNA配列はランダムプライマー法を用いて32Pまたは35Sによって標識してもよい。適した検出マーカーが得られれば、検出マーカーを対象試料に接触させるために当業者に周知の様々な方法を用いてもよい。例えば、標準的な技法を用いてDNA-DNA、RNA-RNAおよびDNA-RNAハイブリダイゼーションを行ってもよい。核酸を検出する様々な方法は当技術分野で周知であり、例えばサザンおよびノザンブロッティング、PCR、プライマー伸長等がある。さらに、被験者から得られたmRNA、cRNA、cDNAまたはゲノムDNAをシークエンシングして、TIRC7またはその変異型の発現に関連した障害におけるTIRC7変異の特徴的フィンガープリントであってもよい変異を同定してもよい。本発明はさらに、そのようなフィンガープリントを被験者から得られたDNAまたはRNAのRFLPによって産生してもよく、選択的にDNAまたはRNAを分析前に増幅してもよい、その方法が当技術分野で周知である方法を含む。RNAフィンガープリントは例えば、適したRNA酵素、例えばRNアーゼT1、RNアーゼT2等またはリボザイムによって被験者から得られたRNA試料を消化し、例えば電気泳動によって分離して、上記のようにまたは添付の請求の範囲に示すようにPAGE上でRNA断片を検出することによって実施してもよい。
【0066】
好ましい態様において、本発明の薬学的組成物は少なくとも1つの第二の物質、好ましくは目的とする用途に応じてT細胞刺激を阻害または活性化する物質を含む。そのような物質には、例えば受容体/リガンド相互作用等を遮断するまたは模倣して、その結果T細胞をそれぞれ抑制および活性化することができる分子が含まれる。
【0067】
そのような物質は例えば、共刺激分子、インテグリン、Igスーパーファミリー分子、セレクチンの活性を阻害する物質と共に、ケモカインおよびそのそれぞれの受容体相互作用を遮断する物質、IL-2/IL-2受容体相互作用を遮断する薬剤、およびIL-2R mAb、IL-トキシンおよびIL-ミューテインのようなその他の従来の免疫抑制剤を含む。共刺激分子およびそのリガンドの例は先行技術、例えばシュワルツ(Schwartz)、Cell 71(1992)、1065〜1068において記述されている。B7-2に対するCD28と、B7-1およびB7-2に対するCTLA4との相互作用に対するmAbまたは可溶性のCTLA4Igを用いた受容体/リガンド相互作用の妨害は、ブレーザー(Blazar)、J. Immnol. 157(1996)、3250〜3259;ブルーストーン(Bluestone)、Immunity 2(1995)、555〜559;リンスレー(Linsley)、Science 257(1992)、792〜95に記載されている。CD40またはCD40Lに対するmAbを用いることによって受容体/リガンド相互作用を遮断する例はバーデン(Burden)、Nature 381(1996)、434〜435;カーク(Kirk)、Proc. Natl. Acad. Sci. USA 94(1997)、8789〜8794によって報告されている。CD2抗原およびそのリガンドであるLFA-3は、バゴーギ・リ(Bagogui Li)らの総説「接着分子、融合蛋白質、新規ペプチド、およびモノクローナル抗体、移植医学の最近の進歩(Adhesion Molecule, Fusion proteins, Novel Peptides, and Monoclonal Antibodies, Recent Developments in Transplantation Medicine)」第二巻、1995、フィジシャンズ&サイエンティストパブリッシングカンパニーインク、に記述されており、mAb(抗-Leu-5b、OKT11、T11)またはCD2.IgG1融合蛋白質を用いてその相互作用を遮断することは、ブルムバーグ(Brumberg)、Transplantation 51(1991)、219〜225に報告されている。CD4分子に対するモノクローナル抗体の使用は、コシミ(Cosimi)、Surgery 108(1990)、406〜414に記述されている。mAbによるCD47遮断はラインホルト(Reinhold)、J. Exp. Med. 185(1997)、1〜11に記述されている。インテグリンおよびIgスーパーファミリー分子には、LFA-1とそのリガンドICAM-1、-2、-3;Mac-1とそのリガンドICAM-1、-3;ICAM-1とそのリガンドLFA-1、Mac-1、CD43;ICAM-2とそのリガンドLFA-1;ICAM-3とそのリガンドLFA-1、Mac-1;VLA4およびVCAM-1が含まれる。例えばデビッド・アダムス(David Adams)の総説「接着分子、融合蛋白質、新規ペプチド、およびモノクローナル抗体、移植医学の最近の進歩(Adhesion Molecule, Fusion proteins, Novel Peptides, and Monoclonal Antibodies, Recent Developments in Transplantation Medicine)」第二巻、1995、フィジシャンズ&サイエンティストパブリッシングカンパニーインク;イソベ(Isobe)、Science 255(1992)、1125〜1127;コシミ(Cosimi)、J. Immunlogy 144(1990)、4604〜4612;ハイネス(Hynes)、Cell 69(1992)、11〜25を参照のこと。さらに、α4インテグリン鎖(CD49d)に対するVLA-4 mAbを選択的に妨害する物質を用いることができ、β1インテグリン鎖(CD29)、またはVLA-4の活性化誘導ネオエピトープと共に、可溶性フィブロネクチンもしくはその関連ペプチド(GPEILDVPST)のような可溶性VLA-4リガンド、または可溶性VCAM-1もしくはその関連ペプチドを用いることができる。より選択的な遮断剤は、α4、β1、またはVCAM-1 mRNAと選択的にハイブリダイズするようデザインされたアンチセンスオリゴヌクレオチドである;フェドセエバ(Fedoseyeva)、J. Immunol. 57(1994)、606〜612。
【0068】
もう一つの例は、VCAM-1の発現を遮断することができる薬剤ペントキシフィリン(PTX)である;ベスラー(Besler)、J. Leukoc. Biol. 40(1986)、747〜754。さらに、VCAM-1 mAb、M/K-2、抗マウス抗体は、例えば同種異系移植片の定着を延長することができる、オロズ(Orosz)、Transplantation 56(1993)、453〜460。
【0069】
mAbを用いてインテグリンファミリーのメンバーおよびそのリガンドを遮断することは、キュピエック・ウェグリンスキー(Kupiec-Weglinski)の総説「接着分子、融合蛋白質、新規ペプチド、およびモノクローナル抗体、移植医学の最近の進歩(Adhesion Molecule, Fusion proteins, Novel Peptides, and Monoclonal Antibodies, Recent Developments in Transplantation Medicine)」第二巻、1995、フィジシャンズ&サイエンティストパブリッシングカンパニーインクに記載されている。
【0070】
セレクチン、例えば、L-セレクチン(CD62L)、E-セレクチン(CD62E)、P-セレクチン(CD62P)はフォレスト&ポールソン(Forrest and Paulson)の「接着分子のセレクチンファミリー(Selectin Family of Adhesion molecules)」、グランガー&シュミット・ショーンベイン(Granger and Schmid-Schonbein)編、「白血球接着の生理学と病理生理学(Physiology and Pathophysiology of Leukocyte Adhesion)」、ニューヨーク、オックスフォードプレス、1995、68〜146頁に記述されている。
【0071】
従来の免疫抑制剤、例えばATG、ALG、OKT3、アザチオプリン、ミコフェニレート、モフェチル、シクロスポリンA、FK506、コルチコステロイドの併用は、コシミ(Cosimi)、Transplantation 32(1981)、535〜539;シールド(Shield)Transplantation、38(1984)、695〜701に記述されるように用いてもよい。
【0072】
ケモカインとそれぞれの受容体との相互作用のmAbによる妨害はラスター(Luster)、「ケモカイン−炎症を媒介する化学遊走性サイトカイン(Chemokines-chemotactic cytokines that mediate inflammation)」、New Engl. J. Med. Feb.(1998)、436〜445に論評されている。
【0073】
このように、上記のおよび例として引用した如何なる物質も、本発明の薬学的組成物または下記に記述する方法および使用に従って用いることができる。一方、本発明のポリヌクレオチド、ベクター、蛋白質、ペプチド、ポリペプチド、抗体、細胞、および薬学的組成物は、上記で言及したT細胞刺激分子、阻害剤および薬剤に関して記述された方法および用途に関して用いることができることは当業者に明らかである。
【0074】
本発明の薬学的組成物は臓器移植、自己免疫疾患の治療、アレルギーもしくは感染疾患または腫瘍の治療に用いることを意図すると都合がよい。同種異系移植片または異種移植片の寛容を改善するために本発明の薬学的組成物を用いる例はLFA-3とCD-2結合蛋白質の投与に関してそれぞれ、国際公開公報第93/06852号に記述されている。
【0075】
さらに、本発明は(抗原特異的)T細胞不応性を調節する方法に関する。本明細書において用いられる「T細胞不応性」という用語は、T細胞増殖、リンフォカイン分泌、または抗原(または抗原性部分)に暴露された場合のT細胞によるイフェクター機能の誘導の減少または欠損を指す。本発明の薬学的組成物は、インビトロまたはインビボで抗原に対するT細胞の不応性を誘導、維持または逆転させる手段を提供する。したがって、本発明の化合物は(抗原特異的)T細胞不応性を調節するために特に有用である。「調節」という用語は不応状態を誘導および維持することおよび不応状態の逆転、例えばT細胞反応性の回復を含むと解釈される。
【0076】
実施例3に記述するように、抗TIRC7抗体処理後、外から加えたIL-2が抗体の抗増殖作用を逆転したため、T細胞は不応性のままであるが機能的状態である。このように、もう一つの態様において、本発明は、TIRC7膜蛋白質を通じてT細胞の刺激を阻害する物質とT細胞を接触させることを含む、抗原に対するT細胞の不応性を誘導または維持するためのインビトロ法に関する。T細胞不応性を調節する方法を実施する方法のレシピは一般的に当業者に既知であり、例えば、国際公開公報第95/24217号および本明細書に引用した参考文献に記述されている。
【0077】
従って、本発明はまた、被験者において抗原に対するT細胞不応性を誘導または維持するために、TIRC7膜蛋白質を通じてT細胞刺激を阻害する物質を薬学的組成物の調製に使用することに関する。本発明の方法および使用は、当業者による解釈に応じてプライミングした、またはプライミングしていないT細胞と共に用いてもよい。
【0078】
好ましくは、本発明の方法または使用において、物質はTIRC7膜蛋白質とそのリガンドとの相互作用を遮断する。上記のように、本発明の範囲内で行われた実験の結果から、TIRC7蛋白質と相互作用し、それによってT細胞増殖を刺激するリガンドが存在することが示唆される。そのような相互作用を、例えばTIRC7膜蛋白質に由来する抗体または(ポリ)ペプチドによって遮断すれば、T細胞不応性を起こすはずである。このように、本発明の方法または使用の好ましい態様において、物質は本明細書にこれまでに記述したように、ポリヌクレオチド、ベクター、細胞、ペプチドもしくはポリペプチド、または抗体である。
【0079】
本発明のもう一つの好ましい態様において、上記方法または使用は、上記のように第二の物質の使用をさらに含む。
【0080】
もう一つの態様において、本発明はTIRC7膜蛋白質を通じてT細胞を刺激する第一の物質、および選択的に薬学的に許容される担体を含む薬学的組成物に関する。当業者には直ちに明らかであるように、本発明の新規TIRC7蛋白質を提供することによって、T細胞刺激および対応する疾患の治療に対するもう一つのアプローチの方法が開かれる。TIRC7膜蛋白質を通じてT細胞を刺激する物質は、(活性化)T細胞の増殖を著しく増強すると予想され、このように免疫応答を増強することができる。このタイプの「ワクチン」の例は例えば、国際公開公報第91/11194号および文献、例えば上記引用した文献に記述されている。そのような物質はTIRC7蛋白質コード遺伝子のコード領域の前に、例えば遺伝子トランスファーおよび遺伝子の5'非翻訳領域における相同組換えを通じて、挿入することができる。上記も参照のこと。そのようなプロモーターを調節してもよく、このようにして特定の細胞におけるTIRC7蛋白質の制御された発現が容認される可能性がある。
【0081】
好ましくは、物質はTIRC7膜蛋白質のリガンドであり、または上記の抗TIRC7膜蛋白質抗体の少なくとも1つである。
【0082】
本発明の好ましい態様において、薬学的組成物は、T細胞増殖を刺激する第二の物質、例えばIL-2、IL-4またはCD2、CD28、CD40、またはCTLA4表面受容体を通じてT細胞を刺激する物質をさらに含む。
【0083】
さらなる態様において、本発明は、抗原の存在下でTIRC7膜蛋白質を通じてT細胞を刺激する第一の物質とT細胞を接触させることを含む、抗原に対して不応性であるT細胞による抗原に対する反応性を回復するインビトロ方法に関する。リガンドそのものの応用のほかに、TIRC7リガンドは好ましくは、TIRC7リガンドをコードする核酸分子を細胞表面上でのTIRC7リガンドの発現にとって適した形で細胞に導入することによって細胞表面上に発現してもよい。好ましくは細胞は腫瘍細胞である。そのような核酸分子を導入するベクターおよび方法は当業者に周知であり、例えば上記の文献に記述されている。
【0084】
本発明の方法は、上記の薬学的組成物に関して定義したように、T細胞を第二の物質と接触させる段階をさらに含むことができる。好ましくは、T細胞は第一の物質と接触させる前に第二の物質と接触させる。
【0085】
本発明の方法の好ましい態様において、第二の物質、好ましくはCD2、CD28、CTLA4リガンドまたはCD40は、CD2、CD28、CTLA4リガンドまたはCD40をコードする核酸分子を、細胞表面上での該リガンドの発現に適した形で細胞に導入することによって細胞表面に発現される。
【0086】
もう一つの態様において、本発明はTIRC7膜蛋白質を通じてT細胞を刺激することができる上記で定義した第一の物質を、腫瘍を有する被験者において腫瘍細胞に対するT細胞反応を刺激する薬学的組成物の調製に使用することに関する。そのような物質は例えば、上記の双特異的抗体を含む。好ましくは、腫瘍細胞はTIRC7リガンドおよび/またはCD2、CD28、CTLA4リガンドまたはCD40を好ましくは腫瘍細胞表面に発現するように改変されている。
【0087】
本発明の使用の好ましい態様において、腫瘍細胞は被験者から得て、エクスビボで改変した腫瘍細胞を形成するように改変して、該改変した腫瘍細胞を、被験者に投与するようデザインされる薬学的組成物の調製に用いる。
【0088】
本発明の使用のもう一つの好ましい態様において、T細胞を被験者から得て、エクスビボでIL-2またはIL-4と接触させて、被験者に投与するようデザインされる薬学的組成物の調製に該改変T細胞を用いる。
【0089】
本発明の特に好ましい態様において、使用、方法および薬学的組成物は、骨髄移植または末梢幹細胞移植のレシピエントである被験者に適用すると解釈される。好ましくは薬学的組成物はレシピエントに移植する前に骨髄または末梢幹細胞と接触するようデザインされる。
【0090】
さらに特に好ましい態様において、本発明の方法および使用は、臓器移植、末梢幹細胞移植、または自己免疫疾患もしくはアレルギーの治療に適用される。
【0091】
さらに、本発明は以下を含む、T細胞活性化もしくは共刺激化合物を同定する、またはT細胞活性化および刺激の阻害剤を同定する方法に関する;
(a)上記のTIRC7蛋白質、(ポリ)ペプチド、抗体または細胞の存在下で、および選択的にT細胞活性化に反応して検出可能なシグナルを提供することができる成分の存在下で、TIRC7蛋白質、(ポリ)ペプチド、抗体または細胞と化合物との相互作用が起こるような条件下でスクリーニングする化合物と共にT細胞を培養する段階;
(b)化合物と細胞の相互作用から生じたシグナルの有無を検出する段階。
【0092】
本発明の方法において「化合物」という用語は、単一の物質または同一であってもなくてもよい複数の物質を含む。
【0093】
化合物は、例えば試料、例えば植物、動物、または微生物からの細胞抽出物に含まれていてもよい。さらに、化合物は当技術分野において既知であるがこれまでT細胞活性化を阻害することが知られていない、またはT細胞共刺激因子として有用であることが知られていない化合物であってもよい。複数の化合物を例えば、培養培地に加えてもまたは細胞に注射してもよい。
【0094】
化合物(一つまたは複数)含む試料が本発明の方法において同定されれば、疑われる化合物を含むと同定された最初の試料から化合物を単離することが可能であるか、または最初の試料をさらに分けて、例えばこれが複数の異なる化合物を含む場合、試料あたりの異なる物質数が減少するように、最初の試料を分割する方法を繰り返すことが可能である。次に、本明細書および添付の実施例に記述のような当技術分野で既知の方法によって、試料または化合物が所望の特性を示すか否かを決定することができる。試料の複雑さに応じて、上記の段階は数回、好ましくは本発明の方法に従って同定された試料が限られた数の物質のみまたは唯一の物質(複数)を含むまで行うことができる。好ましくは試料は、類似の化学および/または物理的性質を有する物質を含み、最も好ましくは物質は同一である。本発明の方法は、例えば先行技術に記載されたその他の細胞に基づくアッセイ法に従って(例えば、欧州特許A 0 403 506号を参照のこと)、または添付の実施例に記述の方法を用いて改変することによって、当業者によって容易に実施およびデザインすることができる。さらに、当業者は本発明の方法を実施するためにさらなる化合物および/または細胞、例えばB細胞、インターロイキン、または必要であれば例えばT細胞活性化を刺激または抑制する前駆体へと特定の化合物を変換する酵素、または共刺激シグナルを提供する酵素を用いてもよいと容易に認識するであろう。本発明の方法をそのように応用することも当業者の技術範囲内であり、過度の実験を行うことなく実施することができる。
【0095】
本発明の方法に従って用いることができる化合物には、ペプチド、蛋白質、cDNA発現ライブラリを含む核酸、抗体、有機小分子、リガンド、ペプチド模倣体、PNA等が含まれる。化合物はまた既知のT細胞活性化剤または阻害剤の機能的誘導体または類似体となりうる。化学的誘導体および類似体の調製法は当業者には周知であり、例えば、ベイルスタイン(Beilstein)、「有機化学ハンドブック(Handbook of Organic Chemistry)」、スプリンガー(Springer)編、ニューヨークインク、10010 ニューヨーク市5番街175、アメリカ、および「有機合成(Organic Synthesis)」、ウィリー、ニューヨーク、アメリカに記述されている。さらに、誘導体および類似体は、当技術分野に既知の方法に従って、または添付の実施例に記述のようにその作用を調べることができる。さらに、下記の方法に従って、T細胞活性化の適当な活性化剤または阻害物質のペプチド模倣体および/またはコンピューターによるデザインを用いることができる。相補的構造モチーフに対するコンピューター補助調査によって、適当なコンピュータープログラムを、推定の阻害剤とTIRC7蛋白質との相互作用部位の同定に用いることができる(ファッシナ(Fassina)、Immunomethods 5(1994)、114〜120)。さらに、蛋白質またはペプチドをコンピューターによってデザインするために適当なコンピューターシステムは、先行技術において、例えばベリー(Berry)、Biochem. Soc. Trans. 22(1994)、1033〜1036;ウォダック(Wodak)、Ann. N. Y. Acad. Sci. 501(1987)、1〜13;パボ(Pabo)、Biochemistry 25(1986)、5987〜5991 に記述されている。上記コンピューター分析から得られた結果は、例えば既知のT細胞活性化剤または阻害剤を最適にするために本発明の方法と組み合わせて用いることができる。適当なペプチド模倣体はまた、一連の化学改変を通じてのペプチド模倣体組合せライブラリの合成および、例えば本明細書および添付の実施例に記述の方法によって得られた化合物を調べることによって同定することができる。ペプチド模倣体の組合せライブラリの作製および使用法は先行技術、例えばオストレッシュ(Ostresh)、Methods in Enzymology 267(1996)、220〜234、およびドーナー(Dorner)、Bioorg. Med. Chem. 4(1996)、709〜715において記述されている。さらに、T細胞刺激の阻害剤または活性化剤の3次元および/または結晶学的構造を、本発明の方法において調べるT細胞刺激のペプチド模倣体の阻害剤または活性化剤のデザインに用いることができる(ローズ(Rose)、Biochemistry 35(1996)、12933〜12944;ルーテンベール(Rutenber)、Bioorg. Med. Chem. 4(1996)、1545〜1558)。
【0096】
要約すると、本発明はT細胞媒介免疫応答を調節することができる化合物を同定する方法を提供する。したがって、本発明の方法に従って、T細胞刺激の阻害剤または活性化剤としてそれぞれ同定される化合物はまた、本発明の範囲内である。
【0097】
T細胞媒介反応を活性化することが判明した化合物は癌および関連疾患の治療に用いてもよい。さらに、化合物はウイルス疾患を特異的に阻害し、それによってウイルス感染またはウイルス伝搬を防止することができるかも知れない。T細胞活性化または刺激の抑制物質として同定される化合物は、例えば皮膚疾患を治療するために(例えば、国際公開公報第93/06866号)または移植片拒絶を防止するために同種異系もしくは異種細胞においてまたは臓器移植において用いることができる;上記も参照のこと。
【0098】
本発明の方法に従って同定された、または得られた化合物はこのように、診断および特に治療的応用において非常に有用であると予想される。
【0099】
したがって、さらなる態様において、本発明は発明の上記方法の段階(b)において同定された化合物を、薬学的に許容される形で製剤化および選択的に合成することを含む、薬学的組成物の産生法に関する。従って、本発明は一般に本発明の蛋白質、(ポリ)ペプチド、ポリヌクレオチド、ベクター、抗体または化合物を、該物質の治療的有効量を患者に提供するために十分量を合成することを含む治療物質を作製する方法に関する。これらの物質を合成する方法は、当技術分野で周知であり、例えば上記に記述される。
【0100】
本発明の方法に従って同定される治療的に有用な化合物は、特定の化合物に対して適当な方法で、例えば経口、静脈内、非経口、経皮、経粘膜、または手術もしくは化合物の作用が望まれる部位もしくはその近傍での植え込み(例えば化合物が固体または半固体の生物学的適合性で吸収性のマトリクス形状である場合)によって患者に投与してもよい。治療用量は当業者によって適当と思われる量が決定される、上記も参照のこと。
【0101】
そのような有用な化合物は例えば、本発明のTIRC7蛋白質と結合するトランス作用因子となりうる。トランス作用因子の同定は当技術分野の標準的な方法に従って実施することができる(例えば、サムブルック(Sambook)、上記およびアウスユベール(Ausubel)、上記を参照のこと)。蛋白質が本発明のTIRC7蛋白質に結合するか否かを決定するために、標準的な未変性ゲルシフト分析を行うことができる。本発明のTIRC7に結合するトランス作用因子を同定するために、本発明のポリペプチドおよびペプチドを標準的な蛋白質精製法においてアフィニティ試薬として、または発現ライブラリをスクリーニングするためのプローブとして用いることができる。トランス作用因子が同定されれば、本発明のTIRC7蛋白質に対するトランス作用因子の結合に対する阻害剤のスクリーニングから始めて、本発明のTIRC7蛋白質に対するその結合の調節を追跡することができる。TIRC7特異的遺伝子の活性化または抑制はトランス作用因子(もしくはその阻害剤)、またはそれをコードする遺伝子を例えば、本明細書おいて上記の態様において記述したベクターに適用することによって、被験者において得ることができる。さらに、トランス作用因子の活性型がダイマーである場合、その活性を阻害するためにトランス作用因子のドミナントネガティブ変異体を作製することができる。さらに、トランス作用因子の同定に基づき、本発明のTIRC7蛋白質をコードする遺伝子の活性化(例えば、シグナル伝達)または抑制に至る経路におけるさらなる成分を同定することができる。そうすれば本発明のTIRC7蛋白質の発現または活性を調節するさらなる薬剤および方法を開発するために、これらの成分の活性の調節を追求することができる。
【0102】
本発明のポリヌクレオチドを、遺伝子療法に利用するためおよび相同な分子を同定するために使用するという上記の可能性の他に、記述のポリヌクレオチドを他のいくつかの応用に、例えば上記のTIRC7蛋白質と相互作用する蛋白質をコードする核酸分子を同定するために用いてもよい。これは、いわゆる「酵母の2ハイブリッド系」を用いることによって、スコフィールド(Scofield 、Science 274(1996)、2063〜2065)に記述のような当技術分野で周知のアッセイ法によって得ることができる。この系において、本発明のポリヌクレオチドによってコードされる(ポリ)ヌクレオチド、またはそのより小さい部分はGAL4転写因子のDNA結合ドメインに結合している。この融合蛋白質を発現し、GAL4転写因子によって認識される適当なプロモーターによって駆動されるlacZリポーター遺伝子を含む酵母の株を、動物、好ましくは活性化ドメインと融合した哺乳類の蛋白質またはそのペプチドを発現するcDNAライブラリによって形質転換する。このように、cDNAの一つによってコードされるペプチドが本発明の(ポリ)ペプチドを含む融合蛋白質と相互作用することができれば、複合体はリポーター遺伝子の発現を指向することができる。このようにして、本発明のポリヌクレオチドおよびコードされるペプチドはTIRC7蛋白質と相互作用するペプチドおよび蛋白質を同定するために用いることができる。
【0103】
本発明のTIRC7蛋白質またはそのような分子をコードする核酸分子と相互作用する化合物を同定するその他の方法は、例えば、ファージディスプレイ系によるインビトロスクリーニングと共にフィルター結合解析、または例えばBIAコア装置(ファルマシア社)を用いた相互作用の「リアルタイム」測定である;上記引用文献を参照のこと。
【0104】
さらに、本発明は本発明のポリヌクレオチド、ベクター、ペプチド、ポリペプチド、抗体および細胞と共に、上記の本発明の方法に従って同定された化合物を、T細胞活性化を含み、Th1およびTh2免疫応答に関連した疾患を治療するため、同種異系および異種臓器移植ならびに骨髄移植者の急性および慢性拒絶を治療するため、リウマチ性関節炎、紅斑性狼瘡、多発性硬化症、脳炎、血管炎、真性糖尿病、膵炎、胃炎、甲状腺炎を治療するため、T、B、もしくはNK細胞の悪性障害を治療するため、喘息、レプラマトーシス(lepramatosis)、ヘリコバクター・ピロリ関連胃炎を治療するため、または皮膚腫瘍、副腎腫瘍もしくは肺腫瘍を治療するための薬学的組成物の調製に使用することに関する。
【0105】
本発明のポリヌクレオチド、ベクター、蛋白質、(ポリ)ペプチド、抗体、阻害物質、活性化物質、薬学的組成物、使用および方法は、これまでT細胞の調節に関連している、または依存していることが知られていない全ての種類の疾患の治療に用いることができる。本発明の薬学的組成物、方法および使用は望ましくはヒトにおいて用いられるが、動物の治療もまた本明細書に記述の方法および使用に含まれる。
【0106】
これらおよびその他の態様は本発明の説明および実施例によって開示され、含まれる。本発明に従って用いられる抗体、方法、使用および化合物のいずれか一つに関するさらなる文献は、公共の図書館およびデータベースから、例えば電子機器を用いて検索してもよい。例えば、インターネット上で利用できる公共のデータベースである「メッドライン」http://www.ncbi.nlm.nih.gov/pubMed/medline.htmlを用いてもよい。http://www.ncbi.nlm.nih.gov/、http://www.infobiogen.fr/、http://www.fmi.ch/biology/research_tools/html、http://www/tigr.org/のようなさらなるデータベースおよびアドレスは当業者に既知であり、例えばhttp://www.lycos.comを用いて得ることができる。バイオテクノロジーにおける特許情報の概要ならびにレトロスペクティブ調査用および現状認識に有用な関連特許情報源の調査は、バークス(Berks)、TIBTECH 12(1994)、352〜364において得られる。
【0107】
本発明およびその多くの利点は、以下の実施例の説明によってよりよく理解されると思われる。
【0108】
実施例
実施例1:アロ活性化ヒトT細胞において異なるように発現される遺伝子をコードする新規膜蛋白質(TIRC7)のクローニング
アロ抗原に反応したT細胞活性化の初期段階の際に誘導される新規遺伝子を同定するために、ヒトリンパ球混合培養(MLR)の開始後0時間および24時間にmRNAの示差表示RT-PCR分析を実施した。ヒト実験に関する施設内規定に従って、末梢血リンパ球(PBL)を健康なボランティアから標準的なフィコール遠心法を用いて単離して、10%仔ウシ胎児血清を含むRPMIに希釈した。放射線照射した(3000 rad、13分)刺激性PBLの等量によって反応性PBLを刺激した。細胞を組織培養フラスコにおいて、RNAを単離するために106個/mlの初回濃度で24時間共培養した。RNAゾルB法(テルテスト・インク)を用いてMLRから0および24時間目に総RNAを単離し、既に記述されているように(コジマ(Kojima)ら、1996)示差表示を行った。簡単に説明すると、総RNA 2μgをオリゴ-dTプライマーおよび200 U MMLV逆転写酵素(ギブコ/BRL社)を用いて逆転写した。cDNA 1μg、1.25 mM MgCl2、50 mM KCl、10 mMトリス塩酸(pH 8.3)、2.5 nMプライマー、5μCi 35S-dATP、および0.3 UTaqポリメラーゼを用いて、総量10 μlでPCR増幅40サイクルを実施した。PCR増幅に用いたプライマーは5'-GACGGAACAGCTTC-3'(配列番号:10)および5'-TGCGTCTGGTTCT-3'(配列番号:11)であった。PCR産物を4℃で保存して6%ポリアクリルアミド・尿素ゲル中の電気泳動によって分離して、フィルターにトランスファーして乾燥させてオートラジオグラフを行った。異なるように発現されたcDNA断片をゲルから切り出して、溶出させて、再増幅させ、pBluescriptSK+プラスミドにクローニングして、ハワード・ヒューズバイオポリマー研究所またはハーバード・メディカルスクールのダナハーバー癌研究所バイオポリマー研究所でシークエンシングを行った。相同性の調査はNCBIでBLASTを用いて行った。配置はジーンワークス2.1.1.を用いて行った。図1Aに示すように、刺激の24時間後に誘導される350 bp cDNA断片を同定して、これを用いてヒトT細胞のλ-gt-10 cDNAライブラリからいくつかのクローンを同定した。PHAによって48時間活性化したヒトT細胞から調製したλgt-10 cDNAライブラリ(クロンテック社)を350 bp TIRC7 cDNA断片とによってスクリーニングした。簡単に説明すると、異なるcDNAクローン1,200,000個のプラークを32P-標識cDNAと、40%ホルムアミド、10%硫酸デキストラン、4×SSC(1×SSCは150 mM NaCl、15 mMクエン酸ナトリウムを含む、pH 7.0)、0.8×デンハート溶液(1×デンハート溶液は0.02%ポリビニルピロリドン、0.02%フィコール、0.02%ウシ血清アルブミンを含む)、0.5%ドデシル硫酸ナトリウム(SDS)、およびサケ精子DNA 20 mgを含む溶液中で42℃で24時間ハイブリダイズさせた。フィルターを室温で、2×SSC、10%SDSによって20分を2回洗浄して、0.2×SSC、10%SDS中で65℃で30分洗浄した後、オートラジオグラフィーを行った。陽性クローン3個を選択してプラークを精製した。cDNAはプライマーウォーキング法を用いて双方向にシークエンシングした。TIRC7のORF cDNAを含む2kb cDNAプローブを用いてPACゲノムライブラリをスクリーニングし、TIRC7およびOC116の全ゲノムcDNAを双方向にシークエンシングした。配列分析により、1842 ヌクレオチドのオープンリーディングフレームを含み、蛋白質の推定の長さがアミノ酸614個(配列番号:2)(図1B)である、2488 bpのcDNA(配列番号:1)が認められ、これをTIRC7(T細胞免疫応答cDNA7;Genbankアクセッション番号;AF025374)と命名した。さらに、他のTIRC7 cDNAによってコードされる蛋白質のアミノ酸配列と、アミノ酸121位でアミノ酸置換(アルギニン→グルタミン)1個が存在することを除いては同一であるアミノ酸配列をコードするTIRC7の第二のcDNAをクローニングした(配列番号:12)。したがって、両cDNAはTIRC7コード遺伝子の対立遺伝子を表すという結論に達した。蛋白質配列の疎水性分析から、7個の疎水性ドメインが明らかになり、これは膜貫通ドメインと矛盾しない。TIRC7のN末端はコンセンサスシグナルペプチド配列を欠損し、その後に細胞内N末端および細胞外方向のCドメインの形状を予想する7個の疎水性ドメインが続いた(図2)。TIRC7はPKCの燐酸化部位(アミノ酸58、98、および148位)ならびにPKA(アミノ酸21位)と共に、N結合グリコシル化部位(アミノ酸267位および287位)を含む翻訳後改変の多数の推定部位を含む。T細胞活性化に関与することが知られている如何なる蛋白質ともアミノ酸相同性を認めなかった。TIRC7は多様な種において液胞のプロトンポンプH+-ATPアーゼ(VPP)の推定サブユニットとして報告されているいつかの蛋白質とアミノ酸相同性を共有しなかった(12〜83%)(ボウマン(Bowman)ら、1988;リー(Lee)ら、1990;ペン(Peng)ら、1994;ペリン(Perin)ら、1991、マノルソン(Manolson)ら、1992、マノルソン(Manolson)ら、1994;ソリオズ&デービース(Solioz and Davies)、1994;リ(Li)ら、1996)。TIRC7の完全なゲノムDNA構築の分析から、TIRC7と、OC116と呼ばれる(リ(Li)ら、1996)最近報告されたヒト破骨細胞特異的cDNAとが、同じ遺伝子の異なるスプライシングによって得られた転写物であることが判明した。OC116の機能はこれまで知られておらず、814残基の蛋白質をコードする2640ヌクレオチドのmRNAが、ヒト破骨細胞に限って発現されていることが証明された。TIRC7とこれらの推定のVPPとの最も強い相同性領域は、主に推定膜貫通ドメインおよびC末端である。このように、TIRC7はその機能が明確に解明されていない構造的に関連する膜蛋白質のより大きいファミリーに属する。
【0109】
TIRC7の発現キネティクスを調べるために、アロ抗原活性化リンパ球から得た総RNAのノザンブロット分析を実施した。ノザンブロットは、これまでに記述されているように(コジマ(Kojima)ら、1996)総RNA7〜10 μgを用いて調製した。様々なヒト組織からのRNAを含むポリ(A)+ノザンブロットはクロンテック社から購入した。ノザンブロットは完全長のTIRC cDNAまたはTIRC7-特異的cDNA断片(ヌクレオチド52〜391位)をプローブとして調べた。32P標識cDNAプローブ(106 cpm/μl)によって42℃で40%ホルムアミド、10%硫酸デキストラン、4×SSC、7 mMトリス(pH 7.6)、0.8×デンハート溶液、0.02 mg/mlサケ精子DNA、および10%SDS中で、一晩ハイブリダイゼーションを実施した。ブロットを2×SSCおよび0.1%SDS中で室温で20分を2回洗浄して、0.2×SSC、0.1%SDS中で65℃で1回洗浄して-80℃でオートラジオグラフィーを行った。TIRC7特異的cDNAプローブは、2.5 kbと推定される転写物と共にさらに未知起源の4kbのmRNAを検出した(図3A〜B)。T細胞のアロ活性化の結果、TIRC7発現は24時間で20倍のアップレギュレーションを示した(図3A)。TIRC7発現は一過性であり、1時間では増加を認めず、24時間でピーク発現を示し、72時間でベースライン値に戻った。TIRC7のアップレギュレーションが反応性T細胞集団に起こったことを証明するために、T細胞を枯渇させた刺激性細胞を用いてさらなるMLRを行った。TIRC7発現の誘導または阻害に関する試験のために、PBLをコンカナバリンA(10 ng/ml)、植物性血球凝集素(PHA)(20 mg/ml)、黄色ブドウ球菌(Staphylococcus aureus)エンテロトキシンB(10 μg/ml)、OKT3-mAb(10 mg/ml)、シクロスポリンA(1 mg/ml)、またはrIL-2(10 U/ml)に暴露した。OKT3-mAbによる刺激は、抗体をプラスチック製培養プレート上に4℃で一晩固定化して、その後に細胞懸濁液を加えることによって実施した。CD4+およびCD8+ヒトT細胞からのRNA単離に関しては、抗CD4抗体および抗CD8 IgGをコーティングした免疫磁石ビーズと共にPBLをインキュベートして、その後磁石によって分離した。TIRC7 mRNA発現は共培養の24時間後反応性T細胞において増加することが判明した。
【0110】
カルシニューリン依存的T細胞活性化経路の阻害剤であるシクロスポリンA(Cyc A)は、MLRにおいてTIRC7の誘導を遮断した(図3B)。さらに、外から加えるIL-2はTIRC7発現の強力な誘導物質であったが、黄色ブドウ球菌エンテロトキシンB(SEB)またはOKT3-mAbによる刺激の場合では24時間後にTIRC7発現の中等度の増加を認めたが、OKT3-mAbは48時間後にTIRC7発現をアロ抗原によって誘導されたものと同程度のレベルまで増加させた。対照的に、コンカナバリンA(Con A)も植物性血球凝集素(PHA)のいずれも24時間または48時間においてTIRC7発現を増加しなかった。
【0111】
ノザン分析から、TIRC7がほぼ免疫組織に限って発現され、脾臓、リンパ節、末梢血および虫垂では高レベルのmRNA発現の高レベルを示し、骨髄、胎児肝、および胸腺ではそれぞれ発現レベルはより低いことが判明した。TIRC7はまた、CD4+およびCD8+リンパ球において検出されるが、EBV-形質転換した初代培養B細胞、バーキットリンパ腫細胞、EBV-感染バーキットリンパ腫細胞、および休止期または活性型ジャーカト細胞では検出されなかった。
【0112】
ウェスタンブロット分析では、分子量約75 kDaの単一の蛋白質がヒトリンパ球の膜抽出物において多量に検出された(図4A)。PBLを50 mMトリス(pH 7.59)、150 mM NaCl、1%トライトン、アプロチニン(0.15 U/ml)、20 mMロイペプチン、および1mMフェニルメチルスルホニルフルオライド中で溶解した。溶解物をSDS-PAGEによって分離して、ニトロセルロース・メンブレンにトランスファーした。メンブレンを一次(下記実施例2を参照のこと)および二次抗体と共にそれぞれ1時間インキュベートして、結合した一次抗体をホースラディッシュ・ペルオキシダーゼ結合二次抗体によって検出してその後強化化学発光を行った(ベーリンガー社)。ポリクローナルAb79(下記の実施例2を参照のこと)を5000倍希釈で用いた。ペルオキシダーゼ結合二次抗体(抗ウサギIgG)を2000倍希釈で用いた。TIRC7/c-myc融合蛋白質を検出するために、抗c-myc抗体を1000倍希釈で用いて二次抗体(抗マウスIgG)を2000倍希釈で用いた。CHO細胞およびc-mycタグTIRC7発現ベクターで安定かつ一過性にトランスフェクトしたCOS-7細胞(図4B)からの膜調製物において、同じ蛋白質を認めた。完全長のTIRC7 ORFをc-mycエピトープ配列の上流でクローニングして、哺乳類の発現ベクター(プロメガ社)において融合蛋白質構築物を作製した。COS7細胞の一過性のトランスフェクションおよびCHO細胞の安定なトランスフェクションは、記述のような(シューライン(Schulein)ら、1996)リポフェクタミン・トランスフェクション法によって実施した。抗c-myc抗体(インビトロゲン社)を用いて蛋白質を検出した。TIRC7の細胞膜への局在は、ヒトリンパ球と共に安定にトランスフェクトしたCHO細胞において共焦点顕微鏡およびフローサイトメトリー分析によって確認した。
【0113】
実施例2:TIRC7はT細胞活性化の初期事象の際の必須のシグナルを媒介する
T細胞活性化に必要な多くの蛋白質の機能的重要性は、特異的抗体のターゲティングによるそのシグナル伝達の調節によって決定されている。TIRC7に対して作製された抗体がT細胞増殖反応を変化させるか否かを調べるために、TIRC7蛋白質の異なるドメイン(P1〜P7;配列番号:3〜9)を表す合成ペプチド7個を用いてポリクローナウサギ抗ペプチド抗体(図2)を作製した。TIRC7の抗原性非膜貫通領域はPSORTおよびPC-GENEを用いて同定し、これを短いペプチド配列のデザインに用いた。精製した合成ペプチド(P1〜P7)(ヘンクライン社、ドイツのベルリン)をウサギ(セラミュン、ドイツのベルリン)の免疫に用いた。動物を3および6週間後に追加免役した。異なる7個のペプチド(P1〜P7)に対してポリクローナル抗体を全体で14個作製した。ペプチドをBSAに結合させた後、プールした抗血清をアフィニティクロマトグラフィーによって精製した。全ての抗体をそれぞれのペプチドに関してELISAによって調べた。図5Aに示すように、細胞外ドメインP4、P6およびP2(配列番号:5、7および3)に対して作製された抗体Ab73、Ab76、およびAb79の3つはそれぞれ、アロ活性化T細胞の増殖を87〜93%阻害することが判明した。増殖解析に関しては、反応性PBLを等量の放射線照射刺激性細胞の存在下で、培地のみ、抗体または対照血清と共に丸底96ウェルマイクロタイタープレートに最終容量200 μlとして播種した(全体で2×106個/ml)。抗TIRC7抗血清を5000倍希釈でMLRに加えた。プレートを37℃、5%CO2でインキュベートして、培養の最後の18時間に1ウェルあたり1μCi [3H]-チミジン(ICNバイオケミカルズ社)によってパルスした。プレートを全て回収して、ベータプレート液体シンチレーションカウンターによって計数した。カウントは18時間パルス後の72時間目に回収したウェル4個づつの平均cpmとして表した。補体による細胞の溶解を防止するために、抗体を使用前に52℃で20分間インキュベートした。ペプチドブロッキング実験は、MLRGを開始する前に抗体を適当なペプチドと共に4℃で30分インキュベートすることによって実施した。TIRC7蛋白質を用いた実験に関しては、透析したインビトロ翻訳TIRC7蛋白質の連続希釈液(200倍、300倍、600倍)をMLRSに加えて3H-チミジン取り込みによって阻害を測定した。IL-2、IL-4およびインターフェロン-γのサイトカイン発現は、ELISAによって培養上清中に検出した。IL-2(ラボサーブ)、IL-4(ラボサーブ)、およびIFN-γ(メドジェニックス)に関しては市販のキットを用いた。抗TIRC7抗体はT細胞増殖を用量依存的に阻害した。抗体を特異的に中和するためにそれぞれのペプチドを反応に加えると、阻害は消失した。MLRを開始して24〜72時間後に加えても抗体は作用を示さず、このことはTIRC7媒介シグナルがT細胞反応の初期事象に対して特異的であることを示した。これらの3個の抗TIRC7抗体はまた、ConA、PHA、およびOKT3-mAbによって誘発されるT細胞活性化の有効な阻害をそれぞれ引き起こした。
【0114】
T細胞活性化に関連した膜蛋白質はしばしば、CD28/B7と可溶性蛋白質CTLA4Igとの相互作用を遮断することによって証明されているように(リンスレー(Linsley)、1992)、外因性の可溶性蛋白質によって遮断することができるリガンド受容体相互作用に関係する。したがって、インビトロで翻訳されたTIRC7蛋白質を、0時間で200倍、300倍、600倍希釈液でMLR培養にこれを加えることによってMLRの阻害能の有無を調べた。TIRC7 cDNA2μgを、35Sメチオニン(ICN)を含むインビトロ翻訳TNT溶解系(プロメガ社)において翻訳した。産物をSDS-PAGE(11%)によって可視化して、オートラジオグラフィーを行った。MLR阻害実験に関しては、TIRC7蛋白質をミクロソーム膜の存在下でインビトロで合成した。次に、インビトロ翻訳混合物をPBS 500 μlに懸濁して、PBSに対して24時間透析した。図5Bに示すように、外から加えたTIRC7蛋白質はアロ反応性T細胞の増殖を用量依存的に有意に抑制した。対照実験では、インビトロ翻訳反応混合においてベクターのみ(図5B)またはもう一つの非翻訳cDNAのいずれかを用いて阻害を認めなかった。
【0115】
実施例3:TIRC7媒介シグナルのターゲティングはTh1特異的サイトカイン発現を阻害し、これは外因性rIL-2によって逆転する。
【0116】
TIRC7によって媒介されるシグナルがT細胞サブセットに異なる影響を及ぼすか否かをさらに識別するために、ヒトT細胞にOKT3-mAb、ConAまたはPHAのいずれかを処置して、Th1およびTh2リンパ球サブセット特異的サイトカインプロフィールを抗TIRC7抗体の存在下または非存在下において分析した。図5Cに示すように、PHAで刺激したリンパ球の全ての培養において、48時間目にTh1特異的サイトカインであるIL2およびIFN-γの有意な減少を認めた。調べた3つのマイトゲンの中で、ConAおよびPHA活性化培養では24時間目にIL2およびIFN-γのダウンレギュレーションが起こったが、OKT3-mAb刺激T細胞は24時間目でIL-2の有意な減少を示したがIFN-γの減少は48時間後のみであった。Th2リンパ球に特異的であるIL-4産生のダウンレギュレーションは、24および48時間後ではマイトゲン活性化T細胞のいずれにおいても認めなかった。注目すべきことに、組換え型IL-2を、抗TIRC7抗体と共にインキュベートしたマイトゲン活性化培養に外から加えると、減少したT細胞増殖が回復した(図5D)。
【0117】
実施例4:TIRC7抗体ターゲティングは腎同種異系移植片のインビボでの定着を有意に延長する
TIRC7媒介シグナルを調節する作用を、ウィスター・ファース(Wister Furth)系からルイス(Lewis)系ラットへの腎移植を特徴とする動物モデルにおいて調べた。雄性近交系ラット200〜250 g(ハーラン・ウィンクルマン社、ドイツ)を実験全体に使用した。ウィスター・ファース系ラット(WF、RT1u)の移植片を両側の腎臓を摘出したルイス系ラット(LEW、RT11)に顕微鏡外科技法を用いて移植した;虚血時間は30±5分であった。凍結切片をホルマリンで固定した。固定した組織をパラフィンで抱埋して組織切片をヘマトキシリン・エオジンで染色した。最初の実験では、放射線照射したウィスター・ファース系ラットのリンパ球によってインビトロで刺激したルイス系ラットのリンパ球の増殖を抗ヒトTIRC7抗体が阻害するか否かを調べた。Ab73はラットT細胞増殖を強く遮断することが示された。腎移植実験では、動物を無処置(n=7)のまま、免疫前のウサギ血清(n=7)または抗TIRC7抗体Ab73(n=7)のいずれかを移植の2時間前、直後、および移植後1、2、4および6日目に投与した。抗TIRC7抗体処置群では一過性の軽度の下痢を認めたことを除いては、副作用を認めなかった。抗TIRC7抗体は処置動物の移植定着時間を有意に延長した(p<0.001)。抗TIRC7処置動物のアロ移植片7個中6個が抗体投与終了後45日以上機能していた。抗TIRC7抗体で処置した動物1匹が21日目に死亡した。対照的に、双方の対照群の動物は移植後7〜9日までに腎不全のために死亡した(図6)。移植後7日目に屠殺した抗体処置動物さらに2匹からの腎移植片の組織学的検査では、非常に軽度のリンパ球浸潤が認められたが組織壊死の徴候は認められなかった(図7B)。対照的に対照動物からの腎移植片は、広汎な単核球浸潤と共に広範囲の壊死領域を含む急性移植片拒絶の著しい証拠を示した(図7A)。
【0118】
要約:TIRC7は新規T細胞アクセサリ蛋白質である
TIRC7はT細胞活性化において必須の役割を果たす新規蛋白質である。T細胞受容体の刺激後初期にTIRC mRNAのレベルは一過性に増加する。T細胞をIL-2と共にインキュベートした後にもTIRC7 mRNAのアップレギュレーションが認められ、TIRC7アップレギュレーションの遮断がシクロスポリンAによって得られることから、発現のこのような増加はIL-2依存的経路に依存するように思われる。ConAまたはPHAのようなマイトゲンによるT細胞刺激はTIRC7発現を一貫してアップレギュレートすることができない。TIRC7は、胸腺、骨髄および胎児肝では発現は低いものの、全てのリンパ様組織において発現されるため、組織発現パターンから、TIRC7が成熟したリンパ様細胞の産物であることが示唆される。TIRC7蛋白質は細胞膜上に多量に発現され、外部リガンドに対する標的と一致する。7個の膜貫通ドメイン構造から3つの細胞外ループおよび細胞外方向のカルボキシ末端が予想される。
【0119】
蛋白質の細胞外ドメインに対して作製した抗TIRC7抗体は、リンパ球混合培養においてアロ活性化に反応した、またはマイトゲンに反応したT細胞の増殖を有効に抑制することができるが、蛋白質の推定細胞内ドメインを認識する抗体は抑制しなかった。異なる多様な刺激経路によって誘導されたT細胞に抗TIRC7抗体が阻害作用を及ぼすことから、TIRC7がT細胞活性化において中心的な役割を果たしていることが示唆される。その上、TIRC7の抗体ターゲティングによってMLRにおいてT細胞増殖が阻害されたことは、TIRC7と特異的に相互作用するリガンドが存在することを示唆している。この仮説は、インビトロで翻訳された可溶性TIRC7蛋白質の存在下ではMLRにおいてT細胞増殖が用量依存的に阻害されることが根拠となっている。
【0120】
TIRC7は、マウスT細胞株から単離された蛋白質であるJ6B7と38%のアミノ酸相同性を示す(リー(Lee)ら、1990)。TIRC7と同様に、J6B7は、推定のラットH+-ATPアーゼサブユニットVPP116とかなりの相同性を示す(マノルソン(Manolson)ら、1992 )。インビトロで翻訳されたJ6B7蛋白質は、MLRにおけるマウスT細胞増殖を89%阻害することが示され、これは本試験のヒトMLRにおいてインビトロで翻訳された可溶性TIRC7蛋白質について得られた結果と同等である。
【0121】
TIRC7の抗体ターゲティングは、IL-2およびIFN-γサイトカイン産生を阻害するが、IL-4サイトカイン産生を阻害しないことによって示されるように、Th1リンパ球サブセットに対して選択的阻害作用を有する。抗TIRC7抗体処置を行うと、外から加えた組換え型IL-2が抗TIRC7抗体の抗増殖作用を逆転したことから、細胞は無反応性のままであるが機能的であるように思われる。抗TIRC7抗体がインビボラット腎移植モデルにおいて同種異系移植片拒絶を防止するか否かはインビトロ試験で得られた知見を反映する。その上、TIRC7の抗体ターゲティングの作用は共刺激分子のターゲティングによって認められた結果と非常に類似している。TIRC7は既知のT細胞アクセサリ分子のいずれとも構造的または配列相同性を示さない。このように、TIRC7はT細胞活性化の過程において初期に誘導される明確なシグナル伝達経路に関与する可能性がある。
【0122】
TIRC7と既知のT細胞アクセサリ分子との間に機能的類似性が存在すると仮定すると、TIRC7の構造的新規性によってT細胞反応における独自の機構の理解がさらに深まるであろうと予想される。その上、抗TIRC7抗体がインビボで同種異系移植片の定着を有意に顕著に延長することができることは、ヒト臓器移植および自己免疫疾患における望ましからぬT細胞活性化の選択的阻害に対する新規アプローチとなる。
【0123】
当業者は、日常的な実験のみを用いて本明細書に記述した本発明の特定の態様と同等な多くの態様を認識する、または確認することができるであろう。そのような同等の態様は、以下の請求の範囲に含まれると解釈される。
【0124】
参考文献
【0125】
本開示は参照として本明細書に組み入れられる添付の図面と共に最もよく理解されると思われる。
【図面の簡単な説明】
【図1】 アロ活性化T細胞からのTIRC7の同定
(A)ヒトT細胞をアロ活性化した24時間後にアップレギュレートされた350bp転写物の示差表示同定。それぞれのレーンは活性化の0または24時間後のいずれかにおける一方向MLRからのmRNA発現パターンを示す。異なる2つのMLR(aおよびb)は、遺伝子発現の類似のパターンを示した。
(B)TIRC7 cDNAのヌクレオチド配列。
TIRC7転写物のcDNAおよび導出した614個のアミノ酸配列を示す。推定膜貫通領域を下線の太字で示す。
【図2】 TIRC7の推定二次構造
TIRC7蛋白質の推定二次構造は7個の膜貫通ドメイン(TM)を含む。推定の細胞内アミノ末端(NH3)、細胞外カルボキシ末端(COOH)、および最大の細胞内(IC)および細胞外(EC)ループの配列に従って合成したペプチド(P1〜P7)を用いて、ウサギ抗TIRC7ポリクローナル抗体を産生した。T細胞反応調節作用を有する抗TIRC7抗体を枠の中に示す。
【図3】 TIRC7はT細胞活性化においてアップレギュレートされ、細胞膜に局在する。
(A)TIRC mRNA発現はアロ刺激ヒトT細胞においてアップレギュレートされている。MLR-0およびMLR-24はそれぞれ、同種異系反応性リンパ球と刺激性リンパ球を共にインキュベートした後の0時間および24時間目の時点を示す。
(B)MLR(24時間)におけるTIRC mRNAアップレギュレーションはシクロスポリンA(Cyc A)によって予防される。
【図4】 TIRC7蛋白質の局在
(A)ヒトリンパ球の膜蛋白質抽出物において、単一の75 kDa蛋白質が抗TIRC7抗体(Ab79を示す)によって多量に検出される。TIRC7に対するAb79の結合はそれぞれのペプチドP2(Ab+P2)の存在下で消失する。
(B)同じ単一の75 kDa蛋白質はまた、c-mycタグTIRC7発現ベクター(COS7-t)によって一過性にトランスフェクトさせたCOS-7細胞の膜調製物においても抗c-myc抗体によって検出されるが、トランスフェクトしていないCOS-7細胞(COS7-nt)では検出されない。
【図5】 抗TIRC7抗体はT細胞増殖およびIL-2産生を阻害する。
(A)細胞外に存在するTIRC7ペプチド(P4、P6、P2)に対して作製した抗TIRC7抗体(Ab73、Ab76、Ab79)は、[3H]-チミジン取り込みによって測定すると、アロ抗原刺激T細胞の増殖を阻害する。抗体をそれぞれのペプチドとプレインキュベートすると阻害は消失した。24時間後のMLRにおける増殖を陽性対照として示す。増殖は免疫前の血清(対照Ab)によって影響を受けなかった。それぞれのバーは異なる7実験の平均値およびSDを表す。
(B)外因性TIRC7蛋白質による増殖の阻害
一方向MLRにおいて、インビトロで翻訳されたTIRC7蛋白質は用量依存的に増殖を阻害した。蛋白質希釈液を示す。インビトロ翻訳調製物においてベクターのみ(vecter)または非翻訳cDNA(unrel)を用いる場合には、増殖阻害を認めなかった。
(C)抗TIRC7抗体はTh1特異的サイトカイン発現を阻害する。PHAによって刺激したヒトリンパ球をAb73、Ab76、およびAb79と共にそれぞれインキュベートした。マイトゲン刺激培養上清を24時間および48時間目に採取した。上清中のサイトカイン発現をELISAによって決定した。それぞれのバーは異なる3連の実験の平均値およびSDである。
(D)PHA活性化T細胞の増殖の抗TIRC-7抗体媒介性阻害は外因性IL-2により再構成される。各バーは、異なる3連の実験の平均値およびSDである。
【図6】 抗TIRC7抗体のインビボターゲティングは同種異系移植片の定着を有意に延長する。
(A)ウィスター・ファース(Wister Furth)系ラット腎同種移植片を移植したルイス(Lewis)系ラットレシピエントに、抗TIRC7 Ab73(n=7)、免疫前血清からの対照抗体(n=7)、または無処置のいずれかを行った。処置は移植の2時間前および移植直後に行い、移植後1、2、4、および6日に繰り返した。対照抗体を処置した動物の平均生存日数は8±1日であり、無処置対照群を表す動物の平均生存日数は7±2日であった。実験群の動物7匹中6匹が機能的移植片を45日以上維持した。抗TIRC7抗体を処置した実験群のラット1匹は21日の生存期間を示した。移植45日後に評価すると、この群の平均生存日数は41.5日であった(対照と比較してp<0.001)。
【図7】 移植7日後の腎同種異系移植片の組織学的分析
(A)対照抗体を投与したラットの腎同種異系移植片は、重度の組織破壊および広汎な単球浸潤を示し、これは無処置動物の腎同種移植片における組織学的所見と類似であった。
(B)さらに2つの抗TIRC7抗体を処置して7日目に屠殺した動物の腎同種異系移植片は、非常に軽度の単球の間質内浸潤を示した。これらの動物の同種異系移植片では組織病変は同定されなかった。
【配列表】
(1) 一般情報:
(i) 出願人:
(A) 名称: Dr. Utku
(B) 街路名: Knesebeckstr. 5
(C) 市名: Berlin
(D) 州名: none
(E) 国名: Germany
(F) 郵便番号:10623
(ii) 発明の名称:A novel T-cell membrane protein (TIRC7) and
uses thereof
(iii) 配列数:13
(iv) コンピューター読み取りフォーム:
(A) メディア形式: Floppy disk
(B) コンピューター:IBM PC compatible
(C) 運転システム: PC-DOS/MS-DOS
(D) ソフトウェア: PatentIn Release #1.0, Version #1.30 (EPO)
(2) 配列番号:1の情報:
(i) 配列の特性:
(A) 配列の長さ: 2488塩基
(B) 配列の型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー: 直鎖状
(ii) 配列の種類: cDNA
(iii) ハイポセティカル: NO
(ix) 配列の特徴:
(A) 特徴を表す記号: CDS
(B) 存在位置: 537..2378
(xi) 配列の記載:配列番号:1:
GGACGCCCCT GCTCCAGGCC CCCGGGGGGC CGCACCAGGA CCTGAGGGTC AAGTGAGTGA 60
GGGATGACCT CATGCCCTTT CTGGCCAGCC CAGAACCCCT GGCCAGTCGC TGGGCTGGGC 120
CAGGCTGAGC TCCGACTCCT TGTCCAGTGC TCTCCCCAGG CTGGCCCCGC CTCCTCCTTC 180
AGGCCCGGAA CTTCCCACAG TCCCAAGCCC TAGCCCTAGG GGGTTCTCCT CTTCTGGTCC 240
TGCCCGGGAG GCCTCCTGCC TTCCCCTGTG GGCAGGGCCA GTGTGCCCAA TTGCCCGATT 300
GCCCGTGCTG GGCAGGGTCC TGCCCGGGGG GCCTGGTGGG GGAGGCAGGG CAGGAGGTTG 360
GAGCAGCCCT GCCCAGCCCC GTGGCCGCCA GCTTTGTGGC AGGTGCCGTG GAGCCCCACA 420
AGGCCCCTGC CCTAGAGCGC CTGCTCTGGA GGGCCTGCCG CGGCTTCCTC ATTGCCAGCT 480
TCAGGGAGCT GGAGCAGCCG CTGGAGCACC CCGTGACGGG CGAGCCAGCC ACGTGG 536
ATG ACC TTC CTC ATC TCC TAC TGG GGT GAG CAG ATC GGA CAG AAG ATC 584
Met Thr Phe Leu Ile Ser Tyr Trp Gly Glu Gln Ile Gly Gln Lys Ile
1 5 10 15
CGC AAG ATC ACG GAC TGC TTC CAC TGC CAC GTC TTC CCG TTT CTG CAG 632
Arg Lys Ile Thr Asp Cys Phe His Cys His Val Phe Pro Phe Leu Gln
20 25 30
CAG GAG GAG GCC CGC CTC GGG GCC CTG CAG CAG CTG CAA CAG CAG AGC 680
Gln Glu Glu Ala Arg Leu Gly Ala Leu Gln Gln Leu Gln Gln Gln Ser
35 40 45
CAG GAG CTG CAG GAG GTC CTC GGG GAG ACA GAG CGG TTC CTG AGC CAG 728
Gln Glu Leu Gln Glu Val Leu Gly Glu Thr Glu Arg Phe Leu Ser Gln
50 55 60
GTG CTA GGC CGG GTG CTG CAG CTG CTG CCG CCA GGG CAG GTG CAG GTC 776
Val Leu Gly Arg Val Leu Gln Leu Leu Pro Pro Gly Gln Val Gln Val
65 70 75 80
CAC AAG ATG AAG GCC GTG TAC CTG GCC CTG AAC CAG TGC AGC GTG AGC 824
His Lys Met Lys Ala Val Tyr Leu Ala Leu Asn Gln Cys Ser Val Ser
85 90 95
ACC ACG CAC AAG TGC CTC ATT GCC GAG GCC TGG TGC TCT GTG CGA GAC 872
Thr Thr His Lys Cys Leu Ile Ala Glu Ala Trp Cys Ser Val Arg Asp
100 105 110
CTG CCC GCC CTG CAG GAG GCC CTG CGG GAC AGC TCG ATG GAG GAG GGA 920
Leu Pro Ala Leu Gln Glu Ala Leu Arg Asp Ser Ser Met Glu Glu Gly
115 120 125
GTG AGT GCC GTG GCT CAC CGC ATC CCC TGC CGG GAC ATG CCC CCC ACA 968
Val Ser Ala Val Ala His Arg Ile Pro Cys Arg Asp Met Pro Pro Thr
130 135 140
CTC ATC CGC ACC AAC CGC TTC ACG GCC AGC TTC CAG GGC ATC GTG GAT 1016
Leu Ile Arg Thr Asn Arg Phe Thr Ala Ser Phe Gln Gly Ile Val Asp
145 150 155 160
GCC TAC GGC GTG GGC CGC TAC CAG GAG GTC AAC CCC GCT CCC TAC ACC 1064
Ala Tyr Gly Val Gly Arg Tyr Gln Glu Val Asn Pro Ala Pro Tyr Thr
165 170 175
ATC ATC ACC TTC CCC TTC CTG TTT GCT GTG ATG TTC GGG GAT GTG GGC 1112
Ile Ile Thr Phe Pro Phe Leu Phe Ala Val Met Phe Gly Asp Val Gly
180 185 190
CAC GGG CTG CTC ATG TTC CTC TTC GCC CTG GCC ATG GTC CTT GCG GAG 1160
His Gly Leu Leu Met Phe Leu Phe Ala Leu Ala Met Val Leu Ala Glu
195 200 205
AAC CGA CCG GCT GTG AAG GCC GCG CAG AAC GAG ATC TGG CAG ACT TTC 1208
Asn Arg Pro Ala Val Lys Ala Ala Gln Asn Glu Ile Trp Gln Thr Phe
210 215 220
TTC AGG GGC CGC TAC CTG CTC CTG CTT ATG GGC CTG TTC TCC ATC TAC 1256
Phe Arg Gly Arg Tyr Leu Leu Leu Leu Met Gly Leu Phe Ser Ile Tyr
225 230 235 240
ACC GGC TTC ATC TAC AAC GAG TGC TTC AGT CGC GCC ACC AGC ATC TTC 1304
Thr Gly Phe Ile Tyr Asn Glu Cys Phe Ser Arg Ala Thr Ser Ile Phe
245 250 255
CCC TCG GGC TGG AGT GTG GCC GCC ATG GCC AAC CAG TCT GGC TGG AGT 1352
Pro Ser Gly Trp Ser Val Ala Ala Met Ala Asn Gln Ser Gly Trp Ser
260 265 270
GAT GCA TTC CTG GCC CAG CAC ACG ATG CTT ACC CTG GAT CCC AAC GTC 1400
Asp Ala Phe Leu Ala Gln His Thr Met Leu Thr Leu Asp Pro Asn Val
275 280 285
ACC GGT GTC TTC CTG GGA CCC TAC CCC TTT GGC ATC GAT CCT ATT TGG 1448
Thr Gly Val Phe Leu Gly Pro Tyr Pro Phe Gly Ile Asp Pro Ile Trp
290 295 300
AGC CTG GCT GCC AAC CAC TTG AGC TTC CTC AAC TCC TTC AAG ATG AAG 1496
Ser Leu Ala Ala Asn His Leu Ser Phe Leu Asn Ser Phe Lys Met Lys
305 310 315 320
ATG TCC GTC ATC CTG GGC GTC GTG CAC ATG GCC TTT GGG GTG GTC CTC 1544
Met Ser Val Ile Leu Gly Val Val His Met Ala Phe Gly Val Val Leu
325 330 335
GGA GTC TTC AAC CAC GTG CAC TTT GGC CAG AGG CAC CGG CTG CTG CTG 1592
Gly Val Phe Asn His Val His Phe Gly Gln Arg His Arg Leu Leu Leu
340 345 350
GAG ACG CTG CCG GAG CTC ACC TTC CTG CTG GGA CTC TTC GGT TAC CTC 1640
Glu Thr Leu Pro Glu Leu Thr Phe Leu Leu Gly Leu Phe Gly Tyr Leu
355 360 365
GTG TTC CTA GTC ATC TAC AAG TGG CTG TGT GTC TGG GCT GCC AGG GCC 1688
Val Phe Leu Val Ile Tyr Lys Trp Leu Cys Val Trp Ala Ala Arg Ala
370 375 380
GCC TCG GCC CCC AGC ATC CTC ATC CAC TTC ATC AAC ATG TTC CTC TTC 1736
Ala Ser Ala Pro Ser Ile Leu Ile His Phe Ile Asn Met Phe Leu Phe
385 390 395 400
TCC CAC AGC CCC AGC AAC AGG CTG CTC TAC CCC CGG CAG GAG GTG GTC 1784
Ser His Ser Pro Ser Asn Arg Leu Leu Tyr Pro Arg Gln Glu Val Val
405 410 415
CAG GCC ACG CTG GTG GTC CTG GCC TTG GCC ATG GTG CCC ATC CTG CTG 1832
Gln Ala Thr Leu Val Val Leu Ala Leu Ala Met Val Pro Ile Leu Leu
420 425 430
CTT GGC ACA CCC CTG CAC CTG CTG CAC CGC CAC CGC CGC CGC CTG CGG 1880
Leu Gly Thr Pro Leu His Leu Leu His Arg His Arg Arg Arg Leu Arg
435 440 445
AGG AGG CCC GCT GAC CGA CAG GAG GAA AAC AAG GCC GGG TTG CTG GAC 1928
Arg Arg Pro Ala Asp Arg Gln Glu Glu Asn Lys Ala Gly Leu Leu Asp
450 455 460
CTG CCT GAC GCA TCT GTG AAT GGC TGG AGC TCC GAT GAG GAA AAG GCA 1976
Leu Pro Asp Ala Ser Val Asn Gly Trp Ser Ser Asp Glu Glu Lys Ala
465 470 475 480
GGG GGC CTG GAT GAT GAA GAG GAG GCC GAG CTC GTC CCC TCC GAG GTG 2024
Gly Gly Leu Asp Asp Glu Glu Glu Ala Glu Leu Val Pro Ser Glu Val
485 490 495
CTC ATG CAC CAG GCC ATC CAC ACC ATC GAG TTC TGC CTG GGC TGC GTC 2072
Leu Met His Gln Ala Ile His Thr Ile Glu Phe Cys Leu Gly Cys Val
500 505 510
TCC AAC ACC GCC TCC TAC CTG CGC CTG TGG GCC CTG AGC CTG GCC CAC 2120
Ser Asn Thr Ala Ser Tyr Leu Arg Leu Trp Ala Leu Ser Leu Ala His
515 520 525
GCC CAG CTG TCC GAG GTT CTG TGG GCC ATG GTG ATG CGC ATA GGC CTG 2168
Ala Gln Leu Ser Glu Val Leu Trp Ala Met Val Met Arg Ile Gly Leu
530 535 540
GGC CTG GGC CGG GAG GTG GGC GTG GCG GCT GTG GTG CTG GTC CCC ATC 2216
Gly Leu Gly Arg Glu Val Gly Val Ala Ala Val Val Leu Val Pro Ile
545 550 555 560
TTT GCC GCC TTT GCC GTG ATG ACC GTG GCT ATC CTG CTG GTG ATG GAG 2264
Phe Ala Ala Phe Ala Val Met Thr Val Ala Ile Leu Leu Val Met Glu
565 570 575
GGA CTC TCA GCC TTC CTG CAC GCC CTG CGG CTG CAC TGG GTG GAA TTC 2312
Gly Leu Ser Ala Phe Leu His Ala Leu Arg Leu His Trp Val Glu Phe
580 585 590
CAG AAC AAG TTC TAC TCA GGC ACG GGC TAC AAG CTG AGT CCC TTC ACC 2360
Gln Asn Lys Phe Tyr Ser Gly Thr Gly Tyr Lys Leu Ser Pro Phe Thr
595 600 605
TTC GCT GCC ACA GAT GAC TAGGGCCCAC TGCAGGTCCT GCCAGACCTC 2408
Phe Ala Ala Thr Asp Asp
610
CTTCCTGACC TCTGAGGCAG GAGAGGAATA AAGACGGTCC GCCCTGGCAA AAAAAAAAAA 2468
AAAAAAAAAA AAAAAAAAAA 2488
(2) 配列番号:2の情報:
(i) 配列の特性:
(A) 配列の長さ: 614アミノ酸
(B) 配列の型: アミノ酸
(D) トポロジー: 直鎖状
(ii) 配列の種類: タンパク質
(xi) 配列の記載:配列番号:2:
Met Thr Phe Leu Ile Ser Tyr Trp Gly Glu Gln Ile Gly Gln Lys Ile
1 5 10 15
Arg Lys Ile Thr Asp Cys Phe His Cys His Val Phe Pro Phe Leu Gln
20 25 30
Gln Glu Glu Ala Arg Leu Gly Ala Leu Gln Gln Leu Gln Gln Gln Ser
35 40 45
Gln Glu Leu Gln Glu Val Leu Gly Glu Thr Glu Arg Phe Leu Ser Gln
50 55 60
Val Leu Gly Arg Val Leu Gln Leu Leu Pro Pro Gly Gln Val Gln Val
65 70 75 80
His Lys Met Lys Ala Val Tyr Leu Ala Leu Asn Gln Cys Ser Val Ser
85 90 95
Thr Thr His Lys Cys Leu Ile Ala Glu Ala Trp Cys Ser Val Arg Asp
100 105 110
Leu Pro Ala Leu Gln Glu Ala Leu Arg Asp Ser Ser Met Glu Glu Gly
115 120 125
Val Ser Ala Val Ala His Arg Ile Pro Cys Arg Asp Met Pro Pro Thr
130 135 140
Leu Ile Arg Thr Asn Arg Phe Thr Ala Ser Phe Gln Gly Ile Val Asp
145 150 155 160
Ala Tyr Gly Val Gly Arg Tyr Gln Glu Val Asn Pro Ala Pro Tyr Thr
165 170 175
Ile Ile Thr Phe Pro Phe Leu Phe Ala Val Met Phe Gly Asp Val Gly
180 185 190
His Gly Leu Leu Met Phe Leu Phe Ala Leu Ala Met Val Leu Ala Glu
195 200 205
Asn Arg Pro Ala Val Lys Ala Ala Gln Asn Glu Ile Trp Gln Thr Phe
210 215 220
Phe Arg Gly Arg Tyr Leu Leu Leu Leu Met Gly Leu Phe Ser Ile Tyr
225 230 235 240
Thr Gly Phe Ile Tyr Asn Glu Cys Phe Ser Arg Ala Thr Ser Ile Phe
245 250 255
Pro Ser Gly Trp Ser Val Ala Ala Met Ala Asn Gln Ser Gly Trp Ser
260 265 270
Asp Ala Phe Leu Ala Gln His Thr Met Leu Thr Leu Asp Pro Asn Val
275 280 285
Thr Gly Val Phe Leu Gly Pro Tyr Pro Phe Gly Ile Asp Pro Ile Trp
290 295 300
Ser Leu Ala Ala Asn His Leu Ser Phe Leu Asn Ser Phe Lys Met Lys
305 310 315 320
Met Ser Val Ile Leu Gly Val Val His Met Ala Phe Gly Val Val Leu
325 330 335
Gly Val Phe Asn His Val His Phe Gly Gln Arg His Arg Leu Leu Leu
340 345 350
Glu Thr Leu Pro Glu Leu Thr Phe Leu Leu Gly Leu Phe Gly Tyr Leu
355 360 365
Val Phe Leu Val Ile Tyr Lys Trp Leu Cys Val Trp Ala Ala Arg Ala
370 375 380
Ala Ser Ala Pro Ser Ile Leu Ile His Phe Ile Asn Met Phe Leu Phe
385 390 395 400
Ser His Ser Pro Ser Asn Arg Leu Leu Tyr Pro Arg Gln Glu Val Val
405 410 415
Gln Ala Thr Leu Val Val Leu Ala Leu Ala Met Val Pro Ile Leu Leu
420 425 430
Leu Gly Thr Pro Leu His Leu Leu His Arg His Arg Arg Arg Leu Arg
435 440 445
Arg Arg Pro Ala Asp Arg Gln Glu Glu Asn Lys Ala Gly Leu Leu Asp
450 455 460
Leu Pro Asp Ala Ser Val Asn Gly Trp Ser Ser Asp Glu Glu Lys Ala
465 470 475 480
Gly Gly Leu Asp Asp Glu Glu Glu Ala Glu Leu Val Pro Ser Glu Val
485 490 495
Leu Met His Gln Ala Ile His Thr Ile Glu Phe Cys Leu Gly Cys Val
500 505 510
Ser Asn Thr Ala Ser Tyr Leu Arg Leu Trp Ala Leu Ser Leu Ala His
515 520 525
Ala Gln Leu Ser Glu Val Leu Trp Ala Met Val Met Arg Ile Gly Leu
530 535 540
Gly Leu Gly Arg Glu Val Gly Val Ala Ala Val Val Leu Val Pro Ile
545 550 555 560
Phe Ala Ala Phe Ala Val Met Thr Val Ala Ile Leu Leu Val Met Glu
565 570 575
Gly Leu Ser Ala Phe Leu His Ala Leu Arg Leu His Trp Val Glu Phe
580 585 590
Gln Asn Lys Phe Tyr Ser Gly Thr Gly Tyr Lys Leu Ser Pro Phe Thr
595 600 605
Phe Ala Ala Thr Asp Asp
610
(2) 配列番号:3の情報:
(i) 配列の特性:
(A) 配列の長さ: 13アミノ酸
(B) 配列の型: アミノ酸
(C) 鎖の数: 一本鎖
(D) トポロジー: 直鎖状
(ii) 配列の種類: ペプチド
(iii) ハイポセティカル: YES
(xi) 配列の記載:配列番号:3:
Arg Arg Pro Ala Asp Arg Gln Glu Glu Asn Lys Ala Gly
1 5 10
(2) 配列番号:4の情報:
(i) 配列の特性:
(A) 配列の長さ: 14アミノ酸
(B) 配列の型: アミノ酸
(C) 鎖の数: 一本鎖
(D) トポロジー: 直鎖状
(ii) 配列の種類: ペプチド
(iii) ハイポセティカル: YES
(xi) 配列の記載:配列番号:4:
Ser Ser Asp Glu Glu Lys Ala Gly Gly Leu Asp Asp Glu Glu
1 5 10
(2) 配列番号:5の情報:
(i) 配列の特性:
(A) 配列の長さ: 14アミノ酸
(B) 配列の型: アミノ酸
(C) 鎖の数: 一本鎖
(D) トポロジー: 直鎖状
(ii) 配列の種類: ペプチド
(iii) ハイポセティカル: YES
(xi) 配列の記載:配列番号:5:
Val Glu Phe Gln Asn Lys Phe Tyr Ser Gly Thr Gly Tyr Lys
1 5 10
(2) 配列番号:6の情報:
(i) 配列の特性:
(A) 配列の長さ: 16アミノ酸
(B) 配列の型: アミノ酸
(C) 鎖の数: 一本鎖
(D) トポロジー: 直鎖状
(ii) 配列の種類: ペプチド
(iii) ハイポセティカル: YES
(xi) 配列の記載:配列番号:6:
Ser Gly Thr Gly Tyr Lys Leu Ser Pro Phe Thr Phe Ala Ala Thr Asp
1 5 10 15
(2) 配列番号:7の情報:
(i) 配列の特性:
(A) 配列の長さ: 14アミノ酸
(B) 配列の型: アミノ酸
(C) 鎖の数: 一本鎖
(D) トポロジー: 直鎖状
(ii) 配列の種類: ペプチド
(iii) ハイポセティカル: YES
(xi) 配列の記載:配列番号:7:
Asp Leu Pro Asp Ala Ser Val Asn Gly Trp Ser Ser Asp Glu
1 5 10
(2) 配列番号:8の情報:
(i) 配列の特性:
(A) 配列の長さ: 14アミノ酸
(B) 配列の型: アミノ酸
(C) 鎖の数: 一本鎖
(D) トポロジー: 直鎖状
(ii) 配列の種類: ペプチド
(iii) ハイポセティカル: YES
(xi) 配列の記載:配列番号:8:
Gln Glu Ala Leu Arg Asp Ser Ser Met Glu Glu Gly Val Ser Ala
1 5 10
(2) 配列番号:9の情報:
(i) 配列の特性:
(A) 配列の長さ: 14アミノ酸
(B) 配列の型: アミノ酸
(C) 鎖の数: 一本鎖
(D) トポロジー: 直鎖状
(ii) 配列の種類: ペプチド
(iii) ハイポセティカル: YES
(xi) 配列の記載:配列番号:9:
Ala Asn Gln Ser Gly Trp Ser Asp Ala Phe Leu Ala Gln His
1 5 10
(2) 配列番号:10:
(i) 配列の特性:
(A) 配列の長さ: 14塩基
(B) 配列の型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー: 直鎖状
(ii) 配列の種類: 他の核酸
(A) 他の核酸の説明: /desc = "oligonucleotide"
(iii) ハイポセティカル: YES
(xi) 配列の記載:配列番号:10:
GACGGAACAG CTTC 14
(2) 配列番号:11の情報:
(i) 配列の特性:
(A) 配列の長さ: 13塩基
(B) 配列の型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー: 直鎖状
(ii) 配列の種類: 他の核酸
(A) 他の核酸の説明 /desc = "oligonucleotide"
(iii) ハイポセティカル: YES
(xi) 配列の記載:配列番号:11:
TGCGTCTGGT TCT 13
(2) 配列番号:12の説明:
(i) 配列の特性:
(A) 配列の長さ: 2488塩基
(B) 配列の型: 核酸
(C) 鎖の数: 一本鎖
(D) トポロジー: 直鎖状
(ii) 配列の種類: cDNA
(iii) ハイポセティカル: NO
(ix) 配列の特徴:
(A) 特徴を表す記号: CDS
(B) 存在位置: 537..2378
(xi) 配列の記載:配列番号:12:
GGACGCCCCT GCTCCAGGCC CCCGGGGGGC CGCACCAGGA CCTGAGGGTC AAGTGAGTGA 60
GGGATGACCT CATGCCCTTT CTGGCCAGCC CAGAACCCCT GGCCAGTCGC TGGGCTGGGC 120
CAGGCTGAGC TCCGACTCCT TGTCCAGTGC TCTCCCCAGG CTGGCCCCGC CTCCTCCTTC 180
AGGCCCGGAA CTTCCCACAG TCCCAAGCCC TAGCCCTAGG GGGTTCTCCT CTTCTGGTCC 240
TGCCCGGGAG GCCTCCTGCC TTCCCCTGTG GGCAGGGCCA GTGTGCCCAA TTGCCCGATT 300
GCCCGTGCTG GGCAGGGTCC TGCCCGGGGG GCCTGGTGGG GGAGGCAGGG CAGGAGGTTG 360
GAGCAGCCCT GCCCAGCCCC GTGGCCGCCA GCTTTGTGGC AGGTGCCGTG GAGCCCCACA 420
AGGCCCCTGC CCTAGAGCGC CTGCTCTGGA GGGCCTGCCG CGGCTTCCTC ATTGCCAGCT 480
TCAGGGAGCT GGAGCAGCCG CTGGAGCACC CCGTGACGGG CGAGCCAGCC ACGTGG 536
ATG ACC TTC CTC ATC TCC TAC TGG GGT GAG CAG ATC GGA CAG AAG ATC 584
Met Thr Phe Leu Ile Ser Tyr Trp Gly Glu Gln Ile Gly Gln Lys Ile
1 5 10 15
CGC AAG ATC ACG GAC TGC TTC CAC TGC CAC GTC TTC CCG TTT CTG CAG 632
Arg Lys Ile Thr Asp Cys Phe His Cys His Val Phe Pro Phe Leu Gln
20 25 30
CAG GAG GAG GCC CGC CTC GGG GCC CTG CAG CAG CTG CAA CAG CAG AGC 680
Gln Glu Glu Ala Arg Leu Gly Ala Leu Gln Gln Leu Gln Gln Gln Ser
35 40 45
CAG GAG CTG CAG GAG GTC CTC GGG GAG ACA GAG CGG TTC CTG AGC CAG 728
Gln Glu Leu Gln Glu Val Leu Gly Glu Thr Glu Arg Phe Leu Ser Gln
50 55 60
GTG CTA GGC CGG GTG CTG CAG CTG CTG CCG CCA GGG CAG GTG CAG GTC 776
Val Leu Gly Arg Val Leu Gln Leu Leu Pro Pro Gly Gln Val Gln Val
65 70 75 80
CAC AAG ATG AAG GCC GTG TAC CTG GCC CTG AAC CAG TGC AGC GTG AGC 824
His Lys Met Lys Ala Val Tyr Leu Ala Leu Asn Gln Cys Ser Val Ser
85 90 95
ACC ACG CAC AAG TGC CTC ATT GCC GAG GCC TGG TGC TCT GTG CGA GAC 872
Thr Thr His Lys Cys Leu Ile Ala Glu Ala Trp Cys Ser Val Arg Asp
100 105 110
CTG CCC GCC CTG CAG GAG GCC CTG CAG GAC AGC TCG ATG GAG GAG GGA 920
Leu Pro Ala Leu Gln Glu Ala Leu Gln Asp Ser Ser Met Glu Glu Gly
115 120 125
GTG AGT GCC GTG GCT CAC CGC ATC CCC TGC CGG GAC ATG CCC CCC ACA 968
Val Ser Ala Val Ala His Arg Ile Pro Cys Arg Asp Met Pro Pro Thr
130 135 140
CTC ATC CGC ACC AAC CGC TTC ACG GCC AGC TTC CAG GGC ATC GTG GAT 1016
Leu Ile Arg Thr Asn Arg Phe Thr Ala Ser Phe Gln Gly Ile Val Asp
145 150 155 160
GCC TAC GGC GTG GGC CGC TAC CAG GAG GTC AAC CCC GCT CCC TAC ACC 1064
Ala Tyr Gly Val Gly Arg Tyr Gln Glu Val Asn Pro Ala Pro Tyr Thr
165 170 175
ATC ATC ACC TTC CCC TTC CTG TTT GCT GTG ATG TTC GGG GAT GTG GGC 1112
Ile Ile Thr Phe Pro Phe Leu Phe Ala Val Met Phe Gly Asp Val Gly
180 185 190
CAC GGG CTG CTC ATG TTC CTC TTC GCC CTG GCC ATG GTC CTT GCG GAG 1160
His Gly Leu Leu Met Phe Leu Phe Ala Leu Ala Met Val Leu Ala Glu
195 200 205
AAC CGA CCG GCT GTG AAG GCC GCG CAG AAC GAG ATC TGG CAG ACT TTC 1208
Asn Arg Pro Ala Val Lys Ala Ala Gln Asn Glu Ile Trp Gln Thr Phe
210 215 220
TTC AGG GGC CGC TAC CTG CTC CTG CTT ATG GGC CTG TTC TCC ATC TAC 1256
Phe Arg Gly Arg Tyr Leu Leu Leu Leu Met Gly Leu Phe Ser Ile Tyr
225 230 235 240
ACC GGC TTC ATC TAC AAC GAG TGC TTC AGT CGC GCC ACC AGC ATC TTC 1304
Thr Gly Phe Ile Tyr Asn Glu Cys Phe Ser Arg Ala Thr Ser Ile Phe
245 250 255
CCC TCG GGC TGG AGT GTG GCC GCC ATG GCC AAC CAG TCT GGC TGG AGT 1352
Pro Ser Gly Trp Ser Val Ala Ala Met Ala Asn Gln Ser Gly Trp Ser
260 265 270
GAT GCA TTC CTG GCC CAG CAC ACG ATG CTT ACC CTG GAT CCC AAC GTC 1400
Asp Ala Phe Leu Ala Gln His Thr Met Leu Thr Leu Asp Pro Asn Val
275 280 285
ACC GGT GTC TTC CTG GGA CCC TAC CCC TTT GGC ATC GAT CCT ATT TGG 1448
Thr Gly Val Phe Leu Gly Pro Tyr Pro Phe Gly Ile Asp Pro Ile Trp
290 295 300
AGC CTG GCT GCC AAC CAC TTG AGC TTC CTC AAC TCC TTC AAG ATG AAG 1496
Ser Leu Ala Ala Asn His Leu Ser Phe Leu Asn Ser Phe Lys Met Lys
305 310 315 320
ATG TCC GTC ATC CTG GGC GTC GTG CAC ATG GCC TTT GGG GTG GTC CTC 1544
Met Ser Val Ile Leu Gly Val Val His Met Ala Phe Gly Val Val Leu
325 330 335
GGA GTC TTC AAC CAC GTG CAC TTT GGC CAG AGG CAC CGG CTG CTG CTG 1592
Gly Val Phe Asn His Val His Phe Gly Gln Arg His Arg Leu Leu Leu
340 345 350
GAG ACG CTG CCG GAG CTC ACC TTC CTG CTG GGA CTC TTC GGT TAC CTC 1640
Glu Thr Leu Pro Glu Leu Thr Phe Leu Leu Gly Leu Phe Gly Tyr Leu
355 360 365
GTG TTC CTA GTC ATC TAC AAG TGG CTG TGT GTC TGG GCT GCC AGG GCC 1688
Val Phe Leu Val Ile Tyr Lys Trp Leu Cys Val Trp Ala Ala Arg Ala
370 375 380
GCC TCG GCC CCC AGC ATC CTC ATC CAC TTC ATC AAC ATG TTC CTC TTC 1736
Ala Ser Ala Pro Ser Ile Leu Ile His Phe Ile Asn Met Phe Leu Phe
385 390 395 400
TCC CAC AGC CCC AGC AAC AGG CTG CTC TAC CCC CGG CAG GAG GTG GTC 1784
Ser His Ser Pro Ser Asn Arg Leu Leu Tyr Pro Arg Gln Glu Val Val
405 410 415
CAG GCC ACG CTG GTG GTC CTG GCC TTG GCC ATG GTG CCC ATC CTG CTG 1832
Gln Ala Thr Leu Val Val Leu Ala Leu Ala Met Val Pro Ile Leu Leu
420 425 430
CTT GGC ACA CCC CTG CAC CTG CTG CAC CGC CAC CGC CGC CGC CTG CGG 1880
Leu Gly Thr Pro Leu His Leu Leu His Arg His Arg Arg Arg Leu Arg
435 440 445
AGG AGG CCC GCT GAC CGA CAG GAG GAA AAC AAG GCC GGG TTG CTG GAC 1928
Arg Arg Pro Ala Asp Arg Gln Glu Glu Asn Lys Ala Gly Leu Leu Asp
450 455 460
CTG CCT GAC GCA TCT GTG AAT GGC TGG AGC TCC GAT GAG GAA AAG GCA 1976
Leu Pro Asp Ala Ser Val Asn Gly Trp Ser Ser Asp Glu Glu Lys Ala
465 470 475 480
GGG GGC CTG GAT GAT GAA GAG GAG GCC GAG CTC GTC CCC TCC GAG GTG 2024
Gly Gly Leu Asp Asp Glu Glu Glu Ala Glu Leu Val Pro Ser Glu Val
485 490 495
CTC ATG CAC CAG GCC ATC CAC ACC ATC GAG TTC TGC CTG GGC TGC GTC 2072
Leu Met His Gln Ala Ile His Thr Ile Glu Phe Cys Leu Gly Cys Val
500 505 510
TCC AAC ACC GCC TCC TAC CTG CGC CTG TGG GCC CTG AGC CTG GCC CAC 2120
Ser Asn Thr Ala Ser Tyr Leu Arg Leu Trp Ala Leu Ser Leu Ala His
515 520 525
GCC CAG CTG TCC GAG GTT CTG TGG GCC ATG GTG ATG CGC ATA GGC CTG 2168
Ala Gln Leu Ser Glu Val Leu Trp Ala Met Val Met Arg Ile Gly Leu
530 535 540
GGC CTG GGC CGG GAG GTG GGC GTG GCG GCT GTG GTG CTG GTC CCC ATC 2216
Gly Leu Gly Arg Glu Val Gly Val Ala Ala Val Val Leu Val Pro Ile
545 550 555 560
TTT GCC GCC TTT GCC GTG ATG ACC GTG GCT ATC CTG CTG GTG ATG GAG 2264
Phe Ala Ala Phe Ala Val Met Thr Val Ala Ile Leu Leu Val Met Glu
565 570 575
GGA CTC TCA GCC TTC CTG CAC GCC CTG CGG CTG CAC TGG GTG GAA TTC 2312
Gly Leu Ser Ala Phe Leu His Ala Leu Arg Leu His Trp Val Glu Phe
580 585 590
CAG AAC AAG TTC TAC TCA GGC ACG GGC TAC AAG CTG AGT CCC TTC ACC 2360
Gln Asn Lys Phe Tyr Ser Gly Thr Gly Tyr Lys Leu Ser Pro Phe Thr
595 600 605
TTC GCT GCC ACA GAT GAC TAGGGCCCAC TGCAGGTCCT GCCAGACCTC 2408
Phe Ala Ala Thr Asp Asp
610
CTTCCTGACC TCTGAGGCAG GAGAGGAATA AAGACGGTCC GCCCTGGCAA AAAAAAAAAA 2468
AAAAAAAAAA AAAAAAAAAA 2488
(2) 配列番号:13の情報:
(i) 配列の特性:
(A) 配列の長さ:614アミノ酸
(B) 配列の型: アミノ酸
(D) トポロジー:直鎖状
(ii) 配列の種類: タンパク質
(xi) 配列の記載:配列番号:13:
Met Thr Phe Leu Ile Ser Tyr Trp Gly Glu Gln Ile Gly Gln Lys Ile
1 5 10 15
Arg Lys Ile Thr Asp Cys Phe His Cys His Val Phe Pro Phe Leu Gln
20 25 30
Gln Glu Glu Ala Arg Leu Gly Ala Leu Gln Gln Leu Gln Gln Gln Ser
35 40 45
Gln Glu Leu Gln Glu Val Leu Gly Glu Thr Glu Arg Phe Leu Ser Gln
50 55 60
Val Leu Gly Arg Val Leu Gln Leu Leu Pro Pro Gly Gln Val Gln Val
65 70 75 80
His Lys Met Lys Ala Val Tyr Leu Ala Leu Asn Gln Cys Ser Val Ser
85 90 95
Thr Thr His Lys Cys Leu Ile Ala Glu Ala Trp Cys Ser Val Arg Asp
100 105 110
Leu Pro Ala Leu Gln Glu Ala Leu Gln Asp Ser Ser Met Glu Glu Gly
115 120 125
Val Ser Ala Val Ala His Arg Ile Pro Cys Arg Asp Met Pro Pro Thr
130 135 140
Leu Ile Arg Thr Asn Arg Phe Thr Ala Ser Phe Gln Gly Ile Val Asp
145 150 155 160
Ala Tyr Gly Val Gly Arg Tyr Gln Glu Val Asn Pro Ala Pro Tyr Thr
165 170 175
Ile Ile Thr Phe Pro Phe Leu Phe Ala Val Met Phe Gly Asp Val Gly
180 185 190
His Gly Leu Leu Met Phe Leu Phe Ala Leu Ala Met Val Leu Ala Glu
195 200 205
Asn Arg Pro Ala Val Lys Ala Ala Gln Asn Glu Ile Trp Gln Thr Phe
210 215 220
Phe Arg Gly Arg Tyr Leu Leu Leu Leu Met Gly Leu Phe Ser Ile Tyr
225 230 235 240
Thr Gly Phe Ile Tyr Asn Glu Cys Phe Ser Arg Ala Thr Ser Ile Phe
245 250 255
Pro Ser Gly Trp Ser Val Ala Ala Met Ala Asn Gln Ser Gly Trp Ser
260 265 270
Asp Ala Phe Leu Ala Gln His Thr Met Leu Thr Leu Asp Pro Asn Val
275 280 285
Thr Gly Val Phe Leu Gly Pro Tyr Pro Phe Gly Ile Asp Pro Ile Trp
290 295 300
Ser Leu Ala Ala Asn His Leu Ser Phe Leu Asn Ser Phe Lys Met Lys
305 310 315 320
Met Ser Val Ile Leu Gly Val Val His Met Ala Phe Gly Val Val Leu
325 330 335
Gly Val Phe Asn His Val His Phe Gly Gln Arg His Arg Leu Leu Leu
340 345 350
Glu Thr Leu Pro Glu Leu Thr Phe Leu Leu Gly Leu Phe Gly Tyr Leu
355 360 365
Val Phe Leu Val Ile Tyr Lys Trp Leu Cys Val Trp Ala Ala Arg Ala
370 375 380
Ala Ser Ala Pro Ser Ile Leu Ile His Phe Ile Asn Met Phe Leu Phe
385 390 395 400
Ser His Ser Pro Ser Asn Arg Leu Leu Tyr Pro Arg Gln Glu Val Val
405 410 415
Gln Ala Thr Leu Val Val Leu Ala Leu Ala Met Val Pro Ile Leu Leu
420 425 430
Leu Gly Thr Pro Leu His Leu Leu His Arg His Arg Arg Arg Leu Arg
435 440 445
Arg Arg Pro Ala Asp Arg Gln Glu Glu Asn Lys Ala Gly Leu Leu Asp
450 455 460
Leu Pro Asp Ala Ser Val Asn Gly Trp Ser Ser Asp Glu Glu Lys Ala
465 470 475 480
Gly Gly Leu Asp Asp Glu Glu Glu Ala Glu Leu Val Pro Ser Glu Val
485 490 495
Leu Met His Gln Ala Ile His Thr Ile Glu Phe Cys Leu Gly Cys Val
500 505 510
Ser Asn Thr Ala Ser Tyr Leu Arg Leu Trp Ala Leu Ser Leu Ala His
515 520 525
Ala Gln Leu Ser Glu Val Leu Trp Ala Met Val Met Arg Ile Gly Leu
530 535 540
Gly Leu Gly Arg Glu Val Gly Val Ala Ala Val Val Leu Val Pro Ile
545 550 555 560
Phe Ala Ala Phe Ala Val Met Thr Val Ala Ile Leu Leu Val Met Glu
565 570 575
Gly Leu Ser Ala Phe Leu His Ala Leu Arg Leu His Trp Val Glu Phe
580 585 590
Gln Asn Lys Phe Tyr Ser Gly Thr Gly Tyr Lys Leu Ser Pro Phe Thr
595 600 605
Phe Ala Ala Thr Asp Asp
610
Claims (41)
- 以下の配列からなる群より選択される、約75kDaのTIRC7膜蛋白質をコードするポリヌクレオチド:
(i)配列番号:2のアミノ酸1位〜614位に示されるアミノ酸配列をコードするヌクレオチド配列;
(ii)配列番号:1に示すヌクレオチド配列;および
(iii)その相補鎖が(i)または(ii)に定義されるポリヌクレオチドとハイブリダイズし、且つ少なくとも90%同一であって、T細胞増殖を阻害する活性を有する蛋白質をコードするDNA配列。 - 請求項1記載のポリヌクレオチドまたはその相補鎖と特異的にハイブリダイズする長さが少なくとも15ヌクレオチドの核酸分子の、請求項1記載のポリヌクレオチドの検出および/もしくは増幅、または請求項1記載のポリヌクレオチドを含む遺伝子の発現の抑制を目的とする使用。
- 請求項1記載のポリヌクレオチドを含むベクター。
- ポリヌクレオチドが核酸分子の転写および任意で発現を可能にする調節配列に機能的に結合している、請求項3記載のベクター。
- 請求項1記載のポリヌクレオチドまたは請求項3もしくは4記載のベクターを含む宿主細胞。
- 以下の段階を含む、TIRC7膜蛋白質を製造する方法:
(a)蛋白質の発現を可能にする条件下で請求項5記載の宿主を培養する段階;または
(b)請求項1記載のポリヌクレオチドのインビトロ翻訳;
および(a)もしくは(b)において産生された蛋白質を回収する段階。 - 請求項1記載のポリヌクレオチドによってコードされる、または請求項6記載の方法によって産生される、TIRC7膜蛋白質。
- 請求項7記載のTIRC7膜蛋白質の細胞外ドメインを特異的に認識する抗体であって、該細胞外ドメインが配列番号:5、7および3のいずれか一つに示される配列を含む、抗体。
- 請求項7記載の蛋白質または請求項8記載の抗体を発現するように改変された正常細胞。
- 請求項7記載のTIRC膜蛋白質または請求項8記載の抗体、ならびに選択的に薬学的に許容される担体を含む、薬学的組成物。
- 前記蛋白質が可溶型である、請求項10記載の薬学的組成物。
- 前記蛋白質が配列番号:5、7および3のいずれか一つに示すアミノ酸配列を含む、請求項10または11記載の薬学的組成物。
- T細胞増殖を阻害する第二の物質をさらに含む、請求項10〜12のいずれか一項記載の薬学的組成物。
- 第二の物質が、T細胞増殖に関係する受容体もしくはリガンドに対する抗体であるか、または該受容体の可溶型である、請求項13記載の薬学的組成物。
- 第二の物質がCD2、CD28、CTLA4またはCD40表面受容体とCD2、CD28、CTLA4、またはCD40リガンドとの相互作用を遮断する、請求項14記載の薬学的組成物。
- 細胞もしくは臓器移植に用いられる、自己免疫、アレルギー、もしくは感染性疾患を治療するための、または腫瘍を治療するための、請求項10〜15のいずれか一項記載の薬学的組成物。
- 請求項1記載のポリヌクレオチド、請求項3もしくは4記載のベクター、請求項5もしくは9記載の細胞、請求項7記載の蛋白質、または請求項8記載の抗体、または請求項10〜12のいずれか一項に定義される蛋白質もしくは抗体を含む、診断的組成物。
- 請求項7記載のTIRC7膜蛋白質を通じてT細胞増殖を阻害する物質と、T細胞を接触させることを含む、インビトロで抗原に対するT細胞の不応性を誘導する、または維持する方法。
- 被験者において抗原に対するT細胞不応性を誘導する、もしくは維持するための薬学的組成物の調製を目的とする、請求項7記載のTIRC7膜蛋白質を通じてT細胞増殖を阻害する物質の使用。
- 物質がTIRC7膜蛋白質とそのリガンドとの相互作用を遮断する、請求項18記載の方法または請求項19記載の使用。
- 物質が、請求項7記載のTIRC7膜蛋白質または請求項8記載の抗体である、請求項20記載の方法または使用。
- 請求項13〜16のいずれか一項に定義される第二の物質の使用をさらに含む、請求項18、20もしくは21のいずれか一項記載の方法、または請求項19〜21のいずれか一項記載の使用。
- 請求項7記載のTIRC7膜蛋白質を通じてT細胞増殖を刺激する第一の物質と選択的に薬学的に許容される担体とを含む、薬学的組成物。
- 物質がTIRC7膜蛋白質のリガンドである、または抗TIRC7膜蛋白質抗体の少なくとも一つである、請求項23記載の薬学的組成物。
- T細胞増殖を刺激する第二の物質をさらに含む、請求項23または24に記載の薬学的組成物。
- 物質が、IL-2、IL-4、またはCD2、CD28、CD40もしくはCTLA4表面受容体を通じてT細胞増殖を刺激する物質である、請求項25記載の薬学的組成物。
- 請求項7記載のTIRC7膜蛋白質を通じてT細胞増殖を刺激する第一の物質とT細胞を抗原の存在下で接触させることを含む、抗原に不応性であるT細胞によって抗原に対する反応性をインビトロで回復させる方法。
- 細胞表面上でのTIRC7リガンドの発現に適した形で、TIRC7リガンドをコードする核酸分子を細胞に導入することによって、TIRC7リガンドを細胞表面上に発現させる、請求項27記載の方法。
- 細胞が腫瘍細胞である、請求項28記載の方法。
- 請求項25または26に定義した第二の物質とT細胞を接触することをさらに含む、請求項27〜29のいずれか一項記載の方法。
- T細胞を第一の物質と接触させる前に第二の物質と接触させる、請求項30記載の方法。
- 細胞表面上でのリガンドの発現に適した形で、CD2、CD28、CD40もしくはCTLA4リガンドをコードする核酸分子を細胞に導入することによって、CD2、CD28、CD40もしくはCTLA4リガンドを細胞表面に発現させる、請求項30もしくは31記載の方法。
- 腫瘍を有する被験者において腫瘍細胞に対するT細胞増殖を刺激するための薬学的組成物の調製を目的とする、請求項23または24に定義した第一の物質の使用。
- 腫瘍細胞が、好ましくは腫瘍細胞表面でTIRC7リガンドおよび/またはCD2、CD28、CD40またはCTLA4リガンドを発現するよう改変されている、請求項33記載の使用。
- T細胞が被験者から得られ、エクスビボでIL-2またはIL-4と接触させ、且つ被験者に投与するためにデザインされる薬学的組成物の調製に該改変したT細胞を用いる、請求項33または34記載の使用。
- 被験者が末梢幹細胞または骨髄移植のレシピエントである、請求項19〜22、33、および34のいずれか一項記載の使用。
- 薬学的組成物を、レシピエントへの移植前に末梢幹細胞または骨髄細胞と接触させるようにデザインする、請求項36記載の使用。
- 臓器移植片移植における、または自己免疫疾患の治療のための、請求項18、20〜22のいずれか一項記載の、または請求項27〜32のいずれか一項記載の方法、または請求項19〜22、33〜35のいずれか一項記載の使用。
- 以下を含む、T細胞活性化もしくは共刺激化合物を同定する、またはT細胞活性化および増殖の阻害物質を同定する方法:
(a)請求項7記載の蛋白質、請求項8記載の抗体、または請求項5もしくは9記載の細胞の存在下で、ならびに選択的に、T細胞活性化に反応して検出可能なシグナルを提供することができる成分の存在下で、スクリーニングすべき化合物と共にT細胞を、化合物と、蛋白質、抗体または細胞との相互作用が起こるような条件下で培養する段階;ならびに
(b)細胞と化合物との相互作用によって生じたシグナルの有無を検出する段階。 - 請求項39記載の方法の段階、および製剤化する段階、ならびに選択的に、薬学的に許容される形で段階(b)において同定された化合物を合成する段階を含む薬学的組成物の製造法。
- 請求項1記載のポリヌクレオチド、請求項3もしくは4記載のベクター、請求項7記載の蛋白質、請求項8記載の抗体、請求項5もしくは9記載の細胞、または請求項39記載の方法によって同定された化合物の、T細胞活性化ならびにTh1およびTh2免疫応答を含む急性および慢性疾患の治療、同種異系および異種臓器移植ならびに骨髄移植の急性および慢性拒絶の治療、リウマチ性関節炎、紅斑性狼瘡、多発性硬化症、脳炎、血管炎、真性糖尿病、膵炎、胃炎、甲状腺炎の治療、T、B、もしくはNK細胞の悪性障害の治療、喘息、レプラマトーシス(lepramatosis)、ヘリコバクター・ピロリ菌関連胃炎の治療、または皮膚腫瘍、副腎腫瘍もしくは肺腫瘍の治療のための薬学的組成物の調製を目的とする使用。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19738710A DE19738710A1 (de) | 1997-08-29 | 1997-08-29 | Verwendung von TIRC7 zur Herstellung von Mitteln zur Inhibition der Immunantwort |
| DE19738710.1 | 1997-08-29 | ||
| DE29802653.8 | 1998-02-12 | ||
| DE29802653 | 1998-02-12 | ||
| PCT/EP1998/005462 WO1999011782A1 (en) | 1997-08-29 | 1998-08-28 | T-cell membrane protein (tirc7), peptides and antibodies derived therefrom and uses thereof |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2001514852A JP2001514852A (ja) | 2001-09-18 |
| JP2001514852A5 JP2001514852A5 (ja) | 2006-01-05 |
| JP4459435B2 true JP4459435B2 (ja) | 2010-04-28 |
Family
ID=26039678
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000508792A Expired - Lifetime JP4459435B2 (ja) | 1997-08-29 | 1998-08-28 | 新規t細胞膜蛋白質(tirc7)、ペプチドおよびそれに由来する抗体ならびにその使用 |
Country Status (10)
| Country | Link |
|---|---|
| EP (2) | EP0996726B1 (ja) |
| JP (1) | JP4459435B2 (ja) |
| AT (1) | ATE256185T1 (ja) |
| AU (1) | AU751151C (ja) |
| CA (1) | CA2301499C (ja) |
| DE (1) | DE69820449T2 (ja) |
| DK (1) | DK0996726T3 (ja) |
| ES (1) | ES2213295T3 (ja) |
| PT (1) | PT996726E (ja) |
| WO (1) | WO1999011782A1 (ja) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL134830A0 (en) * | 2000-03-01 | 2001-05-20 | Chay 13 Medical Res Group N V | Peptides and immunostimulatory and anti-bacterial pharmaceutical compositions containing them |
| ATE399019T1 (de) * | 2000-05-03 | 2008-07-15 | Cellact Pharma Gmbh | Verwendungen von tgap7 zur modulation der aktivierung von leukozyten |
| ATE333889T1 (de) * | 2000-10-30 | 2006-08-15 | Genpat77 Pharmacogenetics Ag | Verfahren zur gewinnung von inhibitoren der tirc7-liganden-bindung und verwendungszwecke dafür |
| US6905827B2 (en) | 2001-06-08 | 2005-06-14 | Expression Diagnostics, Inc. | Methods and compositions for diagnosing or monitoring auto immune and chronic inflammatory diseases |
| CA2486545A1 (en) * | 2001-09-17 | 2003-03-27 | Nalan Utku | Peptides capable of modulating immune response |
| AU2002360946A1 (en) * | 2001-11-27 | 2003-06-10 | Genpat77 Pharmacogenetics Ag | Use of T-cell immune response cDNA 7 (TIRC7) for modulation of angiogenesis and/or neovascularization |
| CA2486930A1 (en) | 2001-12-21 | 2003-07-03 | Genpat77 Pharmacogenetics Ag | Anti-tirc7 antibodies in therapy of inflammatory diseases |
| JP2005525792A (ja) * | 2001-12-21 | 2005-09-02 | ゲンパト77 ファーマコジェネティクス エージー | 免疫関連疾患および他の疾患に用いる治療的抗tirc7抗体 |
| CA2483630A1 (en) * | 2002-02-04 | 2003-08-14 | Nalan Utku | Compositions and methods for modulation of effects on phagocyte and lymphoid cell populations |
| US20050221424A1 (en) * | 2002-04-26 | 2005-10-06 | Nalan Utku | Bispecific molecules for use in therapy and diagnosis of immune related and other diseases |
| US20070274998A1 (en) * | 2002-04-29 | 2007-11-29 | Genpatzz Pharmacogentetics Ag | Novel Bispecific Molecules For Use In Therapy And Diagnosis |
| US8642512B2 (en) * | 2005-05-17 | 2014-02-04 | Cellact Pharma Gmbh | Method of detecting early immune activation |
| EP1931371A1 (en) * | 2005-05-17 | 2008-06-18 | CellAct Pharma GmbH | Peptides capable of modulating the function of tirc7 |
| DE202011103324U1 (de) | 2011-07-12 | 2012-01-02 | Nekonal S.A.R.L. | Therapeutische anti-TIRC7 Antikörper für die Verwendung in Immun und anderen Krankheiten |
| WO2018029266A1 (en) | 2016-08-09 | 2018-02-15 | Nekonal S.A.R.L. | Tirc7 based diagnostic and therapy of cancer |
| WO2018029296A1 (en) | 2016-08-10 | 2018-02-15 | Nekonal S.A.R.L. | Tirc7 based diagnostic and therapy of solid cancer |
| US20220288120A1 (en) | 2019-08-14 | 2022-09-15 | Nekonal S.A.R.L. | Method for producing engineered tirc7 specific t-regulatory cells (tregs) |
-
1998
- 1998-08-28 AU AU92654/98A patent/AU751151C/en not_active Ceased
- 1998-08-28 ES ES98945293T patent/ES2213295T3/es not_active Expired - Lifetime
- 1998-08-28 WO PCT/EP1998/005462 patent/WO1999011782A1/en active IP Right Grant
- 1998-08-28 EP EP98945293A patent/EP0996726B1/en not_active Expired - Lifetime
- 1998-08-28 EP EP03015210A patent/EP1350848A3/en not_active Withdrawn
- 1998-08-28 DK DK98945293T patent/DK0996726T3/da active
- 1998-08-28 DE DE69820449T patent/DE69820449T2/de not_active Expired - Lifetime
- 1998-08-28 PT PT98945293T patent/PT996726E/pt unknown
- 1998-08-28 CA CA2301499A patent/CA2301499C/en not_active Expired - Fee Related
- 1998-08-28 JP JP2000508792A patent/JP4459435B2/ja not_active Expired - Lifetime
- 1998-08-28 AT AT98945293T patent/ATE256185T1/de active
Also Published As
| Publication number | Publication date |
|---|---|
| EP1350848A3 (en) | 2004-02-04 |
| WO1999011782A1 (en) | 1999-03-11 |
| PT996726E (pt) | 2004-04-30 |
| CA2301499C (en) | 2010-01-26 |
| JP2001514852A (ja) | 2001-09-18 |
| EP0996726B1 (en) | 2003-12-10 |
| EP1350848A2 (en) | 2003-10-08 |
| ATE256185T1 (de) | 2003-12-15 |
| DK0996726T3 (da) | 2004-04-13 |
| ES2213295T3 (es) | 2004-08-16 |
| DE69820449T2 (de) | 2005-03-10 |
| DE69820449D1 (de) | 2004-01-22 |
| AU751151B2 (en) | 2002-08-08 |
| AU751151C (en) | 2006-09-14 |
| EP0996726A1 (en) | 2000-05-03 |
| AU9265498A (en) | 1999-03-22 |
| CA2301499A1 (en) | 1999-03-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4459435B2 (ja) | 新規t細胞膜蛋白質(tirc7)、ペプチドおよびそれに由来する抗体ならびにその使用 | |
| US6338851B1 (en) | Method of suppressing an immune response to a transplanted organ or tissue by administering an OX-2 protein | |
| JP4169478B2 (ja) | Cd19×cd3特異的ポリペプチドおよびその使用 | |
| EP2332978B1 (en) | Novel polypeptides involved in immune response | |
| JP4426724B2 (ja) | Ldcamと称される分子 | |
| CA3016482A1 (en) | B7-h1, a novel immunoregulatory molecule | |
| JPH09509826A (ja) | 活性化cd4▲上+▼t細胞の表層上のレセプターに対するリガンド(act−4−l) | |
| US7931901B2 (en) | T-cell membrane protein (TIRC7), peptides and antibodies derived therefrom and uses thereof | |
| WO1995017506A9 (en) | Mediators of chronic allograft rejection | |
| EP0749476A1 (en) | Mediators of chronic allograft rejection | |
| MXPA04003057A (es) | Proteina 4 de enlace ul16. | |
| WO2000019988A1 (en) | NOVEL Th2-SPECIFIC MOLECULES AND USES THEREOF | |
| WO1997021450A1 (en) | Ox-2 costimulatory molecule | |
| US20070212714A1 (en) | Novel genes TZap7/A, TZap7/B and TZap7 involved in T cell activation and uses thereof | |
| WO1995002611A1 (en) | Cell surface protein present on nk (natural killer cells) named dx1 | |
| EP1278535B1 (en) | Uses of tgap7 for the modulation of leucocyte activation | |
| EP0795014A1 (en) | Purified genes encoding mammalian cell surface antigens; proteins and antibodies | |
| US20030219424A1 (en) | Novel T-cell protein (TZON7), peptides and antibodies derived therefrom and uses thereof | |
| MXPA97003956A (en) | Purified genes that codify antigens of surface of mammali cells, proteins and antibody | |
| MXPA01007843A (en) | Novel polypeptides involved in immune response |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050825 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050825 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080702 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20080930 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20081007 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20081031 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20081110 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20081128 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20081205 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090105 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20090305 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090402 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20090422 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090824 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091007 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091007 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20091102 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100114 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20100210 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130219 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140219 Year of fee payment: 4 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |