JP4359654B2 - 抗原特異的免疫応答を生起させる遺伝子発現ベクターおよびその使用方法 - Google Patents
抗原特異的免疫応答を生起させる遺伝子発現ベクターおよびその使用方法 Download PDFInfo
- Publication number
- JP4359654B2 JP4359654B2 JP52775297A JP52775297A JP4359654B2 JP 4359654 B2 JP4359654 B2 JP 4359654B2 JP 52775297 A JP52775297 A JP 52775297A JP 52775297 A JP52775297 A JP 52775297A JP 4359654 B2 JP4359654 B2 JP 4359654B2
- Authority
- JP
- Japan
- Prior art keywords
- antigen
- gene expression
- polynucleotide
- immunostimulatory
- sequence
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/145—Orthomyxoviridae, e.g. influenza virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/53—DNA (RNA) vaccination
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55561—CpG containing adjuvants; Oligonucleotide containing adjuvants
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/16011—Orthomyxoviridae
- C12N2760/16111—Influenzavirus A, i.e. influenza A virus
- C12N2760/16122—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/16011—Orthomyxoviridae
- C12N2760/16111—Influenzavirus A, i.e. influenza A virus
- C12N2760/16134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
Description
本明細書において開示されている研究は、補助金AI37305および/またはAR25443として米国国立保健衛生研究所(National Institute of Health)より支援を得たものであり得る。
関連特許出願の参照的記述
本出願は、1995年6月7日に出願された米国特許出願第08/446,691号の一部継続出願であり、同出願はまた1993年8月26日に出願された米国特許出願第08/112,440号の一部継続出願である。
発明の分野
本発明は、抗原に対して宿主を免疫する方法および試薬に関する。具体的には、本発明は、抗原に対する宿主のワクチン接種のアジュバントとして使用する組換え発現ベクター、およびそのようなベクターの使用方法に関する。
発明の背景
従来、ある抗原に対する宿主の免疫は、免疫原性のある形態の標的抗原を宿主に繰り返しワクチン接種することにより達成されてきた。ワクチン設計の新たな領域においては、標的抗原に対する免疫応答を指令し且つ増強するサイトカインを使用する(これにより、防御を誘導するために必要な寛容性抗原(tolerizing antigen)の総用量を低減し得る)。
例えば、IL-12サイトカインは、(体液性免疫において活性な)TH2細胞よりも、(細胞性免疫において活性な)CD4+ TH1細胞や細胞障害性Tリンパ球(CTL)の増殖を促進すると考えられている。IL-12はまた、細胞障害性Tリンパ球を含むリンパ球の増殖および分化を実質的に高めることが示されている。IL-12には、細胞内抗原に対する免疫防御を付与する重要な役割を果たすという証拠がある(例えば、Scott, J.Immunol., 147:3149(1991)[IL-12の存在下でのマウスにおけるL.majorに対する防御効果は、IL-12源を排除するとなくなる]を参照のこと)。しかし、精製サイトカインを宿主に投与すると、特に宿主免疫系を刺激するのに十分な投薬量において毒性となるおそれがある。同じ危険性が、従来のワクチン接種スキームにおける標的抗原の宿主に対する投与により引き起こされる。
上記理由のために、(目的の抗原および/またはサイトカインをコードする遺伝子を投与して、タンパク質抗原および/またはサイトカインを宿主に導入するための)遺伝子移入は、関心が高く、従来の抗原主体の免疫化プロトコルに代わるものである。しかし、その場の(in situ)遺伝子発現によく使用されるウイルスベクターは、内因性遺伝物質を宿主のゲノムに組み込み、宿主細胞の遺伝物質に対し障害に関わる健康上の潜在的な危険性を与える可能性がある。
最近、「裸の(naked)」遺伝子発現ベクター(例えば、標的ポリペプチドの発現のためのプラスミド)が、コードされたポリペプチドをin vivo発現することが示された。この分野の最も初期段階の1つは、NIHにおいて1984年に行われた。Seegerらは、リスにリス肝炎の裸のクローン化プラスミドDNAを肝臓内注入すると、リス体内におけるウイルス感染および抗ウイルス抗体の形成がともに生じることを示すデータを報告した(Seegerら、Proc.Nat’l.Acad.Sci USA, 81:5849-5852, 1984)。数年後、Felgnerらが、マウスの骨格筋組織に注入したプラスミドからウイルスタンパク質の発現を得たことを報告した(Felgnerら、Science, 247:1465, 1990;国際出願公開第90/11092号パンフレットも参照のこと)。
さらに最近、裸の遺伝子発現ベクターの期待される治療的使用に関する研究は、種々のプロモーター、デリバリー媒介物および投与経路を使用することによる遺伝子発現の増強を目的としてきた(例えば、Striblingら、Proc.Natl.Acad.Sci.USA, 89:11277-11281, 1992[リポソーム送達系の使用により、遺伝子のエーロゾル送達後に発現が生じた];およびTangら、Nature, 356:152-154, 1992[金コロイドビーズに結合したhGHプラスミドをワクチン「銃」で注射]を参照のこと)。
しかし、遺伝子ワクチン投与経路として筋肉を使用すると、特定の障害が伴う。例えば、Ottawa大学の研究者は最近、「横紋筋はプラスミドDNAの形態で移入されるリポーター遺伝子を取り込み発現できることが判明した唯一の組織であるが...我々の知見は注入法によって障害を受けた繊維はプラスミドDNAを取り込み発現しないことを示す」ことを観察した(Davisら、Human Gene Therapy, 4:151-159, 1993)。
筋肉以外の組織における裸の遺伝子ベクターの発現産物に対する体液性免疫応答の産生が、ワクチン用のビヒクルとして、また免疫刺激性サイトカインを標的細胞に送達するために(例えば、最近のヒト治験においては、IL-2およびIL-4がレトロウイルスベクターおよびex vivo形質転換細胞によって送達された。)、上記ベクターを使用することに関心を引き起こしたが、裸の遺伝子発現ベクターをワクチン接種に使用するには、発現抗原に対する細胞性免疫応答が比較的まれであることが障害となっている。
一般的に、(特に細胞障害性T細胞集団の増殖を介した)抗原に対する細胞性免疫応答は、その抗原に対する長期防御には必要であると予想され得る。しかし、抗原に対するクラスI制限細胞障害性T細胞応答が誘導される前に抗原提示細胞に取り込まれるために、抗原を発現するいかなる体細胞もまず抗原を細胞外空間に放出しなければならない(例えば、Huangら、Science, 264:961-965, 1994を参照)。つまり、抗原提示細胞の刺激や細胞性免疫応答の誘導のない遺伝子発現の増強は、ワクチン接種プロトコルにおける裸の遺伝子発現ベクターの効果的な使用を可能とするには不十分であろうと思われる。
発明の要旨
1つの態様において、本発明は、裸の遺伝子による免疫感作に使用するための組換え発現ベクター(「裸の遺伝子発現ベクター」)を含む。本発明の裸の遺伝子発現ベクターは、強力な細胞性免疫応答を誘発する免疫刺激性ポリヌクレオチドを含む。本発明はまた、TH1コンパートメントに対する細胞性免疫応答を操作するのに使用する裸の遺伝子発現ベクターを含む。
本発明について本明細書において用いる「裸の遺伝子発現ベクター」という用語は、少なくとも1つの非コード化免疫刺激ポリヌクレオチド領域を含み、また好ましくは目的のペプチド(例えば、抗原およびサイトカイン)をコードし、且つデリバリー媒介物(例えば、リポソーム、コロイド粒子等)と会合していないプラスミドまたはコスミドを指す。非ウイルス性ベクターについて賞賛される主要な利点の1つは、ベクター自身が刺激する免疫応答がないことであったが、本発明者らは、裸の遺伝子発現ベクターを効果的なワクチン接種ビヒクルとして使用することを可能とするために、宿主免疫系のベクター媒介性刺激が望ましい目標であり、必要でありうることを見い出した。
特に、本発明の遺伝子発現ベクターの設計は、組換え発現ベクターによる抗原発現の増強が発現抗原に対する防御免疫応答を引き出すのに十分でないという知見を利用する。特に、遺伝子免疫感作に使用するために通常試験される非ウイルス性ベクター(本発明の免疫刺激性ポリヌクレオチドを欠く。)から得られる比較的高い発現レベルは、種々の強さの体液性免疫応答を引き出し得るが、抗原に対する長期防御に必要な細胞性免疫応答をめったに産生しない。
その後者の目的のために、本発明の裸の遺伝子発現ベクターは、抗原提示細胞(APC)によるインターフェロンα(IFNα)のin vivo転写を選択的に刺激し、その後IL-12の産生および細胞障害性Tリンパ球(CTL)の増殖を刺激すると考えられる核酸の免疫学的活性領域を含む。
本発明の方法によれば、APCによる抗原取り込みは増大され、抗原に対する宿主の細胞性応答は増強され、その結果、抗原に対する宿主の細胞性免疫を増強する。この点で、本発明の裸の遺伝子発現ベクターは、宿主を細胞内(例えばウイルス)感染に対して免疫するのに特に有用である。ベクターはまた、TH2コンパートメントよりもTH1コンパートメントを刺激するのに特に有用であり、その結果、発現抗原に応答してIgE産生を抑制する。
本発明の裸の遺伝子発現ベクターは、隣接した非メチル化シトシン-グアニン(CG)ヌクレオチドからなるジヌクレオチド配列を少なくとも1つ含む1つ以上の非コード化免疫刺激ポリヌクレオチドを含む。本発明において有用な免疫刺激ポリヌクレオチドは、二本鎖または一本鎖のDNAまたはRNAであり得るが、二本鎖パリンドロームを形成することが好ましい。最も好ましくは、本発明の免疫刺激ポリヌクレオチドの各CGジヌクレオチド配列は、その一端(上流または下流)で2つ以上のプリンヌクレオチドによって、他端(上流または下流)で2つ以上のピリミジンヌクレオチドによって隣接される。裸の遺伝子発現ベクターはまた、抗原およびサイトカイン等の目的のポリペプチドをコードし得る。
本発明の免疫刺激ポリヌクレオチドの免疫刺激特性が付与される場合、該免疫刺激ポリヌクレオチドが他の組換え遺伝子発現ベクターや抗原主体のワクチン組成物に含有されていても、宿主の抗-抗原免疫応答を増強することが期待できる。つまり、本発明の他の態様は、本発明の免疫刺激ポリヌクレオチドが挿入された、デリバリー媒介物(例えば、リポソームまたはコロイド粒子)を伴うウイルス性組換え遺伝子発現ベクターおよび非ウイルス性組換え遺伝子発現ベクターを含む。さらに、本発明の免疫刺激ポリヌクレオチドをウイルス遺伝子発現ベクターに導入する技術と同じ技術を用いて、該ポリヌクレオチドを、ウイルス抗原に対する免疫応答を増大するために、生ウイルスワクチンに導入することができる。
他の態様において、本発明は、本発明の裸の遺伝子発現ベクターを用いて、抗原に対して宿主を免疫する方法を含む。本発明の好ましい方法によれば、裸の遺伝子発現ベクターは、他の宿主組織(例えば、筋肉)に比べて、比較的高い濃度の抗原提示細胞(APC)をもつ宿主の組織(例えば、皮膚または粘膜)に導入される。裸の遺伝子発現ベクターを宿主に導入するためにいかなる適切な手段も用い得るが、表皮または粘膜の上部細胞層を化学的または機械的に刺激する等の比較的非侵入的(non-invasive)な手段で行うことが好ましい。抗原または抗原をコードする組換え発現ベクターを同時投与することにより、本発明の裸の遺伝子発現ベクターは、抗原に対する宿主の免疫応答を増強するアジュバントとして働く。
本発明は、いかなる特定の作用機序によっても制限されないが、本発明の裸の遺伝子発現ベクターを宿主APCへ導入することにより、TH2免疫応答よりもTH1免疫応答を刺激するクラスIプロセシング経路によって抗原のAPC提示が促進されるものと予想される。抗原が皮膚または粘膜に注入される組換え発現ベクターによってコードされる、本発明の方法により得られる更なる利点は、比較的少ない用量の抗原(例えば、約50μg以下)で防御免疫応答が引き起こされ得るという点にある。従って、IL-12は細胞タンパク質発現を抑制する(従って、抗原提示を時間経過とともに妨げる)と考えられるが、本発明においては所望の宿主免疫を付与するのに十分な抗原発現を達成することができる。
【図面の簡単な説明】
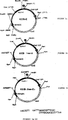
図1は、2コピーの免疫刺激ポリヌクレオチドパリンドロームAACGTT(配列番号1)を含むpCMV-LacZベクターの地図である。
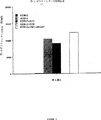
図2は、裸の遺伝子発現ベクターpCMV-LacZ、免疫刺激ポリヌクレオチドを欠くベクター(pKCB-LacZ)、または後者のベクターとKanR(KCB)およびAmpR(ACB)遺伝子もしくは(顆粒球-単球コロニー刺激因子をコードする)pCMV-GMCSFとの組み合わせのいずれかで皮内に免疫したマウスの抗β-ガラクトシダーゼ抗体反応を比較したグラフである。
図3aは、免疫刺激ポリヌクレオチドを欠くpKCB-LacZベクターの地図であり;図3bは、1コピーの配列番号1のポリヌクレオチドが挿入されたpKCB-LACZベクターの地図であり(pKCB-1aaZ);図3cは、2コピーの配列番号1のポリヌクレオチドが挿入されたpKCB-LacZベクターの地図である(pKCB-2aaZ)。
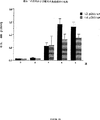
図4は、pCMV-LacZベクター、pKCB-LacZベクター、pKCB-1aaZベクター、pKCB-2aaZベクター、ならびにpKCB-LacZベクターとKanR(KCB)およびAmpR(ACB)遺伝子との組み合わせのそれぞれで皮内に免疫したマウスの抗β-ガラクトシダーゼIgG抗体反応を比較したグラフである。
図5は、pCMV-LacZまたはpKCB-LacZベクターを単独で、およびpUC-19と組み合わせてそれぞれ皮内に免疫した後、β-ガラクトシダーゼに対するマウスのIgG抗体反応を比較したグラフである。
図6は、pKCB-LacZベクター、pCMV-LacZベクター、または対照ベクターのそれぞれで免疫した後のマウスの細胞性免疫(CTL)応答を示すグラフである。
図7は、pKCB-LacZベクター、またはこのベクターとpUC-19ベクターを組み合わせてそれぞれで免疫した後のマウスの細胞性免疫(CTL)応答を示すグラフである。
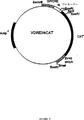
図8は、リガンド誘導可能な核受容体プロモーターを含む、本発明の免疫刺激ポリヌクレオチドの挿入に適したpVDREtkベクターの地図である。
図9aは、pCMV-NP(ウイルス核タンパク質)ベクターで皮内に免疫したマウスの抗ウイルス抗原抗体反応を示し;図9bは、同ベクターを筋肉内注射したマウスの前記反応を比較している。
図10は、pCMV-LacZまたはpKCB-LacZプラスミドのいずれかで形質転換したチャイニーズ・ハムスター卵巣(CHO)細胞にて検出されたLacZ遺伝子発現のレベルを示す。
図11は、本発明の方法によりウイルス抗原に対してワクチン接種したマウス、およびワクチン接種していないマウスのKaplan-Meyer生存曲線である。
図12は、pCMV-LacZで皮内または筋肉内に免疫したマウス体内の抗原に対する記憶T細胞応答を示すグラフである。
図13は、pCMV-LacZで皮内に免疫したマウス、またはpCMV-LacZもしくは抗原で筋肉内に免疫したマウスの抗原に対するIgG 2a反応を示すグラフである。
図14は、pCMV-LacZで皮内に免疫したマウス、またはpCMV-LacZもしくは抗原で筋肉内に免疫したマウスの抗原に対するIgG 2a反応を示すグラフである。
図15は、図13において述べたマウスの、追加抗原刺激後のIgG 2a反応を示すグラフである。
図16は、図13において述べたマウスの、追加抗原刺激後のIgG 1反応を示すグラフである。
図17は、pCMV-LacZプラスミドで免疫したマウスの抗β-ガラクトシダーゼIgE抗体反応のグラフである。
図18は、ケラチン溶解剤(keratinolytic agent)で処理した皮膚を介してpCMV-NPベクターまたは抗原を吸収させて免疫したマウスの抗-NP(インフルエンザ核タンパク質)反応を示す。
図19は、pKCB-LacZ、pCMV-LacZ、またはpKCB-LacZとpUC-19とを組み合わせた投薬で免疫し、その後抗原でチャレンジしたマウスの脾細胞によるIFN-γ産生の相対レベルを示す。
図20は、pKCB-LacZ、pCMV-LacZ、またはpKCB-LacZとpUC-19とを組み合わせた投薬で免疫し、その後抗原でチャレンジしたマウスの脾細胞によるIL-4産生の相対レベルを示す。
好ましい態様の説明
I.本発明の遺伝子発現ベクターに使用するための免疫刺激ポリヌクレオチド
A.非コード化免疫刺激ポリヌクレオチド配列
本発明の非コード化免疫刺激ポリヌクレオチドはCTL活性を刺激するポリヌクレオチド(本発明の免疫刺激ポリヌクレオチドをもたない対照ベクターへの応答と比較して)であり、好ましくはリンパ球によるインターフェロン(IFN)の産生を刺激するものである。二本鎖形では、このようなポリヌクレオチドは少なくとも1つのパリンドローム領域(すなわち、一本の鎖のヌクレオチド配列が相補鎖の対応する領域に逆相補的であるような領域)を含む。各パリンドローム領域は、相補鎖配列、パリンドローム外領域、挿入された制限酵素部位およびリンカーを除いて、約6ヌクレオチド長さ(およびあらゆる最大長さ)程度まで小さいものである。
さらに、本発明の免疫刺激ポリヌクレオチドの各パリンドローム領域は、非メチル化CGジヌクレオチド配列;すなわち、少なくとも2つの隣接するヌクレオチドであって、そのうちの1つのヌクレオチドがシトシンであり、他方のヌクレオチドがグアニンである配列を含む。二本鎖分子においては、免疫刺激ポリヌクレオチドのパリンドローム領域中に存在する各CGジヌクレオチド配列はパリンドロームである;すなわち、1本の鎖上にあるCG配列のシトシンは相補鎖上にあるCG配列のグアニンと対合する。一本鎖分子においては、免疫刺激ポリヌクレオチド中の各CG配列の相対的位置は5’-CG-3’であることが好ましい(すなわち、Cは、3’位にあるGに関して5’位にある)。
最も好ましくは、本発明の各免疫刺激ポリヌクレオチドの各CGジヌクレオチド配列は、少なくとも2つのプリンヌクレオチド(例えば、GAまたはAA)と少なくとも2つのピリミジンヌクレオチド(例えば、TCまたはTT)と隣接して、該免疫刺激ポリヌクレオチドのBリンパ球刺激活性を増強する(例えばKrieg, et al., Nature, 374:546-549, 1995参照)。
本発明の免疫刺激ポリヌクレオチドは当業者に周知の方法(例えば後述するII節を参照)によって、裸の(naked)遺伝子発現ベクター中に挿入される。制限部位、リンカーなどとして使用するのに適したポリヌクレオチド配列を、裸の遺伝子発現ベクター中に挿入すべき本発明の免疫刺激ポリヌクレオチド中に含めることができる。本発明の免疫刺激ポリヌクレオチドは裸の遺伝子発現ベクター中のいかなる位置に挿入してもよく、好ましくは、得られるベクターが本発明のパリンドローム領域を少なくとも2つ含むように、少なくとも2回挿入する。
本発明の免疫刺激ポリヌクレオチドの例としては以下のものを含む:
もしも上述したような免疫刺激ポリヌクレオチドが組換え遺伝子発現ベクターに存在しない場合には、たとえ抗原の発現レベルが増加したとしても、発現した抗原に対する体液性または細胞性免疫応答がほとんど刺激されない。例えば、図2に示すように、マウスにプラスミド(pCMV-LacZ;これは配列番号1の免疫刺激ポリヌクレオチドを2コピー含む)を皮内注射すると、本発明の免疫刺激ポリヌクレオチドをもたないカナマイシン耐性酵素をコードする遺伝子(KCB)を含むプラスミドの皮内注射に応答した刺激よりも、コードされたリポーター分子(β−ガラクトシダーゼ、または「LacZ」)に対する実質的に大きな抗−抗原抗体応答が刺激された(図3aのpKCB-LacZのベクターマップおよび実施例IIを参照)。配列番号1の免疫刺激ポリヌクレオチドの1コピー以上をベクターに挿入した場合(pKCB-1aaZおよびpKCB-2aaZが形成:図3bおよび図3cのベクターマップ;図4のデータ;および実施例IIを参照)、ならびに配列番号1の免疫刺激ポリヌクレオチド2コピーを含む別のプラスミド(pUC-19)または顆粒球刺激因子をコードするベクター(pCMV-GMCSF)(図5)を同時に投与した後では、pKCB-1acZに免疫刺激が与えられた。
同様に、pCMV-LacZプラスミドに対する、そしてpUC-19とKCBプラスミドの同時投与に対するこのマウスの細胞性免疫応答は、本発明の免疫刺激ポリヌクレオチドをもたないpKCB-LacZプラスミドを皮内注射したマウスの応答よりも実質的に大きかった(図6[pKCB-LacZ、pCMV-LacZまたは対照でトランスフェクトした細胞のCTL溶解];図7[pKCB-LacZ、または種々の量のpUC-19とpKCB-LacZで形質転換した細胞のCTL溶解];実施例III;図19[pKCB-LacZ(低産生レベル)、pCMV-LacZ(より高い産生レベル)またはpKCB-LacZとpUC-19の組み合わせ(より高い産生レベル)で免疫したマウス由来の脾臓細胞によるIFN-γ産生];図20[図19でIFN-γ産生を試験したのと同じ脾臓細胞によるIL-4産生];および実施例IX参照)。
非修飾pKCBプラスミドを注射した後で免疫応答がないことは(配列番号1の免疫刺激ポリヌクレオチドを含むプラスミドと比較して)、pKCB-LacZプラスミドの注射後にin vivoで得られるより高いレベルの抗原発現(pCMV-LacZプラスミドと比較して)という観点からすると、特に驚くべきことである(図10参照)。理論的には、抗原の発現が大きいと抗原に対する免疫応答の大きさに反映されると予測するであろう。しかしながら、発現ベクターの非コード領域中に免疫刺激ポリヌクレオチドがない場合には、この発現はin vivoで遂行されない。
従って、当業界における現在の理論とは反対に、抗原の発現レベルの増加は、発現抗原に対する動物の免疫応答を必ずしも増強しない。本発明の状況においては、遺伝子免疫プロトコルにおいて発現した抗原に対する宿主の免疫応答を増強するのは、抗原の発現の大きさだけではなく、むしろ本発明の免疫刺激ポリヌクレオチドなのである。本発明の免疫刺激ポリヌクレオチド(およびこれを含む組換え遺伝子発現ベクター)によるこの活性、ならびにこの活性の有利なアジュバント効果は、DNAが免疫原としては不十分であり、遺伝子置換やワクチン接種プロトコールに用いる遺伝子発現ベクターに対する免疫応答を避けるべきである(後者の場合には求める抗−抗原応答と比較してという意味である)という当業界の一般的観点からすると、予測できないものである。
本発明の免疫刺激ポリヌクレオチドのその他の例は以下のものを含む(各パリンドロームの一本の鎖のみを示す):
当業者であれば(a)上述する本発明の免疫刺激ポリヌクレオチドの構造特性をもち;(b)慣用の検出法(例えば後述する実施例に記載のもの)で測定したときにin vivoの体液性と細胞性の免疫応答を両方とも刺激するようなその他のパリンドロームポリヌクレオチドを容易に同定できるであろう。裸の遺伝子発現ベクター中に導入するものとして、これらの全てのポリヌクレオチドは本発明の範囲内にある。
B.本発明の裸の遺伝子発現ベクター中に挿入するための免疫刺激性、免疫原性かつサイトカインをコードするポリヌクレオチドの調製
本明細書で使用する「ポリヌクレオチド」の語は、分離した断片の形での、またはより大きな構造体中の一成分としての、デオキシリボヌクレオチドまたはリボヌクレオチドのポリマーをいう。本発明の非コード化免疫刺激ポリヌクレオチドは、組換え発現ベクター、好ましくは裸の遺伝子発現ベクター中に挿入された二本鎖または一本鎖のDNAまたはRNAである。このようなポリヌクレオチドは非複製性であるか、あるいは当業者に公知の手段によって宿主ゲノム中に複製しないように遺伝子操作されていなければならない。本発明の組換え遺伝子発現ベクターは抗原、サイトカイン、T細胞エピトープおよびその他の免疫治療的に重要なポリペプチドを発現するためのコード領域を含んでいてもよい。
適当なプローブまたは抗体が入手可能である限り、核酸ハイブリダイゼーションに基づくスクリーニング法によっていかなるポリヌクレオチド配列でも生物から単離できる。問題となっているタンパク質をコードする配列の一部に対応するオリゴヌクレオチドプローブは化学的に合成できる。このためには、アミノ酸配列中の短いオリゴペプチド配列を知る必要がある。タンパク質をコードするDNA配列は遺伝子コードから推定することもできるが、コードの縮重を考慮に入れなければならない。
例えば、対象のポリヌクレオチドを含むと思われるcDNAライブラリーは、cDNA由来の種々のmRNAを卵母細胞に挿入し、cDNA遺伝子産物の発現をさせるのに十分な時間をおいて、所望のcDNA発現産物の存在を、例えば対象のポリヌクレオチドによってコードされるペプチドに特異的な抗体を用いるか、あるいは対象のポリヌクレオチドによってコードされるペプチドに特徴的な繰り返しモチーフおよび組織発現パターンに対するプローブを用いることによってスクリーニングすることができる。あるいは、cDNAライブラリーは、ペプチドに特異的な抗体を用いて、少なくとも1つのエピトープをもつ対象のペプチドの発現を間接的にスクリーニングすることができる。このような抗体はポリクローナルまたはモノクローナル由来のいずれでもよく、また対象のcDNAの存在を示す発現産物の検出に使用できる。
本発明で使用するポリヌクレオチドは、当業者に公知の方法と核酸合成装置を用いて合成することもできる。この分野の参考としては、Ausubel, et al., Current Protocol in Molecular Biology, Chs. 2 and 4(Wiley Interscience, 1989)(ゲノムDNA);およびManiatis, et al., Molecular Cloning: A Laboratory Manual(Cold Spring Harbor Lab., New York, 1982)(cDNA)を参照されたい。構築と使用を簡単なものにするために、合成したポリヌクレオチドとcDNAを本発明の組換え遺伝子発現ベクターに使用するのが一般に好ましい。
本発明の免疫刺激ポリヌクレオチドに加えて、本発明の組換え遺伝子発現ベクターは治療的または免疫刺激的に対象のペプチドのコード領域を含むよう構築できる。例えば、1以上の抗原に対して宿主を免疫し、および/または宿主の免疫応答をさらに刺激する(例えば、組換え遺伝子発現ベクターにTGFβのような免疫抑制サイトカインまたは関連の組織適合性タンパク質を作動的にコードする遺伝子を含めることによって)ためには、ポリヌクレオチドの混合物を投与、または複数のポリヌクレオチドを別々に同時投与することが有用である。
本発明の組換え遺伝子発現ベクターは、1以上の生物活性をもつペプチドをコードすることもできる。例えば、免疫刺激ペプチドを作動的にコードするポリヌクレオチドを、抗体を作動的にコードするポリヌクレオチドと結合するか、あるいは同時投与してペプチドと抗体の両方を発現させる。例としては、LI-2と抗-gp71を一緒に発現する遺伝子を投与すると、(IL-2タンパク質で得られた結果に基づいて)マウスにおいてネズミ白血球ウイルス(MuLV)に応答して発生した腫瘍組織中に抗体が局在するようになる(IL-2/抗-gp71 mAbの同時投与で得られる結果についてはSchultz, et al., Cancer Res., 50:5421-5425, 1990を参照)。さらに、同じベクターが抗原、T細胞エピトープ、サイトカインまたはその他のポリペプチドを組み合わせてコードする場合もある。
適当なプラスミドまたはコスミドによって200個までのポリヌクレオチド配列を1つのプロモーターの制御下に発現することができる。このような「カクテル」ベクターは、似た症状を引き起こす異なる種の病原体による感染治療に特に有用である。例えば、似た臨床症状をもつ呼吸疾患を引き起こす既知のライノウイルスが100種以上ある。特定の感染種を同定する(これは手間がかかり、不正確な方法であることが多い)よりはむしろ、多くの異なるライノウイルスに対する免疫応答を刺激することのできる本発明の方法を用いてカクテルワクチンを投与できる。このアプローチを用いると、異なる患者由来のエンベロープ遺伝子の単離物を集めて(必要ならこの遺伝子を増幅してもよい)、これを用いて種々のHIV株に対するワクチンを構築することも可能となる。
このような対象のポリペプチドをコードする遺伝子についての既知のポリヌクレオチド配列を当業者は容易に利用でき、あるいは知ることができる。
II.組換えおよび裸の遺伝子発現ベクターの構築法
本発明の組換え遺伝子発現ベクターは、本発明の免疫刺激ポリヌクレオチドを含むプラスミドまたはコスミドであることが好ましいが、ウイルスまたはレトロウイルスであってもよい。上述したように、ベクターには対象のペプチド(例えば抗原やサイトカイン)を作動的にコードする1または複数の遺伝子を含めることもできる。最も好ましくは、ベクターは「裸(naked)」である、すなわちデリバリー媒介物(例えばリポソーム、コロイド粒子など)と関連していない。便宜性のために、本明細書で使用する「プラスミド」の語は、プラスミドまたはコスミドをいい、対象のペプチドの発現に使用するのにどちらが適しているかによる(2つのうちのどちらを選ぶかは、対象のペプチドをコードする遺伝子の大きさによって決まる)。「作動的に(operatively)コードする」とは、ポリペプチドの発現に必要な全ての制御配列に関連する遺伝子をいう。
本発明の免疫刺激ポリヌクレオチドは、抗原またはサイトカインをコードするポリヌクレオチドと同様に、これらのポリペプチドの発現を制御する制御タンパク質を作動的にコードする別のポリヌクレオチドと結合または関連させて使用でき、あるいは認識、プロモーターおよび分泌配列を含むことができる。当業者は過度の実験を必要とせずに、制御ポリヌクレオチドを選択して、これを本発明の組換え遺伝子発現ベクター中に(ベクター中に既に存在していないならば)導入することができる。例えば、ネズミまたはヒトの系で使用するのに適当なプロモーターとその使用はAusubel, Current Protocols in Molecular Biology(前掲),第1章に記載されている。
一般に、本発明に使用するプラスミドベクターは、宿主細胞と適合性である種に由来するプロモーターおよび制御配列を含む。例えば、大腸菌は典型的には大腸菌の種に由来するプラスミドであるpBR322を用いて形質転換する(Bolivar, et al., Gene, 2:95, 1977)。pBR322はアンピシリン耐性(AMPR)およびテトラサイクリン耐性をもち(このうちの前者は本発明で有用なポリヌクレオチド断片を含む)、従って形質転換細胞を容易に同定する手段を提供する。しかしながら、ヒトに使用するには、宿主にアンピシリン耐性を与える組換え発現ベクターの使用を米国食品医薬品局(FDA)は現在のところ禁止している。pBR322プラスミドまたはその他の微生物プラスミドは、組換えDNAの構築に一般に用いられるプロモーターおよびその他の制御エレメントを含んでいるか、あるいは含むように改変されていなければならない。
「制御配列」または「制御領域」とは、転写または翻訳のいずれかの制御に関与する真核生物遺伝子の5’および3’末端にある特定配列をいう。ほとんど全ての真核生物遺伝子は転写開始位置から約25〜30塩基上流に位置するATに富む領域をもっている。多くの遺伝子の転写開始位置から70〜80塩基上流に見られる別の配列はCCAAT領域であり、ここでXはいかなるヌクレオチドであってもよい。ほとんどの真核生物遺伝子の3’末端にはAATAAA配列があり、これは転写したmRNAの3’末端にポリAテイルを付けるためのシグナルである。
対象のポリペプチドを作動的にコードする遺伝子を含む本発明の組換え遺伝子発現ベクターに使用するベクターにとって、哺乳動物宿主細胞のベクターからの転写を制御する好ましいプロモーターは種々の材料、例えばポリオーマ、サルウイルス(SV40)、アデノウイルス、レトロウイルス、肝炎Bウイルス、そして最も好ましくはサイトメガロウイルスなどのウイルスゲノムから、または異種の哺乳動物プロモーター、例えばβアクチンプロモーターから得ることができる。SV40ウイルスの初期および後期プロモーターは便宜的にはSV40ウイルス複製起源をも含むSV40制限断片として得られる(Fiers, et al., Nature, 273:113, 1978)。ヒトサイトメガロウイルスの即時(immediate)初期プロモーターは便宜的にはHindIII制限断片として得られる(Greenaway, et al., Gene, 18:355-360, 1982)。宿主細胞または関連種由来のプロモーターも本発明で使用できる。
原核生物宿主に使用するのに適したプロモーターにはβ−ラクタマーゼおよびラクトースプロモーター系(Chang, et al., Nature, 275:615, 1978;およびGoeddel, et al., Nature, 281:544, 1979)、アルカリホスファターゼ、トリプトファン(trp)プロモーター系(Goeddel, Nucleic Acids Res., 8:4057, 1980)およびtaqプロモーターのようなハイブリッドプロモーター(de Boer, et al., Proc. Natl. Acad. Sci. USA, 80:21-25, 1983)を含む。しかし、その他の機能的細菌プロモーターも適している。そのヌクレオチド配列は当業者に公知であり、従って当業者は必要なリンカーまたはアダプターを用いて対象のペプチドをコードするポリヌクレオチドに結合して、あらゆる制限部位を供給することができる(Siebenlist, et al., Cell, 20:269, 1980)。
原核生物に加えて、酵母培養物のような真核微生物も対照配列の材料として使用できる。その他の多くの株も使用可能であるが、酵母菌(Saccharomyces cerevisiae)または普通のパン酵母がこの分野で最もよく使用される真核微生物である。
酵母宿主に使用するのに適した促進配列には、3−ホスホグリセレートキナーゼ(Hitzeman, et al., J. Biol. Chem., 255:2073, 1980)またはエノラーゼ、グリセルアルデヒド−3−ホスフェート、デヒドロゲナーゼ、ヘキソキナーゼ、ピルビン酸デカルボキシラーゼ、ホスホフラクトキナーゼ、グルコース−6−ホスフェートイソメラーゼ、3−ホスホグリセレートムターゼ、ピルビン酸キナーゼ、トリオースホスフェートイソメラーゼ、ホスホグルコースイソメラーゼおよびグルコキナーゼのようなその他の解糖系酵素(Hess, et al., J. Adv. Enzyme Reg. 7:149, 1968;およびHolland, Biochemistry, 17:4900, 1978)のためのプロモーターを含む。
増殖条件で制御される転写にさらに有利な誘導可能なプロモーターであるその他の酵母プロモーターは、アルコールデヒドロゲナーゼ2、イソチトクロームC、酸ホスファターゼ、窒素代謝に関連する分解酵素、メタロチオニン、グリセルアルデヒド−3−ホスフェートデヒドロゲナーゼならびにマルトースおよびガラクトースの利用を行う酵素のためのプロモーター領域である。酵母エンハンサーも酵母プロモーターとともに使用すると有利である。対象のポリペプチドをコードするDNAの高等真核生物による転写は、ベクターにエンハンサー配列を挿入することによって増加される。エンハンサーは通常約10〜300塩基対のDNAのシス作用性エレメントであり、プロモーターに作用してその転写を増加する。エンハンサーは転写単位の5’(Laimins, et al., Proc. Natl. Sci. Acad. USA, 78:993, 1981)および3’(Lusky, et al., Mol. Cell Bio., 3:1108, 1983)に見いだされてきた方向と位置とは相対的に独立であり、イントロンの中に(Banerji, et al., Cell, 33:729, 1983)、また同様にコード配列自体の中にあることが見いだされている(Osborne, et al., Mol. Cell Bio., 4:1293, 1984)。哺乳動物遺伝子(グロビン、エラスターゼ、アルブミン、α−フェトタンパクおよびインシュリン)から多くのエンハンサー配列が知られている。しかしながら、典型的には真核細胞ウイルス由来のエラスターゼが使用される。例としては、複製起点の後期側にあるSV40エンハンサー(100〜270塩基対)、サイトメガロウイルス初期プロモーターエンハンサー、複製起点の後期側にあるポリオーマエンハンサーおよびアデノウイルスエンハンサーを含む。
ポリペプチドを作動的にコードし、真核宿主細胞(酵母、真菌、昆虫、植物、動物、ヒトまたはその他の多細胞生物由来の有核細胞)に導入するための遺伝子を含む発現ベクターは、mRNA発現に影響するかもしれない転写を停止するのに必要な配列も含むであろう。発現ベクターには選択可能なマーカーとも呼ばれる選択遺伝子も含むであろう。当業界で公知の哺乳動物細胞用の適当な選択可能なマーカーの例には、ジヒドロ葉酸還元酵素(DHFR)、チミジンキナーゼまたはネオマイシンが含まれる。このような選択可能なマーカーをうまく哺乳動物宿主細胞中に移送すると、形質転換された哺乳動物宿主細胞は、選択的圧力下においた場合に(すなわち、薬剤耐性または宿主細胞の栄養要求性を変更する遺伝子を付与されることによって)生存できる。
当業者は、本発明の非コード化免疫刺激ポリヌクレオチドをもつ組換え発現ベクターとして使用するためのウイルスおよびレトロウイルスをよく知っており、あるいはこれを容易に同定できる。このような当業者はまた、リポソームやコロイド粒子のようなデリバリー媒介物と関連した非ウイルス性ベクターを過度な実験を必要とせずに構築することもできるであろう。従って、このようなウイルス性および非ウイルス性のベクターについては簡単なまとめのみを概説として以下に記載する。
抗原としてポリヌクレオチドのAPC認識に依存しない本発明の態様のためには、標的送達のためにコロイド分散系を使用できる。コロイド分散系には巨大分子複合体、ナノカプセル、小球、ビーズ、および水中油エマルジョンを含む脂質ベースの系、ミセル、混合ミセルおよびリポソームを含む。本発明の好ましいコロイド系はリポソームである。
リポソームはin vitroおよびin vivoでのデリバリー媒介物として有用な人工膜小胞である。0.2〜0.4μmのサイズの大きな単ラメラ小胞(LUV)は大きな巨大分子を含む水性緩衝液のかなりの部分を封入することができる。RNA、DNAおよび完全なビリオンを水性内部に封入して生物活性形態で細胞に送達することができる(Fraley, et al., Trends Biochem. Sci., 6:77, 1981)。哺乳動物細胞に加えて、リポソームは植物、酵母および細菌細胞中のポリヌクレオチドの送達にも使用されてきた。リポソームが有効な遺伝子輸送ベヒクルであるためには、以下の性質をもっていなければならない:(1)高効率でアンチセンスポリヌクレオチドをコードする遺伝子を封入するが、その生物活性を損なわないこと;(2)非標的細胞と比較して標的細胞と優先的かつ実質的に結合すること;(3)高効率で標的細胞の細胞質に小胞の水性内容物を送達すること;そして(4)遺伝子情報を正確かつ効率よく発現すること(Mannino, et al., Biotechniques, 6:682, 1988)。
リポソームの組成は通常はリン脂質、特に高相転移温度のリン脂質と、通常はステロイド、特にコレステロールとの組み合わせである。その他のリン脂質又はその他の脂質も使用できる。リポソームの物理的性質はpH、イオン強度、および二価カチオンの存在に依存する。
リポソーム製造に有用な脂質の例には、ホスファチジル化合物、例えばホスファチジルグリセロール、ホスファチジルコリン、ホスファチジルセリン、ホスファチジルエタノールアミン、スフィンゴ脂質、セレブロシドおよびガングリオシドを含む。特に有用なのはジアシルホスファチジルグリセロールであり、ここで脂質部分には14〜18の炭素原子、特に16〜18の炭素原子を含み、飽和である。リン脂質の例には卵ホスファチジルコリン、ジパルミトイルホスファチジルコリンおよびジステアロイルホスファチジルコリンを含む。
リポソームの標的化は解剖学的ならびに機械的要因に基づいて分類できる。解剖学的分類は選択性のレベル、例えば器官特異性、細胞特異性およびオルガネラ特異性に基づく。機械的標的化はそれが受動的か能動的かに基づいて区別できる。受動的標的化では、ジヌソイド毛細血管を含む器官中における細胞内皮系(RES)の細胞にリポソームが自然に拡散する傾向を利用する。他方、能動的標的化は、モノクローナル抗体、糖、糖脂質、またはタンパク質のような特定リガンドにリポソームを結合するか、あるいは自然に起こる局在部位以外の器官や細胞への標的化を達成するためにリポソームの組成やサイズを変えることによってリポソームを改変することを含む。
標的化デリバリーシステムの表面は種々の方法で修飾することができる。リポソーム標的化デリバリーシステムでは、リポソームの脂質二重層中に脂質基を導入して、標的化リガンドがリポソーム二重層と安定な会合を維持するようにすることができる。脂質鎖を標的リガンドと結合するためには種々の結合基を用いることができる。
本発明で利用することができる種々のウイルスベクターには、アデノウイルス、ヘルペスウイルス、ワクシニア、または好ましくはレトロウイルスなどのRNAウイルスを含む。好ましくは、レトロウイルスはネズミまたはトリレトロウイルスの誘導体である。1つの外来遺伝子を挿入することのできるレトロウイルスベクターの例としては、モロニーネズミ白血球ウイルス(MoMuLV)、ハーベイネズミ肉腫ウイルス(HaMuSV)、ネズミ乳腺腫瘍ウイルス(MuMTV)およびラウス肉腫ウイルス(RSV)を含むが、これに限定されない。多数の別のレトロウイルスは複数の遺伝子を組み込むことができる。これらのベクターの全ては、形質導入した細胞を同定して増殖できるように選択可能なマーカーのための遺伝子を転移または組み込むことができる。
例えば特定標的細胞上の受容体のためのリガンドをコードする別の遺伝子とともに、ウイルスベクター中に対象の1以上の配列を挿入することによって、ベクターは標的特異的になる。例えば糖、糖脂質またはタンパク質をコードするポリヌクレオチドを挿入することによってレトロウイルスベクターを標的特異的にすることができる。好ましい標的化は、レトロウイルスベクターを標的とする抗体を使用することによって達成できる。対象のポリヌクレオチドを含むレトロウイルスベクターを標的特異的に送達できるようにするために、レトロウイルスゲノムに挿入することのできる特異的ポリヌクレオチド配列を当業者は過度の実験を行う事なく容易に確認することができる。必要ならば、置換遺伝子を細胞に標的送達するために別のベクターを利用することができる。アンチセンスオリゴヌクレオチドは多型を含む標的遺伝子に対してのみ特異的なので、アンチセンス治療においてはアンチセンスオリゴヌクレオチドと置換遺伝子とを同じベクターを介して送達することもできる。
組換えレトロウイルスは欠失性なので、感染性のベクター粒子を産生するためには補助を必要とする。この補助は例えば、LTR内の制御配列の制御下にレトロウイルスの構造遺伝子の全てをコードするプラスミドを含むヘルパー細胞系を使用することによって提供される。これらのプラスミドはカプシド化のためのRNA転写物を認識するパッケージングメカニズムを可能にするヌクレオチド配列を欠いている。パッケージングシグナルが欠失しているヘルパー細胞系はΨ2、PA317およびPA12を含むが、これに限定されない。これらの細胞系はゲノムがパッケージングされないので空のビリオンを産生する。もしもレトロウイルスベクターを、パッケージングシグナルは完全であるが構造遺伝子が対象の別の遺伝子で置換されているこのようなヘルパー細胞中に導入した場合には、ベクターはパッケージングされてベクタービリオンが産生される。
本発明の免疫刺激ポリヌクレオチドをウイルス性の遺伝子発現ベクター中に導入するのに使用するのと同じ方法を用いて、ワクチンに使用するための生きた弱毒生ウイルス中に配列を導入することができることが理解できよう。このような修飾ウイルスワクチンは、ウイルスワクチン自体よりも大きな免疫刺激性をもつことが期待できる。
所望のコード配列、非コード配列および制御配列を含む適当なベクターの構築には標準のライゲーション法を用いる。単離したプラスミドまたはDNA断片を切断し、目的に合わせて手を入れ、所望の形に再ライゲーションして必要なプラスミドを構築する。
例えば、構築したプラスミド中に正しい配列があるかを確認するための分析には、ライゲーション混合物を用いて宿主細胞を形質転換し、適当な抗生物質耐性によって正しい形質転換体を選択する。形質転換体からのプラスミドを調製し、制限酵素で分析し、および/または例えばMessingらの方法(Nucleic Acids Res., 9:309, 1981)、Maxamらの方法(Methods in Enzymolozy, 65:499, 1980)または当業者に公知のその他の適当な方法を用いて配列決定する。切断断片のサイズ分離は例えばManiatisら(Molecular Cloning, pp.133-134, 1982)が記載する慣用のゲル電気泳動を用いて実施できる。
宿主細胞を本発明の発現ベクターで形質転換し、プロモーターの誘導に適すように修飾した慣用の栄養培地中で培養し、形質転換体または増幅遺伝子を選択する。温度、pHなどの培養条件は以前にその宿主細胞の発現の選択に使用したものであり、当業者には自明である。
発現をモニターする目的で、組換え遺伝子発現ベクターを修飾して既知のリポーターポリヌクレオチドを作動的にコードする遺伝子を含めることができる。例えば、文献(Norton, et al., Mol. Cell. Biol., 5:281, 1985)に記載のpRSV lac-Z DNAベクターはタンパク質発現を伴ってβ−ガラクトシダーゼを産生する。ルシフェラーゼとクロラムフェニコールアセチルトランスフェラーゼ(「CAT」;例えばpRSV-CATプラスミドの構築について前掲のGormanらの文献を参照のこと)も使用できる。慣用のプラスミド増殖は大腸菌で得られる(例えば前掲のMolecular Cloning: A Laboratory Mannualを参照)。
本発明における修飾および使用に特に好ましいプラスミドはpRSV(ラウス肉腫ウイルス)およびpCMV(サイトメガロウイルス)プロモーターベクターである。これらのプロモーターのうち、筋肉以外の組織に導入するポリヌクレオチドにはCMVが好ましい。これは、CMVプロモーターを用いた場合には本発明では高レベルの発現が達成されるという観察に基づいている。
RSVプロモーターの単離とプラスミドベクターの構築へのその使用についての適切なプロトコルは文献(Gorman, et al., Proc. Natl. Acad. Sci. USA, 79:6777, 1982)に記載されている。その他の好ましいプラスミドベクターはpREP7およびpREVであり、これらはカリフォルニア州、サンディエゴのInvitrogen社から入手可能である。ポリヌクレオチドのクローニングにおいて、mRNAの産生に特に適したプラスミドはKreigら(Nucleic Acids Res., 12:7057-7070, 1984)の記載するpSP64Tである。開始コドンをもついかなるcDNAでもこのプラスミドに導入することができ、慣用法を用いて発現したDNA鋳型からmRNAを調製できる。
また、本発明で使用するのに特に有用なベクター構築体は、リガンド誘導性の核受容体プロモーターのような、患者にベクターを投与した後にスイッチを「オン」または「オフ」できるプロモーターを含むものである。このようなプロモーターを含む組換え遺伝子発現ベクターは、ベクターを皮膚または粘膜に導入して、ベクターが導入される部位の吸収を誘導リガンドを用いることによって発現制御できるようなワクチン接種プロトコルにおいて特に使用される。
核受容体は、応答性エレメントとして知られている標的プロモーター中に見られる特定DNA配列と結合することによって作用する転写エンハンサー因子のファミリーを表す。核受容体ファミリーの特定メンバーには、ビタミンD3およびレチノイドのような小さい脂溶性リガンド、ならびにステロイドや甲状腺ホルモン(「活性化リガンド」)のための主要細胞内標的を含む。
特定の活性化リガンドによって活性化された核受容体は真核生物発現ベクター中のプロモーターとして使用するのに適している。なぜなら遺伝子の発現を受容体にとって利用可能なリガンドの濃度を制御するだけで制御できるからである。例えば、マウス乳腺腫瘍ウイルス(MMTV)のロングターミナルリピートのプロモーターのようなグルココルチコイド誘導性のプロモーターは、グルココルチコイド応答性エレメントが多様な細胞型で発現されるので、この面で広く使用されてきた。多様なステロイドホルモン(例えばデキサメタゾンおよびプロゲステロン)に対して作用するグルココルチコイド応答性エレメントを利用する1つの発現系は、HeLa細胞中に形質転換されたpGREtkプラスミド(pBLCAT8+中に単純ヘルペスウイルスチミジンキナーゼ(tk)の上流に1以上のラットチロシンアミノトランスフェラーゼグルココルチコイド応答性エレメントを含む)である(Mader and White, Proc. Natl. Acad. Sci. USA, 90:5603-5607, 1993[pGRE2tk];およびKlein-Hitpass, et al., Cell, 46:1053-1061, 1986[pBLCAT8+];これらの開示は、この引用により、核受容体応答性エレメント由来の適当なプロモーター[「NRREプロモーター」]の構築に関する当業界の知識を説明するために、本明細書に組み込まれる)。pGREtkプロモーター(図8のマップを参照)が真核細胞におけるクローン化遺伝子の制御された過発現を刺激するのに特に有効である(Made and White,前掲,5607)。
本発明に使用する別の特に適切なNRREプロモーターはビタミンD3化合物である1,25-ジヒドロキシビタミンD3およびその非高カルシウム血症性類自体(「ビタミンD3活性化リガンド」と総称する)によって誘導可能なものである。ビタミンD3活性化リガンドによって誘導可能なNRREプロモーターには、3塩基対で隔てられている直接リピートを認識するビタミンD3受容体(VDR)応答性エレメントPurG(G/T)TCAを含む。ビタミンD3応答性エレメントはヒトオステオカルシンおよびマウスオステオポンチン遺伝子の上流に見られる;これらの遺伝子の転写はVDRの結合により活性化される(例えば、Morrison and Eisman, J. Bone Miner. Res., 6:893-899, 1991;およびFerrara, et al., J. Biol. Chem., 269:2971-2981, 1994;これらの開示をビタミンD3応答性の誘導可能なプロモーターの当業界の知識を説明するための文献として援用する)。先端を短くした単純ヘルペスウイルスチミジンキナーゼ(tk)プロモーターの上流にマウスオステオポンチンVDRを含む組み換え発現ベクターの試験から得られた最近の実験結果によると、9-シス-レチノイン酸が1,25-ジヒドロキシビタミンD3に対するVDRの応答を増大できることを示唆している(Carlberg, et al., Nature, 361:657-660, 1993参照)。
Ferraraらは、複数コピーの強いVDR、特にマウスオステオポンチンVDR(3塩基対で隔てられているPurGTTCAモチーフの直接リピートからなる)を用いて構築した組換え発現ベクター中のビタミンD3誘導可能なプロモーターについても記載している。このVDRはビタミンD3に対してのみでなく、甲状腺ホルモンおよび/またはレチノイン酸に対しても応答性であることが以前に示されているPurGG/TTCAコンセンサスモチーフに従っている。単純ヘルペスウイルスtkプロモーターのすぐ上流においてpBLCAT8+にマウスVDR3コピーを挿入した(例えば図8[pVDREtkのマップ]参照)。得られるVDREtkベクターでCOS細胞をトランスフェクトする(「VDR発現系」が得られる)と、VDRをその応答性エレメントに結合するための代替因子として作用することが以前に示されていた核レチノイドX受容体(RXR)をCOS細胞が含むという点で特に有用であることが判明した。
VDR発現系(および例えばヒトオステオカルシン遺伝子プロモーターの制御下で機能的に均等な発現系)は本発明で使用するのに特に適している。特に、本発明に従って哺乳動物に表皮または皮膚経路(特に前者)でビタミンD3応答性発現系で投与したポリペプチドの発現は、1,25-ジヒドロキシビタミンD3調製物の局所投与によって投与時点でスイッチをオンにすることができる(そしてにビタミンD3調製物の投与をやめるか、および/またはレチノイン酸の源を投与時点まで投与するか、または投与時点からやめるかすることによって調節することによってオフにすることができる)。便宜的には、1,25-ジヒドロキシビタミンD3およびその非高カルシウム血症性類自体は米国食品医薬品局によって乾癬治療のための局所製剤としての使用が認められており、市販されている。
NRREプロモーターのin vivo試験では、その対応する応答性エレメントに全身を曝すと誘導可能であることを示している。投与時点で表皮または皮膚から投与したポリヌクレオチドの予期される維持を仮定すると(従って、局所的に吸収した応答性エレメントに曝されることが可能になる)、このようなポリヌクレオチドの発現のためにNRREプロモーターを使用することにより、適当なNRREプロモーター活性化リガンド(例えば、対象のポリヌクレオチドの発現のためのVDR発現ベクターをもつ1,25-ジヒドロキシビタミンD3転写活性剤)の局所投与によるそのin vivo制御が可能になることが容易に予測できる。
従って、本発明によりコード化および免疫刺激非コード化ポリヌクレオチドの投与と発現のためにNRREプロモーター組換え遺伝子発現ベクターを使用すると、例えば、作動が必要なときだけ発現スイッチをオンにし、発現したタンパク質またはペプチドに副作用がある場合には発現スイッチをオフにするように発現の制御が可能になる。
III.組換え遺伝子発現ベクターの医薬製剤
組換え遺伝子発現ベクターの組成物は、製剤学上許容しうる懸濁液、溶液または乳濁液にすることができる。好適な媒体としては食塩水が挙げられ、標的組織へのポリヌクレオチドの送達のために抗原提示細胞に頼らない適用では、リポソーム製剤であり得る。しかし、本発明の方法に関して以下でさらに検討されるように、本発明の組換え遺伝子発現ベクターがリポソームに会合していないこと、もしくは宿主免疫系が該ベクターを外来のものとして認識するのを妨げる可能性のある任意の他の物質と共に用いられないこと、が好ましい。
さらに詳細には、本発明の裸の遺伝子発現ベクターと共に使用するのに好ましい製剤学上許容しうる担体には、無菌の水性または非水性溶液、懸濁液および乳濁液が含まれ得る。非水性溶剤の例は、プロピレングリコール、ポリエチレングリコール、植物油(例えば、オリーブ油)および注射用有機エステル(例えば、オレイン酸エチル)である。水性担体としては、水、アルコール/水性溶液、乳濁液または懸濁液(食塩水および緩衝化媒体を含む)が挙げられる。非経口用賦形剤としては、塩化ナトリウム溶液、リンゲル(Ringer)のデキストロース、デキストロース、および塩化ナトリウム、乳酸加リンゲル液または不揮発油が挙げられる。静脈内用賦形剤としては、流動性および栄養補液、電解質補液(例えば、リンゲルのデキストロースをベースとするもの)などが挙げられる。例えば抗微生物剤、酸化防止剤、キレート剤、および不活性ガスなどの保存剤、ならびに他の添加剤も存在し得る。さらに、組換え遺伝子発現ベクターの組成物は、その後の用時調製および本発明による使用のために、当業界で周知の手段を用いて凍結乾燥することが可能である。
等張の緩衝溶液は、裸の遺伝子発現ベクターの最大の取込みのためには好ましい媒体である。さらに、組換え遺伝子発現ベクター組成物の導入部位からの送達を促進するためには、吸収促進剤、界面活性剤、化学的刺激剤または機械的刺激手段の使用も好ましい。有機およびペプチドベースの薬剤の粘膜送達において有利に用いられているプロモーターおよび界面活性剤に関する一般原理については、Chien, Novel Drug Delivery Systems,第4章(Marcel Dekker、1992)を参照のこと。鼻腔ドラッグデリバリーの公知の手段および原理に関する詳細な情報は、Chien,前掲,第5章に述べられている。好適な鼻腔吸収促進剤の例は、第5章の表2および3に述べられている。より温和な剤が好ましい。さらに、経皮ドラッグデリバリーの公知の手段および原理もChien,前掲、第7章で述べられている。粘膜/鼻腔デリバリーのための本発明の方法で使用するのに適した剤も、Changら,Nasal Drug Delivery,「Treatise on Controlled Drug Delivery」第9章およびその表3〜4B(Marcel Dekker, 1992)に記載されている。皮膚からの薬剤の吸収を増大させることが知られている好適な剤は、Sloan, Use of Solubility Parameters from Regular Solution Theory to Describe Partitioning-Driven Processes,第5章,「Prodrugs:Topical and Ocular Drug Delivery」(Marcel Dekker, 1992)およびこの本文の他の場所に記載されている。
当業者であれば、これらの技術(およびドラッグデリバリーを促進するために従来用いられる他の技術)は、過度な実験操作を行わなくとも、本発明の方法で使用するための組換え遺伝子発現ベクターの調製に適合させ得ることが予測されよう。特に、上記段落で述べたアプローチは、本発明者らの知る限りでは、以前にはポリヌクレオチドの送達に用いられてはいないが、それらのアプローチは、その目的で使用するのに好適であると考えられる。この理由により、上記の文献は、本発明の組成物および方法にとって本質的ではないが、それを参考として本明細書に組み入れるものとする。
IV.本発明の裸の遺伝子発現ベクターのin vitroでの使用方法
A.定義
以下の定義は、本発明の方法を理解するのに用いられる。
a.「抗原提示細胞(antigen presenting cells)」または「APC」には、ランゲルハンス細胞、輸入リンパ管のベイル細胞、リンパ器官の樹状細胞および指状突起細胞などの既知のAPCが含まれる。この定義には、さらに、(1)本発明によるポリヌクレオチドを皮膚において取り込みかつ発現するリンパ球およびマクロファージ、および(2)本明細書中に含まれる組織写真に示される単核細胞のような単核細胞も含まれる。これらの細胞は、組織細胞ではなく、抗原提示細胞の可能性がある。これらの中で、本発明に関して最も重要なものは、リンパ組織の上皮および胸腺依存性領域に多数存在することがわかっているAPCであり、例えば、頬粘膜、膣、子宮頸部および食道の表皮および偏平粘膜上皮(APCの濃度が「比較的高い」領域)が挙げられる。したがって、後述するそれらの定義に加えて、本明細書中で用いられる「皮膚」および「粘膜」は、特に、APCが集中しているこれらの部位を意味する。さらに、「プロフェッショナルAPC(professional APCs)」は、主な役割が抗原提示である細胞(すなわち、骨髄由来細胞)を意味する。
b.「界面活性剤/吸収促進剤」は、ある種の小さな分子ならびにペプチドの吸収およびトランスフェクションを促進することが当業界で現在公知である化学物質を意味する。
c.「イオン導入(法)(iontophoresis)」は、ペプチドを連続的に宿主に送達するのに現在用いられている公知の経皮伝達手段を意味する。さらに特定すると、それは、生理的に許容されうる電流をかけることによるイオン性化学種の輸送を促進する方法である。この方法および他の経皮伝達手段はChienら、Transdermal Drug Delivery,「Novel Drug Delivery Systems」第7章、パートC(Marcel Dekker, 1992)に記載されており、これに関連する開示内容は、ドラッグデリバリー技術に関する当業界の知識の現状を説明する目的で、これを参考として本明細書に組み入れるものとする。
d.「宿主」は、本発明により施される治療のレシピエント(受容者)を意味する。宿主は任意の脊椎動物であり得るが、好ましくは哺乳動物である。哺乳動物では、宿主は好ましくはヒトであるが、家畜または愛玩動物でもあり得る。
e.「標的組織」は、ポリヌクレオチドの発現が望まれる宿主の組織を意味する。
f.本明細書中で用いられる「皮膚」は、宿主の表皮組織、真皮組織および皮下組織を意味する。
g.「粘膜」は、宿主の粘膜組織(体内に位置するものであればいずれのものでもよい)を意味し、例えば、呼吸管(気管、肺上皮および鼻上皮を含む)、生殖器管(膣粘膜、陰茎粘膜、および肛門粘膜を含む)、尿管(例えば、尿道、膀胱)、口、目および声帯が挙げられるが、それらに限定されない。
h.「導入部位(point of entry)」は、宿主へのポリヌクレオチドの導入部位を意味し、すぐ隣りの組織を含む。
i.「皮膚投与」および「表皮投与」は、ポリヌクレオチドを皮膚へ、または皮膚を経由して適用する投与経路を意味する。皮膚経路には、皮内および皮下注入、ならびに経皮伝達が含まれる。表皮経路には、刺激物質に対する免疫応答を引き出すのに十分に皮膚の最外層を刺激する任意の手段が含まれる。刺激物質は機械的または化学的(好ましくは局所的)作用物質であり得る。
j.「上皮投与」には、化学的刺激物質が粘膜の上皮に適用される以外は化学的表皮投与と本質的に同じ方法が含まれる。
k.「IL」はインターロイキンを意味し、「IFN」はインターフェロンを意味する。
l.「TH1応答」は、特定のAPC(すなわち、マクロファージおよび樹状細胞)に結合してそれを活性化する抗原によって優先的に誘発される細胞性免疫応答を意味する。
B.本発明の裸の遺伝子発現ベクターを、高濃度の抗原提示細胞を有する標的組織に導入する方法:宿主免疫応答に対する裸の遺伝子発現ベクター使用の効果
本発明の方法は、本発明の裸の遺伝子発現ベクターを使用するのに適した実施態様について記載することにする。しかし、他の組換え発現ベクターも同様の経路で投与可能であると理解されよう。但し、ウイルス発現ベクターの使用は望ましいものではなく、裸でない発現ベクター(すなわち、デリバリー媒介物を伴う)の使用は、本発明の免疫刺激ポリヌクレオチドの免疫刺激活性を有意に低下させると予想できる。
本発明の方法は、宿主の免疫応答が刺激されて該宿主に抗原からの防御をもたらす作用機構に関する特定の理論によって制約を受けるものではないが、(抗原をコードする裸の遺伝子発現ベクターをAPCに導入するための)本発明の好ましい方法は、IL-12放出のためのTH1(ヘルパーT細胞)リンパ球の産生を選択的かつ効率的に促進するするように、そしてCTL活性を増大させるように設計される。この実施態様では、Tリンパ球免疫応答のTH1成分が、一般に、IgE抗体の産生を媒介するTH2リンパ球の抗原刺激に優先して刺激される。
さらに詳細には、ここ数年にわたって、CD4+細胞が一般に、2つの異なるサブセットであるTH1細胞およびTH2細胞の一方に分類されることが示されている。TH1細胞は主にIL-2、IFN-γ、IFN-α、IL-12およびINFβ(後ろの2つはマクロファージ活性化および遅延型過敏症を媒介する)を分泌し、一方、TH2細胞は主にIL-4(IgE抗体の産生を刺激する)、IL-5、IL-6およびIL-10を分泌する。これらのCD4+サブセットは、互いにネガティブな影響を及ぼす。すなわち、TH1リンホカインの分泌はTH2リンホカインの分泌を抑制し、またその逆も起こる。さらに、TH2細胞をCTLにさらすことによってもTH2細胞の活性は抑制されると考えられる。
ヘルパーT細胞のサブセットがどのようにして示差的に調節されるのかは、完全には明確になっていない。TH1活性化に有利であると考えられる要因は、ウイルス感染によって誘発されるものと類似しており、細胞内病原体、IFN-γ、IFN-αおよびIL-2への曝露、APCの存在ならびに低用量の抗原への曝露が含まれる。TH2活性化に有利であると考えられる要因としては、IL-4およびIL-10への曝露、Bリンパ球の役割に対するAPC活性および高用量の抗原が含まれる。活性なTH1細胞は、細胞性免疫を増強させるので、細胞内感染への応答において特に有用である。一方、活性なTH2細胞は、抗体産生を増大させるため、細胞外感染への応答において有用である。しかし、TH2細胞活性はまた、IL-4の放出によりIgE産生を誘発するので、IgE−抗原複合体の形成を促進する。
マウスでは、IgG 2A抗体はTH1型免疫応答についての血清学的マーカーであり、一方、IgG1抗体はTH2型免疫応答の指標となる。TH2応答には、アレルギー関連IgE抗体クラスを含む。可溶性タンパク質抗原は、比較的強いTH2応答を刺激する傾向がある。これに対して、TH1応答は、マクロファージおよび樹状細胞に結合している抗原によって誘発される。実施例VIおよびVIIに示されるデータからわかるように、抗原コード化ポリヌクレオチドを皮内注射したマウスは、TH1応答の指標であり、ひいてはAPCの細胞内に発現されAPCにより提示される抗原のIgG 2A抗体を優先的に産生した。これに対して、抗原を皮内注射したマウスは、優勢なTH2細胞応答の指標となるIgG 1抗体を優先的に産生した。
したがって、本発明による抗原(または抗原の既知の免疫刺激性断片)をコードする裸の遺伝子発現ベクターの投与は、IgE抗体産生を抑制するだけでなく、治療の最初からそのようであり、かくして従来の免疫療法において問題となっていたアナフィラキシーの危険性を回避する。具体的には、抗原をコードする裸の遺伝子発現ベクターの投与(特に真皮および上皮経路からの投与)により、CD4+ TH1およびCD8+リンパ球の産生がCD4+ TH2リンパ球よりも選択的に刺激され、IL-12およびIFN-α産生が刺激され、そしてINF-γ分泌(これはIgE抗体活性を抑制する)が刺激される。
実施例VIに示すデータに反映されるように、タンパク質抗原(βガラクトシダーゼ)による皮内チャレンジは、マウスにおいてTH2応答を選択的に引き出す。このTH2応答は、従来の免疫治療応答と同じく、抗原脱感作化マウスではTH1応答によって徐々に置き換えられる。しかし、実施例VIIに実証されるように、タンパク質注射マウス内で産生されたIgE抗体のレベルは、同じ抗原を作動可能にコードし、かつ本発明の免疫刺激ポリヌクレオチド(配列番号1)を含む裸の遺伝子発現ベクター(pCMV-LacZ)を注射したマウスのどの処置段階で産生された該レベルよりも、初期治療段階では実質的に高くなっている。
さらに、皮内用量の該プラスミドを用いてチャレンジしたマウスでは、TH1細胞の応答は、TH2細胞の応答を大きく超える。さらに驚くべきことに、pCMV-LacZでチャレンジしたマウスにおけるIgEおよびIL-4のレベルは非常に低く、一方、抗原で刺激されたCTLのレベルおよびTH1細胞のインターフェロン分泌は、タンパク質でチャレンジしたマウスおよび対照のマウスと比較して増強される。さらに、pCMV-LacZでチャレンジしたマウスに付与されるIgE産生に対する防御は、アジュバントと組み合せた場合でさえも、プラスミドまたはタンパク質を用いたその後のチャレンジにもかかわらず、持続する(実施例IV、VおよびVII)。
C.本発明の裸の遺伝子発現ベクターを、高濃度の抗原提示細胞を有する標的組織に導入する方法:投与経路および投薬プロトコール
本発明の裸の遺伝子発現ベクターは、慣用のワクチン接種プロトコールにおいてアジュバントとして用いるか、または遺伝子免疫感作プロトコール[すなわち、標的抗原が、裸の遺伝子発現ベクター(これは、本発明の非コード化免疫刺激ポリヌクレオチドを含むベクターでもあり得る)によってコードされるタンパク質抗原である場合]において用いることが可能である。後者のアプローチが好ましく、投薬および投与プロトコールについては後記において詳細に検討する。単離された非組換え抗原は、慣用のワクチン接種技術に従って投与される。
多くの感染性抗原は皮膚や粘膜から体内に侵入し、その場合、そのような抗原に対する局所免疫が有用であろう。この理由、ならびに哺乳動物の皮膚や粘膜には比較的高濃度のAPCが存在するという理由から、これらの組織が本発明の好ましい標的組織である。
皮膚経路の場合、導入手段は、表皮投与、皮下または皮内注入によるものであり得る。これらの手段の中でも、皮内組織中に高い濃度のAPCが存在することが予想される場合には、表皮投与が好ましい。
しかし、皮膚投与経路の最も好ましい導入手段は、最も侵入的でないものである。これらの手段の中で好ましいものは、経皮伝達および表皮投与である。
経皮伝達の場合、イオン導入法が好適な方法である。イオン導入伝達は、市販の「パッチ(patches)」(薬品を、数日間以上にわたって損傷を受けていない皮膚から連続的に送達するもの)を用いて達成し得る。この方法を用いることにより、比較的高い濃度での医薬組成物の制御された伝達が可能になり、組合せ薬剤の注入(infusion)が可能となり、そして吸収促進剤の同時使用が可能になる。
この方法で用いられる例示的パッチ製品は、登録商標製品LECTRO PATCH(General Medical Company, Los Angels, CA)である。この製品は、レザバー電極(reservior electrodes)を中性のpHに電子的に維持しており、異なる濃度の投薬量を供給するように、連続的に投薬するように、および/または定期的に投薬するように適合させることができる。パッチの調製および使用は、LECTRO PATCH製品に添付されている製造業者の印刷された説明書にしたがって行うべきである(これらの説明書は、これを参考として本明細書に組み入れるものとする)。
表皮投与は、本質的に、刺激物質に対する免疫応答を引き起こすのに十分に機械的または化学的に表皮の最外層を刺激することを伴う。具体的には、刺激は、APCを刺激部位に引き付けるのに十分なものでなければならない。先に検討したように、次いでAPCは投与された裸のポリヌクレオチドを取り込み、発現すると考えられる。
機械的刺激手段の一例は、複数の非常に径が細い短いタイン(tynes)を用いる。このタインは、皮膚を刺激して、該タインの先端から送り込まれる裸のポリヌクレオチドを取り込むようにAPCを刺激部位に引き付けるために用いることができる。例えば、Pastuer Merieux(Lyon, France)製のMONO-VACC型の旧式のツベルクリンテストは、本発明の裸の遺伝子発現ベクターの導入に適した装置を含む。本発明で使用するのに適した別の装置は、アレルギー試験で使用するためにLincoln Diagnostics(Decatur, IL)で製造されたタインデバイス(商品名「MULTITEST▲R▼」で販売されている)である。
そのようなデバイスは、典型的には、一方の端部にシリンジプランジャーを有し、かつ他方の端部にタインディスクを有するプラスチック製容器から成る。該タインディスクは、表皮細胞の最外層にかき傷をつけるのに丁度よい長さを有する径の細い複数のタインを支持する。本発明では、各針は、該タインの先端をポリヌクレオチドの水溶液に浸すことにより、裸の遺伝子発現ベクターの医薬組成物で塗布される。便宜上、その後、該ポリヌクレオチドを該タイン上で乾燥させて、処置時に使用するための該デバイスを用意しなくても投与できるようにするために、該デバイスを凍結させてもよい。
上記デバイスの使用は、デバイス製品に添付された製造業者の説明書に従う。使用および投与に関するこれらの説明書は、該デバイスの慣用的使用を例示するために、これを参考として本明細書に組み入れる(実施例VIIも参照のこと)。
裸のポリヌクレオチドの表皮投与の別の好適なアプローチは、表皮の最外層にある細胞を刺激する化学薬剤の使用によるものであり、このようにして、APCを該領域に引き付けるのに十分な免疫応答を引き起こす。1つの例はケラチン溶解剤であり、例えば、Noxema CorporationからNAIRの商標名で販売されている市販の局所脱毛クリーム中で用いられているサリチル酸が挙げられる。このアプローチは、粘膜の上皮投与を達成するのにも用い得る。また、化学的刺激物質は、機械的刺激物質と共に適用することも可能である(これは、例えば、MONO-VACC型タインにさらに化学的刺激物質を塗った場合に起こる)。裸の遺伝子発現ベクターは、化学的刺激物質も含有している担体中に懸濁するか、もしくは化学的刺激物質と共に同時投与することが可能である(実施例VIII参照)。
粘膜投与の場合、導入手段は導入部位の位置に応じて変わってくる。特に呼吸器感染に対する免疫感作および治療には、鼻腔内投与手段が最も好ましい。これらの手段には、本発明の裸の遺伝子発現ベクターのエアゾール懸濁液または吸入剤の吸入が含まれる。ある特定の粘膜(例えば、生殖器および眼の部位)への導入には、坐薬および局所製剤も好適である。本発明の裸の遺伝子発現ベクターの膣へのデリバリーに関して特に興味深いものは、膣用サンドイッチ型リングおよびペッサリーである。これらの装置およびその使用の例はChien、前掲、第9章に記載されている。
本発明の方法に従って供給される裸の遺伝子発現ベクターの各々の投薬量は、宿主による所望の応答ならびに用いるポリヌクレオチドに応じて変わってくる。一般に、単回投薬において最大100〜200μgのポリヌクレオチドが投与可能であると予想されるが、約0.3μg程度の少量のポリヌクレオチドを皮膚または粘膜から投与しても長期の免疫応答を誘発できる。
しかし、本発明の目的には、裸の遺伝子発現ベクターは、上記ポリヌクレオチドによりコードされる抗原性ポリペプチドの発現を引き起こすのに十分な投薬量で供給されれば十分である。これらの投薬量は、発現の治療レベル、準治療レベルまたは免疫刺激レベルを達成するように変更できる。発現したペプチドの存在および量を確認するための手段は当業者には周知であり、したがって、詳細には記載しない。特定のそのような手段を下記の実施例において説明する。一般に、それらの手段には、イムノアッセイ(例えば、酵素結合イムノソルベントアッセイ)、PCR法、および当業界で周知の技術を用いて行われる免疫組織学的分析が含まれる。ポリヌクレオチドの投薬量は、これらの検出および定量手段、ならびに臨床分野で習熟した医師にとって公知のin vivoでの臨床的兆候により得られる情報に基づいて、所望の発現レベルを達成するように調整できる。
好ましくは、本発明の裸の遺伝子発現ベクターは「低」用量で投与される(例えば、マウスの場合、約50μg以下の免疫刺激ポリヌクレオチド)。当業者であれば、ヒトに用いるための等価の投薬レベルを容易に決定できるであろう。当業者であれば、ワクチン接種および免疫治療のプロトコールに用いる投薬過程[すなわち、感作、追加免疫および維持投薬(maintenance dosing)]に精通しているであろう。これらの過程は本発明の方法において使用するのに好適である。一般に、ヒトにおける感作、追加免疫および維持投薬には、約50μg未満、さらには約10μg未満の免疫刺激ポリペプチドという用量が好適であると予想できる。別法として、感作量の抗原コード化ポリヌクレオチドを投与した後で、追加免疫量および/または維持投与量の抗原を投与することも可能である。
本発明の各実施態様の局面を説明する実施例を以下に示す。それらは本発明を例示するためのものであり、本発明を制限するものと理解すべきではない。本発明は添付の請求の範囲によって規定される。実施例全体を通じて、慣用の略語(例えば、ミリリットルに対しては「ml」)を用いる。
実施例I
裸の遺伝子発現ベクターの皮内注射後のウイルスタンパク質の発現
真皮内での本発明の裸の遺伝子発現ベクターの発現能力を実証するために、インフルエンザ・リボ核タンパク質(NP)の遺伝子をpCMVプラスミドにサブクローニングした。インフルエンザの多数の系統からのNP遺伝子は当業界では公知であり、種々の系統間で配列が高度に保存されている(例えば、Gormanら,J. Virol. 65:3704, 1991参照)。
8週齢のBalb/cマウス4匹に、15μgのpCMV-RNP(100μlのHBSSに懸濁したもの)を3回注射した。注射は、尾の付け根に皮内的に2週間の間隔で行った。CTLは、MHCクラスI分子により提示される抗原を認識し、ウイルス感染した細胞の排除に重要な役割を担う。cDNA発現ベクターによる筋肉内(i.m.)免疫感作は、抗原をMHCクラスI分子に導入し、それゆえ、CTL応答を刺激するための有効な方法となるはずである。本研究では、インフルエンザ・核タンパク質(NP)抗原遺伝子を含有するプラスミドを皮内(i.d.)注射することにより、NP-特異的CTLおよび高力価の抗-NP抗体を誘発した。これらの抗体は、局所的炎症がない場合には、注射後6週間で最大に達し、少なくとも28週間にわたって変化しないままであった。
エチジウムブロミドの存在下でのCsCl結合によりプラスミドDNAを精製し、10mM Tris-HCl、0.1mM EDTA(pH 8.0)中で凍結保存した。注射する前に、該プラスミドをエタノール沈殿させ、0.1mM EDTAを含有する生理食塩水に溶解した。
本質的にVieraら、Int. Immunl. 2:487(1990)に記載されているようなELISAにより、血清中の抗-NP IgGの存在を測定した。このアッセイの結果を図9aに示す。全ての動物が高力価の抗-NP抗体を生じ、これは20週間以上にわたって持続した。図9bに示すように、皮内注射では、等量のプラスミドDNAを筋肉内注射した場合よりも約4倍高い抗体価をもたらすようであった。
図9aおよび9bの軸は、それぞれ、時間に対するELISA力価(平均、1オンス)を表わす。全てのグラフの点での血清希釈度は2560である。
実施例II
本発明の免疫刺激ポリヌクレオチドに対するin vivoでの抗体応答
本発明の免疫刺激ポリヌクレオチドを含有する裸の遺伝子発現ベクターに対する体液性免疫応答とそのようなポリヌクレオチドを含有しない該ベクターに対する体液性免疫応答とを比較するために、実施例Iに記載のpCMV-LacZプラスミド(これは、配列番号1の免疫刺激ポリヌクレオチドを2コピー含有する)を、カナマイシン耐性(KanR)を付与する酵素をコードする遺伝子を置換するように改変した。得られたプラスミド(pKCB-LacZ)は、本発明の免疫刺激ポリヌクレオチドのいずれをも含有していない[図1(pCMV-LacZ)および図3(pKCB-LacZ)のベクター地図を参照]。これに対して、AmpR含有pCMV-LacZプラスミドは、該ベクターのAmpR遺伝子内の2つの別個の位置にAACGTT(配列番号1)パリンドローム配列を含有する。
1群当たり4匹のBalb/cマウスの各々には、尾の付け根に皮内的に、それぞれ50μgのpCMV-LacZプラスミドまたはpKCB-LacZプラスミドを注射した。各注射を1週間の間隔で2回繰り返した。第3群のマウスには、pKCB-LacZを注射し、pUC-19(AmpR遺伝子を含有するプラスミド)を追加的に注射した。対照として、第4群のマウスに、非特異的細菌DNAを注射した。誘発された全体的な免疫応答を比較するために、第5群には、GM-CSF(顆粒球−単球コロニー刺激因子)を作動可能にコードする裸の遺伝子発現ベクターを注射した。6週間後に血清ELISAにより抗-抗原抗体産生を測定した。
図2に示すように、pCMV-LacZを注射したマウスは、発現されたLacZリポーター分子に対する抗体を産生した。しかし、pKCB-LacZプラスミドを投与されたマウスの血清中では、そのベクターによって達成された高いLacZ発現レベル(各ベクターで別個にトランスフェクトされたチャイニーズハムスターの卵巣細胞中でのβ−ガラクトシダーゼ活性の尺度として検出;図10参照)にもかかわらず、抗体の形成は全く検出されなかった。抗-LacZ抗体産生は、pKCB-LacZおよびpUC-19の同時投与によって回復したが(図5)、対照(同上)プラスミドの注射後ではそのような応答は全く検出されなかった。pUC-19ベクターの増大効果は、GM-CSFコード化ベクター(同上)に対する応答を上回った。
体液性免疫応答に対する本発明の免疫刺激ポリヌクレオチドの効果を測定するために、pKCB-LacZプラスミドを、AmpR遺伝子内に見出されるAACGTTポリヌクレオチドパリンドロームの1または2コピーを含むように改変した[pKCB-1aaZ(1コピー)およびpKCB-2aaZ(2コピー)]。比較のために、pKCB-LacZおよびpCMV-LacZを注射したマウスの群に、それぞれ、LacZリポーター分子を含まないKCBプラスミドまたはCMVプラスミドも注入した。上記のように3週間免疫した後4週間目にLacZに対する抗体応答を測定した。
図4に示すように、pKCB-LacZまたはpKCB-LacZ/pKCBを注射したマウスでは、LacZに対する抗体応答は事実上全く測定されなかったが、pCMV-LacZおよびpCMV-LacZ/pCMVを注射したマウスでは、抗体応答が検出された。さらに、改変KCBプラスミドを注射したマウスは、pCMVプラスミドを注射したマウスよりも実質的に高い抗体価を生じ、その応答は、プラスミド中に存在するAACGTTポリヌクレオチド(配列番号1)のコピー数に比例して増大した。pCMVプラスミド(AACGTTポリヌクレオチドを2コピー含有)と比較して増大したこの応答は、おそらくは、KCBベクターにより達成された抗原の高い発現レベルに起因する(図10参照)。
実施例III
本発明の免疫刺激ポリヌクレオチドに応答するin vivo CTL活性
本発明の免疫刺激ポリヌクレオチド(すなわち、パリンドロームCG含有配列)が細胞性および体液性応答を刺激するか否かを調べるために、マウスをpKCB-LacZまたはpCMV-LacZで免疫した後のCTLの溶解活性を試験した。マウスの対照群はミョウバン中の抗原で免疫した。
免疫感作(実施例IIに記載したように実施した)の36週後、マウスを犠牲にし、標準的な混合リンパ球培養で使用するために脾細胞を分離した。培養物を既知の合成β-ガラクトシダーゼペプチドの存在下で増殖させた。5〜6日後に抗LacZCTL活性について培養物をアッセイし、エフェクター(抗原):標的比に対する抗原パルスした細胞の溶解パーセントの関数として測定した。
図6に示すように、エフェクター:標的比が増加するにつれて、pCMV-LacZを注射したマウス由来の細胞の培養物におけるCTL活性は約18%から100%近くにまで増加した。これに対して、pKCB-LacZ注射マウスおよび対照注射マウス由来の培養物におけるCTL活性は、エフェクター:標的比を36:1に高めた場合でさえ、わずかに20%の溶解活性を超えたにすぎなかった。
pCMV-LacZプラスミド中の2コピーの配列番号1の免疫刺激ポリヌクレオチド(AACGTT)の効果を調べるために、pKCB-LacZ注射マウスの別の群には5μgまたは100μgのpUC-19を同時に注射した。後者の群ではほぼ60%溶解へのCTL活性の増加が達成された(図7)。
実施例IV
本発明の免疫刺激ポリヌクレオチドを含有する裸の遺伝子発現ベクターを皮内注射したマウスによるウイルスチャレンジに対する免疫応答
本発明の裸の遺伝子発現ベクターをワクチン接種することで生じた免疫が致死的ウイルスチャレンジから動物を防御できるか否かを試験するために、1群10匹のBalb/cマウスに、配列番号1の免疫刺激ポリヌクレオチドを2コピーとインフルエンザウイルスH1N1株(A/PR/8/34;米国ベイラー医科大学のInocent N. Mbawvike博士から提供された)由来のNP遺伝子を含むpCMVプラスミド(pCMV-NP)15μgを3回皮内注射した。対照群は非注射動物と無関係なプラスミド(pnBL3)を注射した動物を含んでいた。
初回プラスミド注射の6週後に、動物をLD90用量のH3N2インフルエンザ株(A/HK/68;これもMbawuike博士から提供された)でチャレンジした。皮内ワクチン接種動物は非ワクチン接種対照動物と比べてこのチャレンジから有意に防御された(P<0.01)。図11を参照のこと(Kaplan-Meyer生存曲線)。
実施例V
T細胞の抗原刺激により誘導される裸のポリヌクレオチドの皮内投与後の長期免疫記憶
実施例IVに記載したマウスで観察された防御効果が長期の免疫防御記憶を含むか否かを試験するために、CMVプロモーターの制御下に大腸菌酵素β-ガラクトシダーゼをコードする裸の遺伝子発現ベクター0.1、1、10および100μg(0.5〜5ng/1mg DNA内毒素含量)を4匹のマウス/投与量/筋肉内(IM)または皮内(ID)経路の各群に投与した。各プラスミドは2コピーの配列番号1の免疫刺激ポリヌクレオチドを含んでいた(pCMV-LacZ)。
対照として、別の群の4匹のマウスにはβ-ガラクトシダーゼタンパク質(PR)100μgを皮内注射した。注射はすべてキャリアーとして50μlの生理食塩水を用いて行った。IMおよびID注射は0.5ml注射器と28.5ゲージ針を使って行った。その後、酵素結合イムノソルベントアッセイにより抗体を2週間おきに測定した。
固相抗原としてβ-ガラクトシダーゼ(Calbiochem, CA)を用いて全抗β-ガラクトシダーゼ抗体を測定した。マイクロタイタープレート(Costar, Cambridge, MA)に90mMホウ酸塩(pH8.3)および89mM NaCl(すなわち、ホウ酸緩衝食塩水:BBS)中に溶解した抗原5μgを室温で一晩被覆し、BBS中の10mg/mlのウシ血清アルブミンで一晩ブロックした。
血清サンプルを、最初の8週間については1:40の希釈率で出発してBBSで連続希釈し、その後1:320に希釈した。これらのサンプルをプレートに加え、室温で一晩保存した。プレートをBBS + 0.05%ポリソルベート20で洗い、次にアルカリホスファターゼで標識したヤギ抗マウスIgG抗体(Jackson Immunoresearch Labs., Eest Grove, PA)の1:2000希釈物と室温で1時間反応させるか、または同一条件下でアルカリホスファターゼで標識したヤギ抗マウスIgG1抗体(Southern Biotech, AL)の1:2000希釈物と反応させるか、またはアルカリホスファターゼで標識したラット抗マウスIgG 2A抗体(Pharmingen, CA)と反応させた。プレートを再度洗い、1mM MgCl2を含有する0.05M炭酸塩緩衝液(pH9.8)中に1mg/mlのp-ニトロフェノールホスフェート(Boehringer-Mannheim, Indianapolis, IN)を含む溶液を添加した。プレートに基質を添加した1時間後に405nmでの吸光度を読み取った。
ID注射よりもIM注射でpCMV Lac-Zプラスミドを投与された動物において、より低い抗体応答が測定された(データは示してない)。
T細胞記憶について検討するために、その後、動物を0.5μgのPRを用いてID注射により別の部位に追加免疫した。これらの動物がβ-ガラクトシダーゼに対する抗体の産生を制御するために記憶T細胞を誘導した場合には、それらは初回抗原投与に応答して示した免疫応答よりも激しい免疫応答を可溶性タンパク質抗原による追加免疫後には引き起こすことが期待されるだろう。
図12に示すように、pCMV-LacZプラスミドをID注射された動物は、プラスミドまたはPRをIM注射された動物よりも実質的に良好な免疫記憶を誘導していたことが明らかである。さらに、ID注射動物により誘導された免疫記憶は少なくとも約12週間維持された。
実施例VI
裸のポリヌクレオチドの皮内投与後のTH1応答の選択的誘導
マウスでは、IgG 2A抗体がTH1型免疫応答の血清学的マーカーであり、一方、IgG1抗体はTH2型免疫応答の指標である。TH2応答にはアレルギー関連IgE抗体クラスが含まれ、可溶性タンパク質抗原は比較的強いTH2応答を刺激する傾向がある。これに対して、TH1応答はマクロファージおよび樹状細胞に結合する抗原により誘導される。TH1応答はアレルギーおよびエイズの治療において特に重要なものである。
本発明による裸の遺伝子発現ベクターを投与されたマウスが(もし存在するならば)どちらの応答をもたらすのかを調べるために、実施例Vに記載したようにpCMV-LacZベクターまたはタンパク質をマウスにワクチン接種した。2週間おきに、β-ガラクトシダーゼに対するIgG 2AおよびIgG1を、該酵素を被覆したマイクロタイタープレート上で酵素結合イムノソルベントアッセイ(IgG1およびIgG 2Aサブクラスに特異的な抗体を使用)により測定した。
図13に示すように、ID注射によりプラスミドを投与されたマウスのみが高力価のIgG 2A抗体を産生した。図14に示すように、酵素そのもの(PR)によるマウスの免疫感作は比較的高い力価のIgG1抗体の産生を引き出した。IM注射マウスでは、IgG 2AおよびIgG1の両抗体とも、明らかな選択性を示すことなく、低力価で産生された。これらの図面に示したデータは各群4匹のマウスから得られた数値の平均である。
抗体応答の経時的安定性を調べるために、同じ群の動物を0.5μgの酵素の皮内注射により追加免疫した。図15および16に示すように、酵素によるID注射感作動物の追加免疫はIgG 2A抗体応答のほぼ10倍増加を引き出した(すなわち、抗体価が1:640から1:5120に上昇した)が、IgG1応答は刺激しなかった。これらのデータは、裸のポリヌクレオチドのID投与により引き出された選択的TH1応答が、抗原へのその後の暴露にもかかわらず、宿主において維持されることを示している。
実施例VII
抗原コード化ポリヌクレオチドを用いた免疫感作による抗原に対するIgE抗体応答の抑制
実施例VおよびVIに記載した実験プロトコールを用いて、5〜8週齢のBalb/cマウスを本発明の2種類の裸の遺伝子発現ベクターのうちの1つ、すなわち実施例Vに記載したpCMV-LacZプラスミド、または対照プラスミドpCMV-BL(いかなるインサートペプチドもコードせず、免疫刺激ポリヌクレオチドを含まない)で免疫した。第3群のマウスには抗原(β-ガラクトシダーゼ)を注射した。プラスミドDNAを精製し、その内毒素含量を、トリトンX-114(Sigma, St. Louis, MI)で抽出してDNA1mgにつき0.5〜5ngに低下させた。接種前に、pDNAをエタノール沈殿させ、70%エタノールで洗い、発熱物質フリーの生理食塩水中に溶解した。
免疫感作は、MONOVACC▲R▼多重タイン(tyne)デバイス(Connaught Lab, Inc., Swiftwater, PA)の個々のタインにローディング(負荷)したプラスミドDNAの皮内注射により行った。簡単に述べると、タインデバイスをDDWで十分に洗浄し、0.5% SDS(硫酸化ドデシル食塩水)中に一晩浸漬し、再度DDWで洗浄し、0.1% NaOH中に一晩浸漬し、再度DDWで洗浄し、37℃で8時間乾燥させた。生理食塩水に溶解したプラスミドDNA6μlを、下記のそれぞれの接種の直前に、タインデバイスのタイン上にピペットで分注した。1回の接種につき該デバイスにローディングされたpDNAの全量はpCMV-LacZおよびpCMV-BLそれぞれが25μgであった。実際量を見積もるために、タインデバイスにローディングされたpDNA溶液の10%未満がタインの注入時に皮内組織に実際に導入されたと仮定した。
各マウスは尾の基部に皮内注射した1週間おきの2回の各プラスミド接種により3回処理した。別の1群のマウスにはpDNAの代わりに尾の基部に10μgのβ-ガラクトシダーゼタンパク質(生理食塩水50μl中に溶解したもの)を1回皮内注射した。
その後の抗原チャレンジに対するIgE抗体応答を引き出すために、初回免疫感作の14週間後に、各群のマウスに1μgの抗原(β-ガラクトシダーゼ;Calbiochem, San Diego, CA)とアジュバントとしての3mgのALUM水酸化アルミニウム(Pierce Chemical, Rockford, IL)を含有するリン酸緩衝溶液(PBS)0.1mlを1回腹腔内注射した。その後4週間にわたりマウス由来の血清中の全IgEを4回アッセイした。
IgEは96ウェルのポリビニルプレートで固相ラジオイムノアッセイ(RAST)(Coligan,“Current Protocols In Immunology”, Unit 7.12.4, Vol. 1, Wiley & Sons, 1994に記載されたELISA法のラジオアイソトープ変法)を用いて検出した。ただし、ヒトFabに特異的な抗体の代わりにマウスε鎖に特異的な精製ポリクローナルヤギ抗体を使用した。抗LacZ IgE抗体を検出するために、プレートにβ-ガラクトシダーゼ(10μg/ml)を被覆した。採用したアッセイで測定可能な最低IgE濃度は0.4ng/mlのIgEであった。
各群のマウスによる抗抗原応答を特異的に測定すると、図17に示すように、プラスミド注射マウスにおける抗LacZ IgEレベルは追加免疫の前も後も常に低かった(平均するとRASTで約250CPM)が、タンパク質注射マウスは高レベルの抗LacZを示し、特に1回目の追加抗原注射後にはマウスの抗LacZレベルが平均約3000CPMに上昇した。寛容性の獲得と合致して、タンパク質注射マウスの抗LacZ IgEレベルは時間の経過につれて減少したが、β-ガラクトシダーゼに対する免疫感作を受けていない対照マウスでは上昇し続けた。
これらのデータからは、プラスミド注射マウスがプラスミド発現産物に対する抗原特異的TH1応答を生起すると同時にIgE産生の抑制を示したが、タンパク質注射マウスでは実質的に高レベルの全および抗原特異的IgE抗体の誘導後にのみ寛容性を獲得したことがわかる。
実施例VIII
免疫応答を引き出すための化学薬剤を用いる裸の遺伝子発現ベクターの表皮投与
図18は、化学薬剤の適用とともに実施例Iに記載のpCMV-NPベクターを表皮投与した後の抗NP IgGの血清レベルについて実施例Iに記載したように行ったELISAの結果を示す。
プラスミドを等張生理食塩水40μg中に1mlあたり約150μgのプラスミドを含むように懸濁した。この溶液を商標包帯バンドエイド(BAND-AID▲R▼;Johnson & Johnson)の非接着パッドに吸収させた。
Balb/cマウスの尾の基部に沿って毛を剃り落とし、市販のケラチン溶解剤(ここでは、NAIR▲R▼の商標名で販売されている脱毛クリーム)を毛を剃り落とした皮膚に塗布した。数分後、ケラチン溶解剤を皮膚から洗い落とし、そこにプラスミド含有包帯をはりつけた。図18に示すように、処理した動物は1:640の力価で血清抗NP IgGを産生した。
実施例IX
免疫刺激ポリヌクレオチドを含有するプラスミドで免疫した動物におけるインターフェロンおよびサイトカイン(IL-4)産生の増強
2群のマウスを実施例IIIに記載したようにpCMV-LacZまたはpKCB-LacZで免疫した。第3群のマウスには実施例IIに記載したようにpKCB-LacZとpUC-19の組合せ量を投与した。マウスを犠牲にした後、脾細胞を取り出し、in vitroでβ-ガラクトシダーゼ抗原によりチャレンジした。抗原チャレンジ細胞から得られた上清へのIFN-γおよびIL-4の放出を測定した。
pKCB-LacZのみで免疫したマウスは、pCMV-LacZまたはpKCB-LacZ/pUC-19の組合せ量で免疫したマウスと比べてほとんどIFN-γおよびIL-4を産生しなかった(図19および20参照)。
本発明について詳細に説明してきたが、当業者には本発明の他の実施態様および変更が明らかであろう。このような実施態様および変更はすべて、添付の請求の範囲により規定される本発明の範囲内に含まれるものとする。
配列の概要
配列番号1は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号2は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号3は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号4は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号5は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号6は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号7は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号8は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号9は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号10は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号11は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号12は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号13は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号14は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号15は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号16は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号17は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号18は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号19は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列番号20は本発明において有用な非コード化免疫刺激ポリヌクレオチドである。
配列表
(1)一般的情報:
(i)出願人:Carson, Dennis A.;Raz, Eyal
(ii)発明の名称:組換え遺伝子発現ベクターおよび抗原に対する宿主の免疫応答を増強するための該ベクターの使用方法
(iii)配列の数:20
(iv)住 所:
(A)名宛人:フィッシュ&リチャードソンP.C.
(B)通り名:4225エグゼクティブ スクエア、スゥイート1400
(C)市名:ラ・ホヤ
(D)州名:カリフォルニア
(E)国名:アメリカ合衆国
(F)郵便番号:92037
(v)コンピューター読取り可能形式:
(A)媒体の型:フロッピーディスク
(B)コンピューター:IBM PC互換機
(C)オペレーティングシステム:PC−DOS/MS−DOS
(D)ソフトウェア:PatentIn リリース#1.0,バージョン#1.30B
(vi)本出願のデータ:
(A)出願番号:US
(B)出願日:
(C)分類:
(viii)代理人の情報:
(A)代理人名:Howells, Stacy L.
(B)登録番号:34,842
(C)参照/文書番号:07340/044001
(ix)テレコミュニケーションの情報:
(A)電話番号:(619)678−5070
(B)テレファックス:(619)678−5099
(2)配列番号1:
(i)配列の特色:
(A)配列の長さ:6塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(2)配列番号2:
(i)配列の特色:
(A)配列の長さ:6塩基対
(B)配列の型:核酸
(C)鎖の数:二本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(2)配列番号3:
(i)配列の特色:
(A)配列の長さ:6塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..6
(2)配列番号4:
(i)配列の特色:
(A)配列の長さ:6塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..6
(2)配列番号5:
(i)配列の特色:
(A)配列の長さ:6塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..6
(2)配列番号6:
(i)配列の特色:
(A)配列の長さ:6塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..6
(2)配列番号7:
(i)配列の特色:
(A)配列の長さ:6塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..6
(2)配列番号8:
(i)配列の特色:
(A)配列の長さ:6塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..6
(2)配列番号9:
(i)配列の特色:
(A)配列の長さ:6塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..6
(2)配列番号10:
(i)配列の特色:
(A)配列の長さ:6塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..6
(2)配列番号11:
(i)配列の特色:
(A)配列の長さ:6塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1
(2)配列番号12:
(i)配列の特色:
(A)配列の長さ:4塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..4
(2)配列番号13:
(i)配列の特色:
(A)配列の長さ:10塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..10
(2)配列番号14:
(i)配列の特色:
(A)配列の長さ:8塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..8
(2)配列番号15:
(i)配列の特色:
(A)配列の長さ:12塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..12
(2)配列番号16:
(i)配列の特色:
(A)配列の長さ:18塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..18
(2)配列番号17:
(i)配列の特色:
(A)配列の長さ:8塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..8
(2)配列番号18:
(i)配列の特色:
(A)配列の長さ:10塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..10
(2)配列番号19:
(i)配列の特色:
(A)配列の長さ:12塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..12
(2)配列番号20:
(i)配列の特色:
(A)配列の長さ:14塩基対
(B)配列の型:核酸
(C)鎖の数:一本鎖
(D)トポロジー:直鎖状
(ii)配列の種類:DNA(genomic)
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..14
Claims (15)
- 配列5’-シトシン-グアニン-3’を含む免疫刺激ポリヌクレオチドおよび抗原またはその免疫原性エピトープを含んでなる、哺乳動物における抗原刺激IgE産生低減のための医薬製剤。
- 配列5’-シトシン-グアニン-3’を含む免疫刺激ポリヌクレオチドおよび抗原またはその免疫原性エピトープを含んでなる、哺乳動物における抗原刺激IgE関連障害治療のための医薬製剤であって、該抗原刺激IgE関連障害がアナフィラキシーまたはアレルギーである、前記医薬製剤。
- 前記IgE産生がアレルギーと関連する、請求項1記載の医薬製剤。
- 前記ポリヌクレオチドが抗原またはその免疫原性エピトープをさらにコードする、請求項1〜3のいずれか1項に記載の医薬製剤。
- 前記抗原がポリペプチドである、請求項1〜3のいずれか1項に記載の医薬製剤。
- 前記免疫刺激ポリヌクレオチドの長さが少なくとも6ヌクレオチドである、請求項1〜5のいずれか1項に記載の医薬製剤。
- 前記免疫刺激ポリヌクレオチドが配列5’-プリン-プリン-C-G-ピリミジン-ピリミジン-3’を含む、請求項1〜6のいずれか1項に記載の医薬製剤。
- 前記免疫刺激ポリヌクレオチドが配列5’-ピリミジン-ピリミジン-C-G-プリン-プリン-3’を含む、請求項1〜6のいずれか1項に記載の医薬製剤。
- 前記免疫刺激ポリヌクレオチドが配列(TCG)n(ここで、nは1〜3の整数のいずれかである)を含む、請求項1〜6のいずれか1項に記載の医薬製剤。
- 前記免疫刺激ポリヌクレオチドが、GCGCGC、AGCGCT、CGATCG、CGCGCG、ACCGGT、GACGATCGTC、CGACGATCGTCG、CGACGACGATCGTCGTCG、CAACGTTG、AACAACGTTGTT、CAACAACGTTGTTG、GACGTC、ATCGAT、CGTACG、TCGCGA、ACGT、ACGATCGT、ACAACGTTGT、およびAACGTTからなる群から選択される配列を含む、請求項1〜6のいずれか1項に記載の医薬製剤。
- 皮膚または粘膜に投与される、請求項1〜10のいずれか1項に記載の医薬製剤。
- 筋肉に投与される、請求項1〜10のいずれか1項に記載の医薬製剤。
- 前記哺乳動物がヒトである、請求項1〜12のいずれか1項に記載の医薬製剤。
- 前記免疫刺激ポリヌクレオチドがプラスミド中にある、請求項1〜13のいずれか1項に記載の医薬製剤。
- 前記免疫刺激ポリヌクレオチドがコスミド中にある、請求項1〜13のいずれか1項に記載の医薬製剤。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US59355496A | 1996-01-30 | 1996-01-30 | |
| US08/593,554 | 1996-01-30 | ||
| PCT/US1997/001277 WO1997028259A1 (en) | 1996-01-30 | 1997-01-28 | Gene expression vectors which generate an antigen specific immune response and methods of using the same |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2000503853A JP2000503853A (ja) | 2000-04-04 |
| JP2000503853A5 JP2000503853A5 (ja) | 2004-11-11 |
| JP4359654B2 true JP4359654B2 (ja) | 2009-11-04 |
Family
ID=24375188
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP52775297A Expired - Lifetime JP4359654B2 (ja) | 1996-01-30 | 1997-01-28 | 抗原特異的免疫応答を生起させる遺伝子発現ベクターおよびその使用方法 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20030203861A1 (ja) |
| EP (1) | EP0879284B1 (ja) |
| JP (1) | JP4359654B2 (ja) |
| AT (1) | ATE437943T1 (ja) |
| CA (1) | CA2244946C (ja) |
| DE (1) | DE69739515D1 (ja) |
| WO (1) | WO1997028259A1 (ja) |
Families Citing this family (72)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2711670B1 (fr) | 1993-10-22 | 1996-01-12 | Pasteur Institut | Vecteur nucléotidique, composition le contenant et vaccin pour l'immunisation à l'encontre d'une hépatite. |
| US6727230B1 (en) | 1994-03-25 | 2004-04-27 | Coley Pharmaceutical Group, Inc. | Immune stimulation by phosphorothioate oligonucleotide analogs |
| US6429199B1 (en) | 1994-07-15 | 2002-08-06 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules for activating dendritic cells |
| US6239116B1 (en) | 1994-07-15 | 2001-05-29 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| US7935675B1 (en) | 1994-07-15 | 2011-05-03 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| US20030026782A1 (en) | 1995-02-07 | 2003-02-06 | Arthur M. Krieg | Immunomodulatory oligonucleotides |
| US6207646B1 (en) | 1994-07-15 | 2001-03-27 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| US20030078223A1 (en) * | 1996-01-30 | 2003-04-24 | Eyal Raz | Compositions and methods for modulating an immune response |
| ATE292980T1 (de) | 1996-10-11 | 2005-04-15 | Univ California | Immunostimulierende oligonucleotidekonjugate |
| EP0855184A1 (en) | 1997-01-23 | 1998-07-29 | Grayson B. Dr. Lipford | Pharmaceutical composition comprising a polynucleotide and an antigen especially for vaccination |
| EP1039935A4 (en) | 1997-02-28 | 2005-04-27 | Univ Iowa Res Found | USE OF NUCLEIC ACIDS CONTAINING NON-METHYLATED CpG DINUCLEOTIDES IN THE TREATMENT OF LIPOPOLYSACCHARIDE-ASSOCIATED ILLNESSES |
| WO1998040100A1 (en) * | 1997-03-10 | 1998-09-17 | Ottawa Civic Loeb Research Institute | USE OF NUCLEIC ACIDS CONTAINING UNMETHYLATED CpG DINUCLEOTIDE AS AN ADJUVANT |
| US6406705B1 (en) | 1997-03-10 | 2002-06-18 | University Of Iowa Research Foundation | Use of nucleic acids containing unmethylated CpG dinucleotide as an adjuvant |
| AU7690898A (en) | 1997-05-20 | 1998-12-11 | Ottawa Civic Hospital Loeb Research Institute | Vectors and methods for immunization or therapeutic protocols |
| US6589940B1 (en) | 1997-06-06 | 2003-07-08 | Dynavax Technologies Corporation | Immunostimulatory oligonucleotides, compositions thereof and methods of use thereof |
| JP2001515052A (ja) * | 1997-08-13 | 2001-09-18 | ザ ユーエイビー リサーチ ファンデーション | 遺伝子ベクターの局所施用によるワクチン接種 |
| ES2283070T3 (es) * | 1997-09-05 | 2007-10-16 | The Regents Of The University Of California | Utilizacion de oligonucleotidos inmunoestimulantes para la prevencion o tratamiento del asma. |
| DE69935507T2 (de) | 1998-04-03 | 2007-12-06 | University Of Iowa Research Foundation | Verfahren und produkte zur stimulierung des immunsystems mittels immunotherapeutischer oligonukleotide und zytokine |
| JP2002514397A (ja) * | 1998-05-14 | 2002-05-21 | コーリー ファーマシューティカル ゲーエムベーハー | CpGオリゴヌクレオチドを用いる造血調節の方法 |
| SI1077722T1 (sl) | 1998-05-22 | 2007-02-28 | Ottawa Health Research Inst | Metode in produkti za induciranje sluznicne imunosti |
| US20030022854A1 (en) | 1998-06-25 | 2003-01-30 | Dow Steven W. | Vaccines using nucleic acid-lipid complexes |
| US6977245B2 (en) | 1999-04-12 | 2005-12-20 | The United States Of America As Represented By The Department Of Health And Human Services | Oligodeoxynucleotide and its use to induce an immune response |
| WO2000061151A2 (en) | 1999-04-12 | 2000-10-19 | The Government Of The United States Of America, Represented By The Secretary, Department Of Health And Human Services | Oligodeoxynucleotide and its use to induce an immune response |
| WO2001012223A2 (en) | 1999-08-19 | 2001-02-22 | Dynavax Technologies Corporation | Methods of modulating an immune response using immunostimulatory sequences and compositions for use therein |
| US6949520B1 (en) | 1999-09-27 | 2005-09-27 | Coley Pharmaceutical Group, Inc. | Methods related to immunostimulatory nucleic acid-induced interferon |
| ATE395930T1 (de) * | 1999-10-22 | 2008-06-15 | Aventis Pasteur | Verfahren zur erregung und/oder verstärkung der immunantwort gegen tumorantigene |
| US7223398B1 (en) | 1999-11-15 | 2007-05-29 | Dynavax Technologies Corporation | Immunomodulatory compositions containing an immunostimulatory sequence linked to antigen and methods of use thereof |
| AU2001227889A1 (en) | 2000-01-14 | 2001-07-24 | The United States of America, represented by The Secretary, Department of Health & Human Services | Oligodeoxynucleotide and its use to induce an immune response |
| AU2001231245A1 (en) | 2000-01-31 | 2001-08-07 | The Regents Of The University Of California | Immunomodulatory polynucleotides in treatment of an infection by an intracellular pathogen |
| US20030129251A1 (en) | 2000-03-10 | 2003-07-10 | Gary Van Nest | Biodegradable immunomodulatory formulations and methods for use thereof |
| US7129222B2 (en) | 2000-03-10 | 2006-10-31 | Dynavax Technologies Corporation | Immunomodulatory formulations and methods for use thereof |
| US20010046967A1 (en) | 2000-03-10 | 2001-11-29 | Gary Van Nest | Methods of preventing and treating respiratory viral infection using immunomodulatory polynucleotide |
| US7157437B2 (en) | 2000-03-10 | 2007-01-02 | Dynavax Technologies Corporation | Methods of ameliorating symptoms of herpes infection using immunomodulatory polynucleotide sequences |
| US20020098199A1 (en) | 2000-03-10 | 2002-07-25 | Gary Van Nest | Methods of suppressing hepatitis virus infection using immunomodulatory polynucleotide sequences |
| KR100881923B1 (ko) | 2000-12-27 | 2009-02-04 | 다이나박스 테크놀로지 코퍼레이션 | 면역자극 폴리뉴클레오티드 및 그것의 사용 방법 |
| US7128911B2 (en) | 2001-01-19 | 2006-10-31 | Cytos Biotechnology Ag | Antigen arrays for treatment of bone disease |
| PT1404873E (pt) | 2001-06-21 | 2013-07-30 | Dynavax Tech Corp | Compostos de imunomodulação quiméricos e métodos de utilização dos mesmos |
| US7666674B2 (en) | 2001-07-27 | 2010-02-23 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Use of sterically stabilized cationic liposomes to efficiently deliver CPG oligonucleotides in vivo |
| WO2003014316A2 (en) | 2001-08-07 | 2003-02-20 | Dynavax Technologies Corporation | Immunomodulatory compositions, formulations, and methods for use thereof |
| US7354909B2 (en) | 2001-08-14 | 2008-04-08 | The United States Of America As Represented By Secretary Of The Department Of Health And Human Services | Method for rapid generation of mature dendritic cells |
| EP1450856B1 (en) | 2001-09-14 | 2009-11-11 | Cytos Biotechnology AG | Packaging of immunostimulatory cpg into virus-like particles: method of preparation and use |
| AU2002366710A1 (en) * | 2001-12-20 | 2003-07-09 | The Government Of The United States Of America As Represented By The Secretary Of The Department Of | USE OF CpG OLIGODEOXYNUCLEOTIDES TO INDUCE ANGIOGENESIS |
| US8466116B2 (en) | 2001-12-20 | 2013-06-18 | The Unites States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Use of CpG oligodeoxynucleotides to induce epithelial cell growth |
| KR20050052467A (ko) | 2002-08-12 | 2005-06-02 | 다이나박스 테크놀로지 코퍼레이션 | 면역조절 조성물, 이의 제조방법 및 이의 이용방법 |
| US8263091B2 (en) | 2002-09-18 | 2012-09-11 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Method of treating and preventing infections in immunocompromised subjects with immunostimulatory CpG oligonucleotides |
| JP2006515277A (ja) | 2002-10-29 | 2006-05-25 | コーリー ファーマシューティカル グループ, リミテッド | C型肝炎ウィルス感染の処置および予防に関する方法および製品 |
| US7758876B2 (en) | 2002-11-01 | 2010-07-20 | The United States Of America As Represented By The Department Of Health And Human Services | Method of preventing infections from bioterrorism agents with immunostimulatory CpG oligonucleotides |
| JP2006512927A (ja) | 2002-12-11 | 2006-04-20 | コーリー ファーマシューティカル グループ,インコーポレイテッド | 5’cpg核酸およびその使用方法 |
| AU2003302743B2 (en) | 2002-12-23 | 2008-09-04 | Dynavax Technologies Corporation | Branched immunomodulatory compounds and methods of using the same |
| US8158768B2 (en) | 2002-12-23 | 2012-04-17 | Dynavax Technologies Corporation | Immunostimulatory sequence oligonucleotides and methods of using the same |
| PT1575977E (pt) | 2002-12-23 | 2009-12-15 | Dynavax Tech Corp | Oligonucleótidos de sequência imunoestimuladora e métodos de utilização dos mesmos |
| US7537767B2 (en) | 2003-03-26 | 2009-05-26 | Cytis Biotechnology Ag | Melan-A- carrier conjugates |
| BRPI0408623A (pt) | 2003-03-26 | 2006-03-07 | Cytos Biotechnology Ag | conjugados de partìcula semelhante ao vìrus análogo de peptìdeo de melan-a |
| WO2006096497A2 (en) | 2005-03-04 | 2006-09-14 | Dynavax Technologies Corporation | Vaccines comprising oligonucleotides having immunostimulatory sequences (iss) wherein the iss are conjugated to antigens and stabilized by buffer conditions and further excipients |
| WO2006110655A2 (en) | 2005-04-08 | 2006-10-19 | Chimerix, Inc. | Compounds, compositions and methods for the treatment of poxvirus infections |
| CA2612162C (en) | 2005-07-01 | 2016-05-17 | Index Pharmaceuticals Ab | Use of oligonucleotides in steroid refractory or steroid dependent inflammatory conditions |
| US8148341B2 (en) | 2005-07-01 | 2012-04-03 | Index Pharmaceuticals Ab | Method for modulating responsiveness to steroids |
| WO2007050034A1 (en) | 2005-10-28 | 2007-05-03 | Index Pharmaceuticals Ab | Composition and method for the prevention, treatment and/or alleviation of an inflammatory disease |
| EP1973608A1 (en) | 2005-12-14 | 2008-10-01 | Cytos Biotechnology AG | Immunostimulatory nucleic acid packaged particles for the treatment of hypersensitivity |
| WO2007139190A1 (ja) * | 2006-05-31 | 2007-12-06 | Toray Industries, Inc. | 免疫刺激オリゴヌクレオチド及びその医薬用途 |
| AU2007260236B2 (en) | 2006-06-12 | 2013-05-16 | Kuros Us Llc | Processes for packaging oligonucleotides into virus-like particles of RNA bacteriophages |
| CN101636495A (zh) | 2006-11-09 | 2010-01-27 | 戴纳瓦克斯技术公司 | 使用免疫刺激性寡核苷酸进行长期的疾病修饰 |
| JP5727367B2 (ja) | 2008-05-15 | 2015-06-03 | ダイナバックス テクノロジーズ コーポレイション | 免疫賦活オリゴヌクレオチドを使用する長期疾患改良 |
| WO2010078556A1 (en) | 2009-01-05 | 2010-07-08 | Epitogenesis Inc. | Adjuvant compositions and methods of use |
| JP2012515146A (ja) * | 2009-01-13 | 2012-07-05 | トランジェーヌ、ソシエテ、アノニム | 免疫刺激のためのサッカロマイセス・セレビシエのミトコンドリア核酸画分の使用 |
| EP2534150B1 (en) | 2010-02-12 | 2017-04-05 | Chimerix, Inc. | Methods of treating viral infection |
| EA201290876A1 (ru) | 2010-03-05 | 2013-03-29 | Президент Энд Феллоуз Оф Гарвард Колледж | Композиции индуцированных дендритных клеток и их использование |
| EP2596806A1 (en) | 2011-11-25 | 2013-05-29 | Index Pharmaceuticals AB | Method for prevention of colectomy |
| US9717657B2 (en) | 2012-10-24 | 2017-08-01 | Amy Dukoff | Composition and method of using medicament for endodontic irrigation, stem cell preparations and tissue regeneration |
| MX2015012576A (es) | 2013-03-14 | 2016-06-02 | Harvard College | Composiciones a base de nanoparticulas. |
| US10751412B2 (en) | 2015-05-29 | 2020-08-25 | Merck Sharp & Dohme Corp. | Combination of a PD-1 antagonist and CPG-C type oligonucleotide for treating cancer |
| WO2023081486A1 (en) | 2021-11-08 | 2023-05-11 | Nurix Therapeutics, Inc. | Toll-like receptor therapy combinations with cbl-b inhibitor compounds |
Family Cites Families (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3596660A (en) * | 1969-05-12 | 1971-08-03 | Illinois Tool Works | Injection device |
| EP0468520A3 (en) * | 1990-07-27 | 1992-07-01 | Mitsui Toatsu Chemicals, Inc. | Immunostimulatory remedies containing palindromic dna sequences |
| US20030109469A1 (en) * | 1993-08-26 | 2003-06-12 | Carson Dennis A. | Recombinant gene expression vectors and methods for use of same to enhance the immune response of a host to an antigen |
| US5985847A (en) * | 1993-08-26 | 1999-11-16 | The Regents Of The University Of California | Devices for administration of naked polynucleotides which encode biologically active peptides |
| US5849719A (en) * | 1993-08-26 | 1998-12-15 | The Regents Of The University Of California | Method for treating allergic lung disease |
| US6207646B1 (en) * | 1994-07-15 | 2001-03-27 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| DE69535905D1 (de) * | 1994-07-15 | 2009-02-26 | Coley Pharm Group Inc | Immunomodulatorische Oligonukleotide |
| ATE292980T1 (de) * | 1996-10-11 | 2005-04-15 | Univ California | Immunostimulierende oligonucleotidekonjugate |
| US6406705B1 (en) * | 1997-03-10 | 2002-06-18 | University Of Iowa Research Foundation | Use of nucleic acids containing unmethylated CpG dinucleotide as an adjuvant |
| US6426334B1 (en) * | 1997-04-30 | 2002-07-30 | Hybridon, Inc. | Oligonucleotide mediated specific cytokine induction and reduction of tumor growth in a mammal |
| AU7690898A (en) * | 1997-05-20 | 1998-12-11 | Ottawa Civic Hospital Loeb Research Institute | Vectors and methods for immunization or therapeutic protocols |
| ES2283070T3 (es) * | 1997-09-05 | 2007-10-16 | The Regents Of The University Of California | Utilizacion de oligonucleotidos inmunoestimulantes para la prevencion o tratamiento del asma. |
| US20030138808A1 (en) * | 1998-02-19 | 2003-07-24 | Simard John J.L. | Expression vectors encoding epitopes of target-associated antigens |
| DE69935507T2 (de) * | 1998-04-03 | 2007-12-06 | University Of Iowa Research Foundation | Verfahren und produkte zur stimulierung des immunsystems mittels immunotherapeutischer oligonukleotide und zytokine |
| JP2002514397A (ja) * | 1998-05-14 | 2002-05-21 | コーリー ファーマシューティカル ゲーエムベーハー | CpGオリゴヌクレオチドを用いる造血調節の方法 |
| US6562798B1 (en) * | 1998-06-05 | 2003-05-13 | Dynavax Technologies Corp. | Immunostimulatory oligonucleotides with modified bases and methods of use thereof |
| US6887464B1 (en) * | 1999-02-02 | 2005-05-03 | Biocache Pharmaceuticals, Inc. | Advanced antigen presentation platform |
| US6514948B1 (en) * | 1999-07-02 | 2003-02-04 | The Regents Of The University Of California | Method for enhancing an immune response |
| AU2001231245A1 (en) * | 2000-01-31 | 2001-08-07 | The Regents Of The University Of California | Immunomodulatory polynucleotides in treatment of an infection by an intracellular pathogen |
| US7585847B2 (en) * | 2000-02-03 | 2009-09-08 | Coley Pharmaceutical Group, Inc. | Immunostimulatory nucleic acids for the treatment of asthma and allergy |
| CA2399550A1 (en) * | 2000-02-23 | 2001-08-30 | The Regents Of The University Of California | Method for treating inflammatory bowel disease and other forms of gastrointestinal inflammation |
| US7129222B2 (en) * | 2000-03-10 | 2006-10-31 | Dynavax Technologies Corporation | Immunomodulatory formulations and methods for use thereof |
| US20010046967A1 (en) * | 2000-03-10 | 2001-11-29 | Gary Van Nest | Methods of preventing and treating respiratory viral infection using immunomodulatory polynucleotide |
| DK1296714T3 (da) * | 2000-06-22 | 2009-12-07 | Coley Pharm Gmbh | Kombination af CpG og antistoffer, der er rettet mod CD19, CD20, CD22 eller CD40 til behandling eller forebyggelse af kræft |
| EP1322329A1 (en) * | 2000-10-02 | 2003-07-02 | GlaxoSmithKline Biologicals S.A. | Split enveloped virus preparation |
| EP1985702A3 (en) * | 2000-12-08 | 2010-08-18 | Coley Pharmaceutical GmbH | CPG-like nucleic acids and methods of use thereof |
| US20030050268A1 (en) * | 2001-03-29 | 2003-03-13 | Krieg Arthur M. | Immunostimulatory nucleic acid for treatment of non-allergic inflammatory diseases |
| US20030162734A1 (en) * | 2001-06-28 | 2003-08-28 | Miller Carol A. | Modulation of DENN-MADD expression and interactions for treating neurological disorders |
| CA2388049A1 (en) * | 2002-05-30 | 2003-11-30 | Immunotech S.A. | Immunostimulatory oligonucleotides and uses thereof |
| US7576066B2 (en) * | 2002-07-03 | 2009-08-18 | Coley Pharmaceutical Group, Inc. | Nucleic acid compositions for stimulating immune responses |
| ATE318916T1 (de) * | 2002-09-01 | 2006-03-15 | Univ Washington | Kontrollierte bakterielle lyse zur verabreichung von dna vakzinvektoren und impfantigen |
| GB0304424D0 (en) * | 2003-02-26 | 2003-04-02 | Glaxosmithkline Biolog Sa | Novel compounds |
| US20060193821A1 (en) * | 2004-03-05 | 2006-08-31 | Diener John L | Aptamers to the human IL-12 cytokine family and their use as autoimmune disease therapeutics |
| JP2008506789A (ja) * | 2004-07-18 | 2008-03-06 | シーエスエル、リミテッド | インターフェロン−ガンマ応答強化を誘発するための免疫刺激複合体及びオリゴヌクレオチド処方物 |
| US8110196B2 (en) * | 2005-04-29 | 2012-02-07 | Polytopas LLC | Methods and compositions for polytopic vaccination |
-
1997
- 1997-01-28 WO PCT/US1997/001277 patent/WO1997028259A1/en active Application Filing
- 1997-01-28 EP EP97903998A patent/EP0879284B1/en not_active Revoked
- 1997-01-28 DE DE69739515T patent/DE69739515D1/de not_active Revoked
- 1997-01-28 JP JP52775297A patent/JP4359654B2/ja not_active Expired - Lifetime
- 1997-01-28 AT AT97903998T patent/ATE437943T1/de not_active IP Right Cessation
- 1997-01-28 CA CA2244946A patent/CA2244946C/en not_active Expired - Lifetime
-
2001
- 2001-09-04 US US09/947,209 patent/US20030203861A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| EP0879284B1 (en) | 2009-07-29 |
| WO1997028259A1 (en) | 1997-08-07 |
| DE69739515D1 (de) | 2009-09-10 |
| ATE437943T1 (de) | 2009-08-15 |
| CA2244946A1 (en) | 1997-08-07 |
| JP2000503853A (ja) | 2000-04-04 |
| EP0879284A4 (en) | 2002-05-29 |
| CA2244946C (en) | 2010-04-13 |
| US20030203861A1 (en) | 2003-10-30 |
| EP0879284A1 (en) | 1998-11-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4359654B2 (ja) | 抗原特異的免疫応答を生起させる遺伝子発現ベクターおよびその使用方法 | |
| US20030186921A1 (en) | Recombinant gene expression vectors and methods for use of same to enhance the immune response of a host to an antigen | |
| US5804566A (en) | Methods and devices for immunizing a host through administration of naked polynucleotides with encode allergenic peptides | |
| US6951845B2 (en) | Method for treating allergic lung disease | |
| US5830877A (en) | Method, compositions and devices for administration of naked polynucleotides which encode antigens and immunostimulatory | |
| US5985847A (en) | Devices for administration of naked polynucleotides which encode biologically active peptides | |
| AU705889B2 (en) | Method, compositions and devices for administration of naked polynucleotides which encode antigens and immunostimulatory peptides | |
| CA2203991C (en) | Methods and devices for immunizing a host to tumor-associated antigens through administration of naked polynucleotides which encode tumor-associated antigenic peptides | |
| US6210663B1 (en) | Methods of augmenting mucosal immunity through systemic priming and mucosal boosting | |
| WO1995005853A9 (en) | Method, compositions and devices for administration of naked polynucleotides which encode biologically active peptides | |
| Wang et al. | Enhanced immunogenicity of BCG vaccine by using a viral-based GM-CSF transgene adjuvant formulation | |
| Baca-Estrada et al. | Vaccine delivery: lipid-based delivery systems | |
| AU759590B2 (en) | Gene expression vectors which generate an antigen specific immune response and methods of using the same | |
| AU1841897A (en) | Gene expression vectors which generate an antigen specific immune response and methods of using the same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20040123 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20040123 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070821 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20071115 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20071221 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080221 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20081014 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090202 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20090409 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20090428 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090518 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20090525 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20090518 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120821 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120821 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130821 Year of fee payment: 4 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |