JP4317455B2 - 多量のアルファ−ラクトアルブミンを含む幼児用処方の組成物 - Google Patents
多量のアルファ−ラクトアルブミンを含む幼児用処方の組成物 Download PDFInfo
- Publication number
- JP4317455B2 JP4317455B2 JP2003555904A JP2003555904A JP4317455B2 JP 4317455 B2 JP4317455 B2 JP 4317455B2 JP 2003555904 A JP2003555904 A JP 2003555904A JP 2003555904 A JP2003555904 A JP 2003555904A JP 4317455 B2 JP4317455 B2 JP 4317455B2
- Authority
- JP
- Japan
- Prior art keywords
- protein
- alpha
- lactalbumin
- infant formula
- howay
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000000203 mixture Substances 0.000 title claims description 86
- 235000013350 formula milk Nutrition 0.000 title claims description 75
- 102000004407 Lactalbumin Human genes 0.000 title claims description 48
- 108090000942 Lactalbumin Proteins 0.000 title claims description 48
- 235000021241 α-lactalbumin Nutrition 0.000 title claims description 48
- 235000018102 proteins Nutrition 0.000 claims description 87
- 102000004169 proteins and genes Human genes 0.000 claims description 87
- 108090000623 proteins and genes Proteins 0.000 claims description 87
- 102000008192 Lactoglobulins Human genes 0.000 claims description 35
- 108010060630 Lactoglobulins Proteins 0.000 claims description 34
- 229940024606 amino acid Drugs 0.000 claims description 22
- 150000001413 amino acids Chemical class 0.000 claims description 21
- 210000004080 milk Anatomy 0.000 claims description 21
- 239000008267 milk Substances 0.000 claims description 21
- 235000013336 milk Nutrition 0.000 claims description 20
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 claims description 17
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 claims description 17
- 241000283690 Bos taurus Species 0.000 claims description 15
- 239000000463 material Substances 0.000 claims description 15
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 14
- 229960003067 cystine Drugs 0.000 claims description 7
- 229910052757 nitrogen Inorganic materials 0.000 claims description 7
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 claims description 5
- 239000004473 Threonine Substances 0.000 claims description 5
- 108010046377 Whey Proteins Proteins 0.000 claims description 5
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 claims description 4
- 239000004472 Lysine Substances 0.000 claims description 4
- 239000005018 casein Substances 0.000 claims description 4
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 claims description 3
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 claims description 3
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 claims description 3
- 235000021240 caseins Nutrition 0.000 claims description 3
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 claims description 3
- 239000004475 Arginine Substances 0.000 claims description 2
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 claims description 2
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 claims description 2
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 claims description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 claims description 2
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 claims description 2
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 claims description 2
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 claims description 2
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 claims description 2
- 229960000310 isoleucine Drugs 0.000 claims description 2
- 229930182817 methionine Natural products 0.000 claims description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 claims description 2
- 239000005862 Whey Substances 0.000 claims 3
- 102000007544 Whey Proteins Human genes 0.000 claims 3
- LEVWYRKDKASIDU-QWWZWVQMSA-N D-cystine Chemical compound OC(=O)[C@H](N)CSSC[C@@H](N)C(O)=O LEVWYRKDKASIDU-QWWZWVQMSA-N 0.000 claims 1
- 235000020256 human milk Nutrition 0.000 description 31
- 210000004251 human milk Anatomy 0.000 description 31
- 238000009472 formulation Methods 0.000 description 24
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 22
- 239000000243 solution Substances 0.000 description 11
- NLKNQRATVPKPDG-UHFFFAOYSA-M potassium iodide Chemical compound [K+].[I-] NLKNQRATVPKPDG-UHFFFAOYSA-M 0.000 description 9
- 239000000843 powder Substances 0.000 description 9
- 230000015572 biosynthetic process Effects 0.000 description 8
- 238000003786 synthesis reaction Methods 0.000 description 8
- 229940088594 vitamin Drugs 0.000 description 8
- 229930003231 vitamin Natural products 0.000 description 8
- 235000013343 vitamin Nutrition 0.000 description 8
- 239000011782 vitamin Substances 0.000 description 8
- 230000002411 adverse Effects 0.000 description 7
- 239000012141 concentrate Substances 0.000 description 7
- 235000019197 fats Nutrition 0.000 description 7
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 6
- LEVWYRKDKASIDU-IMJSIDKUSA-N L-cystine Chemical compound [O-]C(=O)[C@@H]([NH3+])CSSC[C@H]([NH3+])C([O-])=O LEVWYRKDKASIDU-IMJSIDKUSA-N 0.000 description 6
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 6
- 238000004128 high performance liquid chromatography Methods 0.000 description 6
- 238000011160 research Methods 0.000 description 6
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 6
- XOAAWQZATWQOTB-UHFFFAOYSA-N taurine Chemical compound NCCS(O)(=O)=O XOAAWQZATWQOTB-UHFFFAOYSA-N 0.000 description 6
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 6
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 239000008367 deionised water Substances 0.000 description 5
- 229910021641 deionized water Inorganic materials 0.000 description 5
- 235000020776 essential amino acid Nutrition 0.000 description 5
- 239000003797 essential amino acid Substances 0.000 description 5
- 229910052500 inorganic mineral Inorganic materials 0.000 description 5
- 239000008101 lactose Substances 0.000 description 5
- 238000000034 method Methods 0.000 description 5
- 235000010755 mineral Nutrition 0.000 description 5
- 239000011707 mineral Substances 0.000 description 5
- 235000020183 skimmed milk Nutrition 0.000 description 5
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 4
- 108010076119 Caseins Proteins 0.000 description 4
- 102000011632 Caseins Human genes 0.000 description 4
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 4
- 102000014171 Milk Proteins Human genes 0.000 description 4
- 108010011756 Milk Proteins Proteins 0.000 description 4
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 4
- YZXBAPSDXZZRGB-DOFZRALJSA-N arachidonic acid Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O YZXBAPSDXZZRGB-DOFZRALJSA-N 0.000 description 4
- 230000037396 body weight Effects 0.000 description 4
- 235000013305 food Nutrition 0.000 description 4
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 4
- 239000004615 ingredient Substances 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 235000021239 milk protein Nutrition 0.000 description 4
- 239000002773 nucleotide Substances 0.000 description 4
- 125000003729 nucleotide group Chemical group 0.000 description 4
- 235000015097 nutrients Nutrition 0.000 description 4
- 235000015497 potassium bicarbonate Nutrition 0.000 description 4
- 239000011736 potassium bicarbonate Substances 0.000 description 4
- 229910000028 potassium bicarbonate Inorganic materials 0.000 description 4
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 238000000108 ultra-filtration Methods 0.000 description 4
- PMYDPQQPEAYXKD-UHFFFAOYSA-N 3-hydroxy-n-naphthalen-2-ylnaphthalene-2-carboxamide Chemical compound C1=CC=CC2=CC(NC(=O)C3=CC4=CC=CC=C4C=C3O)=CC=C21 PMYDPQQPEAYXKD-UHFFFAOYSA-N 0.000 description 3
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 3
- 102000007562 Serum Albumin Human genes 0.000 description 3
- 108010071390 Serum Albumin Proteins 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 235000010323 ascorbic acid Nutrition 0.000 description 3
- 239000011668 ascorbic acid Substances 0.000 description 3
- 239000001110 calcium chloride Substances 0.000 description 3
- 229910001628 calcium chloride Inorganic materials 0.000 description 3
- 235000011148 calcium chloride Nutrition 0.000 description 3
- 235000013365 dairy product Nutrition 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 229910000358 iron sulfate Inorganic materials 0.000 description 3
- BAUYGSIQEAFULO-UHFFFAOYSA-L iron(2+) sulfate (anhydrous) Chemical compound [Fe+2].[O-]S([O-])(=O)=O BAUYGSIQEAFULO-UHFFFAOYSA-L 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 230000007935 neutral effect Effects 0.000 description 3
- 235000016709 nutrition Nutrition 0.000 description 3
- 239000003921 oil Substances 0.000 description 3
- 235000019198 oils Nutrition 0.000 description 3
- 229940076279 serotonin Drugs 0.000 description 3
- 239000001509 sodium citrate Substances 0.000 description 3
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 3
- 239000011655 sodium selenate Substances 0.000 description 3
- 235000018716 sodium selenate Nutrition 0.000 description 3
- 229960001881 sodium selenate Drugs 0.000 description 3
- 230000001954 sterilising effect Effects 0.000 description 3
- 238000004659 sterilization and disinfection Methods 0.000 description 3
- 229960003080 taurine Drugs 0.000 description 3
- NWONKYPBYAMBJT-UHFFFAOYSA-L zinc sulfate Chemical compound [Zn+2].[O-]S([O-])(=O)=O NWONKYPBYAMBJT-UHFFFAOYSA-L 0.000 description 3
- 229910000368 zinc sulfate Inorganic materials 0.000 description 3
- 229960001763 zinc sulfate Drugs 0.000 description 3
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- 206010010774 Constipation Diseases 0.000 description 2
- 108010024636 Glutathione Proteins 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 2
- 108010063045 Lactoferrin Proteins 0.000 description 2
- 102000010445 Lactoferrin Human genes 0.000 description 2
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 2
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 2
- VYGQUTWHTHXGQB-FFHKNEKCSA-N Retinol Palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C VYGQUTWHTHXGQB-FFHKNEKCSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 2
- 206010047700 Vomiting Diseases 0.000 description 2
- MBMBGCFOFBJSGT-KUBAVDMBSA-N all-cis-docosa-4,7,10,13,16,19-hexaenoic acid Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCC(O)=O MBMBGCFOFBJSGT-KUBAVDMBSA-N 0.000 description 2
- 235000021342 arachidonic acid Nutrition 0.000 description 2
- 229940114079 arachidonic acid Drugs 0.000 description 2
- 229960005070 ascorbic acid Drugs 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 210000000481 breast Anatomy 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 229910000019 calcium carbonate Inorganic materials 0.000 description 2
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 description 2
- 239000000920 calcium hydroxide Substances 0.000 description 2
- 229910001861 calcium hydroxide Inorganic materials 0.000 description 2
- 235000021466 carotenoid Nutrition 0.000 description 2
- 150000001747 carotenoids Chemical class 0.000 description 2
- 229910000365 copper sulfate Inorganic materials 0.000 description 2
- ARUVKPQLZAKDPS-UHFFFAOYSA-L copper(II) sulfate Chemical compound [Cu+2].[O-][S+2]([O-])([O-])[O-] ARUVKPQLZAKDPS-UHFFFAOYSA-L 0.000 description 2
- DDRJAANPRJIHGJ-UHFFFAOYSA-N creatinine Chemical compound CN1CC(=O)NC1=N DDRJAANPRJIHGJ-UHFFFAOYSA-N 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 150000004665 fatty acids Chemical class 0.000 description 2
- 206010016766 flatulence Diseases 0.000 description 2
- 238000005227 gel permeation chromatography Methods 0.000 description 2
- 229960003180 glutathione Drugs 0.000 description 2
- PJJJBBJSCAKJQF-UHFFFAOYSA-N guanidinium chloride Chemical compound [Cl-].NC(N)=[NH2+] PJJJBBJSCAKJQF-UHFFFAOYSA-N 0.000 description 2
- CSSYQJWUGATIHM-IKGCZBKSSA-N l-phenylalanyl-l-lysyl-l-cysteinyl-l-arginyl-l-arginyl-l-tryptophyl-l-glutaminyl-l-tryptophyl-l-arginyl-l-methionyl-l-lysyl-l-lysyl-l-leucylglycyl-l-alanyl-l-prolyl-l-seryl-l-isoleucyl-l-threonyl-l-cysteinyl-l-valyl-l-arginyl-l-arginyl-l-alanyl-l-phenylal Chemical compound C([C@H](N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CS)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CC=CC=C1 CSSYQJWUGATIHM-IKGCZBKSSA-N 0.000 description 2
- 235000021242 lactoferrin Nutrition 0.000 description 2
- 229940078795 lactoferrin Drugs 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 229910001629 magnesium chloride Inorganic materials 0.000 description 2
- 229940099596 manganese sulfate Drugs 0.000 description 2
- 239000011702 manganese sulphate Substances 0.000 description 2
- 235000007079 manganese sulphate Nutrition 0.000 description 2
- SQQMAOCOWKFBNP-UHFFFAOYSA-L manganese(II) sulfate Chemical compound [Mn+2].[O-]S([O-])(=O)=O SQQMAOCOWKFBNP-UHFFFAOYSA-L 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000012466 permeate Substances 0.000 description 2
- 239000011574 phosphorus Substances 0.000 description 2
- 229910052698 phosphorus Inorganic materials 0.000 description 2
- 239000001103 potassium chloride Substances 0.000 description 2
- 235000011164 potassium chloride Nutrition 0.000 description 2
- 239000001508 potassium citrate Substances 0.000 description 2
- 229960002635 potassium citrate Drugs 0.000 description 2
- QEEAPRPFLLJWCF-UHFFFAOYSA-K potassium citrate (anhydrous) Chemical compound [K+].[K+].[K+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O QEEAPRPFLLJWCF-UHFFFAOYSA-K 0.000 description 2
- 235000011082 potassium citrates Nutrition 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 235000002639 sodium chloride Nutrition 0.000 description 2
- 239000007921 spray Substances 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 239000013589 supplement Substances 0.000 description 2
- 230000032258 transport Effects 0.000 description 2
- 239000004474 valine Substances 0.000 description 2
- 230000008673 vomiting Effects 0.000 description 2
- 238000005303 weighing Methods 0.000 description 2
- 235000021119 whey protein Nutrition 0.000 description 2
- 235000021247 β-casein Nutrition 0.000 description 2
- LDVVTQMJQSCDMK-UHFFFAOYSA-N 1,3-dihydroxypropan-2-yl formate Chemical compound OCC(CO)OC=O LDVVTQMJQSCDMK-UHFFFAOYSA-N 0.000 description 1
- PZNPLUBHRSSFHT-RRHRGVEJSA-N 1-hexadecanoyl-2-octadecanoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[C@@H](COP([O-])(=O)OCC[N+](C)(C)C)COC(=O)CCCCCCCCCCCCCCC PZNPLUBHRSSFHT-RRHRGVEJSA-N 0.000 description 1
- FPIPGXGPPPQFEQ-UHFFFAOYSA-N 13-cis retinol Natural products OCC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-UHFFFAOYSA-N 0.000 description 1
- 239000001763 2-hydroxyethyl(trimethyl)azanium Substances 0.000 description 1
- BDDLHHRCDSJVKV-UHFFFAOYSA-N 7028-40-2 Chemical compound CC(O)=O.CC(O)=O.CC(O)=O.CC(O)=O BDDLHHRCDSJVKV-UHFFFAOYSA-N 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 101000946377 Bos taurus Alpha-lactalbumin Proteins 0.000 description 1
- 101001008231 Bos taurus Beta-lactoglobulin Proteins 0.000 description 1
- 102000005701 Calcium-Binding Proteins Human genes 0.000 description 1
- 108010045403 Calcium-Binding Proteins Proteins 0.000 description 1
- 235000019743 Choline chloride Nutrition 0.000 description 1
- UDMBCSSLTHHNCD-UHFFFAOYSA-N Coenzym Q(11) Natural products C1=NC=2C(N)=NC=NC=2N1C1OC(COP(O)(O)=O)C(O)C1O UDMBCSSLTHHNCD-UHFFFAOYSA-N 0.000 description 1
- ZAKOWWREFLAJOT-CEFNRUSXSA-N D-alpha-tocopherylacetate Chemical compound CC(=O)OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C ZAKOWWREFLAJOT-CEFNRUSXSA-N 0.000 description 1
- 239000011626 DL-alpha-tocopherylacetate Substances 0.000 description 1
- 235000001809 DL-alpha-tocopherylacetate Nutrition 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- AANLCWYVVNBGEE-IDIVVRGQSA-L Disodium inosinate Chemical compound [Na+].[Na+].O[C@@H]1[C@H](O)[C@@H](COP([O-])([O-])=O)O[C@H]1N1C(NC=NC2=O)=C2N=C1 AANLCWYVVNBGEE-IDIVVRGQSA-L 0.000 description 1
- 101001065501 Escherichia phage MS2 Lysis protein Proteins 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 244000020551 Helianthus annuus Species 0.000 description 1
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- VYGQUTWHTHXGQB-UHFFFAOYSA-N Retinol hexadecanoate Natural products CCCCCCCCCCCCCCCC(=O)OCC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C VYGQUTWHTHXGQB-UHFFFAOYSA-N 0.000 description 1
- 235000019485 Safflower oil Nutrition 0.000 description 1
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 1
- 235000019486 Sunflower oil Nutrition 0.000 description 1
- FPIPGXGPPPQFEQ-BOOMUCAASA-N Vitamin A Natural products OC/C=C(/C)\C=C\C=C(\C)/C=C/C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-BOOMUCAASA-N 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 229930003448 Vitamin K Natural products 0.000 description 1
- 235000019742 Vitamins premix Nutrition 0.000 description 1
- PNNCWTXUWKENPE-UHFFFAOYSA-N [N].NC(N)=O Chemical compound [N].NC(N)=O PNNCWTXUWKENPE-UHFFFAOYSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- UDMBCSSLTHHNCD-KQYNXXCUSA-N adenosine 5'-monophosphate Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@H]1O UDMBCSSLTHHNCD-KQYNXXCUSA-N 0.000 description 1
- 229950006790 adenosine phosphate Drugs 0.000 description 1
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical compound OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- -1 aromatic amino acid Chemical class 0.000 description 1
- 229940072107 ascorbate Drugs 0.000 description 1
- 238000012865 aseptic processing Methods 0.000 description 1
- 235000021053 average weight gain Nutrition 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- FNAQSUUGMSOBHW-UHFFFAOYSA-H calcium citrate Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O FNAQSUUGMSOBHW-UHFFFAOYSA-H 0.000 description 1
- 239000001354 calcium citrate Substances 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- JYYOBHFYCIDXHH-UHFFFAOYSA-N carbonic acid;hydrate Chemical compound O.OC(O)=O JYYOBHFYCIDXHH-UHFFFAOYSA-N 0.000 description 1
- 108010067454 caseinomacropeptide Proteins 0.000 description 1
- 230000001364 causal effect Effects 0.000 description 1
- 235000013351 cheese Nutrition 0.000 description 1
- 229960003178 choline chloride Drugs 0.000 description 1
- SGMZJAMFUVOLNK-UHFFFAOYSA-M choline chloride Chemical compound [Cl-].C[N+](C)(C)CCO SGMZJAMFUVOLNK-UHFFFAOYSA-M 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 229960000355 copper sulfate Drugs 0.000 description 1
- 229940109239 creatinine Drugs 0.000 description 1
- IERHLVCPSMICTF-UHFFFAOYSA-N cytidine monophosphate Natural products O=C1N=C(N)C=CN1C1C(O)C(O)C(COP(O)(O)=O)O1 IERHLVCPSMICTF-UHFFFAOYSA-N 0.000 description 1
- IERHLVCPSMICTF-ZAKLUEHWSA-N cytidine-5'-monophosphate Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@@H](O)[C@H](COP(O)(O)=O)O1 IERHLVCPSMICTF-ZAKLUEHWSA-N 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- PVBRXXAAPNGWGE-LGVAUZIVSA-L disodium 5'-guanylate Chemical compound [Na+].[Na+].C1=2NC(N)=NC(=O)C=2N=CN1[C@@H]1O[C@H](COP([O-])([O-])=O)[C@@H](O)[C@H]1O PVBRXXAAPNGWGE-LGVAUZIVSA-L 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 229910000397 disodium phosphate Inorganic materials 0.000 description 1
- 235000019800 disodium phosphate Nutrition 0.000 description 1
- KURVIXMFFSNONZ-WFIJOQBCSA-L disodium;[(2r,3s,4r,5r)-5-(2,4-dioxopyrimidin-1-yl)-3,4-dihydroxyoxolan-2-yl]methyl phosphate Chemical compound [Na+].[Na+].O[C@@H]1[C@H](O)[C@@H](COP([O-])([O-])=O)O[C@H]1N1C(=O)NC(=O)C=C1 KURVIXMFFSNONZ-WFIJOQBCSA-L 0.000 description 1
- MAMJNXVNGGBHFN-UHFFFAOYSA-N docosa-1,3,5,7,9,11-hexaene Chemical compound CCCCCCCCCCC=CC=CC=CC=CC=CC=C MAMJNXVNGGBHFN-UHFFFAOYSA-N 0.000 description 1
- 235000020669 docosahexaenoic acid Nutrition 0.000 description 1
- 229940090949 docosahexaenoic acid Drugs 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 229960004198 guanidine Drugs 0.000 description 1
- 229960000789 guanidine hydrochloride Drugs 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000000265 homogenisation Methods 0.000 description 1
- 230000036737 immune function Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 235000021125 infant nutrition Nutrition 0.000 description 1
- 229910017053 inorganic salt Inorganic materials 0.000 description 1
- 229960000367 inositol Drugs 0.000 description 1
- CDAISMWEOUEBRE-GPIVLXJGSA-N inositol Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](O)[C@@H]1O CDAISMWEOUEBRE-GPIVLXJGSA-N 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 230000006651 lactation Effects 0.000 description 1
- 239000012263 liquid product Substances 0.000 description 1
- 235000020667 long-chain omega-3 fatty acid Nutrition 0.000 description 1
- 235000020978 long-chain polyunsaturated fatty acids Nutrition 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 230000007102 metabolic function Effects 0.000 description 1
- 239000011785 micronutrient Substances 0.000 description 1
- 235000013369 micronutrients Nutrition 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- BDRTVPCFKSUHCJ-UHFFFAOYSA-N molecular hydrogen;potassium Chemical compound [K].[H][H] BDRTVPCFKSUHCJ-UHFFFAOYSA-N 0.000 description 1
- 235000019799 monosodium phosphate Nutrition 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 235000006286 nutrient intake Nutrition 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid group Chemical group C(CCCCCCC\C=C/CCCCCCCC)(=O)O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 235000020665 omega-6 fatty acid Nutrition 0.000 description 1
- 238000009928 pasteurization Methods 0.000 description 1
- SHUZOJHMOBOZST-UHFFFAOYSA-N phylloquinone Natural products CC(C)CCCCC(C)CCC(C)CCCC(=CCC1=C(C)C(=O)c2ccccc2C1=O)C SHUZOJHMOBOZST-UHFFFAOYSA-N 0.000 description 1
- 235000019175 phylloquinone Nutrition 0.000 description 1
- 239000011772 phylloquinone Substances 0.000 description 1
- MBWXNTAXLNYFJB-NKFFZRIASA-N phylloquinone Chemical compound C1=CC=C2C(=O)C(C/C=C(C)/CCC[C@H](C)CCC[C@H](C)CCCC(C)C)=C(C)C(=O)C2=C1 MBWXNTAXLNYFJB-NKFFZRIASA-N 0.000 description 1
- 230000007180 physiological regulation Effects 0.000 description 1
- 229960001898 phytomenadione Drugs 0.000 description 1
- 229960004839 potassium iodide Drugs 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 230000035935 pregnancy Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 239000012088 reference solution Substances 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 229940108325 retinyl palmitate Drugs 0.000 description 1
- 235000019172 retinyl palmitate Nutrition 0.000 description 1
- 239000011769 retinyl palmitate Substances 0.000 description 1
- 239000003813 safflower oil Substances 0.000 description 1
- 235000005713 safflower oil Nutrition 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 1
- 239000011669 selenium Substances 0.000 description 1
- 229910052711 selenium Inorganic materials 0.000 description 1
- 235000011649 selenium Nutrition 0.000 description 1
- 229940091258 selenium supplement Drugs 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 230000004620 sleep latency Effects 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 235000021055 solid food Nutrition 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 239000008347 soybean phospholipid Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000002600 sunflower oil Substances 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000009469 supplementation Effects 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 229940042585 tocopherol acetate Drugs 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 235000013337 tricalcium citrate Nutrition 0.000 description 1
- PHYFQTYBJUILEZ-IUPFWZBJSA-N triolein Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC(OC(=O)CCCCCCC\C=C/CCCCCCCC)COC(=O)CCCCCCC\C=C/CCCCCCCC PHYFQTYBJUILEZ-IUPFWZBJSA-N 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 235000019871 vegetable fat Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 235000019155 vitamin A Nutrition 0.000 description 1
- 239000011719 vitamin A Substances 0.000 description 1
- QYSXJUFSXHHAJI-YRZJJWOYSA-N vitamin D3 Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C\C=C1\C[C@@H](O)CCC1=C QYSXJUFSXHHAJI-YRZJJWOYSA-N 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 235000019168 vitamin K Nutrition 0.000 description 1
- 239000011712 vitamin K Substances 0.000 description 1
- 150000003721 vitamin K derivatives Chemical class 0.000 description 1
- 229940045997 vitamin a Drugs 0.000 description 1
- 150000003722 vitamin derivatives Chemical class 0.000 description 1
- 229940046010 vitamin k Drugs 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
- 230000004584 weight gain Effects 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23C—DAIRY PRODUCTS, e.g. MILK, BUTTER OR CHEESE; MILK OR CHEESE SUBSTITUTES; MAKING OR TREATMENT THEREOF
- A23C9/00—Milk preparations; Milk powder or milk powder preparations
- A23C9/15—Reconstituted or recombined milk products containing neither non-milk fat nor non-milk proteins
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23C—DAIRY PRODUCTS, e.g. MILK, BUTTER OR CHEESE; MILK OR CHEESE SUBSTITUTES; MAKING OR TREATMENT THEREOF
- A23C11/00—Milk substitutes, e.g. coffee whitener compositions
- A23C11/02—Milk substitutes, e.g. coffee whitener compositions containing at least one non-milk component as source of fats or proteins
- A23C11/04—Milk substitutes, e.g. coffee whitener compositions containing at least one non-milk component as source of fats or proteins containing non-milk fats but no non-milk proteins
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23C—DAIRY PRODUCTS, e.g. MILK, BUTTER OR CHEESE; MILK OR CHEESE SUBSTITUTES; MAKING OR TREATMENT THEREOF
- A23C9/00—Milk preparations; Milk powder or milk powder preparations
- A23C9/15—Reconstituted or recombined milk products containing neither non-milk fat nor non-milk proteins
- A23C9/1512—Reconstituted or recombined milk products containing neither non-milk fat nor non-milk proteins containing isolated milk or whey proteins, caseinates or cheese; Enrichment of milk products with milk proteins in isolated or concentrated form, e.g. ultrafiltration retentate
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES, NOT OTHERWISE PROVIDED FOR; PREPARATION OR TREATMENT THEREOF
- A23L33/00—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof
- A23L33/10—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof using additives
- A23L33/17—Amino acids, peptides or proteins
- A23L33/19—Dairy proteins
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES, NOT OTHERWISE PROVIDED FOR; PREPARATION OR TREATMENT THEREOF
- A23L33/00—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof
- A23L33/40—Complete food formulations for specific consumer groups or specific purposes, e.g. infant formula
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S426/00—Food or edible material: processes, compositions, and products
- Y10S426/801—Pediatric
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Food Science & Technology (AREA)
- Polymers & Plastics (AREA)
- Health & Medical Sciences (AREA)
- Mycology (AREA)
- Nutrition Science (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Pediatric Medicine (AREA)
- Dairy Products (AREA)
- Coloring Foods And Improving Nutritive Qualities (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
Description
本発明は幼児の寛容性の改善を示す幼児用処方の組成物に関する。詳細には、本発明は特定量のアルファ−ラクトアルブミンおよびベータ−ラクトグロブリンを含む修飾されたホウェイ蛋白濃縮物を含む幼児用処方の組成物に関する。
人乳は生まれてから4ヶ月ないし6ヶ月の間新生児に栄養を与えるための好ましい手段である。母乳を与えることが適切でない、またはうまくいかない場合に、あるいは母親が母乳を与えないことを選択した場合に、人乳に代わる、または人乳を補足するための幼児用処方が開発されてきた。幼児用処方の組成物を改良する試みは、母乳の組成をより完全にまねることに焦点が当てられてきた。
幼児用処方に80年以上にわたって牛乳が用いられてきた。しかしながら、人乳と牛乳の蛋白系は、量および質の両方において実質的に異なっている。顕著な量的違いとして、人乳の全蛋白分(11g/L)が牛乳のそれ(33g/L)と比べて低いこと、およびホウェイ蛋白のカゼインに対する割合の違い(牛乳では18:82であり、人乳では60:40である)が挙げられる。
本発明は、幼児が十分に我慢できる、幼児用処方の組成物に関する。本発明の幼児用処方組成物は、ホウェイフラクションの全蛋白の40%以下がアルファ−ラクトアルブミンであり、ホウェイフラクションの全蛋白の8%以上がベータ−ラクトグロブリンである;ただし、ホウェイフラクション中のアルファ−ラクトアルブミンの割合がベータ−ラクトグロブリンの割合よりも大きい、ホウェイフラクションを含む。
本発明はさらには、100キロカロリーを利用するに際して約1.0ないし約1.2グラムの蛋白を提供するのに十分な量の牛乳と、100キロカロリーを利用するに際して約1.0ないし約1.2グラムの蛋白を提供するのに十分な量のウシホウェイ材料とを含む、栄養学的に完全な幼児用処方であって、ウシホウェイ材料が全蛋白のアルファーラクトアルブミン分約28%ないし約40%およびベータ−ラクトグロブリン分約8%ないし約33%を含む、幼児用処方に関する。好ましくは、ホウェイ材料は全蛋白の約28%と約36%の間のアルファーラクトアルブミン分および約10%と約29%の間のベータ−ラクトアルブミン分を有する。この処方において、そのホウェイフラクションのアルファーラクトアルブミンの百分率は、そのホウェイフラクションのベータ−ラクトグロブリンの百分率によりも大きい。好ましくは、そのホウェイフラクションのベータ−ラクトグロブリン分は、そのホウェイフラクションのアルファーラクトアルブミンの百分率から7%を引いた百分率よりも大きくない。
本発明の特定量のアルファーラクトアルブミンおよびベータ−ラクトグロブリンの組成を有する修飾されたホウェイは、全窒素の約15%(百分率はw/wを基礎とする;以下、同じ)またはそれ以下の蛋白以外の窒素分;約12.5ないし約95%の全蛋白分;約15%以下の脂質分;および約4.5%以下の灰分を有することが好ましい。好ましくは、修飾されたホウェイの全蛋白分は約35%ないし約80%の間にあり、より好ましくは約73%ないし約77%の間にある。
本発明の幼児用処方は、付加的に、当該分野にて知られている栄養学的に有益な成分、例えば、アラキドン酸およびドコサヘキサエン酸などの長鎖ポリ不飽和脂肪酸を提供する油と一緒に処方することができる。本発明の幼児用処方はさらに、ビタミン、ミネラル、セレニウム、天然カロチノイド、ヌクレオチド、タウリンおよび他の栄養物質と一緒に処方することもできる。
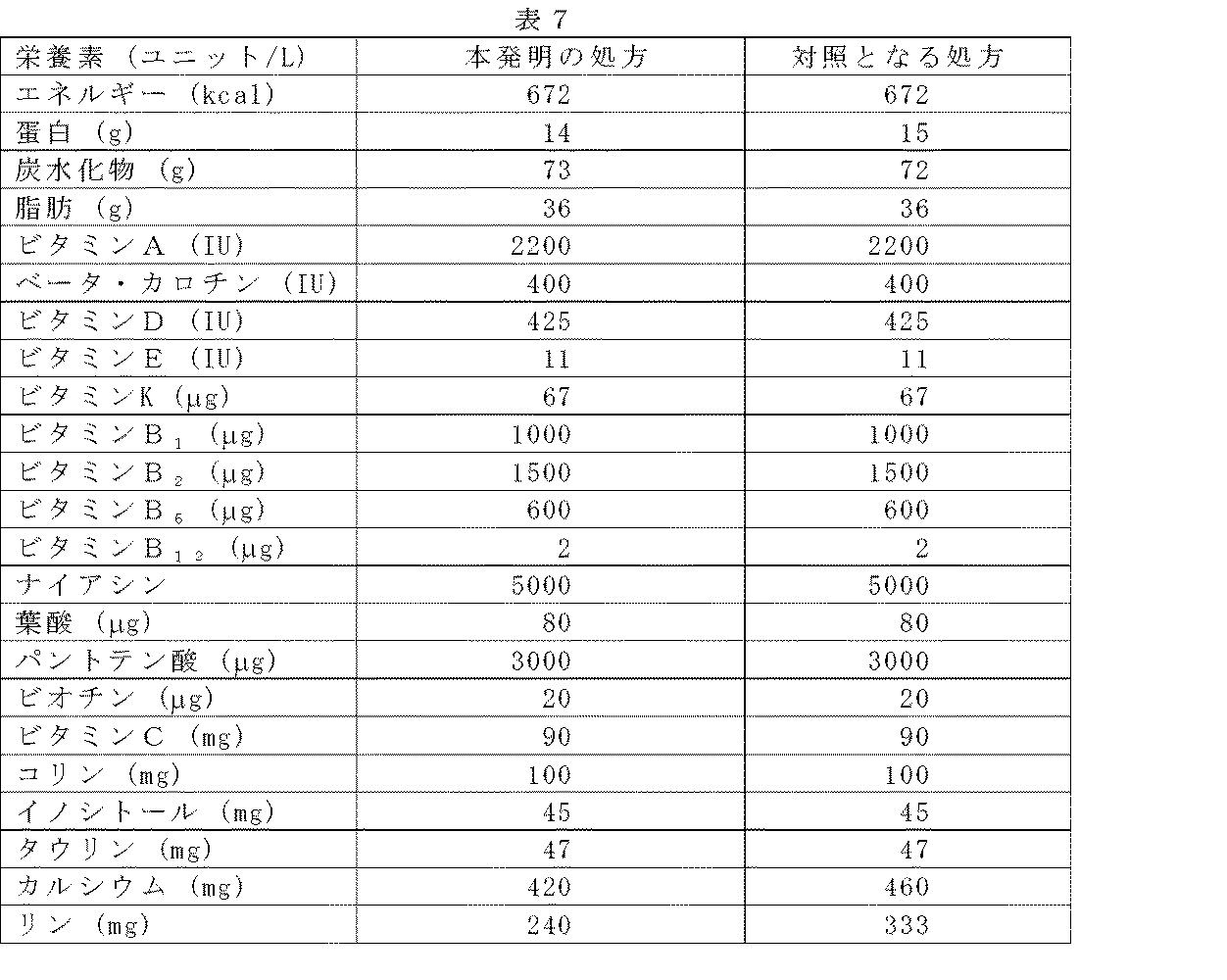
単なる蛋白源として未修飾牛乳で製造した現行の幼児用処方は、15−16g/Lの蛋白を含有し、カゼイン−優勢であり、わずか0.5g/Lのアルファ−ラクトアルブミンを含有するにすぎない(表1)。蛋白組成について修飾されていないホウェイ蛋白で製造された当該幼児用処方は15g/Lの蛋白を含有する。脱ミネラル化されたホウェイはこれらの幼児用処方にある蛋白の半分を提供する。これらの幼児用処方は等容量の人乳にて略半分の、1.2g/Lのアルファ−ラクトアルブミンを含有する(表1)。
アルファ−ラクトアルブミンについては富んでいるが、ベータ−ラクトグロブリンを有意なレベルにて含有するホウェイ蛋白濃縮物を、本発明の幼児用処方に用いるために調製した。当該濃縮物は以下の近似値ならびにミネラル組成およびホウェイ蛋白割合を有した。
実施例1のホウェイ蛋白濃縮物を等量の蛋白を含有する一定量の脱脂粉乳と混合し、ホウェイ蛋白のカゼインに対する割合を60:40とした。アルファ−ラクトアルブミンがこの蛋白混合物にて優勢なホウェイ蛋白であることがわかった。
この蛋白混合物を用い、標準のホウェイをベースとする幼児用処方における蛋白分よりも蛋白分が低く、人乳に見られるそれと近似する、改良された幼児用処方を調製した。当該幼児用処方の蛋白分、ホウェイ蛋白分、アルファ−ラクトアルブミンレベルおよびベータ−ラクトグロブリンレベルを表3に示す。この幼児用処方におけるアルファ−ラクトアルブミンの量はベータ−ラクトグロブリンの量よりも多かった。該幼児用処方中のアルファ−ラクトアルブミンの量は人乳中のアルファ−ラクトアルブミンの量と本質的に同じであった。
各バッチの脂肪ブレンドは、43.54kgの無作為に選択されたパームオレイン、35.2Lのオレイン酸含量の多いヒマワリ油またはサフラワー油、34.6Lのココナッツ油、28.1Lの大豆油、1.36kgの大豆レシチン、1.37kgの蒸留したモノグリセリド、その脂肪酸の38%をアラキドン酸として含有する1.19kgの油(ARASCO、Martek、コロンビア、メリーランド州)およびその脂肪酸の38%をドコサヘキサエン酸として含有する0.74kgの油(DHASCO、Martek、コロンビア、メリーランド州)を合することにより調製した。
ついで、脂溶性ビタミンのビタミンA(ビタミンAパルミチン酸塩および混合天然カロチノイド)、ビタミンD(コレカルシフェロール)、ビタミンE(dl−アルファ−トコフェロール酢酸塩)およびビタミンK(フィトナジオン)をこの脂肪ブレンドに分散させた。
最初の均質化から24時間後、混合物を再び均質化させ、ストークUHT(超高圧)無菌処理システムを介して滅菌し、無菌状態で250mLのフレキシブルな容器に充填した。
脱ミネラル化ホウェイ(典型的には、13.5%蛋白、85%ラクトース、脂肪1%および灰分1.5%未満)で製造した、すぐ授乳することのできる液体幼児用処方の対照となるバッチを、以下の方法にて、4000リットルの量にて製造した。30kgの蛋白を得るのに十分な量の加熱した液体脱脂粉乳を、熱水に溶かしたクエン酸ナトリウムおよびクエン酸カリウムが加えられている合成タンク中の加温した脱イオン水に添加した。脂溶性ビタミンに富む脂肪ブレンドをこの合成タンクに秤量して入れた。主たる乾燥成分、ラクトースおよび脱ミネラル化ホウェイを粉末漏斗エダクターを通して加えた。脱ミネラル化ホウェイの添加量はその蛋白分に応じて一定でなく、30kgの蛋白を得るのに十分であった。タウリンを熱水に溶かし、合成タンクに加えた。以下のミネラルを別々に熱水に溶かすかまたは分散させ、激しくかき混ぜながら合成タンクに加えた:炭酸水素カリウム、塩化カルシウム、塩化カリウム、塩化ナトリウム、クエン酸カルシウム、硫酸鉄、ヨウ化カリウム、硫酸亜鉛、硫酸銅、硫酸マンガンおよび亞セレン酸ナトリウム。
幼児用処方の4つの個々のバッチを本発明に従って製造した。各バッチを標準的な高性能液体クロマトグラフィー操作によりアミノ酸組成について分析した。改良された処方の蛋白にて幼児に不可欠なアミノ酸の平均レベルを表8に示す。この処方は標準的なホウェイ処方よりも人乳のアミノ酸特性に近い特性を有する(表8)。この処方の蛋白源は、標準的なホウェイをベースとする処方よりも、トリプトファン、リジンおよびシスチンにて高く、トレオニンにて低い。
本発明のアミノ酸組成は全蛋白レベルを人乳に近いレベルにまで減少させることができ、これはEUアミノ酸の要件に合致する。
実施例2の改良された処方および対照となる処方を、予想される、多施設の、無作為の、制御され、色分けされた、並行なグループの外来患者の研究において、健康な満期産児にて評価した。幼児は2つの処方の一方を無作為に受け、12週間追跡した。
幼児は妊娠期間に適する体重および身長を有する健康な完全満期産児であった。身長に対する体重の割合は国立健康統計センタ(NCHS)により提供される成長曲線によれば年齢で10番と90番の百分順位の間にあった。
研究を行う幼児はわずか14日齢であった。体重と身長はまだ、NCHS成長曲線によれば年齢で10番と90番の百分順位の間にあった。幼児には専ら研究用の幼児用処方を与えた。
日齢、身長および頭囲についてのベースライン値は2つの研究した群で同様であった。実験群および対照群について、各々、ベースラインの平均日齢は10.1日および10.5日であり、平均身長は51.5cmおよび51.3cmであり、平均頭囲は35.4cmおよび35.5cmであった。体重においては2つのベースラインでの研究した群の間で統計学的に有意な違いがあった(p=0.04)。実験群の幼児は対照群の幼児よりも平均してわずかに重かった(3536.4g対3458.5g)。
Claims (11)
- 牛乳およびホウェイフラクションを含む幼児用調製乳組成物であって、そのホウェイフラクション中の全蛋白の40重量%またはそれ以下がアルファーラクトアルブミンであり、そのホウェイフラクション中の全蛋白の8重量%以上がベータ−ラクトグロブリンである;ただし、 アルファ−ラクトアルブミンの割合はそのホウェイフラクション中にあるベータ−ラクトグロブリンの割合よりも大きい、幼児用調製乳組成物。
- 牛乳 対 ホウェイフラクション中における100キロカロリーあたりの蛋白グラム数の比率が1:1.2〜1.2:1の範囲である、請求項1記載の幼児用調製乳組成物。
- 1.0ないし1.2グラムの蛋白で100キロカロリーの利用可能なカロリーを付与する一定量の牛乳と、1.0ないし1.2グラムの蛋白で100キロカロリーの利用可能なカロリーを付与する一定量のウシホウェイ材料とを含む幼児用調製乳組成物であって、ウシホウェイ材料が全蛋白の28%ないし40%のアルファ−ラクトアルブミン分および8%ないし33%のベータ−ラクトグロブリン分を含む、幼児用調製乳組成物。
- ウシホウェイ材料が全蛋白の28%ないし36%のアルファーラクトアルブミン分および10%ないし29%のベータ−ラクトグロブリン分を含むところの、請求項2記載の幼児用調製乳組成物。
- ウシホウェイ材料がさらに
(a)全窒素の15%またはそれ以下の蛋白以外の窒素分;
(b)12.5%ないし95%の全蛋白分;
(c)15%またはそれ以下の脂肪分;および
(d)4.5%またはそれ以下の灰分
により特徴付けられるところの、請求項2記載の幼児用調製乳組成物。 - ウシホウェイ材料が35%ないし80%の全蛋白分を有するところの、請求項4記載の幼児用調製乳組成物。
- ウシホウェイ材料が73%ないし77%の全蛋白分を有するところの、請求項5記載の幼児用調製乳組成物。
- ウシホウェイ材料が、全蛋白100グラムに付き、グラム単位にて少なくとも以下のアミノ酸分:
(a)アルギニン(3.1);
(b)シスチン(1.4);
(c)ヒスチジン(1.6);
(d)イソロイシン(1.0);
(e)ロイシン(5.3);
(f)リジン(3.9);
(g)メチオニン(0.3);
(h)フェニルアラニン(1.2);
(i)トレオニン(3.2);
(j)トリプトファン(1.5);
(k)チロシン(0.9);および
(l)バリン(1.0)
によりさらに特徴付けられるところの、請求項2記載の幼児用調製乳組成物。 - アルファ−ラクトアルブミンの量が利用可能な670キロカロリーに付き2.2グラム(0.33g/100キロカロリー)以上であるところの、請求項2記載の幼児用調製乳組成物。
- アルファ−ラクトアルブミンの量が利用可能な670キロカロリーに付き2.2ないし2.5グラムであるところの、請求項2記載の幼児用調製乳組成物。
- ホウェイ蛋白のカゼインに対する割合が重量にて60:40であるところの、請求項2〜10のいずれか1項記載の幼児用調製乳組成物。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US34325301P | 2001-12-21 | 2001-12-21 | |
| PCT/US2002/040811 WO2003055322A1 (en) | 2001-12-21 | 2002-12-18 | Infant formula compositions comprising increased amounts of alpha-lactalbumin |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005514017A JP2005514017A (ja) | 2005-05-19 |
| JP4317455B2 true JP4317455B2 (ja) | 2009-08-19 |
Family
ID=23345331
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003555904A Expired - Fee Related JP4317455B2 (ja) | 2001-12-21 | 2002-12-18 | 多量のアルファ−ラクトアルブミンを含む幼児用処方の組成物 |
Country Status (28)
| Country | Link |
|---|---|
| US (1) | US6913778B2 (ja) |
| EP (1) | EP1455585B1 (ja) |
| JP (1) | JP4317455B2 (ja) |
| KR (1) | KR100955408B1 (ja) |
| CN (2) | CN100456936C (ja) |
| AR (1) | AR037909A1 (ja) |
| AT (1) | ATE439044T1 (ja) |
| AU (1) | AU2002357354B2 (ja) |
| BR (1) | BR0215198A (ja) |
| CA (1) | CA2471423C (ja) |
| CO (1) | CO5590862A2 (ja) |
| CY (1) | CY1109503T1 (ja) |
| DE (1) | DE60233346D1 (ja) |
| DK (1) | DK1455585T3 (ja) |
| EA (1) | EA007148B1 (ja) |
| EC (1) | ECSP045154A (ja) |
| ES (1) | ES2329667T3 (ja) |
| IL (2) | IL162244A0 (ja) |
| MX (1) | MXPA04005887A (ja) |
| NO (1) | NO20043108L (ja) |
| NZ (1) | NZ534041A (ja) |
| PL (1) | PL371379A1 (ja) |
| PT (1) | PT1455585E (ja) |
| SG (1) | SG169897A1 (ja) |
| TW (1) | TWI301052B (ja) |
| UA (1) | UA81903C2 (ja) |
| WO (1) | WO2003055322A1 (ja) |
| ZA (1) | ZA200405777B (ja) |
Families Citing this family (47)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7651716B2 (en) * | 2001-12-21 | 2010-01-26 | Wyeth Llc | Methods for reducing adverse effects of feeding formula to infants |
| PL376378A1 (en) * | 2002-10-10 | 2005-12-27 | Wyeth | Infant formula containing nucleotides |
| US7829126B2 (en) * | 2005-10-26 | 2010-11-09 | Abbott Laboratories | Infant formulas containing docosahexaenoic acid and lutein |
| US20080089981A1 (en) † | 2006-10-17 | 2008-04-17 | N.V. Nutricia | Ketogenic diet |
| EP1932437A1 (en) * | 2006-12-15 | 2008-06-18 | Nestec S.A. | Infant formula |
| NL1033521C2 (nl) * | 2007-03-08 | 2008-09-09 | Friesland Brands Bv | Kindervoedingen met geoptimaliseerde aminozuursamenstelling. |
| JP5322405B2 (ja) * | 2007-06-07 | 2013-10-23 | 小林製薬株式会社 | タンパク質含有組成物 |
| US8586122B2 (en) * | 2007-07-26 | 2013-11-19 | Loders Croklaan Usa Llc | Composition suitable for use in baking |
| US20110172305A1 (en) * | 2007-10-02 | 2011-07-14 | Ester Fride | Endocannabinoids for Enhancing Growth and Development in Infants |
| JP5604764B2 (ja) * | 2008-04-29 | 2014-10-15 | ディーエスエム アイピー アセッツ ビー.ブイ. | カゼインミセルとトリプトファンの豊富なペプチドとを含むパッケージ化水性液体組成物の製造方法 |
| WO2009132951A1 (en) * | 2008-04-29 | 2009-11-05 | Unilever Nv | Composition comprising carbohydrates and peptides which comprise tryptophan |
| US8498729B2 (en) | 2008-08-29 | 2013-07-30 | Smp Logic Systems Llc | Manufacturing execution system for use in manufacturing baby formula |
| JP2013509171A (ja) * | 2009-10-28 | 2013-03-14 | ヴァリオ・リミテッド | ホエータンパク質製品およびその調製方法 |
| CN101831415B (zh) * | 2010-05-12 | 2012-05-30 | 江苏博立生物制品有限公司 | 一种提高糖化酶发酵水平的方法 |
| WO2012077076A1 (en) * | 2010-12-08 | 2012-06-14 | Holt Patrick G | Treating or preventing sensitivity to milk allergens |
| WO2012091542A1 (en) * | 2010-12-28 | 2012-07-05 | N.V. Nutricia | Combination of components for the prevention and treatment of frailty |
| NZ612095A (en) * | 2010-12-30 | 2015-02-27 | Abbott Lab | Improved tolerance in a low calorie infant formula |
| US20120171328A1 (en) * | 2011-01-05 | 2012-07-05 | Dattatreya Banavara | Composition comprising heat labile milk proteins and process for preparing same |
| WO2012107865A2 (en) | 2011-02-10 | 2012-08-16 | Wyeth Llc | Modulation of growth of bifidobacteria using a combination of oligosaccharides found in human milk |
| FI123267B (fi) * | 2011-02-18 | 2013-01-15 | Valio Oy | Juusto ja sen valmistus |
| WO2012147075A1 (en) * | 2011-04-28 | 2012-11-01 | Shemen Industries Ltd | Vegetable based oil preparation for baked goods |
| MX389785B (es) | 2011-07-26 | 2025-03-18 | Nucitec Sa De Cv | Composicion nutrimental para niños que presentan reflujo, colico y/o estreñimiento. |
| WO2013068879A2 (en) * | 2011-11-10 | 2013-05-16 | Pfizer Inc. | Infant formula with high sn-2 palmitate and oligofructose |
| FI125332B (fi) * | 2011-11-11 | 2015-08-31 | Valio Oy | Menetelmä maitotuotteen valmistamiseksi |
| CN102630803A (zh) * | 2012-05-15 | 2012-08-15 | 东北农业大学 | 母乳化牛乳蛋白及其制备方法 |
| MX2012010488A (es) * | 2012-09-11 | 2014-03-26 | Nucitec Sa De Cv | Formula infantil para el optimo crecimiento, proteccion gastrointestinal y proteccion inmunologica de infantes. |
| MX2012010487A (es) * | 2012-09-11 | 2014-03-26 | Nucitec Sa De Cv | Composicion de nutrimientos y sustancias bioactivas que favorecen el crecimiento y que disminuyen la intolerancia y los efectos adversos en infantes prematuros. |
| CN103027116A (zh) * | 2012-12-04 | 2013-04-10 | 内蒙古伊利实业集团股份有限公司 | 一种有助于睡眠的奶粉及其制备方法 |
| WO2015154262A1 (en) * | 2014-04-09 | 2015-10-15 | Nestle (China) Ltd. | Gender specific synthetic nutritional compositions and nutritional systems comprising them. |
| CN106659227B (zh) | 2014-05-19 | 2022-02-11 | N·V·努特里奇亚 | 包含优化的氨基酸谱的配方物 |
| WO2015178762A1 (en) * | 2014-05-19 | 2015-11-26 | N.V. Nutricia | Enteral formulations for preterm infants comprising optimised phenylalanine intake levels |
| CN104012657B (zh) * | 2014-05-21 | 2016-04-13 | 澳优乳业(中国)有限公司 | 一种氨基酸母乳化婴幼儿配方奶粉及其制备方法 |
| CN104522175A (zh) * | 2014-12-29 | 2015-04-22 | 光明乳业股份有限公司 | 一种低敏婴儿配方奶粉的制备及检测方法 |
| EP3355722A4 (en) * | 2015-09-28 | 2019-03-13 | Nestec S.A. | GENDER SYNTHETIC NUTRITIONAL COMPOSITIONS AND NUTRITIONAL SYSTEMS THEREWITH |
| US10039765B1 (en) * | 2016-02-26 | 2018-08-07 | Michelle Ann Toothman | Vitamin supplement compositions with enhanced bioavailability |
| US10617700B1 (en) * | 2016-02-26 | 2020-04-14 | Michelle Ann Toothman | Vitamin supplement compositions with enhanced bioavailability |
| US10039805B1 (en) * | 2016-02-26 | 2018-08-07 | Michelle Ann Toothman | Infant formulas having vitamin complexes with enhanced bioavailability |
| US11122833B1 (en) * | 2016-02-26 | 2021-09-21 | Michelle Ann Toothman | Infant formulas having vitamin complexes with enhanced bioavailability |
| EP3338841A1 (en) * | 2016-12-23 | 2018-06-27 | Ferdinand Haschke | Liquid human milk supplement |
| MX2019011388A (es) * | 2017-05-03 | 2019-10-30 | Nestle Sa | Extractos de proteina de suero de leche y su uso como fuente de esfingomielina. |
| CA3119300A1 (en) * | 2017-11-13 | 2019-05-16 | Cancer Research Technology Ltd. | Dietary product |
| US11197917B2 (en) | 2017-12-01 | 2021-12-14 | ByHeart, Inc. | Formulations for nutritional support in subjects in need thereof |
| AU2019411230B2 (en) | 2018-12-21 | 2025-04-17 | Société des Produits Nestlé S.A. | Nutritional composition for inducing a feeling of satiety, a better sleep and/or limiting nocturnal awaking in infants or young children |
| EP4030921B1 (en) | 2019-09-16 | 2024-02-21 | Société des Produits Nestlé S.A. | Whey-based nutritional compositions fortified with calcium |
| KR102536585B1 (ko) * | 2020-08-04 | 2023-05-24 | 주식회사 엘지생활건강 | 액상 조제유 조성물 |
| WO2022177965A1 (en) * | 2021-02-16 | 2022-08-25 | Abbott Laboratories | Nutritional compositions comprising human milk oligosaccharides and bovine immunoglobulin |
| CN114568705B (zh) * | 2022-03-22 | 2023-04-25 | 中国农业大学 | 一种有利于锌吸收的蛋白口服液及其制备方法 |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2459619B1 (fr) | 1979-06-26 | 1983-07-29 | Agronomique Inst Nat Rech | Procede pour l'obtention a partir de lactoserum, d'un produit enrichi en alpha-lactalbumine et applications dudit procede |
| CA1243887A (en) | 1984-07-03 | 1988-11-01 | Shuryo Nakai | REDUCING .beta.-LACTOGLOBULIN CONTENT IN WHEY PROTEIN CONCENTRATES FOR INFANT FORMULA USE |
| AU616411B2 (en) | 1987-05-14 | 1991-10-31 | Commonwealth Scientific And Industrial Research Organisation | Whey protein fractions |
| GB8723651D0 (en) | 1987-10-08 | 1987-11-11 | Express Foods Group Ltd | Process for containing concentrates |
| US5436020A (en) | 1990-02-19 | 1995-07-25 | Meiji Milk Products Company Limited | Method for producing a formulated milk for infants analogous to human milk |
| US5169666A (en) | 1991-11-14 | 1992-12-08 | The United States Of America As Represented By The Secretary Of Agriculture | Preparation of simulated human milk protein by low temperature microfiltration |
| JP2622789B2 (ja) | 1992-02-18 | 1997-06-18 | 雪印乳業株式会社 | ホエーからα−ラクトアルブミン含有量の高い画分を製造する方法及び該画分を含有せしめてなる母乳代替物または栄養組成物 |
| DK0604684T3 (da) | 1992-12-23 | 1998-01-26 | Campina Melkunie Bv | Fremgangsmåde til genvinding af alphalactalbumin og betalactoglobulin fra et mælkeproteinprodukt |
| US6312755B1 (en) * | 1999-07-16 | 2001-11-06 | Ampc | Whey treatment process for achieving high concentration of α-lactalbumin |
| AU2002211115A1 (en) | 2000-10-05 | 2002-04-15 | Massey University | Process for recovering proteins from whey protein containing feedstocks |
-
2002
- 2002-12-13 US US10/318,977 patent/US6913778B2/en not_active Expired - Lifetime
- 2002-12-18 KR KR1020047009722A patent/KR100955408B1/ko not_active Expired - Fee Related
- 2002-12-18 NZ NZ534041A patent/NZ534041A/en not_active IP Right Cessation
- 2002-12-18 PT PT02805966T patent/PT1455585E/pt unknown
- 2002-12-18 PL PL02371379A patent/PL371379A1/xx not_active IP Right Cessation
- 2002-12-18 EP EP02805966A patent/EP1455585B1/en not_active Expired - Lifetime
- 2002-12-18 DE DE60233346T patent/DE60233346D1/de not_active Expired - Lifetime
- 2002-12-18 ES ES02805966T patent/ES2329667T3/es not_active Expired - Lifetime
- 2002-12-18 EA EA200400849A patent/EA007148B1/ru not_active IP Right Cessation
- 2002-12-18 CN CNB028253116A patent/CN100456936C/zh not_active Expired - Lifetime
- 2002-12-18 WO PCT/US2002/040811 patent/WO2003055322A1/en not_active Ceased
- 2002-12-18 SG SG200603158-7A patent/SG169897A1/en unknown
- 2002-12-18 BR BR0215198-7A patent/BR0215198A/pt not_active Application Discontinuation
- 2002-12-18 AT AT02805966T patent/ATE439044T1/de not_active IP Right Cessation
- 2002-12-18 AU AU2002357354A patent/AU2002357354B2/en not_active Expired
- 2002-12-18 UA UA20040705922A patent/UA81903C2/uk unknown
- 2002-12-18 AR ARP020104954A patent/AR037909A1/es active IP Right Grant
- 2002-12-18 CN CN2008101863703A patent/CN101427802B/zh not_active Expired - Lifetime
- 2002-12-18 DK DK02805966T patent/DK1455585T3/da active
- 2002-12-18 JP JP2003555904A patent/JP4317455B2/ja not_active Expired - Fee Related
- 2002-12-18 MX MXPA04005887A patent/MXPA04005887A/es active IP Right Grant
- 2002-12-18 IL IL16224402A patent/IL162244A0/xx unknown
- 2002-12-18 CA CA2471423A patent/CA2471423C/en not_active Expired - Fee Related
- 2002-12-19 TW TW091136637A patent/TWI301052B/zh not_active IP Right Cessation
-
2004
- 2004-05-30 IL IL162244A patent/IL162244A/en not_active IP Right Cessation
- 2004-06-15 EC EC2004005154A patent/ECSP045154A/es unknown
- 2004-06-16 CO CO04056263A patent/CO5590862A2/es not_active Application Discontinuation
- 2004-07-20 NO NO20043108A patent/NO20043108L/no unknown
- 2004-07-20 ZA ZA200405777A patent/ZA200405777B/en unknown
-
2009
- 2009-10-21 CY CY20091101092T patent/CY1109503T1/el unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4317455B2 (ja) | 多量のアルファ−ラクトアルブミンを含む幼児用処方の組成物 | |
| US20230248043A1 (en) | Nutritional composition | |
| US9889162B2 (en) | Prophylactic use for prevention of infections | |
| CA2584247A1 (en) | Compositions and methods of formulation for enteral formulas containing sialic acid | |
| Guo | Human milk biochemistry and infant formula manufacturing technology | |
| US7651716B2 (en) | Methods for reducing adverse effects of feeding formula to infants | |
| EP4057841B1 (en) | Use of alpha-lactalbumin enriched whey protein extract as a source of cholesterol and synthetic nutritional composition comprising an alpha-lactalbumin enriched whey protein extract | |
| JP2016506753A (ja) | 食品組成物及びその使用 | |
| HK1065925B (en) | Infant formula compositions comprising increased amounts of alpha-lactalbumin | |
| Lightdale et al. | Human milk: nutritional properties | |
| HK40081708A (en) | Use of alpha-lactalbumin enriched whey protein extract as a source of cholesterol and synthetic nutritional composition comprising an alpha-lactalbumin enriched whey protein extract | |
| HK40081708B (en) | Use of alpha-lactalbumin enriched whey protein extract as a source of cholesterol and synthetic nutritional composition comprising an alpha-lactalbumin enriched whey protein extract |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20051115 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20081028 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20081111 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090210 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090218 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090311 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090318 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090410 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20090507 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20090522 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120529 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120529 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130529 Year of fee payment: 4 |
|
| LAPS | Cancellation because of no payment of annual fees |