JP4092012B2 - 臭素化合物の製造方法 - Google Patents
臭素化合物の製造方法 Download PDFInfo
- Publication number
- JP4092012B2 JP4092012B2 JP11355798A JP11355798A JP4092012B2 JP 4092012 B2 JP4092012 B2 JP 4092012B2 JP 11355798 A JP11355798 A JP 11355798A JP 11355798 A JP11355798 A JP 11355798A JP 4092012 B2 JP4092012 B2 JP 4092012B2
- Authority
- JP
- Japan
- Prior art keywords
- water
- bromide
- bromine
- general formula
- bis
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 title claims description 13
- 229910052794 bromium Inorganic materials 0.000 title claims description 13
- -1 bromine compound Chemical class 0.000 title description 18
- 238000004519 manufacturing process Methods 0.000 title description 2
- 150000001875 compounds Chemical class 0.000 claims description 17
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 15
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 11
- 238000006243 chemical reaction Methods 0.000 claims description 7
- 150000004714 phosphonium salts Chemical group 0.000 claims description 4
- 150000003242 quaternary ammonium salts Chemical class 0.000 claims description 4
- 238000003756 stirring Methods 0.000 description 10
- 238000000034 method Methods 0.000 description 9
- 239000003960 organic solvent Substances 0.000 description 9
- 238000005893 bromination reaction Methods 0.000 description 8
- 239000002994 raw material Substances 0.000 description 8
- 150000001450 anions Chemical class 0.000 description 6
- 238000004128 high performance liquid chromatography Methods 0.000 description 6
- 239000000843 powder Substances 0.000 description 6
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 6
- 238000002844 melting Methods 0.000 description 5
- 230000008018 melting Effects 0.000 description 5
- JRMUNVKIHCOMHV-UHFFFAOYSA-M tetrabutylammonium bromide Chemical compound [Br-].CCCC[N+](CCCC)(CCCC)CCCC JRMUNVKIHCOMHV-UHFFFAOYSA-M 0.000 description 5
- GKQHIYSTBXDYNQ-UHFFFAOYSA-M 1-dodecylpyridin-1-ium;chloride Chemical compound [Cl-].CCCCCCCCCCCC[N+]1=CC=CC=C1 GKQHIYSTBXDYNQ-UHFFFAOYSA-M 0.000 description 4
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 4
- HTZCNXWZYVXIMZ-UHFFFAOYSA-M benzyl(triethyl)azanium;chloride Chemical compound [Cl-].CC[N+](CC)(CC)CC1=CC=CC=C1 HTZCNXWZYVXIMZ-UHFFFAOYSA-M 0.000 description 4
- 230000031709 bromination Effects 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- QLAJNZSPVITUCQ-UHFFFAOYSA-N 1,3,2-dioxathietane 2,2-dioxide Chemical compound O=S1(=O)OCO1 QLAJNZSPVITUCQ-UHFFFAOYSA-N 0.000 description 3
- CWZVMVIHYSYLSI-UHFFFAOYSA-N 1,3-dibromo-5-[3,5-dibromo-4-(2,3-dibromopropoxy)phenyl]sulfonyl-2-(2,3-dibromopropoxy)benzene Chemical compound C1=C(Br)C(OCC(Br)CBr)=C(Br)C=C1S(=O)(=O)C1=CC(Br)=C(OCC(Br)CBr)C(Br)=C1 CWZVMVIHYSYLSI-UHFFFAOYSA-N 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- 230000002411 adverse Effects 0.000 description 3
- 125000000217 alkyl group Chemical group 0.000 description 3
- 125000003710 aryl alkyl group Chemical group 0.000 description 3
- 125000003118 aryl group Chemical group 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 125000000623 heterocyclic group Chemical group 0.000 description 3
- 239000000203 mixture Substances 0.000 description 3
- 235000010265 sodium sulphite Nutrition 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 150000003457 sulfones Chemical class 0.000 description 3
- LXIZRZRTWSDLKK-UHFFFAOYSA-N 1,3-dibromo-5-[2-[3,5-dibromo-4-(2,3-dibromopropoxy)phenyl]propan-2-yl]-2-(2,3-dibromopropoxy)benzene Chemical compound C=1C(Br)=C(OCC(Br)CBr)C(Br)=CC=1C(C)(C)C1=CC(Br)=C(OCC(Br)CBr)C(Br)=C1 LXIZRZRTWSDLKK-UHFFFAOYSA-N 0.000 description 2
- RNFJDJUURJAICM-UHFFFAOYSA-N 2,2,4,4,6,6-hexaphenoxy-1,3,5-triaza-2$l^{5},4$l^{5},6$l^{5}-triphosphacyclohexa-1,3,5-triene Chemical compound N=1P(OC=2C=CC=CC=2)(OC=2C=CC=CC=2)=NP(OC=2C=CC=CC=2)(OC=2C=CC=CC=2)=NP=1(OC=1C=CC=CC=1)OC1=CC=CC=C1 RNFJDJUURJAICM-UHFFFAOYSA-N 0.000 description 2
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 238000000862 absorption spectrum Methods 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 239000003063 flame retardant Substances 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 239000002198 insoluble material Substances 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 150000003839 salts Chemical group 0.000 description 2
- RKHXQBLJXBGEKF-UHFFFAOYSA-M tetrabutylphosphanium;bromide Chemical compound [Br-].CCCC[P+](CCCC)(CCCC)CCCC RKHXQBLJXBGEKF-UHFFFAOYSA-M 0.000 description 2
- BRKFQVAOMSWFDU-UHFFFAOYSA-M tetraphenylphosphanium;bromide Chemical compound [Br-].C1=CC=CC=C1[P+](C=1C=CC=CC=1)(C=1C=CC=CC=1)C1=CC=CC=C1 BRKFQVAOMSWFDU-UHFFFAOYSA-M 0.000 description 2
- WOLVEMPZUIFSII-IHHOKICGSA-N (2e,4e)-n-[(2s,5s)-5-(hydroxymethyl)-1-methyl-3-oxo-2-propan-2-yl-2,4,5,6-tetrahydro-1,4-benzodiazocin-8-yl]-5-[4-(trifluoromethyl)phenyl]penta-2,4-dienamide Chemical compound CN([C@H](C(N[C@H](CO)CC1=C2)=O)C(C)C)C1=CC=C2NC(=O)\C=C\C=C\C1=CC=C(C(F)(F)F)C=C1 WOLVEMPZUIFSII-IHHOKICGSA-N 0.000 description 1
- WOQHGFKABTUWJK-UHFFFAOYSA-M (4-bromophenyl)methyl-triethylazanium;bromide Chemical compound [Br-].CC[N+](CC)(CC)CC1=CC=C(Br)C=C1 WOQHGFKABTUWJK-UHFFFAOYSA-M 0.000 description 1
- PIVWQNJJTJZBMY-UHFFFAOYSA-N 1,2,4-trimethylpyridin-1-ium Chemical compound CC1=CC=[N+](C)C(C)=C1 PIVWQNJJTJZBMY-UHFFFAOYSA-N 0.000 description 1
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- ZPFAVCIQZKRBGF-UHFFFAOYSA-N 1,3,2-dioxathiolane 2,2-dioxide Chemical compound O=S1(=O)OCCO1 ZPFAVCIQZKRBGF-UHFFFAOYSA-N 0.000 description 1
- PWXTUWQHMIFLKL-UHFFFAOYSA-N 1,3-dibromo-5-[2-(3,5-dibromo-4-prop-2-enoxyphenyl)propan-2-yl]-2-prop-2-enoxybenzene Chemical compound C=1C(Br)=C(OCC=C)C(Br)=CC=1C(C)(C)C1=CC(Br)=C(OCC=C)C(Br)=C1 PWXTUWQHMIFLKL-UHFFFAOYSA-N 0.000 description 1
- DLPFXLBAHRWRDG-UHFFFAOYSA-N 1,3-dibromo-5-[3,5-dibromo-4-(2,3-dibromopropoxy)phenoxy]-2-(2,3-dibromopropoxy)benzene Chemical compound BrCC(Br)COc1c(Br)cc(Oc2cc(Br)c(OCC(Br)CBr)c(Br)c2)cc1Br DLPFXLBAHRWRDG-UHFFFAOYSA-N 0.000 description 1
- UHAKAEWPYVEYPH-UHFFFAOYSA-N 1,3-dibromo-5-[3,5-dibromo-4-(2,3-dibromopropoxy)phenyl]sulfanyl-2-(2,3-dibromopropoxy)benzene Chemical compound C1=C(Br)C(OCC(Br)CBr)=C(Br)C=C1SC1=CC(Br)=C(OCC(Br)CBr)C(Br)=C1 UHAKAEWPYVEYPH-UHFFFAOYSA-N 0.000 description 1
- WRBWPOUJZOXKKJ-UHFFFAOYSA-M 1-dodecyl-1-methylpiperidin-1-ium;bromide Chemical compound [Br-].CCCCCCCCCCCC[N+]1(C)CCCCC1 WRBWPOUJZOXKKJ-UHFFFAOYSA-M 0.000 description 1
- IAQQDIGGISSSQO-UHFFFAOYSA-N 2-(4-fluorophenyl)piperidine Chemical compound C1=CC(F)=CC=C1C1NCCCC1 IAQQDIGGISSSQO-UHFFFAOYSA-N 0.000 description 1
- CWPKTBMRVATCBL-UHFFFAOYSA-N 3-[1-[1-[(2-methylphenyl)methyl]piperidin-4-yl]piperidin-4-yl]-1h-benzimidazol-2-one Chemical compound CC1=CC=CC=C1CN1CCC(N2CCC(CC2)N2C(NC3=CC=CC=C32)=O)CC1 CWPKTBMRVATCBL-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- 125000006283 4-chlorobenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1Cl)C([H])([H])* 0.000 description 1
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 description 1
- 101100046776 Arabidopsis thaliana TPPB gene Proteins 0.000 description 1
- SZKLQXUXBMJUMM-UHFFFAOYSA-M CC1=CC=C(C=C1)S(=O)(=O)[O-].C[N+](CC1=CC=CC=C1)(CC2=CC=CC=C2)CC3=CC=CC=C3 Chemical compound CC1=CC=C(C=C1)S(=O)(=O)[O-].C[N+](CC1=CC=CC=C1)(CC2=CC=CC=C2)CC3=CC=CC=C3 SZKLQXUXBMJUMM-UHFFFAOYSA-M 0.000 description 1
- FDOMYWWHVFNLLN-UHFFFAOYSA-N CC[N+]1=CC=CC(=C1)C(=O)O.CC1=CC=C(C=C1)S(=O)(=O)[O-] Chemical compound CC[N+]1=CC=CC(=C1)C(=O)O.CC1=CC=C(C=C1)S(=O)(=O)[O-] FDOMYWWHVFNLLN-UHFFFAOYSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- OKIZCWYLBDKLSU-UHFFFAOYSA-M N,N,N-Trimethylmethanaminium chloride Chemical compound [Cl-].C[N+](C)(C)C OKIZCWYLBDKLSU-UHFFFAOYSA-M 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- USFRYJRPHFMVBZ-UHFFFAOYSA-M benzyl(triphenyl)phosphanium;chloride Chemical compound [Cl-].C=1C=CC=CC=1[P+](C=1C=CC=CC=1)(C=1C=CC=CC=1)CC1=CC=CC=C1 USFRYJRPHFMVBZ-UHFFFAOYSA-M 0.000 description 1
- IISBACLAFKSPIT-UHFFFAOYSA-N bisphenol A Chemical class C=1C=C(O)C=CC=1C(C)(C)C1=CC=C(O)C=C1 IISBACLAFKSPIT-UHFFFAOYSA-N 0.000 description 1
- 150000001768 cations Chemical group 0.000 description 1
- 239000007810 chemical reaction solvent Substances 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- QLZHNIAADXEJJP-UHFFFAOYSA-L dioxido-oxo-phenyl-$l^{5}-phosphane Chemical compound [O-]P([O-])(=O)C1=CC=CC=C1 QLZHNIAADXEJJP-UHFFFAOYSA-L 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 125000001421 myristyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- PSZYNBSKGUBXEH-UHFFFAOYSA-M naphthalene-1-sulfonate Chemical compound C1=CC=C2C(S(=O)(=O)[O-])=CC=CC2=C1 PSZYNBSKGUBXEH-UHFFFAOYSA-M 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 125000003854 p-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Cl 0.000 description 1
- 125000006503 p-nitrobenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1[N+]([O-])=O)C([H])([H])* 0.000 description 1
- 125000001037 p-tolyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 1
- FIKAKWIAUPDISJ-UHFFFAOYSA-L paraquat dichloride Chemical compound [Cl-].[Cl-].C1=C[N+](C)=CC=C1C1=CC=[N+](C)C=C1 FIKAKWIAUPDISJ-UHFFFAOYSA-L 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 125000004079 stearyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000000967 suction filtration Methods 0.000 description 1
- HWCKGOZZJDHMNC-UHFFFAOYSA-M tetraethylammonium bromide Chemical compound [Br-].CC[N+](CC)(CC)CC HWCKGOZZJDHMNC-UHFFFAOYSA-M 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- HJHUXWBTVVFLQI-UHFFFAOYSA-N tributyl(methyl)azanium Chemical compound CCCC[N+](C)(CCCC)CCCC HJHUXWBTVVFLQI-UHFFFAOYSA-N 0.000 description 1
- GNMJFQWRASXXMS-UHFFFAOYSA-M trimethyl(phenyl)azanium;bromide Chemical compound [Br-].C[N+](C)(C)C1=CC=CC=C1 GNMJFQWRASXXMS-UHFFFAOYSA-M 0.000 description 1
- FAPSXSAPXXJTOU-UHFFFAOYSA-L trimethyl-[6-(trimethylazaniumyl)hexyl]azanium;dibromide Chemical compound [Br-].[Br-].C[N+](C)(C)CCCCCC[N+](C)(C)C FAPSXSAPXXJTOU-UHFFFAOYSA-L 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/52—Improvements relating to the production of bulk chemicals using catalysts, e.g. selective catalysts
Landscapes
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Description
【発明の属する技術分野】
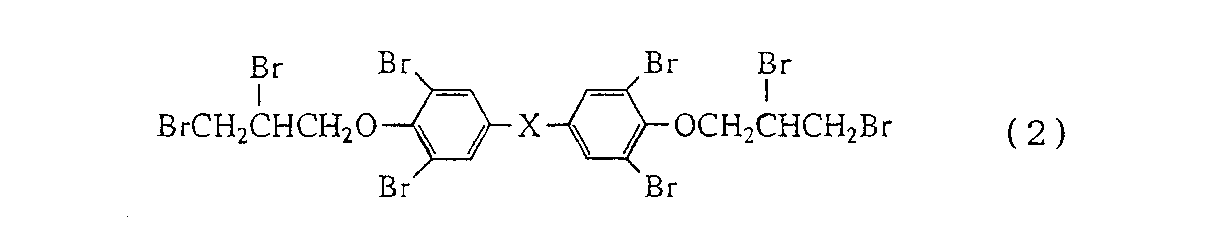
本発明は、難燃剤として有用な下記一般式(2)で表される臭素化されたビスフェノール類誘導体の改良された製造方法に関する。
【0002】
【従来の技術】
従来、一般式(2)の臭素化合物は、原料化合物であるビス(4−アリルオキシ−3,5−ジブロモフェニル)誘導体(1)を、臭素に不活性な有機溶媒、例えば塩化メチレン、クロロホルム、1,2−ジクロロエタンなどに溶解し、常温又は加温下に臭素化反応させることにより製造されてきた(特公昭50−23693号、特公昭50−35103号、特公昭57−289号、特開平8−3090号など参照)。
【0003】
しかしながら、この臭素化反応に用いられてきた、臭素に不活性な有機溶媒は、いずれも人体への毒性が懸念される化合物であるほか、環境への悪影響が心配されるため、その使用の削減が望まれていた。
【0004】
【発明が解決しようとする課題】
本発明は、上記の臭素化反応に際して、人体への毒性や、環境への悪影響が心配される臭素に不活性な有機溶媒を使用することなく、水中で反応させて下記の化合物(2)を得る方法を提供することを目的とする。
【0005】
【課題を解決するための手段】
本発明者らは、上記の課題を解決するために鋭意検討を行った結果、ビス(4−アリルオキシ−3,5−ジブロモフェニル)誘導体(1)を、水中で臭素化するという簡単な方法により、容易に、高品質の一般式(2)で表される含臭素化合物を製造できる方法を見出し、本発明に至った。
【0006】
すなわち、本発明は、一般式(1):
【0007】
【化4】
【0008】
(式中、Xは
【0009】
【化5】
【0010】
を示す)
で表される化合物を、臭素と反応させて、一般式(2):
【0011】
【化6】
【0012】
(式中、Xは前記と同じである)
で表される化合物を製造する方法において、四級アンモニウム塩又は四級ホスホニウム塩の存在下に、水中で反応させることを特徴とする方法である。
【0013】
一般式(2)で表される化合物としては、2,2−ビス〔3,5−ジブロモ−4−(2,3−ジブロモプロピルオキシ)フェニル〕プロパン、ビス〔3,5−ジブロモ−4−(2,3−ジブロモプロピルオキシ)フェニル〕スルホン、ビス〔3,5−ジブロモ−4−(2,3−ジブロモプロピルオキシ)フェニル〕チオエーテル及びビス〔3,5−ジブロモ−4−(2,3−ジブロモプロピルオキシ)フェニル〕エーテルを挙げることができる。
【0014】
本発明に使用される四級アンモニウム塩又は四級ホスホニウム塩としては、一般式(3):
【0015】
【化7】
【0016】
(式中、R1 〜R4 は、同一でも異なっていてもよく、それぞれアルキル基、アラルキル基、アリール基及び複素環式基より選ばれる1価基、またはR1 〜R4 の2つ以上の基が一緒になって、Y+ と共に環状構造を形成することができる基である。YはN又はPを示す。Zはアニオンを示すが、R1 〜R4 の基がアニオンを含む置換基を有する場合は不存在とする)で表すことができる。
【0017】
一般式(3)の化合物において、R1 〜R4 のアルキル基としては、置換又は非置換の直鎖状又は分岐状アルキル基であり、例えばメチル、エチル、n−プロピル、3−スルホプロピル、n−ブチル、iso −ブチル、3−カルボキシプロピル、2−エトキシエチル、n−ヘキシル、n−オクチル、2−エチルヘキシル、iso −デシル、ミリスチル、ステアリルなどが挙げられる。
【0018】
また、R1 〜R4 のアラルキル基としては、置換又は非置換のアラルキル基であり、例えばベンジル、p−クロロベンジル、p−ニトロベンジル、p−カルボキシベンジル、p−スルホベンジル、β−フェネチル、2−(4−クロロフェニル)エチルなどが挙げられる。
【0019】
R1 〜R4 のアリール基としては、置換又は非置換のアリール基であり、例えばフェニル、p−クロロフェニル、p−トリル、p−メトキシフェニル、ナフチルなどが挙げられる。
【0020】
R1 〜R4 の複素環式基としては、置換又は非置換の複素環式基であり、例えば1−エチルピリジニウム−4−イルなどが挙げられる。
【0021】
Zは、1価又は多価のアニオンであり、Zが多価アニオンである場合は、一般式(3)のカチオン部分Y+ が、多価アニオンZ- と等価になるように存在する。Z- の具体例としては、クロライド、ブロマイド、ヨウダイド、ナイトレート、メトサルフェート、エトサルフェート、メタンスルホネート、ベンゼンスルホネート、サルフェート、ナフタレンジスルホネート、フェニルホスホネートなどのアニオンが挙げられる。
【0022】
一般式(3)で示される化合物の具体例としては、
テトラメチルアンモニウムクロライド、
テトラエチルアンモニウムブロマイド、
テトラ(n−ブチル)アンモニウムブロマイド、
n−オクチルトリメチルアンモニウムブロマイド、
メチルトリ(n−ブチル)アンモニウムメトサルフェート、
p−ブロモベンジルトリエチルアンモニウムブロマイド、
メチルトリベンジルアンモニウム−p−トルエンスルホネート、
フェニルトリメチルアンモニウムブロマイド、
1−ドデシルピリジニウムクロライド、
1,2,4−トリメチルピリジニウムメトサルフェート、
アンヒドロ−1−(4−スルホブチル)ピリジニウムハイドロオキサイド、
1,1′−ジメチル−4,4′−ビピリジニウムジクロライド、
1−エチル−3−カルボキシピリジニウム−p−トルエンスルホネート、
ヘキサメチレンビス(トリメチルアンモニウム)ジブロマイド、
1−ドデシル−1−メチル−ピペリジニウムブロマイド、
テトラ(n−ブチル)ホスホニウムブロマイド、
テトラフェニルホスホニウムブロマイド、
ベンジルトリフェニルホスホニウムクロライド
などが挙げられる。
【0023】
本発明に使用される四級アンモニウム塩又は四級ホスホニウム塩は、単独で使用することができるが、2種類以上の化合物を混合使用してもよい。これら化合物の使用量は、原料のジアリルエーテル化合物(1)1モルに対して、0.5〜等モルの範囲であり、等モル以上の使用は可能であるが、特に利点が認められない。
【0024】
本発明の臭素化方法における反応時の温度は、0〜100℃までであり、好ましくは常温〜80℃の範囲で実施される。また、その際の水の使用量は、特に限定されないが、反応時の撹拌が円滑に行われる範囲内で使用することが望ましい。
【0025】
本発明で使用される原料ビスアリルエーテル化合物(1)は、粉体の形状であることが望ましいが、板状など粉体以外の形状であっても、臭素化される際に効率的な撹拌が実現できれば使用可能である。
【0026】
本発明の臭素化方法において使用される臭素の量は、従来の有機溶剤中での臭素化の場合と大差なく、原料中のアリル基1モルに対して、等モル〜小過剰程度までの範囲で実施が可能である。具体的には、原料中のアリル基1モルに対して、0.95〜1.3モルの範囲内で選択できる。
【0027】
本発明で使用される反応溶媒は、水であるが、有機溶媒以外の化合物を水に添加することも可能である。例えば、反応の均一化を促進するために、少量の臭化水素酸を使用することや、液のpHをコントロールする目的で、水酸化マグネシウム、酢酸ナトリウムなどの適当量を用いることもできる。また、反応に実質的な影響を与えない範囲で、水可溶性有機溶媒の使用を妨げるものではない。
【0028】
本発明の臭素化反応後の工程は、水に不溶な生成物をろ取し、水洗して乾燥すればよく、有機溶剤を全く使用していないので、液相互の分離や加温濃縮の工程は不要であり、従来の方法のように、製造された製品の中に有害な溶剤が残留することはない。
【0029】
また、有機溶媒中で、ビスアリルエーテル化合物(1)を臭素化する従来の方法では、後処理後に得られる臭素化物の融点が低いため、商品としての取扱に困難を伴う場合があるが、本法により得られる臭素化物(2)は、後述の実施例で示すとおり、高い融点を示す生成物を得ることができるので、通常の取扱により、製品の固結が発生することがない。
【0030】
【実施例】
以下に実施例を挙げて本発明をさらに詳細に説明するが、本発明はこれらの実施例に限定されるものではない。
【0031】
実施例1
ビス(4−アリルオキシ−3,5−ジブロモフェニル)スルホン25.8g、テトラブチルアンモニウムブロマイド0.3g及び水100mlを55℃に加温し、撹拌下臭素14.1gを約3時間で滴下した後、50〜60℃で3時間撹拌放置し、室温で一夜撹拌を続けた。亜硫酸ナトリウムを加え1時間撹拌した後、不溶物をろ別、水洗、乾燥して、融け始め温度112.5℃の淡黄色粉末38.5gを得た。赤外吸収スペクトルと高速液体クロマトグラフィーの保持時間を標品と比較して、生成物の構造がビス〔3,5−ジブロモ−4−(2,3−ジブロモプロピルオキシ)フェニル〕スルホンであることを確認した。また、高速液状クロマトグラフィーによる原料残存率は2%であった。
上記の系からテトラブチルアンモニウムブロマイドを除いた系で、同様に実験を行ったが、臭素約半量を滴下した頃から、粉体相互の融着が始まって撹拌が困難となり、反応を完結することができなかった。
【0032】
実施例2
ビス(4−アリルオキシ−3,5−ジブロモフェニル)スルホン25.8g及び水100mlに、下記表中の四級塩類を、原料スルホンに対して10モル%になるように添加した液を、撹拌しながら、内温50〜60℃で臭素12.8gを2時間かけて滴下した。滴下終了後、同温下に1時間撹拌放置の後、亜硫酸ナトリウム2.5gを加えて一夜室温下に撹拌を続けた。水不溶物を吸引ろ取し、ロート上で3回水洗し、乾燥して得られたビス〔3,5−ジブロモ−4−(2,3−ジブロモプロピルオキシ)フェニル〕スルホンの収量、融点(融け始め温度)と、高速液体クロマトグラフィーによる原料残存率を測定し、表1に示す結果を得た。
No. 1〜5の実験で得られた化合物は、高速液体クロマトグラフィーにより、主生成物が、実施例1で得られた化合物と同一であることを確認した。また、すべての実験において、粉体相互の融着は認められなかった。
【0033】
【表1】
【0034】
LPC :ラウリルピリジニウムクロライド
TBAB :テトラブチルアンモニウムブロマイド
TPPB :テトラフェニルホスホニウムブロマイド
BTEAC:ベンジルトリエチルアンモニウムクロライド
TBPB :テトラブチルホスホニウムブロマイド
【0035】
以上の結果より、本実施例に使用された四級塩類は、いずれも、本臭素化方法に有効であることがわかる。
【0036】
実施例3
2,2−ビス(4−アリルオキシ−3,5−ジブロモフェニル)プロパン12.5g、ラウリルピリジニウムクロライド5.7g及び水50mlを、撹拌下、内温15〜25℃で臭素7.7gを2時間かけて滴下し、そのまま一夜撹拌を続けた。その後、80℃までゆっくり昇温した後、室温付近まで冷却して、亜硫酸ナトリウム2.0gを加え撹拌し、水不溶物をろ過、水洗、乾燥して、融け始め温度104.5℃の淡黄色粉末17.4gを得た。ここで得られた化合物の赤外吸収スペクトルと高速液体クロマトグラフィーの保持時間を、標品と比較し、主生成物が2,2−ビス〔3,5−ジブロモ−4−(2,3−ジブロモプロピルオキシ)フェニル〕プロパンであることを確認した。また、高速液体クロマトグラフィーによる原料残存率は、0.5%であった。
上記の系からラウリルピリジニウムクロライドを除いた系で、同様の実験を行ったが、臭素滴下時に内容物が固着して撹拌不能となり、反応を中止した。
【0037】
【発明の効果】
本発明の方法によれば、人体及び環境への悪影響が心配される有機溶媒を全く用いることなく、難燃剤として広く使用されている一般式(2)の化合物を簡単かつ高品質に製造することができる。
Claims (1)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP11355798A JP4092012B2 (ja) | 1998-04-23 | 1998-04-23 | 臭素化合物の製造方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP11355798A JP4092012B2 (ja) | 1998-04-23 | 1998-04-23 | 臭素化合物の製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH11302213A JPH11302213A (ja) | 1999-11-02 |
| JP4092012B2 true JP4092012B2 (ja) | 2008-05-28 |
Family
ID=14615316
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP11355798A Expired - Fee Related JP4092012B2 (ja) | 1998-04-23 | 1998-04-23 | 臭素化合物の製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4092012B2 (ja) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1304354B1 (en) | 2000-07-25 | 2007-01-24 | Mitsui Chemicals, Inc. | Curable composition and uses thereof |
| CN102898337A (zh) * | 2012-09-14 | 2013-01-30 | 三峡大学 | 一种颗粒状阻燃剂八溴s醚的生产方法 |
| CN105622362B (zh) * | 2016-03-25 | 2017-08-25 | 江苏丹霞新材料有限公司 | 甲基八溴醚类阻燃剂的制备方法 |
| CN112830869A (zh) * | 2021-02-02 | 2021-05-25 | 山东迈特新材料科技有限公司 | 一种高纯度八溴醚的制备方法 |
| CN113185387A (zh) * | 2021-05-10 | 2021-07-30 | 江苏欣舟化工科技有限公司 | 一种高纯度八溴醚的制备方法 |
-
1998
- 1998-04-23 JP JP11355798A patent/JP4092012B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JPH11302213A (ja) | 1999-11-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Safari et al. | Structure, synthesis and application of azines: a historical perspective | |
| JP3485227B2 (ja) | 置換ベンゼンジチオール金属錯体およびその製造方法 | |
| JP4092012B2 (ja) | 臭素化合物の製造方法 | |
| JP2004529956A (ja) | 置換試薬としてのイオン性の組成物の使用、フッ素化試薬を構成する組成物およびそれを用いる方法 | |
| JP2711491B2 (ja) | スルホニウム錯体またはオキソスルホニウム錯体 | |
| CN100482344C (zh) | 亲核取代用催化剂、它的合成、包含它的组合物以及它的用途 | |
| JP7692465B2 (ja) | ペンタフルオロスルファニル基含有アリール化合物の製造方法 | |
| EP3580207B1 (en) | Diazomethylation reagent and process for using it | |
| US12071399B2 (en) | Process for the preparation of arylsulfonylpropenenitriles | |
| JPH07110863B2 (ja) | 1−メチル−3,5,7−トリアザ−1−アゾニアトリシクロデカンハライドの製造方法 | |
| Hascall et al. | Synthesis and Structural Characterization of [{(Et2O) Mg} 6 (NPh) 4Br4]: A Magnesium–Imide Cage Species Derived from a Dimagnesylamine Solution | |
| JP2648961B2 (ja) | ベンゾチアゾリウム化合物及びその製造方法 | |
| US20070135634A1 (en) | Fluorinating agent and method for producing fluorine-containing compound using the same | |
| WO2024185814A1 (ja) | トリチルスルファニル基含有アリール化合物の製造方法 | |
| CN104661987A (zh) | 使用羰基化合物生成碳碳键的方法 | |
| WO2002049992A2 (en) | Process for preparing fluorinated organic compounds | |
| JP2715319B2 (ja) | N,N,N▲’▼,N▲’▼‐テトラキス(p―ジアルキルアミノフェニル)―p―フェニレンジアミンのアミニウム塩の製造方法 | |
| CN101010291A (zh) | 有机阳离子的三氰基甲基化合物的制备方法 | |
| JP5748210B2 (ja) | 複素環化合物の製造方法 | |
| JP3630714B2 (ja) | 第四級アンモニウムハイドロオキサイド乃至その塩の包接錯体並びに該包接錯体の製造方法 | |
| JP4440891B2 (ja) | アデニン誘導体の製造方法 | |
| JP3048001B2 (ja) | クロロスルホニルピラゾール化合物の製造法 | |
| CN103384654A (zh) | 放射氟化方法 | |
| JP2003221441A (ja) | フェニルアゾメチンデンドロンとその錯体 | |
| JP2003238572A (ja) | ピリジン−トリ(置換又は非置換フェニル)ボランの製造法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050224 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20080218 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20080226 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080303 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110307 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120307 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130307 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130307 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140307 Year of fee payment: 6 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |