JP3692149B2 - 特定のリガンドを標的とするバイオディテクター - Google Patents
特定のリガンドを標的とするバイオディテクター Download PDFInfo
- Publication number
- JP3692149B2 JP3692149B2 JP53822497A JP53822497A JP3692149B2 JP 3692149 B2 JP3692149 B2 JP 3692149B2 JP 53822497 A JP53822497 A JP 53822497A JP 53822497 A JP53822497 A JP 53822497A JP 3692149 B2 JP3692149 B2 JP 3692149B2
- Authority
- JP
- Japan
- Prior art keywords
- biodetector
- signal
- transducer
- light
- substance
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 239000003446 ligand Substances 0.000 title claims description 51
- 238000000034 method Methods 0.000 claims abstract description 47
- 239000000126 substance Substances 0.000 claims abstract description 39
- 238000001514 detection method Methods 0.000 claims description 57
- 108090000623 proteins and genes Proteins 0.000 claims description 57
- 108060001084 Luciferase Proteins 0.000 claims description 33
- 239000005089 Luciferase Substances 0.000 claims description 24
- 230000001580 bacterial effect Effects 0.000 claims description 24
- 230000019491 signal transduction Effects 0.000 claims description 19
- 102000004169 proteins and genes Human genes 0.000 claims description 18
- 241000700605 Viruses Species 0.000 claims description 15
- 238000005415 bioluminescence Methods 0.000 claims description 15
- 230000029918 bioluminescence Effects 0.000 claims description 15
- 230000031146 intracellular signal transduction Effects 0.000 claims description 12
- 150000007523 nucleic acids Chemical class 0.000 claims description 11
- 230000000694 effects Effects 0.000 claims description 10
- 239000012528 membrane Substances 0.000 claims description 10
- 108020004707 nucleic acids Proteins 0.000 claims description 10
- 102000039446 nucleic acids Human genes 0.000 claims description 10
- 108091027981 Response element Proteins 0.000 claims description 9
- 244000005700 microbiome Species 0.000 claims description 7
- 239000007787 solid Substances 0.000 claims description 7
- 238000006243 chemical reaction Methods 0.000 claims description 6
- 150000002500 ions Chemical class 0.000 claims description 6
- 230000003834 intracellular effect Effects 0.000 claims description 5
- 230000029279 positive regulation of transcription, DNA-dependent Effects 0.000 claims description 5
- 241001430294 unidentified retrovirus Species 0.000 claims description 5
- 235000000346 sugar Nutrition 0.000 claims description 4
- 150000008163 sugars Chemical class 0.000 claims description 2
- 230000001404 mediated effect Effects 0.000 claims 2
- 230000003100 immobilizing effect Effects 0.000 claims 1
- 108700008625 Reporter Genes Proteins 0.000 abstract description 21
- 230000035945 sensitivity Effects 0.000 abstract description 18
- 230000003993 interaction Effects 0.000 abstract description 7
- 239000013076 target substance Substances 0.000 abstract description 6
- 230000007246 mechanism Effects 0.000 abstract description 5
- 239000007788 liquid Substances 0.000 abstract description 4
- 230000027455 binding Effects 0.000 description 26
- 210000004027 cell Anatomy 0.000 description 26
- 241000894006 Bacteria Species 0.000 description 23
- 239000000427 antigen Substances 0.000 description 21
- 108091007433 antigens Proteins 0.000 description 21
- 102000036639 antigens Human genes 0.000 description 21
- 238000003556 assay Methods 0.000 description 20
- 230000014509 gene expression Effects 0.000 description 19
- 238000012544 monitoring process Methods 0.000 description 15
- 230000004913 activation Effects 0.000 description 14
- 210000004369 blood Anatomy 0.000 description 14
- 239000008280 blood Substances 0.000 description 14
- 102000004190 Enzymes Human genes 0.000 description 12
- 108090000790 Enzymes Proteins 0.000 description 12
- 238000003384 imaging method Methods 0.000 description 11
- 108020001507 fusion proteins Proteins 0.000 description 10
- 102000037865 fusion proteins Human genes 0.000 description 10
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 8
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 8
- 238000011161 development Methods 0.000 description 8
- 230000018109 developmental process Effects 0.000 description 8
- 230000004044 response Effects 0.000 description 8
- 239000000758 substrate Substances 0.000 description 8
- 230000008685 targeting Effects 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- 238000004458 analytical method Methods 0.000 description 7
- 230000033228 biological regulation Effects 0.000 description 7
- 201000010099 disease Diseases 0.000 description 7
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 7
- 230000004927 fusion Effects 0.000 description 7
- 239000003550 marker Substances 0.000 description 7
- 239000000523 sample Substances 0.000 description 7
- 230000009870 specific binding Effects 0.000 description 7
- 230000008901 benefit Effects 0.000 description 6
- 238000011109 contamination Methods 0.000 description 6
- 238000003745 diagnosis Methods 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- 208000015181 infectious disease Diseases 0.000 description 6
- 230000003287 optical effect Effects 0.000 description 6
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 5
- CYCGRDQQIOGCKX-UHFFFAOYSA-N Dehydro-luciferin Natural products OC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 CYCGRDQQIOGCKX-UHFFFAOYSA-N 0.000 description 5
- BJGNCJDXODQBOB-UHFFFAOYSA-N Fivefly Luciferin Natural products OC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 BJGNCJDXODQBOB-UHFFFAOYSA-N 0.000 description 5
- DDWFXDSYGUXRAY-UHFFFAOYSA-N Luciferin Natural products CCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3C DDWFXDSYGUXRAY-UHFFFAOYSA-N 0.000 description 5
- 241001465754 Metazoa Species 0.000 description 5
- 241000607142 Salmonella Species 0.000 description 5
- 230000003213 activating effect Effects 0.000 description 5
- 229960000723 ampicillin Drugs 0.000 description 5
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 5
- 230000003321 amplification Effects 0.000 description 5
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 5
- 230000036770 blood supply Effects 0.000 description 5
- 239000003795 chemical substances by application Substances 0.000 description 5
- 229960005091 chloramphenicol Drugs 0.000 description 5
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 235000013305 food Nutrition 0.000 description 5
- 229930027917 kanamycin Natural products 0.000 description 5
- 229960000318 kanamycin Drugs 0.000 description 5
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 5
- 229930182823 kanamycin A Natural products 0.000 description 5
- 108020001756 ligand binding domains Proteins 0.000 description 5
- 230000004807 localization Effects 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 238000003199 nucleic acid amplification method Methods 0.000 description 5
- 229910052760 oxygen Inorganic materials 0.000 description 5
- 239000001301 oxygen Substances 0.000 description 5
- 102000004196 processed proteins & peptides Human genes 0.000 description 5
- 108090000765 processed proteins & peptides Proteins 0.000 description 5
- 238000012216 screening Methods 0.000 description 5
- 230000002463 transducing effect Effects 0.000 description 5
- 238000005406 washing Methods 0.000 description 5
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 108091006146 Channels Proteins 0.000 description 4
- 241000588724 Escherichia coli Species 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- 241000725303 Human immunodeficiency virus Species 0.000 description 4
- 102000009097 Phosphorylases Human genes 0.000 description 4
- 108010073135 Phosphorylases Proteins 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- KSMVZQYAVGTKIV-UHFFFAOYSA-N decanal Chemical compound CCCCCCCCCC=O KSMVZQYAVGTKIV-UHFFFAOYSA-N 0.000 description 4
- 239000008103 glucose Substances 0.000 description 4
- 238000003018 immunoassay Methods 0.000 description 4
- 230000001939 inductive effect Effects 0.000 description 4
- 238000004020 luminiscence type Methods 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- 230000026731 phosphorylation Effects 0.000 description 4
- 238000006366 phosphorylation reaction Methods 0.000 description 4
- 238000011160 research Methods 0.000 description 4
- ZKHQWZAMYRWXGA-KQYNXXCUSA-N Adenosine triphosphate Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)[C@@H](O)[C@H]1O ZKHQWZAMYRWXGA-KQYNXXCUSA-N 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- 241000206602 Eukaryota Species 0.000 description 3
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 3
- 108010047357 Luminescent Proteins Proteins 0.000 description 3
- 102000006830 Luminescent Proteins Human genes 0.000 description 3
- 241000191940 Staphylococcus Species 0.000 description 3
- 238000003491 array Methods 0.000 description 3
- 210000001124 body fluid Anatomy 0.000 description 3
- 239000010839 body fluid Substances 0.000 description 3
- 239000000356 contaminant Substances 0.000 description 3
- 238000002405 diagnostic procedure Methods 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 239000012634 fragment Substances 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 230000001965 increasing effect Effects 0.000 description 3
- 239000002502 liposome Substances 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 229920001184 polypeptide Polymers 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 230000002285 radioactive effect Effects 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 238000012827 research and development Methods 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 238000013518 transcription Methods 0.000 description 3
- 230000035897 transcription Effects 0.000 description 3
- 238000013519 translation Methods 0.000 description 3
- 210000002700 urine Anatomy 0.000 description 3
- 239000013598 vector Substances 0.000 description 3
- 244000052613 viral pathogen Species 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- 208000035143 Bacterial infection Diseases 0.000 description 2
- 241000193403 Clostridium Species 0.000 description 2
- 241000254173 Coleoptera Species 0.000 description 2
- 241001337994 Cryptococcus <scale insect> Species 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 108090000331 Firefly luciferases Proteins 0.000 description 2
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 2
- 241000224466 Giardia Species 0.000 description 2
- 208000009889 Herpes Simplex Diseases 0.000 description 2
- 102000008072 Lymphokines Human genes 0.000 description 2
- 108010074338 Lymphokines Proteins 0.000 description 2
- XUMBMVFBXHLACL-UHFFFAOYSA-N Melanin Chemical compound O=C1C(=O)C(C2=CNC3=C(C(C(=O)C4=C32)=O)C)=C2C4=CNC2=C1C XUMBMVFBXHLACL-UHFFFAOYSA-N 0.000 description 2
- 102000018697 Membrane Proteins Human genes 0.000 description 2
- 108010052285 Membrane Proteins Proteins 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- 241000254064 Photinus pyralis Species 0.000 description 2
- 241000607568 Photobacterium Species 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- -1 Seattle) Substances 0.000 description 2
- 206010040047 Sepsis Diseases 0.000 description 2
- 241000607757 Xenorhabdus Species 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 244000052616 bacterial pathogen Species 0.000 description 2
- 239000012620 biological material Substances 0.000 description 2
- 238000003390 bioluminescence detection Methods 0.000 description 2
- 244000078885 bloodborne pathogen Species 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 238000007385 chemical modification Methods 0.000 description 2
- 239000003086 colorant Substances 0.000 description 2
- 238000006356 dehydrogenation reaction Methods 0.000 description 2
- 230000030609 dephosphorylation Effects 0.000 description 2
- 238000006209 dephosphorylation reaction Methods 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 206010014599 encephalitis Diseases 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- 210000003527 eukaryotic cell Anatomy 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 150000004665 fatty acids Chemical class 0.000 description 2
- 244000053095 fungal pathogen Species 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000005090 green fluorescent protein Substances 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 208000006454 hepatitis Diseases 0.000 description 2
- 231100000283 hepatitis Toxicity 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 150000002611 lead compounds Chemical class 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 230000011987 methylation Effects 0.000 description 2
- 238000007069 methylation reaction Methods 0.000 description 2
- 239000003068 molecular probe Substances 0.000 description 2
- 239000002547 new drug Substances 0.000 description 2
- 230000004297 night vision Effects 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 244000052769 pathogen Species 0.000 description 2
- 108010083127 phage repressor proteins Proteins 0.000 description 2
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 238000003752 polymerase chain reaction Methods 0.000 description 2
- 238000007639 printing Methods 0.000 description 2
- 238000011002 quantification Methods 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 238000011896 sensitive detection Methods 0.000 description 2
- 239000002689 soil Substances 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 201000008827 tuberculosis Diseases 0.000 description 2
- 241001529453 unidentified herpesvirus Species 0.000 description 2
- NCYCYZXNIZJOKI-IOUUIBBYSA-N 11-cis-retinal Chemical compound O=C/C=C(\C)/C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C NCYCYZXNIZJOKI-IOUUIBBYSA-N 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 231100000582 ATP assay Toxicity 0.000 description 1
- 108010013043 Acetylesterase Proteins 0.000 description 1
- 108010000239 Aequorin Proteins 0.000 description 1
- 241000606660 Bartonella Species 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 241000588807 Bordetella Species 0.000 description 1
- 241000222120 Candida <Saccharomycetales> Species 0.000 description 1
- 240000008886 Ceratonia siliqua Species 0.000 description 1
- 241000819038 Chichester Species 0.000 description 1
- 241000606161 Chlamydia Species 0.000 description 1
- 241001112696 Clostridia Species 0.000 description 1
- 241000223205 Coccidioides immitis Species 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 206010010099 Combined immunodeficiency Diseases 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 201000003883 Cystic fibrosis Diseases 0.000 description 1
- 108090000204 Dipeptidase 1 Proteins 0.000 description 1
- 201000010374 Down Syndrome Diseases 0.000 description 1
- 108010067770 Endopeptidase K Proteins 0.000 description 1
- 241000588914 Enterobacter Species 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 1
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 1
- 206010056438 Growth hormone deficiency Diseases 0.000 description 1
- 241000589989 Helicobacter Species 0.000 description 1
- 241000714260 Human T-lymphotropic virus 1 Species 0.000 description 1
- 241000701027 Human herpesvirus 6 Species 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 1
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 208000026350 Inborn Genetic disease Diseases 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 241000710842 Japanese encephalitis virus Species 0.000 description 1
- 102000003855 L-lactate dehydrogenase Human genes 0.000 description 1
- 108700023483 L-lactate dehydrogenases Proteins 0.000 description 1
- 241000589248 Legionella Species 0.000 description 1
- 208000007764 Legionnaires' Disease Diseases 0.000 description 1
- 239000000232 Lipid Bilayer Substances 0.000 description 1
- 241000186781 Listeria Species 0.000 description 1
- 208000016604 Lyme disease Diseases 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- JLVVSXFLKOJNIY-UHFFFAOYSA-N Magnesium ion Chemical compound [Mg+2] JLVVSXFLKOJNIY-UHFFFAOYSA-N 0.000 description 1
- 241000204031 Mycoplasma Species 0.000 description 1
- 238000004497 NIR spectroscopy Methods 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 108020004711 Nucleic Acid Probes Proteins 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 239000004677 Nylon Substances 0.000 description 1
- 108090000854 Oxidoreductases Proteins 0.000 description 1
- 102000004316 Oxidoreductases Human genes 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 239000002033 PVDF binder Substances 0.000 description 1
- 241000321453 Paranthias colonus Species 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 201000011252 Phenylketonuria Diseases 0.000 description 1
- 108010030688 Photinus luciferase Proteins 0.000 description 1
- 102000004257 Potassium Channel Human genes 0.000 description 1
- 108091000054 Prion Proteins 0.000 description 1
- 102000029797 Prion Human genes 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 102000055027 Protein Methyltransferases Human genes 0.000 description 1
- 108700040121 Protein Methyltransferases Proteins 0.000 description 1
- 241000588769 Proteus <enterobacteria> Species 0.000 description 1
- 241000589516 Pseudomonas Species 0.000 description 1
- 241001427618 Pyrophorus plagiophthalamus Species 0.000 description 1
- 241000242743 Renilla reniformis Species 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- 102100040756 Rhodopsin Human genes 0.000 description 1
- 108090000820 Rhodopsin Proteins 0.000 description 1
- AUNGANRZJHBGPY-SCRDCRAPSA-N Riboflavin Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-SCRDCRAPSA-N 0.000 description 1
- 241000606701 Rickettsia Species 0.000 description 1
- 241000702670 Rotavirus Species 0.000 description 1
- 108010022999 Serine Proteases Proteins 0.000 description 1
- 102000012479 Serine Proteases Human genes 0.000 description 1
- 208000009642 Severe combined immunodeficiency due to adenosine deaminase deficiency Diseases 0.000 description 1
- 241000607768 Shigella Species 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- 108010052164 Sodium Channels Proteins 0.000 description 1
- 102000018674 Sodium Channels Human genes 0.000 description 1
- 241000589970 Spirochaetales Species 0.000 description 1
- 241000194017 Streptococcus Species 0.000 description 1
- 208000002903 Thalassemia Diseases 0.000 description 1
- 208000024780 Urticaria Diseases 0.000 description 1
- 241000607598 Vibrio Species 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- QPMSXSBEVQLBIL-CZRHPSIPSA-N ac1mix0p Chemical compound C1=CC=C2N(C[C@H](C)CN(C)C)C3=CC(OC)=CC=C3SC2=C1.O([C@H]1[C@]2(OC)C=CC34C[C@@H]2[C@](C)(O)CCC)C2=C5[C@]41CCN(C)[C@@H]3CC5=CC=C2O QPMSXSBEVQLBIL-CZRHPSIPSA-N 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 238000003915 air pollution Methods 0.000 description 1
- 102000013529 alpha-Fetoproteins Human genes 0.000 description 1
- 108010026331 alpha-Fetoproteins Proteins 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000036436 anti-hiv Effects 0.000 description 1
- 230000003302 anti-idiotype Effects 0.000 description 1
- 230000000845 anti-microbial effect Effects 0.000 description 1
- 238000000149 argon plasma sintering Methods 0.000 description 1
- 238000002820 assay format Methods 0.000 description 1
- 208000036556 autosomal recessive T cell-negative B cell-negative NK cell-negative due to adenosine deaminase deficiency severe combined immunodeficiency Diseases 0.000 description 1
- 208000022362 bacterial infectious disease Diseases 0.000 description 1
- 230000037358 bacterial metabolism Effects 0.000 description 1
- 108010081355 beta 2-Microglobulin Proteins 0.000 description 1
- 102000015736 beta 2-Microglobulin Human genes 0.000 description 1
- 102000006635 beta-lactamase Human genes 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 238000005842 biochemical reaction Methods 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 230000001851 biosynthetic effect Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000001720 carbohydrates Chemical group 0.000 description 1
- 230000021523 carboxylation Effects 0.000 description 1
- 238000006473 carboxylation reaction Methods 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 201000003486 coccidioidomycosis Diseases 0.000 description 1
- 230000001332 colony forming effect Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- PBKSAWGZZXKEBJ-UHFFFAOYSA-N cyclopenta-1,3-diene;4-cyclopenta-2,4-dien-1-ylphenol;iron(2+) Chemical compound [Fe+2].C=1C=C[CH-]C=1.C1=CC(O)=CC=C1[C-]1C=CC=C1 PBKSAWGZZXKEBJ-UHFFFAOYSA-N 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000007123 defense Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 239000003344 environmental pollutant Substances 0.000 description 1
- 238000003912 environmental pollution Methods 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 108091006047 fluorescent proteins Proteins 0.000 description 1
- 102000034287 fluorescent proteins Human genes 0.000 description 1
- 230000004907 flux Effects 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 208000016361 genetic disease Diseases 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 239000003673 groundwater Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 150000003278 haem Chemical class 0.000 description 1
- 239000002920 hazardous waste Substances 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 1
- 210000001822 immobilized cell Anatomy 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 238000003364 immunohistochemistry Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- COHYTHOBJLSHDF-BUHFOSPRSA-N indigo dye Chemical compound N\1C2=CC=CC=C2C(=O)C/1=C1/C(=O)C2=CC=CC=C2N1 COHYTHOBJLSHDF-BUHFOSPRSA-N 0.000 description 1
- COHYTHOBJLSHDF-UHFFFAOYSA-N indigo powder Natural products N1C2=CC=CC=C2C(=O)C1=C1C(=O)C2=CC=CC=C2N1 COHYTHOBJLSHDF-UHFFFAOYSA-N 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 239000011147 inorganic material Substances 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 238000003670 luciferase enzyme activity assay Methods 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 108091005452 macrophage Fc receptors Proteins 0.000 description 1
- 229910001425 magnesium ion Inorganic materials 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000009456 molecular mechanism Effects 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- 239000002853 nucleic acid probe Substances 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 230000000886 photobiology Effects 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 238000007747 plating Methods 0.000 description 1
- 231100000719 pollutant Toxicity 0.000 description 1
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 1
- 108020001213 potassium channel Proteins 0.000 description 1
- 230000035935 pregnancy Effects 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000000644 propagated effect Effects 0.000 description 1
- 235000019419 proteases Nutrition 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 230000004850 protein–protein interaction Effects 0.000 description 1
- 239000000700 radioactive tracer Substances 0.000 description 1
- 238000003127 radioimmunoassay Methods 0.000 description 1
- 238000009790 rate-determining step (RDS) Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 238000010187 selection method Methods 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 208000007056 sickle cell anemia Diseases 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 244000000000 soil microbiome Species 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 230000010473 stable expression Effects 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 238000003325 tomography Methods 0.000 description 1
- 239000003440 toxic substance Substances 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000024540 transposon integration Effects 0.000 description 1
- 229960005486 vaccine Drugs 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 238000003911 water pollution Methods 0.000 description 1
- 108091005957 yellow fluorescent proteins Proteins 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
- C12N9/0069—Oxidoreductases (1.) acting on single donors with incorporation of molecular oxygen, i.e. oxygenases (1.13)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/02—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving viable microorganisms
- C12Q1/04—Determining presence or kind of microorganism; Use of selective media for testing antibiotics or bacteriocides; Compositions containing a chemical indicator therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/66—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving luciferase
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54366—Apparatus specially adapted for solid-phase testing
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
- G01N33/56983—Viruses
- G01N33/56988—HIV or HTLV
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Organic Chemistry (AREA)
- Biomedical Technology (AREA)
- General Health & Medical Sciences (AREA)
- Microbiology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Medicinal Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Cell Biology (AREA)
- Virology (AREA)
- Food Science & Technology (AREA)
- General Engineering & Computer Science (AREA)
- Biophysics (AREA)
- Tropical Medicine & Parasitology (AREA)
- AIDS & HIV (AREA)
- Toxicology (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Investigating Or Analysing Materials By The Use Of Chemical Reactions (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Enzymes And Modification Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Description
本発明は、分子を液体、気体状でまたは固体マトリクス上で検出および定量するためのバイオディテクターに関する。より具体的には、本発明は、標的物質と相互作用する際にレポーター遺伝子を発現する分子スイッチング機構を含むバイオディテクターに関する。本発明は更に、このようなバイオディテクターを用いて、選択された物質を高特異性および高感度で検出および定量する方法にも関する。
II.発明の背景
生物学的試料、身体または環境中の低レベルの生物学的および無機的物質の検出は困難であることが多い。この種の検出アッセイは、一次抗体の結合、複数回の洗浄段階、二次抗体の結合、更なる洗浄段階、およびその検出システムによっては、更なる酵素的および洗浄段階を含み得る多数の段階を必要とする。このようなアッセイは更に、感度が悪くなり、不正確である。例えば、古典的なイムノアッセイは、感染症の30%を検出し損なうことがある。
分子プローブアッセイは、敏感であるが、高度熟練者と生物体の核酸配列が分かっていることを必要とする。核酸プローブの使用とポリメラーゼ連鎖反応(PCR)に基づくアッセイはいずれも、抽出のために複雑な操作を必要とし、かつ疾患状態または汚染物質の一次インジケーターであり得る核酸を検出できるにすぎない。いずれの種類のアッセイ形式も、検出対象の情報が僅かしか入手できない場合、その適用領域は限られている。
患者の身体的パラメーターを測定するための現在の非侵襲性手段、例えば、CATまたはMRIは、高価であり、入手し難いことが多い。よって、多くの医学的問題のモニタリングには、依然として時間がかかりかつ高価な試験が必要である。実際の試験から症状を確認するまでの時間は、非常に重要である。例えば、敗血症の場合、多くの患者が、感染確認し、その感染生物を同定する前に絶命してしまい、そのため処置が経験的で、効果も低いものとなる傾向にある。その他の例には、供給血を病原体についてスクリーニングする場合がある。
供給血が病原体フリーであることを確認するには、大きな労力を要する多くのアッセイが必要である。AIDSを引き起こすウイルスであるHIV−1の場合、現今のアッセイは、ウイルス自身ではなく抗HIV抗体についてスクリーニングするものである。しかし、当ウイルスに曝露後に、抗体は検出できないが、血液が大量の感染性ウイルスを含んでなるという期間が何週間も続く。Clark et al., 1994, J. Infect. Dis. 170: 194-197; Piatak et al., 1993, Aids Suppl. 2:S65-71.
例えば、供給血がHIV−1フリーであることを確認するには、大きな労働力を要する高価な試験を幾つか実施しなければならない。更に、現在、初期スクリーニングに使用されている試験は、比較的低レベルで存在し得るウイルス自身を同定するのではなく、初期感染後数週間では存在しないHIV抗体を指向するものである。Clark et al., 1994, J. Infect. Dis. 170:194-197; Piatak et al., 1993, Aids Suppl. 2: S65-71.よって、供給血のスクリーニングは、時間がかかって緩慢であるだけでなく、不正確でもある。
同様に、空気中および水中汚染などの環境において物質を検出する能力は、非常に重要である。例えば、地下水のモニタリング、工業プロセス、食物加工の制御および安価な多目的アッセイを使用する実時間での操作が望まれる。しかしながら、現存の方法は、このような“オンライン”モニタリングに適していない。
現存の方法に限界があるのには幾つかの理由がある。第1に、検出すべき物質を十分量入手するのが困難であり得る。例えば、対象となる生物学的物質が身体内部だけに存在する事が多いので、生物学的物質の検出は困難であり、またエクスビボモニタリング用に大量に入手するのも困難である。従って、少量の物質に使用するための感度のよいアッセイが必要である。このことは、シグナル増幅法が必要であることを示している。増幅法は、核酸の検出については確立されているが、抗原検出法にはない。
第2の問題は、標的物質が少量で存在し得るので、その存在の検出は時間のかかる高価な技術的副次関連プロセスを必要とするため、実時間での検知が困難であることである。例えば、血中細菌感染である敗血症の場合、血液試料1〜10ml中ほんの1〜2細菌でありうる。現今の方法は、検出のためにまず細菌を増殖させる必要がある。Askin, 1995, J. Obstet. Gynecol. Neonatal. Nurs. 24: 653-643.処理の遅れや疾患の誤処理は生と死ほどの相違を意味するので、このタイムラグは好ましくない。
これらの限界を回避する試みは他にもあり、抗体と放射性または蛍光標識とを組み合わせて用いるものである(Harlow et al., (1988), Antibodies. A Laboratory Manual(Cold Spring Harbor, NY: Cold Spring Laboratory Press)。抗体ベースのアッセイは、典型的に、標的分子に対する抗体の結合、続いて、結合しなかった抗体全てを除去するための洗浄段階を含む。その標的分子に対する抗体の結合は、典型的に、同定用分子(identifier molecule)、例えば、検出可能標識を含む標的分子特異的抗体を特異的に認識する二次抗体によって検出する。この段階の次に、複数洗浄段階もある。あるいは、標的特異的抗体は、検出可能標識に直接結合させてもよい。標識には、放射性トレーサー、蛍光標識および化学発光検出システムがある。Harlow and Lane, 1998, Antibodies. A Laboratory Manual(Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press).
このような抗体ベースのアッセイを用いて特異的シグナルを発生させる必要のある一連の段階は、時間がかかり、また大きな労働力を要する。更に、これらのアッセイ型は、ある種のマトリクスに固定化させた抗原の検出に限定されている。この種の検出システムの例には、ウェスタン・ブロット、免疫組織化学およびELISAがある。現在、放射性アイソトープおよび化学発光標識を用いて最大感度が達成されている。しかしながら、これらの検出システムの感度、即ち、バックグラウンドを超える特異的シグナルは、限定要因のままであることが多い。
同様に、バックグラウンド放射線は、放射性イムノアッセイ技術の感度を制限する。更に、これらの技術は、時間がかかり、高価である。最終的に、放射性アプローチは、それらが重大な廃棄物問題を提示するので、環境に敵対するものである。
物質をモニタリングするその他のアプローチは、光の使用である。光は、容易に測定可能であり、非侵襲性かつ定量性であるという利点を有する。Von Bally et al.,(1982), Optics in Biomedical Sciences: Proceedings of the International Conference(Berlin, New York: Springer-Verlag).
典型的な分光学では、光を物質に照射し、吸光度または光の散乱に基づき濃度を計算する。Von Bally et al., (1982), Optics in Biomedical Sciences: Proceedings of the International Conference(Berlin, New York: Springer-Verlag).光学技術は、光吸収または光散乱物質の濃度変化を検出する。Von Bally et al., (1982). Optics in Biomedical Sciences: Proceedings of the International Conference(Berlin, New York: Springer-Verlag).近赤外分光学は、組織に浸透できる医療用プローブと同程度に機能する非イオン化性の比較的安全な放射線形態であることが証明されている。更に、これは、大容量でも十分に耐えられる。例えば、光は、現在、血中(Nellcor)または体内(Benaronイメージ)の酸素濃度を計算するのに、または体内(Sandia)のグルコースをモニターするのにも使用されている。Banaron and Stevenson, 1993, Science 259: 1463-1466: Benaron et al., 1993, in: Medical Optical Tomography: Functional Imaging and Monitoring, G. Muller, B. Chance, R. Alfano and et al., eds. (Bellingham, WA USA: SPIE Press), pp. 3-9; Benaron and Stevenson, 1994, Adv. Exp. Med. Biol. 361: 609-617.しかしながら、現在の技術は、多くの物質が、容易かつ定量的に光学的に査定できる固有の分光学的シグナルを持たない点で制限される。Von Bally et al., (1982), Optics in Biomedical Sciences: Proceedings of the International Conference(Berlin, New York: Springer-Verlag).更に、低濃度の物質の検出は、特に、組織などの生物学的媒体において、高いバックグラウンドシグナルによって阻害されることも多い。Von Bally et al., (1982), Optics in Biomedical Sciences: Proceedings of the International Conference(Berlin, New York: Springer Verlag).
過去にわたり、光照射に基づくアッセイ、例えば、化学発光(Tatsu and Yoshikawa, 1990, Anal. Chem. 62:2103-2106)は、光を検出および定量する極めて感度のよい方法の開発として、大きな注目を集めた。Hooper et al., 1994, J. Biolumin. Chemilumin. 9: 113-112.化学発光を利用する生物医学的研究の一例は、イムノアッセイおよび核酸検出用のECL検出システム(Amersham)である。生物学的アッセイに対する生物学的光源、バイオ発光は、光検出用の類似装置が必要であるので、化学発光検出の開発と平行して使用されてきた。Kricka, 1991, Clin. Chem. 37: 1472-1481.最も普通に使用される生物学的光源の1つはルシフェラーゼ、Photinus pyralis(アメリカホタル)、Renilla reniformis(燐光性サンゴ)、Photobacterium(発光細菌種)を含むある種の生物体により合成される発光酵素である。一般に、ルシフェラーゼは、低分子量オキシドレダクターゼであり、酸素、ATPおよびマグネシウムイオンの存在下でルシフェリンの脱水素を触媒する。このプロセス中、放出される約96%のエネルギーが可視光として現れる。検討のため、Jassim et al., 1990, J. Biolumin. Chemilumin. 5: 115-122参照。
光子検出感度および細菌および他の細胞を操作してバイオ発光タンパク質を発現させる能力により、環境研究における感度のよいバイオセンサーとして、このような細胞が使用できる。Guzzo et al., 1992, Toxicol. Lett. 64: 687-693; Heitzer et al., 1994, Appl. Environ. Microbiol. 60: 1487-1494; Karube and Nakanishi, 1994, Curr. Opin. Biotechnol. 5: 54-59; Phadke, 1992, Biosystems 27: 203-206; Selifonova et al., 1993, Appl. Environ. Microbiol. 59: 3083-3090.例えば、Selifonova et al.は、環境中の汚染物質検出用のバイオセンサーについて記載している。より具体的には、Hg(II)誘導性Tn21オペロンと、Vivrio fischeri由来のプロモーターなしのluxCDABEとの融合物を用いて、Hg(II)検出用の高感度バイオセンサーを構築している。
バイオ発光を特定条件、例えば、上記Hg(II)の存在の検出法として使用するシステム以外に、ルシフェラーゼアッセイは細胞生存能に左右されることから、ルシフェラーゼの構成性発現が細菌細胞の生存能を追跡するためのマーカーとして採用されている。例えば、ルシフェラーゼの構成性発現は、最近、細菌性疾患に対する薬剤およびワクチンの開発用に用いられている。具体的には、ルシフェラーゼ発現性を高めたMycrobacterium tuberculosis株を採用して、マウスにおける抗微生物活性を評価した。Hickey et al., 1996, Antibacterial Agents and Chemotherapy 40: 400-407.
しかしながら、ルシフェラーゼを作動させる細菌受容体に頼るバイオセンサーは、ルシフェラーゼ遺伝子に融合させることができる既知のプロモーター領域に連結させた、対応する細菌受容体を持つような分子の検知に限られる。更に、マウスにおいて抗菌活性を試験するのに使用されるルシフェラーゼ発現性細菌は非特異的である。
従って、各種方法は、非常に特定された応用のためのバイオ発光センサーとして、一般にバイオ発光、特にルシフェラーゼを用いて探求されるが、本発明は、非常に広範囲の応用のための高感度かつ高選択性リガンド特異的バイオディテクターに関するものである。より具体的には、本発明は、予め定めたリガンドに光子放出で特異的に応答する系を用いて、リガンド特異的結合の選択性および抗体性能の融通性をバイオ発光検出感度と組み合わせるものである。こうして本発明の手法により、商業的に重要なあらゆる分子を検出する広範囲のアッセイの開発のための、極めて感度の良いバイオディテクターの製造が可能である。
III.発明の概要
本発明は、選択物質を検出およびモニターするための標的化リガンド特異的バイオディテクターに関する。より具体的には、本発明のバイオディテクターは、容易に、例えば、所望により検出される独特の特性を持つポリペプチドをコードする(4)レポーター遺伝子に作動可能に連結されるプロモーターなどの(3)応答要素(responsive element)を活性化する能力のあるその活性形態で、(2)トランスデューサー成分を活性化する能力のある細胞内シグナル変換ドメインに融合させた細胞外リガンド特異的結合部分を含む、(1)シグナル転換要素(element)を含む。よって、本発明のバイオディテクターは、標的物質、即ち、リガンドへの結合を検出可能なシグナルへと変換する。本発明の好ましい実施態様では、バイオディテクターにより発生するシグナルは、光であり、光検出装置により検出される。従って、対象となる物質が同定できる。
本発明は、更に、高感度および高特異性で選択物質を検出およびモニターするバイオディテクターなどを使用する方法に関する。本発明のバイオディテクターを使用する方法には、食品産業および農産業における汚染物質の検出、医学および研究における診断およびモニタリング、環境または防御設定における毒物または汚染物質の検出がある。
【図面の簡単な説明】
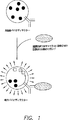
図1は、バイオディテクターの主要成分を示す一般モデルを表す。バイオディテクターは、検知能を持つもの(表面上のY型構造)、伝達性成分(バイオディテクターの内側のY型構造の一部)および光放出性成分(小さい円)からなる。
図2は、分子レベルでのバイオディテクターのより詳細な図式を表す。
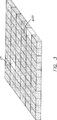
図3は、試料中の様々な物質を同時に検出できるように、固相支持体上に規則正しく並べたバイオディテクターを表す。
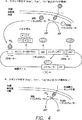
図4は、実施例1に詳説する、細菌ゲノムにおけるトランスポゾンの組込みにより生じるバイオディテクターを表す。ルシフェラーゼオペロンは、共にバイオ発光を示すことができる(遺伝子A、B、C、DおよびE由来の)5種のタンパク質をコードする。Chl、クロラムフェニコール耐性遺伝子;Kan、カナマイシン耐性遺伝子;Amp、アンピシリン耐性遺伝子;PO4、ホスフェート基(トランスデューサーのアクチベーターとして)。
図5は、バイオ発行サルモネラからの光放出に対するヒト血液の影響を表し、ほぼ単一の細胞検出を示す。
V.定義
特記しない限り、本明細書で使用した全ての用語は、当業者により理解されるのと同じ意味を持つ。
本明細書で使用した用語“標的分子”は、検出および/または定量すべき物質を表す。
本明細書で使用した用語“ルシフェラーゼ”は、特記しない限り、原核生物および真核生物のルシフェラーゼ、並びに変化に富むあるいは変更された物理的および/または放出特性を持つ変種を含む。
本明細書で使用した用語“バイオディテクター”は、標的分子との結合またはその他の相互作用に光学シグナルで応答する系を表す。
本明細書で使用した用語“光学シグナル”は、光モニタリング技術を用いて識別できるあらゆる生化学的反応または物質を表す。これには、光子放出、蛍光および吸光度がある。
本明細書で使用した用語“光”は、特記しない限り、波長約220nmから約1100nmの間の電磁波を表す。
本明細書で使用した用語“プロモーター誘導”は、選択した誘導性遺伝子要素(element)の直接的または間接的活性化をもたらす事象を表す。
VI.発明の詳細な説明
A.本発明の概観
本発明は、微生物、分子およびイオンを含む選択物質を検出およびモニターするための標的化リガンド特異的バイオディテクターに関する。本発明のバイオディテクターは、予め定めたリガンドの結合に光子放出で特異的に応答する系を採用することにより、リガンド特異的結合の特異性と選択性をバイオ発光検出の感度と組み合わせたものである。よって、本発明の手法により、あらゆる選択物質を検出およびモニターする広範囲のアッセイの開発のための感度の良いバイオディテクターの製造が可能である。
より具体的には、本発明のバイオディテクターは、“分子スイッチ”、即ち、シグナル伝達を介するリガンド特異的結合と、リガンド結合に対する応答における検出可能なレポーター分子の活性化との組合わせに備えるものである。本発明のバイオディテクターは、細菌などの生存可能な生物系、またはリポソームなどの非生物系から成ることもできる。全体機構として、バイオディテクターは、リガンドを特異的に認識し、リガンドへの結合を測定可能なシグナル、例えば、光放出へと転換する能力を特徴とする。例えば、細菌をリガンド特異的バイオディテクターとして採用してもよく、これは、予め定めたリガンドに光子放出で特異的に応答する。
本発明のバイオディテクターは、広範囲の物質、例えば、ヒト血中の微生物、ウイルスおよび細菌、毒性分子、イオン、癌細胞、抗原、低分子(例えばグルコース)、pH、酸素および金属の高感度検出を可能にする。更に、本発明は、あらゆる選択物質を検出する広範囲のアッセイにおける、かかるバイオディテクターの使用に備えるものである。一般に、本発明のバイオディテクターは、トランスデューサー成分を活性化する能力のある細胞内シグナル変換ドメインに結合させた細胞外リガンド特異的結合部分を含む、シグナル転換要素を含む。このトランスデューサー成分はその活性形態で、容易に検出される独特の特性を持つ診断用ポリペプチドをコードするレポーター遺伝子に作動可能に連結させたプロモーターなどの、応答要素を活性化する能力がある。あるいは、レポーター分子は、シグナル転換要素のその他の細胞内シグナル変換ドメインに結合することにより、直接活性化される。よって、本発明のバイオディテクターは、標的物質、即ち、リガンドへの結合を検出可能なシグナルへと転換する。本発明の好ましい実施態様では、バイオディテクターにより発生するシグナルは、光であり、光検出装置により検出される。従って、この相互作用に基づき、標的化リガンドを定量および同定できる。
B.バイオディテクター
本発明のバイオディテクターは、それらが標的化物質の存在に応答してインビボまたはインビトロのいずれかで検出可能なシグナルを発生させることを特徴とする。
具体的な一実施態様では、光が標的化物質の存在に応答してバイオディテクターにより発生される検出可能なシグナルである。正常組織および他の有機または無機物質から生じるバックグラウンド光は事実上ないので、このシステムの感度は、バイオディテクターのバックグラウンドノイズによってのみ制限される。より具体的には、本発明の標的化リガンド特異的バイオディテクターは、“分子スイッチ”を介して検出可能なタンパク質をコードするレポーター遺伝子に連結させたリガンド特異的ドメインからなる。そのため、レポーター遺伝子はリガンドの特異的ドメインへの結合に応答して活性化される。リガンド特異的結合部分は、対象の物質に選択的に結合するあらゆる抗体であり得る。“分子スイッチ”は、応答要素の活性化とリガンド結合とをつなぐシグナル伝達性成分である。伝達性分子は、ホスフェート領域または真核生物トランスデューサを含むどの細菌の二成分制御系であってもよい。応答要素は、レポーター遺伝子に作動可能に連結させた誘導性プロモーターであり得る。このレポーター遺伝子の転写および翻訳により、光などの検出可能なシグナルを発生させる遺伝子産物が生じる。シグナルは適切な手段で検出され、シグナルが光の場合、この手段は光検出装置である。
例えば、光放出バイオディテクター系のイメージングには、極めて低レベルの光、典型的には、単一光子事象を検出できる光検出器の使用が必要である。必要ならば、シグナルの位置特定は、イメージを構築できるまで光子放出を積分することにより測定できる。このような高感度光検出器の例には、単一光子事象を増強する装置(例えば、マイクロチャネルプレート増強器および光電子増倍管)がある。増強器はカメラの前に置いてもよい。更に、検出システムに固有のバックグラウンドノイズをこえる単一光子を検出できる感光カメラ(例えば、液体窒素で冷却したもの)もまた使用できる。
一旦、光子放出イメージが作られると、典型的には、それをその対象の“普通の”反射光イメージ上に重ね、放出光子源に対して準拠座標系を提供する。この場合、このような“混成”イメージを分析して、対象中の標的の位置および/または量を測定する。殆どの情況で、光源のイメージは必要でない。試料から放出される光子数(例えば、照度計によって検出される)を単純に定量したものが、光放出性レポーターの濃度を示す。よって、光子数は、特定の検出器が検知している標的化リガンドの量に比例する。イメージの必要性に束縛されることなく、光放出バイオディテクターに非常に近い位置に検出器を置くことができ、そうして、アッセイの光学検出および感度を最適化できる。マイクロチャネルプレート増強器は、このような配置で使用でき、結果、単一光子が検出できる。このような装置は、現在、Hamamatsu Corporationにより製造されている。このHamamatsuシステムでは、溶解緩衝液、ルシフェラーゼおよび基質、ルシフェリンを固定化細胞上に噴霧することにより単一細胞のATP濃度をアッセイできる。
リガンド特異的バイオディテクターの全体機構は、図1に示す。図2は、好ましいバイオディテクターの分子機構をより具体的に示す。図示した例では、バイオディテクターは、細胞内シグナル変換ドメインに結合させた細胞外リガンド特異的結合部分、例えば、抗体を含む、トランスメンブレン標的特異的シグナル転換要素を発現する細菌細胞である。標的特異的シグナル転換要素は、“細胞外”成分と“細胞内”成分とを隔てる膜、例えば、細菌膜に組込まれる。リガンド特異的部分は、選択物質に結合する能力があり、細胞内シグナル変換ドメインの活性化を誘発する。すると今度は活性化細胞内シグナル変換ドメインが不活性トランスデューサーを活性トランスデューサーへと転換する。トランスデューサーは、活性形態に転換されたときに、レポーター遺伝子に作動可能に連結させたプロモーター要素(element)に結合できるという能力を特徴とする。レポーター遺伝子またはオペロンの転写および翻訳により、光などの検出可能なシグナルを発生する遺伝子産物を生じる。本発明の好ましい実施態様では、レポーターは、ルシフェラーゼーオペロンであり、可視光を生成し、高感度で容易にモニター、測定および定量できる。
あるいは、このシグナル変換ドメインは、修飾レポーター分子に直接作用することもできる。このレポーター分子を修飾して、不活性状態で発現させ、次いで、これをシグナル変換ドメインとの直接的な相互作用により活性化できる。
予め定めた選択物質に応答する“光スイッチ”を提供するバイオディテクターは、現存のものを超える多数の利点を示す。第1に、このスイッチは、複雑な混合物中に存在する抗原の検出が可能であり、非結合抗体を洗浄除去する必要がなく、よって検出を簡便化できる。抗体に結合したリガンドが光を発生させ、また試料中にバックグラウンド光がないことから、洗浄してシグナル対ノイズ比率を低減する必要はなく、低いノイズが感度を増大し、そして、特異的相互作用のみが光を発生させる。
一旦、リガンドに結合すると、酵素カスケードが活性化されて、シグナルを伝達する働きをする。
更に、標的化リガンドが、例えば、病原菌の表面に豊富に発現されるならば、多くのバイオ検出性細菌が単一の標的に結合してシグナルを増幅する働きをし、結果、極めて感度のよい検出システムが得られるであろう。
また、バイオディテクターシステムのシグナル転換要素のリガンド特異的ドメインはカセットのように交換できるので、望まれるまたは選択されるあらゆる物質を認識する無制限数のバイオディテクターが製造できる。よって、本発明のバイオディテクターは、選択範囲の広さにかかわらず、あらゆる選択物質を認識するのに適合できる順応性のある一般的なシステムを提供するものである。対象の物質を標的とするバイオディテクターが迅速に開発できる。
本発明のバイオディテクターは、溶液状態または固定化センサープレート上でインビボで効果的であるので、多目的に利用できる。更に、これらのバイオディテクターのアレイが構築でき、異なる波長でまたは“バイオセンサーチップ”の異なる位置で操作し、複数の作用要因、遺伝子、遺伝子産物またはその他の標的の同時モニタリングおよびスクリーニングが可能である。図3参照。例えば、バイオディテクターは、一段階で広範囲かつ強力に分析できるシステムを構築するために、ユニークなマルチディテクターアレイ配置で組み立てることもできる。例えば、このバイオディテクターは、普通のシグナル検出器具、発生したシグナルが光である場合、例えば電荷結合素子(CCD)チップであり得る、の頂部にあるゲル上に置いてもよい。CCDアレイはシグナルを空間的に認識するので、バイオディテクターアレイは、1つのセンサーチップ上に置いた複数個の異なるセンサーを用いて、光ベースの分析に備えることもできる。従って、例えば、血液型、HIV曝露、肝炎状態、リンホカインプロフィールおよびCMV陽性についての分析を同時に実施できる。複合型感染も迅速かつ同時にスクリーニングできる。
光がレポーターにより発生されるシグナルである場合、光は、例えば組織を通して検出できるので、そのシグナルは非侵襲的に検出できる。出典明示により本明細書の一部とする同時係属合衆国特許出願08/270,631号参照。
更に、本発明のバイオディテクターは生体適合性であり、それ自体環境に優しいので、特に、放射能ベースのアッセイなどの有害廃棄物を伴うような方法と比較した場合、開発費用は比較的安く、使用者の負担も少ない。
本発明のバイオディテクターの更に重要な利点は、多くの診断試験を実施するのに必要な時間および労力の低減である。多くの試験および診断分野に共通の律速段階は、迅速な情報を提供するのに適した正確な検知および検出システムに対する要望である。その例には、AIDSウイルスおよびその他の血液運搬病原体に対する供給血のスクリーニング、組織培養または動物モデルにおける新規薬剤の研究および評価、および遺伝子治療後に産出される治療用タンパク質のモニタリングがある。例えば、HIVやその他の作用要因に対する供給血の強制スクリーニングは、現在のところ多くの試験を必要とする。内蔵されている確認試験により多くの血液運搬病原体を検出する安価で迅速かつ特異的なセンサーは、プロセスを顕著に合理化でき、使用者にかかる正味費用を低減する。同様に、リード化合物として知られている将来性ある新規薬剤の製薬会社による評価には、現在、入念かつ高価な組織培養や動物治検が必要である。薬物動態や効果のインビトロおよびインビボモニタリングを可能にする安価なセンサーや関連ハードウェアは、リード化合物開発を合理化する方法を模索する製薬会社にとって大きな価値を持つ。
要するに、本発明のバイオディテクターは、現在利用できる診断用検出システムを超える多くの利点を提供するものである。
1.バイオディテクターを保護するもの
バイオディテクターの生物学的成分は、実質的な相互作用を安定化する生存系または非生存系内含まれるか、そうでなければ、それらと結合させてもよい。これらの成分自体を配置することにより、特異性および選択性の大きい少数のリガンドを検出できるマイクロ検知システムが得られる。
生存系。最も典型的には、バイオディテクター系は、必要な全ての成分を含むように遺伝子操作した生存細胞である。生存系には、これらに限定されないが、原核生物、真核生物、ウイルス、レトロウイルス、ベクター、プラスミド、ファージ、形質転換真核細胞、例えば、リンパ球、マクロファージ、樹立細胞系列がある。最も典型的には、E.コリなどの遺伝子操作した細菌細胞を保護するものである。遺伝子的に修飾した細菌は、低コストで迅速に増殖させることができるので、バイオディテクター系として生存細胞を使用する利点は、一旦、最初のバイオディテクターを構築すれば、これらのバイオディテクターのプールが複製および増殖され得ることである。
“生存”バイオディテクター系の使用は、幾つかの利点を持つ。第1に、一旦、センサーを操作すれば、低コストでバイオディテクターの増殖が可能である。第2に、ディテクターを増殖継続させて、従来の無機センサーのように消耗するのではなく、むしろ組織内で展開させることができるシステムが可能である。第3に、生存バイオディテクターは、検出シグナルを増幅できる。例えば、1つの抗原が細菌の表面に結合すると、一連の光発生物質の製造を引き起こすことができ、それらが各自、繰り返し光を発生し得る。よって、1つの抗原が結合して、このシステムを適切に刺激することにより、1つの生存バイオセンサーから大量の光子が生産される。第4に、これらのバイオセンサーは、大多数、標的に結合し得るので、多くのバイオディテクター、即ち、細菌がそれぞれ結合事象を増幅し、高度の増幅を導くという結果になる。よって、最大高感度が達成できる。
非生存系。しかしながら、非生物バイオディテクターも製造できる。バイオディテクターシステムは、無生物ゲル、非生物カプセルおよびリポソームに入れることもでき、またそれ自体を体内に注入したり、プレート上に載せることもできる。更に、脂質二重層などの、媒介代謝物を保護できるその他のものは全て、採用できる。
2.シグナル転換要素
シグナル転換要素は、特定の物質に選択的に結合する“細胞外”部分と、トランスデューサーを活性化する能力のある“細胞内”部分とからなる。典型的に、シグナル転換要素は、細胞外リガンド結合部分、例えば、抗体および細胞内酵素部分からなるトランスメンブレン融合タンパク質であり、細胞外部分が選択標的に結合すると活性化される。従って、シグナル転換要素は、特定の物質、即ち、リガンドの認識および結合を細胞内シグナルへと転換して、トランスデューサー成分の活性化をもたらすように設計し、次いでトランスデューサー成分がレポーター遺伝子の発現を制御するプロモーターを活性化する。
リガンド結合ドメイン。本発明により同定できる物質には、これらに限定されないが、タンパク質、ペプチド、糖、脂肪酸、イオン、細菌を含む微生物、ウイルスおよびレトロウイルスがある。従って、リガンド結合ドメインは、抗体、抗体フラグメント、細胞性レポーターまたはその他あらゆるリガンド結合ドメイン、例えば、スタフィロコッカスのプロテインAおよびG、マクロファージFc受容体、カルボヒドレート部分、またはイオン結合部分、例えば、ナトリウムおよびカリウムチャンネル由来のドメインであり得る。
具体的な実施態様では、リガンド結合ドメインは、抗体またはそれらの誘導体であり、ポリクローナル抗体、モノクローナル抗体(mAbs)、ヒト化またはキメラ抗体、一本鎖抗体、Fabフラグメント、F(ab')2フラグメント、Fab発現ライブラリーにより生産されるフラグメント、抗イディオタイプ(抗Id)抗体、および上記のもののエピトープ結合フラグメントがあるが、これらに限定されない。特に、モノクローナル抗体技術および、細菌細胞における機能的抗体の発現技術の近年の発達は、望まれるどの標的にも適したリガンド結合ドメインを同定できる融通性と容易さを増した。細菌細胞における抗体の発現についての詳細は、中でも、Collet et al., 1992, Proc. Natl. Acad. Sci. U.S.A 89: 10026-10030およびHuse et al., 1989, Science 246: 1275-1281参照。
更に、抗体コード領域源は、その抗体の特異性が既知であり、そのままで単一クローンであるハイブリドーマ細胞系列からクローン化したものに限定されない。むしろ、大きい抗体ライブラリーを採用して、不特定範囲の抗原を検出するための大多数のバイオディテクターが製造できるように、融合タンパク質を生産してもよい。
シグナル変換ドメイン。シグナル変換ドメインは、リン酸化、脱リン酸化、メチル化、アセチル化およびプロテアーゼ活性を含み得る幾つかのタンパク質修飾機能を持つ酵素または酵素の活性ドメインからなる。このような酵素には、タンパク質キナーゼ、ホスホリラーゼ、タンパク質メチラーゼ、アセチラーゼ、プロテアーゼ、プロテイナーゼK、セリンプロテアーゼその他がある。本発明の具体的な実施態様では、細菌ホスホリラーゼPhoQの活性ドメインを遺伝子融合で重鎖抗体cDNAの領域に融合させる。それ自体、発現した融合タンパク質と標的化抗原(リガンド)との相互作用は、抗体ホスホリラーゼ融合におけるコンフォメーション変化をもたらし、それが、特異的なホスホリラーゼ活性を活性化すると、リン酸化/脱リン酸化事象により、PhoP、トランスデューサータンパク質が活性化される。活性PhoPは、レポーターオペロンluxの発現を制御するために使用されるPhoプロモーターを活性化する。シグナル転換要素のトランスデューサー活性化ドメインは、それが特定の分子に結合すると、コンフォメーションまたは電荷を変えて、トランスデューサーの活性化をもたらすという特徴がある、このトランスデューサーは、リン酸化、グリコシル化、メチル化、電子輸送、水素輸送、カルボキシル化、脱水素化、酸化/還元またはその他の化学修飾により活性化できる。
3.トランスデューサー
トランスデューサーは、リガンド結合時にシグナル転換要素により活性化される。トランスデューサーは、コンフォメーションや電荷の変化、化学亜族の付加または除去、例えばリン酸化、グリコシル化を認識し、それに応答でき、検出可能な応答を誘発する能力もあるあらゆる分子であり得る。
本発明の具体的な実施態様では、トランスデューサーの活性化が、転写活性化要素、例えば、プロモーターの活性化を直接的または間接的に誘発して、レポーター遺伝子またはレポーターオペロンの活性化をもたらす。レポーター遺伝子またはオペロンの転写および翻訳により、次は検出可能なシグナル、たとえば光を発生する遺伝子産物が得られる。しかしながら、別の実施態様では、トランスデューサーの活性化により直接的に可視測定可能なシグナルを生じることもある。
4.レポーター遺伝子およびオペロン
広範囲のレポーター遺伝子またはレポーターオペロンが採用でき、それにはバイオ発光、比色性反応または蛍光を生じるようなものがある。例えば、レポーター遺伝子は、色素(Bonhoeffer, 1995, Arzneimittelforschung 45: 351-356)、例えば細菌ロドプシン(Ng et al., 1995, Biochemistry 34: 879-890)、メラニン(Vitkin et al., 1994, Photochemistry and Photobiology 59: 455-462)、アクオリン(Molecular Probes, Seattle)、緑色蛍光タンパク質(GFP, Clonetech, Palo Alto; Chalfie et al., 1994, Science 263: 802-805; Cubitt et al., 1995, TIBS 20: 448-455)、黄色蛍光タンパク質(Daubner et al., 1987, Proc. Natl. Acad. Sci. U.S.A. 84: 8912-8916)、フラビン、バイオフラビノイド、ヘモグラビン(Chance et al., 1995, Analytical Biochemistry 227: 351-362; Shen et al., 1993, Proc. Natl. Acad. Sci. U.S.A. 90: 8108-8112)、ヘム(Pieulle et al., 1996, Biochem. Biophys. Acta 1273: 51-61)、インディゴ染料(Murdock et al., 1993, Biotechnology 11: 381-386)、ペリジニン−クロロフィルaタンパク質(PCP)(Ogata at al., 1994, FEBS Letters, 356:367-371)またはピオシアニン(al-Shibib and Kanadela, 1993, Acta Microbiologica Polonica 42: 275-280)をコードできる。あるいは、レポーター遺伝子は、吸色性基質、例えば、β−ラクタマーゼ、発光および蛍光タンパク質を切断できる酵素、蛍光基質を持つ酵素をコードしていてもよく、あるいは、光学活性な化学物質をコードする、または基質を光学活性化合物に転換できるその他の遺伝子である。更に別のものとして、レポーター遺伝子は、光タンパク質をコードすることもできる。それぞれの場合で、レポーターは、トランスデューサー成分の活性形態によって活性化される誘導性プロモーターに作動可能に連結させる。
本発明の具体的な実施態様では、バイオ発光レポーターを採用する。
バイオ発光ベースのレポーター遺伝子およびオペロン。ルシフェラーゼファミリーを含む数種のバイオ発光レポーター遺伝子が知られている(例えば、Wood et al., 1989, Science 244: 700-702)。ルシフェラーゼファミリーの構成員は、様々な種類の原核生物および真核生物において同定されている。原核生物発光(lux)システム並びに対応するlux遺伝子に関与するルシフェラーゼおよびその他の酵素は、VibrioおよびPhotobacterium属の海洋細菌から、またphotorhalodusとも呼ばれるXenorhabdus属の陸上細菌から単離された。
ルシフェラーゼシステム(lux)を含む真核生物の例は、キタアメリカホタルPhotinus pyralisである。ホタルルシフェラーゼは、詳細に研究されており、ATPアッセイにおいて広く使用されている。Pyrophorus plagiophthalamus、その他の種、コメツキムシ由来のルシフェラーゼをコードするcDNAがクローン化され、発現されている(Wood et al., 1989, Science 244: 700-702)。このコメツキムシは、この種の異なるメンバーが、異なる色のバイオ発光を放出する点で珍しい。互いに95−99%の相同性を持つ4種のクローンが単離された。これらは、546nm(緑色)、560nm(黄緑色)、578nm(黄色)および593nm(オレンジ色)の光を放出する。
ルシフェラーゼは、ATP、NAD(P)Hなどのエネルギー源および基質、例えば、ルシフェリン、デカナール(細菌酵素)またはコエレントリジンおよび酸素を必要とする。
基質ルシフェリンが発光するためには、ルシフェラーゼ酵素を供給する必要がある。そのため、ルシフェリンを供給する従来の方法は、ルシフェラーゼだけでなく、基質デカナール合成用の生合成酵素も発現させるものである。この場合、Luxオペロンからこれらのタンパク質を発現する細菌において、酸素はバイオ発光にとって単なる付帯的要件である。
例えば、土壌細菌Xenorhabdus luminescenceから得られるluxオペロン(Franckman et al., 1990, J. Bact. 172: 5767-5773)は、形質転換E.コリに、ヘテロ二量体ルシフェラーゼの2つのサブユニットと3つのアクセサリータンパク質の発現によって光子を放出する能力を与えるので、レポーターオペロンとして使用できる(Frackman et al.,前掲)。
X. luminescenceのlux遺伝子を発現するE.コリに最適なバイオ発光は、37℃で観察され(Szittner and Meighen 1990, J. Biol. Chem. 265: 16581-16587; Xi et al., 1991, J. Bact. 173: 1399-1405)、真核生物および他の原核発光生物由来のルシフェラーゼは低温で最適であるのとは対照的である(Campbell, 1988, Chemiluminescence, Principles and Applications in Biology and Medicine(Chichester, England: Ellis Horwood Ltd. and VCH Verlagsgesellschaft mbH))。よって、レポーターオペロンは、具体的な応用の性質と要件に従い選択できる。そのため、例えば、X. luminescence由来のルシフェラーゼは、動物での研究用マーカーとして使用するのに非常に適している。
ルシフェラーゼベクター構築物は、殆どの細菌や多くの真核生物細胞を含む様々な宿主細胞の形質転換に使用するのに適応させることができる。更に、ある種のウイルス、例えば、ウイルスや痘疹ウイルスは、遺伝子操作して、ルシフェラーゼを発現させることができる。例えば、Kovacs and Mettenlieter, 1991, J. Gen. Viol. 72: 2999-3008は、ヘルペスウイルスにおけるホタルルシフェラーゼをコードする遺伝子の安定な発現を教示している。Brasier and Ron, 1992, Meth. in Enzymol. 216: 386-396は、哺乳動物細胞におけるルシフェラーゼ遺伝子構築物の使用を教示している。培養哺乳動物細胞からのルシフェラーゼ発現は、CCDイメージングを用いて巨視的(Israel and Honigman, 1991, Gene 104: 139-145)にも微視的(Hooper et al., 1990, J. Biolum. and Chemilum. 5: 123-130)にも研究されてきた。
C.光放出バイオディテクターのイメージング
光放出バイオディテクターは、多くの方法でイメージングできる。かかるイメージングの概略並びに具体的な実施例は、下記である。
1.光検出装置
バイオディテクターにより発生されるシグナルが光である本発明の一実施態様において、重要な特徴は、微かな光のイメージングを可能にするのに十分感度の高い光検出装置の選択である。更に、バイオディテクターを生存対象にて使用する場合、そのイメージングは、妥当な時間、好ましくは約30分以下でなければならず、イメージ構築装置から生じるシグナルを使用しなければならない。
極めて明るい光発生部分を使用し、および/またはイメージングする対象または動物の表面近くに局在する光放出コンジュゲートを検出することが可能な場合、一対の“暗視”ゴーグルまたは標準高感度ビデオカメラ、例えば、Silicon Intensified Tube(SIT)カメラ(例えば、Hamamatsu Photonic Systems, Bridgewater, NJ)を使用する。しかしながら、より典型的には、より感度のよい光検出法が要求される。
本発明の実施の際に起こり得るような極めて低い光レベルでは、単位面積当りの光子束は、イメージングするコマが連続しないほど非常に低くなる。その代わり、互いに時間的かつ空間的に別個の個々の光子によって表される。モニターを観測すると、かかるイメージは、光のシンチレーションポイントとして現れ、それぞれ単一検出光子を示す。
これらの検出光子を時間毎にデジタルイメージプロセッサーで集積することにより、イメージを入手し、構築することができる。あるいは、そのシンチレーションポイントを数えて、数値で報告すれば、イメージ再構築段階を回避することによって分析を促進できる。各イメージポイントでのシグナルが明暗度を決める常用のカメラとは反対に、光子計数イメージングではシグナルの振幅は全く重要でない。その目的は、単にシグナル(光子)の存在を検出すること、およびその位置に関する経時毎のシグナルの出現を計数することてある。
少なくとも2種類の下記光検出装置が、個々の光子を検出でき、イメージプロセッサーにより分析できるシグナルを発生できる。
ノイズ低減光検出装置。第1種目は、光子シグナルを増幅するのとは反対に、光子ディテクターのバックグラウンドノイズを低減することにより感度を達成する装置からなる。まず、ディテクターアレイを冷却することによりノイズを下げる。この装置は、“バック薄片化(backthinned)”冷却CCDカメラと呼ばれる電荷結合素子(CCD)カメラを含む。より感度のよい器具では、例えば、液体窒素を用いて冷却し、CCDアレイの温度をおよそ−120℃にする。“バック薄片化”とは、光子が後に検出されるパス長(path length)を低くし、それによって量子効率を増大する、超薄バックプレートを表す。特に感度のよいバック薄片化低温CCDカメラは、Photometrics, Ltd. (Tucson, AZ)から入手できるカメニシリーズ200の“TECH 512”である。
光子増幅装置。第2種目の高感度光検出器には、光子が検出スクリーンにぶつかる前に光子を増幅する装置がある。この種には、マイクロチャネル増強器などの増強器付きCCDカメラがある。マイクロチャネル増強器は、典型的に、カメラの検出スクリーンに対して垂直かつ同一範囲にあるチャネルの金属アレイを含有する。マイクロチャネルアレイは、試料、対象、またはイメージングする動物およびカメラの間に設置する。アレイチャネルに入る殆どの光子は、出て行く前にチャネルの側面に接触する。アレイ全域に電圧をかけると、多くの電子が各光子衝突から放出する。このような衝突から生じた電子が“ショットガン”パターンでその元のチャネルから出ると、それをカメラが検出する。
増強マイクロチャネルアレイを直列に設置することにより、一層高い感度を達成でき、すると最初の段階で生成された電子は、次に第2段階で電子の増幅シグナルをもたらす、しかしながら、感度の増大は、空間的解像度を犠牲にして達成されるので、それぞれの新たな増幅段階で減少してしまう。
本発明の実施に適したマイクロチャネル増強器ベースの単一光子検出装置の一例は、Hamamatsuから入手できる2400シリーズである。
イメージプロセッサー。光子を計数する光検出装置により発生されるシグナルは、イメージプロセッサーにより処理して、例えば、モニターに表示したり、ビデオプリンターにプリントできるイメージを構築する必要がある。このようなイメージプロセッサーは、典型的には、上記の高感度光子計数カメラを含むシステムの一部として販売されており、よって、同じ販売元(例えば、Photometrics, Ltd.およびHamamatsu)から入手できる。その他の販売元のイメージプロセッサーも使用できるが、機能的なシステムを得るには一般的に若干手間がかかる。
イメージプロセッサーは、普通、IBM社のコンパチブルPCまたはApple社のMacintosh(Apple Computer, Cupertino, CA)などのパーソナルコンピューターにつなげるが、場合によっては購入したイメージングシステムの一部として含まれていることもある。一旦イメージをデジタルファイル形態にすれば、様々なイメージ処理プログラム(例えば、“ADOBE PHOTOSHOP”,Adobe Systems, Adobe Systems, Mountain View, CA)によって操作でき、プリントできる。
2.光子放出のイメージを構築する
例外的に明るい光を発生する部分により、および/または対象表面近くに光放出コンジュゲートが局在化することにより、一対の“暗視”ゴーグルまたは高感度ビデオカメラを用いてイメージを得た場合、そのイメージは、単に、ビデオモニターで見たり、モニターに表示するだけである。所望ならばビデオカメラからのシグナルをイメージプロセッサーに転用でき、そうするとメモリー中の個々のビデオフレームを分析またはプリント用に貯蔵でき、および/または分析およびプリント用のイメージをコンピューター上にデジタル化できる。
あるいは、光子計数法を用いるならば、光子放出の測定は数列を生成し、イメージプロセッサーにおいて各ピクセル位置で検出された光子の数を表す。これらの数を使用して、典型的には、光子計数を(固定した予め選択した値またはどのピクセルにおいても検出された最大数のいずれかに対して)正規化し、正規化した数をモニター上に表示される明るさ(グレースケール)または色(疑似色)に変換することにより、イメージを生成する。疑似色表示では、典型的な色の指定は下記のとおりである。光子計数ゼロのピクセルは黒、低い計数は青、計数が増大するにつれて高い波長の色とし、最大光子計数値を赤とした。モニター上の色の位置は、光子放出分布、よって、光放出コンジュゲートの位置を示す。
コンジューゲートについての準拠座標系を提供するため、典型的には、光子放出が測定された対象のグレースケールイメージを構築する。このようなイメージは、例えば、ほのかな室内光でイメージング室またはボックスのドアを開け、反射した光子を(典型的には、光子放出を測定するのにかかる僅かの時間)測定する。グレースケールイメージは、光子放出を測定する前、あるいは後のいずれかに構築できる。
光子放出のイメージは、典型的には、グレースケールイメージに重ねて、その対象について光子放出の混成イメージを作る。
光放出コンジュゲートの経時的な位置特定および/またはシグナルに続いて、例えば、選択した生体適合性部分の分布および/または位置特定に対する処置効果の記録を望むならば、光子放出の測定またはイメージングを所定の時間間隔で繰り返して一連のイメージを構築する。その間隔は、ピコ秒(高速ゲートカメラ)または秒程度の短さから、インテグレーティングカメラの場合は数日または数週間であってよい。
D.応用
バイオディテクターの具体的な応用には、疾患の診断、臨床関連物質、環境汚染の検出、食物汚染の検出がある。更に、本発明のバイオディテクターは、基礎研究および開発において多くの応用を見出している。
感染病の診断。このバイオディテクターは、血液または尿を含む体液、または組織および他の体液中の抗原の検出に使用できる。適切な標的抗原には、細菌病原体、ウイルス病原体、真菌病原体、血清タンパク質、リンホカイン、サイトカイン、サイトカイン、インターフェロン、β−2ミクログロブリン、免疫グロブリン、ペプチドおよびポリペプチドがあるが、これらに限定されない。
細菌病原体を標的とする具体的な診断試験には、ライム病、ストレプトコッカス、サルモネラ、ツベルクロシス、スタフィロコッカス、シュードモナス、ヘリコバクター、リステリア、シゲラ、プロテウス、エンテロコッシ、クロストリジウム、ボルダテラ、バルトネラ、リケッチア、クラミジア、スピロヘータの診断があるが、これらに限定されない。ウイルス病原体を標的とする診断試験には、HIV−1、HTLV−1などのレトロウイルス、肝炎ウイルス(HBV、HCV、HAV)、EBV、CMV、単純ヘルペスI、単純ヘルペスIIおよびHHV−6を含むヘルペスウイルス、日本脳炎ウイルス、東洋および西洋脳炎ウイルスを含む脳炎、ロタウイルス、既知かつ更にヒトおよび動物ウイルス病原体として同定されたもの全て、およびアルツハイマーおよびクルツフェルト・ヤコブ病(プリオン)に関連するような異例の要因の検出があるが、これらに限定されない。標的真菌病原体には、クリプトコッカス、ヒトスプラズマ症、コクシジオイデス症、カンジダ、ジアルディアがあるが、これらに限定されない。
その他の臨床関連物質の検出。バイオディテクターの応答には、体液、例えば、血液または尿、または組織中の糖分子、脂肪酸、タンパク質または微生物などの臨床関連物質の検出があり得る。標的化抗原には、臓器の適切な機能を知らせる乳酸デヒドロゲナーゼなどの酵素、尿、グルコース、およびその他の分子、およびサイトカインがある。アルファフェトプロテインは、スピノビフィダ(spinobifida)診断の標的であり得る。ある種の細菌種またはその他の微生物は、腸および膣フローラなどの混合集団群中にそれらがあるかどうかを測定するための標的となる。ある範囲の疾患の診断および予防のために重要な診断標的は、リンホカインであろう。現今の方法では、リンホカインのプロフィールは、容易に測定できないが、それが測定できれば、疾患と疾患状態との関係について知られていない様々な特徴を解明できると期待されている。更に、重要な医学的応用は、嚢胞性繊維症、鎌状赤血球貧血、ダウン症候群、フェニルケトン尿症、ADA欠乏症、サラセミア、成長ホルモン欠乏症、癌の疾病素質を含む遺伝病の妊娠初期診断であろう。最後に、本バイオディテクターは、例えば、グルコースレベルや薬剤レベルの実時間モニタリングにおける応用を見出すこともできる。
農業的および獣医学的応用。上記の医学的応用は全て獣医学に応用できる。
環境汚染の検出。例えば、本バイオディテクターは、上水道における汚染検出のために使用できる。選択標的には、ジアルディア、クリプトコッカス、レジオネラ、クロストリジア毒素、エンテロバクター、E.コリ、原生動物、重金属があるが、これらに限定されない。更に、土壌集団中のある種の細菌が存在するかどうかが本バイオディテクターにより測定できる。土壌をスクリーニングして、環境中に放出され得る遺伝子操作生物体を追跡できる。
食物汚染の検出。本バイオディテクターは、サルモネラ、大腸菌、スタフィロコッカス、クロストリジウムなどの細菌および真菌を含む食物中の汚染、ただしこれらに限定されない、を同定するのにも使用できる。
基礎研究および開発。本バイオディテクターは、基礎研究および開発において多くの応用を見出す。例として、ウェスタン・ブロット、ELISAなどの標準イムノアッセイにおける検出システム、リンホカインプロフィールの測定、マイコプラズマを含む細胞培養汚染の検出がある。更に、本バイオディテクターは、CD4、CD8、接着帯(adhereins)などの細胞表面マーカーを検出するための発現アッセイにおける検出システムとして有用である。
非生物バイオディテクター。ある種の応用の場合、抗原性が論点(即ち、インビボ)である場合、非生物バイオディテクターが望まれることがある。例として、感染、組織損傷および他の病状のインビボ検出および位置特定がある。一般に不活性の小胞二重層または膜、あるいは非生物であって、かつ媒介代謝物を保護するその他のもの(リポソームなど)に、リガンドと接触して光を生じるような方法でバイオディテクター機構を封入すると、インビボでこのシステムが使用可能である。
下記の実施例は、本発明をより詳細に説明するものである。下記の製造例および実施例は、当業者が本発明をより明確に理解し実施できるようにするものである。しかしながら、本発明は、例示的実施態様により範囲を限定されるものではなく、その実施態様は本発明の単なる一態様の例示であることを意図しており、また機能的に関連する方法は、本発明の範囲内にある。実際に、本明細書に記載したもの以外に本発明を様々に修飾できることは、上記の説明および添付の図面から当業者には明らかである。かかる修飾は、添付の請求の範囲内にあると解釈される。
VII.実施例
最初の3つの実施例は、特定遺伝子の発現とにシグナル伝達とを関連づけるのに使用できる3つの方法である。
A.実施例1:特定遺伝子の調節とシグナル伝達とを関連づける(方法1)
下記の実施例は、特定遺伝子の調節とシグナル伝達とを関連づけるのに使用できる方法を例示説明する。
表面発現リガンド結合分子、例えば抗体へのリガンド結合により活性化されるプロモーターを同定するために、トランスポゾンを構築する。プロモーターのないレポーターシステムは、細菌中の様々な調節配列を同定するために使用される。Ronald et al., 1990, Gene 90: 145-148.トランスポゾンは、(i)(1)バイオ発光の遺伝子を含有するプロモーターなしのオペロン、(2)選択マーカー(カナマイシン耐性遺伝子;Kan)および(3)負のレギュレーター(ランダレプレッサー);(ii)ラムダオペレーターにより発現される別の選択マーカー(クロラムフェニコール耐性遺伝子;Chl);および(iii)構成的に発現させる第3の選択マーカー(アンピシリン耐性遺伝子;Amp)からなる。対象の抗体を発現する細菌細胞は、トランスポゾンで形質転換させる。トランスメンブレン抗体融合タンパク質のコンフォメーション変化は、lux構築物のプロモーター領域にメッセージを中断するよう設計されたトランスデューサーの活性化または化学修飾のシグナルとなる。陽性形質転換体は、得られたAmp耐性の測定により選択する。抗原の存在下で活性である(構成性発現を含む)プロモーターの後ろのトランスポゾンを含有する細胞は、抗原の存在下でKan耐性であり、抗原の不在下でオフであるプロモーターの後ろのトランスポゾンを含有する細胞は、抗原の不在下でChl耐性である。一連の増殖条件で継代培養することにより、抗原に応答してルシフェラーゼを適切に発現する所望の形質転換体が同定される。次いで、プロモーターを特性化でき、別のバイオディテクターを構築するのに使用できる。
図4は、実施例1に記載のようにして製造したバイオディテクターを図示する。図4Aに示したように、抗原の不在下では、融合タンパク質は、組込まれたトランスポゾンによりコードされるクローン化遺伝子の発現を制御するプロモーターにシグナルを伝達しない。そのため、提示したE.コリの表現型は、抗原不在下ではアンピシリン耐性、クロラムフェニコール耐性、カナマイシン耐性であり、バイオ発光性でない。アンピシリン耐性は、構成的に発現されて、組込まれたトランスポゾンの選択を支持するものである。
しかしながら、融合タンパク質へのリガンド結合により活性化された活性化トランスデューサーの結合によりプロモーターが作動すると、ルシフェラーゼオペロン、カナマイシン耐性遺伝子、およびラムダレプレッサーが発現する。ラムダレプレッサーは、ラムダオペロン上に働くことによって、クロラムフェニコール耐性遺伝子の発現を制止する。そのため、抗原の存在下における細胞の表現型の特徴は、アンピシリン耐性、カナマイシン耐性、クロラムフェニコール感度およびバイオ発光である。
よって、上記のとおり、遺伝子の誘導および活性化により、抗原に対する所望の応答についての陽性選択が可能になる。より具体的には、記載のトランスポゾンを適切な部位でゲノム内に組込むような細菌細胞のみが選択操作に役立つのに対し、非応答細菌は死滅する。
B.実施例2:特定遺伝子の調節とシグナル伝達とを関連づける(方法2)
下記の実施例は、特定遺伝子の調節とシグナル伝達とを関連づけるのに使用できる第2の方法を例示説明する。
抗体重鎖および遺伝子調節のためにシグナル伝達することが知られている表面タンパク質およびこのシグナルに影響を受けるプロモーターからなる融合タンパク質を、マーカー遺伝子の前部に置く。抗体軽鎖は、バイオディテクター中で同時発現し、別のリガンド特異性を与える(Borrebaeck et al., 1992, Biotechnology 10: 697-698)。細菌ホスファターゼは、細菌中の表面発現融合タンパク質を同定するのに通用することから、表面遺伝子融合の初期トランスメンブレンおよびシグナル伝達成分として選ばれており(Kohl et al., 1990, Nucleic Acids Res. 18: 1069; Weiss and Orfanoudakis, 1994; J. Biotechnol. 33: 43-53)、比色性基質がホスファターゼ活性を測定するのに利用できる。抗体フラグメント−ホスファターゼ融合物は、リガンド結合特異性とホスファターゼ活性の両方を持って製造されてきた(Kohl et al., 1991, Acad. Sci. 646: 106-114; Wels et al., 1992, Biotechnology 10: 1128-1132)。ホスファターゼ−抗体融合物は、イムノアッセイ用の標識化抗体を製造するのに使用されてきた(Carrier et al., 1995, J. Immunol. Methods 181: 177-186; Ducancel et al., 1993, Biotechnology 11: 601-605; Weiss et al., 1994, J. Biotechnol. 33: 43-53; Weiss and Orfanoudakis, 1994, J. Biotechnol. 33: 43-53 Wels et al., 1992, Biotechnology 10: 1128-1132)。更に、修飾細菌ホスファターゼに対する抗体は、ホスファターゼ機能を変えることが示されており(Brennan et al., 1995, Proc. Natl. Acad. Sci. U.S.A. 92: 5783-5787)、これはタンパク質−タンパク質相互作用がおそらくホスファターゼ分子のコンフォメーション変化によりホスファターゼ活性を変調できることを示している。細菌細胞表面上のホスファターゼ融合タンパク質の発現は、特定の遺伝子の発現を誘導する細胞内にシグナル、リン酸化を伝達する。このシステムを修飾して、マーカータンパク質、ルシフェラーゼとそのアクセサリータンパク質の発現を、リガンドの抗体−ホスファターゼ融合タンパク質への結合に緊密に関連づけることができ、即ちリガンド依存性分子スイッチである。
C.実施例3:特定遺伝子の調節とシグナル伝達とを関連づける(方法3)
下記の実施例は、特定遺伝子の調節とシグナル伝達とを関連づけるのに使用できる第3の方法を例示説明する。
実施例1および2に記載した方法は、ホスファターゼ−抗体融合物を発現する細胞において上記トランスポゾンを併用したものである。
例えば、phoオペロンのもののようなトランスデューサー分子の活性化に特異的に応答する誘導性プロモーターに連結させたレポーター遺伝子を持つ細菌株を作る。次いで、pho膜タンパク質と抗体とを融合するベクター内にクローン化した抗体性能ライブラリーを上記細菌株内に入れる。その後、このバイオディテクターのライブラリーを、検出対象の特定分子に対して試験でき、適切なバイオディテクターを選択できる。こうして得られたバイオディテクターを大量に増やす。
D.実施例4:溶液状物質の検出
下記は、ウイルスおよび細菌抗原を全血や血漿などの溶液状で含むリガンドを検出するアッセイ例である。
検出および定量するリガンドを含有する試料を標準に沿って96ウェルプレート中で希釈(2倍)する。特定のバイオディテクターを生存活性細胞として各ウェルに加え、直ちに分析した。プレートから生じるバイオ発光シグナルは、電荷結合素子(CCDカメラ)または照度計を用いて96ウェル形式で検出する。未知試料から生じた相対バイオ発光を定量用の標準曲線上にプロットした。
E.実施例5:固相支持体上の物質の検出
下記は、例えば、ウエスタン・ブロット分析におけるニトロセルロースまたはナイロン膜などの固相支持体上の物質を特定のバイオディテクターを用いて検出するアッセイ例である。
標準法を用いて固相支持体(PVDFインモビロン膜、Millipore)にタンパク質を移した後、その膜を乾燥させ、細菌代謝の栄養分を含有する最小培地またはその他の透明緩衝液にて、生物学的活性細胞として特定のバイオディテクターを含有する皿に移す。室温で30分インキュベーション後、膜を取り出し、まだ湿っている間に、ジップロックまたは熱密閉プラスチックバックに密閉する。膜に結合したバイオディテクターから生じたバイオ発光シグナルは、X線フィルム、CCD検出器、またはその他の光感受性検出法を用いて検出する。シグナルは、標準イメージ分析ソフトウェアを用いて定量できる。
F.実施例6:バイオ発光サルモネラからの光放出に対するヒト血液の影響
次の実施例に示したように、10以下の細菌細胞は増強CCD検出器で検出できる。
ルシフェラーゼオペロンの構成性発現を付与するプラスミドで形質転換させておいたサルモネラLB5000株の2倍連続希釈物を、96ウェルプレートに入れ、同一のものを2つ準備した。希釈物を、増殖培地30μl単独(LB5000と指定)のものと血液30μlを加えたものとで、その検出限度で散乱および吸収培地として血液の影響について測定した。各希釈物と、濃縮ウェルから試料を平板培養して得られたコロニー形成単位(CFU)数は図5に示す。CCD検出器により得られたイメージの分析により測定される各ウェル毎の相対バイオ発光を示す(図5)。もっと濃縮したウェルのシグナルは、スケール外であり、よってその数は、より高い濃度でも直線でない。
全ての文献は、その全体を本明細書の一部としている。
Claims (20)
- 選択物質を検出するためのバイオディテクターであって、
(a)細胞外リガンド特異的部分が選択物質を選択的に認識し、その認識が細胞内シグナル変換ドメインを活性化する、細胞外リガンド特異的部分と細胞内シグナル変換ドメインを含むシグナル転換要素、
(b)互いに別個の不活性形態および活性形態を持ち、かつ該活性化細胞内シグナル変換ドメインがその不活性形態を活性形態へと転換する、トランスデューサー、および
(c)該トランスデューサーの該活性形態により活性化されて、検出可能なシグナルを生じる、応答要素
を含む、バイオディテクター。 - 該応答要素が、該トランスデューサーの活性形態により活性化される転写活性化要素を含む、請求の範囲第1項記載のバイオディテクター。
- 該応答要素が、更に、1または複数の遺伝子産物をコードする核酸を含み、遺伝子産物は検出可能なシグナルを発生するものであり、該核酸は該転写活性化要素に作動可能に連結している、請求の範囲第2項記載のバイオディテクター。
- 該検出可能なシグナルが光である、請求の範囲第3項記載のバイオディテクター。
- 該遺伝子産物が、バイオ発光、比色性反応または蛍光からなる群から選択される手段により検出可能である、請求の範囲第3項記載のバイオディテクター。
- 該核酸がルシフェラーゼオペロンを含む、請求の範囲第3項記載のバイオディテクター。
- 該細胞内シグナル変換要素が膜シグナルトランスデューサーである、請求の範囲第6項記載のバイオディテクター。
- 該膜シグナルトランスデューサーが、細菌性二成分制御系、真核生物レポーター媒介シグナルトランスデューサー、原核生物レポーター媒介シグナルトランスデューサーからなる群から選択される、請求の範囲第7項記載のバイオディテクター。
- 該物質が、微生物、ウイルス、レトロウイルス、タンパク質、糖、イオンからなる群から選択される、請求の範囲第6項記載のバイオディテクター。
- 選択物質の検出法であって、
(a)(i)細胞外リガンド特異的部分が選択物質を選択的に認識し、その認識が細胞内シグナル変換ドメインを活性化する、細胞外リガンド特異的部分と細胞内シグナル変換ドメインを含むシグナル転換要素
(ii)別個の不活性形態および活性形態を持ち、かつ該不活性形態が該活性化細胞内シグナル変換ドメインにより該活性形態へと転換される、トランスデューサー、および
(iii)該トランスデューサーの該活性形態により活性化されて、検出可能なシグナルを生じる、応答要素
を含む、バイオディテクターを製造し、
(b)該バイオディテクターを試料に加え、
(c)該検出可能なシグナルを測定および定量し、
(d)該検出可能なシグナルのレベルを該物質の存在および量と相関させる、
ことを含む、方法。 - 該バイオディテクターの該応答要素が、該トランスデューサーの活性形態により活性化される転写活性化要素を含む、請求の範囲第10項記載の方法。
- 該応答要素が、更に、1または複数の遺伝子産物をコードする核酸を含み、遺伝子産物は該検出可能なシグナルを発生するものであり、該核酸は該転写活性化要素に作動可能に連結している、請求の範囲第10項記載の方法。
- 該検出可能なシグナルが光である、請求の範囲第12項記載の方法。
- 該遺伝子産物が、バイオ発光、比色性反応または蛍光からなる群から選択される手段により検出可能である、請求の範囲第12項記載の方法。
- 該核酸がルシフェラーゼオペロンを含む、請求の範囲第12項記載の方法。
- 該物質が、微生物、ウイルス、レトロウイルス、タンパク質、糖、イオンからなる群から選択される、請求の範囲第10項記載の方法。
- 該検出可能なシグナルが光検出システムによって検出される、請求の範囲第13項記載の方法。
- 該光検出システムが、照度計、分光光度計、蛍光計、CCD検出器から選択される、請求の範囲第17項記載の方法。
- バイオディテクターまたは試料が固相支持体上に固定されている、請求の範囲第18項記載の方法。
- 試料中に含まれる様々な物質を検出できるように、更に、固相支持体上に規則正しく並べて一連のバイオディテクターを固定することを含む、請求の範囲第19項記載の方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US1563396P | 1996-04-19 | 1996-04-19 | |
| US60/015,633 | 1996-04-19 | ||
| US08/844,336 US8349602B1 (en) | 1996-04-19 | 1997-04-18 | Biodetectors targeted to specific ligands |
| US08/844,336 | 1997-04-18 | ||
| PCT/US1997/006578 WO1997040381A1 (en) | 1996-04-19 | 1997-04-21 | Biodetectors targeted to specific ligands |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2001502048A JP2001502048A (ja) | 2001-02-13 |
| JP2001502048A5 JP2001502048A5 (ja) | 2004-12-02 |
| JP3692149B2 true JP3692149B2 (ja) | 2005-09-07 |
Family
ID=26687637
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP53822497A Expired - Lifetime JP3692149B2 (ja) | 1996-04-19 | 1997-04-21 | 特定のリガンドを標的とするバイオディテクター |
Country Status (10)
| Country | Link |
|---|---|
| US (3) | US8349602B1 (ja) |
| EP (1) | EP0900376B8 (ja) |
| JP (1) | JP3692149B2 (ja) |
| CN (1) | CN1154845C (ja) |
| AT (1) | ATE365916T1 (ja) |
| BR (1) | BR9708713A (ja) |
| CA (1) | CA2251826A1 (ja) |
| DE (1) | DE69737857T2 (ja) |
| IL (1) | IL126605A (ja) |
| WO (1) | WO1997040381A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20230071312A1 (en) * | 2021-09-08 | 2023-03-09 | PassiveLogic, Inc. | External Activation of Quiescent Device |
Families Citing this family (66)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6649143B1 (en) | 1994-07-01 | 2003-11-18 | The Board Of Trustees Of The Leland Stanford Junior University | Non-invasive localization of a light-emitting conjugate in a mammal |
| US7255851B2 (en) | 1994-07-01 | 2007-08-14 | The Board Of Trustees Of The Leland Stanford Junior University | Non-invasive localization of a light-emitting conjugate in a mammal |
| GB9827584D0 (en) * | 1998-12-15 | 1999-02-10 | Celsis Int Plc | Hygiene Monitoring |
| WO2000036106A2 (en) | 1998-12-17 | 2000-06-22 | Xenogen Corporation | Non-invasive evaluation of physiological response in a mammal |
| US6610503B1 (en) | 1999-03-17 | 2003-08-26 | Xenogen Corporation | Animal models for predicting sepsis mortality |
| JP2003504014A (ja) * | 1999-06-30 | 2003-02-04 | エボテック オーアーイー アクチェンゲゼルシャフト | ウイルス状粒子、それらの調製及び好ましくは薬学的スクリーニング及び機能的ゲノムにおけるそれらの使用 |
| US6737245B1 (en) | 1999-09-08 | 2004-05-18 | Xenogen Corporation | Luciferase expression cassettes and methods of use |
| TWI237695B (en) * | 1999-12-14 | 2005-08-11 | Joy Biomedical Corp | Helicobacter pylori antigens in blood |
| US6867348B1 (en) | 1999-12-16 | 2005-03-15 | Xenogen Corporation | Methods and compositions for screening for angiogenesis modulating compounds |
| IT1311335B1 (it) | 1999-12-21 | 2002-03-12 | Otc Optical Technologies Ct S | Procedimento e dispositivo per realizzare reticoli in fibra ottica. |
| US20020192726A1 (en) * | 2000-04-25 | 2002-12-19 | Jay Leng | Cell proliferation assay |
| SE0001642D0 (sv) * | 2000-05-04 | 2000-05-04 | Sahltech Ab | Reagent for detection of biomolecules, and use thereof |
| US7056728B2 (en) | 2000-07-06 | 2006-06-06 | Xenogen Corporation | Compositions and methods for use thereof in modifying the genomes of microorganisms |
| US8489176B1 (en) | 2000-08-21 | 2013-07-16 | Spectrum Dynamics Llc | Radioactive emission detector equipped with a position tracking system and utilization thereof with medical systems and in medical procedures |
| US7826889B2 (en) | 2000-08-21 | 2010-11-02 | Spectrum Dynamics Llc | Radioactive emission detector equipped with a position tracking system and utilization thereof with medical systems and in medical procedures |
| US8036731B2 (en) | 2001-01-22 | 2011-10-11 | Spectrum Dynamics Llc | Ingestible pill for diagnosing a gastrointestinal tract |
| US8909325B2 (en) | 2000-08-21 | 2014-12-09 | Biosensors International Group, Ltd. | Radioactive emission detector equipped with a position tracking system and utilization thereof with medical systems and in medical procedures |
| US8565860B2 (en) | 2000-08-21 | 2013-10-22 | Biosensors International Group, Ltd. | Radioactive emission detector equipped with a position tracking system |
| WO2002048195A2 (en) * | 2000-10-23 | 2002-06-20 | Engeneos, Inc. | Engineered stimulus-responsive switches |
| EP1359845B1 (en) | 2001-01-22 | 2012-11-14 | Spectrum Dynamics LLC | Ingestible device |
| US7403812B2 (en) | 2001-05-17 | 2008-07-22 | Xenogen Corporation | Method and apparatus for determining target depth, brightness and size within a body region |
| US7298415B2 (en) | 2001-07-13 | 2007-11-20 | Xenogen Corporation | Structured light imaging apparatus |
| US20030053951A1 (en) * | 2001-07-26 | 2003-03-20 | Millennium Pharmaceuticals, Inc. | Use of non-invasive imaging technologies to monitor in vivo gene-expression |
| US20060074034A1 (en) * | 2001-09-17 | 2006-04-06 | Collins Douglas A | Cobalamin mediated delivery of nucleic acids, analogs and derivatives thereof |
| US7663022B1 (en) | 2002-07-15 | 2010-02-16 | Bruce Eric Hudkins | Transgenic bioluminescent plants |
| US7049483B1 (en) * | 2002-07-15 | 2006-05-23 | Bruce Eric Hudkins | Transgenic bioluminescent plants |
| EP1573495B1 (en) * | 2002-11-04 | 2009-11-04 | Spectrum Dynamics LLC | Apparatus and methods for imaging and attenuation correction |
| WO2007010534A2 (en) | 2005-07-19 | 2007-01-25 | Spectrum Dynamics Llc | Imaging protocols |
| WO2006075333A2 (en) | 2005-01-13 | 2006-07-20 | Spectrum Dynamics Llc | Multi-dimensional image reconstruction and analysis for expert-system diagnosis |
| US8586932B2 (en) | 2004-11-09 | 2013-11-19 | Spectrum Dynamics Llc | System and method for radioactive emission measurement |
| WO2006051531A2 (en) * | 2004-11-09 | 2006-05-18 | Spectrum Dynamics Llc | Radioimaging |
| US9470801B2 (en) | 2004-01-13 | 2016-10-18 | Spectrum Dynamics Llc | Gating with anatomically varying durations |
| US8571881B2 (en) | 2004-11-09 | 2013-10-29 | Spectrum Dynamics, Llc | Radiopharmaceutical dispensing, administration, and imaging |
| US7176466B2 (en) | 2004-01-13 | 2007-02-13 | Spectrum Dynamics Llc | Multi-dimensional image reconstruction |
| WO2007010537A2 (en) | 2005-07-19 | 2007-01-25 | Spectrum Dynamics Llc | Reconstruction stabilizer and active vision |
| US7968851B2 (en) | 2004-01-13 | 2011-06-28 | Spectrum Dynamics Llc | Dynamic spect camera |
| US9040016B2 (en) | 2004-01-13 | 2015-05-26 | Biosensors International Group, Ltd. | Diagnostic kit and methods for radioimaging myocardial perfusion |
| EP1766550A2 (en) | 2004-06-01 | 2007-03-28 | Spectrum Dynamics LLC | Methods of view selection for radioactive emission measurements |
| EP1778957A4 (en) | 2004-06-01 | 2015-12-23 | Biosensors Int Group Ltd | OPTIMIZING THE MEASUREMENT OF RADIOACTIVE EMISSIONS IN SPECIFIC BODY STRUCTURES |
| US8423125B2 (en) | 2004-11-09 | 2013-04-16 | Spectrum Dynamics Llc | Radioimaging |
| US9943274B2 (en) | 2004-11-09 | 2018-04-17 | Spectrum Dynamics Medical Limited | Radioimaging using low dose isotope |
| US9316743B2 (en) | 2004-11-09 | 2016-04-19 | Biosensors International Group, Ltd. | System and method for radioactive emission measurement |
| US8615405B2 (en) | 2004-11-09 | 2013-12-24 | Biosensors International Group, Ltd. | Imaging system customization using data from radiopharmaceutical-associated data carrier |
| WO2008059489A2 (en) | 2006-11-13 | 2008-05-22 | Spectrum Dynamics Llc | Radioimaging applications of and novel formulations of teboroxime |
| US20060214141A1 (en) * | 2005-03-23 | 2006-09-28 | Yankielun Norbert E | Luminescent illumination adjunct for night vision |
| US8044996B2 (en) | 2005-05-11 | 2011-10-25 | Xenogen Corporation | Surface construction using combined photographic and structured light information |
| US8837793B2 (en) | 2005-07-19 | 2014-09-16 | Biosensors International Group, Ltd. | Reconstruction stabilizer and active vision |
| US7705316B2 (en) | 2005-11-09 | 2010-04-27 | Spectrum Dynamics Llc | Dynamic SPECT camera |
| WO2007074466A2 (en) | 2005-12-28 | 2007-07-05 | Starhome Gmbh | Late forwarding to local voicemail system of calls to roaming users |
| US8894974B2 (en) | 2006-05-11 | 2014-11-25 | Spectrum Dynamics Llc | Radiopharmaceuticals for diagnosis and therapy |
| US10775308B2 (en) | 2006-08-24 | 2020-09-15 | Xenogen Corporation | Apparatus and methods for determining optical tissue properties |
| US10335038B2 (en) | 2006-08-24 | 2019-07-02 | Xenogen Corporation | Spectral unmixing for in-vivo imaging |
| US9275451B2 (en) | 2006-12-20 | 2016-03-01 | Biosensors International Group, Ltd. | Method, a system, and an apparatus for using and processing multidimensional data |
| WO2009036070A1 (en) * | 2007-09-10 | 2009-03-19 | University Of Kentucky Research Foundation | Spores for the stabilization and on-site application of bacterial whole-cell biosensing systems |
| US8521253B2 (en) | 2007-10-29 | 2013-08-27 | Spectrum Dynamics Llc | Prostate imaging |
| US8227965B2 (en) * | 2008-06-20 | 2012-07-24 | Arradiance, Inc. | Microchannel plate devices with tunable resistive films |
| WO2010062787A1 (en) | 2008-11-03 | 2010-06-03 | Washington University | Bioluminescence imaging of myeloperoxidase activity in vivo, methods, compositions and apparatuses therefor |
| EP2230793A3 (en) | 2009-03-16 | 2011-09-07 | Technische Universität München | On-Chip Electric Waves: An Analog Circuit Approach to Physical Uncloneable Functions: PUF |
| AU2010240670B2 (en) * | 2009-04-20 | 2015-08-20 | Oxford Nanopore Technologies Limited | Lipid bilayer sensor array |
| US8338788B2 (en) | 2009-07-29 | 2012-12-25 | Spectrum Dynamics Llc | Method and system of optimized volumetric imaging |
| WO2012045754A1 (de) | 2010-10-07 | 2012-04-12 | Boehringer Ingelheim Microparts Gmbh | Verfahren zum waschen einer mikrofluidischen kavität |
| US8859256B2 (en) | 2011-10-05 | 2014-10-14 | Genelux Corporation | Method for detecting replication or colonization of a biological therapeutic |
| EP2835146B1 (en) | 2013-08-09 | 2020-09-30 | Boehringer Ingelheim International GmbH | Nebulizer |
| RU2596398C1 (ru) | 2015-02-25 | 2016-09-10 | Закрытое акционерное общество "ЕВРОГЕН" | Метод и реактивы для детекции активности люциферазы |
| US12081063B2 (en) | 2021-07-12 | 2024-09-03 | PassiveLogic, Inc. | Device energy use determination |
| IL313024A (en) * | 2021-12-10 | 2024-07-01 | Massachusetts Inst Technology | Prediction, biosynthesis and integration as biosensors of compounds with unique light absorption signatures and remote sensing detections using multispectral or hyperspectral cameras |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB8422650D0 (en) | 1984-09-07 | 1984-10-10 | Technology Licence Co Ltd | Monoclonal antibodies |
| GB8422653D0 (en) | 1984-09-07 | 1984-10-10 | Technology Licence Co Ltd | Monoclonal antibodies |
| SE444025B (sv) | 1984-09-15 | 1986-03-17 | Sigarth Ind Ab | Lasanordning for fastlasning av exempelvis en kedja |
| US4745181A (en) | 1986-10-06 | 1988-05-17 | Ciba Corning Diagnostics Corp. | Polysubstituted aryl acridinium esters |
| US4762701A (en) | 1986-10-31 | 1988-08-09 | Smithkline Beckman Corporation | In vivo cellular tracking |
| US4912031A (en) | 1987-10-23 | 1990-03-27 | E. I. Du Pont De Nemours And Company | Method for detecting carcinomatous and precarcinomatous colo-rectal disease |
| US5200051A (en) | 1988-11-14 | 1993-04-06 | I-Stat Corporation | Wholly microfabricated biosensors and process for the manufacture and use thereof |
| US5622868A (en) | 1989-04-27 | 1997-04-22 | Microbiological Research Authority Camr (Centre For Applied Microbiology & Research) | Analytical apparatus utilizing a colorimetric or other optically detectable effect |
| GB8916806D0 (en) | 1989-07-22 | 1989-09-06 | Univ Wales Medicine | Modified proteins |
| AU6753390A (en) | 1989-10-02 | 1991-04-28 | University Of Michigan, The | Bioanalytical detection system |
| US5283179A (en) | 1990-09-10 | 1994-02-01 | Promega Corporation | Luciferase assay method |
| DE4122598C1 (ja) | 1991-07-08 | 1992-07-30 | Deutsches Krebsforschungszentrum Stiftung Des Oeffentlichen Rechts, 6900 Heidelberg, De | |
| AU2422792A (en) | 1991-07-30 | 1993-03-02 | Bio-Technical Resources | Device for detecting aqueous contaminants |
| US5348867A (en) | 1991-11-15 | 1994-09-20 | George Georgiou | Expression of proteins on bacterial surface |
| US5418132A (en) | 1992-06-18 | 1995-05-23 | Washington University | Genetically engineered cell line for detecting infectious herpes simplex virus and method therefore |
| US5521066A (en) * | 1993-09-13 | 1996-05-28 | Bristol-Myers Squibb Company | Periplasmic membrane-bound system for detecting protein-protein interactions |
| US5650135A (en) | 1994-07-01 | 1997-07-22 | The Board Of Trustees Of The Leland Stanford Junior University | Non-invasive localization of a light-emitting conjugate in a mammal |
| JPH08217693A (ja) | 1995-02-17 | 1996-08-27 | Yoshihisa Naito | 新規医薬組成物 |
| WO1997008553A1 (en) | 1995-08-22 | 1997-03-06 | The Regents Of The University Of California | Targeting of proteins to the cell wall of gram-positive bacteria |
-
1997
- 1997-04-18 US US08/844,336 patent/US8349602B1/en not_active Expired - Fee Related
- 1997-04-21 JP JP53822497A patent/JP3692149B2/ja not_active Expired - Lifetime
- 1997-04-21 IL IL12660597A patent/IL126605A/en not_active IP Right Cessation
- 1997-04-21 EP EP97921279A patent/EP0900376B8/en not_active Expired - Lifetime
- 1997-04-21 CA CA002251826A patent/CA2251826A1/en not_active Abandoned
- 1997-04-21 CN CNB971938946A patent/CN1154845C/zh not_active Expired - Fee Related
- 1997-04-21 BR BR9708713-0A patent/BR9708713A/pt not_active Application Discontinuation
- 1997-04-21 WO PCT/US1997/006578 patent/WO1997040381A1/en active IP Right Grant
- 1997-04-21 AT AT97921279T patent/ATE365916T1/de not_active IP Right Cessation
- 1997-04-21 DE DE69737857T patent/DE69737857T2/de not_active Expired - Lifetime
-
1998
- 1998-10-30 US US09/183,566 patent/US6638752B2/en not_active Expired - Lifetime
-
2003
- 2003-09-18 US US10/666,925 patent/US20040235003A1/en not_active Abandoned
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20230071312A1 (en) * | 2021-09-08 | 2023-03-09 | PassiveLogic, Inc. | External Activation of Quiescent Device |
Also Published As
| Publication number | Publication date |
|---|---|
| US8349602B1 (en) | 2013-01-08 |
| IL126605A0 (en) | 1999-08-17 |
| DE69737857T2 (de) | 2008-02-28 |
| EP0900376A4 (en) | 2004-08-11 |
| JP2001502048A (ja) | 2001-02-13 |
| DE69737857D1 (de) | 2007-08-09 |
| BR9708713A (pt) | 2000-01-04 |
| EP0900376A1 (en) | 1999-03-10 |
| CN1154845C (zh) | 2004-06-23 |
| US20020086424A1 (en) | 2002-07-04 |
| IL126605A (en) | 2004-12-15 |
| CN1219239A (zh) | 1999-06-09 |
| WO1997040381A1 (en) | 1997-10-30 |
| EP0900376B8 (en) | 2008-05-28 |
| EP0900376B1 (en) | 2007-06-27 |
| US6638752B2 (en) | 2003-10-28 |
| CA2251826A1 (en) | 1997-10-30 |
| ATE365916T1 (de) | 2007-07-15 |
| US20040235003A1 (en) | 2004-11-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3692149B2 (ja) | 特定のリガンドを標的とするバイオディテクター | |
| Syed et al. | Applications of bioluminescence in biotechnology and beyond | |
| Billard et al. | Bioluminescence-based assays for detection and characterization of bacteria and chemicals in clinical laboratories | |
| Roda et al. | Bioluminescence in analytical chemistry and in vivo imaging | |
| US8545814B2 (en) | Non-invasive localization of a light-emitting conjugate in a mammal | |
| US6916462B2 (en) | Non-invasive localization of a light-emitting conjugate in a mammal | |
| EP0861093B1 (en) | Non-invasive Detection of the Integration of a Transgene in Mammals | |
| US6495355B1 (en) | Red-shifted luciferase | |
| Cox | 10 Bacteriophage-based Methods of Bacterial Detection and Identification | |
| AU6555001A (en) | Biodetectors targeted to specific ligands | |
| MXPA98008577A (es) | Biodetectores dirigidos a ligandos especificos | |
| Boy et al. | Reporter gene systems: A powerful tool for Leishmania studies | |
| Chang et al. | A Low-Cost, Sensitive Reporter System Using Membrane-Tethered Horseradish Peroxidase for Efficient Gene Expression Analysis | |
| Thakur et al. | Nanoparticles and biophotonics as efficient tools in resonance energy transfer-based biosensing for monitoring food toxins and pesticides | |
| Yağdıran et al. | Bioluminescence sensor: enzymes, reaction and utilization as an energy source | |
| Xu et al. | Engineering autobioluminescent eukaryotic cells as tools for environmental and biomedical surveillance | |
| Close et al. | Light without substrate amendment: the bacterial luciferase gene cassette as a mammalian bioreporter | |
| Lu et al. | Optical Approaches to Visualization of Cellular Activity | |
| JP2004105170A (ja) | 哺乳動物中の発光複合体の非侵襲的局在化 | |
| Campbell | Living Light: From the Ocean to the Hospital Bed | |
| SINGH et al. | NEW CONCEPT OF USING GENETICALLY ENGINEERED MICROBIAL BIOSENSORS |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20040308 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20040308 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20050531 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20050620 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20090624 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20090624 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100624 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100624 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110624 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120624 Year of fee payment: 7 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130624 Year of fee payment: 8 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |