JP2024137125A - ゲル化剤、液体組成物及びハイドロゲル - Google Patents
ゲル化剤、液体組成物及びハイドロゲル Download PDFInfo
- Publication number
- JP2024137125A JP2024137125A JP2023048520A JP2023048520A JP2024137125A JP 2024137125 A JP2024137125 A JP 2024137125A JP 2023048520 A JP2023048520 A JP 2023048520A JP 2023048520 A JP2023048520 A JP 2023048520A JP 2024137125 A JP2024137125 A JP 2024137125A
- Authority
- JP
- Japan
- Prior art keywords
- cellulose
- liquid composition
- cellulose oligomer
- polysaccharide
- aqueous solution
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
- A61K47/38—Cellulose; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K3/00—Materials not provided for elsewhere
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M3/00—Tissue, human, animal or plant cell, or virus culture apparatus
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Zoology (AREA)
- Biomedical Technology (AREA)
- Inorganic Chemistry (AREA)
- Wood Science & Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Sustainable Development (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Virology (AREA)
- Materials Engineering (AREA)
- Biochemistry (AREA)
- General Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Cell Biology (AREA)
- Medicinal Preparation (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
Abstract
【課題】新規なゲル化剤、及び、それを用いたゲル化可能な新規な液体組成物、ハイドロゲルを提供する。
【解決手段】実施形態に係るゲル化剤は、ヒアルロン酸等の多糖類をゲル化させるためのゲル化剤であって、平均重合度が5以上20以下であるセルロースオリゴマーを含む。実施形態に係るゲル化可能な液体組成物は、平均重合度が5以上20以下であるセルロースオリゴマーと、多糖類と、水を含む。
【選択図】図1
【解決手段】実施形態に係るゲル化剤は、ヒアルロン酸等の多糖類をゲル化させるためのゲル化剤であって、平均重合度が5以上20以下であるセルロースオリゴマーを含む。実施形態に係るゲル化可能な液体組成物は、平均重合度が5以上20以下であるセルロースオリゴマーと、多糖類と、水を含む。
【選択図】図1
Description
本発明は、ゲル化剤、ゲル化可能な液体組成物、及び、該液体組成物がゲル化してなるハイドロゲルに関する。
セルロース又はその誘導体と、ヒアルロン酸等の多糖類とを含む組成物により形成されるゲルが知られている。例えば、特許文献1には、ヒアルロン酸とカルボキシメチルセルロースを含有するpH3.5以下の水溶液を凍結し、次いで解凍することにより、ヒアルロン酸とカルボキシメチルセルロースからなる共架橋ゲル組成物を製造することが開示されている。
一方、特許文献2には、細胞を培養するための培地に添加される培地添加剤として、平均重合度が5~20であるセルロースオリゴマーを用いることが開示されている。セルロースオリゴマーは、グルコースがβ-1,4-グリコシド結合により連結された構造を持つオリゴ糖である。特許文献2においてセルロースオリゴマーは培地中に細胞を浮遊させるために添加されており、セルロースオリゴマーを多糖類と組み合わせることでゲル化させることは開示されていない。
本発明者らは、上記セルロースオリゴマーの新たな用途を検討していくなかで、セルロースオリゴマーがヒアルロン酸等の多糖類との相互作用によりハイドロゲルを形成することを見い出した。
本発明の実施形態は、上記知見に基づくものであり、多糖類をゲル化させることができる新規なゲル化剤、及び、多糖類を含むゲル化可能な液体組成物、及び該液体組成物がゲル化してなるハイドロゲルを提供することを目的とする。
本発明は以下に示される実施形態を含む。
[1] 多糖類をゲル化させるためのゲル化剤であって、平均重合度が5以上20以下であるセルロースオリゴマーを含む、ゲル化剤。
[2] 平均重合度が5以上20以下であるセルロースオリゴマーと、多糖類と、水を含む、ゲル化可能な液体組成物。
[3] 前記セルロースオリゴマーと前記多糖類を含むアルカリ水溶液である、酸で中和することによりゲル化可能な[2]に記載の液体組成物。
[4] 前記セルロースオリゴマーと前記多糖類を含むアルカリ水溶液を酸で中和することにより前記セルロースオリゴマーを析出させてなる、[2]に記載の液体組成物。
[5] 前記多糖類が非セルロース系多糖類である、[2]又は[3]に記載の液体組成物。
[6] 前記多糖類が、グリコサミノグリカン、及び、α-1,4-グリコシド結合とα-1,6-グリコシド結合によって重合したグルコース及び/又はグルコース誘導体のみで構成される水溶性多糖からなる群から選択された少なくとも1種である、[2]又は[3]に記載の液体組成物。
[7] 前記多糖類100質量部に対して前記セルロースオリゴマーを0.5~100質量部含む、[2]~[6]のいずれか1項に記載の液体組成物。
[8] [2]~[7]のいずれか1項に記載の液体組成物がゲル化してなるハイドロゲル。
[1] 多糖類をゲル化させるためのゲル化剤であって、平均重合度が5以上20以下であるセルロースオリゴマーを含む、ゲル化剤。
[2] 平均重合度が5以上20以下であるセルロースオリゴマーと、多糖類と、水を含む、ゲル化可能な液体組成物。
[3] 前記セルロースオリゴマーと前記多糖類を含むアルカリ水溶液である、酸で中和することによりゲル化可能な[2]に記載の液体組成物。
[4] 前記セルロースオリゴマーと前記多糖類を含むアルカリ水溶液を酸で中和することにより前記セルロースオリゴマーを析出させてなる、[2]に記載の液体組成物。
[5] 前記多糖類が非セルロース系多糖類である、[2]又は[3]に記載の液体組成物。
[6] 前記多糖類が、グリコサミノグリカン、及び、α-1,4-グリコシド結合とα-1,6-グリコシド結合によって重合したグルコース及び/又はグルコース誘導体のみで構成される水溶性多糖からなる群から選択された少なくとも1種である、[2]又は[3]に記載の液体組成物。
[7] 前記多糖類100質量部に対して前記セルロースオリゴマーを0.5~100質量部含む、[2]~[6]のいずれか1項に記載の液体組成物。
[8] [2]~[7]のいずれか1項に記載の液体組成物がゲル化してなるハイドロゲル。
本発明の実施形態によれば、多糖類をゲル化させることができる新規なゲル化剤、多糖類を含むゲル化可能な液体組成物、及び、該液体組成物がゲル化してなるハイドロゲルを提供することができる。
[ゲル化剤]
実施形態に係るゲル化剤は、多糖類をゲル化させるためのゲル化剤であって、平均重合度が5~20のセルロースオリゴマーを含む。
実施形態に係るゲル化剤は、多糖類をゲル化させるためのゲル化剤であって、平均重合度が5~20のセルロースオリゴマーを含む。
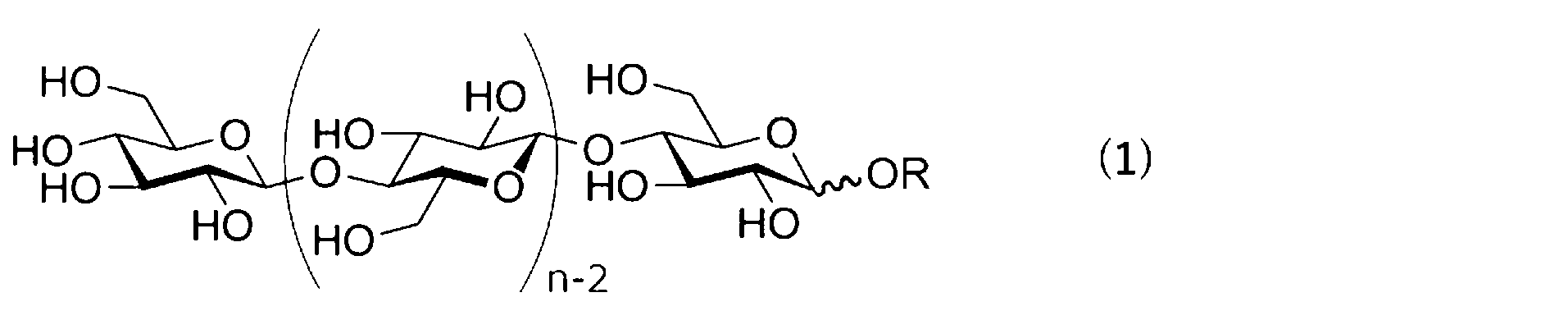
セルロースオリゴマーは、グルコースがβ-1,4-グリコシド結合により連結された構造を持つオリゴ糖であり、セロオリゴ糖とも称される。セルロースオリゴマーは、置換基を有しないものでもよく、また、還元末端のアノマー位に置換基を持つものでもよい。
本実施形態では、セルロースオリゴマーとして、平均重合度(DP)(一分子中に存在するグルコース単位の数の平均値)が5~20であるものを用いる。平均重合度(DP)は、より均一なゲルが形成可能という観点から、5~18であることが好ましく、より好ましくは6~15であり、更に好ましくは6~10であり、更に好ましくは7~9である。セルロースオリゴマーの平均重合度は、セルロースオリゴマーの質量比に応じた重合度の加重平均値である。セルロースオリゴマーは、通常、重合度の異なる化合物の混合物であり、例えば重合度4~20のものを含んでもよく、重合度5~18のものを含んでもよく、重合度5~13のものを含んでもよい。
式(1)中、Rは、水素原子、又は水素原子の代わりに導入される置換基を表す。なお、還元末端の一位の炭素(アノマー炭素)とOR基との間の結合における波線は、OR基の立体配位がα体、β体、又はα体とβ体の混合物であることを示す。OR基の立体配位は好ましくはβ体である。
式(1)中、nは平均重合度であって5~20の数を表す。nは、好ましくは5~18であり、より好ましくは6~15であり、更に好ましくは6~10であり、更に好ましくは7~9である。
セルロースオリゴマーの合成方法は、特に限定されない。例えば、α-グルコース-1-リン酸(以下、αG1Pということがある。)と、グルコース、セロビオース及びそれらの誘導体からなる群から選択される少なくとも一種のプライマーとを、セロデキストリンホスホリラーゼ(以下、CDPということがある。)と反応させる方法が挙げられる。この反応は、CDPの逆反応を利用した合成方法であり、αG1Pをグルコース供与体とし、グルコース、セロビオース及びそれらの誘導体からなる群から選択される少なくとも一種をプライマー(即ち、グルコース受容体)として、これらをCDPと反応させることにより、プライマーに対してαG1Pがモノマーとして逐次的に重合される。なお、プライマーにおけるアノマー位のヒドロキシ基の水素原子を置換基に替えておくことで、様々な置換基を持つセルロースオリゴマーを合成することができる。
セルロースオリゴマーとしては、上記のようにCDPを用いて合成したものをそのまま用いてもよく、あるいはアルカリ水溶液に溶解したものを用いてもよく、あるいはまた自己集合化したものを用いてもよい。
自己集合化したセルロースオリゴマーは、次のようにして調製することができる。すなわち、セルロースオリゴマーをアルカリ水溶液に溶解させた水溶液を調製し、得られた水溶液を酸で中和する。これにより、セルロースオリゴマーは不溶性となって析出し、その際、攪拌・振動等しながら又は静置した状態でインキュベーションすることにより、セルロースオリゴマーは自己集合化する。すなわち、セルロースオリゴマーの分子が整列してセルロースII型の結晶構造を持つセルロースオリゴマー集合体となる。一実施形態において、セルロースオリゴマーは、式(1)で表される化合物を構成成分とするセルロースII型の結晶構造を持つセルロースオリゴマー集合体でもよい。
セルロースオリゴマー集合体は、シート状の構造(セルロースナノシート)を持つものでもよい。ここで、シート状の構造は、細長いリボン状の構造(セルロースナノリボン)を包含する概念である。
一実施形態において、ゲル化剤は、上記セルロースオリゴマーの水分散体でもよい。すなわち、ゲル化剤は、上記セルロースオリゴマー集合体が水に分散した分散液でもよい。あるいは、一実施形態において、ゲル化剤は、上記セルロースオリゴマーをアルカリ水溶液に溶解させた水溶液でもよい。あるいは、一実施形態において、ゲル化剤は、セルロースオリゴマーの水分散体や水溶液を凍結乾燥等により乾燥してなる粉末状でもよい。
ゲル化剤が上記の水分散体である場合、セルロースオリゴマーの含有量(濃度)は、特に限定されず、例えば0.10~15%(w/v)であることが好ましく、より好ましくは0.12~5.0%(w/v)であり、更に好ましくは0.12~1.0%(w/v)である。
ゲル化剤が上記の水溶液である場合、セルロースオリゴマーの含有量(濃度)は、特に限定されず、例えば0.12~1.3%(w/v)であることが好ましく、より好ましくは0.14~0.70%(w/v)である。
本明細書において、「%(w/v)」は、質量体積パーセント濃度であり、100mLの体積にしめる対象物質の質量(g)である。
ゲル化剤には、セルロースオリゴマー、及び、分散媒ないし溶媒としての水とともに、例えば、アルカリ剤、緩衝剤、無機塩等の様々な添加剤が含まれてもよい。
アルカリ剤としては、例えば、水酸化ナトリウム、水酸化カリウム、水酸化リチウム等が挙げられる。
緩衝剤としては、例えば、リン酸緩衝生理食塩水(PBS)、2-モルホリノエタンスルホン酸(MES)緩衝液、トリスヒドロキシメチルアミノメタン(Tris)緩衝液、3-モルホリノプロパンスルホン酸(MOPS)緩衝液、4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸(HEPES)緩衝液等を構成する緩衝剤が挙げられる。
無機塩としては、例えば、塩化ナトリウム、塩化カリウム、塩化リチウム等が挙げられる。
上記ゲル化剤は、多糖類をゲル化させるために用いられる。多糖類としては、非セルロース系多糖類が好ましく用いられる。より好ましくは、多糖類としては、(A)グリコサミノグリカン、及び、(B)α-1,4-グリコシド結合とα-1,6-グリコシド結合によって重合したグルコース及び/又はグルコース誘導体のみで構成される水溶性多糖が挙げられ、これらはいずれか1種用いても2種以上併用してもよい。これらの多くは細胞外マトリックスの構成多糖であり、本実施形態において好適に用いられる。
上記(A)のグリコサミノグリカンは、糖のヒドロキシ基がアミノ基で置換された構造を持つアミノ糖を有する多糖である。グリコサミノグリカンとしては、例えば、ヒアルロン酸、コンドロイチン硫酸、ヘパリン、ケラタン硫酸、ヘパラン硫酸等が挙げられる。
上記(B)の水溶性多糖は、グルコース及び/又はグルコース誘導体がα-1,4-グリコシド結合とα-1,6-グリコシド結合によって重合した構造を持つ多糖類であり、例えば、デキストラン及びその誘導体(例えば、カルボキシメチルデキストラン(CM-Dex)等)、プルラン等が挙げられる。
なお、本明細書において、上記の多糖類は、それらがアニオン性基を有する場合、そのナトリウム塩等の塩も包括する概念である。
一実施形態において、多糖類は、ヒアルロン酸、コンドロイチン硫酸、ヘパリン、カルボキシメチルデキストラン、及びプルランからなる群から選択される少なくとも1種であることが好ましい。
[液体組成物]
実施形態に係る液体組成物は、上記ゲル化剤を含むものであり、従って、平均重合度が5以上20以下であるセルロースオリゴマーと、多糖類と、水を含む、ゲル化可能な液体組成物である。
実施形態に係る液体組成物は、上記ゲル化剤を含むものであり、従って、平均重合度が5以上20以下であるセルロースオリゴマーと、多糖類と、水を含む、ゲル化可能な液体組成物である。
該液体組成物において、セルロースオリゴマー及び多糖類については上述したとおりであり、説明は省略する。
該液体組成物において、セルロースオリゴマーの含有量は、多糖類100質量部に対して0.5~100質量部であることが好ましい。セルロースオリゴマーは多糖類の水溶液をゲル化させるためのゲル化剤として用いられるため、セルロースオリゴマーの含有量は、多糖類の含有量に対して同量以下であることが好ましい。セルロースオリゴマーの含有量は、多糖類100質量部に対して1~80質量部であることが好ましく、より好ましくは2~70質量部であり、更に好ましくは3~60質量部であり、更に好ましくは4~50質量部である。
一実施形態において、多糖類としてヒアルロン酸を用いる場合、セルロースオリゴマーの含有量は、ヒアルロン酸100質量部に対して5~100質量部であることが好ましく、より好ましくは8~80質量部であり、更に好ましくは10~60質量部であり、更に好ましくは15~40質量部である。
該液体組成物において、セルロースオリゴマーの含有量(濃度)は、特に限定されず、例えば0.10~1.0%(w/v)であることが好ましく、より好ましくは0.12~0.50%(w/v)であり、更に好ましくは0.15~0.40%(w/v)であり、更に好ましくは0.18~0.35%(w/v)であり、更に好ましくは0.20~0.30%(w/v)である。
該液体組成物において、多糖類の含有量(濃度)は、特に限定されず、例えば0.30~10.0%(w/v)でもよく、0.50~8.0%(w/v)でもよく、0.60~6.0%(w/v)でもよく、0.80~5.0%(w/v)でもよい。一実施形態において、多糖類としてヒアルロン酸を用いる場合、液体組成物におけるヒアルロン酸の含有量(濃度)は、特に限定されないが、0.50~1.5%(w/v)であることが好ましく、より好ましくは0.60~1.3%(w/v)であり、更に好ましくは0.80~1.2%(w/v)である。
該液体組成物において、セルロースオリゴマーは、アルカリ水溶液中に溶解された形態で含まれてもよく、セルロースオリゴマー集合体として水に分散した形態で含まれてもよい。
例えば、一実施形態において、液体組成物は、セルロースオリゴマーと多糖類を含むアルカリ水溶液でもよい。その場合、該液体組成物は、酸で中和することによりゲル化させることができる。
また、一実施形態において、液体組成物は、水に分散したセルロースオリゴマー集合体と、水に溶解した多糖類とを含むものでもよい。その場合、ゲル化可能な液体組成物は、セルロースオリゴマーと多糖類を含むアルカリ水溶液を、酸で中和することにより、セルロースオリゴマーを析出させて得られる。
該液体組成物には、セルロースオリゴマー、多糖類、及び水とともに、例えば、アルカリ剤、緩衝剤、無機塩、有機低分子化合物、タンパク質等の様々な添加剤が含まれてもよい。アルカリ剤、緩衝剤及び無機塩については上述したとおりであり、説明は省略する。
[ハイドロゲル]
上記液体組成物は、ゲル化することでハイドロゲルを形成することができる。そのため、実施形態に係るハイドロゲルは、上記液体組成物がゲル化してなるものである。よって、該ハイドロゲルは、上記セルロースオリゴマーと、上記多糖類と、水を含み、更に上記液体組成物に含まれる様々な添加剤を含んでもよい。なお、該ハイドロゲルにおけるセルロースオリゴマー及び多糖類の含有量及び両者の割合は、液体組成物において上述したとおりであり、説明は省略する。
上記液体組成物は、ゲル化することでハイドロゲルを形成することができる。そのため、実施形態に係るハイドロゲルは、上記液体組成物がゲル化してなるものである。よって、該ハイドロゲルは、上記セルロースオリゴマーと、上記多糖類と、水を含み、更に上記液体組成物に含まれる様々な添加剤を含んでもよい。なお、該ハイドロゲルにおけるセルロースオリゴマー及び多糖類の含有量及び両者の割合は、液体組成物において上述したとおりであり、説明は省略する。
ここで、ハイドロゲルとは、水を分散媒とする分散系が流動性を失って固化したものをいう。詳細には、後述するゲル化評価試験において、バイアルを反転倒立させて10分経過後に分散系がバイアル底部に全く流れ落ちておらずバイアル上部に全て保持されていれば、ゲル化している(すなわち、ハイドロゲルが形成されている)と判断する。
上記液体組成物は、ゲル化能に関して温度応答性を有する。すなわち、上記液体組成物は、加熱することによりゲル化し(又は、低温環境にある場合よりも速くゲル化させることができ)、その後に冷却してもゲル状態を維持することができる。
上記ハイドロゲルは、セルロースオリゴマーと多糖類との相互作用により両者が複合化して形成されるものである。詳細には、ハイドロゲルにおいて、セルロースオリゴマーは、自己集合化してなるセルロースオリゴマー集合体として含まれており、該セルロースオリゴマー集合体が凝集することで多糖類の分子鎖間を連結する架橋剤(物理的架橋)として機能すると考えられる。
ハイドロゲルを形成するための方法としては、例えば、セルロースオリゴマーを自己集合化させてセルロースオリゴマー集合体の水分散体としてから、該水分散体と多糖類又はその水溶液とを混ぜてもよい。但し、好ましくは、セルロースオリゴマーと多糖類を含むアルカリ水溶液を酸で中和することによりセルロースオリゴマーを析出させることである。これにより、より均一なハイドロゲルを形成することができる。
図1は、一実施形態に係るゲル化の推測メカニズムを示す概念図である。ここでは、アルカリ水溶液を中和させてハイドロゲルを形成する場合について説明する。セルロースオリゴマーと多糖類を溶解させたアルカリ水溶液に、酸を添加して中和(中性pH化)する。その際、酸には緩衝剤を添加しておいてもよい。中和後の水溶液を高温環境(例えば37℃)に所定時間(例えば24時間)置いた場合、水溶液の流動性が失われてハイドロゲルが形成される。これに対し、中和後の水溶液を低温環境(例えば4℃)に所定時間(例えば24時間)置いた場合、水溶液は流動性を維持し、ゾルが形成される。そして、該ゾルを高温環境(例えば37℃)に所定時間(例えば24時間)置くと、流動性が失われてハイドロゲルが形成される。
かかるゲル化のメカニズムは次のように推測される。上記アルカリ水溶液を中和することにより、セルロースオリゴマーは不溶性となって析出し、自己集合化してセルロースオリゴマー集合体が形成される。その際、水溶液中には多糖類が存在するため、図1に示すように、セルロースオリゴマーの自己集合と多糖類の分子鎖との間で相互作用が生じるとともに、高温環境下ではセルロースオリゴマー集合体が凝集し、該凝集体が多糖類の分子鎖間を連結する架橋剤として働くと考えられる。そのため、多糖類の分子鎖と該凝集体により、三次元網目を持つハイドロゲルが形成される。
一方、低温環境下では、セルロースオリゴマー集合体と多糖類の分子鎖との間での相互作用は生じるものの、セルロースオリゴマー集合体の凝集が起こらず(又はその凝集速度が遅いことから所定時間内では流動性を失うほどの十分な凝集が生じず)、流動性を持つゾルが形成されると考えられる。該ゾルを高温環境に置くと、セルロースオリゴマー集合体の凝集が促進されて、多糖類の分子鎖間を連結する架橋構造が形成され、三次元網目を持つハイドロゲルが形成されると考えられる。
上記液体組成物をゲル化させる温度は特に限定されず、例えば15℃以上でもよく、20℃以上でもよく、25℃以上でもよい。ゲル化させる温度の上限も特に限定されず、例えば60℃以下でもよく、50℃以下でもよい。上記液体組成物をゲル化させる時間は特に限定されず、10時間以上でもよく、15時間以上でもよく、18時間以上でもよい。
[用途]
実施形態に係るハイドロゲルの用途は特に限定されず、例えば細胞培養の足場が挙げられる。また、ハイドロゲル中に薬物や有用蛋白を入れて、体内でのそれらの分布をコントロールするためのドラッグデリバリーシステム用途が挙げられる。
実施形態に係るハイドロゲルの用途は特に限定されず、例えば細胞培養の足場が挙げられる。また、ハイドロゲル中に薬物や有用蛋白を入れて、体内でのそれらの分布をコントロールするためのドラッグデリバリーシステム用途が挙げられる。
以下、実施例により更に説明するが、本発明はこれらに限定されるものではない。
[セルロースオリゴマーの合成]
T.Serizawaら,Polym.J.,2016年,48,539-544に記載の方法に従い(D-グルコースをプライマーとして使用)、下記式で表される、平均重合度が9(n=9)のセルロースオリゴマー(グルコース由来)を合成した。また、T.Serizawaら,Langmuir,2017年,33,13415-13422に記載の方法に従い(セロビオースをプライマーとして使用)、下記式で表される、平均重合度が7(n=7)のセルロースオリゴマー(セロビオース由来)を合成した。
T.Serizawaら,Polym.J.,2016年,48,539-544に記載の方法に従い(D-グルコースをプライマーとして使用)、下記式で表される、平均重合度が9(n=9)のセルロースオリゴマー(グルコース由来)を合成した。また、T.Serizawaら,Langmuir,2017年,33,13415-13422に記載の方法に従い(セロビオースをプライマーとして使用)、下記式で表される、平均重合度が7(n=7)のセルロースオリゴマー(セロビオース由来)を合成した。
詳細には、200mmol/LのαG1P、50mmol/LのD-グルコース又はセロビオース、及び0.2U/mLのセロデキストリンホスホリラーゼ(CDP)を、500mmol/Lの2-[4-(2-ヒドロキシエチル)-1-ピペラジニル]エタンスルホン酸(HEPES)緩衝液(pH7.5)中で混合し、60℃で3日間インキュベートした。生成物を含む反応液を遠心(15000rpm、10分間以上、4℃)し、上清を取り除いた後、超純水を加えて生成物を再分散させ、遠心(同条件)する操作を繰り返すことで、上清の置換率が99.999%以上となるまで精製して、セルロースオリゴマーを得た。
生成物の平均重合度は、プロトン核磁気共鳴(NMR)装置により測定した。試料は、凍結乾燥した12mg以上の生成物を600μLの4質量%重水酸化ナトリウム重水溶液に溶解させることで調製した。NMR装置は、ADVANCE III HD500(Bruker Biospin、磁場強度:500MHz、積算回数16回)を用いた。平均重合度は、セルロースオリゴマーの還元末端のアノマー位(δ~5.1、4.5)及びそれ以外のアノマー位(δ~4.3)のプロトンの積分値をもとに算出した。
[多糖類]
実施例で使用した多糖類は以下のとおりである。
・ヒアルロン酸:ナカライテスク社製
・CM-Dex:東京化成工業社製
・コンドロイチン硫酸Cナトリウム:ナカライテスク社製
・ヘパリンナトリウム:ナカライテスク社製
実施例で使用した多糖類は以下のとおりである。
・ヒアルロン酸:ナカライテスク社製
・CM-Dex:東京化成工業社製
・コンドロイチン硫酸Cナトリウム:ナカライテスク社製
・ヘパリンナトリウム:ナカライテスク社製
[試験例1:実施例1~3,比較例1~4]
容器としては1mLマイティーバイアルを用いた。セルロースオリゴマーとヒアルロン酸を溶解させた1mol/LのNaOH水溶液を、1mol/LのHCl水溶液で中和して、300μLの水溶液を調製した。その際、HCl水溶液にはリン酸緩衝成分を添加しておくことで、中和後の水溶液がリン酸緩衝生理食塩水(PBS、[NaCl]137mmol/L)となるようにした。また、中和後の水溶液におけるセルロースオリゴマー及びヒアルロン酸の濃度は下記表1になるようにした。また、セルロースオリゴマーの種類は表1に示すとおりである。得られた水溶液を25℃の雰囲気で24時間静置した後、ゲル化評価を行った。
容器としては1mLマイティーバイアルを用いた。セルロースオリゴマーとヒアルロン酸を溶解させた1mol/LのNaOH水溶液を、1mol/LのHCl水溶液で中和して、300μLの水溶液を調製した。その際、HCl水溶液にはリン酸緩衝成分を添加しておくことで、中和後の水溶液がリン酸緩衝生理食塩水(PBS、[NaCl]137mmol/L)となるようにした。また、中和後の水溶液におけるセルロースオリゴマー及びヒアルロン酸の濃度は下記表1になるようにした。また、セルロースオリゴマーの種類は表1に示すとおりである。得られた水溶液を25℃の雰囲気で24時間静置した後、ゲル化評価を行った。
ゲル化評価は、静置後のバイアルを反転倒立させ、反転倒立してから10分後に水溶液(分散系)がバイアル底部に全く流れ落ちておらずバイアル上部に全て保持されていればゲル化したと判断した。表1には、ゲル化したものを「ゲル」、ゲル化しなかったものを「ゾル」と示した。
結果は表1に示すとおりである。セルロースオリゴマーを配合していない比較例1ではゲル化しなかった。ヒアルロン酸を配合していない比較例2と3及び比較例4についてもゲル化しなかった。これに対し、セルロースオリゴマーとヒアルロン酸を併用した実施例1~3ではゲル化しており、セルロースオリゴマーとヒアルロン酸との相互作用により両者が複合化したハイドロゲルが得られた。
図2は反転倒立から24時間後の状態を示す写真であり、実施例1~3であると24時間経過後も流れ落ちておらず、ゲル状態が維持されていた。セルロースオリゴマーの種類を比較した場合、セロビオース由来のセルロースオリゴマーを用いた実施例1と2は、グルコース由来のセルロースオリゴマーを用いた実施例3に対して透明性が高く均一なゲルが形成されていた。
[試験例2:比較例5,6]
1mLマイティーバイアルに、カルボキシメチルセルロースナトリウム(ナカライテスク社製)とヒアルロン酸を溶解させた300μLの水溶液を調製した。その際、該水溶液におけるカルボキシメチルセルロースナトリウムの濃度は、比較例5では0.20%(w/v)とし、比較例6では0.30%(w/v)とした。また、ヒアルロン酸の濃度は、比較例5,6ともに1.0%(w/v)とした。得られた水溶液を25℃の雰囲気で24時間静置した後、試験例1と同様にしてゲル化評価を行った。
1mLマイティーバイアルに、カルボキシメチルセルロースナトリウム(ナカライテスク社製)とヒアルロン酸を溶解させた300μLの水溶液を調製した。その際、該水溶液におけるカルボキシメチルセルロースナトリウムの濃度は、比較例5では0.20%(w/v)とし、比較例6では0.30%(w/v)とした。また、ヒアルロン酸の濃度は、比較例5,6ともに1.0%(w/v)とした。得られた水溶液を25℃の雰囲気で24時間静置した後、試験例1と同様にしてゲル化評価を行った。
その結果、セルロースオリゴマーの代わりにカルボキシメチルセルロースナトリウムを用いた比較例5,6では、いずれも静置後のバイアルを反転倒立してから10分後に水溶液が流れ落ちる様子が確認され、ゲル化しなかった。
[試験例3:実施例4~6]
中和後の水溶液におけるヒアルロン酸の濃度を、実施例4では0.40%(w/v)とし、実施例5では0.60%(w/v)とし、実施例6では0.80%(w/v)とし、その他は実施例1と同様にして、中和後の水溶液を得て、25℃の雰囲気で24時間静置した後、ゲル化評価を行った。その結果、実施例4~6では、静置後のバイアルを反転倒立してから10分後に水溶液が流れ落ちておらず、ゲル化していた。また、実施例4~6では反転倒立から24時間経過後にも流れ落ちておらず、ゲル状態が維持されていた。
中和後の水溶液におけるヒアルロン酸の濃度を、実施例4では0.40%(w/v)とし、実施例5では0.60%(w/v)とし、実施例6では0.80%(w/v)とし、その他は実施例1と同様にして、中和後の水溶液を得て、25℃の雰囲気で24時間静置した後、ゲル化評価を行った。その結果、実施例4~6では、静置後のバイアルを反転倒立してから10分後に水溶液が流れ落ちておらず、ゲル化していた。また、実施例4~6では反転倒立から24時間経過後にも流れ落ちておらず、ゲル状態が維持されていた。
[試験例4:実施例7~9,比較例7~12:静置温度依存性]
1mLマイティーバイアルにおいて、セルロースオリゴマーとヒアルロン酸を溶解させた1mol/LのNaOH水溶液を、リン酸緩衝成分を添加した1mol/LのHCl水溶液で中和して、中和後の水溶液がリン酸緩衝生理食塩水(PBS、[NaCl]137mmol/L)である300μLの水溶液を調製した。その際、中和後の水溶液におけるセルロースオリゴマー(セロビオース由来)の濃度が0.20%(w/v)、かつヒアルロン酸の濃度が1.0%(w/v)となるようにした。得られた水溶液を、実施例7では4℃の雰囲気で、実施例8では25℃の雰囲気で、実施例9では37℃の雰囲気で、それぞれ24時間静置した後、試験例1と同様のゲル化評価を行った。
1mLマイティーバイアルにおいて、セルロースオリゴマーとヒアルロン酸を溶解させた1mol/LのNaOH水溶液を、リン酸緩衝成分を添加した1mol/LのHCl水溶液で中和して、中和後の水溶液がリン酸緩衝生理食塩水(PBS、[NaCl]137mmol/L)である300μLの水溶液を調製した。その際、中和後の水溶液におけるセルロースオリゴマー(セロビオース由来)の濃度が0.20%(w/v)、かつヒアルロン酸の濃度が1.0%(w/v)となるようにした。得られた水溶液を、実施例7では4℃の雰囲気で、実施例8では25℃の雰囲気で、実施例9では37℃の雰囲気で、それぞれ24時間静置した後、試験例1と同様のゲル化評価を行った。
比較例7~9ではセルロースオリゴマーを添加せず、その他は実施例7~9と同様にして水溶液を調製し、得られた水溶液を、比較例7では4℃の雰囲気で、比較例8では25℃の雰囲気で、比較例9では37℃の雰囲気で、それぞれ24時間静置した後、試験例1と同様のゲル化評価を行った。
比較例10~12ではヒアルロン酸を添加せず、その他は実施例7~9と同様にして水溶液を調製し、得られた水溶液を、比較例10では4℃の雰囲気で、比較例11では25℃の雰囲気で、比較例12では37℃の雰囲気で、それぞれ24時間静置した後、試験例1と同様のゲル化評価を行った。
結果は下記表2に示すとおりである。セルロースオリゴマーを添加せずにヒアルロン酸のみを配合した比較例7~9では4℃、25℃及び37℃のいずれの雰囲気に静置してもゲル化しなかった。同様に、ヒアルロン酸を添加せずにセルロースオリゴマーのみを配合した比較例10~12では4℃、25℃及び37℃のいずれの雰囲気に静置してもゲル化しなかった。これに対し、セルロースオリゴマーとヒアルロン酸を配合した場合、4℃で静置した実施例7ではゲル化しなかったものの、25℃及び37℃で静置した実施例8,9では、反転倒立から10分経過後はもちろんのこと、反転倒立から24時間経過後にもゲル状態が維持されていた。これにより、静置温度によりゲル化を制御できることが分かった。また、静置温度の上昇に伴ってゲルの白濁が強くなる傾向が見られた。このことから、セルロースオリゴマー集合体の凝集がゲル化に寄与している可能性が示唆された。
上記のゲル化しなかった実施例7のゾルを含むバイアルを正立させた後、37℃の雰囲気で24時間静置してから同様のゲル化評価を行ったところ、ゾルがゲル化しており反転倒立から24時間経過後にもゲル状態が維持されていた。更に、このゲル状態にあるバイアルを正立させた後、4℃の雰囲気に24時間静置してから反転倒立させたところ、反転倒立から24時間経過後にゲル状態が維持されていた。このように4℃で静置して得られた液体状態の生成物(ゾル)を37℃で静置することによりゲル化することが分かった。また、このようにゲル化した後には、4℃に戻しても液体状態には戻らなかった。すなわち、一度形成したゲルは温度変化に対して安定であることが分かった。このことから、一度凝集したセルロースオリゴマー集合体は温度を下げても分散しないことが示唆された。
[試験例5:静置時間依存性]
上記実施例1と同様にして中和後の水溶液(ヒアルロン酸濃度:1.0%(w/v)、セルロースオリゴマー(セロビオース由来)濃度:0.20%(w/v)、NaCl濃度:137mmol/L(PBS条件))を調製した。得られた中和後の水溶液を、25℃の雰囲気で、下記表3に示す静置時間にてそれぞれ静置し、試験例1と同様のゲル化評価を行った。
上記実施例1と同様にして中和後の水溶液(ヒアルロン酸濃度:1.0%(w/v)、セルロースオリゴマー(セロビオース由来)濃度:0.20%(w/v)、NaCl濃度:137mmol/L(PBS条件))を調製した。得られた中和後の水溶液を、25℃の雰囲気で、下記表3に示す静置時間にてそれぞれ静置し、試験例1と同様のゲル化評価を行った。
結果は下記表3に示すとおりであり、実施例1の配合では18時間以上静置することでゲル化することが分かった。セルロースオリゴマーの自己集合化にかかる時間はより短いと考えられることから、セルロースオリゴマー集合体の凝集がゲル化に寄与している可能性が支持された。
[試験例6:ハイドロゲルの安定性評価]
上記実施例1と同様にして中和後の水溶液(ヒアルロン酸濃度:1.0%(w/v)、セルロースオリゴマー(セロビオース由来)濃度:0.20%(w/v)、NaCl濃度:137mmol/L(PBS条件))を調製し、得られた中和後の水溶液を、25℃の雰囲気で24時間静置して実施例10のハイドロゲルを作製した。また、セルロースオリゴマー濃度を1.0%(w/v)とし、その他は実施例10と同様にして、実施例11のハイドロゲルを作製した。次いで、実施例10,11の各バイアルに超純水600μLを注入し、それぞれハイドロゲル上に超純水の層を形成した後、25℃の雰囲気に静置し、静置開始直後から60日経過までハイドロゲルの状態を観察した。
上記実施例1と同様にして中和後の水溶液(ヒアルロン酸濃度:1.0%(w/v)、セルロースオリゴマー(セロビオース由来)濃度:0.20%(w/v)、NaCl濃度:137mmol/L(PBS条件))を調製し、得られた中和後の水溶液を、25℃の雰囲気で24時間静置して実施例10のハイドロゲルを作製した。また、セルロースオリゴマー濃度を1.0%(w/v)とし、その他は実施例10と同様にして、実施例11のハイドロゲルを作製した。次いで、実施例10,11の各バイアルに超純水600μLを注入し、それぞれハイドロゲル上に超純水の層を形成した後、25℃の雰囲気に静置し、静置開始直後から60日経過までハイドロゲルの状態を観察した。
その結果、実施例10,11ともに、ハイドロゲルは超純水の添加後、少なくとも2ヶ月はゲル状態が維持されていた。セルロースオリゴマー濃度が1.0%(w/v)である実施例11では、静置開始から6日経過頃からバイアル内でハイドロゲルが浮き上がってくる様子が観察された。このことから、実施例11では、浸透圧により内部の塩が流出していることが示唆された。但し、ハイドロゲルの形状自体は変化無く維持されていた。そのため、実施例10,11のハイドロゲルは、超純水に対して安定であり、超純水への浸漬で崩れないほど強いネットワーク構造が構築されている可能性が示唆された。
[試験例7:実施例12:低温長期静置]
上記実施例7と同様にして中和後の水溶液(ヒアルロン酸濃度:1.0%(w/v)、セルロースオリゴマー(セロビオース由来)濃度:0.20%(w/v)、NaCl濃度:137mmol/L(PBS条件))を調製し、得られた中和後の水溶液を、4℃の雰囲気で24時間静置した。これを反転倒立させたところ、水溶液は流れ落ち、ゲル化していなかった。反転倒立させたまま4℃で24時間静置した後、バイアルの口に溜まった水溶液を落として再度正立させた状態とし、4℃の雰囲気に静置させた。すると、中和後から合計2週間静置した時点で白濁している様子が観察された。そこで、これを反転倒立させてゲル化評価を行ったところ、10分後に流れ落ちることなく、ゲル化していた。更に反転倒立させたまま25℃で24時間静置したところ、24時間経過後にもゲル状態が維持されていた。このことから、4℃で静置した場合でも、静置時間を長くすることでゲル化することが分かった。4℃という低温環境では、セルロースオリゴマー集合体の凝集にかかる時間が長いためであると考えられる。
上記実施例7と同様にして中和後の水溶液(ヒアルロン酸濃度:1.0%(w/v)、セルロースオリゴマー(セロビオース由来)濃度:0.20%(w/v)、NaCl濃度:137mmol/L(PBS条件))を調製し、得られた中和後の水溶液を、4℃の雰囲気で24時間静置した。これを反転倒立させたところ、水溶液は流れ落ち、ゲル化していなかった。反転倒立させたまま4℃で24時間静置した後、バイアルの口に溜まった水溶液を落として再度正立させた状態とし、4℃の雰囲気に静置させた。すると、中和後から合計2週間静置した時点で白濁している様子が観察された。そこで、これを反転倒立させてゲル化評価を行ったところ、10分後に流れ落ちることなく、ゲル化していた。更に反転倒立させたまま25℃で24時間静置したところ、24時間経過後にもゲル状態が維持されていた。このことから、4℃で静置した場合でも、静置時間を長くすることでゲル化することが分かった。4℃という低温環境では、セルロースオリゴマー集合体の凝集にかかる時間が長いためであると考えられる。
[試験例8:実施例13~17及び比較例13~15]
下記表4に従い、ヒアルロン酸1.0%(w/v)の代わりに、CM-Dex、コンドロイチン硫酸Cナトリウム、及びヘパリンナトリウムを濃度5.0%(w/v)とし、かつセルロースオリゴマー(セロビオース由来)の濃度を表4に記載のとおりとし、その他は試験例1と同様にして、中和後の水溶液を調製し、得られた水溶液を25℃の雰囲気で24時間静置した後、ゲル化評価を行った。
下記表4に従い、ヒアルロン酸1.0%(w/v)の代わりに、CM-Dex、コンドロイチン硫酸Cナトリウム、及びヘパリンナトリウムを濃度5.0%(w/v)とし、かつセルロースオリゴマー(セロビオース由来)の濃度を表4に記載のとおりとし、その他は試験例1と同様にして、中和後の水溶液を調製し、得られた水溶液を25℃の雰囲気で24時間静置した後、ゲル化評価を行った。
結果は下記表4に示すとおりである。多糖類としてCM-Dex、コンドロイチン硫酸Cナトリウム、及びヘパリンナトリウムのいずれを用いた場合も、セルロースオリゴマーを配合していない比較例13~15ではゲル化しなかった。これに対し、これら多糖類とともにセルロースオリゴマーを配合した実施例13~17であると、反転倒立から10分後に水溶液が流れ落ちておらずゲル化していた。
なお、明細書に記載の種々の数値範囲は、それぞれそれらの上限値と下限値を任意に組み合わせることができ、それら全ての組み合わせが好ましい数値範囲として本明細書に記載されているものとする。また、「X~Y」との数値範囲の記載は、X以上Y以下を意味する。
以上、本発明のいくつかの実施形態を説明したが、これら実施形態は、例として提示したものであり、発明の範囲を限定することは意図していない。これら実施形態は、その他の様々な形態で実施されることが可能であり、発明の要旨を逸脱しない範囲で、種々の省略、置き換え、変更を行うことができる。これら実施形態やその省略、置き換え、変更などは、発明の範囲や要旨に含まれると同様に、特許請求の範囲に記載された発明とその均等の範囲に含まれるものである。
Claims (8)
- 多糖類をゲル化させるためのゲル化剤であって、平均重合度が5以上20以下であるセルロースオリゴマーを含む、ゲル化剤。
- 平均重合度が5以上20以下であるセルロースオリゴマーと、多糖類と、水を含む、ゲル化可能な液体組成物。
- 前記セルロースオリゴマーと前記多糖類を含むアルカリ水溶液である、酸で中和することによりゲル化可能な請求項2に記載の液体組成物。
- 前記セルロースオリゴマーと前記多糖類を含むアルカリ水溶液を酸で中和することにより前記セルロースオリゴマーを析出させてなる、請求項2に記載の液体組成物。
- 前記多糖類が非セルロース系多糖類である、請求項2に記載の液体組成物。
- 前記多糖類が、グリコサミノグリカン、及び、α-1,4-グリコシド結合とα-1,6-グリコシド結合によって重合したグルコース及び/又はグルコース誘導体のみで構成される水溶性多糖からなる群から選択された少なくとも1種である、請求項2に記載の液体組成物。
- 前記多糖類100質量部に対して前記セルロースオリゴマーを0.5~100質量部含む、請求項2に記載の液体組成物。
- 請求項2~7のいずれか1項に記載の液体組成物がゲル化してなるハイドロゲル。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2023048520A JP2024137125A (ja) | 2023-03-24 | 2023-03-24 | ゲル化剤、液体組成物及びハイドロゲル |
| CN202480019772.1A CN120882830A (zh) | 2023-03-24 | 2024-03-22 | 胶凝剂、液体组合物及水凝胶 |
| PCT/JP2024/011311 WO2024203856A1 (ja) | 2023-03-24 | 2024-03-22 | ゲル化剤、液体組成物及びハイドロゲル |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2023048520A JP2024137125A (ja) | 2023-03-24 | 2023-03-24 | ゲル化剤、液体組成物及びハイドロゲル |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2024137125A true JP2024137125A (ja) | 2024-10-07 |
Family
ID=92906361
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023048520A Pending JP2024137125A (ja) | 2023-03-24 | 2023-03-24 | ゲル化剤、液体組成物及びハイドロゲル |
Country Status (3)
| Country | Link |
|---|---|
| JP (1) | JP2024137125A (ja) |
| CN (1) | CN120882830A (ja) |
| WO (1) | WO2024203856A1 (ja) |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009185228A (ja) * | 2008-02-08 | 2009-08-20 | Asahi Kasei Chemicals Corp | ゲル化剤 |
| US20180334696A1 (en) * | 2014-12-23 | 2018-11-22 | E I Du Pont De Nemours And Company | Enzymatically produced cellulose |
| JP6604581B2 (ja) * | 2015-01-15 | 2019-11-13 | Jxtgエネルギー株式会社 | セルロースナノ構造体及びその製造方法 |
| CN109983067B (zh) * | 2016-11-16 | 2022-11-15 | 营养与生物科学美国4公司 | 纤维素/多糖复合材料 |
-
2023
- 2023-03-24 JP JP2023048520A patent/JP2024137125A/ja active Pending
-
2024
- 2024-03-22 WO PCT/JP2024/011311 patent/WO2024203856A1/ja active Pending
- 2024-03-22 CN CN202480019772.1A patent/CN120882830A/zh active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| CN120882830A (zh) | 2025-10-31 |
| WO2024203856A1 (ja) | 2024-10-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Zhao et al. | Freeze-thaw induced gelation of alginates | |
| Draget et al. | Chitosan cross-linked with Mo (VI) polyoxyanions: a new gelling system | |
| CN110790885B (zh) | 一种聚乙烯醇/壳聚糖季铵盐抗菌自愈水凝胶及其制备方法和应用 | |
| CN102604141B (zh) | 一种制备季铵化壳聚糖络合碘的抗菌膜的方法 | |
| Montembault et al. | Rheometric study of the gelation of chitosan in a hydroalcoholic medium | |
| JP2009537597A (ja) | アニオン性及びカチオン性多糖類のポリマー混合物並びにその使用 | |
| Peniche et al. | Chitosan based polyelectrolyte complexes | |
| CN101602814B (zh) | 羧甲基可德胶物理水凝胶及其制备方法 | |
| CN102585303A (zh) | 一种壳聚糖/聚赖氨酸原位凝胶及其制备方法 | |
| CN107099042A (zh) | 一种温敏型可注射水凝胶的制备方法 | |
| CN113372575B (zh) | 一种基于胶质多糖及纤维素衍生物温敏水凝胶及其制备方法和应用 | |
| CN100522247C (zh) | 一种可注射型温敏性壳聚糖/甲基纤维素凝胶及其制备方法 | |
| CN114042034A (zh) | 一种可注射温敏型药物缓释载体水凝胶及其制备方法 | |
| WO2017084300A1 (zh) | 透明质酸‐甲基纤维素复合凝胶及其制备和应用 | |
| CN114805856B (zh) | 一种可注射pH/ROS双重响应水凝胶及其制备方法和应用 | |
| CN108926574A (zh) | 一种杂化抗菌水凝胶及其制备方法 | |
| Ding et al. | Tunable thermosensitive behavior of multiple responsive chitin | |
| Qiao et al. | Konjac glucomannan/xanthan synergistic interaction gel: Effect of the fine structure of xanthan on enthalpy driven assembly behavior and gel strength | |
| CN110339155A (zh) | 巯基化壳聚糖/明胶/β-甘油磷酸钠复合水凝胶及其制备方法 | |
| JP2024137125A (ja) | ゲル化剤、液体組成物及びハイドロゲル | |
| CN105694030A (zh) | 一种寡聚氨基酸与海藻酸钠复合的杂化抗菌水凝胶 | |
| Qian et al. | Regulation of physicochemical properties of alginate-based hydrogels and preliminary applications in wound healing | |
| Wu et al. | Stable thermosensitive in situ gel-forming systems based on the lyophilizate of chitosan/α, β-glycerophosphate salts | |
| CN114891239A (zh) | 一种硼氮内配位硼酸酯水凝胶及其制备方法 | |
| Chang et al. | Preparation and properties of a novel thermosensitive N-trimethyl chitosan hydrogel |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230330 |